Изобретение относится к области биоизмерительных технологий, а именно к способам оценки с помощью тестовых микроорганизмов токсичности различных материалов (включающих как отдельные химические вещества и частицы, так и их разнообразные смеси).
Известен «Способ определения чувствительности микроорганизмов к антимикробным веществам» (патент RU №2505813, МПК G01N 33/48, дата приоритета 06.11.2012, опубликовано 27.01.2014), в котором антимикробную активность тестируемых веществ по отношению к тому или иному биоматериалу предлагается определять, исходя из количества колоний микроорганизмов, исходно содержащихся в означенном биоматериале и выросших на плотной накопительной питательной среде в присутствии тестируемого препарата, а также времени проявления видимого роста этих колоний. Недостатками этого способа являются его длительность (до 3-х суток), большая трудоемкость, большая материалоемкость по компонентам питательных сред, а также то, что антимикробная активность тестируемых веществ определяется визуально, а следовательно, достаточно субъективно.
Известен «Способ оценки эффективности антимикробного воздействия антисептиков на бактерии, существующие в форме биопленки» (патент RU №2603100, МПК C12Q, дата приоритета 29.10.2015, опубликовано 20.11.2016), в котором эффективность действия антисептиков на бактерии, выделенные из клинического материала пациента и существующие в жидкой питательной среде (ЖПС) в форме биопленки, предлагается определять как отношение рабочей концентрации антисептика к его минимальной подавляющей концентрации. При этом регистрацию эффективности действия той или иной концентрации тестируемого антисептика на биопленку предлагается проводить с помощью фотометра - по изменению цвета и помутнению ЖПС с тестовыми микроорганизмами, инкубируемой при заданной температуре в течение заданного времени (от 5-и суток и более) в присутствии тестируемого антисептика, взятого в упомянутой концентрации. Основными недостатками этого способа, как и в предыдущих случаях, являются его большая длительность и трудоемкость, а также невысокая объективность, поскольку рассматриваемый способ позволяет оценивать влияние тестируемых веществ лишь на скорость роста тестовых микроорганизмов, но не на интенсивность их метаболизма.
Наиболее близким к предлагаемому техническому решению является «Способ определения бактерицидных свойств сыворотки крови» (патент RU №2489489, МПК C12Q 1/18, дата приоритета 26.12.2011, опубликовано 10.08.2013), в котором бактерицидные свойства проб сыворотки крови определяют по уменьшению интенсивности люминесценции инкубируемого в LB-бульоне в присутствии тестируемых проб тестового трансгенного штамма Bacillus subtilis ВКПМ В-10548, эффективно экспрессирующего luxAB-гены грамотрицательного морского микроорганизма Photobacterium leiognathi (в результате чего синтезируется фермент люцифераза, обеспечивающий активное свечение, интенсивность которого зависит от общего количества жизнеспособных тестовых микроорганизмов и активности их метаболизма). При этом анализ осуществляют следующим образом:
на первом (подготовительном) этапе выращивают штамм Bacillus subtilis ВКПМ В-10548 на LB-arape в присутствии канамицина в конечной концентрации 40 мкг/мл (что позволяет исключить рост не люминесцирующих штаммов) при 37°С в течение 24 часов. Полученную биомассу смывают стерильным LB-бульоном, после чего полученную суспензию стандартизуют до оптической плотности 1,2 отн. ед. при 540 нм (измеряемой в кюветах с длиной оптического пути 1 см);
на втором (основном) этапе смешивают суспензию бактериальных клеток и исследуемого образца сыворотки крови в соотношении 1:1 и инкубируют полученную смесь при 37°С в течение 30 минут. При этом до и после инкубации из тестовой смеси производят отбор аликвот по 250 мкл в кюветы для биолюминометра. И дополнительно вносят в них по 2 мкл деканаля в конечной концентрации 7×10-6 М (окисляемого в присутствии молекулярного кислорода ферментом люциферазой - что и обеспечивает активное свечение тестового штамма).
На завершающем этапе осуществляют регистрацию уровня свечения в пробах в видимой сине-зеленой области спектра (420-600 им). При этом в качестве измерительного прибора могут использоваться биохемилюмино-метр «Биоток-10М», а также прочие отечественные и зарубежные люмино-метры, работающие в обозначенной области спектра и обеспечивающие соответствующую чувствительность измерений.
К основным недостаткам данного технического решения можно отнести:
- узкую область применения (анализ бактерицидных свойств только лишь сыворотки крови человека и животных);
- необходимость использования специально выведенного, трансгенного, узкоспециализированного штамма тестовых микроорганизмов - что дополнительно ограничивает область применения данного технического решения, поскольку для тестирования про- и антибиотических свойств разных материалов могут требоваться разные тестовые организмы (либо лучше даже совокупность из нескольких разных видов и штаммов тестовых организмов);
- кроме того, штамм Bacillus subtilis ВКПМ В-10548, применяемый при реализации данного технического решения, не является широко доступным, и потому достаточно трудно сначала получить данный штамм, а затем длительное время поддерживать его чистоту, жизнеспособность и специфические свойства (выражающиеся, в частности, в активном синтезе фермента люциферазы);
- а также то, что рассматриваемый метод обладает не очень высокой объективностью, поскольку влияние тестируемых объектов (в качестве которых в данном случае выступают образцы сыворотки крови животных и человека) на тестовые организмы определяется всего лишь по одному косвенному параметру (интенсивности хемилюминесценции этих объектов).
В связи с неуклонным ростом производства и потребления человеческим обществом различной продукции все более актуальной в настоящее время становится проблема разработки достаточно экспрессных, объективных, простых, дешевых и доступных для широкого использования методов оценки про- и антибиотических свойств различных веществ, материалов, препаратов, пищевой и иной продукции, отходов различных производств и т.п.
В связи с вышесказанным, целью заявляемого изобретения стало создание способа, позволяющего, по сравнению с прототипом, более широкому кругу пользователей с большей объективностью оценивать токсичность существенно более широкого круга тестируемых материалов (включающих как различные отдельные химические вещества и частицы, так и их разнообразные смеси).
Цель эта достигается за счет того, что в предлагаемом способе (который включает такие операции как: подготовка тестовых образцов, инкубирование этих образцов как в присутствии тестируемых материалов, так и в их отсутствие, сопровождающееся измерением свойств этих образцов в начале и в конце их инкубации, и последующее определение токсичности тестируемых материалов на основании упомянутых измерений) тестовые образцы перед началом их инкубирования представляют собой Chlorella vulgaris в количестве от 5×105 до 5×106 жизнеспособных клеток на мл, суспендированную в водном растворе, изначально содержащем 0,9-1,3 г/л NH4NO3, 0,4-0,6 г/л KН2РO4, 0,4-0,6 г/л NaH2PO4, 0,6-0,8 г/л (NH4)2SO4, 0,5-0,9 г/л (NH4)2CO3, 0,18-0,22 г/л Mg(NO3)2, 0,05-0,07 г/л FeCl3 и 0,018-0,022 г/л СаСl2 и имеющего рН 6,6-7,4; инкубирование этих образцов в присутствии тестируемых материалов проводят в течение 10-20 часов при 15-25°С; свойства тестовых образцов определяют путем измерения интенсивности света, упруго рассеиваемого на длине волны 540±10 нм (Iod), оптической плотности на длине волны 435±10 нм (Avd) и интенсивности фотофлуоресценции при длинах волн возбуждения и эмиссии 370±10 и 685±10 нм (Iff); после чего общую степень активирования или ингибирования (+/-) жизнедеятельности тестовых микроорганизмов тестируемыми материалами определяют по формуле:
εS=(εIod+εAvd+εIff)/3,
где εIod, εAvd и εIff определяют по формулам εY=100×(ΔYt-ΔYc)/ΔYc,
где ΔY=Ye-Yb - разности значений Iod, Avd или Iff, регистрируемых в начале (Yb) и в конце (Ye) инкубации тестовых образцов в присутствии тестируемых материалов (ΔYt) и в их отсутствие (ΔYc).
При этом, выбор Chlorella vulgaris в качестве тестовых микроорганизмов связан с тем, что эти одноклеточные зеленые водоросли широко распространены в природе, обладая развитой ферментной системой, активно участвуют в естественном разложении многих природных и антропогенных материалов, легко культивируются и, вследствие всего вышеупомянутого, достаточно широко используются в различных методах биотестирования, научных исследованиях, а также биотехнологических процессах (см. патент RU 2192459 «Штамм микроводоросли Chlorella vulgaris bin для получения биомассы и очистки сточных вод», 2002; патент RU 2508398 «Штамм микроводоросли Chlorella vulgaris для получения липидов в качестве сырья для производства моторного топлива», 2014 и др.).
Выбор количества жизнеспособных тестовых микроорганизмов, которое должно присутствовать в тестовых образцах перед началом их инкубации в присутствии и в отсутствие тестируемых веществ (от 5×105 до 5×106 кл/мл), определяется тем, что при меньшем количестве таковых микроорганизмов увеличивается длительность инкубации, необходимая для достижения максимальной чувствительности заявляемого способа анализа; а при большем количестве тестовых микроорганизмов снижается интенсивность их роста и метаболизма, что приводит к уменьшению чувствительности анализа.
Выбор исходного состава жидкой питательной среды, входящей в состав тестируемых образцов (водный раствор с рН 6,6-7,4, содержащий 0,9-1,3 г/л NH4NO3, 0,4-0,6 г/л KН2РO4, 0,4-0,6 г/л NaH2PO4, 0,6-0,8 г/л (NH4)2SO4, 0,5-0,9 г/л (NH4)2CO3, 0,18-0,22 г/л Mg(NO3)2, 0,05-0,07 г/л FeCl3 и 0,018-0,022 г/л СаСl2), связан с необходимостью обеспечения оптимальных условий для развития в этой среде тестовых микроорганизмов - что, как и в предыдущем случае, нужно для увеличения чувствительности и снижения продолжительности анализа.
Выбор режима инкубирования тестовых образцов (10-20 часов при 15-25°С) связан с тем, что при более длительном инкубировании снижается интенсивность роста и метаболизма тестовых микроорганизмов (что приводит к соответствующему снижению чувствительности анализа); при других температурах инкубирования интенсивность роста и метаболизма тестовых микроорганизмов также снижается (что приводит к уменьшению чувствительности анализа и необходимости увеличения его длительности); а при меньшем времени инкубирования тестовые микроорганизмы не успевают в достаточной степени среагировать на изменения в окружающей их среде, вызванные присутствием там тестируемых материалов (что приводит к снижению как чувствительности, так и объективности анализа).
Увеличение (по сравнению с прототипом) объективности и спектра применимости заявляемого способа анализа обеспечивается тем, что в ходе него осуществляется точная, инструментальная, количественная оценка изменения таких трех параметров тестовых образцов, как интенсивность света, упруго рассеиваемого на длине волны 540±10 нм, оптической плотность на длине волны 435±10 нм и интенсивность фотофлуоресценции при длинах волны возбуждения и эмиссии 370±10 и 685±10 нм, характеризующих изменения в интенсивности роста и метаболической активности такого широко-используемого тестового микроорганизма, как Chlorella vulgaris, вознивающией вследствие воздействия на последние широкого круга тестируемых материалов (которые могут включать в себя как различные отдельные химические вещества и частицы, так и их разнообразные смеси). В то время как в прототипе влияние тестируемых материалов на тестовые микроорганизмы определялось всего лишь по одному параметру тестовых образцов (а именно, интенсивности их хемилюминесценции), достаточно косвенно характеризующему метаболическую активность тестовых микроорганизмов. Причем данным способом предлагалось оценивать бактерицидные свойства весьма узкого круга тестируемых материалов (а именно, сыворотки крови человека и животных), и к тому же, с помощью трансгенного, узкоспециализированного штамма тестовых микроорганизмов (Bacillus subtilis ВКПМ В-10548) с достаточно не типичным метаболизмом.
А доступность заявляемого способа анализа более широкому кругу пользователей обеспечивается применением при анализе минимального числа дополнительных реагентов и ручных операций по засеву и оценке роста и метаболической активности тестовых микроорганизмов в присутствии тестируемых материалов (в то время как в прототипе предлагалось использовать такие специфические химические реагенты, как канамицин, деканаль и т.п., а также осуществлять множество дополнительных ручных операций по выращиванию тестовых микроорганизмов на LB-arape и последующему приготовлению суспензии бактериальных клеток в LB-бульоне). А также возможностью применения для анализа такого хорошо доступного и легко культивируемого вида тестовых микроорганизмов, как Chlorella vulgaris (в то время как в прототипе в качестве тестовых микроорганизмов предлагалось использовать штамм Bacillus subtilis ВКПМ В-10548, мало доступный и трудно культивируемый в условиях необходимости поддержания требуемой степени чистоты и жизнеспособности данной микробиологической культуры, нужных для осуществления Bacillus subtilis ВКПМ В-10548 таких специфических свойств, как, в частности, активный синтез фермента люциферазы).
Реализация предлагаемого способа определения токсичности различных материалов осуществляется следующим образом:
Этап 1. Готовится питательная среда (ПС), представляющая собой стерильный водный раствор с рН 6,6-7,4, содержащий 0,9-1,3 г/л NH4NO3, 0,4-0,6 г/л KН2РO4, 0,4-0,6 г/л NaH2PO4, 0,6-0,8 г/л (NH4)2SO4, 0,5-0,9 г/л (NH4)2CO3, 0,18-0,22 г/л Mg(N03)2, 0,05-0,07 г/л FeCl3 и 0,018-0,022 г/л СаСl2. Далее, все емкости с ЖПС закрываются и стерилизуются. После чего все емкости с ПС хранятся в герметично закрытом виде, в отсутствие света, при 2-4°С.
Этап 2. Отбираются тестируемые материалы (ТМ); после чего доставляются в лабораторию и хранятся там до начала анализа в темном месте, в герметически закрытом виде, при 2-4°С.
Этап 3. Подготавливается исходный тестовый образец (ТО). Для чего в одну большую емкость с ПС стерильно вносится 1-10 об. % закваски, содержащей суспендированные в ПС жизнеспособные клетки Chlorella vulgaris После чего упомянутая емкость закрывается и инкубируется в течение 48 ч при 15-25°С с обеспечением достаточного уровня освещенности, а также циркуляции воздуха и питательных веществ (с помощью различных ламп, шейкера и ватно-марлевых пробок либо иными способами).
Затем в упомянутой емкости измеряется интенсивность света, упруго рассеиваемого ТО на длине волны 540±10 нм (Iod). И по предварительно построенному калибровочному графику (представляющему собой зависимость Iod ТО от концентрации содержащихся в нем клеток Chlorella vulgaris) удостоверяется, что полученное значение Iod соответствует концентрации Chlorella vulgaris в ТО от 5×105 до 5×106 клеток на мл (кл/мл).
После этого, если измеренная Iod соответствует концентрации Chlorella vulgaris в ТО меньше 5×105 кл/мл; то емкость с ТО инкубируется в тех же условиях что и ранее в течение еще 6 ч; после чего для нее проводится повторное определение Iod. А если измеренная Iod соответствует концентрации Chlorella vulgaris в ТО больше 5×106 кл/мл; то ТО в той же емкости разбавляется необходимым количеством ПС.
Этап 4. Если нас интересует концентрационная зависимость про- или антимикробных свойств тестируемых материалов, либо эти материалы имеют слишком высокую исходную токсичность (так что ожидается, что в неразведенном виде они будут слишком сильно ингибировать развитие тестовых микроорганизмов), то делается необходимое количество разведений исходных материалов. После чего каждый материал или каждое его разведение делится на 3-5 равных частей, каждая из которых помещается в отдельную емкость, куда также добавляется ТО, подготовленного на 3-м этапе анализа.
Этап 5. Все емкости, приготовленные на 4-м этапе анализа, плюс некоторое количество контрольных емкостей, содержащих ТО без добавок тестируемых материалов (а также, в случае необходимости, ТО с заданным количеством вещества или смеси веществ, про- или антимикробная активность которых известны заранее) перемешиваются, закрываются и инкубируются в течение 10-20 часов при 15-25°С и достаточном уровне освещенности, а также циркуляции воздуха и питательных веществ. При этом непосредственно перед началом и после окончания этой инкубации во всех упомянутых емкостях регистрируются значения таких параметров ТО (изменяющихся вследствие роста и размножения там тестовых микроорганизмов, а также преобразования ими в ходе метаболической активности одних веществ, входящих в состав ТО, в другие) как интенсивность света, упруго рассеиваемого на длине волны 540±10 нм (Iod), оптическая плотность на длине волны 435±10 нм (Avd) и интенсивность фотофлуоресценции при длинах волн возбуждения и эмиссии 370±10 и 685±10 нм (Iff).
Этап 6. После этого общая степень активирования или ингибирования (+/-) жизнедеятельности тестовых микроорганизмов тестируемыми материалами рассчитывается по формуле: εS=(εIod+εAvd+εIff)/3, где εIod, εAvd и εIff определяют по формулам εY=100×(ΔYt-ΔYc)/ΔYc, где ΔY=Ye-Yb - разности значений Iod, Avd или Iff, регистрируемых в начале (Yb) и в конце (Ye) инкубации ТО в присутствии тестируемых материалов (AYt) и в их отсутствие (AYc).
Упомянутый способ может быть реализован с применением фотофлуо-риметра «СМ-2203» или иного, позволяющего с достаточной степенью чувствительности измерять для жидких, водных образцов интенсивность света, упруго рассеиваемого на длине волны 540±10 нм, оптическую плотность на длине волны 435±10 нм и интенсивность фотофлуоресценции при длинах волн возбуждения и эмиссии 370±10 и 685±10 нм.
Более детально настоящее изобретение описывается следующим конкретным примером. Для анализа было взято 4-е образца, содержащих свежеприготовленные 0,1 М водные растворы FeCl3, FeCl2, СоС12 и NiCl2. Каждый из этих образцов помещался в 6 пробирок (так, чтобы в 3-х из них конечная концентрация тестируемого образца составляла 0,03 М, а в других 3-х - 0,003 М), в которые затем дополнительно было налито по 6 мл тестовой среды (ТС), в качестве которой использовалась суспензия, содержащая около 106 жизнеспособных клеток Chlorella vulgaris АТСС 9765 в 1 мл водного раствора, исходно стерильного, имевшего рН 7,0±0,2 и содержавшего 1,1±0,1 г/л NH4NO3+0,5+0,05 г/л KН2РO4+0,5±0,05 г/л NaH2PO4+0,7±0,05 г/л (NH4)2SO4+0,7±0,05 г/л (NH4)2CO3+0,2±0,02 г/л Mg(NO3)2+0,06±0,003 г/л FeCl3+0,02±0,001 г/л СаСl2.
Затем все эти пробирки (включая 3-й контрольные, содержавшие ту же ТС, но без добавления какого-либо из тестируемых материалов) перемешивались, закрывались ватно-марлевыми пробками и инкубировались в течение 16-и часов при комнатной температуре, на шейкере, освещаемом фитолампой. При этом непосредственно перед началом инкубации и сразу после ее окончания последовательно у ТС в каждой из пробирок с помощью спектроф-луориметра «СМ-2203» регистрировались интенсивность света, упруго рассеиваемого на длине волны 540±10 нм (Iod), оптическая плотность на длине волны 435±10 нм (Avd) и интенсивность фотофлуоресценции на длине волны 685±10 нм при возбуждения оной на длине волны 370±10 нм (Iff).
Далее, изменения каждого из измеренных параметров ТС рассчитывались по формуле: AY=Ye-Yb (где Yb и Ye - значения Iod, Avd или Iff, зарегистрированные в каждой из контрольных и тестовых пробирок в начале и в конце их инкубирования). Затем все полученные значения AY; усреднялись (по пробиркам, содержащим одни и те же концентрации одних и тех же образцов), и для каждого из усредненных значений рассчитывался 95% доверительный интервал. После чего общая степень активирования или ингибирования (+/-) жизнедеятельности тестовых микроорганизмов тестируемыми материалами рассчитывалась по формуле εS=(εIod+εAvd+εIff)/3,
где SY=100×(ΔYt-ΔYc)/ΔYc, a ΔYt и ΔYc - изменения значений Iod, Avd или Iff, произошедшие за время инкубирования ТС в присутствии различных количеств тестируемых проб (ΔYt) и в их отсутствие (ΔYc). Результаты этих расчетов представлены в таблице 1.
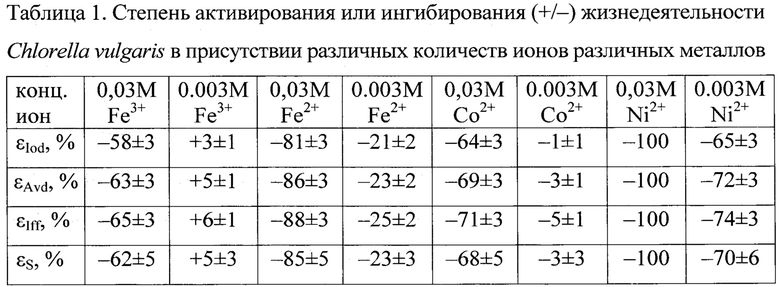
Из представленных данных можно сделать следующие выводы. Антимикробная активность тестируемых ионов металлов в отношении С.vulgaris увеличивалась в следующем ряду Fe3+<Со2+<Fe2+<Ni2+. При этом ингибирование жизнедеятельности тестовых микроорганизмов было тем большим, чем выше была концентрация тестируемого иона металла в ТС, и наблюдалось в большей степени для активности метаболизма C.vulgaris (выражаемой значениями Avd и Iff) нежели для интенсивности их роста и размножения (выражаемой значениями Iod).
Таким образом, заявляемый способ может обеспечить расширение области применения определения токсичности различных материалов, а также повышение объективности такого определения и доступности его для использования более широким кругом пользователей.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ определения токсичности проб | 2018 |
|
RU2688745C1 |
| Способ определения антибиотических свойств материалов | 2018 |
|
RU2688119C1 |
| Способ определения бактерицидных свойств материалов | 2018 |
|
RU2689359C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ БАКТЕРИЦИДНЫХ СВОЙСТВ ВЕЩЕСТВ | 2018 |
|
RU2688328C1 |
| Способ оценки про- и антимикробных свойств проб | 2018 |
|
RU2688117C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ УСТОЙЧИВОСТИ МАТЕРИАЛОВ К БИОДЕГРАДАЦИИ | 2017 |
|
RU2676094C1 |
| Способ определения устойчивости органических полимеров к деградации, индуцируемой различными факторами | 2018 |
|
RU2687174C1 |
| Способ определения содержания тетрациклина в воздухе с применением тест-объекта Chlorella vulgaris | 2023 |
|
RU2811841C1 |
| Недеструктивный способ оценки цитотоксичности наночастиц с использованием микроводоросли Dunaliella salina в качестве биосенсора | 2018 |
|
RU2692675C1 |
| ШТАММ БАКТЕРИЙ Brevibacillus laterosporus, ПРОДУЦИРУЮЩИЙ ШИРОКИЙ СПЕКТР БИОЛОГИЧЕСКИ АКТИВНЫХ СОЕДИНЕНИЙ | 2010 |
|
RU2422511C1 |
Изобретение относится к биотехнологии и может быть использовано для оценки токсичности различных материалов. Способ определения токсичности материалов предусматривает выращивание Chlorella vulgaris в водном растворе, содержащем NH4NO3, KH2PO4, NaH2PO4, (NH4)2SO4, (NH4)2CO3, Mg(NO3)2, FeCl3 и CaCl2 в заданном количестве компонентов и при заданных параметрах как в присутствии различных количеств тестируемых материалов, так и в их отсутствие. В начале и в конце инкубации у образцов измеряют интенсивность света, упруго рассеиваемого на длине волны 540±10 нм (Iod), оптическую плотность на длине волны 435±10 нм (Avd) и интенсивность фотофлуоресценции при длинах волн возбуждения и эмиссии 367±10 нм и 685±10 нм (Iff). Общую степень активирования или ингибирования (+/-) жизнедеятельности тестовых микроорганизмов тестируемыми материалами определяют по формуле: εS=(εIod+εAvd+εIff)/3, где εIod, εAvd и εIff определяют по формулам εY=100×(ΔYt-ΔYc)/ΔYc, где ΔY=Ye-Yb - разности значений Iod, Avd или Iff, регистрируемых в начале (Yb) и в конце (Ye) инкубации тестовых образцов в присутствии тестируемых материалов (ΔYt) и в их отсутствие (ΔYc). Изобретение позволяет повысить объективность определения токсичности материалов. 1 табл.
Способ определения токсичности материалов, включающий подготовку тестовых образцов, содержащих достаточное количество жизнедеятельных тестовых микроорганизмов, суспендированных в изначально стерильной жидкой питательной среде, инкубирование этих образцов как в присутствии тестируемых материалов, так и в их отсутствие, сопровождающееся измерением свойств тестовых образцов в начале и в конце их инкубирования, и последующее определение токсичности тестируемых материалов, отличающийся тем, что тестовые микроорганизмы представляют собой Chlorella vulgaris, количество которой в тестовых образцах перед началом инкубации последних должно составлять от 5×105 до 5×106 жизнеспособных клеток на мл, жидкая питательная среда, используемая для приготовления тестовых образцов, представляет собой стерильный водный раствор с рН 6,6-7,4, содержащий 0,9-1,3 г/л NH4NO3, 0,4-0,6 г/л KH2PO4, 0,4-0,6 г/л NaH2PO4, 0,6-0,8 г/л (NH4)2SO4, 0,5-0,9 г/л (NH4)2CO3, 0,18-0,22 г/л Mg(NO3)2, 0,05-0,07 г/л FeCl3 и 0,018-0,022 г/л CaCl2, инкубирование тестовых образцов проводят в течение 10-20 часов при 15-25°С, свойства образцов определяют путем измерения интенсивности света, упруго рассеиваемого на длине волны 540±10 нм (Iod), оптической плотности на длине волны 435±10 нм (Avd) и интенсивности фотофлуоресценции при длинах волн возбуждения и эмиссии 370±10 нм и 685±10 нм (Iff), после чего общую степень активирования или ингибирования (+/-) жизнедеятельности тестовых микроорганизмов тестируемыми материалами определяют по формуле: εS=(εIod+εAvd+εIff)/3,
где εIod, εAvd и εIff определяют по формулам: sY=100×(ΔYt-ΔYc)/ΔYc,
где ΔY=Ye-Yb - разности значений Iod, Avd или Iff, регистрируемых в начале (Yb) и в конце (Ye) инкубации тестовых образцов в присутствии тестируемых материалов (ΔYt) и в их отсутствие (ΔYc).
| ЧЕСНОКОВА С.М., ЧУГАЙ Н.В | |||
| Биологические методы оценки качества объектов окружающей среды | |||
| Методы биотестирования, 2008, Владимир, ч.2 | |||
| Из-во Владимирского государственного университета, с | |||
| Выбрасывающий ячеистый аппарат для рядовых сеялок | 1922 |
|
SU21A1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ БАКТЕРИЦИДНЫХ СВОЙСТВ СЫВОРОТКИ КРОВИ | 2011 |
|
RU2489489C1 |
| АФАНАСЬЕВ Д.Ф., ЦЫБУЛЬСКИЙ И.Е | |||
| и др | |||
| Разработка тест-системы оценки токсичности компонентов экосистем морских водоемов на | |||
Авторы
Даты
2019-12-04—Публикация
2019-01-23—Подача