Область техники, к которой относится изобретение
Изобретение относится к области медицины, а именно урологии, онкоурологии, и может быть использовано для предоперационного планирования и оценки интра - и ранних послеоперационных осложнений, включающих возникновение кровотечений и образование мочевых свищей в первые трое суток после проведения органосохраняющей операции при опухолях паренхимы почек.
Уровень техники
Из уровня техники известны способ оценки интра - и послеоперационных осложнений, наиболее известными среди них являются: шкала PADUA - Preoperative aspects and dimensions used for an anatomical), С-индекс - отношение расстояния от центра опухоли (см) до центра почки к радиусу опухоли (см), а также шкала R.E.N.A.L. [Simmons MN, Ching СВ, Samplaski MK, Park СН, Gill IS. Kidney tumor location measurement using the С index method. J Urol. 2010; 183:1708-13. [PubMed] Kutikov A, Uzzo RG. The R.E.N.A.L. Nephrometry score: A comprehensive standardized system for quantitating renal tumor size, location and depth. J Urol. 2009; 182:844-53. [PubMed] Ficarra V, Novara G, Secco S, Macchi V, Porzionato A, De Caro R, et al. Preoperative aspects and dimensions used for an anatomical (PADUA) classification of renal tumours in patients who are candidates for nephron-sparing surgery. Eur Urol. 2009; 56:786-93. [PubMed].
Однако известные способы являются субъективными, т.к. оценка основана на данных, полученных на основании МСКТ (мультиспиральной компьютерной томографии), которые, в частности, не дают подробной информации о соотношении опухоли с чашечно-лоханочной системой и ее связи с сосудами.
Наиболее близким к заявляемому решению является способ прогнозирования вероятности интра - и ранних послеоперационных осложнений при органосохраняющих операциях при опухолях паренхимы почек с использованием шкалы R.E.N.A.L. [Kutikov A, Uzzo RG. The R.E.N.A.L. Nephrometry score: A comprehensive standardized system for quantitating renal tumor size, location and depth. J Urol. 2009; 182:844-53. [PubMed]. Способ основан на определении следующих параметров: R (radius, размер опухоли в см), Е (exophytic/endophytic - экзофитный или эндофитный характер опухоли), N (nearness, близость опухоли к полостной системе почки или ее синусу, мм), A (anterior, расположение опухоли по передней или задней поверхности почки), L (location, локализация опухоли относительно поперечных линий, проведенных через края почечного синуса), каждый из которых оценивают по изображениям МСКТ в баллах, по сумме которых строят прогноз вероятности интра - и ранних послеоперационных осложнений.
Однако, данный способ основан только на интерпретации изображения МСКТ, и не учитывает комплекс иных значимых анатомических параметров, которые можно получить по итогам 3D моделирования опухоли, что снижает достоверность и точность получения прогнозных оценок. Кроме того, данный способ является сложным для предоперационного планирования, осуществляемого урологом/онкологом, поскольку требует использования специальных знаний в области лучевой диагностики и владения соответствующим программным обеспечением, что повышает риск получения ошибочных умозаключений.
Раскрытие изобретения
Технической проблемой, решаемой изобретением, является создание способа прогнозирования вероятности интра - и ранних послеоперационных осложнений при органосохраняющих операциях по поводу опухолей паренхимы почек, обеспечивающего получение более достоверных и точных прогнозных оценок. Способ основан на построении 3D модели патологического очага, с последующей оценкой оригинального комплекса параметров по 3D нефрометрической шкале.
Техническим результатом, на достижение которого направлено заявленное изобретение, является возможность получения более объективной прогнозной оценки посредством использования комплекса критериев, измеренных на 3D-модели патологического очага, полученной по итогам лучевых методов исследования (например, КТ, микро КТ, МРТ, МСКТ).
Технический результат достигается при реализации способа прогнозирования вероятности интра - и ранних послеоперационных осложнений при органосохраняющих операциях при опухолях паренхимы почек, включающего проведение исследования опухоли паренхимы почек лучевыми методами с построением 3D-модели патологического очага, определение диагностических признаков, в качестве которых используют:
количество артерий, питающих опухоль (x1), которое измеряют в баллах, при этом отсутствие артерий определяют как 0 баллов, наличие от 1 до 3 артерий включительно - 1 балл, более 3-2 балла;
объем опухоли (х2), который измеряют в баллах, при этом опухоли объемом до 20000 voxel присваивают 0 баллов, 20000-40000 voxel - 1 балл, 40001-60000 voxel - 2 балла, более 60000 - 3 балла;
максимальный размер опухоли (x3), который измеряют в мм;
наибольший диаметр артерий (сосудов), питающих опухоль (х4), который измеряют в мм;
расстояние от ближайшего края опухоли до мочеточника или ЧЛС (x5), которое определяется минимальным расстоянием от края опухоли до ближайшей из указанных структур, которое измеряют в мм;
расстояние от края опухоли до магистральных сосудов (х6), которое измеряют в мм, (наименьшее расстояние между опухолью и ближайшим магистральным сосудом, т.е. расстояние от ближайшего края опухоли до ближайшего магистрального сосуда - артерии 1 или 2 порядка).
По полученным значениям рассчитывают значения функций D1 и D2,
D1 = -9,501 + 1,663х1 - 2,212x2 + 0,310х3 + 1,005х4 + 0,437х5 + 0,132х6
D2 = -9,915 + 2,734x1 - 1,663х2 + 0,296х3 + 0,890x4 + 0,336х5 + 0,143х6,
где линейная дискриминантная функция D1 характеризует отсутствие осложнений, линейная дискриминантная функция D2 - наличие осложнений, x1-x6 - значения признаков, включенных в модель.
Согласно способу сравнивают рассчитанные значения D1 и D2, при этом в случае получения большего значения у функции D2 делают вывод о высокой вероятности осложнений, в случае получения большего числа в функции D1 делают вывод о высокой вероятности отсутствия осложнений.
В качестве лучевых методов используют КТ, микро КТ, МРТ.
Краткое описание чертежей
Изобретение поясняется чертежами, где на фиг. 1 представлены ROC-кривые прогнозирования осложнений при оперативном лечении рака почки, полученные при использовании заявляемого способа и другими существующими методами; на фиг. 2 представлена построенная 3D модель опухоли паренхимы почки на основании полученных данных МСКТ.
Осуществление изобретения
Ниже представлено более детальное описание заявляемого способа.
При разработке способа авторами было исследовано 264 пациента, которые были поделены на 2 группы - 221 человек, у которых инра- и послеоперационный период протекал без осложнений (без возникновения кровотечений и образования мочевых свищей в первые трое суток) и 43 пациента, у которых были отмечены осложнения в виде кровопотери более 600 мл и/или образование свищей.
При исследовании проводилась оценка степени связи различных показателей (признаков), характеризующих опухоль паренхимы почек, с прогнозными выводами об интра- и ранних послеоперационных осложнениях с использованием стандартных статистических методик (метод дискриминантного анализа). В результате были отобраны те из них, которые дали коэффициенты корреляции наиболее близкие к 1, что говорит о наиболее сильной взаимосвязи показателей с оцениваемым событием.
В итоговую модель было включено 6 классификационных признаков, на основе которых была сформирована каноническая дискриминантная функция:
максимальный размер опухоли (мм);
расстояние от ближайшего края опухоли до мочеточника или ЧЛС, которое определяется минимальным расстоянием от края опухоли до ближайшей из указанных структур (мм);
количество артерий, питающих опухоль (баллы);
расстояние до магистральных сосудов (мм), т.е. расстояние от ближайшего края опухоли до ближайшего магистрального сосуда - артерии 1 или 2 порядка;
наибольший диаметр сосудов (артерий), питающих опухоль (мм);
объем опухоли (баллы).
Для классификации единиц наблюдения по признакам одного пациента производился расчет линейных дискриминантных функций с коэффициентами каждой из групп. Прогнозируемый случай относится к той группе, для которой дискриминантная функция принимает максимальное значение. Для проверки гипотезы об однородности ковариационных матриц исследуемых групп использовался многомерный М-критерий Бокса. Чувствительность и специфичность комплекса критериев оценивалась при помощи ROC-анализа. Количественная интерпретация результатов проводилась по ROC-кривым с оценкой показателя AUC (Area under ROC curve - площадь под ROC-кривой).
Структурная матрица корреляции дискриминантных переменных с канонической дискриминантной функцией, на основании которой были отобраны переменные, представлена в таблице 1.
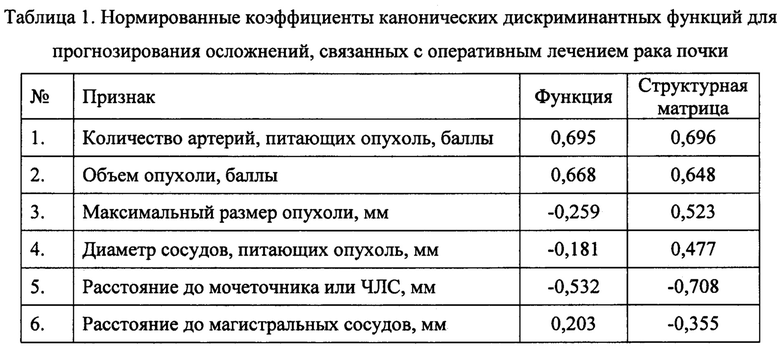
Каноническая корреляция, описывающая меру связи между дискриминирующей функцией и сопоставляемыми подгруппами, составила 0,304, что объясняет 30,4% дисперсии исходной бинарной переменной наличия или отсутствия осложнений. Лямбда Уилкса при оценке канонической дискриминантной функции составила 0,908 (χ2=25,114; р<0,001).
Наибольший вклад в результаты классификации из отобранных переменных вносят показатели: количество артерий, питающих опухоль, объем опухоли, расстояние до мочеточника.
Матрицы ковариаций (дисперсий) в группах наблюдения статистически значимо отличались друг от друга по критерию М Бокса (р=0,002).
Коэффициенты линейных моделей дискриминантной функции, включающих в себя классификационные признаки, которые характеризуют принадлежность пациентов к группе с отмеченными интра- или поле операционными осложнениями, представлены в таблице 2.


Исходя из таблицы 2, прогнозирование вероятности интра - и ранних послеоперационных осложнений (при возникновении кровотечений с кровопотерей более 500 мл. и/или образования мочевых свищей в первые трое суток) при оперативном лечении рака почки осуществляют посредством определения D1 и D2.
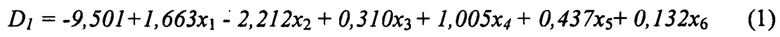

где D1 - линейная дискриминантная функция, моделирующая отсутствие осложнений; D2 - линейная дискриминантная функция, моделирующая наличие осложнений (кровопотеря более 500 мл и/или возникновение свища); x1-x6 - значения признаков, включенных в модель.
При получении двух значений функций D1 и D2 производят их сравнение, и в случае получения большего значения у функции D2 делают вывод о высокой вероятности осложнений, в случае получения большего числа в функции D1 делают вывод о высокой вероятности отсутствия осложнений.
Итоговая классификация наблюдений на основании полученных дискриминантных функций представлена в таблице 3.
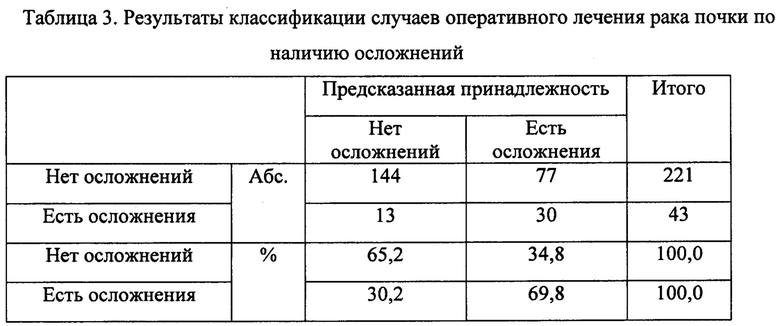
Чувствительность данной модели в плане предсказания осложнений составила 69,8%, специфичность модели составила 65,2%. Общая точность модели - 65,9%.
Для сравнения, для аналогичной дискриминантной модели с использованием в качестве предиктора индекса RENAL чувствительность составила 72,1%, специфичность - 53,2%, общая точность - 56,3%; для модели с использованием индекса PADOVA - чувствительность 67,4%, специфичность - 66,5%, общая точность - 66,7%. Модель с включением С-индекса показывает чувствительность 72,1%, при этом отмечена самая низкая специфичность - 46,6%, общая точность модели с использованием С-индекса составила 50,8%. Таким образом, прогностическая точность модели с использованием набора предикторов осложнений сопоставима с моделью с использованием индекса PADOVA, а по специфичности и общей точности превосходит R.E.N.A.L. и С-индекс (фиг. 1).
Для реализации заявляемого способа всем пациентам перед оперативным лечением выполняют лучевую диагностику, например, КТ, микро КТ, МРТ, МСКТ. По полученным данным сроят 3D-модель патологического очага. Построение 3D-модели может быть осуществлено с использованием любых известных из уровня техники программно-реализуемых средств, обеспечивающих адекватную визуализацию анатомических структур, оцениваемых по предложенной шкале (максимальный размер опухоли, расстояние до мочеточника и\или ЧЛС, количество артерий, питающих опухоль, расстояние до магистральных сосудов, диаметр сосудов (артерий), питающих опухоль, объем опухоли (voxel)).
В качестве ПО может быть использована, например, программа Amira версии 5.4.5. (https://amira.software.informer.com/5.6/). В случае необходимости корректировки полученной 3D-модели - она может быть осуществлена, например, с помощью программного обеспечения Amira (VisageImaging).
Для построения 3D модели в программе Amira полученные данные (изображения) с помощью КТ, микро КТ, МРТ, 3D микроскопии и другими методами, загружают в программу Amira, производят фильтрацию (удаление артефактов) и предварительную обработку изображений, формируют 3D-изображение из полученных данных. На полученной модели выделяют анатомические структуры, которые измеряют и анализируют, визуализируют их пространственное взаимоотношение.
3D-моделирование позволяет без искажений эффективно совместить на одном интегральном изображении все четыре фазы визуализации (контрастирования): 1 - нативное исследование, 2 - артериальную фазу, 3 - паренхиматозную, 4 - экскреторную, что дает исчерпывающую информацию об анатомических особенностях пораженной опухолевым процессом почки, такие как количество сосудов, питающих опухоль, их диаметр, соотношение опухоли и ЧЛС и т.д.
Оценку риска/вероятности интра - и ранних послеоперационных осложнений при органосохраняющих операциях при опухолях паренхимы почек производят по указанным выше формулам с использованием измеренных параметров (см. Таблицу 1).
Ниже представлены примеры реализации заявляемого изобретения.
Пример 1. Пациент А., 47 лет.
Анамнез: случайно выявленное образование при ультразвуковом исследовании. По данным МСКТ выявлена опухоль правой почки размером до 50 мм. На основании полученных данных МСКТ выполнено 3D моделирование (фиг. 2).
В качестве предоперационного планирования выполнен расчет вероятности осложнений при органосохраняющем пособии.
По данным 3D моделирования у пациента выявлены:
одна артерия, питающая опухоль (х1 = 1 балл);
объем опухоли составил 63000 voxel (х2 = 3 балла);
максимальный размер опухоли составил 52.31 мм (х3 = 52.31);
диаметр артерии, питающей опухоль, составил 2.17 мм (x4 = 2.17),
минимальное расстояние от ЧЛС или мочеточника до опухоли составило 1.4 мм (x5 = 1.4);
минимальное расстояние от опухоли до магистральных сосудов (почечная артерия или сегментарные артерии первого порядка) составило 1.37 мм (х6 = 1.37).
Далее по формулам (1) и (2) были рассчитаны значения линейной дискриминантной функции D1 и D2. Значение D1 составило 4.71559, значение D2 составило 5.91137.
D1 = -9,501 + 1,663x1 - 2,212x3 + 0,310x52.31 + 1,005x2.17 + 0,437x1.4 + 0,132x1.37 = 4.71559
D2 = -9,915 + 2,734x1 - 1,663x3 + 0,296x52.31 + 0,890x2.17 + 0,336x1.4 + 0,143x1.37 = 5.91137
Полученное значение D2 превысило значение D1, у пациента по данным произведенных расчетов перед операцией выявлен высокий риск вероятности осложнений.
Пациенту была выполнена лапароскопическая энуклеаация опухоли почки. В раннем послеоперационном периоде (через 4 часа после операции возникло кровотечение из зоны операции, что потребовало нефрэктомии).
Таким образом, заявляемый способ показал свою состоятельность и возможность использования в практической работе.
Пример 2. Пациент Б., 65 лет.
Анамнез: случайно выявленное образование при ультразвуковом исследовании. По данным МСКТ выявлена опухоль правой почки размером до 60 мм. На основании полученных данных МСКТ выполнено 3D моделирование. В качестве предоперационного планирования выполнен расчет вероятности осложнений при органосохраняющем пособии.
По данным 3D моделирования у пациента выявлены:
две артерии, питающие опухоль (х1 =1 балл);
объем опухоли составил 61200 voxel (х2 = 3 балла);
максимальный размер опухоли составил 65 мм (x3 = 65);
наибольший диаметр артерии, питающей опухоль, составил 2.0 мм (x4 = 2.0) (при наличии более одной артерии измеряют диаметр большей артерии);
минимальное расстояние от ЧЛС до опухоли составило 1 мм (x5 = 1),
минимальное расстояние от опухоли до магистральных сосудов (почечная артерия или сегментарные артерии первого порядка) составило 20 мм (х6 = 20).
Далее по формулам (1) и (2) были рассчитаны значения линейной дискриминантной функции D1 и D2. Значение D1 составило 10.763, значение D2 составило 12.046.
Полученное значение D2 превысило значение D1, у пациента по данным произведенных расчетов перед операцией выявлен высокий риск вероятности осложнений.
Пациенту была выполнена лапароскопическая энуклеаация опухоли почки. В раннем послеоперационном периоде (через 1 час после операции) по дренажу начала выделяться моча (образовался мочевой свищ).
Пример 3. Пациент X., 55 лет.
Анамнез: случайно выявленное образование при ультразвуковом исследовании. По данным МСКТ выявлена опухоль левой почки размером до 30 мм. На основании полученных данных МСКТ выполнено 3D моделирование. В качестве предоперационного планирования выполнен расчет вероятности осложнений при органосохраняющем пособии.
По данным 3D моделирования у пациента выявлены:
артерии, питающие опухоль, не определяются (х1 = 0 баллов);
объем опухоли составил 35230 (x2 = 1 балл);
максимальный размер опухоли составил 30 мм (х3 = 30);
диаметр артерии, питающей опухоль - артерии не обнаружены (x4 = 0);
минимальное расстояние от ЧЛС до опухоли составило 35 мм (x5 = 35),
минимальное расстояние от опухоли до магистральных сосудов (почечная артерия или сегментарные артерии первого порядка) составило 45 мм (х6 = 45).
Далее по формулам (1) и (2) были рассчитаны значения линейной дискриминантной функции D1 и D2. Значение D1 составило 18.822, значение D2 составило 15.497.
Полученное значение D1 превысило значение D2, у пациента по данным произведенных расчетов перед операцией выявлен низкий риск вероятности осложнений.
Послеоперационный период протекал без осложнений.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПРОГНОЗИРОВАНИЯ ОБЪЕМА ИНТРАОПЕРАЦИОННОЙ КРОВОПОТЕРИ ПРИ ОРГАНОСОХРАНЯЮЩИХ ОПЕРАЦИЯХ ПРИ ОПУХОЛЯХ ПАРЕНХИМЫ ПОЧЕК | 2019 |
|
RU2698546C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ОПТИМАЛЬНОГО ВРЕМЕНИ ТЕПЛОВОЙ ИШЕМИИ ПРИ ОРГАНОСОХРАНЯЮЩИХ ОПЕРАЦИЯХ ПРИ ОПУХОЛЯХ ПАРЕНХИМЫ ПОЧЕК | 2019 |
|
RU2707062C1 |
| СПОСОБ ОЦЕНКИ ВЕРОЯТНОСТИ НАЛИЧИЯ ТЯЖИСТОЙ ПАРАНЕФРАЛЬНОЙ ЖИРОВОЙ КЛЕТЧАТКИ, СПАЯННОЙ С КАПСУЛОЙ ПОЧКИ, ПРИ ПЛАНИРОВАНИИ ОРГАНОСОХРАНЯЮЩИХ ОПЕРАЦИЙ НА ПОЧКЕ | 2020 |
|
RU2736908C1 |
| СИМУЛЯТОР ДЛЯ ОСВОЕНИЯ НАВЫКОВ ВЫПОЛНЕНИЯ ОПЕРАЦИЙ НА ПОЧКЕ | 2018 |
|
RU2691524C1 |
| Способ оценки риска злокачественности опухоли почки | 2022 |
|
RU2804234C1 |
| СПОСОБ СКРИНИНГОВОГО ОПРЕДЕЛЕНИЯ ВЕРОЯТНОСТИ НАЛИЧИЯ РАКА ПОЧКИ | 2023 |
|
RU2816798C1 |
| Способ лапароскопической резекции образования почки с суперселективной баллонной эмболизацией почечной артерии | 2017 |
|
RU2651055C1 |
| СПОСОБ ОПЕРАТИВНОГО ЛЕЧЕНИЯ БОЛЬНЫХ ОПУХОЛЬЮ ПОЧКИ | 2012 |
|
RU2492816C1 |
| СПОСОБ ОРГАНОСОХРАНЯЮЩЕГО ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ БОЛЬНЫХ ЛОКАЛЬНЫМ РАКОМ ПОЧКИ | 2015 |
|
RU2584090C1 |
| СПОСОБ ОТБОРА ПАЦИЕНТОВ С РЕЦИДИВОМ РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ ПОСЛЕ ПРОВЕДЕНИЯ НИЗКОДОЗНОЙ БРАХИТЕРАПИИ ДЛЯ ЛЕЧЕНИЯ ТРАНСРЕКТАЛЬНЫМ ВЫСОКОИНТЕНСИВНЫМ ФОКУСИРОВАННЫМ УЛЬТРАЗВУКОМ | 2019 |
|
RU2735656C1 |

Изобретение относится к области медицины, а именно к урологии, онкоурологии, и может быть использовано для предоперационного планирования и оценки интра- и ранних послеоперационных осложнений. Диагностическими признаками являются количество артерий, питающих опухоль (х1), объем опухоли (х2), максимальный размер опухоли (x3), наибольший диаметр артерий, питающих опухоль (x4), расстояние от ближайшего края опухоли до мочеточника или ЧЛС (x5), расстояние от края опухоли до магистральных сосудов (х6). По заявленным формулам определяют D1 и D2. Сравнивают рассчитанные значения D1 и D2. При этом в случае получения большего значения у функции D2 делают вывод о высокой вероятности осложнений. В случае получения большего числа в функции D1 делают вывод о высокой вероятности отсутствия осложнений. Способ обеспечивает возможность получения более объективной прогнозной оценки посредством использования комплекса диагностических признаков, измеренных на 3D-модели патологического очага, полученной по итогам лучевых методов исследования. 2 ил., 3 табл., 3 пр.
Способ прогнозирования вероятности интра- и ранних послеоперационных осложнений при органосохраняющих операциях при опухолях паренхимы почек, включающий проведение исследования опухоли паренхимы почек лучевыми методами с построением 3D-модели патологического очага, определение диагностических признаков, в качестве которых используют:
количество артерий, питающих опухоль (х1), которое измеряют в баллах, при этом отсутствие артерий определяют как 0 баллов, наличие от 1 до 3 артерий включительно - 1 балл, более 3 - 2 балла;
объем опухоли (х2), который измеряют в баллах, при этом опухоли объемом до 20000 voxel присваивают 0 баллов, 20000-40000 voxel - 1 балл, 40001-60000 voxel - 2 балла, более 60000 voxel - 3 балла;
максимальный размер опухоли (х3), который измеряют в мм;
наибольший диаметр артерий, питающих опухоль (х4), который измеряют в мм;
расстояние от ближайшего края опухоли до мочеточника или ЧЛС (x5), которое измеряют в мм;
расстояние от края опухоли до магистральных сосудов (х6), которое измеряют в мм,
по полученным значениям рассчитывают значения функций D1 и D2:
D1 = -9,501 + 1,663х1 - 2,212x2 + 0,310х3 + 1,005х4 + 0,437х5 + 0,132х6,
D2 = -9,915 + 2,734x1 - 1,663х2 + 0,296х3 + 0,890x4 + 0,336х5 + 0,143х6,
где функция D1 характеризует отсутствие осложнений, D2 - наличие осложнений, сравнивают рассчитанные значения D1 и D2, при этом в случае получения большего значения у функции D2 делают вывод о высокой вероятности осложнений, в случае получения большего числа в функции D1 делают вывод о высокой вероятности отсутствия осложнений.
| KUTIKOV A | |||
| The R.E.N.A.L | |||
| Nephrometry score: A comprehensive standardized system for quantitating renal tumor size, location and depth | |||
| J | |||
| Urol | |||
| Колосоуборка | 1923 |
|
SU2009A1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ПОСЛЕОПЕРАЦИОННЫХ ОСЛОЖНЕНИЙ | 1994 |
|
RU2090894C1 |
| СПОСОБ КОМБИНИРОВАННОЙ МАЛОИНВАЗИВНОЙ НЕФРОЛИТОТОМИИ | 2009 |
|
RU2412670C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РАННИХ ГНОЙНО-СЕПТИЧЕСКИХ ПОСЛЕОПЕРАЦИОННЫХ ОСЛОЖНЕНИЙ У БОЛЬНЫХ ПОЧЕЧНО-КЛЕТОЧНЫМ РАКОМ | 2004 |
|
RU2279082C2 |
| WO 2015028612 A1, 05.03.2015 | |||
| ДУБРОВИН В.Н | |||
| Использование технологии дополненной реальности на основе | |||
Авторы
Даты
2019-12-23—Публикация
2019-03-29—Подача