Область техники
Изобретение относится области биохимической диагностики, в частности, к способам оценки концентрации антигенов при проведении анализов сыворотки крови, мочи, пищевых продуктов, образцов окружающей среды и других жидкостей с помощью иммунохроматографии.
Уровень техники
В настоящее время метод иммунохроматографии (ИХ), который в английской литературе часто называется Lateral Flow test, широко используется в стационарных медицинских и других лабораториях, а также в переносных устройствах во внелабораторных условиях для быстрого и высокочувствительного обнаружения и определения содержания в исследуемых образцах широкого спектра соединений, представляющих практический интерес, таких как, например, гормоны, наркотики и их метаболиты, антибиотики и др. (Lateral Flow Immunoassay. Eds. Wong R.C. Т. H. Y. - New York: Humana Press, 2009; M. Sajid, A.-N. Kawde, M. Daud. Designs, formats and applications of lateral flow assay: A literature review. Journal of Saudi Chemical Society 2015, v. 19, pp. 689-7056 https://www.creative-diagnostics.com/Immunochromatography-guide. htm.).
Принцип ИХ основан на способности анализируемого соединения (аналита) перемещаться вместе с потоком жидкости под действием капиллярных сил вдоль иммунохроматографической мембраны, обычно изготовляемой в виде узкой полоски (ИХ-полоска). ИХ-полоска имеет одну или несколько зон захвата иммунных комплексов и контрольную зону захвата, которые представляют собой полосы, расположенные поперек продольной оси полоски. Полосы имеют ширину от долей миллиметра до миллиметра и содержат аффинные вещества (антитела, антигены или конъюгаты низкомолекулярных гаптенов), способные специфически связываться с аналитом. Возле места нанесения анализируемого образца к ИХ-полоске прикреплена реагентная подушечка (обычно из стекловолокна), содержащая конъюгат антител с каким-либо маркером, позволяющим в дальнейшем определять аналит визуально или с помощью прибора. Схема ИХ-полоски для выявления антител по сэндвич методу показана на Фиг. 1.
Известно, что ИХ тесты наиболее широко используют для визуальной оценки интенсивности окрашивания полосы захвата после прохождения по ИХ-полоске исследуемого образца (http://faktor.ru/o_produktsii/iha). Множество отечественных и зарубежных фирм предлагают ИХ-полоски для проведения десятков различных клинико-диагностических тестов у людей, животных, и в окружающей среде (https://en.wikipedia.org/wiki/Lateral_low_test). Известно также, что интенсивность окрашивания полосы захвата может измеряться с помощью приборов (Quantitative detection of analytes on immunochtomatographic strips, 1996, US patent 5569608, A.E Урусов, А.В. Жердев, Т.А.Старовойтова, Ю.Ю. Венгеров, Б.Б. Дзантиев. Приборная регистрация иммунохроматографических тестов. Клиническая лабораторная диагностика, 2016, Том 51, №3. Стр. 173-179). Некоторые фирмы выпускают специализированные приборы для регистрации результатов ИХ анализа (www.synteco.ru/produktsiya/narkologiya, http://www.dirui-rus.com/katalog produktsii /analizatoryi mochi/h_100). При приборной регистрации ИХ тесты могут применяться для полуколичественных определений содержания аналита с построением калибровочных кривых, которые позволяют рассчитывать концентрацию аналита в образце по интенсивности окраски зоны захвата ИХ-полоски.
Одним из направлений в развитии методов ИХ является применение тест-полосок для одновременного определения концентрации нескольких аналитов в исследуемом образце. С этой целью ИХ-полоску изготавливают таким образом, что она содержит несколько зон захвата с аффинными реагентами, специфичными к разным аналитам (Single or multiple analyte semi quantitative/ quantitative rapid diagnostic flow test system for large molecules. 2001, R. Buck, US patent 6,258,548. Multi-analyte assay. 2007, Japan patent JP 5214723 B2). Другим направлением развития методов ИХ является повышение чувствительности. С этой целью для детекции связывания аналитов с аффинными реагентами применяют маркеры, обладающие флуоресценцией при облучении видимым светом (Method and test strip for determining an analyte. 2002, Jorg Bausback US patent 6,335,205 B1, Lateral flow quantitative assay method and strip and laser-induced fluorescence detection device therefor, Kie-Bong Nahm, et. al. 2002, US patent 7371582 B2).
Из уровня техники известно также проведение количественных исследований с помощью ИХ полосок посредством измерения скорости накопления окраски в процессе прохождения аналита с конъюгатом вдоль полоски (фирма Scienion). Однако достоверность и точность результатов, полученных с использованием данного метода, вызывает сомнения, так как известно, что вязкость и температура, которые влияют на скорость окрашивания тестовой полосы, не учитываются в данном методе.
Вместе с тем важнейшим показателем ИХ тестов является их точность. При прохождении по ИХ-полоске исследуемого образца только часть аналита взаимодействует с аффинными реагентами зоны захвата. Другая часть образца с аналитом продвигается дальше по полоске, достигая контрольной полосы, или вообще уходя во всасывающую подушку; при этом, количество аналита, связавшегося с зоной захвата, зависит от концентрации его в исследуемом образце, а также от вязкости образца и от температуры, при которой проходит реакция (https://dspace.lboro.ac.uk/dspace-jspui/bitstream/2134/12905/1/Thesis-2004-Li.pdf).
Известно, что одним из основных направлений при разработке современных методов ИХ является разработка способов повышения точности определения связавшегося аналита (Truus Posthuma-Trumpie, Jakob Korf Lateral Flow Assay: Its Strengths, Weaknesses, Opportunities and Threats. A Literature Survey, Analytical and Bioanalytical Chemistry, 2008, v. 393(2), pp. 569-582. U. Babu, F. Aberl, M. Scheibenzuber, R. Sambursky, R. VanDine, J. Sambursky. Method to increase specificity and/or accuracy of lateral flow immunoassays. 2016, US patent 9.250,236 B2, Dongfang Li, 2004, Development of immunoassay screening methods using long wavelength fluorescence Doctoral Thesis Loughborough University). Для повышения точности анализа некоторые фирмы предлагают специальные приемы и устройства, которые позволяют уменьшить влияние вязкости исследуемого образца (Viscosity independent paper microfluidic inhibition. W. Guo, J. Hansson, and W. van der Wijngaart. Proceedings of The 20th International Conference on Miniaturized Systems for Chemistry and Life Sciences, MicroTAS 2016 (pp. 13-14). а также проводить ИХ при постоянной поддерживаемой температуре (https://atl-ltd.ru/wp-content/uploads/2015/06/heatsensor-duo.png). Однако эти приемы усложняют и удорожают проведение анализа, что ограничивает области применения способа.
Для повышения точности способа ИХ необходимо выявить весь аналит, который нанесен на полоску из исследуемого образца. В связи с этим наиболее близкими решениями к предлагаемому изобретению являются методы, в которых описано применение ИХ-полосок, содержащих несколько зон захвата с одними и теми же аффинными реагентами. Такой способ проведения ИХ анализа описан в нескольких патентах (Method for the determination of analyte concentration if a lateral flow sandwich immunoassay exhibiting high-dose Hai-Hang Kuo, 2001, US patent 6,183,972 B1. Device and method for obtaining clinically significant analyte ratios Hai-Hang Kuo 2002, US patent 6,436,721 B1). Авторы запатентованных решений предлагают использовать такие полоски для расширения динамического диапазона измеряемых концентраций аналита. Часть аналита, не связавшаяся с первой полосой захвата, движется по ИХ-полоске дальше и реагирует со следующей зоной захвата. Авторы предлагаемых патентов предлагают использовать каждую зону захвата для определения концентрации аналита в одном диапазоне, но не предлагают использовать данный подход для повышения точности измерений. К тому же две-три дополнительных полосы не позволяют построить кривую истощения аналита при прохождении по ИХ-полоске, не дают полной уверенности, что весь аналит связался с зонами захвата. Кроме того, интенсивность окрашивания каждой зоны захвата по-прежнему будет зависеть от скорости движения образца по ИХ-полоске.
Сущность изобретения
Технической проблемой является отсутствие решений, позволяющих с высокой точностью определять концентрацию меченного маркером аналита, в образце с использованием ИХ анализа.
Технический результат достигается тем, что для анализа используют ИХ-полоску с зоной захвата, сформированной в виде протяженной непрерывной или прерывистой полосы, содержащей аффинные молекулы к аналиту, которые обеспечивают его истощение по ходу движения вдоль полоски под действием капиллярных сил. Регистрацию результатов анализа производят путем измерения концентрации маркера по интегральной интенсивности окрашивания зоны захвата во время или после прохождения образца через эту зону, при этом, полученная величина интенсивности окрашивания, а также характер изменения интенсивности окрашивания внутри зоны захвата характеризуют концентрацию и интегральное содержание исследуемого аналита в образце.
Техническим результатом данного изобретения является повышение точности определения концентрации аналита в исследуемом образце за время, требуемое для прохождения образца вдоль зоны захвата ИХ-полоски. По мере продвижения образца по зоне захвата ИХ-полоски происходит истощение аналита аффинными реагентами и интенсивность окрашивания зоны захвата (зон захвата), изготовленной в виде протяженного объекта (продольной полосы или набора индивидуальных пятен, идущих вдоль продольной оси ИХ-полоски), уменьшается. Определение интегральной интенсивности окрашивания зоны захвата (зон захвата), а также регистрация изменений интенсивности окрашивания по мере прохождения образца вдоль ИХ-полоски, позволяет в значительной мере уменьшить влияние на результаты количественного анализа аналита (аналитов) в образце вязкости образца и окружающей температуры и повысить точность анализа. Дополнительно с помощью той же ИХ-полоски можно измерять интенсивность окрашивания зон захвата для контрольного образца, содержащего известное количество аналита сравнения.
Определение концентрации аналита в образце достигается путем измерений интенсивности окрашивания зон захвата ИХ-полоски и последующего анализа полученных данных, в случае, когда зоны захвата представлены в виде непрерывной полосы определенной ширины или в виде нескольких пятен определенного диаметра, содержащих аффинные реагенты и расположенных вдоль продольной оси ИХ-полоски. При этом с помощью прибора регистрируется (А) интенсивность окрашивания каждой зоны захвата после прохождения образца вдоль ИХ-полоски, и (или) (Б) скорость изменения интенсивности окраски зон захвата по мере прохождения образца вдоль ИХ-полоски.
Краткое описание чертежей
На фиг. 1. представлена схема стандартной ИХ-полоски при проведении анализа по сэндвич методу, где:
1. Зона нанесения образца (подушка)
2. Зона, содержащая конъюгат (подушка)
3. Тестовая зона
4. Контрольная зона
5. Всасывающая подушка
6. Начало анализа (нанесение образца)
7. Продвижение комплексов коньюгата с антигеном по полоске
8. Конечная стадия анализа. Не связавшиеся реагенты перешли во всасывающую подушку.
9. Антиген
10. Конъюгат (антитела к антигену, содержащие метку)
11. Комплексы антиген-конъюгат
12. Антитела специфические
13. Антитела вторичные
14. Комплексы конъюгата с вторичными антителами
15. Комплексы вторичное антитело-конъюгат-антиген
На фиг. 2 представлены изображения зон захвата десяти ИХ-полосок, изготовленных в виде пятен с одинаковой концентрацией аффинных реагентов (антитела к тотальному IgE) и расположенных вдоль продольной оси ИХ-полоски. Цифры под изображениями (от 2 до 1000 ед/мл) показывают концентрацию аналита в исследуемом образце. Маркер - флуорохром Су5, изображения инвертированы. Перемещение образца слева направо.
На фиг. 3 показана интенсивность флуоресценции индивидуальных пятен ИХ-полоски после анализа изображений, показанных на фиг. 2. Каждая кривая соответствует одной концентрации аналита (IgE). Концентрации аналита указаны справа от графика. Седьмое пятно отличается от фона только при самой большой концентрации IgE (1000 ед.)
На фиг. 4 схематически показаны варианты расположения зон (зоны) захвата на ИХ-полоске. 16 - зона захвата представляет собой сплошную полосу, содержащую антитела к аналиту; 17 - зоны захвата представляют собой индивидуальные пятна, содержащие одинаковые концентрации аффинных реагентов; 18 - зоны захвата представляют собой индивидуальные пятна, содержащие увеличивающуюся концентрацию аффинных реагентов.
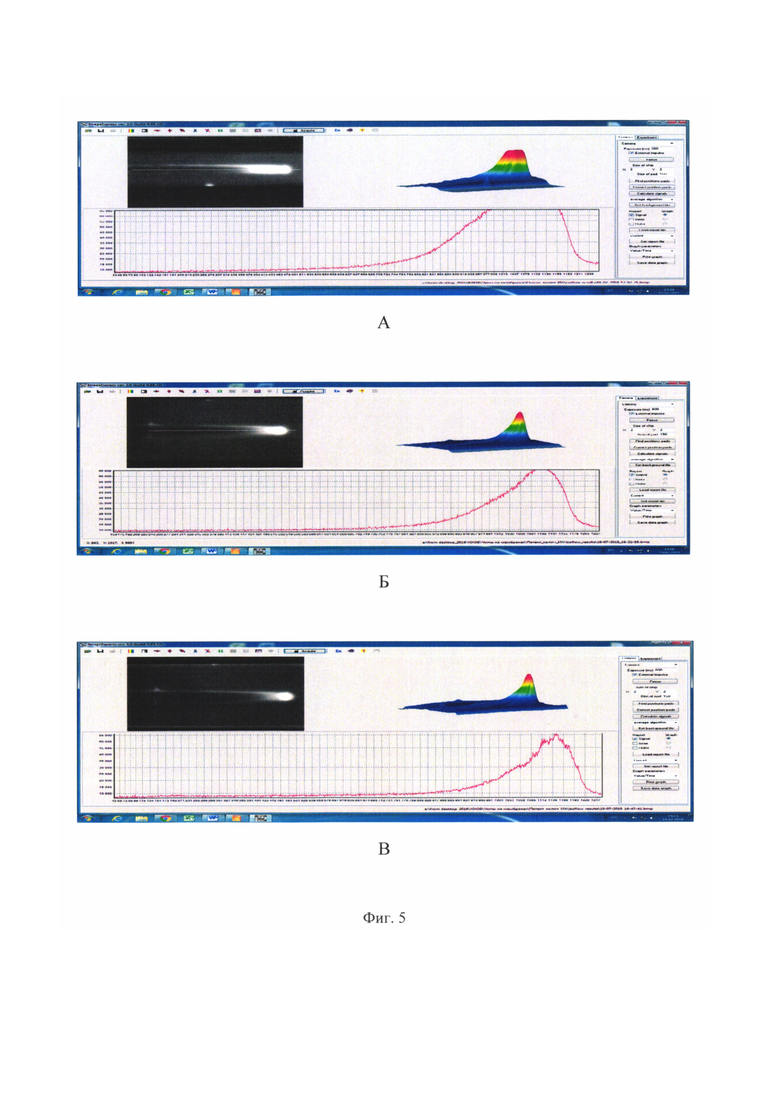
На фиг. 5 представлены изображения ИХ-полосок при изготовлении зоны захвата в виде непрерывной полосы в свете флуоресценции маркера после проведения иммунохроматографии с образцами (представляющими собой сыворотки крови), содержащими различное количество аналита (аналит - тотальный IgE). В качестве зонда выбран anti-IgE в концентрации 1 мг/мл, нанесенный в виде полосы, идущей вдоль ИХ-полоски. Маркер - краситель Су5. Вдоль каждого изображения нанесена линия и под изображениями показано изменение интенсивности флуоресценции красителя Су5 вдоль этой линии.
А - Концентрация IgE - 50 мг/мл.
Б - Концентрация IgE - 25 мг/мл.
В - Концентрация IgE - 12,5 мг/мл.
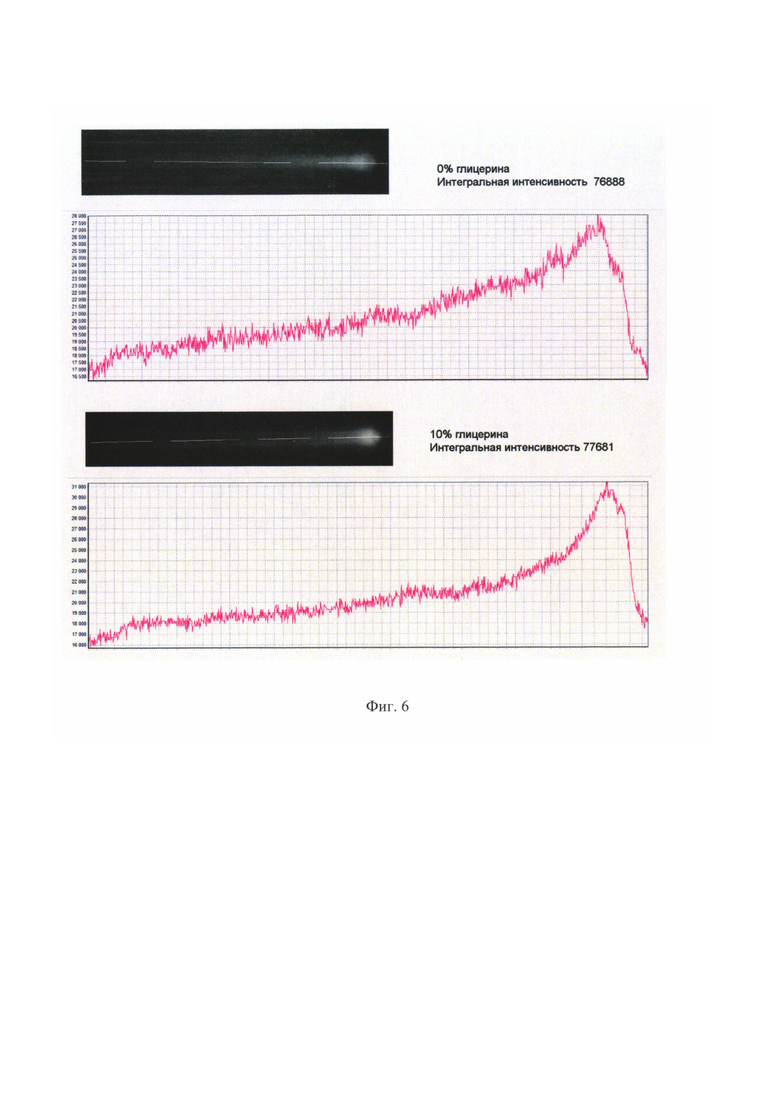
На фиг. 6 показано изображение зон захвата ИХ-полосок после анализа образцов с разной вязкостью. Вдоль каждого изображения нанесена линия и под изображениями показано изменение интенсивности флуоресценции красителя Су5 вдоль линии.
А. к образцу добавлено 10% бычьего сывороточного альбумина (БСА) по объему (образец с низкой вязкостью).
Б. к образцу добавлено 10% по объему глицерина (образец с повышенной вязкостью).
Осуществление изобретения
Ниже представлено более подробное описание заявляемого изобретения. Настоящее изобретение может подвергаться различным изменениям и модификациям, понятным специалисту на основе прочтения данного описания. Такие изменения не ограничивают объем притязаний. Например, могут изменяться маркеры для визуализации, и прибор для регистрации результатов анализа, программа анализа изображения, зонды, нанесенные на ИХ-полоску и т.д.
В качестве ИХ-полосок может выступать мембрана, в которой имеются зоны захвата со специфическими аффинными реагентами к исследуемому аналиту, и по которой исследуемый образец с аналитом может двигаться за счет капиллярных сил. Наиболее широко для изготовления ИХ-полосок используются нитроцеллюлозные мембраны. В качестве мембраны также может выступать политетрафторэтилен, нейлон и т.д. Размер пор определяет скорость диффузии образца по мембране, что, в свою очередь, детерминирует время проведения анализа, поскольку при более крупных порах образец движется по ИХ-полоске быстрее.
Зоны захвата ИХ-полосок могут содержать одинаковую или разную концентрацию аффинных реагентов, причем, в зависимости от концентрации аффинных реагентов меняется количество связавшегося с ними аналита. В качестве аффинных реагентов могут выступать антигены или антитела к исследуемым аналитам.
При проведении анализа по сэндвич-методу исследуемый образец наносят на начало ИХ-полоски (аналогично исследованию с помощью стандартной полоски, показанной на Фиг. 1), далее образец движется вдоль ИХ-полоски, и нанесенный на полоску аналит образца, связывается с конъюгатом, содержащим какой-либо маркер и находящимся зоне 2, образуя комплекс аналит-конъюгат. Маркером может служить коллоидное золото, краситель, флуорохром или другое вещество, концентрация которого может быть определена с помощью соответствующего прибора-анализатора. Этот комплекс движется вдоль ИХ-полоски и взаимодействует с аффинными реагентами, иммобилизованными в зоне или зонах захвата (расположенных в виде индивидуальных пятен или непрерывной полосы), в результате чего, в зависимости от применяемого маркера, эти зоны окрашиваются или начинают флуоресцировать.
В качестве исследуемых образцов могут выступать любые биологические жидкости, содержащие вещества (аналиты), к которым имеются специфические аффинные вещества, иммобилизуемые в зонах захвата. Регистрацию интенсивности окрашивания зон захвата осуществляют с помощью прибора в зависимости от типа применяемого маркера. Например, при использовании маркера в виде коллоидного золота используют рефлектометр, регистрирующий интенсивность отражения, при использовании флуоресцирующих маркеров используют флуориметр, измеряющий интенсивность флуоресценции участков ИХ-полоски.
Ниже представлено описание примеров реализации изобретения, демонстрирующее результаты анализа 10 образцов с зонами захвата, изготовленными в виде индивидуальных пятен с одинаковым содержанием аффинного реагента на нитроцеллюлозной ИХ-полоске. На полоску нанесены два ряда по 7 пятен, содержащих одинаковое количество аффинного реагента (anti-IgE в концентрации 1 мг/мл). Образцы содержат различные концентрации аналита (см. фиг. 2). При прохождении образца через первую зону захвата (первую тестовую зону) часть аналита, содержащего в качестве маркера флуоресцирующий краситель Су5, связывается с реагентами, иммобилизованными в этой зоне, при этом количество связавшегося аналита зависит от его концентрации в образце, а также от скорости движения образца по ИХ-полоске. Не связавшийся с первым пятном аналит продолжает движение вдоль ИХ-полоски и вступает во взаимодействие с аффинными реагентами, находящимися во втором пятне и т.д. Видно, что пятна, расположенные ближе к началу полоски, окрашены сильнее; по мере продвижения образца вдоль полоски происходит истощение образца, в результате чего следующие пятна окрашены слабее. На Фиг. 3 показано распределение интенсивности флуоресценции пятен. Как видно по данным, представленным на фигуре 3, даже при высокой концентрации аналита в исследуемом образце последнее пятно дает сигнал, практически совпадающий с фоном, что свидетельствует о высокой степени истощения аналита по мере продвижения его вдоль ИХ-полоски. Количество пятен и содержание в них аффинного вещества подбирают таким образом, чтобы интенсивность окраски последнего пятна не отличалась от окраски фона, то есть, чтобы после прохождения исследуемым образцом всех зон захвата в нанесенном на полоску образце уже не осталось аналита, поскольку практически весь аналит связался с реагентами зон захвата. Обычно, при расположении вдоль ИХ полоски 7-ми пятен последнее пятно уже не окрашено, что свидетельствует о том, что по мере продвижения образца по ИХ полоске происходит его полное связывание с реагентами зон захвата. Интенсивность окрашивания зон захвата измеряют по мере прохождения образца по ИХ-полоске. В нашем случае измерение проводили с помощью прибора, аналогичного описанному ранее (Yu. Lysov, V. Barsky, D. Urasov, R. Urasov, A. Cherepanov, D. Mamaev, Y. Yegorov, A. Chudinov, S. Surzhikov, A. Rubina, O. Smokdovskaya, A. Zasedatelev. Biomedical Optics Express, Vol.8, No. 11, Nov 2017, 4799) и программы, например, Imageware (D. Gryadunov, E. Dementieva, V. Mikhailovich, T. Nasedkina, A. Rubina, E. Savvateeva, E. Fesenko, A.Chudinov, D. Zimenkov, A. Kolchinsky, and A. Zasedatelev, "Gel-based microarrays in clinical diagnostics in Russia", Expert Rev. Mol. Diagn. 11(8), 839-853 (2011).
На Фиг. 3 показана величина сигналов индивидуальных пятен ИХ-полосок после проведения анализов образцов с разной концентрацией аналита. Даже при высокой концентрации аналита в исследуемом образце последнее пятно дает сигнал, практически совпадающий с фоном, что свидетельствует о высокой степени истощения аналита по мере продвижения его вдоль ИХ-полоски.
При воспроизводимых условиях постановки анализа для каждого образца интенсивность окрашивания зоны захвата пропорциональна концентрации аналита в исследуемом образце. В случае одинаковой концентрации проявляющих веществ в пятнах с аффинными реагентами, интенсивность их окрашивания по мере удаления от старта будет закономерно уменьшаться, и содержание аналита в исследуемом образце можно определять разными способами.
1. Как и при стандартном анализе ИХ-полосок, интенсивность окрашивания любого пятна после прохождения образца отражает исходную концентрацию аналита в образце для данной вязкости образца и данной температуре. Именно этот способ регистрации результатов иммунохроматографического анализа применяется при использовании стандартных ИХ-полосок. Регистрация интенсивности окрашивания всех пятен дает более точную информацию о концентрации аналита в исследуемом образце.
2. Скорость нарастания интенсивности окрашивания пятна во времени также отражает концентрацию аналита в образце. В этом случае скорость нарастания сигнала кроме величины исходной концентрации аналита зависит также от вязкости образца и от температуры.
3. Разница во времени появления достоверного сигнала между соседними пятнами характеризует вязкость образца и температуру проведения анализа.
4. Сумма интенсивностей окрашивания всех пятен (всех зон захвата) является мерой концентрации аналита в исследуемом образце независимо от вязкости образца и от температуры.
Зоны захвата ИХ-полоски могут быть изготовлены по-разному. На фиг. 4 показано изображение ИХ-полоски, в которой зона захвата представляет собой полосу определенной ширины, содержащую одинаковую концентрацию аффинных реагентов вдоль полосы. Зоны захвата могут быть представлены в виде индивидуальных пятен, в которых концентрация аффинных реагентов остается постоянной или постепенно увеличивается.
На Фиг. 5 показаны примеры определения концентрации IgE в сыворотках крови, содержащих различные концентрации IgE. Для определения была изготовлена полоска из нитроцеллюллозы NC-150 фирмы Sartorius размером 5×50 мм. На этой полоске зона захвата была изготовлена в виде одной продольной полосы, содержащей аллерген тотальный Anti-IgE в концентрации 1 мг/мл. Длина полосы составляла 3 мм, ширина -около 0,8 мм. С одной стороны полоски прикрепляли несколько слоев фильтровальной бумаги для впитывания нанесенного на полоску раствора.
Сыворотки, содержащие IgE, выдерживали в растворе конъюгата, содержащего в качестве маркера Су5 в течение 2-х мин, затем полученную смесь (различные белки сыворотки, связавшиеся с окрашенным конъюгатом IgE, и чистый конъюгат) наносили на край ИХ полоски, противоположный тому, к которому была прикреплена фильтровальная бумага, и позволяли свободно диффундировать. Через 30 мин. получали изображение полоски в свете флуоресценции Су5 с помощью микрофлуориметра (Yu. Lysov, V. Barsky, D. Urasov, R. Urasov, A. Cherepanov, D. Mamaev, Y. Yegorov, A. Chudinov, S. Surzhikov, A. Rubina, O. Smokdovskaya, A. Zasedatelev. Biomedical Optics Express, Vol.8, No. 11, Nov 2017, 4799) и изображения оцифровывали.
На изображении нитроцеллюлозной полоски видно, что по мере продвижения анализируемого образца содержание маркера (Су5) в зоне захвата, содержащей anti-IgE, падает. При этом в центре полосы содержание маркера падает быстрее, чем по краям, полоса с anti-IgE после реакции имеет как-бы два «хвоста». Это явление воспроизводится при всех постановках опыта с разными концентрациями IgE в сыворотке и объясняется тем, что образец двигается одним фронтом по всей ширине полоски, и кроме того, молекулы, находящиеся в движущемся комплексе, двигаются не только вдоль нитроцеллюлозной мембраны, но и постоянно диффундируют поперек мембраны. Поэтому в центре полосы с anti-IgE происходит закономерное истощение образца с окрашенным IgE; а за счет поперечной диффузии свежих порций IgE наблюдается дополнительное окрашивание краев полосы и истощения IgE по краям полосы не наблюдается. Кроме того, наблюдается повышение интенсивности флуоресценции всей полоски, вызванное неспецифической адсорбцией компонентов диффундирующей смеси молекул, в том числе, содержащих Су5, с нитроцеллюлозой.
На этом же рисунке (фиг. 5) показано, как изменяется интенсивность флуоресценции маркера вдоль линии, проведенной по оси зоны захвата. На фиг. 5А, 5Б, 5В показано, как меняется содержание маркера вдоль оси зоны захвата при иммунохроматографии образцов с разным содержанием IgE. Видно, что по мере уменьшения IgE в образце уменьшается высота пика и скорость падения интенсивности окрашивания вдоль оси. Это результат того, что для данной концентрации anti-IgE уменьшение концентрации IgE в образце приводит к более быстрому его истощению по мере продвижения вдоль зоны захвата.
При повторном проведении ИХ определения концентрации аналита IgE в одной и той же сыворотке площади под кривой, отражающей изменение флуоресценции маркера вдоль зоны захвата, варьируют в пределах ±5%. Величины максимума сигнала и площадей под кривыми для разных разведений этой сыворотки, показаны в Таблице, в которой представлены значения площадей под кривыми, характеризующими изменение концентрации маркера (Су5) при прохождении образцов, содержащих уменьшающуюся концентрацию аналита (тотальный IgE) вдоль полосы, содержащей аффинный реагент.
По данным, представленным в Таблице, наблюдается корреляция между концентрацией аналита и измеряемыми величинами.

Следует отметить, что в данном эксперименте ИХ определение проводилось в идентичных условиях для сыворотки с одной и той же величиной вязкости. Для проверки того, как работает предлагаемый способ при анализе сывороток с разной вязкостью, мы изготовили два разведения одной той же сыворотки. В первом случае в исходную сыворотку добавили 10% по объему глицерина, во втором случае в ту же сыворотку добавили 10 по объему БСА. Таким образом, мы получили две образца с одинаковой концентрацией аналита (в данном случае анализировали аналит тотальный IgE), но с разной вязкостью. На фиг. 6 показано изменение максимальной интенсивности и формы кривой изменения интенсивности флуоресценции маркера для одной и этой сыворотки, с добавкой глицерина или буфера. Изображения ИХ-полосок после взаимодействия с аффинными реагентами в зоне захвата в свете флуоресценции маркера показаны на фиг. 6. Судя по данным, представленным на фиг. 6, как величина максимума, так и форма кривой изменения содержания маркера вдоль зоны захвата меняются при изменении вязкости сыворотки. Так, для образца, разбавленного глицерином, максимальная величина сигнала маркера составляет 31000 у.е., в то время, как для сыворотки, разбавленной буфером -28000. В то же время площадь под кривой, отражающей взаимодействие маркера с аффинными реагентами, остается постоянной. Эти данные еще раз свидетельствуют о том, что только измерение величины окрашивания зоны захвата в стандартных ИХ = полосках недостаточно для точных измерений, в то время.
При проведении исследований конкурентным методом ИХ-полоска также содержит реагентную подушку и зоны захвата (http://www.ivdtechnology.com/article/concurrent-engineering-lateral-flow-diagnostics), однако в этом случае концентрацию аффинных реагентов в зонах захвата и количество зон захвата подбирают таким образом, чтобы в первом пятне, расположенном по ходу движения образца, не было никакой окраски.
В случае нанесения на ИХ-полоску несколько различных протяженных зон захвата, содержащих аффинные реагенты к разным аналитам, такая полоска может быть использована для параллельного мультипараметрического анализа нескольких аналитов.
Для повышения точности измерений на ИХ-полоске можно расположить несколько наборов полос или пятен, содержащих аффинные реагенты, идентичные первому набору, идущих параллельно первому набору и расположенных поперек продольной оси ИХ-полоски.
Дополнительное увеличение точности определения концентрация аналита может быть достигнуто путем введения поправки на вязкость образца и температуру анализа. Такую поправку можно внести путем добавления в исследуемый образец какого-либо другого, контрольного аналита в известной концентрации. При этом на ИХ-полоске должны находиться зоны захвата с аффинными реагентами, специфичными к контрольному реагенту. При калибровке ИХ-полоски производителем в паспорте полоски должны находиться поправочные коэффициенты. Эти коэффициенты необходимо вводить, если кривая изменения яркости контрольной зоны захвата аффинными реагентами у контрольного аналита отличается от заложенной для нормальных вязкостей или температуры.
| название | год | авторы | номер документа |
|---|---|---|---|
| ТЕСТ-СИСТЕМА ДЛЯ ПОЛУКОЛИЧЕСТВЕННОГО ИММУНОХРОМАТОГРАФИЧЕСКОГО АНАЛИЗА | 2012 |
|
RU2510510C1 |
| ВЯЗКОСТЬ СРЕДЫ КАК ИНСТРУМЕНТ КОНТРОЛЯ ПРЕДЕЛА ОБНАРУЖЕНИЯ ИММУНОХРОМАТОГРАФИЧЕСКИХ ТЕСТ-СИСТЕМ | 2016 |
|
RU2645907C1 |
| СПОСОБ ВЫСОКОЧУВСТВИТЕЛЬНОГО КОНКУРЕНТНОГО ИММУНОХРОМАТОГРАФИЧЕСКОГО АНАЛИЗА | 2022 |
|
RU2789545C1 |
| ТЕСТ-ПОЛОСКА ДЛЯ ВЫСОКОЧУВСТВИТЕЛЬНОГО ИММУНОХРОМАТОГРАФИЧЕСКОГО АНАЛИЗА | 2013 |
|
RU2523393C1 |
| УНИВЕРСАЛЬНАЯ ТЕСТ-ПОЛОСКА ДЛЯ ВЫБОРОЧНОГО ОПРЕДЕЛЕНИЯ МИКОТОКСИНОВ МЕТОДОМ ИММУНОХРОМАТОГРАФИИ | 2021 |
|
RU2806175C2 |
| Тест-система для визуального полуколичественного иммунохроматографического анализа | 2018 |
|
RU2707526C1 |
| СПОСОБ СНИЖЕНИЯ ПРЕДЕЛА ОБНАРУЖЕНИЯ ИММУНОХРОМАТОГРАФИЧЕСКИХ МЕТОДОВ КОНТРОЛЯ СОДЕРЖАНИЯ НИЗКОМОЛЕКУЛЯРНЫХ СОЕДИНЕНИЙ | 2011 |
|
RU2497126C2 |
| СПОСОБ ПРОВЕДЕНИЯ ИММУНОХРОМАТОГРАФИЧЕСКОГО АНАЛИЗА С ВЫСОКОЙ СТЕПЕНЬЮ ВЫЯВЛЕНИЯ МАРКЕРА | 2015 |
|
RU2623075C1 |
| Способ проведения микроскопического анализа клеточного образца | 2023 |
|
RU2835203C1 |
| Способ проведения цитометрического анализа образца | 2023 |
|
RU2835213C1 |


Изобретение относится области биохимической диагностики, в частности к способам оценки концентрации антигенов при проведении анализов сыворотки крови, мочи, пищевых продуктов, образцов окружающей среды и других жидкостей с помощью иммунохроматографии. Описан способ определения концентрации аналита в исследуемом образце крови с помощью иммунохроматографических тест-полосок (ИХ-полосок), содержащих, по меньшей мере, одну зону захвата с, по меньшей мере, одним аффинным реагентом, включающий: нанесение на ИХ-полоску исследуемого образца; регистрацию и обработку результатов реакции при прохождении аналита через зоны захвата с их последующей интерпретацией, причем: а) используют ИХ-полоску с зоной захвата, сформированной в виде протяженного объекта, обеспечивающего истощение образца аффинными реагентами по ходу его движения под действием капиллярных сил; б) регистрацию и обработку результатов реакции производят путем измерения интегральной интенсивности окрашивания всех участков зоны захвата после прохождения образца через эту зону, при этом полученная величина интенсивности окрашивания является мерой концентрации исследуемого аналита в образце, а также путем измерения интенсивности окрашивания участков зоны захвата, которое производят с начала реакции с определенной периодичностью, при этом скорость нарастания окрашивания участка является мерой концентрации исследуемого аналита в образце, а время продвижения окраски вдоль участков зоны захвата является мерой вязкости раствора и температуры, которую учитывают при определении концентрации аналита, при этом итоговую концентрацию аналита в образце определяют по результатам сравнения с калибровочными данными, полученными для исследуемого аналита. Технический результат - способ позволяет с высокой точностью определять концентрацию меченного маркером аналита в образце с использованием ИХ анализа. 4 з.п. ф-лы, 6 ил., 1 табл.
1. Способ определения концентрации аналита в исследуемом образце крови с помощью иммунохроматографических тест-полосок (ИХ-полосок), содержащих, по меньшей мере, одну зону захвата с, по меньшей мере, одним аффинным реагентом, включающий
- нанесение на ИХ-полоску исследуемого образца,
- регистрацию и обработку результатов реакции при прохождении аналита через зоны захвата с их последующей интерпретацией,
отличающийся тем, что:
а) используют ИХ-полоску с зоной захвата, сформированной в виде протяженного объекта, обеспечивающего истощение образца аффинными реагентами по ходу его движения под действием капиллярных сил;
б) регистрацию и обработку результатов реакции производят путем измерения интегральной интенсивности окрашивания всех участков зоны захвата после прохождения образца через эту зону, при этом полученная величина интенсивности окрашивания является мерой концентрации исследуемого аналита в образце, а также путем измерения интенсивности окрашивания участков зоны захвата, которое производят с начала реакции с определенной периодичностью, при этом скорость нарастания окрашивания участка является мерой концентрации исследуемого аналита в образце, а время продвижения окраски вдоль участков зоны захвата является мерой вязкости раствора и температуры, которую учитывают при определении концентрации аналита, при этом итоговую концентрацию аналита в образце определяют по результатам сравнения с калибровочными данными, полученными для исследуемого аналита.
2. Способ по п. 1, отличающийся тем, что протяженный объект, обеспечивающий истощение образца, сформирован в виде линии или набора пятен.
3. Способ по п. 1, отличающийся тем, что концентрация аффинного реагента в зоне захвата постоянна или изменяется по заранее определенному закону по длине зоны захвата.
4. Способ по п. 1, отличающийся тем, что в образец вводят контрольный аналит, присутствие которого потенциально невозможно в исследуемом образце, в известной концентрации, при этом ИХ-полоска содержит зону или зоны захвата с аффинными реагентами, специфичными к контрольному аналиту.
5. Способ по п. 1, отличающийся тем, что обработку полученных результатов осуществляют путем сопоставления интегральной интенсивности окрашивания данной зоны захвата, а также характера изменений интенсивности окрашивания внутри зоны захвата и/или скорости изменения интенсивности окрашивания данной зоны захвата или ее участков с заранее полученными калибровочными данными, для контрольного аналита определяются поправочные коэффициенты, используемые при определении концентрации исследуемого аналита.
| US 6183972 B2, 06.02.2001 | |||
| US 6436721 B1, 20.08.2002 | |||
| Сотников Д.В | |||
| Определение специфических антител методом иммунохроматографии: количественные закономерности и практические приложения | |||
| Дисс | |||
| на соик | |||
| уч | |||
| ст | |||
| к.х.н., Москва 2016 | |||
| СПОСОБ ПРОВЕДЕНИЯ ИММУНОХРОМАТОГРАФИЧЕСКОГО АНАЛИЗА ДЛЯ СЕРОДИАГНОСТИКИ | 2012 |
|
RU2532352C2 |
| ВЯЗКОСТЬ СРЕДЫ КАК ИНСТРУМЕНТ КОНТРОЛЯ ПРЕДЕЛА ОБНАРУЖЕНИЯ ИММУНОХРОМАТОГРАФИЧЕСКИХ ТЕСТ-СИСТЕМ | 2016 |
|
RU2645907C1 |
| US 6335205 B1, 01.01.2002. | |||
Авторы
Даты
2020-01-27—Публикация
2018-11-28—Подача