Изобретение относится к медицине, в частности к кардиохирургии и может быть использовано для интраоперационной оценки степени иссечения миокарда межжелудочковой перегородки при выполнении септальной миоэктомии на остановленном и разгруженном сердце.
Гипертрофическая обструктивная кардиомиопатия характеризуется значительным утолщением межжелудочковой перегородки. Это приводит к сужению выходного тракта левого желудочка. Происходит увеличение нагрузки на миокард в связи с необходимостью преодоления гидродинамического сопротивления в зоне сужения. В выходном тракте левого желудочка увеличивается скорость потока крови, что обусловливает смещение в систолу передней створки митрального клапана в сторону полости левого желудочка (эффект Вентури) и развитие митральной недостаточности. Таким образом, при прогрессировании гипертрофической обструктивной кардиомиопатии развиваются сужение выходного тракта левого желудочка и недостаточность митрального клапана, которые обусловливают развитие хронической сердечной недостаточности. Помимо этого развивается диастолическая дисфункция левого желудочка, которая наряду с гипертрофией миокарда обусловливают его ишемию. Гипертрофическая обструктивная кардиомиопатия является генетически детерминированным заболеванием и неизлечима медикаментозными средствами.
Оперативное лечение позволяет в ряде случаев радикально ликвидировать обструкцию выходного тракта левого желудочка и митральную недостаточность, связанную с SAM - синдромом (SAM - systolic anterior motion - переднесистолическое движение створок митрального клапана). По данным литературы рекомендуется иссечение миокарда гипертрофированной части межжелудочковой перегородки, в ряде случаев требуется мобилизация или иссечение гипертрофированных папиллярных мышц, протезирование митрального клапана низкопрофильными протезами. При этом большинством авторов отмечается техническая сложность обеспечения визуализации межжелудочковой перегородки [Бокерия Л.А., Борисов К.В., Синев А.Ф., Злочевская Е.В. Хирургическое лечение гипертрофической обструктивной кардиомиопатии у детей. // Детские болезни сердца и сосудов. - 2005. - №1. - С. 23-28. Maron B.J. Surgery for hypertrophic obstructive cardiomyopathy // Circulation. - 2005. - Vol. 111. - 2016 - 2018. https://doi.org/10.1161/01.CIR.0000164396.80300.1A].
Известным способом интраоперационного контроля остаточной толщины межжелудочковой перегородки при выполнении септальной миоэктомии является чрезпищеводная эхокардиография [2014 ESC Guidelines on diagnosis and management of hypertrophic cardiomyopathy. (2014). European Heart Journal, 35(39), pp. 2733-2779. https://doi.org/10.1093/eurhearti/ehu284]. С помощью сложных приборов и установок, работа которых основана на различных физических принципах, производится визуализация структур сердца, в частности производится измерение толщины межжелудочковой перегородки на разных уровнях, протяженность зоны утолщения, измеряется градиент давления между левым желудочком сердца и восходящим отделом аорты.
В известном способе после введения в наркоз и интубации трахеи, в пищевод пациента вводят пищеводный ультразвуковой датчик. Измеряют толщину межжелудочковой перегородки, протяженность зоны утолщения, оценивают наличие переднесистолического движения створок митрального клапана, митральной недостаточности, измеряют скорость кровотока и градиент давления в выходном тракте левого желудочка. После выполнения септальной миоэктомии, восстанавливают сердечную деятельность и отключают аппарат искусственного кровообращения, проводят повторную оценку перечисленных выше параметров, в частности измерение толщины межжелудочковой перегородки в зоне операции и градиента давления в выходном тракте левого желудочка. Если сохраняется значимая обструкция выходного тракта, а остаточная толщина межжелудочковой перегородки больше или равна 16 мм, то проводят дополнительную миоэктомию. При чрезмерном истончении межжелудочковой перегородки в зоне операции, возможен ее разрыв, который требует срочной хирургической коррекции.
Недостатком известного способа является то, что оценить остаточную толщину межжелудочковой перегородки возможно только после восстановления сердечной деятельности, когда в камерах сердца отсутствует воздух (непроницаемый для ультразвука). В случаях недостаточной или избыточной степени иссечения миокарда, когда требуется дополнительная хирургическая коррекция, необходимо повторно накладывать зажим на аорту, проводить кардиоплегию, что чревато острым повреждением миокарда, риском эмболических осложнений, удлинением времени искусственного кровообращения и аноксии. Кроме того требуется использование дорогостоящего оборудования. Использование известного способа связано также с возможностью ряда осложнений, таких как повреждение пищевода, зубов, ларингоспазм, бронхоспазм, нарушения сердечного ритма. [Шиллер Н.Б., Осипов М.А. "Клиническая эхокардиография, второе издание". - М., Практика, 2005., стр. 256-280; Hauser N.D., Swanevelder J. "Trans-oesophageal echocardiography (TOE): contra-indications, complications and safety of perioperative TOE". Echo Res Pract. 2018 Dec; 5(4): R101-R113. https://dx.doi.org/10.1530%2FERP-18-0047].
Технический результат, достигаемый изобретением, заключается в повышении эффективности операции септальной миоэктомии за счет повышения надежности и качества операции, уменьшения риска осложнений.
Заявленный технический результат достигается в способе контроля остаточной толщины межжелудочковой перегородки при выполнении септальной миоэктомии, за счет того, что в полость правого желудочка вводят источник света, вплотную прилегающий к межжелудочковой перегородке, производят послойное иссечение миокарда межжелудочковой перегородки до визуализации свечения источника света через межжелудочковую перегородку требуемой остаточной толщины, при этом источник света обеспечивает расчетную локальную освещенность, позволяющую просвечивать требуемую остаточную толщину миокарда.
Предложенный способ контроля остаточной толщины межжелудочковой перегородки при выполнении септальной миоэктомии позволяет хирургу с высокой точностью добиться требуемой остаточной толщины перегородки в любой ее зоне и предотвратить как чрезмерное ее истончение, так и недостаточное иссечение миокарда. Чрезмерное иссечение миокарда может приводить к разрыву перегородки, что требует экстренных мер по его устранению. Недостаточное иссечение миокарда ведет к сохранению обструкции выходного тракта левого желудочка. При значительной ее выраженности требуется повторное пережатие аорты и выполнение дополнительной миоэктомии.
Предлагаемое изобретение поясняется иллюстрациями на фиг. 1-12, где:
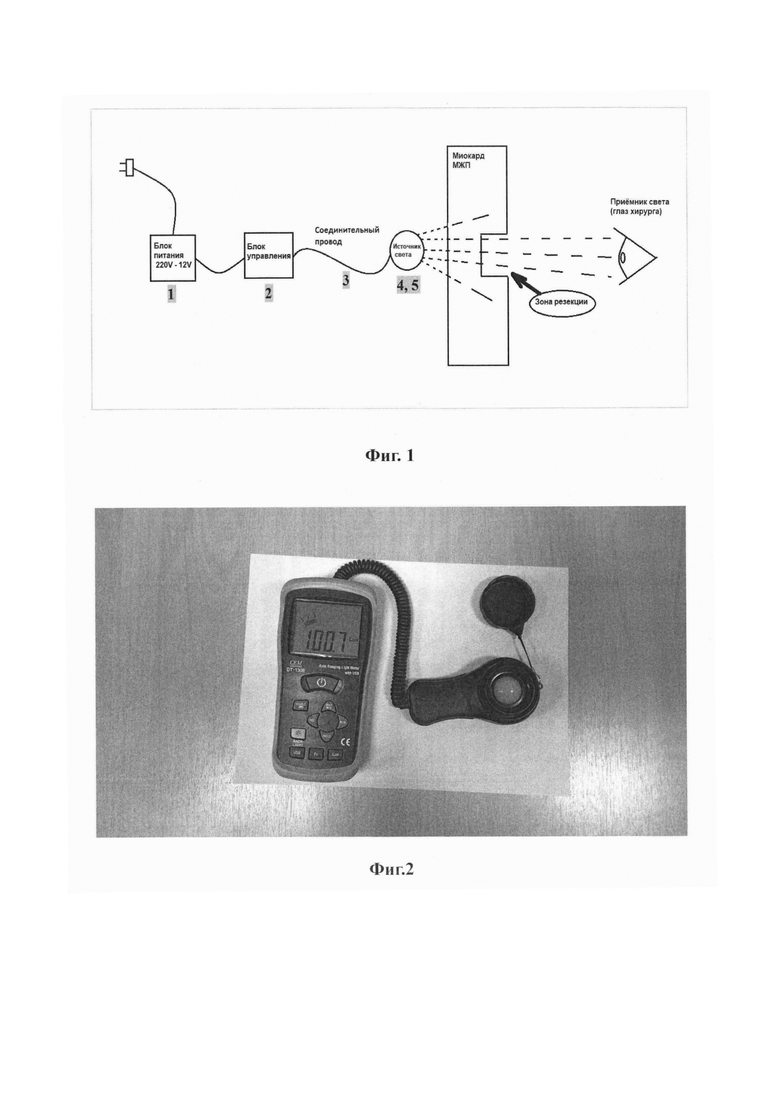
на фиг. 1 - представлена блок-схема реализации способа;
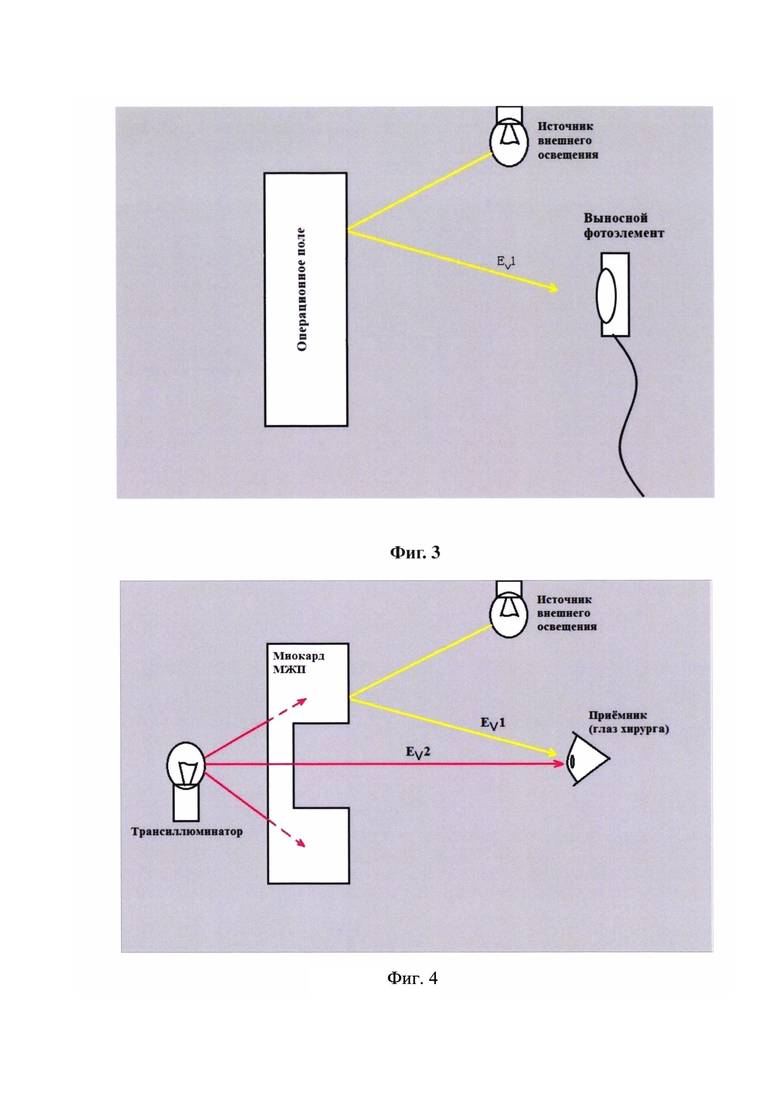
на фиг. 2 - представлен люксметр с выносным фотоэлементом
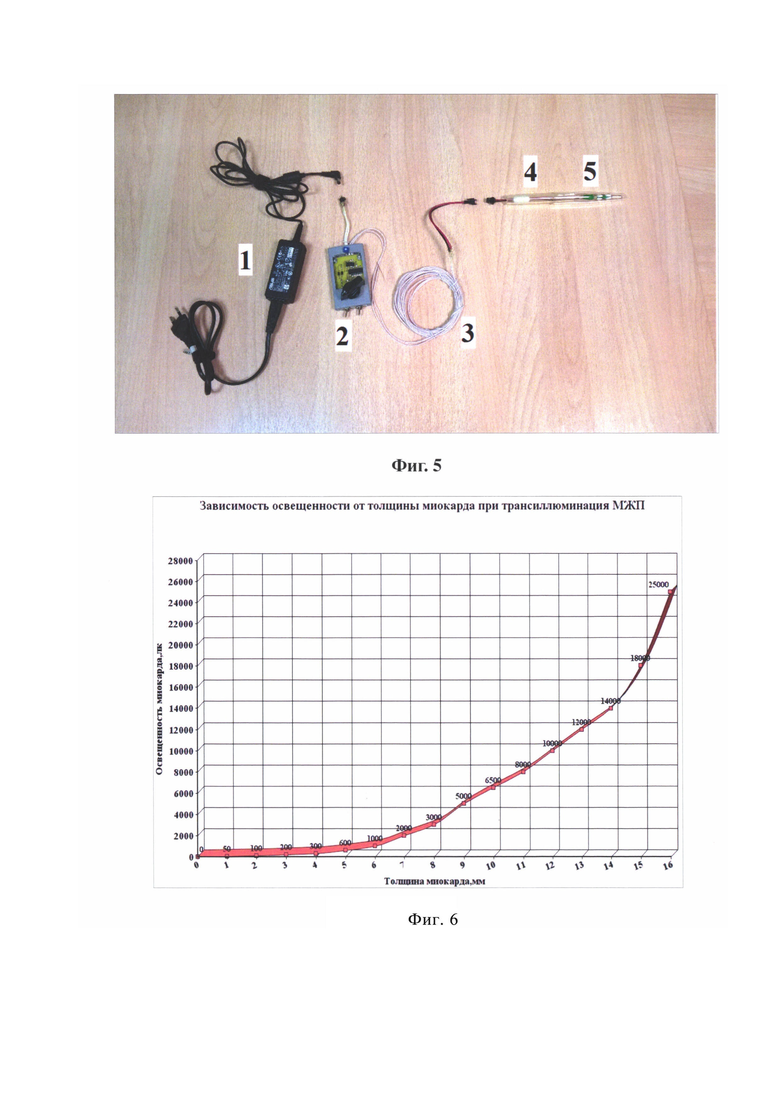
на фиг. 3 - представлена схема измерения внешней освещенности на уровне глаз хирурга
на фиг. 4 - представлен макет принципа реализации способа;
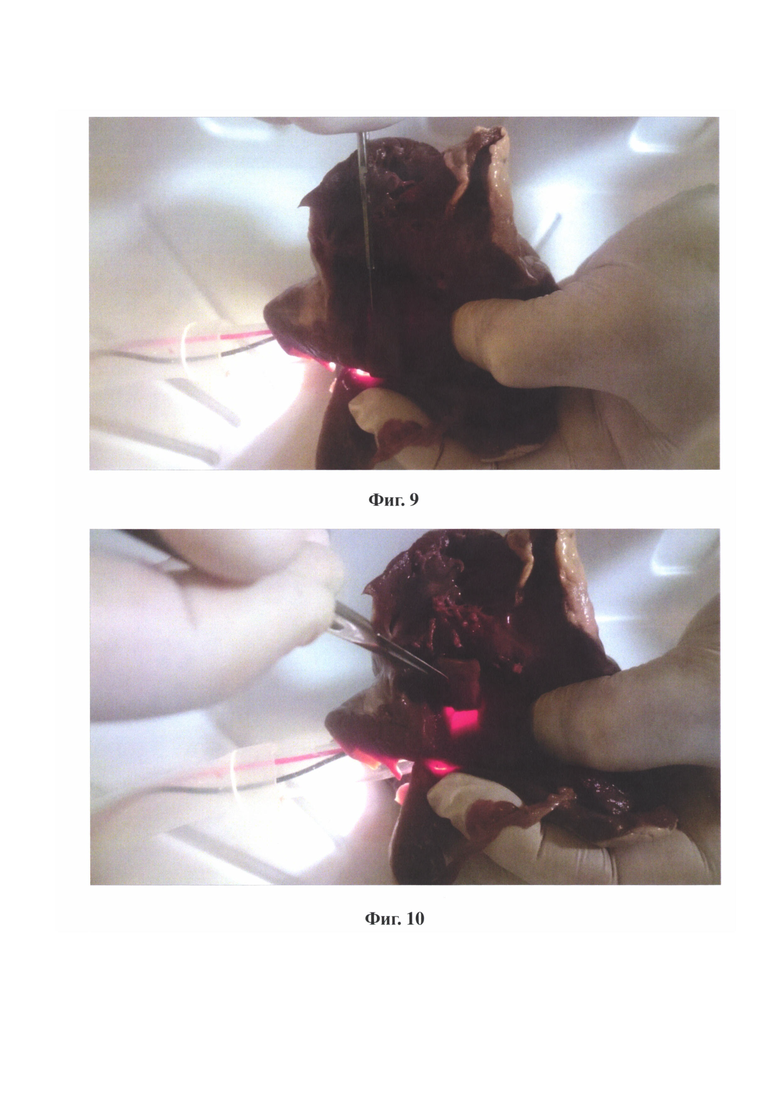
на фиг. 5 - представлены основные составные части трансиллюминатора;
на фиг. 6 - представлен график зависимости просвечиваемой толщины миокарда от величины локальной освещенности, создаваемой трансиллюминатором;
на фиг. 7 - вид сердца во время эксперимента. Трансиллюминатор введен в правый желудочек через разрез в легочном стволе;
на фиг. 8 - показано свечение тканей на дне разреза миокарда
на фиг. 9 - показаны два разреза межжелудочковой перегородки по технике A. Morrow. Вид свечения тканей в глубине разрезов;
на фиг. 10 - показан поперечный разрез по Morrow. Вид свечения тканей на дне зоны иссечения;
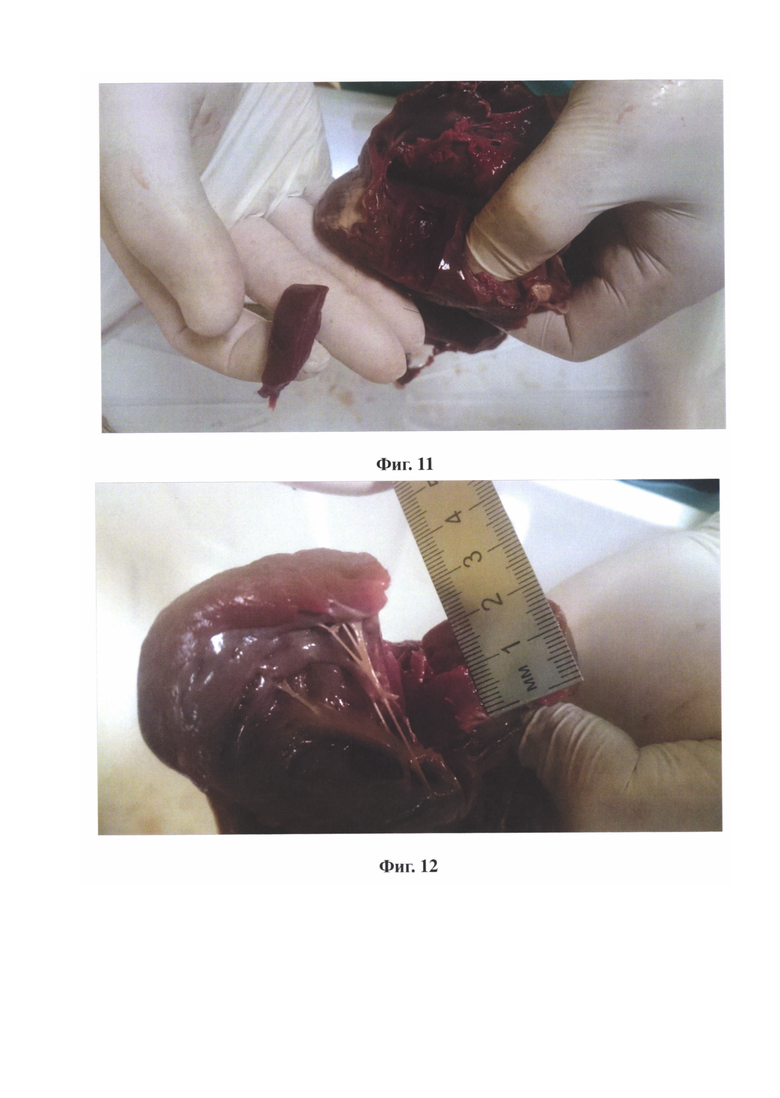
на фиг. 11 - вид экспериментального образца без осветителя;
на фиг. 12 - прямое измерение остаточной толщины миокарда в зоне миоэктомии.
Способ осуществляют, следующим образом: Для осуществления способа требуется специальный инструмент - трансиллюминатор. Он состоит из блока питания 1, блока управления 2, соединительного провода 3, корпуса 4 и источника света 5 (Фиг. 1 и 5). Блок питания 1 представляет собой устройство преобразующее сетевой переменный ток напряжением 220 В в постоянный ток со значениями силы и напряжения необходимыми для питания блока управления 2 и источника света 5. Блок управления 2 представляет собой регулятор мощности, позволяющий произвольно изменять силу светового потока путем изменения частоты и ширины импульсов (скважности) тока с частотой от 1 Гц до 200 Гц, подаваемых на источник света 5 трансиллюминатора. Корпус 4 представляет собой гибкую трубку из поливинилхлорида. С одного ее конца находится источник света 5, представляющий собой плату с осветительными светодиодами типа SMD LED, установленными на ней так, чтобы свет распространялся равномерно во все стороны, помещенную в тонкостенный стеклянный цилиндр, один конец которого плотно прикрепляется к корпусу 4, а другой слепо заканчивается. При изготовлении прототипа была использована плата со светодиодами модели TDS-P001L4U15 (TDS LIGHTING CO., LTD). Через другой конец корпуса 4 трансиллюминатора проходит соединительный провод 3, обеспечивающий электроснабжение источника света 5. На конце соединительного провода 3 имеется разъем, при помощи которого он подключается к блоку управления 2. Корпус 4 и источник света 5 трансиллюминатора являются герметичными. Корпус 4 трансиллюминатора с источником света 5 и соединительным проводом 3 (с разъемом) предварительно подвергаются упаковке и стерилизации методом низкотемпературной плазменной стерилизации (оборудование типа STERRAD, Johnson & Johnson). Во время операции указанная система извлекается из упаковки в стерильном виде. Длина соединительного провода 3 составляет 3 метра, что позволяет во время операции сбрасывать его из стерильной зоны в нестерильную и подключать к блоку управления 2 через разъем. При помощи блока управления 2 на источник света 5 трансиллюминатора подается напряжение, обеспечивающее световой поток заданной силы. Локальная освещенность, создаваемая трансиллюминатором является крайне важной величиной и контролируется при помощи люксметра с выносным фотоэлементом (Фиг. 2) - перед применением устройства проводится контрольный тест. Для этого выносной фотоэлемент люксметра (Фиг. 2) помещается в стерильный прозрачный полиэтиленовый пакет, к которому прикладывается включенный источник света 5 трансиллюминатора. Если при контрольном тесте локальная освещенность, создаваемая источником света 5, отличается от требуемой, она регулируется при помощи блока управления 2. Необходимые значения локальной освещенности найдены эмпирически для конкретной модели и экземпляра платы со светодиодами, использованной в источнике света 5, в результате экспериментов с миокардом, удаленным во время операций септальной миоэктомии, а также со свиным миокардом. Оптические свойства человеческого и свиного миокарда оказались идентичными, представлены в виде графика (Фиг. 6). Вторым важным параметром является внешняя освещенность операционного поля. Глаз хирурга воспринимает свет, отраженный от операционного поля. Метод основан на различении разницы между освещенностью глаза хирурга, создаваемой 1) светом отраженным от операционного поля и 2) светом от источника света 5 трансиллюминатора, прошедщим сквозь миокард (при его просвечивании в зоне резекции) (Фиг. 4). Освещенность контролируется при помощи люксметра, выносной фотоэлемент которого располагается на уровне глаз хирурга (Фиг. 3). Яркость операционных ламп уменьшается до такой степени, чтобы освещенность на уровне глаз хирурга составляла 50 люкс. При этом освещенность операционного поля визуально выглядит недостаточной, что требует использования налобного осветителя, луч которого позволяет локально подсвечивать зону интереса. При отведении луча в сторону освещенность глаза хирурга будет составлять установленные 50 люкс.
При наличии графика зависимости толщины просвечиваемого миокарда от уровня освещенности на входе в миокард (Фиг. 6) для конкретного трансиллюминатора, существует принципиальная возможность устанавливать любую требуемую толщину миокарда из доступного диапазона. При изучении данных эхокардиографии 150 пациентов после успешной септальной миоэктомии было установлено, что остаточная толщина миокарда межжелудочковой перегородки в зоне выполнения септальной миоэктомии составляет 10±2,4 мм. Минимальная остаточная толщина перегородки в зоне операции, при которой не происходило ее разрыва составила 7 мм. Исходя из вышесказанного, локальная освещенность, создаваемая трансиллюминатором, устанавливалась такой, чтобы надежно просвечивался массив миокарда толщиной в 10 мм при освещенности глаза хирурга в 50 люкс (светом отраженным от операционного поля). Для источника света 5 на основе платы со светодиодами модели TDS-P001L4U15 (TDS LIGHTING CO., LTD) это значение составляет 6700 люкс в лабораторных условиях. Проведенные эксперименты по выполнению септальной миоэктомии на трупных сердцах показывают, что при выполнении разреза межжелудочковой перегородки, точка появления свечения миокарда нередко "проскакивается". Глубина разреза оказывается на 2 - 3 мм больше и толщина миокарда в зоне разреза получается меньше заданной. Исходя из этого, представляется необходимым устанавливать уровень локальной освещенности, создаваемой трансиллюминатором, в пределах 12000 - 12500 Лк. Это позволяет просвечивать массив миокарда толщиной 12 - 13 мм и с учетом погрешностей при выполнении разреза позволит исключить чрезмерное истончение межжелудочковой перегородки.
Пациент вводится в наркоз по стандартной методике. Обрабатывается и накрывается операционное поле. Выполняется разрез кожи, подкожной жировой клетчатки. Параллельно выполняется транспищеводное эхокардиографическое исследование, оценивается толщина межжелудочковой перегородки, ее анатомические особенности, наличие SAM - синдрома и митральной недостаточности. Производится продольная стернотомия. Осуществляется гемостаз, устанавливается ранорасширитель. "Т"-образным разрезом вскрывается перикард. Параллельно вводится гепарин в дозе 300 Ед\кг. Края перикарда фиксируются лигатурами - держалками. Рассекается перикард вокруг устьев полых вен, правых легочных вен и прилежащих участков левого предсердия, вокруг восходящей аорты. Также продлевается перикардиотомный разрез влево, вдоль диафрагмы до левого диафрагмального нерва. Далее выполняется наложение кисетных швов на восходящую аорту вблизи устья брахиоцефального ствола, на верхнюю полую вену максимально дистально, на стенку правого предсердия вблизи устья нижней полой вены. Вскрывается аорта в центре кисета, устанавливается аортальная канюля аппарата искусственного кровообращения, заполняется и подсоединяется к магистрали. Аналогичным образом устанавливаются венозные канюли в верхнюю и нижнюю полые вены. Вокруг верхней и нижней полых вен проводятся резиновые обтяжки. Накладываются кисетные швы на свободную стенку правого предсердия между нижней полой веной и ушком правого предсердия, а также на ушко правого предсердия. Начинается искусственное кровообращение. Предсердие вскрывается в центре кисета (на свободной стенке правого предсердия), устанавливается ретроградная кардиоплегическая канюля в коронарный синус. Накладывается кисет на восходящую аорту и через него устанавливается антеградная кардиоплегическая канюля. Накладывается последний кисет на правую верхнюю легочную вену. Аорта пережимается. Устанавливается левый дренаж через кисет на правой верхней легочной вене. Левым дренажем сердце опустошается. Проводится сеанс анте - ретроградной кровяной кардиоплегии. Затягиваются обтяжки на полых венах. Вскрывается (или пересекается) восходящая аорта. Осуществляется визуальная оценка межжелудочковой перегородки через створ аортального клапана. Источник света 5 с корпусом 4 и соединительным проводом 3 извлекаются из стерильной упаковки, подключаются к блоку управления, на нем устанавливается необходимая сила светового потока, которая проверяется при помощи контрольного теста. Поперечным разрезом на 1 - 1,5 см выше клапана легочной артерии вскрывается легочный ствол. Через указанный разрез полость правого желудочка освобождается от крови коронарным отсосом. Источник света 5 трансиллюминатора через разрез стенки легочного ствола и просвет клапана легочной артерии вводится в полость правого желудочка (Фиг. 7). Оперирующий хирург пальпаторно через стенку правого желудочка контролирует положение источника света 5, располагает его с противоположной стороны от зоны иссечения межжелудочковой перегородки, плотно прижимает к ней. При этом перегородка смешается источником света 5 в просвет выходного тракта левого желудочка и зона операции (базальные и срединные отделы межжелудочковой перегородки) становится видна значительно лучше. Прибор включается, при этом просвечивается стенка выходного тракта правого желудочка. Ассистент фиксирует источник света 5 в положении, указанном ему оператором. Под контролем люксметра, выносной фотоэлемент которого располагается на уровне глаз хирурга, уменьшается яркость операционной лампы до такой степени, что освещенность глаз хирурга будет составлять 50 люкс. Локальная подсветка осуществляется налобным фонарем. Хирург выполняет миоэктомию с использованием любой известной техники. Разрез межжелудочковой перегородки производится послойно, углубляясь с каждым проходом скальпеля на 1 - 2 мм. После каждого прохода скальпеля луч налобного осветителя отводится в сторону и осуществляется визуальный контроль. Как только толщина межжелудочковой перегородки станет равна или меньше той, через которую проникает световой поток установленной силы, хирург начинает видеть свечение тканей в глубине разреза миокарда (Фиг. 8-12). Это служит сигналом о достижении установленной толщины миокарда в месте свечения (10 мм). Свечение тканей является сигналом к прекращению углубления разреза в этой зоне. После иссечения миокарда на необходимом протяжении процедура миоэктомии заканчивается. Трансиллюминатор выключается и извлекается из правого желудочка и легочной артерии. Восстанавливается целостность легочного ствола и аорты. Снимаются обтяжки с полых вен. Проводится реперфузия до восстановления сердечной деятельности и начинается профилактика воздушной эмболии. Снимается зажим с аорты. Профилактика воздушной эмболии продолжается. Аппарат искусственного кровообращения останавливается и выполняется транспищеводная эхокардиография. Оценивается наличие SAM - синдрома, толщина межжелудочковой перегородки, градиент давления в выходном тракте левого желудочка, наличие митральной регургитации, сброса крови через межжелудочковую перегородку. В случае удовлетворительного результата операции следует типичное ее завершение.
Конкретные примеры применения указанного способа:
Процедура септальной миоэктомии выполнена в эксперименте на 20 изолированных трупных свиных сердцах с использованием классической техники по A. Morrow. Использовалась локальная освещенность в 12000 люкс, которая подтверждалась при помощи контрольного теста. Освещенность на уровне глаз хирурга устанавливалась равной 50 люкс под контролем люксметра. Источник света 5 вводился в полость правого желудочка через разрез легочного ствола (Фиг. 7) и включался. Согласно классической технике миоэктомии проводились 2 параллельных продольных разреза в 10 мм друг от друга в проекции правой коронарной створки аортального клапана от точки на 5 мм ниже фиброзного кольца аортального клапана к верхушке ЛЖ на протяжении 40 мм (Фиг. 8 - 9). При определении глубины разрезов ориентировались на появление свечения тканей на дне разрезов. Затем оба продольных разреза соединяли третьим поперечным разрезом (Фиг. 10), высекая таким образом прямоугольный фрагмент миокарда длиной 40 мм, шириной 10 мм и переменной толщины в зависимости от исходной толщины МЖП. При этом дно образовавшегося дефекта МЖП равномерно отчетливо светилось. Затем источник света 5 выключался, извлекался из правого желудочка и легочного ствола, межжелудочковая перегородка разрезалась вдоль от фиброзного кольца аортального клапана до верхушки и проводилось прямое измерение толщины миокарда в зоне операции (Фиг. 11 - 12). По результатам 20 измерений, остаточная толщина миокарда в зоне операции составила 10±2 мм
Использование заявляемого способа позволяет хирургу с высокой точностью добиться заданной остаточной толщины межжелудочковой перегородки в любой ее зоне и предотвратить как чрезмерное, так и недостаточное иссечение миокарда.
Таким образом предлагаемый способ позволяет повысить эффективность операции септальной миоэктомии, уменьшить риск осложнений.
Заявитель просит рассмотреть представленные материалы заявки «Способ контроля остаточной толщины межжелудочковой перегородки при выполнении септальной миоэктомии» на предмет выдачи патента РФ на изобретение.

Изобретение относится к медицине, в частности к кардиохирургии. В полость правого желудочка вводят источник света - трансиллюминатор с уровнем локальной освещенности 12000-12500 Лк, который вплотную прилегает к межжелудочковой перегородке. После чего производят послойное иссечение миокарда межжелудочковой перегородки до визуализации свечения трансиллюминатора через межжелудочковую перегородку требуемой остаточной толщины. Способ позволяет с высокой точностью добиться требуемой остаточной толщины перегородки в любой ее зоне и предотвратить ее чрезмерное истончение, так и недостаточное иссечение миокарда, а также позволяет избежать послеоперационных осложнений. 1 з.п. ф-лы, 1 пр., 12 ил.
1. Способ контроля остаточной толщины межжелудочковой перегородки при выполнении септальной миоэктомии, отличающийся тем, что в полость правого желудочка вводят источник света - трансиллюминатор с уровнем локальной освещенности 12000-12500 Лк, который вплотную прилегает к межжелудочковой перегородке, после чего производят послойное иссечение миокарда межжелудочковой перегородки до визуализации свечения трансиллюминатора через межжелудочковую перегородку требуемой остаточной толщины.
2. Способ контроля остаточной толщины межжелудочковой перегородки при выполнении септальной миоэктомии по п. 1, отличающийся тем, что источник света - трансиллюминатор обеспечивает расчетную локальную освещенность, позволяющую просвечивать требуемую остаточную толщину миокарда.
| Elliott PM et al., 2014 ESC Guidelines on diagnosis and management of hypertrophic cardiomyopathy | |||
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| European Heart Journal, 35(39), pp | |||
| Киноленты, не требующие перемотки их | 1924 |
|
SU2733A1 |
| Способ хирургического лечения гипертрофической обструктивной кардиомиопатии | 2015 |
|
RU2608705C1 |
| СПОСОБ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ ГИПЕРТРОФИЧЕСКОЙ ОБСТРУКТИВНОЙ КАРДИОМИОПАТИИ СО СРЕДНЕЖЕЛУДОЧКОВОЙ ОБСТРУКЦИЕЙ ПОД ЭХОКАРДИОГРАФИЧЕСКИМ КОНТРОЛЕМ | 1999 |
|
RU2199960C2 |
| БОКЕРИЯ Л.А | |||
| и др | |||
| Оригинальный способ хирургического лечения гипертрофической обструктивной кардиомиопатии | |||
| Грудная и сердечно-сосудистая | |||
Авторы
Даты
2020-02-05—Публикация
2019-02-07—Подача