УРОВЕНЬ ТЕХНИКИ
Область техники
Настоящее изобретение относится к биологически активным соединениям, композициям, содержащим их, и к способам применения таких биологически активных соединений и композиций для лечения рака и других заболеваний.
Описание предшествующего уровня техники
Перспективные новые противораковые терапевтические агенты включают доластатины и синтетические аналоги доластатина, такие как ауристатины (патенты США №5635483, 5780588, 6323315 и 6884869; Shnyder et al. (2007) Int. J. Oncol. 31: 353-360; Otani, M. et al. Jpn. J. Cancer Res. 2000, 91, 837-844; PCT Intl. Publ. № WO 01/18032 A3, WO 2005/039492, WO 2006/132670 и WO 2009/095447; Fennell, В.J. et al. J. Antimicrob. Chemther. 2003, 51, 833-841). Было показано, что доластатины и ауристатины нарушают динамику микротрубочек, препятствуя делению клеток (Woyke et al. (2001) Antimicrob. Agents Chemother. 45(12): 3580-3584), и обладают противораковым (патент США №5663149) и противогрибковым действием (Pettit et al. (1998) Antimicrob. Agents Chemother. 42: 2961-2965). К сожалению, несмотря на первоначальное воодушевление, доластатин 10 продемонстрировал слабые результаты в качестве агента монотерапии в клинических испытаниях II фазы (Shnyder (2007), supra). Было показано, что некоторые соединения семейства ауристатинов являются более перспективными в качестве кандидатов с улучшенной эффективностью и фармакологическими характеристиками по сравнению с доластатинами (Pettit et al. (1995) Anti-Cancer Drug Des. 10: 529-544; Pettit et al. (1998) Anti-Cancer Drug Des. 13: 243-277; Shnyder (2007), supra). Были описаны различные синтетические аналоги указанного структурного типа (патент США №6569834; патент США №6124431; и Pettit et al. (2011) J. Nat. Prod. 74: 962-968).
Ауристатины обладают несколькими свойствами, которые обусловливают их привлекательность для разработки фармацевтических препаратов. Во-первых, указанные соединения являются чрезвычайно эффективными. Во-вторых, их получение является весьма простым вследствие пептидного каркаса. В-третьих, они обладают хорошими фармакокинетическими и метаболическими профилями, по сравнению с пептидами в целом, или с другими классами противораковых лекарств - в частности. Наконец, пептидная структура ауристатинов аналогична структуре антитела, поэтому при использовании указанных соединений в составе конъюгата антитела с лекарственным веществом (ADC) они менее вероятно вызывают осаждение или образование высокомолекулярных агрегатов (Doronina et al. (2003) Nat. Biotechnology 21(7): 778-784).
Эффективные цитотоксические и антимитотические композиции весьма востребованы для лечения множества изнуряющих расстройств, включая рак. Несмотря на то что получено множество аналогов ауристатина, многие из них демонстрируют сниженную эффективность, которая ограничивает их применение в способах медицинского лечения. По вышеуказанным причинам, несмотря на некоторый прогресс в данной области, существует потребность в дополнительных эффективных антимитотических и цитотоксических соединениях, обладающих предпочтительными характеристиками, обеспечивающими их пригодность для лечения множества расстройств, включая рак. Настоящее описание удовлетворяет указанные потребности и обеспечивает дополнительные сопутствующие преимущества.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Вкратце, настоящее описание относится к биологически активным соединениям, композициям, содержащим их, и к способам применения таких соединений и композиций. Предложены соединения Формулы I:

и их фармацевтически приемлемые соли, где:
R1 выбран из: амино-C1-C6 алкила, амино-арила, амино-С3-С7 циклоалкила, амино-гетероциклила и гетероциклила, каждый из которых необязательно замещен одним или более заместителями, выбранными из арила, арил-C1-C6 алкила, C1-C6 алкила, C1-C6 алкилтио, карбоксила, карбоксамида, C3-C7 циклоалкила, C3-C7 циклоалкил-C1-C6 алкила, гуанидино, галогена, C1-C6 галогеналкила, гетероциклила, гетероциклил-C1-C6 алкила, гидроксила и тио; или
R1 представляет собой RaRbNCH(Rc)-;
Ra выбран из: Н и C1-C6 алкила;
Rb представляет собой C1-C6 алкил; и
Rc представляет собой Rd-C(CH3)2; и
Rd выбран из: Н, арила, С3-С7 циклоалкила и гетероарила, каждый из которых необязательно замещен одним или более заместителями, выбранными из: C1-C4 ацилтио, C2-C4 алкенила, C1-C4 алкила, C1-C4 алкиламино, C1-C4 алкилокси, амино, амино-C1-C4 алкила, галогена, C1-C4 галогеналкила, гидроксила, гидрокси-C1-C4 алкила и тио, где C2-C4 алкенил, C1-C4 алкиламино и C1-C4 алкилокси дополнительно необязательно замещены одним заместителем, выбранным из C1-C4 алкиларила, гидроксила и тио; или
Rb и Rc вместе с атомами, с которыми они связаны, образуют гетероциклилдиил;
R2 выбран из: C2-C6 алкила, арила, арил-C1-C6 алкила, C4-C7 циклоалкила, С3-С7 циклоалкил-C1-C6 алкила, гетероарила, гетероарил-C1-C6 алкила и гетероциклила, каждый из которых необязательно замещен одним или более заместителями, выбранными из: C1-C6 алкокси, C1-C6 алкоксикарбонила, C1-C6 алкила, C1-C6 алкиламино, амино, амино-C1-C6 алкила, амино-арила, амино-С3-С7 циклоалкила, арила, карбоксамида, карбоксила, циано, C1-C6 галогенацила, C1-C6 галогеналкила, C1-C6 галогеналкокси, галогена, гидроксила, нитро, тио и тио-C1-C6 алкила; и
Х представляет собой -C(O)NHCH(CH2R3)-, или Х отсутствует; и
R3 выбран из: арила, гетероарила и С3-С7 циклоалкила, каждый из которых необязательно замещен одним заместителем, выбранным из амино и гидроксила.
В одном из вариантов реализации настоящего изобретения предложен способ получения соединения, описанного в настоящем документе, или его фармацевтически приемлемой соли.
В другом варианте реализации предложена фармацевтическая композиция, содержащая соединение, описанное в настоящем документе, или его фармацевтически приемлемую соль, и фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество.
В другом варианте реализации предложен способ применения соединения, описанного в настоящем документе, или его фармацевтически приемлемой соли в терапии. В частности, в настоящем описании предложен способ лечения рака у млекопитающего, включающий введение млекопитающему, нуждающемуся в этом, эффективного количества соединения, описанного в настоящем документе, или его фармацевтически приемлемой соли, или фармацевтической композиции, содержащей соединение, описанное в настоящем документе, или его фармацевтически приемлемую соль, и фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество.
В другом варианте реализации настоящего описания предложен способ подавления роста опухоли у млекопитающего, включающий введение млекопитающему, нуждающемуся в этом, эффективного количества соединения, описанного в настоящем документе, или его фармацевтически приемлемой соли, или фармацевтической композиции, содержащей соединение, описанное в настоящем документе, или его фармацевтически приемлемую соль, и фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество.
В другом варианте реализации настоящего описания предложен способ уничтожения раковых клеток in vitro с применением соединения, описанного в настоящем документе, или его фармацевтически приемлемой соли. В другом варианте реализации настоящего описания предложен способ уничтожения раковых клеток in vivo у млекопитающего, включающий введение млекопитающему, нуждающемуся в этом, эффективного количества соединения, описанного в настоящем документе, или его фармацевтически приемлемой соли, или фармацевтической композиции, содержащей соединение, описанное в настоящем документе, или его фармацевтически приемлемую соль, и фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество.
В другом варианте реализации настоящего описания предложен способ увеличения времени выживания млекопитающего, страдающего от рака, включающий введение такому млекопитающему эффективного количества соединения, описанного в настоящем документе, или его фармацевтически приемлемой соли, или фармацевтической композиции, содержащей соединение, описанное в настоящем документе, или его фармацевтически приемлемую соль, и фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество.
В другом варианте реализации настоящего описания предложено применение соединения, описанного в настоящем документе, или его фармацевтически приемлемой соли, в производстве лекарственного препарата для лечения рака у млекопитающего.
В другом варианте реализации настоящего изобретения предложено применение соединения, описанного в настоящем документе, или его фармацевтически приемлемой соли, в производстве лекарственного препарата для подавления роста опухоли у млекопитающего.
В другом варианте реализации настоящего изобретения предложено применение соединения, описанного в настоящем документе, или его фармацевтически приемлемой соли, в производстве лекарственного препарата для увеличения выживаемости млекопитающего, страдающего от рака.
В другом варианте реализации настоящего изобретения предложено соединение или фармацевтическая композиция, описанная в настоящем документе, для применения в способе лечения организма человека или животного посредством терапии.
В другом варианте реализации настоящего описания предложено соединение или фармацевтическая композиция, описанная в настоящем документе, для применения при лечении рака у млекопитающего.
В другом варианте реализации настоящего описания предложено соединение или фармацевтическая композиция, описанная в настоящем документе, для применения для подавления роста опухоли у млекопитающего.
В другом варианте реализации настоящего описания предложено соединение или фармацевтическая композиция, описанная в настоящем документе, для применения для увеличения выживаемости млекопитающего, страдающего от рака.
В одном из вариантов реализации предложены композиции, содержащие биологически активное соединение, описанное в настоящем документе, или его фармацевтически приемлемую соль, связанную прямо или косвенно с направляющим фрагментом.
В одном из вариантов реализации настоящего изобретения предложены композиции Формулы II:

где (Т) представляет собой направляющий фрагмент, (L) представляет собой необязательный линкер, и (D) представляет собой соединение Формулы I, Ia, Ib, Ic, Id, Ie, If, Ig, Ih, Ii, Ij или Ik, или его фармацевтически приемлемую соль. (D) ковалентно связан с (L), если (L) присутствует, или с (Т), если (L) отсутствует.
В одном из вариантов реализации направляющий фрагмент представляет собой антитело. Соответственно, в одном из вариантов реализации предложены конъюгаты антитела с лекарственным веществом (ADC), содержащие соединение, описанное в настоящем документе, или его фармацевтически приемлемую соль или пролекарство.
В одном из вариантов реализации настоящего изобретения предложен способ получения композиции Формулы II.
В другом варианте реализации предложена фармацевтическая композиция, содержащая композицию Формулы II или ее фармацевтически приемлемую соль и фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество.
В другом варианте реализации предложен способ применения композиции Формулы II в терапии. В частности, в настоящем описании предложен способ лечения рака у млекопитающего, включающий введение млекопитающему, нуждающемуся в этом, эффективного количества композиции Формулы II или фармацевтической композиции, содержащей композицию Формулы II, и фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество.
В другом варианте реализации настоящего описания предложен способ подавления роста опухоли у млекопитающего, включающий введение млекопитающему, нуждающемуся в этом, эффективного количества композиции Формулы II или фармацевтической композиции, содержащей композицию Формулы II, и фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество.
В другом варианте реализации настоящего описания предложен способ уничтожения раковых клеток in vitro с применением композиции Формулы II. В другом варианте реализации настоящего описания предложен способ уничтожения раковых клеток in vivo у млекопитающего, включающий введение млекопитающему, нуждающемуся в этом, эффективного количества композиции Формулы II или фармацевтической композиции, содержащей композицию Формулы II, и фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество.
В другом варианте реализации настоящего описания предложен способ увеличения времени выживания млекопитающего, страдающего от рака, включающий введение млекопитающему, нуждающемуся в этом, эффективного количества композиции Формулы II, или фармацевтической композиции, содержащей композицию Формулы II, и фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество.
В другом варианте реализации настоящего описания предложено применение композиции Формулы II или ее фармацевтически приемлемой соли в производстве лекарственного препарата для лечения рака у млекопитающего.
В другом варианте реализации настоящего описания предложено применение композиции Формулы II в производстве лекарственного препарата для подавления роста опухоли у млекопитающего.
В другом варианте реализации настоящего описания предложено применение композиции Формулы II в производстве лекарственного препарата для увеличения выживаемости млекопитающего, страдающего от рака.
В другом варианте реализации настоящего описания предложена композиция Формулы II или фармацевтическая композиция, содержащая композицию Формулы II, для применения в способе лечения организма человека или животного посредством терапии.
В другом варианте реализации настоящего описания предложена композиция Формулы II или фармацевтическая композиция, содержащая композицию Формулы II, для применения при лечении рака у млекопитающего.
В другом варианте реализации настоящего описания предложена композиция Формулы II или фармацевтическая композиция, содержащая композицию Формулы II, для применения для подавления роста опухоли у млекопитающего.
В другом варианте реализации настоящего описания предложена композиция Формулы II или фармацевтическая композиция, содержащая композицию Формулы II, для применения для увеличения выживаемости млекопитающего, страдающего от рака.
Эти и другие аспекта настоящего описания станут понятны со ссылкой на следующее подробное описание.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На Фиг. 1 представлена цитотоксичность Соединения 5 в отношении Her2-положительной клеточной линии НСС1954.
На Фиг. 2 представлена цитотоксичность Соединения 5 в отношении Her2-отрицательной клеточной линии Jurkat.
На Фиг. 3 представлена цитотоксичность ADC трастузумаба с Соединением 5 в отношении Her2-положительной клеточной линии NCI-N87.
На Фиг. 4 представлена цитотоксичность ADC трастузумаба с Соединением 5 в отношении Her2-положительной клеточной линии НСС1954.
На Фиг. 5 представлена цитотоксичность ADC трастузумаба с Соединением 5 в отношении Her2-отрицательной клеточной линии Jurkat.
На Фиг. 6 представлены результаты анализа равновесного нативного связывания, использованного для сравнения связывания некоторых ADC с клеточной линией MDA-МВ-231.
На Фиг. 7 представлена эффективность некоторых ADC в модели опухоли NCI-N87 с применением мышей линии NOD SCID Gamma.
На Фиг. 8 представлена эффективность некоторых ADC в модели опухоли Karpas 299 с применением мышей линии C.B-17/IcrHsd-Prkdcscid.
На Фиг. 9 представлены результаты испытания переносимости ADC трастузумаба с Соединением 14 у самок крыс Спрага-Доули.
На Фиг. 10 представлены результаты испытания переносимости ADC трастузумаба с Соединением 5 у самок крыс Спрага-Доули.
На Фиг. 11 представлены результаты анализы ареста клеточного цикла в клеточной линии Jurkat, обработанной Соединением 5.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Для обеспечения полного понимания различных вариантов реализации настоящего описания в нижеследующем описании изложены некоторые конкретные детали. Тем не менее, специалистам в данной области техники будет понятно, что настоящее описание может быть реализовано на практике без указанных деталей.
Определения
Если не указано иное, следующие термины и выражения в данном контексте имеют следующие значения. При использовании торговых названий авторы настоящего изобретения предусматривают независимое включение состава продукта торговой марки, воспроизведенный лекарственный препарат и активный фармацевтический ингредиент(-ы) продукта указанной торговой марки.
Если контекст не требует иного, в тексте настоящего описания и формулы изобретения слово «содержит» и его вариации, такие как «включает» и «содержащий» следует понимать в открытом, включающем смысле, то есть как «включающий, но не ограничиваясь этим».
В настоящем описании ссылка на «один вариант реализации» или на «вариант реализации» означает, что конкретный признак, структура или характеристика, описанная в связи с указанным вариантом реализации, включена по меньшей мере в один вариант реализации настоящего описания. Таким образом, появление фраз «в одном из вариантов реализации» или «в одном варианте реализации» в различных местах по всему описанию не обязательно относится к ссылке на один и тот же вариант реализации. Следует понимать, что некоторые признаки настоящего изобретения, которые для ясности описаны в контексте различных вариантов реализации, могут быть представлены в комбинации в одном варианте реализации. И наоборот, различные признаки изобретения, которые для краткости описаны в одном варианте реализации изобретения, также могут быть представлены отдельно или в любой подходящей субкомбинации.
Химические группы
Все комбинации вариантов реализации изобретения, касающихся химических групп, представленных переменными (например, Ra, Rb, Rc, Rd, Re, Rf, Rg, Rh, Ri, Rj, Rk, Rm, R1, R2, R2a, R3, R4, R5, R6, R7, R8, R9, R4, R10, R11, R12, R13, R14, R15, R16, x, Y и Z, содержащимися в общих химических формулах, описанных в настоящем документе (например, I, Ia, Ib, Ic, Id, Ie, If, Ig, Ih, Ii, Ij, Ik, Im, In, II, III, IV, V, VI, VII и VIII), специально включены в настоящее изобретение, как если бы все и каждая комбинация была описана по отдельности в явном виде, в той степени, в которой такие комбинации охватывают соединения, приводящие к образованию стабильных соединений (т.е. соединений, которые могут быть выделены, охарактеризованы и испытаны на биологическую активность). Кроме того, все субкомбинации химических групп, указанных в вариантах реализации, описывающих такие переменные, а также все субкомбинации вариантов применения и медицинских показаний, описанных в настоящем документе. Также специально включены в настоящее изобретение, как если бы все и каждая субкомбинация химических групп и субкомбинация вариантов применения и медицинских показаний была по отдельности и в явном виде описана в настоящем документе. Кроме того, если указан список заместителей для любых конкретных Ra, Rb, Rc, Rd, Re, Rf, Rg, Rh, Ri, Rj, Rk, Rm, R1, R2, R2a, R3, R4, R5, R6, R7, R8, R9, R4, R10, R11, R12, R13, R14, R15, R16, X, Y или Z в каком-либо конкретном варианте реализации и/или пункте формулы изобретения, следует понимать, что каждый отдельный заместитель может быть исключен из данного конкретного варианта реализации и/или пункта формулы изобретения, и что остальной перечень заместителей следует считать входящим в сферу действия настоящего описания.
Термин «ацилокси» в данном контексте включает -ОС(O)-алкил, где алкил является таким, как определено в настоящем документе. Примеры ацилокси включают, но не ограничиваются ими: формилокси, ацетокси, пропионилокси, изобутирилокси, пивалоилокси и т.п.
Термин «ацилтио» в данном контексте относится к -SC(O)-алкилу, где алкил является таким, как определено в настоящем документе. Примеры ацилтио включают, но не ограничиваются ими: формилтио, ацетилтио, пропионилтио, изобутирилтио, пивалоилтио и т.п.
Термин «алкокси» в данном контексте относится к -O-алкилу, где алкил является таким, как определено в настоящем документе. Примеры алкила включают, но не ограничиваются ими: метокси, этокси, н-пропокси, изопропокси, н-бутокси, втор-бутокси, изобутокси, трет-бутокси, пентилокси, изопентилокси, трет-пентилокси, неопентилокси, 1-метилбутокси, 2-метилбутокси, н-гексилокси и т.п.
Термин «алкоксикарбонил» в данном контексте относится к -С(O)O-алкилу. Примеры алкоксикарбонила включают, но не ограничиваются ими: метоксикарбонил, этоксикарбонил, н-пропоксикарбонил, изопропоксикарбонил, н-бутоксикарбонил, втор-бутоксикарбонил, изобутоксикарбонил, трет-бутоксикарбонил, пентилоксикарбонил, изопентилоксикарбонил, трет-пентилоксикарбонил, неопентилоксикарбонил, 1-метилбутоксикарбонил, 2-метилбутоксикарбонил, н-гексилоксикарбонил и т.п.
Термин «алкенилдиил» в данном контексте относится к неразветвленному или разветвленному ненасыщенному углеводородному двухвалентному радикалу, содержащему указанное количество атомов углерода и одну или более двойных углерод-углеродных связей, например, C2-C6 алкенилдиил, C2-C4 алкенилдиил или С2 алкенилдиил. Примеры алкенилдиила включают, но не ограничиваются ими: этенилдиил, н-пропенилдиил, изопропенилдиил, н-бутенилдиил, втор-бутенилдиил, изобутенилдиил, трет-бутенилдиил, пентенилдиил, изопентенилдиил, трет-пентенилдиил, неопентенилдиил, 1-метилбутенилдиил, 2-метилбутенилдиил, н-гексенилдиил и т.п.
Термин «алкил» в данном контексте относится к неразветвленному или разветвленному насыщенному углеводородному радикалу, содержащему указанное количество атомов углерода, например, C1-C6 алкил, C1-C4 алкил или С2 алкил. Примеры алкила включают, но не ограничиваются ими: метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил, трет-бутил, пентил, изопентил, трет-пентил, неопентил, 1-метилбутил, 2-метилбутил, н-гексил и т.п.
Термин «алкилдиил» в данном контексте относится к неразветвленному или разветвленному насыщенному углеводородному двухвалентному радикалу, содержащему указанное количество атомов углерода, например, C1-C6 алкилдиил, C1-C4 алкилдиил или С2 алкилдиил. Примеры алкилдиила включают, но не ограничиваются ими: метилдиил, этилдиил, н-пропилдиил, изопропилдиил, н-бутилдиил, втор-бутилдиил, изобутилдиил, трет-бутилдиил, пентилдиил, изопентилдиил, трет-пентилдиил, неопентилдиил, 1-метилбутилдиил, 2-метилбутилдиил, н-гексилдиил и т.п.
Термин «алкиламино» в данном контексте относится к -NH-алкилу, где алкил является таким, как определено в настоящем документе. Примеры алкиламино включают, но не ограничиваются ими: метиламино, этиламино, н-пропиламино, изопропиламино, н-бутиламино, втор-бутиламино, изобутиламино, трет-бутиламино, пентиламино, изопентиламино, трет-пентиламино, неопентиламино, 1-метилбутиламино, 2-метилбутиламино, н-гексиламино и т.п.
Термин «алкилтио» в данном контексте относится к -S-алкилу, где алкил является таким, как определено в настоящем документе. Примеры алкилтио включают, но не ограничиваются ими: метилтио, этилтио, н-пропилтио, изопропилтио, н-бутилтио, втор-бутилтио, изобутилтио, трет-бутилтио, пентилтио, изопентилтио, трет-пентилтио, неопентилтио, 1-метилбутилтио, 2-метилбутилтио, н-гексилтио и т.п.
Термин «амино» в данном контексте относится к -NH2.
Термин «аминоциклоалкил» в данном контексте относится к циклоалкильной группе, замещенной одним амино-заместителем, где указанные термины являются такими, как определено в настоящем документе. Примеры аминоциклоалкила включают, но не ограничиваются ими: аминоциклопропил, аминоциклобутил, аминоциклопентил, аминоциклогексил и т.п.
Термин «аминоалкил» в данном контексте относится к алкильной группе, замещенной одним амино-заместителем, где указанные термины являются такими, как определено в настоящем документе. Примеры аминоалкила включают, но не ограничиваются ими: аминометил, аминоэтил, амино-н-пропил, амино-изопропил, амино-н-бутил, амино-втор-бутил, амино-изобутил, амино-трет-бутил, амино-пентил, амино-изопентил, амино-трет-пентил, амино-неопентил, амино-1-метилбутил, амино-2-метилбутил, амино-н-гексил и т.п.
Термин «аминоарил» в данном контексте относится к арильной группе, замещенной одним амино-заместителем, где указанные термины являются такими, как определено в настоящем документе. Примеры аминоарила включают, но не ограничиваются ими: аминофенил, аминонафталенил и т.п.
Термин «аминогетероциклил» в данном контексте относится к гетероциклильной группе, замещенной одним амино-заместителем, где указанные термины являются такими, как определено в настоящем документе. Примеры аминогетероциклила включают, но не ограничиваются ими: аминопирролидинил, аминопиперидинил и т.п.
Термин «арил» в данном контексте относится к радикалу, полученному из 6-12-членной моно- или бициклической углеводородной кольцевой системы, в которой по меньшей мере одно кольцо является ароматическим. Примеры арила включают, но не ограничиваются ими: фенил, нафталенил, 1,2,3,4-тетрагидронафталенил, 5,6,7,8-тетрагидронафталенил, инданил и т.п.
Термин «арилалкил» в данном контексте относится к алкильной группе, замещенной одним арильным заместителем, где указанные термины являются такими, как определено в настоящем документе. Примеры арилалкила включают, но не ограничиваются ими: бензил, фенетил, фенилпропил, нафталенилметил и т.п.
Термин «арилдиил» в данном контексте относится к двухвалентному радикалу, полученному из 6-12-членной моно- или бициклической углеводородной кольцевой системы, в которой по меньшей мере одно кольцо является ароматическим. Примеры арилдиила включают фенилдиил, нафталенилдиил, 1,2,3,4-тетрагидронафталенилдиил, 5,6,7,8-тетрагидронафталенилдиил, инданилдиил и т.п.
Термин «карбоксамид» в данном контексте относится к -C(O)NH2.
Термин «карбоксил» в данном контексте относится к -С(O)ОН.
Термин «циано» в данном контексте относится к -CN.
Термин «циклоалкил» в данном контексте относится к циклическому насыщенному углеводородному радикалу, содержащему указанное количество атомов углерода, например, С3-С7 алкил или C4-C7 алкилдиил. Примеры циклоалкила включают, но не ограничиваются ими: циклопропил, циклобутил, циклопентил, циклогексил и т.п.
Термин «циклоалкил-алкил» в данном контексте относится к алкильной группе, замещенной одним циклоалкильным заместителем, где указанные термины являются такими, как определено в настоящем документе. Примеры циклоалкил-алкила включают, но не ограничиваются ими: циклопропилметил, циклобутилметил, циклопентилметил, циклогексилметил, циклопропилэтил, циклобутилэтил, циклопентилэтил, циклогексилэтил и т.п.
Термин «циклоалкилдиил» в данном контексте относится к двухвалентному циклическому насыщенному углеводородному радикалу, содержащему указанное количество атомов углерода, например, С3-С7 циклоалкилдиил или C4-C7 алкилдиил. Примеры циклоалкилдиила включают, но не ограничиваются ими: циклопропилдиил, циклобутилдиил, циклопентилдиил, циклогексилдиил и т.п.
Термин «гуанидино» в данном контексте относится к -NH-C(=NH)-NH2.
Термин «галоген» в данном контексте относится к -F, -Cl, -Br и -I.
Термин «галогенацил» в данном контексте относится к -С(O)-галогеналкилу, где галогеналкил является таким, как определено в настоящем документе. Примеры галогенацила включают, но не ограничиваются ими: дифторацетил, трифторацетил, 3,3,3-трифторпропаноил, пентафторпропаноил и т.п.
Термин «галогеналкокси» в данном контексте относится к -O-галогеналкилу, где галогеналкил является таким, как определено в настоящем документе. Примеры галогеналкокси включают, но не ограничиваются ими: дифторметокси, трифторметокси, 2,2,2-трифторэтокси, пентафторэтокси и т.п.
Термин «галогеналкил» в данном контексте относится к алкильной группе, как определено в настоящем документе, замещенной одним или более атомами галогена. Полностью замещенный галогеналкил может быть представлен формулой CnL2n+1, где L представляет собой галоген. При наличии более одного атома галогена, они могут быть одинаковыми или различными и выбранными из группы, состоящей из F, Cl, Br и I. Примеры галогеналкильных групп включают, но не ограничиваются ими: фторметил, дифторметил, трифторметил, хлордифторметил, 2,2,2-трифторэтил, пентафторэтил и т.п.
Термин «гетероарил» в данном контексте относится к радикалу, полученному из 6-12-членной моно- или бициклической кольцевой системы, в которой по меньшей мере один кольцевой атом представляет собой гетероатом, и по меньшей мере одно кольцо является ароматическим. Примеры гетероатома включают, но не ограничиваются ими: О, S, N и т.п. Примеры гетероарила включают, но не ограничиваются ими: пиридил, бензофуранил, пиразинил, пиридазинил, пиримидинил, триазинил, хинолинил, бензоксазолил, бензотиазолил, 1H-бензимидазолил, изохинолинил, хиназолинил, хиноксалинил, пирролил, индолил, 1H-бензимидазол-2-ил, бензо[1,3]диоксол-5-ил, 3,4-дигидро-2H-бензо[1,4]оксазин-7-ил, 2,3-дигидробензофуран-7-ил, 2,3-дигидроиндол-1-ил и т.п.
Термин «гетероарил-алкил» в данном контексте относится к алкильной группе, замещенной одним гетероарильным заместителем, где указанные термины являются такими, как определено в настоящем документе. Примеры гетероарил-алкила включают, но не ограничиваются ими: пиридилметил, бензофуранилметил, пиразинилметил, пиридазинилметил, пиримидинилметил, триазинилметил, хинолинилметил, бензоксазолилметил, бензотиазолилметил, 1H-бензимидазолилметил, изохинолинилметил, хиназолинилметил, хиноксалинилметил, пирролилметил, индолилметил, 1Н-бензимидазол-2-илметил, бензо[1,3]диоксол-5-илметил, 3,4-дигидро-2H-бензо[1,4]оксазин-7-илметил, 2,3-дигидробензофуран-7-илметил, 2,3-дигидроиндол-1-илметил и т.п.
Термин «гетероарилдиил» в данном контексте относится к двухвалентному радикалу, полученному из 6-12-членной моно- или бициклической кольцевой системы, в которой по меньшей мере один кольцевой атом представляет собой гетероатом, и по меньшей мере одно кольцо является ароматическим. Примеры гетероатома включают, но не ограничиваются ими: О, S, N и т.п. Примеры гетероарилдиила включают, но не ограничиваются ими: тиазолилдиил, 2,4-тиазолилдиил, триазолилдиил, 1,2,3-триазолил-1,4-диил, пиридилдиил, бензофуранилдиил, пиразинилдиил, пиридазинилдиил, пиримидинилдиил, триазинилдиил, хинолинилдиил, бензоксазолилдиил, бензотиазолилдиил, 1H-бензимидазолилдиил, изохинолинилдиил, хиназолинилдиил, хиноксалинилдиил, пирролилдиил, индолилдиил, 1H-бензимидазол-2-илдиил, бензо[1,3]диоксол-5-диил, 3,4-дигидро-2H-бензо[1,4]оксазин-7-илдиил, 2,3-дигидробензофуран-7-илдиил, 2,3-дигидроиндол-1-илдиил и т.п. Примеры включают, но не ограничиваются ими: и т.п.
Термин «гетероциклил» в данном контексте относится к радикалу, полученному из 3-12-членной моно- или бициклической неароматической кольцевой системы, в которой по меньшей мере один кольцевой атом представляет собой гетероатом. Примеры гетероатома включают, но не ограничиваются ими: О, S, N и т.п. Гетероциклильный заместитель может быть присоединен через любой из доступных кольцевых атомов, например, кольцевой атом углерода или кольцевой атом азота. В некоторых вариантах реализации гетероциклильная группа представляет собой 3-, 4-, 5-, 6- или 7-членное кольцо. Примеры гетероциклильной группы включают, но не ограничиваются ими: азиридин-1-ил, азиридин-2-ил, азетидин-1-ил, азетидин-2-ил, азетидин-3-ил, пиперидин-1-ил, пиперидин-2-ил, пиперидин-3-ил, пиперидин-4-ил, морфолин-ил, морфолин-3-ил, морфолин-4-ил, пиперазин-1-ил, пиперазин-2-ил, пиперазин-3-ил, пиперазин-4-ил, пирролидин-1-ил, пирролидин-2-ил, пирролидин-3-ил, [1,3]-диоксолан-2-ил, тиоморфолин-4-ил, [1,4]оксазепан-4-ил, 1,1-диоксо-1λ6-тиоморфолин-4-ил, азепан-1-ил, азепан-2-ил, азепан-3-ил, азепан-4-ил, октагидрохинолин-1-ил, октагидроизохинолин-2-ил и т.п.
Термин «гетероциклил-алкил» в данном контексте относится к алкильной группе, замещенной одним гетероциклильным заместителем, где указанные термины являются такими, как определено в настоящем документе. Примеры гетероциклил-алкила включают, но не ограничиваются ими: азетидин-3-илметил, пиперидин-1-илметил, пиперидин-2-илметил, пиперидин-3-илметил, пиперидин-4-илметил, морфолин-2-илметил, морфолин-3-илметил, морфолин-4-илметил, пиперазин-1-илметил, пиперазин-2-илметил, пиперазин-3-илметил, пиперазин-4-илметил, пирролидин-1-илметил, пирролидин-2-илметил, пирролидин-3-илметил, [1,3]-диоксолан-2-илметил, тиоморфолин-4-илметил, [1,4]оксазепан-4-илметил, 1,1-диоксо-1λ6-тиоморфолин-4-илметил, азепан-1-илметил, азепан-2-илметил, азепан-3-илметил, азепан-4-илметил, октагидрохинолин-1-илметил, октагидроизохинолин-2-ил и т.п.
Термин «гетероциклилдиил» в данном контексте относится к двухвалентному радикалу, полученному из 3-12-членной моно- или бициклической неароматической кольцевой системы, в которой по меньшей мере один кольцевой атом представляет собой гетероатом. Примеры гетероатома включают, но не ограничиваются ими: О, S, N и т.п. Гетероциклилдиильный заместитель может быть присоединен через любые два из доступных кольцевых атомов, например, кольцевые атомы углерода или кольцевые атомы азота. В некоторых вариантах реализации гетероциклилдиильная группа представляет собой 3-, 4-, 5-, 6- или 7-членное кольцо. Примеры гетероциклилдиильной группы включают, но не ограничиваются ими: азиридин-1-илдиил, азиридин-2-илдиил, азетидин-1-илдиил, азетидин-2-илдиил, азетидин-3-илдиил, пиперидин-1-илдиил, пиперидин-2-илдиил, пиперидин-3-илдиил, пиперидин-4-илдиил, морфолин-2-илдиил, морфолин-3-илдиил, морфолин-4-илдиил, пиперазин-1-илдиил, пиперазин-2-илдиил, пиперазин-3-илдиил, пиперазин-4-илдиил, пирролидин-1-илдиил, пирролидин-2-илдиил, пирролидин-3-илдиил, [1,3]-диоксолан-2-илдиил, тиоморфолин-4-илдиил, [1,4]оксазепан-4-илдиил, 1,1-диоксо-1λ6-тиоморфолин-4-илдиил, азепан-1-илдиил, азепан-2-илдиил, азепан-3-илдиил, азепан-4-илдиил, октагидрохинолин-1-илдиил, октагидроизохинолин-2-илдиил и т.п.
Термин «гидроксил» в данном контексте относится к -ОН.
Термин «гидроксиалкил» в данном контексте относится к алкильной группе, замещенной одним гидроксильным заместителем, где указанные термины являются такими, как определено в настоящем документе. Примеры гидроксиалкила включают, но не ограничиваются ими: гидроксиметил, гидроксиэтил, гидрокси-н-пропил, гидрокси-изопропил, гидрокси-н-бутил, гидрокси-втор-бутил, гидрокси-изобутил, гидрокси-трет-бутил, гидроксипентил, гидрокси-изопентил, гидрокси-трет-пентил, гидрокси-неопентил, гидрокси-1-метилбутил, гидрокси-2-метилбутил, гидрокси-н-гексил и т.п.
Термин «нитро» в данном контексте относится к -NO2.
Термин «оксо» в данном контексте относится к =O.
Термин «тио» в данном контексте относится к -SH.
Термин «тиоалкил» в данном контексте относится к -S-алкилу, где алкил является таким, как определено в настоящем документе. Примеры включают, но не ограничиваются ими: метилтио, этилтио, н-пропилтио, изопропилтио, н-бутилтио, втор-бутилтио, изобутилтио, трет-бутилтио, пентилтио, изопентилтио, трет-пентилтио, неопентилтио, 1-метилбутилтио, 2-метилбутилтио, н-гексилтио и т.п.
В данном контексте «замещенный» означает, что по меньшей мере один атом водорода химической группы замещен неводородным заместителем или группой, где неводородный заместитель или группа может быть одновалентной или двухвалентной. Если заместитель или группа является двухвалентной, то следует понимать, что указанная группа дополнительно замещена другим заместителем или группой. Если химическая группа в данном контексте является «замещенной», то она может иметь такое количество замещений, которое соответствует полному значению валентностей; например, метильная группа может быть замещена 1, 2 или 3 заместителями, метиленовая (метилдиильная) группа может быть замещена 1 или 2 заместителями, фенильная группа может быть замещена 1, 2, 3, 4 или 5 заместителями, нафтильная группа может быть замещена 1, 2, 3, 4, 5, 6 или 7 заместителями и т.п. Аналогично, «замещенный одним или более заместителями» относится к замещению группы таким количеством заместителей, которое составляет от одного до общего количества заместителей, физически допустимых в такой группе. Кроме того, если группа замещена более чем одной группой, то они могут быть одинаковыми, или они могут быть различными.
Соединения, описанные в настоящем документе, могут включать также таутомерные формы, такие как кето-енольные таутомеры и т.п. Таутомерные формы могут находиться в равновесии или быть стерически заблокированы в одной форме с использованием подходящего замещения. Следует понимать, что различные таутомерные формы входят в объем соединений согласно настоящему изобретению.
Следует понимать и учитывать, что соединения Формулы I и формул, связанных с ней, могут иметь один или более хиральных центров, и, следовательно, могут существовать в виде энантиомеров и/или диастереоизомеров. Следует понимать, что настоящее изобретение включает и охватывает все такие энантиомеры, диастереоизомеры и их смеси, включая, но не ограничиваясь ими, рацематы. Следует понимать, что соединения Формулы I и формул, используемых в тексте настоящего описания, предназначены для репрезентации всех отдельных энантиомеров и их смесей, если не указано или не показано иное.
Термин «защитная группа» в данном контексте относится к подвижному химическому фрагменту, который известен в данной области техники для защиты реакционноспособных групп, включая, без ограничения, гидроксильные и аминогруппы, от нежелательных реакций во время синтеза. Гидроксильные и аминогруппы, защищенные защитной группой, в настоящем документе упомянуты как «защищенные гидроксильные группы» и «защищенные аминогруппы», соответственно. Защитные группы, как правило, используют селективно и/или ортогонально для защиты определенных центров во время реакций на других реакционноспособных центрах, и они могут быть затем удалены с образованием незащищенной группы как таковой или для обеспечения ее доступности для дальнейших реакций. Защитные группы, известные в данной области техники, описаны, в целом, в публикации Greene and Wuts, Protective Groups in Organic Synthesis, 3-е издание, John Wiley & Sons, Нью-Йорк (1999). Группы могут быть селективно внедрены в соединения согласно настоящему описанию в виде предшественников. Например, аминогруппа может быть внедрена в соединение, описанное в настоящем документе, в виде азидогруппы, которая может быть химически преобразована в аминогруппу в требуемой точке синтеза. Как правило, группы являются защищенными или присутствуют в виде предшественника, который инертен в реакциях, модифицирующих другие области исходной молекулы, для превращения их в конечные группы в подходящее время. Дополнительные иллюстративные защитные группы или группы-предшественники описаны в публикации Agrawal, et al., Protocols for Oligonucleotide Conjugates, ред., Humana Press; Нью-Джерси, 1994; том 26, сс. 1 72. Примеры «гидроксил-защитных групп» включают, но не ограничиваются ими, трет-бутил, трет-бутоксиметил, метоксиметил, тетрагидропиранил, 1-этоксиэтил, 1-(2-хлорэтокси)этил, 2-триметилсилилэтил, п-хлорфенил, 2,4-динитрофенил, бензил, 2,6-дихлорбензил, дифенилметил, п-нитробензил, трифенилметил, триметилсилил, триэтилсилил, трет-бутилдиметилсилил, трет-бутилдифенилсилил (TBDPS), трифенилсилил, бензоилформиат, ацетат, хлорацетат, трихлорацетат, трифторацетат, пивалоат, бензоат, п-фенилбензоат, 9-флуоренилметилкарбонат, мезилат и тозилат.Примеры «амино-защитных групп» включают, но не ограничиваются ими, карбамат-защитные группы, такие как 2-триметилсилилэтоксикарбонил (Теос), 1-метил-1-(4-бифенилил)этоксикарбонил (Врос), трет-бутоксикарбонил (ВОС), аллилоксикарбонил (Alloc), 9-флуоренилметилоксикарбонил (Fmoc) и бензилоксикарбонил (Cbz); амид-защитные группы, такие как формил, ацетил, тригалогенацетил, бензоил и нитрофенилацетил; сульфонамид-защитные группы, такие как 2-нитробензолсульфонил; и иминные и циклические имидные защитные группы, такие как фталимидо и дитиасукциноил.
«Пролекарство» в данном контексте относится к соединению, которое может быть превращено в физиологических условиях или посредством сольволиза в биологически активное соединение, описанное в настоящем документе. Таким образом, термин «пролекарство» относится к метаболическому предшественнику соединения, описанного в настоящем документе, который является фармацевтически приемлемым. Пролекарство может быть неактивным при введении субъекту, нуждающемуся в этом, но превращается in vivo в активное соединение, описанное в настоящем документе. В одном из вариантов реализации пролекарство быстро преобразуется in vivo с образованием исходного соединения, описанного в настоящем документе, например, посредством гидролиза в крови. В одном из вариантов реализации пролекарство может быть стабильным в плазме или крови. В одном из вариантов реализации пролекарство может представлять собой форму направленного действия соединения, описанного в настоящем документе. Соединение-пролекарство зачастую обладает преимуществом растворимости, совместимости с тканью или отсроченного высвобождения в организме млекопитающего (см. Bundgard, H., Design of Prodrugs (1985), сс. 7 9, 21 24 (Elsevier, Амстердам)). Описание пролекарств представлено в публикации Higuchi, Т., et al., А. С. S. Symposium Series, том 14, и в публикации Bioreversible Carriers in Drug Design, ред. Edward В. Roche, American Pharmaceutical Association and Pergamon Press, 1987.
Термин «пролекарство» включает любые ковалентно связанные носители, которые высвобождают активное соединение, описанное в настоящем документе, in vivo при введении такого пролекарства млекопитающему субъекту. Конъюгаты, включая ADC, описанные в настоящем документе, представляют собой такие пролекарства соединений, описанных в настоящем документе. Пролекарства соединения, описанного в настоящем документе, могут быть получены модификацией функциональных групп, присутствующих в соединении, описанном в настоящем документе, таким образом, что указанные модификации расщепляются посредством стандартной обработки или in vivo с образованием исходного соединения, описанного в настоящем документе. Пролекарства включают соединения, описанные в настоящем документе, в которых гидроксильные, амино или меркапто-группы связаны с любой группой, которая при введении пролекарства соединения, описанного в настоящем документе, млекопитающему субъекту, расщепляется с образованием свободной гидроксильной группы, свободной аминогруппы или свободной меркапто-группы, соответственно. Примеры пролекарств включают, но не ограничиваются ими, ацетатные, формиатные и бензоатные производные спиртовых функциональных групп и амидные производные аминных функциональных групп в соединениях, описанных в настоящем документе, и т.п.
Настоящее описание включает также все соединения, описанные в настоящем документе, с изотопной меткой, имеющие один или более атомов, замещенных на атом, имеющий другую атомную массу или массовое число. Примеры изотопов, которые могут быть введены в описанные соединения, включают изотопы водорода, углерода, азота, кислорода, фосфора, фтора, хлора и йода, такие как 2H, 3H, 11С, 13С, 14С, 13N, 15N, 15O, 17O, 18О, 31Р, 32Р, 35S, 18F, 36Cl, 123I и 125I, соответственно. Указанные соединения с радиоактивной меткой пригодны для облегчения определения или измерения эффективности соединений, посредством характеристики, например, места или способа действия или аффинности связывания с фармакологически важным местом действия. Некоторые соединения с изотопной меткой, описанные в настоящем документе, например, соединения, содержащие радиоактивный изотоп, пригодны для анализов распределения лекарства и/или субстрата в тканях. Радиоактивные изотопы тритий, т.е. 3Н, и углерод-14, т.е. 14С, являются особенно удобными для этой цели в связи с простотой их внедрения и наличием готовых средств обнаружения.
Замещение более тяжелыми изотопами, такими как дейтерий, т.е. 2H, может обеспечивать некоторые терапевтические преимущества в результате более высокой метаболической устойчивости, например, увеличение периода полувыведения in vivo или снижение необходимых доз, и, следовательно, может быть предпочтительным в некоторых обстоятельствах.
Замещения позитрон-излучающими изотопами, такими как 11С, 18F, 15O и 13N, могут быть применимы в исследованиях позитрон-эмиссионной томографии (ПЭТ) для изучения занятости рецепторов субстратом. Меченные изотопами соединения, описанные в настоящем документе, как правило, могут быть получены обычными способами, известными специалистам в данной области техники, или способами, аналогичными способам, которые описаны в представленных ниже разделах «Способы получения» и «Примеры», с применением соответствующих меченных изотопом реагентов вместо реагентов без изотопной метки, используемых ранее.
Настоящее описание включает также in vivo метаболические продукты описанных соединений. Такие продукты могут быть образованы, например, в результате окисления, восстановления, гидролиза, амидирования, эстерификации и т.п. введенного соединения, главным образом, вследствие ферментативных процессов. Соответственно, настоящее описание включает соединения, полученные способом, включающим введение соединения согласно настоящему описанию млекопитающему в течение периода времени, достаточного для получения его метаболического продукта. Такие продукты, как правило, идентифицируют посредством введения радиоактивно меченного соединения, описанного в настоящем документе, в обнаруживаемой дозе животному, такому как крыса, мышь, морская свинка, обезьяна, или человеку, обеспечения достаточного времени для протекания метаболизма и выделения продуктов его превращения из мочи, крови или других биологических образцов.
«Стабильное соединение» и «стабильная структура» в данном контексте относятся к соединению, которое является достаточно прочным, чтобы выдерживать выделение из реакционной смеси до подходящей степени чистоты, и составление в композицию эффективного терапевтического агента.
Прочие определения
Термин «антитело» в данном контексте использован в самом широком смысле и включает, в частности, интактные моноклональные антитела, поликлональные антитела, полиспецифические антитела (например, биспецифические антитела), полученные из по меньшей мере двух интактных антител, и фрагменты антител, при условии, что они проявляют желательную биологическую активность. Термин «антитело» относится к полноразмерной молекуле иммуноглобулина или функционально активной части полноразмерной молекулы иммуноглобулина, т.е. к молекуле, которая содержит антигенсвязывающий сайт, который иммуноспецифически связывается с антигеном рассматриваемой мишени или ее части. Иммуноглобулин, описанный в настоящем документе, может быть любого типа (например, IgG, IgE, IgM, IgD и IgA), класса (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2) или подкласса молекулы иммуноглобулина. Иммуноглобулин может быть получен из любых видов. В одном аспекте Иммуноглобулин имеет человеческое, мышиное или кроличье происхождение. В другом аспекте антитела представляют собой поликлональные, моноклональные, полиспецифические {например, биспецифические), человеческие, гуманизированные или химерные антитела, линейные антитела, одноцепочечные антитела, диатела, макситела, минитела, Fv, фрагменты Fab, фрагменты F(ab'), фрагменты F(ab')2, фрагменты, полученные с помощью экспрессионной библиотеки Fab, анти-идиотипические (анти-Id) антитела, CDR и эпитоп-связывающие фрагменты любых из вышеперечисленных, которые иммуноспецифически связываются с антигеном-мишенью.
Термин «моноклональное антитело» в данном контексте относится к антителу, полученному из популяции по существу однородных антител, т.е. отдельные антитела, образующие популяцию, являются идентичными, за исключением возможных природных мутаций, которые могут присутствовать в незначительных количествах. Моноклональные антитела включают «химерные» антитела, в которых часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям в антителах, полученных из конкретных видов или принадлежащих конкретному классу или подклассу антител, тогда как остальная часть цепи(-ей) идентична или гомологична соответствующим последовательностям в антителах, полученных из другого вида или принадлежащих другому классу или подклассу антител, а также фрагменты таких антител (см., например, патент США №4816567; и Morrison et al., 1984, Proc. Natl. Acad. Sci. USA 81: 6851-6855). Моноклональные антитела включают также гуманизированные антитела, которые могут содержать полностью человеческую константную область и CDR нечеловеческого происхождения.
«Интактное» антитело представляет собой антитело, которое содержит антигенсвязывающую вариабельную область, а также константный домен легкой цепи (CL) и константные домены тяжелой цепи. CH1, CH2 и CH3. Константные домены могут быть константными доменами нативной последовательности (например, константные домены нативной последовательности человека) или их вариантами аминокислотной последовательности.
Интактное антитело может иметь одну или более «эффекторных функций», которые относятся к тем видам биологической активности, которые присущи Fc-области (Fc-области нативной последовательности или варианта аминокислотной последовательности Fc-области) антитела. Примеры эффекторных функций антител включают связывание C1q; комплемент-зависимую цитотоксичность (CDC); связывание с рецептором Fc; антитело-зависимую клеточно-опосредованную цитотоксичность (ADCC); фагоцитоз; подавление рецепторов поверхности клетки (например, рецептора В-клеток; BCR), и т.д. В некоторых вариантах реализации антитело не проявляет эффекторной функции.
«Фрагменты антитела» содержат часть интактного антитела, предпочтительно содержащую его антиген-связывающую или вариабельную область. Примеры фрагментов антител включают фрагменты Fab, Fab', F(ab')2 и Fv; диатела; линейные антител; молекулы одноцепочечных антител; макситела; минитела; и полиспецифические антитела, образованные из фрагмента(-ов) антител.
«Выделенное» антитело представляет собой антитело, идентифицированное и отделенное и/или извлеченное из компонентов его природного окружения. Загрязняющие компоненты среды, окружающей его в природе, представляют собой материалы, которые могут помешать применению антитела для диагностических или терапевтических целей, и могут включать ферменты, гормоны и другие белковые или небелковые растворенные вещества. В некоторых вариантах реализации антитело очищают (1) до более 95% по массе антитела, согласно методике Лоури, и наиболее предпочтительно - до более 99% по массе, (2), до степени, достаточной для получения по меньшей мере 15 остатков N-концевой или внутренней аминокислотной последовательности посредством использования секвенатора с вращающейся чашкой, или (3) до однородности согласно электрофорезу в ДСН-ПААГ в востановливающих или невосстанавливающих условиях с использованием красителя Кумасси синего или предпочтительно окрашивания серебром. Выделенное антитело включает антитело in situ в рекомбинантных клетках, поскольку по меньшей мере один из компонентов природной среды антитела отсутствует. При этом, как правило, выделенное антитело получают с использованием по меньшей мере одного этапа очистки.
Антитело, «которое связывает» рассматриваемый антиген, представляет собой антитело, способное к связыванию указанного антигена с достаточной аффинностью, так что указанное антитело можно использовать при целевом воздействии на клетку, экспрессирующую антиген.
Полипептид «нативной последовательности» представляет собой полипептид, который имеет такую же аминокислотную последовательность, как полипептид природного происхождения. Такие полипептиды с нативной последовательностью могут быть выделены из природы или могут быть получены рекомбинантными или синтетическими способами. Таким образом, полипептид с нативной последовательностью может иметь аминокислотную последовательность природного человеческого полипептида, мышиного полипептида или полипептида из любого другого вида млекопитающих.
Термин «внутриклеточный метаболит» относится к соединению, полученному в результате метаболического процесса или реакции внутри клетки, протекающей с участием композиции, описанной в настоящем документе (например, конъюгата антитела с лекарственным препаратом (ADC)). Метаболический процесс или реакция может представлять собой ферментативный процесс, такой как протеолитическое расщепление пептидного линкера рассматриваемой композиции, или гидролиз функциональной группы, такой как гидразон, сложный эфир или амид, в рассматриваемой композиции. В контексте конъюгатов, включая ADC, внутриклеточные метаболиты включают, но не ограничиваются ими, антитела и свободное лекарство, которые разделены внутриклеточно, т.е. после проникновения, диффузии, поглощения или транспортировки в клетку (например, посредством ферментативного расщепления ADC под действием внутриклеточного фермента).
В контексте конъюгатов, включая ADC, термины «расщепленный внутриклеточно» и «внутриклеточное расщепление» относятся к метаболическим процессам или реакциям внутри клетки, протекающим с участием композиции, описанной в настоящем документе, в результате которых разрушается ковалентная связь, например, линкер (L), между лекарственным фрагментом (D) и направляющим фрагментом (Т) (например, антителом) с образованием свободного лекарства, диссоциированного из (Т) внутри клетки. Таким образом, в одном из вариантов реализации расщепленные фрагменты рассматриваемых композиций представляют собой внутриклеточные метаболиты (например, Т, фрагмент Т-L, фрагмент D-L и D). Соответственно, в одном из вариантов реализации настоящего изобретения предложены композиции, которые представляют собой продукты расщепления композиции Формулы II, и указанные продукты расщепления содержат композиции, содержащие соединения Формулы I.
Термин «внеклеточное расщепление» относится к метаболическому процессу или реакции за пределами клетки, протекающим с участием композиции, описанной в настоящем документе, в результате которых разрушается ковалентная связь, например, линкер (L), между лекарственным фрагментом (D) и направляющим фрагментом (Т) (например, антителом) с образованием свободного лекарства, диссоциированного из (Т) вне клетки. Таким образом, в одном из вариантов реализации расщепленные фрагменты рассматриваемых композиций представляют собой внеклеточные метаболиты (например, Т, фрагмент T-L, фрагмент D-L и D), которые могут двигаться внутри клетки вследствие диффузии и клеточной проницаемости или транспорта. Соответственно, в одном из вариантов реализации настоящего изобретения предложены композиции, которые представляют собой продукты расщепления композиции Формулы II, и указанные продукты расщепления содержат композиции, содержащие соединения Формулы I.
«Млекопитающее» включает людей, а также одомашненных животных, таких как лабораторные животные и домашние животные (например, кошки, собаки, свиньи, крупный рогатый скот, овцы, козы, лошади, кролики) и не одомашненных животных, таких как дикие животные, и т.п.
«Необязательный» или «необязательно» означает, что описанное далее событие или обстоятельство не обязательно должно иметь место, и что описание включает случаи, когда указанное событие или обстоятельство имеет место, и случаи, когда их нет. Например, «необязательно замещенный арил» означает, что арильный заместитель может быть или не быть замещенным, и что описание включает замещенные арильные заместители и арильные заместители без замещения.
«Фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество» включает, без ограничения, любой адъювант, носитель, вспомогательное вещество, скользящий агент, подсластитель, разбавитель, консервант, краситель/красящее вещество, усилитель вкуса, поверхностно-активное вещество, смачивающий агент, диспергирующий агент, суспендирующий агент, стабилизатор, изотонический агент, растворитель или эмульгатор, одобренный Управлением по контролю качества продуктов питания и лекарственных средств США (или другим аналогичным регулирующим органом другой юрисдикции) как приемлемый для применения у людей или домашних животных.
«Фармацевтически приемлемая соль» включает соли присоединения кислот и оснований.
«Фармацевтически приемлемая соль присоединения кислоты» относится к солям, которые сохраняют биологическую эффективность и свойства свободных оснований, которые не являются биологически или иным образом нежелательными и которые образованы с неорганическими кислотами, такими как, но не ограничиваясь ими, хлористоводородная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и т.п., и органическими кислотами, такими как, но не ограничиваясь ими, уксусная кислота, 2,2-дихлоруксусная кислота, адипиновая кислота, альгиновая кислота, аскорбиновая кислота, аспарагиновая кислота, бензолсульфоновая кислота, бензойная кислота, 4-ацетамидобензойная кислота, камфорная кислота, камфор-10-сульфоновая кислота, каприновая кислота, капроновая кислота, каприловая кислота, угольная кислота, коричная кислота, лимонная кислота, цикламиновая кислота, додецилсерная кислота, этан-1,2-дисульфоновая кислота, этансульфоновая кислота, 2-гидроксиэтансульфоновая кислота, муравьиная кислота, фумаровая кислота, галактаровая кислота, гентизиновая кислота, глюкогептоновая кислота, глюконовая кислота, глюкуроновая кислота, глутаминовая кислота, глутаровая кислота, 2-оксоглутаровая кислота, глицерофосфорная кислота, гликолевая кислота, гиппуровая кислота, изомасляная кислота, молочная кислота, лактобионовая кислота, лауриновая кислота, малеиновая кислота, яблочная кислота, малоновая кислота, миндальная кислота, метансульфоновая кислота, муциновая кислота, нафталин-1,5-дисульфоновая кислота, нафталин-2-сульфоновая кислота, 1-гидрокси-2-нафтойная кислота, никотиновая кислота, олеиновая кислота, оротовая кислота, щавелевая кислота, пальмитиновая кислота, памоевая кислота, пропионвоая кислота, пироглутаминовая кислота, пировиноградная кислота, салициловая кислота, 4-аминосалициловая кислота, себациновая кислота, себациновая кислота, янтарная кислота, винная кислота, тиоциановая кислота, п-толуолсульфоновая кислота, трифторуксусная кислота, ундециленовая кислота и т.п.
«Фармацевтически приемлемая соль присоединения основания» относится к солям, которые сохраняют биологическую эффективность и свойства свободных кислот, которые не являются биологически или иным образом нежелательными. Указанные соли получают посредством присоединения неорганического основания или органического основания к свободной кислоте. Соли, полученные из неорганических оснований, включают, но не ограничиваются ими, соли натрия, калия, лития, аммония, кальция, магния, железа, цинка, меди, марганца, алюминия и т.п. Предпочтительные неорганические соли представляют собой соли аммония, натрия, калия, кальция и магния. Соли, полученные из органических оснований, включают, но не ограничиваются ими, соли первичных, вторичных и третичных аминов, замещенных аминов, включая природные замещенные амины, циклических аминов и основных ионообменных смол, такие как соли аммония, изопропиламина, триметиламина, диэтиламина, триэтиламина, трипропиламина, диэтаноламина, этаноламина, динола, 2-диметиламиноэтанола, 2-диэтиламиноэтанола, дициклогексиламина, лизина, аргинина, гистидина, кофеина, прокаина, гидрабамина, холина, бетаина, бенетамина, бензатина, этилендиамина, глюкозамина, метилглюкамина, теобромина, триэтаноламина, трометамина, пуринов, пиперазина, пиперидина, N-этилпиперидина, полиаминных смол и т.п. Особенно предпочтительные органические основания представляют собой изопропиламин, диэтиламин, этаноламин, триметиламин, дициклогексиламин, холин и кофеин.
Зачастую в результате кристаллизации получают сольват соединения, описанного в настоящем документе. В данном контексте термин «сольват» относится к агрегату, который содержит одну или более молекул соединения, описанного в настоящем документе, с одной или более молекул растворителя. Растворитель может быть водой, и в таком случае сольват может быть гидратом. В альтернативном варианте растворитель может быть органическим растворителем. Таким образом, соединения согласно настоящему описанию могут существовать в виде гидрата, включая моногидрат, дигидрат, полугидрат, полуторагидрат, тригидрат, тетрагидрат и т.п., а также в соответствующих сольватированных формах. Соединение, описанное в настоящем документе, может представлять собой истинные сольваты, тогда как в других случаях соединение, описанное в настоящем документе, может лишь сохранять привнесенную воду или может представлять собой смесь воды и некоторого количества привнесенного растворителя.
«Фармацевтическая композиция» относится к композиции соединения, описанного в настоящем документе, и среды, как правило, признанной в данной области техники для доставки биологически активного соединения млекопитающим, например, людям. Такая среда включает все фармацевтически приемлемые носители, разбавители или вспомогательные вещества для них.
Неограничивающие примеры расстройств, подлежащих лечению согласно настоящему описанию, включают доброкачественные и злокачественные опухоли; лейкоз и лимфоидные злокачественные заболевания, в частности, рак молочной железы, яичников, желудка, эндометрия, слюнной железы, легких, почек, толстой кишки, щитовидной железы, поджелудочной железы, предстательной железы или мочевого пузыря; нейрональные, глиальные, астроцитальные, гипоталамические и другие гландулярные, макрофагальные, эпителиальные, стромальные и бластоцельные расстройства, аутоиммунные заболевания, воспалительные заболевания, фиброз и инфекционные заболевания. С учетом характеристик и, в частности, эффективности рассматриваемых композиций, специалистам в данной области техники станет понятно, что соединения, описанные в настоящем документе, могут быть показаны для применения для лечения любого заболевания, при котором желательно возникновение цитотоксического действия или цитотоксического эффекта на клетку-мишень.
В одном из вариантов реализации композиции, описанные в настоящем документе, используют для лечения аутоиммунного заболевания. Антитела, иммуноспецифические к антигену клетки, которая отвечает за выработку аутоиммунных антител, могут быть приобретены у любой организации (например, у ученого сотрудника университета или у компании, такой как Genentech) или могут быть получены любым способом, известным специалистам в данной области техники, таким как, например, химический синтез или технология рекомбинантной экспрессии. В другом варианте реализации подходящие лигандные антитела, которые являются иммуноспецифическими для лечения аутоиммунных заболеваний, включают, но не ограничиваются ими: анти-нуклеарное антитело; анти-дцДНК; анти-оцДНК, анти-кардиолипиновое антитело IgM, IgG; анти-фосфолипидное антитело IgM, IgG; анти-SM антитело; анти-митохондриальное антитело; тиреоидное антитело; микросомальное антитело; антитело к тиреоглобулину; анти-SCL-70; анти-Jo; анти-U1RNP; анти-La/SSB; анти-SSA; анти-SSB; антитела к париетальным клеткам; анти-гистоны; анти-RNP; C-ANCA; P-ANCA; анти-центромер; анти-фибриллярин и анти-GBM антитело. В некоторых предпочтительных вариантах реализации антитела, пригодные в способах согласно настоящему изобретению, могут связываться с рецептором или рецепторным комплексом, экспрессируемым на активированном лимфоците.
Рецептор или рецепторный комплекс может содержать член суперсемейства гена иммуноглобулина, член суперсемейства рецептора TNF, интегрин, цитокиновый рецептор, хемокиновый рецептор, главный белок гистосовместимости, лектин или белок, регулирующий комплемент. Неограничивающие примеры подходящих членов суперсемейства иммуноглобулина представляют собой CD2, CD3, CD4, CD8, CD19, CD22, CD28, CD79, CD90, CD152/CTLA-4, PD-1 и ICOS.
Неограничивающие примеры подходящих членов суперсемейства рецептора TNF представляют собой CD27, CD40, CD95/Fas, CD134/OX40, CD137/4-1BB, TNF-R1, TNFR-2, RANK, TACI, BCMA, остеопротегерин, Apo2/TRAIL-R1, TRAIL-R2, TRAIL-R3, TRAIL-R4 и АРО-3. Неограничивающие примеры подходящих интегринов представляют собой CD1 la, CD1lb, CD11c, CD18, CD29, CD41, CD49a, CD49b, CD49c, CD49d, CD49e, CD49f, CD103 и CD104. Неограничивающие примеры подходящих лектинов представляют собой лектин С типа, S типа и I типа.
В одном из вариантов реализации лиганд представляет собой антитело, которое связывается с активированным лимфоцитом, связанным с аутоиммунным заболеванием.
Иммунологические заболевания, которые характеризуется патологической активацией иммунных клеток и которые можно лечить или предупреждать способами, описанными в настоящем документе, могут быть классифицированы, например, по типу(-ам) реакции(-ий) сверхчувствительности, которые являются первопричиной расстройства. Указанные реакции обычно разделяют на четыре типа: анафилактические реакции, цитотоксические (цитолитические) реакции, реакции иммунного комплекса или реакции клеточно-опосредованного иммунитета (CMI) (также называемые реакциями сверхчувствительности замедленного типа (DTH)). (см., например, Fundamental Immunology (William E. Paul ред., Raven Press, Нью-Йорк, 3-е изд. 1993)).
Конкретные примеры таких иммунологических заболеваний включают следующие: ревматоидный артрит, аутоиммунные демиелинативные заболевания (например, рассеянный склероз, аллергический энцефаломиелит), эндокринная офтальмопатия, увеоретинит, системная красная волчанка, миастения гравис, болезнь Грейвса, гломерулонефрит, аутоиммунное гепатологическое расстройство, воспалительная болезнь кишечника (например, болезнь Крона), анафилаксия, аллергическая реакция, синдром Шегрена, сахарный диабет I типа, первичный билиарный цирроз, гранулематоз Вегенера, фибромиалгия, полимиозит, множественная эндокринная недостаточность, синдром Шмидта, аутоиммунный увеит, болезнь Аддисона, адреналит, тиреоидит, тиреоидит Хашимото, аутоиммунная болезнь щитовидной железы, пернициозная анемия, желудочная атрофия, хронический гепатит, люпоидный гепатит, атеросклероз, подострая кожная красная волчанка, гипопаратиреоз, синдром Дресслера, аутоиммунная тромбоцитопения, идиопатическая тромбоцитопеническая пурпура, гемолитическая анемия, обыкновенная пузырчатка, пузырчатка, герпетиформный дерматит, очаговая алопеция, пемфигоид, склеродермия, прогрессирующий системный склероз, синдром CREST (кальциноз, виброболезнь Рейно, пищеводная дискинезия, склеродактилия и телеангиэктазия), мужское и женское аутоиммунное бесплодие, анкилозирующий спондилит, неспецифический язвенный колит, смешанное поражение соединительной ткани, нодозный полиартериит, системный некротизирующий васкулит, атопический дерматит, атопический ринит, синдром Гудпасчера, болезнь Шагаса, саркоидоз, острая ревматическая лихорадка, астма, привычный выкидыш, антифосфолипидный синдром, аллергический альвеолит у сельскохозяйственных рабочих, мультиформная эритема, посткардиотомный синдром, синдром Кушинга, аутоиммунный хронический активный гепатит, легочная аллергия птицеводов, токсический эпидермальный некролиз, синдром Альпорта, альвеолит, аллергический альвеолит, фиброзирующий альвеолит, интерстициальная легочная болезнь, узелковая эритема, гангренозная пиодермия, трансфузионная реакция, артериит Такаясу, ревматическая полимиалгия, темпоральный артериит, шистосомиаз, гигантоклеточный артериит, аскаридоз, аспергиллез, синдром Самптера, экзема, лимфоматоидный гранулематоз, болезнь Бехчета, синдром Капалана, болезнь Кавасаки, денье, энцефаломиелит, эндокардит, эндомиокардиальный фиброз, эндофтальмит, стойкая возвышающаяся эритема, псориаз, эритробластоз плода, эозинофильный фасциит, синдром Шульмана, синдром Фелти, филяриоз, циклит, хронический циклит, гетерохронический циклит, циклит Фукса, нефропатия IgA, пурпура Геноха-Шенлейна, болезнь «трансплантат против хозяина», отторжение трансплантата, кардиомиопатия, синдром Итона-Ламберта, рецидивирующий полихондрит, криоглобулинемия, макроглобулинемия Вальденстрема, синдром Эвана и аутоиммунная гонадная дисфункция. Соответственно, способы, описанные в настоящем документе, включают лечение расстройств В-лимфоцитов (например, системной красной волчанки, синдрома Гудпасчера, ревматоидного артрита и диабета I типа), Th1-лимфоцитов (например, ревматоидного артрита, рассеянного склероза, псориаза, синдрома Шегрена, тиреоидита Хашимото, болезни Грейвса, первичного билиарного цирроза, гранулематоза Вегенера, туберкулеза или острой болезни «трансплантат против хозяина» или Th2-лимфоцитов (например, атопического дерматита, системной красной волчанки, атонической астмы, риноконъюнктивита, аллергического ринита, синдрома Оменна, системного склероза или хронической болезни «трансплантат против хозяина»). В целом, расстройства, затрагивающие дендритные клетки, включают расстройства Th1-лимфоцитов или Th2-лимфоцитов.
В некоторых вариантах реализации иммунологическое расстройство опосредовано Т-клетками, которые могут включать активированные Т-клетки. ADC или производные ADC могут быть введены для уменьшения количества таких активированных Т-клеток.
В одном из вариантов реализации композиции, описанные в настоящем документе, могут быть использованы для лечения фиброза. Фиброз может возникать во многих тканях организма, обычно в результате воспаления или повреждения, примеры включают, но не ограничиваются ими: в легких - легочный фиброз, идиопатический легочный фиброз, кистозный фиброз; в печени - цирроз; в сердце - эндомиокардиальный фиброз, перенесенный инфаркт миокарда, атриальный фиброз; в других органах медиастинальный фиброз (мягкая ткань средостения), миелофиброз (костный мозг), ретроперитонеальный фиброз (мягкая ткань забрюшинного пространства), массивный прогрессивный фиброз (легкие); осложнение пневмокониоза шахтеров, нефрогенный системный фиброз (кожа), болезнь Крона (кишечник), келоид (кожа), склеродермия/системный склероз (кожа, легкие), артрофиброз (колени, плечи, другие суставы), болезнь Пейрони (пенис), контрактура Дюпюитрена (руки, пальцы) и некоторые формы адгезивного капсулита (плечи).
В отношении инфекционного заболевания, композиции, описанные в настоящем документе, могут быть использованы непосредственно в отношении инфекционных агентов или патогенов или могут быть использованы для оказания цитостатического или цитотоксического эффекта в отношении клетки-хозяина, несущей или иным образом обеспечивающей инфекционный агент или патоген.
«Эффективное количество» или «терапевтически эффективное количество» относится к такому количеству соединения, описанного в настоящем документе, которое при введении млекопитающему, предпочтительно человеку, является достаточным для эффективного лечения, как определено ниже, конкретного показания (например, раковых или опухолевых клеток у млекопитающего, предпочтительно человека). Количество соединения, описанного в настоящем документе, которое составляет «терапевтически эффективное количество» варьируется в зависимости от соединения, патологического состояния и его тяжести, способа введения и возраста млекопитающего, подлежащего лечению, но может быть стандартным образом определено специалистом в данной области техники с учетом его личных знаний и предложенного описания.
«Лечить» или «лечение» в данном контексте включает лечение рассматриваемого заболевания или патологического состояния у млекопитающего, предпочтительно человека, страдающего от рассматриваемого заболевания или патологического состояния, и включает:
(i) предупреждение возникновения заболевания или патологического состояния у млекопитающего, в частности, если такое млекопитающее предрасположено к патологическому состоянию, но у него еще не диагностировано его наличие;
(ii) подавление заболевания или патологического состояния, т.е. остановку его развития;
(iii) облегчение заболевания или патологического состояния, т.е. инициацию регрессии заболевания или патологического состояния; или
(iv) облегчение симптомов, возникающих в результате заболевания или патологического состояния, т.е. облегчение боли без направленного воздействия на первопричинное заболевание или патологическое состояние.
Терапевтически эффективное количество соединение в отношении лечения рака может снижать количество раковых клеток; уменьшать объем опухоли; ингибировать (т.е. до некоторой степени замедлять и предпочтительно останавливать) инфильтрацию раковых клеток в периферические органы; ингибировать (т.е. до некоторой степени замедлять и предпочтительно останавливать) метастазирование опухоли; до некоторой степени ингибировать рост опухоли; увеличивать время выживания; и/или облегчать до некоторой степени один или более симптомов, связанных с раком. В тех случаях, когда лекарственное средство может предотвращать рост и/или уничтожать существующие раковые клетки, оно может быть цитостатическим и/или цитотоксическим. Соединения согласно настоящему изобретению предпочтительно являются цитотоксическими. Для терапии рака эффективность может быть, например, измерена путем оценки времени до прогрессирования заболевания (ТТР) и/или определения частоты положительного ответа (RR).
«Эффективное количество» в отношении конкретного результата, который должен быть достигнут, представляет собой количество, достаточное для достижения требуемого результата. Например, «эффективное количество» лекарства при упоминании в отношении уничтожения раковых клеток, относится к количеству лекарства, достаточного для обеспечения эффекта уничтожения.
Солидные опухоли, предусмотренные для лечения с применением описанных в настоящем документе соединений, включают, но не ограничиваются ими: саркому, фибросаркому, миксосаркому, липосаркому, хондросаркому, остеогенную саркому, хордому, ангиосаркому, эндотелиосаркому, лимфангиосаркому, лимфангиоэндотелиосаркому, синовиому, мезотелиому, опухоль Юинга, лейомиосаркому, рабдомиосаркому, рак толстой кишки, рак толстой и прямой кишки, рак почек, рак поджелудочной железы, рак костей, рак молочной железы, рак яичников, рак предстательной железы, рак пищевода, рак желудка (например, желудочно-кишечный рак), рак полости рта, рак носовой полости, рак горла, плоскоклеточную карциному (например, легких), базальноклеточную карциному, аденокарциному (например, легких), карциному потовой железы, карциному сальной железы, папиллярную карциному, папиллярную аденокарциному, цистаденокарциному, медуллярную карциному, бронхогенную карциному, почечноклеточную карциному, гепатому, карциному желчных протоков, хориокарциному, семиному, эмбриональную карциному, опухоль Вильмса, рак шейки матки, рак матки, рак яичек, мелкоклеточную карциному легких, карциному мочевого пузыря, рак легких, немелеоклеточный рак легких, эпителиальную карциному, глиому, глиобластому, мультиформную астроцитому, медуллобластому, краниофарингиому, эпендимому, пинеалому, гемангиобластому, акустическую невриному, олигодендроглиому, менингиому, рак кожи, меланому, нейробластому и ретинобластому. Гематологические виды рака, предусмотренные для лечения с применением описанных в настоящем документе соединений, включают, но не ограничиваются ими: острый лимфобластный лейкоз «ALL», острый лимфобластный В-клеточный лейкоз, острый лимфобластный Т-клеточный лейкоз, острый миелобластный лейкоз «AML», острый промиелоцитарный лейкоз «APL», острый монобластный лейкоз, острый эритролейкозный лейкоз, острый мегакариобластный лейкоз, острый миеломоноцитарный лейкоз, острый не лимфоцитарный лейкоз, острый не дифференцированный лейкоз, хронический миелоцитарный лейкоз «CML», хронический лимфоцитарный лейкоз «CLL», лейкоз ворсистых клеток и множественную миелому. Острые и хронические лейкозы, предусмотренные для лечения с применением описанных в настоящем документе соединений, включают, но не ограничиваются ими: лимфобластные, миелогенные, лимфоцитарные и миелоцитарные лейкозы. Лимфомы, предусмотренные для лечения с применением описанных в настоящем документе соединений, включают, но не ограничиваются ими: болезнь Ходжкина, неходжкинскую лимфому, множественную миелому, макроглобулинемию Вальденстрема, болезнь тяжелых цепей и истинную полицитемию. Другие виды рака, предусмотренные для лечения с применением описанных в настоящем документе соединений, включают, но не ограничиваются ими: перитонеальный рак, гепатоцеллюлярный рак, гепатому, рак слюнных желез, рак влагалища, рак щитовидной железы, пенильный рак, анальный рак, рак головы и шеи, почечноклеточную карциному, острую анапластическую крупноклеточную карциному и кожную анапластическую крупноклеточную карциному.
Раковые заболевания, включая, но не ограничиваясь ими, опухоль, метастаз или другое заболевание или расстройство, характеризующееся неконтролируемым или нежелательным ростом клеток, можно лечить или предупреждать посредством введения описанных в настоящем документе соединений.
В других вариантах реализации предложены способы лечения или предупреждения рака, включая введение пациенту, нуждающемуся в этом, эффективного количества соединения, описанного в настоящем документе, в комбинации с дополнительным способом лечения. В одном из вариантов реализации дополнительный способ лечения включает лечение химиотерапевтическим агентом. В одном из вариантов реализации химиотерапевтический агент представляет собой агент, при лечении которым не была обнаружена невосприимчивость рака к лечению. В других вариантах реализации химиотерапевтический агент представляет собой агент, при лечении которым была обнаружена невосприимчивость рака к лечению. Соединение, описанное в настоящем документе, может быть введено до, после или одновременно с указанным химиотерапевтическим агентом.
В одном из вариантов реализации дополнительный способ лечения представляет собой лучевую терапию. Соединение, описанное в настоящем документе, может быть введено до, после или одновременно с облучением.
Соединения, описанные в настоящем документе, также могут быть введены пациенту, который уже прошел или будет проходить хирургическое лечение рака.
В конкретном варианте реализации соединение, описанное в настоящем документе, вводят одновременно с химиотерапевтическим агентом или с лучевой терапией. В другом конкретном варианте реализации химиотерапевтический агент или лучевую терапию вводят до или после введения соединения, описанного в настоящем документе, в одном из аспектов в течение по меньшей мере одного часа, пяти часов, 12 часов, одного дня, недели, месяца, в дополнительных аспектах - нескольких месяцев (например, до трех месяцев) до или после введения соединения, описанного в настоящем документе.
Химиотерапевтический агент может быть введен в несколько приемов. Может быть введен любой химиотерапевтический агент или комбинация агентов, перечисленных в настоящем документе или иным образом известных в данной области техники. В отношении облучения, может быть использован любой протокол лучевой терапии в зависимости от типа рака, подлежащего лечению. Например, но не в качестве ограничения, может быть проведено облучение рентгеновскими лучами; в частности, может быть использовано высокоэнергетическое мегавольтное излучение (облучение с энергией более 1 МэВ) для лечения глубоких опухолей, а для лечения рака кожи может быть использован электронный пучок и ортовольтное рентгеновское излучение. Могут быть введены также радиоизотопы, излучающие гамма-лучи, такие как радиоактивные изотопы радия, кобальта и других элементов.
Кроме того, предложены способы лечения рака с применением соединения, описанного в настоящем документе, в качестве альтернативы химиотерапии или лучевой терапии, если химиотерапия или лучевая терапия достоверно или вероятно является слишком токсичной, например, приводит к неприемлемым или непереносимым побочным эффектам для субъекта, проходящего лечение. Кроме того, способы лечения рака с применением соединения согласно настоящему изобретению предложены в качестве альтернативы хирургии, если хирургия достоверно или вероятно является неприемлемой или непереносимой для субъекта, проходящего лечение.
Соединения, описанные в настоящем документе, также могут быть использованы in vitro или ex vivo, например, для лечения некоторых видов рака, включая, но не ограничиваясь ими, лейкозы и лимфомы, и такое лечение подразумевает трансплантацию аутологичных стволовых клеток. Оно может включать многостадийный процесс, в котором аутологичные гематопоэтические стволовые клетки животного собирают и очищают от всех раковых клеток, затем остальную часть клеток костного мозга животного уничтожают посредством введения высокой дозы соединения, описанного в настоящем документе, вместе с высокой дозой лучевой терапии или без нее, и стволовые клетки прививают обратно животному посредством инфузии. Затем обеспечивают поддерживающую терапию на время восстановления функции костного мозга и выздоровления животного.
Способы лечения рака дополнительно включают введение пациенту, нуждающемуся в этом, эффективного количества соединения, описанного в настоящем документе, и другого терапевтического агента, который представляет собой противораковый агент. Подходящие противораковые агенты включают, но не ограничиваются ими, метотрексат, таксол, L-аспарагиназу, меркаптопурин, тиогуанин, гидроксимочевину, цитарабин, циклофосфамид, ифосфамид, нитрозомочевины, цисплатин, карбоплатин, митомицин, дакарбазин, прокарбазин, топотекан, азотистые иприты, цитоксан, этопозид, 5-фторурацил, BCNU, иринотекан, камптотецин, блеомицин, доксорубицин, идарубицин, даунорубицин, актиномицин D, дактиномицин, пликамицин, митоксантрон, аспарагиназу, винбластин, винкристин, виндезин, винорелбин, паклитаксел и доцетаксел.
Другие примеры химиотерапевтических агентов включают алкилирующие агенты, такие как тиотепа и CYTOXAN® циклофосфамид; алкилсульфонаты, такие как бусульфан, треосульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метиламеламины, включая альтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилолмеламин; TLK 286 (TELCYTA™); ацетогенины (особенно буллатацин и буллатацинон); дельта-9-тетрагидроканнабинол (дронабинол, MARINOL®); бета-лапахон; лапахол; колхицины; бетулиновую кислоту; камптотецин (включая синтетический аналог топотекан (HYCAMTIN®), СРТ-11 (иринотекан, CAMPTOSAR®), ацетилкамптотецин, скополектин и 9-аминокамптотецин); бриостатин; каллистатин; СС-1065 (включая его синтетические аналоги адозелезин, карзелезин и бизелезин); подофиллотоксин; подофиллиновую кислоту; тенипозид; криптофицины (в частности, криптофицин 1 и криптофицин 8); доластатин; дуокармицин (включая синтетические аналоги KW-2189 и СВ1-ТМ1); элеутеробин; панкрастистатин; саркодиктин; спонгистатин; азотистые иприты, такие как хлорамбуцил, хлорнафазин, хлорфосфамид, эстрамустин, ифосфамид, мехлоретамин, мехлоретамина оксид гидрохлорид, мелфалан, новембихин, фенестерин, преднимустин, трофосфамид и урациловый иприт; триазины, такие как дакарбазин; нитрозомочевины, такие как кармустин, хлорозотоцин, фотемустин, ломустин, нимустин и ранимнустин; эпиподофиллины, такие как этопозид, тенипозид, топотекан, 9-аминокамптотецин, камптотецин или криснатол; бисфосфонаты, такие как клодронат; антибиотики, такие как ендииновые антибиотики (например, калихеамицин, особенно калихеамицин гамма 1 и калихеамицин омега 1 (см., например, Agnew, Chem. Intl. Ed. Engl., 33: 183-186 (1994)) и антрациклины, такие как аннамицин, AD 32, алкарубицин, даунорубицин, дексразоксан, DX-52-1, эпирубицин, GPX-100, идарубицин, KRN5500, меногарил, динемицин, включая динемицин А, эсперамицин, неокарзиностатин хромофор и родственные хромопротеиновые энедииновые хромофоры-антибиотики, аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины (например, А2 и В2), кактиномицин, карабицин, каминомицин, карзинофилин, хромомицины, дактиномицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, ADRIAMYCIN®, доксорубицин (включая морфолино-доксорубицин, цианоморфолино-доксорубицин, 2-пирролино-доксорубицин, липосомальный доксорубицин и дезоксидоксорубицин), эзорубицин, марцелломицин, митомицины, такие как митомицин С, микрофеноловая кислота, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, циностатин и зорубицин; фотодинамическую терапию, такую как вертопорфин (BPD-MA), фталоцианин, фотосенсибилизатор Рс4 и деметокси-гипокреллин A (2BA-2-DMHA); аналоги фолиевой кислоты, такие как деноптерин, птероптерин и триметрексат; аналоги пурина, такие как флударабин, 6-меркаптопурин, тиамиприн и тиогуанин; аналоги пиримидина, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, цитозин арабинозид, дидезоксиуридин, доксифлуридин, эноцитабин и флоксуридин; андрогены, такие как калустерон, дромостанолон пропионат, эпитиостанол, мепитиостан и тестолактон; антиадренергические агенты, такие как аминоглутетимид, митотан и трилостан; пополнители фолиевой кислоты, такие как фолиновая кислота (лейковорин); ацеглатон; антифолатные антинеопластические агенты, такие как ALIMTA®, LY231514 пеметрексед, ингибиторы дигидрофолатредуктазы, такие как метотрексат и триметрексат; антиметаболиты, такие как 5-фторурацил (5-ФУ) и его пролекарства, такие как UFT, S-1 и капецитабин, флоксуридин, доксифлуридин и ратитрексед; и ингибиторы тимидилатсинтазы и ингибиторы глицинамид-рибонуклеотид-формилтрансферазы, такие как ралтитрексед (TOMUDEX®, TDX); ингибиторы дигидропиримидин-дегидрогеназы, такие как енилурацил; альдофосфамид-гликозид; аминолевулиновую кислоту; амсакрин; бестрабуцил; бисантрен; эдатраксат; дефофамин; демеколцин; диазиквон; элформитин; эллиптиния ацетат; эпотилон; этоглуцид; нитрат галлия; гидроксимочевину; лентинан; лонидаинин; майтанзиноиды, такие как майтанзин и ансамитоцины; митогуазон; митоксантрон; мопиданмол; нитраэрин; пентостатин; фенамет; пирарубицин; лозоксантрон; 2-этилгидразид; прокарбазин; полисахаридный комплекс PSK® (JHS Natural Products, Юджин, штат Орегон); разоксан; ризоксин; сизофиран; спирогерманий; тенуазоновую кислоту; триазиквон; 2,2',2''-трихлортриэтиламин; трихотецены (особенно токсин Т-2, верракурин А, роридин А и ангвидин); уретан; виндезин (ELDISINE®, FILDESIN®); дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид («Ara-С»); циклофосфамид; тиотепа; таксоиды и таксаны, например, паклитаксел TAXOL® (Bristol-Myers Squibb Oncology, Принстон, штат Нью-Джерси), АВРАХАНЕ™ без кремофора, состав на основе альбуминсодержащих наночастиц паклитаксела (American Pharmaceutical Partners, Шаумбург, штат Иллинойс) и доцетаксел TAXOTERE® (Rhone-Poulenc Rorer, Антони, Франция); хлорамбуцил; гемцитабин (GEMZAR®); 6-тиогуанин; меркаптопурин; платину; платиновые аналоги или аналоги на основе платины, такие как цисплатин, оксалиплатин и карбоплатин; винбластин (VELBAN®); этопозид (VP-16); ифосфамид; митоксантрон; винкристин (ONCOVIN®); алкалоиды барвинка; винорелбин (NAVELBINE®); велкад; ревлимид; талидомид; IMiD3; ловастатин; верапамил; тапсигаргин; 1-метил-4-фенилпиридиний; ингибиторы клеточного цикла, такие как стауроспорин; новантрон; эдатрексат; дауномицин; митоксантрон; аминоптерин; кселоду; ибандронат; ингибитор топоизомеразы RFS 2000; дифторметилорнитин (DMFO); аналоги витамина D3, такие как ЕВ 1089, СВ 1093 и KH 1060; ретиноиды, такие как ретиноевая кислота; фармацевтически приемлемые соли, кислоты или производные любых вышеуказанных средств; а также комбинации двух или более вышеуказанных средств, такие как CHOP, сокращенное название комбинированной терапии с применением циклофосфамида, доксорубицина, винкристина и преднизолона, и FOLFOX, сокращенное название схемы лечения с применением оксалиплатина (ELOXATIN™) в комбинации с 5-ФУ и лейковорином.
Антигормональные агенты, которые действуют для регуляции или ингибирования действия гормонов на опухоли, такие как антиэстрогены и селективные модуляторы рецептора к эстрогену (SERM), включая, например, тамоксифен (включая тамоксифен NOLVADEX®), ралоксифен, мегастрол, дролоксифен, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и торемифен FARESTON®; ингибиторы ароматазы, которые ингибируют фермент ароматазу, регулирующую выработку эстрогена в надпочечниках, такие как, например, 4(5)-имидазолы, аминоглутетимид, мегестрола ацетат MEGASE®, экземестан AROMASIN®, форместатин, фадрозол, ворозол RIVISOR®, летрозол FEMARA® и анастрозол ARIMIDEX®; и антиандрогены, такие как флутамид, бикалутамид, нилутамид, бикалутамид, лейпролид и гозерелин; а также троксацитабин (1,3-диоксоланнуклеозидный аналог цитозина); антисмысловые олигонуклеотиды, в частности, которые ингибируют экспрессию генов в сигнальных каскадах, участвующих в патологической пролиферации клеток, такие как, например, PKC-альфа, Raf, H-Ras и рецептор эпидермального фактора роста (EGF-R); вакцины, такие как вакцины генной терапии, например, вакцина ALLOVECTIN®, вакцина LEUVECTIN® и вакцина VAXID®; PROLEUKIN® rIL-2; ингибитор топоизомеразы 1 LURTOTECAN®; ABARELIX® rmRH; и фармацевтически приемлемые соли, кислоты или производные любых вышеуказанных средств.
Новые соединения
Предложены соединения Формулы I:

и их фармацевтически приемлемые соли, где:
R1 выбран из: амино-C1-C6 алкила, аминоарила, амино-С3-С7 циклоалкила, амино-гетероциклила и гетероциклила, каждый из которых необязательно замещен одним или более заместителями, выбранными из арила, арил-C1-C6 алкила, C1-C6 алкила, C1-C6 алкилтио, карбоксила, карбоксамида, С3-С7 циклоалкила, С3-С7 циклоалкил-C1-C6 алкила, гуанидино, галогена, C1-C6 галогенацила, C1-C6 галогеналкила, гетероциклила, гетероциклил-C1-C6 алкила, гидроксила и тио; или
R1 представляет собой RaRbNCH(Rc)-;
Ra выбран из: Н и C1-C6 алкила;
Rb представляет собой C1-C6 алкил; и
Rc представляет собой Rd-C(CH3)2-; и
Rd выбран из: Н, арила, С3-С7 циклоалкила и гетероарила, каждый из которых необязательно замещен одним или более заместителями, выбранными из: C1-C4 ацилтио, C2-C4 алкенила, C1-C4 алкила, C1-C4 алкиламино, C1-C4 алкилокси, амино, амино-C1-C4 алкила, галогена, C1-C4 галогеналкила, гидроксила, гидрокси-C1-C4 алкила и тио, где C2-C4 алкенил, C1-C4 алкиламино и C1-C4 алкилокси дополнительно необязательно замещены одним заместителем, выбранным из C1-C4 алкиларила, гидроксила и тио; или
Rb и Rc вместе с атомами, с которыми они связаны, образуют гетероциклилдиил;
R2 выбран из: C2-C6 алкила, арила, арил-C1-C6 алкила, C4-C7 циклоалкила, С3-С7 циклоалкил-C1-C6 алкила, гетероарила, гетероарил-C1-C6 алкила и гетероциклила, каждый из которых необязательно замещен одним или более заместителями, выбранными из: C1-C6 алкокси, C1-C6 алкоксикарбонила, C1-C6 алкила, C1-C6 алкиламино, амино, амино-C1-C6 алкила, амино-арила, амино-С3-С7 циклоалкила, арила, карбоксамида, карбоксила, циано, C1-C6 галогенацила, C1-C6 галогеналкила, C1-C6 галогеналкокси, галогена, гидроксила, нитро, тио и тио-C1-C6 алкила; и
Х представляет собой -C(O)NHCH(CH2R3)-, или Х отсутствует; и
R3 выбран из: арила, гетероарила и С3-С7 циклоалкила, каждый из которых необязательно замещен одним заместителем, выбранным из амино и гидроксила.
В некоторых вариантах реализации, если R1 представляет собой 2-метил-1-(метиламино)пропил, и Х представляет собой -C(O)NHCH(CH2Ph)-, то R2 отличен от этила, изопропила, н-бутила и фенила.
Предложены также соединения Формулы I:

и их фармацевтически приемлемые соли, где:
R1 выбран из: амино-C1-C6 алкила, аминоарила, амино-C3-C7 циклоалкила, амино-гетероциклила и гетероциклила, каждый из которых необязательно замещен одним или более заместителями, выбранными из арила, арил-C1-C6 алкила, C1-C6 алкила, C1-C6 алкилтио, карбоксила, карбоксамида, C3-C7 циклоалкила, C3-C7 циклоалкил-C1-C6 алкила, гуанидино, галогена, C1-C6 галогенацила, C1-C6 галогеналкила, гетероциклила, гетероциклил-C1-C6 алкила, гидроксила и тио; или
R1 представляет собой RaRbNCH(Rc)-;
Ra выбран из: Н и C1-C6 алкила;
Rb представляет собой C1-C6 алкил; и
Rc представляет собой Rd-C(CH3)2-; и
Rd выбран из: Н, арила, C3-C7 циклоалкила и гетероарила, каждый из которых необязательно замещен одним или более заместителями, выбранными из: C1-C4 ацилтио, C2-C4 алкенила, C1-C4 алкила, C1-C4 алкиламино, C1-C4 алкилокси, амино, амино-C1-C4 алкила, галогена, C1-C4 галогеналкила, гидроксила, гидрокси-C1-C4 алкила и тио, где C2-C4 алкенил, C1-C4 алкиламино и C1-C4 алкилокси дополнительно необязательно замещены одним заместителем, выбранным из C1-C4 алкиларила, гидроксила и тио; или
Rb и Rc вместе с атомами, с которыми они связаны, образуют гетероциклилдиил;
R2 выбран из: C1-C6 алкила, арила, арил-C1-C6 алкила, C3-C7 циклоалкила, C3-C7 циклоалкил-C1-C6 алкила, гетероарила, гетероарил-C1-C6 алкила и гетероциклила, каждый из которых необязательно замещен одним или более заместителями, выбранными из: C1-C6 алкокси, C1-C6 алкоксикарбонила, C1-C6 алкила, C1-C6 алкиламино, амино, амино-C1-C6 алкила, амино-арила, амино-C3-C7 циклоалкила, арила, карбоксамида, карбоксила, циано, C1-C6 галогенацила, C1-C6 галогеналкила, C1-C6 галогеналкокси, галогена, гидроксила, нитро, тио и тио-C1-C6 алкила; и
Х представляет собой -C(O)NHCH(CH2R3)-, или Х отсутствует; и
R3 выбран из: арила, гетероарила и C3-C7 циклоалкила, каждый из которых необязательно замещен одним заместителем, выбранным из амино и гидроксила.
В некоторых вариантах реализации, если R1 представляет собой 2-метил-1-(метиламино)пропил, и Х представляет собой -C(O)NHCH(CH2Ph)-, то R2 отличен от метила, этила, изопропила, н-бутила, циклопропила и фенила.
Предложены также соединения Формулы I:

и их фармацевтически приемлемые соли, где:
R1 выбран из: амино-C1-C6 алкила, аминоарила, амино-C3-C7 циклоалкила, амино-гетероциклила и гетероциклила, каждый из которых необязательно замещен одним или более заместителями, выбранными из арила, арил-C1-C6 алкила, C1-C6 алкила, C1-C6 алкилтио, карбоксила, карбоксамида, C3-C7 циклоалкила, C3-C7 циклоалкил-C1-C6 алкила, гуанидино, галогена, C1-C6 галогенацила, C1-C6 галогеналкила, гетероциклила, гетероциклил-C1-C6 алкила, гидроксила и тио; или
R1 представляет собой RaRbNCH(Rc)-;
Ra выбран из: Н и C1-C6 алкила;
Rb представляет собой C1-C6 алкил; и
Rc представляет собой Rd-C(CH3)2-; и
Rd выбран из: Н, арила, C3-C7 циклоалкила и гетероарила, каждый из которых необязательно замещен одним или более заместителями, выбранными из: C1-C4 ацилтио, C2-C4 алкенила, C1-C4 алкила, C1-C4 алкиламино, C1-C4 алкилокси, амино, амино-C1-C4 алкила, галогена, C1-C4 галогеналкила, гидроксила, гидрокси-C1-C4 алкила и тио, где C2-C4 алкенил, C1-C4 алкиламино и C1-C4 алкилокси дополнительно необязательно замещены одним заместителем, выбранным из C1-C4 алкиларила, гидроксила и тио; или
Rb и Rc вместе с атомами, с которыми они связаны, образуют гетероциклилдиил;
R2 выбран из: C2-C6 алкила, арила, арил-C1-C6 алкила, C4-C7 циклоалкила, C3-C7 циклоалкил-C1-C6 алкила, гетероарила, гетероарил-C1-C6 алкила и гетероциклила, каждый из которых необязательно замещен одним или более заместителями, выбранными из: C1-C6 алкокси, C1-C6 алкоксикарбонила, C1-C6 алкила, C1-C6 алкиламино, амино, амино-C1-C6 алкила, амино-арила, амино-C3-C7 циклоалкила, арила, карбоксамида, карбоксила, циано, C1-C6 галогенацила, C1-C6 галогеналкила, C1-C6 галогеналкокси, галогена, гидроксила, нитро, тио и тио-C1-C6 алкила; и
X отсутствует.
Переменная R1
В некоторых вариантах реализации R1 выбран из: амино-C1-C6 алкила, аминоарила, амино-C3-C7 циклоалкила, амино-гетероциклила и гетероциклила, каждый из которых необязательно замещен одним или более заместителями, выбранными из арила, арил-C1-C6 алкила, C1-C6 алкила, C1-C6 алкилтио, карбоксила, карбоксамида, C3-C7 циклоалкила, C3-C7 циклоалкил-C1-C6 алкила, гуанидино, галогена, C1-C6 галогеналкила, гетероциклила, гетероциклил-C1-C6 алкила, гидроксила и тио.
В некоторых вариантах реализации R1 выбран из: амино-C1-C6 алкила, аминоарила, амино-C3-C7 циклоалкила, амино-гетероциклила и гетероциклила, каждый из которых необязательно замещен одним или более заместителями, выбранными из C1-C6 алкила и галогена.
В некоторых вариантах реализации R1 выбран из: 1-(диметиламино)-2-метилпропила, 2-метил-1-(метиламино)пропила, 1-аминоциклопентила, 1-аминоциклопропила, 4-аминофенила, 2-аминопропан-2-ила, 1-аминоциклогексила, 3-аминооксетан-3-ила, 2-(метиламино)пропан-2-ила, 1-амино-2-метилпропан-2-ила, 2-метилпирролидин-2-ила, 2-амино-3-метилбутан-2-ила, 2-аминобутан-2-ила, 2-метил-1-(метиламино)пропан-2-ила, 1-метилпиперидин-2-ила, 3-фторпирролидин-3-ила, 1,2-диметилпирролидин-2-ила и 2-(диметиламино)пропан-2-ила.
В некоторых вариантах реализации R1 выбран из: 1-(диметиламино)-2-метилпропила, 2-метил-1-(метиламино)пропила, 1-аминоциклопентила, 1-аминоциклопропила, 4-аминофенила, 2-аминопропан-2-ила, 1-аминоциклогексила, 3-аминооксетан-3-ила, 2-(метиламино)пропан-2-ила, 1-амино-2-метилпропан-2-ила, 2-метилпирролидин-2-ила, 2-амино-3-метилбутан-2-ила, 2-аминобутан-2-ила, 2-метил-1-(метиламино)пропан-2-ила, 1-метилпиперидин-2-ила, 3-фторпирролидин-3-ила, 1,2-диметилпирролидин-2-ила и 2-(диметиламино)пропан-2-ила, 2-метил-1-(метиламино)-2-фенилпропила, 1-изопропилпиперидин-2-ила, 2-азабицикло[2.2.1]гептан-3-ила и 2-метил-2-азабицикло[2.2.1]гептан-3-ила.
В некоторых вариантах реализации R1 представляет собой 1-(диметиламино)-2-метилпропил.
В некоторых вариантах реализации R1 представляет собой 2-метил-1-(метиламино)пропил.
В некоторых вариантах реализации R1 представляет собой 1-аминоциклопентил.
В некоторых вариантах реализации R1 представляет собой 1-аминоциклопропил.
В некоторых вариантах реализации R1 представляет собой 4-аминофенил.
В некоторых вариантах реализации R1 представляет собой 2-аминопропан-2-ил.
В некоторых вариантах реализации R1 представляет собой 1-аминоциклогексил.
В некоторых вариантах реализации R1 представляет собой 3-аминооксетан-3-ил.
В некоторых вариантах реализации R1 представляет собой 2-(метиламино)пропан-2-ил.
В некоторых вариантах реализации R1 представляет собой 1-амино-2-метилпропан-2-ил.
В некоторых вариантах реализации R1 представляет собой 2-метилпирролидин-2-ил.
В некоторых вариантах реализации R1 представляет собой 2-амино-3-метилбутан-2-ил.
В некоторых вариантах реализации R1 представляет собой 2-аминобутан-2-ил.
В некоторых вариантах реализации R' представляет собой 2-метил-1-(метиламино)пропан-2-ил.
В некоторых вариантах реализации R1 представляет собой 1-метилпиперидин-2-ил.
В некоторых вариантах реализации R1 представляет собой 3-фторпирролидин-3-ил.
В некоторых вариантах реализации R1 представляет собой 2-метил-1-(метиламино)пропил.
В некоторых вариантах реализации R1 представляет собой (R)-1-(диметиламино)-2-метилпропил.
В некоторых вариантах реализации R1 представляет собой (R)-2-метил-1-(метиламино)пропил.
В некоторых вариантах реализации R1 представляет собой RaRbNCH(Rc)-.
В некоторых вариантах реализации R1 представляет собой 2-метил-1-(метиламино)-2-фенилпропил.
В некоторых вариантах реализации R1 представляет собой 1-изопропилпиперидин-2-ил.
В некоторых вариантах реализации R1 представляет собой 2-азабицикло[2.2.1]гептан-3-ил.
В некоторых вариантах реализации R1 представляет собой 2-метил-2-азабицикло[2.2.1]гептан-3-ил.
Переменная Ra
В некоторых вариантах реализации Ra выбран из: Н и C1-C6 алкила;
В некоторых вариантах реализации Rb выбран из: Н, метила и изопропила.
В некоторых вариантах реализации Rc представляет собой Н.
В некоторых вариантах реализации Rd представляет собой метил.
В некоторых вариантах реализации Re представляет собой изопропил.
Переменная Rb
В некоторых вариантах реализации Rb представляет собой C1-C6 алкил.
В некоторых вариантах реализации Rb представляет собой метил.
Переменная Rc
В некоторых вариантах реализации Rc представляет собой Rd-C(CH3)2-.
Переменная Rd
В некоторых вариантах реализации R4 выбран из: Н, арила, C3-C7 циклоалкила и гетероарила, каждый из которых необязательно замещен одним или более заместителями, выбранными из: C1-C4 ацилтио, C2-C4 алкенила, C1-C4 алкила, C1-C4 алкиламино, C1-C4 алкилокси, амино, амино-C1-C4 алкила, галогена, C1-C4 галогеналкила, гидроксила, гидрокси-C1-C4 алкила и тио, где C2-C4 алкенил, C1-C4 алкиламино и C1-C4 алкилокси дополнительно необязательно замещены одним заместителем, выбранным из C1-C4 алкиларила, гидроксила и тио.
В некоторых вариантах реализации Rd выбран из: Н, арила, C3-C7 циклоалкила и гетероарила, каждый из которых необязательно замещен одним или более заместителями, выбранными из: C1-C4 ацилтио, C2-C4 алкенила, C1-C4 алкила, C1-C4 алкиламино, C1-C4 алкилокси, амино, амино-C1-C4 алкила, галогена, C1-C4 галогеналкила, гидроксила, гидрокси-C1-C4 алкила и тио, где C2-C4 алкенил, C1-C4 алкиламино и C1-C4 алкилокси дополнительно необязательно замещены одним заместителем, выбранным из n-толила, гидроксила и тио.
В некоторых вариантах реализации Rd выбран из: Н, арила, C3-C7 циклоалкила и гетероарила, каждый из которых необязательно замещен одним или более заместителями, выбранными из: (2-гидроксиэтил)амино, (2-меркаптоэтил)амино, 2-(ацетилтио)этокси, 2-аминоэтокси, 2-гидроксиэтокси, 2-меркаптоэтокси, 3-метокси, 4-метилстирила, амино, аминометила, хлора, фтора, гидроксила, гидроксиметила, метила, тио и трифторметила.
В некоторых вариантах реализации Rd выбран из: Н, циклогексила, 1H-индол-3-ила, фенила и тиен-2-ила, каждый из которых необязательно замещен одним или более заместителями, выбранными из: (2-гидроксиэтил)амино, (2-меркаптоэтил)амино, 2-(ацетилтио)этокси, 2-аминоэтокси, 2-гидроксиэтокси, 2-меркаптоэтокси, 3-метокси, 4-метилстирила, амино, аминометила, хлора, фтора, гидроксила, гидроксиметила, метила, тио и трифторметила.
В некоторых вариантах реализации Rd выбран из: Н, 1H-индол-3-ила, 1-метил-1Н-индол-3-ила, 2-метоксифенила, 3-((2-гидроксиэтил)амино)фенила, 3-((2-меркаптоэтил)амино)фенила, 3-(2-(ацетилтио)этокси)фенила, 3-(2-гидроксиэтокси)фенила, 3-(2-меркаптоэтокси)фенила, 3-(4-метилстирил)фенила, 3-(аминометил)фенила, 3-(гидроксиметил)фенила, 3-гидроксифенила, 3,5-дифторфенила, 3,5-диметилфенила, 3-аминофенила, 3-хлорфенила, 3-меркаптофенила, 3-метоксифенила, 3-трифторметилфенила, 4-((2-гидроксиэтил)амино)фенила, 4-((2-меркаптоэтил)амино)фенила, 4-(2-(ацетилтио)этокси)фенила, 4-(2-аминоэтокси)фенила, 4-(2-гидроксиэтокси)фенила, 4-(2-меркаптоэтокси)фенила, 4-(аминометил)фенила, 4-(гидроксиметил)фенила, 4-аминофенила, 4-гидроксифенила, 4-меркаптофенила, 4-метоксифенила, циклогексила, тиен-2-ила, м-толила и фенила.
В некоторых вариантах реализации Rd выбран из: Н, 1H-индол-3-ила, 1-метил-1Н-индол-3-ила, 2-метоксифенила, 3-((2-гидроксиэтил)амино)фенила, 3-((2-меркаптоэтил)амино)фенила, 3-(2-гидроксиэтокси)фенила, 3-(2-меркаптоэтокси)фенила, 3,5-дифторфенила, 3,5-диметилфенила, 3-хлорфенила, 3-меркаптофенила, 3-метоксифенила, 3-трифторметилфенила, 4-((2-гидроксиэтил)амино)фенила, 4-((2-меркаптоэтил)амино)фенила, 4-4-(2-гидроксиэтокси)фенила, 4-(2-меркаптоэтокси)фенила, 4-меркаптофенила, 4-метоксифенила, циклогексила, тиен-2-ила, м-толила и фенила.
В некоторых вариантах реализации Rd представляет собой фенил.
В некоторых вариантах реализации Rd представляет собой 1H-индол-3-ил.
В некоторых вариантах реализации Rd представляет собой 1-метил-1H-индол-3-ил.
В некоторых вариантах реализации Rd представляет собой 2-метоксифенил.
В некоторых вариантах реализации Rd представляет собой 3-((2-гидроксиэтил)амино)фенил.
В некоторых вариантах реализации Rd представляет собой 3-((2-меркаптоэтил)амино)фенил.
В некоторых вариантах реализации Rd представляет собой 3-(2-гидроксиэтокси)фенил.
В некоторых вариантах реализации Rd представляет собой 3-(2-меркаптоэтокси)фенил.
В некоторых вариантах реализации Rd представляет собой 3,5-дифторфенил.
В некоторых вариантах реализации Rd представляет собой 3,5-диметилфенил.
В некоторых вариантах реализации Rd представляет собой 3-хлорфенил.
В некоторых вариантах реализации Rd представляет собой 3-меркаптофенил.
В некоторых вариантах реализации Rd представляет собой 3-метоксифенил.
В некоторых вариантах реализации Rd представляет собой 3-трифторметилфенил.
В некоторых вариантах реализации Rd представляет собой 4-((2-гидроксиэтил)амино)фенил.
В некоторых вариантах реализации Rd представляет собой 4-((2-меркаптоэтил)амино)фенил.
В некоторых вариантах реализации Rd представляет собой 4- 4-(2-гидроксиэтокси)фенил.
В некоторых вариантах реализации Rd представляет собой 4-(2-меркаптоэтокси)фенил.
В некоторых вариантах реализации Rd представляет собой 4-меркаптофенил.
В некоторых вариантах реализации Rd представляет собой 4-метоксифенил.
В некоторых вариантах реализации Rd представляет собой циклогексил.
В некоторых вариантах реализации Rd представляет собой тиен-2-ил.
В некоторых вариантах реализации Rd представляет собой м-толил.
Переменная R2
В некоторых вариантах реализации R2 выбран из: C2-C6 алкила, арила, арил-C1-C6 алкила, C4-C7 циклоалкила, C3-C7 циклоалкил-C1-C6 алкила, гетероарила, гетероарил-C1-C6 алкила и гетероциклила, каждый из которых необязательно замещен одним или более заместителями, выбранными из: C1-C6 алкокси, C1-C6 алкоксикарбонила, C1-C6 алкила, C1-C6 алкиламино, амино, амино-C1-C6 алкила, амино-арила, амино-C3-C7 циклоалкила, арила, карбоксамида, карбоксила, циано, C1-C6 галогенацила, C1-C6 галогеналкила, C1-C6 галогеналкокси, галогена, гидроксила, нитро, тио и тио-C1-C6 алкила.
В некоторых вариантах реализации R2 выбран из: C2-C6 алкила, арила, арил-C1-C6 алкила, C4-C7 циклоалкила, C3-C7 циклоалкил-C1-C6 алкила, гетероарила, гетероарил-C1-C6 алкила и гетероциклила, каждый из которых необязательно замещен одним или более заместителями, выбранными из: 1-аминоциклопропила, 4-аминофенила, амино, аминометила, брома, трет-бутила, карбоксамида, карбоксила, хлора, циано, этила, фтора, гидрокси, изопропила, метокси, метила, нитро, фенила, тио, тиометила, трифторметокси и трифторметила.
В некоторых вариантах реализации R2 выбран из: 5,6,7,8-тетрагидронафталин-1-ила, бензила, циклогексила, этила, гексан-2-ила, метила, нафталин-2-ила, пиперидин-1-ила, фенила, пропила, пиридин-3-ила и тиен-2-ила, каждый из которых необязательно замещен одним или более заместителями, выбранными из: 1-аминоциклопропила, 4-аминофенила, амино, аминометила, брома, трет-бутила, карбоксамида, карбоксила, хлора, циано, этила, фтора, гидрокси, изопропила, метокси, метила, нитро, фенила, тио, тиометила, трифторметокси и трифторметила.
В некоторых вариантах реализации R2 выбран из: 5,6,7,8-тетрагидронафталин-1-ила, бензила, циклогексила, этила, гексан-2-ила, нафталин-2-ила, пиперидин-1-ила, фенила, пропила, пиридин-3-ила и тиен-2-ила, каждый из которых необязательно замещен одним или более заместителями, выбранными из: 1-аминоциклопропила, 4-аминофенила, амино, аминометила, брома, трет-бутила, карбоксамида, карбоксила, хлора, циано, этила, фтора, гидрокси, изопропила, метокси, метила, нитро, фенила, тио, тиометила, трифторметокси и трифторметила.
В некоторых вариантах реализации R2 выбран из: 4-аминобензила, 4-(аминометил)бензила, 4-(аминометил)фенила, 4-аминофенила, бензила, 3-меркаптопропила, 2-меркаптоэтила, 4-(меркаптометил)фенила, n-толила, 2,4,6-триметилфенила, 4-(трифторметокси)фенила, 2,4,6-триизопропилфенила, 4-трет-бутилфенила, 4-хлорфенила, 3-цианофенила, 2-нитрофенила, 4-метокси-2-нитрофенила, 4-аминокарбонил-2-нитрофенила, 4-метоксифенила, фенила, 2-фторбензила, пиперидин-1-ила, о-толила, 4-бромфенила, нафталин-2-ила, 4-метоксикарбонилфенила, 2-(трифторметил)бензила, гексан-2-ила, 2-метоксиэтила, циклопентилметила, циклогексила, пиридин-3-илметила, 4-карбоксифенила, 3-аминофенила, пиридин-3-ила, тиен-2-ила, 4-гидроксифенила, 4-(1-аминоциклопропил)бензила, 4-(1-аминоциклопропил)фенила, 2-метилбензила, 4-нитробензила, 4-хлорбензила, фенетила, 4-бромбензила, 4-цианобензила, 3-нитробензила, 4-трет-бутилбензила, 2-нитробензила, 4-нитрофенетила, 2-хлор-3-метоксикарбонилфенила, 2-аминофенила, [1,1'-бифенил]-4-ила, 4'-амино-[1,1'-бифенил]-4-ила, 4-фторбензила, 3-(трифторметил)бензила, 3-(трифторметокси)бензила, 3,4-дихлорбензила, 2-цианобензила, 3-хлорбензила, 4-амино-2-этилфенила, 4-амино-3-(трифторметокси)фенила, 4-амино-2,3-диметилфенила, 4-амино-5,6,7,8-тетрагидронафталин-1-ила, 4-амино-3-метилфенила, 4-амино-3-фторфенила, 4-амино-3-этилфенила и 4-амино-3-(трифторметил)фенила.
В некоторых вариантах реализации R2 выбран из: 4-аминобензила, 4-(аминометил)бензила, 4-(аминометил)фенила, 4-аминофенила, бензила, 3-меркаптопропила, 2-меркаптоэтила, 4-(меркаптометил)фенила, n-толила, 2,4,6-триметилфенила, 4-(трифторметокси)фенила, 2,4,6-триизопропилфенила, 4-трет-бутилфенила, 4-хлорфенила, 3-цианофенила, 2-нитрофенила, 4-метокси-2-нитрофенила, 4-аминокарбонил-2-нитрофенила, 4-метоксифенила, фенила, 2-фторбензила, пиперидин-1-ила, о-толила, 4-бромфенила, нафталин-2-ила, 4-метоксикарбонилфенила, 2-(трифторметил)бензила, гексан-2-ила, 2-метоксиэтила, циклопентилметила, циклогексила, пиридин-3-илметила, 4-карбоксифенила, 3-аминофенила, пиридин-3-ила, тиен-2-ила, 4-гидроксифенила, 4-(1-аминоциклопропил)бензила, 4-(1-аминоциклопропил)фенила, 2-метилбензила, 4-нитробензила, 4-хлорбензила, фенетила, 4-бромбензила, 4-цианобензила, 3-нитробензила, 4-трет-бутилбензила, 2-нитробензила, 4-нитрофенетила, 2-хлор-3-метоксикарбонилфенила, 2-аминофенила, [1,1'-бифенил]-4-ила, 4'-амино-[1,1'-бифенил]-4-ила, 4-фторбензила, 3-(трифторметил)бензила, 3-(трифторметокси)бензила, 3,4-дихлорбензила, 2-цианобензила, 3-хлорбензила, 4-амино-2-этилфенила, 4-амино-3-(трифторметокси)фенила, 4-амино-2,3-диметилфенила, 4-амино-5,6,7,8-тетрагидронафталин-1-ила, 4-амино-3-метилфенила, 4-амино-3-фторфенила, 4-амино-3-этилфенила, 4-амино-3-(трифторметил)фенила и 4-(метоксикарбонил)фенила.
В некоторых вариантах реализации R2 выбран из: арила и арил-C1-C6 алкила, каждый из которых необязательно замещен одним или более заместителями, выбранными из: амино и амино-C1-C6 алкила.
В некоторых вариантах реализации R2 выбран из: 4-аминобензила, 4-(аминометил)бензила, 4-(аминометил)фенила, 4-аминофенила и бензила.
В некоторых вариантах реализации R2 представляет собой 4-аминобензил.
В некоторых вариантах реализации R2 представляет собой 4-(аминометил)бензил.
В некоторых вариантах реализации R2 представляет собой 4-(аминометил)фенил.
В некоторых вариантах реализации R2 представляет собой 4-аминофенил.
В некоторых вариантах реализации R2 представляет собой бензил.
В некоторых вариантах реализации R2 представляет собой 3-меркаптопропил.
В некоторых вариантах реализации R2 представляет собой 2-меркаптоэтил.
В некоторых вариантах реализации R2 представляет собой 4-(меркаптометил)фенил.
В некоторых вариантах реализации R2 представляет собой n-толил.
В некоторых вариантах реализации R2 представляет собой 2,4,6-триметилфенил.
В некоторых вариантах реализации R2 представляет собой 4-(трифторметокси)фенил.
В некоторых вариантах реализации R2 представляет собой 2,4,6-триизопропилфенил.
В некоторых вариантах реализации R2 представляет собой 4-трет-бутилфенил.
В некоторых вариантах реализации R2 представляет собой 4-хлорфенил.
В некоторых вариантах реализации R2 представляет собой 3-цианофенил.
В некоторых вариантах реализации R2 представляет собой 2-нитрофенил.
В некоторых вариантах реализации R2 представляет собой 4-метокси-2-нитрофенил.
В некоторых вариантах реализации R2 представляет собой 4-аминокарбонил-2-нитрофенил.
В некоторых вариантах реализации R2 представляет собой метоксифенил.
В некоторых вариантах реализации R2 представляет собой фенил.
В некоторых вариантах реализации R2 представляет собой 2-фторбензил.
В некоторых вариантах реализации R2 представляет собой пиперидин-1-ил.
В некоторых вариантах реализации R2 представляет собой о-толил.
В некоторых вариантах реализации R2 представляет собой 4-бромфенил.
В некоторых вариантах реализации R2 представляет собой нафталин-2-ил.
В некоторых вариантах реализации R2 представляет собой 4-метоксикарбонилфенил.
В некоторых вариантах реализации R2 представляет собой (трифторметил)бензил.
В некоторых вариантах реализации R2 представляет собой гексан-2-ил.
В некоторых вариантах реализации R2 представляет собой 2-метоксиэтил.
В некоторых вариантах реализации R2 представляет собой циклопентилметил.
В некоторых вариантах реализации R2 представляет собой циклогексил.
В некоторых вариантах реализации R2 представляет собой пиридин-3-илметил.
В некоторых вариантах реализации R2 представляет собой 4-карбоксифенил.
В некоторых вариантах реализации R2 представляет собой аминофенил.
В некоторых вариантах реализации R2 представляет собой пиридин-3-ил.
В некоторых вариантах реализации R2 представляет собой тиен-2-ил.
В некоторых вариантах реализации R2 представляет собой 4-гидроксифенил.
В некоторых вариантах реализации R2 представляет собой 4-(1-аминоциклопропил)бензил.
В некоторых вариантах реализации R2 представляет собой 4-(1-аминоциклопропил)фенил.
В некоторых вариантах реализации R2 представляет собой 2-метилбензил.
В некоторых вариантах реализации R2 представляет собой 4-нитробензил.
В некоторых вариантах реализации R2 представляет собой 4-хлорбензил.
В некоторых вариантах реализации R2 представляет собой фенетил.
В некоторых вариантах реализации R2 представляет собой 4-бромбензил.
В некоторых вариантах реализации R2 представляет собой 4-цианобензил.
В некоторых вариантах реализации R2 представляет собой 3-нитробензил.
В некоторых вариантах реализации R2 представляет собой 4-трет-бутилбензил.
В некоторых вариантах реализации R2 представляет собой 2-нитробензил.
В некоторых вариантах реализации R2 представляет собой нитрофенетил.
В некоторых вариантах реализации R2 представляет собой 2-хлор-3-метоксикарбонилфенил.
В некоторых вариантах реализации R2 представляет собой 2-аминофенил.
В некоторых вариантах реализации R2 представляет собой [1,1'-бифенил]-4-ил.
В некоторых вариантах реализации R2 представляет собой 4'-амино-[1,1'-бифенил]-4-ил.
В некоторых вариантах реализации R2 представляет собой 4-фторбензил.
В некоторых вариантах реализации R2 представляет собой 3-(трифторметил)бензил.
В некоторых вариантах реализации R2 представляет собой 3-(трифторметокси)бензил.
В некоторых вариантах реализации R2 представляет собой 3,4-дихлорбензил.
В некоторых вариантах реализации R2 представляет собой 2-цианобензил.
В некоторых вариантах реализации R2 представляет собой 3-хлорбензил.
В некоторых вариантах реализации R2 представляет собой 4-амино-2-этилфенил.
В некоторых вариантах реализации R2 представляет собой 4-амино-3-(трифторметокси)фенил.
В некоторых вариантах реализации R2 представляет собой 4-амино-2,3-диметилфенил.
В некоторых вариантах реализации R2 представляет собой 4-амино-5,6,7,8-тетрагидронафталин-1-ил.
В некоторых вариантах реализации R2 представляет собой 4-амино-3-метилфенил.
В некоторых вариантах реализации R2 представляет собой 4-амино-3-фторфенил.
В некоторых вариантах реализации R2 представляет собой 4-амино-3-этилфенил.
В некоторых вариантах реализации R2 представляет собой 4-амнио-3-(трифторметил)фенил.
В некоторых вариантах реализации R2 представляет собой 4-(метоксикарбонил)фенил.
Переменная R3
В некоторых вариантах реализации R3 выбран из: арила, гетероарила и C3-C7 циклоалкила, каждый из которых необязательно замещен одним заместителем, выбранным из амино и гидроксила.
В некоторых вариантах реализации R3 выбран из: 1H-индол-3-ила, 4-аминофенила, 4-гидроксифенила, 5-гидроксипиридин-2-ила, циклогексила и фенила.
В некоторых вариантах реализации R3 представляет собой 1H-индол-3-ил.
В некоторых вариантах реализации R3 представляет собой 4-аминофенил.
В некоторых вариантах реализации R3 представляет собой 4-гидроксифенил.
В некоторых вариантах реализации R3 представляет собой 5-гидроксипиридин-2-ил.
В некоторых вариантах реализации R3 представляет собой циклогексил.
В некоторых вариантах реализации R3 представляет собой фенил.
Переменная R4
В некоторых вариантах реализации R4 выбран из: Н и C1-C6 алкила.
В некоторых вариантах реализации R4 представляет собой Н.
В некоторых вариантах реализации R4 представляет собой C1-C6 алкил.
В некоторых вариантах реализации R4 представляет собой метил.
Переменная R5
В некоторых вариантах реализации R5 выбран из: Н и C1-C6 алкила.
В некоторых вариантах реализации R5 представляет собой Н.
В некоторых вариантах реализации R5 представляет собой C1-C6 алкил.
В некоторых вариантах реализации R5 представляет собой метил.
Переменная Х
В некоторых вариантах реализации Х представляет собой -C(O)NHCH(CH2R3)-или Х отсутствует.
В некоторых вариантах реализации Х представляет собой -C(O)NHCH(CH2R3)-
В некоторых вариантах реализации Х отсутствует.
Некоторые комбинации
В некоторых вариантах реализации Rb представляет собой C1-C6 алкил; и Rc представляет собой Rd-С(CH3)2-.
В некоторых вариантах реализации Rb и Rc вместе с атомами, с которыми они связаны, образуют гетероциклилдиил.
В некоторых вариантах реализации Rb и Rc вместе с атомами, с которыми они связаны, образуют гетероциклилдиил, выбранный из: пирролидинилдиила, пиперидинилдиила и азепанилдиила.
В некоторых вариантах реализации Rb и Rc вместе с атомами, с которыми они связаны, образуют пирролидинилдиил.
В некоторых вариантах реализации Rb и Rc вместе с атомами, с которыми они связаны, образуют пиперидинилдиил.
В некоторых вариантах реализации Rb и Rc вместе с атомами, с которыми ни связаны, образуют азепанилдиил.
В некоторых вариантах реализации R4 и R5, каждый независимо, выбраны из: Н и C1-C6 алкила.
В некоторых вариантах реализации R4 и R5, каждый независимо, выбраны из: Н и метила.
В некоторых вариантах реализации каждый R4 и R5 представляет собой метил.
В некоторых вариантах реализации R4 представляет собой Н, и R5 представляет собой метил.
Предложены также соединения Формулы Ia:
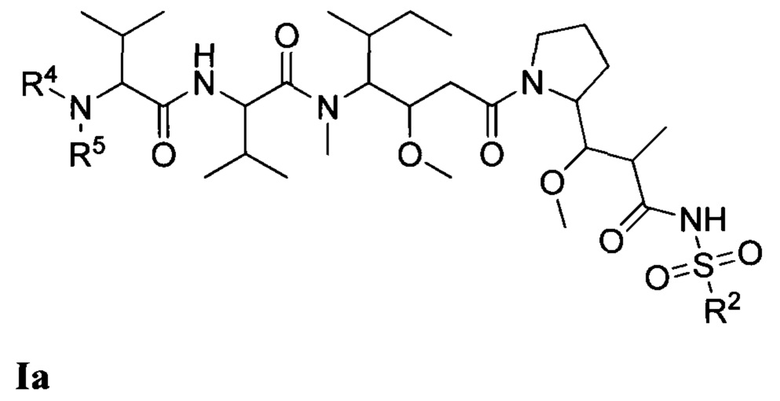
и их фармацевтически приемлемые соли, где:
R2 выбран из: C1-C6 алкила, арила, арил-C1-C6 алкила, C4-C7 циклоалкила, C3-C7 циклоалкил-C1-C6 алкила, гетероарила, гетероарил-C1-C6 алкила и гетероциклила, каждый из которых необязательно замещен одним или более заместителями, выбранными из: C1-C6 алкокси, C1-C6 алкоксикарбонила, C1-C6 алкила, C1-C6 алкиламино, амино, амино-C1-C6 алкила, аминоарила, амино-C3-C7 циклоалкила, арила, карбоксамида, карбоксила, циано, C1-C6 галогеналкила, C1-C6 галогеналкокси, галогена, гидроксила, нитро, тио и тио-C1-C6 алкила; и
R4 и R5, каждый независимо, выбраны из: Н и C1-C6 алкила.
Предложены также соединения Формулы Ia:

и их фармацевтически приемлемые соли, где:
R2 выбран из: 4-аминобензила, 4-(аминометил)бензила, 4-(аминометил)фенила, 4-аминофенила, бензила, 3-меркаптопропила, 2-меркаптоэтила, 4-(меркаптометил)фенила, n-толила, 2,4,6-триметилфенила, 4-(трифторметокси)фенила, 2,4,6-триизопропилфенила, 4-трет-бутилфенила, 4-хлорфенила, 3-цианофенила, 2-нитрофенила, 4-метокси-2-нитрофенила, 4-аминокарбонил-2-нитрофенила, 4-метоксифенила, фенила, 2-фторбензила, пиперидин-2-ила, о-толила, 4-бромфенила, нафталин-2-ила, 4-метоксикарбонилфенила, 2-(трифторметил)бензила, гексан-2-ила, 2-метоксиэтила, циклопентилметила, циклогексила, пиридин-3-илметила, 4-карбоксифенила, 3-аминофенила, пиридин-3-ила, тиен-2-ила, 4-гидроксифенила, 4-(1-аминоциклопропил)бензила, 4-(1-аминоциклопропил)бензила, 2-метилбензила, 4-нитробензила, 4-хлорбензила, фенетила, 4-бромбензила, 4-цианобензила, 3-нитробензила, 4-трет-бутилбензила, 2-нитробензила, 4-нитрофенетила, 2-хлор-3-метоксикарбонилфенила, 2-аминофенила, [1,1'-бифенил]-4-ила, 4'-амино-[1,1'-бифенил]-4-ила, 4-фторбензила, 3-(трифторметил)бензила, 3-(трифторметокси)бензила, 3,4-дихлорбензила, 2-цианобензила, 3-хлорензила, 4-амино-2-этилфенила, 4-амино-3-(трифторметокси)фенила, 4-амино-2,3-диметилфенила, 4-амино-5,6,7,8-тетрагидронафталин-1-ила, 4-амино-3-метилфенила, 4-амино-3-фторфенила, 4-амино-3-этилфенила и 4-амино-3-(трифторметил)фенила; и
R4 и R5, каждый независимо, выбраны из: Н и метила.
Предложены также соединения Формулы Ib:
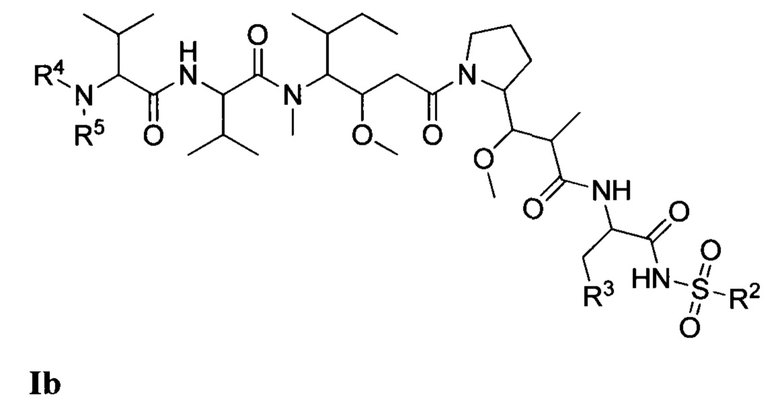
и их фармацевтически приемлемые соли, где:
R2 выбран из: C2-C6 алкила, арила, арил-C1-C6 алкила, C4-C7 циклоалкила, C3-C7 циклоалкил-C1-C6 алкила, гетероарила, гетероарил-C1-C6 алкила и гетероциклила, каждый из которых необязательно замещен одним или более заместителями, выбранными из: C1-C6 алкокси, C1-C6 алкоксикарбонила, C1-C6 алкила, C1-C6 алкиламино, амино, амино-C1-C6 алкила, аминоарила, амино-C3-C7 циклоалкила, арила, карбоксамида, карбоксила, циано, C1-C6 галогеналкила, C1-C6 галогеналкокси, галогена, гидроксила, нитро, тио и тио-C1-C6 алкила;
R3 выбран из: арила, гетероарила и C3-C7 циклоалкила, каждый из которых необязательно замещен одним заместителем, выбранным из амино и гидроксила; и
R4 и R5, каждый независимо, выбраны из: Н и C1-C6 алкила.
Предложены также соединения Формулы Ib:
и их фармацевтически приемлемые соли, где:
R2 выбран из: 4-аминобензила, 4-(аминометил)бензила, 4-(аминометил)фенила, 4-аминофенила, бензила, 3-меркаптопропила, 2-меркаптоэтила, 4-(меркаптометил)фенила, n-толила, 2,4,6-триметилфенила, 4-(трифторметокси)фенила, 2,4,6-триизопропилфенила, 4-тиреот-бутилфенила, 4-хлорфенила, 3-цианофенила, 2-нитрофенила, 4-метокси-2-нитрофенила, 4-аминокарбонил-2-нитрофенила, 4-метоксифенила, фенила, 2-фторбензила, пиперидин-1-ила, о-толила, 4-бромфенила, нафталин-2-ила, 4-метоксикарбонилфенила, 2-(трифторметил)бензила, гексан-2-ила, 2-метоксиэтила, циклопентилметила, циклогексила, пиридин-3-илметила, 4-карбоксифенила, 3-аминофенила, пиридин-3-ила, тиен-2-ила, 4-гидроксифенила, 4-(1-аминоциклопропил)бензила, 4-(1-аминоциклопропил)фенила, 2-метилбензила, 4-нитробензила, 4-хлорбензила, фенетила, 4-бромбензила, 4-цианобензила, 3-нитробензила, 4-трет-бутилбензила, 2-нитробензила, 4-нитрофенетила, 2-хлор-3-метоксикарбонилфенила, 2-аминофенила, [1,1'-бифенил]-4-ила, 4'-амино-[1,1'-бифенил]-4-ила, 4-фторбензила, 3-(трифторметил)бензила, 3-(трифторметокси)бензила, 3,4-дихлорбензила, 2-цианобензила, 3-хлорбензила, 4-амино-2-этилфенила, 4-амино-3-(трифторметокси)фенила, 4-амино-2,3-диметилфенила, 4-амино-5,6,7,8-тетрагидронафталин-1-ила, 4-амино-3-метилфенила, 4-амино-3-фторфенила, 4-амино-3-этилфенила и 4-амино-3-(трифторметил)фенила;
R3 выбран из: 1H-индол-3-ила, 4-аминофенила, 4-гидроксифенила, 5-гидроксипиридин-2-ила, циклогексила и фенила; и
R4 и R5, каждый независимо, выбраны из: Н и метила.
Предложены также соединения Формулы Ic:

и их фармацевтически приемлемые соли, где:
R2 выбран из: C2-C6 алкила, арила, арил-C1-C6 алкила, C4-C7 циклоалкила, C3-C7 циклоалкил-C1-C6 алкила, гетероарила, гетероарил-C1-C6 алкила и гетероциклила, каждый из которых необязательно замещен одним или более заместителями, выбранными из: C1-C6 алкокси, C1-C6 алкоксикарбонила, C1-C6 алкила, C1-C6 алкиламино, амино, амино-C1-C6 алкила, аминоарила, амино-C3-C7 циклоалкила, арила, карбоксамида, карбоксила, циано, C1-C6 галогеналкила, C1-C6 галогеналкокси, галогена, гидроксила, нитро, тио и тио-C1-C6 алкила; и
Х представляет собой -C(O)NHCH(CH2R3)-, или Х отсутствует; и
R3 выбран из: арила, гетероарила и C3-C7 циклоалкила, каждый из которых необязательно замещен одним заместителем, выбранным из амино и гидроксила; и
R4 и R5, каждый независимо, выбраны из: Н и C1-C6 алкила.
Предложены также соединения Формулы Ic:

или его фармацевтически приемлемая соль,
где:
R2 выбран из: 4-аминобензила, 4-(аминометил)бензила, 4-(аминометил)фенила, 4-аминофенила, бензила, 3-меркаптопропила, 2-меркаптоэтила, 4-(меркаптометил)фенила, n-толила, 2,4,6-триметилфенила, 4-(трифторметокси)фенила, 2,4,6-триизопропилфенила, 4-трет-бутилфенила, 4-хлорфенила, 3-цианофенила, 2-нитрофенила, 4-метокси-2-нитрофенила, 4-аминокарбонил-2-нитрофенила, 4-метоксифенила, фенила, 2-фторбензила, пиперидин-2-ила, о-толила, 4-бромфенила, нафталин-2-ила, 4-метоксикарбонилфенила, 2-(трифторметил)бензила, гексан-2-ила, 2-метоксиэтила, циклопентилметила, циклогексила, пиридин-3-илметила, 4-карбоксифенила, 3-аминофенила, пиридин-3-ила, тиен-2-ила, 4-гидроксифенила, 4-(1-аминоциклопропил)бензила, 4-(1-аминоциклопропил)бензила, 2-метилбензила, 4-нитробензила, 4-хлорбензила, фенетила, 4-бромбензила, 4-цианобензила, 3-нитробензила, 4-трет-бутилбензила, 2-нитробензила, 4-нитрофенетила, 2-хлор-3-метоксикарбонилфенила, 2-аминофенила, [1,1'-бифенил]-4-ила, 4'-амино-[1,1'-бифенил]-4-ила, 4-фторбензила, 3-(трифторметил)бензила, 3-(трифторметокси)бензила, 3,4-дихлорбензила, 2-цианобензила, 3-хлорензила, 4-амино-2-этилфенила, 4-амино-3-(трифторметокси)фенила, 4-амино-2,3-диметилфенила, 4-амино-5,6,7,8-тетрагидронафталин-1-ила, 4-амино-3-метилфенила, 4-амино-3-фторфенила, 4-амино-3-этилфенила и 4-амино-3-(трифторметил)фенила; и
Х представляет собой -C(O)NHCH(CH2R3)-, или Х отсутствует; и
R3 выбран из: 1H-индол-3-ила, 4-аминофенила, 4-гидроксифенила, 5-гидроксипиридин-2-ила, циклогексила и фенила; и
R4 и R5, каждый независимо, выбраны из: Н и метила.
Предложены также соединения Формулы Id:
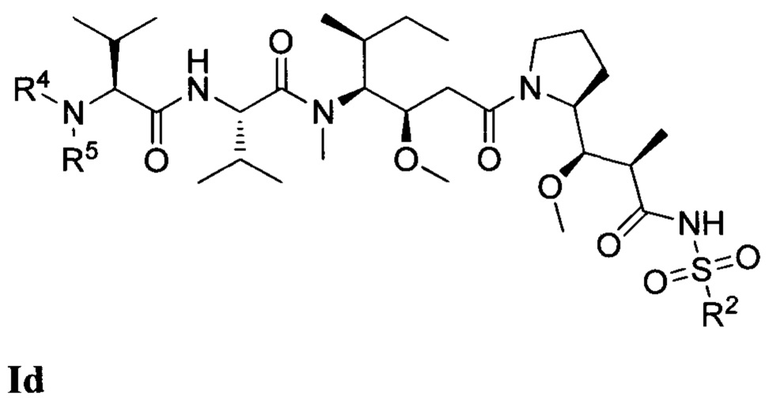
и их фармацевтически приемлемые соли, где:
R2 выбран из: C2-C6 алкила, арила, арил-C1-C6 алкила, C4-C7 циклоалкила, C3-C7 циклоалкил-C1-C6 алкила, гетероарила, гетероарил-C1-C6 алкила и гетероциклила, каждый из которых необязательно замещен одним или более заместителями, выбранными из: C1-C6 алкокси, C1-C6 алкоксикарбонила, C1-C6 алкила, C1-C6 алкиламино, амино, амино-C1-C6 алкила, аминоарила, амино-C3-C7 циклоалкила, арила, карбоксамида, карбоксила, циано, C1-C6 галогеналкила, C1-C6 галогеналкокси, галогена, гидроксила, нитро, тио и тио-C1-C6 алкила; и
R4 и R5, каждый независимо, выбраны из: Н и C1-C6 алкила.
Предложены также соединения Формулы Id:

и их фармацевтически приемлемые соли, где:
R2 выбран из: 4-аминобензила, 4-(аминометил)бензила, 4-(аминометил)фенила, 4-аминофенила, бензила, 3-меркаптопропила, 2-меркаптоэтила, 4-(меркаптометил)фенила, n-толила, 2,4,6-триметилфенила, 4-(трифторметокси)фенила, 2,4,6-триизопропилфенила, 4-трет-бутилфенила, 4-хлорфенила, 3-цианофенила, 2-нитрофенила, 4-метокси-2-нитрофенила, 4-аминокарбонил-2-нитрофенила, 4-метоксифенила, фенила, 2-фторбензила, пиперидин-2-ила, о-толила, 4-бромфенила, нафталин-2-ила, 4-метоксикарбонилфенила, 2-(трифторметил)бензила, гексан-2-ила, 2-метоксиэтила, циклопентилметила, циклогексила, пиридин-3-илметила, 4-карбоксифенила, 3-аминофенила, пиридин-3-ила, тиен-2-ила, 4-гидроксифенила, 4-(1-аминоциклопропил)бензила, 4-(1-аминоциклопропил)бензила, 2-метилбензила, 4-нитробензила, 4-хлорбензила, фенетила, 4-бромбензила, 4-цианобензила, 3-нитробензила, 4-трет-бутилбензила, 2-нитробензила, 4-нитрофенетила, 2-хлор-3-метоксикарбонилфенила, 2-аминофенила, [1,1'-бифенил]-4-ила, 4'-амино-[1,1'-бифенил]-4-ила, 4-фторбензила, 3-(трифторметил)бензила, 3-(трифторметокси)бензила, 3,4-дихлорбензила, 2-цианобензила, 3-хлорензила, 4-амино-2-этилфенила, 4-амино-3-(трифторметокси)фенила, 4-амино-2,3-диметилфенила, 4-амино-5,6,7,8-тетрагидронафталин-1-ила, 4-амино-3-метилфенила, 4-амино-3-фторфенила, 4-амино-3-этилфенила и 4-амино-3-(трифторметил)фенила; и
R4 и R5, каждый независимо, выбраны из: Н и метила.
Предложены также соединения Формулы Ie:

и их фармацевтически приемлемые соли, где:
R2 выбран из: C2-C6 алкила, арила, арил-C1-C6 алкила, C4-C7 циклоалкила, C3-C7 циклоалкил-C1-C6 алкила, гетероарила, гетероарил-C1-C6 алкила и гетероциклила, каждый из которых необязательно замещен одним или более заместителями, выбранными из: C1-C6 алкокси, C1-C6 алкоксикарбонила, C1-C6 алкила, C1-C6 алкиламино, амино, амино-C1-C6 алкила, аминоарила, амино-C3-C7 циклоалкила, арила, карбоксамида, карбоксила, циано, C1-C6 галогеналкила, C1-C6 галогеналкокси, галогена, гидроксила, нитро, тио и тио-C1-C6 алкила; и
R3 выбран из: арила, гетероарила и C3-C7 циклоалкила, каждый из которых необязательно замещен одним заместителем, выбранным из амино и гидроксила; и
R4 и R5, каждый независимо, выбраны из: Н и C1-C6 алкила.
Предложены также соединения Формулы Ie:
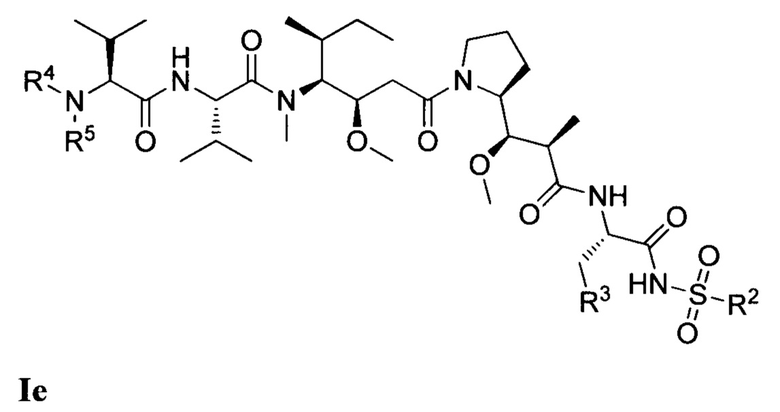
и их фармацевтически приемлемые соли, где:
R2 выбран из: 4-аминобензила, 4-(аминометил)бензила, 4-(аминометил)фенила, 4-аминофенила, бензила, 3-меркаптопропила, 2-меркаптоэтила, 4-(меркаптометил)фенила, n-толила, 2,4,6-триметилфенила, 4-(трифторметокси)фенила, 2,4,6-триизопропилфенила, 4-трет-бутилфенила, 4-хлорфенила, 3-цианофенила, 2-нитрофенила, 4-метокси-2-нитрофенила, 4-аминокарбонил-2-нитрофенила, 4-метоксифенила, фенила, 2-фторбензила, пиперидин-2-ила, о-толила, 4-бромфенила, нафталин-2-ила, 4-метоксикарбонилфенила, 2-(трифторметил)бензила, гексан-2-ила, 2-метоксиэтила, циклопентилметила, циклогексила, пиридин-3-илметила, 4-карбоксифенила, 3-аминофенила, пиридин-3-ила, тиен-2-ила, 4-гидроксифенила, 4-(1-аминоциклопропил)бензила, 4-(1-аминоциклопропил)бензила, 2-метилбензила, 4-нитробензила, 4-хлорбензила, фенетила, 4-бромбензила, 4-цианобензила, 3-нитробензила, 4-трет-бутилбензила, 2-нитробензила, 4-нитрофенетила, 2-хлор-3-метоксикарбонилфенила, 2-аминофенила, [1,1'-бифенил]-4-ила, 4'-амино-[1,1'-бифенил]-4-ила, 4-фторбензила, 3-(трифторметил)бензила, 3-(трифторметокси)бензила, 3,4-дихлорбензила, 2-цианобензила, 3-хлорензила, 4-амино-2-этилфенила, 4-амино-3-(трифторметокси)фенила, 4-амино-2,3-диметилфенила, 4-амино-5,6,7,8-тетрагидронафталин-1-ила, 4-амино-3-метилфенила, 4-амино-3-фторфенила, 4-амино-3-этилфенила и 4-амино-3-(трифторметил)фенила; и
R3 выбран из: 1H-индол-3-ила, 4-аминофенила, 4-гидроксифенила, 5-гидроксипиридин-2-ила, циклогексила и фенила; и
R4 и R5, каждый независимо, выбраны из: Н и метила.
Предложены также соединения Формулы If:

и их фармацевтически приемлемые соли, где:
R2 выбран из: C2-C6 алкила, арила, арил-C1-C6 алкила, C4-C7 циклоалкила, C3-C7 циклоалкил-C1-C6 алкила, гетероарила, гетероарил-C1-C6 алкила и гетероциклила, каждый из которых необязательно замещен одним или более заместителями, выбранными из: C1-C6 алкокси, C1-C6 алкоксикарбонила, C1-C6 алкила, C1-C6 алкиламино, амино, амино-C1-C6 алкила, аминоарила, амино-C3-C7 циклоалкила, арила, карбоксамида, карбоксила, циано, C1-C6 галогеналкила, C1-C6 галогеналкокси, галогена, гидроксила, нитро, тио и тио-C1-C6 алкила; и
Х представляет собой -C(O)NHCH(CH2R3)-, или Х отсутствует; и
R3 выбран из: арила, гетероарила и C3-C7 циклоалкила, каждый из которых необязательно замещен одним заместителем, выбранным из амино и гидроксила.
Предложены также соединения Формулы If:

и их фармацевтически приемлемые соли, где:
R2 выбран из: 4-аминобензила, 4-(аминометил)бензила, 4-(аминометил)фенила, 4-аминофенила; и
Х представляет собой -C(O)NHCH(CH2R3)-, или Х отсутствует; и
R3 выбран из: 1H-индол-3-ила, 4-аминофенила, 4-гидроксифенила, 5-гидроксипиридин-2-ила, циклогексила и фенила.
Предложены также соединения Формулы Ig:
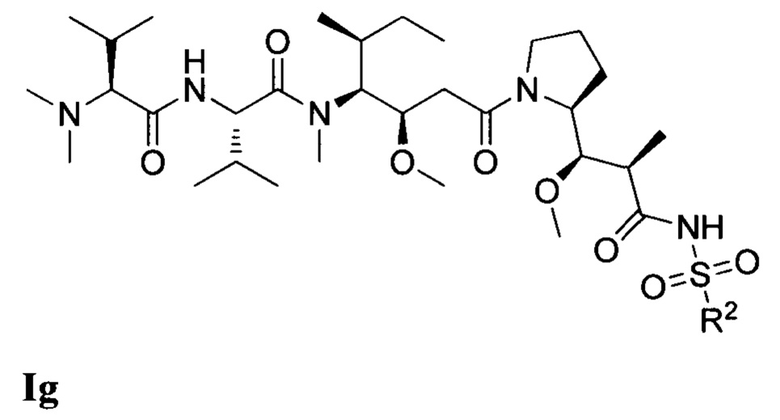
и их фармацевтически приемлемые соли, где:
R2 выбран из: C2-C6 алкила, арила, арил-C1-C6 алкила, C4-C7 циклоалкила, C3-C7 циклоалкил-C1-C6 алкила, гетероарила, гетероарил-C1-C6 алкила и гетероциклила, каждый из которых необязательно замещен одним или более заместителями, выбранными из: C1-C6 алкокси, C1-C6 алкоксикарбонила, C1-C6 алкила, C1-C6 алкиламино, амино, амино-C1-C6 алкила, аминоарила, амино-C3-C7 циклоалкила, арила, карбоксамида, карбоксила, циано, C1-C6 галогеналкила, C1-C6 галогеналкокси, галогена, гидроксила, нитро, тио и тио-C1-C6 алкила.
Предложены также соединения Формулы Ig:

и их фармацевтически приемлемые соли, где:
R2 выбран из: 4-аминобензила, 4-(аминометил)бензила, 4-(аминометил)фенила, 4-аминофенила.
Предложены также соединения Формулы Ih:

и их фармацевтически приемлемые соли, где:
R2 выбран из: C2-C6 алкила, арила, арил-C1-C6 алкила, C4-C7 циклоалкила, C3-C7 циклоалкил-C1-C6 алкила, гетероарила, гетероарил-C1-C6 алкила и гетероциклила, каждый из которых необязательно замещен одним или более заместителями, выбранными из: C1-C6 алкокси, C1-C6 алкоксикарбонила, C1-C6 алкила, C1-C6 алкиламино, амино, амино-C1-C6 алкила, аминоарила, амино-C3-C7 циклоалкила, арила, карбоксамида, карбоксила, циано, C1-C6 галогеналкила, C1-C6 галогеналкокси, галогена, гидроксила, нитро, тио и тио-C1-C6 алкила; и
R3 выбран из: арила, гетероарила и C3-C7 циклоалкила, каждый из которых необязательно замещен одним заместителем, выбранным из амино и гидроксила.
Предложены также соединения Формулы Ih:

и их фармацевтически приемлемые соли, где:
R2 выбран из: 4-аминобензила, 4-(аминометил)бензила, 4-(аминометил)фенила, 4-аминофенила; и
R3 выбран из: 1H-индол-3-ила, 4-аминофенила, 4-гидроксифенила, 5-гидроксипиридин-2-ила, циклогексила и фенила.
Предложены также соединения Формулы Ii:

и их фармацевтически приемлемые соли, где:
R2 выбран из: C2-C6 алкила, арила, арил-C1-C6 алкила, C4-C7 циклоалкила, C3-C7 циклоалкил-C1-C6 алкила, гетероарила, гетероарил-C1-C6 алкила и гетероциклила, каждый из которых необязательно замещен одним или более заместителями, выбранными из: C1-C6 алкокси, C1-C6 алкоксикарбонила, C1-C6 алкила, C1-C6 алкиламино, амино, амино-C1-C6 алкила, аминоарила, амино-C3-C7 циклоалкила, арила, карбоксамида, карбоксила, циано, C1-C6 галогеналкила, C1-C6 галогеналкокси, галогена, гидроксила, нитро, тио и тио-C1-C6 алкила;
Х представляет собой -C(O)NHCH(CH2R3)-, или Х отсутствует; и
R3 выбран из: арила, гетероарила и C3-C7 циклоалкила, каждый из которых необязательно замещен одним заместителем, выбранным из амино и гидроксила.
Предложены также соединения Формулы Ii:
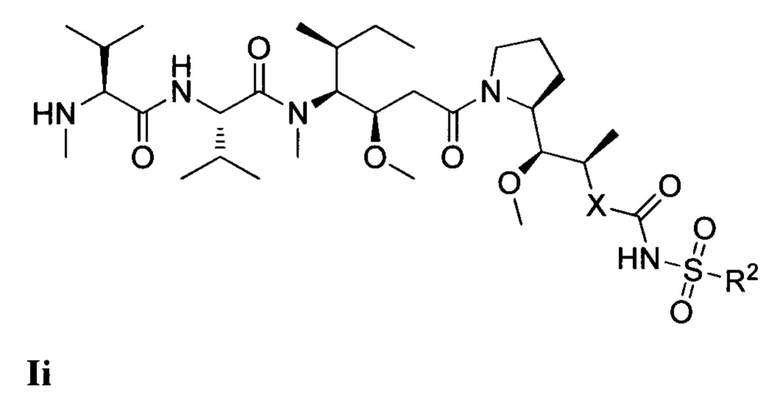
и их фармацевтически приемлемые соли, где:
R2 выбран из: 4-аминобензила, 4-(аминометил)бензила, 4-(аминометил)фенила, 4-аминофенила, бензила, 3-меркаптопропила, 2-меркаптоэтила, 4-(меркаптометил)фенила, n-толила, 2,4,6-триметилфенила, 4-(трифторметокси)фенила, 2,4,6-триизопропилфенила, 4-трет-бутилфенила, 4-хлорфенила, 3-цианофенила, 2-нитрофенила, 4-метокси-2-нитрофенила, 4-аминокарбонил-2-нитрофенила, 4-метоксифенила, фенила, 2-фторбензила, пиперидин-1-ила, о-толила, 4-бромфенила, нафталин-2-ила, 4-метоксикарбонилфенила, 2-(трифторметил)бензила, гексан-2-ила, 2-метоксиэтила, циклопентилметила, циклогексила, пиридин-3-илметила, 4-карбоксифенила, 3-аминофенила, пиридин-3-ила, тиен-2-ила, 4-гидроксифенила, 4-(1-аминоциклопропил)бензила, 4-(1-аминоциклопропил)фенила, 2-метилбензила, 4-нитробензила, 4-хлорбензила, фенетила, 4-бромбензила, 4-цианобензила, 3-нитробензила, 4-трет-бутилбензила, 2-нитробензила, 4-нитрофенетила, 2-хлор-3-метоксикарбонилфенила, 2-аминофенила, [1,1'-бифенил]-4-ила, 4'-амино-[1,1'-бифенил]-4-ила, 4-фторбензила, 3-(трифторметил)бензила, 3-(трифторметокси)бензила, 3,4-дихлорбензила, 2-цианобензила, 3-хлорбензила, 4-амино-2-этилфенила, 4-амино-3-(трифторметокси)фенила, 4-амино-2,3-диметилфенила, 4-амино-5,6,7,8-тетрагидронафталин-1-ила, 4-амино-3-метилфенила, 4-амино-3-фторфенила, 4-амино-3-этилфенила и 4-амино-3-(трифторметил)фенила;
Х представляет собой -C(O)NHCH(CH2R3)-, или Х отсутствует; и
R3 выбран из: 1H-индол-3-ила, 4-аминофенила, 4-гидроксифенила, 5-гидроксипиридин-2-ила, циклогексила и фенила.
Предложены также соединения Формулы Ij:

и их фармацевтически приемлемые соли, где:
R2 выбран из: C2-C6 алкила, арила, арил-C1-C6 алкила, C4-C7 циклоалкила, C3-C7 циклоалкил-C1-C6 алкила, гетероарила, гетероарил-C1-C6 алкила и гетероциклила, каждый из которых необязательно замещен одним или более заместителями, выбранными из: C1-C6 алкокси, C1-C6 алкоксикарбонила, C1-C6 алкила, C1-C6 алкиламино, амино, амино-C1-C6 алкила, аминоарила, амино-C3-C7 циклоалкила, арила, карбоксамида, карбоксила, циано, C1-C6 галогеналкила, C1-C6 галогеналкокси, галогена, гидроксила, нитро, тио и тио-C1-C6 алкила.
Предложены также соединения Формулы Ij:

или его фармацевтически приемлемая соль,
где:
R2 выбран из: 4-аминобензила, 4-(аминометил)бензила, 4-(аминометил)фенила, 4-аминофенила, бензила, 3-меркаптопропила, 2-меркаптоэтила, 4-(меркаптометил)фенила, n-толила, 2,4,6-триметилфенила, 4-(трифторметокси)фенила, 2,4,6-триизопропилфенила, 4-трет-бутилфенила, 4-хлорфенила, 3-цианофенила, 2-нитрофенила, 4-метокси-2-нитрофенила, 4-аминокарбонил-2-нитрофенила, 4-метоксифенила, фенила, 2-фторбензила, пиперидин-1-ила, о-толила, 4-бромфенила, нафталин-2-ила, 4-метоксикарбонилфенила, 2-(трифторметил)бензила, гексан-2-ила, 2-метоксиэтила, циклопентилметила, циклогексила, пиридин-3-илметила, 4-карбоксифенила, 3-аминофенила, пиридин-3-ила, тиен-2-ила, 4-гидроксифенила, 4-(1-аминоциклопропил)бензила, 4-(1-аминоциклопропил)фенила, 2-метилбензила, 4-нитробензила, 4-хлорбензила, фенетила, 4-бромбензила, 4-цианобензила, 3-нитробензила, 4-трет-бутилбензила, 2-нитробензила, 4-нитрофенетила, 2-хлор-3-метоксикарбонилфенила, 2-аминофенила, [1,1'-бифенил]-4-ила, 4'-амино-[1,1'-бифенил]-4-ила, 4-фторбензила, 3-(трифторметил)бензила, 3-(трифторметокси)бензила, 3,4-дихлорбензила, 2-цианобензила, 3-хлорбензила, 4-амино-2-этилфенила, 4-амино-3-(трифторметокси)фенила, 4-амино-2,3-диметилфенила, 4-амино-5,6,7,8-тетрагидронафталин-1-ила, 4-амино-3-метилфенила, 4-амино-3-фторфенила, 4-амино-3-этилфенила и 4-амино-3-(трифторметил)фенила.
Предложены также соединения Формулы Ik:

и их фармацевтически приемлемые соли, где:
R2 выбран из: C2-C6 алкила, арила, арил-C1-C6 алкила, C4-C7 циклоалкила, C3-C7 циклоалкил-C1-C6 алкила, гетероарила, гетероарил-C1-C6 алкила и гетероциклила, каждый из которых необязательно замещен одним или более заместителями, выбранными из: C1-C6 алкокси, C1-C6 алкоксикарбонила, C1-C6 алкила, C1-C6 алкиламино, амино, амино-C1-C6 алкила, аминоарила, амино-C3-C7 циклоалкила, арила, карбоксамида, карбоксила, циано, C1-C6 галогеналкила, C1-C6 галогеналкокси, галогена, гидроксила, нитро, тио и тио-C1-C6 алкила; и
R3 выбран из: арила, гетероарила и C3-C7 циклоалкила, каждый из которых необязательно замещен одним заместителем, выбранным из амино и гидроксила.
Предложены также соединения Формулы Ik:
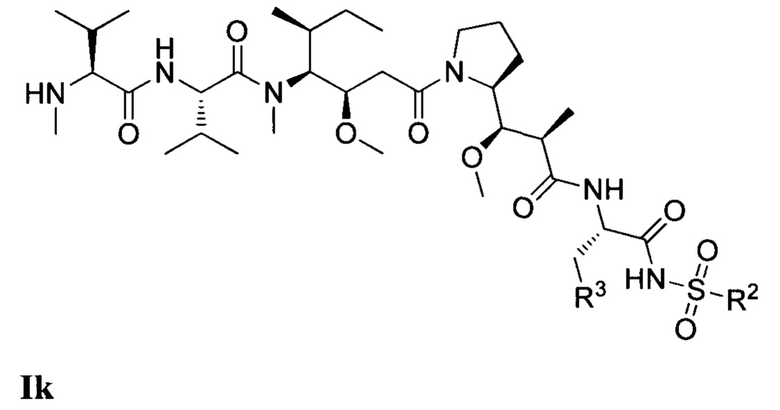
и их фармацевтически приемлемые соли, где:
R2 выбран из: 4-аминобензила, 4-(аминометил)бензила, 4-(аминометил)фенила, 4-аминофенила, бензила, 3-меркаптопропила, 2-меркаптоэтила, 4-(меркаптометил)фенила, n-толила, 2,4,6-триметилфенила, 4-(трифторметокси)фенила, 2,4,6-триизопропилфенила, 4-трет-бутилфенила, 4-хлорфенила, 3-цианофенила, 2-нитрофенила, 4-метокси-2-нитрофенила, 4-аминокарбонил-2-нитрофенила, 4-метоксифенила, фенила, 2-фторбензила, пиперидин-2-ила, о-толила, 4-бромфенила, нафталин-2-ила, 4-метоксикарбонилфенила, 2-(трифторметил)бензила, гексан-2-ила, 2-метоксиэтила, циклопентилметила, циклогексила, пиридин-3-илметила, 4-карбоксифенила, 3-аминофенила, пиридин-3-ила, тиен-2-ила, 4-гидроксифенила, 4-(1-аминоциклопропил)бензила, 4-(1-аминоциклопропил)бензила, 2-метилбензила, 4-нитробензила, 4-хлорбензила, фенетила, 4-бромбензила, 4-цианобензила, 3-нитробензила, 4-трет-бутилбензила, 2-нитробензила, 4-нитрофенетила, 2-хлор-3-метоксикарбонилфенила, 2-аминофенила, [1,1'-бифенил]-4-ила, 4'-амино-[1,1'-бифенил]-4-ила, 4-фторбензила, 3-(трифторметил)бензила, 3-(трифторметокси)бензила, 3,4-дихлорбензила, 2-цианобензила, 3-хлорензила, 4-амино-2-этилфенила, 4-амино-3-(трифторметокси)фенила, 4-амино-2,3-диметилфенила, 4-амино-5,6,7,8-тетрагидронафталин-1-ила, 4-амино-3-метилфенила, 4-амино-3-фторфенила, 4-амино-3-этилфенила и 4-амино-3-(трифторметил)фенила; и
R3 выбран из: 1H-индол-3-ила, 4-аминофенила, 4-гидроксифенила, 5-гидроксипиридин-2-ила, циклогексила и фенила.
Предложены также соединения Формулы Im:

и их фармацевтически приемлемые соли, где:
R1 выбран из: амино-C1-C6 алкила, аминоарила, амино-C3-C7 циклоалкила, амино-гетероциклила и гетероциклила, каждый из которых необязательно замещен одним или более заместителями, выбранными из арила, арил-C1-C6 алкила, C1-C6 алкила, C1-C6 алкилтио, карбоксила, карбоксамида, C3-C7 циклоалкила, C3-C7 циклоалкил-C1-C6 алкила, гуанидино, галогена, C1-C6 галогенацила, C1-C6 галогеналкила, гетероциклила, гетероциклил-C1-C6 алкила, гидроксила и тио; или
R1 представляет собой RaRbNCH(Rc)-;
Ra выбран из: Н и C1-C6 алкила;
Rb представляет собой C1-C6 алкил; и
Rc представляет собой Rd-C(CH3)2-; и
Rd выбран из: Н, арила, C3-C7 циклоалкила и гетероарила, каждый из которых необязательно замещен одним или более заместителями, выбранными из: C1-C4 ацилтио, C2-C4 алкенила, C1-C4 алкила, C1-C4 алкиламино, C1-C4 алкилокси, амино, амино-C1-C4 алкила, галогена, C1-C4 галогеналкила, гидроксила, гидрокси-C1-C4 алкила и тио, где C2-C4 алкенил, C1-C4 алкиламино и C1-C4 алкилокси дополнительно необязательно замещены одним заместителем, выбранным из C1-C4 алкиларила, гидроксила и тио; или
Rb и Rc вместе с атомами, с которыми они связаны, образуют гетероциклилдиил;
R2 выбран из: C2-C6 алкила, арила, арил-C1-C6 алкила, C4-C7 циклоалкила, C3-C7 циклоалкил-C1-C6 алкила, гетероарила, гетероарил-C1-C6 алкила и гетероциклила, каждый из которых необязательно замещен одним или более заместителями, выбранными из: C1-C6 алкокси, C1-C6 алкоксикарбонила, C1-C6 алкила, C1-C6 алкиламино, амино, амино-C1-C6 алкила, амино-арила, амино-C3-C7 циклоалкила, арила, карбоксамида, карбоксила, циано, C1-C6 галогенацила, C1-C6 галогеналкила, C1-C6 галогеналкокси, галогена, гидроксила, нитро, тио и тио-C1-C6 алкила.
Предложены также соединения Формулы Im:

и их фармацевтически приемлемые соли, где:
R1 выбран из: 1-(диметиламино)-2-метилпропила, 2-метил-1-(метиламино)пропила, 1-аминоциклопентила, 1-аминоциклопропила, 4-аминофенила, 2-аминопропан-2-ила, 1-аминоциклогексила, 3-аминооксетан-3-ила, 2-(метиламино)пропан-2-ила, 1-амино-2-метилпропан-2-ила, 2-метилпирролидин-2-ила, 2-амино-3-метилбутан-2-ила, 2-аминобутан-2-ила, 2-метил-1-(метиламино)пропан-2-ила, 1-метилпиперидин-2-ила, 3-фторпирролидин-3-ила, 1,2-диметилпирролидин-2-ила и 2-(диметиламино)пропан-2-ила; и
R2 выбран из: 4-аминобензила, 4-(аминометил)бензила, 4-(аминометил)фенила, 4-аминофенила, бензила, 3-меркаптопропила, 2-меркаптоэтила, 4-(меркаптометил)фенила, n-толила, 2,4,6-триметилфенила, 4-(трифторметокси)фенила, 2,4,6-триизопропилфенила, 4-трет-бутилфенила, 4-хлорфенила, 3-цианофенила, 2-нитрофенила, 4-метокси-2-нитрофенила, 4-аминокарбонил-2-нитрофенила, 4-метоксифенила, фенила, 2-фторбензила, пиперидин-1-ила, о-толила, 4-бромфенила, нафталин-2-ила, 4-метоксикарбонилфенила, 2-(трифторметил)бензила, гексан-2-ила, 2-метоксиэтила, циклопентилметила, циклогексила, пиридин-3-илметила, 4-карбоксифенила, 3-аминофенила, пиридин-3-ила, тиен-2-ила, 4-гидроксифенила, 4-(1-аминоциклопропил)бензила, 4-(1-аминоциклопропил)фенила, 2-метилбензила, 4-нитробензила, 4-хлорбензила, фенетила, 4-бромбензила, 4-цианобензила, 3-нитробензила, 4-трет-бутилбензила, 2-нитробензила, 4-нитрофенетила, 2-хлор-3-метоксикарбонилфенила, 2-аминофенила, [1,1'-бифенил]-4-ила, 4'-амино-[1,1'-бифенил]-4-ила, 4-фторбензила, 3-(трифторметил)бензила, 3-(трифторметокси)бензила, 3,4-дихлорбензила, 2-цианобензила, 3-хлорбензила, 4-амино-2-этилфенила, 4-амино-3-(трифторметокси)фенила, 4-амино-2,3-диметилфенила, 4-амино-5,6,7,8-тетрагидронафталин-1-ила, 4-амино-3-метилфенила, 4-амино-3-фторфенила, 4-амино-3-этилфенила и 4-амино-3-(трифторметил)фенила.
Предложены также соединения Формулы Im:

и их фармацевтически приемлемые соли, где:
R1 выбран из: амино-C1-C6 алкила, аминоарила, амино-C3-C7 циклоалкила, амино-гетероциклила и гетероциклила, каждый из которых необязательно замещен одним или более заместителями, выбранными из арила, арил-C1-C6 алкила, C1-C6 алкила, C1-C6 алкилтио, карбоксила, карбоксамида, C3-C7 циклоалкила, C3-C7 циклоалкил-C1-C6 алкила, гуанидино, галогена, C1-C6 галогенацила, C1-C6 галогеналкила, гетероциклила, гетероциклил-C1-C6 алкила, гидроксила и тио; или
R1 представляет собой RaRbNCH(Rc)-;
Ra выбран из: Н и C1-C6 алкила;
Rb представляет собой C1-C6 алкил; и
Rc представляет собой Rd-C(CH3)2-; и
Rd выбран из: Н, арила, C3-C7 циклоалкила и гетероарила, каждый из которых необязательно замещен одним или более заместителями, выбранными из: C1-C4 ацилтио, C2-C4 алкенила, C1-C4 алкила, C1-C4 алкиламино, C1-C4 алкилокси, амино, амино-C1-C4 алкила, галогена, C1-C4 галогеналкила, гидроксила, гидрокси-C1-C4 алкила и тио, где C2-C4 алкенил, C1-C4 алкиламино и C1-C4 алкилокси дополнительно необязательно замещены одним заместителем, выбранным из C1-C4 алкиларила, гидроксила и тио; или
Rb и Rc вместе с атомами, с которыми они связаны, образуют гетероциклилдиил;
R2 выбран из: C1-C6 алкила, арила, арил-C1-C6 алкила, C3-C7 циклоалкила, C3-C7 циклоалкил-C1-C6 алкила, гетероарила, гетероарил-C1-C6 алкила и гетероциклила, каждый из которых необязательно замещен одним или более заместителями, выбранными из: C1-C6 алкокси, C1-C6 алкоксикарбонила, C1-C6 алкила, C1-C6 алкиламино, амино, амино-C1-C6 алкила, амино-арила, амино-C3-C7 циклоалкила, арила, карбоксамида, карбоксила, циано, C1-C6 галогенацила, C1-C6 галогеналкила, C1-C6 галогеналкокси, галогена, гидроксила, нитро, тио и тио-C1-C6 алкила.
Предложены также соединения Формулы Im:

и их фармацевтически приемлемые соли, где:
R1 выбран из: 1-(диметиламино)-2-метилпропила, 2-метил-1-(метиламино)пропила, 1-аминоциклопентила, 1-аминоциклопропила, 4-аминофенила, 2-аминопропан-2-ила, 1-аминоциклогексила, 3-аминооксетан-3-ила, 2-(метиламино)пропан-2-ила, 1-амино-2-метилпропан-2-ила, 2-метилпирролидин-2-ила, 2-амино-3-метилбутан-2-ила, 2-аминобутан-2-ила, 2-метил-1-(метиламино)пропан-2-ила, 1-метилпиперидин-2-ила, 3-фторпирролидин-3-ила, 1,2-диметилпирролидин-2-ила и 2-(диметиламино)пропан-2-ила, 2-метил-1-(метиламино)-2-фенилпропила, 1-изопропилпиперидин-2-ила, 2-азабицикло[2.2.1]гептан-3-ила и 2-метил-2-азабицикло[2.2.1]гептан-3-ила; и
R2 выбран из: 4-аминобензила, 4-(аминометил)бензила, 4-(аминометил)фенила, 4-аминофенила, бензила, 3-меркаптопропила, 2-меркаптоэтила, 4-(меркаптометил)фенила, n-толила, 2,4,6-триметилфенила, 4-(трифторметокси)фенила, 2,4,6-триизопропилфенила, 4-трет-бутилфенила, 4-хлорфенила, 3-цианофенила, 2-нитрофенила, 4-метокси-2-нитрофенила, 4-аминокарбонил-2-нитрофенила, 4-метоксифенила, фенила, 2-фторбензила, пиперидин-1-ила, о-толила, 4-бромфенила, нафталин-2-ила, 4-метоксикарбонилфенила, 2-(трифторметил)бензила, гексан-2-ила, 2-метоксиэтила, циклопентилметила, циклогексила, пиридин-3-илметила, 4-карбоксифенила, 3-аминофенила, пиридин-3-ила, тиен-2-ила, 4-гидроксифенила, 4-(1-аминоциклопропил)бензила, 4-(1-аминоциклопропил)фенила, 2-метилбензила, 4-нитробензила, 4-хлорбензила, фенетила, 4-бромбензила, 4-цианобензила, 3-нитробензила, 4-трет-бутилбензила, 2-нитробензила, 4-нитрофенетила, 2-хлор-3-метоксикарбонилфенила, 2-аминофенила, [1,1'-бифенил]-4-ила, 4'-амино-[1,1'-бифенил]-4-ила, 4-фторбензила, 3-(трифторметил)бензила, 3-(трифторметокси)бензила, 3,4-дихлорбензила, 2-цианобензила, 3-хлорбензила, 4-амино-2-этилфенила, 4-амино-3-(трифторметокси)фенила, 4-амино-2,3-диметилфенила, 4-амино-5,6,7,8-тетрагидронафталин-1-ила, 4-амино-3-метилфенила, 4-амино-3-фторфенила, 4-амино-3-этилфенила, 4-амино-3-(трифторметил)фенила и 4-(метоксикарбонил)фенила.
Предложены также соединения Формулы In:

и их фармацевтически приемлемые соли, где:
R1 выбран из: амино-C1-C6 алкила, аминоарила, амино-C3-C7 циклоалкила, амино-гетероциклила и гетероциклила, каждый из которых необязательно замещен одним или более заместителями, выбранными из арила, арил-C1-C6 алкила, C1-C6 алкила, C1-C6 алкилтио, карбоксила, карбоксамида, C3-C7 циклоалкила, C3-C7 циклоалкил-C1-C6 алкила, гуанидино, галогена, C1-C6 галогенацила, C1-C6 галогеналкила, гетероциклила, гетероциклил-C1-C6 алкила, гидроксила и тио; или
R1 представляет собой RaRbNCH(Rc)-;
Ra выбран из: Н и C1-C6 алкила;
Rb представляет собой C1-C6 алкил; и
Rc представляет собой Rd-C(CH3)2-; и
Rd выбран из: Н, арила, C3-C7 циклоалкила и гетероарила, каждый из которых необязательно замещен одним или более заместителями, выбранными из: C1-C4 ацилтио, C2-C4 алкенила, C1-C4 алкила, C1-C4 алкиламино, C1-C4 алкилокси, амино, амино-C1-C4 алкила, галогена, C1-C4 галогеналкила, гидроксила, гидрокси-C1-C4 алкила и тио, где C2-C4 алкенил, C1-C4 алкиламино и C1-C4 алкилокси дополнительно необязательно замещены одним заместителем, выбранным из C1-C4 алкиларила, гидроксила и тио; или
Rb и Rc вместе с атомами, с которыми они связаны, образуют гетероциклилдиил;
R2 выбран из: C2-C6 алкила, арила, арил-C1-C6 алкила, C4-C7 циклоалкила, C3-C7 циклоалкил-C1-C6 алкила, гетероарила, гетероарил-C1-C6 алкила и гетероциклила, каждый из которых необязательно замещен одним или более заместителями, выбранными из: C1-C6 алкокси, C1-C6 алкоксикарбонила, C1-C6 алкила, C1-C6 алкиламино, амино, амино-C1-C6 алкила, амино-арила, амино-C3-C7 циклоалкила, арила, карбоксамида, карбоксила, циано, C1-C6 галогенацила, C1-C6 галогеналкила, C1-C6 галогеналкокси, галогена, гидроксила, нитро, тио и тио-C1-C6 алкила; и
R3 выбран из: арила, гетероарила и C3-C7 циклоалкила, каждый из которых необязательно замещен одним заместителем, выбранным из амино и гидроксила;
при условии, что если R1 представляет собой 2-метил-1-(метиламино)пропил), и R3 представляет собой фенил, то R2 отличен от этила, изопропила, н-бутила и фенила.
Предложены также соединения Формулы In:

и их фармацевтически приемлемые соли, где:
R1 выбран из: 1-(диметиламино)-2-метилпропила, 2-метил-1-(метиламино)пропила, 1-аминоциклопентила, 1-аминоциклопропила, 4-аминофенила, 2-аминопропан-2-ила, 1-аминоциклогексила, 3-аминооксетан-3-ила, 2-(метиламино)пропан-2-ила, 1-амино-2-метилпропан-2-ила, 2-метилпирролидин-2-ила, 2-амино-3-метилбутан-2-ила, 2-аминобутан-2-ила, 2-метил-1-(метиламино)пропан-2-ила, 1-метилпиперидин-2-ила, 3-фторпирролидин-3-ила, 1,2-диметилпирролидин-2-ила и 2-(диметиламино)пропан-2-ила; и
R2 выбран из: 4-аминобензила, 4-(аминометил)бензила, 4-(аминометил)фенила, 4-аминофенила, бензила, 3-меркаптопропила, 2-меркаптоэтила, 4-(меркаптометил)фенила, n-толила, 2,4,6-триметилфенила, 4-(трифторметокси)фенила, 2,4,6-триизопропилфенила, 4-трет-бутилфенила, 4-хлорфенила, 3-цианофенила, 2-нитрофенила, 4-метокси-2-нитрофенила, 4-аминокарбонил-2-нитрофенила, 4-метоксифенила, фенила, 2-фторбензила, пиперидин-2-ила, о-толила, 4-бромфенила, нафталин-2-ила, 4-метоксикарбонилфенила, 2-(трифторметил)бензила, гексан-2-ила, 2-метоксиэтила, циклопентилметила, циклогексила, пиридин-3-илметила, 4-карбоксифенила, 3-аминофенила, пиридин-3-ила, тиен-2-ила, 4-гидроксифенила, 4-(1-аминоциклопропил)бензила, 4-(1-аминоциклопропил)бензила, 2-метилбензила, 4-нитробензила, 4-хлорбензила, фенетила, 4-бромбензила, 4-цианобензила, 3-нитробензила, 4-трет-бутилбензила, 2-нитробензила, 4-нитрофенетила, 2-хлор-3-метоксикарбонилфенила, 2-аминофенила, [1,1'-бифенил]-4-ила, 4'-амино-[1,1'-бифенил]-4-ила, 4-фторбензила, 3-(трифторметил)бензила, 3-(трифторметокси)бензила, 3,4-дихлорбензила, 2-цианобензила, 3-хлорензила, 4-амино-2-этилфенила, 4-амино-3-(трифторметокси)фенила, 4-амино-2,3-диметилфенила, 4-амино-5,6,7,8-тетрагидронафталин-1-ила, 4-амино-3-метилфенила, 4-амино-3-фторфенила, 4-амино-3-этилфенила и 4-амино-3-(трифторметил)фенила; и
R3 выбран из: 1H-индол-3-ила, 4-аминофенила, 4-гидроксифенила, 5-гидроксипиридин-2-ила, циклогексила и фенила,
при условии, что если R1 представляет собой 2-метил-1-(метиламино)пропил), и R3 представляет собой фенил, то R2 отличен от этила, изопропила, н-бутила и фенила.
Предложены также соединения Формулы In:

и их фармацевтически приемлемые соли, где:
R1 выбран из: 1-(диметиламино)-2-метилпропила, 2-метил-1-(метиламино)пропила, 1-аминоциклопентила, 1-аминоциклопропила, 4-аминофенила, 2-аминопропан-2-ила, 1-аминоциклогексила, 3-аминооксетан-3-ила, 2-(метиламино)пропан-2-ила, 1-амино-2-метилпропан-2-ила, 2-метилпирролидин-2-ила, 2-амино-3-метилбутан-2-ила, 2-аминобутан-2-ила, 2-метил-1-(метиламино)пропан-2-ила, 1-метилпиперидин-2-ила, 3-фторпирролидин-3-ила, 1,2-диметилпирролидин-2-ила и 2-(диметиламино)пропан-2-ила, 2-метил-1-(метиламино)-2-фенилпропила, 1-изопропилпиперидин-2-ила, 2-азабицикло[2.2.1]гептан-3-ила и 2-метил-2-азабицикло[2.2.1]гептан-3-ила; и
R2 выбран из: 4-аминобензила, 4-(аминометил)бензила, 4-(аминометил)фенила, 4-аминофенила, бензила, 3-меркаптопропила, 2-меркаптоэтила, 4-(меркаптометил)фенила, n-толила, 2,4,6-триметилфенила, 4-(трифторметокси)фенила, 2,4,6-триизопропилфенила, 4-трет-бутилфенила, 4-хлорфенила, 3-цианофенила, 2-нитрофенила, 4-метокси-2-нитрофенила, 4-аминокарбонил-2-нитрофенила, 4-метоксифенила, фенила, 2-фторбензила, пиперидин-1-ила, о-толила, 4-бромфенила, нафталин-2-ила, 4-метоксикарбонилфенила, 2-(трифторметил)бензила, гексан-2-ила, 2-метоксиэтила, циклопентилметила, циклогексила, пиридин-3-илметила, 4-карбоксифенила, 3-аминофенила, пиридин-3-ила, тиен-2-ила, 4-гидроксифенила, 4-(1-аминоциклопропил)бензила, 4-(1-аминоциклопропил)фенила, 2-метилбензила, 4-нитробензила, 4-хлорбензила, фенетила, 4-бромбензила, 4-цианобензила, 3-нитробензила, 4-трет-бутилбензила, 2-нитробензила, 4-нитрофенетила, 2-хлор-3-метоксикарбонилфенила, 2-аминофенила, [1,1'-бифенил]-4-ила, 4'-амино-[1,1'-бифенил]-4-ила, 4-фторбензила, 3-(трифторметил)бензила, 3-(трифторметокси)бензила, 3,4-дихлорбензила, 2-цианобензила, 3-хлорбензила, 4-амино-2-этилфенила, 4-амино-3-(трифторметокси)фенила, 4-амино-2,3-диметилфенила, 4-амино-5,6,7,8-тетрагидронафталин-1-ила, 4-амино-3-метилфенила, 4-амино-3-фторфенила, 4-амино-3-этилфенила, 4-амино-3-(трифторметил)фенила и 4-(метоксикарбонил)фенила; и
R3 выбран из: 1H-индол-3-ила, 4-аминофенила, 4-гидроксифенила, 5-гидроксипиридин-2-ила, циклогексила и фенила,
при условии, что если R1 представляет собой 2-метил-1-(метиламино)пропил), и R3 представляет собой фенил, то R2 отличен от этила, изопропила, н-бутила и фенила.
Предложены также соединения Формулы VI:

и их фармацевтически приемлемые соли, где:
R6 выбран из: амино-C1-C6 алкила, аминоарила, амино-C3-C7 циклоалкила, амино-гетероциклила и гетероциклила, каждый из которых необязательно замещен одним или более заместителями, выбранными из арила, арил-C1-C6 алкила, C1-C6 алкила, C1-C6 алкилтио, карбоксила, карбоксамида, C3-C7 циклоалкила, C3-C7 циклоалкил-C1-C6 алкила, гуанидино, галогена, C1-C6 галогенацила, C1-C6 галогеналкила, гетероциклила, гетероциклил-C1-C6 алкила, гидроксила и тио; или
R6 представляет собой ReRfNCH(Rg)-;
Re выбран из: Н и C1-C6 алкила;
Rf представляет собой C1-C6 алкил; и
Rg представляет собой Rh-C(CH3)2-; и
Rh выбран из: Н, арила, C3-C7 циклоалкила и гетероарила, каждый из которых необязательно замещен одним или более заместителями, выбранными из: C1-C4 ацилтио, C2-C4 алкенила, C1-C4 алкила, C1-C4 алкиламино, C1-C4 алкилокси, амино, амино-C1-C4 алкила, галогена, C1-C4 галогеналкила, гидроксила, гидрокси-C1-C4 алкила и тио, где C2-C4 алкенил, C1-C4 алкиламино и C1-C4 алкилокси дополнительно необязательно замещены одним заместителем, выбранным из C1-C4 алкиларила, гидроксила и тио; или
Re и Rf вместе с атомами, с которыми они связаны, образуют гетероциклилдиил;
R7 представляет собой C2-C4 алкил, необязательно замещенный C1-C6 алкилтио-группой;
R8 представляет собой C2-C4 алкил, необязательно замещенный C1-C6 алкилтио-группой;
R9 выбран из: Н и C1-C3 алкила;
R10 выбран из: C1-C6 алкила, арила, арил-C1-C6 алкила, C3-C7 циклоалкила, C3-C7 циклоалкил-C1-C6 алкила, гетероарила, гетероарил-C1-C6 алкила и гетероциклила, каждый из которых необязательно замещен одним или более заместителями, выбранными из: C1-C6 алкокси, C1-C6 алкоксикарбонила, C1-C6 алкила, C1-C6 алкиламино, амино, амино-C1-C6 алкила, амино-арила, амино-C3-C7 циклоалкила, арила, карбоксамида, карбоксила, циано, C1-C6 галогенацила, C1-C6 галогеналкила, C1-C6 галогеналкокси, галогена, гидроксила, нитро, тио и тио-C1-C6 алкила;
Y представляет собой -C(O)NHCH(CH2R11)- или Y отсутствует; и
R11 выбран из: арила, гетероарила и C3-C7 циклоалкила, каждый из которых необязательно замещен одним заместителем, выбранным из амино и гидроксила.
Предложены также соединения Формулы VI:
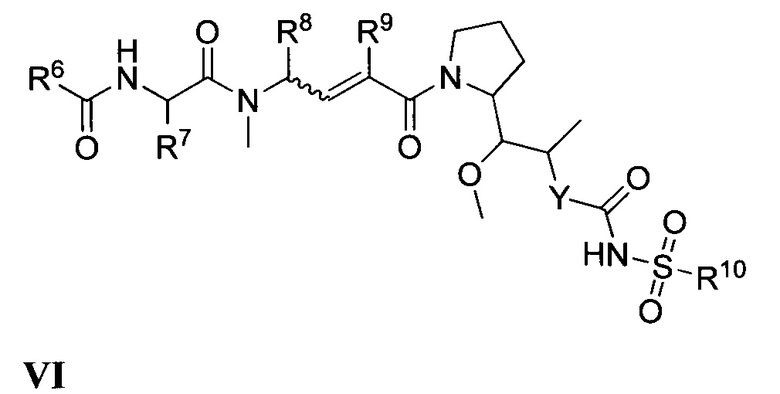
и их фармацевтически приемлемые соли, где:
R6 выбран из: 1-(диметиламино)-2-метилпропила, 2-метил-1-(метиламино)пропила, 1-аминоциклопентила, 1-аминоциклопропила, 4-аминофенила, 2-аминопропан-2-ила, 1-аминоциклогексила, 3-аминооксетан-3-ила, 2-(метиламино)пропан-2-ила, 1-амино-2-метилпропан-2-ила, 2-метилпирролидин-2-ила, 2-амино-3-метилбутан-2-ила, 2-аминобутан-2-ила, 2-метил-1-(метиламино)пропан-2-ила, 1-метилпиперидин-2-ила, 3-фторпирролидин-3-ила, 1,2-диметилпирролидин-2-ила и 2-(диметиламино)пропан-2-ила, 2-метил-1-(метиламино)-2-фенилпропила, 1-изопропилпиперидин-2-ила, 2-азабицикло[2.2.1]гептан-3-ила и 2-метил-2-азабицикло[2.2.1]гептан-3-ила; и
R7 выбран из: изопропила, изобутила, втор-бутила, трет-бутила и 2-(метилтио)этила;
R8 выбран из: изопропила, изобутила, втор-бутила и 2-(метилтио)этила;
R9 выбран из: метила, этила и н-пропила;
R10 выбран из: 4-аминобензила, 4-(аминометил)бензила, 4-(аминмоетил)фенила, 4-аминофенила, бензила, 3-меркаптопропила, 2-меркаптоэтила, 4-(меркаптометил)фенила, n-толила, 2,4,6-триметилфенила, 4-(трифторметокси)фенила, 2,4,6-триизопропилфенила, 4-трет-бутилфенила, 4-хлорфенила, 3-цианофенила, 2-нитрофенила, 4-метокси-2-нитрофенила, 4-аминокарбонил-2-нитрофенила, 4-метоксифенила, фенила, 2-фторбензила, пиперидин-1-ила, о-толила, 4-бромфенила, нафталин-2-ила, 4-метоксикарбонилфенила, 2-(трифторметил)бензила, гексан-2-ила, 2-метоксиэтила, циклопентилметила, циклогексила, пиридин-3-илметила, 4-карбоксифенила, 3-аминфоенила, пиридин-3-ила, тиен-2-ила, 4-гидроксифенила, 4-(1-аминоциклопропил)бензила, 4-(1-аминоциклопропил)фенила, 2-метилбензила, 4-нитробензила, 4-хлорбензила, фенетила, 4-бромбензила, 4-цианобензила, 3-нитробензила, 4-трет-бутилбензила, 2-нитробензила, 4-нитрофенетила, 2-хлор-3-метоксикарбонилфенила, 2-аминофенила, [1,1'-бифенил]-4-ила, 4'-амино-[1,1'-бифенил]-4-ила, 4-фторбензила, 3-(трифторметил)бензила, 3-(трифторметокси)бензила, 3,4-дихлорбензила, 2-цианобензила, 3-хлорбензила, 4-амино-2-этилфенила, 4-амино-3-(трифторметокси)фенила, 4-амино-2,3-диметилфенила, 4-амино-5,6,7,8-тетрагидронафталин-1-ила, 4-амино-3-метилфенила, 4-амино-3-фторфенила, 4-амино-3-этилфенила, 4-амино-3-(трифторметил)фенила и 4-(метоксикарбонил)фенила;
Y представляет собой -C(O)NHCH(CH2R11)- или Y отсутствует; и
R11 выбран из: 1H-индол-3-ила, 4-аминофенила, 4-гидроксифенила, 5-гидроксипиридин-2-ила, циклогексила и фенила.
Предложены также соединения Формулы VII:

и их фармацевтически приемлемые соли, где:
R6 выбран из: амино-C1-C6 алкила, аминоарила, амино-C3-C7 циклоалкила, амино-гетероциклила и гетероциклила, каждый из которых необязательно замещен одним или более заместителями, выбранными из арила, арил-C1-C6 алкила, C1-C6 алкила, C1-C6 алкилтио, карбоксила, карбоксамида, C3-C7 циклоалкила, C3-C7 циклоалкил-C1-C6 алкила, гуанидино, галогена, C1-C6 галогенацила, C1-C6 галогеналкила, гетероциклила, гетероциклил-C1-C6 алкила, гидроксила и тио; или
R6 представляет собой ReRfNCH(Rg)-;
Re выбран из: Н и C1-C6 алкила;
Rf представляет собой C1-C6 алкил; и
Rg представляет собой Rh-C(CH3)2-; и
Rh выбран из: Н, арила, C3-C7 циклоалкила и гетероарила, каждый из которых необязательно замещен одним или более заместителями, выбранными из: C1-C4 ацилтио, C2-C4 алкенила, C1-C4 алкила, C1-C4 алкиламино, C1-C4 алкилокси, амино, амино-C1-C4 алкила, галогена, C1-C4 галогеналкила, гидроксила, гидрокси-C1-C4 алкила и тио, где C2-C4 алкенил, C1-C4 алкиламино и C1-C4 алкилокси дополнительно необязательно замещены одним заместителем, выбранным из C1-C4 алкиларила, гидроксила и тио; или
Re и Rf вместе с атомами, с которыми они связаны, образуют гетероциклилдиил;
R7 представляет собой C2-C4 алкил, необязательно замещенный C1-C6 алкилтио-группой;
R8 представляет собой C2-C4 алкил, необязательно замещенный C1-C6 алкилтио-группой;
R9 выбран из: Н и C1-C3 алкила;
R10 выбран из: C1-C6 алкила, арила, арил-C1-C6 алкила, C3-C7 циклоалкила, C3-C7 циклоалкил-C1-C6 алкила, гетероарила, гетероарил-C1-C6 алкила и гетероциклила, каждый из которых необязательно замещен одним или более заместителями, выбранными из: C1-C6 алкокси, C1-C6 алкоксикарбонила, C1-C6 алкила, C1-C6 алкиламино, амино, амино-C1-C6 алкила, амино-арила, амино-C3-C7 циклоалкила, арила, карбоксамида, карбоксила, циано, C1-C6 галогенацила, C1-C6 галогеналкила, C1-C6 галогеналкокси, галогена, гидроксила, нитро, тио и тио-C1-C6 алкила;
Y представляет собой -C(O)NHCH(CH2R11)- или Y отсутствует; и
R11 выбран из: арила, гетероарила и C3-C7 циклоалкила, каждый из которых необязательно замещен одним заместителем, выбранным из амино и гидроксила.
Предложены также соединения Формулы VII:
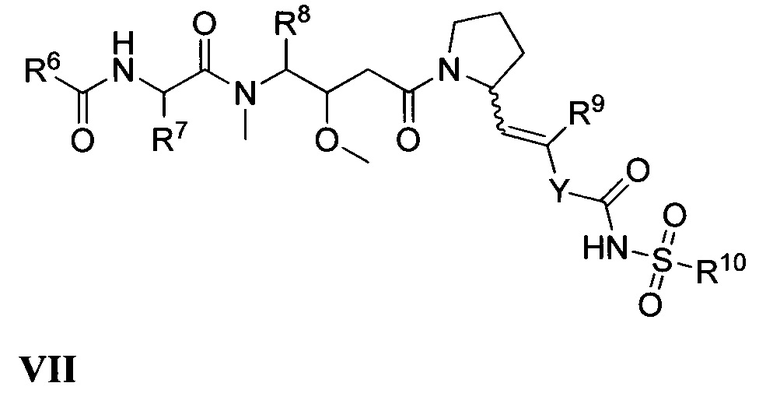
и их фармацевтически приемлемые соли, где:
R6 выбран из: 1-(диметиламино)-2-метилпропила, 2-метил-1-(метиламино)пропила, 1-аминоциклопентила, 1-аминоциклопропила, 4-аминофенила, 2-аминопропан-2-ила, 1-аминоциклогексила, 3-аминооксетан-3-ила, 2-(метиламино)пропан-2-ила, 1-амино-2-метилпропан-2-ила, 2-метилпирролидин-2-ила, 2-амино-3-метилбутан-2-ила, 2-аминобутан-2-ила, 2-метил-1-(метиламино)пропан-2-ила, 1-метилпиперидин-2-ила, 3-фторпирролидин-3-ила, 1,2-диметилпирролидин-2-ила и 2-(диметиламино)пропан-2-ила, 2-метил-1-(метиламино)-2-фенилпропила, 1-изопропилпиперидин-2-ила, 2-азабицикло[2.2.1]гептан-3-ила и 2-метил-2-азабицикло[2.2.1]гептан-3-ила;
R7 выбран из: изопропила, изобутила, втор-бутила, трет-бутила и 2-(метилтио)этила;
R8 выбран из: изопропила, изобутила, втор-бутила и 2-(метилтио)этила;
R9 выбран из: метила, этила и н-пропила;
R10 выбран из: 4-аминобензила, 4-(аминометил)бензила, 4-(аминмоетил)фенила, 4-аминофенила, бензила, 3-меркаптопропила, 2-меркаптоэтила, 4-(меркаптометил)фенила, n-толила, 2,4,6-триметилфенила, 4-(трифторметокси)фенила, 2,4,6-триизопропилфенила, 4-трет-бутилфенила, 4-хлорфенила, 3-цианофенила, 2-нитрофенила, 4-метокси-2-нитрофенила, 4-аминокарбонил-2-нитрофенила, 4-метоксифенила, фенила, 2-фторбензила, пиперидин-1-ила, о-толила, 4-бромфенила, нафталин-2-ила, 4-метоксикарбонилфенила, 2-(трифторметил)бензила, гексан-2-ила, 2-метоксиэтила, циклопентилметила, циклогексила, пиридин-3-илметила, 4-карбоксифенила, 3-аминфоенила, пиридин-3-ила, тиен-2-ила, 4-гидроксифенила, 4-(1-аминоциклопропил)бензила, 4-(1-аминоциклопропил)фенила, 2-метилбензила, 4-нитробензила, 4-хлорбензила, фенетила, 4-бромбензила, 4-цианобензила, 3-нитробензила, 4-трет-бутилбензила, 2-нитробензила, 4-нитрофенетила, 2-хлор-3-метоксикарбонилфенила, 2-аминофенила, [1,1'-бифенил]-4-ила, 4'-амино-[1,1'-бифенил]-4-ила, 4-фторбензила, 3-(трифторметил)бензила, 3-(трифторметокси)бензила, 3,4-дихлорбензила, 2-цианобензила, 3-хлорбензила, 4-амино-2-этилфенила, 4-амино-3-(трифторметокси)фенила, 4-амино-2,3-диметилфенила, 4-амино-5,6,7,8-тетрагидронафталин-1-ила, 4-амино-3-метилфенила, 4-амино-3-фторфенила, 4-амино-3-этилфенила, 4-амино-3-(трифторметил)фенила и 4-(метоксикарбонил)фенила;
Y представляет собой -C(O)NHCH(CH2R11)- или Y отсутствует; и
R11 выбран из: 1H-индол-3-ила, 4-аминофенила, 4-гидроксифенила, 5-гидроксипиридин-2-ила, циклогексила и фенила.
Предложены также соединения Формулы VIII:

и их фармацевтически приемлемые соли, где:
R12 выбран из: амино-C1-C6 алкила, аминоарила, амино-C3-C7 циклоалкила, амино-гетероциклила и гетероциклила, каждый из которых необязательно замещен одним или более заместителями, выбранными из арила, арил-C1-C6 алкила, C1-C6 алкила, C1-C6 алкилтио, карбоксила, карбоксамида, C3-C7 циклоалкила, C3-C7 циклоалкил-C1-C6 алкила, гуанидино, галогена, C1-C6 галогенацила, C1-C6 галогеналкила, гетероциклила, гетероциклил-C1-C6 алкила, гидроксила и тио; или
R12 представляет собой RiRjNCH(Rk)-;
Ri выбран из: Н и C1-C6 алкила;
Rj представляет собой C1-C6 алкил; и
Rk представляет собой Rm-C(CH3)2-; и
Rm выбран из: Н, арила, C3-C7 циклоалкила и гетероарила, каждый из которых необязательно замещен одним или более заместителями, выбранными из: C1-C4 ацилтио, C2-C4 алкенила, C1-C4 алкила, C1-C4 алкиламино, C1-C4 алкилокси, амино, амино-C1-C4 алкила, галогена, C1-C4 галогеналкила, гидроксила, гидрокси-C1-C4 алкила и тио, где C2-C4 алкенил, C1-C4 алкиламино и C1-C4 алкилокси дополнительно необязательно замещены одним заместителем, выбранным из C1-C4 алкиларила, гидроксила и тио; или
Ri и Rj вместе с атомами, с которыми они связаны, образуют гетероциклилдиил;
R13 представляет собой C2-C4 алкил, необязательно замещенный C1-C6 алкилтио-группой;
R14 представляет собой C2-C4 алкил, необязательно замещенный C1-C6 алкилтио-группой;
R15 выбран из: C2-C6 алкила, арила, арил-C1-C6 алкила, C4-C7 циклоалкила, C3-C7 циклоалкил-C1-C6 алкила, гетероарила, гетероарил-C1-C6 алкила и гетероциклила, каждый из которых необязательно замещен одним или более заместителями, выбранными из: C1-C6 алкокси, C1-C6 алкоксикарбонила, C1-C6 алкила, C1-C6 алкиламино, амино, амино-C1-C6 алкила, амино-арила, амино-C3-C7 циклоалкила, арила, карбоксамида, карбоксила, циано, C1-C6 галогенацила, C1-C6 галогеналкила, C1-C6 галогеналкокси, галогена, гидроксила, нитро, тио и тио-C1-C6 алкила;
Z представляет собой -C(O)NHCH(CH2R16)- или Z отсутствует; и
R16 выбран из: арила, гетероарила и C3-C7 циклоалкила, каждый из которых необязательно замещен одним заместителем, выбранным из амино и гидроксила;
при условии, что если R12 представляет собой 2-метил-1-(метиламино)пропил, R13 представляет собой изопропил, и R14 представляет собой втор-бутил, и Z представляет собой -C(O)NHCH(CH2Ph)-, то R15 отличен от этила, изопропила, н-бутила и фенила.
Предложены также соединения Формулы VIII:
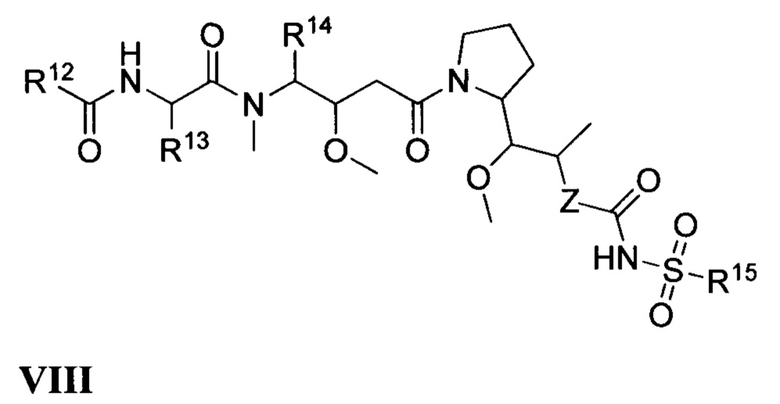
и их фармацевтически приемлемые соли, где:
R12 выбран из: 1-(диметиламино)-2-метилпропила, 2-метил-1-(метиламино)пропила, 1-аминоциклопентила, 1-аминоциклопропила, 4-аминофенила, 2-аминопропан-2-ила, 1-аминоциклогексила, 3-аминооксетан-3-ила, 2-(метиламино)пропан-2-ила, 1-амино-2-метилпропан-2-ила, 2-метилпирролидин-2-ила, 2-амино-3-метилбутан-2-ила, 2-аминобутан-2-ила, 2-метил-1-(метиламино)пропан-2-ила, 1-метилпиперидин-2-ила, 3-фторпирролидин-3-ила, 1,2-диметилпирролидин-2-ила и 2-(диметиламино)пропан-2-ила, 2-метил-1-(метиламино)-2-фенилпропила, 1-изопропилпиперидин-2-ила, 2-азабицикло[2.2.1]гептан-3-ила и 2-метил-2-азабицикло[2.2.1]гептан-3-ила; и
R13 выбран из: изопропила, изобутила, втор-бутила, трет-бутила и 2-(метилтио)этила;
R14 выбран из: изопропила, изобутила, втор-бутила и 2-(метилтио)этила;
R15 выбран из: 4-аминобензила, 4-(аминометил)бензила, 4-(аминмоетил)фенила, 4-аминофенила, бензила, 3-меркаптопропила, 2-меркаптоэтила, 4-(меркаптометил)фенила, n-толила, 2,4,6-триметилфенила, 4-(трифторметокси)фенила, 2,4,6-триизопропилфенила, 4-трет-бутилфенила, 4-хлорфенила, 3-цианофенила, 2-нитрофенила, 4-метокси-2-нитрофенила, 4-аминокарбонил-2-нитрофенила, 4-метоксифенила, фенила, 2-фторбензила, пиперидин-1-ила, о-толила, 4-бромфенила, нафталин-2-ила, 4-метоксикарбонилфенила, 2-(трифторметил)бензила, гексан-2-ила, 2-метоксиэтила, циклопентилметила, циклогексила, пиридин-3-илметила, 4-карбоксифенила, 3-аминфоенила, пиридин-3-ила, тиен-2-ила, 4-гидроксифенила, 4-(1-аминоциклопропил)бензила, 4-(1-аминоциклопропил)фенила, 2-метилбензила, 4-нитробензила, 4-хлорбензила, фенетила, 4-бромбензила, 4-цианобензила, 3-нитробензила, 4-трет-бутилбензила, 2-нитробензила, 4-нитрофенетила, 2-хлор-3-метоксикарбонилфенила, 2-аминофенила, [1,1'-бифенил]-4-ила, 4'-амино-[1,1'-бифенил]-4-ила, 4-фторбензила, 3-(трифторметил)бензила, 3-(трифторметокси)бензила, 3,4-дихлорбензила, 2-цианобензила, 3-хлорбензила, 4-амино-2-этилфенила, 4-амино-3-(трифторметокси)фенила, 4-амино-2,3-диметилфенила, 4-амино-5,6,7,8-тетрагидронафталин-1-ила, 4-амино-3-метилфенила, 4-амино-3-фторфенила, 4-амино-3-этилфенила, 4-амино-3-(трифторметил)фенила и 4-(метоксикарбонил)фенила;
Z представляет собой -C(O)NHCH(CH2R16)- или Z отсутствует; и
R16 выбран из: 1H-индол-3-ила, 4-аминофенила, 4-гидроксифенила, 5-гидроксипиридин-2-ила, циклогексила и фенила;
при условии, что если R12 представляет собой 2-метил-1-(метиламино)пропил, R13 представляет собой изопропил, и R14 представляет собой втор-бутил, и Z представляет собой -C(O)NHCH(CH2Ph)-, то R15 отличен от этила, изопропила, н-бутила и фенила.
Предложены также соединения Формулы VIIIa:

и их фармацевтически приемлемые соли, где:
R12 выбран из: амино-C1-C6 алкила, аминоарила, амино-C3-C7 циклоалкила, амино-гетероциклила и гетероциклила, каждый из которых необязательно замещен одним или более заместителями, выбранными из арила, арил-C1-C6 алкила, C1-C6 алкила, C1-C6 алкилтио, карбоксила, карбоксамида, C3-C7 циклоалкила, C3-C7 циклоалкил-C1-C6 алкила, гуанидино, галогена, C1-C6 галогенацила, C1-C6 галогеналкила, гетероциклила, гетероциклил-C1-C6 алкила, гидроксила и тио; или
R12 представляет собой RiRjNCH(Rk)-;
Ri выбран из: Н и C1-C6 алкила;
Rj представляет собой C1-C6 алкил; и
Rk представляет собой Rm-C(CH3)2-; и
Rm выбран из: Н, арила, C3-C7 циклоалкила и гетероарила, каждый из которых необязательно замещен одним или более заместителями, выбранными из: C1-C4 ацилтио, C2-C4 алкенила, C1-C4 алкила, C1-C4 алкиламино, C1-C4 алкилокси, амино, амино-C1-C4 алкила, галогена, C1-C4 галогеналкила, гидроксила, гидрокси-C1-C4 алкила и тио, где C2-C4 алкенил, C1-C4 алкиламино и C1-C4 алкилокси дополнительно необязательно замещены одним заместителем, выбранным из C1-C4 алкиларила, гидроксила и тио; или
Ri и Rj вместе с атомами, с которыми они связаны, образуют гетероциклилдиил;
R13 представляет собой C2-C4 алкил, необязательно замещенный C1-C6 алкилтио-группой;
R14 представляет собой C2-C4 алкил, необязательно замещенный C1-C6 алкилтио-группой; и
R15 выбран из: C1-C6 алкила, арила, арил-C1-C6 алкила, C3-C7 циклоалкила, C3-C7 циклоалкил-C1-C6 алкила, гетероарила, гетероарил-C1-C6 алкила и гетероциклила, каждый из которых необязательно замещен одним или более заместителями, выбранными из: C1-C6 алкокси, C1-C6 алкоксикарбонила, C1-C6 алкила, C1-C6 алкиламино, амино, амино-C1-C6 алкила, амино-арила, амино-C3-C7 циклоалкила, арила, карбоксамида, карбоксила, циано, C1-C6 галогенацила, C1-C6 галогеналкила, C1-C6 галогеналкокси, галогена, гидроксила, нитро, тио и тио-C1-C6 алкила.
Предложены также соединения Формулы VIIIa:

и их фармацевтически приемлемые соли, где:
R12 выбран из: 1-(диметиламино)-2-метилпропила, 2-метил-1-(метиламино)пропила, 1-аминоциклопентила, 1-аминоциклопропила, 4-аминофенила, 2-аминопропан-2-ила, 1-аминоциклогексила, 3-аминооксетан-3-ила, 2-(метиламино)пропан-2-ила, 1-амино-2-метилпропан-2-ила, 2-метилпирролидин-2-ила, 2-амино-3-метилбутан-2-ила, 2-аминобутан-2-ила, 2-метил-1-(метиламино)пропан-2-ила, 1-метилпиперидин-2-ила, 3-фторпирролидин-3-ила, 1,2-диметилпирролидин-2-ила и 2-(диметиламино)пропан-2-ила, 2-метил-1-(метиламино)-2-фенилпропила, 1-изопропилпиперидин-2-ила, 2-азабицикло[2.2.1]гептан-3-ила и 2-метил-2-азабицикло[2.2.1]гептан-3-ила; и
R13 выбран из: изопропила, изобутила, втор-бутила, трет-бутила и 2-(метилтио)этила;
R14 выбран из: изопропила, изобутила, втор-бутила и 2-(метилтио)этила; и
R15 выбран из: 4-аминобензила, 4-(аминометил)бензила, 4-(аминометил)фенила, 4-аминофенила, бензила, 3-меркаптопропила, 2-меркаптоэтила, 4-(меркаптометил)фенила, n-толила, 2,4,6-триметилфенила, 4-(трифторметокси)фенила, 2,4,6-триизопропилфенила, 4-трет-бутилфенила, 4-хлорфенила, 3-цианофенила, 2-нитрофенила, 4-метокси-2-нитрофенила, 4-аминокарбонил-2-нитрофенила, 4-метоксифенила, фенила, 2-фторбензила, пиперидин-1-ила, о-толила, 4-бромфенила, нафталин-2-ила, 4-метоксикарбонилфенила, 2-(трифторметил)бензила, гексан-2-ила, 2-метоксиэтила, циклопентилметила, циклогексила, пиридин-3-илметила, 4-карбоксифенила, 3-аминофенила, пиридин-3-ила, тиен-2-ила, 4-гидроксифенила, 4-(1-аминоциклопропил)бензила, 4-(1-аминоциклопропил)фенила, 2-метилбензила, 4-нитробензила, 4-хлорбензила, фенетила, 4-бромбензила, 4-цианобензила, 3-нитробензила, 4-трет-бутилбензила, 2-нитробензила, 4-нитрофенетила, 2-хлор-3-метоксикарбонилфенила, 2-аминофенила, [1,1'-бифенил]-4-ила, 4'-амино-[1,1'-бифенил]-4-ила, 4-фторбензила, 3-(трифторметил)бензила, 3-(трифторметокси)бензила, 3,4-дихлорбензила, 2-цианобензила, 3-хлорбензила, 4-амино-2-этилфенила, 4-амино-3-(трифторметокси)фенила, 4-амино-2,3-диметилфенила, 4-амино-5,6,7,8-тетрагидронафталин-1-ила, 4-амино-3-метилфенила, 4-амино-3-фторфенила, 4-амино-3-этилфенила, 4-амино-3-(трифторметил)фенила и 4-(метоксикарбонил)фенила.
Предложены также соединения Формулы VIIIb:

и их фармацевтически приемлемые соли, где:
R12 выбран из: амино-C1-C6 алкила, аминоарила, амино-C3-C7 циклоалкила, амино-гетероциклила и гетероциклила, каждый из которых необязательно замещен одним или более заместителями, выбранными из арила, арил-C1-C6 алкила, C1-C6 алкила, C1-C6 алкилтио, карбоксила, карбоксамида, C3-C7 циклоалкила, C3-C7 циклоалкил-C1-C6 алкила, гуанидино, галогена, C1-C6 галогенацила, C1-C6 галогеналкила, гетероциклила, гетероциклил-C1-C6 алкила, гидроксила и тио; или
R12 представляет собой RiRjNCH(Rk)-;
Ri выбран из: Н и C1-C6 алкила;
Rj представляет собой C1-C6 алкил; и
Rk представляет собой Rm-С(СН3)2-; и
Rm выбран из: Н, арила, C3-C7 циклоалкила и гетероарила, каждый из которых необязательно замещен одним или более заместителями, выбранными из: C1-C4 ацилтио, C2-C4 алкенила, C1-C4 алкила, C1-C4 алкиламино, C1-C4 алкилокси, амино, амино-C1-C4 алкила, галогена, C1-C4 галогеналкила, гидроксила, гидрокси-C1-C4 алкила и тио, где C2-C4 алкенил, C1-C4 алкиламино и C1-C4 алкилокси дополнительно необязательно замещены одним заместителем, выбранным из C1-C4 алкиларила, гидроксила и тио; или
Ri и Rj вместе с атомами, с которыми они связаны, образуют гетероциклилдиил;
R13 представляет собой C2-C4 алкил, необязательно замещенный C1-C6 алкилтио-группой;
R14 представляет собой C2-C4 алкил, необязательно замещенный C1-C6 алкилтио-группой;
R15 выбран из: C2-C6 алкила, арила, арил-C1-C6 алкила, C4-C7 циклоалкила, C3-C7 циклоалкил-C1-C6 алкила, гетероарила, гетероарил-C1-C6 алкила и гетероциклила, каждый из которых необязательно замещен одним или более заместителями, выбранными из: C1-C6 алкокси, C1-C6 алкоксикарбонила, C1-C6 алкила, C1-C6 алкиламино, амино, амино-C1-C6 алкила, амино-арила, амино-C3-C7 циклоалкила, арила, карбоксамида, карбоксила, циано, C1-C6 галогенацила, C1-C6 галогеналкила, C1-C6 галогеналкокси, галогена, гидроксила, нитро, тио и тио-C1-C6 алкила; и
R16 выбран из: арила, гетероарила и C3-C7 циклоалкила, каждый из которых необязательно замещен одним заместителем, выбранным из амино и гидроксила;
при условии, что если R12 представляет собой 2-метил-1-(метиламино)пропил, R13 представляет собой изопропил, и R14 представляет собой втор-бутил, и R16 представляет собой фенил, то R15 отличен от этила, изопропила, н-бутила и фенила.
Предложены также соединения Формулы VIIIb:

и их фармацевтически приемлемые соли, где:
R12 выбран из: 1-(диметиламино)-2-метилпропила, 2-метил-1-(метиламино)пропила, 1-аминоциклопентила, 1-аминоциклопропила, 4-аминофенила, 2-аминопропан-2-ила, 1-аминоциклогексила, 3-аминооксетан-3-ила, 2-(метиламино)пропан-2-ила, 1-амино-2-метилпропан-2-ила, 2-метилпирролидин-2-ила, 2-амино-3-метилбутан-2-ила, 2-аминобутан-2-ила, 2-метил-1-(метиламино)пропан-2-ила, 1-метилпиперидин-2-ила, 3-фторпирролидин-3-ила, 1,2-диметилпирролидин-2-ила и 2-(диметиламино)пропан-2-ила, 2-метил-1 -(метиламино)-2-фенилпропила, 1-изопропилпиперидин-2-ила, 2-азабицикло[2.2.1]гептан-3-ила и 2-метил-2-азабицикло[2.2.1]гептан-3-ила; и
R13 выбран из: изопропила, изобутила, втор-бутила, трет-бутила и 2-(метилтио)этила;
R14 выбран из: изопропила, изобутила, втор-бутила и 2-(метилтио)этила;
R15 выбран из: 4-аминобензила, 4-(аминометил)бензила, 4-(аминометил)фенила, 4-аминофенила, бензила, 3-меркаптопропила, 2-меркаптоэтила, 4-(меркаптометил)фенила, n-толила, 2,4,6-триметилфенила, 4-(трифторметокси)фенила, 2,4,6-триизопропилфенила, 4-трет-бутилфенила, 4-хлорфенила, 3-цианофенила, 2-нитрофенила, 4-метокси-2-нитрофенила, 4-аминокарбонил-2-нитрофенила, 4-метоксифенила, фенила, 2-фторбензила, пиперидин-1-ила, о-толила, 4-бромфенила, нафталин-2-ила, 4-метоксикарбонилфенила, 2-(трифторметил)бензила, гексан-2-ила, 2-метоксиэтила, циклопентилметила, циклогексила, пиридин-3-илметила, 4-карбоксифенила, 3-аминофенила, пиридин-3-ила, тиен-2-ила, 4-гидроксифенила, 4-(1-аминоциклопропил)бензила, 4-(1-аминоциклопропил)фенила, 2-метилбензила, 4-нитробензила, 4-хлорбензида, фенетила, 4-бромбензила, 4-цианобензила, 3-нитробензила, 4-трет-бутилбензила, 2-нитробензила, 4-нитрофенетила, 2-хлор-3-метоксикарбонилфенила, 2-аминофенила, [1,1'-бифенил]-4-ила, 4'-амино-[1,1'-бифенил]-4-ила, 4-фторбензила, 3-(трифторметил)бензила, 3-(трифторметокси)бензила, 3,4-дихлорбензила, 2-цианобензила, 3-хлорбензила, 4-амино-2-этилфенила, 4-амино-3-(трифторметокси)фенила, 4-амино-2,3-диметилфенила, 4-амино-5,6,7,8-тетрагидронафталин-1-ила, 4-амино-3-метилфенила, 4-амино-3-фторфенила, 4-амино-3-этилфенила, 4-амино-3-(трифторметил)фенила и 4-(метоксикарбонил)фенила; и
R16 выбран из: 1H-индол-3-ила, 4-аминофенила, 4-гидроксифенила, 5-гидроксипиридин-2-ила, циклогексила и фенила;
при условии, что если R12 представляет собой 2-метил-1-(метиламино)пропил, R13 представляет собой изопропил, и R14 представляет собой втор-бутил, и R16 представляет собой фенил, то R15 отличен от этила, изопропила, н-бутила и фенила.
Некоторые варианты реализации настоящего изобретения включают любые комбинации одного или более соединений, выбранных из следующей группы, представленной в таблице А.
Некоторые варианты реализации настоящего изобретения включают любые комбинации одного или более соединений, выбранных из следующей группы, представленной в таблице В.
Некоторые варианты реализации настоящего изобретения включают любые комбинации одного или более соединений, выбранных из следующей группы, представленной в таблице С.
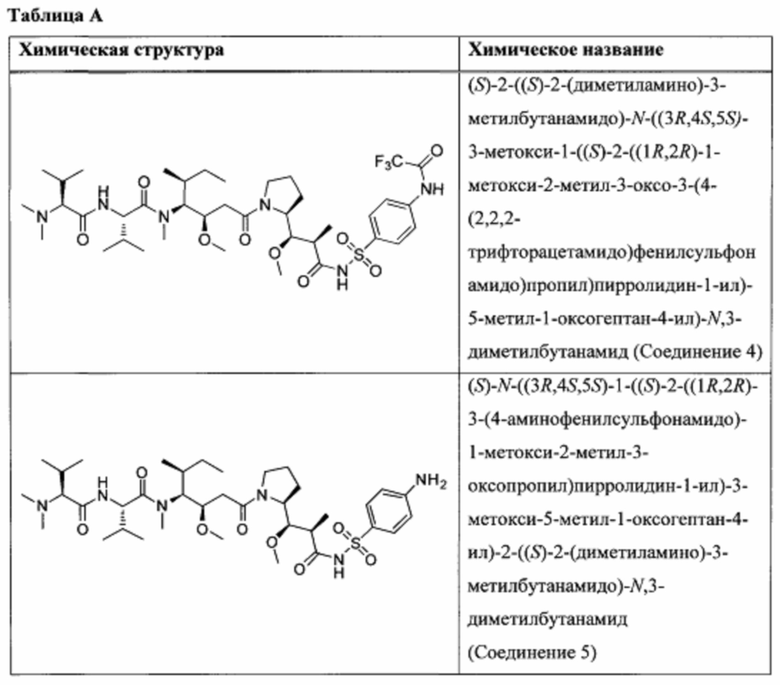


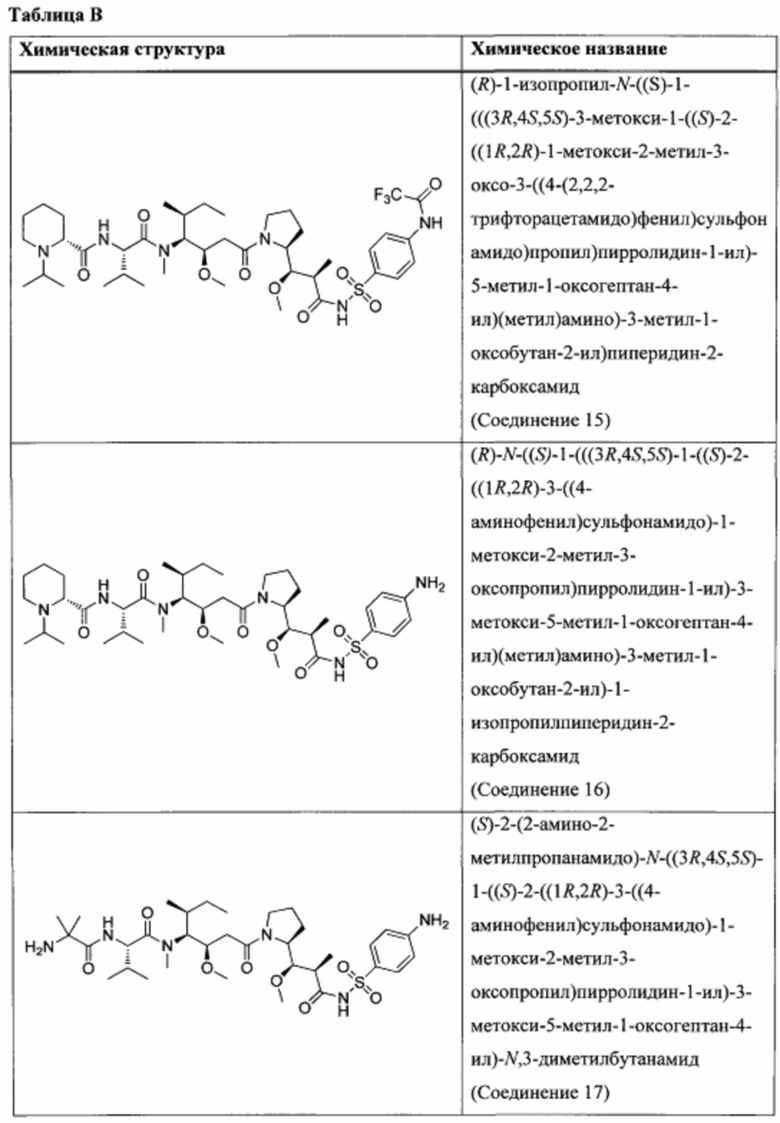


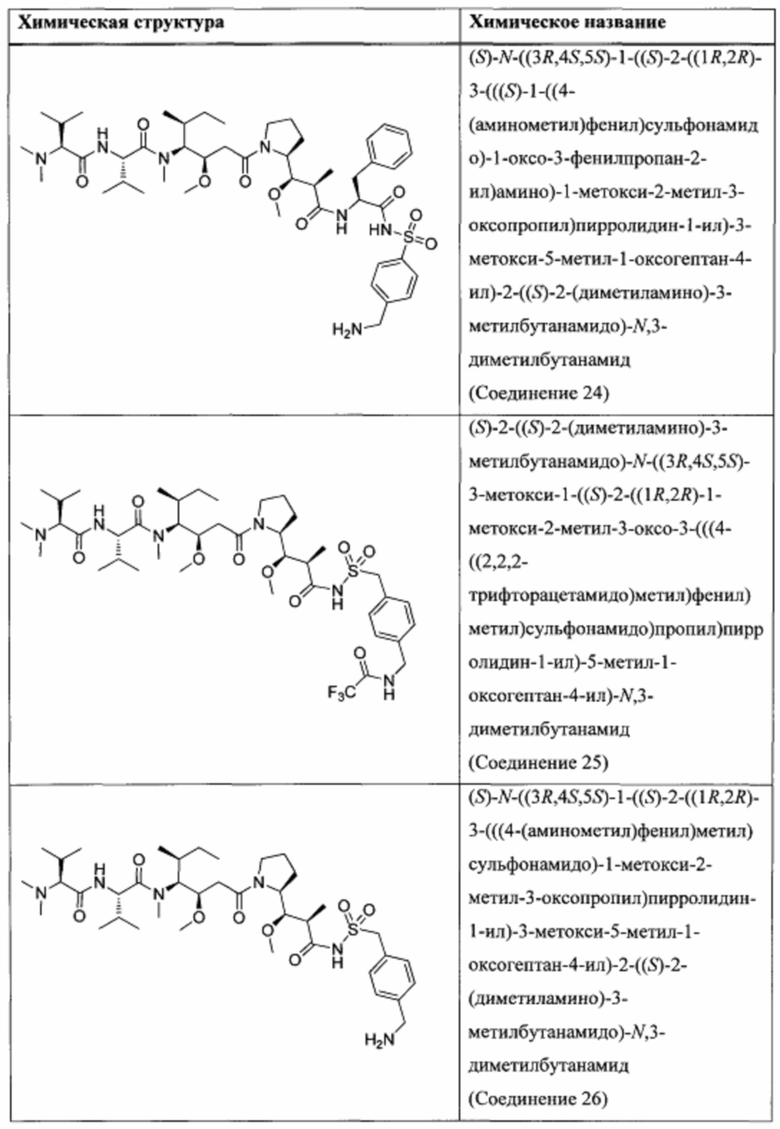

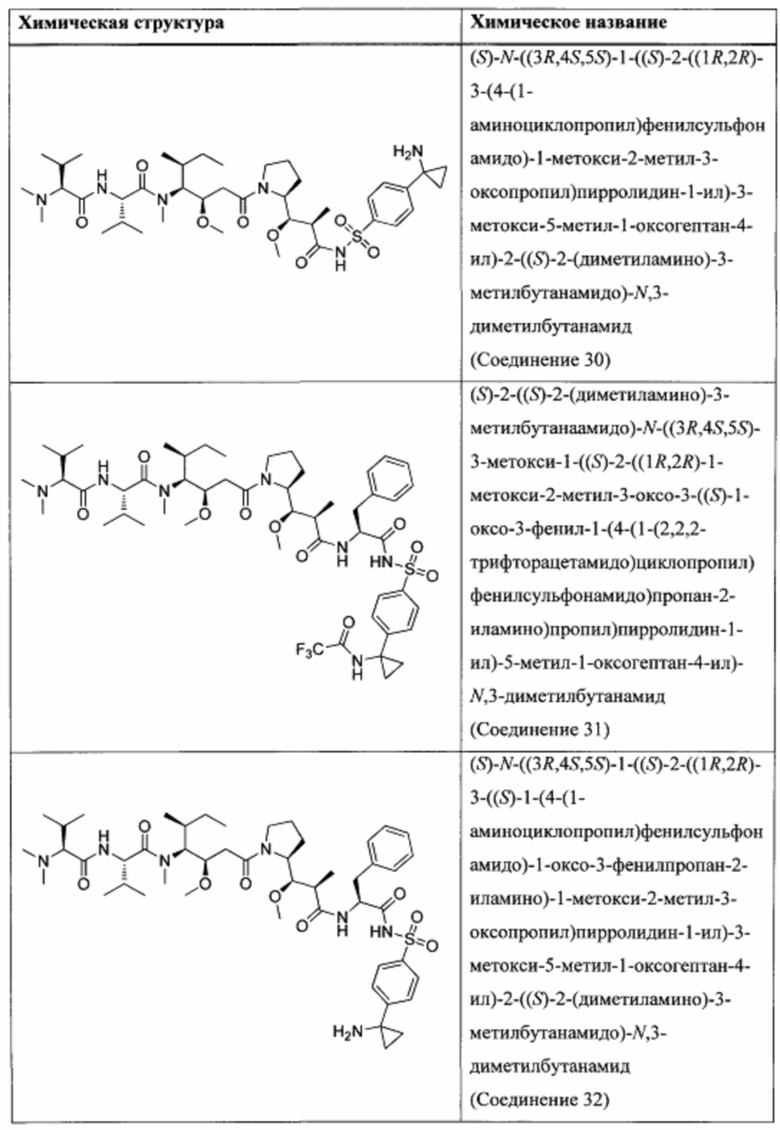

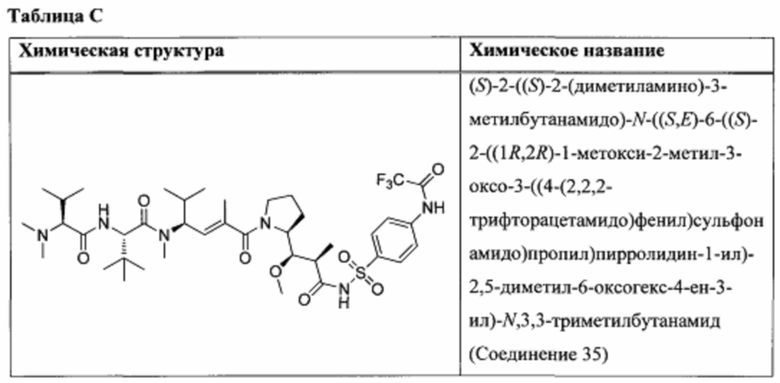
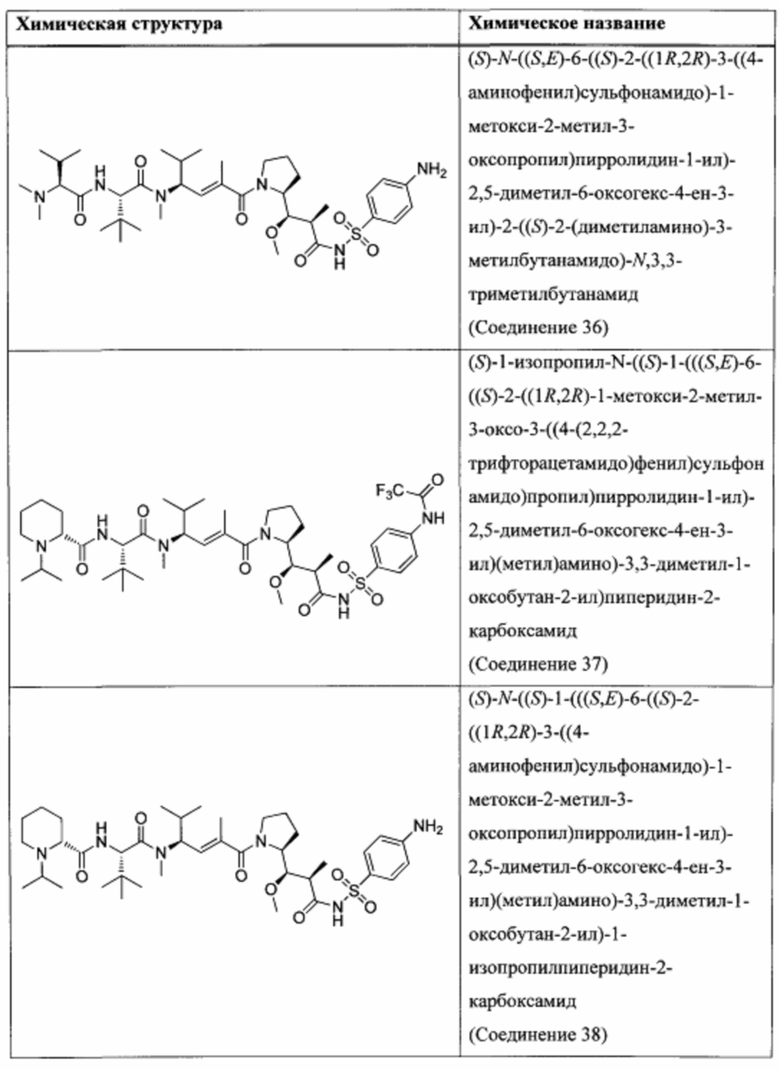
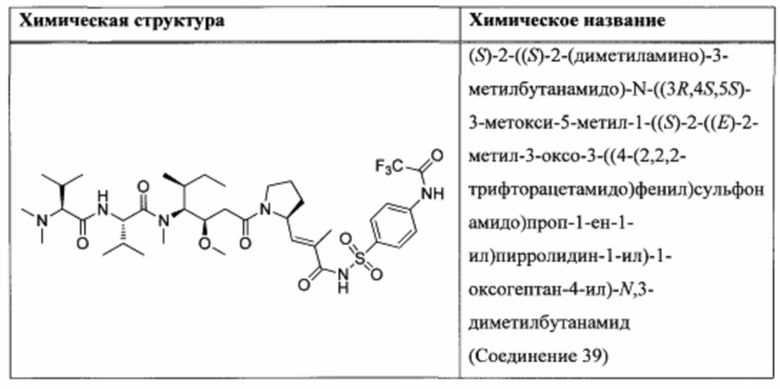
Кроме того, отдельные соединения и химические классы согласно настоящему изобретения, например, соединения, представленные в таблице А, в таблице B и в таблице С, включая их диастереоизомеры и энантиомеры, включают все фармацевтически приемлемые соли. Соединения Формулы I могут быть получены в соответствии с релевантными опубликованными в литературе способами, которые используют специалисты в данной области техники. Иллюстративные реагенты и способы осуществления указанных реакций представлены далее в рабочих примерах. В одном из вариантов реализации настоящего изобретения предложен способ получения соединения, описанного в настоящем документе.
Конъюгаты, содержащие новые соединения
Соединения, описанные в настоящем документе, могут быть использованы для получения конъюгатов, например, конъюгатов антитела с лекарственным средством (ADC). Соответственно, в одном из вариантов реализации настоящего описания предложены композиции конъюгата Формулы II:

где (Т) представляет собой направляющий фрагмент, (L) представляет собой необязательный линкер, и (D) представляет собой соединение Формулы I. В одном из вариантов реализации (Т) представляет собой антитело. Соответственно, в одном из вариантов реализации предложены конъюгаты антитела с лекарственным веществом (ADC), содержащие соединения (D) Формулы I.
Как понятно специалистам в данной области техники, существует множество различных способов ковалентного связывания (T)-(L)-(D). Для связывания компонентов конъюгата может быть использован любой известный способ. Для связывания (Т) с (D) может быть использована любая известная линкерная технология. Кроме того, (Т), (L) и (D) могут модифицированы любым подходящим способом, известным специалистам в данной области техники, для облегчения образования конъюгата.
Направляющий фрагмент (Т)
Направляющий фрагмент (Т) рассматриваемых композиций включает в свой объем любое звено (Т), которое связывается или ассоциируется посредством реакции, или образует комплекс с рецептором, антигеном или другим способным к связыванию фрагментом, связанным с данной группой клеток-мишеней. (Т) представляет собой молекулу, которая связывается, образует комплекс или реагирует с фрагментом группы клеток, подлежащих направленному воздействию. В одном аспекте (Т) действует для доставки лекарства (D) в определенную группу клеток-мишеней, с которыми взаимодействует (Т). Такие (Т) включают, но не ограничиваются ими, высокомолекулярные белки, такие как, например, полноразмерные антитела, фрагменты антител, более низкомолекулярные белки, полипептиды или пептиды, лектины, гликопротеины, не пептиды, витамины, молекулы для транспорта питательных веществ (такие как, но не ограничиваясь ими, трансферрин) или любые клеточносвязывающие молекулы или вещества.
(Т) может образовывать связь с линкерным звеном (L) или лекарством (D). (Т) может образовывать связь со звеном (L) через гетероатом в (Т). Гетероатомы, которые могут присутствовать в (Т), включают серу (в одном из вариантов реализации из сульфгидрильной группы (Т)), кислород (в одном из вариантов реализации из карбонильной, карбоксильной или гидроксильной группы (Т)) и азот (в одном из вариантов реализации из первичной или вторичной аминогруппы (Т)). Указанные гетероатомы могут присутствовать в (Т) в естественном состоянии (Т), например, в природном антителе, или могут быть внедрены в (Т) посредством химической модификации.
В одном из вариантов реализации (Т) имеет сульфгидрильную группу, и (Т) связывается с (L) через атом серы сульфгидрильной группы. В другом варианте реализации (Т) содержит один или более лизиновых остатков, которые могут быть химически модифицированы для внедрения одной или более сульфгидрильных групп.(Т) связывается со звеном (L) через сульфгидрильную группу. Реагенты, которые могут быть использованы для модификации лизинов, включают, но не ограничиваются ими, N-сукцинимидил-S-ацетилтиоацетат (SATA) и 2-иминотиолана гидрохлорид (реагент Трота).
В другом варианте реализации (L) может содержать одну или более углеводных групп, которые могут быть химически модифицированы для получения одной или более сульфгидрильных групп.(Т) связывается с (L) через атом серы сульфгидрильной группы. В другом варианте реализации (Т) может иметь одну или более углеводных групп, которые могут быть окислены с получением альдегидной (-СНО) группы (см., например, Laguzza et al., 1989, J. Med. Chem. 32(3): 548-55). Соответствующий альдегид может образовывать связь с реакционноспособным сайтом в определенной части (L). Реакционноспособные сайты, которые могут взаимодействовать с карбонильной группой в (Т), включают, но не ограничиваются ими, гидразин и гидроксиламин. Другие протоколы для модификации белков для присоединения или ассоциации (D), описаны в публикации Coligan et al., Current Protocols in Protein Science, том 2, John Wiley & Sons (2002), содержание которой включено в настоящий документ посредством ссылки.
(Т) может включать, например, белок, полипептид или пептид, включая, но не ограничиваясь ими, трансферрин, эпидермальные факторы роста («EGF»), бомбезин, гастрин, гастрин-высвобождающий пептид, тромбоцитарный фактор роста, IL-2, IL-6, трансформирующий фактор роста («TGF»), такой как TGF-α или TGF-β, фактор роста вируса осповакцины («VGF»), инсулин и инсулиноподобные факторы роста I и II, лектины и апопротеин из липопротеина низкой плотности.
(Т) также может включать антитело, такое как поликлональные антитела или моноклональные антитела. Антитело может быть направлено на определенную антигенную детерминанту, включая, например, антиген раковых клеток, вирусный антиген, микробный антиген, белок, пептид, углевод, химическое соединение, нуклеиновую кислоту или их фрагменты. Способы получения поликлональных антител известны в данной области техники. Моноклональное антитело (mAb) к рассматриваемому антигену может быть получено с помощью любо технологии, известной в данной области техники. Они включают, но не ограничиваются ими, гибридомную технологию, первоначально описанную авторами Kohler и Milstein (1975, Nature 256, 495-497), гибридомную технологию на основе В-клеток человека (Kozbor et al., 1983, Immunology Today 4: 72) и EBV-гибридомную технологию (Cole et al., 1985, Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, Inc., cc. 77-96). Способ получения антител из выбранных лимфоцитов (SLAM) (Babcook, J.S., et al., A novel strategy for generating monoclonal antibodies from single, isolated lymphocytes producing antibodies of defined specificities. Proc Natl Acad Sci USA, 1996. 93 (15): с. 7843-8.) и (McLean GR, Olsen OA, Watt IN, Rathanaswami P, Leslie KB, Babcook JS, Schrader JW. Recognition of human cytomegalovirus by human primary immunoglobulins identifies an innate foundation to an adaptive immune response. J Immunol. 2005 Apr 15; 174(8): 4768-78. Такие антитела могут относиться к любому классу иммуноглобулина, включая IgG, IgM, IgE, IgA и IgD, и любым их подклассам. Гибридомы, вырабатывающие mAb, подходящие для применения согласно настоящему изобретению, могут быть выращены in vitro или in vivo.
Моноклональное антитело может представлять собой, например, человеческое моноклональное антитело, гуманизированное моноклональное антитело, фрагмент антитела или химерное антитело (например, антитело человека-мыши). Человеческие моноклональные антитела могут быть получены с помощью любой из множества технологий, известных в данной области техники (например, Teng et al., 1983, Proc. Natl. Acad. Sci. USA 80: 7308-7312; Kozbor et al., 1983, Immunology Today 4: 72-79; и Olsson et al., 1982, Meth. Enzymol. 92: 3-16). См. также Huse et al., 1989, Science 246: 1275-1281 и McLean et al. J Immunol. 2005 Apr 15; 174(8): 4768-78.
Антитело также может представлять собой биспецифическое антитело. Способы получения биспецифических антител известны в данной области техники. Традиционное получение полноразмерных биспецифических антител основано на совместной экспрессии двух пар иммуноглобулиновых тяжелой-легкой цепей, где две цепи обладают различной специфичностью (см., например, Milstein et al., 1983, Nature 305: 537-539; международную публикацию № WO 93/08829, Traunecker et al., 1991, EMBO J. 10: 3655-3659.
В соответствии с другим подходом, вариабельные домены антитела с требуемой специфичностью связывания (сайтами связывания антитела с антигеном) являются слитыми с последовательностями константных доменов иммуноглобулина. Гибридизация предпочтительно происходит в константном домене тяжелой цепи иммуноглобулина, содержащем по меньшей мере часть шарнирных, CH2 и CH3, областей. Предпочтительно иметь первую константную область тяжелой цепи (СН1), содержащую сайт, необходимый для связывания легкой цепи, присутствующий в по меньшей мере одном из слияний. Нуклеиновые кислоты с последовательностями, кодирующими слияния тяжелой цепи иммуноглобулина, и, если необходимо, легкой цепи иммуноглобулина, встраивают в отдельные векторы экспрессии и совместно трансфицируют в подходящий организм хозяина. Это обеспечивает большую гибкость в регулировке соотношений трех полипептидных фрагментов в тех вариантах реализации, в которых неравные соотношения трех полипептидных цепей, используемые при построении, обеспечивают оптимальный выход. Однако можно встраивать кодирующие последовательности для двух или всех трех полипептидных цепей в один экспрессирующий вектор, если экспрессия по меньшей мере двух полипептидных цепей в равных соотношениях приводит к высоким выходам или если указанные соотношения не имеют существенного значения.
Например, биспецифические антитела могут содержать гибридную тяжелую цепь иммуноглобулина с первой специфичностью связывания в одном плече, и гибридную пару тяжелой цепи и легкой цепи иммуноглобулина (обеспечивающую вторую специфичность связывания) во втором плече. Такая асимметричная структура облегчает отделение требуемого биспецифического соединения от нежелательных комбинаций цепи иммуноглобулина, поскольку наличие легкой цепи иммуноглобулина только в одной половине биспецифической молекулы обеспечивает простой способ разделения (международная публикация №WO 94/04690), полное содержание которой включено в настоящий документ посредством ссылки.
Дополнительные подробности получения биспецифических антител представлены, например, в публикации Suresh et al., 1986, Methods in Enzymology 121: 210; Rodrigues et al., 1993, J. Immunology 151: 6954-6961; Carter et al., 1992, Bio/Technology 10: 163-167; Carter et al., 1995, J. Hematotherapy 4: 463-470; Merchant et al., 1998, Nature Biotechnology 16: 677-681. С применением таких технологий могут быть получены биспецифические антитела для применения для лечения или предупреждения заболевания, описанного в настоящем документе.
Бифункциональные антитела описаны также в публикации европейского патента № ЕРА 0 105 360. Как описано в указанной ссылке, гибридные или бифункциональные антитела могут быть получены либо биологически, т.е. с помощью технологий клеточного слияния, либо химически, особенно с помощью сшивающих агентов или реагентов, образующих дисульфидный мостик, и могут содержать целые антитела или их фрагменты. Способы получения таких гибридных антител описаны, например, в международной публикации WO 83/03679 и в публикации европейского патента № ЕРА 0 217 577, содержание которых включено в настоящий документ посредством ссылки.
Антитело также может представлять собой функционально активный фрагмент, производное или аналог антитела, которое специфически связывается с антигеном-мишенью (например, раковым антигеном, вирусным антигеном, микробным антигеном, или другие антитела, связанные с клетками или матриксом). В этом отношении «функционально активный» означает, что фрагмент, производное или аналог может распознавать тот же антиген, который распознает антитело, из которого получен фрагмент, производное или аналог. В частности, в иллюстративном варианте реализации антигенность идиотипа молекулы иммуноглобулина может быть усилена посредством удаления каркасных и CDR последовательностей, которые являются С-концевыми относительно последовательности CDR, которая специфически распознает антиген. Для определения того, какие последовательности CDR связывают антиген, могут быть использованы синтетические пептиды, содержащие последовательности CDR, в анализах связывания с антигеном посредством любого способа проведения анализа связывания, известного в данной области техники (например, ядерный анализ BIA) (см. например, Kabat et al., 1991, Sequences of Proteins of Immunological Interest, пятое издание. National Institute of Health, Бетесда, штат Мэриленд; Kabat et al., 1980, J. Immunology 125(3): 961-969).
Другие подходящие антитела включают фрагменты антител, такие как, но не ограничиваясь ими, фрагменты F(ab')2, фрагменты Fab, Fab', фрагменты Fv и димеры тяжелой цепи и легкой цепи антител, или любые их минимальные фрагменты, такие как Fv или одноцепочечные антитела (SCA) (например, как описано в патенте США №4946778; Bird, 1988, Science 242: 423-42; Huston et al., 1988, Proc. Natl. Acad. Sci. USA 85: 5879-5883; и в Ward et al., 1989, Nature 334: 544-54).
Также могут быть использованы рекомбинантные антитела, такие как химерные и гуманизированные моноклональные антитела, содержащие человеческие и нечеловеческие части, которые могут быть получены с применением стандартных технологий рекомбинантной ДНК (см., например, патент США №4816567; и патент США №4816397). Гуманизированные антитела представляют собой молекулы антитела из видов нечеловеческого происхождения, имеющие одну или более определяющих комплементарность областей (CDR) из видов нечеловеческого происхождения и каркасную область из молекулы иммуноглобулина человека, (см., например, патент США №5585089). Химерные и гуманизированные моноклональные антитела могут быть получены с помощью технологий рекомбинантной ДНК, известных в данной области техники, например, с помощью способов, описанных в международной публикации № WO 87/02671; в публикации европейского патента №0 184 187; в публикации европейского патента №0 171 496; в публикации европейского патента №0 173 494; в международной публикации № WO 86/01533; в патенте США №4816567; в публикации европейского патента №012 023; в Berter et al., 1988, Science 240: 1041-1043; Liu et al., 1987, Proc. Natl. Acad. Sci. USA 84: 3439-3443; Liu et al., 1987, J. Immunol. 139: 3521-3526; Sun et al., 1987, Proc. Natl. Acad. Sci. USA 84: 214-218; Nishimura et al., 1987, Cancer. Res. 47: 999-1005; Wood et al., 1985, Nature 314: 446-449; Shaw et al., 1988, J. Natl. Cancer Inst. 80: 1553-1559; Morrison, 1985, Science 229: 1202-1207; Oi et al., 1986, BioTechniques 4: 214; в патенте США №5225539; в Jones et al., 1986, Nature 321: 552-525; Verhoeyan et al., 1988, Science 239: 1534; и в Beidler et al., 1988, J. Immunol. 141: 4053-4060.
Могут быть использованы полностью человеческие антитела. Человеческие антитела могут быть получены, например, с применением трансгенных мышей, которые не способны экспрессировать гены тяжелой и легкой цепей эндогенного иммуноглобулина, но которые могут экспрессировать гены тяжелой и легкой цепей человека. Трансгенных мышей иммунизируют обычным образом выбранным антигеном, например, целым полипептидом или его частью. Моноклональные антитела, направленные против антигена, могут быть получены с применением стандартной гибридомной технологии. Трансгены человеческого иммуноглобулина, которые несут трансгенные мыши, перестраиваются во время дифференцировки В-клеток, а затем подвергаются переключению классов и соматической мутации. Таким образом, с помощью такой технологии можно получить терапевтически пригодные антитела IgG, IgA, IgM и IgE. Обзор указанной технологии получения человеческих антител представлен в публикации Lonberg и Huszar (1995, Int. Rev. Immunol. 13: 65-93). Подробное описание указанной технологии получения человеческих антител и человеческих моноклональных антител, а также протоколы для получения таких антител представлены например, в патентах США №5625126; 5633425; 5569825; 5661016; и 5545806.
Человеческие антитела, которые распознают выбранный эпитоп, также могут быть получены с помощью технологии, называемой «направленным отбором». В этом подходе выбранное нечеловеческое моноклональное антитело, например, мышиное антитело, используют для направленного отбора полностью человеческого антитела, распознающего тот же эпитоп. (см., например, Jespers et al., 1994, Biotechnology 12: 899-903.) Человеческие антитела также могут быть получены с помощью различных технологий, известных в данной области техники, включая библиотеки фагового дисплея (см. например, Hoogenboom and Winter, 1991, J. Mol. Biol. 227: 381; Marks et al., 1991, J. Mol. Biol. 222: 581; Quan and Carter, 2002, "The rise of monoclonal antibodies as therapeutics," в Anti-IgE and Allergic Disease, Jardieu, P.M. and Fick Jr., R.В, ред., Marcel Dekker, Нью-Йорк, штат Нью-Йорк, глава 20, сс. 427-469).
В других вариантах реализации антитело представляет собой гибридный белок антитела или его функционально активного фрагмента. Например, антитело может быть гибридизовано посредством ковалентной связи (например, пептидной связи) на N-конце или на С-конце с аминокислотной последовательностью другого белка (или его части, такой как часть белка из по меньшей мере 10, 20 или 50 аминокислот), который не является антителом.
Антитела включают также аналоги и производные, которые являются модифицированными, т.е. посредством ковалентного присоединения любого типа молекулы, при условии, что такое ковалентное присоединение обеспечивает возможность сохранения антиген-связывающей иммуноспецифичности антитела. В качестве неограничивающего примера, производные и аналоги антител включают те, которые были дополнительно модифицированы, например, путем гликозилирования, ацетилирования, пэгилирования, фосфорилирования, амидирования, дериватизации с помощью известных защитных/блокирующих групп, протеолитического расщепления, связывания с клеточным звеном антитела или другим белком и т.д. Любая из многочисленных химических модификаций может быть осуществлена известными методами, включая, но не ограничиваясь ими, специфическое химическое расщепление, ацетилирование, формилирование, метаболический синтез в присутствии туникамицина и т.д. Соответственно, аналог или производное может содержать одну или более неприродных аминокислот.
Антитела могут иметь модификации (например, замещения, делеции или присоединения) в аминокислотных остатках, которые взаимодействуют с рецепторами Fc. В частности, антитела, включают антитела, содержащие модификации в аминокислотных остатках, идентифицированных как участвующие во взаимодействии между анти-Fc доменом и рецептором FcRn (см. например, международную публикацию № WO 97/34631, полное содержание которой включено в настоящий документ посредством ссылки). Антитела, иммуноспецифические к антигену-мишени, могут быть приобретены в продаже или из другого источника, или могут быть получены любым способом, известным специалистам в данной области техники, таким как, например, химический синтез или технология рекомбинантной экспрессии. Нуклеотидная последовательность, кодирующая антитела, иммуноспецифические к антигену раковой клетки, могут быть получены, например, из базы данных GenBank или аналогичной базы данных, из литературных публикаций или посредством обычного клонирования и секвенирования.
Примеры антител, доступных для лечения рака, включают, но не ограничиваются ими, гуманизированное анти-HER2 моноклональное антитело, HERCEPTIN® (трастузумаб; Genentech); RITUXAN® (ритуксимаб; Genentech), который является химерным анти-CD20 моноклональным антителом для лечения пациентов с неходжкинской лимфомой; OvaRex (AltaRex Corporation, штат Массачусетс), который является мышиным антителом для лечения рака яичников; панорекс (Glaxo Wellcome, штат Северная Каролина), который является мышиным IgG2a антителом для лечения рака толстой и прямой кишок; цетуксимаб эрбитукс (Imclone Systems Inc., штат Нью-Йорк), который является анти-EGFR IgG химерным антителом дл ялечения раковых заболеваний, позитивных к эпидермальному фактору роста, таких как рак головы и шеи; витаксин (MedImmune, Inc., штат Мэриленд), который является гуманизированным антителом для лечения саркомы; Campath I/H (Leukosite, штат Массачусетс), который является гуманизированным IgG1 антителом для лечения хронического лимфоцитарного лейкоза (CLL); Smart MI95 (Protein Design Labs, Inc., штат Калифорния), который является гуманизированным анти-CD33 IgG антителом для лечения острого миелоидного лейкоза (AML); LymphoCide (Immunomedics, Inc., штат Нью-Джерси), который является гуманизированным анти-CD22 IgG антителом для лечения неходжкинской лимфомы; Smart ID10 (Protein Design Labs, Inc., штат Калифорния), который является гуманизированным анти-HLA-DR антителом для лечения неходжкинской лимфомы; онколим (Techniclone, Inc., штат Калифорния), который является мышиным анти-HLA-Dr10 антителом с радиоактивной меткой для лечения неходжкинской лимфомы; алломун (BioTransplant, штат Калифорния), который является гуманизированным анти-CD2 mAb для лечения болезни Ходжкина или неходжкинской лимфомы; авастин (Genentech, Inc., штат Калифорния, который является анти-VEGF гуманизированным антителом для лечения рака легких и рака толстой и прямой кишок; эпратузумаб (Immunomedics, Inc., штат Нью-Джерси, и Amgen, штат Калифорния), который является анти-CD22 антителом для лечения нехождкинской лимфомы; и CEAcide (Immunomedics, штат Нью-Джерси), который является гуманизированным анти-СЕА антителом для лечения рака толстой и прямой кишок.
Другие антитела, подходящие для лечения рака, включают, но не ограничиваются ими, антитела против следующих антигенов (в скобках указаны иллюстративные раковые заболевания): СА125 (рак яичников), СА15-3 (карцинома), СА19-9 (карцинома), L6 (карцинома), Lewis Y (карцинома), Lewis X (карцинома), альфа-фетопротеин (карцинома), СА 242 (рак толстой и прямой кишок), плацентарная щелочная фосфатаза (карцинома), простатический специфический мембранный антиген (рак предстательной железы), (рак предстательной железы), эпидермальный фактор роста (карцинома), MAGE-1 (карцинома), MAGE-2 (карцинома), MAGE-3 (карцинома), MAGE-4 (карцинома), антитрансферриновый рецептор (карцинома), р97 (меланома), MUC1-KLH (рак молочной железы), СЕА (рак толстой и прямой кишок), gp100 (меланома), MART1 (меланома), простатический специфический антиген (PSA) (рак предстательной железы), рецептор IL-2 (Т-клеточный лейкоз и лимфома), CD20 (неходжкинская лимфома), CD52 (leukemia), CD33 (лейкоз), CD22 (лимфома), человеческих хорионический гонадотропин (карцинома), CD38 (множественная миелома), CD40 (лимфома), муцин (карцинома), Р21 (карцинома), MPG (меланома) и онкогенный продукт Neu (карцинома). Некоторые конкретные подходящие антитела включают, но не ограничиваются ими, BR96 mAb (Trail et al., 1993, Science 261: 212-215), BR64 (Trail et al., 1997, Cancer Research 57: 100-105), mAb против антигена CD40, такие как S2C6 mAb (Francisco et al., 2000, Cancer Res. 60: 3225-3231) и их химерные и гуманизированные варианты; mAb против антигена cD33, mAb против антигена EphA2; mAb против антигена CD70, такие как 1F6 mAb и 2F2 mAb, и их химерные и гуманизированные варианты, и mAb против антигена CD30, такие как АС 10 (Bowen et al., 1993, J. Immunol. 151: 5896-5906; Wahl et al., 2002, Cancer Res. 62(13): 3736-42), и их химерные и гуманизированные варианты. Могут быть использованы и описаны многие другие интернализирующие антитела, которые связываются с ассоциированными с опухолью антигенами (см., например, Franke et al., 2000, Cancer Biother. Radiopharm. 15: 459 76; Murray, 2000, Semin. Oncol. 27: 64 70; Breitling et al., Recombinant Antibodies, John Wiley and Sons, Нью-Йорк, 1998).
Антитело также может представлять собой антитело, которое связывается с антигеном, присутствующим на клетке-мишени или группе клеток-мишеней. Например, трансмембранные полипептиды и другие маркеры могут быть специфически экспрессированы на поверхности одного или более конкретных типов клеток-мишеней (например, раковых клеток), по сравнению с одной или более нормальными клетками (например, не раковой клеткой(-ауим)). Зачастую такие маркеры более обильно экспрессируются на поверхности клеток-мишеней или демонстрируют более высокую иммуногенность по сравнению с маркерами на поверхности нормальных клеток. Идентификация таких антигенных полипептидов клеточной поверхности обеспечила возможность специфического разрушения клеток-мишеней терапевтическими средствами на основе антител. Так, в некоторых вариантах реализации антитела включают, но не ограничиваются ими, антитела против опухолеассоциированных антигенов (ТАА). Такие опухолеассоциированные антигены известны в данной области техники и могут быть получены для применения при получении антител с помощью способов и информации, общеизвестных в данной области техники.
См. также ЕР 2552957, WO/2012/116453, WO/2012/032080. См. также Zybody™, http: //www.zyngenia.com/science-technology/technology-approach. asp. См. также технологию на основе антител, имеющих только тяжелую цепь человека, http: //www.crescendobiologics.com/. См. также WO 2010001251, платформу получения человеческих антител на основе дрожжей http: //www.adimab.com/platform-overview, платформу mAbLogix™ http: //www.dna.com/OurApproach/ComplementaryTechnologies/AntibodyDiscovery, моноклональную исследовательскую платформу http: //www.igenica.com/science.php, WO 2009/157771, EP 2560993, WO 2013004842, WO 2012166560.
В дополнение к антителам, направляющий фрагмент (Т) рассматриваемых композиций включает в свой объем любое звено (Т), которое связывается или ассоциируется посредством реакции, или образует комплекс с рецептором, антигеном или другим способным к связыванию фрагментом, связанным с данной группой клеток-мишеней. (Т) представляет собой молекулу, которая связывается, образует комплекс или реагирует с фрагментом группы клеток, подлежащих направленному воздействию. Например, в объем (Т) включены лиганды для рецепторов клеточной поверхности, полученные из различных источников, включая полученные из клеток человека, лиганды, полученные из бактерий, и лиганды, полученные из патогенов. В данной области техники известно многочисленные подходящие направляющие фрагменты. Например, см. WO 2013117705.
Линкерный фрагмент (L)
Рассматриваемые композиции необязательно дополнительно содержат линкерный фрагмент (L). (L) представляет собой бифункциональное соединение, которое может быть использовано для связывания (D) и (Т) с получением композиции конъюгата, T-L-D. Такие конъюгаты обеспечивают возможность селективной доставки лекарств к клеткам-мишеням (например, опухолевым клеткам). (L) включают двухвалентные заместители, такие как алкилдиил, арилдиил, гетероарилдиил, такие фрагменты как: -(CR2)nO(CR2)n-, повторяющиеся звенья алкилокси (например, полиэтиленокси, ПЭГ, полиметиленокси) и алкиламино (например, полиэтиленамино, Jeffamine™); и сложные эфиры и амиды дикислот, включая сукцинат, сукцинамид, дигликолят, малонат и капроамид.
Рассматриваемые композиции могут быть получены с помощью звена (L), содержащего реакционноспособный сайт для связывания с (D) и (Т). В некоторых вариантах реализации (L) содержит реакционноспособный сайт, который имеет электрофильную группу, которая является реакционноспособной в отношении нуклеофильной группы, присутствующей в (Т). Подходящие нуклеофильные группы в (Т) включают, но не ограничиваются ими, сульфгидрильные, гидроксильные и аминогруппы. Гетероатом нуклеофильной группы (Т) является реакционноспособным в отношении электрофильной группы в (L) и образует ковалентную связь с (L). Подходящие электрофильные группы включают, но не ограничиваются ими, малеимидные и галогенацитамидные группы. Нуклеофильная группа в (Т) обеспечивает подходящий сайт для присоединения к (L).
В другом варианте реализации (L) содержит реакционноспособный сайт, который имеет нуклеофильную группу, которая является реакционноспособной в отношении электрофильной группы, присутствующей в (Т). Подходящие электрофильные группы в (Т) включают, но не ограничиваются ими, альдегидные и кетонные карбонильные группы. Гетероатом нуклеофильной группы (L) может взаимодействовать с электрофильной группой (Т) и образовывать ковалентную связь с (Т). Подходящие нуклеофильные группы в (L) включают, но не ограничиваются ими, гидразид, оксим, амино, гидразин, тиосемикарбазон, гидразинкарбоксилат и арилгидразид. Электрофильная группа в (Т) обеспечивает подходящий сайт для присоединения к (L).
Карбоксильные функциональные группы и хлорформиатные функциональные группы также являются подходящими реакционноспособными сайтами для (L), поскольку они могут взаимодействовать с аминогруппами в (D) с образованием амидной связи. В качестве реакционноспособного сайта подходит также карбонатная функциональная группа в (L), такая как, но не ограничиваясь ими, п-нитрофенилкарбонат, которая может взаимодействовать с аминогруппой в (D) с образованием карбаматной связи.
Следует понимать, что любые линкерные фрагменты, описанные в известном уровне техники, и, в частности, описанные для применения в контексте доставки лекарств, могут быть использованы в соответствии с настоящим изобретением. Без ограничения объема предшествующего утверждения, в одном из вариантов реализации (L) включает линкерный фрагмент, описанный в WO 2012/113847. В другом варианте реализации (L) включает линкерный фрагмент, описанный в патенте США8288352. В другом варианте реализации (L) включает линкерный фрагмент, описанный в патенте США5028697. В другом варианте реализации (L) включает линкерный фрагмент, описанный в патенте США5006652. В другом варианте реализации (L) включает линкерный фрагмент, описанный в патенте США5094849. В другом варианте реализации (L) включает линкерный фрагмент, описанный в патенте США5053394. В другом варианте реализации (L) включает линкерный фрагмент, описанный в патенте США5122368. В другом варианте реализации (L) включает линкерный фрагмент, описанный в патенте США5387578. В другом варианте реализации (L) включает линкерный фрагмент, описанный в патенте США5547667. В другом варианте реализации (L) включает линкерный фрагмент, описанный в патенте США5 622929. В другом варианте реализации (L) включает линкерный фрагмент, описанный в патенте США5 708146. В другом варианте реализации (L) включает линкерный фрагмент, описанный в патенте США6468522. В другом варианте реализации (L) включает линкерный фрагмент, описанный в патенте США6103236. В другом варианте реализации (L) включает линкерный фрагмент, описанный в патенте США6638509. В другом варианте реализации (L) включает линкерный фрагмент, описанный в патенте США6214345. В другом варианте реализации (L) включает линкерный фрагмент, описанный в патенте США6759509. В другом варианте реализации (L) включает линкерный фрагмент, описанный в WO 2007/103288. В другом варианте реализации (L) включает линкерный фрагмент, описанный в WO 2008/083312. В другом варианте реализации (L) включает линкерный фрагмент, описанный в WO 2003/068144. В другом варианте реализации (L) включает линкерный фрагмент, описанный в WO 2004/016801. В другом варианте реализации (L) включает линкерный фрагмент, описанный в WO 2009/134976. В другом варианте реализации (L) включает линкерный фрагмент, описанный в WO 2009/134952. В другом варианте реализации (L) включает линкерный фрагмент, описанный в WO 2009/134977. В другом варианте реализации (L) включает линкерный фрагмент, описанный в WO 2002/08180. В другом варианте реализации (L) включает линкерный фрагмент, описанный в WO 2004/043493. В другом варианте реализации (L) включает линкерный фрагмент, описанный в WO 2007/018431. В другом варианте реализации (L) включает линкерный фрагмент, описанный в WO 2003/026577. В другом варианте реализации (L) включает линкерный фрагмент, описанный в WO 2005/077090. В другом варианте реализации (L) включает линкерный фрагмент, описанный в WO 2005/082023. В другом варианте реализации (L) включает линкерный фрагмент, описанный в WO 2007/011968. В другом варианте реализации (L) включает линкерный фрагмент, описанный в WO 2007/038658. В другом варианте реализации (L) включает линкерный фрагмент, описанный в WO 2007/059404. В другом варианте реализации (L) включает линкерный фрагмент, описанный в WO 2006/110476. В другом варианте реализации (L) включает линкерный фрагмент, описанный в WO 2005/112919. В другом варианте реализации (L) включает линкерный фрагмент, описанный в WO 2008/103693. В другом варианте реализации (L) включает линкерный фрагмент, описанный в патенте США6756037. В другом варианте реализации (L) включает линкерный фрагмент, описанный в патенте США7087229. В другом варианте реализации (L) включает линкерный фрагмент, описанный в патенте США7122189. В другом варианте реализации (L) включает линкерный фрагмент, описанный в патенте США7332164. В другом варианте реализации (L) включает линкерный фрагмент, описанный в патенте США5556623. В другом варианте реализации (L) включает линкерный фрагмент, описанный в патенте США5643573. В другом варианте реализации (L) включает линкерный фрагмент, описанный в патенте США5665358.
В предпочтительном варианте реализации (L) включает линкерный фрагмент, описанный в предварительной заявке на патент США 61/921242, поданной 27 декабря 2013 года. Соответственно, предложены композиции конъюгата Формулы III:

где (Т) представляет собой направляющий фрагмент, где (D1) имеет следующую структуру (IV):

где R1 и Х являются такими, как описано в настоящем документе supra и infra;
где R2a выбран из: C2-C6 алкилдиила, арилдиила, C4-C7 циклоалкилдиила, гетероарилдиила и гетероциклилдиила, каждый из которых необязательно замещен одним или более заместителями, выбранными из: C1-C6 алкокси, C1-C6 алкоксикарбонила, C1-C6 алкила, C1-C6 алкиламино, амино, амино-C1-C6 алкила, аминоарила, амино-C3-C7 циклоалкила, арила, карбоксамида, карбоксила, циано, C1-C6 галогеналкила, C1-C6 галогеналкокси, галогена, гидроксила, нитро, тио и тио-C1-C6 алкила;
и где (L1)-(T) имеет следующую структуру (V)

где группа -NH-, связанная с R2a в Формуле IV, образует пептидную связь (JPB) с (AA)1 в Формуле V, где JPB является ферментативно расщепляемой, где каждый АА независимо представляет собой аминокислоту, где n представляет собой целое число от 0 до 25, где (L2) необязательно представляет собой остальную часть линкера (L1), где (Т) представляет собой направляющий фрагмент, и где (AA)1-(AA)n вместе содержат аминокислотную последовательность, способную облегчать ферментативное расщепление JPB.
Могут быть использованы также линкеры (L), содержащие саморасщепляющийся компонент. Например, см. патент США №6214345. Примером саморасщепляющегося компонента является п-аминобензилкарбамоил (РАВС).
В настоящем изобретении могут быть использованы имеющиеся в продаже линкеры. Например, может быть использован имеющийся в продаже расщепляемый линкер сульфосукцинимидил-6-[3'(2-пиридилдитио)пропанамидо]гексаноат (сульфо-LC-SPDP: Thermo Pierce кат. №21650) и не расщепляемый линкер сукцинимидил-4-[N-малеимидометил]циклогексан-1-карбоксилат (SMCC: Thermo Pierce кат. №22360), как показано в настоящем документе.
См. также WO 2012171020, WO 2010138719, ассортимент имеющихся в продаже линкеров, например, компании Concortis http: //www.concortis.com/home. См. также Kim et al., Bioconjugate Chemistry, 21 (8): 1513-1519, август 2010 года. См. также ЕР 2326349. См. также линкеры для клик-химии, не содержащие меди, Angew. Chem. Int. ред., 2010, 49, с. 9422-9425, ChemBioChem, 2011, 12, с. 1309-1312, http: //www.com.synaffix /technology/.
Лекарственный фрагмент (D)
(D) представляет собой соединение Формулы I, как описано в настоящем документе. Специалистам в данной области техники следует понимать, что соединения, описанные в настоящем документе, могут быть соответствующим образом модифицированы для облегчения реакции конъюгации с (L), или при отсутствии (L) - с (Т), и образования конъюгата (T)-(L)-(D) или (T)-(D). Может быть использована любая точка присоединения в (D). В одном из вариантов реализации С-конец (D) образует точку присоединения в конъюгате (T)-(L)-(D). В другом варианте реализации N-конец (D) образует точку присоединения в конъюгате (T)-(L)-(D). В другом варианте реализации боковая цепь (D) образует точку присоединения в конъюгате (T)-(L)-(D).
Введение
Для целей введения, соединения согласно настоящему описанию могут быть введены в виде исходного химического соединения или могут быть составлены в виде фармацевтических композиций. Фармацевтические композиции согласно настоящему описанию содержат соединение, описанное в настоящем документе, и фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество. Соединение, описанное в настоящем документе, присутствует в композиции в количестве, которое является эффективным для лечения конкретного рассматриваемого заболевания или патологического состояния, например, в количестве, достаточном для лечения роста раковых или опухолевых клеток, и предпочтительно с приемлемой токсичностью для пациента. Активность соединений, описанных в настоящем документе, может быть определена специалистом в данной области техники, например, как описано ниже в разделе «Примеры». Специалисты в данной области техники могут без труда определить подходящие концентрации и дозы.
Введение соединений, описанных в настоящем документе, или их фармацевтически приемлемых солей в чистой форме или в виде подходящей фармацевтической композиции может быть осуществлено любым приемлемым способом введения агентов, предназначенных для подобных применений. Фармацевтические композиции согласно настоящему описанию могут быть получены посредством комбинирования соединения, описанного в настоящем документе, с подходящим фармацевтически приемлемым носителем, разбавителем или вспомогательным веществом, и могут быть составлены в препараты в твердых, полутвердых, жидких или газообразных формах, таких как таблетки, капсулы, порошки, гранулы, мази, растворы, суппозитории, препараты для инъекций, средства для ингаляции, гели, микросферы и аэрозоли. Типичные способы введения таких фармацевтических композиций включают, без ограничения, пероральный, местный, трансдермальный, посредством ингаляции, парентеральный, сублингвальный, буккальный, ректальный, вагинальный и интраназальный. Термин «парентеральный», используемый в данном документе, включает подкожные инъекции, внутривенную, внутримышечную, интрастернальную инъекцию или процедуры инфузии. Фармацевтические композиции согласно настоящему описанию составляют так, чтобы обеспечивать биодоступность активных ингредиентов, содержащихся в них, при введении композиции пациенту. Композиции, подлежащие введению субъекту или пациенту, имеют форму одной или более единиц дозирования, при этом, например, таблетка может быть одной единицей дозирования, а контейнер с соединением, описанным в настоящем документе, в аэрозольной форме может содержать множество единиц дозирования. Существующие способы получения таких лекарственных форм известны или понятны специалистам в данной области техники; см. Remington: The Science and Practice of Pharmacy (22-e изд.), ред. Loyd V. Allen, Jr., et al., Pharmaceutical Press, 2012. Композиция, подлежащая введению, в любом случае содержит терапевтически эффективное количество соединения, описанного в настоящем документе, или его фармацевтически приемлемой соли для лечения рассматриваемого заболевания или патологического состояния в соответствии с идеей настоящего описания.
Фармацевтическая композиция, описанная в настоящем документе, может быть в твердой или жидкой форме. В одном аспекте носитель(-и) является веществом в виде частиц, так что указанные композиции представлены, например, в форме таблетки или порошка. Носитель(-и) может быть жидким, при этом композиции представляют собой, например, сироп для перорального введения, жидкость для инъекций или аэрозоль, который может быть использован, например, при введении посредством ингаляции.
При предполагаемом применении посредством перорального введения фармацевтические композиции согласно настоящему описанию, как правило, представлены в твердой или жидкой форме, при этом в формы, считающиеся в настоящем документе твердыми или жидкими, включают также полутвердые, полужидкие, суспензионные и гелеобразные формы.
В качестве твердой композиции для перорального введения, фармацевтические композиции могут быть составлены в форме порошка, гранулы, прессованной таблетки, пилюли, капсулы, жевательной резинки, пастилки и т.п. Такая твердая композиция, как правило, содержит один или более инертных разбавителей или съедобных носителей. Кроме того, может присутствовать один или более следующих агентов: связующие вещества, такие как карбоксиметилцеллюлоза, этилцеллюлоза, микрокристаллическая целлюлоза, трагакантовая камедь или желатин; вспомогательные вещества, такие как крахмал, лактоза или декстрины, разрыхлители, такие как альгиновая кислота, альгинат натрия, Primogel, кукурузный крахмал и т.п.; смазывающие агенты, такие как стеарат магния или Sterotex; скользящие добавки, такие как коллоидный диоксид кремния; подсластители, такие как сахароза или сахарин; ароматизаторы, такие как перечная мята, метилсалицилат или апельсиновый ароматизатор; и красящий агент.
Если фармацевтическая композиция представлена в форме капсулы, например желатиновой капсулы, она может содержать, помимо материалов перечисленных выше типов, жидкий носитель, такой как полиэтиленгликоль или масло.
Фармацевтические композиции, описанные в настоящем документе, могут быть в форме жидкости, например, эликсира, сиропа, раствора, эмульсии или суспензии. Жидкость может быть предназначена для перорального введения или для доставки посредством инъекции, в качестве двух примеров. При предполагаемом применении посредством перорального введения, фармацевтические композиции, описанные в настоящем документе, обычно содержат, помимо представленных соединений, один или более подсластителей, консервантов, красителей/красящих агентов и усилителей вкуса. В композицию, предполагаемую для введения посредством инъекции, может быть включено одно или более поверхностно-активных веществ, консервантов, смачивающих агентов, диспергирующих агентов, суспендирующих агентов, буферов, стабилизаторов и изотоничных агентов.
Жидкие фармацевтические композиции, описанные в настоящем документе, в случае растворов, суспензий или других подобных форм, могут содержать один или более из следующих адъювантов: стерильные разбавители, такие как вода для инъекций, солевой раствор, предпочтительно физиологический солевой раствор, раствор Рингера, изотонический раствор хлорида натрия, нелетучие масла, такие как синтетические моно- или диглицериды, которые могут служить в качестве растворителя или суспендирующей среды, полиэтиленгликоли, глицерин, пропиленгликоль или другие растворители; антибактериальные агенты, такие как бензиловый спирт или метилпарабен; антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия; хелатообразующие агенты, такие как этилендиаминтетрауксусная кислота; буферы, такие как ацетаты, цитраты или фосфаты, и агенты для регулирования тоничности, такие как хлорид натрия или декстроза. Препараты для парентерального введения могут быть разлиты в ампулы, одноразовые шприцы или флаконы, содержащие несколько доз и изготовленные из стекла или пластика. Предпочтительным адъювантом является физиологический солевой раствор. Предпочтительно, фармацевтическая композиция для инъекций является стерильной.
Жидкая фармацевтическая композиция, описанная в настоящем документе и предназначенная для парентерального или перорального введения, должна содержать такое количество соединения, описанного в настоящем документе, чтобы можно было получить подходящую дозу.
Фармацевтические композиции, описанные в настоящем документе, могут быть предназначены для местного введения, и в этом случае носитель может для удобства содержать раствор, эмульсию, мазь или основу для геля. Такая основа, например, может содержать одно или более из следующих: петролатум, ланолин, полиэтиленгликоли, пчелиный воск, минеральное масло, разбавители, такие как вода и спирт, и эмульгаторы и стабилизаторы. В фармацевтической композиции для местного применения могут присутствовать загустители. При предполагаемого применении посредством трансдермального введения, композиция может содержать трансдермальный пластырь или устройство для ионтофореза.
Фармацевтические композиции, описанные в настоящем документе, могут быть предназначены для ректального введения, в форме, например, суппозитория, который плавится в прямой кишке и высвобождает лекарство. Композиции для ректального введения могут содержать маслянистую основу в качестве подходящего не раздражающего вспомогательного вещества. Такие основы включают, без ограничения, ланолин, масло какао и полиэтиленгликоль.
Фармацевтические композиции, описанные в настоящем документе, могут содержать различные материалы, которые модифицируют физическую форму твердой или жидкой дозированной единицы. Например, композиция может содержать материалы, которые образуют покрывающую оболочку вокруг активных ингредиентов. Материалы, которые образуют покрывающую оболочку, обычно являются инертными, и могут быть выбраны, например, из сахара, шеллака и других энтеросолюбильных покрывающих агентов. В альтернативном варианте активные ингредиенты могут быть помещены в желатиновую капсулу.
Фармацевтические композиции, описанные в настоящем документе, могут быть получены в дозированных единицах, которые могут быть введены в виде аэрозоля. Термин «аэрозоль» используют для обозначения различных систем, от систем коллоидной природы до систем, состоящих из упаковок под давлением. Доставка может быть осуществлена с помощью сжиженного или находящегося под давлением газа, или с помощью подходящей насосной системы, обеспечивающей дозирование активных ингредиентов. Аэрозоли соединений, описанных в настоящем документе, могут быть доставлены в виде однофазных, двухфазных или трехфазных систем для обеспечения доставки активного ингредиента(-ов). Доставка аэрозоля включает необходимый контейнер, активаторы, клапаны, субконтейнеры и т.п., которые вместе могут образовывать набор. Специалисты в данной области техники могут определить предпочтительные аэрозоли без лишних экспериментов.
Фармацевтические композиции, описанные в настоящем документе, могут быть получены с помощью методик, общеизвестных в области фармацевтики. Например, фармацевтическая композиция, предполагаемая для введения посредством инъекции, может быть получена комбинированием соединения, описанного в настоящем документе, со стерильной, дистиллированной водой с получением раствора. Для облегчения образования однородного раствора или суспензии может быть добавлено поверхностно-активное вещество. Поверхностно-активные вещества представляют собой соединения, которые ковалентно не взаимодействуют с соединением, описанным в настоящем документе, для облегчения растворения или получения однородной суспензии соединения в водной системе доставки.
Соединения, описанные в настоящем документе, или их фармацевтически приемлемые соли вводят в терапевтически эффективном количестве, которое варьируется в зависимости от множества факторов, включая активность конкретного используемого соединения; метаболическую стабильность и продолжительность действия соединения; возраст, массу тела, общее состояние здоровья, пол и рацион пациента; способ и время введения; скорость экскреции; комбинацию лекарств; тяжесть конкретного расстройства или патологического состояния; и субъекта, проходящего лечение.
Соединения, описанные в настоящем документе, или их фармацевтически приемлемые производные также могут быть введены одновременно, до или после введения одного или более других терапевтических агентов. Такая комбинированная терапия включает введение одной фармацевтической дозы препарата, который содержит соединение, описанное в настоящем документе, и одного или более дополнительных активных агентов, а также введение соединения, описанного в настоящем документе и каждого активного агента в виде отдельной фармацевтической дозы препарата. Например, соединение, описанное в настоящем документе, и другой активный агент могут быть введены пациенту вместе в виде одной пероральной дозы композиции, такой как таблетка или капсула, или каждый агент вводят в виде отдельных пероральных доз препаратов. При использовании отдельных доз препаратов, соединения, описанные в настоящем документе, и один или более дополнительных активных агентов могут быть введены по существу в одно время, т.е. одновременно, или в разное время, т.е. последовательно; комбинированную терапию подразумевают как включающую все указанные схемы.
В представленных ниже примерах иллюстрированы различные споосбы получения соединений, описанных в настоящем документе, т.е. соединений Формулы I и родственных формул. Следует понимать, что специалисты в данной области техники могут получить указанные соединения подобными способами или посредством комбинирования других способов, известных специалистам в данной области техники. Следует также понимать, что специалисты в данной области техники, таким же образом, как описано ниже, могут получить другие соединения Формулы I, в явном виде не представленные ниже, используя подходящие исходные компоненты и модифицируя при необходимости параметры синтеза. В частности, исходные компоненты могут быть приобретены у таких компаний как Sigma Aldrich, Lancaster Synthesis, Inc., Maybridge, Matrix Scientific, TCI и Fluorochem USA, и т.д., или могут быть синтезированы в соответствии с литературными источниками, известными специалистам в данной области техники (см., например. Advanced Organic Chemistry: Reactions, Mechanisms, and Structure, 5-е издание (Wiley, декабрь 2000 года)), или могут быть получены так, как описано в настоящем документе.
Следующие примеры представлены в иллюстративных целях, а не для ограничения.
ПРИМЕРЫ
Пример 1: Общие способы синтеза.
Схема синтеза А

Схема синтеза В

Схема С

Пример 1.1: Общий способ 1 - получение трифторацетамида.
К перемешанной суспензии амина в 1,4-диоксане добавляли трифторуксусный ангидрид (1,1 экв.). Реакционная смесь превращалась из суспензии в раствор и снова обратно в суспензию. Ход реакции до завершения контролировали по ТСХ и/или ВЭЖХ-МС. После полного расходования исходного материала реакционную смесь разбавляли гексанами или диэтиловым эфиром, фильтровали на воронке Бюхнера и сушили полученное твердое вещество при пониженном давлении с получением чистого трифторацетамида.
Пример 1.2: Общий способ 2
Способ А: DCC/DMAP-опосредованное получение N-ацилсульфонамида.
К перемешанному раствору кислоты в дихлорметане добавляли раствор сульфонамида (1,3 экв., в дихлорметане, N,N-диметилформамиде или их смеси, при необходимости). Добавляли дициклогексилкарбодиимид (1,2 экв.), а затем N,N-диметиламинопиридин (1,2 экв.). Ход реакции контролировали по ВЭЖХ-МС (обычно 16 ч.), а избыток побочных продуктов может быть осажден добавлением диэтилового эфира. Твердое вещество удаляли фильтрацией и промывали 1:1 смесью диэтилового эфира/дихлорметана. Объединенные органические слои концентрировали, а остаток очищали хроматографией на силикагеле или необязательно препаративной ВЭЖХ с получением требуемого N-ацилсульфонамида.
Способ В: DCC- или EDCI/DMAP-опосредованное получение N-ацилсульфонамида.
К перемешанному раствору кислоты в дихлорметане, этилацетате или их смеси добавляли раствор сульфонамида (1,3 экв., в дихлорметане, этилацетате или N,N-диметилформамиде, или их смеси, при необходимости). Добавляли дициклогексилкарбодиимид или EDCI (1,2 экв.), а затем N,N-диметиламинопиридин (1,2 экв.). Ход реакции контролировали по ВЭЖХ-МС (обычно 16 ч.), а избыток побочных продуктов может быть осажден добавлением диэтилового эфира. Твердое вещество удаляли фильтрацией и промывали 1: 1 смесью диэтилового эфира/дихлорметана. Объединенные органические слои концентрировали, а остаток очищали хроматографией на силикагеле или необязательно препаративной ВЭЖХ с получением требуемого N-ацилсульфонамида.
Пример 1.3: Общий способ 3. Альтернативное AcBt-опосредованное получение N-ацилсульфонамида
Указанный способ адаптировали из способа, описанного в ARKIVOC 2004 (xii), 14-22.
Пример 1.4: Общий способ 4 - Омыление трифторацетамида.
К раствору конструкта, содержащего трифторацетамид, в 1,4-диоксане или метаноле, добавляли гидроксид лития (10 экв.) и воду (10% об./об.). Реакционную смесь перемешивали при комнатной температуре или необязательно нагревали до 50°С. Ход реакции контролировали по ВЭЖХ-МС. После завершения реакции удаляли летучие вещества при пониженном давлении, рН водного слоя при необходимости регулировали, и последовательно промывали дихлорметаном или этилацетатом. Органические фазы объединяли, сушили над MgSO4, фильтровали и концентрировали. Продукт реакции использовали либо так, «как есть», либо при необходимости очищали хроматографией на силикагеле.
Пример 1.4.1: Общий способ 4.1 - Омыление амида/сложного эфира.
К раствору конструкта, содержащего амид/сложный эфир, в 1,4-диоксане или метаноле, добавляли гидроксид лития (10 экв.) и воду (10% об./об.). Реакционную смесь перемешивали при комнатной температуре или необязательно нагревали до 50°С. Ход реакции контролировали по ВЭЖХ-МС. После завершения реакции удаляли летучие вещества при пониженном давлении, рН водного слоя при необходимости регулировали, и последовательно промывали дихлорметаном или этилацетатом. Органические фазы объединяли, сушили над MgSO4, фильтровали и концентрировали. Продукт реакции использовали либо так, «как есть», либо при необходимости очищали хроматографией на силикагеле.
Пример 1.5: Общий способ 5 - DIC/Cu(II)-опосредованное образование пептидной связи
К перемешанному раствору карбоновой кислоты в минимальном количестве 30% N,N-диметилформамида в дихлорметане последовательно добавляли 1-этил-3-(3-диметиламинопропил)карбодиимид (0,95 экв.), 1-гидрокси-7-азабензотриазол (1,0 экв.), амин (0,33 экв.) и безводный хлорид меди(II) (1,0 экв.), с короткими паузами между каждым последующим реагентом. Перемешивание продолжали при комнатной температуре, и ход реакции контролировали по ВЭЖХ-МС. После завершения реакции летучие вещества удалили при пониженном давлении, а остаточный материал очищали хроматографией на силикагеле или обращенно-фазовой ВЭЖХ с получением требуемого амида с достаточной чистотой.
Пример 1.6: Общий способ 6 - HATU-опосредованное образование пептидной связи.
К перемешанному раствору карбоновой кислоты в минимальном количестве дихлорметана или N,N-диметилформамида, или их смеси, при 0°С добавляли HATU (1,05-1,2 экв.) и либо N,N-диизопропиламин (2-4 экв.), либо 2,4,6-коллидин (2-4 экв.). Перемешивание продолжали в течение короткого периода индукции (5-20 минут), и в этом время в реакционную смесь загружали раствор амина в дихлорметана. Реакционную смесь оставляли нагреваться до комнатной температуре и контролировали ход реакции по ВЭЖХ-МС. После завершения реакции летучие вещества удалили при пониженном давлении, а остаточный материал очищали хроматографией на силикагеле или обращенно-фазовой ВЭЖХ с получением амида с достаточной чистотой.
Пример 1.7: Общий способ 7 - Удаление группы Fmoc.
Fmoc-защищенный пептидный конструкт растворяли в 20% пиперидине в N,N-диметилформамиде. Ход реакции контролировали по ВЭЖХ-МС. После завершения реакции все летучие вещества удалили при пониженном давлении с получением остатка, который либо очищали хроматографией на силикагеле, либо напрямую использовали на следующей стадии.
Пример 1.8: Общий способ 8 - N-Ацилирование аминов с помощью NHS-активированных сложных эфиров.
К раствору амина в минимальном количестве N,N-диметилформамида добавляли соответствующий сложный эфир, содержащий N-гидроксисукцинимид (1,5 экв.), и необязательно диизопропиламин (2-4 экв.). Ход реакции контролировали по ВЭЖХ-МС (обычно ~16 ч.), и в это время удаляли все летучие вещества при пониженном давлении. Затем остаток очищали хроматографией на силикагеле или обращенно-фазовой ВЭЖХ с получением требуемого амидного продукта.
Пример 1.9: Общий способ 9 - Удаление группы Boc.
К раствору Вос-защищенного конструкта в дихлорметане добавляли 10% об./об. раствор трифторуксусной кислоты. Ход реакции контролировали по ВЭЖХ-МС. После завершения реакции все летучие вещества удаляли при пониженном давлении. Остаточный материал очищали обращенно-фазовой ВЭЖХ, хроматографией на силикагеле или осаждением из смеси холодного метанола/дихлорметана/диэтилового эфира.
Пример 1.9.1: Общий способ 9.1 - Удаление группы Boc и t-Bu сложного эфира.
К раствору Вос-защищенного амина или t-Bu сложного эфира в дихлорметане добавляли 10-20% об./об. раствор трифторуксусной кислоты. Ход реакции контролировали по ВЭЖХ-МС. После завершения реакции все летучие вещества удаляли при пониженном давлении. Остаточный материал очищали обращенно-фазовой ВЭЖХ, хроматографией на силикагеле или осаждением из смеси холодного метанола/дихлорметана/диэтилового эфира.
Пример 1.10: Fmoc-Val-Cit-OH: (S)-2-((S)-2-((((9H-Флуорен-9-ил)метокси)карбонил)амино)-3-метилбутанамидо)-5-уреидопентановая кислота, Fmoc-валин-цитруллин-ОН, Fmoc-VC-ОН.

Указанное в заголовке соединение получали в соответствии со способом, описанным Dubowchik et al., Bioconjugate Chem., 2002, 13, 855-869.
1H ЯМР (400 МГц, ДМСО-d6) δ 12,56 (с, 1Н), 8,21 (д, J=7,3 Гц, 1Н), 7,90 (д, J=7,5 Гц, 2Н), 7,76 (т, J=7,0 Гц, 2Н), 7,49-7,39 (м, 3Н), 7,38-7,23 (м, 2Н), 5,96 (т, J=5,9 Гц, 1Н), 5,40 (с, 2Н), 4,34-4,09 (м, 4Н), 3,93 (дд, J=9,1, 7,1 Гц, 1Н), 3,39 (к, J=7,0 Гц, 3Н), 2,96 (к, J=6,5 Гц, 2Н), 1,97 (д, J=6,9 Гц, 1Н), 1,86-1,63 (м, 1Н), 1,57 (дтд, J=13,9, 9,0, 5,4 Гц, 1Н), 1,41 (дгепт, J=13,2, 6,9 Гц, 2Н), 0,88 (дд, J=13,3, 6,7 Гц, 6Н). C26H32N4O6 расч. [М+Н]+ 497,23. Найдено [М+Н]+ 497,19.
Пример 1.11: (S)-2-((S)-2-((трет-Бутоксикарбонил)амино)-3-метилбутанамидо)-5-уреидопентановая кислота, Вос-валин-цитруллин-ОН, Boc-VC-OH.

Указанное в заголовке соединение синтезировали в соответствии с US 2010/0233190 A1 с совпадающими спектроскопическими данными.
Пример 1.12: MC-NHS: 2,5-Диоксопирролидин-1-ил-6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексаноат.

К перемешанному раствору 6-аминокапроновой кислоты (10,0 г, 76,2 ммоль, 1,0 экв.) в уксусной кислоте (75 мл) добавляли малеиновый ангидрид (7,85 г, 80,0 ммоль, 1,05 экв.). Твердые вещества растворялись в течение нескольких минут, затем примерно через 5 минут твердые вещества начинали разрушаться. Через час суспензия загустела с образованием белого сгустка. Материал соскабливали на стеклянную воронку и промывали толуолом, и сушили в вакууме при нагревании для удаления следов уксусной кислоты.
Порошок промежуточного соединения растворяли в толуоле (250 мл), добавляли триэтиламин (21,3 мл, 152 ммоль, 2,0 экв.) и нагревали смесь с обратным холодильником с насадкой Дина-Старка. Через 5 часов нагревания с обратным холодильником смесь охлаждали и декантировали прозрачный толуольный слой от остальной части липкого остатка в колбе. Толуол удаляли in vacuo с получением триэтиламинной соли 6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексаноата. Соль повторно растворяли в толуоле и добавляли небольшое количество уксусной кислоты, затем концентрировали. Затем смесь растворяли в 50% насыщенном растворе бикарбоната натрия и добавляли 1 М HCl до рН 3 с получением осадка молочного цвета. Смесь три раза экстрагировали EtOAc, объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали in vacuo с получением чистого 6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексаноата (3,08 г, 19%).
К перемешанному раствору 6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексаноата (3,08 г, 14,6 ммоль, 1,0 экв.) и N-гидроксисукцинимида (1,76 г, 15,3 ммоль, 1,05 экв.) в EtOAc (30 мл) при 0°С добавляли дициклогексилкарбодиимид (3,16 г, 15,3 ммоль, 1,05 экв.). Затем реакционную смесь оставляли нагреваться до комнатной температуры. Через 20 часов реакционную смесь отфильтровывали и промывали EtOAc и концентрировали фильтрат. Остаток очищали флэш-хроматографией с получением указанного в заголовке соединения (2,16 г, 48%) в виде прозрачного маслянистого вещества, которое медленно затвердевало с образованием воскообразного белого вещества. 1H ЯМР (400 МГц, хлороформ-d) δ 6,71 (с, 2Н), 3,56 (т, J=7,2 Гц, 2Н), 2,86 (с, 4Н), 2,63 (т, J=7,4 Гц, 2Н), 1,80 (п, J=7,4 Гц, 2H), 1,73-1,57 (м, 2Н), 1,50-1,35 (м, 2Н), m/z расч. для C14H16N2O6 = 308,10. Найдено [М+Н]+=309,13. Rf=0,28 (50% EtOAc/гексан).
Пример 1.13: МТ-ОН: 3-(2-(2-(2-(2,5-Диоксо-2,5-дигидро-1H-пиррол-1-ил)этокси)этокси)этокси)пропановая кислота.

Указанное в заголовке соединение получали в соответствии со способом, описанным Wamecke, A., Kratz, F. Bioconjugate Chemistry 2003, 14, 377-387.
1H ЯМР (400 МГц, хлороформ-d) δ 6., 4 (с, 2Н), 3,87-3,72 (м, 4Н), 3,72-3,62 (м, 10Н), 2,73-2,64 (м, 2Н). m/z расч. для C13H29NO7 = 301,12. Найдено [М+Н]+=302,14.
Пример 1.14: MT-NHS: 2,5-Диоксопирролидин-1-ил-3-(2-(2-(2-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)этокси)этокси)этокси)пропаноат.

МТ-ОН (2,6 г, 8,6 ммоль, 1,0 экв.) обрабатывали дициклогексилкарбодиимидом (1,87 г, 9,06 ммоль, 1,05 экв.) и N-гидроксисукцинимидом (1,04 г, 6,06 ммоль, 1,05 экв.) в 30 мл 5:1 смеси EtOAc/диоксана при комнатной температуре. Через 36 часов смесь отфильтровывали, промывали EtOAc и очищали остаток флэш-хроматографией с получением указанного в заголовке соединения (309 мг, 9,0%) в виде прозрачного маслянистого вещества вместе с исходным материалом (1,31 г, выделено 50%).
1H ЯМР (400 МГц, хлороформ-d) δ 6,72 (с, 2Н), 3,87 (т, J=6,4 Гц, 2Н), 3,74 (т, J=5,6 Гц, 2Н), 3,70-3,58 (м, 10Н), 2,93 (т, J=6,4 Гц, 2Н), 2,86 (с, 4Н), 1,32-1,19 (м, 2Н), m/z расч. для C17H22N2O9 = 398,13. Найдено [М+Н]+=399,15, [M+Na]+=421,14. Rf=0,59 (10% (5% АсОН/МеОН)/10% гексан/CH2Cl2).
Пример 1.15: MT-VC-OH: (14R,17R)-1-(2,5-Диоксо-2,5-дигидро-1H-пиррол-1-ил)-14-изопропил-12,15-диоксо-17-(3-уреидопропил)-3,6,9-триокса-13,16-диазаоктадекан-18-оновая кислота.

Способ А
К раствору (R)-2-((R)-2-(трет-бутоксикарбониламино)-3-метилбутанамидо)-5-уреидопентановой кислоты (Boc-VC-OH, 0,600 r, 1,602 ммоль) в дихлорметане (2,5 мл) добавляли трифторуксусную кислоту (2,5 мл). Ход реакции по поглощению исходного материала контролировали с помощью ВЭЖХ, а затем концентрировали при пониженном давлении, повторно суспендировали в толуоле, концентрировали при пониженном давлении и оставляли под высоким вакуумом на 4 часа. Часть продукта (H-VC-OH. ТФК, 0,5 г, 1,287 ммоль) суспендировали в 1,4-диоксане (0,5 мл) и одной порцией добавляли MT-NHS (0,512 г, 1,287 ммоль), затем добавляли диизопропилэтиламин (0,90 мл, 4 экв.) и оставляли реакционную смесь перемешиваться в течение ночи. Реакционную смесь концентрировали досуха, и полученное маслянистое вещество растворяли в метаноле, затем очищали препаративной ВЭЖХ. В результате лиофилизации требуемых фракций получали указанное в заголовке соединение в виде белого порошка (0,351 г).
Способ В
Указанное в заголовке соединение получали в соответствии со способом, описанным в WO 2015095953 А1.
Пример 1.16: (S)-2-Амино-3-фенил-N-(4-(2,2,2-трифторацетамидо)фенилсульфонил)пропанамид (Соединение 1).
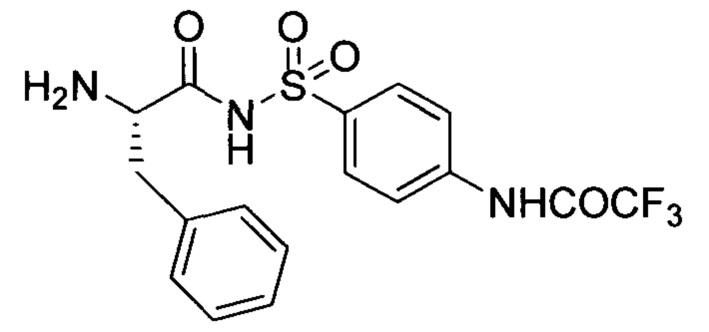
Получали из Вос-фенилаланина и 2,2,2-трифтор-N-(4-сульфамоилфенил)ацетамида в соответствии с общими способами 2 и 9. 1H ЯМР (400 МГц, ДМСО-d6) δ 11,42 (с, 1Н), 7,84 (д, J=8,7 Гц, 2Н), 7,73-7,64 (м, 1Н), 7,69 (д, J=8,7 Гц, 2Н), 7,24-7,14 (м, 3Н), 7,13-7,06 (м, 2Н), 3,65-3,60 (м, 1Н), 3,06 (дд, J=14,2, 5,1 Гц, 1Н), 2,91 (дд, J=14,1, 7,1 Гц, 1Н). C17H16F3N3O4S расч. m/z=415,08, найдено [М+Н]+=416,5.
Пример 1.17: (S)-2-Амино-3-фенил-N-((4-(2,2,2-трифторацетамидо)бензил)сульфонил)пропанамид (Соединение 2).

Получали из Вос-фенилаланина и 2,2,2-трифтор-N-(4-сульфамоилфенил)ацетамида (Пример 1.39) в соответствии с общими способами 3 и 9. 1H NMR (400 МГц, ДМСО-d6) δ 7,76-7,71 (м, 2Н), 7,58 (д, J=8,4 Гц, 2Н), 7,36-7,21 (м, 8Н), 4,34 (д, J=13,1 Гц, 1Н), 4,30 (д, J=13,1 Гц, 1Н), 3,62 (дд, J=8,2, 4,6 Гц, 1Н), 3,21-3,09 (м, 1Н), 2,89 (дд, J=14,3, 8,3 Гц, 1Н). C18H18F3N3O4S расч. m/z=429,10, найдено [М+Н]+=430,7.
Пример 1.18: трет-Бутил-(S)-1-(((3R,4S,5S)-3-метокси-1-((S)-2-((1R,2R)-1-метокси-2-метил-3-оксо-3-(4-(2,2,2-трифторацетамидо)фенилсульфонамидо)пропил)пирролидин-1-ил)-5-метил-1-оксогептан-4-ил)(метил)амино)-3-метил-1-оксобутан-2-илкарбамат (Соединение 3).

Указанное в заголовке соединение синтезировали из имеющегося в продаже Вос-Val-Dip-Dap-OH (0,08 г) и 2,2,2-трифтор-N-(4-сульфамоилфенил)ацетамида по общему способу 2. C37H58F3N5O10S расч. m/z=821,39, найдено [М+Н]+=823,04.
Пример 1.19: (S)-2-((S)-2-(Диметиламино)-3-метилбутанамидо)-N-((3R,4S,5S)-3-метокси-1-((S)-2-((1R,2R)-1-метокси-2-метил-3-оксо-3-(4-(2,2,2-трифторацетамидо)фенилсульфонамидо)пропил)пирролидин-1-ил)-5-метил-1-оксогептан-4-ил)-N,3-диметилбутанамид (Соединение 4).

Указанное в заголовке соединение получали из Соединения 3 и N,N-диметилвалина по общим способам 9 и 6. C39H63F3N6O9S расч. m/z=848,43, найдено [М+Н]+ 850,11.
Пример 1.20: (S)-N-((3R,4S,5S)-1-((S)-2-((1R,2R)-3-(4-аминофенилсульфонамидо)-1-метокси-2-метил-3-оксопропил)пирролидин-1-ил)-3-метокси-5-метил-1-оксогептан-4-ил)-2-((S)-2-(диметиламино)-3-метилбутанамидо)-N,3-диметилбутанамид (Соединение 5).

Указанное в заголовке соединение получали из Соединения 4 по общему способу 4. C37H64N6O8S расч. m/z=752,45, найдено [М+Н]+ 754,16.
Пример 1.21: трет-Бутил-(S)-1-(((3R,4S,5S)-3-метокси-1-((S)-2-((1R,2R)-1-метокси-2-метил-3-оксо-3-((4-(2,2,2-трифторацетамидо)фенил)метилсульфонамидо)пропил)пирролидин-1-ил)-5-метил-1-оксогептан-4-ил)(метил)амино)-3-метил-1-оксобутан-2-илкарбамат (Соединение 6).

Указанное в заголовке соединение получали из имеющегося в продаже Boc-Val-Dil-Dap-OH по общему способу 2. C38H60F3N5O10S расч. m/z=835,40, найдено [М+Н]+=836,7.
Пример 1.22: (S)-2-((S)-2-(Диметиламино)-3-метилбутанамидо)-N-((3R,4S,5S)-3-метокси-1-((S)-2-((1R,2R)-1-метокси-2-метил-3-оксо-3-((4-(2,2,2-трифторацетамидо)фенил)метилсульфонамидо)пропил)пирролидин-1-ил)-5-метил-1-оксогептан-4-ил)-N,3-диметилбутанамид (Соединение 7).

Указанное в заголовке соединение получали из Соединения 6 по общему способу 6. C40H65F3N6O9S расч. m/z=862,45, найдено [М+Н]+=863,2.
Пример 1.23: (S)-N-((3R,4S,5S)-1-((S)-2-((IR,2R)-3-((4-Аминофенил)метилсульфонамидо)-1-метокси-2-метил-3-оксопропил)пирролидин-1-ил)-3-метокси-5-метил-1-оксогептан-4-ил)-2-((S)-2-(диметиламино)-3-метилбутанамидо)-N,3-диметилбутанамид (Соединение 8).
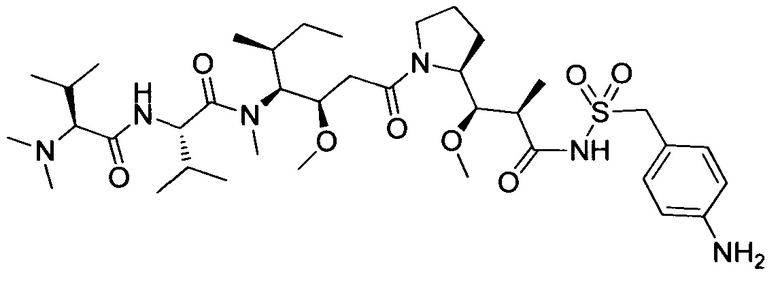
Указанное в заголовке соединение получали из Соединения 7 по общему способу 4. C38H66N6O8S расч. m/z=766,47, найдено [M-C7H8O2S+H]+=599,0 (хинон-метидная фрагментация и потеря 4-аминобензилсульфоната).
Пример 1.24; трет-Бутил-(S)-1-(((3R,4S,5S)-3-метокси-1-((S)-2-((1R,2R)-1-метокси-2-метил-3-оксо-3-((S)-1-оксо-3-фенил-1-(4-(2,2,2-трифторацетамидо)фенилсульфонамидо)пропан-2-иламино)пропил)пирролидин-1-ил)-5-метил-1-оксогептан-4-ил)(метил)амино)-3-метил-1-оксобутан-2-илкарбамат (Соединение 9).

Указанное в заголовке соединение синтезировали из имеющегося в продаже Вос-Val-Dip-Dap-OH (0,07 г) и Соединения 1 по общему способу 6. C46H67F3N6O11S расч. m/z=968,45, найдено [M+Na]+=992,1.
Пример 1.25: (S)-2-((S)-2-(Диметиламино)-3-метилбутанамидо)-N-((3R,4S,5S)-3-метокси-1-((S)-2-((1R,2R)-1-метокси-2-метил-3-оксо-3-((S)-1-оксо-3-фенил-1-(4-(2,2,2-трифторацетамидо)фенилсульфонамидо)пропан-2-иламино)пропил)пирролидин-1-ил)-5-метил-1-оксогептан-4-ил)-N,3-диметилбутанамид (Соединение 10).

Указанное в заголовке соединение получали из Соединения 9 (110 мг) и N,N-диметилвалина по общим способам 9 и 6. C48H72F3N7O10S расч. m/z=995,50, найдено [М+Н]+ 997,3.
Пример 1.26: (S)-N-((3R,4S,5S)-1-((S)-2-((1R,2R)-3-((S)-1-(4-Аминофенилсульфонамидо)-1-оксо-3-фенилпропан-2-иламино)-1-метокси-2-метил-3-оксопропил)пирролидин-1-ил)-3-метокси-5-метил-1-оксогептан-4-ил)-2-((S)-2-(диметиламино)-3-метилбутанамидо)-N,3-диметилбутанамид (Соединение 11).

Указанное в заголовке соединение получали из Соединения 10 (100 мг) по общему способу 4. C46H73N7O9S расч. m/z=899,52, найдено [М+Н]+ 901,3.
Пример 1.27: трет-Бутил-(S)-1-(((3R,4S,5S)-3-метокси-1-((S)-2-((1R,2R)-1-метокси-2-метил-3-оксо-3-((S)-1-оксо-3-фенил-1-(4-(2,2,2-трифторацетамидо)фенилметилсульфонамидо)пропан-2-иламино)пропил)пирролидин-1-ил)-5-метил-1-оксогептан-4-ил)(метил)амино)-3-метил-1-оксобутан-2-илкарбамат (Соединение 12).
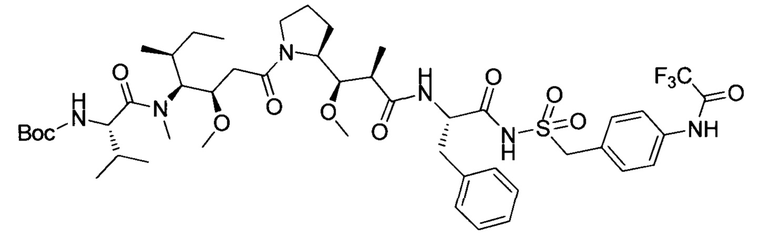
Указанное в заголовке соединение получали из имеющегося в продаже Boc-Val-Dil-Dap-OH и Соединения 2 по общему способу 6. C47H69F3N6O11S расч. m/z=982,47, найдено [М+Na]+=1006,2.
Пример 1.28: (S)-2-((S)-2-(Диметиламино)-3-метилбутанамидо)-N-((3R,4S,5S)-3-метокси-1-((S)-2-((1R,2R)-1-метокси-2-метил-3-оксо-3-((S)-1-оксо-3-фенил-1-(4-(2,2,2-трифторацетамидо)фенилметилсульфонамидо)пропан-2-иламино)пропил)пирролидин-1-ил)-5-метил-1-оксогептан-4-ил)-N,3-диметилбутанамид (Соединение 13).
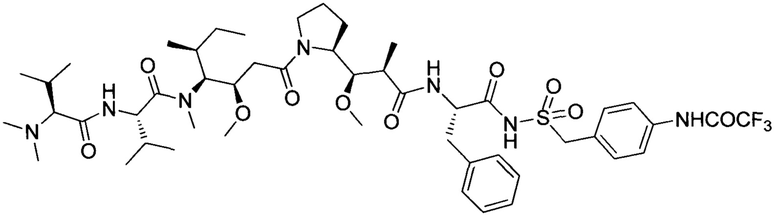
Указанное в заголовке соединение получали из Соединения 12 и диметилвалина по общему способу 6. C49H74F3N7O10S расч. m/z=1009,52, найдено [М+Н]+=1011,0.
Пример 1.29: (S)-N-((3R,4S,5S)-l-((S)-2-((1R,2R)-3-((S)-1-(4-Аминофенилметилсульфонамидо)-1-оксо-3-фенилпропан-2-иламино)-1-метокси-2-метил-3-оксопропил)пирролидин-1-ил)-3-метокси-5-метил-1-оксогептан-4-ил)-2-((S)-2-(диметиламино)-3-метилбутанамидо)-N,3-диметилбутанамид (Соединение 14).
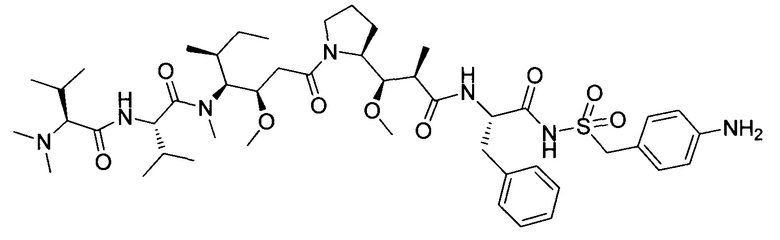
Указанное в заголовке соединение получали из Соединения 13 по общему способу 4. C47H75N7O9S расч. m/z=913,53, найдено [M-C7H8O2S+Na]+=768,1 (хинон-метидная фрагментация и потеря 4-аминобензилсульфоната).
Пример 1.30: Общий способ 10 - гидрирование.
В раствор образца, подлежащего восстановлению, в метаноле, этаноле, уксусной кислоте, этилацетате, их смеси или в другом подходящем растворителе помещали магнитную мешалку. Колбу, содержащую перемешанный раствор, оснащали двухходовой соединительной вставкой для подачи газа и вакуумировали при пониженном давлении, и заполняли азотом. Этот процесс повторяли 3 раза. Добавляли 10% Pd/C в виде твердого вещества или суспензии, обычно с содержанием 10 мол. % палладия относительно реагента. Емкость снова вакуумировали при пониженном давлении и заполняли водородом из баллона. Завершение реакции контролировали по ВЭЖХ-МС, и после завершения отфильтровывали через слой целита на фильтровальной воронке. Фильтрат концентрировали при пониженном давлении и использовали в таком виде или очищали хроматографией на силикагеле или препаративной ВЭЖХ.
Пример 1.31: Перфторфенил-3-(2-(2-(2-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)этокси)этокси)этокси)пропаноат.
К перемешанному раствору 3-(2-(2-(2-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)этокси)этокси)этокси)пропановой кислоты (Пример 1.13) (2,28 г, 7,57 ммоль) в дихлорметане (100 мл) добавляли 1-этил-3-(3-диметиламинопропил)карбодиимида гидрохлорид (1,59 г, 1,1 экв.) и пентафторфенол (1,53 г, 1,1 экв.). Реакционную смесь перемешивали в течение ночи, и в это время ВЭЖХ-МС показал отсутствие остаточного исходного материала (Rt=5,30 мин., 490,4 m/z, полный градиент). Неочищенную реакционную смесь разбавляли насыщенным раствором бикарбоната натрия (~20 мл) и переносили смесь в делительную воронку. Органическую фазу промывали насыщенным солевым раствором (~50 мл), сушили над MgSO4, фильтровали и концентрировали с получением светло-желтого маслянистого вещества. Маслянистое вещество растворяли в минимальном количестве дихлорметана и загружали на 100 г силикагелевую колонку для очистки (Isolera, 10-100% EtOAc в гексанах за 12 объемов колонки). Фракции, содержащие требуемое вещество, объединяли и концентрировали при пониженном давлении с получением бесцветного маслянистого вещества (3,32 г, 94%).
Пример 1.32: (3R,4S,5S)-трет-Бутил-4-((S)-2-(бензилоксикарбониламино)-N,3-диметилбутанамидо)-3-метокси-5-метилгептаноат, Cbz-Val-Dil-OtBu.
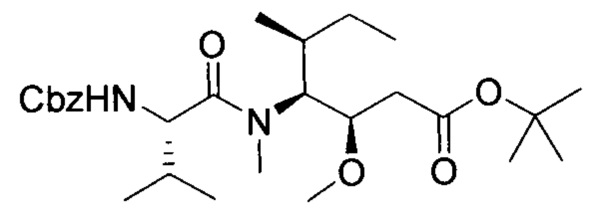
Указанное в заголовке соединение получали из имеющихся в продаже Cbz-Val-OH и H-Dil-OtBu⋅HCl по общему способу 6.
1H ЯМР (400 МГц, хлороформ-d) δ 7,40-7,30 (м, 5Н), 5,54 (д, J=9,2 Гц, 1Н), 5,12 (с, 2Н), 4,73 (с, 1Н), 4,54 (дд, J=9,2, 5,6 Гц, 1Н), 3,91 (с, 1Н), 3,37 (с, 3Н), 2,98 (с, 3Н), 2,47 (д, J=16,5 Гц, 1Н), 2,33 (дд, J=15,6, 9,1 Гц, 1Н), 2,07-1,96 (м, 1Н), 1,84-1,60 (м, 1Н), 1,48 (с, 9Н), 1,45-1,32 (м, 2Н), 1,04 (д, J=6,8 Гц, 3Н), 0,98 (д, J=6,6 Гц, 3Н), 0,94 (д, J=6,8 Гц, 3Н), 0,86 (т, J=7,4 Гц, 3Н). C27H44N2O6 расч. m/z=492,32, найдено [М+Н]+=515,8 [M+Na]+. Rf=0,78 (50% EtOAc/гексан).
Пример 1.33: (3R,4S,5S)-4-((S)-2-(((Бензилокси)карбонил)амино)-N,3-диметилбутанамидо)-3-метокси-5-метилгептановая кислота, Cbz-Val-Dil-ОН.
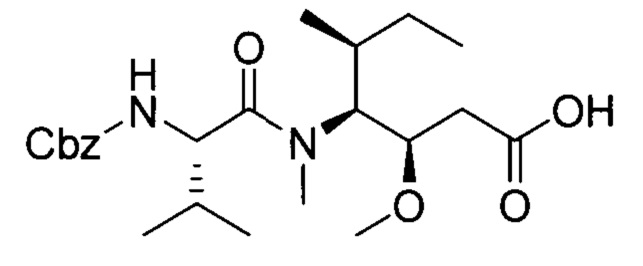
Указанное в заголовке соединение получали из Cbz-Val-Dil-OtBu (Пример 1.32) по общему способу 9. C23H36N2O6 расч. m/z=436,26, найдено [M+Na]+ 459,81. 1Н NMR (400 МГц, метанол-d4) δ 7,47-7,22 (м, 5Н), 5,21-4,99 (м, 2Н), 4,83-4,54 (м, 1Н), 4,39 (д, J=8,0 Гц, 1Н), 3,96 (с, 1Н), 3,43-3,33 (с, 3Н), 3,07 (с, 3Н), 2,63 (дд, J=15,9, 2,9 Гц, 1Н), 2,38 (дд, J=15,8, 9,3 Гц, 1Н), 2,15-1,95 (м, 1Н), 1,83 (с, 1Н), 1,52-1,30 (м, 1Н), 1,07-0,91 (м, 9Н), 0,85 (т, J=7,4 Гц, 3Н).
Пример 1.34: (3R,4S,5S)-трет-Бутил-4-((S)-2-амино-N,3-диметилбутанамидо)-3-метокси-5-метилгептаноат, H-Val-Dil-OtBu.

Указанное в заголовке соединение получали из Cbz-Val-Dil-OtBu (438 мг, 0,889 ммоль) по общему способу 10 с получением требуемого продукта (288 мг, 90%) в виде прозрачной пленки. 1H ЯМР (400 МГц, хлороформ-d) δ 4,76 (с, 1Н), 3,92 (с, 1Н), 3,50 (д, J=5,1 Гц, 1Н), 3,38 (с, 3Н), 2,92 (с, 3Н), 2,48 (дц, J=15,7, 3,1 Гц, 1Н), 2,35 (дд, J=15,6, 8,8 Гц, 1Н), 1,93 (дк, J=10,9, 6,5 Гц, 1Н), 1,82-1,60 (м, 1Н), 1,51-1,46 (м, 11Н), 1,05-0,85 (м, 12Н). C19H38N2O4 расч. m/z=358,28, найдено [M+Na]+=381,8.
Пример 1.35: (3R,4S,5S)-трет-Бутил-4-((S)-2-((S)-2-(диметиламино)-3-метилбутанамидо)-N,3-диметилбутанамидо)-3-метокси-5-метилгептаноат, Dov-Val-Dil-OtBu.
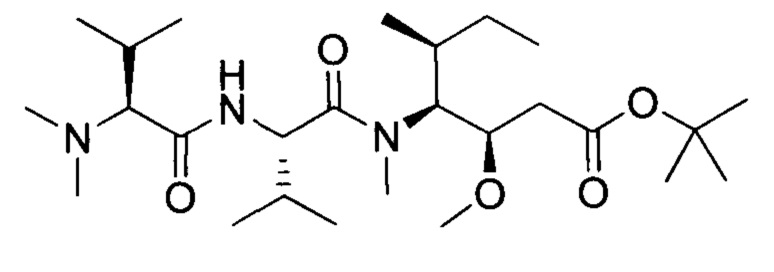
Указанное в заголовке соединение получали из H-Val-Dil-OtBu и N,N-диметилвалина по общему способу 6.
1H ЯМР (400 МГц, хлороформ-d) δ 7,09 (д, J=8,8 Гц, 1Н), 4,79 (т, J=7,6 Гц, 1Н), 4,00-3,81 (м, 1Н), 3,75 (с, 1Н), 3,37 (с, 3H), 3,26 (с, 1Н), 3,00 (с, 3H), 2,74 (с, 6Н), 2,49 (д, J=15,9 Гц, 1Н), 2,38-2,20 (м, 2Н), 2,13-2,05 (м, 1Н), 1,81-1,62 (м, 1Н), 1,51-1,43 (м, 10Н), 1,33 (с, 1Н), 1,18-0,89 (м, 15Н), 0,83 (т, J=7,2 Гц, 3Н). C26H51N3O5 расч. m/z=485,38, найдено [M+Na]+=508,9. Rf=0,36 (5% МеОН/CH2Cl2).
Пример 1.36: (3R,4S,5S)-трет-Бутил-4-((S)-2-((S)-2-(Диметиламино)-3-метилбутанамидо)-N,3-диметилбутанамидо)-3-метокси-5-метилгептановая кислота, Dov-Val-Dil-OH.

Указанное в заголовке соединение получали из Dov-Val-Dil-OtBu по общему способу 9.
1H ЯМР (400 МГц, хлороформ-d) δ 4,98 (т, J=10,0 Гц, 1Н), 4,65 (дд, J=9,3, 3,1 Гц, 1Н), 4,08 (д, J=10,6 Гц, 1Н), 3,61-3,53 (м, 1Н), 3,39 (с, 3Н), 3,24 (с, 3Н), 3,13 (с, 3Н), 2,93 (с, 3Н), 2,77 (дд, J=17,0, 9,8 Гц, 1Н), 2,66 (дд, J=17,3, 1,9 Гц, 1Н), 2,31-2,26 (м, 1Н), 2,07 (дт, J=10,8, 5,5 Гц, 1Н), 1,97-1,85 (м, 1Н), 1,29-1,24 (м, 1Н), 1,13 (д, J=6,7 Гц, 3Н), 1,08-1,01 (м, 6Н), 1,01-0,95 (м, 6Н), 0,90-0,81 (м, 1Н), 0,77 (т, J=6,9 Гц, 3Н) C22H43N3O5 расч. m/z=429,32, найдено [М+Н]+=430,8.
Пример 1.37: трет-Бутил-(5S,8S,11S,12R)-11-((S)-втор-бутил)-1-(9H-флуорен-9-ил)-5,8-диизопропил-12-метокси-4,10-диметил-3,6,9-триоксо-2-окса-4,7,10-триазатетрадекан-14-оат,Fmoc-(Me)Val-Val-Dil-OtBu.
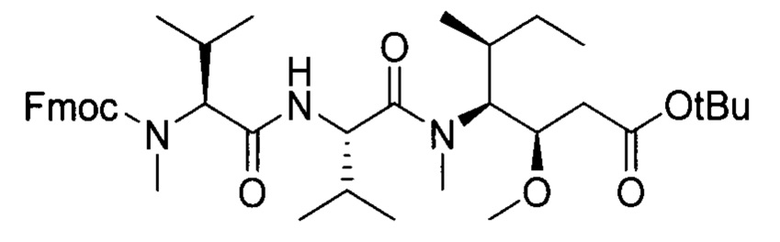
Указанное в заголовке соединение получали из Fmoc-(Ме)-(L)-валин-ОН и H-Val-Dil-OtBu по общему способу 6. C40H59N3O7 расч. m/z=693,44, найдено [М+Н]+ 694,98.
Пример 1.38: (5S,8S,11S,12R)-11-((S)-втор-Бутил)-1-(9H-флуорен-9-ил)-5,8-диизопропил-12-метокси-4,10-диметил-3,6,9-триоксо-2-окса-4,7,10-триазатетрадекан-14-овая кислота, Fmoc-(Me)Val-Val-Dil-OH.

Указанное в заголовке соединение получали из Fmoc-(Me)Val-Val-Dil-OtBu по общему способу 9. C36H51N3O7 расч. m/z=637,37, найдено [М+Н]+ 638,91.
Пример 1.39: 2,2,2-Трифтор-N-(4-сульфамоилфенил)ацетамид.
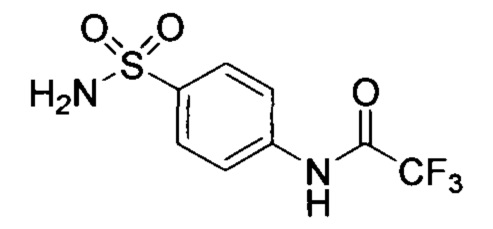
К перемешанной суспензии сульфаниламида (1,72 г, 10 ммоль) в диоксане (20 мл) добавляли трифторуксусный ангидрид (1,69 мл, 1,2 экв.). Твердые вещества медленно растворялись с образованием однородного раствора и через короткий интервал времени образовался новый набор твердых веществ. Реакционную смесь разбавляли диэтиловым эфиром (100 мл) и отфильтровывали полученную суспензию на воронке Бюхнера. Твердое вещество собирали и сушили при пониженном давлении с получением указанного в заголовке соединения с достаточной чистотой для дальнейшего использования (2,60 г, 97%).
Пример 1.40: (2R,3R)-3-Метокси-2-метил-3-((S)-пирролидин-2-ил)-N-(4-(2,2,2-трифторацетамидо)фенилсульфонил)пропанамид.

Указанное в заголовке соединение получали из имеющегося в продаже Boc-Dap-ОН и 2,2,2-трифтор-N-(4-сульфамоилфенил)амида по общим способам 2 и 9.
1H ЯМР (400 МГц, метанол-d4) δ 8,06 (д, J=8,9 Гц, 2Н), 7,92 (д, J=8,9 Гц, 2Н), 3,69 (дд, J=6,6, 3,0 Гц, 1Н), 3,48 (с, 3Н), 3,51-3,39 (м, 1Н), 3,33-3,14 (м, 2Н), 2,64 (п, J=7,0 Гц, 1Н), 2,06-1,68 (м, 4Н), 1,19 (д, J=7,1 Гц, 3Н). C17H22F3N3O5S расч. m/z=437,1, найдено [М+Н]+=438,6.
Пример 1.41: Бензил-((S)-1-(((3R,4S,5S)-3-метокси-1-((S)-2-((1R,2R)-1-метокси-2-метил-3-оксо-3-((4-(2,2,2-трифторацетамидо)фенил)сульфонамидо)пропил)пирролидин-1-ил)-5-метил-1-оксогептан-4-ил)(метил)амино)-3-метил-1-оксобутан-2-ил)карбамат.

Указанное в заголовке соединение получали из Cbz-Val-Dil-OH и продукта примера 1.40 по общему способу 2. C40H56F3N5O10S расч. m/z=855,37, найдено [М+Н]+ 857,07.
Пример 1.42: (S)-2-Амино-N-((3R,4S,5S)-3-метокси-1-((S)-2-((1R,2R)-1-метокси-2-метил-3-оксо-3-((4-(2,2,2-трифторацетамидо)фенил)сульфонамидо)пропил)пирролидин-1-ил)-5-метил-1-оксогептан-4-ил)-N,3-диметилбутанамид.
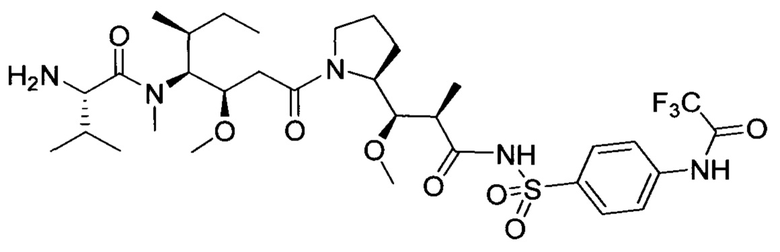
Указанное в заголовке соединение получали из продукта примера 1.41 по общему способу 10. C32H50F3N5O8S расч. m/z=721,33, найдено [М+Н]+ 722,70.
Пример 1.43: трет-Бутил-(3R,4S,5S)-4-((S)-2-((R)-1-изопропилпиперидин-2-карбоксамидо)-N,3-диметилбутанамидо)-3-метокси-5-метилгептаноат.

Указанное в заголовке соединение получали из (R)-1-изопропилпиперидин-2-карбоновой кислоты и H-Val-Dil-OtBu по общему способу 6. C28H53N3O5 расч. m/z=511,40, найдено [М+Н]+ 512,77.
Пример 1.44: (3R,4S,5S)-4-((S)-2-((R)-1-Изопропилпиперидин-2-карбоксамидо)-N,3-диметилбутанамидо)-3-метокси-5-метилгептановая кислота.

Указанное в заголовке соединение получали из трет-бутильного продукта примера 1.43 по общему способу 9. C24H45N3O5 расч. m/z=455,34, найдено [М+Н]+ 456,70.
Пример 1.45: (R)-1-Изопропил-N-((S)-1-(((3R,4S,5S)-3-метокси-1-((S)-2-((1R,2R)-1-метокси-2-метил-3-оксо-3-((4-(2,2,2-трифторацетамидо)фенил)сульфонамидо)пропил)пирролидин-1-ил)-5-метил-1-оксогептан-4-ил)(метил)амино)-3-метил-1-оксобутан-2-ил)пиперидин-2-карбоксамид (Соединение 15).
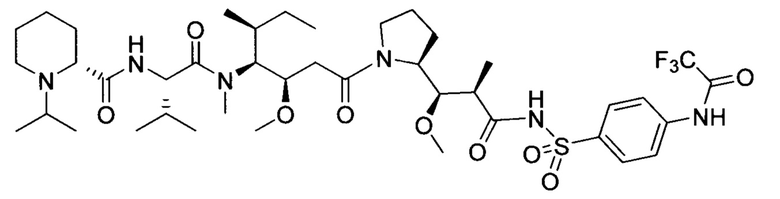
Указанное в заголовке соединение получали из продукта примера 1.40 и продукта примера 1.44 по общему способу 6. C41H65F3N6O9S расч. m/z=874,45, найдено [М+Н]+ 876,0.
Пример 1.46: (R)-N-((S)-1-(((3R,4S,5S)-1-((S)-2-((1R,2R)-3-((4-Аминофенил)сульфонамидо)-1-метокси-2-метил-3-оксопропил)пирролидин-1-ил)-3-метокси-5-метил-1-оксогептан-4-ил)(метил)амино)-3-метил-1-оксобутан-2-ил)-1-изопропилпиперидин-2-карбоксамид (Соединение 16).

Указанное в заголовке соединение получали из Соединения 15 по общему способу 4. C39H66N6O8S расч. m/z=778,47, найдено [М+Н]+ 780,06.
Пример 1.47: трет-Бутил-(1-(((S)-1-(((3R,4S,5S)-3-метокси-1-((S)-2-((1R,2R)-1-метокси-2-метил-3-оксо-3-((4-(2,2,2-трифторацетамидо)фенил)сульфонамидо)пропил)пирролидин-1-ил)-5-метил-1-оксогептан-4-ил)(метил)амино)-3-метил-1-оксобутан-2-ил)амино)-2-метил-1-оксопропан-2-ил)карбамат.

Указанное в заголовке соединение получали из продукта примера 1.42 и приобретенной в продаже α-(Вос-амино)изомасляной кислоты по общему способу 6. C41H65F3N6O11S расч. m/z=906,44, найдено [М+Н]+ 907,80.
Пример 1.48: трет-Бутил-(1-(((S)-1-(((3R,4S,5S)-1-((S)-2-((1R,2R)-3-((4-аминофенил)сульфонамидо)-1-метокси-2-метил-3-оксопропил)пирролидин-1-ил)-3-метокси-5-метил-1-оксогептан-4-ил)(метил)амино)-3-метил-1-оксобутан-2-ил)амино)-2-метил-1-оксопропан-2-ил)карбамат.

Указанное в заголовке соединение получали из продукта примера 1.47 по общему способу 4. C39H66N6O10S расч. m/z=810,46, найдено [М+Н]+ 811,84.
Пример 1.49: (S)-2-(2-Амино-2-метилпропанамидо)-N-((3R,4S,5S)-1-((S)-2-((1R,2R)-3-((4-аминофенил)сульфонамидо)-1-метокси-2-метил-3-оксопропил)пирролидин-1-ил)-3-метокси-5-метил-1-оксогептан-4-ил)-N,3-диметилбутанамида (Соединение 17).

Указанное в заголовке соединение получали из продукта примера 1.48 по общему способу 9. C34H58N6O8S расч. m/z=710,40, найдено [М+Н]+ 711,77.
Пример 1.50 трет-Бутил-(6S,9S,12S,13R)-12-((S)-втор-бутил)-9-изопропил-13-метокси-2,2,5,11-тетраметил-4,7,10-триоксо-6-(2-фенилпропан-2-ил)-3-окса-5,8,11-триазапентадекан-15-оат.

Указанное в заголовке соединение получали из (S)-2-((трет-бутоксикарбонил)(метил)амино)-3-метил-3-фенилбутановой кислоты (полученной в соответствии с WO 2015095953 А1) и H-Val-Dil-OtBu по общему способу 6. C36H61N3O7 расч. m/z=647,45, найдено [М+Н]+ 649,12.
Пример 1.51: (3R,4S,5S)-4-((S)-N,3-Диметил-2-((S)-3-метил-2-(метиламино)-3-фенилбутанамидо)бутанамидо)-3-метокси-5-метилгептановая кислота.

Указанное в заголовке соединение получали из продукта примера 1.50 по общему способу 9. C27H45N3O5 расч. m/z=491,34, найдено [М+Н]+ 492,73.
Пример 1.52: трет-Бутил-(1-(((S)-1-(((3R,4S,5S)-3-метокси-1-((S)-2-((1R,2R)-1-метокси-2-метил-3-оксо-3-((4-(2,2,2-трифторацетамидо)фенил)сульфонамидо)пропил)пирролидин-1-ил)-5-метил-1-оксогептан-4-ил)(метил)амино)-3-метил-1-оксобутан-2-ил)амино)-2-метил-1-оксопропан-2-ил)карбамат (Соединение 18).

Указанное в заголовке соединение получали из продукта примера 1.51 и продукта примера 1.42 по общему способу 6. C44H65F3N6O9S расч. m/z=910,45, найдено [М+Н]+ 911,91.
Пример 1.53 (S)-N-((3R,4S,5S)-1-((S)-2-((1R,2R)-3-((4-Аминофенил)сульфонамидо)-1-метокси-2-метил-3-оксопропил)пирролоидин-1-ил)-3-метокси-5-метил-1-оксогептан-4-ил)-N,3-диметил-2-((S)-3-метил-2-(метиламино)-3-фенилбутанамидо)бутанамид (Соединение 19).

Указанное в заголовке соединение получали из продукта примера 1.52 по общему способу 4. C42H66N6O8S расч. m/z=814,47, найдено [М+Н]+ 816,08.
Пример 1.54: трет-Бутил-((S)-1-(((S)-1-(((3R,4S,5S)-3-метокси-1-((S)-2-((1R,2R)-1-метокси-2-метил-3-оксо-3-((4-(2,2,2-трифторацетамидо)фенил)сульфонамидо)пропил)пирролидин-1-ил)-5-метил-1-оксогептан-4-ил)(метил)амино)-3-метил-1-оксобутан-2-ил)амино)-3-метил-1-оксобутан-2-ил)(метил)карбамат.

Указанное в заголовке соединение получали из продукта примера 1.42 и приобретенного в продаже Вос-(Ме)-(L)-валин-ОН по общему способу 6. C43H69F3N6O11S расч. m/z=934,47, найдено [М+Н]+ 935,87.
Пример 1.55: трет-Бутил-((S)-1-(((S)-1-(((3R,4S,5S)-1-((S)-2-((1R,2R)-3-((4-аминофенил)сульфонамидо)-1-метокси-2-метил-3-оксопропил)пирролидин-1-ил)-3-метокси-5-метил-1-оксогептан-4-ил)(метил)амино)-3-метил-1-оксобутан-2-ил)амино)-3-метил-1-оксобутан-2-ил)(метил)карбамат.

Указанное в заголовке соединение получали из продукта примера 1.54 по общему способу 4. C41H70N6O10S расч. m/z=838,49, найдено [М+H]+ 839,85.
Пример 1.56: (S)-N-((3R,4S,5S)-1-((S)-2-((1R,2R)-3-((4-Аминофенил)сульфонамидо)-1-метокси-2-метил-3-оксопропил)пирролидин-1-ил)-3-метокси-5-метил-1-оксогептан-4-ил)-N,3-диметил-2-((S)-3-метил-2-(метиламино)бутанамидо)бутанамид (Соединение 20).

Указанное в заголовке соединение получали из продукта примера 1.54 по общему способу 9. C36H62N6O5S расч. m/z=738,43, найдено [М+Н]+ 739,84.
Пример 1.57: 2,2,2-Трифтор-N-(4-(сульфамоилметил)фенил)ацетамид.

Указанное в заголовке соединение получали в соответствии с WO 2015095953 А1.
Пример 1.58: 2,2,2-Трифтор-N-(4-сульфамоилбензил)ацетамид.

Указанное в заголовке соединение получали в соответствии с WO 2015095953 А1.
Пример 1.59: трет-Бутил-(S)-2-((1R,2R)-1-метокси-2-метил-3-оксо-3-((4-((2,2,2-трифторацетамидо)метил)фенил)сульфонамидо)пропил)пирролидин-1-карбоксилат.
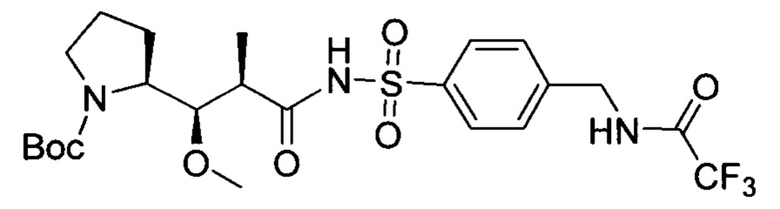
Указанное в заголовке соединение получали из приобретенного в продаже Вос-долапролин-ОН и 2,2,2-трифтор-N-(4-сульфамоилбензил)ацетамида по общему способу 2. C23H32F3N3O7S расч. m/z=551,19, найдено [M+Na]+ 574,92.
Пример 1.60: (2R,3R)-3-Метокси-2-метил-3-((S)-пирролидин-2-ил)-N-((4-((2,2,2-трифторацетамидо)метил)фенил)сульфонил)пропанамид.
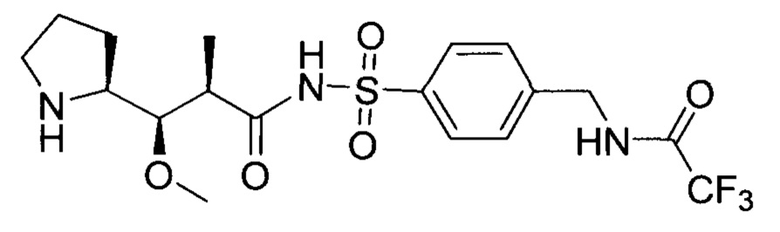
Указанное в заголовке соединение получали из продукта примера 1.59 по общему способу 9. C18H24F3N3O5S расч. m/z=451,14, найдено [М+Н]+ 452,71.
Пример 1.61: (S)-2-((S)-2-(Диметиламино)-3-метилбутанамидо)-N-((3R,4S,5S)-3-метокси-1-((S)-2-((1R,2R)-1-метокси-2-метил-3-оксо-3-((4-((2,2,2-трифторацетамидо)метил)фенил)сульфонамидо)пропил)пирролидин-1-ил)-5-метил-1-оксогептан-4-ил)-N,3-диметилбутанамид (Соединение 21).

Указанное в заголовке соединение получали из Dov-Val-Dil-OH (Пример 1.36) и продукта примера 1.60 по общему способу 6. C40H65F3N6O9S расч. m/z=862,45, найдено [М+Н]+ 863,80.
Пример 1.62: (S)-N-((3R,4S,5S)-1-((S)-2-((1R,2R)-3-((4-(Аминометил)фенил)сульфонамидо)-1-метокси-2-метил-3-оксопропил)пирролидин-1-ил)-3-метокси-5-метил-1-оксогептан-4-ил)-2-((S)-2-(диметиламино)-3-метилбутанамидо)-N,3-диметилбутанамид (Соединение 22).

Указанное в заголовке соединение получали из Соединения 51 по общему способу 4. C38H66N6O8S расч. m/z=766,47, найдено [М+Н]+ 767,85.
Пример 1.63: трет-Бутил-(S)-(1-оксо-3-фенил-1-((4-((2,2,2-трифторацетамидо)метил)фенил)сульфонамидо)пропан-2-ил)карбамат (Соединение 63)
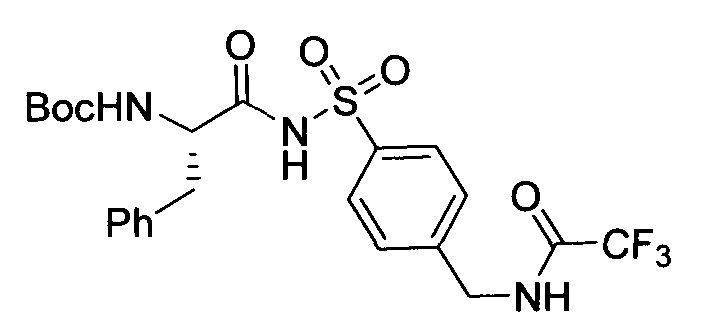
Указанное в заголовке соединение получали из Boc-(L)-Phe-OH и 2,2,2-трифтор-N-(4-сульфамоилбензил)ацетамида (Пример 1.58) по общему способу 2. C23H26F3N3O6S расч. m/z=529,15, найдено [M+Na]+552,52.
Пример 1.64: (S)-2-Амино-3-фенил-N-((4-((2,2,2-трифторацетамидо)метил)фенил)сульфонил)пропанамид.

Указанное в заголовке соединение получали из продукта примера 1.63 по общему способу 9. C18H18F3N3O4S расч. m/z=429,10, найдено [М+Н]+ 430,51. 1H ЯМР (400 МГц, метанол-d4) δ 8,05-7,98 (м, 2Н), 7,56 (д, J=8,2 Гц, 2Н), 7,33-7,22 (м, 3Н), 7,09 (д, J=6,7 Гц, 2Н), 4,59 (д, J=4,4 Гц, 2Н), 4,06 (т, J=6,8 Гц, 1Н), 3,15 (дд, J=14,1, 6,3 Гц, 1Н), 3,03 (дд, J=14,2, 7,4 Гц, 1Н).
Пример 1.65: трет-Бутил-(S)-2-((1R,2R)-1-метокси-2-метил-3-оксо-3-(((S)-1-оксо-3-фенил-1-((4-((2,2,2-трифторацетамидо)метил)фенил)сульфонамидо)пропан-2-ил)амино)пропил)пирролидин-1-карбоксилат.

Указанное в заголовке соединение получали из имеющегося в продаже Вос-долапролин-ОН и продукта примера 1.64 по общему способу 6. C32H41F3N4O8S расч. m/z=698,26, найдено [M+Na]+ 721,62.
Пример 1.66: (2R,3R)-3-Метокси-2-метил-N-((S)-1-оксо-3-фенил-1-((4-((2,2,2-трифторацетамидо)метил)фенил)сульфонамидо)пропан-2-ил)-3-((S)-пирролидин-2-ил)пропанамид.

Указанное в заголовке соединение получали из продукта примера 1.65 по общему способу 9. C27H33F3N4O6S расч. m/z=598,21, найдено [М+Н]+ 599,62.
Пример 1.67: (S)-2-((S)-2-(Диметиламино)-3-метилбутанамидо)-N-((3R,4S,5S)-3-метокси-1-((S)-2-((1R,2R)-1-метокси-2-метил-3-оксо-3-(((S)-1-оксо-3-фенил-1-((4-((2,2,2-трифторацетамидо)метил)фенил)сульфонамидо)пропан-2-ил)амино)пропил)пирролидин-1-ил)-5-метил-1-оксогептан-4-ил)-N,3-диметилбутанамид (Соединение 23).

Указанное в заголовке соединение получали из Dov-Val-Dil-OH (Пример 1.36) и продукта примера 1.66 по общему способу 6. C49H74F3N7O10S расч. m/z=1009,52, найдено [М+Н]+ 1011,04.
Пример 1.68: (S)-N-((3R,4S,5S)-1-((S)-2-((1R,2R)-3-(((S)-1-((4-(Аминометил)фенил)сульфонамидо)-1-оксо-3-фенилпропан-2-ил)амино)-1-метокси-2-метил-3-оксопропил)пирролидин-1-ил)-3-метокси-5-метил-1-оксогептан-4-ил)-2-((S)-2-(диметиламино)-3-метилбутанамидо)-N,3-диметилбутанамид (Соединение 24).

Указанное в заголовке соединение получали из продукта примера 1.67 по общему способу 4. C47H75N7O9S расч. m/z=913,53, найдено [М+Н]+ 915,09.
Пример 1.69: 2,2,2-Трифтор-N-(4-(сульфамоилметил)бензил)ацетамид.

Указанное в заголовке соединение получали в соответствии с WO 2015095953 А1.
Пример 1.70: трет-Бутил-(S)-2-((1R,2R)-1-метокси-2-метил-3-оксо-3-(((4-((2,2,2-трифторацетамидо)метил)фенил)метил)сульфонамидо)пропил)пирролидин-1-карбоксилат.

Указанное в заголовке соединение получали из приобретенного в продаже Вос-долапролин-ОН и 2,2,2-трифтор-N-(4-(сульфамоилметил)бензил)ацетамида (Пример 1.69) по общему способу 2. C24H34F3N3O7S расч. m/z=565,21, найдено [M+Na]+ 588,75.
Пример 1.71: (2R,3R)-3-Метокси-2-метил-3-((S)-пирролидин-2-ил)-N-((4-((2,2,2-трифторацетамидо)метил)бензил)сульфонил)пропанамид.
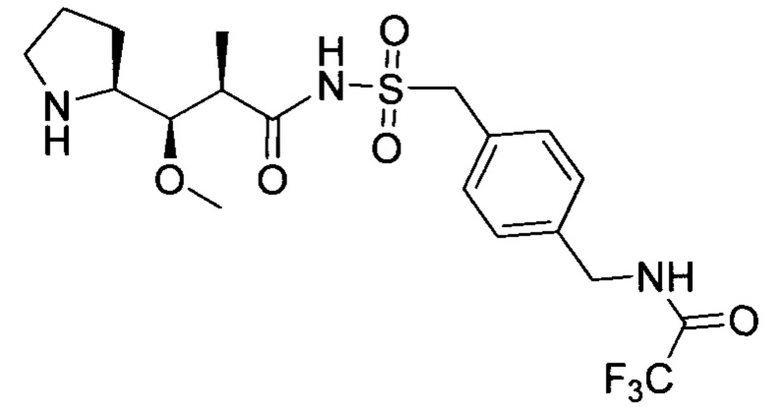
Указанное в заголовке соединение получали из продукта примера 1.69 по общему способу 9. C19H26F3N3O5S расч. m/z=465,15, найдено [М+Н]+ 466,77.
Пример 1.72: (S)-2-((S)-2-(Диметиламино)-3-метилбутанамидо)-N-((3R,4S,5S)-3-метокси-1-((S)-2-((1R,2R)-1-метокси-2-метил-3-оксо-3-(((4-((2,2,2-трифторацетамидо)метил)фенил)метил)сульфонамидо)пропил)пирролидин-1-ил)-5-метил-1-оксогептан-4-ил)-N,3-диметилбутанамид (Соединение 25).

Указанное в заголовке соединение получали из продукта примера 1.36 и продукта примера 1.71 по общему способу 6. C41H67F3N5O9S расч. m/z=876,46, найдено [М+Н]+ 878,22.
Пример 1.73: (S)-N-((3R,4S,5S)-1-((S)-2-((1R,2R)-3-(((4-(Аминометил)фенил)метил)сульфонамидо)-1-метокси-2-метил-3-оксопропил)пирролидин-1-ил)-3-метокси-5-метил-1-оксогептан-4-ил)-2-((S)-2-(диметиламино)-3-метилбутанамидо)-N,3-диметилбутанамид (Соединение 26).

Указанное в заголовке соединение получали из продукта примера 1.72 по общему способу 4. C39H68N6O8S расч. m/z=780,48, найдено [М+Н]+ 782,20.
Пример 1.74: трет-Бутил-(S)-(1-оксо-3-фенил-1-(((4-((2,2,2-трифторацетамидо)метил)фенил)метил)сульфонамидо)пропан-2-ил)карбамат.

Указанное в заголовке соединение получали из Boc-(Z)-Phe-OH и 2,2,2-трифтор-N-(4-(сульфамоилметил)бензил)ацетамида (Пример 1.69) по общему способу 2. C24H28F3N3O6S расч. m/z=543,17, найдено [M+Na]+ 566,78.
Пример 1.75: (S)-2-Амино-3-фенил-N-((4-((2,2,2-трифторацетамидо)метил)бензил)сульфонил)пропанамид.

Указанное в заголовке соединение получали из продукта примера 1.74 по общему способу 9. C19H20F3N3O4S расч. m/z=443,11, найдено [М+Н]+ 444,55. 1H ЯМР (400 МГц, метанол-d4) δ 7,46-7,27 (м, 9Н), 4,51 (с, 2Н), 4,46 (с, 2Н), 3,84 (дд, J=9,3, 4,3 Гц, 1Н), 3,29 (дд, 1Н), 2,95 (дд, J=14,5, 9,4 Гц, 1Н).
Пример 1.76: (S)-2-((1R,2R)-1-Метокси-2-метил-3-оксо-3-(((S)-1-оксо-3-фенил-1-(((4-((2,2,2-трифторацетамидо)метил)фенил)метил)сульфонамидо)пропан-2-ил)амино)пропил)пирролидин-1-карбоксилат.
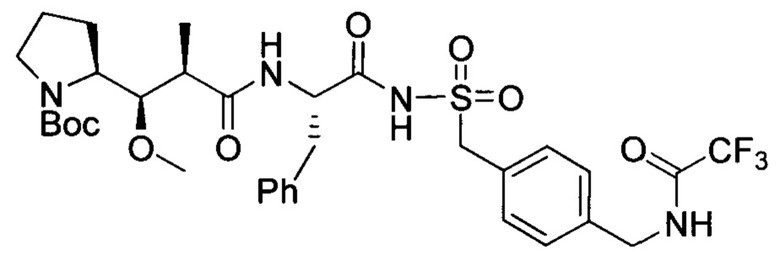
Указанное в заголовке соединение получали из имеющегося в продаже Вос-долапролин-ОН и продукта примера 1.75 по общему способу 6. C33H43F3N4O8S расч. m/z=712,28, найдено [М+Na]+ 735,65.
Пример 1.77: (2R,3R)-3-Метокси-2-метил-N-((S)-1-оксо-3-фенил-1-(((4-((2,2,2-трифторацетамидо)метил)фенил)метил)сульфонамидо)пропан-2-ил)-3-((S)-пирролидин-2-ил)пропанамид.
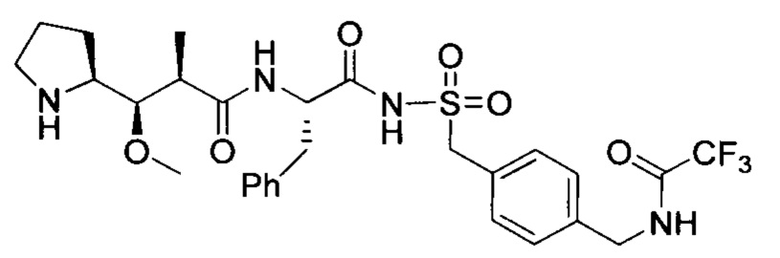
Указанное в заголовке соединение получали из продукта примера 1.76 по общему способу 9. C28H35F3N4O6S расч. m/z=612,22, найдено [М+H]+613,58.
Пример 1.78: (S)-2-((S)-2-(Диметиламино)-3-метилбутанамидо)-N-((3R,4S,5S)-3-метокси-1-((S)-2-((1R,2R)-1-метокси-2-метил-3-оксо-3-(((S)-1-оксо-3-фенил-1-(((4-((2,2,2-трифторацетамидо)метил)фенил)метил)сульфонамидо)пропан-2-ил)амино)пропил)пирролидин-1-ил)-5-метил-1-оксогептан-4-ил)-N,3-диметилбутанамид (Соединение 27).

Указанное в заголовке соединение получали из Dov-Val-Dil-OH (Пример 1.36) и продукта примера 1.77 по общим способам 9 и 6. C50H76F3N7O10S расч. m/z=1023,53, найдено [М+Н]+ 1024,94.
Пример 1.79: (S)-N-((3R,4S,5S)-1-((S)-2-((1R,2R)-3-(((S)-1-(((4-(Аминометил)фенил)метил)сульфонамидо)-1-оксо-3-фенилпропан-2-ил)амино)-1-метокси-2-метил-3-оксопропил)пирролидин-1-ил)-3-метокси-5-метил-1-оксогептан-4-ил)-2-((S)-2-(диметиламино)-3-метилбутанамидо)-N,3-диметилбутанамид
(Соединение 28)
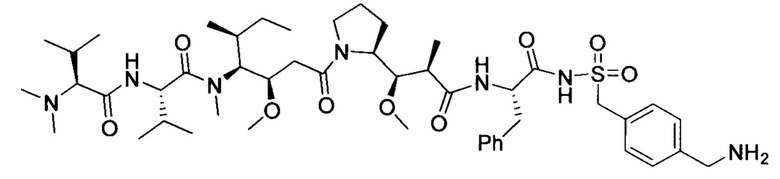
Указанное в заголовке соединение получали из продукта примера 1.78 по общему способу 4. C48H77N7O9S расч. m/z=927,55, найдено [М+H]+ 928,92.
Пример 1.80: 2,2,2-Трифтор-N-(1-(4-сульфамоилфенил)циклопропил)ацетамид.

Указанное в заголовке соединение получали в соответствии с WO 2015095953 А1.
Пример 1.81: (2R,3R)-3-метокси-2-метил-3-((S)-пирролидин-2-ил)-N-(4-(1-(2,2,2-трифторацетамидо)циклопропил)фенилсульфонил)пропанамид.

Указанное в заголовке соединение получали из приобретенного в продаже Вос-Dap-OH и 2,2,2-трифтор-N-(1-(4-сульфамоилфенил)циклопропил)ацетамида (Пример 1.80) по общим способам 2 и 9. 1H ЯМР (400 МГц, ДМСО-d6) δ 12,19 (с, 1Н), 10,32 (с, 1Н), 7,86 (д, J=8,6 Гц, 2Н), 7,35 (д, J=8,6 Гц, 2Н), 7,31 (с, 1Н), 3,58 (дд, J=5,7, 3,7 Гц, 1Н), 3,28 (с, 3Н), 3,11 (т, J=6,8 Гц, 2Н), 2,59 (дк, J=13,0, 6,5 Гц, 1Н), 1,90-1,68 (м, 3Н), 1,63-1,56 (м, 1Н), 1,44-1,35 (м, 4Н), 1,04 (д, J=7,0 Гц, 3Н). C20H26F3N3O5S расч. m/z=477,15, найдено [М+Н]+=478,6.
Пример 1.82: (S)-2-((S)-2-(Диметиламино)-3-метилбутанамидо)-N-((3R,4S,5S)-3-метокси-1-((S)-2-((1R,2R)-1-метокси-2-метил-3-оксо-3-(4-(1-(2,2,2-трифторацетамидо)циклопропил)фенилсульфонамидо)пропил)пирролидин-1-ил)-5-метил-1-оксогептан-4-ил)-N,3-диметилбутанамид (Соединение 29).

Указанное в заголовке соединение получали из Dov-Val-Dil-OH (Пример 1.36) и продукта примера 1.81 по общему способу 6. C42H67F3N6O9S рач. m/z=888,46, найдено [М+Н]+=889,3.
Пример 1.83: (S)-N-((3R,4S,5S)-1-((S)-2-((1R,2R)-3-(4-(1-Аминоциклопропил)фенилсульфонамидо)-1-метокси-2-метил-3-оксопропил)пирролидин-1-ил)-3-метокси-5-метил-1-оксогептан-4-ил)-2-((S)-2-(диметиламино)-3-метилбутанамидо)-N,3-диметилбутанамид (Соединение 30).

Указанное в заголовке соединение получали из продукта примера 1.82 по общему способу 4. C40H68N6O8S расч. m/z=792,48, найдено [M+Na]+=815,9.
Пример 1.84: (S)-2-Амино-3-фенил-N-(4-(1-(2,2,2-трифторацетамидо)циклопропил)фенилсульфонил)пропанамид.

Указанное в заголовке соединение получали из Boc-Phe-OH и 2,2,2-трифтор-N-(1-(4-сульфамоилфенил)циклопропил)ацетамида (Пример 1.80) по общим способам 2 и 9. 1H NMR (400 МГц, ДМСО-d6) δ 10,30 (с, 1Н), 7,87 (ш, 3Н), 7,79 (д, J=8,3 Гц, 2Н), 7,25 (д, J=8,2 Гц, 2Н), 7,23-7,16 (м, 3Н), 7.08 (дд, J=6,6, 2,9 Гц, 2Н), 3,78 (с, 1Н), 3,06 (дд, J=14,2, 5,3 Гц, 1Н), 2,93 (дд, J=14,1, 7,2 Гц, 1Н), 1,36 (дд, J=6,6, 3,0 Гц, 4Н). C20H20F3N3O4S расч. m/z=455,11, найдено [М+Н]+=456,6.
Пример 1.85: трет-Бутил-(S)-1-(((3R,4S,5S)-3-метокси-1-((S)-2-((1R,2R)-1-метокси-2-метил-3-оксо-3-((S)-1-оксо-3-фенил-1-(4-(1-(2,2,2-трифторацетамидо)циклопропил)фенилсульфонамидо)пропан-2-иламино)пропил)пирролидин-1-ил)-5-метил-1-оксогептан-4-ил)(метил)амино)-3-метил-1-оксобутан-2-илкарбамат.

Указанное в заголовке соединение получали из приобретенного в продаже Boc-Val-Dil-Dap-OH и продукта примера 1.84 по общему способу 2. C49H71F3N6O11S расч. m/z=1008,49, найдено [M+Na]+=1031,9.
Пример 1.86: (S)-2-((S)-2-(Диметиламино)-3-метилбутанамидо)-N-((3R,4S,5S)-3-метокси-1-((S)-2-((1R,2R)-1-метокси-2-метил-3-оксо-3-((S)-1-оксо-3-фенил-1-(4-(1-(2,2,2-трифторацетамидо)циклопропил)фенилсульфонамидо)пропан-2-иламино)пропил)пирролидин-1-ил)-5-метил-1-оксогептан-4-ил)-N,3-диметилбутанамид (Соединение 31).
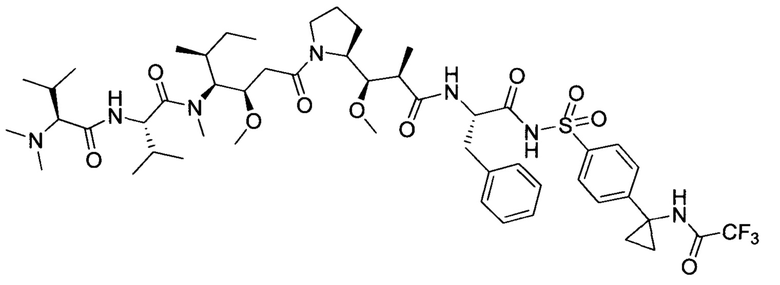
Указанное в заголовке соединение получали из продукта примера 1.85 и N,N-диметилвалина по общим способам 9 и 6. C51H76F3N7O10S расч. m/z=1035,53, найдено [М+Н]+=1036,5.
Пример 1.87: (S)-N-((3R,4S,5S)-1-((S)-2-((1R,2R)-3-((S)-1-(4-(1-Аминоциклопропил)фенилсульфонамидо)-1-оксо-3-фенилпропан-2-иламино)-1-метокси-2-метил-3-оксопропил)пирролидин-1-ил)-3-метокси-5-метил-1-оксогептан-4-ил)-2-((S)-2-(диметиламино)-3-метилбутанамидо)-N,3-диметилбутанамид (Соединение 32).

Указанное в заголовке соединение получали из продукта примера 1.86 по общему способу 4. C49H77N7O9S расч. m/z=939,55, найдено [М+Н]+=940,5.
Пример 1.88: трет-Бутил-(S)-2-((1R,2R)-1-метокси-2-метил-3-оксо-3-((фенилметил)сульфонамидо)пропил)пирролидин-1-карбоксилат.

Указанное в заголовке соединение получали из приобретенного в продаже Вос-долапролин-ОН и бензилсульфонамида по общему способу 2. C21H32N2O6S расч. m/z=440,20, найдено [М+Н]+ 463,71.
Пример 1.89: (2R,3R)-N-(Бензилсульфонил)-3-метокси-2-метил-3-((S)-пирролидин-2-ил)пропанамид.

Указанное в заголовке соединение получали из продукта примера 1.88 по общему способу 9. C16H24N2O4S расч. m/z=340,15, найдено [М+Н]+ 341,75.
Пример 1.90: (9H-Флуроен-9-ил)метил-((S)-1-(((S)-1-(((3R,4S,5S)-3-метокси-1-((S)-2-((1R,2R)-1-метокси-2-метил-3-оксо-3-((фенилметил)сульфонамидо)пропил)пирролидин-1-ил)-5-метил-1-оксогептан-4-ил)(метил)амино)-3-метил-1-оксобутан-2-ил)амино)-3-метил-1-оксобутан-2-ил)(метил)карбамат.
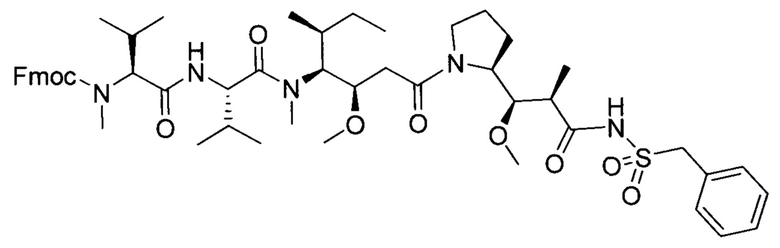
Указанное в заголовке соединение получали из продукта примера 1.89 и продукта примера 1.38 по общему способу 6. C52H73N5O10S расч. m/z=959,51, найдено [М+Н]+ 961,15.
Пример 1.91: (S)-N-((3R,4S,5S)-3-Метокси-1-((S)-2-((1R,2R)-1-метокси-2-метил-3-оксо-3-((фенилметил)сульфонамидо)пропил)пирролидин-1-ил)-5-метил-1-оксогептан-4-ил)-N,3-диметил-2-((S)-3-метил-2-(метиламино)бутанамидо)бутанамид (Соединение 33).

Указанное в заголовке соединение получали из продукта примера 1.90 по общему способу 7. C37H63N5O8S расч. m/z=737,44, найдено [М+H]+739,07.
Пример 1.92: трет-Бутил-(S)-2-((1R,2R)-1-метокси-3-((4-(метоксикарбонил)фенил)сульфонамидо)-2-метил-3-оксопропил)пирролидин-1-карбоксилат.

Указанное в заголовке соединение получали из метил-4-сульфамоилбензоата и Boc-Dap-OH по общему способу 2. C22H32N2O8S расч. m/z=484,19, найдено [M+Na]+=507,6.
Пример 1.93: Метил-4-(N-((2R,3R)-3-((S)-1-((3R,4S,5S)-4-((S)-2-((S)-2-(диметиламино)-3-метилбутанамидо)-N,3-диметилбутанамидо)-3-метокси-5-метилгептаноил)пирролидин-2-ил)-3-метокси-2-метилпропаноил)сульфамоил)бензоат (Соединение 34).

Указанное в заголовке соединение получали из продукта примера 1.92 и Dov-Val-Dil-OH (Пример 1.36) по общим способам 9 и 6. C22H32N2O8S расч. m/z=795,45, найдено [M+Na]+=818,8.
Пример 1.94: (S,E)-4-((S)-2-((трет-Бутоксикарбонил)амино)-N,3,3-триметилбутанамидо)-2,5-диметилгекс-2-еновая кислота (Соединение 83)

Указанное в заголовке соединение получали из этил-(S,E)-4-((S)-2-((трет-бутоксикарбонил)амино)-N,3,3-триметилбутанамидо)-2,5-диметилгекс-2-еноата по общему способу 4. C20H36N2O5 расч. m/z=384,26, найдено [M+H]+=407,71. 1H ЯМР (400 МГц, хлороформ-d) δ 6,80 (дд, J=9,6, 1,8 Гц, 1Н), 5,29 (д, J=10,1 Гц, 1Н), 5,16 (т, J=10,0 Гц, 1Н), 4,46 (д, J=10,1 Гц, 1Н), 3,03 (с, 3Н), 1,95 (д, J=1,5 Гц, 3Н), 1,44 (с, 9Н), 0,99 (с, 9Н), 0,92 (д, J=6,5 Гц, 3Н), 0,88 (д, J=6,5 Гц, 3Н).
Пример 1.95: Метил-(2R,3R)-3-метокси-2-метил-3-((S)-пирролидин-2-ил)пропаноат.

К перемешанному раствору Boc-Dap-OH (0,635 г, 2,21 ммоль) в дихлорметане/метаноле (95: 5, об./об., 10 мл) добавляли TMS-диазометан (2 М в гексанах, 1,35 мл, 1,2 экв.). Ход реакции контролировали, и после прекращения выделения газа анализ ВЭЖХ-МС показал полное превращение в сложный эфир. Оставшийся TMS-диазометан гасили добавлением уксусной кислоты и после полного исчезновения желтого цвета реакционную смесь концентрировали при пониженном давлении. Остаток растворяли в дихлорметане и удаляли защитную группу Вое в соответствии с общим способом 9. 1. Материал использовали «как есть» без дополнительной очистки. C10H19NO3 расч. m/z=201,14, найдено [М+Н]+=202,56. 1H ЯМР (400 МГц, метанол-d4) δ 3,88 (дд, J=6,0, 3,6 Гц, 1Н), 3,74 (с, 3Н), 3,73-3,62 (м, 1Н), 3,52 (с, 3Н), 3,32-3,26 (м, 2Н), 2,88-2,74 (м, 1Н), 2,15-1,87 (м, 4Н), 1,29 (д, J=7,2 Гц, 3Н).
Пример 1.96: Метил-(2R,3R)-3-((S)-1-((S,Е)-4-((S)-2-((трет-бутоксикарбонил)амино)-N,3,3-триметилбутанамидо)-2,5-диметилгекс-2-еноил)пирролидин-2-ил)-3-метокси-2-метилпропаноат.

Указанное в заголовке соединение получали из продукта примера 1.94 и продукта примера 1.95 по общему способу 6. C30H53N3O7 расч. m/z=567,39, найдено [M+Na]+=590,85. 1H ЯМР (400 МГц, хлороформ-d) δ 5,53 (дд, J=9,0, 1,8 Гц, 1Н), 5,18 (д, J=10,1 Гц, 1Н), 5,02 (дд, J=10,6, 8,8 Гц, 1Н), 4,37 (д, J=10,1 Гц, 1Н), 4,11-4,01 (м, 1Н), 3,92 (дд, J=8,2, 2,8 Гц, 1Н), 3,66 (с, 3Н), 3,51-3,42 (м, 1Н), 3,39 (с, 3H), 3,34-3,23 (м, 1Н), 2,89 (с, 3H), 2,54-2,43 (м, 1Н), 1,86 (с, 3Н), 1,95-1,77 (м, 3Н), 1,70-1,52 (м, 1Н), 1,36 (с, 9Н), 1,21 (д, J=6,9 Гц, 3H), 0,92 (с, 9Н), 0,88 (д, J=6,6 Гц, 3H), 0,78 (д, J=6,6 Гц 3H).
Пример 1.97: (2R,3R)-3-((S)-1-((S,E)-4-((S)-2-((трет-Бутоксикарбонил)амино)-N,3,3-триметилбутанамидо)-2,5-диметилгекс-2-еноил)пирролидин-2-ил)-3-метокси-2-метилпропановая кислота.

Указанное в заголовке соединение получали из продукта примера 1.96 по общему способу 4. 1. C29H51N3O7 расч. m/z=553,37, найдено [M+Na]+=576,81. 1H ЯМР (400 МГц, хлороформ-d) δ 5,64 (д, J=8,8 Гц, 1Н), 5,37 (д, J=10,1 Гц, 1Н), 5,05 (с, 1Н), 4,42 (д, J=10,1 Гц, 1Н), 4,23-4,17 (м, 1Н), 4,02 (дд, J=8,8, 2,5 Гц, 1Н), 3,53-3,46 (м, 1Н), 3,45 (с, 3H), 3,39-3,27 (м, 1Н), 2,93 (с, 3H), 2,51-2,36 (м, 1Н), 2,08-1,77 (м, 4Н), 1,90 (с, 3H), 1,73-1,60 (м, 1Н), 1,40 (с, 9Н), 1,25 (д, J=7,1 Гц, 3H), 0,95 (с, 9Н), 0,91 (д, J=6,5 Гц, 3H), 0,82 (д, J=6,5 Гц, 3Н).
Пример 1.98: трет-Бутил-((S)-1-(((S,E)-6-((S)-2-((1R,2R)-1-метокси-2-метил-3-оксо-3-((4-(2,2,2-трифторацетамидо)фенил)сульфонамидо)пропил)пирролидин-1-ил)-2,5-диметил-6-оксогекс-4-ен-3-ил)(метил)амино)-3,3-диметил-1-оксобутан-2-ил)карбамат.

Указанное в заголовке соединение получали из продукта примера 1.97 и продукта примера 1.39 по общему способу 2. C37H56F3N5O9S расч. m/z=803,38, найдено [M+Na]+=826,69. 1H ЯМР (400 МГц, хлороформ-d) δ 9,66 (с, 1Н), 8,03 (д, J=8,8 Гц, 2Н), 7,82 (д, J=8,8 Гц, 2Н), 5,62 (д, J=8,6 Гц, 1Н), 5,54 (д, J=10,0 Гц, 1Н), 5,10-4,98 (м, 1Н), 4,45 (д, J=10,1 Гц, 1Н), 4,01 (дд, J=7,2, 2,4 Гц, 1Н), 3,94-3,83 (м, 1Н), 3,48-3,43 (м, 1Н), 3,41 (с, 3H), 3,35-3,22 (м, 1Н), 2,95 (с, 3H), 2,66-2,55 (м, 1Н), 1,87 (с, 3H), 1,91-1,75 (м, 2Н), 1,67-1,53 (м, 2Н), 1,41 (с, 9Н), 1,14 (д, J=6,9 Гц, 3H), 0,96 (с, 9Н), 0,89 (д, J=6,4 Гц, 3H), 0,82 (д, J=6,5 Гц, 3Н).
Пример 1.99: (S)-2-Амино-N-((S,E)-6-((S)-2-((1R,2R)-1-метокси-2-метил-3-оксо-3-((4-(2,2,2-трифторацетамидо)фенил)сульфонамидо)пропил)пирролидин-1-ил)-2,5-диметил-6-оксогекс-4-ен-3-ил)-N,3,3-триметилбутанамид.

Указанное в заголовке соединение получали из продукта примера 1.98 по общему способу 9. 1. C32H48F3N5O7S расч. m/z=703,32, найдено [М+Н]+=704,68. 1H ЯМР (400 МГц, метанол-d4) δ 8,06 (д, J=8,5 Гц, 2Н), 7,90 (д, J=8,5 Гц, 2Н), 5,71 (дд, J=9,5, 1,9 Гц, 1Н), 5,10-5,00 (м, 2Н), 4,30 (с, 1Н), 3,85 (дд, J=8,1, 2,7 Гц, 1Н), 3,79-3,71 (м, 1Н), 3,55-3,48 (м, 1Н), 3,36 (с, 3H), 3,40-3,28 (м, 1Н), 3,00 (с, 3H), 2,52-2,39 (м, 1Н), 2,09-1,96 (м, 1Н), 1,91 (с, 3H), 1,95-1,83 (м, 1Н), 1,79-1,69 (м, 1Н), 1,69-1,51 (м, 1Н), 1,14 (д, J=6,9 Гц, 3H), 1,10 (с, 9Н), 0,97 (д, J=6,5 Гц, 3H), 0,93 (д, J=6,5 Гц, 3H).
Пример 1.100: (S)-2-((S)-2-(Диметиламино)-3-метилбутанамидо)-N-((S,E)-6-((S)-2-((1R,2R)-1-метокси-2-метил-3-оксо-3-((4-(2,2,2-трифторацетамидо)фенил)сульфонамидо)пропил)пирролидин-1-ил)-2,5-диметил-6-оксогекс-4-ен-3-ил)-N,3,3-триметилбутанамид (Соединение 35).

Указанное в заголовке соединение получали из продукта примера 1.99 и N,N-диметилвалина по общему способу 6. C39H61F3N5O8S расч. m/z=830,42, найдено [М+Н]+=831,75.
Пример 1.101: (S)-N-((S,E)-6-((S)-2-((1R,2R)-3-((4-Аминофенил)сульфонамидо)-1-метокси-2-метил-3-оксопропил)пирролидин-1-ил)-2,5-диметил-6-оксогекс-4-ен-3-ил)-2-((S)-2-(диметиламино)-3-метилбутанамидо)-N,3,3-триметилбутанамид (Соединение 36).

Указанное в заголовке соединение получали из продукта примера 1.100 по общему способу 4. 1. C37H62N6O7S расч. m/z=734,44, найдено [М+Н]+=735,72.
Пример 1.102: (S)-1-Изопропил-N-((S)-1-(((S,E)-6-((S)-2-((1R,2R)-1-метокси-2-метил-3-оксо-3-((4-(2,2,2-трифторацетамидо)фенил)сульфонамидо)пропил)пирролидин-1-ил)-2,5-диметил-6-оксогекс-4-ен-3-ил)(метил)амино)-3,3-диметил-1-оксобутан-2-ил)пиперидин-2-карбоксамид (Соединение 37).

Указанное в заголовке соединение получали из продукта примера 1.99 и (R)-1-изопропилпиперидин-2-карбоновой кислоты по общему способу 6. C41H63F3N6O8S расч. m/z=856,44, найдено [М+Н]+=857,80.
Пример 1.103: (S)-N-((S)-1-(((S,E)-6-((S)-2-((1R,2R)-3-((4-Аминофенил)сульфонамидо)-1-метокси-2-метил-3-оксопропил)пирролидин-1-ил)-2,5-диметил-6-оксогекс-4-ен-3-ил)(метил)амино)-3,3-диметил-1-оксобутан-2-ил)-1-изопропилпиперидин-2-карбоксамид (Соединение 38).

Указанное в заголовке соединение получали из продукта примера 1.102 по общему способу 4. 1. C39H64N6O7S расч. m/z=760,46, найдено [М+Н]+=761,77.
Пример 1.104: (S,E)-3-(1-(трет-Бутоксикарбонил)пирролидин-2-ил)-2-метилакриловая кислота.

Указанное в заголовке соединение синтезировали из трет-бутил-(S,E)-2-(3-этокси-2-метил-3-оксопроп-1-ен-1-ил)пирролидин-1-карбоксилата (полученного в соответствии с J. Org. Chem., 2003, 68 (16), сс. 6459-6462) по общему способу 4. 1. C13H21NO4 расч. m/z=255,15, найдено [М-Вос+Н]+=156,5, [M-Boc+MeCN]+=197,5.
Пример 1.105: трет-Бутил-(S,E)-2-(2-метил-3-оксо-3-((4-(2,2,2-трифторацетамидо)фенил)сульфонамидо)проп-1-ен-1-ил)пирролидин-1-карбоксилат.

Указанное в заголовке соединение получали из продукта примера 1.104 и продукта примера 1.39 по общему способу 2. C21H26F3N3O6S расч. m/z=505,15, найдено [М-Вос+Н]+=406,5, [M+Na]+=528,5.
Пример 1.106: (S,E)-2-Метил-3-(пирролидин-2-ил)-N-((4-(2,2,2-трифторацетамидо)фенил)сульфонил)акриламид.

Указанное в заголовке соединение получали из продукта примера 1.105 по общему способу 9. 1. C16H18F3N3O4S расч. m/z=405,10, найдено [М+Н]+=406,5.
Пример 1.107: (S)-2-((S)-2-(Диметиламино)-3-метилбутанамидо)-N-((3R,4S,5S)-3-метокси-5-метил-1-((S)-2-((E)-2-метил-3-оксо-3-((4-(2,2,2-трифторацетамидо)фенил)сульфонамидо)проп-1-ен-1-ил)пирролидин-1-ил)-1-оксогептан-4-ил)-N,3-диметилбутанамид (Соединение 39).

Указанное в заголовке соединение получали из продукта примера 1.106 и продукта примера 1.36 по общему способу 6. C38H59F3N6O8S расч. m/z=816,41, найдено [М+Н]+=817,7.
Пример 2: Синтез конъюгатов лекарственного агента и линкера согласно настоящему изобретению.
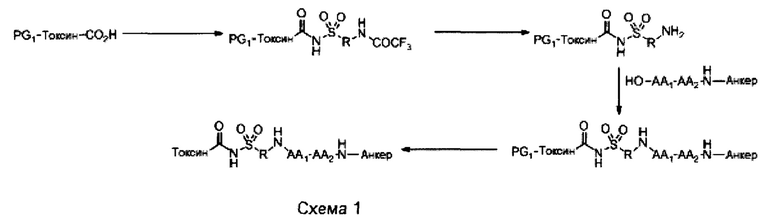
На схеме 1 представлен конкретный вариант реализации общей схемы синтеза комплекса D-L. В дополнительных вариантах реализации настоящего изобретения защитную группу (PG1) удаляют из токсина (или лекарства) до присоединения аминокислоты (например, AA1-AA2). В некоторых вариантах реализации настоящего изобретения анкер содержит функциональную группу, которая может образовывать ковалентную связь с мишенью. В других вариантах реализации настоящего изобретения анкер содержит удлинитель.
Пример 2. 1: (S)-N-(4-(N-((2R,3R)-3-((S)-1-((3R,4S,5S)-4-((S)-2-((S)-2-(диметиламино)-3-метилбутанамидо)-N,3-диметилбутанамидо)-3-метокси-5-метилгептаноил)пирролидин-2-ил)-3-метокси-2-метилпропаноил)сульфамоил)фенил)-2-((S)-1-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)-14-изопропил-12-оксо-3,6,9-триокса-13-азапентадекан-15-амидо)-5-уреидопентанамид.

Указанное в заголовке соединение синтезировали по общему способу 5 из MT-VC-ОН и Соединения 5, и очищали препаративной ВЭЖХ хроматографией. C61H101N11O17S расч. m/z=1291,71, найдено [М+Н]+ 1292,89.
Пример 2. 2: (S)-N-(4-((N-((2R,3R)-3-((S)-1-((3R,4S,5S)-4-((S)-2-((S)-2-(Диметиламино)-3-метилбутанамидо)-N,3-диметилбутанамидо)-3-метокси-5-метилгептаноил)пирролидин-2-ил)-3-метокси-2-метилпропаноил)сульфамоил)метил)фенил)-2-((S)-1-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)-14-изопропил-12-оксо-3,6,9-триокса-13-азапентадекан-15-амидо)-5-уреидопентанамид.

Указанное в заголовке соединение синтезировали по общему способу 5 из MT-VC-ОН и Соединения 8, и очищали препаративной ВЭЖХ хроматографией. C61H101N11O17S расч. m/z=1305,73, найдено [М+Н]+=1306,9.
Пример 2. 3: (S)-N-(4-(N-(((2R,3R)-3-((S)-1-((3R,4S,5S)-4-((S)-2-((S)-2-(Диметиламино)-3-метилбутанамидо)-N,3-диметилбутанамидо)-3-метокси-5-метилгептаноил)пирролидин-2-ил)-3-метокси-2-метилпропаноил)-L-фенилаланил)сульфамоил)фенил)-2-((S)-1-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)-14-изопропил-12-оксо-3,6,9-триокса-13-азапентадекан-15-амидо)-5-уреидопентанамид.

Указанное в заголовке соединение получали из MT-VC-OH и Соединения 11 по общему способу 5. C70H110N12O18S расч. m/z=1438,8 а.е.м.; найдено [М+Н]+=1440,2, [(M+2H)/2]2+=720,5.
Пример 2. 4: (S)-N-(4-((N-(((2R,3R)-3-((S)-1-((3R,4S,5S)-4-((S)-2-((S)-2-(Диметиламино)-3-метилбутанамидо)-N,3-диметилбутанамидо)-3-метокси-5-метилгептаноил)пирролидин-2-ил)-3-метокси-2-метилпропаноил)-L-фенилаланил)сульфамоил)метил)фенил)-2-((S)-1-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)-14-изопропил-12-оксо-3,6,9-триокса-13-азапентадекан-15-амидо)-5-уреидопентанамид.

Получали из Соединения 14 и MT-VC-OH по общему способу 5, и очищали препаративной ВЭЖХ. C71H112N12O18S расч. m/z=1452,80 а.е.м.; найдено [М+Н]+=1453,7.
Пример 2. 5: (S)-2-((S)-2-(Диметиламино)-3-метилбутанамидо)-N-((3R,4S,5S)-1-((S)-2-((1R,2R)-3-((4-(3-(2-(2-(2-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)этокси)этокси)этокси)пропанамидо)фенил)сульфонамидо)-1-метокси-2-метил-3-оксопропил)пирролидин-1-ил)-3-метокси-5-метил-1-оксогептан-4-ил)-N,3-диметилбутанамид.

Указанное в заголовке соединение получали из Соединения 5 и МТ-ОН по общему способу 6. C50H81N7O14S расч. m/z 1035,56, найдено [M+H]+ 1037,97.
Пример 2. 6: (S)-N-(1-(4-(N-((2R,3R)-3-((S)-1-((3R,4S,5S)-4-((S)-2-((S)-2-(Диметиламино)-3-метилбутанамидо)-N,3-диметилбутанамидо)-3-метокси-5-метилгептаноил)пирролидин-2-ил)-3-метокси-2-метилпропаноил)сульфамоил)фенил)циклопропил)-2-((S)-1-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)-14-изопропил-12-оксо-3,6,9-триокса-13-азапентадекан-15-амидо)-5-уреидопентанамид.

Указанное в заголовке соединение получали из Соединения 30, Boc-VC-OH и МТ-NHS по общему способу 8. C64H105N11O17S расч. m/z=1331,74, найдено [М+Н]+=1332,8.
Пример 2. 7: трет-Бутил-((S)-1-(((S)-1-((1-(4-(N-(((2R,3R)-3-((S)-1-((3R,4S,5S)-4-((S)-2-((S)-2-(диметиламино)-3-метилбутанамидо)-N,3-диметилбутанамидо)-3-метокси-5-метилгептаноил)пирролидин-2-ил)-3-метокси-2-метилпропаноил)-L-фенилаланил)сульфамоил)фенил)циклопропил)амино)-1-оксо-5-уреидопентан-2-ил)амино)-3-метил-1-оксобутан-2-ил)карбамат.

Указанное в заголовке соединение получали из Соединения 32 и Boc-VC-OH по общему способу 5. C65H105N11O14S расч. m/z=1295,76, найдено [М+Н]+=1297,2.
Пример 2. 8: (S)-N-(1-(4-(N-(((2R,3R)-3-((S)-1-((3R,4S,5S)-4-((S)-2-((S)-2-(Диметиламино)-3-метилбутанамидо)-N,3-диметилбутанамидо)-3-метокси-5-метилгептаноил)пирролидин-2-ил)-3-метокси-2-метилпропаноил)-L-фенилаланил)сульфамоил)фенил)циклопропил)-2-((S)-1-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)-14-изопропил-12-оксо-3,6,9-триокса-13-азапентадекан-15-амидо)-5-уреидопентанамид.
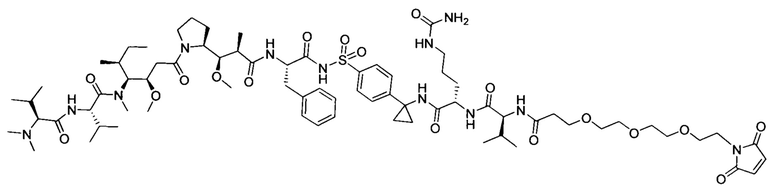
Указанное в заголовке соединение получали из продукта примера 2. 7 и MT-NHS по общим способам 9 и 8. C73H114N12O18S расч. m/z=1478,81, найдено [М+Н]+=1479,7.
Пример 2. 9: 4-((S)-2-((S)-2-(6-(2,5-Диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанамидо)-3-метилбутанамидо)-5-уреидопентанамидо)бензил-((S)-1-(((S)-1-(((3R,4S,5R)-3-метокси-1-((S)-2-((1R,2R)-1-метокси-2-метил-3-оксо-3-((фенилметил)сульфонамидо)пропил)пирролидин-1-ил)-5-метил-1-оксогептан-4-ил)(метил)амино)-3-метил-1-оксобутан-2-ил)амино)-3-метил-1-оксобутан-2-ил)(метил)карбамат.

Указанное в заголовке соединение получали из Соединения 33 и приобретенного в продаже MC-VC-PABC-OPnp. C66H101N11O16S расч. m/z=1335,71, найдено [М+Н]+ 1337,28.
Специалистам в данной области техники понятно, что химические превращения, показанные на представленных выше схемах, могут быть осуществлены с модификациями одного или более параметров. Например, для осуществления указанных химических реакций могут быть пригодны альтернативные не нуклеофильные растворители, такие как ТГФ, ДМФА, толуол и т.д. Может быть изменена температура реакции. В качестве дегидратирующих или активирующих кислоту агентов могут быть пригодны альтернативные реагенты, которые обычно используют в реакциях образования амидов, такие как пентафторфениловые сложные эфиры, сложные эфиры NHS, EDAC, HBTU, НОВТ и т.д.
Пример 3: Цитотоксичность соединений Формулы I в клеточных линиях Jurkat и НСС1954.
Соединения испытывали на клеточных линиях Jurkat и НСС1954 для оценки их цитотоксичности. Соединения титровали 1:3, начиная с различных концентраций (от 30 нМ до 1000 нМ). Титровали также контрольный токсин HTI-286 (см., например, патент США 7579323), 1:3, начиная с концентрации 30 нМ. Планшеты инкубировали в течение 3 дней. Жизнеспособность клеток количественно определяли с помощью 1× реагента CellTiter-Glo, 30 мкл/лунку. Контрольный цитотоксин обеспечивал успешное уничтожение клеток Jurkats в ожидаемой концентрации.
Каждую клеточную линию выращивали в соответствующей питательной среде до дня посева. Клетки извлекали из культуральных емкостей и подсчитывали полученную клеточную суспензию с помощью ViCell. Затем клетки разбавляли в их питательной среде до 25000/mL, так что 100 мкл/лунку = 2500 клеток/лунку. Каждую клеточную линию высевали во внутренние 60 лунок 96-луночных планшетов ТС с черными стенками, а внешние лунки заполняли водой. НСС1954 высевали за один до начала анализа. Цитотоксины разбавляли так, как описано ниже, получали раствор с 5× концентрацией дозы-ответа для каждого соединения, используя RPMI + 10% FBS в 96-луночном планшете с глубокими лунками. Такой «исходный» планшет разбавлений использовали для каждой клеточной линии. 25 мкл раствора с 5× концентрацией дозы-ответа вводили в каждую клеточную линию в трех экземплярах. Планшеты возвращали в инкубатор и инкубировали в течение 3 ночей. Через 3 ночи жизнеспособность клеток количественно определяли с помощью 1× реагента CellTiter-glo, 30 мкл/лунку. Через по меньшей мере 10 минут инкубации измеряли люминесценцию, используя SpectraMax (интегрирование 500 мс). Результаты представлены в таблице 2 и на Фиг. 1 и 2.


Пример 3. 1: Оценка клеточной цитотоксичности соединений Формулы I в клеточных линиях Jurkat, HCC1954, NCI-N87, ВхРС-3, SK-OV-3 и JIMT-1.
Соединения испытывали на одной или более клеточных линиях Т-клеточного лейкоза человека Jurkat (ATCC: TIB-152); клеточных линиях рака молочной железы человека HCC1954 (ATCC: CRL-2338) и JIMT-1 (DSMZ: АСС 589); клеточной линии рака поджелудочной железы человека ВхРС-3 (ATCC: CRL. 1687), клеточной линии аденокарциномы яичника человека SK-OV-3 (ATCC: HTB-77) и клеточной линии карциномы желудка человека NCI-N87 (ATCC: CRL. 5822); для оценки их цитотоксичности.
Вкратце, клетки приобретали из коммерческих источников и выращивали так, так описано на предоставленном информационном листке продукта. Клетки извлекали из культуральных емкостей и подсчитывали полученную клеточную суспензию с помощью ViCell (Beckman Coulter), затем высеивали с плотностью 25000 клеток/мл (2500 клеток/лунку в плоскодонных 96-луночных планшетах с черными стенками Costar 3904 (клетки высевали во внутренние 60 лунок 96-луночных планшетов ТС, а лунки у внешних границ заполняли водой). Адгезивные клеточные линии инкубировали в течение одной ночи при 37°С/в атмосфере 5% CO2 для обеспечения возможности прикрепления клеток к поверхности микротитровального планшета, тогда как суспензионные клетки (Jurkat) помещали на планшет непосредственно перед использованием. Цитотоксины растворяли и серийно разбавляли в диметилсульфоксиде, а затем добавляли растворы к полной питательной среде в концентрации, в пять раз превышающей требуемую максимальную конечную концентрацию. Затем цитотоксины титровали в питательной среде, обычно 1:3, за восемь стадий. Контроль без исследуемых соединений (только питательная среда) включали в каждый микротитровальный планшет в шести экземплярах. Полученные титрованные токсины добавляли (25 мкл/лунку) в трех экземплярах к каждой анализируемой клеточной линии. Клетки и титрованные соединения инкубировали при 37°С/5% CO2 в течение трех ночей (Jurkat) и пяти ночей (все остальные клеточные линии). После инкубации измеряли жизнеспособность клеток с помощью CellTiter-Glo®, добавляя 30 мкл приготовленного реагента CellTiter-Glo® в каждую анализируемую лунку. Смеси инкубировали в течение по меньшей мере двадцати минут в темноте, а затем измеряли испускаемую люминесценцию, используя микропланшетный люминометр (время интегрирования 500 мс). Полученные относительные единицы люминесценции (ОЕЛ) преобразовывали в % цитотоксичности, используя вышеупомянутый контрольный образец, содержащий только питательную среду (% цитотоксичности = 1 - [ОЕЛ лунки/среднее значение ОЕЛ контрольной питательной среды] × 100%). Данные (% цитотоксичности от концентрации ADC (log10(нМ)) наносили на график и аппроксимировали к кривым, используя методы нелинейной регрессии (четырехпараметрическое распределение-переменный наклон), используя программное обеспечение GraphPad Prism версии 5. 02 для получения расчетных значений ЕС50. Контрольный цитотоксин, обычно HTI-286 (см., например, патент 7579323), обеспечивал успешное уничтожение всех клеточных линий в ожидаемой концентрации. Результаты представлены в таблице 2.1.

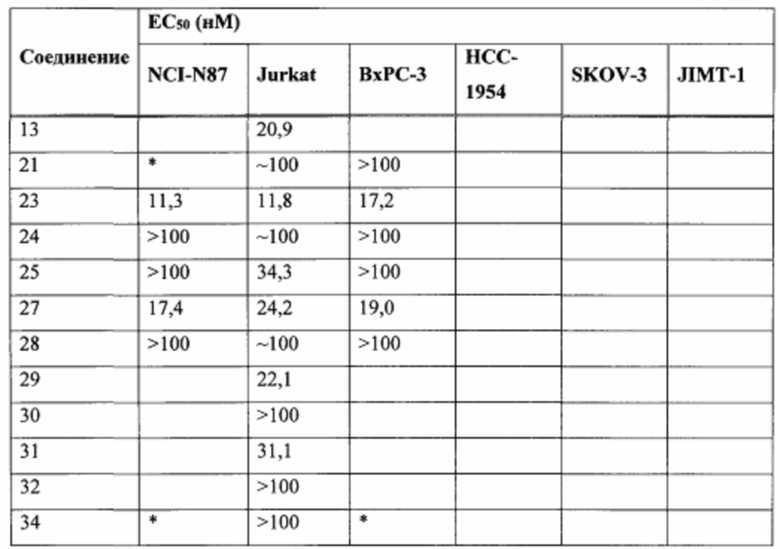
*Не является цитотоксичным в концентрации 300 нМ.
Пример 4: Биологические анализы.
Клеточные линии: Клеточная линия Т-клеточного лейкоза человека Jurkat (ATCC: TIB-152); HCC 1954 (ATCC: CRL. 2338); клеточные линии поджелудочной железы человека: AsPC-1 (ATCC: CRL-1682), ВхРС-3 (ATCC: CRL. 1687), HPAF-II (ATCC: CRL. 1997), MiaPaCa2 (ATCC: CRL. 1420), PANC-1 (ATCC: CRL. 1469), Capan-1 (ATCC: HTB-79), Capan-2 (ATCC: HTB-80) и клеточная линия карциномы желудка человека NCI-N87 (ATCC: CRL. 5822); AML-193 (ATCC: CRL. 9589), CCRF-CEM (ATCC: CCL-119), DU145 (ATCC: HTB-81), PC-3 (ATCC: CRL. 1435), A-431 (ATCC: CRL. 1555), HT-29 (ATCC: HTB-38), A-172 (ATCC: CRL. 1620), NCI-H358 (ATCC: CRL. 5807), A549 (ATCC: CCL-185), Colo-205 (ATCC: CCL-222), MDA-MB-231 (ATCC: HTB-26), OVCAR-3 (ATCC: HTB-161), OV-90 (ATCC: CRL. 11732), OE19 (Sigma: 96071721), RT112/84 (Sigma: 85061106).
За один день до добавления соединений клетки HCC 1954 AsPC-1, ВхРС-3, HPAF-II, MiaPaCa2, PANC-1, Capan-1, Capan-2 и NCI-N87 добавляли в 96-луночные обработанные тканевой культурой микротитровальные планшеты с непрозрачными стенками, используя полную питательную среду, с плотностью 2500 клеток/100 микролитров (мкл) среды. Указанные адгезивные клеточные линии инкубировали в течение одной ночи при 37°С/5% CO2 для обеспечения возможности прикрепления клеток к поверхности микротитровального планшета. В день добавления соединений клетки Jurkat помещали в отдельные 96-луночные микротитровальные планшеты в концентрации 2500 клеток/100 мкл, используя такую же питательную среду, как в случае НСС1954. Сначала соединения серийно разбавляли в диметилсульфоксиде, а затем полученные разбавления добавляли к полной питательной среде в концентрации, в пять раз превышающей конечную концентрацию. Затем соединения титровали 1:3, за восемь стадий. Контроль без исследуемых соединений (только питательная среда) включали в каждый микротитровальный планшет в шести экземплярах. Полученные титрованные соединения добавляли (25 мкл/лунку) в трех экземплярах. Клетки и титрованные соединения инкубировали при 37°С/5% CO2 в течение трех ночей. После инкубации измеряли жизнеспособность клеток с использованием реагента CellTiter-Glo® путем добавления 30 мкл приготовленного CellTiter-Glo® в каждую анализируемую лунку. Смеси инкубировали в течение по меньшей мере двадцати минут в темноте, а затем измеряли испускаемую люминесценцию, используя микропланшетный люминометр (время интегрирования 500 мс). Полученные относительные единицы люминесценции (ОЕЛ) преобразовывали в % цитотоксичности, используя вышеупомянутый контрольный образец, содержащий только питательную среду (% цитотоксичности = 1 - [ОЕЛ лунки/среднее значение ОЕЛ контрольной питательной среды]).
Для получения значений EC50 использовали GraphPad Prism®, посредством построения трехпараметрической кривой нелинейной регрессии.
Пример 5: Типичные конъюгаты антитело-лекарственное вещество.
1. Типичные линкеры
Как понятно специалистам в данной области техники, конкретный линкер, используемый для получения конъюгата, зависит от реакционноспособной группы реагирующего соединения, используемого для образования связи. Например, и в пределах сферы действия настоящего изобретения, для получения конъюгата могут быть использованы соединения, содержащие тиольный фрагмент. В некоторых предложенных примерах используют имеющийся в продаже расщепляемый линкер сульфосукцинимидил-6-[3'(2-пиридилдитио)пропанамидо)гексаноат (сульфо-LC-SPDP: Thermo Pierce кат. №21650) и не расщепляемый линкер сукцинимидил-4-[N-малеимидометил]циклогексан-1-карбоксилат (SMCC: Thermo Pierce кат. №22360) для реакций конъюгации антитела с лекарственным средством. Процедуру связывания проводят в две основные стадии: 1) внедрение линкеров в антитело посредством взаимодействия с первичными аминогруппами антитела (лизиновыми остатками) и N-гидроксисукцинимидным (NHS) сложноэфирным фрагментом линкеров; и 2) взаимодействие внедренной малеимидной группы (SMCC) или 2-пиридилдитио-группы (LC-SPDP) с тиолсодержащими соединениями.
2. Активация антитела с помощью расщепляемых (LC-SPDP) или не расщепляемых (SMCC) линкеров
Антитело (Herceptin®) разбавляли в фосфатно-калиевом буфере с рН 8 (сульфо-LC-SPDP) или в D-PBS (Invitrogen) с рН 7,4 (SMCC) до 5 мг/мл. К разбавленному антителу добавляли свежий разбавленный линкер, используя ультрачистую воду для сульфо-LC-SPDP или безводный N,N-диметилацетамид (DMA) для SMCC. 10-14-кратный молярный избыток SMCC: антитела или сульфо-LC-SPDP: антитела приводит к внедрению 5-7 линкеров на одно антитело. Реакцию «активации» линкера-антитела инкубируют при 28°С в течение 2 часов. После инкубации не прореагировавший линкер удаляют из каждого образца антитела, используя эксклюзионную хроматографию/обессоливающие колонки Zeba™ 40 кДа (Thermo Pierce кат. №87771 или 87772 в зависимости от масштаба). Во время той же стадии хроматографии буфер меняют, готовясь к следующей реакции: фосфатный буфер/ЭДТА с рН 6,5 (LC-SPDP) или цитратный буфер/ЭДТА с рН 5 (SMCC). Затем очищенные препараты анализируют на общее содержание белка относительно стандартной кривой антитела, используя адаптированный к микропланшетам анализ ВСА (Thermo Pierce кат. №23225). Для оценки степени внедрения линкера проводят мелкомасштабную реакцию с избытком (~10 раз относительно концентрации белка) цистеина. После 10 минут инкубации не прореагировавший цистеин обнаруживают, используя 5,5-дитио-бис-(2-нитробензойную кислоту) (реагент Эллмана, Thermo Pierce кат. №22582). Интерполируя концентрацию по стандартной кривой цистеина, определяют концентрацию линкера, вычитая определенное значение из известной концентрации использованного цистеина.
3. Взаимодействие тиолсодержащих соединений с антителом с активированным линкером
На второй стадии реакции связывания используют активированное антитело, первоначально разбавляя препарат до 2 мг/мл с помощью фосфатного буфера/ЭДТА с рН 6,5 (LC-SPDP) или цитратного буфера/ЭДТА с рН 5 (SMCC). Перед использованием тиол-содержащие N-ацилсульфонамидные соединения восстанавливают с помощью ТСЕР-агарозных гранул для обеспечения доступности тиольных групп для взаимодействия с внедренными линкерами. Вкратце, соединения разбавляли до 5 мМ в фосфатном буфере/ЭДТА с рН 6,5. При слабой растворимости в воде добавляли небольшой объем 37% HCl (1:300), и этого было достаточно для солюбилизации соединений при 5 мМ. ТСЕР-агарозные гранулы (Thermo Pierce кат. №77712) уравновешивали с фосфатным буфером/ЭДТА/10% DMA перед использованием. Разбавленные растворы соединений вращали с ТСЕР-агарозными гранулами в течение по меньшей мере 0,5 часа или до 3 часов. Восстановленные соединения собирали центрифугированием на фильтре, который не пропускает ТСЕР-агарозу. Степень восстановления и концентрацию тиола измеряли с помощью реагента Эллмана (по сравнению со стандартной кривой цистеина). Затем восстановленные тиолсодержащие соединения добавляли к образцам активированного антитела с молярным избытком ~2 раза по сравнению с определенными ранее концентрациями линкера. Для контролирования эффективности реакции связывания получали «ночной» контрольный образец конъюгации, разбавляя каждое соединение в фосфатном буфере/ЭДТА с рН 6,5 или в цитратном буфере/ЭДТА с рН 5, с таким же фактором разбавления, который использовали в реакции конъюгации. Остальные исходные растворы соединений замораживали при -80°С. Реакционные смеси и «ночные» контрольные образцы инкубировали при комнатной температуре в течение ночи. На следующее утро оттаивали замороженные исходные растворы соединений и получали еще один контрольный образец для каждого соединения, точно так же, как «ночные» контрольные образцы - в данном случае «свежий» контрольный образец. Небольшой объем каждой реакции конъюгации сравнивали с «ночным» и «свежим» контрольными образцами соединения, используя реагент Эллмана. Не прореагировавшее соединение отделяли от ADC, используя эксклюзионные/обессоливающие колонки Zeba™ 40 кДа; во время той же стадии меняли буфер на D-PBS с рН 7,4 (Invitrogen). Затем очищенные ADC анализировали на предмет: общего содержания белка (анализ ВСА, протокол Pierce микроВСА), относительной аффинности к связыванию антигена (равновесное нативное связывание) и селективного цитотоксичного цитолиза HER2-положительных клеток (НСС1954) по сравнению с HER2-отрицательными клетками (Jurkat).
4. Анализ цитотоксичности
За один день до добавления исследуемых соединений клетки НСС1954 добавляли в 96-луночные обработанные тканевой культурой микротитровальные планшеты с непрозрачными стенками, используя полную питательную среду, с плотностью 2500 клеток/100 мкл среды. Клетки НСС1954 инкубировали в течение одной ночи при 37°С/5% CO2 для обеспечения возможности прикрепления клеток к поверхности микротитровального планшета. В день добавления исследуемых соединений клетки Jurkat помещали в отдельные 96-луночные микротитровальные планшеты в концентрации 2500 клеток/100 мкл, используя такую же питательную среду, как в случае НСС1954. Для сравнения цитолиза ADC с цитолизом свободных соединений N-ацилсульфонамидные соединения сначала серийно разбавляли в диметилсульфоксиде или DMA, а затем полученные разбавления добавляли к полной питательной среде в концентрации, в пять раз превышающей конечную концентрацию. Затем соединения титровали 1:3, за восемь стадий. Для испытания ADC их разбавляли непосредственно в питательной среде в концентрации, в пять раз превышающей конечную концентрацию. Затем ADC титровали 1:3, за восемь стадий. Контроль без исследуемых соединений (только питательная среда) включали в каждый микротитровальный планшет в шести экземплярах. Полученные титрованные соединения/ADC добавляли (25 мкл/лунку) в трех экземплярах к клеткам НСС 1954 и клеткам Jurkat. Клетки и титрованные соединения инкубировали при 37°С/5% CO2 в течение трех ночей. После инкубации измеряли жизнеспособность клеток с использованием реагента CellTiter-Glo® путем добавления 30 мкл приготовленного CellTiter-Glo® в каждую анализируемую лунку. Смеси инкубировали в течение по меньшей мере двадцати минут в темноте, а затем измеряли испускаемую люминесценцию, используя микропланшетный люминометр (время интегрирования 500 мс). Полученные относительные единицы люминесценции (ОЕЛ) преобразовывали в % цитотоксичности, используя вышеупомянутый контрольный образец, содержащий только питательную среду (% цитотоксичности = 1 - [ОЕЛ лунки/среднее значение ОЕЛ контрольной питательной среды]).
5. Анализ конъюгата антитела с лекарственным препаратом (ADC) с помощью времяпролетной масс-спектрометрии с электрораспылительной ионизацией.
Использовали масс-спектрометр (МС) для времяпролетной масс-спектрометрии с электрораспылительной ионизацией (EsiToF) (QStar XL гибридный квадрупольный-TOF ЖХ/МСМС; АВ Sciex) для определения молекулярной массы ADC и оценки отношения лекарственного препарата к антителу (DAR). Прибор EsiToF-MC оснащали турбореактивным источником электрораспылительной ионизации. Данные считывали в режиме определения положительных ионов, и считывали общий ионный ток образца в диапазоне масс от 2000 m/z до 4000 m/z, используя программное обеспечение Analyst QS 1. 1. Источник ионов эксплуатировали с напряжением ионораспылительной иглы 5,2 кВ, распылением (газ 1) 25 (произвольные единицы), «газовой завесой» 30 (произвольные единицы), потенциалом декластеризации 150 В и при температуре 150°С. Растворы испытуемых образцов ADC вводили со скоростью 5 мкл/мин. в источник ионов путем непосредственной инфузии через капилляр из кварцевого стекла с помощью шприца и шприцевого насоса. Как правило, значения DAR варьировались от 0 до 4.
6. Получение образца ADC для анализа MC-ESI-ToF
Все образцы ADC дегликозилировали с помощью эндогликозидазы EndoS(IgGZERO)™ и меняли буфер на воду перед проведением анализа MC-EsiToF. Вкратце, исходный образец ADC пропускали через концентратор Amicon с НОММ 100 тыс. для замены буфера в фосфатно-натриевом буфере. Затем образец с замененным буфером обрабатывали реагентом IgGZERO™ (1 ед. /1 мкг антитела) в фосфатно-натриевом расщепляющем буфере, содержащем 150 мМ NaCl, и инкубировали в течение 30 минут при 37°С.Полученный дегликозилированный ADC снова подвергали замене буфера на воду, используя концентратор Amicon с НОММ 100 тыс., и разбавляли 0,1% муравьиной кислотой в ацетонитриле/воде (50/50 об./об. %) до концентрации 3,0 мкг/мкл перед анализом.
Пример 6: Типичные конъюгаты антитело-лекарственное вещество
1. Получение конъюгатов антитела с лекарственным веществом из токсинов MCvcPABC, общие способы
К раствору антитела (1-10 мг/мл) в 25 мМ борате натрия, 25 мМ хлориде натрия, 1 мМ DTPA (рН 8,0) добавляли ТСЕР из свежеприготовленного исходного раствора (1-10 мМ) в том же буфере (2,0-3,0 мол. экв.). Раствор тщательно перемешивали и инкубировали при 37°С в течение 2 часов, а затем охлаждали на льду. В некоторых случаях раствор восстановленного антитела дополнительно разбавляли ледяным фосфатно-солевым буферным раствором, содержащим 1 мМ DTPA (конечная концентрация белка 2,0 мг/мл) или ледяным 25 мМ боратом натрия, 25 мМ хлоридом натрия, 1 мМ DTPA (рН 8,0), с получением раствора с конечной концентрацией белка от 1 до 4 мг/мл. К раствору восстановленного белка, выдержанного на льду, добавляли малеимид-функционализированный токсин (10-12 мол. экв.) из 10 мМ исходного раствора в ДМСО. Реакционную смесь сразу тщательно перемешивали посредством переворачивания и проводили реакцию конъюгации на льду в течение приблизительно 1 часа, затем очищали посредством пропускания через вращающиеся обессоливающие колонки Zeba™ (НОММ 40 кДа; Peirce), предварительно уравновешенные фосфатно-солевым буферным раствором или 10 мМ цитратом натрия, 150 мМ хлоридом натрия с рН 5,5. Элюат сливали, стерилизовали посредством фильтрации (Steriflip®, Millipore) и хранили при 4°С. Очищенные ADC анализировали на общее содержание белка (анализ с бицинхониновой кислотой, протокол микро-ВСА, Pierce, кат. №23225). Продукт ADC описывали с помощью восстановительного и не восстановительного электрофореза в полиакриламидном геле (PAGE), ВЭЖХ-ХГВ, ГПХ и ОФ-СВЭЖХ-МС. В результате интерпретации данных ХГВ и ЖХ-МС, с учетом не восстановительного PAGE, получали среднее значение DAR и распределение лекарственного вещества. Средние расчетные значения DAR обычно составляли 3,5-4,5. Относительную аффинность ADC к связыванию антигена (равновесное нативное связывание) определяли так, как описано в настоящем документе (выше/ниже). Селективную цитотоксичность конъюгатов антитела с лекарственным веществом оценивали посредством испытания цитолиза антиген-положительных и антиген-отрицательных клеточных линий.
2. Анализ селективной In Vitro цитотоксичности конъюгатов антитела с лекарственным веществом в отношении антиген-положительных клеток
Селективный цитолиз антиген-положительной клеточной линии (включая клеточные линии НСС1954, NCI-N87, HPAF-II и ВхРС-3) по сравнению с антиген-отрицательными клетками Jurkat продемонстрирован для каждого полученного конъюгата. Вкратце, клетки приобретали у АТСС и выращивали так, как описано на предоставленном информационном листке продукта. Клетки высевали в концентрации 25000 клеток/мл (2500 клеток/лунку) в плоскодонных 96-луночных планшетах с черными стенками Costar 3904. Адгезивные клеточные линии инкубировали в течение одной ночи при 37°С/в атмосфере 5% CO2 для обеспечения возможности прикрепления клеток к поверхности микротитровального планшета, тогда как суспензионные клетки (Jurkat) помещали на планшет непосредственно перед использованием. ADC разбавляли непосредственно в подходящей среде роста клеток в концентрации, в пять раз превышающей требуемую конечную концентрацию. Затем ADC титровали, обычно 1:3, за восемь стадий. Контроль без исследуемых соединений (только питательная среда) включали в каждый микротитровальный планшет в шести экземплярах. Полученные титрованные ADC добавляли (25 мкл/лунку) в трех экземплярах к каждой анализируемой клеточной линии. Клетки и титрованные соединения инкубировали при 37°С/5% CO2 в течение трех ночей (Jurkat) и пяти ночей (все остальные клеточные линии). После инкубации измеряли жизнеспособность клеток с использованием реагента CellTiter-Glo® путем добавления 30 мкл приготовленного CellTiter-Glo® в каждую анализируемую лунку. Смеси инкубировали в течение по меньшей мере двадцати минут в темноте, а затем измеряли испускаемую люминесценцию, используя микропланшетный люминометр (время интегрирования 500 мс). Полученные относительные единицы люминесценции (ОЕЛ) преобразовывали в % цитотоксичности, используя вышеупомянутый контрольный образец, содержащий только питательную среду (% цитотоксичности = 1 - [ОЕЛ лунки/среднее значение ОЕЛ контрольной питательной среды]). Данные (% цитотоксичности от концентрации ADC (log10(нМ)) наносили на график и аппроксимировали к кривым, используя методы нелинейной регрессии (четырехпараметрическое распределение-переменный наклон), используя программное обеспечение GraphPad Prism версии 5. 02 для получения расчетных значений EC50.
3. Оценка отношения лекарственного вещества к антителу (DAR)
Среднюю степень конъюгации токсина-линкера с антителом оценивали с помощью хроматографии с гидрофобным взаимодействием и высокоэффективной жидкостной хроматографии-масс-спектрометрии. Указанные технологии описаны в публикации Antibody Drug Conjugates, Methods in Molecular Biology, том 1045, 2013. сс. 275-284. L. Ducry, ред., и Asish В. Chakraborty, Scott J. Berger and John C. Gebler, Characterization of an IgG1 Monoclonal Antibody and related Sub-structures by LC/ESI-TOF/MS: Application note, Waters Corporation, март 2007 года. 720002107EN. Как правило, значения DAR варьировались от 0 до 4.
Способ 1. Хроматография с гидрофобным взаимодействием
Конъюгаты антитела с лекарственным веществом анализировали посредством хроматографии с гидрофобным взаимодействием (ХГВ) на колонке TSKgel® Butyl-NPR (Tosoh Bioscience; 4,6 мм × вн. диам. 35 мм; размер частиц 2,5 мкм), подключенной к ВЭЖХ Agilent серии 1100. Образцы вводили (5 мкл) со скоростью 4 мг/мл или более. При необходимости ADC концентрировали перед вводом пробы с помощью центробежных концентрирующих устройств PALL Nanosep Omega (изд. № OD010C34). Использовали элюирование линейным градиентом, начиная с 95% подвижной фазы А/5% подвижной фазы В с переходом на 5% подвижной фазы А/95% подвижной фазы В за 12 минут (подвижная фаза А: 1,5 М сульфат аммония + 25 мМ фосфат натрия при рН 6,95, и подвижная фаза В: 25% изопропанола, 75% 25 мМ фосфата натрия при рН 6,95). Ввод пробы не модифицированного антитела обеспечивал способ идентификации пика с DAR=0. Антитела обнаруживали на основании поглощения при 280 нм.
Способ 2. Сверхэффективная жидкостная хроматография-масс-спектрометрия для оценки DAR
Для характеристики конъюгатов антитела с лекарственным веществом по степени конъюгации лекарства после восстановления дитиотреитолом использовали обращенно-фазовую сверхэффективную жидкостную хроматографию в тандеме с ИЭР-QToF-масс-спектрометрией (СВЭЖХ-ИЭР-QToF-MC). Характеристику проводили, используя Acquity-UPLC® (класса Н) Bio, подключенный к QToF масс-спектрометру Quattro-Premier™ с источником электрораспылительной ионизации (WATERS Corporation). СВЭЖХ анализ восстановленного образца ADC проводили при 70°C с помощью колонки PolymerX™ 5u PR-1 100А, 50×2,0 мм (Phenomenex, Inc.) и с подвижной фазой, состоящей из растворителя А: ацетонитрил/вода/трифторуксусная кислота/муравьиная кислота (10/90/0,1/0,1, об./об. %) и растворителя В: ацетонитрил/муравьиная кислота (100/0,1 об./об.). Компоненты образца восстановленного ADC элюировали линейным градиентом, начиная с растворителя А/растворителя В (80/20 об./об.) и со скоростью потока 0,3 мл/мин., до растворителя А/растворителя В (40/60, об./об.) за 25 минут, а затем до растворителя А/растворителя В (10/90, об./об. %) за 2 минуты, затем снова уравновешивали до исходных условий. Общее время хроматографирования составило 30 минут. Данные общего ионного тока (TIC) в ESI-ToF-МС записывали в диапазоне 500-4500 m/z с помощью программного обеспечения для сбора данных MassLynx™ (Waters Corporation). Данные о массе компонентов образца записывали в V-режиме определения положительных ионов, а источник ИЭР эксплуатировали при температуре источника: 150°С, температура десольватации: 350°С, газ десольватации: 800 л/ч., напряжение на пробоотборном конусе: 60 В, капиллярное напряжение: 3,0 кВ, газ десольватации: азот, и газ для соударений: аргон. Суммарные масс-спектры TIC для каждого пика разворачивали по алгоритму Maximum Entropy™ I (Мах-Ent1) с получением данных о нейтральной массе компонента пика.
4. Получение образцов восстановленных ADC для анализа СВЭЖХ/ИЭР-ToF-МС
Восстановление дисульфидных связей в антителе ADC (~ 1 мкг/мкл раствор) с получением легких и тяжелых цепей проводили с помощью 20 мМ DTT при 60°С в течение 20 минут. Для анализа СВЭЖХ/ИЭР-ToF-MC использовали объем вводимой пробы образца восстановленного ADC 5-10 мкл.
Пример 6.1. Типичные конъюгаты антитело-лекарственное вещество
1. Получение конъюгатов антитела с лекарственным веществом из малеимид-функционализированных лекарственных веществ с линкерами, общие способы.
К раствору антитела (1-10 мг/мл) в фосфатно-солевом буферном растворе (рН 7,4) добавляли ТСЕР из свежеприготовленного исходного раствора (1-10 мМ) в том же буфере (2,0-3,0 мол. экв.). Раствор тщательно перемешивали и инкубировали при 37°С в течение 2 часов, а затем охлаждали на льду. В некоторых случаях раствор восстановленного антитела дополнительно разбавляли ледяным фосфатно-солевым буферным раствором, содержащим 1 мМ DTPA с получением раствора с конечной концентрацией белка от 1 до 5 мг/мл. К раствору восстановленного белка, выдержанного на льду, добавляли малеимид-функционализированное лекарство с линкером (8-10 мол. экв.) из 10-20 мМ исходного раствора в ДМСО. Реакционную смесь сразу тщательно перемешивали посредством переворачивания и проводили реакцию конъюгации на льду в течение приблизительно 1 часа, затем очищали посредством пропускания через вращающиеся обессоливающие колонки Zeba™ (НОММ 40 кДа; Peirce), предварительно уравновешенные фосфатно-солевым буферным раствором. Элюат сливали, стерилизовали посредством фильтрации (Steriflip®, Millipore) и хранили при 4°С. Очищенные ADC анализировали на общее содержание белка (анализ с бицинхониновой кислотой, протокол микро-ВСА, Pierce, кат. №23225). Продукт ADC описывали с помощью восстановительного и не восстановительного электрофореза в полиакриламидном геле (PAGE), ВЭЖХ-ХГВ, ГПХ и ОФ-СВЭЖХ-МС. В результате интерпретации данных ХГВ и ЖХ-МС, с учетом не восстановительного PAGE, получали среднее значение DAR и распределение лекарственного вещества. Средние расчетные значения DAR обычно составляли 3,5-4,2. Относительную аффинность ADC к связыванию антигена (равновесное нативное связывание) определяли так, как описано в настоящем документе (ниже). Селективную цитотоксичность конъюгатов антитела с лекарственным веществом оценивали посредством испытания цитолиза антиген-положительных и антиген-отрицательных клеточных линий в анализе клеточной цитотоксичности.
2. Анализ селективной In Vitro цитотоксичности конъюгатов антитела с лекарственным веществом в отношении антиген-положительных клеток
Конъюгаты антитела с лекарственным веществом испытывали на цитотоксичность на выращенных клеточных линиях, в том числе на клеточной линии Т-клеточного лейкоза человека Jurkat (ATCC: TIB-152); клеточных линиях рака молочной железы человека НСС1954 (ATCC: CRL-2338) и JIMT-1 (DSMZ: АСС 589), клеточной линии аденокарциномы яичника человека SK-OV-3 (ATCC: HTB-77); клеточной линии карциномы желудка человека NCI-N87 (ATCC: CRL-5822); клеточной линии неходжкинской лимфомы человека Karpas299 (Health Protection Agency Culture Collections: 06072604); и клеточной линии человеческой лимфомы Беркитта Ramos (ATCC: CRL-1596). Селективный цитолиз антиген-положительной клеточной линии (включая клеточные линии НСС1954, NCI-N87, SK-OV-3 и ЛМТ-1 для конъюгатов на основе трастузумаба; клеточную линию Ramos для конъюгатов на основе ритуксимаба; Karpas 299 для конъюгатов на основе брентуксимаба (сАС-10)) по сравнению с одной или более антиген-отрицательными клеточными линиями (Jurkat, Karpas299 и Ramos для конъюгатов на основе трастузумаба; NCI-N87 для конъюгатов на основе бретуксимаба (сАС-10) и ритуксимаба) был продемонстрирован для каждого полученного конъюгата. Вкратце, клетки приобретали из коммерческих источников и выращивали так, как описано на предоставленном информационном листке продукта. Клетки высевали в концентрации 25000 клеток/мл (2500 клеток/лунку) в плоскодонных 96-луночных планшетах с черными стенками Costar 3904. Адгезивные клеточные линии инкубировали в течение одной ночи при 37°С/в атмосфере 5% CO2 для обеспечения возможности прикрепления клеток к поверхности микротитровального планшета, тогда как суспензионные клетки (Jurkat) помещали на планшет непосредственно перед использованием. ADC разбавляли непосредственно в подходящей среде роста клеток в концентрации, в пять раз превышающей требуемую конечную максимальную концентрацию. Затем ADC титровали, обычно 1:3, за восемь стадий. Контроль без исследуемых соединений (только питательная среда) включали в каждый микротитровальный планшет в шести экземплярах. Полученные титрованные ADC добавляли (25 мкл/лунку) в трех экземплярах к каждой анализируемой клеточной линии. Клетки и титрованные соединения инкубировали при 37°С/5% CO2 в течение трех ночей (Jurkat) и пяти ночей (все остальные клеточные линии). После инкубации измеряли жизнеспособность клеток с помощью CellTiter-Glo®, добавляя 30 мкл приготовленного реагента CellTiter-Glo® в каждую анализируемую лунку. Смеси инкубировали в течение по меньшей мере двадцати минут в темноте, а затем измеряли испускаемую люминесценцию, используя микропланшетный люминометр (время интегрирования 500 мс). Полученные относительные единицы люминесценции (ОЕЛ) преобразовывали в % цитотоксичности, используя вышеупомянутый контрольный образец, содержащий только питательную среду (% цитотоксичности = 1 - [ОЕЛ лунки/среднее значение ОЕЛ контрольной питательной среды]). Данные (% цитотоксичности от концентрации ADC (log10(нМ)) наносили на график и аппроксимировали к кривым, используя методы нелинейной регрессии (четырехпараметрическое распределение-переменный наклон), используя программное обеспечение GraphPad Prism версии5. 02 для получения расчетных значений ЕС50.
3. Оценка отношения лекарственного вещества к антителу (DAR)
Среднюю степень конъюгации токсина-линкера с антителом оценивали с помощью хроматографии с гидрофобным взаимодействием и высокоэффективной жидкостной хроматографии-масс-спектрометрии. Указанные технологии описаны в публикации Antibody Drug Conjugates, Methods in Molecular Biology, том 1045, 2013. сс. 275-284. L. Ducry, ред., и Asish В. Chakraborty, Scott J. Berger and John C. Gebler, Characterization of an IgGI Monoclonal Antibody and related Sub-structures by LC/ESI-TOF/MS: Application note, Waters Corporation, март 2007 года. 720002107EN.
Способ 1. Хроматография с гидрофобным взаимодействием
Конъюгаты антитела с лекарственным веществом анализировали посредством хроматографии с гидрофобным взаимодействием (ХГВ) на колонке TSKgel® Butyl-NPR (Tosoh Bioscience; 4,6 мм × вн. диам. 35 мм; размер частиц 2,5 мкм), подключенной к ВЭЖХ Agilent серии 1100. Образцы вводили (5 мкл) со скоростью 4 мг/мл или более. Использовали элюирование линейным градиентом, начиная с 95% подвижной фазы А/5% подвижной фазы В с переходом на 5% подвижной фазы А/95% подвижной фазы В за 12 минут (подвижная фаза А: 1,5 М сульфат аммония + 25 мМ фосфат натрия при рН 6,95, и подвижная фаза В: 25% изопропанола, 75% 25 мМ фосфата натрия при рН 6,95). Альтернативные градиенты, содержащие такие же компоненты подвижных фаз, обеспечивали улучшенное разделение некоторых конъюгатов. Ввод пробы не модифицированного антитела обеспечивал способ идентификации пика с DAR=0. Антитела обнаруживали на основании поглощения при 280 нм.
Способ 2. Сверхэффективная жидкостная хроматография-масс-спектрометрия для оценки DAR
Для характеристики конъюгатов антитела с лекарственным веществом по степени конъюгации лекарства после восстановления дитиотреитолом использовали обращенно-фазовую сверхэффективную жидкостную хроматографию в тандеме с ИЭР-QToF-масс-спектрометрией (СВЭЖХ-ИЭР-QToF-MC). Характеристику проводили, используя Acquity-UPLC® (класса Н) Bio, подключенный к QToF масс-спектрометру Quattro-Premier™ с источником электрораспылительной ионизации (WATERS Corporation). СВЭЖХ анализ восстановленного образца ADC проводили при 70°C с помощью колонки PolymerX™ 5u PR-1 100A, 50×2,0 мм (Phenomenex, Inc.) и с подвижной фазой, состоящей из растворителя А: ацетонитрил/вода/трифторуксусная кислота/муравьиная кислота (10/90/0,1/0,1, об./об. %) и растворителя В: ацетонитрил/муравьиная кислота (100/0,1 об./об.). Компоненты образца восстановленного ADC элюировали линейным градиентом, начиная с растворителя А/растворителя В (80/20 об./об.) и со скоростью потока 0,3 мл/мин., до растворителя А/растворителя В (40/60, об./об.) за 25 минут, а затем до растворителя А/растворителя В (10/90, об./об. %) за 2 минуты, затем снова уравновешивали до исходных условий. Общее время хроматографирования составило 30 минут. Данные общего ионного тока (TIC) в ESI-ToF-MC записывали в диапазоне 500-4500 m/z с помощью программного обеспечения для сбора данных MassLynx™ (Waters Corporation). Данные о массе компонентов образца записывали в V-режиме определения положительных ионов, а источник ИЭР эксплуатировали при температуре источника: 150°С, температура десольватации: 350°С, газ десольватации: 800 л/ч, напряжение на пробоотборном конусе: 60 В, капиллярное напряжение: 3,0 кВ, газ десольватации: азот, и газ для соударений: аргон. Суммарные масс-спектры TIC для каждого пика разворачивали по алгоритму Maximum Entropy™ I (Мах-Ent1) с получением данных о нейтральной массе компонента пика.
4. Получение образцов восстановленных ADC для анализа СВЭЖХ/ИЭР-ToF-МС
Восстановление дисульфидных связей в антителе ADC (~ 1 мкг/мкл раствор) с получением легких и тяжелых цепей проводили с помощью 20 мМ DTT при 60°С в течение 20 минут. Для анализа СВЭЖХ/ИЭР-ToF-MC использовали объем вводимой пробы образца восстановленного ADC 5-10 мкл.
5. Определение относительной аффинности ADC к антигену с применением анализа равновесного нативного связывания
Связывание антител и их конъюгатов классифицировали с помощью анализа равновесного нативного связывания. Эксперимент проводили для сравнения связывания трастузумаба и конъюгатов антитела с лекарственным веществом на основе трастузумаба с клеточной линией MDA-MB-231 (АТСС: НТВ-26). Клетки MDA-MB-231 выращивали так, как описано на предоставленном информационном листке поставщика. Клетки (конфлюентность ~ 60%) один раз промывали PBS и извлекали из культуральной колбы с помощью буфера для диссоциации клеток (Sigma 5914), затем повторно суспендировали в среде для выращивания культуры и переносили в 96-луночный планшет с V-образным дном (Sartstedt 82. 1583. 001; 50000 клеток на лунку), затем центрифугировали клетки (400 × g, 3 мин.) и отбрасывали надосадочный раствор. Антитело и конъюгаты антитела с лекарственным веществом титровали в ледяной среде для клеточных культур, 1:3, от исходной концентрации 60 мкг/мл. Титрованные соединения (20 мкл) использовали для повторного суспендирования клеточного осадка, а затем выращивали с клетками в течение ночи до достижения равновесия. Несвязанное антитело вымывали посредством двукратного центрифугирования и повторного суспендирования клеток в буфере FACS (200 мкл; PBS рН 7,4, содержащий 1% FBS), затем центрифугировали и повторно суспендировали в том же буфере (200 мкл), содержащем 2 мкг/мл козьего античеловеческого IgG-Fc-Alexa647 (Jackson Immuno кат. №109-605-098) и 2,5 мкг/мл 7-актиномицина D (Sigma кат. № A9400), и инкубировали на льду в течение 30 минут. Клетки промывали так, как описано выше, повторно суспендировали в 50 мкл буфера FACS и анализировали проточной цитометрией (BD Accuri), и исключали 7-AAD-положительные события. Использовали GraphPad Prism для построения кривых по данным, используя анализ нелинейной регрессии с 4 параметрами и переменным наклоном. Данные представительного эксперимента ранжирования относительной аффинности представлены на Фиг. 6.
Пример 7: Конъюгаты антитела и лекарственного вещества с соединениями Формулы I.
Используя такие же способы, как описаны в примерах 5 и 6, получали следующие ADC трастузумаба, где n=0, 1, 2, 3, 4, 5, 6, 7 или 8. Средний n составлял ~ 4.
T-MTvc-Соединение 5
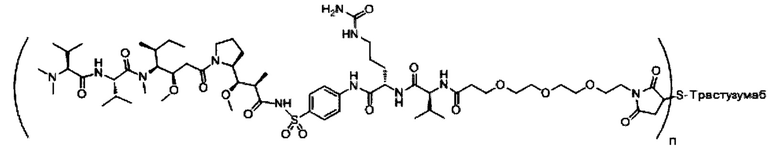
Цитотоксичность T-MTvc-Соединения 5 в отношении Her2-положительных клеточных линий NCI-N87 и НСС1954 и в отношении Her2-отрицательной клеточной линии Jurkat представлена в таблице 3 и на Фиг. 3-5.

Пример 7. 1: Конъюгаты антитела и лекарственного вещества с соединениями Формулы I.
Используя такие же способы, как описаны в примере 6. 1, получали следующие конъюгаты антитела с лекарственным веществом из трастузумаба (герцептин, Roche), ритуксимаба (ритуксан, Roche) и брентуксимаба (сАС-10), где n в среднем был равен 4.
T-MTvc-Соединение 5

B-MTvc-Соединение 5

R-MTvc-Соединение 5

T-MTvc-Соединение 11

B-MTvc-Соединение 11

T-MTvc-Соединение 14
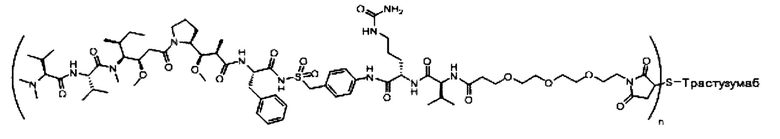
B-MTvc-Соединение 14

T-MTvc-Соединение 8

T-MTvc-Соединение 32

T-MTvc-Соединение 30

Т-МТ-Соединение 5

T-MCvcPABC-Соединение 80
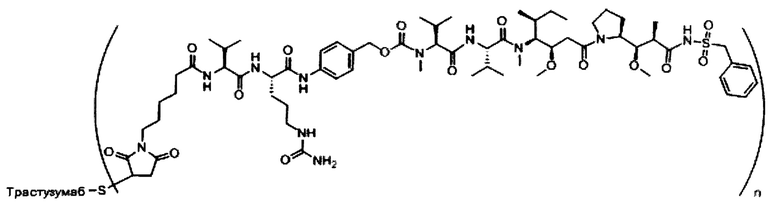
Цитотоксичность конъюгатов антитела с лекарственным веществом из примера 7 испытывали на антиген-положительных и антиген-отрицательных клеточных линиях. Результаты представлены в таблице 3.1.
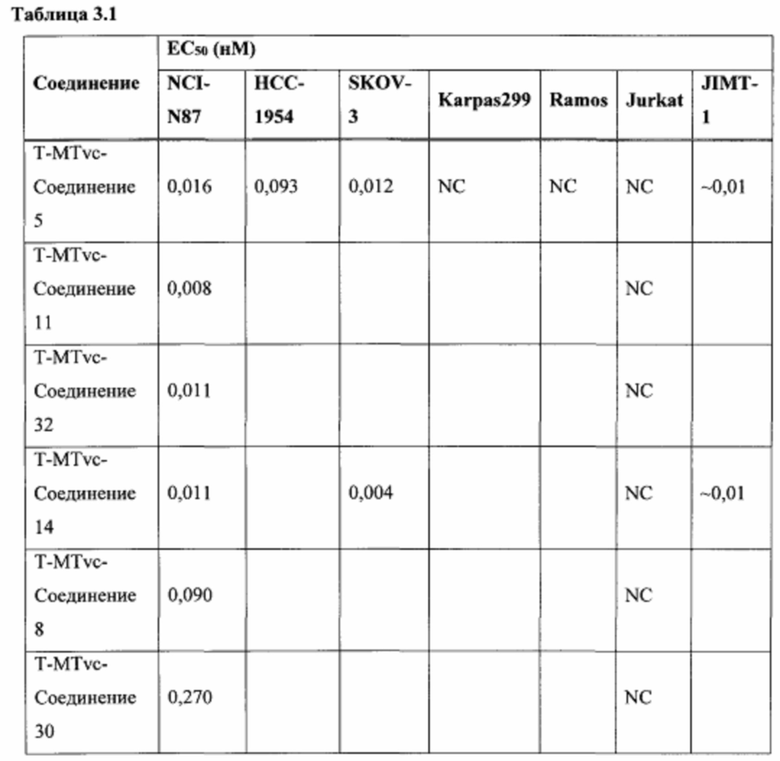

NC = не является цитотоксичным.
Пример 8: Испытание эффективности токсинов у мышей с опухолью РС-3
Исследуемые соединения вводили внутривенно (IV). Доза примерно равна максимально переносимой дозе. Одну инъекцию исследуемого соединения вводили каждые семь дней в течение четырех повторов/инъекций или в виде одной инъекции каждые семь дней в течение трех повторов/инъекций. Носитель: 6,3% трегалоза, 0,05% Tween® 20, 20 мМ цитратный буфер, рН 5,0, 4°С.
1. Описание методики
Самок бестимусных «голых» мышей, приобретенных у компании Harlan Laboratories, возрастом 7-8 недель, инокулировали подкожной инъекцией в спину 5×106 опухолевых клеток PC-3 в 0 день эксперимента. Еженедельно в понедельник, среду и пятницу. После того, как опухоли достигали в объеме 150-200 мм3, животных распределяли в одну из 4 групп лечения с целью уравновешивания среднего объема опухоли среди групп. Животных лечили соответствующим соединением, измерения опухоли продолжали каждый понедельник, среду и пятницу.
2. Клетки РС-3: Получение клеток - тканевая культура
Клеточную линию аденокарциномы предстательной железы человека приобретали у АТСС (кат. № CRL-1435). Клетки выращивали из замороженного в пробирке лабораторного раствора, замороженного в оригинальной пробирке АТСС, проверяли на отрицательный результат микоплазмы и хранили в лабораторных резервуарах с жидким азотом. Клеточные культуры с пересевом №3-№10 и степенью слияния 80-90% собирали для in vivo исследований. Клетки выращивали в среде Хэма F12 с добавлением 2 мМ L-глутамина и 10% FBS при 37°С/в среде с 5% CO2. Один раз в неделю клетки пересевали с индексом разведения от 1:3 до 1:6 и обеспечивали их расширение. Раз в неделю обновляли среду.
3. Получение клеток - сбор для имплантации
Клетки один раз быстро промывали 2 мл свежего раствора трипсина/ЭДТА (0,25% трипсина с ЭДТА. 4Na), затем аспирировали избыточный трипсин/ЭДТА. Затем добавляли 1,5 мл трипсина/ЭДТА и укладывали пробирку горизонтально, чтобы все клетки были покрыты трипсином/ЭДТА. Затем клетки инкубировали при 37°С в течение нескольких минут. Клетки наблюдали под инвертационным микроскопом, чтобы убедиться в диспергировании клеточного слоя, затем добавляли свежую среду и брали образец клеточной суспензии объемом 50 мкл, и смешивали с трипановым синим (1:1), и подсчитывали клетки, и оценивали жизнеспособность клеток с помощью Cellometer® Auto T4. Клетки центрифугировали при 1000 об/мин в течение 7 минут и аспирировали надосадочную жидкость. Затем клетки повторно суспендировали в питательной среде до приблизительной концентрации для инокуляции. Объем инъекции составлял 100 мкл на одно животное.
4. Имплантация опухолевых клеток - подкожно в спину
На 0 день 5,0×106 опухолевых клеток имплантировали подкожно в спину мышей в объеме 100 мкл, используя иглу номер 27/28 под изофлурановой анестезией.
5. Условия содержания животных
Животных содержали в проветриваемых клетках, по 2-5 животных на клетку, с 12-часовым циклом освещения/темноты. Животным давали стерильную пищу и воду ad libitum, а содержание и использование животных проводили в соответствии с руководством Канадского совета по уходу за животными. С животными работали в асептических условиях, и клетки меняли каждые 10-14 дней.
6. Сбор данных (размер опухоли)
Развитие опухоли у мышей контролировали каждый понедельник, среду и пятницу. Размеры образовавшихся опухолей измеряли штангенциркулем. Объем опухоли рассчитывали по уравнению [L×W2]÷2, где длина (L) представляет собой наибольшую ось опухоли. Во время измерения опухоли животных также взвешивали. Опухоли оставляли достигать максимального размера 800 мм3.
7. Методы анализа: Кривые роста объема опухоли в зависимости от дня эксперимента
Объем опухоли в каждой группе наносили на график зависимости от дня лечения. Кривые роста отсекали в каждой группе в тот момент времени, когда первое животное достигало экспериментальной конечной точки размера опухоли (800 мм3), или в последний день испытаний. Любое животное, вышедшее из исследования до отсечения кривой роста в группе, полностью исключали из исследования.
8. Исключение животных
Животных с изъязвленными опухолями, требующими усыпления животного, с объемом опухоли 700 мм3 или менее, исключали из исследования и не учитывали при анализе данных (за исключением дней до рецидива, если конечный объем опухоли был >2,0 раза больше, чем в день лечения).
Пример 9: Определение диапазона эффективности доз конъюгатов антитела с лекарственным веществом в модели опухоли NCI-N87 с использованием NOD SCID гамма-мышей
Исследуемые соединения вводили внутривенно (IV), только один раз. Испытывали дозы 3, 7 и 12 мг/кг. Носитель: 20 мМ цитрат натрия, 6,3% трегалоза, 0,02% Tween® 20, рН 5, 4°С.
1. Описание методики
Семьдесят шесть (76) самок NOD/SCID гамма-мышей (NSG), приобретенных у компании The Jackson Laboratory (JAX® Mice), возрастом 7-8 недель, инокулировали подкожной инъекцией в нижнюю часть спины 5×106 опухолевых клеток NCI-N87 в матригеле в 0 день эксперимента. Еженедельно в понедельник, среду и пятницу. После того, как опухоли достигали в объеме 150-200 мм3, животных распределяли в одну из 10 групп лечения с целью уравновешивания среднего объема опухоли среди групп. Животных лечили соответствующим соединением, измерения опухоли продолжали каждый понедельник, среду и пятницу.
2. Получение клеток - тканевая культура: Клетки NCI-N87
Клетки карциномы желудка человека NCI-N87 получали из печеночного метастаза хорошо дифференцированной карциномы желудка перед цитотоксической терапией. Опухоль перевивали в виде ксенотрансплантата у бестимусных «голых» мышей в три пересева до образования клеточной линии. Клетки NCI-N87 приобретали у компании АТСС (кат. № CRL-5822) и проверяли на отрицательный результат на RADIL в отношении микоплазмы и мышиных патогенов.
Клетки выращивали из замороженного в пробирке лабораторного раствора, замороженного в оригинальной пробирке АТСС, и хранили в лабораторных резервуарах с жидким азотом. Клеточные культуры с пересевом №3-№10 и степенью слияния 80-90% собирали для in vivo исследований. Клетки NCI-N87 выращивали в среде RPMI 1640 с 1,0 мМ L-глутамина и 10% FBS при 37°С/в среде с 5% CO2. Один раз или два раза в неделю клетки пересевали с индексом разведения 1:3 или 1:4. Раз в неделю обновляли среду. Клетки замораживали с 5% ДМСО.
3. Получение клеток - сбор для имплантации
Клетки один раз быстро промывали сбалансированным солевым раствором Хэнкса без Са, Mg. Добавляли свежий раствор трипсина/ЭДТА (0,25% трипсина с ЭДТА. 4Na) и укладывали пробирку горизонтально, чтобы все клетки были покрыты трипсином/ЭДТА, а затем аспирировали избыточный трипсин/ЭДТА. Клетки инкубировали при 37°С в течение нескольких минут. Клетки наблюдали под инвертационным микроскопом до полного диспергирования клеточного слоя, а затем добавляли свежую среду. Затем брали образец клеточной суспензии объемом 50 мкл и смешивали с трипановым синим (1:1), и подсчитывали клетки, и оценивали жизнеспособность клеток с помощью гемоцитометра. Жизнеспособность должна быть ≥90%. Клетки центрифугировали при 125 RCF (1000 об./мин.) в течение 7 минут и аспирировали надосадочную жидкость. Клетки повторно суспендировали в холодной питательной среде до 2-кратной требуемой конечной концентрации (100×106/мл). Суспензию смешивали (на льду) с матригелем (1:1). Полученную клеточную суспензию (50×106 клеток/мл) использовали для доставки 5×106 клеток в объеме инъекции 100 мкл на одно животное. Все оборудование, приводимое в контакт с матригелем (иглы, шприцы, кончики пипеток), охлаждали перед инъекцией.
4. Имплантация опухолевых клеток - подкожно (SC) (NCI-N87)
Перед инокуляцией у каждой мыши в нижней части спины выбривали область размером приблизительно 2×2 см и очищали спиртом. На 0 день 5,0×106 опухолевых клеток имплантировали подкожно в спину мышей в объеме 100 мкл, используя иглу номер 27/28 под изофлурановой анестезией.
5. Условия содержания животных
Животных содержали в проветриваемых клетках, по 2-5 животных на клетку, с 12-часовым циклом освещения/темноты. Животным давали стерильную пищу и воду ad libitum, а содержание и использование животных проводили в соответствии с руководством Канадского совета по уходу за животными. С животными работали в асептических условиях, и клетки меняли каждые 10-14 дней.
6. Сбор данных (размер опухоли)
Развитие опухоли у мышей контролировали каждый понедельник, среду и пятницу. Размеры образовавшихся опухолей измеряли штангенциркулем. Объем опухоли рассчитывали по уравнению [L×W2]÷2, где длина (L) представляет собой наибольшую ось опухоли. Во время измерения опухоли животных также взвешивали. Опухоли оставляли достигать максимального размера 800 мм3.
7. Методы анализа: Кривые роста объема опухоли в зависимости от дня эксперимента
Объем опухоли в каждой группе наносили на график зависимости от дня лечения. Кривые роста отсекали в каждой группе в тот момент времени, когда первое животное достигало экспериментальной конечной точки размера опухоли (800 мм3), или в последний день испытаний. Любое животное, вышедшее из исследования до отсечения кривой роста в группе, полностью исключали из исследования.
8. Исключение животных
Животных с изъязвленными опухолями, требующими усыпления животного, с объемом опухоли 700 мм3 или менее, исключали из исследования и не учитывали при анализе данных (за исключением дней до рецидива, если конечный объем опухоли был >2,0 раза больше, чем в день лечения).
Пример 10: Сравнение эффективности коньюгатов антитела с лекарственным веществом в модели опухоли NCI-N87 с использованием NOD SCID гамма-мышей.
Исследуемые соединения вводили внутривенно (IV), одно введение, 3 мг/кг. Носитель: 20 мМ цитрат натрия, 6,3% трегалоза, 0,02% Tween® 20, рН 5.
1. Описание методики
Двадцати четырем (24) самкам NOD/SCID гамма-мышей (NSG), приобретенным у компании The Jackson Laboratory (JAX® Mice), возрастом 7-8 недель, инокулировали подкожной инъекцией в нижнюю часть спины 5×106 опухолевых клеток NCI-N87 в матригеле в 0 день эксперимента. Еженедельно в понедельник, среду и пятницу. После того, как опухоли достигали в объеме 150-200 мм3, животных распределяли в одну из 3 групп лечения с целью уравновешивания среднего объема опухоли среди групп. Животных лечили соответствующим соединением, измерения опухоли продолжали каждый понедельник, среду и пятницу.
2. Получение клеток - тканевая культура: Клетки NCI-N87
Клетки карциномы желудка человека NCI-N87 получали из печеночного метастаза хорошо дифференцированной карциномы желудка перед цитотоксической терапией. Опухоль перевивали в виде ксенотрансплантата у бестимусных «голых» мышей в три пересева до образования клеточной линии. Клетки NCI-N87 приобретали у компании АТСС (кат. № CRL-5822) и проверяли на отрицательный результат в отношении микоплазмы и мышиных патогенов.
Клетки выращивали из замороженного в пробирке лабораторного раствора, замороженного в оригинальной пробирке АТСС, и хранили в лабораторных резервуарах с жидким азотом. Клеточные культуры с пересевом №3-№10 и степенью слияния 80-90% собирали для т vivo исследований. Клетки NCI-N87 выращивали в среде RPMI 1640 с 1,0 мМ L-глутамина и 10% FBS при 37°С/в среде с 5% CO2. Один раз или два раза в неделю клетки пересевали с индексом разведения 1:3 или 1:4. Раз в неделю обновляли среду. Клетки замораживали с 5% ДМСО.
3. Получение клеток - сбор для имплантации
Клетки один раз быстро промывали сбалансированным солевым раствором Хэнкса без Са, Mg. Добавляли свежий раствор трипсина/ЭДТА (0,25% трипсина с ЭДТА. 4Na) и укладывали пробирку горизонтально, чтобы все клетки были покрыты трипсином/ЭДТА, а затем аспирировали избыточный трипсин/ЭДТА. Клетки инкубировали при 37°С в течение нескольких минут. Клетки наблюдали под инвертационным микроскопом до полного диспергирования клеточного слоя, а затем добавляли свежую среду. Затем брали образец клеточной суспензии объемом 50 мкл и смешивали с трипановым синим (1:1), и подсчитывали клетки, и оценивали жизнеспособность клеток с помощью гемоцитометра. Жизнеспособность должна быть ≥90%. Клетки центрифугировали при 125 RCF (1000 об./мин.) в течение 7 минут и аспирировали надосадочную жидкость. Клетки повторно суспендировали в холодной питательной среде до 2-кратной требуемой конечной концентрации (100×106/мл). Суспензию смешивали (на льду) с матригелем (1:1). Полученную клеточную суспензию (50×106 клеток/мл) использовали для доставки 5×106 клеток в объеме инъекции 100 мкл на одно животное. Все оборудование, приводимое в контакт с матригелем (иглы, шприцы, кончики пипеток), охлаждали перед инъекцией.
4. Имплантация опухолевых клеток - подкожно (NCI-N87)
Перед инокуляцией у каждой мыши в нижней части спины выбривали область размером приблизительно 2×2 см и очищали спиртом. На 0 день 5,0×106 опухолевых клеток имплантировали подкожно в спину мышей в объеме 100 мкл, используя иглу номер 27/28 под изофлурановой анестезией.
5. Условия содержания животных
Животных содержали в проветриваемых клетках, по 2-5 животных на клетку, с 12-часовым циклом освещения/темноты. Животным давали стерильную пищу и воду ad libitum, а содержание и использование животных проводили в соответствии с руководством Канадского совета по уходу за животными. С животными работали в асептических условиях, и клетки меняли каждые 10-14 дней.
6. Сбор данных (размер опухоли)
Развитие опухоли у мышей контролировали каждый понедельник, среду и пятницу. Размеры образовавшихся опухолей измеряли штангенциркулем. Объем опухоли рассчитывали по уравнению [L×W2]÷2, где длина (L) представляет собой наибольшую ось опухоли. Во время измерения опухоли животных также взвешивали. Опухоли оставляли достигать максимального размера 800 мм3.
7. Методы анализа: Кривые роста объема опухоли в зависимости от дня эксперимента
Объем опухоли в каждой группе наносили на график зависимости от дня лечения. Кривые роста отсекали в каждой группе в тот момент времени, когда первое животное достигало экспериментальной конечной точки размера опухоли (800 мм3), или в последний день испытаний. Любое животное, вышедшее из исследования до отсечения кривой роста в группе, полностью исключали из исследования.
8. Исключение животных
Животных с изъязвленными опухолями, требующими усыпления животного, с объемом опухоли 700 мм3 или менее, исключали из исследования и не учитывали при анализе данных (за исключением дней до рецидива, если конечный объем опухоли был >2,0 раза больше, чем в день лечения).
Пример 10. 1: Сравнение эффективности конъюгатов антитела с лекарственным веществом в модели опухоли NCI-N87 с использованием NOD SCID гамма-мышей.
Исследуемые соединения вводили внутривенно (IV), только один раз, 5 мг/кг. Носитель: фосфатно-солевой буферный раствор без кальция или магния, рН 7,4.
1. Описание методики
Самкам NOD/SCID гамма-мышей (NSG), приобретенным у компании The Jackson Laboratory (JAX® Mice), возрастом 7-8 недель, инокулировали подкожной инъекцией в нижнюю часть спины 5×106 опухолевых клеток NCI-N87 в матригеле в 0 день эксперимента. Опухоли измеряли каждый понедельник, среду и пятницу. После того, как опухоли достигали в объеме 150-200 мм3, животных распределяли в одну из 10 групп лечения с целью уравновешивания среднего объема опухоли среди групп. Животных лечили соответствующим соединением, измерения опухоли продолжали каждый понедельник, среду и пятницу.
2. Получение клеток - тканевая культура: Клетки NCI-N87
Клетки карциномы желудка человека NCI-N87 получали из печеночного метастаза хорошо дифференцированной карциномы желудка перед цитотоксической терапией. Опухоль перевивали в виде ксенотрансплантата у бестимусных «голых» мышей в три пересева до образования клеточной линии. Клетки NCI-N87 приобретали у компании АТСС (кат. № CRL-5822) и проверяли на отрицательный результат в отношении микоплазмы и мышиных патогенов.
Клетки выращивали из замороженного в пробирке лабораторного раствора, замороженного в оригинальной пробирке АТСС, и хранили в лабораторных резервуарах с жидким азотом. Клеточные культуры с пересевом №3-№10 и степенью слияния 80-90% собирали для in vivo исследований. Клетки NCI-N87 выращивали в среде RPMI 1640 с 1,0 мМ L-глутамина и 10% FBS при 37°С/в среде с 5% CO2. Один раз или два раза в неделю клетки пересевали с индексом разведения 1:3 или 1:4. Раз в неделю обновляли среду. Клетки замораживали с 5% ДМСО.
3. Получение клеток - сбор для имплантации
Клетки один раз быстро промывали сбалансированным солевым раствором Хэнкса без Са, Mg. Добавляли свежий раствор трипсина/ЭДТА (0,25% трипсина с ЭДТА. 4Na) и укладывали пробирку горизонтально, чтобы все клетки были покрыты трипсином/ЭДТА, а затем аспирировали избыточный трипсин/ЭДТА. Клетки инкубировали при 37°С в течение нескольких минут. Клетки наблюдали под инвертационным микроскопом до полного диспергирования клеточного слоя, а затем добавляли свежую среду. Затем брали образец клеточной суспензии объемом 50 мкл и смешивали с трипановым синим (1:1), и подсчитывали клетки, и оценивали жизнеспособность клеток с помощью гемоцитометра. Жизнеспособность составляла ≥90%. Клетки центрифугировали при 125 RCF (1000 об./мин.) в течение 7 минут и аспирировали надосадочную жидкость. Клетки повторно суспендировали в холодной питательной среде до 2-кратной требуемой конечной концентрации (100×106/мл). Суспензию смешивали (на льду) с матригелем (1:1). Полученную клеточную суспензию (50×106 клеток/мл) использовали для доставки 5×106 клеток в объеме инъекции 100 мкл на одно животное. Все оборудование, приводимое в контакт с матригелем (иглы, шприцы, кончики пипеток), охлаждали перед инъекцией.
4. Имплантация опухолевых клеток - подкожно (SC) (NCI-N87)
Перед инокуляцией у каждой мыши в нижней части спины выбривали область размером приблизительно 2×2 см и очищали спиртом. На 0 день 5,0×106 опухолевых клеток имплантировали подкожно в спину мышей в объеме 100 мкл, используя иглу номер 27/28 под изофлурановой анестезией.
5. Условия содержания животных
Животных содержали в проветриваемых клетках, по 2-5 животных на клетку, с 12-часовым циклом освещения/темноты. Животным давали стерильную пищу и воду ad libitum, а содержание и использование животных проводили в соответствии с руководством Канадского совета по уходу за животными. С животными работали в асептических условиях, и клетки меняли каждые 10-14 дней.
6. Сбор данных (размер опухоли)
Развитие опухоли у мышей контролировали каждый понедельник, среду и пятницу. Размеры образовавшихся опухолей измеряли штангенциркулем. Объем опухоли рассчитывали по уравнению [L×W2]÷2, где длина (L) представляет собой наибольшую ось опухоли. Во время измерения опухоли животных также взвешивали. Опухоли оставляли достигать максимального размера 800 мм3.
7. Методы анализа: Кривые роста объема опухоли в зависимости от дня эксперимента
Объем опухоли в некоторых группах лечения в течение экспериментальных дней представлен на графиках на Фиг. 7. Кривые роста отсекали в каждой группе в тот момент времени, когда первое животное достигало экспериментальной конечной точки размера опухоли (800 мм3), или в последний день испытаний. Любое животное, вышедшее из исследования до отсечения кривой роста в группе, полностью исключали из исследования.
8. Исключение животных
Животных с изъязвленными опухолями, требующими усыпления животного, с объемом опухоли 700 мм3 или менее, исключали из исследования и не учитывали при анализе данных (за исключением дней до рецидива, если конечный объем опухоли был >2,0 раза больше, чем в день лечения).
Пример 11: Сравнение эффективности конъюгатов антитела с лекарственным веществом в модели опухоли Karpas 299 с использованием мышей линии С.В-17/IcrHsd-Prkdcscid.
Исследуемые соединения вводили IV, в виде четырех введений по 1 мг/кг на 21 день, 25 день, 29 день и 33 день. Носитель: фосфатно-солевой буферный раствор без кальция или магния, рН 7,4.
1. Описание методики
Самкам мышей C.B-17/lcrHsd-Prkdcscid (СВ. 17-SCID), приобретенным у компании Harlan, подкожно, в нижнюю часть спины инокулировали 1 миллион клеток линии Karpas 299, экспрессирующих CD30. Развитие опухоли у мышей контролировали каждый понедельник, среду и пятницу. Размеры образовавшихся опухолей измеряли штангенциркулем. Объем опухоли рассчитывали по уравнению [L×W2]÷2, где длина представляет собой наибольшую ось опухоли. Во время измерения опухоли животных также взвешивали. Животных рандомизировали на 21 день по объему опухоли, когда средний объем опухоли достиг 141,32 мм3. Во время рандомизации количество мышей в группе уменьшали до 6. Мышам по графику вводили четыре отдельные внутривенные инъекции соответствующего соединения на 21 день, 25 день, 29 день и 33 день, и измеряли опухоли каждый понедельник, среду и пятницу.
1. Получение клеток - тканевая культура: Karpas 299
Клеточная линия Т-клеточной лимфомы человека Karpas 299 была получена из периферической крови 25-летнего мужчины с Т-клеточной неходжкинской лимфомой в 1986 году; в настоящее время она классифицирована как CD30+ анапластическая крупноклеточная лимфома (ALCL); клетки несут гибридный ген NPM-ALK. Клетки Karpas 299 приобретали у компании Health Protection Agency Culture Collections (кат №06072604 и испытывали на отрицательный результат в отношении микоплазмы).
Клетки выращивали из замороженного в пробирке лабораторного раствора. Клеточные культуры 3-10 пересева и с плотностью, поддерживаемой на уровне от 5×105 до 2×106 клеток/мл, собирали для in vivo исследований. Клетки выращивали в виде суспензии в среде RPMI 1640 + 2 мМ глутамина + 20% эмбриональной бычьей сыворотки при 37°С в среде с 5% СО2. Два раза в неделю клетки пересевали с индексом разведения 1:3 и обеспечивали их расширение.
2. Получение клеток - сбор для имплантации
Клетки центрифугировали и один раз промывали сбалансированным солевым раствором Хэнкса без Са, Mg. Затем брали 50 мкл клеточной суспензии и смешивали с трипановым синим (1:1), и подсчитывали клетки, и оценивали на жизнеспособность с помощью Cellometer Auto4. Жизнеспособность составляла ≥90%. Клетки центрифугировали при 200 g в течение 7 минут и аспирировали надосадочную жидкость. Клетки повторно суспендировали в питательной среде для подкожной инокуляции. Полученную клеточную суспензию использовали для подкожной доставки 1×106 клеток в объеме 50 мкл.
3. Имплантация опухолевых клеток - подкожно (Karpas 299)
Перед инокуляцией у каждой мыши в нижней части спины выбривали область размером приблизительно 2×2 см и очищали спиртом. На 0 день 0,1×106 клеток имплантировали подкожно в спину мышей в объеме 50 мкл, используя иглу номер 27/28 под изофлурановой анестезией.
4. Условия содержания животных
Животных содержали в проветриваемых клетках, по 3-4 животных на клетку, с 12-часовым циклом освещения/темноты. Животным давали стерильную пищу и воду ad libitum, а содержание и использование животных проводили в соответствии с руководством Канадского совета по уходу за животными. С животными работали в асептических условиях, и клетки меняли каждые 10-14 дней.
5. Сбор данных (размер опухоли)
Развитие опухоли у мышей контролировали каждый будний день, начиная с 11 дня после инокуляции. Размеры образовавшихся опухолей измеряли штангенциркулем. Объем опухоли рассчитывали по уравнению [L×W2]÷2, где длина (мм) представляет собой наибольшую ось опухоли. Во время измерения опухоли животных также взвешивали (только в понедельник, среду и пятницу). После введения лекарственных препаратов опухоли измеряли три раза в неделю в понедельник, среду и пятницу. Опухоли оставляли достигать максимального размера 800 мм3.
6. Методы анализа: Кривые роста объема опухоли в зависимости от дня эксперимента
Объем опухоли в каждой группе наносили на график зависимости от дня лечения, представленный на Фиг. 8. Кривые роста отсекали в каждой группе в тот момент времени, когда первое животное достигало экспериментальной конечной точки размера опухоли (800 мм3), или в последний день испытаний. Любое животное, вышедшее из исследования до отсечения кривой роста в группе, полностью исключали из исследования.
7. Исключение животных
Животных с изъязвленными опухолями, требующими усыпления животного, с объемом опухоли 700 мм3 или менее, исключали из исследования и не учитывали при анализе данных (за исключением дней до рецидива, если конечный объем опухоли был >2,0 раза больше, чем в день лечения).
Пример 12: Переносимость конъюгатов антитела с лекарственным веществом у самок крыс Спрага-Доули
Исследуемые соединения вводили внутривенно (IV), одно введение, в 0 день. Состав исследуемого препарата: фосфатно-солевой буферный раствор без кальция или магния, рН 7,4.
1. Описание методики
Сорок три самки Спрага-Доули (линия 001) приобретали у компании Charles River Labs и оставляли на 5 дней для акклиматизации до начала исследования. Исследуемые соединения вводили IV в 0 день. Измеряли массу тела животных и проводили клинические наблюдения до инъекции в день инъекции, ежедневно в течение по меньшей мере трех дней после введения, затем три раза в неделю до конца исследования (предпочтительно каждый понедельник, среду и пятницу), а также непосредственно перед усыплением. На 22 день животных усыпляли с помощью CO2 и проводили вскрытие. Необычные наблюдения фотографировали.
2. Условия содержания животных
Животных содержали в проветриваемых клетках, по 2-3 животных на клетку, с 12-часовым циклом освещения/темноты. Животным давали пищу и воду ad libitum, а содержание и использование животных проводили в соответствии с руководством Канадского совета по уходу за животными. Клетки меняли один раз в неделю. Период акклиматизации в течение по меньшей мере 5 дней был обязательным до начала лечения. Во время периода акклиматизации проводили подробный клинический осмотр и измеряли массу тела. Для исследования использовали только здоровых животных. Всех животных маркировали с помощью татуировки на хвосте. Клетки маркировали индивидуальными картами с информацией, содержащей номер протокола, номер комнаты, имя руководителя исследования, телефон руководителя исследования, вид и штамм, пол, массу, дату поступления и название поставщика.
3. Введение исследуемого соединения
Животных взвешивали по отдельности и вводили требуемые объемы исследуемого соединения так, чтобы введение обеспечивало предписанную дозу.
4. Внутривенное введение
Крысам вводили растворы посредством болюсной внутривенной (IV) инъекции. Растворы доз вводили посредством внутривенного болюса, используя иглу размером <23, через латеральную хвостовую вену. Объем дозы, составляющий 7 мл/кг, корректировали в соответствии с индивидуальной массой тела, измеренной за один день до дня инъекции. Обработанных крыс возвращали в клетки и наблюдали до момента гемостаза.
5. Наблюдение животных и сбор данных
Наблюдение эффектов острой токсичности проводили с помощью «Отчета о клинических наблюдениях после инъекции» для оценки тяжести течения заболевания и облегчения определения гуманных конечных точек до 24 часов после введения. В конце рабочего дня в день введения (~ 6 часов после введения дозы), если животные демонстрировали клинические симптомы такой степени, что их нельзя было оставить в течение ночи без наблюдения, их либо усыпляли и считали достигшими конечной точки токсичности, либо регулярно наблюдали до того момента, когда можно было их безопасно оставить на ночь.
Через 24 часа после введения животных наблюдали на хроническую токсичность, используя «Отчет о клинических наблюдениях в испытании переносимости». Животных наблюдали в соответствии со следующей периодичностью/схемой: До инъекции в день инъекции, ежедневно в течение по меньшей мере трех дней после введения, затем три раза в неделю до конца исследования (предпочтительно каждый понедельник, среду и пятницу), а также непосредственно перед усыплением. Животных наблюдали чаще, если они проявляли значительные признаки тяжелого течения заболевания. Животных, достигших гуманной конечной точки, усыпляли и проводили вскрытие для определения любых значительных патологий в печени, селезенке, почках, легких, сердце, желудочно-кишечном тракте и мочевом пузыре.
Результаты испытания переносимости представлены на Фиг. 9 и 10.
Полученные данные демонстрируют, что укороченные соединения Формулы I, в которых Х отсутствует, переносятся лучше, чем их полноразмерные аналоги, где Х представляет собой -C(O)NHCH(CH2R3)-.
Пример 13. Анализ ареста клеточного цикла
Клетки Jurkat (ATCC), выращенные в среде RMPI-1640 с добавлением 10% FBS, получали с логарифмическим ростом. 1 миллион клеток/мл высевали на 12-луночные, обработанные тканевой культурой планшеты в объеме 950 мкл. Клетки обрабатывали Соединением 5 в 50 мкл питательной среды, так что конечная концентрация Соединения 5 составляла 50 нМ, контрольные клетки обрабатывали только 50 мкл питательной среды. Клетки инкубировали в течение 24 часов при 37°С, 5% CO2 в увлажненном инкубаторе. После инкубации клетки повторно тщательно суспендировали и переносили в пробирки FACS объемом 5 мл, и хранили на льду. Проводили два промывания, замедляя вращение клеток в центрифуге с бакет-ротором при 450 × g в течение 4 минут, повторно суспендируя в 1 мл ледяного PBS. Клетки фиксировали, по каплям добавляя 3 мл ледяного 100% этанола на вортексе, и сразу хранили при 4°С в течение 1 часа. В течение 1 часа инкубации получали следующий окрашивающий раствор в ледяном PBS: 10 мкг/мл йодида пропидия, 10 Е/мл РНКазы If и 0,05% Triton X-100. Через 1 час фиксирующей инкубации удаляли этанол посредством вращения клеток, как описано выше, и два раза промывали, используя 1 мл ледяного PBS. Клетки повторно суспендировали в 500 мкл описанного выше окрашивающего раствора и инкубировали при комнатной температуре в течение 1 часа. Данные о событиях получали на цитометре BD C6 HTFC, удаляя дебрис и слипшиеся частицы с помощью дискриминационного окна. Гистограммы строили с помощью FCS Express, нанося на график количество событий в зависимости от флуоресценции в FL-3.
Иллюстративные данные анализа представлены на Фиг. 11. Гистограммы содержания ДНК демонстрируют, что большинство необработанных клеток находятся в фазе G0/G1 с выраженным сдвигом в сторону фазы G2/M клеточного цикла после обработки Соединением 5.
Все патенты США, публикации заявок на патент США, заявки на патент США, иностранные патенты, иностранные заявки на патент и не патентные публикации, упомянутые в настоящем описании, включены в настоящий документ посредством ссылки в полном объеме, до той степени, до которой они не противоречат настоящему описанию. Из изложенного выше описания понятно, что несмотря на то, что конкретные варианты реализации, описанные в настоящем документе, описаны в иллюстративных целях, могут быть сделаны различные модификации без отступления от сущности и объема изобретения, описанного в настоящем документе. Соответственно, настоящее описание не имеет иного ограничения, кроме прилагаемой формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СУЛЬФОНАМИДСОДЕРЖАЩИЕ СВЯЗЫВАЮЩИЕ СИСТЕМЫ ДЛЯ ЛЕКАРСТВЕННЫХ КОНЪЮГАТОВ | 2014 |
|
RU2729194C2 |
| ПРОИЗВОДНЫЕ ТЕТРАГИДРОБЕНЗИМИДАЗОЛА В КАЧЕСТВЕ МОДУЛЯТОРОВ АКТИВНОСТИ TNF | 2014 |
|
RU2684637C1 |
| ЛЕЧЕНИЕ СОСТОЯНИЙ, АССОЦИИРОВАННЫХ С ГИПЕРИНСУЛИНЕМИЕЙ | 2015 |
|
RU2722179C2 |
| ПРОИЗВОДНЫЕ ИМИДАЗОТРИАЗИНА В КАЧЕСТВЕ МОДУЛЯТОРОВ АКТИВНОСТИ TNF | 2014 |
|
RU2677699C1 |
| ПРОИЗВОДНЫЕ ПУРИНА В КАЧЕСТВЕ МОДУЛЯТОРОВ АКТИВНОСТИ TNF | 2014 |
|
RU2684644C1 |
| НОВЫЕ ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫ, ИХ ПОЛУЧЕНИЕ, ИХ ПРИМЕНЕНИЕ И СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ ПРЕПАРАТЫ | 1998 |
|
RU2240326C2 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛОПИРИДИНА В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗЫ | 2015 |
|
RU2733400C2 |
| СПОСОБ ЛЕЧЕНИЯ ИЛИ ПРОФИЛАКТИКИ РВОТЫ У МЛЕКОПИТАЮЩИХ И ЧЕЛОВЕКА С ИСПОЛЬЗОВАНИЕМ НЕКОТОРЫХ ХИНУКЛИДИНОВЫХ ПИПЕРИДИНОВЫХ, АЗАНОРБОРНАНОВЫХ, ЭТИЛЕНДИАМИНОВЫХ ПРОИЗВОДНЫХ И РОДСТВЕННЫХ ИМ СОЕДИНЕНИЙ | 1994 |
|
RU2135179C1 |
| СОСТАВ ДЛЯ ПОЛУЧЕНИЯ МЕТАТЕЗИСНЫХ ПОЛИМЕРИЗАТОВ | 1995 |
|
RU2171815C2 |
| ЛИЗИНСПЕЦИФИЧЕСКИЕ ИНГИБИТОРЫ ДЕМЕТИЛАЗЫ-1 И ИХ ПРИМЕНЕНИЕ | 2011 |
|
RU2599248C2 |

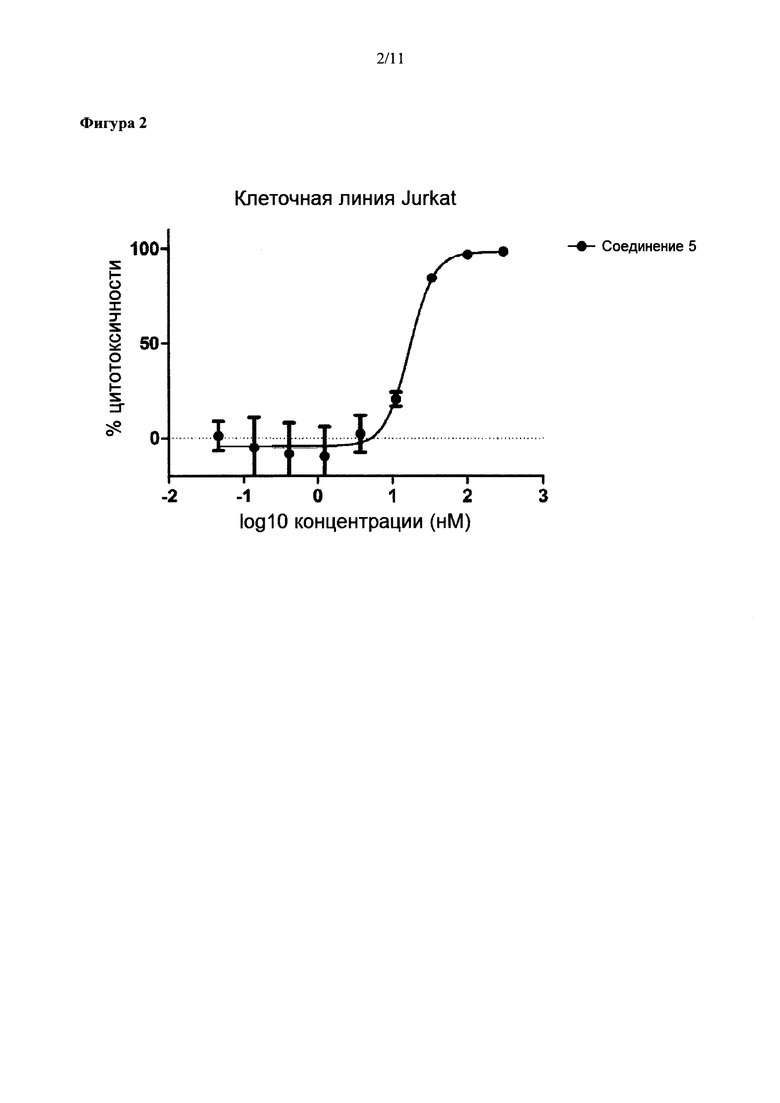
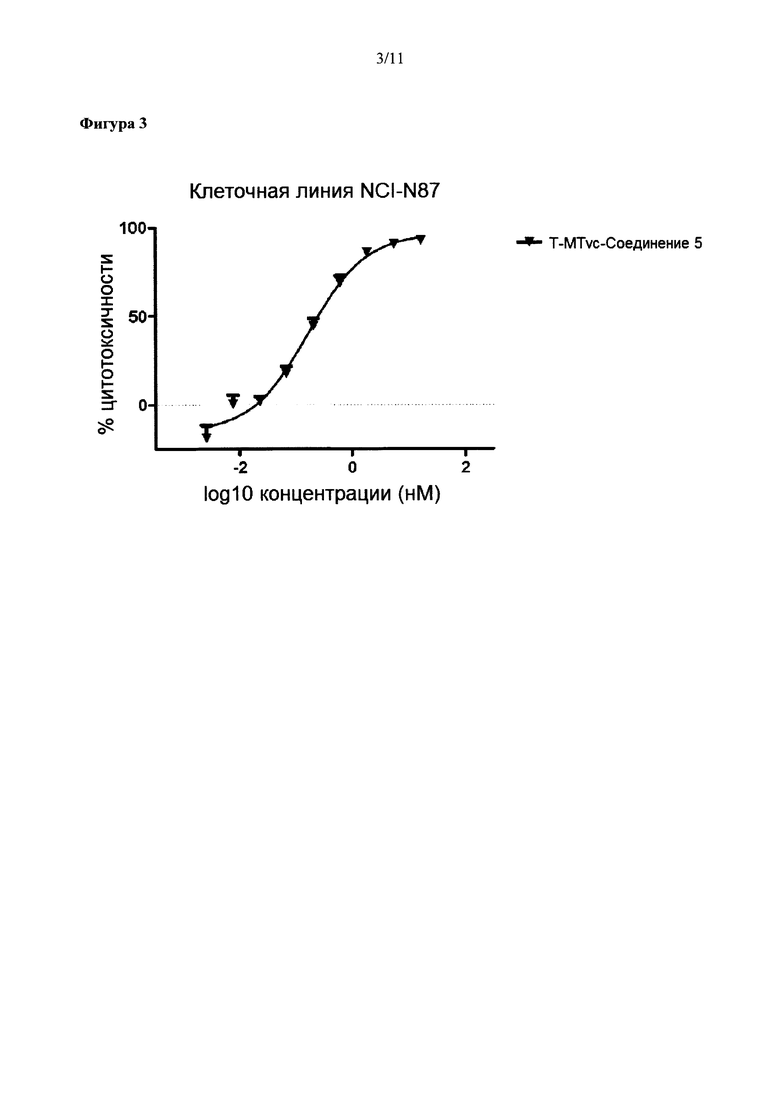

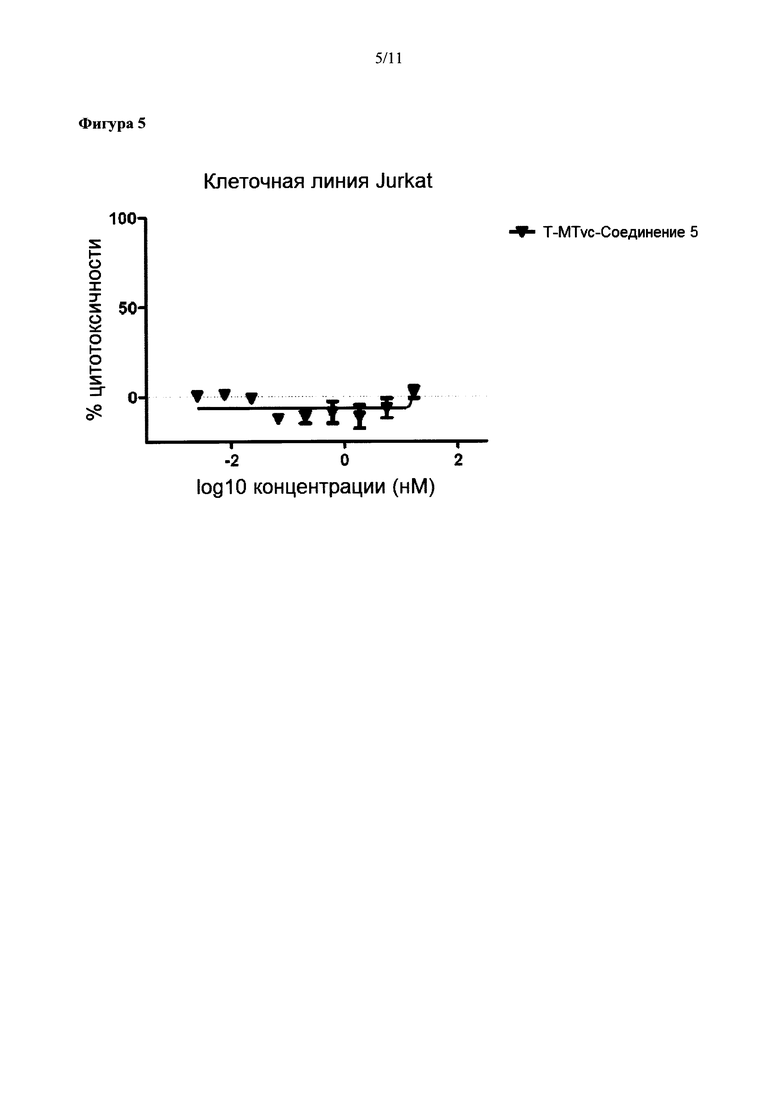





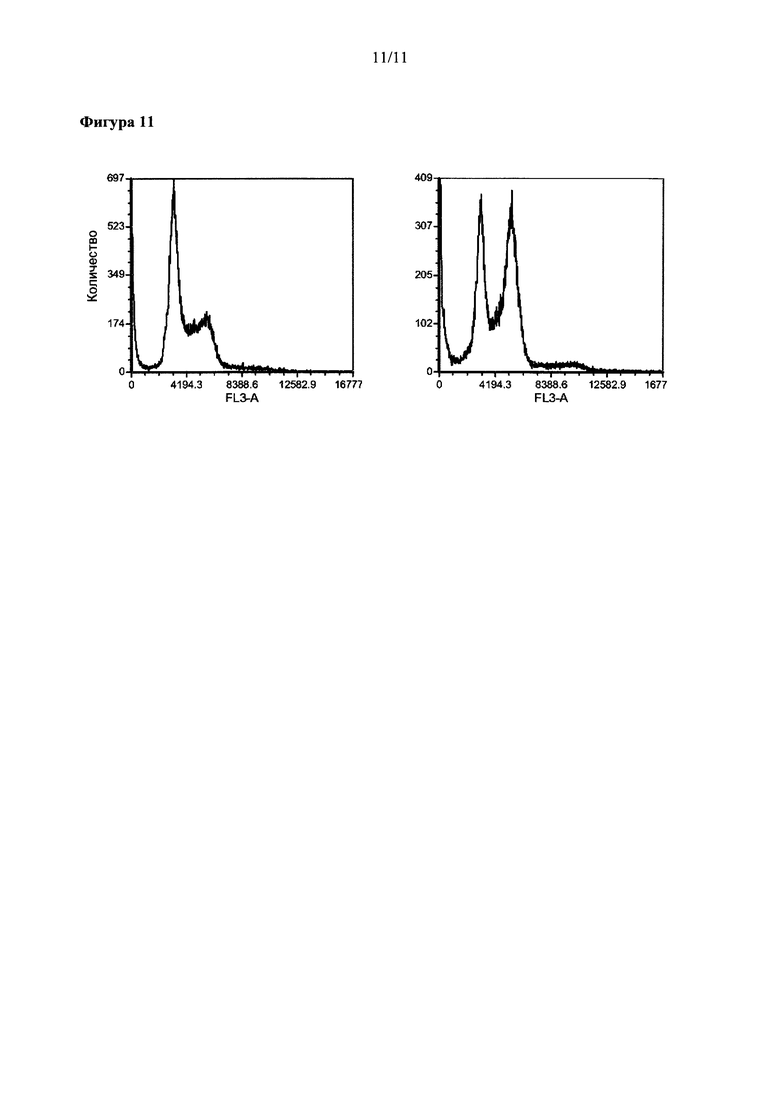
Изобретение относится к соединения, которые являются аналогами ауристатина, и обладают цитотоксической и/или антимитотической активностью. Также описаны конъюгаты таких соединений с антителом или фрагментом антитела, предназначенные для доставки к раковой клетке-мишени, фармацевтические композиции, содержащие соединения или их конъюгаты. Соединения предназначены для лечения рака, представляющего собой солидную опухоль или лимфому. 7 н. и 27 з.п. ф-лы, 7 табл., 13 пр., 11 ил.
1. Соединение Формулы I:

или его фармацевтически приемлемая соль, где:
R1 выбран из: амино-С1-С6 алкила и гетероциклила, каждый из которых необязательно замещен одним или более заместителями, выбранными из арила, арил-С1-С6 алкила, C1-С6 алкила, С3-С7 циклоалкила, С3-С7 циклоалкил-С1-С6 алкила, галогена и C1-С6 галогеналкила; или
R1 представляет собой RaRbNCH(Rc)-; Ra выбран из: Н и C1-С6 алкила; Rb представляет собой C1-С6 алкил; и Rc представляет собой Rd-C(CH3)2-; и
Rd выбран из: Н, арила и С3-С7 циклоалкила, каждый из которых необязательно замещен одним или более заместителями, выбранными из: С1-С4 алкила, С1-С4 алкиламино, амино, амино-С1-С4 алкила, галогена и С1-С4 галогеналкила; или
Rb и Rc вместе с атомами, с которыми они связаны, образуют пиперидинилдиил;
X отсутствует, и
R2 выбран из: C1-С6 алкила, арила, арил-С1-С6 алкила, С3-С7 циклоалкила, С3-С7 циклоалкил-С1-С6 алкила, гетероарила, гетероарил-С1-С6 алкила и гетероциклила, каждый из которых необязательно замещен одним или более заместителями, выбранными из: C1-С6 алкоксикарбонила, C1-С6 алкила, C1-С6 алкиламино, амино, амино-С1-С6 алкила, амино-арила, амино-С3-С7 циклоалкила, C1-С6 галогенацила, C1-С6 галогеналкила и галогена;
и где
каждый арил представляет собой С6-С12 моноциклическую или бициклическую кольцевую систему, содержащую по меньшей мере одно ароматическое кольцо;
каждый гетероарил представляет собой 6-12-членную моноциклическую или бициклическую кольцевую систему, содержащую по меньшей мере один гетероатом и по меньшей мере одно ароматическое кольцо, и
каждый гетероциклил представляет собой 3-12-членную моноциклическую или бициклическую неароматическую кольцевую систему, содержащую по меньшей мере один гетероатом.
2. Соединение по п. 1, где R1 выбран из: амино-С1-С6 алкила и гетероциклила, каждый из которых необязательно замещен одним или более заместителями, выбранными из C1-С6 алкила и галогена.
3. Соединение по п. 1, где R1 представляет собой RaRbNCH(Rc)-.
4. Соединение по п. 1, где R2 выбран из: арила, арил-С1-С6 алкила, гетероарила и гетероарил-С1-С6 алкила, каждый из которых необязательно замещен одним или более заместителями, выбранными из: C1-С6 алкоксикарбонила, C1-С6 алкила, C1-С6 алкиламино, амино, амино-C1-С6 алкила, амино-арила, амино-С3-С7 циклоалкила, C1-С6 галоацила, C1-С6 галоалкила и галогена.
5. Соединение по п. 1, где R2 выбран из: арила и арил-C1-С6 алкила, каждый из которых необязательно замещен одним или более заместителями, выбранными из: амино, амино-С1-С6 алкила и амино-С3-С7 циклоалкила.
6. Соединение по п. 1, где:
R1 выбран из: амино-С1-С6 алкила и гетероциклила, каждый из которых необязательно замещен одним или более заместителями, выбранными из C1-С6 алкила и гало, и
R2 выбран из: арила, арил-С1-С6 алкила, гетероарила и гетероарил-C1-С6 алкила, каждый из которых необязательно замещен одним или более заместителями, выбранными из: C1-С6 алкоксикарбонила, C1-С6 алкила, C1-С6 алкиламино, амино, амино-С1-С6 алкила, амино-арила, амино-С3-С7 циклоалкила, C1-С6 галоацила, C1-С6 галоалкила и галогена.
7. Соединение по п. 1, имеющее Формулу Ia:

или его фармацевтически приемлемая соль, где:
R2 выбран: C1-С6 алкила, арила, арил-С1-С6 алкила, С3-С7 циклоалкила, С3-С7 циклоалкил-С1-С6 алкила, гетероарила, гетероарил-С1-С6 алкила и гетероциклила, каждый из которых необязательно замещен одним или более заместителями, выбранными из: C1-С6 алкоксикарбонила, C1-С6 алкила, C1-С6 алкиламино, амино, амино-С1-С6 алкила, аминоарила, амино-С3-С7 циклоалкила C1-С6 галогенацила, C1-С6 галогеналкила и галогена; и
R4 и R5 каждый независимо выбраны из: Н и C1-С6 алкила.
8. Соединение по п. 7, где R4 и R5 каждый представляет собой C1-С6 алкил.
9. Соединение по п. 7, где R4 представляет собой Н, и R5 представляет собой C1-С6 алкил.
10. Соединение по п. 7, где R4 и R5 каждый представляет собой метил.
11. Соединение по п. 7, где R4 представляет собой Н, и R5 представляет собой метил.
12. Соединение по п. 1, имеющее Формулу Id:
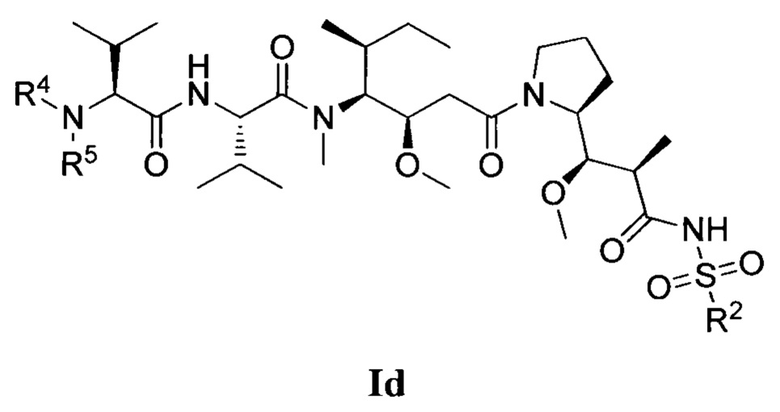
или его фармацевтически приемлемая соль, где:
R2 выбран из: C1-С6 алкила, арила, арил-С1-С6 алкила, С3-С7 циклоалкила, С3-С7 циклоалкил-С1-С6алкила, гетероарила, гетероарил-С1-С6алкила и гетероциклила, каждый из которых необязательно замещен одним или более заместителями, выбранными из: C1-С6 алкоксикарбонила, C1-С6 алкила, C1-С6 алкиламино, амино, амино-С1-С6 алкила, аминоарила, амино-С3-С7 циклоалкила, C1-С6 галоацила, C1-С6 галоалкила и галогена; и
R4 и R5 каждый независимо выбраны из: Н и C1-С6 алкила.
13. Соединение по п. 12, где R4 и R5 каждый представляет собой C1-С6 алкил.
14. Соединение по п. 12, где R4 представляет собой Н, и R5 представляет собой C1-С6 алкил.
15. Соединение по п. 12, где R4 и R5 каждый представляет собой метил.
16. Соединение по п. 12, где R4 представляет собой Н, и R5 представляет собой метил.
17. Соединение по любому из пп. 7-16, где R2 выбран из: арила, арил-С1-С6 алкила, гетероарила и гетероарил-С1-С6 алкила, каждый из которых необязательно замещен одним или более заместителями, выбранными из: C1-С6 алкоксикарбонила, C1-С6 алкила, C1-С6 алкиламино, амино, амино-С1-С6 алкила, амино-арила, амино-С3-С7 циклоалкила, C1-С6 галоацила, C1-С6 галоалкила и гало.
18. Соединение по любому из пп. 7-16, где R2 выбран из: арила и арил-С1-С6 алкила, каждый из которых необязательно замещен одним или более заместителями, выбранными из: амино, амино-С1-С6 алкила и амино-С3-С7 циклоалкила.
19. Соединение по п. 1, выбранное из следующих соединений, или его фармацевтически приемлемая соль:
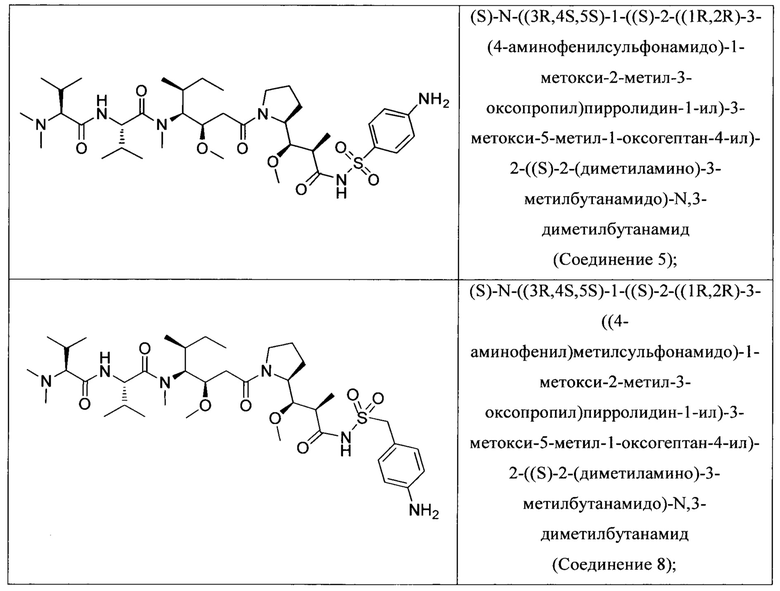

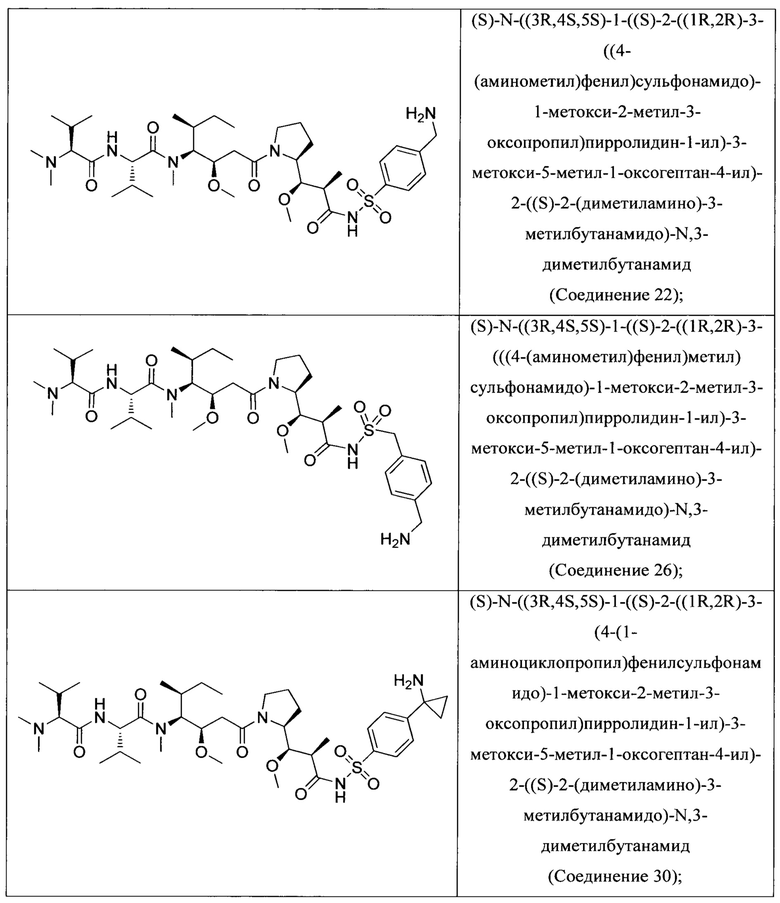
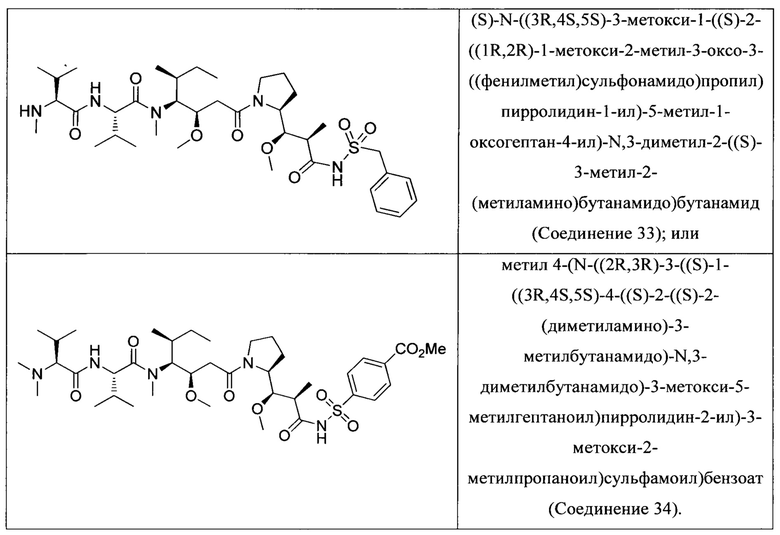
20. Конъюгат для доставки соединения по любому из пп. 1-19 к раковой клетке-мишени, причем конъюгат имеет Формулу II:

где:
(D) представляет собой соединение по любому из пп. 1-19;
(Т) представляет собой антитело или фрагмент антитела, который связывается с фрагментом на поверхности раковой клетки-мишени, и
(L) представляет собой бифункциональный линкер, который ковалентно связан с электрофильной или нуклеофильной группой, присутствующей на (Т), и с электрофильной или нуклеофильной группой на N-конце, на С-конце или на боковой цепи (D), и содержит один или более фрагментов, выбранных из: алкилдиила, арилдиила, гетероарилдиила, повторяющихся звеньев алкокси, повторяющихся звеньев алкиламино, сложного эфира дикислоты, амида дикислоты и аминокислоты.
21. Лекарство-линкер для получения конъюгата, при этом лекарство-линкер имеет одну из следующих структур:

22. Конъюгат для доставки цитотоксического соединения (D1) к раковой клетке-мишени, причем конъюгат имеет Формулу III:

где:
(Т) представляет собой антитело или фрагмент антитела, который связывается с фрагментом на поверхности раковой клетки-мишени;
(L1) представляет собой бифункциональный линкер, который ковалентно связан с электрофильной или нуклеофильной группой, присутствующей на (Т), и с -NH- группой, связанной с R2a в Формуле IV (D1), и
(D1) имеет структуру (IV):

где:
R1 выбран из: амино-С1-С6 алкила и гетероциклила, каждый из которых необязательно замещен одним или более заместителями, выбранными из арила, арил-С1-С6 алкила, C1-С6 алкила, С3-С7 циклоалкила, С3-С7 циклоалкил-С1-С6 алкила, гало и C1-С6 галоалкила; или
R1 представляет собой RaRbNCH(Rc)-;
Ra выбран из: Н и C1-С6 алкила;
Rb представляет собой C1-С6 алкил; и
Rc представляет собой Rd-C(CH3)2-; и
Rd выбран из: Н, арила и С3-С7 циклоалкила, каждый из которых необязательно замещен одним или более заместителями, выбранными из: С1-С4 алкила, С1-С4 алкиламино, амино, амино-C1-С4 алкила, гало и С1-С4 галоалкила; или
Rb и Rc вместе с атомами, с которыми они связаны, образуют пиперидинилдиил; X отсутствует; и
R2a выбран из: C1-С6 алкилдиила, арилдиила, С3-С7 циклоалкилдиила, гетероарилдиила и гетероциклилдиила, каждый из которых необязательно замещен одним или более заместителями, выбранными из: C1-С6 алкоксикарбонила, C1-С6 алкила, C1-С6 алкиламино, амино, амино-C1-С6 алкила, амино-арила, амино-С3-С7 циклоалкила, арила, C1-С6 галоацила, C1-С6 галоалкила, C1-С6 галоалкокси и гало;
и
(L1)-(T) имеет структуру (V):

где:
-NH- группа, связанная с R2a в Формуле IV, образует ферментативно расщепляемую пептидную связь (JPB) с (AA)1 в Формуле V;
каждый АА независимо представляет собой аминокислоту;
n представляет собой целое число от 0 до 25, и
(L2) необязательно представляет собой оставшуюся часть линкера (L1), где (AA)1-(AA)n, взятые вместе, содержат аминокислотную последовательность, способную облегчать ферментативное расщепление JPB, и где
каждый арил представляет собой С6-С12 моноциклическую или бициклическую кольцевую систему, содержащую по меньшей мере одно ароматическое кольцо;
каждый гетероарил представляет собой 6-12-членную моноциклическую или бициклическую кольцевую систему, содержащую по меньшей мере один гетероатом и по меньшей мере одно ароматическое кольцо, и
каждый гетероциклил представляет собой 3-12-членную моноциклическую или бициклическую неароматическую кольцевую систему, содержащую по меньшей мере один гетероатом.
23. Конъюгат по п. 22, где R2a выбран из: C1-С6 алкилдиила, арилдиила и гетероарилдиила, каждый из которых необязательно замещен одним или более заместителями, выбранными из: C1-С6 алкоксикарбонила, C1-С6 алкила, C1-С6 алкиламино, амино, амино-C1-С6 алкила, амино-арила, амино-С3-С7 циклоалкила, арила, C1-С6 галоацила, C1-С6 галоалкила и гало.
24. Конъюгат по п. 22, где R2a выбран из: C1-С6 алкилдиила и арилдиила, каждый из которых необязательно замещен одним или более заместителями, выбранными из: амино, амино-С1-С6 алкила, аминоарила и амино-С3-С7 циклоалкила.
25. Конъюгат по п. 22, где:
R1 выбран из: амино-С1-С6 алкила и гетероциклила, каждый из которых необязательно замещен одним или более заместителями, выбранными из C1-С6 алкила и гало, и
R2a выбран из: C1-С6 алкилдиила, арилдиила и гетероарилдиила, каждый из которых необязательно замещен одним или более заместителями, выбранными из: C1-С6 алкоксикарбонила, C1-С6 алкила, C1-С6 алкиламино, амино, амино-С1-С6 алкила, амино-арила, амино-С3-С7 циклоалкила, арила, C1-С6 галоацила, C1-С6 галоалкила и гало.
26. Конъюгат по п. 22, где (AA)1-(AA)n содержит валин-цитруллин.
27. Конъюгат по п. 22, где (L2) содержит удлинитель.
28. Конъюгат по п. 22, где (AA)1-(AA)n содержит валин-цитруллин, и (L2) содержит удлинитель.
29. Конъюгат по п. 22, где (T)-(L1)-(D1) имеет одну из следующих структур:

где (Т) представляет собой антитело, которое связывается с фрагментом на поверхности раковой клетки-мишени.
30. Конъюгат по любому из пп. 20 и 22-29, где антитело или фрагмент антитела представляет собой биспецифическое антитело или фрагмент антитела.
31. Конъюгат по любому из пп. 20 и 22-29, где фрагмент на поверхности раковой клетки-мишени представляет собой HER2.
32. Фармацевтическая композиция для лечения рака у млекопитающего, при этом фармацевтическая композиция содержит терапевтически эффективное количество соединения по любому из пп. 1-19 или его фармацевтически приемлемой соли, либо конъюгата по любому из пп. 20 и 22-29, и фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество.
33. Способ лечения рака у млекопитающего, включающий введение млекопитающему, нуждающемуся в этом, эффективного количества соединения по любому из пп. 1-19 или его фармацевтически приемлемой соли, либо конъюгата по любому из пп. 20 и 22-29, причем рак представляет собой солидную опухоль или лимфому.
34. Способ подавления роста опухоли у млекопитающего, включающий введение млекопитающему, нуждающемуся в этом, эффективного количества соединения по любому из пп. 1-19 или его фармацевтически приемлемой соли, либо конъюгата по любому из пп. 20 и 22-29, причем опухоль представляет собой солидную опухоль или лимфому.
| ЦИТОТОКСИЧЕСКИЕ ПЕПТИДЫ И ИХ КОНЪЮГАТЫ АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2012 |
|
RU2586885C2 |
| WO 2013173393 A1, 21.11.2013 | |||
| WO 2015095952 A1, 02.07.2015 | |||
| WO 2015095953 A1, 02.07.2015. | |||
Авторы
Даты
2020-06-17—Публикация
2015-09-17—Подача