Настоящее изобретение относится к органическим соединениям, полезным для терапии или профилактики у млекопитающего, и, в частности, к двойным ингибиторам аутотаксина (ATX; autotaxin)/карбоангидразы (CA), которые являются ингибиторами продуцирования лизофосфатидной кислоты (LPA; lysophosphatidic acid) и, следовательно, модуляторами уровней LPA и ассоциированной передачи сигнала, для лечения или профилактики воспалительных состояний, патологических состояний нервной системы, сосудистых и сердечно-сосудистых патологических состояний, рака и глазных патологических состояний.
В настоящем изобретении предложены новые соединения формулы I,
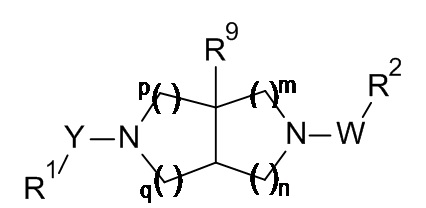
где:
R1 представляет собой замещенный фенил, замещенный фенил-C1-6 алкил, замещенный фенокси-C1-6 алкил, замещенный фенил-C2-6 алкенил, замещенный фенил-C2-6 алкинил, замещенный пиридинил, замещенный пиридинил-C1-6 алкил, замещенный пиридинил-C2-6 алкенил, замещенный пиридинил-C2-6 алкинил, замещенный тиофенил, замещенный тиофенил-C1-6 алкил, замещенный тиофенил-C2-6 алкенил или замещенный тиофенил-C2-6 алкинил, где замещенный фенил, замещенный фенил-C1-6 алкил, замещенный фенокси-C1-6 алкил, замещенный фенил-C2-6 алкенил, замещенный фенил-C2-6 алкинил, замещенный пиридинил, замещенный пиридинил-C1-6 алкил, замещенный пиридинил-C2-6 алкенил, замещенный пиридинил-C2-6 алкинил, замещенный тиофенил, замещенный тиофенил-C1-6 алкил, замещенный тиофенил-C2-6 алкенил и замещенный тиофенил-C2-6 алкинил замещены группами R3, R4 и R5;
Y представляет собой -OC(O)- или -C(O)-;
W представляет собой -C(O)-, -S(O)2- или -CR6R7-;
R2 представляет собой замещенный фенил, замещенный пиридинил или замещенный тиофенил, где замещенный фенил, замещенный пиридинил и замещенный тиофенил замещены группами R6, R7 и R8;
R3 представляет собой атом галогена, гидрокси, циано, C1-6 алкил, C1-6 алкокси, C1-6 алкокси-C1-6 алкил, галоген-C1-6 алкокси, галоген-C1-6 алкил, гидрокси-C1-6 алкил, C3-8 циклоалкил, C3-8 циклоалкил-C1-6 алкил, C3-8 циклоалкил-C1-6 алкокси, C3-8 циклоалкокси, C3-8 циклоалкокси-C1-6 алкил, C1-6 алкиламино, C1-6 алкилкарбониламино, C3-8 циклоалкилкарбониламино, C1-6 алкилтетразолил, C1-6 алкилтетразолил-C1-6 алкил или гетероциклоалкил-C1-6 алкокси;
R4 и R5 независимо выбраны из H, атома галогена, гидрокси, циано, C1-6 алкила, C1-6 алкокси, C1-6 алкокси-C1-6 алкила, галоген-C1-6 алкокси, галоген-C1-6 алкила, гидрокси-C1-6 алкила, C3-8 циклоалкила, C3-8 циклоалкил-C1-6 алкила, C3-8 циклоалкил-C1-6 алкокси, C3-8 циклоалкокси, C3-8 циклоалкокси-C1-6 алкила, C1-6 алкилкарбониламино, C3-8 циклоалкилкарбониламино, C1-6 алкилтетразолила, C1-6 алкилтетразолил-C1-6 алкила или гетероциклоалкил-C1-6 алкокси;
R6 представляет собой аминосульфонил;
R7 и R8 независимо выбраны из H, атома галогена, гидрокси, циано, C1-6 алкила, C1-6 алкокси, C1-6 алкокси-C1-6 алкила, галоген-C1-6 алкокси, галоген-C1-6 алкила, гидрокси-C1-6 алкила, C3-8 циклоалкила, C3-8 циклоалкил-C1-6 алкила, C3-8 циклоалкил-C1-6 алкокси, C3-8 циклоалкокси и C3-8 циклоалкокси-C1-6 алкила;
R9 представляет собой C1-6 алкил, C1-6 алкокси или атом галогена;
m, n, p и q независимо выбраны из 1 или 2;
или их фармацевтически приемлемые соли.
Аутотаксин (ATX) представляет собой секретируемый фермент, также называемый эктонуклеотидпирофосфатазой/фосфодиэстеразой 2 или лизофосфолипазой D, важный для преобразования лизофосфатидилхолина (LPC; lysophosphatidyl choline) в биологически активную сигнальную молекулу лизофосфатидной кислоты (LPA). Показана высокая корреляция концентраций LPA в плазме крови с активностью ATX, и, следовательно, ATX считают важным источником внеклеточной LPA. Ранние эксперименты с прототипным ингибитором ATX показали, что такое соединение способно ингибировать активность синтеза LPA в плазме крови мышей. В работах, проведенных в 1970-е и ранние 1980-е годы, продемонстрировано, что LPA может вызывать широкое разнообразие клеточных ответов, в том числе сокращение гладкомышечных клеток, активацию тромбоцитов, пролиферацию клеток, хемотаксис и другие ответы. Действия LPA опосредованы передачей сигнала к нескольким сопряженным с G-белком рецепторам (GPCR; G protein coupled receptors); первые члены данного семейства первоначально были обозначены как рецепторы гена дифференцировки эндотелиальных клеток Edg (endothelial cell differentiation gene) или гена-1 вентрикулярной зоны (vzg-1), но в настоящее время их называют рецепторами LPA. В настоящее время их прототипную группу составляют LPA1/Edg-2/VZG-1, LPA2/Edg-4 и LPA3/Edg-7. Недавно описано три дополнительных рецептора LPA LPA4/p2y9/GPR23, LPA5/GPR92 и LPA6/p2Y5, обладающих более близким родством с нуклеотид-селективными пуринергическими рецепторами, чем с прототипными рецепторами LPA1-3. Ось передачи сигнала ATX-LPA вовлечена в широкий ряд физиологических и патофизиологических функций, включающих, например, функцию нервной системы, развитие кровеносных сосудов, физиологию сердечно-сосудистой системы, репродуктивную функцию, функцию иммунной системы, хронические воспаление, метастазы и прогрессирование опухоли, фиброз органов, а также ожирение и/или другие метаболические заболевания, такие как сахарный диабет. Таким образом, повышенная активность ATX и/или повышенные уровни LPA, измененная экспрессия рецепторов LPA и измененные ответы на LPA могут вносить вклад в возникновение, прогрессирование и/или исход ряда различных патофизиологических состояний, связанных с осью ATX/LPA.
Карбоангидразы (CA) представляют собой семейство цинкзависимых ферментов, которые катализируют создание равновесного состояния между диоксидом углерода и водой и гидрокарбонатом и протоном. Реакция CA вовлечена во многие физиологические и патологические процессы. Ингибирование карбоангидразы полезно для лечения глазных патологических состояний, состояний, обусловленных недостаточным кровотоком, рака, отека и воспалительных состояний, включая бактериальные инфекции.
Ожидают, что ингибиторы ATX/CA двойного действия снижают внутриглазное давление, способствуя двум независимым метаболическим путям, например, посредством ингибирования выработки внутриглазной жидкости (AH; aqueous humor) в цилиарном теле в результате ингибирования CA и обеспечения возможности оттока AH в результате ингибирования ATX внутри дренажной системы AH. Показано или ожидается, что при состояниях, связанных с выпотом жидкости через сосуды, таких как диабетическая ретинопатия, возрастная макулярная дегенерация или окклюзия вены сетчатки, уровни CA в глазу повышаются, что способствует повышению pH. Ожидают, что в результате происходит активация множества гидролитических ферментов, включая ATX, которые могут вносить вклад в прогрессирование заболевания, и предполагают дополнительное ингибирование ATX за счет смещения оптимального pH.
В соответствии с изобретением соединения формулы (I) или их фармацевтически приемлемые соли и сложные эфиры можно применять для лечения или профилактики заболеваний, расстройств или патологических состояний, связанных с активностью аутотаксина и/или с биологической активностью лизофосфатидной кислоты (LPA).
Соединения формулы (I) или их фармацевтически приемлемые соли и сложные эфиры в данном случае ингибируют активность аутотаксина и активность карбоангидразы и, следовательно, ингибируют продуцирование LPA и модулируют уровни LPA и ассоциированную передачу сигнала. Описанные в настоящем документе двойные ингибиторы ATX/CA-II полезны в качестве средств для лечения или предупреждения заболеваний или патологических состояний, при которых активность ATX и/или передача сигнала LPA вовлечена в этиологию или патологию заболевания или иначе связана с по меньшей мере одним симптомом заболевания. Ось ATX-LPA вовлечена, например, в ангиогенез, хроническое воспаление, аутоиммунные заболевания, фибротические заболевания, рак и метастазы и прогрессирование опухоли, глазные патологические состояния, метаболические патологические состояния, такие как ожирение и/или сахарный диабет, такие патологические состояния, как холестатический зуд или другие формы хронического зуда, а также острое и хроническое отторжение трансплантата органа.
Объектами настоящего изобретения являются соединения формулы (I) и их упомянутые выше соли и сложные эфиры и их применение в качестве терапевтически активных веществ, способ получения этих соединений, промежуточные соединения, фармацевтические композиции, лекарственные средства, содержащие данные соединения, их фармацевтически приемлемые соли или сложные эфиры, применение этих соединений, солей или сложных эфиров для лечения или профилактики расстройств или патологических состояний, связанных с активностью ATX и/или с биологической активностью лизофосфатидной кислоты (LPA), в частности, в лечении или профилактике воспалительных состояний, патологических состояний нервной системы, патологических состояний дыхательной системы, сосудистых и сердечно-сосудистых патологических состояний, фибротических заболеваний, рака, глазных патологических состояний, метаболических патологических состояний, холестатического зуда и других форм хронического зуда и острого и хронического отторжения трансплантата органа, и применение этих соединений, солей или сложных эфиров для получения лекарственных средств для лечения или профилактики воспалительных состояний, патологических состояний нервной системы, патологических состояний дыхательной системы, сосудистых и сердечно-сосудистых патологических состояний, фибротических заболеваний, рака, глазных патологических состояний, метаболических патологических состояний, холестатического зуда и других форм хронического зуда и острого и хронического отторжения трансплантата органа. Более конкретно объектами настоящего изобретения являются соединения формулы (I) и их упомянутые выше соли и сложные эфиры и их применение в качестве терапевтически активных веществ, способ получения этих соединений, промежуточные соединения, фармацевтические композиции, лекарственные средства, содержащие данные соединения, их фармацевтически приемлемые соли или сложные эфиры, применение этих соединений, солей или сложных эфиров для лечения или профилактики глазных патологических состояний, еще более конкретно глаукомы.
Термин «C1-6 алкокси» означает группу формулы -O-R', где R' представляет собой C1-6 алкильную группу. Примеры C1-6 алкоксигруппы включают метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси и трет-бутокси. Конкретным примером является метоксигруппа.
Термин «C2-6 алкенил» означает одновалентную нормальную или разветвленную углеводородную группу из атомов углерода в количестве от 2 до 6 с по меньшей мере одной двойной связью. Конкретным примером является этиленил.
Термин «C1-6 алкокси-C1-6 алкил» означает C1-6 алкильную группу, где по меньшей мере один из атомов водорода C1-6 алкильной группы замещен C1-6 алкоксигруппой. Конкретными примерами являются метоксиметил, метоксиэтил, этоксиметил, этоксиэтил, изопропоксиметил и изопропоксиэтил.
Термин «C1-6 алкил» означает одновалентную нормальную или разветвленную углеводородную группу из атомов углерода в количестве от 1 до 6. Примеры C1-6 алкила включают метил, этил, пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил и пентил. Конкретные алкильные группы включают метил, этил, изопропил, н-бутил и втор-бутил.
Термин «C1-6 алкиламино» означает группу формулы -NH-R', где R' представляет собой C1-6 алкильную группу. Конкретной группой «C1-6 алкиламино» является группа формулы -NH-R', где R' представляет собой трет-бутил.
Термин «C1-6 алкилкарбониламино» означает группу формулы -NH-C(O)-R', где R' представляет собой C1-6 алкильную группу. Конкретной группой «C1-6 алкилкарбониламино» является группа формулы -NH-C(O)-R', где R' представляет собой трет-бутил.
Термин «C1-6 алкилтетразолил» означает тетразолильную группу, замещенную одной C1-6 алкильной группой. Конкретным C1-6 алкилтетразолилом является метилтетразолил.
Термин «C1-6 алкилтетразолил-C1-6 алкил» означает C1-6 алкильную группу, где один из атомов водорода C1-6 алкильной группы замещен C1-6 алкилтетразолильной группой. Конкретным примером является метилтетразолилметил.
Термин «C2-6 алкинил» означает одновалентную нормальную или разветвленную углеводородную группу из атомов углерода в количестве от 2 до 6 с по меньшей мере одной тройной связью.
Термин «амино» означает группу -NH2.
Термин «аминосульфонил» означает группу -S(O)2-NH2.
Термин «циано» означает группу -C≡N.
Термин «C3-8 циклоалкокси» означает группу формулы -O-R', где R' представляет собой C3-8 циклоалкил.
Термин «C3-8 циклоалкокси-C1-6 алкил» означает C1-6 алкильную группу, где по меньшей мере один из атомов водорода алкильной группы замещен C3-8 циклоалкоксигруппой.
Термин «C3-8 циклоалкил» означает одновалентную насыщенную моноциклическую или бициклическую углеводородную группу из кольцевых атомов углерода в количестве от 3 до 8. Бициклическая система означает кольцевую систему, состоящую из двух насыщенных карбоциклов, имеющих два общих атома углерода. Примерами моноциклического циклоалкила являются циклопропил, циклобутанил, циклопентил, циклогексил или циклогептил. Примерами бициклического C3-8 циклоалкила являются бицикло[2.2.1]гептанил или бицикло[2.2.2]октанил. Конкретной C3-8 циклоалкильной группой является циклопропил.
Термин «C3-8 циклоалкил-C1-6 алкокси» означает C1-6 алкильную группу, где по меньшей мере один из атомов водорода алкильной группы замещен C3-8 циклоалкильной группой.
Термин «C3-8 циклоалкил-C1-6 алкил» означает C1-6 алкильную группу, где по меньшей мере один из атомов водорода алкильной группы замещен C3-8 циклоалкильной группой.
Термин «C3-8 циклоалкилкарбониламино» означает группу формулы -NH-C(O)-R', где R' представляет собой C3-8 циклоалкильную группу.
Термин «галоген-C1-6 алкокси» означает C1-6 алкоксигруппу, где по меньшей мере один из атомов водорода алкоксигруппы замещен одинаковыми или разными атомами галогена. Конкретным примером является трифторметокси.
Термины «атом галогена» и «галоген» в настоящем документе используются взаимозаменяемо и означают атом фтора, хлора, брома или йода. Конкретными атомами галогена являются атомы хлора и фтора.
Термин «галоген-C1-6 алкил» означает C1-6 алкильную группу, где по меньшей мере один из атомов водорода C1-6 алкильной группы замещен одинаковыми или разными атомами галогена. Конкретным примером является трифторметил.
Термин «гетероциклоалкил» означает одновалентную насыщенную или частично ненасыщенную моно- или бициклическую кольцевую систему из кольцевых атомов в количестве от 4 до 9, содержащую 1, 2 или 3 кольцевых гетероатома, выбранных из N, O и S, где остальными кольцевыми атомами являются атомы углерода. Бициклическая система означает систему, состоящую из двух циклов, имеющих два общих кольцевых атома, т. е. мостик, разделяющий два кольца, представляет собой либо простую связь, либо цепь из одного или двух кольцевых атомов. Примерами моноциклического насыщенного гетероциклоалкила являются 4,5-дигидро-оксазолил, оксетанил, азетидинил, пирролидинил, 2-оксо-пирролидин-3-ил, тетрагидрофуранил, тетрагидро-тиенил, пиразолидинил, имидазолидинил, оксазолидинил, изоксазолидинил, тиазолидинил, пиперидинил, тетрагидропиранил, тетрагидротиопиранил, пиперазинил, морфолинил, тиоморфолинил, 1,1-диоксо-тиоморфолин-4-ил, азепанил, диазепанил, гомопиперазинил или оксазепанил. Примерами бициклического насыщенного гетероциклоалкила являются 8-аза-бицикло[3.2.1]октил, хинуклидинил, 8-окса-3-аза-бицикло[3.2.1]октил, 9-аза-бицикло[3.3.1]нонил, 3-окса-9-аза-бицикло[3.3.1]нонил или 3-тиа-9-аза-бицикло[3.3.1]нонил. Примерами частично ненасыщенного гетероциклоалкила являются дигидрофурил, имидазолинил, дигидро-оксазолил, тетрагидро-пиридинил или дигидропиранил. Конкретным примером гетероциклоалкильной группы является тетрагидропиранил.
Термин «гетероциклоалкил-C1-6 алкокси» означает C1-6 алкоксигруппу, где по меньшей мере один из атомов водорода алкильной группы замещен гетероциклоалкильной группой. Конкретным примером гетероциклоалкил-C1-6 алкокси является тетрагидропиранил-C1-6 алкокси, более конкретно тетрагидропиранилметокси.
Термин «гидрокси» означает группу -OH.
Термин «гидрокси-C1-6 алкил» означает C1-6 алкильную группу, где один из атомов водорода алкильной группы замещен гидроксигруппой. Конкретными примерами являются гидроксиметил и гидроксиэтил.
Термин «фенокси» означает группу формулы -O-R', где R' представляет собой фенильную группу.
Термин «фенокси-C1-6 алкил» означает C1-6 алкильную группу, где один из атомов водорода алкильной группы замещен феноксигруппой.
Термин «фенил-C2-6 алкенил» означает C2-6 алкенильную группу, где один из атомов водорода алкильной группы замещен фенильной группой. Конкретным примером фенил-C2-6 алкенила является фенилэтенил.
Термин «фенил-C1-6 алкил» означает C1-6 алкильную группу, где один из атомов водорода алкильной группы замещен фенильной группой. Конкретными примерами фенил-C1-6 алкила являются фенилметил и фенилэтил.
Термин «фенил-C2-6 алкинил» означает C2-6 алкинильную группу, где один из атомов водорода алкильной группы замещен фенильной группой.
Термин «пиридинил-C2-6 алкенил» означает C2-6 алкенильную группу, где один из атомов водорода алкильной группы замещен пиридинильной группой.
Термин «пиридинил-C1-6 алкил» означает C1-6 алкильную группу, где один из атомов водорода алкильной группы замещен пиридинильной группой. Конкретным примером пиридинил-C1-6 алкила является пиридинилметил, более конкретно 2-пиридинилметил.
Термин «пиридинил-C2-6 алкинил» означает C2-6 алкинильную группу, где один из атомов водорода алкильной группы замещен пиридинильной группой.
Термин «тиофенил-C2-6 алкенил» означает C2-6 алкенильную группу, где один из атомов водорода алкильной группы замещен тиофенильной группой.
Термин «тиофенил-C1-6 алкил» означает C1-6 алкильную группу, где один из атомов водорода алкильной группы замещен тиофенильной группой.
Термин «тиофенил-C2-6 алкинил» означает C2-6 алкинильную группу, где один из атомов водорода алкильной группы замещен тиофенильной группой.
Термин «фармацевтически приемлемые соли» относится к солям, сохраняющим биологическую эффективность и свойства свободных оснований или свободных кислот, и не являющимся нежелательными ни в биологическом, ни в ином отношении. Эти соли образуют с неорганическими кислотами, такими как соляная кислота, бромисто-водородная кислота, серная кислота, азотная кислота, фосфорная кислота и т. п., в частности, соляная кислота, и с органическими кислотами, такими как уксусная кислота, пропионовая кислота, гликолевая кислота, пировиноградная кислота, щавелевая кислота, малеиновая кислота, малоновая кислота, янтарная кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, пара-толуолсульфоновая кислота, салициловая кислота, N-ацетилцистеин и т. п. В дополнение к этому эти соли могут быть получены путем присоединения неорганического основания или органического основания к свободной кислоте. Соли, образованные из неорганического основания, включают без ограничений соли натрия, калия, лития, аммония, кальция, магния и т. п. Соли, образованные из органических оснований, включают без ограничений соли первичных, вторичных и третичных аминов, замещенных аминов, в том числе встречающихся в природе замещенных аминов, циклических аминов и основных ионообменных смол, таких как изопропиламин, триметиламин, диэтиламин, триэтиламин, трипропиламин, этаноламин, лизин, аргинин, N-этилпиперидин, пиперидин, полииминные смолы и т. п. Конкретными фармацевтически приемлемыми солями соединений формулы (I) являются соли гидрохлориды, соли метансульфоновой кислоты и соли лимонной кислоты.
«Фармацевтически приемлемые сложные эфиры» означают, что соединения общей формулы (I) могут быть дериватизированы по функциональным группам таким образом, чтобы получить производные, способные к обратному преобразованию в исходные соединения in vivo. Примеры таких соединений включают физиологически приемлемые и метаболически лабильные сложноэфирные производные, такие как метоксиметиловые эфиры, метилтиометиловые эфиры и пивалоилоксиметиловые эфиры. Дополнительно в пределах объема данного изобретения находятся любые физиологически приемлемые эквиваленты соединений общей формулы (I), подобные метаболически лабильным сложным эфирам, которые способны к образованию исходных соединений общей формулы (I) in vivo.
Термин «защитная группа» (PG, protecting group) в значении, традиционно связанном с ним в химии органического синтеза, означает группу, которая селективно блокирует активный центр в многофункциональном соединении так, что химическая реакция может протекать селективно при другом незащищенном активном центре. Защитные группы могут быть удалены в соответствующий момент. Примерами защитных групп являются амино-защитные группы, карбокси-защитные группы или гидрокси-защитные группы. Конкретными защитными группами являются группы трет-бутоксикарбонил (Boc), бензилоксикарбонил (Cbz), флуоренилметоксикарбонил (Fmoc) и бензил (Bn). Более конкретными защитными группами являются группы трет-бутоксикарбонил (Boc) и флуоренилметоксикарбонил (Fmoc). Более конкретной защитной группой является группа трет-бутоксикарбонил (Boc).
Сокращение мкМ означает микромоль и эквивалентно символу μM.
Сокращение мкл означает микролитр и эквивалентно символу μL.
Сокращение мкг означает микрограмм и эквивалентно символу μg.
Соединения формулы (I) могут содержать несколько асимметрических центров и могут быть представлены в форме оптически чистых энантиомеров, смесей энантиомеров, таких как, например, рацематы, оптически чистых диастереоизомеров, смесей диастереоизомеров, диастереоизомерных рацематов или смесей диастереоизомерных рацематов.
Согласно правилу Кана - Ингольда - Прелога асимметрический атом углерода может иметь R или S конфигурацию.
Одно воплощение настоящего изобретения также представляет собой описанные в настоящем документе соединения согласно формуле (I) и их фармацевтически приемлемые соли или сложные эфиры, в частности, описанные в настоящем документе соединения согласно формуле (I) и их фармацевтически приемлемые соли, более конкретно описанные в настоящем документе соединения согласно формуле (I).
Другое воплощение настоящего изобретения представляет собой описанные в настоящем документе соединения согласно формуле (I), где
R1 представляет собой замещенный фенил-C1-6 алкил, замещенный фенокси-C1-6 алкил, замещенный фенил-C2-6 алкенил, замещенный пиридинил или замещенный пиридинил-C1-6 алкил, где замещенный фенил-C1-6 алкил, замещенный фенокси-C1-6 алкил, замещенный фенил-C2-6 алкенил, замещенный пиридинил и замещенный пиридинил-C1-6 алкил замещены группами R3, R4 и R5;
Y представляет собой -OC(O)- или -C(O)-;
W представляет собой -C(O)-;
R2 представляет собой замещенный фенил или замещенный пиридинил, где замещенный фенил и замещенный пиридинил замещены группами R6, R7 и R8;
R3 представляет собой галоген-C1-6 алкокси, C1-6 алкилкарбониламино или тетрагидропиранил-C1-6 алкокси;
R4 представляет собой H, C1-6 алкил или C3-8 циклоалкил;
R5 представляет собой H;
R6 представляет собой аминосульфонил;
R7 и R8 независимо выбраны из H и атома галогена;
R9 представляет собой C1-6 алкил, C1-6 алкокси или атом галогена;
m, n, p и q равны 1;
или их фармацевтически приемлемые соли.
Конкретное воплощение настоящего изобретения представляют собой описанные в настоящем документе соединения согласно формуле (I), где R1 представляет собой замещенный фенил-C1-6 алкил, замещенный фенокси-C1-6 алкил, замещенный фенил-C2-6 алкенил, замещенный пиридинил или замещенный пиридинил-C1-6 алкил, где замещенный фенил-C1-6 алкил, замещенный фенокси-C1-6 алкил, замещенный фенил-C2-6 алкенил, замещенный пиридинил и замещенный пиридинил-C1-6 алкил замещены группами R3, R4 и R5.
Следующее конкретное воплощение настоящего изобретения представляет собой описанные в настоящем документе соединения согласно формуле (I), где R1 представляет собой замещенный пиридинил или замещенный пиридинил-C1-6 алкил, где замещенный пиридинил и замещенный пиридинил-C1-6 алкил замещены группами R3, R4 и R5.
Конкретное воплощение настоящего изобретения представляют собой описанные в настоящем документе соединения согласно формуле (I), где Y представляет собой -C(O)-.
Конкретное воплощение настоящего изобретения представляет собой описанные в настоящем документе соединения согласно формуле (I), где R2 представляет собой замещенный фенил или замещенный пиридинил, где замещенный фенил и замещенный пиридинил замещены группами R6, R7 и R8.
Конкретное воплощение настоящего изобретения представляет собой описанные в настоящем документе соединения согласно формуле (I), где R3 представляет собой галоген-C1-6 алкокси, C1-6 алкилкарбониламино или тетрагидропиранил- C1-6 алкокси.
Следующее конкретное воплощение настоящего изобретения представляет собой описанные в настоящем документе соединения согласно формуле (I), где R3 представляет собой тетрагидропиранил-C1-6 алкокси.
Конкретное воплощение настоящего изобретения представляет собой описанные в настоящем документе соединения согласно формуле (I), где R4 представляет собой H, C1-6 алкил или C3-8 циклоалкил.
Следующее конкретное воплощение настоящего изобретения представляет собой описанные в настоящем документе соединения согласно формуле (I), где R4 представляет собой C3-8 циклоалкил.
Конкретное воплощение настоящего изобретения представляет собой описанные в настоящем документе соединения согласно формуле (I), где R5 представляет собой H.
Конкретное воплощение настоящего изобретения представляет собой описанные в настоящем документе соединения согласно формуле (I), где R7 и R8 независимо выбраны из H и атома галогена.
Следующее конкретное воплощение настоящего изобретения представляет собой описанные в настоящем документе соединения согласно формуле (I), где R7 представляет собой H или атом галогена.
Следующее конкретное воплощение настоящего изобретения представляет собой описанные в настоящем документе соединения согласно формуле (I), где R8 представляет собой H.
Конкретное воплощение настоящего изобретения представляет собой описанные в настоящем документе соединения согласно формуле (I), где R9 представляет собой атом галогена или C1-6 алкокси.
Конкретное воплощение настоящего изобретения представляет собой описанные в настоящем документе соединения согласно формуле (I), где m, n, p и q равны 1.
Более конкретное воплощение настоящего изобретения представляет собой описанные в настоящем документе соединения согласно формуле (I), где:
R1 представляет собой замещенный пиридинил или замещенный пиридинил-C1-6 алкил, где замещенный пиридинил и замещенный пиридинил-C1-6 алкил замещены группами R3, R4 и R5;
Y представляет собой -C(O)-;
W представляет собой -C(O)-;
R2 представляет собой замещенный фенил или замещенный пиридинил, где замещенный фенил и замещенный пиридинил замещены группами R6, R7 и R8;
R3 представляет собой тетрагидропиранил- C1-6 алкокси;
R4 представляет собой C3-8 циклоалкил;
R5 представляет собой H;
R6 представляет собой аминосульфонил;
R7 представляет собой H или атом галогена;
R8 представляет собой H;
R9 представляет собой атом галогена или C1-6 алкокси;
m, n, p и q равны 1;
или их фармацевтически приемлемые соли.
Конкретное воплощение настоящего изобретения представляет собой описанные в настоящем документе соединения согласно формуле I(a)
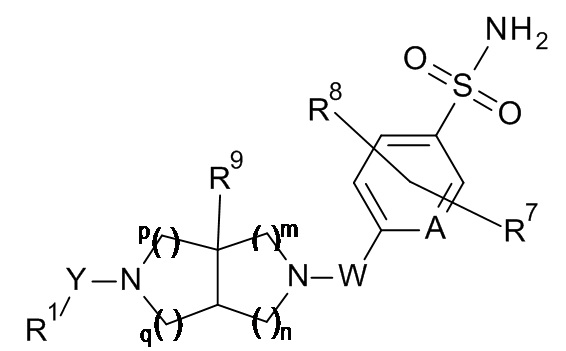 I(a)
I(a)
где:
R1 представляет собой замещенный фенил-C1-6 алкил, замещенный фенокси-C1-6 алкил, замещенный фенил-C2-6 алкенил, замещенный пиридинил или замещенный пиридинил-C1-6 алкил, где замещенный фенил-C1-6 алкил, замещенный фенокси-C1-6 алкил, замещенный фенил-C2-6 алкенил, замещенный пиридинил и замещенный пиридинил-C1-6 алкил замещены группами R3, R4 и R55;
Y представляет собой -OC(O)- или -C(O)-;
W представляет собой -C(O)-;
R2 представляет собой замещенный фенил или замещенный пиридинил, где замещенный фенил и замещенный пиридинил замещены группами R6, R7 и R8;
R3 представляет собой галоген-C1-6 алкокси, C1-6 алкилкарбониламино или тетрагидропиранил-C1-6 алкокси;
R4 представляет собой H, C1-6 алкил или C3-8 циклоалкил;
R5 представляет собой H;
R7 и R8 независимо выбраны из H и атома галогена;
R9 представляет собой C1-6 алкил, C1-6 алкокси или атом галогена;
m, n, p и q равны 1;
или его фармацевтически приемлемые соли.
Следующее конкретное воплощение настоящего изобретения представляет собой описанные в настоящем документе соединения согласно формуле I(b)
 (Ib)
(Ib)
где:
R1 представляет собой замещенный пиридинил или замещенный пиридинил-C1-6 алкил, где замещенный пиридинил и замещенный пиридинил-C1-6 алкил замещены группами R3, R4 и R5;
Y представляет собой -C(O)-;
W представляет собой -C(O)-;
R2 представляет собой замещенный фенил или замещенный пиридинил, где замещенный фенил и замещенный пиридинил замещены группами R6, R7 и R8;
R3 представляет собой тетрагидропиранил- C1-6 алкокси;
R4 представляет собой C3-8 циклоалкил;
R5 представляет собой H;
R7 представляет собой H или атом галогена;
R8 представляет собой H;
R9 представляет собой атом галогена или C1-6 алкокси;
m, n, p и q равны 1;
или их фармацевтически приемлемые соли.
Конкретные примеры описанных в настоящем документе соединений формулы (I) выбраны из:
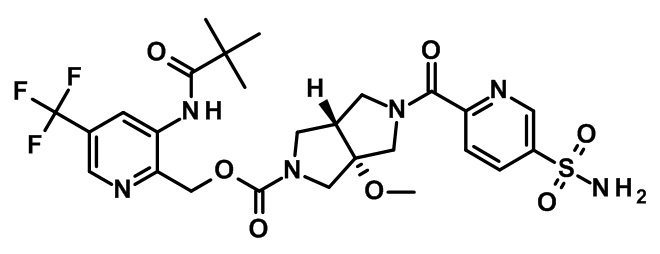
транс-5-(2-фтор-4-сульфамоил-бензоил)-3a-метокси-гексагидро-пирроло[3,4-c]пиррол-2-карбоновой кислоты 3-(2,2-диметил-пропиониламино)-5-трифторметил-пиридин-2-илметилового эфира;
транс-4-[3a-метокси-2-[3-[4-(трифторметокси)фенил]пропаноил]-3,4,6,6a-тетрагидро-1H-пирроло[3,4-c]пиррол-5-карбонил]-3-фторбензолсульфонамида;
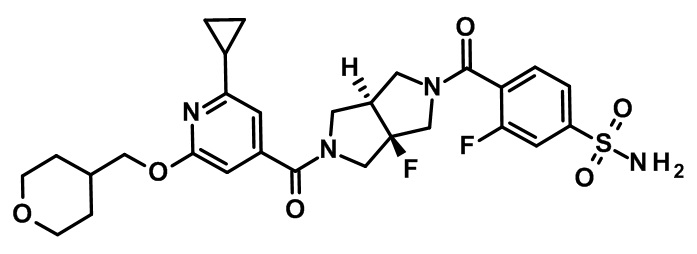
транс-4-[5-[2-циклопропил-6-(оксан-4-илметокси)пиридин-4-карбонил]-3a-метокси-3,4,6,6a-тетрагидро-1H-пирроло[3,4-c]пиррол-2-карбонил]-3-фторбензолсульфонамида;
транс-5-(4-сульфамоил-бензоил)-3a-метокси-гексагидро-пирроло[3,4-c]пиррол-2-карбоновой кислоты 3-(2,2-диметил-пропиониламино)-5-трифторметил-пиридин-2-илметилового эфира;
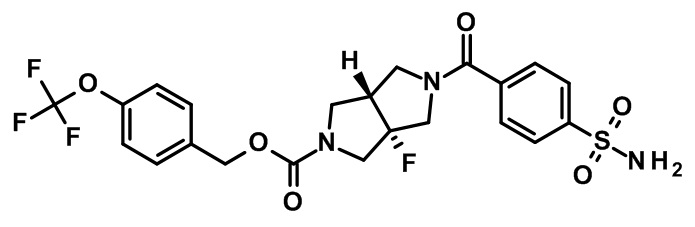
транс-5-(4-сульфамоил-бензоил)-3a-фтор-гексагидро-пирроло[3,4-c]пиррол-2-карбоновой кислоты 4-трифторметокси-бензилового эфира;
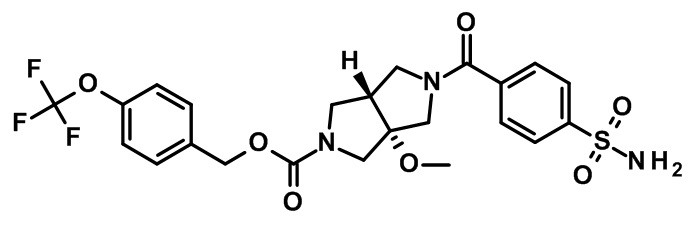
транс-5-(4-сульфамоил-бензоил)-3a-метокси-гексагидро-пирроло[3,4-c]пиррол-2-карбоновой кислоты 4-трифторметокси-бензилового эфира;
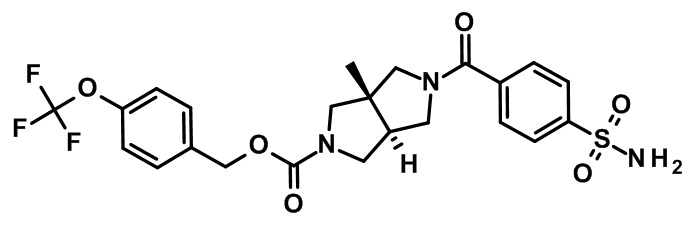
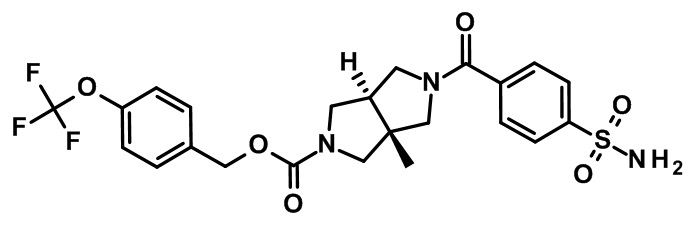
транс-3а-метил-5-(4-сульфамоил-бензоил)-гексагидро-пирроло[3,4-c]пиррол-2-карбоновой кислоты 4-трифторметокси-бензилового эфира;
транс-5-(5-сульфамоилпиридин-2-карбонил)-3a-метокси-гексагидро-пирроло[3,4-c]пиррол-2-карбоновой кислоты 3-(2,2-диметил-пропиониламино)-5-трифторметил-пиридин-2-илметилового эфира;
транс-6-[3a-метокси-2-[3-[4-(трифторметокси)фенил]пропаноил]-3,4,6,6a-тетрагидро-1H-пирроло[3,4-c]пиррол-5-карбонил]пиридин-3-сульфонамида;
транс-6-[5-[2-циклопропил-6-(оксан-4-илметокси)пиридин-4-карбонил]-3a-метокси-3,4,6,6a-тетрагидро-1H-пирроло[3,4-c]пиррол-2-карбонил]пиридин-3-сульфонамида;
транс-5-(2-фтор-4-сульфамоил-бензоил)-3a-фтор-гексагидро-пирроло[3,4-c]пиррол-2-карбоновой кислоты 4-трифторметокси-бензилового эфира;
транс-4-[3a-фтор-2-[(E)-3-[4-(трифторметокси)фенил]проп-2-еноил]-3,4,6,6a-тетрагидро-1H-пирроло[3,4-c]пиррол-5-карбонил]-3-фторбензолсульфонамида;
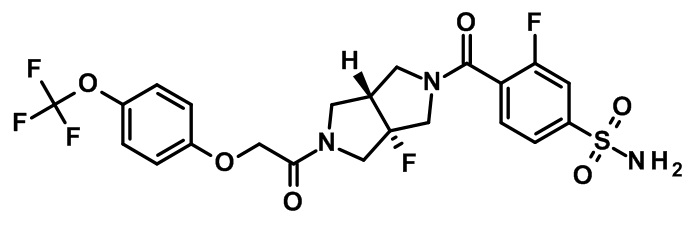
транс-4-[3a-фтор-2-[2-[4-(трифторметокси)фенокси]ацетил]-3,4,6,6a-тетрагидро-1H-пирроло[3,4-c]пиррол-5-карбонил]-3-фторбензолсульфонамида;
транс-4-[5-[2-циклопропил-6-(оксан-4-илметокси)пиридин-4-карбонил]-3a-фтор-3,4,6,6a-тетрагидро-1H-пирроло[3,4-c]пиррол-2-карбонил]-3-фторбензолсульфонамида;
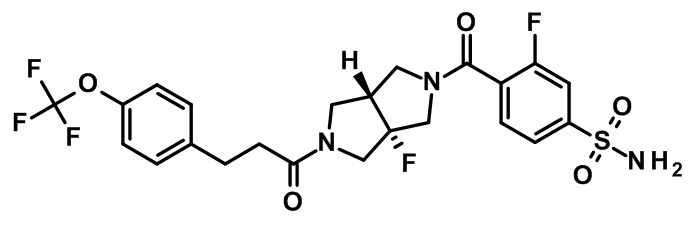
транс-4-[3a-фтор-2-[3-[4-(трифторметокси)фенил]пропаноил]-3,4,6,6a-тетрагидро-1H-пирроло[3,4-c]пиррол-5-карбонил]-3-фторбензолсульфонамида;
(+)-(3aR,6aR)-3а-метил-5-(4-сульфамоил-бензоил)-гексагидро-пирроло[3,4-c]пиррол-2-карбоновой кислоты 4-трифторметокси-бензилового эфира;
(-)-транс-5-(4-сульфамоил-бензоил)-3a-метокси-гексагидро-пирроло[3,4-c]пиррол-2-карбоновой кислоты 4-трифторметокси-бензилового эфира;
(-)-транс-5-(4-сульфамоил-бензоил)-3a-фтор-гексагидро-пирроло[3,4-c]пиррол-2-карбоновой кислоты 4-трифторметокси-бензилового эфира;
(-)-транс-5-(4-сульфамоил-бензоил)-3a-метокси-гексагидро-пирроло[3,4-c]пиррол-2-карбоновой кислоты 3-(2,2-диметил-пропиониламино)-5-трифторметил-пиридин-2-илметилового эфира;
(-)-(3aS,6aS)-3а-метил-5-(4-сульфамоилбензоил)-гексагидро-пирроло[3,4-c]пиррол-2-карбоновой кислоты 4-трифторметокси-бензилового эфира;
(+)-транс-5-(4-сульфамоил-бензоил)-3a-метокси-гексагидро-пирроло[3,4-c]пиррол-2-карбоновой кислоты 4-трифторметокси-бензилового эфира;
(+)-транс-5-(4-сульфамоил-бензоил)-3a-фтор-гексагидро-пирроло[3,4-c]пиррол-2-карбоновой кислоты 4-трифторметокси-бензилового эфира;
(+)-транс-5-(4-сульфамоил-бензоил)-3a-метокси-гексагидро-пирроло[3,4-c]пиррол-2-карбоновой кислоты 3-(2,2-диметил-пропиониламино)-5-трифторметил-пиридин-2-илметилового эфира;
и их фармацевтически приемлемых солей.
Более конкретные примеры описанных в настоящем документе соединений формулы (I) выбраны из:
транс-4-[5-[2-циклопропил-6-(оксан-4-илметокси)пиридин-4-карбонил]-3a-метокси-3,4,6,6a-тетрагидро-1H-пирроло[3,4-c]пиррол-2-карбонил]-3-фторбензолсульфонамида;
транс-6-[5-[2-циклопропил-6-(оксан-4-илметокси)пиридин-4-карбонил]-3a-метокси-3,4,6,6a-тетрагидро-1H-пирроло[3,4-c]пиррол-2-карбонил]пиридин-3-сульфонамида;
транс-4-[5-[2-циклопропил-6-(оксан-4-илметокси)пиридин-4-карбонил]-3a-фтор-3,4,6,6a-тетрагидро-1H-пирроло[3,4-c]пиррол-2-карбонил]-3-фторбензолсульфонамида;
и их фармацевтически приемлемых солей.
Способы получения описанных в настоящем документе соединений формулы (I) являются объектом изобретения.
Получение соединений формулы (I) по настоящему изобретению может быть выполнено последовательными или конвергентными путями синтеза. Синтезы по изобретению показаны на приведенных ниже общих схемах. Специалисты в данной области техники обладают навыками, необходимыми для проведения реакций и очистки полученных в результате продуктов. В том случае, когда в процессе реакции получают смесь энантиомеров или диастереоизомеров, эти энантиомеры или диастереоизомеры можно разделить способами, описанными в настоящем документе или известными специалистам в данной области техники, такими как, например, (хиральная) хроматография или кристаллизация. Заместители и индексы, используемые в последующем описании способов, имеют приведенное в настоящем документе значение.
Соединения общей формулы (I) можно синтезировать из аминного предшественника 1 и соответствующих реагентов, используя способы, хорошо известные в данной области техники.
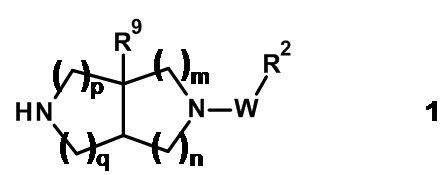
Например, амин 1 подвергают взаимодействию с приемлемой карбоновой кислотой формулы R1-COOH (2) с получением соединения формулы (I), где Y представляет собой -C(O)-. Эту реакцию проводят в присутствии агента сочетания, такого как 1,1'-карбонилдиимидазол, N,N'-дициклогексилкарбодиимид, 1-(3-диметиламинопропил)-3-этил-карбодиимида гидрохлорид, O-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат, O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат или бром-трис-пирролидино-фосфония гексафторфосфат, в апротонных растворителях, таких как дихлорметан, тетрагидрофуран, N,N-диметилформамид, N-метилпирролидинон и их смеси, при температурах от -40°C до 80°C в присутствии или в отсутствие основания, такого как триэтиламин, диизопропилэтиламин, 4-метилморфолин и/или 4-(диметиламино)пиридин.
Амин 1 можно также подвергать взаимодействию с приемлемыми ацилирующими реагентами, такими как хлорангидриды формулы R1-COCl (3), с получением соединений формулы (I), где Y представляет собой -C(O)-. Эту реакцию проводят в растворителе, таком как дихлорметан, тетрагидрофуран или N,N-диметилформамид, в присутствии основания, такого как триэтиламин или 4-метилморфолин, при температурах от 0°C до 80°C.
Альтернативно амин 1 подвергают взаимодействию с приемлемым сложным эфиром формулы R1-O-C(O)-Cl (4) или со сложным эфиром имидазол-1-карбоксилатом формулы (3) с получением соединения формулы (I), где Y представляет собой -OC(O)-.
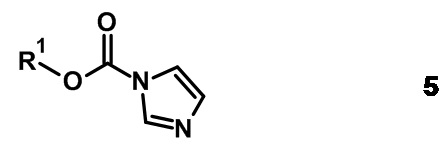
Реакцию проводят в приемлемом растворителе, таком как дихлорметан, тетрагидрофуран, N,N-диметилформамид, ацетонитрил, ацетон, вода или их смеси, в присутствии основания, например триэтиламина, диизопропилэтиламина, пиридина, гидрокарбоната калия, карбоната калия, при температурах от 0°C до температуры кипения растворителя или смеси растворителей.
Сложные эфиры хлорформиаты 4 имеются в продаже или могут быть синтезированы из соответствующего спирта формулы R1-OH путем взаимодействия с фосгеном или эквивалентом фосгена (например, дифосгеном, трифосгеном), как описано в литературе.
Сложные эфиры имидазол-1-карбоксилаты 5 синтезируют из соответствующих спиртов формулы R1-OH путем взаимодействия с 1,1'-карбонилдиимидазолом. Реакцию проводят при комнатной температуре в растворителе, таком как дихлорметан, тетрагидрофуран или ацетонитрил. Сложные эфиры имидазол-1-карбоксилаты 5, как правило, не выделяют, а непосредственно подвергают взаимодействию с аминами 1, как описано выше.
Спирты формулы R1-OH имеются в продаже или могут быть получены способами, описанными в настоящем документе или известными в данной области техники.
Карбоновые кислоты (2) и ацилгалоиды (3) имеются в продаже или могут быть получены, как описано в настоящем документе или в литературе.
Амины общей формулы 1 синтезируют из соответствующим образом защищенных предшественников 6.
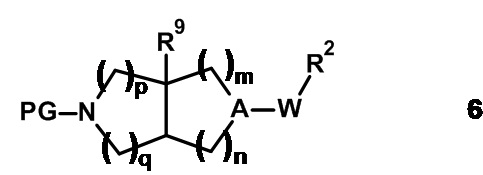
Приемлемыми защитными группами (PG) являются трет-бутоксикарбонил или бензилоксикарбонил. Удаление защиты промежуточных соединений 6 может быть выполнено, используя известные в данной области техники способы и реагенты.
Например, в случае, где PG представляет собой бензилоксикарбонил, удаление защиты может быть выполнено путем гидрогенизации при значениях давления от 1 бар до 100 бар в присутствии приемлемого катализатора, такого как палладий на активированном угле, при температурах от 20°C до 150°C в растворителях, таких как метанол или этанол.
Альтернативно в случае, где PG представляет собой трет-бутоксикарбонил, удаление защиты может быть выполнено в присутствии приемлемой кислоты, например соляной кислоты или трифторуксусной кислоты, в растворителе, таком как вода, 2-пропанол, дихлорметан или 1,4-диоксан, при температурах от 0°C до 30°C.
Промежуточные соединения 6 могут быть получены из аминных предшественников общей формулы 7 путем взаимодействия с надлежащими реагентами, используя известные в данной области техники способы.
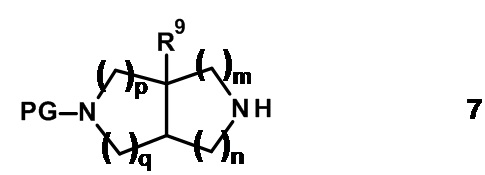
Например, соединение 7 подвергают взаимодействию с алкилирующими агентами общей формулы X-CR7R8-R2 (8), где X представляет собой уходящую группу, такую как Cl, Br, I или OSO2CH3, с получением соединения 6, где W представляет собой -CR7R8-.
Эту реакцию проводят в растворителе, таком как тетрагидрофуран или N,N-диметилформамид, в присутствии основания, например триэтиламина или карбоната калия, при температурах от 0°C до 100°C.
Альтернативно для соединений формулы 6, где W представляет собой -CR7R8-, R7 представляет собой атом водорода, алкил или циклоалкил, а R8 представляет собой H, амин 7 подвергают взаимодействию с альдегидами или кетонами общей формулы R7-C(O)-R2 (9) в реакции восстановительного аминирования с получением соединения 6.
Эту реакцию проводят в присутствии приемлемого восстанавливающего агента, например боргидрида натрия или триацетоксиборгидрида натрия, в растворителе, таком как метанол, уксусная кислота, тетрагидрофуран, 1,2-дихлорэтан или их смеси, при температурах от 0°C до 50°C.
Альтернативно амин 7 подвергают взаимодействию с приемлемой карбоновой кислотой формулы R2-COOH (10) с получением соединений формулы 6, где W представляет собой -C(O)-.
Эту реакцию проводят в присутствии агента сочетания, такого как 1,1'-карбонилдиимидазол, N,N'-дициклогексилкарбодиимид, 1-(3-диметиламинопропил)-3-этил-карбодиимида гидрохлорид, O-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат, O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат или бром-трис-пирролидино-фосфония гексафторфосфат, в апротонных растворителях, таких как дихлорметан, тетрагидрофуран, N,N-диметилформамид, N-метилпирролидинон и их смеси, при температурах от -40°C до 80°C в присутствии или в отсутствие основания, такого как триэтиламин, диизопропилэтиламин, 4-метилморфолин и/или 4-(диметиламино)пиридин.
Альтернативно амин 7 подвергают взаимодействию с приемлемым сульфонилхлоридом формулы R2-SO2Cl (11) с получением соединений формулы 6, где W представляет собой -S(O2)-.
Реакцию проводят в приемлемом растворителе, таком как дихлорметан, тетрагидрофуран, N,N-диметилформамид, ацетонитрил, ацетон, вода или их смеси, в присутствии основания, например триэтиламина, диизопропилэтиламина, пиридина, гидрокарбоната калия, карбоната калия, при температурах от 0°C до температуры кипения растворителя или смеси растворителей.
Амины 7, алкилирующие агенты 8, альдегиды/кетоны 9, карбоновые кислоты 10 и сульфонилхлориды 11 имеются в продаже или могут быть синтезированы, как описано в настоящем документе или в литературе.
Соединения формулы (I) могут быть получены из аминных предшественников общей формулы 12 путем взаимодействия с надлежащими реагентами, используя известные в данной области техники способы.
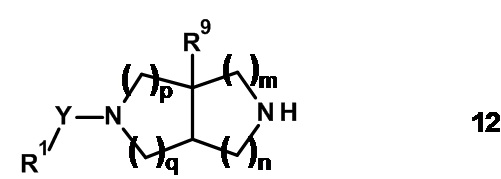
Например, амин формулы 12 подвергают взаимодействию с алкилирующими агентами общей формулы X-CR7R8-R2 (8), где X представляет собой уходящую группу, такую как Cl, Br, I или OSO2CH3, с получением соединений формулы (I), где W представляет собой -CR7R8-. Эту реакцию проводят в растворителе, таком как тетрагидрофуран или N,N-диметилформамид, в присутствии основания, например триэтиламина или карбоната калия, при температурах от 0°C до 100°C.
Альтернативно амин формулы 12 подвергают взаимодействию с альдегидами или кетонами общей формулы R7-C(O)-R2 (9) в реакции восстановительного аминирования с получением соединений формулы (I), где W представляет собой -CR7R8-, R7 представляет собой атом водорода, алкил или циклоалкил, а R8 представляет собой H. Эту реакцию проводят в присутствии приемлемого восстанавливающего агента, например боргидрида натрия или триацетоксиборгидрида натрия, в растворителе, таком как метанол, уксусная кислота, тетрагидрофуран, 1,2-дихлорэтан или их смеси, при температурах от 0°C до 50°C.
Альтернативно амин 12 подвергают взаимодействию с приемлемой карбоновой кислотой формулы R2-COOH (10) с получением соединений формулы (I), где W представляет собой -C(O)-. Реакцию проводят в присутствии агента сочетания, такого как 1,1'-карбонилдиимидазол, N,N'-дициклогексилкарбодиимид, 1-(3-диметиламинопропил)-3-этил-карбодиимида гидрохлорид, O-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат, O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат или бром-трис-пирролидино-фосфония гексафторфосфат, в апротонных растворителях, таких как дихлорметан, тетрагидрофуран, N,N-диметилформамид, N-метилпирролидинон и их смеси, при температурах от -40°C до 80°C в присутствии или в отсутствие основания, такого как триэтиламин, диизопропилэтиламин, 4-метилморфолин и/или 4-(диметиламино)пиридин.
Альтернативно амин 12 подвергают взаимодействию с приемлемым сульфонилхлоридом формулы R2-SO2Cl (11) с получением соединений формулы (I), где W представляет собой -S(O2)-. Реакцию проводят в приемлемом растворителе, таком как дихлорметан, тетрагидрофуран, N,N-диметилформамид, ацетонитрил, ацетон, вода или их смеси, в присутствии основания, например триэтиламина, диизопропилэтиламина, пиридина, гидрокарбоната калия, карбоната калия, при температурах от 0°C до температуры кипения растворителя или смеси растворителей.
Амины 12 можно синтезировать из их трет-бутилкарбаматных производных формулы 13 путем удаления защитной группы карбамата. Удаление защиты может быть выполнено в присутствии приемлемой кислоты, например соляной кислоты или трифторуксусной кислоты, в растворителе, таком как вода, 2-пропанол, дихлорметан или 1,4-диоксан, при температурах от 0°C до 30°C.
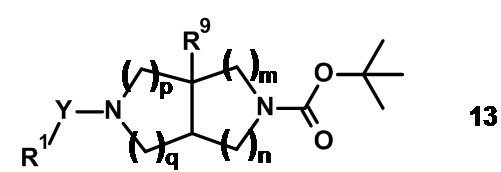
трет-Бутилкарбаматы 13 можно синтезировать из аминных предшественников формулы 14 и соответствующих реагентов, используя способы, хорошо известные в данной области техники.
Например, амин 14 подвергают взаимодействию с приемлемой карбоновой кислотой формулы R1-COOH (2) с получением соединений формулы 21, где Y представляет собой -C(O)-. Эту реакцию проводят в присутствии агента сочетания, такого как 1,1'-карбонилдиимидазол, N,N'-дициклогексилкарбодиимид, 1-(3-диметиламинопропил)-3-этил-карбодиимида гидрохлорид, O-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат, O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат или бром-трис-пирролидино-фосфония гексафторфосфат, в апротонных растворителях, таких как дихлорметан, тетрагидрофуран, N,N-диметилформамид, N-метилпирролидинон и их смеси, при температурах от -40°C до 80°C в присутствии или в отсутствие основания, такого как триэтиламин, диизопропилэтиламин, 4-метилморфолин и/или 4-(диметиламино)пиридин.
Амин 14 можно также подвергать взаимодействию с приемлемыми ацилирующими реагентами, такими как хлорангидриды формулы R1-COCl (3), с получением соединений формулы 13, где Y представляет собой -C(O)-. Эту реакцию проводят в растворителе, таком как дихлорметан, тетрагидрофуран или N,N-диметилформамид, в присутствии основания, такого как триэтиламин или 4-метилморфолин, при температурах от 0°C до 80°C.
Альтернативно амин 14 подвергают взаимодействию с приемлемым сложным эфиром хлорформиатом формулы R1-O-C(O)-Cl (4) или со сложным эфиром имидазол-1-карбоксилатом формулы (5) с получением соединения формулы 13, где Y представляет собой -OC(O)-. Реакцию проводят в приемлемом растворителе, таком как дихлорметан, тетрагидрофуран, N,N-диметилформамид, ацетонитрил, ацетон, вода или их смеси, в присутствии основания, например триэтиламина, диизопропилэтиламина, пиридина, гидрокарбоната калия, карбоната калия, при температурах от 0°C до температуры кипения растворителя или смеси растворителей.
Альтернативно амин 14 можно подвергать взаимодействию с фосгеном или эквивалентом фосгена (например, трифосгеном) с получением соответствующего N-хлоркарбониламина 14A в присутствии основания (например, пиридина) в подходящем растворителе, например, в дихлорметане, при температурах от -78°C до +20°C. Затем N-хлоркарбониламин 14A подвергают взаимодействию со спиртом формулы R1-OH с получением соединения формулы 13, где Y представляет собой -OC(O)-. Эту реакцию проводят в приемлемом растворителе (например, в ацетонитриле или дихлорметане) в присутствии приемлемого основания (например, гидрида натрия, пиридина или связанного с полистиролом 2-трет-бутилимино-2-диэтиламино-1,3-диметилпергидро-1,3,2-диазафосфорина) при температурах от 20°C до температуры кипения растворителя.
Амины формулы 22 имеются в продаже или могут быть получены, как описано в настоящем документе или в литературе.
Воплощение настоящего изобретения также составляет способ получения соединения формулы (I), как определено выше, включающий взаимодействие соединения формулы (II) в присутствии соединения формулы (III);
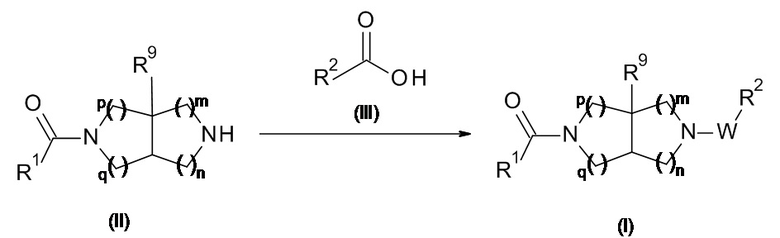
где R1, R2, R9, m, n, p и q являются такими, как определено выше, а W представляет собой -C(O)-,
в частности, в присутствии агента сочетания, такого как 1,1'-карбонилдиимидазол, N,N'-дициклогексилкарбодиимид, 1-(3-диметиламинопропил)-3-этил-карбодиимида гидрохлорид, O-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат, O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат или бром-трис-пирролидино-фосфония гексафторфосфат, в апротонных растворителях, таких как дихлорметан, тетрагидрофуран, N,N-диметилформамид, N-метилпирролидинон и их смеси, при температурах от -40°C до 80°C в присутствии или в отсутствие основания, такого как триэтиламин, диизопропилэтиламин, 4-метилморфолин и/или 4-(диметиламино)пиридин, в частности, в присутствии 4-метилморфолина и при температуре, составляющей от -78°C до температуры образования флегмы, в частности, от -10°C до комнатной температуры.
Объектом настоящего изобретения также является описанное в настоящем документе соединение согласно формуле (I) для применения в качестве терапевтически активной субстанции.
Аналогичным образом объектом настоящего изобретения является фармацевтическая композиция, содержащая описанное в настоящем документе соединение согласно формуле (I) и терапевтически инертный носитель.
Конкретное воплощение настоящего изобретения составляет описанное в настоящем документе соединение согласно формуле (I) для лечения или профилактики глазных патологических состояний, в частности глаукомы.
Настоящее изобретение также относится к применению описанного в настоящем документе соединения согласно формуле (I) для получения лекарственного средства для лечения или профилактики глазных патологических состояний, в частности глаукомы.
Объектом изобретения также является способ лечения или профилактики глазного состояния, в частности глаукомы, включающий введение эффективного количества описанного в настоящем документе соединения согласно формуле (I).
Воспалительные состояния включают без ограничений артрит, остеоартрит, рассеянный склероз, системную красную волчанку, воспалительное заболевание кишечника, нарушение нормальной эвакуации и т. п., а также воспалительные заболевания дыхательных путей, такие как идиопатический легочный фиброз (ИЛФ), хроническая обструктивная болезнь легких (ХОБЛ) или хроническая бронхиальная астма.
Дополнительные патологические состояния дыхательной системы включают без ограничений другие диффузные заболевания легочной паренхимы различной этиологии, в том числе ятрогенный фиброз, обусловленный действием лекарственного средства, профессиональный и/или индуцированный условиями окружающей среды фиброз, системные заболевания и васкулиты, гранулематозные заболевания (саркоидоз, аллергический альвеолит), коллагеновое сосудистое заболевание, альвеолярный протеиноз, легочный гранулематоз из клеток Лангерганса, лимфангиолейомиоматоз, наследственные заболевания (синдром Германского-Пудлака, туберозный склероз, нейрофиброматоз, метаболические болезни накопления, семейную интерстициальную болезнь легких), фиброз, индуцированный облучением, силикоз, индуцированный вдыханием асбестовой пыли легочный фиброз или острый респираторный дистресс-синдром (ОРДС).
Патологические состояния нервной системы включают без ограничений невропатическую боль, шизофрению, воспаление нервов (например, астроглиоз), периферические и/или аутоиммунные (диабетические) невропатии и т. п.
Патологические состояния сосудов включают без ограничений атеросклероз, тромботические сосудистые заболевания, а также тромботические микроангиопатии, пролиферативную артериопатию (такие как набухшие миоинтимальные клетки, окруженные слизистым внеклеточным матриксом, и узловые утолщения), атеросклероз, сниженную податливость сосудов (например, жесткость сосудов, сниженная податливость желудочков и сниженная податливость сосудов), эндотелиальную дисфункцию и т. п.
Сердечно-сосудистые патологические состояния включают без ограничений острый коронарный синдром, ишемическую болезнь сердца, инфаркт миокарда, артериальную и легочную гипертензию, сердечную аритмию, такую как фибрилляция предсердий, инсульт и другое повреждение сосудов.
Фибротические заболевания включают без ограничений фиброз миокарда и сосудов, фиброз почек, фиброз печени, фиброз легких, фиброз кожи, склеродерму и инкапсулирующий перитонит.
Рак и метастазы рака включают без ограничений рак молочной железы, рак яичника, рак легкого, рак предстательной железы, мезотелиому, глиому, карциному печени, различные виды рака желудочно-кишечного тракта и их прогрессирование и метастатическую агрессивность.
Глазные патологические состояния включают без ограничений пролиферативную и непролиферативную (диабетическую) ретинопатию, сухую и влажную формы возрастной макулярной дегенерации (ВМД), макулярный отек, окклюзию центральной артерии/вены сетчатки, травматическое повреждение, глаукому и т. п. В частности, глазное патологическое состояние представляет собой глаукому.
Метаболические патологические состояния включают без ограничений ожирение и диабет.
Воплощение настоящего изобретения также составляют описанные в настоящем документе соединения формулы (I), полученные в соответствии с любым из описанных способов.
Методики анализа
Получение полноразмерного ATX человека с гистидиновой меткой и без гистидиновой метки
Клонирование аутотаксина (ATX - ENPP2): кДНК получали из коммерческой суммарной РНК гемопоэтических клеток человека и использовали в качестве матрицы в перекрывающейся ПЦР для создания полноразмерной открытой рамки считывания (ОРС) ENPP2 человека, включающей или не включающей метку 3'-6xHis. Эти полноразмерные вставки клонировали в векторе pcDNA3.1V5-His TOPO (Invitrogen). Были проверены последовательности ДНК нескольких отдельных клонов. ДНК из корректного полноразмерного клона использовали для трансфекции клеток Hek293 для проверки экспрессии белка. Последовательность кодируемого белка ENPP2 соответствует последовательности из базы данных Swissprot, номер входа Q13822, включающей или не включающей дополнительную C-концевую метку 6xHis.
Ферментация ATX: Рекомбинантный белок продуцировали путем крупномасштабной транзиентной трансфекции в биореакторах с контролируемым механическим перемешиванием объемом 20 л (Sartorius). В процессе роста и трансфекции клеток температуру, скорость мешалки, pH и концентрацию растворенного кислорода поддерживали при 37°C, 120 об/мин, 7,1 и 30% DO соответственно. Клетки FreeStyle 293-F (Invitrogen) культивировали в суспензии в среде FreeStyle 293 (Invitrogen) и трансфицировали в количестве приблизительно 1-1,5x10E6 клеток/мл описанными выше плазмидными ДНК, используя X-tremeGENE Ro-1539 (коммерческий препарат, Roche Diagnostics) в качестве агента комплексообразования. Клетки подпитывали концентрированным питательным раствором (J Immunol Methods 194 (1996), 19, 1-199 (page 193)), через 72 ч после трансфекции проводили индукцию бутиратом натрия (2 мМ) и собирали клетки через 96 ч после трансфекции. Экспрессию анализировали с помощью Вестерн-блоттинга, ферментативного анализа и/или аналитической аффинной хроматографии на иммобилизованных ионах металлов (IMAC; Immobilized Metal Affinity Chromatography). После охлаждения суспензии клеток до 4°C в проточном теплообменнике отделение клеток и стерильное фильтрование супернатанта проводили путем фильтрования через фильтрующие устройства Zeta Plus 60M02 E16 (Cuno) и Sartopore 2 XLG (Sartorius). До очистки супернатант хранили при 4°C.
Очистка ATX: 20 литров супернатанта культуры кондиционировали для ультрафильтрации путем добавления реагента Бридж 35 до конечной концентрации 0,02% и доведения pH до 7,0, используя 1 M HCl. Затем супернатант сначала подвергали микрофильтрации через полиэфирсульфоновый (ПЭС) фильтр с открытыми каналами 0,2 мкм Ultran-Pilot (Whatman), а затем концентрировали до 1 литра через сетчатый ПЭС фильтр Ultran-Pilot Screen Channel PES с порогом отсечения молекулярной массы 30 кДа (Whatman). Перед хроматографией IMAC добавляли NiSO4 до конечной концентрации 1 мМ. Затем осветленный супернатант наносили на колонку HisTrap (GE Healthcare), предварительно уравновешенную в буферном растворе 50 мМ Na2HPO4 pH 7,0, 0,5 M NaCl, 10% глицерина, 0,3% 3-[(3-холанидопропил)диметиламмоний]-1-пропансульфоната (CHAPS), 0,02% NaN3. Колонку промывали ступенчатым градиентом такого же буферного раствора, содержащего 20 мМ, 40 мМ и 50 мМ имидазола соответственно. Белок последовательно элюировали, используя линейный градиент до 0,5 M имидазола в 15 объемах колонки. Фракции, содержащие ATX, объединяли и концентрировали, используя ячейку Amicon, оборудованную фильтрационной ПЭС мембраной 30 кДа. Белок дополнительно очищали эксклюзионной хроматографией на препаративной колонке Superdex S-200 (XK 26/100) (GE Healthcare) в буферном растворе 20 мМ бицина pH 8,5, 0,15 M NaCl, 10% глицерина, 0,3% CHAPS, 0.02% NaN3. Конечный выход белка после очистки составлял 5-10 мг ATX на литр супернатанта культуры. Белок хранили при -80°C.
Анализ ингибирования фермента ATX человека
Ингибирование ATX количественно определяли с помощью анализа с тушением флуоресценции, используя специфично меченый аналог субстрата (субстрат MR121). Для получения этого субстрата MR121 BOC- и TBS-защищенный (R)-3-({2-[3-(2-{2-[2-(2-амино-этокси)-этокси]-этокси}-этокси)-пропиониламино]-этокси}-гидрокси-фосфорилокси)-2-гидрокси-пропиловый эфир 6-амино-гексановой кислоты (Ferguson et al., Org Lett 2006, 8 (10), 2023) метили флуорофором MR121 (CAS 185308-24-1, 1-(3-карбоксипропил)-11-этил-1,2,3,4,8,9,10,11-октагидро-дипиридо[3,2-b:2',3'-i]феноксазин-13-ий) со стороны свободного амина этаноламина, а затем после удаления защиты последовательно метили триптофаном со стороны аминогексановой кислоты.
Рабочие растворы для анализа готовили, как описано ниже:
Аналитический буферный раствор (50 мМ Трис-HCl, 140 мМ NaCl, 5 мМ KCl, 1 мМ CaCl2, 1 мМ MgCl2, 0,01% Тритон-X-100, pH 8,0;
раствор ATX: исходный раствор ATX (человека, His-меченый) (1,08 мг/мл в буферном растворе 20 мМ бицина, pH 8,5, 0,15 M NaCl, 10% глицерина, 0,3% CHAPS, 0,02% NaN3), разведенный до 1,4-2,5-кратной конечной концентрации в аналитическом буферном растворе; раствор субстрата MR121: исходный раствор субстрата MR121 (800 мкМ раствор субстрата MR121 в диметилсульфоксиде (ДМСО)), разведенный до 1,4-2,5-кратной конечной концентрации в аналитическом буферном растворе.
Исследуемые соединения (10 мМ исходный раствор в ДМСО, 8 мкл), полученные в 384-луночных планшетах для образцов (Corning Costar #3655), разводили 8 мкл ДМСО. Серийные разведения по рядам готовили путем перенесения 8 мкл раствора соединения в следующий ряд до ряда O. Растворы соединения и контрольные растворы перемешивали пять раз и переносили по 2 мкл в 384-луночные аналитические планшеты (Corning Costar # 3702). Затем добавляли 15 мкл 41,7 нМ раствора ATX (конечная концентрация 30 нМ), перемешивали пять раз, а затем инкубировали в течение 15 минут при 30°C. Добавляли 10 мкл раствора субстрата MR121 (конечная концентрация 1 мкМ), перемешивали 30 раз, а затем инкубировали в течение 15 минут при 30°C. Затем измеряли флуоресценцию каждые 2 минуты в течение 1 часа (мультимодальное считывающее устройство видимого света для планшетов Perkin Elmer); интенсивность света: 2,5%; время экспозиции: 1,4 с, фильтр: Fluo_630/690 нм), и на основании показаний считывающего устройства рассчитывали значения 50% ингибирующей концентрации (IC50).
Анализ ингибирования карбоангидразы-II человека
Ингибирование карбоангидразы II человека (hCA-II) количественно определяли способом измерения оптической плотности, используя 4-нитрофенилацетат (4-NPA) в качестве ее субстрата.
Активная hCA II может катализировать 4-NPA посредством цинк-гидроксидного механизма.
Нитрофенолят в продуктах может претерпевать ионизацию с образованием ярко-желтого аниона с высокой оптической плотностью при длине волны от 348 до 400 нм, как описано в литературе (Armstrong et al., J. Biol. Chem. 1966, 241, 5137-5149).
Для обнаружения преобразования субстрата hCA II использовали OD 340 нм.
Рабочие растворы для анализа готовили, как описано ниже:
Аналитический буферный раствор:
50 мМ 3-N-морфолинпропансульфоновой кислоты (MOPS), 33 мМ Na2SO4, 1 мМ этилендиаминтетрауксусной кислоты (ЭДТА), 0,5 мг/мл бычьего сывороточного альбумина (БСА), pH 7,5;
Раствор фермента: исходный раствор hCA-II (человеческая, полноразмерная) (1,0 мг/мл в растворе 20 мМ N-2-гидроксиэтил-пиперазин-N-2-этансульфоновой кислоты (ГЭПЭС), 50 мМ NaCl, pH 7,4), разведенный до 2133-кратной конечной концентрации в аналитическом буферном растворе;
Раствор субстрата 4-NPA: исходный раствор субстрата 4-NPA (250 мМ в диметилсульфоксиде (ДМСО), хранили при -20°C), разведенный до 50-кратной конечной концентрации в деионизированной воде.
Исследуемые соединения (10 мМ исходный раствор в ДМСО, 100 мкл) были получены в 96-луночных планшетах для образцов (Corning Costar #3655) и разведены до концентрации 0,5 мМ.
Серийные разведения по вертикальным рядам готовили путем перенесения 20 мкл растворов соединений в следующий вертикальный ряд, от 3-го до 22-го ряда.
После этого по 1,2 мкл переносили в 384-луночные аналитические планшеты (Corning Costar # 3701).
Затем добавляли 30 мкл 16 нМ раствора hCA II (конечная концентрация 8 нМ), перемешивали пять раз.
Добавляли 30 мкл раствора субстрата 4-NPA (конечная концентрация 2,5 нМ), перемешивали пять раз.
Затем сразу измеряли оптическую плотность при 340 нм как нулевой момент времени.
Аналитические планшеты инкубировали при комнатной температуре в течение 1 часа, а затем измеряли как момент времени 1 час (Perkin Elmer EnVision 2103; фильтр: Photometric 340; интенсивность света 60%; число вспышек: 10).
На основании этих показаний рассчитывали значения 50% ингибирующей концентрации (IC50) и константы ингибирования (Ki).
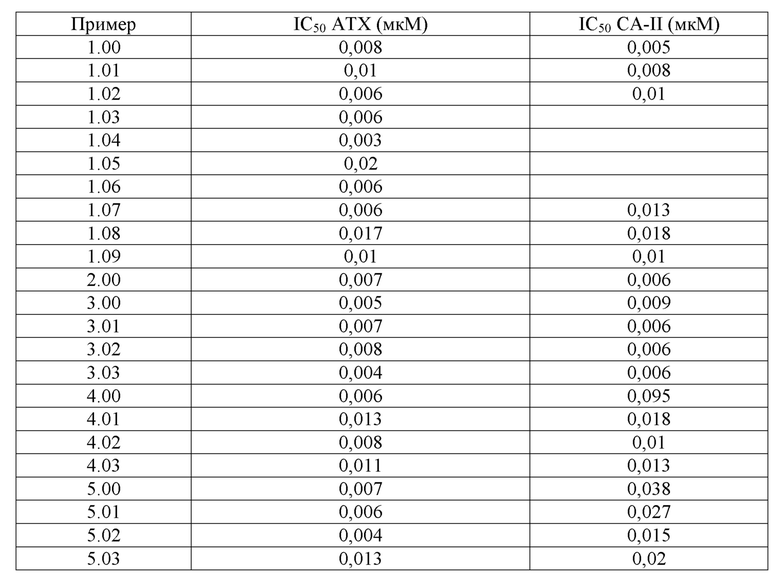
Описанные в настоящем документе соединения формулы (I) и их фармацевтически приемлемые соли или сложные эфиры имеют значения IC50 от 0,00001 мкМ до 1000 мкМ, конкретные соединения имеют значения IC50 от 0,0005 мкМ до 500 мкМ, более конкретные соединения имеют значения IC50 от 0,0005 мкМ до 50 мкМ, более конкретные соединения имеют значения IC50 от 0,0005 мкМ до 5 мкМ. Эти результаты получены путем использования описанного выше ферментативного анализа.
Соединения формулы (I) и их фармацевтически приемлемые соли можно применять в качестве лекарственных средств (например в форме фармацевтических препаратов). Эти фармацевтические препараты можно вводить внутрь, например перорально (например, в форме таблеток, таблеток с покрытием, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий), назально (например, в форме назальных спреев), ректально (например, в форме суппозиториев) или местным глазным путем (например, в форме растворов, мазей, гелей или водорастворимых полимерных вкладок). Введение можно, однако, также осуществлять парентерально, например внутримышечным, внутривенным или внутриглазным путем (например, в форме стерильных инъекционных растворов).
Соединения формулы (I) и их фармацевтически приемлемые соли можно обрабатывать с фармацевтически инертными неорганическими или органическими вспомогательными веществами для получения таблеток, таблеток с покрытием, драже, твердых желатиновых капсул, инъекционных растворов или лекарственных форм для местного применения. В качестве таких вспомогательных веществ для таблеток, драже и твердых желатиновых капсул можно использовать, например, лактозу, кукурузный крахмал или его производные, тальк, стеариновую кислоту или ее соли и т. д.
Приемлемыми вспомогательными веществами для мягких желатиновых капсул являются, например, растительные масла, воски, жиры, полутвердые вещества и жидкие полиолы и т. д.
Приемлемыми вспомогательными веществами для получения растворов и сиропов являются, например, вода, полиолы, сахароза, инвертный сахар, глюкоза и т. п.
Приемлемыми вспомогательными веществами для инъекционных растворов являются, например, вода, спирты, полиолы, глицерин, растительные масла и т. д.
Приемлемыми вспомогательными веществами для суппозиториев являются, например, натуральные или отвержденные масла, воски, жиры, полужидкие или жидкие полиолы и т. п.
Приемлемыми вспомогательными веществами для лекарственных форм для местного глазного применения являются, например, циклодекстрины, маннит или многие другие носители и эксципиенты, известные в данной области техники.
Кроме того, фармацевтические препараты могут содержать консерванты, солюбилизаторы, вещества, повышающие вязкость, стабилизаторы, смачивающие агенты, эмульгаторы, подсластители, красители, корригенты, соли для изменения осмотического давления, буферные растворы, маскирующие агенты или антиоксиданты. Они могут также содержать другие терапевтически ценные вещества.
Дозировка может изменяться в широких пределах и, конечно, в каждом конкретном случае будет приспособлена к индивидуальным потребностям. Как правило, в случае перорального введения целесообразна суточная дозировка от приблизительно 0,1 мг до 20 мг на кг массы тела, предпочтительно от приблизительно 0,5 мг до 4 мг на кг массы тела (например, приблизительно 300 мг на человека), предпочтительно разделенная на 1-3 отдельные дозы, которые могут состоять, например, из одинаковых количеств. В случае местного введения лекарственная форма может содержать от 0,001% до 15 масс.% лекарственного средства, и требуемую дозу, которая может составлять от 0,1 до 25 мг, можно вводить либо в виде однократной дозы раз в день или раз в неделю, либо в виде многократных доз (от 2 до 4) в день или многократных доз в неделю. Тем не менее должно быть понятно, что приведенные в настоящем документе верхние или нижние пределы могут быть превышены в том случае, когда это показано.
Далее в настоящем документе изобретение проиллюстрировано примерами, не имеющими ограничительного характера.
В случае получения препаративных примеров в виде смеси энантиомеров чистые энантиомеры можно получить описанными в настоящем изобретении способами, либо способами, известными специалистам в данной области техники, такими как, например, хиральная хроматография или кристаллизация.
ПРИМЕРЫ
Все примеры и промежуточные соединения были получены в атмосфере азота, если не указано иное.
Сокращения: водн. - водный раствор; CAS-RN - регистрационный номер в журнале Кемикал Абстрактс (Chemical Abstracts Service Registry Number); ВЭЖХ - высокоэффективная жидкостная хроматография; МС - масс-спектр; PS-BEMP - связанный с полистиролом 2-трет-бутилимино-2-диэтиламино-1,3-диметилпергидро-1,3,2-диазафосфорин; нас. - насыщенный раствор
Пример 1
транс-5-(2-Фтор-4-сульфамоил-бензоил)-3a-метокси-гексагидро-пирроло[3,4-c]пиррол-2-карбоновой кислоты 3-(2,2-диметил-пропиониламино)-5-трифторметил-пиридин-2-илметиловый эфир
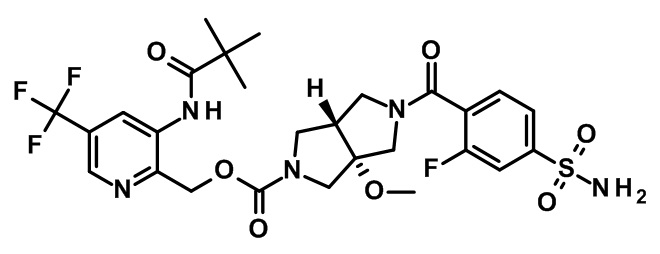
К раствору транс-3a-метокси-гексагидро-пирроло[3,4-c]пиррол-2-карбоновой кислоты 3-(2,2-диметил-пропиониламино)-5-трифторметил-пиридин-2-илметилового эфира дигидрохлорида (промежуточное соединение 5; 96 мг, 186 мкмоль), 4-метилморфолина (113 мг, 1,11 ммоль) и 2-фтор-4-сульфамоилбензойной кислоты (CAS-RN 714968-42-0; 42,8 мг, 186 мкмоль) в N,N-диметилформамиде (3 мл) добавляли O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат (70,6 мг, 186 мкмоль) при комнатной температуре, затем через 18 ч реакционную смесь распределяли между нас. водным раствором гидрокарбоната натрия и смесью этилацетат/2-метилтетрагидрофуран 4:1.
Органический слой промывали нас. водным раствором хлорида аммония и раствором хлорида натрия, высушивали над сульфатом магния, фильтровали и выпаривали.
В результате хроматографии (силикагель; градиент от дихлорметана до смеси дихлорметан/метанол/25% водный раствор аммиака 90:10:0,25) получили соединение, указанное в заголовке (107 мг, 80%).
Белое твердое вещество, МС: 646,2 (M+H)+.
Следующие примеры получили по аналогии с примером 1, заменяя транс-3a-метокси-гексагидро-пирроло[3,4-c]пиррол-2-карбоновой кислоты 3-(2,2-диметил-пропиониламино)-5-трифторметил-пиридин-2-илметилового эфира дигидрохлорид соответствующим амином, а 2-фтор-4-сульфамоилбензойную кислоту - соответствующей карбоновой кислотой.
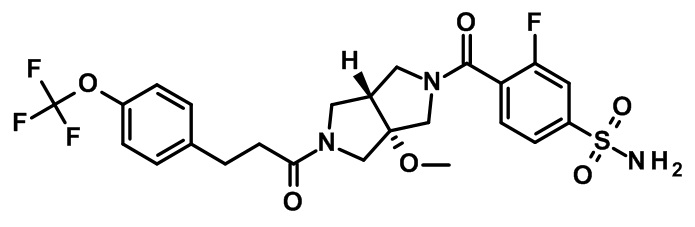
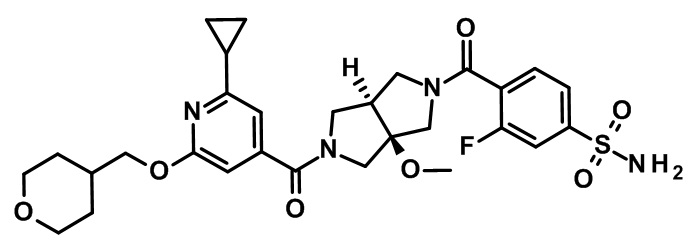
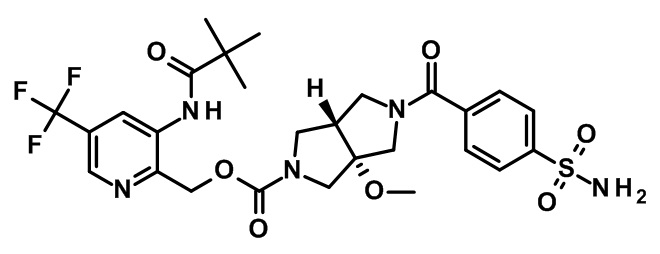
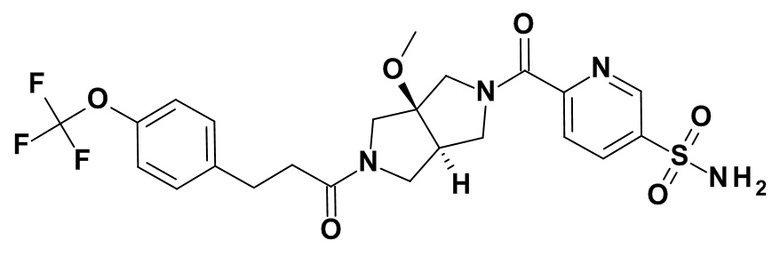
(CAS-RN 1308677-67-9)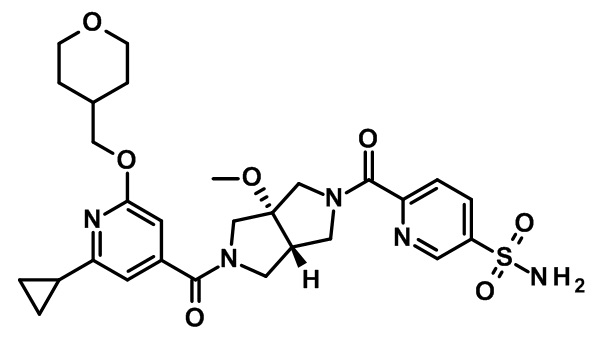
Пример 2
транс-5-(2-Фтор-4-сульфамоил-бензоил)-3a-фтор-гексагидро-пирроло[3,4-c]пиррол-2-карбоновой кислоты 4-трифторметокси-бензиловый эфир
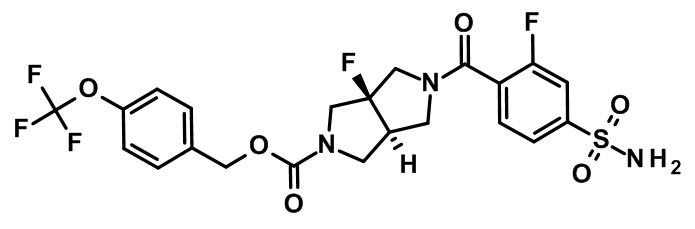
К раствору (4-(трифторметокси)фенил)метанола (26,1 мг, 136 мкмоль) в ацетонитриле (5 мл) добавляли 1,1'-карбонилдиимидазол (22 мг, 136 мкмоль), и реакционную смесь нагревали при 50°C в течение 2 ч, затем добавляли триэтиламин (68,8 мг, 680 мкмоль) и 3-фтор-4-(транс-3a-фтороктагидропирроло[3,4-c]пиррол-2-карбонил)бензолсульфонамида гидрохлорид (50 мг, 136 мкмоль), и реакционную смесь нагревали с обратным холодильником в течение еще 15 ч. После охлаждения реакционную смесь распределяли между этилацетатом и нас. водн. раствором гидрокарбоната натрия.
Органический слой промывали нас. водным раствором хлорида аммония и раствором хлорида натрия, высушивали над сульфатом магния, фильтровали и выпаривали.
В результате хроматографии (силикагель; градиент от дихлорметана до смеси дихлорметан/метанол/25% водный раствор аммиака 90:10:0,25) получили соединение, указанное в заголовке (59 мг, 79%).
Белая пена, МС: 550,1 (M+H)+.
Пример 3
транс-4-[3a-Фтор-2-[(E)-3-[4-(трифторметокси)фенил]проп-2-еноил]-3,4,6,6a-тетрагидро-1H-пирроло[3,4-c]пиррол-5-карбонил]-3-фторбензолсульфонамид
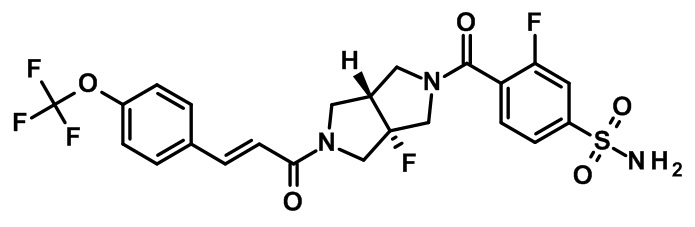
К раствору ((3aR,6aS)-3a-фтороктагидропирроло[3,4-c]пиррол-2-карбонил)бензолсульфонамида гидрохлорида (промежуточное соединение 9; 50 мг, 122 мкмоль), 4-метилморфолина (61,9 мг, 612 мкмоль) и (E)-3-(4-(трифторметокси)фенил)акриловой кислоты (29 мг, 122 мкмоль) в N,N-диметилформамиде (4 мл) добавляли O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат (46,5 мг, 122 мкмоль) при комнатной температуре, затем через 18 ч реакционную смесь распределяли между нас. водн. раствором гидрокарбоната натрия и смесью этилацетат/2-метилтетрагидрофуран 4:1.
Органический слой промывали нас. водн. раствором хлорида аммония и раствором хлорида натрия, высушивали над сульфатом магния, фильтровали и выпаривали.
В результате хроматографии (силикагель; градиент смеси дихлорметан/метанол/25% водный раствор аммиака от 97,5:2,5:0,25 до 95:5:0,25) получили соединение, указанное в заголовке (48 мг, 72%).
Белое твердое вещество, МС: 546,1 (M+H)+.
Следующие примеры получили по аналогии с примером 3, заменяя 3-фтор-4-((3aR,6aS)-3а-фтороктагидропирроло[3,4-c]пиррол-2-карбонил)бензолсульфонамида гидрохлорид соответствующим амином, а (E)-3-(4-(трифторметокси)фенил)акриловую кислоту - соответствующей карбоновой кислотой.
Примеры 4 и 5
(+)-(3aR,6aR)-3a-Метил-5-(4-сульфамоил-бензоил)-гексагидро-пирроло[3,4-c]пиррол-2-карбоновой кислоты 4-трифторметокси-бензиловый эфир и (-)-(3aS,6aS)-3a-метил-5-(4-сульфамоил-бензоил)-гексагидро-пирроло[3,4-c]пиррол-2-карбоновой кислоты 4-трифторметокси-бензиловый эфир
 и
и 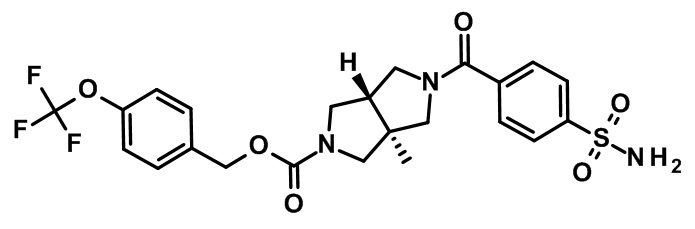
Рацемический транс-3a-метил-5-(4-сульфамоил-бензоил)-гексагидро-пирроло[3,4-c]пиррол-2-карбоновой кислоты 4-трифторметокси-бензиловый эфир (пример 1.06; 180 мг, 341 мкмоль) разделяли препаративной ВЭЖХ, используя колонку Chiralpak AD в качестве стационарной фазы и смесь гептан/этанол/ацетат аммония 60:40:0,004 в качестве элюента.
Таким образом получили (+)-энантиомер, элюирующий быстрее (пример 4; 67 мг, 37%; белая пена, МС: 528,2 (M+H)+), и (-)-энантиомер, элюирующий медленнее (пример 5; 63 мг, 35%; белая пена, МС: 528,2 (M+H)+).
Следующие примеры получили по аналогии с примерами 4 и 5 путем хирального разделения на ВЭЖХ их рацематов, используя стационарную фазу и элюент, как указано ниже.
Промежуточные соединения
Промежуточное соединение 1
транс-трет-Бутил-3a-метилгексагидропирроло[3,4-c]пиррол-2(1H)-карбоксилат
Стадия 1: транс-диметил-1-бензил-3-метилпирролидин-3,4-дикарбоксилат
Раствор N-бензил-1-метокси-N-((триметилсилил)метил)метанамина (CAS-RN 93102-05-7; 1,74 г, 17,0 ммоль) в дихлорметане (5 мл) добавляли к охлажденной во льду смеси диметил-2-метилфумарата (CAS-RN 617-53-8; 1,00 г, 6,32 ммоль) и трифторуксусной кислоты (79,3 мг, 696 мкмоль) в дихлорметане (10 мл) при 0-5°C. Полученный в результате желтый раствор оставляли до достижения комнатной температуры на 20 ч, затем распределяли между нас. водным раствором гидрокарбоната натрия и дихлорметаном.
Органический слой промывали раствором хлорида натрия, высушивали над сульфатом магния, фильтровали и выпаривали.
В результате хроматографии (силикагель; градиент от дихлорметана до смеси дихлорметан/метанол/25% водный раствор аммиака 95:5:0,25) получили соединение, указанное в заголовке (1,61 г, 87%).
Светло-желтое масло, МС: 292,2 (M+H)+.
Стадия 2: транс-1-трет-бутил-3,4-диметил-3-метилпирролидин-1,3,4-трикарбоксилат
Раствор транс-диметил-1-бензил-3-метилпирролидин-3,4-дикарбоксилата (1,56 г, 5,35 ммоль) и ди-трет-бутилдикарбоната (1,29 г, 5,89 ммоль) в метаноле (20 мл) перемешивали при комнатной температуре в атмосфере водорода (1 бар) в присутствии палладия (10% на активированном угле, 165 мг, 1,55 ммоль).
Через 3 ч нерастворимое вещество удаляли фильтрованием через диатомовую землю, и фильтрат концентрировали.
В результате хроматографии (силикагель; градиент от гептана до смеси этилацетат/гептан 1:1) получили соединение, указанное в заголовке (1,47 г, 91%).
Бесцветное масло, МС: 202,1 (M+H-Me3COCO)+.
Стадия 3: транс-трет-бутил-3,4-бис(гидроксиметил)-3-метилпирролидин-1-карбоксилат
Раствор транс-1-трет-бутил-3,4-диметил-3-метилпирролидин-1,3,4-трикарбоксилата (1,47 г, 4,87 ммоль) в тетрагидрофуране (12 мл) охлаждали до 0°C и обрабатывали раствором боргидрида лития (2 M в тетрагидрофуране, 5,47 мл, 10,9 ммоль), затем через 30 мин ледяную баню удаляли, и реакционную смесь перемешивали при комнатной температуре.
Через 18 ч избыток реагента разрушали медленным добавлением 1 M водного раствора соляной кислоты при 0°C до pH 1.
Полученный в результате прозрачный раствор экстрагировали дихлорметаном, органический слой промывали водой и раствором хлорида натрия, высушивали над сульфатом магния, фильтровали и выпаривали.
В результате хроматографии (силикагель; градиент гептан - этилацетат) получили соединение, указанное в заголовке (1,05 г, 88%).
Бесцветное вязкое масло, МС: 190,1 (M+H-изобутен)+.
Стадия 4: транс-трет-бутил-3-метил-3,4-бис(((метилсульфонил)окси)метил)пирролидин-1-карбоксилат
Метансульфонилхлорид (1,41 g, 12,4 ммоль) добавляли по каплям при 0°C к прозрачному бесцветному раствору транс-трет-бутил-3,4-бис(гидроксиметил)-3-метилпирролидин-1-карбоксилата (1,01 g, 4,12 ммоль) и N,N-диизопропилэтиламина (3,19 г, 24,7 ммоль) в дихлорметане (10 мл) и охлаждали до 0°C. Через 30 мин реакционную смесь распределяли между нас. водным раствором хлорида аммония и дихлорметаном.
Органические слои промывали нас. водным раствором гидрокарбоната натрия и раствором хлорида натрия, высушивали над сульфатом магния, фильтровали и выпаривали.
В результате хроматографии (силикагель; градиент гептан - этилацетат) получили соединение, указанное в заголовке (1,53 г, 92%).
Желтое вязкое масло, МС: 346,1 (M+H-изобутен)+.
Стадия 5: транс-трет-бутил-5-бензил-3a-метилгексагидропирроло[3,4-c]пиррол-2(1H)-карбоксилат
К раствору транс-трет-бутил-3-метил-3,4-бис(((метилсульфонил)окси)метил)пирролидин-1-карбоксилата (1,52 г, 3,79 ммоль) в толуоле (20 мл) добавляли триэтиламин (1,15 г, 11,4 ммоль) и бензиламин (811 мг, 7,57 ммоль).
Реакционную смесь нагревали с обратным холодильником, затем через 20 ч добавляли другую порцию триэтиламина (1,15 г, 11,4 ммоль) и бензиламина (811 мг, 7,57 ммоль), затем после еще 20 ч кипячения с обратным холодильником реакционную смесь промывали 1 M водным раствором гидроксида натрия и раствором хлорида натрия, высушивали над сульфатом магния, фильтровали и выпаривали.
В результате хроматографии (силикагель; градиент гептан - этилацетат) получили соединение, указанное в заголовке (875 мг, 73%).
Светло-желтое твердое вещество, МС: 317,2 (M+H)+.
Стадия 6: транс-трет-бутил-3a-метилгексагидропирроло[3,4-c]пиррол-2(1H)-карбоксилат
Раствор (3aR,6aR)-трет-бутил-5-бензил-3a-метилгексагидропирроло[3,4-c]пиррол-2(1H)-карбоксилата (870 мг, 2,75 ммоль) в метаноле (10 мл) перемешивали при комнатной температуре в атмосфере водорода (1 бар) в присутствии палладия (10% на активированном угле, 146 мг, 1,37 ммоль), затем через 5 ч нерастворимое вещество удаляли фильтрованием через диатомовую землю.
Фильтрат выпаривали с получением соединения, указанного в заголовке (640 мг, 93%), содержащего около 10% метанола.
Бесцветное вязкое масло, МС: 227,2 (M+H)+.
Промежуточное соединение 2
транс-трет-Бутил-3a-фторгексагидропирроло[3,4-c]пиррол-2(1H)-карбоксилат
Соединение, указанное в заголовке, получили по аналогии с промежуточным соединением 1, заменяя диметил-2-метилфумарат диэтил-2-фторфумаратом (CAS-RN 4495-77-6).
Бесцветное вязкое масло, МС: 231,2 (M+H)+.
Промежуточное соединение 3
транс-трет-Бутил-3a-метоксигексагидропирроло[3,4-c]пиррол-2(1H)-карбоксилат
Соединение, указанное в заголовке, получили по аналогии с промежуточным соединением 1, заменяя диметил-2-метилфумарат 2-метоксифумаратом (CAS-RN 2215-05-6).
Бесцветное вязкое масло, МС: 243,2 (M+H)+.
Промежуточное соединение 4
транс-3a-метил-Гексагидро-пирроло[3,4-c]пиррол-2-карбоновой кислоты 4-трифторметокси-бензилового эфира гидрохлорид
Стадия 1: транс-2-трет-бутил-5-(4-(трифторметокси)бензил) 3a-метилтетрагидропирроло[3,4-c]пиррол-2,5(1H,3H)-дикарбоксилат
К раствору (4-(трифторметокси)фенил)метанола (474 мг, 2,47 ммоль) в ацетонитриле (20 мл) добавляли 1,1'-карбонилдиимидазол (413 мг, 2,47 ммоль), и реакционную смесь нагревали до 50°C, затем через 3 ч добавляли триэтиламин (1,25 g, 12,3 ммоль) и транс-трет-бутил-3a-метилгексагидропирроло[3,4-c]пиррол-2(1H)-карбоксилат (промежуточное соединение 1; 621 мг, 2,47 ммоль), и реакционную смесь нагревали с обратным холодильником.
Через 15 ч реакционную смесь распределяли между этилацетатом и нас. водным раствором гидрокарбоната натрия.
Органический слой промывали нас. водным раствором хлорида аммония и раствором хлорида натрия, высушивали над сульфатом магния, фильтровали и выпаривали.
В результате хроматографии (силикагель; градиент от дихлорметана до смеси дихлорметан/метанол/25% водный раствор аммиака 95:5:0,25) получили соединение, указанное в заголовке (821 мг, 75%).
Светло-желтое масло, МС: 389,2 (M+H-изобутен)+.
Стадия 2: транс-3a-метил-гексагидро-пирроло[3,4-c]пиррол-2-карбоновой кислоты 4-трифторметокси-бензилового эфира гидрохлорид
Раствор транс-2-трет-бутил-5-(4-(трифторметокси)бензил)-3a-метилтетрагидропирроло[3,4-c]пиррол-2,5(1H,3H)-дикарбоксилата (812 мг, 1,83 ммоль) и раствор соляной кислоты (5-6 M в 2-пропаноле, 10,2 мл, 51,2 ммоль) в 2-пропаноле (5 мл) перемешивали в течение 15 ч при комнатной температуре, затем концентрировали до сухого состояния.
Остаток растирали в трет-бутилметиловом эфире, и осадок собирали фильтрованием с получением соединения, указанного в заголовке (662 мг, 95%).
Белое твердое вещество, МС: 345,1 (M+H)+.
Промежуточное соединение 4.01
транс-3a-фтор-Гексагидро-пирроло[3,4-c]пиррол-2-карбоновой кислоты 4-трифторметокси-бензиловый эфир
Соединение, указанное в заголовке, получили по аналогии с промежуточным соединением 4, заменяя транс-трет-бутил-3a-метилгексагидропирроло[3,4-c]пиррол-2(1H)-карбоксилат транс-трет-бутил-3a-фторгексагидропирроло[3,4-c]пиррол-2(1H)-карбоксилатом (промежуточным соединением 2).
Белое твердое вещество, МС: 349,1 (M+H)+.
Промежуточное соединение 5
транс-3a-Метокси-гексагидро-пирроло[3,4-c]пиррол-2-карбоновой кислоты 3-(2,2-диметил-пропиониламино)-5-трифторметил-пиридин-2-илметилового эфира дигидрохлорид
Стадия 1: транс-трет-бутил-5-(хлоркарбонил)-3a-метоксигексагидропирроло[3,4-c]пиррол-2(1H)-карбоксилат
К раствору транс-трет-бутил-3a-метоксигексагидропирроло[3,4-c]пиррол-2(1H)-карбоксилата (промежуточное соединение 3; 440 мг, 1,82 ммоль) и пиридина (646 мг, 8,17 ммоль) в дихлорметане (5 мл) добавляли по каплям раствор трифосгена (242 мг, 817 мкмоль) в дихлорметане (4 мл) при 0°C. Через 30 мин ледяную баню удаляли, затем через 4 ч реакционную смесь распределяли между дихлорметаном и 1 M водным раствором соляной кислоты.
Органический слой промывали водой и раствором хлорида натрия, высушивали над сульфатом магния, фильтровали и выпаривали с получением соединения, указанного в заголовке (372 мг, 67%), в виде светло-желтой пены.
Стадия 2: транс-2-трет-Бутил-5-((3-пиваламидо-5-(трифторметил)пиридин-2-ил)метил) 3a-метокситетрагидропирроло[3,4-c]пиррол-2,5(1H,3H)-дикарбоксилат
К раствору транс-трет-бутил-5-(хлоркарбонил)-3a-метоксигексагидропирроло[3,4-c]пиррол-2(1H)-карбоксилата (370 мг, 1,21 ммоль) в ацетонитриле (25 мл) добавляли N-(2-(гидроксиметил)-5-(трифторметил)пиридин-3-ил)пиваламид (промежуточное соединение 8; 335 мг, 1,21 ммоль) и PS-BEMP (CAS-RN 1446424-86-7; 1,5 г, 1,21 ммоль).
Оранжевую суспензию нагревали с обратным холодильником в течение 21 ч, затем нерастворимое вещество удаляли фильтрованием.
К фильтрату добавляли трисамин, нанесенный на полимерную подложку (PS-Trisamine; polymer-supported trisamine) (CAS-RN 1226492-10-9; 315 мг, 1,21 ммоль), и реакционную смесь перемешивали при комнатной температуре в течение 18 ч, затем нерастворимое вещество удаляли фильтрованием, и фильтрат выпаривали.
В результате хроматографии (силикагель; градиент от дихлорметана до смеси дихлорметан/метанол/25% водный раствор аммиака 95:5:0,25) получили соединение, указанное в заголовке (333 мг, 50%).
Белая пена, МС: 545,3 (M+H)+.
Стадия 3: транс-3a-метокси-гексагидро-пирроло[3,4-c]пиррол-2-карбоновой кислоты 3-(2,2-диметил-пропиониламино)-5-трифторметил-пиридин-2-илметилового эфира дигидрохлорид
Раствор транс-2-трет-бутил-5-((3-пиваламидо-5-(трифторметил)пиридин-2-ил)метил)3a-метокситетрагидропирроло[3,4-c]пиррол-2,5(1H,3H)-дикарбоксилата (325 мг, 597 мкмоль) и раствор соляной кислоты (5-6 M в 2-пропаноле, 3,34 мл, 16,7 ммоль) в 2-пропаноле (2 мл) перемешивали при комнатной температуре в течение 18 ч, затем реакционную смесь концентрировали до сухого состояния.
Остаток растирали в трет-бутилметиловом эфире, и осадок собирали фильтрованием с получением соединения, указанного в заголовке (291 мг, 94%).
Белое твердое вещество, МС: 445,2 (M+H)+.
Промежуточное соединение 6
транс-(2 циклопропил-6-((тетрагидро-2H-пиран-4-ил)метокси)пиридин-4-ил)-3a-метоксигексагидропирроло[3,4-c]пиррол-2(1H)-ил)метанона дигидрохлорид
Стадия 1: транс-трет-бутил-5-(2-циклопропил-6-((тетрагидро-2H-пиран-4-ил)метокси)изоникотиноил)-3a-метоксигексагидропирроло[3,4-c]пиррол-2(1H)-карбоксилат
К раствору транс-трет-бутил-3a-метоксигексагидропирроло[3,4-c]пиррол-2(1H)-карбоксилата (500 мг, 2,06 ммоль) в N,N-диметилформамиде (40 мл) добавляли 2-циклопропил-6-((тетрагидро-2H-пиран-4-ил)метокси)изоникотиновую кислоту (промежуточное соединение 7; 572 мг, 2,06 ммоль) и 4-метилморфолин (1,04 г, 10,3 ммоль).
Раствор охлаждали до 0°C, затем добавляли O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат (824 мг, 2,17 ммоль).
Ледяную баню удаляли, затем через 96 ч реакционную смесь распределяли между раствором гидрокарбоната натрия и смесью этилацетат/2-метилтетрагидрофуран 4:1.
Органический слой промывали нас. водным раствором хлорида аммония и раствором хлорида натрия, высушивали над сульфатом магния, фильтровали и выпаривали.
В результате хроматографии (силикагель; градиент от дихлорметана до смеси дихлорметан/метанол/25% водный раствор аммиака 90:10:0,25) получили соединение, указанное в заголовке (977 мг, 94%).
Желтое вязкое масло, МС: 502,3 (M+H)+.
Стадия 2: транс-(2-циклопропил-6-((тетрагидро-2H-пиран-4-ил)метокси)пиридин-4-ил)3a-метоксигексагидропирроло[3,4-c]пиррол-2(1H)-ил)метанона дигидрохлорид
Раствор транс-трет-бутил-5-(2-циклопропил-6-((тетрагидро-2H-пиран-4-ил)метокси)изоникотиноил)-3a-метоксигексагидропирроло[3,4-c]пиррол-2(1H)-карбоксилата (977 мг, 1,95 ммоль) и раствор соляной кислоты (5-6 M в 2-пропаноле, 8,57 мл, 42,8 ммоль) в 2-пропаноле (8 мл) перемешивали при комнатной температуре в течение 16 ч, затем реакционную смесь концентрировали до сухого состояния.
Остаток растирали в трет-бутилметиловом эфире, и осадок собирали фильтрованием с получением соединения, указанного в заголовке (858 мг, 88%).
Белое твердое вещество, МС: 402,3 (M+H)+.
Промежуточное соединение 6.01
транс-1-(3a-Метоксигексагидропирроло[3,4-c]пиррол-2(1H)-ил)-3-(4-(трифторметокси)фенил)пропан-1-она дигидрохлорид
Соединение, указанное в заголовке, получили по аналогии с примером 6, заменяя 2 циклопропил-6-((тетрагидро-2H-пиран-4-ил)метокси)изоникотиновую кислоту 3-(4-(трифторметокси)фенил)пропановой кислотой.
Коричневое вязкое масло, МС: 359,2 (M+H)+.
Промежуточное соединение 7
2-Циклопропил-6-((тетрагидро-2H-пиран-4-ил)метокси)изоникотиновая кислота
Стадия 1:
Метил-6-циклопропил-2-оксо-1,2-дигидропиридин-4-карбоксилат
К суспензии 6-циклопропил-2-оксо-1,2-дигидропиридин-4-карбоновой кислоты (CAS-RN 150190-28-6; 400 мг, 2,23 ммоль) в метаноле (4 мл) добавляли серную кислоту (12 мкл) и нагревали при 70°C в течение 48 ч, затем концентрировали в вакууме.
Остаток суспендировали в дихлорметане (10 мл), затем нерастворимое вещество удаляли фильтрованием, и фильтрат выпаривали с получением соединения, указанного в заголовке (427 мг, 99%).
Светло-коричневое полутвердое вещество, МС: 194,1 (M+H)+.
Стадия 2:
Метил-2 циклопропил-6-((тетрагидро-2H-пиран-4-ил)метокси)изоникотинат
К перемешанной суспензии метил-6-циклопропил-2-оксо-1,2-дигидропиридин-4-карбоксилата (212 мг, 1,1 ммоль) в ацетонитриле (5 мл) добавляли карбонат калия (455 мг, 3,29 ммоль) и 4-(йодметил)тетрагидро-2H-пиран (CAS-RN 101691-94-5; 744 мг, 3,29 ммоль).
Реакционную смесь перемешивали при 80°C в течение 16 ч, а затем выпаривали в вакууме.
Остаток очищали хроматографией (силикагель; градиент гептан - этилацетат) получили соединение, указанное в заголовке (188 мг, 59%).
Бесцветное масло, МС: 292,2 (M+H)+.
Стадия 3:
2-Циклопропил-6-((тетрагидро-2H-пиран-4-ил)метокси)изоникотиновая кислота
К раствору метил-2-циклопропил-6-((тетрагидро-2H-пиран-4-ил)метокси)изоникотината (184 мг, 632 мкмоль) в смеси тетрагидрофурана (2 мл) и воды (2 мл) добавляли моногидрат гидроксида лития (53,0 мг, 1,26 ммоль), и полученную в результате смесь перемешивали при комнатной температуре в течение 16 ч. Смесь частично выпаривали, чтобы удалить тетрагидрофуран.
Водную фазу распределяли между 1 M водным раствором соляной кислоты и этилацетатом.
Органический слой промывали раствором хлорида натрия, высушивали над сульфатом магния, фильтровали и выпаривали с получением соединения, указанного в заголовке (218 мг, количественный выход).
Бесцветное масло, МС: 276,1 (M-H)-.
Промежуточное соединение 8
N-(2-(Гидроксиметил)-5-(трифторметил)пиридин-3-ил)пиваламид
Стадия 1:
Метил-3-пиваламидо-5-(трифторметил)пиколинат
К коричневому раствору метил-3-амино-5-(трифторметил)пиколината (CAS-RN 866775-17-9; 2,00 г, 8,63 ммоль) в пиридине (25 мл) добавляли пивалоилхлорид (2,08 г, 17,3 ммоль) при 0°C. Через 20 мин ледяную баню удаляли, затем через 5 ч реакционную смесь распределяли между 1 M водным раствором соляной кислоты и этилацетатом.
Органический слой промывали водой и раствором хлорида натрия, высушивали над сульфатом магния, фильтровали и выпаривали.
В результате хроматографии (силикагель; градиент гептан - этилацетат) получили соединение, указанное в заголовке (2,46 г, 92%).
Светло-желтое твердое вещество, МС: 305,1 (M+H)+.
Стадия 2:
N-(2-(Гидроксиметил)-5-(трифторметил)пиридин-3-ил)пиваламид
К прозрачному светло-желтому раствору метил-3-пиваламидо-5-(трифторметил)пиколината (2,45 г, 8,05 ммоль) в тетрагидрофуране (60 мл) добавляли раствор хлорида кальция (1,79 г, 16,1 ммоль) в этаноле (60 мл), затем добавляли боргидрид натрия (914 мг, 24,2 ммоль) тремя порциями за период 30 мин. Белую суспензию перемешивали в течение 90 мин при комнатной температуре, затем распределяли между водой и нас. водным раствором хлорида аммония.
Органический слой промывали раствором хлорида натрия, высушивали над сульфатом магния, фильтровали и выпаривали.
В результате хроматографии (силикагель; градиент гептан - этилацетат) получили соединение, указанное в заголовке (1,97 г, 89%).
Желтое вязкое масло, МС: 277,1 (M+H)+.
Промежуточное соединение 9
3-Фтор-4-(транс-3a-фтороктагидропирроло[3,4-c]пиррол-2-карбонил)бензолсульфонамида гидрохлорид
Стадия 1: транс-трет-бутил-3a-фтор-5-(2-фтор-4-сульфамоилбензоил)гексагидропирроло[3,4-c]пиррол-2(1H)-карбоксилат
Соединение, указанное в заголовке, получили по аналогии с промежуточным соединением 6, стадия 1, заменяя транс-трет-бутил-3a-метоксигексагидропирроло[3,4-c]пиррол-2(1H)-карбоксилат транс-трет-бутил-3a-фторгексагидропирроло[3,4-c]пиррол-2(1H)-карбоксилатом и 2-циклопропил-6-((тетрагидро-2H-пиран-4-ил)метокси)изоникотиновую кислоту - 2-фтор-4-сульфамоилбензойной кислотой (CAS-RN 714968-42-0).
Светло-желтая пена, МС: 432,2 (M+H)+.
Стадия 2:
3-Фтор-4-(транс-3a-фтороктагидропирроло[3,4-c]пиррол-2-карбонил)бензолсульфонамида гидрохлорид
Соединение, указанное в заголовке, получили по аналогии с промежуточным соединением 6, стадия 2, из транс-трет-бутил-3a-фтор-5-(2-фтор-4-сульфамоилбензоил)гексагидропирроло[3,4-c]пиррол-2(1H)-карбоксилат.
Белое твердое вещество, МС: 332,0 (M+H)+.
Пример A
Соединение формулы (I) можно применять способом, который сам по себе известен, в качестве активного ингредиента для получения таблеток следующей композиции:

Пример B
Соединение формулы (I) можно применять способом, который сам по себе известен, в качестве активного ингредиента для получения капсул следующей композиции:

| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЕ БИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ДУАЛЬНЫХ ИНГИБИТОРОВ ATX/CA | 2016 |
|
RU2724899C2 |
| АМИДЫ КОНДЕНСИРОВАННОГО ПИПЕРИДИНА В КАЧЕСТВЕ МОДУЛЯТОРОВ ИОННЫХ КАНАЛОВ | 2014 |
|
RU2741810C2 |
| ПОЛИЦИКЛИЧЕСКИЕ СРЕДСТВА ДЛЯ ЛЕЧЕНИЯ РЕСПИРАТОРНО-СИНЦИТИАЛЬНЫХ ВИРУСНЫХ ИНФЕКЦИЙ | 2004 |
|
RU2422444C2 |
| НОВЫЕ ФОСФАТНЫЕ СОЕДИНЕНИЯ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ИХ | 2014 |
|
RU2617682C2 |
| КОНДЕНСИРОВАННЫЕ ПИРРОЛДИКАРБОКСАМИДЫ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ФАРМАЦЕВТИЧЕСКИХ СРЕДСТВ | 2013 |
|
RU2650111C2 |
| НОВЫЕ СОЕДИНЕНИЯ И КОМПОЗИЦИИ ДЛЯ ИНГИБИРОВАНИЯ NAMPT | 2011 |
|
RU2617988C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ ИНГИБИТОРЫ Hh-СИГНАЛЬНОГО КАСКАДА, ЛЕКАРСТВЕННЫЕ КОМПОЗИЦИИ НА ИХ ОСНОВЕ И СПОСОБ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, СВЯЗАННЫХ С АББЕРАНТНОЙ АКТИВНОСТЬЮ Hh СИГНАЛЬНОЙ СИСТЕМЫ | 2007 |
|
RU2364597C1 |
| ПРОИЗВОДНЫЕ АЗАСПИРОАЛКАНОВ В КАЧЕСТВЕ ИНГИБИТОРОВ МЕТАЛЛОПРОТЕАЗ | 2004 |
|
RU2379303C2 |
| ЦИКЛИЧЕСКИЕ АЗАИНДОЛ-3-КАРБОКСАМИДЫ, ИХ ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ В КАЧЕСТВЕ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ | 2009 |
|
RU2487874C2 |
| НОВЫЕ СОЕДИНЕНИЯ И КОМПОЗИЦИИ ДЛЯ ИНГИБИРОВАНИЯ NAMPT | 2011 |
|
RU2617424C2 |
Изобретение относится к соединению формулы (I)
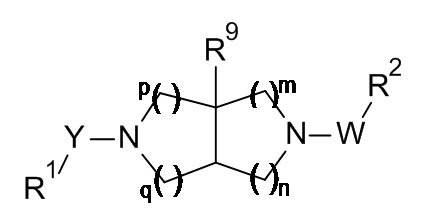 ,
,
где R1 представляет собой замещенный фенил-C1-6 алкил, замещенный фенокси-C1-6 алкил, замещенный фенил-C2-6 алкенил, замещенный пиридинил или замещенный пиридинил-C1-6 алкил, где замещенный фенил-C1-6 алкил, замещенный фенокси-C1-6 алкил, замещенный фенил-C2-6 алкенил, замещенный пиридинил и замещенный пиридинил-C1-6 алкил замещены группами R3, R4 и R5, Y представляет собой -OC(O)- или -C(O)-, W представляет собой -C(O)-, R2 представляет собой замещенный фенил или замещенный пиридинил, где замещенный фенил и замещенный пиридинил замещены группами R6, R7 и R8, R3 представляет собой галоген-C1-6 алкокси, C1-6 алкилкарбониламино или тетрагидропиранил-C1-6 алкокси, R4 представляет собой H, C1-6 алкил или C3-8 циклоалкил, R5 представляет собой H, R6 представляет собой аминосульфонил, R7 представляет собой H или атом галогена, R8 представляет собой H, R9 представляет собой C1-6 алкил, C1-6 алкокси или атом галогена, m, n, p и q равны 1, или его фармацевтически приемлемым солям. Также предложены фармацевтическая композиция, применение соединения и способ лечения. Предложенные соединения обладают ингибиторной активностью в отношении аутоксина и карбоангидразы II и могут применяться для лечения или профилактики глазных патологических состояний. 7 н. и 10 з.п. ф-лы, 7 пр.
1. Соединения формулы (I)
 (I),
(I),
где R1 представляет собой замещенный фенил-C1-6 алкил, замещенный фенокси-C1-6 алкил, замещенный фенил-C2-6 алкенил, замещенный пиридинил или замещенный пиридинил-C1-6 алкил, где замещенный фенил-C1-6 алкил, замещенный фенокси-C1-6 алкил, замещенный фенил-C2-6 алкенил, замещенный пиридинил и замещенный пиридинил-C1-6 алкил замещены группами R3, R4 и R5;
Y представляет собой -OC(O)- или -C(O)-;
W представляет собой -C(O)-;
R2 представляет собой замещенный фенил или замещенный пиридинил, где замещенный фенил и замещенный пиридинил замещены группами R6, R7 и R8;
R3 представляет собой галоген-C1-6 алкокси, C1-6 алкилкарбониламино или тетрагидропиранил-C1-6 алкокси;
R4 представляет собой H, C1-6 алкил или C3-8 циклоалкил;
R5 представляет собой H;
R6 представляет собой аминосульфонил;
R7 представляет собой H или атом галогена;
R8 представляет собой H;
R9 представляет собой C1-6 алкил, C1-6 алкокси или атом галогена;
m, n, p и q равны 1;
или их фармацевтически приемлемые соли.
2. Соединение по п. 1, где R1 представляет собой замещенный пиридинил или замещенный пиридинил-C1-6 алкил, где замещенный пиридинил и замещенный пиридинил-C1-6 алкил замещены группами R3, R4 и R5.
3. Соединение по любому из пп. 1, 2, где Y представляет собой -C(O)-.
4. Соединение по любому из пп. 1-3, где R3 представляет собой тетрагидропиранил-C1-6 алкокси.
5. Соединение по любому из пп. 1-4, где R4 представляет собой C3-8 циклоалкил.
6. Соединение по любому из пп. 1-5, где R7 представляет собой H.
7. Соединение по любому из пп. 1-6, где R9 представляет собой атом галогена или C1-6 алкокси.
8. Соединение по п. 1,
где R1 представляет собой замещенный пиридинил или замещенный пиридинил-C1-6 алкил, где замещенный пиридинил и замещенный пиридинил-C1-6 алкил замещены группами R3, R4 и R5;
Y представляет собой -C(O)-;
W представляет собой -C(O)-;
R2 представляет собой замещенный фенил или замещенный пиридинил, где замещенный фенил и замещенный пиридинил замещены группами R6, R7 и R8;
R3 представляет собой тетрагидропиранил-C1-6 алкокси;
R4 представляет собой C3-8 циклоалкил;
R5 представляет собой H;
R6 представляет собой аминосульфонил;
R7 представляет собой H или атом галогена;
R8 представляет собой H;
R9 представляет собой атом галогена или C1-6 алкокси;
m, n, p и q равны 1;
или его фармацевтически приемлемые соли.
9. Соединение по п. 1 и формулы I(a)
 I(a),
I(a),
где R1 представляет собой замещенный фенил-C1-6 алкил, замещенный фенокси-C1-6 алкил, замещенный фенил-C2-6 алкенил, замещенный пиридинил или замещенный пиридинил-C1-6 алкил, где замещенный фенил-C1-6 алкил, замещенный фенокси-C1-6 алкил, замещенный фенил-C2-6 алкенил, замещенный пиридинил и замещенный пиридинил-C1-6 алкил замещены группами R3, R4 и R5;
Y представляет собой -OC(O)- или -C(O)-;
W представляет собой -C(O)-;
А представляет собой СН или N;
R3 представляет собой галоген-C1-6 алкокси, C1-6 алкилкарбониламино или тетрагидропиранил-C1-6 алкокси;
R4 представляет собой H, C1-6 алкил или C3-8 циклоалкил;
R5 представляет собой H;
R7 представляет собой H или атом галогена;
R8 представляет собой Н;
R9 представляет собой C1-6 алкил, C1-6 алкокси или атом галогена;
m, n, p и q равны 1;
или его фармацевтически приемлемые соли.
10. Соединение, выбранное из
транс-5-(2-фтор-4-сульфамоил-бензоил)-3a-метокси-гексагидро-пирроло[3,4-c]пиррол-2-карбоновой кислоты 3-(2,2-диметил-пропиониламино)-5-трифторметил-пиридин-2-илметилового эфира;
транс-4-[3a-метокси-2-[3-[4-(трифторметокси)фенил]пропаноил]-3,4,6,6a-тетрагидро-1H-пирроло[3,4-c]пиррол-5-карбонил]-3-фторбензолсульфонамида;
транс-4-[5-[2-циклопропил-6-(оксан-4-илметокси)пиридин-4-карбонил]-3a-метокси-3,4,6,6a-тетрагидро-1H-пирроло[3,4-c]пиррол-2-карбонил]-3-фторбензолсульфонамида;
транс-5-(4-сульфамоил-бензоил)-3a-метокси-гексагидро-пирроло[3,4-c]пиррол-2-карбоновой кислоты 3-(2,2-диметил-пропиониламино)-5-трифторметил-пиридин-2-илметилового эфира;
транс-5-(4-сульфамоил-бензоил)-3a-фтор-гексагидро-пирроло[3,4-c]пиррол-2-карбоновой кислоты 4-трифторметокси-бензилового эфира;
транс-5-(4-сульфамоил-бензоил)-3a-метокси-гексагидро-пирроло[3,4-c]пиррол-2-карбоновой кислоты 4-трифторметокси-бензилового эфира;
транс-3а-метил-5-(4-сульфамоил-бензоил)-гексагидро-пирроло[3,4-c]пиррол-2-карбоновой кислоты 4-трифторметокси-бензилового эфира;
транс-5-(5-сульфамоилпиридин-2-карбонил)-3a-метокси-гексагидро-пирроло[3,4-c]пиррол-2-карбоновой кислоты 3-(2,2-диметил-пропиониламино)-5-трифторметил-пиридин-2-илметилового эфира;
транс-6-[3a-метокси-2-[3-[4-(трифторметокси)фенил]пропаноил]-3,4,6,6a-тетрагидро-1H-пирроло[3,4-c]пиррол-5-карбонил]пиридин-3-сульфонамида;
транс-6-[5-[2-циклопропил-6-(оксан-4-илметокси)пиридин-4-карбонил]-3a-метокси-3,4,6,6a-тетрагидро-1H-пирроло[3,4-c]пиррол-2-карбонил]пиридин-3-сульфонамида;
транс-5-(2-фтор-4-сульфамоил-бензоил)-3a-фтор-гексагидро-пирроло[3,4-c]пиррол-2-карбоновой кислоты 4-трифторметокси-бензилового эфира;
транс-4-[3a-фтор-2-[(E)-3-[4-(трифторметокси)фенил]проп-2-еноил]-3,4,6,6a-тетрагидро-1H-пирроло[3,4-c]пиррол-5-карбонил]-3-фторбензолсульфонамида;
транс-4-[3a-фтор-2-[2-[4-(трифторметокси)фенокси]ацетил]-3,4,6,6a-тетрагидро-1H-пирроло[3,4-c]пиррол-5-карбонил]-3-фторбензолсульфонамида;
транс-4-[5-[2-циклопропил-6-(оксан-4-илметокси)пиридин-4-карбонил]-3a-фтор-3,4,6,6a-тетрагидро-1H-пирроло[3,4-c]пиррол-2-карбонил]-3-фторбензолсульфонамида;
транс-4-[3a-фтор-2-[3-[4-(трифторметокси)фенил]пропаноил]-3,4,6,6a-тетрагидро-1H-пирроло[3,4-c]пиррол-5-карбонил]-3-фторбензолсульфонамида;
(+)-(3aR,6aR)-3а-метил-5-(4-сульфамоил-бензоил)-гексагидро-пирроло[3,4-c]пиррол-2-карбоновой кислоты 4-трифторметокси-бензилового эфира;
(-)-транс-5-(4-сульфамоил-бензоил)-3a-метокси-гексагидро-пирроло[3,4-c]пиррол-2-карбоновой кислоты 4-трифторметокси-бензилового эфира;
(-)-транс-5-(4-сульфамоил-бензоил)-3a-фтор-гексагидро-пирроло[3,4-c]пиррол-2-карбоновой кислоты 4-трифторметокси-бензилового эфира;
(-)-транс-5-(4-сульфамоил-бензоил)-3a-метокси-гексагидро-пирроло[3,4-c]пиррол-2-карбоновой кислоты 3-(2,2-диметил-пропиониламино)-5-трифторметил-пиридин-2-илметилового эфира;
(-)-(3aS,6aS)-3а-метил-5-(4-сульфамоилбензоил)-гексагидро-пирроло[3,4-c]пиррол-2-карбоновой кислоты 4-трифторметокси-бензилового эфира;
(+)-транс-5-(4-сульфамоил-бензоил)-3a-метокси-гексагидро-пирроло[3,4-c]пиррол-2-карбоновой кислоты 4-трифторметокси-бензилового эфира;
(+)-транс-5-(4-сульфамоил-бензоил)-3a-фтор-гексагидро-пирроло[3,4-c]пиррол-2-карбоновой кислоты 4-трифторметокси-бензилового эфира;
(+)-транс-5-(4-сульфамоил-бензоил)-3a-метокси-гексагидро-пирроло[3,4-c]пиррол-2-карбоновой кислоты 3-(2,2-диметил-пропиониламино)-5-трифторметил-пиридин-2-илметилового эфира;
и их фармацевтически приемлемых солей.
11. Соединение, выбранное из
транс-4-[5-[2-циклопропил-6-(оксан-4-илметокси)пиридин-4-карбонил]-3a-метокси-3,4,6,6a-тетрагидро-1H-пирроло[3,4-c]пиррол-2-карбонил]-3-фторбензолсульфонамида;
транс-6-[5-[2-циклопропил-6-(оксан-4-илметокси)пиридин-4-карбонил]-3a-метокси-3,4,6,6a-тетрагидро-1H-пирроло[3,4-c]пиррол-2-карбонил]пиридин-3-сульфонамида;
транс-4-[5-[2-циклопропил-6-(оксан-4-илметокси)пиридин-4-карбонил]-3a-фтор-3,4,6,6a-тетрагидро-1H-пирроло[3,4-c]пиррол-2-карбонил]-3-фторбензолсульфонамида;
и их фармацевтически приемлемых солей.
12. Соединение по любому из пп. 1-11 для применения в качестве терапевтически активного вещества.
13. Фармацевтическая композиция, обладающая ингибиторной активностью в отношении аутотаксина и карбоангидразы II, содержащая эффективное количество соединения по любому из пп. 1-11 и терапевтически инертный носитель.
14. Применение соединения по любому из пп. 1-11 для лечения или профилактики глазных патологических состояний.
15. Соединение по любому из пп. 1-11 для лечения или профилактики глазных патологических состояний.
16. Применение соединения по любому из пп. 1-11 для получения лекарственного средства для лечения или профилактики глазных патологических состояний.
17. Способ лечения или профилактики глазных патологических состояний, включающий введение эффективного количества соединения по любому из пп. 1-11.
| WO 2014048865 A1, 03.04.2014 | |||
| WO 2014139978 A1, 18.09.2014 | |||
| WO 2010028761 A1, 18.03.2010 | |||
| АМИДЫ ДИАЗАБИЦИКЛОАЛКАНОВ, СЕЛЕКТИВНЫЕ В ОТНОШЕНИИ АЦЕТИЛХОЛИНОВОГО ПОДТИПА НИКОТИНОВЫХ РЕЦЕПТОРОВ | 2007 |
|
RU2517693C2 |
| СОЕДИНЕНИЯ ХИНОЛИНА, ПРИГОДНЫЕ ДЛЯ ЛЕЧЕНИЯ НАРУШЕНИЙ, ЯВЛЯЮЩИХСЯ ОТВЕТОМ НА МОДУЛЯЦИЮ РЕЦЕПТОРА 5-HT СЕРОТОНИНА | 2008 |
|
RU2483068C2 |
Авторы
Даты
2020-06-30—Публикация
2016-09-20—Подача