Изобретение относится к области медицины, а именно к гематологии, и может быть использовано для прогнозирования риска развития хронического миелолейкоза.
Хронический миелоидный лейкоз (ХМЛ) - клональное заболевание гемопоэтических стволовых клеток с усиленной пролиферацией и сниженным апоптозом гемопоэтических клеток-предщественниц. У 95-98% больных встречается транслокация t(9;22)(q34;q11), в результате которой на укороченной (так называемой «филадельфийской», Ph) хромосоме 22 образуется химерный онкоген BCR-ABL1, приводящий к продукции конституционально активной тирозинкиназы с преимущественно цитоплазматической локализацией. ХМЛ, как правило, диагностируется в развернутой хронической стадии, когда филадельфийская хромосома присутствует почти во всех клетках костного мозга.
Несмотря на достигнутые успехи в понимании отдельных звеньев патогенеза, этиологические факторы неизвестны. В последние годы накапливается все больше данных, свидетельствующих о том, что определенный вклад в возникновение злокачественных заболеваний, включая лейкозы, могут вносить конституциональные особенности генома, в частности полиморфизм ряда генов ферментов биотрансформации ксенобиотиков (ФБК). К числу таких ферментов, несомненно, следует отнести ключевой фермент детоксикации ксенобиотиков фазы I - цитохром Р4501А2 (CYP1A2), который участвует в метаболической активации ряда проканцерогенов, таких как полиароматические углеводороды и гетероциклические амины, нитроароматические соединения, микотоксины (в частности афлотоксин В1), кофеин, ацетаминофен. Подобная активация приводит к образованию реактивных метаболитов, которые при связывании с ДНК образуют аддукты, способные вызвать мутации, в частности, в протоонкогенах и/или антионкогенах, что, в конечном счете, может вызвать онкозаболевания, в том числе ХМЛ.
В свете вышеизложенного особый интерес вызывает функционально значимый полиморфизм -2467T>delT гена CYP1A2, расположенный в положении -2467, являющимся ключевым для области связывания (положения -2495 и -2000) чувствительного ксенобиотического элемента (XRE), участвующего в механизме индукции CYP1A2. В частности, в ядре активируется лиганд рецептора ароматических углеводородов (лиганд-AhR) и образует гетеродимер с ядерным транслокатором рецептора Ah (Arnt), как результат связывания с полиароматическими химическими веществами. Затем этот гетеродимер активирует транскрипцию CYP1A2 путем связывания XRE в положениях -2495 и -2000. В результате можно предположить, что полиморфизм CYP1A2 - 2467delT может модифицировать участки связывания (в структуре хроматина), тем самым увеличивая индукцию CYP1A2 компонентами полиароматических химических веществ.
Вышеприведенные сведения свидетельствуют о перспективности использования полиморфного маркера -2467T>delT гена CYP1A2 для определения риска развития ХМЛ.
В настоящее время известен способ прогнозирования развития ХМЛ, основанный на идентификации однонуклеотидных полиморфных маркеров T-309G и G-1082A соответственно генов MDM2 и IL-10 (Овсепян В.А., Габдулхакова А.Х., Лучинин А.С., Докшина И.А. «Возможная роль полиморфизмов генов MDM2 и IL10 в патогенезе хронического миелоидного лейкоза» // «Злокачественные опухоли». - 2016. - №4s (21). - С. 205-206). Способ включает выделение ДНК из цельной периферической крови с последующими типированием указанных генов методом аллель-специфичной полимеразной цепной реакции (ПЦР) и последующим анализом ее продуктов с помощью электрофореза в 7% полиакриламидном геле (ПААГ).
Установлен повышенный риск развития ХМЛ при совместном носительстве генотипов IL10*1082AA и MDM2*309GG. Недостатком приведенного способа является трудоемкость, связанного с раздельным исследованием полиморфных маркеров двух генов.
Известен другой способ прогнозирования развития ХМЛ (Овсепян В.А., Лучинин А.С., Загоскина Т.П. «Роль полиморфизмов генов глутатион-S-трансфераз M1 (GSTM1) и T1 (GSTT1) в развитии и прогрессировании хронического миелолейкоза, а также в формировании ответа на терапию иматинибом» // Бюллетень экспериментальной биологии и медицины. - 2014. - №8.- С. 78-81), который нами был выбран качестве прототипа. В основе данного способа лежит идентификация полиморфных маркеров генов глутатион-S-трансфераз M1 (GSTM1) и T1 (GSTT1), характеризующихся наличием или отсутствием протяженных делеций, выявляемых с помощью мультиплексной ПЦР и последующим анализом ее продуктов с помощью электрофореза в 7% ПААГ. Недостатком данного способа прогнозирования предрасположенности к ХМЛ является невозможность дифференцировать гетерозигот и гомозигот по аллелю с отсутствием делеций, что, в частности, не позволяет проводить тестирование исследуемых выборок на соблюдение равновесия Харди-Вайнберга.
В связи с вышеизложенным технической задачей изобретения является разработка простого и экономичного способа прогнозирования развития ХМЛ, лишенного указанного недостатка прототипа.
Технический результат - получение объективных критериев оценки риска развития ХМЛ.
Указанный технический результат достигается разработанным способом, включающим:
• выделение ДНК из периферической крови;
• амплификацию фрагмента ДНК, содержащего локус -2467T>delT гена CYP1A2;
• обработку амплифицированных фрагментов ДНК эндонуклеазой рестрикции FauNDI;
• анализ продуктов ПЦР-ПДРФ (полиморфизм длин рестрикционных фрагментов), соответствующих аллелям -2467Т и -2467delT, с помощью электрофореза в ПААГ;
• оценку риска развития ХМЛ.
Способ осуществляют следующим образом.
В качестве материала для генотипирования используют ДНК, полученную стандартным методом фенольно-хлороформной экстракции. К 3 мл периферической крови добавляют 27 мл 0,84% раствора NH4Cl, для гемолиза выдерживают в течение 15 минут при температуре от 4°С до 8°С, затем центрифугируют 10 минут при 2700 об/мин. Осадки растворяют в 1 мл буфера, содержащего 0,32 М сахарозы, 5 мМ MgCl2, 1% раствор тритона Х-100, 0,01 М Tris-HCl. Затем центрифугируют в течение 5 минут при 5000 об/мин и к осадку добавляют 0,4 мл буфера, содержащего 5 М NaCl и 0,5 М ЕДТА (рН=8,0), 0,02 мл 10% SDS, 0,01 мл протеиназы К (10 мг/мл). Смесь инкубируют 3-4 часа при температуре 56°С. Затем проводят последовательную фенол-хлороформную экстракцию ДНК. Осаждение ДНК проводят в 0,8 мл 96% этилового спирта с добавлением 0,04 мл 3М ацетата натрия. Затем ДНК растворяют в ТЕ-буфере.
Исследование полиморфизма -2467T>delT гена CYP1A2 проводят методом ПЦР-ПДРФ. Нуклеотидная последовательность использованных праймеров представлена в таблице 1.

Амплификацию полиморфных ДНК-локусов проводят в 10>20 мкл общего объема смеси, содержащей 1 мкл буфера Hot Start, 1,25 мМ MgCl2, 0,1 мкг геномной ДНК, по 10 пМ каждого праймера (таблица 1), по 200 мкМ dNTP и 1 единицу Taq-полимеразы. Амплификацию проводят на программируемом термоциклере фирмы «BIO-RAD» при следующих условиях: денатурация при 94°С - 10 мин, 35 циклов в режиме 94°С - 30 с, 62°С - 10 с, 72°С - 60 с, заключительный синтез - 72°С, 10 мин. Амплифицированные фрагменты ДНК обрабатывают эндонуклеазой рестрикции FauNDI при 37°С в течение 16 ч. Продукты ПЦР-ПДРФ, соответствующие аллелям -2467Т и -2467delT гена CYP1A2, разделяют методом электрофореза в 7% полиакриламидном геле с последующей окраской бромистым этидием и визуализацией в проходящем УФ-свете. Результаты регистрируют с помощью гель-документирующей системы («Vilber Lourmat»).
Полиморфные маркеры идентифицируют по длине фрагмента рестрикции, представленной в таблице 2.

Статистическую обработку полученной в ходе исследования информации проводили с помощью программ SPSS for Windows version 12 и StatSoft version 6.
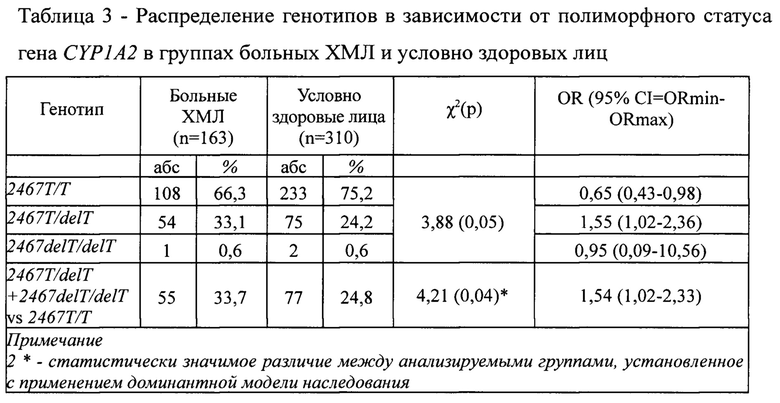
Возможность применения предложенного способа для прогнозирования риска развития ХМЛ подтверждает анализ результатов наблюдений 163 больных ХМЛ и 310 человек популяционного контроля (условно здоровые жители Вятского края). Пациенты включались в группу больных только после установления диагноза заболевания, подтвержденного с помощью клинико-лабораторных методов обследования.
Достоверность различий в распределении частот генотипов ДНК-маркера -2467T>delT гена CYP1A2 в обследованных группах определяли с помощью критерия χ2 Пирсона. В случаях малого числа наблюдений применяли точный критерий Фишера. Тесты на соблюдение равновесия Харди-Вайнберга проводили с помощью программы, доступной на сайте http://gen-exp.ru/calculator_or.php.
Обе группы соответствовали равновесию по Харди-Вайнбергу.
Ассоциации генотипов ДНК-маркера -2467T>delT с предрасположенностью к хроническому миелолейкозу определяли по величине отношения шансов (OR - odds ratio) с доверительным интервалом (CI) при уровне доверия 95%.
Установлено, что носительство, по крайней мере, одного делеционного аллеля -2467delT гена CYP1A2 является фактором, предрасполагающим к развитию ХМЛ (OR=1,54, 95%CI: 1,02-2,33; р=0,04) (таблица 3). Гомозиготное носительство же аллеля -2467Т играет протективную роль в отношении развития ХМЛ (OR=0,65, 95%CI: 0,43-0,98; р=0,05) (таблица 3).
Ниже приведены результаты апробации.
Пример 1.
Пациент П., 1982 года рождения. Диагностирована хроническая фаза хронического миелоидного лейкоза в декабре 2017 года в КНИИГиПК ФМБА России. Диагноз подтвержден анализом флуоресцентной in situ гибридизации (FISH): в 99,5% интерфазных клеток костного мозга выявлен химерный ген BCR/ABL1. На фоне приема ИТК I у больного развилась гематологическая токсичность 3 ст., согласно критериям ELN-2009 констатирована неудача терапии. Пациенту показана АллоТГСК.
Для проведения анализа полиморфизма -2467T>delT гена цитохрома Р450 CYP1A2 у больного было взято 3 мл периферической крови, из которой выделена ДНК методом фенольно-хлороформной экстракции. Исследование полиморфного ДНК-локуса -2467T>delT проводилось с помощью ПЦР с последующей обработкой эндонуклеазой рестрикции FauNDI и анализом продуктов указанной обработки с помощью электрофореза в ПААГ. В результате выявлено, что пациент П. является носителем генотипа CYP1A2-T/delT2467 - маркера повышенного риска развития ХМЛ. Проведенное обследование пациента подтвердило высокую точность прогноза с применением предложенного способа.
Пример 2.
Донор К., 1969 года рождения. На момент проведения исследования гематологических новообразований не обнаружено. Для проведения анализа полиморфизма -2467T>delT гена цитохрома Р450 CYP1A2 у донора было взято 3 мл периферической крови, из которой выделена ДНК методом фенольно-хлороформной экстракции. Исследование полиморфного ДНК-локуса -2467T>delT проводилось с помощью ПЦР с последующей обработкой эндонуклеазой рестрикции FauNDI и анализом продуктов указанной обработки с помощью электрофореза в ПААГ. В результате выявлено, что донор К. является носителем генотипа CYP1A2-T/delT2467 - маркера повышенного риска развития ХМЛ.
Донору К. рекомендовано воздержаться от курения, в том числе пассивного, ограничить воздействие генотоксических факторов и проводить регулярные исследования (не менее 1 раза в полгода) показателей крови.
Применение предложенного нами способа может стать основой для организации профилактических мероприятий по предупреждению развития хронического миелолейкоза у лиц, предрасположенных к заболеванию. Указанные мероприятия должны основываться на ограничении воздействия генотоксических факторов внешней среды, и прежде всего, воздействия полиароматических углеводородов и гетероциклических аминов, нитроароматических соединений, микотоксинов (в частности афлотоксин В1), кофеина, ацетаминофена.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПРОГНОЗИРОВАНИЯ БЕСПЛОДИЯ У ЖЕНЩИН - РАБОТНИЦ НЕФТЕХИМИЧЕСКИХ ПРОИЗВОДСТВ | 2008 |
|
RU2386133C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РИСКА РАЗВИТИЯ БРОНХИАЛЬНОЙ АСТМЫ | 2006 |
|
RU2324937C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РАННЕГО РАЗВИТИЯ ЯЗВЕННОЙ БОЛЕЗНИ ДВЕНАДЦАТИПЕРСТНОЙ КИШКИ | 2016 |
|
RU2652275C2 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РИСКА РАЗВИТИЯ ПАРАНОИДНОЙ ШИЗОФРЕНИИ | 2012 |
|
RU2506595C2 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ЭФФЕКТИВНОСТИ ПРОФИЛАКТИКИ АЛЬБЕНДАЗОЛОМ ПОСЛЕОПЕРАЦИОННОГО РЕЦИДИВА ЦИСТНОГО ЭХИНОКОККОЗА | 2015 |
|
RU2601902C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РАЗВИТИЯ СИРИНГОМИЕЛИИ | 2006 |
|
RU2304774C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РАЗВИТИЯ И ТЕЧЕНИЯ ХРОНИЧЕСКОГО ЛИМФОЛЕЙКОЗА | 2003 |
|
RU2248574C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РАЗВИТИЯ ПРОФЕССИОНАЛЬНЫХ ГИПЕРКЕРАТОЗОВ У РАБОТНИКОВ ПРОИЗВОДСТВА СТЕКЛОВОЛОКНА | 2014 |
|
RU2558041C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РАЗВИТИЯ САХАРНОГО ДИАБЕТА ТИПА 1 В ПОПУЛЯЦИЯХ НАРОДОВ БАШКОРТОСТАНА | 2008 |
|
RU2368325C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РАЗВИТИЯ САХАРНОГО ДИАБЕТА 2 ТИПА У НАСЕЛЕНИЯ БАШКОРТОСТАНА | 2018 |
|
RU2688208C1 |
Изобретение относится к биотехнологии, а именно к гематологии, и может быть использовано для определения риска развития хронического миелолейкоза. Указанный технический результат достигается тем, что проводят выделение ДНК из периферической крови методом фенол-хлороформной экстракции, затем определяют полиморфный статус гена цитохрома Р450 CYP1A2 (-2467T>delT) методом полимеразной цепной реакции (ПЦР) с последующим анализом полиморфизма длин рестрикционных фрагментов (ПДРФ) у практически здоровых лиц. При наличии делеционного аллеля delT2467 гена CYP1A2 прогнозируют повышенный риск развития хронического миелолейкоза, а выявление носительства генотипа -2467Т/Т служит протективным фактором в отношении развития ХМЛ. 3 табл., 2 пр.
Способ прогнозирования риска развития хронического миелоидного лейкоза, заключающийся в выделении ДНК из периферической крови методом фенол-хлороформной экстракции и отличающийся тем, что проводят генотипирование полиморфного маркера -2467T>delT гена CYP1A2 методом полимеразной цепной реакции с последующим анализом полиморфизма длин рестрикционных фрагментов и при выявлении генотипов, содержащих хотя бы один делеционный аллель delT2467 гена CYP1A2, прогнозируют высокий риск развития хронического миелоидного лейкоза, при выявлении же генотипа -2467Т/Т прогнозируют низкий риск развития заболевания.
| Dong Hwan (Dennis)Kim et al, Clinical Relevance of a Pharmacogenetic Approach Using Multiple Candidate Genes to Predict Response and Resistance to Imatinib Therapy in Chronic Myeloid Leukemia, Clin Cancer Research, July 15 2009, (15), pp | |||
| ПРИСПОСОБЛЕНИЕ ДЛЯ ПЕРЕДАЧИ ПОКУПАЕМЫХ ПРЕДМЕТОВ И УПЛАЧИВАЕМЫХ ДЕНЕГ | 1926 |
|
SU4750A1 |
| Зельцер А.Н | |||
| И др., Молекулярно-генетическая характеристика хронического миелоидного лейкоза, | |||
Авторы
Даты
2020-07-14—Публикация
2019-10-16—Подача