ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Данная заявка заявляет приоритет заявки на патент США №62/219927, поданной 17 сентября 2015 г., в полном объеме включенной в данный документ посредством ссылки во всех смыслах.
ССЫЛКА НА ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ, ПОДАННЫЙ В ВИДЕ ТЕКСТОВОГО ФАЙЛА ПОСРЕДСТВОМ EFS WEB
[0002] Перечень последовательностей, записанный в файле 484387SEQLIST.txt, имеющем размер 9,17 кб, был создан 16 сентября 2016 г. и включен в данный документ посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
[0003] Создание генетически модифицированных мышей, несущих направленные мутации, обычно осуществляется с помощью XY ЭС клеточных линий, полученных из мужских эмбрионов. Инъекция ЭС клеток в эмбрионы на стадии бластоцисты, которые могут быть как мужскими, так и женскими, с последующей пересадкой в матку суррогатной матери приводит к рождению химерных детенышей поколения F0, имеющих генетический вклад как эмбриона-хозяина, так и ЭС клеток. Признаком успеха в этом типе экспериментов является нарушение соотношения полов у мышей F0 в пользу самцов в результате колонизации XY ЭС клетками развивающегося полового тяжа женских XX эмбрионов и преобразования в мужской пол. Химерные самцы с сильным вкладом ЭС клеток в цвет шерсти с большой вероятностью вырабатывают сперму, несущую направленную мутацию и, следовательно, считаются хорошими кандидатами для передачи ЭС-клеточного генома своему потомству. Хотя химерные самки иногда могут достигать передачи зародышевой линии со слабой эффективностью, ожидается, что они имеют слабый вклад ЭС клеток и обычно их не используют при скрещивании для создания мутантных мышиных линий.
[0004] Чтобы ускорить получение генетически модифицированных мышей, мы разработали способ VELOCIMOUSE®, в котором ЭС клетки, инъецированные в эмбрионы на 8-клеточной стадии, превращаются в полностью полученных из ЭС клеток мышей поколения F0 (Poueymirou et al. (2007) Nat. Biotech. 25(1):91-99). Так как в способе VELOCIMOUSE® исключаются химеры, все мыши VELOCIMICE® имеют генотип ЭС клеток, из которых они были получены. Ожидается, что XY ЭС клетки приводят к получению исключительно самцов мышей VELOCIMICE®. Хотя сообщалось об изменении пола у мышей XY, такие мыши часто являются нефертильными или имеют очень низкую фертильность.
[0005] Большинство генетических модификаций проводят путем направленного воздействия на XY ЭС клетки для создания модификации одного или двух существующих аллелей, при этом получаемая в результате донорская мышиная ЭС клетка является гетерозиготной в отношении генетической модификации. Однако часто необходимо получить мышь, являющуюся гомозиготной в отношении генетической модификации. Так как в поколении F0 практически не рождается полностью полученных из ЭС клеток самок мышей, которые содержат модификацию, самца F0, как правило, скрещивают с самкой (например, совпадающей инбредной самкой), чтобы получить по меньшей мере потомство, в котором по меньшей мере одна самка (самка F1) может быть гетерозиготной в отношении генетической модификации. Затем гетерозиготную самку F1 скрещивают с гетерозиготным самцом F1 для получения гомозиготного потомства. Такие требования к разведению представляют дорогостоящие и времязатратные этапы.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[0006] Предложены способы и композиции для создания донорских XY плюрипотентных клеток отличного от человека млекопитающего, способных давать F0 XY потомство отличного от человека млекопитающего, включающее фертильное XY отличное от человека млекопитающее с женским фенотипом. В одном аспекте в изобретении предложены способы скрининга целевого соединения для феминизирующей активности в XY плюрипотентных клетках отличного от человека млекопитающего, включающие: (а) культивирование первой популяции и второй популяции XY плюрипотентных клеток отличного от человека млекопитающего в среде, содержащей основную среду и добавки, подходящие для поддержания плюрипотентности XY плюрипотентных клеток отличного от человека млекопитающего, причем первую популяцию культивируют в присутствии целевого соединения, а вторую популяцию культивируют в отсутствие целевого соединения; и (b) анализ одной или более XY плюрипотентных клеток отличного от человека млекопитающего в каждой из первой и второй популяций XY плюрипотентных клеток отличного от человека млекопитающего в отношении экспрессии и/или активности одного или более из Ddx3y, Uty и Eif2s3y, в соответствии с чем феминизирующую активность определяют по снижению экспрессии и/или активности одного или более из Ddx3y, Uty и Eif2s3y в одной или более XY плюрипотентных клетках отличного от человека млекопитающего из первой популяции по сравнению с одной или более XY плюрипотентными клетками отличного от человека млекопитающего из второй популяции. Необязательно, такой способ может дополнительно включать: (с) выбор донорской XY плюрипотентной клетки отличного от человека млекопитающего из первой популяции для получения фертильного XY отличного от человека млекопитающего с женским фенотипом в поколении F0 на основании экспрессии и/или активности одного или более из Ddx3y, Uty и Eif2s3y, причем доля фертильных XY отличных от человека млекопитающих с женским фенотипом в поколении F0 обратно пропорционально экспрессии и/или активности одного или более из Ddx3y, Uty и Eif2s3y. Необязательно, такой способ может дополнительно включать: (d) внесение донорской XY плюрипотентной клетки отличного от человека млекопитающего в эмбрион-хозяин; (е) внесение эмбриона-хозяина по этапу (d) в организм реципиентной самки отличного от человека млекопитающего и вынашивание эмбриона-хозяина; и (f) получение F0 XY потомства отличного от человека млекопитающего, включающего XY отличное от человека млекопитающее с женским фенотипом, причем после достижения половой зрелости F0 XY отличное от человека млекопитающее с женским фенотипом является фертильным или является фертильным и плодовитым.
[0007] В некоторых таких способах анализ на этапе (b) выявляет экспрессию одного или более из Ddx3y, Uty и Eif2s3y на уровне мРНК. В некоторых таких способах анализ на этапе (b) выявляет экспрессию одного или более из Ddx3y, Uty и Eif2s3y на уровне белка.
[0008] В некоторых способах феминизирующую активность определяют на этапе (b) по отсутствию экспрессии и/или активности одного или более из Ddx3y, Uty и Eif2s3y в одной или более XY плюрипотентных клетках отличного от человека млекопитающего из первой популяции. В некоторых способах феминизирующую активность определяют на этапе (b) по снижению экспрессии и/или активности Ddx3y, Uty и Eif2s3y в одной или более XY плюрипотентных клетках отличного от человека млекопитающего из первой популяции по сравнению с одной или более XY плюрипотентными клетками отличного от человека млекопитающего из второй популяции. В некоторых способах феминизирующую активность определяют на этапе (b) по отсутствию экспрессии и/или активности Ddx3y, Uty и Eif2s3y в одной или более XY плюрипотентных клетках отличного от человека млекопитающего из первой популяции.
[0009] В некоторых способах донорская XY плюрипотентная клетка отличного от человека млекопитающего на этапе (с) характеризуется сниженной экспрессией и/или активностью одного или более из Ddx3y, Uty и Eif2s3y по сравнению с контрольной XY плюрипотентной клеткой отличного от человека млекопитающего, которую культивировали в среде, достаточной для поддержания плюрипотентности контрольной XY плюрипотентной клетки отличного от человека млекопитающего, но не для изменения способности клетки давать фертильное потомство женского пола. В некоторых способах донорская XY плюрипотентная клетка отличного от человека млекопитающего на этапе (с) характеризуется сниженной экспрессией и/или активностью одного или более из Ddx3y, Uty и Eif2s3y по сравнению с контрольной XY плюрипотентной клеткой отличного от человека млекопитающего из второй популяции. В некоторых способах донорская XY плюрипотентная клетка отличного от человека млекопитающего на этапе (с) характеризуется сниженной экспрессией и/или активностью Ddx3y, Uty и Eif2s3y по сравнению с контрольной XY плюрипотентной клеткой отличного от человека млекопитающего. В некоторых способах этап (b) включает анализ по меньшей мере двух XY плюрипотентных клеток отличного от человека млекопитающего в первой популяции в отношении экспрессии и/или активности одного или более из Ddx3y, Uty и Eif2s3y, а этап (с) включает выбор в качестве донорской XY плюрипотентной клетки отличного от человека млекопитающего клетки, проанализированной на этапе (b), имеющей самую низкую экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y по сравнению с другими анализируемыми клетками. В некоторых способах донорская XY плюрипотентная клетка отличного от человека млекопитающего на этапе (с) характеризуется отсутствием экспрессии и/или активности одного или более из Ddx3y, Uty и Eif2s3y. В некоторых способах донорская XY плюрипотентная клетка отличного от человека млекопитающего на этапе (с) характеризуется отсутствием экспрессии и/или активности Ddx3y, Uty и Eif2s3y.
[0010] В некоторых способах первую популяцию культивируют в присутствии целевого соединения в течение по меньшей мере 1 суток, 2 суток, 3 суток, 4 суток, 5 суток, 6 суток, 7 суток, 8 суток, 9 суток, 10 суток, 11 суток, 12 суток, 13 суток, 2 недель, 3 недель или 4 недель перед этапом анализа (b).
[0011] В некоторых способах плюрипотентная клетка представляет собой эмбриональную стволовую (ЭС) клетку. Необязательно, плюрипотентная клетка представляет собой мышиную ЭС клетку VGF1.
[0012] В некоторых способах в отсутствие целевого соединения среда на этапе (а) является достаточнй для поддержания плюрипотентности XY плюрипотентных клеток отличного от человека млекопитающего, но не изменяет способности клетки давать фертильное потомство женского пола.
[0013] В некоторых способах в отсутствие целевого соединения среда на этапе (а) представляет собой среду с низкой осмоляльностью, имеющую осмоляльность от около 200 мОсм/кг до менее чем около 329 мОсм/кг. Необязательно, среда с низкой осмоляльностью имеет одно или более из следующих свойств: (I) среда с низкой осмоляльностью имеет осмоляльность от около 218 мОсм/кг до около 322 мОсм/кг; (II) среда с низкой осмоляльностью имеет осмоляльность 218 мОсм/кг; (III) среда с низкой осмоляльностью имеет проводимость от около 11 мСм/см до около 13 мСм/см; (IV) основная среда содержит соль щелочного металла и галида в концентрации от около 50 мМ до около 110 мМ; (V) основная среда содержит хлорид натрия в концентрации от около 50 мМ до около 110 мМ; (VI) основная среда содержит соль карбоновой кислоты в концентрации от около 17 мМ до около 30 мМ; (VII) основная среда содержит бикарбонат натрия в концентрации от около 13 мМ до около 25 мМ; (VIII) основная среда имеет общую концентрацию соли галида щелочного металла и соли карбоновой кислоты от около 85 мМ до около 130 мМ; (IX) основная среда содержит хлорид натрия в концентрации 87±5 мМ, а среда с низкой осмоляльностью имеет осмоляльность 261±26 мОсм/кг; (X) основная среда содержит соль щелочного металла и галида в концентрации от около 50 мМ до около 110 мМ и соль карбоновой кислоты в концентрации от около 17 мМ до около 30 мМ, а среда с низкой осмоляльностью имеет осмоляльность от около 200 мОсм/кг до около 329 мОсм/кг; и (XI) среда с низкой осмоляльностью имеет осмоляльность 218 мОсм/кг, а основная среда содержит хлорид натрия в концентрации от 50 мМ до 110 мМ и бикарбонат натрия в концентрации от 13 мМ до 25 мМ. Необязательно, основная среда содержит соль карбоновой кислоты в концентрации от около 18 мМ до около 44 мМ. Необязательно, основная среда содержит соль щелочного металла и галида в концентрации от около 50 мМ до около 110 мМ. Необязательно, соль карбоновой кислоты представляет собой бикарбонат натрия, соль щелочного металла и галида представляет собой хлорид натрия, а среда с низкой осмоляльностью имеет осмоляльность от около 216 мОсм/кг до около 322 мОсм/кг. Необязательно, основная среда содержит хлорид натрия в концентрации около 3 мг/мл и бикарбонат натрия в концентрации около 2,2 мг/мл, а среда с низкой осмоляльностью имеет осмоляльность около 216 мОсм/кг.
[0014] В некоторых способах отличное от человека млекопитающее является грызуном. Необязательно, грызун представляет собой крысу или мышь. В некоторых способах грызун представляет собой мышь, которая относится к линии C57BL/6. Необязательно, Y-хромосома получена из линии C57BL/6. В некоторых способах грызун представляет собой мышь, которая относится к линии 129. Необязательно, Y-хромосома получена из линии 129. Необязательно, Y-хромосома получена из линии BALB/c. В некоторых способах мышь не относится к линии 129. В некоторых способах Y-хромосома получена не из линии 129. В некоторых способах грызун представляет собой мышь, которая относится к линии C57BL/6 и линии 129.
[0015] В некоторых способах плюрипотентная клетка содержит направленную генетическую модификацию в целевом геномном локусе. Необязательно, направленная генетическая модификация содержит вставку, делецию, нокаут, нокин, точечную мутацию или их комбинацию.
[0016] Некоторые способы дополнительно включают: (g) скрещивание F0 XY фертильной самки отличного от человека млекопитающего для получения потомства. Необязательно, по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95% или все животные из XY потомства имеют мужской фенотип и являются фертильными. Необязательно, ни одно животное из XY потомства не имеет женский фенотип. Необязательно, все животные из XY потомства имеют мужской фенотип и являются фертильными. Необязательно, скрещивание включает спаривание F0 XY фертильной самки отличного от человека млекопитающего с XY самцом отличного от человека млекопитающего из группы F0, причем каждое животное из F0 XY фертильной самки отличного от человека млекопитающего и F0 XY самца отличного от человека млекопитающего является гетерозиготным в отношении генетической модификации, и получение F1 потомства отличного от человека млекопитающего, являющегося гомозиготным в отношении генетической модификации.
[0017] В некоторых способах эмбрион-хозяин представляет собой эмбрион на стадии пре-морулы, а этап (d) дополнительно включает культивирование эмбриона-хозяина до стадии бластоцисты.
[0018] В некоторых способах XY плюрипотентную клетку отличного от человека млекопитающего культивируют в присутствии целевого соединения в течение по меньшей мере 1 суток, 2 суток, 3 суток, 4 суток, 5 суток, 6 суток, 7 суток, 8 суток, 9 суток, 10 суток, 11 суток, 12 суток, 13 суток, 2 недель, 3 недель или 4 недель перед внесением в эмбрион-хозяин.
[0019] В некоторых способах по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95% животных F0 XY потомства представляют собой XY отличных от человека млекопитающих с женским фенотипом, которые являются фертильными после достижения половой зрелости. Необязательно, процентная доля F0 XY потомства, которая представляет собой фертильных XY животных с женским фенотипом, выше для F0 XY потомства, полученного из XY плюрипотентной клетки отличного от человека млекопитающего, имеющей сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y, по сравнению с F0 XY потомством, полученным из XY плюрипотентной клетки отличного от человека млекопитающего, имеющей более высокую экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y.
[0020] В некоторых способах F0 самки, полученные из донорской XY плюрипотентной клетки отличного от человека млекопитающего, имеют генотип XY.
[0021] В некоторых способах по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95% самок F0 XY, полученных из донорской XY плюрипотентной клетки отличного от человека млекопитающего, являются фертильными. Необязательно, процентная доля F0 XY самок, являющихся фертильными, выше для F0 XY потомства, полученного из XY плюрипотентной клетки отличного от человека млекопитающего, имеющей сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y, по сравнению с F0 XY потомством, полученным из XY плюрипотентной клетки отличного от человека млекопитающего, имеющей более высокую экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y.
[0022] В некоторых способах по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95% самок F0 XY, полученных из донорской XY плюрипотентной клетки отличного от человека млекопитающего, способны производить пометы, содержащие по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9 или 10 детенышей. Необязательно, средний размер помета, производимого F0 XY самками или фертильными F0 XY самками, выше для F0 XY самок или фертильных F0 XY самок, полученных из XY плюрипотентной клетки отличного от человека млекопитающего, имеющей сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y, по сравнению с F0 XY самками или фертильными F0 XY самками, полученными из XY плюрипотентной клетки отличного от человека млекопитающего, имеющей более высокую экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y.
[0023] В некоторых способах по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95% самок F0 XY, полученных из донорской XY плюрипотентной клетки отличного от человека млекопитающего, способны давать по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9 или 10 пометов в течение жизни. Необязательно, среднее число пометов, производимое на протяжении жизни F0 XY самками или фертильными F0 XY самками, выше для F0 XY самок или фертильных F0 XY самок, полученных из XY плюрипотентной клетки отличного от человека млекопитающего, имеющей сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y, по сравнению с F0 XY самками или фертильными F0 XY самками, полученными из XY плюрипотентной клетки отличного от человека млекопитающего, имеющей более высокую экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y.
[0024] В некоторых способах среднее число потомков, производимое на протяжении жизни F0 XY самками или фертильными F0 XY самками, выше для F0 XY самок или фертильных F0 XY самок, полученных из XY плюрипотентной клетки отличного от человека млекопитающего, имеющей сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y, по сравнению с F0 XY самками или фертильными F0 XY самками, полученными из XY плюрипотентной клетки отличного от человека млекопитающего, имеющей более высокую экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y.
[0025] В другом аспекте в изобретении предложены способы создания донорской XY плюрипотентной клетки отличного от человека млекопитающего, включающие: (а) культивирование популяции XY плюрипотентных клеток отличного от человека млекопитающего в среде с низкой осмоляльностью, содержащей основную среду и добавки, подходящие для поддержания плюрипотентности XY плюрипотентных клеток отличного от человека млекопитающего, причем среда с низкой осмоляльностью имеет осмоляльность от около 200 мОсм/кг до менее чем около 329 мОсм/кг; (b) анализ одной или более XY плюрипотентных клеток отличного от человека млекопитающего в популяции XY плюрипотентных клеток отличного от человека млекопитающего в отношении экспрессии и/или активности одного или более из Ddx3y, Uty и Eif2s3y; и (с) выбор донорской XY плюрипотентной клетки отличного от человека млекопитающего для получения фертильного XY отличного от человека млекопитающего с женским фенотипом в поколении F0 на основании экспрессии и/или активности одного или более из Ddx3y, Uty и Eif2s3y, причем доля фертильных XY отличных от человека млекопитающих с женским фенотипом в поколении F0 обратно пропорционально экспрессии и/или активности одного или более из Ddx3y, Uty и Eif2s3y.
[0026] В некоторых таких способах анализ на этапе (b) выявляет экспрессию одного или более из Ddx3y, Uty и Eif2s3y на уровне мРНК. В некоторых таких способах анализ на этапе (b) выявляет экспрессию одного или более из Ddx3y, Uty и Eif2s3y на уровне белка.
[0027] В некоторых способах донорская XY плюрипотентная клетка отличного от человека млекопитающего выбрана на основании сниженной экспрессии и/или активности одного или более из Ddx3y, Uty и Eif2s3y по сравнению с контрольной XY плюрипотентной клеткой отличного от человека млекопитающего, которую культивировали в среде, достаточной для поддержания плюрипотентности контрольной XY плюрипотентной клетки отличного от человека млекопитающего, но не для изменения способности клетки давать фертильное потомство женского пола. В некоторых способах донорская XY плюрипотентная клетка отличного от человека млекопитающего характеризуется сниженной экспрессией и/или активностью Ddx3y, Uty и Eif2s3y по сравнению с контрольной XY плюрипотентной клеткой отличного от человека млекопитающего. В некоторых способах этап (b) включает анализ по меньшей мере двух XY плюрипотентных клеток отличного от человека млекопитающего в популяции XY плюрипотентных клеток отличного от человека млекопитающего в отношении экспрессии и/или активности одного или более из Ddx3y, Uty и Eif2s3y, а этап (с) включает выбор в качестве донорской XY плюрипотентной клетки отличного от человека млекопитающего клетки, проанализированной на этапе (b), имеющей самую низкую экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y по сравнению с другими анализируемыми клетками. В некоторых способах донорская XY плюрипотентная клетка отличного от человека млекопитающего характеризуется отсутствием экспрессии и/или активности одного или более из Ddx3y, Uty и Eif2s3y. В некоторых способах донорская XY плюрипотентная клетка отличного от человека млекопитающего характеризуется отсутствием экспрессии и/или активности Ddx3y, Uty и Eif2s3y.
[0028] В некоторых способах XY плюрипотентную клетку отличного от человека млекопитающего культивируют в среде с низкой осмоляльностью в течение по меньшей мере 1 суток, 2 суток, 3 суток, 4 суток, 5 суток, 6 суток, 7 суток, 8 суток, 9 суток, 10 суток, 11 суток, 12 суток, 13 суток, 2 недель, 3 недель или 4 недель перед этапом анализа (b).
[0029] В некоторых способах плюрипотентная клетка представляет собой эмбриональную стволовую (ЭС) клетку. Необязательно, плюрипотентная клетка представляет собой мышиную ЭС клетку VGF1.
[0030] В некоторых способах среда с низкой осмоляльностью имеет одно или более из следующих свойств: (I) среда с низкой осмоляльностью имеет осмоляльность от около 218 мОсм/кг до около 322 мОсм/кг; (II) среда с низкой осмоляльностью имеет осмоляльность 218 мОсм/кг; (III) среда с низкой осмоляльностью имеет проводимость от около 11 мСм/см до около 13 мСм/см; (IV) основная среда содержит соль щелочного металла и галида в концентрации от около 50 мМ до около 110 мМ; (V) основная среда содержит хлорид натрия в концентрации от около 50 мМ до около 110 мМ; (VI) основная среда содержит соль карбоновой кислоты в концентрации от около 17 мМ до около 30 мМ; (VII) основная среда содержит бикарбонат натрия в концентрации от около 13 мМ до около 25 мМ; (VIII) основная среда имеет общую концентрацию соли галида щелочного металла и соли карбоновой кислоты от около 85 мМ до около 130 мМ; (IX) основная среда содержит хлорид натрия в концентрации 87±5 мМ, а среда с низкой осмоляльностью имеет осмоляльность 261±26 мОсм/кг; (X) основная среда содержит соль щелочного металла и галида в концентрации от около 50 мМ до около 110 мМ и соль карбоновой кислоты в концентрации от около 17 мМ до около 30 мМ, а среда с низкой осмоляльностью имеет осмоляльность от около 200 мОсм/кг до около 329 мОсм/кг; и (XI) среда с низкой осмоляльностью имеет осмоляльность 218 мОсм/кг, а основная среда содержит хлорид натрия в концентрации от 50 мМ до 110 мМ и бикарбонат натрия в концентрации от 13 мМ до 25 мМ. Необязательно, основная среда содержит соль карбоновой кислоты в концентрации от около 18 мМ до около 44 мМ. Необязательно, основная среда содержит соль щелочного металла и галида в концентрации от около 50 мМ до около 110 мМ. Необязательно, соль карбоновой кислоты представляет собой бикарбонат натрия, соль щелочного металла и галида представляет собой хлорид натрия, а среда с низкой осмоляльностью имеет осмоляльность от около 216 мОсм/кг до около 322 мОсм/кг. Необязательно, основная среда содержит хлорид натрия в концентрации около 3 мг/мл и бикарбонат натрия в концентрации около 2,2 мг/мл, а среда с низкой осмоляльностью имеет осмоляльность около 216 мОсм/кг.
[0031] В некоторых способах отличное от человека млекопитающее является грызуном. Необязательно, грызун представляет собой крысу или мышь. В некоторых способах грызун представляет собой мышь, которая относится к линии C57BL/6 Необязательно, Y-хромосома получена из линии C57BL/6. В некоторых способах грызун представляет собой мышь, которая относится к линии 129. Необязательно, Y-хромосома получена из линии 129. Необязательно, Y-хромосома получена из линии BALB/c. В некоторых способах мышь не относится к линии 129. В некоторых способах Y-хромосома получена не из линии 129. В некоторых способах грызун представляет собой мышь, которая относится к линии C57BL/6 и линии 129.
[0032] В некоторых способах плюрипотентная клетка содержит направленную генетическую модификацию в целевом геномном локусе. Необязательно, направленная генетическая модификация содержит вставку, делецию, нокаут, нокин, точечную мутацию или их комбинацию.
[0033] Некоторые способы дополнительно включают: (d) внесение донорской XY плюрипотентной клетки отличного от человека млекопитающего в эмбрион-хозяин; (е) внесение эмбриона-хозяина по этапу (d) в организм реципиентной самки отличного от человека млекопитающего и вынашивание эмбриона-хозяина; и (f) получение F0 XY потомства отличного от человека млекопитающего, включающего XY отличное от человека млекопитающее с женским фенотипом, причем после достижения половой зрелости F0 XY отличное от человека млекопитающее с женским фенотипом является фертильным или является фертильным и плодовитым. Некоторые способы дополнительно включают: (g) скрещивание F0 XY фертильной самки отличного от человека млекопитающего для получения потомства. Необязательно, по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95% или все XY потомство имеет мужской фенотип и является фертильным. Необязательно, ни одно животное из XY потомства не имеет женский фенотип. Необязательно, все животные из XY потомства имеют мужской фенотип и являются фертильными. Необязательно, скрещивание включает спаривание F0 XY фертильной самки отличного от человека млекопитающего с XY самцом отличного от человека млекопитающего из группы F0, причем каждое животное из F0 XY фертильной самки отличного от человека млекопитающего и F0 XY самца отличного от человека млекопитающего является гетерозиготным в отношении генетической модификации, и получение F1 потомства отличного от человека млекопитающего, являющегося гомозиготным в отношении генетической модификации.
[0034] В некоторых способах эмбрион-хозяин представляет собой эмбрион на стадии пре-морулы, а этап (d) дополнительно включает культивирование эмбриона-хозяина до стадии бластоцисты.
[0035] В некоторых способах XY плюрипотентную клетку отличного от человека млекопитающего культивируют в среде с низкой осмоляльностью в течение по меньшей мере 1 суток, 2 суток, 3 суток, 4 суток, 5 суток, 6 суток, 7 суток, 8 суток, 9 суток, 10 суток, 11 суток, 12 суток, 13 суток, 2 недель, 3 недель или 4 недель перед внесением в эмбрион-хозяин.
[0036] В некоторых способах по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95% животных F0 XY потомства представляют собой XY отличных от человека млекопитающих с женским фенотипом, которые являются фертильными после достижения половой зрелости. Необязательно, процентная доля F0 XY потомства, которая представляет собой фертильных XY животных с женским фенотипом, выше для F0 XY потомства, полученного из XY плюрипотентной клетки отличного от человека млекопитающего, имеющей сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y, по сравнению с F0 XY потомством, полученным из XY плюрипотентной клетки отличного от человека млекопитающего, имеющей более высокую экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y.
[0037] В некоторых способах F0 самки, полученные из донорской XY плюрипотентной клетки отличного от человека млекопитающего, имеют генотип XY.
[0038] В некоторых способах по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95% самок F0 XY, полученных из донорской XY плюрипотентной клетки отличного от человека млекопитающего, являются фертильными. Необязательно, процентная доля F0 XY самок, являющихся фертильными, выше для F0 XY потомства, полученного из XY плюрипотентной клетки отличного от человека млекопитающего, имеющей сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y, по сравнению с F0 XY потомством, полученным из XY плюрипотентной клетки отличного от человека млекопитающего, имеющей более высокую экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y.
[0039] В некоторых способах по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95% самок F0 XY, полученных из донорской XY плюрипотентной клетки отличного от человека млекопитающего, способны производить пометы, содержащие по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9 или 10 детенышей. Необязательно, средний размер помета, производимого F0 XY самками или фертильными F0 XY самками, выше для F0 XY самок или фертильных F0 XY самок, полученных из XY плюрипотентной клетки отличного от человека млекопитающего, имеющей сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y, по сравнению с F0 XY самками или фертильными F0 XY самками, полученными из XY плюрипотентной клетки отличного от человека млекопитающего, имеющей более высокую экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y.
[0040] В некоторых способах по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95% самок F0 XY, полученных из донорской XY плюрипотентной клетки отличного от человека млекопитающего, способны давать по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9 или 10 пометов в течение жизни. Необязательно, среднее число пометов, производимое на протяжении жизни F0 XY самками или фертильными F0 XY самками, выше для F0 XY самок или фертильных F0 XY самок, полученных из XY плюрипотентной клетки отличного от человека млекопитающего, имеющей сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y, по сравнению с F0 XY самками или фертильными F0 XY самками, полученными из XY плюрипотентной клетки отличного от человека млекопитающего, имеющей более высокую экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y.
[0041] В некоторых способах среднее число потомков, производимое на протяжении жизни F0 XY самками или фертильными F0 XY самками, выше для F0 XY самок или фертильных F0 XY самок, полученных из XY плюрипотентной клетки отличного от человека млекопитающего, имеющей сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y, по сравнению с F0 XY самками или фертильными F0 XY самками, полученными из XY плюрипотентной клетки отличного от человека млекопитающего, имеющей более высокую экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y.
[0042] В другом аспекте в изобретении предложен набор, содержащий: (а) выявляющий реагент для выявления уровней экспрессии и/или активности одного или более из Ddx3y, Uty и Eif2s3y в XY плюрипотентной клетке отличного от человека млекопитающего; и (b) инструкции по применению выявляющих реагентов и соотнесению выявления с прогнозируемой предрасположенностью XY плюрипотентной клетки отличного от человека млекопитающего к тому, чтобы давать фертильных XY отличных от человека млекопитающих с женским фенотипом в поколении F0. Необязательно, выявляющий реагент содержит один или более наборов праймеров и/или один или более зондов для выявления экспрессии одного или более из Ddx3y, Uty и Eif2s3y.
[0043] В другом аспекте в изобретении предложены способы оптимизации концентрации целевого компонента среды в феминизирующей среде, включающие: (а) культивирование первой популяции и второй популяции XY плюрипотентных клеток отличного от человека млекопитающего в среде, содержащей основную среду и добавки, подходящие для поддержания плюрипотентности XY плюрипотентных клеток отличного от человека млекопитающего, причем первую популяцию культивируют в присутствии первой концентрации целевого компонента среды, а вторую популяцию культивируют в присутствии второй концентрации целевого компонента среды, которая отличается от первой концентрации; (b) анализ одной или более XY плюрипотентных клеток отличного от человека млекопитающего в каждой из первой и второй популяций XY плюрипотентных клеток отличного от человека млекопитающего в отношении экспрессии и/или активности одного или более из Ddx3y, Uty и Eif2s3y; и (с) выбор первой концентрации, если экспрессия и/или активность одного или более из Ddx3y, Uty и Eif2s3y снижается в одной или более XY плюрипотентных клетках отличного от человека млекопитающего из первой популяции по сравнению с одной или более XY плюрипотентными клетками отличного от человека млекопитающего из второй популяции. Некоторые такие способы дополнительно включают: (d) выбор донорской XY плюрипотентной клетки отличного от человека млекопитающего из первой популяции для получения фертильного XY отличного от человека млекопитающего с женским фенотипом в поколении F0 на основании экспрессии и/или активности одного или более из Ddx3y, Uty и Eif2s3y, причем доля фертильных XY отличных от человека млекопитающих с женским фенотипом в поколении F0 обратно пропорционально экспрессии и/или активности одного или более из Ddx3y, Uty и Eif2s3y. Некоторые такие способы дополнительно включают: (е) внесение донорской XY плюрипотентной клетки отличного от человека млекопитающего в эмбрион-хозяин; (f) внесение эмбриона-хозяина по этапу (е) в организм реципиентной самки отличного от человека млекопитающего; и вынашивание эмбриона-хозяина; и (g) получение F0 XY потомства отличного от человека млекопитающего, включающего XY отличное от человека млекопитающее с женским фенотипом, причем после достижения половой зрелости F0 XY отличное от человека млекопитающее с женским фенотипом является фертильным или является фертильным и плодовитым.
[0044] В некоторых способах анализ на этапе (b) выявляет экспрессию одного или более из Ddx3y, Uty и Eif2s3y на уровне мРНК. В некоторых способах анализ на этапе (b) выявляет экспрессию одного или более из Ddx3y, Uty и Eif2s3y на уровне белка.
[0045] В некоторых способах на этапе (с) выбирают первую концентрацию, если в одной или более XY плюрипотентных клетках отличного от человека млекопитающего из первой популяции отсутствует экспрессия и/или активность одного или более из Ddx3y, Uty и Eif2s3y. В некоторых способах на этапе (с) выбирают первую концентрацию, если одна или более XY плюрипотентных клеток отличного от человека млекопитающего из первой популяции имеют сниженную экспрессию и/или активность Ddx3y, Uty и Eif2s3y по сравнению с одной или более XY плюрипотентными клетками отличного от человека млекопитающего из второй популяции. В некоторых способах на этапе (с) выбирают первую концентрацию, если в одной или более XY плюрипотентных клетках отличного от человека млекопитающего из первой популяции отсутствует экспрессия и/или активность Ddx3y, Uty и Eif2s3y.
[0046] В некоторых способах донорская XY плюрипотентная клетка отличного от человека млекопитающего на этапе (с) характеризуется сниженной экспрессией и/или активностью одного или более из Ddx3y, Uty и Eif2s3y по сравнению с контрольной XY плюрипотентной клеткой отличного от человека млекопитающего, которую культивировали в среде, достаточной для поддержания плюрипотентности контрольной XY плюрипотентной клетки отличного от человека млекопитающего, но не для изменения способности клетки давать фертильное потомство женского пола. В некоторых способах донорская XY плюрипотентная клетка отличного от человека млекопитающего на этапе (с) характеризуется сниженной экспрессией и/или активностью одного или более из Ddx3y, Uty и Eif2s3y по сравнению с контрольной XY плюрипотентной клеткой отличного от человека млекопитающего из второй популяции. В некоторых способах донорская XY плюрипотентная клетка отличного от человека млекопитающего характеризуется сниженной экспрессией и/или активностью Ddx3y, Uty и Eif2s3y по сравнению с контрольной XY плюрипотентной клеткой отличного от человека млекопитающего. В некоторых способах этап (b) включает анализ по меньшей мере двух XY плюрипотентных клеток отличного от человека млекопитающего в первой популяции XY плюрипотентных клеток отличного от человека млекопитающего в отношении экспрессии и/или активности одного или более из Ddx3y, Uty и Eif2s3y, а этап (d) включает выбор в качестве донорской XY плюрипотентной клетки отличного от человека млекопитающего клетки, проанализированной на этапе (b), имеющей самую низкую экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y по сравнению с другими анализируемыми клетками. В некоторых способах донорская XY плюрипотентная клетка отличного от человека млекопитающего характеризуется отсутствием экспрессии и/или активности одного или более из Ddx3y, Uty и Eif2s3y. В некоторых способах донорская XY плюрипотентная клетка отличного от человека млекопитающего характеризуется отсутствием экспрессии и/или активности Ddx3y, Uty и Eif2s3y.
[0047] В некоторых способах первую и вторую популяции культивируют в присутствии целевого компонента среды в течение по меньшей мере 1 суток, 2 суток, 3 суток, 4 суток, 5 суток, 6 суток, 7 суток, 8 суток, 9 суток, 10 суток, 11 суток, 12 суток, 13 суток, 2 недель, 3 недель или 4 недель перед этапом анализа (b).
[0048] В некоторых способах плюрипотентная клетка представляет собой эмбриональную стволовую (ЭС) клетку. Необязательно, плюрипотентная клетка представляет собой мышиную ЭС клетку VGF1.
[0049] В некоторых способах среда на этапе (а) представляет собой среду с низкой осмоляльностью, имеющую осмоляльность от около 200 мОсм/кг до менее чем около 329 мОсм/кг. Необязательно, среда с низкой осмоляльностью имеет одно или более из следующих свойств: (I) среда с низкой осмоляльностью имеет осмоляльность от около 218 мОсм/кг до около 322 мОсм/кг; (II) среда с низкой осмоляльностью имеет осмоляльность 218 мОсм/кг; (III) среда с низкой осмоляльностью имеет проводимость от около 11 мСм/см до около 13 мСм/см; (IV) основная среда содержит соль щелочного металла и галида в концентрации от около 50 мМ до около 110 мМ; (V) основная среда содержит хлорид натрия в концентрации от около 50 мМ до около 110 мМ; (VI) основная среда содержит соль карбоновой кислоты в концентрации от около 17 мМ до около 30 мМ; (VII) основная среда содержит бикарбонат натрия в концентрации от около 13 мМ до около 25 мМ; (VIII) основная среда имеет общую концентрацию соли галида щелочного металла и соли карбоновой кислоты от около 85 мМ до около 130 мМ; (IX) основная среда содержит хлорид натрия в концентрации 87±5 мМ, а среда с низкой осмоляльностью имеет осмоляльность 261±26 мОсм/кг; (X) основная среда содержит соль щелочного металла и галида в концентрации от около 50 мМ до около 110 мМ и соль карбоновой кислоты в концентрации от около 17 мМ до около 30 мМ, а среда с низкой осмоляльностью имеет осмоляльность от около 200 мОсм/кг до около 329 мОсм/кг; и (XI) среда с низкой осмоляльностью имеет осмоляльность 218 мОсм/кг, а основная среда содержит хлорид натрия в концентрации от 50 мМ до 110 мМ и бикарбонат натрия в концентрации от 13 мМ до 25 мМ. Необязательно, основная среда содержит соль карбоновой кислоты в концентрации от около 18 мМ до около 44 мМ. Необязательно, основная среда содержит соль щелочного металла и галида в концентрации от около 50 мМ до около 110 мМ.
Необязательно, соль карбоновой кислоты представляет собой бикарбонат натрия, соль щелочного металла и галида представляет собой хлорид натрия, а среда с низкой осмоляльностью имеет осмоляльность от около 216 мОсм/кг до около 322 мОсм/кг. Необязательно, основная среда содержит хлорид натрия в концентрации около 3 мг/мл и бикарбонат натрия в концентрации около 2,2 мг/мл, а среда с низкой осмоляльностью имеет осмоляльность около 216 мОсм/кг.
[0050] В некоторых способах отличное от человека млекопитающее является грызуном. Необязательно, грызун представляет собой крысу или мышь. В некоторых способах грызун представляет собой мышь, которая относится к линии C57BL/6 Необязательно, Y-хромосома получена из линии C57BL/6. В некоторых способах грызун представляет собой мышь, которая относится к линии 129. Необязательно, Y-хромосома получена из линии 129. Необязательно, Y-хромосома получена из линии BALB/c. В некоторых способах мышь не относится к линии 129. В некоторых способах Y-хромосома получена не из линии 129. В некоторых способах грызун представляет собой мышь, которая относится к линии C57BL/6 и линии 129.
[0051] В некоторых способах плюрипотентная клетка содержит направленную генетическую модификацию в целевом геномном локусе. Необязательно, направленная генетическая модификация содержит вставку, делецию, нокаут, нокин, точечную мутацию или их комбинацию.
[0052] Некоторые способы дополнительно включают: (h) скрещивание F0 XY фертильной самки отличного от человека животного для получения потомства. Необязательно, по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95% или все XY потомство имеет мужской фенотип и является фертильным. Необязательно, ни одно животное из XY потомства не имеет женский фенотип. Необязательно, все животные из XY потомства имеют мужской фенотип и являются фертильными. Необязательно, скрещивание включает спаривание F0 XY фертильной самки отличного от человека млекопитающего с XY самцом отличного от человека млекопитающего из группы F0, причем каждое животное из F0 XY фертильной самки отличного от человека млекопитающего и F0 XY самца отличного от человека млекопитающего является гетерозиготным в отношении генетической модификации, и получение F1 потомства отличного от человека млекопитающего, являющегося гомозиготным в отношении генетической модификации.
[0053] В некоторых способах эмбрион-хозяин представляет собой эмбрион на стадии пре-морулы, а этап (е) дополнительно включает культивирование эмбриона-хозяина до стадии бластоцисты
[0054] В некоторых способах XY плюрипотентную клетку отличного от человека млекопитающего культивируют в присутствии целевого компонента среды в течение по меньшей мере 1 суток, 2 суток, 3 суток, 4 суток, 5 суток, 6 суток, 7 суток, 8 суток, 9 суток, 10 суток, 11 суток, 12 суток, 13 суток, 2 недель, 3 недель или 4 недель перед внесение в эмбрион-хозяин.
[0055] В некоторых способах по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95% животных F0 XY потомства представляют собой XY отличных от человека млекопитающих с женским фенотипом, которые являются фертильными после достижения половой зрелости. Необязательно, процентная доля F0 XY потомства, которая представляет собой фертильных XY животных с женским фенотипом, выше для F0 XY потомства, полученного из XY плюрипотентной клетки отличного от человека млекопитающего, имеющей сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y, по сравнению с F0 XY потомством, полученным из XY плюрипотентной клетки отличного от человека млекопитающего, имеющей более высокую экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y.
[0056] В некоторых способах F0 самки, полученные из донорской XY плюрипотентной клетки отличного от человека млекопитающего, имеют генотип XY.
[0057] В некоторых способах по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95% самок F0 XY, полученных из донорской XY плюрипотентной клетки отличного от человека млекопитающего, являются фертильными. Необязательно, процентная доля F0 XY самок, являющихся фертильными, выше для F0 XY потомства, полученного из XY плюрипотентной клетки отличного от человека млекопитающего, имеющей сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y, по сравнению с F0 XY потомством, полученным из XY плюрипотентной клетки отличного от человека млекопитающего, имеющей более высокую экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y.
[0058] В некоторых способах по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95% самок F0 XY, полученных из донорской XY плюрипотентной клетки отличного от человека млекопитающего, способны производить пометы, содержащие по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9 или 10 детенышей. Необязательно, средний размер помета, производимого F0 XY самками или фертильными F0 XY самками, выше для F0 XY самок или фертильных F0 XY самок, полученных из XY плюрипотентной клетки отличного от человека млекопитающего, имеющей сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y, по сравнению с F0 XY самками или фертильными F0 XY самками, полученными из XY плюрипотентной клетки отличного от человека млекопитающего, имеющей более высокую экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y.
[0059] В некоторых способах по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95% самок F0 XY, полученных из донорской XY плюрипотентной клетки отличного от человека млекопитающего, способны давать по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9 или 10 пометов в течение жизни. Необязательно, среднее число пометов, даваемое на протяжении жизни F0 XY самками или фертильными F0 XY самками, выше для F0 XY самок или фертильных F0 XY самок, полученных из XY плюрипотентной клетки отличного от человека млекопитающего, имеющей сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y, по сравнению с F0 XY самками или фертильными F0 XY самками, полученными из XY плюрипотентной клетки отличного от человека млекопитающего, имеющей более высокую экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y.
[0060] В некоторых способах среднее число потомков, производимое на протяжении жизни F0 XY самками или фертильными F0 XY самками, выше для F0 XY самок или фертильных F0 XY самок, полученных из XY плюрипотентной клетки отличного от человека млекопитающего, имеющей сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y, по сравнению с F0 XY самками или фертильными F0 XY самками, полученными из XY плюрипотентной клетки отличного от человека млекопитающего, имеющей более высокую экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y.
[0061] В одном аспекте в изобретении предложены способы создания донорской XY плюрипотентной клетки отличного от человека млекопитающего, включающие: модификацию XY плюрипотентной клетки отличного от человека млекопитающего для сайленсинга области Y-хромосомы и получения донорской XY плюрипотентной клетки отличного от человека млекопитающего, причем сайленсинг достигается средствами, отличными от поддержания XY плюрипотентной клетки отличного от человека млекопитающего в среде с низкой осмоляльностью, содержащей основную среду, имеющую осмоляльность от около 200 мОсм/кг до менее чем около 329 мОсм/кг, а донорская XY плюрипотентная клетка отличного от человека млекопитающего способна давать F0 XY потомство отличного от человека млекопитающего, включающее фертильное XY отличное от человека млекопитающее с женским фенотипом. Необязательно, плюрипотентная клетка представляет собой эмбриональную стволовую (ЭС) клетку.
[0062] В некоторых способах указанная область содержит все или часть малого плеча Y-хромосомы. В некоторых способах из указанной области исключены один или более из кластера Rbmy, Zfy2 и Sry. В некоторых способах указанная область содержит всю или часть секции Y-хромосомы, соответствующей области Sxra и/или области Sxrb мышиной Y-хромосомы. В некоторых способах указанная область содержит всю или часть секции Y-хромосомы, соответствующей одному или более из интервала делеции 1, интервала делеции 2 и интервала делеции 3 в мышиной Y-хромосоме. В некоторых способах указанная область содержит всю или часть секции Y-хромосомы, соответствующей интервалу делеции 2 в мышиной Y-хромосоме. В некоторых способах указанная область содержит часть Y-хромосомы, теломерную в отношении Kdm5d или центромерную в отношении Usp9y. В некоторых способах указанная область является теломерной в отношении Zfy2, Sry или кластера Rbmy. В некоторых способах указанная область является теломерной в отношении гена Zfy2.
[0063] В некоторых способах сайленсинг снижает уровень и/или активность белка, кодируемого геном, расположенным в области малого плеча Y-хромосомы. В некоторых способах происходит снижение уровня и/или активности одного или более из Ddx3y, Uty и Eif2s3y. Необязательно, происходит элиминация уровня и/или активности одного или более из Ddx3y, Uty и Eif2s3y. В некоторых способах происходит снижение уровня и/или активности одного или более из Sry и Zfy2. Необязательно, происходит элиминация уровня и/или активности одного или более из Sry и Zfy2.
[0064] В некоторых способах сайленсинг является перманентным. В некоторых способах сайленсинг достигается одним или более из следующих способов: (1) направленная генетическая модификация; (2) делеция или разрушение области; (3) РНК-интерференция или антисмысловое ингибирование мРНК, транскрибируемой с одного или более генов в пределах области; (4) направленное разрушение белков, кодируемых одним или более генами в пределах области; (5) опосредованный гетерохроматином сайленсинг; (6) повышение уровней фосфорилированной формы варианта гистона γН2АХ в Y-хромосоме; и (7) снижение транскрипции одного или более генов в пределах области. Необязательно, указанную область удаляют или разрушают с помощью нацеленной нуклеазы. Необязательно, нуклеаза представляет собой цинк-пальцевую нуклеазу (ZFN), эффекторную нуклеазу, подобную активаторам транскрипции (TALEN), мегануклеазу или ассоциированный с короткими палиндромными повторами, регулярно расположенными группами (CRISPR), белок (Cas) и направляющую РНК (нРНК).
[0065] В некоторых способах сайленсинг происходит во время по меньшей мере одного из следующих периодов: (1) после внесения донорской XY плюрипотентной клетки отличного от человека млекопитающего в эмбрион-хозяин; (2) после внесения эмбриона-хозяина, содержащего донорскую XY плюрипотентную клетку отличного от человека млекопитающего, в организм реципиентной самки отличного от человека млекопитающего; (3) во время эмбрионального развития, когда запускается программа определения мужского пола; (4) во время эмбрионального развития вплоть до, по меньшей мере, стадии развития, соответствующей Е11-Е12, у мышей; (5) во время эмбрионального развития вплоть до, по меньшей мере, стадии развития, соответствующей Е17-Е19, у мышей; (6) в течение всего эмбрионального развития; (7) в течение всего периода оогенеза; (8) во время мейотической профазы развития ооцитов; (9) во время первых двух клеточных делений после оплодотворения ооцита; и (10) в ооцитах после овуляции в течение первых двух клеточных делений после оплодотворения. В некоторых способах изменение пола может быть передано потомству F1.
[0066] В некоторых способах XY плюрипотентную клетку отличного от человека млекопитающего не культивируют в среде с низкой осмоляльностью, содержащей основную среду, имеющую осмоляльность от около 200 мОсм/кг до менее чем около 329 мОсм/кг. Другие способы дополнительно включают культивирование XY плюрипотентной клетки отличного от человека млекопитающего в среде, содержащей основную среду и добавки, подходящие для поддержания XY плюрипотентной клетки отличного от человека млекопитающего в культуре, причем среда представляет собой среду с низкой осмоляльностью, содержащую основную среду, имеющую осмоляльность от около 200 мОсм/кг до менее чем около 329 мОсм/кг. В некоторых способах область содержит один или более из кластера Rbmy, Zfy2 и Sry, a XY плюрипотентную клетку отличного от человека млекопитающего культивируют в среде, содержащей основную среду и добавки, подходящие для поддержания XY плюрипотентной клетки отличного от человека млекопитающего в культуре, причем среда представляет собой среду с низкой осмоляльностью, содержащую основную среду, имеющую осмоляльность от около 200 мОсм/кг до менее чем около 329 мОсм/кг. Необязательно, среда с низкой осмоляльностью содержит основную среду, содержащую одно или более из следующего: (1) осмоляльность от около 218 мОсм/кг до около 322 мОсм/кг; (2) осмоляльность 218 мОсм/кг; (3) проводимость от около 11 мСм/см до около 13 мСм/см; (4) соль щелочного металла и галида в концентрации от около 50 мМ до около 110 мМ; (5) хлорид натрия в концентрации от около 50 мМ до около 110 мМ; (6) соль карбоновой кислоты в концентрации от около 17 мМ до около 30 мМ; (7) бикарбонат натрия в концентрации от около 13 мМ до около 25 мМ; (8) общую концентрацию соли галида щелочного металла и соли карбоновой кислоты от около 85 мМ до около 130 мМ; (9) хлорид натрия в концентрации 87±5 мМ и осмоляльность 261±26 мОсм/кг; (10) соль щелочного металла и галида в концентрации от около 50 мМ до около 110 мМ, соль карбоновой кислоты в концентрации от около 17 мМ до около 30 мМ и осмоляльность от около 200 мОсм/кг до около 329 мОсм/кг; и (11) осмоляльность 218 мОсм/кг, хлорид натрия в концентрации от 50 мМ до 110 мМ и бикарбонат натрия в концентрации от 13 мМ до 25 мМ. В некоторых способах XY плюрипотентную клетку отличного от человека млекопитающего поддерживают в среде с низкой осмоляльностью в течение по меньшей мере 1 суток, 2 суток, 3 суток, 4 суток, 5 суток, 6 суток, 7 суток, 8 суток, 9 суток, 10 суток, 11 суток, 12 суток, 13 суток, 2 недель, 3 недель или 4 недель перед внесением в эмбрион-хозяин.
[0067] В некоторых способах отличное от человека млекопитающее является грызуном. Необязательно, грызун представляет собой крысу или мышь. В некоторых способах грызун представляет собой мышь, которая относится к линии C57BL/6. Необязательно, Y-хромосома получена из линии C57BL/6. В некоторых способах грызун представляет собой мышь, которая относится к линии 129. Необязательно, Y-хромосома получена из линии 129. В некоторых способах мышь не относится к линии 129. В некоторых способах Y-хромосома получена не из линии 129. В некоторых способах грызун представляет собой мышь, которая относится к линии C57BL/6 и линии 129. Необязательно, плюрипотентная клетка представляет собой мышиную ЭС клетку VGF1.
[0068] В некоторых способах плюрипотентная клетка содержит направленную генетическую модификацию в целевом геномном локусе. Необязательно, направленная генетическая модификация содержит вставку, делецию, нокаут, нокин, точечную мутацию или их комбинацию.
[0069] В некоторых способах указанная область содержит Zfy2, a XY плюрипотентная клетка отличного от человека млекопитающего дополнительно содержит модификацию, которая снижает уровень и/или активность белка Sry. Необязательно, отличное от человека млекопитающее представляет собой мышь, которая относится к линии C57BL/6, отличное от человека млекопитающее представляет собой мышь, которая не относится к линии 129, отличное от человека млекопитающее представляет собой мышь, причем Y-хромосома происходит из линии C57BL/6, или отличное от человека млекопитающее представляет собой мышь, причем Y-хромосома не происходит из линии 129. Необязательно, такие способы дополнительно включают культивирование XY плюрипотентной клетки отличного от человека млекопитающего в среде, содержащей основную среду и добавки, подходящие для поддержания XY плюрипотентной клетки отличного от человека млекопитающего в культуре, причем среда представляет собой среду с низкой осмоляльностью, содержащую основную среду, имеющую осмоляльность от около 200 мОсм/кг до менее чем около 329 мОсм/кг.
[0070] В изобретении также предложены in vitro культуры, содержащие донорские XY плюрипотентные клетки отличного от человека млекопитающего, полученные любым из вышеуказанных способов создания донорской XY плюрипотентной клетки отличного от человека млекопитающего.
[0071] В изобретении также предложены способы получения эмбриона, включающие внесение донорской XY плюрипотентной клетки отличного от человека млекопитающего, полученной любым из вышеуказанных способов, в эмбрион-хозяин, причем эмбрион-хозяин способен давать фертильное XY отличное от человека млекопитающее с женским фенотипом в поколении F0.
[0072] В изобретении также предложены модифицированные эмбрионы отличного от человека млекопитающего, полученные вышеуказанными способами получения эмбриона. В изобретении также предложены модифицированные эмбрионы отличного от человека млекопитающего, содержащие клетку, имеющую в геноме модификацию, которая приводит к сайленсингу области Y-хромосомы.
[0073] В изобретении также предложены способы создания фертильного XY отличного от человека млекопитающего с женским фенотипом в поколении F0, включающие: (а) внесение донорской XY плюрипотентной клетки отличного от человека млекопитающего в эмбрион-хозяин, полученный любым из вышеуказанных способов создания донорской XY плюрипотентной клетки отличного от человека млекопитающего; (b) внесение эмбриона-хозяина по этапу (а) в организм реципиентной самки отличного от человека млекопитающего и вынашивание эмбриона-хозяина; и (с) получение F0 XY потомства отличного от человека млекопитающего, включающего XY отличное от человека млекопитающее с женским фенотипом, причем после достижения половой зрелости F0 XY отличное от человека млекопитающее с женским фенотипом является фертильным. В альтернативном варианте предложены способы создания фертильного XY отличного от человека млекопитающего с женским фенотипом в поколении F0, включающие: (а) внесение модифицированного эмбриона в организм реципиентной самки отличного от человека млекопитающего и вынашивание эмбриона, причем эмбрион получен вышеуказанными способами; и (b) получение F0 XY потомства отличного от человека млекопитающего, включающего XY отличное от человека млекопитающее с женским фенотипом, причем после достижения половой зрелости F0 XY отличное от человека млекопитающее с женским фенотипом является фертильным.
[0074] В некоторых способах по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95% животных F0 XY потомства представляют собой XY отличных от человека млекопитающих с женским фенотипом, которые являются фертильными после достижения половой зрелости. В некоторых способах F0 самки, полученные из донорской XY плюрипотентной клетки отличного от человека млекопитающего, имеют генотип XY. В некоторых способах по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95% самок F0 XY, полученных из донорской XY плюрипотентной клетки отличного от человека млекопитающего, являются фертильными. В некоторых способах по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95% самок F0 XY, полученных из донорской XY плюрипотентной клетки отличного от человека млекопитающего, способны производить пометы, содержащие по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9 или 10 детенышей. В некоторых способах по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95% самок F0 XY, полученных из донорской XY плюрипотентной клетки отличного от человека млекопитающего, способны производить по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9 или 10 пометов в течение жизни.
[0075] В изобретении также предложено фертильное XY отличное от человека млекопитающее с женским фенотипом, полученное любым из вышеуказанных способов создания фертильного XY отличного от человека млекопитающего с женским фенотипом в поколении F0.
[0076] В изобретении также предложены способы получения трансгенного отличного от человека млекопитающего, гомозиготного в отношении направленной генетической модификации в целевом геномном локусе, в поколении F1, включающие: (а) скрещивание F0 XY фертильной самки, полученной вышеуказанным способами, с F0 XY самцом отличного от человека млекопитающего, причем каждое животное из F0 XY фертильной самки отличного от человека млекопитающего и F0 XY самца отличного от человека млекопитающего является гетерозиготным в отношении направленной генетической модификации; и (b) получение F1 потомства отличного от человека млекопитающего, являющегося гомозиготным в отношении направленной генетической модификации. Необязательно, F0 XY самец является клональным сиблингом из группы, полученной из того же самого клона плюрипотентной клетки, что и F0 XY фертильная самка.
[0077] В изобретении также предложены способы создания фертильного XY отличного от человека млекопитающего с женским фенотипом в поколении F0, включающие: (а) создание донорской XY плюрипотентной клетки отличного от человека млекопитающего путем модификации XY плюрипотентной клетки отличного от человека млекопитающего для осуществления сайленсинга области Y-хромосомы, содержащей часть Y-хромосомы за пределами гена Sry, причем донорская XY плюрипотентная клетка отличного от человека млекопитающего дополнительно содержит модификацию, которая снижает уровень и/или активность белка Sry; (b) внесение донорской XY плюрипотентной клетки отличного от человека млекопитающего в эмбрион-хозяин; (с) внесение эмбриона-хозяина по этапу (b) в организм реципиентной самки отличного от человека млекопитающего и вынашивание эмбриона-хозяина; и (d) получение F0 XY потомства отличного от человека млекопитающего, включающего XY отличное от человека млекопитающее с женским фенотипом, причем после достижения половой зрелости F0 XY отличное от человека млекопитающее с женским фенотипом является фертильным. Необязательно, плюрипотентная клетка представляет собой эмбриональную стволовую клетку.
[0078] В некоторых способах указанная область содержит все или часть малого плеча Y-хромосомы; не содержит один или более из кластера Rbmy, Zfy2 и Sry; содержит всю или часть секции Y-хромосомы, соответствующей области Sxra и/или области Sxrb мышиной Y-хромосомы; содержит всю или часть секции Y-хромосомы, соответствующей одному или более из интервала делеции 1, интервала делеции 2 и интервала делеции 3 в мышиной Y-хромосоме; содержит часть Y-хромосомы, теломерную в отношении Kdm5d или центромерную в отношении Usp9y; или является теломерной в отношении Zfy2, Sry или кластера Rbmy.
[0079] В некоторых способах сайленсинг снижает уровень и/или активность белка, кодируемого геном, расположенным в указанной области. Необязательно, происходит снижение уровня и/или активности одного или более из Ddx3y, Uty и Eif2s3y; происходит элиминация уровня и/или активности одного или более из Ddx3y, Uty и Eif2s3y; происходит снижение уровня и/или активности одного или более из Sry и Zfy2; или происходит элиминация уровня и/или активности одного или более из Sry и Zfy2. В некоторых способах сайленсинг является перманентным.
[0080] В некоторых способах сайленсинг достигается одним или более из следующих способов: (1) направленная генетическая модификация; (2) делеция или разрушение области; (3) РНК-интерференция или антисмысловое ингибирование мРНК, транскрибируемой с одного или более генов в пределах области; (4) направленное разрушение белков, кодируемых одним или более генами в пределах области; (5) опосредованный гетерохроматином сайленсинг; (6) повышение уровней фосфорилированной формы варианта гистона γН2АХ в Y-хромосоме; и (7) снижение транскрипции одного или более генов в пределах области. Необязательно, указанную область удаляют или разрушают с помощью нацеленной нуклеазы. Необязательно, нуклеаза представляет собой цинк-пальцевую нуклеазу (ZFN), эффекторную нуклеазу, подобную активаторам транскрипции (TALEN), мегануклеазу или ассоциированный с короткими палиндромными повторами, регулярно расположенными группами (CRISPR), белок (Cas) и направляющую РНК (нРНК).
[0081] В некоторых способах сайленсинг происходит во время по меньшей мере одного из следующих периодов: (1) после внесения донорской XY плюрипотентной клетки отличного от человека млекопитающего в эмбрион-хозяин; (2) после внесения эмбриона-хозяина, содержащего донорскую XY плюрипотентную клетку отличного от человека млекопитающего, в организм реципиентной самки отличного от человека млекопитающего; (3) во время эмбрионального развития, когда запускается программа определения мужского пола; (4) во время эмбрионального развития вплоть до, по меньшей мере, стадии развития, соответствующей Е11-Е12, у мышей; (5) во время эмбрионального развития вплоть до, по меньшей мере, стадии развития, соответствующей Е17-Е19, у мышей; (6) в течение всего эмбрионального развития; (7) в течение всего периода оогенеза; (8) во время мейотической профазы развития ооцитов; (9) во время первых двух клеточных делений после оплодотворения ооцита; и (10) в ооцитах после овуляции в течение двух первых клеточных делений после оплодотворения. В некоторых способах изменение пола может быть передано потомству F1.
[0082] В некоторых способах XY плюрипотентную клетку отличного от человека млекопитающего не культивируют в среде с низкой осмоляльностью, содержащей основную среду, имеющую осмоляльность от около 200 мОсм/кг до менее чем около 329 мОсм/кг. Другие способы дополнительно включают культивирование XY плюрипотентной клетки отличного от человека млекопитающего в среде, содержащей основную среду и добавки, подходящие для поддержания XY плюрипотентной клетки отличного от человека млекопитающего в культуре, причем среда представляет собой среду с низкой осмоляльностью, содержащую основную среду, имеющую осмоляльность от около 200 мОсм/кг до менее чем около 329 мОсм/кг. Необязательно, среда с низкой осмоляльностью содержит основную среду, содержащую одно или более из следующего: (1) осмоляльность от около 218 мОсм/кг до около 322 мОсм/кг; (2) осмоляльность 218 мОсм/кг; (3) проводимость от около 11 мСм/см до около 13 мСм/см; (4) соль щелочного металла и галида в концентрации от около 50 мМ до около 110 мМ; (5) хлорид натрия в концентрации от около 50 мМ до около 110 мМ; (6) соль карбоновой кислоты в концентрации от около 17 мМ до около 30 мМ; (7) бикарбонат натрия в концентрации от около 13 мМ до около 25 мМ; (8) общую концентрацию соли галида щелочного металла и соли карбоновой кислоты от около 85 мМ до около 130 мМ; (9) хлорид натрия в концентрации 87±5 мМ и осмоляльность 261±26 мОсм/кг; (10) соль щелочного металла и галида в концентрации от около 50 мМ до около 110 мМ, соль карбоновой кислоты в концентрации от около 17 мМ до около 30 мМ и осмоляльность от около 200 мОсм/кг до около 329 мОсм/кг; и (11) осмоляльность 218 мОсм/кг, хлорид натрия в концентрации от 50 мМ до 110 мМ и бикарбонат натрия в концентрации от 13 мМ до 25 мМ. В некоторых способах XY плюрипотентную клетку отличного от человека млекопитающего поддерживают в среде с низкой осмоляльностью в течение по меньшей мере 1 суток, 2 суток, 3 суток, 4 суток, 5 суток, 6 суток, 7 суток, 8 суток, 9 суток, 10 суток, 11 суток, 12 суток, 13 суток, 2 недель, 3 недель или 4 недель перед внесением в эмбрион-хозяин.
[0083] В некоторых способах отличное от человека млекопитающее является грызуном, крысой или мышью. Необязательно, мышь относится к линии C57BL/6; мышь относится к линии 129; мышь не относится к линии 129; мышь относится к линии C57BL/6 и линии 129; отличное от человека животное представляет собой мышь, причем Y-хромосома происходит из линии C57BL/6; отличное от человека животное представляет собой мышь, причем Y-хромосома происходит из линии 129; отличное от человека животное представляет собой мышь, причем Y-хромосома не происходит из линии 129; или отличное от человека животное представляет собой мышь, а плюрипотентная клетка представляет собой мышиную ЭС клетку VGF1.
[0084] В некоторых способах плюрипотентная клетка содержит направленную генетическую модификацию в целевом геномном локусе. Необязательно, направленная генетическая модификация содержит вставку, делецию, нокаут, нокин, точечную мутацию или их комбинацию.
[0085] В некоторых способах указанная область содержит Zfy2. Необязательно, отличное от человека млекопитающее представляет собой мышь, которая относится к линии C57BL/6, отличное от человека млекопитающее представляет собой мышь, которая не относится к линии 129, отличное от человека млекопитающее представляет собой мышь, причем Y-хромосома происходит из линии C57BL/6, или отличное от человека млекопитающее представляет собой мышь, причем Y-хромосома не происходит из линии 129. Необязательно, такие способы дополнительно включают культивирование XY плюрипотентной клетки отличного от человека млекопитающего в среде, содержащей основную среду и добавки, подходящие для поддержания XY плюрипотентной клетки отличного от человека млекопитающего в культуре, причем среда представляет собой среду с низкой осмоляльностью, содержащую основную среду, имеющую осмоляльность от около 200 мОсм/кг до менее чем около 329 мОсм/кг.
[0086] В некоторых способах по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% животных F0 XY потомства представляют собой XY отличных от человека млекопитающих с женским фенотипом, которые являются фертильными после достижения половой зрелости. Необязательно, процентная доля F0 XY потомства, представленного фертильными XY отличными от человека млекопитающими с женским фенотипом, является большей, чем процентная доля фертильных XY отличных от человека млекопитающих с женским фенотипом, полученных из XY плюрипотентной клетки отличного от человека млекопитающего, которая не содержит сайленсинг области Y-хромосомы, содержащей часть Y-хромосомы за пределами гена Sry.
[0087] В некоторых способах F0 самки, полученные из донорской XY плюрипотентной клетки отличного от человека млекопитающего, имеют генотип XY.
[0088] В некоторых способах по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% самок F0 XY, полученных из донорской XY плюрипотентной клетки отличного от человека млекопитающего, являются фертильными. Необязательно, процентная доля F0 XY самок, полученных из XY плюрипотентной клетки отличного от человека млекопитающего, являющихся фертильными, больше, чем процентная доля фертильных F0 XY самок, полученных из XY плюрипотентной клетки отличного от человека млекопитающего, которая не содержит сайленсинг области Y-хромосомы, содержащей часть Y-хромосомы за пределами гена Sry.
[0089] В некоторых способах по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95% самок F0 XY, полученных из донорской XY плюрипотентной клетки отличного от человека млекопитающего, способны производить пометы, содержащие по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9 или 10 детенышей. Необязательно, средний размер помета, производимого F0 XY самками, полученными из донорской XY плюрипотентной клетки отличного от человека млекопитающего, больше, чем средний размер помета, производимого F0 XY самками, полученными из XY плюрипотентной клетки отличного от человека млекопитающего, которая не содержит сайленсинг области Y-хромосомы, содержащей часть Y-хромосомы за пределами гена Sry.
[0090] В некоторых способах по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90% или по меньшей мере 95% самок F0, полученных из донорской XY плюрипотентной клетки отличного от человека млекопитающего, способны давать по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9 или 10 пометов в течение жизни. Необязательно, среднее число пометов, производимых F0 XY самками, полученными из донорской XY плюрипотентной клетки отличного от человека млекопитающего, больше, чем среднее число пометов, производимых F0 XY самками, полученными из XY плюрипотентной клетки отличного от человека млекопитающего, которая не содержит сайленсинг области Y-хромосомы, содержащей часть Y-хромосомы за пределами гена Sry. Необязательно, среднее число потомков, производимое на протяжении жизни F0 XY самками, полученными из донорской XY плюрипотентной клетки отличного от человека млекопитающего, больше, чем среднее число потомков, производимое на протяжении жизни F0 XY самками, полученными из XY плюрипотентной клетки отличного от человека млекопитающего, которая не содержит сайленсинг области Y-хромосомы, содержащей часть Y-хромосомы за пределами гена Sry.
[0091] В изобретении также предложены способы создания фертильного XY отличного от человека млекопитающего с женским фенотипом в поколении F0, включающие: (а) создание донорской XY плюрипотентной клетки отличного от человека млекопитающего путем модификации XY плюрипотентной клетки отличного от человека млекопитающего для осуществления сайленсинга области Y-хромосомы, причем XY плюрипотентную клетку отличного от человека млекопитающего поддерживают в среде с низкой осмоляльностью, но сайленсинг достигается средствами, отличными от или дополняющими поддержание XY плюрипотентной клетки отличного от человека млекопитающего в среде с низкой осмоляльностью, причем среда с низкой осмоляльностью содержит основную среду и добавки, подходящую для поддержания XY плюрипотентной клетки отличного от человека млекопитающего в культуре, при этом основная среда имеет осмоляльность от около 200 мОсм/кг до менее чем около 329 мОсм/кг; (b) внесение донорской XY плюрипотентной клетки отличного от человека млекопитающего в эмбрион-хозяин; (с) внесение эмбриона-хозяина по этапу (b) в организм реципиентной самки отличного от человека млекопитающего и вынашивание эмбриона-хозяина; и (d) получение F0 XY потомства отличного от человека млекопитающего, включающего XY отличное от человека млекопитающее с женским фенотипом, причем после достижения половой зрелости F0 XY отличное от человека млекопитающее с женским фенотипом является фертильным. Необязательно, плюрипотентная клетка представляет собой эмбриональную стволовую (ЭС) клетку.
[0092] В некоторых способах указанная область содержит все или часть малого плеча Y-хромосомы; не содержит один или более из кластера Rbmy, Zfy2 и Sry; содержит всю или часть секции Y-хромосомы, соответствующей области Sxra и/или области Sxrb мышиной Y-хромосомы; содержит всю или часть секции Y-хромосомы, соответствующей одному или более из интервала делеции 1, интервала делеции 2 и интервала делеции 3 в мышиной Y-хромосоме; содержит часть Y-хромосомы, теломерную в отношении Kdm5d или центромерную в отношении Usp9y; или является теломерной в отношении Zfy2, Sry или кластера Rbmy.
[0093] В некоторых способах сайленсинг снижает уровень и/или активность белка, кодируемого геном, расположенным в указанной области. Необязательно, происходит снижение уровня и/или активности одного или более из Ddx3y, Uty и Eif2s3y; происходит элиминация уровня и/или активности одного или более из Ddx3y, Uty и Eif2s3y; происходит снижение уровня и/или активности одного или более из Sry и Zfy2; или происходит элиминация уровня и/или активности одного или более из Sry и Zfy2. В некоторых способах сайленсинг является перманентным.
[0094] В некоторых способах сайленсинг достигается одним или более из следующих способов: (1) направленная генетическая модификация; (2) делеция или разрушение области; (3) РНК-интерференция или антисмысловое ингибирование мРНК, транскрибируемой с одного или более генов в пределах области; (4) направленное разрушение белков, кодируемых одним или более генами в пределах области; (5) опосредованный гетерохроматином сайленсинг; (6) повышение уровней фосфорилированной формы варианта гистона γН2АХ в Y-хромосоме; и (7) снижение транскрипции одного или более генов в пределах области. Необязательно, указанную область удаляют или разрушают с помощью нацеленной нуклеазы. Необязательно, нуклеаза представляет собой цинк-пальцевую нуклеазу (ZFN), эффекторную нуклеазу, подобную активаторам транскрипции (TALEN), мегануклеазу или ассоциированный с короткими палиндромными повторами, регулярно расположенными группами (CRISPR), белок (Cas) и направляющую РНК (нРНК).
[0095] В некоторых способах сайленсинг происходит во время по меньшей мере одного из следующих периодов: (1) после внесения донорской XY плюрипотентной клетки отличного от человека млекопитающего в эмбрион-хозяин; (2) после внесения эмбриона-хозяина, содержащего донорскую XY плюрипотентную клетку отличного от человека млекопитающего, в организм реципиентной самки отличного от человека млекопитающего; (3) во время эмбрионального развития, когда запускается программа определения мужского пола; (4) во время эмбрионального развития вплоть до, по меньшей мере, стадии развития, соответствующей Е11-Е12, у мышей; (5) во время эмбрионального развития вплоть до, по меньшей мере, стадии развития, соответствующей Е17-Е19, у мышей; (6) в течение всего эмбрионального развития; (7) в течение всего периода оогенеза; (8) во время мейотической профазы развития ооцитов; (9) во время первых двух клеточных делений после оплодотворения ооцита; и (10) в ооцитах после овуляции в течение двух первых клеточных делений после оплодотворения. В некоторых способах изменение пола может быть передано потомству F1.
[0096] В некоторых способах среда с низкой осмоляльностью содержит основную среду, содержащую одно или более из следующего: (1) осмоляльность от около 218 мОсм/кг до около 322 мОсм/кг; (2) осмоляльность 218 мОсм/кг; (3) проводимость от около 11 мСм/см до около 13 мСм/см; (4) соль щелочного металла и галида в концентрации от около 50 мМ до около 110 мМ; (5) хлорид натрия в концентрации от около 50 мМ до около 110 мМ; (6) соль карбоновой кислоты в концентрации от около 17 мМ до около 30 мМ; (7) бикарбонат натрия в концентрации от около 13 мМ до около 25 мМ; (8) общую концентрацию соли галида щелочного металла и соли карбоновой кислоты от около 85 мМ до около 130 мМ; (9) хлорид натрия в концентрации 87±5 мМ и осмоляльность 261±26 мОсм/кг; (10) соль щелочного металла и галида в концентрации от около 50 мМ до около 110 мМ, соль карбоновой кислоты в концентрации от около 17 мМ до около 30 мМ и осмоляльность от около 200 мОсм/кг до около 329 мОсм/кг; и (11) осмоляльность 218 мОсм/кг, хлорид натрия в концентрации от 50 мМ до 110 мМ и бикарбонат натрия в концентрации от 13 мМ до 25 мМ. В некоторых способах XY плюрипотентную клетку отличного от человека млекопитающего поддерживают в среде с низкой осмоляльностью в течение по меньшей мере 1 суток, 2 суток, 3 суток, 4 суток, 5 суток, 6 суток, 7 суток, 8 суток, 9 суток, 10 суток, 11 суток, 12 суток, 13 суток, 2 недель, 3 недель или 4 недель перед внесением в эмбрион-хозяин.
[0097] В некоторых способах отличное от человека млекопитающее является грызуном, крысой или мышью. Необязательно, мышь относится к линии C57BL/6; мышь относится к линии 129; мышь не относится к линии 129; мышь относится к линии C57BL/6 и линии 129; отличное от человека животное представляет собой мышь, причем Y-хромосома происходит из линии C57BL/6; отличное от человека животное представляет собой мышь, причем Y-хромосома происходит из линии 129; отличное от человека животное представляет собой мышь, причем Y-хромосома не происходит из линии 129; или отличное от человека животное представляет собой мышь, а плюрипотентная клетка представляет собой мышиную ЭС клетку VGF1.
[0098] В некоторых способах плюрипотентная клетка содержит направленную генетическую модификацию в целевом геномном локусе. Необязательно, направленная генетическая модификация содержит вставку, делецию, нокаут, нокин, точечную мутацию или их комбинацию.
[0099] В некоторых способах указанная область содержит Zfy2, a XY плюрипотентная клетка отличного от человека млекопитающего дополнительно содержит модификацию, которая снижает уровень и/или активность белка Sry.
[00100] В некоторых способах по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% животных F0 XY потомства представляют собой XY отличных от человека млекопитающих с женским фенотипом, которые являются фертильными после достижения половой зрелости. Необязательно, процентная доля F0 XY потомства, представленного фертильными XY отличными от человека млекопитающими с женским фенотипом, является большей, чем процентная доля фертильных XY отличных от человека млекопитающих с женским фенотипом, полученных из XY плюрипотентной клетки отличного от человека млекопитающего, которая не содержит сайленсинг области Y-хромосомы.
[00101] В некоторых способах F0 самки, полученные из донорской XY плюрипотентной клетки отличного от человека млекопитающего, имеют генотип XY.
[00102] В некоторых способах по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% самок F0 XY, полученных из донорской XY плюрипотентной клетки отличного от человека млекопитающего, являются фертильными. Необязательно, процентная доля F0 XY самок, полученных из XY плюрипотентной клетки отличного от человека млекопитающего, являющихся фертильными, больше, чем процентная доля фертильных F0 XY самок, полученных из XY плюрипотентной клетки отличного от человека млекопитающего, которая не содержит сайленсинг области Y-хромосомы.
[00103] В некоторых способах по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95% самок F0 XY, полученных из донорской XY плюрипотентной клетки отличного от человека млекопитающего, способны производить пометы, содержащие по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9 или 10 детенышей. Необязательно, средний размер помета, производимого F0 XY самками, полученными из донорской XY плюрипотентной клетки отличного от человека млекопитающего, больше, чем средний размер помета, производимого F0 XY самками, полученными из XY плюрипотентной клетки отличного от человека млекопитающего, которая не содержит сайленсинг области Y-хромосомы.
[00104] В некоторых способах по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95% самок F0 XY, полученных из донорской XY плюрипотентной клетки отличного от человека млекопитающего, способны производить по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9 или 10 пометов в течение жизни. Необязательно, среднее число пометов, производимое F0 XY самками, полученными из донорской XY плюрипотентной клетки отличного от человека млекопитающего, больше, чем среднее число пометов, производимое F0 XY самками, полученными из XY плюрипотентной клетки отличного от человека млекопитающего, которая не содержит сайленсинг области Y-хромосомы.
Необязательно, среднее число потомков, производимое на протяжении жизни F0 XY самками, полученными из донорской XY плюрипотентной клетки отличного от человека млекопитающего, больше, чем среднее число потомков, производимое на протяжении жизни F0 XY самками, полученными из XY плюрипотентной клетки отличного от человека млекопитающего, которая не содержит сайленсинг области Y-хромосомы.
[00105] В изобретении также предложены способы осуществления сайленсинга области Y-хромосомы в XY плюрипотентной клетке отличного от человека млекопитающего, включающие: (а) поддержание XY плюрипотентной клетки отличного от человека млекопитающего в среде, содержащей основную среду и добавки, подходящие для роста XY плюрипотентной клетки отличного от человека млекопитающего в культуре с поддержанием плюрипотентности, причем основная среда имеет осмоляльность от около 200 мОсм/кг до менее чем около 329 мОсм/кг; и (b) анализ XY плюрипотентной клетки отличного от человека млекопитающего для выявления сайленсинга области Y-хромосомы. Необязательно, плюрипотентная клетка представляет собой эмбриональную стволовую (ЭС) клетку.
[00106] В некоторых способах среда с низкой осмоляльностью содержит основную среду, содержащую одно или более из следующего: (1) осмоляльность от около 218 мОсм/кг до около 322 мОсм/кг; (2) осмоляльность 218 мОсм/кг; (3) проводимость от около 11 мСм/см до около 13 мСм/см; (4) соль щелочного металла и галида в концентрации от около 50 мМ до около 110 мМ; (5) хлорид натрия в концентрации от около 50 мМ до около 110 мМ; (6) соль карбоновой кислоты в концентрации от около 17 мМ до около 30 мМ; (7) бикарбонат натрия в концентрации от около 13 мМ до около 25 мМ; (8) общую концентрацию соли галида щелочного металла и соли карбоновой кислоты от около 85 мМ до около 130 мМ; (9) хлорид натрия в концентрации 87±5 мМ и осмоляльность 261±26 мОсм/кг; (10) соль щелочного металла и галида в концентрации от около 50 мМ до около 110 мМ, соль карбоновой кислоты в концентрации от около 17 мМ до около 30 мМ и осмоляльность от около 200 мОсм/кг до около 329 мОсм/кг; и (11) осмоляльность 218 мОсм/кг, хлорид натрия в концентрации от 50 мМ до 110 мМ и бикарбонат натрия в концентрации от 13 мМ до 25 мМ. Необязательно, XY плюрипотентную клетку отличного от человека млекопитающего поддерживают в среде с низкой осмоляльностью в течение по меньшей мере 1 суток, 2 суток, 3 суток, 4 суток, 5 суток, 6 суток, 7 суток, 8 суток, 9 суток, 10 суток, 11 суток, 12 суток, 13 суток, 2 недель, 3 недель или 4 недель перед проведением анализа.
[00107] В некоторых способах указанная область содержит все или часть малого плеча Y-хромосомы; не содержит один или более из кластера Rbmy, Zfy2 и Sry; содержит всю или часть секции Y-хромосомы, соответствующей области Sxra и/или области Sxrb мышиной Y-хромосомы; содержит всю или часть секции Y-хромосомы, соответствующей одному или более из интервала делеции 1, интервала делеции 2 и интервала делеции 3 в мышиной Y-хромосоме; содержит часть Y-хромосомы, теломерную в отношении Kdm5d или центромерную в отношении Usp9y; или является теломерной в отношении Zfy2, Sry или кластера Rbmy.
[00108] В некоторых способах сайленсинг снижает уровень и/или активность белка, кодируемого геном, расположенным в указанной области. Необязательно, происходит снижение уровня и/или активности одного или более из Ddx3y, Uty и Eif2s3y; происходит элиминация уровня и/или активности одного или более из Ddx3y, Uty и Eif2s3y; происходит снижение уровня и/или активности одного или более из Sry и Zfy2; или происходит элиминация уровня и/или активности одного или более из Sry и Zfy2.
[00109] Некоторые такие способы дополнительно включают: (b) внесение XY плюрипотентной клетки отличного от человека млекопитающего в эмбрион-хозяин; и (с) внесение эмбриона-хозяина по этапу (b) в организм реципиентной самки отличного от человека млекопитающего и вынашивание эмбриона-хозяина. Необязательно, XY плюрипотентную клетку отличного от человека млекопитающего поддерживают в среде с низкой осмоляльностью в течение по меньшей мере 1 суток, 2 суток, 3 суток, 4 суток, 5 суток, 6 суток, 7 суток, 8 суток, 9 суток, 10 суток, 11 суток, 12 суток, 13 суток, 2 недель, 3 недель или 4 недель перед внесением в эмбрион-хозяин.
[00110] В изобретении также предложены способы создания донорской XY плюрипотентной клетки отличного от человека млекопитающего, включающие: (а) поддержание популяции одной или более XY плюрипотентных клеток отличного от человека млекопитающего в среде с низкой осмоляльностью, содержащей основную среду и добавки, подходящие для поддержания XY плюрипотентной клетки отличного от человека млекопитающего в культуре, причем основная среда имеет осмоляльность от около 200 мОсм/кг до менее чем около 329 мОсм/кг; (b) анализ одной или более XY плюрипотентных клеток отличного от человека млекопитающего в отношении экспрессии и/или активности одного или более из Ddx3y, Uty и Eif2s3y; и (с) выбор донорской XY плюрипотентной клетки отличного от человека млекопитающего, имеющей сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y, причем донорская XY плюрипотентная клетка отличного от человека млекопитающего способна давать фертильное XY отличное от человека млекопитающее с женским фенотипом в поколении F0. Необязательно, XY плюрипотентную клетку отличного от человека млекопитающего поддерживают в среде с низкой осмоляльностью в течение по меньшей мере 1 суток, 2 суток, 3 суток, 4 суток, 5 суток, 6 суток, 7 суток, 8 суток, 9 суток, 10 суток, 11 суток, 12 суток, 13 суток, 2 недель, 3 недель или 4 недель перед этапом анализа (b). Необязательно, плюрипотентная клетка представляет собой эмбриональную стволовую (ЭС) клетку.
[00111] В некоторых способах среда с низкой осмоляльностью содержит основную среду, содержащую одно или более из следующего: (1) осмоляльность от около 218 мОсм/кг до около 322 мОсм/кг; (2) осмоляльность 218 мОсм/кг; (3) проводимость от около 11 мСм/см до около 13 мСм/см; (4) соль щелочного металла и галида в концентрации от около 50 мМ до около 110 мМ; (5) хлорид натрия в концентрации от около 50 мМ до около 110 мМ; (6) соль карбоновой кислоты в концентрации от около 17 мМ до около 30 мМ; (7) бикарбонат натрия в концентрации от около 13 мМ до около 25 мМ; (8) общую концентрацию соли галида щелочного металла и соли карбоновой кислоты от около 85 мМ до около 130 мМ; (9) хлорид натрия в концентрации 87±5 мМ и осмоляльность 261±26 мОсм/кг; (10) соль щелочного металла и галида в концентрации от около 50 мМ до около 110 мМ, соль карбоновой кислоты в концентрации от около 17 мМ до около 30 мМ и осмоляльность от около 200 мОсм/кг до около 329 мОсм/кг; и (11) осмоляльность 218 мОсм/кг, хлорид натрия в концентрации от 50 мМ до 110 мМ и бикарбонат натрия в концентрации от 13 мМ до 25 мМ. Необязательно, XY плюрипотентную клетку отличного от человека млекопитающего поддерживают в среде с низкой осмоляльностью в течение по меньшей мере 1 суток, 2 суток, 3 суток, 4 суток, 5 суток, 6 суток, 7 суток, 8 суток, 9 суток, 10 суток, 11 суток, 12 суток, 13 суток, 2 недель, 3 недель или 4 недель перед проведением анализа.
[00112] В некоторых способах донорская XY плюрипотентная клетка отличного от человека млекопитающего характеризуется сниженной экспрессией и/или активностью Ddx3y, Uty и Eif2s3y. В некоторых способах донорская XY плюрипотентная клетка отличного от человека млекопитающего характеризуется отсутствием экспрессии и/или активности одного или более из Ddx3y, Uty и Eif2s3y. В некоторых способах донорская XY плюрипотентная клетка отличного от человека млекопитающего характеризуется отсутствием экспрессии и/или активности Ddx3y, Uty и Eif2s3y.
[00113] В некоторых способах отличное от человека млекопитающее является грызуном. Необязательно, грызун представляет собой крысу или мышь. В некоторых способах грызун представляет собой мышь, которая относится к линии C57BL/6 Необязательно, Y-хромосома получена из линии C57BL/6. В некоторых способах грызун представляет собой мышь, которая относится к линии 129. Необязательно, Y-хромосома получена из линии 129. В некоторых способах мышь не относится к линии 129. В некоторых способах Y-хромосома получена не из линии 129. В некоторых способах грызун представляет собой мышь, которая относится к линии C57BL/6 и линии 129. Необязательно, плюрипотентная клетка представляет собой мышиную ЭС клетку VGF1.
[00114] В некоторых способах плюрипотентная клетка содержит направленную генетическую модификацию в целевом геномном локусе. Необязательно, направленная генетическая модификация содержит вставку, делецию, нокаут, нокин, точечную мутацию или их комбинацию.
[00115] В изобретении также предложены способы получения эмбриона, включающие внесение в эмбрион-хозяин донорской XY плюрипотентной клетки отличного от человека млекопитающего, имеющей сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y, полученной вышеуказанными способами создания донорской XY плюрипотентной клетки отличного от человека млекопитающего, причем эмбрион-хозяин способен давать фертильное XY отличное от человека млекопитающее с женским фенотипом в поколении F0.
[00116] В изобретении также предложены способы создания фертильного XY отличного от человека млекопитающего с женским фенотипом в поколении F0, включающие: (а) внесение в эмбрион-хозяин донорской XY плюрипотентной клетки отличного от человека млекопитающего, имеющей сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y, полученной вышеуказанными способами создания донорской XY плюрипотентной клетки отличного от человека млекопитающего; (b) внесение эмбриона-хозяина по этапу (а) в организм реципиентной самки отличного от человека млекопитающего и вынашивание эмбриона-хозяина; и (с) получение F0 XY потомства отличного от человека млекопитающего, включающего XY отличное от человека млекопитающее с женским фенотипом, причем после достижения половой зрелости F0 XY отличное от человека млекопитающее с женским фенотипом является фертильным. В альтернативном варианте предложены способы создания фертильного XY отличного от человека млекопитающего с женским фенотипом в поколении F0, включающие: (а) внесение эмбриона в организм реципиентной самки отличного от человека млекопитающего и вынашивание эмбриона, причем эмбрион получен вышеуказанными способами и содержит клетку, имеющую сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y; и (b) получение F0 XY потомства отличного от человека млекопитающего, включающего XY отличное от человека млекопитающее с женским фенотипом, причем после достижения половой зрелости F0 XY отличное от человека млекопитающее с женским фенотипом является фертильным. Необязательно, эмбрион-хозяин представляет собой эмбрион на стадии пре-морулы.
Необязательно, способ дополнительно включает культивирование эмбриона-хозяина до стадии бластоцисты.
[00117] В некоторых способах XY плюрипотентную клетку отличного от человека млекопитающего поддерживают в среде с низкой осмоляльностью в течение по меньшей мере 1 суток, 2 суток, 3 суток, 4 суток, 5 суток, 6 суток, 7 суток, 8 суток, 9 суток, 10 суток, 11 суток, 12 суток, 13 суток, 2 недель, 3 недель или 4 недель перед внесением в эмбрион-хозяин.
[00118] В некоторых способах по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95% животных F0 XY потомства представляют собой XY отличных от человека млекопитающих с женским фенотипом, которые являются фертильными после достижения половой зрелости. В некоторых способах процентная доля F0 XY потомства, которая представляет собой фертильных XY животных с женским фенотипом, выше для F0 XY потомства, полученного из XY плюрипотентной клетки отличного от человека млекопитающего, имеющей сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y, по сравнению с F0 XY потомством, полученным из XY плюрипотентной клетки отличного от человека млекопитающего, имеющей более высокую экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y.
[00119] В некоторых способах F0 самки, полученные из донорской XY плюрипотентной клетки отличного от человека млекопитающего, имеют генотип XY.
[00120] В некоторых способах по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95% самок F0 XY, полученных из донорской XY плюрипотентной клетки отличного от человека млекопитающего, являются фертильными. В некоторых способах процентная доля F0 XY самок, которые являются фертильными, выше для F0 XY потомства, полученного из XY плюрипотентной клетки отличного от человека млекопитающего, имеющей сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y, по сравнению с F0 XY потомством, полученным из XY плюрипотентной клетки отличного от человека млекопитающего, имеющей более высокую экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y.
[00121] В некоторых способах по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95% самок F0 XY, полученных из донорской XY плюрипотентной клетки отличного от человека млекопитающего, способны производить пометы, содержащие по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9 или 10 детенышей. В некоторых способах средний размер помета, производимого F0 XY самками или фертильными F0 XY самками, выше для F0 XY самок или фертильных самок F0 XY, полученных из XY плюрипотентной клетки отличного от человека млекопитающего, имеющей сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y, по сравнению с F0 XY самками или фертильными F0 XY самками, полученными из XY плюрипотентной клетки отличного от человека млекопитающего, имеющей более высокую экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y.
[00122] В некоторых способах по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95% самок F0 XY, полученных из донорской XY плюрипотентной клетки отличного от человека млекопитающего, способны производить по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9 или 10 пометов в течение жизни. В некоторых способах среднее число пометов, производимое на протяжении жизни F0 XY самками или фертильными F0 XY самками, выше для F0 XY самок или фертильных F0 XY самок, полученных из XY плюрипотентной клетки отличного от человека млекопитающего, имеющей сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y, по сравнению с F0 XY самками или фертильными F0 XY самками, полученными из XY плюрипотентной клетки отличного от человека млекопитающего, имеющей более высокую экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y. В некоторых способах среднее число потомков, производимое на протяжении жизни F0 XY самками или фертильными F0 XY самками, выше для F0 XY самок или фертильных F0 XY самок, полученных из XY плюрипотентной клетки отличного от человека млекопитающего, имеющей сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y, по сравнению с F0 XY самками или фертильными F0 XY самками, полученными из XY плюрипотентной клетки отличного от человека млекопитающего, имеющей более высокую экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y.
[00123] В изобретении также предложен набор, содержащий: (а) выявляющий реагент для выявления уровней экспрессии и/или активности одного или более из Ddx3y, Uty и Eif2s3y в XY плюрипотентной клетке отличного от человека млекопитающего; и (b) инструкции по применению выявляющих реагентов и соотнесению выявления с прогнозируемой предрасположенностью XY плюрипотентной клетки отличного от человека млекопитающего к тому, чтобы давать фертильных XY отличных от человека млекопитающих с женским фенотипом в поколении F0.
КРАТКОЕ ОПИСАНИЕ ФИГУР
[00124] На ФИГ. 1А приведено схематическое изображение мышиной Y-хромосомы, включая интервалы делеций 1-7, области Sxra и Sxrb и гены, картированные относительно делеции Sxrb.
[00125] На ФИГ. 1В приведено схематическое изображение короткого плеча (Yp) мышиной Y-хромосомы.
[00126] На ФИГ. 2 изображены уровни Sry в половых тяжах из эмбрионов, полученных из клонов 1823СЕ6 и 1823CF11. Проанализированные стадии развития эмбрионов соответствовали диапазону от 13 до 25 хвостовых сомитов (хс). Эмбрионы CD1 XY при 20 хс использовали в качестве положительного контроля, а эмбрионы CD1 XX при 20 хс использовали в качестве отрицательного контроля. По оси х изображена стадия хс, а по оси у изображена экспрессия Sry, измеренная с помощью количественной полимеразной цепной реакции с обратной транскриптазой (ОТ-кПЦР) TAQMAN® мРНК, нормализованная относительно экспрессии эталонного гена Sf1. Такие же результаты были получены, когда в качестве нормализующего эталонного гена использовали Hprt. Нормализованные значения экспрессии нанесены на график в сравнении с одним из образцов 1823CF11 хс 14, чье значение было произвольно установлено как 1.
[00127] На ФИГ. 3 изображены относительные уровни экспрессии Ddx3y в тех же образцах половых тяжей, которые приведены для экспрессии Sry на ФИГ. 2, таким же образом нормализованные и нанесенные на график.
[00128] На ФИГ. 4 изображены относительные уровни экспрессии Eif2s3y в тех же образцах половых тяжей, которые приведены для экспрессии Sry на ФИГ. 2, таким же образом нормализованные и нанесенные на график.
[00129] На ФИГ. 5A-5D изображены относительные уровни экспрессии определяющих мужской пол генов Sox9 (ФИГ. 5А), Fgf9 (ФИГ. 5В), mDhh (ФИГ. 5С) и Amh (ФИГ. 5D) в тех же образцах половых тяжей, которые приведены для экспрессии Sry на ФИГ. 2, таким же образом нормализованные и нанесенные на график.
[00130] На ФИГ. 6А и 6В изображены относительные уровни экспрессии определяющих женский пол генов Foxl2 (ФИГ. 6А) и Rspo1 (ФИГ. 6В) в тех же образцах половых тяжей, которые приведены для экспрессии Sry на ФИГ. 2, таким же образом нормализованные и нанесенные на график.
[00131] На ФИГ. 7 изображены относительные уровни экспрессии Sry в половых тяжах, вырезанных из эмбрионов, полученных из двух меняющих пол клонов XY ЭС клеток, культивируемых в KO-DMEM. Проанализированные стадии развития эмбрионов соответствовали диапазону от 11 до 34 хвостовых сомитов (хс). Использовали три контроля: XY мышиные эмбрионы, созданные посредством скрещивания; XY мышиные эмбрионы из ЭС клеток, не подвергнутых направленному воздействию; и XY мышиные эмбрионы из линии, которая не меняет пол в KO-DMEM. По оси х изображена стадия хс, а по оси у изображена экспрессия Sry, измеренная с помощью количественной полимеразной цепной реакции с обратной транскриптазой (ОТ-кПЦР) TAQMAN® мРНК, нормализованная относительно экспрессии эталонного гена Sf1.
[00132] На ФИГ. 8А-С изображены относительные уровни экспрессии Eif2s37 (ФИГ. 8А), Uty (ФИГ. 8В) и Ddx3y (ФИГ. 8С) в половых тяжах, вырезанных из эмбрионов, полученных из двух меняющих пол клонов XY ЭС клеток, культивируемых в KO-DMEM. Проанализированные стадии развития эмбрионов соответствовали диапазону от 16 до 22 хвостовых сомитов (хс). Использовали три контроля: XY мышиные эмбрионы, созданные посредством скрещивания; XY мышиные эмбрионы из ЭС клеток, не подвергнутых направленному воздействию; и XY мышиные эмбрионы из линии, которая не меняет пол в KO-DMEM. По оси х изображена стадия хс, а по оси у изображена экспрессия, измеренная с помощью количественной полимеразной цепной реакции с обратной транскриптазой (ОТ-кПЦР) TAQMAN® мРНК, нормализованная относительно экспрессии эталонного гена Sf1.
[00133] На ФИГ. 9 изображены относительные уровни экспрессии Sry, Eif2s3y, Uty и Ddx3y в половых тяжах, вырезанных из эмбрионов, полученных из двух меняющих пол клонов XY ЭС клеток, культивируемых в KO-DMEM. Нормализованные уровни экспрессии усреднены по стадиям развития эмбрионов в диапазоне от 17 до 20 хвостовых сомитов (хс). Использовали три контроля: XY мышиные эмбрионы, созданные посредством скрещивания; XY мышиные эмбрионы из ЭС клеток, не подвергнутых направленному воздействию; и XY мышиные эмбрионы из линии, которая не меняет пол. По оси х изображена стадия хс, а по оси у изображена экспрессия, измеренная с помощью количественной полимеразной цепной реакции с обратной транскриптазой (ОТ-кПЦР) TAQMAN® мРНК, нормализованная относительно экспрессии эталонного гена Sf1.
[00134] На ФИГ. 10A-D изображены относительные уровни экспрессии Ddx3y (ФИГ. 10А), Uty (ФИГ. 10В), Eif2s3y (ФИГ. 10С) и Kdm5d (ФИГ. 10D) в разных тканях через одну неделю после рождения у мышей, полученных из меняющего пол клона XY ЭС клеток, культивируемых в KO-DMEM. Использовали два контроля: XY мышиные эмбрионы из ЭС клеток, не подвергнутых направленному воздействию; и XY мышиные эмбрионы из линии, которая не меняет пол в KO-DMEM. По оси х изображен тип ткани, а по оси у изображена экспрессия, измеренная с помощью количественной полимеразной цепной реакции с обратной транскриптазой (ОТ-кПЦР) TAQMAN® мРНК, нормализованная относительно экспрессии эталонного гена Gapdh.
[00135] На ФИГ. 11А-В изображены относительные уровни экспрессии во время стадий определения пола генов, включаемых на самых ранних стадиях развития мужских гонад. На ФИГ. 11А изображены относительные уровни экспрессии Sox9, а на ФИГ. 11В изображены относительные уровни экспрессии Fgf9 в половых тяжах, вырезанных из эмбрионов, полученных из двух меняющих пол клонов XY ЭС клеток, культивируемых в KO-DMEM. Проанализированные стадии развития эмбрионов соответствовали диапазону от 12 до 25 хвостовых сомитов (хс). Использовали четыре контроля: XY мышиные эмбрионы, созданные посредством скрещивания; XX мышиные эмбрионы, созданные посредством скрещивания; XY мышиные эмбрионы из ЭС клеток, не подвергнутых направленному воздействию; и XY мышиные эмбрионы из линии, которая не меняет пол в KO-DMEM. По оси х изображена стадия хс, а по оси у изображена экспрессия Sox9, измеренная с помощью количественной полимеразной цепной реакции с обратной транскриптазой (ОТ-кПЦР) TAQMAN® мРНК, нормализованная относительно экспрессии эталонного гена Sf1.
[00136] На ФИГ. 12А-В изображены относительные уровни экспрессии во время стадий определения пола маркеров развития мужских гонад. На ФИГ. 11А изображены относительные уровни экспрессии Dhh, а на ФИГ. 11В изображены относительные уровни экспрессии Amh в половых тяжах, вырезанных из эмбрионов, полученных из двух меняющих пол клонов XY ЭС клеток, культивируемых в KO-DMEM. Проанализированные стадии развития эмбрионов соответствовали диапазону от 12 до 25 хвостовых сомитов (хс). Использовали четыре контроля: XY мышиные эмбрионы, созданные посредством скрещивания; XX мышиные эмбрионы, созданные посредством скрещивания; XY мышиные эмбрионы из ЭС клеток, не подвергнутых направленному воздействию; и XY мышиные эмбрионы из линии, которая не меняет пол в KO-DMEM. По оси х изображена стадия хс, а по оси у изображена экспрессия Sox9, измеренная с помощью количественной полимеразной цепной реакции с обратной транскриптазой (ОТ-кПЦР) TAQMAN® мРНК, нормализованная относительно экспрессии эталонного гена Sf1.
[00137] На ФИГ. 13 изображены относительные уровни экспрессии во время стадий определения пола маркера развития женских гонад. На ФИГ. 13 изображены относительные уровни экспрессии Foxl2 в половых тяжах, вырезанных из эмбрионов, полученных из двух меняющих пол клонов XY ЭС клеток, культивируемых в KO-DMEM. Проанализированные стадии развития эмбрионов соответствовали диапазону от 12 до 25 хвостовых сомитов (хс). Использовали два контроля: XY мышиные эмбрионы, созданные посредством скрещивания; и XX мышиные эмбрионы, созданные посредством скрещивания. По оси х изображена стадия хс, а по оси у изображена экспрессия Sox9, измеренная с помощью количественной полимеразной цепной реакции с обратной транскриптазой (ОТ-кПЦР) TAQMAN® мРНК, нормализованная относительно экспрессии эталонного гена Sf1.
[00138] На ФИГ. 14А-Е изображены относительные уровни экспрессии Eif2s3y, Uty и Ddx3y, определенные методом ОТ-ПЦР, в субклонах эмбриональных стволовых клеток из трех родительских F1H4 XY клонов эмбриональных стволовых клеток, которые дают как XY самцов, так и XY самок мышей (родительские клоны 979 АС7 (ФИГ. 14А), 4048 ВС4 (ФИГ. 14В) и 15069 CD1 (ФИГ. 14С)), и из двух родительских F1H4 XY клонов эмбриональных стволовых клеток, которые дают только самцов мышей (985 АА8 (ФИГ. 14D) и 1823 С11 (ФИГ. 14Е)). Экспрессия приведена в сравнении с B2m. В качестве контроля использовали Drosha.
[00139] На ФИГ. 15 приведен обзор сигнальных путей определения пола у мышей. В время мышиного эмбриогенеза бипотенциальные гонады появляются из половых тяжей на 10,5 сутки после коитуса (спк). В соматических клетках XY половых тяжей экспрессия Sry (определяющей пол области Y-хромосомы) начинается на 10,5 спк, достигает пика на 11,5 спк и прекращается к 12,5 спк. Экспрессия Sox9 (содержащий SRY-бокс ген 9) повышается на несколько часов позже, чтобы индуцировать дифференцировку клеток Сертоли. Экспрессия Sox9 достигает пика на 11,5-12,5 спк, продолжается после рождения и поддерживается несколькими петлями с положительной обратной связью (включая FGF9 (фактор роста фибробластов 9)), a SOX9 впоследствии активирует много специфических в отношении мужского пола генов, включая Amh (антимюллеров гормон). На 12,5 спк формируются зачатки семенников и становятся очевидны различия между семенниками и яичниками. В отсутствие SRY такие гены, как Wnt4 (семейство сайтом интеграции бескрылого типа MMTV, представитель 4), Rspo1 (R-спондин 1) и Foxl2 (forkhead бокс L2), экспрессируются специфическим в отношении женского пола образом и индуцируют развитие яичников, что характеризуется экспрессией фоллистатина и многих других специфических в отношении яичников генов.
ОПРЕДЕЛЕНИЯ
[00140] Термины «белок», «полипептид» и «пептид», взаимозаменяемо употребляемые в данном документе, включают полимерные формы аминокислот любой длины, включая кодируемые и некодируемые аминокислоты и химически или биохимически модифицированные или дериватизированные аминокислоты. Эти термины также включают модифицированные полимеры, такие как полипептиды, содержащие модифицированные пептидные остовы.
[00141] Термины «нуклеиновая кислоты» и «полинуклеотид», взаимозаменяемо употребляемые в данном документе, включают полимерные формы нуклеотидов любой длины, включая рибонуклеотиды, дезоксирибонуклеотиды или их аналоги или модифицированные версии. Они включают одно-, двух- и многоцепочечную ДНК или РНК, геномную ДНК, кДНК, гибриды ДНК-РНК и полимеры, содержащие пуриновые основания, пиримидиновые основания или другие природные, химически модифицированные, биохимически модифицированные, неприродные или дериватизированные нуклеотидные основания.
[00142] Термин «ген» относится к последовательности ДНК в хромосоме, которая кодирует продукт (например, РНК-продукт и/или полипептидный продукт) и включает кодирующую область, прерываемую некодирующими нитронами, и последовательность, расположенную смежно с кодирующей областью со стороны 5' и 3' концов так, что ген соответствует полноразмерной мРНК (включая 5' и 3' нетранслируемые последовательности). Термин «ген» также включает другие некодирующие последовательности, включая регуляторные последовательности (например, промоторы, энхансеры и сайты связывания транскрипционных факторов), сигналы полиаденилирования, участки внутренней посадки рибосомы, сайленсеры, изолирующую последовательность и участки прикрепления к матриксу. Эти последовательности могут располагаться близко к кодирующей области гена (например, в пределах 10 т.п.о.) или в удаленных участках и они влияют на уровень или скорость транскрипции и трансляции гена.
[00143] Термин «дики тип» включает компоненты, имеющие структуру и активность, обнаруживаемые в нормальном (в противоположность мутантному, болезненному, измененному и т.д.) состоянии или контексте. Гены и полипептиды дикого типа часто существуют в большом количестве разных форм (например, аллели).
[00144] «Фертильность» и «фертильный» относятся к способности самки животного скрещиваться, становиться беременной и приносить живорожденного потомка. Чтобы считаться фертильным, животному нужно произвести хотя бы одного живорожденного потомка.
[00145] «Плодовитость» и «плодовитый» относятся к качеству фертильности. Плодовитость может представлять собой качественный показатель, такой как общее количество живых потомков, рожденных на протяжении жизни животного или в определенных экспериментальных временных рамках. Число и частота пометов и число потомков на помет также являются показателями плодовитости. Животное может быть фертильным, но не очень плодовитым (например, давать только один или несколько небольших пометов).
[00146] Композиции или способы, «содержащие» или «включающие» один или более перечисленных элементов, могут включать другие элементы, которые не были специальным образом перечислены. Например, композиция, которая «содержит» или «включает» белок, может содержать белок один или в комбинации с другими ингредиентами.
[00147] Указания диапазона значений включает все целочисленные значения, находящиеся в пределах или определяющие диапазон, и все поддиапазоны, определяемые целочисленными значениями в пределах диапазона.
[00148] Если не иное не очевидно из контекста, термин «около» включает значения в пределах стандартных границ погрешности измерения (например, СПС) указанного значения.
[00149] Формы единственного числа, применимые к объектам, включают множественные отсылки, если иное четко не следует из контекста. Например, термин «белок Cas» или «по меньшей мере один белок Cas» может включать несколько белков Cas, включая их смеси.
[00150] Статистически значимый означает р≤0,05.
ПОДРОБНОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
I. Обзор
[00151] Предложены способы и композиции для получения F0 фертильных XY самок животных. Эти способы и композиции включают создание XY плюрипотентных или тотипотентных клеток животных, in vitro клеточных культур или эмбрионов, способных давать фертильных XY самок животных в поколении F0. Такие клетки (а также эмбрионы и животных, полученных из них) можно создавать путем культивирования XY плюрипотентных или тотипотентных клеток в феминизирующей среде и оценки экспрессии и/или активности одного или более из Ddx3y, Uty и Eif2s3y. Предрасположенность клонов XY плюрипотентных или тотипотентных клеток животных к тому, чтобы давать фертильных XY животных с женским фенотипом в поколении F0 обратно коррелирует с экспрессией или активностью Ddx3y, Uty и Eif2s3y в этих клонах. В альтернативном варианте такие клетки (а также эмбрионы и животных, полученных из них) можно создавать посредством сайленсинга области Y-хромосомы. Необязательно, клетки также можно культивировать в феминизирующей среде и/или модифицировать так, чтобы снизить уровень и/или активность белка Sry. Также предложены способы и композиции для сайленсинга области Y-хромосомы в XY плюрипотентной или тотипотентной клетке животного (или полученных из нее in vitro клеточных культурах, эмбрионах или животных) путем поддержания XY плюрипотентной или тотипотентной клетки животного в феминизирующей среде, такой как среда с низкой осмоляльностью. Также предложены способы и композиции для поддержания популяции XY плюрипотентных или тотипотентных клеток животных в феминизирующей среде и отбора клеток или клонов, имеющих повышенную способность давать фертильных XY самок животных в поколении F0. Также предложены способы и композиции для проведения скрининга в отношении соединений с феминизирующей активностью или для оптимизации концентрации компонентов в феминизирующей среде путем оценки экспрессии и/или активности одного или более из Ddx3y, Uty и Eif2s3y, чья экспрессия и/или активность в XY плюрипотентных или тотипотентных клетках обратно коррелирует с предрасположенностью клонов XY плюрипотентных или тотипотентных клеток животных к тому, чтобы давать фертильных XY животных с женским фенотипом в поколении F0.
[00152] Большинство линий ЭС клеток для создания отличных от человека млекопитающих (например, мышей) имеют мужской XY генотип. Вследствие доминантности Y-хромосомы в определении пола у млекопитающих, при внесении XY ЭС клеток в эмбрион-хозяин и их вынашивании, что практически всегда приводит к первому поколению (F0) из животных с мужским фенотипом, которые являются химерами, содержащими клетки, полученные из мужской донорской ЭС клетки (XY), и клеток, полученных из эмбриона-хозяина, которые могут быть как мужскими (XY), так и женскими (XX). В той мере, в какой в поколении F0 присутствуют фенотипические самки, они, как правило, получены в результате внесения XY ЭС клеток в женский XX эмбрион, что приводит к получению химер, вклада ЭС клеток которых недостаточно, чтобы маскулинизировать эмбриональный половой тяж. В большинстве случаев такие женские химеры не производят ооциты, полученные из XY ЭС клеток и, следовательно, не способны передавать геном ЭС клетки следующему поколению.
[00153] Используя способ VELOCIMOUSE® (смотрите, например, патенты США №7659442; 7576259; и 7294754; и Poueymirou et al. (2007) Nat. Biotech. 25(1):91-99; которые все в полном объеме включены в данный документ посредством ссылки во всех смыслах), возможно получить поколение F0 мышей, которые полностью получены из донорской ЭС клетки. В нормальных обстоятельствах и стандартных экспериментальных условиях XY донорские ЭС клетки дают только полностью полученных из ЭС клетки мышей с мужским фенотипом, тогда как ЭС клетки, которые являются XX или ХО (XY ЭС клетки, которые утратили Y-хромосому), дают только полностью полученных из ЭС клетки мышей с женским фенотипом. Чтобы получить мышей с гомозиготными направленными мутациями от самца и самки полностью полученных из ЭС клетки мышей, необходимо два последовательных поколения скрещивания, чтобы сначала получить гетерозиготных самцов и самок поколения F1, которые при скрещивании между собой потенциально могут давать гомозиготное потомство в поколении F2.
[00154] Мыши с женским фенотипом и генотипом XY могут быть результатом конкретных мутаций. Смотрите, например, Lovell-Badge et al. (1990) Development 109:635-646; также смотрите Colvin et al. (2001) Cell 104(6):875-889. Однако такие XY самки мышей часто стерильны или имеют очень ограниченную фертильность.
[00155] В WO 2011/156723 (в полном объеме включенной в данный документ посредством ссылки во всех смыслах) предложены способы и композиции, в которых используется феминизирующая культуральная среда (например, среда с низкой осмоляльностью или среда с низким содержанием солей, как описано в другом месте данного документа) для поддержания XY донорских клеток в культуре так, чтобы после внесения XY донорских клеток в эмбрион-хозяин и вынашивания в подходящем организме-хозяине можно было получать фертильных XY самок животных в популяции F0. Такие композиции находят применение в создании потомства F1, которое является гомозиготным в отношении заданной направленной генетической модификации в целевом геномном локусе.
[00156] В настоящей заявке предложены способы создания фертильного XY отличного от человека млекопитающего (например, мыши) с женским фенотипом из XY донорской клетки (например, XY донорской клетки, полученной от мыши с мужским фенотипом) и подходящего эмбриона-хозяина. Способ включает создание такого отличного от человека млекопитающего в поколении F0, которое позволяет формировать пару для скрещивания (самца F0 и самку F0) в поколении F0. В частности, это применимо в случае, когда донорская клетка содержит гетерозиготную генетическую модификацию и необходимо отличное от человека млекопитающее, гомозиготное в отношении генетической модификации. Хотя в данном описании изобретение проиллюстрировано в контексте создания фертильных XY мышей с женским фенотипом из донорских мышиных XY ЭС клеток, описанные в данном документе способы и композиции можно применять для получения фертильных XY отличных от человека млекопитающих с женским фенотипом из любой подходящие клетки отличного от человека млекопитающего (например, индуцированной плюрипотентной стволовой (иПС) клетки, ЭС клетки или плюрипотентной клетки) и любого подходящего эмбриона отличного от человека млекопитающего.
[00157] В настоящей заявке предложены способы и композиции, в которых используются XY донорские клетки, имеющие модификацию, которая приводит к сайленсингу области Y-хромосомы, для стимуляции получения анатомически нормальных, фертильных и плодовитых XY F0 самок. Такие способы и композиции позволяют создавать фертильную XY самку отличного от человека животного в поколении F0. Эти способы и композиции можно дополнительно использовать в комбинации с модификацией, которая снижает уровень и/или активность белка Sry, и/или культивированием в феминизирующей культуральной среде (например, среде с низкой осмоляльностью), описанной в другом месте данного документа, для того, чтобы существенно повысить процентную долю фертильного женского XY потомства в поколении F0. Эти фертильные XY отличные от человека млекопитающие с женским фенотипом включают отличных от человека млекопитающих, которые в достаточной мере проявляют характеристики женского фенотипа, чтобы овулировать и выносить эмбрион после оплодотворения яйцеклетки, полученной в результате овуляции у животного, в том числе, чтобы выносить эмбрион до необходимого срока и родить живое животное.
[00158] Способы эффективного преобразования мужского пола в женский ценны для промышленного животноводства. Например, телята женского пола намного ценнее для молочного скотоводства, чем телята мужского пола. То же самое касается птиц. В целях скрещивания, вне зависимости от того, будет ли это крупный рогатый скот, свиньи или овцы, предпочтительнее выращивать большое количество самок всего на несколько быков, хряков или баранов. Таким образом, различные предложенные в данном документе способы находят применение в различных коммерчески важных отраслях промышленного разведения.
II. Способы и композиции для создания фертильного XY животного в поколении F0
А. Способы создания XY плюрипотентных или тотипотентных клеток, способных давать фертильных XY самок в поколении F0
[00159] Животных с женским фенотипом (например, мышей) и генотипом XY можно получать в результате конкретных мутаций. Смотрите, например, Lovell-Badge et al. (1990) Development 109:635-646; также смотрите Colvin et al. (2001) Cell 104(6):875-889. Однако такие XY самки животных часто стерильны или, если фертильны, то имеют очень плохую плодовитость. Для наибольшей пользы в контексте получения животных, гомозиготных в отношении направленной генетической мутации в целевом геномном локусе, у самки XY необходимо достичь как изменения пола, так и фертильности. Согласно предложенным в данном документе способам и композициям можно создавать XY плюрипотентные или тотипотентные клетки или эмбрионы животных, способные давать фертильных XY самок животных в поколении F0. Такие клетки (а также in vitro клеточные культуры, эмбрионы и животных, полученных из них) можно создавать посредством сайленсинга области Y-хромосомы. Необязательно, клетки также можно культивировать в феминизирующей среде и/или модифицировать так, чтобы снизить уровень и/или активность белка Sry.
i. Сайленсинг области Y-хромосомы
[00160] Предложены способы и композиции для модификации XY клеток животных (например, XY плюрипотентных или тотипотентных клеток, таких как XY ЭС клетки) для осуществления сайленсинга области Y-хромосомы с преобразованием, таким образом, некоторых из клеток в донорские XY плюрипотентные или тотипотентные клетки, которые потенциально могут развиваться в фертильных самок животных, так, чтобы клетки можно было имплантировать в реципиентный эмбрион и получить фертильное потомство женского пола. Таким образом, донорские XY плюрипотентные или тотипотентные клетки способны давать F0 XY потомство, содержащее фертильное животное с женским фенотипом.
[00161] Областью, сайленсинг которой проводят, может быть любая часть Y-хромосомы, такая как область, содержащая все или часть малого плеча Y-хромосомы, или область, сайленсинг которой проводят путем обработки феминизирующей средой, как описано в другом месте данного документа. Сайленсинг также может влиять на другие части Y-хромосомы (например, длинное плечо (Yq)), в частности, части, которые несут гены, необходимые для мужской фертильности и сперматогенеза. Например, область может содержать всю или часть области Sxra (например, часть, содержащую ген Sry) и/или область может содержать всю или часть области Sxrb (например, часть, содержащую ген Zfy2) мышиной Y-хромосомы (смотрите Фиг. 1А) или соответствующую область Y-хромосом от других видов (например, области AZFa, AZFb или AZFc человеческой Y-хромосомы). Например, область может содержать части областей или полные области Sxra и Sxrb. Границами области Sxrb, например, являются Zfy1 и Zfy2 (смотрите Фиг. 1А и Mazeyrat et al. (1998) Human Molecular Genetics 7(11):1713-1724, в полном объеме включенную посредством ссылки во всех смыслах). Соответствующие области от других видов животных включают области, содержащие один или более генов, являющихся ортологичными или гомологичными генам в области в мышиной Y-хромосоме. Например, область AZFa человеческой области соответствует области Sxrb мышиной Y-хромосомы, в которой каждая область содержит Uty, Dby (Ddx3y) и Dffry (Usp9y). Смотрите, например, Affara (2001) Expert Rev. Mol. Med., Jan. 3; 2001: 1-16; Mazeyrat et al. (1998) Human Molecular Genetics 7(11);1713-1724; и Sargent et al. (1999) J. Med. Genet. 36:370-377, которые все в полном объеме включены посредством ссылки во всех смыслах. Указанная область также может содержать всю или часть области Smy или области Spy (смотрите Фиг. 1А и Affara (2001) Expert Rev. Mol. Med., Jan. 3; 2001: 1-16). Аналогично, область может содержать всю или часть одного или более из интервала делеции 1, интервала делеции 2, интервала делеции 3, интервала делеции 4, интервала делеции 5, интервала делеции 6 и интервала делеции 7 мышиной Y-хромосомы или соответствующие области Y-хромосом от других видов животных (смотрите, например, Фиг. 1А и Affara (2001) Expert Rev. Mol. Med, Jan. 3; 2001: 1-16). Например, область может содержать всю или часть одного или более из интервала делеции 1, интервала делеции 2 и интервала делеции 3 мышиной Y-хромосомы или соответствующие области Y-хромосом от других видов животных (смотрите, например, Фиг. 1А). В одном примере область может содержать интервал делеции 2 и интервал делеции 3 или часть интервала делеции 2 и часть интервала делеции 3.
[00162] Указанная область может содержать одно или более из следующего: кластер Rbmy, H2al2y, Sry, Zfy2, Usp9y, Ddx3y, Uty, Tspy-ps, Eif2s3y, Kdm5d, Uba1y или Zfy1 (смотрите Таблицу А). Указанная область может быть теломерной в отношении кластера Rbmy или может быть центромерной или теломерной в отношении H2al2y, Sry, Zfy2, Usp9y, Ddx3y, Uty, Tspy-ps, Eif2s3y, Kdm5d, Uba1y или Zfy1. Например, область может содержать часть Y-хромосомы, теломерную в отношении Kdm5d или центромерную в отношении Uspy9y, или область может быть теломерной в отношении Zfy2, Sry или кластера Rbmy. Из указанной области могут быть исключены одно или более из кластера Rbmy, H2al2y, Sry, Zfy2, Usp9y, Ddx3y, Uty, Tspy-ps, Eif2s3y, Kdm5d, Uba1y или Zfy1. Например, из области могут быть исключены одно или более из кластера Rbmy, Zfy2 и Sry. Аналогично, область может включать часть Y-хромосомы за пределами одного или более из кластера Rbmy, H2al2y, Sry, Zfy2, Usp9y, Ddx3y, Uty, Tspy-ps, Eif2s3y, Kdm5d, Uba1y или Zfy1. Например, область может содержать часть Y-хромосомы за пределами одного или более из кластера Rbmy, Zfy2 и Sry.
[00163]
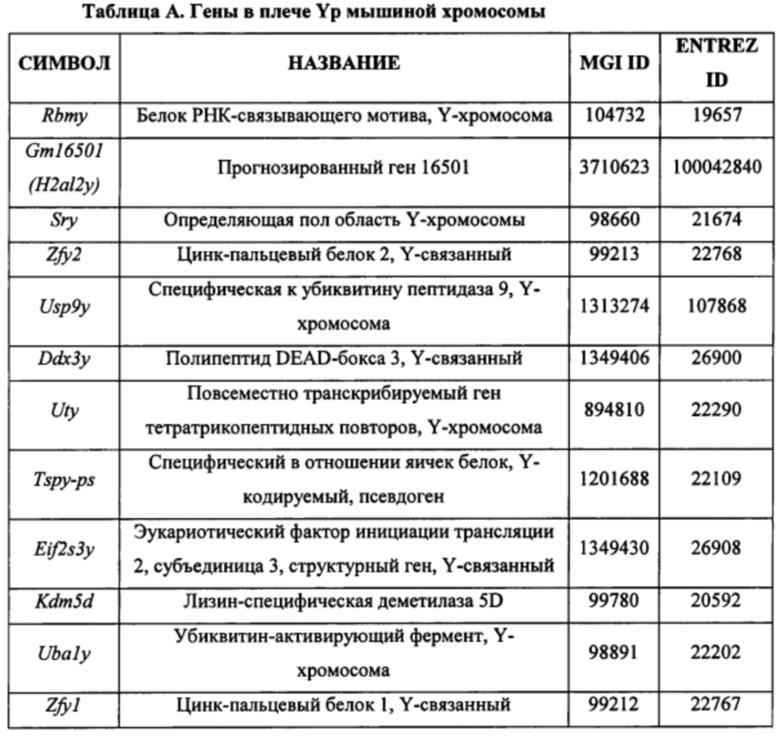
[00164] Сайленсинг может снижать уровень и/или активность белка, кодируемого геном, расположенным в Y-хромосоме. Например, может быть снижен уровень и/или активность одного или более белков, кодируемых кластером Rbmy, H2al2y, Sry, Zfy2, Usp9y, Ddx3y, Uty, Tspy-ps, Eif2s3y, Kdm5d, Uba1y или Zfy1. В альтернативном варианте сайленсинг может приводить к элиминации экспрессии гена, расположенного в Y-хромосоме (т.е. ген не экспрессируется, или в клетке отсутствует выявляемая экспрессия гена). В некоторых способах, например, при сайленсинге не экспрессируются одно или более из кластера Rbmy, H2al2y, Sry, Zfy2, Usp9y, Ddx3y, Uty, Tspy-ps, Eif2s3y, Kdm5d, Uba1y или Zfy1. В некоторых способах снижается уровень и/или активность одного или более белков, кодируемых Ddx3y, Eif2s3y, Uty, Zfy2 и Sry, или не экспрессируются один или более из Ddx3y, Eif2s3y, Uty, Zfy2 и Sry.
[00165] Сайленсинг области может включать, например, удаление области из генома, снижение экспрессии одного или более генов в пределах области или снижение активности одного или более белков или РНК, кодируемых генами в пределах области. Снижение экспрессии или активности в клетке субъекта может включать любое статистически значимое снижение уровней экспрессии или активности по сравнению с соответствующей контрольной клеткой. В общем случае снижение экспрессии или активности происходит, если экспрессия или активность статистически ниже, чем экспрессия или активность в соответствующей контрольной клетке, которая не была модифицирована так, чтобы осуществить сайленсинг области Y-хромосомы. Такое снижение включает уменьшение по меньшей мере на 1%, 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 99% или более по сравнению с контрольной клеткой, которая не была модифицирована так, чтобы осуществить сайленсинг области Y-хромосомы. Статистически значимый означает р≤0,05. Снижение экспрессии или активности может происходить посредством любого механизма на любой стадии. Например, снижение экспрессии может происходить посредством модификаций, прямым или непрямым образом осуществленных в области, или посредством явлений или регуляции, которая происходит во время транскрипции, после транскрипции, во время трансляции или после трансляции.
[00166] В некоторых случаях гены в пределах области, для которой был осуществлен сайленсинг, не экспрессируются (например, экспрессия элиминирована или в клетке отсутствует выявляемая экспрессия гена). Ген не экспрессируется, если не происходит транскрипция гена или если отсутствуют выявляемые уровни продуктов гена (например, мРНК или белка) определяемые обычными методами, известными в данной области техники. Уровень экспрессии полипептида можно определять прямым образом, например, путем анализа уровня полипептида в клетке или организме (например, анализа методом вестерн-блоттинга, анализа FACS, ELISA), или непрямым образом, например, путем определения активности полипептида. В других случаях снижение экспрессии и/или активности гена можно определять, применяя способы, которые включают, например, анализ методом саузерн-блоттинга, секвенирование ДНК, ПЦР-анализ, анализ методом нозерн-блоттинга, количественный ОТ-ПЦР-анализ, секвенирование нового поколения (NGS - от англ. «Next Generation Sequencing»), микроматричный анализ или фенотипический анализ.
[00167] «Исследуемая клетка» представляет собой клетку, которая была подвергнута генетическому изменению, такому как описанная в данном документе генетическая модификация, или клетку, которая происходит от клетки, измененной таким образом, и которая содержит это изменение. «Контроль» или «контрольная клетка» обеспечивает эталонный показатель для определения изменений в фенотипе исследуемой клетки. Контрольная клетка также может насколько это возможно близко совпадать с клеткой со сниженными уровнями и/или активностью белка, за исключением того, что она не содержит генетическую модификацию или мутацию, приводящую к снижению уровней или активности (например, соответствующие клетки могут происходить из одной линии клеток). В других случаях контрольная клетка может содержать, например: (а) клетку дикого типа (т.е. имеющую такой же генотип, что и стартовый материал для генетического изменения, которое приводит к получению исследуемой клетки); (b) клетку, имеющую такой же генотип, что и стартовый материал, но которая была генетически модифицирована нулевой конструкцией (т.е. конструкцией, которая, как известно, не оказывает воздействие на представляющий интерес признак, такой как конструкция, содержащая маркерный ген); (с) клетку, которая представляет собой не модифицированное генетически потомство исследуемой клетки (т.е. контрольная клетка и исследуемая клетка происходят из одной клеточной линии); (d) клетку, генетически идентичную исследуемой клетке, но которую не подвергают условиям или стимуляции, которые изменили бы уровни белка и/или уровни активности; или (е) саму исследуемую клетку в условиях, в которых генетическая модификация не приводит к изменению экспрессии уровней белка и/или уровней активности.
[00168] Сайленсинг может представлять собой перманентное генетическое изменение или временное. Перманентное генетическое изменение может представлять собой, например, изменение, которое сохраняется без проведения дополнительного этапа для его обращения (например, посредством дополнительной модификации), тогда как временное изменение может представлять собой изменение, которое длится только определенное время даже в случае отсутствия дополнительных этапов для его обращения (например, сайленсинг, достигаемый культивированием в феминизирующей среде). В некоторых способах сайленсинг достигается средствами, отличными от поддержания XY плюрипотентной или тотипотентной клетки в феминизирующей среде, описанной в другом месте данного документа (например, среде с низкой осмоляльностью, содержащей основную среду, имеющую осмоляльность от около 200 мОсм/кг до менее чем около 329 мОсм/кг). В других способах сайленсинг достигается путем культивирования XY плюрипотентной или тотипотентной клетки в феминизирующей среде, описанной в другом месте данного документа (например, среде с низкой осмоляльностью, имеющей осмоляльность от около 200 мОсм/кг до менее чем около 329 мОсм/кг, или среде с низкой осмоляльностью, содержащей основную среду, имеющую осмоляльность от около 200 мОсм/кг до менее чем около 329 мОсм/кг). Например, сайленсинг можно достигать одним или более из следующих способов: (1) направленная генетическая модификация, такая как делеция или разрушение области; (2) РНК-интерференция или антисмысловое ингибирование мРНК, транскрибируемой с одного или более генов в пределах области; (3) направленное разрушение белков, кодируемых одним или более генами в пределах области; (4) опосредованный гетерохроматином сайленсинг или изменение образования гетерохроматина в одной или более локациях Y-хромосомы; (5) повышение уровней фосфорилированной формы варианта гистона γН2АХ в Y-хромосоме; или (6) снижение транскрипции одного или более генов в пределах области. Направленные генетические модификации и способы их осуществления описаны в другом месте данного документа. Сайленсинг также можно достигать посредством применения ингибиторных нуклеиновых кислот, таких как короткие интерферирующие нуклеиновые кислоты (например, короткие интерферирующие РНК (киРНК), двухцепочечные РНК (дцРНК), микро-РНК (миРНК) и короткие шпилечные РНК (кшРНК)) или антисмысловые олигонуклеотиды, специфические в отношении генного транскрипта. Сайленсинг также можно достигать посредством применения ингибиторов белков, кодируемых одним или более генами в пределах области, или их первичной регуляции путем посттрансляционной модификации посредством, например, фосфорилирования, убиквитинирования и сумоилирования. Изменение образования гетерохроматина в Y-хромосоме также может приводить к сайленсингу. Например, делеция первой области Y-хромосомы может сделать вторую область ближе к домену гетерохроматина центромера и привести к сайленсингу второй области. Повышение уровней фосфорилированной формы варианта гистона γН2АХ в Y-хромосоме также может приводить к сайленсингу области Y-хромосомы. Известно, что фосфорилированный гистон γН2АХ связан с репрессией транскрипции и связан с репрессией транскрипции X и Y-хромосом в организме XY пола во время мейотической профазы. Смотрите, например, Alton et al. (2008) Reproduction 135:241-252. Снижение транскрипции одного или более генов в пределах области также может приводить к сайленсингу области Y-хромосомы. Репрессию транскрипции одного или более генов можно осуществлять, например, используя ДНК-связывающие белки, слитые с доменами транскрипционного репрессора или доменами эпигенетической модификации (смотрите, например, WO 2014/089290, в полном объеме включенную в данный документ посредством ссылки во всех смыслах).
[00169] Снижения уровня и/или активности белка можно достичь путем направленной генетической модификации гена, кодирующего белок, или геномного локуса, который влияет на уровни или активность белка или регулирует их. Такие направленные модификации могут включать, например, добавление одного или более нуклеотидов, делеции одного или более нуклеотидов, замены одного или более нуклеотидов, нокаут представляющего интерес полинуклеотида или его части, нокин представляющего интерес полинуклеотида или его части, замещение эндогенной нуклеотидной последовательности гетерологичной нуклеотидной последовательностью или их комбинацию. Например, чтобы получить направленную генетическую модификацию, можно изменить по меньшей мере 1, 2, 3, 4, 5, 7, 8, 9, 10 или более нуклеотидов. Для создания направленной генетической модификации можно использовать различные способы. Смотрите, например, Wang et al. (2013) Cell 153:910-918; Mandalos et al. (2012) PLOS ONE 7:e45768:1-9; и Wang et al. (2013) Nat Biotechnol. 31:530-532, которые все в полном объеме включены в данный документ посредством ссылки во всех смыслах. Кроме того, различные описанные в данном документе способы можно применять для внесения направленной генетической модификации в ген, кодирующий белок, или другие геномные локусы.
[00170] Можно использовать различные способы создания направленных генетических модификаций, которые снижают уровень и/или активность белка, и которые описаны в другом месте данного документа.
[00171] Направленная генетическая модификация гена, кодирующего белок, или любого другого целевого геномного локуса, может возникать, когда клетку (например, ЭС клетку) поддерживают в феминизирующей среде (например, среде с низкой осмоляльностью), описанной в другом месте данного документа (например, среде, которая стимулирует развитие XY F0 фертильных самок). И наоборот, клетку можно культивировать в среде, которая не является феминизирующей средой, описанной в данном документе (например, среде с низкой осмоляльностью, содержащей основную среду, имеющую осмоляльность от около 200 мОсм/кг до менее чем около 329 мОсм/кг). В альтернативном варианте направленная генетическая модификация гена или другого целевого геномного локуса, может возникать, когда клетку поддерживают в другой культуральной среде, а после этого переносят в феминизирующую культуральную среду (например, с низкой осмоляльностью), описанную в данном документе.
[00172] Активность и/или уровень белка также могут быть снижены или элиминированы путем внесения в клетку полинуклеотида, который ингибирует уровень или активность белка. Полинуклеотид может ингибировать экспрессию белка напрямую, путем предотвращения трансляции матричной РНК Sry, или косвенно, путем кодирования полипептида, который ингибирует транскрипцию гена, кодирующего белок. В альтернативном варианте активность белка снижают или элиминируют путем внесения в клетку последовательности, кодирующей полипептид, который ингибирует активность белка.
[00173] Уровень и/или активность белка также может регулироваться посредством применения кондиционального аллеля, который снижает активность и/или уровень белка. Кондициональный аллель содержит модифицированный ген, кодирующий белок, сконструированный так, чтобы иметь сниженный уровень и/или активность белка в необходимый момент развития и/или в необходимой представляющей интерес ткани. Сниженные уровень и/или активность можно сравнивать с контрольной клеткой, в которой отсутствует модификация, из которой происходит кондициональный аллель, или, в случае снижения активности в необходимый момент развития, с предшествующим и/или последующим моментами, или, в случае необходимой ткани, со средней активностью по всем тканям. Например, кондициональный аллель может содержать кондициональный нулевой аллель гена, кодирующего белок, который можно выключать в необходимый момент развития и/или в конкретных тканях. Такой кондициональный аллель можно использовать для создания фертильных XY самок, полученных из любого клона с направленным воздействием на ген. Как описано в другом месте данного документа, такой способ обеспечивает возможность создания необходимой гомозиготной генетической модификации в поколении F1. Такие способы обеспечивают быстрое определение фенотипа без необходимости в скрещивании до поколения F2.
[00174] Кондициональный аллель также может представлять собой мультифункциональный аллель, описанный в US 2011/0104799, которая в полном объеме включена посредством ссылки во всех смыслах. Например, такой кондициональный аллель может содержать: (а) приводящую в действие последовательность в смысловой ориентации относительно транскрипции целевого гена и кассету отбора по чувствительности к лекарственному препарату (DSC) в смысловой или антисмысловой ориентации; (b) представляющую интерес нуклеотидную последовательность (NSI) в антисмысловой ориентации и обеспечивающий кондициональность инверсионный модуль (COIN), в котором используется расщепляющий экзоны интрон и инвертируемый genetrap-подобный модуль (смотрите, например, US 2011/0104799, которая в полном объеме включена посредством ссылки во всех смыслах); и (с) рекомбинирующие единицы, которые рекомбинируют после воздействия первой рекомбиназы с образованием кондиционального аллеля, в котором (i) отсутствует приводящая в действие последовательность и DSC, и (и) присутствует NSI в смысловой ориентации и COIN в антисмысловой ориентации.
[00175] Кондициональный аллель гена, кодирующего белок, может быть создан в любом типе клеток и не ограничивается XY плюрипотетной или тотипотентной клеткой. Такие типы клеток наряду с неограничивающими способами направленного воздействия на геномный локус в Y-хромосоме дополнительно подробно обсуждаются в другом месте данного документа.
[00176] Сайленсинг может возникать, когда XY плюрипотентную или тотипотентную клетку культивируют, после того, как донорскую XY плюрипотентную или тотипотентную клетку вносят в эмбрион-хозяин, или после того, как эмбрион-хозяин, содержащий донорскую XY плюрипотентную или тотипотентную клетку, вносят в организм реципиентной самки. Сайленсинг также может возникать во время разных стадий эмбрионального развития или в течение эмбрионального развития. В некоторых случаях сайленсинг продолжается после рождения. Например, после оплодотворения ооцита некоторая степень сайленсинга может сохраняться в течение первых двух клеточных делений. Изменение пола, вызванное сайленсингом, также может передаваться потомству F1. Некоторые примеры периодов, в течение которых может происходить сайленсинг, включают одно или более из следующего: (1) во время эмбрионального развития, когда запускается программа определения мужского пола; (2) во время эмбрионального развития вплоть до, по меньшей мере, стадии развития, соответствующей Е11-Е12 у мышей (например, стадий развития, важных для определения пола или изменения пола); (3) во время эмбрионального развития вплоть до, по меньшей мере, стадии развития, соответствующей Е17-Е19 у мышей (например, стадий развития, важных для фертильности в эмбриональный ооцитах); (4) в течение всего периода оогенеза; (5) во время мейотической профазы развития ооцитов, которая инициируется в эмбрионе непосредственно перед рождением; (6) во время оплодотворения ооцита (например, во время его первых двух клеточных делений; или (7) в ооцитах после овуляции в течение первых двух клеточных делений после оплодотворения.
ii. Культивирование и поддержание в феминизирующей среде
[00177] Культуральная среда, применяемая в различных способах и композициях, которая стимулирует получение XY фертильных самок в поколении F0, является такой, которая поддерживает плюрипотентные или тотипотентные клетки (например, ЭС клетки, иПС клетки, XY ЭС клетки, XY иПС клетки и т.д.). Термины «поддерживать», «поддержание» и «поддерживание» относятся к стабильному сохранению по меньшей мере одной или более характеристик или фенотипов плюрипотентных или тотипотентных клеток, описанных в данном документе (включая ЭС клетки или иПС клетки). Такие фенотипы могут включать сохранение плюрипотентности или тотипотентности, клеточной морфологии, профилей генной экспрессии и других функциональных характеристик клетки. Термины «поддерживать», «поддержание» и «поддерживание» также могут включать размножение клеток или увеличение числа культивируемых клеток. Эти термины дополнительно подразумевают культуральные условия, которые позволяют клетке оставаться плюрипотентной, тогда как клетки могут продолжать или не продолжать делиться или увеличиваться в числе. Клетки можно культивировать при различных концентрациях диоксида углерода. В одном примере клетки культивируют в 5% диоксиде углерода.
[00178] XY плюрипотентные или тотипотентные клетки, имеющие модификацию, которая приводит к сайленсингу области Y-хромосомы, можно поддерживать путем культивирования в любой основной среде, известной в данной области техники (например, DMEM), которая подходит для применения (с добавками) для выращивания или поддержания плюрипотентных или тотипотентных клеток (например, ЭС клеток, иПС клеток, XY ЭС клеток, XY иПС клеток и т.д.) в культуре. Такие культивируемые XY плюрипотентные или тотипотентные клетки (например, ЭС клетки) потенциально могут развиваться в фертильных самок животных вследствие сайленсинга области Y-хромосомы и сохранять плюрипотентность или тотипотентность так, чтобы клетки можно было имплантировать в реципиентный эмбрион и вырастить фертильное потомство женского пола.
1. Феминизирующая среда
[00179] Сайленсинг области Y-хромосомы может быть достигнут путем культивирования или поддержания XY плюрипотентных или тотипотентных клеток в феминизирующей среде, определение которой дополнительно приведено ниже. Аналогично, XY плюрипотентные или тотипотентные клетки, имеющие дополнительную модификацию, которая приводит к сайленсингу области Y-хромосомы, также можно поддерживать путем культивирования в феминизирующей среде, дополнительно определенной ниже. Путем культивирования клеток в течение достаточного времени в среде можно превратить клетки в XY плюрипотентные или тотипотентные клетки, которые потенциально могут развиваться в фертильных самок животных, чтобы клетки можно было имплантировать в реципиентный эмбрион и вырастить фертильное потомство женского пола. В WO 2011/156723 и Kuno et al. (2015) Transgenic Res. 24(1):19-29 (которые все в полном объеме включены в данный документ посредством ссылки во всех смыслах) предложены способы и композиции, в которых используется такая феминизирующая культуральная среда (например, среда с низкой осмоляльностью или среда с низким содержанием солей, как описано в другом месте данного документа) для поддержания XY донорских клеток в культуре так, чтобы после внесения XY донорских клеток в эмбрион-хозяин и вынашивания в подходящем организме-хозяине можно было получать фертильных XY самок животных в популяции F0. В некоторых таких способах предрасположенность конкретного клона XY плюрипотентных или тотипотентных клеток к тому, чтобы давать фертильных XY самок животных, может составлять от 0% до 60%, а это феминизирующее действие не может быть обращено путем повторного выращивания клонов в контрольной не феминизирующей среде. Такие F0 XY самки могут иметь нормальную внешнюю и внутреннюю анатомию, присущую самкам, могут быть полностью получены из донорской клетки с отсутствием вклада эмбриона-хозяина и химеризма, могут иметь одну X и одну Y хромосому во всех тканях, включая половые органы, и могут иметь нормальный XY мужской кариотип с отсутствием видимых хромосомных аберраций. F0 XY самки, полученные из XY плюрипотентных или тотипотентных клеток, культивируемых в феминизирующей среде, могут иметь фертильность и плодовитость, сравнимые с XX самками. Например, в некоторых таких способах F0 XY самки имеют фертильность 60-70% по сравнению с приблизительно 90% для F1 XX контрольных самок. В некоторых таких способах отсутствует различие в плодовитости между F0 XY самками и F1 XX самками в 9-месячных испытаниях скрещивания.
[00180] Культивирование в феминизирующей среде может приводить к репрессии или сайленсингу генов Y-хромосомы (смотрите Пример 1). Например, может происходить сайленсинг области Y-хромосомы, например всего или части короткого плеча Y-хромосомы. Хотя для практической реализации не требуется понимание механизма, сайленсинг в коротком плече Y-хромосомы может простираться до ключевого регулятора пути определения мужского пола, гена Sry, который не экспрессируется в достаточной степени в надлежащее время Е11-Е12 во время развития мышиного эмбриона, что приводит к экспрессии программы определения женского пола в бипотенциальном половом тяже (смотрите Пример 1 и ФИГ. 2A-D). Также может отсутствовать экспрессия других генов, таких как Ddx3y и Eif2s3y (смотрите Пример 1 и ФИГ. 3 и 4). После этого эмбрион с измененным полом может развиваться до рождения (поколение F0) как самка и затем вырастать в нормальную, фертильную самку мыши, несмотря на генотип XY. В некоторых способах индуцированный феминизирующей средой сайленсинг Y-хромосомы не является перманентным генетическим изменением и не сохраняется в поколении F1 (т.е. в поколении F1 от F0 XY самок отсутствуют самки XY).
[00181] Хотя для практической реализации не требуется понимание механизма, изменения в хроматине и/или повышение уровней фосфорилированной формы варианта гистона γН2АХ в Y-хромосоме могут вносить свой вклад в сайленсинг. Известно, что фосфорилированный гистон γН2АХ связан с репрессией транскрипции и связан с репрессией транскрипции X и Y-хромосом в организме XY пола во время мейотической профазы. Смотрите, например, Alton et al. (2008) Reproduction 135:241-252.
[00182] В некоторых случаях исходный индуцированный феминизирующей средой сайленсинг Y-хромосомы в XY плюрипотентных или тотипотентных клетках не является полным для всех клеток клона, поэтому некоторые эмбрионы, в которые инъецировали клетки из клона, будут развиваться в нормальных самцов. Этих F0 самцов можно скрещивать с их генетически идентичными клональными сиблингами с измененным на женский полом, чтобы получить гомозиготных генетически модифицированных мышей в первом (F1) поколении, тем самым устраняя необходимость во времени и затратах на дополнительное поколение (F2) скрещивания, что обычно необходимо для получения гомозиготных мышей.
[00183] Феминизирующая среда может стимулировать развитие XY F0 фертильных самок. Таким образом, культивирование в такой среде может повышать процентную долю XY F0 потомства, которое представляет собой XY животных с женским фенотипом, которые являются фертильными после достижения половой зрелости, процентную долю фертильных XY F0 самок или процентную долю XY F0 самок, способных давать нормальное количество пометов, нормальный размер пометов и нормальное количество потомков на протяжении жизни (например, по сравнению с самками животных дикого типа), по сравнению с XY плюрипотентными или тотипотентными клетками, культивируемыми в соответствующей контрольной среде (такой как, например, среда на основе DMEM) или по сравнению с клонами XY плюрипотентных или тотипотентных клеток, у которых отсутствует способность или которые имеют сниженную способность давать XY самок мышей, несмотря на культивирование в феминизирующей среде.
[00184] XY плюрипотентные или тотипотентные клетки могут дополнительно содержать по меньшей мере одну дополнительную направленную генетическую модификацию в целевом геномном локусе. В способах, включающих модификацию по меньшей мере одного дополнительного целевого геномного локуса, XY плюрипотентные или тотипотентные клетки можно культивировать в феминизирующей среде в течение всего процесса направленного воздействия, например, электропорации, отбора устойчивых к лекарственному препарату колоний, скрининга в отношении направленных мутаций, экспансии и криоконсервации, или только в течение одной или более частей всего процесса направленного воздействия. Аналогично, клетки можно культивировать в феминизирующей среде до и/или во время, и/или после процесса направленного воздействия.
[00185] «Основная среда» или «основные среды» включает, например, известную в данной области техники основную среду (например, DMEM), которая подходит для применения (с добавками) для выращивания или поддержания плюрипотентных или тотипотентных клеток (например, ЭС клеток, иПС клеток, XY ЭС клеток, XY иПС клеток и т.д.) в культуре. Основная среда, которая стимулирует получение фертильных XY самок (т.е. «феминизирующая среда» (например, «среда с низким содержанием солей» или «среда с низкой осмоляльностью»)), отличается от основной среды, обычно применяемой для поддержания ЭС клеток в культуре. В целях общего обсуждения основной среды, основная среда, которая не стимулирует получение фертильных XY самок, описана в этом разделе и в Таблице 1 как «DMEM» (например, типичная среда DMEM). В целях обсуждения основной среды, которая стимулирует получение фертильных XY самок, используется выражение «феминизирующая среда» (например, «среда с низким содержанием солей», «DMEM с низким содержанием солей», «среда с низкой осмоляльностью» или «DMEM с низкой осмоляльностью»). В данном документе подчеркивается разница между основной средой, обычно применяемой для поддержания плюрипотентных или тотипотентных клеток в культуре (например, DMEM), и основной средой, которая стимулирует получение фертильных XY самок (например, «феминизирующей средой», такой как «DMEM с низкой осмоляльностью»). Выражение «среда с низким содержанием солей» используется для удобства; подходящая DMEM для получения фертильных XY самок демонстрирует характеристики, не ограниченные «низким содержанием солей», но включает описанные в данном документе. Например, DMEM, приведенную в Таблице 1, можно сделать подходящей для получения фертильных XY самок путем изменения концентраций хлорида натрия и/или бикарбоната натрия, как предложено в данном документе, что также приведет к отличной осмоляльности и отличной проводимости по сравнению с DMEM, приведенной в Таблице 1. Примером основной среды является среда Игла, модифицированная по способу Дульбекко (DMEM) в различных формах (например, Invitrogen DMEM, Кат. №1 1971-025; Таблица 1). Подходящая DMEM с низким содержанием солей коммерчески доступна как KO-DMEM™ (Invitrogen Кат. №10829-018). Основная среда, как правило, дополнена некоторым количеством добавок, известных в данной области техники, в случае применения для поддержания клеток в культуре для применения в качестве донорских клеток. В данном описании такие добавки обозначены как «добавки» или «+ добавки».
[00186]

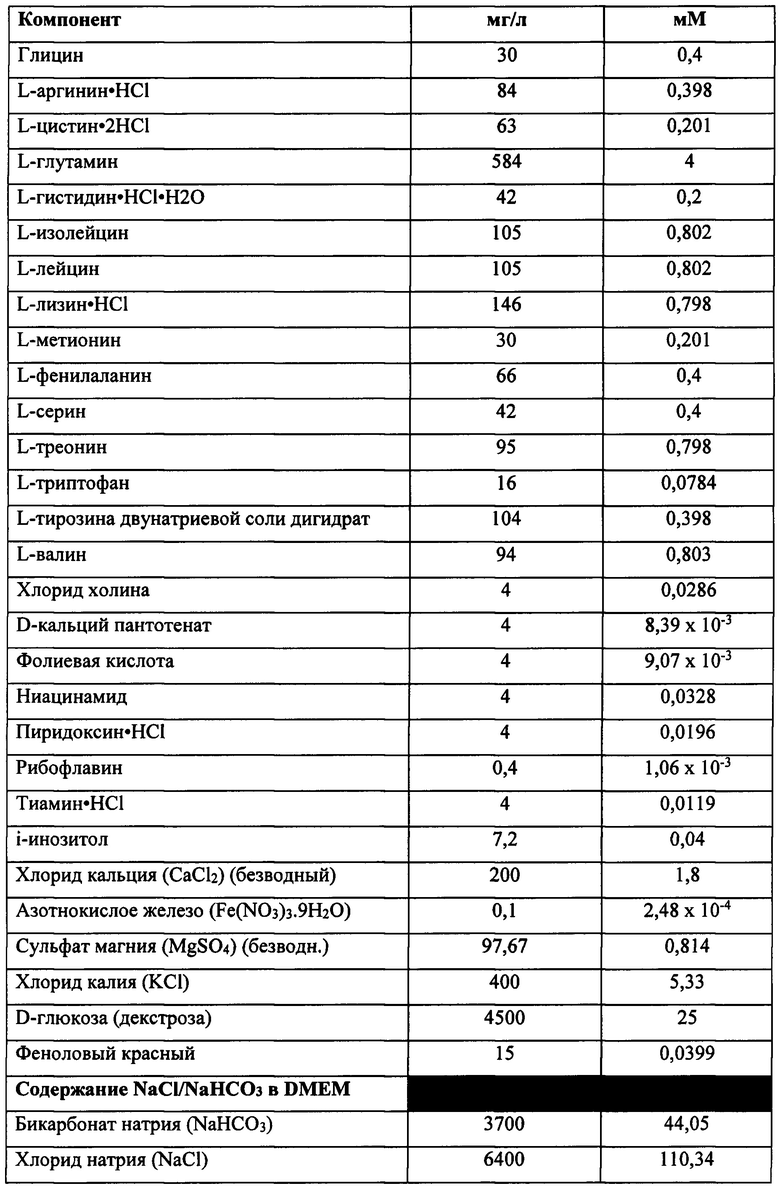
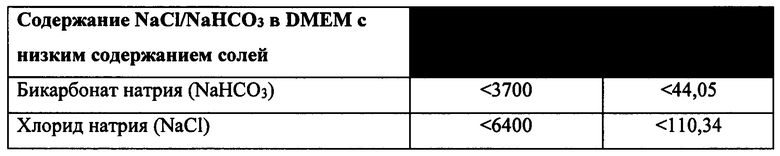
[00187] «Добавки» или выражение «+ добавки» включают элементы, элементы, добавляемые к основной среде для выращивания или поддержания плюрипотентных или тотипотентных клеток (например, XY ЭС клеток или XY иПС клеток) в культуре (например, для сохранения плюрипотентности или тотипотентности донорских клеток в культуре). Например, добавки к среде, подходящие для выращивания или поддержания плюрипотентных или тотипотентных клеток в культуре, включают, но не ограничиваются этим, фетальную бычью сыворотку (ФБС), глутамин, антибиотик(-и), пенициллин и стрептомицин (например, пенстреп), пируватные соли (например, пируват натрия), заменимые аминокислоты (например, MEM NEAA), 2-меркаптоэтанол и фактор, ингибирующий лейкемию (LIF).
[00188] В некоторых способах основная среда содержит одну или более добавок, подходящих для поддержания плюрипотентных или тотипотентных клеток в культуре, включая, например, XY ЭС клетки или XY иПС клетки, имеющие сниженную способность влиять на программу развития определения мужского пола после инъекции в эмбрион и внутриматочный перенос суррогатной матери-мыши. В случае некоторых клеточных линий среда представляет собой Wnt-кондиционированную среду, например, Wnt-3а-кондиционированную среду.
[00189] Например, основная среда может содержать одну или более из следующих добавок: ФБС (90 мл ФБС/0,5 л основной среды), глутамин (2,4 ммоль/0,5 л основной среды), пируват натрия (0,6 ммоль/0,5 л основной среды), заменимые аминокислоты (<0,1 ммоль/0,5 л основной среды), 2-меркаптоэтанол, LIF и один или более антибиотиков. Один пример среды для поддержания плюрипотентных или тотипотентных клеток в культуре, включая, например, XY ЭС клетки или XY иПС клетки, имеющие сниженную способность влиять на программу развития определения мужского пола после инъекции в эмбрион и внутриматочный перенос суррогатной матери-мыши, содержит около 500 мл основной среды, в которую были добавлены следующие добавки: около 90 мл ФБС (например, Hyclone ФБС Кат. № SH30070.03), около 2,4 миллимоля глутамина (например, около 12 мл 200 мМ раствора глутамина, например, Invitrogen Кат. №25030-081, пенициллин : стрептомицин (например, 60000 единиц пенициллина G натрия и 60 мг стрептомицина сульфата с около 51 мг NaCl; например, около 6 мл пенстреп от Invitrogen, Кат. №15140-122), около 0,6 миллимоля пирувата натрия (например, 6 мл 100 мМ пирувата натрия, Invitrogen Кат. №1 1360-070), около 0,06 миллимоля заменимых аминокислот (например, около 6 мл MEM NEAA, например, MEM NEAA от Invitrogen Кат. №1 1 140-050), около 1,2 мл 2-меркаптоэтанола и около 1,2 микрограмма LIF (например, около 120 микролитров 106 единиц/мл препарата LIF; например, около 120 микролитров Millipore ESGRO™-LIF, Кат. № ESG1 107). При составлении основной среды для поддержания плюрипотентных или тотипотентных XY клеток (например, XY ЭС клеток или XY иПС клеток) для получения фертильных XY самок, как правило, применяют те же добавки приблизительно в таких же количествах, но композиция основной среды будет отличаться (от DMEM, например, от среды, описанной в Таблице 1), а отличие(-ия) соответствует(-ют) отличию(-ям), изложенному(-ым) в данном документе.
[00190] Другие характеристики феминизирующей среды, которые можно менять, включают осмоляльность, проводимость, концентрацию солей, концентрацию солей щелочных металлов и галидов, концентрацию солей карбоновой кислоты, общую концентрацию солей галидов щелочных металлов и карбоновой кислоты и молярное соотношение солей щелочных металлов и галидов и солей уксусной кислоты. Например, основная среда может представлять собой среду с низким содержанием солей (например, DMEM с низким содержанием солей, имеющую концентрацию NaCl 85-130 мМ (от около 5,0 до 7,6 мг/мл)), среду с низкой осмоляльностью (например, DMEM с низкой осмоляльностью, имеющую осмоляльность 250-310 мОсм/кг или 218-322 мОсм/кг) или среду с низкой проводимостью (например, DMEM с низкой проводимостью, имеющую проводимость 11-13 мСм/см).
[00191] Осмоляльность основной среды или среды, содержащей основную среду и добавки, может составлять, например, не более чем около 320, 310, 300, 290, 280, 275, 270, 260, 250, 240, 230, 220, 210 или 200 мОсм/кг. В альтернативном варианте осмоляльность основной среды или среды, содержащей основную среду и добавки, может составлять, например, не более чем около 340 мОсм/кг или 330 мОсм/кг. Необязательно, основная среда имеет осмоляльность, составляющую не более, чем около 340, 330, 320, 310, 300, 290, 280, 275, 270, 260, 250, 240, 230, 220, 210 или 200 мОсм/кг, причем осмоляльность не меняется более чем на 1%, 2%, 3%, 4%, 5%, 10%, 15%, 20% или 25% после добавления добавок, подходящих для поддержания плюрипотентности или тотипотентности XY плюрипотентных или тотипотентных клеток отличного от человека животного, в основную среду. Например, основная среда или среда, содержащая основную среду и добавки, может иметь осмоляльность около 200-329, 218-322, 240-320, 250-310, 275-295 или 260-300 мОсм/кг. Необязательно, основная среда имеет осмоляльность, составляющую около 200-329, 218-322, 240-320, 250-310, 275-295 или 260-300 мОсм/кг, причем осмоляльность не меняется более чем на 1%, 2%, 3%, 4%, 5%, 10%, 15%, 20% или 25% после добавления добавок, подходящих для поддержания плюрипотентности или тотипотентности XY плюрипотентных или тотипотентных клеток отличного от человека животного, в основную среду. В альтернативном варианте основная среда или среда, содержащая основную среду и добавки, может иметь осмоляльность, составляющую около 214, около 216, около 200-322, около 200-340, около 200-292, около 214-322, около 216-322, около 218-322, около 214-332, около 216-332 или около 218-332 мОсм/кг. Необязательно, основная среда имеет осмоляльность, составляющую около 214, около 216, около 200-322, около 200-340, около 200-292, около 214-322, около 216-322, около 218-322, около 214-332, около 216-332 или около 218-332 мОсм/кг, причем осмоляльность не меняется более чем на 1%, 2%, 3%, 4%, 5%, 10%, 15%, 20% или 25% после добавления добавок, подходящих для поддержания плюрипотентности или тотипотентности XY плюрипотентных или тотипотентных клеток отличного от человека животного, в основную среду. Например, основная среда или среда, содержащая основную среду и добавки, может иметь осмоляльность около 270 мОсм/кг или 218 мОсм/кг. В альтернативном варианте осмоляльность может составлять 218±22 мОсм/кг, 261±26 мОсм/кг, 294±29 мОсм/кг или 322±32 мОсм/кг. В альтернативном варианте осмоляльность может составлять около 216 или 214 мОсм/кг, или 216±22 мОсм/кг, или 214±22 мОсм/кг. Необязательно, основная среда имеет осмоляльность, составляющую около 270 мОсм/кг, около 218 мОсм/кг, 216 мОсм/кг, 214 мОсм/кг, 218±22 мОсм/кг, 261±26 мОсм/кг, 294±29 мОсм/кг, 322±32 мОсм/кг, 216±22 мОсм/кг или 214±22 мОсм/кг, причем осмоляльность не меняется более чем на 1%, 2%, 3%, 4%, 5%, 10%, 15%, 20% или 25% после добавления добавок, подходящих для поддержания плюрипотентности или тотипотентности XY плюрипотентных или тотипотентных клеток отличного от человека животного, в основную среду.
[00192] Проводимость основной среды или среды, содержащей основную среду и добавки, может составлять, например, не более чем около 10,0, 10,5, 11,0, 11,5, 12,0, 12,5, 13,0, 13,5 или 14,0 мСм/см. Например, основная среда или среда, содержащая основную среду и добавки, может иметь проводимость, составляющую не более чем около 10-14 мСм/см, около 11-13 мСм/см или около 12-13 мСм/см.
[00193] рН основной среды или среды, содержащей основную среду и добавки, может составлять, например, от около 6,9 до около 7,5, от около 6,98 до около 7,41, от около 7,0 до около 7,4, от около 7,05 до около 7,35, от около 7,1 до около 7,3, от около 7,15 до около 7,25, от около 7,18 до около 7,22, от около 7,19 до около 7,23 или около 7,2 до около 7,22, или рН может составлять около 7,21, около 7,17, около 7,38, около 6,99, около 6,98, около 7,40, около 7,41, около 7,34 или около 7,37.
[00194] Некоторые среды имеют некоторую концентрацию солей щелочных металлов и галидов, таких как NaCl. Концентрация соли щелочного металла и галида в основной среде или среде, содержащей основную среду и добавки, может составлять, например, не более чем около 100, 90, 80, 70, 60 или 50 мМ. Например, в случае NaCl, его концентрация в основной среде или среде, содержащей основную среду и добавки, может составлять, например, не более чем около 5,8, 5,3, 4,7, 4,1, 3,5 или 2,9 мг/мл. Например, основная среда или среда, содержащая основную среду и добавки, может иметь концентрацию соли щелочного металла и галида около 50-110, 60-105, 70-95, 80-90, 90 или 85 мМ. Например, в случае NaCl, его концентрация в основной среде или среде, содержащей основную среду и добавки, может составлять, например, около 2,9-6,4, 3,5-6,1, 4,1-5,6, 4,7-5,3, 5,3 или 5,0 мг/мл. В альтернативном варианте концентрация соли щелочного металла и галида может составлять 50±5 мМ, 87±5 мМ, 110±5 мМ, около 3 мг/мл, около 5,1 мг/мл или около 6,4 мг/мл.
[00195] Некоторые среды имеют некоторую концентрацию солей карбоновой кислоты (карбонатов), например, солей натрия (например, бикарбоната натрия). Концентрация соли карбоновой кислоты в основной среде или среде, содержащей основную среду и добавки, может составлять, например, не более чем около 45, 40, 35, 30, 25 или 20 мМ. Например, в случае бикарбоната натрия, его концентрация в основной среде или среде, содержащей основную среду и добавки, может составлять, например, не более чем около 3,8, 3,4, 2,9, 2,5, 2,1 или 1,7 мг/мл. Например, основная среда или среда, содержащая основную среду и добавки, может иметь концентрацию соли карбоновой кислоты в основной среде около 10-40, 18-44, 17-30, 18-26, 13-25, 20-30, 25-26, 18 или 26 мМ. Например, в случае бикарбоната натрия, его концентрация в основной среде или среде, содержащей основную среду и добавки, может составлять, например, около 0,8-3,4, 1,5-3,7, 1,4-2,5, 1,5-2,2, 1,1-2,1, 1,7-2,5, 2,1-2,2, 1,5 или 2,2 мг/мл. В альтернативном варианте концентрация соли карбоновой кислоты может составлять 18±5 мМ, 26±5 мМ, около 1,5 мг/мл или около 2,2 мг/мл.
[00196] Суммарная концентрация соли щелочного металла и галида и соли карбоновой кислоты в основной среде или среде, содержащей основную среду и добавки, может составлять, например, не более чем около 140, 130, 120, 110, 100, 90 или 80 мМ. Например, основная среда или среда, содержащая основную среду и добавки, может иметь суммарную концентрацию соли щелочного металла и галида и соли карбоновой кислоты около 80-140, 85-130, 90-120, 95-120, 100-120 или 115 мМ.
[00197] Молярное соотношение соли щелочного металла и галида и соли карбоновой кислоты в основной среде или среде, содержащей основную среду и добавки, может составлять, например, более 2,5. Например, основная среда или среда, содержащая основную среду и добавки, может иметь молярное соотношение соли щелочного металла и галида и соли карбоновой кислоты около 2,6-4,0, 2,8-3,8, 3,0-3,6, 3,2-3,4, 3,3-3,5 или 3,4.
[00198] Одним примером феминизирующей среды (например, среды с низкой осмоляльностью) является среда, содержащая основную среду, имеющую одну или более из следующих характеристик: (а) осмоляльность от около 200 мОсм/кг до менее чем около 329 мОсм/кг; (b) проводимость от около 11 мСм/см до около 13 мСм/см; (с) соль щелочного металла и галида в концентрации от около 50 мМ до около 110 мМ; (d) соль карбоновой кислоты в концентрации от около 17 мМ до около 30 мМ; и (е) общую концентрацию соли галида щелочного металла и соли карбоновой кислоты от около 85 мМ до около 130 мМ. В альтернативном варианте среда, содержащая основную среду и добавки, может иметь осмоляльность от около 200 мОсм/кг до менее чем около 329 мОсм/кг или проводимость от около 11 мСм/см до около 13 мСм/см.
[00199] Другим примером феминизирующей среды (например, среды с низкой осмоляльностью) является среда, содержащая основную среду, имеющую одну или более из следующих характеристик: (а) соль щелочного металла и галида в концентрации от около 50 мМ до около 110 мМ; (b) соль карбоновой кислоты в концентрации от около 17 мМ до около 30 мМ; и (с) осмоляльность от около 200 мОсм/кг до около 329 мОсм/кг. Например, основная среда может содержать NaCl в концентрации около 2,9-6,4 мг/мл и/или может содержать бикарбонат натрия в концентрации около 1,4-2,5 мг/мл. В альтернативном варианте среда, содержащая основную среду и добавки, может иметь осмоляльность от около 200 мОсм/кг до около 329 мОсм/кг.
[00200] Другим примером феминизирующей среды (например, среды с низкой осмоляльностью) является среда, содержащая основную среду, имеющую одну или более из следующих характеристик: (а) соль щелочного металла и галида (например, NaCl) в концентрации от около 50 мМ до около 110 мМ; (b) соль карбоновой кислоты (например, NaHCO3) в концентрации от около 18 мМ до около 44 мМ или от около 18 мМ до около 26 мМ; и (с) осмоляльность от около 218 мОсм/кг до около 322 мОсм/кг. Например, основная среда может содержать NaCl в концентрации около 2,9-6,4 мг/мл и/или может содержать бикарбонат натрия в концентрации около 1,5-3,7 мг/мл или 1,5-2,2 мг/мл. В альтернативном варианте среда, содержащая основную среду и добавки, может иметь осмоляльность от около 218 мОсм/кг до около 322 мОсм/кг.
[00201] Другим примером феминизирующей среды (например, среды с низкой осмоляльностью) является среда, содержащая основную среду, имеющую одну или более из следующих характеристик: (а) осмоляльность около 250-310 мОсм/кг; (b) проводимость около 11-13 мСм/см; (с) соль щелочного металла и галида в концентрации около 60-105 мМ; (d) соль карбоновой кислоты в концентрации около 20-30 мМ; и (е) общую концентрацию соли галида щелочного металла и соли карбоновой кислоты около 85-130 мМ. В альтернативном варианте среда, содержащая основную среду и добавки, может иметь осмоляльность около 250-310 мОсм/кг.
[00202] Другим примером феминизирующей среды (например, среды с низкой осмоляльностью) является среда, содержащая основную среду, имеющую проводимость около 12-13 мСм/см и осмоляльность около 260-300 мОсм/кг. В альтернативном варианте среда, содержащая основную среду и добавки, может иметь проводимость около 12-13 мСм/см и осмоляльность около 260-300 мОсм/кг. Необязательно, основная среда дополнительно содержит хлорид натрия в концентрации около 70-95 мМ (т.е., около 4,1-5,6 мг/мл) или около 90 мМ NaCl (т.е., около 5,3 мг/мл). Необязательно, основная среда дополнительно содержит бикарбонат натрия в концентрации менее чем около 35 мМ (т.е., около 2,9 мг/мл) или около 20-30 мМ (т.е., около 1,7-2,5 мг/мл).
[00203] Другим примером феминизирующей среды (например, среды с низкой осмоляльностью) является среда, содержащая основную среду, имеющую осмоляльность около 250-310 мОсм/кг и концентрацию соли галида щелочного металла и соли карбоновой кислоты около 60-105 мМ. В альтернативном варианте среда, содержащая основную среду и добавки, может иметь осмоляльность около 250-310 мОсм/кг. Например, основная среда может содержать около 3,5-6,1 мг/мл NaCl с осмоляльностью около 250-310 мОсм/кг или основная среда может содержать около 3,5-6,1 мг/мл NaCl, а среда, содержащая основную среду и добавки, может иметь осмоляльность около 250-310 мОсм/кг. Необязательно, основная среда имеет концентрацию соли карбоновой кислоты около 20-30 мМ. Например, основная среда может содержать около 1,7-2,5 мг/мл бикарбоната натрия. Необязательно, суммарная концентрация соли щелочного металла и галида и соли карбоновой кислоты составляет около 80-140 мМ. Необязательно, проводимость основной среды составляет около 12-13 мСм/см. Необязательно, проводимость среды, содержащей основную среду и добавки, составляет около 12-13 мСм/см.
[00204] Другим примером феминизирующей среды (например, среды с низкой осмоляльностью) является среда, содержащая основную среду, содержащую около 50±5 мМ NaCl и около 26±5 мМ карбоната (например, бикарбоната натрия), с осмоляльностью около 218±22 мОсм/кг. В альтернативном варианте среда, содержащая основную среду и добавки, может иметь осмоляльность около 218±22 мОсм/кг. Например, среда может содержать основную среду, содержащую около 2,6-3,2 мг/мл NaCl и около 1,8-2,6 мг/мл бикарбоната натрия, а основная среда или среда, содержащая основную среду и добавки, может иметь осмоляльность около 218±22 мОсм/кг. Например, основная среда может содержать около 3 мг/мл NaCl и около 2,2 мг/мл бикарбоната натрия с осмоляльностью около 218 мОсм/кг. В альтернативном варианте среда, содержащая основную среду и добавки, может иметь осмоляльность около 218 мОсм/кг.
[00205] Другим примером феминизирующей среды (например, среды с низкой осмоляльностью) является среда, содержащая основную среду, содержащую около 87±5 мМ NaCl и около 18±5 мМ карбоната (например, бикарбоната натрия), с осмоляльностью около 261±26 мОсм/кг. В альтернативном варианте среда, содержащая основную среду и добавки, может иметь осмоляльность около 261±26 мОсм/кг. Например, основная среда может содержать около 4,8-5,4 мг/мл NaCl и около 1,1-1,9 мг/мл бикарбоната натрия, а основная среда или среда, содержащая основную среду и добавки, может иметь осмоляльность около 261±26 мОсм/кг. Например, основная среда может содержать около 5,1 мг/мл NaCl и около 1,5 мг/мл бикарбоната натрия с осмоляльностью около 261 мОсм/кг. В альтернативном варианте среда, содержащая основную среду и добавки, может иметь осмоляльность около 261 мОсм/кг. Необязательно, основная среда может дополнительно содержать 4,5 мг/мл глюкозы.
[00206] Другим примером феминизирующей среды (например, среды с низкой осмоляльностью) является среда, содержащая основную среду, содержащую около 110±5 мМ NaCl и около 18±5 мМ карбоната (например, бикарбоната натрия), с осмоляльностью около 294±29 мОсм/кг. В альтернативном варианте среда, содержащая основную среду и добавки, может иметь осмоляльность около 294±29 мОсм/кг. Например, основная среда может содержать около 6,1-6,7 мг/мл NaCl и около 1,1-1,9 мг/мл бикарбоната натрия, а основная среда или среда, содержащая основную среду и добавки, может иметь осмоляльность около 294±29 мОсм/кг. Например, основная среда может содержать около 6,4 мг/мл NaCl и около 1,5 мг/мл бикарбоната натрия с осмоляльностью около 294 мОсм/кг. В альтернативном варианте среда, содержащая основную среду и добавки, может иметь осмоляльность около 294 мОсм/кг. Необязательно, основная среда может дополнительно содержать 4,5 мг/мл глюкозы.
[00207] Другим примером феминизирующей среды (например, среды с низкой осмоляльностью) является среда, содержащая основную среду, содержащую около 87±5 мМ NaCl и около 26±5 мМ карбоната (например, бикарбоната натрия), с осмоляльностью около 270±27 мОсм/кг. В альтернативном варианте среда, содержащая основную среду и добавки, может иметь осмоляльность около 270±27 мОсм/кг. Например, среда может содержать основную среду, содержащую около 4,8-5,4 мг/мл NaCl и около 1,8-2,6 мг/мл бикарбоната натрия, а основная среда или среда, содержащая основную среду и добавки, может иметь осмоляльность около 270±27 мОсм/кг. Например, основная среда может содержать около 5,1 мг/мл NaCl и около 2,2 мг/мл бикарбоната натрия с осмоляльностью около 270 мОсм/кг. В альтернативном варианте среда, содержащая основную среду и добавки, может иметь осмоляльность около 270 мОсм/кг. Например, основная среда может содержать около 5,1 мг/мл NaCl и около 2,2 мг/мл бикарбоната натрия, а основная среда или среда, содержащая основную среду и добавки, может иметь осмоляльность около 275 мОсм/кг. Например, основная среда может содержать около 5,1 мг/мл NaCl и около 2,2 мг/мл бикарбоната натрия, а основная среда или среда, содержащая основную среду и добавки, может иметь осмоляльность около 268 мОсм/кг. Например, основная среда может содержать около 5,1 мг/мл NaCl и около 2,2 мг/мл бикарбоната натрия, а основная среда или среда, содержащая основную среду и добавки, может иметь осмоляльность около 280 мОсм/кг. Необязательно, основная среда может дополнительно содержать 4,5 мг/мл глюкозы.
[00208] Другим примером феминизирующей среды (например, среды с низкой осмоляльностью) является среда, содержащая основную среду, содержащую около 87±5 мМ NaCl, около 26±5 мМ карбоната (например, бикарбоната натрия) и около 86±5 мМ глюкозы, с осмоляльностью около 322±32 мОсм/кг. В альтернативном варианте среда, содержащая основную среду и добавки, может иметь осмоляльность около 322±32 мОсм/кг. Например, среда может содержать основную среду, содержащую около 4,8-5,4 мг/мл NaCl и около 1,8-2,6 мг/мл бикарбоната натрия, а основная среда или среда, содержащая основную среду и добавки, может иметь осмоляльность около 322±32 мОсм/кг. Например, основная среда может содержать около 5,1 мг/мл NaCl, около 2,2 мг/мл бикарбоната натрия и около 15,5 мг/мл глюкозы с осмоляльностью около 322 мОсм/кг. В альтернативном варианте среда, содержащая основную среду и добавки, может иметь осмоляльность около 322 мОсм/кг.
[00209] Другим примером феминизирующей среды (например, среды с низкой осмоляльностью) является среда, содержащая основную среду, содержащую около 50±5 мМ NaCl и около 26±5 мМ карбоната, с осмоляльностью 218±22 мОсм/кг. В альтернативном варианте среда, содержащая основную среду и добавки, может иметь осмоляльность около 218±22 мОсм/кг. Например, среда может содержать основную среду, содержащую около 2,6-3,2 мг/мл NaCl и около 1,8-2,6 мг/мл бикарбоната натрия, а основная среда или среда, содержащая основную среду и добавки, может иметь осмоляльность 218±22 мОсм/кг. Например, основная среда может содержать около 3 мг/мл NaCl и около 2,2 мг/мл бикарбоната натрия с осмоляльностью около 218 мОсм/кг. В альтернативном варианте среда, содержащая основную среду и добавки, может иметь осмоляльность около 218 мОсм/кг. В альтернативном варианте основная среда может содержать около 3 мг/мл NaCl и около 2,2 мг/мл бикарбоната натрия, а основная среда или среда, содержащая основную среду и добавки, может иметь осмоляльность около 216 мОсм/кг. В альтернативном варианте основная среда может содержать около 3 мг/мл NaCl и около 2,2 мг/мл бикарбоната натрия, а основная среда или среда, содержащая основную среду и добавки, может иметь осмоляльность около 214 мОсм/кг. Необязательно, основная среда может дополнительно содержать 4,5 мг/мл глюкозы.
[00210] Другим примером феминизирующей среды (например, среды с низкой осмоляльностью) является среда, содержащая основную среду, содержащую около 50±5 мМ NaCl и около 44±5 мМ карбоната (например, бикарбоната натрия), а основная среда или среда, содержащая основную среду и добавки, может иметь осмоляльность около 238±24 мОсм/кг. Например, среда может содержать основную среду, содержащую около 2,6-3,2 мг/мл NaCl и около 3,3-4,1 мг/мл бикарбоната натрия, а основная среда или среда, содержащая основную среду и добавки, может иметь осмоляльность около 238±24 мОсм/кг. Например, основная среда может содержать около 3 мг/мл NaCl и около 3,7 мг/мл бикарбоната натрия, а основная среда или среда, содержащая основную среду и добавки, может иметь осмоляльность около 238 мОсм/кг. Необязательно, основная среда может дополнительно содержать 4,5 мг/мл глюкозы.
[00211] Другим примером феминизирующей среды (например, среды с низкой осмоляльностью) является среда, содержащая основную среду, содержащую около 87±5 мМ NaCl и около 44±5 мМ карбоната (например, бикарбоната натрия), а основная среда или среда, содержащая основную среду и добавки, может иметь осмоляльность около 288±29 мОсм/кг. Например, среда может содержать основную среду, содержащую около 4,8-5,4 мг/мл NaCl и около 3,3-4,1 мг/мл бикарбоната натрия, а основная среда или среда, содержащая основную среду и добавки, может иметь осмоляльность около 288±29 мОсм/кг. Например, основная среда может содержать около 5,1 мг/мл NaCl и около 3,7 мг/мл бикарбоната натрия, а основная среда или среда, содержащая основную среду и добавки, может иметь осмоляльность около 288 мОсм/кг. Необязательно, основная среда может дополнительно содержать 4,5 мг/мл глюкозы.
[00212] Другим примером феминизирующей среды (например, среды с низкой осмоляльностью) является среда, содержащая основную среду, содержащую около 3 мг/мл NaCl и около 1,5 мг/мл бикарбоната натрия, а основная среда или среда, содержащая основную среду и добавки, может иметь осмоляльность около 203 мОсм/кг.
[00213] Другим примером феминизирующей среды (например, среды с низкой осмоляльностью) является среда, содержащая основную среду, содержащую около 44 мМ бикарбоната натрия (т.е. около 3,7 мг/мл), а основная среда или среда, содержащая основную среду и добавки, может иметь осмоляльность около 290 мОсм/кг. Другим примером феминизирующей среды (например, среды с низкой осмоляльностью) является среда, содержащая основную среду, содержащую около 26 мМ (т.е. около 2,2 мг/мл) бикарбоната натрия, а основная среда или среда, содержащая основную среду и добавки, может иметь осмоляльность около 264 мОсм/кг. Другим примером феминизирующей среды (например, среды с низкой осмоляльностью) является среда, содержащая основную среду, содержащую около 18 мМ (т.е. около 1,5 мг/мл) бикарбоната натрия, а основная среда или среда, содержащая основную среду и добавки, может иметь осмоляльность около 292 мОсм/кг. Другим примером феминизирующей среды (например, среды с низкой осмоляльностью) является среда, содержащая основную среду, содержащую около 18 мМ (т.е. около 1,5 мг/мл) бикарбоната натрия, а основная среда или среда, содержащая основную среду и добавки, может иметь осмоляльность около 251 мОсм/кг.
[00214] Другие среды, которые можно применять, включают среду DMEM с высоким содержанием глюкозы (LifeTech) с концентрацией NaHCO3, указанной в данном документе (например, около 44 мМ, 26 мМ или 18 мМ), и с добавлением 0,1 мМ заменимых аминокислот, 1 мМ пирувата натрия, 0,1 мМ 2-меркаптоэтанола, 2 мМ L-глутамина, 50 мкг/мл каждого из пенициллина и стрептомицина (LifeTech), 15% ФБС (Hyclone) и 2000 Е/мл LIF (Millipore).
[00215] Другие примеры феминизирующих сред (например, сред с низкой осмоляльностью) описаны в WO 2011/156723, US 2011/0307968 и US 2015/0067901, которые все в полном объеме включены в данный документ посредством ссылки во всех целях. Другие примеры феминизирующих сред описаны в Kuno et al. (2015) Transgenic Res. 24(1):19-29, которая в полном объеме включена в данный документ посредством ссылки во всех смыслах.
2. Отбор XY плюрипотентных или тотипотентных клеток или их клонов с повышенной способностью давать фертильных XY самок животных
[00216] Предложены способы и композиции для определения предрасположенности XY плюрипотентной или тотипотентной клетки животного или ее клона к тому, чтобы давать фертильных XY животных с женским фенотипом в поколении F0. Предрасположенность клонов XY плюрипотентных или тотипотентных клеток животных к тому, чтобы давать фертильных XY животных с женским фенотипом в поколении F0 обратно коррелирует с экспрессией или активностью Ddx3y, Uty и Eif2s3y в этих клонах. Прекращение экспрессии одного или более из этих генов в XY плюрипотентных или тотипотентных клетках животных (например, XY ЭС клетках) может спрогнозировать, какие клеточные клоны будут давать XY самок животных в поколении F0: чем сильнее наблюдаемый сайленсинг Ddx3y, Uty и Eif2s3y, тем выше предрасположенность клона XY ЭС клетки к тому, чтобы давать фертильных XY животных с женским фенотипом в поколении F0 (смотрите, например, Пример 3). Аналогично, прекращение активности или снижение экспрессии и/или активности одного или более из этих генов в XY плюрипотентных или тотипотентных клетках животных (например, XY ЭС клетках) может спрогнозировать, какие клеточные клоны будут давать XY самок животных в поколении F0: чем ниже наблюдаемая экспрессия Ddx3y, Uty и Eif2s3y, тем выше предрасположенность клона XY ЭС клетки к тому, чтобы давать фертильных XY животных с женским фенотипом в поколении F0 (смотрите, например, Пример 3). Другими словами, экспрессия и/или активность одного или более из этих генов может служить суррогатным маркером для прогнозирования получения XY самок.
[00217] Эту информацию можно использовать для отбора XY плюрипотентных или тотипотентных клеток животных, имеющих высокую предрасположенность к тому, чтобы давать фертильных XY животных с женским фенотипом в поколении F0. Например, если популяцию XY плюрипотентных или тотипотентных клеток животных (например, ЭС клеток) поддерживают в феминизирующей среде (например, среде с низкой осмоляльностью), такой способ может включать оценку одной или более XY плюрипотентных или тотипотентных клеток животного в отношении экспрессии и/или активности одного или более из Ddx3y, Uty и Eif2s3y, и выбор донорской XY плюрипотентной или тотипотентной клетки животного, имеющей сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y, причем донорская XY плюрипотентная или тотипотентная клетка животного способна давать фертильное XY животное с женским фенотипом в поколении F0. Например, такая донорская XY плюрипотентная или тотипотентная клетка животного может иметь сниженную экспрессию и/или активность Ddx3y, Uty, Eif2s3y, Ddx3y и Uty, Ddx3y и Eif2s3y, Uty и Eif2s3y или Ddx3y, Uty и Eif2s3y.
[00218] Затем донорскую XY плюрипотентную или тотипотентную клетку животного можно вносить в эмбрион-хозяин, причем эмбрион-хозяин способен давать фертильное XY животное с женским фенотипом в поколении F0. Например, эмбрион-хозяин может представлять собой эмбрион на стадии пре-морулы и эмбрион-хозяин можно культивировать до стадии бластоцисты после внесения донорской XY плюрипотентной или тотипотентной клетки животного. Животные, эмбрионы, способы внесения XY плюрипотентных или тотипотентных клеток животных в эмбрионы и способы получения F0 животных описаны в другом месте данного документа.
[00219] Феминизирующая среда (например, основная среда и добавки, подходящие для поддержания XY плюрипотентных или тотипотентных клеток животных в культуре, причем основная среда имеет осмоляльность от около 200 мОсм/кг до менее чем около 329 мОсм/кг) и способы поддержания клеток в такой среде описаны в другом месте данного документа.
[00220] XY плюрипотентные или тотипотентные клетки животных можно поддерживать в среде в течение различных периодов времени перед этапом анализа и/или перед внесением в эмбрион-хозяин. Например, XY плюрипотентную или тотипотентную клетку животного можно поддерживать в феминизирующей среде в течение по меньшей мере 1 суток, 2 суток, 3 суток, 4 суток, 5 суток, 6 суток, 7 суток, 8 суток, 9 суток, 10 суток, 11 суток, 12 суток, 13 суток, 2 недель, 3 недель или 4 недель перед этапом анализа и/или внесением в эмбрион-хозяин. В альтернативном варианте XY плюрипотентную или тотипотентную клетку животного можно поддерживать в феминизирующей среде в течение не более чем 1 суток, 2 суток, 3 суток, 4 суток, 5 суток, 6 суток, 7 суток, 8 суток, 9 суток, 10 суток, 11 суток, 12 суток, 13 суток, 2 недель, 3 недель или 4 недель перед этапом анализа и/или внесением в эмбрион-хозяин. В некоторых способах XY плюрипотентную или тотипотентную клетку культивируют или поддерживают в феминизирующей среде до проведения инъекции клетки в эмбрион. В других способах эмбрион, в который инъецировали XY плюрипотентную или тотипотентную клетку, культивируют или поддерживают в феминизирующей среде до переноса в организм суррогатной матери.
[00221] Этап анализа может включать анализ самого клона и определение уровня экспрессии или активности для одного или более из Ddx3y, Uty и Eif2s3y. В альтернативном варианте этап анализа может включать анализ нескольких субклонов, полученных из клона, и определение, например, процентной доли субклонов, имеющих сниженную экспрессию и/или активность, или в которых отсутствует экспрессия и/или активность одного или более из Ddx3y, Uty и Eif2s3y. В альтернативном варианте этап анализа может включать анализ нескольких субклонов, полученных из клона, и определение сравнительной экспрессии и/или активности одного или более из Ddx3y, Uty и Eif2s3y среди субклонов. Может происходить снижение экспрессии и/или активности одного или более из Ddx3y, Uty и Eif2s3y или может происходить снижение экспрессии и/или активности всех из Ddx3y, Uty и Eif2s3y. В альтернативном варианте в XY плюрипотентных или тотипотентных клетках животного отсутствует экспрессия и/или активность одного или более из Ddx3y, Uty и Eif2s3y или отсутствует экспрессия и/или активность всех из Ddx3y, Uty и Eif2s3y. Например, может отсутствовать выявляемая экспрессия всех из Ddx3y, Uty и Eif2s3y.
[00222] Экспрессию можно оценивать на уровне белка или на уровне мРНК. Уровень экспрессии полипептида можно определять прямым образом, например, путем анализа уровня полипептида в клетке или организме (например, анализа методом вестерн-блоттинга, анализа FACS, ELISA), или непрямым образом, например, путем определения активности полипептида. В других случаях снижение экспрессии и/или активности гена можно определить, применяя способы, которые включают, например, анализ методом саузерн-блоттинга, секвенирование ДНК, ПЦР-анализ, анализ методом нозерн-блоттинга, количественный ОТ-ПЦР-анализ, секвенирование нового поколения (NGS), микроматричный анализ или фенотипический анализ. Например, экспрессию гена можно оценивать путем измерения уровней мРНК методом ОТ-ПЦР, РНК-секвенирования, цифровой ПЦР или любым другим подходящим методом для измерения уровней мРНК. В одном примере можно проводить измерение уровней РНК методом ОТ-ПЦР относительно контрольного гена, такого как B2m. В некоторых случаях, например, ΔCt между контрольным геном (например, B2m) и целевым геном может составлять по меньшей мере 2, по меньшей мере 4, по меньшей мере 6 или по меньшей мере 8. Аналогично, в некоторых случаях через 30, 31, 32, 33, 34, 35, 36, 37, 38, 39 или 40 циклов будет отсутствовать выявляемая РНК для целевого гена.
[00223] Необязательно, при измерении уровней экспрессии мРНК или полипептида можно проводить контрольный эксперимент для подтверждения присутствия Y-хромосомы. Например, можно проводить анализ числа копий TAQMAN®, чтобы подтвердить присутствие одной копии Y-хромосомы, используя зонды к разным геномным последовательностям в Y-хромосоме. Такие методы анализа разработаны для определения вариации числа копий в пределах генома.
[00224] Снижение экспрессии или активности гена или белка, который он кодирует, в исследуемой клетке, эмбрионе или животном может включать любое статистически значимое уменьшение уровней экспрессии или активности по сравнению с соответствующей контрольной клеткой, эмбрионом или животным, или популяцией контрольных клеток, эмбрионов или животных. В общем случае снижение экспрессии или активности происходит, если экспрессия или активность статистически ниже, чем экспрессия или активность в соответствующей контрольной клетке, эмбрионе или полученном из них животном (например, XY плюрипотентной клетке животного), которые культивировали в соответствующей контрольной среде, не являющейся феминизирующей средой, XY плюрипотентной клетке животного, которая исторически дает исключительно самцов мышей, несмотря на культивирование в феминизирующей среде. Такое снижение включает уменьшение по меньшей мере на 1%, 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 99% или более по сравнению с контрольной клеткой. Статистически значимый означает р≤0,05. Снижение экспрессии или активности может происходить посредством любого механизма на любой стадии. Например, снижение экспрессии может происходить посредством явлений или регуляции, которая происходит во время транскрипции, после транскрипции, во время трансляции или после трансляции.
[00225] «Исследуемая клетка» представляет собой клетку, которую культивировали в феминизирующей среде (например, среде с низкой осмоляльностью), или клетку, которая происходит от клетки, культивируемой в феминизирующей среде. «Контроль» или «контрольная клетка» обеспечивает эталонный показатель для определения изменений в фенотипе исследуемой клетки. Контрольная клетка предпочтительно насколько это возможно близко совпадает с исследуемой клеткой (например, соответствующие клетки могут происходить из одной линии клеток или одного клона клеток, или могут иметь одинаковый генотип), за исключением того, что ее не культивировали в феминизирующей среде или у нее отсутствует способность или наблюдается сниженная способность к тому, чтобы давать XY самок мышей, несмотря на культивирование в феминизирующей среде. Например, контрольная клетка может содержать: (а) клетку, имеющую такой же генотип, или которая происходит из одной линии клеток или одного клона, что и исследуемая клетка, но которую культивировали в соответствующей контрольной среде, не являющейся феминизирующей средой (например, DMEM или среде другого типа, которая является достаточнй для поддержания плюрипотентности или тотипотентности XY плюрипотентной или тотипотентной клетки животного, но не для изменения клетки путем придания ей способности давать фертильное потомство женского пола); (b) XY плюрипотентную или тотипотентную клетку животного, генетически идентичную исследуемой клетке или полученную из одной линии клеток или одного клона, но которая генетически не изменена или не подвергнута условиям или стимулу, которые бы обеспечили потенциальную возможность получения фертильных XY самок животных; и (с) XY плюрипотентную или тотипотентную клетку животного, культивируемую в феминизирующей среде (например, среде с низкой осмоляльностью), но которая исторически дает исключительно самцов животных, несмотря на культивирование в феминизирующей среде.
[00226] В некоторых экспериментах популяцию XY плюрипотентных или тотипотентных клеток животного (например, ЭС клеток) или их клонов поддерживают в феминизирующей среде (например, среде с низкой осмоляльностью), а две или более клеток или клонов анализируют в отношении экспрессии и/или активности одного или более из Ddx3y, Uty и Eif2s3y. Клетка или клон с самой низкой экспрессией и/или активностью одного или более из Ddx3y, Uty и Eif2s3y затем может быть выбрана, чтобы служить донорской XY плюрипотентной или тотипотентной клеткой животного или ее клоном, причем донорская XY плюрипотентная или тотипотентная клетка животного способна давать фертильное XY животное с женским фенотипом в поколении F0.
[00227] Выбор донорской XY плюрипотентной или тотипотентной клетки, имеющей сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y, может привести к более высокой процентной доле F0 потомства, которое представляет собой XY животных с женским фенотипом, более высокой процентной доле F0 потомства, которое представляет собой XY животных с женским фенотипом, являющихся фертильными, более высокой процентной доле F0 XY потомства, которое представляет собой XY животных с женским фенотипом, являющихся фертильными, более высокой процентной доле F0 XY самок, являющихся фертильными, большему среднему числу пометов, производимых в течение жизни F0 XY самками или фертильными F0 XY самками, и большему среднему размеру пометов, производимых F0 XY самками или фертильными F0 XY самками. Такое F0 потомство может быть получено из донорских XY плюрипотентных или тотипотентных клеток животного после внесения клеток в эмбрион-хозяин и вынашивания эмбриона-хозяина с помощью способов, описанных в другом месте данного документа.
[00228] Повышение может представлять собой любое статистически значимое повышение по сравнению с соответствующим контролем. Например, повышение может составлять по меньшей мере 1,1 раза, 1,2 раза, 1,3 раза, 1,4 раза, 1,5 раза, 1,6 раза, 1,7 раза, 1,8 раза, 1,9 раза, 2 раза, 2,5 раза, 3 раза, 3,5 раза, 4 раза, 4,5 раза или 5 раз по сравнению с соответствующим контролем.
[00229] Например, процентная доля F0 потомства или F0 XY потомства, которое представляет собой XY животных с женским фенотипом, может быть повышена путем выбора донорской XY плюрипотентной или тотипотентной клетки животного, имеющей сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y. В некоторых способах процентная доля F0 потомства или F0 XY потомства, которая представляет собой фертильных XY животных с женским фенотипом, выше для F0 потомства, полученного из донорских XY плюрипотентных или тотипотентных клеток животных, имеющих сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y, по сравнению с F0 потомством, полученным из XY плюрипотентных или тотипотентных клеток животных, имеющих более высокую экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y.
[00230] Процентная доля F0 потомства или F0 XY потомства, которое представляет собой фертильных XY животных с женским фенотипом, также может быть повышена путем выбора донорской XY плюрипотентной или тотипотентной клетки животного, имеющей сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y. В некоторых способах процентная доля F0 потомства или F0 XY потомства, которая представляет собой фертильных животных XY с женским фенотипом, выше для F0 потомства, полученного из донорских XY плюрипотентных или тотипотентных клеток животных, имеющих сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y, по сравнению с F0 потомством, полученным из XY плюрипотентных или тотипотентных клеток животных, имеющих более высокую экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y.
[00231] Процентная доля F0 XY самок, являющихся фертильными, также может быть повышена путем выбора донорской XY плюрипотентной или тотипотентной клетки животного, имеющей сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y. В некоторых способах процентная доля F0 XY самок, являющихся фертильными, выше для F0 XY потомства, полученного из донорских XY плюрипотентных или тотипотентных клеток животных, имеющих сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y, по сравнению с F0 XY потомством, полученным из XY плюрипотентных или тотипотентных клеток животных, имеющих более высокую экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y.
[00232] Процентная доля F0 XY самок, способных давать нормальное число пометов и/или нормальный размер пометов (например, по сравнению с самками животных дикого типа), также может быть повышена путем выбора донорской XY плюрипотентной или тотипотентной клетки животного, имеющей сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y. В некоторых способах процентная доля F0 XY самок, которые способны давать нормальное число пометов и/или нормальный размер пометов, выше для F0 XY потомства, полученного из донорских XY плюрипотентных или тотипотентных клеток животных, имеющих сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y, по сравнению с F0 XY потомством, полученным из XY плюрипотентных или тотипотентных клеток животных, имеющих более высокую экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y.
[00233] Средний размер помета, производимого F0 XY самками или фертильными F0 XY самками, также может быть повышен путем выбора донорской XY плюрипотентной или тотипотентной клетки животного, имеющей сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y. В некоторых способах средний размер помета, производимого F0 XY самками или фертильными F0 XY самками, выше для F0 XY самок или фертильных F0 XY самок, полученных из донорских XY плюрипотентных или тотипотентных клеток животных, имеющих сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y, по сравнению с F0 XY самками или фертильными F0 XY самками, полученными из XY плюрипотентных или тотипотентных клеток животных, имеющих более высокую экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y.
[00234] Среднее число пометов, производимое на протяжении жизни F0 XY самками или фертильными F0 XY самками, также может быть повышено путем выбора донорской XY плюрипотентной или тотипотентной клетки животного, имеющей сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y. В некоторых способах среднее число пометов, производимое на протяжении жизни F0 XY самками или фертильными F0 XY самками, выше для F0 XY самок или фертильных F0 XY самок, полученных из донорских XY плюрипотентных или тотипотентных клеток животных, имеющих сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y, по сравнению с F0 XY самками или фертильными F0 XY самками, полученными из XY плюрипотентных или тотипотентных клеток животных, имеющих более высокую экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y.
[00235] Среднее число потомков, производимое на протяжении жизни F0 XY самками или фертильными F0 XY самками, также может быть повышено путем выбора донорской XY плюрипотентной или тотипотентной клетки животного, имеющей сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y. В некоторых способах среднее число потомков, производимое на протяжении жизни F0 XY самками или фертильными F0 XY самками, выше для F0 XY самок или фертильных F0 XY самок, полученных из донорских XY плюрипотентных или тотипотентных клеток животных, имеющих сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y, по сравнению с F0 XY самками или фертильными F0 XY самками, полученными из XY плюрипотентных или тотипотентных клеток животных, имеющих более высокую экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y.
[00236] Также предложены наборы для определения предрасположенности XY плюрипотентной или тотипотентной клетки животного или ее клона к тому, чтобы давать фертильных XY животных с женским фенотипом в поколении F0. Такие наборы могут содержать, например, выявляющий реагент для одного или более из Ddx3y, Uty и Eif2s3y. Выявляющий реагент может определять уровни экспрессии и/или активности одного или более из Ddx3y, Uty и Eif2s3y. Например, выявляющий реагент можно использовать для выявления уровня экспрессии мРНК или белка из одного или более из Ddx3y, Uty и Eif2s3y в плюрипотентной или тотипотентной клетке животного. Такой выявляющий реагент может содержать один или более наборов праймеров и/или один или более зондов для выявления экспрессии одного или более из Ddx3y, Uty и Eif2s3y в плюрипотентной или тотипотентной клетке животного.
[00237] Такие наборы также могут включать информационную этикетку. Наборы, как правило, содержат информацию по препарату с руководством по применению набора. Информация по препарату в общем случае относится к любому письменному или записанному материалу, который прикреплен или каким-либо другим образом присоединен к набору в любой момент во время его производства, транспортировки, продажи или применения. Например, термин информация по препарату включает рекламные листовки и брошюры, упаковочные материалы, инструкции, аудио- или видеокассеты, компьютерные диски, а также текст, напечатанный непосредственно на наборах.
[00238] Такие наборы могут дополнительно содержать инструкции по применению выявляющих реагентов и проведению соотнесения выявления с прогнозной предрасположенностью XY плюрипотентной или тотипотентной клетки животного или ее клона к тому, чтобы давать фертильных XY животных с женским фенотипом в поколении F0.
iii. Модификация, которая снижает уровень и/или активность белка Sry
[00239] XY плюрипотентные или тотипотентные клетки, имеющие модификацию, которая приводит к сайленсингу области Y-хромосомы, могут дополнительно содержать генетическую модификацию, которая приводит к снижению уровня и/или активности белка Sry, для превращения некоторых клеток в XY плюрипотентные или тотипотентные клетки, которые потенциально могут развиваться в фертильных самок животных так, чтобы клетки можно было имплантировать в реципиентный эмбрион и получать фертильное потомство женского пола. Аналогично, XY плюрипотентные или тотипотентные клетки, культивируемые в феминизирующей среде, описанной в другом месте данного документа, могут содержать генетическую модификацию, которая приводит к снижению уровня и/или активности белка Sry, или могут не содержать генетическую модификацию, которая приводит к снижению уровня и/или активности белка Sry. Белок «определяющей пол области Y» или белок «Sry» представляет собой транскрипционный фактор, который является представителем семейства группы белков с высокой подвижностью (HMG-бокса) ДНК-связывающих белков. Sry представляет собой фактор развития семенников, который инициирует определение мужского пола. Известна последовательность белка Sry из многих организмов, включая мышей (номер доступа № Q05738); крыс (GenBank: САА61882.1); человека (номер доступа № Q05066); кошек (номер доступа № Q67C50), и лошадей (номер доступа № Р36389), которые все в полном объеме включены в данный документ посредством ссылки во всех смыслах.
[00240] Способы получения XY животных с женским фенотипом в поколении F0 посредством модификации XY плюрипотентных или тотипотентных клеток для снижения уровня и/или активности белка Sry раскрыты в WO 2015/200805 и US 2015/0376651, которые все в полном объеме включены посредством ссылки во всех смыслах. В случае некоторых типов генетического фона (например, при применении линии ЭС клеток мышей VGB6, которые имеют Y-хромосому из линии C57BL/6), модификация ЭС клетки для снижения уровня и/или активности Sry и применение таких клеток для создания F0 мышей приводит к получению F0 XY мышей с женским фенотипом, но все мыши являются нефертильными или стерильными. Об этой нефертильности или очень ограниченной фертильности также сообщалось в работах других авторов. Смотрите, например, Kato et al. (2013) Scientific Reports 3:3136 и Vernet et al. (2014) Development 141:855-866. Однако в случае других типов генетического фона (например, при применении линии ЭС клеток мышей VGF1, которые имеют Y-хромосому из линии 129), модификация ЭС клетки для снижения уровня и/или активности Sry и применение таких клеток для создания F0 мышей приводит к получению F0 XY мышей с женским фенотипом, большинство которых являются фертильными. При дополнительном культивировании этих клеток VGF1 в феминизирующей среде, описанной в данном документе, можно достичь фертильности более высокой процентной доли F0 XY мышей с женским фенотипом. Смотрите WO 2015/200805 и US 2015/0376651, которые все в полном объеме включены посредством ссылки во всех смыслах.
[00241] Модификация XY плюрипотентных или тотипотентных клеток так, чтобы они содержали не только генетическую модификацию, которая приводит к снижению уровня и/или активности белка Sry, но также сайленсинг дополнительной области Y-хромосомы, может стимулировать развитие F0 XY фертильных самок (например, путем повышения получения F0 XY самок и/или путем дополнительного повышения фертильности и/или плодовитости F0 XY самок). Такая комбинация модификаций может повысить процентную долю F0 XY потомства, которое представляет собой XY животных с женским фенотипом, являющихся фертильными после достижения половой зрелости, процентную долю F0 XY самок, являющихся фертильными, или процентную долю F0 XY самок, способных производить нормальное число пометов и нормальный размер пометов (например, по сравнению с самками животных дикого типа), по сравнению с XY плюрипотентными или тотипотентными клетками без генетической модификации, которая приводит к снижению уровня и/или активности белка Sry.
[00242] В общем случае снижение уровня и/или активности белка Sry происходит, если уровень белка и/или уровень активности белка Sry статистически ниже, чем уровень белка Sry в соответствующей контрольной клетке, которая не была подвержена генетической модификации или мутагенезу для ингибирования экспрессии и/или активности белка Sry. Например, происходит снижение концентрации и/или активности белка Sry по меньшей мере на 1%, 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 99% или более по сравнению с контрольной клеткой, которая не была модифицирована так, чтобы иметь сниженный уровень и/или активность белка Sry.
[00243] «Исследуемая клетка» представляет собой клетку, которая была подвергнута генетическому изменению, такому как описанная в данном документе генетическая модификация, или клетку, которая происходит от клетки, измененной таким образом, и которая содержит это изменение. «Контроль» или «контрольная клетка» обеспечивает эталонный показатель для определения изменений в фенотипе исследуемой клетки. Контрольная клетка может насколько это возможно близко совпадать с клеткой со сниженной активностью Sry, за исключением того, что она не содержит генетическую модификацию или мутацию, приводящую к снижению активности (например, соответствующие клетки могут происходить из одной линии клеток). В других случаях контрольная клетка может содержать, например: (а) клетку дикого типа (т.е. имеющую такой же генотип, что и стартовый материал для генетического изменения, которое приводит к получению исследуемой клетки); (b) клетку, имеющую такой же генотип, что и стартовый материал, но которая была генетически модифицирована нулевой конструкцией (т.е. конструкцией, которая, как известно, не оказывает воздействие на представляющий интерес признак, такой как конструкция, содержащая маркерный ген); (с) клетку, которая представляет собой не модифицированное генетически потомство исследуемой клетки (т.е. контрольная клетка и исследуемая клетка происходят из одной клеточной линии); (d) клетку, генетически идентичную исследуемой клетке, но которую не подвергают условиям или стимуляции, которые изменили бы уровни белка Sry и/или уровни активности; или (е) саму исследуемую клетку в условиях, в которых генетическая модификация не приводит к изменению экспрессии уровней белка Sry и/или уровней активности.
[00244] Уровень экспрессии полипептида Sry можно определять прямым образом, например, путем анализа уровня полипептида Sry в клетке или организме, или непрямым образом, например, путем определения активности полипептида Sry. Известны различные способы определения активности белка Sry. Смотрите Wang et al. (2013) Cell 153:910-918; Mandalos et al. (2012) PLOS ONE 7:e45768:1-9; и Wang et al. (2013) Nat Biotechnol. 31:530-532, которые все в полном объеме включены в данный документ посредством ссылки во всех смыслах.
[00245] В других случаях клетки, имеющие направленную генетическую модификацию, которая снижает активность и/или уровень полипептида Sry, выбирают, применяя способы, которые включают, например, анализ методом саузерн-блоттинга, секвенирование ДНК, ПЦР-анализ, анализ методом нозерн-блоттинга, количественный ОТ-ПЦР-анализ, секвенирование нового поколения (NGS), микроматричный анализ или фенотипический анализ.
[00246] Снижение уровня и/или активности белка Sry может быть достигнуто посредством направленной генетической модификации гена Sry или геномного локуса, который влияет на или регулирует уровни или активность белка Sry. Такие направленные модификации могут включать, например, добавление одного или более нуклеотидов, делеции одного или более нуклеотидов, замены одного или более нуклеотидов, нокаут представляющего интерес полинуклеотида или его части, нокин представляющего интерес полинуклеотида или его части, замещение эндогенной нуклеотидной последовательности гетерологичной нуклеотидной последовательностью или их комбинацию. Например, чтобы получить направленную генетическую модификацию, можно изменить по меньшей мере 1, 2, 3, 4, 5, 7, 8, 9, 10 или более нуклеотидов. Для создания направленной генетической модификации можно использовать различные способы. Смотрите, например, Wang et al. (2013) Cell 153:910-918; Mandalos et al. (2012) PLOS ONE 7:e45768:1-9; и Wang et al. (2013) Nat Biotechnol. 31:530-532, которые все в полном объеме включены в данный документ посредством ссылки во всех смыслах. Кроме того, для внесения направленной генетической модификации в ген Sry или другие геномные локусы можно использовать различные описанные в данном документе способы.
[00247] Для создания направленных генетических модификаций, которые снижают уровень и/или активность белка Sry, можно использовать различные способы, которые описаны в другом месте данного документа.
[00248] Направленная генетическая модификация гена Sry или другого целевого геномного локуса может происходить, когда клетку (например, ЭС клетку) поддерживают в феминизирующей культуральной среде (например, среде с низкой осмоляльностью), описанной в другом месте данного документа (например, среде, которая стимулирует развитие XY F0 фертильных самок). В альтернативном варианте направленная генетическая модификация гена Sry или другого целевого геномного локуса может происходить, когда клетку поддерживают в другой культуральной среде и, необязательно, впоследствии переносят в феминизирующую культуральную среду (например, среду с низкой осмоляльностью), описанную в другом месте данного документа (например, среду, которая стимулирует развитие XY F0 фертильных самок).
[00249] Активность и/или уровень полипептида Sry также может быть снижена или элиминирована путем внесения в клетку полинуклеотида, который ингибирует уровень или активность полипептида Sry. Полинуклеотид может ингибировать экспрессию полипептида Sry напрямую, путем предотвращения трансляции матричной РНК Sry, или косвенно, путем кодирования полипептида, который ингибирует транскрипцию гена, кодирующего белок Sry. В альтернативном варианте активность полипептида Sry снижают или элиминируют путем внесения в клетку последовательности, кодирующей полипептид, который ингибирует активность полипептида Sry.
[00250] Уровень и/или активность белка Sry также может регулироваться посредством применения кондиционального аллеля Sry, который снижает активность и/или уровень белка Sry. «Кондициональный аллель Sry» содержит модифицированный ген Sry, сконструированный так, чтобы иметь сниженный уровень и/или активность белка Sry в необходимый момент развития и/или в необходимой представляющей интерес ткани.
Сниженные уровень и/или активность можно сравнивать с контрольной клеткой, в которой отсутствует модификация, из которой происходит кондициональный аллель, или, в случае снижения активности в необходимый момент развития, с предшествующим и/или последующим моментами, или, в случае необходимой ткани, со средней активностью по всем тканям. Например, кондициональный аллель Sry может содержать кондициональный нулевой аллель Sry, который можно выключать в необходимый момент развития и/или в конкретных тканях. Такой кондициональный аллель можно использовать для создания фертильных XY самок, полученных из любого клона с направленным воздействием на гены. Как описано в другом месте данного документа, такой способ обеспечивает возможность создания необходимой гомозиготной генетической модификации в поколении F1. Такие способы обеспечивают быстрое определение фенотипа без необходимости в выращивании поколения F2.
[00251] Кондициональный аллель Sry также может представлять собой мультифункциональный аллель, описанный в US 2011/0104799, которая в полном объеме включена посредством ссылки во всех смыслах. Например, такой кондициональный аллель может содержать: (а) приводящую в действие последовательность в смысловой ориентации относительно транскрипции целевого гена и кассету отбора по чувствительности к лекарственному препарату (DSC) в смысловой или антисмысловой ориентации; (b) представляющую интерес нуклеотидную последовательность (NSI) в антисмысловой ориентации и обеспечивающий кондициональность инверсионный модуль (COIN), в котором используется расщепляющий экзоны интрон и инвертируемый genetrap-подобный модуль (смотрите, например, US 2011/0104799, которая в полном объеме включена посредством ссылки во всех смыслах); и (с) рекомбинирующие единицы, которые рекомбинируют после воздействия первой рекомбиназы с образованием кондиционального аллеля, в котором (i) отсутствуют приводящая в действие последовательность и DSC, и (ii) присутствует NSI в смысловой ориентации и COIN в антисмысловой ориентации.
[00252] Кондициональный аллель Sry может быть создан в любом типе клеток и не ограничивается XY плюрипотентной или тотипотентной клеткой. Такие типы клеток наряду с неограничивающими способами направленного воздействия на геномный локус в Y-хромосоме дополнительно подробно обсуждаются в другом месте данного документа.
iv. Комбинации
[00253] Способы и композиции, предложенные для модификации XY плюрипотентных или тотипотентных клеток животных для осуществления сайленсинга области Y-хромосомы, можно комбинировать со способами, включающими культивирование XY плюрипотентных или тотипотентных клеток животных в феминизирующей среде (например, среде с низкой осмоляльностью), и/или способами, включающими модификацию XY плюрипотентных или тотипотентных клеток животных для снижения уровня и/или активности белка Sry. Аналогично, способы, включающие культивирование XY плюрипотентных или тотипотентных клеток животных в феминизирующей среде (например, среде с низкой осмоляльностью), можно комбинировать со способами и композициями, предложенными для модификации XY плюрипотентных или тотипотентных клеток животных для осуществления сайленсинга области Y-хромосомы, и/или способами, включающими модификацию XY плюрипотентных или тотипотентных клеток животных для снижения уровня и/или активности белка Sry. XY плюрипотентные или тотипотентные клетки могут дополнительно содержать по меньшей мере одну дополнительную направленную генетическую модификацию в целевом геномном локусе.
[00254] В способах, в которых XY плюрипотентные или тотипотентные клетки животных культивируют в феминизирующей среде, клетки можно культивировать в феминизирующей среде в течение всего процесса сайленсинга или только в течение одной или более частей всего процесса сайленсинга. Это означает, что в способах, в которых XY плюрипотентные или тотипотентные клетки животных культивируют в феминизирующей среде и в которых сайленсинг области Y-хромосомы осуществляют с помощью другого процесса сайленсинга, клетки можно культивировать в феминизирующей среде в течение всего процесса сайленсинга или только в течение одной или более частей всего процесса сайленсинга. Аналогично, клетки можно культивировать в феминизирующей среде до и/или во время, и/или после процесса сайленсинга. В способах, которые включают как поддержание клеток в феминизирующей среде, так и снижение уровня и/или активности белка Sry, клетки можно культивировать в феминизирующей среде в течение всего процесса снижения уровня и/или активности белка Sry или только в течение одной или более частей процесса. Аналогично, клетки можно культивировать в феминизирующей среде до и/или во время, и/или после процесса снижения уровня и/или активности белка Sry.
[00255] В некоторых таких комбинациях со способами, включающими культивирование XY плюрипотентных или тотипотентных клеток в феминизирующей среде, XY плюрипотентную или тотипотентную клетку можно поддерживать в феминизирующей среде (например, среде с низкой осмоляльностью), но сайленсинг области Y-хромосомы достигается средствами, отличными от поддержания клетки в феминизирующей среде или дополняющими его. В некоторых таких комбинациях со способами, включающими модификацию XY плюрипотентной или тотипотентной клетки для снижения уровня и/или активности белка Sry, сайленсинг области Y-хромосомы может представлять собой сайленсинг области, содержащей часть Y-хромосомы за пределами гена Sry.
[00256] В одном примере сайленсинг гена Sry осуществляют в дополнение к одному или более дополнительным генам в Y-хромосоме. Хотя для практической реализации не требуется понимание механизма, сайленсинг Sry может повысить изменение пола в таких XY эмбрионах (например, вследствие сайленсинга в соматических клетках гонад на ~11,0 спк), а сайленсинг одного или более других генов в Y-хромосоме может повысить фертильность и/или плодовитость XY самок, полученных из XY эмбрионов, в которых произошло изменение пола (например, вследствие сайленсинга в ооцитах на ~18,5 спк и более). Например, можно осуществлять сайленсинг обоих генов Zfy2 и Sry (например, в ЭС клетке мыши XY из линии C57BL, линии C57BL/6 или линии, отличной от 129, или с Y-хромосомой из линии C57BL, линии C57BL/6 или линии, отличной от 129), a XY плюрипотентную или тотипотентную клетку животного, необязательно, культивировать в феминизирующей среде (например, среде с низкой осмоляльностью), описанной в данном документе. В некоторых способах сайленсинг Sry может повысить степень изменение пола в XY эмбрионах (например, вследствие сайленсинга в соматических клетках гонад на ~11,0 спк), а сайленсинг Zfy2 может повысить фертильность и/или плодовитость XY самок (например, вследствие сайленсинга в ооцитах на ~18,5 спк и более).
[00257] Такие комбинации могут привести к более высокой процентной доле F0 потомства, которое представляет собой XY животных с женским фенотипом, более высокой процентной доле F0 потомства, которое представляет собой XY животных с женским фенотипом, являющихся фертильными, более высокой процентной доле F0 XY потомства, которое представляет собой XY животных с женским фенотипом, являющихся фертильными, более высокой процентной доле F0 XY самок, являющихся фертильными, большему среднему числу пометов, производимых в течение жизни F0 XY самками или фертильными F0 XY самками, и большему среднему размеру пометов, производимых F0 XY самками или фертильными F0 XY самками. Такое F0 потомство может быть получено из донорских XY плюрипотентных или тотипотентных клеток животного после внесения клеток в эмбрион-хозяин и вынашивания эмбриона-хозяина с помощью способов, описанных в другом месте данного документа.
[00258] Повышение может представлять собой любое статистически значимое повышение по сравнению с соответствующим контролем. Например, повышение может составлять по меньшей мере 1,1 раза, 1,2 раза, 1,3 раза, 1,4 раза, 1,5 раза, 1,6 раза, 1,7 раза, 1,8 раза, 1,9 раза, 2 раза, 2,5 раза, 3 раза, 3,5 раза, 4 раза, 4,5 раза или 5 раз по сравнению с соответствующим контролем.
[00259] Например, процентную долю F0 потомства или F0 XY потомства, которое представляет собой XY животных с женским фенотипом, можно повысить, используя описанные в данном документе комбинации. В некоторых способах процентная доля F0 потомства или F0 XY потомства, которое представляет собой XY животных с женским фенотипом, выше в случае F0 потомства, полученного из донорских XY плюрипотентных или тотипотентных клеток животных, модифицированных так, чтобы осуществить сайленсинг области Y-хромосомы, и дополнительно модифицированных так, чтобы снизить уровень и/или активность белка Sry, по сравнению с F0 потомством, полученным из XY плюрипотентных или тотипотентных клеток животных, не модифицированных так, чтобы снизить уровень и/или активность белка Sry. Аналогично, в некоторых способах процентная доля F0 потомства или F0 XY потомства, которое представляет собой XY животных с женским фенотипом, выше в случае F0 потомства, полученного из донорских XY плюрипотентных или тотипотентных клеток животных, модифицированных так, чтобы осуществить сайленсинг области Y-хромосомы, и дополнительно модифицированных так, чтобы снизить уровень и/или активность белка Sry, по сравнению с F0 потомством, полученным из XY плюрипотентных или тотипотентных клеток животных, не модифицированных так, чтобы осуществить сайленсинг области Y-хромосомы.
[00260] В некоторых способах процентная доля F0 потомства или F0 XY потомства, которое представляет собой XY животных с женским фенотипом, выше в случае F0 потомства, полученного из донорских XY плюрипотентных или тотипотентных клеток животных, модифицированных так, чтобы осуществить сайленсинг области Y-хромосомы, и культивируемых в феминизирующей среде, по сравнению с F0 потомством, полученным из XY плюрипотентных или тотипотентных клеток животных, которые культивируют в соответствующей контрольной среде (например, среде на основе DMEM). Аналогично, в некоторых способах процентная доля F0 потомства или F0 XY потомства, которое представляет собой XY животных с женским фенотипом, выше в случае F0 потомства, полученного из донорских XY плюрипотентных или тотипотентных клеток животных, модифицированных так, чтобы осуществить сайленсинг области Y-хромосомы, и культивируемых в феминизирующей среде, по сравнению с F0 потомством, полученным из XY плюрипотентных или тотипотентных клеток животных, не модифицированных так, чтобы осуществить сайленсинг области Y-хромосомы.
[00261] Процентную долю F0 потомства или F0 XY потомства, которое представляет собой фертильных XY животных с женским фенотипом, можно повысить, используя описанные в данном документе комбинации. В некоторых способах процентная доля F0 потомства или F0 XY потомства, которое представляет собой фертильных XY животных с женским фенотипом, выше в случае F0 потомства, полученного из донорских XY плюрипотентных или тотипотентных клеток животных, модифицированных так, чтобы осуществить сайленсинг области Y-хромосомы, и дополнительно модифицированных так, чтобы снизить уровень и/или активность белка Sry, по сравнению с F0 потомством, полученным из XY плюрипотентных или тотипотентных клеток животных, не модифицированных так, чтобы снизить уровень и/или активность белка Sry. Аналогично, в некоторых способах процентная доля F0 потомства или F0 XY потомства, которое представляет собой фертильных XY животных с женским фенотипом, выше в случае F0 потомства, полученного из донорских XY плюрипотентных или тотипотентных клеток животных, модифицированных так, чтобы осуществить сайленсинг области Y-хромосомы, и дополнительно модифицированных так, чтобы снизить уровень и/или активность белка Sry, по сравнению с F0 потомством, полученным из XY плюрипотентных или тотипотентных клеток животных, не модифицированных так, чтобы осуществить сайленсинг области Y-хромосомы.
[00262] В некоторых способах процентная доля F0 потомства или F0 XY потомства, которое представляет собой фертильных XY животных с женским фенотипом, выше в случае F0 потомства, полученного из донорских XY плюрипотентных или тотипотентных клеток животных, модифицированных так, чтобы осуществить сайленсинг области Y-хромосомы, и культивируемых в феминизирующей среде, по сравнению с F0 потомством, полученным из XY плюрипотентных или тотипотентных клеток животных, которые культивируют в соответствующей контрольной среде (например, среде на основе DMEM). Аналогично, в некоторых способах процентная доля F0 потомства или F0 XY потомства, которое представляет собой фертильных XY животных с женским фенотипом, выше в случае F0 потомства, полученного из донорских XY плюрипотентных или тотипотентных клеток животных, модифицированных так, чтобы осуществить сайленсинг области Y-хромосомы, и культивируемых в феминизирующей среде, по сравнению с F0 потомством, полученным из XY плюрипотентных или тотипотентных клеток животных, не модифицированных так, чтобы осуществить сайленсинг области Y-хромосомы.
[00263] Процентную долю F0 XY самок, являющихся фертильными, также можно повысить, используя описанные в данном документе комбинации. В некоторых способах процентная доля F0 XY самок, являющихся фертильными, выше в случае F0 XY потомства, полученного из донорских XY плюрипотентных или тотипотентных клеток животных, модифицированных так, чтобы осуществить сайленсинг области Y-хромосомы, и дополнительно модифицированных так, чтобы снизить уровень и/или активность белка Sry, по сравнению с F0 XY потомством, полученным из XY плюрипотентных или тотипотентных клеток животных, не модифицированных так, чтобы снизить уровень и/или активность белка Sry. Аналогично, в некоторых способах процентная доля F0 XY самок, являющихся фертильными, выше в случае F0 XY потомства, полученного из донорских XY плюрипотентных или тотипотентных клеток животных, модифицированных так, чтобы осуществить сайленсинг области Y-хромосомы, и дополнительно модифицированных так, чтобы снизить уровень и/или активность белка Sry, по сравнению с F0 XY потомством, полученным из XY плюрипотентных или тотипотентных клеток животных, не модифицированных так, чтобы осуществить сайленсинг области Y-хромосомы.
[00264] В некоторых способах процентная доля F0 XY самок, являющихся фертильными, выше в случае F0 XY потомства, полученного из донорских XY плюрипотентных или тотипотентных клеток животных, модифицированных так, чтобы осуществить сайленсинг области Y-хромосомы, и культивируемых в феминизирующей среде, по сравнению с F0 XY потомством, полученным из XY плюрипотентных или тотипотентных клеток животных, которые культивируют в соответствующей контрольной среде (например, среде на основе DMEM). Аналогично, в некоторых способах процентная доля F0 XY самок, являющихся фертильными, выше в случае F0 XY потомства, полученного из донорских XY плюрипотентных или тотипотентных клеток животных, модифицированных так, чтобы осуществить сайленсинг области Y-хромосомы, и культивируемых в феминизирующей среде, по сравнению с F0 XY потомством, полученным из XY плюрипотентных или тотипотентных клеток животных, не модифицированных так, чтобы осуществить сайленсинг области Y-хромосомы.
[00265] Процентную долю F0 XY самок, способных производить нормальное число пометов и/или пометы нормальных размеров (например, по сравнению с самками животных дикого типа), также можно повысить, используя описанные в данном документе комбинации. В некоторых способах процентная доля F0 XY самок, способных производить нормальное число пометов и/или пометы нормальных размеров, выше в случае F0 XY потомства, полученного из донорских XY плюрипотентных или тотипотентных клеток животных, модифицированных так, чтобы осуществить сайленсинг области Y-хромосомы, и дополнительно модифицированных так, чтобы снизить уровень и/или активность белка Sry, по сравнению с F0 XY потомством, полученным из XY плюрипотентных или тотипотентных клеток животных, не модифицированных так, чтобы снизить уровень и/или активность белка Sry. Аналогично, в некоторых способах процентная доля F0 XY самок, способных производить нормальное число пометов и/или пометы нормальных размеров, выше в случае F0 XY потомства, полученного из донорских XY плюрипотентных или тотипотентных клеток животных, модифицированных так, чтобы осуществить сайленсинг области Y-хромосомы, и дополнительно модифицированных так, чтобы снизить уровень и/или активность белка Sry, по сравнению с F0 XY потомством, полученным из XY плюрипотентных или тотипотентных клеток животных, не модифицированных так, чтобы осуществить сайленсинг области Y-хромосомы.
[00266] В некоторых способах процентная доля F0 XY самок, способных производить нормальное число пометов и/или пометы нормальных размеров, выше в случае F0 XY потомства, полученного из донорских XY плюрипотентных или тотипотентных клеток животных, модифицированных так, чтобы осуществить сайленсинг области Y-хромосомы, и культивируемых в феминизирующей среде, по сравнению с F0 XY потомством, полученным из XY плюрипотентных или тотипотентных клеток животных, которые культивируют в соответствующей контрольной среде (например, среде на основе DMEM). Аналогично, в некоторых способах процентная доля F0 XY самок, способных производить нормальное число пометов и/или пометы нормальных размеров, выше в случае F0 XY потомства, полученного из донорских XY плюрипотентных или тотипотентных клеток животных, модифицированных так, чтобы осуществить сайленсинг области Y-хромосомы, и культивируемых в феминизирующей среде, по сравнению с F0 XY потомством, полученным из XY плюрипотентных или тотипотентных клеток животных, не модифицированных так, чтобы осуществить сайленсинг области Y-хромосомы.
[00267] Средний размер помета, производимого фертильными F0 XY самками, также можно повысить, используя описанные в данном документе комбинации. В некоторых способах средний размер помета, производимого F0 XY самками или фертильными F0 XY самками, выше в случае F0 XY самок или фертильных F0 XY самок, полученных из донорских XY плюрипотентных или тотипотентных клеток животных, модифицированных так, чтобы осуществить сайленсинг области Y-хромосомы, и дополнительно модифицированных так, чтобы снизить уровень и/или активность белка Sry, по сравнению с F0 XY самками или фертильными F0 XY самками, полученными из XY плюрипотентных или тотипотентных клеток животных, не модифицированных так, чтобы снизить уровень и/или активность белка Sry. Аналогично, в некоторых способах средний размер помета, производимого F0 XY самками или фертильными F0 XY самками, выше в случае F0 XY самок или фертильных F0 XY самок, полученных из донорских XY плюрипотентных или тотипотентных клеток животных, модифицированных так, чтобы осуществить сайленсинг области Y-хромосомы, и дополнительно модифицированных так, чтобы снизить уровень и/или активность белка Sry, по сравнению с F0 XY самками или фертильными F0 XY самками, полученными из XY плюрипотентных или тотипотентных клеток животных, не модифицированных так, чтобы осуществить сайленсинг области Y-хромосомы.
[00268] В некоторых способах средний размер помета, производимого F0 XY самками или фертильными F0 XY самками, выше в случае F0 XY самок или фертильных F0 XY самок, полученных из донорских XY плюрипотентных или тотипотентных клеток животных, модифицированных так, чтобы осуществить сайленсинг области Y-хромосомы, и культивируемых в феминизирующей среде, по сравнению с F0 XY самками или фертильными F0 XY самками, полученными из XY плюрипотентных или тотипотентных клеток животных, которые культивируют в соответствующей контрольной среде (например, среде на основе DMEM). Аналогично, в некоторых способах средний размер помета, производимого F0 XY самками или фертильными F0 XY самками, выше в случае F0 XY самок или фертильных F0 XY самок, полученных из донорских XY плюрипотентных или тотипотентных клеток животных, модифицированных так, чтобы осуществить сайленсинг области Y-хромосомы, и культивируемых в феминизирующей среде, по сравнению с F0 XY самками или фертильными F0 XY самками, полученными из XY плюрипотентных или тотипотентных клеток животных, не модифицированных так, чтобы осуществить сайленсинг области Y-хромосомы.
[00269] Среднее число пометов, производимое на протяжении жизни F0 XY самками или фертильными F0 XY самками, также можно повысить, используя описанные в данном документе комбинации. В некоторых способах среднее число пометов, производимое на протяжении жизни F0 XY самками или фертильными F0 XY самками, выше в случае F0 XY самок или фертильных F0 XY самок, полученных из донорских XY плюрипотентных или тотипотентных клеток животных, модифицированных так, чтобы осуществить сайленсинг области Y-хромосомы, и дополнительно модифицированных так, чтобы снизить уровень и/или активность белка Sry, по сравнению с F0 XY самками или фертильными F0 XY самками, полученными из XY плюрипотентных или тотипотентных клеток животных, не модифицированных так, чтобы снизить уровень и/или активность белка Sry. Аналогично, в некоторых способах среднее число пометов, производимое на протяжении жизни F0 XY самками или фертильными F0 XY самками, выше в случае F0 XY самок или фертильных F0 XY самок, полученных из донорских XY плюрипотентных или тотипотентных клеток животных, модифицированных так, чтобы осуществить сайленсинг области Y-хромосомы, и дополнительно модифицированных так, чтобы снизить уровень и/или активность белка Sry, по сравнению с F0 XY самками или фертильными F0 XY самками, полученными из XY плюрипотентных или тотипотентных клеток животных, не модифицированных так, чтобы осуществить сайленсинг области Y-хромосомы.
[00270] В некоторых способах среднее число пометов, производимое на протяжении жизни F0 XY самками или фертильными F0 XY самками, выше в случае F0 XY самок или фертильных F0 XY самок, полученных из донорских XY плюрипотентных или тотипотентных клеток животных, модифицированных так, чтобы осуществить сайленсинг области Y-хромосомы, и культивируемых в феминизирующей среде, по сравнению с F0 XY самками или фертильными F0 XY самками, полученными из XY плюрипотентных или тотипотентных клеток животных, которые культивируют в соответствующей контрольной среде (например, среде на основе DMEM). Аналогично, в некоторых способах среднее число пометов, производимое на протяжении жизни F0 XY самками или фертильными F0 XY самками, выше в случае F0 XY самок или фертильных F0 XY самок, полученных из донорских XY плюрипотентных или тотипотентных клеток животных, модифицированных так, чтобы осуществить сайленсинг области Y-хромосомы, и культивируемых в феминизирующей среде, по сравнению с F0 XY самками или фертильными F0 XY самками, полученными из XY плюрипотентных или тотипотентных клеток животных, не модифицированных так, чтобы осуществить сайленсинг области Y-хромосомы.
[00271] Среднее число потомков, производимое на протяжении жизни F0 XY самками или фертильными F0 XY самками, также можно повысить, используя описанные в данном документе комбинации. В некоторых способах среднее число потомков, производимое на протяжении жизни F0 XY самками или фертильными F0 XY самками, выше в случае F0 XY самок или фертильных F0 XY самок, полученных из донорских XY плюрипотентных или тотипотентных клеток животных, модифицированных так, чтобы осуществить сайленсинг области Y-хромосомы, и дополнительно модифицированных так, чтобы снизить уровень и/или активность белка Sry, по сравнению с F0 XY самками или фертильными F0 XY самками, полученными из XY плюрипотентных или тотипотентных клеток животных, не модифицированных так, чтобы снизить уровень и/или активность белка Sry. Аналогично, в некоторых способах среднее число потомков, производимое на протяжении жизни F0 XY самками или фертильными F0 XY самками, выше в случае F0 XY самок или фертильных F0 XY самок, полученных из донорских XY плюрипотентных или тотипотентных клеток животных, модифицированных так, чтобы осуществить сайленсинг области Y-хромосомы, и дополнительно модифицированных так, чтобы снизить уровень и/или активность белка Sry, по сравнению с F0 XY самками или фертильными F0 XY самками, полученными из XY плюрипотентных или тотипотентных клеток животных, не модифицированных так, чтобы осуществить сайленсинг области Y-хромосомы.
[00272] В некоторых способах среднее число потомков, производимое на протяжении жизни F0 XY самками или фертильными F0 XY самками, выше в случае F0 XY самок или фертильных F0 XY самок, полученных из донорских XY плюрипотентных или тотипотентных клеток животных, модифицированных так, чтобы осуществить сайленсинг области Y-хромосомы, и культивируемых в феминизирующей среде, по сравнению с F0 XY самками или фертильными F0 XY самками, полученными из XY плюрипотентных или тотипотентных клеток животных, которые культивируют в соответствующей контрольной среде (например, среде на основе DMEM). Аналогично, в некоторых способах среднее число потомков, производимое на протяжении жизни F0 XY самками или фертильными F0 XY самками, выше в случае F0 XY самок или фертильных F0 XY самок, полученных из донорских XY плюрипотентных или тотипотентных клеток животных, модифицированных так, чтобы осуществить сайленсинг области Y-хромосомы, и культивируемых в феминизирующей среде, по сравнению с F0 XY самками или фертильными F0 XY самками, полученными из XY плюрипотентных или тотипотентных клеток животных, не модифицированных так, чтобы осуществить сайленсинг области Y-хромосомы.
В. In Vitro клеточные культуры и способы культивирования и поддержания плюрипотентных или тотипотентных клеток в культуре
[00273] Дополнительно предложены in vitro клеточные культуры, содержащие донорскую XY плюрипотентную или тотипотентную клетку, модифицированную так, чтобы осуществлять сайленсинг области Y-хромосомы. Также предложены in vitro клеточные культуры, содержащие донорскую XY плюрипотентную или тотипотентную клетку, культивируемую в феминизирующей среде, описанной в другом месте данного документа. Также предложены способы и композиции для поддержания или культивирования таких клеток. Клетки могут дополнительно содержать модификацию, которая снижает уровень и/или активность белка Sry. Аналогично, XY плюрипотентные или тотипотентные клетки могут дополнительно содержать по меньшей мере одну дополнительную направленную генетическую модификацию в целевом геномном локусе.
[00274] Предложен способ поддержания или культивирования XY плюрипотентной или тотипотентной клетки в in vitro культуре, причем клетку поддерживают в in vitro культуре в присутствии феминизирующей среды, описанной в данном документе. Аналогично, предложен способ поддержания или культивирования XY плюрипотентной или тотипотентной клетки в in vitro культуре, причем клетка содержит модификацию, которая приводит к сайленсингу области Y-хромосомы, и клетку поддерживают в in vitro культуре в условиях, описанных в данном документе. Такие способы поддержания или культивирования XY плюрипотентной или тотипотентной клетки в in vitro культуре направлены на стимуляцию повышения числа XY F0 фертильных самок животных после внесения XY ЭС клеток отличного от человека животного в эмбрион-хозяин и после вынашивания эмбриона-хозяина.
[00275] Хотя для таких способов поддержания или культивирования можно применять любую описанную в данном документе среду, один неограничивающий пример включает культивирование в среде, содержащей основную среду и добавки, подходящие для поддержания или культивирования XY плюрипотентной или тотипотентной клетки в культуре. Например, среда может содержать феминизирующую среду, описанную в другом месте данного документа (например, среду с низкой осмоляльностью, в которой основная среда или среда, содержащая основную среду и добавки, демонстрирует осмоляльность от около 200 мОсм/кг до менее чем 329 мОсм/кг).
[00276] Период времени, в течение которого XY плюрипотентную или тотипотентную клетку поддерживают в феминизирующей среде, может варьироваться. Например, XY плюрипотентную или тотипотентную клетку можно поддерживать в среде в течение периода, составляющего около или по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 или 13 суток, или 2 недели, 3 недели или 4 недели, перед внесением в эмбрион-хозяин (например, поддерживать в среде в течение около или по меньшей мере 3 суток, около или по меньшей мере 1 недели или около или по меньшей мере 2-4 недель перед внесением в эмбрион-хозяин). Аналогично, XY плюрипотентную или тотипотентную клетку можно поддерживать в среде в течение периода, составляющего не более чем 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 или 13 суток, или 2 недель, 3 недель или 4 недель, перед внесением в эмбрион-хозяин. В альтернативном варианте XY плюрипотентную или тотипотентную клетку можно поддерживать (например, в замороженном виде) в феминизирующей среде (например, которая стимулирует получение XY фертильных F0 самок), а затем размораживать и поддерживать в феминизирующей среде (например, которая стимулирует получение XY фертильных F0 самок) в течение по меньшей мере 1, 2, 3, 4 или более суток перед внесением XY плюрипотентной или тотипотентной клетки в эмбрион-хозяин. Аналогично, XY плюрипотентную или тотипотентную клетку можно поддерживать (например, в замороженном виде) в феминизирующей среде (например, которая стимулирует получение XY фертильных F0 самок), а затем размораживать и поддерживать в феминизирующей среде (например, которая стимулирует получение XY фертильных F0 самок) в течение не более 1, 2, 3, 4 или более суток перед внесением XY плюрипотентной или тотипотентной клетки в эмбрион-хозяин. Например, XY плюрипотентную или тотипотентную клетку можно по меньшей мере один раз пассировать в феминизирующей среде, после чего клетку замораживают в феминизирующей среде, а после этого клетку размораживают в феминизирующей среде и выращивают в течение около или по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 или 13 суток, или 2 недель, 3 недель или 4 недель, перед внесением в эмбрион-хозяин. В альтернативном варианте XY плюрипотентную или тотипотентную клетку можно по меньшей мере один раз пассировать в феминизирующей среде, после чего клетку замораживают в феминизирующей среде, а после этого клетку размораживают в феминизирующей среде и выращивают в течение не более чем 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 или 13 суток, или 2 недель, 3 недель или 4 недель, перед внесением в эмбрион-хозяин.
[00277] В некоторых способах XY плюрипотентную или тотипотентную клетку культивируют или поддерживают в феминизирующей среде до проведения инъекции клетки в эмбрион. В других способах эмбрион, в который инъецировали XY плюрипотентную или тотипотентную клетку, культивируют или поддерживают в феминизирующей среде до переноса в организм суррогатной матери.
С. Эмбрионы, способные давать фертильных XY самок в поколении F0
[00278] Дополнительно предложен эмбрион F0, содержащий внутреннюю клеточную массу, содержащую по меньшей мере одну гетерологичную донорскую XY плюрипотентную или тотипотентную клетку, модифицированную так, чтобы осуществить сайленсинг области Y-хромосомы. Аналогично, дополнительно предложен эмбрион F0, содержащий внутреннюю клеточную массу, содержащую по меньшей мере одну гетерологичную донорскую XY плюрипотентную или тотипотентную клетку, которую культивировали или поддерживали в феминизирующей среде, описанной в другом месте данного документа. Гетерологичную донорскую XY плюрипотентную или тотипотентную клетку можно получать описанными в данном документе способами. Гетерологичная донорская XY плюрипотентная или тотипотентная клетка может дополнительно содержать модификацию, которая снижает уровень и/или активность белка Sry. Аналогично, гетерологичная донорская XY плюрипотентная или тотипотентная клетка может дополнительно содержать по меньшей мере одну дополнительную направленную генетическую модификацию в целевом геномном локусе.
[00279] Такие эмбрионы можно получать путем внесения донорской XY плюрипотентной или тотипотентной клетки животного в эмбрион-хозяин. Например, эмбрион может представлять собой эмбрион на стадии пре-морулы и эмбрион можно культивировать до стадии бластоцисты после внесения донорской XY плюрипотентной или тотипотентной клетки. В способах, в которых донорскую XY плюрипотентную или тотипотентную клетку животного культивируют в феминизирующей среде (например, среде с низкой осмоляльностью), XY плюрипотентную или тотипотентную клетку животного можно поддерживать в феминизирующей среде в течение любого периода времени перед внесением в эмбрион-хозяин. Например, XY плюрипотентную или тотипотентную клетку животного можно поддерживать в феминизирующей среде в течение по меньшей мере 1 суток, 2 суток, 3 суток, 4 суток, 5 суток, 6 суток, 7 суток, 8 суток, 9 суток, 10 суток, 11 суток, 12 суток, 13 суток, 2 недель, 3 недель или 4 недель перед внесением в эмбрион-хозяин. В альтернативном варианте XY плюрипотентную или тотипотентную клетку животного можно поддерживать в феминизирующей среде в течение не более чем 1 суток, 2 суток, 3 суток, 4 суток, 5 суток, 6 суток, 7 суток, 8 суток, 9 суток, 10 суток, 11 суток, 12 суток, 13 суток, 2 недель, 3 недель или 4 недель перед внесением в эмбрион-хозяин.
[00280] В некоторых F0 эмбрионах гетерологичная донорская XY плюрипотентная или тотипотентная клетка и/или эмбрион-хозяин не получены из одного или более из следующих видов: Akodon spp., Myopus spp., Microtus spp., Talpa spp. Аналогично, в некоторых способах гетерологичная донорская XY плюрипотентная или тотипотентная клетка и/или эмбрион-хозяин не получены из любого из видов, для которых нормальной характеристикой дикого типа является фертильность XY самок. В некоторых способах, в которых гетерологичная донорская XY плюрипотентная или тотипотентная клетка и/или эмбрион-хозяин содержит дополнительную генетическую модификацию, генетическая модификация не представляет собой XYY или XXY, Tdy-отрицательное (т.е. Sry-отрицательное) изменение пола, Tdy-положительное изменение пола, модификацию Х0, анеуплоидию, генотип Fgf9-/- или модификацию Sox9.
D. Способы создания F0 фертильных XY самок и F1 потомства
[00281] Различные способы и композиции, в которых используются XY плюрипотентные или тотипотентные клетки, имеющие модификацию, включающую сайленсинг области Y-хромосомы, можно применять для создания фертильных F0 XY самок животных, которые, необязательно, содержат дополнительную направленную генетическую модификацию в целевом геномном локусе. Аналогично, различные способы и композиции, в которых используются XY плюрипотентные или тотипотентные клетки, культивируемые или поддерживаемые в феминизирующей среде, описанной в другом месте данного документа, можно применять для создания фертильных F0 XY самок животных, которые, необязательно, содержат дополнительную направленную генетическую модификацию в целевом геномном локусе. Например, F0 XY самка животного, полученная описанными в данном документе способами, может быть фертильной при скрещивании с животным дикого типа для создания поколения F1.
i. Способы получения фертильных XY самок животных в поколении F0
[00282] Предложены способы и композиции для создания фертильного XY животного женского пола в поколении F0. Также предложены получаемые в результате фертильные XY животные с женским фенотипом, полученные такими способами. Способы создания фертильного XY животного с женским фенотипом в поколении F0 могут включать (а) внесение любой из модифицированных донорских XY плюрипотентных или тотипотентных клеток, описанных в другом месте данного документа (т.е. донорских XY плюрипотентных или тотипотентных клеток, которые способны давать фертильных XY самок в поколении F0), в эмбрион-хозяин; (b) внесение эмбриона-хозяина по этапу (а) в организм реципиентной самки животного и вынашивание эмбриона-хозяина; и (с) получение F0 XY потомства животного, содержащего XY животное с женским фенотипом, причем после достижения половой зрелости F0 XY животное с женским фенотипом является фертильным. Другие способы создания фертильного XY животного с женским фенотипом в поколении F0 могут включать (а) внесение любого из модифицированных эмбрионов, описанных в другом месте данного документа, в организм реципиентной самки животного и вынашивание эмбриона; и (b) получение F0 XY потомства животного, содержащего XY животное с женским фенотипом, причем после достижения половой зрелости F0 XY животное с женским фенотипом является фертильным.
[00283] Клетки, которые были имплантированы в эмбрион, могут называться «донорскими клетками», а эмбрионы, которые получили эти клетки, могут называться «эмбрионами-хозяевами». В некоторых способах донорская XY плюрипотентная или тотипотентная клетка может содержать по меньшей мере одну дополнительную направленную генетическую модификацию в целевом геномном локусе. Например, применяемая XY плюрипотентная или тотипотентная клетка может содержать (1) модификацию, приводящую к сайленсингу области Y-хромосомы, и (2) одну или более дополнительных направленных генетических модификаций в одном или более целевых геномных локусах. Такие модификации подробно описаны в другом месте данного документа. Как отмечено в другом месте данного документа, в XY плюрипотентной или тотипотентной клетке может быть проведено по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 дополнительных направленных генетических модификаций. В таких случаях F0 фертильная XY самка животного может содержать одну или более из этих дополнительных направленных генетических модификаций. Животных, несущих генетически модифицированный геномный локус, можно идентифицировать с помощью анализа модификации аллеля (МА), как описано в данном документе.
[00284] Донорская XY плюрипотентная или тотипотентная клетка может происходить из той же линии, что и эмбрион-хозяин, или из линии, отличной от линии эмбриона-хозяина. Аналогично, суррогатная мать может происходить из той же линии, что и донорская XY плюрипотентная или тотипотентная клетка и/или эмбрион-хозяин, или суррогатная мать может происходить из линии, отличной от линии донорской XY плюрипотентной или тотипотентной клетки и/или эмбриона-хозяина.
[00285] Генотип XY плюрипотентной или тотипотентной клетки может быть таким же, что и генотип эмбриона-хозяина, или другим. Например, XY донорскую клетку можно имплантировать в XX эмбриона-хозяина.
[00286] Можно использовать множество эмбрионов-хозяев. XY донорские клетки можно имплантировать, например, в эмбрион-хозяин на 2-клеточной стадии, 4-клеточной стадии, 8-клеточной стадии, 16-клеточной стадии, 32-клеточной стадии или 64-клеточной стадии. Например, XY плюрипотентные или тотипотентные клетки можно вносить в эмбрион на стадии пре-морулы (например, эмбрион на 8-клеточной стадии) из соответствующего организма. Смотрите, например, US 7576259; US 7659442; US 7294754; и US 2008-0078000 A1, которые все в полном объеме включены в данный документ посредством ссылки. Аналогично, эмбрион-хозяин может представлять собой бластоцисту, эмбрион на стадии пре-бластоцисты, на стадии пре-морулы, на стадии морулы, на стадии некомпактной морулы или на стадии компактной морулы. В альтернативном варианте эмбрион-хозяин может представлять собой агрегированный эмбрион-хозяин на стадии морулы. В случае мышей стадия эмбриона-хозяина может представлять собой, например, эмбрион, соответствующий стадии по Тейлеру 1 (TS1), TS2, TS3, TS4, TS5 или TS6 (например, выбранной из TS1, TS2, TS3 и TS4), со ссылкой на стадии по Тейлеру, описанные в Theiler (1989) "The House Mouse: Atlas of Mouse Development," Springer-Verlag, New York. В способах, в которых эмбрион-хозяин содержит блестящую оболочку, донорскую клетку (например, XY ЭС клетку) можно вносить в эмбрион-хозяин через отверстие в блестящей оболочке. Также можно использовать эмбрионы без оболочки.
[00287] В некоторых способах донорская плюрипотентная или тотипотентная клетка и/или эмбрион-хозяин не получены из одного или более из следующих видов: Akodon spp., Myopus spp., Microtus spp., Talpa spp. Аналогично, в некоторых способах донорская клетка и/или эмбрион-хозяин не получены из любого из видов, для которых нормальной характеристикой дикого типа является фертильность XY самок. В некоторых способах, в которых донорская клетка и/или эмбрион-хозяин содержит дополнительную генетическую модификацию, генетическая модификация не представляет собой XYY или XXY, Tdy-отрицательное (т.е. Sry-отрицательное) изменение пола, Tdy-положительное изменение пола, модификацию Х0, анеуплоидию, генотип Fgf9-/- или модификацию Sox9.
[00288] Для создания животных также можно применять методы ядерного переноса. Вкратце, методы ядерного переноса могут включать этапы: (1) удаления ядра ооцита; (2) выделение донорской клетки или ядра для объединения с ооцитом с удаленным ядром; (3) внесение клетки или ядра в ооцит с удаленным ядром для образования восстановленной клетки; (4) имплантацию восстановленной клетки в матку животного для образования эмбриона; и (5) создание возможности для развития эмбриона. В таких способах ооциты в общем случае получают от мертвых животных, хотя они могут быть выделены также из маточных труб и/или яичников живых животных. Перед удалением ядра созревание ооцитов может быть обеспечено в различных средах, известных специалистам в данной области техники. Удаление ядра ооцита можно проводить большим количеством способов, хорошо известных специалистам в данной области техники. Внесение донорской клетки или ядра в ооцит с удаленным ядром для образования восстановленной клетки обычно проводят путем микроинъекции донорской клетки под блестящую оболочку перед слиянием. Слияние можно индуцировать применением электрических импульсов постоянного тока через плоскость контакта/слияния (электрослияние), путем воздействия на клетки стимулирующих слияние химических веществ, таких как полиэтиленгликоль, или посредством инактивированного вируса, такого как вирус Сендай. Восстановленную клетку, как правило, активируют электрическими и/или неэлектрическими средствами до, во время и/или после слияния донорского ядра и реципиентного ооцита. Способы активации включают электрические импульсы, химически индуцированный шок, проникновение спермия, повышение уровней двухвалентных катионов в ооците и снижение фосфорилирования клеточных белков (например, посредством ингибиторов киназ) в ооците. Активированные восстановленные клетки или эмбрионы, как правило, культивируют в среде, хорошо известной специалистам в данной области техники, а затем переносят в матку животного. Смотрите, например, US 2008/0092249; WO 1999/005266 А2; US 2004/0177390; WO 2008/017234 A1; и патент США №7612250, которые все в полном объеме включены в данный документ посредством ссылки во всех смыслах.
[00289] Эмбрион-хозяин, содержащий донорскую XY плюрипотентную или тотипотентную клетку, можно инкубировать до стадии бластоцисты, а затем имплантировать суррогатной матери для получения F0 животного. Затем суррогатная мать может вынашивать эмбрион-хозяин.
[00290] В некоторых способах эмбрион-хозяин, содержащий донорские XY плюрипотентные или тотипотентные клетки, можно поддерживать в феминизирующей среде (например, среде с низкой осмоляльностью или основной среде с низким содержанием солей), которая стимулирует развитие XY фертильных женских ЭС клеток, в течение одних, двух, трех или четырех или более суток перед имплантацией в подходящего хозяина. В альтернативном варианте эмбрион-хозяин, содержащий донорские XY плюрипотентные или тотипотентные клетки, можно поддерживать в феминизирующей среде (например, среде с низкой осмоляльностью или основной среде с низким содержанием солей), которая стимулирует развитие XY фертильных женских ЭС клеток, в течение по меньшей мере одних, двух, трех или четырех или более суток или не более чем одних, двух, трех или четырех или более суток перед имплантацией в подходящего хозяина. Такие предложенные способы могут стимулировать создание F0 фертильной самки животного.
[00291] В некоторых способах после внесения донорских XY плюрипотентных или тотипотентных клеток отличного от человека животного (например, XY ЭС клетки или XY иПС клетки) в эмбрион-хозяин и вынашивания эмбриона-хозяина по меньшей мере 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 75%, 80% 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или все F0 потомство или F0 XY потомство представляет собой XY животных с женским фенотипом.
[00292] Фертильность и плодовитость F0 XY самок животных, полученных этими способами, может быть сравнима с XX самками животных дикого типа. В некоторых способах после внесения донорских XY плюрипотентных или тотипотентных клеток отличного от человека животного (например, XY ЭС клетки или XY иПС клетки) в эмбрион-хозяин и вынашивания эмбриона-хозяина по меньшей мере 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 75%, 80% 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или все F0 потомство представляет собой XY животных с женским фенотипом, являющихся фертильными после достижения половой зрелости.
[00293] В некоторых способах по меньшей мере 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или все F0 XY потомство представляет собой XY животных с женским фенотипом, являющихся фертильными после достижения половой зрелости.
[00294] В некоторых способах по меньшей мере 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или все F0 самки, полученные из донорской XY плюрипотентной или тотипотентной клетки, имеют генотип XY.
[00295] В некоторых способах по меньшей мере 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или все F0 самки, полученные из донорской XY плюрипотентной или тотипотентной клетки, являются фертильными.
[00296] В некоторых способах по меньшей мере 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или все F0 самки, полученные из донорской XY плюрипотентной или тотипотентной клетки, способны производить такое число пометов и/или такое число детенышей на помет, и/или такое число потомков на протяжении жизни, которое сравнимо с XX самками мышей дикого типа. В некоторых способах F0 фертильная XY самка отличного от человека животного может производить 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 пометов в течение жизни (например, 2-6 пометов). В некоторых способах по меньшей мере 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или все F0 самки, полученные из донорской XY плюрипотентной или тотипотентной клетки, способны производить 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 пометов в течение жизни (например, 2-6 пометов). В некоторых способах F0 фертильная XY самка отличного от человека животного может производить по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 потомков (т.е. детенышей) на помет (например, 4-6 потомков на помет). В некоторых способах по меньшей мере 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или все F0 самки, полученные из донорской XY плюрипотентной или тотипотентной клетки, способны производить пометы, содержащие по меньшей мере по 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 потомков (т.е. детенышей) на помет (например, 4-6 потомков на помет). Например, F0 фертильная XY самка отличного от человека животного может производить 2-6 пометов, причем каждый помет содержит по меньшей мере 2, 3, 4, 5 или 6 потомков. В некоторых способах по меньшей мере около 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 60%, 70%, 80%, 85%, 90%, 95% или 100% потомков представляют собой XY фертильных потомков женского пола (например, 15%-25% потомков представляют собой XY фертильных потомков женского пола).
[00297] В других вариантах реализации изобретения потомство F0, полученное такими способами, на около 3%, около 10% или более или около 63% или более получено из донорской XY плюрипотентной или тотипотентной клетки.
[00298] Предложенные в данном документе способы и композиции обеспечивают возможность того, что по меньшей мере 1%, 3%, 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75% или более F0 животных имеют направленную генетическую модификацию (например, направленную генетическую модификацию, приводящую к сайленсингу области Y-хромосомы, и/или направленную генетическую модификацию в другом целевом геномном локусе) для передачи генетической модификации F1 потомству.
[00299] В некоторых способах одна или более XY самок отличного от человека животного поколения F0 (например, по меньшей мере 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или все XY самки отличного от человека животного поколения F0) по меньшей мере на 90%, 92%, 94%, 96%, 98%, 99% или 99,8% получены из донорской XY плюрипотентной или тотипотентной клетки. Например, одна или более F0 XY самок отличного от человека животного могут иметь цвет шерсти, который на 100% происходит от донорской XY плюрипотентной или тотипотентной клетки. Вклад клетки эмбриона-хозяина в XY самку отличного от человека животного в поколении F0 можно определить, например, с помощью количественного анализа, который может выявлять 1 клетку из 2000 (0,05%), и ни один тип ткани XY самки отличного от человека животного не является положительным в отношении вклада эмбриона-хозяина.
ii. Способы скрещивания фертильных XY самок поколения F0
[00300] В некоторых способах получаемое в результате поколение F0 фертильных XY самок, полученное из XY плюрипотентных или тотипотентных клеток (например, XY ЭС клеток или XY иПС клеток), имеющих генетическую модификацию, приводящую к сайленсингу области Y-хромосомы, скрещивают с животным для получения потомства поколения F1. XY самка отличного от человека животного поколения F0 может быть по меньшей мере на 20%, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 90%, по меньшей мере на 92%, по меньшей мере на 94%, по меньшей мере на 96%, по меньшей мере на 98%, по меньшей мере на 99%, по меньшей мере на 99,5% или полностью получена из донорской XY плюрипотентной или тотипотентной клетки (например, XY ЭС клетки).
[00301] Аналогично, получаемое в результате поколение F0 фертильных XY самок, полученное из XY плюрипотентных или тотипотентных клеток, созданных любым другим описанным в данном документе способом (например, посредством применения среды с низкой осмоляльностью или другой феминизирующей среды, описанной в другом месте данного документа), можно скрещивать с животным для получения потомства поколения F1. XY самка отличного от человека животного поколения F0 может быть по меньшей мере на 20%, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 90%, по меньшей мере на 92%, по меньшей мере на 94%, по меньшей мере на 96%, по меньшей мере на 98%, по меньшей мере на 99%, по меньшей мере на 99,5% или полностью получена из донорской XY плюрипотентной или тотипотентной клетки (например, XY ЭС клетки). Потомство (например, F1 потомство и/или любые или все другие поколения потомства) может быть таким, что по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95% или все XY потомство имеет нормальный мужской фенотип или имеет нормальный мужской фенотип и является фертильным. В некоторых случаях менее чем 20%, менее чем 15%, менее чем 10%, менее чем 5%, менее чем 1% или ни один представитель XY потомства (например, F1 потомства и/или любых или всех других поколений потомства) не имеет женский фенотип. В некоторых случаях все XY потомство (например, F1 потомство и/или любые или все другие поколения потомства) имеет нормальный мужской фенотип или имеет нормальный мужской фенотип и является фертильным. В некоторых случаях по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95% или все потомство имеет ожидаемый половой фенотип (т.е. мужской или женский) с учетом генотипа (т.е. XY или XX).
[00302] Отличное от человека животное, с которым можно скрещивать XY самку отличного от человека животного поколения F0 может представлять собой XY самца отличного от человека животного, который также по меньшей мере на 20%, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 90%, по меньшей мере на 92%, по меньшей мере на 94%, по меньшей мере на 96%, по меньшей мере на 98%, по меньшей мере на 99%, по меньшей мере на 99,5% или полностью получен из донорской XY плюрипотентной или тотипотентной клетки (например, XY ЭС клетки). Например, F0 XY самка отличного от человека животного и/или XY самец отличного от человека животного могут иметь цвет шерсти, который на 100% происходит от донорской XY плюрипотентной или тотипотентной клетки. Каждое животное из пары для скрещивания, используемой для получения потомков поколения F1, может быть полностью получено из донорской XY плюрипотентной или тотипотентной клетки (например, ЭС клетки или иПС клетки) в одном поколении F0. Например, F0 XY может быть клональным сиблингом из группы, полученной из того же самого клона плюрипотентной или тотипотентной XY клетки (например, XY ЭС клетки), что и F0 XY фертильная самка. Потомство поколения F1 может содержать геном, полностью полученный из донорской ЭС клетки. В некоторых случаях частота скрещивания самцов мышей поколения F0 и самок мышей поколения F0, которые дают полностью полученных из ЭС клетки мышей, составляет 100%.
[00303] Можно проводить генотипирование потомства F1, используя специфические праймеры и/или зонды, чтобы определить наличие направленной генетической модификации, включающей сайленсинг области Y-хромосомы. Если в поколении F0 присутствовали дополнительные направленные генетические модификации (например, модификация, которая снижает уровень и/или активность белка Sry, или одна или более дополнительных направленных генетических модификаций в целевом геномном локусе), можно проводить генотипирование потомства F1, используя специфические праймеры и/или зонды, чтобы определить наличие таких модификаций. Затем можно идентифицировать соответствующее необходимому применению потомство F1. Например, можно выбрать потомство F1, в котором отсутствует генетическая модификация, включающая сайленсинг области Y-хромосомы, или можно выбрать потомство F1, в котором отсутствует генетическая модификация, включающая сайленсинг области Y-хромосомы, но присутствует по меньшей мере одна дополнительная направленная генетическая модификация в целевом геномном локусе. После генотипирования специфическими праймерами и/или зондами, F1 животных, гетерозиготных в отношении дополнительной направленной генетической модификации в целевом геномном локусе, и с отсутствием генетической модификации, включающей сайленсинг области Y-хромосомы, можно скрещивать друг с другом. Такое скрещивание приводит к получению потомства F2, гомозиготного в отношении представляющего интерес генетически модифицированного геномного локуса, и не содержащего генетическую модификацию, приводящую к сайленсингу области Y-хромосомы.
[00304] Дополнительно предложены способы получения трансгенного отличного от человека млекопитающего, гомозиготного в отношении направленной генетической модификации в целевом геномном локусе в поколении F1. Указанный способ включает (а) скрещивание F0 XY фертильной самки отличного от человека животного, имеющей модификацию, включающую сайленсинг области Y-хромосомы, с F0 XY самцом отличного от человека животного, причем F0 XY фертильная самка отличного от человека животного и F0 XY самец отличного от человека животного являются гетерозиготными в отношении направленной генетической модификации в целевом геномном локусе, и (b) получение потомства F1, гомозиготного в отношении направленной генетической модификации в целевом геномном локусе. В некоторых способах F0 XY самец является клональным сиблингом из группы, полученной из того же самого клона плюрипотентной или тотипотентной клетки, что и F0 XY фертильная самка. Например, можно выбрать потомство F1, которое является гомозиготным в отношении направленной генетической модификации в целевом геномном локусе, но у которого отсутствует модификация, приводящая к сайленсингу области Y-хромосомы. Если F0 XY фертильная самка дополнительно содержит модификацию, которая снижает уровень и/или активность белка Sry, можно выбрать потомство F1, которое является гомозиготным в отношении направленной генетической модификации в целевом геномном локусе, но у которого отсутствует как модификация, приводящая к сайленсингу области Y-хромосомы, так и модификация, которая снижает уровень и/или активность белка Sry.
Е. Способы создания направленных генетических модификаций
[00305] Можно использовать различные способы и композиции для создания направленных генетических модификаций (например, которые приводят к сайленсингу области Y-хромосомы, которые снижают уровень и/или активность белка Sry или которые модифицируют любой дополнительный целевой геномный локус, как описано в другом месте данного документа). Одним средством создания направленной генетической модификации является рекомбинация, которая включает любой процесс обмена генетической информацией между двумя полинуклеотидами. Рекомбинация в ответ на двухцепочечные разрывы (ДЦР) происходит, главным образом, посредством двух консервативных путей репарации ДНК: негомологичного соединения концов (НГСК) и гомологичной рекомбинации (ГР). Смотрите Kasparek & Humphrey (2011) Seminars in Cell & Dev. Biol. 22:886-897, в полном объеме включенную в данный документ посредством ссылки во всех смыслах. НГСК включает репарацию двухцепочечных разрывов в нуклеиновой кислоте путем прямого лигирования концов разрыва друг с другом без необходимости в гомологичной матрице. Лигирование несмежных последовательностей посредством НГСК часто может приводить к делециям, вставкам или транслокациям вблизи участка двухцепочечного разрыва. Такие системы применяются, например, при создании генетических модификаций, связанных с направленной потерей функций.
[00306] Рекомбинация также может происходить посредством направляемой гомологией репарации (НГР) или гомологичной рекомбинации (ГР). НГР или ГР включает форму репарации нуклеиновых кислот, для которой может требоваться гомология нуклеотидных последовательностей, в которой используется «донорская» молекула для матричной репарации молекулы-«мишени» (т.е. молекулы, имеющей двухцепочечный разрыв) и которая приводит к переносу генетической информации от донора к мишени. Не ограничиваясь какой-либо конкретной теорией, такой перенос может включать ошибочную коррекцию гетеродуплекса ДНК, который образуется между мишенью с разрывом и донором, и/или зависимую от синтеза гибридизацию цепей, в которой донор используется для повторного синтеза генетической информации, которая станет частью мишени, и/или сходные процессы. В некоторых случаях донорский полинуклеотид, часть донорского полинуклеотида, копия донорского полинуклеотида или часть копии донорского полинуклеотида интегрируется в ДНК-мишень. Неограничивающие способы создания такой направленной генетической модификации подробно обсуждаются в другом месте данного документа, включая, например, применение нацеливающих плазмид, небольших нацеливающих векторов (smallTVEC) или больших нацеливающих векторов. Также смотрите Wang et al. (2013) Cell 153:910-918; Mandalos et al. (2012) PLOS ONE 7:e45768:1-9; и Wang et al. (2013) Nat Biotechnol. 31:530-532, которые все в полном объеме включены в данный документ посредством ссылки во всех смыслах.
[00307] Способы создания направленных генетических модификаций могут включать, например, применение нацеливающего вектора (например, smallTVEC или LTVEC), одного или в комбинации с одной или более нуклеазами, как описано в другом месте данного документа. Смотрите, например, US 2015/0159175, US 2015/0159174, US 2014/0310828, US 2014/0309487 и US 2013-0309670, которые все в полном объеме включены в данный документ посредством ссылки во всех смыслах. Аналогично, способы создания направленных генетических модификаций могут включать применение одной или более нуклеаз, одних или в комбинации с нацеливающим вектором.
[00308] Например, предложены способы модификации целевого геномного локуса (например, в Y-хромосоме) в клетке, включающие: (а) внесение в клетку одного или более нуклеазных агентов, которые индуцируют один или более ников или двухцепочечных разрывов в участке распознавания в целевом геномном локусе или вблизи него; и (b) определение по меньшей мере одной клетки, содержащей в геноме модификацию в целевом геномном локусе.
[00309] Другие способы модификации целевого геномного локуса в клетке включают: (a) внесение в клетку нацеливающего вектора, содержащего полинуклеотидную вставку, фланкируемую 5' и 3' плечами гомологии, соответствующими 5' и 3' целевым участкам; и (b) определение по меньшей мере одной клетки, содержащей в геноме полинуклеотидную вставку, интегрированную в целевой геномный локус.
[00310] Другие способы модификации целевого геномного локуса в клетке включают: (а) внесение в клетку: (i) нуклеазного агента, причем нуклеазный агент индуцирует ник или двухцепочечный разрыв в участке распознавания в пределах целевого геномного локуса; и (ii) нацеливающего вектора, содержащего вставку нуклеиновой кислоты, фланкируемую 5' и 3' плечами гомологии, соответствующими 5' и 3' целевым участкам, расположенным в достаточной близости к участку распознавания; и (с) определение по меньшей мере одной клетки, содержащей модификацию (например, интеграцию вставки нуклеиновой кислоты) в целевом геномном локусе.
[00311] Направленная генетическая модификация, которая приводит к сайленсингу области Y-хромосомы, и любая другая направленная генетическая модификация (например, модификация, которая снижает уровень и/или активность белка Sry, или направленная генетическая модификация в любом целевом геномном локусе) может возникать, когда XY плюрипотентную или тотипотентную клетку поддерживают в феминизирующей среде (например, среде с низкой осмоляльностью), описанной в другом месте данного документа (например, среде, которая стимулирует развитие XY F0 фертильных самок). В альтернативном варианте направленная генетическая модификация, которая приводит к сайленсингу области Y-хромосомы, и/или другая направленная генетическая модификация любого другого целевого геномного локуса может возникать, когда XY плюрипотентную или тотипотентную клетку поддерживают в другой культуральной среде. Необязательно, клетку можно впоследствии переносить в феминизирующую культуральную среду (например, среду с низкой осмоляльностью), описанную в другом месте данного документа (например, среду, которая стимулирует развитие XY F0 фертильный самок).
[00312] Направленная генетическая модификация, которая приводит к сайленсингу области Y-хромосомы, и любая другая направленная генетическая модификация (например, модификация, которая снижает уровень и/или активность белка Sry, или направленная генетическая модификация в любом целевом геномном локусе) могут быть внесены одновременно или последовательно.
i. Нуклеазные агенты
[00313] В описанных в данном документе способах и композициях можно использовать любой нуклеазный агент, который индуцирует ник или двухцепочечный разрыв в необходимом участке распознавания. Можно применять природный или нативный нуклеазный агент или можно применять модифицированный или сконструированный нуклеазный агент (например, нуклеазный агент, сконструированный (модифицированный или полученный) из своей нативной формы так, чтобы специфически распознавать и индуцировать ник или двухцепочечный разрыв в необходимом участке распознавания).
[00314] Одним из типов нуклеазных агентов является эффекторная нуклеаза, подобная активаторам транскрипции (TALEN). TAL эффекторные нуклеазы создают путем слияния нативного или сконструированного подобного активаторам транскрипции (TAL) эффектора или его функциональной части с каталитическим доменом эндонуклеазы, таким как, например, FokI. Смотрите WO 2010/079430; Morbitzer et al. (2010) PNAS 10.1073/pnas. 1013133107; Scholze & Boch (2010) Virulence 1:428-432; Christian et al. Genetics (2010) 186:757-761; Li et al. (2010) Nuc. Acids Res. (2010) doi:10.1093/nar/gkq704; и Miller et al. (2011) Nature Biotechnology 29:143-148, которые все в полном объеме включены в данный документ посредством ссылки во всех смыслах. Примеры подходящих TAL нуклеаз и способов получения подходящих TAL нуклеаз описаны, например, в US 2011/0239315 A1, US 2011/0269234 A1, US 2011/0145940 A1, US 2003/0232410 A1, US 2005/0208489 A1, US 2005/0026157 A1, US 2005/0064474 A1, US 2006/0188987 A1 и US 2006/0063231 A1, которые все в полном объеме включены в данный документ посредством ссылки во всех смыслах.
[00315] Другим типом нуклеазного агента является цинк-пальцевая нуклеаза (ZFN). В некоторых ZFN каждый мономер ZFN содержит 3 или более ДНК-связывающих доменов на основе цинковых пальцев, причем каждый ДНК-связывающий домен на основе цинковых пальцев связывается с 3 п.о. субсайтом. В других ZFN указанная ZFN представляет собой химерный белок, содержащий ДНК-связывающий домен на основе цинковых пальцев, функционально связанный с независимой нуклеазой, такой как эндонуклеаза FokI. Например, нуклеазный агент может содержать первую ZFN и вторую ZFN, причем каждая из первой ZFN и второй ZFN функционально связана с субъединицей нуклеазы FokI, при этом первая и вторая ZFN распознает две непрерывные последовательности ДНК в каждой цепи целевой последовательности ДНК, разделенные спейсером длиной около 5-7 п.о., и при этом субъединицы нуклеазы FokI димеризуются с образованием активной нуклеазы, которая создает двухцепочечный разрыв. Смотрите, например, US 20060246567; US 20080182332; US 20020081614; US 20030021776; WO/2002/057308 A2; US 20130123484; US 20100291048; WO/2011/017293 А2; и Gaj et al. (2013) Trends in Biotechnology, 31(7):397-405, которые все в полном объеме включены в данный документ посредством ссылки во всех смыслах.
[00316] Другим типом нуклеазного агента является мегануклеаза. Мегануклеазы были классифицированы как относящиеся к четырем семействам на основании мотивов с консервативными последовательностями, и этими семействами являются семейства LAGLIDADG, GIY-YIG, H-N-H и His-Cys бокса. Эти мотивы участвуют в координации ионов металлов и гидролизе фосфодиэфирных связей. Мегануклеазы примечательны своим длинным участкам распознавания и переносимостью некоторой степени полиморфизма последовательности в ДНК-субстратах. Известны домены, структура и функция мегануклеаз. Смотрите, например, Guhan and Muniyappa (2003) Crit Rev Biochem Mol Biol 38:199-248; Lucas et al., (2001) Nucleic Acids Res 29:960-9; Jurica and Stoddard, (1999) Cell Mol Life Sci 55:1304-26; Stoddard, (2006) Q Rev Biophys 38:49-95; и Moure et al, (2002) Nat Struct Biol 9:764.
[00317] Нуклеазные агенты могут дополнительно включать рестрикционные эндонуклеазы, которые включают эндонуклеазы типа I, типа II, типа III и типа IV.
Рестрикционные эндонуклеазы типа I и типа III распознают специфические участки распознавания, но, как правило, расщепление происходит в позиции, отличающейся от участка связывания нуклеазы, который может находиться в сотнях пар оснований от участка расщепления (участка распознавания). В системах типа II рестрикционная активность не зависит от какой-либо метилазной активности, а расщепление, как правило, происходит в конкретных участках в пределах или вблизи участка связывания. Большинство ферментов типа II разрезают палиндромные последовательности, однако ферменты типа IIa распознают не палиндромные участки распознавания, а расщепление происходит за пределами участка распознавания, ферменты типа IIb разрезают последовательности дважды, при этом оба участка находятся за пределами участка распознавания, а ферменты типа IIs распознают асимметричный участок распознавания, а расщепление происходит с одной стороны на определенном расстоянии, составляющем 1-20 нуклеотидов, от участка распознавания. Рестрикционные ферменты типа IV нацелены на метилированную ДНК. Рестрикционные ферменты дополнительно описаны и классифицированы, например, в базе данных REBASE (веб-страница на rebase.neb.com; Roberts et al., (2003) Nucleic Acids Res 31:418-20); Roberts et al., (2003) Nucleic Acids Res 31:1805-12; и Belfort et al., (2002) в Mobile DNA II, pp. 761-783, Eds. Craigie et al., (ASM Press, Washington, DC), которые все в полном объеме включены в данный документ посредством ссылки во всех смыслах.
[00318] Нуклеазные агенты могут дополнительно включать короткие палиндромные повторы, регулярно расположенные группами (CRISPR)/CRISPR-ассоциированные (Cas) системы или компоненты таких систем. Системы CRISPR/Cas включают транскрипты и другие элементы, вовлеченные в экспрессию или направление активности генов Cas. В системах CRISPR/Cas используются комплексы CRISPR (содержащие направляющую РНК (нРНК), комплексированную с белком Cas) для сайт-направленного расщепления нуклеиновых кислот. Смотрите, например, WO/2013/176772 A1, WO/2014/065596 А1, WO/2014/089290 A1, WO/2014/093622 A2, WO/2014/099750 A2, WO/2013142578 A1, WO 2014/131833 А1, US 2015/0159175, US 2015/0159174, US 2014/0310828 и US 2014/0309487, которые все в полном объеме включены в данный документ посредством ссылки во всех смыслах.
[00319] Белки Cas, такие как Cas9, в общем случае содержат по меньшей мере один домен распознавания или связывания РНК, который взаимодействует с направляющими РНК (нРНК), и один или более нуклеазных доменов. Белки Cas также могут представлять собой слитые белки, например, для регуляции транскрипции или экспрессии гена. Например, белок Cas может быть слит с доменом расщепления, доменом эпигенетической модификации, доменом активации транскрипции или доменом репрессии транскрипции. Смотрите WO 2014/089290, в полном объеме включенную в данный документ посредством ссылки во всех смыслах. Примеры представителей семейства Cas9 описаны в WO 2014/131833, в полном объеме включенной в данный документ посредством ссылки во всех смыслах.
[00320] «Направляющая РНК» или «нРНК» включает молекулу РНК, которая связывается с белком Cas и нацеливает белок Cas на конкретный участок в пределах целевой ДНК. Направляющие РНК могут содержать два сегмента: «ДНК-нацеливающий сегмент» и «белок-связывающий сегмент». Некоторые нРНК содержат две отдельные молекулы РНК: (1) «активатор-РНК» («транс-действующая CRISPR РНК» или «tracrРНК», или «скаффолд»); и (2) «нацеливатель-РНК» («CRISPR РНК» или «нацеливатель-РНК», или «crРНК», или «crРНК повтор»). crРНК содержит как ДНК-нацеливающий сегмент (одноцепочечный) нРНК, так и ряд нуклеотидов, которые образуют одну половину двойной спирали дцРНК белок-связывающего сегмента нРНК. Соответствующая tracrРНК (активатор-РНК) содержит ряд нуклеотидов, которые образуют другую половину двойной спирали дцРНК белок-связывающего сегмента нРНК. Ряд нуклеотидов crРНК являются комплементарными и гибридизируются с рядом нуклеотидов tracrРНК с образованием двойной спирали дцРНК белок-связывающего домена нРНК. Следовательно, можно сказать, что каждая crРНК имеет соответствующую tracrРНК.
[00321] Другие нРНК представляют собой молекулу РНК (одиночный полинуклеотид РНК), которая также может называться «одномолекулярной РНК», «одиночной направляющей РНК» или «онРНК». Смотрите, например, WO/2013/176772 A1, WO/2014/065596 A1, WO/2014/089290 A1, WO/2014/093622 A2, WO/2014/099750 A2, WO/2013142578 A1 и WO 2014/131833 А1, которые все в полном объеме включены в данный документ посредством ссылки во всех смыслах. Термины «направляющая РНК» и «нРНК» включают как двухмолекулярные нРНК, так и одномолекулярные нРНК.
[00322] crРНК и соответствующая tracrРНК гибридизируются с образованием нРНК. crРНК дополнительно обеспечивает одноцепочечный ДНК-нацеливающий сегмент, который гибридизируется с последовательностью распознавания CRISPR РНК в целевой ДНК. Смотрите, например, Mali et al. (2013) Science 339:823-826; Jinek et al. (2012) Science 337:816-821; Hwang et al. (2013) Nat. Biotechnol. 31:227-229; Jiang et al. (2013) Nat. Biotechnol. 31:233-239; и Cong et al. (2013) Science 339:819-823, которые все в полном объеме включены в данный документ посредством ссылки во всех смыслах. Сайт-специфическое расщепление целевой ДНК Cas9 может происходит в участках, определяемых (i) комплементарностью спаривания оснований между нРНК и целевой ДНК и (ii) коротким мотивом, называемым мотивом, прилегающим к протоспейсеру (РАМ), в целевой ДНК. РАМ может фланкировать последовательность распознавания CRISPR РНК.
ii. Нацеливающие векторы
[00323] Нацеливающие векторы можно применять для внесения вставки нуклеиновой кислоты в целевой геномный локус, и они содержат вставку нуклеиновой кислоты и плечи гомологии, которые фланкируют вставку нуклеиновой кислоты. Нацеливающие векторы могут иметь линейную форму или кольцевую форму и могут быть одноцепочечными или двухцепочечными. Для удобства отнесения в данном документе плечи гомологии называются 5' и 3' (т.е. вышележащее и нижележащее) плечами гомологии. Эта терминология относится к относительному положению плеч гомологии по отношению к вставке нуклеиновой кислоты в пределах нацеливающего вектора. 5' и 3' плечи гомологии соответствуют областям в пределах целевого локуса, которые в данном документе называются «5' целевой последовательностью» и «3' целевой последовательностью» соответственно.
[00324] Вставки нуклеиновой кислоты включают сегменты ДНК, предназначенные для интеграции в целевые геномные локусы. Интеграция вставки нуклеиновой кислоты в целевой локус может привести к добавлению представляющей интерес нуклеотидной последовательности в целевом локусе, удалению представляющей интерес нуклеотидной последовательности в целевом локусе и/или замещению представляющей интерес нуклеотидной последовательности в целевом локусе. Кроме того, вставка нуклеиновой кислоты или соответствующая замещаемая нуклеиновая кислота в целевом локусе может иметь любую необходимую длину, включая, например, от около 10 нуклеотидов до около 500 т.п.о. или более.
[00325] Вставки нуклеиновой кислоты могут содержать полинуклеотид, кодирующий селективный маркер, репортерный ген или одну или более экспрессионных кассет или делеционных кассет. Заданная кассета может содержать представляющую интерес нуклеотидную последовательность, нуклеиновую кислоту, кодирующую селективный маркер и/или репортерный ген, наряду с различными регуляторными компонентами, которые влияют на экспрессию.
[00326] Вставка нуклеиновой кислоты может содержать нуклеиновую кислоту, фланкируемую целевыми последовательностями сайт-специфической рекомбинации (например, loxP, lox511, lox2272, lox66, lox71, loxM2, lox5171, FRT, FRT11, FRT71, attp, art, FRT, rox). Вся вставка нуклеиновой кислоты может фланкироваться такими целевыми последовательностями сайт-специфической рекомбинации, или любая область или отдельный представляющий интерес полинуклеотид в пределах вставки нуклеиновой кислоты может фланкироваться такими сайтами. Например, сайты сайт-специфической рекомбинации могут фланкировать полинуклеотид, кодирующий селективный маркер и/или репортерный ген, содержащийся в пределах вставки нуклеиновой кислоты. После интеграции вставки нуклеиновой кислоты в целевом локусе последовательности между сайтами сайт-специфической рекомбинации можно удалять.
[00327] Плечо гомологии и целевая последовательность «соответствуют» или являются «соответствующими» друг другу, если между двумя областями существует достаточный уровень идентичности последовательностей друг с другом, чтобы служить субстратами для реакции гомологичной рекомбинации. Термин «гомология» включает последовательности ДНК, которые идентичны или имеют некоторую степень идентичности с соответствующей последовательностью. Идентичность последовательностей между заданной целевой последовательностью и соответствующим плечом гомологии, находящемся в нацеливающем векторе, может представлять любую степень идентичности последовательностей, которая позволяет осуществлению гомологичной рекомбинации. Кроме того, соответствующая область гомологии между плечом гомологии и соответствующей целевой последовательностью может иметь любую длину, которой достаточно, чтобы стимулировать гомологичную рекомбинацию в расщепленном участке распознавания. Например, заданное плечо гомологии и/или соответствующая целевая последовательность может содержать соответствующие области гомологии, которые, например, имеют длину от около 5 т.п.о. до около 300 т.п.о. или более так, что плечо гомологии имеет достаточную гомологию для прохождения гомологичной рекомбинации с соответствующими целевыми последовательностями в пределах генома клетки.
[00328] Нуклеазные агенты (например, системы CRISPR/Cas) можно применять в комбинации с нацеливающими векторами для того, чтобы способствовать модификации целевого локуса. Такие нуклеазные агенты могут стимулировать гомологичную рекомбинацию между нацеливающим вектором и целевым локусом. Когда нуклеазные агенты применяют в комбинации с нацеливающим вектором, нацеливающий вектор может содержать 5' и 3' плечи гомологии, соответствующие 5' и 3' целевым последовательностям, расположенным в достаточной близости к участку расщепления нуклеазы так, чтобы стимулировать явление гомологичной рекомбинации между целевыми последовательностями и плечами гомологии после создания ника или двухцепочечного разрыва в участке расщепления нуклеазой. Целевые последовательности в пределах целевого локуса, которые соответствуют 5' и 3' плечам гомологии нацеливающего вектора, «расположены в достаточной близости» к участку расщепления нуклеазой, если расстояние является таким, чтобы стимулировать явление гомологичной рекомбинации между 5' и 3' целевыми последовательностями и плечами гомологии после создания ника или двухцепочечного разрыва в участке распознавания.
[00329] Комбинированное применение нацеливающего вектора (включая, например, большой нацеливающий вектор (LTVEC) или малый нацеливающий вектор (smallTVEC)) с нуклеазным агентом может привести к повышению эффективности нацеливания по сравнению с применение одного нацеливающего вектора.
1. Малые нацеливающие векторы (SmallTVEC)
[00330] В некоторых способах применяется малый нацеливающий вектор или smallTVEC. Примеры применения smallTVEC для создания направленных генетических модификаций в Y-хромосоме описаны, например, в WO 2015/200805 и US 2015/0376651, которые в полном объеме включены посредством ссылки во всех смыслах. «smallTVEC» включает нацеливающий вектор, который содержит короткие плечи гомологии. Длина плеча гомологии в smallTVEC может составлять, например, от около 400 п.о. до около 1000 п.о. Плечо гомологии smallTVEC может иметь любую длину, которой достаточно для стимуляции явления гомологичной рекомбинации с соответствующим целевым участком, включая, например, от около 400 п.о. до около 500 п.о., от около 500 п.о. до около 600 п.о., от около 600 п.о. до около 700 п.о., от около 700 п.о. до около 800 п.о., от около 800 п.о. до около 900 п.о. или от около 900 п.о. до около 1000 п.о. Предпочтительная длина плеча гомологии в smallTVEC составляет от около 700 п.о. до около 800 п.о. Суммарная длина 5' и 3' плеч гомологии smallTVEC может составлять, например, от около 0,5 т.п.о. до около 10 т.п.о. В таких способах короткая длина плеч гомологии может повышать эффективность нацеливания по сравнению с нацеливающим вектором с более длинными плечами гомологии. Вследствие природы Y-хромосомы, которая содержит последовательности с большим количеством повторов, короткие плечи smallTVEC могут обеспечивать высокоспецифическое нацеливание на Y-хромосому.
2. Большие нацеливающие векторы (LTVEC)
[00331] Некоторые нацеливающие векторы представляют собой «большие нацеливающие векторы» или «LTVEC», которые включают нацеливающие векторы, содержащие плечи гомологии, которые соответствуют нуклеотидным последовательностям или получены из нуклеотидных последовательностей, больших, чем те, которые обычно применяются в других подходах, направленных на проведение гомологичной рекомбинации в клетках. Примеры создания направленных генетических модификаций с применением LTVEC описаны, например, в WO 2015/088643, US 2015/0159175, US 2015/0159174, US 2014/0310828, US 2014/0309487 и US 2013-0309670, которые все в полном объеме включены в данный документ посредством ссылки во всех смыслах. LTVEC также включают нацеливающие векторы, содержащие вставки нуклеиновой кислоты, имеющие нуклеотидные последовательности, большие, чем те, которые обычно применяются в других подходах, направленных на проведение гомологичной рекомбинации в клетках. Например, LTVEC позволяют осуществлять модификацию крупных локусов, которую невозможно провести с помощью традиционных нацеливающих векторов на основе плазмид вследствие их ограничений по размеру. Например, локус, на который проводится нацеливание, может представлять собой (т.е. 5' и 3' плечи гомологии могут соответствовать) локус клетки, на который невозможно провести нацеливание, используя традиционный способ, или нацеливание на который можно провести только неправильным образом или только с достаточно низкой эффективностью в отсутствие ника или двухцепочечного разрыва, индуцируемого нуклеазным агентом (например, белком Cas).
[00332] Примеры LTVEC включают векторы, полученные из бактериальной искусственной хромосомы (ВАС), человеческой искусственной хромосомы или дрожжевой искусственной хромосомы (YAC). Неограничивающие примеры LTVEC и способы их получения описаны, например, в патенте США №6586251; патенте США №6596541; патенте США №7105348; и WO 2002/036789, которые все в полном объеме включены в данный документ посредством ссылки во всех смыслах. LTVEC могут иметь линейную форму или кольцевую форму.
[00333] LTVEC могут иметь любую длину, включая, например, по меньшей мере 10 т.п.о. или от около 50 т.п.о. до около 400 т.п.о. или больше. Размер LTVEC может быть слишком большим, чтобы проводить исследование нацеливания традиционными методами анализа, например, саузерн-блоттинга и ПЦР в широком диапазоне (например, от 1 т.п.о. до 5 т.п.о.). Суммарная длина 5' плеча гомологии и 3' плеча гомологии может составлять, например, по меньшей мере 10 т.п.о. (каждое плечо гомологии может находиться в диапазоне, например, от около 5 т.п.о. до около 200 т.п.о.). LTVEC и вставка нуклеиновой кислоты могут быть сконструированы так, чтобы обеспечивать делецию в целевом локусе длиной, например, от около 5 т.п.о. до около 3 м.п.о. (например, около 500 т.п.о. или более). Аналогично, LTVEC и вставка нуклеиновой кислоты могут быть сконструированы так, чтобы обеспечивать вставку в целевом локусе экзогенной нуклеотидной последовательности длиной, например, в диапазоне от около 5 т.п.о. до около 400 т.п.о. или более.
iii. Внесение компонентов в клетки
[00334] В данном документе предложены различные способы и композиции, позволяющие вносить в клетку нуклеиновую кислоту. В некоторых случаях система, применяемая для внесения нуклеиновой кислоты, позволяет осуществлять направленную интеграцию в конкретном геномном локусе. В таких системах применяется множество компонентов, и для упрощения отнесения термин «система направленной геномной интеграции» в общем случае включает все компоненты, необходимые для интеграции (например, один или более нуклеазных агентом, участков расщепления нуклеазами, вставок полинуклеотидов ДНК, нацеливающих векторов, целевых геномных локусов и представляющих интерес полинуклеотидов).
[00335] Предложенные в данном документе способы могут включать внесение в клетку одного или более полинуклеотидов или полипептидных конструкций, содержащих один или более компонентов системы направленной геномной интеграции. «Внесение» включает введение в клетку последовательности (полипептидной или полинуклеотидной) таким образом, чтобы последовательность получала доступ в внутренней части клетки. Предложенные в данном документе способы не зависят от конкретного способа внесения нуклеиновой кислоты или белка в клетку, за исключением того, что нуклеиновая кислота или белок получает доступ к внутренней части по меньшей мере одной клетки. Способы внесения нуклеиновых кислот и белков в различные типы клеток известны в данной области техники и включают, например, методы стабильной трансфекции, методы временной трансфекции и вирус-опосредованные методы.
[00336] Протоколы трансфекции, а также протоколы внесения полипептидов или полинуклеотидных последовательностей в клетки могут варьироваться. Неограничивающие примеры методов трансфекции включают химические методы трансфекции с применением липосом; наночастиц; фосфата кальция (Graham et al. (1973) Virology 52 (2): 456-67, Bacchetti et al. (1977) Proc Natl Acad Sci USA 74 (4): 1590-4, и Kriegler, M (1991). Transfer and Expression: A Laboratory Manual. New York: W.H. Freeman and Company. pp. 96-97); дендримеров; или катионных полимеров, таких как ДЭАЭ-декстран или полиетиленимин. Нехимические методы включают электропорацию, сонопорацию и оптическую трансфекцию. Трансфекция на основании частиц включает применение генной пушки или трансфекцию с помощью магнитов (Bertram (2006) Current Pharmaceutical Biotechnology 7, 277-28). Также для трансфекции можно применять вирусные методы.
[00337] В некоторых случаях внесение нуклеиновых кислот или белков в клетку опосредовано электропорацией, внутрицитоплазматической инъекцией, инфицированием вирусом, аденовирусом, лентивирусом, ретровирусом, трансфекцией, опосредованной липидами трансфекцией или нуклеофекцией (Nucleofection™).
[00338] Внесение нуклеиновых кислот или белков в клетку можно проводить один раз или несколько раз в течение некоторого периода времени. Например, внесение можно проводить по меньшей мере два раза в течение некоторого периода времени, по меньшей мере три раза в течение некоторого периода времени, по меньшей мере четыре раза в течение некоторого периода времени, по меньшей мере пять раз в течение некоторого периода времени, по меньшей мере шесть раз в течение некоторого периода времени, по меньшей мере семь раз в течение некоторого периода времени, по меньшей мере восемь раз в течение некоторого периода времени, по меньшей мере девять раз в течение некоторого периода времени, по меньшей мере десять раз в течение некоторого периода времени, по меньшей мере одиннадцать раз, по меньшей мере двенадцать раз в течение некоторого периода времени, по меньшей мере тринадцать раз в течение некоторого периода времени, по меньшей мере четырнадцать раз в течение некоторого периода времени, по меньшей мере пятнадцать раз в течение некоторого периода времени, по меньшей мере шестнадцать раз в течение некоторого периода времени, по меньшей мере семнадцать раз в течение некоторого периода времени, по меньшей мере восемнадцать раз в течение некоторого периода времени, по меньшей мере девятнадцать раз в течение некоторого периода времени или по меньшей мере двадцать раз в течение некоторого периода времени.
[00339] Когда в клетку вносят как нуклеазные агенты, так и нацеливающие векторы (например, LTVEC), они могут быть внесены одновременно. В альтернативном варианте нуклеазный агент может быть внесен отдельно от нацеливающего вектора. Например, нуклеазный агент может быть внесен перед внесением нацеливающего вектора или он может быть внесен после внесения нацеливающего вектора.
iv. Типы модификации
[00340] Для сайленсинга области Y-хромосомы можно применять различные типы направленных генетических модификаций (например, посредством делеции или разрушения области Y-хромосомы). Например, снижение уровня и/или активности белка может быть достигнуто посредством направленной генетической модификации гена, кодирующего белок, или геномного локуса, который влияет на или регулирует уровни или активность белка. Такие направленные модификации могут включать, например, добавление одного или более нуклеотидов, делеции одного или более нуклеотидов, замены одного или более нуклеотидов, точечную мутацию, нокаут представляющего интерес полинуклеотида или его части, нокин представляющего интерес полинуклеотида или его части, замещение эндогенной нуклеотидной последовательности гетерологичной, эксзогенной или ортологичной нуклеотидной последовательностью, замену домена, замену экзона, замену интрона, замену регуляторной последовательности, замену гена или их комбинацию. Например, чтобы получить направленную генетическую модификацию, можно изменить по меньшей мере 1, 2, 3, 4, 5, 7, 8, 9, 10 или более нуклеотидов. Делеции, вставки или замены могут быть любого размера, как описано в другом месте данного документа. Для создания направленной генетической модификации можно использовать различные способы. Смотрите, например, Wang et al. (2013) Cell 153:910-918; Mandalos et al. (2012) PLOS ONE 7:e45768:1-9; и Wang et al. (2013) Nat Biotechnol. 31:530-532, каждая из которых в полном объеме включена в данный документ посредством ссылки во всех смыслах.
[00341] Делеция в Y-хромосоме может представлять собой делецию любой нуклеотидной последовательности, такой как ген, связанный с фертильностью/нефертильностью или с половым развитием. Делеция в Y-хромосоме может включать делецию нескольких генов. Например, могут быть удалены 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более генов. В случае применения двух нуклеазных агентов может быть удалена последовательность между соответствующими участками распознавания. Диапазон делеции может составлять, например, от около 5 т.п.о. до около 10 т.п.о., от около 10 т.п.о. до около 20 т.п.о., от около 20 т.п.о. до около 40 т.п.о., от около 40 т.п.о. до около 60 т.п.о., от около 60 т.п.о. до около 80 т.п.о., от около 80 т.п.о. до около 100 т.п.о., от около 100 т.п.о. до около 150 т.п.о., от около 150 т.п.о. до около 200 т.п.о., от около 200 т.п.о. до около 300 т.п.о., от около 300 т.п.о. до около 400 т.п.о., от около 400 т.п.о. до около 500 т.п.о., от около 500 т.п.о. до около 600 т.п.о., от около 600 т.п.о. до около 700 т.п.о., от около 700 т.п.о. до около 800 т.п.о., от около 800 т.п.о. до около 900 т.п.о., от около 900 т.п.о. до около 1 м.п.о., от около 500 т.п.о. до около 1 м.п.о., от около 1 м.п.о. до около 1.5 м.п.о., от около 1.5 м.п.о. до около 2 м.п.о., от около 2 м.п.о. до около 2.5 м.п.о. или от около 2.5 м.п.о. до около 3 м.п.о. Например, делеция может составлять более чем 500 т.п.о., от около 500 т.п.о. до около 600 т.п.о. или около 500 т.п.о.
[00342] Аналогично, разрушение Y-хромосомы может представлять собой разрушение любой нуклеотидной последовательности, такой как ген, связанный с фертильностью/нефертильностью или с половым развитием. Разрушение Y-хромосомы может включать разрушение нескольких генов. Например, могут быть разрушены 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более генов. Разрушение эндогенной нуклеотидной последовательности может происходить, например, в результате репарации двухцепочечного разрыва, созданного нуклеазой, путем опосредованной негомологичным соединением концов (НГСК) репарацией ДНК, которая создает мутантный аллель, содержащий вставку или делецию нуклеотидной последовательности и, таким образом, приводит к разрушению этого геномного локуса. Примеры разрушения включают изменение регуляторного элемента (например, промотора или энхансера), миссенс-мутацию, нонсенс-мутацию, мутацию со сдвигом рамки, мутацию с усечением, нулевую мутацию или вставку или делецию небольшого количества нуклеотидов (например, приводящую к мутации со сдвигом рамки). Разрушение может привести к инактивации (т.е. потере функции) или потере аллеля.
v. Идентификация клеток с направленной модификацией
[00343] Для идентификация клеток, имеющих направленную модификацию, такую как делеция или вставка, можно применять различные способы. Такие способы могут включать идентификацию одной клетки, имеющей направленную модификацию в целевом локусе (например, между первой и второй последовательностями распознавания CRISPR РНК). Для идентификации таких клеток с модифицированными геномными локусами можно проводить скрининг.
[00344] Этап скрининга может включать количественный анализ для оценки модификации аллеля (МА) родительской хромосомы. Например, количественный анализ можно проводить методом количественной ПЦР, такой как ПЦР в режиме реального времени (кПЦР). Для ПЦР в режиме реального времени можно использовать первый набор праймеров, которые распознают целевой локус, и второй набор праймеров, которые распознают нецелевой эталонный локус. Набор праймеров может содержать флуоресцентный зонд, который распознает амплифицированную последовательность.
[00345] Другие примеры подходящих вариантов количественного анализа включают флуоресцентную in situ гибридизацию (FISH), сравнительную геномную гибридизацию, изотермическую амплификацию ДНК, количественную гибридизацию с иммобилизованными зондами, Invader Probes®, анализ ММР, TAQMAN® Molecular Beacon или технологию Eclipse™ с применением зондов (смотрите, например, US 2005/0144655, которая в полном объеме включена в данный документ посредством ссылки).
F. Клетки и животные
[00346] Животные в вышеописанных способах и композициях (например, клетки, эмбрионы) могут включать любое животное, включая млекопитающих, рыб и птиц. Млекопитающие включают, например, человека, отличных от человека млекопитающих, отличных от человека приматов (например, обезьян, мармозеток, макаков-резус и высших обезьян), грызунов (например, мышей, крыс, хомяков и морских свинок), домашний скот или сельскохозяйственных млекопитающих (например, коз, быков, оленей, бизонов, лошадиных, таких как лошади, бычьих, таких как коровы и быки, овечьих, таких как овцы, и свиных, таких как свиньи и хряки) и домашних животных (например, кошек, собак, кроликов и хорьков). Птицы включают, например, кур, индеек, страусов, гусей и уток. Отличные от человека животные могут представлять собой любых животных за исключение человека. Например, отличное от человека животное может представлять собой отличное от человека животное, грызуна, мышь, крысу, хомяка, обезьяну, сельскохозяйственное млекопитающее, домашнее млекопитающее, рыбу или птицу.
[00347] Плюрипотентные клетки в вышеописанных способах и композициях включают любые недифференцированные клетки, обладающие способностью развиваться в более чем один тип дифференцированной клетки. Например, плюрипотентные клетки в вышеописанных способах и композициях могут представлять собой эмбриональные стволовые (ЭС) клетки или индуцированные плюрипотентные стволовые (иПС) клетки. ЭС клетки включают полученные из эмбриона тотипотентные или плюрипотентные клетки, которые способны стать составляющей частью любой ткани развивающегося эмбриона после внесения в эмбрион. В альтернативном варианте они могут представлять собой взрослые стволовые клетки или клетки-предшественники с ограничением в процессе развития. Плюрипотентные клетки могут происходить от любого животного. Например, плюрипотентная клетка может представлять собой человеческую ЭС клетку, нечеловеческую ЭС клетку, ЭС клетку млекопитающего, ЭС клетку отличного от человека млекопитающего, ЭС клетку грызуна, ЭС клетку мыши, ЭС клетку крысы или ЭС клетку хомяка.
[00348] В случае тех млекопитающих, для которых на недоступны подходящие генетически модифицируемые плюрипотентные клетки, применяются другие способы для перепрограммирования соматических клеток в плюрипотентные клетки, например, путем внесения в соматические клетки (например, фибробласты) комбинации индуцирующих плюрипотентность факторов, включая, но не ограничиваясь этим, Oct3/4, Sox2, KLF4, Мус, Nanog, LIN28 и Glis1.
[00349] Мышиная плюрипотентная клетка, тотипотентная клетка или эмбрион-хозяин может происходить из любой линии мышей, включая, например, инбредные линии, гибридные линии и неродственные линии. Примеры мышиных линий включают линию 129, линию C57BL (например, линию C57BL/6), микс 129 и C57BL/6 (например, 50% 129 и 50% C57BL/6), линию BALB/c и линию Swiss Webster. Примеры линий 129 включают 129Р1, 129Р2, 129Р3, 129X1, 129S1 (например, 12951/SV, 12951/SvIm), 129S2, 129S4, 129S5, 12959/SvEvH, 129S6 (129/SvEvTac), 129S7, 129S8, 129Т1 и 129Т2 (смотрите, например, Festing et al. (1999) Revised nomenclature for strain 129 mice, Mammalian Genome 10:836). Примеры линий C57BL включают C57BL/A, C57BL/An, C57BL/GrFa, C57BL/KaLwN, C57BL/6, C57BL/6J, C57BL/6ByJ, C57BL/6NJ, C57BL/10, C57BL/10ScSn, C57BL/10Cr и C57BL/01a. Мыши могут быть представлены миксами вышеуказанной линии 129 (например, линии 129S6 (129/SvEvTac)) и вышеуказанной линии C57BL/6, миксами одной или более вышеуказанных линий 129 или одной или более вышеуказанных линий C57BL. Мыши также могут происходить из линии, исключающей линии 129. Например, мышь или мышиная клетка, применяемая в предложенных в данном документе способах, может представлять микс линий 129 и C57BL/6, микс линий BALB/c и C57BL/6, микс линий 129 и BALB/c или микс линий BALB/c, C57BL/6, и 129. Например, мышь или мышиная клетка, применяемая в предложенных в данном документе способах, может, по меньшей мере частично, происходить из линии BALB/c (например, по меньшей мере на около 25%, по меньшей мере на около 50%, по меньшей мере на около 75% быть полученной из линии BALB/c или на около 25%, на около 50%, на около 75% или на около 100% быть полученной из линии BALB/c). В одном примере мыши или мышиные клетки могут принадлежать линии, включающей 50% BALB/c, 25% C57BL/6 и 25% 129. В альтернативном варианте мыши или мышиные клетки могут принадлежать линии или комбинации линий, которая исключает BALB/c.
[00350] Y-хромосома в мышиной XY плюрипотентной клетке может происходить из любой линии. Например, Y-хромосома в мышиной XY плюрипотентной клетке (например, мышиной XY ЭС клетке) может происходить из линии 129 или линии C57BL (например, линии C57BL/6). В альтернативном варианте Y-хромосома может происходить из линии BALB/c. Примером мышиной XY ЭС клетки, имеющей Y-хромосому из линии 129, является мышиная ЭС клетка VGF1. Мышиные ЭС клетки VGF1 (также известные как F1H4) были получены из гибридных эмбрионов, полученных путем скрещивания самки мыши C57BL/6NTac с самцом мыши 129S6/SvEvTac. Следовательно, ЭС клетки VGF1 содержат Y-хромосому мыши 129S6/SvEvTac. Смотрите, например, Auerbach, W. et al. (2000) Biotechniques 29, 1024-1028, 1030, 1032, в полном объеме включенную в данный документ посредством ссылки во всех смыслах. В альтернативном варианте Y-хромосома в мышиной XY плюрипотентной клетке не происходит из линии 129 (например, происходит из линии C57BL/6). Линия ЭС клеток VGB6 была получена из одного мужского эмбриона (XY) на стадии бластоцисты, полученного при спаривании самца и самки мыши из линии C57BL/6NTac.
[00351] Крысиная плюрипотентная клетка, тотипотентная клетка или эмбрион-хозяин может происходить из любой линии крыс, включая, например, инбредные линии, гибридные линии и неродственные линии. Примеры крысиных линий включают линию крыс ACI, линию крыс Dark Agouti (DA), линию крыс Wistar, линию крыс LEA, линию крыс Sprague Dawley (SD) или линию крыс Fischer, такой как Fisher F344 или Fisher F6. Крысиные плюрипотентные клетки, тотипотентные клетки или эмбрионы-хозяев также можно получать из линии, полученной из микса двух или более вышеперечисленных линий. Например, крысиная плюрипотентная клетка, тотипотентная клетка или эмбрион-хозяин могут быть получены из линии, выбранной из линии DA и линии ACI. Линия крыс ACI характеризуется черной дикой окраской с белым животом и лапами и гаплотипом RT1avl. Такие линии доступны из множества источников, включая Harlan Laboratories. Примером крысиной линии ЭС клеток крыс ACI являются ЭС клетки крыс ACI.G1. Линия крыс Dark Agouti (DA) характеризуется черной дикой окраской шерсти и гаплотипом RT1av1. Такие крысы доступны из множества источников, включая Charles River и Harlan Laboratories. Примерами крысиной линии ЭС клеток крыс DA являются линия ЭС клеток крыс DA.2B или линия ЭС клеток крыс DA.2C. Другие примеры крысиных линий приведены, например, в US 2014/0235933, US 2014/0310828 и US 2014/0309487, которые все в полном объеме включены в данный документ посредством ссылки во всех целях.
[00352] В некоторых способах и композициях животное не принадлежит одному или более из следующих видов: Akodon spp., Myopus spp., Microtus spp. и Talpa spp. Аналогично, в некоторых способах и композициях животное не представлено каким-либо видом, для которого нормальной характеристикой дикого типа является фертильность XY самок.
III. Способы скрининга соединений
[00353] Предложены способы и композиции для проведения скрининга в отношении соединений, оказывающих феминизирующую активность на XY плюрипотентную или тотипотентную клетку животного или ее клон (т.е. повышающих предрасположенность клетки или клона к тому, чтобы давать фертильных XY животных с женским фенотипом в поколении F0), когда клетку или клон культивируют в присутствии этого соединения. Предрасположенность клонов XY плюрипотентных или тотипотентных клеток животных к тому, чтобы давать фертильных XY животных с женским фенотипом в поколении F0 обратно коррелирует с экспрессией или активностью Ddx3y, Uty и Eif2s3y в этих клонах. Прекращение экспрессии одного или более из этих генов в XY плюрипотентных или тотипотентных клетках животных (например, XY ЭС клетках) может спрогнозировать, какие клеточные клоны будут давать XY самок животных в поколении F0: чем сильнее наблюдаемый сайленсинг Ddx3y, Uty и Eif2s3y, тем выше предрасположенность клона XY ЭС клетки к тому, чтобы давать фертильных XY животных с женским фенотипом в поколении F0 (смотрите, например, Пример 3). Аналогично, прекращение активности или снижение экспрессии и/или активности одного или более из этих генов в XY плюрипотентных или тотипотентных клетках животных (например, XY ЭС клетках) может спрогнозировать, какие клеточные клоны будут давать XY самок животных в поколении F0: чем ниже наблюдаемая экспрессия Ddx3y, Uty и Eif2s3y, тем выше предрасположенность клона XY ЭС клетки к тому, чтобы давать фертильных XY животных с женским фенотипом в поколении F0 (смотрите, например, Пример 3). Другими словами, экспрессия и/или активность одного или более из этих генов может служить суррогатным маркером для прогнозирования получения XY самок.
[00354] Эту информацию можно использовать для проведения скрининга в отношении соединений, которые позволят получать XY плюрипотентные или тотипотентные клетки животных, имеющие высокую предрасположенность к тому, чтобы давать фертильных XY животных с женским фенотипом в поколении F0. Например, такой способ может включать культивирование первой популяции и второй популяции XY плюрипотентных или тотипотентных клеток отличного от человека животного в среде, содержащей основную среду и добавки, подходящие для поддержания плюрипотентности или тотипотентности клеток, причем первую популяцию культивируют в присутствии целевого соединения, а вторую популяцию культивируют в отсутствие целевого соединения. Способ может дополнительно включать анализ одной или более XY плюрипотентных или тотипотентных клеток отличного от человека животного в каждой из первой и второй популяций в отношении экспрессии и/или активности одного или более из Ddx3y, Uty и Eif2s3y, в соответствии с чем феминизирующую активность определяют по снижению экспрессии и/или активности одного или более из Ddx3y, Uty и Eif2s3y в одной или более клетках из первой популяции по сравнению с одной или более клетками из второй популяции. Таким образом, способ может дополнительно включать анализ одной или более XY плюрипотентных или тотипотентных клеток отличного от человека животного в каждой из первой и второй популяций в отношении экспрессии и/или активности одного или более из Ddx3y, Uty и Eif2s3y, и выбор целевого соединения, если происходит снижение экспрессии и/или активности одного или более из Ddx3y, Uty и Eif2s3y в одной или более клетках из первой популяции по сравнению с одной или более клетками из второй популяции. Может происходить снижение экспрессии и/или активности Ddx3y, Uty, Eif2s3y, Ddx3y и Uty, Ddx3y и Eif2s3y, Uty и Eif2s3y или Ddx3y, Uty и Eif2s3y.
[00355] Примеры соединений, для которых можно проводить скрининг, включают антитела, антигенсвязывающие белки, сайт-специфические ДНК-связывающие белки (например, комплексы CRISPR-Cas, библиотеки CRISPRi, библиотеки CRISPRa), полипептиды, миметики бета-изгибов, полисахариды, фосфолипиды, гормоны, простагландины, стероиды, ароматические соединения, гетероциклические соединения, бензодиазепины, олигомерные N-замещенные глицины и олигокарбаматы. Большие комбинаторные библиотеки соединений можно создавать с помощью метода кодируемых синтетических библиотек (ESL - от англ. «encoded synthetic libraries»), описанного в WO 1995/012608, WO 1993/006121, WO 1994/008051, WO 1995/035503 и WO 1995/030642, которые все в полном объеме включены в данный документ посредством ссылки во всех целях. Также методами фагового дисплея можно создавать пептидные библиотеки. Смотрите, например, US 5432018, в полном объеме включенную в данный документ посредством ссылки во всех смыслах. Применение библиотек направляющих РНК для нацеливания систем CRISPR-Cas на разные гены описано, например, в WO 2014/204727, WO 2014/093701, WO 2015/065964, WO 2016/011080, Shalem et al. (2014) 343(6166):84-87 (общегеномная библиотека CRISPR-Cas9 нокаута (GeCKO)) и Konermann et al. (2015) 517(7536):583-588 (объединенная библиотека медиаторов синергической активации (SAM - от англ. «Synergistic Activation Mediator») CRISPR/Cas9), которые все в полном объеме включены в данный документ посредством ссылки во всех целях.
[00356] Первую популяцию клеток можно культивировать в присутствии целевого соединения в течение любого времени. В качестве примера первую популяцию клеток можно культивировать в присутствии целевого соединения в течение по меньшей мере 1 суток, 2 суток, 3 суток, 4 суток, 5 суток, 6 суток, 7 суток, 8 суток, 9 суток, 10 суток, 11 суток, 12 суток, 13 суток, 2 недель, 3 недель или 4 недель перед анализом.
[00357] Среда может представлять собой среду, достаточную для поддержания плюрипотентности или тотипотентности клеток, но без изменения способности клеток давать фертильное потомство женского пола. В альтернативном варианте среда может представлять собой феминизирующую среду. Феминизирующая среда (например, основная среда и добавки, подходящая для поддержания XY плюрипотентных или тотипотентных клеток животных в культуре, причем основная среда или среда, содержащая основную среду и добавки, имеет осмоляльность от около 200 мОсм/кг до менее чем около 329 мОсм/кг) и способы поддержания клеток в такой среде описаны в другом месте данного документа.
[00358] Феминизирующую активность целевого соединения можно определять множеством способов. Например, феминизирующую активность можно определять по отсутствию экспрессии и/или активности одного или более из Ddx3y, Uty и Eif2s3y в клетках из первой популяции. В альтернативном варианте феминизирующую активность можно определять по снижению экспрессии и/или активности одного или более из Ddx3y, Uty и Eif2s3y в клетках из первой популяции по сравнению с клетками из второй популяции. В альтернативном варианте феминизирующую активность можно определять по отсутствию экспрессии и/или активности всех из Ddx3y, Uty и Eif2s3y в клетках из первой популяции. Способы оценки экспрессии и/или активности дополнительно подробно обсуждаются ниже.
[00359] Некоторые способы скрининга могут дополнительно включать выбор донорской XY плюрипотентной или тотипотентной клетки отличного от человека животного из первой популяции для получения фертильного отличного от человека XY животного с женским фенотипом в поколении F0 на основании экспрессии и/или активности одного или более из Ddx3y, Uty и Eif2s3y, причем доля фертильных отличных от человека XY животных с женским фенотипом в поколении F0 обратно пропорционально экспрессии и/или активности одного или более из Ddx3y, Uty и Eif2s3y.
[00360] Затем донорскую XY плюрипотентную или тотипотентную клетку животного можно вносить в эмбрион-хозяин, причем эмбрион-хозяин способен давать фертильное XY животное с женским фенотипом в поколении F0. Например, эмбрион-хозяин может представлять собой эмбрион на стадии пре-морулы и эмбрион-хозяин можно культивировать до стадии бластоцисты после внесения донорской XY плюрипотентной или тотипотентной клетки животного. Животные, эмбрионы, способы внесения XY плюрипотентных или тотипотентных клеток животных в эмбрионы и способы получения F0 животных описаны в другом месте данного документа.
[00361] XY плюрипотентные или тотипотентные клетки животных можно поддерживать в среде в течение различных периодов времени перед этапом анализа и/или перед внесением в эмбрион-хозяин. Например, XY плюрипотентную или тотипотентную клетку животного можно поддерживать в феминизирующей среде в течение по меньшей мере 1 суток, 2 суток, 3 суток, 4 суток, 5 суток, 6 суток, 7 суток, 8 суток, 9 суток, 10 суток, 11 суток, 12 суток, 13 суток, 2 недель, 3 недель или 4 недель перед этапом анализа и/или внесением в эмбрион-хозяин. В альтернативном варианте XY плюрипотентную или тотипотентную клетку животного можно поддерживать в феминизирующей среде в течение не более чем 1 суток, 2 суток, 3 суток, 4 суток, 5 суток, 6 суток, 7 суток, 8 суток, 9 суток, 10 суток, 11 суток, 12 суток, 13 суток, 2 недель, 3 недель или 4 недель перед этапом анализа и/или внесением в эмбрион-хозяин. В некоторых способах XY плюрипотентную или тотипотентную клетку культивируют или поддерживают в феминизирующей среде до проведения инъекции клетки в эмбрион. В других способах эмбрион, в который инъецировали XY плюрипотентную или тотипотентную клетку, культивируют или поддерживают в феминизирующей среде до переноса в организм суррогатной матери.
[00362] Донорскую клетку можно выбирать после анализа одной или более клеток из первой популяции в отношении экспрессии и/или активности для одного или более из Ddx3y, Uty и Eif2s3y. Этап анализа может включать анализ самой клетки или самого клона и определение уровня экспрессии и/или активности для одного или более из Ddx3y, Uty и Eif2s3y. В альтернативном варианте этап анализа может включать анализ нескольких субклонов, полученных из клона, и определение, например, процентной доли субклонов, имеющих сниженную экспрессию и/или активность, или в которых отсутствует экспрессия и/или активность одного или более из Ddx3y, Uty и Eif2s3y. В альтернативном варианте этап анализа может включать анализ нескольких субклонов, полученных из клона, и определение сравнительной экспрессии и/или активности одного или более из Ddx3y, Uty и Eif2s3y среди субклонов. Может происходить снижение экспрессии и/или активности одного или более из Ddx3y, Uty и Eif2s3y или может происходить снижение экспрессии и/или активности всех из Ddx3y, Uty и Eif2s3y. В альтернативном варианте в XY плюрипотентной или тотипотентной клетке животного отсутствует экспрессия и/или активность одного или более из Ddx3y, Uty и Eif2s3y или отсутствует экспрессия и/или активность всех из Ddx3y, Uty и Eif2s3y. Например, может отсутствовать выявляемая экспрессия всех из Ddx3y, Uty и Eif2s3y.
[00363] Экспрессию можно оценивать на уровне белка или на уровне мРНК. Уровень экспрессии полипептида можно определять прямым образом, например, путем анализа уровня полипептида в клетке или организме (например, анализа методом вестерн-блоттинга, анализа FACS, ELISA), или непрямым образом, например, путем определения активности полипептида. В других случаях снижение экспрессии и/или активности гена можно определить, применяя способы, которые включают, например, анализ методом саузерн-блоттинга, секвенирование ДНК, ПЦР-анализ, анализ методом нозерн-блоттинга, количественный ОТ-ПЦР-анализ, секвенирование нового поколения (NGS), микроматричный анализ или фенотипический анализ. Например, экспрессию гена можно оценивать путем измерения уровней мРНК методом ОТ-ПЦР, РНК-секвенирования, цифровой ПЦР или любым другим подходящим методом для измерения уровней мРНК. В одном примере можно проводить измерение уровней РНК методом ОТ-ПЦР относительно контрольного гена, такого как B2m. В некоторых случаях, например, ΔCt между контрольным геном (например, B2m) и целевым геном может составлять по меньшей мере 2, по меньшей мере 4, по меньшей мере 6 или по меньшей мере 8. Аналогично, в некоторых случаях через 30, 31, 32, 33, 34, 35, 36, 37, 38, 39 или 40 циклов будет отсутствовать выявляемая РНК для целевого гена.
[00364] Необязательно, при измерении уровней экспрессии мРНК или полипептида можно проводить контрольный эксперимент для подтверждения присутствия Y-хромосомы. Например, можно проводить анализ числа копий TAQMAN®, чтобы подтвердить присутствие одной копии Y-хромосомы, используя зонды к разным геномным последовательностям в Y-хромосоме. Такие методы анализа разработаны для определения вариации числа копий в пределах генома.
[00365] Снижение экспрессии или активности гена или белка, который он кодирует, в исследуемой клетке, эмбрионе или животном может включать любое статистически значимое уменьшение уровней экспрессии или активности по сравнению с соответствующей контрольной клеткой, эмбрионом или животным, или популяцией контрольных клеток, эмбрионов или животных. В общем случае снижение экспрессии или активности происходит, если экспрессия или активность статистически ниже, чем экспрессия или активность в соответствующей контрольной клетке, эмбрионе или полученном из них животном (например, XY плюрипотентной клетке животного), которые культивировали в соответствующей контрольной среде, не являющейся феминизирующей средой, XY плюрипотентной клетке животного, которая исторически дает исключительно самцов мышей, несмотря на культивирование в феминизирующей среде. Такое снижение включает уменьшение по меньшей мере на 1%, 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 99% или более по сравнению с контрольной клеткой. Статистически значимый означает р≤0,05. Снижение экспрессии или активности может происходить посредством любого механизма на любой стадии. Например, снижение экспрессии может происходить посредством явлений или регуляции, которая происходит во время транскрипции, после транскрипции, во время трансляции или после трансляции.
[00366] «Исследуемая клетка» представляет собой клетку, которую культивировали в феминизирующей среде (например, среде с низкой осмоляльностью), или клетку, которая происходит от клетки, культивируемой в феминизирующей среде. «Контроль» или «контрольная клетка» обеспечивает эталонный показатель для определения изменений в фенотипе исследуемой клетки. Контрольная клетка предпочтительно насколько это возможно близко совпадает с исследуемой клеткой (например, соответствующие клетки могут происходить из одной линии клеток или одного клона клеток, или могут иметь одинаковый генотип), за исключением того, что ее не культивировали в феминизирующей среде или у нее отсутствует способность или наблюдается сниженная способность к тому, чтобы давать XY самок мышей, несмотря на культивирование в феминизирующей среде. Например, контрольная клетка может содержать: (а) клетку, имеющую такой же генотип, или которая происходит из одной линии клеток или одного клона, что и исследуемая клетка, но которую культивировали в соответствующей контрольной среде, не являющейся феминизирующей средой (например, DMEM или среде другого типа, которая является достаточной для поддержания плюрипотентности или тотипотентности XY плюрипотентной или тотипотентной клетки, но не для изменения клетки путем придания ей способности давать фертильное потомство женского пола); (b) XY плюрипотентную или тотипотентную клетку животного, генетически идентичную исследуемой клетке или полученную из одной линии клеток или одного клона, но которая генетически не изменена или не подвергнута условиям или стимулу, которые бы обеспечили потенциальную возможность получения фертильных XY самок животных; и (с) XY плюрипотентную или тотипотентную клетку животного, культивируемую в феминизирующей среде (например, среде с низкой осмоляльностью), но которая исторически дает исключительно самцов животных, несмотря на культивирование в феминизирующей среде. Например, контрольная клетка может представлять собой XY плюрипотентную или тотипотентную клетку животного, которую культивировали в среде, достаточной для поддержания плюрипотентности или тотипотентности клетки, но не для изменения способности клетки давать фертильное потомство женского пола. Необязательно, снижение экспрессии и/или активности можно оценивать относительно контрольной XY плюрипотентной или тотипотентной клетки отличного от человека животного из второй популяции.
[00367] В некоторых экспериментах две или более клеток или клонов в первой популяции анализируют в отношении экспрессии и/или активности одного или более из Ddx3y, Uty и Eif2s3y. Клетка или клон с самой низкой экспрессией и/или активностью одного или более из Ddx3y, Uty и Eif2s3y затем может быть выбрана, чтобы служить донорской XY плюрипотентной или тотипотентной клеткой животного или ее клоном, причем донорская XY плюрипотентная или тотипотентная клетка животного способна давать фертильное XY животное с женским фенотипом в поколении F0.
[00368] Выбор донорской XY плюрипотентной или тотипотентной клетки, имеющей сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y, может привести к более высокой процентной доле F0 потомства, которое представляет собой XY животных с женским фенотипом, более высокой процентной доле F0 потомства, которое представляет собой XY животных с женским фенотипом, являющихся фертильными, более высокой процентной доле F0 XY потомства, которое представляет собой XY животных с женским фенотипом, являющихся фертильными, более высокой процентной доле F0 XY самок, являющихся фертильными, большему среднему числу пометов, производимых в течение жизни F0 XY самками или фертильными F0 XY самками, и большему среднему размеру пометов, производимых F0 XY самками или фертильными F0 XY самками. Такое F0 потомство может быть получено из донорских XY плюрипотентных или тотипотентных клеток животного после внесения клеток в эмбрион-хозяин и вынашивания эмбриона-хозяина с помощью способов, описанных в другом месте данного документа.
[00369] Повышение может представлять собой любое статистически значимое повышение по сравнению с соответствующим контролем. Например, повышение может составлять по меньшей мере 1,1 раза, 1,2 раза, 1,3 раза, 1,4 раза, 1,5 раза, 1,6 раза, 1,7 раза, 1,8 раза, 1,9 раза, 2 раза, 2,5 раза, 3 раза, 3,5 раза, 4 раза, 4,5 раза или 5 раз по сравнению с соответствующим контролем.
[00370] Например, процентная доля F0 потомства или F0 XY потомства, которое представляет собой XY животных с женским фенотипом, может быть повышена путем выбора донорской XY плюрипотентной или тотипотентной клетки животного, имеющей сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y. В некоторых способах процентная доля F0 потомства или F0 XY потомства, которая представляет собой фертильных XY животных с женским фенотипом, выше для F0 потомства, полученного из донорских XY плюрипотентных или тотипотентных клеток животных, имеющих сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y, по сравнению с F0 потомством, полученным из XY плюрипотентных или тотипотентных клеток животных, имеющих более высокую экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y.
[00371] Процентная доля F0 потомства или F0 XY потомства, которое представляет собой фертильных XY животных с женским фенотипом, также может быть повышена путем выбора донорской XY плюрипотентной или тотипотентной клетки животного, имеющей сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y. В некоторых способах процентная доля F0 потомства или F0 XY потомства, которая представляет собой фертильных XY животных с женским фенотипом, выше для F0 потомства, полученного из донорских XY плюрипотентных или тотипотентных клеток животных, имеющих сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y, по сравнению с F0 потомством, полученным из XY плюрипотентных или тотипотентных клеток животных, имеющих более высокую экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y.
[00372] Процентная доля F0 XY самок, являющихся фертильными, также может быть повышена путем выбора донорской XY плюрипотентной или тотипотентной клетки животного, имеющей сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y. В некоторых способах процентная доля F0 XY самок, являющихся фертильными, выше для F0 XY потомства, полученного из донорских XY плюрипотентных или тотипотентных клеток животных, имеющих сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y, по сравнению с F0 XY потомством, полученным из XY плюрипотентных или тотипотентных клеток животных, имеющих более высокую экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y.
[00373] Процентная доля F0 XY самок, способных производить нормальное число пометов и/или нормальный размер пометов (например, по сравнению с самками животных дикого типа), также может быть повышена путем выбора донорской XY плюрипотентной или тотипотентной клетки животного, имеющей сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y. В некоторых способах процентная доля F0 XY самок, которые способны производить нормальное число пометов и/или нормальный размер пометов, выше для F0 XY потомства, полученного из донорских XY плюрипотентных или тотипотентных клеток животных, имеющих сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y, по сравнению с F0 XY потомством, полученным из XY плюрипотентных или тотипотентных клеток животных, имеющих более высокую экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y.
[00374] Средний размер помета, производимого F0 XY самками или фертильными F0 XY самками, также может быть повышен путем выбора донорской XY плюрипотентной или тотипотентной клетки животного, имеющей сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y. В некоторых способах средний размер помета, производимого F0 XY самками или фертильными F0 XY самками, выше для F0 XY самок или фертильных F0 XY самок, полученных из донорских XY плюрипотентных или тотипотентных клеток животных, имеющих сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y, по сравнению с F0 XY самками или фертильными F0 XY самками, полученными из XY плюрипотентных или тотипотентных клеток животных, имеющих более высокую экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y.
[00375] Среднее число пометов, производимое на протяжении жизни F0 XY самками или фертильными F0 XY самками, также может быть повышено путем выбора донорской XY плюрипотентной или тотипотентной клетки животного, имеющей сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y. В некоторых способах среднее число пометов, производимое на протяжении жизни F0 XY самками или фертильными F0 XY самками, выше для F0 XY самок или фертильных F0 XY самок, полученных из донорских XY плюрипотентных или тотипотентных клеток животных, имеющих сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y, по сравнению с F0 XY самками или фертильными F0 XY самками, полученными из XY плюрипотентных или тотипотентных клеток животных, имеющих более высокую экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y.
[00376] Среднее число потомков, производимое на протяжении жизни F0 XY самками или фертильными F0 XY самками, также может быть повышено путем выбора донорской XY плюрипотентной или тотипотентной клетки животного, имеющей сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y. В некоторых способах среднее число потомков, производимое на протяжении жизни F0 XY самками или фертильными F0 XY самками, выше для F0 XY самок или фертильных F0 XY самок, полученных из донорских XY плюрипотентных или тотипотентных клеток животных, имеющих сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y, по сравнению с F0 XY самками или фертильными F0 XY самками, полученными из XY плюрипотентных или тотипотентных клеток животных, имеющих более высокую экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y.
V. Способы оптимизации концентрации компонентов в феминизирующей среде
[00377] Предложены способы и композиции для оптимизации концентрации компонента в феминизирующей среде для повышения феминизирующей активности на XY плюрипотентную или тотипотентную клетку животного или ее клон (т.е. повышения предрасположенности клетки или клона к тому, чтобы давать фертильных XY животных с женским фенотипом в поколении F0). Предрасположенность клонов XY плюрипотентных или тотипотентных клеток животных к тому, чтобы давать фертильных XY животных с женским фенотипом в поколении F0, обратно коррелирует с экспрессией или активностью Ddx3y, Uty и Eif2s3y в этих клонах. Прекращение экспрессии одного или более из этих генов в XY плюрипотентных или тотипотентных клетках животных (например, XY ЭС клетках) может спрогнозировать, какие клеточные клоны будут давать XY самок животных в поколении F0: чем сильнее наблюдаемый сайленсинг Ddx3y, Uty и Eif2s3y, тем выше предрасположенность клона XY ЭС клетки к тому, чтобы давать фертильных XY животных с женским фенотипом в поколении F0 (смотрите, например, Пример 3). Аналогично, прекращение активности или снижение экспрессии и/или активности одного или более из этих генов в XY плюрипотентных или тотипотентных клетках животных (например, XY ЭС клетках) может спрогнозировать, какие клеточные клоны будут давать XY самок животных в поколении F0: чем ниже наблюдаемая экспрессия Ddx3y, Uty и Eif2s3y, тем выше предрасположенность клона XY ЭС клетки к тому, чтобы давать фертильных XY животных с женским фенотипом в поколении F0 (смотрите, например, Пример 3). Другими словами, экспрессия и/или активность одного или более из этих генов может служить суррогатным маркером для прогнозирования получения XY самок.
[00378] Эту информацию можно использовать для исследования оптимальных концентраций компонентов среды, которые имеют повышенное феминизирующее действие и позволяют получать XY плюрипотентные или тотипотентные клетки животных, имеющие высокую предрасположенность к тому, чтобы давать фертильных XY животных с женским фенотипом в поколении F0. Например, такой способ может включать культивирование первой популяции и второй популяции XY плюрипотентных или тотипотентных клеток отличного от человека животного в среде, содержащей основную среду и добавки, подходящие для поддержания плюрипотентности или тотипотентности клеток, причем первую популяцию культивируют в присутствии первой концентрации целевого компонента среды, а вторую популяцию культивируют в присутствии второй концентрации целевого компонента среды, которая отличается от первой концентрации. Первая концентрация может быть выше или ниже, чем вторая концентрация. Способ может дополнительно включать анализ одной или более XY плюрипотентных или тотипотентных клеток отличного от человека животного в каждой из первой и второй популяций в отношении экспрессии и/или активности одного или более из Ddx3y, Uty и Eif2s3y. Затем может быть выбрана первая концентрация, если происходит снижение экспрессии и/или активности одного или более из Ddx3y, Uty и Eif2s3y в одной или более клетках из первой популяции по сравнению с одной или более клетками из второй популяции. Может происходить снижение экспрессии и/или активности Ddx3y, Uty, Eif2s3y, Ddx3y и Uty, Ddx3y и Eif2s3y, Uty и Eif2s3y или Ddx3y, Uty и Eif2s3y.
[00379] Примеры компонентов среды, чьи концентрации можно менять, включают соли щелочного металла и галида (например, хлорид натрия), соли карбоновой кислоты (например, бикарбонат натрия), глюкозу, фетальную бычью сыворотку (ФБС), глутамин, антибиотик(-и), пенициллин и стрептомицин (например, пенстреп), пируватные соли (например, пируват натрия), заменимые аминокислоты (например, MEM NEAA), 2-меркаптоэтанол и фактор, ингибирующий лейкемию (LIF). Другие компоненты среды, чьи концентрации можно менять, перечислены в Таблице 1. Типичные компоненты среды более подробно обсуждаются в другом месте данного документа.
[00380] Первую популяцию клеток можно культивировать в присутствии целевого соединения в течение любого времени. В качестве примера первую популяцию клеток можно культивировать в присутствии целевого соединения в течение по меньшей мере 1 суток, 2 суток, 3 суток, 4 суток, 5 суток, 6 суток, 7 суток, 8 суток, 9 суток, 10 суток, 11 суток, 12 суток, 13 суток, 2 недель, 3 недель или 4 недель перед анализом.
[00381] Среда может представлять собой среду, достаточную для поддержания плюрипотентности или тотипотентности клеток, но без изменения способности клеток давать фертильное потомство женского пола. В альтернативном варианте среда может представлять собой феминизирующую среду. Феминизирующая среда (например, основная среда и добавки, подходящие для поддержания XY плюрипотентных или тотипотентных клеток животных в культуре, причем основная среда или среда, содержащая основную среду и добавки, имеет осмоляльность от около 200 мОсм/кг до менее чем около 329 мОсм/кг) и способы поддержания клеток в такой среде описаны в другом месте данного документа.
[00382] Феминизирующую активность первой концентрации компонента среды можно определять множеством способов. Например, первая концентрация может быть выбрана, если в клетках из первой популяции отсутствует экспрессия и/или активность одного или более из Ddx3y, Uty и Eif2s3y. В альтернативном варианте первая концентрация может быть выбрана, если клетки из первой популяции имеют сниженную экспрессию и/или активность всех из Ddx3y, Uty и Eif2s3y по сравнению с клетками из второй популяции. В альтернативном варианте первая концентрация может быть выбрана, если в клетках из первой популяции отсутствует экспрессия и/или активность всех из Ddx3y, Uty и Eif2s3y. Способы оценки экспрессии и/или активности дополнительно подробно обсуждаются ниже.
[00383] Некоторые способы скрининга могут дополнительно включать выбор донорской XY плюрипотентной или тотипотентной клетки отличного от человека млекопитающего из первой популяции для получения фертильного XY отличного от человека млекопитающего с женским фенотипом в поколении F0 на основании экспрессии и/или активности одного или более из Ddx3y, Uty и Eif2s3y, причем доля фертильных XY отличных от человека млекопитающих с женским фенотипом в поколении F0 обратно пропорционально экспрессии и/или активности одного или более из Ddx3y, Uty и Eif2s3y.
[00384] Затем донорскую XY плюрипотентную или тотипотентную клетку животного можно вносить в эмбрион-хозяин, причем эмбрион-хозяин способен давать фертильное XY животное с женским фенотипом в поколении F0. Например, эмбрион-хозяин может представлять собой эмбрион на стадии пре-морулы и эмбрион-хозяин можно культивировать до стадии бластоцисты после внесения донорской XY плюрипотентной или тотипотентной клетки животного. Животные, эмбрионы, способы внесения XY плюрипотентных или тотипотентных клеток животных в эмбрионы и способы получения F0 животных описаны в другом месте данного документа.
[00385] XY плюрипотентные или тотипотентные клетки животных можно поддерживать в среде в течение различных периодов времени перед этапом анализа и/или перед внесением в эмбрион-хозяин. Например, XY плюрипотентную или тотипотентную клетку животного можно поддерживать в феминизирующей среде в течение по меньшей мере 1 суток, 2 суток, 3 суток, 4 суток, 5 суток, 6 суток, 7 суток, 8 суток, 9 суток, 10 суток, 11 суток, 12 суток, 13 суток, 2 недель, 3 недель или 4 недель перед этапом анализа и/или внесением в эмбрион-хозяин. В альтернативном варианте XY плюрипотентную или тотипотентную клетку животного можно поддерживать в феминизирующей среде в течение не более чем 1 суток, 2 суток, 3 суток, 4 суток, 5 суток, 6 суток, 7 суток, 8 суток, 9 суток, 10 суток, 11 суток, 12 суток, 13 суток, 2 недель, 3 недель или 4 недель перед этапом анализа и/или внесением в эмбрион-хозяин. В некоторых способах XY плюрипотентную или тотипотентную клетку культивируют или поддерживают в феминизирующей среде до проведения инъекции клетки в эмбрион. В других способах эмбрион, в который инъецировали XY плюрипотентную или тотипотентную клетку, культивируют или поддерживают в феминизирующей среде до переноса в организм суррогатной матери.
[00386] Донорскую клетку можно выбирать после анализа одной или более клеток из первой популяции в отношении экспрессии или активности одного или более из Ddx3y, Uty и Eif2s3y. Этап анализа может включать анализ самой клетки или самого клона и определение уровня экспрессии или активности для одного или более из Ddx3y, Uty и Eif2s3y. В альтернативном варианте этап анализа может включать анализ нескольких субклонов, полученных из клона, и определение, например, процентной доли субклонов, имеющих сниженную экспрессию и/или активность, или в которых отсутствует экспрессия и/или активность одного или более из Ddx3y, Uty и Eif2s3y. В альтернативном варианте этап анализа может включать анализ нескольких субклонов, полученных из клона, и определение сравнительной экспрессии и/или активности одного или более из Ddx3y, Uty и Eif2s3y среди субклонов. Может происходить снижение экспрессии и/или активности одного или более из Ddx3y, Uty и Eif2s3y или может происходить снижение экспрессии и/или активности всех из Ddx3y, Uty и Eif2s3y. В альтернативном варианте в XY плюрипотентной или тотипотентной клетке животного отсутствует экспрессия и/или активность одного или более из Ddx3y, Uty и Eif2s3y или отсутствует экспрессия и/или активность всех из Ddx3y, Uty и Eif2s3y. Например, может отсутствовать выявляемая экспрессия всех из Ddx3y, Uty и Eif2s3y.
[00387] Экспрессию можно оценивать на уровне белка или на уровне мРНК. Уровень экспрессии полипептида можно определять прямым образом, например, путем анализа уровня полипептида в клетке или организме (например, анализа методом вестерн-блоттинга, анализа FACS, ELISA), или непрямым образом, например, путем определения активности полипептида. В других случаях снижение экспрессии и/или активности гена можно определить, применяя способы, которые включают, например, анализ методом саузерн-блоттинга, секвенирование ДНК, ПЦР-анализ, анализ методом нозерн-блоттинга, количественный ОТ-ПЦР-анализ, секвенирование нового поколения (NGS), микроматричный анализ или фенотипический анализ. Например, экспрессию гена можно оценивать путем измерения уровней мРНК методом ОТ-ПЦР, РНК-секвенирования, цифровой ПЦР или любым другим подходящим методом для измерения уровней мРНК. В одном примере можно проводить измерение уровней РНК методом ОТ-ПЦР относительно контрольного гена, такого как B2m. В некоторых случаях, например, ΔCt между контрольным геном (например, B2m) и целевым геном может составлять по меньшей мере 2, по меньшей мере 4, по меньшей мере 6 или по меньшей мере 8. Аналогично, в некоторых случаях через 30, 31, 32, 33, 34, 35, 36, 37, 38, 39 или 40 циклов будет отсутствовать выявляемая РНК для целевого гена.
[00388] Необязательно, при измерении уровней экспрессии мРНК или полипептида можно проводить контрольный эксперимент для подтверждения присутствия Y-хромосомы. Например, можно проводить анализ числа копий TAQMAN®, чтобы подтвердить присутствие одной копии Y-хромосомы, используя зонды к разным геномным последовательностям в Y-хромосоме. Такие методы анализа хорошо известны и разработаны для определения вариации числа копий в пределах генома.
[00389] Снижение экспрессии или активности гена или белка, который он кодирует, в исследуемой клетке, эмбрионе или животном может включать любое статистически значимое уменьшение уровней экспрессии или активности по сравнению с соответствующей контрольной клеткой, эмбрионом или животным, или популяцией контрольных клеток, эмбрионов или животных. В общем случае снижение экспрессии или активности происходит, если экспрессия или активность статистически ниже, чем экспрессия или активность в соответствующей контрольной клетке, эмбрионе или полученном из них животном (например, XY плюрипотентной клетке животного), которые культивировали в соответствующей контрольной среде, не являющейся феминизирующей средой, XY плюрипотентной клетке животного, которая исторически дает исключительно самцов мышей, несмотря на культивирование в феминизирующей среде. Такое снижение включает уменьшение по меньшей мере на 1%, 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 99% или более по сравнению с контрольной клеткой. Статистически значимый означает р≤0,05. Снижение экспрессии или активности может происходить посредством любого механизма на любой стадии. Например, снижение экспрессии может происходить посредством явлений или регуляции, которая происходит во время транскрипции, после транскрипции, во время трансляции или после трансляции.
[00390] «Исследуемая клетка» представляет собой клетку, которую культивировали в феминизирующей среде (например, среде с низкой осмоляльностью), или клетку, которая происходит от клетки, культивируемой в феминизирующей среде. «Контроль» или «контрольная клетка» обеспечивает эталонный показатель для определения изменений в фенотипе исследуемой клетки. Контрольная клетка предпочтительно насколько это возможно близко совпадает с исследуемой клеткой (например, соответствующие клетки могут происходить из одной линии клеток или одного клона клеток, или могут иметь одинаковый генотип), за исключением того, что ее не культивировали в феминизирующей среде или у нее отсутствует способность или наблюдается сниженная способность к тому, чтобы давать XY самок мышей, несмотря на культивирование в феминизирующей среде. Например, контрольная клетка может содержать: (а) клетку, имеющую такой же генотип, или которая происходит из одной линии клеток или одного клона, что и исследуемая клетка, но которую культивировали в соответствующей контрольной среде, не являющейся феминизирующей средой (например, DMEM или среде другого типа, которая является достаточной для поддержания плюрипотентности или тотипотентности XY плюрипотентной или тотипотентной клетки, но не для изменения клетки путем придания ей способности давать фертильное потомство женского пола); (b) XY плюрипотентную или тотипотентную клетку животного, генетически идентичную исследуемой клетке или полученную из одной линии клеток или одного клона, но которая генетически не изменена или не подвергнута условиям или стимулу, которые бы обеспечили потенциальную возможность получения фертильных XY самок животных; и (с) XY плюрипотентную или тотипотентную клетку животного, культивируемую в феминизирующей среде (например, среде с низкой осмоляльностью), но которая исторически дает исключительно самцов животных, несмотря на культивирование в феминизирующей среде. Например, контрольная клетка может представлять собой XY плюрипотентную или тотипотентную клетку, которую культивировали в среде, достаточной для поддержания плюрипотентности или тотипотентности клетки, но не для изменения способности клетки давать фертильное потомство женского пола. Необязательно, снижение экспрессии и/или активности можно оценивать относительно контрольной XY плюрипотентной или тотипотентной клетки отличного от человека животного из второй популяции.
[00391] В некоторых экспериментах две или более клеток или клонов в первой популяции анализируют в отношении экспрессии и/или активности одного или более из Ddx3y, Uty и Eif2s3y. Клетка или клон с самой низкой экспрессией и/или активностью одного или более из Ddx3y, Uty и Eif2s3y затем может быть выбрана, чтобы служить донорской XY плюрипотентной или тотипотентной клеткой животного или ее клоном, причем донорская XY плюрипотентная или тотипотентная клетка животного способна давать фертильное XY животное с женским фенотипом в поколении F0.
[00392] Выбор донорской XY плюрипотентной или тотипотентной клетки, имеющей сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y, может привести к более высокой процентной доле F0 потомства, которое представляет собой XY животных с женским фенотипом, более высокой процентной доле F0 потомства, которое представляет собой XY животных с женским фенотипом, являющихся фертильными, более высокой процентной доле F0 XY потомства, которое представляет собой XY животных с женским фенотипом, являющихся фертильными, более высокой процентной доле F0 XY самок, являющихся фертильными, большему среднему числу пометов, производимых в течение жизни F0 XY самками или фертильными F0 XY самками, и большему среднему размеру пометов, производимых F0 XY самками или фертильными F0 XY самками. Такое F0 потомство может быть получено из донорских XY плюрипотентных или тотипотентных клеток животного после внесения клеток в эмбрион-хозяин и вынашивания эмбриона-хозяина с помощью способов, описанных в другом месте данного документа.
[00393] Повышение может представлять собой любое статистически значимое повышение по сравнению с соответствующим контролем. Например, повышение может составлять по меньшей мере 1,1 раза, 1,2 раза, 1,3 раза, 1,4 раза, 1,5 раза, 1,6 раза, 1,7 раза, 1,8 раза, 1,9 раза, 2 раза, 2,5 раза, 3 раза, 3,5 раза, 4 раза, 4,5 раза или 5 раз по сравнению с соответствующим контролем.
[00394] Например, процентная доля F0 потомства или F0 XY потомства, которое представляет собой XY животных с женским фенотипом, может быть повышена путем выбора донорской XY плюрипотентной или тотипотентной клетки животного, имеющей сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y. В некоторых способах процентная доля F0 потомства или F0 XY потомства, которая представляет собой фертильных XY животных с женским фенотипом, выше для F0 потомства, полученного из донорских XY плюрипотентных или тотипотентных клеток животных, имеющих сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y, по сравнению с F0 потомством, полученным из XY плюрипотентных или тотипотентных клеток животных, имеющих более высокую экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y.
[00395] Процентная доля F0 потомства или F0 XY потомства, которое представляет собой фертильных XY животных с женским фенотипом, также может быть повышена путем выбора донорской XY плюрипотентной или тотипотентной клетки животного, имеющей сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y. В некоторых способах процентная доля F0 потомства или F0 XY потомства, которая представляет собой фертильных XY животных с женским фенотипом, выше для F0 потомства, полученного из донорских XY плюрипотентных или тотипотентных клеток животных, имеющих сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y, по сравнению с F0 потомством, полученным из XY плюрипотентных или тотипотентных клеток животных, имеющих более высокую экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y.
[00396] Процентная доля F0 XY самок, являющихся фертильными, также может быть повышена путем выбора донорской XY плюрипотентной или тотипотентной клетки животного, имеющей сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y. В некоторых способах процентная доля F0 XY самок, являющихся фертильными, выше для F0 XY потомства, полученного из донорских XY плюрипотентных или тотипотентных клеток животных, имеющих сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y, по сравнению с F0 XY потомством, полученным из XY плюрипотентных или тотипотентных клеток животных, имеющих более высокую экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y.
[00397] Процентная доля F0 XY самок, способных производить нормальное число пометов и/или пометы нормальных размеров (например, по сравнению с самками животных дикого типа), также может быть повышена путем выбора донорской XY плюрипотентной или тотипотентной клетки животного, имеющей сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y. В некоторых способах процентная доля F0 XY самок, которые способны производить нормальное число пометов и/или пометы нормальных размеров, выше для F0 XY потомства, полученного из донорских XY плюрипотентных или тотипотентных клеток животных, имеющих сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y, по сравнению с F0 XY потомством, полученным из XY плюрипотентных или тотипотентных клеток животных, имеющих более высокую экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y.
[00398] Средний размер помета, производимого F0 XY самками или фертильными F0 XY самками, также может быть повышен путем выбора донорской XY плюрипотентной или тотипотентной клетки животного, имеющей сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y. В некоторых способах средний размер помета, производимого F0 XY самками или фертильными F0 XY самками, выше для F0 XY самок или фертильных F0 XY самок, полученных из донорских XY плюрипотентных или тотипотентных клеток животных, имеющих сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y, по сравнению с F0 XY самками или фертильными F0 XY самками, полученными из XY плюрипотентных или тотипотентных клеток животных, имеющих более высокую экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y.
[00399] Среднее число пометов, производимое на протяжении жизни F0 XY самками или фертильными F0 XY самками, также может быть повышено путем выбора донорской XY плюрипотентной или тотипотентной клетки животного, имеющей сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y. В некоторых способах среднее число пометов, производимое на протяжении жизни F0 XY самками или фертильными F0 XY самками, выше для F0 XY самок или фертильных F0 XY самок, полученных из донорских XY плюрипотентных или тотипотентных клеток животных, имеющих сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y, по сравнению с F0 XY самками или фертильными F0 XY самками, полученными из XY плюрипотентных или тотипотентных клеток животных, имеющих более высокую экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y.
[00400] Среднее число потомков, производимое на протяжении жизни F0 XY самками или фертильными F0 XY самками, также может быть повышено путем выбора донорской XY плюрипотентной или тотипотентной клетки животного, имеющей сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y. В некоторых способах среднее число потомков, производимое на протяжении жизни F0 XY самками или фертильными F0 XY самками, выше для F0 XY самок или фертильных F0 XY самок, полученных из донорских XY плюрипотентных или тотипотентных клеток животных, имеющих сниженную экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y, по сравнению с F0 XY самками или фертильными F0 XY самками, полученными из XY плюрипотентных или тотипотентных клеток животных, имеющих более высокую экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y.
V. Другие применения
[00401] Также предложены способы и композиции для сайленсинга области Y-хромосомы в XY плюрипотентной или тотипотентной клетке животного (или полученных из нее in vitro клеточных культурах, эмбрионах или животных) путем поддержания XY плюрипотентной или тотипотентной клетки животного в феминизирующей среде (например, среде с низкой осмоляльностью), описанной в другом месте данного документа, и анализа XY плюрипотентной или тотипотентной клетки для определения сайленсинга области Y-хромосомы. Такие способы можно применять, например, в контексте, в котором направленную модификацию использовали бы для снижения или элиминирования экспрессии гена (например, нокаут для ингибирования активности белка, кодируемого геном). Сайленсинг путем культивирования в феминизирующей среде требует намного меньшего времени, чем создание конкретных направленных модификаций, и, следовательно, является более эффективным средством достижения сайленсинга.
[00402] Примеры феминизирующих сред, а также их компонентов и характеристик описаны в другом месте данного документа. Аналогично, примеры тайминга и времени культивирования XY плюрипотентных или тотипотентных клеток в феминизирующей среде описаны в другом месте данного документа.
[00403] Культивирование в феминизирующей среде приводит к репрессии или сайленсингу генов Y-хромосомы. Например, может происходить сайленсинг области Y-хромосомы, например всего или части короткого плеча Y-хромосомы. Сайленсинг в коротком плече Y-хромосомы может простираться до ключевого регулятора пути определения мужского пола, гена Sry, который не экспрессируется в достаточной степени в надлежащее время Е11-Е12 во время развития мышиного эмбриона, что приводит к экспрессии программы определения женского пола в бипотенциальном половом тяже (смотрите Пример 1 и ФИГ. 2A-D). Также может отсутствовать экспрессия других генов, таких как Ddx3y и Eif2s3y (смотрите Пример 1 и ФИГ. 3 и 4). После этого эмбрион с измененным полом может развиваться до рождения (поколение F0) как самка и затем вырастать в нормальную, фертильную самку мыши, несмотря на генотип XY. В некоторых способах индуцированный феминизирующей средой сайленсинг Y-хромосомы не является перманентным генетическим изменением и не сохраняется в поколении F1 (т.е. в поколении F1 от F0 XY самок отсутствуют самки XY).
[00404] Другие области Y-хромосомы, сайленсинг которых можно осуществлять с помощью феминизирующей среды, в дополнение к, в пределах или включая все или часть малого плеча Y-хромосомы, описаны в другом месте данного документа. Области, в которых осуществляется сайленсинг, также могут включать длинное плечо (Yq), в частности, другие гены в Y-хромосоме, необходимые для сперматогенеза. Например, область может содержать всю или часть области Sxra (например, часть, содержащую ген Sry) и/или область может содержать всю или часть области Sxrb region (например, часть, содержащую ген Zfy2) мышиной Y-хромосомы (смотрите Фиг. 1А) или соответствующую область Y-хромосом от других видов (например, области AZFa, AZFb или AZFc человеческой Y-хромосомы). Например, область может содержать части областей или полные области Sxra и Sxrb. Границами области Sxrb, например, являются Zfy1 и Zfy2 (смотрите Фиг. 1А и Mazeyrat et al. (1998) Human Molecular Genetics 7(11): 1713-1724, в полном объеме включенную посредством ссылки во всех смыслах). Соответствующие области от других видов животных включают области, содержащие один или более генов, являющихся ортологичными или гомологичными генам в области в мышиной Y-хромосоме. Например, область AZFa человеческой области соответствует области Sxrb мышиной Y-хромосомы, в которой каждая область содержит Uty, Dby (Ddx3y) и Dffry (Usp9y). Смотрите, например, Affara (2001) Expert Rev. Mol. Med., Jan. 3; 2001: 1-16; Mazeyrat et al. (1998) Human Molecular Genetics 7(11);1713-1724; и Sargent et al. (1999) J. Med. Genet. 36:370-377, которые все в полном объеме включены посредством ссылки во всех смыслах. Указанная область также может содержать всю или часть области Smy или области Spy (смотрите Фиг. 1А и Affara (2001) Expert Rev. Mol. Med., Jan. 3; 2001: 1-16). Аналогично, область может содержать всю или часть одного или более из интервала делеции 1, интервала делеции 2, интервала делеции 3, интервала делеции 4, интервала делеции 5, интервала делеции 6 и интервала делеции 7 мышиной Y-хромосомы или соответствующие области Y-хромосом от других видов животных (смотрите, например, Фиг. 1А и Affara (2001) Expert Rev. Mol. Med., Jan. 3; 2001: 1-16). Например, область может содержать всю или часть одного или более из интервала делеции 1, интервала делеции 2 и интервала делеции 3 мышиной Y-хромосомы или соответствующие области Y-хромосом от других видов животных (смотрите, например, Фиг. 1А). В одном примере область может содержать интервал делеции 2 и интервал делеции 3 или часть интервала делеции 2 и часть интервала делеции 3.
[00405] Указанная области может включать одно или более из кластера Rbmy, H2al2y, Sry, Zfy2, Usp9y, Ddx3y, Uty, Tspy-ps, Eif2s3y, Kdm5d, Uba1y или Zfy1. Указанная область может быть теломерной в отношении кластера Rbmy или может быть центромерной или теломерной в отношении H2al2y, Sry, Zfy2, Usp9y, Ddx3y, Uty, Tspy-ps, Eif2s3y, Kdm5d, Uba1y или Zfy1. Например, область может содержать часть Y-хромосомы, теломерную в отношении Kdm5d или центромерную в отношении Uspy9y, или область может быть теломерной в отношении Zfy2, Sry или кластера Rbmy. Из указанной области могут быть исключены одно или более из кластера Rbmy, H2al2y, Sry, Zfy2, Usp9y, Ddx3y, Uty, Tspy-ps, Eif2s3y, Kdm5d, Uba1y или Zfy1. Например, из области могут быть исключены одно или более из кластера Rbmy, Zfy2 и Sry. Аналогично, область может включать часть Y-хромосомы за пределами одного или более из кластера Rbmy, H2al2y, Sry, Zfy2, Usp9y, Ddx3y, Uty, Tspy-ps, Eif2s3y, Kdm5d, Uba1y или Zfy1. Например, область может содержать часть Y-хромосомы за пределами одного или более из кластера Rbmy, Zfy2 и Sry.
[00406] Сайленсинг может снижать уровень и/или активность белка, кодируемого геном, расположенным в Y-хромосоме. Например, может быть снижен уровень и/или активность одного или более белков, кодируемых кластером Rbmy, H2al2y, Sry, Zfy2, Usp9y, Ddx3y, Uty, Tspy-ps, Eif2s3y, Kdm5d, Uba1y или Zfy1. В альтернативном варианте сайленсинг может приводить к элиминации экспрессии гена, расположенного в Y-хромосоме (т.е. ген не экспрессируется). В некоторых способах, например, при сайленсинге не экспрессируются одно или более из кластера Rbmy, H2al2y, Sry, Zfy2, Usp9y, Ddx3y, Uty, Tspy-ps, Eif2s3y, Kdm5d, Uba1y или Zfy1. В некоторых способах снижается уровень и/или активность одного или более белков, кодируемых Ddx3y, Eif2s3y, Zfy2 и Sry, или не экспрессируются один или более из Ddx3y, Eif2s3y, Zfy2 и Sry.
[00407] Снижение экспрессии или активности в клетке субъекта, эмбрионе или у животного может включать любое статистически значимое снижение уровней экспрессии или активности по сравнению с соответствующей контрольной клеткой, эмбрионом или животным. В общем случае снижение экспрессии или активности происходит, если экспрессия или активность статистически ниже, чем экспрессия или активность в соответствующей контрольной клетке, эмбрионе или полученном из них животном (например, XY плюрипотентной клетке животного), которые культивировали в соответствующей контрольной среде, не являющейся феминизирующей средой, XY плюрипотентной клетке животного, которая исторически дает исключительно самцов мышей, несмотря на культивирование в феминизирующей среде. Такое снижение включает уменьшение по меньшей мере на 1%, 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 99% или более по сравнению с контрольной клеткой. Статистически значимый означает р≤0,05.
[00408] «Исследуемая клетка» представляет собой клетку, которую культивировали в феминизирующей среде (например, среде с низкой осмоляльностью), или клетку, которая происходит от клетки, культивируемой в феминизирующей среде. «Контроль» или «контрольная клетка» обеспечивает эталонный показатель для определения изменений в фенотипе исследуемой клетки. Контрольная клетка предпочтительно насколько это возможно близко совпадает с исследуемой клеткой (например, соответствующие клетки могут происходить из одной линии клеток или одного клона клеток, или могут иметь одинаковый генотип), за исключением того, что ее не культивировали в феминизирующей среде или у нее отсутствует способность или наблюдается сниженная способность к тому, чтобы давать XY самок мышей, несмотря на культивирование в феминизирующей среде. Например, контрольная клетка может содержать: (а) клетку, имеющую такой же генотип, или которая происходит из одной линии клеток или одного клона, что и исследуемая клетка, но которую культивировали в соответствующей контрольной среде, не являющейся феминизирующей средой (например, DMEM или среде другого типа, которая является достаточной для поддержания плюрипотентности или тотипотентности XY плюрипотентной или тотипотентной клетки, но не для изменения клетки путем придания ей способности давать фертильное потомство женского пола); (b) XY плюрипотентную или тотипотентную клетку животного, генетически идентичную исследуемой клетке или полученную из одной линии клеток или одного клона, но которая генетически не изменена или не подвергнута условиям или стимулу, которые бы обеспечили потенциальную возможность получения фертильных XY самок животных; и (с) XY плюрипотентную или тотипотентную клетку животного, культивируемую в феминизирующей среде (например, среде с низкой осмоляльностью), но которая исторически дает исключительно самцов животных, несмотря на культивирование в феминизирующей среде.
[00409] Снижение экспрессии или активности может происходить посредством любого механизма на любой стадии. Например, снижение экспрессии может происходить посредством модификаций, прямым или непрямым образом осуществленных в области, или посредством явлений или регуляции, которая происходит во время транскрипции, после транскрипции, во время трансляции или после трансляции.
[00410] Хотя для практической реализации не требуется понимание механизма, изменения в хроматине и/или повышение уровней фосфорилированной формы варианта гистона γН2АХ в Y-хромосоме могут вносить свой вклад в сайленсинг. Известно, что фосфорилированный гистон γН2АХ связан с репрессией транскрипции и связан с репрессией транскрипции X и Y-хромосом в организме XY пола во время мейотической профазы. Смотрите, например, Alton et al. (2008) Reproduction 135:241-252.
[00411] Сайленсинг может возникать, когда XY плюрипотентную или тотипотентную клетку культивируют, после того, как донорскую XY плюрипотентную или тотипотентную клетку вносят в эмбрион-хозяин, или после того, как эмбрион-хозяин, содержащий донорскую XY плюрипотентную или тотипотентную клетку, вносят в организм реципиентной самки. Сайленсинг также может возникать во время разных стадий эмбрионального развития или в течение эмбрионального развития. В некоторых случаях сайленсинг продолжается после рождения. Например, после оплодотворения ооцита некоторая степень сайленсинга может сохраняться в течение первых двух клеточных делений. Изменение пола, вызванное сайленсингом, также может передаваться потомству F1. Некоторые примеры периодов, в течение которых может возникать сайленсинг, включают одно или более из следующего: (1) во время эмбрионального развития, когда запускается программа определения мужского пола; (2) во время эмбрионального развития вплоть до, по меньшей мере, стадии развития, соответствующей E11-E12 у мышей (например, стадий развития, важных для определения пола или изменения пола); (3) во время эмбрионального развития вплоть до, по меньшей мере, стадии развития, соответствующей Е17-Е19 у мышей (например, стадий развития, важных для фертильности в эмбриональный ооцитах); (4) в течение всего периода оогенеза; (5) во время мейотической профазы развития ооцитов, которая инициируется в эмбрионе непосредственно перед рождением; (6) во время оплодотворения ооцита (например, во время его первых двух клеточных делений; или (7) в ооцитах после овуляции в течение первых двух клеточных делений после оплодотворения.
[00412] Для анализа клетки в отношении сайленсинга области Y-хромосомы можно использовать любые средства, известные в данной области техники. Например, гены в пределах области, для которой был осуществлен сайленсинг, могут не экспрессироваться (например, экспрессия элиминирована или в клетке отсутствует выявляемая экспрессия гена). Ген не экспрессируется, если не происходит транскрипция гена или если отсутствуют выявляемые уровни продуктов гена (например, мРНК или белка) согласно обычным методам, известным в данной области техники. Уровень экспрессии полипептида можно определять прямым образом, например, путем анализа уровня полипептида в клетке или организме (например, анализа методом вестерн-блоттинга, анализа FACS, ELISA), или непрямым образом, например, путем определения активности полипептида. В других случаях снижение экспрессии и/или активности гена можно определить, применяя способы, которые включают, например, анализ методом саузерн-блоттинга, секвенирование ДНК, ПЦР-анализ, анализ методом нозерн-блоттинга, количественный ОТ-ПЦР-анализ, секвенирование нового поколения (NGS), микроматричный анализ или фенотипический анализ. Анализ также может включать определение, в каких областях, подобластях или генах Y-хромосомы был осуществлен сайленсинг.
[00413] Все патентные заявки, веб-страницы, другие публикации, номера доступа и тому подобное, цитируемые выше или ниже, в полном объеме включены посредством ссылки во всех смыслах в той же степени, как если бы для каждого отдельного пункта было специально и отдельно указано, что он в полном объеме включен посредством ссылки во всех смыслах. Если разным версиям последовательности присвоен номер доступа в разное время, значение имеет версия, которой присвоен номер доступа на момент действительной даты подачи этой заявки. Действительная дата подачи заявки означает ранее фактической даты подачи или дату подачи приоритетной заявки, ссылающейся на номер доступа, в соответствующих случаях. Аналогично, если разные версии публикации, веб-страницы и тому подобного опубликованы в разное время, значение имеет самая последняя опубликованная версия на момент действительной даты подачи заявки, если не указано иное. Любой признак, этап, элемент, вариант реализации или аспект изобретения можно использовать в комбинации с любым другим, если специально не указано иное. Хотя настоящее изобретение было описано с некоторыми подробностями посредством иллюстрации и примера в целях ясности и понимания, должно быть очевидно, что в пределах объема прилагаемой формулы изобретения возможна практическая реализация определенных изменений.
КРАТКОЕ ОПИСАНИЕ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
[00414] Нуклеотидные и аминокислотные последовательности, перечисленные в прилагающемся перечне последовательностей, приведены с применением стандартных буквенных обозначений нуклеотидных оснований и трехбуквенного кода для аминокислот. Нуклеотидные последовательности следуют стандартной конвенции, начинаясь в 5' конце последовательности и продолжаясь вперед (т.е. слева направо в каждой строке) к 3' концу. Показана только одна цепь каждого нуклеотида, но понятно, что комплементарная цепь включена посредством ссылки в показанную цепь. Аминокислотные последовательности следуют стандартной конвенции, начинаясь в амино-конце последовательности и продолжаясь вперед (т.е. слева направо в каждой строке) к карбокси-концу.
[00415]

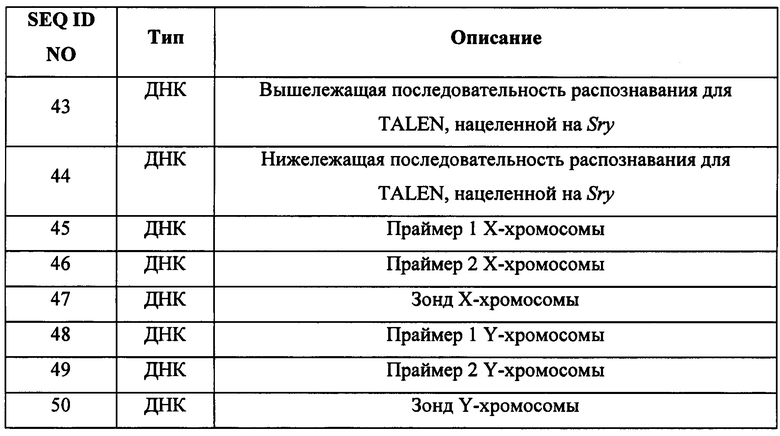
ПРИМЕРЫ
Пример 1. Создание фертильных и плодовитых F0 XY самок мышей из XY ЭС клеток.
Материалы и методы
[00416] Культура ЭС клеток Все описанные результаты были получены в экспериментах, проводимых с VGF1, нашей гибридной XY ЭС клеточной линией C57BL6NTac/129S6SvEv F1 (Poueymirou et al. (2007) Nat. Biotechnol. 25:91-99; Valenzuela et al. (2003) Nat. Biotechnol. 21:652-659). ЭС клетки культивировали, как было описано ранее (Matise et al. (2000) Production of targeted embryonic stem cell clones. B: Joyner AL (ed) Gene targeting: a practical approach. Oxford University press, New York, pp 101-132). Специально приготовленную среду DMEM с высоким содержанием глюкозы (LifeTech) с концентрацией NaHCO3, указанной в Таблице 3, дополняли 0,1 мМ заменимых аминокислот, 1 мМ пирувата натрия, 0,1 мМ 2-меркаптоэтанола, 4 мМ L-глутамина, 100 Е/мл пенициллина и 100 мкг/мл стрептомицина (Life Technologies), 15% ФБС (Hyclone) и 2000 Е/мл фактора, ингибирующего лейкемию (LIF, Millipore). Осмоляльность среды измеряли с помощью осмометра для одиночных образцов (Advanced Instruments, Inc., модель 3250). Для электропорации смешивали 1,5 мкг ДНК нацеливающего вектора, растворенной в 120 мкл буфера для электропорации (Millipore), с 7,5×106 ЭС клеток и переносили в многолуночный планшет ВТХ для электропорации (Harvard Apparatus). После электропорации клетки инкубировали на льду в течение 10 мин перед тем, как высевать в два 15 см желатинизированных планшета. Через 48 ч после электропорации добавляли селекционную среду и после этого меняли ее ежедневно. Колонии собирали через 10 дней после электропорации и переносили в отдельные лунки 96-луночного планшета, содержащие трипсин, после чего клетки высевали в желатинизированные 96-луночные планшеты. Через три дня клетки снова трипсинизировали и замораживали две трети содержимого каждой лунки, а оставшуюся одну треть переносили в новый планшет для экстракции ДНК.
[00417] Скрининг ЭС клеток, генотипирование мышей и подсчет X и Y хромосом.
Мы применяли метод потери аллеля (Frendewey et al. (2000) Methods Enzymol. 476:295-307), чтобы выявить клоны ЭС клеток, подвергнутые правильному направленному воздействию, и определить генотипы мышиных аллелей. Мы определяли число X и Y хромосом с помощью следующего анализа методом количественной ПЦР (кПЦР) TAQMAN® (Biosearch Technologies): для X, праймеры (5'-3')  (SEQ ID NO: 45) и
(SEQ ID NO: 45) и 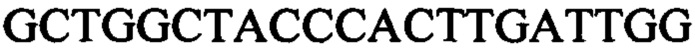 (SEQ ID NO: 46) и зонд
(SEQ ID NO: 46) и зонд  (SEQ ID NO: 47); и для Y, праймеры
(SEQ ID NO: 47); и для Y, праймеры  (SEQ ID NO: 48) и
(SEQ ID NO: 48) и 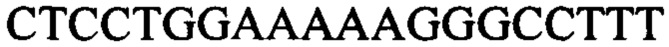 (SEQ ID NO: 49) и зонд
(SEQ ID NO: 49) и зонд 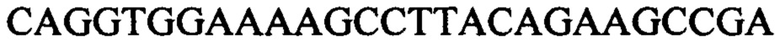 (SEQ ID NO: 50). Анализ методом кПЦР в отношении мутации альбинизма в гене тирозиназы, который несет линия Swiss Webster и который не присутствует в геноме ЭС клеток VGF1, позволил количественно оценить вклад эмбриона-хозяина. Предел обнаружения в этом анализе соответствует приблизительно одному аллелю альбинизма на 2000 гаплоидных геномных эквивалентов (Poueymirou et al. (2007) Nat. Biotechnol. 25:91-99). Вырезанные селезенки посылали в институт Ван Анделя (Van Andel Institute, Grand Rapids, Michigan) для проведения спектрального кариотипирования (SKY).
(SEQ ID NO: 50). Анализ методом кПЦР в отношении мутации альбинизма в гене тирозиназы, который несет линия Swiss Webster и который не присутствует в геноме ЭС клеток VGF1, позволил количественно оценить вклад эмбриона-хозяина. Предел обнаружения в этом анализе соответствует приблизительно одному аллелю альбинизма на 2000 гаплоидных геномных эквивалентов (Poueymirou et al. (2007) Nat. Biotechnol. 25:91-99). Вырезанные селезенки посылали в институт Ван Анделя (Van Andel Institute, Grand Rapids, Michigan) для проведения спектрального кариотипирования (SKY).
[00418] Микроинъекция. В день проведения инъекции ЭС клетки трипсинизировали и ресуспендировали в ЭС клеточной среде без LIF. Замороженные 8-клеточные эмбрионы Swiss Webster (Charles River Laboratories) размораживали и инкубировали в среде KSOM (Millipore) при 37°С в 7,5% СО2 в течение 90 мин перед микроинъекцией. Инъекции ЭС клеток в 8-клеточные эмбрионы проводили так, как было описано ранее (Poueymirou et al. (2007) Nat. Biotechnol. 25:91-99). После инъекций эмбрионы культивировали в течение ночи и переносили в организм псевдобеременных реципиентных самок мышей через 2,5 суток после коитуса.
Результаты
[00419] Чтобы оптимизировать результаты VELOCIMICE® как для исследований скрещивания, так и фенотипирования, мы исследовали разные культуральные среды для ЭС клеток во время экспериментов по направленному воздействию на гены и перед инъекцией в 8-клеточные эмбрионы. Одним из оцениваемых нами компонентов была основная среда, известная как Knockout ТМ DMEM (KO-DMEM, Life Technologies). Сначала казалось, что ЭС клетки, выращиваемые в среде, приготовленной с KO-DMEM, демонстрируют плохую эффективность по сравнению с клетками, которые поддерживали в среде, приготовленной со стандартной DMEM (средой Игла, модифицированная по способу Дульбекко), в которой мы получили меньшее количество самцов VELOCIMICE®. Но также мы наблюдали большое повышение количества самок VELOCIMICE®: 31% мышей VELOCIMICE®, полученных после инъекции 78 клонов, полученных в экспериментах с направленным воздействием на 34 гена, были самками (Таблица 3, KO-DMEM). Ретроспективное сравнение результатов, записанных в нашей базе данных по получению мышей, для инъекции более 500 клонов ЭС клеток, подвергнутых направленному воздействию, выращиваемых в традиционной среде DMEM, продемонстрировало, что только 1% из всех мышей VELOCIMICE® были самками (Таблица 3, DMEM). Немногочисленных самок VELOCIMICE® не скрещивали и дополнительно не исследовали. Несмотря на высокую долю самок из клонов XY ЭС клеток, выращенных в среде KO-DMEM, 18% общего выхода VELOCIMICE®, самцов и самок, в этом эксперименте были идентичны с клонами из наших предыдущих экспериментов, полученных в среде DMEM (Таблица 3, KO-DMEM и DMEM).
[00420] Клоны ЭС клеток, выращенные в KO-DMEM, давали самок VELOCIMICE® в долях в диапазоне от 0 до 60%. Предрасположенность к тому, чтобы давать самок VELOCIMICE®, была своей для каждого клона. Клоны, которые не давали самок, сохраняли эту характеристику при повторных микроинъекциях, тогда как в случае клонов, которые давали самок, наблюдалась тенденция к выходу приблизительно одинаковой доли самок в экспериментах с повторными микроинъекциями. Чтобы узнать, можно ли изменить способность клона давать самок VELOCIMICE®, мы проводили эксперименты з заменой среды. Клоны ЭС клеток из экспериментов с направленным воздействием на гены, в которых ЭС клетки выращивали и поддерживали в среде на основе DMEM или на основе KO-DMEM в течение всего процесса направленного воздействия - электропорации, отбора колоний, устойчивых к лекарственному препарату, скрининга в отношении направленных мутаций, размножения и криоконсервации, - размораживали и выращивали в противоположной среде в течение 3 суток, готовя к микроинъекции в 8-клеточные эмбрионы. После инкубации в течение ночи в KSOM, чтобы эмбрионы могли дифференцироваться в бластоцисты, их переносили в организм суррогатных матерей. Мы подсчитали долю полученных XY самок среди живорожденных мышей VELOCIMICE®.
[00421]
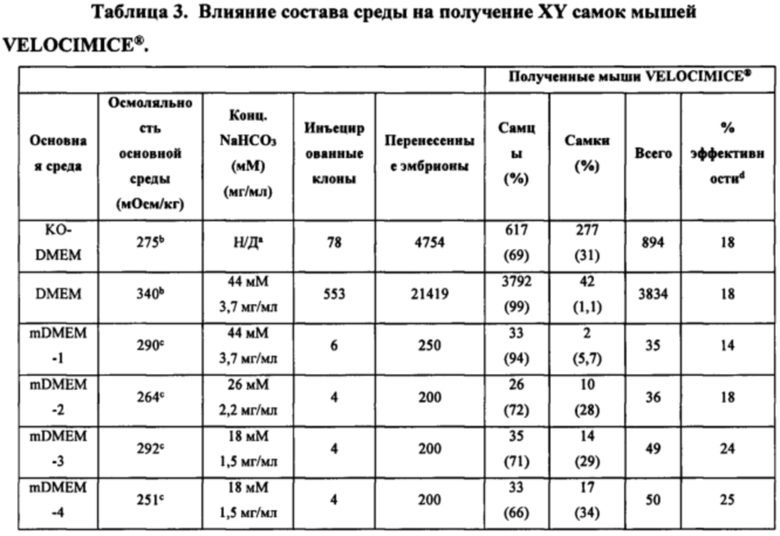
а Нет данных
b Среднее значение согласно сертификату поставщика анализа
с Измеренные значения
d Соотношение полученных мышей VELOCIMICE® к количеству перенесенных эмбрионов, выраженное в виде процентной доли.
[00422] Для исследования замены DMEM на KO-DMEM мы выбрали 11 клонов из пяти разных экспериментов по направленному воздействию на гены, проводимых в среде DMEM, разморозили их и выращивали в KO-DMEM или DMEM в качестве контроля. Приблизительно 400 эмбрионов, перенесенных из ЭС клеток, при замене DMEM на KO-DMEM дали 105 живорожденных мышей VELOCIMICE®, из которых только 2 (1,9%) были самками (Таблица 4, направленное воздействие в DMEM, размораживание в KO-DMEM), аналогично доле самок, полученных (2,4%) при применении контрольных эмбрионов, в которые инъецировали ЭС клетки, поддерживаемые в DMEM (Таблица 4, направленное воздействие в DMEM, размораживание в DMEM). Для обратного эксперимента мы выбрали три клона из эксперимента по направленному воздействию на гены, проводимого в KO-DMEM, разморозили их и выращивали в DMEM или KO-DMEM в качестве контроля. Три сотни эмбрионов, перенесенных из ЭС клеток, при замене KO-DMEM на DMEM дали 41 мышь VELOCIMICE®, из которых 8 (20%) были самками (Таблица 4, направленное воздействие в KO-DMEM, размораживание в DMEM), аналогично доле самок VELOCIMICE® (18%), полученных при применении контрольных эмбрионов, в которые инъецировали ЭС клетки, поддерживаемые в KO-DMEM (Таблица 4, направленное воздействие в KO-DMEM, размораживание в KO-DMEM).
[00423]
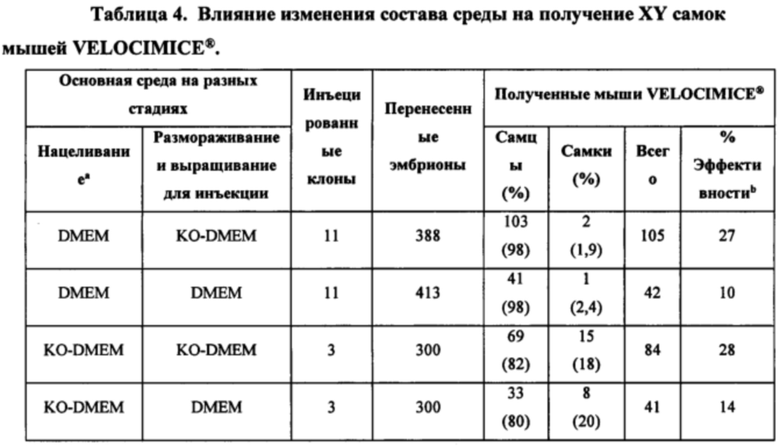
а Размораживание ЭС клеток, выращивание, электропорация, отбор по чувствительности к лекарственному препарату, скрининг, размножение и криоконсервация клонов, подвергнутых направленному воздействию.
b Соотношение полученных мышей VELOCIMICE® к количеству перенесенных эмбрионов, выраженное в виде процентной доли.
[00424] Эти результаты свидетельствуют о том, что клоны, полученные в среде на основе DMEM, сохраняли низкую частоту получения самок VELOCIMICE® аналогично с нашим предыдущим опытом (Таблица 3, DMEM), и мы не могли повысить эту частоту кратковременным воздействием KO-DMEM. Аналогично, клоны, полученные в среде на основе KO-DMEM, демонстрировали более высокую частоту получения самок VELOCIMICE®, а кратковременное воздействие DMEM не снижало предрасположенности XY клонов давать самок. В обоих ответвлениях эксперимента, вне зависимости от получения в DMEM или KO-DMEM, клоны, подвергнутые воздействию KO-DMEM после размораживания, имели более высокую и аналогичную эффективность общего получения мышей VELOCIMOUSE® (27% и 28%) по сравнению с клонами, размороженными в среде DMEM (10% и 14%).
[00425] Анатомически нормальные самки, полностью полученные из XY ЭС клеток. Чтобы устранить химеризм, как объяснение явлению появления самок VELOCIMOUSE®, мы подтвердили, что все самки были очевидным образом полностью получены из ЭС клеток и по вкладу в цвет шерсти действительно были VELOCIMICE®, с помощью анализа кПЦР для образцов биопсии хвоста, который показал отсутствие генетического вклада от 8-клеточного эмбриона-хозяина Swiss Webster, в который инъецировали ЭС клетки (Poueymirou et al. (2007) Nat. Biotechnol. 25:91-99). Мы знали, что самок VELOCIMICE® можно получить из ХО ЭС клеток, которые дают исключительно самок VELOCIMICE®, но эта возможность была отброшена по результатам кПЦР-анализа по подсчету хромосом, который установил, что самки VELOCIMICE® (далее называемые XY самками) имеют по одной копии каждой хромосомы X и Y. XY результаты кПЦР были подтверждены SKY клеток селезенки, полученных от пяти XY самок, которые также продемонстрировали нормальное число аутосом с отсутствие выявляемых транслокаций или делеций.
[00426] Обследование брюшной полости пятнадцати XY самок подтвердило, что нормальная женская анатомия, демонстрируемая всеми XY самками в отношении внешних половых органов, распространялась и на внутренние органы. Все животные продемонстрировали наличие нормальных женских репродуктивных органов без проявлений гермафродитизма, овотестиса или других показателей неполного женского полового развития. Они имели нормальные маточные трубы и хорошо васкуляризированные рога матки и, как оказалось, имели нормальные яичники с геморрагической кистой, которая позволяет предположить наличие активного процесса овуляции. Кроме того, мы обнаружили, что XY самки имели массу тела и биохимический профиль сыворотки, соответствующие диапазону значений, наблюдаемых у самок мышей дикого типа, полученных путем скрещивания.
[00427] Чтобы устранить возможность тканеспецифического химеризма эмбриона-хозяина в женских половых органах, мы проводили анализ кПЦР для маркера эмбриона-хозяина Swiss Webster и для X и Y хромосом в тканях, полученных от пятнадцати XY самок, исследованных в отношении нормальной анатомии. В случае всех мышей мы обнаружили отсутствие вклада эмбриона-хозяина и по одной копии каждой из X и Y хромосом во всех тканях, включая яичники, маточные трубы и матку. Мы заключили, что XY самки имеют нормальный мужской кариотип, полностью получены из инъецированных XY ЭС клеток и не демонстрируют выявляемый генетический вклад эмбриона-хозяина. Они демонстрируют внешнюю и внутреннюю анатомию, неотличимую от нормальных самок мышей.
[00428] XY самки с измененным полом являются фертильными и плодовитыми Чтобы исследовать фертильность XY самок, мы скрещивали 119 самок F0 VELOCIMICE® (50% C57BL/6N: 50% 129SvEvS6), полученных из нескольких независимых XY клонов ЭС клеток с генами, подвергнутыми направленному воздействию, с самцами C57BL/6NTac дикого типа. Шестьдесят три процента (75) XY самок произвели по меньшей мере один помет. Этот уровень фертильности, хотя и ниже приблизительно 90% фертильности, наблюдаемой нами по результатам скрещивания для XX самок поколения F1 (75% C57BL/6N: 25% 129SvEvS6), полученных из той же родительской линии ЭС клеток, является необычно высоким по сравнению с предыдущими описанными случаями изменения пола с мужского на женский. Чтобы сравнить плодовитость XY самок с XX самками, полученными путем нормального скрещивания, мы скрещивали самцов C57BL/6NTac с 18 XY самками или с 14 XX F1 самками дикого типа. В течение девятимесячного периода мы не наблюдали существенной разницы между XY самками-матерями и XX контрольными самками по трем показателям плодовитости - количеству детенышей и пометов в расчете на самку и размеру помета (Таблица 5).
[00429]
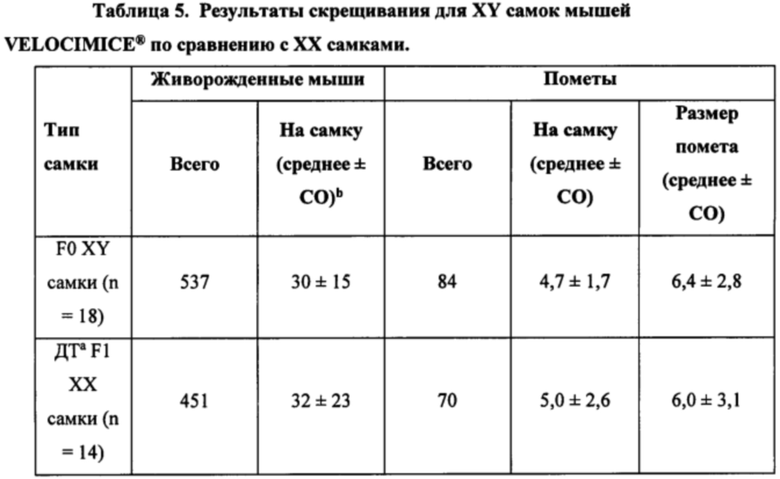
а Дикий тип
b Стандартное отклонение
[00430] Признак, состоящий в изменении пола с мужского на женский, не передается поколению F1. Чтобы исследовать наследуемость XY женского признака, мы проводили количественную оценку X и Y хромосом в потомстве 394 F1, полученном от спаривания между XY самками и самцами C57BL/6NTac. Мы обнаружили, что ни одно животное из потомства с женским фенотипом не имело генотип XY, а все мыши с по меньшей мере одной Y-хромосомой имели мужской фенотип. При этом мы наблюдали вдвое большее количество самцов (260), чем самок, (134) и некоторое количество аберрантных половых хромосом как у самцов, так и у самок мышей. Сообщалось об аберрантных мужских кариотипах (XXY и XYY) в потомстве F1 от скрещивания химерных самок, полученных путем инъекции XY ЭС клеток в бластоцисты (Bronson et al. (1995) Proc. Natl. Acad. Sci. USA 92:3120-3123), которые были связаны с нефертильностью. Мы также обнаружили, что XXY и XYY мужское потомство F1 от XY самок было нефертильным с очень маленькими семенниками, которые характеризовались либо аспермией либо очень низким количеством спермиев.
[00431] Условия среды, которые стимулируют создание XY самок из XY ЭС клеток. ЭС клетки, выращиваемые в среде на основе KO-DMEM, имели намного большую предрасположенность к тому, чтобы давать XY самок после инъекции в 8-клеточные эмбрионы, чем клоны, выращиваемые в традиционной среде DMEM (Таблица 3). В спецификациях поставщика указана разница в осмоляльности между этими двумя средами: приблизительно 275 мОсм/кг для KO-DMEM по сравнению с приблизительно 340 мОсм/кг для DMEM. Следовательно, мы приготовили модифицированные версии DMEM (mDMEM) со сниженной измеренной осмоляльностью путем изменения концентраций солей и сахарных компонентов, а затем оценили получение мышей VELOCIMOUSE® для ЭС клеток, подвергнутых направленному воздействию и полученных в модифицированной среде (Таблица 3). В других экспериментах исследовали разные осмоляльности, концентрации солей и концентрации карбоната в отношении их влияния на XY ЭС клетки и F0 мышей, получаемых из этих ЭС клеток. Фертильных F0 XY самок успешно получали при осмоляльности от 218 и 322 мОсм/кг, при концентрациях солей и щелочных металлов и галидов (например, NaCl) от 3,0 до 6,4 мг/мл (от ~51,3 мМ до ~109,5 мМ) и при концентрациях солей уксусной кислоты (например, NaHCO3) 1,5-3,7 мг/мл (от ~17,9 мМ до ~44,0 мМ) (Таблицы 6 и 7). Для 2 ряда в Таблице 7 (DMEM) типичная осмоляльность основной среды составляет 337-341 или 340-341 мОсм/кг, а типичная осмоляльность полной среды (DMEM плюс 15% ФБС, пен/стреп, заменимые аминокислоты, пируват натрия, бета-меркаптоэтанол, L-глутамин и LIF) составляет 329-338 мОсм/кг. Для 1 ряда в Таблице 7 (KO-DMEM) типичная осмоляльность основной среды составляет 271-278, а типичная осмоляльность полной среды (основная среда KO-DMEM плюс 15% ФБС, пен/стреп, заменимые аминокислоты, пируват натрия, бета-меркаптоэтанол, L-глутамин и LIF) составляет 278-280 мОсм/кг. Для 4 ряда в Таблице 7 (основная среда с низким содержанием NaCl) типичная осмоляльность основной среды составляет 200 мОсм/кг, а типичная осмоляльность полной среды составляет около 216 мОсм/кг.
[00432] Единственным компонентом, чья вариация стабильно коррелировала с изменениями в получении XY самок, был бикарбонат натрия, независимо от концентрации других солей, измеренной осмоляльности или рН. Влияние бикарбоната натрия видно при сравнении четырех исследуемых нами модифицированных сред. Применение среды на основе mDMEM-1 (Таблица 3), которая имела такую же концентрацию бикарбоната натрия, что и среда DMEM (44 мМ), в экспериментах по направленному воздействию на гены давало ЭС клетки, которые приводили к получению низкой доли (5,7%) XY самок, несмотря на осмоляльность, которая по результатам измерений была снижена по сравнению со средой DMEM. Снижение концентрации бикарбоната натрия по сравнению с DMEM (26 мМ для mDMEM-2 и 18 мМ для mDMEM-3 и -4) приводило к получению в среднем 30% XY самок (Таблица 3), что аналогично доле, наблюдаемой нами с KO-DMEM. Среда mDMEM-4 имела самую низкую осмоляльность и приводила к получению наибольшей доли XY самок (34%) и наибольшей эффективности общего получения мышей VELOCIMOUSE® (25%). Но низкая осмоляльность не всегда коррелировала с высокой частотой получения XY самок. Среды mDMEM-1 и -3 имели практически идентичную осмоляльность, но стимулировали получение очень разных долей самок XY. В общем случае мы наблюдали прямую корреляцию между тенденцией среды к тому, чтобы давать XY самок и выходом полностью полученных из ЭС клеток F0 мышей.
[00433]
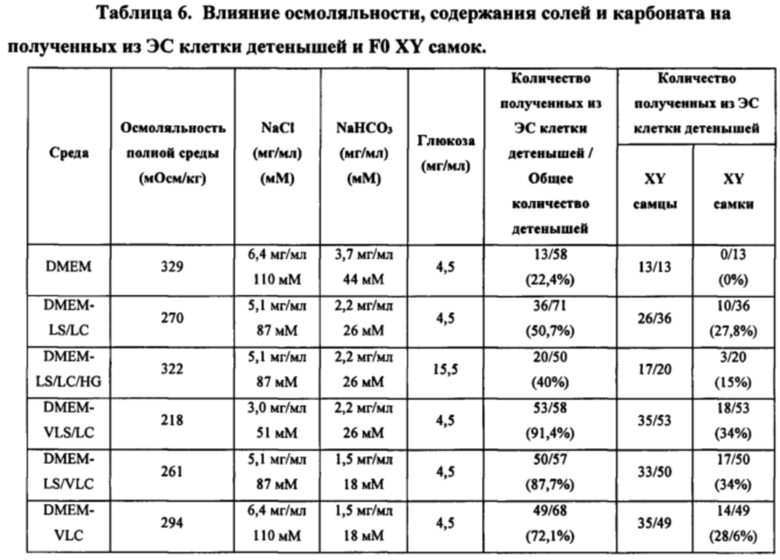
[00434]


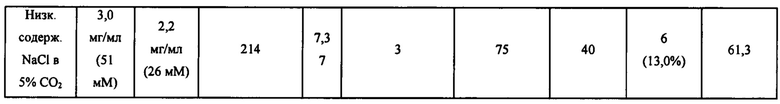
[00435] Фенотипирование мышей, полученных при скрещивании изогенных XY самцов и самок VELOCIMICE®. В качестве примеров, которые иллюстрируют значение фертильных и плодовитых XY самок, мы сравнивали фенотипы поколения F1 мышей с нокаутом, полученных при скрещивании гетерозиготных изогенных XY самцов и самок VELOCIMICE®, с животными поколения F2 мышей с нокаутом, полученных при традиционном скрещивании, в отношении двух генов: Ctsk, который кодирует катепсин K, цистеиновую протеазу, играющую важнейшую роль в костном гомеостазе; и Cldn7, который кодирует клаудин-7, основной компонент плотных соединений. В случае обоих генов мы проводили замещение всей кодирующей области последовательностью, кодирующей репортер бета-галактозидазы, слитый в рамке со стартовым кодоном, за которым следовала неомицинфосфотрансферазная кассета отбора по чувствительности к лекарственному препарату. Мы создали подопытные группы поколения F1 мышей дикого типа (+/+), гетерозиготных мышей (+/-) и несущих нокаут гомозиготных мышей (-/-) путем скрещивания F0 XY самок с их клональными сиблингами, XY самцами VELOCIMICE®. В случае нокаута Cldn7 мы создали дополнительную контрольную группу традиционного скрещивания путем скрещивания самцов F0 VELOCIMICE® с самками C57BL/6NTac для получения F1 гетерозиготных мышей, а затем скрещивали этих мышей между собой для получения F2 подопытных групп.
[00436] В соответствии с предыдущими данными по мышам с нокаутом Ctsk, мы обнаружили, что мыши Ctsk-/-, полученные путем скрещивания XY самок, были жизнеспособными и фертильными, но по сравнению с однопометными мышами Ctsk+/+ они экспрессировали большое количество костных дефектов, включая существенное повышение МПКТ и повышенное сохранение бедренной костной перекладины у самок. Как и ожидалось после предыдущих данных по нокауту Cldn7, мыши Cldn7-/- как из традиционной схемы скрещивания, так и схемы с XY самками были мелкими и погибали через несколько дней после рождения. Среди живорожденных мышей мы наблюдали сниженное число гомозиготных мутантных мышей, полученных как путем традиционного скрещивания (Cldn7+/+, 32; Cldn7+/-, 74; Cldn7-/- 13; Р=4,2×10-7, критерий χ2), так и путем скрещивания XY самок (Cldn7+/+, 54; Cldn7+/-, 108; Cldn7-/-, 24; Р=9,2×10-4, критерий χ2), что указывает на неполностью проявляющуюся эмбриональную летальность. В соответствии с дефектом почек и так же, как и в случае мутантных мышей согласно опубликованным данным, у новорожденных мышей Cldn7-/- как из традиционной схемы скрещивания, так и схемы с XY самками, наблюдалось нарушение надлежащей регуляции ионов кальция в плазме. В дополнение к совпадающим фенотипам роста и почечной функции, мы наблюдали идентичные профили общей экспрессии бета-галактозидазы в основных взрослых органах гетерозигот в обеих группах скрещивания - традиционной и с самками XY.
Обсуждение
[00437] Вне зависимости от того, является ли причиной несовместимость генетического фона (Eicher et al. (1982) Science 217:535-537; Taketo-Hosotani et al. (1989) Development 107:95-105) или мутации в генах, необходимых для изменения пола (Bagheri-Fam et al. (2008) Dev. Biol. 314:71-83; Barrionuevo et al. (2006) Biol. Reprod. 74:195-201; Bogani et al. (2009) PLoS Biol 7:e1000196; Chaboissier et al. (2004) Development 131:1891-1901; Colvin et al. (2001) Cell 104:875-889; Gierl et al. (2012) Dev. Cell 23:1032-1042; Hammes et al. (2001) Cell 106:319-329; Katoh-Fukui et al. (1998) Nature 393:688-692; Meeks et al. (2003) Nat. Genet. 34:32-33; Tevosian et al. (2002) Development 129:4627-4634; Warr et al. (2012) Dev. Cell 23:1020-1031), изменение пола с мужского на женский у мышей практически всегда сопровождается нефертильностью. Некоторые XY самки, несущие мутации в основном гене определения мужского пола, Sry, являются фертильными, но имеют небольшие нечастые пометы и короткие репродуктивные периоды (Lovell-Badge and Robertson (1990) Development 109:635-646). Недавно сообщалось об аналогичной низкой фертильности и плодовитости для XY самок мышей, несущих делецию Sry длиной 41 пар оснований (п.о.), которая была получена путем направленного нацеливания эффекторной нуклеазы, подобной активаторам транскрипции (TALEN) (Wang et al. (2013) Nat. Biotechnol. 31:530-532). В другом примере TALEN-индуцированной мутации Sry было обнаружено, что одна XY самка мыши, несущая 2 п.о. делецию, является стерильной (Kato et al. (2013) Sci. Rep. 3:3136).
[00438] Составляя разительный контраст с этими случаями нарушенной фертильности, XY самки VELOCIMICE®, полученные из ЭС клеток, подвергнутых направленному воздействию на гены, демонстрируют беспрецедентный высокий уровень фертильности и нормальную плодовитость, что может противоречить ожиданиям. Помимо нормальных 20Х гамет XY самка может вырабатывать аномальные 20Y, 19O и 21XY типы яйцеклеток, при этом последние два появляются в результате явлений нерасхождения во время мейоза I, что объясняет кариотипы половых хромосом XXY, XYY и ХО в потомстве F1 XY самок. Следовательно, существует возможность, что XY самки могут иметь сниженное количество жизнеспособных и функциональных яйцеклеток. В действительности доля различных F1 кариотипов половых хромосом наилучшим образом описывается (согласно анализу χ2) моделью, которая предполагает 25-30% потерю четырех типов потомства, полученного в результате жизнеспособного оплодотворения из этих трех аномальных типов гамет. Такая потеря привела бы только к 20% потере для всех типов яйцеклеток, что вряд ли привело бы к разнице в плодовитости, которую мы могли бы увидеть в нашем девятимесячном исследовании скрещивания.
[00439] Высокая фертильность и плодовитость XY самок, описанная в данном документе, позволяет предположить наличие уникального механизма изменения пола с мужского на женский. Отсутствие способности передавать XY женский признак указывает на то, что изменение пола является временным явлением, при котором некоторые клетки в клоне ЭС клеток, подвергнутом направленному генетическому воздействию, приобретают эпигенетический признак или какое-либо другое физиологическое изменение, которое предопределяет получение XY самок. Вне зависимости от того, какой признак или изменение приобретают ЭС клетки, он, по-видимому, является постоянным и стабильным. Предрасположенность к тому, чтобы давать XY самок, характерна для каждого клона XY ЭС клеток, подвергнутого направленному генетическому воздействию. Обычно каждый дает воспроизводимую долю XY самок в каждом повторном эксперименте с инъекциями, а индивидуальные клоны нельзя «феминизировать» или «маскулинизировать» путем помещения их в другие культуральные условия после процесса направленного воздействия на гены. Отличительной характеристикой явления XY самок является то, что оно затрагивает только те ЭС клетки, которые поддерживали в феминизирующей среде в течение всего процесса направленного воздействия на гены - размораживания, выращивания, пассирования, электропорации, отбора по чувствительности к антибиотику, размножения и замораживания - что позволяет предположить, что стресс процесса направленного воздействия на гены может случайно индуцировать эпигенетический признак, который придает «феминизированный» характер XY ЭС клеткам.
[00440] Сначала мы наблюдали XY самок в значительных количествах после того, как мы заменили основную среду с DMEM, которая является гипертонической (>300 мОсм/кг), на изотоническую (275-295 мОсм/кг) KO-DMEM. Клетки реагируют на осмотический стресс путем активации пути киназы MAP а мутации в Map3k4 и Gadd45c, которые являются представителями пути киназы MAP, или в пути инсулина, сигнализация которого происходит посредством киназ MAP, могут привести к снижению экспрессии Sry и отсутствию индукции развития семенников в недифференцированном половом тяже. Культивирование ЭС клеток в гипертонической среде может стимулировать путь киназы MAP и стимулировать физиологическое или эпигенетическое окружение, которое усиливает мужскую дифференциацию после того, как клетки достигли стадии развивающегося эмбриона. И наоборот, культивирование ЭС клеток в тоничной или слегка гипертоничной среде может подавлять сигнализацию посредством пути киназы MAP и, таким образом, имитировать действие мутаций, приводящих к изменению пола.
[00441] Помимо этих выводов для понимания определения пола, описанное нами в данном документе явление изменения пола с мужского на женский имеет важные практические последствия для получения генетически модифицированных мышей. Так как XY самки являются фертильными и плодовитыми, мы можем скрещивать между собой F0 сиблингов, чтобы получить F1 гомозиготных мышей, несущих нокаут, с фенотипами, которые воспроизводят получаемые при применении природных схем скрещивания, как в наших лабораториях, так и описанных в опубликованной литературе. Даже если исключить мышей, несущих аномальные кариотипы половых хромосом, остается достаточное количество нормальных F1 XX самок и XY самцов для создания групп для исследований. Наш способ культивирования является более быстрым и легким, чем создание фертильных самок из клонов ХО ЭС клеток, так как нет необходимости в проведении субклонирования и скрининга в отношении редких потерь Y-хромосомы. Дополнительные исследования условий, которые стимулируют изменение пола, и отвечающих за это молекулярных механизмов могут обеспечить возможность разработки усовершенствованного способа для надежного, прогнозируемого и эффективного получения самцов и самок VELOCIMICE® из любого клона ЭС клеток, подвергнутых направленному воздействию.
Пример 2. Происходит сайленсинг или снижение экспрессии Ddx3y (Dby), Eif2s3y, и Sry в эмбрионах, полученных из XY ЭС клеток, культивируемых в среде с низкой осмоляльностью.
[00442] Получали эмбрионы на стадии развития, соответствующей 11,5 суткам после коитуса (спк), а их приблизительную стадию определяли, используя стадирование по Тейлеру. Гестационный срок сильно варьировался в пределах помета, а более точное стадирование индивидуальных эмбрионов проводили путем подсчета числа хвостовых сомитов (хс) от задней части до зачатка задней конечности до конца хвоста. Согласно этой методике эмбрион с 8 хвостовыми сомитами соответствует 10,5 спк, с 18 хвостовыми сомитами соответствует 11,5 спк и с 30 хвостовыми сомитами соответствует 12,5 спк (из Hacker, Capel, Goodfellow and Lovell-Badge, Devel 1995).
[00443] Сообщалось, что у мышей В6 Sry выявляется приблизительно при 13 хс, достигает пика приблизительно при 17-18 хс и снижается приблизительно при 27 хс. Эмбрионы, имеющие 12-27 хс, вырезали из мышей, чтобы захватить весь период активности Sry. Из эмбрионов на этих стадиях вырезали половые тяжи (содержащие гонаду и прилегающий мезонефрос), отделяли от стенки тела и метанефроса (развивающаяся почка) и сохраняли в Trizol для выделения РНК.
[00444] Определяющий пол ген в Y-хромосоме (Sry) отвечает за инициацию определения мужского пола у млекопитающих. Этот ген экспрессируется в ограниченной популяции клеток в гонаде во время узкого окна развития (приблизительно 11,5 спк у мышей). Во время этого окна Sry инициирует все изменения, необходимые для того, чтобы гонада стала семенником, а организм приобрел мужские признаки. Однако, если экспрессия Sry снижена во время этого окна или даже происходит на несколько часов позже, у XY организмов развиваются яичники, они становятся самками и считаются имеющими измененный пол.
[00445] Чтобы определить, почему некоторые XY клоны дают мышей с измененным полом, мы применяли ОТ-ПЦР, чтобы определить уровни экспрессии маркеров раннего определения пола, как у самцов, так и у самок. В случае мужского пути мы обращали внимание на гены, вовлеченные в инициацию определения мужского пола: Sry, Sox9 (предположительно являющийся прямой мишенью Sry; необходимый для инициации и поддержания развития семенников), гены, вовлеченные в аспекты супрессии женского пути (Fgf9), и гены, являющиеся хорошими маркерами ранней дифференциации семенников (Dhh и Amh). В случае женского пути мы обращали внимание на гены, которые активны на очень ранних стадиях женского развития (Foxl2) и вовлечены в аспекты супрессии мужского пути (Rspo1). Смотрите ФИГ. 15.
[00446] Чтобы приготовить образцы для ОТ-ПЦР, ткани гомогенизировали в TRIzol, а для фазового разделения использовали хлороформ. Водную фазу, содержащую общую РНК, выделяли, используя MagMAX™-96 для набора для микроматричного выделения общей РНК (Ambion от Life Technologies, Кат. # AM1839) в соответствии со спецификациями производителя. Геномную ДНК удаляли, используя буфер MagMAX™Turbo™DNase и TURBO DNase из вышеуказанного набора MagMAX (Ambion от Life Technologies, Кат. # AM1839). Проводили обратную транскрипцию мРНК в кДНК, используя мастер-микс Superscript® VILO™ (Invitrogen от Life Technologies, Кат. # 11755500). кДНК амплифицировали с помощью мастер-микса для генной экспрессии TAQMAN® (Applied Biosystems от Life Technologies, Кат. # 4370074), используя систему для выявления последовательностей ABI 7900НТ (Applied Biosystems). Условия проведения циклов состояли из 10 минут при 95°С с последующими 40 циклами при 95°С в течение 3 секунд и при 60°С в течение 30 секунд. Hprt использовали в качестве гена внутреннего контроля для нормализации разницы ввода кДНК. Эталонным образцом служил образец #1, с которым проводили сравнение всех других образцов в методе сравнительного анализа разницы СТ. Все зонды метили как 6FAM в качестве репортера и как BHQ1 в качестве гасителя. Последовательности приведены в Таблице 8.
[00447]
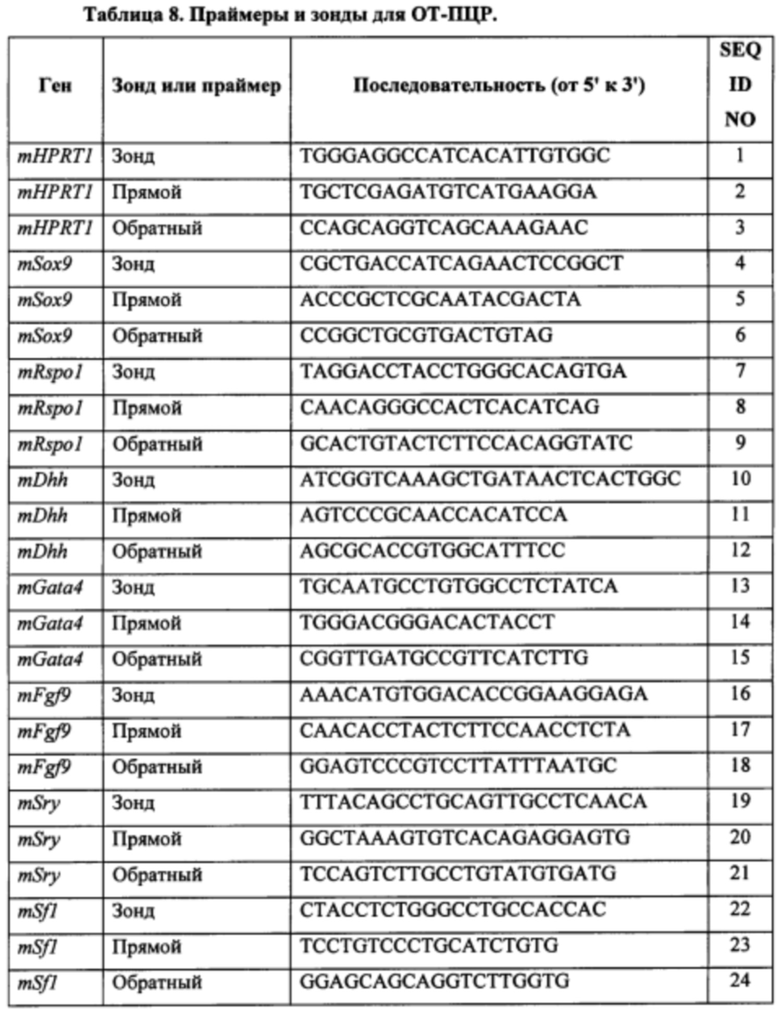
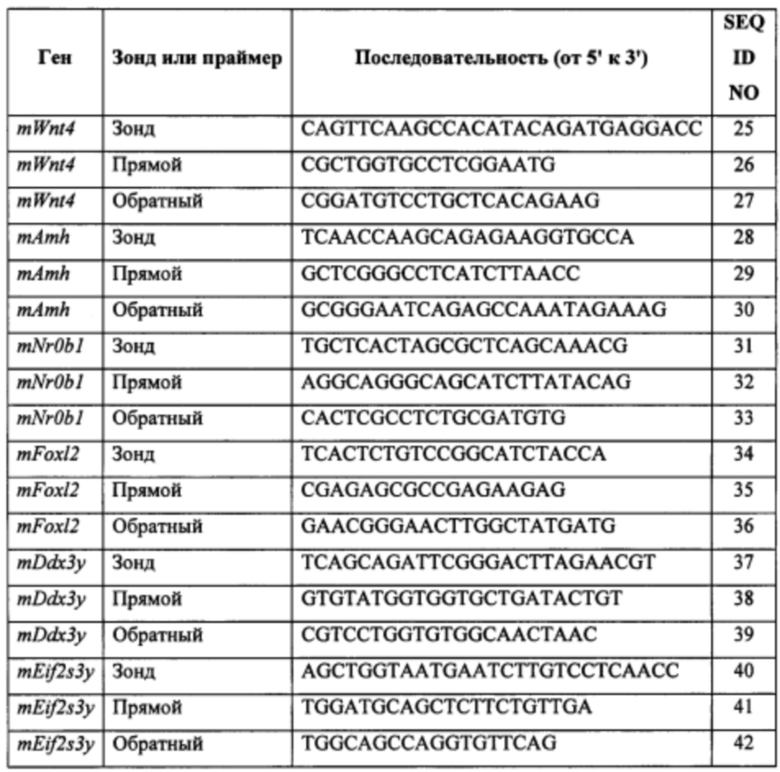
[00448] Чтобы нормализовать образцы ОТ-ПЦР, мы использовали общий конститутивный ген (Hprt), а также гены, специфические для полового тяжа и экспрессируемые на равных уровнях в случае обоих полов на этих стадиях (Sf1 и Gata4).
[00449] Предыдущие эксперименты свидетельствуют о том, что два гена в Y-хромосоме, которые нормально экспрессируются в ЭС клетках, эскпрессировались на сниженном уровне в ЭС клетках из линий с измененным полом (Ddx3y и Eif2s3y; смотрите ФИГ. 1). Эти гены находятся в коротком плече Y-хромосомы в области Sxrb. Благодаря исследованиям делеций известно, что эта область является критически важной для сперматогенеза, но не вовлечена в определение пола. Оба этих гена экспрессируются в мужских гонадах во время этого периода развития, но не в яичниках (аффиметрические данные с GUDMAP.org); следовательно, мы использовали зонды против этих генов, чтобы показать, влияет ли процесс, который обеспечивает изменение пола, на экспрессию других генов Y-хромосомы, помимо вовлеченных в определение пола.
[00450] Для этого эксперимента использовали два клона: 1823CF11, который ранее давал только самцов VELOCIMICE® в поколении F0, тогда как 1823СЕ6 давал 88% самок XY VELOCIMICE® (с измененным полом) в поколении F0. Оба клона выращивали в идентичных условиях на протяжении их выделения и размножения в среде на основе KO-DMEM. Их каждого клона было получено по одиннадцать пометов VELOCIMICE®: 2 помета из каждого оставили до завершения термина, чтобы проверить степень изменения пола, оставив 9 пометов из каждого клона для получения половых тяжей (смотрите Таблицу 9). Из пометов из каждого клона, оставленных до завершения термина, чтобы можно было определить пол потомков, CF11 дал 11 XY самцов VELOCIMICE® и ни одной XY самки VELOCIMICE®, плюс 2 химерных самцов и 1 химерную самку. Клон СЕ6 дал 2 XY самцов VELOCIMICE® и 6 XY самок VELOCIMICE®, плюс 3 химерных самцов и 6 химерных самок.
[00451] Несмотря на тайминг инъекций бластоцист и одинаковое время начала вырезания в один день для каждого клона, пометы для клона СЕ6 с измененным полом были более развиты по сравнению с CF11 (смотрите Таблицу 10). Например, CF11 самцов, полученных в 8:30 утра и 9:30 утра, имели сомиты в диапазоне 12-13 хс, тогда как пометы СЕ6 в этом время имели сомиты в диапазоне 16-20 хс. В целом это соответствует приблизительно 8 часам опережения СЕ6 по сравнению с CF11 и означает, что наиболее ранние стадии экспрессии Sry не измеримы в этом эксперименте в линии СЕ6. При этом временной пик экспрессии Sry, соответствующий 17-18 хс, сохраняется.
[00452]
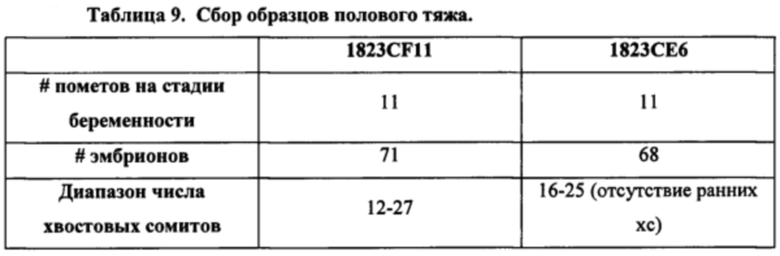
[00453]
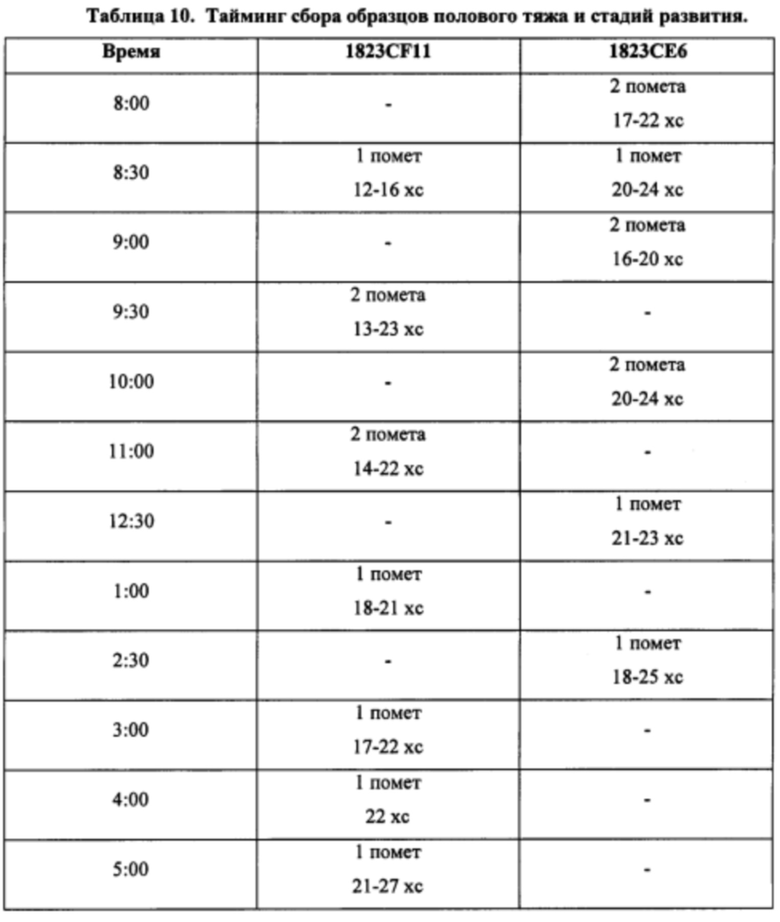
[00454] В случае контролей мы также получали половые тяжи из неродственной линии CD1 во время окна определения пола (20 хс). XY образцы из этой неродственной линии должны экспрессировать высокие уровни Sry в это время и служить сильно положительным контролем. XX образцы не имеют Y-хромосомы и, следовательно, являются отрицательным контролем в отношении Sry, генов в Y-хромосоме и других маркеров мужского пути.
[00455] Способ создания бластоцист VELOCIMOUSE® в большом количестве дает мышей, полученных полностью из инъецированных ЭС клеток, но все еще образуется низкое количество полученных из хозяев эмбрионов и химер как клеток-хозяев, так и ЭС клеток. Чтобы убрать эти образцы из рассмотрения, мы применяли ПЦР, чтобы проверить наличие разных аллелей тирозиназы, гена цвета шерсти, мутированного в линии бластоцист-хозяев Swiss Webster (TyrMut) и функционального в клетках F1H4 ES (TyrWt). Образцы исключали, если они имели TyrMut, превышающий или равный 0,5, или уровни TyrWt, меньшие или равные 1,5, и TyrMut, составляющий более 20% от TyrWt.
[00456] Чтобы нормализовать данные ОТ-ПЦР относительно количества гонадной ткани в каждом образце, мы исследовали уровни двух генов, специфически экспрессируемых в гонадах обоих полов: Sf1 и Gata4. Sf1 имеет относительно постоянную экспрессию в гонадах по сравнению с конститутивным геном Hprt для стадий развития, которые мы исследовали и, следовательно, применялся в качестве нормализующего гена в последующих образцах. Gata4, как оказалось, имеет повышенные уровни на ранних стадиях и, следовательно, его не применяли в качестве нормализующего гена.
[00457] Как показано на ФИГ. 2, экспрессия Sry выявляется в гонадах линии CF11 в нормальном окне определения пола. Экспрессия Sry на ФИГ. 2 показана относительно Sf1, маркера соматических клеток в половых тяжах обоих полов на этой стадии. Аналогичные результаты наблюдали, когда экспрессию Sry нормализовали относительно экспрессии Hprt (данные не показаны). CD1 XY и XX образцы при 20 хс использовали в качестве контроля (CD1 XY в качестве положительного контроля в отношении экспрессии Sry, a CD1 XX в качестве отрицательного контроля). Как показано на ФИГ. 2, экспрессия Sry становится выявляемой, начиная приблизительно с 13 хс, достигает пика приблизительно при 16-17 хс и снижается приблизительно при 25 хс. Однако в гонадах, полученных из меняющего пол клона СЕ6, экспрессия Sry в основном не выявляется во время всех исследованных стадий определения пола (16-25 хс). Большинство гонад из клона СЕ6 не имели выявляемых значения СТ даже после 40 циклов.
[00458] Гены Y-хромосомы Ddx3y и Eif2s3y экспрессируются, как и ожидалось, в гонадах CF11 на этой стадии, но в основном не выявляются в гонадах из клона СЕ6 с измененным полом, как показано на ФИГ. 3 и ФИГ. 4. На ФИГ. 3 показана экспрессия Ddx3y относительно Sf1 в СЕ6 и CF11. На ФИГ. 4 показана экспрессия Eif2s3y относительно Sf1 в СЕ6 и CF11. XY CD1 и XX CD1 использовали в качестве положительного и отрицательного контроля соответственно (20 хс). Вместе с данными по экспрессии Sry эти данные свидетельствуют о том, что происходит сильная репрессия трех неродственных генов в Y-хромосоме в клоне с измененным полом (СЕ6), что позволяет предположить наличие сайленсинга крупных участков Y-хромосомы в клонах с измененным полом.
[00459] На ФИГ. 5А, 5В, 5С и 5D показано, что маркеры определения мужского пола и развития семенников ниже Sry снижены в гонадах из клона СЕ6 с измененным полом по сравнению с клоном CF11 с не измененным полом. На ФИГ. 5А показана экспрессия Sox9 относительно Sf1, на ФИГ. 5В показана экспрессия Fgf9 относительно Sf1, на ФИГ. 5С показана экспрессия mDhh относительно Sf1, а на ФИГ. 5D показана экспрессия Amh относительно Sf1. XY CD1 и XX CD1 использовали в качестве положительного и отрицательного контроля соответственно (20 хс).
[00460] На ФИГ. 6А и 6В показаны маркеры определения женского пола и развития яичников в гонадах из клона SE6 с измененным полом по сравнению с клоном CF11 с не измененным полом. На ФИГ. 6А показана экспрессия Foxl2 относительно Sf1, а на ФИГ. 6В показана экспрессия Rspo1 относительно Sf1. XY CD1 и XX CD1 использовали в качестве положительного и отрицательного контроля соответственно (20 хс). Инициация маркеров определения женского пола и развития яичников в общем случае происходит на стадиях, немного более поздних чем эти, однако один из наиболее ранних маркеров развития яичников (Foxl2) сильно повышен в гонадах из клона СЕ6 с измененным полом. Маркер яичников Rspo1 также немного повышен в образцах с измененным полом. Небольшая разница может быть просто связана с тем, что эта стадия является слишком ранней для выявления большей части специфического в отношении яичников развития.
[00461] Так как позже было продемонстрировано, что клон 1823СЕ6 теряет свою Y-хромосому в некоторый момент времени, эксперименты с экспрессией повторяли, как описано выше, используя дополнительные клоны XY ЭС клеток, включая одну линию с умеренным изменением пола и одну линию с сильным изменением пола, чтобы быть уверенными, что в обоих сохраняется Y-хромосома для всех моментов времени в эксперименте. Клоны выращивали в идентичных условиях на протяжении их выделения и размножения в среде на основе KO-DMEM. Как более подробно объясняется ниже, эти эксперименты подтвердили, что экспрессия Sry, генов Y-хромосомы и определяющих мужской пол генов снижена в меняющих пол линиях XY ЭС клеток, и наблюдается тенденция к более сильной репрессии в линиях, которые характеризуются наибольшей частотой изменения пола, по сравнению с линиями, которые характеризуются меньшей частотой изменения пола. Кроме того, эти эксперименты продемонстрировали, что гены Y-хромосомы являются хорошим способом индикации явления изменения пола, так как они в значительной степени репрессируются в линиях с измененным полом во время мышиного развития и во всех исследуемых органах после рождения. Кроме того, в одной линии XY ЭС клеток, в которой никогда не происходило изменение пола, наблюдался необычно высокий уровень большинства генов Y-хромосомы и генов определения мужского пола.
[00462] На ФИГ. 7 измеряли экспрессию Sry в гонадах во время определения пола. Использовали три контрольные линии: XY мышиные эмбрионы, созданные посредством скрещивания; XY мышиные эмбрионы из XY ЭС клеток, не подвергнутых направленному воздействию; и XY мышиные эмбрионы из линии XY ЭС клеток (1823-CF11), которая не меняет пол. Эти контроли продемонстрировали нормальную временную динамику экспрессии Sry с инициацией около 14 хс, пиком при 17-18 хс и окончанием при 26 хс. Две меняющие пол линии продемонстрировали заметно меньшую экспрессию Sry во время этого критического периода. Линия #1 представляет собой линию с сильным изменением пола (в среднем 86% XY самок) и демонстрировала меньшую экспрессию Sry во время этого периода, чем линия #2 (15069-CD1; 45% XY самок). Эмбрионы XX мышей не демонстрировали какой-либо экспрессии (вследствие отсутствия Y-хромосомы) и служили в качестве отрицательного контроля.
[00463] На ФИГ. 8А-С показаны уровни экспрессии трех генов в Y-хромосоме в половых тяжах во время определения пола: Eif2s3y (ФИГ. 8А), Uty (ФИГ. 8В) и Ddx3y (ФИГ. 8С). Все три продемонстрировали наибольшую экспрессию в мышиных эмбрионах, полученных из линии XY ЭС клеток, не меняющей пол, умеренные уровни в контрольных эмбрионах (XY мышиных эмбрионах, полученных путем скрещивания, и XY мышиных эмбрионах из XY ЭС клеток, не подвергнутых направленному воздействию) и самые низкие уровни в XY мышиных эмбрионах, полученных из двух меняющих пол линий XY ЭС клеток, что свидетельствует о влиянии этого процесса на многие гены в Y-хромосоме помимо Sry. На ФИГ. 9 приведены те же данные, что и на ФИГ. 7 и 8А-С, только в сжатом виде, показывающие средние значения по всем 4 генам Y-хромосомы, анализируемым в эмбриональном половом тяже.
[00464] Чтобы определить, происходит ли репрессия геном Y-хромосомы у мышей, полученных из меняющих пол линий, после рождения, определяли уровни экспрессии Ddx3y (ФИГ. 10А), Uty (ФИГ. 10В), Eif2s3y (ФИГ. 10С) и Kdm5d (ФИГ. 10D) в нескольких органах через одну неделю после рождения у мышей, полученных из линии XY ЭС клеток, не подвергнутых направленному воздействию, не меняющей пол линии XY ЭС клеток и меняющей пол линии. Уровни экспрессии исследовали в гонадах, почках, сердце, печени и лапах. На ФИГ. 10A-D показано, что репрессия генов Y-хромосомы все еще происходит у мышей, полученных из меняющей пол линии, в нескольких органах после рождения, а уровни экспрессии этих генов ниже, чем уровни у мышей из XY ЭС клеток, не подвергнутых направленному воздействию, и у мышей из линии XY ЭС клеток, которая не меняет пол.
[00465] На ФИГ. 11A (Sox9) и 11B (Fgf9) показано, что маркеры определения мужского пола и развития семенников ниже Sry снижены в гонадах из мышиных эмбрионов, созданных из меняющих пол линий XY ЭС клеток по сравнению с не меняющей пол линией XY ЭС клеток, контрольной линией XY ЭС клеток, не подвергнутых направленному воздействию, и XX мышиными эмбрионами, полученными путем скрещивания. XY мышиные эмбрионы, полученные путем скрещивания, использовали в качестве дополнительного контроля. Как Sox9, так и Fgf9 являются критически важными ранними генами в мужском пути, а экспрессия их обоих повышена в районе пика экспрессии Sry (16-18 хс) в гонадах и необходима для развития мужских семенников. Уровни Sox9 и Fgf9 наиболее высоки в гонадах из линии, которая не меняет пол, имеют средние значения в контрольных эмбрионах (XY мышиных эмбрионах, полученных путем скрещивания, и мышиных эмбрионах из XY ЭС клеток, не подвергнутых направленному воздействию) и наименьшие в XX мышиных эмбрионах, полученных путем скрещивания. XX мышиные эмбрионы использовали для указания женского уровня экспрессии для Sox9 и Fgf9 во время этого периода. Уровни экспрессии в мышиных эмбрионах, полученных из двух меняющих пол линий, находятся между контрольными XX и XY уровнями, при этом линия #1 с более выраженным изменением демонстрирует более низкие уровни, чем #2 во время периода индукции Sox9.
[00466] Dhh и Amh являются маркерами развития семенников, экспрессия которых сильно и специфическим образом повышается во время развития семенников, и которые не присутствуют во время развития яичников. Смотрите ФИГ. 15. Оба этих гена имели наибольшую экспрессию в гонадах контрольных самцов (XY мышиных эмбрионах из линии, которая не меняет пол, XY мышиных эмбрионах, полученных путем скрещивания, и XY мышиных эмбрионах из ЭС клеток, не подвергнутых направленному воздействию). Мыши, полученные из двух меняющих пол линий, имели уровни экспрессии, находящиеся между XX и XY контролями скрещивания, при этом линия #1 с более выраженным изменением демонстрирует более низкие, ближе к женским, уровни, чем #2 (ФИГ. 12А (Dhh) и 12В (Amh)).
[00467] Foxl2 является самым ранним маркером женского развития, а его экспрессия сильно повышена в женских гонадах между 21-23 хс. Смотрите ФИГ. 15. Как показано на ФИГ. 13, уровни экспрессии этого гена у мышей, полученных из двух меняющих пол линий XY ЭС клеток находятся между XX и XY контролями скрещивания.
Пример 3. Отсутствие или снижение экспрессии Ddx3y (Dby), Eif2s3y и Uty в клонах XY ЭС клеток коррелирует с получением XY F0 самок мышей из этих клонов XY ЭС клеток.
[00468] В Таблице 11 показана предрасположенность клонов XY ЭС клеток полученных после направленного воздействия на гены в линии ЭС клеток VGF1, давать самок VELOCIMICE® после микроинъекции клонов XY ЭС клеток в 8-клеточные эмбрионы. Все клоны поддерживали и культивировали в среде на основе KO-DMEM во время процессов направленного воздействия и микроинъекции. Из этого образца клонов понятно, что способность давать XY самок VELOCIMICE® является специфической в отношении клона и находится в диапазоне 0-60%. Эти результаты воспроизводились в нескольких экспериментах с микроинъекциями: клоны, которые не давали самок, сохраняли эту характеристику при повторных микроинъекциях, тогда как в случае клонов, которые давали самок, наблюдалась тенденция к выходу приблизительно одинаковой доли самок в экспериментах с повторными микроинъекциями. Этот эффект невозможно обратить при повторном выращивании клонов в среде на основе DMEM. Клоны ЭС клеток из экспериментов с направленным воздействием на гены, в которых ЭС клетки выращивали и поддерживали в среде на основе DMEM или на основе KO-DMEM в течение всего процесса направленного воздействия - электропорации, отбора колоний, устойчивых к лекарственному препарату, скрининга в отношении направленных мутаций, размножения и криоконсервации, - размораживали и выращивали в противоположной среде в течение трех суток, готовя к микроинъекции в 8-клеточные эмбрионы. Клоны, полученные в среде на основе DMEM, сохраняли низкую частоту получения самок VELOCIMICE®, которую нельзя было повысить путем кратковременного воздействия KO-DMEM. Аналогично, клоны, полученные в среде на основе KO-DMEM, демонстрировали более высокую частоту получения самок VELOCIMICE®, а кратковременное воздействие DMEM не снижало предрасположенности XY клонов давать самок.
[00469]
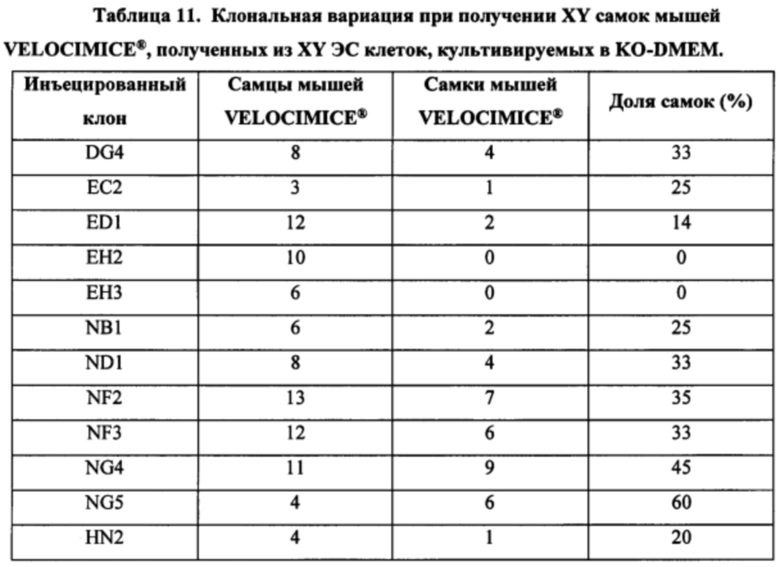
[00470] Затем проводили сравнение профилей генной экспрессии в феминизированных и нефеминизированных клонах XY ЭС клеток, подвергнутых направленному воздействию на гены (смотрите Таблицу 12). Использовали четыре клона ЭС клеток, которые обрабатывали одинаковым образом. Все четыре клона были получены из клеток VGF1, выращиваемых в одинаковой среде на основе KO-DMEM в течение всего процесса, включая начальное размораживание, электропорацию нацеливающим вектором, отбор клонов, устойчивых к лекарственному препарату, и замораживание. Два клона не давали XY самок VELOCIMICE® при нескольких микроинъекциях; два клона давали >50% XY самок VELOCIMICE® при повторных микроинъекциях. Уровни экспрессии для генов Y-хромосомы Ddx3y, Uty и Eif2s3y были в 10-20 ниже в феминизированных ЭС клетках по сравнению с нефеминизированными ЭС клетками. Два гена из хромосом, отличных от Y-хромосомы (Col10a1 и Tm4sf1), использовали в качестве контроля.
[00471]
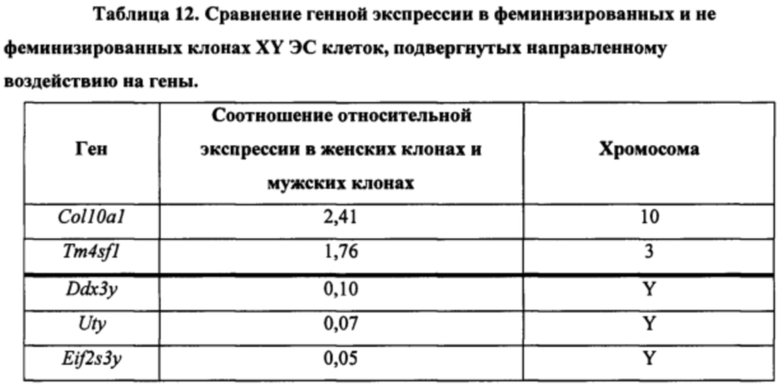
[00472] В другом эксперименте было отобрано пять клонов ЭС клеток, подвергнутых направленному воздействию на гены, полученных в идентичных условиях в среде KO-DMEM, для проведения эксперимента по субклонированию. Клоны 985-АА8 и 1823-CF11 давали только самцов VELOCIMICE® в трех отдельных экспериментах с микроинъекциями, тогда как клоны 15069-CD1, 4048-ВС4 и 979-АС7 давали в среднем от 30% до 50% XY самок VELOCIMICE® при повторных микроинъекциях (смотрите Таблицу 13). Клоны ЭС клеток размораживали после хранения в жидком азоте и субклонировали в двух репликах в 96-луночных планшетах, один из которых хранили при -150°С, тогда как содержимое другого выращивали и пассировали в два других планшета для получения препаратов ДНК и РНК. ДНК-планшет использовали для скрининга в отношении Y-хромосомы, тогда как РНК-планшет, использовали, чтобы исследовать экспрессию Eif2s3y, Uty и Ddx3y методом ОТ-кПЦР. Как показано в Таблице 13, предрасположенность клонов к тому, чтобы давать XY самок VELOCIMICE®, была прямо пропорциональна процентной доле клонов, характеризующихся отсутствием экспрессии или сниженной экспрессией Eif2s3y, Uty и Ddx3y, что указывает на то, что утрата экспрессии гена Y-хромосомы в субклонах может прогнозировать вероятность того, что клон будет давать XY самок VELOCIMICE®: чем больше доля субклонов с сайленсингом в отношении экспрессии Eif2s3y, Uty и Ddx3y, тем выше предрасположенность родительского клона ЭС клеток к тому, чтобы давать XY самок VELOCIMICE®.
[00473]
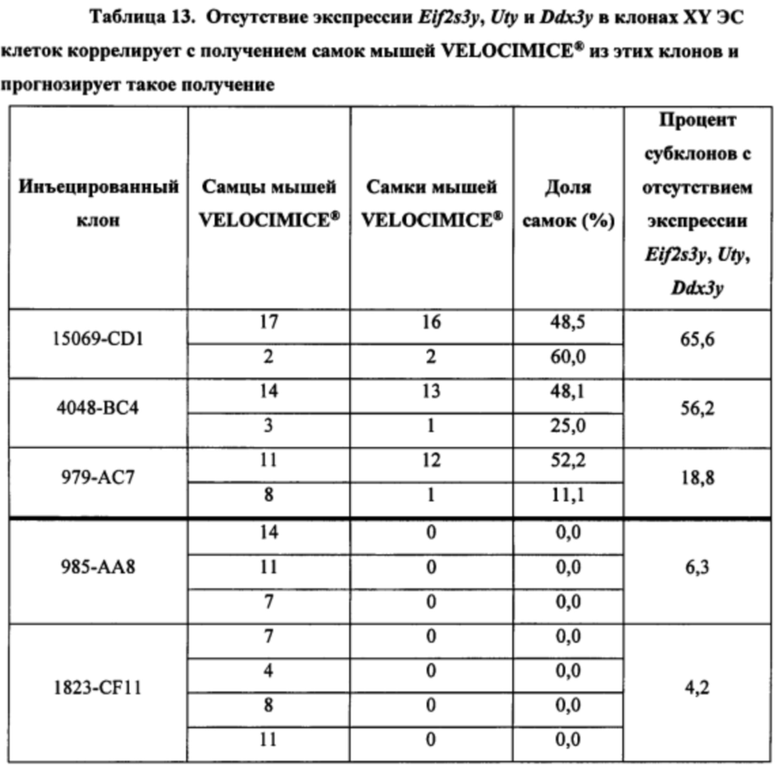
[00474] Чтобы получить данные в верхней части Таблицы 13, субклоны из трех родительских линий XY ЭС клеток, которые дают как самок, так и самцов XY мышей, подвергали РНК-анализу генной экспрессии Eif2s3y, Uty и Ddx3y. Три исследуемых клона с частичным изменением пола включали 979-АС7, 4048-ВС4 и 15069-CD1. Для каждого исследовали тридцать два субклона, включая субклоны А1-А4, В1-В4, С1-С4, D1-D4, Е1-Е4, F1-F4, G1-G4 и Н1-Н4 для клона 979-АС7, субклоны А5-А8, В5-В8, С5-С8, D5-D8, Е5-Е8, F5-F8, G5-G8 и Н5-Н8 для клона 4048-ВС4 и субклоны А9-А12, В9-В12, С9-С12, D9-D12, Е9-Е12, F9-F12, G9-G12 и Н9-Н12 для клона 15069-CD1. Экспрессию Drosha использовали в качестве контроля, а экспрессию каждого гена определяли относительно экспрессии B2m. Результаты ОТ-ПЦР показаны в форме ΔCt (представляющий интерес ген - B2m) на ФИГ. 14А-С. Отрицательное значение ΔCt свидетельствует о более высокой относительной экспрессии, а положительное значение ΔCt свидетельствует о более низкой относительной экспрессии. Как показано на ФИГ. 14А, в б из 32 субклонов (18,8%) для клона 979-АС7 не было выявлено экспрессии Eif2s3y, Uty или Ddx3y. Как показано на ФИГ. 14В, в 18 из 32 субклонов (56,2%) для клона 4048-ВС4 не было выявлено экспрессии Eif2s3y, Uty или Ddx3y. Как показано на ФИГ. 14С, в 22 из 32 субклонов для клона 15069-CD1 не было выявлено экспрессии Eif2s3y, Uty или Ddx3y. Однако последующий анализ 32 субклонов показал, что один из 32 субклонов - клон D9 - утратил Y-хромосому, что означает, что 21 из 32 субклонов (65,6%) для 15069 CD1 имел Y-хромосому, но не характеризовался выявляемой экспрессией Eif2s3y, Uty или Ddx3y. Оценку наличия Y-хромосомы проводили с помощью анализа числа копий с зондами для двух генов в Y-хромосоме: Sry и Eif2s3y. Все 32 субклона для клона 979-АС7, все 32 субклона для клона 4048-ВС4 и 31/32 субклонов для клона 15069-CD1 были подтверждены с помощью анализа числа копий, как имеющие по одной копии Y-хромосомы.
[00475] Чтобы получить данные в нижней части Таблицы 13, субклоны из двух родительских линий XY ЭС клеток, которые дают только самцов XY мышей, подвергали РНК-анализу генной экспрессии Eif2s3y, Uty и Ddx3y. Два исследуемых клона включали 985-АА8 и 1823-CF11. Для каждого исследовали сорок восемь субклонов, включая субклоны А1-А6, В1-В6, С1-С6, D1-D6, Е1-Е6, F1-F6, G1-G6 и Н1-Н6 для клона 985-АА8 и субклоны А7-А12, В7-В12, С7-С12, D7-D12, Е7-Е12, F7-F12, G7-G12 и Н7-Н12 для клона 1823-CF11. Экспрессию Drosha использовали в качестве контроля, а экспрессию каждого гена определяли относительно экспрессии B2m. Результаты ОТ-ПЦР показаны в форме ΔCt (представляющий интерес ген - B2m) на ФИГ. 14D-E. Отрицательное значение ΔCt свидетельствует о более высокой относительной экспрессии, а положительное значение ΔCt свидетельствует о более низкой относительной экспрессии. Как показано на ФИГ. 14D, в 3 из 48 субклонов (6,25%; клоны А4, F6 и Н3) для клона 985-АА8 не было выявлено экспрессии Eif2s3y, Uty или Ddx3y. Было показано, что два других субклона 985-АА8 - D1 и F2 - утратили Y-хромосому. Как показано на ФИГ. 14Е, в 2 из 48 субклонов (4,16%; клоны А9 и Е8) для клона 1823-CF11 не было выявлено экспрессии Eif2s3y, Uty или Ddx3y. Было показано, что один другой субклон 1823-CF11 - С12 - утратил Y-хромосому. Оценку наличия Y-хромосомы проводили с помощью анализа числа копий с зондами для одного гена в Y-хромосоме: Sry. Наличие одной копии Y-хромосомы было подтверждено с помощью анализа числа копий в 46/48 субклонов для 985 АА8 и 47/48 субклонов для 1823 CF11.
Пример 4. Повышение фертильности F0 XY самок с помощью TALEN-индуцированных мутаций в гене Y-хромосомы Sry.
[00476] Направленные делеции, включающие замещающий аллель lacZ для Sry, создавали с помощью большого нацеливающего вектора (LTVEC), содержащего инсерционную кассету, содержащую lacZ, слитый в рамке со стартовым кодоном Sry, и ген устойчивости к неомицину, фланкируемый плечами гомологии длиной 38 и 37 т.п.о., на основе ВАС из библиотеки bMQ (129S7/SvEv Brd-Hprt b-m2). LTVEC (смотрите проект NIH KOMP VG12778 LTVEC (доступный через интернет на World Wide Web (www) по адресу URL "velocigene.com/komp/detail/12778")) содержит в своих плечах гомологии все известные регуляторные элементы для экспрессии Sry. Его lacZ-кодируемая бета-галактозидаза служит в качестве репортера для тканеспецифической и специфической в отношении стадии развития экспрессии гена Sry. Аллель, созданный путем правильного направленного воздействия на ген Sry с помощью нацеливающего вектора, содержит делецию кодирующей последовательности Sry и замещение инсерционной кассетой. Нацеливающий вектор использовали для направленного воздействия на ген Sry в обеих F1 гибридных линиях ЭС клеток VGB6 (или В6А6) C57BL/6 и VGF1 (или F1H4) C57BL6/129. Мышиные ЭС клетки VGF1 (F1H4) были получены из гибридных эмбрионов, полученных путем скрещивания самки мыши C57BL/6NTac с самцом мыши 129S6/SvEvTac. Следовательно, ЭС клетки VGF1 содержат Y-хромосому мыши 129S6/SvEvTac. Самки XY мышей, полученные из клеточной линии VGF1, содержали Y-хромосому, полученную от мыши 129S6/SvEvTac.
[00477] Мы получили TALEN, сконструированную для направленного воздействия на часть кодирующей последовательности ДНК-связывающего мотива HMG-бокса (вышележащая последовательность распознавания: 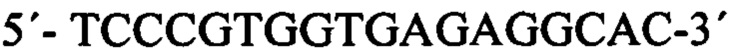 (SEQ ID NO: 43); нижележащая последовательность распознавания:
(SEQ ID NO: 43); нижележащая последовательность распознавания:  (SEQ ID NO: 44)) в гене Sry. TALEN-1 была активной при создании НГСК-мутаций в локусе Sry в нескольких экспериментах.
(SEQ ID NO: 44)) в гене Sry. TALEN-1 была активной при создании НГСК-мутаций в локусе Sry в нескольких экспериментах.
[00478] Делеционные мутации, главным образом, в результате репарации двухцепочечных разрывов в ДНК, включающей негомологичное соединение концов (НГСК), создавали в гене Sry посредством воздействия TALEN. Обе мышиные линии ЭС клеток, VGB6 и VGF1, были получены с TALEN-индуцированными мутациями. В Таблице 14 приведен перечень всех клонов и размеры делеционных мутаций, которые они несут, а также информация о наличии в них инсерционной кассеты LTVEC lacZ-neo в локусе Sry. В Таблице 14 также приведены результаты для поколения F0 мышей VELOCIMICE®, полученных посредством микроинъекции Sry-мутантных клонов ЭС клеток в 8-клеточные эмбрионы, и результаты по скрещиванию XY самок VELOCIMICE® (самки с измененным полом) с мутациями в гене Sry.
[00479] Все мыши VELOCIMICE® с Sry-мутациями, полученные из ЭС клеток VGB6, были самками, как и ожидалось при инактивации Sry. Как показано в Таблице 14, Sry-мутантные самки В6 VELOCIMICE® оказались стерильными при исследовании скрещивания, что согласуется с литературой, касающейся мутаций Sry. Из-за стерильности нацеливание LTVEC (т.е. клоны с правильными делециями Sry и вставками lacZ-neo) не не было формально подтверждено передачей мутантного аллеля потомству F1. Однако наши данные продемонстрировали очень разные результаты с клонами VGF1.
[00480] В отличие от ЭС клеток VGB6, которые нельзя поддерживать в среде, подобной KO-DMEM и имеющей низкую осмотическую силу, и сохранять способность давать мышей, клетки VGF1 можно поддерживать в среде, подобной KO-DMEM и имеющей низкую осмотическую силу. Таким образом, проводили эксперименты, чтобы определить, можно ли феминизировать VGF1 XY ЭС клетки с мутациями в Sry с помощью среды (т.е. чтобы определить, могут ли они, в отличие от VGB6 iSry-мутантных XY ЭС клеток, давать некоторое количество фертильных XY Sry-мутантных самок). Сначала VGF1 ЭС клетки поддерживали, как обычно, в подобной KO-DMEM и имеющей низкую осмотическую силу феминизирующей среде для роста: некоторые из микроинъецированных XY клонов, выращенных в этой среде, дадут фертильных XY самок даже если они не несут мутации. Например, клон ТН4 (данные не показаны) не содержал мутацию Sry, но дал 2 самок и 6 самцов VELOCIMICE®.
[00481] Были микроинъецированы шесть клонов ЭС клеток VGF1 с TALEN-индуцированными небольшими делециями в диапазоне от 5 т.п.о. до более чем 1 м.п.о. Нацеливание LTVEC (т.е. клоны с правильными делециями Sry и вставками lacZ-neo) не наблюдали в ЭС клетках VGF1, выращенных в подобной KO-DMEM и имеющей низкую осмотическую силу среде для роста. Все дали самок VELOCIMICE®, 32 из которых скрещивали. Примечательно, что все Sry-мутантные XY самки VELOCIMICE® были фертильными: каждая принесла по меньшей мере один помет (Таблица 14). Многие из Sry-мутантных XY самок принесли по несколько пометов с нормальным размером помета, тогда как некоторые XY самки принесли только один или два небольших помета. Из 299 F1 мышей из этих скрещиваний, которые были генотипированы, приблизительно половина (146, 49%) представляли собой нормальных XY самцов или нормальных XX самок. 174 (58%) F1 мышей имели женский фенотип, тогда как 125 (42%) имели мужской фенотип. 26 самок (15% самок, 8,6% из всего поколения F1) представляли собой XY самок, которые унаследовали мутантный аллель Sry. Вследствие мейотического нерасхождения, связанного с XY ооцитами, в потомстве F1 Sry-мутантных XY самок VELOCIMICE® наблюдали некоторое количество аберрантных генотипов - XXY, XYY, ХО, XXYY, - некоторые из которых включали мутантные аллели Sry.
[00482] В Таблице 14 также приведены результаты по фертильности XY самок, полученных из ЭС клеток, выращенных в традиционной среде на основе DMEM, которые имели мутации Sry. Неожиданно, по сравнению с результатами для аналогичного эксперимента с ЭС клетками, выращенными в среде на основе KO-DMEM, нацеливание LTVEC в среде на основе DMEM дало клоны с правильными делециями Sry и вставками lacZ-neo (т.е. направленная LTVEC делеция-замещение с помощью TALEN). Девять из десяти XYSry(lacZ) самок, полученных из четырех клонов, подвергнутых направленному воздействию, произвели живорожденных детенышей после спаривания, что соответствует 90% уровню фертильности.
[00483]
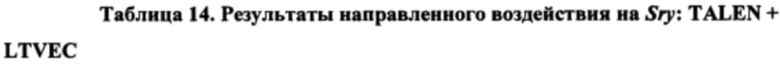
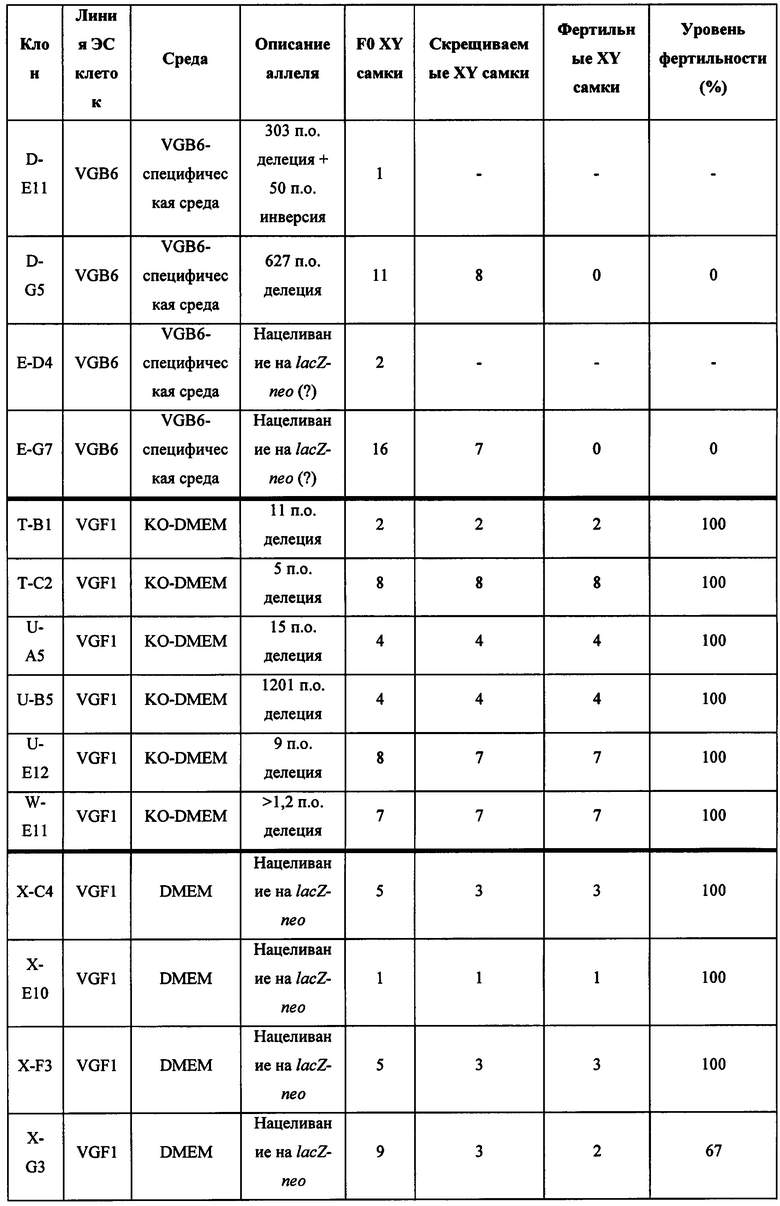
[00484] Чтобы сохранить фертильность мышей VELOCIMICE® с мутациями Sry, полученных из XY ЭС клеток VGB6, или чтобы повысить фертильность или плодовистость мышей VELOCIMICE® с мутациями Sry, полученных из ЭС клеток VGF1, выращенных в традиционной среде на основе DMEM, проводили сайленсинг дополнительных областей Y-хромосомы в XY ЭС клетках. Такой дополнительный сайленсинг также может повысить получение XY самок. В одном примере сайленсинг гена Zfy2 проводят путем направленной генетической модификации с помощью нуклеазы (например, ZFN, TALEN, мегануклеазы или CRISPR-Cas нуклеазы) и/или нацеливающего вектора, такого как LTVEC, как описано выше для направленного воздействия на ген Sry.
Пример 5. Экспрессия генов Y-хромосомы в ЭС клетках.
[00485] Чтобы определить, какие гены Y-хромосомы экспрессируются в мышиных эмбриональных стволовых (ЭС) клетках и могут быть использованы как маркеры изменения пола, проводили анализ секвенирования РНК для ЭС клеток F1H4. Как показано в Таблице 15, Eif2s3y, Ddx3y, Erdr1, Kdm5d, Uty, Ube1y1, Zfy1, Zfy2, Rbmy1a1, Sly, Usp9y, LOC100041346 имели выявляемые уровни экспрессии в ЭС клетках F1H4. Sry не имел выявляемых уровней экспрессии в ЭС клетках F1H4.
[00486]

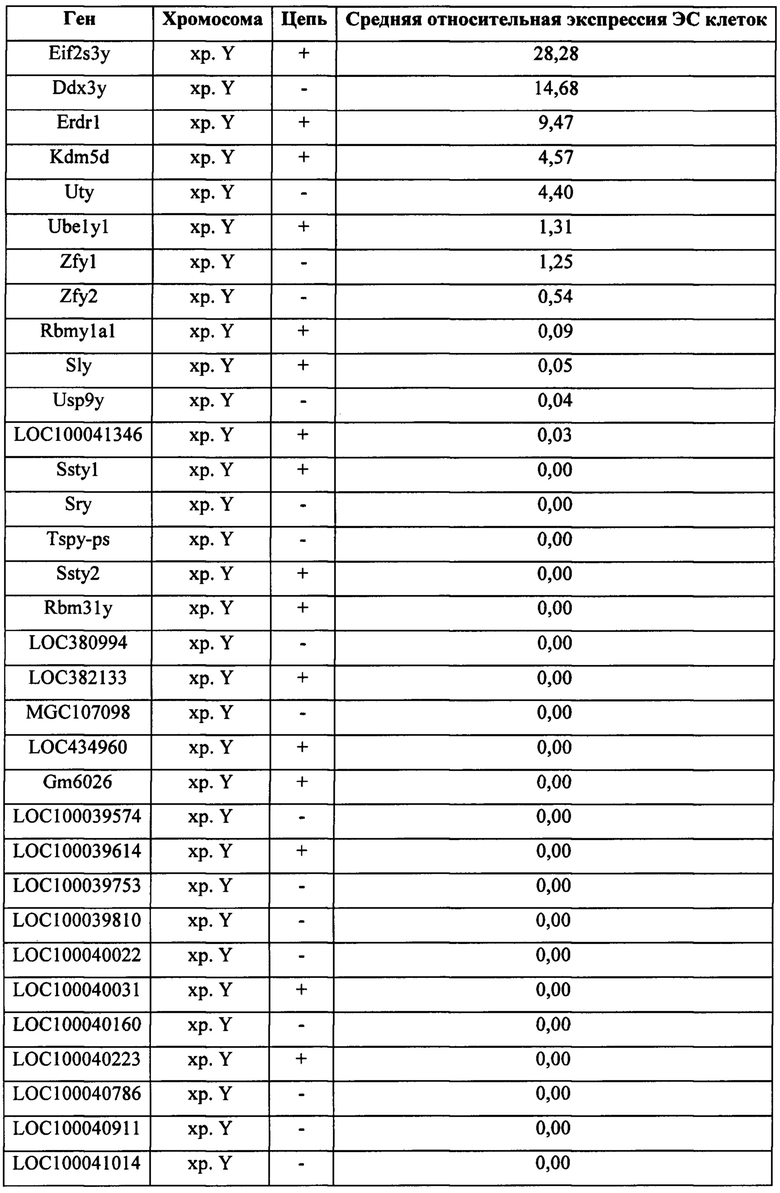
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ НАЦЕЛЕННЫХ ГЕНЕТИЧЕСКИХ МОДИФИКАЦИЙ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2711740C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ НАЦЕЛЕННЫХ ГЕНЕТИЧЕСКИХ МОДИФИКАЦИЙ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2771532C2 |
| ГЕНЕТИЧЕСКАЯ МОДИФИКАЦИЯ КРЫС | 2014 |
|
RU2690352C2 |
| ГЕНЕТИЧЕСКАЯ МОДИФИКАЦИЯ КРЫС | 2014 |
|
RU2774076C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ НАПРАВЛЕННОЙ МОДИФИКАЦИИ ГЕНОМА | 2014 |
|
RU2725520C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ НАПРАВЛЕННОЙ МОДИФИКАЦИИ ГЕНОМА | 2014 |
|
RU2685914C1 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ НАПРАВЛЕННОЙ МОДИФИКАЦИИ ГЕНОМА | 2020 |
|
RU2751237C1 |
| ГИБРИДНЫЙ МОЛОЧНЫЙ СКОТ И СИСТЕМЫ ДЛЯ МАКСИМИЗАЦИИ ВЫГОДЫ ПРИМЕНЕНИЯ ГИБРИДА | 2015 |
|
RU2721252C2 |
| НЕ ЯВЛЯЮЩИЕСЯ ЧЕЛОВЕКОМ ЖИВОТНЫЕ С ДЕФИЦИТОМ ДПНРНК | 2014 |
|
RU2721855C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ПОЛУЧЕНИЯ ИЛИ ПОДДЕРЖАНИЯ ПЛЮРИПОТЕНТНЫХ КЛЕТОК | 2015 |
|
RU2706965C2 |

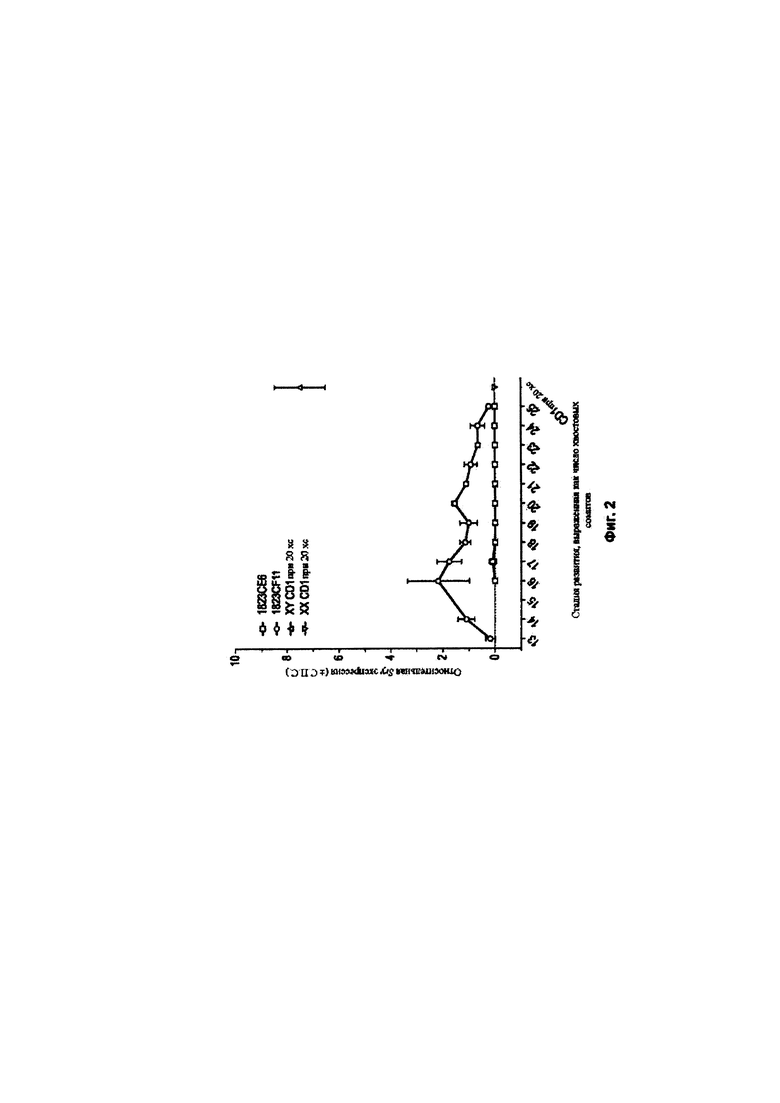
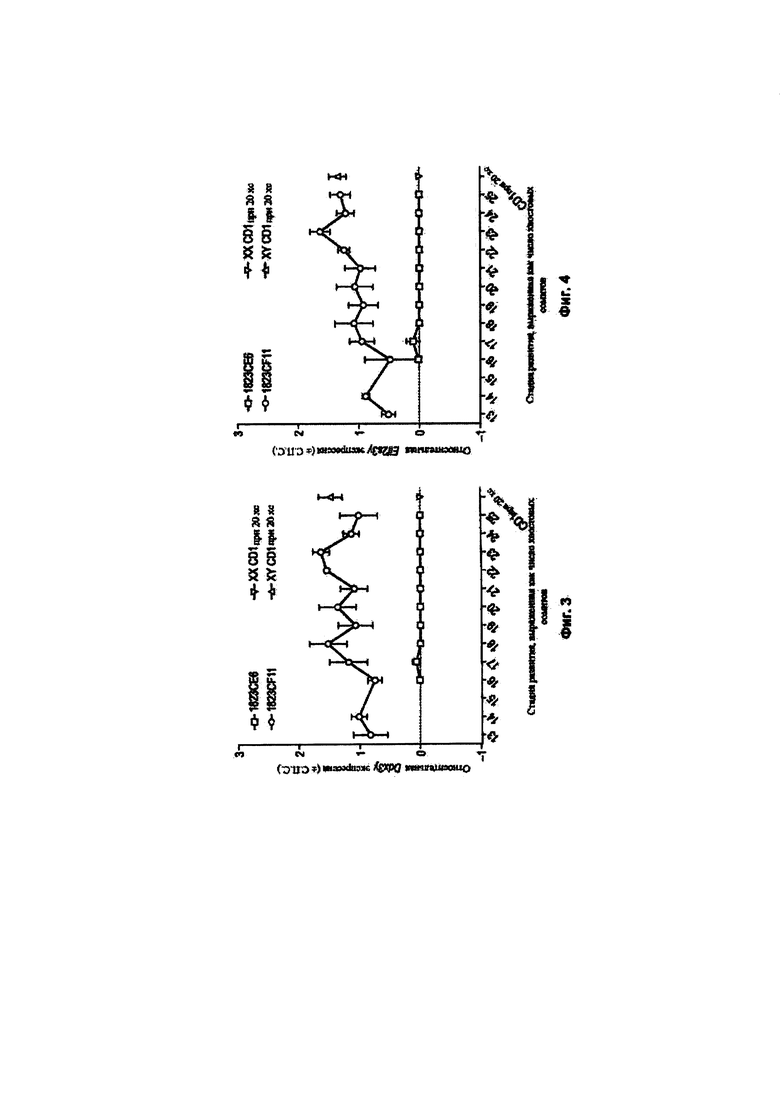

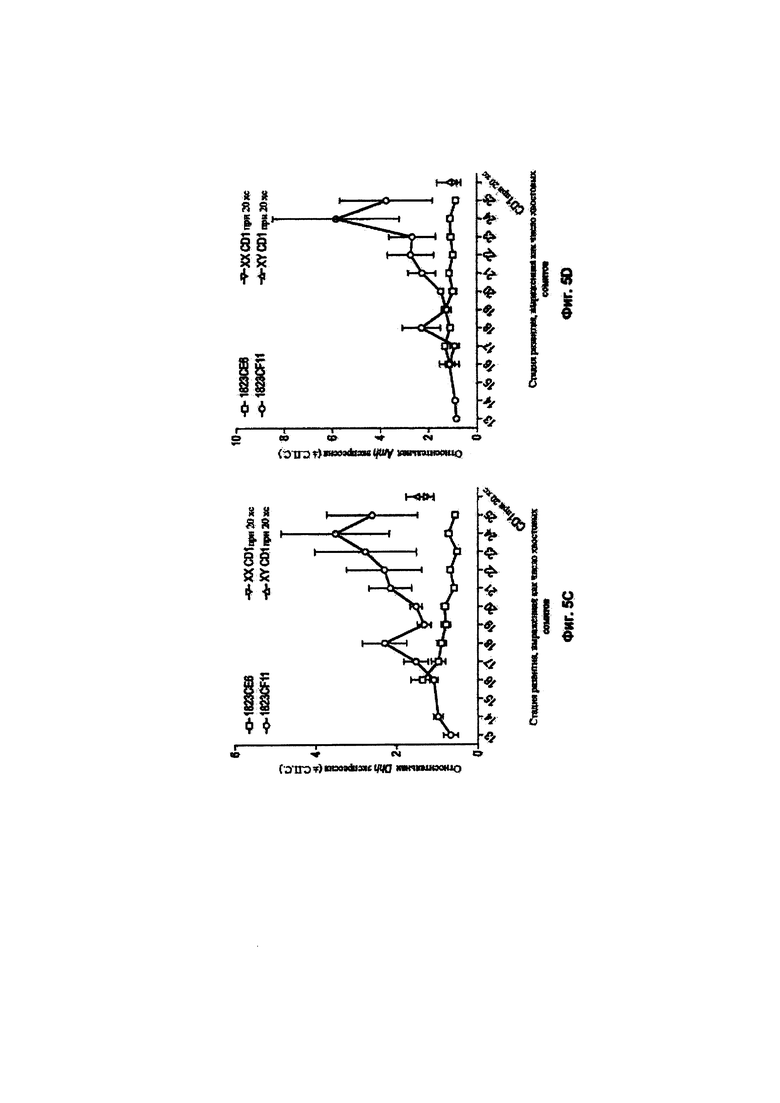
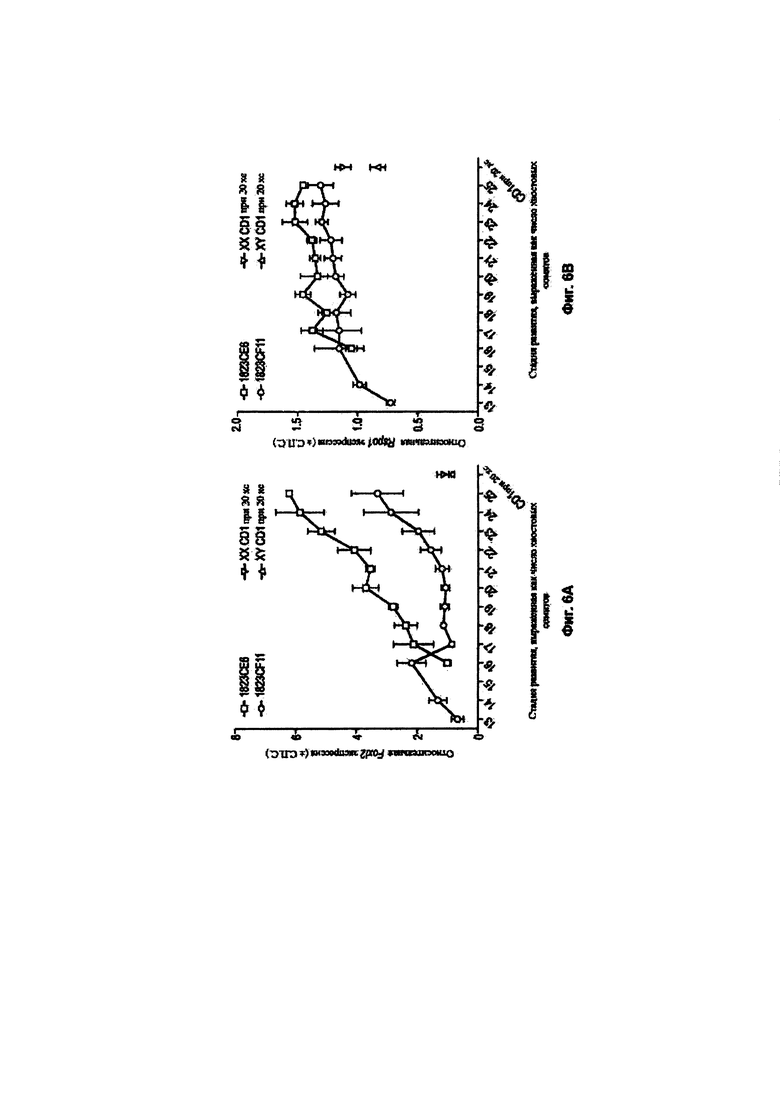
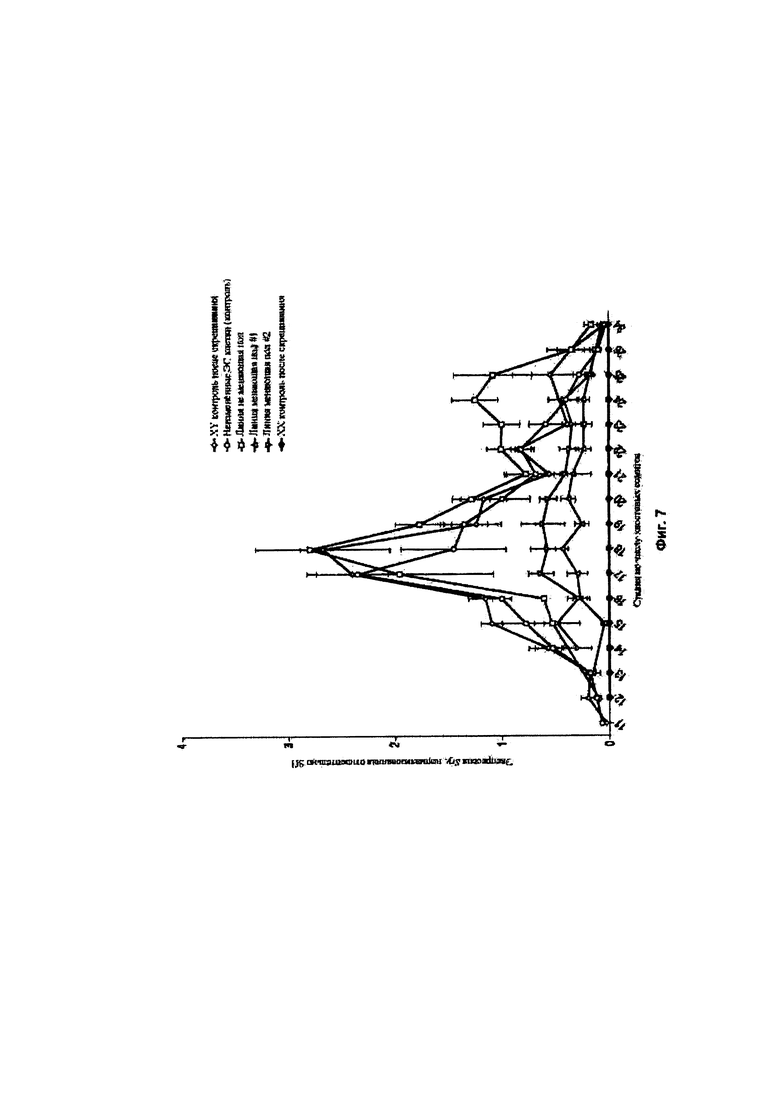
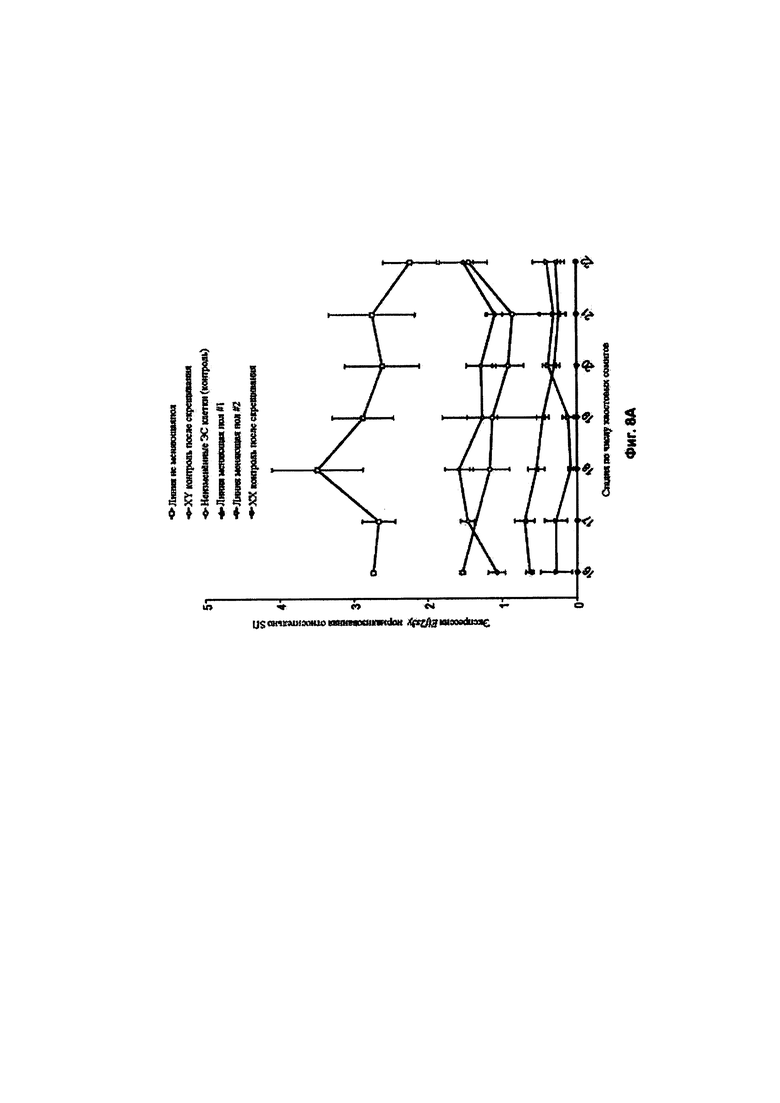
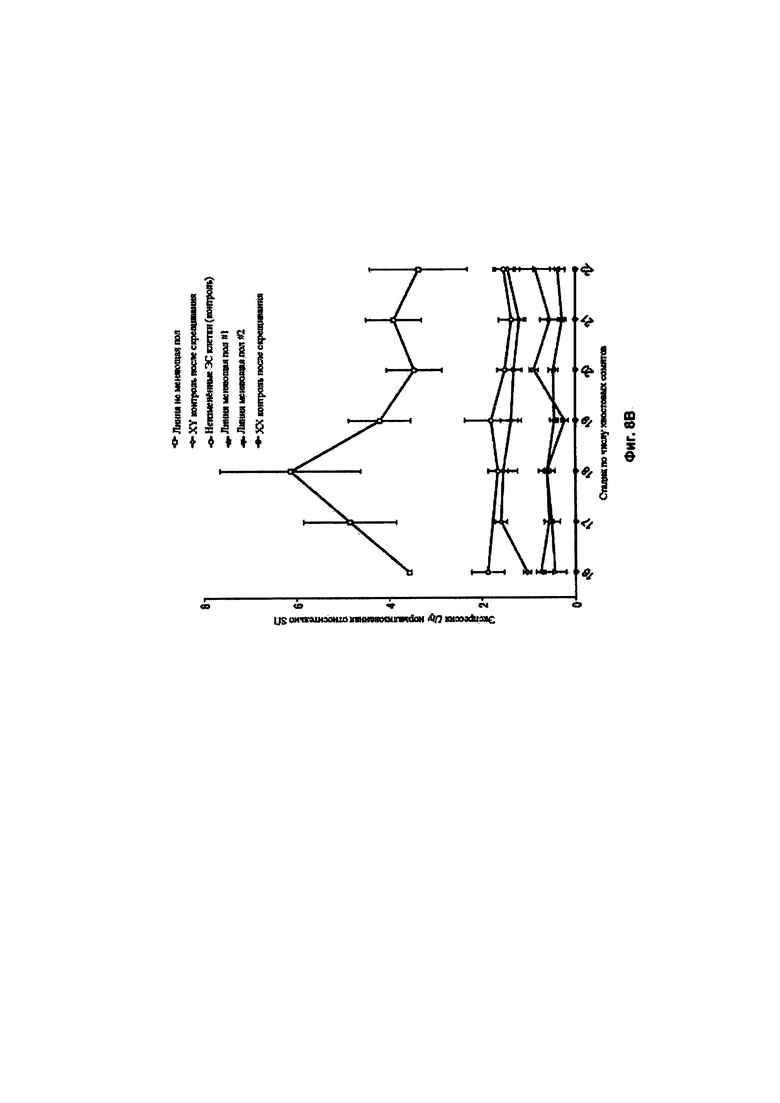
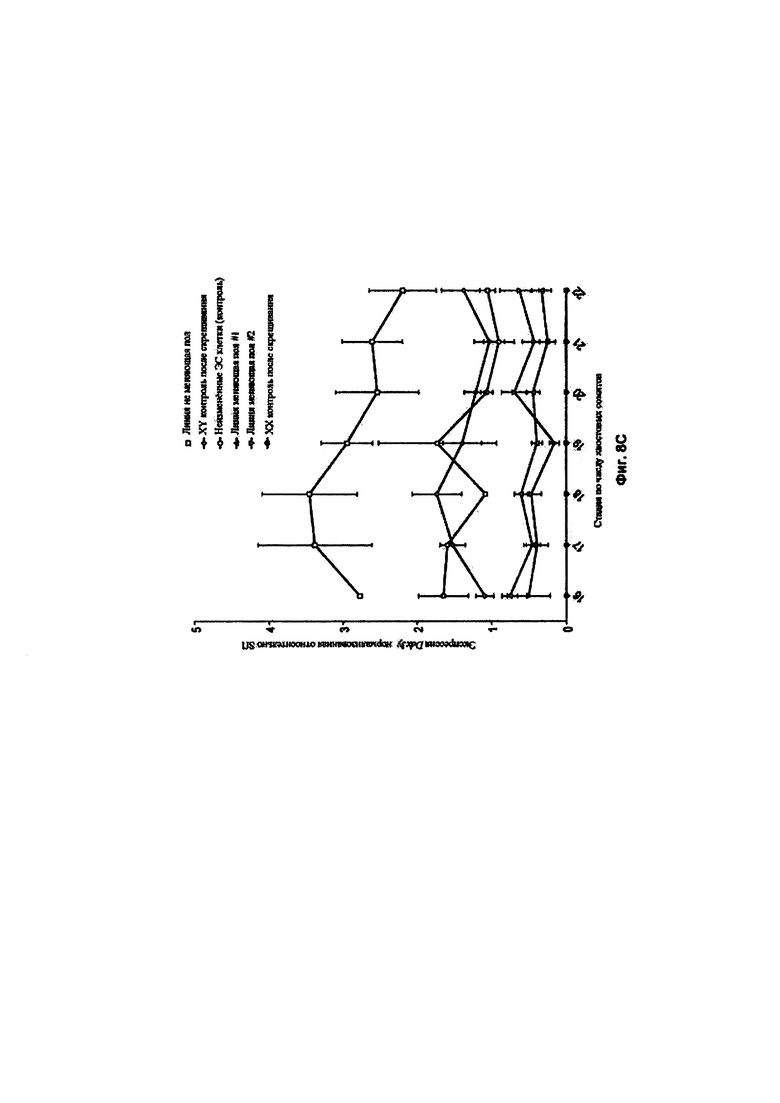
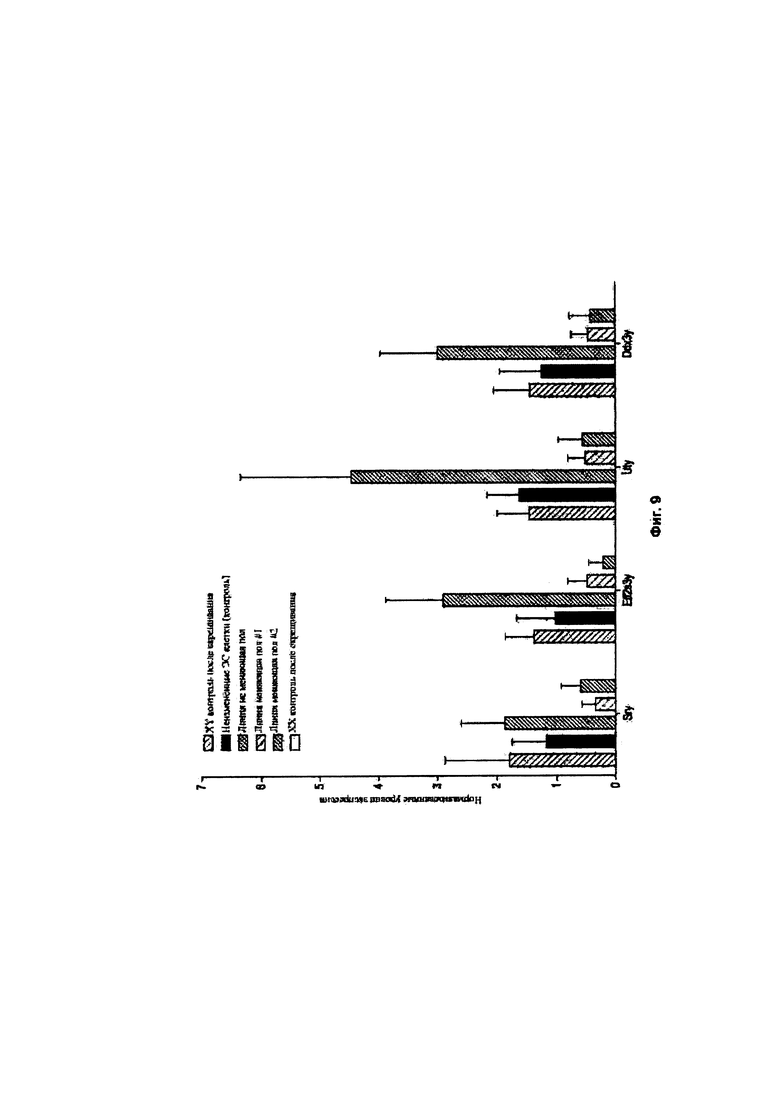

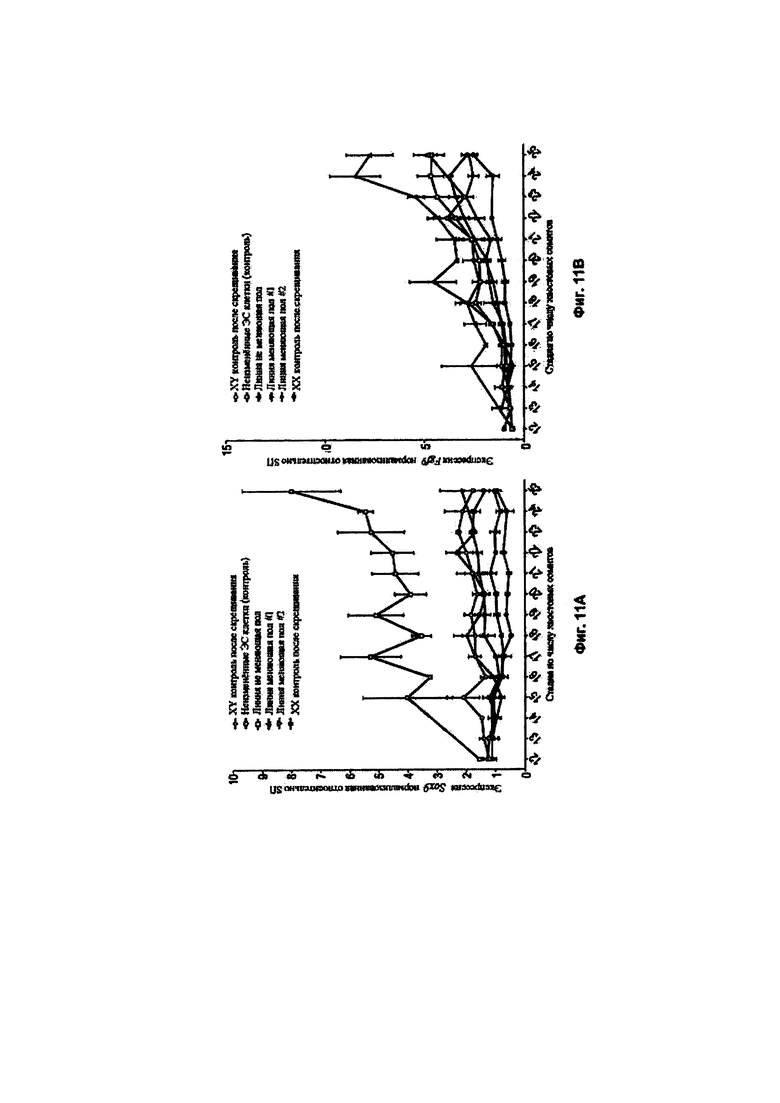
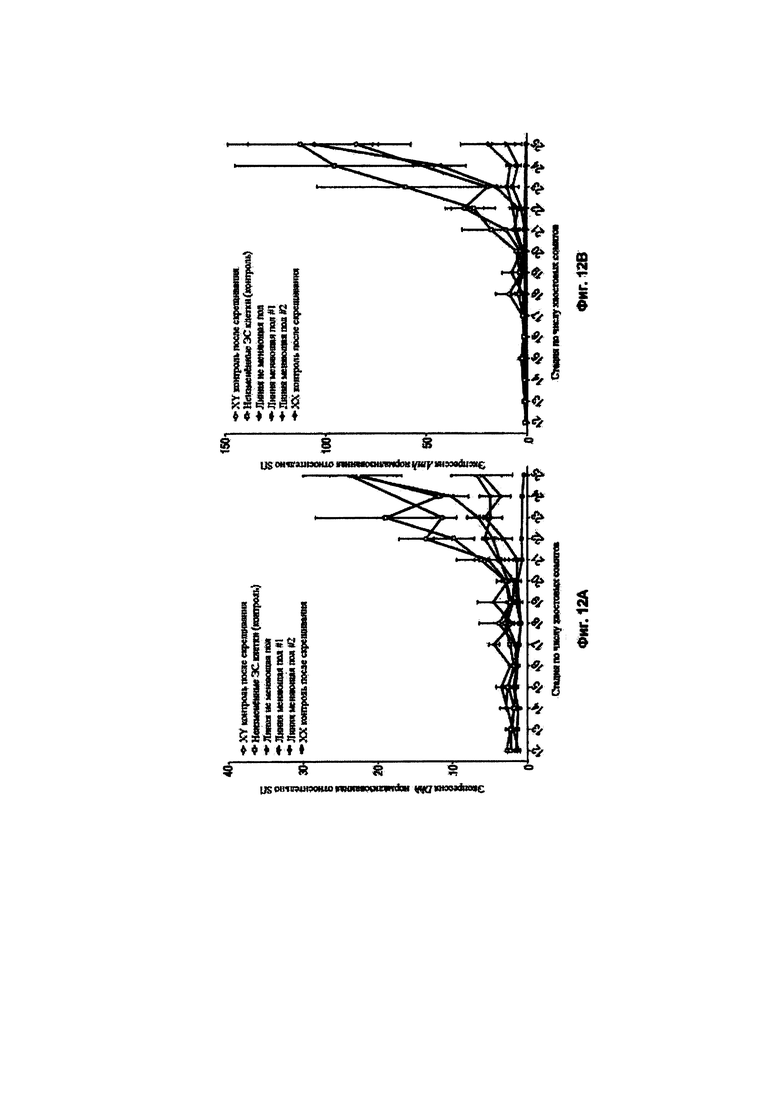
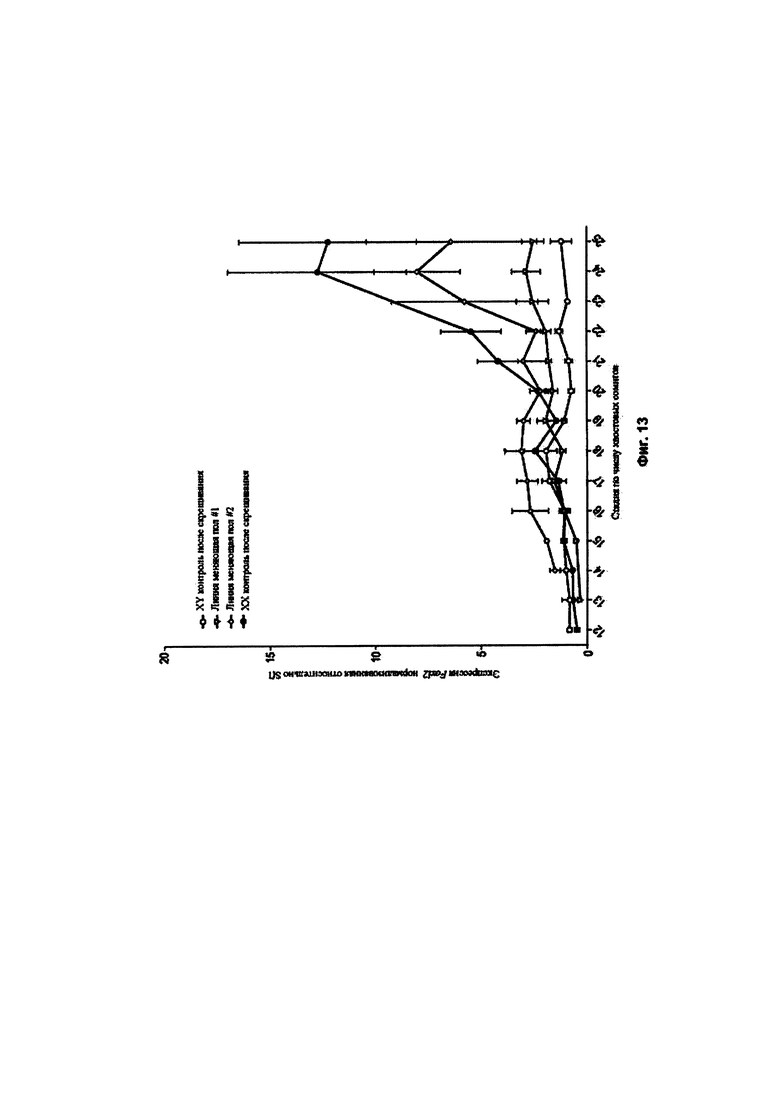



Изобретение относится к области биотехнологии, а именно к скринингу целевого соединения для феминизирующей активности в XY плюрипотентных клетках отличного от человека млекопитающего, оптимизации концентрации целевого соединения в феминизирующей среде и созданию донорской XY плюрипотентной клетки отличного от человека млекопитающего. Способ включает культивирование первой популяции и второй популяции XY плюрипотентных клеток отличного от человека млекопитающего в среде, содержащей основную среду и добавки, подходящие для поддержания плюрипотентности XY плюрипотентных клеток отличного от человека млекопитающего, причем первую популяцию культивируют в присутствии целевого соединения, а вторую популяцию культивируют в отсутствие целевого соединения. Затем осуществляют анализ одной или более XY плюрипотентных клеток отличного от человека млекопитающего в каждой из первой и второй популяций XY плюрипотентных клеток отличного от человека млекопитающего в отношении экспрессии и/или активности одного или более из Ddx3y, Uty и Eif2s3y, в соответствии с чем феминизирующую активность определяют по снижению экспрессии и/или активности одного или более из Ddx3y, Uty и Eif2s3y в одной или более XY плюрипотентных клетках отличного от человека млекопитающего из первой популяции по сравнению с одной или более XY плюрипотентными клетками отличного от человека млекопитающего из второй популяции. Изобретение позволяет расширить арсенал технических средств 3 н. и 24 з.п. ф-лы, 15 ил., 16 табл., 5 пр.
1. Способ скрининга целевого соединения для феминизирующей активности в XY плюрипотентных клетках отличного от человека млекопитающего, включающий:
(a) культивирование первой популяции и второй популяции XY плюрипотентных клеток отличного от человека млекопитающего в среде, содержащей основную среду и добавки, подходящие для поддержания плюрипотентности XY плюрипотентных клеток отличного от человека млекопитающего, причем первую популяцию культивируют в присутствии целевого соединения, а вторую популяцию культивируют в отсутствие целевого соединения; и
(b) анализ одной или более XY плюрипотентных клеток отличного от человека млекопитающего в каждой из первой и второй популяций XY плюрипотентных клеток отличного от человека млекопитающего в отношении экспрессии и/или активности одного или более из Ddx3y, Uty и Eif2s3y, в соответствии с чем феминизирующую активность определяют по снижению экспрессии и/или активности одного или более из Ddx3y, Uty и Eif2s3y в одной или более XY плюрипотентных клетках отличного от человека млекопитающего из первой популяции по сравнению с одной или более XY плюрипотентными клетками отличного от человека млекопитающего из второй популяции.
2. Способ по п. 1, дополнительно включающий
(c) выбор донорской XY плюрипотентной клетки отличного от человека млекопитающего из первой популяции для получения фертильного XY отличного от человека млекопитающего с женским фенотипом в поколении F0 на основании экспрессии и/или активности одного или более из Ddx3y, Uty и Eif2s3y, причем доля фертильных XY отличных от человека млекопитающих с женским фенотипом в поколении F0 обратно пропорционально экспрессии и/или активности одного или более из Ddx3y, Uty и Eif2s3y; необязательно при этом способ дополнительно содержит:
(d) внесение донорской XY плюрипотентной клетки отличного от человека млекопитающего в эмбрион-хозяин и необязательно культивирование эмбриона-хозяина до стадии бластоцисты;
(e) внесение эмбриона-хозяина по этапу (d) в организм реципиентной самки отличного от человека млекопитающего и вынашивание эмбриона-хозяина; и
(f) получение F0 XY потомства отличного от человека млекопитающего, включающего XY отличное от человека млекопитающее с женским фенотипом, причем после достижения половой зрелости F0 XY отличное от человека млекопитающее с женским фенотипом является фертильным и плодовитым.
3. Способ по п. 1 или 2, отличающийся тем, что в отсутствие целевого соединения среда на этапе (а) является достаточной для поддержания плюрипотентности XY плюрипотентных клеток отличного от человека млекопитающего, но не изменяет способности клетки давать фертильное потомство женского пола.
4. Способ по любому из пп. 1-3, отличающийся тем, что феминизирующую активность определяют на этапе (b) по снижению экспрессии и/или активности Ddx3y, Uty и Eif2s3y в одной или более XY плюрипотентных клетках отличного от человека млекопитающего из первой популяции по сравнению с одной или более XY плюрипотентными клетками отличного от человека млекопитающего из второй популяции.
5. Способ по любому из пп. 1-4, отличающийся тем, что анализ на этапе (b) выявляет экспрессию одного или более из Ddx3y, Uty и Eif2s3y на уровне мРНК и необязательно, при этом феминизирующую активность определяют, если экспрессия мРНК одного или более из Ddx3y, Uty и Eif2s3y в одной или более XY плюрипотентных клетках отличного от человека млекопитающего из первой популяции по меньшей мере на 90% ниже чем экспрессия мРНК одного или более из Ddx3y, Uty и Eif2s3y в одной или более XY плюрипотентных клетках отличного от человека млекопитающего из второй популяции.
6. Способ по любому из пп. 1-5, отличающийся тем, что феминизирующую активность определяют на этапе (b) по отсутствию экспрессии и/или активности одного или более из Ddx3y, Uty и Eif2s3y в одной или более XY плюрипотентных клетках отличного от человека млекопитающего из первой популяции, необязательно при этом феминизирующую активность определяют на этапе (b) по отсутствию экспрессии и/или активности Ddx3y, Uty и Eif2s3y в одной или более XY плюрипотентных клетках отличного от человека млекопитающего из первой популяции.
7. Способ оптимизации концентрации целевого соединения в феминизирующей среде, включающий:
(а) культивирование первой популяции и второй популяции XY плюрипотентных клеток отличного от человека млекопитающего в среде, содержащей основную среду и добавки, подходящие для поддержания плюрипотентности XY плюрипотентных клеток отличного от человека млекопитающего,
причем первую популяцию культивируют в присутствии первой концентрации целевого соединения, а вторую популяцию культивируют в присутствии второй концентрации целевого соединения, которая отличается от первой концентрации; и
(b) анализ одной или более XY плюрипотентных клеток отличного от человека млекопитающего в каждой из первой и второй популяций XY плюрипотентных клеток отличного от человека млекопитающего в отношении экспрессии и/или активности одного или более из Ddx3y, Uty и Eif2s3y; и выбор первой концентрации, если экспрессия и/или активность одного или более из Ddx3y, Uty и Eif2s3y снижается в одной или более XY плюрипотентных клетках отличного от человека млекопитающего из первой популяции по сравнению с одной или более XY плюрипотентными клетками отличного от человека млекопитающего из второй популяции.
8. Способ по п. 7, дополнительно включающий:
(c) выбор донорской XY плюрипотентной клетки отличного от человека млекопитающего из первой популяции для получения фертильного XY отличного от человека млекопитающего с женским фенотипом в поколении F0 на основании экспрессии и/или активности одного или более из Ddx3y, Uty и Eif2s3y, причем доля фертильных XY отличных от человека млекопитающих с женским фенотипом в поколении F0 обратно пропорционально экспрессии и/или активности одного или более из Ddx3y, Uty и Eif2s3y; необязательно при этом способ дополнительно включает:
(d) внесение донорской XY плюрипотентной клетки отличного от человека млекопитающего в эмбрион-хозяин и необязательно культивирование эмбриона-хозяина до стадии бластоцисты;
(e) внесение эмбриона-хозяина по этапу (d) в организм реципиентной самки отличного от человека млекопитающего и вынашивание эмбриона-хозяина; и
(f) получение F0 XY потомства отличного от человека млекопитающего, включающего XY отличное от человека млекопитающее с женским фенотипом, причем после достижения половой зрелости F0 XY отличное от человека млекопитающее с женским фенотипом является фертильным и плодовитым.
9. Способ по п. 7 или 8, отличающийся тем, что на этапе (b) выбирают первую концентрацию, если одна или более XY плюрипотентных клеток отличного от человека млекопитающего из первой популяции имеют сниженную экспрессию и/или активность Ddx3y, Uty и Eif2s3y по сравнению с одной или более XY плюрипотентными клетками отличного от человека млекопитающего из второй популяции.
10. Способ по любому из пп. 7-9, отличающийся тем, что анализ на этапе (b) выявляет экспрессию одного или более из Ddx3y, Uty и Eif2s3y на уровне мРНК и необязательно, при этом первую концентрацию выбирают, если экспрессия мРНК одного или более из Ddx3y, Uty и Eif2s3y в одной или более XY плюрипотентных клетках отличного от человека млекопитающего из первой популяции по меньшей мере на 90% ниже, чем экспрессия мРНК одного или более из Ddx3y, Uty и Eif2s3y в одной или более XY плюрипотентных клетках отличного от человека млекопитающего из второй популяции.
11. Способ по любому из пп. 7-10, отличающийся тем, что на этапе (b) выбирают первую концентрацию, если в одной или более XY плюрипотентных клетках отличного от человека млекопитающего из первой популяции отсутствует экспрессия и/или активность одного или более из Ddx3y, Uty и Eif2s3y, необязательно при этом на этапе (b) выбирают первую концентрацию, если в одной или более XY плюрипотентных клетках отличного от человека млекопитающего из первой популяции отсутствует экспрессия и/или активность Ddx3y, Uty и Eif2s3y.
12. Способ по любому из пп. 1-11, отличающийся тем, что первую популяцию культивируют в присутствии целевого соединения в течение по меньшей мере 1 суток, 2 суток, 3 суток, 4 суток, 5 суток, 6 суток, 7 суток, 8 суток, 9 суток, 10 суток, 11 суток, 12 суток, 13 суток, 2 недель, 3 недель или 4 недель перед этапом анализа (b).
13. Способ по любому из пп. 2-6 и 8-12, отличающийся тем, что
(I) донорская XY плюрипотентная клетка отличного от человека млекопитающего на этапе (с) характеризуется сниженной экспрессией и/или активностью одного или более из Ddx3y, Uty и Eif2s3y по сравнению с контрольной XY плюрипотентной клеткой отличного от человека млекопитающего, которую культивировали в среде, достаточной для поддержания плюрипотентности контрольной XY плюрипотентной клетки отличного от человека млекопитающего, но не для изменения способности клетки дать фертильное потомство женского пола, необязательно при этом донорская XY плюрипотентная клетка отличного от человека млекопитающего на этапе (с) характеризуется сниженной экспрессией и/или активностью Ddx3y, Uty nEi/2s3y по сравнению с контрольной XY плюрипотентной клеткой отличного от человека млекопитающего; или
(II) донорская XY плюрипотентная клетка отличного от человека млекопитающего на этапе (с) характеризуется сниженной экспрессией и/или активностью одного или более из Ddx3y, Uty и Eif2s3y по сравнению с контрольной XY плюрипотентной клеткой отличного от человека млекопитающего из второй популяции, необязательно при этом донорская XY плюрипотентная клетка отличного от человека млекопитающего на этапе (с) характеризуется сниженной экспрессией и/или активностью Ddx3y, Uty и Eif2s3y по сравнению с контрольной XY плюрипотентной клеткой отличного от человека млекопитающего.
14. Способ по любому из пп. 1-13, отличающийся тем, что первая популяция и вторая популяция происходят из одной клеточной линии или одного клона или имеют одинаковый генотип.
15. Способ создания донорской XY плюрипотентной клетки отличного от человека млекопитающего, включающий:
(a) культивирование популяции XY плюрипотентных клеток отличного от человека млекопитающего в среде с низкой осмоляльностью, содержащей основную среду и добавки, подходящие для поддержания плюрипотентности XY плюрипотентных клеток отличного от человека млекопитающего, причем среда с низкой осмоляльностью имеет осмоляльность от около 200 мОсм/кг до менее чем около 329 мОсм/кг;
(b) анализ одной или более XY плюрипотентных клеток отличного от человека млекопитающего в популяции XY плюрипотентных клеток отличного от человека млекопитающего в отношении экспрессии и/или активности одного или более из Ddx3y, Uty и Eif2s3y; и
(c) выбор донорской XY плюрипотентной клетки отличного от человека млекопитающего для получения фертильного XY отличного от человека млекопитающего с женским фенотипом в поколении F0 на основании экспрессии и/или активности одного или более из Ddx3y, Uty и Eif2s3y, причем доля фертильных XY отличных от человека млекопитающих с женским фенотипом в поколении F0 обратно пропорциональна экспрессии и/или активности одного или более из Ddx3y, Uty и Eif2s3y.
16. Способ по п. 15, дополнительно включающий:
(d) внесение донорской XY плюрипотентной клетки отличного от человека млекопитающего в эмбрион-хозяин и необязательно культивирование эмбриона-хозяина до стадии бластоцисты;
(e) внесение эмбриона-хозяина по этапу (d) в организм реципиентной самки отличного от человека млекопитающего и вынашивание эмбриона-хозяина; и
(f) получение F0 XY потомства отличного от человека млекопитающего, включающего XY отличное от человека млекопитающее с женским фенотипом, причем после достижения половой зрелости F0 XY отличное от человека млекопитающее с женским фенотипом является фертильным и плодовитым.
17. Способ по п. 15 или 16, отличающийся тем, что XY плюрипотентную клетку отличного от человека млекопитающего культивируют в среде с низкой осмоляльностью в течение по меньшей мере 1 суток, 2 суток, 3 суток, 4 суток, 5 суток, 6 суток, 7 суток, 8 суток, 9 суток, 10 суток, 11 суток, 12 суток, 13 суток, 2 недель, 3 недель или 4 недель перед этапом анализа (b).
18. Способ по любому из пп. 15-17, отличающийся тем, что донорская XY плюрипотентная клетка отличного от человека млекопитающего на этапе (с) характеризуется сниженной экспрессией и/или активностью одного или более из Ddx3y, Uty и Eif2s3y по сравнению с контрольной XY плюрипотентной клеткой отличного от человека млекопитающего, которую культивировали в среде, достаточной для поддержания плюрипотентности контрольной XY плюрипотентной клетки отличного от человека млекопитающего, но не для изменения способности клетки давать фертильное потомство женского пола, необязательно при этом донорская XY плюрипотентная клетка отличного от человека млекопитающего на этапе (с) характеризуется сниженной экспрессией и/или активностью Ddx3y, Uty и Eif2s3y по сравнению с контрольной XY плюрипотентной клеткой отличного от человека млекопитающего.
19. Способ по п. 18, отличающийся тем, что анализ на этапе (b) выявляет экспрессию одного или более из Ddx3y, Uty и Eif2s3y на уровне мРНК и необязательно, при этом донорскую XY плюрипотентную клетку отличного от человека млекопитающего выбирают на этапе (с), если экспрессия мРНК одного или более из Ddx3y, Uty и Eif2s3y в донорской XY плюрипотентной клетке отличного от человека млекопитающего по меньшей мере на 90% ниже, чем экспрессия мРНК одного или более из Ddx3y, Uty и Eif2s3y в контрольной XY плюрипотентной клетке отличного от человека млекопитающего.
20. Способ по любому из пп. 1-14, отличающийся тем, что среда на этапе (а) представляет собой среду с низкой осмоляльностью, имеющую осмоляльность от около 200 мОсм/кг до менее чем около 329 мОсм/кг.
21. Способ по любому из пп. 15-20, отличающийся тем, что среда с низкой осмоляльностью имеет одно или более из следующих свойств:
(I) среда с низкой осмоляльностью имеет осмоляльность от около 218 мОсм/кг до около 322 мОсм/кг;
(II) среда с низкой осмоляльностью имеет осмоляльность 218 мОсм/кг;
(III) среда с низкой осмоляльностью имеет проводимость от около 11 мСм/см до около 13 мСм/см;
(IV) основная среда содержит соль щелочного металла и галида в концентрации от около 50 мМ до около 110 мМ;
(V) основная среда содержит хлорид натрия в концентрации от около 50 мМ до около 110 мМ;
(VI) основная среда содержит соль карбоновой кислоты в концентрации от около 17 мМ до около 30 мМ;
(VII) основная среда содержит бикарбонат натрия в концентрации от около 13 мМ до около 25 мМ;
(VIII) основная среда имеет общую концентрацию соли галида щелочного металла и соли карбоновой кислоты от около 85 мМ до около 130 мМ;
(IX) основная среда содержит хлорид натрия в концентрации 87±5 мМ, а среда с низкой осмоляльностью имеет осмоляльность 261±26 мОсм/кг;
(X) основная среда содержит соль щелочного металла и галида в концентрации от около 50 мМ до около 110 мМ и соль карбоновой кислоты в концентрации от около 17 мМ до около 30 мМ, а среда с низкой осмоляльностью имеет осмоляльность от около 200 мОсм/кг до около 329 мОсм/кг;
(XI) среда с низкой осмоляльностью имеет осмоляльность 218 мОсм/кг, а основная среда содержит хлорид натрия в концентрации от 50 мМ до 110 мМ и бикарбонат натрия в концентрации от 13 мМ до 25 мМ;
(XII) основная среда содержит соль карбоновой кислоты в концентрации от около 18 мМ до около 44 мМ;
(XIII) основная среда содержит соль щелочного металла и галида в концентрации от около 50 мМ до около 110 мМ;
(XIV) соль карбоновой кислоты представляет собой бикарбонат натрия, соль щелочного металла и галида представляет собой хлорид натрия, а среда с низкой осмоляльностью имеет осмоляльность от около 216 мОсм/кг до около 322 мОсм/кг; и
(XV) основная среда содержит хлорид натрия в концентрации около 3 мг/мл и бикарбонат натрия в концентрации около 2,2 мг/мл, а среда с низкой осмоляльностью имеет осмоляльность около 216 мОсм/кг.
22. Способ по любому из пп. 1-21, отличающийся тем, что анализ на этапе (b) выявляет экспрессию одного или более из Ddx3y, Uty и Eif2s3y на уровне белка.
23. Способ по любому из пп. 2-6 и 8-22, отличающийся тем, что этап (b) включает анализ по меньшей мере двух XY плюрипотентных клеток отличного от человека млекопитающего в первой популяции в отношении экспрессии и/или активности одного или более из Ddx3y, Uty и Eif2s3y, а этап (с) включает выбор в качестве донорской XY плюрипотентной клетки отличного от человека млекопитающего клетки, проанализированной на этапе (b), имеющей самую низкую экспрессию и/или активность одного или более из Ddx3y, Uty и Eif2s3y по сравнению с другими анализируемыми клетками.
24. Способ по любому из пп. 2-6 и 8-23, отличающийся тем, что донорская XY плюрипотентная клетка отличного от человека млекопитающего на этапе (с) характеризуется отсутствием экспрессии и/или активности одного или более из Ddx3y, Uty и Eif2s3y, необязательно
при этом донорская XY плюрипотентная клетка отличного от человека млекопитающего на этапе (с) характеризуется отсутствием экспрессии и/или активности Ddx3y, Uty и Eif2s3y.
25. Способ по любому из пп. 1-24, отличающийся тем, что XY плюрипотентные клетки отличного от человека млекопитающего представляют собой эмбриональные стволовые (ЭС) клетки, необязательно при этом
ЭС клетки представляют собой мышиные ЭС клетки VGF1.
26. Способ по любому из пп. 1-25, отличающийся тем, что отличное от человека млекопитающее является грызуном, необязательно при этом
грызун представляет собой крысу или мышь, необязательно при этом
грызун представляет собой мышь, которая относится к линии C57BL/6, необязательно при этом Y-хромосома получена из линии C57BL/6, линии 129 или линии BALB/c, и необязательно при этом грызун представляет собой мышь, которая относится к линии C57BL/6 и линии 129.
27. Способ по любому из пп. 1-26, отличающийся тем, что XY плюрипотентные клетки отличного от человека млекопитающего содержат направленную генетическую модификацию в целевом геномном локусе, необязательно
при этом направленная генетическая модификация содержит вставку, делецию, нокаут, нокин, точечную мутацию или их комбинацию.
| GUELER B., et al | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| XU J., et al | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
Авторы
Даты
2020-08-06—Публикация
2016-09-16—Подача