ПЕРЕКРЕСТНАЯ ССЫЛКА НА СМЕЖНЫЕ ЗАЯВКИ
Настоящая заявка испрашивает преимущество по предварительной заявке на патент США №62/017,582, поданной 26 июня 2014 г., и предварительной заявке на патент США №62/017,627, поданной 26 июня 2014 г., каждая из которых полностью включена в настоящий документ путем ссылки.
ССЫЛКА НА СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ, ПОДАННЫЙ В ВИДЕ ТЕКСТОВОГО ФАЙЛА ЧЕРЕЗ СЕТЬ EFS-WEB
Официальная копия списка последовательностей представлена в электронном виде через EFS-Web в виде файла со списком последовательностей в формате ASCII с наименованием 463545SEQLIST.TXT, созданного 25 июня 2015 г., имеющего размер 14 Кб и поданного одновременно со спецификацией. Список последовательностей, содержащийся в данном документе в формате ASCII, является частью спецификации и полностью включен в настоящий документ путем ссылки.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к способам и композициям для сохранения или культивирования плюрипотентных и/или тотипотентных клеток и способам и композициям для создания клеточных популяций и трансгенных животных.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Вероятно, из-за уникальных структурных особенностей Y-хромосомы успех стандартных стратегий нацеливания генов в мышиных эмбриональных стволовых клетках для создания мутаций в Y-связанных генах ограничен. Таким образом, понимание функционирования мышиных Y-связанных генов часто ограничено выводами, полученными в исследованиях мышей, которые несут спонтанные делеции, случайные инсерции генных ловушек или аутосомальные трансгены. Необходимы способы для улучшения способности нацеливания на геномный локус на Y-хромосоме.
Белок Sry (определяющая пол область Y-хромосомы) представляет собой ключевой регулятор определения мужского пола у плацентарных млекопитающих. Ген Sry, также известный как фактор развития семенников (TDF), располагается на Y-хромосоме. Считают, что Sry представляет собой транскрипционный фактор, который связывает ДНК посредством своего домена группы белков с высокой подвижностью (HMG). Экспрессия мышиного гена Sry ограничена половым тяжем в узком временном окне около 11-го дня эмбрионального развития; причем обнаруживаются как мРНК Sry, так и белок. В пределах этого временного окна должно вырабатываться достаточное количество Sry, чтобы превратить бипотенциальный половой тяж в направлении мужской программы формирования семенников, при этом ингибируя женскую программу развития яичников. Во взрослых семенниках обнаруживают кольцевой транскрипт Sry, но не белок Sry. Мутации в гене Sry, которые вызывают выработку неактивного белка Sry или которые изменяют время и интенсивность генной экспрессии, могут вызвать реверсию пола от мужского к женскому, что приводит к появлению животных, которые имеют Х- и Y-хромосому, но анатомически являются самками. Так называемые самки XY часто являются стерильными или имеют низкую фертильность. Способность управлять определением пола посредством регуляции Sry имела бы значительную ценность для получения генетически модифицированных животных.
ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Предлагается способ создания линии эмбриональных стволовых (ЭС) клеток XY, способной к производству фертильной самки XY не относящегося к человеку млекопитающего поколения F0. Способ включает: (а) модификацию эмбриональной стволовой (ЭС) клетки XY не относящегося к человеку млекопитающего для получения модификации, которая снижает уровень и/или активность белка Sry; и (b) культивацию модифицированной линии ЭС-клеток в условиях, которые позволяют создать линию ЭС-клеток, способную производить фертильную самку XY не относящегося к человеку млекопитающего поколения F0.
Также предлагается способ создания фертильной самки XY не относящегося к человеку млекопитающего в поколении F0. Способ включает: (а) введение ЭС-клетки XY не относящегося к человеку млекопитающего, полученной посредством вышеуказанного способа, имеющей модификацию, которая снижает уровень и/или активность белка Sry, в эмбрион-хозяина; (b) вынашивание эмбриона-хозяина; и (с) получение самки XY F0 не относящегося к человеку млекопитающего, причем после достижения половой зрелости самка XY F0 не относящегося к человеку млекопитающего является фертильной. В одном варианте осуществления самка XY F0 не относящегося к человеку млекопитающего является фертильной при скрещивании с мышью дикого типа. В конкретных вариантах осуществления мышь дикого типа представляет собой C57BL/6.
В одном варианте осуществления ЭС-клетка XY не относящегося к человеку млекопитающего получена от грызуна. В конкретном варианте осуществления грызун представляет собой мышь. В одном варианте осуществления мышиную ЭС-клетку XY получают из линии 129. В одном варианте осуществления мышиная ЭС-клетка XY представляет собой мышиную ЭС-клетку линии VGF1. В одном варианте осуществления мышиная ЭС-клетка XY содержит Y-хромосому, полученную из линии 129. В одном варианте осуществления мышиная ЭС-клетка XY получена из линии C57BL/6. В другом варианте осуществления грызун представляет собой крысу или хомяка.
В некоторых вариантах осуществления сниженные уровень и/или активность белка Sry являются результатом генетической модификации в гене Sry. В некоторых таких способах генетическая модификация в гене Sry содержит инсерцию одного или более нуклеотидов, делецию одного или более нуклеотидов, замену одного или более нуклеотидов, нокаут, нокин, замещение эндогенной нуклеотидной последовательности гомологичной, гетерологичной или ортологичной нуклеотидной последовательностью или их комбинацию.
В способах, предложенных в настоящем документе, нацеленная генетическая модификация может содержать инсерцию, делецию, нокаут, нокин, точечную мутацию или их комбинацию. В другом варианте осуществления нацеленная генетическая модификация находится на аутосоме.
В некоторых вариантах осуществления модификация гена Sry содержит инсерцию селективного маркера и/или репортерного гена, функционально связанного с промотором, активным в ЭС-клетке не относящегося к человеку млекопитающего. В некоторых вариантах осуществления модификация гена Sry содержит инсерцию репортерного гена, функционально связанного с эндогенным промотором Sry. В конкретных вариантах осуществления репортерный ген кодирует репортерный белок LacZ.
В одном варианте осуществления этап культивирования включает культивирование ЭС-клетки XY не относящегося к человеку млекопитающего в среде, содержащей основную среду и добавки, приемлемые для сохранения в культуре ЭС-клетки не относящегося к человеку млекопитающего, причем среда представляет собой среду с низкой осмоляльностью. В одном варианте осуществления среда с низкой осмоляльностью демонстрирует осмоляльность от около 200 мОсм/кг до менее чем около 329 мОсм/кг. В других вариантах осуществления среда с низкой осмоляльностью демонстрирует одну или более из следующих характеристик: проводимость от около 11 мСм/см до около 13 мСм/см; концентрация соли щелочного металла и галида от около 50 мМ до около 110 мМ; концентрация соли угольной кислоты от около 17 мМ до около 30 мМ; общая концентрация соли галида щелочного металла и соли угольной кислоты от около 85 мМ до около 130 мМ и/или комбинацию любых двух или более из них.
В некоторых вариантах осуществления после введения ЭС-клеток XY не относящегося к человеку млекопитающего в эмбрион-хозяина и последующего вынашивания эмбриона-хозяина по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% не относящихся к человеку млекопитающих F0 представляют собой самок XY, причем после достижения половой зрелости самка XY F0 не относящегося к человеку млекопитающего является фертильной.
В одном варианте осуществления ЭС-клетка XY не относящегося к человеку млекопитающего содержит целевой геномный локус на Y-хромосоме, содержащий сайт распознавания для нуклеазного агента, и при этом нуклеазный агент индуцирует одно- или двухцепочечный разрыв в сайте распознавания. Такой способ может дополнительно включать воздействие нуклеазного агента на ЭС-клетку в присутствии нацеливающего вектора, содержащего полинуклеотидную вставку, причем после воздействия нуклеазного агента и нацеливающего вектора ЭС-клетка модифицируется таким образом, что содержит полинуклеотидную вставку. В одном варианте осуществления нуклеазный агент представляет собой мРНК, кодирующую нуклеазу. В конкретных вариантах осуществления нуклеазный агент представляет собой: (а) нуклеазу с «цинковыми пальцами» (ZFN); (b) эффекторную нуклеазу, подобную активатору транскрипции (TALEN); или (с) мегануклеазу. В других вариантах осуществления нуклеазный агент содержит белок (Cas), ассоциированный с короткими палиндромными повторами, регулярно расположенными группами (CRISPR), и гидовую РНК (гРНК). В таких способах гидовая РНК (гРНК) содержит: (а) РНК коротких палиндромных повторов, регулярно расположенных группами (CRISPR) (крРНК), нацеленную на первый сайт распознавания; и (b) трансактивирующую РНК CRISPR (тракрРНК). В некоторых случаях сайт распознавания непосредственно фланкирован последовательностью мотива, прилежащего к протоспейсеру (РАМ). В одном варианте осуществления белок Cas представляет собой Cas9.
Также предложена культура in vitro, содержащая линию ЭС-клеток XY не относящегося к человеку млекопитающего, в соответствии с любым из способов, предложенных в настоящем документе.
Предложена культура in vitro, и она содержит: (а) эмбриональную стволовую (ЭС) клетку XY не относящегося к человеку млекопитающего, имеющую модификацию, которая снижает уровень и/или активность белка Sry; и (b) среду, содержащую основную среду и добавки, приемлемые для сохранения в культуре ЭС-клетки не относящегося к человеку млекопитающего. В одном варианте осуществления основная среда демонстрирует осмоляльность от около 200 мОсм/кг до менее чем около 329 мОсм/кг. В других вариантах осуществления основная среда демонстрирует одну или более из следующих характеристик: проводимость от около 11 мСм/см до около 13 мСм/см; концентрация соли щелочного металла и галида от около 50 мМ до около 110 мМ; концентрация соли угольной кислоты от около 17 мМ до около 30 мМ; общая концентрация соли галида щелочного металла и соли угольной кислоты от около 85 мМ до около 130 мМ и/или комбинацию любых двух или более из них. В одном варианте осуществления ЭС-клетка XY не относящегося к человеку млекопитающего получена от грызуна. В одном варианте осуществления грызун представляет собой мышь или крысу. В одном варианте осуществления мышиная ЭС-клетка XY представляет собой мышиную ЭС-клетку линии VGF1. В одном варианте осуществления грызун представляет собой крысу или хомяка. В одном варианте осуществления сниженные уровень и/или активность белка Sry получены в результате генетической модификации в гене Sry. В одном варианте осуществления генетическая модификация в гене Sry содержит инсерцию одного или более нуклеотидов, делецию одного или более нуклеотидов, замену одного или более нуклеотидов, нокаут, нокин, замещение эндогенной нуклеотидной последовательности гетерологичной нуклеотидной последовательностью или их комбинацию. В одном варианте осуществления ЭС-клетка не относящегося к человеку млекопитающего содержит одну, две, три или более нацеленных генетических модификаций. В одном варианте осуществления нацеленная генетическая модификация содержит инсерцию, делецию, нокаут, нокин, точечную мутацию или их комбинацию. В одном варианте осуществления нацеленная генетическая модификация содержит по меньшей мере одну инсерцию гетерологичного полинуклеотида в геном ЭС-клетки XY. В одном варианте осуществления нацеленная генетическая модификация находится на аутосоме. В одном варианте осуществления основная среда демонстрирует характеристики: 50±5 мМ NaCl, 26±5 мМ карбоната и 218±22 мОсм/кг. В одном варианте осуществления основная среда демонстрирует характеристики: около 3 мг/мл NaCl, 2,2 мг/мл бикарбоната натрия и 218 мОсм/кг. В одном варианте осуществления основная среда демонстрирует характеристики: 87±5 мМ NaCl, 18±5 мМ карбоната и 261±26 мОсм/кг. В одном варианте осуществления основная среда демонстрирует характеристики: около 5,1 мг/мл NaCl, 1,5 мг/мл бикарбоната натрия и 261 мОсм/кг. В одном варианте осуществления основная среда демонстрирует характеристики: 110±5 мМ NaCl, 18±5 мМ карбоната и 294±29 мОсм/кг. В одном варианте осуществления основная среда демонстрирует характеристики: около 6,4 мг/мл NaCl, 1,5 мг/мл бикарбоната натрия и 294 мОсм/кг. В одном варианте осуществления основная среда демонстрирует характеристики: 87±5 мМ NaCl, 26±5 мМ карбоната и 270±27 мОсм/кг. В одном варианте осуществления основная среда демонстрирует характеристики: около 5,1 мг/мл NaCl, 2,2 мг/мл бикарбоната натрия и 270 мОсм/кг. В одном варианте осуществления основная среда демонстрирует характеристики: 87±5 мМ NaCl, 26±5 мМ карбоната, 86±5 мМ глюкозы и 322±32 мОсм/кг. В одном варианте осуществления основная среда демонстрирует характеристики: около 5,1 мг/мл NaCl, 2,2 мг/мл бикарбоната натрия, 15,5 мг/мл глюкозы и 322 мОсм/кг. В одном варианте осуществления после введения ЭС-клеток XY не относящегося к человеку млекопитающего в эмбрион-хозяина и последующего вынашивания эмбриона-хозяина по меньшей мере 80% не относящихся к человеку млекопитающих F0 представляют собой самок XY, причем после достижения половой зрелости самка XY F0 не относящегося к человеку млекопитающего является фертильной.
Дополнительно предложен способ создания фертильной самки XY не относящегося к человеку млекопитающего в поколении F0, включающий: (а) культивирование донорской эмбриональной стволовой (ЭС) клетки XY не относящегося к человеку млекопитающего, имеющей модификацию, которая снижает уровень и/или активность белка Sry, в среде, содержащей основную среду и добавки, приемлемые для сохранения в культуре ЭС-клетки не относящегося к человеку млекопитающего; (b) введение донорской ЭС-клетки XY не относящегося к человеку млекопитающего в эмбрион-хозяина; (с) вынашивание эмбриона-хозяина; и (d) получение самки XY F0 не относящегося к человеку млекопитающего, причем после достижения половой зрелости самка XY F0 не относящегося к человеку млекопитающего является фертильной. В одном варианте осуществления среда демонстрирует осмоляльность от около 200 мОсм/кг до менее чем около 329 мОсм/кг. В других вариантах осуществления среда демонстрирует характеристику, включающую одно или более из следующего: проводимость от около 11 мСм/см до около 13 мСм/см; концентрация соли щелочного металла и галида от около 50 мМ до около 110 мМ; концентрация соли угольной кислоты от около 17 мМ до около 30 мМ; общая концентрация соли галида щелочного металла и соли угольной кислоты от около 85 мМ до около 130 мМ и/или комбинацию любых двух или более из них. В одном варианте осуществления ЭС-клетка XY не относящегося к человеку млекопитающего получена от грызуна. В одном варианте осуществления грызун представляет собой мышь или крысу. В одном варианте осуществления мышиная ЭС-клетка XY представляет собой мышиную ЭС-клетку линии VGF1. В одном варианте осуществления грызун представляет собой крысу или хомяка. В одном варианте осуществления сниженные уровень и/или активность белка Sry получены в результате генетической модификации в гене Sry. В одном варианте осуществления генетическая модификация в гене Sry содержит инсерцию одного или более нуклеотидов, делецию одного или более нуклеотидов, замену одного или более нуклеотидов, нокаут, нокин, замещение эндогенной нуклеотидной последовательности гетерологичной нуклеотидной последовательностью или их комбинацию. В одном варианте осуществления ЭС-клетка не относящегося к человеку млекопитающего содержит одну, две, три или более нацеленных генетических модификаций. В одном варианте осуществления нацеленная генетическая модификация содержит инсерцию, делецию, нокаут, нокин, точечную мутацию или их комбинацию. В одном варианте осуществления нацеленная генетическая модификация содержит по меньшей мере одну инсерцию гетерологичного полинуклеотида в геном ЭС-клетки XY. В одном варианте осуществления нацеленная генетическая модификация находится на аутосоме. В одном варианте осуществления основная среда демонстрирует характеристики: 50±5 мМ NaCl, 26±5 мМ карбоната и 218±22 мОсм/кг. В одном варианте осуществления основная среда демонстрирует характеристики: около 3 мг/мл NaCl, 2,2 мг/мл бикарбоната натрия и 218 мОсм/кг. В одном варианте осуществления основная среда демонстрирует характеристики: 87±5 мМ NaCl, 18±5 мМ карбоната и 261±26 мОсм/кг. В одном варианте осуществления основная среда демонстрирует характеристики: около 5,1 мг/мл NaCl, 1,5 мг/мл бикарбоната натрия и 261 мОсм/кг. В одном варианте осуществления основная среда демонстрирует характеристики: 110±5 мМ NaCl, 18±5 мМ карбоната и 294±29 мОсм/кг. В одном варианте осуществления основная среда демонстрирует характеристики: около 6,4 мг/мл NaCl, 1,5 мг/мл бикарбоната натрия и 294 мОсм/кг. В одном варианте осуществления основная среда демонстрирует характеристики: 87±5 мМ NaCl, 26±5 мМ карбоната и 270±27 мОсм/кг. В одном варианте осуществления основная среда демонстрирует характеристики: около 5,1 мг/мл NaCl, 2,2 мг/мл бикарбоната натрия и 270 мОсм/кг. В одном варианте осуществления основная среда при этом демонстрирует характеристики: 87±5 мМ NaCl, 26±5 мМ карбоната, 86±5 мМ глюкозы и 322±32 мОсм/кг. В одном варианте осуществления основная среда при этом демонстрирует характеристики: около 5,1 мг/мл NaCl, 2,2 мг/мл бикарбоната натрия, 15,5 мг/мл глюкозы и 322 мОсм/кг.
Дополнительно предложены способы производства не относящегося к человеку трансгенного млекопитающего, гомозиготного по целевой генетической мутации в поколении F1, включающие: (а) скрещивание фертильной самки XY F0, имеющей сниженные уровень и/или активность белка Sry, с когортным клональным сиблингом, полученным из того же ЭС-клеточного клона, самцом XY F0 не относящегося к человеку млекопитающего, причем каждый из фертильной самки XY F0 не относящегося к человеку млекопитающего и самца XY F0 не относящегося к человеку млекопитающего является гетерозиготным по генетической мутации; и (b) получение потомства мышей F1, которое является гомозиготным по генетической модификации.
Также предложен способ модификации целевого геномного локуса на Y-хромосоме в клетке, который включает: (а) обеспечение клетки, содержащей целевой геномный локус на Y-хромосоме, содержащий сайт распознавания для нуклеазного агента; (b) введение в клетку: (i) нуклеазного агента, причем нуклеазный агент индуцирует одно- или двухцепочечный разрыв на первом сайте распознавания; и (ii) первого нацеливающего вектора, содержащего первую полинуклеотидную вставку, фланкированную первым и вторым гомологичными плечами, соответствующими первому и второму целевым сайтам, расположенным достаточно близко к первому сайту распознавания; и (с) идентификацию по меньшей мере одной клетки, содержащей в своем геноме первую полинуклеотидную вставку, интегрированную в целевой геномный локус. В одном варианте осуществления суммарная длина первого гомологичного плеча и второго гомологичного плеча составляет по меньшей мере 4 т. п. н., но менее чем 150 т. п. н. В одном варианте осуществления длина первого гомологичного плеча и/или второго гомологичного плеча составляет по меньшей мере 400 п. н., но менее чем 1000 п. н. В другом варианте осуществления длина первого гомологичного плеча и/или второго гомологичного плеча составляет от около 700 п. н. до около 800 п. н.
Дополнительно предложен способ модификации целевого геномного локуса на Y-хромосоме в клетке, который включает: (а) обеспечение клетки, содержащей целевой геномный локус на Y-хромосоме, содержащий сайт распознавания для нуклеазного агента; (b) введение в клетку первого нацеливающего вектора, содержащего первую полинуклеотидную вставку, фланкированную первым и вторым гомологичными плечами, соответствующими первому и второму целевым сайтам; и (с) идентификацию по меньшей мере одной клетки, содержащей в своем геноме первую полинуклеотидную вставку, интегрированную в целевой геномный локус. В одном варианте осуществления длина первого гомологичного плеча и/или второго гомологичного плеча составляет по меньшей мере 400 п. н., но менее чем 1000 п. н. В другом варианте осуществления длина первого гомологичного плеча и/или второго гомологичного плеча составляет от около 700 п. н. до около 800 п. н. В одном варианте осуществления клетка представляет собой клетку млекопитающего. В одном варианте осуществления клетка млекопитающего представляет собой не относящуюся к человеку клетку. В одном варианте осуществления клетка млекопитающего получена от грызуна. В одном варианте осуществления грызун представляет собой крысу, мышь или хомяка. В одном варианте осуществления клетка представляет собой плюрипотентную клетку. В одном варианте осуществления клетка млекопитающего представляет собой индуцированную плюрипотентную стволовую (ИПС) клетку. В одном варианте осуществления плюрипотентная клетка представляет собой не относящуюся к человеку эмбриональную стволовую (ЭС) клетку. В одном варианте осуществления плюрипотентная клетка представляет собой эмбриональную стволовую (ЭС) клетку грызуна, эмбриональную стволовую (ЭС) клетку мыши или эмбриональную стволовую (ЭС) клетку крысы. В одном варианте осуществления нуклеазный агент представляет собой мРНК, кодирующую нуклеазу. В одном варианте осуществления нуклеазный агент представляет собой нуклеазу с «цинковыми пальцами» (ZFN). В одном варианте осуществления нуклеазный агент представляет собой эффекторную нуклеазу, подобную активатору транскрипции (TALEN). В одном варианте осуществления нуклеазный агент представляет собой мегануклеазу. В некоторых вариантах осуществления нуклеазный агент содержит белок (Cas), ассоциированный с короткими палиндромными повторами, регулярно расположенными группами (CRISPR), и гидовую РНК (гРНК). В таком способе гидовая РНК (гРНК) может содержать: (а) РНК коротких палиндромных повторов, регулярно расположенных группами (CRISPR) (крРНК), нацеленную на первый сайт распознавания; и (b) трансактивирующую РНК CRISPR (тракрРНК). В одном варианте осуществления первый или второй сайт распознавания непосредственно фланкирован последовательностью мотива, прилежащего к протоспейсеру (РАМ). В некоторых вариантах осуществления белок Cas представляет собой Cas9.
В некоторых вариантах осуществления модификация содержит делецию эндогенной нуклеотидной последовательности. В некоторых вариантах осуществления делеция находится в диапазоне от около 5 т. п. н. до около 10 т. п. н., от около 10 т. п. н. до около 20 т. п. н., от около 20 т. п. н. до около 40 т. п. н., от около 40 т. п. н. до около 60 т. п. н., от около 60 т. п. н. до около 80 т. п. н., от около 80 т. п. н. до около 100 т. п. н., от около 100 т. п. н. до около 150 т. п. н., или от около 150 т. п. н. до около 200 т. п. н., от около 200 т. п. н. до около 300 т. п. н., от около 300 т. п. н. до около 400 т. п. н., от около 400 т. п. н. до около 500 т. п. н., от около 500 т. п. н. до около 1 млн п. н., от около 1 млн п. н. до около 1,5 млн п. н., от около 1,5 млн п. н. до около 2 млн п. н., от около 2 млн п. н. до около 2,5 млн п. н., или от около 2,5 млн п. н. до около 3 млн п. н. В конкретных вариантах осуществления делеция составляет по меньшей мере 500 т. п. н. В одном варианте осуществления клетка представляет собой клетку млекопитающего. В одном варианте осуществления клетка млекопитающего представляет собой не относящуюся к человеку клетку. В одном варианте осуществления клетка млекопитающего получена от грызуна. В одном варианте осуществления грызун представляет собой крысу, мышь или хомяка. В одном варианте осуществления клетка представляет собой плюрипотентную клетку. В одном варианте осуществления клетка млекопитающего представляет собой индуцированную плюрипотентную стволовую (ИПС) клетку. В одном варианте осуществления плюрипотентная клетка представляет собой не относящуюся к человеку эмбриональную стволовую (ЭС) клетку. В одном варианте осуществления плюрипотентная клетка представляет собой эмбриональную стволовую (ЭС) клетку грызуна, эмбриональную стволовую (ЭС) клетку мыши или эмбриональную стволовую (ЭС) клетку крысы. В некоторых вариантах осуществления нуклеазный агент содержит белок (Cas), ассоциированный с короткими палиндромными повторами, регулярно расположенными группами (CRISPR), и гидовую РНК (гРНК). В таком способе гидовая РНК (гРНК) может содержать: (а) РНК коротких палиндромных повторов, регулярно расположенных группами (CRISPR) (крРНК), нацеленную на первый сайт распознавания; и (b) трансактивирующую РНК CRISPR (тракрРНК). В одном варианте осуществления первый или второй сайт распознавания непосредственно фланкирован последовательностью мотива, прилежащего к протоспейсеру (РАМ). В некоторых вариантах осуществления белок Cas представляет собой Cas9. В одном варианте осуществления нуклеазный агент представляет собой нуклеазу с «цинковыми пальцами» (ZFN). В одном варианте осуществления нуклеазный агент представляет собой эффекторную нуклеазу, подобную активатору транскрипции (TALEN). В одном варианте осуществления нуклеазный агент представляет собой мегануклеазу.
В способах модификации Y-хромосомы, включающих воздействие на Y-хромосому белком Cas и РНК CRISPR в присутствии большого нацеливающего вектора (LTVEC), содержащего нуклеотидную последовательность длиной по меньшей мере 10 т. п. н., включающих последующее воздействие белком Cas, РНК CRISPR и LTVEC, Y-хромосома модифицируется таким образом, что содержит нуклеотидную последовательность длиной по меньшей мере 10 т. п. н. LTVEC может содержать нуклеотидную последовательность длиной по меньшей мере 20 т. п. н., по меньшей мере 30 т. п. н., по меньшей мере 40 т. п. н., по меньшей мере 50 т. п. н., по меньшей мере 60 т. п. н., по меньшей мере 70 т. п. н., по меньшей мере 80 т. п. н. или по меньшей мере 90 т. п. н. В других вариантах осуществления LTVEC содержит нуклеотидную последовательность длиной по меньшей мере 100 т. п. н., по меньшей мере 150 т. п. н. или по меньшей мере 200 т. п. н.
Дополнительно предложен способ модификации целевого геномного локуса на Y-хромосоме, включающий: (а) обеспечение клетки млекопитающего, содержащей целевой геномный локус на Y-хромосоме, причем целевой геномный локус содержит целевую последовательность гидовой РНК (гРНК); (b) введение в клетку млекопитающего: (i) большого нацеливающего вектора (LTVEC), содержащего первую нуклеиновую кислоту, фланкированную нацеливающими плечами, гомологичными целевому геномному локусу, причем длина LTVEC составляет по меньшей мере 10 т. п. н.; (ii) первой экспрессионной конструкции, содержащей первый промотор, функционально связанный со второй нуклеиновой кислотой, кодирующей белок Cas; и (iii) второй экспрессионной конструкции, содержащей второй промотор, функционально связанный с третьей нуклеиновой кислотой, кодирующей гидовую РНК (гРНК), содержащую нуклеотидную последовательность, которая гибридизируется с целевой последовательностью гРНК, и трансактивирующую РНК CRISPR (тракрРНК), при этом первый и второй промоторы являются активными в клетке млекопитающего; и (с) идентификацию модифицированной клетки млекопитающего, содержащей нацеленную генетическую модификацию в целевом геномном локусе на Y-хромосоме. В других вариантах осуществления длина LTVEC составляет по меньшей мере 15 т. п. н., по меньшей мере 20 т. п. н., по меньшей мере 30 т. п. н., по меньшей мере 40 т. п. н., по меньшей мере 50 т. п. н., по меньшей мере 60 т. п. н., по меньшей мере 70 т. п. н., по меньшей мере 80 т. п. н. или по меньшей мере 90 т. п. н. В других вариантах осуществления длина LTVEC составляет по меньшей мере 100 т. п. н., по меньшей мере 150 т. п. н. или по меньшей мере 200 т. п. н. В одном варианте осуществления клетка млекопитающего представляет собой клетку не относящегося к человеку млекопитающего. В одном варианте осуществления клетка млекопитающего представляет собой клетку-фибробласт. В одном варианте осуществления клетка млекопитающего получена от грызуна. В одном варианте осуществления грызун представляет собой крысу, мышь или хомяка. В одном варианте осуществления клетка млекопитающего представляет собой плюрипотентную клетку. В одном варианте осуществления плюрипотентная клетка представляет собой индуцированную плюрипотентную стволовую (ИПС) клетку. В одном варианте осуществления плюрипотентная клетка представляет собой эмбриональную стволовую (ЭС) клетку мыши или эмбриональную стволовую (ЭС) клетку крысы. В одном варианте осуществления плюрипотентная клетка представляет собой онтогенетически ограниченную человеческую клетку-предшественник. В одном варианте осуществления белок Cas представляет собой белок Cas9. В одном варианте осуществления целевая последовательность гРНК непосредственно фланкирована последовательностью мотива, прилежащего к протоспейсеру (РАМ). В одном варианте осуществления суммарная длина 5'- и 3'-гомологичных плеч LTVEC составляет от около 10 т. п. н. до около 150 т. п. н. В одном варианте осуществления суммарная длина 5'- и 3'-гомологичных плеч LTVEC составляет от около 10 т. п. н. до около 20 т. п. н., от около 20 т. п. н. до около 40 т. п. н., от около 40 т. п. н. до около 60 т. п. н., от около 60 т. п. н. до около 80 т. п. н., от около 80 т. п. н. до около 100 т. п. н., от около 100 т. п. н. до около 120 т. п. н. или от около 120 т. п. н. до около 150 т. п. н. В одном варианте осуществления нацеленная генетическая модификация содержит: (а) замещение эндогенной нуклеотидной последовательности гомологичной или ортологичной нуклеотидной последовательностью; (b) делецию эндогенной нуклеотидной последовательности, (с) делецию эндогенной нуклеотидной последовательности, причем делеция находится в диапазоне от около 5 т. п. н. до около 10 т. п. н., от около 10 т. п. н. до около 20 т. п. н., от около 20 т. п. н. до около 40 т. п. н., от около 40 т. п. н. до около 60 т. п. н., от около 60 т. п. н. до около 80 т. п. н., от около 80 т. п. н. до около 100 т. п. н., от около 100 т. п. н. до около 150 т. п. н., от около 150 т. п. н. до около 200 т. п. н., от около 200 т. п. н. до около 300 т. п. н., от около 300 т. п. н. до около 400 т. п. н., от около 400 т. п. н. до около 500 т. п. н., от около 500 т. п. н. до около 1 млн п. н., от около 1 млн п. н. до около 1,5 млн п. н., от около 1,5 млн п. н. до около 2 млн п. н., от около 2 млн п. н. до около 2,5 млн п. н. или от около 2,5 млн п. н. до около 3 млн п. н.; (d) инсерцию экзогенной нуклеотидной последовательности; (е) инсерцию экзогенной нуклеотидной последовательности, находящейся в диапазоне от около 5 т. п. н. до около 10 т. п. н., от около 10 т. п. н. до около 20 т. п. н., от около 20 т. п. н. до около 40 т. п. н., от около 40 т. п. н. до около 60 т. п. н., от около 60 т. п. н. до около 80 т. п. н., от около 80 т. п. н. до около 100 т. п. н., от около 100 т. п. н. до около 150 т. п. н., от около 150 т. п. н. до около 200 т. п. н., от около 200 т. п. н. до около 250 т. п. н., от около 250 т. п. н. до около 300 т. п. н., от около 300 т. п. н. до около 350 т. п. н., от около 350 т. п. н. до около 400 т. п. н.; (f) инсерцию экзогенной нуклеотидной последовательности, содержащей гомологичную или ортологичную нуклеотидную последовательность; (g) инсерцию химерной нуклеотидной последовательности, содержащей человеческую и не относящуюся к человеку нуклеотидные последовательности; (h) инсерцию условного аллеля, фланкированного целевыми последовательностями сайт-специфической рекомбинации; (i) инсерцию селективного маркера или репортерного гена, функционально связанного с третьим промотором, активным в клетке млекопитающего; или (j) их комбинацию. В одном варианте осуществления целевой геномный локус содержит: (i) 5'-целевую последовательность, которая гомологична 5'-гомологичному плечу; и (ii) 3'-целевую последовательность, которая гомологична 3'-гомологичному плечу. В одном варианте осуществления 5'-целевая последовательность и 3'-целевая последовательность разделены по меньшей мере 5 т. п. н., но менее чем 3 млн п. н. В одном варианте осуществления 5'-целевая последовательность и 3'-целевая последовательность разделены по меньшей мере 5 т. п. н., но менее чем 10 т. п. н., по меньшей мере 10 т. п. н., но менее чем 20 т. п. н., по меньшей мере 20 т. п. н., но менее чем 40 т. п. н., по меньшей мере 40 т. п. н., но менее чем 60 т. п. н., по меньшей мере 60 т. п. н., но менее чем 80 т. п. н., по меньшей мере около 80 т. п. н., но менее чем 100 т. п. н., по меньшей мере 100 т. п. н., но менее чем 150 т. п. н. или по меньшей мере 150 т. п. н., но менее чем 200 т. п. н., по меньшей мере около 200 т. п. н., но менее чем около 300 т. п. н., по меньшей мере около 300 т. п. н., но менее чем около 400 т. п. н., по меньшей мере около 400 т. п. н., но менее чем около 500 т. п. н., по меньшей мере около 500 т. п. н., но менее чем около 1 млн п. н., по меньшей мере около 1 млн п. н., но менее чем около 1,5 млн п. н., по меньшей мере около 1,5 млн п. н., но менее чем около 2 млн п. н., по меньшей мере около 2 млн п. н., но менее чем около 2,5 млн п. н. или по меньшей мере около 2,5 млн п. н., но менее чем около 3 млн п. н. В одном варианте осуществления первая и вторая экспрессионные конструкции расположены на одной молекуле нуклеиновой кислоты. В одном варианте осуществления целевой геномный локус представляет собой локус Sry.
Дополнительно предложен способ нацеленной генетической модификации на Y-хромосоме не относящегося к человеку животного, включающий: (а) модификацию интересующего геномного локуса не относящейся к человеку плюрипотентной клетки в соответствии со способами, описанными в настоящем документе, с производством таким образом генетически модифицированной не относящейся к человеку плюрипотентной клетки, содержащей нацеленную генетическую модификацию на Y-хромосоме; (b) введение модифицированной не относящейся к человеку плюрипотентной клетки, полученной на этапе (а) в не относящийся к человеку эмбрион-хозяина; и вынашивание не относящегося к человеку эмбриона-хозяина, содержащего модифицированную плюрипотентную клетку, в организме суррогатной матери, причем суррогатная мать производит потомство F0, содержащее нацеленную генетическую модификацию, при этом нацеленная генетическая модификация может быть передана через зародышевую линию. В одном варианте осуществления интересующий геномный локус представляет собой локус Sry.
Предложены способы и композиции для создания нацеленных генетических модификаций на Y-хромосоме. Композиции включают культуру in vitro, содержащую плюрипотентную и/или тотипотентную клетку XY животного (т.е. ЭС-клетки XY или ИПС-клетки XY), имеющие модификацию, которая снижает уровень и/или активность белка Sry; и культивирование этих клеток в среде, которая способствует развитию фертильных самок XY F0. Такие композиции находят применение в различных способах создания поколения F0 фертильных самок XY не относящихся к человеку млекопитающих.
КРАТКОЕ ОПИСАНИЕ ФИГУР
На ФИГ. 1 представлена схема нацеливания CRISPR Cas9/гPHK на мышиный ген Sry. VG-1 (SEQ ID NO: 10); VG-2 (SEQ ID NO: 11); VG-3 (SEQ ID NO: 12). Праймеры и зонды, указанные на Фиг. 1, представлены в SEQ ID NO: 13-29.
На ФИГ. 2 представлена схема нацеливания на ген Sry с помощью TALEN и CRISPR с использованием репортерного гена lacZ. Ген Sry был нацелен с помощью как LTVEC, так и короткоплечевого вектора (smallTVEC), имеющего гомологичные плечи, меньшие чем LTVEC, с целью избежания затрудняющих локусов на Y-хромосоме.
На ФИГ. 3 проиллюстрирована экспрессия LacZ в эмбрионах.
На ФИГ. 4 представлена схема большой делеции более чем 500 т. п. н. на Y-хромосоме, опосредованной ZFN или посредством гидовой РНК CRISPR в комбинации с ДНК эндонуклеазы Cas9.
На ФИГ. 5А, В и С представлено подтверждение секвенированием большой делеции на Y-хромосоме в различных клонах. На ФИГ. 5 А представлен результат секвенирования для клона 1-D5. Последовательности Kdm5 UP и Uspy9 DOWN представлены SEQ ID NO: 30; 1-D5 1500F (SEQ ID NO: 31); 1-D5 1000R (SEQ ID NO: 32). На ФИГ. 5B представлен результат секвенирования для клона 5-С4. Последовательности Kdm5 UP и Uspy9 DOWN представлены SEQ ID NO: 33; 1500F (SEQ ID NO: 34); 1000R (SEQ ID NO: 35); 1000F (SEQ ID NO: 36); и на ФИГ. 5C представлен результат секвенирования для клона 6-А12. Последовательности Kdm5 UP и Uspy9 DOWN представлены SEQ ID NO: 37; 1500F (SEQ ID NO: 38); 1000R (SEQ ID NO: 39); 1000F (SEQ ID NO: 40); 1500R (SEQ ID NO: 41). Области, обозначенные прямоугольниками на ФИГ. 5В и ФИГ. 5С, представляют собой области микрогомологии.
ПОДРОБНОЕ ОПИСАНИЕ
ОПРЕДЕЛЕНИЯ
Термины «белок», «полипептид» и «пептид», используемые в настоящем документе на взаимозаменяемой основе, включают полимерные формы аминокислот любой длины, включая кодированные и некодированные аминокислоты и химически или биохимически модифицированные или дериватизированные аминокислоты. Термины также включают полимеры, которые подверглись модификации, например полипептиды с модифицированными основными цепями пептидов.
Термины «нуклеиновая кислота» и «полинуклеотид», используемые в настоящем документе на взаимозаменяемой основе, включают полимерные формы нуклеотидов любой длины, включая рибонуклеотиды, дезоксирибонуклеотиды или их аналоги и модифицированные формы. Эти термины включают одно-, двух- и многоцепочечные ДНК или РНК, геномную ДНК, кДНК, гибриды ДНК-РНК и полимеры, содержащие пуриновые основания, пиримидиновые основания или другие природные, химически модифицированные, биохимически модифицированные, неприродные и дериватизированные нуклеотидные основания. Для простоты размер нуклеиновой кислоты может выражаться в т. п. н. если нуклеиновая кислота находится в двух- или одноцепочечной форме, в последнем случае т. п. н. являются таковыми, которые формируются, если и когда одноцепочечная нуклеиновая кислота удвоена своей точно комплементарной цепью.
«Оптимизация кодонов» по существу включает в себя процесс модификации нуклеотидной последовательности для улучшения экспрессии в конкретных клетках-хозяевах путем замены по меньшей мере одного кодона нативной последовательности кодоном, который более часто или наиболее часто используется в генах клетки-хозяина при сохранении нативной аминокислотной последовательности. Например, нуклеиновая кислота, кодирующая белок Cas, может быть модифицирована, чтобы использовать в качестве замены кодоны, имеющие более высокую частоту использования в данной прокариотической или эукариотической клетке, включая бактериальную клетку, дрожжевую клетку, человеческую клетку, не относящуюся к человеку клетку, клетку млекопитающего, клетку грызуна, клетку мыши, клетку крысы, клетку хомяка или любую другую клетку-хозяина по сравнению со встречающейся в природе нуклеотидной последовательностью. Таблицы использования кодонов являются общедоступными, например, в базе данных Codon Usage Database. Эти таблицы можно адаптировать несколькими способами. См. Nakamura et al. (2000) Nucleic Acids Research 28:292. Также имеются компьютерные алгоритмы для оптимизации кодонов с конкретной последовательностью для экспрессии в конкретном хозяине (см., например, Gene Forge).
Термин «функциональная связь» или «функционально связанный» относится к смежному размещению двух или более компонентов (например, промотора и другого элемента последовательности) таким образом, чтобы оба компонента нормально функционировали и обеспечивалась возможность того, чтобы по меньшей мере один из компонентов мог опосредовать функцию, осуществляемую в отношении по меньшей мере одного из других компонентов. Например, промотор может быть функционально связан с кодирующей последовательностью, если промотор контролирует уровень транскрипции кодирующей последовательности в ответ на присутствие или отсутствие одного или более факторов регуляции транскрипции.
Термин «комплементарность» нуклеиновых кислот означает, что нуклеотидная последовательность в одной цепи нуклеиновой кислоты вследствие ориентации нуклеотидных оснований образует водородные связи с другой последовательностью на противоположной цепи нуклеиновой кислоты. В ДНК, как правило, комплементарны основания А и Т, а также С и G. В РНК это, как правило, С и G, а также U и А. Комплементарность может быть идеальной или существенной/достаточной. Идеальная комплементарность двух нуклеиновых кислот означает, что две нуклеиновые кислоты могут образовывать дуплекс, в котором каждое основание связано с комплементарным основанием, образуя пары Уотсона-Крика. Термин «существенная» или «достаточная» комплементарность означает, что последовательность одной цепи не полностью и/или не идеально комплементарна последовательности противоположной цепи, но между основаниями на двух цепях создается достаточное связывание, чтобы образовывался стабильный гибридный комплекс при некотором наборе условий гибридизации (например, концентрации солей и температуре). Такие условия можно спрогнозировать, используя последовательности и стандартные математические расчеты для предсказания Tm гибридизованных цепей, или путем эмпирического определения Tm традиционными способами. Tm относится к температуре, при которой популяция гибридизационных комплексов, образовавшихся между двумя цепями нуклеиновых кислот, является денатурированной на 50%. При температуре ниже Tm преимущество имеет образование гибридизационного комплекса, тогда как при температуре выше Tm преимущество имеет плавление или разделение цепей гибридизационного комплекса. Tm можно оценить для нуклеиновой кислоты с известным содержанием G+С в водном 1 М растворе NaCl, используя, например, выражение Tm = 81,5+0,41 (% G+С), хотя в других известных расчетах Tm принимаются во внимание структурные характеристики нуклеиновых кислот.
Термин «условие гибридизации» означает совокупную среду, в которой одна цепь нуклеиновой кислоты связывается со второй цепью нуклеиновой кислоты в результате комплементарного взаимодействия цепей и водородного связывания с образованием гибридизационного комплекса. Такие условия включают в себя химические компоненты и их концентрации (например, соли, хелатирующие агенты, формамид) в водном или органическом растворе, содержащем нуклеиновые кислоты, и температуру смеси. Свой вклад в среду могут вносить другие факторы, такие как длительность инкубации или размеры инкубационной камеры. См., например, Sambrook et al., Molecular Cloning, A Laboratory Manual, 2.sup.nd ed., pp. 1.90-1.91, 9.47-9.51, 1 1.47-11.57 (Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 1989).
Для гибридизации требуется, чтобы две нуклеиновые кислоты содержали комплементарные последовательности, хотя возможны несовпадения между основаниями. Условия, подходящие для гибридизации между двумя нуклеиновыми кислотами, зависят от длины нуклеиновых кислот и степени комплементации, и эти переменные хорошо известны специалистам в данной области. Чем больше степень комплементации между двумя нуклеотидными последовательностями, тем выше температура плавления (Tm) гибридов нуклеиновых кислот с этими последовательностями. При гибридизации нуклеиновых кислот с короткими участками комплементарности (например, с комплементарностью более 35 нуклеотидов или менее, 30 или менее, 25 или менее, 22 или менее, 20 или менее или 18 или менее) становится важным положение несовпадающих оснований (см. выше Sambrook et al., 11.7-11.8). Как правило, длина пригодной для гибридизации нуклеиновой кислоты составляет по меньшей мере около 10 нуклеотидов. Значения иллюстративной минимальной длины пригодных для гибридизации нуклеиновых кислот включают по меньшей мере около 15 нуклеотидов, по меньшей мере около 20 нуклеотидов, по меньшей мере около 22 нуклеотидов, по меньшей мере около 25 нуклеотидов и по меньшей мере около 30 нуклеотидов. Кроме того, температуру и концентрацию солей в промывном растворе можно регулировать по мере необходимости, в зависимости от таких факторов, как длина области комплементации и степень комплементации.
Для обеспечения специфической гибридизации последовательность полинуклеотида не обязательно должна быть на 100% комплементарна целевой нуклеиновой кислоте. Кроме того, полинуклеотид может гибридизоваться на одном или более сегментах, так что промежуточные или соседние сегменты не вовлечены в событие гибридизации (например, структура петли или шпильки). Полинуклеотид (например, гРНК) может иметь по меньшей мере 70%-ную, по меньшей мере 80%-ную, по меньшей мере 90%-ную, по меньшей мере 95%-ную, по меньшей мере 99%-ную или 100%-ную комплементарность последовательности относительно целевой области в целевой нуклеотидной последовательности, на которую он нацелен. Например, гРНК, в которой 18 из 20 нуклеотидов комплементарны целевой области и, следовательно, могут специфически гибридизоваться, будет представлять 90% комплементарности. В этом примере оставшиеся не комплементарные нуклеотиды могут быть кластеризованы или рассеяны среди комплементарных нуклеотидов и не должны быть обязательно смежными друг с другом или с комплементарными нуклеотидами.
Процентную долю комплементарности между конкретными участками нуклеотидных последовательностей в пределах нуклеиновых кислот можно определять типовым способом, используя программы BLAST (средства поиска основных локальных выравниваний) и PowerBLAST, известные в данной области (Altschul et al. (1990) J. Mol. Biol. 215:403-410; Zhang and Madden (1997) Genome Res. 7:649-656), или с помощью программы Gap (Wisconsin Sequence Analysis Package, Version 8 for Unix, Genetics Computer Group, University Research Park, г. Мэдисон, штат Висконсин, США), с использованием заданных по умолчанию параметров, где используется алгоритм Смита - Ватермана (Adv. Appl. Math., 1981, 2, 482-489).
В предложенных в настоящем документе способах и композициях используются разнообразные компоненты. В описании признано, что некоторые компоненты могут иметь активные варианты и фрагменты. Такие компоненты включают в себя, например, белки Cas, РНК CRISPR, тракрРНК и гидовые РНК. Биологическая активность каждого из этих компонентов описана в других разделах настоящего документа.
Термин «идентичность последовательности» или «идентичность» в контексте двух полинуклеотидов или полипептидных последовательностей означает ссылку на остатки, которые одинаковы в двух последовательностях при выравнивании для максимального соответствия в установленном окне сравнения. Если термин «процентная доля идентичности последовательности» применяется в отношении белков, следует понимать, что положения с остатками, не являющимися идентичными, зачастую отличаются консервативными заменами аминокислот, где остатки аминокислот заменяются на другие остатки аминокислот с аналогичными химическими свойствами (например, зарядом или гидрофобностью) и поэтому не изменяют функциональные свойства молекулы. Если последовательности отличаются консервативными заменами, процентную долю идентичности последовательностей можно скорректировать в сторону увеличения, чтобы учесть консервативный характер замены. Последовательности, отличающиеся такими консервативными заменами, считаются имеющими «сходство последовательностей» или «сходство». Способы внесения данной корректировки хорошо известны специалистам в данной области. Как правило, они включают в себя оценку консервативной замены как частичного, а не полного несовпадения, в результате чего повышается процент идентичности последовательности. Таким образом, например, если идентичной аминокислоте присваивают оценку 1, то неконсервативной замене присваивают оценку, равную нулю, а консервативная замена получает оценку от нуля до 1. Вычисляют оценку консервативных замен, например, в соответствии с реализацией в программе PC/GENE (Intelligenetics, г. Маунтин-Вью, штат Калифорния, США).
Термин «процентная доля идентичности последовательности» означает значение, которое определяют путем сравнения двух оптимально выровненных последовательностей в окне сравнения, причем участок полинуклеотидной последовательности в окне сравнения может содержать добавления или делеции (т.е. гэпы) в сравнении с эталонной последовательностью (которая не содержит добавлений или делеций) для оптимального выравнивания двух последовательностей. Процент рассчитывают путем определения числа положений, в которых в обеих последовательностях встречаются идентичные нуклеиновые основания или аминокислотные остатки, деления числа совпадающих положений на общее число положений в окне сравнения и умножения результата на 100 с получением процента идентичности последовательности.
Если не указано иное, значения идентичности/сходства последовательности включают значение, полученное с использованием программного обеспечения GAP версии 10 с использованием следующих параметров: для нуклеотидной последовательности % идентичности и % сходства обнаруживают с применением штрафа за начало пропуска 50 и штрафа за удлинение пропуска 3 и матрицы замен nwsgapdna.cmp; для аминокислотной последовательности % идентичности или % сходства определяют с применением штрафа за начало пропуска 8 и штрафа за удлинение пропуска 2 и матрицы замен BLOSUM62; или любого эквивалентного программного обеспечения. Термин «эквивалентное программное обеспечение» включает в себя любое программное обеспечение для сравнения последовательностей, которое для любых двух рассматриваемых последовательностей создает выравнивание, обладающее идентичными соответствиями нуклеотидов или аминокислотных остатков и идентичным процентом идентичности последовательности при сравнении с соответствующим выравниванием, получаемым посредством программного обеспечения GAP версии 10.
Композиции или способы, «содержащие» или «включающие в себя» один или несколько упомянутых элементов, могут включать в себя другие элементы, специально не упомянутые. Например, композиция, которая «содержит» или «включает в себя» белок, может содержать белок отдельно или в комбинации с другими ингредиентами.
Обозначение диапазона значений включает в себя все целые числа, входящие в диапазон или образующие его, а также все поддиапазоны, образованные целыми числами, входящими в диапазон.
Если иное не очевидно из контекста, термин «около» охватывает значения в пределах стандартных границ погрешности измерения (например, стандартной погрешности среднего СПС) указанного значения.
Все элементы, указанные в единственном числе, также могут быть использованы и во множественном, если контекст явно не диктует иное. Например, термин «белок Cas» или «по меньшей мере один белок Cas» может включать множество белков Cas, включая их смеси.
I. Способы и композиции для создания фертильной самки XY животного в поколении F0
Известны способы создания не относящихся к человеку животных из донорской ЭС-клетки и эмбрионов-хозяев. Донорские ЭС-клетки выбирают по определенным характеристикам, которые усиливают способность клеток заселять эмбрион-хозяина и, таким образом, принимать частичное участие в создании животного, формируемого донорской ЭС-клеткой и эмбрионом-хозяином, или по существу являться его частью. Формируемое животное может быть самцом или самкой на основании, в значительной мере, генотипа ЭС-клетки (например, XY или XX).
Большинство линий ЭС-клеток для создания трансгенных животных имеют мужской генотип XY. Из-за доминирования Y-хромосомы в определении пола млекопитающих, когда ЭС-клетки XY вводятся в бластоцисту эмбриона-хозяина и вынашиваются, они практически всегда производят в первом поколении (F0) фенотипически самцов, которые являются химерами, т.е. содержат клетки, полученные из мужской донорской ЭС-клетки (XY), и клетки, полученные из эмбриона-хозяина, которые могут быть либо мужскими (XY), либо женскими (XX). При введении ЭС-клеток XY в 8-клеточный эмбрион-хозяина посредством способа VelociMouse и их вынашивании в первом поколении (F0) могут быть произведены фенотипически животные мужского пола, которые полностью происходят из ЭС-клеток XY.
В WO 2011/156723 предложены способы и композиции, в которых используются культуральные среды для сохранения в культуре донорских клеток XY так, что после введения донорских клеток XY в эмбрион-хозяина и вынашивания их в подходящем хозяине в популяции F0 производятся фертильные самки XY животных. Такие композиции находят применение в создании потомства F1, которое является гомозиготным по данной нацеленной генетической модификации.
В настоящей заявке предложены способы и композиции, в которых используется комбинация донорских клеток XY, имеющих модификацию, которая снижает уровень и/или активность белка Sry, в комбинации с культуральными средами, которые способствуют производству анатомически нормальных, фертильных и плодовитых самок XY поколения F0. Такие способы и композиции позволяют создать фертильную самку XY не относящегося к человеку млекопитающего поколения F0. Комбинация ЭС-клеток XY, имеющих модификацию, которая снижает уровень и/или активность белка Sry, в комбинации с культуральными средами, описанными в настоящем документе, значительно увеличивает процентное соотношение фертильного потомства самок XY в поколении F0. Способы эффективной конверсии пола с мужского на женский представляют ценность в индустрии домашних животных. Например, телята женского пола представляют значительно большую ценность для индустрии выращивания молочного крупного рогатого скота, чем телята мужского пола. То же самое верно и для птицеводства. Для целей разведения крупного рогатого скота, или свиней, или овец, предпочтительно разводить множество животных женского пола по отношению к лишь небольшому числу быков, хряков или баранов. Таким образом, различные способы, предложенные в настоящем документе, находят применение в различных коммерчески важных индустриях разведения животных.
Также предлагаются способы и композиции для создания линии эмбриональных стволовых (ЭС) клеток XY, способной к производству фертильной самки XY не относящегося к человеку млекопитающего в поколении F0 без культивирования в феминизирующих средах. В таких способах линия ЭС-клеток XY, имеющих модификацию, которая снижает уровень и/или активность белка Sry, может производить линию ЭС-клеток, способных к производству фертильной самки XY не относящегося к человеку млекопитающего в поколении F0 при отсутствии феминизирующих сред, предложенных в других разделах настоящего документа {например, посредством культивирования в основной среде, такой как DMEM, описанной в других разделах настоящего документа).
А. Животные клетки XY, имеющие модификацию, которая снижает уровень и/или активность белка Sry
В настоящем документе предложены различные композиции и способы, которые содержат различные плюрипотентные и/или тотипотентные клетки XY, полученные от животного. Термин «плюрипотентная клетка», используемый в настоящем документе, включает недифференцированную клетку, которая обладает способностью развиваться в более чем один дифференцированный тип клеток. Такие плюрипотентные и/или тотипотентные клетки XY могут представлять собой, например, эмбриональную стволовую (ЭС) клетку или индуцированную плюрипотентную стволовую (ИПС) клетку. Термин «эмбриональная стволовая клетка», или «ЭС-клетка», используемый в настоящем документе, включает полученную из эмбриона тотипотентную или плюрипотентную клетку, которая при введении в эмбрион может участвовать в развитии любой ткани развивающегося эмбриона.
Термин «животное» по отношению к клеткам, плюрипотентным и/или тотипотентным клеткам, клеткам XY, ЭС-клеткам, ИПС-клеткам, донорским клеткам и/или эмбриону-хозяину включает млекопитающих, рыб и птиц. Млекопитающие включают, например, людей, не относящихся к человеку приматов, обезьяну, человекообразного примата, кошку, собаку, лошадь, быка, оленя, бизона, овцу, грызунов (например, мышей, крыс, хомяков, морских свинок), домашний скот (например, вид бычьих, например, коровы, вол и т.п.; вид бараньих, например, овцы, козы и т.п.; и вид свиней, например, свиньи и хряки). Птицы включают, например, цыплят, индеек, страуса, гусей, уток и т.п. Также включены домашние животные и сельскохозяйственные животные. Фраза «не относящееся к человеку животное» по отношению к клеткам, клеткам XY, ЭС-клеткам, донорским клеткам и/или эмбрионам-хозяевам исключает людей.
В конкретных вариантах осуществления плюрипотентная клетка представляет собой человеческую ЭС-клетку XY, человеческую ИПС-клетку XY, ЭС-клетку XY взрослого человека, онтогенетически ограниченную человеческую ЭС-клетку-предшественник, не относящуюся к человеку ЭС-клетку XY, не относящуюся к человеку ИПС-клетку XY, ЭС-клетку XY грызуна, ИПС-клетку XY грызуна, ЭС-клетку XY мыши, ИПС-клетку XY мыши, ЭС-клетку XY крысы, ИПС-клетку XY крысы, ЭС-клетку XY хомяка, ИПС-клетку XY хомяка, ЭС-клетку XY обезьяны, ИПС-клетку XY обезьяны, ЭС-клетку XY сельскохозяйственного млекопитающего животного, ИПС-клетку XY сельскохозяйственного млекопитающего животного, ЭС-клетку XY домашнего млекопитающего животного или ИПС-клетку XY домашнего млекопитающего животного. Кроме того, ЭС-клетка XY или ИПС-клетка XY может быть получена от инбредной линии, гибридной линии или аутбредной линии. В описании дополнительно признано, что плюрипотентные и/или тотипотентные клетки XY могут иметь кариотип XYY или кариотип XXY.
Мышиные плюрипотентные и/или тотипотентные клетки (т.е. ЭС-клетки XY или ИПС-клетки XY) могут быть получены из линии 129, линии C57BL/6, смеси линий 129 и C57BL/6, линии BALB/c или линии Swiss Webster. В конкретных вариантах осуществления мышь представляют собой на 50% линию 129 и на 50% линию C57BL/6. В одном варианте осуществления мышь представляет собой мышь линии 129, которую выбирают из группы, состоящей из 129Р1, 129Р2, 129Р3, 129X1, 129S1 (например, 129S1/SV, 129S1/Svlm), 129S2, 129S4, 129S5, 129S9/SvEvH, 129S6 (129/SvEvTac), 129S7, 129S8, 129Т1, 129Т2. См., например, Festing et al. (1999) Mammalian Genome 10:836). В одном варианте осуществления мышь представляет собой мышь линии C57BL и в конкретном варианте осуществления выбрана из C57BL/A, C57BL/An, C57BL/GrFa, C57BL/Kal_wN, C57BL/6, C57BL/6J, C57BL/6ByJ, C57BL/6NJ, C57BL/6NTac, C57BL/10, C57BL/10ScSn, C57BL/10Cr или C57BL/Ola. В конкретном варианте осуществления мышь представляет собой смесь вышеупомянутой линии 129 и вышеупомянутой линии C57BL/6. В другом конкретном варианте осуществления мышь представляет собой смесь вышеупомянутых линий 129 или смесь вышеупомянутых линий BL/6. В конкретном варианте осуществления линия 129 смеси представляет собой линию 129S6 (129/SvEvTac). В некоторых вариантах осуществления мышиная ЭС-клетка XY содержит Y-хромосому, полученную из линии 129.
В еще одном варианте осуществления ЭС-клетка XY мыши представляет собой ЭС-клетку мыши линии VGF1. ЭС-клетки мыши VGF1 (также известные как F1H4) были получены от гибридных эмбрионов, произведенных посредством скрещивания самки мыши C57BL/6NTac с самцом мыши 129S6/SvEvTac. Таким образом, ЭС-клетки VGF1 содержат Y-хромосому от мыши 129S6/SvEvTac. См., например, публикацию Auerbach, W. et al. (2000) Establishment and chimera analysis of 129/SvEv- and C57BL/6-derived mouse embryonic stem cell lines. Biotechniques 29, 1024-1028, 1030, 1032, которая полностью включена в настоящий документ путем ссылки.
Плюрипотентная и/или тотипотентная клетка крысы (т.е. ЭС-клетка XY или ИПС-клетка XY) может быть получена из любой линии крыс, включая, без ограничений, линию крыс ACI, линию крыс Dark Agouti (DA), линию крыс Wistar, линию крыс LEA, линию крыс Sprague Dawley (SD) или линию крыс Fischer, такую как Fisher F344 или Fisher F6. Плюрипотентные и/или тотипотентные клетки крысы (т.е. ЭС-клетки XY или ИПС-клетки XY) можно также получить из линии, происходящей от смеси двух или более вышеупомянутых линий. В одном варианте осуществления плюрипотентная и/или тотипотентная клетка крысы (т.е. ЭС-клетка XY или ИПС-клетка XY) получена из линии, которую выбирают из линии DA и линии ACI. В конкретном варианте осуществления плюрипотентная и/или тотипотентная клетка крысы (т.е. ЭС-клетка XY или ИПС-клетка XY) получена из линии ACI. Линия крыс ACI характеризуется наличием черной окраски «агути» с белым брюхом и лапами и гаплотипом RT1avl. Такие линии доступны из различных источников, включая Harlan Laboratories. В других вариантах осуществления плюрипотентная и/или тотипотентная клетка различных крыс (т.е. ЭС-клетка XY или ИПС-клетка XY) получены из линии крысы Dark Agouti (DA), который характеризуется наличием шерсти «агути» и гаплотипом RT1avl. Такие крысы доступны из различных источников, включая Charles River и Harlan Laboratories. В дополнительном варианте осуществления плюрипотентные и/или тотипотентные крысиные клетки (т.е. ЭС-клетки XY или ИПС-клетки XY) получены из инбредной линии крыс. В конкретных вариантах осуществления линия крысиных ЭС-клеток получена от крысы ACI и содержит ЭС-клетку крысы ACI.G1. В другом варианте осуществления линия крысиных ЭС-клеток получена от крысы DA и содержит линию ЭС-клеток крысы DA.2B или линию ЭС-клеток крысы DA.2C. См., например, заявку на патент на изобретение №14/185,703, поданную 20 февраля 2014 г. и полностью включенную в настоящий документ путем ссылки.
В различных вариантах осуществления плюрипотентная и/или тотипотентная клетка (т.е. ЭС-клетка XY или ИПС-клетка XY), донорская клетка и/или эмбрион-хозяин получены не из одного или более следующих видов: Akodon spp., Myopus spp., Microtus spp., Talpa spp. В различных вариантах осуществления донорская клетка и/или эмбрион-хозяин получены не из видов, у которых нормальной характеристикой дикого типа является фертильность самки XY. В различных вариантах осуществления, если генетическая модификация присутствует в плюрипотентной и/или тотипотентной клетке (т.е. ЭС-клетке XY или ИПС-клетке XY), донорской клетке или эмбрионе-хозяине, генетическая модификация не является XYY или XXY, Tdy-отрицательной реверсией пола, Tdy-положительной реверсией пола, модификацией Х0, анеуплоидией, генотипом fgf9-/- или модификацией SOX9.
Плюрипотентные и/или тотипотентные клетки XY (т.е. ЭС-клетка XY или ИПС-клетка XY), используемые в способах и композициях, имеют генетическую модификацию, которая приводит к сниженному уровню и/или активности белка Sry. Белок, «определяющий пол участок Y-хромосомы» (или белок Sry), представляет собой транскрипционный фактор, который является представителем семейства ДНК-связывающих белков группы с высокой подвижностью (HMG)-бoкс. Sry представляет собой фактор, определяющий развитие семенников, который инициирует определение мужского пола. Известна последовательность белка Sry из различных организмов, включая мышь (номер доступа Q05738); крысу (GenBank: САА61882.1); человека (номер доступа Q05066); кошку (номер доступа Q67C50) и лошадь (номер доступа Р36389), каждая из которых включена в настоящий документ путем ссылки.
В общем случае уровень и/или активность белка Sry снижены, если уровень белка и/или уровень активности белка Sry статистически ниже, чем уровень белка Sry в подходящей контрольной клетке, которую не подвергали генетической модификации или мутагенезу для ингибирования экспрессии и/или активности белка Sry. В конкретных вариантах осуществления концентрация и/или активность белка Sry снижены на по меньшей мере 1%, 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% или 90%) по отношению к контрольной клетке, которую не подвергали модификации для получения сниженного уровня и/или активности белка Sry.
«Клетка-субъект» представляет собой клетку, в которой осуществили генетическое изменение, такое как генетическая модификация, описанная в настоящем документе, или представляет собой клетку, которая произошла от измененной таким образом клетки и которая содержит данное изменение. «Контроль» или «контрольная клетка» обеспечивает эталонную точку для измерения изменений в фенотипе клетки-субъекта. В одном варианте осуществления контрольная клетка наиболее близко соответствует клетке со сниженной активностью белка Sry, за исключением того, что у нее отсутствует генетическая модификация или мутация, приводящая к сниженной активности (например, соответствующие клетки могут происходить из одной и той же клеточной линии). В других случаях контрольная клетка может представлять собой, например: (а) клетку дикого типа, т.е. того же генотипа, что и исходный материал для генетического изменения, результатом которого является клетка-субъект; (b) клетку того же генотипа, что и исходный материал, но которую подвергали генетически модификации с помощью нулевого конструкта (т.е. с помощью конструкта, который не оказывает известного влияния на интересующий признак, например, конструкта, содержащего маркерный ген); (с) клетку, которая не является генетически модифицированным потомством клетки-субъекта (т.е. контрольная клетка и клетка-субъект происходят из одной клеточной линии); (d) клетку, генетически идентичную клетке-субъекту, но которую не подвергали действию условий или раздражителей, которые могли бы индуцировать экспрессию интересующего гена; или (е) саму клетку-субъект в условиях, в которых генетическая модификация не приводит к изменению экспрессии интересующего полинуклеотида.
Уровень экспрессии полипептида Sry можно измерять непосредственно, например с помощью анализа измерения уровня полипептида Sry в клетке или организме, или опосредованно, например посредством измерения активности полипептида Sry. Известны различные способы определения активности белка Sry. См. публикации Wang et al. (2013) Cell 153:910-918, Mandalos et al. (2012) PLOS ONE 7:e45768:1-9 и Wang et al. (2013) Nat Biotechnol. 31:530-532, каждая из которых включена в настоящий документ путем ссылки.
В других случаях клетки, имеющие нацеленную генетическую модификацию, которая снижает активность и/или уровень полипептида Sry, выбирают с использованием способов, которые включают, без ограничений, анализ саузерен-блот, секвенирование ДНК, анализ ПЦР или фенотипический анализ. Такие клетки затем используют в различных способах, композициях и наборах, описанных в настоящем документе.
Нацеленная генетическая модификация может содержать целевое изменение интересующего полинуклеотида, включая, например, целевое изменение в целевом геномном локусе на Y-хромосоме, целевое изменение гена Sry или целевое изменение других заданных полинуклеотидов. Такие нацеленные модификации включают, без ограничений, добавление одного или более нуклеотидов, делеции одного или более нуклеотидов, замены одного или более нуклеотидов, нокаут интересующего полинуклеотида или его части, нокин интересующего полинуклеотида или его части, замещение эндогенной нуклеотидной последовательности гетерологичной нуклеотидной последовательностью или их комбинацию. В конкретных вариантах осуществления по меньшей мере 1, 2, 3, 4, 5, 7, 8, 9, 10 или более нуклеотидов изменяют таким образом, чтобы образовать нацеленную геномную модификацию.
Снижение уровня и/или активности белка Sry может происходить в результате генетической модификации в гене Sry (т.е. генетической модификации в регуляторной области, кодирующей области и/или интронах и т.п.). Такие генетические модификации включают, без ограничений, добавления, делеции и замены нуклеотидов в геноме. Такие генетические модификации могут включать изменение гена Sry, включая, например, инсерцию одного или более нуклеотидов в ген Sry, делецию одного или более нуклеотидов из гена Sry, замену одного или более нуклеотидов в гене Sry, нокаут гена Sry или его части, нокин гена Sry или его части, замещение эндогенной нуклеотидной последовательности гетерологичной нуклеотидной последовательностью или их комбинацию. Таким образом, в конкретных вариантах осуществления активность полипептида Sry может быть снижена или устранена путем нарушения работы гена, кодирующего полипептид Sry. В конкретных вариантах осуществления в гене Sry изменяют по меньшей мере 1, 2, 3, 4, 5, 7, 8, 9, 10 или более нуклеотидов. Можно использовать различные способы для создания дополнительной нацеленной генетической модификации. См., например, публикации Wang et al. (2013) Cell 153:910-918, Mandalos et al. (2012) PLOS ONE 7:e45768:1-9 и Wang et al. (2013) Nat Biotechnol. 31:530-532, каждая из которых включена в настоящий документ путем ссылки. Кроме того, различные способы, описанные в настоящем документе для модификации геномного локуса на Y-хромосоме, можно использовать для введения нацеленной генетической модификации в ген Sry.
В других вариантах осуществления активность и/или уровень полипептида Sry снижены или устранены посредством введения в клетку полинуклеотида, который ингибирует уровень или активность полипептида Sry. Полинуклеотид может ингибировать экспрессию полипептида Sry непосредственно, предотвращая транскрипцию или трансляцию информационной РНК Sry, или косвенно, кодируя полипептид, ингибирующий транскрипцию или трансляцию гена, кодирующего полипептид Sry. В других вариантах осуществления активность полипептида Sry снижена или устранена посредством введения в клетку последовательности, кодирующей полипептид, который ингибирует активность полипептида Sry.
В одном варианте осуществления плюрипотентные и/или тотипотентные клетки XY (т.е. ЭС-клетка XY или ИПС-клетка XY) содержат условный аллель Sry, который снижает активность и/или уровень белка Sry. «Условный» аллель Sry включает в себя модифицированный ген Sry, разработанный со сниженным уровнем и/или активностью белка Sry в заданный момент развития и/или в пределах заданной интересующей ткани. Сниженные уровень и/или активность можно сравнивать с контрольной клеткой, в которой отсутствует модификация, дающая начало условному аллелю, или, в случае сниженной активности во время заданного момента развития, с предыдущими и/или последующими моментами, или, в случае заданной ткани, со средней активностью всех тканей. В одном варианте осуществления условный аллель Sry представляет собой условный нулевой аллель Sry, который можно выключать в заданный момент развития и/или в конкретных тканях. Такой условный аллель можно использовать для создания фертильных самок XY, происходящих от любого клона с нацеленным геном. Как описано в других разделах настоящего документа, такой способ делает возможным создание заданной гомозиготной генетической модификации в поколении F1. Такие способы обеспечивают быструю оценку фенотипа без необходимости выращивания поколения F2.
В не имеющем ограничительного характера варианте осуществления условный аллель Sry является многофункциональным аллелем, как описано в публикации US 2011/0104799, которая в полном объеме включена в настоящий документ путем ссылки. В конкретных вариантах осуществления условный аллель содержит: (а) запускающую последовательность в смысловой ориентации по отношению к транскрипции целевого гена и кассету селекции лекарственными средствами (DSC) в смысловой или антисмысловой ориентации; (b) в антисмысловой ориентации интересующую нуклеотидную последовательность (NSI) и условный по инверсии модуль (COIN с использованием интрона, расщепляющего экзон, и обратимого модуля, подобного ловушке для генов; см., например, публикацию US 2011/0104799, которая в полном объеме включена в настоящий документ путем ссылки); и (с) поддающиеся рекомбинации блоки, которые рекомбинируются при воздействии первой рекомбиназы с образованием условного аллеля, в котором: (i) отсутствует запускающая последовательность и DSC; и (ii) содержится NSI в смысловой ориентации и COIN в антисмысловой ориентации.
Условный аллель гена Sry можно создать в клетке любого типа, и он не ограничен плюрипотентной и/или тотипотентной клеткой XY. Такие типы клеток вместе с не имеющими ограничительного характера способами нацеливания на геномный локус на Y-хромосоме более подробно обсуждаются в других разделах настоящего документа.
Как обсуждается в других разделах настоящего документа, плюрипотентная и/или тотипотентная клетка XY (т.е. ЭС-клетка XY или ИПС-клетка XY), имеющая генетическую модификацию, которая снижает уровень и/или активность белка Sry, может дополнительно содержать по меньшей мере одну дополнительную нацеленную генетическую модификацию интересующего полинуклеотида. По меньшей мере одна дополнительная нацеленная генетическая модификация может содержать замену одной или более нуклеиновых кислот, замещение эндогенной нуклеотидной последовательности гетерологичной нуклеотидной последовательностью, нокаут и нокин. Дополнительная нацеленная генетическая модификация может находиться на Y-хромосоме, Х-хромосоме или на аутосоме. Можно использовать различные способы создания дополнительной нацеленной генетической модификации, включая использование нацеливающих плазмид и больших нацеливающих векторов, как описано в других разделах настоящего документа. См. также US 20080092249, WO/1999/005266A2, US 20040177390, WO/2008/017234A1 и патент США №7,612,250, каждый из которых полностью включен в настоящий документ путем ссылки и в которых описаны способы, относящиеся к ядерному переносу. Кроме того, различные описанные в настоящем документе способы модификации геномного локуса на Y-хромосоме (т.е. гена Sry) также можно использовать для введения нацеленных генетических модификаций в интересующие полинуклеотиды, которые расположены не на Y-хромосоме.
В. Среды для культивирования плюрипотентных и/или тотипотентных клеток XY, имеющих модификацию, которая снижает уровень и/или активность белка Sry
Культуральные среды, используемые в различных способах и композициях, которые способствуют получению фертильной самки XY в поколении F0, являются таковыми, что они сохраняют плюрипотентные и/или тотипотентные клетки (т.е. ЭС-клетку, ИПС-клетки, ЭС-клетки XY, ИПС-клетки XY и т.п.). Термины «сохранять», «сохранение», «сохранность» относятся к стабильному сохранению по меньшей мере одной или более характеристик или фенотипов плюрипотентных и/или тотипотентных клеток, описанных в настоящем документе (включая ЭС-клетки или ИПС-клетки). Такие фенотипы могут включать в себя сохранение плюрипотентности и/или тотипотентности, клеточной морфологии, профилей экспрессии генов и других функциональных характеристик клеток. Термины «сохранять», «сохранение», «сохранность» могут также охватывать размножение клеток или увеличение числа культивируемых клеток. Данные термины дополнительно предусматривают условия культивирования, которые позволяют клеткам оставаться плюрипотентными, при этом может продолжаться или не продолжаться деление и увеличение количества клеток.
В некоторых вариантах осуществления клетки XY, имеющие генетическую модификацию, которая снижает уровень и/или активность белка Sry, сохраняют посредством культивирования в любой основной среде, известной в данной области (например, DMEM), которая является приемлемой для использования (с добавлением добавок) для выращивания или сохранения в культуре плюрипотентных и/или тотипотентных клеток (например, ЭС-клеток, ИПС-клеток, ЭС-клеток XY, ИПС-клеток XY и т.п.). В таких случаях культивируемые ЭС-клетки XY обладают потенциалом развития в фертильных самок животных, но при этом сохраняют плюрипотентность и/или тотипотентность, так что клетки могут быть внедрены в эмбрион-реципиент и дать начало фертильному женскому потомству.
В других вариантах осуществления клетки XY, имеющие генетическую модификацию, которая снижает уровень и/или активность белка Sry, сохраняют посредством культивирования в среде, подробно определенной ниже, в течение достаточного времени, так что некоторые из клеток превращаются в клетки XY с возможностью развития в фертильных самок животных с сохранением плюрипотентности и/или тотипотентности, так что клетки могут быть внедрены в эмбрион-реципиент и дать начало фертильному женскому потомству.
Среда, используемая для сохранения плюрипотентных и/или тотипотентных клеток XY (т.е. ЭС-клеток XY, ИПС-клеток XY и т.п.), имеющих генетическую модификацию, которая снижает уровень и/или активность белка Sry, способствует развитию фертильных самок XY поколения F0. Таким образом, культивирование в такой среде увеличивает количество полученных фертильных самок XY F0 по сравнению с культивированием в соответствующей контрольной среде (такой как, например, среда на основе DMEM). Таким образом, увеличенное количество самок XY F0 может составлять по меньшей мере 10%, 15%, 20%, 25%, 30%, 40%, 50%, 60%, 70%, 75%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% F0 не относящихся к человеку животных (после введения ЭС-клеток XY не относящегося к человеку животного в эмбрион-хозяина и вынашивания эмбриона-хозяина) и представляют собой самок XY, и при этом после достижения половой зрелости самка XY F0 не относящегося к человеку млекопитающего является фертильной.
Фраза «основная среда» или «основные среды» включает, например, основную среду, известную в данной области (например, DMEM), которая является приемлемой для использования (с добавлением добавок) для выращивания или сохранения в культуре плюрипотентных и/или тотипотентных клеток (например, ЭС-клетки, ИПС-клеток, ЭС-клеток XY, ИПС-клеток XY и т.п.). Основные среды, приемлемые для создания фертильной самки XY (т.е. «низкосолевая DMEM» или «среда с низкой осмоляльностью») отличаются от основных сред, обычно используемых для сохранения в культуре ЭС-клеток. Для целей обсуждения основных сред в целом основные среды, которые не приемлемы для создания фертильных самок XY, в этом разделе и в таблице 1 упоминаются как DMEM (т.е. типичные среды DMEM). Для целей обсуждения основных сред, приемлемых для создания фертильных самок XY, используется фраза «низкосолевая DMEM» или «среда DMEM с низкой осмоляльностью». В настоящем документе изложены отличия между основными средами, обычно используемыми для сохранения в культуре плюрипотентных и/или тотипотентных клеток (например, DMEM) и основными средами, приемлемыми для создания фертильных самок XY (например, «низкосолевая DMEM»). Фраза «низкосолевая DMEM» используется для удобства; приемлемая DMEM для создания фертильных самок XY демонстрирует характеристики, не ограниченные «низким содержанием соли», но также включает среды, описанные в настоящем документе. Например, DMEM, приведенная в таблице 1, может быть сделана приемлемой для создания фертильных самок XY посредством изменения концентраций хлорида натрия и/или бикарбоната натрия, как указано в настоящем документе, что также приведет к отличной по сравнению с DMEM осмоляльности, приведенной в таблице 1. Примером основной среды является модифицированная по способу Дульбекко среда Игла (DMEM) в различных формах (например, DMEM Invitrogen, номер по каталогу 1 1971-025) (таблица 1). Приемлемая низкосолевая DMEM коммерчески доступна под названием KO-DMEM™ (Invitrogen, номер по каталогу 10829-018). Основная среда обычно поставляется с рядом различных добавок, известных в данной области, при использовании для сохранения клеток в культуре для использования в качестве донорских клеток. В настоящем описании такие добавки указаны как «добавки» или «+ добавки».
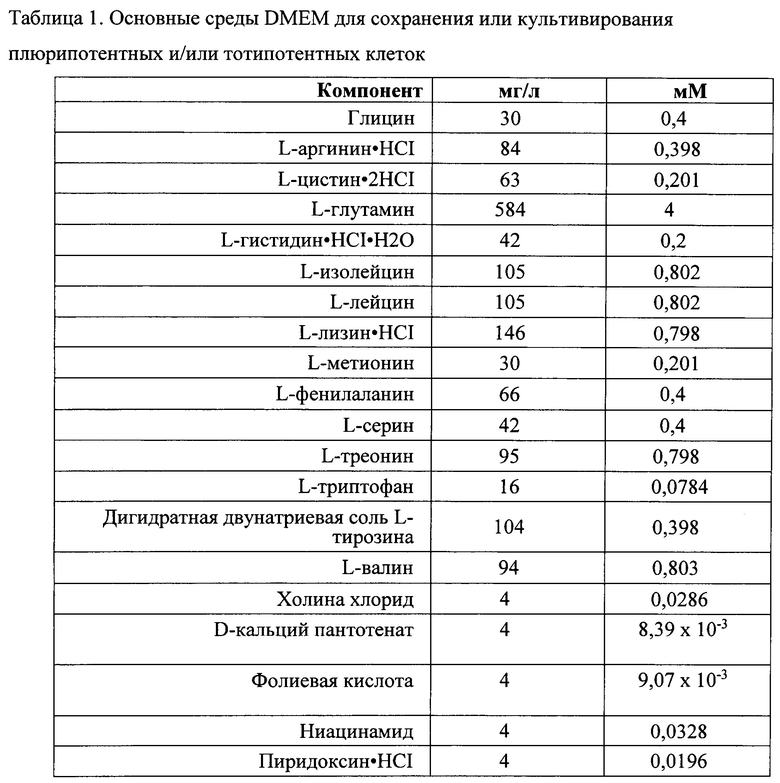
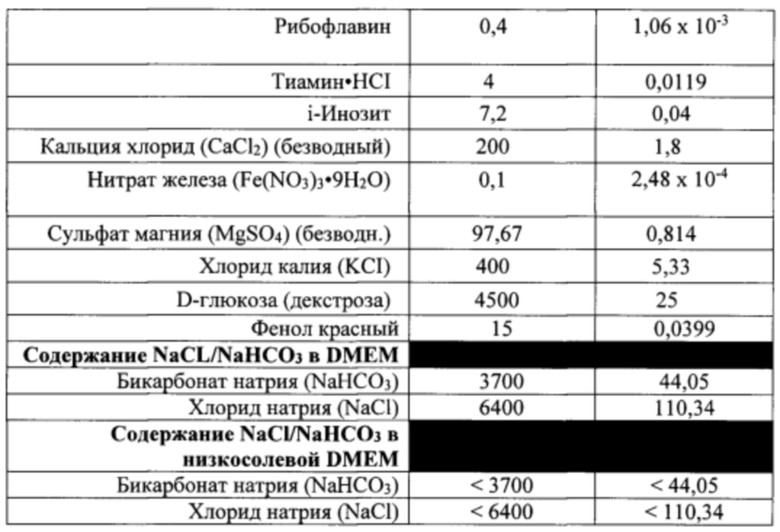
Термин «добавки» или фраза «+добавки» включает элементы, добавленные к основной среде для выращивания или сохранения в культуре плюрипотентных и/или тотипотентных клеток (т.е. ЭС-клеток XY или ИПС-клеток XY), например, для сохранения в культуре плюрипотентности или тотипотентности донорских клеток. Например, добавки к средам, приемлемые для выращивания или сохранения в культуре плюрипотентных и/или тотипотентных клеток включают, без ограничений, эмбриональную бычью сыворотку (FBS), глутамин, антибиотик (-и), пенициллин и стрептомицин (например, пенстреп), пируватные соли (например, пируват натрия), заменимые аминокислоты (например, MEM NEAA), 2-меркаптоэтанол и фактор, ингибирующий лейкемию (LIF).
В одном варианте осуществления основная среда содержит одну или более добавок, приемлемых для сохранения в культуре плюрипотентных клеток, включая, например, ЭС-клетки XY или ИПС-клетки XY, имеющие сниженную способность вносить вклад в программу развития определения мужского пола после инъекции в эмбрион и внутриматочного переноса в мышь-суррогатную мать.
В конкретных вариантах осуществления одна или более добавок, приемлемых для сохранения в культуре плюрипотентной клетки, представляют собой FBS (90 мл FBS/0,5 л основной среды), глутамин (2,4 ммоль/0,5 л основной среды), пируват натрия (0,6 ммоль/0,5 л основной среды), заменимые аминокислоты (< 0,1 ммоль/0,5 л основной среды), 2-меркаптоэтанол, LIF и один или более антибиотиков.
В других вариантах осуществления среда для сохранения в культуре плюрипотентных клеток, включая, например, ЭС-клетки XY или ИПС-клетки XY, имеющие сниженную способность вносить вклад в программу развития определения мужского пола после инъекции в эмбрион и внутриматочного переноса в мышь-суррогатную мать, содержит около 500 мл основной среды, в которую добавлены следующие добавки: около 90 мл FBS (например, Hylcone FBS, номер по каталогу SH30070.03), около 2,4 миллимоля глутамина (например, около 12 мл 200 мМ раствора глутамина, например Invitrogen, номер по каталогу 25030-081, пенициллин: стрептомицин (например, 60000 единиц пенициллина G натрия и 60 мг сульфата стрептомицина с около 51 мг NaCl; например, около 6 мл пенстреп от компании Invitrogen, номер по каталогу 15140-122), около 0,6 миллимоля пирувата натрия (например, 6 мл 100 мМ пирувата натрия, Invitrogen, номер по каталогу 1 1360-070), около 0,06 миллимоля заменимых аминокислот (например, около 6 мл MEM NEAA, например, MEM NEAA от компании Invitrogen, номер по каталогу 1 1 140-050), около 1,2 мл 2-меркаптоэтанола, и около 1,2 микрограмма LIF (например, около 120 микролитров препарата LIF в концентрации 106 единиц/мл; например, около 120 микролитров Millipore ESGRO™-LIF, номер по каталогу ESG1/107). При составлении композиции основных сред для сохранения ЭС-клеток XY или ИПС-клеток XY для создания фертильных самок XY обычно используют одинаковые добавки в приблизительно одинаковых количествах, но с отличиями композиции основной среды (от DMEM, например, от среды, описанной в вышеприведенной таблице), и при этом отличие(-я) соответствует(-ют) отличию(-ям), указанному(-ым) в настоящем документе.
В некоторых вариантах осуществления добавки включают среды, кондиционированные Wnt, например среды, кондиционированные Wnt-3a.
В одном варианте осуществления плюрипотентную клетку, включая, например, ЭС-клетку XY или ИПС-клетку XY, имеющую сниженную способность вносить вклад в программу развития определения мужского пола после инъекции в эмбрион и внутриматочного переноса в мышь-суррогатную мать, сохраняют в культуре in vitro в среде, содержащей основную среду и добавки, причем основная среда демонстрирует одну или более из следующих характеристик: (а) осмоляльность от около 200 мОсм/кг до менее чем около 329 мОсм/кг; (b) проводимость от около 11 мСм/см до около 13 мСм/см; (с) концентрация соли щелочного металла и галида от около 50 мМ до около 110 мМ; (d) концентрация соли угольной кислоты от около 17 мМ до около 30 мМ; (е) общая концентрация соли галида щелочного металла и соли угольной кислоты от около 85 мМ до около 130 мМ; и/или (f) комбинацию любых двух или более из них. В других вариантах осуществления плюрипотентные и/или тотипотентные клетки XY (т.е. ЭС-клетку XY или ИПС-клетку XY) сохраняют в культуре in vitro в средах, описанных в публикации WO 2011/156723, включенной в полном объеме в настоящий документ путем ссылки.
В одном варианте осуществления основная среда представляет собой низкосолевую DMEM. В конкретном варианте осуществления низкосолевая DMEM имеет концентрацию NaCl 85-130 мМ. В одном варианте осуществления основная среда представляет собой DMEM с низкой осмоляльностью. В конкретном варианте осуществления DMEM с низкой осмоляльностью имеет осмоляльность 250-310 мОсм/кг. В одном варианте осуществления основная среда представляет собой DMEM с низкой проводимостью. В конкретном варианте осуществления DMEM с низкой проводимостью имеет проводимость 11-13 мСм/см.
В других вариантах осуществления основная среда демонстрирует осмоляльность не более чем около 320, 310, 300, 290, 280, 275, 270, 260, 250 или 240 мОсм/кг. В одном варианте осуществления основная среда или среда, содержащая основную среду и добавки, демонстрирует осмоляльность не более чем около 240-320, 250-310, 275-295 или 260-300 мОсм/кг. В конкретном варианте осуществления основная среда или среда, содержащая основную среду и добавки, демонстрирует осмоляльность 270 мОсм/кг.
В других вариантах осуществления основная среда демонстрирует проводимость не более чем около 10,0, 10,5, 1 1,0, 1 1,5, 12,0, 12,5, 13,0, 13,5 или 14,0 мСм/см. В одном варианте осуществления основная среда демонстрирует проводимость не более чем около 10-14 мСм/см или 11-13 мСм/см. В конкретном варианте осуществления основная среда демонстрирует проводимость около 12-13 мСм/см.
В конкретном варианте осуществления основная среда демонстрирует проводимость около 12-13 мСм/см и осмоляльность около 260-300 мОсм/кг. В дополнительном конкретном варианте осуществления основная среда содержит хлорид натрия в концентрации около 90 мМ NaCl. В дополнительном конкретном варианте осуществления концентрация хлорида натрия составляет около 70-95 мМ. В дополнительном конкретном варианте осуществления основная среда содержит бикарбонат натрия в концентрации менее чем около 35 мМ. В дополнительном конкретном варианте осуществления концентрация бикарбоната натрия составляет около 20-30 мМ.
В одном варианте осуществления основная среда демонстрирует концентрацию соли щелочного металла и галида не более чем около 100 мМ. В одном варианте осуществления соль щелочного металла и галида представляет собой NaCl. В одном варианте осуществления концентрация соли щелочного металла и галида составляет не выше чем 90, 80, 70, 60 или 50 мМ. В одном варианте осуществления концентрация соли щелочного металла и галида в основной среде составляет около 60-105, 70-95 или 80-90 мМ. В конкретном варианте осуществления концентрация составляет около 85 мМ.
В одном варианте осуществления основная среда демонстрирует концентрацию соли угольной кислоты. В одном варианте осуществления соль угольной кислоты представляет собой натриевую соль. В одном варианте осуществления натриевая соль представляет собой бикарбонат натрия. В одном варианте осуществления концентрация соли угольной кислоты в основной среде составляет не более чем 40, 35, 30, 25 или 20 мМ. В одном варианте осуществления концентрация соли угольной кислоты в основной среде составляет около 10-40, в другом варианте осуществления около 20-30 мМ. В конкретном варианте осуществления концентрация составляет около 25 или 26 мМ. В других вариантах осуществления концентрация бикарбоната натрия составляет около 26 мМ, около 18 мМ, от около 18 мМ до около 26 мМ или от около 18 мМ до около 44 мМ.
В одном варианте осуществления сумма концентраций соли щелочного металла и галида и соли угольной кислоты в основной среде составляет не более чем 140, 130, 120, 110, 100, 90 или 80 мМ. В одном варианте осуществления сумма концентраций соли щелочного металла и галида и соли угольной кислоты в основной среде составляет около 80-140, 85-130, 90-120, 95-120 или 100-120 мМ. В конкретном варианте осуществления сумма концентраций соли щелочного металла и галида и соли угольной кислоты в основной среде составляет около 115 мМ.
В одном варианте осуществления молярное отношение соли щелочного металла и галида и соли угольной кислоты составляет более чем 2,5 мМ. В одном варианте осуществления отношение составляет около 2,6-4,0, 2,8-3,8, 3-3,6 или 3,2-3,4. В одном варианте осуществления отношение составляет 3,3-3,5. В конкретном варианте осуществления отношение составляет 3,4.
В одном варианте осуществления основная среда демонстрирует осмоляльность около 250-310 мОсм/кг и концентрацию соли щелочного металла и галида около 60-105 мМ. В дополнительном варианте осуществления основная среда имеет концентрацию соли угольной кислоты около 20-30 мМ. В дополнительном варианте осуществления сумма концентраций соли щелочного металла и галида и соли угольной кислоты составляет около 80-140 мМ. В дополнительном варианте осуществления проводимость основной среды составляет около 12-13 мСм/см.
В одном варианте осуществления основная среда содержит около 50±5 мМ NaCl и около 26±5 мМ карбоната с осмоляльностью около 218±22 мОсм/кг. В конкретном варианте осуществления основная среда содержит около 3 мг/мл NaCl и 2,2 мг/мл бикарбоната натрия с осмоляльностью около 218 мОсм/кг.
В другом варианте осуществления основная среда содержит около 87±5 мМ NaCl и около 18±5 мМ с осмоляльностью около 261±26 мОсм/кг. В конкретном варианте осуществления основная среда содержит около 5,1 мг/мл NaCl и около 1,5 мг/мл бикарбоната натрия с осмоляльностью около 261 мОсм/кг.
В другом варианте осуществления основная среда содержит около 110±5 мМ NaCl и около 18±5 мМ карбоната с осмоляльностью около 294±29 мОсм/кг. В конкретном варианте осуществления основная среда содержит около 6,4 мг/мл NaCl и около 1,5 мг/мл бикарбоната натрия с осмоляльностью около 294 мОсм/кг.
В другом варианте осуществления основная среда демонстрирует около 87±5 мМ NaCl и около 26±5 мМ карбоната с осмоляльностью около 270±27 мОсм/кг. В конкретном варианте осуществления основная среда демонстрирует около 5,1 мг/мл NaCl и около 2,2 мг/мл бикарбоната натрия с осмоляльностью около 270 мОсм/кг.
В другом варианте осуществления основная среда содержит около 87±5 мМ NaCl, около 26±5 мМ карбоната и около 86±5 мМ глюкозы с осмоляльностью около 322±32 мОсм/кг. В конкретном варианте осуществления основная среда содержит около 5,1 мг/мл NaCl, около 2,2 мг/мл бикарбоната натрия и около 15,5 мг/мл глюкозы с осмоляльностью около 322 мОсм/кг.
Дополнительные основные среды, которые можно использовать в различных способах и композициях, описанных в настоящем документе, включают основную среду, содержащую 50±5 мМ NaCl и 26±5 мМ карбоната с осмоляльностью 218±22 мОсм/кг. В отдельном варианте осуществления основная среда содержит около 3 мг/мл NaCl и 2,2 мг/мл бикарбоната натрия с осмоляльностью около 218 мОсм/кг.
В других вариантах осуществления основная среда содержит 50±5 мМ NaCl и 26±5 мМ карбоната с осмоляльностью 218±22 мОсм/кг. В конкретном варианте осуществления основная среда содержит около 3 мг/мл NaCl и 2,2 мг/мл бикарбоната натрия с осмоляльностью около 218 мОсм/кг.
В других вариантах осуществления в среды DMEM с высоким содержанием глюкозы (LifeTech) с концентрациями NaHCO3, описанные в настоящем документе, включающие около 44 мМ, 26 мМ или 18 мМ, добавляли 0,1 мМ заменимых аминокислот, 1 мМ пирувата натрия, 0,1 мМ 2-меркаптоэтанола, 2 мМ L-глутамина, по 50 мкг/мл каждого из пенициллина и стрептомицина (LifeTech), 15% FBS (Hyclone) и 2000 Ед/мл LIF (Millipore).
С. Способ создания нацеленных генетических модификаций
Можно использовать различные способы создания нацеленных генетических модификаций, которые снижают уровень и/или активность белка Sry. Например, в одном случае для нацеленной генетической модификации используется система, которая будет производить нацеленную генетическую модификацию посредством события гомологичной рекомбинации. В других случаях клетку животного можно модифицировать с использованием нуклеазных агентов, которые производят одно- или двухцепочечный разрыв в местоположении целевого генома. Одно- или двухцепочечный разрыв затем восстанавливается посредством пути соединения негомологичных концов (NHEJ). Такие системы находят применение, например, в производстве нацеленных генетических модификаций потери функции. Не имеющие ограничительного характера способы создания нацеленной генетической модификации подробно описаны в других разделах настоящего документа, включая, например, использование нацеливающих плазмид, малых нацеливающих векторов (smallTVEC) или больших нацеливающих векторов. См. также публикации Wang et al. (2013) Cell 153:910-918, Mandalos et al. (2012) PLOS ONE 7:e45768:1-9 и Wang et al. (2013) Nat Biotechnol. 31:530-532, каждая из которых включена в настоящий документ путем ссылки.
Следует понимать, что в конкретных вариантах осуществления нацеленная генетическая модификация гена Sry и/или нацеленная генетическая модификация любого другого интересующего полинуклеотида может происходить в то время, когда плюрипотентную клетку (т.е. ЭС-клетку) сохраняют в культуральных средах, описанных в настоящем документе (например, в среде, которая способствует развитию фертильных самок XY F0). В альтернативном варианте осуществления нацеленная генетическая модификация гена Sry и/или любого другого интересующего полинуклеотида может происходить в то время, когда плюрипотентную клетку (т.е. ЭС-клетку) сохраняют в различных культуральных средах и после этого переносят в культуральные среды, описанные в настоящем документе (например, в среду, которая способствует развитию фертильных самок XY F0).
D. Способ культивирования и сохранения плюрипотентной и/или тотипотентной клетки в культуре
Предложен способ сохранения или культивирования плюрипотентной и/или тотипотентной клетки XY (т.е. ЭС-клетки XY или ИПС-клетки XY) в культуре in vitro, причем клетка содержит модификацию, которая снижает уровень и/или активность белка Sry, и при этом клетку сохраняют в культуре in vitro в условиях, описанных в настоящем документе. Такие способы сохранения или культивирования плюрипотентной и/или тотипотентной клетки XY (т.е. ЭС-клетки XY или ИПС-клетки XY) в культуре in vitro являются таковыми, что способствуют увеличению числа фертильных самок XY F0 животных при введении ЭС-клетки XY не относящегося к человеку животного в эмбрион-хозяина и последующего вынашивания эмбриона-хозяина.
Хотя для таких способов сохранения или культивирования можно использовать любые среды, описанные в настоящем документе, один не имеющий ограничительного характера пример включает культивирование в среде, содержащей основную среду и добавки, приемлемые для сохранения или культивирования плюрипотентной и/или тотипотентной клетки XY (т.е. ЭС-клетки XY или ИПС-клетки XY) в культуре, причем основная среда или среда, содержащая основную среду и добавки, демонстрирует осмоляльность от около 200 мОсм/кг до менее чем около 329 мОсм/кг.
В некоторых вариантах осуществления основная среда или среда, содержащая основную среду и добавки, демонстрирует одну или более из следующих характеристик: проводимость от около 11 мСм/см до около 13 мСм/см; концентрация соли щелочного металла и галида от около 50 мМ до около 110 мМ; концентрация соли угольной кислоты от около 17 мМ до около 30 мМ; общая концентрация соли галида щелочного металла и соли угольной кислоты от около 85 мМ до около 130 мМ и/или комбинацию любых двух или более из них.
В одном варианте осуществления способ включает сохранение или культивирование плюрипотентной и/или тотипотентной клетки XY (т.е. ЭС-клетки XY или ИПС-клетки XY) в приемлемой культуральной среде, которая содержит основную среду и добавки, причем основная среда или среда, содержащая основную среду и добавки, имеет осмоляльность около 240-320 мОсм/кг, проводимость около 10-14 мСм/см, концентрацию галидной соли щелочного металла около 50-105 мМ, концентрацию соли угольной кислоты 10-40 мМ и/или комбинированную концентрацию соли щелочного металла и соли угольной кислоты около 80-140 мМ. В одном варианте осуществления плюрипотентную и/или тотипотентную клетку XY (т.е. ЭС-клетку XY или ИПС-клетку XY) перед введением в эмбрион-хозяина сохраняют в среде (с добавками для сохранения ЭС-клеток) в течение 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, или 13 дней, или 2 недель, 3 недель, или 4 недель. В конкретном варианте осуществления плюрипотентную и/или тотипотентную клетку XY (т.е. ЭС-клетку XY или ИПС-клетку XY) перед введением в эмбрион-хозяина сохраняют в среде (низкосолевой основной среде с добавками для сохранения ЭС-клеток) в течение около 2-4 недель.
В другом варианте осуществления перед введением донорской клетки в эмбрион-хозяина плюрипотентную и/или тотипотентную клетку XY (т.е. ЭС-клетку XY или ИПС-клетку XY) сохраняют в среде с низкосолевой основной средой в течение по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 дней, 2 недель, 3 недель или 4 недель. В конкретном варианте осуществления перед введением клетки в эмбрион-хозяина плюрипотентную и/или тотипотентную клетку XY (т.е. ЭС-клетку XY или ИПС-клетку XY) сохраняют в среде с низкосолевой основной средой в течение по меньшей мере 2-4 недель.
В другом варианте осуществления плюрипотентную и/или тотипотентную клетку XY (т.е. ЭС-клетку XY или ИПС-клетку XY) сохраняют (например, замороженной) в среде, которая способствует развитию фертильных самок XY F0, и донорскую клетку размораживают и сохраняют в среде, которая способствует развитию фертильных самок XY F0 в течение по меньшей мере 1, 2, 3 или 4 или более дней перед введением плюрипотентной и/или тотипотентной клетки XY (т.е. ЭС-клетки XY или ИПС-клетки XY) в эмбрион-хозяина. В конкретном варианте осуществления плюрипотентную и/или тотипотентную клетку XY (т.е. ЭС-клетку XY или ИПС-клетку XY) пересевают по меньшей мере однократно в среду, которая способствует развитию фертильных самок XY F0, причем клетку замораживают в среде, которая способствует развитию фертильных самок XY F0, и клетку размораживают в среде, которая способствует развитию фертильных самок XY F0, и выращивают в течение 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 или 13 дней, 2 недель, 3 недель, 4 недель или более перед введением донорской клетки в эмбрион-хозяина.
В еще одном варианте осуществления плюрипотентную и/или тотипотентную клетку XY (т.е. ЭС-клетку XY или ИПС-клетку XY) перед введением в эмбрион-хозяина сохраняют в среде, которая способствует развитию фертильных самок XY F0, в течение одного, двух, трех или четырех дней. В одном варианте осуществления плюрипотентную и/или тотипотентную клетку XY (т.е. ЭС-клетку XY или ИПС-клетку XY) сохраняют в среде, которая способствует развитию фертильных самок XY F0, в течение 3 дней.
В одном варианте осуществления плюрипотентную и/или тотипотентную клетку XY (т.е. ЭС-клетку XY или ИПС-клетку XY) перед введением в эмбрион-хозяина сохраняют в среде, которая способствует развитию фертильных самок XY F0, в течение около 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 дней, 2 недель, 3 недель или 4 недель или более. В конкретном варианте осуществления донорскую клетку перед введением в эмбрион-хозяина сохраняют в среде, которая способствует развитию фертильных самок XY F0, в течение по меньшей мере недели. В конкретном варианте осуществления плюрипотентную и/или тотипотентную клетку XY (т.е. ЭС-клетку XY или ИПС-клетку XY) перед введением в эмбрион-хозяина сохраняют в среде, которая способствует развитию фертильных самок XY F0, в течение 2-4 недель.
Таким образом, предложен способ сохранения или культивирования плюрипотентной и/или тотипотентной клетки XY (т.е. ЭС-клетки XY или ИПС-клетки XY) в культуре, причем клетку сохраняют в условиях, которые способствуют или благоприятствуют развитию самки XY животного с последующим введением клетки XY в эмбрион-хозяина и с последующим вынашиванием в приемлемом хозяине женского пола.
В одном аспекте предложен способ сохранения или культивирования донорской плюрипотентной и/или тотипотентной клетки XY (т.е. ЭС-клетки XY или ИПС-клетки XY) в культуре в условиях, описанных в настоящем документе, причем с последующим введением донорской ЭС-клетки XY в эмбрион-хозяина с получением эмбриона F0 и вынашиванием эмбриона F0 в приемлемом животном, причем эмбрион F0 развивается в животное F0, которое является по меньшей мере на 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более XY и представляет собой самку, которая после достижения половой зрелости является фертильной.
Е. Получение эмбрионов F0 и потомства F1, имеющих нацеленную генетическую модификацию
Для создания генетически модифицированного животного можно использовать различные способы и композиции, в которых используют плюрипотентную и/или тотипотентную клетку XY (т.е. ЭС-клетку XY или ИПС-клетку XY), имеющую сниженные уровень и/или активность белка Sry. Различные способы введения генетических модификаций подробно описаны в других разделах настоящего документа.
i Способ создания фертильной самки XY не относящегося к человеку животного в поколении F0
Предлагается способ создания фертильной самки XY не относящегося к человеку животного в поколении F0. Такие способы включают: (а) сохранение или культивирование донорской плюрипотентной и/или тотипотентной клетки XY (т.е. ЭС-клетки XY или ИПС-клетки XY) не относящегося к человеку животного, имеющей модификацию, которая снижает уровень и/или активность белка Sry, в среде, которая способствует развитию фертильных женских ЭС-клеток XY; (b) введение донорской плюрипотентной и/или тотипотентной клетки XY (т.е. ЭС-клетки XY или ИПС-клетки XY) не относящегося к человеку животного XY в эмбрион-хозяина; (с) вынашивание эмбриона-хозяина; и (d) получение самки XY F0 не относящегося к человеку животного, причем после достижения половой зрелости самка XY F0 не относящегося к человеку животного является фертильной. В конкретных вариантах осуществления донорская клетка XY донорского не относящегося к человеку животного может содержать по меньшей мере одну дополнительную нацеленную генетическую модификацию в интересующем полинуклеотиде. Такие модификации подробно обсуждаются в других разделах настоящего документа.
ЭС-клетки XY, имеющие модификацию, которая снижает уровень и/или активность белка Sry, можно сохранять без низкосолевой среды, и они могут развиваться в фертильную самку XY.
В некоторых вариантах осуществления среда, которая способствует развитию фертильных самок XY F0 животных, может содержать низкосолевую основную среду, которая содержит основную среду и добавки, приемлемые для сохранения или культивирования ЭС-клетки не относящегося к человеку млекопитающего в культуре, причем низкосолевая основная среда демонстрирует характеристики, включающие одно или более из следующего: осмоляльность от около 200 мОсм/кг до менее чем около 329 мОсм/кг; проводимость от около 11 мСм/см до около 13 мСм/см; концентрация соли щелочного металла и галида от около 50 мМ до около 110 мМ; концентрация соли угольной кислоты от около 17 мМ до около 30 мМ; общая концентрация соли галида щелочного металла и соли угольной кислоты от около 85 мМ до около 130 мМ и/или комбинацию любых двух или более из них.
В других вариантах осуществления такие способы создания фертильной самки XY животного в поколении F0 можно осуществить, используя среды, описанные в настоящем документе, включающие, без ограничений: (а) основную среду, содержащую 50±5 мМ NaCl, 26±5 мМ карбоната и 218±22 мОсм/кг; (b) основную среду, содержащую около 3 мг/мл NaCl, 2,2 мг/мл бикарбоната натрия и 218 мОсм/кг; (с) основную среду, содержащую 87±5 мМ NaCl, 18±5 мМ карбоната и 261±26 мОсм/кг; (d) основную среду, содержащую около 5,1 мг/мл NaCl, 1,5 мг/мл бикарбоната натрия и 261 мОсм/кг; (е) основную среду, содержащую 110±5 мМ NaCl, 18±5 мМ карбоната и 294±29 мОсм/кг; (f) основную среду, содержащую около 6,4 мг/мл NaCl, 1,5 мг/мл бикарбоната натрия и 294 мОсм/кг; (g) основную среду, содержащую 87±5 мМ NaCl, 26±5 мМ карбоната и 270±27 мОсм/кг; (h) основную среду, содержащую около 5,1 мг/мл NaCl, 2,2 мг/мл бикарбоната натрия и 270 мОсм/кг; (i) основную среду, содержащую 87±5 мМ NaCl, 26±5 мМ карбоната, 86±5 мМ глюкозы и 322±32 мОсм/кг; и/или (j) основную среду, содержащую около 5,1 мг/мл NaCl, 2,2 мг/мл бикарбоната натрия, 15,5 мг/мл глюкозы и 322 мОсм/кг.
Генетически модифицированная плюрипотентная и/или тотипотентная клетка XY (т.е. ЭС-клетка XY или ИПС-клетка XY), имеющая модификацию, которая снижает уровень и/или активность белка Sry, и культивируемая в среде, которая способствует развитию фертильных самок XY F0, может быть имплантирована в эмбрион-хозяина. Клетки, которые были имплантированы в эмбрион-хозяина, в настоящем документе именуются «донорские клетки». В конкретных вариантах осуществления плюрипотентная и/или тотипотентная клетка XY (т.е. ЭС-клетка XY или ИПС-клетка XY) получена из той же линии, что и эмбрион-хозяин, или из дугой линии, чем эмбрион-хозяин. Подобным образом суррогатная мать может быть получена из той же линии, что и генетически модифицированная плюрипотентная и/или тотипотентная клетка XY (т.е. ЭС-клетка XY или ИПС-клетка XY) и/или эмбрион-хозяин, или суррогатная мать может быть получена из другой линии, чем генетически модифицированная плюрипотентная и/или тотипотентная клетка XY (т.е. ЭС-клетка XY или ИПС-клетка XY) и/или эмбрион-хозяин. В одном варианте осуществления донорскую клетку XY имплантируют в эмбрион-хозяина XX.
В способах и композициях, описанных в настоящем документе, можно использовать различные эмбрионы-хозяева. В некоторых вариантах осуществления плюрипотентные и/или тотипотентные клетки XY (т.е. ЭС-клетку XY или ИПС-клетку XY), имеющие нацеленную генетическую модификацию, приводящую к сниженному уровню и/или активности белка Sry, вводят в эмбрион, полученный из соответствующего организма, на стадии до образования морулы, например, в эмбрион на стадии 8 клеток. См., например, публикации US 7,576,259, US 7,659,442, US 7,294,754, и US 2008-0078000 A1, все из которых полностью включены в настоящий документ путем ссылки. В других вариантах осуществления донорские ЭС-клетки можно имплантировать в эмбрион-хозяина на стадии 2 клеток, стадии 4 клеток, стадии 8 клеток, стадии 16 клеток, стадии 32 клеток или стадии 64 клеток эмбриона-хозяина. В другом варианте осуществления эмбрион-хозяин представляет собой бластоцисту. В одном варианте осуществления эмбрион-хозяин находится на стадии, которую выбирают из эмбриона на стадии до образования бластоцисты, стадии до образования морулы, стадии морулы, стадии некомпактной морулы и стадии компактной морулы. В одном варианте осуществления при использовании эмбриона мыши стадию эмбриона-хозяина выбирают из стадии Тейлера 1 (TS1), TS2, TS3, TS4, TS5 и TS6 со ссылкой на стадии Тейлера, описанные в работе Theiler (1989) The House Mouse: Atlas of Mouse Development, Springer-Verlag, New York. В конкретном варианте осуществления стадию Тейлера выбирают из TS1, TS2, TS3 и TS4. В одном варианте осуществления эмбрион-хозяин содержит вителлиновый слой и донорская клетка представляет собой ЭС-клетку XY, которую вводят в эмбрион-хозяина через отверстие в вителлиновом слое, тогда как в других вариантах осуществления эмбрион-хозяин представляет собой эмбрион, не имеющий вителлинового слоя. В других дополнительных конкретных вариантах осуществления стадия морулы эмбриона-хозяина является агрегированной.
Для создания генетически модифицированных животных можно также использовать методики ядерного переноса. В кратком изложении методы ядерного переноса включают этапы, на которых: (1) проводят энуклеацию ооцита; (2) выделяют донорскую клетку или ядро для объединения с энуклеированным ооцитом; (3) выполняют вставку клетки или ядра в энуклеированный ооцит с образованием реконструированной клетки; (4) имплантируют реконструированную клетку в матку животного с получением эмбриона; и (5) предоставляют эмбриону возможность развития. В таких способах ооциты обычно извлекают из умерших животных, хотя их можно выделять также из яйцеводов и/или яичников живых животных. До энуклеации ооциты могут созревать в различных средах, известных обычным специалистам в данной области. Энуклеация ооцитов может быть выполнена с помощью ряда способов, хорошо известных обычным специалистам в данной области. Вставку донорской клетки или ядра в энуклеированный ооцит с образованием реконструированной клетки обычно проводят перед слиянием путем микроинъекции донорской клетки под вителлиновый слой. Слияние можно индуцировать применением электрического импульса постоянного тока в плоскости контакта/слияния (электрослияние) путем воздействия на клетки химическими веществами, стимулирующими слияние, такими как полиэтиленгликоль, или путем использования инактивированного вируса, например вируса Сендай. Реконструированную клетку, как правило, активируют с использованием электричества и/или неэлектрического средства до, во время и/или после слияния ядра донора и ооцита реципиента. Способы активации включают в себя электрические импульсы, химически индуцированный шок, пенетрацию с помощью сперматозоида, повышение уровней двухвалентных катионов в ооцитах, а также снижение фосфорилирования клеточных белков (например, с помощью ингибиторов киназы) в ооците. Активированные реконструированные клетки или эмбрионы обычно культивируют в среде, хорошо известной обычным специалистам в данной области, после чего переносят в матку животного. См., например, US 20080092249, WO/1999/005266 A2, US 20040177390, WO/2008/017234 A1 и патент США №7,612,250, каждый из которых полностью включен в настоящий документ путем ссылки.
Эмбрион-хозяин, содержащий генетически модифицированную плюрипотентную и/или тотипотентную клетку XY (т.е. ЭС-клетку XY или ИПС-клетку XY), имеющую сниженные уровень и/или активность белка Sry, инкубируют до стадии бластоцисты и затем имплантируют в суррогатную мать для производства животного F0. Животные, несущие генетически модифицированный геномный локус, могут быть идентифицированы посредством анализа определения модификации аллеля (МОА), как описано в настоящем документе.
В одном варианте осуществления эмбрион-хозяин, содержащий генетически модифицированные плюрипотентные и/или тотипотентные клетки XY (т.е. ЭС-клетку XY или ИПС-клетку XY), имеющие сниженные уровень и/или активность белка Sry, перед имплантацией приемлемому хозяину сохраняют в среде, которая способствует развитию ЭС-клеток XY фертильной самки (т.е. в низкосолевой основной среде) в течение одного, двух, трех или четырех или более дней. Такие способы обеспечивают благоприятствование созданию фертильной самки животного F0.
В одном варианте осуществления культивированный эмбрион-хозяин имплантируют в суррогатную мать, и культивированный эмбрион-хозяин вынашивается в суррогатной матери.
В конкретных вариантах осуществления после введения плюрипотентных и/или тотипотентных клеток XY (т.е. ЭС-клетки XY или ИПС-клетки XY) не относящегося к человеку животного в эмбрион-хозяина и последующего вынашивания эмбриона-хозяина, по меньшей мере 15%, 20%, 30%, 40%, 50%, 60%, 70%, 75%, 80% 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% не относящихся к человеку животных F0 представляют собой самок XY, причем после достижения половой зрелости самка XY F0 не относящегося к человеку млекопитающего является фертильной.
Дополнительно предложен эмбрион F0, содержащий внутреннюю клеточную массу, имеющую по меньшей мере одну гетерологичную стволовую клетку, представляющую собой ЭС-клетку XY или ИПС-клетку XY, имеющую нацеленную генетическую модификацию, которая снижает уровень и/или активность белка Sry.
В различных способах, описанных в настоящем документе, для создания фертильной самки XY не относящегося к человеку животного в поколении F0 можно использовать плюрипотентные и/или тотипотентные клетки XY (т.е. ЭС-клетку XY или ИПС-клетку XY), имеющие: (1) генетическую модификацию для снижения уровня и/или активности полипептида Sry; и, в конкретных вариантах осуществления, (2) одну или более дополнительных нацеленных генетических модификаций в интересующем полинуклеотиде. Как отмечено в других разделах настоящего документа, в плюрипотентной и/или тотипотентной клетке XY (т.е. ЭС-клетке XY или ИПС-клетке XY) можно создать по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более дополнительных нацеленных генетических модификаций. В таких случаях фертильная самка XY F0 не относящегося к человеку животного может содержать одну или более из этих дополнительных нацеленных генетических модификаций.
В других вариантах осуществления фертильная самка XY F0 не относящегося к человеку животного за период своей жизни производит 1, 2, 3, 4, 5, 6, 7, 8 или 9 пометов. В одном варианте осуществления фертильная самка XY F0 не относящегося к человеку животного производит по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 потомков на помет. В одном варианте осуществления фертильная самка XY F0 не относящегося к человеку животного производит около 4-6 потомков на помет. В одном варианте осуществления фертильная самка XY F0 не относящегося к человеку животного производит 2-6 пометов, причем в каждом помете имеется по меньшей мере 2, 3, 4, 5 или 6 потомков. В одном варианте осуществления по меньшей мере около 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 60%, 70%, 80%, 85%, 90%, 95% или 100% потомков представляют собой фертильных потомков-самок XY.
Также предложен способ создания помета грызунов (т.е. помета мышей или крыс), и он включает введение плюрипотентной и/или тотипотентной донорской клетки XY (т.е. донорской ЭС-клетки XY или донорской ИПС-клетки XY), имеющей сниженные уровень и/или активность белка Sry, полученной в соответствии со способами, приведенными в настоящем документе, в эмбрионы-хозяев, вынашивание эмбрионов в приемлемой сегрегатной матери и получение потомства F0, которое содержит по меньшей мере одну самку XY грызуна, которая по достижении половой зрелости является фертильной самкой XY грызуна. В одном варианте осуществления процентное отношение самок XY рожденных грызунов F0, которые по достижении половой зрелости являются фертильными, составляет около 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 60%, 70%, 75%, 80%, 85%, 95% или 100%.
В других вариантах осуществления потомство F0, произведенное с помощью таких способов, на около 3%, около 10% или более или около 63% или более происходит от генетически модифицированной донорской клетки XY.
Способы и композиции, предложенные в настоящем документе, позволяют по меньшей мере 1%, 3%, 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%), 65%, 70%), 75% или более из животных F0 иметь нацеленную генетическую модификацию (т.е. снижение уровня и/или активности белка Sry и/или нацеленную генетическую модификацию в интересующем полинуклеотиде) для переноса генетической модификации в поколение F1.
В одном варианте осуществления самка XY не относящегося к человеку животного и/или самец XY не относящегося к человеку животного поколения F0 по меньшей мере на 90%, 92%, 94%, 96%, 98%, 99%, или 99,8% происходит от донорской клетки. В одном варианте осуществления самка XY F0 не относящегося к человеку животного и/или самец XY F0 не относящегося к человеку животного имеет цвет шерсти, который на 100% происходит от донорской клетки.
В одном варианте осуществления самка XY не относящегося к человеку животного в поколении F0 представляет собой грызуна (т.е. мышь или крысу) и имеет цвет шерсти, который на 100% происходит от донорской клетки. В одном варианте осуществления не относящаяся к человеку самка XY не относящегося к человеку животного в поколении F0 по меньшей мере на 90%, 92%, 94%, 96%», 98% или 99,8% происходит от донорской клетки XY. В одном варианте осуществления самка XY не относящегося к человеку животного в поколении F0 на около 100% происходит от донорской клетки. В одном варианте осуществления вклад клетки эмбриона-хозяина в не относящуюся к человеку самку XY животного в поколении F0 определяют с помощью количественного анализа, который способен обнаруживать 1 клетку из 2000 (0,05%)), и ни одна ткань самки XY животного не является положительной в отношении вклада клетки эмбриона-хозяина.
ii. Различные способы разведения фертильной самки XY поколения F0
В конкретных вариантах осуществления полученную фертильную самку XY поколения F0, полученную из плюрипотентных и/или тотипотентных клеток XY (т.е. ЭС-клетки XY или ИПС-клетки XY), имеющих генетическую модификацию, которая снижает уровень и/или активность белка Sry, скрещивают с животным для получения потомства поколения F1. В конкретных вариантах осуществления фертильную самку XY F0 скрещивают с животным дикого типа. В одном варианте осуществления самка XY F0 не относящегося к человеку млекопитающего является фертильной при скрещивании с мышью дикого типа. В конкретных вариантах осуществления мышь дикого типа представляет собой C57BL/6. Потомство F1 можно генотипировать с использованием специфичных праймеров и/или зондов для определения того, присутствует ли нацеленная генетическая модификация, содержащая сниженные уровень и/или активность белка Sry. Кроме того, если в поколении F0 присутствовали дополнительные нацеленные генетические модификации, потомство F1 можно генотипировать с использованием специфичных праймеров и/или зондов для определения наличия таких модификаций. Можно идентифицировать подходящее потомство F1 для заданного применения. В конкретных вариантах осуществления отбирают потомство F1, в котором отсутствует генетическая модификация, снижающая уровень и/или активность белка Sry. В других вариантах осуществления отбирают потомство F1, в котором отсутствует генетическая модификация, снижающая уровень и/или активность белка Sry, и которое содержит по меньшей мере одну дополнительную нацеленную генетическую модификацию.
В одном не имеющем ограничительного характера примере после генотипирования с использованием специфичных праймеров и/или зондов животных F1, которые являются гетерозиготными по нацеленной генетической модификации в интересующем полинуклеотиде и у которых отсутствует нацеленная модификация, снижающая уровень и/или активность белка Sry, скрещивают друг с другом. При таком скрещивании производится потомство F2, которое является гомозиготным по интересующему генетически модифицированному геномному локусу и не содержит генетической модификации для снижения уровня и/или активности белка Sry.
Дополнительно предложен способ производства трансгенного не относящегося к человеку животного, гомозиготного по нацеленной генетической модификации в поколении F1. Способ включает: (а) скрещивание фертильной самки XY F0 не относящегося к человеку животного, имеющей нацеленную генетическую модификацию, которая снижает уровень и/или активность белка Sry, с самцом XY F0 не относящегося к человеку животного, причем каждый из фертильной самки XY F0 не относящегося к человеку животного и самца XY F0 не относящегося к человеку животного является гетерозиготным по одной и той же генетической модификации интересующего полинуклеотида; и (b) получение потомства F1, которое является гомозиготным по нацеленной генетической модификации в интересующем полинуклеотиде. В конкретном варианте осуществления отобранное потомство F1 является гомозиготным по нацеленной генетической модификации в интересующем полинуклеотиде и не имеет нацеленной генетической модификации, которая снижает уровень и/или активность белка Sry. Такие способы можно использовать для создания селекционных пар не относящихся к человеку животных, каждое из которых полностью происходит от донорской ЭС-клетки или ИПС-клетки в одном и том же поколении F0.
Для получения F0 животных, описанных выше, можно использовать различные способы. В одном не имеющем ограничительного характера варианте осуществления выделяют клон клетки XY с нацеленной модификацией в интересующем полинуклеотиде на любой хромосоме. Следует понимать, что для создания нацеленной модификации в интересующем полинуклеотиде можно использовать различные способы. На втором этапе нацеленную модификацию вводят в ген Sry так, что модификация снижает уровень и/или активность белка Sry. В таких способах дополнительно используют культивирование ЭС-клетки XY в средах, которые способствуют развитию фертильных самок XY F0, как подробно описано в других разделах настоящего документа. Способы нацеленной модификации гена Sry подробно описаны в других разделах настоящего документа и могут включать, например, использование нацеливающего вектора (включая LTVEC), либо в одиночку, либо в сочетании с нуклеазой, как описано в других разделах настоящего документа (т.е. TALEN, или система CRISPR, или ZFN). Выделяют субклон, который содержит как первую нацеленную модификацию в интересующем полинуклеотиде, так и вторую нацеленную модификацию гена Sry, которая снижает уровень и/или активность белка Sry. Как исходный клон XY с нацеленной модификацией в интересующем полинуклеотиде, так и субклон XY, содержащий как нацеленную модификацию гена Sry, так и интересующий полинуклеотид, вводят в отдельные не относящиеся к человеку эмбрионы-хозяев, как описано в других разделах настоящего документа. В конкретных вариантах осуществления не относящиеся к человеку эмбрионы-хозяева представляют собой эмбрионы на стадии до наступления морулы (т.е. стадия 8-клеточного эмбриона). Каждый из не относящихся к человеку эмбрионов-хозяев, содержащий модифицированные плюрипотентные клетки, вводят в суррогатную мать для вынашивания. Каждая из суррогатных матерей производит потомство F0, содержащее нацеленную геномную модификацию (т.е. самца XY F0, имеющего нацеленную модификацию в интересующем полинуклеотиде и фертильную самку XY F0, имеющую нацеленную модификацию в интересующем полинуклеотиде и имеющую генетическую модификацию, которая снижает уровень и/или активность белка Sry). В конкретных вариантах осуществления каждая из нацеленных генетических модификаций способна передаваться через зародышевую линию. Каждое из этих животных F0 скрещивают друг с другом для создания животного F1, содержащего гомозиготную нацеленную модификацию в интересующем полинуклеотиде. Ожидается, что одна четверть из поколения F1 будет гомозиготной по нацеленной модификации в интересующем полинуклеотиде. Можно отобрать потомство F1, сохраняющее нацеленную модификацию в гене Sry, или можно отобрать потомство F1, не сохраняющее нацеленную модификацию в гене Sry.
В другом варианте осуществления введение нацеленной модификации гена Sry с использованием нацеливающего вектора (и, в конкретных вариантах осуществления, нуклеаз, таких как TALEN, CRISPR или ZFN) может происходить одновременно с использованием вектора, нацеливающего на генетическую модификацию интересующего полинуклеотида. Такие способы позволяют создавать ЭС-клетки XY, имеющие генетическую модификацию, которая снижает уровень и/или активность белка Sry, и дополнительно содержащие нацеленную модификацию в интересующем полинуклеотиде.
В одном варианте осуществления потомство поколения F1 содержит геном, полностью происходящий от донорской ЭС-клетки. В других вариантах осуществления частота скрещиваний самцов поколения F0 и самок мышей поколения F0, которые дают начало мышам, полностью происходящим от ЭС-клетки, составляет 100%.
II. Способы и композиции для модификации затрудняющего целевого геномного локуса или целевого геномного локуса на Y-хромосоме
Предложены способы и композиции, позволяющие модификацию целевого геномного локуса на Y-хромосоме в клетке. Дополнительно предложены способы, позволяющие модификацию «затрудняющих» геномных локусов. Термин «затрудняющий локус» включает область хромосомы, на которую трудно выполнить нацеливание посредством стандартных стратегий нацеливания на гены. Такие локусы могут быть расположены на Y-хромосоме, Х-хромосоме или аутосоме. В определенных вариантах осуществления затрудняющие локусы расположены в пределах или вблизи областей хромосомы с незначительным количеством генов и с большим количеством повторов и/или в значительной степени гетерохроматиновых областях хромосомы. См., например, публикацию Bernardini et al., Proc. Natl. Acad. Sci. USA 111:7600-7605 (2014), полностью включенную в настоящий документ путем ссылки для всех целей. В определенных вариантах осуществления затрудняющий локус расположен в пределах или вблизи хромосомных областей, в которых доступность хромосомной ДНК ограничена хроматиновой структурой. В определенных вариантах осуществления затрудняющий локус находится в пределах или вблизи хромосомных областей, которые характеризуются высоким процентным содержанием гетерохроматина, например по меньшей мере около ~ 20%, по меньшей мере около ~ 30%, по меньшей мере около 40%, по меньшей мере около 50%, по меньшей мере около 60% или по меньшей мере около 70% гетерохроматина. В определенных вариантах осуществления затрудняющий локус расположен в пределах или вблизи хромосомных областей, которые подверглись дупликациям и перестройкам или которые характеризуются присутствием повторов или инвертированных повторов. См., например, публикацию Gubbay et al., Proc. Natl. Acad. Sci. USA 89:7953-7957 (1992), полностью включенную в настоящий документ путем ссылки для всех целей.
Термин «хроматин» включает нуклеопротеиновые комплексы, которые уплотняют и организовывают клеточный генетический материал для содержания внутри клетки. Термин «гетерохроматин» включает области в геноме, которые находятся в высококонденсированном состоянии и, как правило, являются транскрипционно молчащими. Гетерохроматин, как правило, более плотно свернут в спирали и, как правило, имеет больше повторяющихся последовательностей ДНК, чем эухроматин. Термин «эухроматин» включает области в геноме, которые характеризуются более удлиненными и менее конденсированными доменами хроматина, которые часто являются транскрипционно активными и доступными.
Термин «экспонирование» включает в себя использование любого способа, посредством которого заданные компоненты приводят в непосредственную близость или в прямой контакт.
Предложены способы и композиции, позволяющие модификацию затрудняющего целевого геномного локуса или целевого геномного локуса на Y-хромосоме в клетке. Вероятно, из-за уникальных структурных особенностей Y-хромосомы успех стандартных стратегий нацеливания генов в мышиных эмбриональных стволовых клетках для создания мутаций в Y-связанных генах ограничен. Таким образом, понимание функционирования мышиных Y-связанных генов часто ограничено выводами, полученными в исследованиях мышей, которые несут спонтанные делеции, случайные инсерции генных ловушек или аутосомальные трансгены. Способы, предложенные в настоящем документе, позволяют нацеливание на геномный локус на Y-хромосоме посредством использования нацеливающего вектора при отсутствии нуклеазного агента или в комбинации с ним.
В некоторых из таких способов используют малый нацеливающий вектор или smallTVEC. SmallTVEC представляет собой нацеливающий вектор, который содержит короткие гомологичные плечи. Длина гомологичного плеча на smallTVEC может составлять около 400-1000 п. н. Гомологичное плечо smallTVEC может иметь любую длину, достаточную для способствования событию гомологичной рекомбинации с соответствующим целевым сайтом, включая, например, длину от около 400 п. н. до около 500 п. н., от около 500 п. н. до около 600 п. н., от около 600 п. н. до около 700 п. н., от около 700 п. н. до около 800 п. н., от около 800 п. н. до около 900 п. н. или от около 900 п. н. до около 1000 п. н. Предпочтительная длина гомологичного плеча на smallTVEC составляет от около 700 п. н. до около 800 п. н. В другом варианте осуществления суммарная длина 5' и 3'-гомологичных плеч smallTVEC составляет около 0,5 т. п. н., 1 т. п. н., 1,5 т. п. н., 2 т. п. н., 3 т. п. н., 4 т. п. н., 5 т. п. н., 6 т. п. н., 7 т. п. н., 8 т. п. н., 9 т. п. н., от около 0,5 т. п. н. до около 1 т. п. н., от около 1 т. п. н. до около 1,5 т. п. н., от около 1,5 т. п. н. до около 2 т. п. н., от около 2 т. п. н. до около 3 т. п. н., от около 3 т. п. н. до около 4 т. п. н., от около 4 т. п. н. до около 5 т. п. н., от около 5 т. п. н. до около 6 т. п. н., от около 6 т. п. н. до около 7 т. п. н., от около 8 т. п. н. до около 9 т. п. н. или по меньшей мере 10 т. п. н. В таких способах короткая длина гомологичных плеч увеличивает эффективность нацеливания по сравнению с нацеливающим вектором с более длинными гомологичными плечами. Благодаря природе Y-хромосомы, которая имеет высокое содержание повторяющихся последовательностей, короткие плечи smallTVEC позволяют высокоспецифичное нацеливание на Y-хромосому.
Предложены способы модификации целевого геномного локуса на Y-хромосоме в клетке, включающие: (а) обеспечение клетки, содержащей целевой геномный локус на Y-хромосоме, содержащий сайт распознавания для нуклеазного агента; (b) введение в клетку первого нацеливающего вектора, содержащего первую полинуклеотидную вставку, фланкированную первым и вторым гомологичными плечами, соответствующими первому и второму целевым сайтам; и (с) идентификацию по меньшей мере одной клетки, содержащей в своем геноме первую полинуклеотидную вставку, интегрированную в целевой геномный локус на Y-хромосоме. В конкретных вариантах осуществления суммарная длина первого гомологичного плеча и второго гомологичного плеча нацеливающего вектора составляет около 0,5 т. п. н., 1 т. п. н., 1,5 т. п. н., 2 т. п. н., 3 т. п. н., 4 т. п. н., 5 т. п. н., 6 т. п. н., 7 т. п. н., 8 т. п. н., 9 т. п. н., от около 0,5 т. п. н. до около 1 т. п. н., от около 1 т. п. н. до около 1,5 т. п. н., от около 1,5 т. п. н. до около 2 т. п. н., от около 2 т. п. н. до около 3 т. п. н., от около 3 т. п. н. до около 4 т. п. н., от около 4 т. п. н. до около 5 т. п. н., от около 5 т. п. н. до около 6 т. п. н., от около 6 т. п. н. до около 7 т. п. н., от около 8 т. п. н. до около 9 т. п. н. или составляет по меньшей мере 10 т. п. н. или по меньшей мере 10 т. п. н. и менее чем 150 т. п. н. В некоторых вариантах осуществления используют smallTVEC. В некоторых вариантах осуществления используют LTVEC. Подобные способы можно выполнять при нацеливании на затрудняющий целевой геномный локус. В одном не имеющем ограничительного характера варианте осуществления такие способы выполняют с использованием культуральных сред, которые способствуют развитию фертильных самок XY F0, описанных в настоящем документе, и таким образом создают фертильных самок XY F0 животных. В других случаях способы, описанные в настоящем документе, используют для получения нацеленной генетической модификации в гене Sry, как описано в других разделах настоящего документа.
Дополнительно предложены способы модификации целевого геномного локуса на Y-хромосоме в клетке, включающие: (а) обеспечение клетки, содержащей целевой геномный локус на Y-хромосоме, содержащий сайт распознавания для нуклеазного агента; (b) введение в клетку: (i) нуклеазного агента, причем нуклеазный агент индуцирует одно- или двухцепочечный разрыв на первом сайте распознавания; и (ii) первого нацеливающего вектора, содержащего первую полинуклеотидную вставку, фланкированную первым и вторым гомологичными плечами, соответствующими первому и второму целевым сайтам, расположенным достаточно близко к первому сайту распознавания; и (с) идентификацию по меньшей мере одной клетки, содержащей в своем геноме первую полинуклеотидную вставку, интегрированную в целевой геномный локус на Y-хромосоме. В конкретных вариантах осуществления суммарная длина первого гомологичного плеча и второго гомологичного плеча нацеливающего вектора составляет около 0,5 т. п. н., 1 т. п. н., 1,5 т. п. н., 2 т. п. н., 3 т. п. н., 4 т. п. н., 5 т. п. н., 6 т. п. н., 7 т. п. н., 8 т. п. н., 9 т. п. н., от около 0,5 т. п. н. до около 1 т. п. н., от около 1 т. п. н. до около 1,5 т. п. н., от около 1,5 т. п. н. до около 2 т. п. н., от около 2 т. п. н. до около 3 т. п. н., от около 3 т. п. н. до около 4 т. п. н., от около 4 т. п. н. до около 5 т. п. н., от около 5 т. п. н. до около 6 т. п. н., от около 6 т. п. н. до около 7 т. п. н., от около 8 т. п. н. до около 9 т. п. н. или составляет по меньшей мере 10 т. п. н. или по меньшей мере 10 т. п. н. и менее чем 150 т. п. н. В некоторых вариантах осуществления используют smallTVEC. В некоторых вариантах осуществления используют LTVEC. Подобные способы можно выполнять при нацеливании на затрудняющий целевой геномный локус. В одном не имеющем ограничительного характера варианте осуществления такие способы выполняют с использованием культуральных сред, которые способствуют развитию фертильных самок XY F0, описанных в настоящем документе, и таким образом создают фертильных самок XY F0 животных. В других случаях способы, описанные в настоящем документе, используют для получения нацеленной генетической модификации в гене Sry, как описано в других разделах настоящего документа.
Следует понимать, что различные способы, описанные в настоящем документе, для производства нацеленной модификации в геномном локусе на Y-хромосоме (или любом затрудняющем геномном локусе), в которых используют нацеливающий вектор, smallTVEC или LTVEC, можно выполнять в клетке любого типа, и он не ограничен XY плюрипотентной и/или тотипотентной клеткой. Такие типы клеток включают в себя, без ограничений, человеческую клетку, не относящуюся к человеку клетку, клетку млекопитающего, клетку не относящегося к человеку млекопитающего, клетку грызуна, клетку мыши, клетку крысы, клетку-фибробласт или любую другую клетку-хозяина. Такие клетки включают в себя плюрипотентные клетки, включая, например, индуцированные плюрипотентные стволовые (ИПС) клетки, эмбриональные стволовые (ЭС) клетки мыши, эмбриональные стволовые (ЭС) клетки крысы, эмбриональные стволовые (ЭС) клетки человека или онтогенетически ограниченную человеческую клетку-предшественник.
Дополнительно описаны способы создания большой делеции на Y-хромосоме, в которых используют любой из нуклеазных агентов, представленных в настоящем документе (например, гРНК CRISPR в комбинации с Cas9; ZFN или TALEN). Такая делеция на Y-хромосоме может быть делецией эндогенной нуклеотидной последовательности. Делеция может находиться в диапазоне от около 5 т. п. н. до около 10 т. п. н., от около 10 т. п. н. до около 20 т. п. н., от около 20 т. п. н. до около 40 т. п. н., от около 40 т. п. н. до около 60 т. п. н., от около 60 т. п. н. до около 80 т. п. н., от около 80 т. п. н. до около 100 т. п. н., от около 100 т. п. н. до около 150 т. п. н., от около 150 т. п. н. до около 200 т. п. н., от около 200 т. п. н. до около 300 т. п. н., от около 300 т. п. н. до около 400 т. п. н., от около 400 т. п. н. до около 500 т. п. н., от около 500 т. п. н. до около 600 т. п. н., от около 600 т. п. н. до около 700 т. п. н., от около 700 т. п. н. до около 800 т. п. н., от около 800 т. п. н. до около 900 т. п. н., от около 900 т. п. н. до около 1 млн п. н., от около 500 т. п. н. до около 1 млн п. н., от около 1 млн п. н. до около 1,5 млн п. н., от около 1,5 млн п. н. до около 2 млн п. н., от около 2 млн п. н. до около 2,5 млн п. н. или от около 2,5 млн п. н. до около 3 млн п. н. В одном варианте осуществления делеция составляет больше чем 500 т. п. н. В другом варианте осуществления делеция составляет от около 500 т. п. н. до около 600 т. п. н. В конкретном варианте осуществления делеция составляет около 500 т. п. н. Такая делеция на Y-хромосоме может быть делецией любой нуклеотидной последовательности. В одном варианте осуществления делеция содержит ген, который связан с фертильностью/стерильностью. Делеция на Y-хромосоме может содержать делецию множества генов. В таких способах можно удалить 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более генов. В конкретных вариантах осуществления мишенью для делеции является ген Kdm5d (лизин (K)-специфичная деметилаза 5d; например, Entrez Gene ID 20592 (mus musculus)) и/или ген Usp9y (убиквитин-специфичная пептидаза 9, у-связанная; например, Entrez Gene ID 107868 (mus musculus)). В других вариантах осуществления мишенью для делеции является ген Sry.
А. Нуклеазные агенты и сайты распознавания для нуклеазных агентов
Термин «сайт распознавания для нуклеазного агента» включает последовательность ДНК, в которой нуклеазный агент индуцирует одно- или двухцепочечный разрыв. Сайт распознавания для нуклеазного агента может быть эндогенным (или нативным) по отношению к клетке, или сайт распознавания может быть экзогенным по отношению к клетке. В конкретных вариантах осуществления сайт распознавания является экзогенным по отношению к клетке и, таким образом, не встречается в геноме клетки в природе. В других дополнительных вариантах осуществления сайт распознавания является эндогенным по отношению к клетке и интересующим полинуклеотидам, которые необходимо разместить в целевом локусе. В дополнительных вариантах осуществления экзогенный или эндогенный сайт распознавания присутствует в геноме клетки-хозяина только один раз. В конкретных вариантах осуществления идентифицирован эндогенный или нативный сайт, который присутствует в геноме только один раз. Впоследствии такой сайт может быть использован для конструирования нуклеазных агентов, которые будут создавать на эндогенном сайте распознавания одно- или двухцепочечный разрыв.
Длина сайта распознавания может изменяться и, например, включает сайты распознавания для пары нуклеаз с «цинковыми пальцами» (ZFN) длиной около 30-36 п. н. (т.е. около 15-18 п. н. для каждой ZFN), для эффекторной нуклеазы, подобной активатору транскрипции (TALEN), длиной около 36 п. н. или для гидовой РНК CRISPR/Cas9 длиной около 20 п. н.
В одном варианте осуществления каждый мономер нуклеазного агента распознает сайт распознавания длиной по меньшей мере 9 нуклеотидов. В других вариантах осуществления сайт распознавания составляет от около 9 до около 12 нуклеотидов в длину, от около 12 до около 15 нуклеотидов в длину, от около 15 до около 18 нуклеотидов в длину или от около 18 до около 21 нуклеотидов в длину и любую комбинацию таких поддиапазонов (например, 9-18 нуклеотидов). Следует понимать, что данный нуклеазный агент может связывать сайт распознавания и расщеплять сайт связывания или, в альтернативном варианте осуществления, нуклеазный агент может связываться с последовательностью, которая отличается от сайта распознавания. Кроме того, термин «сайт распознавания» содержит как сайт связывания нуклеазного агента, так и сайт одноцепочечного разрыва/расщепления, независимо от того, расположен ли сайт одноцепочечного разрыва/расщепления в пределах или за пределами сайта связывания нуклеазного агента. В другой разновидности расщепление нуклеазным агентом может происходить в положениях нуклеотидов, расположенных непосредственно друг напротив друга для производства разреза с тупым концом или, в других случаях, разрезы могут быть ступенчатыми для производства одноцепочечных нависаний, также именуемых «липкие концы», которые могут быть 5'-нависаниями или 3'-нависаниями.
В описанных в настоящем документе способах и композициях может использоваться любой нуклеазный агент, который индуцирует одно- или двухцепочечный разрыв в заданном сайте распознавания. Встречающийся в природе, или нативный, нуклеазный агент может использоваться при условии, что нуклеазный агент индуцирует в заданном сайте распознавания одно- или двухцепочечный разрыв. В альтернативном варианте осуществления может использоваться модифицированный или сконструированный нуклеазный агент. «Сконструированный нуклеазный агент» включает нуклеазу, сконструированную (модифицированную или производную) из ее нативной формы для того, чтобы она специфически распознавала и индуцировала одно- или двухцепочечный разрыв в заданном сайте распознавания. Таким образом, сконструированный нуклеазный агент может быть получен из нативного встречающегося в природе нуклеазного агента, или он может быть создан или синтезирован искусственно. Модификация нуклеазного агента может быть незначительной, например она может представлять собой модификацию одной аминокислоты в агенте расщепления белка или одного нуклеотида в агенте расщепления нуклеиновой кислоты. В некоторых вариантах осуществления сконструированная нуклеаза индуцирует одно- или двухцепочечный разрыв в сайте распознавания, причем сайт распознавания не является последовательностью, которая могла бы быть распознана нативным (не сконструированным или не модифицированным) нуклеазным агентом. Создание одно- или двухцепочечного разрыва в сайте распознавания или другой ДНК в настоящем документе может называться «разрезанием» или «расщеплением» сайта распознавания или другой ДНК.
Также представлены активные варианты и фрагменты сайтов распознавания, приведенных в качестве примера. Идентичность последовательности таких активных вариантов данному сайту распознавания составляет по меньшей мере 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более, причем активные варианты сохраняют биологическую активность и, следовательно, могут распознаваться и расщепляться нуклеазным агентом последовательность-специфическим образом. Анализы измерения двухцепочечного разрыва сайта распознавания посредством нуклеазного агента известны в данной области (например, из публикации TaqMan® qPCR assay, Frendewey D. et al., Methods in Enzymology, 2010, 476:295-307, которая включена в настоящий документ в полном объеме путем ссылки).
В конкретных вариантах осуществления сайт распознавания расположен внутри полинуклеотида, кодирующего селективный маркер. Такое положение может находиться в пределах кодирующей области селективного маркера или в пределах регуляторных областей, оказывающих влияние на экспрессию селективного маркера. Таким образом, сайт распознавания нуклеазного агента может быть расположен в интроне селективного маркера, промоторе, энхансере, регуляторной области или любой не кодирующей белок области полинуклеотида, кодирующего селективный маркер. В конкретных вариантах осуществления одно- или двухцепочечный разрыв на сайте распознавания нарушает активность селективного маркера. Известны методы анализа на наличие или отсутствие функционального селективного маркера.
В одном варианте осуществления нуклеазный агент представляет собой эффекторную нуклеазу, подобную активатору транскрипции (TALEN). TAL-эффекторные нуклеазы представляют собой класс последовательность-специфических нуклеаз, которые можно использовать для выполнения двухцепочечных разрывов на специфических целевых последовательностях в геноме прокариотического или эукариотического организма. TAL-эффекторные нуклеазы создают путем слияния нативного или сконструированного эффектора, подобного активатору транскрипции (TAL), или его функциональной части с каталитическим доменом эндонуклеазы, например FokI. Уникальный модульный TAL-эффекторный ДНК-связывающий домен обеспечивает конструирование белков с потенциально любой заданной специфичностью распознавания ДНК. Таким образом, для распознавания целевых сайтов со специфической ДНК могут быть сконструированы ДНК-связывающие домены TAL-эффекторных нуклеаз, и, таким образом, их можно использовать для двухцепочечных разрывов на заданных целевых последовательностях. См. WO 2010/079430; Morbitzer et al. (2010) PNAS 10.1073/pnas.1013133107; Scholze & Boch (2010) Virulence 1:428-432; Christian et al. Genetics (2010) 186:757-761; Li et al. (2010) Nuc. Acids Res. (2010) doi:10.1093/nar/gkq704; и Miller et al. (2011) Nature Biotechnology 29:143-148; все из которых полностью включены в настоящий документ путем ссылки.
Примеры подходящих TAL-нуклеаз и способы получения подходящих TAL-нуклеаз описаны, например, в заявках на патент США №№2011/0239315 А1, 2011/0269234 А1, 2011/0145940 А1, 2003/0232410 А1, 2005/0208489 А1, 2005/0026157 А1, 2005/0064474 А1, 2006/0188987 А1 и 2006/0063231 А1 (каждая включена в настоящий документ путем ссылки). В различных вариантах осуществления сконструированы TAL-эффекторные нуклеазы, которые «выполняют разрез» в целевой нуклеотидной последовательности или возле нее, например в интересующем локусе или интересующем геномном локусе, в котором целевая нуклеотидная последовательность находится на последовательности, подлежащей модификации посредством нацеливающего вектора, или возле нее. TAL-нуклеазы, подходящие для использования с различными способами и композициями, предложенными в настоящем документе, включают те, которые специфически разработаны для связывания на целевой нуклеотидной последовательности, подлежащей модификации посредством нацеливающих векторов, или возле нее, как описано в настоящем документе.
В одном варианте осуществления каждый мономер TALEN содержит 33-35 повторов TAL, которые распознают одну пару нуклеотидов с помощью двух гипервариабельных остатков. В одном варианте осуществления нуклеазный агент представляет собой химерный белок, содержащий ДНК-связывающий домен на основе TAL-повторов, функционально связанный с независимой нуклеазой. В одном варианте осуществления независимая нуклеаза представляет собой эндонуклеазу FokI. В одном варианте осуществления нуклеазный агент содержит первый ДНК-связывающий домен на основе TAL-повторов и второй ДНК-связывающий домен на основе TAL-повторов, причем каждый из первого и второго ДНК-связывающего домена на основе TAL-повторов функционально связан с нуклеазой FokI, при этом первый и второй ДНК-связывающие домены на основе TAL-повторов распознают две смежные целевые последовательности ДНК в каждой цепи целевой последовательности ДНК, разделенные последовательностью спейсера различной длины (12-20 п. н.), и при этом субъединицы нуклеазы FokI димеризуются для создания активной нуклеазы, которая выполняет двухцепочечный разрыв на целевой последовательности.
Нуклеазный агент, используемый в различных способах и композициях, описанных в настоящем документе, может дополнительно содержать нуклеазу с «цинковыми пальцами» (ZFN). В одном варианте осуществления каждый мономер ZFN содержит 3 или более ДНК-связывающих доменов на основе «цинковых пальцев», причем каждый ДНК-связывающий домен на основе «цинковых пальцев» связывается с субсайтом из 3 п. н. В других вариантах осуществления ZFN представляет собой химерный белок, содержащий ДНК-связывающий домен на основе «цинковых пальцев», функционально связанный с независимой нуклеазой. В одном варианте осуществления независимая эндонуклеаза представляет собой эндонуклеазу FokI. В одном варианте осуществления нуклеазный агент содержит первую ZFN и вторую ZFN, причем каждая из первой ZFN и второй ZFN функционально связана с субъединицей нуклеазы FokI, при этом первая и вторая ZFN распознают две смежные целевые последовательности ДНК в каждой цепи целевой последовательности ДНК, разделенные спейсером длиной около 5-7 п. н., и при этом субъединицы нуклеазы FokI димеризуются для создания активной нуклеазы, которая выполняет двухцепочечный разрыв. См., например, публикации US 20060246567; US 20080182332; US 20020081614; US 20030021776; WO/2002/057308 A2; US 20130123484; US 20100291048; WO/2011/017293 А2; и Gaj et al. (2013) Trends in Biotechnology, 31 (7):397-405, каждая из которых полностью включена в настоящий документ путем ссылки.
В еще одном варианте осуществления нуклеазный агент представляет собой мегануклеазу. Мегануклеазы были разделены на четыре семейства на основе консервативных мотивов последовательностей, семейства представляют собой LAGLIDADG, GIY-YIG, H-N-H и His-Cys box. Эти мотивы участвуют в координации ионов металлов и гидролизе фосфодиэфирных связей. Мегануклеазы отличаются своими длинными сайтами распознавания и допуском некоторых видов полиморфизма последовательностей в их ДНК-субстратах. Известны домены, структура и функция мегануклеазы, см., например, Guhan and Muniyappa (2003) Crit Rev Biochem Mol Biol 38:199-248; Lucas et al., (2001) Nucleic Acids Res 29:960-9; Jurica and Stoddard, (1999) Cell Mol Life Sci 55:1304-26; Stoddard, (2006) Q Rev Biophys 38:49-95; и Moure et al., (2002) Nat Struct Biol 9:764. В некоторых примерах используют встречающийся в природе вариант и/или сконструированное производное мегануклеазы. Известны способы модификации кинетики, взаимодействий кофакторов, экспрессии, оптимальных условий и/или специфичности сайта распознавания и скрининга в отношении активности, см., например, Epinat et al., (2003) Nucleic Acids Res 31:2952-62; Chevalier et al., (2002) Mol Cell 10:895-905; Gimble et al., (2003) Mol Biol 334:993-1008; Seligman et al., (2002) Nucleic Acids Res 30:3870-9; Sussman et al., (2004) J Mol Biol 342:31-41; Rosen et al., (2006) Nucleic Acids Res 34:4791-800; Chames et al., (2005) Nucleic Acids Res 33:el78; Smith et al., (2006) Nucleic Acids Res 34:e149; Gruen et al., (2002) Nucleic Acids Res 30:e29; Chen and Zhao, (2005) Nucleic Acids Res 33:e154; WO 2005105989; WO 2003078619; WO 2006097854; WO 2006097853; WO 2006097784 и WO 2004031346.
Здесь может использоваться любая мегануклеаза, включая, без ограничений, I-SceI, I-SceII, I-SceIII, I-SceIV, I-SceV, I-SceVI, I-SceVII, I-CeuI, I-CeuAIIP, I-CreI, I-CrepsbIP, I-CrepsbIIP, I-CrepsbIIIP, I-CrepsbIVP, I-TliI, I-PpoI, PI-PspI, F-SceI, F-SceII, F-SuvI, F-TevI, F-TevII, I-AmaI, I-AniI, I-ChuI, I-CmoeI, I-CpaI, I-CpaII, I-CsmI, I-CvuI, I-CvuAIP, I-DdiI, I-DdiII, I-DirI, I-DmoI, I-HmuI, I-HmuII, I-HsNIP, I-LlaI, I-MsoI, I-NaaI, I-NanI, I-NcIIP, I-NgrIP, I-NitI, I-NjaI, I-Nsp236IP, I-PakI, I-PboIP, I-PcuIP, I-PcuAI, I-PcuVI, I-PgrIP, I-PobIP, I-PorI, I-PorIIP, I-PbpIP, I-SpBetaIP, I-ScaI, I-SexIP, I-SneIP, I-SpomI, I-SpomCP, I-SpomIP, I-SpomIIP, I-SquIP, I-Ssp6803I, I-SthPhiJP, I-SthPhiST3P, I-SthPhiSTe3bP, I-TdeIP, I-TevI, I-TevII, I-TevIII, I-UarAP, I-UarHGPAIP, I-UarHGPA13P, I-VinIP, I-ZbiIP, PI-MtuI, PI-MtuHIP PI-MtuHIIP, PI-PfuI, PI-PfuII, PI-PkoI, PI-PkoII, PI-Rma43812IP, PI-SpBetaIP, PI-SceI, PI-TfuI, PI-TfuII, PI-ThyI, PI-TliI, PI-TliII или их любые активные варианты или фрагменты.
В одном варианте осуществления мегануклеаза распознает двухцепочечные последовательности ДНК, состоящие из 12-40 пар нуклеотидов. В одном варианте осуществления мегануклеаза распознает одну идеально соответствующую целевую последовательность в геноме. В одном варианте осуществления мегануклеаза представляет собой самонаводящуюся нуклеазу. В одном варианте осуществления самонаводящаяся нуклеаза принадлежит к семейству самонаводящихся нуклеаз LAGLIDADG. В одном варианте осуществления семейство самонаводящихся нуклеаз LAGLIDADG выбирают из I-SceI, I-CreI и I-Dmol.
Нуклеазные агенты могут дополнительно содержать рестрикционные эндонуклеазы, которые включают эндонуклеазы I типа, II типа, III типа и IV типа. Рестрикционные эндонуклеазы I типа и III типа распознают специфические сайты распознавания, но, как правило, осуществляют расщепление в разных положениях на расстоянии от сайта связывания нуклеазы, которые могут находиться на расстоянии сотен пар нуклеотидов от сайта расщепления (сайта распознавания). В системах II типа рестрикционная активность не зависит от метилазной активности и расщепление обычно происходит в специфических сайтах в пределах сайта связывания или вблизи него. Большинство ферментов II типа разрезает палиндромные последовательности, однако ферменты IIа типа распознают непалиндромные сайты распознавания и осуществляют расщепление за пределами сайта распознавания, ферменты IIs типа разрезают последовательности дважды на двух сайтах за пределами сайта распознавания, а ферменты IIs типа распознают асимметричный сайт распознавания и осуществляют расщепление с одной стороны и на определенном расстоянии от сайта распознавания, составляющем около 1-20 нуклеотидов. Рестрикционные ферменты IV типа нацелены на метилированную ДНК. Рестрикционные ферменты дополнительно описаны и классифицированы, например, в базе данных REBASE (адрес веб-страницы: rebase.neb.com; Roberts et al., (2003) Nucleic Acids Res 31:418-20), Roberts et al., (2003) Nucleic Acids Res 31:1805-12 и Belfort et al., (2002) в Mobile DNA II, pp. 761-783, Eds. Craigie et al. (ASM Press, Washington, DC).
Нуклеазный агент, используемый в различных способах и композициях, может также содержать систему CRISPR/Cas. В таких системах может использоваться нуклеаза Cas9, которая в некоторых случаях является кодон-оптимизированной для требуемого типа клеток, в которых она должна экспрессироваться. В системе дополнительно используется слитая конструкция крРНК-тракрРНК, функционирующая с кодон-оптимизированной Cas9. Эту одинарную РНК часто называют гидовой РНК или гРНК. В пределах гРНК участок крРНК определяют как «целевую последовательность» для данного сайта распознавания, а тракрРНК часто называют «каркасом». Было продемонстрировано, что эта система функционирует в различных эукариотических и прокариотических клетках. Коротко говоря, выполняется вставка короткого фрагмента ДНК, содержащего целевую последовательность, в плазмиду экспрессии гидовой РНК. Плазмида экспрессии гРНК содержит целевую последовательность (в некоторых вариантах осуществления длиной приблизительно 20 нуклеотидов), вид последовательности тракрРНК (каркас), а также подходящий промотор, который является активным в клетке, и элементы, необходимые для соответствующего процессинга в эукариотических клетках. Многие из систем основаны на обычных, комплементарных олигонуклеотидах, которые ренатурируют с образованием двухцепочечной ДНК, после чего клонируют в плазмиду экспрессии гРНК. Затем экспрессионную кассету гРНК и экспрессионную кассету Cas9 вводят в клетку. См., например, публикации Mali Р et al. (2013) Science 2013 Feb 15; 339 (6121):823-6; Jinek M et al. Science 2012 Aug 17; 337(6096):816-21; Hwang WY et al. Nat Biotechnol 2013 Mar; 31(3):227-9; Jiang W et al. Nat Biotechnol 2013 Mar; 31(3):233-9; и Cong L et al. Science 2013 Feb 15; 339(6121):819-23, каждая из которых полностью включена в настоящий документ путем ссылки.
В способах и композициях, описанных в настоящем документе, для модификации генома внутри клетки могут использоваться системы коротких палиндромных повторов, регулярно расположенных группами (CRISPR)/системы, ассоциированные с CRISPR (Cas), или компоненты таких систем. Системы CRISPR/Cas включают в себя транскрипты и другие элементы, участвующие в экспрессии или управлении активностью генов Cas. Система CRISPR/Cas может представлять собой систему I типа, II типа или III типа. В способах и композициях, описанных в настоящем документе, для сайт-направленного расщепления нуклеиновых кислот используются системы CRISPR/Cas посредством использования комплексов CRISPR (содержащих гидовую РНК (гРНК), образующую комплекс с белком Cas).
Некоторые системы CRISPR/Cas, используемые в способах, описанных в настоящем документе, не встречаются в природе. «Не встречающаяся в природе» система имеет признаки вмешательства человека, например, один или более компонентов системы изменены или мутированы по сравнению с их природным состоянием, при этом они по меньшей мере по существу не содержат по меньшей мере один другой компонент, с которым они естественно ассоциированы в природе, или они ассоциированы по меньшей мере с другим компонентом, с которым они не ассоциированы в природе. Например, в некоторых системах CRISPR/Cas используются не встречающиеся в природе комплексы CRISPR, которые содержат гРНК и белок Cas, не встречающиеся в природе вместе.
(i) А. Эндонуклеазы, направляемые РНК Cas
Белки Cas обычно содержат по меньшей мере один домен распознавания или связывания РНК. Такие домены могут взаимодействовать с гидовыми РНК (гРНК, описаны более подробно ниже). Белки Cas могут также содержать нуклеазные домены (например, домены ДНКазы или РНКазы), ДНК-связывающие домены, геликазные домены, домены межбелковых взаимодействий, домены димеризации и другие домены. Нуклеазный домен обладает каталитической активностью в отношении расщепления нуклеиновых кислот. Расщепление включает разрушение ковалентных связей молекулы нуклеиновой кислоты. В результате расщепления могут образовываться тупые концы или ступенчатые концы, и расщепление может быть одноцепочечным или двухцепочечным.
Примеры белков Cas включают Cas1, Cas1B, Cas2, Cas3, Cas4, Cas5, Cas5e (CasD), Cas6, Cas6e, Cas6f, Cas7, Cas8a1, Cas8a2, Cas8b, Cas8c, Cas9 (Csn1 или Csx12), Cas10, Cas10d, CasF, CasG, CasH, Csy1, Csy2, Csy3, Cse1 (CasA), Cse2 (CasB), Cse3 (CasE), Cse4 (CasC), Csc1, Csc2, Csa5, Csn2, Csm2, Csm3, Csm4, Csm5, Csm6, Cmr1, Cmr3, Cmr4, Cmr5, Cmr6, Csb1, Csb2, Csb3, Csx17, Csx14, Csx10, Csx16, CsaX, Csx3, Csx1, Csx15, Csf1, Csf2, Csf3, Csf4 и Cu1966 и их гомологи или модифицированные варианты.
Белки Cas могут быть из системы CRISPR/Cas II типа. Например, белок Cas может быть белком Cas9 или может быть получен из белка Cas9. Белки Cas9 обычно имеют четыре общих основных мотива с консервативной архитектурой. Мотивы 1, 2 и 4 представляют собой RuvC-подобные мотивы, а мотив 3 представляет собой мотив HNH. Белок Cas9 может быть, например, получен из Streptococcus pyogenes, Streptococcus thermophilus, Streptococcus sp., Staphylococcus aureus, Nocardiopsis dassonvillei, Streptomyces pristinaespiralis, Streptomyces viridochromogenes, Streptomyces viridochromogenes, Streptosporangium roseum, Streptosporangium roseum, AlicyclobacHlus acidocaldarius, Bacillus pseudomycoides, Bacillus selenitireducens, Exiguobacterium sibiricum, Lactobacillus delbrueckii, Lactobacillus salivarius, Microscilla marina, Burkholderiales bacterium, Polaromonas naphthalenivorans, Polaromonas sp., Crocosphaera watsonii, Cyanothece sp., Microcystis aeruginosa, Synechococcus sp., Acetohalobium arabaticum, Ammonifex degensii, Caldicelulosiruptor becscii, Candidatus Desulforudis, Clostridium botulinum, Clostridium difficile, Finegoldia magna, Natranaerobius thermophilus, Pelotomaculum thermopropionicum, Acidithiobacillus caldus, Acidithiobacillus ferrooxidans, Allochromatium vinosum, Marinobacter sp., Nitrosococcus halophilus, Nitrosococcus watsoni, Pseudoalteromonas haloplanktis, Ktedonobacter racemifer, Methanohalobium evestigatum, Anabaena variabilis, Nodularia spumigena, Nostoc sp., Arthrospira maxima, Arthrospiraplatensis, Arthrospira sp., Lyngbya sp., Microcoleus chthonoplastes, Oscillatoria sp., Petrotoga mobilis, Thermosipho africanus или Acaryochloris marina. Дополнительные примеры представителей семейства Cas9 описаны в публикации WO 2014/131833, которая полностью включена в настоящий документ путем ссылки. Предпочтительным ферментом является белок Cas9 из S. pyogenes или его производное. Белку Cas9 из S. pyogenes в базе данных SwissProt присвоен номер доступа Q99ZW2.
Белки Cas могут являться белками дикого типа (т.е. встречающимися в природе), модифицированными белками Cas (т.е. вариантами белков Cas) или фрагментами белков Cas дикого типа или модифицированных белков Cas. Белки Cas могут также являться активными вариантами или фрагментами белков Cas дикого типа или модифицированных белков Cas. Идентичность последовательности таких активных вариантов или фрагментов белку Cas дикого типа или модифицированному белку Cas или его части может составлять по меньшей мере 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более, причем активные варианты сохраняют способность разрезания на требуемом сайте расщепления и, следовательно, сохраняют активность, индуцирующую одно- или двухцепочечный разрыв. Анализы определения активности, индуцирующей одно- или двухцепочечный разрыв, известны и, как правило, измеряют общую активность и специфичность белка Cas на субстратах ДНК, содержащих сайт расщепления.
Белки Cas могут быть модифицированы для увеличения или уменьшения аффинности связывания нуклеиновых кислот, специфичности связывания нуклеиновых кислот и/или ферментативной активности. Белки Cas могут также быть модифицированы для изменения любого другого вида активности или свойства белка, например стабильности. Например, один или более нуклеазных доменов белка Cas могут быть изменены, удалены или инактивированы, или белок Cas может быть усечен, чтобы удалить домены, которые не являются необходимыми для функционирования белка, или для оптимизации (например, увеличения или уменьшения) активности белка Cas.
Некоторые белки Cas содержат по меньшей мере два нуклеазных домена, таких как домены ДНКазы. Например, белок Cas9 может содержать RuvC-подобный нуклеазный домен и HNH-подобный нуклеазный домен. Каждый из доменов RuvC и HNH может разрезать отличную цепь двухцепочечной ДНК, чтобы выполнить двухцепочечный разрыв в ДНК. См., например, публикацию Jinek et al. 2012) Science 337:816-821, которая полностью включена в настоящий документ путем ссылки.
Один или оба нуклеазных домена могут быть удалены или подвергнуты мутации таким образом, чтобы прекратить их функционирование или уменьшить нуклеазную активность. При удалении или мутации одного из нуклеазных доменов полученный белок Cas (например, Cas9) может называться «никаза» и может производить одноцепочечный разрыв на последовательности распознавания РНК CRISPR в пределах двухцепочечной ДНК, но не двухцепочечный разрыв (т.е. он может расщеплять комплементарную цепь или некомплементарную цепь, но не обе). При удалении или мутации обоих нуклеазных доменов полученный белок Cas (например, Cas9) будет иметь пониженную способность расщеплять обе цепи двухцепочечной ДНК. Примером мутации, превращающей Cas9 в никазу, является мутация D10A (замена аспартата на аланин в положении 10 в Cas9) в домене RuvC белка Cas9 из S. pyogenes. Подобным образом мутация Н939А (замена гистидина на аланин в положении аминокислоты 839) или Н840А (замена гистидина на аланин в положении аминокислоты 840) в домене HNH Cas9 из S. pyogenes может превращать Cas9 в никазу. Другие примеры мутаций, превращающих Cas9 в никазу, включают соответствующие мутации Cas9 из S. thermophilics. См., например, публикации Sapranauskas et al. (2011) Nucleic Acids Research 39:9275-9282 и WO 2013/141680, каждая из которых полностью включена в настоящий документ путем ссылки. Такие мутации могут быть созданы с использованием таких методов, как сайт-направленный мутагенез, ПЦР-опосредованный мутагенез или полный синтез гена. Примеры других мутаций, создающих никазы, можно найти, например, в публикациях WO/2013/176772 A1 и WO/2013/142578 A1, каждая из которых включена в настоящий документ путем ссылки.
Белки Cas также могут представлять собой слитные белки. Например, белок Cas может быть слит с доменом расщепления, доменом эпигенетических модификаций, доменом транскрипционной активации или доменом транскрипционного репрессора. См. публикацию № WO 2014/089290, которая полностью включена в настоящий документ путем ссылки. Белки Cas также могут быть слиты с гетерологичным полипептидом, обеспечивающим повышенную или сниженную стабильность. Слитый домен или гетерологичный полипептид может быть расположен на N-конце, на С-конце или находиться внутри белка Cas.
Белок Cas может быть слит с гетерологичным полипептидом, который обеспечивает субклеточную локализацию. Такие гетерологичные пептиды включают в себя, например, сигнал ядерной локализации (NLS), например NLS SV40, для нацеливания на ядро, сигнал митохондриальной локализации для нацеливания на митохондрии, сигнал удержания ER и т.п. См., например, Lange et al. (2007) J. Biol. Chem. 282:5101-5105. Такие сигналы субклеточной локализации могут быть расположены на N-конце, на С-конце или в других местах внутри белка Cas. NLS может содержать участок из основных аминокислот и может быть представлен одинарной последовательностью или двойной последовательностью.
Белки Cas также могут быть связаны с проникающим в клетку доменом. Например, проникающий в клетку домен может быть получен из белка TAT HIV-1, проникающего в клетку мотива TLM из вируса гепатита В человека, MPG, Рер-1, VP22, проникающего в клетку пептида из вируса простого герпеса или из последовательности пептида полиаргинина. См., например, публикацию WO 2014/089290, которая полностью включена в настоящий документ путем ссылки. Проникающий в клетку домен может быть расположен на N-конце, на С-конце или в других местах внутри белка Cas.
Белки Cas также могут содержать гетерологичный полипептид для простоты отслеживания или очистки, например флуоресцентный белок, метку очистки или эпитопную метку. Примеры флуоресцентных белков включают зеленые флуоресцентные белки (например, GFP, GFP-2, tagGFP, turboGFP, eGFP, Emerald, Azami Green, мономерный Azami Green, CopGFP, AceGFP, ZsGreenl), желтые флуоресцентные белки (например, YFP, eYFP, Citrine, Venus, YPet, PhiYFP, ZsYellowl), синие флуоресцентные белки (например, eBFP, eBFP2, Azurite, mKalamal, GFPuv, Sapphire, T-sapphire), голубые флуоресцентные белки (например, eCFP, Cerulean, CyPet, AmCyanl, Midoriishi-Cyan), красные флуоресцентные белки (mKate, mKate2, mPlum, мономерный DsRed, mCherry, mRFPl, DsRed-Express, DsRed2, DsRed-monomer, HcRed-Tandem, HcRedl, AsRed2, eqFP611, mRaspberry, mStrawberry, Jred), оранжевые флуоресцентные белки (mOrange, mKO, Kusabira-Orange, мономерный Kusabira-Orange, mTangerine, tdTomato) и любые другие подходящие флуоресцентные белки. Примеры меток включают глутатион-S-трансферазу (GST), хитин-связывающий белок (СВР), мальтоза-связывающий белок, тиоредоксин (TRX), поли(NANP), метку тандемной аффинной очистки (ТАР), myc, AcV5, AU1, AU5, Е, ECS, Е2, FLAG, гемагглютинин (НА), nus, Softag 1, Softag 3, Strep, SBP, Glu-Glu, HSV, KT3, S, S1, T7, V5, VSV-G, гистидин (His), биотин-карбоксил-переносящий белок (BCCP) и кальмодулин.
Белки Cas могут быть обеспечены в любом виде. Например, белок Cas может быть обеспечен в виде белка, такого как белок Cas, образующий комплекс с гРНК. В альтернативном варианте осуществления белок Cas может быть обеспечен в виде нуклеиновой кислоты, кодирующей белок Cas, например РНК (например, матричной РНК (мРНК)) или ДНК. Необязательно нуклеиновая кислота, кодирующая белок Cas, может быть кодон-оптимизированной для эффективной трансляции в белок в конкретной клетке или организме.
Нуклеиновые кислоты, кодирующие белки Cas, могут быть стабильно интегрированы в геном клетки и функционально связаны с активным в клетке промотором. В альтернативном варианте осуществления нуклеиновые кислоты, кодирующие белки Cas, могут быть функционально связаны с промотором в экспрессионной конструкции. Экспрессионные конструкции включают в себя любые нуклеотидные конструкции, которые способны управлять экспрессией гена или другой интересующей нуклеотидной последовательности (например, гена Cas) и которые могут переносить такую интересующую нуклеотидную последовательность в клетку-мишень. Промоторы, которые могут использоваться в экспрессионной конструкции, включают, например, промоторы, активные в плюрипотентной клетке крысы, эукариота, млекопитающего, не относящегося к человеку млекопитающего, человека, грызуна, мыши или хомяка. В других разделах настоящего документа описаны примеры других промоторов.
(ii) В. Гидовые РНК (гРНК)
«Гидовая РНК», или «гРНК», включает в себя молекулу РНК, которая связывается с белком Cas и нацеливает белок Cas в специфическое местоположение внутри целевой ДНК. Гидовые РНК могут содержать два сегмента: «сегмент ДНК-нацеливания» и «белок-связывающий сегмент». «Сегмент» представляет собой сегмент, часть или область молекулы, например непрерывный участок из нуклеотидов в РНК. Некоторые гРНК содержат две отдельные молекулы РНК: «РНК-активатор» и «РНК-нацеливатель». Другие гРНК представляют собой одинарные молекулы РНК (одинарный полинуклеотид РНК), которые также можно назвать «одномолекулярной гРНК», «одногидовой РНК» или «огРНК». См., например, публикации WO/2013/176772 A1, WO/2014/065596 A1, WO/2014/089290 A1, WO/2014/093622 A2, WO/2014/099750 A2, WO/2013142578 A1 и WO 2014/131833 А1, каждая из которых включена в настоящий документ путем ссылки. Термины «гидовая РНК» и «гРНК» включают как двухмолекулярные гРНК, так и одномолекулярные гРНК.
Примеры двухмолекулярных гРНК включают крРНК-подобную молекулу («РНК CRISPR», или «РНК-нацеливатель», или «крРНК», или «повтор крРНК») и соответствующую тракрРНК-подобную молекулу («транс-действующую РНК CRISPR», или «РНК-активатор», или «тракрРНК», или «каркас»). крРНК содержит оба сегмента (одноцепочечные) ДНК-нацеливания гРНК и участок нуклеотидов, который образует одну половину дуплекса дцРНК белок-связывающего сегмента гРНК.
Соответствующая тракрРНК (РНК-активатор) содержит участок нуклеотидов, который образует другую половину дуплекса дцРНК белок-связывающего сегмента гРНК. Участок нуклеотидов крРНК комплементарен участку нуклеотидов тракрРНК и гибридизируется с ним с образованием дуплекса дцРНК белок-связывающего домена гРНК. Таким образом, можно сказать, что каждая крРНК имеет соответствующую тракрРНК.
крРНК и соответствующая тракрРНК гибридизируются с образованием гРНК. крРНК дополнительно обеспечивает одноцепочечный сегмент ДНК-нацеливания, который гибридизируется с последовательностью распознавания РНК CRISPR. Для использования для модификации внутри клетки может быть разработана точная последовательность данной молекулы крРНК или тракрРНК, которая будет специфичной для тех видов, в которых будут использоваться молекулы РНК. См., например, публикации Mali et al. (2013) Science 339:823-826; Jinek et al. (2012) Science 337:816-821; Hwang et al. (2013) Nat. Biotechnol. 31:227-229; Jiang et al. (2013) Nat. Biotechnol. 31:233-239; и Cong et al. (2013) Science 339:819-823, каждая из которых включена в настоящий документ путем ссылки.
Сегмент ДНК-нацеливания (крРНК) данной гРНК содержит нуклеотидную последовательность, которая является комплементарной последовательности в целевой ДНК. Сегмент ДНК-нацеливания гРНК взаимодействует с целевой ДНК последовательность-специфическим образом посредством гибридизации (т.е. спаривания нуклеотидов). Таким образом, нуклеотидная последовательность сегмента ДНК-нацеливания может изменяться и определяет местоположение внутри целевой ДНК, с которым будет взаимодействовать гРНК и целевая ДНК. Сегмент ДНК-нацеливания обсуждаемой гРНК может быть модифицирован для гибридизации с любой заданной последовательностью внутри целевой ДНК. Встречающиеся в природе крРНК различаются в зависимости от системы Cas9 и организма, но часто содержат нацеливающий сегмент длиной от 21 до 72 нуклеотидов, фланкированный двумя прямыми повторами (DR) длиной от 21 до 46 нуклеотидов (см., например, WO 2014/131833). В случае S. pyogenes длина DR составляет 36 нуклеотидов, а длина нацеливающего сегмента составляет 30 нуклеотидов. DR, расположенный на 3'-конце, является комплементарным и гибридизируется с соответствующей тракрРНК, которая в свою очередь связывается с белком Cas9.
Сегмент ДНК-нацеливания может иметь длину от около 12 нуклеотидов до около 100 нуклеотидов. Например, сегмент ДНК-нацеливания может иметь длину от около 12 нуклеотидов (нт) до около 80 нт, от около 12 нт до около 50 нт, от около 12 нт до около 40 нт, от около 12 нт до около 30 нт, от около 12 нт до около 25 нт, от около 12 нт до около 20 нт или от около 12 нт до около 19 нт. В альтернативном варианте осуществления сегмент ДНК-нацеливания может иметь длину от около 19 нт до около 20 нт, от около 19 нт до около 25 нт, от около 19 нт до около 30 нт, от около 19 нт до около 35 нт, от около 19 нт до около 40 нт, от около 19 нт до около 45 нт, от около 19 нт до около 50 нт, от около 19 нт до около 60 нт, от около 19 нт до около 70 нт, от около 19 нт до около 80 нт, от около 19 нт до около 90 нт, от около 19 нт до около 100 нт, от около 20 нт до около 25 нт, от около 20 нт до около 30 нт, от около 20 нт до около 35 нт, от около 20 нт до около 40 нт, от около 20 нт до около 45 нт, от около 20 нт до около 50 нт, от около 20 нт до около 60 нт, от около 20 нт до около 70 нт, от около 20 нт до около 80 нт, от около 20 нт до около 90 нт или от около 20 нт до около 100 нт.
Нуклеотидная последовательность сегмента ДНК-нацеливания, являющаяся комплементарной нуклеотидной последовательности (последовательности распознавания РНК CRISPR) целевой ДНК, может иметь длину по меньшей мере около 12 нт. Например, последовательность ДНК-нацеливания (т.е. последовательность в пределах сегмента ДНК-нацеливания, являющаяся комплементарной последовательности распознавания РНК CRISPR в пределах целевой ДНК) может иметь длину по меньшей мере около 12 нт, по меньшей мере около 15 нт, по меньшей мере около 18 нт, по меньшей мере около 19 нт, по меньшей мере около 20 нт, по меньшей мере около 25 нт, по меньшей мере около 30 нт, по меньшей мере около 35 нт или по меньшей мере около 40 нт. В альтернативном варианте осуществления последовательность ДНК-нацеливания может иметь длину от около 12 нуклеотидов (нт) до около 80 нт, от около 12 нт до около 50 нт, от около 12 нт до около 45 нт, от около 12 нт до около 40 нт, от около 12 нт до около 35 нт, от около 12 нт до около 30 нт, от около 12 нт до около 25 нт, от около 12 нт до около 20 нт, от около 12 нт до около 19 нт, от около 19 нт до около 20 нт, от около 19 нт до около 25 нт, от около 19 нт до около 30 нт, от около 19 нт до около 35 нт, от около 19 нт до около 40 нт, от около 19 нт до около 45 нт, от около 19 нт до около 50 нт, от около 19 нт до около 60 нт, от около 20 нт до около 25 нт, от около 20 нт до около 30 нт, от около 20 нт до около 35 нт, от около 20 нт до около 40 нт, от около 20 нт до около 45 нт, от около 20 нт до около 50 нт или от около 20 нт до около 60 нт.В некоторых случаях последовательность ДНК-нацеливания может иметь длину около 20 нт.
тракрРНК могут быть любого вида (например, полноразмерные тракрРНК или активные частичные тракрРНК) и различной длины. Они могут включать в себя первичные транскрипты или подвергнутые процессингу формы. Например, тракрРНК (как часть одногидовой РНК или в виде отдельной молекулы в составе двухмолекулярной гРНК) может содержать всю или часть последовательности тракрРНК дикого типа или состоять из всей или части последовательности тракрРНК дикого типа (например, около или более чем около 20, 26, 32, 45, 48, 54, 63, 67, 85 или более нуклеотидов последовательности тракрРНК дикого типа). Примеры последовательностей тракрРНК дикого типа из S. pyogenes включают варианты из 171 нуклеотида, 89 нуклеотидов, 75 нуклеотидов и 65 нуклеотидов. См., например, публикации Deltcheva et al. (2011) Nature 471:602-607; WO 2014/093661, каждая из которых полностью включена в настоящее описание путем ссылки. Примеры тракрРНК в пределах одногидовых РНК (огРНК) включают сегменты тракрРНК, встречающиеся в пределах вариантов огРНК +48, +54, +67 и +85, где «+n» означает, что в огРНК включено до +n нуклеотидов тракрРНК дикого типа. См. публикацию US 8,697,359, полностью включенную в настоящий документ путем ссылки.
Процент комплементарности между последовательностью ДНК-нацеливания и последовательностью распознавания РНК CRISPR в пределах целевой ДНК может составлять по меньшей мере 60% (например, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%», по меньшей мере 85%), по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 97%, по меньшей мере 98%), по меньшей мере 99% или 100%). Процент комплементарности между последовательностью ДНК-нацеливания и последовательностью распознавания РНК CRISPR в пределах целевой ДНК может составлять по меньшей мере 60% на протяжении около 20 непрерывных нуклеотидов. В качестве примера, процент комплементарности между последовательностью ДНК-нацеливания и последовательностью распознавания РНК CRISPR в пределах целевой ДНК составляет 100%» на протяжении 14 непрерывных нуклеотидов на 5'-конце последовательности распознавания РНК CRISPR в пределах комплементарной цепи целевой ДНК и всего 0% в оставшейся части. В таком случае можно считать, что длина последовательности ДНК-нацеливания составляет 14 нуклеотидов. В качестве другого примера, процент комплементарности между последовательностью ДНК-нацеливания и последовательностью распознавания РНК CRISPR в пределах целевой ДНК составляет 100% на протяжении семи непрерывных нуклеотидов на 5'-конце последовательности распознавания РНК CRISPR в пределах комплементарной цепи целевой ДНК и всего 0% в оставшейся части. В таком случае можно считать, что длина последовательности ДНК-нацеливания составляет 7 нуклеотидов.
Белок-связывающий сегмент гРНК может содержать два участка нуклеотидов, которые комплементарны друг другу. Комплементарные нуклеотиды белок-связывающего сегмента гибридизируются с образованием дуплекса двухцепочечной РНК (дцРНК). Белок-связывающий сегмент обсуждаемой гРНК взаимодействует с белком Cas, и гРНК управляет связыванием белка Cas со специфической нуклеотидной последовательностью в пределах ДНК с помощью сегмента ДНК-нацеливания.
Гидовые РНК могут включать в себя модификации или последовательности, которые обеспечивают дополнительные желательные характеристики (например, модифицированную или регулируемую стабильность; субклеточное нацеливание, отслеживание с помощью флуоресцентной метки; сайт связывания для белка или белкового комплекса и т.п.). Примеры таких модификаций включают, например, 5'-кэп (например, 7-метилгуанилатный кэп (m7G)); 3'-полиаденилированный хвост (т.е. 3'-поли(А) хвост); последовательность-рибопереключатель (например, для обеспечения регулируемой стабильности и/или регулируемой доступности белками и/или белковыми комплексами); последовательность контроля стабильности; последовательность, образующая дуплекс дцРНК (т.е. шпилька)); модификацию или последовательность, которая нацеливает РНК в субклеточное местоположение (например, ядро, митохондрии, хлоропласты и т.п.); модификацию или последовательность, которая обеспечивает отслеживание (например, прямая конъюгация с флуоресцентной молекулой, конъюгация с фрагментом, который способствует флуоресцентной детекции, последовательность, которая позволяет флуоресцентную детекцию и т.д.); модификацию или последовательность, которая обеспечивает сайт связывания для белков (например, белков, которые действуют на ДНК, включая активаторы транскрипции, репрессоры транскрипции, ДНК-метилтрансферазы, ДНК-деметилазы, гистонацетилтрансферазы, гистондеацетилазы и т.п.); и их комбинации.
Гидовые РНК могут быть обеспечены в любом виде. Например, гРНК может быть обеспечена в виде РНК, либо как две молекулы (отдельно крРНК и тракрРНК), либо как одна молекула (огРНК) и, необязательно, в виде комплекса с белком Cas. гРНК может быть обеспечена также в виде ДНК, кодирующей РНК. ДНК, кодирующая гРНК, может кодировать одну молекулу РНК (огРНК) или отдельные молекулы РНК (например, отдельно крРНК и тракрРНК). В последнем случае ДНК, кодирующая гРНК, может быть обеспечена как отдельные молекулы ДНК, кодирующие соответственно крРНК и тракрРНК.
ДНК, кодирующие гРНК, могут быть стабильно интегрированы в геном клетки и функционально связаны с активным в клетке промотором. В альтернативном варианте осуществления ДНК, кодирующие гРНК, могут быть функционально связаны с промотором в экспрессионной конструкции. Такие промоторы могут быть активными, например, в плюрипотентной клетке крысы, эукариота, млекопитающего, не относящегося к человеку млекопитающего, человека, грызуна, мыши или хомяка. В некоторых случаях промотор представляет собой промотор РНК-полимеразы III, такой как промотор U6 человека, промотор U6 полимеразы III крысы или промотор U6 полимеразы III мыши. В других разделах настоящего документа описаны примеры других промоторов.
В альтернативном варианте осуществления гРНК можно получать с помощью различных других способов. Например, гРНК можно получать посредством транскрипции in vitro с использованием, например, Т7 РНК-полимеразы (см., например, WO 2014/089290 и WO 2014/065596). Гидовые РНК могут также быть синтетическими молекулами, полученными путем химического синтеза.
(iii) С.Последовательности распознавания РНК CRISPR
Термин «последовательность распознавания РНК CRISPR» включает нуклеотидные последовательности, присутствующие в целевой ДНК, с которой будет связываться сегмент ДНК-нацеливания гРНК, при условии существования достаточных условий для связывания. Например, последовательности распознавания РНК CRISPR включают последовательности, которым должна быть комплементарна сконструированная гидовая РНК, где гибридизация между последовательностью распознавания РНК CRISPR и последовательностью ДНК-нацеливания способствует образованию комплекса CRISPR. Полная комплементарность не является обязательным требованием при условии достаточной комплементарности, чтобы вызвать гибридизацию и способствовать образованию комплекса CRISPR. Последовательности распознавания РНК CRISPR также включают сайты расщепления для белков Cas, более подробно описанные ниже. Последовательность распознавания РНК CRISPR может содержать любой полинуклеотид, который может быть расположен, например, в ядре или цитоплазме клетки или внутри органеллы клетки, такой как митохондрия или хлоропласт.
На последовательность распознавания РНК CRISPR в пределах целевой ДНК может быть нацелен (т.е. может связывать, или гибридизировать, или быть комплементарным) белок Cas или гРНК. Подходящие условия связывания ДНК/РНК включают физиологические условия, обычно существующие в клетке. Другие подходящие условия связывания ДНК/РНК (например, условия в бесклеточной системе) известны в данной области (см., например, Molecular Cloning: A Laboratory Manual, 3rd Ed. (Sambrook et al., Harbor Laboratory Press 2001)). Цепь целевой ДНК, которая является комплементарной и гибридизируется с белком Cas или гРНК, можно назвать «комплементарной цепью», а цепь целевой ДНК, которая комплементарна «комплементарной цепи» (и, таким образом, не комплементарна белку Cas или гРНК), можно назвать «некомплементарной цепью» или «матричной цепью».
Белок Cas может расщеплять нуклеиновую кислоту на сайте внутри или за пределами нуклеотидной последовательности, присутствующей в целевой ДНК, с которой будет связываться сегмент ДНК-нацеливания гРНК. «Сайт расщепления» включает положение нуклеиновой кислоты, в котором белок Cas производит одноцепочечный разрыв или двухцепочечный разрыв. Например, образование комплекса CRISPR (содержащего гРНК, гибридизованную с последовательностью распознавания РНК CRISPR и образующую комплексы с белком Cas) может приводить к расщеплению одной или обеих цепей внутри или возле (например, на расстоянии в пределах 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 50 или более пар нуклеотидов от) нуклеотидной последовательности, присутствующей в целевой ДНК, с которой будет связываться сегмент ДНК-нацеливания гРНК. Если сайт расщепления находится за пределами нуклеотидной последовательности, с которой будет связываться сегмент ДНК-нацеливания гРНК, то сайт расщепления все еще считается находящимся в пределах «последовательности распознавания РНК CRISPR». Сайт расщепления может находиться только на одной цепи или на обеих цепях нуклеиновой кислоты. Сайты расщепления могут находиться в одном и том же положении на обеих цепях нуклеиновой кислоты (образуя тупые концы) или могут находиться на разных сайтах на каждой цепи (образуя ступенчатые концы). Ступенчатые концы можно получать, например, с использованием двух белков Cas, каждый из которых производит одноцепочечный разрыв на отличающемся сайте расщепления на каждой цепи, производя таким образом двухцепочечный разрыв. Например, первая никаза может создавать одноцепочечный разрыв на первой цепи двухцепочечной ДНК (дцДНК), а вторая никаза может создавать одноцепочечный разрыв на второй цепи дцДНК таким образом, что образуются нависающие последовательности. В некоторых случаях последовательность распознавания РНК CRISPR никазы на первой цепи разделена с последовательностью распознавания РНК CRISPR никазы на второй цепи по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 40, 50, 75, 100, 250, 500 или 1000 пар нуклеотидов.
Сайт-специфическое расщепление целевой ДНК белком Cas9 может происходить в местах, определенных как (i) комплементарностью спариваемых нуклеотидов между гРНК и целевой ДНК, так и (ii) наличием в целевой ДНК короткого мотива, называемого мотивом, прилежащим к протоспейсеру (РАМ). РАМ может фланкировать последовательность распознавания РНК CRISPR. Необязательно, последовательность распознавания РНК CRISPR может быть фланкирована РАМ. Например, сайт расщепления Cas9 может находиться на расстоянии от около 1 до около 10 или от около 2 до около 5 пар нуклеотидов (например, 3 пар нуклеотидов) выше или ниже последовательности РАМ. В некоторых случаях (например, когда используется Cas9 из S. pyogenes или близкородственный Cas9) последовательность РАМ некомплементарной цепи может представлять собой 5'-N1GG-3', где N1 является любым нуклеотидом ДНК и находится непосредственно на 3'-конце последовательности распознавания РНК CRISPR некомплементарной цепи целевой ДНК. По существу, последовательность РАМ комплементарной цепи будет представлять собой 5'-СС N2-3', где N2 является любым нуклеотидом ДНК и находится непосредственно на 5'-конце последовательности распознавания РНК CRISPR комплементарной цепи целевой ДНК. В некоторых таких случаях N1 и N2 могут быть комплементарными, и пара нуклеотидов N1-N2 может быть любой парой нуклеотидов (например, N1=С и N2=G; N1=G и N2=С; N1=А и N2=Т, N1=Т и N2=А).
Примеры последовательностей распознавания РНК CRISPR включают последовательность ДНК, комплементарную сегменту ДНК-нацеливания гРНК, или такую последовательность ДНК в дополнение к последовательности РАМ. Например, целевой мотив может представлять собой последовательность ДНК длиной 20 нуклеотидов, непосредственно предшествующую мотиву NGG, распознаваемому белком Cas (см., например, WO 2014/165825). Гуанин на 5'-конце может способствовать транскрипции РНК-полимеразы в клетках. Другие примеры последовательностей распознавания РНК CRISPR могут включать два гуаниннуклеотида на 5'-конце (например, GGN20NGG; SEQ ID NO: 9) для облегчения эффективной транскрипции Т7-полимеразой in vitro. См., например, WO 2014/065596.
Последовательность распознавания РНК CRISPR может представлять собой любую нуклеотидную последовательность, эндогенную или экзогенную по отношению к клетке. Последовательность распознавания РНК CRISPR может представлять собой последовательность, кодирующую генный продукт (например, белок), или некодирующую последовательность (например, регуляторную последовательность), или может включать в себя обе.
В одном варианте осуществления целевая последовательность непосредственно фланкирована последовательностью мотива, прилежащего к протоспейсеру (РАМ). В одном варианте осуществления интересующий локус содержит нуклеотидную последовательность SEQ ID NO: 1. В одном варианте осуществления гРНК содержит третью нуклеотидную последовательность, кодирующую РНК коротких палиндромных повторов, регулярно расположенных группами (CRISPR) (крРНК), и трансактивирующую РНК CRISPR (тракрРНК). В другом варианте осуществления геном плюрипотентной клетки крысы содержит область целевой ДНК, комплементарную целевой последовательности. В некоторых таких способах белок Cas представляет собой Cas9. В некоторых вариантах осуществления гРНК содержит: (а) химерную РНК нуклеотидной последовательности SEQ ID NO: 2; или (b) химерную РНК нуклеотидной последовательности SEQ ID NO: 3. В некоторых таких способах крРНК содержит последовательность, приведенную в SEQ ID NO: 4, SEQ ID NO: 5 или SEQ ID NO: 6. В некоторых таких способах тракрРНК содержит последовательность, приведенную в SEQ ID NO: 7 или SEQ ID NO: 8.
Также предложены активные варианты и фрагменты нуклеазных агентов (т.е. сконструированный нуклеазный агент). Идентичность последовательности таких активных вариантов нативному нуклеазному агенту может составлять по меньшей мере 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более, причем активные варианты сохраняют способность разрезать заданный сайт распознавания и, таким образом, сохраняют активность индуцирования одно- или двухцепочечного разрыва. Например, любой из нуклеазных агентов, описанных в настоящем документе, может быть модифицирован из нативной последовательности эндонуклеазы и сконструирован для распознавания и индуцирования одно- или двухцепочечного разрыва на сайте распознавания, который не распознавался нативным нуклеазным агентом. Таким образом, в некоторых вариантах осуществления сконструированная нуклеаза обладает специфической способностью индуцировать одно- или двухцепочечный разрыв на сайте распознавания, который отличается от сайта распознавания соответствующего нативного нуклеазного агента. Анализы определения активности, индуцирующей одно- или двухцепочечный разрыв, известны и, как правило, измеряют общую активность и специфичность эндонуклеазы на субстратах ДНК, содержащих сайт распознавания.
Нуклеазный агент может быть введен в клетку любыми способами, известными в данной области. Полипептид, кодирующий нуклеазный агент, может быть непосредственно введен в клетку. В альтернативном варианте осуществления в клетку может быть введен полинуклеотид, кодирующий нуклеазный агент. Если в клетку вводят полинуклеотид, кодирующий нуклеазный агент, то нуклеазный агент может экспрессироваться внутри клетки временно, условно или конститутивно. Таким образом, полинуклеотид, кодирующий нуклеазный агент, может содержаться в экспрессионной кассете и быть функционально связанным с условным промотором, индуцируемым промотором, конститутивным промотором или тканеспецифическим промотором. Такие интересующие промоторы обсуждаются более подробно в других разделах настоящего документа. В альтернативном варианте осуществления нуклеазный агент вводят в клетку в качестве мРНК, кодирующей нуклеазный агент.
В конкретных вариантах осуществления полинуклеотид, кодирующий нуклеазный агент, стабильно интегрирован в геном клетки и функционально связан с активным в клетке промотором. В других вариантах осуществления полинуклеотид, кодирующий нуклеазный агент, находится в том же нацеливающем векторе, который содержит полинуклеотидную вставку, хотя в других случаях полинуклеотид, кодирующий нуклеазный агент, находится в векторе или плазмиде, которая отделена от нацеливающего вектора, содержащего полинуклеотидную вставку.
Если нуклеазный агент вводят в клетку посредством введения полинуклеотида, кодирующего нуклеазный агент, то такой полинуклеотид, кодирующий нуклеазный агент, может быть модифицирован, чтобы заменить кодоны, имеющие более высокую частоту использования в интересующей клетке по сравнению со встречающейся в природе полинуклеотидной последовательностью, кодирующей нуклеазный агент. Например, полинуклеотид, кодирующий нуклеазный агент, может быть модифицирован, чтобы заменить кодоны, имеющие более высокую частоту использования в данной интересующей прокариотической или эукариотической клетке, включая бактериальную клетку, дрожжевую клетку, человеческую клетку, не относящуюся к человеку клетку, клетку млекопитающего, клетку грызуна, клетку мыши, клетку крысы или любую другую интересующую клетку-хозяина по сравнению со встречающейся в природе полинуклеотидной последовательностью.
В. Использование системы CRISPR/Cas в комбинации с большим нацеливающим вектором (LTVEC) или малым нацеливающим вектором (smallTVEC) для модификации затрудняющего геномного локуса или локуса Y-хромосомы
Не имеющие ограничительного характера способы модификации затрудняющего геномного локуса или локуса Y-хромосомы включают воздействие на хромосому (т.е. Y-хромосому) белком Cas и РНК CRISPR в присутствии большого нацеливающего вектора (LTVEC), содержащего нуклеотидную последовательность длиной по меньшей мере 10 т. п. н., причем после воздействия белком Cas, РНК CRISPR и LTVEC хромосома (т.е. Y-хромосома) модифицируется таким образом, что содержит нуклеотидную последовательность длиной по меньшей мере 10 т. п. н.
В способе можно использовать любой из LTVEC или smallTVEC, описанных в настоящем документе. В не имеющих ограничительного характера вариантах осуществления LTVEC или smallTVEC содержит нуклеотидную последовательность длиной по меньшей мере 20 т. п. н., по меньшей мере 30 т. п. н., по меньшей мере 40 т. п. н., по меньшей мере 50 т. п. н., по меньшей мере 60 т. п. н., по меньшей мере 70 т. п. н., по меньшей мере 80 т. п. н., по меньшей мере 90 т. п. н., по меньшей мере 100 т. п. н., по меньшей мере 150 т. п. н. или по меньшей мере 200 т. п. н. В других вариантах осуществления суммарная длина 5' и 3'-гомологичных плеч LTVEC составляет от около 10 т. п. н. до около 150 т. п. н., от около 10 т. п. н. до около 20 т. п. н., от около 20 т. п. н. до около 40 т. п. н., от около 40 т. п. н. до около 60 т. п. н., от около 60 т. п. н. до около 80 т. п. н., от около 80 т. п. н. до около 100 т. п. н., от около 100 т. п. н. до около 120 т. п. н. или от около 120 т. п. н. до около 150 т. п. н. В другом варианте осуществления суммарная длина 5' и 3'-гомологичных плеч smallTVEC составляет около 0,5 т. п. н., 1 т. п. н., 1,5 т. п. н., 2 т. п. н., 3 т. п. н., 4 т. п. н., 5 т. п. н., 6 т. п. н., 7 т. п. н., 8 т. п. н., 9 т. п. н., от около 0,5 т. п. н. до около 1 т. п. н., от около 1 т. п. н. до около 1,5 т. п. н., от около 1,5 т. п. н. до около 2 т. п. н., от около 2 т. п. н. до около 3 т. п. н., от около 3 т. п. н. до около 4 т. п. н., от около 4 т. п. н. до около 5 т. п. н., от около 5 т. п. н. до около 6 т. п. н., от около 6 т. п. н. до около 7 т. п. н., от около 8 т. п. н. до около 9 т. п. н. или по меньшей мере 10 т. п. н.
Дополнительно предложен способ модификации затрудняющего целевого локуса или целевого геномного локуса на Y-хромосоме, включающий: (а) обеспечение клетки млекопитающего, содержащей затрудняющий целевой локус или целевой геномный локус на Y-хромосоме, причем целевой геномный локус содержит целевую последовательность гидовой РНК (гРНК); (b) введение в клетку млекопитающего: (i) большого нацеливающего вектора (LTVEC), содержащего первую нуклеиновую кислоту, фланкированную нацеливающими плечами, гомологичными целевому геномному локусу, причем длина LTVEC составляет по меньшей мере 10 т. п. н.; (ii) первой экспрессионной конструкции, содержащей первый промотор, функционально связанный со второй нуклеиновой кислотой, кодирующей белок Cas; и (iii) второй экспрессионной конструкции, содержащей второй промотор, функционально связанный с третьей нуклеиновой кислотой, кодирующей гидовую РНК (гРНК), содержащую нуклеотидную последовательность, которая гибридизируется с целевой последовательностью гРНК, и трансактивирующую РНК CRISPR (тракрРНК), при этом первый и второй промоторы являются активными в клетке млекопитающего; и (с) идентификацию модифицированной клетки млекопитающего, содержащей нацеленную генетическую модификацию в затрудняющем целевом геномном локусе или в целевом геномном локусе на Y-хромосоме. В конкретных вариантах осуществления первая и вторая экспрессионные конструкции расположены на одной молекуле нуклеиновой кислоты. В других вариантах осуществления целевой геномный локус Y-хромосомы представляет собой локус Sry.
Как указано выше, в одном варианте осуществления белок Cas может представлять собой белок Cas9. В другом варианте осуществления целевая последовательность гРНК непосредственно фланкирована последовательностью мотива, прилежащего к протоспейсеру (РАМ).
В способе можно использовать любой из LTVEC или smallTVEC, описанных в настоящем документе. В не имеющих ограничительного характера вариантах осуществления длина LTVEC или smallTVEC составляет по меньшей мере 0,5 т. п. н., по меньшей мере 1 т. п. н., по меньшей мере 5 т. п. н., по меньшей мере 10 т. п. н., по меньшей мере 15 т. п. н., по меньшей мере 20 т. п. н., по меньшей мере 30 т. п. н., по меньшей мере 40 т. п. н., по меньшей мере 50 т. п. н., по меньшей мере 60 т. п. н., по меньшей мере 70 т. п. н., по меньшей мере 80 т. п. н., по меньшей мере 90 т. п. н., по меньшей мере 100 т. п. н., по меньшей мере 150 т. п. н. или по меньшей мере 200 т. п. н. В других вариантах осуществления суммарная длина 5' и 3'-гомологичных плеч LTVEC составляет от около 10 т. п. н. до около 150 т. п. н., от около 10 т. п. н. до около 20 т. п. н., от около 20 т. п. н. до около 40 т. п. н., от около 40 т. п. н. до около 60 т. п. н., от около 60 т. п. н. до около 80 т. п. н., от около 80 т. п. н. до около 100 т. п. н., от около 100 т. п. н. до около 120 т. п. н. или от около 120 т. п. н. до около 150 т. п. н.
Различные способы, в которых используют систему CRISPR/Cas (или любой способ, описанный в настоящем документе) можно, например, выполнять на клетках млекопитающего, клетках не относящегося к человеку млекопитающего, клетках-фибробластах, клетках грызунов, клетках крысы, клетках мыши или клетках хомяка. Клетка может представлять собой плюрипотентную клетку, индуцированную плюрипотентную стволовую (ИПС) клетку, эмбриональную стволовую (ЭС) клетку мыши, эмбриональную стволовую (ЭС) клетку крысы, эмбриональную стволовую (ЭС) клетку человека или онтогенетически ограниченную человеческую клетку-предшественник.
Как подробно описано ниже, после модификации затрудняющего геномного локуса или интересующего геномного локуса на Y-хромосоме (т.е. локуса Sry) не относящейся к человеку плюрипотентной клетки, включающей, например, использование описанной выше системы CRISPR/CAS, полученную генетически модифицированную не относящуюся к человеку плюрипотентную клетку можно ввести в не относящийся к человеку эмбрион-хозяина; и не относящийся к человеку эмбрион-хозяин, содержащий модифицированную плюрипотентную клетку, вынашивается в суррогатной матери. Суррогатная мать производит потомство F0, содержащее нацеленную генетическую модификацию. В конкретных вариантах осуществления нацеленная генетическая модификация способна передаваться через зародышевую линию.
C. Селективные маркеры
В способах и композициях, описанных в настоящем документе, можно использовать различные селективные маркеры, которые обеспечивают модификацию целевого геномного локуса на Y-хромосоме или затрудняющего целевого геномного локуса. Такие маркеры описаны в других разделах настоящего документа и включают в себя, без ограничений, селективные маркеры, которые придают устойчивость к антибиотикам, таким как G418, гигромицин, бластицидин, неомицин или пуромицин. Полинуклеотиды, кодирующие селективные маркеры, функционально связаны с активным в клетке промотором. Такие экспрессионные кассеты и их различные регуляторные компоненты обсуждаются более подробно в других разделах настоящего документа.
D. Целевой геномный локус
Предложены различные способы и композиции, которые обеспечивают интеграцию по меньшей мере одной полинуклеотидной вставки в целевой локус на Y-хромосоме или в затрудняющий целевой геномный локус. Используемый в настоящем документе термин «целевой геномный локус на Y-хромосоме» означает любой сегмент или область ДНК на Y-хромосоме, в которую желательно интегрировать полинуклеотидную вставку.
Геномный локус на Y-хромосоме или затрудняющий целевой геномный локус, на который осуществляют нацеливание, может быть нативным для клетки или, в альтернативном варианте осуществления, может содержать гетерологичный или экзогенный сегмент ДНК, который был интегрирован в хромосому клетки. Такие гетерологичные или экзогенные сегменты ДНК могут включать в себя трансгены, экспрессионные кассеты, полинуклеотиды, кодирующие селективные маркеры или гетерологичные или экзогенные области геномной ДНК. Целевой геномный локус на Y-хромосоме или затрудняющий целевой геномный локус может содержать любую систему нацеленной геномной интеграции, включая, например, сайт распознавания, селективный маркер, ранее интегрированные полинуклеотидные вставки, полинуклеотиды, кодирующие нуклеазные агенты, промоторы и т.п. В альтернативном варианте осуществления целевой геномный локус на Y-хромосоме или затрудняющий целевой геномный локус может быть расположен внутри дрожжевой искусственной хромосомы (YAC), бактериальной искусственной хромосомы (ВАС), человеческой искусственной хромосомы или любой другой сконструированной геномной области, содержащейся в соответствующей клетке-хозяине. Таким образом, в конкретных вариантах осуществления целевой геномный локус на Y-хромосоме или затрудняющий целевой геномный локус может содержать нативную, гетерологичную или экзогенную геномную нуклеотидную последовательность из не относящегося к человеку млекопитающего, не относящейся к человеку клетки, от грызуна, человека, крысы, мыши, хомяка, кролика, свиньи, коровы, оленя, овцы, козы, курицы, кошки, собаки, хорька, примата (например, мартышки, макаки-резус), домашнего млекопитающего животного или сельскохозяйственного млекопитающего животного или любого другого интересующего организма или их комбинации.
Не имеющие ограничительного характера примеры целевого геномного локуса на Y-хромосоме включают ген Sry, ген Uty, ген Eif2s3y, ген Ddx3y, ген, ген Ube1y, ген Tspy, ген Usp9y, ген Zfy1 и ген Zfy2 и область на Y-хромосоме, охватывающая гены Kdm5d, Eif2s3y, Tspy, Uty, Ddx3y и Usp9y. Такой локус на Y-хромосоме может быть получен от не относящегося к человеку млекопитающего, млекопитающего, грызуна, человека, крысы, мыши, хомяка, кролика, свиньи, коровы, оленя, овцы, козы, курицы, кошки, собаки, хорька, примата (например, мартышки, макаки-резус), домашнего млекопитающего животного, или сельскохозяйственного млекопитающего животного, или любого другого интересующего организма, или их комбинации. Такие клетки включают в себя плюрипотентные клетки, включая, например, индуцированные плюрипотентные стволовые (ИПС) клетки, эмбриональные стволовые (ЭС) клетки мыши, эмбриональные стволовые (ЭС) клетки крысы, эмбриональную стволовую (ЭС) клетку человека или онтогенетически ограниченную человеческую клетку-предшественник.
Как описано в других разделах настоящего документа, предложены различные способы и композиции, которые содержат плюрипотентные и/или тотипотентные клетки XY (такие как ЭС-клетки или ИПС-клетки XY), имеющие сниженную активность или уровень белка Sry. Различные способы, описанные в настоящем документе для модификации геномного локуса на Y-хромосоме, также можно использовать для введения нацеленных генетических модификаций в интересующие полинуклеотиды, которые расположены не на Y-хромосоме.
Е. Нацеливающие векторы и полинуклеотидные вставки
Как отмечено выше, в способах и композициях, предложенных в настоящем документе, используют нацеливающие векторы сами по себе или в комбинации с нуклеазным агентом. Термин «гомологичная рекомбинация» обычно относится к обмену ДНК-фрагментов между двумя ДНК-молекулами на сайтах кроссинговера в пределах областей гомологии.
i. Полинуклеотидная вставка
Используемый в настоящем документе термин «полинуклеотидная вставка» означает сегмент ДНК, который желательно интегрировать в целевой геномный локус. В конкретных вариантах осуществления целевой геномный локус расположен на Y-хромосоме. В других вариантах осуществления целевой геномный локус представляет собой затрудняющий геномный локус. В одном варианте осуществления полинуклеотидная вставка содержит один или более интересующих полинуклеотидов. В других вариантах осуществления полинуклеотидная вставка может содержать одну или более экспрессионных кассет. Данная экспрессионная кассета может содержать интересующий полинуклеотид, полинуклеотид, кодирующий селективный маркер и/или репортерный ген, наряду с различными регуляторными компонентами, влияющими на экспрессию. Не имеющие ограничительного характера примеры интересующих полинуклеотидов, селективных маркеров и репортерных генов, которые могут быть включены в полинуклеотидную вставку, обсуждаются более подробно в других разделах настоящего документа.
В конкретных вариантах осуществления полинуклеотидная вставка может содержать геномную нуклеиновую кислоту. В одном варианте осуществления геномную нуклеиновую кислоту получают от животного, мыши, человека, не от человека, от грызуна, не от человека, от крысы, хомяка, кролика, свиньи, коровы, оленя, овцы, козы, курицы, кошки, собаки, хорька, примата (например, мартышки, макаки-резус), домашнего млекопитающего животного или сельскохозяйственного млекопитающего животного, птицы, или любого другого интересующего организма, или их комбинации.
В дополнительных вариантах осуществления полинуклеотидная вставка содержит условный аллель. В одном варианте осуществления условный аллель является многофункциональным аллелем, как описано в публикации US 2011/0104799, которая включена в настоящий документ в полном объеме путем ссылки. В конкретных вариантах осуществления условный аллель содержит: (а) запускающую последовательность в смысловой ориентации по отношению к транскрипции целевого гена и кассету селекции лекарственными средствами в смысловой или антисмысловой ориентации; (b) в антисмысловой ориентации интересующую нуклеотидную последовательность (NSI) и условный по инверсии модуль (COIN с использованием интрона, расщепляющего экзон, и обратимого модуля, подобного ловушке для генов; см., например, публикацию US 2011/0104799, которая включена в настоящий документ в полном объеме путем ссылки); и (с) поддающиеся рекомбинации блоки, которые рекомбинируются при воздействии первой рекомбиназы с образованием условного аллеля, в котором (i) отсутствует запускающая последовательность и DSC и (ii) содержится NSI в смысловой ориентации и COIN в антисмысловой ориентации.
Полинуклеотидная вставка может иметь длину от около 5 т. п. н. до около 200 т. п. н., от около 5 т. п. н. до около 10 т. п. н., от около 10 т. п. н. до около 20 т. п. н., от около 20 т. п. н. до около 30 т. п. н., от около 30 т. п. н. до около 40 т. п. н., от около 40 т. п. н. до около 50 т. п. н., от около 60 т. п. н. до около 70 т. п. н., от около 80 т. п. н. до около 90 т. п. н., от около 90 т. п. н. до около 100 т. п. н., от около 100 т. п. н. до около 110 т. п. н., от около 120 т. п. н. до около 130 т. п. н., от около 130 т. п. н. до около 140 т. п. н., от около 140 т. п. н. до около 150 т. п. н., от около 150 т. п. н. до около 160 т. п. н., от около 160 т. п. н. до около 170 т. п. н., от около 170 т. п. н. до около 180 т. п. н., от около 180 т. п. н. до около 190 т. п. н., от около 190 т. п. н. до около 200 т. п. н., от около 200 т. п. н. до около 250 т. п. н., от около 250 т. п. н. до около 300 т. п. н., от около 300 т. п. н. до около 350 т. п. н. или от около 350 т. п. н. до около 400 т. п. н.
В конкретных вариантах осуществления полинуклеотидная вставка содержит нуклеиновую кислоту, фланкированную целевыми последовательностями сайт-специфической рекомбинации. Общепризнано, что в то время как вся полинуклеотидная вставка может быть фланкирована такой целевой последовательностью сайт-специфической рекомбинации, любая область или отдельный интересующий полинуклеотид внутри полинуклеотидной вставки также может быть фланкирован такими сайтами. Используемый в настоящем документе термин «сайт рекомбинации» включает нуклеотидную последовательность, которая распознается сайт-специфической рекомбиназой и может служить в качестве субстрата для события рекомбинации. Используемый в настоящем документе термин «сайт-специфическая рекомбиназа» включает группу ферментов, которые могут способствовать рекомбинации между сайтами рекомбинации, когда два сайта рекомбинации физически разделены в пределах одной молекулы нуклеиновой кислоты или находятся на отдельных молекулах нуклеиновой кислоты. Примеры сайт-специфических рекомбиназ включают, без ограничений, рекомбиназы Cre, Flp и Dre. Сайт-специфическая рекомбиназа может быть введена в клетку с помощью любых средств, в том числе путем введения в клетку полипептида рекомбиназы или путем введения в клетку-хозяина полинуклеотида, кодирующего сайт-специфическую рекомбиназу. Полинуклеотид, кодирующий сайт-специфическую рекомбиназу, может быть расположен внутри полинуклеотидной вставки или внутри отдельного полинуклеотида. Сайт-специфическая рекомбиназа может быть функционально связана с активным в клетке промотором, включая, например, индуцируемый промотор, промотор, являющийся эндогенным по отношению к клетке, промотор, являющийся гетерологичным по отношению к клетке, клеточноспецифический промотор, тканеспецифический промотор или промотор, специфический для стадии развития. Целевые последовательности сайт-специфической рекомбинации, которые могут фланкировать полинуклеотидную вставку или любой интересующий полинуклеотид в полинуклеотидной вставке, могут включать в себя, без ограничений, последовательности loxP, lox511, lox2272, lox66, lox71, loxM2, lox5171, FRT, FRT11, FRT71, attp, art, FRT, rox и их комбинацию.
В других вариантах осуществления сайты сайт-специфической рекомбинации фланкируют полинуклеотид, кодирующий селективный маркер и/или репортерный ген, содержащийся внутри полинуклеотидной вставки. В таких случаях после интеграции полинуклеотидной вставки в целевой геномный локус последовательности между сайтами сайт-специфической рекомбинации можно удалить.
В одном варианте осуществления полинуклеотидная вставка содержит полинуклеотид, кодирующий селективный маркер. Такие селективные маркеры включают, без ограничений, неомицинфосфотрансферазу (neor), гигромицин-В-фосфотрансферазу (hygr), пуромицин-N-ацетилтрансферазу (puror), бластицидин-S-дезаминазу (bsrr), ксантин/гуанинфосфорибозилтрансферазу (gpt) или тимидинкиназу вируса простого герпеса (HSV-k) или их комбинацию. В одном варианте осуществления полинуклеотид, кодирующий селективный маркер, функционально связан с активным в клетке промотором. Как указывалось выше, при последовательном мозаичном расположении интересующих полинуклеотидов в целевом геномном локусе селективный маркер может содержать сайт распознавания для нуклеазного агента. В одном варианте осуществления полинуклеотид, кодирующий селективный маркер, фланкирован целевыми последовательностями сайт-специфической рекомбинации.
Полинуклеотидная вставка может дополнительно содержать репортерный ген, функционально связанный с промотором, причем репортерный ген кодирует репортерный белок, который выбирают из группы, состоящей из белков LacZ, mPlum, mCherry, tdTomato, mStrawberry, J-Red, DsRed, mOrange, mKO, mCitrine, Venus, YPet, усиленного желтого флуоресцентного белка (EYFP), Emerald, усиленного зеленого флуоресцентного белка (EGFP), CyPet, голубого флуоресцентного белка (CFP), Cerulean, T-Sapphire, люциферазы, щелочной фосфатазы и их комбинации. Такие репортерные гены могут быть функционально связаны с активным в клетке промотором. Такие промоторы могут представлять собой индуцируемый промотор, промотор, являющийся эндогенным по отношению к репортерному гену или клетке, промотор, являющийся гетерологичным по отношению к репортерному гену или клетке, клеточноспецифический промотор, тканеспецифический промотор или промотор, специфический для стадии развития.
ii. Нацеливающие векторы
Нацеливающие векторы используют для введения полинуклеотидной вставки в целевой геномный локус на Y-хромосоме, или в затрудняющий целевой локус, или на другой интересующей хромосоме. Нацеливающий вектор содержит полинуклеотидную вставку и дополнительно содержит вышележащее и нижележащее гомологичные плечи, которые фланкируют полинуклеотидную вставку. Гомологичные плечи, которые фланкируют полинуклеотидную вставку, соответствуют геномным областям в пределах целевого геномного локуса. Для удобства ссылки соответствующие геномные области в пределах целевого геномного локуса упоминаются в настоящем документе как «целевые сайты». Таким образом, в одном примере нацеливающий вектор может содержать первую полинуклеотидную вставку, фланкированную первым и вторым гомологичными плечами, которые соответствуют первому и второму целевым сайтам, расположенным достаточно близко к первому сайту распознавания внутри полинуклеотида, кодирующего селективный маркер. Как таковой, нацеливающий вектор тем самым помогает интеграции в целевой геномный локус полинуклеотидной вставки посредством события гомологичной рекомбинации, которое происходит между гомологичными плечами и соответствующими целевыми сайтами в пределах генома клетки.
Гомологичное плечо нацеливающего вектора может иметь любую длину, достаточную для стимуляции события гомологичной рекомбинации с соответствующим целевым сайтом, включая, например, длину от около 400 п. н. до около 500 п. н., от около 500 п. н. до около 600 п. н., от около 600 п. н. до около 700 п. н., от около 700 п. н. до около 800 п. н., от около 800 п. н. до около 900 п. н. или от около 900 п. н. до около 1000 п. н.; или по меньшей мере 5-10, 5-15, 5-20, 5-25, 5-30, 5-35, 5-40, 5-45, 5-50, 5-55, 5-60, 5-65, 5-70, 5-75, 5-80, 5-85, 5-90, 5-95, 5-100, 100-200 или 200-300 тысяч пар нуклеотидов или более. В конкретных вариантах осуществления суммарная длина нацеливающих плеч составляет по меньшей мере 0,5 т. п. н., 1 т. п. н., 1,5 т. п. н., 2 т. п. н., 3 т. п. н., 4 т. п. н., 5 т. п. н., 6 т. п. н., 7 т. п. н., 8 т. п. н., 9 т. п. н. или по меньшей мере 10 т. п. н. В других вариантах осуществления суммарная длина гомологичных плеч составляет от около 0,5 т. п. н. до около 1 т. п. н., от около 1 т. п. н. до около 1,5 т. п. н., от около 1,5 т. п. н. до около 2 т. п. н., от около 2 т. п. н. до около 3 т. п. н., от около 3 т. п. н. до около 4 т. п. н., от около 4 т. п. н. до около 5 т. п. н., от около 5 т. п. н. до около 6 т. п. н., от около 6 т. п. н. до около 7 т. п. н., от около 7 т. п. н. до около 8 т. п. н., от около 8 т. п. н. до около 9 т. п. н. или от около 10 т. п. н. до около 150 т. п. н. Как описано более подробно ниже, в больших нацеливающих векторах могут использоваться нацеливающие плечи большей длины.
Целевые сайты в пределах целевого геномного локуса, которые соответствуют вышележащему и нижележащему гомологичным плечам нацеливающего вектора, расположены «достаточно близко к сайту распознавания», расположенному в полинуклеотиде, кодирующем селективный маркер. В контексте настоящего описания вышележащее и нижележащее гомологичные плечи нацеливающего вектора «расположены в достаточной близости» к сайту распознавания, когда расстояние является таким, чтобы способствовать возникновению события гомологичной рекомбинации между целевыми сайтами и гомологичными плечами при одно- или двухцепочечном разрыве на сайте распознавания. Таким образом, в конкретных вариантах осуществления целевые сайты, соответствующие вышележащему и/или нижележащему гомологичному плечу нацеливающего вектора, находятся в пределах по меньшей мере от 10 нуклеотидов до около 14 т. п. н. данного сайта распознавания. В конкретных вариантах осуществления сайт распознавания непосредственно смежен с по меньшей мере одним или обоими целевыми сайтами.
Пространственное отношение целевых сайтов, соответствующих гомологичным плечам нацеливающего вектора и сайту распознавания в пределах полинуклеотида, кодирующего селективный маркер, может изменяться. Например, оба целевых сайта могут быть расположены в направлении 5'-конца от сайта распознавания, оба целевых сайта могут быть расположены в направлении 3'-конца от сайта распознавания, или целевые сайты могут фланкировать сайт распознавания.
В конкретных вариантах осуществления целевой геномный локус содержит: (i) 5'-целевую последовательность, которая гомологична 5'-гомологичному плечу; и (ii) 3'-целевую последовательность, которая гомологична 3'-гомологичному плечу. В конкретных вариантах осуществления 5'-целевая последовательность и 3'-целевая последовательность разделены по меньшей мере 5 т. п. н., но менее чем 3 млн п. н., по меньшей мере 5 т. п. н., но менее чем 10 т. п. н., по меньшей мере 10 т. п. н., но менее чем 20 т. п. н., по меньшей мере 20 т. п. н., но менее чем 40 т. п. н., по меньшей мере 40 т. п. н., но менее чем 60 т. п. н., по меньшей мере 60 т. п. н., но менее чем 80 т. п. н., по меньшей мере около 80 т. п. н., но менее чем 100 т. п. н., по меньшей мере 100 т. п. н., но менее чем 150 т. п. н., или по меньшей мере 150 т. п. н., но менее чем 200 т. п. н., по меньшей мере около 200 т. п. н., но менее чем около 300 т. п. н., по меньшей мере около 300 т. п. н., но менее чем около 400 т. п. н., по меньшей мере около 400 т. п. н., но менее чем около 500 т. п. н., по меньшей мере около 500 т. п. н., но менее чем около 1 млн п. н., по меньшей мере около 1 млн п. н., но менее чем около 1,5 млн п. н., по меньшей мере около 1,5 млн п. н., но менее чем около 2 млн п. н., по меньшей мере около 2 млн п. н., но менее чем около 2,5 млн п. н., или по меньшей мере около 2,5 млн п. н., но менее чем около 3 млн п. н.
В контексте настоящего описания гомологичное плечо и целевой сайт «соответствуют» или являются «соответствующими» друг другу, если две области имеют достаточную степень идентичности последовательности друг другу для того, чтобы действовать как субстраты для реакции гомологичной рекомбинации. Под «гомологичными» понимают последовательности ДНК, которые или являются идентичными, или имеют идентичность последовательности с соответствующей последовательностью. Идентичность последовательности между данным целевым сайтом и соответствующим гомологичным плечом, находящимся на нацеливающем векторе, может иметь любую степень идентичности последовательности, которая обеспечивает возникновение гомологичной рекомбинации. Например, степень идентичности последовательности между гомологичным плечом нацеливающего вектора (или его фрагмента) и целевым сайтом (или его фрагментом) может составлять по меньшей мере 50%, 55%, 60%, 65%, 70%, 75%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичности последовательности так, что последовательности подвергаются гомологичной рекомбинации. Кроме того, соответствующая область гомологии между гомологичным плечом и соответствующим целевым сайтом может иметь любую длину, которая является достаточной для стимуляции гомологичной рекомбинации на расщепленном сайте распознавания. Например, данное гомологичное плечо и/или соответствующий целевой сайт может содержать соответствующие области гомологии, длина которых составляет от около 400 п. н. до около 500 п. н., от около 500 п. н. до около 600 п. н., от около 600 п. н. до около 700 п. н., от около 700 п. н. до около 800 п. н., от около 800 п. н. до около 900 п. н. или от около 900 п. н. до около 1000 п. н. (например, как описано в других разделах настоящего документа для векторов smallTVEC); или по меньшей мере около 5-10, 5-15, 5-20, 5-25, 5-30, 5-35, 5-40, 5-45, 5-50, 5-55, 5-60, 5-65, 5-70, 5-75, 5-80, 5-85, 5-90, 5-95, 5-100, 100-200 или 200-300 тысяч пар нуклеотидов или более (так, как описано в других разделах настоящего документа для векторов LTVEC) так, что гомологичное плечо имеет достаточную гомологию, чтобы подвергаться гомологичной рекомбинации с соответствующими целевыми сайтами в пределах генома клетки.
Для удобства ссылки термины «гомологичные плечи» в настоящем документе относятся к вышележащему и нижележащему гомологичным плечам. Эта терминология относится к относительному положению гомологичных плеч к полинуклеотидной вставке внутри нацеливающего вектора.
Таким образом, гомологичные плечи нацеливающего вектора сконструированы так, чтобы соответствовать целевому сайту с целевым геномным локусом на Y-хромосоме или в пределах затрудняющего целевого локуса. Таким образом, гомологичные плечи могут соответствовать геномному локусу, который является нативным по отношению к клетке, или, в альтернативном варианте осуществления, они могут соответствовать области гетерологичного или экзогенного сегмента ДНК, который был интегрирован в Y-хромосому, включая, без ограничений, трансгены, экспрессионные кассеты или гетерологичные или экзогенные области геномной ДНК. В альтернативном варианте осуществления гомологичные плечи нацеливающего вектора могут соответствовать области дрожжевой искусственной хромосомы (YAC), бактериальной искусственной хромосомы (ВАС), человеческой искусственной хромосомы или любой другой сконструированной геномной области, содержащейся в соответствующей клетке-хозяине. Еще дополнительно гомологичные плечи нацеливающего вектора могут соответствовать или могут быть получены из области из библиотеки ВАС, библиотеки космид или библиотеки фага Р1. Таким образом, в конкретных вариантах осуществления гомологичные плечи нацеливающего вектора соответствуют геномному локусу на Y-хромосоме или затрудняющему целевому локусу, который является нативным, гетерологичным или экзогенным в отношении не относящегося к человеку млекопитающего, грызуна, человека, крысы, мыши, хомяка, кролика, свиньи, коровы, оленя, овцы, козы, курицы, кошки, собаки, хорька, примата (например, мартышки, макаки-резус), домашнего млекопитающего животного или сельскохозяйственного млекопитающего животного, птицы или любого другого интересующего организма. В дополнительных вариантах осуществления при отсутствии одно- или двухцепочечного разрыва, индуцированного нуклеазным агентом, гомологичные плечи соответствуют геномному локусу клетки, на который нельзя выполнить нацеливание с использованием стандартных способов, или нацеливание может быть только неверным или иметь очень низкую эффективность. В одном варианте осуществления гомологичные плечи получены из синтетической ДНК.
В других вариантах осуществления вышележащее и нижележащее гомологичные плечи соответствуют тому же геному, что и целевой геном. В одном варианте осуществления гомологичные плечи получены из родственного генома, например, целевой геном представляет собой геном мыши первой линии, а нацеливающие плечи получены из генома мыши второй линии, причем первая линия и вторая линия являются разными. В других вариантах осуществления гомологичные плечи получены из генома одного животного или получены из генома одной линии, например, целевой геном представляет собой геном мыши первой линии, и нацеливающие плечи получены из генома той же мыши или мыши той же линии.
Нацеливающий вектор (например, большой нацеливающий вектор) может также содержать кассету селекции или репортерный ген, как обсуждается в других разделах настоящего документа. Кассета селекции может содержать нуклеотидную последовательность, кодирующую селективный маркер, причем нуклеотидная последовательность функционально связана с промотором. Такие промоторы могут представлять собой индуцируемый промотор, промотор, являющийся эндогенным по отношению к репортерному гену или клетке, промотор, являющийся гетерологичным по отношению к репортерному гену или клетке, клеточноспецифический промотор, тканеспецифический промотор или промотор, специфический для стадии развития. В одном варианте осуществления селективный маркер выбирают из неомицинфосфотрансферазы (neor), гигромицин-В-фосфотрансферазы (hygr), пуромицин-N-ацетилтрансферазы (puror), бластицидин-S-дезаминазы (bsrr), ксантин/гуанинфосфорибозилтрансферазы (gpt) и тимидинкиназы вируса простого герпеса (HSV-k) и их комбинации. Селективный маркер нацеливающего вектора может быть фланкирован вышележащим и нижележащим гомологичными плечами или находиться в направлении 5' или 3' от гомологичных плеч.
В одном варианте осуществления нацеливающий вектор (например, большой нацеливающий вектор) содержит репортерный ген, функционально связанный с промотором, причем репортерный ген кодирует репортерный белок, который выбирают из группы, состоящей из белков LacZ, mPlum, mCherry, tdTomato, mStrawberry, J-Red, DsRed, mOrange, mKO, mCitrine, Venus, YPet, усиленного желтого флуоресцентного белка (EYFP), Emerald, усиленного зеленого флуоресцентного белка (EGFP), CyPet, голубого флуоресцентного белка (CFP), Cerulean, T-Sapphire, люциферазы, щелочной фосфатазы и их комбинации. Такие репортерные гены могут быть функционально связаны с активным в клетке промотором. Такие промоторы могут представлять собой индуцируемый промотор, промотор, являющийся эндогенным по отношению к репортерному гену или клетке, промотор, являющийся гетерологичным по отношению к репортерному гену или клетке, клеточноспецифический промотор, тканеспецифический промотор или промотор, специфический для стадии развития.
В одном не имеющем ограничительного характера варианте осуществления совместное использование нацеливающего вектора (включая, например, большой нацеливающий вектор) с нуклеазным агентом приводит к повышению эффективности нацеливания по сравнению с использованием только нацеливающего вектора. В одном варианте осуществления, в котором нацеливающий вектор применяют вместе с нуклеазным агентом, эффективность нацеливания нацеливающего вектора увеличивается по меньшей мере в два раза, по меньшей мере в три раза, по меньшей мере в 4 раза или по меньшей мере в 10 раз по сравнению с использованием только нацеливающего вектора.
iii. Большие нацеливающие векторы
Используемый в настоящем документе термин «большой нацеливающий вектор» или LTVEC включает большие нацеливающие векторы, содержащие гомологичные плечи, которые соответствуют нуклеотидным последовательностям и получены из нуклеотидных последовательностей, имеющих большую длину, чем те, что обычно используются в других подходах, предназначенных для проведения гомологичного нацеливания в клетках, и/или содержащие полинуклеотидные вставки, которые содержат нуклеотидные последовательности, имеющие большую длину, чем те, что обычно используются в других подходах, предназначенных для проведения нацеливающей гомологичной рекомбинации в клетках. В конкретных вариантах осуществления гомологичные плечи и/или полинуклеотидная вставка LTVEC содержат геномную последовательность эукариотической клетки. Размер LTVEC является слишком большим, чтобы имелась возможность скрининга событий таргетинга с помощью стандартных анализов, например саузерн-блота и ПЦР для амплификации протяженных участков (например, 1 т. п. н. - 5 т. п. н.). Примеры LTVEC включают, без ограничений, векторы, полученные из бактериальной искусственной хромосомы (ВАС), человеческой искусственной хромосомы или дрожжевой искусственной хромосомы (YAC). Не имеющие ограничительного характера примеры LTVEC и способов их получения описаны, например, в патентах США №№6,586,251, 6,596,541, 7,105,348 и WO 2002/036789 (PCT/US 01/45375), каждый из которых полностью включен в настоящий документ путем ссылки.
LTVEC может иметь любую длину, включая, без ограничений, по меньшей мере около 10 т. п. н., около 15 т. п. н., около 20 т. п. н., около 30 т. п. н., около 40 т. п. н., около 50 т. п. н., около 60 т. п. н., около 70 т. п. н., около 80 т. п. н., около 90 т. п. н., около 100 т. п. н., около 150 т. п. н., около 200 т. п. н., от около 10 т. п. н. до около 15 т. п. н., от около 15 т. п. н. до около 20 т. п. н., от около 20 т. п. н. до около 30 т. п. н., от около 30 т. п. н. до около 50 т. п. н., от около 50 т. п. н. до около 300 т. п. н., от около 50 т. п. н. до около 75 т. п. н., от около 75 т. п. н. до около 100 т. п. н., от около 100 т. п. н. до 125 т. п. н., от около 125 т. п. н. до около 150 т. п. н., от около 150 т. п. н. до около 175 т. п. н., от около 175 т. п. н. до около 200 т. п. н., от около 200 т. п. н. до около 225 т. п. н., от около 225 т. п. н. до около 250 т. п. н., от около 250 т. п. н. до около 275 т. п. н. или от около 275 т. п. н. до около 300 т. п. н.
В одном варианте осуществления LTVEC содержит полинуклеотидную вставку длиной в диапазоне от около 5 т. п. н. до около 200 т. п. н., от около 5 т. п. н. до около 10 т. п. н., от около 10 т. п. н. до около 20 т. п. н., от около 20 т. п. н. до около 30 т. п. н., от около 30 т. п. н. до около 40 т. п. н., от около 40 т. п. н. до около 50 т. п. н., от около 60 т. п. н. до около 70 т. п. н., от около 80 т. п. н. до около 90 т. п. н., от около 90 т. п. н. до около 100 т. п. н., от около 100 т. п. н. до около 110 т. п. н., от около 120 т. п. н. до около 130 т. п. н., от около 130 т. п. н. до около 140 т. п. н., от около 140 т. п. н. до около 150 т. п. н., от около 150 т. п. н. до около 160 т. п. н., от около 160 т. п. н. до около 170 т. п. н., от около 170 т. п. н. до около 180 т. п. н., от около 180 т. п. н. до около 190 т. п. н., или от около 190 т. п. н. до около 200 т. п. н., от около 200 т. п. н. до около 250 т. п. н., от около 250 т. п. н. до около 300 т. п. н., от около 300 т. п. н. до около 350 т. п. н., или от около 350 т. п. н. до около 400 т. п. н.
В других случаях конструкция LTVEC может быть такой, чтобы позволять замещение данной последовательности, которая имеет длину от около 5 т. п. н. до около 200 т. п. н. или от около 5 т. п. н. до около 3,0 млн п. н., как описано в настоящем документе. В одном варианте осуществления замещение составляет от около 5 т. п. н. до около 10 т. п. н., от около 10 т. п. н. до около 20 т. п. н., от около 20 т. п. н. до около 30 т. п. н., от около 30 т. п. н. до около 40 т. п. н., от около 40 т. п. н. до около 50 т. п. н., от около 50 т. п. н. до около 60 т. п. н., от около 60 т. п. н. до около 70 т. п. н., от около 80 т. п. н. до около 90 т. п. н., от около 90 т. п. н. до около 100 т. п. н., от около 100 т. п. н. до около 110 т. п. н., от около 110 т. п. н. до около 120 т. п. н., от около 120 т. п. н. до около 130 т. п. н., от около 130 т. п. н. до около 140 т. п. н., от около 140 т. п. н. до около 150 т. п. н., от около 150 т. п. н. до около 160 т. п. н., от около 160 т. п. н. до около 170 т. п. н., от около 170 т. п. н. до около 180 т. п. н., от около 180 т. п. н. до около 190 т. п. н., от около 190 т. п. н. до около 200 т. п. н., от около 5 т. п. н. до около 10 т. п. н., от около 10 т. п. н. до около 20 т. п. н., от около 20 т. п. н. до около 40 т. п. н., от около 40 т. п. н. до около 60 т. п. н., от около 60 т. п. н. до около 80 т. п. н., от около 80 т. п. н. до около 100 т. п. н., от около 100 т. п. н. до около 150 т. п. н. или от около 150 т. п. н. до около 200 т. п. н., от около 200 т. п. н. до около 300 т. п. н., от около 300 т. п. н. до около 400 т. п. н., от около 400 т. п. н. до около 500 т. п. н., от около 500 т. п. н. до около 1 млн п. н., от около 1 млн п. н. до около 1,5 млн п. н., от около 1,5 млн п. н. до около 2 млн п. н., от около 2 млн п. н. до около 2,5 млн п. н. или от около 2,5 млн п. н. до около 3 млн п. н.
В одном варианте осуществления гомологичные плечи LTVEC получены из библиотеки ВАС, библиотеки космид или библиотеки фага Р1. В других вариантах осуществления гомологичные плечи получены из целевого геномного локуса клетки, и в некоторых случаях нацеливание на целевой геномный локус, для нацеливания на который сконструирован LTVEC, нельзя выполнить с помощью стандартного способа. В других вариантах осуществления гомологичные плечи получены из синтетической ДНК.
В одном варианте осуществления суммарная длина вышележащего гомологичного плеча и нижележащего гомологичного плеча в LTVEC составляет по меньшей мере 10 т. п. н. В других вариантах осуществления длина вышележащего гомологичного плеча находится в диапазоне от около 5 т. п. н. до около 100 т. п. н. В одном варианте осуществления длина нижележащего гомологичного плеча находится в диапазоне от около 5 т. п. н. до около 100 т. п. н. В других вариантах осуществления суммарная длина вышележащего и нижележащего гомологичных плеч составляет от около 5 т. п. н. до около 10 т. п. н., от около 10 т. п. н. до около 20 т. п. н., от около 20 т. п. н. до около 30 т. п. н., от около 30 т. п. н. до около 40 т. п. н., от около 40 т. п. н. до около 50 т. п. н., от около 50 т. п. н. до около 60 т. п. н., от около 60 т. п. н. до около 70 т. п. н., от около 70 т. п. н. до около 80 т. п. н., от около 80 т. п. н. до около 90 т. п. н., от около 90 т. п. н. до около 100 т. п. н., от около 100 т. п. н. до около 110 т. п. н., от около 110 т. п. н. до около 120 т. п. н., от около 120 т. п. н. до около 130 т. п. н., от около 130 т. п. н. до около 140 т. п. н., от около 140 т. п. н. до около 150 т. п. н., от около 150 т. п. н. до около 160 т. п. н., от около 160 т. п. н. до около 170 т. п. н., от около 170 т. п. н. до около 180 т. п. н., от около 180 т. п. н. до около 190 т. п. н. или от около 190 т. п. н. до около 200 т. п. н. В одном варианте осуществления размер делеции является таким же, как размер суммарной длины 5' и 3'-гомологичных плеч LTVEC или подобным ему.
В одном варианте осуществления LTVEC содержит кассету селекции или репортерный ген, как обсуждается в других разделах настоящего документа.
iv. Способы интегрирования полинуклеотидной вставки вблизи сайта распознавания на Y-хромосоме посредством гомологичной рекомбинации
Предложены способы модификации целевого геномного локуса на Y-хромосоме в клетке, включающие: (а) обеспечение клетки, содержащей целевой геномный локус на Y-хромосоме; (b) введение в клетку первого нацеливающего вектора, содержащего первую полинуклеотидную вставку, фланкированную первым и вторым гомологичными плечами, соответствующими первому и второму целевым сайтам; и (с) идентификацию по меньшей мере одной клетки, содержащей в своем геноме первую полинуклеотидную вставку, интегрированную в целевой геномный локус на Y-хромосоме. Подобные способы можно выполнять для нацеливания на затрудняющий хромосомный локус. Как подробно описано в других разделах настоящего документа, в конкретных вариантах осуществления суммарная длина первого гомологичного плеча и второго гомологичного плеча нацеливающего вектора составляет около 0,5 т. п. н., 1 т. п. н., 1,5 т. п. н., 2 т. п. н., 3 т. п. н., 4 т. п. н., 5 т. п. н., 6 т. п. н., 7 т. п. н., 8 т. п. н., 9 т. п. н., от около 0,5 т. п. н. до около 1 т. п. н., от около 1 т. п. н. до около 1,5 т. п. н., от около 1,5 т. п. н. до около 2 т. п. н., от около 2 т. п. н. до около 3 т. п. н., от около 3 т. п. н. до около 4 т. п. н., от около 4 т. п. н. до около 5 т. п. н., от около 5 т. п. н. до около 6 т. п. н., от около 6 т. п. н. до около 7 т. п. н., от около 8 т. п. н. до около 9 т. п. н. или составляет по меньшей мере 10 т. п. н. или по меньшей мере 10 т. п. н. и менее чем 150 т. п. н. В некоторых вариантах осуществления используют LTVEC. В других конкретных вариантах осуществления используют smallTVEC. В одном не имеющем ограничительного характера варианте осуществления такие способы выполняют с использованием культуральных сред, которые способствуют развитию фертильных самок XY F0, описанных в настоящем документе, и таким образом создают фертильных самок XY F0 животных. В других случаях способы, описанные в настоящем документе, используют для получения нацеленной генетической модификации в гене Sry, как описано в других разделах настоящего документа.
Дополнительно предложены способы модификации целевого геномного локуса на Y-хромосоме в клетке, включающие: (а) обеспечение клетки, содержащей целевой геномный локус на Y-хромосоме, содержащий сайт распознавания для нуклеазного агента; (b) введение в клетку: (i) нуклеазного агента, причем нуклеазный агент индуцирует одно- или двухцепочечный разрыв на первом сайте распознавания; и (ii) первого нацеливающего вектора, содержащего первую полинуклеотидную вставку, фланкированную первым и вторым гомологичными плечами, соответствующими первому и второму целевым сайтам, расположенным достаточно близко к первому сайту распознавания; и (с) идентификацию по меньшей мере одной клетки, содержащей в своем геноме первую полинуклеотидную вставку, интегрированную в целевой геномный локус на Y-хромосоме. Подобные способы можно выполнять для нацеливания на затрудняющий целевой локус. Как подробно описано в других разделах настоящего документа, в конкретных вариантах осуществления суммарная длина первого гомологичного плеча и второго гомологичного плеча нацеливающего вектора составляет около 0,5 т. п. н., 1 т. п. н., 1,5 т. п. н., 2 т. п. н., 3 т. п. н., 4 т. п. н., 5 т. п. н., 6 т. п. н., 7 т. п. н., 8 т. п. н., 9 т. п. н., от около 0,5 т. п. н. до около 1 т. п. н., от около 1 т. п. н. до около 1,5 т. п. н., от около 1,5 т. п. н. до около 2 т. п. н., от около 2 т. п. н. до около 3 т. п. н., от около 3 т. п. н. до около 4 т. п. н., от около 4 т. п. н. до около 5 т. п. н., от около 5 т. п. н. до около 6 т. п. н., от около 6 т. п. н. до около 7 т. п. н., от около 8 т. п. н. до около 9 т. п. н. или составляет по меньшей мере 10 т. п. н. или по меньшей мере 10 т. п. н. и менее чем 150 т. п. н. В некоторых вариантах осуществления используют LTVEC. В других конкретных вариантах осуществления используют smallTVEC. В одном не имеющем ограничительного характера варианте осуществления такие способы выполняют с использованием культуральных сред, которые способствуют развитию фертильных самок XY F0, описанных в настоящем документе, и таким образом создают фертильных самок XY F0 животных. В других случаях способы, описанные в настоящем документе, используют для получения нацеленной генетической модификации в гене Sry, как описано в других разделах настоящего документа.
Для идентификации клеток, имеющих интегрированную в целевой геномный локус полинуклеотидную вставку, можно также использовать различные способы. Инсерция полинуклеотидной вставки в целевой геномный локус приводит к «модификации аллеля». Термин «модификация аллеля» или МОА включает модификацию точной последовательности ДНК одного аллеля гена(-ов) хромосомного локуса(-ов) в геноме. Примеры «модификации аллеля» (МОА) включают, без ограничений, делеции, замены или инсерции всего одного нуклеотида или делеции многих тысяч пар нуклеотидов, охватывающих интересующий(-ие) ген(-ы) или хромосомный(-ые) локус(-ы), а также любые и все возможные модификации между этими двумя крайностями.
В различных вариантах осуществления для облегчения идентификации нацеленной модификации используют высокопроизводительный количественный анализ, а именно - анализ определения модификации аллеля (МОА). Описанный в настоящем документе анализ МОА позволяет проводить крупномасштабный скрининг модифицированного(-ых) аллеля(-ей) в родительской хромосоме после генетической модификации. Анализ МОА можно проводить посредством различных аналитических методик, включая, без ограничений, количественную ПЦР, например ПЦР в реальном времени (кПЦР). Например, ПЦР в реальном времени включает в себя первый набор праймеров-зондов, который распознает целевой локус, и второй набор праймеров-зондов, который распознает нецелевой эталонный локус. Кроме того, набор праймеров-зондов содержит флуоресцентный зонд, который распознает амплифицированную последовательность. Количественный анализ также может быть осуществлен посредством различных аналитических методик, включая, без ограничений, флуоресцентную гибридизацию in situ (FISH), сравнительную геномную гибридизацию, изотермическую амплификацию ДНК, количественную гибридизацию с иммобилизованным(-ыми) зондом(-ами), Invader Probes®, ММР assays®, технологии с использованием зондов TaqMan® Molecular Beacon и Eclipse™. (См., например, публикацию US 2005/0144655, включенную в настоящий документ в полном объеме путем ссылки).
В различных вариантах осуществления в присутствии одно- или двухцепочечного разрыва эффективность нацеливания нацеливающего вектора (такого как LTVEC или smallTVEC) в целевом геномном локусе увеличивается по меньшей мере приблизительно в 2 раза, по меньшей мере приблизительно в 3 раза, по меньшей мере приблизительно в 4 раза по сравнению с отсутствием одно- или двухцепочечного разрыва (при использовании, например, того же нацеливающего вектора и тех же гомологичных плеч и соответствующих целевых сайтов в интересующем геномном локусе, но без добавления нуклеазного агента, который выполняет одно- или двухцепочечный разрыв).
Различные способы, изложенные выше, могут последовательно повторяться, чтобы обеспечить нацеленную интеграцию любого количества полинуклеотидных вставок в данный целевой геномный локус на Y-хромосоме или в затрудняющий целевой локус. Таким образом, различные способы обеспечивают вставку в целевой геномный локус на Y-хромосоме или в затрудняющий целевой локус по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или более полинуклеотидных вставок. В некоторых вариантах осуществления такие способы последовательного мозаичного расположения позволяют проводить реконструкцию больших геномных областей из клетки животного или из клетки млекопитающего (т.е. человека, не относящегося к человеку животного, грызуна, мыши, обезьяны, крысы, хомяка, домашнего млекопитающего животного или сельскохозяйственного животного) в целевом геномном локусе на Y-хромосоме. В таких случаях перенос и реконструкция геномных областей, которые включают в себя как кодирующие, так и некодирующие области, позволяет сохранить сложность данной области путем сохранения, по меньшей мере частично, кодирующих областей, некодирующих областей и вариантов числа копий в нативной геномной области. Таким образом, в различных способах предложены, например, способы создания «гетерологичных» или «экзогенных» геномных областей в пределах любой клетки млекопитающего или интересующего животного. В одном не имеющем ограничительного характера примере в не относящемся к человеку животном создается «гуманизированная» геномная область.
Кроме того, следует понимать, что вместе с модификацией целевого геномного локуса на Y-хромосоме различные способы и композиции, описанные в настоящем документе, можно также использовать для создания нацеленной генетической модификации на другой хромосоме.
v. Интересующие полинуклеотиды
Любой интересующий полинуклеотид может содержаться в различных полинуклеотидных вставках и, таким образом, быть интегрированным в целевой геномный локус на Y-хромосоме или в затрудняющий целевой локус. Способы, описанные в настоящем документе, обеспечивают интеграцию в целевой геномный локус по меньшей мере 1, 2, 3, 4, 5, 6 или более интересующих полинуклеотидов.
При интеграции в целевой геномный локус на Y-хромосоме или в затрудняющий целевой локус интересующий полинуклеотид, находящийся внутри полинуклеотидной вставки, может вводить одну или более генетических модификаций в клетку. Генетическая модификация может представлять собой делецию эндогенной нуклеотидной последовательности и/или добавление экзогенного, или гетерологичного, или ортологичного полинуклеотида в целевой геномный локус. В одном варианте осуществления генетическая модификация представляет собой замещение в целевом геномном локусе эндогенной нуклеотидной последовательности интересующим экзогенным полинуклеотидом. Таким образом, в настоящем документе предложены способы, обеспечивающие получение генетической модификации, представляющей собой нокаут, делецию, инсерцию, замещение (нокин), точечную мутацию, перестановку доменов, перестановку экзонов, перестановку интронов, перестановку регуляторных последовательностей, перестановку генов или их комбинацию в целевом геномном локусе на Y-хромосоме. Такие модификации могут происходить при интеграции в целевой геномный локус первой, второй, третьей, четвертой, пятой, шестой, седьмой или любой последующей полинуклеотидной вставки.
Интересующий полинуклеотид внутри полинуклеотидной вставки и/или интегрированный в целевой геномный локус может содержать последовательность, которая является нативной или гомологичной по отношению к клетке, в которую он вводится; интересующий полинуклеотид может быть гетерологичным по отношению к клетке, в которую он вводится; интересующий полинуклеотид может быть экзогенным по отношению к клетке, в которую он вводится; интересующий полинуклеотид может быть ортологичным по отношению к клетке, в которую он вводится; или интересующий полинуклеотид может быть из другого вида, чем клетка, в которую он вводится. Используемый в настоящем документе термин «гомологичный» в отношении последовательности представляет собой последовательность, которая является нативной по отношению к клетке. В настоящем документе термин «гетерологичный» в отношении последовательности означает последовательность, полученную из другого вида, или, если она получена от того же вида, по существу подвергнутую модификации относительно ее нативной формы в композиции и/или в геномном локусе в результате целенаправленного вмешательства человека. Используемый в настоящем документе термин «экзогенный» в отношении последовательности представляет собой последовательность, которая происходит из другого вида. Используемый в настоящем документе термин «ортологичный» представляет собой полинуклеотид из одного вида, который является функционально эквивалентным известной эталонной последовательности из другого вида (т.е. видовой вариант). Интересующий полинуклеотид может быть получен из любого интересующего организма, включая, без ограничений, не относящегося к человеку животного, грызуна, хомяка, мышь, крысу, человека, обезьяну, птицу, сельскохозяйственное млекопитающее животное или несельскохозяйственное млекопитающее животное. Интересующий полинуклеотид может дополнительно содержать кодирующую область, некодирующую область, регуляторную область или геномную ДНК. Таким образом, 1, 2, 3, 4, 5, 6, 7-я и/или любая из последующих полинуклеотидных вставок может содержать такие последовательности.
В одном варианте осуществления интересующий полинуклеотид внутри полинуклеотидной вставки и/или интегрированный в целевой геномный локус на Y-хромосоме является гомологичным по отношению к нуклеотидной последовательности мыши, нуклеиновой кислоте человека, нуклеиновой кислоте не относящегося к человеку животного, нуклеиновой кислоте грызуна, нуклеиновой кислоте крысы, нуклеиновой кислоте хомяка, нуклеиновой кислоте обезьяны, нуклеиновой кислоте сельскохозяйственного млекопитающего животного или нуклеиновой кислоте несельскохозяйственного млекопитающего животного. В других дополнительных вариантах осуществления интересующий полинуклеотид, интегрированный в целевой локус, представляет собой фрагмент геномной нуклеиновой кислоты. В одном варианте осуществления геномная нуклеиновая кислота представляет собой геномную нуклеиновую кислоту мыши, геномную нуклеиновую кислоту человека, нуклеиновую кислоту не относящегося к человеку животного, нуклеиновую кислоту грызуна, нуклеиновую кислоту крысы, нуклеиновую кислоту хомяка, нуклеиновую кислоту обезьяны, нуклеиновую кислоту сельскохозяйственного млекопитающего животного, или нуклеиновую кислоту несельскохозяйственного млекопитающего животного, или их комбинацию.
В одном варианте осуществления интересующий полинуклеотид может иметь длину в диапазоне от около 500 нуклеотидов до около 200 т. п. н., как описано выше. Интересующий полинуклеотид может иметь длину от около 500 нуклеотидов до около 5 т. п. н., от около 5 т. п. н. до около 200 т. п. н., от около 5 т. п. н. до около 10 т. п. н., от около 10 т. п. н. до около 20 т. п. н., от около 20 т. п. н. до около 30 т. п. н., от около 30 т. п. н. до около 40 т. п. н., от около 40 т. п. н. до около 50 т. п. н., от около 60 т. п. н. до около 70 т. п. н., от около 80 т. п. н. до около 90 т. п. н., от около 90 т. п. н. до около 100 т. п. н., от около 100 т. п. н. до около 110 т. п. н., от около 120 т. п. н. до около 130 т. п. н., от около 130 т. п. н. до около 140 т. п. н., от около 140 т. п. н. до около 150 т. п. н., от около 150 т. п. н. до около 160 т. п. н., от около 160 т. п. н. до около 170 т. п. н., от около 170 т. п. н. до около 180 т. п. н., от около 180 т. п. н. до около 190 т. п. н. или от около 190 т. п. н. до около 200 т. п. н.
Интересующий полинуклеотид внутри полинуклеотидной вставки и/или вставленный в целевой геномный локус на Y-хромосоме или в затрудняющий целевой локус может кодировать полипептид, может кодировать микроРНК, может кодировать длинную некодирующую РНК или может содержать любые регуляторные области или интересующие некодирующие области, включая, например, регуляторную последовательность, последовательность промотора, последовательность энхансера, последовательность, связывающую транскрипционный репрессор или делецию не кодирующей белок последовательности, но не содержит делецию кодирующей белок последовательности. Кроме того, интересующий полинуклеотид внутри полинуклеотидной вставки и/или вставленный в целевой геномный локус на Y-хромосоме или в затрудняющий целевой локус может кодировать белок, который экспрессируется в нервной системе, костной системе, пищеварительной системе, кровеносной системе, мышечной системе, дыхательной системе, сердечно-сосудистой системе, лимфатической системе, эндокринной системе, мочевыделительной системе, репродуктивной системе или их комбинации.
Интересующий полинуклеотид внутри полинуклеотидной вставки и/или интегрированный в целевой геномный локус на Y-хромосоме или в затрудняющий целевой локус может содержать генетическую модификацию в кодирующей последовательности. Такие генетические модификации включают, без ограничений, мутацию делеции кодирующей последовательности или слияние двух кодирующих последовательностей.
Интересующий полинуклеотид внутри полинуклеотидной вставки и/или интегрированный в целевой геномный локус на Y-хромосоме или в затрудняющий целевой локус может содержать полинуклеотид, кодирующий мутантный белок. В одном варианте осуществления мутантный белок характеризуется измененной характеристикой связывания, измененной локализацией, измененной экспрессией и/или измененным характером экспрессии. В одном варианте осуществления интересующий полинуклеотид внутри полинуклеотидной вставки и/или интегрированный в целевой геномный локус на Y-хромосоме или в затрудняющий целевой локус содержит по меньшей мере один аллель заболевания. В таких случаях аллель заболевания может быть доминантным аллелем или аллель заболевания является рецессивным аллелем. Кроме того, аллель заболевания может представлять собой аллель однонуклеотидного полиморфизма (SNP). Интересующий полинуклеотид, кодирующий мутантный белок, может быть получен из любого организма, включая, без ограничений, кодирующий мутантный белок полинуклеотид от млекопитающего, не относящегося к человеку млекопитающего, грызуна, мыши, крысы, человека, обезьяны, сельскохозяйственного млекопитающего животного или домашнего млекопитающего животного.
Интересующий полинуклеотид внутри полинуклеотидной вставки и/или интегрированный в целевой геномный локус на Y-хромосоме или в затрудняющий целевой локус может также содержать регуляторную последовательность, включая, например, последовательность промотора, последовательность энхансера, последовательность, связывающую транскрипционный репрессор, или последовательность терминатора транскрипции. В конкретных вариантах осуществления интересующий полинуклеотид внутри полинуклеотидной вставки и/или интегрированный в целевой геномный локус на Y-хромосоме или в затрудняющий целевой локус содержит полинуклеотид с делецией не кодирующей белок последовательности, но не содержит делецию кодирующей белок последовательности. В одном варианте осуществления делеция не кодирующей белок последовательности содержит делецию регуляторной последовательности. В другом варианте осуществления делеция регуляторного элемента содержит делецию последовательности промотора. В одном варианте осуществления делеция регуляторного элемента содержит делецию последовательности энхансера. Такой интересующий полинуклеотид может быть получен из любого организма, включая, без ограничений, кодирующий мутантный белок полинуклеотид от млекопитающего, не относящегося к человеку млекопитающего, грызуна, мыши, крысы, человека, обезьяны, сельскохозяйственного млекопитающего животного или домашнего млекопитающего животного.
Различные способы, описанные в настоящем документе, можно использовать для создания различных модификаций в затрудняющем геномном локусе или в локусе Y-хромосомы (таком, как Sry). Такие модификации включают, например, замещение эндогенной нуклеотидной последовательности гомологичной или ортологичной нуклеотидной последовательностью; делецию эндогенной нуклеотидной последовательности, делецию эндогенной нуклеотидной последовательности, причем делеция находится в диапазоне от около 5 т. п. н. до около 10 т. п. н., от около 10 т. п. н. до около 20 т. п. н., от около 20 т. п. н. до около 40 т. п. н., от около 40 т. п. н. до около 60 т. п. н., от около 60 т. п. н. до около 80 т. п. н., от около 80 т. п. н. до около 100 т. п. н., от около 100 т. п. н. до около 150 т. п. н., от около 150 т. п. н. до около 200 т. п. н., от около 200 т. п. н. до около 300 т. п. н., от около 300 т. п. н. до около 400 т. п. н., от около 400 т. п. н. до около 500 т. п. н., от около 500 т. п. н. до около 600 т. п. н., от около 600 т. п. н. до около 700 т. п. н., от около 700 т. п. н. до около 800 т. п. н., от около 800 т. п. н. до около 900 т. п. н., от около 900 т. п. н. до около 1 млн п. н., от около 500 т. п. н. до около 1 млн п. н., от около 1 млн п. н. до около 1,5 млн п. н., от около 1,5 млн п. н. до около 2 млн п. н., от около 2 млн п. н. до около 2,5 млн п. н. или от около 2,5 млн п. н. до около 3 млн п. н.; инсерцию экзогенной нуклеотидной последовательности; инсерцию экзогенной нуклеотидной последовательности, находящейся в диапазоне от около 5 т. п. н. до около 10 т. п. н., от около 10 т. п. н. до около 20 т. п. н., от около 20 т. п. н. до около 40 т. п. н., от около 40 т. п. н. до около 60 т. п. н., от около 60 т. п. н. до около 80 т. п. н., от около 80 т. п. н. до около 100 т. п. н., от около 100 т. п. н. до около 150 т. п. н., от около 150 т. п. н. до около 200 т. п. н., от около 200 т. п. н. до около 250 т. п. н., от около 250 т. п. н. до около 300 т. п. н., от около 300 т. п. н. до около 350 т. п. н., от около 350 т. п. н. до около 400 т. п. н.; инсерцию экзогенной нуклеотидной последовательности, содержащей гомологичную или ортологичную нуклеотидную последовательность; инсерцию химерной нуклеотидной последовательности, содержащей человеческую и не относящуюся к человеку нуклеотидные последовательности; инсерцию условного аллеля, фланкированного целевыми последовательностями сайт-специфической рекомбинации; инсерцию селективного маркера или репортерного гена, функционально связанного с третьим промотором, активным в клетке млекопитающего; или их комбинацию.
III. Способы введения последовательностей и создания трансгенных животных
Как указывалось выше, в настоящем документе предложены способы и композиции для обеспечения нацеленной генетической модификации одного или более интересующих полинуклеотидов, расположенных на Y-хромосоме, в затрудняющем целевом локусе или снижения уровня и/или активности белка Sry. Кроме того, следует понимать, что кроме нацеленной генетической модификации последовательности на Y-хромосоме или в затрудняющем целевом хромосомном локусе можно создавать дополнительную нацеленную генетическую модификацию на других хромосомах. В таких системах, позволяющих эти нацеленные генетические модификации, могут использоваться различные компоненты, и для удобства ознакомления в настоящем документе термин «система нацеленной геномной интеграции» в целом включает все компоненты, необходимые для события интеграции (т.е. к различным нуклеазным агентам, сайтам распознавания, полинуклеотидным ДНК-вставкам, нацеливающим векторам, целевому геномному локусу и интересующим полинуклеотидам).
Предложенные в настоящем документе способы включают введение в клетку одного или более полинуклеотидов или полипептидных конструкций, содержащих различные компоненты системы нацеленной геномной интеграции. «Введение» означает передачу в клетку последовательности (полипептидной или полинуклеотидной) таким образом, что эта последовательность получает доступ к внутренней части клетки. Предложенные в настоящем документе способы не зависят от конкретного способа введения любого компонента системы нацеленной геномной интеграции в клетку, а зависят только от получения доступа полинуклеотида к внутренней части по меньшей мере одной клетки. Способы введения полинуклеотидов в различные типы клеток известны в данной области и включают, без ограничений, способы устойчивой трансфекции, способы временной трансфекции и вирус-опосредованные способы.
В некоторых вариантах осуществления клетки, используемые в способах и композициях, имеют стабильно встроенную в их геном конструкцию ДНК. Термин «стабильно встроенный» или «стабильно введенный» означает введение полинуклеотида в клетку таким образом, что нуклеотидная последовательность интегрируется в геном клетки и способна передаваться по наследству ее потомству. Для стабильного встраивания конструкций ДНК или различных компонентов системы нацеленной геномной интеграции может использоваться любой протокол.
Протоколы трансфекции, а также протоколы введения полипептидов или полинуклеотидных последовательностей в клетки могут быть разными. Не имеющие ограничительного характера способы трансфекции включают химические способы трансфекции, включающие использование липосом; наночастиц; фосфата кальция (Graham et al. (1973). Virology 52 (2): 456-67, Bacchetti et al. (1977) Proc Natl Acad Sci USA 74 (4): 1590-4 и Kriegler, M (1991). Transfer and Expression: A Laboratory Manual. New York: W. H. Freeman and Company, pp.96-97); дендримеров или катионных полимеров, таких как ДЭАЭ-декстран или полиэтиленимин. Нехимические способы включают электропорацию, сонопорацию и оптическую трансфекцию. Трансфекция с использованием частиц включает применение «генной пушки», магнитной трансфекции (Bertram, J. (2006) Current Pharmaceutical Biotechnology 7, 277-28). Для трансфекции также можно использовать вирусные способы.
В одном варианте осуществления нуклеазный агент вводят в клетку одновременно с нацеливающим вектором, smallTVEC или большим нацеливающим вектором (LTVEC). В альтернативном варианте осуществления нуклеазный агент вводят отдельно от нацеливающего вектора, smallTVEC или LTVEC за определенный период времени. В одном варианте осуществления нуклеазный агент вводят перед введением нацеливающего вектора, smallTVEC или LTVEC, тогда как в других вариантах осуществления нуклеазный агент вводят после введения нацеливающего вектора, smallTVEC или LTVEC.
С помощью различных способов, описанных в настоящем документе, можно создавать не относящихся к человеку животных. Такие способы включают: (1) интеграцию одного или более интересующих полинуклеотидов в целевой геномный локус Y-хромосомы плюрипотентной клетки не относящегося к человеку животного для создания генетически модифицированной плюрипотентной клетки, содержащей полинуклеотидную вставку в целевом геномном локусе Y-хромосомы с использованием способов, описанных в настоящем документе; (2) отбор генетически модифицированной плюрипотентной клетки, имеющей в целевом геномном локусе Y-хромосомы один или более интересующих полинуклеотидов; (3) введение генетически модифицированной плюрипотентной клетки в эмбрион-хозяина не относящегося к человеку животного на стадии до образования морулы; и (4) имплантацию эмбриона-хозяина, содержащего генетически модифицированную плюрипотентную клетку, в организм суррогатной матери для получения из генетически модифицированной плюрипотентной клетки поколения F0. Подобные способы можно использовать для нацеливания на затрудняющий целевой хромосомный локус.Не относящееся к человеку животное может быть не относящимся к человеку млекопитающим животным, грызуном, мышью, крысой, хомяком, обезьяной, сельскохозяйственным млекопитающим животным или домашним млекопитающим животным, или рыбой, или птицей.
Плюрипотентная клетка может быть человеческой ЭС-клеткой, не относящейся к человеку ЭС-клеткой, ЭС-клеткой грызуна, ЭС-клеткой мыши, ЭС-клеткой крысы, ЭС-клеткой хомяка, ЭС-клеткой обезьяны, ЭС-клеткой сельскохозяйственного млекопитающего животного или ЭС-клеткой домашнего млекопитающего животного. В других вариантах осуществления плюрипотентная клетка представляет собой клетку млекопитающего, клетку человека, клетку не относящегося к человеку млекопитающего, плюрипотентную клетку человека, ЭС-клетку человека, стволовую клетку взрослого человека, онтогенетически ограниченную человеческую клетку-предшественник, ИПС-клетку человека, клетку человека, клетку грызуна, клетку крысы, клетку мыши, клетку хомяка. В одном варианте осуществления нацеленная генетическая модификация снижает уровень и/или активность белка Sry. В таких случаях плюрипотентная клетка может представлять собой ЭС-клетку XY или ИПС-клетку XY. Способы культивирования таких клеток для способствования развитию фертильных самок XY F0 животных подробно описаны в других разделах настоящего документа.
Для создания не относящегося к человеку млекопитающего животного можно также использовать методики ядерного переноса. В кратком изложении методы ядерного переноса включают этапы, на которых: (1) проводят энуклеацию ооцита; (2) выделяют донорскую клетку или ядро для объединения с энуклеированным ооцитом; (3) выполняют вставку клетки или ядра в энуклеированный ооцит с образованием реконструированной клетки; (4) имплантируют реконструированную клетку в матку животного с получением эмбриона; и (5) предоставляют эмбриону возможность развития. В таких способах ооциты обычно извлекают из умерших животных, хотя их можно выделять также из яйцеводов и/или яичников живых животных. До энуклеации ооциты могут созревать в различных средах, известных обычным специалистам в данной области. Энуклеация ооцитов может быть выполнена с помощью ряда способов, хорошо известных обычным специалистам в данной области. Вставку донорской клетки или ядра в энуклеированный ооцит с образованием реконструированной клетки обычно проводят перед слиянием путем микроинъекции донорской клетки под вителлиновый слой. Слияние можно индуцировать применением электрического импульса постоянного тока в плоскости контакта/слияния (электрослияние), путем воздействия на клетки химическими веществами, стимулирующими слияние, такими как полиэтиленгликоль, или путем использования инактивированного вируса, например вируса Сендай. Реконструированную клетку, как правило, активируют с использованием электричества и/или неэлектрического средства до, во время и/или после слияния ядра донора и ооцита реципиента. Способы активации включают в себя электрические импульсы, химически индуцированный шок, пенетрацию с помощью сперматозоида, повышение уровней двухвалентных катионов в ооцитах, а также снижение фосфорилирования клеточных белков (например, с помощью ингибиторов киназы) в ооците. Активированные реконструированные клетки или эмбрионы обычно культивируют в среде, хорошо известной обычным специалистам в данной области, после чего переносят в матку животного. См., например, US 20080092249, WO/1999/005266 А2, US 20040177390, WO/2008/017234 A1 и патент США №7,612,250, каждый из которых полностью включен в настоящий документ путем ссылки.
Предложены другие описанные в настоящем документе способы создания не относящегося к человеку животного, содержащего в своей зародышевой линии одну или более генетических модификаций, которые включают: (а) модификацию целевого геномного локуса на Y-хромосоме не относящегося к человеку животного в прокариотической клетке с использованием различных способов, описанных в настоящем документе; (b) отбор модифицированной прокариотической клетки, содержащей в целевом геномном локусе генетическую модификацию; (с) выделение из генома модифицированной прокариотической клетки генетически модифицированного нацеливающего вектора; (d) введение генетически модифицированного нацеливающего вектора в плюрипотентную клетку не относящегося к человеку животного с получением генетически модифицированной плюрипотентной клетки, содержащей в целевом геномном локусе Y-хромосомы нуклеотидную вставку; (е) отбор генетически модифицированной плюрипотентной клетки; (f) введение генетически модифицированной плюрипотентной клетки в эмбрион-хозяина не относящегося к человеку животного на стадии до образования морулы; и (g) имплантацию эмбриона-хозяина, содержащего генетически модифицированную плюрипотентную клетку, в организм суррогатной матери для получения из генетически модифицированной плюрипотентной клетки поколения F0. В таких способах нацеливающий вектор может представлять собой большой нацеливающий вектор или smallTVEC. Подобные способы можно использовать для нацеливания на затрудняющий целевой локус. Не относящееся к человеку животное может быть не относящимся к человеку млекопитающим животным, грызуном, мышью, крысой, хомяком, обезьяной, сельскохозяйственным млекопитающим животным или домашним млекопитающим животным. Плюрипотентная клетка может быть человеческой ЭС-клеткой, не относящейся к человеку ЭС-клеткой, ЭС-клеткой грызуна, ЭС-клеткой мыши, ЭС-клеткой крысы, ЭС-клеткой хомяка, ЭС-клеткой обезьяны, ЭС-клеткой сельскохозяйственного млекопитающего животного или ЭС-клеткой домашнего млекопитающего животного. В других вариантах осуществления плюрипотентная клетка представляет собой клетку млекопитающего, клетку человека, клетку не относящегося к человеку млекопитающего, плюрипотентную клетку человека, ЭС-клетку человека, стволовую клетку взрослого человека, онтогенетически ограниченную человеческую клетку-предшественник, ИПС-клетку человека, клетку человека, клетку грызуна, клетку крысы, клетку мыши, клетку хомяка. В одном варианте осуществления нацеленная генетическая модификация снижает уровень и/или активность белка Sry. В таких случаях плюрипотентная клетка может представлять собой ЭС-клетку XY или ИПС-клетку XY. Способы культивирования таких клеток для способствования развитию фертильных самок XY F0 животных подробно описаны в других разделах настоящего документа.
В дополнительных способах этап выделения (с) дополнительно включает этап (c1) линеаризации генетически модифицированного нацеливающего вектора (т.е. генетически модифицированного LTVEC). В других дополнительных вариантах осуществления этап введения (d) дополнительно включает этап (d1) введения в плюрипотентную клетку нуклеазного агента, как описано в настоящем документе. В одном варианте осуществления этапы отбора (b) и/или (е) осуществляют путем применения селективного агента, как описано в настоящем документе, в прокариотической клетке или плюрипотентной клетке. В одном варианте осуществления этапы отбора (b) и/или (е) выполняют посредством анализа определения модификации аллеля (МОА), как описано в настоящем документе.
Предложены дополнительные способы модификации целевого геномного локуса клетки животного посредством бактериальной гомологичной рекомбинации (BHR) в прокариотической клетке, которые включают: (а) обеспечение прокариотической клетки, содержащей целевой геномный локус Y-хромосомы; (b) введение в прокариотическую клетку нацеливающего вектора (как описано выше), содержащего полинуклеотидную вставку, фланкированную первым вышележащим гомологичным плечом и первым нижележащим гомологичным плечом, при этом полинуклеотидная вставка содержит геномную область от млекопитающего, и введение в прокариотическую клетку нуклеазного агента, который выполняет одно- или двухцепочечный разрыв на первом сайте распознавания или возле него; и (с) отбор целевой прокариотической клетки, содержащей в целевом геномном локусе хромосомы полинуклеотидную вставку, при этом прокариотическая клетка способна экспрессировать рекомбиназу, которая опосредует BHR. Подобные способы можно использовать для нацеливания на затрудняющий целевой локус. Этапы (а)-(с) можно последовательно повторять так, как описано в настоящем документе, чтобы обеспечить введение множества полинуклеотидных вставок в целевой геномный локус в прокариотической клетке. После «построения» целевого геномного локуса с прокариотической клеткой нацеливающий вектор, содержащий модифицированный целевой геномный локус Y-хромосомы, можно выделить из прокариотической клетки и ввести в целевой геномный локус Y-хромосомы внутрь клетки млекопитающего. Из клеток млекопитающего, содержащих модифицированный геномный локус Y-хромосомы, впоследствии можно получать не относящихся к человеку трансгенных животных.
Предложены дополнительные способы модификации целевого геномного локуса клетки животного посредством бактериальной гомологичной рекомбинации (BHR) в прокариотической клетке, которые включают: (а) обеспечение прокариотической клетки, содержащей целевой геномный локус Y-хромосомы; (b) введение в прокариотическую клетку нацеливающего вектора (как описано выше), содержащего полинуклеотидную вставку, фланкированную первым вышележащим гомологичным плечом и первым нижележащим гомологичным плечом, при этом полинуклеотидная вставка содержит геномную область от млекопитающего; и (c) отбор целевой прокариотической клетки, содержащей в целевом геномном локусе хромосомы полинуклеотидную вставку, при этом прокариотическая клетка способна экспрессировать рекомбиназу, которая опосредует BHR. Подобные способы можно использовать для нацеливания на затрудняющий целевой локус.Этапы (а)-(с) можно последовательно повторять так, как описано в настоящем документе, чтобы обеспечить введение множества полинуклеотидных вставок в целевой геномный локус в прокариотической клетке. После «построения» целевого геномного локуса с прокариотической клеткой нацеливающий вектор, содержащий модифицированный целевой геномный локус Y-хромосомы, можно выделить из прокариотической клетки и ввести в целевой геномный локус Y-хромосомы внутрь клетки млекопитающего. Из клеток млекопитающего, содержащих модифицированный геномный локус Y-хромосомы, впоследствии можно получать не относящихся к человеку трансгенных животных.
В некоторых вариантах осуществления различные генетические модификации целевых геномных локусов, описанные в настоящем документе, можно проводить с помощью ряда реакций гомологичной рекомбинации (BHR) в бактериальных клетках с использованием LTVEC, полученного из ДНК бактериальной искусственной хромосомы (ВАС) с помощью технологии генной инженерии VELOCIGENE® (см., например, патент США №6,586,251 и публикацию Valenzuela, D. М. et al. (2003) High-throughput engineering of the mouse genome coupled with high-resolution expression analysis, Nature Biotechnology 21(6): 652-659, полностью включенные в настоящий документ путем ссылки).
В некоторых вариантах осуществления целевые плюрипотентные и/или тотипотентные клетки XY (т.е. ЭС-клетки XY или ИПС-клетки XY), содержащие различные генетические модификации, как описано в настоящем документе, используют как вставляемые донорские клетки и вводят на стадии до образования морулы в эмбрион, полученный из соответствующего организма, например, эмбрион мыши на стадии 8 клеток, посредством способа VELOCIMOUSE® (см., например, публикации US 7,576,259, US 7,659,442, US 7,294,754, и US 2008-0078000 A1., все из которых в полном объеме включены в настоящий документ путем ссылки). Эмбрион не относящегося к человеку животного, содержащий генетически модифицированные плюрипотентные и/или тотипотентные клетки XY (т.е. ЭС-клетки XY или ИПС-клетки XY), инкубируют до стадии бластоцисты и затем имплантируют в суррогатную мать для производства поколения F0. В некоторых вариантах осуществления целевые ЭС-клетки млекопитающего, содержащие различные генетические модификации, как описано в настоящем документе, вводят в эмбрион на стадии бластоцисты. Не относящиеся к человеку животные, несущие генетически модифицированный геномный локус Y-хромосомы, могут быть идентифицированы посредством анализа определения модификации аллеля (МОА), как описано в настоящем документе. Поколение F0 не относящегося к человеку животного, полученное из генетически модифицированных плюрипотентных и/или тотипотентных клеток XY (т.е. ЭС-клеток XY или ИПС-клеток XY) скрещивают с не относящимся к человеку животным дикого типа, чтобы получить потомство поколения F1. После генотипирования со специфическими праймерами и/или зондами не относящихся к человеку животных F1, которые являются гетерозиготными по генетически модифицированному геномному локусу, скрещивают друг с другом, чтобы получить потомство не относящихся к человеку животных поколения F2, которые являются гомозиготными по генетически модифицированному геномному локусу Y-хромосомы или по генетически модифицированному затрудняющему целевому локусу.
IV. Клетки и экспрессионные кассеты
В различных способах, описанных в настоящем документе, используют системы нацеливания на геномный локус для Y-хромосомы или для затрудняющего целевого локуса в клетке. Такие клетки включают прокариотические клетки, такие как бактериальные клетки, включая Е. coli, или эукариотические клетки, такие как клетки дрожжей, насекомых, земноводных, растений или млекопитающих, включая, без ограничений, клетку мыши, клетку крысы, клетку кролика, клетку свиньи, клетку коровы, клетку оленя, клетку овцы, клетку козы, клетку курицы, клетку кота, клетку собаки, клетку хорька, клетку примата (например, мартышки, макаки-резус) и т.п. и клетки домашних млекопитающих животных или клетки сельскохозяйственных млекопитающих животных. Некоторые клетки являются клетками, не относящимися к человеку, в частности, клетками не относящегося к человеку млекопитающего. В некоторых вариантах осуществления для тех млекопитающих, для которых нет легкодоступных подходящих генетически модифицируемых плюрипотентных клеток, для перепрограммирования соматических клеток в плюрипотентные клетки используют другие способы, например введение в соматические клетки комбинации факторов, индуцирующих плюрипотентность, включая, без ограничений, Oct3/4, Sox2, KLF4, Мус, Nanog, LIN28 и Glis1. В таких способах клетка может быть клеткой млекопитающего, клеткой человека, клеткой не относящегося к человеку млекопитающего, не относящейся к человеку клеткой, клеткой грызуна, крысы, мыши, хомяка, клеткой-фибробластом или любой другой клеткой-хозяином. В других вариантах осуществления клетка представляет собой плюрипотентную клетку, индуцированную плюрипотентную стволовую (ИПС) клетку, не относящуюся к человеку эмбриональную стволовую (ЭС) клетку. Такие клетки включают в себя плюрипотентные клетки, включая, например, индуцированные плюрипотентные стволовые (ИПС) клетки, эмбриональные стволовые (ЭС) клетки мыши, эмбриональные стволовые (ЭС) клетки крысы, эмбриональные стволовые (ЭС) клетки человека или онтогенетически ограниченную человеческую клетку-предшественник, эмбриональную стволовую (ЭС) клетку грызуна, эмбриональную стволовую (ЭС) клетку мыши или эмбриональную стволовую (ЭС) клетку крысы.
Термины «полинуклеотид», «полинуклеотидная последовательность», «нуклеотидная последовательность» и «фрагмент нуклеиновой кислоты» применяются в настоящем документе взаимозаменяемо. Эти термины охватывают нуклеотидные последовательности и т.п. Полинуклеотид может представлять собой полимер РНК и ДНК, который образует одну или две цепи, необязательно содержащих синтетические, отсутствующие в природе или измененные нуклеотидные основания. Полинуклеотид в форме полимера ДНК можно образовать из одного или более сегментов кДНК, геномной ДНК, синтетической ДНК или их смесей. Полинуклеотиды могут представлять собой дезоксирибонуклеотиды и рибонуклеотиды, включая как встречающиеся в природе молекулы, так и синтетические аналоги, а также любые их комбинации. Полинуклеотиды, предложенные в настоящем документе, также охватывают все формы последовательностей, включая, без ограничений, одноцепочечные формы, двухцепочечные формы, шпильки, структуры «стебель-петля» и т.п.
Дополнительно предложены рекомбинантные полинуклеотиды. Термины «рекомбинантный полинуклеотид» и «рекомбинантная конструкция ДНК» используются в настоящем документе взаимозаменяемо. Рекомбинантная конструкция содержит искусственную или гетерологичную комбинацию нуклеотидных последовательностей, например регуляторной и кодирующей последовательностей, которые вместе не встречаются в природе. В других вариантах осуществления рекомбинантная конструкция может содержать регуляторные последовательности и кодирующие последовательности, полученные из разных источников, или регуляторные последовательности и кодирующие последовательности, полученные из того же источника, но расположенные способом, отличным от встречающегося в природе. Такая конструкция может быть использована сама по себе или может быть использована в сочетании с вектором. Если используется вектор, то выбор вектора зависит от способа, который используется для преобразования клеток-хозяев, как хорошо известно специалистам в данной области. Например, можно использовать плазмидный вектор. Скрининг можно выполнять, среди прочего, с помощью саузерн-блот-анализа ДНК, нозерн-блот-анализа экспрессии мРНК, анализа иммуноблоттинга экспрессии белка или фенотипического анализа.
В конкретных вариантах осуществления в экспрессионной кассете можно обеспечить один или более из описанных в настоящем документе компонентов для экспрессии в плюрипотентной и/или тотипотентной клетке. Кассета может включать 5' и 3'-регуляторные последовательности, функционально связанные с полинуклеотидом, представленным в настоящем документе. Термин «функционально связанный» означает наличие функциональной связи между двумя или более элементами. Например, функциональная связь между интересующим полинуклеотидом и регуляторной последовательностью (т.е. промотором) представляет собой функциональную связь, позволяющую экспрессию интересующего полинуклеотида. Функционально связанные элементы могут быть непрерывными или могут не быть непрерывными. Используемый для обозначения соединения двух кодирующих белок областей термин «функционально связанный» означает, что кодирующие области находятся в одной рамке считывания. В другом случае нуклеотидная последовательность, кодирующая белок, может быть функционально связана с регуляторными последовательностями (например, последовательностью промотора, энхансера, сайленсера и т.п), чтобы сохранить соответствующее регулирование транскрипции. Кассета может дополнительно содержать по меньшей мере один дополнительный интересующий полинуклеотид, предназначенный для одновременного введения в ЭС-клетку. В альтернативном варианте осуществления дополнительный интересующий полинуклеотид может быть обеспечен на множестве экспрессионных кассет. Такая экспрессионная кассета обеспечена множеством сайтов рестрикции и/или сайтов рекомбинации для вставки рекомбинантного полинуклеотида, который должен находиться под транскрипционным контролем регуляторных областей. Экспрессионная кассета может дополнительно содержать гены селективных маркеров.
Экспрессионная кассета может включать в себя в направлении транскрипции 5'-3' область инициации транскрипции и трансляции (т.е. промотор), рекомбинантный полинуклеотид, предложенный в настоящем документе, и область терминации транскрипции и трансляции (т.е. область терминации), действующие в интересующей клетке млекопитающего или клетке-хозяине. Регуляторные области (т.е. промоторы, регуляторные области транскрипции и области терминации транскрипции и трансляции) и/или полинуклеотид, предложенный в настоящем документе, могут быть нативными/аналогичными клетке-хозяину или друг другу. В альтернативном варианте осуществления регуляторные области и/или а полинуклеотид, предложенный в настоящем документе, могут быть гетерологичными клетке-хозяину или друг другу. Например, промотор, функционально связанный с гетерологичным полинуклеотидом, происходит из вида, отличного от вида, из которого был получен полинуклеотид, или, если он получен из того же/аналогичного вида, один или оба являются по существу модифицированными по сравнению с их изначальной формой и/или геномным локусом, или промотор не является нативным промотором, функционально связанным с полинуклеотидом. В альтернативном варианте осуществления регуляторные области и/или рекомбинантный полинуклеотид, предложенный в настоящем документе, могут быть полностью синтетическими.
Область терминации может быть нативной с областью инициации транскрипции, может быть нативной с функционально связанным рекомбинантным полинуклеотидом, может быть нативной с клеткой-хозяином или может быть получена из другого источника (т.е. чужеродного или гетерологичного) по отношению к промотору, рекомбинантному полинуклеотиду, клетке-хозяину или любой их комбинации.
При получении экспрессионной кассеты могут быть проведены манипуляции с различными фрагментами ДНК, чтобы обеспечить подходящую ориентацию последовательностей ДНК. С этой целью для соединения фрагментов ДНК могут быть использованы адаптеры или линкеры или могут быть проведены другие манипуляции, чтобы обеспечить удобные сайты рестрикции, удалить лишние ДНК, удалить сайты рестрикции и т.п. Для этой цели можно использовать in vitro мутагенез, восстановление праймера, рестрикцию, отжиг, повторные замены, например переходы и трансверсии.
В экспрессионных кассетах, предложенных в настоящем документе, можно использовать некоторое количество промоторов. Промоторы можно выбирать на основе желаемого результата. Следует признать, что различные виды применения могут быть расширены за счет использования в экспрессионных кассетах различных промоторов для модуляции времени, места и/или уровня экспрессии интересующего полинуклеотида. Такие экспрессионные конструкции также при необходимости могут содержать промоторную регуляторную область (например, область, придающую индуцибельную или конститутивную, зависящую от окружающей среды или стадии развития, или клеточно- или тканеспецифичную/селективную экспрессию), инициирующий транскрипцию начальный сайт, сайт связывания рибосомы, сигнал РНК-процессинга, сайт терминации транскрипции и/или сигнал полиаденилирования.
Не имеющие ограничительного характера варианты осуществления включают перечисленные ниже.
1. Культура in vitro, содержащая:
(a) эмбриональную стволовую (ЭС) клетку XY не относящегося к человеку млекопитающего, имеющую модификацию, которая снижает уровень и/или активность белка Sry; и
(b) среду, содержащую основную среду и добавки, приемлемые для сохранения ЭС-клеток не относящегося к человеку млекопитающего в культуре, причем среда демонстрирует одну или более из следующих характеристик: осмоляльность от около 200 мОсм/кг до менее чем около 329 мОсм/кг; проводимость от около 11 мСм/см до около 13 мСм/см; концентрация соли щелочного металла и галида от около 50 мМ до около 110 мМ; концентрация соли угольной кислоты от около 17 мМ до около 30 мМ; общая концентрация соли галида щелочного металла и соли угольной кислоты от около 85 мМ до около 130 мМ и/или комбинацию любых двух или более из них.
2. Культура in vitro по п. 1, в которой ЭС-клетка XY не относящегося к человеку млекопитающего получена от грызуна.
3. Культура in vitro по п. 2, в которой грызун представляет собой мышь.
4. Культура in vitro по варианту осуществления 3, в которой мышиная ЭС-клетка XY представляет собой мышиную ЭС-клетку VGF1.
5. Культура in vitro по варианту осуществления 2, в которой грызун представляет собой крысу или хомяка.
6. Культура in vitro по любому из вариантов осуществления 1-5, в которой сниженные уровень и/или активность белка Sry получены в результате генетической модификации в гене Sry.
7. Культура in vitro по варианту осуществления 6, в которой генетическая модификация в гене Sry содержит инсерцию одного или более нуклеотидов, делецию одного или более нуклеотидов, замену одного или более нуклеотидов, нокаут, нокин, замещение эндогенной нуклеотидной последовательности гетерологичной нуклеотидной последовательностью или их комбинацию.
8. Культура in vitro по любому из вариантов осуществления 1-7, в которой ЭС-клетка не относящегося к человеку млекопитающего содержит одну, две, три или более нацеленных генетических модификаций.
9. Культура in vitro по варианту осуществления 8, в которой нацеленная генетическая модификация содержит инсерцию, делецию, нокаут, нокин, точечную мутацию или их комбинацию.
10. Культура in vitro по варианту осуществления 8, в которой нацеленная генетическая модификация содержит по меньшей мере одну инсерцию гетерологичного полинуклеотида в геноме ЭС-клетки XY.
11. Культура in vitro по любому из вариантов осуществления 8-10, в которой нацеленная генетическая модификация находится на аутосоме.
12. Культура in vitro по любому из вариантов осуществления 1-11, в которой основная среда демонстрирует характеристики: 50±5 мМ NaCl, 26±5 мМ карбоната и 218±22 мОсм/кг.
13. Культура in vitro по любому из вариантов осуществления 1-11, в которой основная среда демонстрирует характеристики: около 3 мг/мл NaCl, 2,2 мг/мл бикарбоната натрия и 218 мОсм/кг.
14. Культура in vitro по любому из вариантов осуществления 1-11, в которой основная среда демонстрирует характеристики: 87±5 мМ NaCl, 18±5 мМ карбоната и 261±26 мОсм/кг.
15. Культура in vitro по любому из вариантов осуществления 1-11, в которой основная среда демонстрирует характеристики: около 5,1 мг/мл NaCl, 1,5 мг/мл бикарбоната натрия и 261 мОсм/кг.
16. Культура in vitro по любому из вариантов осуществления 1-11, в которой основная среда демонстрирует характеристики: 110±5 мМ NaCl, 18±5 мМ карбоната и 294±29 мОсм/кг.
17. Культура in vitro по любому из вариантов осуществления 1-11, в которой основная среда демонстрирует характеристики: около 6,4 мг/мл NaCl, 1,5 мг/мл бикарбоната натрия и 294 мОсм/кг.
18. Культура in vitro по любому из вариантов осуществления 1-11, в которой основная среда демонстрирует характеристики: 87±5 мМ NaCl, 26±5 мМ карбоната и 270±27 мОсм/кг.
19. Культура in vitro по любому из вариантов осуществления 1-11, в которой основная среда демонстрирует характеристики: около 5,1 мг/мл NaCl, 2,2 мг/мл бикарбоната натрия и 270 мОсм/кг.
20. Культура in vitro по любому из вариантов осуществления 1-11, в которой основная среда демонстрирует характеристики: 87±5 мМ NaCl, 26±5 мМ карбоната, 86±5 мМ глюкозы и 322±32 мОсм/кг.
21. Культура in vitro по любому из вариантов осуществления 1-11, в которой основная среда демонстрирует характеристики: около 5,1 мг/мл NaCl, 2,2 мг/мл бикарбоната натрия, 15,5 мг/мл глюкозы и 322 мОсм/кг.
22. Культура in vitro по любому из вариантов осуществления 1-21, в которой после введения ЭС-клеток XY не относящегося к человеку млекопитающего в эмбрион-хозяина и последующего вынашивания эмбриона-хозяина по меньшей мере 80% не относящихся к человеку млекопитающих F0 представляют собой самок XY, причем после достижения половой зрелости самка XY F0 не относящегося к человеку млекопитающего является фертильной.
23. Способ создания фертильной самки XY не относящегося к человеку млекопитающего в поколении F0, включающий:
(a) культивирование донорской эмбриональной стволовой (ЭС) клетки XY не относящегося к человеку млекопитающего, имеющей модификацию, которая снижает уровень и/или активность белка Sry в среде, содержащей основную среду и добавки, приемлемые для сохранения ЭС-клеток не относящегося к человеку млекопитающего в культуре, причем среда демонстрирует одну или более из следующих характеристик: осмоляльность от около 200 мОсм/кг до менее чем около 329 мОсм/кг; проводимость от около 11 мСм/см до около 13 мСм/см; концентрация соли щелочного металла и галида от около 50 мМ до около 110 мМ; концентрация соли угольной кислоты от около 17 мМ до около 30 мМ; общая концентрация соли галида щелочного металла и соли угольной кислоты от около 85 мМ до около 130 мМ и/или комбинацию любых двух или более из них;
(b) введение донорской ЭС-клетки XY не относящегося к человеку млекопитающего в эмбрион-хозяина;
(c) вынашивание эмбриона-хозяина; и
(d) получение самки XY F0 не относящегося к человеку млекопитающего, причем после достижения половой зрелости самка XY F0 не относящегося к человеку млекопитающего является фертильной.
24. Способ по варианту осуществления 23, в котором ЭС-клетка XY не относящегося к человеку млекопитающего получена от грызуна.
25. Способ по варианту осуществления 24, в котором грызун представляет собой мышь.
26. Способ по варианту осуществления 25, в котором мышиная ЭС-клетка XY представляет собой мышиную ЭС-клетку VGF1.
27. Способ по варианту осуществления 24, в котором грызун представляет собой крысу или хомяка.
28. Способ по любому из вариантов осуществления 23-27, в котором сниженные уровень и/или активность белка Sry получены в результате генетической модификации в гене Sry.
29. Способ по варианту осуществления 28, в котором генетическая модификация в гене Sry содержит инсерцию одного или более нуклеотидов, делецию одного или более нуклеотидов, замену одного или более нуклеотидов, нокаут, нокин, замещение эндогенной нуклеотидной последовательности гетерологичной нуклеотидной последовательностью или их комбинацию.
30. Способ по любому из вариантов осуществления 23-29, в котором ЭС-клетка не относящегося к человеку млекопитающего содержит одну, две, три или более нацеленных генетических модификаций.
31. Способ по варианту осуществления 30, в котором нацеленная генетическая модификация содержит инсерцию, делецию, нокаут, нокин, точечную мутацию или их комбинацию.
32. Способ по варианту осуществления 30, в котором нацеленная генетическая модификация содержит по меньшей мере одну инсерцию гетерологичного полинуклеотида в геноме ЭС-клетки XY.
33. Способ по любому из вариантов осуществления 30-32, в котором нацеленная генетическая модификация находится на аутосоме.
34. Способ по любому из вариантов осуществления 23-33, в котором основная среда демонстрирует характеристики: 50±5 мМ NaCl, 26±5 мМ карбоната и 218±22 мОсм/кг.
35. Способ по любому из вариантов осуществления 23-33, в котором основная среда демонстрирует характеристики: около 3 мг/мл NaCl, 2,2 мг/мл бикарбоната натрия и 218 мОсм/кг.
36. Способ по любому из вариантов осуществления 23-33, в котором основная среда демонстрирует характеристики: 87±5 мМ NaCl, 18±5 мМ карбоната и 261±26 мОсм/кг.
37. Способ по любому из вариантов осуществления 23-33, в котором основная среда демонстрирует характеристики: около 5,1 мг/мл NaCl, 1,5 мг/мл бикарбоната натрия и 261 мОсм/кг.
38. Способ по любому из вариантов осуществления 23-33, в котором основная среда демонстрирует характеристики: 110±5 мМ NaCl, 18±5 мМ карбоната и 294±29 мОсм/кг.
39. Способ по любому из вариантов осуществления 23-33, в котором основная среда демонстрирует характеристики: около 6,4 мг/мл NaCl, 1,5 мг/мл бикарбоната натрия и 294 мОсм/кг.
40. Способ по любому из вариантов осуществления 23-33, в котором основная среда демонстрирует характеристики: 87±5 мМ NaCl, 26±5 мМ карбоната и 270±27 мОсм/кг.
41. Способ по любому из вариантов осуществления 23-33, в котором основная среда демонстрирует характеристики: около 5,1 мг/мл NaCl, 2,2 мг/мл бикарбоната натрия и 270 мОсм/кг.
42. Способ по любому из вариантов осуществления 23-33, в котором основная среда демонстрирует характеристики: 87±5 мМ NaCl, 26±5 мМ карбоната, 86±5 мМ глюкозы и 322±32 мОсм/кг.
43. Способ по любому из вариантов осуществления 23-33, в котором основная среда демонстрирует характеристики: около 5,1 мг/мл NaCl, 2,2 мг/мл бикарбоната натрия, 15,5 мг/мл глюкозы и 322 мОсм/кг.
44. Способ производства не относящегося к человеку трансгенного млекопитающего, гомозиготного по целевой генетической мутации в поколении F1, включающий: (а) скрещивание фертильной самки XY F0, имеющей сниженные уровень и/или активность белка Sry, с когортным клональным сиблингом, полученным из того же ЭС-клеточного клона, самцом XY F0 не относящегося к человеку млекопитающего, причем каждый из фертильной самки XY F0 не относящегося к человеку млекопитающего и самца XY F0 не относящегося к человеку млекопитающего является гетерозиготным по генетической мутации; и (b) получение потомства мышей F1, которое является гомозиготным по генетической модификации.
45. Способ модификации целевого геномного локуса на Y-хромосоме в клетке, включающий: (а) обеспечение клетки, содержащей целевой геномный локус на Y-хромосоме, содержащий сайт распознавания для нуклеазного агента, (b) введение в клетку: (i) нуклеазного агента, причем нуклеазный агент индуцирует одно- или двухцепочечный разрыв на первом сайте распознавания; и (ii) первого нацеливающего вектора, содержащего первую полинуклеотидную вставку, фланкированную первым и вторым гомологичными плечами, соответствующими первому и второму целевым сайтам, расположенным достаточно близко к первому сайту распознавания, при этом суммарная длина первого гомологичного плеча и второго гомологичного плеча составляет по меньшей мере 4 т. п. н., но менее чем 150 т. п. н.; и (с) идентификацию по меньшей мере одной клетки, содержащей в своем геноме первую полинуклеотидную вставку, интегрированную в целевой геномный локус.
46. Способ модификации целевого геномного локуса на Y-хромосоме в клетке, включающий:
(a) обеспечение клетки, содержащей целевой геномный локус на Y-хромосоме, содержащий сайт распознавания для нуклеазного агента;
(b) введение в клетку первого нацеливающего вектора, содержащего первую полинуклеотидную вставку, фланкированную первым и вторым гомологичными плечами, соответствующими первому и второму целевым сайтам, причем суммарная длина первого гомологичного плеча и второго гомологичного плеча составляет по меньшей мере 4 т. п. н., но менее чем 150 т. п. н.; и
(c) идентификацию по меньшей мере одной клетки, содержащей в своем геноме первую полинуклеотидную вставку, интегрированную в целевой геномный локус.
47. Способ по варианту осуществления 45 или 46, в котором клетка представляет собой клетку млекопитающего.
48. Способ по варианту осуществления 47, в котором клетка млекопитающего представляет собой не относящуюся к человеку клетку.
49. Способ по варианту осуществления 47, в котором клетка млекопитающего получена от грызуна.
50. Способ по варианту осуществления 49, в котором грызун представляет собой крысу, мышь или хомяка.
51. Способ по любому из вариантов осуществления 45-50, в котором клетка представляет собой плюрипотентную клетку.
52. Способ по любому из вариантов осуществления 45-50, в котором клетка млекопитающего представляет собой индуцированную плюрипотентную стволовую (ИПС) клетку.
53. Способ по варианту осуществления 51, в котором плюрипотентная клетка представляет собой не относящуюся к человеку эмбриональную стволовую (ЭС) клетку.
54. Способ по варианту осуществления 51, в котором плюрипотентная клетка представляет собой эмбриональную стволовую (ЭС) клетку грызуна, эмбриональную стволовую (ЭС) клетку мыши или эмбриональную стволовую (ЭС) клетку крысы.
55. Способ по любому из вариантов осуществления 45 и 47-54, в котором нуклеазный агент представляет собой мРНК, кодирующую нуклеазу.
56. Способ по любому из вариантов осуществления 45 и 47-54, в котором нуклеазный агент представляет собой нуклеазу с «цинковыми пальцами» (ZFN).
57. Способ по любому из вариантов осуществления 45 и 47-54, в котором нуклеазный агент представляет собой эффекторную нуклеазу, подобную активатору транскрипции (TALEN).
58. Способ по любому из вариантов осуществления 45 и 47-54, в котором нуклеазный агент представляет собой мегануклеазу.
59. Способ по любому из вариантов осуществления 45 и 47-54, в котором нуклеазный агент представляет собой эндонуклеазу Cas9, направляемую РНК CRISPR.
60. Способ модификации Y-хромосомы, включающий воздействие на Y-хромосому белком Cas и РНК CRISPR в присутствии большого нацеливающего вектора (LTVEC), содержащего нуклеотидную последовательность длиной по меньшей мере 10 т. п. н., причем после воздействия белком Cas, РНК CRISPR и LTVEC, Y-хромосома модифицируется таким образом, что содержит нуклеотидную последовательность длиной по меньшей мере 10 т. п. н.
61. Способ по варианту осуществления 60, в котором LTVEC содержит нуклеотидную последовательность длиной по меньшей мере 20 т. п. н., по меньшей мере 30 т. п. н., по меньшей мере 40 т. п. н., по меньшей мере 50 т. п. н., по меньшей мере 60 т. п. н., по меньшей мере 70 т. п. н., по меньшей мере 80 т. п. н. или по меньшей мере 90 т. п. н.
62. Способ по варианту осуществления 60, в котором LTVEC содержит нуклеотидную последовательность длиной по меньшей мере 100 т. п. н., по меньшей мере 150 т. п. н. или по меньшей мере 200 т. п. н.
63. Способ модификации целевого геномного локуса на Y-хромосоме, включающий: (а) обеспечение клетки млекопитающего, содержащей целевой геномный локус на Y-хромосоме, причем целевой геномный локус содержит целевую последовательность гидовой РНК (гРНК); (b) введение в клетку млекопитающего: (i) большого нацеливающего вектора (LTVEC), содержащего первую нуклеиновую кислоту, фланкированную нацеливающими плечами, гомологичными целевому геномному локусу, причем длина LTVEC составляет по меньшей мере 10 т. п. н.; (ii) первой экспрессионной конструкции, содержащей первый промотор, функционально связанный со второй нуклеиновой кислотой, кодирующей белок Cas; и (iii) второй экспрессионной конструкции, содержащей второй промотор, функционально связанный с третьей нуклеиновой кислотой, кодирующей гидовую РНК (гРНК), содержащую нуклеотидную последовательность, которая гибридизируется с целевой последовательностью гРНК, и трансактивирующую РНК CRISPR (тракрРНК), при этом первый и второй промоторы являются активными в клетке млекопитающего; и (с) идентификацию модифицированной клетки млекопитающего, содержащей нацеленную генетическую модификацию в целевом геномном локусе на Y-хромосоме.
64. Способ по варианту осуществления 63, в котором длина LTVEC составляет по меньшей мере 15 т. п. н., по меньшей мере 20 т. п. н., по меньшей мере 30 т. п. н., по меньшей мере 40 т. п. н., по меньшей мере 50 т. п. н., по меньшей мере 60 т. п. н., по меньшей мере 70 т. п. н., по меньшей мере 80 т. п. н. или по меньшей мере 90 т. п. н.
65. Способ по варианту осуществления 63, в котором длина LTVEC составляет по меньшей мере 100 т. п. н., по меньшей мере 150 т. п. н. или по меньшей мере 200 т. п. н.
66. Способ по варианту осуществления 63, в котором клетка млекопитающего представляет собой клетку не относящегося к человеку млекопитающего.
67. Способ по варианту осуществления 63, в котором клетка млекопитающего представляет собой фибробласт.
68. Способ по варианту осуществления 63, в котором клетка млекопитающего получена от грызуна.
69. Способ по варианту осуществления 68, в котором грызун представляет собой крысу, мышь или хомяка.
70. Способ по варианту осуществления 63, в котором клетка млекопитающего представляет собой плюрипотентную клетку.
71. Способ по варианту осуществления 70, в котором плюрипотентная клетка представляет собой индуцированную плюрипотентную стволовую (ИПС) клетку.
72. Способ по варианту осуществления 70, в котором плюрипотентная клетка представляет собой эмбриональную стволовую (ЭС) клетку мыши или эмбриональную стволовую (ЭС) клетку крысы.
73. Способ по варианту осуществления 70, в котором плюрипотентная клетка представляет собой онтогенетически ограниченную человеческую клетку-предшественник.
74. Способ по варианту осуществления 63, в котором белок Cas представляет собой белок Cas9.
75. Способ по варианту осуществления 74, в котором целевая последовательность гРНК непосредственно фланкирована последовательностью мотива, прилежащего к протоспейсеру (РАМ).
76. Способ по варианту осуществления 63, в котором суммарная длина 5'-и 3'-гомологичных плеч LTVEC составляет от около 10 т. п. н. до около 150 т. п. н.
77. Способ по варианту осуществления 76, в котором суммарная длина 5'-и 3'-гомологичных плеч LTVEC составляет от около 10 т. п. н. до около 20 т. п. н., от около 20 т. п. н. до около 40 т. п. н., от около 40 т. п. н. до около 60 т. п. н., от около 60 т. п. н. до около 80 т. п. н., от около 80 т. п. н. до около 100 т. п. н., от около 100 т. п. н. до около 120 т. п. н. или от около 120 т. п. н. до около 150 т. п. н.
78. Способ по варианту осуществления 63, в котором нацеленная генетическая модификация содержит: (а) замещение эндогенной нуклеотидной последовательности гомологичной или ортологичной нуклеотидной последовательностью; (b) делецию эндогенной нуклеотидной последовательности; (с) делецию эндогенной нуклеотидной последовательности, причем делеция находится в диапазоне от около 5 т. п. н. до около 10 т. п. н., от около 10 т. п. н. до около 20 т. п. н., от около 20 т. п. н. до около 40 т. п. н., от около 40 т. п. н. до около 60 т. п. н., от около 60 т. п. н. до около 80 т. п. н., от около 80 т. п. н. до около 100 т. п. н., от около 100 т. п. н. до около 150 т. п. н., от около 150 т. п. н. до около 200 т. п. н., от около 200 т. п. н. до около 300 т. п. н., от около 300 т. п. н. до около 400 т. п. н., от около 400 т. п. н. до около 500 т. п. н., от около 500 т. п. н. до около 1 млн п. н., от около 1 млн п. н. до около 1,5 млн п. н., от около 1,5 млн п. н. до около 2 млн п. н., от около 2 млн п. н. до около 2,5 млн п. н. или от около 2,5 млн п. н. до около 3 млн п. н.; (d) инсерцию экзогенной нуклеотидной последовательности; (e) инсерцию экзогенной нуклеотидной последовательности, находящейся в диапазоне от около 5 т. п. н. до около 10 т. п. н., от около 10 т. п. н. до около 20 т. п. н., от около 20 т. п. н. до около 40 т. п. н., от около 40 т. п. н. до около 60 т. п. н., от около 60 т. п. н. до около 80 т. п. н., от около 80 т. п. н. до около 100 т. п. н., от около 100 т. п. н. до около 150 т. п. н., от около 150 т. п. н. до около 200 т. п. н., от около 200 т. п. н. до около 250 т. п. н., от около 250 т. п. н. до около 300 т. п. н., от около 300 т. п. н. до около 350 т. п. н., от около 350 т. п. н. до около 400 т. п. н.; (f) инсерцию экзогенной нуклеотидной последовательности, содержащей гомологичную или ортологичную нуклеотидную последовательность; (g) инсерцию химерной нуклеотидной последовательности, содержащей человеческую и не относящуюся к человеку нуклеотидные последовательности; (h) инсерцию условного аллеля, фланкированного целевыми последовательностями сайт-специфической рекомбинации; (i) инсерцию селективного маркера или репортерного гена, функционально связанного с третьим промотором, активным в клетке млекопитающего; или (j) их комбинацию.
79. Способ по варианту осуществления 63, в котором целевой геномный локус содержит: (i) 5'-целевую последовательность, которая гомологична 5'-гомологичному плечу; и (ii) 3'-целевую последовательность, которая гомологична 3'-гомологичному плечу.
80. Способ по варианту осуществления 79, в котором 5'-целевая последовательность и 3'-целевая последовательность разделены по меньшей мере 5 т. п. н., но менее чем 3 млн п. н.
81. Способ по варианту осуществления 79, в котором 5'-целевая последовательность и 3'-целевая последовательность разделены по меньшей мере 5 т. п. н., но менее чем 10 т. п. н., по меньшей мере 10 т. п. н., но менее чем 20 т. п. н., по меньшей мере 20 т. п. н., но менее чем 40 т. п. н., по меньшей мере 40 т. п. н., но менее чем 60 т. п. н., по меньшей мере 60 т. п. н., но менее чем 80 т. п. н., по меньшей мере около 80 т. п. н., но менее чем 100 т. п. н., по меньшей мере 100 т. п. н., но менее чем 150 т. п. н., или по меньшей мере 150 т. п. н., но менее чем 200 т. п. н., по меньшей мере около 200 т. п. н., но менее чем около 300 т. п. н., по меньшей мере около 300 т. п. н., но менее чем около 400 т. п. н., по меньшей мере около 400 т. п. н., но менее чем около 500 т. п. н., по меньшей мере около 500 т. п. н., но менее чем около 1 млн п. н., по меньшей мере около 1 млн п. н., но менее чем около 1,5 млн п. н., по меньшей мере около 1,5 млн п. н., но менее чем около 2 млн п. н., по меньшей мере около 2 млн п. н., но менее чем около 2,5 млн п. н., или по меньшей мере около 2,5 млн п. н., но менее чем около 3 млн п. н.
82. Способ по варианту осуществления 63, в котором первая и вторая экспрессионные конструкции расположены на одной молекуле нуклеиновой кислоты.
83. Способ по варианту осуществления 63, в котором целевой геномный локус представляет собой локус Sry.
84. Способ нацеленной генетической модификации на Y-хромосоме не относящегося к человеку животного, включающий: (а) модификацию интересующего геномного локуса не относящейся к человеку плюрипотентной клетки в соответствии со способом по варианту осуществления 4 с производством таким образом генетически модифицированной не относящейся к человеку плюрипотентной клетки, содержащей нацеленную генетическую модификацию на Y-хромосоме; (b) введение модифицированной не относящейся к человеку плюрипотентной клетки, полученной на этапе (а) в не относящийся к человеку эмбрион-хозяина; и (с) вынашивание не относящегося к человеку эмбриона-хозяина, содержащего модифицированную плюрипотентную клетку, в организме суррогатной матери, причем суррогатная мать производит потомство F0, содержащее нацеленную генетическую модификацию, при этом нацеленная генетическая модификация может быть передана через зародышевую линию.
85. Способ по варианту осуществления 84, в котором интересующий геномный локус представляет собой локус Sry.
86. Способ модификации целевого геномного локуса на Y-хромосоме в клетке, включающий: (а) обеспечение клетки, содержащей целевой геномный локус на Y-хромосоме, содержащий сайт распознавания для нуклеазного агента; (b) введение в клетку: (i) нуклеазного агента, причем нуклеазный агент индуцирует одно- или двухцепочечный разрыв на первом сайте распознавания; и (ii) первого нацеливающего вектора, содержащего первую полинуклеотидную вставку, фланкированную первым и вторым гомологичными плечами, соответствующими первому и второму целевым сайтам, расположенным достаточно близко к первому сайту распознавания, при этом длина первого гомологичного плеча и/или второго гомологичного плеча составляет по меньшей мере 400 п. н., но менее чем 1000 п. н.; и (с) идентификацию по меньшей мере одной клетки, содержащей в своем геноме первую полинуклеотидную вставку, интегрированную в целевой геномный локус.
87. Способ по варианту осуществления 86, в котором длина первого гомологичного плеча и/или второго гомологичного плеча составляет от около 700 п. н. до около 800 п. н.
88. Способ по варианту осуществления 86, в котором модификация содержит делецию эндогенной нуклеотидной последовательности.
89. Способ по варианту осуществления 88, в котором делеция находится в диапазоне от около 5 т. п. н. до около 10 т. п. н., от около 10 т. п. н. до около 20 т. п. н., от около 20 т. п. н. до около 40 т. п. н., от около 40 т. п. н. до около 60 т. п. н., от около 60 т. п. н. до около 80 т. п. н., от около 80 т. п. н. до около 100 т. п. н., от около 100 т. п. н. до около 150 т. п. н. или от около 150 т. п. н. до около 200 т. п. н., от около 200 т. п. н. до около 300 т. п. н., от около 300 т. п. н. до около 400 т. п. н., от около 400 т. п. н. до около 500 т. п. н., от около 500 т. п. н. до около 1 млн п. н., от около 1 млн п. н. до около 1,5 млн п. н., от около 1,5 млн п. н. до около 2 млн п. н., от около 2 млн п. н. до около 2,5 млн п. н. или от около 2,5 млн п. н. до около 3 млн п. н.
90. Способ по варианту осуществления 88, в котором делеция составляет по меньшей мере 500 т. п. н.
Представленные способы и композиции можно осуществлять во многих различных формах и они не должны быть истолкованы как ограничивающие варианты осуществления, изложенные в настоящем документе; скорее, эти варианты осуществления предложены для того, чтобы описание удовлетворяло применимым правовым требованиям. Для указания одинаковых элементов используются одинаковые числа.
Специалисту в области, к которой принадлежат эти способы и композиции, будут ясны многие модификации и другие варианты осуществления представленных в настоящем документе способов и композиций, имеющих преимущества идей, представленных в изложенных ниже описаниях и связанных рисунках. Таким образом, следует понимать, что способы и композиции не должны быть ограничены конкретными описанными вариантами осуществления и что модификации и другие варианты осуществления включены в объем приложенных пунктов формулы изобретения. Хотя в настоящем документе используются конкретные термины, они применяются только в общем и описательном смысле, а не для целей ограничения.
Следующие примеры предлагаются в качестве иллюстрации, а не в качестве ограничения.
ПРИМЕРЫ
Пример 1. Нацеливание на ген Sry Y-хромосомы. опосредованное TALEN или CRISPR
Создавали целевую делецию, содержащую замещение аллеля lacZ для Sry, с помощью нацеливающего вектора, содержащего в указанном порядке: вышележащее гомологичное плечо длиной приблизительно 700 п. н., последовательность, кодирующую бетагалактозидазу (lacZ) с последующим сигналом полиаденилирования, кассету устойчивости к неомицину, фланкированную сайтами loxP, содержащими человеческий промотор убиквитина С, включая первый экзон, первый интрон и часть второго экзона, последовательность, кодирующую неомицинфосфотрансферазу, и сигнал полиаденилирования, и нижележащее гомологичное плечо длиной приблизительно 650 п. н. Аллель, созданный посредством корректного нацеливания на ген Sry с помощью нацеливающего вектора, содержит делецию длиной приблизительно 1 т. п. н., открытую рамку считывания Sry и замещение кассетой lacZ-neo, так что последовательность, кодирующая бетагалактозидазу, слита в рамке в старт-кодоне Sry. Нацеливающий вектор использовали для нацеливания на ген Sry в F1 гибридных ЭС-клеточных линиях VGB6 (также известной как В6А6) C57BL/6 и VGF1 (также известной как F1H4) C57BL6/129. ЭС-клетки мыши VGF1 (F1H4) были получены от гибридных эмбрионов, произведенных посредством скрещивания самки мыши C57BL/6NTac с самцом мыши 129S6/SvEvTac. Таким образом, ЭС-клетки VGF1 содержат Y-хромосому от мыши 129S6/SvEvTac. Самки XY мышей, полученные из клеточной линии VGF1, содержат Y-хромосому, происходящую от мыши 129S6/SvEvTac.
Пример 2. TALEN- или CRISPR-индуцированные мутации в гене Sry Y-хромосомы
В гене Sry создавали мутации-делеции, предположительно в результате репарационного соединения негомологичных концов (NHEJ) двухцепочечных разрывов ДНК, которые имели размер в диапазоне от 3 п. н. до 1,2 т. п. н. и более, посредством воздействия гидовых РНК TALEN или CRISPR в сочетании с ДНК-эндонуклеазой Cas9 (см. ФИГ. 1). ЭС-клетки, содержащие TALEN- и CRISPR-индуцированные мутации в гене Sry, также были носителями случайных трансгенных инсерций LTVEC проекта NIH КОМР VG12778 (доступен через Интернет на world wide web (www) по URL «velocigene.com/komp/detail/12778»), который содержит делецию последовательности, кодирующей Sry, и замещение кассетой инсерции, содержащей lacZ, слитой в рамке со старт-кодоном Sry и геном устойчивости к неомицину, фланкированным гомологичными плечами длиной 38 и 37 т. п. н. и основанным на ВАС из библиотеки bMQ (129S7/SvEv Brd-Hprt b-m2). LTVEC содержит в своих гомологичных плечах все известные управляющие элементы для экспрессии Sry. Его бетагалактозидаза, кодируемая lacZ, служит в качестве репортера для тканеспецифичной и специфичной в отношении стадии развития экспрессии гена Sry. TALEN- и CRISPR-индуцированные мутации, сопровождающиеся инсерциями LTVEC, создавали как в линии ЭС-клеток VGB6 (также известной как В6А6), так и в линии VGF1 (также известной как F1H4).
Авторы изобретения получили TALEN (TALEN-1), сконструированный для нацеливания на часть бокса HMG последовательности, кодирующей ДНК-связывающий мотив (вышележащая последовательность распознавания: 5'-TCCCGTGGTGAGAGGCAC-3' (SEQ ID NO: 72); нижележащая последовательность распознавания: 5'-TATTTTGCATGCTGGGAT-3' (SEQ ID NO: 73) в гене Sry. TALEN-1 был активен в создании мутаций NHEJ в локусе Sry во множественных экспериментах.
Были созданы ЭС-клетки мышей с TALEN-индуцированными мутациями как линии VGB6, так и линии VGF1. В таблице 1 содержится список всех клонов и размеров мутаций-делеций, которые они несут.(HO в таблице 1 указывает, что мутация была обнаружена с помощью анализа кПЦР, но точная молекулярная природа мутации не была определена). Все клоны также несут по меньшей мере одну копию LTVEC проекта NIH KOMP VG12778.
* Также содержали инсерцию длиной 50 п. н.
Результаты микроинъекций клонов с мутацией Sry представлены в таблице 2, а результаты скрещивания самок с реверсией пола представлены в таблице 3.
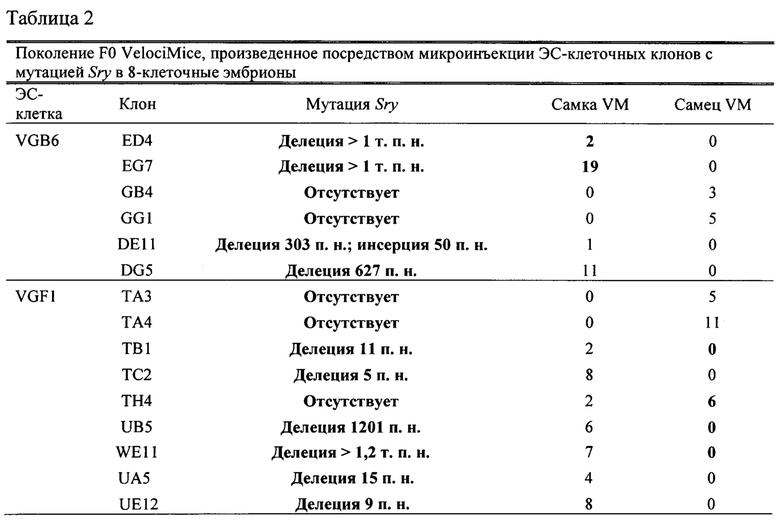

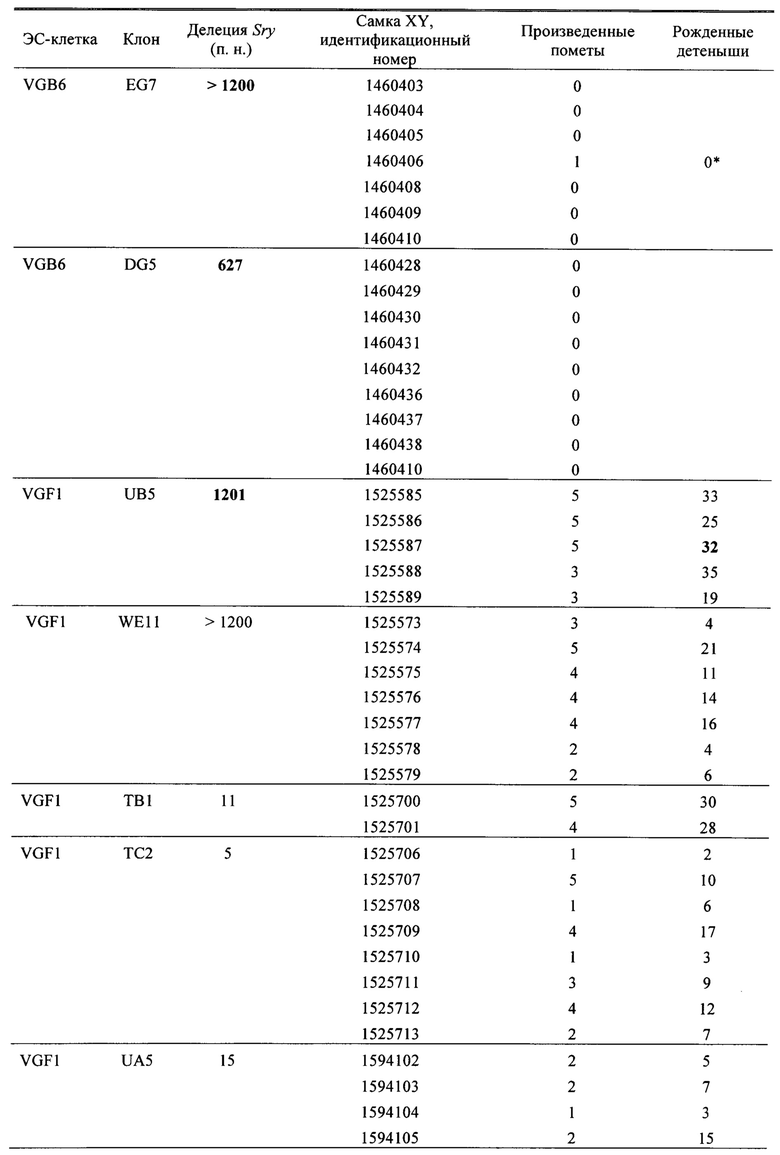

* Самку XY c ID 1460406 пришлось подвергнуть эвтаназии до родов, посколько у нее был предродовой кризис и роды были невозможны. Ее мертвые детеныши (4 самца, 5 самок) были извлечены посредством диссекции, и ни один из них не был носителем мутации Sry.
Все мыши VelociMice с мутацией Sry, происходящие от ЭС-клеток VGB6, были самками, как ожидалось для инактивации Sry (таблица 2). Особи без мутаций Sry, но являющиеся носителями по меньшей мере одной копии LTVEC NIH КОМР VG12778, производили только самцов VelociMice (таблица 2, клоны GB4 и GG1). Когда 17 самок В6 VelociMice с мутацией Sry подвергли тестовому скрещиванию, только одна забеременела после около четырех месяцев от начала скрещиваний (таблица 3), и эту самку пришлось подвергнуть эвтаназии до родов, поскольку у нее был предродовой кризис и роды были невозможны. Все ее мертвые детеныши (4 самца, 5 самок), извлеченные посредством диссекции, были дикого типа; ни один из них не был носителем мутации Sry. Было сделано заключение, что практически все мыши с мутацией Sry, полученные от ЭС-клеток VGB6, являются стерильными, что согласуется с данными литературы по мутациям Sry. Однако данные авторов исследования показали значительно отличающийся результат для клонов VGF1.
Во-первых, ЭС-клетки VGF1 сохраняли, как обычно, в разработанной авторами изобретения KO-DMEM-подобной ростовой среде с низкой осмоляльной силой, которая является феминизирующей: некоторые из полученных посредством микроинъекции клонов XY, выращиваемых на этой среде, будут производить фертильных самок XY, т.е. феномен самки XY, даже если они не являются носителями мутаций. Примером является клон ТН4, который не имеет мутации Sry, но несет по меньшей мере одну копию LTVEC NIH КОМР VG12778. Этот клон произвел 2 самки и 6 самцов VelociMice (таблица 2). Два других клона VGF1 без мутаций Sry (ТА3 и ТА4, таблица 2) произвели только самцов VelociMice. Авторы изобретения намеревались определить, можно ли посредством среды феминизировать ЭС-клетки XY VGF1 с мутацией в Sry. Другими словами, произведут ли они, в отличие от ЭС-клеток VGB6 с мутацией Sry, некоторое количество фертильных самок XY с мутацией Sry? (Отметим, что ЭС-клетки VGB6 нельзя сохранять в KO-DMEM-подобных средах с низкой осмотической силой и поддерживать способность к производству мышей.) Как показано в таблице 3, ответом является «да».
Осуществляли микроинъекцию шести ЭС-клеточных клонов VGF1 с TALEN-индуцированными малыми делециями в диапазоне от 5 п. н. до более 1 т. п. н. Все они производили самок VelociMice, 32 из которых подвергали скрещиванию. Примечательно, что все самки XY с мутацией Sry были фертильными; каждая произвела по меньшей мере один помет (таблица 3). Многие из самок XY с мутацией Sry производили множество пометов с нормальным размером помета, тогда как некоторые из самок XY производили только один или два небольших помета. Из 299 мышей F1 от этих скрещиваний, которые подвергали генотипированию, приблизительно половина (146, 49%) представляла собой нормальных самцов XY или нормальных самок XX. 174 (58%) из мышей F1 были фенотипически самками, тогда как 125 (42%) были фенотипически самцами. 26 из самок (15%) из самок, 8,7% от всего поколения F1) были самками XY, которые унаследовали мутантный аллель Sry. Из-за мейотических событий нерасхождения, связанных с ооцитами XY, в потомстве F1 самок XY VelociMice с мутацией Sry наблюдали некоторое число аберрантных генотипов - XXY, XYY, ХО, XXYY - некоторые из которых включали в себя мутантные аллели Sry.
Был открыт способ эффективного создания фертильных самок XY VelociMice из ЭС-клеток XY. Если инактивирующие мутации были созданы в гене Sry в ЭС-клетках, которые сохраняли в феминизирующей ростовой среде, получали высокое соотношение фертильных самок XY мышей, которые при скрещивании с самцами производят преимущественно самцов и самок мышей с нормальными Х- и Y-хромосомами.
Пример 3. Восстановление эмбриона в KO-DMEM или DMEM после TALEN-индуцированных мутаций в гене Sry Y-хромосомы
Корректное нацеливание на мышиный Sry посредством LTVEC подтверждали или опровергали посредством генотипирования потомства F1, происходящего от самок F0, которые представляли собой XY и были носителями мутации Sry. Косегрегация кассеты LacZ/Neo вместе с мутацией Sry (что установлено посредством анализа LOA Sry) у мышей F1 дает веские основания предположить корректное нацеливание. Невозможность косегрегации LacZ/Neo с данной мутацией свидетельствует о том, что первоначальный клон содержал мутацию-делецию Sry (индуцированную посредством TALEN), связанную с трансгенной инсерцией LacZ/Neo в других участках генома.
Потомство самок XY с мутациями Sry с высокой частотой демонстрировали многообразие аномальных кариотипов (включая XXY, XYY и ХО). Число половых хромосом оценивали с использованием несвязанных анализов утраты аллеля (LOA) для генов на Х- и Y-хромосомах. Затем число копий Sry определяли с использованием анализов LOA. Предполагали присутствие мутантного аллеля Sry у мышей, у которых число копий Y-хромосомы превышало число копий Sry (например, 1 копия Y и 0 копий Sry или 2 копии Y и 1 копия Sry). Наконец, присутствие LacZ и Neo определяли с использованием анализов TaqMan.
В первоначальном наборе клонов, которые были созданы посредством Sry LTVEC вместе с нуклеазой TALEN и выращены в KO-DMEM, было очевидным, что кассета LacZ/Neo не была косегрегирована с мутацией Sry. Пример помета от этих клонов показан в таблице 4.
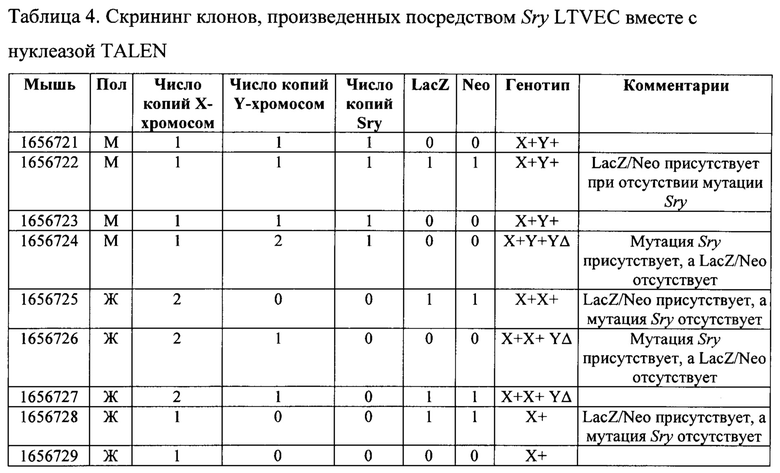
В последующем наборе клонов, которые были созданы посредством Sry LTVEC вместе с нуклеазой TALEN и выращены в DMEM, кассета LacZ/Neo была полностью косегрегирована с мутацией Sry, указывая на корректное нацеливание. Типичный помет от этих клонов показан в таблице 5.
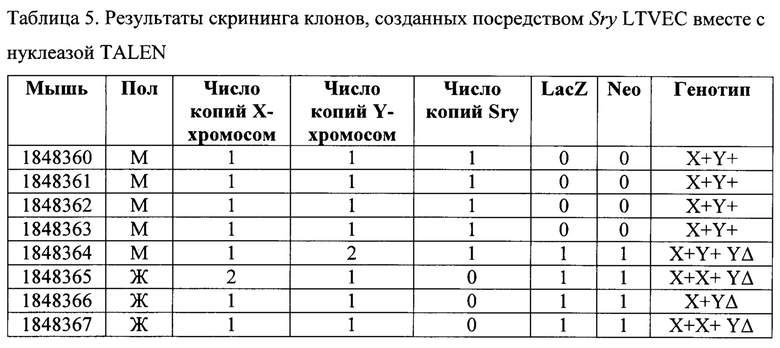
Пример 4. TALEN- и CRISPR-опосредованное нацеливание на Sry посредством SmallTVEC или LTVEC
Как показано на ФИГ. 2, целевую делецию, содержащую замещение lacZ аллеля для Sry, создавали с помощью либо LTVEC, либо малого нацеливающего вектора (smallTVEC) вместе либо с нуклеазой TALEN, либо с гидовыми РНК CRISPR в сочетании с ДНК-эндонуклеазой Cas9. smallTVEC содержал в указанном порядке: вышележащее гомологичное плечо длиной приблизительно 700-800 п. н., последовательность, кодирующую бетагалактозидазу (lacZ) с последующим сигналом полиаденилирования, кассету устойчивости к неомицину, фланкированную сайтами 1охР, содержащими человеческий промотор убиквитина С, включая первый экзон, первый интрон и часть второго экзона, последовательность, кодирующую неомицинфосфотрансферазу, и сигнал полиаденилирования, и нижележащее гомологичное плечо длиной приблизительно 700-800 п. н. Аллель, созданный посредством корректного нацеливания на ген Sry с помощью нацеливающего вектора, содержит делецию длиной приблизительно 1 т. п. н., открытую рамку считывания Sry и замещение кассетой lacZ-neo, так что последовательность, кодирующая бетагалактозидазу, слита в рамке в старт-кодоне Sry. Использовали нацеливающий вектор для нацеливания на ген Sry у F1 гибридной линии ЭС-клеток VGF1 (также известной как F1H4) C57BL6/129 и линии ЭС-клеток VGB6 (также известной как В6А6).
Как показано в таблице 6, производили клоны, произведенные с использованием четырех различных гРНК и одной пары TALEN, и подвергали их скринингу на расщепление и утрату аллеля посредством анализов TaqMan.
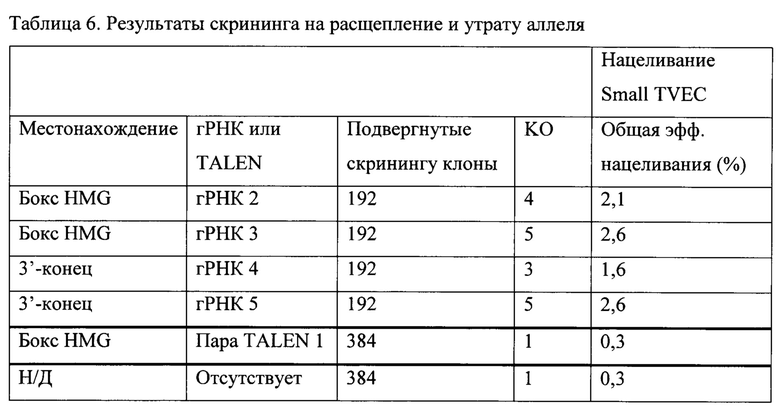
Трансгенные клоны LTVEC производили эмбрионы с таким же шаблоном lacZ. На ФИГ. 3 проиллюстрирована экспрессия LacZ в эмбрионах. В таблице 7 приведены результаты для самок XY, происходящих от ЭС-клеток, выращенных в стандартной среде на основе DMEM, которые имели TALEN-опосредованные, нацеленные с помощью LTVEC мутации делеции-замещения Sry. Неожиданно, в сравнении с результатами похожего эксперимента с ЭС-клетками, выращенными в среде на основе KO-DEMEM (таблица 3), нацеливание с помощью LTVEC в среде на основе DMEM произвело клоны с корректно нацеленными на Sry делециями и инсерциями lacZ-neo. Сорок из 41 самки XYSry(lacZ), происходящих от четырех нацеленных клонов, после спаривания произвели живорожденных детенышей - показатель фертильности составил 98%. Таким образом, авторы настоящего изобретения разработали два новых пути производства высокофертильных самок XY из мутантных ЭС-клеток: (1) TALEN-индуцированные инактивирующие мутации в Sry в ЭС-клетках, выращиваемых в среде на основе KO-DMEM; и (2) TALEN-опосредованные, нацеливаемые с помощью LTVEC точные мутации делеции-замещения в ЭС-клетках, выращиваемых в среде на основе DMEM.

Пример 5. Большая делеция на Y-хромосоме, опосредованная ZFN
Как показано на ФИГ. 4, большие делеции, длиной 500 т. п. н. или более, создавали на Y-хромосоме с использованием нацеливания ZFN на гены Kdm5d и Usp9y. В таблице 8 представлены примеры последовательностей «цинковых пальцев» на Y-хромосоме.
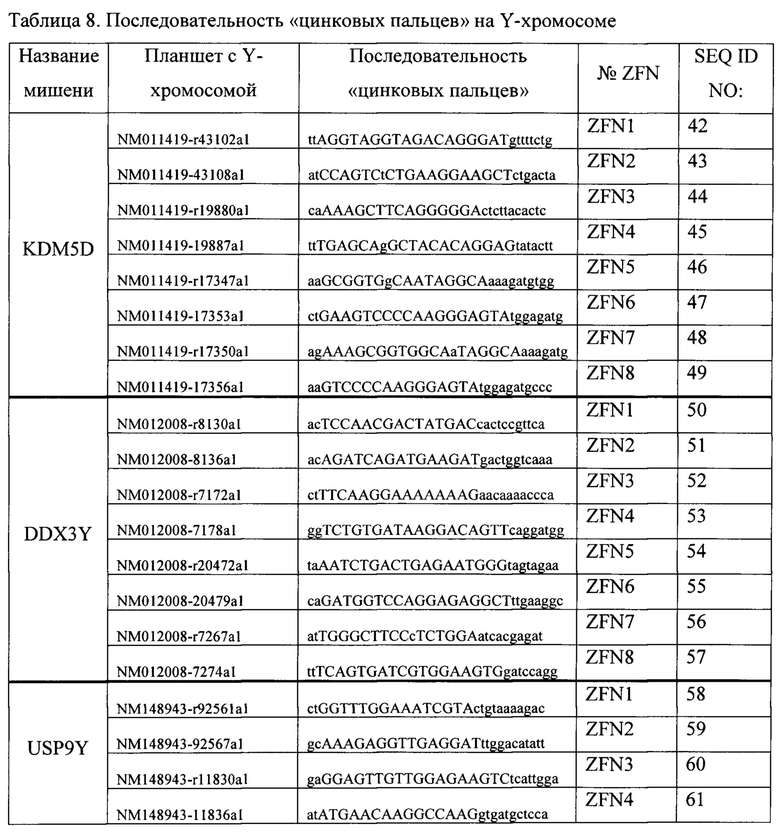

В одном эксперименте для обеспечения селекции на устойчивость к пуромицину 3,3 миллиона ЭС-клеток от VGB6 клонов D-G5 и E-G7 (таблица 3) подвергали электропорации с использованием пар мРНК ZFN Kdm5d-ZFN5(NM011419-r17347a1)/ZFN6(NM011419-17353a1) и Usp9y-ZFN3(NM148943-r11830a1)/ZFN4(NM148943-11836a1) (каждая no 10 мкг) и с помощью нацеливания LTVEC на ген Ch25h (0,67 мкг). Пуромицин-устойчивые колонии собирали и подвергали скринингу на данную делецию. Результаты представлены в таблице 9.
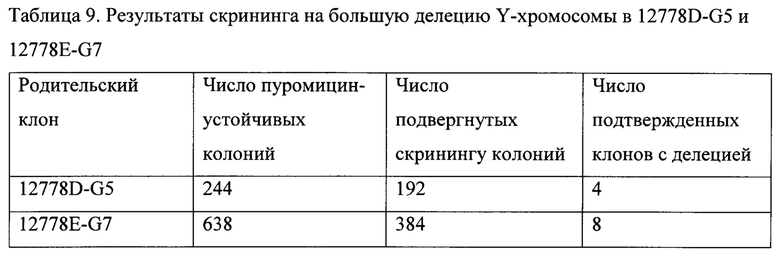
В таблице 10 показаны точные размеры делеций длиной более 500 т. п. н., которые определяли точно для одного клона с делецией (4306A-D5), происходящего от родительского клона E-G7 (таблица 3) и двух клонов с делециями (4306Е-С4 и 4306F-А12), происходящих от родительского клона D-G5 (таблица 3).
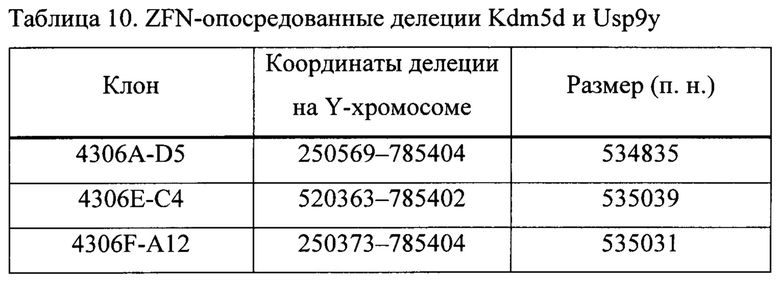
Делеции генов Kdm5d, Eif2s3y, Uty, Ddx3y и Usp9y (ФИГ. 4) подтверждали в анализах на делецию на утрату аллеля и ДНК-секвенированием, как показано на ФИГ. 5. После микроинъекции в эмбрионы на стадии 8 клеток и переноса в суррогатных матерей клон 4306A-D5 произвел девять самок XY, полностью произошедших от ЭС-клеток VelociMice. Ни одна из самок XY из клона 4306A-D5 не была фертильной.
Пример 6. Большая делеция на Y-хромосоме, опосредованная CRISPR/Cas
Была создана большая делеция на Y-хромосоме, нацеленная на область между генами Kdm5d и Usp9y с использованием гидовых РНК CRISPR в сочетании с ДНК-эндонуклеазой Cas9. гРНК были сконструированы для нацеливания на ген Kdm5d и ген Usp9y. Для нацеливания на Kdm5d сконструировали следующие гРНК: Kdm5dgA (гид №1) UUUGCCGAAUAUGCUCUCGU (SEQ ID NO: 66); Kdm5dgB (гид №2) UUGCCGAAUAUGCUCUCGUG (SEQ ID NO: 67); и Kdm5dgC (гид №5) CGGGCAUCUCCAUACUCCCU (SEQ ID NO: 68). Для нацеливания на Usp9y сконструировали следующие гРНК: Usp9ygA (гид №1) UAGCUCGUUGUGUAGCACCU (SEQ ID NO: 69); Usp9ygB (гид №1) UAUAGUUUCUUCGGGGUAAC (SEQ ID NO: 70); и Usp9ygC (гид №2) GGAUACCCUUCUAUAGGCCC (SEQ ID NO: 71).
Для обеспечения селекции на устойчивость к пуромицину ЭС-клетки мыши VGF1 подвергали электропорации с использованием 5 мкг плазмиды, в которой экспрессировался Cas9 и по 10 мкг каждой из плазмид, в которых экспрессировались гРНК В Kdm5d и гРНК С Usp9y, и с использованием LTVEC, нацеленного на ген Ch25h (0,67 мкг).
Как показано на ФИГ. 4, для нацеливания на делецию генов Kdm5d и Usp9y использовали Kdm5dgB (гРНК В) и Usp9ygC (гРНК С). Полученные в результате клоны подвергали скринингу на делецию посредством анализов на утрату аллеля для последовательностей в генах Kdm5d и Usp9y и генах между (Eif2s3y, Uty и Ddx3y) и для генов за пределами целевой делеции (Zfy2 и Sry). Как показано в таблице 11, были получены четыре клона, содержащих большую делецию. После микроинъекции в эмбрионы на стадии 8 клеток и переноса в суррогатных матерей клон R-A8 произвел семь самцов XY и 3 самки XY, полностью происходящие от ЭС-клеток VelociMice.

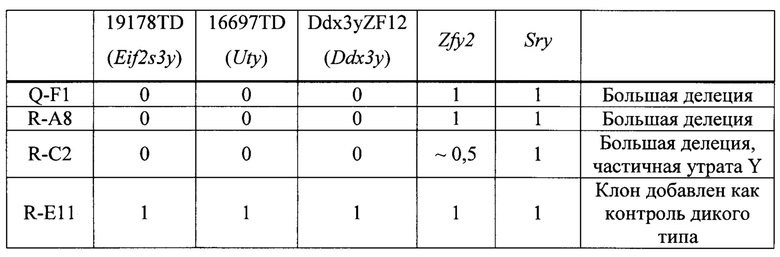
Все публикации и заявки на патенты, упомянутые в настоящем техническом описании, являются показателем уровня среднего специалиста в данной области, к которой относится настоящее изобретение. Все публикации и заявки на патенты включены в настоящий документ путем ссылки в той степени, как если бы каждая отдельная публикация или заявка на патент была конкретно и индивидуально обозначена как включенная путем ссылки. Если информация, связанная со ссылкой на документ, например, номер депонирования, изменяется со временем, подразумевается действующая версия информации на действительную дату подачи данной заявки, при этом действительная дата подачи обозначает актуальную дату подачи заявки или дату приоритетной заявки, в которой впервые содержится ссылка на документ. Если из контекста не следует иное, любой вариант осуществления, аспект, этап или признак изобретения может быть использован в сочетании с любым другим. Ссылка на диапазон включает в себя любые целые числа в пределах диапазона, любой поддиапазон в пределах диапазона. Ссылка на множество диапазонов включает в себя комбинации таких диапазонов.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ НАЦЕЛЕННЫХ ГЕНЕТИЧЕСКИХ МОДИФИКАЦИЙ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2771532C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ МОДИФИКАЦИИ ЦЕЛЕВОГО ЛОКУСА | 2015 |
|
RU2704283C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ПОЛУЧЕНИЯ ИЛИ ПОДДЕРЖАНИЯ ПЛЮРИПОТЕНТНЫХ КЛЕТОК | 2015 |
|
RU2706965C2 |
| НАПРАВЛЕННАЯ МОДИФИКАЦИЯ ГЕНОМА КРЫСЫ | 2014 |
|
RU2676708C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ НАПРАВЛЕННОЙ МОДИФИКАЦИИ ГЕНОМА | 2014 |
|
RU2725520C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ НАПРАВЛЕННОЙ МОДИФИКАЦИИ ГЕНОМА | 2020 |
|
RU2751237C1 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ НАПРАВЛЕННОЙ МОДИФИКАЦИИ ГЕНОМА | 2014 |
|
RU2685914C1 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ НАЦЕЛЕННОЙ ГЕНЕТИЧЕСКОЙ МОДИФИКАЦИИ ПОСРЕДСТВОМ ОДНОЭТАПНОГО МНОЖЕСТВЕННОГО НАЦЕЛИВАНИЯ | 2015 |
|
RU2707137C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ НАЦЕЛЕННОЙ ГЕНЕТИЧЕСКОЙ МОДИФИКАЦИИ С ИСПОЛЬЗОВАНИЕМ ПАРНЫХ ГИДОВЫХ РНК | 2015 |
|
RU2734770C2 |
| СЕЛЕКЦИЯ ПЛЮРИПОТЕНТНЫХ КЛЕТОК ДЛЯ ПРОДУЦИРОВАНИЯ ФЕРТИЛЬНЫХ XY САМОК МЫШЕЙ | 2016 |
|
RU2729407C1 |



















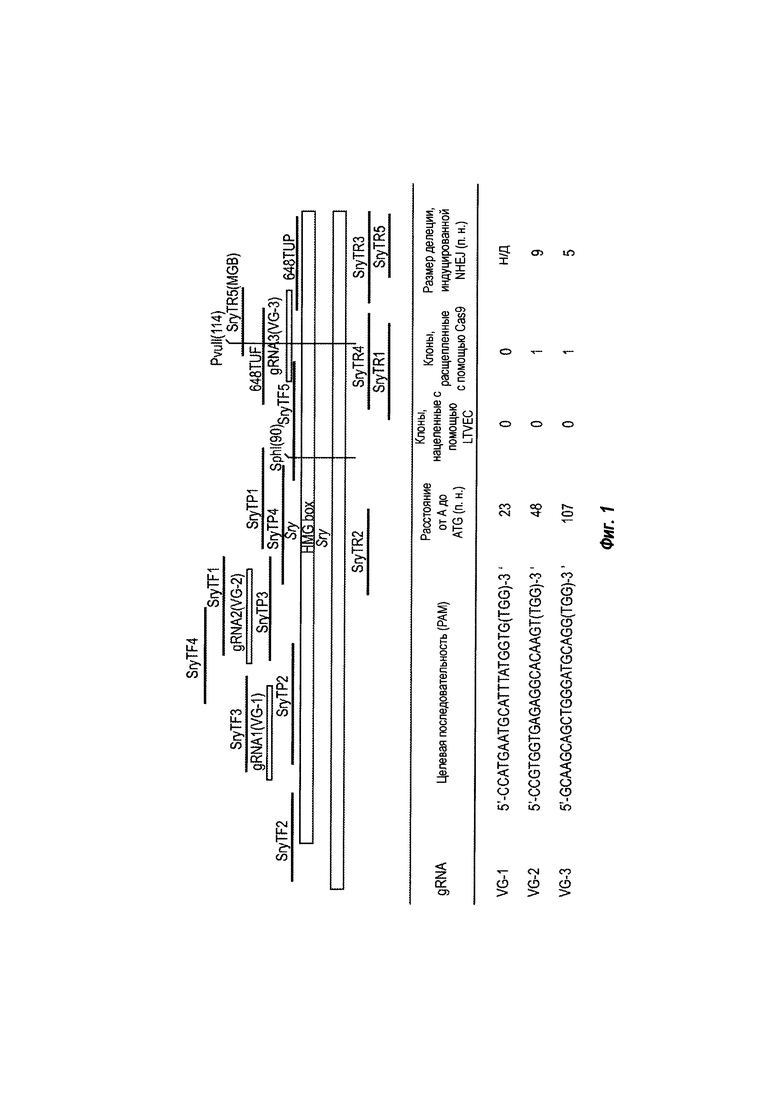
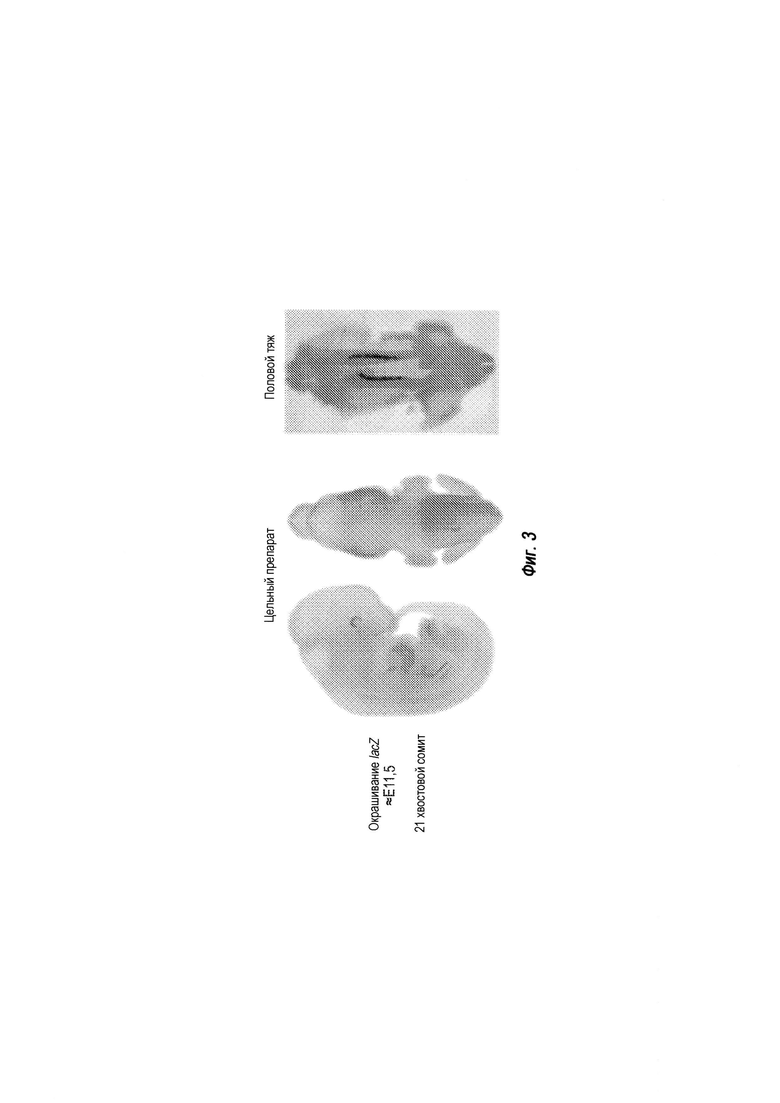
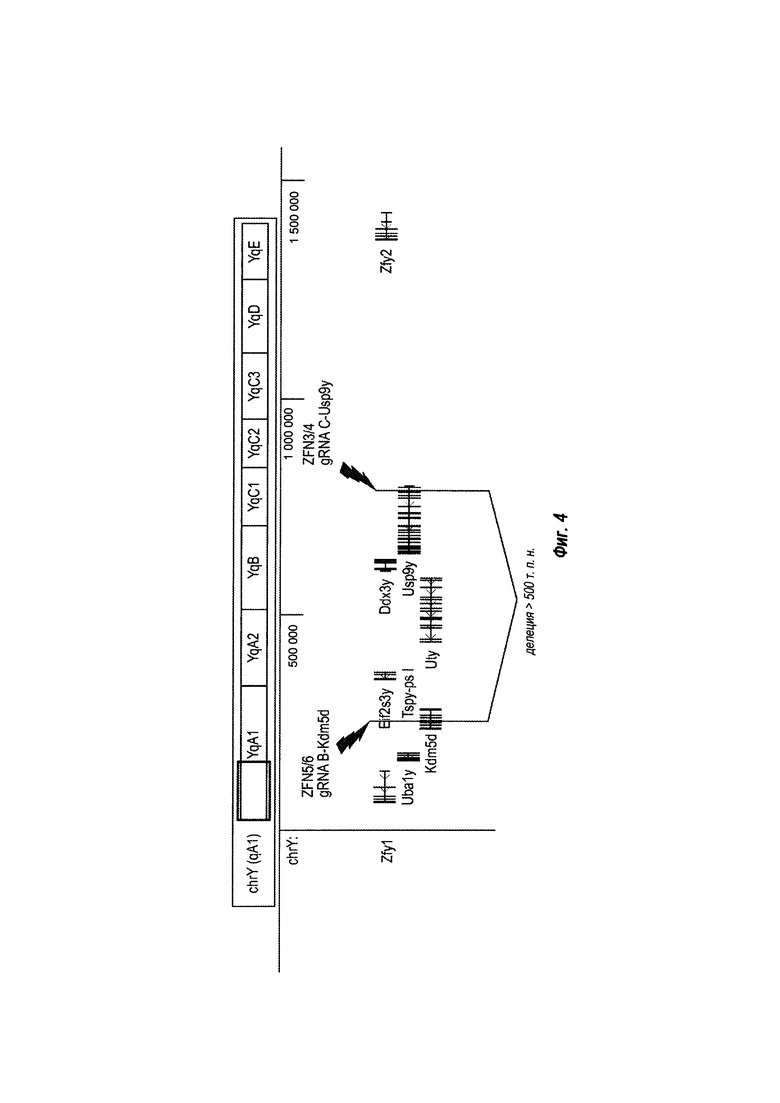
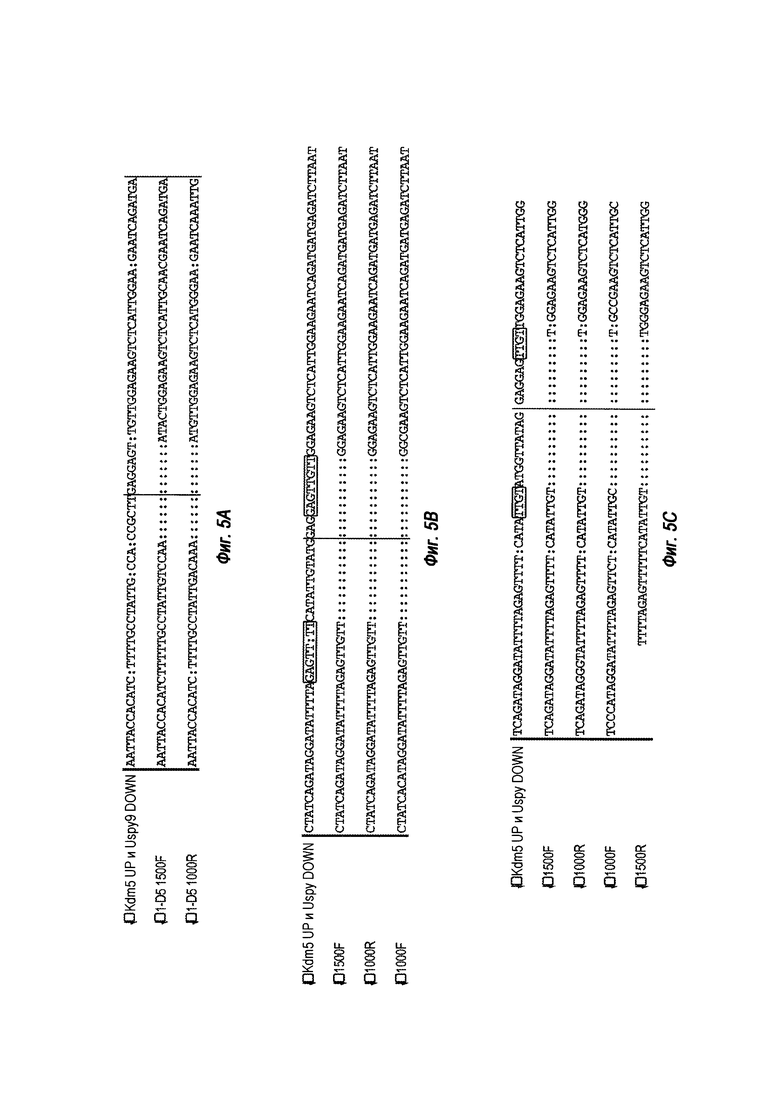
Изобретение относится к области биохимии, в частности к способу модификации целевого геномного локуса на Y-хромосоме в мышиной эмбриональной стволовой клетке (ЭС). При этом способ предусматривает: обеспечение мышиной ЭС клетки, содержащей целевой геномный локус на Y-хромосоме, причем целевой геномный локус содержит сайт распознавания для нуклеазного агента, и где мышиная ЭС клетка находится в культуре, содержащей основную среду DMEM, введение в мышиную ЭС клетку нуклеазного агента или полинуклеотида, кодирующего нуклеазный агент, причем нуклеазный агент индуцирует одно- или двухцепочечный разрыв на сайте распознавания, и большого нацеливающего вектора, содержащего полинуклеотидную вставку, и идентификацию по меньшей мере одной мышиной ЭС клетки, содержащей в своем геноме полинуклеотидную вставку, интегрированную в целевой геномный локус. Изобретение позволяет эффективно модифицировать целевой геномный локус на Y-хромосоме в мышиной эмбриональной стволовой клетке. 11 з.п. ф-лы, 5 ил., 11 табл., 4 пр.
1. Способ модификации целевого геномного локуса на Y-хромосоме в мышиной эмбриональной стволовой клетке (ЭС), включающий:
(a) обеспечение мышиной ЭС клетки, содержащей целевой геномный локус на Y-хромосоме, причем целевой геномный локус содержит сайт распознавания для нуклеазного агента, и где мышиная ЭС клетка находится в культуре, содержащей основную среду DMEM;
(b) введение в мышиную ЭС клетку:
(i) нуклеазного агента или полинуклеотида, кодирующего нуклеазный агент, причем нуклеазный агент индуцирует одно- или двухцепочечный разрыв на сайте распознавания, и
(ii) большого нацеливающего вектора, содержащего полинуклеотидную вставку, фланкированную первым и вторым гомологичными плечами, соответствующими первому и второму целевым сайтам, расположенным в пределах целевого геномного локуса, в котором суммарная длина первого гомологичного плеча и второго гомологичного плеча составляет по меньшей мере 10 т.п.н., и где нацеливающий вектор способствует гомологичной рекомбинации с целевым геномным локусом; и
(c) идентификацию по меньшей мере одной мышиной ЭС клетки, содержащей в своем геноме полинуклеотидную вставку, интегрированную в целевой геномный локус, причем интеграция полинуклеотидной вставки вводит генетическую модификацию, содержащую делецию эндогенной нуклеотидной последовательности и замещение экзогенной нуклеотидной последовательностью в целевом геномном локусе.
2. Способ по п. 1, в котором суммарная длина первого гомологичного плеча и второго гомологичного плеча составляет менее чем 150 т.п.н.
3. Способ по п. 1 или 2, в котором нуклеазный агент представляет собой:
(a) нуклеазу с «цинковыми пальцами» (ZFN);
(b) эффекторную нуклеазу, подобную активатору транскрипции (TALEN);
(c) мегануклеазу;
(d) белок (Cas), ассоциированный с короткими палиндромными повторами, регулярно расположенными группами (CRISPR), и гидовую РНК (гРНК); или
(e) мРНК, кодирующую нуклеазу.
4. Способ по п. 3, в котором нуклеазный агент представляет собой белок Cas и гРНК, причем белок Cas представляет собой Cas9, и при этом гРНК включает:
(a) РНК CRISPR (крРНК), нацеленную на сайт распознавания, при этом сайт распознавания непосредственно фланкирован последовательностью мотива, прилежащего к протоспейсеру (РАМ); и
(b) трансактивирующую РНК CRISPR (тракрРНК).
5. Способ по любому из пп. 1-4, в котором длина полинуклеотидной вставки составляет от около 5 т.п.н. до около 200 т.п.н., от около 200 т.п.н. до около 250 т.п.н., от около 250 т.п.н. до около 300 т.п.н., от около 300 т.п.н. до около 350 т.п.н. или от около 350 т.п.н. до около 400 т.п.н.
6. Способ по любому из пп. 1-5, в котором полинуклеотидная вставка содержит условный аллель, полинуклеотид, кодирующий селективный маркер, нуклеиновую кислоту, фланкированную целевыми последовательностями сайт-специфической рекомбинации, или репортерный ген, функционально связанный с промотором, причем репортерный ген кодирует репортерный белок, который выбирают из группы, состоящей из белков LacZ, mPlum, mCherry, tdTomato, mStrawberry, J-Red, DsRed, mOrange, mKO, mCitrine, Venus, YPet, усиленного желтого флуоресцентного белка (EYFP), Emerald, усиленного зеленого флуоресцентного белка (EGFP), CyPet, голубого флуоресцентного белка (CFP), Cerulean, T-Sapphire, люциферазы, щелочной фосфатазы и их комбинации.
7. Способ по любому из пп. 1-6, в котором модификация содержит перестановку доменов, перестановку экзонов, перестановку интронов, перестановку регуляторных последовательностей, перестановку генов или их комбинацию.
8. Способ по любому из пп. 1-7, в котором делеция эндогенной нуклеотидной последовательности находится в диапазоне от около 5 т.п.н. до около 10 т.п.н., от около 10 т.п.н. до около 20 т.п.н., от около 20 т.п.н. до около 40 т.п.н., от около 40 т.п.н. до около 60 т.п.н., от около 60 т.п.н. до около 80 т.п.н., от около 80 т.п.н. до около 100 т.п.н., от около 100 т.п.н. до около 150 т.п.н. или от около 150 т.п.н. до около 200 т.п.н., от около 200 т.п.н. до около 300 т.п.н., от около 300 т.п.н. до около 400 т.п.н., от около 400 т.п.н. до около 500 т.п.н., от около 500 т.п.н. до около 1 млн п.н., от около 1 млн п.н. до около 1,5 млн п.н., от около 1,5 млн п.н. до около 2 млн п.н., от около 2 млн п.н. до около 2,5 млн п.н. или от около 2,5 млн п.н. до около 3 млн п.н.
9. Способ по любому из пп. 1-8, в котором делеция эндогенной нуклеотидной последовательности составляет по меньшей мере 500 т.п.н.
10. Способ по любому из пп. 1-9, в котором модификация содержит замещение эндогенной нуклеотидной последовательности гомологичной или ортологичной нуклеотидной последовательностью.
11. Способ по любому из пп. 1-10, в котором целевой геномный локус на Y-хромосоме представляет собой ген Sry, ген Uty, ген Eif2s3y, ген Ddx3y, ген Ube1y, ген Tspy, ген Usp9y, ген Zfyl, ген Zfy2 или область, охватывающую гены Kdm5d, Eif2s3y, Tspy, Uty, Ddx3y и Usp9y.
12. Способ по любому из пп. 1-10, в котором целевой геномный локус на Y-хромосоме содержит ген Sry.
| HAOYI WANG et al., TALEN-mediated editing of the mouse Y chromosome, NATURE BIOTECHNOLOGY, vol | |||
| Способ очистки нефти и нефтяных продуктов и уничтожения их флюоресценции | 1921 |
|
SU31A1 |
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| Шпалорезный станок | 1921 |
|
SU530A1 |
| HAOYI WANG et al., Supplementary information: TALEN-mediated editing of the mouse Y chromosome", NATURE BIOTECHNOLOGY, vol | |||
| Способ очистки нефти и нефтяных продуктов и уничтожения их флюоресценции | 1921 |
|
SU31A1 |
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| DECHIARA T | |||
| M | |||
| et al., VelociMouse: Fully ES Cell-Derived F0-Generation | |||
Авторы
Даты
2020-01-21—Публикация
2015-06-26—Подача