Изобретение относится к медицине, конкретно к фармакологии, и касается средств, обладающих гиполипидемическими свойствами, и может быть использовано в лечении заболеваний, сопровождающихся развитием дислипидемий. Изобретение позволяет снизить уровень холестерина и триглицеридов в сыворотке крови и обеспечивает расширение арсенала гиполипидемических средств.
Для коррекции нарушений липидного профиля крови (дислипидемий) имеются гиполипидемические средства с разнообразными механизмами влияния на метаболизм холестерола и триглицеролов. Центральное место занимает терапия ингибиторами 3-гидрокси-3-метилглутарил коэнзим А (ГМГ-КоА) редуктазы (статины), активаторами липопротеинлипазы (никотиновая кислота, фибраты), средствами, тормозящими всасывание холестерола в кишечнике (эзетимиб) [1, 2]. В патогенезе дислипидемий и состояний, ассоциированных с нарушением липидного состава сыворотки крови, значительную роль играет JNK (c-Jun N-terminal kinase) [3-7]. Известны способы лечения заболеваний или патологических состояний человека с использованием химических соединений, обладающих способностью ингибировать активность протеинкиназ, в том числе JNK [8]. Однако, гиполипидемическая активность JNK ингибиторов предполагается авторами исходя из биологической роли этой киназы и не подкреплена экспериментальными данными.
Известны также способы коррекции атеросклероза с применением гетероарильных соединений, обладающих свойствами ингибитора протеинкиназы Cθ, mTOR и JNK [9], а также с использованием диаминопиримидиновых соединений, обладающих свойствами ингибитора JNK1/JNK2 [10]. Описан способ применения изотиазолоантрона, изоксазолоантрона, изоиндолантрона и их производных, включая их фармацевтически приемлемые соли [11]. Однако, мишенью такого воздействия в подавляющем большинстве случаев является контроль клеточного цикла и ангиогенез, а не снижение уровней ТАГ и ХС крови до целевых значений.
Кроме того, известен способ коррекции метаболических нарушений (включая нарушения липидного обмена) с использованием высокоселективных ингибиторов JNK [12-15], но приведенные способы относятся к терапии или предотвращению развития инсулинорезистентности, диабета и/или ожирения, а также состояний, при которых требуется изменение пищевого поведения. Возможность влияния на липидный профиль крови не представлена.
Описаны способы [16-17], в соответствии с которыми ингибиторы JNK могут быть использованы для лечения метаболических нарушений (в т.ч. дислипидемий). Тем не менее, в этих изобретениях не изучена способность ингибиторов модулировать уровни нормы холестерина (ХС) и триглицеридов (ТАГ) в сыворотке крови. Вещества представлены пептидными ингибиторами пути передачи сигнала JNK, отличающимися коротким периодом жизни после проникновения в клетку. Это связано с тем, что данные вещества быстро подвергаются протеолитической деградации.
Описано изобретение, которое относится к способу лечения атеросклероза и включает введение пациенту ингибитора JNK [18]. В указанном способе антиатеросклеротическое действие ингибитора JNK достигается за счет подавления основных стадий формирования атером в интиме сосудов: миграции лейкоцитов [19], образования пенистых клеток [20], вовлечения Т-клеток в процесс [21-25], аномальной пролиферации гладких мышц сосудов [26-27]. Недостатком приведенного выше способа является его влияние на патогенетические звенья развития атеросклеротического поражения на стадиях формирования атером с отсутствием влияния на липидный профиль крови,
Применение ингибиторов JNK с целью снижения уровней ТАГ и ХС в сыворотке крови в литературе не описано.
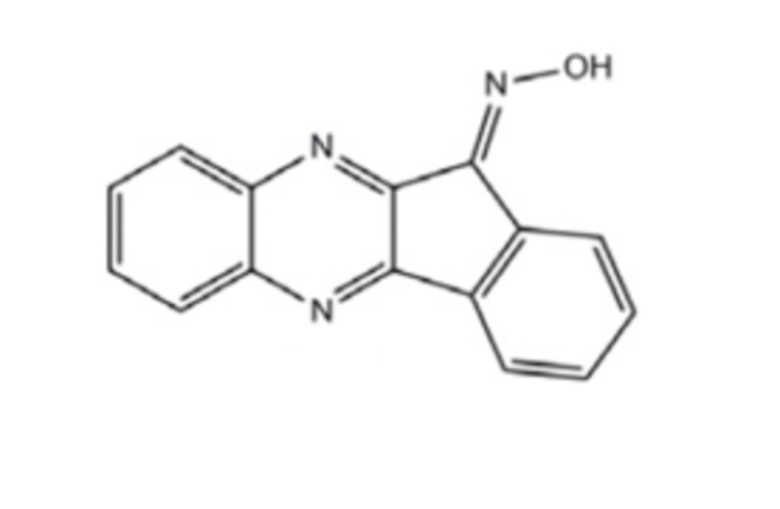
Таким образом, принципиально новым в предполагаемом изобретении является то, что в качестве гиполипидемического средства используется 11Н-индено[1,2-b]хиноксалин-11-он-оксим (IQ-1). Соединение может быть использовано для коррекции заболеваний, связанных с дислипидемией.
В основу настоящего изобретения положена задача расширения номенклатуры средств, обладающих гиполипидемическими свойствами.
Поставленная задача решается использованием 11Н-индено[1,2-b]хиноксалин-11-он оксима в качестве гиполипидемического средства.
Известно, что соединение обладает свойствами специфического ингибитора с-Jun-N-терминальной киназы [28] и противовоспалительной активностью на модели коллаген-индуцированного артрита [29]. Также имеются данные о том, что IQ-1 улучшает исход инсульта у мышей в условиях модели фокальной ишемии головного мозга с реперфузией и может быть донатором NO в ходе ферментативного метаболизма в микросомах печени [30]. Кроме того, у соединения IQ-1 выявлен антирадикальный эффект [31]. Известны способы использования данного соединения в качестве гемостимулирующего средства [32], а также средства, обладающего антиагрегантной активностью [33]. Исследование гипотриацилглицеролемических и гипохолестеролемических свойств соединения при дислипидемиях в литературе не описано.
Гиполипидемическая активность 11Н-индено[1,2-b]хиноксалин-11-он оксима (IQ-1) была обнаружена благодаря экспериментальным исследованиям.
Эксперименты проводили на 24 аутбредных крысах самцах массой 300-350 г. Животные находились в стандартных условиях содержания в виварии на естественном световом режиме, при свободном доступе к воде и пище.
Для изучения гиполипидемической активности новых веществ широкое применение находит способ моделирования гиперлипидемии с помощью длительного (5-6 недель) кормления экспериментальных животных высокожировой диетой, богатой холестеролом с последующей инъекцией низкой дозы диабетогена стрептозотоцина [34, 35]. Готовый высокожировой корм, состоял из 26% кокосового масла, 2% холестерина и 72% стандартного корма для лабораторных животных (55% энергии за счет жира). Стандартный лабораторный корм представлял собой гранулы с минеральными и витаминными добавками для лабораторных крыс с общей калорийностью 3660 ккал / кг.
Животные были рандомизированы случайным образом на три группы: 1-я группа - контрольные животные, получавшие стандартный лабораторный корм в течение всего эксперимента, 2-я группа - животные с экспериментальной дислипидемией, 3-я группа - животные с экспериментальной дислипидемией, получавшие исследуемое соединение. Экспериментальные животные 2 и 3 групп получали атерогенную диету (высокожировой корм) в течение 4 недель. На 29 сутки животным, получавшим высокожировой корм, после 12-часового голодания, вводили однократно внутрибрюшинно свежеприготовленный раствор стрептозотоцина (35 мг/кг) в 0,1 М цитратном буфере (pH 4,5), после чего животные содержались на высокожировой диете в течение 2 недель. Начиная с 44 дня экспериимента животным 3 группы ежедневно интраперитонеально вводили водную суспензию 11H-индено[1,2-b]хиноксалин-11-он-оксима IQ-1 (20 мг/кг) в течение 14 суток. Животным 1 и 2 групп вводили носитель (вода для инъекций).
В конце эксперимента крыс декапитировали после СО2-асфиксии. В сыворотке крови определяли уровень общего холестерола (ХС), холестерола в липопротеинах низкой (ХС-ЛНП) и высокой (ХС-ЛВП) плотности, а также триацилглицеролов. Измерения проводили спектрофотометрически с использованием наборов фирмы Chronolab и RANDOX. На основе полученных экспериментальных данных был вычислен индекс атерогенности по формуле ИА = (общий ХС - ЛПВП-ХС)/ЛПВП-ХС [36].
Для статистической обработки полученных результатов использовался пакет прикладных программ SPSS Statistics 23 (IBM). Применялся непараметрический дисперсионный анализ Краскела-Уоллиса для независимых групп с последующим попарным сравнением по критерию Манна-Уитни.
Результаты исследований гиполипидемической активности IQ-1 представлены в примерах 1-5.
Пример 1. Кормление лабораторных животных высокожировой диетой в течение 28 дней приводит к развитию значительной гиперхолестеролемии: уровень общего холестерола в плазме крови крыс (табл. 1: Модель дислипидемии) составил 13,59 (8,29-17,34) ммоль/л. Ежедневное интраперитонеальное введение водной суспензии IQ-1 в дозе 20 мг/кг приводит к снижению содержания общего холестерола в сыворотке крови лабораторных животных с моделью экспериментальной дислипидемии до 5,75 (3,58-7,88) ммоль/л (табл. 1).
Пример 2. Кормление лабораторных животных высокожировой диетой в течение 28 дней приводит к увеличению содержания холестерола в липопротеинах низкой плотности (ХС-ЛНП) сыворотки крови крыс (табл. 2: Модель дислипидемии) до 5,55 (3,76-7,59) ммоль/л. Ежедневное интраперитонеальное введение водной суспензии IQ-1 в дозе 20 мг/кг приводит к снижению содержания ХС-ЛНП в сыворотке крови лабораторных животных с моделью экспериментальной дислипидемии до 1,83 (1,05-4,14) ммоль/л (табл. 2).
Пример 3. Кормление лабораторных животных высокожировой диетой в течение 28 дней не приводит к изменению содержания холестерола в липопротеинах высокой плотности (ХС-ЛВП) сыворотки крови крыс (табл. 3: Модель дислипидемии). Ежедневное интраперитонеальное введение водной суспензии IQ-1 в дозе 20 мг/кг также не приводит к снижению содержания антиатерогенного ХС-ЛВП в сыворотке крови лабораторных животных с моделью экспериментальной дислипидемии (табл. 3).
Пример 4. Кормление лабораторных животных высокожировой диетой в течение 28 дней приводит к увеличению индекса атерогенности (ИА) сыворотки крови крыс (табл. 4: Модель дислипидемии) до 14,0 (8,86-16,62). Ежедневное интраперитонеальное введение водной суспензии IQ-1 в дозе 20 мг/кг приводит к снижению ИА сыворотки крови лабораторных животных с моделью экспериментальной дислипидемии до 4,93 (3,75-7,12) (табл. 4).
Пример 5. Кормление лабораторных животных высокожировой диетой в течение 28 дней приводит к увеличению уровня триацилглицеролов в сыворотке крови крыс (табл. 5) до 5,08 (2,92-7,03) ммоль/л. Ежедневное интраперитонеальное введение водной суспензии IQ-1 в дозе 20 мг/кг приводит к снижению уровня триацилглицеролов в сыворотке крови лабораторных животных с моделью экспериментальной дислипидемии до 1,85 (1,33-3,11) ммоль/л (табл. 5).
Таким образом, соединение 11H-индено[1,2-b]хинокса-лин-11-он-оксим (IQ-1) обладает гиполипидемической активностью и эффективно нормализует показатели липидного профиля крови лабораторных крыс в условиях экспериментальной дислипидемии.
Источники литературы, принятые во внимание
1. Карпов, Ю. А. Европейские рекомендации по лечению дислипидемий - 2016. Липидснижающая терапия у пациентов с острым коронарным синдромом и чрескожными коронарными вмешательствами / Ю. А. Карпов, О. С. Булкина // Медицинский совет. - 2016. - № 17. - С. 18-23.
2. Efficacy and safety of LDL-lowering therapy among men and women: me-ta-analysis of individual data from 174,000 participants in 27 random-ized trials / J. Fulcher, R. O'Connell, M. Voysey et al. // Lancet. - 2015. - Vol. 385, N 9976. - P. 1397-1405.
3. RU 2657757 C2 «Новые экстракты из cynara scolymus, coffea spp. и olea europaea для лечения метаболического синдрома»
4. RU 2432959 C1 «Средство, обладающее антиоксидантным, кардиопротекторным, противодиабетическим, противовоспалительным, гепатопротекторным, противоопухолевым и противовирусным действием»
5. RU 2696310 C1 «Бициклические гетероциклические соединения и их применение в терапии»
6. RU 2696269 C1 «Замещенные 3-азабицикло[3.1.0]гексаны в качестве ингибиторов кетогексокиназы»
7. WO 2006130297 «Solid forms of a JNK inhibitor»
8. RU 2487121 C2 «Соединения и способы модулирования киназ и показания к применению указанных соединений и способов»
9. RU 2478635 C2 «Гетероарильные соединения, содержащие их композиции и способы лечения с применением этих соединений»
10. RU 2697712 C2 «Замещенные диаминокарбоксамидные и диаминокарбонитрильные производные пиримидинов, их композиции и способы лечения с их помощью»
11. US 2004092562 «Methods for treating inflammatory conditions or inhibiting JNK»
12. US 2016185818 «Bidentate-binding modulators of lrrk2 and JNK kinases»
13. US 2005148624 «JNK inhibitor»
14. US 2006019910 «Methods for treating and preventing insulin resistance and related disorders»
15. US 2007207137 «Inhibition of Jun Kinase»
16. MX 2016017308 «New use of cell-permeable peptide inhibitors of the JNK signal transduction pathway for the treatment of various diseases»
17. JP 2013081479 «Cell-permeable peptide inhibitor of JNK signal transduction pathway»
18. WO 2005074921 «Treatment of atherosclerosis»
19. The Ras-JNK pathway is involved in shear-induced gene expression / Y.S.Li, J.Y. Shyy, S. Li et al. // Mol Cell Biol. – 1996. - Vol. 16, N 11. - P. 5947-54
20. Mietus-Snyder M., Glass C.K., Pitas R.E. Transcriptional activation of scavenger receptor expression in human smooth muscle cells requires AP-1/c-Jun and C/EBPbeta: both AP-1 binding and JNK activation are induced by phorbol esters and oxidative stress / M. Mietus-Snyder, C.K. Glass, R.E. Pitas // Arterioscler Thromb Vasc Biol. – 1998 – Vol. 18, N 9. – P. 1440-9
21. Cytokine expression in advanced human atherosclerotic plaques: dominance of pro-inflammatory (Th1) and macrophage-stimulating cytokines / J. Frostegеrd, A.K. Ulfgren, P. Nyberg et al. // Atherosclerosis. – 1999. – Vol. 145, N 1. – P. 33-43
22. JNK1 is required for T cell-mediated immunity against Leishmania major infection / S.L. Constant, C. Dong, D.D. Yang et al. // J Immunol. – 2000. – Vol. 165, N 5, P. 2671-6.
23. JNK is required for effector T-cell function but not for T-cell activation / C. Dong, D.D. Yang, C. Tournier et al. // Nature. – 2000 – Vol. 405, N 6782. – P. 91-4.
24. Differentiation of CD4+ T cells to Th1 cells requires MAP kinase JNK2 / D.D. Yang, D. Conze, A.J. Whitmarsh et al. // Immunity. – 1998 – Vol. 9, N 4. – P. 575-85
25. Defective T cell differentiation in the absence of Jnk1 / C. Dong, D.D. Yang, M. Wysk et al. // Science. – 1998. – Vol. 282, N 5396. – P. 2092-5
26. Dominant negative c-Jun inhibits platelet-derived growth factor-directed migration by vascular smooth muscle cells / T. Ioroi, M. Yamamori, K, Yagi et al. // J Pharmacol Sci. – 2003. – Vol. 91, N 2. – P. 145-8
27. Effects of dominant-negative c-Jun on platelet-derived growth factor-induced vascular smooth muscle cell proliferation / Y. Zhan, S. Kim, H. Yasumoto et al. // Arterioscler Thromb Vasc Biol. – 2002. – Vol. 22, N 1. – P. 82-8.
28. Schepetkin I.A., Kirpotina I.N, Khlebnikov A.I. et al. Identification and characterization of a novel class of c-Jun N-terminal kinase inhibitors // Mol. Pharmacol. – 2012. – Vol. 81. – P. 832-845.
29. Schepetkin I.A., Kirpotina I.N, Hammaker D.et al. Anti-inflammatory effects and joint protection in collagen-induced arthritis following treatment with IQ-1S, a selective c-Jun N-terminal kinase inhibitor // J. Pharmacol. Exp.Ther. – 2015. – Vol. 353. – P. 505–516.
30. Atochin D.N., Schepetkin I.A., Khlebnikov A.I. et al. A Novel dual NO-donating oxime and c-Jun N-terminal kinase inhibitor protects against cer-ebral ischemia-reperfusion injury in mice // Neurosci. Lett. – 2016. – Vol. 618. – Р. 45–49.
31. Хлебников А.И., Аточин Д.Н., Щепеткин И.А. и др. Поиск нейропротекторов с мультитаргетными свойствами в ряду производных инденохиноксалина // Сборник тезисов докладов Третьего Междисципли-нарного Симпозиума по Медицинской, Органической и Биологической Химии и Фармацевтике 2017 / под редакцией К.В. Кудрявцева и Е.М. Пниной. – М.: «Перо», 2017. – С. 55.
32. RU 2647833 C1«Гемостимулирующее средство»
33. RU 2696583 C1«Средство, обладающее антиагрегантной активностью»
34. Руководство по проведению доклинических исследований лекарственных средств. Часть первая / Под ред. А. Н. Миронова. - М.: Гриф и К. - 2013. - 944 с
35. Skovs∅ S. Modeling type 2 diabetes in rats using high fat diet and streptozotocin / S. Skovs∅ // J Diabetes Investig. - 2014. - Vol. 5, N 4. - P. 349-58.
36. Haglund, O. The effects of fish oil on triglycerides, cholesterol, fibrinogen and malondialdehyde in humans supplemented with vitamin E / O. Haglund, R. Luostarinen, R. Wallin // J. Nutr. - 1991. - V. 121. - P.165-169.
Приложение
Табл.1
р 2_1<0,05 (0,001)
(п=8)
р з.}<0,05 (0,002)
р з-2<0,05 (0^005)
Примечание, п - количество животных в группе; р - уровень статистической значимости различий между группами.
р2-1<0,05 (0,001)
р 3_1<0.05 (0,002)
р з-2<0,05 (0,021)
Примечание: n - количество животных в группе; р - уровень статистической значимости различий между группами.
Табл.3
р 2-1“0,752
р з-1 = 0,958
Р 34 =0,753
Примечание: п - количество животных в группе; р - уровень статистической значимости различий между группами.
Табл. 4
р 2-1 <0,05 (0,00.1)
р 3_1<0,05 (0,003)
р з_2<0,05 (0,006)
Примечание: п - количество животных в группе; р - уровень статистической значимости различий между- группами.
Табл. 5
p2-i<0,05 (0,001)
р з_1<0.05 (0.036)
р з-2<0,05 (0,016)
Примечание: п - количество животных в группе; р - уровень статистической значимости различий между группами.
| название | год | авторы | номер документа |
|---|---|---|---|
| Средство на основе L-рамнопиранозил-6-O-метил-D-галактуронана, обладающее гиполипидемической активностью | 2019 |
|
RU2699802C1 |
| Липидкоррегирующее средство из морских водорослей | 2021 |
|
RU2767908C1 |
| ГИПОЛИПИДЕМИЧЕСКОЕ ФИТОСРЕДСТВО | 2013 |
|
RU2553309C2 |
| Применение производного роданина 3-(2 -фенилэтил)-2-тиоксо-1,3 тиазолидин-4-она для коррекции нарушений обмена веществ | 2019 |
|
RU2768171C2 |
| СПОСОБ ПОСТАДИЙНОГО МОДЕЛИРОВАНИЯ НЕАЛКОГОЛЬНОЙ ЖИРОВОЙ БОЛЕЗНИ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ У КРЫС | 2021 |
|
RU2770555C1 |
| Способ моделирования диет-индуцированного метаболического синдрома | 2020 |
|
RU2740007C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ЭЛЕКТРОЛИТНОЙ НЕФРОПАТИИ У КРЫС | 2003 |
|
RU2256953C2 |
| СПОСОБ МОДЕЛИРОВАНИЯ ПОЛИОРГАННОЙ ПАТОЛОГИИ У КРЫС | 2011 |
|
RU2453002C1 |
| Применение 2-метил-N-(2-метилфенил)-4-(2-фурил)-5-циано-6-({ 2-[(4-этоксифенил)амино]-2-оксоэтил} тио)-1,4-дигидропиридин-3-карбоксамида в качестве гипогликемического, гиполипидемического средства, способствующего снижению массы тела | 2023 |
|
RU2812569C1 |
| Гемостимулирующее средство | 2017 |
|
RU2647833C1 |



Изобретение относится к применению 11H-индено[1,2-b]хиноксалин-11-он-оксима (IQ-1) в качестве гиполипидемического средства. Изобретение позволяет снизить уровень холестерина и триглицеридов в сыворотке крови и обеспечивает расширение арсенала гиполипидемических средств. 1 ил., 5 табл., 4 пр.
Применение 11H-индено[1,2-b]хиноксалин-11-он-оксима (IQ-1) в качестве гиполипидемического средства.
| I.A.SCHEPETKIN et al., Identification and characterization of a novel class of c-Jun N-terminal kinase inhibitors, MOLECULAR PHARMACOLOGY, 2012, V.81, No.6, p.832-845 | |||
| T | |||
| LIU et al., Curcumin inhibits monocyte chemoattractant protein-1 expression and enhances cholesterol efflux by suppressing the c-Jun N-terminal kinase pathway in macrophage, |
Авторы
Даты
2020-09-18—Публикация
2020-02-04—Подача