Изобретение относится к медицине и фармации и касается фармацевтических композиций, обладающих нейропротекторной активностью, выполненных в форме таблетки, диспергирующейся в полости рта, содержащей в качестве действующего вещества гексаметиленамида бис-(N-моносукцинил-L-глутамил-L-лизина).
Хронические сосудистые заболевания головного мозга являются по распространенности второй в мире причиной деменции после болезни Альцгеймера (БА). Стратегически значимыми направлениями в терапии цереброваскулярных расстройств являются: нормализация гемоперфузии и нейропротекция [Суслина З.А., Кистенев Б.А., Шарыпова Т.Н. и др. Кавинтон в лечении больных с ишемическими нарушениями мозгового кровообращения // Русск. мед. журн. 2002, №25, 1170-1174.]. Потенциально эффективными в фармакотерапии хронической ишемии мозга и других нейродегенеративных заболеваний являются препараты на основе эндогенного нейропротектора - фактора роста нервов (NGF), который участвует в поддержании жизнеспособности и функционирования периферических и центральных нейронов. NGF также активно участвует в патогенезе БА, так как прогрессирующее снижение когнитивных функций при БА связано с дегенерацией холинергических нейронов базальных отделов переднего мозга, которые в центральной нервной системе являются основной мишенью данного нейротрофина, обеспечивающего сохранение их биохимического и морфологического фенотипа, выживаемость в присутствии повреждающих факторов [Sofroniew М.V., Howe С.L., Mobley W.С. Nerve growth factor signaling, neuroprotection, and neural repair // Annual review of neuroscience. - 2001. - T. 24. - №.1. - C. 1217-1281.; Gelfo F. et al. Brain and serum levels of nerve growth factor in a rat model of Alzheimer's disease // Journal of Alzheimer's Disease. - 2011. - T. 25. - №.2. - C. 213-217.].
Было продемонстрировано, что применение NGF при внутримозговом введении в условиях моделирования ишемии головного мозга значительно повышает выживаемость нейронов, ингибирует экспрессию проапоптотического белка каспазы-3 и индуцирует экспрессию антиапоптотического белка Bcl-2 [Yang J.P. et al. Therapeutic time window for the neuroprotective effects of NGF when administered after focal cerebral ischemia // Neurological Sciences. - 2011. - T. 32. - №.3. - C. 433-441.].
Однако попытки применения рекомбинантного NGF в клинике были безуспешными в связи с его плохими фармакокинетическими свойствами и развитием побочных эффектов, в частности, болевого синдрома [Jönhagen М.Е. Nerve growth factor treatment in dementia // Alzheimer Disease & Associated Disorders. - 2000. - Т. 14. - №. 1. - C. S31-S38.].
Одна из стратегий, направленных на преодоление недостатков нативных нейротрофинов, состоит в создании низкомолекулярных агентов, способных вызывать NGF-подобные терапевтические эффекты при системном введении и свободных от побочных эффектов, свойственных исходному NGF. Описано несколько таких соединений, в частности NGF-миметики непептидной структуры, соединения МТ-2 [Scarpi D. et al. Low molecular weight, non-peptidic agonists of TrkA receptor with NGF-mimetic activity // Cell death & disease. - 2012. - Т. 3. - №. 7. - С. е339.] и D3 [Bruno М.А. Long-Lasting Rescue of Age-Associated Deficits in Cognition and the CNS Cholinergic Phenotype by a Partial Agonist Peptidomimetic Ligand of TrkA / M.A. Bruno // J. Neurosci. - 2004. - T. 24 - №37 - 8009-8018c] и пептидный NGF-миметик BB14 [Papa M. et al. Astrocyte-neuron interplay in maladaptive plasticity //Neuroscience & Biobehavioral Reviews. - 2014. - T. 42. - C. 35-54., Cirillo G. et al. Modulation of matrix metalloproteinases activity in the ventral horn of the spinal cord re-stores neuroglial synaptic homeostasis and neurotrophic support following peripheral nerve injury // PLoS One. - 2016. - T. 11. - №. 3. - С. e0152750.]. Следует отметить, что известные из литературы миметики NGF не решают проблему разделения терапевтических и нежелательных эффектов полноразмерного белка.
В ФГБНУ «НИИ фармакологии имени В.В. Закусова» на основе структуры β-изгиба 4-й петли NGF сконструирован димерный дипептид - гексаметилендиамид бис-(моносукинил-глутамил-лизин) [Середенин С.Б., Гудашева Т.А. // 2010. Патент РФ №2410392], получивший рабочий шифр ГК-2. Было показано методом вестерн-блот анализа, что ГК-2 активирует специфические для NGF тирозинкиназные TrkA рецепторы и избирательно активирует пострецепторный PI3K/AKT путь, вовлеченный в нейропротекцию, не активируя при этом MAP/ERK путь, ассоциированный с развитием гиперальгезии [Gudasheva ТА, Povarnina PY, Antipova ТА, Firsova YN, Konstantinopolsky MA, Seredenin SB. Dimeric dipeptide mimetics of the nerve growth factor Loop 4 and Loop 1 activate TRKA with different patterns of intracellular signal transduction // J Biomed Sci. 2015. №22. P. 106]. ГК-2 продемонстрировал высокую NGF-подобную нейропротективную активность в микро- и наномолярных концентрациях в экспериментах in vitro [Антипова Т.А., Гудашева Т.А., Середенин С.Б. Исследование in vitro нейропротективных свойств нового оригинального миметика фактора роста нервов ГК-2. Бюл эксп биол. - 2011. - V. 150. - №11. - P. 607-9]. В экспериментах in vivo ГК-2 также проявлял нейропротекторную активность (в дозах 0,01-5 мг/кг при внутрибрюшинном введении и 5-10 мг/кг при пероральном введении) на моделях болезни Альцгеймера и Паркинсона, а также на различных моделях нарушений мозгового кровообращения, включая модель хронической церебральной ишемии, вызванной перманентной окклюзией сонных артерий и модель обширного инсульта, вызванного транзиторной окклюзией средней мозговой артерии [Середенин С.Б., Т.А. Гудашева. Создание фармакологически активной малой молекулы, обладающей свойствами фактора роста нервов. Журн. неврологии и психиатрии им. С.С. Корсакова. - 2015. - №6. - С. 63-70]. В частности, в результате исследований выяснено, что антикаталептогенное действие ГК-2 сохраняется при пероральном введении за 24 ч до галоперидола. У группы животных, получивших ГК-2 в дозе 10 мг/кг (per os) время каталепсии достоверно снизилось по сравнению с контрольной группой. [Поварнина П.Ю. и др. Антипаркинсонические свойства дипептидного миметика фактора роста нервов ГК-2 в экспериментах in vivo //Бюл. эксперим. биологии и медицины. - 2011. - Т. 151. - №.6. - С. 634-637.] При этом ГК-2 был лишен основных побочных эффектов, характерных для полноразмерного белка, а именно гиперальгезии и потери веса [Gudasheva ТА, Povarnina PY, Antipova ТА, Firsova YN, Konstantinopolsky MA, Seredenin SB. Dimeric dipeptide mimetics of the nerve growth factor Loop 4 and Loop 1 activate TRKA with different patterns of intracellular signal transduction // J Biomed Sci. 2015. №22. P. 106].
Известно, что, технологии лиофилизации как и прямого прессования дают возможность создания лекарственных форм (ЛФ), избегая процессов разрушения пептидной фармацевтической субстанции (ФС), возможных, например, при влажном гранулировании, сублимации при повышенных температурах с использованием летучих компонентов, экструзии расплава и т.д. [Goel H. et al. Orally disintegrating systems: innovations in formulation and technology //Recent patents on drug delivery & formulation. 2008. T. 2. №. 3. C. 258-274.].
Наиболее предпочтительными ЛФ для продолжительного приема являются твердые ЛФ благодаря удобству применения, высокой степени комплаенса, а также длительному сроку хранения. Средства, обладающие нейропротективной активностью, предполагают их прием лицами, часто страдающими дисфагией или испытывающими затруднения при глотании, в частности, пациентами пожилого возраста, что сказывается на приверженности лечению.
В связи с изложенным, актуальной задачей является разработка нейропротективных средств, содержащих компонент пептидной природы, пригодных для длительного приема пациентами, в частности, лицами страдающими затруднениями при глотании.
Данная цель достигается созданием композиции на основе гексаметиленамида бис-(N-моносукцинил-L-глутамил-L-лизина), выполненной в форме таблеток, диспергируемых в полости рта, получаемых методами прямого прессования или лиофилизации, соответствующих требованиям Государственной фармакопеи (ГФ) XIII.
Сущность представленного изобретения - фармацевтическая композиция (ФК), обладающая нейропротекторными свойствами, выполненная в виде орально диспергирующихся форм, содержащая терапевтически эффективное количество гексаметиленамида бис-(N-моносукцинил-L-глутамил-L-лизина) и вспомогательные вещества.
Содержание гексаметиленамид бис-(N-моносукцинил-L-глутамил-L-лизина) 5-55%.
Количественные соотношения вспомогательных компонентов показаны в таблицах 1 и 2, предпочтительные эксципиенты соответствующих групп представлены далее.
Фармацевтическая композиция, вариант №1

В качестве матрицеобразователя в данном варианте композиции применяется одно или более соединений, способных обеспечить связующую способность и каркас лиофилизированной таблетки. Предпочтительными матрицеобразователями являются: мальтодекстрин, декстраны, желатин, соли альгиновой кислоты, поливинилпирролидоны.
В качестве кристаллического наполнителя в данном варианте композиции применяется одно или несколько соединений, которые придают продукту прочность, твердость и механическую устойчивость к внешним воздействиям, оказывают криопротекторное действие. Предпочтительными кристаллическими наполнителями являются полиолы, такие как маннит, сорбит, глицерол; аминокислоты, например, глицин.
В качестве солюбилизаторов в данном варианте композиции применяется одно или несколько соединений, которые увеличивают водопроницаемость таблетки и улучшают всасывание фармацевтической субстанции. Предпочтительными растворителями являются натрия лаурилсульфат, полоксамеры 188 и 407, твин 80, полимеры, такие как поливинилпирролидоны, полиэтиленгликоли с молекулярной массой от 1500 до 8000 г/моль.
Фармацевтическая композиция в данном варианте может быть получена любым технологически подходящим способом, обеспечивающим однородность дозирования. Предпочтительно таблетки, диспергируемые в полости рта, получают методом лиофилизации.
Лекарственная форма, полученная из гексаметиленамида бис-(N-моносукцинил-L-глутамил-L-лизина), способом лиофилизации
предпочтительно содержит (на таблетку) от приблизительно 2 до приблизительно 15 мг гексаметиленамида бис-(N-моносукцинил-L-глутамил-L-лизина). Масса полученной лиофилизированной таблетки предпочтительно составляет от приблизительно 0,0275 г до приблизительно 0,0580 г.
Фармацевтическая композиция, вариант №2
В качестве наполнителя во втором варианте композиции используются соединения, обеспечивающие необходимую массу, оптимальное время распадаемости, механическую прочность таблетки, а также обладающие приятными вкусовыми качествами, Предпочтительными наполнителями являются полиолы: D-маннитол, сорбитол, ксилит; сахара: сахароза, лактоза, декстроза, мальтоза.
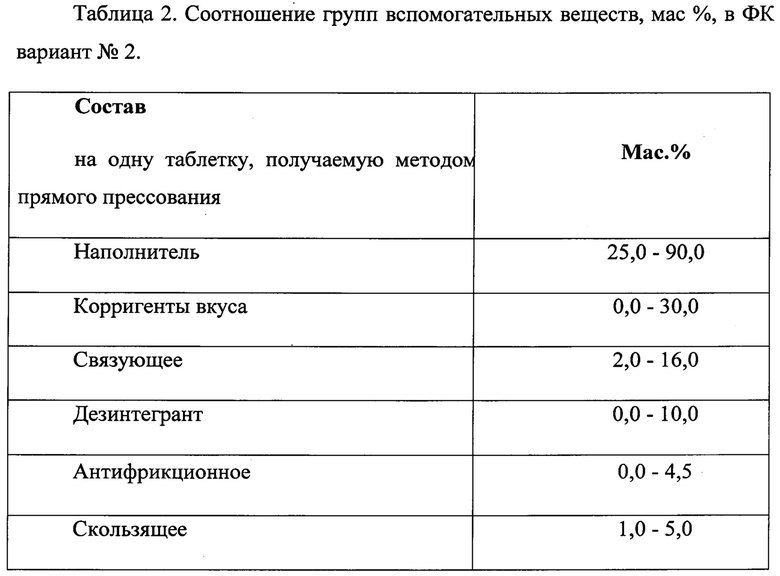
В качестве корригентов вкуса в данном варианте композиции могут быть использованы соединения, позволяющие маскировать неприятные ощущения, увеличивающие приверженность пациентов к лечению. Предпочтительными корригентами вкуса являются ксилит, фруктоза, аспартам, сорбитол, стевиозид.
В качестве связующего в данном варианте композиции используются соединения, обеспечивающие высокую механическую прочность таблетки. Предпочтительными связующими являются микрокристаллическая целлюлоза, прежелатинизированный крахмал, колликут® SR 30 D (физическая смесь поливинилацетата и поливинилпирролидона в соотношении 10:1).
В качестве дезинтегранта в данном варианте композиции могут быть использованы соединения, облегчающие диспергирование таблетки в ротовой полости. Предпочтительным дезинтегрантом является кросповидон (поперчносшитый поливинилпирролидон).
В качестве антифрикционного вещества в данном варианте композиции могут быть использованы соединения, улучшающие сыпучесть таблеточной массы. Предпочтительными антифрикционными веществами являются магния алюмосиликат, кремния диоксид коллоидный.
Кроме предложенного сочетания вспомогательных веществ описанных групп (наполнители и связующие, а также корригенты вкуса, дезинтегранты, антифрикционные) для производства фармацевтической композиции варианта 2 могут использоваться готовые комплексные наполнители такие как F-melt® (D-маннитол, ксилит, МКЦ, кросповидон, магния алюмосиликат), Pearlitol Flash® (D-маннитол (90%), прежелатинизированный крахмал (10%)), Prosolv ODT® (микрокристаллическая целлюлоза, кремния диоксид коллоидный, маннитол, фруктоза, кросповидон), Ludiflash® (маннитол (90%), колликут® SR 30 D (физическая смесь поливинилацетата и поливинилпирролидона в соотношении 10:1) (5% твердых частиц), коллидон® CL-SF (мелкодисперсный кросповидон) (5%)).
В качестве скользящего вещества, используют производные высших жирных кислот и их солей, в частности натрия или магния стеаратофумарат.
На основе данной фармацевтической композиции получают прессованные таблетки любым подходящим для этого способом, обеспечивающим однородность дозирования. Для изготовления таблеток диспергируемых в полости рта преимущественно применение технологии прямого прессования.
Технический результат изобретения - повышение эффективности использования гексаметиленамида бис-(N-моносукцинил-L-глутамил-L-лизина); расширение арсенала нейропротекторных средств, диспергируемых в ротовой полости: создание фармацевтической композиции, обладающей нейропротективным свойством, в орально диспергирующейся форме.
Осуществление настоящего изобретения демонстрируется следующими примерами, не ограничивающими объем притязаний. Количество ингредиентов фармацевтической композиции, использованных в примерах, представлено в единицах массы.
Пример 1.
Способ получения таблеток, диспергируемых в полости рта, методом лиофилизации. 27 мг гексаметиленамида бис-(N-моносукцинил-L-глутамил-L-лизина) растворяют в 2 мл воды и добавляют 200 мг мальтодекстрина, 200 мг маннита и 20 мг полоксамера 188, затем перемешивают до полного растворения. Полученной таким способом смесью наполняют 10 ячеек блистера для лиофилизации. Содержимое замораживают выдерживанием -блистеров при температуре ниже -35°С. Стадию первичной сублимации процесса лиофилизации осуществляют при температуре ниже 0°С и давлении ниже 100 миллибар. Вторичную сушку лиофилизата проводят предпочтительно при температуре выше 0°С и при давлении ниже 100 миллибар. Полученные методом лиофилизации таблетки диспергируемые в полости рта соответствуют всем требованиям ГФ XIII.
Пример 2.
Способ получения таблеток, диспергируемых в полости рта, методом лиофилизации. 50 мг гексаметиленамида бис-(N-моносукцинил-L-глутамил-L-лизина) растворяют в 2 мл воды и добавляют 5 мг желатина, 300 мг маннита и 5 мг полоксамера 407, затем перемешивают до полного растворения. Полученной таким способом смесью наполняют 10 ячеек блистера для лиофилизации. Содержимое замораживают выдерживанием блистеров при температуре ниже -35°С. Стадию первичной сублимации процесса лиофилизации осуществляют при температуре ниже 0°С и давлении ниже 100 миллибар. Вторичную сушку лиофилизата проводят предпочтительно при температуре выше 0°С и при давлении ниже 100 миллибар. Полученные методом лиофилизации таблетки диспергируемые в полости рта соответствуют всем требованиям ГФ XIII.
Пример 3.
Способ получения таблеток, диспергируемых в полости рта, методом лиофилизации. 150 мг гексаметиленамида бис-(N-моносукцинил-L-глутамил-L-лизина) растворяют в 2 мл воды и добавляют 5 мг желатина, 120 мг глицина, затем перемешивают до полного растворения. Полученной таким способом смесью наполняют 10 ячеек блистера для лиофилизации. Содержимое замораживают выдерживанием блистеров при температуре ниже -35°С. Стадию первичной сублимации процесса лиофилизации осуществляют при температуре ниже 0°С и давлении ниже 100 миллибар. Вторичную сушку лиофилизата проводят предпочтительно при температуре выше 0°С и при давлении ниже 100 миллибар. Полученные методом лиофилизации таблетки диспергируемые в полости рта соответствуют всем требованиям ГФ XIII.
Пример 4.
Способ получения таблеток, диспергируемых в полости рта, методом лиофилизации. 50 мг гексаметиленамида бис-(N-моносукцинил-L-глутамил-L-лизина) растворяют в 2 мл воды и добавляют 200 мг мальтодекстрина, 300 мг маннита и 30 мг полиэтиленгликоля, затем перемешивают до полного растворения. Полученной таким способом смесью наполняют 10 ячеек блистера для лиофилизации. Содержимое замораживают выдерживанием блистеров при температуре ниже -35°С. Стадию первичной сублимации процесса лиофилизации осуществляют при температуре ниже 0°С и давлении ниже 100 миллибар. Вторичную сушку лиофилизата проводят предпочтительно при температуре выше 0°С и при давлении ниже 100 миллибар. Полученные методом лиофилизации таблетки диспергируемые в полости рта соответствуют всем требованиям ГФ XIII.
Пример 5.
Способ получения таблеток диспергируемых в полости рта методом лиофилизации. 50 мг гексаметиленамида бис-(N-моносукцинил-L-глутамил-L-лизина) растворяют в 2 мл воды и добавляют 350 мг мальтодекстрина, 50 мг маннита и 50 мг полиэтиленгликоля 6000, затем перемешивают до полного растворения. Полученной таким способом смесью наполняют 10 ячеек блистера для лиофилизации. Содержимое замораживают выдерживанием блистеров при температуре ниже -35°С. Стадию первичной сублимации процесса лиофилизации осуществляют при температуре ниже 0°С и давлении ниже 100 миллибар. Вторичную сушку лиофилизата проводят предпочтительно при температуре выше 0°С и при давлении ниже 100 миллибар. Полученные методом лиофилизации таблетки диспергируемые в полости рта соответствуют всем требованиям ГФ XIII.
Пример 6.
Отвешивают и просеивают 260,0 г D-маннитола, 300,0 г ксилита, 200,0 г микрокристаллической целлюлозы, 100,0 г кросповидона, 45,0 г магния алюмосиликата, 45,0 г натрия стеаратофумарата и 50,0 г гексаметиленамида бис-(N-моносукцинил-L-глутамил-L-лизина). Берут точную навеску просеянного 260,0 г D-маннитола, 300,0 г ксилита, 200,0 г микрокристаллической целлюлозы, 100,0 г кросповидона, 45,0 г магния алюмосиликата, 45,0 г натрия стеаратофумарата и 50,0 г гексаметиленамида бис-(N-моносукцинил-L-глутамил-L-лизина) и смешивают до однородной массы. Далее из однородной смеси получают таблетки массой 0,100 г в количестве 10000 таблеток.
Пример 7.
Отвешивают и просеивают 870,0 г Маннитола, 20,0 г прежелатинизированного крахмала, 10,0 г натрия стеаратофумарата и 100,0 г гексаметиленамида бис-(N-моносукцинил-L-глутамил-L-лизина). Отмеряют точную навеску просеянного 870,0 г Маннитола, 20,0 г прежелатинизированного крахмала, 10,0 г натрия стеаратофумарата и 100,0 г гексаметиленамида бис-(N-моносукцинил-L-глутамил-L-лизина) и смешивают до однородной массы. Далее из однородной смеси получают таблетки массой 0,100 г в количестве 10000 таблеток.
Пример 8.
Отвешивают и просеивают 160,0 г микрокристаллической целлюлозы, 16,0 г кремния диоксида коллоидного, 464,0 г маннитола, 120,0 г фруктозаы, 40,0 г кросповидона, 50,0 г магния стеаратфумарат и 150,0 г гексаметиленамида бис-(N-моносукцинил-L-глутамил-L-лизина) и смешивают до однородной массы. Далее из однородной смеси получают таблетки массой 0,100 г в количестве 10000 таблеток.
Пример 9.
Отвешивают и просеивают 940,0 г F-melt, 10,0 г магния стеаратфумарат и 50,0 г гексаметиленамида бис-(N-моносукцинил-L-глутамил-L-лизина). Берут точную навеску просеянного 940,0 г F-melt, 10,0 г натрия стеаратофумарата и 50,0 г гексаметиленамида бис-(N-моносукцинил-L-глутамил-L-лизина) и смешивают до однородной массы. Далее из однородной смеси получают таблетки массой 0,100 г в количестве 10000 таблеток.
Пример 10.
Результаты исследования технологических характеристик таблеток, изготовленных согласно примерам 1-9 представлены в таблице 3.
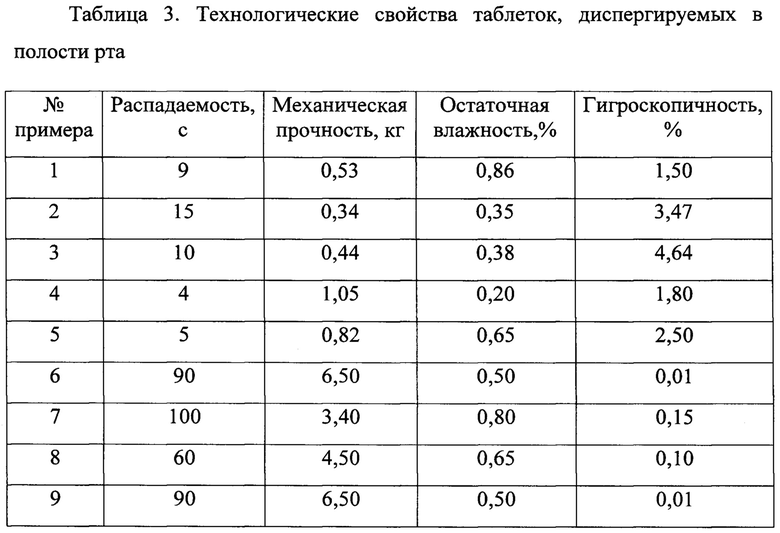
Таким образом, полученные результаты доказывают соответствие представленных лекарственных форм требованиям ГФ XIII.
Пример 11.
Изучение действия фармацевтических композиций, полученных по примерам 4 и 6, на модели галоперидоловой каталепсии у крыс в дозах 5 мг/кг вводимых перорально.
Эксперименты проведены на беспородных крысах-самках массой 240-260 г. В каждой группе было по 9 крыс.
Крысы были случайным образом разделены на 3 группы. Двум группам вводили перорально ГК-2 в лекарственной форме из расчета 1 мл/кг. Контрольным животным вводили перорально дистиллированную воду. Через 24 часа всем животным вводили в/б галоперидол (2 мг/кг, в/б). Через 60 и 120 минут после введения галоперидола регистрировали каталепсию: животное ставили передними лапами на подставку высотой 8 см и замеряли время удержания неподвижной позы. Делали три подхода для каждого животного в каждую временную точку, затем считали среднее время удержания неподвижной позы.
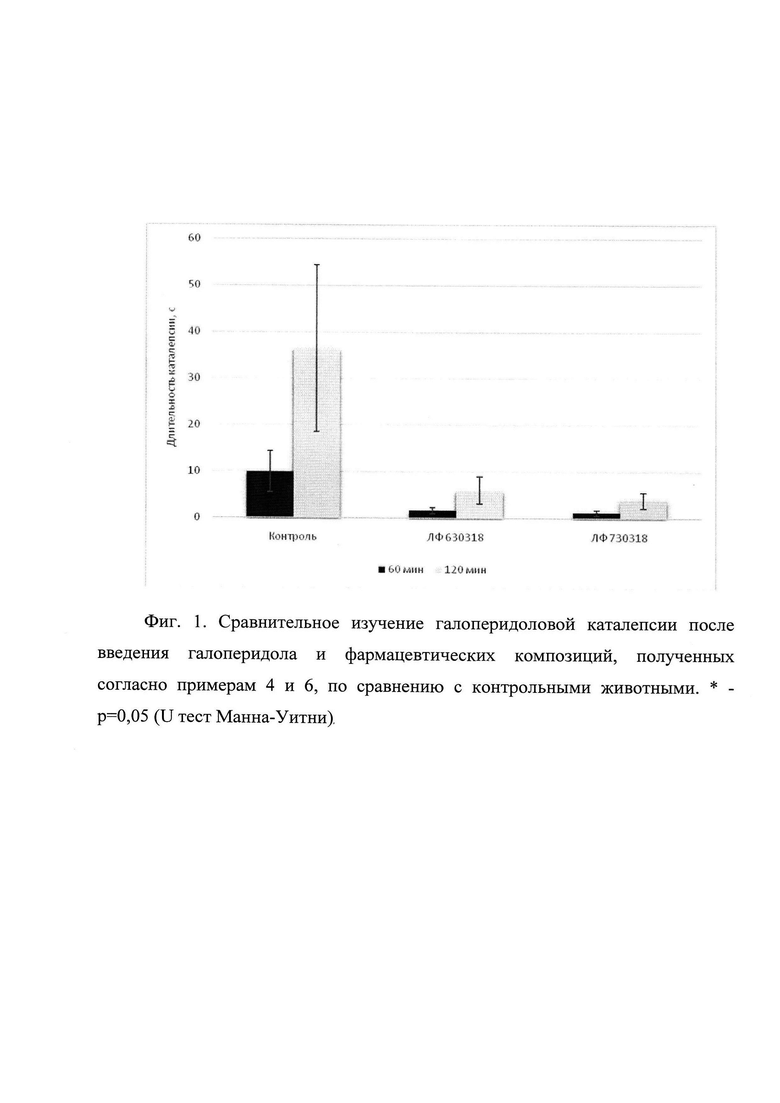
Через 60 мин после введения галоперидола каталепсия во всех группах животных была выражена слабо. Статистически значимых межгрупповых различий в эту временную точку не было выявлено. Через 120 мин после введения галоперидола выраженность каталепсии в контрольной группе значительно увеличилась (среднее 36,5 с). ГК-2 в фармацевтической композиции, описанной в примере 6 статистически значимо, снижал интенсивность каталепсии (среднее в этой группе 2,9 с). ГК-2 в виде фармацевтической композиции, описанной в примере 4, также снижал интенсивность каталепсии, но отличия от контрольной группы не были статистически значимыми (Фиг. 1. Сравнительное изучение галоперидоловой каталепсии после введения галоперидола и фармацевтических композиций, полученных согласно примерам 4 и 6, по сравнению с контрольными животными. * - p=0,05 (U тест Манна-Уитни)).
Краткое описание чертежа
На фиг. 1 показано сравнительное изучение проявлений галоперидоловой каталепсии у контрольных животных после введения галоперидола и у животных, которым вводили за сутки до этого фармацевтические композиции, описанные в примерах 4 и 6. Номер на фигуре ЛФ 630318 соответствует ФК описанной в примере №4, а ЛФ 730318 соответствует ФК описанной в примере №6.
Ось абсцисс - выраженность каталепсии среди трех групп животных после 60 мин и 120 мин после введения галоперидола; ось ординат - длительность каталепсии (с). Данные представлены в виде средних и стандартных ошибок среднего. * - p=0,05 (U тест Манна-Уитни).
| название | год | авторы | номер документа |
|---|---|---|---|
| Фармацевтическая композиция нейропротекторного действия для парентерального применения на основе гексаметилендиамида бис-(N-моносукцинил-L-глутамил-L-лизина) в лиофилизированной лекарственной форме | 2017 |
|
RU2678203C2 |
| Фармацевтическая композиция на основе гексаметилендиамида бис-(N-моносукцинил-L-серил-L-лизина) (ГСБ-106) | 2018 |
|
RU2697254C1 |
| СПОСОБ ПОЛУЧЕНИЯ ФАРМАЦЕВТИЧЕСКОЙ КОМПОЗИЦИИ НА ОСНОВЕ ГЕКСАМЕТИЛЕНДИАМИДА БИС-(N-МОНОСУКЦИНИЛ-L-СЕРИЛ-L-ЛИЗИНА) | 2021 |
|
RU2790827C1 |
| ЛЕКАРСТВЕННОЕ СРЕДСТВО С АНТИАРИТМИЧЕСКИМ И АНТИФИБРИЛЛЯТОРНЫМ ДЕЙСТВИЕМ | 2010 |
|
RU2477144C2 |
| Гепатопротекторное действие низкомолекулярного миметика NGF | 2022 |
|
RU2790828C1 |
| ВЕЩЕСТВА, ОБЛАДАЮЩИЕ АНГИОГЕННОЙ АКТИВНОСТЬЮ | 2013 |
|
RU2613184C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ КОМБИНАЦИЮ МЕМАНТИНА И МЕЛАТОНИНА | 2016 |
|
RU2623865C1 |
| Малые молекулы с NGF-подобной активностью, обладающие антидиабетическими свойствами | 2013 |
|
RU2613314C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ КОМБИНАЦИЮ МЕМАНТИНА И МЕЛАТОНИНА | 2016 |
|
RU2654713C1 |
| ВЕЩЕСТВО, ОБЛАДАЮЩЕЕ АНТИАНГИОГЕННОЙ АКТИВНОСТЬЮ | 2013 |
|
RU2625752C2 |
Изобретение относится к медицине и фармации и касается фармацевтических композиций, обладающих нейропротекторной активностью, выполненных в форме таблетки, диспергирующейся в полости рта, содержащей в качестве действующего вещества гексаметиленамида бис-(N-моносукцинил-L-глутамил-L-лизина). Действие композиции показано на модели галоперидоловой каталепсии. Предложенные таблетки отвечают требованиям Государственной Фармакопеи XIII. Технический результат изобретения - повышение эффективности использования гексаметиленамида бис-(N-моносукцинил-L-глутамил-L-лизина) посредством создания фармацевтических композиций, обладающих нейропротекторным действием; расширение арсенала нейропротекторных средств, диспергируемых в ротовой полости. 14 з.п. ф-лы, 11 пр., 3 табл., 1 ил.
1. Фармацевтическая композиция, обладающая нейропротекторными свойствами, выполненная в виде орально диспергирующейся лекарственной формы, содержащая терапевтически эффективное количество гексаметилендиамида бис-(N-моносукцинил-L-глутамил-L-лизина) и вспомогательные вещества.
2. Фармацевтическая композиция по п. 1, отличающаяся тем, что содержит действующее вещество гексаметилендиамид бис-(N-моносукцинил-L-глутамил-L-лизина) в количестве от 5,0 до 15,0 мас.%.
3. Фармацевтическая композиция по пп. 1 и 2, отличающаяся тем, что содержит действующее вещество и вспомогательные вещества в следующем соотношении, мас.%:
4. Фармацевтическая композиция по п. 3, отличающаяся тем, что в качестве матрицеобразователя содержит мальтодекстрин, желатин.
5. Фармацевтическая композиция по п. 3, отличающаяся тем, что в качестве кристаллического наполнителя содержит маннит.
6. Фармацевтическая композиция по п. 3, отличающаяся тем, что в качестве солюбилизатора содержит полоксамер 188, полоксамер 407, полиэтиленгликоль.
7. Фармацевтическая композиция по пп. 1, 2 и 3, предназначенная для получения диспергируемых в полости рта таблеток методом лиофилизации.
8. Фармацевтическая композиция по пп. 1 и 2, отличающаяся тем, что содержит действующее вещество и вспомогательные вещества в следующем соотношении, мас.%:
9. Фармацевтическая композиция по п. 8, отличающаяся тем, что в качестве наполнителя содержит D-маннитол.
10. Фармацевтическая композиция по п. 8, отличающаяся тем, что в качестве корригентов вкуса содержит ксилит, фруктозу.
11. Фармацевтическая композиция по п. 8, отличающаяся тем, что в качестве связующего содержит микрокристаллическую целлюлозу, прежелатинизированный крахмал.
12. Фармацевтическая композиция по п. 8, отличающаяся тем, что в качестве дезинтегранта содержит кросповидон.
13. Фармацевтическая композиция по п. 8, отличающаяся тем, что в качестве антифрикционного вещества содержит магния алюмосиликат, кремния диоксид коллоидный.
14. Фармацевтическая композиция по п. 8, отличающаяся тем, что в качестве скользящего содержит натрия стеаратофумарат, магния стеаратофумарат.
15. Фармацевтическая композиция по пп. 1, 2 и 8, предназначенная для получения диспергируемых в полости рта таблеток путем прямого прессования.
| ДИПЕПТИДНЫЕ МИМЕТИКИ НЕЙРОТРОФИНОВ NGF И BDNF | 2009 |
|
RU2410392C2 |
| КОМБИНАЦИЯ В ВИДЕ ОРОДИСПЕРГИРУЕМОЙ ФОРМЫ С ТЕРАПЕВТИЧЕСКИМ ДЕЙСТВИЕМ НА ВОЗБУЖДАЮЩИЕ И ТОРМОЗНЫЕ ФУНКЦИИ НЕРВНОЙ СИСТЕМЫ (ВАРИАНТЫ) | 2011 |
|
RU2464013C1 |
| Allison, S | |||
| D | |||
| et al., Optimization of storage stability of lyophilized actin using combinations of disaccharides and dextran, Journal of pharmaceutical sciences, 2000, т | |||
| Способ размножения копий рисунков, текста и т.п. | 1921 |
|
SU89A1 |
| ПЕЧНОЙ ЖЕЛЕЗНЫЙ РУКАВ (ТРУБА) | 1920 |
|
SU199A1 |
Авторы
Даты
2021-01-20—Публикация
2018-11-13—Подача