Изобретение относится к области медицинской диагностики и может быть использовано для прогнозирования веса новорожденного у беременных русской национальности, являющихся уроженками Центрального Черноземья России, с преэклампсией (далее ПЭ) без отягощенного семейного анамнеза по ПЭ, и в сочетании с синдромом задержки роста плода, на основе полиморфизма гена-кандидата наследственных тромбофилий.
Внутриутробная задержка роста плода (ЗРП) является одним из наиболее часто встречающихся осложнений беременности, ей частота может достигать 10% [Fetal growth restriction: current knowledge [Text]/ Nardozza, L. M. M., Caetano, A. C. R., Zamarian, A. C. P., Mazzola, J. B., Silva, C. P., Marçal, V. M. G., et al.// Arch. Gynecol. Obstet. 2017. 295, 1061–1077]. Рост плода напрямую зависит от нормальной плацентации, так как плацента обеспечивает транспортную, трофическую, эндокринную и метаболическую функции [Intrauterine Growth Restriction – A Review Article [Text]/ Heshmat SH. Anatomy Physiol. Biochem. Int. J. 2017;1 (5):555-572]. Необходимый уровень маточно-плацентарного кровообращения вместе с быстрым ангиогенезом ворсинок хориона являются ключевыми факторами, необходимыми для адекватного развития и функционирования плаценты и последующего роста плода [Intrauterine Growth Restriction: Antenatal and Postnatal Aspects [Text]/ Sharma D, Shastri S, Sharma P.// Clinical Medicine Insights: Pediatrics. 2016; 10:67-83.]. Нарушения развития плаценты могут приводит к неполному ремоделированию спиральных артерий и уменьшению маточно-плацентарного кровотока что в конечном итоге связано с развитием преэклампсии (ПЭ) и задержки роста плода [Pathophysiology of placental-derived fetal growth restriction. [Text]/ Burton G.J., Jauniaux E. // Am. J. Obstet. Gynecol. 2018; 218 (2S):745-761]. В пренатальном периоде в зависимости от степени несоответствия фетометрических показателей и массы плода предполагаемому сроку гестации выделяют 3 степени ЗРП: I степень – отставание размеров плода от нормативных для его срока значений на 1–2 недели, II степень – на 2–3 недели, III степень – более чем на 3 недели. Низкая масса тела при рождении и задержка развития плода являются разными показателями [Будюхина О.А. Синдром задержки роста пода – современный взгляд на проблему (обзор литературы). Проблемы здоровья и экологии. 2009; 1(19):83-89]. Согласно данным ВОЗ среднее значение массы новорожденного составляет 3200 г. для девочек и 3300 г. для мальчиков, дети с массой менее 2500 г. считаются плодами с низкой массой при рождении [https://www.who.int/ru/]. Следует отметить, что ЗРП является известным фактором риска перинатальной заболеваемости и смертности. [Neonatal Morbidities of Fetal Growth Restriction: Pathophysiology and Impact [Text]/ Malhotra A, Allison BJ, Castillo-Melendez M, Jenkin G, Polglase GR, Miller SL.// Front Endocrinol (Lausanne). 2019; 10:55].
Среди причин развития ЗРП выделяют три группы факторов: материнские (аутоиммунные заболевания, гипергомоцистинемия, тромбофилические состояния, нарушения питания, лекарственные препараты и др.), плацентарные (нарушения плацентации, изменение метиллирования генов и профиля экспрессии микро-РНК в плаценте и др.) фетальные (наследственные синдромы и хромосомные перестройки) [Молекулярно-генетические и эпигенетические аспекты нарушения рецептивности эндометрия у женщин с низкой массой тела при рождении [Текст]/ Мелкозерова О.А., Башмакова Н.В., Третьякова Т.Б., Щедрина И.Д.// Вопросы гинекологии, акушерства и перинатологии. 2019; 18(4): 35–43]. Значимая роль в развитии ЗРП отводится генетическим факторам материнского организма [Продукция и секреция IL-10 в крови в зависимости от полиморфизма гена IL-10 А-1082G у беременных женщин с задержкой роста плода. [Текст]/ Малышкина А.И., Бойко Е.Л., Сотникова Н.Ю., Панова И.А., Фетисова И.Н., Воронин Д.Н., Милеева П.Л.// Акушерство и гинекология. 2019; 6:40-46], и в том числе определяющим возникновение тромбофилических состояний (наследственные тромбофилии).
Из области техники известен патент РФ № 2472446 от 20.10. 2011 «Способ прогнозирования массы тела новорожденного», который включает оценку питания матери во время беременности и комплекса социально-экономических и медико-биологических факторов риска, оказывающих влияние на родителей. Массу тела новорожденного определяют по формуле: Y1=2477,41-59,63X1+82,46X2+46,1X3+0,88X4-0,44X5+1,63X6-5,005X7-86,53X8+345,93X9+152,06X10+1,56X11-3,5X12+493,13X13+834,11X14-127,71X15+90,32X16+397,68X17-245,04X18+418,51X19-446,33X20+174,90X21, где Y1- масса тела новорожденного; X1- количество в рационе белка животного происхождения (г), X2- количество общего белка в рационе (г), X3- жиры в рационе (г), X4- натрий в рационе (мг), X5- калий в рационе (мг), X6- кальций (мг), X7- фосфор (мг); X8- железо (мг), X9- рибофлавин (мг), X10- ниацин (мг), X11- витамин С (мг), X12- калорийность рациона (ккал), X13- общий стаж работы матери: до 4 лет - 1 балл, от 5 до 9 лет - 2 балла, от 10 до 14 лет - 3 балла, от 15 до 19 лет - 4 балла, от 20 до 24 лет - 5 баллов, более 25 лет - 6 баллов, X14- семейное положение: замужем - 1 балл, не замужем - 2 балла; X15- индекс массы тела женщины, до наступления беременности; X16- условия труда матери во время беременности: нет вредностей - 1 балл, перегревание - 2 балла, переохлаждение - 3 балла, вибрация - 4 балла, шум - 5 баллов, загазованность - 6 баллов, запыленность - 7 баллов, психоэмоциональные нагрузки - 8 баллов; X17- стрессовые нагрузки на производстве и в семье - 1 балл, 2 балла - отсутствие; X18- социальные условия: доход на одного члена семьи до 5000 рублей - 1 балл, от 5000-10000 рублей - 2 балла, от 10000-15000 рублей - 3 балла, свыше 15000 рублей - 4 балла; X19- режим питания: 1 раз в день - 1 балл, 2 раза - 2 балла, 3 раза в день - 3 балла, 4 раза - 4 балла, 5 и более раз - 5 баллов; X20- стаж работы отца ребенка на момент зачатия: до 4 лет - 1 балл, от 5 до 9 лет - 2 балла, от 10 до 14 лет - 3 балла, от 15 до 19 лет - 4 балла, от 20 до 24 лет - 5 баллов, более 25 лет - 6 баллов, X21- характер трудовой деятельности отца на момент зачатия: без особенностей - 1 балл, преимущественно сидячий 2 балла, преимущественно стоячий - 3 балла, преимущественно активный - 4 балла, поднятие тяжести - 5 баллов, с нервно-эмоциональным напряжением - 6 баллов. Недостатками данного метода являются: 1) учет большого количества критериев, что является сложным и дорогостоящим процессом; 2) способ не включает генетические маркеры, что исключает раннюю диагностику и проведение профилактических мероприятий по предотвращению рождения детей с низкой массой тела.
За прототип выбран патент РФ № 2557952 по заявке № 2014124787/15 от 18.06. 2014 «Способ прогнозирования веса новорожденного с учетом полиморфных вариантов локуса 10976 G/A FVII». Способ включает выделение ДНК из периферической венозной крови и проведение анализа полиморфизма генов VII фактора коагуляции 10976G/A FVII. Вес тела новорожденного определяют при рождении на сроке 37 и более недель беременности. У женщин, рожающих не в первый раз, вес тела новорожденного определяют по уравнению: y=6123,431-25,579x1+0,267x2+205,739x3, где y - прогнозируемый вес новорожденного, x1- рост женщины в сантиметрах; x2- вес ребенка в предыдущих родах в граммах, x3- генетический вариант локуса 10976G/A FVII, при этом x3=1 для генотипа 10976 GG FVII, x3=2 для генотипов 10976 GA и 10976 AA FVII. У первородящих женщин вес тела новорожденного определяют по уравнению: y=6278,037-21,739x1+232,170x2, где x1- рост женщины в сантиметрах; x2- генетический вариант локуса 10976 G/A FVII, при этом x2=1 для генотипа 10976 GG FVII, x2=2 для генотипов 10976 GA и 10976 AA FVII. Недостатком способа является невозможность прогнозирования веса новорожденного на ранних сроках беременности у женщин с ПЭ и ЗРП, которые относятся к группе высокого риска по рождению детей с низкой массой тела.
Ген F13A1 расположен на коротком плече 6 хромосомы и кодирует А1 субъединицу фактора коагуляции XIII. Фактор коагуляции XIII (F13) (состоит из двух А-субъединиц и двух В-субъединиц) является гликопротеином, который циркулирует в плазме крови в комплексе с фибриногеном. При активации фактор коагуляции XIII образует ковалентные связи между нитями растворимого фибрина, что приводит к формированию фибрина-полимера. При повышенной активности фактора коагуляции XIII повышаются риски тромбообразования и соответственно при снижении активности фактора XIII сгустки крови достаточно быстро распадаются, даже при нормальной фибринолитической активности крови [Фибриноген и фактор XIII при беременности [Текст]/ Павловская Ю.М., Воробьёва Н.А.// Вестник Северного (Арктического) федерального университета. Медико-биологические науки. 2015; 1:68-75]. Изменения в свертывающей системе при физиологически протекающей беременности связаны с повышенным синтезом фибриногена и других факторов свертывания в сочетании со снижением уровня естественных ингибиторов свертывания крови, а также с подавлением фибринолиза [Тромбофилия как важнейшее звено патогенеза осложнений беременности [Текст]/ Бицадзе В.О., Макацария А.Д., Хизроева Д.Х., Макацария Н.А., Яшенина Е.В., Казакова Л.А.// Практическая медицина. 20 12; 9: 24-31]. Повышенное тромбообразование, и в том числе связанное с наследственными тромбофилиями, может являться причиной развития таких осложнений беременности, как синдром потери плода, плацентарная недостаточность, задержка роста плода, внутриутробная гибель плода, преждевременная отслойка нормально расположенной плаценты, преэклампсия и др. [Роль наследственной тромбофилии в генезе осложненного течения беременности [Текст]/ Зарудская О.М., Чурносов М.И.// Акушерство и гинекология. 2013. 7. 4-7].
В изученной научно-медицинской и доступной патентной литературе не было обнаружено способа прогнозирования веса новорожденного у женщин с преэкламсией в сочетании с синдромом задержки роста плода, не имеющих отягощенного семейного анамнеза, на основе данных о полиморфном локусе гена наследственных тромбофилий (rs5985 F13A1) отсутствуют.
В Российской Федерации исследования вовлеченности генов наследственных тромбофилий в формирование критериев прогнозирования веса новорожденного у женщин с преэкламсией в сочетании с ЗРП без отягощенного семейного анамнеза по ПЭ фрагментарны, а данные о роли полиморфизма rs5985 гена наследственных тромбофилий F13A1 отсутствуют.
Задачей настоящего исследования является расширение арсенала способов прогнозирования веса новорожденного, а именно создание способа прогнозирования веса новорожденного у беременных с преэклампсией в сочетании с синдромом задержки роста плода без отягощенного семейного анамнеза с учетом данных о полиморфном локусе rs5985 гена наследственных тромбофилий F13A1.
Технический результат использования изобретения – получение критериев оценки прогноза веса новорожденного у беременных с преэклампсией в сочетании с ЗРП русской национальности, являющихся уроженками Центрального Черноземья России и не имеющих отягощенного семейного анамнеза по ПЭ на основе данных о полиморфизме rs5985 гена F13A1.
Поставленную задачу решает предложенный способ, включающий:
- выделение ДНК из периферической венозной крови;
- анализ полиморфизма rs5985 гена наследственных тромбофилий F13A1;
- прогнозирование веса новорожденного: при выявлении минорного аллеля Т полиморфизма rs5985 гена F13A1 прогнозируется нормальный вес новорожденного. При определении аллеля G rs5985 F13A1 прогнозируется низкий вес плода.
Новизна и изобретательский уровень заключаются в том, что из уровня техники не известна возможность прогнозирования веса новорожденного у беременных с преэклампсией в сочетании с ЗРП без отягощенного семейного анамнеза по ПЭ с учетом данных о полиморфном локусе rs5985 гена наследственных тромбофилий F13A1.
Способ осуществляют следующим образом:
Выделение геномной ДНК из периферической крови осуществляют методом фенольно-хлороформной экстракции (Mathew, 1984) в два этапа. На первом этапе к 4 мл крови с ЭДТА добавляют 25 мл лизирующего буфера, содержащего 320мМ сахарозы, 1% тритон Х-100, 5мМ MgCl2, 10мМ трис-HCl с pH=7,6. Полученную смесь перемешивают и центрифугируют при 4ºС, 4000 об./мин. в течение 20 минут. После центрифугирования надосадочную жидкость сливают, к осадку добавляют 4 мл раствора, содержащего 25 мМ ЭДТА с рН=8,0 и 75 мМ NaCl, ресуспензируют. Затем прибавляют 0,4 мл 10% SDS, 35 мкл протеиназы К, 10мг/мл, и инкубируют образец при 37ºС в течение 16 часов.
На втором этапе из полученного лизата последовательно проводят экстракцию ДНК равными объемами фенола, фенол-хлороформа (1:1) и хлороформа с центрифугированием при 4000 об./мин. в течение 10 минут. После каждого центрифугирования производят отбор водной фазы. ДНК осаждают из раствора двумя объемами охлажденного 96% этанола. После лиофилизации полученную ДНК растворяют в бидистиллированной, деионизованной воде и хранят при минус 20°С. Выделенную ДНК используют для проведения полимеразной цепной реакции синтеза ДНК.
Анализ полиморфизма rs5985 гена наследственных тромбофилий F13A1 проводят методом ПЦР-синтеза ДНК на амплификаторе СFX96 (Bio-Rad) с использованием стандартных олигонуклеотидных праймеров и зондов с последующим анализом полиморфизма методом дискриминации аллелей. Реакционная смесь объемом 25 мкл включает: 67 мМ трис-HCl с pH=8,8, 2,5мМ MgCl2, 0,1 мкг геномной ДНК, по 10 пМ каждого праймера, по 5 пкмоль каждого зонда, по 200 мкМ dATP, dGTP, dCTP, dTTP и 1 единицу активной Taq-полимеразы. После денатурации в течение 5 мин при 95°С выполняют 40 циклов амплификации по схеме: отжиг праймеров – 1 мин. при t=54°С; денатурация – 15 сек при t=95°С. При проведении ПЦР в амплификаторе CFX96 с флюоресцентной детекцией генотипирование осуществляют методом Tag Man зондов по данным величин ОЕФ (относительные единицы флуоресценции). Для rs5985 гена F13A1 зонд с флуоресцентным красителем ROX соответствует аллелю G, зонд с красителем FAM – аллелю Т (фиг.1).
Изобретение характеризуется фигурами.
Фиг. 1. Дискриминации аллелей методом детекции TaqMan зондов по данным величин ОЕФ (относительные единицы флуоресценции) каждого зонда на амплификаторе CFX96 c детектирующей системой в режиме реального времени полиморфизма rs5985 гена F13A1:  - GG,
- GG,  - ТТ,
- ТТ,  - GТ, ♦ - отрицательный контроль.
- GТ, ♦ - отрицательный контроль.
Генотипирование полиморфизма rs5985 гена F13A1 осуществляют методом детекции TagMan зондов по данным величин ОЕФ (относительные единицы флуоресценции) каждого зонда на амплификаторе CFX96 c детектирующей системой в режиме реального времени.
Изучение ассоциации полиморфного локуса rs5985 гена F13A1 с весом новорожденного производилось с использованием лог-линейного регрессионного анализа в программе PLINK v. 2.050 (http://zzz.bwh.harvard.edu/plink/) . Рассчитывались коэффициенты регрессии (β) и их ошибки (SE), характеризующие направленность изменения изучаемого количественного показателя (веса новорожденного) на один полиморфный генетический вариант (минорный аллель). При проведении расчетов выполнялась коррекция на множественные сравнения с помощью адаптивного пермутационного теста (pperm). Статистически значимым считали уровень pperm<0,05.
Возможность использования предложенного способа прогнозирования веса новорожденного у беременных с преэклампсией в сочетании с синдромом задержки роста плода, не имеющих без отягощенного семейного анамнеза по ПЭ, подтверждает анализ результатов наблюдений 70 женщин с ПЭ и задержкой роста плода (средний возраст 27,39±5,22 лет). Диагноз ПЭ ставился на основании наличия генерализованных отеков, артериальной гипертензии и протеинурии. ЗРП устанавливали на основании расчетного веса плода ниже 10-го процентиля для соответствующего гестационного возраста. В исследуемую группу включались не родственные русские женщины, родившиеся в Центрально-Черноземном регионе России. К критериям исключения были отнесены: заболеваниями матки (фибромиома матки, аномалии развития внутренних половых органов), другая патология беременности (аномалии прикрепления и расположения плаценты, резус-конфликт), патологией плода (ВПР), многоплодная беременность. Клиническое и клинико-лабораторное обследование беременных проводилось на базе перинатального центра Белгородской областной клинической больницы Святителя Иоасафа на сроке родоразрешения. Соматометрия новорожденных проводилась стандартными методами. Типирование молекулярно-генетических маркеров осуществлялось в лаборатории «Молекулярной генетики человека» медицинского факультета Белгородского государственного национального исследовательского университета. От каждой женщины, включенной в исследование, было получено информированное согласие. Исследование проводилось под контролем этического комитета медицинского факультета НИУ БелГУ.
При проведении лог-линейного регрессионного анализа установлена ассоциация полиморфного локуса rs5985 гена наследственных тромбофилий F13A1 с весом новорожденного у женщин с ПЭ и задержкой роста плода: минорный аллель Т полиморфизма rs5985 гена F13A1 достоверно связан в более высоким весом новорожденных относительно среднего показателя (для аллельной модели β = 156,60, p=0,05, рperm=0,05, для аддитивной модели β = 155,20, p=0,05, рperm=0,05). Соответственно референсный аллель G этого полиморфизма гена F13A1 - ассоциирован с низким весом новорожденных (рperm=0,05) (Таблица).
Таблица. Ассоциация веса новорожденного с полиморфным локусом rs5985 гена F13A1 у беременных с преэклампсией в сочетании с синдромом задержки роста плода, не имеющих отягощенного семейного анамнеза.
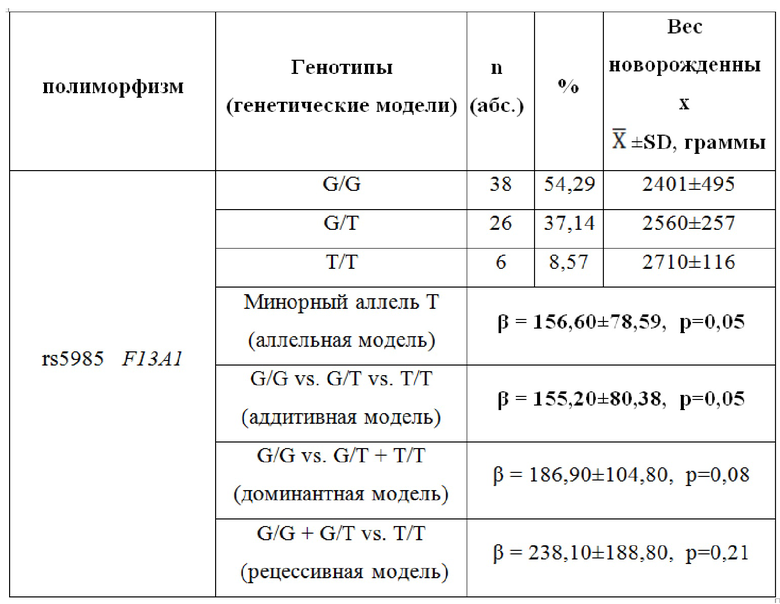
Примечание: β±SE – коэффициент линейной регресси и (изменение веса новорожденного на минорный аллель, граммы) и его ошибка, получены с помощью линейной регрессии с учетом коррекции на ковариаты (возраст беременной и ее индекс массы тела до беременности); р – уровень значимости, жирным выделены значимые различия.
В качестве примеров конкретного применения разработанного способа приведено добровольное генетическое обследование по локусу rs5985 F13A1 женщин с преэклампсией и задержкой роста плода, являющихся уроженками Центрального Черноземья, русской национальности, которые не имеют отягощенного семейного анамнеза по ПЭ и не являются родственниками между собой.
Пример 1. У беременной женщины З. без отягощенного семейного анамнеза по ПЭ, установлен диагноз: преэклампсия средней тяжести, задержка роста плода I степени. Произведен забор венозной крови и при генотипировании ДНК-маркеров выявлен генотип GT, что позволило отнести ее в группу с повышенным риском рождения плода с низкой массой тела. Наблюдение за данной пациенткой показало, что вес новорожденного, родившегося на сроке 38-39 недель, составил 2350 грамм.
Пример 2. У беременной женщины Л. без отягощенного семейного анамнеза по ПЭ, установлен диагноз: преэклампсия средней тяжести, задержка роста плода I степени. После забора венозной крови и генотипирования ДНК-маркеров был определен генотип ТT, что позволило отнести ее в группу с низким риском рождения плода с низкой массой тела. Наблюдение за данной пациенткой показало, что вес новорожденного, родившегося на сроке 38-39 недель, составил 2800 грамм.
Пример 3. У беременной женщины К без отягощенного семейного анамнеза по ПЭ, установлен диагноз: тяжелая преэклампсия, задержка роста плода II степени. По данным молекулярно-генетического обследования выявлен генотип GG, что позволило отнести ее в группу с высоким риском рождения плода с низкой массой тела. Наблюдение за данной пациенткой показало, что вес новорожденного, родившегося на сроке 36-37 недель, составил 1950 грамм.
Пример 4. У беременной женщины Т. без отягощенного семейного анамнеза по ПЭ, установлен диагноз: преэклампсия средней тяжести, задержка роста плода I степени, произведен забор венозной крови, при генотипировании ДНК-маркеров выявлен генотип GT, что позволило отнести ее в группу с повышенным риском рождения плода с низкой массой тела. Наблюдение за данной пациенткой показало, что вес новорожденного, родившегося на сроке 37-38 недель, составил 2400 грамм.
Таким образом, предложенный способ дает возможность прогнозирования веса новорожденного у женщин русской национальности, являющихся уроженками Центрального Черноземья России, с преэклампсией, без отягощенного семейного анамнеза по ПЭ, и задержкой роста плода, с учетом полиморфизма rs5985 гена наследственных тромбофилий F13A1.
Прогнозирование рождения детей с низкой массой поможет улучшить комплекс мероприятий, направленных на профилактику и лечение данного осложнения беременности, что позволит улучшить перинатальные исходы.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ прогнозирования веса новорожденного у беременных с преэклампсией и отягощенным семейным анамнезом по преэклампсии | 2020 |
|
RU2738685C1 |
| Способ прогнозирования риска развития преэклампсии у беременных с синдромом задержки роста плода | 2021 |
|
RU2754956C1 |
| Способ прогнозирования риска развития синдрома задержки роста плода у женщин с отягощенным семейным анамнезом | 2021 |
|
RU2770869C1 |
| Способ прогнозирования веса новорожденного с учетом полиморфного локуса гексокиназы 2, дифференциально экспрессирующегося в плаценте | 2021 |
|
RU2786313C1 |
| Способ прогнозирования риска развития задержки роста плода с учетом эпистатических взаимодействий полиморфных локусов менархе | 2021 |
|
RU2775432C1 |
| Способ прогнозирования веса новорожденного с учетом генетических факторов | 2021 |
|
RU2775436C1 |
| Способ прогнозирования веса новорожденного на основе генетических данных матерей | 2023 |
|
RU2818358C1 |
| Способ прогнозирования роста новорожденных с использованием данных о генетическом полиморфизме матерей | 2023 |
|
RU2820498C1 |
| Способ прогнозирования риска развития синдрома задержки роста плода у женщин без отягощенного семейного анамнеза с использованием молекулярно-генетических данных | 2020 |
|
RU2738680C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ВЕСА НОВОРОЖДЕННОГО С УЧЕТОМ ПОЛИМОРФНЫХ ВАРИАНТОВ ЛОКУСА 10976 G/AFVII | 2014 |
|
RU2557952C1 |

Изобретение относится к области медицинской диагностики. Предложен способ прогнозирования веса новорожденного у беременных русской национальности, являющихся уроженками Центрального Черноземья России с преэклампсией, не имеющих отягощенного семейного анамнеза по преэклампсии, и в сочетании с синдромом задержки роста плода. Осуществляют выделение ДНК из периферической венозной крови, анализ полиморфизма rs5985 гена F13A1, прогнозирование нормального веса новорожденного при выявлении аллеля Т полиморфного локуса rs5985 гена F13A1, прогнозирование низкого веса новорожденного при выявлении аллеля G полиморфизма гена F13A1. Изобретение обеспечивает получение критериев оценки прогноза веса новорожденного у беременных с преэклампсией в сочетании с синдромом задержки роста плода на основе данных о полиморфизме rs5985 гена F13A1. 1 ил., 1 табл., 4 пр.
Способ прогнозирования веса новорожденного у беременных русской национальности, являющихся уроженками Центрального Черноземья России с преэклампсией, не имеющих отягощенного семейного анамнеза по преэклампсии, и в сочетании с синдромом задержки роста плода, включающий выделение ДНК из периферической венозной крови, анализ полиморфизма rs5985 гена F13A1, прогнозирование нормального веса новорожденного при выявлении аллеля Т полиморфного локуса rs5985 гена F13A1, прогнозирование низкого веса новорожденного при выявлении аллеля G полиморфизма гена F13A1.
| СПОСОБ ПРОГНОЗИРОВАНИЯ ВЕСА НОВОРОЖДЕННОГО С УЧЕТОМ ПОЛИМОРФНЫХ ВАРИАНТОВ ЛОКУСА 10976 G/AFVII | 2014 |
|
RU2557952C1 |
| CN 105167742 B, 02.11.2018 | |||
| RYCKMAN K.K | |||
| et al | |||
| Replication of genetic associations in the inflammation, complement and coagulation pathways with intraventricular hemorrhage in low birth weight preterm neonates | |||
| Pediatr Res | |||
| Способ приготовления лака | 1924 |
|
SU2011A1 |
Авторы
Даты
2021-01-29—Публикация
2020-08-13—Подача