ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к антителам к PD1 (белок запрограммированной смерти 1) и к способам их применения.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
PD-1
Костимуляция или предоставление двух отличных сигналов Т-клеткам является общепринятой моделью лимфоцитарной активации покоящихся Т-лимфоцитов посредством антигенпрезентирующих клеток (АРС) (Lafferty et al., Aust. J. Exp. Biol. Med. Sci. 53: 27-42 (1975)).
Согласно данной модели дополнительно предложено различение иммунотолерантности в отношении «своего» и «не своего» (Bretscher et al., Science 169: 1042-1049 (1970); Bretscher, P.A., P.N.A.S. USA 96: 185-190 (1999); Jenkins et al., J. Exp. Med. 165: 302-319 (1987)). Первичный сигнал, или антигенспецифичный сигнал, трансдуцируется через Т-клеточный рецептор (TCR) после распознавания чужеродного антигенного пептида, презентированного в контексте главного комплекса гистосовместимости (МНС). Вторичный или костимулирующий сигнал доставляется к Т-клеткам костимулирующими молекулами, экспрессируемыми на антигенпрезентирующих клетках (АРС), и он индуцирует Т-клетки к стимуляции клонального размножения, секреции цитокинов и эффекторной функции (Lenschow et al., Ann. Rev. Immunol. 14:233 (1996)). В отсутствие костимуляции Т-клетки могут становиться невосприимчивыми к стимуляции антигеном, не формируют эффективного иммунного ответа, и дополнительно это может приводить к истощению популяции или толерантности по отношению к чужеродным антигенам.
Данная простая модель двух сигналов может представлять собой чрезмерное упрощение, так как на самом деле сила сигнала TCR имеет количественное влияние на активацию и дифференциацию Т-клеток (Viola et al., Science 273: 104-106 (1996); Sloan-Lancaster, Nature 363: 156-159 (1993)). Кроме того, активация Т-клеток может происходить даже в отсутствие костимулирующих сигналов, если сила сигнала TCR является высокой. Более важно то, что Т-клетки получают как положительные, так и отрицательные вторичные костимулирующие сигналы. Регуляция таких положительных и отрицательных сигналов является критически важной для максимизации защитных иммунных ответов хозяина при поддержании иммунологической толерантности и предупреждении аутоиммунитета.
Отрицательные вторичные сигналы, по-видимому, являются необходимыми для индукции толерантности Т-клеток, тогда как положительные сигналы стимулируют активацию Т-клеток. В то время как простая модель двух сигналов все еще предоставляет состоятельное объяснение для наивных лимфоцитов, иммунный ответ хозяина представляет собой динамический процесс, и костимулирующие сигналы также могут быть предоставлены для Т-клеток, подвергающихся воздействию антигена.
Механизм костимулирования представляет терапевтический интерес, так как было показано то, что манипулирование костимулирущими сигналами предоставляет средство либо для усиления, либо для прекращения иммунного ответа на клеточной основе. Недавно открыли то, что дисфункция или анергия Т-клеток происходит параллельно с индуцированной и поддерживающейся экспрессией ингибирующего рецептора - полипептида запрограммированной смерти 1 (PD-1). В результате, терапевтическое направленное воздействие на PD-1 является областью живого интереса.
Белок запрограммированной смерти 1 (PD-1) представляет собой ингибирующего члена семейства рецепторов CD28, которое также включает CD28, CTLA-4 (антиген 4 цитотоксических Т-лимфоцитов), ICOS (индуцируемый Т-клеточный костимулятор) и BTLA. PD-1 экспрессируется на активированных В-клетках, Т-клетках и миелоидных клетках (Agata et al, выше; Okazaki et al (2002) Curr. Opin. Immunol. 14: 391779-82; Bennett et al. (2003) J Immunol 170:711-8). Исходные члены семейства - CD28 и ICOS - были открыты по функциональным эффектам на увеличение пролиферации Т-клеток после добавления моноклональных антител (Hutloff et al (1999) Nature 397:263-266; Hansen et al (1980) Immunogenics 10:247-260). PD-1 был открыт посредством скрининга на дифференциальную экспрессию в апоптических клетках (Ishida et al (1992) EMBO J 11:3887-95). Другие члены семейства - CTLA-4 и BTLA - были открыты посредством скрининга на дифференциальную экспрессию в цитотоксических Т-лимфоцитах и клетках ТН1 (Т-хэлпер 1-го типа) соответственно. Все из CD28, ICOS и CTLA-4 имеют неспаренный остаток цистеина, обеспечивающий гомодимеризацию. В отличие от этого, предполагается то, что PD-1 существует в виде мономера, не имея неспаренного остатка цистеина, характерного у других членов семейства CD28.
Ген PD-1 кодирует 55 кДа трансмембранный белок типа I, который является частью надсемейства генов Ig (Agata et al. (1996) bit Immunol 8:765-72). PD-1 содержит мембранный проксимальный иммунорецепторный тирозиновый ингибирующий мотив (ITIM) и мембранный дистальный основанный на тирозине переключающий мотив (ITSM) (Thomas, MX. (1995) J Exp A4edW,: 1953-6; Vivier, E and Daeron, M (1997) Immunol Today 18:286-91). Несмотря на структурное сходство с CTLA-4, у PD-1 отсутствует мотив MYPPPY, который является критически важным для связывания В7-1 и В7-2. Идентифицировали два лиганда PD-1 - PD-L1 и PD-L2, для которых была показана понижающая регуляция активации Т-клеток при связывании с PD-1 (Freeman et al (2000) J Exp Med 192: 1027-34; Latchman et al (2001) Nat Immunol 2:261-8; Carter et al (2002) Eur J Immunol 32:634-43). И PD-L1, и PD-L2 являются гомологами В7, которые связываются с PD-1, но не связываются с другими членами семейства CD28. Одного лиганда PD-1 - PD-L1 - много при целом ряде человеческих раковых заболеваний (Dong et al (2002) Nat. Med 8:787-9). Взаимодействие между PD-1 и PD-Ll приводит к уменьшению числа инфильтрующих опухоль лимфоцитов, уменьшению пролиферации, опосредованной рецептором Т-клеток, и ускользанию раковых клеток от иммунологического надзора (Dong et al. (2003) J. MoI. Med. 81:281-7; Blank et al. (2005) Cancer Immunol. Immunother. 54:307-314; Konishi et al. (2004) Clin. Cancer Res. 10:5094-100). Иммунодепрессия может обращаться ингибированием местного взаимодействия PD-1 с PD-L1, и данный эффект является аддитивным также при блокировании взаимодействия PD-1 с PD-L2 (Iwai et al. (2002) Proc. Nat 7. Acad. ScL USA 99: 12293-7; Brown et al. (2003) J. Immunol. 170:1257-66).
PD1 является ингибирующим членом семейства CD28, экспрессируемым на активированных В-клетках, Т-клетках и миелоидных клетках (Agata et al, выше; Okazaki et al. (2002) Curr Opin Immunol 14: 391779-82; Bennett et al. (2003) J Immunol YWJl 1-8). У PD-1-дефицитных животных развиваются разные аутоиммунные фенотипы, включающие аутоиммунную кардиомиопатию и волчанкоподобный синдром с артритом и нефритом (Nishimura et al. (1999) Immunity H: 141-51; Nishimura et al. (2001) Science 291:319-22). Дополнительно обнаружили то, что PD1 играет роль в аутоиммунном энцефаломиелите, системной красной волчанке, заболевании «трансплантат против хозяина» (GVHD), диабете типа I и ревматоидном артрите (Salama et al. (2003) J Exp Med 198:71-78: Prokunina and Alarcon-Riquelme (2004) Hum MoI Genet 13_:R143; Nielsen et al. (2004) Lupus 11:510). В линии мышиной В-клеточной опухоли было показано то, что ITSM PD1 является существенным для блокирования опосредованного BCR (В-клеточный рецептор) тока Ca2+ и фосфорилирования тирозина последующих эффекторных молекул (Okazaki et al. (2001) PNAS 98: 13866-71).
В разных патентных заявках раскрыты продукция антител к PD-1 и/или способы усиления иммунных ответов с использованием агента (включающего антитело к PD-1), который препятствует связыванию с PD-L1 и/или сигнализации PD-1, включая следующие: US2003/0039653, US2004/0213795, US2006/0110383, US2007/0065427, US2007/0122378, US2012/237522, WO2004/072286, WO2006/121168, WO2006/133396, WO2007/005874, WO2008/083174, WO2008/156712, WO2009/024531, WO2009/014708, WO2009/114335, WO2010/027828, WO2010/027423, WO2010/036959, WO2010/029435, WO2010/029434, WO2010/063011, WO2010/089411, WO2011/066342, WO2011/110604, WO2011/110621 и WO2012/145493.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Согласно данному изобретению предложены антитела к PD1 и способы их применения.
Одним аспектом данного изобретения является такое антитело к PD1, где данное антитело:
i) конкурирует за связывание с PD-1 с антителом к PD1, содержащим VH и VL PD1-0103, и/или
ii) связывается с PD-1 человека и яванского макака; и/или
iii) усиливает секрецию интерферона-гамма (IFN-гамма) аллогенными стимулированными Т-клетками на 85% или более при концентрации антитела 10 мкг/мл; и/или
iv) усиливает секрецию фактора некроза опухолей альфа (TNF альфа) аллогенными стимулированными Т-клетками на 200% или более при концентрации антитела 10 мкг/мл.
Другим аспектом изобретения является антитело, которое связывается с человеческим PD1, где данное антитело усиливает секрецию интерферона-гамма (IFN-гамма) аллогенными стимулированными Т-клетками на 85% или более при концентрации антитела 10 мкг/мл в анализе реакции смешанной культуры лимфоцитов (MLR).
Другим аспектом изобретения является антитело, которое связывается с человеческим PD1, где данное антитело усиливает секрецию фактора некроза опухолей альфа (TNF альфа) аллогенными стимулированными Т-клетками на 200% или более при концентрации антитела 10 мкг/мл в анализе реакции смешанной культуры лимфоцитов (MLR).
Согласно данному изобретению предложено выделенное антитело, которое связывается с человеческим PD1, где данное антитело содержит:
А) (а) HVR-H1 (гипервариабельная область 1 тяжелой цепи), содержащую аминокислотную последовательность SEQ ID NO: 1; (б) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 2; (в) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 3; (г) HVR-L1 (гипервариабельная область 1 легкой цепи), содержащую аминокислотную последовательность SEQ ID NO: 4; (д) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 5; и (е) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 6; или
Б) (а) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 9; (б) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 10; (в) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 11; (г) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 12; (д) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 13; и (е) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 14; или
В) (а) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 17; (б) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 18; (в) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 19; (г) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 20; (д) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 21; и (е) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 22; или
Г) (а) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 25; (б) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 26; (в) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 27; (г) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 28; (д) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 29; и (е) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 30; или
Д) (а) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 33; (б) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 34; (в) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 35; (г) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 36; (д) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 37; и (е) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 38; или
Е) (а) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 41; (б) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 42; (в) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 43; (г) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 44; (д) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 45; и (е) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 46; или
Ж) (а) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 49; (б) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 50; (в) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 51; (г) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 52; (д) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 53; и (е) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 54.
Согласно данному изобретению дополнительно предложено выделенное антитело, которое связывается с человеческим PD1, где данное антитело содержит
А) (а) домен VH, содержащий (i) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 1, (ii) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 2, и (iii) HVR-H3, содержащую аминокислотную последовательность, выбранную из SEQ ID NO: 3, и (б) домен VL, содержащий (i) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 4, (ii) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 5, и (iii) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 6; или
Б) (а) домен VH, содержащий (i) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 9, (ii) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 10, и (iii) HVR-H3, содержащую аминокислотную последовательность, выбранную из SEQ ID NO: 11, и (б) домен VL, содержащий (i) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 12, (ii) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 13, и (iii) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 14; или
В) (а) домен VH, содержащий (i) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 17, (ii) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 18, и (iii) HVR-H3, содержащую аминокислотную последовательность, выбранную из SEQ ID NO: 19, и (б) домен VL, содержащий (i) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 20, (ii) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 21, и (iii) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 22; или
Г) (а) домен VH, содержащий (i) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 25, (ii) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 26, и (iii) HVR-H3, содержащую аминокислотную последовательность, выбранную из SEQ ID NO: 27, и (б) домен VL, содержащий (i) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 28, (ii) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 29, и (iii) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 30; или
Д) (а) домен VH, содержащий (i) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 33, (ii) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 34, и (iii) HVR-H3, содержащую аминокислотную последовательность, выбранную из SEQ ID NO: 35, и (б) домен VL, содержащий (i) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 36, (ii) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 37, и (iii) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 38; или
Е) (а) домен VH, содержащий (i) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 41, (ii) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 42, и (iii) HVR-H3, содержащую аминокислотную последовательность, выбранную из SEQ ID NO: 43, и (б) домен VL, содержащий (i) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 44, (ii) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 45, и (iii) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 46; или
Ж) (а) домен VH, содержащий (i) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 49, (ii) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 50, и (iii) HVR-H3, содержащую аминокислотную последовательность, выбранную из SEQ ID NO: 51, и (б) домен VL, содержащий (i) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 52, (ii) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 53, и (iii) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 54.
Согласно данному изобретению дополнительно предложено выделенное антитело, которое связывается с человеческим PD1, где данное антитело
А)
i) содержит последовательность VH SEQ ID NO: 7 и последовательность VL SEQ ID NO: 8;
ii) или гуманизированный вариант VH и VL антитела согласно i);
или Б)
i) содержит последовательность VH SEQ ID NO: 57 и последовательность VL SEQ ID NO: 58;
ii) содержит последовательность VH SEQ ID NO: 57 и последовательность VL SEQ ID NO: 59;
iii) содержит последовательность VH SEQ ID NO: 57 и последовательность VL SEQ ID NO: 60;
iv) содержит последовательность VH SEQ ID NO: 57 и последовательность VL SEQ ID NO: 61.
или В)
i) содержит последовательность VH SEQ ID NO: 15 и последовательность VL SEQ ID NO: 16;
ii) или гуманизированный вариант VH и VL антитела согласно i);
или Г)
i) содержит последовательность VH SEQ ID NO: 23 и последовательность VL SEQ ID NO: 24;
ii) или гуманизированный вариант VH и VL антитела согласно i);
или Д)
i) содержит последовательность VH SEQ ID NO: 31 и последовательность VL SEQ ID NO: 32;
ii) или гуманизированный вариант VH и VL антитела согласно i);
или Е)
i) содержит последовательность VH SEQ ID NO: 39 и последовательность VL SEQ ID NO: 40;
ii) или гуманизированный вариант VH и VL антитела согласно i);
или Ж)
i) содержит последовательность VH SEQ ID NO: 47 и последовательность VL SEQ ID NO: 48;
ii) или гуманизированный вариант VH и VL антитела согласно i);
или З)
i) содержит последовательность VH SEQ ID NO: 55 и последовательность VL SEQ ID NO: 56;
ii) или гуманизированный вариант VH и VL антитела согласно i);
В одном воплощении антитело к PD1 согласно изобретению представляет собой моноклональное антитело.
В одном воплощении антитело к PD1 согласно изобретению представляет собой человеческое, гуманизированное или химерное антитело.
В одном воплощении антитело к PD1 согласно изобретению представляет собой фрагмент антитела, который связывается с PD1.
В одном воплощении антитело к PD1 согласно изобретению представляет собой фрагмент Fab.
Согласно изобретению предложена выделенная нуклеиновая кислота, кодирующая антитело согласно любому из предшествующих пунктов.
Согласно изобретению предложена клетка-хозяин, содержащая такую нуклеиновую кислоту.
Согласно изобретению предложен способ продуцирования антитела, включающий культивирование клетки-хозяина таким образом, что продуцируется антитело.
Согласно изобретению предложен такой способ продуцирования антитела, дополнительно включающий выделение антитела из клетки-хозяина.
Согласно изобретению предложен фармацевтический препарат, содержащий антитело, описанное в данном документе, и фармацевтически приемлемый носитель.
Согласно изобретению предложено антитело, описанное в данном документе, для применения в качестве лекарственного средства.
Согласно изобретению предложено антитело, описанное в данном документе, для применения в лечении рака.
Согласно изобретению предложено применение антитела, описанного в данном документе, в изготовлении лекарственного средства. В одном воплощении данное лекарственное средство предназначено для лечения рака.
Согласно изобретению предложен способ лечения индивида, имеющего рак, включающий введение данному индивиду эффективного количества антитела, описанного в данном документе.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фиг. 1: блокада PD1 химерным PD1-0103 сильно увеличивает секрецию IFN-гамма аллогенными стимулированными первичными человеческими Т-клетками.
Фиг. 2: блокада PD1 химерным PD1-0103 сильно увеличивает секрецию интерферона-гамма (IFN-γ) аллогенными стимулированными первичными человеческими Т-клетками.
Фиг. 3: блокада PD1 химерным PD1-0103 сильно увеличивает секрецию фактора некроза опухолей альфа (TNF) аллогенными стимулированными первичными человеческими Т-клетками.
Фиг. 4: 4А) частота Т-клеток CD4, продуцирующих гранзим Б, и 4Б) количество IFN-γ, выявленное по поглощению (оптической плотности, О.П.), в супернатанте MLR в присутствии возрастающих концентраций разных антител к PD-1.
Фиг. 5: 5A) влияние блокады PD1/PD-L1 на реактивацию подавленной сигнализации Т-клеточного рецептора в присутствии разных антител к PD-1; 5Б) влияние блокады PD1/PD-L1 на реактивацию подавленной сигнализации Т-клеточного рецептора в присутствии разных антител к PD-1.
Фиг. 6: структура PD1-ECD в комплексе с Fab PD1-0103.
Фиг. 7: структура комплекса PD1-ECD с Fab PD1-0103: гликозилирование на ASN58 на PD1 участвует во взаимодействии.
Фиг. 8: структура комплекса PD1-ECD с Fab PD1-0103: вид на эпитоп/паратоп.
Фиг. 9: контакты центральной боковой сахарной цепи на Asn58 PD1 - тяжелой цепи Fab PD1-0103: контакты, идентифицированные по пороговому расстоянию 5Å.
Фиг. 10: остатки PD1-ECD, которые взаимодействуют с антителом - вид последовательности с подробными свойствами контактов - PD-1.
Фиг. 11: остатки антитела, которые взаимодействуют с PD1-ECD - вид последовательности с подробными свойствами контактов - тяжелая цепь.
Фиг. 12: остатки антитела, которые взаимодействуют с PD1-ECD - вид последовательности с подробными свойствами контактов - легкая цепь.
Фиг. 13А: связывание разных антител с PD1, негликозилированным на Asn58 (слева), и с PD1, гликозилированным на Asn58 (справа) (сенсограммы Biacore).
Фиг. 13Б: связывание разных антител с PD1, негликозилированным на Asn58, и с PD1, гликозилированным на Asn58 - скорость ассоциации - диссоциации Mab, определенная Biacore.
Фиг. 14А: ингибирование роста опухоли in vivo PD1-0103-0312 (aPD-1) по сравнению с ниволумабом в комбинации с биспецифичным антителом CEA-CD3 - при высоких дозах.
Фиг. 14Б: ингибирование роста опухоли in vivo PD1-0103-0312 (aPD-1) по сравнению с ниволумабом в комбинации с биспецифичным антителом CEA-CD3 - при высоких дозах.
ПОДРОБНОЕ ОПИСАНИЕ ВОПЛОЩЕНИЙ ИЗОБРЕТЕНИЯ
Термин «акцепторная человеческая каркасная область» для целей данного документа представляет собой каркасную область, содержащую аминокислотную последовательность каркасной области вариабельного домена легкой цепи (VL) или каркасной области вариабельного домена тяжелой цепи (VH), происходящую из каркасной области человеческого иммуноглобулина или человеческой консенсусной каркасной области, как определено ниже. Акцепторная человеческая каркасная область, «происходящая из» каркасной области человеческого иммуноглобулина или человеческой консенсусной каркасной области, может содержать такую же аминокислотную последовательность, как и они, или она может содержать изменения аминокислотной последовательности. В некоторых воплощениях число изменений аминокислот составляет 10 или меньше, 9 или меньше, 8 или меньше, 7 или меньше, 6 или меньше, 5 или меньше, 4 или меньше, 3 или меньше, или 2 или меньше. В некоторых воплощениях акцепторная человеческая каркасная область VL является идентичной по последовательности последовательности каркасной области VL человеческого иммуноглобулина или последовательности человеческой консенсусной каркасной области.
Термин «PD1», «человеческий PD1», «PD-1» или «человеческий PD-1» при использовании в данном документе относится к человеческому белку PD1 (SEQ ID NO: 68) (белок без сигнальной последовательности) / (SEQ ID NO: 70) (белок с сигнальной последовательностью). Фраза антитело «связывающееся с человеческим PD1», «специфично связывающееся с человеческим PD1», «которое связывается с человеческим PD1» или «антитело к PD1» в том виде, в котором она используется в данном документе, относится к антителу, специфично связывающемуся с человеческим антигеном PD1 или его внеклеточным доменом (ECD) с аффинностью связывания со значением KD 1,0×10-8 моль/л или меньше, в одном воплощении - со значением KD 1,0×10-9 моль/л или меньше, в одном воплощении - со значением KD от 1,0×10-9 моль/л до 1,0×10-13 моль/л. Аффинность связывания определяется стандартным анализом связывания, таким как методика поверхностного плазмонного резонанса (BIAcore®, GE-Healthcare, Упсала, Швеция), например, с использованием внеклеточного домена PD1.
Человеческий PD1 имеет сайты N-связанного гликозилирования на остатках PD-1 49, 58, 74 SEQ ID NO: 70 (см., например, D.Y. Lin et al, PNAS 105 (2008) 3011-3016)). Древо центральной сахарной цепи (N-связанного гликозилирования) в положении Asn58 PD-1 имеет следующую структуру в отношении моносахаридов. В одном воплощении центральная сахарная цепь на Asn58 PD1 относится к первым 5 сахарам (моносахаридам), которые присоединяются к PD1 на Asn58.
Asn58-N-GlcNAc(FUC) - GlcNAc- - BMA - MAN (см. Фиг. 9), где используются следующие сокращения.
[GlcNAc] - NGA - N-ацетил-бета-D-галактозамин - 2-(ацетиламино)-2-дезокси-бета-D-галактопираноза
[FUC] - альфа-L-фукоза
[BMA] - бета-D-маннопираноза
[MAN] - альфа-D-маннопираноза
Первый GlcNAc в сахарной цепи является фукозилированным, что сокращается как GlcNAc(FUC).
В одном воплощении центральная сахарная цепь на Asn58 PD1 относится к первым 5 сахарам (моносахаридам) GlcNAc, FUC, GlcNAc, BMA, MAN, которые присоединяются к PD1 на Asn58.
Термин «антитело» используется в данном документе в самом широком смысле и охватывает разные структуры антител, включая моноклональные антитела, поликлональные антитела, мультиспецифичные антитела (например, биспецифичные антитела) и фрагменты антител, но не ограничиваясь ими, при условии, что они демонстрируют желательную активность связывания антигена.
Термин «фрагмент антитела» относится к молекуле, отличной от интактного антитела, которая содержит часть интактного антитела, которая связывается с антигеном, с которым связывается интактное антитело. Примеры фрагментов антитела включают Fv, Fab, Fab', Fab'-SH, F(ab')2; диатела; линейные антитела; одноцепочечные молекулы антител (например, scFv) и мультиспецифичные антитела, образованные из фрагментов антител, но не ограничиваются ими.
Фраза «антитело, которое связывается с тем же самым эпитопом», что и контрольное антитело, относится к антителу, которое блокирует связывание контрольного антитела с его антигеном в конкурентном анализе на 50% или более, или, наоборот, контрольное антитело блокирует связывание антитела с его антигеном в конкурентном анализе на 50% или более. В данном документе приводится типичный конкурентный анализ.
Термин «химерное» антитело относится к антителу, в котором часть тяжелой и/или легкой цепи происходит из конкретного источника или вида, тогда как остальная тяжелая и/или легкая цепь происходит из другого источника или вида.
«Класс» антитела относится к типу константного домена или константной области, которыми обладает его тяжелая цепь. Существуют пять главных классов антител: IgA, IgD, IgE, IgG и IgM, и несколько из них могут дополнительно подразделяться на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелой цепи, которые соответствуют разным классам иммуноглобулинов, называются α, δ, ε, γ и μ соответственно.
Термин «цитотоксический агент» в том виде, в котором он используется в данном документе, относится к веществу, которое ингибирует или предотвращает клеточную функцию и/или вызывает гибель или разрушение клетки. Цитотоксические агенты включают радиоактивные изотопы (например, At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, Pb212 и радиоактивные изотопы Lu); химиотерапевтические агенты или лекарственные средства (например, метотрексат, адриамицин, алкалоиды барвинка (винкристин, винбластин, этопозид), доксорубицин, мелфалан, митомицин С, хлорамбуцил, даунорубицин или другие интеркалирующие агенты); агенты, ингибирующие рост; ферменты и их фрагменты, такие как нуклеолитические ферменты; антибиотики; токсины, такие как низкомолекулярные токсины или ферментативно активные токсины бактериального, грибного, растительного или животного происхождения, включая их фрагменты и/или варианты; и разные противоопухолевые или противораковые агенты, раскрытые ниже, но не ограничиваются ими.
«Эффективное количество» агента, например, фармацевтического препарата, относится к эффективному количеству в необходимых дозировках и в течение необходимых периодов времени для достижения желательного терапевтического или профилактического результата.
Термин «область Fc» используется в данном документе для определения С-концевой области тяжелой цепи иммуноглобулина, которая содержит по меньшей мере часть константной области. Данный термин включает области Fc с природной последовательностью и варианты области Fc. В одном воплощении область Fc тяжелой цепи человеческого IgG простирается от Cys226 или от Pro230 до карбоксильного конца тяжелой цепи. Однако С-концевой лизин (Lys447) области Fc может присутствовать или может отсутствовать. Если в данном документе не определено иначе, нумерация аминокислотных остатков в области Fc или в константной области осуществляется согласно системе нумерации EU, также именуемой индекс EU, как описано в Kabat, E.A. et al., Sequences of Proteins of Immunological Interest, 5th ed., Public Health Service, National Institutes of Health, Bethesda, MD (1991), NIH Publication 91-3242.
«Каркасная область» или «FR» относится к остаткам вариабельного домена, отличным от остатков гипервариабельной области (HVR). FR вариабельного домена обычно состоит из четырех FR доменов: FR1, FR2, FR3 и FR4. Соответственно, последовательности HVR и FR обычно появляются в VH (или VL) в следующей последовательности: FR1-H1(L1)-FR2-H2(L2)-FR3-H3(L3)-FR4.
Термины «полноразмерное антитело», «интактное антитело» и «полное антитело» используются в данном документе взаимозаменяемо для названия антитела, имеющего по существу аналогичную структуру структуре природного антитела, или имеющего тяжелые цепи, которые содержат область Fc, как определено в данном документе.
Термины «клетка-хозяин», «линия клеток-хозяев» и «культура клеток-хозяев» используются взаимозаменяемо и относятся к клеткам, в которые была введена экзогенная нуклеиновая кислота, включая потомство таких клеток. Клетки-хозяева включают «трансформантов» и «трансформированные клетки», которые включают первичные трансформированные клетки и потомство, полученное от них, независимо от числа пассажей. Потомство может не быть полностью идентичным родительской клетке по содержанию нуклеиновых кислот, но может содержать мутации. Сюда включено мутантное потомство, которое имеет такую же функцию или биологическую активность, на которую осуществляется скрининг или отбор у исходно трансформированной клетки.
«Человеческое антитело» представляет собой антитело, которое обладает аминокислотной последовательностью, которая соответствует аминокислотной последовательности антитела, продуцируемого человеком или человеческой клеткой, или происходит из источника, не являющегося человеческим, в котором используется человеческий репертуар антител или других последовательностей, кодирующих человеческие антитела. Данное определение человеческого антитела конкретно исключает гуманизированное антитело, содержащее антигенсвязывающие остатки, не являющиеся человеческими.
«Человеческая консенсусная каркасная область» представляет собой каркасную область, которая представляет собой чаще всего встречающиеся аминокислотные остатки в наборе последовательностей каркасных областей VL или VH человеческого иммуноглобулина. В общем, набор последовательностей VL или VH человеческого иммуноглобулина происходит из подгруппы последовательностей вариабельного домена. Обычно данная подгруппа последовательностей представляет собой такую же подгруппу, что и в Kabat, E.A. et al., Sequences of Proteins of Immunological Interest, 5th ed., Bethesda MD (1991), NIH Publication 91-3242, Vols. 1-3. В одном воплощении для VL данной подгруппой является подгруппа каппа I, такая же, как и в Kabat et al., выше. В одном воплощении для VH данной подгруппой является подгруппа III, такая же, как и в Kabat et al., выше.
Термин «гуманизированное» антитело относится к химерному антителу, содержащему аминокислотные остатки из HVR, не являющихся человеческими, и аминокислотные остатки из человеческих FR. В некоторых воплощениях гуманизированное антитело будет содержать по существу все из по меньшей мере одного и типично двух вариабельных доменов, в которых все или по существу все из HVR (например, CDR (область, определяющая комплементарность)) соответствуют HVR антитела, не являющегося человеческим, и все или по существу все FR соответствуют FR человеческого антитела. Гуманизированное антитело возможно может содержать по меньшей мере часть константной области антитела, происходящей из человеческого антитела. Термин «гуманизированная форма» антитела, например, антитела, не являющегося человеческим, относится к антителу, которое подверглось гуманизации.
Термин «гипервариабельная область» или «HVR» в том виде, в котором он используется в данном документе, относится к каждой из областей вариабельного домена антитела, которые являются гипервариабельными по последовательности («области, определяющие комплементарность» или «CDR») и/или образуют структурно определенные петли («гипервариабельные петли»), и/или содержат остатки, контактирующие с антигеном («контакты с антигеном»). В общем, антитела содержат шесть HVR: три в VH (H1, H2, H3) и три в VL (L1, L2, L3). Типичные HVR в данном документе включают:
(а) гипервариабельные петли, находящиеся в аминокислотных остатках 26-32 (L1), 50-52 (L2), 91-96 (L3), 26-32 (H1), 53-55 (H2) и 96-101 (H3) (Chothia and Lesk, J. Mol. Biol. 196:901-917 (1987));
(б) CDR, находящиеся в аминокислотных остатках 24-34 (L1), 50-56 (L2), 89-97 (L3), 31-35b (H1), 50-65 (H2) и 95-102 (H3) (Kabat et al., Sequences of Proteins of Immunological Interest, 5th ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991));
(в) контакты с антигеном, находящиеся в аминокислотных остатках 27c-36 (L1), 46-55 (L2), 89-96 (L3), 30-35b (H1), 47-58 (H2) и 93-101 (H3) (MacCallum et al. J. Mol. Biol. 262: 732-745 (1996)); и
(г) комбинации (а), (б) и/или (в), включающие аминокислотные остатки HVR 46-56 (L2), 47-56 (L2), 48-56 (L2), 49-56 (L2), 26-35 (H1), 26-35b (H1), 49-65 (H2), 93-102 (H3) и 94-102 (H3).
Если не указано иное, остатки HVR и другие остатки в вариабельном домене (например, остатки FR) нумеруются в данном документе согласно Kabat et al., выше.
«Иммуноконъюгат» представляет собой антитело, конъюгированное с одной или более чем одной гетерологичной молекулой, включающей цитотоксический агент, но не ограничивающейся им.
«Индивид» или «субъект» представляет собой млекопитающее. Млекопитающие включают домашних животных (например, коров, овец, кошек, собак и лошадей), приматов (например, человека и приматов, не являющихся человеком, таких как обезьяны), кроликов и грызунов (например, мышей и крыс), но не ограничиваются ими. В некоторых воплощениях индивид или субъект представляет собой человека.
«Выделенное» антитело представляет собой антитело, которое было отделено от компонента его природного окружения. В некоторых воплощениях антитело очищают до чистоты, большей, чем 95% или 99% при определении, например, электрофоретическими (например, SDS-PAGE (электрофорез в полиакриламидном геле с додецилсульфатом натрия), изоэлектрофокусировка (IEF), капиллярный электрофорез) или хроматографическими (например, ионообменная ВЭЖХ (высокоэффективная жидкостная хроматография) или ВЭЖХ с обращенной фазой) способами. Относительно обзора способов оценки чистоты антител, см., например, Flatman, S. et al., J. Chromatogr. B 848 (2007) 79-87.
Термин «выделенная» нуклеиновая кислота относится к молекуле нуклеиновой кислоты, которая была отделена от компонента ее природного окружения. Выделенная нуклеиновая кислота включает молекулу нуклеиновой кислоты, содержащуюся в клетках, которые обычно содержат данную молекулу нуклеиновой кислоты, но данная молекула нуклеиновой кислоты присутствует внехромосомно или в участке хромосомы, который отличается от ее природного хромосомного участка.
Фраза «выделенная нуклеиновая кислота, кодирующая антитело к PD1» относится к одной или более чем одной молекуле нуклеиновой кислоты, кодирующей тяжелую и легкую цепи антитела (или их фрагменты), включая такую(кие) молекулу(лы) нуклеиновой кислоты в одном векторе или отдельных векторах, и такую(кие) молекулу(лы) нуклеиновой кислоты, присутствующие в одном или более чем одном положении в клетке-хозяине.
Термин «моноклональное антитело» в том виде, в котором он используется в данном документе, относится к антителу, полученному из популяции по существу гомогенных антител, т.е. индивидуальные антитела, составляющие популяцию, являются идентичными и/или связываются с тем же самым эпитопом, за исключением возможных вариантов антител, например, содержащих встречающиеся в природе мутации или возникающих во время получения препарата моноклонального антитела, причем такие варианты обычно присутствуют в минорных количествах. В отличие от препаратов поликлональных антител, которые типично включают разные антитела, направленные против разных детерминант (эпитопов), каждое моноклональное антитело препарата моноклональных антител направлено против одной детерминанты на антигене. Таким образом, модификатор «моноклональный» указывает на характер антитела как полученного из по существу гомогенной популяции антител, и его не следует истолковывать как требующий продукции антитела каким-либо конкретным способом. Например, моноклональные антитела, подлежащие применению согласно настоящему изобретению, можно получать целым рядом методик, включающих способ гибридомы, способы генной инженерии, способы фагового дисплея и способы с использованием трансгенных животных, содержащих все локусы человеческого иммуноглобулина или их часть, но не ограничивающихся ими, причем такие способы и другие типичные способы для получения моноклональных антител описываются в данном документе.
Термин «голое антитело» относится к антителу, которое не конъюгировано с гетерологичной группировкой (например, цитотоксической группировкой) или радиоактивной меткой. Голое антитело может присутствовать в фармацевтическом препарате.
Термин «природные антитела» относится к встречающимся в природе молекулам иммуноглобулинов с варьирующими структурами. Например, природные антитела IgG представляют собой гетеротетрамерные гликопротеины с молекулярной массой примерно 150000 Дальтон, состоящие из двух идентичных легких цепей и двух идентичных тяжелых цепей, которые связаны дисульфидными связями. От N- до С-конца каждая тяжелая цепь имеет вариабельную область (VH), также именуемую вариабельный тяжелый домен или вариабельный домен тяжелой цепи, с последующими тремя константными доменами (СН1, СН2 и СН3). Аналогичным образом, от N- до С-конца каждая легкая цепь имеет вариабельную область (VL), также именуемую вариабельный легкий домен или вариабельный домен легкой цепи, с последующим константным легким доменом (CL). Легкая цепь антитела может быть приписана к одному из двух типов, именуемых каппа (κ) и лямбда (λ), на основе аминокислотной последовательности ее константного домена.
Термин «листок-вкладыш в упаковке» используется для названия инструкций, традиционно включаемых в имеющиеся в продаже упаковки терапевтических продуктов, которые содержат информацию о показаниях, применении, дозировке, введении, комбинированной терапии, противопоказаниях и/или предупреждениях, касающихся применения таких терапевтических продуктов.
«Процент (%) идентичности аминокислотной последовательности» по отношению к контрольной последовательности полипептида определяется как процентная доля аминокислотных остатков в последовательности-кандидате, которые являются идентичными аминокислотным остаткам в контрольной последовательности полипептида, после выравнивания данных последовательностей и, если необходимо, введения пробелов для достижения максимального процента идентичности последовательности, и не рассматривая любые консервативные замены как часть идентичности последовательности. Выравнивание для целей определения процента идентичности аминокислотной последовательности может достигаться разными способами, которые находятся в пределах квалификации в данной области, например, с использованием общедоступных компьютерных программ, таких как программы BLAST, BLAST-2, ALIGN или Megalign (DNASTAR). Специалисты в данной области могут определять подходящие параметры для выравнивания последовательностей, включая любые алгоритмы, необходимые для достижения максимального выравнивания по всей длине сравниваемых последовательностей. Для целей данного документа, однако, значения % идентичности аминокислотной последовательности получаются с использованием компьютерной программы сравнения последовательностей ALIGN-2. Авторство компьютерной программы сравнения последовательностей ALIGN-2 принадлежит Genentech, Inc., и исходный код с пользовательской документацией был подан в Бюро регистрации авторских прав США, Washington D.C., 20559, где он зарегистрирован под регистрационным № авторского права США TXU510087. Программа ALIGN-2 является общедоступной от Genentech, Inc., Южный Сан-Франциско, Калифорния, или может быть составлена из исходного кода. Программу ALIGN-2 следует составлять для применения в операционной системе UNIX, включая цифровую UNIX V4.0D. Все параметры сравнения последовательностей устанавливаются программой ALIGN-2 и не варьируют.
В ситуациях, когда ALIGN-2 применяется для сравнений аминокислотных последовательностей, % идентичности аминокислотной последовательности данной аминокислотной последовательности А с или относительно данной аминокислотной последовательности Б (что может быть альтернативно сформулировано как данная аминокислотная последовательность А, которая имеет или содержит определенный % идентичности аминокислотной последовательности с или относительно данной аминокислотной последовательности Б) рассчитывается следующим образом:
100 умножить на долю X/Y
где Х представляет собой число аминокислотных остатков, подсчитанных как идентичные совпадения, посредством программы выравнивания последовательностей ALIGN-2 в выравнивании А и Б данной программой, и где Y представляет собой общее число аминокислотных остатков в Б. Будет понятно то, что когда длина аминокислотной последовательности А не равна длине аминокислотной последовательности Б, % идентичности аминокислотной последовательности А с Б не будет равен % идентичности аминокислотной последовательности Б с А. Если конкретно не утверждается иное, все значения % идентичности аминокислотной последовательности, используемые в данном документе, как описано в непосредственно предшествующем абзаце, получены с использованием компьютерной программы ALIGN-2.
Термин «фармацевтический препарат» относится к препарату, который находится в такой форме, чтобы обеспечивать эффективную биологическую активность содержащегося в нем активного ингредиента, и который не содержит дополнительных компонентов, которые являются неприемлемо токсичными для субъекта, которому вводился бы препарат.
Термин «фармацевтически приемлемый носитель» относится к ингредиенту в фармацевтическом препарате, отличному от активного ингредиента, который является нетоксичным для субъекта. Фармацевтически приемлемый носитель включает буфер, эксципиент, стабилизатор или консервант, но не ограничивается ими.
Термин «лечение» (и его грамматические вариации, такие как «лечить» или «осуществление лечения») в том виде, в котором он используется в данном документе, относится к клиническому вмешательству в попытке изменить природный ход заболевания индивида, которого лечат, и оно может осуществляться либо для профилактики, либо по ходу клинической патологии. Желательные эффекты лечения включают предупреждение появления или рецидива заболевания, облегчение симптомов, уменьшение любых прямых или опосредованных патологических последствий заболевания, предупреждение метастазов, уменьшение скорости прогрессирования заболевания, уменьшение интенсивности или временное ослабление болезненного состояния и ремиссию или улучшенный прогноз, но не ограничиваются ими. В некоторых воплощениях антитела по изобретению используются для задержки развития заболевания или для замедления прогрессирования заболевания.
Термин «вариабельная область» или «вариабельный домен» относится к домену тяжелой или легкой цепи антитела, который участвует в связывании антитела с антигеном. Вариабельные домены тяжелой цепи и легкой цепи (VH и VL соответственно) природного антитела обычно имеют аналогичные структуры, причем каждый домен содержит четыре консервативные каркасные области (FR) и три гипервариабельные области (HVR). (См., например, Kindt, T.J., et al. Kuby Immunology, 6th ed., W.H. Freeman and Co., N.Y. (2007), страница 91). Один домен VH или VL может быть достаточным для придания специфичности связывания с антигеном. Кроме того, антитела, которые связываются с конкретным антигеном, могут быть выделены с использованием домена VH или VL из антитела, которое связывается с антигеном, для скрининга библиотеки комплементарных доменов VL или VH соответственно. См., например, Portolano, S. et al., J. Immunol. 150 (1993) 880-887; Clackson, T. et al., Nature 352 (1991) 624-628).
Термин «вектор» в том виде, в котором он используется в данном документе, относится к молекуле нуклеиновой кислоты, способной размножать другую нуклеиновую кислоту, с которой он связан. Данный термин включает вектор в качестве структуры самореплицирующейся нуклеиновой кислоты, а также вектор, включенный в геном клетки-хозяина, в которую он был введен. Определенные векторы способны управлять экспрессией нуклеиновых кислот, с которыми они связаны функциональным образом. Такие векторы называются в данном документе «экспрессионными векторами».
I. КОМПОЗИЦИИ И СПОСОБЫ
В одном аспекте данное изобретение отчасти основано на данных о том, что выбранные антитела к PD1 по изобретению связываются с определенными эпитопами PD1 и имеют способность увеличивать активацию разных иммунных клеток (например, Т-клеток, В-клеток, клеток NK (натуральный киллер), дендритных клеток (DC), моноцитов и макрофагов). Например, они увеличивают высвобождение (секрецию) иммуномодулирующих цитокинов (например, интерферона-гамма и гранзима В). Другими иммуномодулирующими цитокинами, уровень которых увеличивается или может быть увеличен, являются, например, секреция фактора некроза опухолей альфа (TNF альфа) и IL-12 (интерлейкин-12). Термины секреция интерферона-гамма (IFN-гамма), фактора некроза опухолей альфа (TNF альфа), IL-12 и т.д. в том виде, в котором они используются в данном документе, относятся к человеческим цитокинам.
В некоторых воплощениях предложены антитела, которые связываются с PD1. Антитела по изобретению являются полезными, например, для диагностики или лечения рака.
А. Типичные антитела к PD1
В одном аспекте согласно изобретению предложены выделенные антитела, которые связываются с человеческим PD1.
В некоторых воплощениях предложено антитело к PD1, где данное антитело:
i) конкурирует за связывание с PD-1 с антителом к PD1, содержащим VH и VL PD1-0103, и
ii) связывается с PD-1 человека и яванского макака; и
iii) усиливает секрецию интерферона-гамма (IFN-гамма) аллогенными стимулированными Т-клетками на 85% или более (в одном предпочтительном воплощении на 90% или более, в одном предпочтительном воплощении на 95% или более) при концентрации антитела 10 мкг/мл (где секреция без антитела принята за 0% (базальный уровень IFN-гамма), и секреция с 20 EU/мл рекомбинантного человеческого IL-2 принята за 100% (в анализе реакции смешанной культуры (аллогенных) лимфоцитов (MLR) согласно Примеру 3); и/или
iv) усиливает секрецию фактора некроза опухолей альфа (TNF альфа) аллогенными стимулированными Т-клетками на 200% или более (в одном предпочтительном воплощении на 250% или более) при концентрации антитела 10 мкг/мл (где секреция без антитела принята за 0% (базальный уровень IFN-гамма), и секреция с 20 EU/мл рекомбинантного человеческого IL-2 принята за 100% (в анализе реакции смешанной культуры (аллогенных) лимфоцитов (MLR) согласно Примеру 3).
В одном аспекте согласно изобретению предложено антитело к PD1, содержащее (а) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 1; (б) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 2; (в) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 3; (г) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 4; (д) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 5; и (е) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 6.
В другом аспекте антитело по изобретению содержит (а) домен VH, содержащий (i) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 1; (ii) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 2; и (iii) HVR-H3, содержащую аминокислотную последовательность, выбранную из SEQ ID NO: 3; и (б) домен VL, содержащий (i) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 4; (ii) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 5; и (iii) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 6.
В одном воплощении такое антитело к PD1 содержит
i) последовательность VH SEQ ID NO: 7 и последовательность VL SEQ ID NO: 8;
ii) или гуманизированный вариант VH и VL антитела согласно i);
В одном воплощении такое антитело к PD1 содержит
i) последовательность VH SEQ ID NO: 57 и последовательность VL SEQ ID NO: 58; или
ii) последовательность VH SEQ ID NO: 57 и последовательность VL SEQ ID NO: 59; или
iii) последовательность VH SEQ ID NO: 57 и последовательность VL SEQ ID NO: 60; или
iv) последовательность VH SEQ ID NO: 57 и последовательность VL SEQ ID NO: 61.
В одном воплощении такое антитело к PD1 содержит последовательность VH SEQ ID NO: 57 и последовательность VL SEQ ID NO: 58.
В одном воплощении такое антитело к PD1 содержит последовательность VH SEQ ID NO: 57 и последовательность VL SEQ ID NO: 59.
В одном воплощении такое антитело к PD1 содержит последовательность VH SEQ ID NO: 57 и последовательность VL SEQ ID NO: 60.
В одном воплощении такое антитело к PD1 содержит последовательность VH SEQ ID NO: 57 и последовательность VL SEQ ID NO: 61.
В одном аспекте согласно изобретению предложено антитело к PD1, содержащее по меньшей мере одну, две, три, четыре, пять или шесть HVR, выбранных из (а) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO: 9; (б) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO: 10; (в) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO: 11; (г) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO: 12; (д) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO: 13; и (е) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO: 14.
В одном аспекте согласно изобретению предложено антитело к PD1, содержащее (а) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 9; (б) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 10; (в) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 11; (г) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 12; (д) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 13; и (е) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 14.
В другом аспекте антитело по изобретению содержит (а) домен VH, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности HVR VH, выбранные из (i) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO: 9; (ii) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO: 10; и (iii) HVR-H3, содержащей аминокислотную последовательность, выбранную из SEQ ID NO: 11; и (б) домен VL, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности HVR VL, выбранные из (i) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO: 12; (ii) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO: 13; и (iii) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO: 14.
В другом аспекте антитело по изобретению содержит (а) домен VH, содержащий (i) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 9; (ii) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 10; и (iii) HVR-H3, содержащую аминокислотную последовательность, выбранную из SEQ ID NO: 11; и (б) домен VL, содержащий (i) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 12; (ii) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 13; и (iii) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 14.
В одном воплощении такое антитело к PD1 содержит
i) последовательность VH SEQ ID NO: 15 и последовательность VL SEQ ID NO: 16;
ii) или гуманизированный вариант VH и VL антитела согласно i).
В одном аспекте согласно изобретению предложено антитело к PD1, содержащее по меньшей мере одну, две, три, четыре, пять или шесть HVR, выбранных из (а) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO: 17; (б) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO: 18; (в) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO: 19; (г) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO: 20; (д) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO: 21; и (е) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO: 22.
В одном аспекте согласно изобретению предложено антитело к PD1, содержащее (а) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 17; (б) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 18; (в) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 19; (г) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 20; (д) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 21; и (е) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 22.
В другом аспекте антитело по изобретению содержит (а) домен VH, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности HVR VH, выбранные из (i) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO: 17; (ii) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO: 18; и (iii) HVR-H3, содержащей аминокислотную последовательность, выбранную из SEQ ID NO: 19; и (б) домен VL, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности HVR VL, выбранные из (i) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO: 20; (ii) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO: 21; и (iii) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO: 22.
В другом аспекте антитело по изобретению содержит (а) домен VH, содержащий (i) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 17; (ii) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 18; и (iii) HVR-H3, содержащую аминокислотную последовательность, выбранную из SEQ ID NO: 19; и (б) домен VL, содержащий (i) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 20; (ii) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 21; и (iii) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 22.
В одном воплощении такое антитело к PD1 содержит
i) последовательность VH SEQ ID NO: 23 и последовательность VL SEQ ID NO: 24;
ii) или гуманизированный вариант VH и VL антитела согласно i).
В одном аспекте согласно изобретению предложено антитело к PD1, содержащее по меньшей мере одну, две, три, четыре, пять или шесть HVR, выбранных из (а) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO: 25; (б) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO: 26; (в) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO: 27; (г) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO: 28; (д) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO: 29; и (е) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO: 30.
В одном аспекте согласно изобретению предложено антитело к PD1, содержащее (а) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 25; (б) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 26; (в) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 27; (г) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 28; (д) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 29; и (е) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 30.
В другом аспекте антитело по изобретению содержит (а) домен VH, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности HVR VH, выбранные из (i) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO: 25; (ii) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO: 26; и (iii) HVR-H3, содержащей аминокислотную последовательность, выбранную из SEQ ID NO: 27; и (б) домен VL, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности HVR VL, выбранные из (i) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO: 28; (ii) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO: 29; и (iii) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO: 30.
В другом аспекте антитело по изобретению содержит (а) домен VH, содержащий (i) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 25; (ii) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 26; и (iii) HVR-H3, содержащую аминокислотную последовательность, выбранную из SEQ ID NO: 27; и (б) домен VL, содержащий (i) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 28; (ii) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 29; и (iii) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 30.
В одном воплощении такое антитело к PD1 содержит
i) последовательность VH SEQ ID NO: 31 и последовательность VL SEQ ID NO: 32;
ii) или гуманизированный вариант VH и VL антитела согласно i).
В одном аспекте согласно изобретению предложено антитело к PD1, содержащее по меньшей мере одну, две, три, четыре, пять или шесть HVR, выбранных из (а) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO: 33; (б) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO: 34; (в) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO: 35; (г) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO: 36; (д) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO: 37; и (е) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO: 38.
В одном аспекте согласно изобретению предложено антитело к PD1, содержащее (а) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 33; (б) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 34; (в) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 35; (г) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 36; (д) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 37; и (е) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 38.
В другом аспекте антитело по изобретению содержит (а) домен VH, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности HVR VH, выбранные из (i) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO: 33; (ii) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO: 34; и (iii) HVR-H3, содержащей аминокислотную последовательность, выбранную из SEQ ID NO: 35; и (б) домен VL, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности HVR VL, выбранные из (i) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO: 36; (ii) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO: 37; и (iii) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO: 38.
В другом аспекте антитело по изобретению содержит (а) домен VH, содержащий (i) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 33; (ii) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 34; и (iii) HVR-H3, содержащую аминокислотную последовательность, выбранную из SEQ ID NO: 35; и (б) домен VL, содержащий (i) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 36; (ii) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 37; и (iii) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 38.
В одном воплощении такое антитело к PD1 содержит
i) последовательность VH SEQ ID NO: 39 и последовательность VL SEQ ID NO: 40;
ii) или гуманизированный вариант VH и VL антитела согласно i).
В одном аспекте согласно изобретению предложено антитело к PD1, содержащее по меньшей мере одну, две, три, четыре, пять или шесть HVR, выбранных из (а) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO: 41; (б) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO: 42; (в) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO: 43; (г) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO: 44; (д) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO: 45; и (е) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO: 46.
В одном аспекте согласно изобретению предложено антитело к PD1, содержащее (а) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 41; (б) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 42; (в) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 43; (г) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 44; (д) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 45; и (е) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 46.
В другом аспекте антитело по изобретению содержит (а) домен VH, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности HVR VH, выбранные из (i) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO: 41; (ii) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO: 42; и (iii) HVR-H3, содержащей аминокислотную последовательность, выбранную из SEQ ID NO: 43; и (б) домен VL, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности HVR VL, выбранные из (i) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO: 44; (ii) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO: 45; и (iii) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO: 46.
В другом аспекте антитело по изобретению содержит (а) домен VH, содержащий (i) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 41; (ii) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 42; и (iii) HVR-H3, содержащую аминокислотную последовательность, выбранную из SEQ ID NO: 43; и (б) домен VL, содержащий (i) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 44; (ii) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 45; и (iii) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 46.
В одном воплощении такое антитело к PD1 содержит
i) последовательность VH SEQ ID NO: 47 и последовательность VL SEQ ID NO: 48;
ii) или гуманизированный вариант VH и VL антитела согласно i).
В одном аспекте согласно изобретению предложено антитело к PD1, содержащее по меньшей мере одну, две, три, четыре, пять или шесть HVR, выбранных из (а) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO: 49; (б) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO: 50; (в) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO: 51; (г) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO: 52; (д) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO: 53; и (е) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO: 54.
В одном аспекте согласно изобретению предложено антитело к PD1, содержащее (а) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 49; (б) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 50; (в) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 51; (г) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 52; (д) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 53; и (е) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 54.
В другом аспекте антитело по изобретению содержит (а) домен VH, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности HVR VH, выбранные из (i) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO: 49; (ii) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO: 50; и (iii) HVR-H3, содержащей аминокислотную последовательность, выбранную из SEQ ID NO: 51; и (б) домен VL, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности HVR VL, выбранные из (i) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO: 52; (ii) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO: 53; и (iii) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO: 54.
В другом аспекте антитело по изобретению содержит (а) домен VH, содержащий (i) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 49; (ii) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 50; и (iii) HVR-H3, содержащую аминокислотную последовательность, выбранную из SEQ ID NO: 51; и (б) домен VL, содержащий (i) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 52; (ii) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 53; и (iii) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 54.
В одном воплощении такое антитело к PD1 содержит
i) последовательность VH SEQ ID NO: 47 и последовательность VL SEQ ID NO: 48;
ii) или гуманизированный вариант VH и VL антитела согласно i).
В одном предпочтительном воплощении предложено антитело, которое связывается с тем же самым эпитопом, что и антитело к PD1, содержащее последовательность VH SEQ ID NO: 7 и последовательность VL SEQ ID NO: 8.
В одном предпочтительном воплощении предложено антитело, которое конкурирует за связывание с человеческим PD1 с антителом к PD1, содержащим последовательность VH SEQ ID NO: 7 и последовательность VL SEQ ID NO: 8 (при определении в конкурентном анализе, описанном в Примере 2 (ELISA (твердофазный иммуноферментый анализ) картирования эпитопов/конкурентный анализ связывания)).
В одном аспекте согласно изобретению предложено антитело к PD1 (например, антитело, которое связывается с человеческим PD1), содержащее
А) (а) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 1; (б) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 2; (в) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 3; (г) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 4; (д) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 5; и (е) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 6; или
В другом аспекте согласно изобретению предложено антитело к PD1 (например, антитело, которое связывается с человеческим PD1), содержащее
(а) домен VH, содержащий (i) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 1; (ii) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 2; и (iii) HVR-H3, содержащую аминокислотную последовательность, выбранную из SEQ ID NO: 3; и (б) домен VL, содержащий (i) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 4; (ii) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 5; и (iii) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 6.
В одном аспекте согласно изобретению предложено антитело, которое связывается с человеческим PD1, которое
А)
i) содержит последовательность VH SEQ ID NO: 7 и последовательность VL SEQ ID NO: 8;
ii) или гуманизированный вариант VH и VL антитела согласно i);
или Б)
i) содержит последовательность VH SEQ ID NO: 57 и последовательность VL SEQ ID NO: 58.
ii) содержит последовательность VH SEQ ID NO: 57 и последовательность VL SEQ ID NO: 59.
iii) содержит последовательность VH SEQ ID NO: 57 и последовательность VL SEQ ID NO: 60.
iv) содержит последовательность VH SEQ ID NO: 57 и последовательность VL SEQ ID NO: 61.
или В)
i) содержит последовательность VH SEQ ID NO: 15 и последовательность VL SEQ ID NO: 16;
ii) или гуманизированный вариант VH и VL антитела согласно i);
или Г)
i) содержит последовательность VH SEQ ID NO: 23 и последовательность VL SEQ ID NO: 24;
ii) или гуманизированный вариант VH и VL антитела согласно i);
или Д)
i) содержит последовательность VH SEQ ID NO: 31 и последовательность VL SEQ ID NO: 32;
ii) или гуманизированный вариант VH и VL антитела согласно i);
или Е)
i) содержит последовательность VH SEQ ID NO: 39 и последовательность VL SEQ ID NO: 40;
ii) или гуманизированный вариант VH и VL антитела согласно i);
или Ж)
i) содержит последовательность VH SEQ ID NO: 47 и последовательность VL SEQ ID NO: 48;
ii) или гуманизированный вариант VH и VL антитела согласно i);
или З)
i) содержит последовательность VH SEQ ID NO: 55 и последовательность VL SEQ ID NO: 56;
ii) или гуманизированный вариант VH и VL антитела согласно i);
В одном аспекте согласно изобретению предложено антитело, которое связывается с человеческим PD1, которое
i) содержит последовательность VH SEQ ID NO: 7 и последовательность VL SEQ ID NO: 8;
ii) или гуманизированный вариант VH и VL антитела согласно i).
В одном аспекте согласно изобретению предложено антитело, которое связывается с человеческим PD1, которое содержит последовательность VH SEQ ID NO: 57 и последовательность VL SEQ ID NO: 58.
В одном аспекте согласно изобретению предложено антитело, которое связывается с человеческим PD1, которое содержит последовательность VH SEQ ID NO: 57 и последовательность VL SEQ ID NO: 59.
В одном аспекте согласно изобретению предложено антитело, которое связывается с человеческим PD1, которое содержит последовательность VH SEQ ID NO: 57 и последовательность VL SEQ ID NO: 60.
В одном аспекте согласно изобретению предложено антитело, которое связывается с человеческим PD1, которое содержит последовательность VH SEQ ID NO: 57 и последовательность VL SEQ ID NO: 61.
В другом аспекте согласно изобретению предложено антитело к PD1 (например, антитело, которое связывается с человеческим PD1), содержащее
А) (а) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 1; (б) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 2; (в) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 3; (г) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 4; (д) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 5; и (е) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 6; или
Б) (а) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 9; (б) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 10; (в) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 11; (г) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 12; (д) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 13; и (е) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 14; или
В) (а) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 17; (б) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 18; (в) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 19; (г) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 20; (д) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 21; и (е) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 22; или
Г) (а) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 25; (б) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 26; (в) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 27; (г) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 28; (д) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 29; и (е) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 30; или
Д) (а) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 33; (б) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 34; (в) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 35; (г) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 36; (д) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 37; и (е) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 38; или
Е) (а) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 41; (б) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 42; (в) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 43; (г) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 44; (д) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 45; и (е) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 46; или
Ж) (а) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 49; (б) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 50; (в) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 51; (г) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 52; (д) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 53; и (е) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 54;
где данное антитело характеризуется независимо одним или более чем одним из следующих свойств: антитело к PD-1
i) конкурирует за связывание с PD-1 с антителом к PD-1, содержащим VH и VL PD1-0103, и/или
ii) связывается с PD-1 человека и яванского макака; и/или
iii) усиливает секрецию интерферона-гамма (IFN-гамма) аллогенными стимулированными Т-клетками на 85% или более (в одном предпочтительном воплощении на 90% или более, в одном предпочтительном воплощении - на 95% или более) при концентрации антитела 10 мкг/мл (где секреция без антитела принята за 0% (базальный уровень IFN-гамма), и секреция с 20 EU/мл рекомбинантного человеческого IL-2 принята за 100% (в анализе реакции (аллогенной) смешанной культуры лимфоцитов (MLR) согласно Примеру 3); и/или
iv) усиливает секрецию фактора некроза опухолей альфа (TNF альфа) аллогенными стимулированными Т-клетками на 200% или более (в одном предпочтительном воплощении на 250% или более) при концентрации антитела 10 мкг/мл (где секреция без антитела принята за 0% (базальный уровень IFN-гамма), и секреция с 20 EU/мл рекомбинантного человеческого IL-2 принята за 100% (в анализе реакции (аллогенной) смешанной культуры лимфоцитов (MLR) согласно Примеру 3).
В другом аспекте согласно изобретению предложено антитело к PD1 (например, антитело, которое связывается с человеческим PD1), содержащее
А) (а) домен VH, содержащий (i) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 1; (ii) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 2; и (iii) HVR-H3, содержащую аминокислотную последовательность, выбранную из SEQ ID NO: 3; и (б) домен VL, содержащий (i) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 4; (ii) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 5; и (iii) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 6; или
Б) (а) домен VH, содержащий (i) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 9; (ii) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 10; и (iii) HVR-H3, содержащую аминокислотную последовательность, выбранную из SEQ ID NO: 11; и (б) домен VL, содержащий (i) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 12; (ii) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 13; и (iii) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 14; или
В) (а) домен VH, содержащий (i) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 17; (ii) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 18; и (iii) HVR-H3, содержащую аминокислотную последовательность, выбранную из SEQ ID NO: 19; и (б) домен VL, содержащий (i) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 20; (ii) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 21; и (iii) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 22; или
Г) (а) домен VH, содержащий (i) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 25; (ii) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 26; и (iii) HVR-H3, содержащую аминокислотную последовательность, выбранную из SEQ ID NO: 27; и (б) домен VL, содержащий (i) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 28; (ii) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 29; и (iii) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 30; или
Д) (а) домен VH, содержащий (i) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 33; (ii) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 34; и (iii) HVR-H3, содержащую аминокислотную последовательность, выбранную из SEQ ID NO: 35; и (б) домен VL, содержащий (i) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 36; (ii) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 37; и (iii) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 38; или
Е) (а) домен VH, содержащий (i) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 41; (ii) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 42; и (iii) HVR-H3, содержащую аминокислотную последовательность, выбранную из SEQ ID NO: 43; и (б) домен VL, содержащий (i) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 44; (ii) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 45; и (iii) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 46; или
Ж) (а) домен VH, содержащий (i) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 49; (ii) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 50; и (iii) HVR-H3, содержащую аминокислотную последовательность, выбранную из SEQ ID NO: 51; и (б) домен VL, содержащий (i) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 52; (ii) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 53; и (iii) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 54;
где данное антитело характеризуется независимо одним или более чем одним из следующих свойств: антитело к PD-1
i) конкурирует за связывание с PD-1 с антителом к PD-1, содержащим VH и VL PD1-0103, и/или
ii) связывается с PD-1 человека и яванского макака; и/или
iii) усиливает секрецию интерферона-гамма (IFN-гамма) аллогенными стимулированными Т-клетками на 85% или более (в одном предпочтительном воплощении на 90% или более, в одном предпочтительном воплощении - на 95% или более) при концентрации антитела 10 мкг/мл (где секреция без антитела принята за 0% (базальный уровень IFN-гамма), и секреция с 20 EU/мл рекомбинантного человеческого IL-2 принята за 100% (в анализе реакции (аллогенной) смешанной культуры лимфоцитов (MLR) согласно Примеру 3); и/или
iv) усиливает секрецию фактора некроза опухолей альфа (TNF альфа) аллогенными стимулированными Т-клетками на 200% или более (в одном предпочтительном воплощении на 250% или более) при концентрации антитела 10 мкг/мл (где секреция без антитела принята за 0% (базальный уровень IFN-гамма), и секреция с 20 EU/мл рекомбинантного человеческого IL-2 принята за 100% (в анализе реакции (аллогенной) смешанной культуры лимфоцитов (MLR) согласно Примеру 3).
В другом аспекте изобретения антитело к PD1 согласно любому из приведенных выше воплощений представляет собой моноклональное антитело, включающее химерное, гуманизированное или человеческое антитело. В одном воплощении антитело к PD1 представляет собой фрагмент антитела, например, Fv, Fab, Fab', scFv, диатело или фрагмент F(ab')2. В другом воплощении антитело представляет собой полноразмерное антитело, например, интактное антитело IgG1 или IgG4, или другой класс или изотип антитела, как определено в данном документе.
В другом аспекте антитело к PD1 согласно любому из приведенных выше воплощений может включать любые из характеристик, одиночно или в комбинации, как описано в Разделах 1-7 ниже:
1. Аффинность антитела
В некоторых воплощениях антитело, предложенное в данном документе, имеет константу диссоциации KD, меньшую или равную 1 мкМ, меньшую или равную 100 нМ, меньшую или равную 10 нМ, меньшую или равную 1 нМ, меньшую или равную 0,1 нМ, меньшую или равную 0,01 нМ или меньшую или равную 0,001 нМ (например, 10-8 М или меньше, например, от 10-8 М до 10-13 М, например, от 10-9 М до 10-13 М).
В одном предпочтительном воплощении KD измеряется с использованием анализов поверхностного плазмонного резонанса с использованием BIACORE® при 25°С с чипами СМ5 с иммобилизованным антигеном при ~10 единицах ответа (RU). Вкратце, биосенсорные чипы на основе карбоксиметилированного декстрана (СМ5, BIACORE, Inc.) активируются N-этил-N'-(3-диметиламинопропил)-карбодиимида гидрохлоридом (EDC) и N-гидроксисукцинимидом (NHS) согласно инструкциям поставщика. Антиген разводится 10 мМ ацетатом натрия, рН 4,8, до 5 мкг/мл (~0,2 мкМ) перед инъекцией при скорости тока 5 мкл/минуту для достижения приблизительно 10 единиц ответа (RU) связанного белка. После инъекции антигена инъецируется 1 М этаноламин для блокирования непрореагировавших групп. Для измерений кинетики инъецируются двухкратные серийные разведения Fab (от 0,78 нМ до 500 нМ) в PBS (фосфатно-солевой буферный раствор) с 0,05% поверхностно-активного вещества полисорбат 20 (TWEEN-20™) (PBST) при 25°С при скорости тока приблизительно 25 мкл/мин. Скорости ассоциации (kon или ka) и скорости диссоциации (koff или kd) рассчитываются с использованием простой модели связывания один к одному Лангмюра (BIACORE® Evaluation Software, версия 3.2) посредством одновременной аппроксимации сенсограмм ассоциации и диссоциации. Равновесная константа диссоциации KD рассчитывается как отношение kd/ka (koff/kon). См., например, Chen, Y. et al., J. Mol. Biol. 293 (1999) 865-881. Если скорость ассоциации превышает 106 М-1 с-1 при измерении посредством описанного выше анализа поверхностного плазмонного резонанса, тогда скорость ассоциации можно определять с использованием методики гашения флуоресценции, в которой измеряется увеличение или уменьшение интенсивности испускания флуоресценции (возбуждение - 295 нм; испускание - 340 нм, полоса пропускания - 16 нм) 20 нМ антитела против антигена (в виде Fab) при 25°С в PBS, pH 7,2, в присутствии возрастающих концентраций антигена при измерении в спектрометре, таком как спектрофотометр, оснащенный остановленной струей (Aviv Instruments), или спектрофотометр серии 8000 SLM-AMINCO™ (ThermoSpectronic) с кюветой с перемешиванием.
2. Фрагменты антител
В некоторых воплощениях антитело, предложенное в данном документе, представляет собой фрагмент антитела. Фрагменты антитела включают фрагменты Fab, Fab', Fab'-SH, F(ab')2, Fv и scFv, и другие фрагменты, описанные ниже, но не ограничиваются ими. Для обзора определенных фрагментов антитела, см. Hudson, P.J. et al., Nat. Med. 9 (2003) 129-134. Для обзора фрагментов scFv см., например, Plueckthun, A., In; The Pharmacology of Monoclonal Antibodies, Vol. 113, Rosenburg and Moore (eds.), Springer-Verlag, New York (1994), pp. 269-315; см. также WO 93/16185; и патенты США № 5571894 и 5587458. Для обсуждения фрагментов Fab и F(ab')2, содержащих остатки эпитопа, связываемого рецептором утилизации, и имеющих повышенные периоды полувыведения in vivo, см. патент США № 5869046.
Диатела представляют собой фрагменты антител с двумя антигенсвязывающими сайтами, которые могут быть двухвалентными или биспецифичными. См., например, EP 0 404 097; WO 1993/01161; Hudson, P.J. et al., Nat. Med. 9 (2003) 129-134 и Holliger, P. et al., Proc. Natl. Acad. Sci. USA 90 (1993) 6444-6448. Триатела и тетратела также описываются в Hudson, P.J. et al., Nat. Med. 9 (20039 129-134).
Однодоменные антитела представляют собой фрагменты антител, содержащие весь вариабельный домен тяжелой цепи антитела или его часть, или весь вариабельный домен легкой цепи антитела или его часть. В некоторых воплощениях однодоменное антитело представляет собой человеческое однодоменное антитело (Domantis, Inc., Waltham, MA; см., например, патент США № 6248516 В1).
Фрагменты антитела могут быть получены разными методиками, включающими протеолитическое расщепление интактного антитела, а также продукцию рекомбинантными клетками-хозяевами (например, E. coli или фагом), но не ограничивающимися ими, как описано в данном документе.
3. Химерные и гуманизированные антитела
В некоторых воплощениях антитело, предложенное в данном документе, представляет собой химерное антитело. Определенные химерные антитела описываются, например, в патенте США № 4816567; и Morrison, S.L. et al., Proc. Natl. Acad. Sci. USA 81 (1984) 6851-6855). В одном примере химерное антитело содержит вариабельную область, не являющуюся человеческой (например, вариабельную область, происходящую от мыши, крысы, хомяка, кролика или примата, не являющегося человеком, такого как обезьяна), и человеческую константную область. В другом воплощении химерное антитело представляет собой антитело «с переключением класса», у котрого класс или подкласс был изменен от класса или подкласса родительского антитела. Химерные антитела включают их антигенсвязывающие фрагменты.
В некоторых воплощениях химерное антитело представляет собой гуманизированное антитело. Типично антитело, не являющееся человеческим, гуманизируют для уменьшения иммуногенности у человека при сохранении специфичности и аффинности родительского антитела, не являющегося человеческим. В общем, гуманизированное антитело содержит один или более чем один вариабельный домен, в котором HVR, например, CDR (или их части) происходят из антитела, не являющегося человеческим, и FR (или их части) происходят из последовательностей человеческого антитела. Гуманизированное антитело возможно также будет содержать по меньшей мере часть человеческой константной области. В некоторых воплощениях некоторые остатки FR в гуманизированном антителе заменены соответствующими остатками из антитела, не являющегося человеческим (например, антитела, из которого происходят остатки HVR), например, для восстановления или улучшения специфичности или аффинности антитела.
Обзор гуманизированных антител и способов их получения делается, например, в Almagro, J.C. and Fransson, J., Front. Biosci. 13 (2008) 1619-1633 и дополнительно описывается, например, в Riechmann, I. et al., Nature 332 (1988) 323-329; Queen, C. et al., Proc. Natl. Acad. Sci. USA 86 (1989) 10029-10033; патентах США № 5821337, 7527791, 6982321 и 7087409; Kashmiri, S.V. et al., Methods 36 (2005) 25-34 (описывающей пересадку SDR (a-CDR) (область, определяющая специфичность)); Padlan, E.A., Mol. Immunol. 28 (1991) 489-498 (описывающей «изменение поверхности (вариабельного домена)»); Dall'Acqua, W.F. et al., Methods 36 (2005) 43-60 (описывающей «перетасовку FR»); и Osbourn, J. et al., Methods 36 (2005) 61-68 и Klimka, A. et al., Br. J. Cancer 83 (2000) 252-260 (описывающей подход «направленного отбора» для перетасовки FR).
Человеческие каркасные области, которые можно использовать для гуманизации, включают каркасные области, отобранные с использованием способа «наилучшей аппроксимации» (см., например, Sims, M.J. et al., J. Immunol. 151 (1993) 2296-2308; каркасные области, происходящие из консенсусной последовательности вариабельных областей легкой или тяжелой цепи конкретной подгруппы человеческих антител (см., например, Carter, P. et al., Proc. Natl. Acad. Sci. USA 89 (1992) 4285-4289; и Presta, L.G. et al., J. Immunol. 151 (1993) 2623-2632); человеческие зрелые (соматически мутировавшие) каркасные области или человеческие каркасные области зародышевой линии (см., например, Almagro, J.C. and Fransson, J., Front. Biosci. 13 (2008) 1619-1633); и каркасные области, полученные в результате скрининга библиотек FR (см., например, Baca, M. et al., J. Biol. Chem. 272 (1997) 10678-10684 и Rosok, M.J. et al., J. Biol. Chem. 271 (19969 22611-22618), но не ограничиваются ими.
4. Человеческие антитела
В некоторых воплощениях антитело, предложенное в данном документе, представляет собой человеческое антитело. Человеческие антитела могут быть получены с использованием разных методик, известных в данной области. Человеческие антитела в общем описываются в van Dijk, M.A. and van de Winkel, J.G., Curr. Opin. Pharmacol. 5 (2001) 368-374 и Lonberg, N., Curr. Opin. Immunol. 20 (2008) 450-459.
Человеческие антитела могут быть получены введением иммуногена трансгенным животным, которые были модифицированы для продукции интактных человеческих антител или интактных антител с человеческими вариабельными областями в ответ на антигенную стимуляцию. Такие животные типично содержат все локусы человеческого иммуноглобулина или их часть, которые заменяют локусы эндогенных иммуноглобулинов, или которые присутствуют внехромосомно или случайным образом интегрируют в хромосомы животного. У таких трансгенных мышей локусы эндогенных иммуноглобулинов обычно были инактивированы. Относительно обзора способов получения человеческих антител из трансгенных животных см. Lonberg, N., Nat. Biotech. 23 (2005) 1117-1125. См. также, например, патенты США № 6075181 и 6150584, описывающие технологию XENOMOUSE™; патент США № 5770429, описывающий технологию HuMab®; патент США № 7041870, описывающий технологию K-M MOUSE®, и публикацию заявки на патент США № US 2007/0061900, описывающую технологию VelociMouse®). Человеческие вариабельные области из интактных антител, полученные посредством таких животных, могут быть дополнительно модифицированы, например, посредством объединения с другой человеческой константной областью.
Человеческие антитела также могут быть получены способами на основе гибридомы. Были описаны человеческие миеломные и мышино-человеческие гетеромиеломные линии клеток для продукции человеческих моноклональных антител. (См. например, Kozbor, D., J. Immunol. 133 (1984) 3001-3005; Brodeur, B.R. et al., Monoclonal Antibody Production Techniques and Applications, Marcel Dekker, Inc., New York (1987), pp. 51-63 и Boerner, P. et al., J. Immunol. 147 (1991) 86-95). Человеческие антитела, полученные посредством технологии человеческой В-клеточной гибридомы, также описываются в Li, J. et al., Proc. Natl. Acad. Sci. USA 103 (2006) 3557-3562. Дополнительные способы включают способы, описанные, например, в патенте США № 7189826 (описывающем продукцию моноклональных человеческих антител IgM из гибридомных линий клеток) и Ni, J., Xiandai Mianyixue 26 (2006) 265-268 (описывающей человеческо-человеческие гибридомы). Технология человеческой гибридомы (технология триомы) также описываются в Vollmers, H.P. and Brandlein, S., Histology and Histopathology 20 (2005) 927-937 и Vollmers, H.P. and Brandlein, S., Methods and Findings in Experimental and Clinical Pharmacology 27 (2005) 185-191.
Человеческие антитела также могут быть получены посредством выделения последовательностей вариабельного домена клона Fv, отобранных из библиотек фагового дисплея человеческого происхождения. Такие последовательности вариабельного домена можно затем объединять с желательным человеческим константным доменом. Методики отбора человеческих антител из библиотек антител описываются ниже.
5. Антитела, полученные из библиотеки
Антитела по изобретению могут быть выделены посредством скрининга комбинаторных библиотек антител с желательной активностью или активностями. Например, в данной области известен целый ряд способов для получения библиотек фагового дисплея и скрининга таких библиотек на антитела, обладающие желательными характеристиками связывания. Обзор таких способов приводится, например, в Hoogenboom, H.R. et al., Methods in Molecular Biology 178 (2001) 1-37, и они дополнительно описываются, например, в McCafferty, J. et al., Nature 348 (1990) 552-554; Clackson, T. et al., Nature 352 (1991) 624-628; Marks, J.D. et al., J. Mol. Biol. 222 (1992) 581-597; Marks, J.D. and Bradbury, A., Methods in Molecular Biology 248 (2003) 161-175; Sidhu, S.S. et al., J. Mol. Biol. 338 (2004) 299-310; Lee, C.V. et al., J. Mol. Biol. 340 (2004) 1073-1093; Fellouse, F.A., Proc. Natl. Acad. Sci. USA 101 (2004) 12467-12472 и Lee, C.V. et al., J. Immunol. Methods 284 (2004) 119-132.
В некоторых способах фагового дисплея репертуары генов VH и VL раздельно клонируются полимеразной цепной реакцией (ПЦР) и случайным образом рекомбинируют в фаговые библиотеки, которые затем можно подвергать скринингу на антигенсвязывающий фаг, как описано в Winter, G. et al., Ann. Rev. Immunol. 12 (1994) 433-455. Фаг типично подвергает дисплею фрагменты антител либо в виде одноцепочечных фрагментов Fv (scFv), либо в виде фрагментов Fab. Библиотеки из иммунизированных источников предоставляют высокоаффинные антитела к иммуногену без необходимости конструирования гибридом. В качестве альтернативы, может быть клонирован наивный репертуар (например, от человека) с предоставлением одного источника антител на широкий спектр чужеродных и также собственных антигенов без какой-либо иммунизации, как описано Griffiths, A.D. et al., EMBO J. 12 (1993) 725-734. Наконец, наивные библиотеки также могут быть получены синтетически посредством клонирования не подвергавшихся реаранжировке сегментов V-генов из стволовых клеток и применения праймеров ПЦР, содержащих случайную последовательность, для кодирования сильно вариабельных областей CDR3 и для осуществления реаранжировки in vitro, как описано Hoogenboom, H.R. and Winter, G., J. Mol. Biol. 227 (1992) 381-388. Патентные публикации, описывающие фаговые библиотеки человеческих антител, включают, например: патент США № 5750373 и патентные публикации США № 2005/0079574, 2005/0119455, 2005/0266000, 2007/0117126, 2007/0160598, 2007/0237764, 2007/0292936 и 2009/0002360.
Антитела или фрагменты антител, выделенные из библиотек человеческих антител, считаются в данном документе человеческими антителами или фрагментами человеческих антител.
6. Мультиспецифичные антитела
В некоторых воплощениях антитело, предложенное в данном документе, представляет собой мультиспецифичное антитело, например, биспецифичное антитело. Мультиспецифичные антитела представляют собой моноклональные антитела, которые имеют специфичности связывания в отношении по меньшей мере двух разных сайтов. В некоторых воплощениях одна из специфичностей связывания направлена в отношении PD1, и другая - в отношении любого другого антигена. В некоторых воплощениях биспецифичные антитела могут связываться с двумя разными эпитопами PD1. Биспецифичные антитела также могут использоваться для локализации цитотоксических агентов в клетках, которые экспрессируют PD1. Биспецифичные антитела можно получать в виде полноразмерных антител или фрагментов антител.
Методики получения мультиспецифичных антител включают рекомбинантную соэкспрессию двух пар тяжелой цепи-легкой цепи иммуноглобулина, имеющих разные специфичности (см. Milstein, C. and Cuello, A.C., Nature 305 (1983) 537-540, WO 93/08829 и Traunecker, A. et al., EMBO J. 10 (1991) 3655-3659), и генетическую инженерию «выступ во впадину» (см., например, патент США № 5731168). Мультиспецифичные антитела также можно получать инженерией эффектов электростатического наведения для получения Fc-гетеродимерных молекул антитела (WO 2009/089004); поперечным связыванием двух или более чем двух антител или фрагментов (см., например, патент США № 4676980 и Brennan, M. et al., Science 229 (1985) 81-83); применением лейциновых молний для получения биспецифичных антител (см., например, Kostelny, S.A. et al., J. Immunol. 148 (1992) 1547-1553; применением технологии «диатела» для получения биспецифичных фрагментов антител (см., например, Holliger, P. et al., Proc. Natl. Acad. Sci. USA 90 (1993) 6444-6448) и применением димеров одноцепочечных Fv (sFv) (см., например, Gruber, M et al., J. Immunol. 152 (1994) 5368-5374); и получением триспецифичных антител, как описано, например, в Tutt, A. et al., J. Immunol. 147 (1991) 60-69).
В данный документ также включены генетически модифицированные антитела с тремя или более чем тремя функциональными антигенсвязывающими сайтами, включающие «антитела-осьминоги» (см., например, US 2006/0025576).
Антитело или фрагмент в данном документе также включает «Fab двойного действия» или «DAF», содержащий антигенсвязывающий сайт, который связывается с PD1, а также с другим, отличным антигеном (см., например, US 2008/0069820).
Антитело или фрагмент в данном документе также включает мультиспецифичные антитела, описанные в WO 2009/080251, WO 2009/080252, WO 2009/080253, WO 2009/080254, WO 2010/112193, WO 2010/115589, WO 2010/136172, WO 2010/145792 и WO 2010/145793, WO2011/117330, WO2012/025525, WO2012/025530, WO2013/026835, WO2013/026831, WO2013/164325 или WO 2013/174873.
7. Варианты антител
В некоторых воплощениях рассматриваются предложенные в данном документе варианты аминокислотной последовательности антител. Например, может быть желательным улучшение аффинности связывания и/или других биологических свойств антитела. Варианты аминокислотной последовательности антитела могут быть получены введением подходящих модификаций в нуклеотидную последовательность, кодирующую антитело, или посредством пептидного синтеза. Такие модификации включают, например, делеции из и/или вставки в, и/или замены остатков в пределах аминокислотных последовательностей антитела. Можно сделать любую комбинацию делеции, вставки и замены для получения конечной конструкции, при условии, что данная конечная конструкция обладает желательными характеристиками, например, связывания антигена.
а) Варианты с заменой, вставкой и делецией
В некоторых воплощениях предложены варианты антитела, имеющие одну или более чем одну аминокислотную замену. Интересующие сайты для мутагенеза, приводящего к заменам, включают HVR и FR. В Таблице 1 приводятся типичные замены под заголовком «типичные замены», и, как описано далее ниже по отношению к классам боковых цепей аминокислот. Консервативные замены показаны в Таблице 1 под заголовком «предпочтительные замены». В интересующее антитело могут быть введены аминокислотные замены, и продукты подвергаются скринингу в отношении желательной активности, например, сохраненного/улучшенного связывания антигена, пониженной иммуногенности или улучшенной ADCC (антителозависимая клеточная цитотоксичность) или CDC (комплементзависимая цитотоксичность).
Таблица 1
Аминокислоты могут быть сгруппированы согласно общим свойствам боковой цепи:
(1) гидрофобные: норлейцин, Met, Ala, Val, Leu, Ile;
(2) нейтральные гидрофильные: Cys, Ser, Thr, Asn, Gln;
(3) кислотные: Asp, Glu;
(4) основные: His, Lys, Arg;
(5) остатки, которые влияют на ориентацию цепи: Gly, Pro;
(6) ароматические: Trp, Tyr, Phe.
Неконсервативные замены будут влечь за собой замену члена одного из данных классов на другой класс.
Один тип варианта с заменами включает замену одного или более чем одного остатка гипервариабельной области родительского антитела (например, гуманизированного или человеческого антитела). В общем, полученный(ные) в результате вариант(ты), отобранный(ные) для дальнейшего исследования, будет(дут) иметь модификации (например, улучшения) некоторых биологических свойств (например, повышенную аффинность, пониженную иммуногенность) относительно родительского антитела и/или будет(дут) иметь по существу сохраняющиеся определенные биологические свойства родительского антитела. Типичным вариантом с заменами является антитело с созревшей аффинностью, которое может быть с удобством получено, например, с использованием методик созревания аффинности на основе фагового дисплея, таких как методики, описанные в данном документе. Вкратце, один или более чем один остаток HVR мутируется, варианты антитела подвергаются дисплею на фаге и подвергаются скринингу на определенную биологическую активность (например, аффинность связывания).
Изменения (например, замены) могут быть сделаны в HVR, например, для улучшения аффинности антитела. Такие изменения могут быть сделаны в «горячих точках» HVR, т.е. остатках, кодируемых кодонами, которые с высокой частотой подвергаются мутации во время процесса соматического созревания (см., например, Chowdhury, P.S., Methods Mol. Biol. 207 (2008) 179-196), и/или SDR (a-CDR), причем полученные в результате варианты VH или VL тестируются на аффинность связывания. Созревание аффинности посредством конструирования и повторного отбора из вторичных библиотек было описано, например, в Hoogenboom, H.R. et al. в Methods in Molecular Biology 178 (2002) 1-37. В некоторых воплощениях созревания аффинности в выбранные для созревания вариабельные гены вводится разнообразие посредством любого из целого ряда способов (например, ПЦР, склонная к ошибкам, перетасовка цепи или мутагенез, управляемый олигонуклеотидом). Затем создается вторичная библиотека. Данная библиотека затем подвергается скринингу для идентификации любых вариантов антитела с желательной аффинностью. Другой способ введения разнообразия включает подходы, направленные на HVR, в которых рандомизируются несколько остатков HVR (например, 4-6 остатков за раз). Остатки HVR, участвующие в связывании антигена, могут быть специфично идентифицированы, например, с использованием мутагенеза на основе аланинового сканирования или моделирования. В частности, часто в качестве мишени используются CDR-H3 и CDR-L3.
В некоторых воплощениях замены, вставки или делеции могут происходить в пределах одной или более чем одной HVR, при условии, что такие изменения по существу не уменьшают способность антитела к связыванию антигена. Например, в HVR могут быть сделаны консервативные изменения (например, консервативные замены, как предложено в данном документе), которые по существу не уменьшают аффинность связывания. Такие изменения могут находиться вне «горячих точек» HVR или SDR. В некоторых воплощениях вариантов последовательностей VH и VL, предложенных выше, каждая HVR либо является неизменной, либо содержит не больше, чем одну, две или три аминокислотные замены.
Полезный способ идентификации остатков или областей антитела, которые могут служить в качестве мишени для мутагенеза, называется «мутагенезом на основе аланинового сканирования», как описано Cunningham, B.C. and Wells, J.A., Science 244 (1989) 1081-1085. В данном способе остаток или группа остатков-мишеней (например, заряженных остатков, таких как Arg, Asp, His, Lys и Glu) идентифицируется и заменяется нейтральной или отрицательно заряженной аминокислотой (например, аланином или полиаланином) для определения того, подвергается ли влиянию взаимодействие антитела с антигеном. Дополнительные замены могут быть введены в положениях аминокислот, демонстрирующих функциональную чувствительность к исходным заменам. В качестве альтернативы или дополнительно, может быть определена кристаллическая структура комплекса антиген-антитело для идентификации контактных точек между антителом и антигеном. Такие контактные остатки и соседние остатки могут служить в качестве мишени или устраняться в качестве кандидатов для замены. Варианты могут быть подвергнуты скринингу для определения того, имеют ли они желательные свойства.
Вставки в аминокислотную последовательность включают амино- и/или карбоксиконцевые слияния, варьирующие по длине от одного остатка до полипептидов, содержащих сто или более чем сто остатков, а также вставки внутри последовательности одиночных или многих аминокислотных остатков. Примеры концевых вставок включают антитело с N-концевым метионильным остатком. Другие вставочные варианты молекулы антитела включают слияние с N- или С-концом антитела фермента (например, для ADEPT (антителоопосредованная терапия с использованием ферментов и пролекарств)) или полипептида, который увеличивает период полувыведения антитела в сыворотке.
б) Варианты области Fc
В некоторых воплощениях в область Fc антитела, предложенного в данном документе, могут быть введены одна или более чем одна аминокислотная модификация, генерируя, посредством этого, вариант области Fc. Данный вариант области Fc может содержать последовательность человеческой области Fc (например, области Fc человеческого IgG1, IgG2, IgG3 или IgG4), содержащую аминокислотную модификацию (например, замену) в одном или более чем одном положении аминокислоты.
Антитела с пониженной эффекторной функцией включают антитела с заменой одного или более чем одного остатка области Fc 238, 265, 269, 270, 297, 327 и 329 (патент США № 6737056). Такие мутанты Fc включают мутантов Fc с заменами в двух или более чем двух положениях аминокислот 265, 269, 270, 297 и 327, включая так называемый мутант Fc «DANA» с заменой остатков 265 и 297 на аланин (патент США № 7332581).
Описаны некоторые варианты антител с улучшенным или уменьшенным связыванием с FcR. (См., например, патент США № 6737056; WO 2004/056312 и Shields, R.L. et al., J. Biol. Chem. 276 (2001) 6591-6604).
В одном воплощении изобретения такое антитело представляет собой IgG1 с мутациями L234A и L235A или с мутациями L234A, L235A и P329G. В другом воплощении предложен IgG4 с мутациями S228P и L235E или S228P, L235E и/или P329G (нумерация согласно индексу EU, Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD, 1991).
Антитела с увеличенными периодами полувыведения и улучшенным связыванием с неонатальным рецептором Fc (FcRn), который отвечает за перенос материнских IgG в плод (Guyer, R.L. et al., J. Immunol. 117 (1976) 587-593 и Kim, J.K. et al., J. Immunol. 24 (1994) 2429-2434), описываются в US 2005/0014934. Данные антитела содержат область Fc c одной или более чем одной заменой в ней, которая улучшает связывание области Fc с FcRn. Такие варианты Fc включают варианты с заменами в одном или более чем одном остатке Fc: 238, 256, 265, 272, 286, 303, 305, 307, 311, 312, 317, 340, 356, 360, 362, 376, 378, 380, 382, 413, 424 или 434, например, с заменой остатка 434 области Fc (патент США № 7371826).
См. также Duncan, A.R. and Winter, G., Nature 322 (1988) 738-740; US 5648260; US 5624821 и WO 94/29351 относительно других примеров вариантов области Fc.
в) Варианты антител, модифицированные по цистеину
В некоторых воплощениях может быть желательным создание антител, модифицированных по цистеину, например, «тиоМАб», в которых один или более чем один остаток антитела заменен остатками цистеина. В конкретных воплощениях замененные остатки встречаются в доступных сайтах антитела. Посредством замены данных остатков на цистеин реакционноспособные тиольные группы располагаются в доступных сайтах антитела и могут быть использованы для конъюгирования антитела с другими группировками, такими как группировки лекарственных средств или группировки линкер-лекарственное средство, с созданием иммуноконъюгата, как описано в данном документе далее. В некоторых воплощениях любой один или более чем один из следующих остатков может быть заменен на цистеин: V205 (нумерация по Kabat) легкой цепи; А118 (нумерация EU) тяжелой цепи и S400 (нумерация EU) тяжелой цепи области Fc. Антитела, модифицированные по цистеину, могут быть получены, как описано, например, в патенте США № 7521541.
г) Производные антител
В некоторых воплощениях предложенное в данном документе антитело может быть дополнительно модифицировано так, чтобы оно содержало дополнительные небелковые группировки, которые известны в данной области и являются легко доступными. Группировки, подходящие для дериватизации антитела, включают водорастворимые полимеры, но не ограничиваются ими. Неограничивающие примеры водорастворимых полимеров включают полиэтиленгликоль (PEG), сополимеры этиленгликоля/пропиленгликоля, карбоксиметилцеллюлозу, декстран, поливиниловый спирт, поливинилпирролидон, поли-1, 3-диоксолан, поли-1,3,6-триоксан, сополимер этилена/малеинового ангидрида, полиаминокислоты (либо гомополимеры, либо случайные сополимеры) и декстран или поли(н-винилпирролидон)полиэтиленгликоль, гомополимеры пропиленгликоля, сополимеры полипропиленоксида/этиленоксида, полиоксиэтилированные полиолы (например, глицерин), поливиниловый спирт и их смеси, но не ограничиваются ими. Полиэтиленгликольпропиональдегид может иметь преимущества в производстве из-за его стабильности в воде. Полимер может иметь любую молекулярную массу и может быть разветвленным или неразветвленным. Число полимеров, присоединенных к антителу, может варьировать, и, при присоединении более чем одного полимера, они могут быть одинаковыми или разными молекулами. В общем, число и/или тип полимеров, используемых для дериватизации, могут определяться на основе соображений, включающих конкретные свойства или функции антитела, подлежащие улучшению, но не ограничивающиеся ими, независимо от того, будет ли производное антитела использоваться в терапии при определенных условиях, и т.д.
В другом воплощении предложены конъюгаты антитела и небелковой группировки, которая может быть селективно нагрета под воздействием радиации. В одном воплощении небелковая группировка представляет собой углеродную нанотрубку (Kam, N.W. et al., Proc. Natl. Acad. Sci. USA 102 (2005) 11600-11605). Радиация может иметь любую длину волны и включает длины волн, которые не причиняют вреда обычным клетках, но которые нагревают небелковую группировку до температуры, при которой умерщвляются клетки, приближенные к небелковой группировке антитела, но не ограничивается ими.
Б. Способы и композиции генной инженерии
Антитела могут быть получены с использованием способов и композиций генной инженерии, например, как описано в патенте США № 4816567. В одном воплощении предложена выделенная нуклеиновая кислота, кодирующая антитело к PD1, описанное в данном документе. Такая нуклеиновая кислота может кодировать аминокислотную последовательность, содержащую VL, и/или аминокислотную последовательность, содержащую VH антитела (например, легкую и/или тяжелую цепи антитела). В другом воплощении предложен один или более чем один вектор (например, экспрессионный вектор), содержащий такую нуклеиновую кислоту. В другом воплощении предложена клетка-хозяин, содержащая такую нуклеиновую кислоту. В одном таком воплощении клетка-хозяин содержит (например, была трансформирована): (1) вектором, содержащим нуклеиновую кислоту, которая кодирует аминокислотную последовательность, содержащую VL антитела, и аминокислотную последовательность, содержащую VH антитела, или (2) первый вектор, содержащий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, содержащую VL антитела, и второй вектор, содержащий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, содержащую VH антитела. В одном воплощении клетка-хозяин является эукариотической, например, клеткой яичника китайского хомяка (СНО) или лимфоидной клеткой (например, клеткой Y0, NS0, Sp20). В одном воплощении предложен способ получения антитела к PD1, где данный способ включает культивирование клетки-хозяина, содержащей нуклеиновую кислоту, кодирующую антитело, как предложено выше, при подходящих условиях для экспрессии антитела и, возможно, выделение антитела из клетки-хозяина (или культуральной среды клетки-хозяина).
Для рекомбинантной продукции антитела к PD1 нуклеиновую кислоту, кодирующую антитело, например, как описано выше, выделяют и вставляют в один или более чем один вектор для дальнейшего клонирования и/или экспрессии в клетке-хозяине. Такую нуклеиновую кислоту можно легко выделять и секвенировать с использованием традиционных методик (например, посредством применения олигонуклеотидных зондов, которые способны к специфичному связыванию с генами, кодирующими тяжелую и легкую цепи антитела).
Подходящие клетки-хозяева для клонирования или экспрессии векторов, кодирующих антитело, включают прокариотические или эукариотические клетки, описанные в данном документе. Например, антитела могут быть продуцированы в бактериях, в частности, когда не требуются гликозилирование и эффекторная функция Fc. Относительно экспрессии фрагментов антитела и полипептидов в бактериях, см., например, US 5648237, US 5789199 и US 5840523. (См. также Charlton, K.A., In: Methods in Molecular Biology, Vol. 248, Lo, B.K.C. (ed.), Humana Press, Totowa, NJ (2003), pp. 245-254, описывающую экспрессию фрагментов антитела в E. coli.). После экспрессии антитело может быть выделено из пасты бактериальных клеток в растворимой фракции и может быть дополнительно очищено.
Помимо прокариотов, подходящими хозяевами клонирования или экспрессии для векторов, кодирующих антитело, являются эукариотические микробы, такие как нитчатые грибки или дрожжи, включающие штаммы грибков и дрожжей, пути гликозилирования которых были «гуманизированы», приводя к продукции антитела с частично или полностью человеческой картиной гликозилирования. См. Gerngross, T.U., Nat. Biotech. 22 (2004) 1409-1414 и Li, H. et al., Nat. Biotech. 24 (2006) 210-215.
Подходящие клетки-хозяева для экспрессии гликозилированного антитела также происходят из многоклеточных организмов (беспозвоночных и позвоночных). Примеры клеток безпозвоночных включают клетки растений и насекомых. Были идентифицированы многочисленные бакуловирусные штаммы, которые можно использовать в сочетании с клетками насекомых, в частности, для трансфекции клеток Spodoptera frugiperda.
В качестве хозяев также можно использовать культуры клеток растений. См., например, патенты США № 5959177, 6040498, 6420548, 7125978 и 6417429 (описывающие технологию PLANTIBODIES™ для продуцирования антител в трансгенных растениях).
В качестве хозяев также можно использовать клетки позвоночных. Например, могут быть полезными линии клеток млекопитающих, которые адаптированы для роста в суспензии. Другими примерами полезных линий клеток-хозяев млекопитающих являются линия почки обезьяны CV1, трансформированная SV40 (COS-7); линия эмбриональной почки человека (293 или клетки 293, как описано, например, в Graham, F.L. et al., J. Gen Virol. 36 (1977) 59-74); клетки эмбриональной почки хомяка (BHK); мышиные клетки сертоли (клетки ТМ4, как описано, например, в Mather, J.P., Biol. Reprod. 23 (1980) 243-252); клетки почки обезьяны (CV1); клетки почки африканской зеленой мартышки (VERO-76); клетки карциномы шейки матки человека (HELA); клетки почки собаки (MDCK); клетки печени серой крысы (BRL 3A); клетки легкого человека (W138); клетки печени человека (Hep G2); клетки опухоли молочной железы мыши (ММТ 060562); клетки TRI, как описано, например, в Mather, J.P. et al., Annals N.Y. Acad. Sci. 383 (1982) 44-68; клетки MRC 5 и клетки FS4. Другие полезные линии клеток-хозяев млекопитающих включают клетки яичника китайского хомяка (СНО), включающие клетки СНО DHFR- (негативные по дегидрофолатредуктазе) (Urlaub, G. et al., Proc. Natl. Acad. Sci. USA 77 (1980) 4216-4220), и миеломные линии клеток, такие как Y0, NS0 и Sp2/0. Относительно обзора определенных линий клеток-хозяев млекопитающих, подходящих для продукции антител, см., например, Yazaki, P. and Wu, A.M., Methods in Molecular Biology, Vol. 248, Lo, B.K.C. (ed.), Humana Press, Totowa, NJ (2004), pp. 255-268.
В. Анализы
Предложенные в данном документе антитела к PD1 могут быть идентифицированы, подвергнуты скринингу или охарактеризованы на их физические/химические свойства и/или биологические активности посредством разных анализов, известных в данной области.
1. Анализы связывания и другие анализы
В одном аспекте антитело по изобретению тестируется на его активность связывания антигена, например, известными способами, такими как ELISA (твердофазный иммуноферментный анализ), вестерн-блоттинг и т.д.
В другом аспекте можно использовать конкурентные анализы для идентификации антитела, которое конкурирует с PD1-0103 (содержащим последовательность VH SEQ ID NO: 7 и последовательность VL SEQ ID NO: 8) за связывание с PD1 (или, в качестве альтернативы, с гуманизированными вариантами PD1-0103 - антителами PD1-0103-0312, PD1-0103-0313, PD1-0103-0314, PD1-0103-0315 с идентичными 5-6 HVR). Одним воплощением изобретения является антитело, которое конкурирует за связывание с PD1 человека с антителом к PD1, содержащим все 3 HVR последовательности VH SEQ ID NO: 7 и все 3 HVR последовательности VL SEQ ID NO: 8. Одним воплощением изобретения является антитело, которое конкурирует за связывание с PD1 человека с антителом к PD1, содержащим все 3 HVR последовательности VH SEQ ID NO: 57 и все 3 HVR последовательности VL SEQ ID NO: 58. В некоторых воплощениях такое конкурирующее антитело связывается с тем же самым эпитопом (например, линейным или конформационным эпитопом), с которым связывается антитело к PD1 PD1-0103. Подробные типичные способы картирования эпитопа, с которым связывается антитело, приводятся в Morris, G.E. (ed.), Epitope Mapping Protocols, In: Methods in Molecular Biology, Vol. 66, Humana Press, Totowa, NJ (1996).
В типичном конкурентном анализе иммобилизованный PD1(-ECD) инкубируется в растворе, содержащем первое меченое антитело, которое связывается с PD1 (например, антитело к PD1 PD1-0103 или гуманизированное антитело PD1-0103-0312), и второе немеченое антитело, которое тестируется на его способность конкурировать с первым антителом за связывание с PD1. Второе антитело может присутствовать в супернатанте гибридомы. В качестве контроля иммобилизованный PD1 инкубируется в растворе, содержащем первое меченое антитело, но не второе немеченое антитело. После инкубирования при пермиссивных условиях для связывания первого антитела с PD1 удаляется избыток несвязавшегося антитела, и измеряется количество метки, ассоциированной с иммобилизованным PD1. Если количество метки, ассоциированной с иммобилизованным PD1, существенно снижается в опытном образце относительно контрольного образца, тогда это указывает на то, что второе антитело является конкурирующим с первым антителом за связывание с PD1. См. Harlow, E. and Lane, D., Antibodies: A Laboratory Manual, Chapter 14, Cold Spring Harbor Laboratory, Cold Spring Harbor, NY (1988). Относительно другого типичного конкурентного анализа см. Пример 2 (ELISA картирования эпитопов/конкуретный анализ связывания).
2. Анализы активности
В одном аспекте предложены анализы для идентификации антител к PD1, имеющих биологическую активность. Биологическая активность может включать, например, способность к усилению активации и/или пролиферации разных иммунных клеток, особенно Т-клеток. Например, они усиливают секрецию иммуномодулирующих цитокинов (например, интерферона-гамма (IFN-гамма) и/или фактора некроза опухолей альфа (TNF альфа)). Другими иммуномодулирующими цитокинами, уровень которых увеличивается или может быть увеличен, являются, например, IL-12, гранзим В и т.д. Биологическая активность также может включать перекрестную реактивность при связывании с антигенами яванского макака, а также связывание с другими типами клеток. Также предоставляются антитела, имеющие такую биологическую активность in vivo и/или in vitro.
В некоторых воплощениях антитело по изобретению тестируется на такую биологическую активность, как описано, например, ниже в Примерах.
Г. Иммуноконъюгаты (только рак или модификация в отношении мишени)
Согласно изобретению также предложены иммуноконъюгаты, содержащие антитело к PD1, как описано в данном документе, конъюгированное с одним или более чем одним цитотоксическим агентом, таким как химиотерапевтические агенты или лекарственные средства, агенты, ингибирующие рост, токсины (например, белковые токсины, ферментативно активные токсины бактериального, грибкового, растительного или животного происхождения, или их фрагменты) или радиоактивные изотопы.
В одном воплощении иммуноконъюгат представляет собой конъюгат антитело-лекарственное средство (ADC), в котором антитело конъюгировано с одним или более чем одним лекарственным средством, включающим майтансиноид (см. US 5208020, US 5416064 и EP 0 425 235 B1); ауристатин, такой как монометильные лекарственные группировки ауристатина DE и DF (MMAE и MMAF) (см. US 5635483, US 5780588 и US 7498298); доластатин; калихеамицин или его производное (см. US 5712374, US 5714586, US 5739116, US 5767285, US 5770701, US 5770710, US 5773001 и US 5877296; Hinman, L.M. et al., Cancer Res. 53 (1993) 3336-3342 и Lode, H.N. et al., Cancer Res. 58 (1998) 2925-2928); антрациклин, такой как дауномицин или доксорубицин (см. Kratz, F. et al., Curr. Med. Chem. 13 (2006) 477-523; Jeffrey, S.C. et al., Bioorg. Med. Chem. Lett. 16 (2006) 358-362; Torgov, M.Y. et al., Bioconjug. Chem. 16 (2005) 717-721; Nagy, A. et al., Proc. Natl. Acad. Sci. USA 97 (2000) 829-834; Dubowchik, G.M. et al., Bioorg. & Med. Chem. Letters 12 (2002) 1529-1532; King, H.D. et al., J. Med. Chem. 45 (20029 4336-4343 и патент США № 6630579); метотрексат; виндезин; таксан, такой как доцетаксел, паклитаксел, ларотаксел, тезетаксел и ортатаксел; трихотецен и СС1065, но не ограничивающимся ими.
В другом воплощении иммуноконъюгат содержит антитело, как описано в данном документе, конъюгированное с ферментативно активным токсином или его фрагментом, включающим цепь А дифтерийного токсина, несвязывающиеся активные фрагменты дифтерийного токсина, цепь А экзотоксина (из Pseudomonas aeruginosa), цепь А рицина, цепь А абрина, цепь А модексина, альфа-сарцин, белки Aleurites fordii, диантиновые белки, белки Phytolaca americana (PAPI, PAPII и PAP-S), ингибитор Momordica charantia, курцин, кротин, ингибитор Saponaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трикотецены, но не ограничивающимся ими.
В другом воплощении иммуноконъюгат содержит антитело, как описано в данном документе, конъюгированное с радиоактивным атомом, с образованием радиоконъюгата. Для получения радиоконъюгатов доступен целый ряд радиоактивных изотопов. Примеры включают At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, Pb212 и радиоактивные изотопы Lu. При использовании радиоконъюгата для выявления, он может содержать радиоактивный атом для сцинтиграфических исследований, например, TC99m или I123, или спиновую метку для визуализации посредством ядерного магнитного резонанса (ЯМР) (также известного как магнитно-резонансная томография), такую как опять-таки йод-123, йод-131, индий-111, фтор-19, углерод-13, азот-15, кислород-17, гадолиний, марганец или железо.
Конъюгаты антитела и цитотоксического агента можно получать с использованием целого ряда бифункциональных агентов связывания с белком, таких как N-сукцинимидил-3-(2-пиридилтио)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил)-циклогексан-1-карбоксилат (SMCC), иминотиолан (IT), бифункциональные производные имидоэфиров (такие как диметиладипимидат HCl), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаральдегид), бис-азидосоединения (такие как бис-(п-азидобензоил)гександиамин), производные бис-диазония (такие как бис-(п-диазонийбензоил)-этилендиамин), диизоцианаты (такие как толуол 2,6-диизоцианат) и бис-активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Например, иммунотоксин рицин может быть получен, как описано в Vitetta, E.S. et al., Science 238 (1987) 1098-1104. Меченная углеродом-14 1-изотиоцианатобензил-3-метилдиэтилентриаминпентауксусная кислота (MX-DTPA) представляет собой типичный хелатирующий агент для конъюгирования радионуклеида с антителом. См. WO 94/11026. Линкер может представлять собой «расщепляемый линкер», облегчающий высвобождение цитотоксического лекарственного средства в клетке. Например, можно использовать кислотолабильный линкер, чувствительный к пептидазе линкер, фотолабильный линкер, диметильный линкер или дисульфидсодержащий линкер (Chari, R.V. et al., Cancer Res. 52 (1992) 127-131; патент США № 5208020).
Среди иммуноконъюгатов или ADC в данном документе прямо рассматриваются конъюгаты, полученные с использованием поперечносвязывающих реактивов, но не ограничивающиеся ими, включающие BMPS, EMCS, GMBS, HBVS, LC-SMCC, MBS, MPBH, SBAP, SIA, SIAB, SMCC, SMPB, SMPH, сульфо-EMCS, сульфо-GMBS, сульфо-KMUS, сульфо-MBS, сульфо-SIAB, сульфо-SMCC, сульфо-SMPB и SVSB (сукцинимидил-(4-винилсульфон)бензоат), но не ограничивающиеся ими, которые имеются в продаже (например, у Pierce Biotechnology, Inc., Rockford, IL., США).
Д. Способы и композиции для диагностики и выявления
В некоторых воплощениях любое из предложенных в данном документе антител к PD1 является полезным для выявления присутствия PD1 в биологическом образце. Термин «выявление» в том виде, в котором он используется в данном документе, охватывает количественное или качественное выявление. В некоторых воплощениях биологический образец содержит клетку или ткань, такую как, иммунная клетка или инфильтраты Т-клеток.
В одном воплощении предложено антитело к PD1 для применения в способе диагностики или выявления. В другом аспекте предложен способ выявления присутствия PD1 в биологическом образце. В некоторых воплощениях данный способ включает приведение биологического образца в контакт с антителом к PD1, как описано в данном документе, при пермиссивных условиях для связывания антитела к PD1 с PD1 и выявление того, образуется ли комплекс между антителом к PD1 и PD1. Такой способ может представлять собой способ in vitro или in vivo. В одном воплощении антитело к PD1 используется для отбора субъектов, подходящих для терапии антителом к PD1, например, где PD1 представляет собой биомаркер для отбора пациентов.
В некоторых воплощениях предложены меченые антитела к PD1. Метки включают метки или группировки, которые выявляются непосредственно (такие как флуоресцентные, хромофорные, элекронноплотные, хемилюминесцентные и радиоактивные метки), а также группировки, такие как ферменты или лиганды, которые выявляются опосредованно, например, через ферментативную реакцию или молекулярное взаимодействие, но не ограничиваются ими. Типичные метки включают радиоизотопы 32P, 14C, 125I, 3H и 131I, флуорофоры, такие как хелаты редкоземельных металлов или флуоресцеин и их производные, родамин и его производные, дансил, умбеллиферон, люциферазы, например, люциферазу светляка и бактериальную люциферазу (патент США № 4737456), люциферин, 2,3-дигидрофталазиндионы, пероксидазу хрена (HRP), щелочную фосфатазу, β-галактозидазу, глюкоамилазу, лизоцим, сахаридоксидазы, например, глюкозооксидазу, галактозооксидазу и глюкозо-6-фосфатдегидрогеназу, гетероциклические оксидазы, такие как уриказу и ксантиноксидазу, связанные с ферментом, который использует пероксид водорода для окисления предшественника красителя, таким как HRP (пероксидаза хрена), лактопероксидаза или микропероксидаза, биотин/авидин, спиновые метки, бактериофаговые метки, стабильные свободные радикалы и тому подобное, но не ограничиваются ими.
Е. Фармацевтические препараты
Фармацевтические препараты антитела к PD1, как описано в данном документе, получают смешиванием такого антитела, имеющего желательную степень чистоты, с одним или более чем одним возможным фармацевтически приемлемым носителем (Remington's Pharmaceutical Sciences, 16th edition, Osol, A. (ed.) (1980)), в форме лиофилизированных препаратов или водных растворов. Фармацевтически приемлемые носители обычно являются нетоксичными для реципиентов в применяемых дозировках и концентрациях и включают: буферы, такие как фосфатный, цитратный и на основе других органических кислот; антиоксиданты, включающие аскорбиновую кислоту и метионин; консерванты (такие как октадецилдиметилбензиламмония хлорид; гексаметония хлорид; бензалкония хлорид; бензэтония хлорид; фенол, бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехин; резорцин; циклогексанол; 3-пентанол и м-крезол); низкомолекулярные (меньше, чем примерно 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поли(винилпирролидон); аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включающие глюкозу, маннозу или декстрины; хелаторы, такие как EDTA (этилендиаминтетрауксусная кислота); сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; комплексы металлов (например, комплексы Zn-белок); и/или неионные поверхностно-активные вещества, такие как полиэтиленгликоль (PEG), но не ограничиваются ими. Типичные фармацевтически приемлемые носители в данном документе дополнительно включают агенты для диспергирования лекарственного средства в кишечнике, такие как растворимые нейтрально-активные гиалуронидазные гликопротеины (sHASEGP), например, человеческие растворимые гиалуронидазные гликопротеины РН-20, такие как rhuPH20 (HYLENEX®, Baxter International, Inc.). Некоторые типичные sHASEGP и способы применения, включая rhuPH20, описываются в публикациях патентов США № 2005/0260186 и 2006/0104968. В одном аспекте sHASEGP объединяется с одной или более чем одной дополнительной гликозаминогликаназой, такой как хондроитиназа.
Типичные лиофилизированные препараты антител описываются в патенте США № 6267958. Водные препараты антител включают препараты, описанные в патенте США № 6171586 и WO 2006/044908, причем последние препараты включают гистидин-ацетатный буфер.
Описанный в данном документе препарат также может содержать более, чем один активный ингредиент, необходимый для конкретного показания, которое лечат, предпочтительно ингредиенты с взаимодополняющими активностями, которые не оказывают вредного влияния друг на друга. Такие активные ингредиенты, подходящим образом, присутствуют в комбинации в количествах, которые являются эффективными для намеченной цели.
Активные ингредиенты могут быть захвачены в микрокапсулы, полученные, например, методиками коацервации или посредством полимеризации на границе раздела фаз, например, в гидроксиметилцеллюлозные или желатиновые микрокапсулы и в поли-(метилметакрилатные) микрокапсулы соответственно, в коллоидные системы доставки лекарственного средства (например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такие методики раскрыты в Remington's Pharmaceutical Sciences, 16th edition, Osol, A. (ed.) (1980).
Могут быть получены препараты с замедленным высвобождением. Подходящие примеры препаратов с замедленным высвобождением включают полупроницаемые матрицы из твердых гидрофобных полимеров, содержащие антитело, которые находятся в виде формованных предметов, например, пленок или микрокапсул.
Препараты, подлежащие применению для введения in vivo, обычно являются стерильными. Стерильность может легко достигаться, например, посредством фильтрования через мембраны для стерилизующего фильтрования.
Ж. Терапевтические способы и композиции
Любое из предложенных в данном документе антител к PD1 (или антигенсвязывающие белки) можно использовать в терапевтических способах.
В одном аспекте предложено антитело к PD1 для применения в качестве лекарственного средства. В других аспектах предложено антитело к PD1 для применения в лечении рака. В некоторых воплощениях предложено антитело к PD1 для применения в способе лечения. В некоторых воплощениях согласно изобретению предложено антитело к PD1 для применения в способе лечения индивида, имеющего рак, включающем введение данному индивиду эффективного количества антитела к PD1.
В других воплощениях согласно изобретению предложено антитело к PD1 для применения в качестве иммуностимулирующего агента или стимулирующего секрецию интерферона-гамма (IFN-гамма). В некоторых воплощениях согласно изобретению предложено антитело к PD1 для применения в способе иммуностимулирования или стимулирования секреции интерферона-гамма (IFN-гамма) у индивида, включающем введение данному индивиду эффективного количества антитела к PD1 для иммуностимулирования или стимулирования секреции интерферона-гамма (IFN-гамма).
В других воплощениях согласно изобретению предложено антитело к PD1 для применения в качестве иммуностимулирующего агента или стимулирующего секрецию фактора некроза опухолей альфа (TNF альфа). В некоторых воплощениях согласно изобретению предложено антитело к PD1 для применения в способе иммуностимулирования или стимулирования секреции фактора некроза опухолей альфа (TNF альфа) у индивида, включающем введение данному индивиду эффективного количества антитела к PD1 для иммуностимулирования или стимулирования секреции фактора некроза опухолей альфа (TNF альфа).
«Индивид» согласно любому из приведенных выше воплощений предпочтительно представляет собой человека. В другом аспекте согласно изобретению предложено применение антитела к PD1 в изготовлении или получении лекарственного средства. В одном воплощении данное лекарственное средство предназначено для лечения рака. В другом воплощении лекарственное средство предназначено для применения в способе лечения рака, включающем введение индивиду, имеющему рак, эффективного количества лекарственного средства. В другом воплощении лекарственное средство предназначено для индуцирования клеточно-опосредованного лизиса раковых клеток. В другом воплощении лекарственное средство предназначено для применения в способе индуцирования клеточно-опосредованного лизиса раковых клеток у индивида, страдающего от рака, включающем введение данному индивиду эффективного количества лекарственного средства для индукции апоптоза в раковой клетке или для ингибирования пролиферации раковых клеток. «Индивид» согласно любому из приведенных выше воплощений может представлять собой человека.
В другом аспекте согласно изобретению предложен способ лечения рака. В одном воплощении данный способ включает введение индивиду, имеющему рак, эффективного количества антитела к PD1. «Индивид» согласно любому из приведенных выше воплощений может представлять собой человека.
В другом аспекте согласно изобретению предложен способ индуцирования клеточно-опосредованного лизиса раковых клеток у индивида, страдающего от рака. В одном воплощении данный способ включает введение индивиду эффективного количества антитела к PD1 для индуцирования клеточно-опосредованного лизиса раковых клеток у индивида, страдающего от рака. В одном воплощении «индивид» представляет собой человека.
В другом аспекте согласно изобретению предложены фармацевтические препараты, содержащие любое из предложенных в данном документе антител к PD1, например, для применения в любом из приведенных выше терапевтических способов. В одном воплощении фармацевтический препарат содержит любое из предложенных в данном документе антител к PD1 и фармацевтически приемлемый носитель.
Антитело по изобретению (и любой дополнительный терапевтический агент) может вводиться любыми подходящими способами, включающими парентеральное, внутрилегочное и интраназальное введение и, если это желательно для местного лечения, - введение в область поражения. Парентеральные инфузии включают внутримышечное, внутривенное, внутриартериальное, внутрибрюшинное или подкожное введение. Дозирование может осуществляться любым подходящим путем, например, посредством инъекций, таких как внутривенные или подкожные инъекции, отчасти в зависимости от того, является ли введение кратковременным или хроническим. В данном документе рассматриваются разные схемы дозирования, включающие однократные или многократные введения на протяжении разных моментов времени, болюсное введение и импульсную инфузию, но не ограничивающиеся ими.
Антитела по изобретению были бы приготовлены, дозированы и введены способом, согласующимся с надлежащей медицинской практикой. В данном контексте факторы для рассмотрения включают конкретное расстройство, которое лечат, конкретное млекопитающее, которое лечат, клиническое состояние индивидуального пациента, причину расстройства, место доставки агента, способ введения, схему введения и другие факторы, известные практикующим врачам. Антитело не обязательно должно, но возможно приготовлено с одним или более чем одним агентом, используемым в настоящее время для предупреждения или лечения рассматриваемого расстройства. Эффективное количество таких других агентов зависит от количества антитела, присутствующего в препарате, типа расстройства или лечения и других факторов, обсуждавшихся выше. Они обычно используются в таких же дозировках и с использованием таких же путей введения, которые описаны в данном документе, или примерно от 1 до 99% от дозировок, описанных в данном документе, или в любой дозировке и посредством любого пути, который эмпирически/клинически определен как подходящий.
Для предупреждения или лечения заболевания подходящая дозировка антитела по изобретению (при применении его одного или в комбинации с одним или более чем одним другим дополнительным терапевтическим агентом) будет зависеть от типа заболевания, подлежащего лечению, типа антитела, тяжести и хода заболевания, того, вводится ли антитело для предупредительных или терапевтических целей, предыдущей терапии, клинической истории и ответа на антитело пациента, и решения лечащего врача. Антитело подходящим образом вводится пациенту за один раз или на протяжении серии обработок. В зависимости от типа и тяжести заболевания, исходной дозировкой-кандидатом для введения пациенту может быть примерно от 1 мкг/кг до 15 мг/кг (например, 0,5 мг/кг - 10 мг/кг) антитела, независимо от того, например, осуществляется ли она одним или более чем одним раздельным введением или посредством непрерывной инфузии. Одна типичная суточная дозировка может варьировать от примерно 1 мкг/кг до 100 мг/кг или более, в зависимости от факторов, упомянутых выше. Для повторных введений на протяжении нескольких суток или дольше, в зависимости от состояния, лечение обычно поддерживалось бы до желательного появления подавления симптомов заболевания. Одна типичная дозировка антитела находилась бы в интервале от примерно 0,05 мг/кг до примерно 10 мг/кг. Таким образом, пациенту могла бы вводиться одна или более чем одна доза примерно 0,5 мг/кг, 2,0 мг/кг, 4,0 мг/кг или 10 мг/кг (или любая их комбинация). Такие дозы могут вводиться периодически, например, каждую неделю или каждые три недели (например, таким образом, что пациент получает от примерно двух до примерно двадцати, или, например, примерно шесть доз антитела). Может вводиться исходная более высокая загрузочная доза, с последующими одной или более чем одной меньшими дозами. Типичная схема дозирования включает введение исходной загрузочной дозы примерно 4 мг/кг, с последующей еженедельной поддерживающей дозой примерно 2 мг/кг антитела. Однако могут быть полезными другие схемы дозировки. Прогресс данной терапии легко отслеживается традиционными методиками и анализами.
Понятно, что любые из приведенных выше препаратов или терапевтических способов могут проводиться с использованием иммуноконъюгата по изобретению вместо или помимо антитела к PD1.
Понятно, что любые из приведенных выше препаратов или терапевтических способов могут проводиться с использованием иммуноконъюгата по изобретению вместо или помимо антитела к PD1.
II. Изделия
В другом аспекте изобретения предложено изделие, содержащее вещества, полезные для лечения, предупреждения и/или диагностики описанных выше расстройств. Изделие содержит контейнер и этикетку или листок-вкладыш в упаковке на или ассоциированные с контейнером. Подходящие контейнеры включают, например, бутыли, флаконы, шприцы, мешки с в.в. (внутривенный) раствором и т.д. Контейнеры могут быть сделаны из целого ряда материалов, таких как стекло или пластмасса. Контейнер содержит композицию, которая сама или в комбинации с другой композицией является эффективной для лечения, предупреждения и/или диагностики состояния, и может иметь стерильный порт доступа (например, контейнер может представлять собой мешок для внутривенного раствора или флакон, имеющий пробку, поддающуюся прокалыванию подкожной инъекционной иглой). По меньшей мере один активный агент в композиции представляет собой антитело по изобретению. На этикетке или листке-вкладыше в упаковке указано то, что композиция используется для лечения выбранного состояния. Кроме того, изделие может содержать (а) первый контейнер с содержащейся в нем композицией, где данная композиция содержит антитело по изобретению; и (б) второй контейнер с содержащейся в нем композицией, где данная композиция содержит дополнительный цитотоксический или иной терапевтический агент. Изделие в данном воплощении изобретения может дополнительно содержать листок-вкладыш в упаковке, на котором указано то, что композиции могут быть использованы для лечения конкретного состояния. Альтернативно или дополнительно, изделие может дополнительно содержать второй (или третий) контейнер, содержащий фармацевтически приемлемый буфер, такой как бактериостатическая вода для инъекции (BWFI), фосфатно-солевой буферный раствор, раствор Рингера и раствор декстрозы. Оно может дополнительно включать другие материалы, желательные с коммерческой или пользовательской точки зрения, включающие другие буферы, разбавители, фильтры, иглы и шприцы.
Понятно, что любое из приведенных выше изделий может включать иммуноконъюгат по изобретению вместо или помимо антитела к PD1.
Описание аминокислотных последовательностей
SEQ ID NO: 1 HVR-H1 тяжелой цепи, PD1-0103
SEQ ID NO: 2 HVR-H2 тяжелой цепи, PD1-0103
SEQ ID NO: 3 HVR-H3 тяжелой цепи, PD1-0103
SEQ ID NO: 4 HVR-L1 легкой цепи, PD1-0103
SEQ ID NO: 5 HVR-L2 легкой цепи, PD1-0103
SEQ ID NO: 6 HVR-L3 легкой цепи, PD1-0103
SEQ ID NO: 7 вариабельный домен VH тяжелой цепи, PD1-0103
SEQ ID NO: 8 вариабельный домен VL легкой цепи, PD1-0103
SEQ ID NO: 9 HVR-H1 тяжелой цепи, PD1-0098
SEQ ID NO: 10 HVR-H2 тяжелой цепи, PD1-0098
SEQ ID NO: 11 HVR-H3 тяжелой цепи, PD1-0098
SEQ ID NO: 12 HVR-L1 легкой цепи, PD1-0098
SEQ ID NO: 13 HVR-L2 легкой цепи, PD1-0098
SEQ ID NO: 14 HVR-L3 легкой цепи, PD1-0098
SEQ ID NO: 15 вариабельный домен VH тяжелой цепи, PD1-0098
SEQ ID NO: 16 вариабельный домен VL легкой цепи, PD1-0098
SEQ ID NO: 17 HVR-H1 тяжелой цепи, PD1-0050
SEQ ID NO: 18 HVR-H2 тяжелой цепи, PD1-0050
SEQ ID NO: 19 HVR-H3 тяжелой цепи, PD1-0050
SEQ ID NO: 20 HVR-L1 легкой цепи, PD1-0050
SEQ ID NO: 21 HVR-L2 легкой цепи, PD1-0050
SEQ ID NO: 22 HVR-L3 легкой цепи, PD1-0050
SEQ ID NO: 23 вариабельный домен VH тяжелой цепи, PD1-0050
SEQ ID NO: 24 вариабельный домен VL легкой цепи, PD1-0050
SEQ ID NO: 25 HVR-H1 тяжелой цепи, PD1-0069
SEQ ID NO: 26 HVR-H2 тяжелой цепи, PD1-0069
SEQ ID NO: 27 HVR-H3 тяжелой цепи, PD1-0069
SEQ ID NO: 28 HVR-L1 легкой цепи, PD1-0069
SEQ ID NO: 29 HVR-L2 легкой цепи, PD1-0069
SEQ ID NO: 30 HVR-L3 легкой цепи, PD1-0069
SEQ ID NO: 31 вариабельный домен VH тяжелой цепи, PD1-0069
SEQ ID NO: 32 вариабельный домен VL легкой цепи, PD1-0069
SEQ ID NO: 33 HVR-H1 тяжелой цепи, PD1-0073
SEQ ID NO: 34 HVR-H2 тяжелой цепи, PD1-0073
SEQ ID NO: 35 HVR-H3 тяжелой цепи, PD1-0073
SEQ ID NO: 36 HVR-L1 легкой цепи, PD1-0073
SEQ ID NO: 37 HVR-L2 легкой цепи, PD1-0073
SEQ ID NO: 38 HVR-L3 легкой цепи, PD1-0073
SEQ ID NO: 39 вариабельный домен VH тяжелой цепи, PD1-0073
SEQ ID NO: 40 вариабельный домен VL легкой цепи, PD1-0073
SEQ ID NO: 41 HVR-H1 тяжелой цепи, PD1-0078
SEQ ID NO: 42 HVR-H2 тяжелой цепи, PD1-0078
SEQ ID NO: 43 HVR-H3 тяжелой цепи, PD1-0078
SEQ ID NO: 44 HVR-L1 легкой цепи, PD1-0078
SEQ ID NO: 45 HVR-L2 легкой цепи, PD1-0078
SEQ ID NO: 46 HVR-L3 легкой цепи, PD1-0078
SEQ ID NO: 47 вариабельный домен VH тяжелой цепи, PD1-0078
SEQ ID NO: 48 вариабельный домен VL легкой цепи, PD1-0078
SEQ ID NO: 49 HVR-H1 тяжелой цепи, PD1-0102
SEQ ID NO: 50 HVR-H2 тяжелой цепи, PD1-0102
SEQ ID NO: 51 HVR-H3 тяжелой цепи, PD1-0102
SEQ ID NO: 52 HVR-L1 легкой цепи, PD1-0102
SEQ ID NO: 53 HVR-L2 легкой цепи, PD1-0102
SEQ ID NO: 54 HVR-L3 легкой цепи, PD1-0102
SEQ ID NO: 55 вариабельный домен VH тяжелой цепи, PD1-0102
SEQ ID NO: 56 вариабельный домен VL легкой цепи, PD1-0102
SEQ ID NO: 57 гуманизированный вариант - вариабельный домен VH тяжелой цепи PD1-0103_01
SEQ ID NO: 58 гуманизированный вариант - вариабельный домен VL легкой цепи PD1-0103_01
SEQ ID NO: 59 гуманизированный вариант - вариабельный домен VL легкой цепи PD1-0103_02
SEQ ID NO: 60 гуманизированный вариант - вариабельный домен VL легкой цепи PD1-0103_03
SEQ ID NO: 61 гуманизированный вариант - вариабельный домен VL легкой цепи PD1-0103_04
SEQ ID NO: 62 константная область человеческой легкой цепи каппа
SEQ ID NO: 63 константная область человеческой легкой цепи лямбда
SEQ ID NO: 64 константная область человеческой тяжелой цепи, происходящая из IgG1
SEQ ID NO: 65 константная область человеческой тяжелой цепи, происходящая из IgG1 с мутациями L234A и L235A
SEQ ID NO: 66 константная область человеческой тяжелой цепи, происходящая из IgG1 с мутациями L234A, L235A и P329G
SEQ ID NO: 67 константная область человеческой тяжелой цепи, происходящая из IgG4
SEQ ID NO: 68 типичная последовательность человеческого PD1 (без сигнальной последовательности)
SEQ ID NO: 69 внеклеточный домен человеческого PD1 (ECD)
SEQ ID NO: 70 типичная последовательность человеческого PD1 (включающая сигнальную последовательность)
SEQ ID NO: 71: минимальная HVR1 PD1-0103 и гуманизированного варианта PD1-0103 - PD1-0103-0312, PD1-0103-0313, PD1-0103-0314 и PD1-0103-0315
SEQ ID NO: 72: минимальная HVR2 PD1-0103 и гуманизированного варианта PD1-0103 - PD1-0103-0312, PD1-0103-0313, PD1-0103-0314 и PD1-0103-0315
SEQ ID NO: 73: минимальная HVR3 PD1-0103 и гуманизированного варианта PD1-0103 - PD1-0103-0312, PD1-0103-0313, PD1-0103-0314 и PD1-0103-0315
SEQ ID NO: 74: минимальная LVR1 PD1-0103 и гуманизированного варианта PD1-0103 - PD1-0103-0312, PD1-0103-0313, PD1-0103-0314 и PD1-0103-0315
SEQ ID NO: 75: минимальная LVR2 PD1-0103 и гуманизированного варианта PD1-0103 - PD1-0103-0312, PD1-0103-0313, PD1-0103-0314 и PD1-0103-0315
SEQ ID NO: 76: минимальная LVR3 PD1-0103 и гуманизированного варианта PD1-0103 - PD1-0103-0312, PD1-0103-0313, PD1-0103-0314 и PD1-0103-0315
SEQ ID NO: 77: фрагмент FR-H3, содержащий аминокислотную последовательность RDN в положениях 71, 72, 73 согласно нумерации Kabat
Далее перечислены следующие аминокислотные последовательности доменов VH и VL, включающие отмеченные HVR (HVR показаны жирными подчеркнутыми буквами), антител к PD1 PD1-0016 (и его гуманизированных версий PD1-0103-0312, PD1-0103-0313, PD1-0103-0314 и PD1-0103-0315), PD1-0098, PD1-0050, PD1-0069, PD1-0073, PD1-0078 и PD1-0102:
Антитело к PD1 PD1-0103:
VH PD1-0103:
EVILVESGGGLVKPGGSLKLSCAASGFSFSSYTMSWVRQTPEKRLDWVATISGGGRDIYYPDSVKGRFTISRDNAKNTLYLEMSSLMSEDTALYYCVLLTGRVYFALDSWGQGTSVTVSS
VL PD1-0103:
KIVLTQSPASLPVSLGQRATISCRASESVDTSDNSFIHWYQQRPGQSPKLLIYRSSTLESGVPARFSGSGSRTDFTLTIDPVEADDVATYYCQQNYDVPWTFGGGTKLEIK
Версии гуманизированного антитела к PD1 PD1-0103: PD1-0103-0312, PD1-0103-0313, PD1-0103-0314 и PD1-0103-0315:
VH PD1-0103-0312= VH PD1-0103-0313= VH PD1-0103-0314= VH PD1-0103-0315:
EVQLLESGGGLVQPGGSLRLSCAASGFSFSSYTMSWVRQAPGKGLEWVATISGGGRDIYYPDSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCVLLTGRVYFALDSWGQGTLVTVSS
VL PD1-0103-0312:
DIVMTQSPDSLAVSLGERATINCKASESVDTSDNSFIHWYQQKPGQSPKLLIYRSSTLESGVPDRFSGSGSGTDFTLTISSLQAEDVAVYYCQQNYDVPWTFGQGTKVEIK
VL PD1-0103-0313:
DVVMTQSPLSLPVTLGQPASISCRASESVDTSDNSFIHWYQQRPGQSPRLLIYRSSTLESGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCQQNYDVPWTFGQGTKVEIK
VL PD1-0103-0314:
EIVLTQSPATLSLSPGERATLSCRASESVDTSDNSFIHWYQQKPGQSPRLLIYRSSTLESGIPARFSGSGSGTDFTLTISSLEPEDFAVYYCQQNYDVPWTFGQGTKVEIK
VL PD1-0103-0315:
EIVLTQSPATLSLSPGERATLSCRASESVDTSDNSFIHWYQQKPGQSPRLLIYRSSTLESGIPARFSGSGSGTDFTLTISSLEPEDFAVYYCQQNYDVPWTFGQGTKVEIK
Антитело к PD1 PD1-0098:
VH PD1-0098:
DVQLQESGPGLVKPSQSLSLTCTVTGYSITSDYAWNWIRQFPGDKLEWLGYITYSGFTNYNPSLKSRISISRDTSKNQFFLQLNSVATEDTATYYCARWHGSAPWYFDYWGRGTTLTVSS
VL PD1-0098:
DVLMTQTPLSLPVSLGDQASISCRSSQNIVHSDGNTYLEWYLQKPGQSPNLLIYKVSRRFSGVPDRFSGSGSGTDFTLKISRVEAEDLGVYYCFQGSHFPLTFGAGTKLELK
VH: 0050
DVQLQESGPGLVKPSQSLSLTCTVTGYSITSDYAWNWIRQFPGNKLEWMGYITYTGRTSYNPSLKSRISITRDTSKNQFFLQLNSVTTEDTATYYCAREMDYYGSTLDYWGQGTTLTVSS
VL: 0050
KIVLTQSPASLAVSLRQRATISCRASESVDRYGNSFIHWYQQKPGQPPKVLIYRASNLESGFPARFSGSGSRTDFTLTIDPVEADDAATYYCQQNNEDPYTFGSGTKLEIK
VH: 0069
QVQLQQSGPELVRPGVSVKISCKGSGYTFTDYAMHWVKQSHARTLEWIGVISTYSGDTNYNQKFKDKATMTVDKSSSTAYLELARMTSEDSAIYYCARLGITTGFAYWGQGTLVTVSA
VL: 0069
DIVLTQSPASLAVSLGQRATISCRASKGVSTSSYSFMHWYQQKPRQPPKLLIKYASYLESGVPARFSGSGSGTDFTLNIHPVEEEDAATYYCHHSREFPWTFGGGTKLEIK
VH: 0073
EVKLVESGGGLVKPGGSLKLSCAASGFTFSNYGMSWIRQTPEKGLEWVATISGGGRDTYYPDSVKGRFTISRDNVKNNLYLQMSSLRSEDTAFYYCASYYYGIDYWGQGTSVTVSS
VL: 0073
DIVMTQPHKFMSTSVGDRVRITCKASQDVTTAVAWYQQKPGQSPKLLIYWASTRHTGVPDRFTGSGSGTEFTLTISSVQAEDLALYYCQQHYSIPWTFGGGTKLEIK
VH: 0078
QVQLQQPGAELVKPGASVKMSCKASGYTFTSTWMHWVKQRPGQGLEWIGAIDPSDSYTTYNQKFKGKATLTVDTSSTTAYMQLSSLTSEDSAVYYCTRSPFDYWGQGTTLTVSS
VL: 0078
DIVMTQSHKFMSTSVGDRVSITCKASQDVSTAVAWYQQKPGQSPKLLIYSASYRYTGVPDRFTGSGSGTDFTFAISSVQAEDLAVYYCQQHYSHPFTFGSGTKLEIK
VH: 0102
DVQLQESGPDLVKPSQSLSLTCTVTGYSITSGYSWHWIRQFPGNKLEWMGFIHSSGDTNYNPSLKSRISFTRDTSKNQFFLQLSSLTDEDTATYYCATYRNWYFDVWGAGTTVTVSS
VL: 0102
DIVMTQSPSSLTVTAGEKVTMRCKSSQSLLNSGTQKNYLTWYQQKPGQPPKLLIYWASTRESGVPNRFTGSGSGTDFTLTISSVQAEDLSVYYCQSDYTFPLTFGGGTKLELK
Далее перечислены конкретные воплощения изобретения:
1. Выделенное антитело, которое связывается с человеческим PD1, где данное антитело связывается с (центральной) сахарной цепью на Asn58 гликозилированного человеческого PD1 SEQ ID NO: 70, который является гликозилированным на Asn58.
2. Антитело по п. 1, где данное антитело дополнительно связывается с одной или более чем одной аминокислотой в положениях 60-64, 68, 78-84, 126-134 человеческого PD1.
3. Антитело по любому из пп. 1 или 2, где данное антитело связывается его тяжелой цепью с сахарной цепью на Asn58.
4. Антитело по любому из пп. 2-3, где данное антитело связывается с одной или более чем одной аминокислотой в положениях 61, 62, 64, 83, 126, 128, 132, 134 человеческого PD1.
5. Антитело по любому из пп. 2-3, где данное антитело связывается с аминокислотами положений 61, 62, 64, 83, 126, 128, 132, 134 человеческого PD1.
6. Антитело по любому из пп. 2-3, где данное антитело связывается с аминокислотами положений 60, 61, 62, 63, 64, 68, 78, 82, 83, 84, 126, 127, 128, 130, 131, 132, 133, 134 человеческого PD1.
7. Антитело по любому из пп. 1-6, где данное антитело связывается с человеческим PD1, на котором антитело связывается с первым и вторым GlNac, FUC, BMA и MAN в пределах (центральной) сахарной цепи Asn58 гликозилированного человеческого PD1 SEQ ID NO: 70, который является гликозилированным на Asn58.
8. Антитело по любому из пп. 1-7, где данное антитело демонстрирует пониженное связывание с человеческим PD1 SEQ ID NO: 70, который не является гликозилированным на Asn58, по сравнению со связыванием с человеческим PD1, который является гликозилированным на Asn58.
9. Выделенное антитело, которое связывается с человеческим PD1, где данное антитело содержит:
(a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 71; (б) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 72; (в) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 73; (г) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 74; (д) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 75; (е) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 76, и (ж) FR-H3, содержащую аминокислотную последовательность SEQ ID NO: 77 (RDN) в положениях 71, 72 и 73 согласно нумерации Kabat.
10. Выделенное антитело, которое связывается с человеческим PD1 по п. 9, где данное антитело
А)
i) содержит последовательность VH SEQ ID NO: 7 и последовательность VL SEQ ID NO: 8;
ii) или гуманизированный вариант VH и VL антитела согласно i);
или Б)
i) содержит последовательность VH SEQ ID NO: 57 и последовательность VL SEQ ID NO: 58;
ii) содержит последовательность VH SEQ ID NO: 57 и последовательность VL SEQ ID NO: 59;
iii) содержит последовательность VH SEQ ID NO: 57 и последовательность VL SEQ ID NO: 60;
iv) содержит последовательность VH SEQ ID NO: 57 и последовательность VL SEQ ID NO: 61.
Далее перечислены конкретные воплощения изобретения:
1. Выделенное антитело, которое связывается с человеческим PD1, где данное антитело содержит:
А) (а) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 1; (б) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 2; (в) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 3; (г) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 4; (д) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 5; и (е) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 6; или
Б) (а) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 9; (б) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 10; (в) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 11; (г) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 12; (д) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 13; и (е) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 14; или
В) (а) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 17; (б) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 18; (в) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 19; (г) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 20; (д) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 21; и (е) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 22; или
Г) (а) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 25; (б) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 26; (в) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 27; (г) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 28; (д) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 29; и (е) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 30; или
Д) (а) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 33; (б) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 34; (в) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 35; (г) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 36; (д) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 37; и (е) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 38; или
Е) (а) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 41; (б) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 42; (в) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 43; (г) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 44; (д) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 45; и (е) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 46; или
Ж) (а) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 49; (б) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 50; (в) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 51; (г) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 52; (д) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 53; и (е) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 54.
2. Выделенное антитело, которое связывается с человеческим PD1, где данное антитело содержит:
А) (а) домен VH, содержащий (i) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 1, (ii) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 2, и (iii) HVR-H3, содержащую аминокислотную последовательность, выбранную из SEQ ID NO: 3, и (б) домен VL, содержащий (i) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 4, (ii) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 5, и (iii) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 6; или
Б) (а) домен VH, содержащий (i) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 9, (ii) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 10, и (iii) HVR-H3, содержащую аминокислотную последовательность, выбранную из SEQ ID NO: 11, и (б) домен VL, содержащий (i) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 12, (ii) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 13, и (iii) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 14; или
В) (а) домен VH, содержащий (i) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 17, (ii) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 18, и (iii) HVR-H3, содержащую аминокислотную последовательность, выбранную из SEQ ID NO: 19, и (б) домен VL, содержащий (i) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 20, (ii) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 21, и (iii) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 22; или
Г) (а) домен VH, содержащий (i) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 25, (ii) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 26, и (iii) HVR-H3, содержащую аминокислотную последовательность, выбранную из SEQ ID NO: 27, и (б) домен VL, содержащий (i) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 28, (ii) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 29, и (iii) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 30; или
Д) (а) домен VH, содержащий (i) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 33, (ii) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 34, и (iii) HVR-H3, содержащую аминокислотную последовательность, выбранную из SEQ ID NO: 35, и (б) домен VL, содержащий (i) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 36, (ii) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 37, и (iii) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 38; или
Е) (а) домен VH, содержащий (i) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 41, (ii) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 42, и (iii) HVR-H3, содержащую аминокислотную последовательность, выбранную из SEQ ID NO: 43, и (б) домен VL, содержащий (i) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 44, (ii) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 45, и (iii) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 46; или
Ж) (а) домен VH, содержащий (i) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 49, (ii) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 50, и (iii) HVR-H3, содержащую аминокислотную последовательность, выбранную из SEQ ID NO: 51, и (б) домен VL, содержащий (i) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 52, (ii) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 53, и (iii) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 54.
3. Выделенное антитело, которое связывается с человеческим PD1, где данное антитело
А)
i) содержит последовательность VH SEQ ID NO: 7 и последовательность VL SEQ ID NO: 8;
ii) или гуманизированный вариант VH и VL антитела согласно i);
или Б)
i) содержит последовательность VH SEQ ID NO: 57 и последовательность VL SEQ ID NO: 58;
ii) содержит последовательность VH SEQ ID NO: 57 и последовательность VL SEQ ID NO: 59;
iii) содержит последовательность VH SEQ ID NO: 57 и последовательность VL SEQ ID NO: 60;
iv) содержит последовательность VH SEQ ID NO: 57 и последовательность VL SEQ ID NO: 61;
или В)
i) содержит последовательность VH SEQ ID NO: 15 и последовательность VL SEQ ID NO: 16;
ii) или гуманизированный вариант VH и VL антитела согласно i);
или Г)
i) содержит последовательность VH SEQ ID NO: 23 и последовательность VL SEQ ID NO: 24;
ii) или гуманизированный вариант VH и VL антитела согласно i);
или Д)
i) содержит последовательность VH SEQ ID NO: 31 и последовательность VL SEQ ID NO: 32;
ii) или гуманизированный вариант VH и VL антитела согласно i);
или Е)
i) содержит последовательность VH SEQ ID NO: 39 и последовательность VL SEQ ID NO: 40;
ii) или гуманизированный вариант VH и VL антитела согласно i);
или Ж)
i) содержит последовательность VH SEQ ID NO: 47 и последовательность VL SEQ ID NO: 48;
ii) или гуманизированный вариант VH и VL антитела согласно i);
или З)
i) содержит последовательность VH SEQ ID NO: 55 и последовательность VL SEQ ID NO: 56;
ii) или гуманизированный вариант VH и VL антитела согласно i).
4. Выделенное антитело, которое связывается с человеческим PD1, где данное антитело
i) содержит последовательность VH SEQ ID NO: 7 и последовательность VL SEQ ID NO: 8;
ii) или гуманизированный вариант VH и VL антитела согласно i).
5. Выделенное антитело, которое связывается с человеческим PD1, где данное антитело содержит последовательность VH SEQ ID NO: 57 и последовательность VL SEQ ID NO: 58.
6. Выделенное антитело, которое связывается с человеческим PD1, где данное антитело содержит последовательность VH SEQ ID NO: 57 и последовательность VL SEQ ID NO: 59.
7. Выделенное антитело, которое связывается с человеческим PD1, где данное антитело содержит последовательность VH SEQ ID NO: 57 и последовательность VL SEQ ID NO: 60.
8. Выделенное антитело, которое связывается с человеческим PD1, где данное антитело содержит последовательность VH SEQ ID NO: 57 и последовательность VL SEQ ID NO: 61.
9. Антитело к PD1 по любому из воплощений 1-8,
где данное антитело характеризуется независимо одним или более чем одним из следующих свойств: антитело к PD1
i) конкурирует за связывание с PD-1 с антителом к PD1, содержащим VH с аминокислотной последовательностью SEQ ID NO: 7 и VL с аминокислотной последовательностью SEQ ID NO: 8, и/или
ii) связывается с PD-1 человека и яванского макака; и/или
iii) усиливает секрецию интерферона-гамма (IFN-гамма) аллогенными стимулированными Т-клетками на 85% или более при концентрации антитела 10 мкг/мл; и/или
iv) усиливает секрецию фактора некроза опухолей альфа (TNF альфа) аллогенными стимулированными Т-клетками на 200% или более при концентрации антитела 10 мкг/мл.
10. Выделенное антитело, которое связывается с PD1, где данное антитело усиливает секрецию фактора некроза опухолей альфа (TNF альфа) аллогенными стимулированными Т-клетками на 200% или более (в одном предпочтительном воплощении на 250% или более) при концентрации антитела 10 мкг/мл в анализе реакции смешанной культуры лимфоцитов (MLR).
11. Выделенное антитело, которое связывается с PD1, где данное антитело усиливает секрецию интерферона-гамма (IFN-гамма) аллогенными стимулированными Т-клетками на 85% или более (в одном предпочтительном воплощении на 90% или более, в одном предпочтительном воплощении на 95% или более) при концентрации антитела 10 мкг/мл в анализе реакции смешанной культуры лимфоцитов (MLR).
12. Выделенное антитело, которое связывается с человеческим PD1, где данное антитело:
i) конкурирует за связывание с PD-1 с антителом к PD1, содержащим VH с аминокислотной последовательностью SEQ ID NO: 7 и VL с аминокислотной последовательностью SEQ ID NO: 8, и/или
ii) связывается с PD-1 человека и яванского макака; и
iii) усиливает секрецию интерферона-гамма (IFN-гамма) аллогенными стимулированными Т-клетками на 85% или более при концентрации антитела 10 мкг/мл; и/или
iv) усиливает секрецию фактора некроза опухолей альфа (TNF альфа) аллогенными стимулированными Т-клетками на 200% или более при концентрации антитела 10 мкг/мл.
13. Антитело по любому из воплощений 1-12, которое представляет собой моноклональное антитело.
14. Антитело по любому из воплощений 1-13, которое представляет собой человеческое, гуманизированное или химерное антитело.
15. Антитело по любому из воплощений 1-14, которое представляет собой фрагмент антитела, который связывается с PD1.
16. Антитело по любому из воплощений 1-15, которое представляет собой полноразмерное антитело IgG1.
17. Антитело по любому из воплощений 1-16, которое представляет собой полноразмерное антитело IgG1 с мутациями L234A, L235A и P329G (нумерация согласно индексу EU по Kabat).
18. Выделенная нуклеиновая кислота, кодирующая антитело по любому из воплощений 1-17.
19. Клетка-хозяин, содержащая нуклеиновую кислоту по воплощению 18.
20. Способ получения антитела, включающий культивирование клетки-хозяина по воплощению 19 таким образом, что продуцируется антитело.
21. Способ по воплощению 20, дополнительно включающий выделение антитела из клетки-хозяина.
22. Фармацевтический препарат, содержащий антитело по любому из воплощений 1-17 и фармацевтически приемлемый носитель.
23. Антитело по любому из воплощений 1-17 для применения в качестве лекарственного средства.
24. Антитело по любому из воплощений 1-17 для применения в лечении рака.
25. Применение антитела по любому из воплощений 1-17 в изготовлении лекарственного средства.
26. Применение по воплощению 25, где лекарственное средство предназначено для лечения рака.
27. Способ лечения индивида, имеющего рак, включающий введение данному индивиду эффективного количества антитела по воплощению 1.
III. ПРИМЕРЫ
Следующее представляет собой примеры способов и композиций по изобретению. Понятно, что можно практиковать разные другие воплощения, принимая во внимание общее описание, приведенное выше.
Хотя вышеизложенное изобретение и было описано в некоторых подробностях посредством иллюстрации и примера для целей ясности понимания, данные описания и примеры не следует истолковывать как ограничивающие объем изобретения. Раскрытия всей патентной и научной литературы, процитированной в данном документе, прямо включены во всей их полноте посредством ссылки.
Пример 1:
Получение антител к PD-1
Иммунизация мышей
Мышей NMRI иммунизировали генетически с использованием плазмидного экспрессионного вектора, кодирующего полноразмерный человеческий PD-1, посредством внутрикожного введения 100 мкг ДНК вектора (плазмида 15300_hPD1-fl), с последующей электропорацией (2 квадратных импульса 1000 В/см, продолжительность 0,1 мс, интервал 0,125 с; с последующими 4 квадратными импульсами 287,5 В/см, продолжительность 10 мс, интервал 0,125 с. Мыши получали 6 последовательных иммунизаций в сутки 0, 14, 28, 42, 56, 70 и 84. Кровь отбирали в сутки 36, 78 и 92, и получали сыворотку, которую использовали для определения титра посредством ELISA (см. ниже). Животных с наивысшими титрами отбирали для повторной иммунизации в сутки 96 посредством внутривенной инъекции 50 мкг рекомбинантной химеры человеческого PD1 с человеческим Fc, и моноклональные антитела выделяли методикой гибридомы посредством слияния спленоцитов с линией миеломных клеток через 3 суток после повторной иммунизации.
Определение сывороточных титров (ELISA)
Химеру человеческого рекомбинантного PD1 с человеческим Fc иммобилизовали на 96-луночном планшете NUNC Maxisorp в концентрации 0,3 мкг/мл, 100 мкл/лунку в PBS (фосфатно-солевой буферный раствор), с последующими: блокированием планшета 2% кротеином С в PBS, 200 мкл/лунку; нанесением серийных разведений антисыворотки в двойных повторностях в 0,5% кротеине С в PBS, 100 мкл/лунку; выявлением антителом козы против мышиного антитела, конъюгированным с HRP (пероксидаза хрена) (Jackson Immunoresearch/Dianova 115-036-071; 1/16 000). Для всех этапов планшеты инкубировали в течение 1 ч при 37°С. Между всеми этапами планшеты 3 раза промывали 0,05% Tween 20 в PBS. Сигнал проявляли добавлением растворимого субстрата POD (пероксидаза) BM Blue (Roche), 100 мкл/лунку; и останавливали развитие реакции добавлением 1 М HCl, 100 мкл/лунку. Поглощение считывали при 450 нм по сравнению с 690 нм в качестве контроля. Титр определяли как разведение антисыворотки, приводящее к полумаксимальному сигналу.
Пример 2:
Характеризация антител к PD1
Связывание антител к PD1 c человеческим PD1
ELISA на hu PD1 (человеческий PD1)
Планшеты Nunc Maxisorp, покрытые стрептавидином (MicroCoat #11974998001) покрывали 25 мкл/лунку биотинилированного PD1-ECD-AviHis и инкубировали при 4°С в течение ночи. После промывки (3×90 мкл/лунку буфером PBST) добавляли 25 мкл образцов антитела к PD1 или контрольных антител (человеческое антитело к PD1; Roche / мышиное антитело к PD1; Biolegend; кат.: 329912) и инкубировали 1 ч при RT (комнатная температура). После промывки (3×90 мкл/лунку буфером PBST) добавляли 25 мкл/лунку антитела козы против H+L (тяжелой и легкой цепи) антитела человека, конъюгированного с POD (JIR, JIR109-036-088) / антитела овцы против мышиного антитела, конъюгированного с POD (GE Healthcare; NA9310), в разведении 1:2000/1:1000 и инкубировали в течение 1 ч при RT на шейкере. После промывки (3×90 мкл/лунку буфером PBST) добавляли 25 мкл/лунку субстрата ТМВ (тетраметилбензидин) (Roche, каталожный № 11835033001) и инкубировали до ОП 2-3. Измерение происходило при 370/492 нм.
Результаты ELISA перечисляются в виде значений ЕС50 (полумаксимальная эффективная концентрация) [нг/мл] в обобщающих Таблицах 2 и 3, приведенных ниже.
Клеточный ELISA на PD1
Прикрепленную линию клеток CHO-K1, стабильно трансфицированную плазмидой 15311_hPD1-fl_pUC_Neo, кодирующей полноразмерный человеческий PD1, и подвергнутую селекции с G418 (маркер устойчивости к неомицину на плазмиде), засевали в концентрации 0,01×10Е6 клеток/лунку в 384-луночные плоскодонные планшеты и выращивали в течение ночи.
На следующие сутки добавляли 25 мкл/лунку образца PD1 или человеческого контрольного антитела к PD1 (Roche)/мышиного контрольного антитела к PD1 (Biolegend; кат.: 329912) и инкубировали в течение 2 ч при 4°С (для того, чтобы избежать интернализации). После тщательной промывки (1×90 мкл/лунку PBST) клетки фиксировали добавлением 30 мкл/лунку 0,05% глутаральдегида (Sigma, кат. №: G5882, 25%), разведенного в 1×буфере PBS, и инкубировали в течение 10 мин при RT. После промывки (3×90 мкл/лунку PBST) добавляли 25 мкл/лунку вторичного антитела для выявления: антитела козы против H+L антитела человека, конъюгированного с POD (JIR, JIR109-036-088) / антитела овцы против мышиного антитела, конъюгированного с POD (GE NA9310), с последующей 1 ч инкубацией при RT на шейкере. После промывки (3×90 мкл/лунку PBST) добавляли 25 мкл/лунку раствора субстрата TMB (Roche 11835033001) и инкубировали до ОП 1,0-2,0. Планшеты измеряли при 370/492 нм.
Результаты клеточного ELISA перечислены в виде значений «ЕС50 СНО-PD1» [нг/мл] в обобщающей Таблице 3, приведенной ниже.
ELISA на PD1 яванского макака
Планшеты Nunc Maxisorp, покрытые стрептавидином (MicroCoat #11974998001) покрывали 25 мкл/лунку биотинилированного cynoPD1-ECD-биотина и инкубировали при 4°С в течение ночи. После промывки (3×90 мкл/лунку буфером PBST) добавляли 25 мкл образцов антитела к PD1 или контрольных антител (человеческое антитело к PD1; Roche) и инкубировали 1 ч при RT на шейкере. После промывки (3×90 мкл/лунку буфером PBST) добавляли 25 мкл/лунку антитела козы против H+L антитела человека, конъюгированного с POD (JIR, JIR109-036-088), в разведении 1:1000 и инкубировали при RT в течение 1 ч на шейкере. После промывки (3×90 мкл/лунку буфером PBST) добавляли 25 мкл/лунку субстрата ТМВ (Roche, 11835033001) и инкубировали до ОП 2-3. Измерение происходило при 370/492 нм.
Результаты ELISA перечисляются в виде значений ЕС50 [нг/мл] в обобщающих Таблицах 2 и 3, приведенных ниже.
Анализ замены лиганда 1 PD
Планшеты Nunc Maxisorp, покрытые стрептавидином (MicroCoat #11974998001) покрывали 25 мкл/лунку биотинилированного PD1-ECD-AviHis и инкубировали при 4°С в течение ночи. После промывки (3×90 мкл/лунку буфером PBST) добавляли 25 мкл образцов антитела к PD1 или контрольных антител (мышиное антитело к PD1; Biolegend; кат.:329912) и инкубировали 1 ч при RT на шейкере. После промывки (3×90 мкл/лунку буфером PBST) добавляли 25 мкл/лунку PD-L1 (химера рекомбинантного человеческого B7-H1/PD-L1 Fc; 156-B7, R&D) и инкубировали 1 ч при RT на шейкере. После промывки (3×90 мкл/лунку буфером PBST) добавляли 25 мкл/лунку антитела козы против H+L антитела человека, конъюгированного с POD (JIR, 109-036-088), в разведении 1:1000 и инкубировали при RT в течение 1 ч на шейкере. После промывки (3×90 мкл/лунку буфером PBST) добавляли 25 мкл/лунку субстрата ТМВ (Roche, 11835033001) и инкубировали до ОП 2-3. Измерение происходило при 370/492 нм.
Результаты ELISA перечисляются в виде значений IC50 (полумаксимальная ингибирующая концентрация) [нг/мл] в обобщающей Таблице 2, приведенной ниже.
Анализ замены лиганда 2 PD
Планшеты Nunc Maxisorp, покрытые стрептавидином (MicroCoat #11974998001) покрывали 25 мкл/лунку биотинилированного PD1-ECD-AviHis и инкубировали при 4°С в течение ночи. После промывки (3×90 мкл/лунку буфером PBST) добавляли 25 мкл образцов антитела к PD1 или контрольного антитела (мышиное антитело к huPD1; Roche) и инкубировали 1 ч при RT на шейкере. После промывки (3×90 мкл/лунку буфером PBST) добавляли 25 мкл/лунку PD-L2 (химера рекомбинантного человеческого B7-DC/PD-L2 Fc; 1224-PL-100, R&D) и инкубировали 1 ч при RT на шейкере. После промывки (3×90 мкл/лунку буфером PBST) добавляли 25 мкл/лунку антитела козы против H+L антитела человека, конъюгированного с POD (JIR, 109-036-088), в разведении 1:2000 и инкубировали при RT в течение 1 ч на шейкере. После промывки (3×90 мкл/лунку буфером PBST) добавляли 25 мкл/лунку субстрата ТМВ (Roche, 11835033001) и инкубировали до ОП 2-3. Измерение происходило при 370/492 нм.
Результаты ELISA перечисляются в виде значений IC50 [нг/мл] в обобщающей Таблице 2, приведенной ниже.
ELISA картирования эпитопов/анализ конкурентного связывания
Планшеты Nunc Maxisorp (Nunc #464718) покрывали 25 мкл/лунку захватывающего антитела (антитело козы против мышиного IgG; JIR; 115-006-071) и инкубировали в течение 1 ч при RT на шейкере. После промывки (3×90 мкл/лунку буфером PBST) планшеты блокировали в течение 1 ч буфером PBS, содержащим 2% BSA (бычий сывороточный альбумин) на шейкере. После промывки (3×90 мкл/лунку буфером PBST) добавляли 25 мкл образцов мышиного антитела к PD1 и инкубировали 1 ч при RT на шейкере. После промывки (3×90 мкл/лунку буфером PBST) захватывающее антитело блокировали 30 мкл/лунку мышиного IgG (JIR; 015-000-003) в течении 1 ч при RT на шейкере. В то же самое время биотинилированный PD1-ECD-AviHis предынкубировали со вторым образцом антитела в течение 1 ч при RT на шейкере. После промывки планшета для анализа (3×90 мкл/лунку буфером PBST) смесь антитела с PD1 переносили на планшет для анализа и инкубировали при RT в течение 1 ч на шейкере. После промывки (3×90 мкл/лунку буфером PBST) добавляли 25 мкл/лунку стрептавидин-POD (Roche, #11089153001) в разведении 1:4000 и инкубировали при RT в течение 1 ч на шейкере. После промывки (3×90 мкл/лунку буфером PBST) добавляли 25 мкл/лунку субстрата ТМВ (Roche, #11089153001) и инкубировали до ОП 1,5-2,5. Измерение происходило при 370/492 нм. Группы эпитопов определяли иерархической кластеризацией относительно контрольных антител.
Таблица 2: связывание, ингибирование PD-L1 и группы областей эпитопов типичных антител (ELISA)
EC50 [нг/мл]
EC50 [нг/мл]
IC50 [нг/мл]
IC50 [нг/мл]
Таблица 3: биохимическое связывание и связывание с клетками гуманизированных антител к PD1, полученных из родительского мышиного антитела PD1-0103 (ELISA)
EC50 [нг/мл]
EC50 [нг/мл]
EC50 [нг/мл]
Характеризация Biacore гуманизированных антител к PD-1
Для определения кинетических параметров связывания между несколькими мышиными связывающими агентами в отношении PD1, а также имеющимися в продаже человеческими контрольными связывающими агентами в отношении PD1 использовали анализ на основе поверхностного плазмонного резонанса (SPR). В связи с этим на поверхности сенсорного чипа СМ5 (Biacore) иммобилизовали антитело к человеческому IgG посредством аминного связывания. Затем захватывали образцы, и с ними был связан PD1-ECD. Поверхность сенсорного чипа регенерировали после каждого цикла анализа. Наконец, получали равновесную константу и кинетические константы скорости посредством аппроксимации данных к модели взаимодействия Лангмюра 1:1.
Примерно 2000 единиц ответа (RU) 20 мкг/мл антитела к IgG человека (GE Healthcare #BR-1008-39) связывали на проточных ячейках 1 и 2 (в качестве альтернативы: 3 и 4) сенсорного чипа СМ5 в Biacore T200 при рН 5,0 с использованием набора для аминного связывания, поставленного GE Healthcare.
Образцом и подвижным буфером были HBS-EP+ (0,01 M HEPES, 0,15 M NaCl, 3 мМ EDTA, 0,05 % об./об. поверхностно-активного вещества P20, pH 7,4). Была установлена температура проточной ячейки 25°С и температура отсека для образца - 12°С. Система была первично обработана подвижным буфером.
Образцы в концентрации 10 нМ инъецировали в течение 20 секунд, и они связывались со второй проточной ячейкой. Затем над каждым образцом в течение 120 с инъецировали полный набор концентраций человеческого PD1-ECD (144 нМ, 48 нМ, 16 нМ, 5,33 нМ, 1,78 нМ, 0,59 нМ, 0,20 нМ и 0 нМ), с последующим временем диссоциации 30/300 с и двумя 20 с стадиями регенерации 3 М MgCl2, из которых последняя стадия содержала «дополнительную промывку после инъекции» подвижным буфером.
Наконец, данные с двойным контролем аппроксимировали к модели взаимодействия Лангмюра 1:1 с использованием программы Biacore T200 Evaluation. Полученные в результате значения KD, ka и kd показаны в Таблице 4.
Таблица 4: кинетические константы скорости и равновесная константа для химерного PD1-0103 и гуманизированных Ab к PD1, определенные посредством Biacore (см. следующую страницу).
Как показано в Таблице 4, все гуманизированные версии химерного PD1-0103 (относительно получения см. Пример 6) демонстрируют кинетические свойства, аналогичные родительскому антителу (химерное PD1-0103).
Кинетика
В систему Biacore 4000 устанавливали сенсор СМ5 серии S, и пятна выявления гидродинамически адресовали согласно инструкциям изготовителя.
Поликлональное кроличье антитело IgG <IgGFCγM>R (Jackson ImmunoResearch Laboratories Inc.) иммобилизовали при 10000 RU на пятнах выявления 1 и 5 в проточных ячейках 1, 2, 3 и 4. Связывание осуществляли посредством химии EDC/NHS согласно инструкциям изготовителя. Остальные пятна в проточных ячейках служили в качестве контроля. Буфером для образца был буфер системы, дополненный 1 мг/мл карбоксиметилдекстрана.
В одном воплощении анализ шел при 25°С. В другом воплощении анализ шел при 37°С. Каждое 50 нМ мышиное моноклональное антитело захватывали на поверхности сенсора посредством 1 мин инъекции со скоростью 10 мкл/мин. Затем инъецировали соответствующие антигены в серии концентраций 100 нМ, 2× 33 нМ, 11 нМ, 4 нМ, 1 нМ и 0 нМ в буфере системы со скоростью 30 мкл/мин в течение 4 мин времени фазы ассоциации. Диссоциацию отслеживали в течение еще 4 мин. Систему захвата регенерировали с использованием 3 мин инъекции 10 мМ глицина, рН 1,5, в концентрации 30 мкл/мин. Релевантные кинетические данные рассчитывали с использованием программы оценки Biacore согласно инструкциям изготовителя.
Картирование эпитопов
В прибор Biacore 4000 устанавливали сенсор Biacore САР, и готовили его подобно рекомендации изготовителя. Буфером прибора был HBS-ET (10 мМ HEPES, рН 7,4, 150 мМ NaCl, 3 мМ EDTA, 0,005% масс./об. Tween 20). Прибор работал при 25°С.
Все образцы разводили в буфере системы. 35 кДа биотинилированый антиген PD1-ECD-AviHis захватывали при 200 RU на поверхности сенсора САР посредством 1 мин инъекции со скоростью 30 мкл/мин в проточных ячейках 1, 2, 3 и 4 в пятнах 1 и 5. Пятна 2, 3 и 4 служили в качестве контроля. В другом воплощении таким же способом захватывали 35 кДа биотинилированый антиген PD1-ECD-AviHis при 200 RU на сенсоре САР.
Затем инъецировали первичное антитело в концентрации 100 нМ в течение 3 мин со скоростью 30 мкл/мин, с последующей инъекцией вторичного антитела в концентрации 100 нМ в течение 3 мин со скоростью 30 мкл/мин. Первичное антитело инъецировали до полного насыщения антигена, присутствующего на поверхности. В конце фаз инъекции первичного и вторичного антитела были установлены отчетные точки «позднее связывание» (BL) для отслеживания ответа в виде связывания соответствующих антител. Рассчитывали молярное отношение - частное между ответом в виде связывания вторичного антитела «BL2» и ответом первичного антитела «BL1». Данное молярное отношение использовали в качестве индикатора доступности антигена для вторичного антитела, когда данный антиген уже находился в комплексе с первичным антителом.
Комплексы полностью удаляли с поверхности сенсора посредством инъекции регенерирующего буфера: 2 М гуанидин-HCl, 250 мМ NaON в течение 2 мин со скоростью 30 мкл/мин, как рекомендовано изготовителем, с последующей 1 мин инъекцией буфера системы со скоростью 30 мкл/мин.
Пример 3
Влияние разных антител к PD1 на продукцию цитокинов в реакции смешанной культуры лимфоцитов (MLR)
3A) Реакция смешанной культуры лимфоцитов (MLR) представляет собой анализ иммунных клеток, в котором измеряется активация лимфоцитов от одного индивида (донор Х) на лимфоциты от другого индивида (донор Y). Реакцию смешанной культуры лимфоцитов использовали для демонстрации эффекта блокирования пути PD1 на лимфоцитарные эффекторные клетки. Т-клетки в данном анализе тестировали на активацию и секрецию ими IFN-гамма в присутствии или в отсутствие mAb к PD1.
Для осуществления аллогенной MLR одноядерные клетки периферической крови (РВМС) по меньшей мере от четырех здоровых доноров с неизвестным типом HLA выделяли посредством центрифугирования в градиенте плотности с использованием Leukosep (Greiner Bio One, 227 288). Вкратце, гепаринизированные образцы крови разводили в три раза превосходящим объемом PBS, и 25 мл аликвоты разведенной крови наслаивали в 50 мл пробирки Leukosep. После центрифугирования при 800 g в течение 15 мин при комнатной температуре (без разрушения) фракции, содержащие лимфоциты, отбирали, промывали в PBS и использовали непосредственно в функциональных анализах или ресуспендировали в замораживающей среде (10% DMSO (диметилсульфоксид), 90% FCS (фетальная телячья сыворотка)) в концентрации 1,0Е+07 клеток/мл и хранили в жидком азоте. Проводили индивидуальные 2-сторонние реакции MLR посредством смешивания РВМС от двух разных доноров в соотношении клетки стимуляторы/респондеры 1:1, и сокультуры осуществляли по меньшей мере в двух повторностях в плоскодонных 96-луночных планшетах в течение 6 суток при 37°С, 5% СО2, в присутствии или без интервала разных концентраций очищенных моноклональных антител к PD1: PD1-0050, PD1-0069, PD1-0073, PD1-0078, PD1-0098, PD1-0102, PD1-0103. В качестве контрольных антител к PD1 синтезировали антитела, содержащие домены VH или VL либо ниволумаба (также известного как MDX-5C4 или MDX-1106), либо пембролизумаба (также известного как MK-3475 или Org 1.09A), и клонировали с использованием остовов человеческого IgG1 (с мутациями L234A, L235A и P329G (индекс EU по Kabat)). В качестве негативного контроля либо не использовали антитело, либо использовали изотипическое контрольное антитело, и в качестве позитивного контроля использовали рекомбинантный человеческий IL-2 (20 EU/мл). После суток 6 из каждой культуры отбирали 100 мкл среды для измерения цитокинов. Уровни IFN-гамма измеряли с использованием набора для ELISA OptEIA (BD Biosciences).
Результаты демонстрируются в Таблице 5 (секреция/высвобождение IFN-γ). Моноклональные антитела к PD1 стимулировали активацию Т-клеток и секрецию IFN-гамма концентрационнозависимым образом. Значение % увеличения секреции IFN-гамма рассчитывали относительно продукции IFN-γ MLR без добавления каких-либо блокирующих mAb (базальная аллогеная стимуляция индуцировала значение IFN-γ, соответствующее Е (экспериментальный образец) минус с (контрольный образец)) и MLR с добавлением 20 EU/мл rec hu IL-2 (позитивный контроль - 100% значения IFN-γ, соответствующее Е плюс с), и рассчитывали согласно формуле: отн. стимуляция [%] = ((Eэкспериментальный - Е - с)/(Е+с-Е-с)*100.
Таблица 5: процентная доля секреции IFN-гамма после аллогенной стимуляции и обработки антителом к PD-1 по сравнению с эффектом обработки рекомбинантным человеческим IL-2 (20 EU/мл) (равно 100%-ному увеличению) в качестве позитивного контроля
Несколько антител, блокирующих PD1: PD1-0050, PD1-0069, PD1-0073, PD1-0078, PD1-0098, PD1-0102, PD1-0103, демонстрировали сильную иммуномодулирующую активность посредством увеличения секреции интерферона-гамма (INF-γ) (данные не показаны для всех антител).
3Б) В дополнительном эксперименте оценивали химерное PD1-0103 (человеческий изотип IgG1 с мутациями L234A, L235A и P329G (индекс EU по Kabat)). Блокада PD1 химерным PD-0103 сильно увеличивает секрецию IFN-гамма аллогенными стимулированными первичными человеческими Т-клетками. Химерное PD1-0103 является более мощным, чем контрольные антитела к PD1 (см. Фиг. 1).
Для сравнения использовали синтезированные контрольные антитела к PD1 антитела, содержащие домены VH или VL либо ниволумаба (также известного как MDX5C4 или MDX-1106), либо пембролизумаба (также известного как MK-3475 или Org 1.09A), и клонированные с остовами человеческого IgG1 (с мутациями L234A, L235A и P329G (индекс EU по Kabat)).
3В) В дополнительных экспериментах в MLR оценивали иммуномодулирующую активность гуманизированных вариантов антитела к PD-1 PD1-0103 (гуманизированные антитела PD1-0103-0312, PD1-0103-0314 на Фиг. 2 и 3, см. также Пример 6 ниже) на а) высвобождение (секрецию) IFN-γ, б) высвобождение (секрецию) TNF-альфа, как описано выше. Эффект химерного антитела PD1-0103 и его гуманизированных версий сравнивали с контрольными антителами к PD1, содержащими домены VH или VL либо ниволумаба (также известного как MDX5C4 или MDX-1106), либо пембролизумаба (также известного как MK-3475 или Org 1.09A) с остовами человеческого IgG1 (с мутациями L234A, L235A и P329G (индекс EU по Kabat)). После 6 суток культуры MLR отбирали 50 мкл супернатанта, и измеряли многочисленные цитокины в одной культуре с использованием анализа человеческих цитокинов Th1/Th2 Bio-Plex Pro™ (Bio-Rad Laboratories Inc.). (Данные для всех цитокинов не показаны).
Химерное антитело PD1-0103 и его гуманизированные версии (PD1-0103_0312 и PD1-0103_0314) были более эффективными по сравнению с контрольными антителами к PD1 в усилении активации Т-клеток и секреции IFN-гамма (см. Фиг. 2).
Кроме того, химерное антитело PD1-0103 и его гуманизированные варианты увеличивают секрецию фактора некроза опухолей альфа (TNF альфа) (см. Фиг. 3) и IL-12 (данные не показаны) антигенпрезентирующими клетками и увеличивают способность моноцитов/макрофагов или антигенпрезентирующих клеток стимулировать Т-клетки.
Пример 4:
Эффект блокады антителом к PD1 на высвобождение цитотоксического гранзима В и секрецию IFN-γ человеческими Т-клетками CD4, сокультивируемыми с аллогеными зрелыми дендритными клетками
Для дальнейшего исследования эффекта обработки антителом к PD-1 в аллогенной ситуации авторы изобретения разработали анализ, в котором свежеочищенные Т-клетки CD4 сокультивировали в течение 5 суток в присутствии происходящих от моноцитов аллогенных зрелых дендритных клеток (mDC). Моноциты выделяли из свежих РВМС за одну неделю до беспрепятственного прикрепления к пластмассе, с последующим удалением неприкрепившихся клеток. Затем авторы изобретения получали незрелые DC из моноцитов посредством их культивирования в средах, содержащих GM-CSF (гранулоцитарно-макрофагальный колониестимулирующий фактор) (50 нг/мл) и IL-4 (100 нг/мл) в течение 5 суток. Для индукции созревания iDC (незрелые дендритные клетки) авторы изобретения добавляли в культуральные среды TNF-альфа, IL-1 бета и IL-6 (по 50 нг/мл каждого) в течение 2 дополнительных суток. Затем авторы изобретения оценивали созревание DC посредством измерения экспрессии на их поверхности главного комплекса гистосовместимости класса II (MHCII), CD80, CD83 и CD86 посредством проточной цитометрии (LSRFortessa, BD Biosciences).
В сутки минимальной реакции смешанных лимфоцитов (mMLR) обогащали Т-клетки CD4 посредством набора микрошариков (Miltenyi Biotec) из 108 РВМС, полученных от неродственного донора. До культивирования Т-клетки CD4 метили 5 мкМ сложного сукцинимидилового эфира карбоксифлуоресцеина (CFSE). Затем высаживали в 96-луночный планшет 105 Т-клеток CD4 совместно со зрелыми алло-DC (5:1) в присутствии или в отсутствие блокирующего антитела к PD1 (либо PD1-0103, химерное PD1-0103, либо гуманизированные антитела PD1-0103-0312, PD1-0103-0313, PD1-0103-0314, PD1-0103-0315, сокращенные на Фиг. 4А и 4Б как 0312, 0313, 0314, 0315) в концентрации 10 мкг/мл, если на Фиг. не указано иное.
Через пять суток авторы изобретения отбирали супернатанты культуры клеток, используемые позднее для измерения уровней IFN-гамма посредством ELISA (R&D Systems), и оставляли клетки при 37 градусах С в течение еще 5 часов в присутствии ингибитора аппарата Гольджи (брефельдин А) и блокатора аппарата Гольджи (моненсин). Клетки затем промывали, окрашивали на поверхности антителом к человеческому CD4 и фиксируемым красителем на живые/мертвые клетки Aqua (Invitrogen) перед фиксацией/пермеабилизацией буфером Fix/Perm (BD Bioscience). Авторы изобретения осуществляли внутриклеточное окрашивание на гранзим В (BD Bioscience), IFN-гамма и IL-2 (оба от eBioscience). Результаты показаны на Фиг. 4А и 4Б.
Авторы изобретения также тестировали разные концентрации гуманизированных вариантов PD1-0103 (гуманизированные антитела PD1-0103-0312, PD1-0103-0313, PD1-0103-0314, PD1-0103-0315, сокращенные на Фиг. как 0312, 0313, 0314, 0315, см. также Пример 6 ниже) и обнаружили, что они являются одинаково хорошими в увеличении уровня гранзима В и интерферона-гамма. DP47 представляет собой несвязывающийся человеческий IgG с мутацией LALA в части Fc для того, чтобы избежать распознавания FcгаммаR (рецептор Fcγ), и его использовали в качестве негативного контроля.
Пример 5:
Производные в виде химерных антител
Химерные антитела к PD1 получали амплификацией вариабельных областей тяжелой и легкой цепи мышиных антител к PD1 PD1-0098, PD1-0103 посредством ПЦР и их клонирования в экспрессионные векторы для тяжелой цепи в виде слитых белков с человеческими остовами IgG1 / человеческой СН1-шарнирная область-СН2-СН3 с мутациями L234A, L235A и P329G (индекс EU по Kabat)) (лейцин 234 до аланина, лейцин 235 до аланина, пролин 329 до глицина), отменяющими эффекторные функции, и в экспрессионные векторы для легкой цепи в виде слитых белков с человеческой С-каппа. Плазмиды LC и НС затем сотрансфицировали в HEK293 и очищали через 7 суток из супернатантов стандартными способами очистки антител. Химерные антитела к PD1 были переименованы в химерное chiPD1-0098 (chiPD1-0098) и химерное PD1-0103 (chiPD1-0103). Для сравнения использовали синтезированные контрольные антитела к PD1, содержащие домены VH или VL либо ниволумаба (также известного как MDX-5C4 или MDX-1106), либо пембролизумаба (также известного как MK-3475 или Org 1.09A), и клонированные с остовами человеческого IgG1 (с мутациями L234A, L235A и P329G (индекс EU по Kabat)).
Пример 6:
Получение, экспрессия и очистка гуманизированных вариантов антитела к PD1 PD-0103 (huMab PD-0103), и характеризация
Гуманизация доменов VH и VL мышиного антитела к PD1 0103
На основе аминокислотной последовательности мышиных доменов VH и VL мышиного антитела к PD1 0103 (SEQ ID NO: 7 и 8) получали гуманизированные варианты антитела к PD1.
Гуманизированный вариант VH основывается на человеческой зародышевой линии IMGT_hVH_3_23 в комбинации с человеческим J-элементом зародышевой линии IGHJ5-01 с несколькими мутациями (приводя к SEQ ID NO: 57).
Гуманизированные варианты VL основываются на человеческих зародышевых линиях IMGT_hVK_4_1, IMGT_hVK_2_30, IMGT_hVK_3_11 и IMGT_hVK_1_39 в комбинации с человеческим J-элементом зародышевой линии IGHJ1-01. Разные мутации приводили к гуманизированным вариантам SEQ ID NO: 58 - SEQ ID NO: 61.
Гуманизированные аминокислотные последовательности для вариабельных областей тяжелой и легкой цепи PD1-0103 обратно транслировали в ДНК, синтезировали полученные в результате кДНК (GenArt) и затем клонировали в экспрессионные векторы для тяжелой цепи в виде слитых белков с остовами человеческого IgG1 / человеческим СН1-шарнирная область-СН2-СН3 с мутациями LALA и PG (лейцин 234 до аланина, лейцин 235 до аланина, пролин 329 до глицина), отменяющими эффекторные функции, или в экспрессионные векторы для легкой цепи в виде слитых белков с человеческой С-каппа. Плазмиды LC и НС затем сотрансфицировали в HEK293 и очищали через 7 суток из супернатантов стандартными способами очистки антител. Полученные в результате гуманизированные антитела к PD1 называли следующим образом:
Таблица 6: последовательности VH и VL гуманизированных вариантов антител PD1-0103
Таблица 7: последовательности HVR гуманизированных вариантов антител PD1-0103
Гуманизированные варианты антитела PD1-0103 и родительское химерное PD1-0103 были охарактеризованы, как описано выше. Результаты показаны в Таблице 8.
Таблица 8: краткое изложение результатов для вариантов гуманизированного антитела PD1-0103 и родительского химерного PD1-0103
(EC50 [нМ])
Пример 7:
Нейтрализующая эффективность антител к PD-1
Для тестирования нейтрализующей эффективности полученных самими авторами изобретения антител к PD-1 в имитации восстановления подавленного ответа Т-клеток in vitro использовали имеющийся в продаже репортерный анализ PD1/PD-L1 (Promega). Данная система состоит из клеток PD+ NFAT Jurkat и партнера PD-L1+ CHO, который также дает активирующий сигнал. В принципе, данная репортерная система основывается на трех стадиях: (1) TCR-опосредованная активация NFAT, (2) ингибирование сигнала NFAT при активации оси PD-1/PD-L1 и (3) восстановление сигнала NFAT посредством антител, блокирующих PD-1.
Материал и методы
• Среда PD-L1: PAN Biotech (#P04-03609); FBS (10%) и L-Gln (4 мМ)
• Среда для анализа: RPMI 1640 (#31870; Invitrogen), 25 мМ HEPES, 2 мМ L-Gln, FBS (2%)
• Клетки, использованные для данного анализа (оба типа клеток приобретены Promega):
клетки CHO PD-L1+ (№ партии #139147): 2-3×104 клеток/96 лунок
клетки Jurkat PD-1+ NFAT (№ партии #133024: 3,5×104 клеток/лунку
В сутки 1 клетки PD-L1+ оттаивали, высевали в указанной концентрции клеток в вышеупомянутую среду и культивировали в течение ночи при 37°С и 5% СО2. На следующие сутки среду удаляли, и клетки PD-L1+ инкубировали с полученными антителами в указанных концентрациях (в среде для анализа). Параллельно клетки Jurkat PD-1+ NFAT оттаивали, и вышеупомянутые количества клеток переносили и сокультивировали к клетками PD-L1+. После инкубации в течение 6 ч при 37°С и 5% СО2 субстрат Bio-Glo нагревали до комнатной температуры (1-2 ч до добавления). Планшет с культурой клеток удаляли из инкубатора и доводили до комнатной температуры (10 мин) перед добавлением 80 мкл раствора Bio-Glo на лунку, инкубировали в течение 5-10 мин перед измерением люминисценции на ридере Tecan Infinite согласно рекомендации изготовителя набора. Результаты можно видеть на Фиг. 5А и 5Б, где показано восстановление опосредованного PD-1/PD-L1 подавления сигнала NFAT разными антителами к PD-1 при стимуляции TCR: Фиг. 5А: химерное PD1_0103 демонстрировало воспроизводимо больший эффект по сравнению с контрольным антителом. В качестве контроля синтезировали антитело к PD-1, содержащее домены VH или VL ниволумаба (также известного как MDX-5C4 или MDX-1106) и клонировали с остовами человеческого IgG1 (с мутациями L234A, L235A и P329G (индекс EU по Kabat)). Фиг. 5Б: четыре гуманизированных варианта PD1_0103 демонстрировали аналогичную эффективность in vitro с лидирующим антителом и также были немного лучше контрольного антитела.
Пример 8:
Кристаллизация Fab PD1-0103 с эктодоменом PD-1:
Для образования комплекса Fab PD1-0103 смешивали в молярном избытке 1,1 с эктодоменом PD-1. После инкубации на льду в течение 1 часа комплекс дегликозилировали посредством стадии с PNGазой для удаления гликанов, которые не участвуют в образовании комплекса. Скрининг кристаллизации на кристаллы комплекса фрагмента Fab PD1-0103 (с человеческим СН1 и CL) с ECD PD-1 проводили при концентрации 15 мг/мл. В экспериментах с диффузией паров в сидячей капле устанавливали температуру капелек кристаллизации 21°С посредством смешивания 0,1 мкл раствора белка с 0,1 мкл резервуарного раствора. Кристаллы появлялись при разных условиях при наличии PEG в качестве осаждающего агента. Кристаллы, используемые для определения структуры, появлялись из 30% PEG1500 в пределах 4 суток и вырастали до конечного размера 0,03×0,06×0,02 мкм в пределах 7 суток.
Кристаллы переносили в резервуарный раствор, дополненный 20% глицерина в качестве криопротектора, и затем быстро охлаждали в жидком N2. Картины дифракции получали с использованием детектора Pilatus 6M при температуре 100K с каналом пучка X10SA Swiss Light Source и обрабатывали с использованием пакета XDS [Kabsch, W. Automatic processing of rotation diffraction data from crystals of initially unknown symmetry and cell constants. J. Appl. Cryst. 26, 795-800 (1993)]. Данные от одного кристалла объединяли с получением набора данных с разрешением 1,9 Å в группе симметрии кристаллической решетки Р1 с двумя молекулами комплекса на кристаллографическую асимметричную ячейку (см. Таблицу 1).
Структуру определяли посредством молекулярного замещения с использованием координат Fab фрагмента из PDB-ID 3UTZ в качестве поисковой модели. В качестве поисковых координат для ECD PD-1 использовали PDB-ID 3RRQ. Fab был разделен на константный и вариабельный домены, и с обоими отдельными поисками в CCP4 использовали программу PHASER CCP4 [CCP4 (Collaborative Computational Project, N. The CCP4 suite: programs for protein crystallography. Acta Crystallogr. D, 760-763 (1994)] для того, чтобы объяснить возможные изменения угла плеча. Модель перестраивали в COOT (Emsley, P., Lohkamp, B., Scott, WG. & Cowtan, K. Features and development of COOT. Acta Crystallogr. D Biol. Crystallogr. 60, 486-501 (2010)) и уточняли с использованием программы CCP4 REFMAC. Этапы конечного уточнения осуществляли с использованием программы BUSTER (Bricogne G., Blanc E., Brandl M., Flensburg C., Keller P., Paciorek W.,Roversi P, Sharff A., Smart O.S., Vonrhein C., Womack T.O. (2016). BUSTER version 2.11.6. Cambridge, United Kingdom: Global Phasing Ltd.).
Таблица 9: сбор данных и статистика уточнения структуры для кристалла Fab PD1-0103-ECD PD-1
1 Значения в скобках относятся к наборам с наивысшим разрешением.
2 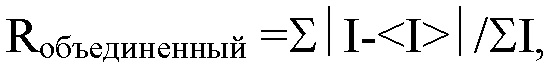 где I представляет собой интенсивность.
где I представляет собой интенсивность.
3 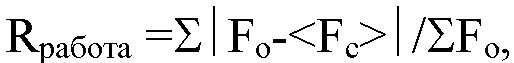 где Fo представляет собой наблюдаемую и Fc представляет собой расчетную амплитуду структурного множителя.
где Fo представляет собой наблюдаемую и Fc представляет собой расчетную амплитуду структурного множителя.
4 Rсвободный был рассчитан на основе 5% от всех данных, опущенных во время уточнения.
Определение структуры Fab PD1-0103 в комплексе с эктодоменом PD-1
Для того чтобы подробно охарактеризовать эпитоп и паратоп, авторы изобретения определили кристаллическую структуру эктодомена PD-1 в комплексе с Fab PD1-0103 до разрешения 1,9 Å. Данная структура выявляет то, что Fab PD1-0103 распознает эпитоп, образованный областями петель ВС и FG и остатками β-тяжей CC'FG передней β-складчатой структуры домена Ig V-типа PD-1. Кроме того, данный эпитоп включает древо N-связанного гликозилирования в положении Asn58, которое является частью петли ВС PD-1. Все CDR, за исключением CDR2 легкой цепи Fab PD1-0103, вносят вклад в паратоп.
Площадь поверхности 1063 Å2 PD-1 покрывается Fab PD1-0103, причем вклад тяжелой цепи составляет 743 Å2, а легкой цепи - 320 Å2. Анализ поверхности контакта связывания с использованием программы PISA выявляет картину взаимодействия Fab PD1-0103 с ECD PD-1 с 6 водородными связями и вандерваальсовыми силами. Водородные связи боковых цепей образуются между остатками CDR1 тяжелой цепи (Thr33) и CDR2 (Ser52, Arg56, Asp57) с Glu61 и Ser62 петли ВС PD-1. Вандерваальсовы контакты, главным образом, управляются CDR3 легкой и тяжелой цепи, в частности, Phe105 HCDR3 и Tyr32 HCDR1, которые находятся на близком расстоянии от остатков Val64 петли ВС, Pro83, Ile126 и Leu128 петли FG. Дополнительные вандерваальсовы контакты наблюдаются между остатками петли FG Pro130, Ala132, Ile134 с CDR2 тяжелой цепи и CDR3 легкой цепи Fab PD1-0103. Легкая цепь Fab PD1-0103 контактирует исключительно с петлей FG PD-1. CDR2 легкой цепи не предоставляет контактов для образования комплекса.
Древо N-связанного гликозилирования в положении Asn58 PD-1 является частью эпитопа и взаимодействует только с остатками тяжелой цепи Fab PD1-0103.
Древо центральной сахарной цепи (N-связанного гликозилирования) в положении Asn58 PD-1 имеет следующую структуру в отношении моносахаридов:
Asn58-N-GlcNAc(FUC) - GlcNAc- - BMA - MAN (см. Фиг. 9), где используются следующие сокращения:
[GlcNAc] = NGA = N-ацетил-бета-D-галактозамин = 2-(ацетиламино)-2-дезокси-бета-D-галактопираноза,
[FUC] = альфа-L-фукоза,
[BMA] = бета-D-маннопираноза,
[MAN] = альфа-D-маннопираноза.
Первый GlcNAc в сахарной цепи фукозилируется, что сокращается как GlcNAc(FUC).
В структуре центральные гликаны хорошо определяются в электронной плотности, за исключением одного маннозного звена. Фукозная группировка направлена в гидрофильный карман, образованный PD-1 с CDR1 и CDR2. Связывание фукозы координируется сетью водородных связей с Ser30 и Ser31 CDR1 вместе с Glu61 и Gln99 PD-1. Дополнительные контакты предоставляются связыванием водородными связями первого GlcNAc с Arg56 и остатками каркаса Arg72, Asp73, Asn74 с Man.
Таблица 10: список контактов PD1 - тяжелая цепь Fab PD1-0103
Контакты, идентифицированные по пороговому расстоянию 5 Å
Таблица 11: список контактов PD1 - легкая цепь Fab PD1-0103
Контакты, идентифицированные по пороговому расстоянию 5 Å
Таблица 12: список контактов центральная сахарная цепь на Asn58 PD1 - тяжелая цепь Fab PD1-0103
Контакты, идентифицированные по пороговому расстоянию 5 Å
Обобщение
• Эпитоп на PD1 имеет сходство с плоской поверхностью, связываемой, главным образом, передней β-складчатой структурой и CDR3 PD1
• Взаимодействия включают полярные и вандерваальсовы контакты
• Большая площадь поверхности взаимодействия PD1 с тяжелой цепью Fab
• Гликозилирование в положении Asn 58 участвует в связывании PD1 с фрагментом Fab
• Фукозное звено занимает карман, образованный PD1 и тяжелой цепью Fab PD1-0103.
Пример 9:
Пониженное связывание антитела с человеческим PD1, который не является гликозилированным на Asn58 по сравнению со связыванием с человеческим PD1, который является гликозилированным на Asn58 (характеризация Biacore антител против PD-1 к гликозилированным и негликозилированным рекомбинантным PD1)
Анализ на основе поверхностного плазмонного резонанса (SPR) использовали для определения кинетических параметров связывания между гликозилированным PD1 и негликозилированным рекомбинантным человеческим PD1. В связи с этим антитело к человеческому IgG иммобилизовали посредством аминного связывания с поверхностью сенсорного чипа СМ5 (Biacore). Затем захватывали образцы, и с ними связывался hu PD1-ECD. Поверхность сенсорного чипа регенерировали после каждого цикла анализа. Наконец, получали равновесную константу и кинетические константы скорости посредством аппроксимации данных к модели взаимодействия Лангмюра 1:1.
Примерно 2000 единиц ответа (RU) 20 мкг/мл антитела к человеческому IgG (GE Healthcare #BR-1008-39) связывали с проточными ячейками 1 и 2 (в качестве альтернативы: 3 и 4) сенсорного чипа СМ5 в Biacore T200 при рН 5,0 посредством применения набора аминного связывания, поставленного GE Healthcare.
Буфером для образца и подвижным буфером был HBS-EP+ (0,01 M HEPES, 0,15 M NaCl, 3 мМ EDTA, 0,05 % об./об. поверхностно-активное вещество P20, pH 7,4). Была установлена температура проточной ячейки 25°С и температура отсека для образца 12°С. Система была первично обработана подвижным буфером.
Образцы c концентрацией 10 нМ инъецировали в течение 20 секунд, и они связывались со второй проточной ячейкой. Затем над каждым образцом в течение 200 с инъецировали полный набор концентраций человеческого PD1-ECD (гликозилированного и негликозилированного) (200 нМ, 66,6 нМ, 22,2 нМ, 7,4 нМ, 2,46 нМ и 0 нМ), с последующим временем диссоциации 0/2000 с (66,6 нМ и 22,2 нМ) и двумя 20 с стадиями регенерации 3 М MgCl2, из которых по меньшей мере одна содержала «дополнительную промывку после инъекции» подвижным буфером.
Наконец, данные с двойным контролем аппроксимировали к модели взаимодействия Лангмюра 1:1 с использованием программы Biacore T200 Evaluation. Полученные в результате значения KD, ka и kd показаны в Таблице 13.
Таблица 13: кинетические константы скорости и равновесная контанта, определенные Biacore
Имеется явное различие между связыванием PD-103-0312 с негликозилированным и гликозилированным PD-1, в отличие от пембролизумаба и ниволумаба (см. также Фиг. 13А и 13Б).
Пример 10:
Противоопухолевая эффективость антител к PD1 in vivo в комбинации с Т-клеточным биспецифичным антителом против СЕА
Гуманизированное животное получали посредством адаптации мышей NOG с последующим адоптивным переносом человеческих гематопоэтических стволовых клеток. Полученные в результате мыши демонстрируют химерное отношение между человеческими и мышиными лейкоцитами, варьирующееся от 20 до 85% клеток человеческого происхождения. В такой модели Т-клетки являются функциональными и могут быть активированы для умерщвления опухолевых клеток посредством биспецифичного антитела, которое связывается с CEA (раковый эмбриональный антиген) и CD3 (которое описывается в WO2014/131712). Таким гуманизированным животным затем инъецировали один миллион СЕА-позитивных опухолевых клеток - карциномы желудка MKN45 - подкожно в латеральный участок. Рост опухоли мог оцениваться измерением 3-мерной оси опухоли посредством циркуля, управляемого оператором, 3 раза в неделю (Фиг. 14А и Б). В сутки 9 после инъекции опухоли мышей рандомизировали на основе размера опухоли для того, чтобы иметь гомогенные группы животных, и начиналось терапевтическое лечение. За исключением групп носителя (Фиг. 14А и 14Б, круги), всем группам мышей внутривенно вводили CEACD3TCB в дозе 2,5 мг/кг дважды в неделю. Кроме того, каждую группу мышей также обрабатывали одним партнером по комбинации: антителом к PD1 (PD1-0103-0212) либо в дозировке 0,15 мг/кг еженедельно (Фиг. 14А, квадраты), либо 1,5 мг/кг (Фиг. 14Б, квадраты) еженедельно внутрибрюшинно; ниволумабом либо в дозировке 0,15 мг/кг еженедельно (Фиг. 14А, ромбы), либо 1,5 мг/кг (Фиг. 14Б, ромбы) еженедельно внутрибрюшинно. Средний размер опухоли в пределах одной группы обработки демонстрируется с течением времени. Каждая группа состояла из 9-10 мышей, и измерение продолжали до тех пор, пока имелось по меньшей мере 3 мыши на группу. Рассчитывали стандартизированную площадь под кривой (sAUC), и однофакторный ANOVA (дисперсионный анализ) использовали для расчета статистической значимости.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> F. Hoffmann-La Roche AG
<120> АНТИТЕЛА К PD1 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ
<130> P33103-WO
<150> EP15188061.4
<151> 2015-10-02
<160> 77
<170> PatentIn version 3.5
<210> 1
<211> 7
<212> ПРТ
<213> Mus Musculus
<400> 1
Gly Phe Ser Phe Ser Ser Tyr
1 5
<210> 2
<211> 3
<212> ПРТ
<213> Mus Musculus
<400> 2
Gly Gly Arg
1
<210> 3
<211> 9
<212> ПРТ
<213> Mus Musculus
<400> 3
Thr Gly Arg Val Tyr Phe Ala Leu Asp
1 5
<210> 4
<211> 11
<212> ПРТ
<213> Mus Musculus
<400> 4
Ser Glu Ser Val Asp Thr Ser Asp Asn Ser Phe
1 5 10
<210> 5
<211> 3
<212> ПРТ
<213> Mus Musculus
<400> 5
Arg Ser Ser
1
<210> 6
<211> 6
<212> ПРТ
<213> Mus Musculus
<400> 6
Asn Tyr Asp Val Pro Trp
1 5
<210> 7
<211> 120
<212> ПРТ
<213> Mus Musculus
<400> 7
Glu Val Ile Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Ser Ser Tyr
20 25 30
Thr Met Ser Trp Val Arg Gln Thr Pro Glu Lys Arg Leu Asp Trp Val
35 40 45
Ala Thr Ile Ser Gly Gly Gly Arg Asp Ile Tyr Tyr Pro Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Glu Met Ser Ser Leu Met Ser Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Val Leu Leu Thr Gly Arg Val Tyr Phe Ala Leu Asp Ser Trp Gly Gln
100 105 110
Gly Thr Ser Val Thr Val Ser Ser
115 120
<210> 8
<211> 111
<212> ПРТ
<213> Mus Musculus
<400> 8
Lys Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu Ser Val Asp Thr Ser
20 25 30
Asp Asn Ser Phe Ile His Trp Tyr Gln Gln Arg Pro Gly Gln Ser Pro
35 40 45
Lys Leu Leu Ile Tyr Arg Ser Ser Thr Leu Glu Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Arg Thr Asp Phe Thr Leu Thr Ile Asp
65 70 75 80
Pro Val Glu Ala Asp Asp Val Ala Thr Tyr Tyr Cys Gln Gln Asn Tyr
85 90 95
Asp Val Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 9
<211> 8
<212> ПРТ
<213> Mus Musculus
<400> 9
Gly Tyr Ser Ile Thr Ser Asp Tyr
1 5
<210> 10
<211> 3
<212> ПРТ
<213> Mus Musculus
<400> 10
Tyr Ser Gly
1
<210> 11
<211> 9
<212> ПРТ
<213> Mus Musculus
<400> 11
His Gly Ser Ala Pro Trp Tyr Phe Asp
1 5
<210> 12
<211> 12
<212> ПРТ
<213> Mus Musculus
<400> 12
Ser Gln Asn Ile Val His Ser Asp Gly Asn Thr Tyr
1 5 10
<210> 13
<211> 3
<212> ПРТ
<213> Mus Musculus
<400> 13
Lys Val Ser
1
<210> 14
<211> 6
<212> ПРТ
<213> Mus Musculus
<400> 14
Gly Ser His Phe Pro Leu
1 5
<210> 15
<211> 120
<212> ПРТ
<213> Mus Musculus
<400> 15
Asp Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Ser Leu Ser Leu Thr Cys Thr Val Thr Gly Tyr Ser Ile Thr Ser Asp
20 25 30
Tyr Ala Trp Asn Trp Ile Arg Gln Phe Pro Gly Asp Lys Leu Glu Trp
35 40 45
Leu Gly Tyr Ile Thr Tyr Ser Gly Phe Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Ile Ser Ile Ser Arg Asp Thr Ser Lys Asn Gln Phe Phe
65 70 75 80
Leu Gln Leu Asn Ser Val Ala Thr Glu Asp Thr Ala Thr Tyr Tyr Cys
85 90 95
Ala Arg Trp His Gly Ser Ala Pro Trp Tyr Phe Asp Tyr Trp Gly Arg
100 105 110
Gly Thr Thr Leu Thr Val Ser Ser
115 120
<210> 16
<211> 112
<212> ПРТ
<213> Mus Musculus
<400> 16
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Gln Asn Ile Val His Ser
20 25 30
Asp Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Asn Leu Leu Ile Tyr Lys Val Ser Arg Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Phe Pro Leu Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105 110
<210> 17
<211> 8
<212> ПРТ
<213> Mus Musculus
<400> 17
Gly Tyr Ser Ile Thr Ser Asp Tyr
1 5
<210> 18
<211> 3
<212> ПРТ
<213> Mus Musculus
<400> 18
Tyr Thr Gly
1
<210> 19
<211> 9
<212> ПРТ
<213> Mus Musculus
<400> 19
Met Asp Tyr Tyr Gly Ser Thr Leu Asp
1 5
<210> 20
<211> 11
<212> ПРТ
<213> Mus Musculus
<400> 20
Ser Glu Ser Val Asp Arg Tyr Gly Asn Ser Phe
1 5 10
<210> 21
<211> 3
<212> ПРТ
<213> Mus Musculus
<400> 21
Arg Ala Ser
1
<210> 22
<211> 6
<212> ПРТ
<213> Mus Musculus
<400> 22
Asn Asn Glu Asp Pro Tyr
1 5
<210> 23
<211> 120
<212> ПРТ
<213> Mus Musculus
<400> 23
Asp Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Ser Leu Ser Leu Thr Cys Thr Val Thr Gly Tyr Ser Ile Thr Ser Asp
20 25 30
Tyr Ala Trp Asn Trp Ile Arg Gln Phe Pro Gly Asn Lys Leu Glu Trp
35 40 45
Met Gly Tyr Ile Thr Tyr Thr Gly Arg Thr Ser Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Ile Ser Ile Thr Arg Asp Thr Ser Lys Asn Gln Phe Phe
65 70 75 80
Leu Gln Leu Asn Ser Val Thr Thr Glu Asp Thr Ala Thr Tyr Tyr Cys
85 90 95
Ala Arg Glu Met Asp Tyr Tyr Gly Ser Thr Leu Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Leu Thr Val Ser Ser
115 120
<210> 24
<211> 111
<212> ПРТ
<213> Mus Musculus
<400> 24
Lys Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Leu Arg
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu Ser Val Asp Arg Tyr
20 25 30
Gly Asn Ser Phe Ile His Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Val Leu Ile Tyr Arg Ala Ser Asn Leu Glu Ser Gly Phe Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Arg Thr Asp Phe Thr Leu Thr Ile Asp
65 70 75 80
Pro Val Glu Ala Asp Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Asn Asn
85 90 95
Glu Asp Pro Tyr Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 25
<211> 7
<212> ПРТ
<213> Mus Musculus
<400> 25
Gly Tyr Thr Phe Thr Asp Tyr
1 5
<210> 26
<211> 3
<212> ПРТ
<213> Mus Musculus
<400> 26
Tyr Ser Gly
1
<210> 27
<211> 7
<212> ПРТ
<213> Mus Musculus
<400> 27
Gly Ile Thr Thr Gly Phe Ala
1 5
<210> 28
<211> 11
<212> ПРТ
<213> Mus Musculus
<400> 28
Ser Lys Gly Val Ser Thr Ser Ser Tyr Ser Phe
1 5 10
<210> 29
<211> 3
<212> ПРТ
<213> Mus Musculus
<400> 29
Tyr Ala Ser
1
<210> 30
<211> 6
<212> ПРТ
<213> Mus Musculus
<400> 30
Ser Arg Glu Phe Pro Trp
1 5
<210> 31
<211> 118
<212> ПРТ
<213> Mus Musculus
<400> 31
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Arg Pro Gly Val
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Ala Met His Trp Val Lys Gln Ser His Ala Arg Thr Leu Glu Trp Ile
35 40 45
Gly Val Ile Ser Thr Tyr Ser Gly Asp Thr Asn Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Lys Ala Thr Met Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ala Arg Met Thr Ser Glu Asp Ser Ala Ile Tyr Tyr Cys
85 90 95
Ala Arg Leu Gly Ile Thr Thr Gly Phe Ala Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ala
115
<210> 32
<211> 111
<212> ПРТ
<213> Mus Musculus
<400> 32
Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Lys Gly Val Ser Thr Ser
20 25 30
Ser Tyr Ser Phe Met His Trp Tyr Gln Gln Lys Pro Arg Gln Pro Pro
35 40 45
Lys Leu Leu Ile Lys Tyr Ala Ser Tyr Leu Glu Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Asn Ile His
65 70 75 80
Pro Val Glu Glu Glu Asp Ala Ala Thr Tyr Tyr Cys His His Ser Arg
85 90 95
Glu Phe Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 33
<211> 7
<212> ПРТ
<213> Mus Musculus
<400> 33
Gly Phe Thr Phe Ser Asn Tyr
1 5
<210> 34
<211> 3
<212> ПРТ
<213> Mus Musculus
<400> 34
Gly Gly Arg
1
<210> 35
<211> 5
<212> ПРТ
<213> Mus Musculus
<400> 35
Tyr Tyr Gly Ile Asp
1 5
<210> 36
<211> 7
<212> ПРТ
<213> Mus Musculus
<400> 36
Ser Gln Asp Val Thr Thr Ala
1 5
<210> 37
<211> 3
<212> ПРТ
<213> Mus Musculus
<400> 37
Trp Ala Ser
1
<210> 38
<211> 6
<212> ПРТ
<213> Mus Musculus
<400> 38
His Tyr Ser Ile Pro Trp
1 5
<210> 39
<211> 116
<212> ПРТ
<213> Mus Musculus
<400> 39
Glu Val Lys Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Gly Met Ser Trp Ile Arg Gln Thr Pro Glu Lys Gly Leu Glu Trp Val
35 40 45
Ala Thr Ile Ser Gly Gly Gly Arg Asp Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Val Lys Asn Asn Leu Tyr
65 70 75 80
Leu Gln Met Ser Ser Leu Arg Ser Glu Asp Thr Ala Phe Tyr Tyr Cys
85 90 95
Ala Ser Tyr Tyr Tyr Gly Ile Asp Tyr Trp Gly Gln Gly Thr Ser Val
100 105 110
Thr Val Ser Ser
115
<210> 40
<211> 107
<212> ПРТ
<213> Mus Musculus
<400> 40
Asp Ile Val Met Thr Gln Pro His Lys Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Arg Ile Thr Cys Lys Ala Ser Gln Asp Val Thr Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Trp Ala Ser Thr Arg His Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Val Gln Ala
65 70 75 80
Glu Asp Leu Ala Leu Tyr Tyr Cys Gln Gln His Tyr Ser Ile Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 41
<211> 7
<212> ПРТ
<213> Mus Musculus
<400> 41
Gly Tyr Thr Phe Thr Ser Thr
1 5
<210> 42
<211> 3
<212> ПРТ
<213> Mus Musculus
<400> 42
Ser Asp Ser
1
<210> 43
<211> 3
<212> ПРТ
<213> Mus Musculus
<400> 43
Pro Phe Asp
1
<210> 44
<211> 7
<212> ПРТ
<213> Mus Musculus
<400> 44
Ser Gln Asp Val Ser Thr Ala
1 5
<210> 45
<211> 3
<212> ПРТ
<213> Mus Musculus
<400> 45
Ser Ala Ser
1
<210> 46
<211> 6
<212> ПРТ
<213> Mus Musculus
<400> 46
His Tyr Ser His Pro Phe
1 5
<210> 47
<211> 114
<212> ПРТ
<213> Mus Musculus
<400> 47
Gln Val Gln Leu Gln Gln Pro Gly Ala Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Thr
20 25 30
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Ala Ile Asp Pro Ser Asp Ser Tyr Thr Thr Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Thr Ser Ser Thr Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Ser Pro Phe Asp Tyr Trp Gly Gln Gly Thr Thr Leu Thr Val
100 105 110
Ser Ser
<210> 48
<211> 107
<212> ПРТ
<213> Mus Musculus
<400> 48
Asp Ile Val Met Thr Gln Ser His Lys Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Ile Thr Cys Lys Ala Ser Gln Asp Val Ser Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Ala Ile Ser Ser Val Gln Ala
65 70 75 80
Glu Asp Leu Ala Val Tyr Tyr Cys Gln Gln His Tyr Ser His Pro Phe
85 90 95
Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 49
<211> 8
<212> ПРТ
<213> Mus Musculus
<400> 49
Gly Tyr Ser Ile Thr Ser Gly Tyr
1 5
<210> 50
<211> 3
<212> ПРТ
<213> Mus Musculus
<400> 50
Ser Ser Gly
1
<210> 51
<211> 6
<212> ПРТ
<213> Mus Musculus
<400> 51
Arg Asn Trp Tyr Phe Asp
1 5
<210> 52
<211> 13
<212> ПРТ
<213> Mus Musculus
<400> 52
Ser Gln Ser Leu Leu Asn Ser Gly Thr Gln Lys Asn Tyr
1 5 10
<210> 53
<211> 3
<212> ПРТ
<213> Mus Musculus
<400> 53
Trp Ala Ser
1
<210> 54
<211> 6
<212> ПРТ
<213> Mus Musculus
<400> 54
Asp Tyr Thr Phe Pro Leu
1 5
<210> 55
<211> 117
<212> ПРТ
<213> Mus Musculus
<400> 55
Asp Val Gln Leu Gln Glu Ser Gly Pro Asp Leu Val Lys Pro Ser Gln
1 5 10 15
Ser Leu Ser Leu Thr Cys Thr Val Thr Gly Tyr Ser Ile Thr Ser Gly
20 25 30
Tyr Ser Trp His Trp Ile Arg Gln Phe Pro Gly Asn Lys Leu Glu Trp
35 40 45
Met Gly Phe Ile His Ser Ser Gly Asp Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Ile Ser Phe Thr Arg Asp Thr Ser Lys Asn Gln Phe Phe
65 70 75 80
Leu Gln Leu Ser Ser Leu Thr Asp Glu Asp Thr Ala Thr Tyr Tyr Cys
85 90 95
Ala Thr Tyr Arg Asn Trp Tyr Phe Asp Val Trp Gly Ala Gly Thr Thr
100 105 110
Val Thr Val Ser Ser
115
<210> 56
<211> 113
<212> ПРТ
<213> Mus Musculus
<400> 56
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Thr Val Thr Ala Gly
1 5 10 15
Glu Lys Val Thr Met Arg Cys Lys Ser Ser Gln Ser Leu Leu Asn Ser
20 25 30
Gly Thr Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asn Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Val Gln Ala Glu Asp Leu Ser Val Tyr Tyr Cys Gln Ser
85 90 95
Asp Tyr Thr Phe Pro Leu Thr Phe Gly Gly Gly Thr Lys Leu Glu Leu
100 105 110
Lys
<210> 57
<211> 120
<212> ПРТ
<213> Искусственная
<220>
<223> гуманизированный вариант - вариабельный домен VH тяжелой цепи PD1-0103_01
<400> 57
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Ser Ser Tyr
20 25 30
Thr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Thr Ile Ser Gly Gly Gly Arg Asp Ile Tyr Tyr Pro Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Leu Leu Thr Gly Arg Val Tyr Phe Ala Leu Asp Ser Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 58
<211> 111
<212> ПРТ
<213> Искусственная
<220>
<223> гуманизированный вариант - вариабельный домен VL легкой цепи PD1-0103_01
<400> 58
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ala Ser Glu Ser Val Asp Thr Ser
20 25 30
Asp Asn Ser Phe Ile His Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro
35 40 45
Lys Leu Leu Ile Tyr Arg Ser Ser Thr Leu Glu Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln Asn Tyr
85 90 95
Asp Val Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 59
<211> 111
<212> ПРТ
<213> Искусственная
<220>
<223> гуманизированный вариант - вариабельный домен VL легкой цепи PD1-0103_02
<400> 59
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ala Ser Glu Ser Val Asp Thr Ser
20 25 30
Asp Asn Ser Phe Ile His Trp Tyr Gln Gln Arg Pro Gly Gln Ser Pro
35 40 45
Arg Leu Leu Ile Tyr Arg Ser Ser Thr Leu Glu Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser
65 70 75 80
Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Gln Gln Asn Tyr
85 90 95
Asp Val Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 60
<211> 111
<212> ПРТ
<213> Искусственная
<220>
<223> гуманизированный вариант - вариабельный домен VL легкой цепи PD1-0103_03
<400> 60
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Glu Ser Val Asp Thr Ser
20 25 30
Asp Asn Ser Phe Ile His Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro
35 40 45
Arg Leu Leu Ile Tyr Arg Ser Ser Thr Leu Glu Ser Gly Ile Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Asn Tyr
85 90 95
Asp Val Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 61
<211> 111
<212> ПРТ
<213> Искусственная
<220>
<223> гуманизированный вариант - вариабельный домен VL легкой цепи PD1-0103_04
<400> 61
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Glu Ser Val Asp Thr Ser
20 25 30
Asp Asn Ser Phe Ile His Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro
35 40 45
Arg Leu Leu Ile Tyr Arg Ser Ser Thr Leu Glu Ser Gly Ile Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Asn Tyr
85 90 95
Asp Val Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 62
<211> 107
<212> ПРТ
<213> Homo Sapiens
<400> 62
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
1 5 10 15
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
20 25 30
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
35 40 45
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
50 55 60
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
65 70 75 80
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
85 90 95
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
100 105
<210> 63
<211> 105
<212> ПРТ
<213> Homo Sapiens
<400> 63
Gln Pro Lys Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu
1 5 10 15
Glu Leu Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe
20 25 30
Tyr Pro Gly Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val
35 40 45
Lys Ala Gly Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys
50 55 60
Tyr Ala Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser
65 70 75 80
His Arg Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu
85 90 95
Lys Thr Val Ala Pro Thr Glu Cys Ser
100 105
<210> 64
<211> 330
<212> ПРТ
<213> Homo Sapiens
<400> 64
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu
225 230 235 240
Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
325 330
<210> 65
<211> 330
<212> ПРТ
<213> homo sapiens
<400> 65
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu
225 230 235 240
Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
325 330
<210> 66
<211> 330
<212> ПРТ
<213> homo sapiens
<400> 66
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Gly Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu
225 230 235 240
Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
325 330
<210> 67
<211> 327
<212> ПРТ
<213> Homo Sapiens
<400> 67
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Ser Cys Pro Ala Pro
100 105 110
Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
115 120 125
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
130 135 140
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
145 150 155 160
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
165 170 175
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
180 185 190
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
195 200 205
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
210 215 220
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
225 230 235 240
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
245 250 255
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
260 265 270
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
275 280 285
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
290 295 300
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
305 310 315 320
Leu Ser Leu Ser Leu Gly Lys
325
<210> 68
<211> 268
<212> ПРТ
<213> Homo Sapiens
<400> 68
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val Val Gly Val Val Gly Gly Leu Leu Gly Ser
145 150 155 160
Leu Val Leu Leu Val Trp Val Leu Ala Val Ile Cys Ser Arg Ala Ala
165 170 175
Arg Gly Thr Ile Gly Ala Arg Arg Thr Gly Gln Pro Leu Lys Glu Asp
180 185 190
Pro Ser Ala Val Pro Val Phe Ser Val Asp Tyr Gly Glu Leu Asp Phe
195 200 205
Gln Trp Arg Glu Lys Thr Pro Glu Pro Pro Val Pro Cys Val Pro Glu
210 215 220
Gln Thr Glu Tyr Ala Thr Ile Val Phe Pro Ser Gly Met Gly Thr Ser
225 230 235 240
Ser Pro Ala Arg Arg Gly Ser Ala Asp Gly Pro Arg Ser Ala Gln Pro
245 250 255
Leu Arg Pro Glu Asp Gly His Cys Ser Trp Pro Leu
260 265
<210> 69
<211> 150
<212> ПРТ
<213> Homo Sapiens
<400> 69
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 70
<211> 288
<212> ПРТ
<213> homo sapiens
<400> 70
Met Gln Ile Pro Gln Ala Pro Trp Pro Val Val Trp Ala Val Leu Gln
1 5 10 15
Leu Gly Trp Arg Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp
20 25 30
Asn Pro Pro Thr Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp
35 40 45
Asn Ala Thr Phe Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val
50 55 60
Leu Asn Trp Tyr Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala
65 70 75 80
Ala Phe Pro Glu Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe Arg
85 90 95
Val Thr Gln Leu Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg
100 105 110
Ala Arg Arg Asn Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser Leu
115 120 125
Ala Pro Lys Ala Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val
130 135 140
Thr Glu Arg Arg Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro
145 150 155 160
Arg Pro Ala Gly Gln Phe Gln Thr Leu Val Val Gly Val Val Gly Gly
165 170 175
Leu Leu Gly Ser Leu Val Leu Leu Val Trp Val Leu Ala Val Ile Cys
180 185 190
Ser Arg Ala Ala Arg Gly Thr Ile Gly Ala Arg Arg Thr Gly Gln Pro
195 200 205
Leu Lys Glu Asp Pro Ser Ala Val Pro Val Phe Ser Val Asp Tyr Gly
210 215 220
Glu Leu Asp Phe Gln Trp Arg Glu Lys Thr Pro Glu Pro Pro Val Pro
225 230 235 240
Cys Val Pro Glu Gln Thr Glu Tyr Ala Thr Ile Val Phe Pro Ser Gly
245 250 255
Met Gly Thr Ser Ser Pro Ala Arg Arg Gly Ser Ala Asp Gly Pro Arg
260 265 270
Ser Ala Gln Pro Leu Arg Pro Glu Asp Gly His Cys Ser Trp Pro Leu
275 280 285
<210> 71
<211> 4
<212> ПРТ
<213> Искусственная
<220>
<223> Минимальная HVR1 PD1-0103 и гуманизированного варианта PD1-0103:
PD1-0103-0312, PD1-0103-0313, PD1-0103-0314 и PD1-0103-0315
<400> 71
Ser Ser Tyr Thr
1
<210> 72
<211> 8
<212> ПРТ
<213> Искусственная
<220>
<223> Минимальная HVR2 PD1-0103 и гуманизированного варианта PD1-0103:
PD1-0103-0312, PD1-0103-0313, PD1-0103-0314 и PD1-0103-0315
<400> 72
Ser Gly Gly Gly Arg Asp Ile Tyr
1 5
<210> 73
<211> 5
<212> ПРТ
<213> Искусственная
<220>
<223> Минимальная HVR3 PD1-0103 и гуманизированного варианта PD1-0103:
PD1-0103-0312, PD1-0103-0313, PD1-0103-0314 и PD1-0103-0315
<400> 73
Gly Arg Val Tyr Phe
1 5
<210> 74
<211> 6
<212> ПРТ
<213> Искусственная
<220>
<223> Минимальная LVR1 PD1-0103 и гуманизированного варианта PD1-0103:
PD1-0103-0312, PD1-0103-0313, PD1-0103-0314 и PD1-0103-0315
<400> 74
Thr Ser Asp Asn Ser Phe
1 5
<210> 75
<211> 7
<212> ПРТ
<213> Искусственная
<220>
<223> Минимальная LVR2 PD1-0103 и гуманизированного варианта PD1-0103:
PD1-0103-0312, PD1-0103-0313, PD1-0103-0314 и PD1-0103-0315
<400> 75
Arg Ser Ser Thr Leu Glu Ser
1 5
<210> 76
<211> 6
<212> ПРТ
<213> Искусственная
<220>
<223> Минимальная LVR3 PD1-0103 и гуманизированного варианта PD1-0103:
PD1-0103-0312, PD1-0103-0313, PD1-0103-0314 и PD1-0103-0315
<400> 76
Asn Tyr Asp Val Pro Trp
1 5
<210> 77
<211> 3
<212> ПРТ
<213> Искусственная
<220>
<223> фрагмент FR-H3, содержащий аминокислотную последовательность RDN в
положениях 71, 72, 73 согласно нумерации Kabat
<400> 77
Arg Asp Asn
1
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| БИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА, СПЕЦИФИЧЕСКИ СВЯЗЫВАЮЩИЕСЯ С PD1 И LAG3 | 2018 |
|
RU2778805C2 |
| АНТИТЕЛА К LAG3 | 2018 |
|
RU2778053C2 |
| АНТИ-HLA-G АНТИТЕЛА И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2797724C2 |
| АНТИТЕЛА ПРОТИВ СИГНАЛ-РЕГУЛЯТОРНОГО БЕЛКА АЛЬФА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2771964C2 |
| АНТИТЕЛА ПРОТИВ ТРАНСФЕРРИНОВОГО РЕЦЕПТОРА, ОБЛАДАЮЩИЕ ИНДИВИДУАЛИЗИРОВАННОЙ АФФИННОСТЬЮ | 2016 |
|
RU2729416C2 |
| АНТИТЕЛА ПРОТИВ ТРАНСФЕРРИНОВОГО РЕЦЕПТОРА, ОБЛАДАЮЩИЕ ИНДИВИДУАЛИЗИРОВАННОЙ АФФИННОСТЬЮ | 2016 |
|
RU2831724C2 |
| АНТИТЕЛА К ВИРУСУ ДЕНГЕ, ПОЛИПЕПТИДЫ, СОДЕРЖАЩИЕ ВАРИАНТЫ FC-ОБЛАСТЕЙ, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2758596C2 |
| АНТИТЕЛА К ВИРУСУ ДЕНГЕ, ОБЛАДАЮЩИЕ ПЕРЕКРЕСТНОЙ РЕАКТИВНОСТЬЮ С ВИРУСОМ ЗИКА | 2019 |
|
RU2811697C2 |
| АНТИТЕЛА ПРОТИВ ТАУ-БЕЛКА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2732122C2 |
| АНТИТЕЛА К С5 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2746356C2 |






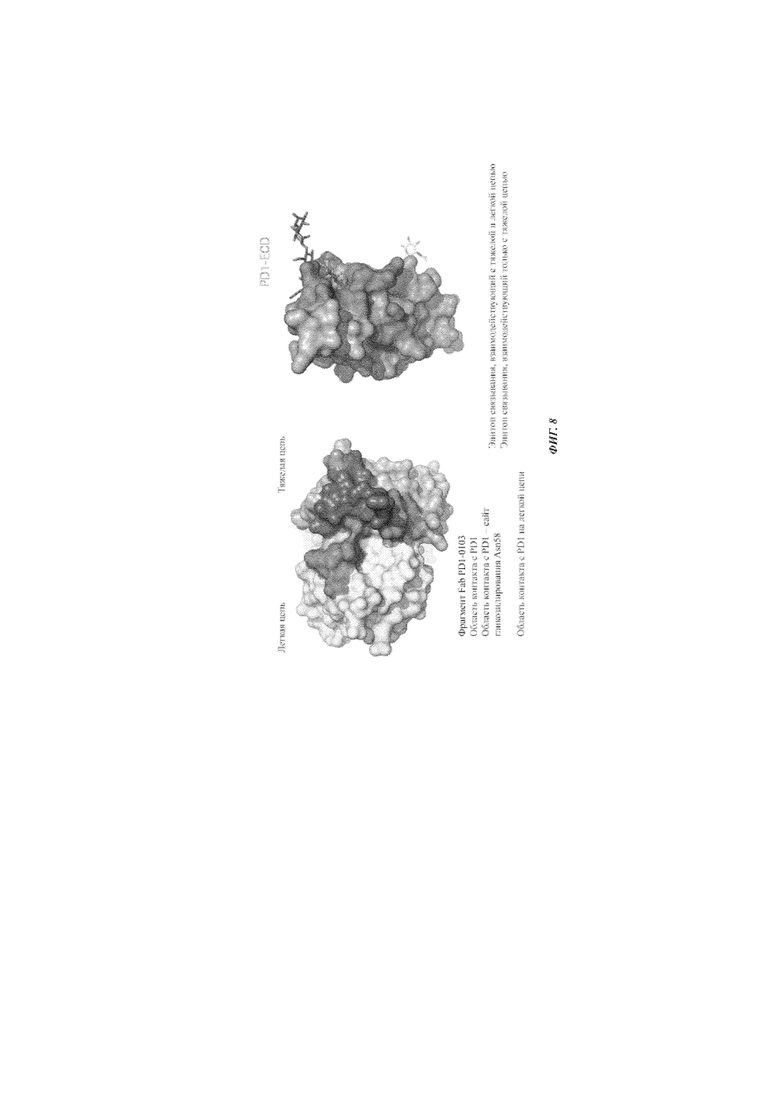

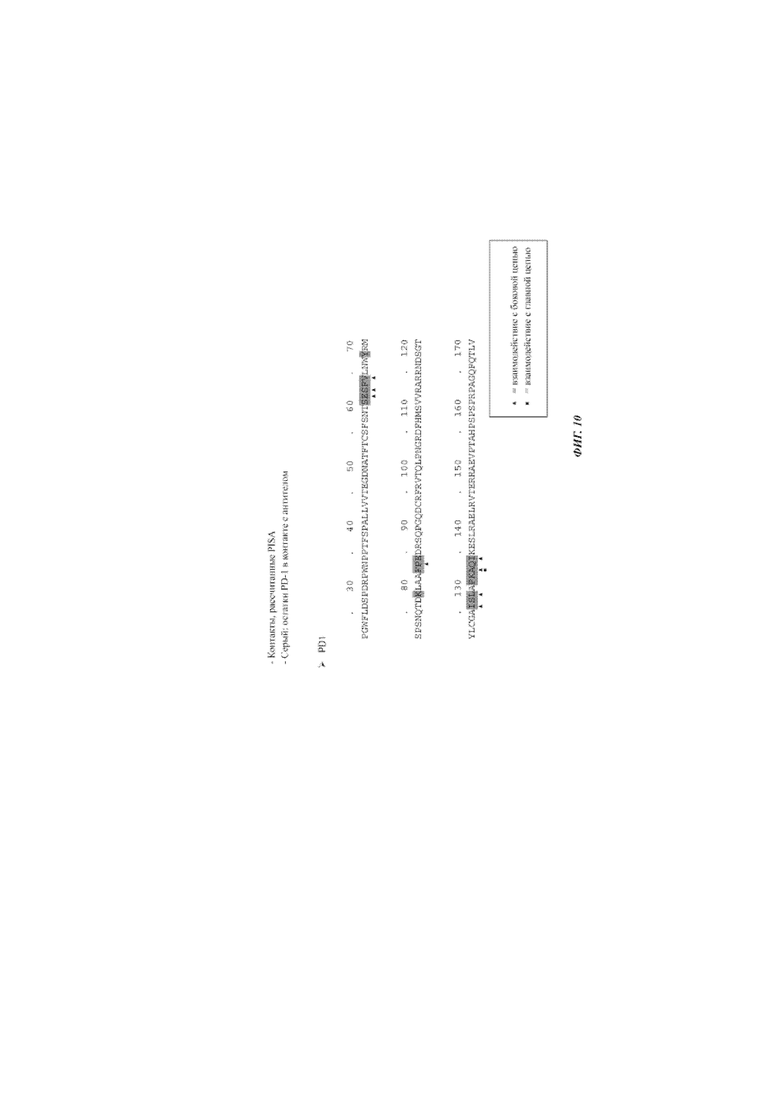


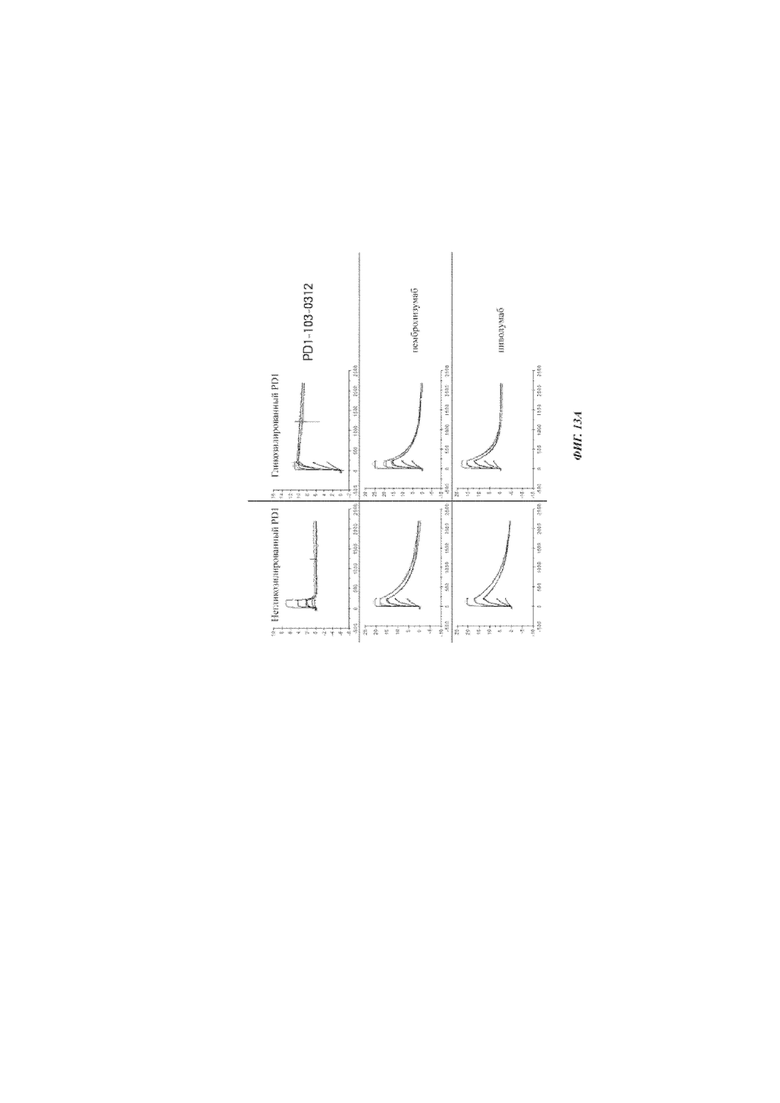
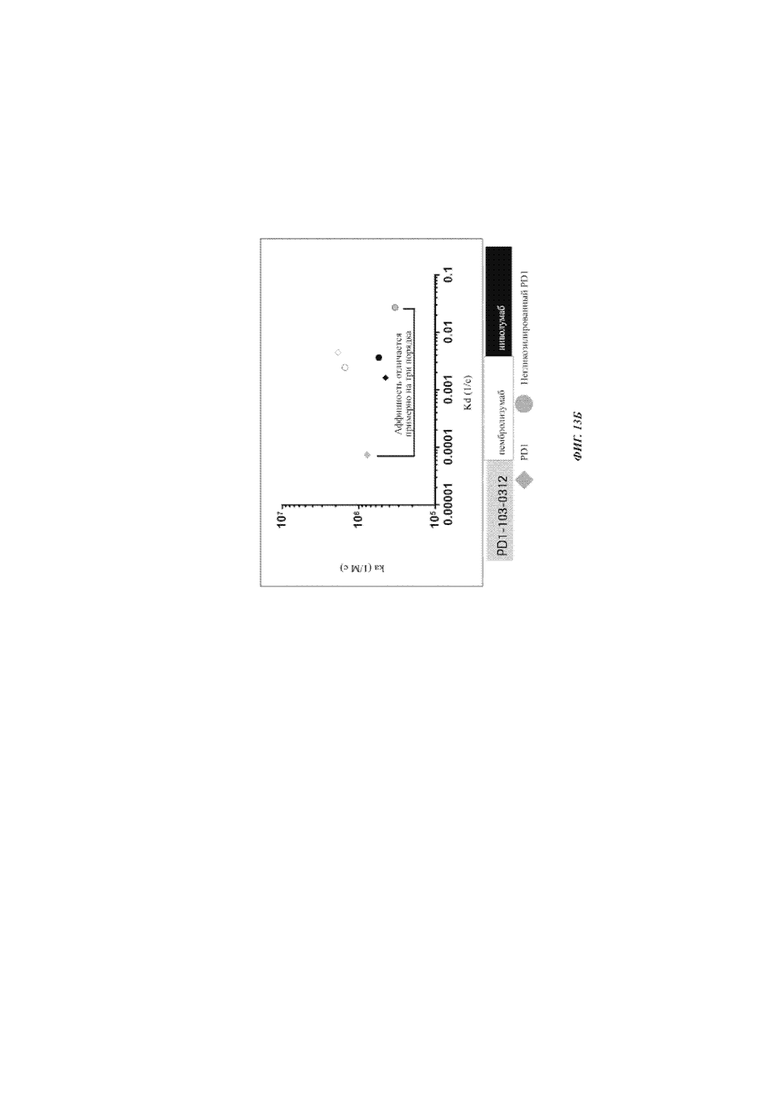
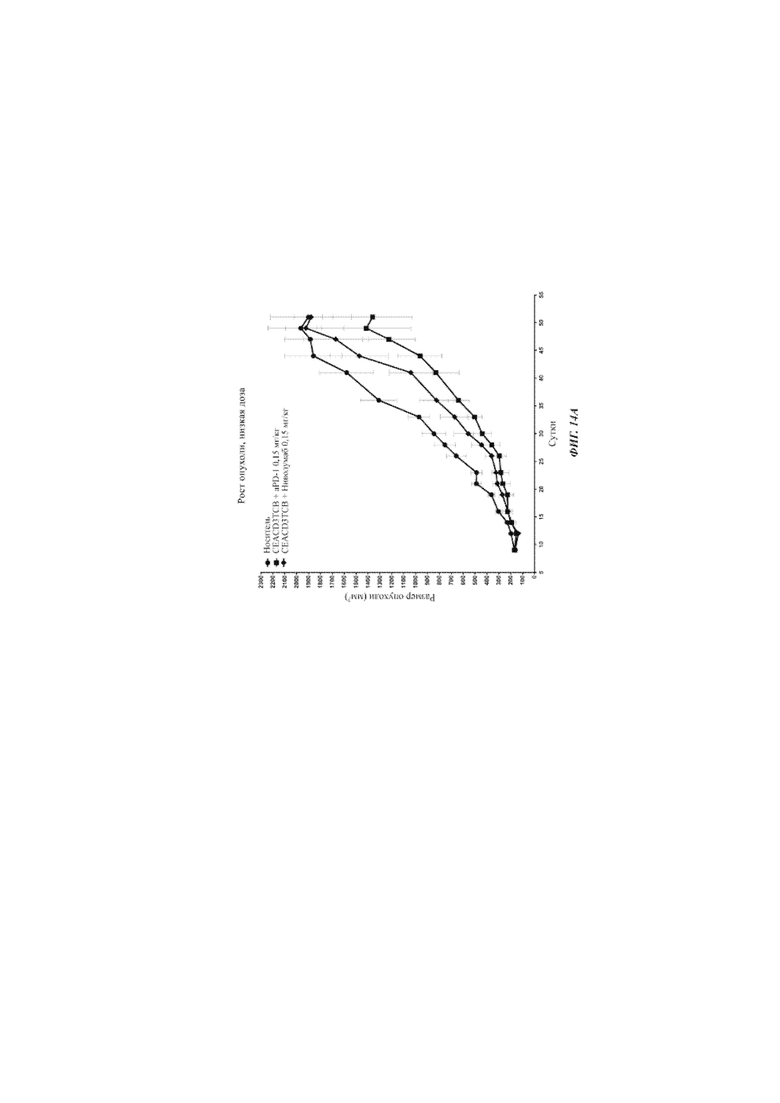

Группа изобретений относится к иммунологии и медицине, в частности к антителам к PD1 и к способам их применения. Предложено выделенное антитело, которое специфично связывается с человеческим PD1 и содержит HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 71; HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 72; HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 73; HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 74; HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 75; HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 76, и FR-H3, содержащую аминокислотную последовательность SEQ ID NO: 77 (RDN) в положениях 71, 72 и 73 согласно нумерации Kabat. Антитело к PD1 конкурирует за связывание с PD-1 с антителом к PD1, содержащим VH с последовательностью SEQ ID NO: 7 и VL с последовательностью SEQ ID NO: 8, и/или связывается с PD-1 человека и яванского макака; и/или усиливает секрецию IFN-гамма и/или усиливает секрецию TNF альфа аллогенными стимулированными Т-клетками на 85% или более при концентрации антитела 10 мкг/мл. Предложенное антитело проявляет пониженное связывание с человеческим PD1, который не является гликозилированным на Asn58 по сравнению со связыванием с человеческим PD1, гликозилированным на Asn58. Антитело может быть использовано для лечения рака. 12 н. и 4 з.п. ф-лы, 14 ил., 13 табл., 10 пр.
1. Выделенное антитело, которое специфично связывается с человеческим PD1, где данное антитело содержит:
(a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 71;
(б) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 72;
(в) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 73;
(г) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 74;
(д) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 75;
(е) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 76, и
(ж) FR-H3, содержащую аминокислотную последовательность SEQ ID NO: 77 (RDN) в положениях 71, 72 и 73 согласно нумерации Kabat.
2. Антитело по п. 1, где данное антитело
А)
i) содержит последовательность VH SEQ ID NO: 7 и последовательность VL SEQ ID NO: 8;
ii) или гуманизированный вариант VH и VL антитела согласно i);
или Б)
i) содержит последовательность VH SEQ ID NO: 57 и последовательность VL SEQ ID NO: 58;
ii) содержит последовательность VH SEQ ID NO: 57 и последовательность VL SEQ ID NO: 59;
iii) содержит последовательность VH SEQ ID NO: 57 и последовательность VL SEQ ID NO: 60;
iv) содержит последовательность VH SEQ ID NO: 57 и последовательность VL SEQ ID NO: 61.
3. Выделенное антитело, которое специфично связывается с человеческим PD1, где данное антитело
i) содержит последовательность VH SEQ ID NO: 7 и последовательность VL SEQ ID NO: 8;
ii) или гуманизированный вариант VH и VL антитела согласно i).
4. Выделенное антитело, которое специфично связывается с человеческим PD1, где данное антитело содержит последовательность VH SEQ ID NO: 57 и последовательность VL SEQ ID NO: 58.
5. Выделенное антитело, которое специфично связывается с человеческим PD1, где данное антитело содержит последовательность VH SEQ ID NO: 57 и последовательность VL SEQ ID NO: 59.
6. Выделенное антитело, которое специфично связывается с человеческим PD1, где данное антитело содержит последовательность VH SEQ ID NO: 57 и последовательность VL SEQ ID NO: 60.
7. Выделенное антитело, которое специфично связывается с человеческим PD1, где данное антитело содержит последовательность VH SEQ ID NO: 57 и последовательность VL SEQ ID NO: 61.
8. Антитело к PD1 по любому из пп. 1-7, где данное антитело характеризуется независимо одним или более чем одним из следующих свойств: антитело к PD1
i) конкурирует за связывание с PD-1 с антителом к PD1, содержащим VH с аминокислотной последовательностью SEQ ID NO: 7 и VL с аминокислотной последовательностью SEQ ID NO: 8, и/или
ii) связывается с PD-1 человека и яванского макака; и/или
iii) усиливает секрецию интерферона-гамма (IFN-гамма) аллогенными стимулированными Т-клетками на 85% или более при концентрации антитела 10 мкг/мл; и/или
iv) усиливает секрецию фактора некроза опухолей альфа (TNF альфа) аллогенными стимулированными Т-клетками на 200% или более при концентрации антитела 10 мкг/мл.
9. Антитело по любому из пп. 1-8, которое представляет собой полноразмерное антитело IgG1 с мутациями L234A, L235A и P329G (нумерация согласно индексу EU по Kabat).
10. Выделенная нуклеиновая кислота, кодирующая антитело, которое специфично связывается с человеческим PD1, по любому из пп. 1-9.
11. Клетка-хозяин для экспрессии антитела по любому из пп. 1-9, содержащая нуклеиновую кислоту по п. 10.
12. Способ получения антитела по любому из пп. 1-9, включающий культивирование клетки-хозяина по п. 11 таким образом, что продуцируется антитело.
13. Способ по п. 12, дополнительно включающий выделение антитела из клетки-хозяина.
14. Фармацевтический препарат для специфичного связывания с человеческим PD1, содержащий антитело по любому из пп. 1-8 и фармацевтически приемлемый носитель.
15. Применение антитела по любому из пп. 1-8 для лечения рака, экспрессирующего PD1.
16. Применение антитела по любому из пп. 1-8 в изготовлении лекарственного средства для лечения рака, экспрессирующего PD1.
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| WO 2011110621 A1, 15.09.2011 | |||
| WO 2011110604 A1, 15.09.2011 | |||
| WO 2010036959 A2, 01.04.2010 | |||
| G | |||
| K | |||
| PHILIPS and M | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Прибор с двумя призмами | 1917 |
|
SU27A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| K | |||
| C | |||
| OHAEGBULAM ET AL.: "Human cancer immunotherapy with antibodies to | |||
Авторы
Даты
2021-04-13—Публикация
2016-09-29—Подача