ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Эта заявка заявляет приоритет предварительной заявки на патент США № 62/397752, поданной 21 сентября 2016 г., и предварительной заявки на патент США № 62/515480, поданной 5 июня 2017, каждая из которых в полном объеме включена в данный документ посредством ссылки.
ПОДАЧА ПЕРЕЧНЯ ПОСЛЕДОВАТЕЛЬНОСТЕЙ В ТЕКСТОВОМ ФАЙЛЕ ASCII
[0002] Содержание следующего поданного текстового файла ASCII в полном объеме включено в данный документ посредством ссылки: машиночитаемая форма (МЧФ) Перечня последовательностей (название файла: 757972000140SEQLIST.txt, дата записи: 20 сентября 2017 г., размер: 411 Кбайт).
ОБЛАСТЬ ТЕХНИКИ
[0003] Настоящее изобретение относится к выделенным антителам, которые связывают внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α v1, внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α v2 или их оба, а также к полинуклеотидам, векторам, клеткам–хозяевам и способам, имеющим к ним отношение.
УРОВЕНЬ ТЕХНИКИ
[0004] Сигнал–регуляторный белок альфа (SIRP–α) является частью семейства рецепторов клеточной поверхности, которые играют важную роль в регуляции иммунной системы (смотрите, например, Barclay, A.N. and Brown, M.H. (2006) Nat. Rev. Immunol, 6:457–64). SIRP–α экспрессируется на поверхности различных клеток, включая лейкоциты, такие как дендритные клетки, эозинофилы, нейтрофилы и макрофаги. SIRP–α содержит внеклеточный домен, который взаимодействует с внешними стимуляторами, такими как лиганды, и внутриклеточный домен, который опосредует ряд внутриклеточных сигналов.
[0005] Одной из основных ролей SIRP–α является регуляция иммунного ответа посредством взаимодействия с CD47. CD47 экспрессируется на поверхности ряда типов клеток. Когда домен IgSF CD47 связывает внеклеточный домен (например, домен D1) SIRP–α, экспрессируемого на иммунной клетке (например, макрофаге), это приводит к передаче SIRP–α–опосредованного сигнала в иммунную клетку, что предотвращает фагоцитоз CD47–экспрессирующей клетки. Таким образом, CD47 служит для передачи так называемого «не ешь меня»–сигнала иммунной системе, что предотвращает фагоцитоз здоровых клеток (смотрите, например, WO2015/138600 и Weiskopf, K. et al. (2013) Science 341:88–91). Однако также было показано, что CD47 экспрессируется на высоких уровнях при ряде раков, и считается, что его взаимодействие с SIRP–α в этом контексте позволяет опухолям имитировать здоровый «не ешь меня»–сигнал, чтобы избежать иммунологического надзора и фагоцитоза макрофагами (смотрите, например, Majeti, R. et al. (2009) Cell 138:286–99; Zhao, X.W. et al. (2011) Proc. Natl. Acad. Sci. 108:18342–7). Следовательно, существует высокая потребность в антителах, которые блокируют это взаимодействие.
[0006] Известно, что SIRP–α является высокополиморфным белком в организме людей, обезьян и мышей. Например, была выявлена 20–аминокислотная разница между белками SIRP–α в линиях мышей NOD и C57BL/6, и эти полиморфизмы приводят к функциональным последствиям, связанным со связыванием CD47 и прививанием человеческих гемопоэтических стволовых клеток в этих линиях мышей. У людей было идентифицировано по меньшей мере 10 разных аллелей гена SIRPΑ (Takenaka, K. et al. (2007) Nat. Immunol. 8:1313–23, Zhao, X. et al. (2011), PNAS. 108:18342–47; van der Heijden, J. (2014). Genetic variation in human Fc gamma receptors: Functional consequences of polymorphisms and copy number variation (Doctoral dissertation) (докторская диссертация по теме «Генетическая вариация в человеческих Fc–гамма–рецепторах: функциональные последовательности полиморфизмов и вариации числа копий»)).
[0007] Из–за важности взаимодействия SIRP–α–CD47 для нормальной иммунной функции и онкогенеза, а также полиморфной природы SIRP–α и существования других рецепторов семейства SIRP, выявление антител, имеющих разную специфичность связывания и внутри– и/или межвидовую перекрестную реактивность, представляет большой интерес для разработки клинических кандидатных средств, являющихся эффективными для людей, и изучения характеристик этих кандидатных средств в различных животных моделях. Таким образом, существует необходимость как в поисковых инструментах, так и в потенциальных клинических кандидатах, которые модулируют функцию SIRP–α, например, его взаимодействие связывания с CD47. Также существует необходимость в способах выделения антител с разной специфичностью связывания SIRP–α и действием на связывание CD47–SIRP–α, для понимания и эффективного нацеливания на это взаимодействие.
[0008] Все цитируемые в данном документе ссылки, включая патентные заявки, патентные публикации, непатентную литературу и номера доступа в UniProtKB/Swiss–Prot, в полном объеме включены в данный документ посредством ссылки, как если бы каждая отдельная ссылка была специально и отдельно указана как включенная посредством ссылки.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0009] Чтобы удовлетворить эти и другие потребности, в данном документе предложены, помимо прочего, выделенные антитела, которые связывают внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α. В некоторых вариантах реализации антитело связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α v1, внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α v2 или их оба. В некоторых вариантах реализации антитело связывает внеклеточный домен человеческого полипептида SIRP–α v1, содержащий аминокислотную последовательность EEELQVIQPDKSVLVAAGETATLRCTATSLIPVGPIQWFRGAGPGRELIYNQKEGHF
PRVTTVSDLTKRNNMDFSIRIGNITPADAGTYYCVKFRKGSPDDVEFKSGAGTELS VRAKPS (SEQ ID NO:5). В некоторых вариантах реализации антитело связывает внеклеточный домен человеческого полипептида SIRP–α v2, содержащий аминокислотную последовательность EEELQVIQPDKSVSVAAGESAILHCTVTSLIPVGPIQWFRGAGPARELIYNQKEGHFP RVTTVSESTKRENMDFSISISNITPADAGTYYCVKFRKGSPDTEFKSGAGTELSVRA KPS (SEQ ID NO:6). В некоторых вариантах реализации антитело связывает внеклеточный домен человеческого полипептида SIRP–α v1, содержащий аминокислотную последовательность EEELQVIQPDKSVLVAAGETATLRCTATSLIPVGPIQWFRGAGPGRELIYNQKEGHF PRVTTVSDLTKRNNMDFSIRIGNITPADAGTYYCVKFRKGSPDDVEFKSGAGTELS VRAKPS (SEQ ID NO:5), и связывает внеклеточный домен человеческого полипептида SIRP–α v2, содержащий аминокислотную последовательность EEELQVIQPDKSVSVAAGESAILHCTVTSLIPVGPIQWFRGAGPARELIYNQKEGHFP
RVTTVSESTKRENMDFSISISNITPADAGTYYCVKFRKGSPDTEFKSGAGTELSVRAKPS (SEQ ID NO:6). В некоторых вариантах реализации антитело связывает внеклеточные домены (например, домены D1) трех, четырех, пяти, шести, семи, восьми, девяти или десяти разных человеческих вариантных полипептидов SIRP–α. В некоторых вариантах реализации каждый из трех, четырех, пяти, шести, семи, восьми, девяти или десяти разных человеческих вариантных полипептидов SIRP–α содержит внеклеточный домен, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 5, 6 и 76–83. В некоторых вариантах реализации антитело связывает внеклеточный домен (например, домен D1) обезьяньего полипептида SIRP–α. В некоторых вариантах реализации обезьяний полипептид SIRP–α представляет собой полипептид SIRP–α яванского макака. В некоторых вариантах реализации антитело связывает внеклеточные домены (например, домены D1) по меньшей мере двух разных обезьяньих вариантных полипептидов SIRP–α. В некоторых вариантах реализации антитело связывает внеклеточный домен полипептида SIRP–α яванского макака, содержащий аминокислотную последовательность SEQ ID NO: 11, внеклеточный домен полипептида SIRP–α яванского макака, содержащий аминокислотную последовательность SEQ ID NO: 12, или их оба. В некоторых вариантах реализации антитело связывает внеклеточный домен (например, домен D1) мышиного полипептида SIRP–α. В некоторых вариантах реализации антитело связывает внеклеточные домены (например, домены D1) двух или более разных мышиных вариантных полипептидов SIRP–α. В некоторых вариантах реализации антитело связывает внеклеточный домен одного или более мышиных полипептидов SIRP–α, и при этом каждый из одного или более мышиных полипептидов SIRP–α содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 7–10. В некоторых вариантах реализации антитело связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–β. В некоторых вариантах реализации антитело связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–γ. В некоторых вариантах реализации антитело не связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–β. В некоторых вариантах реализации антитело не связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–γ. В некоторых вариантах реализации антитело связывает внеклеточный домен человеческого полипептида SIRP–β, содержащий аминокислотную последовательность SEQ ID NO:13, внеклеточный домен человеческого полипептида SIRP–β, содержащий аминокислотную последовательность SEQ ID NO: 14, или их оба. В некоторых вариантах реализации антитело связывает внеклеточный домен человеческого полипептида SIRP–γ, содержащий аминокислотную последовательность SEQ ID NO: 15. В некоторых вариантах реализации антитело модулирует сигнализацию SIRP–α в клетке, экспрессирующей человеческий полипептид SIRP–α. В некоторых вариантах реализации клетка представляет собой лейкоцит, выбранный из группы, состоящей из макрофага, дендритной клетки, нейтрофила, эозинофила и миелоидной супрессорной клетки (МСК). В некоторых вариантах реализации антитело ингибирует сигнализацию SIRP–α в макрофаге, экспрессирующем человеческий полипептид SIRP–α. В некоторых вариантах реализации антитело усиливает фагоцитоз макрофагом, экспрессирующим человеческий полипептид SIRP–α. В некоторых вариантах реализации антитело блокирует связывание между внеклеточным доменом (например, доменом D1) человеческого полипептида SIRP–α и доменом IgSF человеческого полипептида CD47. В некоторых вариантах реализации антитело блокирует связывание между внеклеточным доменом (например, доменом D1) человеческого полипептида SIRP–α, экспрессируемого на поверхности первой клетки, и доменом IgSF человеческого полипептида CD47, экспрессируемого на поверхности второй клетки. В некоторых вариантах реализации антитело не связывает комплекс, содержащий вариант D1 SIRP–α, связанный с доменом IgSF CD47, причем вариант D1 SIRP–α представляет собой высокоаффинный домен D1 SIRP–α искусственного происхождения и при этом вариант D1 SIRP–α связывается с человеческим CD47 с аффинностью, по меньшей мере в 10 раз большей, чем аффинность связывания домена D1 SIRP–α природного происхождения с человеческим CD47. В некоторых вариантах реализации антитело не блокирует связывание между внеклеточным доменом (например, доменом D1) человеческого полипептида SIRP–α и доменом IgSF человеческого полипептида CD47. В некоторых вариантах реализации антитело не блокирует связывание между внеклеточным доменом (например, доменом D1) человеческого полипептида SIRP–α, экспрессируемого на поверхности первой клетки, и доменом IgSF человеческого полипептида CD47, экспрессируемого на поверхности второй клетки. В некоторых вариантах реализации антитело связывает комплекс, содержащий вариант D1 SIRP–α, связанный с доменом IgSF CD47, причем вариант D1 SIRP–α представляет собой высокоаффинный домен D1 SIRP–α искусственного происхождения и при этом вариант D1 SIRP–α связывается с человеческим CD47 с аффинностью, по меньшей мере в 10 раз большей, чем аффинность связывания домена D1 SIRP–α природного происхождения с человеческим CD47. В некоторых вариантах реализации связывание антитела с внеклеточным доменом (например, доменом D1) человеческого полипептида SIRP–α снижает аффинность человеческого полипептида SIRP–α в отношении связывания домена IgSF человеческого полипептида CD47. В некоторых вариантах реализации связывание антитела с внеклеточным доменом (например, доменом D1) человеческого полипептида SIRP–α, экспрессируемого на поверхности первой клетки, снижает аффинность человеческого полипептида SIRP–α в отношении связывания домена IgSF человеческого полипептида CD47, экспрессируемого на поверхности второй клетки. В некоторых вариантах реализации связывание антитела с внеклеточным доменом (например, доменом D1) человеческого полипептида SIRP–α повышает kдисс. человеческого полипептида SIRP–α в отношении связывания домена IgSF человеческого полипептида CD47. В некоторых вариантах реализации связывание антитела с внеклеточным доменом (например, доменом D1) человеческого полипептида SIRP–α, экспрессируемого на поверхности первой клетки, повышает kдисс. человеческого полипептида SIRP–α в отношении связывания домена IgSF человеческого полипептида CD47, экспрессируемого на поверхности второй клетки. В некоторых вариантах реализации антитело связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α v1, внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α v2 или их оба; при этом антитело связывает внеклеточный домен (например, домен D1) обезьяньего полипептида SIRP–α; и при этом антитело не блокирует связывание между внеклеточным доменом (например, доменом D1) человеческого полипептида SIRP–α и доменом IgSF человеческого полипептида CD47. В некоторых вариантах реализации антитело связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α v1, внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α v2 или их оба; при этом антитело связывает внеклеточный домен (например, домен D1) обезьяньего полипептида SIRP–α; и при этом антитело блокирует связывание между внеклеточным доменом (например, доменом D1) человеческого полипептида SIRP–α и доменом IgSF человеческого полипептида CD47. В некоторых вариантах реализации антитело связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α v1, внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α v2 или их оба; при этом антитело связывает внеклеточный домен (например, домен D1) обезьяньего полипептида SIRP–α; и при этом связывание антитела с внеклеточным доменом (например, доменом D1) человеческого полипептида SIRP–α снижает аффинность человеческого полипептида SIRP–α в отношении связывания домена IgSF человеческого полипептида CD47. В некоторых вариантах реализации антитело связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α v1, внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α v2 или их оба; при этом антитело связывает внеклеточный домен (например, домен D1) обезьяньего полипептида SIRP–α; при этом антитело связывает внеклеточный домен (например, домен D1) мышиного полипептида SIRP–α; и при этом антитело не блокирует связывание между внеклеточным доменом (например, доменом D1) человеческого полипептида SIRP–α и доменом IgSF человеческого полипептида CD47. В некоторых вариантах реализации антитело связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α v1, внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α v2 или их оба; при этом антитело связывает внеклеточный домен (например, домен D1) обезьяньего полипептида SIRP–α; при этом антитело связывает внеклеточный домен (например, домен D1) мышиного полипептида SIRP–α; и при этом антитело блокирует связывание между внеклеточным доменом (например, доменом D1) человеческого полипептида SIRP–α и доменом IgSF человеческого полипептида CD47. В некоторых вариантах реализации антитело связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α v1, внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α v2 или их оба; при этом антитело связывает внеклеточный домен (например, домен D1) обезьяньего полипептида SIRP–α; при этом антитело связывает внеклеточный домен (например, домен D1) мышиного полипептида SIRP–α; и при этом связывание антитела с внеклеточным доменом (например, доменом D1) человеческого полипептида SIRP–α снижает аффинность человеческого полипептида SIRP–α в отношении связывания домена IgSF человеческого полипептида CD47. В некоторых вариантах реализации антитело связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α v1, внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α v2 или их оба; при этом антитело связывает внеклеточный домен (например, домен D1) мышиного полипептида SIRP–α; и при этом антитело не блокирует связывание между внеклеточным доменом (например, доменом D1) человеческого полипептида SIRP–α и доменом IgSF человеческого полипептида CD47. В некоторых вариантах реализации антитело связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α v1, внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α v2 или их оба; при этом антитело связывает внеклеточный домен (например, домен D1) мышиного полипептида SIRP–α; и при этом антитело блокирует связывание между внеклеточным доменом (например, доменом D1) человеческого полипептида SIRP–α и доменом IgSF человеческого полипептида CD47. В некоторых вариантах реализации антитело связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α v1, внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α v2 или их оба; при этом антитело связывает внеклеточный домен (например, домен D1) мышиного полипептида SIRP–α; и при этом связывание антитела с внеклеточным доменом (например, доменом D1) человеческого полипептида SIRP–α снижает аффинность человеческого полипептида SIRP–α в отношении связывания домена IgSF человеческого полипептида CD47. В некоторых вариантах реализации антитело связывает внеклеточные домены (например, домены D1) двух или более разных человеческих вариантных полипептидов SIRP–α, мышиного полипептида SIRP–α и обезьяньего полипептида SIRP–α; при этом антитело не связывает по меньшей мере один из внеклеточного домена (например, домена D1) человеческого полипептида SIRP–β и внеклеточного домена (например, домена D1) человеческого полипептида SIRP–γ; и при этом антитело блокирует связывание между внеклеточным доменом (например, доменом D1) человеческого полипептида SIRP–α и доменом IgSF человеческого полипептида CD47. В некоторых вариантах реализации антитело содержит одну, две, три, четыре, пять или шесть последовательностей CDR; последовательность вариабельного домена тяжелой цепи; и/или последовательность вариабельного домена легкой цепи из антитела S130. В некоторых вариантах реализации антитело связывает внеклеточные домены (например, домены D1) двух или более разных человеческих вариантных полипептидов SIRP–α, мышиного полипептида SIRP–α, обезьяньего полипептида SIRP–α и по меньшей мере один из внеклеточного домена (например, домена D1) человеческого полипептида SIRP–β и внеклеточного домена (например, домена D1) человеческого полипептида SIRP–γ; и при этом антитело блокирует связывание между внеклеточным доменом (например, доменом D1) человеческого полипептида SIRP–α и доменом IgSF человеческого полипептида CD47. В некоторых вариантах реализации антитело содержит одну, две, три, четыре, пять или шесть последовательностей CDR; последовательность вариабельного домена тяжелой цепи; и/или последовательность вариабельного домена легкой цепи из антитела, выбранного из группы, состоящей из S8, S13, S14 и S121. В некоторых вариантах реализации антитело связывает внеклеточные домены (например, домены D1) двух или более разных человеческих вариантных полипептидов SIRP–α, мышиного полипептида SIRP–α и обезьяньего полипептида SIRP–α; при этом антитело не связывается или связывается со сниженной аффинностью по меньшей мере с одним из внеклеточного домена (например, домена D1) человеческого полипептида SIRP–β и внеклеточного домена (например, домена D1) человеческого полипептида SIRP–γ; и при этом антитело не блокирует связывание между внеклеточным доменом (например, доменом D1) человеческого полипептида SIRP–α и доменом IgSF человеческого полипептида CD47. В некоторых вариантах реализации антитело содержит одну, две, три, четыре, пять или шесть последовательностей CDR; последовательность вариабельного домена тяжелой цепи; и/или последовательность вариабельного домена легкой цепи из антитела S137. В некоторых вариантах реализации антитело связывает внеклеточные домены (например, домены D1) двух или более разных человеческих вариантных полипептидов SIRP–α и обезьяньего полипептида SIRP–α; при этом антитело не связывает мышиный полипептид SIRP–α; и при этом антитело не связывает по меньшей мере один из внеклеточного домена (например, домена D1) человеческого полипептида SIRP–β и внеклеточного домена (например, домена D1) человеческого полипептида SIRP–γ; и при этом антитело блокирует связывание между внеклеточным доменом (например, доменом D1) человеческого полипептида SIRP–α и доменом IgSF человеческого полипептида CD47. В некоторых вариантах реализации антитело содержит одну, две, три, четыре, пять или шесть последовательностей CDR; последовательность вариабельного домена тяжелой цепи; и/или последовательность вариабельного домена легкой цепи из антитела, выбранного из группы, состоящей из S128. В некоторых вариантах реализации антитело связывает внеклеточные домены (например, домены D1) двух или более разных человеческих вариантных полипептидов SIRP–α, обезьяньего полипептида SIRP–α и по меньшей мере один из внеклеточного домена (например, домена D1) человеческого полипептида SIRP–β и внеклеточного домена (например, домена D1) человеческого полипептида SIRP–γ; и при этом антитело не связывает мышиный полипептид SIRP–α; и при этом антитело блокирует связывание между внеклеточным доменом (например, доменом D1) человеческого полипептида SIRP–α и доменом IgSF человеческого полипептида CD47. В некоторых вариантах реализации антитело содержит одну, две, три, четыре, пять или шесть последовательностей CDR; последовательность вариабельного домена тяжелой цепи; и/или последовательность вариабельного домена легкой цепи из антитела, выбранного из группы, состоящей из S9, S11, S119, S120, S122 и S135. В некоторых вариантах реализации антитело связывает внеклеточные домены (например, домены D1) двух или более разных человеческих вариантных полипептидов SIRP–α и внеклеточные домены (например, домены D1) двух или более разных обезьяньих вариантных полипептидов SIRP–α, и при этом связывание антитела с внеклеточным доменом (например, доменом D1) человеческого полипептида SIRP–α снижает аффинность человеческого полипептида SIRP–α в отношении связывания домена IgSF человеческого полипептида CD47. В некоторых вариантах реализации антитело содержит одну, две, три, четыре, пять или шесть последовательностей CDR; последовательность вариабельного домена тяжелой цепи; и/или последовательность вариабельного домена легкой цепи из антитела, выбранного из группы, состоящей из S115, S116, S117 и S118. В некоторых вариантах реализации антитело содержит VH–домен, содержащий аминокислотную последовательность SEQ ID NO: 120, и/или VL–домен, содержащий аминокислотную последовательность SEQ ID NO: 97. В некоторых вариантах реализации антитело содержит VH–домен, содержащий аминокислотную последовательность SEQ ID NO: 127, и/или VL–домен, содержащий аминокислотную последовательность SEQ ID NO: 104. В некоторых вариантах реализации антитело содержит VH–домен, содержащий аминокислотную последовательность SEQ ID NO: 133, и/или VL–домен, содержащий аминокислотную последовательность SEQ ID NO: 134. В некоторых вариантах реализации антитело содержит VH–домен, содержащий аминокислотную последовательность SEQ ID NO: 135, и/или VL–домен, содержащий аминокислотную последовательность SEQ ID NO: 136. В некоторых вариантах реализации антитело содержит VH–домен, содержащий аминокислотную последовательность SEQ ID NO: 137, и/или VL–домен, содержащий аминокислотную последовательность SEQ ID NO: 138. В некоторых вариантах реализации антитело содержит VH–домен, содержащий аминокислотную последовательность SEQ ID NO: 139, и/или VL–домен, содержащий аминокислотную последовательность SEQ ID NO: 140. В некоторых вариантах реализации антитело содержит VH–домен, содержащий аминокислотную последовательность SEQ ID NO: 141, и/или VL–домен, содержащий аминокислотную последовательность SEQ ID NO: 142.
[0010] В некоторых вариантах реализации антитело содержит VH–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична VH–домену антитела 115 (например, приведенному в таблице 2), и/или VL–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична VL–домену антитела 115 (например, приведенному в таблице 2). В некоторых вариантах реализации антитело содержит VH–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична VH–домену антитела 116 (например, приведенному в таблице 2), и/или VL–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична VL–домену антитела 116 (например, приведенному в таблице 2). В некоторых вариантах реализации антитело содержит VH–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична VH–домену антитела 117 (например, приведенному в таблице 2), и/или VL–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична VL–домену антитела 117 (например, приведенному в таблице 2). В некоторых вариантах реализации антитело содержит VH–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична VH–домену антитела 118 (например, приведенному в таблице 2), и/или VL–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична VL–домену антитела 118 (например, приведенному в таблице 2). В некоторых вариантах реализации антитело содержит VH–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична VH–домену антитела 119 (например, приведенному в таблице 2), и/или VL–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична VL–домену антитела 119 (например, приведенному в таблице 2). В некоторых вариантах реализации антитело содержит VH–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична VH–домену антитела 120 (например, приведенному в таблице 2), и/или VL–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична VL–домену антитела 120 (например, приведенному в таблице 2). В некоторых вариантах реализации антитело содержит VH–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична VH–домену антитела 121 (например, приведенному в таблице 2), и/или VL–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична VL–домену антитела 121 (например, приведенному в таблице 2). В некоторых вариантах реализации антитело содержит VH–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична VH–домену антитела 122 (например, приведенному в таблице 2), и/или VL–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична VL–домену антитела 122 (например, приведенному в таблице 2). В некоторых вариантах реализации антитело содержит VH–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична VH–домену антитела 123 (например, приведенному в таблице 2), и/или VL–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична VL–домену антитела 123 (например, приведенному в таблице 2). В некоторых вариантах реализации антитело содержит VH–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична VH–домену антитела 126 (например, приведенному в таблице 2), и/или VL–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична VL–домену антитела 126 (например, приведенному в таблице 2). В некоторых вариантах реализации антитело содержит VH–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична VH–домену антитела 128 (например, приведенному в таблице 2), и/или VL–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична VL–домену антитела 128 (например, приведенному в таблице 2). В некоторых вариантах реализации антитело содержит VH–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична VH–домену антитела 130 (например, приведенному в таблице 2), и/или VL–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична VL–домену антитела 130 (например, приведенному в таблице 2). В некоторых вариантах реализации антитело содержит VH–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична VH–домену антитела 135 (например, приведенному в таблице 2), и/или VL–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична VL–домену антитела 135 (например, приведенному в таблице 2). В некоторых вариантах реализации антитело содержит VH–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична VH–домену антитела 137 (например, приведенному в таблице 2), и/или VL–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична VL–домену антитела 137 (например, приведенному в таблице 2). В некоторых вариантах реализации антитело содержит VH–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична VH–домену антитела 138 (например, приведенному в таблице 2), и/или VL–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична VL–домену антитела 138 (например, приведенному в таблице 2). В некоторых вариантах реализации антитело содержит VH–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична VH–домену антитела 1 (например, приведенному в таблице 2), и/или VL–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична VL–домену антитела 1 (например, приведенному в таблице 2). В некоторых вариантах реализации антитело содержит VH–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична VH–домену антитела 2 (например, приведенному в таблице 2), и/или VL–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична VL–домену антитела 2 (например, приведенному в таблице 2). В некоторых вариантах реализации антитело содержит VH–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична VH–домену антитела 8 (например, приведенному в таблице 2), и/или VL–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична VL–домену антитела 8 (например, приведенному в таблице 2). В некоторых вариантах реализации антитело содержит VH–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична VH–домену антитела 9 (например, приведенному в таблице 2), и/или VL–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична VL–домену антитела 9 (например, приведенному в таблице 2). В некоторых вариантах реализации антитело содержит VH–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична VH–домену антитела 11 (например, приведенному в таблице 2), и/или VL–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична VL–домену антитела 11 (например, приведенному в таблице 2). В некоторых вариантах реализации антитело содержит VH–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична VH–домену антитела 12 (например, приведенному в таблице 2), и/или VL–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична VL–домену антитела 12 (например, приведенному в таблице 2). В некоторых вариантах реализации антитело содержит VH–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична VH–домену антитела 13 (например, приведенному в таблице 2), и/или VL–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична VL–домену антитела 13 (например, приведенному в таблице 2). В некоторых вариантах реализации антитело содержит VH–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична VH–домену антитела 14 (например, приведенному в таблице 2), и/или VL–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична VL–домену антитела 14 (например, приведенному в таблице 2). В некоторых вариантах реализации антитело содержит VH–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична VH–домену антитела 21, 25, 27 или 66 (например, приведенному в таблице 2), и/или VL–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична VL–домену антитела 21, 25, 27 или 66 (например, приведенному в таблице 2). В некоторых вариантах реализации антитело содержит VH–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 116, и/или VL–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 93. В некоторых вариантах реализации антитело содержит VH–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO:117, и/или VL–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO:94. В некоторых вариантах реализации антитело содержит VH–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 118, и/или VL–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO:95. В некоторых вариантах реализации антитело содержит VH–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 119, и/или VL–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 96. В некоторых вариантах реализации антитело содержит VH–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO:335, и/или VL–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO:97. В некоторых вариантах реализации антитело содержит VH–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 121, и/или VL–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO:98. В некоторых вариантах реализации антитело содержит VH–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 122, и/или VL–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 99. В некоторых вариантах реализации антитело содержит VH–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 123, и/или VL–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 100. В некоторых вариантах реализации антитело содержит VH–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 124, и/или VL–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO:101. В некоторых вариантах реализации антитело содержит VH–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 125, и/или VL–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 102. В некоторых вариантах реализации антитело содержит VH–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 126, и/или VL–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 103. В некоторых вариантах реализации антитело содержит VH–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 127, и/или VL–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 104. В некоторых вариантах реализации антитело содержит VH–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 128, и/или VL–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 105. В некоторых вариантах реализации антитело содержит VH–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 129, и/или VL–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 106. В некоторых вариантах реализации антитело содержит VH–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 130, и/или VL–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 107. В некоторых вариантах реализации антитело содержит VH–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 108, и/или VL–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO:85. В некоторых вариантах реализации антитело содержит VH–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 109, и/или VL–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO:86. В некоторых вариантах реализации антитело содержит VH–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 110, и/или VL–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO:87. В некоторых вариантах реализации антитело содержит VH–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 111, и/или VL–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO:88. В некоторых вариантах реализации антитело содержит VH–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 112, и/или VL–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO:89. В некоторых вариантах реализации антитело содержит VH–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 113, и/или VL–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO:90. В некоторых вариантах реализации антитело содержит VH–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 114, и/или VL–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 91. В некоторых вариантах реализации антитело содержит VH–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO:115, и/или VL–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO:92. В некоторых вариантах реализации антитело содержит VH–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 135, 137, 139 или 141, и/или VL–домен, содержащий аминокислотную последовательность, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 136, 138, 140 или 142.
[0011] В некоторых вариантах реализации антитело содержит (a) VH–домен, содержащий HVR–H1, содержащую аминокислотную последовательность SEQ ID NO:227 или 230, HVR–H2, содержащую аминокислотную последовательность SEQ ID NO:228 или 231, и HVR–H3, содержащую аминокислотную последовательность SEQ ID NO:229; и/или (b) VL–домен, содержащий HVR–L1, содержащую аминокислотную последовательность SEQ ID NO:232, HVR–L2, содержащую аминокислотную последовательность SEQ ID NO:233, и HVR–L3, содержащую аминокислотную последовательность SEQ ID NO:234. В некоторых вариантах реализации антитело содержит (a) VH–домен, содержащий HVR–H1, содержащую аминокислотную последовательность SEQ ID NO:219 или 235, HVR–H2, содержащую аминокислотную последовательность SEQ ID NO:236 или 238, и HVR–H3, содержащую аминокислотную последовательность SEQ ID NO:237; и/или (b) VL–домен, содержащий HVR–L1, содержащую аминокислотную последовательность SEQ ID NO:239, HVR–L2, содержащую аминокислотную последовательность SEQ ID NO:240, и HVR–L3, содержащую аминокислотную последовательность SEQ ID NO:241. В некоторых вариантах реализации антитело содержит (a) последовательность HVR–H1, содержащую аминокислотную последовательность GFSFSX1X2AM3, где X1 представляет собой N или I; X2 представляет собой F или Y; и X3 представляет собой T или S (SEQ ID NO: 185); (b) последовательность HVR–H2, содержащую аминокислотную последовательность TIGX4X5DTYYADSVKG, где X4 представляет собой S или A, а X5 представляет собой G или D (SEQ ID NO: 186); (c) последовательность HVR–H3, содержащую аминокислотную последовательность DSTVX6WSGDFFDY, где X6 представляет собой S или G (SEQ ID NO: 187); (d) последовательность HVR–L1, содержащую аминокислотную последовательность RASQNVX7X8DX9A, где X7 представляет собой K или R; X8 представляет собой N или S; и X9 представляет собой L или I (SEQ ID NO: 188); (e) последовательность HVR–L2, содержащую аминокислотную последовательность AAX10X11RX12T, где X10 представляет собой R или S; X11 представляет собой I или S; и X12 представляет собой E или D (SEQ ID NO: 189); и (f) последовательность HVR–L3, содержащую аминокислотную последовательность QQYYDWPPFT (SEQ ID NO: 148). В некоторых вариантах реализации антитело содержит одну, две, три, четыре, пять или шесть последовательностей HVR из антитела 119 (например, приведенных в таблице 2). В некоторых вариантах реализации антитело содержит одну, две, три, четыре, пять или шесть последовательностей HVR из последовательностей вариабельного домена SEQ ID NO:335 и 97 (например, одну, две или три последовательности HVR тяжелой цепи из последовательности вариабельного домена тяжелой цепи SEQ ID NO: 335 и/или одну, две или три последовательности HVR легкой цепи из последовательности вариабельного домена легкой цепи SEQ ID NO:97). В некоторых вариантах реализации антитело содержит одну, две, три, четыре, пять или шесть последовательностей HVR из антитела 135 (например, приведенных в таблице 2). В некоторых вариантах реализации антитело содержит одну, две, три, четыре, пять или шесть последовательностей HVR из последовательностей вариабельного домена SEQ ID NO:127 и 104 (например, одну, две или три последовательности HVR тяжелой цепи из последовательности вариабельного домена тяжелой цепи SEQ ID NO: 127 и/или одну, две или три последовательности HVR легкой цепи из последовательности вариабельного домена легкой цепи SEQ ID NO: 104). В некоторых вариантах реализации антитело содержит одну, две, три, четыре, пять или шесть последовательностей HVR из последовательностей вариабельного домена SEQ ID NO:97, 104, 120, 335 и 127 (например, одну, две или три последовательности HVR тяжелой цепи из последовательности вариабельного домена тяжелой цепи SEQ ID NO:335 и 127 и/или одну, две или три последовательности HVR легкой цепи из последовательности вариабельного домена легкой цепи SEQ ID NO:97 и 104). В некоторых вариантах реализации антитело содержит одну, две, три, четыре, пять или шесть последовательностей HVR, имеющих аминокислотную последовательность, выбранную из SEQ ID NO: 143–148 (например, одну, две или три последовательности HVR тяжелой цепи, выбранные из SEQ ID NO: 143–145, и/или одну, две или три последовательности HVR легкой цепи, выбранные из SEQ ID NO: 146–148). В некоторых вариантах реализации антитело содержит одну, две, три, четыре, пять или шесть последовательностей HVR, имеющих аминокислотную последовательность, выбранную из SEQ ID NO:148–153 (например, одну, две или три последовательности HVR тяжелой цепи, выбранные из SEQ ID NO: 149–151, и/или одну, две или три последовательности HVR легкой цепи, выбранные из SEQ ID NO: 152, 153 и 148). В некоторых вариантах реализации антитело содержит одну, две, три, четыре, пять или шесть последовательностей HVR из антитела 136 (например, приведенных в таблице 2). В некоторых вариантах реализации антитело содержит одну, две, три, четыре, пять или шесть последовательностей HVR, имеющих аминокислотную последовательность, выбранную из SEQ ID NO: 155–160 (например, одну, две или три последовательности HVR тяжелой цепи, выбранные из SEQ ID NO:155–157, и/или одну, две или три последовательности HVR легкой цепи, выбранные из SEQ ID NO: 158–160). В некоторых вариантах реализации антитело содержит одну, две, три, четыре, пять или шесть последовательностей HVR из антитела 21 (например, приведенных в таблице 2). В некоторых вариантах реализации антитело содержит одну, две, три, четыре, пять или шесть последовательностей HVR, имеющих аминокислотную последовательность, выбранную из SEQ ID NO:161–166 (например, одну, две или три последовательности HVR тяжелой цепи, выбранные из SEQ ID NO:161–163, и/или одну, две или три последовательности HVR легкой цепи, выбранные из SEQ ID NO:164–166). В некоторых вариантах реализации антитело содержит одну, две, три, четыре, пять или шесть последовательностей HVR из антитела 25 (например, приведенных в таблице 2). В некоторых вариантах реализации антитело содержит одну, две, три, четыре, пять или шесть последовательностей HVR, имеющих аминокислотную последовательность, выбранную из SEQ ID NO: 161, 163, 168 и 170–172 (например, одну, две или три последовательности HVR тяжелой цепи, выбранные из SEQ ID NO: 161, 168 и 163, и/или одну, две или три последовательности HVR легкой цепи, выбранные из SEQ ID NO: 170–172). В некоторых вариантах реализации антитело содержит одну, две, три, четыре, пять или шесть последовательностей HVR из антитела 27 (например, приведенных в таблице 2). В некоторых вариантах реализации антитело содержит одну, две, три, четыре, пять или шесть последовательностей HVR, имеющих аминокислотную последовательность, выбранную из SEQ ID NO: 163, 173, 174 и 176–178 (например, одну, две или три последовательности HVR тяжелой цепи, выбранные из SEQ ID NO:163, 173 и 174, и/или одну, две или три последовательности HVR легкой цепи, выбранные из SEQ ID NO:176–178). В некоторых вариантах реализации антитело содержит одну, две, три, четыре, пять или шесть последовательностей HVR из антитела 66 (например, приведенных в таблице 2). В некоторых вариантах реализации антитело содержит одну, две, три, четыре, пять или шесть последовательностей HVR, имеющих аминокислотную последовательность, выбранную из SEQ ID NO: 162, 163, 179 и 182–184 (например, одну, две или три последовательности HVR тяжелой цепи, выбранные из SEQ ID NO: 162, 163 и 179, и/или одну, две или три последовательности HVR легкой цепи, выбранные из SEQ ID NO: 182–184). В некоторых вариантах реализации антитело содержит (a) VH–домен, содержащий HVR–H1, содержащую аминокислотную последовательность SEQ ID NO: 143, 202, 204 или 205, HVR–H2, содержащую аминокислотную последовательность SEQ ID NO: 144, 203 или 206, и HVR–H3, содержащую аминокислотную последовательность SEQ ID NO: 145 или 207; и/или (b) VL–домен, содержащий HVR–L1, содержащую аминокислотную последовательность SEQ ID NO: 146 или 208, HVR–L2, содержащую аминокислотную последовательность SEQ ID NO: 147 или 209, и HVR–L3, содержащую аминокислотную последовательность SEQ ID NO: 148 или 210. В некоторых вариантах реализации антитело содержит (a) VH–домен, содержащий HVR–H1, содержащую аминокислотную последовательность SEQ ID NO:149, 211, 213 или 214, HVR–H2, содержащую аминокислотную последовательность SEQ ID NO:150, 212 или 215, и HVR–H3, содержащую аминокислотную последовательность SEQ ID NO:151 или 216; и/или (b) VL–домен, содержащий HVR–L1, содержащую аминокислотную последовательность SEQ ID NO: 152 или 217, HVR–L2, содержащую аминокислотную последовательность SEQ ID NO:153 или 218, и HVR–L3, содержащую аминокислотную последовательность SEQ ID NO: 148. В некоторых вариантах реализации антитело содержит (a) VH–домен, содержащий HVR–H1, содержащую аминокислотную последовательность SEQ ID NO: 155, 219, 221 или 222, HVR–H2, содержащую аминокислотную последовательность SEQ ID NO: 156 , 220, или 223, и HVR–H3, содержащую аминокислотную последовательность SEQ ID NO:157 или 224; и/или (b) VL–домен, содержащий HVR–L1, содержащую аминокислотную последовательность SEQ ID NO: 158 или 225, HVR–12, содержащую аминокислотную последовательность SEQ ID NO: 159 или 226, и HVR–L3, содержащую аминокислотную последовательность SEQ ID NO: 160. В некоторых вариантах реализации антитело содержит (a) VH–домен, содержащий HVR–H1, содержащую аминокислотную последовательность SEQ ID NO:161, 191 или 194, HVR–H2, содержащую аминокислотную последовательность SEQ ID NO: 162, 192 или 195, и HVR–H3, содержащую аминокислотную последовательность SEQ ID NO: 163 или 193; и/или (b) VL–домен, содержащий HVR–L1, содержащую аминокислотную последовательность SEQ ID NO: 164, HVR–L2, содержащую аминокислотную последовательность SEQ ID NO: 165, и HVR–L3, содержащую аминокислотную последовательность SEQ ID NO: 166. В некоторых вариантах реализации антитело содержит (a) VH–домен, содержащий HVR–H1, содержащую аминокислотную последовательность SEQ ID NO:161, 191 или 194, HVR–H2, содержащую аминокислотную последовательность SEQ ID NO:168, 196 или 197, и HVR–H3, содержащую аминокислотную последовательность SEQ ID NO: 163 или 193; и/или (b) VL–домен, содержащий HVR–L1, содержащую аминокислотную последовательность SEQ ID NO: 170, HVR–L2, содержащую аминокислотную последовательность SEQ ID NO:171, и HVR–L3, содержащую аминокислотную последовательность SEQ ID NO:172. В некоторых вариантах реализации антитело содержит (a) VH–домен, содержащий HVR–H1, содержащую аминокислотную последовательность SEQ ID NO: 173, 198 или 200, HVR–H2, содержащую аминокислотную последовательность SEQ ID NO: 174, 199 или 201, и HVR–H3, содержащую аминокислотную последовательность SEQ ID NO: 163 или 193; и/или (b) VL–домен, содержащий HVR–L1, содержащую аминокислотную последовательность SEQ ID NO: 176, HVR–L2, содержащую аминокислотную последовательность SEQ ID NO: 177, и HVR–L3, содержащую аминокислотную последовательность SEQ ID NO: 178. В некоторых вариантах реализации антитело содержит (a) VH–домен, содержащий HVR–H1, содержащую аминокислотную последовательность SEQ ID NO: 179, HVR–H2, содержащую аминокислотную последовательность SEQ ID NO: 162, и HVR–H3, содержащую аминокислотную последовательность SEQ ID NO: 163; и/или (b) VL–домен, содержащий HVR–L1, содержащую аминокислотную последовательность SEQ ID NO: 182, HVR–L2, содержащую аминокислотную последовательность SEQ ID NO: 183, и HVR–L3, содержащую аминокислотную последовательность SEQ ID NO: 184. В некоторых вариантах реализации антитело содержит VH–домен, содержащий аминокислотную последовательность SEQ ID NO: 135, и/или VL–домен, содержащий HVR–L1, содержащую аминокислотную последовательность SEQ ID NO: 164, HVR–L2, содержащую аминокислотную последовательность SEQ ID NO: 165, и HVR–L3, содержащую аминокислотную последовательность SEQ ID NO: 166. В некоторых вариантах реализации антитело содержит VH–домен, содержащий аминокислотную последовательность SEQ ID NO: 137, и/или VL–домен, содержащий HVR–L1, содержащую аминокислотную последовательность SEQ ID NO:170, HVR–L2, содержащую аминокислотную последовательность SEQ ID NO:171, и HVR–L3, содержащую аминокислотную последовательность SEQ ID NO: 172. В некоторых вариантах реализации антитело содержит VH–домен, содержащий аминокислотную последовательность SEQ ID NO: 139, и/или VL–домен, содержащий HVR–L1, содержащую аминокислотную последовательность SEQ ID NO: 176, HVR–L2, содержащую аминокислотную последовательность SEQ ID NO: 177, и HVR–L3, содержащую аминокислотную последовательность SEQ ID NO: 178. В некоторых вариантах реализации антитело содержит VH–домен, содержащий аминокислотную последовательность SEQ ID NO: 141, и/или VL–домен, содержащий HVR–L1, содержащую аминокислотную последовательность SEQ ID NO: 182, HVR–L2, содержащую аминокислотную последовательность SEQ ID NO: 183, и HVR–L3, содержащую аминокислотную последовательность SEQ ID NO: 184. В некоторых вариантах реализации антитело содержит одну, две, три, четыре, пять или шесть последовательностей HVR из антитела 3 (например, приведенных в таблице 2). В некоторых вариантах реализации антитело содержит (a) VH–домен, содержащий одну, две или три последовательности HVR из SEQ ID NO:242; и/или (b) VL–домен, содержащий одну, две или три последовательности HVR из SEQ ID NO:243. В некоторых вариантах реализации антитело содержит одну, две, три, четыре, пять или шесть последовательностей HVR из антитела 45 (например, приведенных в таблице 2). В некоторых вариантах реализации антитело содержит (a) VH–домен, содержащий одну, две или три последовательности HVR из SEQ ID NO:244; и/или (b) VL–домен, содержащий одну, две или три последовательности HVR из SEQ ID NO:245. В некоторых вариантах реализации антитело содержит VH–домен, содержащий аминокислотную последовательность SEQ ID NO: 135, и/или VL–домен, содержащий HVR–L1, содержащую аминокислотную последовательность SEQ ID NO:164, 170, 176 или 182; HVR–L2, содержащую аминокислотную последовательность SEQ ID NO: 165, 171, 177 или 183; и HVR–L3, содержащую аминокислотную последовательность SEQ ID NO: 166, 172, 178 или 184. В некоторых вариантах реализации антитело содержит VH–домен, содержащий аминокислотную последовательность SEQ ID NO: 137, и/или VL–домен, содержащий HVR–L1, содержащую аминокислотную последовательность SEQ ID NO: 164, 170, 176 или 182, HVR–L2, содержащую аминокислотную последовательность SEQ ID NO: 165, 171, 177 или 183, HVR–L3, и содержащую аминокислотную последовательность SEQ ID NO: 166, 172, 178 или 184. В некоторых вариантах реализации антитело содержит VH–домен, содержащий аминокислотную последовательность SEQ ID NO: 139, и/или VL–домен, содержащий HVR–L1, содержащую аминокислотную последовательность SEQ ID NO: 164, 170, 176 или 182, HVR–L2, содержащую аминокислотную последовательность SEQ ID NO: 165, 171, 177 или 183; и HVR–L3, содержащую аминокислотную последовательность SEQ ID NO: 166. 172, 178 или 184. В некоторых вариантах реализации антитело содержит VH–домен, содержащий аминокислотную последовательность SEQ ID NO: 141, и/или VL–домен, содержащий HVR–L1, содержащую аминокислотную последовательность SEQ ID NO: 164, 170, 176 или 182; HVR–L2, содержащую аминокислотную последовательность SEQ ID NO:165, 171, 177 или 183; и HVR–L3, содержащую аминокислотную последовательность SEQ ID NO:166, 172, 178 или 184. В некоторых вариантах реализации одна, две, три, четыре, пять или шесть последовательностей HVR определены по Kabat. В некоторых вариантах реализации одна, две, три, четыре, пять или шесть последовательностей HVR определены по Chothia. В некоторых вариантах реализации одна, две, три, четыре, пять или шесть последовательностей HVR определены по IMGT. В некоторых вариантах реализации антитело содержит последовательности HVR, определенные по двум или более из систем Kabat, Chothia и IMGT (например, антитело содержит одну или более последовательностей HVR, определенных согласно одному определению границ, и одну или более последовательностей HVR, определенных согласно другому определению границ).
[0012] В других аспектах в данном документе предложено выделенное антитело, которое связывает внеклеточный домен человеческого полипептида SIRP–α (например, домен D1), при этом антитело содержит: (a) вариабельный домен тяжелой цепи (VH), содержащий (i) последовательность HVR–H1, содержащую аминокислотную последовательность NFAMT (SEQ ID NO: 175), NFAVT (SEQ ID NO:204) или NFALT (SEQ ID NO:305), (ii) последовательность HVR–H2, содержащую аминокислотную последовательность TIGSGDTYYADSVKG (SEQ ID NO: 144), и (iii) последовательность HVR–H3, содержащую аминокислотную последовательность DSTVSWSGDEFDY (SEQ ID NO: 145); и/или (b) вариабельный домен легкой цепи (VL), содержащий (i) последовательность HVR–L1, содержащую аминокислотную последовательность RASQNVKNDLA (SEQ ID NO: 146), (ii) последовательность HVR–L2, содержащую аминокислотную последовательность AAR1RET (SEQ ID NO: 147), и (iii) последовательность HVR–L3, содержащую аминокислотную последовательность QQY YDWPPFT (SEQ ID NO: 148). В некоторых вариантах реализации VH–домен содержит аминокислотную последовательность, которая по меньшей мере на 90% идентична аминокислотной последовательности SEQ ID NO: 120, 335, 246, 258 или 327; и/или VL–домен содержит аминокислотную последовательность, которая по меньшей мере на 90% идентична аминокислотной последовательности SEQ ID NO:97 или 312. В некоторых вариантах реализации VH–домен содержит аминокислотную последовательность SEQ ID NO:246, а VL–домен содержит аминокислотную последовательность SEQ ID NO:97; VH–домен содержит аминокислотную последовательность SEQ ID NO:258, а VL–домен содержит аминокислотную последовательность SEQ ID NO:97; VH–домен содержит аминокислотную последовательность SEQ ID NO:335, а VL–домен содержит аминокислотную последовательность SEQ ID NO:97; VH–домен содержит аминокислотную последовательность SEQ ID NO:327, а VL–домен содержит аминокислотную последовательность SEQ ID NO:97; VH–домен содержит аминокислотную последовательность SEQ ID NO:246, а VL–домен содержит аминокислотную последовательность SEQ ID NO:312; VH–домен содержит аминокислотную последовательность SEQ ID NO:258, а VL–домен содержит аминокислотную последовательность SEQ ID NO:312; VH–домен содержит аминокислотную последовательность SEQ ID NO:335, а VL–домен содержит аминокислотную последовательность SEQ ID NO:3I2; или VH–домен содержит аминокислотную последовательность SEQ ID NO:327, а VL–домен содержит аминокислотную последовательность SEQ ID NO:312.
[0013] В других аспектах в данном документе предложено выделенное антитело, которое связывает внеклеточный домен человеческого полипептида SIRP–α (например, домен D1), при этом антитело содержит: (a) вариабельный домен тяжелой цепи (VH), содержащий (i) последовательность HVR–H1, содержащую аминокислотную последовательность IYAMS (SEQ ID NO:269), IYAVS (SEQ ID NO:213) или IYALS (SEQ ID NO:306), (ii) последовательность HVR–H2, содержащую аминокислотную последовательность TIGADDTYYADSVKG (SEQ ID NO: 150), и (iii) последовательность HVR–H3, содержащую аминокислотную последовательность DSTVGWSGDFFDY (SEQ ID NO:151); и/или (b) вариабельный домен легкой цепи (VL), содержащий (i) последовательность HVR–L1, содержащую аминокислотную последовательность RASQNVRSDIA (SEQ ID NO: 152), (ii) последовательность HVR–L2, содержащую аминокислотную последовательность AASSRDT (SEQ ID NO: 153), и (iii) последовательность HVR–L3, содержащую аминокислотную последовательность QQYYDWPPFT (SEQ ID NO: 148). В некоторых вариантах реализации VH–домен содержит аминокислотную последовательность, которая по меньшей мере на 90% идентична аминокислотной последовательности SEQ ID NO:341, 247, 259 или 328; и/или VL–домен содержит аминокислотную последовательность, которая по меньшей мере на 90% идентична аминокислотной последовательности SEQ ID NO: 104 или 248. В некоторых вариантах реализации VH–домен содержит аминокислотную последовательность SEQ ID NO: 127, а VL–домен содержит аминокислотную последовательность SEQ ID NO: 104; VH–домен содержит аминокислотную последовательность SEQ ID NO:247, а VL–домен содержит аминокислотную последовательность SEQ ID NO: 104; VH–домен содержит аминокислотную последовательность SEQ ID NO:259, а VL–домен содержит аминокислотную последовательность SEQ ID NO: 104; VH–домен содержит аминокислотную последовательность SEQ ID NO:328, а VL–домен содержит аминокислотную последовательность SEQ ID NO:104; VH–домен содержит аминокислотную последовательность SEQ ID NO: 127, а VL–домен содержит аминокислотную последовательность SEQ ID NO:248; VH–домен содержит аминокислотную последовательность SEQ ID NO:247, а VL–домен содержит аминокислотную последовательность SEQ ID NO:248; VH–домен содержит аминокислотную последовательность SEQ ID NO:259, а VL–домен содержит аминокислотную последовательность SEQ ID NO:248; или VH–домен содержит аминокислотную последовательность SEQ ID NO:328, а VL–домен содержит аминокислотную последовательность SEQ ID NO:248.
[0014] В других аспектах в данном документе предложено выделенное антитело, которое связывает внеклеточный домен человеческого полипептида SIRP–α (например, домен D1), при этом антитело содержит: (a) вариабельный домен тяжелой цепи (VH), содержащий: (i) последовательность HVR–H1, содержащую аминокислотную последовательность X1X2DX3N, где X1 представляет собой S или T; X2 представляет собой Y или S; а X3 представляет собой M, L или V (SEQ ID NO:307); (ii) последовательность HVR–H2, содержащую аминокислотную последовательность LISGSGETX1YYADSVKG, где X1 представляет собой I или T (SEQ ID NO:308); и (iii) последовательность HVR–H3, содержащую аминокислотную последовательность EX1X2X3YRFFDX4, где Х1 представляет собой N или D; X2 представляет собой N или D; X3 представляет собой R или M; а X4 представляет собой D или Y (SEQ ID NO:309); и/или (b) вариабельный домен легкой цепи (VL) содержащий: (i) последовательность HVR–L1, содержащую аминокислотную последовательность RAX1QSVYX2YLA, где X1 представляет собой S или D; а X2 представляет собой T или S (SEQ ID NO:310); (ii) последовательность HVR–L2, содержащую аминокислотную последовательность X1 AX2X3RAX4, где X1 представляет собой G, A или D; X2 представляет собой S или R; X3 представляет собой S, N или T; а X4 представляет собой T или A (SEQ ID NO:311); и (iii) последовательность HVR–L3, содержащую аминокислотную последовательность QQYYDRPPLT (SEQ ID NO: 160). В некоторых вариантах реализации антитело содержит (a) вариабельный домен тяжелой цепи (VH), содержащий (i) последовательность HVR–H1, содержащую аминокислотную последовательность SYDMN (SEQ ID NO:270), SYDVN (SEQ ID NO:221) или SYDLN (SEQ ID NO:313), (ii) последовательность HVR–H2, содержащую аминокислотную последовательность L1SGSGE1IYY ADSVKG (SEQ ID NO: 156), и (iii) последовательность HVR–H3, содержащую аминокислотную последовательность ENNRYRFFDD (SEQ ID NO: 157); и/или (b) вариабельный домен легкой цепи (VL), содержащий (i) последовательность HVR–L1, содержащую аминокислотную последовательность RASQSVYTYLA (SEQ ID NO: 158), (ii) последовательность HVR–L2, содержащую аминокислотную последовательность GASSRAT (SEQ ID NO: 159), и (iii) последовательность HVR–L3, содержащую аминокислотную последовательность QQYYDRPPLT (SEQ ID NO: 160). В некоторых вариантах реализации VH–домен содержит аминокислотную последовательность, которая по меньшей мере на 90% идентична аминокислотной последовательности SEQ ID NO: 249, 133, 260 или 329; и/или VL–домен содержит аминокислотную последовательность, которая по меньшей мере на 90% идентична аминокислотной последовательности SEQ ID NO: 134, 250 или 251. В некоторых вариантах реализации VH–домен содержит аминокислотную последовательность SEQ ID NO: 133, а VL–домен содержит аминокислотную последовательность SEQ ID NO: 134; VH–домен содержит аминокислотную последовательность SEQ ID NO:260, а VL–домен содержит аминокислотную последовательность SEQ ID NO: 134; VH–домен содержит аминокислотную последовательность SEQ ID NO:329, а VL–домен содержит аминокислотную последовательность SEQ ID NO:134; VH–домен содержит аминокислотную последовательность SEQ ID NO: 133, а VL–домен содержит аминокислотную последовательность SEQ ID NO:250; VH–домен содержит аминокислотную последовательность SEQ ID NO:260, а VL–домен содержит аминокислотную последовательность SEQ ID NO:250; VH–домен содержит аминокислотную последовательность SEQ ID NO:329, а VL–домен содержит аминокислотную последовательность SEQ ID NO:250; VH–домен содержит аминокислотную последовательность SEQ ID NO: 133, а VL–домен содержит аминокислотную последовательность SEQ ID NO:251; VH–домен содержит аминокислотную последовательность SEQ ID NO:260, а VL–домен содержит аминокислотную последовательность SEQ ID NO:251; VH–домен содержит аминокислотную последовательность SEQ ID NO:329, а VL–домен содержит аминокислотную последовательность SEQ ID NO:251; VH–домен содержит аминокислотную последовательность SEQ ID NO:249, а VL–домен содержит аминокислотную последовательность SEQ ID NO: 134: VH–домен содержит аминокислотную последовательность SEQ ID NO:249, а VL–домен содержит аминокислотную последовательность SEQ ID NO:250; или VH–домен содержит аминокислотную последовательность SEQ ID NO:249, а VL–домен содержит аминокислотную последовательность SEQ ID NO: 251.
[0015] В других аспектах в данном документе предложено выделенное антитело, которое связывает внеклеточный домен человеческого полипептида SIRP–α (например, домен D1), при этом антитело содержит: вариабельный домен тяжелой цепи (VH), содержащий последовательность HVR–H1, содержащую аминокислотную последовательность X1X2AX3S, где X1 представляет собой S или T; X2 представляет собой N, Y, H или D; а X3 представляет собой M, L или V (SEQ ID NO:297); последовательность HVR–H2, содержащую аминокислотную последовательность GISX1X2X3X4X5X6YYX7X8SX9KG, где X1 представляет собой A или S; X2 представляет собой G, S или отсутствует; X3 представляет собой S, D или G; X4 представляет собой G или S; X5 представляет собой D, S или G; X6 представляет собой T или A; X7 представляет собой P, G, V, I, A или S; X8 представляет собой A, D или G; а X9 представляет собой V или M (SEQ ID NO:298); и последовательность HVR–H3, содержащую аминокислотную последовательность ETWNHLFDY (SEQ ID NO: 193); и/или вариабельный домен легкой цепи (VL), содержащий: последовательность HVR–L1, содержащую аминокислотную последовательность SGGX1X2 X3SX4YYX5, где X1 представляет собой D, G, S, I или отсутствует; X2 представляет собой S, W, G, Y, D или отсутствует; X3 представляет собой S, Y, T или D; X4 представляет собой Η, T, S, или Y; а X5 представляет собой G или A (SEQ ID NO:299); последовательность HVR–L2, содержащую аминокислотную последовательность SDX1X2RPX3, где X1 представляет собой D или N; X2 представляет собой E, K или Q; а X3 представляет собой S или P (SEQ ID NO:300); и последовательность HVR–L3, содержащую аминокислотную последовательность X1X2YDX3X4X5YX6NX7, где X1 представляет собой G или A; X2 представляет собой G или A; X3 представляет собой G, Y, Q, S или A; X4 представляет собой S, R или T; X5 представляет собой T или S; X6 представляет собой A, I, V, L или T; а X7 представляет собой T, A, D или P (SEQ ID NO:301). В других аспектах в данном документе предложено выделенное антитело, которое связывает внеклеточный домен полипептида SIRP–α (например, домен D1), при этом антитело содержит: вариабельный домен тяжелой цепи (VH), содержащий: последовательность HVR–H1, содержащую аминокислотную последовательность SX1AX2S, где X1 представляет собой N или Y; и где X2 представляет собой M, L, или V (SEQ ID NO:302); последовательность HVR–H2, содержащую аминокислотную последовательность GISX1GX2X3DTYYX4X5SVKG, где X1 представляет собой A или S; X2 представляет собой G или отсутствует; X3 представляет собой S или G; X4 представляет собой P, G, или V; а X5 представляет собой A или D (SEQ ID NO:303); и последовательность HVR–H3, содержащую аминокислотную последовательность ETWNHLFDY (SEQ ID NO: 193); и/или вариабельный домен легкой цепи (VL), содержащий: последовательность HVR–L1, содержащую аминокислотную последовательность SGGX1YSSYYYA, где X1 представляет собой S или A (SEQ ID NO:304); последовательность HVR–L2, содержащую аминокислотную последовательность SDDKRPS (SEQ ID NO:336); и последовательность HVR–L3, содержащую аминокислотную последовательность GGYDQSS YTNP (SEQ ID NO: 172). В некоторых вариантах реализации VH–домен содержит (i) последовательность HVR–H1, содержащую аминокислотную последовательность SNAMS (SEQ ID NO: 194), SNAVS (SEQ ID NO:271) или SNALS (SEQ ID NO:318), (ii) последовательность HVR–H2, содержащую аминокислотную последовательность GISAGGSDTY YPASVKG (SEQ ID NO: 195), и (iii) последовательность HVR–H3, содержащую аминокислотную последовательность ETWNHLFDY (SEQ ID NO: 193). В некоторых вариантах реализации VH–домен содержит аминокислотную последовательность, которая по меньшей мере на 90% идентична аминокислотной последовательности SEQ ID NO: 135, 263, 264 или 330. В некоторых вариантах реализации VH–домен содержит (i) последовательность HVR–H1, содержащую аминокислотную последовательность SNAMS (SEQ ID NO:194), SNAVS (SEQ ID NO:271) или SNALS (SEQ ID NO:318), (ii) последовательность HVR–H2, содержащую аминокислотную последовательность GISSGSDTYYGDSVKG (SEQ ID NO: 197), и (iii) последовательность HVR–H3, содержащую аминокислотную последовательность ETWNHLFDY (SEQ ID NO: 193). В некоторых вариантах реализации VH–домен содержит аминокислотную последовательность, которая по меньшей мере на 90% идентична аминокислотной последовательности SEQ ID NO: 137, 265, 266 или 331. В некоторых вариантах реализации VH–домен содержит (i) последовательность HVR–H1, содержащую аминокислотную последовательность SYAMS (SEQ ID NO: 200), SYAVS (SEQ ID NO:272) или SYALS (SEQ ID NO:319), (ii) последовательность HVR–H2, содержащую аминокислотную последовательность GISSGGDTY YVDSVKG (SEQ ID NO:201), и (iii) последовательность HVR–H3, содержащую аминокислотную последовательность ETWNHLFDY (SEQ ID NO: 193). В некоторых вариантах реализации VH–домен содержит аминокислотную последовательность, которая по меньшей мере на 90% идентична аминокислотной последовательности SEQ ID NO:139, 267, 268 или 332. В некоторых вариантах реализации VL–домен содержит последовательность FW1–HVR–L1–FW2–HVR– L2–FW3–HVR–L3–FW4 (от N–конца к C–концу), где FW1 содержит аминокислотную последовательность SYELTQPPSVSVSPGQTARITC (SEQ ID NO:314), FW2 содержит аминокислотную последовательность WYQQKPGQAPVTLTY (SEQ ID NO:315), FW3 содержит аминокислотную последовательность NIPERFSGSSSGTTVTLTISGVQAEDEADYYC (SEQ ID NO:316), а FW4 содержит аминокислотную последовательность FGGGTKLTVL (SEQ ID NO:317). В некоторых вариантах реализации VL–домен содержит (i) последовательность HVR–L1, содержащую аминокислотную последовательность SGGSYSSYYYA (SEQ ID NO: 170), (ii) последовательность HVR–L2, содержащую аминокислотную последовательность SDDKRPS (SEQ ID NO:336), и (iii) последовательность HVR–L3, содержащую аминокислотную последовательность GGYDQSSYTNP (SEQ ID NO: 172). В некоторых вариантах реализации VL–домен содержит аминокислотную последовательность, которая по меньшей мере на 90% идентична аминокислотной последовательности SEQ ID NO: 252. В некоторых вариантах реализации VL–домен содержит (i) последовательность HVR–L1, содержащую аминокислотную последовательность SGGAYSSYYYA (SEQ ID NO:261), (ii) последовательность HVR–L2, содержащую аминокислотную последовательность SDDKRPS (SEQ ID NO:336), и (iii) последовательность HVR–L3, содержащую аминокислотную последовательность GGYDQSSYTNP (SEQ ID NO: 172). В некоторых вариантах реализации VL–домен содержит аминокислотную последовательность, которая по меньшей мере на 90% идентична аминокислотной последовательности SEQ ID NO:262. В некоторых вариантах реализации VH–домен содержит аминокислотную последовательность SEQ ID NO:263, а VL–домен содержит аминокислотную последовательность SEQ ID NO:252; VH–домен содержит аминокислотную последовательность SEQ ID NO:264, а VL–домен содержит аминокислотную последовательность SEQ ID NO:252; VH–домен содержит аминокислотную последовательность SEQ ID NO:330, а VL–домен содержит аминокислотную последовательность SEQ ID NO:252; VH–домен содержит аминокислотную последовательность SEQ ID NO: 135, а VL–домен содержит аминокислотную последовательность SEQ ID NO:252; VH–домен содержит аминокислотную последовательность SEQ ID NO: 137, а VL–домен содержит аминокислотную последовательность SEQ ID NO:252; VH–домен содержит аминокислотную последовательность SEQ ID NO: 139, а VL–домен содержит аминокислотную последовательность SEQ ID NO:252; VH–домен содержит аминокислотную последовательность SEQ ID NO:265, а VL–домен содержит аминокислотную последовательность SEQ ID NO:252; VH–домен содержит аминокислотную последовательность SEQ ID NO:266, а VL–домен содержит аминокислотную последовательность SEQ ID NO:252; VH–домен содержит аминокислотную последовательность SEQ ID NO:331, а VL–домен содержит аминокислотную последовательность SEQ ID NO:252; VH–домен содержит аминокислотную последовательность SEQ ID NO:267, а VL–домен содержит аминокислотную последовательность SEQ ID NO:252; VH–домен содержит аминокислотную последовательность SEQ ID NO:268, а VL–домен содержит аминокислотную последовательность SEQ ID NO:252; VH–домен содержит аминокислотную последовательность SEQ ID NO:332, а VL–домен содержит аминокислотную последовательность SEQ ID NO:252; VH–домен содержит аминокислотную последовательность SEQ ID NO:263, а VL–домен содержит аминокислотную последовательность SEQ ID NO:262; VH–домен содержит аминокислотную последовательность SEQ ID NO:264, а VL–домен содержит аминокислотную последовательность SEQ ID NO:262; VH–домен содержит аминокислотную последовательность SEQ ID NO:330, а VL–домен содержит аминокислотную последовательность SEQ ID NO:262; VH–домен содержит аминокислотную последовательность SEQ ID NO:265, а VL–домен содержит аминокислотную последовательность SEQ ID NO:262; VH–домен содержит аминокислотную последовательность SEQ ID NO:266, а VL–домен содержит аминокислотную последовательность SEQ ID NO:262; VH–домен содержит аминокислотную последовательность SEQ ID NO:331, а VL–домен содержит аминокислотную последовательность SEQ ID NO:262; VH–домен содержит аминокислотную последовательность SEQ ID NO:267, а VL–домен содержит аминокислотную последовательность SEQ ID NO:262; VH–домен содержит аминокислотную последовательность SEQ ID NO:268, а VL–домен содержит аминокислотную последовательность SEQ ID NO:262; VH–домен содержит аминокислотную последовательность SEQ ID NO:332, а VL–домен содержит аминокислотную последовательность SEQ ID NO:262; VH–домен содержит аминокислотную последовательность SEQ ID NO: 135, а VL–домен содержит аминокислотную последовательность SEQ ID NO:262; VH–домен содержит аминокислотную последовательность SEQ ID NO: 137, а VL–домен содержит аминокислотную последовательность SEQ ID NO:262; или VH–домен содержит аминокислотную последовательность SEQ ID NO: 139, а VL–домен содержит аминокислотную последовательность SEQ ID NO:262.
[0016] В других аспектах в данном документе предложено выделенное антитело, которое связывает внеклеточный домен человеческого полипептида SIRP–α (например, домен D1), при этом антитело связывается с человеческим полипептидом SIRP–α v1 в одной или более аминокислотных позициях, выбранных из группы, состоящей из I31, V33, Q52, K53, T67, R69, N70 и K96 в соответствии с SEQ ID NO:296. В некоторых вариантах реализации антитело связывается с человеческим полипептидом SIRP–α v1 в I31, V33, Q52, K53, T67, R69, N70 и K96 в соответствии с SEQ ID NO: 296. В некоторых вариантах реализации антитело дополнительно связывается с человеческим полипептидом SIRP–α v1 в одной или более аминокислотных позициях, выбранных из группы, состоящей из L30, P32, E54, T62, N71, M72, F74 и R95 в соответствии с SEQ ID NO: 296. В некоторых вариантах реализации антитело дополнительно связывается с человеческим полипептидом SIRP–α v1 в L30, P32, E54, T62, N71, M72, F74 и R95 в соответствии с SEQ ID NO:296.
[0017] В других аспектах в данном документе предложено выделенное антитело, которое связывает внеклеточный домен человеческого полипептида SIRP–α (например, домен D1), при этом антитело связывается с человеческим полипептидом SIRP–α v1 в одной или более аминокислотных позициях, выбранных из группы, состоящей из I7, P9, D10, K11, S12, A42, A108 и E111 в соответствии с SEQ ID NO:296. В некоторых вариантах реализации антитело связывается с человеческим полипептидом SIRP–α v1 в K11, A42, A108 и E111 в соответствии с SEQ ID NO:296. В некоторых вариантах реализации антитело связывается с человеческим полипептидом SIRP–α v1 в I7, P9, D10, K11, S12, A108 и E111 в соответствии с SEQ ID NO: 296. В некоторых вариантах реализации антитело дополнительно связывается с человеческим полипептидом SIRP–α v1 в одной или более аминокислотных позициях, выбранных из группы, состоящей из L14, T26, T28, T88, Y90, S106, S113 и A116 в соответствии с SEQ ID NO:296. В некоторых вариантах реализации антитело дополнительно связывается с человеческим полипептидом SIRP–α v1 в L14, T88, Y90, S106, S113 и A116 и человеческого SIRP–α v1 в соответствии с SEQ ID NO:296. В некоторых вариантах реализации антитело дополнительно связывается с человеческим полипептидом SIRP–α v1 в L14, T26 и T28 в соответствии с SEQ ID NO:296.
[0018] В других аспектах в данном документе предложено выделенное антитело, которое связывает внеклеточный домен человеческого полипептида SIRP–α (например, домен D1), при этом антитело связывается с человеческим полипептидом SIRP–α v1 в одной или более аминокислотных позициях, выбранных из группы, состоящей из E47, L48, P58, R59, T82 и A84 в соответствии с SEQ ID NO:296. В некоторых вариантах реализации антитело связывается с человеческим полипептидом SIRP–α v1 в E47, L48, P58, R59, T82 и A84 в соответствии с SEQ ID NO: 296. В некоторых вариантах реализации антитело дополнительно связывается с человеческим полипептидом SIRP–α v1 в одной или более аминокислотных позициях, выбранных из группы, состоящей из A17, P44, G45, I49, E54, G55, H56, F57 и P83 в соответствии с SEQ ID NO:296. В некоторых вариантах реализации антитело дополнительно связывается с человеческим полипептидом SIRP–α v1 в A17, P44, G45, I49, E54, G55, H56, F57 и P83 человеческого SIRP–α v1 в соответствии с SEQ ID NO: 296.
[0019] В других аспектах в данном документе предложено выделенное антитело, которое связывает внеклеточный домен человеческого полипептида SIRP–α (например, домен D1), при этом антитело связывает внеклеточный домен человеческого полипептида SIRP–α v1 с константой диссоциации (KД) менее 100 нМ и при этом антитело блокирует связывание между внеклеточным доменом человеческого полипептида SIRP–α и доменом IgSF человеческого полипептида CD47. В некоторых вариантах реализации антитело связывает внеклеточный домен человеческого полипептида SIRP–α v1 с константой диссоциации (KД) менее 100 нМ. В некоторых вариантах реализации антитело связывает домен D1 человеческого полипептида SIRP–α v2 и домен D1 человеческого полипептида SIRP–α v2. В некоторых вариантах реализации антитело связывает внеклеточный домен полипептида SIRP–α яванского макака. В некоторых вариантах реализации антитело связывает внеклеточный домен человеческого полипептида SIRP–β. В некоторых вариантах реализации антитело связывает внеклеточный домен человеческого полипептида SIRP–γ. В некоторых вариантах реализации антитело связывает внеклеточный домен мышиного полипептида SIRP–α.
[0020] В других аспектах в данном документе предложено выделенное антитело, которое связывает внеклеточный домен человеческого полипептида SIRP–α (например, домен D1), при этом антитело связывает домен D1 человеческого полипептида SIRP–α и при этом антитело не блокирует связывание между внеклеточным доменом человеческого полипептида SIRP–α и доменом IgSF человеческого полипептида CD47. В некоторых вариантах реализации антитело связывает домен D1 человеческого полипептида SIRP–α с константой диссоциации (KД) менее 100 нМ. В некоторых вариантах реализации антитело связывает домен D1 человеческого полипептида SIRP–α v1 с константой диссоциации (KД) менее 100 нМ и/или связывает домен D1 человеческого полипептида SIRP–α v2 с константой диссоциации (KД) менее 100 нМ. В некоторых вариантах реализации антитело связывает домен D1 человеческого полипептида SIRP–α v1 и домен D1 человеческого полипептида SIRP–α v2. В некоторых вариантах реализации антитело связывает внеклеточный домен полипептида SIRP–α яванского макака. В некоторых вариантах реализации антитело связывает внеклеточный домен человеческого полипептида SIRP–β. В некоторых вариантах реализации антитело связывает внеклеточный домен мышиного полипептида SIRP–α.
[0021] В других аспектах в данном документе предложено выделенное антитело, которое связывает внеклеточный домен человеческого полипептида SIRP–α (например, домен D1), при этом антитело конкурирует за связывание внеклеточного домена человеческого полипептида SIRP–α с эталонным анти–SIRP–α антителом, содержащим вариабельный домен тяжелой цепи (VH) и вариабельный домен легкой цепи (VL) антитела, выбранного из группы, состоящей из антител 119, 120, 121, 122, 21, 25, 27, 66 и 135. В других аспектах в данном документе предложено выделенное антитело, которое связывает внеклеточный домен человеческого полипептида SIRP–α (например, домен D1), при этом антитело конкурирует за связывание внеклеточного домена человеческого полипептида SIRP–α с эталонным анти–SIRP–α антителом, содержащим: (a) вариабельный домен тяжелой цепи (VH), содержащий аминокислотную последовательность SEQ ID NO: 120, и вариабельный домен легкой цепи (VL), содержащий аминокислотную последовательность SEQ ID NO:97; (b) вариабельный домен тяжелой цепи (VH), содержащий аминокислотную последовательность SEQ ID NO: 121, и вариабельный домен легкой цепи (VL), содержащий аминокислотную последовательность SEQ ID NO:98; (c) вариабельный домен тяжелой цепи (VH), содержащий аминокислотную последовательность SEQ ID NO: 130, и вариабельный домен легкой цепи (VL), содержащий аминокислотную последовательность SEQ ID NO: 107; (d) вариабельный домен тяжелой цепи (VH), содержащий аминокислотную последовательность SEQ ID NO: 122, и вариабельный домен легкой цепи (VL), содержащий аминокислотную последовательность SEQ ID NO:99; (e) вариабельный домен тяжелой цепи (VH), содержащий аминокислотную последовательность SEQ ID NO: 135, и вариабельный домен легкой цепи (VL), содержащий аминокислотную последовательность SEQ ID NO: 136; (f) вариабельный домен тяжелой цепи (VH), содержащий аминокислотную последовательность SEQ ID NO: 137, и вариабельный домен легкой цепи (VL), содержащий аминокислотную последовательность SEQ ID NO: 138; (g) вариабельный домен тяжелой цепи (VH), содержащий аминокислотную последовательность SEQ ID NO: 139, и вариабельный домен легкой цепи (VL), содержащий аминокислотную последовательность SEQ ID NO: 140; (h) вариабельный домен тяжелой цепи (VH), содержащий аминокислотную последовательность SEQ ID NO: 141, и вариабельный домен легкой цепи (VL), содержащий аминокислотную последовательность SEQ ID NO: 142; или (i) вариабельный домен тяжелой цепи (VH), содержащий аминокислотную последовательность SEQ ID NO: 127, и вариабельный домен легкой цепи (VL), содержащий аминокислотную последовательность SEQ ID NO: 104.
[0022] В других аспектах в данном документе предложено выделенное антитело, которое связывает внеклеточный домен человеческого полипептида SIRP–α (например, домен D1), при этом антитело конкурирует за связывание внеклеточного домена человеческого полипептида SIRP–α с эталонным анти–SIRP–α антителом, содержащим вариабельный домен тяжелой цепи (VH) и вариабельный домен легкой цепи (VL) антитела, выбранного из группы, состоящей из антител 136 и 137. В других аспектах в данном документе предложено выделенное антитело, которое связывает внеклеточный домен человеческого полипептида SIRP–α (например, домен D1), при этом антитело конкурирует за связывание внеклеточного домена человеческого полипептида SIRP–α с эталонным анти–SIRP–α антителом, содержащим: (a) вариабельный домен тяжелой цепи (VH), содержащий аминокислотную последовательность SEQ ID NO: 133, и вариабельный домен легкой цепи (VL), содержащий аминокислотную последовательность SEQ ID NO: 134; или (b) вариабельный домен тяжелой цепи (VH), содержащий аминокислотную последовательность SEQ ID NO: 128, и вариабельный домен легкой цепи (VL), содержащий аминокислотную последовательность SEQ ID NO: 105.
[0023] В других аспектах в данном документе предложено выделенное антитело, которое связывает внеклеточный домен человеческого полипептида SIRP–α (например, домен D1), при этом антитело конкурирует за связывание внеклеточного домена человеческого полипептида SIRP–α с эталонным анти–SIRP–α антителом, содержащим вариабельный домен тяжелой цепи (VH) и вариабельный домен легкой цепи (VL) антитела, выбранного из группы, состоящей из антител 3, 213, 173 и 209. В других аспектах в данном документе предложено выделенное антитело, которое связывает внеклеточный домен человеческого полипептида SIRP–α (например, домен D1), при этом антитело конкурирует за связывание внеклеточного домена человеческого полипептида SIRP–α с эталонным анти–SIRP–α антителом, содержащим: (a) вариабельный домен тяжелой цепи (VH), содержащий аминокислотную последовательность SEQ ID NO:242, и вариабельный домен легкой цепи (VL), содержащий аминокислотную последовательность SEQ ID NO:243; (b) вариабельный домен тяжелой цепи (VH), содержащий аминокислотную последовательность SEQ ID NO:275, и вариабельный домен легкой цепи (VL), содержащий аминокислотную последовательность SEQ ID NO:276; (c) вариабельный домен тяжелой цепи (VH), содержащий аминокислотную последовательность SEQ ID NO:278, и вариабельный домен легкой цепи (VL), содержащий аминокислотную последовательность SEQ ID NO:279; или (d) вариабельный домен тяжелой цепи (VH), содержащий аминокислотную последовательность SEQ ID NO:280, и вариабельный домен легкой цепи (VL), содержащий аминокислотную последовательность SEQ ID NO:281.
[0024] В других аспектах в данном документе предложено выделенное антитело, которое связывает внеклеточный домен человеческого полипептида SIRP–α (например, домен D1), при этом антитело конкурирует за связывание внеклеточного домена человеческого полипептида SIRP–α с эталонным анти–SIRP–α антителом, содержащим вариабельный домен тяжелой цепи (VH) и вариабельный домен легкой цепи (VL) антитела, выбранного из группы, состоящей из антител 115, 116, 117, 118 и 132. В других аспектах в данном документе предложено выделенное антитело, которое связывает внеклеточный домен человеческого полипептида SIRP–α (например, домен D1), при этом антитело конкурирует за связывание внеклеточного домена человеческого полипептида SIRP–α с эталонным анти–SIRP–α антителом, содержащим: (a) вариабельный домен тяжелой цепи (VH), содержащий аминокислотную последовательность SEQ ID NO:116, и вариабельный домен легкой цепи (VL), содержащий аминокислотную последовательность SEQ ID NO:93; (b) вариабельный домен тяжелой цепи (VH), содержащий аминокислотную последовательность SEQ ID NO: 117, и вариабельный домен легкой цепи (VL), содержащий аминокислотную последовательность SEQ ID NO:94; (c) вариабельный домен тяжелой цепи (VH), содержащий аминокислотную последовательность SEQ ID NO: 118, и вариабельный домен легкой цепи (VL), содержащий аминокислотную последовательность SEQ ID NO:95; (d) вариабельный домен тяжелой цепи (VH), содержащий аминокислотную последовательность SEQ ID NO: 119, и вариабельный домен легкой цепи (VL), содержащий аминокислотную последовательность SEQ ID NO:96; или (e) вариабельный домен тяжелой цепи (VH), содержащий аминокислотную последовательность SEQ ID NO:282, и вариабельный домен легкой цепи (VL), содержащий аминокислотную последовательность SEQ ID NO:283.
[0025] В других аспектах в данном документе предложено выделенное антитело, которое связывает внеклеточный домен человеческого полипептида SIRP–α (например, домен D1), при этом антитело конкурирует за связывание внеклеточного домена человеческого полипептида SIRP–α с эталонным анти–SIRP–α антителом, содержащим вариабельный домен тяжелой цепи (VH) и вариабельный домен легкой цепи (VL) антитела, выбранного из группы, состоящей из антител 218, 123, 149, 161, 162 и 194. В других аспектах в данном документе предложено выделенное антитело, которое связывает внеклеточный домен человеческого полипептида SIRP–α (например, домен D1), при этом антитело конкурирует за связывание внеклеточного домена человеческого полипептида SIRP–α с эталонным анти–SIRP–α антителом, содержащим: (a) вариабельный домен тяжелой цепи (VH), содержащий аминокислотную последовательность SEQ ID NO:284, и вариабельный домен легкой цепи (VL), содержащий аминокислотную последовательность SEQ ID NO:285; (b) вариабельный домен тяжелой цепи (VH), содержащий аминокислотную последовательность SEQ ID NO: 123, и вариабельный домен легкой цепи (VL), содержащий аминокислотную последовательность SEQ ID NO: 100; (c) вариабельный домен тяжелой цепи (VH), содержащий аминокислотную последовательность SEQ ID NO:286, и вариабельный домен легкой цепи (VL), содержащий аминокислотную последовательность SEQ ID NO:287; (d) вариабельный домен тяжелой цепи (VH), содержащий аминокислотную последовательность SEQ ID NO:288, и вариабельный домен легкой цепи (VL), содержащий аминокислотную последовательность SEQ ID NO:289; (e) вариабельный домен тяжелой цепи (VH), содержащий аминокислотную последовательность SEQ ID NO:290, и вариабельный домен легкой цепи (VL), содержащий аминокислотную последовательность SEQ ID NO:291; или (f) вариабельный домен тяжелой цепи (VH), содержащий аминокислотную последовательность SEQ ID NO:292, и вариабельный домен легкой цепи (VL), содержащий аминокислотную последовательность SEQ ID NO:293.
[0026] В других аспектах в данном документе предложено выделенное антитело, которое связывает внеклеточный домен человеческого полипептида SIRP–α (например, домен D1), при этом антитело конкурирует за связывание внеклеточного домена человеческого полипептида SIRP–α с эталонным анти–SIRP–α антителом, содержащим вариабельный домен тяжелой цепи (VH) и вариабельный домен легкой цепи (VL) антитела 45. В других аспектах в данном документе предложено выделенное антитело, которое связывает внеклеточный домен человеческого полипептида SIRP–α (например, домен D1), при этом антитело конкурирует за связывание внеклеточного домена человеческого полипептида SIRP–α с эталонным анти–SIRP–α антителом, содержащим вариабельный домен тяжелой цепи (VH), содержащий аминокислотную последовательность SEQ ID NO:244, и вариабельный домен легкой цепи (VL), содержащий аминокислотную последовательность SEQ ID NO:245.
[0027] В некоторых вариантах реализации любого из вышеприведенных вариантов реализации антитело усиливает фагоцитоз макрофагом, экспрессирующим человеческий полипептид SIRP–α. В некоторых вариантах реализации антитело усиливает активацию дендритной клетки, экспрессирующей человеческий полипептид SIRP–α. В некоторых вариантах реализации антитело ингибирует in vivo рост опухоли, которая экспрессирует CD47. В некоторых вариантах реализации антитело не предотвращает взаимодействия между CD47–экспрессирующей клеткой и Т–клеткой.
[0028] В некоторых вариантах реализации любого из вышеприведенных вариантов реализации антитело представляет собой моноклональное антитело. В некоторых вариантах реализации антитело представляет собой scFv–Fc, однодоменное антитело, антитело из одной тяжелой цепи или антитело из одной легкой цепи. В некоторых вариантах реализации антитело содержит константную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 325, 326 или 426. В некоторых вариантах реализации антитело содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 320–324. В некоторых вариантах реализации антитело содержит Fc–область. В некоторых вариантах реализации Fc–область представляет собой человеческую Fc–область, выбранную из группы, состоящей из Fc–области IgG1, Fc–области IgG2 и Fc–области IgG4. В некоторых вариантах реализации Fc–область содержит Fc–область человеческого IgG1, содержащую одну или более мутаций, выбранных из группы, состоящей из L234A, L235A, L235E, G237A и N297A в соответствии с нумерацией EU. В некоторых вариантах реализации Fc–область содержит Fc–область человеческого IgG2, содержащую одну или более мутаций, выбранных из группы, состоящей из A330S, P331S и N297A в соответствии с нумерацией EU. В некоторых вариантах реализации Fc–область содержит Fc–область человеческого IgG4, содержащую одну или более мутаций, выбранных из группы, состоящей из S228P, E233P, F234V, L235A, L235E, delG236 и N297A в соответствии с нумерацией EU. В некоторых вариантах реализации антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из фрагментов Fab, F(ab')2, Fab'–SH, Fv и scFv. В некоторых вариантах реализации антитело конъюгировано с цитотоксическим агентом или меткой.
[0029] В некоторых вариантах реализации антитело представляет собой биспецифическое антитело. В некоторых вариантах реализации антитело содержит первый антигенсвязывающий домен, который связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α, и второй антигенсвязывающий домен, который связывает антиген, экспрессируемый раковой клеткой. В некоторых вариантах реализации антиген, экспрессируемый раковой клеткой, выбран из группы, состоящей из CD19, CD20, CD22, CD30, CD33, CD38, CD52, CD56, CD70, CD74, CD79b, CD123, CD138, CS1/SLAMF7, Trop–2, 5T4, EphA4, BCMA, муцина 1, муцина 16, PD–L1, PTK7, STEAP1, рецептора эндотелина B, мезотелина, EGFRvIII, ENPP3, SLC44A4, GNMB, нектина 4, NaPi2b, LIV–1A, гуанилил циклазы C, DLL3, EGFR, HER2, VEGF, VEGFR, интегрина αVβ3, интегрина α5β1, MET, IGF1R, TRAILR1, TRAILR2, RANKL, FAP, тенасцина, Ley, EpCAM, CEA, gpA33, PSMA, TAG72, муцина, CAIX, EPHA3, фолатного рецептора α, GD2, GD3 и ГКГС/пептидного комплекса, содержащего пептид из NY–ESO–1/LAGE, SSX–2, белка семейства MAGE, MAGE–A3, gp100/pmel17, Melan–A/MART–1, gp75/TRP1, тирозиназы, TRP2, CEA, PSA, TAG–72, незрелого рецептора ламинина, MOK/RAGE–1, WT–1, SAP–1, BING–4, EpCAM, MUC1, PRAME, сурвивина, BRCA1, BRCA2, CDK4, CML66, MART–2, p53, Ras, β–катенина, TGF–βRII, HPV E6 или HPV E7. В некоторых вариантах реализации антитело представляет собой куриное, гуманизированное, химерное или человеческое антитело. В некоторых вариантах реализации антитело вырабатывается в организме курицы или получено из него.
[0030] Дополнительно в данном документе предложены полинуклеотиды, содержащие антитело в соответствии с любым из вышеприведенных вариантов реализации. Дополнительно в данном документе предложены векторы, содержащие полинуклеотид в соответствии с любым из вышеприведенных вариантов реализации. Дополнительно в данном документе предложены клетки–хозяева, содержащие полинуклеотид или вектор в соответствии с любым из вышеприведенных вариантов реализации. Дополнительно в данном документе предложены способы получения антитела, включающие культивирование клетки–хозяина в соответствии с любым из вышеприведенных вариантов реализации так, чтобы она вырабатывала антитело. В некоторых вариантах реализации способы дополнительно включают выделение антитела из клетки–хозяина.
[0031] Дополнительно в данном документе предложены способы лечения или замедления прогрессирования рака у индивида, включающие введение индивиду эффективного количества антитела в соответствии с любым из вышеприведенных вариантов реализации. В некоторых вариантах реализации способы дополнительно включают введение индивиду эффективного количества второго антитела, в некоторых вариантах реализации второе антитело связывает антиген, экспрессируемый раковой клеткой. В некоторых вариантах реализации антиген, экспрессируемый раковой клеткой, выбран из группы, состоящей из CD19, CD20, CD22, CD30, CD33, CD38, CD52, CD56, CD70, CD74, CD79b, CD123, CD138, CS1/SLAMF7, Trop–2, 5T4, EphA4, BCMA, муцина 1, муцина 16, PTK7, STEAP1, рецептора эндотелина B, мезотелина, EGFRvIII, ENPP3, SLC44A4, GNMB, нектина 4, NaPi2b, LIV–1A, гуанилил циклазы C, DLL3, EGFR, HER2, VEGF, VEGFR, интегрина αVβ3, интегрина α5β1, MET, IGF1R, TRAILR1, TRAILR2, RANKL, FAP, тенасцина, Ley, EpCAM, CEA, gpA33, PSMA, TAG72, муцина, CAIX, EPHA3, фолатного рецептора α, GD2, GD3 и ГКГС/пептидного комплекса, содержащего пептид из NY–ESO–1/LAGE, SSX–2, белка семейства MAGE, MAGE–A3, gp100/pmel17, Melan–A/MART–1, gp75/TRP1, тирозиназы, TRP2, CEA, PSA, TAG–72, незрелого рецептора ламинина, MOK/RAGE–1, WT–1, SAP–1, BING–4, EpCAM, MUC1, PRAME, сурвивина, BRCA1, BRCA2, CDK4, CML66, MART–2, p53, Ras, β–катенина, TGF–βRII, HPV E6 или HPV E7. В некоторых вариантах реализации способы дополнительно включают введение индивиду эффективного количества иммунотерапевтического агента. В некоторых вариантах реализации иммунотерапевтический агент содержит второе антитело. В некоторых вариантах реализации второе антитело связывается с антигеном, выбранным из группы, состоящей из PD–1, PD–L1, OX40, CTLA–4, GD137/4–1BB, TNFR2, B7–H3, FZD7, CD27, CCR4, CSF1R, CSF, TIM–3, LAG–3, VISTA, ICOS, CCR2, IDO, A2R, CD39, CD73, TIGIT, CD80, CD47, аргиназы, TDO и PVRIG. В некоторых вариантах реализации первое антитело связывает внеклеточный домен человеческого полипептида SIRP–α v1, внеклеточный домен человеческого полипептида SIRP–α v2 или внеклеточные домены как человеческого полипептида SIRP–α v1, так и человеческого полипептида SIRP–α v2 с константой диссоциации (KД) менее 100 нМ, при этом первое антитело блокирует связывание между внеклеточным доменом человеческого полипептида SIRP–α и доменом IgSF человеческого полипептида CD47, а второе антитело связывается с PD–1. В некоторых вариантах реализации первое антитело связывает домен D1 человеческого полипептида SIRP–α, при этом первое антитело не блокирует связывание между внеклеточным доменом человеческого полипептида SIRP–α и доменом IgSF человеческого полипептида CD47, а второе антитело связывается с PD–1. В некоторых вариантах реализации первое антитело связывает внеклеточный домен человеческого полипептида SIRP–α v1 с константой диссоциации (KД) менее 100 нМ, при этом первое антитело блокирует связывание между внеклеточным доменом человеческого полипептида SIRP–α и доменом IgSF человеческого полипептида CD47, а второе антитело связывается PD–L1. В некоторых вариантах реализации первое антитело связывает домен D1 человеческого полипептида SIRP–α, при этом первое антитело не блокирует связывание между внеклеточным доменом человеческого полипептида SIRP–α и доменом IgSF человеческого полипептида CD47, а второе антитело связывается с PD–L1.
В некоторых вариантах реализации индивид является человеком.
[0032] Дополнительно в данном документе предложены способы лечения или замедления прогрессирования аутоиммунного заболевания или воспалительного заболевания у индивида, включающие введение индивиду эффективного количества антитела в соответствии с любым из вышеприведенных вариантов реализации. В некоторых вариантах реализации аутоиммунное заболевание или воспалительное заболевание выбрано из группы, состоящей из множественного склероза, ревматоидного артрита, спондилоартропатии, системной красной волчанки, антителоопосредованного воспалительного или аутоиммунного заболевания, болезни «трансплантат против хозяина», сепсиса, диабета, псориаза, псориатического артрита, атеросклероза, синдрома Шегрена, прогрессирующего системного склероза, склеродермы, острого коронарного синдрома, ишемической реперфузии, болезни Крона, язвенного колита, эндометриоза, гломерулонефрита, нефропатии IgA–типа, поликистозной болезни почек, миастении гравис, идиопатического легочного фиброза, астмы, атопического дерматита, острого респираторного дистресс–синдрома (ОРДС), васкулита и воспалительного аутоиммунного миозита. В некоторых вариантах реализации индивид является человеком.
[0033] Дополнительно в данном документе предложены способы идентификации антигенсвязывающего домена, который связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α и не блокирует связывание между человеческим CD47 и человеческим полипептидом SIRP–α, включающие (a) обеспечение антигенсвязывающего домена, который связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α; (b) получение комплекса, содержащего вариант D1 SIRP–α, связанный с полипептидом, содержащим домен IgSF CD47, при этом вариант D1 SIRP–α представляет собой высокоаффинный домен D1 SIRP–α искусственного происхождения и при этом вариант D1 SIRP–α связывается с человеческим CD47 с аффинностью, которая по меньшей мере в 10 раз больше, чем аффинность связывания домена D1 SIRP–α природного происхождения с человеческим CD47; (с) приведение в контакт антигенсвязывающего домена с полученным комплексом; и (d) выявление связывания антигенсвязывающего домена с комплексом, причем связывание антигенсвязывающего домена с комплексом указывает на то, что антигенсвязывающий домен не блокирует связывание между человеческим CD47 и человеческим полипептидом SIRP–α. Дополнительно в данном документе предложены способы идентификации антигенсвязывающего домена, который связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α и не блокирует связывание между человеческим CD47 и человеческим полипептидом SIRP–α, включающие приведение в контакт антитела или антигенсвязывающего домена, который связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α, с комплексом, содержащим вариант D1 SIRP–α, связанный с полипептидом, содержащим домен IgSF CD47, при этом вариант D1 SIRP–α представляет собой высокоаффинный домен D1 SIRP–α искусственного происхождения и при этом вариант D1 SIRP–α связывается с человеческим CD47 с аффинностью, которая по меньшей мере в 10 раз больше, чем аффинность связывания домена D1 SIRP–α природного происхождения с человеческим CD47; и выявление связывания антигенсвязывающего домена с комплексом, причем связывание антигенсвязывающего домена с комплексом указывает на то, что антигенсвязывающий домен не блокирует связывание между человеческим CD47 и человеческим полипептидом SIRP–α. Дополнительно в данном документе предложены способы идентификации антигенсвязывающего домена, который связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α и блокирует связывание между человеческим CD47 и человеческим полипептидом SIRP–α, включающие (a) обеспечение антигенсвязывающего домена, который связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α; (b) получение комплекса, содержащего вариант D1 SIRP–α, связанный с полипептидом, содержащим домен IgSF CD47, при этом вариант D1 SIRP–α представляет собой высокоаффинный домен D1 SIRP–α искусственного происхождения и при этом вариант D1 SIRP–α связывается с человеческим CD47 с аффинностью, которая по меньшей мере в 10 раз больше, чем аффинность связывания домена D1 SIRP–α природного происхождения с человеческим CD47; (с) приведение в контакт антигенсвязывающего домена с полученным комплексом; и (d) выявление связывания антигенсвязывающего домена с комплексом, причем отсутствие связывания антигенсвязывающего домена с комплексом указывает на то, что антигенсвязывающий домен блокирует связывание между человеческим CD47 и человеческим полипептидом SIRP–α. Дополнительно в данном документе предложены способы идентификации антитела или антигенсвязывающего домена, который связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α и блокирует связывание между человеческим CD47 и человеческим полипептидом SIRP–α, включающие приведение в контакт антитела или антигенсвязывающего домена, который связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α, с комплексом, содержащим вариант D1 SIRP–α, связанный с полипептидом, содержащим домен IgSF CD47, при этом вариант D1 SIRP–α представляет собой высокоаффинный домен D1 SIRP–α искусственного происхождения и при этом вариант D1 SIRP–α связывается с человеческим CD47 с аффинностью, которая по меньшей мере в 10 раз больше, чем аффинность связывания домена D1 SIRP–α природного происхождения с человеческим CD47; и (d) выявление связывания антигенсвязывающего домена с комплексом, причем отсутствие связывания антигенсвязывающего домена с комплексом указывает на то, что антигенсвязывающий домен блокирует связывание между человеческим CD47 и человеческим полипептидом SIRP–α. В некоторых вариантах реализации вариант D1 SIRP–α содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 17–52. В некоторых вариантах реализации домен IgSF CD47 содержит аминокислотную последовательность SEQ ID NO: 16. В некоторых вариантах реализации полипептид, содержащий домен IgSF CD47, содержит внеклеточный домен человеческого CD47. В некоторых вариантах реализации полипептид, содержащий домен IgSF CD47, дополнительно содержит Fc–область антитела.
[0034] Дополнительно в данном документе предложены способы получения анти–SIRP–α антитела, которое связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α, включающие: (a) иммунизацию курицы пептидом, содержащим по меньшей мере часть внеклеточного домена (например, домена D1) человеческого SIRP–α; (b) получение антитела из вырабатывающей антитело клетки от иммунизированной курицы; и (c) выявление связывания между антителом, полученным из клетки, и внеклеточными доменами (например, доменами D1) человеческого полипептида SIRP–α, при этом связывание между антителом и внеклеточным доменом (например, доменом D1) человеческого полипептида SIRP–α указывает на то, что антитело является анти–SIRP–α антителом, которое связывает внеклеточный домен (например, домен D1) человеческого вариантного полипептида SIRP–α. В некоторых вариантах реализации антитело представляет собой куриное, гуманизированное, химерное или человеческое антитело. В некоторых вариантах реализации антитело связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α v1, внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α v2 или их оба. В некоторых вариантах реализации антитело связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α v1, содержащий аминокислотную последовательность EEELQVIQPDKSVLVAAGETATLRCTATSLIPVGPIQWFRGAGPGRELIYNQKEGHF PRVTTVSDLTKRNNMDFSIRIGNITPADAGTYYCVKFRKGSPDDVEFKSGAGTELSVRAKPS (SEQ ID NO:5). В некоторых вариантах реализации антитело связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α v2, содержащий аминокислотную последовательность EEELQVIQPDKSVSVAAGESAILHCTVTSLIPVGPIQWFRGAGPARELIYNQKEGHFP RVTTVSESTKRENMDFSISISNITPADAGTYYCVKFRKGSPDTEFKSGAGTELSVRAKPS (SEQ ID NO:6). В некоторых вариантах реализации антитело связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α v1, содержащий аминокислотную последовательность EEELQVIQPDKSVLVAAGETATLRCTATSLIPVGPIQWFRGAGPGRELIYNQKEGHF
PRVTTVSDLTKRNNMDFSIRIGNITPADAGTYYCVKFRKGSPDDVEFKSGAGTELSVRAKPS (SEQ ID NO:5), и связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α v2, содержащий аминокислотную последовательность EEELQVIQPDKSVSVAAGESAILHCTVTSLTPVGPIQWFRGAGPARELIYNQKEGHFP RVTTVSESTKRENMDFSISISNITPADAGTYYCVKFRKGSPDTEFKSGAGTELSVRA KPS (SEQ ID NO:6). В некоторых вариантах реализации антитело связывает внеклеточные домены (например, домены D1) трех, четырех, пяти, шести, семи, восьми, девяти или десяти разных человеческих вариантных полипептидов SIRP–α. В некоторых вариантах реализации каждый из трех, четырех, пяти, шести, семи, восьми, девяти или десяти разных человеческих вариантных полипептидов SIRP–α содержит внеклеточный домен (например, домен D1), содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 5, 6 и 76–83. В некоторых вариантах реализации способы дополнительно включают выявление связывания между антителом, полученным из клетки, и внеклеточным доменом (например, доменом D1) одного или более полипептидов SIRP–α, выбранных из группы, состоящей из обезьяньего полипептида SIRP–α, мышиного полипептида SIRP–α, человеческого полипептида SIRP–β и человеческого полипептида SIRP–γ. В некоторых вариантах реализации антитело связывает внеклеточный домен (например, домен D1) обезьяньего полипептида SIRP–α. В некоторых вариантах реализации обезьяний полипептид SIRP–α представляет собой полипептид SIRP–α яванского макака. В некоторых вариантах реализации антитело связывает внеклеточные домены (например, домены D1) по меньшей мере двух разных обезьяньих вариантных полипептидов SIRP–α. В некоторых вариантах реализации антитело связывает внеклеточный домен (например, домен D1) полипептида SIRP–α яванского макака, содержащий аминокислотную последовательность SEQ ID NO: 11, внеклеточный домен (например, домен D1) полипептида SIRP–α яванского макака, содержащий аминокислотную последовательность SEQ ID NO:12, или их оба. В некоторых вариантах реализации антитело связывает внеклеточный домен (например, домен D1) мышиного полипептида SIRP–α. В некоторых вариантах реализации антитело связывает внеклеточные домены (например, домены D1) двух или более разных мышиных вариантных полипептидов SIRP–α. В некоторых вариантах реализации антитело связывает внеклеточный домен (например, домен D1) одного или более мышиных полипептидов SIRP–α, и при этом каждый из одного или более мышиных полипептидов SIRP–α содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 7–10. В некоторых вариантах реализации антитело связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–β. В некоторых вариантах реализации антитело связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–γ, в некоторых вариантах реализации антитело не связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–β. В некоторых вариантах реализации антитело не связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–γ. В некоторых вариантах реализации антитело связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–β, содержащий аминокислотную последовательность SEQ ID NO: 13, внеклеточный домен (например, домен D1) человеческого полипептида SIRP–β, содержащий аминокислотную последовательность SEQ ID NO: 14, или их оба. В некоторых вариантах реализации антитело связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–γ, содержащий аминокислотную последовательность SEQ ID NO: 15. В некоторых вариантах реализации способы дополнительно включают выявление связывания или отсутствия связывания между антителом, полученным из клетки, и комплексом, содержащим вариант D1 SIRP–α, связанный с доменом IgSF CD47, причем вариант D1 SIRP–α представляет собой высокоаффинный домен D1 SIRP–α искусственного происхождения и при этом вариант D1 SIRP–α связывается с человеческим CD47 с аффинностью, которая по меньшей мере в 10 раз больше, чем аффинность связывания домена D1 SIRP–α природного происхождения с человеческим CD47. В некоторых вариантах реализации антитело связывает комплекс, содержащий вариант D1 SIRP–α, связанный с доменом IgSF CD47, причем вариант D1 SIRP–α представляет собой высокоаффинный домен D1 SIRP–α искусственного происхождения и при этом вариант D1 SIRP–α связывается с человеческим CD47 с аффинностью, которая по меньшей мере в 10 раз больше, чем аффинность связывания домена D1 SIRP–α природного происхождения с человеческим CD47. В некоторых вариантах реализации антитело не блокирует связывание между внеклеточным доменом (например, доменом D1) человеческого полипептида SIRP–α и доменом IgSF человеческого полипептида CD47. В некоторых вариантах реализации антитело не блокирует связывание между внеклеточным доменом (например, доменом D1) человеческого полипептида SIRP–α, экспрессируемого на поверхности первой клетки, и доменом IgSF человеческого полипептида CD47, экспрессируемого на поверхности второй клетки. В некоторых вариантах реализации антитело не связывает комплекс, содержащий вариант D1 SIRP–α, связанный с доменом IgSF CD47, причем вариант D1 SIRP–α представляет собой высокоаффинный домен D1 SIRP–α искусственного происхождения и при этом вариант D1 SIRP–α связывается с человеческим CD47 с аффинностью, которая по меньшей мере в 10 раз больше, чем аффинность связывания домена D1 SIRP–α природного происхождения с человеческим CD47. В некоторых вариантах реализации антитело блокирует связывание между внеклеточным доменом (например, доменом D1) человеческого полипептида SIRP–α и доменом IgSF человеческого полипептида CD47. В некоторых вариантах реализации антитело блокирует связывание между внеклеточным доменом (например, доменом D1) человеческого полипептида SIRP–α, экспрессируемого на поверхности первой клетки, и доменом IgSF человеческого полипептида CD47, экспрессируемого на поверхности второй клетки. В некоторых вариантах реализации связывание антитела с внеклеточным доменом (например, доменом D1) человеческого полипептида SIRP–α снижает аффинность человеческого полипептида SIRP–α в отношении связывания домена IgSF человеческого полипептида CD47. В некоторых вариантах реализации связывание антитела с внеклеточным доменом (например, доменом D1) человеческого полипептида SIRP–α, экспрессируемого на поверхности первой клетки, снижает аффинность человеческого полипептида SIRP–α в отношении связывания домена IgSF человеческого полипептида CD47, экспрессируемого на поверхности второй клетки. В некоторых вариантах реализации связывание антитела с внеклеточным доменом (например, доменом D1) человеческого полипептида SIRP–α повышает kдисс. человеческого полипептида SIRP–α в отношении связывания домена IgSF человеческого полипептида CD47. В некоторых вариантах реализации связывание антитела с внеклеточным доменом (например, доменом D1) человеческого полипептида SIRP–α, экспрессируемого на поверхности первой клетки, повышает kдисс. человеческого полипептида SIRP–α в отношении связывания домена IgSF человеческого полипептида CD47, экспрессируемого на поверхности второй клетки. В некоторых вариантах реализации антитело модулирует сигнализацию SIRP–α в клетке, экспрессирующей человеческий полипептид SIRP–α. В некоторых вариантах реализации клетка представляет собой лейкоцит, выбранный из группы, состоящей из макрофага, дендритной клетки, нейтрофила, эозинофила и миелоидной супрессорной клетки (МСК). В некоторых вариантах реализации антитело ингибирует сигнализацию SIRP–α в макрофаге, экспрессирующем человеческий полипептид SIRP–α. В некоторых вариантах реализации антитело усиливает фагоцитоз макрофагом, экспрессирующим человеческий полипептид SIRP–α.
[0035] Следует понимать, что одно, некоторые или все свойства различных вариантов реализации, описанных в данном документе, можно комбинировать, чтобы получить другие варианты реализации настоящего изобретения. Эти и другие аспекты изобретения станут понятны специалисту в данной области техники. Эти и другие варианты реализации изобретения дополнительно описаны в нижеприведенном подробном описании.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[0036] Фиг. 1A иллюстрирует выравнивание доменов D1 10 разных человеческих вариантных полипептидов SIRP–α. Приведенные последовательности соответствуют SEQ ID NO: 5, 6 и 76–83 (сверху вниз). Аминокислотные различия указаны звездочками.
[0037] Фиг. 1B иллюстрирует выравнивание между доменами D1 SIRP–α v1 человека, v2 человека, яванского макака и мышей 129. Приведенные последовательности соответствуют SEQ ID NO: 5, 6, 11 и 7 (сверху вниз). Аминокислотные различия указаны звездочками.
[0038] Фиг. 1C иллюстрирует выравнивание между различными человеческими и мышиными доменами D1 SIRP–α с указанием петель R1, R2 и R3. Показано выравнивание между доменами D1 SIRP–α v1 человека, v2 человека, мышей 129, мышей NOD, мышей C57BL/6 и мышей BALB/c. Приведенные последовательности соответствуют SEQ ID NO: 5–10 (сверху вниз). Аминокислотные различия указаны звездочками.
[0039] Фиг. 2 иллюстрирует выравнивание между доменами D1 SIRP–α v1 человека, v2 человека, яванского макака, мышей 129 и кур. Приведенные последовательности соответствуют SEQ ID NO: 5, 6, 11, 7 и 84 (сверху вниз). Аминокислотные различия указаны звездочками.
[0040] Фиг. 3A и 3B иллюстрируют специфичность связывания клона антитела S130 в отношении различных пептидов SIRP. Фиг. 3A иллюстрирует кривые связывания ELISA для антитела против доменов D1 SIRP–α v1 человека, v2 человека, мышей и яванского макака, а также человеческого SIRPγ (SEQ ID NO: 15) и преформированного комплекса из высокоаффинных вариантов SIRP–α, связанных с доменом IgSF CD47 (SEQ ID NO: 16). Преформированный комплекс создавали, смешивая два высокоаффинных человеческих полипептида SIRP–α v1 и v2 (SEQ ID NO: 17 и 19) в соотношении 1:1 и комбинируя смесь с CD47 для создания комплекса SIRP–α: CD47. Преформированный комплекс SIRP–α: CD47 на Фиг. 4A–9B готовили аналогично. Фиг. 3B обобщает данные по специфичности связывания для клона против каждой из этих мишеней («+» указывает на связывание; «–» указывает на отсутствие связывания).
[0041] Фиг. 4A и 4B иллюстрируют специфичность связывания клона антитела S121 в отношении различных пептидов SIRP. Фиг. 4A иллюстрирует кривые связывания ELISA для антитела против доменов D1 SIRP–α v1 человека, v2 человека, мышей и яванского макака, а также человеческого SIRPγ (SEQ ID NO: 15) и преформированного комплекса из высокоаффинных вариантов SIRP–α (SEQ ID NO:17 и 19), связанных с доменом IgSF CD47 (SEQ ID NO:16). Фиг. 4B обобщает данные по специфичности связывания для клона против каждой из этих мишеней («+» указывает на связывание; «–» указывает на отсутствие связывания).
[0042] Фиг. 5A и 5B иллюстрируют специфичность связывания клона антитела SI37 в отношении различных пептидов SIRP. Фиг. 5A иллюстрирует кривые связывания ELISA для антитела против доменов D1 SIRP–α v1 человека, v2 человека, мышей и яванского макака, а также человеческого SIRPγ (SEQ ID NO:15) и преформированного комплекса из высокоаффинных вариантов SIRP–α (SEQ ID NO: 17 и 19), связанных с доменом IgSF CD47 (SEQ ID NO: 16). Фиг. 5B обобщает данные по специфичности связывания для клона против каждой из этих мишеней («+» указывает на связывание; «–» указывает на отсутствие связывания).
[0043] Фиг. 6A и 6B иллюстрируют специфичность связывания клона антитела S128 в отношении различных пептидов SIRP. Фиг. 6A иллюстрирует кривые связывания ELISA для антитела против доменов D1 SIRP–α v1 человека, v2 человека, мышей и яванского макака, а также человеческого SIRPγ (SEQ ID NO: 15) и преформированного комплекса из высокоаффинных вариантов SIRP–α (SEQ ID NO:17 и 19), связанных с доменом IgSF CD47 (SEQ ID NO:16). Фиг. 6B обобщает данные по специфичности связывания для клона против каждой из этих мишеней («+» указывает на связывание; «–» указывает на отсутствие связывания).
[0044] Фиг. 7A и 7B иллюстрируют специфичность связывания клона антитела S135 в отношении различных пептидов SIRP. Фиг. 7A иллюстрирует кривые связывания ELISA для антитела против доменов D1 SIRP–α v1 человека, v2 человека, мышей и яванского макака, а также человеческого SIRPγ (SEQ ID NO: 15) и преформированного комплекса из высокоаффинных вариантов SIRP–α (SEQ ID NO:17 и 19), связанных с доменом IgSF CD47 (SEQ ID NO:16). Фиг. 7B обобщает данные по специфичности связывания для клона против каждой из этих мишеней («+» указывает на связывание; «–» указывает на отсутствие связывания).
[0045] Фиг. 8A и 8B иллюстрируют специфичность связывания клона антитела S126 в отношении различных пептидов SIRP. Фиг. 8A иллюстрирует кривые связывания ELISA для антитела против доменов D1 SIRP–α v1 человека, v2 человека, мышей и яванского макака, а также человеческого SIRPγ (SEQ ID NO: 15) и преформированного комплекса высокоаффинных вариантов SIRP–α (SEQ ID NO: 17 и 19), связанных с доменом IgSF CD47 (SEQ ID NO: 16). Фиг. 8B обобщает данные по специфичности связывания для клона против каждой из этих мишеней («+» указывает на связывание; «–» указывает на отсутствие связывания).
[0046] Фиг. 9A и 9B иллюстрируют специфичность связывания клона антитела S138 в отношении различных пептидов SIRP. Фиг. 9A иллюстрирует кривые связывания ELISA для антитела против доменов D1 SIRP–α v1 человека, v2 человека, мышей и яванского макака, а также человеческого SIRPγ (SEQ ID NO: 15) и преформированного комплекса высокоаффинных вариантов SIRP–α (SEQ ID NO: 17 и 19), связанных с доменом IgSF CD47 (SEQ ID NO:16). Фиг. 9B обобщает данные по специфичности связывания для клона против каждой из этих мишеней («+» указывает на связывание; «–» указывает на отсутствие связывания).
[0047] Фиг. 10A иллюстрирует выравнивание доменов VH и VL клонов scFv–Fc, полученных от кур дикого типа. Приведены SEQ ID NO:53–60 (в порядке сверху вниз на выравнивании). Последовательности CDR и линкеров указаны линиями. Аминокислотные различия указаны звездочками.
[0048] Фиг. 10B иллюстрирует выравнивание доменов VH и VL клонов scFv–Fc, полученных от кур, вырабатывающих человеческие антитела. Приведены SEQ ID NO:61–74 (в порядке сверху вниз на выравнивании). Последовательности CDR и линкеров указаны линиями. Аминокислотные различия указаны звездочками.
[0049] Фиг. 11A иллюстрирует выравнивание доменов VH и VL клонов семейства 2. Аминокислотные последовательности доменов VH представлены SEQ ID NO: 294, 139, 358, 362, 354, 380, 384, 350, 137, 374, 356, 352, 135, 348, 376, 346, 342, 344, 141, 360, 370, 382, 364, 366, 368, 372 и 378 (в порядке сверху вниз на выравнивании). Аминокислотные последовательности доменов VL представлены SEQ ID NO: 295, 363, 140, 359, 355, 351, 136, 349, 377, 138, 375, 357, 353, 381, 385, 345, 365, 367, 369, 347, 142, 343, 371, 379, 383, 361 и 373 (в порядке сверху вниз на выравнивании). Последовательности HVR указаны линиями. HVR приведены в соответствии с Kabat. Аминокислотные различия указаны звездочками.
[0050] Фиг. 11B иллюстрирует выравнивание доменов VH и VL клонов семейства 3. Аминокислотные последовательности доменов VH представлены SEQ ID NO: 133, 128, 396, 386, 398,402, 392, 388, 390, 394 и 400 (в порядке сверху вниз на выравнивании). Аминокислотные последовательности доменов VL представлены SEQ ID NO: 134, 105, 387, 389, 395, 397, 399, 403, 391, 393,и 401 (в порядке сверху вниз на выравнивании). Последовательности HVR указаны линиями. HVR приведены в соответствии с Kabat. Аминокислотные различия указаны звездочками.
[0051] Фиг. 11С иллюстрирует выравнивание доменов VH и VL клонов семейства 4. Аминокислотные последовательности доменов VH представлены SEQ ID NO: 116, 117, 118, 119, 282, 404 и 406 (в порядке сверху вниз на выравнивании). Аминокислотные последовательности доменов VL представлены SEQ ID NO: 93, 94, 95, 96, 283, 405 и 407 (в порядке сверху вниз на выравнивании). Последовательности HVR указаны линиями. HVR приведены в соответствии с Kabat. Аминокислотные различия указаны звездочками.
[0052] Фиг. 11D иллюстрирует выравнивание доменов VH и VL семейства 5, клонов группы 4. Аминокислотные последовательности доменов VH представлены SEQ ID NO: 278 и 412 (в порядке сверху вниз на выравнивании). Аминокислотные последовательности доменов VL представлены SEQ ID NO: 279 и 413 (в порядке сверху вниз на выравнивании). Последовательности HVR указаны линиями. HVR приведены в соответствии с Kabat. Аминокислотные различия указаны звездочками.
[0053] Фиг. 11E иллюстрирует выравнивание доменов VH и VL дополнительных клонов группы 4 семейства 5. Аминокислотные последовательности доменов VH представлены SEQ ID NO: 275 и 414 (в порядке сверху вниз на выравнивании). Аминокислотные последовательности доменов VL представлены SEQ ID NO: 276 и 415 (в порядке сверху вниз на выравнивании). Последовательности HVR и линкеров указаны линиями. HVR приведены в соответствии с Kabat.
Аминокислотные различия указаны звездочками.
[0054] Фиг. 11F иллюстрирует последовательности доменов VH и VL (SEQ ID NO: 280 и 281, соответственно, семейство 5, клон S209 группы 4. Последовательности HVR подчеркнуты.
[0055] Фиг. 11G иллюстрирует выравнивание доменов VH и VL семейства 5, клонов группы 5. Аминокислотные последовательности доменов VH представлены SEQ ID NO: 123 и 292 (в порядке сверху вниз на выравнивании). Аминокислотные последовательности доменов VL представлены SEQ ID NO: 100 и 293 (в порядке сверху вниз на выравнивании). Последовательности HVR указаны линиями. HVR приведены в соответствии с Kabat. Аминокислотные различия указаны звездочками.
[0056] Фиг. 11H иллюстрирует выравнивание доменов VH и VL дополнительных клонов группы 5 семейства 5. Аминокислотные последовательности доменов VH представлены SEQ ID NO: 288, 290, 408 и 410 (в порядке сверху вниз на выравнивании). Аминокислотные последовательности доменов VL представлены SEQ ID NO: 289, 291, 409 и 411 (в порядке сверху вниз на выравнивании). Последовательности HVR указаны линиями. HVR приведены в соответствии с Kabat. Аминокислотные различия указаны звездочками.
[0057] Фиг. 11I иллюстрирует последовательности доменов VH и VL клона 149 (SEQ ID NO: 286 и 287, соответственно) и клона 218 (SEQ ID NO: 284 и 285, соответственно). Последовательности HVR подчеркнуты.
[0058] Фиг. 11J иллюстрирует выравнивание доменов VH и VL клонов семейства 1. Аминокислотные последовательности доменов VH представлены SEQ ID NO: 120, 121, 130 и 122 (в порядке сверху вниз на выравнивании). Аминокислотные последовательности доменов VL представлены SEQ ID NO: 97, 98, 107 и 99 (в порядке сверху вниз на выравнивании). Последовательности HVR указаны линиями. HVR приведены в соответствии с Kabat. Аминокислотные различия указаны звездочками.
[0059] Фиг. 12A–12C иллюстрируют профили связывания, полученные методом поверхностного плазмонного резонанса (ППР), репрезентативных клонов антител, связывающих преформированный комплекс из высокоаффинного варианта SIRP–α (SEQ ID NO: 18), смешанного с возрастающими концентрациями домена IgSF CD47 (SEQ ID NO:16). Фиг. 12A иллюстрирует кривую связывания клона антитела (S123), которое не блокирует связывание CD47 с SIRP–α (например, неблокирующего антитела). Фиг. 12B иллюстрирует кривую связывания клона антитела (S119), которое блокирует связывание CD47 с SIRP–α (например, блокирующего антитела). Фиг. 12C иллюстрирует кривую связывания клона антитела (S118), которое связывает SIRP–α и снижает его аффинность в отношении связывания CD47 (например, «отталкивающего» антитела).
[0060] Фиг. 13A–13G иллюстрируют результаты in vitro анализа фагоцитоза опухолевых клеток с применением макрофагов, обработанных анти–SIRP–α антителом (в указанном ряде концентраций), цетуксимабом или трастузумабом, анти–SIRP–α антителом плюс цетуксимабом или трастузумабом или контрольным антителом (IgG1, κ), как указано. Макрофаги, осуществлявшие фагоцитоз опухолевых клеток, были определены как клетки, положительные в отношении CD33, CD206 и CFSE, методом проточной цитометрии. В этом анализе опухолевые клетки представляли собой клетки DLD–1 (Фиг. 13A–13D и 13G) или OE19 (Фиг. 13E и 13F). Исследуемые анти–SIRP–α антитела представляли собой AB3a (Фиг. 13A и 13B), AB45a (Фиг. 13C и 13D), AB119a (Фиг. 13E), AB135a (Фиг. 13F) и AB136c (Фиг. 13G).
[0061] Фиг. 14 иллюстрирует результаты in vivo анализа активации дендритных клеток для дендритных клеток, выделенных из селезенки мышей Balb/c, обработанных анти–SIRP–α антителом AB136b, контрольным крысиным антимышиным анти–SIRP–α антагонистическим антителом (клон p84), крысиным контрольным IgG или мышиным контрольным IgG, как указано. Мышей внутривенно инъецировали указанным антителом при 10 мг/кг, а селезенки вырезали через пять часов после инъекции. Измерения маркера активации CD86 на дендритных клетках проводили методом проточной цитометрии.
[0062] Фиг. 15 иллюстрирует результаты in vivo сингенной модели карциномы толстой кишки мышей для оценки активности отдельного агента. Клетки MC38 подкожно имплантировали мышам C57BL/6 и рандомизировали животных по группам (8 мышей/группа). Мышей обрабатывали базовым раствором (ФСБ), CD47–блокирующим анти–SIRP–α антителом AB25b, CD47–блокирующим анти–SIRP–α антителом AB25c, CD47–блокирующим анти–SIRP–α антителом AB27b, не блокирующим CD47 анти–SIRP–α антителом AB3b или не блокирующим CD47 анти–SIRP–α антителом 136b. Обработку начинали, когда опухоли достигали в среднем 60 мм3, на 7 сутки после имплантации. Мышей внутрибрюшинно (В/Б) дозировали дозой 10 мг/кг анти–SIRP–α антител дважды в неделю в течение трех недель. Животных умерщвляли, когда опухоли достигали объема ~2000 мм3.
[0063] Фиг. 16 иллюстрирует результаты in vivo сингенной модели карциномы толстой кишки мышей для оценки активности отдельного агента. Клетки CT26 подкожно имплантировали мышам BALB/c (использовали 8–9 мышей на группу), которых обрабатывали AB136b или базовым раствором (ФСБ), как указано. Обработку начинали, когда опухоли достигали в среднем 80 мм3, на 7 сутки после имплантации. Мышей внутрибрюшинно (В/Б) дозировали дозой 3 мг/кг или 10 мг/кг анти–SIRP–α антител дважды в неделю в течение трех недель. Животных умерщвляли, когда опухоли достигали объема ~2000 мм3.
[0064] Фиг. 17A иллюстрирует сравнение связывания CD47 и Fab клона анти–SIRP–α антитела 119 с SIRP–α, определенного методом рентгеновской кристаллографии.
[0065] Фиг. 17B иллюстрирует участок взаимодействия между Fab клона анти–SIRP–α антитела 119 и SIRP–α, определенный методом анализа площади погруженной поверхности. Остатки SIRP–α, входящие в состав эпитопа связывания Fab антитела 119, затенены в соответствии с изменениями площади погруженной поверхности. Указаны ключевые остатки антитела в паратопе SIRP–α: (H) = остаток тяжелой цепи; (L) = остаток легкой цепи.
[0066] Фиг. 18A иллюстрирует сравнение связывания CD47 и Fab клона анти–SIRP–α антитела 136 с SIRP–α, определенного методом рентгеновской кристаллографии.
[0067] Фиг. 18B иллюстрирует участок взаимодействия между Fab клона анти–SIRP–α антитела 136 и SIRP–α, определенный методом анализа площади погруженной поверхности. Остатки SIRP–α, входящие в состав эпитопа связывания Fab антитела 136, затенены в соответствии с изменениями площади погруженной поверхности. Указаны ключевые остатки антитела в паратопе SIRP–α: (H) = остаток тяжелой цепи; (L) = остаток легкой цепи.
[0068] Фиг. 19A иллюстрирует сравнение связывания CD47 и Fab клона анти–SIRP–α антитела 3 с SIRP–α, определенного методом рентгеновской кристаллографии.
[0069] Фиг. 19B иллюстрирует участок взаимодействия между Fab клона анти–SIRP–α антитела 3 и SIRP–α, определенный методом анализа площади погруженной поверхности. Остатки SIRP–α, входящие в состав эпитопа связывания Fab антитела 3, затенены в соответствии с изменениями площади погруженной поверхности. Указаны ключевые остатки антитела в паратопе SIRP–α: (H) = остаток тяжелой цепи; (L) = остаток легкой цепи.
[0070] Фиг. 19C иллюстрирует сравнение связывания CD47 и Fab клона анти–SIRP–α антитела 115 с SIRP–α, определенного методом рентгеновской кристаллографии.
[0071] Фиг. 19D иллюстрирует участок взаимодействия между Fab клона анти–SIRP–α антитела 115 и SIRP–α, определенный методом анализа замаскированной поверхности. Остатки SIRP–α, входящие в состав эпитопа связывания Fab антитела 115, затенены в соответствии с изменениями площади погруженной поверхности. Указаны ключевые остатки антитела в паратопе SIRP–α: (H) = остаток тяжелой цепи; (L) = остаток легкой цепи.
[0072] Фиг. 20A иллюстрирует сравнение связывания CD47, клона анти–SIRP–α антитела 119 Fab, клона анти–SIRP–α антитела 136 Fab, клона анти–SIRP–α антитела 3 Fab, клона анти–SIRP–α антитела 115 Fab с SIRP–α, определяемого методом рентгеновской кристаллографии.
[0073] Фиг. 20B иллюстрирует эпитопы связывания CD47, Fab клона анти–SIRP–α антитела 119, Fab клона анти–SIRP–α антитела 136, Fab клона анти–SIRP–α антитела 3 и Fab клона анти–SIRP–α антитела 115 с SIRP–α, определенные методом рентгеновской кристаллографии. Значения указывают разницу между доступной площадью поверхности каждого атома остатка в Fab/CD47 при анализе в отдельности и в комплексе с SIRP–α, выраженную в виде площади погруженной поверхности (Å2). Нумерация остатков приведена в соответствии с SEQ ID NO: 296.
[0074] Фиг. 21A иллюстрирует блок–схему эпитоп–специфической сортировки анти–SIRP–α антител.
[0075] Фиг. 21B иллюстрирует результаты типового анализа для эпитоп–специфической сортировки анти–SIRP–α антител A, B, C, D, E и F.
[0076] Фиг. 22A и 22B иллюстрируют результаты эпитоп–специфической сортировки указанных анти–SIRP–α антител. Номер клона для лиганда (анти–SIRPα), связанного с чипом, указан в строке, а номер клона для аналитов (анти–SIRPα), проводимых через чип, указан в колонке. Белые клетки соответствуют антителам, которые образуют сандвич–структуры (и считается, что они связывают разные эпитопы). Серые клетки соответствуют антителам, которые не образуют сандвич–структуры (и считается, что они связывают один эпитоп). «Х» указаны случаи, когда данные для одной ориентации не согласуются с данными для другой.
[0077] Фиг. 23 представляет модель связывания анти–SIRP–α антитела и CD47 с доменом D1 SIRP–α на основании эпитоп–специфической сортировки. Представлены (и помечены номером) репрезентативные клоны антител для каждой группы.
[0078] Фиг. 24A иллюстрирует выравнивание между тяжелой цепью родительского 119 («119_VH_Wt»), тяжелой цепью варианта 119 с 4 мутациями (3 обратные мутации до последовательности зародышевой линии в каркасной области и одна мутация в CDR–H1 с удалением потенциальной горячей точки окисления; «VH_MutALL»), тяжелой цепью варианта 119 с 3 мутациями (3 обратные мутации до последовательности зародышевой линии только в каркасной области; «VH_MutAll_V34M») и тяжелой цепью варианта 119 с 3 мутациями и мутацией M34L (3 обратные мутации до последовательности зародышевой линии в каркасной области; «VH_MulAll_V34L»). Приведенные последовательности представляют собой: SEQ ID NO:335 для 119_VH_Wt, SEQ ID NO:246 для VH_MutALL, SEQ ID NO:258 для VH_MutAll_V34M и SEQ ID NO:327 для VH_MutAlL_V34L. Последовательности CDR указаны линиями; аминокислотные различия указаны звездочками.
[0079] Фиг. 24B иллюстрирует выравнивание между легкой цепью родительского 119 («119_VL_Wt») и легкой цепью варианта 119 с 4 мутациями (4 обратные мутации до последовательности зародышевой линии в каркасной области; «VL_mutAll»). Приведенные последовательности представляют собой: SEQ ID NO: 97 для 119_VL_Wt и SEQ ID NO:312 для VL_mutAll, последовательности CDR указаны линиями; аминокислотные различия указаны звездочками.
[0080] Фиг. 25A иллюстрирует выравнивание между легкой цепью родительского 135 («VL_wt») и легкой цепью варианта 135 с 2 мутациями (2 обратные мутации до последовательности зародышевой линии в каркасной области; «VL_mutAll»). Приведенные последовательности представляют собой: SEQ ID NO: 104 для 135 VL_wt и SEQ ID NO:248 для 135 VL_MutALL. Последовательности HVR указаны линиями; аминокислотные различия указаны звездочками.
[0081] Фиг. 25B иллюстрирует выравнивание между тяжелой цепью родительского 135 («VH_wt»), тяжелой цепью варианта 135 с 6 мутациями (5 обратных мутаций до последовательности зародышевой линии в каркасной области и одна мутация в CDR–H1 с удалением потенциальной горячей точки окисления; «VH_MutAII»), тяжелой цепью варианта 135 с 5 обратными мутациями до последовательности зародышевой линии в каркасной области («VH_MutAll_V34M») и тяжелой цепью варианта 135 с 5 обратными мутациями до последовательности зародышевой линии в каркасной области и мутацией M34L («VH_MutALL_V34L»). Приведенные последовательности представляют собой: SEQ ID NO:341 для VH_wt, SEQ ID NO:247 для VH_MutAll и SEQ ID NO:259 для VH_MutAll_V34M и SEQ ID NO: 328 для VH_MutAll_V34L. Последовательности HVR указаны линиями; аминокислотные различия указаны звездочками.
[0082] Фиг. 26A иллюстрирует выравнивание между легкой цепью родительского 136 («VL_wt»), легкой цепью варианта 136 с 4 мутациями (4 обратные мутации до последовательности зародышевой линии в каркасной области; «VL_mutaLL»), легкой цепью варианта 136 с одной обратной мутацией I2T до последовательности дикого типа в полностью мутированном («all mut») окружении («VL_Mutall_I2T»). Приведенные последовательности представляют собой: SEQ ID NO: 134 для VL_wt, SEQ ID NO:250 для VL_mutall и SEQ ID NO:251 для VL_Mutall_I2T. Последовательности HVR указаны линиями; аминокислотные различия указаны звездочками.
[0083] Фиг. 26B иллюстрирует выравнивание между тяжелой цепью родительского 136 («VH_wt»), тяжелой цепью варианта 136 с 6 мутациями (5 обратных мутаций до последовательности зародышевой линии в каркасной области и одна мутация в CDR–H1 с удалением потенциальной горячей точки окисления; «VH_mutall»), тяжелой цепью варианта 136 с 5 обратными мутациями до последовательности зародышевой линии в каркасной области («VH_Mutall_V34M») и тяжелой цепью варианта 136 с 5 обратными мутациями до последовательности зародышевой линии в каркасной области и мутацией M34L («VH_Mutall_V34L»). Приведенные последовательности представляют собой: SEQ ID NO: 133 для VH_wt, SEQ ID NO:249 для VH_mutall, SEQ ID NO:260 для VH_Mutall_V34M, и SEQ ID NO:329 для VH_Mutall_V34L. Последовательности HVR указаны линиями; аминокислотные различия указаны звездочками.
[0084] Фиг. 27A иллюстрирует аффинность связывания вариантов антитела 136 с шестью белками SIRP–α: человеческим SIRP–α v1 (SEQ ID NO:5), человеческим SIRP–α v2 (SEQ ID NO:6), SIRP–α яванского макака (SEQ ID NO: 11), SIRP–α мышей NOD (SEQ ID NO:8), SIRP–α мышей BL/6 (SEQ ID NO:9) и SIRP–α мышей BALB/c (SEQ ID NO: 10). Варианты антител имели мутантные («мут» или «mut») или родительские («дт» или «wt») легкие цепи и мутантные или родительские тяжелые цепи, как указано в порядке легкая цепь/тяжелая цепь. На графике по оси y указано соотношение KД mut/KД wt. Соотношение 1 указывает на то, что антитело имеет эквивалентную KД с антителом wt/wt (дт/дт) (указано пунктирной линией); соотношение >1 указывает на меньшую аффинность, чем у wt/wt; а соотношение <1 указывает на большую аффинность, чем у wt/wt.
[0085] Фиг. 27B иллюстрирует аффинность связывания вариантов антитела 136 с семью белками SIRP–α: SIRP–α мышей BL/6 (SEQ ID NO:9), SIRP–α мышей NOD (SEQ ID NO:8), SIRP–α мышей BALB/c (SEQ ID NO: 10), человеческим SIRP–α v1 (SEQ ID NO:5), человеческим SIRP–α v2 (SEQ ID NO:6), SIRP–α яванского макака (SEQ ID NO: 11) и человеческим SIRP–γ v1 (SEQ ID NO: 15). Кроме исследования wt 136 (дикого типа) и all mutant 136 (вариант, содержащий все мутации) конструировали варианты с удалением каждой отдельной мутации в содержащем все мутации окружении легкой цепи. На графике по оси y указано соотношение KД mut/KД wt. Соотношение 1 означает, что антитело имеет эквивалентную KД с антителом wt/wt (указано пунктирной линией); соотношение >1 указывает на меньшую аффинность, чем у wt/wt; а соотношение <1 указывает на большую аффинность, чем у wt/wt.
[0086] Фиг. 28 иллюстрирует сравнение результатов экспрессии и аффинности связывания антител, имеющих указанные человеческие тяжелые цепи и гуманизированные легкие цепи, в клетках 293–FS FreeStyle™ (Thermo Fisher).
[0087] Фиг. 29 иллюстрирует выравнивание между VL–доменами Hum1, Hum 8 и Hum9. Hum 8 был создан на основе Hum1, но с 5 аминокислотными заменами вблизи или в HVR–L1 и –L2, которые повышают человекоподобность. Hum 9 был создан на основе Hum1, но с 4 аминокислотными заменами вблизи или в HVR–L1 и –L2, которые повышают человекоподобность. Представлены SEQ ID NO: 252 (Huml), 416 (Hum 8) и 262 (Hum9). Последовательности HVR указаны линиями; аминокислотные различия указаны звездочками.
[0088] Фиг. 30 иллюстрирует выравнивание между вариантом антитела 21 с обратными мутациями до зародышевой линии («HC_MutAll»), вариантом антитела 21 с обратными мутациями до зародышевой линии и мутацией в CDR–H1 с удалением потенциальной горячей точки окисления M34V («HC_MutAll_M34V»), вариантом антитела 21 с обратными мутациями до зародышевой линии и мутацией M34L («HC_MutAll_M34L»), вариантом антитела 25 с обратными мутациями до зародышевой линии («HC_MutAll»), вариантом антитела 25 с обратными мутациями до зародышевой линии и мутацией в CDR–H1 с удалением потенциальной горячей точки окисления M34V («HC_MutAll_M34V»), вариантом антитела 25 с обратными мутациями до зародышевой линии и мутацией M34L («HC_MutAll_M34L»), вариантом антитела 27 с обратными мутациями до зародышевой линии («HC_MutAll»), вариантом антитела 27 с обратными мутациями до зародышевой линии и мутацией в CDR–H1 с удалением потенциальной горячей точки окисления M34V («HC_MutAll_M34V») и вариантом антитела 27 с обратными мутациями до зародышевой линии и мутацией M34L («HC_MutAll_M34L»). Приведенные последовательности представляют собой SEQ ID NO: 263, 264, 330, 267, 268, 332, 265, 266 и 331 (сверху вниз). Последовательности HVR указаны линиями; аминокислотные различия указаны звездочками.
[0089] Фиг. 31 иллюстрирует результаты in vitro анализа фагоцитоза с применением клеток HER2(+) OE19 в качестве мишени и макрофагов M2 в качестве клеток, осуществляющих фагоцитоз. «Отталкивающие» анти–SIRP–α антитела исследовали в указанных концентрациях в комбинации с анти–HER2 антителом трастузумабом. Фагоцитоз определяли по процентному содержанию клеток CFSE+.
[0090] Фиг. 32 иллюстрирует результаты in vitro анализа фагоцитоза с применением клеток EGFR(+) DLD–1 в качестве мишени и макрофагов M2 в качестве клеток, осуществляющих фагоцитоз. Неблокирующие анти–SIRP–α антитела исследовали в указанных концентрациях в комбинации с анти–EGFR антителом цетуксимабом. Фагоцитоз определяли по процентному содержанию клеток CFSE+.
[0091] Фиг. 33A–33C иллюстрируют результаты in vitro анализа фагоцитоза с применением клеток EGFR(+) DLD–1 в качестве мишени и макрофагов M2 в качестве клеток, осуществляющих фагоцитоз. Анти–SIRP–α антитела исследовали в указанных концентрациях в комбинации с анти–EGFR антителом цетуксимабом. Фагоцитоз определяли по процентному содержанию клеток CFSE+.
[0092] Фиг. 34 иллюстрирует результаты in vitro анализа фагоцитоза с применением клеток EGFR(+) DLD–1 в качестве мишени и макрофагов M2 в качестве клеток, осуществляющих фагоцитоз. Каждое из неблокирующих анти–SIRP–α антител 27 и 136 исследовали в виде полноразмерного антитела (с Fc–областью) или фрагмента F(ab)2 в указанных концентрациях в комбинации с анти–EGFR антителом цетуксимабом. Фагоцитоз определяли по процентному содержанию клеток CFSE+.
[0093] Фиг. 35 иллюстрирует результаты in vitro анализа фагоцитоза с применением клеток EGFR(+) DLD–1 в качестве мишени и макрофагов M2 в качестве клеток, осуществляющих фагоцитоз. Блокирующие варианты анти–SIRP–α антитела 119 исследовали в указанных концентрациях в комбинации с анти–EGFR антителом цетуксимабом. Фагоцитоз определяли по процентному содержанию клеток CFSE+.
[0094] Фиг. 36 иллюстрирует результаты in vitro анализа фагоцитоза с применением клеток EGFR(+) DLD–1 в качестве мишени и макрофагов M2 в качестве клеток, осуществляющих фагоцитоз. Блокирующие варианты анти–SIRP–α антитела 135 исследовали в указанных концентрациях в комбинации с анти–EGFR антителом цетуксимабом. Фагоцитоз определяли по процентному содержанию клеток CFSE+.
[0095] Фиг. 37 иллюстрирует результаты in vitro анализа фагоцитоза с применением клеток EGFR(+) DLD–1 в качестве мишени и макрофагов M2 в качестве клеток, осуществляющих фагоцитоз. Неблокирующие анти–SIRP–α антитела исследовали в указанных концентрациях в комбинации с анти–EGFR антителом цетуксимабом. Фагоцитоз определяли по процентному содержанию клеток CFSE+.
[0096] Фиг. 38A–38B иллюстрируют результаты in vivo анализа активации дендритных клеток указанными анти–SIRP–α антителами. Мышей внутривенно инъецировали указанным антителом при 10 мг/кг, а селезенки вырезали через пять часов после инъекции. Измерения маркеров активации CD86, ГКГСII и CCR7 на дендритных клетках CD4+ проводили методом проточной цитометрии.
[0097] Фиг. 39A иллюстрирует результаты in vitro анализа фагоцитоза с применением клеток EGFR(+) DLD–1 в качестве мишени и макрофагов M2 в качестве клеток, осуществляющих фагоцитоз. Варианты анти–SIRP–α антител 218a и 218 исследовали в указанных концентрациях в комбинации с анти–EGFR антителом цетуксимабом. Фагоцитоз определяли по процентному содержанию клеток CFSE+.
[0098] Фиг. 39B иллюстрирует результаты in vitro анализа фагоцитоза с применением клеток EGFR(+) DLD–1 в качестве мишени и макрофагов M2 в качестве клеток, осуществляющих фагоцитоз. Типовые блокирующие анти–SIRP–α антитела 119a, 120a и 122a исследовали в указанных концентрациях. Фагоцитоз определяли по процентному содержанию клеток CFSE+.
[0099] Фиг. 39C иллюстрируют результаты in vitro анализа фагоцитоза с применением клеток EGFR(+) DLD–1 в качестве мишени и макрофагов M2 в качестве клеток, осуществляющих фагоцитоз. Типовые неблокирующие анти–SIRP–α антитела 136a и 137a исследовали в указанных концентрациях. Фагоцитоз определяли по процентному содержанию клеток CFSE+.
[0100] Фиг. 39D иллюстрируют результаты in vitro анализа фагоцитоза с применением клеток EGFR(+) DLD–1 в качестве мишени и макрофагов M2 в качестве клеток, осуществляющих фагоцитоз. Типовые отталкивающие анти–SIRP–α антитела 115a, 116a, 117a, 118a и 132a исследовали в указанных концентрациях. Фагоцитоз определяли по процентному содержанию клеток CFSE+.
[0101] Фиг. 40 иллюстрируют результаты in vivo сингенной модели карциномы толстой кишки мышей для оценки активности комбинирования обработки анти–SIRP–α с ингибированием пути PD–L1/PD–1. Клетки CT26 подкожно имплантировали мышам C57BL/6 и рандомизировали животных по группам (8 мышей/группа). Мышей обрабатывали базовым раствором (ФСБ), анти–PD–L1 антителом, CD47–блокирующим анти–SIRP–α антителом AB25b или AB25b и PD–L1. Обработку начинали, когда опухоли достигали в среднем 60 мм3, на 7 сутки после имплантации. Мышей дозировали внутрибрюшинно (В/Б) дозой 10 мг/кг дважды в неделю в течение трех недель и умерщвляли, когда опухоли достигали объема ~2000 мм3.
[0102] Фиг. 41 иллюстрируют результаты in vivo сингенной модели карциномы толстой кишки мышей для оценки активности комбинирования обработки анти–SIRP–α с ингибированием пути PD–L1/PD–1. Клетки MC38 подкожно имплантировали мышам C57BL/6 и рандомизировали животных по группам (8 мышей/группа). Мышей обрабатывали базовым раствором (ФСБ), анти–PD–1 антителом, CD47–блокирующим анти–SIRP–α антителом AB25b, AB25b и анти–PD–1, CD47–неблокирующим анти–SIRP–α антителом AB136b или AB136b и анти–PD–1. Обработку начинали, когда опухоли достигали в среднем 60 мм3, на 7 сутки после имплантации. Мышей дозировали внутрибрюшинно (В/Б) дозой 10 мг/кг дважды в неделю в течение трех недель и умерщвляли, когда опухоли достигали объема ~2000 мм3.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0103] В настоящем изобретении описаны антитела, которые связывают внеклеточные домены (например, домены D1) одного или более человеческих полипептидов SIRP–α и имеют различные представляющие потенциальный интерес профили связывания SIRP–α. Эти уникальные профили связывания SIRP–α включают одну или более из следующих связывающих способностей, которые можно комбинировать многофакториальным образом для получения ряда вариантов с уникальной специфичностью. Например, антитело может связывать внеклеточные домены (например, домены D1) человеческого SIRP–α v1, человеческого SIRP–α v2 или их оба; антитело может связывать внеклеточные домены (например, домены D1) одного или более обезьяньих полипептидов SIRP–α или оно может не связываться с ними; антитело может связывать внеклеточные домены (например, домены D1) одного или более мышиных полипептидов SIRP–α или оно может не связываться с ними; антитело может связывать внеклеточный домен (например, домен D1) человеческого полипептида SIRP–β или оно может не связываться с ним; и/или антитело может связывать внеклеточный домен (например, домен D1) человеческого полипептида SIRP–γ или оно может не связываться с ним. Кроме того, в настоящем изобретении описаны антитела, которые блокируют связывание CD47 с SIRP–α, антитела, которые не блокируют связывание CD47 с SIRP–α, и антитела, которые не блокируют связывание CD47 с SIRP–α, но снижают аффинность SIRP–α в отношении CD47, что приводит к более быстрой диссоциации комплекса CD47/SIRP–α. Кроме того, в настоящем изобретении описаны анти–SIRP–α антитела с одним или более in vitro и/или in vivo биологическими свойствами, представляющими интерес, такими как способность усиливать фагоцитоз макрофагами, усиливать активацию дендритных клеток, ингибировать in vivo рост опухоли, которая экспрессирует CD47, и/или способность осуществлять один или более из этих видов активности, не предотвращая взаимодействия между CD47–экспрессирующей клеткой и Т–клеткой.
[0104] Описанные в данном документе способы можно применять для идентификации антител с уникальными комбинациями вышеуказанных вариантов специфичности связывания. Не ограничиваясь теорией считается, что возможность идентифицировать уникальные анти–SIRP–α антитела с разными профилями связывания, описанными выше, позволяет идентифицировать антитела (например, описанные в данном документе) с необходимыми клиническими свойствами и преимуществами для доклинических исследований.
[0105] В одном аспекте в данном документе предложены выделенные антитела, которые связывают внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α v1, внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α v2 или их оба. Дополнительно в данном документе предложены полинуклеотиды и векторы, кодирующие антитела согласно настоящему изобретению, а также связанные с ними способы получения антител.
[0106] В другом аспекте в данном документе предложены способы лечения или замедления прогрессирования рака у индивида, включающие введение индивиду эффективного количества антитела согласно настоящему изобретению.
[0107] В другом аспекте в данном документе предложены способы лечения или замедления прогрессирования аутоиммунного или воспалительного заболевания у индивида, включающие введение индивиду эффективного количества антитела согласно настоящему изобретению.
[0108] В другом аспекте в данном документе предложены способы идентификации антигенсвязывающего домена, который связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α и не блокирует связывание между человеческим CD47 и человеческим полипептидом SIRP–α. В некоторых вариантах реализации способы включают (a) обеспечение антигенсвязывающего домена, который связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α; (b) получение комплекса, содержащего вариант D1 SIRP–α, связанный с полипептидом, содержащим домен IgSF CD47, при этом вариант D1 SIRP–α представляет собой высокоаффинный домен D1 SIRP–α искусственного происхождения и при этом вариант D1 SIRP–α связывается с человеческим CD47 с аффинностью, которая по меньшей мере в 10 раз больше, чем аффинность связывания домена D1 SIRP–α природного происхождения с человеческим CD47; (с) приведение в контакт антигенсвязывающего домена с полученным комплексом; и (d) выявление связывания антигенсвязывающего домена с комплексом, причем связывание антигенсвязывающего домена с комплексом указывает на то, что антигенсвязывающий домен не блокирует связывание между человеческим CD47 и человеческим полипептидом SIRP–α. В другом аспекте в данном документе предложены способы идентификации антигенсвязывающего домена, который связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α и не блокирует связывание между человеческим CD47 и человеческим полипептидом SIRP–α. В некоторых вариантах реализации способы включают приведение в контакт антигенсвязывающего домена или антитела, которое связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α, с комплексом, содержащим вариант D1 SIRP–α, связанный с полипептидом, содержащим домен IgSF CD47, причем вариант D1 SIRP–α представляет собой высокоаффинный домен D1 SIRP–α искусственного происхождения и при этом вариант D1 SIRP–α связывается с человеческим CD47 с аффинностью, которая по меньшей мере в 10 раз больше, чем аффинность связывания домена D1 SIRP–α природного происхождения с человеческим CD47; и выявление связывания антигенсвязывающего домена с комплексом, причем связывание антигенсвязывающего домена с комплексом указывает на то, что антигенсвязывающий домен не блокирует связывание между человеческим CD47 и человеческим полипептидом SIRP–α.
[0109] В другом аспекте в данном документе предложены способы идентификации антигенсвязывающего домена, который связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α и блокирует связывание между человеческим CD47 и человеческим полипептидом SIRP–α. В некоторых вариантах реализации способ включает (a) обеспечение антигенсвязывающего домена, который связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α; (b) получение комплекса, содержащего вариант D1 SIRP–α, связанный с полипептидом, содержащим домен IgSF CD47, при этом вариант D1 SIRP–α представляет собой высокоаффинный домен D1 SIRP–α искусственного происхождения и при этом вариант D1 SIRP–α связывается с человеческим CD47 с аффинностью, которая по меньшей мере в 10 раз больше, чем аффинность связывания домена D1 SIRP–α природного происхождения с человеческим CD47; (с) приведение в контакт антигенсвязывающего домена с полученным комплексом; и (d) выявление связывания антигенсвязывающего домена с комплексом, причем отсутствие связывания антигенсвязывающего домена с комплексом указывает на то, что антигенсвязывающий домен блокирует связывание между человеческим CD47 и человеческим полипептидом SIRP–α. В другом аспекте в данном документе предложены способы идентификации антигенсвязывающего домена, который связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α и блокирует связывание между человеческим CD47 и человеческим полипептидом SIRP–α. В некоторых вариантах реализации способ включает приведение в контакт антигенсвязывающего домена или антитела, которое связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α, с комплексом, содержащим вариант D1 SIRP–α, связанный с полипептидом, содержащим домен IgSF CD47, при этом вариант D1 SIRP–α представляет собой высокоаффинный домен D1 SIRP–α искусственного происхождения и при этом вариант D1 SIRP–α связывается с человеческим CD47 с аффинностью, которая по меньшей мере в 10 раз больше, чем аффинность связывания домена D1 SIRP–α природного происхождения с человеческим CD47; и выявление связывания антигенсвязывающего домена с комплексом, причем отсутствие связывания антигенсвязывающего домена с комплексом указывает на то, что антигенсвязывающий домен блокирует связывание между человеческим CD47 и человеческим полипептидом SIRP–α.
[0110] В другом аспекте в данном документе предложены способы получения анти–SIRP–α антитела, которое связывает внеклеточные домены (например, домены D1) двух или более разных человеческих вариантных полипептидов SIRP–α. В некоторых вариантах реализации способы включают (а) иммунизацию курицы пептидом, содержащим по меньшей мере часть внеклеточного домена (например, домена D1) человеческого SIRP–α; (b) получение антитела из вырабатывающей антитело клетки от иммунизированной курицы; и (c) выявление связывания между антителом, полученным из клетки, и внеклеточными доменами (например, доменами D1) двух или более разных человеческих вариантных полипептидов SIRP–α, при этом связывание между антителом и внеклеточными доменами (например, доменами D1) двух или более разных человеческих вариантных полипептидов SIRP–α указывает на то, что антитело является анти–SIRP–α антителом, которое связывает внеклеточные домены (например, домены D1) двух или более разных человеческих вариантных полипептидов SIRP–α.
Определения
[0111] Перед подробным описанием представленных вариантов реализации следует понимать, что настоящее изобретение не ограничено конкретными композициями или биологическими системами, которые, конечно, могут варьироваться. Также следует понимать, что используемая в данном документе терминология предназначена исключительно для описания конкретных вариантов реализации и не подразумевает ограничения.
[0112] В контексте этого описания и прилагаемой формулы изобретения формы единственного числа включают ссылки на множественное число, если иное четко не следует из контекста. Таким образом, например, ссылка на «молекулу», необязательно, включает комбинацию из двух или более таких молекул, и т. д.
[0113] В контексте данного документа термин «около» относится к обычному диапазону погрешности для соответствующей величины, как известно специалисту в данной области техники. В данном документе употребление «около» в отношении величины или параметра включает (и описывает) варианты реализации, которые непосредственно относятся к этой величине или параметру.
[0114] Следует понимать, что аспекты и варианты реализации настоящего изобретения включают «содержащие», «состоящие» и «преимущественно состоящие» из этих аспектов и вариантов реализации.
[0115] В контексте данного документа «полипептид SIRP–α» может относиться к любому эндогенному или природному полипептиду SIRP–α, кодируемому геномом любого позвоночного животного, включая млекопитающих, таких как люди, обезьяны, грызуны (например, мыши или крысы), и птиц, таких как куры. Этот термин также включает варианты природного происхождения, например, варианты с альтернативным сплайсингом, аллельные варианты или полиморфизмы (например, описанные в данном документе). Этот термин может дополнительно относиться к полноразмерным, не подвергнутым процессингу полипептидам SIRP–α, а также к полипептидам SIRP–α, полученным в результате клеточного процессинга, например, удаления сигнальной последовательности и т. д. Типовые последовательности полипептидов SIRP–α описаны в данном документе. В некоторых вариантах реализации человеческий полипептид SIRP–α кодируется человеческим геном SIRPΑ, например, описанным NCBI Gene ID № 140885. Как описано в данном документе, полипептиды SIRP–α отличаются высокой степенью полиморфизма в пределах и среди видов. Например, было идентифицировано по меньшей мере 10 человеческих вариантов с аминокислотным полиморфизмом во внеклеточном домене.
[0116] Полипептиды SIRP–α содержат внеклеточный домен, который связывается с лигандами/партнерами, например, CD47. Полипептиды SIRP–α содержат 3 высокогомологичных внеклеточных (Ig)–подобные домена иммуноглобулина – D1, D2 и D3. Домен D1 SIRP–α («домен D1») относится к удаленному от мембраны внеклеточному домену SIRP–α и опосредует связывание SIRP–α с CD47 (смотрите, например, Hatherley, D. et al. (2008) Mol. Cell 31:266–77; Hatherley. D, et al. (2007) J. Biol. Chem. 282:14567–75; Hatherley, D. et al. (2009) J. Biol. Chem. 284:26613–9; и Lee, W. Y. et al. (2010) J. Biol Chem. 285:37953–63). Внеклеточный домен в общем случае относится ко всей внеклеточной части SIRP–α, например, экспрессируемой на поверхности клетки, и может включать разные домены SIRP–α, такие как домен D1. Домен D1 содержит остатки, являющиеся критическими для опосредования связывания CD47 (смотрите, например, Lee, W.Y. et al. (2007) J. Immunol. 179:7741–50). В некоторых вариантах реализации антитело, которое связывает внеклеточный домен полипептида SIRP–α, связывает один или более остатков домена D1. Типовые последовательности домена D1 человеческого SIRP–α описаны в тексте настоящего изобретения и включают, без ограничений, SEQ ID NO:5, 6 и 76–83. Последовательности доменов D2 и D3 человеческого SIRP–α также известны и включают, без ограничений,
APWSGPAARATPQHTVSFTCESHGFSPRDITLKWFKNGNELSDFQTNVDPVGESVS YSIHSTAKVVLTREDVHSQVICEVAHVTLQGDPLRGTANLSETIR (SEQ ID NO: 131) для домена D2 и VPPTLEVTQQPVRAENQVNVTCQVRKFYPQRLQLTWLENGNVSRTETASTVTENKD
GTYNWMSWLLVNVSAHRDDVKLTCQVEHDGQPAVSKSHDLKVS (SEQ ID NO: 132) для домена D3.
[0117] В контексте данного документа «CD47» (также известный как ассоциированный с интегрином белок (TAP), MER6 и OA3) относится к полипептиду, который, помимо прочего, выступает в качестве партнера по связыванию для полипептидов SIRP–α. В некоторых вариантах реализации CD47 относится к человеческому полипептиду CD47, например, полипептиду, кодируемому человеческим геном CD47, таким как описан NCBI Ref Seq ID No. 961. Известны типовые аминокислотные последовательности человеческого CD47 (смотрите, например, эталонную последовательность с номером доступа NCBI NP_001768). В частности, домен IgSF CD47 относится к N–концевому внеклеточному домену CD47, который, как известно, является критическим для связывания SIRP–α (смотрите, например, Barclay, A.N. and Brown, M.H. (2006) Nat. Rev. Immunol. 6:457–64 и Hatherley, D. et al, (2009) J. Biol. Chem. 284:26613–9). В некоторых вариантах реализации домен IgSF CD47 содержит аминокислотную последовательность
QLLFNKTKSVEFTFSNDTWIPCFVTNMEAQNTTEVYVKWKFKGRDTYTFDGALNKS
TVPTDFSSAKIEVSQLLKGDASLKMDKSDAVSHTGNYTCEVTELTREGETIIELKYRVVS (SEQ ID NO: 16). Термин «CD47» также может включать модифицированные полипептиды CD47, которые не способны связывать SIRP–α, например, полипептид, содержащий домен IgSF CD47, конъюгированный с другим полипептидом или соединением, например, Fc–областью Ig.
[0118] В контексте данного документа «эпитоп SIRP–α» может относиться к аминокислотам полипептида SIRP–α, которые образуют участок связывания для анти–SIRP–α антитела согласно настоящему изобретению и/или партнера по связыванию SIRP–α, включая, без ограничений, CD47. Можно получать характеристики связывания антитела или других полипептидов с эпитопом и/или проводить их картирование, используя различные методы анализа, известные в данной области техники, включая, без ограничений, анализ перекрестного блокирования (смотрите Antibodies, A Laboratory Manual, Cold Spring Harbor Laboratory, Ed Harlow and David Lane (1988)), картирование эпитопов (смотрите Champe et al., J. Biol. Chem. 270:1388–1394 (1995)), рентгеновскую совместную кристаллографию, эпитоп–специфическую сортировку, сайт–направленный мутагенез, олигопептидное сканирование, высокопроизводительное картирование с мутагенезом, водородно–дейтериевый обмен, ограниченный протеолиз и т. д.
[0119] В контексте данного документа «модуляция сигнализации SIRP–α» может относиться к осуществлению антагонизма, агонизма или какого–либо иного вмешательства в отношении одного или более аспектов сигнализации SIRP–α в клетке, экспрессирующей полипептид SIRP–α. Сигнализация SIRP–α может относиться к одному или более внутриклеточным событиям сигнализации, опосредованным активацией полипептида SIRP–α, включая, без ограничений, фосфорилирование тирозина внутриклеточной области SIRP–α, связывание фосфатазы (например, SHP1), связывание адаптерного белка (например, SCAP2, FYB и/или GRB2), выработку цитокинов (например, IL–10, IL–1β, IFN или TNF) и выработку оксида азота; и/или к одному или более межклеточным фенотипам, включая, без ограничений, фагоцитоз макрофагами и другие активирующие или супрессивные фенотипы макрофагов, эозинофилов, нейтрофилов, дендритных клеток и миелоидных супрессорных клеток (МСК).
[0120] В контексте данного документа термин «антитело» может относиться к интактным антителам; фрагментам антител (включая, без ограничений Fab, F(ab’)2, Fab’–SH, Fv, диатела, scFv, scFv–Fc, однодоменные антитела, антитела из одной тяжелой цепи и антитела из одной легкой цепи) при условии, что они демонстрируют необходимую биологическую активность (например, связывание эпитопа); моноклональным антителам; поликлональным антителам; моноспецифическим антителам; мультиспецифическим антителам (например, биспецифическим антителам); и антитело–подобным белкам.
[0121] В контексте данного документа термин «биспецифический», употребляемый в отношении антитела или фрагмента антитела, включает антитело или фрагмент антитела, которые характеризуются двумя разными специфичностями связывания. Например, каждая специфичность связывания может приводить к распознаванию отличного антигена или же каждая специфичность связывания может приводить к распознаванию одного антигена с разной аффинностью и/или конкретного эпитопа. В некоторых вариантах реализации каждая отдельная специфичность связывания соответствует одному или более разным антигенсвязывающим доменам антитела (например, вариабельным доменам) так, что биспецифическое антитело или фрагмент антитела содержит по меньшей мере первый антигенсвязывающий домен с первой специфичностью связывания и второй антигенсвязывающий домен со второй специфичностью связывания. Различные типовые форматы биспецифических антител описаны в данном документе и известны в данной области техники.
[0122] «Выделенное» антитело может относиться к антителу, которое было отделено и/или отъединено от компонента своего природного окружения, например, клетки–хозяина или организма. В некоторых вариантах реализации антитело очищено до необходимой степени чистоты по массе (например, по меньшей мере 95%); и/или гомогенности методом ДСН–ПААГ с применением, например, окрашивания серебром, кумасси и т. д. В некоторых вариантах реализации выделенное антитело получают, проводя один или более этапов очистки.
[0123] Как известно в данной области техники, «нативные» антитела относятся к, как правило, гетеродимерным комплексам, содержащим две идентичные легкие (L) цепи и две идентичные тяжелые (H) цепи. Две тяжелые цепи соединяет различное число дисульфидных связей, и одна соединяет каждую легкую цепь с тяжелой цепью в дополнение к внутрицепочечным дисульфидным мостикам. Тяжелые цепи содержат вариабельный домен (VH), за которым следуют (от N–конца к С–концу) три или четыре константных домена. Легкие цепи содержат вариабельный домен (VL), за которым следует константный домен (CL). Как правило, легкие цепи млекопитающих относятся к одной или двум категориям на основании аминокислотной последовательности: каппа и лямбда.
[0124] «Константный домен» может относиться к более консервативной части антитела или фрагмента, например, за пределами вариабельных доменов. Этот термин может включать домен CL, а также константные домены тяжелой цепи CH1, CH2, CH3 и, необязательно, CH4.
[0125] Константные домены тяжелой цепи можно отнести к 5 основным типам:
IgA, IgD, IgE, IgG и IgM. В рамках некоторых из этих основных типов существует несколько подтипов. Структуры субъединиц и трехмерные конфигурации разных классов иммуноглобулинов хорошо известны и в целом описаны, например, в Abbas et al. Cellular and Mol. immunology, 4th ed. (W.B. Saunders, Co., 2000).
[0126] В контексте данного документа термин «вариабельный домен антитела» относится к частям легких и тяжелых цепей антитела, которые содержат определяющие комплементарность области (CDR, например, CDR L1, CDR L2, CDR L3, CDR H1, CDR H2 и CDR H3) и каркасные области (FR).
[0127] Термин «вариабельный» относится к тому факту, что подпоследовательности вариабельных доменов существенно отличаются по последовательности между антителами и являются определяющими для специфичности связывания конкретного антитела с его антигеном. Вариабельность сконцентрирована в трех гипервариабельных областях (HVR) в доменах VH и VL. Более консервативные части вариабельных доменов называются каркасными областями (FR), которые перемежаются HVR. Каждый из вариабельных доменов нативных тяжелых и легких цепей содержит четыре FR–области, соединенные тремя HVR, которые образуют петли (смотрите Kabat et al., Sequences of Proteins of Immunological interest, Fifth Edition, National institute of Health, Bethesda, Md. (1991)).
[0128] Термин «гипервариабельная область (HVR)» может относиться к подобласти доменов VH и VL, характеризуемой повышенной вариабельностью последовательности и/или образованием определенных петель. Они включают три HVR в домене VH (H1, H2 и H3) и три HVR в домене VL (L1, L2 и L3). Считается, что H3 является критической в определении точной специфичности связывания, при этом L3 и H3 демонстрируют наибольший уровень разнообразия. Смотрите Johnson and Wu, в Methods in Molecular Biology 248:1–25 (Lo, ed., Human Press, Totowa, N.J., 2003).
[0129] Известно некоторое количество вариантов определения границ HVR. Определяющие комплементарность области по Kabat (CDR) основаны на вариабельности последовательности и являются наиболее применяемыми (Kabat et at, Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)). Chothia, напротив, относится расположению структурных петель (Chothia and Lesk J. Mol Biol 196:901–917 (1987)). HVR по AbM представляют компромиссный вариант между HVR по Kabat и структурными петлями по Chothia, и используются в программном обеспечении для моделирования антител Oxford Molecular's AbM. «Контактные» HVR определяют в анализе доступных кристаллических структур комплексов. Остатки из каждой из этих HVR приведены ниже. Остатки «каркасной области» или «FR» представляют собой остатки вариабельного домена, отличные от остатков HVR.
[0130] Также известны «удлиненные» HVR: 24–36 или 24–34 (L1), 46–56 или 50–56 (L2) и 89–97 или 89–96 (L3) в VL и 26–35 (H1), 50–65 или 49–65 (H2) и 93–102, 94–102, или 95–102 (H3) в VH (нумерация Kabat).
[0131] «Нумерация в соответствии с Kabat» может относиться к системе нумерации, применяемой в отношении вариабельных доменов тяжелой цепи и вариабельных доменов легкой цепи при составлении антител в Kabat et al., выше. Фактическая линейная аминокислотная последовательность может содержать меньшее или дополнительное количество аминокислот, что соответствует укорочению FR или HVR вариабельного домена или вставке в них. Нумерация остатков по Kabat для данного антитела может быть определена путем выравнивания областей гомологии последовательности антитела со «стандартной» пронумерованной по Kabat последовательностью. Как правило, нумерацию Kabat используют в отношении остатков в вариабельных доменах (приблизительно остатки 1–107 легкой цепи и остатки 1–113 тяжелой цепи), тогда как систему нумерации или индекс EU (например, индекс EU по Kabat, нумерация в соответствии с EU IgG1) в общем случае используют в отношении остатков в константной области тяжелой цепи.
[0132] «Полноразмерные» или «интактные» антитела, как правило, содержат тяжелые цепи с Fc–областью, например, в отличие от фрагмента антитела. Антигенсвязывающие фрагменты «Fab» с одним антигенсвязывающим участком можно отделять от остаточного Fc–фрагмента путем расщепления папаином. Фрагменты F(ab’)2 содержат два антигенсвязывающих участка, получаемых при обработке антитела пепсином. При этом фрагменты антител содержат одну или более вариабельных областей антитела.
[0133] Фрагмент «Fv» содержит полный антигенсвязывающий участок. Одноцепочечный Fv (scFv) может содержать домены VH и VL, связанные пептидным линкером с ассоциацией доменов VH и VL, например, как в случае антитела или фрагмента Fab, таким образом, чтобы HVR образовывали антигенсвязывающий участок. Смотрите Pluckthiin, в The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., (Springer–Verlag, New York, 1994), pp. 269–315. В некоторых вариантах реализации scFv слит с Fc–доменом антитела (например, scFv–Fc). Несмотря на то, что антигенсвязывающий участок составляют шесть HVR, один вариабельный домен с тремя HVR все равно способен связывать антиген, хоть и с меньшей аффинностью. Смотрите Hamers–Casterman et al., Nature 363:446–448 (1993); Sheriff et al., Nature Struct. Biol. 3:733–736 (1996). Однодоменныеантитела (например, антитела верблюжьих), как правило, содержат один мономерный вариабельный домен для связывания антигена. Также известны антитела из одной тяжелой цепи (VHH) и одной легкой цепи. Фрагмент Fab’, как правило, содержит несколько дополнительных остатков в С–конце по сравнению с фрагментом Fab. Fab’–SH содержит остатки цистеина со свободным тиолом. В данной области техники известны различные варианты химического сопряжения фрагментов антител.
[0134] «Диатело» содержит фрагменты антитела с двумя антигенсвязывающими участками. Они включают домены VH и VL, соединенные линкером, который, как правило, является слишком коротким для облегчения спаривания доменов из одной цепи. Диатела могут быть бивалентными или биспецифическими. Известны также триатела и тетратела или антитела с другим числом доменов VH/VL. Смотрите Hudson et ah, Nat. Med. 9:129–134 (2003).
[0135] В контексте данного документа «моноклональное» антитело относится к антителу, полученному из популяции по существу гомогенных антител, например, по существу идентичных, но допускающих незначительные уровни фоновых мутаций и/или модификаций. Выражение «моноклональное» указывает на по существу гомогенный характер антител и не требует получения антитела каким–либо конкретным способом. В некоторых вариантах реализации моноклональное антитело выбирают по его последовательностям HVR, VH и/или VL и/или свойствам связывания, например, выбирают из пула клонов (например, полученных рекомбинантным способом, из гибридомы или с помощью фага). Моноклональное антитело может быть сконструировано так, чтобы оно содержало одну или более мутаций, например, для изменения аффинности связывания или других свойств антитела, создания гуманизированного или химерного антитела, улучшения выработки и/или гомогенности антител, конструирования мультиспецифического антитела, при этом получаемые в результате антитела считаются моноклональными по своей природе. Популяцию моноклональных антител можно отличить от поликлональных антител, так как отдельные моноклональные антитела в популяции распознают один и тот же антигенный участок. Известны различные методики получения моноклональных антител; смотрите, например, гибридомный способ (например, Kohler and Milstein, Nature, 256:495–97 (1975); Hongo et al, Hybridoma, 14 (3): 253–260 (1995), Harlow et al. Antibodies: A Laboratory Manual, (Cold Spring Harbor Laboratory Press, 2nd ed. 1988); Hammerling et al., в: Monoclonal Antibodies and T–Cell Hybridomas 563–681 (Elsevier, N.Y., 1981)), методы рекомбинантных ДНК (смотрите, например, патент США № 4816567), технологии фагового дисплея (смотрите, например, Clackson et al, Nature, 352: 624–628 (1991); Marks et al, J. Mol. Biol. 222: 581–597 (1992); Sidhu et al, J. Mol. Biol. 338(2): 299–310 (2004); Lee et al, J. Mol. Biol. 340(5): 1073–1093 (2004); Fellouse, Proc. Natl. Acad. Sci. USA 101(34): 12467–12472 (2004); и Lee et al, J. Immunol. Methods 284(1–2): 119–132 (2004), а также технологии получения человеческих и подобных человеческим антител у животных, которые содержат часть локусов или все локусы человеческого иммуноглобулина или гены, кодирующие последовательности человеческого иммуноглобулина (смотрите, например, WO 1998/24893; WO 1996/34096; WO 1996/33735; WO 1991/10741; Jakobovits et al, Proc. Natl. Acad. Sci. USA 90: 2551 (1993); Jakobovits et al., Nature 362: 255–258 (1993); Bruggemann et al. Year in Immunol 7:33 (1993); патенты США № 5545807; 5545806; 5569825; 5625126; 5633425; и 5661016; Marks et al, Bio/Technology 10: 779–783 (1992); Lonberg et al., Nature 368: 856–859 (1994); Morrison, Nature 368: 812–813 (1994); Fishwild et al, Nature Biotechnol 14: 845–851 (1996); Neuberger, Nature Biotechnol. 14: 826 (1996); и Lonberg and Huszar, Intern. Rev. Immunol. 13: 65–93 (1995).
[0136] «Химерные» антитела могут относиться к антителу с одной частью тяжелой и/или легкой цепи от конкретного изотипа, класса или организма и другой частью от другого изотипа, класса или организма. В некоторых вариантах реализации вариабельная область получена из одного источника или организма, а константная область – из другого.
[0137] «Гуманизированные» антитела могут относиться к антителам с преимущественно человеческой последовательностью и минимальным количеством отличной от человеческой (например, мышиной или куриной) последовательности. В некоторых вариантах реализации гуманизированное антитело содержит одну или более последовательностей HVR (обеспечивающих представляющую интерес специфичность связывания) из антитела, полученного из отличного от человеческого (например, мышиного или куриного) организма, привитых в каркасную область (FR) реципиентного человеческого антитела. В некоторых вариантах реализации нечеловеческие остатки дополнительно привиты в человеческую каркасную область (не присутствующую ни в одном из исходных или реципиентных антител), например, для улучшения свойств антитела. В общем случае гуманизированное антитело будет содержать практически все из по меньшей мере одного и, как правило, двух вариабельных доменов, в которых все или практически все гипервариабельные петли представлены областями нечеловеческого иммуноглобулина, а все или практически все FR представлены последовательностью человеческого иммуноглобулина. Гуманизированное антитело также необязательно будет содержать по меньшей мере часть константной области иммуноглобулина (Fc), как правило, человеческого иммуноглобулина. Смотрите Jones et al., Nature 321:522–525 (1986); Riechmann et al., Nature 332:323–329 (1988); и Presta, Curr. Op. Struct. Biol. 2:593–596 (1992).
[0138] «Человеческое» антитело может относиться к антителу, имеющему аминокислотную последовательность, которая соответствует последовательности антитела, вырабатываемого человеком и/или была получена любым из способов получения человеческих антител, описанных в данном документе. Человеческие антитела можно получать различными способами, известными в данной обрасти техники, включая библиотеки фагового дисплея; Hoogenboom and Winter, J. Mol. Biol, 227:381 (1991); Marks et al, J. Mol. Biol., 222:581 (1991); получение моноклональных человеческих антител, как описано в Cole et al, Monoclonal Antibodies and Cancer Therapy, Alan R, Liss, p. 77 (1985); Boerner et al, J. Immunol, 147(1):86–95 (1991); и путем введения антигена трансгенному животному, которое было модифицировано так, чтобы вырабатывать такие антитела в ответ на антигенную стимуляцию, но чьи эндогенные локусы были инактивированы, например, иммунизированным ксеномышам (смотрите, например, патенты США № 6075181 и 6150584 в отношении технологии XENOMOUSE™) или курам с последовательностью (–ями) человеческого иммуноглобулина (смотрите, например, WO2012162422, WO2011019844 и WO2013059159).
[0139] В контексте данного документа «линкер» относится к связи между двумя элементами, например, белковыми доменами. В некоторых вариантах реализации линкер может представлять собой ковалентную связь или спейсер. Термин «спейсер» относится к соединению (например, полимеру полиэтиленгликоля (ПЭГ)) или аминокислотной последовательности (например, последовательности из 1–200 аминокислот), находящимся между двумя полипептидами или полипептидными доменами и обеспечивающему пространство или гибкость (или как пространство, так и гибкость) между двумя полипептидами или полипептидными доменами. В некоторых вариантах реализации аминокислотный спейсер является частью первичной последовательности полипептида (например, соединен с разнесенными полипептидами или полипептидными доменами посредством полипептидного остова).
[0140] В контексте данного документа термин «цитотоксический агент» может относиться к любому агенту, который ингибирует клеточную пролиферацию или индуцирует гибель клеток. Цитотоксические агенты включают, но не ограничиваются этим, химиотерапевтические агенты; радиоактивные изотопы; агенты, ингибирующие рост; и токсины, такие как низкомолекулярные токсины или ферментативно активные токсины, включая их фрагменты и/или варианты. Типовые цитотоксические агенты включают, без ограничений, ингибиторы метаболизма, агенты против микротрубочек, содержащие платину соединения, алкилирующие агенты, ингибиторы протеасом, ингибиторы топоизомеразы II, антиметаболиты, ингибиторы топоизомеразы I, ингибиторы путей сигнальной трансдукции, ингибиторы ангиогенеза нерецепторной тирозинкиназы, гормоны и аналоги гормонов, проапоптотические агенты, ингибиторы LDH–A, ингибиторы клеточного цикла, ингибиторы HDAC и антибиотики.
[0141] В контексте данного документа «метка» может включать любое соединение, которое служит агентом для выявления, например, связывания между меченым антителом согласно настоящему изобретению и макромолекулой или клеткой. Типовые метки включают, без ограничений, флуоресцентные (например, соединения или белки), радиоактивные или ферментные соединения, а также метки для аффинной очистки.
[0142] В контексте данного документа можно говорить, что антитело «связывает» антиген с аффинностью, достаточной для того, чтобы антитело было применимо для in vitro и/или in vivo манипуляций с антигеном. В некоторых вариантах реализации антитело, которое «связывает» антиген, характеризуется константой диссоциации (KД) в отношении антигена, меньшей или равной 1 мкМ при 25°C.
[0143] В контексте данного документа термин «аффинность» или «аффинность связывания» относится к силе связывающего взаимодействия между двумя молекулами. В общем случае аффинность связывания относится к силе общих нековалентных взаимодействий между молекулой и ее партнером по связыванию, например, высокоаффинным вариантом D1 SIRP–α и CD47. Если не указано иное, аффинность связывания относится к характерной аффинности связывания, которая отображает 1:1 взаимодействие между представителями связывающейся пары. Аффинность связывания между двумя молекулами обычно описывается константой диссоциации (KД) или константой ассоциации (KА). Две молекулы, имеющие низкую аффинность связывания в отношении друг друга в общем случае связываются медленно с тенденцией к быстрой диссоциации и демонстрируют большое значение KД. Две молекулы, имеющие высокую аффинность связывания в отношении друг друга в общем случае связываются легко с тенденцией к тому, чтобы дольше оставаться связанными, и демонстрируют небольшое значение KД. В некоторых вариантах реализации KД двух взаимодействующих молекул определяют, используя известные способы и технологии, например, метод поверхностного плазмонного резонанса (ППР). KД можно рассчитать как соотношение kдисс./kасс..
[0144] В контексте данного документа термин «KД меньше чем» относится к численно меньшему значению KД и повышению аффинности связывания по отношению к указанному значению KД. В контексте данного документа термин «KД больше чем» относится к численно большему значению KД и снижению аффинности связывания по отношению к указанному значению KД.
[0145] В контексте данного документа термин «лечение» может относиться к терапевтическому введению молекулы, соединения, состава, композиции и т. д. с целью изменения одного или более патологических симптомов у подлежащего лечению индивида или в клетке. Желаемое действие лечения может включать, без ограничений, замедление прогрессирования заболевания, уменьшение или облегчение патологического симптома или состояния заболевания, улучшение прогноза и/или достижение ремиссии заболевания. Например, «лечение» рака у индивида считается успешным при уменьшении или устранении одного или более симптомов, связанных с раком, таких как, без ограничений, снижение пролиферации раковых клеток, элиминация раковых клеток или опухолевой нагрузки, уменьшение симптомов, связанных с раком, повышение качества жизни индивида, снижение дозы других лекарственных средств и/или продление жизни индивида. В качестве другого примера «лечение» аутоиммунного или воспалительного заболевания может считаться успешным при уменьшении или устранении одного или более симптомов, связанных с аутоиммунным или воспалительным заболеванием, таких как, без ограничений, снижение числа аутореактивных иммунных клеток и/или воспалительных иммунных клеток или цитокинов, снижение иммунной активации и/или воспаления, замедление или уменьшение повреждения органов в результате заболевания, снижение симптомов, связанных с заболеванием, повышение качества жизни индивида, снижение дозы других лекарственных средств и/или продление жизни индивида.
[0146] В контексте данного документа «замедление прогрессирования» заболевания может относиться к замедлению, задержке, отсрочке, отложению развития, стабилизации или какому–либо иному торможению патологического течения заболевания. В некоторых вариантах реализации этот термин может относиться к замедлению, достаточному для эффективного предотвращения, например, предотвращения развития заболевания у индивида. В некоторых вариантах реализации, например, замедление прогрессирования распространенного рака может включать замедление появления метастазов. Специалисту в данной области техники понятно, что точная величина замедления может зависеть, например, от конкретного заболевания, состояния индивида и т. д.
[0147] Термины «рак» и «раковый» могут описывать нарушение регуляции или отсутствие регуляции роста/пролиферации клеток со стороны клетки или клеток млекопитающего. Может быть включен любой известный в данной области техники тип рака, такой как, без ограничений, карцинома, саркома, лимфома, лейкоз, лимфома и бластома. Более конкретные примеры таких видов рака включают, но не ограничиваются этим, рак легкого, плоскоклеточный рак, опухоли головного мозга, глиобластому, рак головы и шеи, гепатоцеллюлярный рак, колоректальный рак (например, рак толстой или прямой кишки), рак печени, рак мочевого пузыря, рак желудка, рак поджелудочной железы, рак шейки матки, рак яичника, рак мочевыводящих путей, рак молочной железы, перитонеальный рак, рак матки, рак слюнных желез, рак почки, рак предстательной железы, рак вульвы, рак щитовидной железы, карциному анального канала, карциному полового члена, меланому, множественную миелому и B–кеточную лимфому (включая неходжкинскую лимфому (НХЛ)); острый лимфобластный лейкоз (ОЛЛ); хронический лимфоцитарный лейкоз (ХЛЛ); острый миелоидный лейкоз (ОМЛ); карциному из клеток Меркеля; волосатоклеточный лейкоз; хронический миелобластный лейкоз (ХМЛ); и связанные с ними метастазы.
[0148] В контексте данного документа термин «эффективное количество» может относиться к количеству антитела согласно настоящему изобретению или фармацевтической композиции, содержащей антитело согласно настоящему изобретению, являющемуся достаточным и эффективным для обеспечения необходимого терапевтического действия при лечении или замедлении прогрессирования пациента, имеющего заболевание, такое как рак, например, солидную опухоль или рак крови. В некоторых вариантах реализации терапевтически эффективное количество позволяет избежать нежелательных побочных явлений, и/или благоприятное действие превосходит такие побочные явления. Эффективное количество может зависеть от подлежащего лечению индивида, например, возраста, массы, пола, состояния заболевания, а также от способности агента вызывать необходимый ответ. Эффективное количество можно вводить за одно или более введений. В клиническом контексте эффективное количество лекарства, соединения или фармацевтической композиции может быть или не быть обеспечено в сочетании с другим лекарством, соединением или фармацевтической композицией, например, другим терапевтическим агентом. Таким образом, «эффективное количество» также можно рассматривать в контексте введения одного или более других терапевтических агентов, при этом считается, что отдельный агент применяется в эффективном количестве, если в сочетании с одним или более другими агентами может быть обеспечен или обеспечивается необходимый результат.
[0149] В контексте данного документа термин «фармацевтическая композиция» может относиться к медицинскому или фармацевтическому составу, который содержит активный ингредиент, а также вспомогательные вещества или разбавители (или как вспомогательные вещества, так и разбавители), и обеспечивает возможность введения активного ингредиента удобными способами введения. В некоторых вариантах реализации описанные в данном документе фармацевтические композиции содержат фармацевтически приемлемые компоненты, которые совместимы с одним или более антителами согласно настоящему изобретению. В некоторых вариантах реализации фармацевтическая композиция находится в форме таблетки или капсулы для перорального приема или в водной форме для внутривенного или подкожного введения, например, посредством инъекции.
[0150] В контексте данного документа термины «субъект», «индивид» и «пациент» используются взаимозаменяемо и относятся к позвоночному, например, млекопитающему. Млекопитающие включают, но не ограничиваются этим, мышей, обезьян, людей, сельскохозяйственных животных, спортивных животных и домашних животных.
[0151] В контексте данного документа выражения «в сочетании с» или «в комбинации с» могут относиться к введению одного терапевтического средства в дополнение к (например, до, во время и/или после) другому терапевтическому средству.
Антитела
[0152] Некоторые аспекты настоящего изобретения относятся к антителам, которые связывают внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α v1, внеклеточный домен человеческого полипептида SIRP–α v2 или их оба. Как продемонстрировано в данном документе, были получены характеристики антител, которые специфически связываются с v1 или v2, а также антител, которые связываются с обоими белками. У людей было идентифицировано по меньшей мере 10 разных аллелей гена SIRPΑ (смотрите Фиг. 1A; также смотрите Takenaka, K. et al. (2007) Nat. Immunol. 8:1313–23). Описанные в данном документе антитела, которые связывают один или более человеческих полипептидов SIRP–α и обладают одной или более другими специфичностями связывания, являются полезным открытием настоящего изобретения. Кроме того, в настоящем изобретении продемонстрированы способы получения и идентификации антител, представляющих удивительное разнообразие новых профилей специфичности связывания SIRP–α.
[0153] В некоторых вариантах реализации антитело согласно настоящему изобретению связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α v1, содержащий аминокислотную последовательность
EEELQVIQPDKSVLVAAGETATLRCTATSLIPVGPIQWFRGAGPGRELIYNQKEGHFP
RVTTVSDLTKRNNMDFSIRIGN1TPADAGTYYCVKFRKGSPDDVEFKSGAGTELSVRAKPS (SEQ ID NO:5). В некоторых вариантах реализации антитело согласно настоящему изобретению связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α v2, содержащий аминокислотную последовательность EEELQVIQPDKSVSVAAGESAILHCTVTSLIPVGPTQWFRGAGPARELIYNQKEGHFPRVTTVSESTKRENMDFSISISNITPADAGTYYCVKFRKGSPDTEFKSGAGTELSVRAKPS (SEQ ID NO:6). В некоторых вариантах реализации антитело согласно настоящему изобретению связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α v1, содержащий аминокислотную последовательность
EEELQVIQPDKSVLVAAGETATLRCTATSLIPVGPIQWFRGAGPGRELIYNQKEGHFP
RVTTVSDLTKRNNMDFSIRIGNITPADAGTYYCVKFRKGSPDDVEFKSGAGTELSVRAKPS (SEQ ID NO:5), и внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α v2, содержащий аминокислотную последовательность EEELQVIQPDKSVSVAAGESAILHCTVTSLIPVGPIQWFRGAGPARELiYNQKEGHFPR
VTTVSESTKRENMDESISISNiTP AD AGTY YC VKFRKGSPDTEFKSG AGTELSVRAKPS (SEQ ID NO:6).
[0154] В некоторых вариантах реализации антитело согласно настоящему изобретению связывает внеклеточные домены (например, домены D1) 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 разных человеческих вариантных полипептидов SIRP–α. В контексте данного документа выражение «человеческий вариантный полипептид SIRP–α» может относиться к человеческому вариантному полипептиду SIRP–α природного происхождения или полиморфизму, экспрессируемому у людей, например, в отличие от варианта, несущего одну или более сконструированных мутаций. Например, в некоторых вариантах реализации антитело согласно настоящему изобретению связывает внеклеточный домен (например, домен D1) одного или более человеческих вариантных полипептидов SIRP–α, содержащих последовательность, приведенную в таблице 1. В некоторых вариантах реализации антитело согласно настоящему изобретению связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α v1 и/или внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α v2 и связывается с внеклеточным доменом (например, доменом D1) одного или более человеческих полипептидов SIRP–α, выбранных из v3, v4, v5, v6, v7, v8, v9 и v10.
Таблица 1. Последовательности человеческих вариантных полипептидов SIRP–α, соответствующие домену D1.
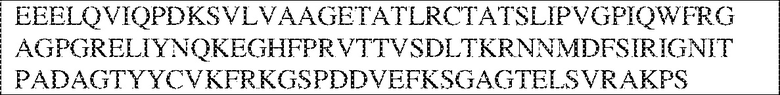
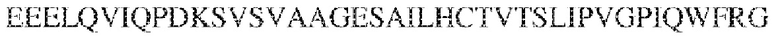
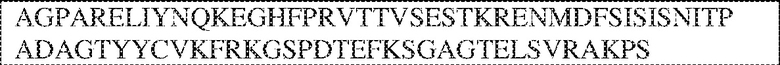
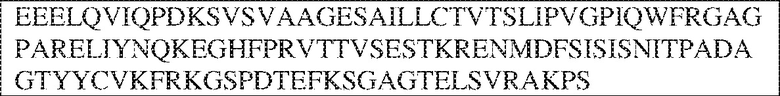
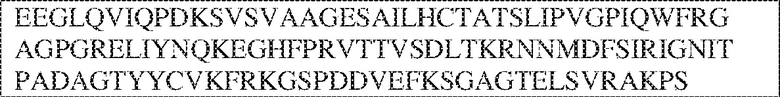


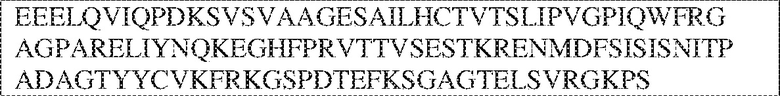

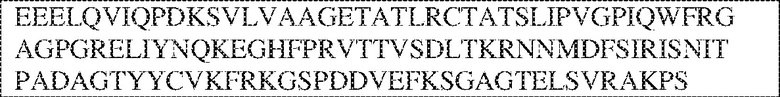
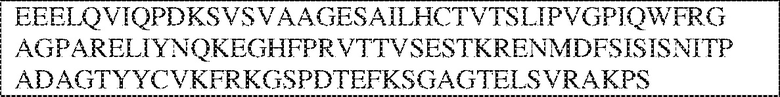
[0155] В некоторых вариантах реализации антитело согласно настоящему изобретению связывает внеклеточный домен (например, домен D1) обезьяньего полипептида SIRP–α (например, домен D1 обезьяньего полипептида SIRP–α). В некоторых вариантах реализации антитело согласно настоящему изобретению связывает внеклеточный домен (например, домен D1) полипептида SIRP–α яванского макака (например, встречающийся в организме Macaca fascicularis). В некоторых вариантах реализации антитело связывает внеклеточные домены (например, домены D1) по меньшей мере двух разных обезьяньих вариантных полипептидов SIRP–α. В некоторых вариантах реализации антитело связывает внеклеточные домены (например, домены D1) по меньшей мере двух разных вариантных полипептидов SIRP–α яванского макака. Например, в некоторых вариантах реализации антитело связывает внеклеточный домен (например, домен D1) полипептида SIRP–α яванского макака, содержащий аминокислотную последовательность EEELQVIQPEKSVSVAAGESATLNCTATSLIPVGPIQWFRGVGPGRELIYHQKEGHFP RVTPVSDPTKRNNMDFSIRISNITPADAGTYYCVKFRKGSPDVELKSGAGTELSVRAKPS (SEQ ID NO: 11, внеклеточный домен (например, домен D1) полипептида SIRP–α яванского макака, содержащий аминокислотную последовательность EEELQVIQPEKSVSVAAGDSATLNCTVSSLIPVGPIQWFRGAGPGRELIYNLKEGHFPRVTAVSDPTKRNNMDFSIRISNITPADAGTYYCVKFRKGSPDVELKSGAGTELSVRAKPS (SEQ ID NO: 12), или их оба.
[0156] В некоторых вариантах реализации антитело согласно настоящему изобретению связывает внеклеточный домен мышиного полипептида SIRP–α (например, встречающийся в организме Mus musculus; например, домен D1 мышиного полипептида SIRP–α). В некоторых вариантах реализации антитело связывает внеклеточные домены (например, домены D1) двух или более разных мышиных вариантных полипептидов SIRP–α. Известно множество мышиных вариантных полипептидов SIRP–α от разных линий мышей. В некоторых вариантах реализации мышиный вариантный полипептид SIRP–α сдержит аминокислотную последовательность, выбранную из
KELKVTQPEKSVSVAAGDSTVLNCTLTSLLPVGPIKWYRGVGQSRLLIYSFTGEHFPRVTNVSDATKRNNMDFSIRISNVTPEDAGTYYCVKFQKGPSEPDTEIQSGGGTEVYVLAKPS (SEQ ID NO: 7; из линии мышей 129),
TEVKVIQPEKSVSVAAGDSTVLNCTLTSLLPVGPIRWYRGVGQSRQLIYSFTTEHFPRVTNVSDATKRSNLDFSIRISNVTPEDAGTYYCVKFQRGSPDTEIQSGGGTEVYVLAK (SEQ ID NO:8; из линии мышей NOD),
KELKVTQPEKSVSVAAGDSTVLNCTLTSLLPVGPIRWYRGVGPSRLLIYSFAGEYVPRIRNVSDTTKRNNMDFSIRISNVTPADAGIYYCVKFQKGSSEPDTEIQSGGGTEVYVLA K (SEQ ID NO:9; из линии мышей C57BL/6) и
TEVKVTQPEKSVSVAAGDSTILNCTVTSLLPVGPIRWYRGVGQSRLLIYSFTGEHFPRIRNVSDTTKRNNMDFSIRISNVTPEDAGTYYCVKFQRGSSEPDTEIQSGGGTEVYVLAK (SEQ ID NO: 10; из линии мышей BALB/c).
[0157] В некоторых вариантах реализации антитело согласно настоящему изобретению связывает внеклеточный домен (например, домен D1) белка человеческого семейства SIRP. В некоторых вариантах реализации антитело согласно настоящему изобретению связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–β. В некоторых вариантах реализации человеческий полипептид SIRP–β относится к полипептиду, кодируемому человеческим геном SIRPB1, например, описываемым NCBI Ref Seq ID No. 10326. В некоторых вариантах реализации внеклеточный домен (например, домен D1) человеческого полипептида SIRP–β содержит аминокислотную последовательность EDELQVIQPEKSVSVAAGESATLRCAMTSLIPVGPIMWFRGAGAGRELIYNQKEGHFPRVTTVSELTKRNNLDFSISISNITPADAGTYYCVKFRKGSPDDVEFKSGAGTELSVRAKPS (SEQ ID NO: 13) или EEELQVIQPDKSISVAAGESATLHCTVTSLIPVGPIQWFRGAGPGRELIYN QKEGHEPRVTTVSDLTKRNNMDFSIRISNITPADAGTYYCVKFRKGSPDHVEFKSGAGTELSVRAKPS (SEQ ID NO: 14).
[0158] В некоторых вариантах реализации антитело согласно настоящему изобретению связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–γ. В некоторых вариантах реализации человеческий полипептид SIRP–γ относится к полипептиду, кодируемому человеческим геном SIRPG, например, описываемым NCBI Ref Seq ID No. 55423. В некоторых вариантах реализации внеклеточный домен (например, домен D1) человеческого полипептида SIRP–γ содержит аминокислотную последовательность EEELQMIQPEKLLLVTVGKTATLHCTVTSLLPVGPVLWFRGVGPGRELIYNQKEGHFPRVTTVSDLTKRNNMDFSIRISSITPADVGTYYCVKFRKGSPENVEFKSGPGTEMALGAKPS (SEQ ID NO: 15).
[0159] Кроме антител, которые связывают один или более из описанных выше полипептидов, в настоящем изобретении предусмотрены антитела, которые не связывают один или более из описанных выше полипептидов. Иными словами, профиль связывания антитела согласно настоящему изобретению может быть охарактеризован путем положительного или отрицательного перечисления любых вариантов специфичности связывания и/или свойств, описанных в данном документе.
[0160] В некоторых вариантах реализации антитело согласно настоящему изобретению модулирует сигнализацию SIRP–α в клетке, экспрессирующей человеческий полипептид SIRP–α. В некоторых вариантах реализации антитело согласно настоящему изобретению антагонизирует сигнализацию SIRP–α в клетке, экспрессирующей человеческий полипептид SIRP–α. В некоторых вариантах реализации антитело согласно настоящему изобретению препятствует сигнализации SIRP–α в клетке, экспрессирующей человеческий полипептид SIRP–α. В некоторых вариантах реализации антитело согласно настоящему изобретению агонизирует сигнализацию SIRP–α в клетке, экспрессирующей человеческий полипептид SIRP–α. В некоторых вариантах реализации сигнализация SIRP–α включает одно или более внутриклеточных сигнальных событий, опосредованных активацией полипептида SIRP–α, включая, без ограничений, фосфорилирование тирозина внутриклеточной области SIRP–α, связывание фосфатазы (например, SHP1), связывание адаптерного белка (например, SCAP2, FYB и/или GRB2) и выработку оксида азота. Различные методы анализа для определения сигнализации SIRP–α в клетке включают, без ограничений, фосфорилирование SIRP–α, совместную иммунопреципитацию SHP1 и SHP2, сигнализацию PI3–киназы, выработку цитокинов (как воспалительных IL–12, IL–23, TNFα, IFN, так и супрессивных цитокинов IL–10, IL–4, IL–13, уровней маркеров клеточной поверхности для маркеров макрофагов M1 и M2) или активацию и функцию дендритных клеток; Kharitonenkov, A. et al. (1997) Nature 386: 181–6; Ochi, F. et al. (1997) Biochem. Biophys. Res. Commun. 239:483–7; Kim, E.J. et al. (2013) Inflammation Research 62:377–86; Yi. T. et al. (2015) Immunity 43:764–75.
[0161] В некоторых вариантах реализации клетка, экспрессирующая человеческий полипептид SIRP–α, представляет собой лейкоцит. В некоторых вариантах реализации клетка представляет собой макрофаг, дендритную клетку, нейтрофил, эозинофил или миелоидную супрессорную клетку (МСК). В некоторых вариантах реализации антитело согласно настоящему изобретению снижает или антагонизирует сигнализацию SIRP–α в клетке, экспрессирующей человеческий полипептид SIRP–α, по меньшей мере на 20%, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80% или по меньшей мере на 90%, например, при применении одного или более методов анализа сигнализации SIRP–α, описанных в данном документе или известных в данной области техники. В некоторых вариантах реализации антитело согласно настоящему изобретению повышает или агонизирует сигнализацию SIRP–α в клетке, экспрессирующей человеческий полипептид SIRP–α, по меньшей мере на 20%, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80% или по меньшей мере на 90%, например, при применении одного или более методов анализа сигнализации SIRP–α, описанных в данном документе или известных в данной области техники.
[0162] В некоторых вариантах реализации антитело согласно настоящему изобретению модулирует межклеточный фенотип, опосредованный SIRP–α. В некоторых вариантах реализации антитело согласно настоящему изобретению усиливает фагоцитоз макрофагом, экспрессирующим человеческий полипептид SIRP–α. Например, фагоцитарную активность макрофага, обработанного или приведенного в контакт с антителом согласно настоящему изобретению, можно сравнивать с фагоцитарной активностью макрофага, не обработанного или не приведенного в контакт с антителом, или же фагоцитарную активность макрофага, который экспрессирует человеческий полипептид SIRP–α и обрабатывается или приводится в контакт с антителом согласно настоящему изобретению, можно сравнивать с фагоцитарной активностью макрофага, который не экспрессирует человеческий полипептид SIRP–α и обрабатывается или приводится в контакт с антителом. Типовые методы анализа фагоцитоза можно найти, например, в Wieskopf, K. et al (2013) Science 341: 88 и Willingham, S.B. et al. (2012) Proc. Natl. Acad. Sci. 109:6662–7. В некоторых вариантах реализации антитело согласно настоящему изобретению повышает фагоцитоз макрофагом, экспрессирующим человеческий полипептид SIRP–α, по меньшей мере на 20%, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80% или по меньшей мере на 90%, например, при применении одного или более методов анализа фагоцитоза, описанных в данном документе или известных в данной области техники.
[0163] В некоторых вариантах реализации антитело согласно настоящему изобретению усиливает активацию дендритной (–ых) клетки (–ок), экспрессирующей (–их) человеческий полипептид SIRP–α (например, повышает уровень активации отдельных дендритных клеток или повышает долю активированных дендритных клеток в популяции образца). Например, активацию дендритных клеток, обработанных или приведенных в контакт с антителом согласно настоящему изобретению, можно сравнивать с активацией дендритных клеток, не обработанных или не приведенных в контакт с антителом, или же активацию дендритных клеток, которые экспрессируют человеческий полипептид SIRP–α и обрабатываются или приводятся в контакт с антителом согласно настоящему изобретению, можно сравнивать с активацией дендритных клеток, которые не экспрессируют человеческий полипептид SIRP–α и обрабатываются или приводятся в контакт с антителом. Типовые методы анализа активации дендритных клеток описаны в данном документе. В некоторых вариантах реализации антитело согласно настоящему изобретению повышает активацию дендритных клеток (например, экспрессирующих человеческий полипептид SIRP–α), по меньшей мере на 20%, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80% или по меньшей мере на 90%, например, при применении одного или более методов анализа активации дендритных клеток, описанных в данном документе или известных в данной области техники.
[0164] В некоторых вариантах реализации антитело согласно настоящему изобретению ингибирует in vivo рост опухоли, которая экспрессирует CD47. Например, in vivo рост опухоли, которая экспрессирует CD47 и обрабатывается антителом согласно настоящему изобретению, можно сравнивать с in vivo ростом опухоли, которая экспрессирует CD47 и не обрабатывается антителом согласно настоящему изобретению. Типовые методы анализа in vivo роста опухоли описаны в данном документе. В некоторых вариантах реализации антитело согласно настоящему изобретению ингибирует in vivo рост опухоли, которая экспрессирует CD47, по меньшей мере на 20%, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80% или по меньшей мере на 90%, например, при применении одного или более методов анализа in vivo роста опухоли, описанных в данном документе или известных в данной области техники.
[0165] В некоторых вариантах реализации антитело согласно настоящему изобретению блокирует связывание между внеклеточным доменом (например, доменом D1) человеческого полипептида SIRP–α и доменом IgSF человеческого полипептида CD47 (например, «блокирующее антитело»). Например, антитело и полипептид CD47 могут «конкурировать» за один и тот же эпитоп SIRP–α и/или связывание антитела с SIRP–α может быть взаимно исключающим со связыванием CD47 с SIRP–α. Область связывания между SIRP–α и CD47, а также остатки обоих белков, которые участвуют в связывании, являются известными: смотрите Hatherley, D. et al. (2007) J. Biol. Chem. 282:14567–75 и Nakaishi, A. et al. (2008) J. Mol. Biol. 375:650–60. Типовые методы анализа для определения того, блокирует ли антитело связывание CD47 с SIRP–α, описаны в данном документе. В некоторых вариантах реализации антитело согласно настоящему изобретению блокирует связывание между внеклеточным доменом (например, доменом D1) человеческого полипептида SIRP–α и доменом IgSF человеческого полипептида CD47 в in vitro анализе, например, с применением очищенных полипептидов SIRP–α и/или CD47. Например, в данном документе описаны методы in vitro анализа ELISA и ППР, хотя это не подразумевает ограничения, так как можно использовать также другие методы in vitro анализа связывания. В некоторых вариантах реализации связывание антитела с комплексом, содержащим вариант D1 SIRP–α (например, связывание высокоаффинного домена D1 SIRP–α искусственного происхождения с CD47 с более высокой аффинностью, чем в случае одного или более вариантов природного происхождения, как описано в данном документе), связанным с доменом IgSF CD47, используют для скрининга в отношении блокирующих, неблокирующих и/или отталкивающих антител. В некоторых вариантах реализации «блокирующие» и/или «неблокирующие» антитела можно исследовать методом поверхностного плазмонного резонанса (ППР; например, как описано в примере 1). Например, может происходить образование комплекса между доменом IgSF CD47 и вариантом D1 SIRP–α (например, связывание высокоаффинного домена D1 SIRP–α искусственного происхождения с CD47 с более высокой аффинностью, чем в случае одного или более вариантов природного происхождения, как описано в данном документе), а затем можно определять связывание исследуемого антитела с комплексом. В случае антитела, которое блокирует связывание SIRP–α с CD47, при повышении концентрации CD47 можно было бы ожидать, что меньше молекул SIRP–α будет доступно для связывания с антителом, так как антитело конкурирует за один и тот же участок связывания, что и CD47, а большинство/весь SIRP–α находится в комплексе CD47. Следовательно, можно ожидать снижение резонанса (РЕ) при повышении концентрации CD47 в смеси. В некоторых вариантах реализации «блокирующее» анти–SIRP–α антитело согласно настоящему изобретению связывается с внеклеточным доменом полипептида SIRP–α (например, доменом D1) в одном или более остатках области связывания между CD47 и SIRP–α, т. е. блокирующее антитело и CD47 используют частично или полностью перекрывающиеся эпитопы. В некоторых вариантах реализации «блокирующее» анти–SIRP–α антитело согласно настоящему изобретению связывается с внеклеточным доменом полипептида SIRP–α (например, доменом D1) в одной или более позициях, которые также связываются CD47 в комплексе CD47: SIRP–α. Области связывания между SIRP–α и типовыми анти–SIRP–α антителами или CD47 описаны в примере 4. В некоторых вариантах реализации антитело согласно настоящему изобретению блокирует связывание между внеклеточным доменом (например, доменом D1) человеческого полипептида SIRP–α, экспрессируемого на поверхности первой клетки, и доменом IgSF человеческого полипептида CD47, экспрессируемого на поверхности второй клетки, например, при применении in vivo анализа связывания между полипептидами, экспрессируемыми на поверхности клеток. В некоторых вариантах реализации in vivo анализ может позволить оценить связывание между внеклеточным доменом (например, доменом D1) человеческого полипептида SIRP–α, экспрессируемого на поверхности первой клетки, и доменом IgSF человеческого полипептида CD47, экспрессируемого на поверхности второй клетки, посредством анализа одного или более аспектов сигнализации SIRP–α, например, одного или более внутриклеточных событий сигнализации, опосредованных активацией полипептида SIRP–α, включая, без ограничений, фосфорилирование тирозина внутриклеточной области SIRP–α, связывание фосфатазы (например, SHP1), связывание адаптерного белка (например, SCAP2, FYB и/или GRB2), выработку цитокинов (например IL–10, IL–1β, IFN или TNF) и выработку оксида азота; и/или одного или более межклеточных фенотипов, включая, без ограничений, фагоцитоз макрофагами и другие активирующие или супрессивные фенотипы макрофагов, эозинофилов, нейтрофилов, дендритных клеток и миелоидных супрессорных клеток (МСК).
[0166] В некоторых вариантах реализации антитело согласно настоящему изобретению не блокирует связывание между внеклеточным доменом (например, доменом D1) человеческого полипептида SIRP–α и доменом IgSF человеческого полипептида CD47 (например, «неблокирующее антитело»). Например, антитело и полипептид CD47 могут связывать различные и/или не перекрывающиеся эпитопы SIRP–α. В некоторых вариантах реализации антитело согласно настоящему изобретению не блокирует связывание между внеклеточным доменом (например, доменом D1) человеческого полипептида SIRP–α и доменом IgSF человеческого полипептида CD47 в in vitro анализе, например, с применением очищенных полипептидов SIRP–α и/или CD47. Например, в данном документе описаны методы in vitro анализа ELISA и ППР, хотя это не подразумевает ограничения, так как можно использовать также другие методы in vitro анализа связывания. В некоторых вариантах реализации связывание антитела с комплексом, содержащим вариант D1 SIRP–α (например, связывание высокоаффинного домена D1 SIRP–α искусственного происхождения с CD47 с более высокой аффинностью, чем в случае одного или более вариантов природного происхождения, как описано в данном документе), связанный с доменом IgSF CD47, используют для скрининга в отношении блокирующих, неблокирующих и/или отталкивающих антител. В некоторых вариантах реализации «блокирующие» и/или «неблокирующие» антитела можно исследовать методом поверхностного плазмонного резонанса (ППР; например, как описано в примере 1). Например, может происходить образование комплекса между доменом IgSF CD47 и вариантом D1 SIRP–α (например, связывание высокоаффинного домена D1 SIRP–α искусственного происхождения с CD47 с более высокой аффинностью, чем в случае одного или более вариантов природного происхождения, как описано в данном документе), а затем можно определять связывание исследуемого антитела с комплексом. В случае антитела, которое не блокирует связывание SIRP–α с CD47, можно ожидать, что антитело будет связывать комплекс SIRP–α /CD47 и образовывать сандвич–структуру. Следовательно, при повышении концентрации CD47 будет возрастать резонанс вследствие повышения образования сандвич–структур. В некоторых вариантах реализации «неблокирующее» анти–SIRP–α антитело согласно настоящему изобретению связывается с внеклеточным доменом полипептида SIRP–α (например, доменом D1) в одном или более остатках, отличных от области связывания между CD47 и SIRP–α, т. е. неблокирующее антитело и CD47 используют полностью не перекрывающиеся эпитопы. Области связывания между SIRP–α и типовыми анти–SIRP–α антителами или CD47 описаны в примере 4. В некоторых вариантах реализации антитело согласно настоящему изобретению не блокирует связывание между внеклеточным доменом (например, доменом D1) человеческого полипептида SIRP–α, экспрессируемого на поверхности первой клетки, и доменом IgSF человеческого полипептида CD47, экспрессируемого на поверхности второй клетки, например, при применении in vivo анализа связывания между полипептидами, экспрессируемыми на поверхности клеток. В некоторых вариантах реализации in vivo анализ может позволить оценить связывание между внеклеточным доменом (например, доменом D1) человеческого полипептида SIRP–α, экспрессируемого на поверхности первой клетки, и доменом IgSF человеческого полипептида CD47, экспрессируемого на поверхности второй клетки, посредством анализа одного или более аспектов сигнализации SIRP–α, например, одного или более внутриклеточных событий сигнализации, опосредованных активацией полипептида SIRP–α, включая, без ограничений, фосфорилирование тирозина внутриклеточной области SIRP–α, связывание фосфатазы (например, SHP1), связывание адаптерного белка (например, SCAP2, FYB и/или GRB2), выработку цитокинов (например IL–10, IL–1β, IFN или TNF) и выработку оксида азота; и/или одного или более межклеточных фенотипов, включая, без ограничений, фагоцитоз макрофагами и другие активирующие или супрессивные фенотипы макрофагов, эозинофилов, нейтрофилов, дендритных клеток и миелоидных супрессорных клеток (МСК). Удивительным открытием настоящего изобретения стало то, что антитела, которые не блокируют взаимодействие SIRP–α с CD47, способны повышать фагоцитоз и блокировать in vivo рост опухоли. Не ограничиваясь теорией считается, что неблокирующие анти–SIRP–α антитела могут модулировать одну или более функций SIRP–α независимо от связывания CD47.
[0167] В некоторых вариантах реализации связывание антитела согласно настоящему изобретению с внеклеточным доменом (например, доменом D1) человеческого полипептида SIRP–α снижает аффинность человеческого полипептида SIRP–α в отношении связывания домена IgSF человеческого полипептида CD47 (например, «отталкивающее» антитело). В некоторых вариантах реализации связывание антитела с внеклеточным доменом (например, доменом D1) человеческого полипептида SIRP–α повышает kдисс. человеческого полипептида SIRP–α в отношении связывания домена IgSF человеческого полипептида CD47. В некоторых вариантах реализации связывание антитела с внеклеточным доменом (например, доменом D1) человеческого высокоаффинного полипептида SIRP–α (например, описанного в данном документе) повышает kдисс. человеческого высокоаффинного полипептида SIRP–α (например, описанного в данном документе) в отношении связывания домена IgSF человеческого полипептида CD47 до более чем около 1×10–3 1/с. Например, антитело и полипептид CD47 могут использовать смежные или частично перекрывающиеся эпитопы SIRP–α так, чтобы антитело было способно связывать SIRP–α, когда оно связано с CD47, но антитело: SIRP–α стимулирует диссоциацию SIRP–α: CD47. В некоторых вариантах реализации антитело согласно настоящему изобретению снижает аффинность внеклеточного домена (например, домена D1) человеческого полипептида SIRP–α в отношении связывания домена IgSF человеческого полипептида CD47 в in vitro анализе, например, с применением очищенных полипептидов SIRP–α и/или CD47. В некоторых вариантах реализации связывание антитела с внеклеточным доменом (например, доменом D1) человеческого полипептида SIRP–α повышает kдисс. человеческого полипептида SIRP–α в отношении связывания домена IgSF человеческого полипептида CD47 в in vitro анализе, например, с применением очищенных полипептидов SIRP–α и/или CD47. Например, в данном документе описаны методы in vitro анализа ELISA и ППР, хотя это не подразумевает ограничения, так как можно использовать также другие методы in vitro анализа связывания. В некоторых вариантах реализации связывание антитела с комплексом, содержащим вариант D1 SIRP–α (например, связывание высокоаффинного домена D1 SIRP–α искусственного происхождения с CD47 с более высокой аффинностью, чем в случае одного или более вариантов природного происхождения, как описано в данном документе), связанный с доменом IgSF CD47, используют для скрининга в отношении блокирующих, неблокирующих и/или отталкивающих антител. В некоторых вариантах реализации антитело согласно настоящему изобретению снижает аффинность внеклеточного домена (например, домена D1) человеческого полипептида SIRP–α, экспрессируемого на поверхности первой клетки, в отношении связывания домена IgSF человеческого полипептида CD47, экспрессируемого на поверхности второй клетки, например, при применении in vivo анализа связывания между полипептидами, экспрессируемыми на поверхности клеток. В некоторых вариантах реализации «отталкивающее» анти–SIRP–α антитело согласно настоящему изобретению связывается с внеклеточным доменом (например, доменом D1) полипептида SIRP–α в одном или более остатках области связывания между CD47 и SIRP–α, т. е. отталкивающее антитело и CD47 используют частично перекрывающиеся эпитопы. В некоторых вариантах реализации «отталкивающее» анти–SIRP–α антитело согласно настоящему изобретению связывается с внеклеточным доменом (например, доменом D1) полипептида SIRP–α в 1 или более остатках, которые также связываются CD47 в комплексе CD47:SIRP–α. Например, «отталкивающее» анти–SIRP–α антитело может связываться с внеклеточным доменом (например, доменом D1) полипептида SIRP–α в 2 или более остатках, которые также связываются CD47 в комплексе CD47:SIRP–α и находятся на периферии эпитопа связывания CD47 на SIRP–α. Области связывания между SIRP–α и типовыми анти–SIRP–α антителами или CD47 описаны в примере 4. В некоторых вариантах реализации связывание антитела согласно настоящему изобретению с внеклеточным доменом (например, доменом D1) человеческого полипептида SIRP–α, экспрессируемого на поверхности первой клетки, повышает kдисс. человеческого полипептида SIRP–α в отношении связывания домена IgSF человеческого полипептида CD47, экспрессируемого на поверхности второй клетки, например, при применении in vivo анализа связывания между полипептидами, экспрессируемыми на поверхности клеток. В некоторых вариантах реализации in vivo анализ может позволить оценить связывание между внеклеточным доменом (например, доменом D1) человеческого полипептида SIRP–α, экспрессируемого на поверхности первой клетки, и доменом IgSF человеческого полипептида CD47, экспрессируемого на поверхности второй клетки, посредством анализа одного или более аспектов сигнализации SIRP–α, например, одного или более внутриклеточных событий сигнализации, опосредованных активацией полипептида SIRP–α, включая, без ограничений, фосфорилирование тирозина внутриклеточной области SIRP–α, связывание фосфатазы (например, SHP1), связывание адаптерного белка (например, SCAP2, FYB и/или GRB2), выработку цитокинов (например, IL–10, IL–1β, IFN или TNF) и выработку оксида азота; и/или одного или более межклеточных фенотипов, включая, без ограничений, фагоцитоз макрофагами и другие активирующие или супрессивные фенотипы макрофагов, эозинофилов, нейтрофилов, дендритных клеток и миелоидных супрессорных клеток (МСК).
[0168] В некоторых вариантах реализации антитело согласно настоящему изобретению модулирует одну или более иммунных функций посредством связывания с двумя или более (или всеми тремя) из SIRP–α, SIRP–β и SIRPγ.
[0169] В некоторых вариантах реализации антитело согласно настоящему изобретению связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α v1, внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α v2 или их оба; связывает внеклеточный домен (например, домен D1) обезьяньего полипептида SIRP–α; и при этом антитело не блокирует связывание между внеклеточным доменом (например, доменом D1) человеческого полипептида SIRP–α и доменом IgSF человеческого полипептида CD47.
[0170] В некоторых вариантах реализации антитело согласно настоящему изобретению связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α v1, внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α v2 или их оба; связывает внеклеточный домен (например, домен D1) обезьяньего полипептида SIRP–α; и при этом антитело блокирует связывание между внеклеточным доменом (например, доменом D1) человеческого полипептида SIRP–α и доменом IgSF человеческого полипептида CD47.
[0171] В некоторых вариантах реализации антитело согласно настоящему изобретению связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α v1, внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α v2 или их оба; связывает внеклеточный домен (например, домен D1) обезьяньего полипептида SIRP–α; и при этом связывание антитела с внеклеточным доменом (например, доменом D1) человеческого полипептида SIRP–α снижает аффинность человеческого полипептида SIRP–α в отношении связывания домена IgSF человеческого полипептида CD47.
[0172] В некоторых вариантах реализации антитело согласно настоящему изобретению связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α v1, внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α v2 или их оба; связывает внеклеточный домен (например, домен D1) мышиного полипептида SIRP–α; и при этом антитело не блокирует связывание между внеклеточным доменом (например, доменом D1) человеческого полипептида SIRP–α и доменом IgSF человеческого полипептида CD47.
[0173] В некоторых вариантах реализации антитело согласно настоящему изобретению связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α v1, внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α v2 или их оба; связывает внеклеточный домен (например, домен D1) мышиного полипептида SIRP–α; и при этом антитело блокирует связывание между внеклеточным доменом (например, доменом D1) человеческого полипептида SIRP–α и доменом IgSF человеческого полипептида CD47.
[0174] В некоторых вариантах реализации антитело согласно настоящему изобретению связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α v1, внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α v2 или их оба; связывает внеклеточный домен (например, домен D1) мышиного полипептида SIRP–α; и при этом связывание антитела с внеклеточным доменом (например, доменом D1) человеческого полипептида SIRP–α снижает аффинность человеческого полипептида SIRP–α в отношении связывания домена IgSF человеческого полипептида CD47.
[0175] В некоторых вариантах реализации антитело согласно настоящему изобретению связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α v1, внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α v2 или их оба; связывает внеклеточный домен (например, домен D1) обезьяньего (например, яванского макака) полипептида SIRP–α; связывает внеклеточный домен (например, домен D1) мышиного полипептида SIRP–α; и при этом антитело не блокирует связывание между внеклеточным доменом (например, доменом D1) человеческого полипептида SIRP–α и доменом IgSF человеческого полипептида CD47.
[0176] В некоторых вариантах реализации антитело согласно настоящему изобретению связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α v1, внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α v2 или их оба; связывает внеклеточный домен (например, домен D1) обезьяньего (например, яванского макака) полипептида SIRP–α; связывает внеклеточный домен (например, домен D1) мышиного полипептида SIRP–α; и при этом антитело блокирует связывание между внеклеточным доменом (например, доменом D1) человеческого полипептида SIRP–α и доменом IgSF человеческого полипептида CD47.
[0177] В некоторых вариантах реализации антитело согласно настоящему изобретению связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α v1, внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α v2 или их оба; связывает внеклеточный домен (например, домен D1) обезьяньего (например, яванского макака) полипептида SIRP–α; связывает внеклеточный домен (например, домен D1) мышиного полипептида SIRP–α; и при этом связывание антитела с внеклеточным доменом (например, доменом D1) человеческого полипептида SIRP–α снижает аффинность человеческого полипептида SIRP–α в отношении связывания домена IgSF человеческого полипептида CD47.
[0178] В некоторых вариантах реализации антитело согласно настоящему изобретению связывает внеклеточные домены (например, домены D1) двух или более разных человеческих вариантных полипептидов SIRP–α, мышиного полипептида SIRP–α и обезьяньего полипептида SIRP–α; при этом антитело не связывает по меньшей мере один из внеклеточного домена (например, домена D1) человеческого полипептида SIRP–β и внеклеточного домена (например, домена D1) человеческого полипептида SIRP–γ; и при этом антитело блокирует связывание между внеклеточным доменом (например, доменом D1) человеческого полипептида SIRP–α и доменом IgSF человеческого полипептида CD47 (смотрите, например, Фиг. 3A и 3B).
[0179] В некоторых вариантах реализации антитело согласно настоящему изобретению связывает внеклеточные домены (например, домены D1) двух или более разных человеческих вариантных полипептидов SIRP–α, мышиного полипептида SIRP–α, обезьяньего полипептида SIRP–α и по меньшей мере один из внеклеточного домена (например, домена D1) человеческого полипептида SIRP–β и внеклеточного домена (например, домена D1) человеческого полипептида SIRP–γ; и при этом антитело блокирует связывание между внеклеточным доменом (например, доменом D1) человеческого полипептида SIRP–α и доменом IgSF человеческого полипептида CD47 (смотрите, например, Фиг. 4A и 4B).
[0180] В некоторых вариантах реализации антитело согласно настоящему изобретению связывает внеклеточные домены (например, домены D1) двух или более разных человеческих вариантных полипептидов SIRP–α, мышиного полипептида SIRP–α и обезьяньего полипептида SIRP–α; при этом антитело не связывает по меньшей мере один из внеклеточного домена (например, домена D1) человеческого полипептида SIRP–β и внеклеточного домена (например, домена D1) человеческого полипептида SIRP–γ; и при этом антитело не блокирует связывание между внеклеточным доменом (например, доменом D1) человеческого полипептида SIRP–α и доменом IgSF человеческого полипептида CD47 (смотрите, например, Фиг. 5A и 5B).
[0181] В некоторых вариантах реализации антитело согласно настоящему изобретению связывает внеклеточные домены (например, домены D1) двух или более разных человеческих вариантных полипептидов SIRP–α и обезьяньего полипептида SIRP–α; при этом антитело не связывает мышиный полипептид SIRP–α; при этом антитело не связывает по меньшей мере один из внеклеточного домена (например, домена D1) человеческого полипептида SIRP–β и внеклеточного домена (например, домена D1) человеческого полипептида SIRP–γ; и при этом антитело блокирует связывание между внеклеточным доменом (например, доменом D1) человеческого полипептида SIRP–α и доменом IgSF человеческого полипептида CD47 (смотрите, например, Фиг. 6A и 6B).
[0182] В некоторых вариантах реализации антитело согласно настоящему изобретению связывает внеклеточные домены (например, домены D1) двух или более разных человеческих вариантных полипептидов SIRP–α, обезьяньего полипептида SIRP–α и по меньшей мере один из внеклеточного домена (например, домена D1) человеческого полипептида SIRP–β и внеклеточного домена (например, домена D1) человеческого полипептида SIRP–γ; при этом антитело не связывает мышиный полипептид SIRP–α; и при этом антитело блокирует связывание между внеклеточным доменом (например, доменом D1) человеческого полипептида SIRP–α и доменом IgSF человеческого полипептида CD47 (смотрите, например, Фиг. 7A и 7B).
[0183] В некоторых вариантах реализации антитело согласно настоящему изобретению содержит три CDR из VH–домена, содержащего последовательность, приведенную в таблице 2, и/или три CDR из VL–домена, содержащего последовательность, приведенную в таблице 2 (последовательности VH и VL с выделенными CDR приведены на Фиг. 10A–10B и 11A–11J). Например, в некоторых вариантах реализации антитело согласно настоящему изобретению содержит три CDR из VH–домена, содержащего последовательность, выбранную из SEQ ID NO: 294, 139, 358, 362, 354, 380, 384, 350, 137, 374, 356, 352, 135, 348, 376, 346, 342, 344, 141, 360, 370, 382, 364, 366, 368, 372, 378, 133, 128, 396, 386, 398,402, 392, 388, 390, 394, 400, 116, 117, 118, 119, 282, 404, 406, 278, 412, 275, 414, 280, 123, 292, 288, 290, 408, 410, 286, 284, 120, 121, 130 и 122, и/или три CDR из VL–домена, содержащего последовательность, выбранную из SEQ ID NO: 295, 363, 140, 359, 355, 351, 136, 349, 377, 138, 375, 357, 353, 381, 385, 345, 365, 367, 369, 347, 142, 343, 371, 379, 383, 361, 373, 134, 105,387,389,395,397,399, 403, 391, 393, 401, 93, 94, 95, 96, 283, 405, 407, 279, 413, 276, 415, 281, 100, 293, 289, 291, 409, 411, 287, 285, 97, 98, 107 и 99. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит VH–домен, содержащий последовательность, приведенную в таблице 2, и/или VL–домен, содержащий последовательность, приведенную в таблице 2 (смотрите Фиг. 10A–10B и 11A–11J). Например, в некоторых вариантах реализации антитело согласно настоящему изобретению содержит VH–домен, содержащий аминокислотную последовательность, выбранную из SEQ ID NO: 294, 139, 358, 362, 354, 380, 384, 350, 137, 374, 356, 352, 135, 348, 376, 346, 342, 344, 141, 360, 370, 382, 364, 366, 368, 372, 378, 133, 128, 396, 386, 398,402, 392, 388, 390, 394, 400, 116, 117, 118, 119, 282, 404, 406, 278, 412, 275, 414, 2,80, 123, 292, 288, 290, 408, 410, 286, 284, 120, 121, 130 и 122, и/или VL–домен, содержащий аминокислотную последовательность, выбранную из SEQ ID NO: 295, 363, 140, 359, 355, 351, 136, 349, 377, 138, 375, 357, 353, 381, 385, 345, 365, 367, 369, 347, 142, 343, 371, 379, 383, 361, 373, 134, 105, 387, 389, 395, 397, 399, 403, 391, 393, 401, 93, 94, 95, 96, 283, 405, 407, 279, 413, 276, 415, 281, 100, 293, 289, 291, 409, 411, 287, 285, 97, 98, 107 и 99. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит шесть последовательностей CDR из антитела, приведенного в таблице 2 (смотрите Фиг. 10A–10B и 11A–11J). В некоторых вариантах реализации антитело согласно настоящему изобретению содержит VL–домен, содержащий последовательность VL–доменов Hum1–Hum9, описанных в данном документе. В некоторых вариантах реализации антитело представляет собой гуманизированное антитело. В некоторых вариантах реализации антитело представляет собой человеческое антитело. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит VH–домен и/или VL–домен из антитела, приведенного в таблице 2. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит VH–домен, содержащий остаток D или E, за которым следует (например, в направлении от N–конца к C–концу) последовательность VH–домена, выбранная из SEQ ID NO: 116–130.
Таблица 2. Аминокислотные последовательности клонов антител, описанных в данном документе.
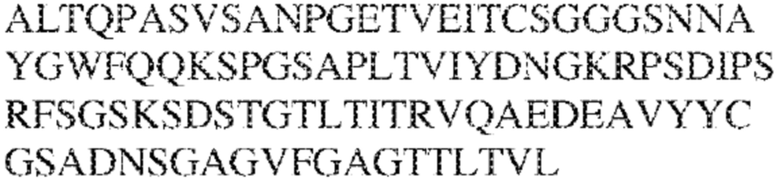

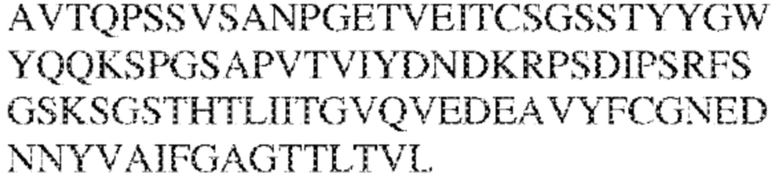
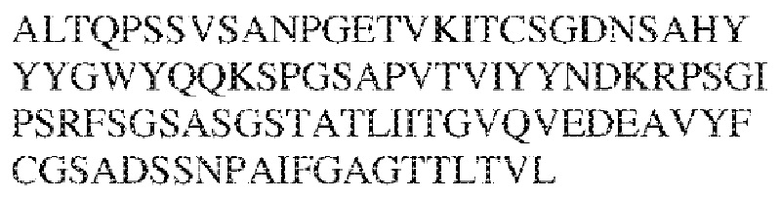
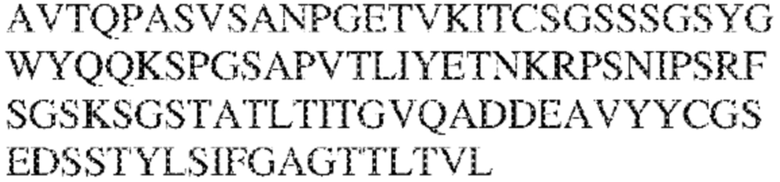
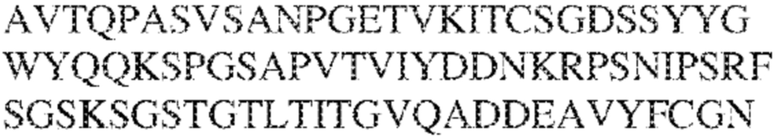
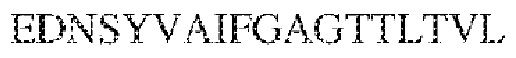
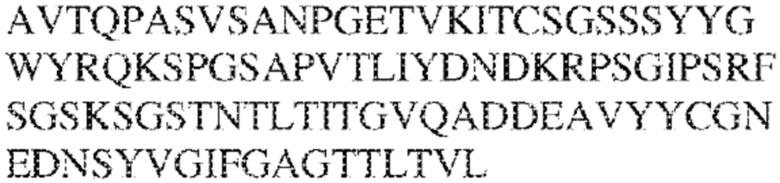

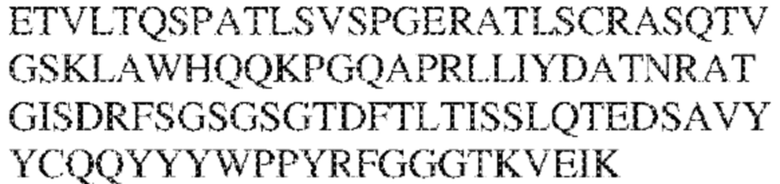
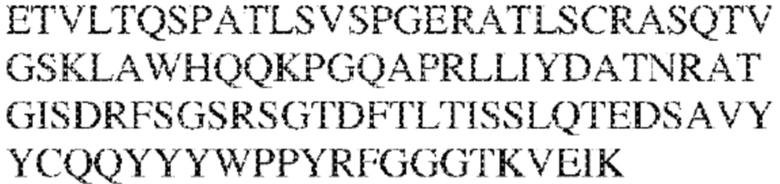

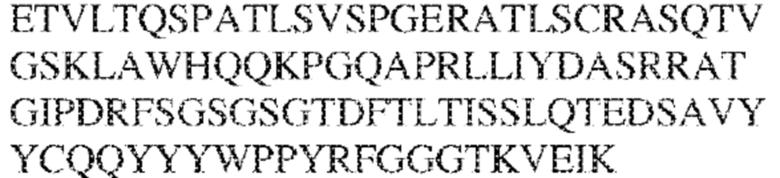


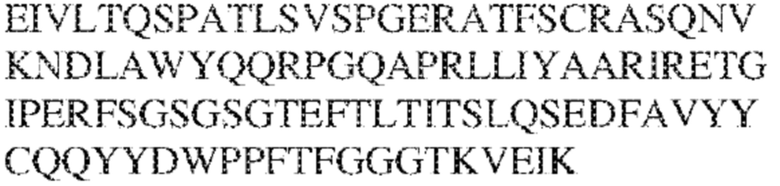
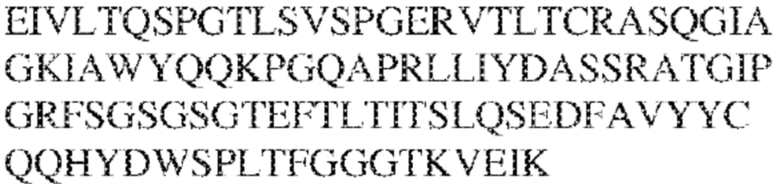
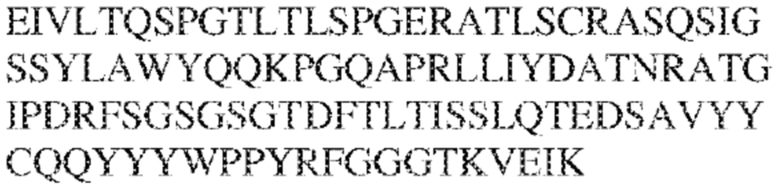


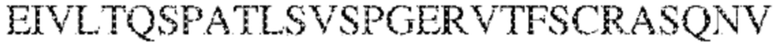
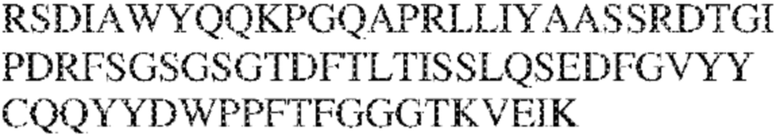
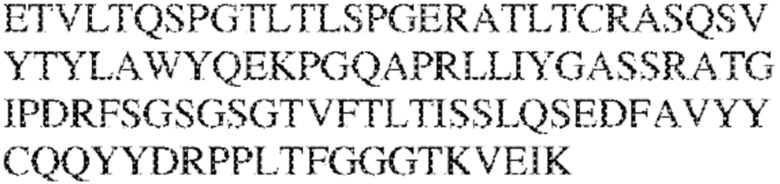
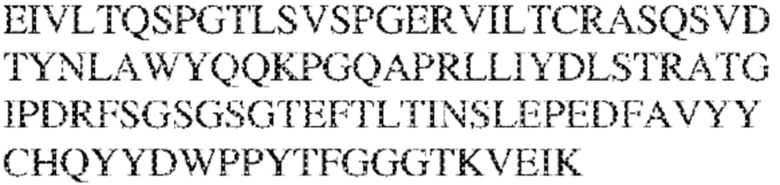
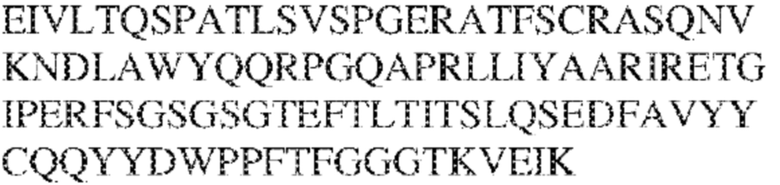

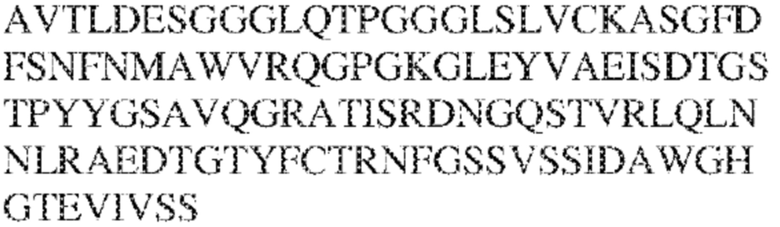


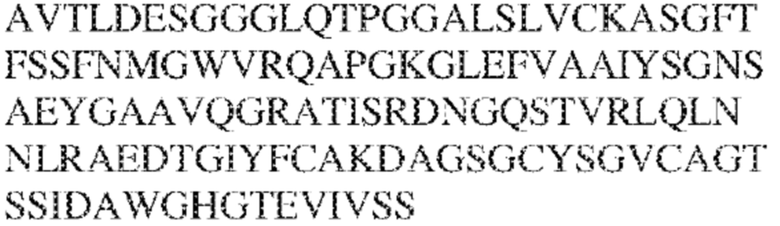

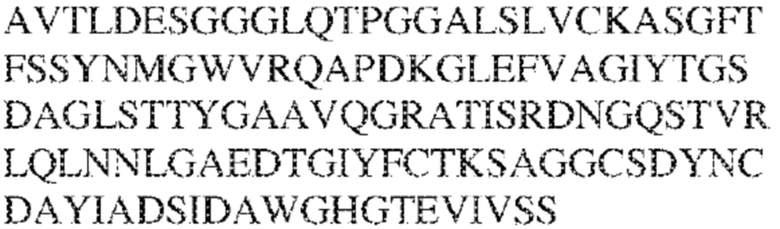
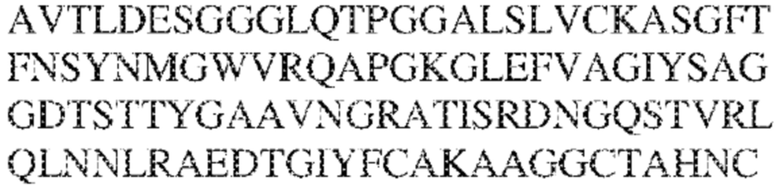
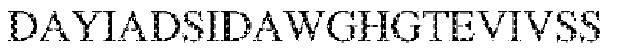









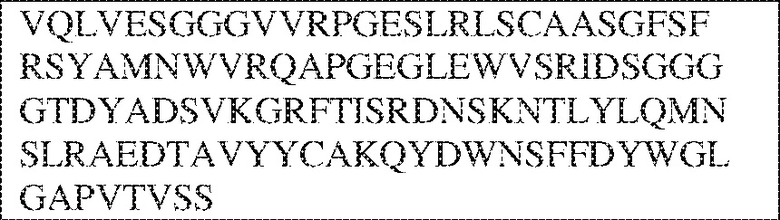









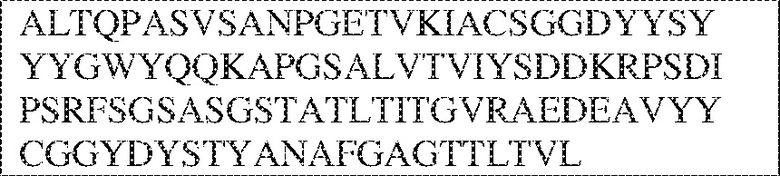

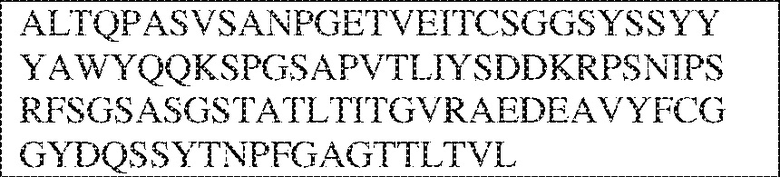

YGWYQQKSPGSAPVTVIYSDDERPSDIPS
RFSGSASGSTATLTITGVRVEDEAIYYCG
AYDGSTYANTFGAGTTLTVL










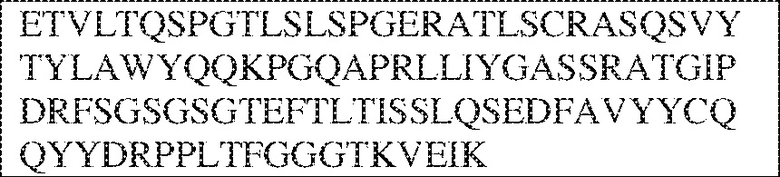
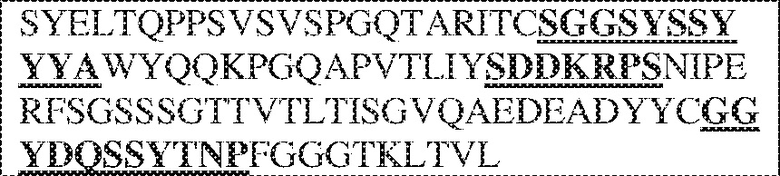



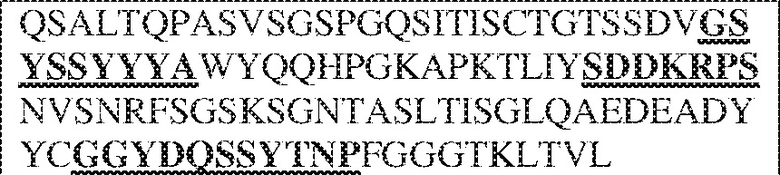

V34M







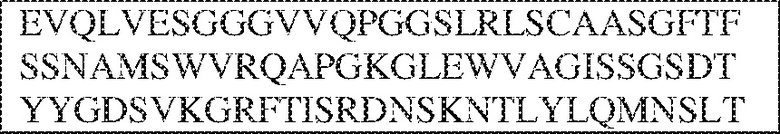


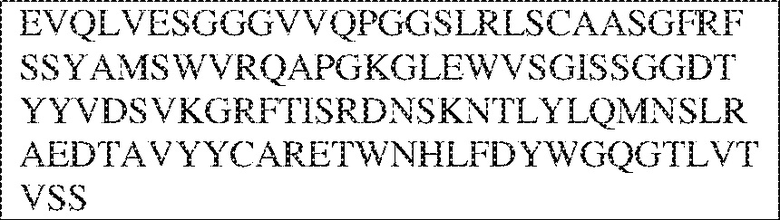








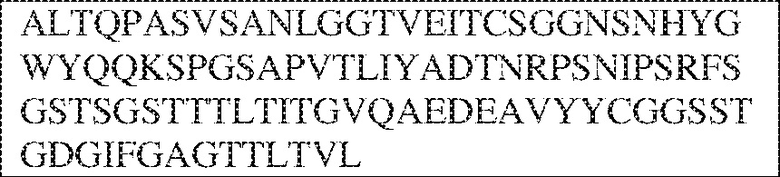

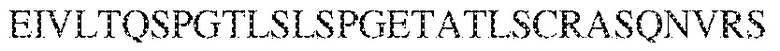



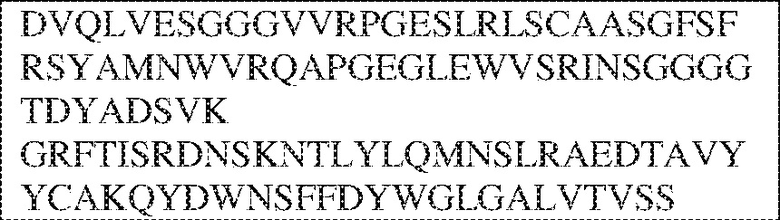






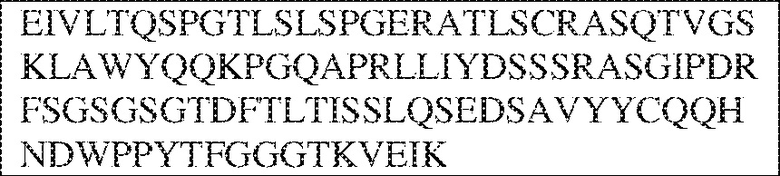


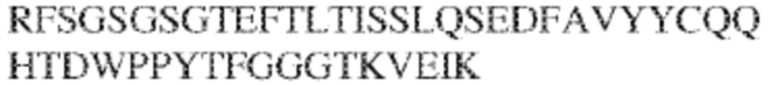

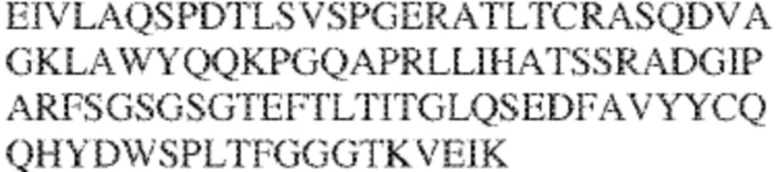
M34L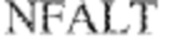
M34L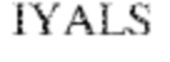
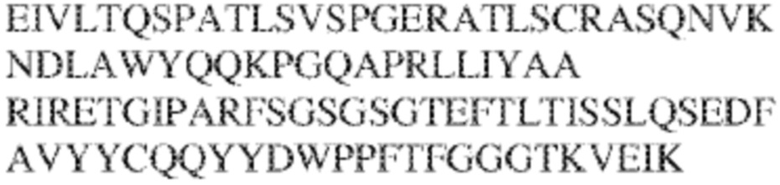
M34L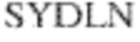
M34L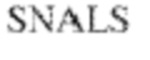
M34L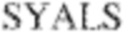

_MutAll
_V34L
_Mutall
_V34L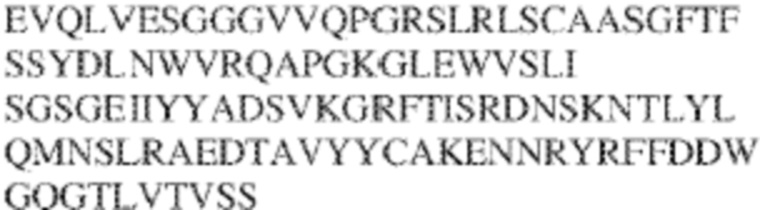
MutAl_M34L
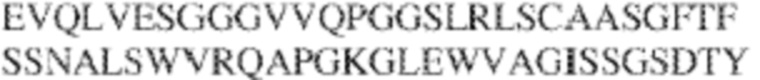
4L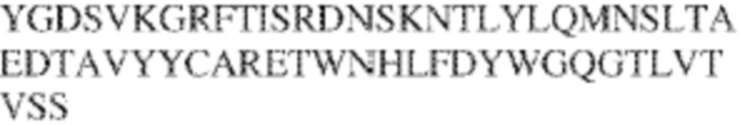


m14 (218 VL с IGLV3 человека)


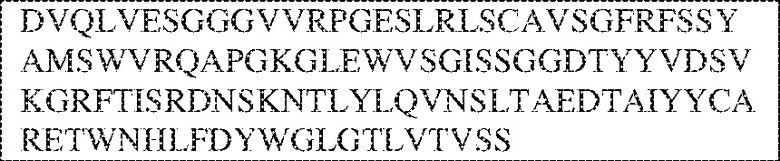

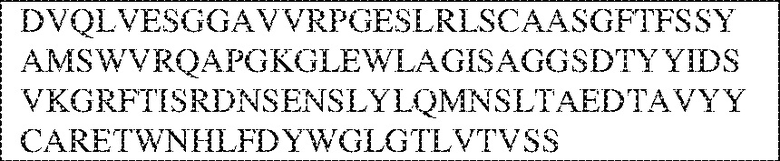
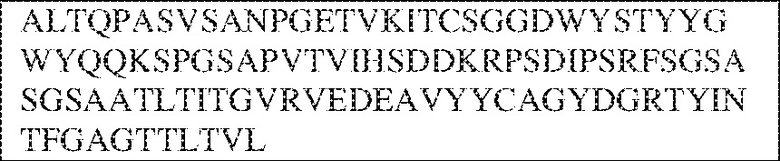
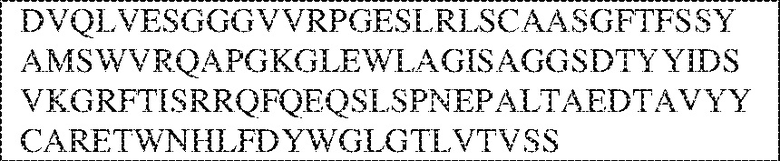




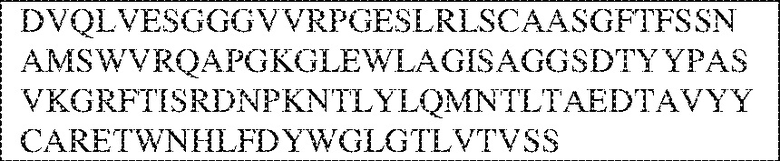



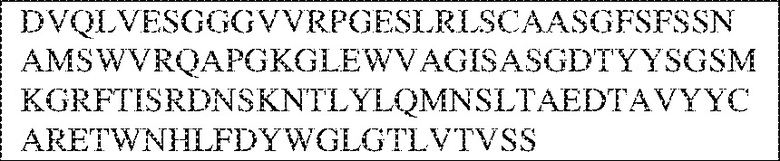

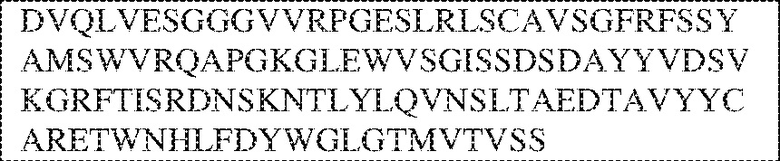

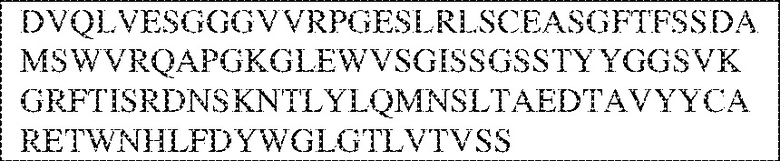
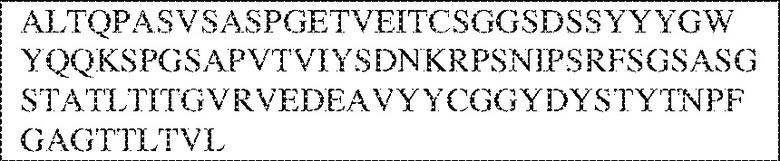
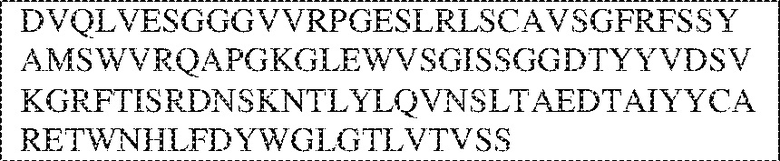
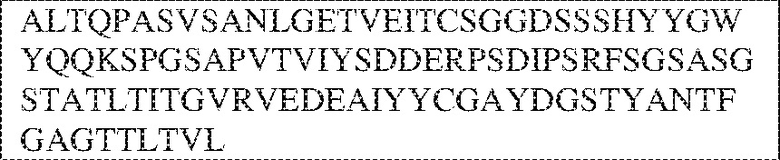
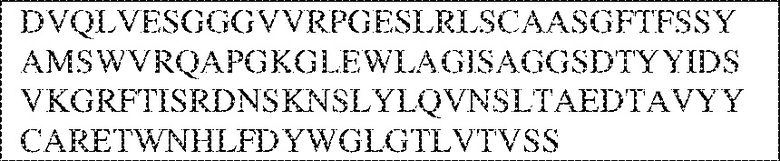
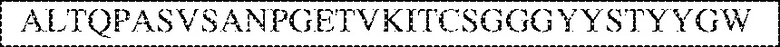
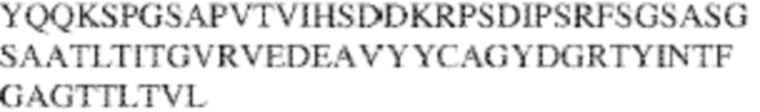
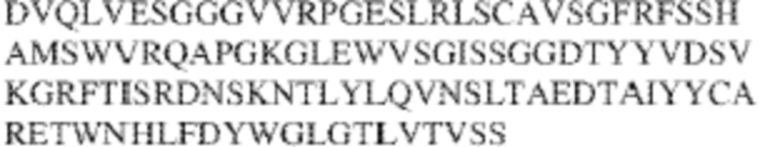
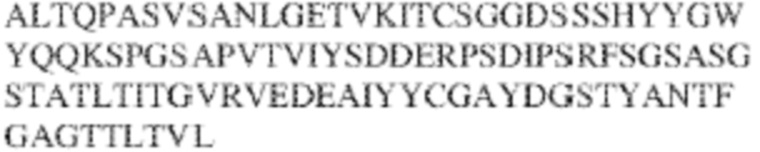
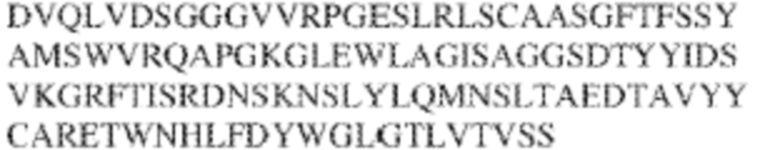
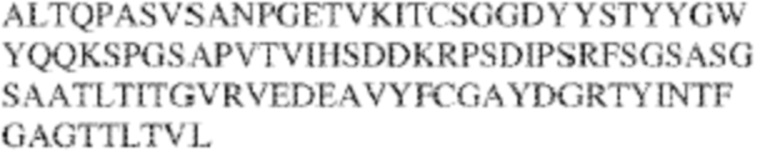
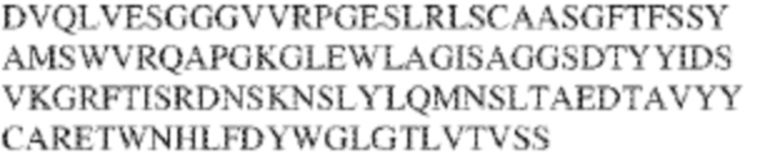
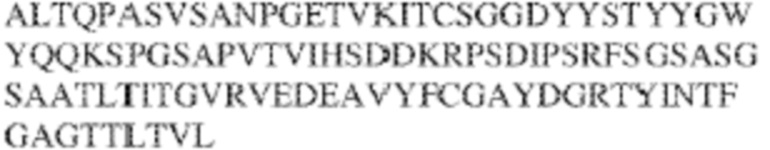
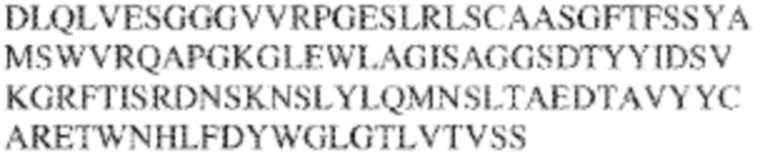
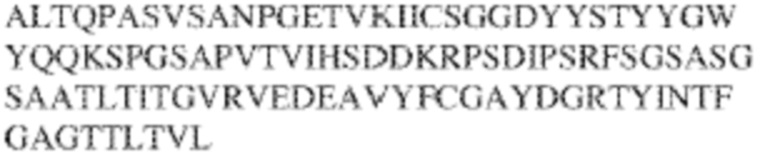
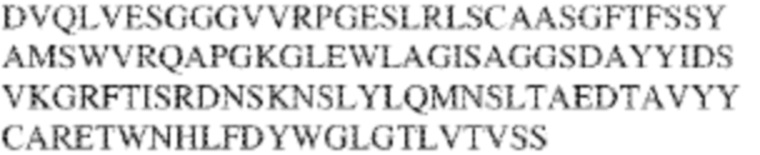
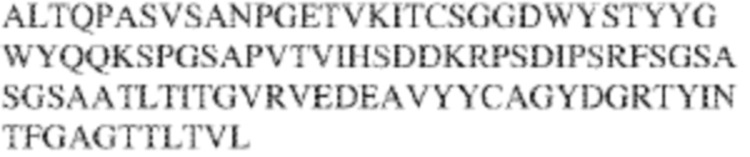
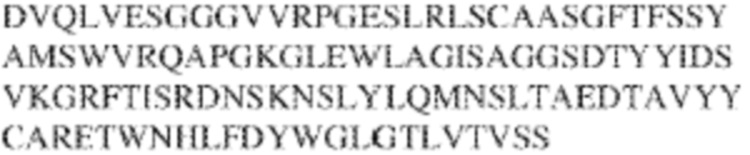
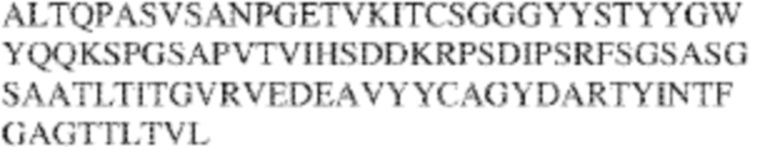
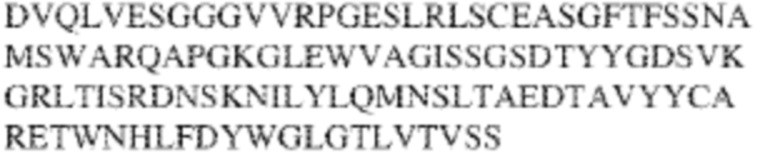
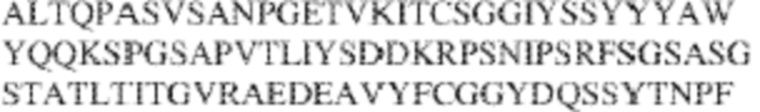
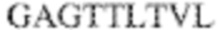
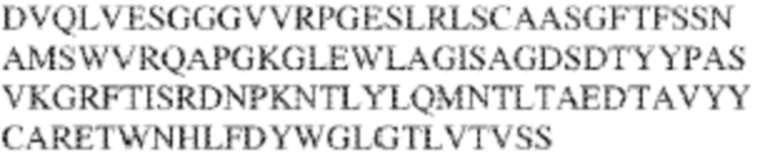
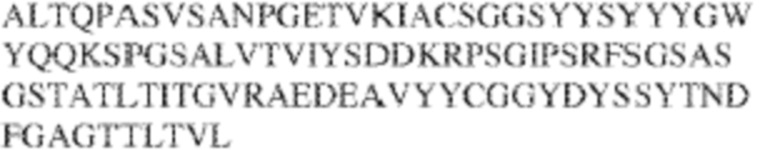
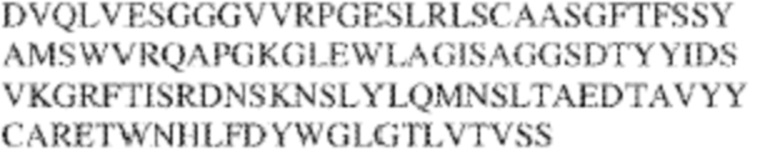
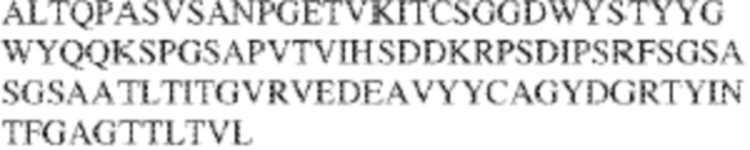
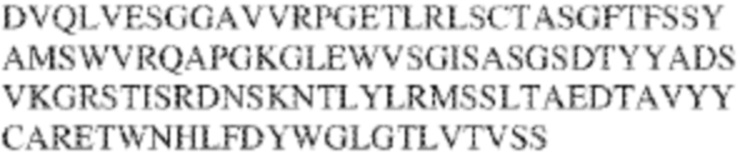
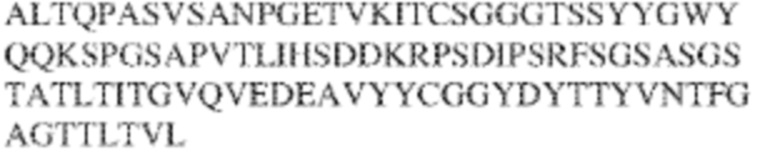
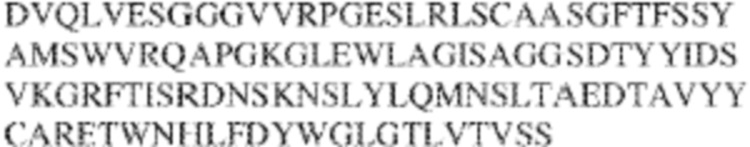
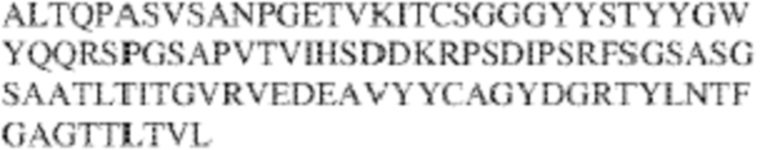
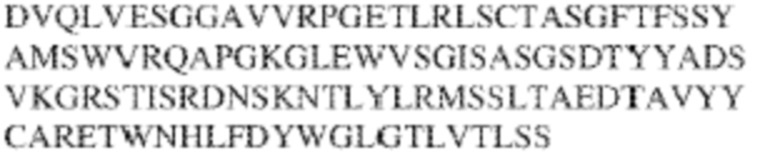
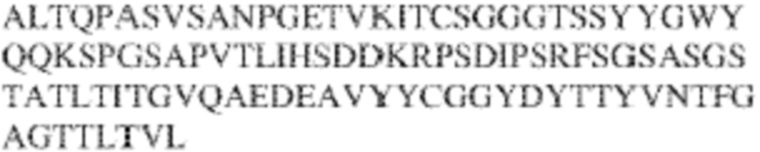
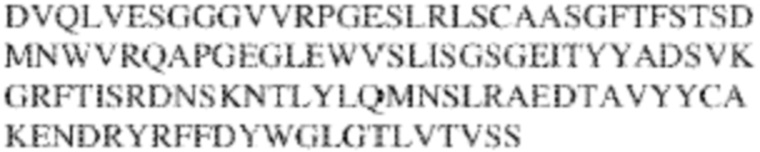
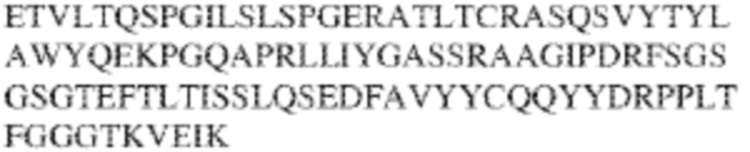
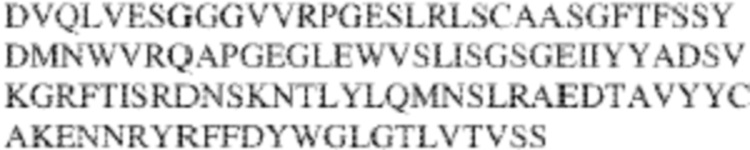
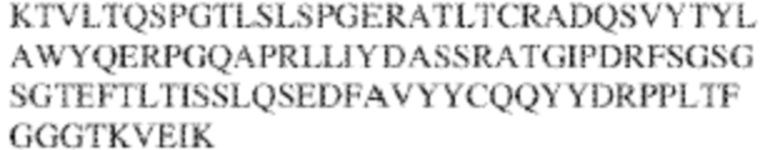
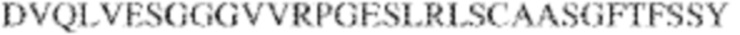
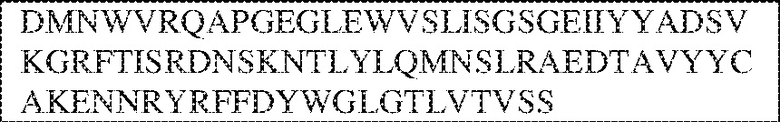

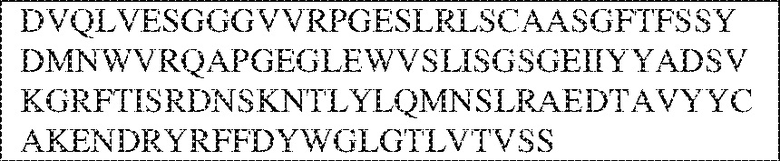

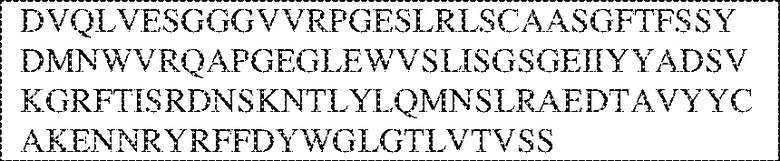

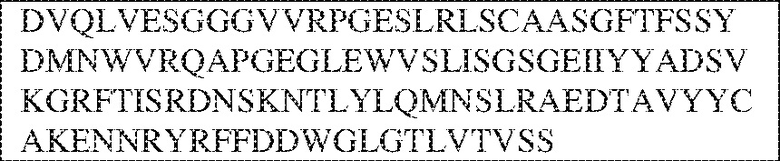

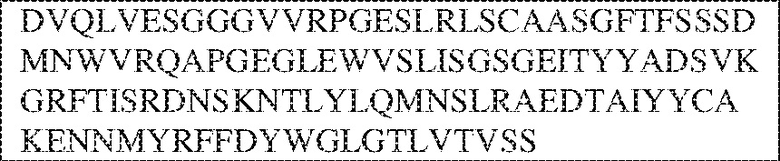

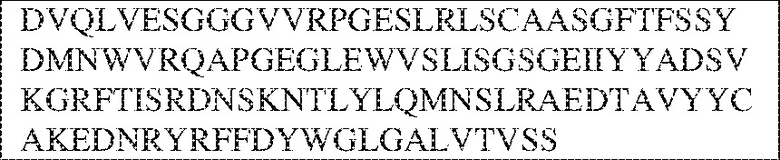



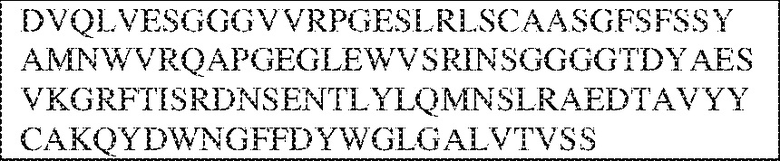

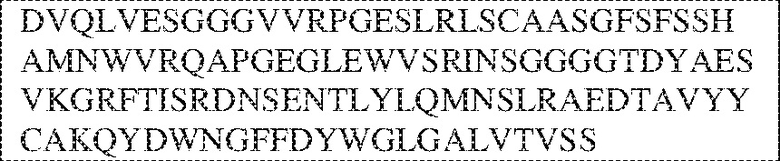
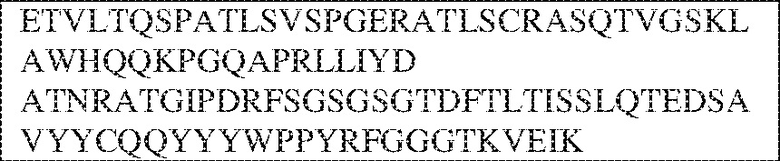


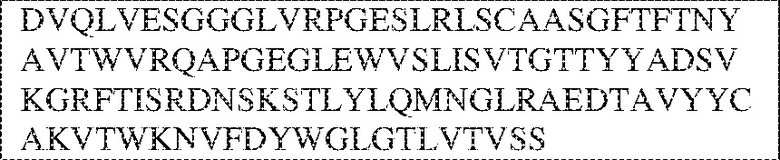

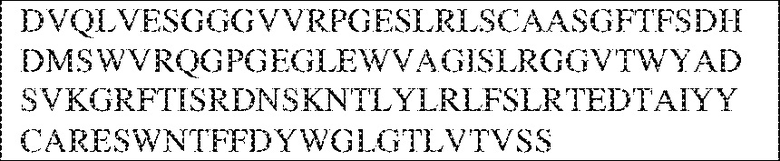

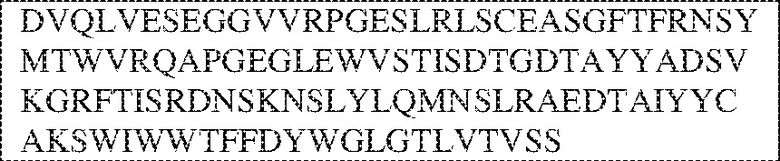

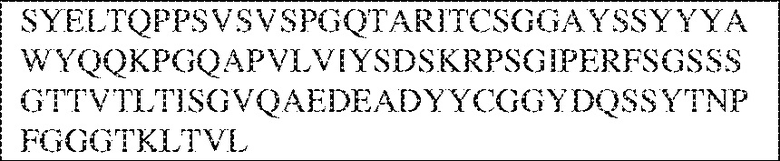



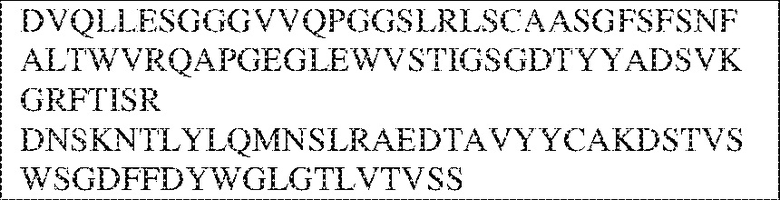
M34V
M34L
M34V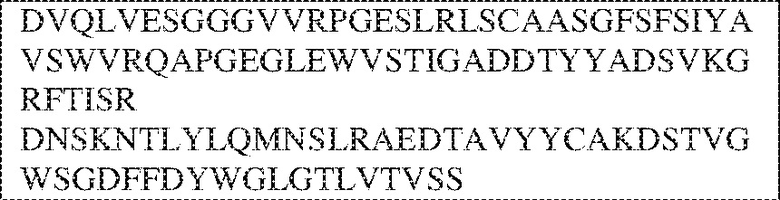
M34L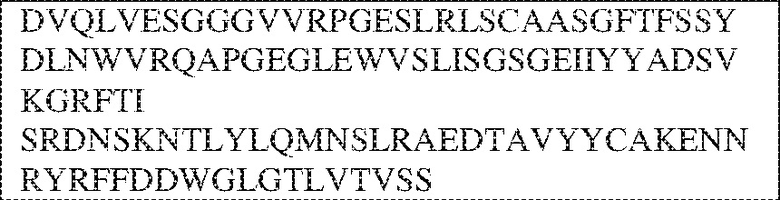
M34V
HVR–H1
[0184] В некоторых вариантах реализации антитело согласно настоящему изобретению связывается с человеческим полипептидом SIRP–α в одном или более остатках. Следует понимать, что остатки полипептида SIRP–α, которые связывает антитело согласно настоящему изобретению, могут быть описаны по отношению к эталонному полипептиду SIRP–α, но такое описание не ограничено единственным полипептидом SIRP–α (т. е. эталонным полипептидом SIRP–α). Скорее конкретные аминокислотные остатки эталонного полипептида SIRP–α описаны, чтобы идентифицировать соответствующие аминокислотные позиции, которые можно идентифицировать в различных полипептидах SIRP–α. Например, конкретные остатки, которые соответствуют одной или более аминокислотным позициям SEQ ID NO: 296, можно идентифицировать для различных человеческих полипептидов SIRP–α, таких как v1 и/или v2. Так как аминокислотные последовательности SEQ ID NO: 296 и SEQ ID NO:5 отличаются только в позиции N80 (за исключением небольшого числа C–концевых остатков SEQ ID NO:296, полезных для выработки и очистки белка), специалисту в данной области техники будет понятно, что ссылки на аминокислотные позиции в отношении аминокислотной последовательности SEQ ID NO:296 будут соответствовать таким же позициям в аминокислотной последовательности SEQ ID NO:5. Способы определения остатков полипептида SIRP–α, связываемых антителом, известны в данной области техники; типовые и неограничивающие описания приведены в примере 4.
[0185] SEQ ID NО: 296
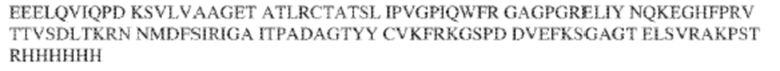
[0186] В некоторых вариантах реализации антитело согласно настоящему изобретению связывается с человеческим полипептидом SIRP–α v1 в одной или более аминокислотных позициях, выбранных из I31, V33, Q52, K53, T67, R69, N70 и K96 в соответствии с SEQ ID NO:296. В некоторых вариантах реализации антитело дополнительно связывается с человеческим полипептидом SIRP–α v1 в одной или более аминокислотных позициях, выбранных из L30, P32, E54, T62, N71, M72, F74 и R95 в соответствии с SEQ ID NO: 296.
[0187] В некоторых вариантах реализации антитело согласно настоящему изобретению связывается с человеческим полипептидом SIRP–α v1 в одной или более аминокислотных позициях, выбранных из I7, P9, D10, K11, S12, A42, A108 и E111 в соответствии с SEQ ID NO:296. В некоторых вариантах реализации антитело связывается с человеческим полипептидом SIRP–α v1 в K11, A42, A108 и E111 в соответствии с SEQ ID NO:296. В некоторых вариантах реализации антитело связывается с человеческим полипептидом SIRP–α v1 в I7, P9, D10, K11, S12, A108 и E111 в соответствии с SEQ ID NO:296. В некоторых вариантах реализации антитело дополнительно связывается с человеческим полипептидом SIRP–α v1 в одной или более аминокислотных позициях, выбранных из L14, T26, T28, T88, Y90, S106, S113 и A116 в соответствии с SEQ ID NO:296. В некоторых вариантах реализации антитело дополнительно связывается с человеческим полипептидом SIRP–α v1 в L14, T88, Y90, S106, S113 и Al16 человеческого SIRP–α v1 в соответствии с SEQ ID NO:296. В некоторых вариантах реализации антитело дополнительно связывается с человеческим полипептидом SIRP–α v1 в L14, T26 и T28 в соответствии с SEQ ID NO:296.
[0188] В некоторых вариантах реализации антитело согласно настоящему изобретению связывается с человеческим полипептидом SIRP–α v1 в одной или более аминокислотных позициях, выбранных из E47, L48, P58, R59, T82 и A84 в соответствии с SEQ ID NO:296. В некоторых вариантах реализации антитело дополнительно связывается с человеческим полипептидом SIRP–α v1 в одной или более аминокислотных позициях, выбранных из A17, P44, G45, I49, E54, G55, H56, F57 и P83 в соответствии с SEQ ID NO: 296.
[0189] В некоторых вариантах реализации антитело согласно настоящему изобретению связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α v1 с константой диссоциации (KД) менее 100 нМ, менее 50 нМ или менее 30 нМ. В некоторых вариантах реализации антитело блокирует связывание между внеклеточным доменом (например, доменом D1) человеческого полипептида SIRP–α и доменом IgSF человеческого полипептида CD47 и при этом антитело связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α v1 с a константой диссоциации (KД) менее 100 нМ, менее 50 нМ или менее 30 нМ. В некоторых вариантах реализации антитело связывает домен D1 человеческого полипептида SIRP–α v1 и домен D1 человеческого полипептида SIRP–α v2. В некоторых вариантах реализации антитело связывает внеклеточный домен (например, домен D1) полипептида SIRP–α яванского макака. В некоторых вариантах реализации антитело связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–β. В некоторых вариантах реализации антитело связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–γ. В некоторых вариантах реализации антитело связывает внеклеточный домен (например, домен D1) мышиного полипептида SIRP–α.
[0190] В некоторых вариантах реализации антитело согласно настоящему изобретению связывает домен D1 человеческого полипептида SIRP–α и не блокирует связывание между внеклеточным доменом (например, доменом D1) человеческого полипептида SIRP–α и доменом IgSF человеческого полипептида CD47. В некоторых вариантах реализации антитело связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α v1 с константой диссоциации (KД) менее 100 нМ, менее 50 нМ или менее 30 нМ. В некоторых вариантах реализации антитело связывает домен D1 человеческого полипептида SIRP–α v1. В некоторых вариантах реализации антитело связывает домен D1 человеческого полипептида SIRP–α v1 и домен D1 человеческого полипептида SIRP–α v2. В некоторых вариантах реализации антитело связывает внеклеточный домен (например, домен D1) полипептида SIRP–α яванского макака. В некоторых вариантах реализации антитело связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–β. В некоторых вариантах реализации антитело связывает внеклеточный домен (например, домен D1) мышиного полипептида SIRP–α.
[0191] В некоторых вариантах реализации антитело согласно настоящему изобретению конкурирует за связывание внеклеточного домена (например, домена D1) человеческого полипептида SIRP–α с эталонным анти–SIRP–α антителом. Способы определения того, конкурирует ли антитело за связывание внеклеточного домена (например, домена D1) человеческого полипептида SIRP–α с эталонным анти–SIRP–α антителом, известны в данной области техники; типовые и неограничивающие описания приведены в примере 5.
[0192] В некоторых вариантах реализации антитело согласно настоящему изобретению конкурирует за связывание внеклеточного домена (например, домена D1) человеческого полипептида SIRP–α с одним или более эталонными анти–SIRP–α антителами, выбранными из 119, 120, 121, 122, 21, 25, 27, 66 и 135. В некоторых вариантах реализации антитело согласно настоящему изобретению конкурирует за связывание внеклеточного домена (например, домена D1) человеческого полипептида SIRP–α с одним или более из следующих эталонных анти–SIRP–α антител: (a) антителом, содержащим VH–домен, содержащий аминокислотную последовательность SEQ ID NO: 120, и VL–домен, содержащий аминокислотную последовательность SEQ ID NO:97; (b) антителом, содержащим VH–домен, содержащий аминокислотную последовательность SEQ ID NO: 121, и VL–домен, содержащий аминокислотную последовательность SEQ ID NO:98; (c) антителом, содержащим VH–домен, содержащий аминокислотную последовательность SEQ ID NO: 130, и VL–домен, содержащий аминокислотную последовательность SEQ ID NO: 107, (d) антителом, содержащим VH–домен, содержащий аминокислотную последовательность SEQ ID NO: 122, и VL–домен, содержащий аминокислотную последовательность SEQ ID NO:99; (e) антителом, содержащим VH–домен, содержащий аминокислотную последовательность SEQ ID NO: 135, и VL–домен, содержащий аминокислотную последовательность SEQ ID NO: 136, (f) антителом, содержащим VH–домен, содержащий аминокислотную последовательность SEQ ID NO: 137, и VL–домен, содержащий аминокислотную последовательность SEQ ID NO: 138, (g) антителом, содержащим VH–домен, содержащий аминокислотную последовательность SEQ ID NO: 139, и VL–домен, содержащий аминокислотную последовательность SEQ ID NO: 140, (h) антителом, содержащим VH–домен, содержащий аминокислотную последовательность SEQ ID NO: 141, и VL–домен, содержащий аминокислотную последовательность SEQ ID NO: 142, и (i) антителом, содержащим VH–домен, содержащий аминокислотную последовательность SEQ ID NO: 127, и VL–домен, содержащий аминокислотную последовательность SEQ ID NO: 104.
[0193] В некоторых вариантах реализации антитело согласно настоящему изобретению конкурирует за связывание внеклеточного домена (например, домена D1) человеческого полипептида SIRP–α с одним или более эталонными анти–SIRP–α антителами, выбранными из 136 и 137. В некоторых вариантах реализации антитело согласно настоящему изобретению конкурирует за связывание внеклеточного домена (например, домена D1) человеческого полипептида SIRP–α с одним или более из следующих эталонных анти–SIRP–α антител: (a) антителом, содержащим VH–домен, содержащий аминокислотную последовательность SEQ ID NO: 133, и VL–домен, содержащий аминокислотную последовательность SEQ ID NO: 134, и (b) антителом, содержащим VH–домен, содержащий аминокислотную последовательность SEQ ID NO: 128, и VL–домен, содержащий аминокислотную последовательность SEQ ID NO: 105.
[0194] В некоторых вариантах реализации антитело согласно настоящему изобретению конкурирует за связывание внеклеточного домена (например, домена D1) человеческого полипептида SIRP–α с одним или более эталонными анти–SIRP–α антителами, выбранными из 3, 213, 173 и 209. В некоторых вариантах реализации антитело согласно настоящему изобретению конкурирует за связывание внеклеточного домена (например, домена D1) человеческого полипептида SIRP–α с одним или более из следующих эталонных анти–SIRP–α антител: (a) антителом, содержащим VH–домен, содержащий аминокислотную последовательность SEQ ID NO:242, и VL–домен, содержащий аминокислотную последовательность SEQ ID NO:243, (b) антителом, содержащим VH–домен, содержащий аминокислотную последовательность SEQ ID NO:275, и VL–домен, содержащий аминокислотную последовательность SEQ ID NO:276, (c) антителом, содержащим VH–домен, содержащий аминокислотную последовательность SEQ ID NO:278, и VL–домен, содержащий аминокислотную последовательность SEQ ID NO:279, и (d) антителом, содержащим VH–домен, содержащий аминокислотную последовательность SEQ ID NO:280, и VL–домен, содержащий аминокислотную последовательность SEQ ID NO:281.
[0195] В некоторых вариантах реализации антитело согласно настоящему изобретению конкурирует за связывание внеклеточного домена (например, домена D1) человеческого полипептида SIRP–α с одним или более эталонными анти–SIRP–α антителами, выбранными из 115, 116, 117, 118 и 132. В некоторых вариантах реализации антитело согласно настоящему изобретению конкурирует за связывание внеклеточного домена (например, домена D1) человеческого полипептида SIRP–α с одним или более из следующих эталонных анти–SIRP–α антител: (a) антителом, содержащим VH–домен, содержащий аминокислотную последовательность SEQ ID NO: 116, и VL–домен, содержащий аминокислотную последовательность SEQ ID NO:93; (b) антителом, содержащим VH–домен, содержащий аминокислотную последовательность SEQ ID NO: 117, и VL–домен, содержащий аминокислотную последовательность SEQ ID NO:94; (c) антителом, содержащим VH–домен, содержащий аминокислотную последовательность SEQ ID NO: 118, и VL–домен, содержащий аминокислотную последовательность SEQ ID NO:95, (d) антителом, содержащим VH–домен, содержащий аминокислотную последовательность SEQ ID NO: 119, и VL–домен, содержащий аминокислотную последовательность SEQ ID NO:96, и (e) антителом, содержащим VH–домен, содержащий аминокислотную последовательность SEQ ID NO:282, и VL–домен, содержащий аминокислотную последовательность SEQ ID NO: 283.
[0196] В некоторых вариантах реализации антитело согласно настоящему изобретению конкурирует за связывание внеклеточного домена (например, домена D1) человеческого полипептида SIRP–α с одним или более эталонными анти–SIRP–α антителами, выбранными из 218, 123, 149, 161, 162 и 194. В некоторых вариантах реализации антитело согласно настоящему изобретению конкурирует за связывание внеклеточного домена (например, домена D1) человеческого полипептида SIRP–α с одним или более из следующих эталонных анти–SIRP–α антител: (a) антителом, содержащим VH–домен, содержащий аминокислотную последовательность SEQ ID NO:284, и VL–домен, содержащий аминокислотную последовательность SEQ ID NO:285, (b) антителом, содержащим VH–домен, содержащий аминокислотную последовательность SEQ ID NO: 123, и VL–домен, содержащий аминокислотную последовательность SEQ ID NO: 100, (c) антителом, содержащим VH–домен, содержащий аминокислотную последовательность SEQ ID NO:286, и VL–домен, содержащий аминокислотную последовательность SEQ ID NO:287, (d) антителом, содержащим VH–домен, содержащий аминокислотную последовательность SEQ ID NO:288, и VL–домен, содержащий аминокислотную последовательность SEQ ID NO:289, (e) антителом, содержащим VH–домен, содержащий аминокислотную последовательность SEQ ID NO:290, и VL–домен, содержащий аминокислотную последовательность SEQ ID NO:291, и (f) антителом, содержащим VH–домен, содержащий аминокислотную последовательность SEQ ID NO:292, и VL–домен, содержащий аминокислотную последовательность SEQ ID NO:293.
[0197] В некоторых вариантах реализации антитело согласно настоящему изобретению конкурирует за связывание внеклеточного домена (например, домена D1) человеческого полипептида SIRP–α с эталонным анти–SIRP–α антителом 45. В некоторых вариантах реализации антитело согласно настоящему изобретению конкурирует за связывание внеклеточного домена (например, домена D1) человеческого полипептида SIRP–α с антителом, содержащим VH–домен, содержащий аминокислотную последовательность SEQ ID NO:244, и VL–домен, содержащий аминокислотную последовательность SEQ ID NO:245.
[0198] В настоящем изобретении предложено некоторое количество семейств анти–SIRP–α антител, при этом каждое семейство содержит некоторое количество антител. Как продемонстрировано в данном документе, антитела в рамках заданного семейства могут обладать некоторыми общими структурными свойствами (например, сходными или идентичными последовательностями HVR или CDR), а также одним или более функциональными свойствами, включая, но не ограничиваясь этим, аффинность связывания с человеческим, обезьяньим и/или мышиным полипептидом (–ами) SIRP–α, аффинность связывания с полипептидами SIRP–β, аффинность связывания с полипептидами SIRP–γ, характер связывания с SIRP–α (например, блокирование CD47, отсутствие блокирования CD47 или «отталкивающее» связывание), индукцию фагоцитоза (например, в in vitro анализе), активацию дендритных клеток, противоопухолевую эффективность, остатки или «группу» связывания эпитопа SIRP–α (например, определенные в анализе сортировки) и т. д. (смотрите, например, таблицы P–T). По причине этих общих свойств подразумевается, что последовательности HVR и/или VH или VL, принадлежащие одному семейству, можно менять или перемешивать между собой, вследствие чего анти–SIRP–α антитело может содержать HVR и/или VH или VL, полученные из более чем одного конкретного анти–SIRP–α антитела, описанного в данном документе. Как более подробно обсуждается в данном документе, в данной области техники известны различные методики определения последовательностей HVR или CDR вариабельных доменов антител, которые можно взаимозаменяемо использовать в контексте данного документа, включая, без ограничений, определения Kabat, Chothia и IMGT, а также их комбинации.
[0199] В некоторых вариантах реализации антитело согласно настоящему изобретению содержит HVR–H1 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 120, 246, 258, 327, 121, 130, 122, 127, 247, 259, 335 и 328; HVR–H2 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 120, 246, 258, 327, 121, 130, 122, 127, 247, 259, 335 и 328; HVR–H3 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 120, 246, 258, 327, 121, 130, 122, 127, 247, 259, 335 и 328; HVR–L1 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO:97, 98, 107, 99, 104 и 312; HVR–L2 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 97, 98, 107, 99, 104 и 312; и/или HVR–L3 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 97, 98, 107, 99, 104 и 312. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит HVR–H1 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 120, 246, 258, 327, 121, 130, 122, 127, 247, 259, 335 и 328; HVR–H2 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 120, 246, 258, 327, 121, 130, 122, 127, 247, 259, 335 и 328; и HVR–H3 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 120, 246, 258, 327, 121, 130, 122, 127, 247, 259, 335 и 328.В некоторых вариантах реализации антитело согласно настоящему изобретению содержит HVR–L1 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 97, 98, 107, 99,104 и 312; HVR–L2 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 97, 98, 107, 99, 104 и 312; и HVR–L3 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 97, 98, 107, 99, 104 и 312. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит HVR–H1 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 120, 246, 258, 327, 121, 130, 122, 127, 247, 259, 335 и 328; HVR–H2 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 120, 246, 258, 327, 121, 130, 122, 127, 247, 259, 335 и 328; HVR–H3 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 120, 246, 258, 327, 121, 130, 122, 127, 247, 259, 335 и 328; HVR–L1 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 97, 98, 107, 99, 104 и 312: HVR–L2 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 97, 98, 107, 99, 104 и 312; и HVR–L3 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 97, 98, 107, 99, 104 и 312.
[0200] В некоторых вариантах реализации антитело согласно настоящему изобретению содержит HVR–H1 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 135, 137, 265, 266, 331, 139, 267, 332, 141, 263, 264, 268, 330, 294, 342, 344, 346, 348, 350, 352, 354, 356, 358, 360, 362, 364, 366, 368, 370, 372, 374, 376, 378, 380, 382 и 384; HVR–H2 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 135, 137, 265, 266, 331, 139, 267, 332, 141, 263, 264, 268, 330, 294, 342, 344, 346, 348, 350, 352, 354, 356, 358, 360, 362, 364, 366, 368, 370, 372, 374, 376, 378, 380, 382 и 384; HVR–H3 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 135, 137, 265, 266, 331, 139, 267, 332, 141, 263, 264, 268, 330, 294, 342, 344, 346, 348, 350, 352, 354, 356, 358, 360, 362, 364, 366, 368, 370, 372, 374, 376, 378, 380, 382 и 384; HVR–L1 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 136, 138, 140, 142, 252, 254, 262, 416, 295, 343, 345, 347, 349, 351, 353, 355, 357, 359, 361, 363, 365, 367, 369, 371, 373, 375, 377, 379, 381, 383 и 385; HVR–L2 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 136, 138, 140, 142, 252, 254, 262, 416, 295, 343, 345, 347, 349, 351, 353, 355, 357, 359, 361, 363, 365, 367, 369, 371, 373,375, 377, 379, 381, 383 и 385; и/или HVR–L3 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 136, 138, 140, 142, 252, 254, 262, 416, 295, 343, 345, 347, 349, 351, 353, 355, 357, 359, 361, 363, 365, 367, 369, 371, 373, 375, 377, 379, 381, 383 и 385. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит HVR–H1 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 135, 137, 265, 266, 331, 139, 267, 332, 141, 263, 264, 268, 330, 294, 342, 344, 346, 348, 350, 352, 354, 356, 358, 360, 362, 364, 366, 368, 370, 372, 374, 376, 378, 380, 382 и 384; HVR–H2 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 135, 137, 265, 266, 331, 139, 267, 332, 141, 263, 264, 268, 330, 294, 342, 344, 346, 348, 350, 352, 354, 356, 358, 360, 362, 364, 366, 368, 370, 372, 374, 376, 378, 380, 382 и 384; и HVR–H3 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 135, 137, 265, 266, 331, 139, 267, 332, 141, 263, 264, 268, 330, 294, 342, 344, 346, 348, 350, 352, 354, 356, 358, 360, 362, 364, 366, 368, 370, 372, 374, 376, 378, 380, 382 и 384. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит HVR–L1 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 136, 138, 140, 142, 252, 254, 262, 416, 295, 343, 345, 347, 349, 351, 353, 355, 357, 359, 361, 363, 365, 367, 369, 371, 373, 375, 377, 379, 381, 383 и 385; HVR–L2 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 136, 138, 140, 142, 252, 254, 262, 416, 295, 343, 345, 347, 349, 351, 353, 355, 357, 359, 361, 363, 365, 367, 369, 371, 373, 375, 377, 379, 381, 383 и 385; и HVR–L3 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 136, 138, 140, 142, 252, 254, 262, 416, 295, 343, 345, 347, 349, 351, 353, 355, 357, 359, 361, 363, 365, 367, 369, 371 373, 375, 377, 379, 381, 383 и 385. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит HVR–H1 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 135, 137, 265, 266, 331, 139, 267, 332, 141, 263, 264, 268, 330, 294, 342, 344, 346, 348, 350, 352, 354, 356, 358, 360, 362, 364, 366, 368, 370, 372, 374, 376, 378, 380, 382 и 384: HVR–H2 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 135, 137, 265, 266, 331, 139, 267, 332, 141, 263, 264, 268, 330, 294, 342, 344, 346, 348, 350, 352, 354, 356, 358, 360, 362, 364, 366, 370, 372, 374, 376, 378, 380, 382 и 384; HVR–H3 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 135, 137, 265, 266, 331, 139, 267, 332, 141, 263, 264, 268, 330, 294, 342, 344, 346, 348, 350, 352, 354, 356, 358, 360, 362, 364, 366, 368, 370, 372, 374, 376, 378, 380, 382 и 384; HVR–L1 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 136, 138, 140, 142, 252, 254, 262, 416, 295, 343, 345, 347, 349, 351, 353, 355, 357, 359, 361, 363, 365, 367, 369, 371, 373, 375, 377, 379, 381, 383 и 385; HVR–L2 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 136, 138, 140, 142, 252, 254, 262, 416, 295, 343, 345, 347, 349, 351, 353, 355, 357, 359, 361, 363, 365, 367, 369, 371, 373, 375, 377, 379, 381, 383 и 385; и HVR–L3 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 136, 138, 140, 142, 252, 254, 262, 416, 295, 343, 345, 347, 349, 351, 353, 355, 357, 359, 361, 363, 365, 367, 369, 371, 373, 375, 377, 379, 381, 383 и 385.
[0201] В некоторых вариантах реализации антитело согласно настоящему изобретению содержит HVR–H1 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 133, 249, 260, 329, 128, 386, 388, 390, 392, 394, 396, 398, 400 и 402; HVR–H2 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 133, 249, 260, 329, 128, 386, 388, 390, 392, 394, 396, 398, 400 и 402; HVR–H3 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 133, 249, 260, 329, 128, 386, 388, 390, 392, 394, 396, 398, 400 и 402; HVR–L1 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO:134, 251, 105, 250, 417, 418, 419, 387, 389, 391, 393, 395, 397, 399, 401 и 403; HVR–L2 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 134, 251, 105, 250, 417, 418, 419, 387, 389, 391, 393, 395, 397, 399, 401 и 403; и/или HVR–L3 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 134, 251, 105, 250, 417, 418, 419, 387, 389, 391, 393, 395, 397, 399, 401 и 403. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит HVR–H1 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 133, 249, 260, 329, 128, 386, 388, 390, 392, 394, 396, 398, 400 и 402; HVR–H2 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 133, 249, 260, 329, 128, 386, 388, 390, 392, 394, 396, 398, 400 и 402; и HVR–H3 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 133, 249, 260, 329, 128, 386, 388, 390, 392, 394, 396, 398, 400 и 402. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит HVR–L1 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 134, 251, 105, 250, 417, 418, 419, 387, 389, 391, 393, 395, 397, 399, 401 и 403; HVR–L2 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 134, 251, 105, 250, 417, 418, 419, 387, 389, 391, 393, 395, 397, 399, 401 и 403; и HVR–L3 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 134, 251, 105, 250, 417, 418, 419, 387, 389, 391, 393, 395, 397, 399, 401 и 403. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит HVR–H1 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 133, 249, 260, 32,9, 128, 386, 388, 390, 392, 394, 396, 398, 400 и 402; HVR–H2 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 133, 249, 260, 329, 128, 386, 388, 390, 392, 394, 396, 398, 400 и 402; HVR–H3 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 133, 249, 260, 329, 128, 386, 388, 390, 392, 394, 396, 398, 400 и 402; HVR–L1 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 134, 251, 105, 250, 417, 418, 419, 387, 389, 391, 393, 395, 397, 399, 401 и 403; HVR–L2 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 134, 251, 105, 250, 417, 418, 419, 387, 389, 391, 393, 395, 397, 399, 401 и 403; и HVR–L3 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 134, 251, 105, 250, 417, 418, 419, 387, 389, 391, 393, 395, 397, 399, 401 и 403.
[0202] В некоторых вариантах реализации антитело согласно настоящему изобретению содержит HVR–H1 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 116, 117, 118, 119, 282, 404 и 406; HVR–H2 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 116, 117, 118, 119, 282, 404 и 406; HVR–H3 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 116, 117, 118, 119, 282, 404 и 406; HVR–L1 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO:93, 94, 95, 96, 283, 405 и 407; HVR–L2 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 93, 94, 95, 96, 283, 405 и 407; и/или HVR–L3 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 93, 94, 95, 96, 283, 405 и 407. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит HVR–H1 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 116, 117, 118, 119, 282, 404 и 406; HVR–H2 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 116, 117, 118, 119, 282, 404 и 406; и HVR– H3 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 116, 117, 118, 119, 282, 404 и 406. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит HVR–L1 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 93, 94, 95, 96, 283, 405 и 407; HVR–L2 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 93, 94, 95, 96, 283, 405 и 407; и HVR–L3 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 93, 94, 95, 96, 283, 405 и 407. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит HVR–H1 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 116, 117, 118, 119, 282, 404 и 406; HVR–H2 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 116, 117, 118, 119, 282, 404 и 406; HVR–H3 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 116, 117, 118, 119, 282, 404 и 406; HVR–L1 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 93, 94, 95, 96, 283, 405 и 407: HVR–L2 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 93, 94, 95, 96, 283, 405 и 407; и HVR–L3 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 93, 94, 95, 96, 283, 405 и 407.
[0203] В некоторых вариантах реализации антитело согласно настоящему изобретению содержит HVR–H1 из последовательности VH–домена, приведенной в SEQ ID NO: 242; HVR–H2 из последовательности VH–домена, приведенной в SEQ ID NO: 242; HVR–H3 из последовательности VH–домена, приведенной в SEQ ID NO: 242; HVR–L1 из последовательности VL–домена, приведенной в SEQ ID NO: 243; HVR–L2 из последовательности VL–домена, приведенной в SEQ ID NO: 243; и/или HVR–L3 из последовательности VL–домена, приведенной в SEQ ID NO: 243. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит HVR–H1 из последовательности VH–домена, приведенной в SEQ ID NO: 242; HVR–H2 из последовательности VH–домена, приведенной в SEQ ID NO: 242; и HVR–H3 из последовательности VH–домена, приведенной в SEQ ID NO: 242. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит HVR–L1 из последовательности VL–домена, приведенной в SEQ ID NO: 243; HVR–L2 из последовательности VL–домена, приведенной в SEQ ID NO: 243; и HVR–L3 из последовательности VL–домена, приведенной в SEQ ID NO: 243. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит HVR–H1 из последовательности VH–домена, приведенной в SEQ ID NO: 242; HVR–H2 из последовательности VH–домена, приведенной в SEQ ID NO: 242; HVR–H3 из последовательности VH–домена, приведенной в SEQ ID NO: 242; HVR–L1 из последовательности VL–домена, приведенной в SEQ ID NO: 243; HVR–L2 из последовательности VL–домена, приведенной в SEQ ID NO: 243; и HVR–L3 из последовательности VL–домена, приведенной в SEQ ID NO: 243.
[0204] В некоторых вариантах реализации антитело согласно настоящему изобретению содержит HVR–H1 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 278 и 412; HVR–H2 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 278 и 412; HVR–H3 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 278 и 412; HVR–L1 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 279 и 413; HVR–L2 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 279 и 413; и/или HVR–L3 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 279 и 413. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит HVR–H1 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 278 и 412; HVR–H2 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 278 и 412; и HVR–H3 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 278 и 412. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит HVR–L1 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 279 и 413; HVR–L2 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 279 и 413; и HVR–L3 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 279 и 413. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит HVR–H1 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 278 и 412; HVR–H2 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 278 и 412; HVR–H3 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 278 и 412; HVR–L1 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 279 и 413; HVR–L2 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 279 и 413; и HVR–L3 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 279 и 413.
[0205] В некоторых вариантах реализации антитело согласно настоящему изобретению содержит HVR–H1 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 275 и 414; HVR–H2 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 275 и 414; HVR–H3 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 275 и 414; HVR–L1 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 276 и 415; HVR–L2 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 276 и 415; и/или HVR–L3 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 276 и 415. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит HVR–H1 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 275 и 414; HVR–H2 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 275 и 414; и HVR–H3 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 275 и 414. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит HVR–L1 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 276 и 415; HVR–L2 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 276 и 415; и HVR–L3 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 276 и 415. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит HVR–H1 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 275 и 414; HVR–H2 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 275 и 414; HVR–H3 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 275 и 414; HVR–L1 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 276 и 415; HVR–L2 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 276 и 415; и HVR–L3 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 276 и 415.
[0206] В некоторых вариантах реализации антитело согласно настоящему изобретению содержит HVR–H1 из последовательности VH–домена, приведенной в SEQ ID NO: 280; HVR–H2 из последовательности VH–домена, приведенной в SEQ ID NO: 280; HVR–H3 из последовательности VH–домена, приведенной в SEQ ID NO: 280; HVR–L1 из последовательности VL–домена, приведенной в SEQ ID NO: 281; HVR–L2 из последовательности VL–домена, приведенной в SEQ ID NO: 281; и/или HVR–L3 из последовательности VL–домена, приведенной в SEQ ID NO: 281. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит HVR–H1 из последовательности VH–домена, приведенной в SEQ ID NO: 280; HVR–H2 из последовательности VH–домена, приведенной в SEQ ID NO: 280; и HVR–H3 из последовательности VH–домена, приведенной в SEQ ID NO: 280. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит HVR–L1 из последовательности VL–домена, приведенной в SEQ ID NO: 281; HVR–L2 из последовательности VL–домена, приведенной в SEQ ID NO: 281; и HVR–L3 из последовательности VL–домена, приведенной в SEQ ID NO: 281. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит HVR–H1 из последовательности VH–домена, приведенной в SEQ ID NO: 280; HVR–H2 из последовательности VH–домена, приведенной в SEQ ID NO: 280; HVR–H3 из последовательности VH–домена, приведенной в SEQ ID NO: 280; HVR–L1 из последовательности VL–домена, приведенной в SEQ ID NO: 281; HVR–L2 из последовательности VL–домена, приведенной в SEQ ID NO: 281; и HVR–L3 из последовательности VL–домена, приведенной в SEQ ID NO: 281.
[0207] В некоторых вариантах реализации антитело согласно настоящему изобретению содержит HVR–H1 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 123 и 292; HVR–H2 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 123 и 292; HVR–H3 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 123 и 292; HVR–L1 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 100 и 293; HVR–L2 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 100 и 293; и/или HVR–L3 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 100 и 293. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит HVR–H1 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 123 и 292; HVR–H2 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 123 и 292; и HVR–H3 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 123 и 292. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит HVR–L1 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 100 и 293; HVR–L2 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 100 и 293; и HVR–L3 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 100 и 293. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит HVR–H1 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 123 и 292; HVR–H2 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 123 и 292; HVR–H3 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 123 и 292; HVR–L1 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 100 и 293; HVR–L2 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 100 и 293; и HVR–L3 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 100 и 293.
[0208] В некоторых вариантах реализации антитело согласно настоящему изобретению содержит HVR–H1 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 288, 290, 408 и 410; HVR–H2 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 288, 290, 408 и 410; HVR–H3 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 288, 290, 408 и 410; HVR–L1 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 289, 291, 409 и 411; HVR–L2 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 289, 291, 409 и 411; и/или HVR–L3 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 289, 291, 409 и 411. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит HVR–H1 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 288, 290, 408 и 410; HVR–H2 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 288, 290, 408 и 410; и HVR–H3 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 288, 290, 408 и 410. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит HVR–L1 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 289, 291, 409 и 411; HVR–L2 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 289, 291, 409 и 411; и HVR–L3 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 289, 291, 409 и 411. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит HVR–H1 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 288, 290, 408 и 410; HVR–H2 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 288, 291, 408 и 410; HVR–H3 из последовательности VH–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 288, 290, 408 и 410; HVR–L1 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 289, 291, 409 и 411; HVR–L2 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 289, 291, 409 и 411; и HVR–L3 из последовательности VL–домена, выбранной из аминокислотных последовательностей SEQ ID NO: 289, 291, 409 и 411.
[0209] В некоторых вариантах реализации антитело согласно настоящему изобретению содержит HVR–H1 из последовательности VH–домена, приведенной в SEQ ID NO: 286; HVR–H2 из последовательности VH–домена, приведенной в SEQ ID NO: 286; HVR–H3 из последовательности VH–домена, приведенной в SEQ ID NO: 286; HVR–L1 из последовательности VL–домена, приведенной в SEQ ID NO: 287; HVR–L2 из последовательности VL–домена, приведенной в SEQ ID NO: 287; и/или HVR–L3 из последовательности VL–домена, приведенной в SEQ ID NO: 287. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит HVR–H1 из последовательности VH–домена, приведенной в SEQ ID NO: 286; HVR–H2 из последовательности VH–домена, приведенной в SEQ ID NO: 286; и HVR–H3 из последовательности VH–домена, приведенной в SEQ ID NO: 286. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит HVR–L1 из последовательности VL–домена, приведенной в SEQ ID NO: 287; HVR–L2 из последовательности VL–домена, приведенной в SEQ ID NO: 287; и HVR–L3 из последовательности VL–домена, приведенной в SEQ ID NO: 287. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит HVR–H1 из последовательности VH–домена, приведенной в SEQ ID NO: 286; HVR–H2 из последовательности VH–домена, приведенной в SEQ ID NO: 286; HVR–H3 из последовательности VH–домена, приведенной в SEQ ID NO: 286; HVR–L1 из последовательности VL–домена, приведенной в SEQ ID NO: 287; HVR–L2 из последовательности VL–домена, приведенной в SEQ ID NO: 287; и HVR–L3 из последовательности VL–домена, приведенной в SEQ ID NO: 287.
[0210] В некоторых вариантах реализации антитело согласно настоящему изобретению содержит HVR–H1 из последовательности VH–домена, приведенной в SEQ ID NO: 284; HVR–H2 из последовательности VH–домена, приведенной в SEQ ID NO: 284; HVR–H3 из последовательности VH–домена, приведенной в SEQ ID NO: 284; HVR–L1 из последовательности VL–домена, приведенной в SEQ ID NO: 285; HVR–L2 из последовательности VL–домена, приведенной в SEQ ID NO: 285; и/или HVR–L3 из последовательности VL–домена, приведенной в SEQ ID NO: 285. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит HVR–H1 из последовательности VH–домена, приведенной в SEQ ID NO: 284; HVR–H2 из последовательности VH–домена, приведенной в SEQ ID NO: 284; и HVR–H3 из последовательности VH–домена, приведенной в SEQ ID NO: 284. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит HVR–L1 из последовательности VL–домена, приведенной в SEQ ID NO: 285; HVR–L2 из последовательности VL–домена, приведенной в SEQ ID NO: 285; и HVR–L3 из последовательности VL–домена, приведенной в SEQ ID NO: 285. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит HVR–H1 из последовательности VH–домена, приведенной в SEQ ID NO: 284; HVR–H2 из последовательности VH–домена, приведенной в SEQ ID NO: 284; HVR–H3 из последовательности VH–домена, приведенной в SEQ ID NO: 284; HVR–L1 из последовательности VL–домена, приведенной в SEQ ID NO: 285; HVR–L2 из последовательности VL–домена, приведенной в SEQ ID NO: 285; и HVR–L3 из последовательности VL–домена, приведенной в SEQ ID NO: 285.
[0211] В некоторых вариантах реализации антитело согласно настоящему изобретению содержит HVR–H1 из последовательности VH–домена, приведенной в SEQ ID NO:244; HVR–H2 из последовательности VH–домена, приведенной в SEQ ID NO: 244; HVR–H3 из последовательности VH–домена, приведенной в SEQ ID NO: 244; HVR–L1 из последовательности VL–домена, приведенной в SEQ ID NO: 245; HVR–L2 из последовательности VL–домена, приведенной в SEQ ID NO: 245; и/или HVR–L3 из последовательности VL–домена, приведенной в SEQ ID NO: 245. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит HVR–H1 из последовательности VH–домена, приведенной в SEQ ID NO: 244; HVR–H2 из последовательности VH–домена, приведенной в SEQ ID NO: 244; и HVR–H3 из последовательности VH–домена, приведенной в SEQ ID NO: 244. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит HVR–L1 из последовательности VL–домена, приведенной в SEQ ID NO:245; HVR–L2 из последовательности VL–домена, приведенной в SEQ ID NO:245; и HVR–L3 из последовательности VL–домена, приведенной в SEQ ID NO:245. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит HVR–H1 из последовательности VH–домена, приведенной в SEQ ID NO:244; HVR–H2 из последовательности VH–домена, приведенной в SEQ ID NO:244; HVR–H3 из последовательности VH–домена, приведенной в SEQ ID NO:244; HVR–L1 из последовательности VL–домена, приведенной в SEQ ID NO:245; HVR–L2 из последовательности VL–домена, приведенной в SEQ ID NO: 245; и HVR–L3 из последовательности VL–домена, приведенной в SEQ ID NO: 245.
[0212] В некоторых вариантах реализации антитело согласно настоящему изобретению содержит одну, две или три последовательности HVR тяжелой цепи из VH–домена, содержащего аминокислотную последовательность SEQ ID NO:242, и/или одну, две или три последовательности HVR легкой цепи из VL–домена, содержащего аминокислотную последовательность SEQ ID NO:243. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит VH–домен, содержащий аминокислотную последовательность SEQ ID NO:242, и/или VL–домен, содержащий аминокислотную последовательность SEQ ID NO:243. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит одну, две или три последовательности HVR тяжелой цепи из VH–домена, содержащего аминокислотную последовательность SEQ ID NO:244, и/или одну, две или три последовательности HVR легкой цепи из VL–домена, содержащего аминокислотную последовательность SEQ ID NO:245. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит VH–домен, содержащий аминокислотную последовательность SEQ ID NO:244, и/или VL–домен, содержащий аминокислотную последовательность SEQ ID NO:245. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит одну, две или три последовательности HVR тяжелой цепи из VH–домена, содержащего аминокислотную последовательность SEQ ID NO:275, и/или одну, две или три последовательности HVR легкой цепи из VL–домена, содержащего аминокислотную последовательность SEQ ID NO:276. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит VH–домен, содержащий аминокислотную последовательность SEQ ID NO:275, и/или VL–домен, содержащий аминокислотную последовательность SEQ ID NO:276. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит одну, две или три последовательности HVR тяжелой цепи из VH–домена, содержащего аминокислотную последовательность SEQ ID NO:278, и/или одну, две или три последовательности HVR легкой цепи из VL–домена, содержащего аминокислотную последовательность SEQ ID NO:279. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит VH–домен, содержащий аминокислотную последовательность SEQ ID NO:278, и/или VL–домен, содержащий аминокислотную последовательность SEQ ID NO:279. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит одну, две или три последовательности HVR тяжелой цепи из VH–домена, содержащего аминокислотную последовательность SEQ ID NO:280, и/или одну, две или три последовательности HVR легкой цепи из VL–домена, содержащего аминокислотную последовательность SEQ ID NO:281. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит VH–домен, содержащий аминокислотную последовательность SEQ ID NO:280, и/или VL–домен, содержащий аминокислотную последовательность SEQ ID NO:281. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит одну, две или три последовательности HVR тяжелой цепи из VH–домена, содержащего аминокислотную последовательность SEQ ID NO:282, и/или одну, две или три последовательности HVR легкой цепи из VL–домена, содержащего аминокислотную последовательность SEQ ID NO:283. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит VH–домен, содержащий аминокислотную последовательность SEQ ID NO:282, и/или VL–домен, содержащий аминокислотную последовательность SEQ ID NO:283. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит одну, две или три последовательности HVR тяжелой цепи из VH–домена, содержащего аминокислотную последовательность SEQ ID NO:284, и/или одну, две или три последовательности HVR легкой цепи из VL–домена, содержащего аминокислотную последовательность SEQ ID NO:285. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит VH–домен, содержащий аминокислотную последовательность SEQ ID NO:284, и/или VL–домен, содержащий аминокислотную последовательность SEQ ID NO:285. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит одну, две или три последовательности HVR тяжелой цепи из VH–домена, содержащего аминокислотную последовательность SEQ ID NO:286, и/или одну, две или три последовательности HVR легкой цепи из VL–домена, содержащего аминокислотную последовательность SEQ ID NO:287. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит VH–домен, содержащий аминокислотную последовательность SEQ ID NO:286, и/или VL–домен, содержащий аминокислотную последовательность SEQ ID NO:287. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит одну, две или три последовательности HVR тяжелой цепи из VH–домена, содержащего аминокислотную последовательность SEQ ID NO:288, и/или одну, две или три последовательности HVR легкой цепи из VL–домена, содержащего аминокислотную последовательность SEQ ID NO:289. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит VH–домен, содержащий аминокислотную последовательность SEQ ID NO:288, и/или VL–домен, содержащий аминокислотную последовательность SEQ ID NO:289. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит одну, две или три последовательности HVR тяжелой цепи из VH–домена, содержащего аминокислотную последовательность SEQ ID NO:290, и/или одну, две или три последовательности HVR легкой цепи из VL–домена, содержащего аминокислотную последовательность SEQ ID NO:291. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит VH–домен, содержащий аминокислотную последовательность SEQ ID NO:290, и/или VL–домен, содержащий аминокислотную последовательность SEQ ID NO:291. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит одну, две или три последовательности HVR тяжелой цепи из VH–домена, содержащего аминокислотную последовательность SEQ ID NO:292, и/или одну, две или три последовательности HVR легкой цепи из VL–домена, содержащего аминокислотную последовательность SEQ ID NO:293. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит VH–домен, содержащий аминокислотную последовательность SEQ ID NO:292, и/или VL–домен, содержащий аминокислотную последовательность SEQ ID NO:293.
[0213] В некоторых вариантах реализации антитело согласно настоящему изобретению содержит одну, две или три последовательности HVR тяжелой цепи из VH–домена, содержащего аминокислотную последовательность SEQ ID NO:278, и/или одну, две или три последовательности HVR легкой цепи из VL–домена, содержащего аминокислотную последовательность SEQ ID NO:279. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит VH–домен, содержащий аминокислотную последовательность SEQ ID NO:278, и/или VL–домен, содержащий аминокислотную последовательность SEQ ID NO:279. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит одну, две или три последовательности HVR тяжелой цепи из VH–домена, содержащего аминокислотную последовательность SEQ ID NO:280, и/или одну, две или три последовательности HVR легкой цепи из VL–домена, содержащего аминокислотную последовательность SEQ ID NO:281. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит VH–домен, содержащий аминокислотную последовательность SEQ ID NO:280, и/или VL–домен, содержащий аминокислотную последовательность SEQ ID NO:281. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит одну, две или три последовательности HVR тяжелой цепи из VH–домена, содержащего аминокислотную последовательность SEQ ID NO:275, и/или одну, две или три последовательности HVR легкой цепи из VL–домена, содержащего аминокислотную последовательность SEQ ID NO:276. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит VH–домен, содержащий аминокислотную последовательность SEQ ID NO:275, и/или VL–домен, содержащий аминокислотную последовательность SEQ ID NO:276. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит одну, две или три последовательности HVR тяжелой цепи из VH–домена, содержащего аминокислотную последовательность SEQ ID NO:414, и/или одну, две или три последовательности HVR легкой цепи из VL–домена, содержащего аминокислотную последовательность SEQ ID NO:415. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит VH–домен, содержащий аминокислотную последовательность SEQ ID NO:414, и/или VL–домен, содержащий аминокислотную последовательность SEQ ID NO:415. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит одну, две или три последовательности HVR тяжелой цепи из VH–домена, содержащего аминокислотную последовательность SEQ ID NO: 123, и/или одну, две или три последовательности HVR легкой цепи из VL–домена, содержащего аминокислотную последовательность SEQ ID NO: 100. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит VH–домен, содержащий аминокислотную последовательность SEQ ID NO: 123, и/или VL–домен, содержащий аминокислотную последовательность SEQ ID NO: 100. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит одну, две или три последовательности HVR тяжелой цепи из VH–домена, содержащего аминокислотную последовательность SEQ ID NO:292, и/или одну, две или три последовательности HVR легкой цепи из VL–домена, содержащего аминокислотную последовательность SEQ ID NO:293. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит VH–домен, содержащий аминокислотную последовательность SEQ ID NO:292, и/или VL–домен, содержащий аминокислотную последовательность SEQ ID NO:293. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит одну, две или три последовательности HVR тяжелой цепи из VH–домена, содержащего аминокислотную последовательность SEQ ID NO:288, и/или одну, две или три последовательности HVR легкой цепи из VL–домена, содержащего аминокислотную последовательность SEQ ID NO:289. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит VH–домен, содержащий аминокислотную последовательность SEQ ID NO:288, и/или VL–домен, содержащий аминокислотную последовательность SEQ ID NO:289. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит одну, две или три последовательности HVR тяжелой цепи из VH–домена, содержащего аминокислотную последовательность SEQ ID NO:290, и/или одну, две или три последовательности HVR легкой цепи из VL–домена, содержащего аминокислотную последовательность SEQ ID NO:291. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит VH–домен, содержащий аминокислотную последовательность SEQ ID NO:290, и/или VL–домен, содержащий аминокислотную последовательность SEQ ID NO:291. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит одну, две или три последовательности HVR тяжелой цепи из VH–домена, содержащего аминокислотную последовательность SEQ ID NO:286, и/или одну, две или три последовательности HVR легкой цепи из VL–домена, содержащего аминокислотную последовательность SEQ ID NO:287. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит VH–домен, содержащий аминокислотную последовательность SEQ ID NO:286, и/или VL–домен, содержащий аминокислотную последовательность SEQ ID NO:287. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит одну, две или три последовательности HVR тяжелой цепи из VH–домена, содержащего аминокислотную последовательность SEQ ID NO:284, и/или одну, две или три последовательности HVR легкой цепи из VL–домена, содержащего аминокислотную последовательность SEQ ID NO:285, 333 или 334. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит VH–домен, содержащий аминокислотную последовательность SEQ ID NO:284, и/или VL–домен, содержащий аминокислотную последовательность SEQ ID NO: 285, 333 или 334.
[0214] В некоторых вариантах реализации антитело согласно настоящему изобретению содержит (a) вариабельный домен тяжелой цепи (VH), содержащий (i) последовательность HVR–H1, содержащую аминокислотную последовательность NFAMT (SEQ ID NO: 175), NFAVT (SEQ ID NO:204) или NFALT (SEQ ID NO:305), (ii) последовательность HVR–H2, содержащую аминокислотную последовательность TIGSGDTYYADSVKG (SEQ ID NO: 144), и (iii) последовательность HVR–H3, содержащую аминокислотную последовательность DSTVSWSGDFFDY (SEQ ID NO: 145); и/или (b) вариабельный домен легкой цепи (VL), содержащий (i) последовательность HVR–L1, содержащую аминокислотную последовательность RASQNVKNDLA (SEQ ID NO: 146), (ii) последовательность HVR–L2, содержащую аминокислотную последовательность AARIRET (SEQ ID NO: 147), и (iii) последовательность HVR–L3, содержащую аминокислотную последовательность QQYYDWPPFT (SEQ ID NO:148). В некоторых вариантах реализации VH–домен содержит аминокислотную последовательность, которая по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 120, 246, 258 или 327; и/или VL–домен содержит аминокислотную последовательность, которая по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или 100% идентична аминокислотной последовательности SEQ ID NO:97 или 312. В некоторых вариантах реализации VH–домен содержит аминокислотную последовательность SEQ ID NO:246, а VL–домен содержит аминокислотную последовательность SEQ ID NO:97; VH–домен содержит аминокислотную последовательность SEQ ID NO:258, а VL–домен содержит аминокислотную последовательность SEQ ID NO:97; VH–домен содержит аминокислотную последовательность SEQ ID NO: 120, а VL–домен содержит аминокислотную последовательность SEQ ID NО:97; VH–домен содержит аминокислотную последовательность SEQ ID NO:327, а VL–домен содержит аминокислотную последовательность SEQ ID NO:97; VH–домен содержит аминокислотную последовательность SEQ ID NO:246, а VL–домен содержит аминокислотную последовательность SEQ ID NO:312; VH–домен содержит аминокислотную последовательность SEQ ID NO:258, а VL–домен содержит аминокислотную последовательность SEQ ID NO:312; VH–домен содержит аминокислотную последовательность SEQ ID NO: 120, а VL–домен содержит аминокислотную последовательность SEQ ID NO:312; или VH–домен содержит аминокислотную последовательность SEQ ID NO:327, а VL–домен содержит аминокислотную последовательность SEQ ID NO:312.
[0215] В некоторых вариантах реализации антитело согласно настоящему изобретению содержит (a) вариабельный домен тяжелой цепи (VH), содержащий (i) последовательность HVR–H1, содержащую аминокислотную последовательность IYAMS (SEQ ID NO:269), IYAVS (SEQ ID NO:313) или IYALS (SEQ ID NO:306), (ii) последовательность HVR–H2, содержащую аминокислотную последовательность TIGADDTYYADSVKG (SEQ ID NO: 150), и (iii) последовательность HVR–H3, содержащую аминокислотную последовательность DSTVGWSGDFFDY (SEQ ID NO:151); и/или (b) вариабельный домен легкой цепи (VL), содержащий (i) последовательность HVR–L1, содержащую аминокислотную последовательность RASQNVRSDIA (SEQ ID NO: 152), (ii) последовательность HVR–L2, содержащую аминокислотную последовательность AASSRDT (SEQ ID NO: 153), и (iii) последовательность HVR–L3, содержащую аминокислотную последовательность QQYYDWPPFT (SEQ ID NO: 148). В некоторых вариантах реализации VH–домен содержит аминокислотную последовательность, которая по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или 100% идентична аминокислотной последовательности SEQ ID NO:341, 127, 247, 259 или 328; и/или VL–домен содержит аминокислотную последовательность, которая по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 104 или 248. В некоторых вариантах реализации VH–домен содержит аминокислотную последовательность SEQ ID NO: 127, а VL–домен содержит аминокислотную последовательность SEQ ID NO: 104; VH–домен содержит аминокислотную последовательность SEQ ID NO:341, а VL–домен содержит аминокислотную последовательность SEQ ID NO: 104; VH–домен содержит аминокислотную последовательность SEQ ID NO:247, а VL–домен содержит аминокислотную последовательность SEQ ID NO:104; VH–домен содержит аминокислотную последовательность SEQ ID NO:259, а VL–домен содержит аминокислотную последовательность SEQ ID NO: 104; VH–домен содержит аминокислотную последовательность SEQ ID NO:328, а VL–домен содержит аминокислотную последовательность SEQ ID NO:104; VH–домен содержит аминокислотную последовательность SEQ ID NO: 127, а VL–домен содержит аминокислотную последовательность SEQ ID NO:248; VH–домен содержит аминокислотную последовательность SEQ ID NO:341 а VL–домен содержит аминокислотную последовательность SEQ ID NO:248; VH–домен содержит аминокислотную последовательность SEQ ID NO:247, а VL–домен содержит аминокислотную последовательность SEQ ID NO:248; VH–домен содержит аминокислотную последовательность SEQ ID NO:259, а VL–домен содержит аминокислотную последовательность SEQ ID NO:248; или VH–домен содержит аминокислотную последовательность SEQ ID 140:328, а VL–домен содержит аминокислотную последовательность SEQ ID NO:248.
[0216] В некоторых вариантах реализации антитело согласно настоящему изобретению содержит (a) вариабельный домен тяжелой цепи (VH), содержащий: (i) последовательность HVR–H1, содержащую аминокислотную последовательность X1X2DX3N, где X1 представляет собой S или T; X2 представляет собой Y или S; и X3 представляет собой M, L или V (SEQ ID NO:307); (ii) последовательность HVR–H2, содержащую аминокислотную последовательность LISGSGEIX1YYADSVKG, где X1 представляет собой I или T (SEQ ID NO:308); и (iii) последовательность HVR–H3, содержащую аминокислотную последовательность EX1X2X3YRFFDX4, где X1 представляет собой N или D; X2 представляет собой N или D; X3 представляет собой R или M; и X4 представляет собой D или Y (SEQ ID NO:309); и/или (b) вариабельный домен легкой цепи (VL), содержащий: (i) последовательность HVR–L1, содержащую аминокислотную последовательность RAX1QSVYX2YLA, где X1 представляет собой S или D; и X2 представляет собой T или S (SEQ ID NO: 10); (ii) последовательность HVR–L2, содержащую аминокислотную последовательность X1AX2X3RAX4, где X1 представляет собой G, A или D; X2 представляет собой S или R; X3 представляет собой S, N или T; и X4 представляет собой T или A (SEQ ID NO:311); и (iii) последовательность HVR–L3, содержащую аминокислотную последовательность QQYYDRPPLT (SEQ ID NO: 160). В некоторых вариантах реализации антитело согласно настоящему изобретению содержит (a) вариабельный домен тяжелой цепи (VH), содержащий (i) последовательность HVR–H1, содержащую аминокислотную последовательность SYDMN (SEQ ID NO:270), SYDVN (SEQ ID NO: 221) или SYDLN (SEQ ID NO:313), (ii) последовательность HVR–H2, содержащую аминокислотную последовательность LISGSGEIIYYADSVKG (SEQ ID NO: 156), и (iii) последовательность HVR–H3, содержащую аминокислотную последовательность ENNRYRFFDD (SEQ ID NO: 157); и/или (b) вариабельный домен легкой цепи (VL), содержащий (i) последовательность HVR–L1, содержащую аминокислотную последовательность RASQSVYTYLA (SEQ ID NO: 158), (ii) последовательность HVR–L2, содержащую аминокислотную последовательность GASSRAT (SEQ ID NO: 159), и (iii) последовательность HVR–L3, содержащую аминокислотную последовательность QQYYDRPPLT (SEQ ID NO: 160). В некоторых вариантах реализации VH–домен содержит аминокислотную последовательность, которая по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 133, 260, 329 или 249; и/или VL–домен содержит аминокислотную последовательность, которая по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или 100% идентична аминокислотной последовательности SEQ ID NO:134, 250, 251, 417, 418 или 419. В некоторых вариантах реализации VH–домен содержит аминокислотную последовательность SEQ ID NO: 133, а VL–домен содержит аминокислотную последовательность SEQ ID NO: 134; VH–домен содержит аминокислотную последовательность SEQ ID NO:260, а VL–домен содержит аминокислотную последовательность SEQ ID NO: 134; VH–домен содержит аминокислотную последовательность SEQ ID NO:329, а VL–домен содержит аминокислотную последовательность SEQ ID NO: 134; VH–домен содержит аминокислотную последовательность SEQ ID NO:249, а VL–домен содержит аминокислотную последовательность SEQ ID NO: 134; VH–домен содержит аминокислотную последовательность SEQ ID NO:133, а VL–домен содержит аминокислотную последовательность SEQ ID NO:417; VH–домен содержит аминокислотную последовательность SEQ ID NO:260, а VL–домен содержит аминокислотную последовательность SEQ ID NO:417; VH–домен содержит аминокислотную последовательность SEQ ID NO:329, а VL–домен содержит аминокислотную последовательность SEQ ID NO:417; VH–домен содержит аминокислотную последовательность SEQ ID NO:249, а VL–домен содержит аминокислотную последовательность SEQ ID NO:417; VH–домен содержит аминокислотную последовательность SEQ ID NO: 133, а VL–домен содержит аминокислотную последовательность SEQ ID NO:418; VH–домен содержит аминокислотную последовательность SEQ ID NO:260, а VL–домен содержит аминокислотную последовательность SEQ ID NO:418; VH–домен содержит аминокислотную последовательность SEQ ID NO:329, а VL–домен содержит аминокислотную последовательность SEQ ID NO:418; VH–домен содержит аминокислотную последовательность SEQ ID NO:249, а VL–домен содержит аминокислотную последовательность SEQ ID NO:418; VH–домен содержит аминокислотную последовательность SEQ ID NO:133, а VL–домен содержит аминокислотную последовательность SEQ ID NO:419; VH–домен содержит аминокислотную последовательность SEQ ID NO:260, а VL–домен содержит аминокислотную последовательность SEQ ID NO:419; VH–домен содержит аминокислотную последовательность SEQ ID NO:329, а VL–домен содержит аминокислотную последовательность SEQ ID NO:419; VH–домен содержит аминокислотную последовательность SEQ ID NO:249, а VL–домен содержит аминокислотную последовательность SEQ ID NO:419; VH–домен содержит аминокислотную последовательность SEQ ID NO: 133, а VL–домен содержит аминокислотную последовательность SEQ ID NO:250; VH–домен содержит аминокислотную последовательность SEQ ID NO:260, а VL–домен содержит аминокислотную последовательность SEQ ID NO:250; VH–домен содержит аминокислотную последовательность SEQ ID NO:329, а VL–домен содержит аминокислотную последовательность SEQ ID NO:250; VH–домен содержит аминокислотную последовательность SEQ ID NO: 133, а VL–домен содержит аминокислотную последовательность SEQ ID NO:251; VH–домен содержит аминокислотную последовательность SEQ ID NO:260, а VL–домен содержит аминокислотную последовательность SEQ ID NO:251; VH–домен содержит аминокислотную последовательность SEQ ID NO:329, а VL–домен содержит аминокислотную последовательность SEQ ID NO:251; VH–домен содержит аминокислотную последовательность SEQ ID NO:249, а VL–домен содержит аминокислотную последовательность SEQ ID NO: 134; VH–домен содержит аминокислотную последовательность SEQ ID NO:249, а VL–домен содержит аминокислотную последовательность SEQ ID NO:250; или VH–домен содержит аминокислотную последовательность SEQ ID NO:249, а VL–домен содержит аминокислотную последовательность SEQ ID NO:251.
[0217] В некоторых вариантах реализации антитело согласно настоящему изобретению содержит (a) вариабельный домен тяжелой цепи (VH), содержащий: (i) последовательность HVR–H1, содержащую аминокислотную последовательность X1X2AX3S, где X1 представляет собой S или T; X2 представляет собой N, Y, H или D; и X3 представляет собой M, L или V (SEQ ID NO:297); (ii) последовательность HVR–H2, содержащую аминокислотную последовательность GISX1X2X3X4X5X6YYX7X8SX9KG. где X1 представляет собой A или S; X2 представляет собой G, S или отсутствует; X3 представляет собой S, D или G; X4 представляет собой G или S; X5 представляет собой D, S или G; X6 представляет собой T или A; X7 представляет собой P, G, V, I, A или S; X8 представляет собой A, D или G; и X9 представляет собой V или M (SEQ ID NO:298); и (iii) последовательность HVR–H3, содержащую аминокислотную последовательность ETWNHLFDY (SEQ ID NO: 193): и/или (b) вариабельный домен легкой цепи (VL), содержащий: (i) последовательность HVR–L1, содержащую аминокислотную последовательность SGGX1X2X3SX4YYX5, где X1 представляет собой D, G, S, I или отсутствует; X2 представляет собой S, W, G, Y, D или отсутствует; X3 представляет собой S, Y, T или D; X4 представляет собой Η, T, S или Y; и X5 представляет собой G или A (SEQ ID NO:299); (ii) последовательность HVR–L2, содержащую аминокислотную последовательность SDX1X2RPX3, где X1 представляет собой D или N; X2 представляет собой E, K, или Q; и X3 представляет собой S или P (SEQ ID NO:300); и (iii) последовательность HVR–L3, содержащую аминокислотную последовательность X1X2YDX3X4X5ΥΧ6ΝΧ7, где X1 представляет собой G или A; X2 представляет собой G или A; X3 представляет собой G, Y, Q, S или A; X4 представляет собой S, R или T; X5 представляет собой T или S; X6, представляет собой A, I, V, L или T; и X7 представляет собой T, A, D или P (SEQ ID NO:301). В некоторых вариантах реализации антитело согласно настоящему изобретению содержит (а) вариабельный домен тяжелой цепи (VH), содержащий: (1) последовательность HVR–H1, содержащую аминокислотную последовательность SX1AX2S, где X1 представляет собой N или Y; и где X2 представляет собой M, L или V (SEQ ID NG:302); (ii) последовательность HVR–H2, содержащую аминокислотную последовательность GISX1GX2X3DTYYX4X5SVKG, где X1 представляет собой A или S; X2 представляет собой G или отсутствует; X3 представляет собой S или G; X4 представляет собой P, G или V; и X5 представляет собой A или D (SEQ ID NO:303); и (iii) последовательность HVR–H3, содержащую аминокислотную последовательность ETWNHLFDY (SEQ ID NO: 193): и/или (b) вариабельный домен легкой цепи (VL), содержащий: (i) последовательность HVR–L1, содержащую аминокислотную последовательность SGGX1YSSYYYA, где X1 представляет собой S или A (SEQ ID NO:304); (ii) последовательность HVR–L2, содержащую аминокислотную последовательность SDDKRPS (SEQ ID NO:336); и (iii) последовательность HVR–L3, содержащую аминокислотную последовательность GGYDQSSYTNP (SEQ ID NO: 172). В некоторых вариантах реализации VH–домен содержит (i) последовательность HVR–H1, содержащую аминокислотную последовательность SNAMS (SEQ ID NO: 194), SNAVS (SEQ ID NO:271) или SNALS (SEQ ID NO:318), (ii) последовательность HVR–H2, содержащую аминокислотную последовательность GISAGGSDTYYPASVKG (SEQ ID NO: 195), и (iii) последовательность HVR–H3, содержащую аминокислотную последовательность ETWNHLFDY (SEQ ID NO: 193). В некоторых вариантах реализации VH–домен содержит аминокислотную последовательность, которая по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 135, 263, 264 или 330. В некоторых вариантах реализации VH–домен содержит (i) последовательность HVR–H1, содержащую аминокислотную последовательность SNAMS (SEQ ID NO: 194), SNAVS (SEQ ID NO:271) или SNALS (SEQ ID NO:318), (ii) последовательность HVR–H2, содержащую аминокислотную последовательность GISSGSDTYYGDSVKG (SEQ ID NO: 197), и (iii) последовательность HVR–H3, содержащую аминокислотную последовательность ETWNHLFDY (SEQ ID NO: 193). В некоторых вариантах реализации VH–домен содержит аминокислотную последовательность, которая по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 137, 265, 266 или 331. В некоторых вариантах реализации VH–домен содержит (i) последовательность HVR–H1, содержащую аминокислотную последовательность SYAMS (SEQ ID NO:200), SYAVS (SEQ ID NO:272) или SYALS (SEQ ID NO:319), (ii) последовательность HVR–H2, содержащую аминокислотную последовательность GISSGGDTYYVDSVKG (SEQ ID NO:201), и (iii) последовательность HVR–H3, содержащую аминокислотную последовательность ETWNHLFDY (SEQ ID NO: 193). В некоторых вариантах реализации VH–домен содержит аминокислотную последовательность, которая по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 139, 267, 268 или 332. В некоторых вариантах реализации VL–домен содержит одну или более человеческих каркасных последовательностей IGLV3. В некоторых вариантах реализации VL–домен содержит четыре человеческие каркасные последовательности IGLV3. В некоторых вариантах реализации VL–домен содержит последовательность FW1–HVR–L1–FW2–HVR–L2–FW3–HVR–L3–FW4 (от N–конца к C–концу), при этом FW1 содержит аминокислотную последовательность SYELTQPPSVSVSPGQTARITC (SEQ ID NO:314), FW2 содержит аминокислотную последовательность WYQQKPGQAPVTLTY (SEQ ID NO:315), FW3 содержит аминокислотную последовательность NIPERFSGSSSGTTVTLTISGVQAEDEADYYC (SEQ ID NO: 316) и FW4 содержит аминокислотную последовательность FGGGTKLTVL (SEQ ID NO:317). В некоторых вариантах реализации VL–домен содержит (i) последовательность HVR–L1, содержащую аминокислотную последовательность SGGSYSSYYYA (SEQ ID NO: 170), (ii) последовательность HVR–L2, содержащую аминокислотную последовательность SDDKRPS (SEQ ID NO:336), и (iii) последовательность HVR–L3, содержащую аминокислотную последовательность GGYDQSSYTNP (SEQ ID NO: 172). В некоторых вариантах реализации VL–домен содержит аминокислотную последовательность, которая по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или 100% идентична аминокислотной последовательности SEQ ID NO:252. В некоторых вариантах реализации VL–домен содержит аминокислотную последовательность, которая по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или 100% идентична аминокислотной последовательности SEQ ID NO:254. В некоторых вариантах реализации VL–домен содержит аминокислотную последовательность, которая по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или 100% идентична аминокислотной последовательности SEQ ID NO:416. В некоторых вариантах реализации VL–домен содержит (i) последовательность HVR–L1, содержащую аминокислотную последовательность SGGAYSSYYYA (SEQ ID NO:261), (ii) последовательность HVR–L2, содержащую аминокислотную последовательность SDDKRPS (SEQ ID NO:336), и (iii) последовательность HVR–L3, содержащую аминокислотную последовательность GGYDQSSYTNP (SEQ ID NO: 172). В некоторых вариантах реализации VL–домен содержит аминокислотную последовательность, которая по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или 100% идентична аминокислотной последовательности SEQ ID NO:262. В некоторых вариантах реализации VH–домен содержит аминокислотную последовательность SEQ ID NO:263, а VL–домен содержит аминокислотную последовательность SEQ ID NO:252; VH–домен содержит аминокислотную последовательность SEQ ID NO:264, а VL–домен содержит аминокислотную последовательность SEQ ID NO:252; VH–домен содержит аминокислотную последовательность SEQ ID NO:330, а VL–домен содержит аминокислотную последовательность SEQ ID NO:252; VH–домен содержит аминокислотную последовательность SEQ ID NO: 135, а VL–домен содержит аминокислотную последовательность SEQ ID NO:252; VH–домен содержит аминокислотную последовательность SEQ ID NO: 137, а VL–домен содержит аминокислотную последовательность SEQ ID NO:252; VH–домен содержит аминокислотную последовательность SEQ ID NO: 139, а VL–домен содержит аминокислотную последовательность SEQ ID NO:252; VH–домен содержит аминокислотную последовательность SEQ ID NO:265, а VL–домен содержит аминокислотную последовательность SEQ ID NO:252; VH–домен содержит аминокислотную последовательность SEQ ID NO:266, а VL–домен содержит аминокислотную последовательность SEQ ID NO:252; VH–домен содержит аминокислотную последовательность SEQ ID NO:331, а VL–домен содержит аминокислотную последовательность SEQ ID NO:252; VH–домен содержит аминокислотную последовательность SEQ ID NO:267, а VL–домен содержит аминокислотную последовательность SEQ ID NO:252; VH–домен содержит аминокислотную последовательность SEQ ID NO:268, а VL–домен содержит аминокислотную последовательность SEQ ID NO:252; VH–домен содержит аминокислотную последовательность SEQ ID NO:332, а VL–домен содержит аминокислотную последовательность SEQ ID NO:252; VH–домен содержит аминокислотную последовательность SEQ ID NO:263, а VL–домен содержит аминокислотную последовательность SEQ ID NO:262; VH–домен содержит аминокислотную последовательность SEQ ID NO:264, а VL–домен содержит аминокислотную последовательность SEQ ID NO:262; VH–домен содержит аминокислотную последовательность SEQ ID NO:330, а VL–домен содержит аминокислотную последовательность SEQ ID NO:262; VH–домен содержит аминокислотную последовательность SEQ ID NO:265, а VL–домен содержит аминокислотную последовательность SEQ ID NO:262; VH–домен содержит аминокислотную последовательность SEQ ID NO:266, а VL–домен содержит аминокислотную последовательность SEQ ID NO:262; VH–домен содержит аминокислотную последовательность SEQ ID NO:331, а VL–домен содержит аминокислотную последовательность SEQ ID NO:262; VH–домен содержит аминокислотную последовательность SEQ ID NO:267, а VL–домен содержит аминокислотную последовательность SEQ ID NO:262; VH–домен содержит аминокислотную последовательность SEQ ID NO:268, а VL–домен содержит аминокислотную последовательность SEQ ID NO:262; VH–домен содержит аминокислотную последовательность SEQ ID NO:332, а VL–домен содержит аминокислотную последовательность SEQ ID NO:262; VH–домен содержит аминокислотную последовательность SEQ ID NO:263, а VL–домен содержит аминокислотную последовательность SEQ ID NO:254; VH–домен содержит аминокислотную последовательность SEQ ID NO:264, а VL–домен содержит аминокислотную последовательность SEQ ID NO: 254; VH–домен содержит аминокислотную последовательность SEQ ID NO:330, а VL–домен содержит аминокислотную последовательность SEQ ID NO: 254; VH–домен содержит аминокислотную последовательность SEQ ID NO:265, а VL–домен содержит аминокислотную последовательность SEQ ID NO: 254; VH–домен содержит аминокислотную последовательность SEQ ID NO:266, а VL–домен содержит аминокислотную последовательность SEQ ID NO: 254; VH–домен содержит аминокислотную последовательность SEQ ID NO:331, а VL–домен содержит аминокислотную последовательность SEQ ID NO: 254; VH–домен содержит аминокислотную последовательность SEQ ID NO:267, а VL–домен содержит аминокислотную последовательность SEQ ID NO: 254; VH–домен содержит аминокислотную последовательность SEQ ID NO:268, а VL–домен содержит аминокислотную последовательность SEQ ID NO: 254; VH–домен содержит аминокислотную последовательность SEQ ID NO:332, а VL–домен содержит аминокислотную последовательность SEQ ID NO: 254; VH–домен содержит аминокислотную последовательность SEQ ID NO:263, а VL–домен содержит аминокислотную последовательность SEQ ID NO: 416; VH–домен содержит аминокислотную последовательность SEQ ID NO:264, а VL–домен содержит аминокислотную последовательность SEQ ID NO: 416; VH–домен содержит аминокислотную последовательность SEQ ID NO:330, а VL–домен содержит аминокислотную последовательность SEQ ID NO: 416; VH–домен содержит аминокислотную последовательность SEQ ID NO:265, а VL–домен содержит аминокислотную последовательность SEQ ID NO: 416; VH–домен содержит аминокислотную последовательность SEQ ID NO:266, а VL–домен содержит аминокислотную последовательность SEQ ID NO: 416; VH–домен содержит аминокислотную последовательность SEQ ID NO:331, а VL–домен содержит аминокислотную последовательность SEQ ID NO: 416; VH–домен содержит аминокислотную последовательность SEQ ID NO:267, а VL–домен содержит аминокислотную последовательность SEQ ID NO: 416; VH–домен содержит аминокислотную последовательность SEQ ID NO:368, а VL–домен содержит аминокислотную последовательность SEQ ID NO: 416; VH–домен содержит аминокислотную последовательность SEQ ID NO:332, а VL–домен содержит аминокислотную последовательность SEQ ID NO: 416, VH–домен содержит аминокислотную последовательность SEQ ID NO: 135, а VL–домен содержит аминокислотную последовательность SEQ ID NO:262; VH–домен содержит аминокислотную последовательность SEQ ID NO: 137, а VL–домен содержит аминокислотную последовательность SEQ ID NO:262; VH–домен содержит аминокислотную последовательность SEQ ID NO: 135, а VL–домен содержит аминокислотную последовательность SEQ ID NO:254; VH–домен содержит аминокислотную последовательность SEQ ID NO: 135, а VL–домен содержит аминокислотную последовательность SEQ ID NO:416; VH–домен содержит аминокислотную последовательность SEQ ID NO: 137, а VL–домен содержит аминокислотную последовательность SEQ ID NO:254; VH–домен содержит аминокислотную последовательность SEQ ID NO: 137, а VL–домен содержит аминокислотную последовательность SEQ ID NO:416; VH–домен содержит аминокислотную последовательность SEQ ID NO: 139, а VL–домен содержит аминокислотную последовательность SEQ ID NO:254; VH–домен содержит аминокислотную последовательность SEQ ID NO: 139, а VL–домен содержит аминокислотную последовательность SEQ ID NO:416; или VH–домен содержит аминокислотную последовательность SEQ ID NO:139, а VL–домен содержит аминокислотную последовательность SEQ ID NO:262.
[0218] В некоторых вариантах реализации антитело согласно настоящему изобретению содержит VH–домен, содержащий аминокислотную последовательность SEQ ID NO: 120, и/или VL–домен, содержащий аминокислотную последовательность SEQ ID NO:97. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит VH–домен, содержащий аминокислотную последовательность SEQ ID NO: 127, и/или VL–домен, содержащий аминокислотную последовательность SEQ ID NO: 104. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит VH–домен, содержащий аминокислотную последовательность SEQ ID NO: 133, и/или VL–домен, содержащий аминокислотную последовательность SEQ ID NO: 134. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит VH–домен, содержащий аминокислотную последовательность SEQ ID NO:135, и/или VL–домен, содержащий аминокислотную последовательность SEQ ID NO: 136. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит VH–домен, содержащий аминокислотную последовательность SEQ ID NO: 137, и/или VL–домен, содержащий аминокислотную последовательность SEQ ID NO: 138. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит VH–домен, содержащий аминокислотную последовательность SEQ ID NO: 139, и/или VL–домен, содержащий аминокислотную последовательность SEQ ID NO: 140. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит VH–домен, содержащий аминокислотную последовательность SEQ ID NO: 141, и/или VL–домен, содержащий аминокислотную последовательность SEQ ID NO: 142.
[0219] В некоторых вариантах реализации антитело содержит (a) последовательность HVR–H1, содержащую аминокислотную последовательность GFSFSX1X2AMX3, где X1 представляет собой N или I; X2 представляет собой F или Y; и X3 представляет собой T или S (SEQ ID NO: 185); (b) последовательность HVR–H2, содержащую аминокислотную последовательность TIGX4X5DTYYADSVKG, где X4 представляет собой S или A и X5 представляет собой G или D (SEQ ID NO: 186); (c) последовательность HVR–H3, содержащую аминокислотную последовательность DSTVX6WSGDFFDY, где X6 представляет собой S или G (SEQ ID NO: 187); (d) последовательность HVR–L1, содержащую аминокислотную последовательность RASQNVX7X8DX9A, где X7 представляет собой K или R; X8 представляет собой N или S; и X9 представляет собой L или I (SEQ ID NO: 188); (e) последовательность HVR–L2, содержащую аминокислотную последовательность AAX10X11RX12T, где X10 представляет собой R или S; X11 представляет собой I или S; и X12 представляет собой E или D (SEQ ID NO: 189); и (f) последовательность HVR–L3, содержащую аминокислотную последовательность QQYYDWPPFT (SEQ ID NO: 148).
[0220] В некоторых вариантах реализации антитело согласно настоящему изобретению содержит одну, две, три, четыре, пять или шесть последовательностей HVR, имеющих аминокислотную последовательность, выбранную из SEQ ID NO: 143–148 (например, одну, две или три последовательности HVR тяжелой цепи, выбранные из SEQ ID NO:143–145, и/или одну, две или три последовательности HVR легкой цепи, выбранные из SEQ ID NO:146–148). В некоторых вариантах реализации антитело согласно настоящему изобретению содержит одну, две, три, четыре, пять или шесть последовательностей HVR, имеющих аминокислотную последовательность, выбранную из SEQ ID NO: 148–153 (например, одну, две или три последовательности HVR тяжелой цепи, выбранные из SEQ ID NO: 149–151, и/или одну, две или три последовательности HVR легкой цепи, выбранные из SEQ ID NO: 152, 153 и 148). В некоторых вариантах реализации антитело согласно настоящему изобретению содержит одну, две, три, четыре, пять или шесть последовательностей HVR, имеющих аминокислотную последовательность, выбранную из SEQ ID NO:155–160 (например, одну, две или три последовательности HVR тяжелой цепи, выбранные из SEQ ID NO: 155–157, и/или одну, две или три последовательности HVR легкой цепи, выбранные из SEQ ID NO: 158–160). В некоторых вариантах реализации антитело согласно настоящему изобретению содержит одну, две, три, четыре, пять или шесть последовательностей HVR, имеющих аминокислотную последовательность, выбранную из SEQ ID NO:161–166 (например, одну, две или три последовательности HVR тяжелой цепи, выбранные из SEQ ID NO: 161–163, и/или одну, две или три последовательности HVR легкой цепи, выбранные из SEQ ID NO: 164–166). В некоторых вариантах реализации антитело согласно настоящему изобретению содержит одну, две, три, четыре, пять или шесть последовательностей HVR, имеющих аминокислотную последовательность, выбранную из SEQ ID NO: 161–166 (например, одну, две или три последовательности HVR тяжелой цепи, выбранные из SEQ ID NO:161–163, и/или одну, две или три последовательности HVR вариабельного домена легкой цепи, приведенного в таблице 2). В некоторых вариантах реализации антитело согласно настоящему изобретению содержит одну, две, три, четыре, пять или шесть последовательностей HVR, имеющих аминокислотную последовательность, выбранную из SEQ ID NO: 161, 163, 168 и 170–172 (например, одну, две или три последовательности HVR тяжелой цепи, выбранные из SEQ ID NO: 161, 168 и 163, и/или одну, две или три последовательности HVR легкой цепи, выбранные из SEQ ID NO: 170–172). В некоторых вариантах реализации антитело согласно настоящему изобретению содержит одну, две, три, четыре, пять или шесть последовательностей HVR, имеющих аминокислотную последовательность, выбранную из SEQ ID NO: 161, 163, 168 и 170–172 (например, одну, две или три последовательности HVR тяжелой цепи, выбранные из SEQ ID NO: 161, 168 и 163, и/или одну, две или три последовательности HVR вариабельного домена легкой цепи, приведенного в таблице 2). В некоторых вариантах реализации антитело согласно настоящему изобретению содержит одну, две, три, четыре, пять или шесть последовательностей HVR, имеющих аминокислотную последовательность, выбранную из SEQ ID NO: 163, 173, 174 и 176–178 (например, одну, две или три последовательности HVR тяжелой цепи, выбранные из SEQ ID NO: 163, 173 и 174, и/или одну, две или три последовательности HVR легкой цепи, выбранные из SEQ ID NO: 176–178). В некоторых вариантах реализации антитело согласно настоящему изобретению содержит одну, две, три, четыре, пять или шесть последовательностей HVR, имеющих аминокислотную последовательность, выбранную из SEQ ID NO: 162, 163, 179 и 182–184 (например, одну, две или три последовательности HVR тяжелой цепи, выбранные из SEQ ID NO: 162, 163 и 179, и/или одну, две или три последовательности HVR легкой цепи, выбранные из SEQ ID NO: 182–184). В некоторых вариантах реализации антитело согласно настоящему изобретению содержит одну, две, три, четыре, пять или шесть последовательностей HVR, имеющих аминокислотную последовательность, выбранную из SEQ ID NO: 162, 163, 179 и 182–184 (например, одну, две или три последовательности HVR тяжелой цепи, выбранные из SEQ ID NO: 162, 163 и 179, и/или одну, две или три последовательности HVR вариабельного домена легкой цепи, приведенного в таблице 2). В некоторых вариантах реализации антитело согласно настоящему изобретению содержит одну, две, три, четыре, пять или шесть последовательностей HVR, имеющих аминокислотную последовательность, выбранную из SEQ ID NO: 120 и 97 (например, одну, две или три последовательности HVR тяжелой цепи из последовательности вариабельного домена тяжелой цепи SEQ ID NO: 120 и/или одну, две или три последовательности HVR легкой цепи из последовательности вариабельного домена легкой цепи SEQ ID NO:97). В некоторых вариантах реализации антитело согласно настоящему изобретению содержит одну, две, три, четыре, пять или шесть последовательностей HVR из последовательностей вариабельного домена SEQ ID NO: 127 и 104 (например, одну, две или три последовательности HVR тяжелой цепи из последовательности вариабельного домена тяжелой цепи SEQ ID NO: 127 и/или одну, две или три последовательности HVR легкой цепи из последовательности вариабельного домена легкой цепи SEQ ID NO: 104). В некоторых вариантах реализации антитело согласно настоящему изобретению содержит одну, две, три, четыре, пять или шесть последовательностей HVR из последовательностей вариабельного домена SEQ ID NO:97, 104, 120 и 127 (например, одну, две или три последовательности HVR тяжелой цепи из последовательности вариабельного домена тяжелой цепи SEQ ID NO: 120 и 127, и/или одну, две или три последовательности HVR легкой цепи из последовательности вариабельного домена легкой цепи SEQ ID NO:97 и 104).
[0221] В некоторых вариантах реализации антитело согласно настоящему изобретению содержит (a) VH–домен, содержащий HVR–H1, содержащую аминокислотную последовательность SEQ ID NO: 143, HVR–H2, содержащую аминокислотную последовательность SEQ ID NO: 144, и HVR–H3, содержащую аминокислотную последовательность SEQ ID NO: 145; и/или (b) VL–домен, содержащий HVR–L1, содержащую аминокислотную последовательность SEQ ID NO: 146, HVR–L2, содержащую аминокислотную последовательность SEQ ID NO: 147, и HVR–L3, содержащую аминокислотную последовательность SEQ ID NO: 148. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит (a) VH–домен, содержащий HVR–H1, содержащую аминокислотную последовательность SEQ ID NO:149, HVR–H2, содержащую аминокислотную последовательность SEQ ID NO:150, и HVR–H3, содержащую аминокислотную последовательность SEQ ID NO: 151; и/или (b) VL–домен, содержащий HVR–L1, содержащую аминокислотную последовательность SEQ ID NO: 152, HVR–L2, содержащую аминокислотную последовательность SEQ ID NO: 153, и HVR–L3, содержащую аминокислотную последовательность SEQ ID NO: 148. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит (a) VH–домен, содержащий HVR–H1, содержащую аминокислотную последовательность SEQ ID NO: 143 или 149, HVR–H2, содержащую аминокислотную последовательность SEQ ID NO: 144 или 150, и HVR–H3, содержащую аминокислотную последовательность SEQ ID NO: 145 или 151, и/или (b) VL–домен, содержащий HVR–L1, содержащую аминокислотную последовательность SEQ ID NO: 146 или 152, HVR–L2, содержащую аминокислотную последовательность SEQ ID NO: 147 или 153, и HVR–L3, содержащую аминокислотную последовательность SEQ ID NO: 148. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит (a) VH–домен, содержащий HVR–H1, содержащую аминокислотную последовательность SEQ ID NO: 155, HVR–H2, содержащую аминокислотную последовательность SEQ ID NO: 156, и HVR–H3, содержащую аминокислотную последовательность SEQ ID NO: 157; и/или (b) VL–домен, содержащий HVR–L1, содержащую аминокислотную последовательность SEQ ID NO: 158, HVR–L2, содержащую аминокислотную последовательность SEQ ID NO: 159, и HVR–L3, содержащую аминокислотную последовательность SEQ ID NO: 160. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит (a) VH–домен, содержащий HVR–H1, содержащую аминокислотную последовательность SEQ ID NO: 161, HVR–H2, содержащую аминокислотную последовательность SEQ ID NO: 162, и HVR–H3, содержащую аминокислотную последовательность SEQ ID NO: 163, и/или (b) VL–домен, содержащий HVR–L1, содержащую аминокислотную последовательность SEQ ID NO:164, HVR–L2, содержащую аминокислотную последовательность SEQ ID NO:165, и HVR–L3, содержащую аминокислотную последовательность SEQ ID NO: 166. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит (a) VH–домен, содержащий HVR–H1, содержащую аминокислотную последовательность SEQ ID NO: 161, HVR–H2, содержащую аминокислотную последовательность SEQ ID NO:168, и HVR–H3, содержащую аминокислотную последовательность SEQ ID NO: 163; и/или (b) VL–домен, содержащий HVR–L1, содержащую аминокислотную последовательность SEQ ID NO: 170, HVR–L2, содержащую аминокислотную последовательность SEQ ID NO:171, и HVR–L3, содержащую аминокислотную последовательность SEQ ID NO: 172. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит (a) VH–домен, содержащий HVR–H1, содержащую аминокислотную последовательность SEQ ID NO: 173, HVR–H2, содержащую аминокислотную последовательность SEQ ID NO: 174, и HVR–H3, содержащую аминокислотную последовательность SEQ ID NO: 163; и/или (b) VL–домен, содержащий HVR–L1, содержащую аминокислотную последовательность SEQ ID NO: 176, HVR–L2, содержащую аминокислотную последовательность SEQ ID NO: 177, и HVR–L3, содержащую аминокислотную последовательность SEQ ID NO: 178. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит (a) VH–домен, содержащий HVR–H1, содержащую аминокислотную последовательность SEQ ID NO: 179, HVR–H2, содержащую аминокислотную последовательность SEQ ID NO:162, и HVR–H3, содержащую аминокислотную последовательность SEQ ID NO: 163; и/или (b) VL–домен, содержащий HVR–L1, содержащую аминокислотную последовательность SEQ ID NO: 182, HVR–L2, содержащую аминокислотную последовательность SEQ ID NO: 183, и HVR–L3, содержащую аминокислотную последовательность SEQ ID NO: 184.
[0222] В некоторых вариантах реализации антитело согласно настоящему изобретению содержит VH–домен, содержащий аминокислотную последовательность SEQ ID NO: 135, и/или VL–домен, содержащий HVR–L1, содержащую аминокислотную последовательность SEQ ID NO: 164, HVR–L2, содержащую аминокислотную последовательность SEQ ID NO: 165, и HVR–L3, содержащую аминокислотную последовательность SEQ ID NO: 166. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит VH–домен, содержащий аминокислотную последовательность SEQ ID NO: 137, и/или VL–домен, содержащий HVR–L1, содержащую аминокислотную последовательность SEQ ID NO: 170, HVR–L2, содержащую аминокислотную последовательность SEQ ID NO: 171, и HVR–L3, содержащую аминокислотную последовательность SEQ ID NO: 172. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит VH–домен, содержащий аминокислотную последовательность SEQ ID NO:139, и/или VL–домен, содержащий HVR–L1, содержащую аминокислотную последовательность SEQ ID NO: 176, HVR–L2, содержащую аминокислотную последовательность SEQ ID NO: 177, и HVR–L3, содержащую аминокислотную последовательность SEQ ID NO: 178. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит VH–домен, содержащий аминокислотную последовательность SEQ ID NO: 141, и/или VL–домен, содержащий HVR–L1, содержащую аминокислотную последовательность SEQ ID NO: 182, HVR–L2, содержащую аминокислотную последовательность SEQ ID NO: 183, и HVR–L3, содержащую аминокислотную последовательность SEQ ID NO: 184.
[0223] В некоторых вариантах реализации антитело согласно настоящему изобретению содержит (a) VH–домен, содержащий HVR–H1, содержащую аминокислотную последовательность SEQ ID NO:161, HVR–H2, содержащую аминокислотную последовательность SEQ ID NO:162, и HVR–H3, содержащую аминокислотную последовательность SEQ ID NO: 163; и/или (b) VL–домен, содержащий HVR–L1, содержащую аминокислотную последовательность SEQ ID NO: 164, 170, 176 или 182, HVR–L2, содержащую аминокислотную последовательность SEQ ID NO:165, 171, 177 или 183, и HVR–L3, содержащую аминокислотную последовательность SEQ ID NO:166, 172, 178 или 184. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит (a) VH–домен, содержащий HVR–H1, содержащую аминокислотную последовательность SEQ ID NO: 161, HVR–H2, содержащую аминокислотную последовательность SEQ ID NO: 168, HVR–H3, содержащую аминокислотную последовательность SEQ ID NO:163; и/или (b) VL–домен, содержащий HVR–L1, содержащую аминокислотную последовательность SEQ ID NO: 164, 170, 176 или 182, HVR–L2, содержащую аминокислотную последовательность SEQ ID NO: 165, 171, 177 или 183, и HVR–L3, содержащую аминокислотную последовательность SEQ ID NO: 166, 172, 178 или 184. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит (а) VH–домен, содержащий HVR–H1, содержащую аминокислотную последовательность SEQ ID NO: 173, HVR–H2, содержащую аминокислотную последовательность SEQ ID NO: 174, и HVR–H3, содержащую аминокислотную последовательность SEQ ID NO: 163; и/или (b) VL–домен, содержащий HVR–L1, содержащую аминокислотную последовательность SEQ ID NO:164, 170, 176 или 182, HVR–L2, содержащую аминокислотную последовательность SEQ ID NO:165, 171, 177 или 183, и HVR–L3, содержащую аминокислотную последовательность SEQ ID NO: 166, 172, 178 или 184. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит (a) VH–домен, содержащий HVR–H1, содержащую аминокислотную последовательность SEQ ID NO: 179, HVR–H2, содержащую аминокислотную последовательность SEQ ID NO: 162, и HVR–H3, содержащую аминокислотную последовательность SEQ ID NO: 163; и/или (b) VL–домен, содержащий HVR–L1, содержащую аминокислотную последовательность SEQ ID NO:164, 170, 176 или 182, HVR–L2, содержащую аминокислотную последовательность SEQ ID NO: 165, 171, 177 или 183, и HVR–L3, содержащую аминокислотную последовательность SEQ ID NO: 166, 172, 178 или 184. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит VH–домен, содержащий аминокислотную последовательность SEQ ID NO: 135, и/или VL–домен, содержащий HVR–L1, содержащую аминокислотную последовательность SEQ ID NO: 164, 170, 176 или 182, HVR–L2, содержащую аминокислотную последовательность SEQ ID NO: 165, 171, 177 или 183; и HVR–L3, содержащую аминокислотную последовательность SEQ ID NO:166, 172, 178 или 184. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит VH–домен, содержащий аминокислотную последовательность SEQ ID NO: 137, и/или VL–домен, содержащий HVR–L1, содержащую аминокислотную последовательность SEQ ID NO: 164, 170, 176 или 182, HVR–L2, содержащую аминокислотную последовательность SEQ ID NO: 165, 171, 177 или 183, HVR–L3, и содержащую аминокислотную последовательность SEQ ID NO: 166, 172, 178 или 184. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит VH–домен, содержащий аминокислотную последовательность SEQ ID NO: 139, и/или VL–домен, содержащий HVR–L1, содержащую аминокислотную последовательность SEQ ID NO: 164, 170, 176 или 182, HVR–L2, содержащую аминокислотную последовательность SEQ ID NO: 165, 171, 177 или 183; и HVR–L3, содержащую аминокислотную последовательность SEQ ID NO:166, 172, 178 или 184. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит VH–домен, содержащий аминокислотную последовательность SEQ ID NO: 141, и/или VL–домен, содержащий HVR–L1, содержащую аминокислотную последовательность SEQ ID NO: 164, 170, 176 или 182, HVR–L2, содержащую аминокислотную последовательность SEQ ID NO: 165, 171, 177 или 183, HVR–L3, и содержащую аминокислотную последовательность SEQ ID NO: 166, 172, 178 или 184.
[0224] В некоторых вариантах реализации антитело согласно настоящему изобретению содержит (a) VH–домен, содержащий одну, две или три последовательности HVR из SEQ ID NO:242; и/или (b) VL–домен, содержащий одну, две или три последовательности HVR из SEQ ID NO:243. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит (a) VH–домен, содержащий одну, две или три последовательности HVR из SEQ ID NO:244; и/или (b) VL–домен, содержащий одну, две или три последовательности HVR из SEQ ID NO:245.
[0225] Как описано выше, в данной области техники известны различные способы определения границ гипервариабельных областей (HVR) или определяющих комплементарность областей (CDR), которые можно применять в отношении описанных в данном документе последовательностей вариабельных доменов. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит HVR по определению Chothia, Kabat, IMGT или их комбинации (например, одну или более HVR по определению согласно одному варианту определения границ и одну или более HVR по определению согласно другому варианту определения границ). Последовательности HVR антител согласно настоящему изобретению, определенные согласно трем известным вариантам определения границ (Chothia, Kabat и IMGT), приведены в таблице 5. В контексте данного документа, если не указано иное, нумерация остатков HVR определена по нумерации Kabat.
Таблица 5. Варианты определения границ HVR.
(Chothia)
(Kabat)
(IMGT)
(Chothia)
(Kabat)
(IMGT)
(Chothia)
(Kabat)
(IMGT)
(Chothia)
(Kabat)
(IMGT)
(Chothia)
(Kabat)
(IMGT)
(Chothia)
(Kabat)
(IMGT)
(Chothia)
(Kabat)
(IMGT)
(Chothia)
(Kabat)
(IMGT)
(Chothia)
(Kabat)
(IMGT)
(Kabat)
(Chothia)
(Chothia)
(Kabat)
(Kabat)
(Chothia)
(Chothia)
(Kabat)
[0226] В некоторых вариантах реализации антитело согласно настоящему изобретению содержит 1, 2, 3, 4, 5 или 6 HVR, перечисленных в таблице 5 (например, VL–домен, содержащий 1, 2 или 3 HVR легкой цепи, перечисленных в таблице 5, и/или VH–домен, содержащий 1, 2 или 3 HVR тяжелой цепи, перечисленных в таблице 5).
[0227] В некоторых вариантах реализации антитело согласно настоящему изобретению содержит VH–домен, содержащий HVR–H1, содержащую аминокислотную последовательность SEQ ID NO: 191, HVR–H2, содержащую аминокислотную последовательность SEQ ID NO: 192, и HVR–H3, содержащую аминокислотную последовательность SEQ ID NO: 193. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит VH–домен, содержащий HVR–H1, содержащую аминокислотную последовательность SEQ ID NO: 191, HVR–H2, содержащую аминокислотную последовательность SEQ ID NO: 196, и HVR–H3, содержащую аминокислотную последовательность SEQ ID NO: 193. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит VH–домен, содержащий HVR–H1, содержащую аминокислотную последовательность SEQ ID NO: 198, HVR–H2, содержащую аминокислотную последовательность SEQ ID NO: 199, и HVR–H3, содержащую аминокислотную последовательность SEQ ID NO: 193. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит VL–домен, содержащий HVR–L1, содержащую аминокислотную последовательность SEQ ID NO: 164, HVR–L2, содержащую аминокислотную последовательность SEQ ID NO: 165, и HVR–L3, содержащую аминокислотную последовательность SEQ ID NO: 166, и/или VH–домен, содержащий HVR–H1, содержащую аминокислотную последовательность SEQ ID NO: 191 или 198, HVR–H2, содержащую аминокислотную последовательность SEQ ID NO: 192, 196 или 199, HVR–H3, содержащую аминокислотную последовательность SEQ ID NO: 193. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит VL–домен, содержащий HVR–L1, содержащую аминокислотную последовательность SEQ ID NO:232, HVR–L2, содержащую аминокислотную последовательность SEQ ID NO:233, и HVR–L3, содержащую аминокислотную последовательность SEQ ID NO:234, и/или VH–домен, содержащий HVR–H1, содержащую аминокислотную последовательность SEQ ID NO:230, HVR–H2, содержащую аминокислотную последовательность SEQ ID NO:231, и HVR–H3, содержащую аминокислотную последовательность SEQ ID NO:232.В некоторых вариантах реализации антитело согласно настоящему изобретению содержит VL–домен, содержащий HVR–L1, содержащую аминокислотную последовательность SEQ ID NO:239, HVR–L2, содержащую аминокислотную последовательность SEQ ID NO:240, и HVR–L3, содержащую аминокислотную последовательность SEQ ID NO:241, и/или VH–домен, содержащий HVR–H1, содержащую аминокислотную последовательность SEQ ID NO:219, HVR–H2, содержащую аминокислотную последовательность SEQ ID NO:238, и HVR–H3, содержащую аминокислотную последовательность SEQ ID NO:237.
[0228] В некоторых вариантах реализации антитело согласно настоящему изобретению содержит VH–домен, содержащий HVR–H1, содержащую аминокислотную последовательность SEQ ID NO: 194, HVR–H2, содержащую аминокислотную последовательность SEQ ID NO: 195, и HVR–H3, содержащую аминокислотную последовательность SEQ ID NO: 193. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит VH–домен, содержащий HVR–H1, содержащую аминокислотную последовательность SEQ ID NO: 194, HVR–H2, содержащую аминокислотную последовательность SEQ ID NO: 197, и HVR–H3, содержащую аминокислотную последовательность SEQ ID NO: 193. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит VH–домен, содержащий HVR–H1, содержащую аминокислотную последовательность SEQ ID NO: 200, HVR–H2, содержащую аминокислотную последовательность SEQ ID NO: 201, и HVR–H3, содержащую аминокислотную последовательность SEQ ID NO: 193. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит VL–домен, содержащий HVR–L1, содержащую аминокислотную последовательность SEQ ID NO: 164, HVR–L2, содержащую аминокислотную последовательность SEQ ID NO: 165, и HVR–L3, содержащую аминокислотную последовательность SEQ ID NO: 166, и/или VH–домен, содержащий HVR–H1, содержащую аминокислотную последовательность SEQ ID NO: 194, 198 или 200, HVR–H2, содержащую аминокислотную последовательность SEQ ID NO: 195, 197 или 201, HVR–H3, содержащую аминокислотную последовательность SEQ ID NO: 193. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит VL–домен, содержащий HVR–L1, содержащую аминокислотную последовательность SEQ ID NO:232, HVR–L2, содержащую аминокислотную последовательность SEQ ID NO:233, и HVR–L3, содержащую аминокислотную последовательность SEQ ID NO:234, и/или VH–домен, содержащий HVR–H1, содержащую аминокислотную последовательность SEQ ID NO:227, HVR–H2, содержащую аминокислотную последовательность SEQ ID NO:228, и HVR–H3, содержащую аминокислотную последовательность SEQ ID NO:230. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит VL–домен, содержащий HVR–L1, содержащую аминокислотную последовательность SEQ ID NO:239, HVR–L2, содержащую аминокислотную последовательность SEQ ID NO:240, и HVR–L3, содержащую аминокислотную последовательность SEQ ID NO:241, и/или VH–домен, содержащий HVR–H1, содержащую аминокислотную последовательность SEQ ID NO:235, HVR–H2, содержащую аминокислотную последовательность SEQ ID NO:236, и HVR–H3, содержащую аминокислотную последовательность SEQ ID NO:237.
[0229] В некоторых вариантах реализации антитело согласно настоящему изобретению содержит VH–домен, содержащий HVR–H1, содержащую аминокислотную последовательность SEQ ID NO: 161, HVR–H2, содержащую аминокислотную последовательность SEQ ID NO: 162, и HVR–H3, содержащую аминокислотную последовательность SEQ ID NO: 163. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит VH–домен, содержащий HVR–H1, содержащую аминокислотную последовательность SEQ ID NO: 161, HVR–H2, содержащую аминокислотную последовательность SEQ ID NO:168, и HVR–H3, содержащую аминокислотную последовательность SEQ ID NO:163. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит VH–домен, содержащий HVR–H1, содержащую аминокислотную последовательность SEQ ID NO: 173, HVR–H2, содержащую аминокислотную последовательность SEQ ID NO: 174, и HVR–H3, содержащую аминокислотную последовательность SEQ ID NO: 163.
[0230] В некоторых вариантах реализации антитело согласно настоящему изобретению содержит (a) VH–домен, содержащий HVR–H1, содержащую аминокислотную последовательность SEQ ID NO: 202, HVR–H2, содержащую аминокислотную последовательность SEQ ID NO: 203, и HVR–H3, содержащую аминокислотную последовательность SEQ ID NO: 145; и/или (b) VL–домен, содержащий HVR–L1, содержащую аминокислотную последовательность SEQ ID NO: 146, HVR–L2, содержащую аминокислотную последовательность SEQ ID NO: 147, и HVR–L3, содержащую аминокислотную последовательность SEQ ID NO:148. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит (a) VH–домен, содержащий HVR–H1, содержащую аминокислотную последовательность SEQ ID NO: 211, HVR–H2, содержащую аминокислотную последовательность SEQ ID NO: 212, и HVR–H3, содержащую аминокислотную последовательность SEQ ID NO: 151; и/или (b) VL–домен, содержащий HVR–L1, содержащую аминокислотную последовательность SEQ ID NO: 152, HVR–L2, содержащую аминокислотную последовательность SEQ ID NO: 153, и HVR–L3, содержащую аминокислотную последовательность SEQ ID NO: 148. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит (a) VH–домен, содержащий HVR–H1, содержащую аминокислотную последовательность SEQ ID NO: 219, HVR–H2, содержащую аминокислотную последовательность SEQ ID NO: 220, и HVR–H3, содержащую аминокислотную последовательность SEQ ID NO: 157; и/или (b) VL–домен, содержащий HVR–L1, содержащую аминокислотную последовательность SEQ ID NO:158, HVR–L2, содержащую аминокислотную последовательность SEQ ID NO: 159, и HVR–L3, содержащую аминокислотную последовательность SEQ ID NO: 160.
[0231] В некоторых вариантах реализации антитело согласно настоящему изобретению содержит (a) VH–домен, содержащий HVR–H1, содержащую аминокислотную последовательность SEQ ID NO: 204, HVR–H2, содержащую аминокислотную последовательность SEQ ID NO: 144, и HVR–H3, содержащую аминокислотную последовательность SEQ ID NO: 145; и/или (b) VL–домен, содержащий HVR–L1, содержащую аминокислотную последовательность SEQ ID NO: 146, HVR–L2, содержащую аминокислотную последовательность SEQ ID NO: 147, и HVR–L3, содержащую аминокислотную последовательность SEQ ID NO: 148. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит (a) VH–домен, содержащий HVR–H1, содержащую аминокислотную последовательность SEQ ID NO: 213, HVR–H2, содержащую аминокислотную последовательность SEQ ID NO: 150, и HVR–H3, содержащую аминокислотную последовательность SEQ ID NO: 151; и/или (b) VL–домен, содержащий HVR–L1, содержащую аминокислотную последовательность SEQ ID NO: 152, HVR–L2, содержащую аминокислотную последовательность SEQ ID NO: 153, и HVR–L3, содержащую аминокислотную последовательность SEQ ID NO: 148. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит (a) VH–домен, содержащий HVR–H1, содержащую аминокислотную последовательность SEQ ID NO: 221, HVR–H2, содержащую аминокислотную последовательность SEQ ID NO: 156, и HVR–H3, содержащую аминокислотную последовательность SEQ ID NO: 157; и/или (b) VL–домен, содержащий HVR–L1, содержащую аминокислотную последовательность SEQ ID NO:158, HVR–L2, содержащую аминокислотную последовательность SEQ ID NO: 159, и HVR–L3, содержащую аминокислотную последовательность SEQ ID NO: 160.
[0232] В некоторых вариантах реализации антитело согласно настоящему изобретению содержит (a) VH–домен, содержащий HVR–H1, содержащую аминокислотную последовательность SEQ ID NO: 205, HVR–H2, содержащую аминокислотную последовательность SEQ ID NO: 206, и HVR–H3, содержащую аминокислотную последовательность SEQ ID NO: 207; и/или (b) VL–домен, содержащий HVR–L1, содержащую аминокислотную последовательность SEQ ID NO: 208, HVR–L2, содержащую аминокислотную последовательность SEQ ID NO: 209, и HVR–L3, содержащую аминокислотную последовательность SEQ ID NO: 210. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит (a) VH–домен, содержащий HVR–H1, содержащую аминокислотную последовательность SEQ ID NO: 214, HVR–H2, содержащую аминокислотную последовательность SEQ ID NO: 215, и HVR–H3, содержащую аминокислотную последовательность SEQ ID NO: 216; и/или (b) VL–домен, содержащий HVR–L1, содержащую аминокислотную последовательность SEQ ID NO: 217, HVR–L2, содержащую аминокислотную последовательность SEQ ID NO: 218, и HVR–L3, содержащую аминокислотную последовательность SEQ ID NO: 148. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит (a) VH–домен, содержащий HVR–H1, содержащую аминокислотную последовательность SEQ ID NO: 222, HVR–H2, содержащую аминокислотную последовательность SEQ ID NO: 223, и HVR–H3, содержащую аминокислотную последовательность SEQ ID NO: 224; и/или (b) VL–домен, содержащий HVR–L1, содержащую аминокислотную последовательность SEQ ID NO: 225, HVR–L2, содержащую аминокислотную последовательность SEQ ID NO: 226, и HVR–L3, содержащую аминокислотную последовательность SEQ ID NO: 160.
[0233] В некоторых вариантах реализации любого из вышеприведенных вариантов реализации антитело усиливает фагоцитоз макрофагом, экспрессирующим человеческий полипептид SIRP–α, усиливает активацию дендритных клеток, экспрессирующих человеческий полипептид SIRP–α, ингибирует in vivo рост опухоли или опухолевых клеток, экспрессирующих CD47, и/или не предотвращает взаимодействие между CD47–экспрессирующей клеткой и Т–клеткой. Типовые методы анализа для определения фагоцитоза, активации дендритных клеток, ингибирования роста опухоли и взаимодействия между CD47–экспрессирующими клетками и Т–клетками (например, анализа адгезии) описаны в данном документе и известны в данной области техники.
Получение антител и другие свойства антител
[0234] Антитело согласно настоящему изобретению можно получать любыми способами, известными в данной области техники. Типовые методики получения антител описаны ниже; однако эти типовые методики приведены исключительно в иллюстративных целях и не подразумевают ограничения. Кроме того, дополнительно описаны свойства типовых антител, подразумеваемые в случае применения описанных в данном документе антител.
[0235] В некоторых вариантах реализации антитело, которое «связывает» антиген, имеет константу диссоциации (KД) в отношении антигена, меньшую или равную 1 мкМ при 25°C. В некоторых вариантах реализации антитело согласно настоящему изобретению имеет константу диссоциации (KД) в отношении человеческих полипептидов SIRP–α v1 и/или v2, меньшую или равную 1 мкМ при 25°C, меньшую или равную 500 нМ при 25°C, меньшую или равную 400 нМ при 25°C, меньшую или равную 300 нМ при 25°C, меньшую или равную 250 нМ при 25°C, меньшую или равную 200 нМ при 25°C, меньшую или равную 200 нМ при 25°C, меньшую или равную 100 нМ при 25°C или меньшую или равную 50 нМ при 25°C. В некоторых вариантах реализации антитело, которое связывает человеческий полипептид SIRP–α и один или более нечеловеческих полипептидов SIRP–α, связывает человеческий полипептид SIRP–α с большей аффинностью (например, в 10 или в 100 раз большей), чем нечеловеческий полипептид SIRP–α, хотя все еще считается, что оно «связывает» оба полипептида. В некоторых вариантах реализации антитело, которое связывает нечеловеческий полипептид SIRP–α и один или более человеческих полипептидов SIRP–α, связывает нечеловеческий полипептид SIRP–α с большей аффинностью (например, в 10 или в 100 раз большей), чем человеческий полипептид SIRP–α, хотя все еще считается, что оно «связывает» оба полипептида. Аналитические методы для определения аффинности связывания известны в данной области техники и включают, без ограничений, метод поверхностного плазмонного резонанса (ППР), например, описанный в данном документе; анализ связывания радиоактивно меченого антигена (РИА), например, с применением Fab–версии антитела и его антигена; и т. д. Другие типовые методы анализа связывания описаны в данном документе.
[0236] Чтобы получить антиген, его можно очистить или каким–либо другим способом получить из природного источника, или же его можно экспрессировать, используя рекомбинантные технологии. В некоторых вариантах реализации антиген можно использовать в виде растворимого белка. В некоторых вариантах реализации антиген может быть конъюгирован с другим полипептидом или другим соединением, например, для повышения его иммуногенности. Например, описанный в данном документе антиген может быть сопряжен с Fc–областью. В некоторых вариантах реализации клетку, экспрессирующую антиген на своей поверхности, можно использовать в качестве антигена.
[0237] Поликлональные антитела можно получать в организме животного посредством нескольких подкожных (П/К) или внутрибрюшинных (В/Б) инъекций антигена и адъюванта. Например, в данном документе приведены описания иммунизации кур. В некоторых вариантах реализации антиген конъюгирован с иммуногенным белком, например, гемоцианином фиссуреллы, сывороточным альбумином, бычьим тироглобулином или ингибитором соевого трипсина, с помощью бифункционального дериватизирующего агента. В данном документе приведены типовые способы иммунизации кур. Релевантные способы, подходящие для ряда других организмов, хорошо известны в данной области техники.
[0238] Как описано выше, моноклональные антитела можно получать рядом способов. В некоторых вариантах реализации моноклональное антитело согласно настоящему изобретению получают, используя гибридомный способ, впервые описанный в Kohler et al., Nature, 256:495 (1975), и дополнительно описанный в Hongo et al, Hybridoma, 14(3): 253–260 (1995); Harlow et al., Antibodies: A Laboratory Manned, (Cold Spring Harbor Laboratory Press, 2nd ed. 1988); и Hammerling et al, в: Monoclonal Antibodies and T–Cell Hybridomas 563–681 (Elsevier, N.Y., 1981). Технология человеческой гибридомы (технология триомы) описана в Vollmers and Brandlein, Histology and Histopathology, 20(3):927–937 (2005) и Vollmers and Brandlein, Methods and Findings in Experimental and Clinical Pharmacology, 27(3): 185–91 (2005). Культуральную среду, в которой растут клетки гибридомы, можно исследовать в отношении наличия представляющего интерес антитела, например, методом in vitro анализа связывания, иммунопреципитации, ELISA, РИА и т. д.; а аффинность связывания можно определить, например, в анализе Скэтчарда. Гибридому, которая вырабатывает антитела с необходимыми связывающими свойствами можно субклонировать и выращивать, используя известные способы культивирования, выращивать in vivo в виде асцитных опухолей в организме животного и т. д.
[0239] В некоторых вариантах реализации моноклональное антитело получают, используя такой метод, как применение библиотеки фагового дисплея. Смотрите, например, Hoogenboom et al. in Methods in Molecular Biology 178:1–37 (O’Brien et al., ed., Human Press, Totowa, N.T. 2001). В некоторых вариантах реализации гены VH и VL клонируют посредством полимеразной цепной реакции (ПЦР) и случайным образом рекомбинируют в фаговых библиотеках, которые затем исследуют в отношении антигенсвязывающего фага, например, как описано в Winter et al., Ann. Rev. Immunol, 12: 433–455 (1994). Фаг, как правило, представляет фрагменты антител, как в виде одноцепочечных фрагментов Fv (scFv), так и в виде фрагментов Fab. В альтернативном варианте можно клонировать наивный репертуар (например, от человека), чтобы получить единый источник антител к широкому диапазону несобственных и также собственных антигенов без какой–либо иммунизации, как описано в Griffiths et al., EMBO J, 12: 725–734 (1993). И наконец, наивные библиотеки также можно получать синтетически, клонируя неперестроенные V–генные сегменты из стволовых клеток и используя ПЦР–праймеры, содержащие случайную последовательность, для кодирования высоковариабельных областей CDR3 и для осуществления перестройки in vitro, как описано в Hoogenboom and Winter, J. Mol. Biol, 227: 381–388 (1992).
[0240] В некоторых вариантах реализации антитело согласно настоящему изобретению представляет собой куриное антитело. Куриные антитела можно получать различными способами, известными в данной обрасти техники; смотрите, например, патенты США № 6143559; 8592644; и 9380769.
[0241] В некоторых вариантах реализации антитело согласно настоящему изобретению представляет собой химерное антитело. Смотрите, например, патент США № 4816567 и Morrison et al., Proc. Natl. Acad. Sci. USA, 81:6851–6855 (1984). В некоторых вариантах реализации химерное антитело содержит нечеловеческую вариабельную область (например, вариабельную область, полученную от курицы, мыши, крысы, хомяка, кролика или отличного от человека примата, такого как обезьяна) и человеческую константную область. В некоторых вариантах реализации химерное антитело представляет собой антитело «с переключенным классом», в котором был изменен класс или подкласс по сравнению с родительским антителом. Химерные антитела включают их антигенсвязывающие фрагменты.
[0242] В некоторых вариантах реализации химерное антитело представляет собой гуманизированное антитело. Нечеловеческое антитело можно гуманизировать, чтобы снизить его иммуногенность для человека, сохраняя при этом специфичность и аффинность родительского нечеловеческого антитела. В общем случае гуманизированное антитело содержит один или более вариабельных доменов, в которых HVR, например, CDR (или их части) получены из нечеловеческого антитела (например, куриного антитела), а FR (или их части) получены из последовательностей человеческого антитела. Гуманизированное антитело также необязательно будет содержать по меньшей мере часть человеческой константной области. В некоторых вариантах реализации некоторые остатки FR в гуманизированном антителе замещены соответствующими остатками из нечеловеческого антитела (например, антитела, из которого получены остатки HVR), например, для восстановления или улучшения специфичности или аффинности антитела. Обзор гуманизированных антител и способов их получения приведен например, в Almagro and Fransson, Front. Biosci. 13:1619–1633 (2008). Также были описаны способы гуманизации куриных антител, например, в WO2005014653.
[0243] Человеческие каркасные области, подходящие для гуманизации, включают, но не ограничиваются этим: каркасные области, выбранные методом «наилучшего соответствия»; каркасные области, полученные из консенсусной последовательности человеческих антител конкретной подгруппы вариабельных областей тяжелой или легкой цепи; человеческие соматически мутированные каркасные области или каркасные области человеческой зародышевой линии; и каркасные области, полученные при скрининге библиотек FR. Смотрите, например, Sims et al. J. Immunol. 151:2296 (1993); Carter et al. Proc. Natl Acad. Sci. USA, 89:4285 (1992); Presta et al. J. Immunol, 151:2623 (1993); Almagro and Fransson, Front. Biosci. 13:1619–1633 (2008); и Baca et al., J. Biol Chem. 272:10678–10684 (1997).
[0244] В некоторых вариантах реализации антитело согласно настоящему изобретению представляет собой человеческое антитело. Человеческие антитела можно получать различными способами, известными в данной обрасти техники. В некоторых вариантах реализации человеческое антитело вырабатывается отличным от человека животным, таким как генетически измененные куры (смотрите, например, патенты США № 8592644; и 9380769) и/или мыши, описанные в данном документе. Вцелом, человеческие антитела описаны в Lonberg, Cun. Opin. Immunol. 20:450–459 (2008).
[0245] В некоторых вариантах реализации антитело согласно настоящему изобретению вырабатывается в организме курицы или получено из него, например, с помощью описанных в данном документе способов.
[0246] В некоторых вариантах реализации антитело согласно настоящему изобретению представляет собой фрагмент антитела, включая, без ограничений, фрагмент Fab, F(ab’)2, Fab’–SH, Fv или scFv, или однодоменное, состоящее из одной тяжелой цепи или состоящее из одной легкой цепи антитело. Фрагменты антител можно получать, например, путем ферментативного расщепления или рекомбинантными способами. В некоторых вариантах реализации для создания фрагмента антитела используют протеолитическое расщепление интактного антитела, например, как описано в Morimoto et al., Journal of Biochemical and Biophysical Methods 24:107–117 (1992) и Brennan et al., Science, 229:81 (1985). В некоторых вариантах реализации фрагмент антитела получают с помощью рекомбинантной клетки–хозяина. Например, фрагменты антител Fab, Fv и ScFv экспрессируются и секретируются E. coli. В альтернативном варианте фрагменты антител можно выделять из фаговой библиотеки антител.
[0247] Фрагменты Fab'–SH можно непосредственно выделять из E. coli и проводить их химическое сопряжение с образованием фрагментов F(ab')2. Смотрите Carter et al., Bio/Technology 10:163–167 (1992). Фрагменты F(ab')2 также можно непосредственно выделять из культуры рекомбинантных клеток–хозяев. Фрагменты Fab и F(ab')2 с повышенным in vivo временем полужизни, содержащие остатки связывания эпитопа рецептора реутилизации, описаны в патенте США № 5869046.
[0248] В некоторых вариантах реализации антитело представляет собой одноцепочечный фрагмент Fv (scFv). Смотрите WO 93/16185 и патенты США № 5571894 и 5587458. Можно конструировать слитые белки scFv с получением слияния эффекторного белка в амино– или карбокси–конце scFv. Фрагмент антитела также может представлять собой «линейное антитело», например, описанное в патенте США № 5641870. Такие линейные антитела могут быть моноспецифическими или биспецифическими.
[0249] В некоторых вариантах реализации антитело согласно настоящему изобретению представляет собой мультиспецифическое антитело. Мультиспецифические антитела обладают специфичностью связывания в отношении более чем одного антигена (например, обладают двумя, тремя или более специфичностями связывания). В некоторых вариантах реализации антитело представляет собой биспецифическое антитело. В некоторых вариантах реализации биспецифическое антитело имеет две разные специфичности связывания в отношении одного антигена (например, характеризующихся разной аффинностью связывания и/или разными конкретными эпитопами одного антигена). В некоторых вариантах реализации биспецифическое антитело характеризуется специфичностью связывания в отношении двух разных антигенов. В некоторых вариантах реализации биспецифическое антитело представляет собой полноразмерное или интактное антитело. В некоторых вариантах реализации биспецифическое антитело представляет собой фрагмент антитела согласно настоящему изобретению.
[0250] В данном документе предусмотрены биспецифические или мультиспецифические антитела с рядом комбинаций вариантов специфичности связывания. В некоторых вариантах реализации биспецифическое антитело имеет первую специфичность связывания в отношении одного или более полипептидов SIRP–α, описанных в данном документе. В некоторых вариантах реализации биспецифическое антитело имеет вторую специфичность связывания в отношении антигена, экспрессируемого раковой клеткой, например, на клеточной поверхности. Примеры таких антигенов включают, без ограничений, CD19, CD20, CD22, CD30, CD33, CD38, CD52, CD56, CD70, CD74, CD79b, CD123, CD138, CS1/SLAMF7, Trop–2, 5T4, EphA4, BCMA, муцин 1, муцин 16, PTK7, PD–L1, STEAP1, рецептор эндотелина B, мезотелин, EGFRvIII, ENPP3, SLC44A4, GNMB, нектин 4, NaPi2b, LIV–1A, гуанилил циклазу C, DLL3, EGFR, HER2, VEGF, VEGFR, интегрин αVβ3, интегрин α5β1, MET, IGF1R, TRAILR1, TRAILR2, RANKL, FAP, тенасцин, Ley, EpCAM, CEA, gpA33, PSMA, TAG72, муцин, CAIX, EPHA3, фолатный рецептор α, GD2, GD3 и ГКГС/пептидного комплекса, содержащего пептид из NY–ESO–1/LAGE, SSX–2, белок семейства MAGE, MAGE–A3, gp100/pmel17, Melan–A/MART–1, gp75/TRP1, тирозиназу, TRP2, CEA, PSA, TAG–72, незрелый рецептор ламинина, MOK/RAGE–1, WT–1, SAP–1, BING–4, EpCAM, MUC1, PRAME, сурвивин, BRCA1, BRCA2, CDK4, CML66, MART–2, p53, Ras, β–катенин, TGF–βRII, HPV E6 или HPV E7. Не ограничиваясь теорией, считается, что комбинация такой специфичности связывания со специфичностью связывания против SIRP–α обеспечивает исключительное преимущество,например, для направления FcR–экспрессирующих лейкоцитов для нацеливания на опухолевую клетку со второй специфичность связывания, в то же время ингибируя восприимчивость SIRP–α, экспрессируемого лейкоцитом, к любому CD47, экспрессируемому опухолевой клеткой с первой специфичностью связывания.
[0251] В данной области техники известны различные способы создания и очистки биспецифических антител. Было описано множество подходов. Одним из подходов является подход «выступ–во–впадину» или «выпуклость–в–углубление» (смотрите, например, патент США № 5731168). В некоторых вариантах реализации гетеродимеризацию мономеров Fc–домена стимулируют, внося разные, но совместимые замены в два мономера Fc–домена, такие как пары остатков «выступ–во–впадину» и заряженные пары остатков. Взаимодействие типа выступ–во–впадину способствует образованию гетеродимера, тогда как взаимодействие «выступ–выступ» и «впадина–впадина» препятствует образованию гетеродимера вследствие стерического несоответствия и устранения благоприятных взаимодействий. Впадиной называется пространство, создаваемое при замещении оригинальной аминокислоты в белке другой аминокислотой, имеющей меньший объем боковой цепи. Выступом называется выпуклость, создаваемая при замещении оригинальной аминокислоты в белке другой аминокислотой, имеющей больший объем боковой цепи. Например, в некоторых вариантах реализации замещаемая аминокислота находится в CH3 константного домена антитела мономера Fc–домена и вовлечена в димеризацию двух мономеров Fc–домена. В некоторых вариантах реализации в CH3 константного домена антитела создается впадина, соответствующая выступу в другом CH3 константного домена антитела, так, что аминокислоты выступа и впадины стимулируют или способствуют гетеродимеризации двух мономеров Fc–домена. В некоторых вариантах реализации впадина в CH3 константного домена антитела создается, чтобы лучше соответствовать оригинальной аминокислоте в другом CH3 константного домена антитела. В некоторых вариантах реализации выступ в CH3 константного домена антитела создается для образования дополнительных взаимодействий с оригинальными аминокислотами в другом CH3 константного домена антитела.
[0252] В некоторых вариантах реализации впадину создают путем замещения аминокислот, имеющих большие боковые цепи, таких как тирозин или триптофан, аминокислотами, имеющими меньшие боковые цепи, такими как аланин, валин или треонин, например, как в случае мутации Y407V в CH3 константного домена антитела. Аналогично, в некоторых вариантах реализации выступ создают путем замещения аминокислот, имеющих меньшие боковые цепи, аминокислотами, имеющими большие боковые цепи, например, как в случае мутации T366W в CH3 константного домена антитела. В некоторых вариантах реализации один мономер Fc–домена содержит мутацию типа «выступа» T366W, а другой мономер Fc–домена содержит мутации типа «впадины» T366S, L358A и Y407V. В некоторых вариантах реализации полипептид согласно изобретению, включая высокоаффинный вариант D1 SIRP–α, слит с мономером Fc–домена, содержащим мутацию типа «выступ» T366W, для ограничения нежелательного образования гомодимера «выступ–выступ». Примеры аминокислотных пар типа «выступ–во–впадину» включены, без ограничений, в таблицу 3.
Таблица 3. Аминокислотные пары типа «выступ–во–впадину».
Fc–
Домена 1
L358A
Y407V
Y407T
Y407A
T394S
F405A
F405W
Y407A
[0253] В другом подходе используются вариабельные домены антитела с необходимой специфичностью связывания (участки связывания антитело–антиген), слитые с последовательностями константного домена иммуноглобулина, например, с константным доменом тяжелой цепи иммуноглобулина, содержащим по меньшей мере часть шарнирной области, а также областей CH2 и CH3. В некоторых вариантах реализации биспецифическое антитело имеет гибридную тяжелую цепь иммуноглобулина с первой специфичностью связывания в одном плече и гибридную пару тяжелая цепь – легкая цепь иммуноглобулина (обеспечивающую вторую специфичность связывания) в другом плече. Смотрите WO 94/04690. В другом подходе используется перекрестное сшивание (смотрите, например, патент США № 4676980) для получения гетероконъюгированного антитела. В некоторых вариантах реализации биспецифические антитела можно получать, используя химическую связь (смотрите, например, Brennan et al., Science, 229: 81 (1985)) для протеолитического расщепления интактного антитела на фрагменты F(ab')2, которые восстанавливаются в присутствии дитиолового комплексирующего агента и превращаются в производные тионитробензоата (ТНБ), одно из которых повторно преобразуется в Fab’–посредством восстановления и смешивается с другим Fab'–ТНБ производным с образованием биспецифического антитела. В некоторых вариантах реализации фрагменты Fab'–SH химически сопряжены. В некоторых вариантах реализации фрагменты биспецифических антител получают в клеточной культуре, используя лейциновые молнии, как описано в Kostelny et al., J. Immunol., 148(5): 1547– 1553 (1992). Информацию о других форматах биспецифических антител смотрите, например, в Spiess, C. et al. (2015) Mol. Immunol. 67:95–106.
[0254] В некоторых вариантах реализации антитело согласно настоящему изобретению представляет собой диатело. Смотрите, например, Hollinger et al., Proc. Natl. Acad. Sci. USA, 90:6444–6448 (1993). В диателе домены VH и VL одного фрагмента спарены с комплементарными доменами VL и VH другого фрагмента, образуя, таким образом, два антигенсвязывающих участка. Сообщалось о другой стратегии получения фрагментов биспецифических антител путем использования димеров из одноцепочечных Fv (sFv). Смотрите Gruber et al, J. Immunol, 152:5368 (1994).
[0255] В некоторых вариантах реализации антитело согласно настоящему изобретению представляет собой однодоменное антитело. Однодоменным антителом называется одиночная полипептидная цепь, содержащая весь или часть вариабельного домена тяжелой цепи или весь или часть вариабельного домена легкой цепи антитела. В определенных вариантах реализации однодоменное антитело представляет собой человеческое однодоменное антитело (смотрите, например, патент США № 6248516 B1). В одном варианте реализации однодоменное антитело содержит весь или часть вариабельного домена тяжелой цепи антитела. Также известны антитела верблюжьих.
[0256] Антитела можно получать рекомбинантными способами. Для рекомбинантного получения антитела против антигена выделяют нуклеиновую кислоту, кодирующую антитело, и вставляют в способный к репликации вектор для дополнительного клонирования (амплификации ДНК) или для экспрессии. ДНК, кодирующую антитело, легко можно выделять и секвенировать, используя традиционные процедуры (например, путем применения олигонуклеотидных зондов, которые способны специфически связываться с генами, кодирующими тяжелую и легкую цепи антитела). Доступно большое количество векторов. Компоненты вектора в общем случае включают, но не ограничиваются этим, один или более из следующих компонентов: сигнальная последовательность, точка начала репликации, один или более маркерных генов, энхансерный элемент, промотор и последовательность терминации транскрипции.
[0257] Антитело согласно настоящему изобретению можно получать рекомбинантным способом в виде полипептида, слитого с гетерологичным полипептидом, например, сигнальной последовательностью или другим полипептидом, имеющим специфический участок расщепления в N–конце зрелого белка или полипептида. Выбранной гетерологичной сигнальной последовательностью может быть последовательность, которая распознается и процессируется (например, расщепляется сигнальной пептидазой) клеткой–хозяином. В случае прокариотических клеток–хозяев, которые не распознают и не процессируют сигнальную последовательность, сигнальную последовательность замещают прокариотической сигнальной последовательностью, выбранной, например, из лидерных последовательностей щелочной фосфатазы, пенициллиназы, lpp или термостабильного энтеротоксина II. В случае дрожжевой секреции нативную сигнальную последовательность можно замещать, например, лидерной последовательностью дрожжевой инвертазы, лидерной последовательностью фактора (включая лидерные последовательности α–фактора Saccharomyces и Kluyveromyces ) или лидерной последовательностью кислой фосфатазы, лидерной последовательностью глюкоамилазы C. albicans и т. д. В случае экспрессии в клетках млекопитающих доступны сигнальные последовательности млекопитающих, а также вирусные секреторные лидерные последовательности, например, gD–сигнал вируса простого герпеса.
[0258] Как экспрессионные, так и клонирующие векторы содержат последовательность нуклеиновой кислоты, которая обеспечивает возможность репликации вектора в одной или более выбранных клетках–хозяевах, например, возможность репликации вектора независимо от хромосомной ДНК хозяина. Эта последовательность может содержать точки начала репликации или последовательности автономной репликации. Такие последовательности хорошо известны для многих бактерий, дрожжей и вирусов. В общем случае компонент точки начала репликации не является необходимым для экспрессионных векторов млекопитающих (можно использовать точку SV40, так как она содержит ранний промотор).
[0259] Экспрессионные и клонирующие векторы могут содержать селективный ген или селективный маркер. Типичные селективные гены кодируют белки, которые (а) придают устойчивость к антибиотикам или другим токсинам, например, к ампициллину, неомицину, метотрексату или тетрациклину, (b) восполняют ауксотрофный дефицит клетки или (c) обеспечивают важные питательные вещества, не доступные в комплексных средах. Примеры доминантной селекции включают применение таких препаратов как неомицин, микофеноловая кислота и гигромицин. Другими примерами подходящих селективных маркеров для клеток млекопитающих являются маркеры, обеспечивающие возможность идентификации клеток, способных поглощать кодирующую антитело нуклеиновую кислоту, такие как DHFR, глутаминсинтетаза (GS), тимидинкинада, металлотионеин–I и –II, предпочтительно гены металлотионеина приматов, аденозиндезаминаза, орнитиндекарбоксилаза и т. д. Например, линию клеток яичника китайского хомяка (CHO) с дефицитом активности эндогенного DHFR, трансформированную геном DHFR, идентифицируют, культивируя трансформантов в культуральной среде, содержащей метотрексат (Mtx), конкурентный антагонист DHFR.
[0260] В альтернативном варианте отбор клеток–хозяев (в частности, хозяев дикого типа, которые содержат эндогенный DHFR), трансформированных или совместно трансформированных последовательностями ДНК, кодирующими представляющее интерес антитело, ген DHFR дикого типа и другой селективный маркер, такой как аминогликозид–3'–фосфотрансфераза (APH), можно проводить по росту клеток в среде, содержащей селективный агент для селективного маркера, такой как аминогликозидный антибиотик, например, канамицин, неомицин или G418.
[0261] Экспрессионные и клонирующие векторы в общем случае содержат промотор, который распознается организмом–хозяином и который функционально связан с нуклеиновой кислотой, кодирующей антитело. Промоторы, подходящие для использования с прокариотическими хозяевами, включают промотор phoA, промоторные системы β–лактамазы и лактозы, промотор щелочной фосфатазы, промоторную систему триптофана (trp) и гибридные промоторы, такие как промотор tac. При этом подходят и другие известные бактериальные промоторы. Промоторные последовательности известны также для эукариот. Дрожжевые промоторы хорошо известны в данной области техники и могут включать индуцибельные промоторы/энхансеры, регулируемые условиями роста. Практически все эукариотические гены имеют AT–богатую область, расположенную приблизительно на 25–30 оснований выше сайта инициации транскрипции. Примеры включают, без ограничений, промоторы 3–фосфоглицераткиназы или других гликолитических ферментов, таких как энолаза, глицеральдегид–3–фосфатдегидрогеназа, гексокиназа, пируватдекарбоксилаза, фосфофруктокиназа, глюкозо–6–фосфат изомераза, 3–фосфоглицератмутаза, пируваткиназа, триозофосфатизомераза, фосфоглюкозоизомераза и глюкокиназа. Транскрипцию антитела из векторов в клетках–хозяевах млекопитающих можно регулировать, например, промоторами, полученными из геномов вирусов. Ранний и поздний промоторы вируса SV40 удобно получать в виде рестрикционного фрагмента SV40, который также содержит вирусную точку начала репликации SV40. Немедленно–ранний промотор человеческого цитомегаловируса удобно получать в виде рестрикционного фрагмента HindIII E. В альтернативном варианте в качестве промотора можно использовать длинный концевой повтор вируса саркомы Рауса.
[0262] Транскрипцию ДНК, кодирующей антитело согласно этому изобретению, высшими эукариотами часто повышают, вставляя в вектор последовательность энхансера. На сегодняшний день известно много последовательностей энхансеров из генов млекопитающих (глобина, эластазы, альбумина, α–фетопротеина и инсулина). Однако, как правило, используют энхансер из вируса эукариотической клетки.
[0263] Экспрессионные векторы, применяемые в эукариотических клетках–хозяевах (дрожжей, грибов, насекомых, растений, животных, людей или ядросодержащих клетках других многоклеточных организмов) также будут содержать последовательности, необходимые для терминации транскрипции и для стабилизации мРНК.
[0264] Клетки–хозяева, подходящие для клонирования или экспрессии ДНК в векторах согласно данному документу являются клетками прокариот, дрожжей или высших эукариот, описанными выше. Подходящие для данной цели прокариоты включают эубактерии, такие как грамотрицательные или грамположительные организмы, например, Enterobactehaceae, такие как Escherichia, например, E. coli, Enterobacter, Erwinia, Klebsiella, Proteus, Salmonella, например. Salmonella typhirnurium, Serratia, например, Serratia marcescans, и Shigella, и т. д. Кроме прокариот эукариотические микроорганизмы, такие как нитевидные грибы или дрожжи, являются подходящими для клонирования или экспрессии хозяевами для антиген–кодирующих векторов. Saccharomyces cerevisiae, или обычные пекарские дрожжи наиболее часто используются среди низших эукариотических микроорганизмов–хозяев. Можно отбирать определенные штаммы грибов и дрожжей, в которых пути гликозилирования были «гуманизированы», что приводит к выработке антитела с частично или полностью человеческим профилем гликозилирования. Смотрите, например, Li et al., Nat. Biotech. 24:210–215 (2006).
[0265] Культуры клеток растений, например, хлопка, кукурузы, картофеля, сои, петунии, томатов, ряски (Leninaceae), люцерны (M. truncatula) и табака, также можно использовать в качестве хозяев.
[0266] Подходящие для экспрессии гликозилированного антитела клетки–хозяева также получают из многоклеточных организмов (беспозвоночных и позвоночных). Примеры клеток беспозвоночных включают клетки растений и насекомых. Были идентифицированы многочисленные бакуловирусные штаммы и варианты и соответствующие пермиссивные клетки–хозяева насекомых из таких хозяев, как Spodoptera frugiperda (гусеница), Aedes aegypti (москит), Aedes albopictus (москит), Drosophila melanogaster (фруктовая муха) и Bombyx mori.
[0267] Клетки позвоночных можно использовать в качестве хозяев, а размножение клеток позвоночных в культуре (тканевой культуре) стало рутинной процедурой. Примерами применимых линий клеток–хозяев млекопитающих являются линия почки обезьяны CV1, трансформированная SV40 (COS–7, ATCC CRL 1651); линия почки эмбриона человека (клетки 293 или 293, субклонированные для роста в суспензионной культуре, Graham et al., J. Gen Virol. 36:59 (1977)); клетки почки новорожденного хомяка (BHK, ATCC CCL 10); клетки сертоли мышей (TM4, Mather, Biol. Reprod. 23:243–251 (1980)); клетки почки обезьяны (CV1 ATCC CCL 70); клетки почки африканской зеленой мартышки (VERO–76, ATCC CRL–1587); клетки карциномы шейки матки человека (HELA, ATCC CCL 2); клетки почки собаки (MDCK, ATCC CCL 34); клетки печени серой крысы (BRL 3 A, ATCC CRL 1442); клетки легкого человека (W138, ATCC CCL 75); клетки печени человека (Hep G2, HB 8065); клетки опухоли молочной железы мышей (MMT 060562, ATCC CCL51); клетки TRI (Mather et al. Annals N.Y. Acad. Sci. 383:44–68 (1982)); клетки MRC 5; клетки FS4; и линия гепатомы человека (Hep G2). Другие применимые линии клеток–хозяев млекопитающих включают клетки яичника китайского хомяка (CHO), включая DHFR–клетки CHO (Urlaub et al, Proc. Natl. Acad. Sci. USA 77:4216 (1980)); и линии клеток миеломы, такие как NS0 и Sp2/0. Обзор некоторых линий клеток–хозяев млекопитающих, подходящих для выработки антител, смотрите, например, в Yazaki and Wu, Methods in Molecular Biology, Vol. 248 (B. K. C. Lo, ed., Humana Press, Totowa, N.J., 2003), pp. 255–268.
[0268] Клетки–хозяев согласно настоящему изобретению можно культивировать в различных средах. Коммерчески доступные среды, такие как среда Ham F10 (Sigma), минимальная питательная среда ((MEM), (Sigma), RPMi–1640 (Sigma) и среда Игла, модифицированная по способу Дульбекко ((DMEM), Sigma), подходят для культивирования клеток–хозяев. Кроме того, среды, описанные в Ham et al, Meth. Enz. 58:44 (1979), Barnes et αl., Anal Biockem. 102:255 (1980), патентах США № 4767704; 4657866; 4927762; 4560655; или 5122469; WO 90/03430; WO 87/00195; или патенте США Re. 30985, можно использовать в качестве культуральной среды для клеток–хозяев. Любые из этих сред можно в случае необходимости дополнять гормонами и/или другими факторами роста (такими как инсулин, трансферрин или эпидермальный фактор роста), солями (такими как хлорид натрия, кальция, магния и фосфат), буферами (такими как ГЭПЭС), нуклеотидами (такими как аденозин и тимидин), антибиотиками (такими как препарат ГЕНТАМИЦИН™), следовыми элементами (определяемыми как неорганические соединения, обычно присутствующие в конечных концентрациях в микромолярном диапазоне) и глюкозой или эквивалентным источником энергии. Любые другие необходимые добавки также могут быть включены в подходящих концентрациях, как известно специалистам в данной области техники. Культуральные условия, такие как температура, pH и т. д., представляют условия, применяемые ранее с клетками–хозяевами, отобранными для экспрессии, и известны для специалиста в данной области техники.
[0269] При применении рекомбинантных технологий антитело можно получать внутриклеточно, в периплазматическом пространстве или оно может напрямую секретироваться в среду. Если антитело вырабатывается внутриклеточно, на первом этапе удаляют дебрис из частиц, как клеток–хозяев, так и лизированных фрагментов, например, путем центрифугирования или ультрафильтрации. В Carter et al, Bio/Technology 10:163–167 (1992) описана процедура выделения антител, которые секретируются в периплазматическое пространство E. coli.
[0270] Композицию антител, полученную из клеток, можно очищать, используя, например, хроматографию с гидроксиапатитом, хроматографию с гидрофобным взаимодействием, гель–электрофорез, диализ и аффинную хроматографию, при этом аффинная хроматография является одним из обычно предпочитаемых этапов очистки.
[0271] В некоторых вариантах реализации антитело согласно настоящему изобретению содержит константную область каппа или лямбда легкой цепи. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит константную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:325, 326 или 426. Типовые и неограничивающие последовательности константной области легкой цепи приведены в таблице 6. В некоторых вариантах реализации антитело согласно настоящему изобретению содержит константную область лямбда легкой цепи IGLC3 или константную область IGLC7.
[0272] В некоторых вариантах реализации антитело согласно настоящему изобретению содержит Fc–область. Например, в некоторых вариантах реализации Fc–область представляет собой человеческую Fc–область, например, IgG1, IgG2 или IgG4 и их подтипов. Типовые и неограничивающие Fc–области приведены в аминокислотных последовательностях SEQ ID NO:320–324, показанных в таблице 6. В некоторых вариантах реализации Fc–область в одной или более аминокислотных последовательностях SEQ ID NO:320–324 содержит одну или более мутаций, описанных в данном документе, например, выше.
Таблица 6. Типовые последовательности константной области


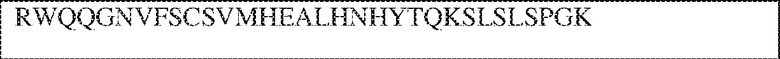



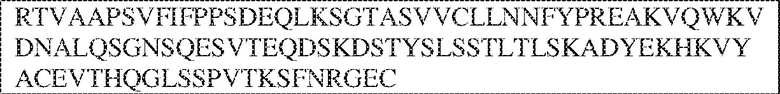


[0273] В некоторых вариантах реализации Fc–область содержит одну или более мутаций, которые влияют на одно или более свойств антитела, таких как стабильность, профиль гликозилирования или другие модификации, эффекторная клеточная функция, фармакокинетика и т. д. В некоторых вариантах реализации антитело согласно настоящему изобретению характеризуется сниженным или минимальным гликозилированием. В некоторых вариантах реализации антитело согласно настоящему изобретению имеет устраненную или сниженную эффекторную функцию. Типовые Fc–мутации включают, без ограничений, (i) мутации Fc–области IgG1 человека L234A, L235A, G237A и N297A; (ii) мутации Fc–области IgG2 человека A330S, P331S и N297A; и (iii) мутации Fc–области IgG4 человека S228P, E233P, F234V, L235A, delG236 и N297A (нумерация EU). В некоторых вариантах реализации Fc–область IgG2 человека содержит мутации A330S и P331S. В некоторых вариантах реализации Fc–область IgG4 человека содержит мутацию S288P. В некоторых вариантах реализации Fc–область IgG4 человека содержит мутации S288P и L235E.
[0274] Антитела, нацеленные на антигены клеточной поверхности, могут запускать иммуностимулирующие и эффекторные функции, которые связаны с привлечением Fc–рецептора (FcR) на иммунных клетках. Существует некоторое количество Fc–рецепторов, специфических для конкретных классов антител, включая IgG (гамма–рецепторы), IgE (эпсилон–рецепторы), IgA (альфа–рецепторы) и IgM (мю–рецепторы). Связывание Fc–области с Fc–рецепторами на клеточной поверхности может запускать многочисленные биологические реакции, включая фагоцитоз покрытых антителами частиц (антителозависимый клеточноопосредованный фагоцитоз или АЗКФ), клиренс иммунных комплексов, лизис покрытых антителами клеток клетками–киллерами (антителозависимая клеточноопосредованная цитотоксичность или АЗКЦ) и высвобождение воспалительных медиаторов, перенос через плаценту и регуляция выработки иммуноглобулина. Кроме того, связывание компонента C1 комплемента с антителами может активировать систему комплемента. Активация комплемента может быть важной для лизиса клеточных патогенов. Однако активация комплемента также может стимулировать воспалительный ответ и также может быть вовлечена в аутоиммунную гиперчувствительность или другие иммунологические нарушения. Вариантные Fc–области со сниженной или устраненной способностью связывать определенные Fc–рецепторы применимы для разработки терапевтических антител и Fc–слитых полипептидных конструкций, действие которых состоит в нацеливании, активации или нейтрализации функций лигандов, и в то же время не приводит к повреждению или разрушению локальных клеток или тканей.
[0275] В некоторых вариантах реализации мономер Fc–домена относится к полипептидной цепи, которая содержит второй и третий константные домены антитела (например, CH2 и CH3). В некоторых вариантах реализации мономер Fc–домена также содержит шарнирный домен. В некоторых вариантах реализации мономер Fc–домена принадлежит антителу любого изотипа иммуноглобулина, включая IgG, IgE, IgM, IgA и IgD. Кроме того, в некоторых вариантах реализации мономер Fc–домена принадлежит любому подтипу IgG (например, IgG1, IgG2, IgG2a, IgG2b, IgG2c, IgG3 и IgG4). В некоторых вариантах реализации мономер Fc–домена содержит до десяти изменений по сравнению с последовательностью мономера Fc–домена дикого типа (например, 1–10, 1–8, 1–6, 1–4 аминокислотных замен, добавлений или вставок, делеций или их комбинаций), которые изменяют взаимодействие между Fc–доменом и Fc–рецептором.
[0276] В некоторых вариантах реализации мономер Fc–домена иммуноглобулина или фрагмент мономера Fc–домена способен образовывать Fc–домен с другим мономером Fc–домена. В некоторых вариантах реализации мономер Fc–домена иммуноглобулина или фрагмент мономера Fc–домена не способен образовывать Fc–домен с другим мономером Fc–домена. В некоторых вариантах реализации мономер Fc–домена или фрагмент Fc–домена слит с полипептидом согласно изобретению для повышения сывороточного времени полужизни полипептида. В некоторых вариантах реализации мономер Fc–домена или фрагмент мономера Fc–домена, слитый с полипептидом согласно изобретению, димеризуется со вторым мономером Fc–домена с образованием Fc–домена, который связывает Fc–рецептор, или, в альтернативном варианте, мономер Fc–домена связывается с Fc–рецептором. В некоторых вариантах реализации Fc–домен или фрагмент Fc–домена, слитый с полипептидом для повышения сывороточного времени полужизни полипептида, не индуцирует ответ со стороны иммунной системы. Fc–домен содержит два мономера Fc–домена, которые димеризуются посредством взаимодействия между константными доменами CH3 антитела.
[0277] Fc–домен дикого типа образует минимальную структуру, которая связывается с Fc–рецептором, например, FcγRI, FcγRIIa, FcγRIIb, FcγRIIIa, FcγRIIIb и FcγRIV. В некоторых вариантах реализации Fc–домен в антителе согласно настоящему изобретению содержит одну или более аминокислотных замен, добавок или вставок, делеций или любые их комбинации, которые приводят к снижению эффекторной функции, например, снижению антителозависимой клеточноопосредованной цитотоксичности (АЗКЦ), снижению комплементзависимого цитолиза (КЗЦ), снижению антителозависимого клеточноопосредованного фагоцитоза (АЗКФ) или любым их комбинациям. Например, антитело согласно настоящему изобретению может демонстрировать сниженное связывание (например, минимальное связывание или отсутствие связывания) с человеческим Fc–рецептором сниженное связывание (например, минимальное связывание или отсутствие связывания) с белком комплемента C1q; сниженное связывание (например, минимальное связывание или отсутствие связывания) с человеческим FcγRI, FcγRIIA, FcγRIIB, FcγRIIIB, FcγRIIIB или любыми их комбинациями и C1q; измененную или сниженную антителозависимую эффекторную функцию, такую как АЗКЦ, КЗЦ, АЗКФ или любые их комбинации; и т. д. Типовые мутации включают, без ограничений, одну или более аминокислотных замен в E233, L234, L235, G236, G237, D265, D270, N297, E318, K320, K322, A327, A330, P331 или P329 (нумерация в соответствии с индексом EU по Kabat (Sequences of Proteins of Immunological interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991)).
[0278] В некоторых вариантах реализации антитело согласно настоящему изобретению характеризуется сниженным или аблированным связыванием с Fcγ–рецепторами CD16a, CD32a, CD32b, CD32c и CD64. В некоторых вариантах реализации антитело с ненативной Fc–областью, описанное данном документе, демонстрирует по меньшей мере 5%, 10%, 15%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или большее снижение в связывании C1q по сравнению с антителом, содержащим Fc–область дикого типа. В некоторых вариантах реализации антитело с ненативной Fc–областью, описанное данном документе, демонстрирует по меньшей мере 5%, 10%, 15%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или большее снижение в КЗЦ по сравнению с антителом, содержащим Fc–область дикого типа.
[0279] В некоторых вариантах реализации Fc–варианты согласно данному документу характеризуются минимальным гликозилированием или сниженным гликозилированием по сравнению с последовательностью дикого типа. В некоторых вариантах реализации дегликозилирование осуществляют с помощью мутации N297A или посредством мутации N297 на любую аминокислоту, отличную от N.
[0280] В некоторых вариантах реализации варианты константных областей антитела IgG (например, Fc–варианты) обладают сниженной способностью специфически связывать Fcγ–рецепторы или обладают сниженной способностью индуцировать фагоцитоз. В некоторых вариантах реализации варианты константных областей антитела IgG (например, Fc–варианты) обладают сниженной способностью специфически связывать Fcγ–рецепторы и обладают сниженной способностью индуцировать фагоцитоз. Например, в некоторых вариантах реализации Fc–домен мутирован так, чтобы у него отсутствовали эффекторные функции, что типично для «мертвого» Fc–домена. Например, в некоторых вариантах реализации Fc–домен содержит конкретные аминокислотные замены, которые, как известно, минимизируют взаимодействие между Fc–доменом и Fcγ–рецептором. В некоторых вариантах реализации мономер Fc–домена получен из антитела IgG1 и содержит одну или более аминокислотных замен L234A, L235A, G237A и N297A (обозначенных в соответствии с системой нумерации EU по Kabat et al., 1991). В некоторых вариантах реализации в такой Fc–вариант IgG1 включены одна или более дополнительных мутаций. Неограничивающие примеры таких дополнительных мутаций для Fc–вариантов человеческого IgG1 включают E318A и K322A. В некоторых случаях Fc–вариант человеческого IgG1 содержит всего до 12, 11, 10, 9, 8, 7, 6, 5 или 4 или менее мутаций по сравнению с последовательностью человеческого IgG1 дикого типа. В некоторых вариантах реализации в такой Fc–вариант IgG1 включены одна или более дополнительных делеций. Например, в некоторых вариантах реализации удален С–концевой лизин константной области тяжелой цепи Fc IgG1, например, для повышения гомогенности полипептида, когда полипептид вырабатывается в клетках бактерий или млекопитающих В некоторых случаях Fc–вариант человеческого IgG1 содержит всего до 12, 11, 10, 9, 8, 7, 6, 5 или 4 или менее делеций по сравнению с последовательностью человеческого IgG1 дикого типа.
[0281] В некоторых вариантах реализации мономер Fc–домена получен из антитела IgG2 и содержит аминокислотные замены A330S, P331S или как A330S, так и P331S. Вышеуказанные аминокислотные позиции определены в соответствии с Kabat, et al. (1991). Нумерация аминокислотных остатков по Kabat для данного антитела может быть определена путем выравнивания областей гомологии последовательности антитела со «стандартной» пронумерованной по Kabat последовательностью. В некоторых вариантах реализации Fc–вариант содержит последовательность Fc человеческого IgG2, содержащую одну или более аминокислотных замен A330S, P331S и N297A (по определению в соответствии с системой нумерации EU по Kabat et al. (1991). В некоторых вариантах реализации в такие Fc–варианты IgG2 включены одна или более дополнительных мутаций. Неограничивающие примеры таких дополнительных мутаций для Fc–варианта человеческого IgG2 включают V234A, G237A, P238S, V309L и H268A (обозначенных в соответствии с системой нумерации EU по Kabat et al. (1991)). В некоторых случаях Fc–вариант человеческого IgG2 содержит всего до 12, 11, 10, 9, 8, 7, 6, 5, 4, 3 или менее мутаций по сравнению с последовательностью человеческого IgG2 дикого типа. В некоторых вариантах реализации в такой Fc–вариант IgG2 включены одна или более дополнительных делеций.
[0282] Если Fc–вариант представляет собой Fc–вариант IgG4, в некоторых вариантах реализации такой Fc–вариант содержит мутацию S228P, E233P, F234V, L235A, L235E или delG236 (обозначенную в соответствии с Kabat, et al. (1991)). В некоторых случаях Fc–вариант человеческого IgG4 содержит всего до 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 мутации (–ий) по сравнению с последовательностью человеческого IgG4 дикого типа.
[0283] В некоторых вариантах реализации Fc–вариант демонстрирует сниженное связывание с Fc–рецептором субъекта по сравнению с Fc–областью человеческого IgG дикого типа. В некоторых вариантах реализации Fc–вариант демонстрирует аблированное связывание с Fc–рецептором субъекта по сравнению с Fc–областью человеческого IgG дикого типа. В некоторых вариантах реализации Fc–вариант демонстрирует снижение фагоцитоза по сравнению с Fc–областью человеческого IgG дикого типа. В некоторых вариантах реализации Fc–вариант демонстрирует аблированный фагоцитоз по сравнению с Fc–областью человеческого IgG дикого типа.
[0284] Антителозависимая клеточноопосредованная цитотоксичность, которая также называется в данном документе АЗКЦ, относится к форме цитотоксичности, при которой секретируемый Ig, связанный с Fc–рецепторами (FcR), присутствует на некоторых цитотоксических клетках (например, естественных клетках–киллерах (NK) и нейтрофилах), позволяя этим цитотоксическим эффекторным клеткам специфически связываться с антиген–несущей клеткой–мишенью и впоследствии уничтожать клетку–мишень. Антителозависимый клеточноопосредованный фагоцитоз, который также называется в данном документе АЗКФ, относится к форме цитотоксичности, при которой секретируемый Ig, связанный с Fc–рецепторами (FcR), присутствует на некоторых фагоцитарных клетках (например, макрофагах), позволяя этим фагоцитарным эффекторным клеткам специфически связываться с антиген–несущей клеткой–мишенью и впоследствии поглощать и расщеплять клетку–мишень. Лиганд–специфические высокоаффинные антитела IgG, направляемые к поверхности клетки, могут стимулировать цитотоксические или фагоцитарные клетки и могут применяться для подобного уничтожения. В некоторых вариантах реализации полипептидные конструкции, содержащие описанный в данном документе Fc–вариант, демонстрируют сниженную АЗКЦ или АЗКФ по сравнению с полипептидной конструкцией, содержащей Fc–область дикого типа. В некоторых вариантах реализации полипептидные конструкции, содержащие описанный в данном документе Fc–вариант, демонстрируют по меньшей мере 5%, 10%, 15%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или большее снижение АЗКЦ или АЗКФ по сравнению с полипептидной конструкцией, содержащей Fc–область дикого типа. В некоторых вариантах реализации антитела, содержащие описанный в данном документе Fc–вариант, демонстрируют аблированную АЗКЦ или АЗКФ по сравнению с полипептидной конструкцией, содержащей Fc–область дикого типа.
[0285] Комплементзависимая цитотоксичность, которая также называется в данном документе КЗЦ, относится к форме цитотоксичности, при которой происходит активация каскада комплемента посредством связывания компонента комплемента C1q с Fc антитела. В некоторых вариантах реализации полипептидные конструкции, содержащие описанный в данном документе Fc–вариант, демонстрируют по меньшей мере 5%, 10%, 15%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или большее снижение в связывании C1q по сравнению с полипептидной конструкцией, содержащей Fc–область дикого типа. В некоторых случаях полипептидные конструкции, содержащие описанный в данном документе Fc–вариант, демонстрируют сниженную КЗЦ по сравнению с полипептидной конструкцией, содержащей Fc–область дикого типа. В некоторых вариантах реализации полипептидные конструкции, содержащие описанный в данном документе Fc–вариант, демонстрируют по меньшей мере 5%, 10%, 15%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или большее снижение в КЗЦ по сравнению с полипептидной конструкцией, содержащей Fc–область дикого типа. В некоторых случаях антитела, содержащие описанный в данном документе Fc–вариант, демонстрируют незначительную КЗЦ по сравнению с полипептидной конструкцией, содержащей Fc–область дикого типа.
[0286] Fc–варианты согласно данному документу включают те, которые демонстрируют сниженное связывание с Fcγ–рецептором по сравнению с Fc–областью человеческого IgG дикого типа. Например, в некоторых вариантах реализации Fc–вариант демонстрирует связывание с Fcγ–рецептором, меньшее, чем связывание с Fcγ–рецептором, демонстрируемое Fc–областью человеческого IgG дикого типа. В некоторых случаях Fc–вариант характеризуется связыванием с Fcγ–рецептором, сниженным на 10%, 20% 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 96%, 97%, 98%, 99% или 100% (полностью аблированная эффекторная функция). В некоторых вариантах реализации снижение связывания наблюдается в отношении одного или более Fcγ–рецепторов, например, CD16a, CD32a, CD32b, CD32c или CD64.
[0287] В некоторых случаях описанные в данном документе Fc–варианты демонстрируют снижение фагоцитоза по сравнению с Fc–областью человеческого IgG дикого типа. Такие Fc–варианты демонстрируют снижение фагоцитоза по сравнению с Fc–областью человеческого IgG дикого типа, при этом снижение фагоцитарной активности составляется, например, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 96%, 97%, 98%, 99% или 100%. В некоторых случаях Fc–вариант демонстрирует аблированный фагоцитоз по сравнению с Fc–областью человеческого IgG дикого типа.
[0288] В некоторых вариантах реализации описанные в данном документе Fc–варианты сопряжены с одним или более партнерами по слиянию. В некоторых случаях партнер по слиянию представляет собой терапевтическое соединение, такое как цитотоксический агент согласно настоящему изобретению. В некоторых случаях партнера по слиянию выбирают, чтобы обеспечить возможность нацеливания экспрессируемого белка, очистки, скрининга, представления и т. д. В некоторых вариантах реализации партнер по слиянию также влияет на степень связывания с Fc–рецепторами или на степень снижения фагоцитоза.
[0289] В некоторых вариантах реализации партнеры по слиянию связаны с последовательностью Fc–варианта посредством линкерной последовательности. В некоторых вариантах реализации линкерная последовательность в общем случае содержит небольшое число аминокислот, например, менее десяти аминокислот, хотя применяются также более длинные линкеры. В некоторых случаях длина линкера составляет менее 10, 9, 8, 7, 6 или 5 аминокислот или меньше. В некоторых случаях длина линкера составляет по меньшей мере 10, 11, 12, 13, 14, 15, 20, 25, 30 или 35 аминокислот или больше. Необязательно, в некоторых вариантах реализации используется отщепляемый линкер.
[0290] В некоторых вариантах реализации партнер по слиянию представляет собой нацеливающую или сигнальную последовательность, которая направляет белок Fc–варианта и любых связанных с ним партнеров по слиянию в необходимую клеточную локацию или во внеклеточную среду. В некоторых вариантах реализации определенные сигнальные последовательности направляют белок для секреции в среду для роста или в периплазматическое пространство, расположенное между внутренней и внешней мембраной клетки. В некоторых вариантах реализации партнер по слиянию представляет собой последовательность, которая кодирует пептид или белок, которые обеспечивают возможность очистки или скрининга. Такие партнеры по слиянию включают, но не ограничиваются этим, полигистидиновые метки (His–метки) (например, His6 и His10) или другие метки для применения в системах аффинной хроматографии на иммобилизованных ионах металлов (IMAC) (например, в аффинных колонках Ni+2), GST–слияниях, MBP–слияниях, Strep–метках, системе–мишени BSP–биотинилирования бактериального фермента BirA и эпитопных метках, являющихся мишенями антител (например, c–myc–метках, flag–метках и т. д.).
[0291] В некоторых вариантах реализации такие метки используют для очистки, для скрининга или в обоих вариантах. Например, в некоторых вариантах реализации Fc–вариант очищают, используя His–метку, посредством ее иммобилизации на аффинной колонке Ni+2, а затем, после очистки, ту же самую His–метку используют для иммобилизации антитела на покрытом Ni+2 планшете для проведения анализа ELISA или другого анализа связывания.
[0292] Доступны различные партнеры по связыванию, которые обеспечивают возможность осуществления различных способов отбора. Например, посредством слияния представителей библиотека Fc–вариантов с белком гена III можно использовать метод фагового дисплея. В некоторых вариантах реализации партнеры по слиянию обеспечивают возможность мечения Fc–вариантов. В альтернативном способе в некоторых вариантах реализации партнер по слиянию связывается с конкретной последовательностью в экспрессионном векторе, что обеспечивает возможность ковалентной или нековалентной связи партнера по слиянию и ассоциированного с ним Fc–варианта с кодирующей их нуклеиновой кислотой.
[0293] В некоторых вариантах реализации, когда партнер по слиянию представляет собой терапевтическое соединение, терапевтическое соединение представляет собой, например, цитотоксический агент, пептид, белок, антитело, миРНК или малую молекулу.
[0294] В некоторых вариантах реализации антитело согласно настоящему изобретению связано с различными носителями или метками и используется для обнаружения конкретных экспрессирующих антиген клеток. Примеры носителей включают стекло, полистирол, полипропилен, полиэтилен, декстран, нейлон, амилазы, природные и модифицированные целлюлозы, полиакриламиды, агарозы и магнетит. По природе носитель может быть как растворимым, так и нерастворимым. Известны различные метки и способы мечения. Примеры меток включают ферменты, радиоактивные изотопы, флуоресцентные соединения, коллоидные металлы, хемилюминесцентные соединения и биолюминесцентные соединения. Доступны различные способы связывания меток с описанными в данном документе антителами. В некоторых вариантах реализации антитела сопряжены с низкомолекулярными гаптенами. Затем эти гаптены можно обнаруживать специфическим образом посредством проведения второй реакции. Например, в некоторых вариантах реализации гаптен биотин используют вместе с авидином или же проводят обнаружение гаптенов динитрофенола, пиридоксаля или флуоресцеина с помощью специфических антител против гаптенов (например, антител против динитрофенола, антител против пиридоксаля и антител против флуоресцеина). В некоторых вариантах реализации описанные в данном документе антитела используют in vitro для проведения анализа связывания, такого как иммунный анализ. Например, в некоторых вариантах реализации антитела используют в жидкой фазе или связанными с твердофазным носителем. В некоторых вариантах реализации антитела, используемые для проведения иммуноанализа, метят выявляемым образом разными способами.
Способы идентификации и/или создания антител
[0295] Определенные аспекты настоящего изобретения относятся к способам идентификации антигенсвязывающего домена, который связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α. Предпочтительно описанные в данном документе способы можно использовать для идентификации антигенсвязывающих доменов, которые блокируют связывание между человеческим CD47 и человеческим полипептидом SIRP–α, не блокируют связывание между человеческим CD47 и человеческим полипептидом SIRP–α или снижают аффинность человеческого полипептида SIRP–α в отношении человеческого CD47.
[0296] В некоторых вариантах реализации способы включают обеспечение антигенсвязывающего домена, который связывает внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α. Типовые антигенсвязывающие домены и антитела, которые связывают внеклеточный домен (например, домен D1) человеческого полипептида SIRP–α и/или другие полипептиды SIRP, описаны в данном документе, как и типовые способы идентификации таких антигенсвязывающих доменов/антител. Типовые способы более подробно описаны в примерах ниже.
[0297] В некоторых вариантах реализации способы включают получение комплекса, содержащего вариант D1 SIRP–α, связанный с полипептидом, содержащим домен IgSF CD47. В некоторых вариантах реализации «получение» комплекса включает обеспечение раствора, содержащего вариант D1 SIRP–α и полипептид, содержащий домен IgSF CD47. В некоторых вариантах реализации вариант D1 SIRP–α представляет собой вариант искусственного происхождения, например, который связывается с человеческим CD47 с аффинностью, которая по меньшей мере в 10 раз, по меньшей мере в 100 раз или по меньшей мере в 100 раз больше, чем аффинность связывания домена D1 SIRP–α природного происхождения с человеческим CD47. Преимущественно это облегчает скрининг антител, так как природное взаимодействие SIRP–α:CD47 может быть слишком слабым, чтобы использовать его в анализе связывания или скрининге. Типовые варианты более подробно описаны ниже.
[0298] В некоторых вариантах реализации способы включают приведение в контакт антигенсвязывающего домена с полученным комплексом. В некоторых вариантах реализации выявляют связывание антигенсвязывающего домена комплексом или его отсутствие или недостаток. В данном документе описаны различные способы выявления. В некоторых вариантах реализации используют ППР или ELISA. Выявляемое связывание антигенсвязывающего домена с комплексом указывает на то, что антигенсвязывающий домен не блокирует связывание между человеческим CD47 и человеческим полипептидом SIRP–α. Отсутствие связывания антигенсвязывающего домена с комплексом указывает на то, что антигенсвязывающий домен блокирует связывание между человеческим CD47 и человеческим полипептидом SIRP–α. Кроме того, используют ППР для разделения блокирующих, неблокирующих и отталкивающих антител. Например, в некоторых вариантах реализации неблокирующее антитело повышает РЕ при введении поверх преформированного комплекса SIRP–α:CD47, отталкивающее антитело повышает Kдисс. преформированного комплекса SIRP–α:CD47, а блокирующее антитело не меняет ни РЕ, ни Kдисс. преформированного комплекса SIRP–α:CD47.
[0299] В некоторых вариантах реализации домен IgSF CD47 представляет собой человеческий домен IgSF. В некоторых вариантах реализации полипептид, содержащий домен IgSF CD47, содержит внеклеточный домен человеческого CD47. В некоторых вариантах реализации домен IgSF CD47 содержит аминокислотную последовательность
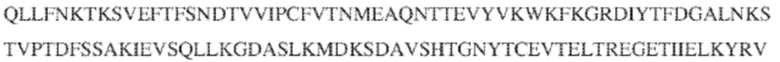
VS (SEQ ID NO: 16). В некоторых вариантах реализации полипептид, содержащий домен IgSF CD47, конъюгирован с другим полипептидом или другим соединением, например, Fc–областью Ig.
Высокоаффинные варианты домена D1 SIRP–α
[0300] Для применения в контексте данного документа предусмотрено множество высокоаффинных вариантов D1 SIRP–α. Например, в определенных вариантах реализации вариант D1 SIRP–α содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 17–52 (смотрите таблицу 4). Дополнительное описание вариантов D1 SIRP–α приведено ниже.
Таблица 4. Типовые аминокислотные последовательности вариантов D1 SIRP–α.


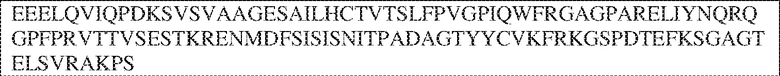

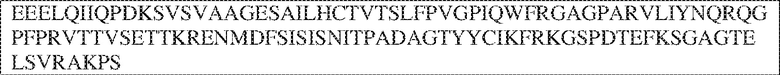


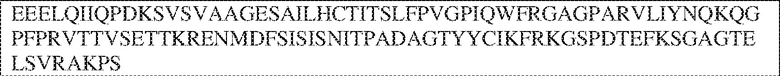

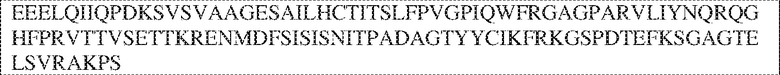


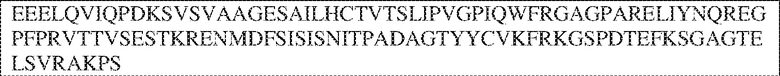
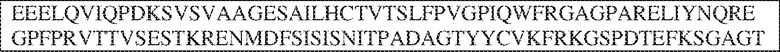


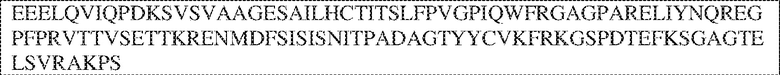

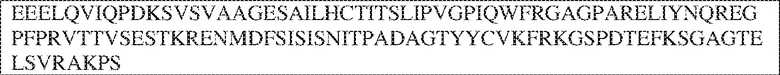
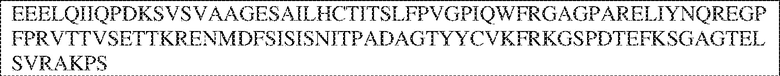











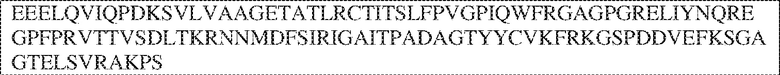






[0301] В некоторых вариантах реализации вариантный полипептид D1 SIRP–α или его фрагмент связывается с CD47 с KД менее 1×10–8 М, менее 5×10–9 М, менее 1×10–9 М, менее 5×10–10 М, менее 1×10–10 М или менее 1×10–11 М. В некоторых вариантах реализации вариантный полипептид D1 SIRP–α или его фрагмент связывается с CD47 с KД от около 500 нМ до 100 нМ, от около 100 нМ до 50 нМ, от около 50 нМ до 10 нМ, от около 10 нМ до 5 нМ, от около 5 нМ до 1 нМ, от около 1 нМ до 500 пМ, от около 500 пМ до 100 пМ, от около 100 пМ до 50 пМ или от около 50 пМ до 10 пМ.
[0302] В некоторых вариантах реализации фрагменты включают полипептиды длиной менее 10 аминокислот, длиной около 10 аминокислот, длиной около 20 аминокислот, длиной около 30 аминокислот, длиной около 40 аминокислот, длиной около 50 аминокислот, длиной около 60 аминокислот, длиной около 70 аминокислот, длиной около 80 аминокислот, длиной около 90 аминокислот, длиной около 100 аминокислот или длиной более чем около 100 аминокислот. Фрагменты сохраняют способность связываться с CD47. Предпочтительно вариантные полипептиды D1 SIRP–α и их фрагменты связываются с CD47 с большей аффинностью, чем в случае связывания полипептидов SIRP–α с CD47.
[0303] В некоторых вариантах реализации вышеупомянутые вариантные полипептиды D1 SIRP–α присоединены или слиты со вторым полипептидом. В некоторых вариантах реализации второй полипептид включает, без ограничений, Fc–полипептид, Fc–вариант, полипептид ЧСА, пептид альбумина, полимер ПЭГ или фрагмент вышеуказанных соединений.
[0304] В некоторых вариантах реализации полипептид включает высокоаффинный домен D1 SIRP–α, который имеет по меньшей мере 85% идентичности последовательности (например, по меньшей мере 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичности последовательности) с любым вариантом, приведенным в таблице 4.
Генерация антител у кур
[0305] Определенные аспекты настоящего изобретения относятся к способам получения анти–SIRP–α антитела, которое связывает внеклеточные домены (например, домены D1) двух или более разных человеческих вариантных полипептидов SIRP–α. Не ограничиваясь теорией считается, что использование кур обеспечивает исключительное преимущество вследствие большой разницы между куриным SIRP–α и SIRP–α млекопитающего (например, человека, обезьяны, мыши и т. д.). Кроме того, филогенетическое различие между курами и млекопитающими позволяет идентифицировать антитела, которые вступают в перекрестную реакцию, например, с человеческими и мышиными полипептидами SIRP–α, что может быть трудно достичь, получая антитела в организме мышей, вследствие аутотолерантности.
[0306] В некоторых вариантах реализации способы включают иммунизацию курицы пептидом, содержащим по меньшей мере часть внеклеточного домена (например, домена D1) человеческого SIRP–α. Типовая схема иммунизации описана ниже. Способы иммунизации кур описаны, например, в Mettler Izquierdo, S. et al. (2016) Microscopy (Oxf) 1–16. В некоторых вариантах реализации способы включают получение антитела из вырабатывающей антитело клетки от иммунизированной курицы.
[0307] В некоторых вариантах реализации способы включают выявление связывания между антителом, полученным из клетки, и внеклеточными доменами (например, доменами D1) двух или более разных человеческих вариантных полипептидов SIRP–α. Например, в некоторых вариантах реализации используют человеческие SIRP–α v1 и v2, например, как описано в данном документе. Типовые способы выявления описаны в данном документе и включают, без ограничений, анализ GEM (смотрите, например, WO2009111014 and Mettler Izquierdo, S. et al. (2016) Microscopy (Oxf) 1–16), ППР и ELISA.
Способы лечения
[0308] Определенные аспекты настоящего изобретения относятся к лечению заболевания или расстройства с помощью описанного в данном документе антитела. В некоторых вариантах реализации заболевание представляет собой рак. В некоторых вариантах реализации заболевание представляет собой аутоиммунное или воспалительное заболевание.
[0309] Например, в данном документе предложены способы лечения или замедления прогрессирования рака у индивида путем введения индивиду эффективного количества антитела согласно настоящему изобретению. Не ограничиваясь теорией считается, что описанные в данном документе антитела можно применять в лечении рака, например, подавляя способность рака ингибировать фагоцитоз и иммунологический надзор посредством сигнальной оси CD47: SIRP–α, или посредством усиления активации иммунной системы каким–либо иным образом (например, путем активации дендритных клеток).
[0310] В некоторых вариантах реализации антитело согласно настоящему изобретению вводят в комбинации с химиотерапевтическим агентом.
[0311] В некоторых вариантах реализации антитело согласно настоящему изобретению вводят в комбинации со вторым антителом, например, антителом, которое связывает антиген, экспрессируемый раком. Типовые антигены, экспрессируемые раками, известны в данной области техники и включают, без ограничений, CD19, CD20, CD22, CD30, CD33, CD38, CD52, CD56, CD70, CD74, CD79b, GD123, CD138, CS1/SLAMF7, Trop–2, 5T4, EphA4, BCMA, муцин 1, муцин 16, PTK7, PD–L1, STEAP1, рецептор эндотелина B, мезотелин, EGFRvIII, ENPP3, SLC44A4, GNMB, нектин 4, NaPi2b, LIV–1A, гуанилил циклазу C, DLL3, EGFR, HER2, VEGF, VEGFR, интегрин αVβ3, интегрин α5β1, MET, IGF1R, TRAILR1, TRAILR2, RANKL, FAP, тенасцин, Ley, EpCAM, CEA, gpA33, PSMA, TAG72, муцин, CAIX, EPHA3, фолатный рецептор α, GD2, GD3 и ГКГС/пептидный комплекс, содержащий пептид из NY–ESO–1/LAGE, SSX–2, белок семейства MAGE, MAGE–A3, gp100/pmel17, Melan–A/MART–1, gp75/TRP1, тирозиназу, TRP2, CEA, PSA, TAG–72, незрелый рецептор ламинина, MOK/RAGE–1, WT–1, SAP–1, BING–4, EpCAM, MUC1, PRAME, сурвивин, BRCA1, BRCA2, CDK4, CML66, MART–2, p53, Ras, β–катенин, TGF–βRII, HPV E6 или HPV E7. Например, в некоторых вариантах реализации антитело согласно настоящему изобретению вводят в комбинации с моноклональным антителом, которое связывает CD123 (также известный как рецептор IL–3 альфа), таким как талакотузумаб (также известный как CSL362 и JNJ–56022473). В некоторых вариантах реализации антитело согласно настоящему изобретению вводят в комбинации с моноклональным антителом, которое связывает EGFR (таким как цетуксимаб). В некоторых вариантах реализации второе антитело имеет одну или более эффекторных функций, например, эффекторных функций, которые связаны с привлечением Fc–рецепторов (FcR) на иммунных клетках, включая, без ограничений, АЗКЦ или АЗКФ и/или комплементзависимую цитотоксичность (КЗЦ). Не ограничиваясь теорией, считается, что комбинация такого антитела согласно настоящему изобретению обеспечивает исключительное преимущество, например, для направления FcR–экспрессирующих лейкоцитов для нацеливания на опухолевую клетку, с которой связано второе антитело, в то же время ингибируя восприимчивость SIRP–α, экспрессируемого лейкоцитом, к любому CD47, экспрессируемому опухолевой клеткой с антителом к SIRP–α.
[0312] В некоторых вариантах реализации антитело согласно настоящему изобретению вводят в комбинации с иммунотерапевтическим агентом. Иммунотерапевтический агент может относиться к любому терапевтическому средству, которое нацелено на иммунную систему и стимулирует терапевтическое перенаправление иммунной системы, такому как модулятор костимуляторного пути, противораковая вакцина, рекомбинантно модифицированная иммунная клетка и т. д. В некоторых вариантах реализации иммунотерапевтический агент включает антитело. Типовые антигены иммунотерапевтических антител известны в данной области техники и включают, без ограничений, PD–1, PD–L1, ОX40, CTLA–4, СD137/4–1BB, B7–H3, FZD7, CD27, TNFR2, CCR4, CSF1R, CSF, TIM–3, LAG–3, VISTA, ICOS, CCR2, IDO, A2R, CD39, CD73, TIGIT, CD80, CD47, аргиназу, TDO и PVRIG. Иммунотерапевтические агенты, утвержденные или находящиеся на поздних стадиях клинических исследований, включают, без ограничений, ипилимумаб, пембролизумаб, ниволумаб, атезолизумаб, авелумаб, дурвалумаб и т. д. Не ограничиваясь теорией, считается, что антитела согласно настоящему изобретению подходят для применения с иммунотерапевтическими агентами благодаря взаимодополняющему механизму действия, например, при активации макрофагов и эффекторных Т–клеток для нацеливания на опухолевые клетки. В определенных вариантах реализации антитело согласно настоящему изобретению вводят в комбинации с ингибитором пути PD–L1/PD–1, например, анти–PD–L1 или анти–PD–1 антителом. Как продемонстрировано в данном документе, комбинированное введение анти–SIRP–α антитела согласно настоящему изобретению и ингибитора пути PD–L1/PD–1 может приводить к синергетической противоопухолевой активности. Например, в некоторых вариантах реализации блокирующее анти–SIRP–α антитело согласно настоящему изобретению вводят в комбинации с анти–PD–1 антителом. В некоторых вариантах реализации неблокирующее анти–SIRP–α антитело согласно настоящему изобретению вводят в комбинации с анти–PD–1 антителом. В некоторых вариантах реализации блокирующее анти–SIRP–α антитело согласно настоящему изобретению вводят в комбинации с анти–PD–L1 антителом. В некоторых вариантах реализации неблокирующее анти–SIRP–α антитело согласно настоящему изобретению вводят в комбинации с анти–PD–L1 антителом.
[0313] Может быть включен любой известный в данной области техники тип рака, такой как, без ограничений, карцинома, саркома, лимфома, лейкоз, лимфома и бластома. Более конкретные примеры таких видов рака включают, но не ограничиваются этим, рак легкого, плоскоклеточный рак, опухоли головного мозга, глиобластому, рак головы и шеи, гепатоцеллюлярный рак, колоректальный рак (например, рак толстой или прямой кишки), рак печени, рак мочевого пузыря, рак желудка, рак поджелудочной железы, рак шейки матки, рак яичника, рак мочевыводящих путей, рак молочной железы, перитонеальный рак, рак матки, рак слюнных желез, рак почки, рак предстательной железы, рак вульвы, рак щитовидной железы, карциному анального канала, карциному полового члена, меланому, множественную миелому и B–кеточную лимфому (включая неходжкинскую лимфому (НХЛ)); острый лимфобластный лейкоз (ОЛЛ); хронический лимфоцитарный лейкоз (ХЛЛ); острый миелоидный лейкоз (ОМЛ); карциному из клеток Меркеля; волосатоклеточный лейкоз; хронический миелобластный лейкоз (ХМЛ); и связанные с ними метастазы.
[0314] Кроме противораковой терапии, предложенные в данном документе антитела применимы в вариантах терапии, при которых моноклональные антитела вводят в целях снижения количества клеток, например, при лечении воспалительных заболеваний путем снижения количества иммунных клеток. В таких целях предложенное в данном документе антитело вводят в комбинации со вторым терапевтическим антителом, например, с ритуксимабом, для снижения количества B–клеток при воспалительных заболеваниях и аутоиммунных состояниях; алемтузумабом в случае множественного склероза; OKT3 в случае иммуносупрессии; другими антителами в случае трансплантационного кондиционирования костного мозга; и т. д.
[0315] Дополнительно в данном документе предложены способы лечения или замедления прогрессирования аутоиммунного заболевания или воспалительного заболевания у индивида путем введения индивиду эффективного количества антитела согласно настоящему изобретению. Аутоиммунные заболевания и воспалительные заболевания, подлежащие лечению в соответствии с изобретением, включают, но не ограничиваются этим, множественный склероз, ревматоидный артрит, спондилоартропатию, системную красную волчанку, антителоопосредованное воспалительное или аутоиммунное заболевание, болезнь «трансплантат против хозяина», сепсис, диабет, псориаз, атеросклероз, синдром Шегрена, прогрессирующий системный склероз, склеродерму, острый коронарный синдром, ишемическую реперфузию, болезнь Крона, эндометриоз, гломерулонефрит, миастению гравис, идиопатический легочный фиброз, астму, острый респираторный дистресс–синдром (ОРДС), васкулит и воспалительный аутоиммунный миозит. В некоторых вариантах реализации антитело согласно настоящему изобретению вводят в комбинации с терапевтическим агентом, таким как иммуносупрессивный, противовоспалительный или иммуномодулирующий агент. В некоторых вариантах реализации предложенное в данном документе антитело используют при лечении аутоиммунного заболевания или воспалительного заболевания, например, множественного склероза, ревматоидного артрита, спондилоартропатии, системной красной волчанки, антителоопосредованного воспалительного или аутоиммунного заболевания, болезни «трансплантат против хозяина», сепсиса, диабета, псориаза, псориатического артрита, атеросклероза, синдрома Шегрена, прогрессирующего системного склероза, склеродермы, острого коронарного синдрома, ишемической реперфузии, болезни Крона, язвенного колита, эндометриоза, гломерулонефрита, нефропатии IgA–типа, поликистозной болезни почек, миастении гравис, идиопатического легочного фиброза, астмы, атопического дерматита, острого респираторного дистресс–синдрома (ОРДС), васкулита или воспалительного аутоиммунного миозита.
[0316] В некоторых вариантах реализации антитело согласно настоящему изобретению является частью фармацевтического состава, например, содержащего антитело и один или более фармацевтически приемлемых носителей. Фармацевтические композиции и составы, описанные в данном документе, можно готовить, смешивая активные ингредиенты (такие как антитела или полипептиды), имеющие необходимую степень чистоты, с одним или более необязательными фармацевтически приемлемыми носителями (Remington’s Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980)), в форме лиофилизированных составов или водных растворов. Фармацевтически приемлемые носители в общем случае являются нетоксичными для реципиентов в применяемых дозировках и концентрациях и включают, но не ограничиваются этим: буферы, такие как фосфатный, цитратный и другие органические кислоты; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты; низкомолекулярные (состоящие из менее чем около 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие агенты, такие как ЭДТА; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; комплексы металлов (например комплексы Zn–белок); и/или неионные поверхностно–активные вещества, такие как полиэтиленгликоль (ПЭГ). В некоторых вариантах реализации антитело согласно настоящему изобретению является лиофилизированным.
ПРИМЕРЫ
[0317] Настоящее изобретение станет более понятным со ссылкой на нижеприведенные примеры. При этом примеры не следует воспринимать как ограничивающие объем настоящего изобретения. Следует понимать, что описанные в данном документе примеры и варианты реализации приведены исключительно в иллюстративных целях, а различные связанные с ними модификации или изменения станут очевидны для специалистов в данной области техники, и подразумевается, что они включены в суть и сферу действия этой заявки и объема прилагаемой формулы изобретения.
Пример 1: Идентификация антител с новыми вариантами специфичности связывания с белками SIRP–α
Способы
Получение антител
[0318] Для иммунизации использовали следующие белки. Каждый содержит человеческий или мышиный пептид SIRP–α, слитый с модифицированной Fc–областью (S228P Fc человеческого IgG4 или L234A/L235A/G237A/N297A Fc человеческого IgG1, обозначаемой IgG1_AAA_N297A), для повышения иммуногенности.
Таблица A. Последовательности иммуногенов.
(Слияние с Fc IgG4_S228P)
(Слияние с Fc IgG4_S228P)
(Слияние с Fc IgG1_AAA_N297A)
(Слияние с Fc IgG1_AAA_N297A)
[0319] Вышеуказанные белки использовали для иммунизации кур дикого типа, кур SynVH, которые представляют собой трансгенных кур, содержащих VH человека и VL курицы, или кур с полностью человеческими локусами иммуноглобулина «HuMAB» (Crystal Bioscience; смотрите, например, WO2012162422, WO2011019844 и WO2013059159). Кур иммунизировали согласно переменным схемам с чередующимися дозами антигена. Типовая схема иммунизации является следующей: начальная иммунизация дозой 100 мкг антигена, имеющего последовательность SEQ ID NO: 1, на 1–ой неделе, бустерная доза 100 мкг антигена, имеющего последовательность SEQ ID NO: 2, на 3–ей неделе, взятие образцов на 4–ой неделе, бустерная доза 50 мкг антигена, имеющего последовательность SEQ ID NO: 1, на 5–ой неделе, взятие образцов на 6–ой неделе, бустерная доза 50 мкг антигена, имеющего последовательность SEQ ID NO: 2, на 7–ой неделе и взятие образцов на 8–ой неделе . Дополнительное описание иммунизации кур можно найти, например, в Mettler Izquierdo, S. et al. (2016) Microscopy (Oxf) 1–16.
Скрининг и экспрессия клонов антител
[0320] Клоны создавали и проводили их скрининг в соответствии с анализом GEM (смотрите Mettler Izquierdo, S. et al. (2016) Microscopy (Oxf) 1–16). Клоны исследовали в формате scFv–Fc, в котором легкая цепь слита посредством линкера с тяжелой цепью. scFv был слит с N–концом человеческой Fc–IgG1. Экспрессия клонов происходила в клетках FreeStyle™ 293–FS (Thermo Fisher), а секретируемую среду использовали для определения характеристик связывания методом ELISA и ППР.
ППР
[0321] Связывание клонов антител с различными белками SIRP определяли, используя выявление методом поверхностного плазмонного резонанса (ППР) на инструменте ProteOn XPR36 (Bio–Rad, Hercules, CA), используя фосфатно–солевой буфер (ФСБ, pH 7,4), дополненный 0,01% Твин–20 (ФСБТ), в качестве подвижного буфера. Предварительно профильтрованную среду, содержащую секретированные антитела, непосредственно использовали для анализа. Сначала проводили аминное сопряжение антитела против человеческого Fc IgG (BR–1008–39, GE Healthcare) с сенсорным чипом GLC для создания захватывающих поверхностей для антител. Достигали около 4000 РЕ на проточную ячейку с иммобилизованными антителами против Fc человеческого IgG. Скрининг каждого клона проводили одним и тем же способом, описанным ниже. Аналиты SIRP, используемые для скрининга, перечислены в таблице С.
[0322] (1) ~5–10 мкл предварительно профильтрованной среды в 10 мМ натрий–ацетатного буфера (pH 4,5) вводили в течение 2 мин при 30 мкл/мин;
[0323] (2) поток буфера в течение 1 мин при 100 мкл/мин;
[0324] (3) аналит SIRP (100 нМ) вводили в течение 1 мин при 100 мкл/мин с последующим циклом диссоциации в течение 10 мин;
[0325] (4) восстановление поверхности чипа с помощью потока 3 М хлорида магния в течение 1 мин при 25 мкл/мин в обеих ориентациях; и
[0326] (5) поток буфера в течение 1 мин при 100 мкл/мин.
[0327] Данные биосенсора дважды корректировали путем вычитания данных в промежутках между точками (не содержащих иммобилизованные антитела против человеческого Fc IgG) из данных для реакционных точек (иммобилизованные антитела против человеческого Fc IgG), а затем вычитания ответа при вводе контрольного буферного аналита из ответа при вводе аналита. Связывание аппроксимировали 1:1 моделью Ленгмюра и рассчитывали значения Kдисс. (1/с). Весь анализ ППР проводили при 25 °C.
ELISA
[0328] Анализ ELISA проводили, чтобы исследовать связывание клонов антител с аналитами SIRP и комплексом SIRP–α:CD47. Вкратце, 96–луночные плоскодонные планшеты с высокой степенью связывания (Greiner Bio–One #655061) покрывали следующими белками в отдельных экспериментах ELISA: авидин (Sigma A9275) (2 мкг/мл) с последующим применением биотинилированного человеческого SIRPα V1 (0,5 мкг/мл), авидин (2 мкг/мл) с последующим применением человеческого SIRPα V2, биотин (0,5 мкг/мл), мышиный NOD SIRPα (2 мкг/мл), человеческий SIRPγ (2 мкг/мл), CD47 (2 мкг/мл) с последующим применением высокоаффинного человеческого SIRPα V1 и V2 (по 2 мкг/мл каждого) или анти–hFc (2 мкг/мл, Rockland 609–4103). Планшеты блокировали ФСБТМ (фосфатно–солевой буфер, pH 7,4, 0,05% Твин–20, 3% молока), добавляли 50 мкл супернатанта, содержащего секретированный scFv–Fc в течение 1 ч при комнатной температуре. Планшеты промывали ФСБТ. Добавляли 50 мкл анти–hFc–HRP (1:5000, Rockland 609–4303) в течение 1 ч при комнатной температуре. Планшеты промывали ФСБТ. Реакцию ТМБ проводили в течение 5 мин, а затем останавливали с помощью 1 Н HCl. Результаты ELISA считывали, используя ридер BioTek Synergy H1 Hybrid Reader. Соответствующие белки, описанные в данном документе и используемые для анализа, представляют собой: человеческий SIRPα V1 (SEQ ID NO: 5); человеческий SIRPα V2 (SEQ ID NO:6); SIRPα яванского макака (SEQ ID NO: 11); SIRPα мышей NOD (SEQ ID NO: 8); человеческий SIRPγ (SEQ ID NO: 15); CD47 (SEQ ID NO: 16); высокоаффинный SIRPα V1 (SEQ ID NO: 42); высокоаффинный SIRPα V2 (SEQ ID NO: 17).
Результаты
[0329] SIRP–α является высокополиморфным белком в организме людей, обезьян и мышей. Например, была выявлена 20–аминокислотная разница между белками SIRP–α в линиях мышей NOD и C57BL/6, и эти полиморфизмы приводят к функциональным последствиям, связанным со связыванием CD47 и прививанием человеческих гемопоэтических стволовых клеток в этих линиях мышей. У людей было идентифицировано по меньшей мере 10 разных аллелей SIRPΑ, а аминокислотные вариации, которые отличают эти аллели, встречаются в прогнозированных CD47–связывающих остатках (Takenaka, K. et al. (2007) Nat. Immunol. 8:1313–23). Выравнивание 10 последовательностей человеческого вариантного белка SIRP–α приведено на Фиг. 1A. Идентификация антител, имеющих разную специфичность связывания и внутри– и/или межвидовую перекрестную реактивность, представляет большой интерес для разработки клинических кандидатных средств, являющихся эффективными для человеческих популяций, и изучения характеристик этих кандидатных средств в различных животных моделях.
[0330] Проводили выравнивание доменов D1 белков SIRP–α человека (варианты v1 и v2), яванского макака и мышей 129, чтобы идентифицировать консервативные аминокислоты (Фиг. 1B). Хотя последовательности яванского макака и мышей 129 намного больше отличаются от человеческих v1 и v2, чем человеческие варианты v3–v10, как показано на Фиг. 1A, эти выравнивания демонстрируют некоторую степень консервативности среди всех четырех белков, что позволяет предположить возможность идентификации перекрестно–реактивных антител. Однако каждый белок также демонстрирует уникальные полиморфизмы, что позволяет предположить, что также возможно существование специфических антител.
[0331] Как показано на Фиг. 1C, также проводили выравнивание последовательностей белка SIRP–α, представляющих ряд человеческих вариантов и линий мышей (например, 129, NOD, C57BL/6 и BALB/c). R1, R2, R3 описывают остатки, расположенные вокруг участков связывания SIRPα с CD47. Эти выравнивания демонстрируют, что R2 и R3 характеризуются значительно большим различием среди и между человеческими и мышиными последовательностями, чем R1. Не ограничиваясь теорией, считается, что анти–SIRP–α антитела, которые связываются с конкретными мышиными белками SIRP–α, можно применять, например, для фармакокинетических исследований (например, с использованием мышей CD–1), получения трансгенных мышей (например, в окружении C57BL/6) и/или изучения характеристик в SCID (например, в окружении NOD) или сингенных (например, в окружении BALB/c или C57BL/6) мышиных моделях.
[0332] Также проводили выравнивание описанных выше доменов D1 SIRP–α млекопитающих с доменом D1 куриного SIRP–α, содержащего последовательность
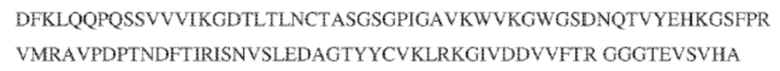
(SEQ ID NO:84) (Фиг. 2). По сравнению с последовательностями SIRP–α млекопитающих было обнаружено, что последовательность куриного SIRP–α характеризуется намного большим расхождением. Попарное сравнение процента идентичности последовательности между различными белками SIRP–α приведено в таблице B.
Таблица B. Попарное сравнение идентичности последовательности (%) между белками SIRP–α.
(SEQ ID NO:6)
(SEQ ID NO:7)
(SEQ ID NO:11)
(SEQ ID NO:84)
[0333] Не ограничиваясь теорией считается, что это расхождение может обеспечить уникальную возможность создавать антитела, которые являются перекрестно–реактивными среди множества белков SIRP–α млекопитающих. Например, может быть затруднительно создавать анти–SIRP–α антитела, являющиеся перекрестно–реактивными с мышиной последовательностью из мышиного организма–хозяина вследствие иммунной толерантности. Кроме того, большее расхождение между иммунными системами кур и млекопитающих может приводить к большему разнообразию при получении антител.
[0334] Чтобы идентифицировать антитела с новыми специфичностями связывания с белками SIRP–α, изучали характеристики клонов антител в формате scFv–Fc, как описано выше. Каждое антитело исследовали в концентрациях от 0,008 до 1,0 мкг/мл, используя анализ ELISA, в отношении связывания со следующими мишенями: доменом D1 человеческого SIRP–α v1 (последовательность в соответствии с SEQ ID NO:5), доменом D1 человеческого SIRP–α v2 (последовательность в соответствии с SEQ ID NO:6), доменом D1 вариантного SIRP–α яванского макака (последовательность в соответствии с SEQ ID NO:11), доменом D1 SIRP–α мышей 129 (последовательность в соответствии с SEQ ID NO:7) и человеческой изоформой SIRPγ (последовательность в соответствии с SEQ ID NO: 15). Далее по тексту клоны антител обозначены по ID–номеру клона. Кроме того, обозначение «S[номер клона]» относится к формату sc–Fv–Fc; обозначение «AB[номер клона]» относится к формату полноразмерного антитела IgG; обозначение «AB[номер клона]a» относится к человеческому IgG1 с мутациями L234A, L235A, G237A и N297A; «AB[номер клона]b» относится к формату мышиного IgG1 с N297A; «AB[номер клона]c» относится к формату мышиного IgG2a; и «[номер клона] Fab» относится к формату фрагмента Fab.
[0335] Кроме того, изучали характеристики связывания каждого клона антитела с пре–комплексом, приготовленным с применением 1:1 смеси из двух высокоаффинных вариантов SIRP–α (SEQ ID NO:42 и SEQ ID NO: 18), связанных с доменом IgSF CD47 (последовательность в соответствии с SEQ ID NO: 16). Преимущественно, так как аффинность между доменом D1 SIRP–α дикого типа и доменом IgSF CD47 является относительно низкой, использование комплекса, содержащего высокоаффинный вариант SIRP–α позволяет проводить идентификацию антител, которые связываются с SIRP–α, когда они комплексированы с CD47 (например, неблокирующее антитело). Также это позволяет проводить идентификацию антител, которые не способны связывать SIRP–α, когда они комплексированы с CD47, что позволяет предположить, что антитело и CD47 конкурируют за одну и ту же поверхность связывания на SIRP–α (например, блокирующее антитело). Два используемых варианта SIRPα (SEQ ID NO: 17 и SEQ ID NO: 19) соответствуют высокоаффинному домену D1 SIRP–α, сконструированному с использованием, соответственно, варианта 1 и варианта 2 человеческого полипептида SIRPα.
[0336] Фиг. 3A иллюстрирует кривую связывания ELISA для клона S130 (SEQ ID NO:71). Этот клон демонстрировал перекрестную реактивность среди белков SIRP–α млекопитающих со связыванием с рядом человеческих вариантов, а также белками яванских макаков и мышей (Фиг. 3B). Однако его связывание также было специфическим в отношении изоформы, так как с человеческим SIRPγ связывание не наблюдали. Этот клон также был идентифицирован как блокирующий взаимодействие между SIRP–α и CD47, так как не было выявлено связывания с преформированным комплексом, содержащим CD47, связанный с высокоаффинным вариантом SIRP–α.
[0337] Фиг. 4A иллюстрирует кривую связывания ELISA для клона S121 (SEQ ID NO:75). Этот клон также демонстрировал перекрестную реактивность среди белков SIRP–α млекопитающих, но также он связывался с человеческим SIRPγ, что указывает на связывание с разными изоформами (Фиг. 4B). Этот клон также был идентифицирован как блокирующий взаимодействие между SIRP–α и CD47.
[0338] Фиг. 5A иллюстрирует кривую связывания ELISA для клона S137 (SEQ ID NO:73). Как и клон, проиллюстрированный на Фиг. 3A и 3B, этот клон демонстрировал перекрестную реактивность среди белков SIRP–α млекопитающих со специфическим в отношении изоформы связыванием, так как он не связывался с человеческим SIRPγ (Фиг. 5B). Однако этот клон был идентифицирован как не блокирующий взаимодействие между SIRP–α и CD47, так как он связывался с преформированным комплексом.
[0339] Фиг. 6А иллюстрирует кривую связывания ELISA для клона S128 (SEQ ID NO:70). Этот клон демонстрировал специфическую в отношении изоформы перекрестную реактивность среди белков SIRP–α приматов, но не связывался с мышиным белком (Фиг. 6B). Этот клон также был идентифицирован как блокирующий взаимодействие между SIRP–α и CD47.
[0340] Фиг. 7A иллюстрирует кривую связывания ELISA для клона S135 (SEQ ID NO:72).
Аналогично клону, проиллюстрированному на Фиг. 6A и 6B, этот блокирующий клон демонстрировал перекрестную реактивность среди белков SIRP–α приматов, но не связывался с мышиным белком (Фиг. 7B). В отличие от клона S128, было обнаружено, что этот клон перекрестно реагирует с человеческим SIRPγ.
[0341] Фиг. 8А иллюстрирует кривую связывания ELISA для клона S126 (SEQ ID NO:69). Было обнаружено, что этот клон является специфическим в отношении белков человека, связываясь с обоими вариантами человеческого SIRP–α, но ни с одним из других пептидов (Фиг. 8B). Этот клон был идентифицирован как блокирующий взаимодействие между SIRP–α и CD47.
[0342] Фиг. 9A иллюстрирует кривую связывания ELISA для клона S138 (SEQ ID NO:74). Этот клон связывал только вариант 1 человеческого SIRP–α, демонстрируя высокую степень внутри– и межвидовой специфичности связывания (Фиг. 9B). Этот клон был идентифицирован как блокирующий взаимодействие между SIRP–α и CD47.
[0343] В заключение необходимо отметить, что были изучены характеристики новых антител с рядом уникальных вариантов специфичности связывания с белками SIRP–α. На Фиг. 10A приведено выравнивание, иллюстрирующее последовательности вариабельного домена scFv–Fc, полученные от курицы, которая вырабатывает куриные антитела (указаны CDR). Фиг. 10B приведено выравнивание, иллюстрирующее последовательности вариабельного домена scFv–Fc, полученные от курицы, которая вырабатывает человеческие антитела (указаны CDR). Эти исследования подчеркивают целесообразность использования кур в качестве источника разнообразия антител для идентификации анти–SIRP–α антител.
[0344] Чтобы оценить, могут ли антитела блокировать связывание SIRPα с CD47, также проводили исследование методом ППР в дополнение к исследованию методом ELISA. Захват антител проводили, используя антитела против IgG–Fc человека, иммобилизованные на поверхности GLC, приготовленные как описано выше. Вариант SIRPα (SEQ ID NO: 17), сконструированный для связывания CD47 (SEQ ID NO: 16) с высокой нМ–аффинностью, использовали для скрининга вместо SIRP–α дикого типа. Причиной этого стало то, что вариант SIRP–α дикого типа имеет низкую мкМ–аффинность с CD47, что не обеспечивает стабильное взаимодействие в комплексе, чтобы оценить образование сандвич–структуры. Использовали фосфатно–солевой буфер (ФСБ, pH 7,4), дополненный 0,01% Твин–20 (ФСБТ), в качестве подвижного буфера.
[0345] Сначала вводили приблизительно 5–10 мкл предварительно профильтрованной среды, содержащей антитела в 10 мМ натрий–ацетатном буфере (pH 4,5), в течение 2 мин при 30 мкл/мин и проводили захват, используя поверхность GLC с иммобилизованными антителами против IgG–Fc человека с последующим кратковременным промыванием потоком буфера в течение 1 мин при 100 мкл/мин. После этого 100 нМ высокоаффинного варианта SIRP–α (SEQ ID NO: 17), предварительно смешанного с CD47 (SEQ ID NO:16) в разных концентрациях, составляющих 0, 20, 55, 500 или 1500 нМ, вводили по отдельности в течение минуты при 100 мкл/мин со временем диссоциации 10 мин. В нижеприведенном описании SIRP–α относится к SEQ ID NO: 17.
[0346] В случае антитела, которое не блокирует связывание SIRP–α с CD47, можно ожидать, что оно будет связываться с комплексом SIRP–α /CD47 и образовывать сандвич–структуру. Следовательно, при повышении концентрации CD47 возрастает резонанс в соответствии с повышением образования сандвич–структур. Было обнаружено, что клон антитела S123 соответствует этому профилю. Пример профиля для S123 приведен на Фиг. 12A.
[0347] В случае антитела, которое блокирует связывание SIRP–α с CD47, профиль будет отличным от неблокирующего антитела. При повышении концентрации CD47 можно было бы ожидать, что меньше молекул SIRP–α будет доступно для связывания с антителом, так как антитело конкурирует за тот же участок связывания, что и CD47, а большинство/весь SIRP–α находится в комплексе CD47. Следовательно, можно ожидать снижение резонанса (РЕ) при повышении концентрации CD47 в смеси. Было обнаружено, что клон антитела S119 соответствует этому профилю. Пример профиля для S119 приведен на Фиг. 12B.
[0348] В дополнение к блокирующим и неблокирующим антителам, была выделена третья категория антител, имеющих «отталкивающий» профиль. Было обнаружено, что клон антитела S118 соответствует этому профилю. Пример профиля для S118 приведен на Фиг. 12C. При высокой концентрации CD47 (например, 500 нМ и 1500 нМ CD47) образовывалась временная сандвич–структура между антителом, SIRP–α и CD47, на что указывает более высокое резонансное значение 300 РЕ, которое снижалось со временем. Это снижение резонансных единиц указывает, что антитело было способно связываться с SIRP–α в комплексе и «отталкивать» SIRP–α от связывания с CD47.
[0349] Уровни kдисс. Для связывания каждого клона с каждым аналитом SIRP определяли, используя ППР (таблица C). Условия проведения ППР–скрининга описаны в данном документе, а значения kдисс. определяли, используя кинетическую аппроксимацию Ленгмюра. Свойства блокирования CD47 (блокирование, отсутствие блокирования, отталкивание) описаны в последней колонке таблицы С. Каждое антитело идентифицировано в соответствии с его соответствующей SEQ ID NO. Последовательности аналитов SIRP были следующими: CV1–3, SEQ ID NO: 18; v1, SEQ ID NO:5; v2, SEQ ID NO:6; cyno1, SEQ ID NO:11; cyno2, SEQ ID NO: 12; m129, SEQ ID NO:7; NOD, SEQ ID NO:8; BL6, SEQ ID NO:9; sirpb1, SEQ ID NO:13; sirpg, SEQ ID NO:15.
Таблица C. Кинетическая аппроксимация Ленгмюра (kдисс., 1/с)
E–03
03
02
03
03
E–03
03
03
E–01
03
03
02
03
04
04
0,3
04
02
E–03
03
05
04
E–04
04
04
04
04
E–02
04
03
E–03
05
04
03
03
04
04
E–02
04
04
03
04
E–02
03
04
04
04
04
03
04
02
E–03
02
04
04
E–03
05
05
04
04
02
E–03
02
05
04
E–04
06
05
05
05
05
E–04
05
05
05
04
05
E–04
05
05
05
05
06
E–04
06
05
05
05
05
05
E–04
04
04
04
04
04
04
E–04
04
04
04
04
04
04
E–04
04
04
04
04
04
04
E–03
03
0,3
03
03
03
02
E–03
03
02
03
E–03
04
05
04
04
04
E–03
03
0,3
0,3
03
04
E–04
03
03
02
ОС=отсутствие связывания
НС=очень низкое связывание (Κдисс. невозможно рассчитать в приближении Ленгмюра)
– = не исследовано
[0350] Эти данные указывают на то, что были идентифицированы клоны антител с различными вариантами специфичности связывания в отношении белков SIRP–α разных видов, а также внутривидовые варианты. Характеристики вариантов специфичности связывания для отобранных антител дополнительно изучали, используя вышеописанный анализ ELISA, путем построения кривых связывания в сравнении с доменами D1 SIRP–α v1 человека (SEQ ID NO:5), v2 человека (SEQ ID NO:6), мышей NOD (SEQ ID NO:8) и яванского макака (SEQ ID NO: 11), а также с SIRPγ человека (SEQ ID NO: 15), и преформированного комплекса 1:1 смеси двух высокоаффинных вариантов SIRP–α (SEQ ID NO: 17 и 19), связанных с доменом IgSF CD47 (SEQ ID NO: 16).
[0351] Исследованные последовательности клонов scFv–Fc приведены в таблице D.
Таблица D. Последовательности scFv–Fc.
CDR




























[0352] Не ограничиваясь теорией, считается, что антитела с перекрестно–реактивным связыванием среди белков человека, яванского макака и/или мышей могут позволить изучать характеристики антител как в животных моделях, так и в клинических исследованиях. Антитела со специфическим в отношении изоформы и/или варианта связыванием могут быть полезны для индивидуализированных медицинских подходов среди конкретных популяций людей и/или для исследований с представляющими интерес конкретными вариантами. Кроме получения профилей внутри– и межвидовой специфичности связывания, описанные в данном документе способы также позволяют идентифицировать антитела, которые блокируют или не блокируют связывание между SIRP–α и CD47, а также антитела, которые «отталкивают» SIRP–α от связывания с CD47.
Пример 2: Идентификация дополнительных антител с новыми вариантами специфичности связывания с белками SIRP–α
Способы
Определение KД
[0353] Взаимодействия анти–SIRPα антител с SIPRα различных видов (v1 человека, v2 человека, яванского макака, мышей 129, BL6, BALBc, NOD), SIRPβ и SIRPγ анализировали, используя два метода, прямой иммобилизации антител (посредством чипа GLC) или захвата посредством биотинилированного протеина A (посредством чипа NLC), в соответствии со следующими протоколами. Все эксперименты проводили при 25°C, используя биосенсор ProteOn XPR36 для ППР (BioRad, Inc, Hercules, CA), оснащенный сенсорными чипами GLC или NLC. Антитела экспрессировали, используя клетки FreeStyle™ 293–FS (Thermo Fisher), как описано в примере 1. Очистку проводили с помощью стандартной аффинной колоночной хроматографии с протеином А и хранили элюированные антитела в буфере ФСБ.
[0354] Подвижным буфером служил ФСБ, pH 7,4, с 0,01% Твин–20 (ФСБТ+). Все аналиты использовали в номинальных концентрациях, определенных по поглощению А280, используя рассчитанный для них молярный коэффициент экстинкции. Аналиты вводили в «однократном» кинетическом режиме, как описано в литературе (смотрите, например, Bravman, T. et al. (2006) Anal. Biochem. 358:281–288).
[0355] В случае метода с применением чипа GLC аналиты вводили и пропускали через анти–SIRPα антитела, иммобилизованные (~1000 РЕ) на чипах GLC с использованием набора для аминного сопряжения от Proteon. Для проведения этапа иммобилизации чип GLC активировали EDAC/сульфо–NHS 1:1 (Biorad), разведенным 1/100, в течение 300 с при 25 мкл/мин. Анти–SIRPα антитела разводили до концентрации 80 нМ в 10 мМ натрий–ацетатном буфере, pH 4,5, и иммобилизовали на чипе при 30 мкл/мин в течение 50 с. Чип инактивировали этаноламином в течение 300 с при 25 мкл/мин. Аналиты (например, SIRP–α от разных видов, SIRP–β, SIRP–γ) вводили в «однократном» кинетическом режиме в номинальных концентрациях 100, 33, 11, 3,7, 1,2 и 0 нМ. Время ассоциации отслеживали в течение 90 с при 100 мкл/мин, а время диссоциации отслеживали в течение 1200 с. Поверхности восстанавливали 2:1 об./об. смесью IgG–элюирующий буфер Pierce/4 М NaCl.
[0356] В альтернативном варианте определение KД проводили, применяя захват антител посредством чипа NLC. В этом случае 15 мкл/мин биотинилированного протеина А (Thermofisher) вводили при 30 мкл/мин в течение 120 с поверх чипа NLC, чтобы получить ответ иммобилизации ~1000–1200 РЕ. После этого вводили анти–SIRPα антитела (~160 нМ) в течение 80 с при 30 мкл/мин. После этого вводили аналиты (SIRP–α от разных видов, SIRP–β и SIPR–γ) в «однократном» кинетическом режиме в номинальных концентрациях 100, 33, 11, 3,7, 1,2 и 0 нМ. Время ассоциации отслеживали в течение 60 с при 25 мкл/мин, а время диссоциации отслеживали в течение 120 с. Поверхности восстанавливали 2:1 об./об. смесью IgG–элюирующий буфер Pierce/4 М NaCl.
[0357] Данные биосенсора дважды корректировали путем вычитания данных в промежутках между точками (не содержащих иммобилизованный белок) из данных для реакционных точек (иммобилизованный белок), а затем вычитания ответа при вводе контрольного буферного аналита из ответа при вводе аналита. Дважды скорректированные данные аппроксимировали в целом простой моделью Ленгмюра, а значение KД рассчитывали из соотношения кажущихся кинетических констант скоростей (KД=kд/kа).
Результаты
[0358] Дополнительно изучали характеристики трех репрезентативных антител (блокирующего, неблокирующего и «отталкивающего» антитела) в отношении связывания с различными белками SIRP–α, –β, –γ, как описано выше. Эти три антитела содержат человеческие последовательности и были получены в экспериментах с иммунизацией кур HuMab. Эти антитела исследовали как антитела в виде полноразмерного человеческого иммуноглобулина IgG1 с мутациями L234A, L235A, G237A и N297A. Исследуемые в этих экспериментах белки соответствовали человеческому SIRP–α v1 (SEQ ID NO:5), человеческому SIRP–α v2 (SEQ ID NO:6), SIRP–α яванского макака (SEQ ID NO: 11), изоформе 1 человеческого SIRPβ (SEQ ID NO:13), изоформе 2 человеческого SIRPβ (SEQ ID NO: 14) и изоформе 1 человеческого SIRPγ (SEQ ID NO: 15). Изоформа 1 человеческого SIRPβ (SEQ ID NO:13) также известна в данной области техники как изоформа 1 SIRΡβ1.
[0359] Значения KД, полученные для трех антител, приведены в таблице E ниже.
Таблица E. Обобщенные данные по значениям KД (М)
[0360] Далее определяли кинетику связывания различных клонов антител с отобранными мышиными белками SIRP–α, как описано выше. Исследуемые мышиные белки включали белки SIRP–α BALBc (SEQ ID NO: 10), BL6 (SEQ ID NO:9), NOD (SEQ ID NO:8) и m129 (SEQ ID NO:7). Результаты обобщены в таблицах F–I ниже. Клоны антител, помеченные «с», исследовали как антитела в виде полноразмерного мышиного IgG2a; клоны антител, помеченные «а», исследовали как антитела в виде полноразмерного человеческого IgG1 с мутациями L234A, L235A, G237A и N297A.
Таблица F. Обобщенные данные по кинетике связывания отобранных антител с белком SIRP–α мышей BALBc (SEQ ID NO: 10)
Таблица G. Обобщенные данные по кинетике связывания отобранных антител с белком SIRP–α мышей BL6 (SEQ ID NO:9)
Таблица H. Обобщенные данные по кинетике связывания отобранных антител с белком SIRP–α мышей NOD (SEQ ID NO: 8)
Таблица I. Обобщенные данные по кинетике связывания отобранных антител с белком SIRP–α мышей m129 (SEQ ID NO: 7)
[0361] В случае вышеуказанных антител последовательности доменов VH и VL (соответственно) были следующими: AB136a: SEQ ID NO: 133 и 134; AB3c: SEQ ID NO: 242 и 243; AB21c: SEQ ID NO: 135 и 136; AB25c: SEQ ID NO: 137 и 138; AB27c: SEQ ID NO: 139 и 140: AB66c: SEQ ID NO: 141 и 142.
[0362] Эти результаты демонстрируют, что некоторое количество клонов антител связывались со всеми четырьмя мышиными белками SIRP–α, что делает эти антитела подходящими для изучения характеристик в in vivo мышиных моделях.
Пример 3: Функциональные свойства анти–SIRP–α антител
[0363] В предыдущих примерах описана идентификация и изучение характеристик анти–SIRP–α с разнообразным набором свойств, таких как специфичность связывания в отношении различных белков SIRP–α человека, яванского макака и/или мышей, SIRP–β и SIRP–γ и то, блокируют ли антитела связывание между SIRP–α и CD47 или нет. Антитела, представляющие конкретные категории, представляющие интерес, далее исследовали в разных in vitro и in vivo функциональных анализах, целью которых было получение характеристик их влияния на биологические функции SIRP–α. В частности, изучали характеристики «блокирующих» антител (т. е. антител, которые блокируют связывание между SIRP–α и CD47) и «неблокирующих» антител (т. е. антител, которые не блокируют связывание между SIRP–α и CD47) в отношении активности в различных in vitro и in vivo анализах.
[0364] Как указано выше, клоны антител, помеченные «а», исследовали как антитела в виде полноразмерного человеческого иммуноглобулина IgG1 с мутациями L234A, L235A, G237A и N297A. Клоны антител, помеченные «b», исследовали как антитела в виде полноразмерного мышиного IgG1 с мутацией N297A. Клоны антител, помеченные «с», исследовали как антитела в виде полноразмерного мышиного IgG2a.
Способы
Культивирование опухолевой линии клеток
[0365] Клетки DLD–1 (колоректальной аденокарциномы человека) и OE19 (карциномы пищевода человека) поддерживали в среде для роста, содержащей RPMI (Gibco), дополненной 10–процентной термоинактивированной фетальной бычьей сывороткой (Gibco), однопроцентным пенициллином/стрептомицином (Gibco) и однопроцентным глутамаксом (Gibco).
Получение и культивирование человеческих моноцитарных макрофагов
[0366] Остатки Trima получали из центров крови стран Тихоокеанского региона и разводили 1:4 фосфатно–солевым буфером (ФСБ, Gibco). Разведенную кровь распределяли по четырем пробиркам с подслоем из 20 мл Ficoll–Paque Plus (GE Healthcare). Пробирки центрифугировали в течение 30 минут при 400 x g. МКПК собирали с поверхности и ресуспендировали в буфере FACS (ФСБ с 0,5–процентным бычьим сывороточным альбумином (Gibco)). Моноциты CD14+ очищали путем негативной селекции, используя набор для выделения моноцитов Monocyte Isolation Kit II (Miltenyi Biotec) и колонки LS (Miltenyi Biotec) в соответствии с протоколом производителя.
[0367] В случае неполяризованных макрофагов моноциты CD14+ высевали в 15 см планшеты для тканевого культивирования (Coming) при плотности 10 миллионов клеток на планшет в 25 мл IMDM (Gibco), дополненной 10–процентной человеческой сывороткой AB (Corning), однопроцентным пенициллином/стрептомицином (Gibco) и однопроцентным глутамаксом (Gibco). Клетки культивировали в течение семи–десяти суток.
[0368] В случае поляризованных макрофагов M2 моноциты CD14+ высевали в 15 см планшеты для тканевого культивирования (Coming) при плотности 6 миллионов клеток на планшет в 25 мл RPMI (Gibco), дополненной 10–процентной фетальной бычьей сывороткой (Thermo Fisher), однопроцентным пенициллином/стрептомицином (Gibco) и однопроцентным глутамаксом (Gibco), и 50 нг/мл M–CSF (Miltenyi). Клетки культивировали в течение семи–десяти суток.
In vitro анализ фагоцитоза
[0369] Клетки DLD–1 и OE19 отсоединяли от культуральных планшетов, дважды промывая 20 мл ФСБ и инкубируя в 10 мл TrypLE Select (Gihco) в течение 10 минут при 37°C. Клетки центрифугировали, промывали в ФСБ и ресуспендировали в среде. Клетки метили с помощью набора для оценки клеточной пролиферации Celltrace CFSE (Thermo Fisher) в соответствии с инструкциями производителя и ресуспендировали в IMDM. Макрофаги отсоединяли от культуральных планшетов, дважды промывая 20 мл ФСБ и инкубируя в 10 мл TrypLE Select в течение 20 минут при 37°C. Клетки удаляли с помощью скребка для клеток (Corning), промывали в ФСБ и ресуспендировали в IMDM.
[0370] Анализ фагоцитоза проводили в 96–луночных планшетах с U–образным дном и ультранизкой степенью присоединения (Corning), содержащих 100000 клеток DLD–1 или OE19, 50000 макрофагов, пятикратные серийные разведения анти–SIRP–α антител от 100 нМ до 6,4 пМ и цетуксимаб (абсолютное антитело) при 1 или 0,01 мкг/мл, трастузумаб при 0,01 мкг/мл или контрольное антитело того же изотипа (Southern Biotech). Все исследуемые анти–SIRP–α антитела содержали человеческий IgG1 с мутациями L234A, L235 A, G237A и N297A, за исключением AB136c, которое имело мышиный IgG2a. Планшеты инкубировали два часа при 37°C в увлажненном инкубаторе с 5 процентами диоксида углерода. Клетки осаждали путем центрифугирования в течение пяти минут при 400 x g и промывали в 250 мкл буфера FACS. Макрофаги окрашивали на льду в течение 15 минут в 50 мкл буфера FACS, содержащего 10 мкл блокирующего реагента для человеческого FcR (Miltenyi Biotec), 0,5 мкл анти–CD33 BV421 (Biolegend) и 0,5 мкл анти–CD206 APC–Cy7 (Biolegend). Клетки промывали в 200 мкл буфера FACS, промывали в 250 мкл ФСБ и окрашивали на льду в течение 30 минут в 50 мкл фиксируемого красителя для оценки жизнеспособности eFluor 506 (ebioscience), разведенном 1:1000 в ФСБ. Клетки дважды промывали в 250 мкл буфера FACS и фиксировали в течение 30 минут на льду в 75 мкл Cytofix (BD Biosciences). Клетки промывали в 175 мкл буфера FACS и ресуспендировали в 75 мкл буфера FACS. Клетки анализировали на FACS Canto II (BD Biosciences) с последующим анализом данных с помощью Flowjo 10.7 (Treestar). Мертвые клетки исключали путем гейтинга на e506–отрицательной популяции. Макрофагов, осуществивших фагоцитоз опухолевых клеток, идентифицировали как клетки, положительные в отношении CD33, CD206 и CFSE.
In vivo активация дендритных клеток
[0371] Мышей Balb/c (n=3/группа) внутривенно инъецировали контрольным крысиным антимышиным анти–SIRP–α антагонистическим антителом (клон p84), крысиным контрольным IgG, AB136b (AB136 с Fc–областью мышиного IgG1 с мутацией N297A), мышиным контрольным IgG или базовым раствором (ФСБ) при 10 мг/кг. Через пять часов после инъекции вырезали селезенки и обрабатывали до одноклеточной суспензии путем механической диссоциации через 70 мкМ фильтр. Клетки дважды промывали ФСБ и проводили лизис красных кровяных клеток. После этого клетки дополнительно промывали два раза ФСБ/10% ФБС и готовили к окрашиванию клеток. Клетки окрашивали конъюгированными с флуорохромом ГКГС–II, CD8, 33D1, CD4, CD11c, CD86, CCR7 и красителем для оценки жизнеспособности при 4 градусах в течение одного часа. Клетки промывали два раза и анализировали, используя проточный цитометр BD Canto II, а данные обрабатывали с помощью Flowjo.
In vivo противоопухолевая активность
[0372] В случае сингенной модели карциномы CT26 толстой кишки мышей клетки CT26 подкожно имплантировали мышам BALB/c и рандомизировали животных по группам (8–9 мышей/группа). Группы обработки включали применение базового раствора (ФСБ) и AB136b. AB136 анти–SIRP–α содержало Fc–область мышиного IgG1 с мутацией N297A. Обработку начинали, когда опухоли достигали в среднем 75–80 мм3, на 7 или 8 сутки после имплантации. Мышей внутрибрюшинно (В/Б) дозировали AB136b при 3 мг/кг дважды в неделю в течение трех недель. Животных умерщвляли, когда опухоли достигали объема ~2000 мм3.
[0373] В случае сингенной модели карциномы MC38 толстой кишки мышей клетки MC38 подкожно имплантировали мышам C57BL/6 и рандомизировали животных по группам (8–10 мышей/группа). Группы обработки включали применение базового раствора (ФСБ), AB25b, AB25c, AB27b, AB3b и AB136b. Все анти–SIRPα антитела содержали Fc–область мышиного IgG1 с мутацией N297A, за исключением AB25c, которое имело мышиный IgG2a. Обработку начинали, когда опухоли достигали в среднем 60–65 мм3, на 7 сутки после имплантации. Мышей внутрибрюшинно (В/Б) дозировали анти–SIRPα при 10 мг/кг дважды в неделю. Животных умерщвляли, когда опухоли достигали объема ~2000 мм3.
Результаты
[0374] Исследовали различные анти–SIRP–α антитела в отношении индукции фагоцитоза в in vitro анализе фагоцитоза, используя поляризованные и неполяризованные макрофаги.
[0375] Дополнительные анти–SIRP–α антитела AB3 и AB45 исследовали в экспериментах, описанных ниже. Они оба являются неблокирующими антителами. Уровни kдисс. для связывания каждого клона (в формате scFv–Fc) с каждым аналитом SIRP определяли, используя ППР (таблица J1). Условия проведения ППР–скрининга описаны в данном документе, а значения Kдисс. определяли, используя кинетическую аппроксимацию Ленгмюра. Последовательности аналитов SIRP были следующими: CV1–3, SEQ ID NO:18; v1, SEQ ID NO:5; v2, SEQ ID NO:6; cyno1, SEQ ID NO: 11; cyno2, SEQ ID NO:12; m129, SEQ ID NO:7; NOD, SEQ ID NO:8; BL6, SEQ ID NO:9; sirpb1, SEQ ID NO:13; sirpg, SEQ ID NO: 15.
Таблица J1. KД (M) по кинетической аппроксимации Ленгмюра для AB3 и AB45
ОС – отсутствие связывания
*Смотрите SEQ ID NO:242 и 243 в отношении доменов VH и VL соответственно.
**Смотрите SEQ ID NO:244 и 245 в отношении доменов VH и VL соответственно.
[0376] Как показано на Фиг. 13A и 13B, было обнаружено, что неблокирующее анти–SIRP–α антитело AB3a индуцирует фагоцитоз опухолевых клеток DLD–1 поляризованными макрофагами M2. В частности, обработка макрофагов цетуксимабом (анти–EGFR антителом) и AB3a приводила к сильной индукции фагоцитоза опухолевых клеток. Аналогично, было обнаружено, что неблокирующее анти–SIRP–α антитело AB45a индуцирует фагоцитоз опухолевых клеток DLD–1 поляризованными макрофагами M2, а обработка макрофагов цетуксимабом (анти–EGFR антителом) и AB45a приводила к сильной индукции фагоцитоза опухолевых клеток (Фиг. 13C и 13D). Также было обнаружено, что блокирующие анти–SIRP–α антитела AB119a (Фиг. 13E) и AB135a (Фиг. 13F) индуцируют фагоцитоз опухолевых клеток OE19 при совместном введении с трастузумабом (анти–HER2 антителом). Также было обнаружено, что неблокирующее анти–SIRP–α антитело AB136c индуцирует фагоцитоз опухолевых клеток DLD–1 (Фиг. 13G).
[0377] Анализ активации дендритных клеток использовали для получения характеристик in vivo действия неблокирующего анти–SIRP–α антитела AB136b (SEQ ID NO: 133 м 134 для последовательностей доменов VH и VL соответственно). Неспособность задействовать рецептор мышиного SIRP–α на дендритных клетках селезенки посредством связывания CD47 приводила к активации дендритных клеток селезенки. Контрольное анти–SIRP–α антагонистическое антитело p84 активировало дендритные клетки селезенки при внутривенной инъекции мышам (Фиг. 14). Неблокирующее анти–SIRP–α антитело AB136b исследовали in vivo, чтобы определить, приводит ли оно к активации дендритных клеток. Интересно, что обработка AB136b приводила к активации дендритных клеток селезенки на одном уровне с p84 (Фиг. 14).
[0378] Далее проводили in vivo анализ противоопухолевого действия различных анти–SIRP–α антител в двух сингенных моделях рака толстой кишки мышей. Противоопухолевую активность блокирующих анти–SIRP–α антител AB25b, AB25c и AB27b и неблокирующих анти–SIRP–α антител AB3b и AB136b исследовали в сингенной модели карциномы MC38 толстой кишки мышей, чтобы оценить их активность как отдельных агентов. Как блокирующие (AB25b, AB25c и AB27b), так и неблокирующие (AB3b и AB136b) анти–SIRP–α антитела замедляли формирование опухолей при 10 мг/кг по сравнению с одним базовым раствором (Фиг. 15) в сингенной мышиной модели MC38. На 25 сутки группы, обрабатываемые анти–SIRP–α антителами, содержали трех мышей с объемом опухолей менее 600 мм3 в случае AB25b и AB27b, четырех мышей с объемом опухолей менее 600 мм3 в случае AB25c и AB3b и пять мышей с объемом опухолей менее 600 мм3 в случае AB136b, тогда как обрабатываемая базовым раствором группа содержала только двух мышей с объемом опухолей менее 600 мм3.
[0379] Далее оценивали противоопухолевую активность неблокирующего AB136b в сингенной модели карциномы CT26 толстой кишки мышей, чтобы оценить его активность как отдельного агента. Эти результаты подтвердили, что обработка AB136b замедляла формирование опухолей при 3 мг/кг по сравнению с одним базовым раствором в сингенной мышиной модели CT26 (Фиг. 16).
[0380] Вместе эти результаты демонстрируют эффективность обработки анти–SIRP–α антителами в отношении индукции фагоцитоза опухолевых клеток макрофагами, активации дендритных клеток и ингибирования роста опухоли in vivo. Было обнаружено, что некоторое количество блокирующих анти–SIRP–α антител стимулируют фагоцитоз опухолевых клеток, активацию дендритных клеток и блокируют in vivo рост опухоли. При этом удивительно, что было обнаружено, что обработка неблокирующим анти–SIRP–α антителом также активирует дендритные клетки селезенки и ингибирует рост опухоли in vivo в двух разных сингенных мышиных моделях опухолей. Открытие, что неблокирующие анти–SIRP–α антитела были способны повышать фагоцитоз и блокировать in vivo рост опухоли, было удивительным и неожиданным. Предыдущая работа позволяла предположить, что только блокирующие анти–SIRP–α антитела будут способны ингибировать in vivo рост опухоли (смотрите Yanagita, T. et al (2017) JCI Insight 2:e89140).
Пример 4: Структурный анализ эпитопов анти–SIRP–α антител на SIRP–α
[0381] Как описано выше в примерах 1–3, были созданы анти–SIRP–α антитела с различными вариантами специфичности и моделями связывания с SIRP–α, например, антитела, которые блокируют связывание CD47 с SIRP–α, антитела, которые не блокируют связывание CD47 с SIRP–α, и антитела, которые связываются с SIRP–α и снижают его аффинность в отношении связывания CD47 («отталкивающие» антитела). Структурный анализ проводили, чтобы понять, как эти типы антител связываются с доменом D1 SIRP–α по сравнению с CD47 и получить характеристики эпитопов отобранных анти–SIRP–α антител.
Способы
Кристаллографический и структурный анализ
[0382] Экспрессию Fab и SIRPα осуществляли аналогично с ранее установленными протоколами, которые включали традиционные методы аффинной хроматографии и эксклюзионной хроматографии для очистки белка. Мутантный человеческий SIRP–α v1, несущий мутацию N80A по сравнению с SEQ ID NO:5, использовали для облегчения получения белка в Expi293 (SEQ ID NO:296). Целью применения N80A SIRPα было получение гомогенной, негликозилированной формы SIRPα, которая больше всего подошла бы для кристаллизации. Конечный буфер для очистки был минимальным и содержал только 10 мМ Трис, pH 7,5, и 50 мМ NaCl. Образец с очищенным комплексом является стабильным при 4°C, и его концентрировали до 10–12 мг/мл в препарате для экспериментов по кристаллизации и определению возможной структуры.
[0383] В применяемых в отношении комплекса Fab: SIRPα способах придерживались хорошо отработанных принципов кристаллографии, начиная с метода разреженных матриц, который приводил к созданию специальных оптимизированных условий, согласно обычному протоколу. Кристаллизацию проводили, используя метод диффузии паров в сидячей капле. Для первичного скрининга разреженной матрицы использовали наборы растворов, коммерчески доступные от Qiagen® (таблица J2). Эксперименты по кристаллизации осуществляли в каплях с разными соотношениями белка и кристаллизационного раствора. Установленные соотношения находились в диапазоне 1:1, 2:1 и 3:1 белок:раствор в общем объеме 1 мкл в подлунках 96–луночного (8 х 12) планшета. 100 мкл кристаллизационного раствора помещали в луночный резервуар. Капли создавали с помощью робота для создания капель Mosquito, а заполненные планшеты закрывали и хранили в инкубаторе при 12°C. Эксперимент отслеживали, наблюдая планшеты/капли под микроскопом, чтобы видеть изменения, которые включали осаждение капель, агрегацию, разделение фаз, образование аморфной структуры, а также первичные белковые кристаллы.
Таблица J2. Наборы, используемые для первичного скрининга разреженной матрицы.
Итоги кристаллизации и сбор кристаллов
[0384] Кристаллизацию 4 комплексов осуществляли с помощью производных двух основных растворов, как показано в таблице J3). Сбор кристаллов проводили для оптимальных кристаллических форм так, чтобы замораживание погружением в жидкий азот не оказывало негативного влияния на целостность кристалла перед исследованием методом рентгеновской дифракции и возможным получением данных. Для предотвращения обледенения во время замораживания использовали криопротектор. Типичный криопротектор включал добавление 20% глицерина в кристаллизационный раствор, который формировал кристалл. Если кристаллы формировались в растворах с 30% ПЭГ 4000 или выше, добавление глицерина было необязательным. Высокое процентное содержание ПЭГ 4000 проявляло себя как действенный криопротектор. Манипуляции с кристаллами комплексов проводили с помощью криопетель, выполненных из нейлона или Mitigen®. Отдельные кристаллы выделяли и извлекали из капли, в которой они формировались, и переносили в криопротектор на короткое время перед погружением в жидкий азот для быстрого замораживания.
Таблица J3. Условия кристаллизации для образования кристаллов комплекса Fab:SIRP–α.
Получение и обработка данных
[0385] Данные получали для кристаллов, которые были быстро заморожены в жидком азоте, как описано выше. Эти образцы оставались в криопотоке во время скрининга в отношении диффузии в белковой решетке перед последующим сбором данных методом колебаний. Сбор происходил с применением усовершенствованного источника фотонов или алмазного источника света. Сжатие наборов данных проводили, используя пакет xia2. xia2 представляет собой скрипт оболочки, который позволяет осуществлять автоматическое сжатие макромолекулярных кристаллографических данных. Эта программа может использовать некоторое количество программ для сжатия данных, таких как XDS, DIALS, Mosfim и Aimless. Эти программы позволяют проводить для дифракционных данных индексирование по соответствующим пространственным группам и элементарным ячейкам, интеграцию интенсивностей и масштабирование для получения оценки интенсивности каждого уникального отражения. В случае первичного набора данных для комплекса 1 фазы рассчитывали, используя молекулярное замещение (МЗ) с помощью Phaser MR из пакета CCP4 с применением гомологичных моделей SIRPα, а также Fab (смотрите PDB CODE: 2UV3 и PDB CODE: 4NM4 соответственно). В случае последующих наборов данных для комплексов 2, 3 и 4 использовали координаты полной структурной модели комплекса 1 в качестве поисковой модели для расчета фазы и построения первичной модели.
Построение и уточнение структуры
[0386] При построении модели использовали программу Coot. Как пример, было рассчитано, что комплекс 1 содержит 4 молекулы в ASU, следовательно, для завершения модели нужно было построить 4 пары ΑΒ119f в комплексе с SIRPα. Стратегия построения структуры состояла во встраивании аминокислотных остатков в электронную плотность согласно известной последовательности целевых белков. Качество данных напрямую коррелирует с соответствием структурной модели наблюдаемому набору кристаллических данных. Следовательно, при построении третичной структуры комплекса придерживались установленного протокола. Сначала строили пептидный остов остатка. После этого следовало размещение боковой цепи остатка в случае, если это позволяла карта электронной плотности. В случае, если оригинальная аминокислота в белковой последовательности не была смоделирована, это происходило вследствие недостатка плотности для соответствующей боковой цепи, таким образом, можно смоделировать только пептидный остов аминокислоты и встроить в этом месте боковую цепь остатка аланина. Участки последовательности могут представлять собой разупорядоченные области и не могут быть построены вследствие недостатка плотности даже для размещения аминокислотного остова. За построением следовали этапы уточнения с помощью программы Refmac, части пакета CCP4. Программу уточнения используют для минимизации координатных параметров посредством максимально вероятного остатка. Уточнение считалось завершенным, когда параметры модели соответствовали благоприятному статистическому допуску: R–фактор, длина и углы связей и соответствие Рамачандрана. Кроме того, чтобы проверить физическое соответствие модели также использовали Molprobity, чтобы гарантировать полное и правильное определение структуры.
Картирование эпитопов и анализ совмещения
[0387] Площадь погруженной поверхности антигена для эпитопа рассчитывали как разницу между доступной для растворителя площадью поверхности одного антигена и антигена в комплексе с Fab–фрагментом антитела. И наоборот, площадь погруженной поверхности тяжелых и легких цепей антитела для паратопа рассчитывали как разницу между доступной для растворителя площадью поверхности одного Fab–фрагмента и в комплексе с антигеном. Доступную площадь поверхности рассчитывали методом падающего шарика с применением зонда радиусом 1,4Å.
Площадь погруженной поверхности представлена в Å2. Проводили совмещение всех комплексов антитело: SIRPα, выбирая SIRPα из каждой структуры и совмещая его атомы углерода, структура комплекса CD47:
SIRPα (вариант V1), используемая для анализа, представляет собой PDB:4CMM. Совмещение и расчет RMSD проводили, используя PYMOL.
Результаты
[0388] Сначала определяли структуру блокирующего антитела 119 Fab, связанного с SIRP–α, и сравнивали со связыванием CD47 с SIRP–α. Как показано на Фиг. 17A, антитело 119 и CD47 связывались с одним и тем же эпитопом домена D1 SIRP–α. 56% остатков SIRP–α остатков в эпитопе антитела 119 также были обнаружены в эпитопе CD47, тогда как 75% остатков SIRP–α в эпитопе CD47 также были обнаружены в эпитопе антитела 119. Остатки SIRP–α, принимающие участие во взаимодействии с антителом 119 (согласно определению по изменению площади погруженной поверхности, как описано выше), затенены и показаны в виде заполненных моделей на Фиг. 17B. Также показаны ключевые остатки из паратопа Fab антитела 119 (черные ветки), включая остатки тяжелой цепи N31, S53, D55, Y57, T99, S101 и W102 (N31 не виден при ориентации структуры, приведенной на Фиг. 17B) и остатки легкой цепи Y92 и W94 (на основании последовательностей вариабельных доменов тяжелой и легкой цепей согласно SEQ ID NO:335 и 97, соответственно).
[0389] Фиг. 18A иллюстрирует сравнение между связыванием CD47 с доменом D1 SIRP–α и связыванием Fab неблокирующего антитела 136 с доменом D1 SIRP–α. Было обнаружено, что эпитопы связывания SIRP–α для антитела 136 и CD47 являются полностью неперекрывающимися. Остатки SIRP–α, принимающие участие во взаимодействии с антителом 136, затенены и показаны в виде заполненных моделей на Фиг. 18B. Также показаны ключевые остатки из паратопа Fab антитела 136 (черные ветки), включая остатки тяжелой цепи E56, Y59 и R102 и остатки легкой цепи Y92 и R94 (на основании последовательностей вариабельных доменов тяжелой и легкой цепей согласно SEQ ID NO:133 и 134, соответственно).
[0390] Фиг. 19A иллюстрирует сравнение между связыванием CD47 с доменом D1 SIRP–α и связыванием Fab неблокирующего антитела 3 с доменом D1 SIRP–α. Было обнаружено, что эпитопы связывания SIRP–α для антитела 3 и CD47 также являются полностью неперекрывающимися. Остатки SIRP–α, принимающие участие во взаимодействии с антителом 3, затенены и показаны в виде заполненных моделей на Фиг. 19B. Также показаны ключевые остатки из паратопа Fab антитела 3 (черные ветки), включая остатки тяжелой цепи R56 и G100 и остатки легкой цепи R24, R26, Y86 и G88 (на основании последовательностей вариабельных доменов тяжелой и легкой цепей согласно SEQ ID NO:242 и 243, соответственно).
[0391] Фиг. 19C иллюстрирует сравнение между связыванием CD47 с доменом D1 SIRP–α и связыванием Fab «отталкивающего» антитела 115 с доменом D1 SIRP–α. Было обнаружено, что эпитоп связывания SIRP–α для антитела 115 прилегает к эпитопу CD47. Хотя было обнаружено, что mAb 115 связывает эпитоп домена D1 SIRP–α, смежный с эпитопом CD47, части эпитопа 115 вероятно перекрываются самим CD47. При сравнении обоих эпитопов было выявлено 2 идентичных остатка, что позволяет предположить, что взаимодействия неперекрывающихся частей каждого эпитопа позволяют Fab 115 и CD47 одновременно связывать SIRP–α. Описанный в данном документе кинетический анализ демонстрирует, что антитело 115 образует временный комплекс с CD47 и SIRP–α, но снижает аффинность CD47 в отношении домена D1 SIRP–α. Остатки SIRP–α, принимающие участие во взаимодействии с антителом 115, затенены на Фиг. 19D. Также показаны ключевые остатки из паратопа Fab антитела 115, включая остатки тяжелой цепи S31, Y32, N52, Y100 и W102 и остатки легкой цепи K32 и Y92 (на основании последовательностей вариабельных доменов тяжелой и легкой цепей согласно SEQ ID NO:273 и 274, соответственно).
[0392] Фиг. 20A иллюстрирует связывание антител 119, 136, 3 и 115 с SIRP–α в сравнении со связыванием CD47 с SIRP–α. Было обнаружено, что блокирующее антитело 119 связывает полностью неперекрывающийся эпитоп SIRP–α по сравнению с эпитопами SIRP–α обоих неблокирующих антител 136 и 3. Остатки SIRP–α и антитела, которые принимают участие в этих взаимодействиях, обобщены в таблице K1. Остатки SIRP–α, которые были определены как взаимодействующие с CD47, были следующими: 29, 30, 31, 33, 34, 35, 36, 37, 50, 51, 52, 53, 54, 66, 67, 68, 69, 74, 93, 96, 97, 98, 99 и 101 (в соответствии с SEQ ID NO:5). На Фиг. 20B обобщены данные по эпитопам для связывания CD47 и Fab анти–SIRP–α 119, 136, 3 и 115 с SIRP–α (остатки в соответствии с SEQ ID NO:296) и перечислены изменения в площади погруженной поверхности. Как описано в данном документе, нумерация аминокислотных остатков антитела, используемых для указания паратопа, основана на нумерации в соответствии с аминокислотной последовательностью тяжелой или легкой цепи, а не на, например, нумерации остатков антитела по Kabat или Chothia.
Таблица K1. Эпитопы SIRP–α и паратопы антител для отобранных анти–SIRP–α антител.
(SEQ ID NO: 296)
(SEQ ID NO:242)
(SEQ ID NO:273)
Таблица K2. Паратопы анти–SIRP–α антител и расчет площади погруженной поверхности
[0393] Эти результаты позволили определить поверхности связывания между доменом D1 SIRP–α и различными анти–SIRP–α антителами, а также поверхность связывания между CD47 и SIRP–α. Также они обеспечивают структурное обоснование тому факту, что антитело 119 блокирует связывание между CD47 и SIRP–α (так как они используют перекрывающиеся эпитопы SIRP–α), что антитела 136 и 3 не блокируют связывание (так как их эпитопы не перекрываются с эпитопом CD47) и что антитело 115 «отталкивает» CD47 от связывания SIRP–α (так как они используют только слегка перекрывающиеся эпитопы SIRP–α). Эти исследования позволили дополнительно выделить конкретные остатки антитела и SIRP–α, которые участвуют в каждом взаимодействии.
[0394] Зная эпитопы связывания SIRPα для неблокирующих (3, 136), блокирующих (119) и отталкивающих (115) антител, определенные методом кристаллографии, можно определить участки связывания для дополнительных анти–SIRPα антител, проводя эпитоп–специфическую сортировку, описанную в примере 5. Например, в случае анти–SIRPα антител, которые конкурируют с неблокирующим антителом 136 за связывание с SIRPα, можно спрогнозировать, что эти антитела будут использовать аналогичные эпитопы связывания, что и 136, по определению методом кристаллографии.
Пример 5: Эпитоп–специфическая сортировка анти–SIRP–α антител
[0395] Далее описанные выше анти–SIRP–α антитела анализировали в экспериментах по эпитоп–специфической сортировке с SIRP–α, чтобы категоризировать антитела, имеющие общие и отличные эпитопы.
Способы
Эпитоп–специфическая сортировка
[0396] Вкратце, эпитоп–специфическую сортировку проводили, как показано на Фиг. 21A. Первое анти–SIRP–α антитело иммобилизовали на чипе, затем вводили человеческий SIRP–α v1 (SEQ ID NO:5). Затем вводили второе анти–SIRP–α антитело. Если второе антитело было способно связывать комплекс, образуемый между первым анти–SIRP–α антителом и SIRP–α, первое и второе антитела определяли как связывающие разные эпитопы. Если второе антитело не было способно связываться, первое и второе антитела определяли как использующие один эпитоп.
[0397] Типовые результаты анализа сортировки с применением анти–SIRP–α антитела (A), иммобилизованного на чипе, и вводом анти–SIRP–α антител (B–F) приведены на Фиг. 21B. Анти–SIRPα антитела (B), (E) и (F) образуют сандвич–структуры с комплексом, на что указывает повышение РЕ в момент времени 60 с (после ввода соответствующих анти–SIRPα антител). Следовательно, они определены как связывающие эпитопы, отличные от анти–SIRPα (А) и указаны белыми прямоугольниками на графике сортировки (Фиг. 22A и 22B). В случае анти–SIRPα антител (C) и (D) они не образуют сандвич–структуры, на что указывает стабильное значение РЕ после ввода соответствующих анти–SIRPα антител. Следовательно, они определены как связывающие тот же эпитоп, что и анти–SIRPα (А) и затенены серым на графике сортировки (Фиг. 22A и 22B). Номер клона для лиганда (анти–SIRPα), связанного с чипом, указан в строке, а номер клона для аналитов (анти–SIRPα), проводимых через чип, указан в колонке на Фиг. 22A и 22B. «Х» указаны случаи, когда данные для одной ориентации не согласуются с данными для другой.
[0398] Сначала анти–SIRPα антитела иммобилизовали на чипах GLC, используя набор для аминного сопряжения от Proteon, как описано в данном документе. Вкратце, для проведения этапа иммобилизации чип GLC активировали EDAC/сульфо–NHS 1:1 (Biorad), разведенном 1/80, в течение 300 с при 25 мкл/мин. Анти–SIRPα антитела разводили до концентрации 80 нМ в 10 мМ натрий–ацетатном буфере, pH 4,5, и иммобилизовали на чипе при 30 мкл/мин в течение 50 с. Чип инактивировали этаноламином в течение 300 с при 25 мкл/мин. После этого сначала вводили SIRP–α v1 (SEQ ID NO:5) (100 нМ) при 100 мкл/мин в течение 60 с, а после вводили исследуемые анти–SIRPα антитела (100–150 нМ) при 100 мкл/мин в течение 60 с. Поверхности восстанавливали 2:1 об./об. смесью IgG–элюирующий буфер Pierce/4 М NaCl. Полученные в результате сенсограммы использовали для оценки и группировки антител по разным группам в соответствии с их профилями связывания.
Результаты
[0399] Проводили сортировку следующих клонов анти–SIRP–α антител: 3, 21, 25, 27, 45, 66, 115, 116, 117, 118, 119, 120, 121, 122, 123, 132, 135, 136, 137, 149, 161, 162, 173, 194, 209, 213 и 218. Как показано на Фиг. 22A и 22B, результаты продемонстрировали, что каждый тип (Б: блокирование, НБ: не блокирование и О: «отталкивание») связывания анти–SIRP–α антител с человеческим SIRP–α v1 был отсортирован отдельно. В случае отсутствия блокирования анти–SIRP–α антитела можно дополнительно разделить на 4 группы на основании их профилей связывания. Например, анти–SIRP–α антитела 123, 149, 161, 162, 194 и 218 были отнесены к группе 5. Анти–SIRP–α антитела 3, 173, 209 и 213 были отнесены к группе 4. Анти–SIRP–α антитела 136 и 137 были отнесены к группе 2. Анти–SIRP–α антитело 45 имеет уникальный профиль связывания и было отнесено к группе 6.
[0400] Вместе со структурным анализом, описанным в примере 4, эти результаты привели к созданию модели связывания антитела и CD47 с доменом D1 SIRP–α, приведенной на Фиг. 23. Например, предполагается, что различные анти–SIRP–α антитела в группах 1, 2, 3 и 4 используют те же эпитопы связывания, что и анти–SIRPα 119, 136, 115 и 3, которые были категоризированы по соответствующим группам. Эпитопы связывания для анти–SIRPα 119, 136, 115 и 3 были получены из кристаллических растворов, как описано в примере 4.
[0401] Кроме того, предполагается, что анти–SIRPα антитела из группы 5 связываются вблизи анти–SIRPα 136 (группа 2) и 115 (группа 3) соответственно и используют перекрывающиеся эпитопы. Это следует из данных сортировки, показывающих, что анти–SIRPα антитела из группы 5 конкурировали с антителами из групп 2 и 3 за связывание с SIRP–α v1 и не конкурировали с антителами из групп 1, 4 и 6 (Фиг. 22B).
[0402] Предполагается, что анти–SIRPα антитело 45 (группа 6) связывается вблизи анти–SIRPα 3 (группа 4) и 136 (группа 2) соответственно, и они используют перекрывающиеся эпитопы. Это следует из данных сортировки, показывающих, что анти–SIRPα 45 конкурировало с антителами из групп 2 и 4 за связывание с SIRP–α v1, и анти–SIRPα 45 не конкурировало с антителами из групп 1, 3 и 5 (Фиг. 22B).
[0403] Модель на Фиг. 23 иллюстрирует эпитоп каждой группы антител на основании анализа структуры и сортировки и также демонстрирует перекрытие между различными группами антител с применением типовых клонов антител. Дополнительные анти–SIRP–α антитела, выделенные согласно данному документу, сгруппированы по семейства и группам на основании профилей картирования эпитопов, гомологии последовательностей доменов VH/VL, специфичности связывания с белками SIRP и источников антител. Например, анти–SIRP–α антитела из семейства 1/группы 1 блокируют CD47 и имеют высокую гомологию последовательностей в доменах VH и VL (таблица P и Фиг. 11J). VH и VL представляют полностью человеческие последовательности. Анти–SIRP–α антитела из семейства 2/группы 1 также блокируют CD47. Их VH и VL имеют высокую степень гомологии и получены из человеческого и куриного источника соответственно (таблица P, Фиг. 11A). Анти–SIRP–α антитела из семейства 3/группы 2 включают не блокирующие CD47 антитела, а их высокогомологичные VH/VL являются полностью человеческими последовательностями (таблица P, Фиг. 11B). Анти–SIRP–α антитела из семейства 4/группы 3 включают отталкивающие антитела, а их высокогомологичные VH/VL являются полностью человеческими последовательностями (таблица P, Фиг. 11C). Семейство 5 включает не блокирующие CD47 антитела, которые отдельно картированы по группам 4, 5 и 6. Выравнивание последовательностей этих антител и профили их связывания приведены на Фиг. 11D–11I и в таблице P, соответственно. Значения Kдисс. связывания с различными полипептидами SIRP–α, SIRP–β и SIRP–γ соответствующих анти–SIRP–α антител из семейств 1–5 представлены в таблице T.
Пример 6: Варианты анти–SIRP–α антител с мутациями зародышевой линии и подверженности
[0404] Некоторые описанные выше анти–SIRP–α антитела являются полностью человеческими антителами, вырабатываемым курами (например, антитела 119, 135 и 136). Следовательно, некоторые из этих антител могут содержать мутации в последовательностях каркасных областей вариабельного домена по сравнению с последовательностью человеческой зародышевой линии дикого типа за счет генерации этих антител в куриных B–клетках. Следовательно, желательно провести «обратную мутацию» соответствующих остатков, чтобы они совпадали с последовательностью человеческой зародышевой линии, с целью ограничения иммуногенности при исследовании этих анти–SIRP–α антител на людях в качестве потенциальных терапевтических средств. Кроме обратных мутаций до зародышевой линии, CDR и каркасную область антител 119, 135 и 136 анализировали в отношении подверженности горячих точек. Этот анализ позволил определить участки, в которых может требоваться внесение изменений, чтобы ограничить риск вследствие модификаций, которые могут возникать во время производства, хранения и/или разработки лекарства анти–SIRP–α антител.
Способ
Мутации зародышевой линии/подверженности
[0405] KД связывания соответствующих мутантов зародышевой линии и подверженности с SIRP определяли, используя прямую иммобилизацию на чипе GLC, как описано выше.
[0406] Антитела дикого и мутантного типа экспрессировали в Expi293 и очищали методом аффинной колоночной хроматографии с протеином А, как было описано ранее. Все антитела экспрессировали в виде Fc человеческих антител IgG1 с мутациями L234A/L235A/G237A/N297A . Мутагенез проводили, используя набор для сайт–направленного мутагенеза QuikChange Lightning в соответствии с инструкциями производителя (номер в каталоге Agilent № 210518).
Результаты
[0407] Исследовали антитела 119, 135 и 136. Отобранные последовательности антител выравнивали с доступными последовательностями человеческой зародышевой линии, используя IgBlast (NCBI). Например, было идентифицировано всего 7 участков в тяжелой и легкой цепях 119. Как показано на Фиг. 24A, для остатков, которые обычно не встречались в последовательности человеческой зародышевой линии VH 119 (например, D1, E43 и L112), проводили обратную мутацию для соответствия с последовательностью человеческой зародышевой линии (например, D1E, E43K и L112Q), оставляя нетронутыми последовательности CDR. В случае VL 119 (Фиг. 24B, для остатков, которые обычно не встречались в последовательности человеческой зародышевой линии VL 119 (например, F21, R39, E60 и T76), проводили обратную мутацию для соответствия с последовательностью человеческой зародышевой линии (например, F21L, R39K, E60A и T76S), оставляя нетронутыми последовательности CDR. В контексте данного документа термины «all mut» и «mut» относятся к вариабельным доменам, содержащие все описанные в данном документе мутации зародышевой линии для вариабельного домена конкретного антитела. Нумерация аминокислот, используемая при описании мутаций зародышевой линии и подверженности, основана на последовательной нумерации согласно соответствующим SEQ ID.
[0408] Кроме того, последовательности антител также анализировали в отношении горячих точек «подверженности», включая остатки, которые могут быть восприимчивыми к окислению, дезамидированию, изомеризации, гидролизу и N–связанному гликозилированию. Потенциальные горячие точки приведены в таблице L. В частности, были созданы варианты M34V и M34L HVR–H1 для VH–домена некоторого количества антител.
Таблица L. Потенциальные и известные горячие точки
[0409] Варианты антитела 119 создавали, используя вариабельные домены тяжелой и/или легкой цепи, несущие обратные мутации зародышевой линии и подверженности. VH–домен мутанта A119 («mut») создавали с помощью обратных мутаций до зародышевой линии D1E, E43K и L112Q, а также мутаций M34V в CDR–H1, которые приводят к удалению остатка метионина, который может потенциально окисляться (смотрите SEQ ID NO:246 для последовательностей VH). Другой вариант создавали с помощью обратных мутаций до зародышевой линии D1E, E43K и L112Q (смотрите SEQ ID NO:258 для последовательности VH). Выравнивание между родительскими и вариантными последовательностями приведено на Фиг. 24A. Легкую цепь мутанта A119 («mut») также создавали с помощью обратных мутаций до зародышевой линии F21L, R39K, E60A и T76S; выравнивание между родительской и вариантной последовательностями приведено на Фиг. 24B.
[0410] Варианты антитела 119 с мутантной тяжелой и/или легкой цепью сравнивали с родительским антителом 119 с Fc–областью IgG1, несущей мутации L234A, L235A, G237A и N297A (нумерация EU), и родительским антителом 119 с Fc–областью IgG4, несущей мутацию S228P (нумерация EU), в отношении аффинности связывания с человеческим SIRP–α v1 (SEQ ID NO:5), человеческим SIRP–α v2 (SEQ ID NO:6) и SIRP–α яванского макака (SEQ ID NO: 11). Было обнаружено, что мутантные тяжелые и легкие цепи 119 приводят к небольшому снижению аффинности связывания со всеми тремя белками SIRP–α. При этом вариант антитела 119 с мутированными тяжелой и легкой цепями все еще демонстрировал сильное связывание с обоими человеческими белками SIRP–α с KД приблизительно 30 нМ (таблица M). По сравнению с родительским антителом выход варианта антитела 119 с мутированными тяжелой и легкой цепями также снизился приблизительно в 4,5 раза (таблица M).
[0411] Чтобы исследовать влияние метионина в HVR–H1 на связывание 119 SIRPα, создавали одиночные мутации M34V и M34L в генетическом окружении VH 119 дикого типа («wt») и комбинировали с легкой цепью 119 дикого типа. Как 119 wt/wt_M34V, так и 119 wt/wt_M34L имели сравнимые значения аффинности (KД, М) в отношении человеческих SIRPα v1 и v2 по сравнению с 119 wt/wt. Это указывает на то, что остаток M34 не является критическим для связывания SIRP–α и может быть замещен с помощью мутаций M34L или M34V. Соответствующие последовательности VH для одиночных мутаций M34V и M34L, созданных в окружении VH 119 дикого типа, представлены SEQ ID NO: 421 и 420 соответственно.
Таблица M. Аффинность связывания (KД, М) вариантов антитела 119 с белками SIRP–α человека и яванского макака
НИ=не исследовано
[0412] Далее создавали аналогичные варианты антитела 135. Мутантную тяжелую цепь A135 («mut») создавали с помощью обратных мутаций до зародышевой линии D1E, R13Q, E16G, E43K и L112Q, а также мутации M34V в CDR–H1, которая приводит к удалению остатка метионина, который может потенциально окисляться (смотрите SEQ ID NO:247 для последовательности VH). Аналогичный вариант конструировали без мутации M34V в CDR–H1 (смотрите SEQ ID NO:259 для последовательности VH). Мутантную легкую цепь A135 («mut») создавали с помощью обратных мутаций до зародышевой линии F21L и D60A (смотрите SEQ ID NO:248 для последовательности VL). Выравнивание между родительскими и вариантными последовательностями приведено на Фиг. 25A и 25B.
[0413] Варианты антитела 135 с мутантной тяжелой и/или легкой цепью сравнивали с родительским антителом 135 в отношении аффинности связывания с человеческим SIRP–α v1 (SEQ ID NO:5), человеческим SIRP–α v2 (SEQ ID NO:6), SIRP–α яванского макака (SEQ ID NO: 11) и человеческим SIRP–γ v1 (SEQ ID NO: 15). Мутантные тяжелая и легкая цепи 135 имели сравнимую аффинность связывания со всеми четырьмя белками SIRP–α, а также сравнимый выход (таблица N1).
[0414] Чтобы исследовать влияние метионина в HVR–H1 135 на связывание SIRP–α, создавали одиночные мутации M34V и M34L в генетическом окружении VH 135 дикого типа и комбинировали с легкой цепью 135 дикого типа. Как 135 wt/wt_M34V, так и 135 wt/wt_M34L имели сравнимые значения аффинности (KД, М) в отношении человеческих SIRPα v1 и v2 по сравнению с 135 wt/wt. Это указывает на то, что остаток M34 не является критическим для связывания SIRP–α и может быть замещен с помощью мутаций M34L или M34V. Соответствующие последовательности VH для одиночных мутаций M34V и M34L, созданных в окружении VH 135 дикого типа, представлены SEQ ID NO: 423 и 422 соответственно.
Таблица N1. Аффинность связывания (KД, М) вариантов антитела 135 с белками SIRP–α человека и яванского макака и белком SIRP–γ человека
НИ=не исследовано
[0415] Создавали аналогичные варианты антитела 136. Мутантную тяжелую цепь A136 («mut») создавали с помощью обратных мутаций до зародышевой линии D1E, R13Q, E16R, E43K и L111Q, а также мутации M34V в CDR–H1, которая приводит к удалению остатка метионина, который может потенциально окисляться (смотрите SEQ ID NO:249 для последовательности VH). Аналогичный вариант конструировали без мутации M34V в CDR–H1 (смотрите SEQ ID NO:260 для последовательности VH). Мутантную легкую цепь A136 («mut») создавали с помощью обратных мутаций до зародышевой линии T2I, T12S, T22S и E38Q (смотрите SEQ ID NO:250 для VL). Выравнивание между родительскими и вариантными последовательностями приведено на Фиг. 26A и 26B.
[0416] Как показано на Фиг. 27A, варианты антитела 136 с мутантной тяжелой и/или легкой цепью сравнивали с родительским («wt») антителом 136 в виде IgG1_AAA_N297A в отношении аффинности связывания с человеческим SIRP–α v1 (SEQ ID NO:5), человеческим SIRP–α v2 (SEQ ID NO:6), SIRP–α яванского макака (SEQ ID NO: 11), SIRP–α мышей NOD (SEQ ID NO:8), SIRP–α мышей BL/6 (SEQ ID NO:9) и SIRP–α мышей BALB/c (SEQ ID NO: 10). На Фиг. 27A по оси Y отложено соотношение KД mut/KД wt для связывания с различными SIRP. Если соотношение=1, это указывало на отсутствие изменения в KД по сравнению со связыванием родительского антитела. Соотношение = > 1 и < 1 указывали на снижение и повышение аффинности связывания с SIRPα по сравнению с родительским антителом. Хотя антитело 136 wt (VL)/mut (VH) демонстрировало поведение, аналогичное с wt (VL)/wt(VH), оба варианта с мутированной легкой цепью имели худшую аффинность связывания, что указывает на неприемлемость некоторых мутаций в VL.
[0417] Чтобы проанализировать влияние каждой обратной мутации в легкой цепи на аффинность связывания, конструировали дополнительные варианты антитела 136 и изучали их характеристики в отношении аффинности связывания с SIRP–α мышей BL/6 (SEQ ID NO:9), SIRP–α мышей NOD (SEQ ID NO:8), SIRP–α мышей BALB/c (SEQ ID NO: 10), человеческим SIRP–α v1 (SEQ ID NO:5), человеческим SIRP–α v2 (SEQ ID NO:6), SIRP–α яванского макака (SEQ ID NO:11) и человеческим SIRP–γ v1 (SEQ ID NO: 15). Начиная с окружения «all mutant» (все мутации присутствуют), проводили обратное мутирование для каждой отдельной мутации. Отдельно исследовали мутации I2T, S12T, S22T и Q38E в легких цепях, которые в остальном соответствовали типу «all mutant», как показано на Фиг. 27B. Мутация I2T в окружении «all mut» систематически демонстрировала сходную аффинность связывания по сравнению с родительским антителом «wt/wt» (смотрите SEQ ID NO:251 для I2T в окружении «all mut» и Фиг. 27A в отношении выравнивания с родительским и мутантным антителами 136). Однако другие три обратные мутации (S12T, S22T и Q38E) систематически демонстрировали аффинность связывания, более сходную с 136 mut/mut, что указывает на то, что мутация T2I отвечает за снижение аффинности связывания с различными белками SIRP. Дополнительные данные по этим экспериментам приведены в таблице Q ниже.
Таблица N2. Аффинность связывания (KД, М) вариантов антител 136 с белками SIRP–α человека, мышей и яванского макака и белком SIRP–γ человека
Пример 7: Гуманизация анти–SIRP–α антител
[0418] В вышеприведенных примерах описано создание анти–SIRP–α антител, имеющих полностью человеческую тяжелую цепь и куриную легкую цепь. Чтобы гуманизировать куриные легкие цепи, куриные HVR этих антител прививали в различные каркасные области человеческой лямбда легкой цепи.
Способы
Гуманизация
[0419] Антитела гуманизировали, используя стандартные методы. Для определения выхода выработки одинаковый объем культур Expi293, экспрессирующих анти–SIRPα антитела, очищали методом аффинной хроматографии на с протеином А. После замены буфера на ФСБ определяли концентрацию белка по A280 и выражали в мг/мл.
Результаты
[0420] Чтобы сконструировать гуманизированные легкие цепи, каждую последовательность куриной легкой цепи выравнивали относительно наиболее близкой каркасной области человеческой зародышевой линии с помощью IgBLAST (NCBI). Согласно этому анализу, наибольшее совпадение с каркасной областью куриной лямбда легкой цепи имеет человеческая IGLV3 (смотрите SEQ ID NO:314–317).
[0421] В другом подходе проводили литературный поиск, чтобы определить оптимальные последовательности каркасной области человеческой лямбда легкой цепи для спаривания с человеческими последовательностями VH3 (человеческой тяжелой цепи, используемой для этих антител). На основании этого анализа посчитали, что человеческая VH3 будет хорошо спариваться с человеческими IGLV1 и IGLV2. Смотрите Glanville, J. et al (2009) Proc. Natl Acad. Sci. 106:20216–20221; Lloyd, C. et al. (2009) Protein Eng. Des. Sel 22:159–168; и Jayaram, N. et al (2012) Protein Eng. Des. Sel 25:523–529.
[0422] Таким образом, было создано шесть гуманизированных легких цепей: Hum1 (AB25 HVR+человеческая каркасная область IGLV3), Hum2 (AB25 HVR+человеческая каркасная область IGLV1), Hum3 (AB66 HVR+человеческая каркасная область IGLV3), Hum4 (AB66 HVR+человеческая каркасная область IGLV1), Hum5 (AB25 HVR+человеческая каркасная область IGLV2) и Hum6 (AB21 HVR+человеческая каркасная область IGLV1). Последовательности полученных в результате вариабельных доменов легкой цепи приведены в таблице О1.
Таблица O1. Исследованные последовательности вариабельных доменов гуманизированной легкой цепи Последовательности HVR выделены жирным шрифтом и подчеркнуты.
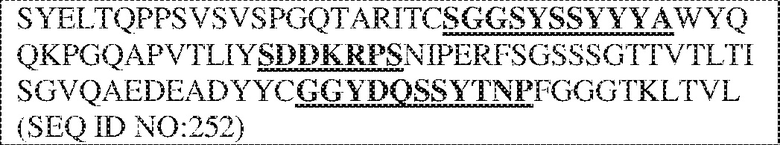



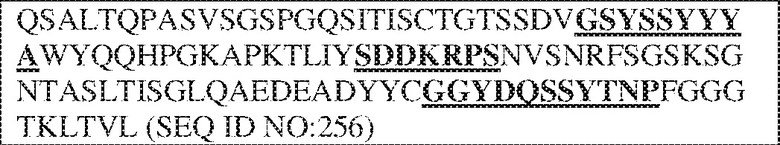

[0424] Каждую из 6 гуманизированных легких цепей спаривали с каждой из четырех тяжелых цепей (полученных из AB21, AB25, AB27 и AB66), создавая 24 уникальных антитела. Антитела экспрессировали, как описано выше. Неожиданно, последовательности человеческой каркасной области IGLV1 приводили к снижению экспрессии антител вне зависимости от тяжелой цепи. Это относится ко всем вариантам спаривания тяжелой цепи с Hum2, Hum4 и Hum6 (за исключением проведения спаривания с тяжелой цепью из AB66). Результаты обобщены на Фиг. 28 под заголовком «выход белка» (строка 1). В противоположность этому, антитела с легкими цепями, содержащими человеческие каркасные области IGLV2 и IGLV3 (Hum 1, Hum3, Hum5), демонстрировали более высокие уровни экспрессии вне зависимости от тяжелой цепи.
[0425] После этого изучали характеристики отобранных антител в отношении связывания с различными белками SIRP (например, с человеческим SIRP–α v1, человеческим SIRP–α v2, SIRP–α яванского макака, SIRP–α мышей BALB/c и человеческим SIRP–γ). Эти данные также обобщены на Фиг. 28. Отобранные гуманизированные легкие цепи приводили к снижению в связывании с одним или более антигенами. Например, было обнаружено, что человеческая каркасная область IGLV3 (представленная Hum1 и Hum3) позволяла получать превосходные уровни выработки антител, не влияя на аффинность связывания. Например, вариабельные домены легкой цепи с каркасными областями IGLV3 и последовательностями HVR любого из антитела 25 или антитела 66 (представленные Hum1 и Hum 3 соответственно) хорошо сочетались с различными тяжелыми цепями (например, вариабельными доменами тяжелых цепей из антител 21, 25, 27 и 66) и демонстрировали сходное связывание с разными белками SIRP–α и SIRP–γ. В противоположность этому, было обнаружено, что каркасные области IGLV1 и IGLV2 (представленные Hum2, Hum4, Hum5 и Hum6) характеризовались более низкой экспрессией и/или сниженным связыванием с SIRP при спаривании с тяжелыми цепями из антител 21, 25, 27 и 66. Дополнительные данные по связыванию, полученные в этих экспериментах, приведены в таблице R ниже. Для дополнительного исследования была отобрана человеческая каркасная область IGLV3.
[0425] Другой целью гуманизации этих антител были последовательности антител, имеющие идентичность с последовательностями легкой цепи/тяжелой цепи человеческой зародышевой линии, большую или равную 85%. Был создан дополнительный VL–домен Hum9 и Hum8 на основе VL–домена Hum1. По сравнению с Hum1, Hum9 содержит 4 аминокислотные замены вблизи или в HVR–L1 и –L2, которые повышают человекоподобность легкой цепи до идентичности с последовательностью человеческой легкой цепи, большей или равной 85% (Фиг. 29). По сравнению с Hum1, Hum8 содержит 5 аминокислотных замен, соответственно вблизи или в HVR–L1 и –L2, которые повышают человекоподобность легкой цепи до идентичности с последовательностью человеческой легкой цепи, большей или равной 85% (Фиг. 29). VL Hum1, Hum8 и Hum9 при спаривании с тяжелой цепью all_mut_AB21 (несущей мутации зародышевой линии) вырабатывали анти–SIRPα антитела, которые связывали человеческий v1 с аффинностью, равной или большей 10 пМ (таблица S). Аналогично, когда VL Hum1, Hum8 и Hum9 спаривали с тяжелой цепью all_mut_AB25 (несущей мутации зародышевой линии), анти–SIRPα антитела связывались с человеческим v1 с аффинностью, равной или большей 10 пМ. Дополнительные данные по связыванию, полученные в этих экспериментах, приведены в таблице S ниже. Эти легкие цепи можно взаимозаменяемо комбинировать с VH–доменами антител 21, 25 и 27 (а также их вариантов, которые были модифицированы, как описано выше для антител 119, 135 и 136; Фиг. 30). Не ограничиваясь теорией, считается, что вышеописанный процесс гуманизации можно применять в отношении легкой цепи любого антитела из семейства 2 (группа 1).
Пример 8: Индукция фагоцитоза и активация дендритных клеток анти–SIRP–α
антителами
[0426] Далее различные анти–SIRP–α антитела, представляющие разные модели связывания с SIRP–α (например, блокирующие, неблокирующие и «отталкивающие» антитела) исследовали в анализе фагоцитоза.
Анализ связывания CD47–Fc
[0427] CD47–Fc конъюгировали с Alexa Fluor 647 (AF647), используя набор для микромасштабного мечения белков Alexa Fluor 647 (Thermo Fisher Scientific). В 96–луночных полипропиленовых планшетах (Corning) суспендировали 100000 МКПК в 100 мкл 0,25 мкМ AF647–меченого CD47–Fc и 1 мкл анти–CD14 PE антитела (Biolegend) в буфере FACS. Клетки инкубировали на льду в течение 30 минут, промывали в буфере FACS и инкубировали в 10–кратных серийных разведениях анти–SIRP–α антител, от 1,25 мкМ до 25 мкМ. Клетки инкубировали на льду в течение 30 минут, промывали в буфере FACS и фиксировали в 75 мкл 0,5–процентного формальдегида. Клетки анализировали на FACS Canto II (BD Biosciences) с последующим анализом данных с помощью Flowjo 10.7 (Treestar). Среднее геометрическое значение интенсивности флуоресценции сигнала CD47–Fc определяли в популяции CD14–положительных моноцитов.
Анализ активации дендритных клеток
[0428] Анализ активации дендритных клеток проводили, как описано в другом месте данного документа. Вкратце, мышей Balb/c (n=3/группа) внутривенно инъецировали контрольным крысиным антимышиным анти–SIRP–α антагонистическим антителом (клон p84), человеческим контрольным IgG1, различными анти–SIRP–α антителами, мышиным контрольным IgG или базовым раствором (ФСБ) при 10 мг/кг. Через пять часов после инъекции вырезали селезенки и обрабатывали до одноклеточной суспензии путем механической диссоциации. Измерения уровня маркеров активации CD86, ГКГСII и CCR7 на дендритных клетках CD4+ селезенки проводили методом проточной цитометрии.
Анализ клеточной адгезии
[0429] Анализ адгезии проводили, используя изогенные клетки с отсутствием или экспрессией человеческого CD47. Хомячьи клетки CHO с нокаутом CD47 (CHOCD47KO) создавали, используя технологию CRISPR. Изогенные клетки, экспрессирующие человеческий CD47, создавали посредством временной трансфекции человеческого CD47 в CHOCD47KO. Через 24 часа после трансфекции трансфицированные человеческим CD47 клетки CHOCD47KO (4×105) повторно высевали в обработанные 24–луночные планшеты для тканевого культивирования и оставляли для повторного присоединения и достижения конфлюэнтности на ночь при 37°C.
[0430] Человеческие мононуклеарные клетки периферической крови (МКПК) отделяли от периферической крови здоровых доноров посредством центрифугирования в градиенте Ficoll. Клетки CD3+ и CD14+ выделяли из МКПК с помощью негативной селекции, используя магнитные гранулы. Выделенные клетки CD3+ и CD14+ (5×106) предварительно инкубировали с антителами Hum1/AB21mutall, Hum9/AB21mutall или 136 wt/mut, содержащими мутированный человеческий IgG1 (L234A L235A G237A и N297A) (20 мкг/мл), при 37°C в течение 20 минут перед высеванием на клетки CHOCD47 KO и CHOhCD47+ и оставляли для прикрепления на 1 час при 37°C. Не прикрепившиеся клетки удаляли путем пятикратной аккуратной промывки ФСБ. Прикрепившиеся клетки отсоединяли трипсином и нейтрализовали 10% ФБС. Клетки переносили в 96–луночный планшет и 2 раза промывали ФСБ+0,5% БСА, после чего метили клеточную поверхность конъюгированными с флуорохромом антителами к человеческим CD3, CD4, CD8 и CD14. Добавляли счетные гранулы и проводили количественное определение клеточной адгезии, используя проточный цитометр BD Canto II. Анализ данных проточной цитометрии проводили, используя Flowjo.
Результаты
[0431] Исследовали пять антител, которые «отталкивали» CD47 от связывания с SIRP–α, в отношении их влияния на фагоцитоз HER2(+) клеток OE19 макрофагами M2 в комбинации с анти–HER2 антителом трастузумабом (Фиг. 31). Было обнаружено, что все 5 «отталкивающих» антител усиливают индуцированный трастузумабом фагоцитоз.
[0432] Далее исследовали пять антител, которые не блокируют связывание CD47 с SIRP–α, в отношении их влияния на фагоцитоз EGFR(+) клеток DLD–1 макрофагами M2 в комбинации с анти–EGFR антителом цетуксимабом (Фиг. 32). Было обнаружено, что все неблокирующие антитела усиливают индуцированный цетуксимабом фагоцитоз.
[0433] Далее исследовали вышеописанные гуманизированные антитела в отношении их влияния на фагоцитоз EGFR(+) клеток DLD–1 макрофагами M2 в комбинации с анти–EGFR антителом цетуксимабом (Фиг. 33А). Было обнаружено, что все гуманизированные антитела усиливают индуцированный цетуксимабом фагоцитоз. Дополнительные варианты антитела 136 (описанные выше) исследовали в отношении их влияния на фагоцитоз EGFR(+) клеток DLD–1 макрофагами M2 в комбинации с анти–EGFR антителом цетуксимабом (Фиг. 33B). Все варианты антитела 136 усиливали индуцированный цетуксимабом фагоцитоз, но в разной степени. Дополнительные гуманизированные антитела, описанные выше (антитела 25 и 27 с вариантными тяжелыми цепями в комбинации с легкими цепями Hum1 или Hum9) исследовали в отношении их влияния на фагоцитоз EGFR(+) клеток DLD–1 макрофагами M2 в комбинации с анти–EGFR антителом цетуксимабом (Фиг. 33C). Было обнаружено, что все гуманизированные антитела усиливают индуцированный цетуксимабом фагоцитоз.
[0434] Чтобы изучить влияние Fc–областей анти–SIRP–α антитела на фагоцитоз, исследовали два неблокирующих антитела в виде полноразмерных антител или фрагментов F(ab)2 в отношении их влияния на фагоцитоз EGFR(+) клеток DLD–1 макрофагами M2 в комбинации с анти–EGFR антителом цетуксимабом (Фиг. 34). Эти результаты показывают, что неблокирующие антитела теряют способность индуцировать фагоцитоз в виде фрагментов F(ab)2, что позволяет предположить, что Fc–область этого класса антител необходима для индукции фагоцитоза.
[0435] Три варианта блокирующего антитела 119 (описанные выше) исследовали в отношении их влияния на фагоцитоз EGFR(+) клеток DLD–1 макрофагами M2 в комбинации с анти–EGFR антителом цетуксимабом (Фиг. 35). Результаты демонстрируют, что все три варианта усиливали индуцированный цетуксимабом фагоцитоз.
[0436] Два варианта блокирующего антитела 135 (описанные выше) исследовали в отношении их влияния на фагоцитоз EGFR(+) клеток DLD–1 макрофагами M2 в комбинации с анти–EGFR антителом цетуксимабом (Фиг. 36). Результаты демонстрируют, что оба варианта усиливали индуцированный цетуксимабом фагоцитоз.
[0437] Дополнительные неблокирующие антитела (описанные выше) исследовали в отношении их влияния на фагоцитоз EGFR(+) клеток DLD–1 макрофагами M2 в комбинации с анти–EGFR антителом цетуксимабом (Фиг. 37). Было обнаружено, что все неблокирующие антитела усиливают индуцированный цетуксимабом фагоцитоз.
[0438] Далее, различные анти–SIRP–α антитела исследовали в отношении их влияния на in vivo активацию дендритных клеток (Фиг. 38A–38B), включая известное анти–SIRP–α антитело p84 (смотрите, например, Tangsheng, Y. et al (2015) Immunity 433:1–12). Неспособность задействовать рецептор мышиного SIRP–α на дендритных клетках селезенки посредством связывания CD47 приводила к активации дендритных клеток селезенки. Контрольное анти–SIRP–α антагонистическое антитело p84 активировало дендритные клетки селезенки при внутривенной инъекции мышам. Исследовали неблокирующие анти–SIRP–α антитела (AB136b, AB3b и AB136 wt/mut) и блокирующие анти–SIRP–α антитела (Hum1/AB21mutall, Hum8/AB21mutall и Hum9/AB21mutall) in vivo, чтобы определить, приводят ли они к активации дендритных клеток. Согласно определению по экспрессии CD86 и ГКГСII, как блокирующие, так и неблокирующие SIRP–α антитела индуцировали активацию дендритных клеток. Эти результаты позволяют предположить, что блокирующие и неблокирующие анти–SIRP–α антитела индуцируют активацию дендритных клеток.
[0439] Было создано два варианта антитела 218, 218–Hum13/VH_wt и 218–Hum14/VH_wt, путем экспрессии гуманизированных легких цепей (Hum13 и Hum14 соответственно) с тяжелой цепью антитела 218 дикого типа. В Hum13 используется человеческая каркасная область IGLV2, тогда как в Hum14 используется человеческая каркасная область IGLV3 (смотрите SEQ ID NO:333 и 334 для последовательностей VL Hum13 и Hum14 соответственно). Оба клона демонстрировали более низкую аффинность связывания с v1 и v2 (KД составляет от –29,3 до 53,1 нМ), как показано в таблице O2.
Таблица O2. Аффинность связывания (KД, М) антитела 218 и вариантов 218 в отношении человеческого SIRP–α v1 и v2.
[0440] Оба антитела исследовали в анализе фагоцитоза в комбинации с цетуксимабом в клетках DLD–1. Интересно, что ни один гуманизированный вариант не был способен усиливать фагоцитоз больше, чем родительское антитело AB218a (Фиг. 39A). Не ограничиваясь теорией, эти результаты дают основание предположить, что антитела с KД в диапазоне приблизительно 30–50 нМ или ниже могут быть более эффективными в отношении индукции фагоцитоза, чем антитела, связывающиеся с более слабой аффинностью.
[0441] Далее типовые блокирующие, неблокирующие и отталкивающие анти–SIRP–α антитела исследовали в отношении индукции фагоцитоза в виде отдельных агентов. Сначала исследовали три антитела, которые блокируют связывание CD47 с SIRP–α, AB119a, AB120a и AB122a, в отношении их влияния, как отдельных агентов, на фагоцитоз EGFR(+) клеток DLD–1 макрофагами M2 (как описано выше). Было обнаружено, что все блокирующие антитела индуцируют фагоцитоз в виде отдельных агентов (Фиг. 39B). Потом исследовали два антитела, которые не блокируют связывание CD47 с SIRP–α, AB136a и AB137a, в отношении их влияния в виде отдельных агентов на фагоцитоз EGFR(+) клеток DLD–1 макрофагами M2. Было обнаружено, что все неблокирующие антитела индуцируют фагоцитоз в виде отдельных агентов (Фиг. 39C). И наконец, исследовали пять «отталкивающих» SIRP–α антител, AB115a, AB116a, AB117a, AB118a и AB132a, в отношении их влияния в виде отдельных агентов на фагоцитоз EGFR(+) клеток DLD–1 макрофагами M2. Было обнаружено, что все «отталкивающие» антитела индуцируют фагоцитоз в виде отдельных агентов (Фиг. 39D).
Пример 9: Синергетическое противоопухолевое действие комбинации блокирующих и неблокирующих анти–SIRP–α антител с ингибированием пути PD–L1/PD–1
Способы
In vivo противоопухолевая активность
[0442] В случае сингенной модели карциномы CT26 толстой кишки мышей клетки CT26 подкожно имплантировали мышам BALB/c и рандомизировали животных по группам (8–9 мышей/группа). Группы обработки включали применение базового раствора (ФСБ), AB25b, анти–PD–L1 и AB25b/анти–PD–L1. Анти–PD–L1 создавали путем слияния VH– и VL–домена атезолизумаба с Fc–областью мышиного IgG1, несущей мутацию N297A. Все анти–SIRP–α также содержали Fc–область мышиного IgG1, несущую мутацию N297A. Обработку начинали, когда опухоли достигали в среднем 75–80 мм3, на 7 или 8 сутки после имплантации. Мышей внутрибрюшинно (В/Б) дозировали дозами 3 мг/кг или 10 мг/кг анти–SIRP–α антител дважды в неделю в течение трех недель и тремя дозами 3 мг/кг анти–PD–L1 через пять суток. Животных умерщвляли, когда опухоли достигали объема ~2000 мм3.
[0443] В случае сингенной модели карциномы MC38 толстой кишки мышей клетки MC38 подкожно имплантировали мышам C57BL/6 и рандомизировали животных по группам (8–10 мышей/группа). Группы обработки включали применение базового раствора (ФСБ), AB25b, AB136b, анти–PD1 (клон RMP1–14, BioXCell), AB136b/анти–PD1 и AB25b/анти–PD1. Все анти–SIRPα антитела содержали Fc–область мышиного IgG1, несущую мутацию N297A, за исключением AB25c Обработку начинали, когда опухоли достигали в среднем 60–65 мм3, на 7 сутки после имплантации. Мышей внутрибрюшинно (В/Б) дозировали дозами 10 мг/кг анти–SIRP–α дважды в неделю в течение трех недель и тремя дозами 2 мг/кг анти–PD1. Животных умерщвляли, когда опухоли достигали объема ~2000 мм3.
Результаты
[0444] Исследовали противоопухолевую активность анти–SIRP–α антитела AB25b, одного и в комбинации с анти–PD–L1 антителом, в сингенной модели карциномы CT26 толстой кишки мышей. Как показано на Фиг. 40, введение AB25b при 10 мг/кг в комбинации с анти–PD–L1 при 3 мг/кг замедляло образование опухоли по сравнению с обработкой каждым отдельным агентом или контрольным раствором. На 27 сутки исследования в группе комбинированной обработки было шесть мышей с объемом опухолей менее 600 мм3 по сравнению с двумя, двумя и двумя мышами с объемом опухолей менее 600 мм3 в группах обработки базовым раствором, одним анти–PD–L1 агентом и одним анти–SIRP–α агентом соответственно.
[0445] Далее исследовали противоопухолевую активность блокирующего анти–SIRP–α антитела AB25b и неблокирующего анти–SIRP–α антитела AB136b, по отдельности и в комбинации с анти–PD–1 антителом, в сингенной модели карциномы MC38 толстой кишки мышей. Как показано на Фиг. 41, комбинация AB25b или AB136b (при 10 мг/кг) с анти–PD–1 при 5 мг/кг замедляла образование опухоли по сравнению с обработкой каждым отдельным агентом или контрольным раствором. На 27 сутки исследования в группе комбинированной обработки AB25b/PD–1 было семь мышей с объемом опухолей менее 600 мм3, а в группе комбинированной обработки AB136b/PD–1 было шесть мышей с объемом опухолей менее 600 мм3 по сравнению с одной, пятью, двумя и одной мышами с объемом опухолей менее 600 мм3 в группах обработки базовым раствором, одним анти–PD–1 агентом, одним агентом AB25b и одним агентом AB136b, соответственно.
[0446] Обобщенные данные по описанным в данном документе антителам и их свойства приведены в таблице P. Дополнительные данные по связыванию приведены в таблице T.
[0447] Хотя вышеприведенное изобретение было довольно подробно описано в качестве иллюстрации и примера в целях ясности понимания, описания и примеры не следует воспринимать как ограничивающие объем настоящего изобретения. Содержание всей патентной и научной литературы, цитируемой в данном документе, явным образом и в полном объеме включено посредством ссылки.
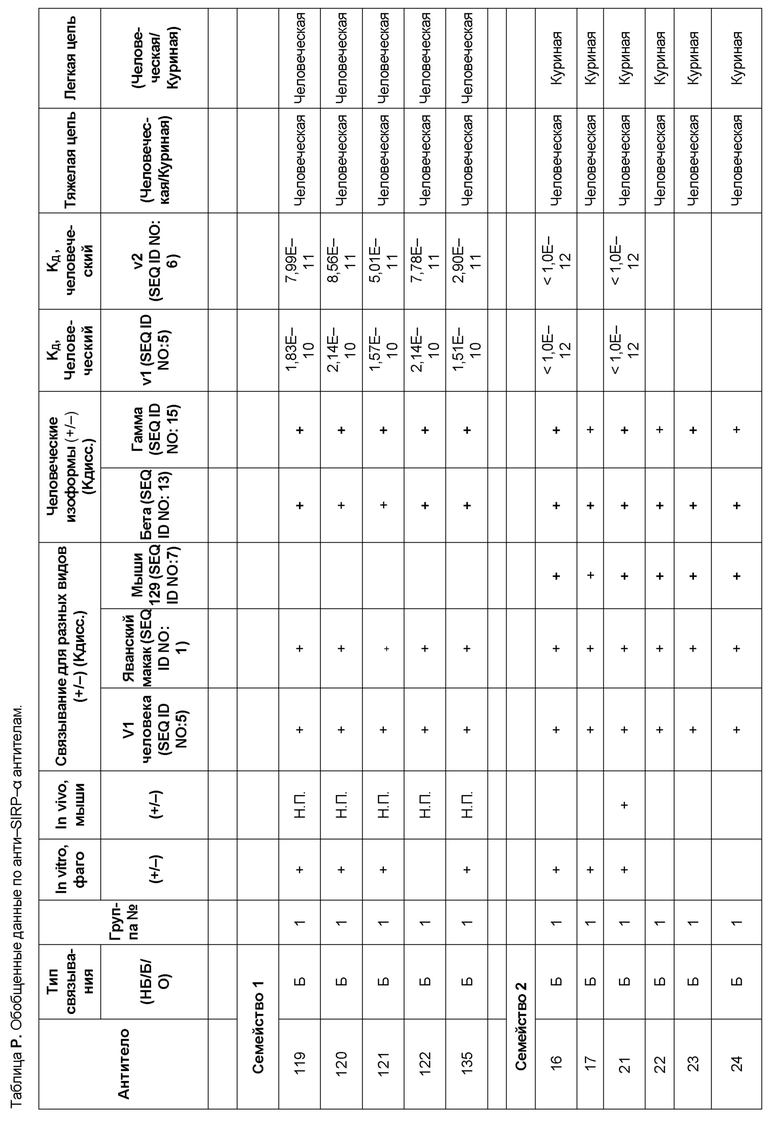
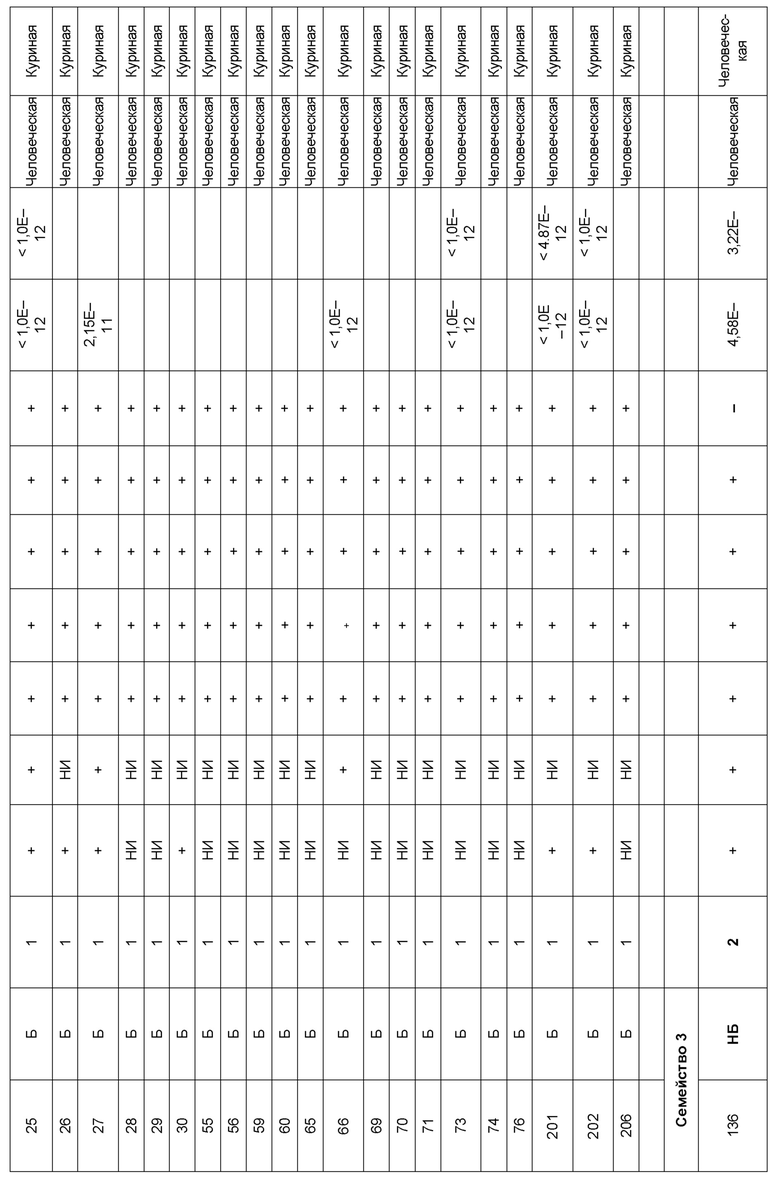
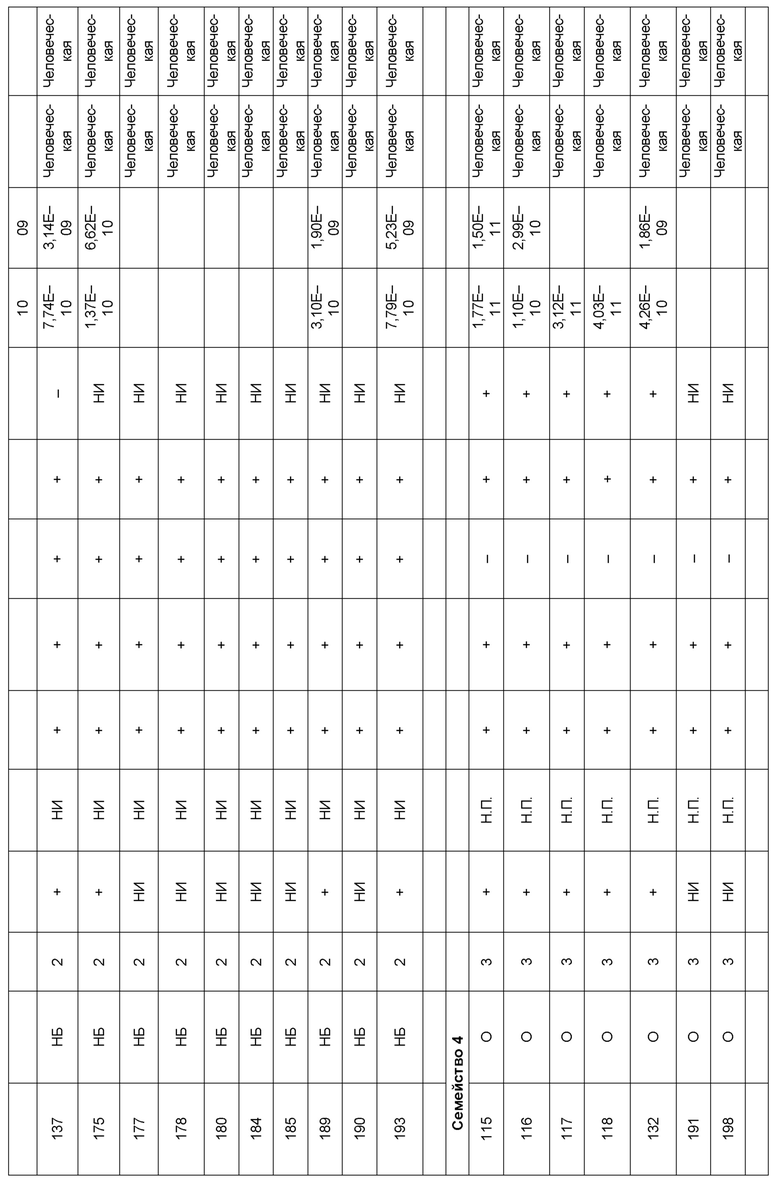
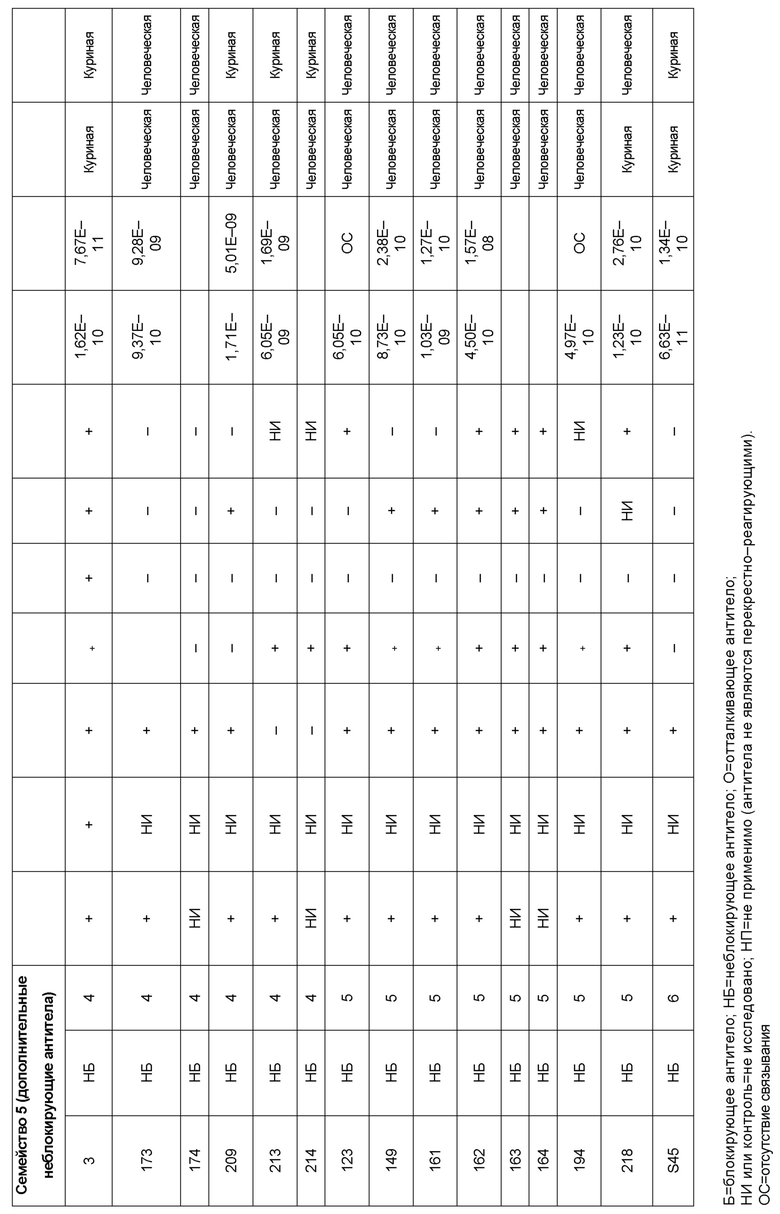
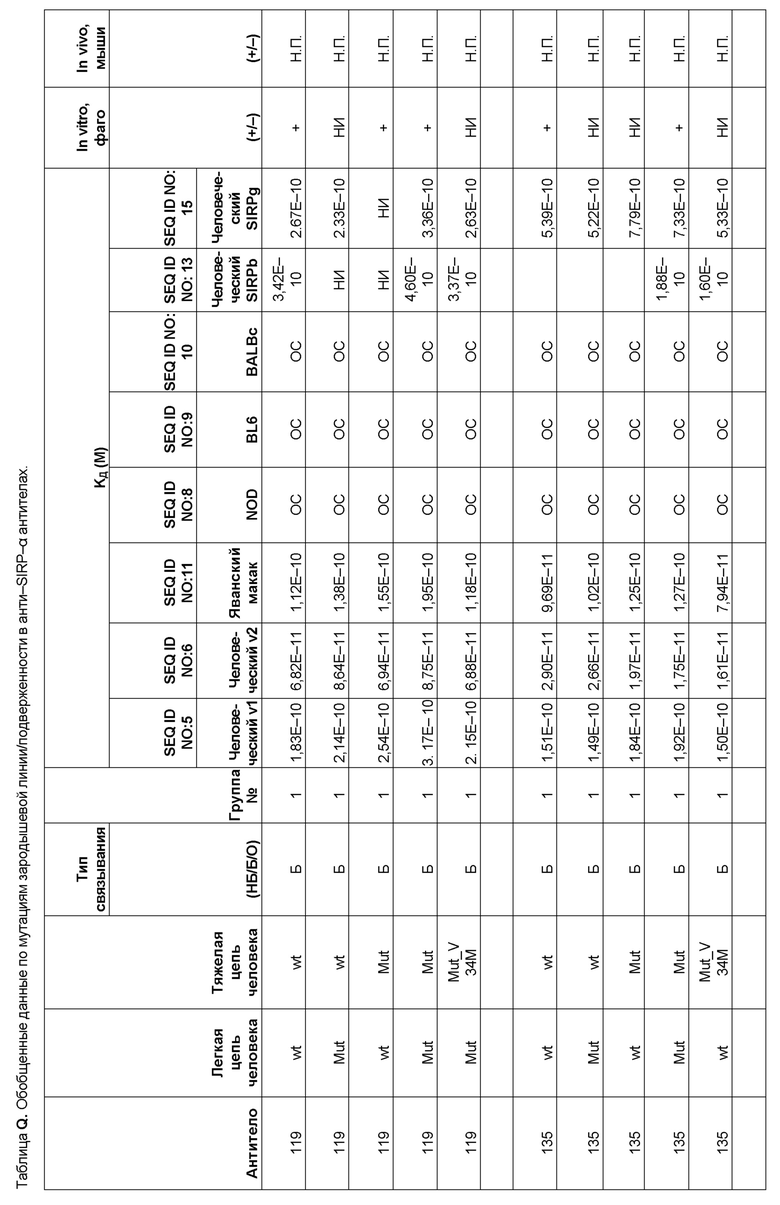

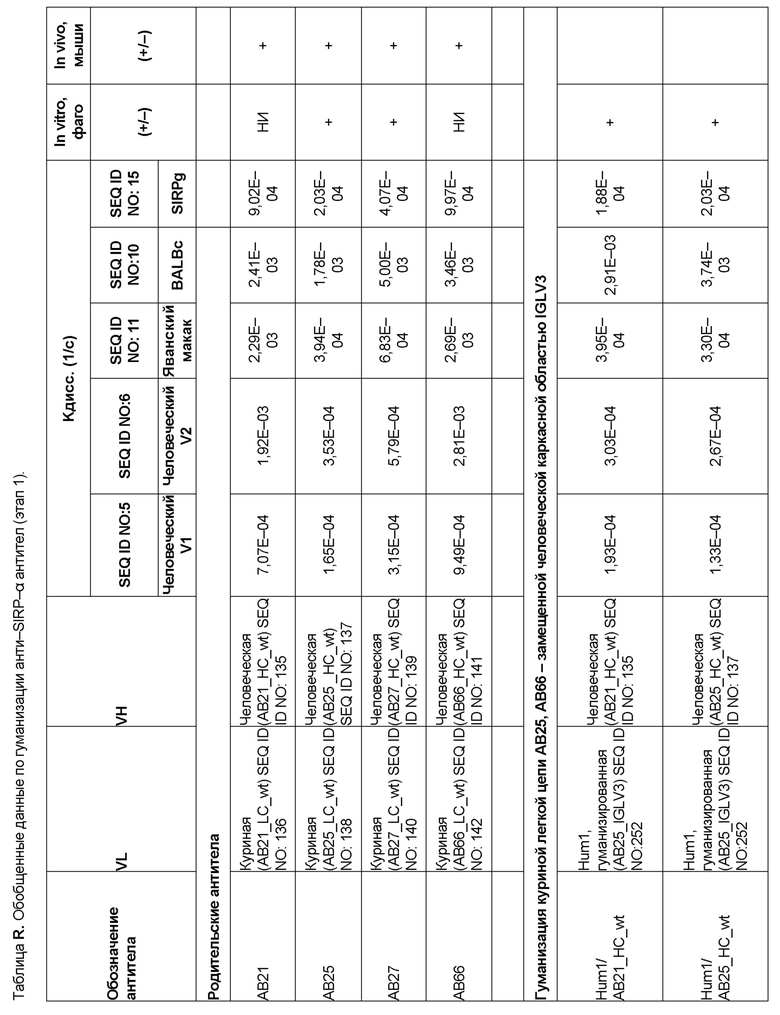
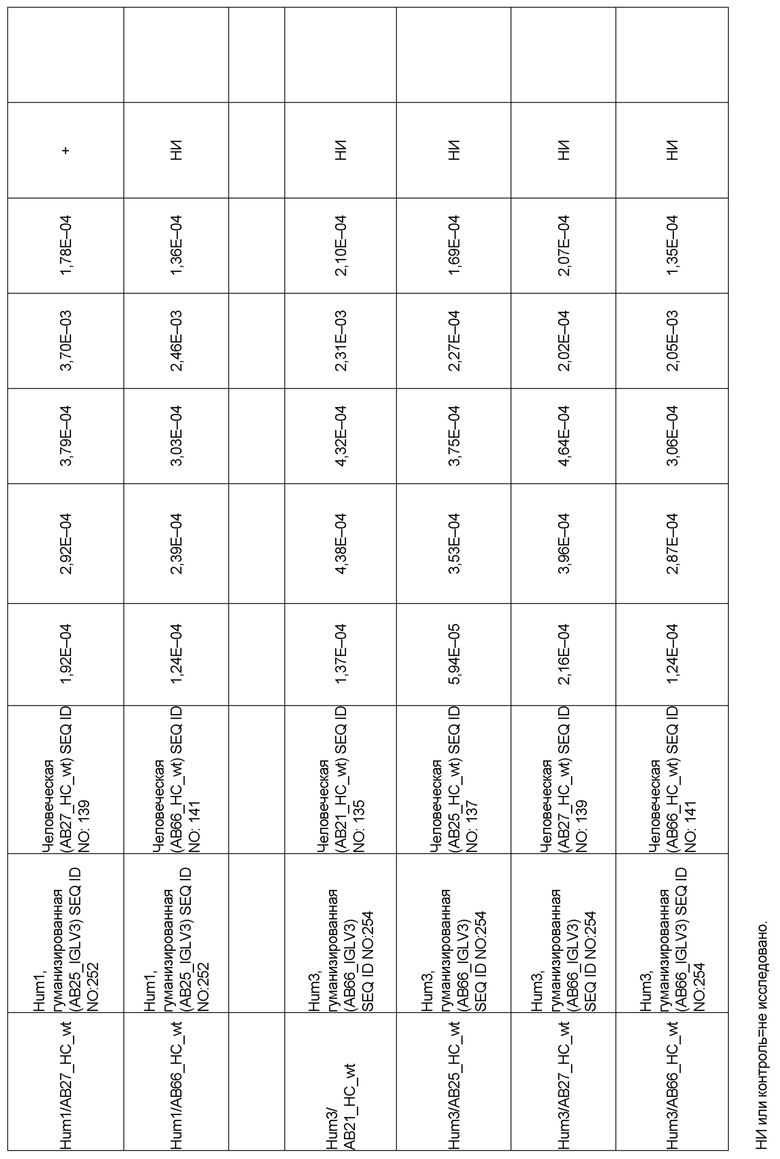
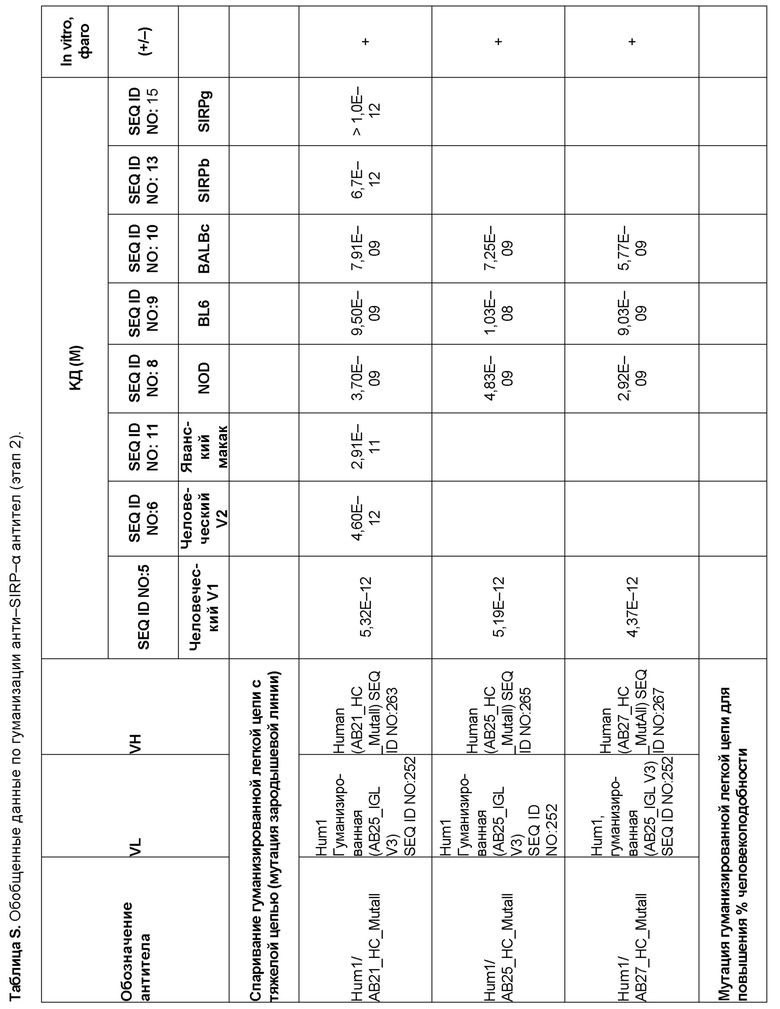
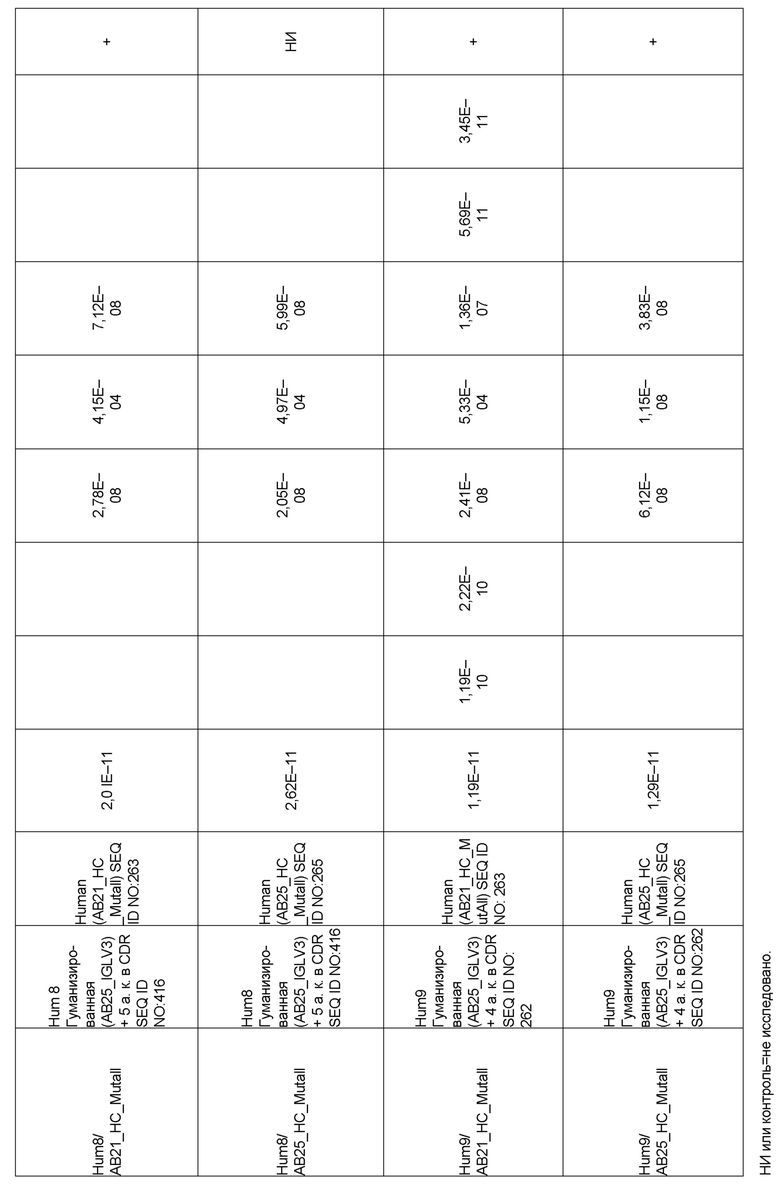

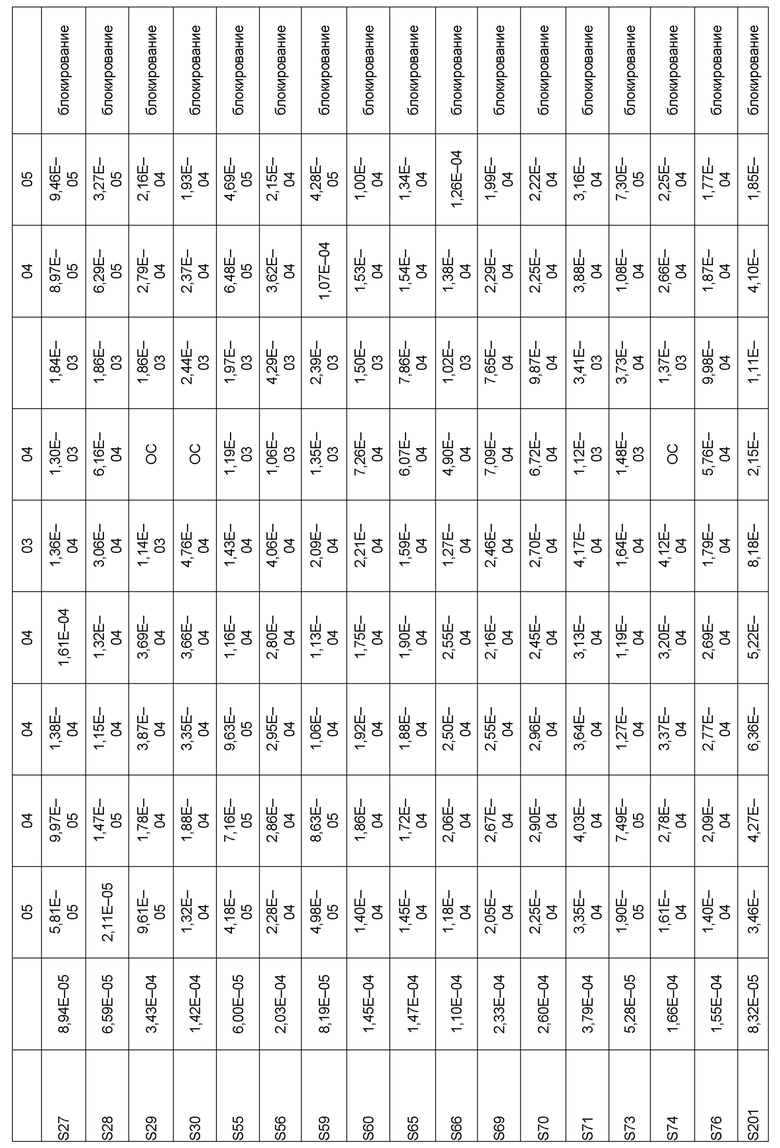
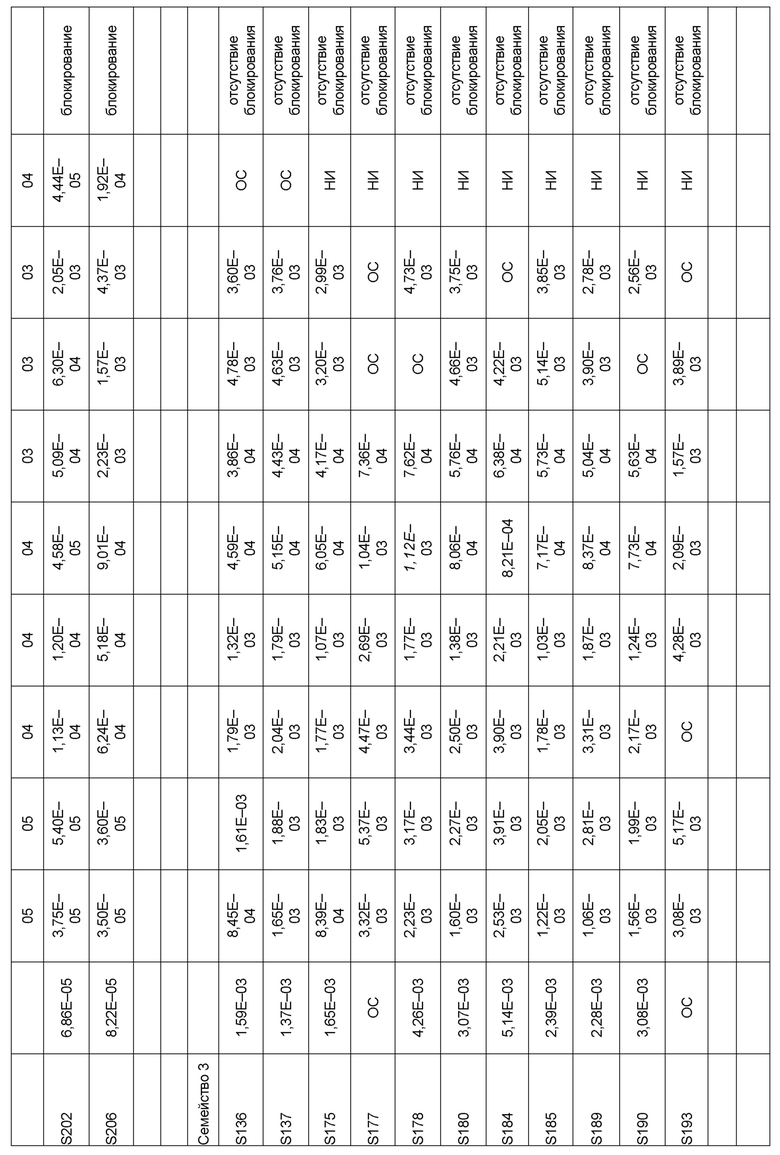
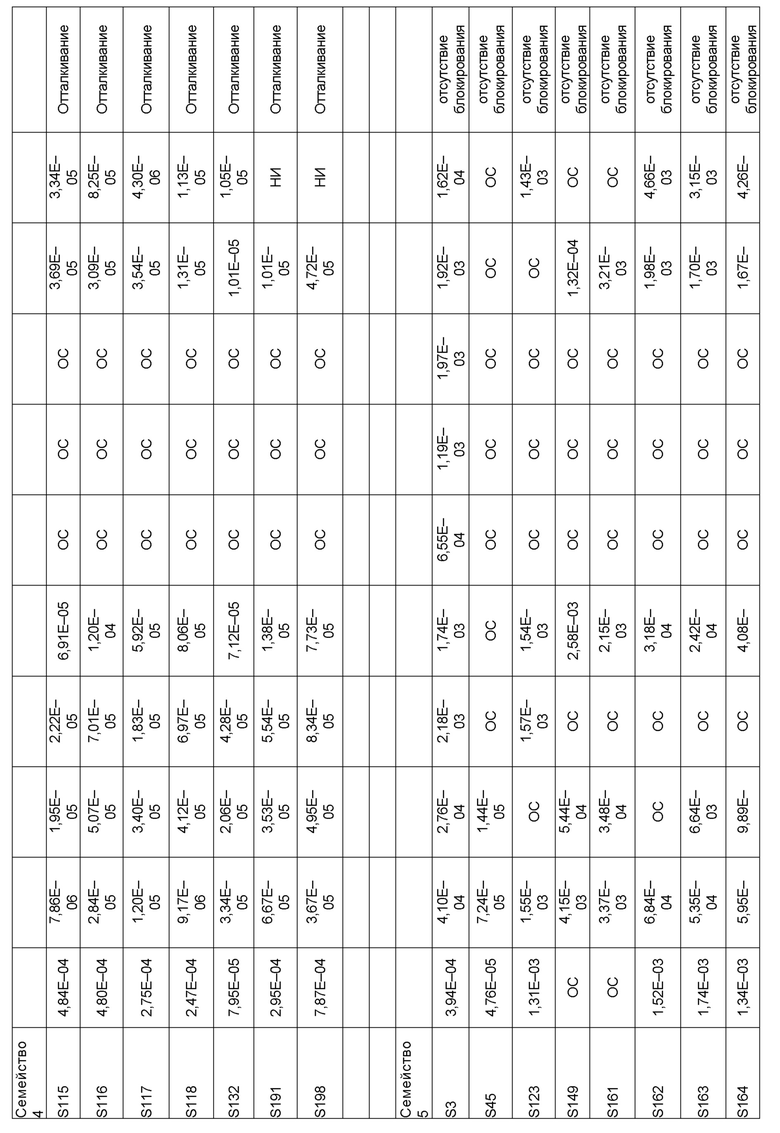
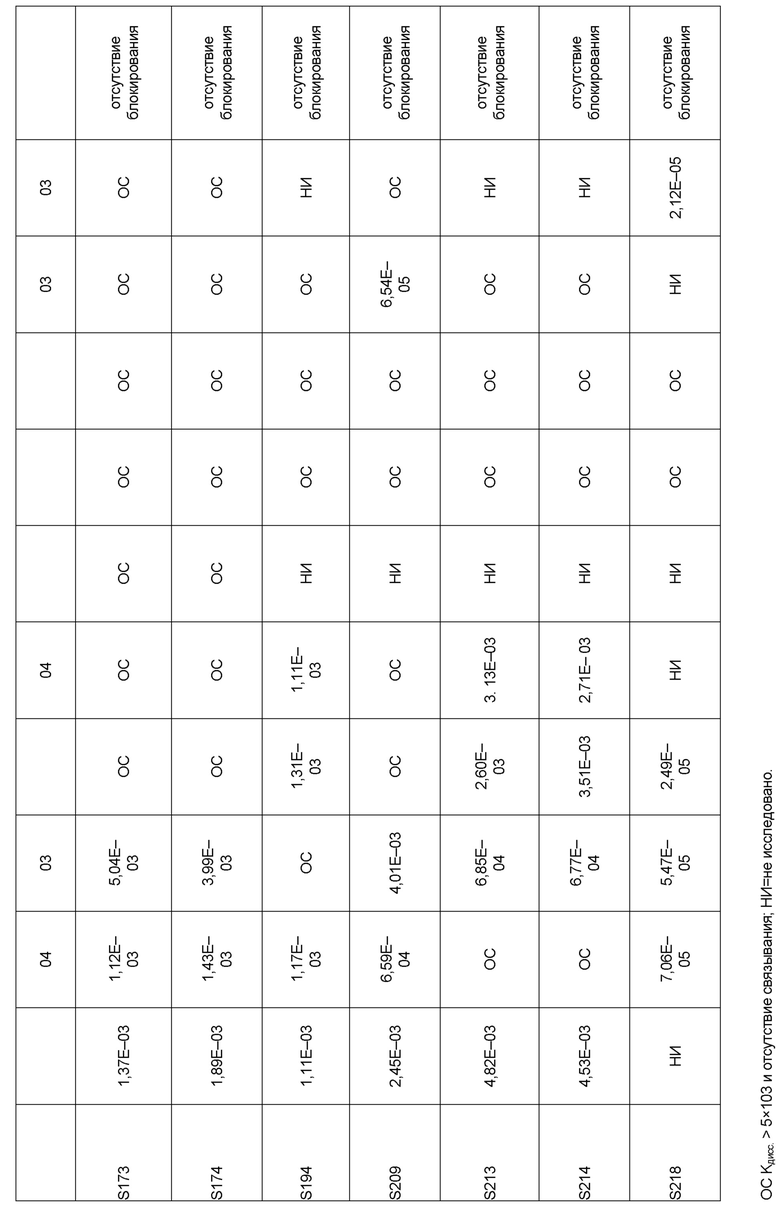
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ALEXO THERAPEUTICS INC.
PONS, Jaume
SIM, Bang Janet
Wan, Hong
KUO, Tracy Chia-Chien
KAUDER, Steven Elliot
HARRIMAN, William Don
IZQUIERDO, Shelley
<120> АНТИТЕЛА ПРОТИВ СИГНАЛ-РЕГУЯТОРНОГО
БЕЛКА АЛЬФА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ
<130> 757972000140
<140> Права не переданы
<141> Одновременно с настоящим документом
<150> US 62/515,480
<151> 2017-06-05
<150> US 62/397,752
<151> 2016-09-21
<160> 426
<170> FastSEQ for Windows, версия 4.0
<210> 1
<211> 348
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 1
Glu Glu Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Leu Val Ala
1 5 10 15
Ala Gly Glu Thr Ala Thr Leu Arg Cys Thr Ala Thr Ser Leu Ile Pro
20 25 30
Val Gly Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Gly Arg Glu Leu
35 40 45
Ile Tyr Asn Gln Lys Glu Gly His Phe Pro Arg Val Thr Thr Val Ser
50 55 60
Asp Leu Thr Lys Arg Asn Asn Met Asp Phe Ser Ile Arg Ile Gly Asn
65 70 75 80
Ile Thr Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys
85 90 95
Gly Ser Pro Asp Asp Val Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu
100 105 110
Ser Val Arg Ala Lys Pro Ser Glu Ser Lys Tyr Gly Pro Pro Cys Pro
115 120 125
Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe
130 135 140
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
145 150 155 160
Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe
165 170 175
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
180 185 190
Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
195 200 205
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
210 215 220
Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala
225 230 235 240
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln
245 250 255
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
260 265 270
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
275 280 285
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
290 295 300
Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu
305 310 315 320
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
325 330 335
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
340 345
<210> 2
<211> 347
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 2
Glu Glu Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Ser Val Ala
1 5 10 15
Ala Gly Glu Ser Ala Ile Leu His Cys Thr Val Thr Ser Leu Ile Pro
20 25 30
Val Gly Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Ala Arg Glu Leu
35 40 45
Ile Tyr Asn Gln Lys Glu Gly His Phe Pro Arg Val Thr Thr Val Ser
50 55 60
Glu Ser Thr Lys Arg Glu Asn Met Asp Phe Ser Ile Ser Ile Ser Asn
65 70 75 80
Ile Thr Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys
85 90 95
Gly Ser Pro Asp Thr Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser
100 105 110
Val Arg Ala Lys Pro Ser Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro
115 120 125
Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro
130 135 140
Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr
145 150 155 160
Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn
165 170 175
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
180 185 190
Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val
195 200 205
Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser
210 215 220
Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys
225 230 235 240
Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu
245 250 255
Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe
260 265 270
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
275 280 285
Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe
290 295 300
Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly
305 310 315 320
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
325 330 335
Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
340 345
<210> 3
<211> 346
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 3
Lys Glu Leu Lys Val Thr Gln Pro Glu Lys Ser Val Ser Val Ala Ala
1 5 10 15
Gly Asp Ser Thr Val Leu Asn Cys Thr Leu Thr Ser Leu Leu Pro Val
20 25 30
Gly Pro Ile Lys Trp Tyr Arg Gly Val Gly Gln Ser Arg Leu Leu Ile
35 40 45
Tyr Ser Phe Thr Gly Glu His Phe Pro Arg Val Thr Asn Val Ser Asp
50 55 60
Ala Thr Lys Arg Asn Asn Met Asp Phe Ser Ile Arg Ile Ser Asn Val
65 70 75 80
Thr Pro Glu Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Gln Lys Gly
85 90 95
Pro Ser Glu Pro Asp Thr Glu Ile Gln Ser Gly Gly Gly Thr Glu Val
100 105 110
Tyr Val Leu Ala Lys Pro Ser Asp Lys Thr His Thr Cys Pro Pro Cys
115 120 125
Pro Ala Pro Glu Ala Ala Gly Ala Pro Ser Val Phe Leu Phe Pro Pro
130 135 140
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
145 150 155 160
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
165 170 175
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
180 185 190
Glu Gln Tyr Ala Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
195 200 205
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
210 215 220
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
225 230 235 240
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu
245 250 255
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
260 265 270
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
275 280 285
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
290 295 300
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
305 310 315 320
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
325 330 335
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
340 345
<210> 4
<211> 342
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 4
Thr Glu Val Lys Val Ile Gln Pro Glu Lys Ser Val Ser Val Ala Ala
1 5 10 15
Gly Asp Ser Thr Val Leu Asn Cys Thr Leu Thr Ser Leu Leu Pro Val
20 25 30
Gly Pro Ile Arg Trp Tyr Arg Gly Val Gly Gln Ser Arg Gln Leu Ile
35 40 45
Tyr Ser Phe Thr Thr Glu His Phe Pro Arg Val Thr Asn Val Ser Asp
50 55 60
Ala Thr Lys Arg Ser Asn Leu Asp Phe Ser Ile Arg Ile Ser Asn Val
65 70 75 80
Thr Pro Glu Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Gln Arg Gly
85 90 95
Ser Pro Asp Thr Glu Ile Gln Ser Gly Gly Gly Thr Glu Val Tyr Val
100 105 110
Leu Ala Lys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu
115 120 125
Ala Ala Gly Ala Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
130 135 140
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
145 150 155 160
Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly
165 170 175
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Ala
180 185 190
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
195 200 205
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro
210 215 220
Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
225 230 235 240
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn
245 250 255
Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
260 265 270
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
275 280 285
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
290 295 300
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
305 310 315 320
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
325 330 335
Ser Leu Ser Pro Gly Lys
340
<210> 5
<211> 119
<212> БЕЛОК
<213> Homo sapiens
<400> 5
Glu Glu Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Leu Val Ala
1 5 10 15
Ala Gly Glu Thr Ala Thr Leu Arg Cys Thr Ala Thr Ser Leu Ile Pro
20 25 30
Val Gly Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Gly Arg Glu Leu
35 40 45
Ile Tyr Asn Gln Lys Glu Gly His Phe Pro Arg Val Thr Thr Val Ser
50 55 60
Asp Leu Thr Lys Arg Asn Asn Met Asp Phe Ser Ile Arg Ile Gly Asn
65 70 75 80
Ile Thr Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys
85 90 95
Gly Ser Pro Asp Asp Val Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu
100 105 110
Ser Val Arg Ala Lys Pro Ser
115
<210> 6
<211> 118
<212> БЕЛОК
<213> Homo sapiens
<400> 6
Glu Glu Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Ser Val Ala
1 5 10 15
Ala Gly Glu Ser Ala Ile Leu His Cys Thr Val Thr Ser Leu Ile Pro
20 25 30
Val Gly Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Ala Arg Glu Leu
35 40 45
Ile Tyr Asn Gln Lys Glu Gly His Phe Pro Arg Val Thr Thr Val Ser
50 55 60
Glu Ser Thr Lys Arg Glu Asn Met Asp Phe Ser Ile Ser Ile Ser Asn
65 70 75 80
Ile Thr Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys
85 90 95
Gly Ser Pro Asp Thr Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser
100 105 110
Val Arg Ala Lys Pro Ser
115
<210> 7
<211> 119
<212> БЕЛОК
<213> Mus musculus
<400> 7
Lys Glu Leu Lys Val Thr Gln Pro Glu Lys Ser Val Ser Val Ala Ala
1 5 10 15
Gly Asp Ser Thr Val Leu Asn Cys Thr Leu Thr Ser Leu Leu Pro Val
20 25 30
Gly Pro Ile Lys Trp Tyr Arg Gly Val Gly Gln Ser Arg Leu Leu Ile
35 40 45
Tyr Ser Phe Thr Gly Glu His Phe Pro Arg Val Thr Asn Val Ser Asp
50 55 60
Ala Thr Lys Arg Asn Asn Met Asp Phe Ser Ile Arg Ile Ser Asn Val
65 70 75 80
Thr Pro Glu Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Gln Lys Gly
85 90 95
Pro Ser Glu Pro Asp Thr Glu Ile Gln Ser Gly Gly Gly Thr Glu Val
100 105 110
Tyr Val Leu Ala Lys Pro Ser
115
<210> 8
<211> 115
<212> БЕЛОК
<213> Mus musculus
<400> 8
Thr Glu Val Lys Val Ile Gln Pro Glu Lys Ser Val Ser Val Ala Ala
1 5 10 15
Gly Asp Ser Thr Val Leu Asn Cys Thr Leu Thr Ser Leu Leu Pro Val
20 25 30
Gly Pro Ile Arg Trp Tyr Arg Gly Val Gly Gln Ser Arg Gln Leu Ile
35 40 45
Tyr Ser Phe Thr Thr Glu His Phe Pro Arg Val Thr Asn Val Ser Asp
50 55 60
Ala Thr Lys Arg Ser Asn Leu Asp Phe Ser Ile Arg Ile Ser Asn Val
65 70 75 80
Thr Pro Glu Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Gln Arg Gly
85 90 95
Ser Pro Asp Thr Glu Ile Gln Ser Gly Gly Gly Thr Glu Val Tyr Val
100 105 110
Leu Ala Lys
115
<210> 9
<211> 117
<212> БЕЛОК
<213> Mus musculus
<400> 9
Lys Glu Leu Lys Val Thr Gln Pro Glu Lys Ser Val Ser Val Ala Ala
1 5 10 15
Gly Asp Ser Thr Val Leu Asn Cys Thr Leu Thr Ser Leu Leu Pro Val
20 25 30
Gly Pro Ile Arg Trp Tyr Arg Gly Val Gly Pro Ser Arg Leu Leu Ile
35 40 45
Tyr Ser Phe Ala Gly Glu Tyr Val Pro Arg Ile Arg Asn Val Ser Asp
50 55 60
Thr Thr Lys Arg Asn Asn Met Asp Phe Ser Ile Arg Ile Ser Asn Val
65 70 75 80
Thr Pro Ala Asp Ala Gly Ile Tyr Tyr Cys Val Lys Phe Gln Lys Gly
85 90 95
Ser Ser Glu Pro Asp Thr Glu Ile Gln Ser Gly Gly Gly Thr Glu Val
100 105 110
Tyr Val Leu Ala Lys
115
<210> 10
<211> 117
<212> БЕЛОК
<213> Mus musculus
<400> 10
Thr Glu Val Lys Val Thr Gln Pro Glu Lys Ser Val Ser Val Ala Ala
1 5 10 15
Gly Asp Ser Thr Ile Leu Asn Cys Thr Val Thr Ser Leu Leu Pro Val
20 25 30
Gly Pro Ile Arg Trp Tyr Arg Gly Val Gly Gln Ser Arg Leu Leu Ile
35 40 45
Tyr Ser Phe Thr Gly Glu His Phe Pro Arg Ile Arg Asn Val Ser Asp
50 55 60
Thr Thr Lys Arg Asn Asn Met Asp Phe Ser Ile Arg Ile Ser Asn Val
65 70 75 80
Thr Pro Glu Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Gln Arg Gly
85 90 95
Ser Ser Glu Pro Asp Thr Glu Ile Gln Ser Gly Gly Gly Thr Glu Val
100 105 110
Tyr Val Leu Ala Lys
115
<210> 11
<211> 118
<212> БЕЛОК
<213> Macaca fascicularis
<400> 11
Glu Glu Glu Leu Gln Val Ile Gln Pro Glu Lys Ser Val Ser Val Ala
1 5 10 15
Ala Gly Glu Ser Ala Thr Leu Asn Cys Thr Ala Thr Ser Leu Ile Pro
20 25 30
Val Gly Pro Ile Gln Trp Phe Arg Gly Val Gly Pro Gly Arg Glu Leu
35 40 45
Ile Tyr His Gln Lys Glu Gly His Phe Pro Arg Val Thr Pro Val Ser
50 55 60
Asp Pro Thr Lys Arg Asn Asn Met Asp Phe Ser Ile Arg Ile Ser Asn
65 70 75 80
Ile Thr Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys
85 90 95
Gly Ser Pro Asp Val Glu Leu Lys Ser Gly Ala Gly Thr Glu Leu Ser
100 105 110
Val Arg Ala Lys Pro Ser
115
<210> 12
<211> 118
<212> БЕЛОК
<213> Macaca fascicularis
<400> 12
Glu Glu Glu Leu Gln Val Ile Gln Pro Glu Lys Ser Val Ser Val Ala
1 5 10 15
Ala Gly Asp Ser Ala Thr Leu Asn Cys Thr Val Ser Ser Leu Ile Pro
20 25 30
Val Gly Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Gly Arg Glu Leu
35 40 45
Ile Tyr Asn Leu Lys Glu Gly His Phe Pro Arg Val Thr Ala Val Ser
50 55 60
Asp Pro Thr Lys Arg Asn Asn Met Asp Phe Ser Ile Arg Ile Ser Asn
65 70 75 80
Ile Thr Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys
85 90 95
Gly Ser Pro Asp Val Glu Leu Lys Ser Gly Ala Gly Thr Glu Leu Ser
100 105 110
Val Arg Ala Lys Pro Ser
115
<210> 13
<211> 119
<212> БЕЛОК
<213> Homo sapiens
<400> 13
Glu Asp Glu Leu Gln Val Ile Gln Pro Glu Lys Ser Val Ser Val Ala
1 5 10 15
Ala Gly Glu Ser Ala Thr Leu Arg Cys Ala Met Thr Ser Leu Ile Pro
20 25 30
Val Gly Pro Ile Met Trp Phe Arg Gly Ala Gly Ala Gly Arg Glu Leu
35 40 45
Ile Tyr Asn Gln Lys Glu Gly His Phe Pro Arg Val Thr Thr Val Ser
50 55 60
Glu Leu Thr Lys Arg Asn Asn Leu Asp Phe Ser Ile Ser Ile Ser Asn
65 70 75 80
Ile Thr Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys
85 90 95
Gly Ser Pro Asp Asp Val Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu
100 105 110
Ser Val Arg Ala Lys Pro Ser
115
<210> 14
<211> 119
<212> БЕЛОК
<213> Homo sapiens
<400> 14
Glu Glu Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Ile Ser Val Ala
1 5 10 15
Ala Gly Glu Ser Ala Thr Leu His Cys Thr Val Thr Ser Leu Ile Pro
20 25 30
Val Gly Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Gly Arg Glu Leu
35 40 45
Ile Tyr Asn Gln Lys Glu Gly His Phe Pro Arg Val Thr Thr Val Ser
50 55 60
Asp Leu Thr Lys Arg Asn Asn Met Asp Phe Ser Ile Arg Ile Ser Asn
65 70 75 80
Ile Thr Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys
85 90 95
Gly Ser Pro Asp His Val Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu
100 105 110
Ser Val Arg Ala Lys Pro Ser
115
<210> 15
<211> 119
<212> БЕЛОК
<213> Homo sapiens
<400> 15
Glu Glu Glu Leu Gln Met Ile Gln Pro Glu Lys Leu Leu Leu Val Thr
1 5 10 15
Val Gly Lys Thr Ala Thr Leu His Cys Thr Val Thr Ser Leu Leu Pro
20 25 30
Val Gly Pro Val Leu Trp Phe Arg Gly Val Gly Pro Gly Arg Glu Leu
35 40 45
Ile Tyr Asn Gln Lys Glu Gly His Phe Pro Arg Val Thr Thr Val Ser
50 55 60
Asp Leu Thr Lys Arg Asn Asn Met Asp Phe Ser Ile Arg Ile Ser Ser
65 70 75 80
Ile Thr Pro Ala Asp Val Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys
85 90 95
Gly Ser Pro Glu Asn Val Glu Phe Lys Ser Gly Pro Gly Thr Glu Met
100 105 110
Ala Leu Gly Ala Lys Pro Ser
115
<210> 16
<211> 117
<212> БЕЛОК
<213> Homo sapiens
<400> 16
Gln Leu Leu Phe Asn Lys Thr Lys Ser Val Glu Phe Thr Phe Ser Asn
1 5 10 15
Asp Thr Val Val Ile Pro Cys Phe Val Thr Asn Met Glu Ala Gln Asn
20 25 30
Thr Thr Glu Val Tyr Val Lys Trp Lys Phe Lys Gly Arg Asp Ile Tyr
35 40 45
Thr Phe Asp Gly Ala Leu Asn Lys Ser Thr Val Pro Thr Asp Phe Ser
50 55 60
Ser Ala Lys Ile Glu Val Ser Gln Leu Leu Lys Gly Asp Ala Ser Leu
65 70 75 80
Lys Met Asp Lys Ser Asp Ala Val Ser His Thr Gly Asn Tyr Thr Cys
85 90 95
Glu Val Thr Glu Leu Thr Arg Glu Gly Glu Thr Ile Ile Glu Leu Lys
100 105 110
Tyr Arg Val Val Ser
115
<210> 17
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 17
Glu Glu Glu Leu Gln Ile Ile Gln Pro Asp Lys Ser Val Leu Val Ala
1 5 10 15
Ala Gly Glu Thr Ala Thr Leu Arg Cys Thr Ile Thr Ser Leu Phe Pro
20 25 30
Val Gly Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Gly Arg Glu Leu
35 40 45
Ile Tyr Asn Gln Arg Glu Gly Pro Phe Pro Arg Val Thr Thr Val Ser
50 55 60
Asp Thr Thr Lys Arg Asn Asn Met Asp Phe Ser Ile Arg Ile Gly Ala
65 70 75 80
Ile Thr Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys
85 90 95
Gly Ser Pro Asp Asp Val Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu
100 105 110
Ser Val Arg Ala Lys Pro Ser
115
<210> 18
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 18
Glu Glu Glu Leu Gln Ile Ile Gln Pro Asp Lys Ser Val Ser Val Ala
1 5 10 15
Ala Gly Glu Ser Ala Ile Leu His Cys Thr Ile Thr Ser Leu Phe Pro
20 25 30
Val Gly Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Ala Arg Val Leu
35 40 45
Ile Tyr Asn Gln Arg Gln Gly Pro Phe Pro Arg Val Thr Thr Val Ser
50 55 60
Glu Thr Thr Lys Arg Glu Asn Met Asp Phe Ser Ile Ser Ile Ser Asn
65 70 75 80
Ile Thr Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Ile Lys Phe Arg Lys
85 90 95
Gly Ser Pro Asp Thr Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser
100 105 110
Val Arg Ala Lys Pro Ser
115
<210> 19
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 19
Glu Glu Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Ser Val Ala
1 5 10 15
Ala Gly Glu Ser Ala Ile Leu His Cys Thr Val Thr Ser Leu Phe Pro
20 25 30
Val Gly Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Ala Arg Glu Leu
35 40 45
Ile Tyr Asn Gln Arg Gln Gly Pro Phe Pro Arg Val Thr Thr Val Ser
50 55 60
Glu Ser Thr Lys Arg Glu Asn Met Asp Phe Ser Ile Ser Ile Ser Asn
65 70 75 80
Ile Thr Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys
85 90 95
Gly Ser Pro Asp Thr Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser
100 105 110
Val Arg Ala Lys Pro Ser
115
<210> 20
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 20
Glu Glu Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Ser Val Ala
1 5 10 15
Ala Gly Glu Ser Ala Ile Leu His Cys Thr Ile Thr Ser Leu Phe Pro
20 25 30
Val Gly Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Ala Arg Val Leu
35 40 45
Ile Tyr Asn Gln Arg Gln Gly Pro Phe Pro Arg Val Thr Thr Val Ser
50 55 60
Glu Thr Thr Lys Arg Glu Asn Met Asp Phe Ser Ile Ser Ile Ser Asn
65 70 75 80
Ile Thr Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Ile Lys Phe Arg Lys
85 90 95
Gly Ser Pro Asp Thr Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser
100 105 110
Val Arg Ala Lys Pro Ser
115
<210> 21
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 21
Glu Glu Glu Leu Gln Ile Ile Gln Pro Asp Lys Ser Val Ser Val Ala
1 5 10 15
Ala Gly Glu Ser Ala Ile Leu His Cys Thr Val Thr Ser Leu Phe Pro
20 25 30
Val Gly Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Ala Arg Val Leu
35 40 45
Ile Tyr Asn Gln Arg Gln Gly Pro Phe Pro Arg Val Thr Thr Val Ser
50 55 60
Glu Thr Thr Lys Arg Glu Asn Met Asp Phe Ser Ile Ser Ile Ser Asn
65 70 75 80
Ile Thr Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Ile Lys Phe Arg Lys
85 90 95
Gly Ser Pro Asp Thr Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser
100 105 110
Val Arg Ala Lys Pro Ser
115
<210> 22
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 22
Glu Glu Glu Leu Gln Ile Ile Gln Pro Asp Lys Ser Val Ser Val Ala
1 5 10 15
Ala Gly Glu Ser Ala Ile Leu His Cys Thr Ile Thr Ser Leu Ile Pro
20 25 30
Val Gly Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Ala Arg Val Leu
35 40 45
Ile Tyr Asn Gln Arg Gln Gly Pro Phe Pro Arg Val Thr Thr Val Ser
50 55 60
Glu Thr Thr Lys Arg Glu Asn Met Asp Phe Ser Ile Ser Ile Ser Asn
65 70 75 80
Ile Thr Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Ile Lys Phe Arg Lys
85 90 95
Gly Ser Pro Asp Thr Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser
100 105 110
Val Arg Ala Lys Pro Ser
115
<210> 23
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 23
Glu Glu Glu Leu Gln Ile Ile Gln Pro Asp Lys Ser Val Ser Val Ala
1 5 10 15
Ala Gly Glu Ser Ala Ile Leu His Cys Thr Ile Thr Ser Leu Phe Pro
20 25 30
Val Gly Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Ala Arg Glu Leu
35 40 45
Ile Tyr Asn Gln Arg Gln Gly Pro Phe Pro Arg Val Thr Thr Val Ser
50 55 60
Glu Thr Thr Lys Arg Glu Asn Met Asp Phe Ser Ile Ser Ile Ser Asn
65 70 75 80
Ile Thr Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Ile Lys Phe Arg Lys
85 90 95
Gly Ser Pro Asp Thr Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser
100 105 110
Val Arg Ala Lys Pro Ser
115
<210> 24
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 24
Glu Glu Glu Leu Gln Ile Ile Gln Pro Asp Lys Ser Val Ser Val Ala
1 5 10 15
Ala Gly Glu Ser Ala Ile Leu His Cys Thr Ile Thr Ser Leu Phe Pro
20 25 30
Val Gly Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Ala Arg Val Leu
35 40 45
Ile Tyr Asn Gln Lys Gln Gly Pro Phe Pro Arg Val Thr Thr Val Ser
50 55 60
Glu Thr Thr Lys Arg Glu Asn Met Asp Phe Ser Ile Ser Ile Ser Asn
65 70 75 80
Ile Thr Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Ile Lys Phe Arg Lys
85 90 95
Gly Ser Pro Asp Thr Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser
100 105 110
Val Arg Ala Lys Pro Ser
115
<210> 25
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 25
Glu Glu Glu Leu Gln Ile Ile Gln Pro Asp Lys Ser Val Ser Val Ala
1 5 10 15
Ala Gly Glu Ser Ala Ile Leu His Cys Thr Ile Thr Ser Leu Phe Pro
20 25 30
Val Gly Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Ala Arg Val Leu
35 40 45
Ile Tyr Asn Gln Arg Glu Gly Pro Phe Pro Arg Val Thr Thr Val Ser
50 55 60
Glu Thr Thr Lys Arg Glu Asn Met Asp Phe Ser Ile Ser Ile Ser Asn
65 70 75 80
Ile Thr Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Ile Lys Phe Arg Lys
85 90 95
Gly Ser Pro Asp Thr Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser
100 105 110
Val Arg Ala Lys Pro Ser
115
<210> 26
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 26
Glu Glu Glu Leu Gln Ile Ile Gln Pro Asp Lys Ser Val Ser Val Ala
1 5 10 15
Ala Gly Glu Ser Ala Ile Leu His Cys Thr Ile Thr Ser Leu Phe Pro
20 25 30
Val Gly Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Ala Arg Val Leu
35 40 45
Ile Tyr Asn Gln Arg Gln Gly His Phe Pro Arg Val Thr Thr Val Ser
50 55 60
Glu Thr Thr Lys Arg Glu Asn Met Asp Phe Ser Ile Ser Ile Ser Asn
65 70 75 80
Ile Thr Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Ile Lys Phe Arg Lys
85 90 95
Gly Ser Pro Asp Thr Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser
100 105 110
Val Arg Ala Lys Pro Ser
115
<210> 27
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 27
Glu Glu Glu Leu Gln Ile Ile Gln Pro Asp Lys Ser Val Ser Val Ala
1 5 10 15
Ala Gly Glu Ser Ala Ile Leu His Cys Thr Ile Thr Ser Leu Phe Pro
20 25 30
Val Gly Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Ala Arg Val Leu
35 40 45
Ile Tyr Asn Gln Arg Gln Gly Pro Phe Pro Arg Val Thr Thr Val Ser
50 55 60
Glu Ser Thr Lys Arg Glu Asn Met Asp Phe Ser Ile Ser Ile Ser Asn
65 70 75 80
Ile Thr Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Ile Lys Phe Arg Lys
85 90 95
Gly Ser Pro Asp Thr Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser
100 105 110
Val Arg Ala Lys Pro Ser
115
<210> 28
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 28
Glu Glu Glu Leu Gln Ile Ile Gln Pro Asp Lys Ser Val Ser Val Ala
1 5 10 15
Ala Gly Glu Ser Ala Ile Leu His Cys Thr Ile Thr Ser Leu Phe Pro
20 25 30
Val Gly Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Ala Arg Val Leu
35 40 45
Ile Tyr Asn Gln Arg Gln Gly Pro Phe Pro Arg Val Thr Thr Val Ser
50 55 60
Glu Thr Thr Lys Arg Glu Asn Met Asp Phe Ser Ile Ser Ile Ser Asn
65 70 75 80
Ile Thr Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys
85 90 95
Gly Ser Pro Asp Thr Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser
100 105 110
Val Arg Ala Lys Pro Ser
115
<210> 29
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 29
Glu Glu Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Ser Val Ala
1 5 10 15
Ala Gly Glu Ser Ala Ile Leu His Cys Thr Val Thr Ser Leu Ile Pro
20 25 30
Val Gly Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Ala Arg Glu Leu
35 40 45
Ile Tyr Asn Gln Arg Glu Gly Pro Phe Pro Arg Val Thr Thr Val Ser
50 55 60
Glu Ser Thr Lys Arg Glu Asn Met Asp Phe Ser Ile Ser Ile Ser Asn
65 70 75 80
Ile Thr Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys
85 90 95
Gly Ser Pro Asp Thr Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser
100 105 110
Val Arg Ala Lys Pro Ser
115
<210> 30
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 30
Glu Glu Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Ser Val Ala
1 5 10 15
Ala Gly Glu Ser Ala Ile Leu His Cys Thr Val Thr Ser Leu Phe Pro
20 25 30
Val Gly Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Ala Arg Glu Leu
35 40 45
Ile Tyr Asn Gln Arg Glu Gly Pro Phe Pro Arg Val Thr Thr Val Ser
50 55 60
Glu Ser Thr Lys Arg Glu Asn Met Asp Phe Ser Ile Ser Ile Ser Asn
65 70 75 80
Ile Thr Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys
85 90 95
Gly Ser Pro Asp Thr Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser
100 105 110
Val Arg Ala Lys Pro Ser
115
<210> 31
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 31
Glu Glu Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Ser Val Ala
1 5 10 15
Ala Gly Glu Ser Ala Ile Leu His Cys Thr Ile Thr Ser Leu Phe Pro
20 25 30
Val Gly Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Ala Arg Glu Leu
35 40 45
Ile Tyr Asn Gln Arg Glu Gly Pro Phe Pro Arg Val Thr Thr Val Ser
50 55 60
Glu Ser Thr Lys Arg Glu Asn Met Asp Phe Ser Ile Ser Ile Ser Asn
65 70 75 80
Ile Thr Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys
85 90 95
Gly Ser Pro Asp Thr Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser
100 105 110
Val Arg Ala Lys Pro Ser
115
<210> 32
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 32
Glu Glu Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Ser Val Ala
1 5 10 15
Ala Gly Glu Ser Ala Ile Leu His Cys Thr Ile Thr Ser Leu Phe Pro
20 25 30
Val Gly Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Ala Arg Glu Leu
35 40 45
Ile Tyr Asn Gln Arg Glu Gly Pro Phe Pro Arg Val Thr Thr Val Ser
50 55 60
Glu Thr Thr Lys Arg Glu Asn Met Asp Phe Ser Ile Ser Ile Ser Asn
65 70 75 80
Ile Thr Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys
85 90 95
Gly Ser Pro Asp Thr Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser
100 105 110
Val Arg Ala Lys Pro Ser
115
<210> 33
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 33
Glu Glu Glu Leu Gln Ile Ile Gln Pro Asp Lys Ser Val Ser Val Ala
1 5 10 15
Ala Gly Glu Ser Ala Ile Leu His Cys Thr Ile Thr Ser Leu Phe Pro
20 25 30
Val Gly Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Ala Arg Glu Leu
35 40 45
Ile Tyr Asn Gln Arg Glu Gly Pro Phe Pro Arg Val Thr Thr Val Ser
50 55 60
Glu Ser Thr Lys Arg Glu Asn Met Asp Phe Ser Ile Ser Ile Ser Asn
65 70 75 80
Ile Thr Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys
85 90 95
Gly Ser Pro Asp Thr Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser
100 105 110
Val Arg Ala Lys Pro Ser
115
<210> 34
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 34
Glu Glu Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Ser Val Ala
1 5 10 15
Ala Gly Glu Ser Ala Ile Leu His Cys Thr Ile Thr Ser Leu Ile Pro
20 25 30
Val Gly Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Ala Arg Glu Leu
35 40 45
Ile Tyr Asn Gln Arg Glu Gly Pro Phe Pro Arg Val Thr Thr Val Ser
50 55 60
Glu Ser Thr Lys Arg Glu Asn Met Asp Phe Ser Ile Ser Ile Ser Asn
65 70 75 80
Ile Thr Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys
85 90 95
Gly Ser Pro Asp Thr Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser
100 105 110
Val Arg Ala Lys Pro Ser
115
<210> 35
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 35
Glu Glu Glu Leu Gln Ile Ile Gln Pro Asp Lys Ser Val Ser Val Ala
1 5 10 15
Ala Gly Glu Ser Ala Ile Leu His Cys Thr Ile Thr Ser Leu Phe Pro
20 25 30
Val Gly Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Ala Arg Glu Leu
35 40 45
Ile Tyr Asn Gln Arg Glu Gly Pro Phe Pro Arg Val Thr Thr Val Ser
50 55 60
Glu Thr Thr Lys Arg Glu Asn Met Asp Phe Ser Ile Ser Ile Ser Asn
65 70 75 80
Ile Thr Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys
85 90 95
Gly Ser Pro Asp Thr Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser
100 105 110
Val Arg Ala Lys Pro Ser
115
<210> 36
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 36
Glu Glu Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Leu Val Ala
1 5 10 15
Ala Gly Glu Thr Ala Thr Leu Arg Cys Thr Ala Thr Ser Leu Phe Pro
20 25 30
Val Gly Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Gly Arg Glu Leu
35 40 45
Ile Tyr Asn Gln Arg Gln Gly Pro Phe Pro Arg Val Thr Thr Val Ser
50 55 60
Asp Leu Thr Lys Arg Asn Asn Met Asp Phe Ser Ile Arg Ile Gly Asn
65 70 75 80
Ile Thr Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys
85 90 95
Gly Ser Pro Asp Asp Val Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu
100 105 110
Ser Val Arg Ala Lys Pro Ser
115
<210> 37
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 37
Glu Glu Glu Leu Gln Ile Ile Gln Pro Asp Lys Ser Val Leu Val Ala
1 5 10 15
Ala Gly Glu Thr Ala Thr Leu Arg Cys Thr Ile Thr Ser Leu Phe Pro
20 25 30
Val Gly Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Gly Arg Glu Leu
35 40 45
Ile Tyr Asn Gln Arg Glu Gly Pro Phe Pro Arg Val Thr Thr Val Ser
50 55 60
Asp Leu Thr Lys Arg Asn Asn Met Asp Phe Ser Ile Arg Ile Gly Asn
65 70 75 80
Ile Thr Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys
85 90 95
Gly Ser Pro Asp Asp Val Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu
100 105 110
Ser Val Arg Ala Lys Pro Ser
115
<210> 38
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 38
Glu Glu Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Leu Val Ala
1 5 10 15
Ala Gly Glu Thr Ala Thr Leu Arg Cys Thr Ile Thr Ser Leu Phe Pro
20 25 30
Val Gly Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Gly Arg Glu Leu
35 40 45
Ile Tyr Asn Gln Arg Glu Gly Pro Phe Pro Arg Val Thr Thr Val Ser
50 55 60
Asp Thr Thr Lys Arg Asn Asn Met Asp Phe Ser Ile Arg Ile Gly Asn
65 70 75 80
Ile Thr Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys
85 90 95
Gly Ser Pro Asp Asp Val Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu
100 105 110
Ser Val Arg Ala Lys Pro Ser
115
<210> 39
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 39
Glu Glu Glu Leu Gln Ile Ile Gln Pro Asp Lys Ser Val Leu Val Ala
1 5 10 15
Ala Gly Glu Thr Ala Thr Leu Arg Cys Thr Ile Thr Ser Leu Phe Pro
20 25 30
Val Gly Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Gly Arg Glu Leu
35 40 45
Ile Tyr Asn Gln Arg Glu Gly Pro Phe Pro Arg Val Thr Thr Val Ser
50 55 60
Asp Thr Thr Lys Arg Asn Asn Met Asp Phe Ser Ile Arg Ile Gly Asn
65 70 75 80
Ile Thr Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys
85 90 95
Gly Ser Pro Asp Asp Val Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu
100 105 110
Ser Val Arg Ala Lys Pro Ser
115
<210> 40
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 40
Glu Glu Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Leu Val Ala
1 5 10 15
Ala Gly Glu Thr Ala Thr Leu Arg Cys Thr Ile Thr Ser Leu Phe Pro
20 25 30
Val Gly Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Gly Arg Glu Leu
35 40 45
Ile Tyr Asn Gln Arg Glu Gly Pro Phe Pro Arg Val Thr Thr Val Ser
50 55 60
Asp Leu Thr Lys Arg Asn Asn Met Asp Phe Ser Ile Arg Ile Gly Asn
65 70 75 80
Ile Thr Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys
85 90 95
Gly Ser Pro Asp Asp Val Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu
100 105 110
Ser Val Arg Ala Lys Pro Ser
115
<210> 41
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 41
Glu Glu Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Leu Val Ala
1 5 10 15
Ala Gly Glu Thr Ala Thr Leu Arg Cys Thr Ala Thr Ser Leu Phe Pro
20 25 30
Val Gly Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Gly Arg Glu Leu
35 40 45
Ile Tyr Asn Gln Arg Glu Gly Pro Phe Pro Arg Val Thr Thr Val Ser
50 55 60
Asp Leu Thr Lys Arg Asn Asn Met Asp Phe Ser Ile Arg Ile Gly Asn
65 70 75 80
Ile Thr Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys
85 90 95
Gly Ser Pro Asp Asp Val Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu
100 105 110
Ser Val Arg Ala Lys Pro Ser
115
<210> 42
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 42
Glu Glu Glu Leu Gln Ile Ile Gln Pro Asp Lys Ser Val Leu Val Ala
1 5 10 15
Ala Gly Glu Thr Ala Thr Leu Arg Cys Thr Ile Thr Ser Leu Phe Pro
20 25 30
Val Gly Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Gly Arg Val Leu
35 40 45
Ile Tyr Asn Gln Arg Gln Gly Pro Phe Pro Arg Val Thr Thr Val Ser
50 55 60
Asp Thr Thr Lys Arg Asn Asn Met Asp Phe Ser Ile Arg Ile Gly Asn
65 70 75 80
Ile Thr Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Ile Lys Phe Arg Lys
85 90 95
Gly Ser Pro Asp Asp Val Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu
100 105 110
Ser Val Arg Ala Lys Pro Ser
115
<210> 43
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 43
Glu Glu Glu Leu Gln Ile Ile Gln Pro Asp Lys Ser Val Leu Val Ala
1 5 10 15
Ala Gly Glu Thr Ala Thr Leu Arg Cys Thr Ile Thr Ser Leu Phe Pro
20 25 30
Val Gly Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Gly Arg Val Leu
35 40 45
Ile Tyr Asn Gln Arg Gln Gly Pro Phe Pro Arg Val Thr Thr Val Ser
50 55 60
Asp Thr Thr Lys Arg Asn Asn Met Asp Phe Ser Ile Arg Ile Gly Ala
65 70 75 80
Ile Thr Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Ile Lys Phe Arg Lys
85 90 95
Gly Ser Pro Asp Asp Val Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu
100 105 110
Ser Val Arg Ala Lys Pro Ser
115
<210> 44
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 44
Glu Glu Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Leu Val Ala
1 5 10 15
Ala Gly Glu Thr Ala Thr Leu Arg Cys Thr Ala Thr Ser Leu Phe Pro
20 25 30
Val Gly Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Gly Arg Glu Leu
35 40 45
Ile Tyr Asn Gln Arg Gln Gly Pro Phe Pro Arg Val Thr Thr Val Ser
50 55 60
Asp Leu Thr Lys Arg Asn Asn Met Asp Phe Ser Ile Arg Ile Gly Ala
65 70 75 80
Ile Thr Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys
85 90 95
Gly Ser Pro Asp Asp Val Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu
100 105 110
Ser Val Arg Ala Lys Pro Ser
115
<210> 45
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 45
Glu Glu Glu Leu Gln Ile Ile Gln Pro Asp Lys Ser Val Leu Val Ala
1 5 10 15
Ala Gly Glu Thr Ala Thr Leu Arg Cys Thr Ile Thr Ser Leu Phe Pro
20 25 30
Val Gly Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Gly Arg Val Leu
35 40 45
Ile Tyr Asn Gln Arg Glu Gly Pro Phe Pro Arg Val Thr Thr Val Ser
50 55 60
Asp Thr Thr Lys Arg Asn Asn Met Asp Phe Ser Ile Arg Ile Gly Ala
65 70 75 80
Ile Thr Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Ile Lys Phe Arg Lys
85 90 95
Gly Ser Pro Asp Asp Val Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu
100 105 110
Ser Val Arg Ala Lys Pro Ser
115
<210> 46
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 46
Glu Glu Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Leu Val Ala
1 5 10 15
Ala Gly Glu Thr Ala Thr Leu Arg Cys Thr Ala Thr Ser Leu Phe Pro
20 25 30
Val Gly Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Gly Arg Glu Leu
35 40 45
Ile Tyr Asn Gln Arg Glu Gly Pro Phe Pro Arg Val Thr Thr Val Ser
50 55 60
Asp Leu Thr Lys Arg Asn Asn Met Asp Phe Ser Ile Arg Ile Gly Ala
65 70 75 80
Ile Thr Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys
85 90 95
Gly Ser Pro Asp Asp Val Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu
100 105 110
Ser Val Arg Ala Lys Pro Ser
115
<210> 47
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 47
Glu Glu Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Leu Val Ala
1 5 10 15
Ala Gly Glu Thr Ala Thr Leu Arg Cys Thr Ile Thr Ser Leu Phe Pro
20 25 30
Val Gly Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Gly Arg Glu Leu
35 40 45
Ile Tyr Asn Gln Arg Glu Gly Pro Phe Pro Arg Val Thr Thr Val Ser
50 55 60
Asp Leu Thr Lys Arg Asn Asn Met Asp Phe Ser Ile Arg Ile Gly Ala
65 70 75 80
Ile Thr Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys
85 90 95
Gly Ser Pro Asp Asp Val Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu
100 105 110
Ser Val Arg Ala Lys Pro Ser
115
<210> 48
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 48
Glu Glu Glu Leu Gln Ile Ile Gln Pro Asp Lys Ser Val Leu Val Ala
1 5 10 15
Ala Gly Glu Thr Ala Thr Leu Arg Cys Thr Ile Thr Ser Leu Phe Pro
20 25 30
Val Gly Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Gly Arg Glu Leu
35 40 45
Ile Tyr Asn Gln Arg Glu Gly Pro Phe Pro Arg Val Thr Thr Val Ser
50 55 60
Asp Leu Thr Lys Arg Asn Asn Met Asp Phe Ser Ile Arg Ile Gly Ala
65 70 75 80
Ile Thr Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys
85 90 95
Gly Ser Pro Asp Asp Val Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu
100 105 110
Ser Val Arg Ala Lys Pro Ser
115
<210> 49
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 49
Glu Glu Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Leu Val Ala
1 5 10 15
Ala Gly Glu Thr Ala Thr Leu Arg Cys Thr Ile Thr Ser Leu Phe Pro
20 25 30
Val Gly Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Gly Arg Glu Leu
35 40 45
Ile Tyr Asn Gln Arg Glu Gly Pro Phe Pro Arg Val Thr Thr Val Ser
50 55 60
Asp Thr Thr Lys Arg Asn Asn Met Asp Phe Ser Ile Arg Ile Gly Ala
65 70 75 80
Ile Thr Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys
85 90 95
Gly Ser Pro Asp Asp Val Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu
100 105 110
Ser Val Arg Ala Lys Pro Ser
115
<210> 50
<211> 119
<212> БЕЛОК
<213> Homo sapiens
<400> 50
Glu Glu Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Leu Val Ala
1 5 10 15
Ala Gly Glu Thr Ala Thr Leu Arg Cys Thr Ala Thr Ser Leu Ile Pro
20 25 30
Val Gly Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Gly Arg Glu Leu
35 40 45
Ile Tyr Asn Gln Lys Glu Gly His Phe Pro Arg Val Thr Thr Val Ser
50 55 60
Asp Leu Thr Lys Arg Asn Asn Met Asp Phe Ser Ile Arg Ile Gly Asn
65 70 75 80
Ile Thr Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys
85 90 95
Gly Ser Pro Asp Asp Val Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu
100 105 110
Ser Val Arg Ala Lys Pro Ser
115
<210> 51
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 51
Glu Glu Glu Leu Gln Ile Ile Gln Pro Asp Lys Ser Val Leu Val Ala
1 5 10 15
Ala Gly Glu Thr Ala Thr Leu Arg Cys Thr Ile Thr Ser Leu Phe Pro
20 25 30
Val Gly Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Gly Arg Glu Leu
35 40 45
Ile Tyr Asn Gln Arg Glu Gly Pro Phe Pro Arg Val Thr Thr Val Ser
50 55 60
Asp Thr Thr Lys Arg Asn Asn Met Asp Phe Ser Ile Arg Ile Gly Ala
65 70 75 80
Ile Thr Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys
85 90 95
Gly Ser Pro Asp Asp Val Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu
100 105 110
Ser Val Arg Ala Lys Pro Ser
115
<210> 52
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 52
Glu Glu Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Leu Val Ala
1 5 10 15
Ala Gly Glu Thr Ala Thr Leu Arg Cys Thr Ala Thr Ser Leu Phe Pro
20 25 30
Val Gly Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Gly Arg Glu Leu
35 40 45
Ile Tyr Asn Gln Arg Gln Gly Pro Phe Pro Arg Val Thr Thr Val Ser
50 55 60
Asp Leu Thr Lys Arg Asn Asn Met Asp Phe Ser Ile Arg Ile Gly Asn
65 70 75 80
Ile Thr Val Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys
85 90 95
Gly Ser Pro Asp Asp Val Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu
100 105 110
Ser Val Arg Ala Lys Pro Ser
115
<210> 53
<211> 484
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 53
Ala Leu Thr Gln Pro Ala Ser Val Ser Ala Asn Pro Gly Glu Thr Val
1 5 10 15
Glu Ile Thr Cys Ser Gly Gly Gly Ser Asn Asn Ala Tyr Gly Trp Phe
20 25 30
Gln Gln Lys Ser Pro Gly Ser Ala Pro Leu Thr Val Ile Tyr Asp Asn
35 40 45
Gly Lys Arg Pro Ser Asp Ile Pro Ser Arg Phe Ser Gly Ser Lys Ser
50 55 60
Asp Ser Thr Gly Thr Leu Thr Ile Thr Arg Val Gln Ala Glu Asp Glu
65 70 75 80
Ala Val Tyr Tyr Cys Gly Ser Ala Asp Asn Ser Gly Ala Gly Val Phe
85 90 95
Gly Ala Gly Thr Thr Leu Thr Val Leu Gly Gln Ser Ser Arg Ser Ser
100 105 110
Gly Gly Gly Gly Ser Ser Gly Gly Gly Gly Ser Met Ala Ala Val Thr
115 120 125
Leu Asp Glu Ser Gly Gly Gly Leu Gln Thr Pro Gly Gly Ala Leu Ser
130 135 140
Leu Val Cys Lys Gly Ser Gly Phe Thr Phe Ser Ser His Ala Met Asn
145 150 155 160
Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Gly Ile
165 170 175
Ser Ser Asp Gly Arg Phe Thr Tyr Tyr Gly Ala Ala Val Gln Gly Arg
180 185 190
Ala Thr Ile Ser Arg Asp Asn Gly Gln Ser Thr Val Arg Leu Gln Leu
195 200 205
Asn Asn Leu Arg Ala Glu Asp Thr Ala Thr Tyr Tyr Cys Thr Lys Asn
210 215 220
Gly Gly Cys Gly Ser Gly Gly Asp Leu Asp Cys Ile Asp Ala Trp Gly
225 230 235 240
His Gly Thr Glu Val Ile Val Ser Ser Ser Leu Asp Pro Lys Ser Ser
245 250 255
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
260 265 270
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
275 280 285
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
290 295 300
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
305 310 315 320
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
325 330 335
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
340 345 350
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
355 360 365
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
370 375 380
Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
385 390 395 400
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
405 410 415
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
420 425 430
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
435 440 445
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
450 455 460
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
465 470 475 480
Pro Gly Lys Val
<210> 54
<211> 480
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 54
Ala Val Thr Gln Pro Ala Ser Val Ser Ala Asn Pro Gly Glu Thr Val
1 5 10 15
Arg Ile Thr Cys Ser Gly Asp Ser Ser Ser Tyr Tyr Ser Trp His Gln
20 25 30
Gln Lys Ser Pro Gly Ser Ala Pro Val Ser Val Ile Tyr Ser Asn Thr
35 40 45
Asp Arg Pro Ser Asp Ile Pro Ser Arg Phe Ser Gly Ser Ala Ser Gly
50 55 60
Ser Thr Ala Thr Leu Thr Ile Thr Gly Val Gln Ala Glu Asp Glu Ala
65 70 75 80
Val Tyr Phe Cys Gly Ala Tyr Asp Ser Ser Ser Asp Ser Asp Ile Phe
85 90 95
Gly Ala Gly Thr Thr Leu Thr Val Leu Gly Gln Ser Ser Arg Ser Ser
100 105 110
Gly Gly Gly Gly Ser Ser Gly Gly Gly Gly Ser Met Ala Ala Val Thr
115 120 125
Leu Asp Glu Ser Gly Gly Gly Leu Gln Thr Pro Gly Gly Gly Leu Ser
130 135 140
Leu Val Cys Lys Ala Ser Gly Phe Asp Phe Ser Asn Phe Asn Met Ala
145 150 155 160
Trp Val Arg Gln Gly Pro Gly Lys Gly Leu Glu Tyr Val Ala Glu Ile
165 170 175
Ser Asp Thr Gly Ser Thr Pro Tyr Tyr Gly Ser Ala Val Gln Gly Arg
180 185 190
Ala Thr Ile Ser Arg Asp Asn Gly Gln Ser Thr Val Arg Leu Gln Leu
195 200 205
Asn Asn Leu Arg Ala Glu Asp Thr Gly Thr Tyr Phe Cys Thr Arg Asn
210 215 220
Phe Gly Ser Ser Val Ser Ser Ile Asp Ala Trp Gly His Gly Thr Glu
225 230 235 240
Val Ile Val Ser Ser Ser Leu Asp Pro Lys Ser Ser Asp Lys Thr His
245 250 255
Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val
260 265 270
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
275 280 285
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
290 295 300
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
305 310 315 320
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
325 330 335
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
340 345 350
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
355 360 365
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
370 375 380
Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
385 390 395 400
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
405 410 415
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
420 425 430
Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
435 440 445
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
450 455 460
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys Val
465 470 475 480
<210> 55
<211> 491
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 55
Ala Val Thr Gln Pro Ser Ser Val Ser Ala Asn Pro Gly Glu Thr Val
1 5 10 15
Glu Ile Thr Cys Ser Gly Ser Ser Thr Tyr Tyr Gly Trp Tyr Gln Gln
20 25 30
Lys Ser Pro Gly Ser Ala Pro Val Thr Val Ile Tyr Asp Asn Asp Lys
35 40 45
Arg Pro Ser Asp Ile Pro Ser Arg Phe Ser Gly Ser Lys Ser Gly Ser
50 55 60
Thr His Thr Leu Ile Ile Thr Gly Val Gln Val Glu Asp Glu Ala Val
65 70 75 80
Tyr Phe Cys Gly Asn Glu Asp Asn Asn Tyr Val Ala Ile Phe Gly Ala
85 90 95
Gly Thr Thr Leu Thr Val Leu Gly Gln Ser Ser Arg Ser Ser Gly Gly
100 105 110
Gly Gly Ser Ser Gly Gly Gly Gly Ser Met Ala Ala Val Thr Leu Asp
115 120 125
Glu Ser Gly Gly Gly Leu Gln Thr Pro Gly Gly Ala Leu Ser Leu Val
130 135 140
Cys Lys Ala Ser Gly Phe Thr Phe Ser Ser Tyr Asn Met Gly Trp Val
145 150 155 160
Arg Gln Ala Pro Gly Lys Gly Leu Glu Phe Val Ala Gly Ile Tyr Ala
165 170 175
Ser Gly Ser Ser Thr Asp Thr Asp Thr Thr Tyr Gly Pro Ala Val Ala
180 185 190
Gly Arg Ala Thr Ile Ser Arg Asp Asn Gly Gln Ser Thr Val Arg Leu
195 200 205
Gln Leu Asn Asn Leu Arg Ala Glu Asp Thr Gly Thr Tyr Tyr Cys Ala
210 215 220
Lys Ala Ala Gly Gly Cys Ser Thr His Thr Cys Thr Ala Tyr Ile Ala
225 230 235 240
Asp Ser Ile Asp Ala Trp Gly His Gly Thr Glu Val Ile Val Ser Ser
245 250 255
Ser Leu Asp Pro Lys Ser Ser Asp Lys Thr His Thr Cys Pro Pro Cys
260 265 270
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
275 280 285
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
290 295 300
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
305 310 315 320
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
325 330 335
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
340 345 350
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
355 360 365
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
370 375 380
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu
385 390 395 400
Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
405 410 415
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
420 425 430
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
435 440 445
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
450 455 460
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
465 470 475 480
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys Val
485 490
<210> 56
<211> 489
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 56
Ala Leu Thr Gln Pro Ser Ser Val Ser Ala Asn Pro Gly Glu Thr Val
1 5 10 15
Lys Ile Thr Cys Ser Gly Asp Asn Ser Ala His Tyr Tyr Tyr Gly Trp
20 25 30
Tyr Gln Gln Lys Ser Pro Gly Ser Ala Pro Val Thr Val Ile Tyr Tyr
35 40 45
Asn Asp Lys Arg Pro Ser Gly Ile Pro Ser Arg Phe Ser Gly Ser Ala
50 55 60
Ser Gly Ser Thr Ala Thr Leu Ile Ile Thr Gly Val Gln Val Glu Asp
65 70 75 80
Glu Ala Val Tyr Phe Cys Gly Ser Ala Asp Ser Ser Asn Pro Ala Ile
85 90 95
Phe Gly Ala Gly Thr Thr Leu Thr Val Leu Gly Gln Ser Ser Arg Ser
100 105 110
Ser Gly Gly Gly Gly Ser Ser Gly Gly Gly Gly Ser Met Ala Ala Val
115 120 125
Thr Leu Asp Glu Ser Gly Gly Gly Leu Gln Thr Pro Gly Arg Ala Leu
130 135 140
Ser Leu Val Cys Arg Gly Ser Gly Phe Ser Ile Ser Ser Tyr Asn Met
145 150 155 160
Gly Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Phe Ile Ala Ser
165 170 175
Ile Gly Ser Asp Gly Ser Ser Thr His Tyr Ala Pro Ala Val Lys Gly
180 185 190
Arg Ala Thr Ile Thr Arg Asp Val Gly Gln Ser Thr Val Arg Leu Gln
195 200 205
Leu Asn Asn Leu Arg Ala Glu Asp Thr Gly Thr Tyr Phe Cys Ala Lys
210 215 220
Asp Ala Tyr Gln Cys Ser Tyr Ala Thr Cys Asn Asp Tyr Leu Asp Thr
225 230 235 240
Ile Asp Ala Trp Gly His Gly Thr Glu Val Ile Val Ser Ser Ser Leu
245 250 255
Asp Pro Lys Ser Ser Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala
260 265 270
Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
275 280 285
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
290 295 300
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
305 310 315 320
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
325 330 335
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
340 345 350
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
355 360 365
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
370 375 380
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr
385 390 395 400
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
405 410 415
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
420 425 430
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
435 440 445
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
450 455 460
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
465 470 475 480
Ser Leu Ser Leu Ser Pro Gly Lys Val
485
<210> 57
<211> 487
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 57
Ala Val Thr Gln Pro Ala Ser Val Ser Ala Asn Pro Gly Glu Thr Val
1 5 10 15
Lys Ile Thr Cys Ser Gly Ser Ser Ser Gly Ser Tyr Gly Trp Tyr Gln
20 25 30
Gln Lys Ser Pro Gly Ser Ala Pro Val Thr Leu Ile Tyr Glu Thr Asn
35 40 45
Lys Arg Pro Ser Asn Ile Pro Ser Arg Phe Ser Gly Ser Lys Ser Gly
50 55 60
Ser Thr Ala Thr Leu Thr Ile Thr Gly Val Gln Ala Asp Asp Glu Ala
65 70 75 80
Val Tyr Tyr Cys Gly Ser Glu Asp Ser Ser Thr Tyr Leu Ser Ile Phe
85 90 95
Gly Ala Gly Thr Thr Leu Thr Val Leu Gly Gln Ser Ser Arg Ser Ser
100 105 110
Gly Gly Gly Gly Ser Ser Gly Gly Gly Gly Ser Met Ala Ala Val Thr
115 120 125
Leu Asp Glu Ser Gly Gly Gly Leu Gln Thr Pro Gly Gly Ala Leu Ser
130 135 140
Leu Val Cys Lys Ala Ser Gly Phe Thr Phe Ser Ser Phe Asn Met Gly
145 150 155 160
Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Phe Val Ala Ala Ile
165 170 175
Tyr Ser Gly Asn Ser Ala Glu Tyr Gly Ala Ala Val Gln Gly Arg Ala
180 185 190
Thr Ile Ser Arg Asp Asn Gly Gln Ser Thr Val Arg Leu Gln Leu Asn
195 200 205
Asn Leu Arg Ala Glu Asp Thr Gly Ile Tyr Phe Cys Ala Lys Asp Ala
210 215 220
Gly Ser Gly Cys Tyr Ser Gly Val Cys Ala Gly Thr Ser Ser Ile Asp
225 230 235 240
Ala Trp Gly His Gly Thr Glu Val Ile Val Ser Ser Ser Leu Asp Pro
245 250 255
Lys Ser Ser Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu
260 265 270
Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
275 280 285
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
290 295 300
Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly
305 310 315 320
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn
325 330 335
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
340 345 350
Leu Asn Gly Glu Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro
355 360 365
Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
370 375 380
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn
385 390 395 400
Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
405 410 415
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
420 425 430
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
435 440 445
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
450 455 460
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
465 470 475 480
Ser Leu Ser Pro Gly Lys Val
485
<210> 58
<211> 489
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 58
Ala Val Thr Gln Pro Ala Ser Val Ser Ala Asn Pro Gly Glu Thr Val
1 5 10 15
Lys Ile Thr Cys Ser Gly Asp Ser Ser Tyr Tyr Gly Trp Tyr Gln Gln
20 25 30
Lys Ser Pro Gly Ser Ala Pro Val Thr Val Ile Tyr Asp Asp Asn Lys
35 40 45
Arg Pro Ser Asn Ile Pro Ser Arg Phe Ser Gly Ser Lys Ser Gly Ser
50 55 60
Thr Gly Thr Leu Thr Ile Thr Gly Val Gln Ala Asp Asp Glu Ala Val
65 70 75 80
Tyr Phe Cys Gly Asn Glu Asp Asn Ser Tyr Val Ala Ile Phe Gly Ala
85 90 95
Gly Thr Thr Leu Thr Val Leu Gly Gln Ser Ser Arg Ser Ser Gly Gly
100 105 110
Gly Gly Ser Ser Gly Gly Gly Gly Ser Met Ala Ala Val Thr Leu Asp
115 120 125
Glu Ser Gly Gly Gly Leu Gln Thr Pro Gly Gly Ala Leu Ser Leu Val
130 135 140
Cys Lys Ala Ser Gly Phe Thr Phe Ser Ser Tyr Asn Met Gly Trp Val
145 150 155 160
Arg Gln Ala Pro Gly Lys Gly Leu Glu Phe Val Ala Gly Ile Tyr Ile
165 170 175
Ala Ser Gly Asp Leu Gly Thr Thr Tyr Gly Ala Ala Val Gln Gly Arg
180 185 190
Ala Thr Ile Ser Arg Asp Asp Gly Gln Ser Thr Val Arg Leu Gln Leu
195 200 205
Asn Asn Leu Arg Ala Glu Asp Thr Gly Thr Tyr Phe Cys Ala Lys Ser
210 215 220
Ala Gly Gly Cys Ser Ala His Ser Cys Asp Thr Tyr Ile Ala Asp Ser
225 230 235 240
Ile Asp Ala Trp Gly His Gly Thr Glu Val Ile Val Ser Ser Ser Leu
245 250 255
Asp Pro Lys Ser Ser Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala
260 265 270
Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
275 280 285
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
290 295 300
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
305 310 315 320
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
325 330 335
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
340 345 350
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
355 360 365
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
370 375 380
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr
385 390 395 400
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
405 410 415
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
420 425 430
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
435 440 445
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
450 455 460
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
465 470 475 480
Ser Leu Ser Leu Ser Pro Gly Lys Val
485
<210> 59
<211> 490
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 59
Ala Val Thr Gln Pro Ala Ser Val Ser Ala Asn Pro Gly Glu Thr Val
1 5 10 15
Lys Ile Thr Cys Ser Gly Ser Ser Ser Tyr Tyr Gly Trp Tyr Arg Gln
20 25 30
Lys Ser Pro Gly Ser Ala Pro Val Thr Leu Ile Tyr Asp Asn Asp Lys
35 40 45
Arg Pro Ser Gly Ile Pro Ser Arg Phe Ser Gly Ser Lys Ser Gly Ser
50 55 60
Thr Asn Thr Leu Thr Ile Thr Gly Val Gln Ala Asp Asp Glu Ala Val
65 70 75 80
Tyr Tyr Cys Gly Asn Glu Asp Asn Ser Tyr Val Gly Ile Phe Gly Ala
85 90 95
Gly Thr Thr Leu Thr Val Leu Gly Gln Ser Ser Arg Ser Ser Gly Gly
100 105 110
Gly Gly Ser Ser Gly Gly Gly Gly Ser Met Ala Ala Val Thr Leu Asp
115 120 125
Glu Ser Gly Gly Gly Leu Gln Thr Pro Gly Gly Ala Leu Ser Leu Val
130 135 140
Cys Lys Ala Ser Gly Phe Thr Phe Ser Ser Tyr Asn Met Gly Trp Val
145 150 155 160
Arg Gln Ala Pro Asp Lys Gly Leu Glu Phe Val Ala Gly Ile Tyr Thr
165 170 175
Gly Ser Asp Ala Gly Leu Ser Thr Thr Tyr Gly Ala Ala Val Gln Gly
180 185 190
Arg Ala Thr Ile Ser Arg Asp Asn Gly Gln Ser Thr Val Arg Leu Gln
195 200 205
Leu Asn Asn Leu Gly Ala Glu Asp Thr Gly Ile Tyr Phe Cys Thr Lys
210 215 220
Ser Ala Gly Gly Cys Ser Asp Tyr Asn Cys Asp Ala Tyr Ile Ala Asp
225 230 235 240
Ser Ile Asp Ala Trp Gly His Gly Thr Glu Val Ile Val Ser Ser Ser
245 250 255
Leu Asp Pro Lys Ser Ser Asp Lys Thr His Thr Cys Pro Pro Cys Pro
260 265 270
Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
275 280 285
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
290 295 300
Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr
305 310 315 320
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
325 330 335
Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
340 345 350
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
355 360 365
Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
370 375 380
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu
385 390 395 400
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
405 410 415
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
420 425 430
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
435 440 445
Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val
450 455 460
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
465 470 475 480
Lys Ser Leu Ser Leu Ser Pro Gly Lys Val
485 490
<210> 60
<211> 489
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 60
Ala Val Thr Gln Pro Ala Ser Val Ser Ala Asn Leu Gly Glu Thr Val
1 5 10 15
Lys Ile Thr Cys Ser Gly Asp Ser Ser Tyr Tyr Gly Trp Tyr Gln Gln
20 25 30
Lys Ala Pro Gly Ser Ala Pro Val Thr Leu Ile Tyr Asp Asn Asp Lys
35 40 45
Arg Pro Ser Asn Ile Pro Ser Arg Phe Ser Gly Ser Lys Ser Gly Ser
50 55 60
Thr Ala Thr Leu Thr Ile Thr Gly Val Gln Ala Asp Asp Glu Ala Val
65 70 75 80
Tyr Tyr Cys Gly Asn Glu Asp Met Asn Tyr Val Gly Ile Phe Gly Ala
85 90 95
Gly Thr Thr Leu Thr Val Leu Gly Gln Ser Ser Arg Ser Ser Gly Gly
100 105 110
Gly Gly Ser Ser Gly Gly Gly Gly Ser Met Ala Ala Val Thr Leu Asp
115 120 125
Glu Ser Gly Gly Gly Leu Gln Thr Pro Gly Gly Ala Leu Ser Leu Val
130 135 140
Cys Lys Ala Ser Gly Phe Thr Phe Asn Ser Tyr Asn Met Gly Trp Val
145 150 155 160
Arg Gln Ala Pro Gly Lys Gly Leu Glu Phe Val Ala Gly Ile Tyr Ser
165 170 175
Ala Gly Gly Asp Thr Ser Thr Thr Tyr Gly Ala Ala Val Asn Gly Arg
180 185 190
Ala Thr Ile Ser Arg Asp Asn Gly Gln Ser Thr Val Arg Leu Gln Leu
195 200 205
Asn Asn Leu Arg Ala Glu Asp Thr Gly Ile Tyr Phe Cys Ala Lys Ala
210 215 220
Ala Gly Gly Cys Thr Ala His Asn Cys Asp Ala Tyr Ile Ala Asp Ser
225 230 235 240
Ile Asp Ala Trp Gly His Gly Thr Glu Val Ile Val Ser Ser Ser Leu
245 250 255
Asp Pro Lys Ser Ser Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala
260 265 270
Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
275 280 285
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
290 295 300
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
305 310 315 320
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
325 330 335
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
340 345 350
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
355 360 365
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
370 375 380
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr
385 390 395 400
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
405 410 415
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
420 425 430
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
435 440 445
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
450 455 460
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
465 470 475 480
Ser Leu Ser Leu Ser Pro Gly Lys Val
485
<210> 61
<211> 480
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 61
Glu Thr Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Thr Val Gly Ser Lys
20 25 30
Leu Ala Trp His Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Thr Asn Arg Ala Thr Gly Ile Ser Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Thr
65 70 75 80
Glu Asp Ser Ala Val Tyr Tyr Cys Gln Gln Tyr Tyr Tyr Trp Pro Pro
85 90 95
Tyr Arg Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Gly Gln Ser Ser
100 105 110
Arg Ser Ser Gly Gly Gly Gly Ser Ser Gly Gly Gly Gly Ser Asp Val
115 120 125
Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu Ser Leu
130 135 140
Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Ser Ser Tyr Ala Met
145 150 155 160
Asn Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Val Ser Arg
165 170 175
Ile Asn Ser Gly Gly Gly Gly Thr Asp Tyr Ala Glu Ser Val Lys Gly
180 185 190
Arg Phe Thr Ile Ser Arg Asp Asn Ser Glu Asn Thr Leu Tyr Leu Gln
195 200 205
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Lys
210 215 220
Gln Tyr Asp Trp Asn Ser Phe Phe Asp Tyr Trp Gly Leu Gly Ala Leu
225 230 235 240
Val Thr Val Ser Ser Ser Leu Asp Pro Lys Ser Ser Asp Lys Thr His
245 250 255
Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val
260 265 270
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
275 280 285
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
290 295 300
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
305 310 315 320
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
325 330 335
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
340 345 350
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
355 360 365
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
370 375 380
Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
385 390 395 400
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
405 410 415
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
420 425 430
Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
435 440 445
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
450 455 460
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys Val
465 470 475 480
<210> 62
<211> 480
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 62
Glu Thr Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Thr Val Gly Ser Lys
20 25 30
Leu Ala Trp His Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Thr Asn Arg Ala Thr Gly Ile Ser Asp Arg Phe Ser Gly
50 55 60
Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Thr
65 70 75 80
Glu Asp Ser Ala Val Tyr Tyr Cys Gln Gln Tyr Tyr Tyr Trp Pro Pro
85 90 95
Tyr Arg Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Gly Gln Ser Ser
100 105 110
Arg Ser Ser Gly Gly Gly Gly Ser Ser Gly Gly Gly Gly Ser Asp Val
115 120 125
Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu Ser Leu
130 135 140
Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Ser Ser Tyr Ala Met
145 150 155 160
Asn Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Val Ser Arg
165 170 175
Ile Asn Ser Gly Gly Gly Gly Thr Asp Tyr Ala Glu Ser Val Lys Gly
180 185 190
Arg Phe Thr Ile Ser Arg Asp Asn Ser Glu Asn Thr Leu Tyr Leu Gln
195 200 205
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Lys
210 215 220
Gln Tyr Asp Trp Asn Ser Phe Phe Asp Tyr Trp Gly Leu Gly Ala Leu
225 230 235 240
Val Thr Val Ser Ser Ser Leu Asp Pro Lys Ser Ser Asp Lys Thr His
245 250 255
Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val
260 265 270
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
275 280 285
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
290 295 300
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
305 310 315 320
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
325 330 335
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
340 345 350
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
355 360 365
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
370 375 380
Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
385 390 395 400
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
405 410 415
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
420 425 430
Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
435 440 445
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
450 455 460
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys Val
465 470 475 480
<210> 63
<211> 480
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 63
Glu Thr Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Thr Val Gly Ser Lys
20 25 30
Leu Ala Trp His Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Thr Asn Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Thr
65 70 75 80
Glu Asp Ser Ala Val Tyr Tyr Cys Gln Gln Tyr Tyr Tyr Trp Pro Pro
85 90 95
Tyr Arg Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Gly Gln Ser Ser
100 105 110
Arg Ser Ser Gly Gly Gly Gly Ser Ser Arg Gly Gly Gly Ser Asp Val
115 120 125
Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu Ser Leu
130 135 140
Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Ser Ser Tyr Ala Met
145 150 155 160
Asn Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Val Ser Arg
165 170 175
Ile Asn Ser Gly Gly Gly Gly Thr Asp Tyr Ala Glu Ser Val Lys Gly
180 185 190
Arg Phe Thr Ile Ser Arg Asp Asn Ser Glu Asn Thr Leu Tyr Leu Gln
195 200 205
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Lys
210 215 220
Gln Tyr Asp Trp Asn Gly Phe Phe Asp Tyr Trp Gly Leu Gly Ala Leu
225 230 235 240
Val Thr Val Ser Ser Ser Leu Asp Pro Lys Ser Ser Asp Lys Thr His
245 250 255
Thr Cys Pro Pro Cys Pro Val Pro Glu Leu Leu Gly Gly Pro Ser Val
260 265 270
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
275 280 285
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
290 295 300
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
305 310 315 320
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
325 330 335
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
340 345 350
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
355 360 365
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
370 375 380
Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
385 390 395 400
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
405 410 415
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
420 425 430
Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
435 440 445
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
450 455 460
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys Val
465 470 475 480
<210> 64
<211> 480
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 64
Glu Thr Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Thr Val Gly Ser Lys
20 25 30
Leu Ala Trp His Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Arg Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Thr
65 70 75 80
Glu Asp Ser Ala Val Tyr Tyr Cys Gln Gln Tyr Tyr Tyr Trp Pro Pro
85 90 95
Tyr Arg Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Gly Gln Ser Ser
100 105 110
Arg Ser Ser Gly Gly Gly Gly Ser Ser Gly Gly Gly Gly Ser Asp Val
115 120 125
Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu Ser Leu
130 135 140
Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Ser Ser Tyr Ala Met
145 150 155 160
Asn Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Val Ser Arg
165 170 175
Ile Asn Ser Gly Gly Gly Gly Thr Asp Tyr Ala Glu Ser Val Lys Gly
180 185 190
Arg Phe Thr Ile Ser Arg Asp Asn Ser Glu Asn Thr Leu Tyr Leu Gln
195 200 205
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Lys
210 215 220
Gln Tyr Asp Trp Asn Gly Phe Phe Asp Tyr Trp Gly Leu Gly Ala Leu
225 230 235 240
Val Thr Val Ser Ser Ser Leu Asp Pro Lys Ser Ser Asp Lys Thr His
245 250 255
Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val
260 265 270
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
275 280 285
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
290 295 300
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
305 310 315 320
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
325 330 335
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
340 345 350
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
355 360 365
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
370 375 380
Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
385 390 395 400
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
405 410 415
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
420 425 430
Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
435 440 445
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
450 455 460
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys Val
465 470 475 480
<210> 65
<211> 481
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 65
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Phe Ser Cys Arg Ala Ser Gln Asn Val Lys Asn Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Arg Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Ala Ala Arg Ile Arg Glu Thr Gly Ile Pro Glu Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Thr Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Tyr Asp Trp Pro Pro
85 90 95
Phe Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Gly Gln Ser Ser
100 105 110
Arg Ser Ser Gly Gly Gly Gly Ser Ser Gly Gly Gly Gly Ser Asp Val
115 120 125
Gln Leu Leu Glu Ser Gly Gly Gly Val Val Gln Pro Gly Gly Ser Leu
130 135 140
Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Ser Asn Phe Ala Met
145 150 155 160
Thr Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Val Ser Thr
165 170 175
Ile Gly Ser Gly Asp Thr Tyr Tyr Ala Asp Ser Val Lys Gly Arg Phe
180 185 190
Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln Met Asn
195 200 205
Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Lys Asp Ser
210 215 220
Thr Val Ser Trp Ser Gly Asp Phe Phe Asp Tyr Trp Gly Leu Gly Thr
225 230 235 240
Leu Val Thr Val Ser Ser Ser Leu Asp Pro Lys Ser Ser Asp Lys Pro
245 250 255
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser
260 265 270
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
275 280 285
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
290 295 300
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
305 310 315 320
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val
325 330 335
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
340 345 350
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
355 360 365
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
370 375 380
Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys
385 390 395 400
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
405 410 415
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
420 425 430
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
435 440 445
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
450 455 460
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
465 470 475 480
Val
<210> 66
<211> 481
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 66
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Phe Ser Cys Arg Ala Ser Gln Asn Val Lys Asn Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Arg Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Ala Ala Arg Ile Arg Glu Thr Gly Ile Pro Glu Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Thr Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Tyr Asp Trp Pro Pro
85 90 95
Phe Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Gly Gln Ser Ser
100 105 110
Arg Ser Ser Gly Gly Gly Gly Ser Ser Gly Gly Gly Gly Ser Asp Val
115 120 125
Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Gly Ser Leu
130 135 140
Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Ser Asn Phe Ala Met
145 150 155 160
Thr Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Val Ser Thr
165 170 175
Ile Gly Ser Gly Asp Thr Tyr Tyr Ala Asp Ser Val Lys Gly Arg Phe
180 185 190
Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln Met Asn
195 200 205
Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Lys Asp Ser
210 215 220
Thr Val Ser Trp Ser Gly Asp Phe Phe Asp Tyr Trp Gly Leu Gly Thr
225 230 235 240
Arg Val Thr Val Ser Ser Ser Leu Asp Pro Lys Ser Ser Asp Lys Thr
245 250 255
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser
260 265 270
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
275 280 285
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
290 295 300
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
305 310 315 320
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val
325 330 335
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
340 345 350
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
355 360 365
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
370 375 380
Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys
385 390 395 400
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
405 410 415
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
420 425 430
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
435 440 445
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
450 455 460
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
465 470 475 480
Val
<210> 67
<211> 481
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 67
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Phe Ser Cys Arg Ala Ser Gln Asn Val Lys Asn Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Arg Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Ala Ala Arg Ile Arg Glu Thr Gly Ile Pro Glu Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Thr Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Tyr Asp Trp Pro Pro
85 90 95
Phe Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Gly Gln Ser Ser
100 105 110
Arg Ser Ser Gly Gly Gly Gly Ser Ser Gly Gly Gly Gly Ser Asp Val
115 120 125
Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu Ser Leu
130 135 140
Arg Leu Ser Cys Ala Ala Ser Gly Phe Arg Phe Ser Asn Phe Ala Met
145 150 155 160
Thr Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Val Ser Thr
165 170 175
Ile Gly Ser Gly Asp Thr Tyr Tyr Ala Asp Ser Val Lys Gly Arg Phe
180 185 190
Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln Met Asn
195 200 205
Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Lys Asp Ser
210 215 220
Thr Val Ser Trp Ser Gly Asp Phe Phe Asp Tyr Trp Gly Leu Gly Thr
225 230 235 240
Leu Val Thr Val Ser Ser Ser Leu Asp Pro Lys Ser Ser Asp Lys Thr
245 250 255
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser
260 265 270
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
275 280 285
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
290 295 300
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
305 310 315 320
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val
325 330 335
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
340 345 350
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
355 360 365
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
370 375 380
Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys
385 390 395 400
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
405 410 415
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
420 425 430
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
435 440 445
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
450 455 460
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
465 470 475 480
Val
<210> 68
<211> 478
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 68
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Val Thr Leu Thr Cys Arg Ala Ser Gln Gly Ile Ala Gly Lys
20 25 30
Ile Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Ser Arg Ala Thr Gly Ile Pro Gly Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Thr Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln His Tyr Asp Trp Ser Pro
85 90 95
Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Gly Gln Ser Ser
100 105 110
Arg Ser Ser Gly Gly Gly Gly Ser Ser Gly Gly Gly Gly Ser Asp Val
115 120 125
Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu
130 135 140
Arg Leu Ser Cys Thr Ala Ser Gly Phe Thr Phe Arg Asn Tyr Gly Met
145 150 155 160
Ser Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Val Ser Ala
165 170 175
Ser Ser Gly Ser Gly Ser Thr Tyr Tyr Thr Asp Ser Val Lys Gly Arg
180 185 190
Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln Met
195 200 205
Asn Ser Leu Arg Ala Glu Asp Thr Ala Ile Tyr Tyr Cys Ala Lys Val
210 215 220
Thr Trp Asn Asn Phe Phe Asp Tyr Trp Gly Leu Gly Thr Leu Val Thr
225 230 235 240
Val Ser Ser Ser Leu Asp Pro Lys Ser Ser Asp Lys Thr His Thr Cys
245 250 255
Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu
260 265 270
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
275 280 285
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
290 295 300
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
305 310 315 320
Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu
325 330 335
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
340 345 350
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
355 360 365
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
370 375 380
Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys
385 390 395 400
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
405 410 415
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
420 425 430
Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
435 440 445
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
450 455 460
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys Val
465 470 475
<210> 69
<211> 478
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 69
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Thr Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Ile Gly Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Asp Ala Thr Asn Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln
65 70 75 80
Thr Glu Asp Ser Ala Val Tyr Tyr Cys Gln Gln Tyr Tyr Tyr Trp Pro
85 90 95
Pro Tyr Arg Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Gly Gln Ser
100 105 110
Ser Arg Ser Ser Gly Gly Gly Ser Ser Ser Gly Gly Gly Gly Ser Asp
115 120 125
Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu Ser
130 135 140
Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr Asp
145 150 155 160
Met Thr Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Val Ser
165 170 175
Gly Ile Ser Gly Asn Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val Lys
180 185 190
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu
195 200 205
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
210 215 220
Met Asn Arg Trp Trp Phe Asp Tyr Trp Gly Leu Gly Thr Leu Val Thr
225 230 235 240
Val Ser Ser Ser Leu Asp Pro Lys Ser Ser Asp Lys Thr His Thr Cys
245 250 255
Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu
260 265 270
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
275 280 285
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
290 295 300
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
305 310 315 320
Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu
325 330 335
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
340 345 350
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
355 360 365
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
370 375 380
Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys
385 390 395 400
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
405 410 415
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
420 425 430
Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
435 440 445
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
450 455 460
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys Val
465 470 475
<210> 70
<211> 480
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 70
Glu Thr Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Thr Val Gly Ser Lys
20 25 30
Leu Ala Trp His Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Thr
65 70 75 80
Glu Asp Ser Ala Val Tyr Tyr Cys Gln Gln Tyr Tyr Tyr Trp Pro Pro
85 90 95
Tyr Arg Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Gly Gln Ser Ser
100 105 110
Arg Ser Ser Gly Gly Gly Gly Ser Ser Gly Gly Gly Gly Ser Asp Val
115 120 125
Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu Ser Leu
130 135 140
Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Arg Ser Tyr Ala Met
145 150 155 160
Asn Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Val Ser Arg
165 170 175
Ile Asp Ser Gly Gly Gly Gly Thr Asp Tyr Ala Asp Ser Val Lys Gly
180 185 190
Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln
195 200 205
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Lys
210 215 220
Gln Tyr Asp Trp Asn Ser Phe Phe Asp Tyr Trp Gly Leu Gly Ala Pro
225 230 235 240
Val Thr Val Ser Ser Ser Leu Asp Pro Lys Ser Ser Asp Lys Thr His
245 250 255
Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val
260 265 270
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
275 280 285
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
290 295 300
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
305 310 315 320
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
325 330 335
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
340 345 350
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
355 360 365
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
370 375 380
Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
385 390 395 400
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
405 410 415
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
420 425 430
Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
435 440 445
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
450 455 460
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys Val
465 470 475 480
<210> 71
<211> 483
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 71
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Asn Val Arg Ser Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Leu Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Asn Thr Arg Ala Thr Asp Ile Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln His Tyr Tyr Asp Trp Pro Pro
85 90 95
Val Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Gly Gln Ser Ser
100 105 110
Arg Ser Ser Gly Gly Gly Gly Ser Ser Gly Gly Gly Gly Ser Asp Val
115 120 125
Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu Ser Leu
130 135 140
Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr Ala Met
145 150 155 160
Ser Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Val Ser Leu
165 170 175
Ile Thr Thr Asn Gly Asp Gly Ala Tyr Tyr Ala Asp Ser Val Lys Gly
180 185 190
Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln
195 200 205
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Ile Tyr Tyr Cys Ala Lys
210 215 220
Asp Gly Ala Ala His Tyr Tyr Asp Ile Phe Phe Asp Tyr Trp Gly Leu
225 230 235 240
Gly Thr Pro Val Thr Val Ser Ser Ser Leu Asp Pro Lys Ser Ser Asp
245 250 255
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly
260 265 270
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
275 280 285
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
290 295 300
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
305 310 315 320
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
325 330 335
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
340 345 350
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
355 360 365
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
370 375 380
Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
385 390 395 400
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
405 410 415
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
420 425 430
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
435 440 445
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
450 455 460
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
465 470 475 480
Gly Lys Val
<210> 72
<211> 481
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 72
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Val Thr Phe Ser Cys Arg Ala Ser Gln Asn Val Arg Ser Asp
20 25 30
Ile Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Arg Asp Thr Gly Ile Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Gly Val Tyr Tyr Cys Gln Gln Tyr Tyr Asp Trp Pro Pro
85 90 95
Phe Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Gly Gln Ser Ser
100 105 110
Arg Ser Ser Gly Gly Gly Gly Ser Ser Gly Gly Gly Gly Ser Asp Val
115 120 125
Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu Ser Leu
130 135 140
Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Ser Ile Tyr Ala Met
145 150 155 160
Ser Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Val Ser Thr
165 170 175
Ile Gly Ala Asp Asp Thr Tyr Tyr Ala Asp Ser Val Lys Gly Arg Phe
180 185 190
Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln Met Asn
195 200 205
Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Lys Asp Ser
210 215 220
Thr Val Gly Trp Ser Gly Asp Phe Phe Asp Tyr Trp Gly Leu Gly Thr
225 230 235 240
Leu Val Thr Val Ser Ser Ser Leu Asp Pro Lys Ser Ser Asp Lys Thr
245 250 255
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser
260 265 270
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
275 280 285
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
290 295 300
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
305 310 315 320
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val
325 330 335
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
340 345 350
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
355 360 365
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
370 375 380
Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys
385 390 395 400
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
405 410 415
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
420 425 430
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
435 440 445
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
450 455 460
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
465 470 475 480
Val
<210> 73
<211> 480
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 73
Glu Thr Val Leu Thr Gln Ser Pro Gly Thr Leu Thr Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Thr Cys Arg Ala Ser Gln Ser Val Tyr Thr Tyr
20 25 30
Leu Ala Trp Tyr Gln Glu Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Val Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Tyr Asp Arg Pro Pro
85 90 95
Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Gly Gln Ser Ser
100 105 110
Arg Ser Ser Gly Gly Gly Gly Ser Ser Gly Gly Gly Gly Ser Asp Val
115 120 125
Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu Ser Leu
130 135 140
Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr Asp Met
145 150 155 160
Asn Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Val Ser Leu
165 170 175
Ile Ser Gly Ser Gly Glu Ile Ile Tyr Tyr Ala Asp Ser Val Lys Gly
180 185 190
Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln
195 200 205
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Lys
210 215 220
Glu Asn Asn Arg Tyr Arg Phe Phe Asp Asp Trp Gly Leu Gly Thr Leu
225 230 235 240
Val Thr Val Ser Ser Ser Leu Asp Pro Lys Ser Ser Asp Lys Thr His
245 250 255
Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val
260 265 270
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
275 280 285
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
290 295 300
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
305 310 315 320
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
325 330 335
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
340 345 350
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
355 360 365
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
370 375 380
Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
385 390 395 400
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
405 410 415
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
420 425 430
Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
435 440 445
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
450 455 460
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys Val
465 470 475 480
<210> 74
<211> 315
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 74
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Val Ile Leu Thr Cys Arg Ala Ser Gln Ser Val Asp Thr Tyr
20 25 30
Asn Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Asp Leu Ser Thr Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Asn Ser Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys His Gln Tyr Tyr Asp Trp Pro
85 90 95
Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Gly Gln Ser
100 105 110
Ser Arg Ser Ser Gly Gly Gly Gly Ser Ser Gly Gly Gly Gly Ser Asp
115 120 125
Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu Ser
130 135 140
Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr Ala
145 150 155 160
Met Asn Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Val Ser
165 170 175
Gly Ile Ser Gly Arg Gly Gly Asp Thr Tyr Tyr Ala Asp Ser Val Lys
180 185 190
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu
195 200 205
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Ile Tyr Tyr Cys Ala
210 215 220
Lys Gly Thr Trp Asn Tyr Gly Ser Phe Asp Tyr Trp Gly Leu Gly Thr
225 230 235 240
Leu Val Thr Val Ser Ser Ser Leu Asp Pro Lys Ser Ser Asp Lys Thr
245 250 255
Asp Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser
260 265 270
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
275 280 285
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
290 295 300
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val
305 310 315
<210> 75
<211> 481
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 75
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Phe Ser Cys Arg Ala Ser Gln Asn Val Lys Asn Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Arg Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Ala Ala Arg Ile Arg Glu Thr Gly Ile Pro Glu Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Thr Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Tyr Asp Trp Pro Pro
85 90 95
Phe Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Gly Gln Ser Ser
100 105 110
Arg Ser Ser Gly Gly Gly Gly Ser Ser Gly Gly Gly Gly Ser Asp Val
115 120 125
Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Gly Ser Leu
130 135 140
Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Ser Asn Phe Ala Met
145 150 155 160
Thr Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Val Ser Thr
165 170 175
Ile Gly Ser Gly Asp Thr Tyr Tyr Ala Asp Ser Val Lys Gly Arg Phe
180 185 190
Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln Met Asn
195 200 205
Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Lys Asp Ser
210 215 220
Thr Val Ser Trp Ser Gly Asp Phe Phe Asp Tyr Trp Gly Leu Gly Thr
225 230 235 240
Leu Val Thr Val Ser Ser Ser Leu Asp Pro Lys Ser Ser Asp Lys Thr
245 250 255
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser
260 265 270
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
275 280 285
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
290 295 300
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
305 310 315 320
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val
325 330 335
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
340 345 350
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
355 360 365
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
370 375 380
Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys
385 390 395 400
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
405 410 415
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
420 425 430
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
435 440 445
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
450 455 460
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
465 470 475 480
Val
<210> 76
<211> 118
<212> БЕЛОК
<213> Homo sapiens
<400> 76
Glu Glu Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Ser Val Ala
1 5 10 15
Ala Gly Glu Ser Ala Ile Leu Leu Cys Thr Val Thr Ser Leu Ile Pro
20 25 30
Val Gly Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Ala Arg Glu Leu
35 40 45
Ile Tyr Asn Gln Lys Glu Gly His Phe Pro Arg Val Thr Thr Val Ser
50 55 60
Glu Ser Thr Lys Arg Glu Asn Met Asp Phe Ser Ile Ser Ile Ser Asn
65 70 75 80
Ile Thr Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys
85 90 95
Gly Ser Pro Asp Thr Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser
100 105 110
Val Arg Ala Lys Pro Ser
115
<210> 77
<211> 119
<212> БЕЛОК
<213> Homo sapiens
<400> 77
Glu Glu Gly Leu Gln Val Ile Gln Pro Asp Lys Ser Val Ser Val Ala
1 5 10 15
Ala Gly Glu Ser Ala Ile Leu His Cys Thr Ala Thr Ser Leu Ile Pro
20 25 30
Val Gly Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Gly Arg Glu Leu
35 40 45
Ile Tyr Asn Gln Lys Glu Gly His Phe Pro Arg Val Thr Thr Val Ser
50 55 60
Asp Leu Thr Lys Arg Asn Asn Met Asp Phe Ser Ile Arg Ile Gly Asn
65 70 75 80
Ile Thr Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys
85 90 95
Gly Ser Pro Asp Asp Val Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu
100 105 110
Ser Val Arg Ala Lys Pro Ser
115
<210> 78
<211> 119
<212> БЕЛОК
<213> Homo sapiens
<400> 78
Glu Glu Glu Leu Gln Val Ile Gln Pro Asp Lys Phe Val Leu Val Ala
1 5 10 15
Ala Gly Glu Thr Ala Thr Leu Arg Cys Thr Ala Thr Ser Leu Ile Pro
20 25 30
Val Gly Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Gly Arg Glu Leu
35 40 45
Ile Tyr Asn Gln Lys Glu Gly His Phe Pro Arg Val Thr Thr Val Ser
50 55 60
Asp Leu Thr Lys Arg Asn Asn Met Asp Phe Ser Ile Arg Ile Gly Asn
65 70 75 80
Ile Thr Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys
85 90 95
Gly Ser Pro Asp Asp Val Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu
100 105 110
Ser Val Arg Ala Lys Pro Ser
115
<210> 79
<211> 119
<212> БЕЛОК
<213> Homo sapiens
<400> 79
Glu Glu Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Leu Val Ala
1 5 10 15
Ala Gly Glu Thr Ala Thr Leu Arg Cys Thr Ala Thr Ser Leu Ile Pro
20 25 30
Val Gly Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Gly Arg Glu Leu
35 40 45
Ile Tyr Asn Gln Lys Glu Gly His Phe Pro Arg Val Thr Thr Val Ser
50 55 60
Asp Leu Thr Lys Arg Asn Asn Met Asp Phe Pro Ile Arg Ile Gly Asn
65 70 75 80
Ile Thr Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys
85 90 95
Gly Ser Pro Asp Asp Val Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu
100 105 110
Ser Val Arg Ala Lys Pro Ser
115
<210> 80
<211> 118
<212> БЕЛОК
<213> Homo sapiens
<400> 80
Glu Glu Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Ser Val Ala
1 5 10 15
Ala Gly Glu Ser Ala Ile Leu His Cys Thr Val Thr Ser Leu Ile Pro
20 25 30
Val Gly Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Ala Arg Glu Leu
35 40 45
Ile Tyr Asn Gln Lys Glu Gly His Phe Pro Arg Val Thr Thr Val Ser
50 55 60
Glu Ser Thr Lys Arg Glu Asn Met Asp Phe Ser Ile Ser Ile Ser Asn
65 70 75 80
Ile Thr Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys
85 90 95
Gly Ser Pro Asp Thr Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser
100 105 110
Val Arg Gly Lys Pro Ser
115
<210> 81
<211> 118
<212> БЕЛОК
<213> Homo sapiens
<400> 81
Glu Glu Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Leu Val Ala
1 5 10 15
Ala Gly Glu Thr Ala Thr Leu Arg Cys Thr Ala Thr Ser Leu Ile Pro
20 25 30
Val Gly Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Ala Arg Glu Leu
35 40 45
Ile Tyr Asn Gln Lys Glu Gly His Phe Pro Arg Val Thr Thr Val Ser
50 55 60
Glu Ser Thr Lys Arg Glu Asn Met Asp Phe Ser Ile Ser Ile Ser Asn
65 70 75 80
Ile Thr Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys
85 90 95
Gly Ser Pro Asp Thr Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser
100 105 110
Val Arg Ala Lys Pro Ser
115
<210> 82
<211> 119
<212> БЕЛОК
<213> Homo sapiens
<400> 82
Glu Glu Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Leu Val Ala
1 5 10 15
Ala Gly Glu Thr Ala Thr Leu Arg Cys Thr Ala Thr Ser Leu Ile Pro
20 25 30
Val Gly Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Gly Arg Glu Leu
35 40 45
Ile Tyr Asn Gln Lys Glu Gly His Phe Pro Arg Val Thr Thr Val Ser
50 55 60
Asp Leu Thr Lys Arg Asn Asn Met Asp Phe Ser Ile Arg Ile Ser Asn
65 70 75 80
Ile Thr Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys
85 90 95
Gly Ser Pro Asp Asp Val Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu
100 105 110
Ser Val Arg Ala Lys Pro Ser
115
<210> 83
<211> 118
<212> БЕЛОК
<213> Homo sapiens
<400> 83
Glu Glu Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Ser Val Ala
1 5 10 15
Ala Gly Glu Ser Ala Ile Leu His Cys Thr Val Thr Ser Leu Ile Pro
20 25 30
Val Gly Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Ala Arg Glu Leu
35 40 45
Ile Tyr Asn Gln Lys Glu Gly His Phe Pro Arg Val Thr Thr Val Ser
50 55 60
Glu Ser Thr Lys Arg Glu Asn Met Asp Phe Ser Ile Ser Ile Ser Asn
65 70 75 80
Ile Thr Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys
85 90 95
Gly Ser Pro Asp Thr Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser
100 105 110
Val Arg Ala Lys Pro Ser
115
<210> 84
<211> 110
<212> БЕЛОК
<213> Gallus gallus
<400> 84
Asp Phe Lys Leu Gln Gln Pro Gln Ser Ser Val Val Val Ile Lys Gly
1 5 10 15
Asp Thr Leu Thr Leu Asn Cys Thr Ala Ser Gly Ser Gly Pro Ile Gly
20 25 30
Ala Val Lys Trp Val Lys Gly Trp Gly Ser Asp Asn Gln Thr Val Tyr
35 40 45
Glu His Lys Gly Ser Phe Pro Arg Val Met Arg Ala Val Pro Asp Pro
50 55 60
Thr Asn Asp Phe Thr Ile Arg Ile Ser Asn Val Ser Leu Glu Asp Ala
65 70 75 80
Gly Thr Tyr Tyr Cys Val Lys Leu Arg Lys Gly Ile Val Asp Asp Val
85 90 95
Val Phe Thr Arg Gly Gly Gly Thr Glu Val Ser Val His Ala
100 105 110
<210> 85
<211> 105
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 85
Ala Leu Thr Gln Pro Ala Ser Val Ser Ala Asn Pro Gly Glu Thr Val
1 5 10 15
Glu Ile Thr Cys Ser Gly Gly Gly Ser Asn Asn Ala Tyr Gly Trp Phe
20 25 30
Gln Gln Lys Ser Pro Gly Ser Ala Pro Leu Thr Val Ile Tyr Asp Asn
35 40 45
Gly Lys Arg Pro Ser Asp Ile Pro Ser Arg Phe Ser Gly Ser Lys Ser
50 55 60
Asp Ser Thr Gly Thr Leu Thr Ile Thr Arg Val Gln Ala Glu Asp Glu
65 70 75 80
Ala Val Tyr Tyr Cys Gly Ser Ala Asp Asn Ser Gly Ala Gly Val Phe
85 90 95
Gly Ala Gly Thr Thr Leu Thr Val Leu
100 105
<210> 86
<211> 105
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 86
Ala Val Thr Gln Pro Ala Ser Val Ser Ala Asn Pro Gly Glu Thr Val
1 5 10 15
Arg Ile Thr Cys Ser Gly Asp Ser Ser Ser Tyr Tyr Ser Trp His Gln
20 25 30
Gln Lys Ser Pro Gly Ser Ala Pro Val Ser Val Ile Tyr Ser Asn Thr
35 40 45
Asp Arg Pro Ser Asp Ile Pro Ser Arg Phe Ser Gly Ser Ala Ser Gly
50 55 60
Ser Thr Ala Thr Leu Thr Ile Thr Gly Val Gln Ala Glu Asp Glu Ala
65 70 75 80
Val Tyr Phe Cys Gly Ala Tyr Asp Ser Ser Ser Asp Ser Asp Ile Phe
85 90 95
Gly Ala Gly Thr Thr Leu Thr Val Leu
100 105
<210> 87
<211> 103
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 87
Ala Val Thr Gln Pro Ser Ser Val Ser Ala Asn Pro Gly Glu Thr Val
1 5 10 15
Glu Ile Thr Cys Ser Gly Ser Ser Thr Tyr Tyr Gly Trp Tyr Gln Gln
20 25 30
Lys Ser Pro Gly Ser Ala Pro Val Thr Val Ile Tyr Asp Asn Asp Lys
35 40 45
Arg Pro Ser Asp Ile Pro Ser Arg Phe Ser Gly Ser Lys Ser Gly Ser
50 55 60
Thr His Thr Leu Ile Ile Thr Gly Val Gln Val Glu Asp Glu Ala Val
65 70 75 80
Tyr Phe Cys Gly Asn Glu Asp Asn Asn Tyr Val Ala Ile Phe Gly Ala
85 90 95
Gly Thr Thr Leu Thr Val Leu
100
<210> 88
<211> 106
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 88
Ala Leu Thr Gln Pro Ser Ser Val Ser Ala Asn Pro Gly Glu Thr Val
1 5 10 15
Lys Ile Thr Cys Ser Gly Asp Asn Ser Ala His Tyr Tyr Tyr Gly Trp
20 25 30
Tyr Gln Gln Lys Ser Pro Gly Ser Ala Pro Val Thr Val Ile Tyr Tyr
35 40 45
Asn Asp Lys Arg Pro Ser Gly Ile Pro Ser Arg Phe Ser Gly Ser Ala
50 55 60
Ser Gly Ser Thr Ala Thr Leu Ile Ile Thr Gly Val Gln Val Glu Asp
65 70 75 80
Glu Ala Val Tyr Phe Cys Gly Ser Ala Asp Ser Ser Asn Pro Ala Ile
85 90 95
Phe Gly Ala Gly Thr Thr Leu Thr Val Leu
100 105
<210> 89
<211> 105
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 89
Ala Val Thr Gln Pro Ala Ser Val Ser Ala Asn Pro Gly Glu Thr Val
1 5 10 15
Lys Ile Thr Cys Ser Gly Ser Ser Ser Gly Ser Tyr Gly Trp Tyr Gln
20 25 30
Gln Lys Ser Pro Gly Ser Ala Pro Val Thr Leu Ile Tyr Glu Thr Asn
35 40 45
Lys Arg Pro Ser Asn Ile Pro Ser Arg Phe Ser Gly Ser Lys Ser Gly
50 55 60
Ser Thr Ala Thr Leu Thr Ile Thr Gly Val Gln Ala Asp Asp Glu Ala
65 70 75 80
Val Tyr Tyr Cys Gly Ser Glu Asp Ser Ser Thr Tyr Leu Ser Ile Phe
85 90 95
Gly Ala Gly Thr Thr Leu Thr Val Leu
100 105
<210> 90
<211> 103
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 90
Ala Val Thr Gln Pro Ala Ser Val Ser Ala Asn Pro Gly Glu Thr Val
1 5 10 15
Lys Ile Thr Cys Ser Gly Asp Ser Ser Tyr Tyr Gly Trp Tyr Gln Gln
20 25 30
Lys Ser Pro Gly Ser Ala Pro Val Thr Val Ile Tyr Asp Asp Asn Lys
35 40 45
Arg Pro Ser Asn Ile Pro Ser Arg Phe Ser Gly Ser Lys Ser Gly Ser
50 55 60
Thr Gly Thr Leu Thr Ile Thr Gly Val Gln Ala Asp Asp Glu Ala Val
65 70 75 80
Tyr Phe Cys Gly Asn Glu Asp Asn Ser Tyr Val Ala Ile Phe Gly Ala
85 90 95
Gly Thr Thr Leu Thr Val Leu
100
<210> 91
<211> 103
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 91
Ala Val Thr Gln Pro Ala Ser Val Ser Ala Asn Pro Gly Glu Thr Val
1 5 10 15
Lys Ile Thr Cys Ser Gly Ser Ser Ser Tyr Tyr Gly Trp Tyr Arg Gln
20 25 30
Lys Ser Pro Gly Ser Ala Pro Val Thr Leu Ile Tyr Asp Asn Asp Lys
35 40 45
Arg Pro Ser Gly Ile Pro Ser Arg Phe Ser Gly Ser Lys Ser Gly Ser
50 55 60
Thr Asn Thr Leu Thr Ile Thr Gly Val Gln Ala Asp Asp Glu Ala Val
65 70 75 80
Tyr Tyr Cys Gly Asn Glu Asp Asn Ser Tyr Val Gly Ile Phe Gly Ala
85 90 95
Gly Thr Thr Leu Thr Val Leu
100
<210> 92
<211> 103
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 92
Ala Val Thr Gln Pro Ala Ser Val Ser Ala Asn Leu Gly Glu Thr Val
1 5 10 15
Lys Ile Thr Cys Ser Gly Asp Ser Ser Tyr Tyr Gly Trp Tyr Gln Gln
20 25 30
Lys Ala Pro Gly Ser Ala Pro Val Thr Leu Ile Tyr Asp Asn Asp Lys
35 40 45
Arg Pro Ser Asn Ile Pro Ser Arg Phe Ser Gly Ser Lys Ser Gly Ser
50 55 60
Thr Ala Thr Leu Thr Ile Thr Gly Val Gln Ala Asp Asp Glu Ala Val
65 70 75 80
Tyr Tyr Cys Gly Asn Glu Asp Met Asn Tyr Val Gly Ile Phe Gly Ala
85 90 95
Gly Thr Thr Leu Thr Val Leu
100
<210> 93
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 93
Glu Thr Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Thr Val Gly Ser Lys
20 25 30
Leu Ala Trp His Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Thr Asn Arg Ala Thr Gly Ile Ser Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Thr
65 70 75 80
Glu Asp Ser Ala Val Tyr Tyr Cys Gln Gln Tyr Tyr Tyr Trp Pro Pro
85 90 95
Tyr Arg Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 94
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 94
Glu Thr Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Thr Val Gly Ser Lys
20 25 30
Leu Ala Trp His Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Thr Asn Arg Ala Thr Gly Ile Ser Asp Arg Phe Ser Gly
50 55 60
Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Thr
65 70 75 80
Glu Asp Ser Ala Val Tyr Tyr Cys Gln Gln Tyr Tyr Tyr Trp Pro Pro
85 90 95
Tyr Arg Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 95
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 95
Glu Thr Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Thr Val Gly Ser Lys
20 25 30
Leu Ala Trp His Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Thr Asn Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Thr
65 70 75 80
Glu Asp Ser Ala Val Tyr Tyr Cys Gln Gln Tyr Tyr Tyr Trp Pro Pro
85 90 95
Tyr Arg Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 96
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 96
Glu Thr Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Thr Val Gly Ser Lys
20 25 30
Leu Ala Trp His Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Arg Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Thr
65 70 75 80
Glu Asp Ser Ala Val Tyr Tyr Cys Gln Gln Tyr Tyr Tyr Trp Pro Pro
85 90 95
Tyr Arg Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 97
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 97
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Phe Ser Cys Arg Ala Ser Gln Asn Val Lys Asn Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Arg Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Ala Ala Arg Ile Arg Glu Thr Gly Ile Pro Glu Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Thr Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Tyr Asp Trp Pro Pro
85 90 95
Phe Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 98
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 98
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Phe Ser Cys Arg Ala Ser Gln Asn Val Lys Asn Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Arg Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Ala Ala Arg Ile Arg Glu Thr Gly Ile Pro Glu Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Thr Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Tyr Asp Trp Pro Pro
85 90 95
Phe Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 99
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 99
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Phe Ser Cys Arg Ala Ser Gln Asn Val Lys Asn Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Arg Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Ala Ala Arg Ile Arg Glu Thr Gly Ile Pro Glu Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Thr Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Tyr Asp Trp Pro Pro
85 90 95
Phe Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 100
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 100
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Val Thr Leu Thr Cys Arg Ala Ser Gln Gly Ile Ala Gly Lys
20 25 30
Ile Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Ser Arg Ala Thr Gly Ile Pro Gly Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Thr Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln His Tyr Asp Trp Ser Pro
85 90 95
Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 101
<211> 109
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 101
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Thr Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Ile Gly Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Asp Ala Thr Asn Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln
65 70 75 80
Thr Glu Asp Ser Ala Val Tyr Tyr Cys Gln Gln Tyr Tyr Tyr Trp Pro
85 90 95
Pro Tyr Arg Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 102
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 102
Glu Thr Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Thr Val Gly Ser Lys
20 25 30
Leu Ala Trp His Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Thr
65 70 75 80
Glu Asp Ser Ala Val Tyr Tyr Cys Gln Gln Tyr Tyr Tyr Trp Pro Pro
85 90 95
Tyr Arg Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 103
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 103
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Asn Val Arg Ser Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Leu Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Asn Thr Arg Ala Thr Asp Ile Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln His Tyr Tyr Asp Trp Pro Pro
85 90 95
Val Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 104
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 104
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Val Thr Phe Ser Cys Arg Ala Ser Gln Asn Val Arg Ser Asp
20 25 30
Ile Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Arg Asp Thr Gly Ile Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Gly Val Tyr Tyr Cys Gln Gln Tyr Tyr Asp Trp Pro Pro
85 90 95
Phe Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 105
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 105
Glu Thr Val Leu Thr Gln Ser Pro Gly Thr Leu Thr Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Thr Cys Arg Ala Ser Gln Ser Val Tyr Thr Tyr
20 25 30
Leu Ala Trp Tyr Gln Glu Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Val Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Tyr Asp Arg Pro Pro
85 90 95
Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 106
<211> 109
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 106
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Val Ile Leu Thr Cys Arg Ala Ser Gln Ser Val Asp Thr Tyr
20 25 30
Asn Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Asp Leu Ser Thr Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Asn Ser Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys His Gln Tyr Tyr Asp Trp Pro
85 90 95
Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 107
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 107
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Phe Ser Cys Arg Ala Ser Gln Asn Val Lys Asn Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Arg Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Ala Ala Arg Ile Arg Glu Thr Gly Ile Pro Glu Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Thr Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Tyr Asp Trp Pro Pro
85 90 95
Phe Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 108
<211> 124
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 108
Ala Val Thr Leu Asp Glu Ser Gly Gly Gly Leu Gln Thr Pro Gly Gly
1 5 10 15
Ala Leu Ser Leu Val Cys Lys Gly Ser Gly Phe Thr Phe Ser Ser His
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Gly Ile Ser Ser Asp Gly Arg Phe Thr Tyr Tyr Gly Ala Ala Val
50 55 60
Gln Gly Arg Ala Thr Ile Ser Arg Asp Asn Gly Gln Ser Thr Val Arg
65 70 75 80
Leu Gln Leu Asn Asn Leu Arg Ala Glu Asp Thr Ala Thr Tyr Tyr Cys
85 90 95
Thr Lys Asn Gly Gly Cys Gly Ser Gly Gly Asp Leu Asp Cys Ile Asp
100 105 110
Ala Trp Gly His Gly Thr Glu Val Ile Val Ser Ser
115 120
<210> 109
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 109
Ala Val Thr Leu Asp Glu Ser Gly Gly Gly Leu Gln Thr Pro Gly Gly
1 5 10 15
Gly Leu Ser Leu Val Cys Lys Ala Ser Gly Phe Asp Phe Ser Asn Phe
20 25 30
Asn Met Ala Trp Val Arg Gln Gly Pro Gly Lys Gly Leu Glu Tyr Val
35 40 45
Ala Glu Ile Ser Asp Thr Gly Ser Thr Pro Tyr Tyr Gly Ser Ala Val
50 55 60
Gln Gly Arg Ala Thr Ile Ser Arg Asp Asn Gly Gln Ser Thr Val Arg
65 70 75 80
Leu Gln Leu Asn Asn Leu Arg Ala Glu Asp Thr Gly Thr Tyr Phe Cys
85 90 95
Thr Arg Asn Phe Gly Ser Ser Val Ser Ser Ile Asp Ala Trp Gly His
100 105 110
Gly Thr Glu Val Ile Val Ser Ser
115 120
<210> 110
<211> 133
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 110
Ala Val Thr Leu Asp Glu Ser Gly Gly Gly Leu Gln Thr Pro Gly Gly
1 5 10 15
Ala Leu Ser Leu Val Cys Lys Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Asn Met Gly Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Phe Val
35 40 45
Ala Gly Ile Tyr Ala Ser Gly Ser Ser Thr Asp Thr Asp Thr Thr Tyr
50 55 60
Gly Pro Ala Val Ala Gly Arg Ala Thr Ile Ser Arg Asp Asn Gly Gln
65 70 75 80
Ser Thr Val Arg Leu Gln Leu Asn Asn Leu Arg Ala Glu Asp Thr Gly
85 90 95
Thr Tyr Tyr Cys Ala Lys Ala Ala Gly Gly Cys Ser Thr His Thr Cys
100 105 110
Thr Ala Tyr Ile Ala Asp Ser Ile Asp Ala Trp Gly His Gly Thr Glu
115 120 125
Val Ile Val Ser Ser
130
<210> 111
<211> 128
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 111
Ala Val Thr Leu Asp Glu Ser Gly Gly Gly Leu Gln Thr Pro Gly Arg
1 5 10 15
Ala Leu Ser Leu Val Cys Arg Gly Ser Gly Phe Ser Ile Ser Ser Tyr
20 25 30
Asn Met Gly Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Phe Ile
35 40 45
Ala Ser Ile Gly Ser Asp Gly Ser Ser Thr His Tyr Ala Pro Ala Val
50 55 60
Lys Gly Arg Ala Thr Ile Thr Arg Asp Val Gly Gln Ser Thr Val Arg
65 70 75 80
Leu Gln Leu Asn Asn Leu Arg Ala Glu Asp Thr Gly Thr Tyr Phe Cys
85 90 95
Ala Lys Asp Ala Tyr Gln Cys Ser Tyr Ala Thr Cys Asn Asp Tyr Leu
100 105 110
Asp Thr Ile Asp Ala Trp Gly His Gly Thr Glu Val Ile Val Ser Ser
115 120 125
<210> 112
<211> 127
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 112
Ala Val Thr Leu Asp Glu Ser Gly Gly Gly Leu Gln Thr Pro Gly Gly
1 5 10 15
Ala Leu Ser Leu Val Cys Lys Ala Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Asn Met Gly Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Phe Val
35 40 45
Ala Ala Ile Tyr Ser Gly Asn Ser Ala Glu Tyr Gly Ala Ala Val Gln
50 55 60
Gly Arg Ala Thr Ile Ser Arg Asp Asn Gly Gln Ser Thr Val Arg Leu
65 70 75 80
Gln Leu Asn Asn Leu Arg Ala Glu Asp Thr Gly Ile Tyr Phe Cys Ala
85 90 95
Lys Asp Ala Gly Ser Gly Cys Tyr Ser Gly Val Cys Ala Gly Thr Ser
100 105 110
Ser Ile Asp Ala Trp Gly His Gly Thr Glu Val Ile Val Ser Ser
115 120 125
<210> 113
<211> 131
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 113
Ala Val Thr Leu Asp Glu Ser Gly Gly Gly Leu Gln Thr Pro Gly Gly
1 5 10 15
Ala Leu Ser Leu Val Cys Lys Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Asn Met Gly Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Phe Val
35 40 45
Ala Gly Ile Tyr Ile Ala Ser Gly Asp Leu Gly Thr Thr Tyr Gly Ala
50 55 60
Ala Val Gln Gly Arg Ala Thr Ile Ser Arg Asp Asp Gly Gln Ser Thr
65 70 75 80
Val Arg Leu Gln Leu Asn Asn Leu Arg Ala Glu Asp Thr Gly Thr Tyr
85 90 95
Phe Cys Ala Lys Ser Ala Gly Gly Cys Ser Ala His Ser Cys Asp Thr
100 105 110
Tyr Ile Ala Asp Ser Ile Asp Ala Trp Gly His Gly Thr Glu Val Ile
115 120 125
Val Ser Ser
130
<210> 114
<211> 132
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 114
Ala Val Thr Leu Asp Glu Ser Gly Gly Gly Leu Gln Thr Pro Gly Gly
1 5 10 15
Ala Leu Ser Leu Val Cys Lys Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Asn Met Gly Trp Val Arg Gln Ala Pro Asp Lys Gly Leu Glu Phe Val
35 40 45
Ala Gly Ile Tyr Thr Gly Ser Asp Ala Gly Leu Ser Thr Thr Tyr Gly
50 55 60
Ala Ala Val Gln Gly Arg Ala Thr Ile Ser Arg Asp Asn Gly Gln Ser
65 70 75 80
Thr Val Arg Leu Gln Leu Asn Asn Leu Gly Ala Glu Asp Thr Gly Ile
85 90 95
Tyr Phe Cys Thr Lys Ser Ala Gly Gly Cys Ser Asp Tyr Asn Cys Asp
100 105 110
Ala Tyr Ile Ala Asp Ser Ile Asp Ala Trp Gly His Gly Thr Glu Val
115 120 125
Ile Val Ser Ser
130
<210> 115
<211> 131
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 115
Ala Val Thr Leu Asp Glu Ser Gly Gly Gly Leu Gln Thr Pro Gly Gly
1 5 10 15
Ala Leu Ser Leu Val Cys Lys Ala Ser Gly Phe Thr Phe Asn Ser Tyr
20 25 30
Asn Met Gly Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Phe Val
35 40 45
Ala Gly Ile Tyr Ser Ala Gly Gly Asp Thr Ser Thr Thr Tyr Gly Ala
50 55 60
Ala Val Asn Gly Arg Ala Thr Ile Ser Arg Asp Asn Gly Gln Ser Thr
65 70 75 80
Val Arg Leu Gln Leu Asn Asn Leu Arg Ala Glu Asp Thr Gly Ile Tyr
85 90 95
Phe Cys Ala Lys Ala Ala Gly Gly Cys Thr Ala His Asn Cys Asp Ala
100 105 110
Tyr Ile Ala Asp Ser Ile Asp Ala Trp Gly His Gly Thr Glu Val Ile
115 120 125
Val Ser Ser
130
<210> 116
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 116
Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu Ser
1 5 10 15
Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Ser Ser Tyr Ala
20 25 30
Met Asn Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Val Ser
35 40 45
Arg Ile Asn Ser Gly Gly Gly Gly Thr Asp Tyr Ala Glu Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Glu Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Lys Gln Tyr Asp Trp Asn Ser Phe Phe Asp Tyr Trp Gly Leu Gly Ala
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 117
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 117
Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu Ser
1 5 10 15
Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Ser Ser Tyr Ala
20 25 30
Met Asn Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Val Ser
35 40 45
Arg Ile Asn Ser Gly Gly Gly Gly Thr Asp Tyr Ala Glu Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Glu Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Lys Gln Tyr Asp Trp Asn Ser Phe Phe Asp Tyr Trp Gly Leu Gly Ala
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 118
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 118
Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu Ser
1 5 10 15
Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Ser Ser Tyr Ala
20 25 30
Met Asn Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Val Ser
35 40 45
Arg Ile Asn Ser Gly Gly Gly Gly Thr Asp Tyr Ala Glu Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Glu Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Lys Gln Tyr Asp Trp Asn Gly Phe Phe Asp Tyr Trp Gly Leu Gly Ala
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 119
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 119
Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu Ser
1 5 10 15
Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Ser Ser Tyr Ala
20 25 30
Met Asn Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Val Ser
35 40 45
Arg Ile Asn Ser Gly Gly Gly Gly Thr Asp Tyr Ala Glu Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Glu Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Lys Gln Tyr Asp Trp Asn Gly Phe Phe Asp Tyr Trp Gly Leu Gly Ala
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 120
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 120
Val Gln Leu Leu Glu Ser Gly Gly Gly Val Val Gln Pro Gly Gly Ser
1 5 10 15
Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Ser Asn Phe Ala
20 25 30
Met Thr Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Val Ser
35 40 45
Thr Ile Gly Ser Gly Asp Thr Tyr Tyr Ala Asp Ser Val Lys Gly Arg
50 55 60
Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln Met
65 70 75 80
Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Lys Asp
85 90 95
Ser Thr Val Ser Trp Ser Gly Asp Phe Phe Asp Tyr Trp Gly Leu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 121
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 121
Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Gly Ser
1 5 10 15
Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Ser Asn Phe Ala
20 25 30
Met Thr Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Val Ser
35 40 45
Thr Ile Gly Ser Gly Asp Thr Tyr Tyr Ala Asp Ser Val Lys Gly Arg
50 55 60
Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln Met
65 70 75 80
Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Lys Asp
85 90 95
Ser Thr Val Ser Trp Ser Gly Asp Phe Phe Asp Tyr Trp Gly Leu Gly
100 105 110
Thr Arg Val Thr Val Ser Ser
115
<210> 122
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 122
Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu Ser
1 5 10 15
Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Arg Phe Ser Asn Phe Ala
20 25 30
Met Thr Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Val Ser
35 40 45
Thr Ile Gly Ser Gly Asp Thr Tyr Tyr Ala Asp Ser Val Lys Gly Arg
50 55 60
Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln Met
65 70 75 80
Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Lys Asp
85 90 95
Ser Thr Val Ser Trp Ser Gly Asp Phe Phe Asp Tyr Trp Gly Leu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 123
<211> 116
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 123
Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser
1 5 10 15
Leu Arg Leu Ser Cys Thr Ala Ser Gly Phe Thr Phe Arg Asn Tyr Gly
20 25 30
Met Ser Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Val Ser
35 40 45
Ala Ser Ser Gly Ser Gly Ser Thr Tyr Tyr Thr Asp Ser Val Lys Gly
50 55 60
Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln
65 70 75 80
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Ile Tyr Tyr Cys Ala Lys
85 90 95
Val Thr Trp Asn Asn Phe Phe Asp Tyr Trp Gly Leu Gly Thr Leu Val
100 105 110
Thr Val Ser Ser
115
<210> 124
<211> 115
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 124
Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu Ser
1 5 10 15
Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr Asp
20 25 30
Met Thr Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Val Ser
35 40 45
Gly Ile Ser Gly Asn Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Met Asn Arg Trp Trp Phe Asp Tyr Trp Gly Leu Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 125
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 125
Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu Ser
1 5 10 15
Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Arg Ser Tyr Ala
20 25 30
Met Asn Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Val Ser
35 40 45
Arg Ile Asp Ser Gly Gly Gly Gly Thr Asp Tyr Ala Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Lys Gln Tyr Asp Trp Asn Ser Phe Phe Asp Tyr Trp Gly Leu Gly Ala
100 105 110
Pro Val Thr Val Ser Ser
115
<210> 126
<211> 121
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 126
Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu Ser
1 5 10 15
Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr Ala
20 25 30
Met Ser Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Val Ser
35 40 45
Leu Ile Thr Thr Asn Gly Asp Gly Ala Tyr Tyr Ala Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Ile Tyr Tyr Cys Ala
85 90 95
Lys Asp Gly Ala Ala His Tyr Tyr Asp Ile Phe Phe Asp Tyr Trp Gly
100 105 110
Leu Gly Thr Pro Val Thr Val Ser Ser
115 120
<210> 127
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 127
Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu Ser
1 5 10 15
Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Ser Ile Tyr Ala
20 25 30
Met Ser Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Val Ser
35 40 45
Thr Ile Gly Ala Asp Asp Thr Tyr Tyr Ala Asp Ser Val Lys Gly Arg
50 55 60
Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln Met
65 70 75 80
Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Lys Asp
85 90 95
Ser Thr Val Gly Trp Ser Gly Asp Phe Phe Asp Tyr Trp Gly Leu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 128
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 128
Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu Ser
1 5 10 15
Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr Asp
20 25 30
Met Asn Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Val Ser
35 40 45
Leu Ile Ser Gly Ser Gly Glu Ile Ile Tyr Tyr Ala Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Lys Glu Asn Asn Arg Tyr Arg Phe Phe Asp Asp Trp Gly Leu Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 129
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 129
Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu Ser
1 5 10 15
Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr Ala
20 25 30
Met Asn Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Val Ser
35 40 45
Gly Ile Ser Gly Arg Gly Gly Asp Thr Tyr Tyr Ala Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Ile Tyr Tyr Cys Ala
85 90 95
Lys Gly Thr Trp Asn Tyr Gly Ser Phe Asp Tyr Trp Gly Leu Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 130
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 130
Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Gly Ser
1 5 10 15
Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Ser Asn Phe Ala
20 25 30
Met Thr Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Val Ser
35 40 45
Thr Ile Gly Ser Gly Asp Thr Tyr Tyr Ala Asp Ser Val Lys Gly Arg
50 55 60
Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln Met
65 70 75 80
Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Lys Asp
85 90 95
Ser Thr Val Ser Trp Ser Gly Asp Phe Phe Asp Tyr Trp Gly Leu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 131
<211> 102
<212> БЕЛОК
<213> Homo sapiens
<400> 131
Ala Pro Val Val Ser Gly Pro Ala Ala Arg Ala Thr Pro Gln His Thr
1 5 10 15
Val Ser Phe Thr Cys Glu Ser His Gly Phe Ser Pro Arg Asp Ile Thr
20 25 30
Leu Lys Trp Phe Lys Asn Gly Asn Glu Leu Ser Asp Phe Gln Thr Asn
35 40 45
Val Asp Pro Val Gly Glu Ser Val Ser Tyr Ser Ile His Ser Thr Ala
50 55 60
Lys Val Val Leu Thr Arg Glu Asp Val His Ser Gln Val Ile Cys Glu
65 70 75 80
Val Ala His Val Thr Leu Gln Gly Asp Pro Leu Arg Gly Thr Ala Asn
85 90 95
Leu Ser Glu Thr Ile Arg
100
<210> 132
<211> 99
<212> БЕЛОК
<213> Homo sapiens
<400> 132
Val Pro Pro Thr Leu Glu Val Thr Gln Gln Pro Val Arg Ala Glu Asn
1 5 10 15
Gln Val Asn Val Thr Cys Gln Val Arg Lys Phe Tyr Pro Gln Arg Leu
20 25 30
Gln Leu Thr Trp Leu Glu Asn Gly Asn Val Ser Arg Thr Glu Thr Ala
35 40 45
Ser Thr Val Thr Glu Asn Lys Asp Gly Thr Tyr Asn Trp Met Ser Trp
50 55 60
Leu Leu Val Asn Val Ser Ala His Arg Asp Asp Val Lys Leu Thr Cys
65 70 75 80
Gln Val Glu His Asp Gly Gln Pro Ala Val Ser Lys Ser His Asp Leu
85 90 95
Lys Val Ser
<210> 133
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 133
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Asp Met Asn Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Val
35 40 45
Ser Leu Ile Ser Gly Ser Gly Glu Ile Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Glu Asn Asn Arg Tyr Arg Phe Phe Asp Asp Trp Gly Leu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 134
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 134
Glu Thr Val Leu Thr Gln Ser Pro Gly Thr Leu Thr Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Thr Cys Arg Ala Ser Gln Ser Val Tyr Thr Tyr
20 25 30
Leu Ala Trp Tyr Gln Glu Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Tyr Asp Arg Pro Pro
85 90 95
Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 135
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 135
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Asn
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Ala Gly Ile Ser Ala Gly Gly Ser Asp Thr Tyr Tyr Pro Ala Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Thr Leu Thr Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Thr Trp Asn His Leu Phe Asp Tyr Trp Gly Leu Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 136
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 136
Ala Leu Thr Gln Pro Ala Ser Val Ser Ala Asn Pro Gly Glu Thr Val
1 5 10 15
Lys Ile Ala Cys Ser Gly Gly Asp Tyr Tyr Ser Tyr Tyr Tyr Gly Trp
20 25 30
Tyr Gln Gln Lys Ala Pro Gly Ser Ala Leu Val Thr Val Ile Tyr Ser
35 40 45
Asp Asp Lys Arg Pro Ser Asp Ile Pro Ser Arg Phe Ser Gly Ser Ala
50 55 60
Ser Gly Ser Thr Ala Thr Leu Thr Ile Thr Gly Val Arg Ala Glu Asp
65 70 75 80
Glu Ala Val Tyr Tyr Cys Gly Gly Tyr Asp Tyr Ser Thr Tyr Ala Asn
85 90 95
Ala Phe Gly Ala Gly Thr Thr Leu Thr Val Leu
100 105
<210> 137
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 137
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu
1 5 10 15
Ser Leu Arg Leu Ser Cys Glu Ala Ser Gly Phe Thr Phe Ser Ser Asn
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Gly Ile Ser Ser Gly Ser Asp Thr Tyr Tyr Gly Asp Ser Val Lys
50 55 60
Gly Arg Leu Thr Ile Ser Arg Asp Asn Ser Lys Asn Ile Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Thr Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Glu Thr Trp Asn His Leu Phe Asp Tyr Trp Gly Leu Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 138
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 138
Ala Leu Thr Gln Pro Ala Ser Val Ser Ala Asn Pro Gly Glu Thr Val
1 5 10 15
Glu Ile Thr Cys Ser Gly Gly Ser Tyr Ser Ser Tyr Tyr Tyr Ala Trp
20 25 30
Tyr Gln Gln Lys Ser Pro Gly Ser Ala Pro Val Thr Leu Ile Tyr Ser
35 40 45
Asp Asp Lys Arg Pro Ser Asn Ile Pro Ser Arg Phe Ser Gly Ser Ala
50 55 60
Ser Gly Ser Thr Ala Thr Leu Thr Ile Thr Gly Val Arg Ala Glu Asp
65 70 75 80
Glu Ala Val Tyr Phe Cys Gly Gly Tyr Asp Gln Ser Ser Tyr Thr Asn
85 90 95
Pro Phe Gly Ala Gly Thr Thr Leu Thr Val Leu
100 105
<210> 139
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 139
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe Arg Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Ser Gly Gly Asp Thr Tyr Tyr Val Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu
65 70 75 80
Gln Val Asn Ser Leu Thr Ala Glu Asp Thr Ala Ile Tyr Tyr Cys Ala
85 90 95
Arg Glu Thr Trp Asn His Leu Phe Asp Tyr Trp Gly Leu Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 140
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 140
Ala Leu Thr Gln Pro Ala Ser Val Ser Ala Asp Leu Gly Glu Thr Val
1 5 10 15
Lys Ile Thr Cys Ser Gly Gly Asp Ser Ser Ser His Tyr Tyr Gly Trp
20 25 30
Tyr Gln Gln Lys Ser Pro Gly Ser Ala Pro Val Thr Val Ile Tyr Ser
35 40 45
Asp Asp Glu Arg Pro Ser Asp Ile Pro Ser Arg Phe Ser Gly Ser Ala
50 55 60
Ser Gly Ser Thr Ala Thr Leu Thr Ile Thr Gly Val Arg Val Glu Asp
65 70 75 80
Glu Ala Ile Tyr Tyr Cys Gly Ala Tyr Asp Gly Ser Thr Tyr Ala Asn
85 90 95
Thr Phe Gly Ala Gly Thr Thr Leu Thr Val Leu
100 105
<210> 141
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 141
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Ala Gly Ile Ser Ala Gly Gly Ser Asp Thr Tyr Tyr Ile Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Pro Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Ser Ser Leu Thr Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Thr Trp Asn His Leu Phe Asp Tyr Trp Gly Leu Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 142
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 142
Ala Leu Thr Gln Pro Ala Ser Val Ser Ala Asn Pro Gly Glu Thr Val
1 5 10 15
Lys Ile Thr Cys Ser Gly Gly Asp Tyr Tyr Ser Thr Tyr Tyr Ala Trp
20 25 30
Tyr Gln Gln Lys Ser Pro Gly Ser Ala Pro Val Thr Val Ile His Ser
35 40 45
Asp Asp Lys Arg Pro Ser Asp Ile Pro Ser Arg Phe Ser Gly Ser Ala
50 55 60
Ser Gly Ser Ala Ala Thr Leu Ile Ile Thr Gly Val Arg Val Glu Asp
65 70 75 80
Glu Ala Val Tyr Tyr Cys Gly Gly Tyr Asp Gly Arg Thr Tyr Ile Asn
85 90 95
Thr Phe Gly Ala Gly Thr Thr Leu Thr Val Leu
100 105
<210> 143
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 143
Gly Phe Ser Phe Ser Asn Phe Ala Met Thr
1 5 10
<210> 144
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 144
Thr Ile Gly Ser Gly Asp Thr Tyr Tyr Ala Asp Ser Val Lys Gly
1 5 10 15
<210> 145
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 145
Asp Ser Thr Val Ser Trp Ser Gly Asp Phe Phe Asp Tyr
1 5 10
<210> 146
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 146
Arg Ala Ser Gln Asn Val Lys Asn Asp Leu Ala
1 5 10
<210> 147
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 147
Ala Ala Arg Ile Arg Glu Thr
1 5
<210> 148
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 148
Gln Gln Tyr Tyr Asp Trp Pro Pro Phe Thr
1 5 10
<210> 149
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 149
Gly Phe Ser Phe Ser Ile Tyr Ala Met Ser
1 5 10
<210> 150
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 150
Thr Ile Gly Ala Asp Asp Thr Tyr Tyr Ala Asp Ser Val Lys Gly
1 5 10 15
<210> 151
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 151
Asp Ser Thr Val Gly Trp Ser Gly Asp Phe Phe Asp Tyr
1 5 10
<210> 152
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 152
Arg Ala Ser Gln Asn Val Arg Ser Asp Ile Ala
1 5 10
<210> 153
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 153
Ala Ala Ser Ser Arg Asp Thr
1 5
<210> 154
<400> 154
000
<210> 155
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 155
Gly Phe Thr Phe Ser Ser Tyr Asp Met Asn
1 5 10
<210> 156
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 156
Leu Ile Ser Gly Ser Gly Glu Ile Ile Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 157
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 157
Glu Asn Asn Arg Tyr Arg Phe Phe Asp Asp
1 5 10
<210> 158
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 158
Arg Ala Ser Gln Ser Val Tyr Thr Tyr Leu Ala
1 5 10
<210> 159
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 159
Gly Ala Ser Ser Arg Ala Thr
1 5
<210> 160
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 160
Gln Gln Tyr Tyr Asp Arg Pro Pro Leu Thr
1 5 10
<210> 161
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 161
Gly Phe Thr Phe Ser Ser Asn Ala
1 5
<210> 162
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 162
Ile Ser Ala Gly Gly Ser Asp Thr
1 5
<210> 163
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 163
Ala Arg Glu Thr Trp Asn His Leu Phe Asp Tyr
1 5 10
<210> 164
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 164
Ser Gly Gly Asp Tyr Tyr Ser Tyr Tyr Tyr Gly
1 5 10
<210> 165
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 165
Thr Val Ile Tyr Ser Asp Asp Lys Arg Pro Ser Asp
1 5 10
<210> 166
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 166
Gly Gly Tyr Asp Tyr Ser Thr Tyr Ala Asn Ala
1 5 10
<210> 167
<400> 167
000
<210> 168
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 168
Ile Ser Ser Gly Ser Asp Thr
1 5
<210> 169
<400> 169
000
<210> 170
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 170
Ser Gly Gly Ser Tyr Ser Ser Tyr Tyr Tyr Ala
1 5 10
<210> 171
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 171
Thr Leu Ile Tyr Ser Asp Asp Lys Arg Pro Ser Asn
1 5 10
<210> 172
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 172
Gly Gly Tyr Asp Gln Ser Ser Tyr Thr Asn Pro
1 5 10
<210> 173
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 173
Gly Phe Arg Phe Ser Ser Tyr Ala
1 5
<210> 174
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 174
Ile Ser Ser Gly Gly Asp Thr
1 5
<210> 175
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 175
Asn Phe Ala Met Thr
1 5
<210> 176
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 176
Ser Gly Gly Asp Ser Ser Ser His Tyr Tyr Gly
1 5 10
<210> 177
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 177
Thr Val Ile Tyr Ser Asp Asp Glu Arg Pro Ser Asp
1 5 10
<210> 178
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 178
Gly Ala Tyr Asp Gly Ser Thr Tyr Ala Asn Thr
1 5 10
<210> 179
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 179
Gly Phe Thr Phe Ser Ser Tyr Ala
1 5
<210> 180
<400> 180
000
<210> 181
<400> 181
000
<210> 182
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 182
Ser Gly Gly Asp Tyr Tyr Ser Thr Tyr Tyr Ala
1 5 10
<210> 183
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 183
Thr Val Ile His Ser Asp Asp Lys Arg Pro Ser Asp
1 5 10
<210> 184
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 184
Gly Gly Tyr Asp Gly Arg Thr Tyr Ile Asn Thr
1 5 10
<210> 185
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<220>
<221> VARIANT
<222> 6
<223> Xaa = Asn or Ile
<220>
<221> VARIANT
<222> 7
<223> Xaa = Phe or Tyr
<220>
<221> VARIANT
<222> 10
<223> Xaa = Thr or Ser
<400> 185
Gly Phe Ser Phe Ser Xaa Xaa Ala Met Xaa
1 5 10
<210> 186
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<220>
<221> VARIANT
<222> 4
<223> Xaa = Ser or Ala
<220>
<221> VARIANT
<222> 5
<223> Xaa = Gly or Asp
<400> 186
Thr Ile Gly Xaa Xaa Asp Thr Tyr Tyr Ala Asp Ser Val Lys Gly
1 5 10 15
<210> 187
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<220>
<221> VARIANT
<222> 5
<223> Xaa = Ser or Gly
<400> 187
Asp Ser Thr Val Xaa Trp Ser Gly Asp Phe Phe Asp Tyr
1 5 10
<210> 188
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<220>
<221> VARIANT
<222> 7
<223> Xaa = Lys or Arg
<220>
<221> VARIANT
<222> 8
<223> Xaa = Asn or Ser
<220>
<221> VARIANT
<222> 10
<223> Xaa = Leu or Ile
<400> 188
Arg Ala Ser Gln Asn Val Xaa Xaa Asp Xaa Ala
1 5 10
<210> 189
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<220>
<221> VARIANT
<222> 3
<223> Xaa = Arg or Ser
<220>
<221> VARIANT
<222> 4
<223> Xaa = Ile or Ser
<220>
<221> VARIANT
<222> 6
<223> Xaa = Glu or Asp
<400> 189
Ala Ala Xaa Xaa Arg Xaa Thr
1 5
<210> 190
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 190
Gly Gly Tyr Asp Tyr Ser Thr Tyr Ala
1 5
<210> 191
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 191
Gly Phe Thr Phe Ser Ser Asn
1 5
<210> 192
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 192
Ser Ala Gly Gly Ser Asp
1 5
<210> 193
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 193
Glu Thr Trp Asn His Leu Phe Asp Tyr
1 5
<210> 194
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 194
Ser Asn Ala Met Ser
1 5
<210> 195
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 195
Gly Ile Ser Ala Gly Gly Ser Asp Thr Tyr Tyr Pro Ala Ser Val Lys
1 5 10 15
Gly
<210> 196
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 196
Ser Ser Gly Ser Asp
1 5
<210> 197
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 197
Gly Ile Ser Ser Gly Ser Asp Thr Tyr Tyr Gly Asp Ser Val Lys Gly
1 5 10 15
<210> 198
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 198
Gly Phe Arg Phe Ser Ser Tyr
1 5
<210> 199
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 199
Ser Ser Gly Gly Asp
1 5
<210> 200
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 200
Ser Tyr Ala Met Ser
1 5
<210> 201
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 201
Gly Ile Ser Ser Gly Gly Asp Thr Tyr Tyr Val Asp Ser Val Lys Gly
1 5 10 15
<210> 202
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 202
Gly Phe Ser Phe Ser Asn Phe
1 5
<210> 203
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 203
Gly Ser Gly Asp
1
<210> 204
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 204
Asn Phe Ala Val Thr
1 5
<210> 205
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 205
Gly Phe Ser Phe Ser Asn Phe Ala
1 5
<210> 206
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 206
Ile Gly Ser Gly Asp Thr
1 5
<210> 207
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 207
Ala Lys Asp Ser Thr Val Ser Trp Ser Gly Asp Phe Phe Asp Tyr
1 5 10 15
<210> 208
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 208
Gln Asn Val Lys Asn Asp
1 5
<210> 209
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 209
Ala Ala Arg
1
<210> 210
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 210
Gln Gln Tyr Tyr Asp Trp Pro
1 5
<210> 211
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 211
Gly Phe Ser Phe Ser Ile Tyr
1 5
<210> 212
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 212
Gly Ala Asp Asp
1
<210> 213
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 213
Ile Tyr Ala Val Ser
1 5
<210> 214
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 214
Gly Phe Ser Phe Ser Ile Tyr Ala
1 5
<210> 215
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 215
Ile Gly Ala Asp Asp Thr
1 5
<210> 216
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 216
Ala Lys Asp Ser Thr Val Gly Trp Ser Gly Asp Phe Phe Asp Tyr
1 5 10 15
<210> 217
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 217
Gln Asn Val Arg Ser Asp
1 5
<210> 218
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 218
Ala Ala Ser
1
<210> 219
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 219
Gly Phe Thr Phe Ser Ser Tyr
1 5
<210> 220
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 220
Ser Gly Ser Gly Glu Ile
1 5
<210> 221
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 221
Ser Tyr Asp Val Asn
1 5
<210> 222
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 222
Gly Phe Thr Phe Ser Ser Tyr Asp
1 5
<210> 223
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 223
Ile Ser Gly Ser Gly Glu Ile Ile
1 5
<210> 224
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 224
Ala Lys Glu Asn Asn Arg Tyr Arg Phe Phe Asp Asp
1 5 10
<210> 225
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 225
Gln Ser Val Tyr Thr Tyr
1 5
<210> 226
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 226
Gly Ala Ser
1
<210> 227
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 227
Asp Tyr Gly Met Asn
1 5
<210> 228
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 228
Gln Ile Thr Ser Gly Ser Arg Thr Tyr Tyr Gly Ala Ala Val Lys Gly
1 5 10 15
<210> 229
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 229
Asp Phe Gly Ser Gly Val Gly Ser Ile Asp Ala
1 5 10
<210> 230
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 230
Gly Phe Ile Phe Ser Asp Tyr
1 5
<210> 231
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 231
Thr Ser Gly Ser Arg
1 5
<210> 232
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 232
Ser Gly Ser Arg Gly Arg Tyr Gly
1 5
<210> 233
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 233
Arg Asp Asn Gln Arg Pro Ser
1 5
<210> 234
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 234
Gly Ser Tyr Asp Gly Ser Ile Asp Ile
1 5
<210> 235
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 235
Ser Tyr Ala Met Gly
1 5
<210> 236
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 236
Gly Ile Asp Asp Asp Gly Ser Thr Ala Asn Tyr Gly Pro Ala Val Lys
1 5 10 15
Gly
<210> 237
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 237
Ala Ser Val Thr Gly Trp Ser Ala His Ile Ser Gly Arg Leu Asp Thr
1 5 10 15
<210> 238
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 238
Asp Asp Gly Ser Thr
1 5
<210> 239
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 239
Ser Gly Gly Gly Ile Tyr Tyr Tyr Gly
1 5
<210> 240
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 240
Glu Asn Asp Lys Arg Pro Ser
1 5
<210> 241
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 241
Gly Gly Tyr Asp Ser Asn Thr Thr Ser Gly Ile
1 5 10
<210> 242
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 242
Ala Val Thr Leu Asp Glu Ser Gly Gly Gly Leu Gln Thr Pro Gly Gly
1 5 10 15
Ala Leu Ser Leu Val Cys Lys Ala Ser Gly Phe Ile Phe Ser Asp Tyr
20 25 30
Gly Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Phe Val
35 40 45
Ala Gln Ile Thr Ser Gly Ser Arg Thr Tyr Tyr Gly Ala Ala Val Lys
50 55 60
Gly Arg Ala Thr Ile Ser Arg Asp Asn Arg Gln Ser Thr Val Lys Leu
65 70 75 80
Gln Leu Asn Asn Leu Arg Ala Glu Asp Thr Gly Ile Tyr Phe Cys Ala
85 90 95
Arg Asp Phe Gly Ser Gly Val Gly Ser Ile Asp Ala Trp Gly Asn Gly
100 105 110
Thr Glu Val Ile Val Ser Ser
115
<210> 243
<211> 102
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 243
Ala Leu Thr Gln Pro Ala Ser Val Ser Ala Asn Leu Gly Gly Thr Val
1 5 10 15
Lys Ile Thr Cys Ser Gly Ser Arg Gly Arg Tyr Gly Trp Tyr Gln Gln
20 25 30
Arg Ser Pro Gly Ser Ala Pro Val Thr Val Ile Tyr Arg Asp Asn Gln
35 40 45
Arg Pro Ser Asn Ile Pro Ser Arg Phe Ser Ser Ser Thr Ser Gly Ser
50 55 60
Thr Ser Thr Leu Thr Ile Thr Gly Val Gln Ala Asp Asp Glu Ser Val
65 70 75 80
Tyr Phe Cys Gly Ser Tyr Asp Gly Ser Ile Asp Ile Phe Gly Ala Gly
85 90 95
Thr Thr Leu Thr Val Leu
100
<210> 244
<211> 125
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 244
Ala Val Thr Leu Asp Glu Ser Gly Gly Gly Leu Gln Thr Pro Gly Gly
1 5 10 15
Ala Leu Ser Leu Val Cys Lys Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Gly Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Gly Ile Asp Asp Asp Gly Ser Thr Ala Asn Tyr Gly Pro Ala Val
50 55 60
Lys Gly Arg Ala Thr Ile Ser Arg Asp Asn Gly Gln Ser Thr Val Arg
65 70 75 80
Leu Gln Leu Asn Asn Pro Arg Ala Glu Asp Ser Gly Thr Tyr Phe Cys
85 90 95
Ala Lys Ala Ser Val Thr Gly Trp Ser Ala His Ile Ser Gly Arg Leu
100 105 110
Asp Thr Trp Gly His Gly Thr Glu Val Ile Val Ser Ser
115 120 125
<210> 245
<211> 105
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 245
Ala Leu Thr Gln Pro Ala Ser Val Ser Ala Asn Pro Gly Glu Thr Val
1 5 10 15
Lys Ile Thr Cys Ser Gly Gly Gly Ile Tyr Tyr Tyr Gly Trp Tyr Gln
20 25 30
Gln Lys Ser Pro Gly Ser Ala Pro Val Thr Leu Ile Tyr Glu Asn Asp
35 40 45
Lys Arg Pro Ser Asp Ile Pro Ser Arg Phe Ser Gly Ser Thr Ser Gly
50 55 60
Ser Thr Asn Thr Phe Thr Ile Thr Gly Val Gln Ala Glu Asp Glu Ala
65 70 75 80
Val Tyr Tyr Cys Gly Gly Tyr Asp Ser Asn Thr Thr Ser Gly Ile Phe
85 90 95
Gly Ala Gly Thr Thr Leu Thr Val Leu
100 105
<210> 246
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 246
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Val Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Ser Asn Phe
20 25 30
Ala Val Thr Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Thr Ile Gly Ser Gly Asp Thr Tyr Tyr Ala Asp Ser Val Lys Gly
50 55 60
Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln
65 70 75 80
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Lys
85 90 95
Asp Ser Thr Val Ser Trp Ser Gly Asp Phe Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 247
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 247
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Ser Ile Tyr
20 25 30
Ala Val Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Thr Ile Gly Ala Asp Asp Thr Tyr Tyr Ala Asp Ser Val Lys Gly
50 55 60
Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln
65 70 75 80
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Lys
85 90 95
Asp Ser Thr Val Gly Trp Ser Gly Asp Phe Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 248
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 248
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Val Thr Leu Ser Cys Arg Ala Ser Gln Asn Val Arg Ser Asp
20 25 30
Ile Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Arg Asp Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Gly Val Tyr Tyr Cys Gln Gln Tyr Tyr Asp Trp Pro Pro
85 90 95
Phe Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 249
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 249
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Asp Val Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Leu Ile Ser Gly Ser Gly Glu Ile Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Glu Asn Asn Arg Tyr Arg Phe Phe Asp Asp Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 250
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 250
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Tyr Thr Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Tyr Asp Arg Pro Pro
85 90 95
Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 251
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 251
Glu Thr Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Tyr Thr Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Tyr Asp Arg Pro Pro
85 90 95
Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 252
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 252
Ser Tyr Glu Leu Thr Gln Pro Pro Ser Val Ser Val Ser Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Ser Gly Gly Ser Tyr Ser Ser Tyr Tyr Tyr
20 25 30
Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Thr Leu Ile Tyr
35 40 45
Ser Asp Asp Lys Arg Pro Ser Asn Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Ser Ser Gly Thr Thr Val Thr Leu Thr Ile Ser Gly Val Gln Ala Glu
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gly Gly Tyr Asp Gln Ser Ser Tyr Thr
85 90 95
Asn Pro Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105
<210> 253
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 253
Gln Ser Val Leu Thr Gln Pro Pro Ser Val Ser Ala Ala Pro Gly Gln
1 5 10 15
Lys Val Thr Ile Ser Cys Ser Gly Gly Ser Tyr Ser Ser Tyr Tyr Tyr
20 25 30
Ala Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Thr Leu Ile Tyr
35 40 45
Ser Asp Asp Lys Arg Pro Ser Asn Ile Pro Asp Arg Phe Ser Gly Ser
50 55 60
Lys Ser Gly Thr Ser Ala Thr Leu Gly Ile Thr Gly Leu Gln Thr Gly
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gly Gly Tyr Asp Gln Ser Ser Tyr Thr
85 90 95
Asn Pro Phe Gly Thr Gly Thr Lys Val Thr Val Leu
100 105
<210> 254
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 254
Ser Tyr Glu Leu Thr Gln Pro Pro Ser Val Ser Val Ser Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Ser Gly Gly Asp Tyr Tyr Ser Thr Tyr Tyr
20 25 30
Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Thr Val Ile His
35 40 45
Ser Asp Asp Lys Arg Pro Ser Asp Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Ser Ser Gly Thr Thr Val Thr Leu Thr Ile Ser Gly Val Gln Ala Glu
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gly Gly Tyr Asp Gly Arg Thr Tyr Ile
85 90 95
Asn Thr Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105
<210> 255
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 255
Gln Ser Val Leu Thr Gln Pro Pro Ser Val Ser Ala Ala Pro Gly Gln
1 5 10 15
Lys Val Thr Ile Ser Cys Ser Gly Gly Asp Tyr Tyr Ser Thr Tyr Tyr
20 25 30
Ala Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Thr Val Ile His
35 40 45
Ser Asp Asp Lys Arg Pro Ser Asp Ile Pro Asp Arg Phe Ser Gly Ser
50 55 60
Lys Ser Gly Thr Ser Ala Thr Leu Gly Ile Thr Gly Leu Gln Thr Gly
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gly Gly Tyr Asp Gly Arg Thr Tyr Ile
85 90 95
Asn Thr Phe Gly Thr Gly Thr Lys Val Thr Val Leu
100 105
<210> 256
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 256
Gln Ser Ala Leu Thr Gln Pro Ala Ser Val Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Ile Thr Ile Ser Cys Thr Gly Thr Ser Ser Asp Val Gly Ser Tyr
20 25 30
Ser Ser Tyr Tyr Tyr Ala Trp Tyr Gln Gln His Pro Gly Lys Ala Pro
35 40 45
Lys Thr Leu Ile Tyr Ser Asp Asp Lys Arg Pro Ser Asn Val Ser Asn
50 55 60
Arg Phe Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Ile Ser
65 70 75 80
Gly Leu Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Gly Gly Tyr Asp
85 90 95
Gln Ser Ser Tyr Thr Asn Pro Phe Gly Gly Gly Thr Lys Leu Thr Val
100 105 110
Leu
<210> 257
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 257
Gln Ser Val Leu Thr Gln Pro Pro Ser Val Ser Ala Ala Pro Gly Gln
1 5 10 15
Lys Val Thr Ile Ser Cys Ser Gly Gly Asp Tyr Tyr Ser Tyr Tyr Tyr
20 25 30
Gly Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Thr Val Ile Tyr
35 40 45
Ser Asp Asp Lys Arg Pro Ser Asp Ile Pro Asp Arg Phe Ser Gly Ser
50 55 60
Lys Ser Gly Thr Ser Ala Thr Leu Gly Ile Thr Gly Leu Gln Thr Gly
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gly Gly Tyr Asp Tyr Ser Thr Tyr Ala
85 90 95
Asn Ala Phe Gly Thr Gly Thr Lys Val Thr Val Leu
100 105
<210> 258
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 258
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Val Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Ser Asn Phe
20 25 30
Ala Met Thr Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Thr Ile Gly Ser Gly Asp Thr Tyr Tyr Ala Asp Ser Val Lys Gly
50 55 60
Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln
65 70 75 80
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Lys
85 90 95
Asp Ser Thr Val Ser Trp Ser Gly Asp Phe Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 259
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 259
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Ser Ile Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Thr Ile Gly Ala Asp Asp Thr Tyr Tyr Ala Asp Ser Val Lys Gly
50 55 60
Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln
65 70 75 80
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Lys
85 90 95
Asp Ser Thr Val Gly Trp Ser Gly Asp Phe Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 260
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 260
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Asp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Leu Ile Ser Gly Ser Gly Glu Ile Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Glu Asn Asn Arg Tyr Arg Phe Phe Asp Asp Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 261
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 261
Ser Gly Gly Ala Tyr Ser Ser Tyr Tyr Tyr Ala
1 5 10
<210> 262
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 262
Ser Tyr Glu Leu Thr Gln Pro Pro Ser Val Ser Val Ser Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Ser Gly Gly Ala Tyr Ser Ser Tyr Tyr Tyr
20 25 30
Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Ile Tyr
35 40 45
Ser Asp Asp Lys Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Ser Ser Gly Thr Thr Val Thr Leu Thr Ile Ser Gly Val Gln Ala Glu
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gly Gly Tyr Asp Gln Ser Ser Tyr Thr
85 90 95
Asn Pro Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105
<210> 263
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 263
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Asn
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Gly Ile Ser Ala Gly Gly Ser Asp Thr Tyr Tyr Pro Ala Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Thr Trp Asn His Leu Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 264
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 264
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Asn
20 25 30
Ala Val Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Gly Ile Ser Ala Gly Gly Ser Asp Thr Tyr Tyr Pro Ala Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Thr Trp Asn His Leu Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 265
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 265
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Asn
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Gly Ile Ser Ser Gly Ser Asp Thr Tyr Tyr Gly Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Thr Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Glu Thr Trp Asn His Leu Phe Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 266
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 266
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Asn
20 25 30
Ala Val Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Gly Ile Ser Ser Gly Ser Asp Thr Tyr Tyr Gly Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Thr Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Glu Thr Trp Asn His Leu Phe Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 267
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 267
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Arg Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Ser Gly Gly Asp Thr Tyr Tyr Val Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Glu Thr Trp Asn His Leu Phe Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 268
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 268
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Arg Phe Ser Ser Tyr
20 25 30
Ala Val Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Ser Gly Gly Asp Thr Tyr Tyr Val Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Glu Thr Trp Asn His Leu Phe Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 269
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 269
Ile Tyr Ala Met Ser
1 5
<210> 270
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 270
Ser Tyr Asp Met Asn
1 5
<210> 271
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 271
Ser Asn Ala Val Ser
1 5
<210> 272
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 272
Ser Tyr Ala Val Ser
1 5
<210> 273
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 273
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Ser Ser Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Val
35 40 45
Ser Arg Ile Asn Ser Gly Gly Gly Gly Thr Asp Tyr Ala Glu Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Glu Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Gln Tyr Asp Trp Asn Ser Phe Phe Asp Tyr Trp Gly Leu Gly
100 105 110
Ala Leu Val Thr Val Ser Ser
115
<210> 274
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 274
Glu Thr Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Thr Val Gly Ser Lys
20 25 30
Leu Ala Trp His Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Thr Asn Arg Ala Thr Gly Ile Ser Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Thr
65 70 75 80
Glu Asp Ser Ala Val Tyr Tyr Cys Gln Gln Tyr Tyr Tyr Trp Pro Pro
85 90 95
Tyr Arg Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 275
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 275
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu
1 5 10 15
Ser Leu Arg Leu Ser Cys Glu Ala Ser Gly Phe Thr Phe Arg Asn Tyr
20 25 30
Tyr Met Thr Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Val
35 40 45
Ser Thr Ile Ser Asp Thr Gly Asp Thr Ala Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Asp Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Ala Lys Ser Trp Ile Trp Trp Thr Phe Phe Asp Tyr Trp Gly Leu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 276
<211> 103
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 276
Ala Leu Thr Gln Pro Ala Ser Val Ser Ala Asn Leu Gly Gly Thr Val
1 5 10 15
Glu Ile Thr Cys Ser Gly Gly Asn Ser Asn His Tyr Gly Trp Tyr Gln
20 25 30
Gln Lys Ser Pro Gly Ser Ala Pro Val Thr Leu Ile Tyr Ala Asp Thr
35 40 45
Asn Arg Pro Ser Asn Ile Pro Ser Arg Phe Ser Gly Ser Thr Ser Gly
50 55 60
Ser Thr Thr Thr Leu Thr Ile Thr Gly Val Gln Ala Glu Asp Glu Ala
65 70 75 80
Val Tyr Tyr Cys Gly Gly Ser Ser Thr Gly Asp Gly Ile Phe Gly Ala
85 90 95
Gly Thr Thr Leu Thr Val Leu
100
<210> 277
<400> 277
000
<210> 278
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 278
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ala Phe Ser Asp His
20 25 30
Asp Met Ser Trp Val Arg Gln Gly Pro Gly Glu Gly Leu Glu Trp Val
35 40 45
Ala Gly Ile Ser Leu Arg Gly Gly Val Thr Trp Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Arg Leu Phe Ser Leu Arg Thr Glu Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Ala Arg Glu Ser Trp Asn Thr Phe Phe Asp Tyr Trp Gly Leu Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 279
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 279
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Thr Ala Thr Leu Ser Cys Arg Ala Ser Gln Asn Val Arg Ser Asn
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Gly Asn Gly Pro Pro
85 90 95
Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 280
<211> 121
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 280
Asp Val Gln Leu Val Glu Ser Gly Gly Ala Val Val Arg Pro Gly Glu
1 5 10 15
Ser Leu Arg Leu Ser Cys Lys Ala Ser Gly Phe Thr Phe Thr Asn Phe
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Gly Ser Asp Asp Thr Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Glu Ser Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Lys Asp Ser Thr Val Ser Trp Asn Thr Phe Phe Asp Tyr Trp Gly
100 105 110
Leu Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 281
<211> 110
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 281
Ala Leu Thr Gln Pro Ala Ser Val Ser Ala Asn Leu Gly Gly Thr Val
1 5 10 15
Lys Ile Thr Cys Ser Gly Gly Tyr Gly Ser Asp Asp Gly Ser Ser Ser
20 25 30
Tyr Tyr Gly Trp Tyr Gln Gln Lys Ser Pro Gly Ser Ala Pro Val Ile
35 40 45
Leu Ile Tyr Trp Asp Asp Lys Arg Pro Ser Asp Ile Pro Ser Arg Phe
50 55 60
Ser Gly Ser Thr Ser Gly Ser Thr Thr Thr Leu Thr Ile Thr Gly Val
65 70 75 80
Gln Ala Glu Asp Glu Ala Val Tyr Phe Cys Gly Thr Tyr Asp Thr Ser
85 90 95
Ser Gly Ala Ile Phe Gly Ala Gly Thr Thr Leu Thr Val Leu
100 105 110
<210> 282
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 282
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Arg Ser Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Val
35 40 45
Ser Arg Ile Asn Ser Gly Gly Gly Gly Thr Asp Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Gln Tyr Asp Trp Asn Ser Phe Phe Asp Tyr Trp Gly Leu Gly
100 105 110
Ala Leu Val Thr Val Ser Ser
115
<210> 283
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 283
Glu Thr Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Thr Val Gly Ser Lys
20 25 30
Leu Ala Trp His Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Pro Gln Thr
65 70 75 80
Glu Asp Ser Ala Val Tyr Tyr Cys Gln Gln Tyr Tyr Tyr Trp Pro Pro
85 90 95
Tyr Arg Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 284
<211> 114
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 284
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu
1 5 10 15
Ser Leu Thr Leu Ser Cys Thr Ala Ser Gly Phe Thr Phe Thr Ser Ser
20 25 30
Thr Met Asn Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Asp Trp Val
35 40 45
Ser Ser Ile Ser Thr Ser Gly Val Ile Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Ala Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Arg Leu Phe Ser Leu Arg Ala Asp Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Ala Thr Asp Thr Phe Asp His Trp Gly Pro Gly Thr Leu Val Thr Val
100 105 110
Ser Ser
<210> 285
<211> 102
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 285
Ala Leu Thr Gln Pro Ala Ser Val Ser Ala Asn Pro Gly Glu Thr Val
1 5 10 15
Lys Ile Thr Cys Phe Gly Ser Ser Gly Asn Tyr Gly Trp Phe Gln Gln
20 25 30
Lys Ser Pro Gly Ser Ala Pro Val Thr Val Ile His Tyr Asn Asn Lys
35 40 45
Arg Pro Ser Asp Ile Pro Ser Arg Phe Ser Gly Ser Lys Ser Gly Ser
50 55 60
Thr Gly Thr Leu Thr Ile Thr Gly Val Arg Ala Glu Asp Glu Ala Val
65 70 75 80
Tyr Phe Cys Gly Ala Trp Glu Thr Gly Ser Ala Thr Phe Gly Ala Gly
85 90 95
Thr Thr Leu Thr Val Leu
100
<210> 286
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 286
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Phe
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Val
35 40 45
Ser Leu Ile Ser Val Thr Ala Thr Thr Tyr Tyr Ala Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Lys Val Thr Trp Asn Asn Leu Phe Asp Tyr Trp Gly Leu Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 287
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 287
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Pro Ile Asp Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asn Thr Val Thr Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn Arg Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln His Gln Tyr Asp Trp Pro Pro
85 90 95
Tyr Ile Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 288
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 288
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Phe
20 25 30
Ala Met Thr Trp Val Arg Gln Ala Pro Gly Lys Gly Pro Glu Trp Val
35 40 45
Ser Leu Val Ser Val Thr Ala Thr Thr Tyr Tyr Ala Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Ser Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Lys Ile Thr Trp Asn Asn Leu Phe Asp Tyr Trp Gly Leu Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 289
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 289
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Thr Val Gly Ser Lys
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ser Ser Ser Arg Ala Ser Gly Ile Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Ser Ala Val Tyr Tyr Cys Gln Gln His Asn Asp Trp Pro Pro
85 90 95
Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 290
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 290
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Arg Pro Gly Glu
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Thr Asn Tyr
20 25 30
Ala Val Thr Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Val
35 40 45
Ser Leu Ile Ser Val Thr Gly Thr Thr Tyr Tyr Ala Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Ser Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Lys Val Thr Trp Lys Asn Val Phe Asp Tyr Trp Gly Leu Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 291
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 291
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Phe Ser Cys Arg Ala Ser Gln Thr Val Gly Ser Lys
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Asn Thr Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln His Thr Asp Trp Pro Pro
85 90 95
Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 292
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 292
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Arg Asn Tyr
20 25 30
Gly Met Ser Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Val
35 40 45
Ser Ala Ser Ser Gly Ser Gly Ser Thr Tyr Tyr Ala Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Ile Tyr Tyr Cys Ala
85 90 95
Lys Val Thr Trp Asn Asn Phe Phe Asp Tyr Trp Gly Leu Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 293
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 293
Glu Ile Val Leu Ala Gln Ser Pro Asp Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Thr Cys Arg Ala Ser Gln Asp Val Ala Gly Lys
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
His Ala Thr Ser Ser Arg Ala Asp Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Thr Gly Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln His Tyr Asp Trp Ser Pro
85 90 95
Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 294
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 294
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe Arg Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Ser Gly Gly Asp Thr Tyr Tyr Val Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu
65 70 75 80
Gln Val Asn Ser Leu Thr Ala Glu Asp Thr Ala Ile Tyr Tyr Cys Ala
85 90 95
Arg Glu Thr Trp Asn His Leu Phe Asp Tyr Trp Gly Leu Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 295
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 295
Ala Leu Thr Gln Pro Ala Ser Val Ser Ala Asn Leu Gly Glu Thr Val
1 5 10 15
Lys Ile Thr Cys Ser Gly Gly Asp Ser Ser Ser His Tyr Tyr Gly Trp
20 25 30
Tyr Gln Gln Lys Ser Pro Gly Ser Ala Pro Val Thr Val Ile Tyr Ser
35 40 45
Asp Asp Glu Arg Pro Ser Asp Ile Pro Ser Arg Phe Ser Gly Ser Ala
50 55 60
Ser Gly Ser Thr Ala Thr Leu Thr Ile Thr Gly Val Arg Val Glu Asp
65 70 75 80
Glu Ala Ile Tyr Tyr Cys Gly Ala Tyr Asp Gly Ser Thr Tyr Ala Asn
85 90 95
Thr Phe Gly Ala Gly Thr Thr Leu Thr Val Leu
100 105
<210> 296
<211> 127
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 296
Glu Glu Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Leu Val Ala
1 5 10 15
Ala Gly Glu Thr Ala Thr Leu Arg Cys Thr Ala Thr Ser Leu Ile Pro
20 25 30
Val Gly Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Gly Arg Glu Leu
35 40 45
Ile Tyr Asn Gln Lys Glu Gly His Phe Pro Arg Val Thr Thr Val Ser
50 55 60
Asp Leu Thr Lys Arg Asn Asn Met Asp Phe Ser Ile Arg Ile Gly Ala
65 70 75 80
Ile Thr Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys
85 90 95
Gly Ser Pro Asp Asp Val Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu
100 105 110
Ser Val Arg Ala Lys Pro Ser Thr Arg His His His His His His
115 120 125
<210> 297
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<220>
<221> VARIANT
<222> 1
<223> Xaa = Ser or Thr
<220>
<221> VARIANT
<222> 2
<223> Xaa = Asn or Tyr or His or Asp
<220>
<221> VARIANT
<222> 4
<223> Xaa = Met or Leu or Val
<400> 297
Xaa Xaa Ala Xaa Ser
1 5
<210> 298
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<220>
<221> VARIANT
<222> 4
<223> Xaa = Ala or Ser
<220>
<221> VARIANT
<222> 5
<223> Xaa = Gly or Ser or absent
<220>
<221> VARIANT
<222> 6
<223> Xaa = Ser or Asp or Gly
<220>
<221> VARIANT
<222> 7
<223> Xaa = Gly or Ser
<220>
<221> VARIANT
<222> 8
<223> Xaa = Asp or Ser or Gly
<220>
<221> VARIANT
<222> 9
<223> Xaa = Thr or Ala
<220>
<221> VARIANT
<222> 12
<223> Xaa = Pro or Gly or Val or Ile or Ala or Ser
<220>
<221> VARIANT
<222> 13
<223> Xaa = Ala or Asp or Gly
<220>
<221> VARIANT
<222> 15
<223> Xaa = Val or Met
<400> 298
Gly Ile Ser Xaa Xaa Xaa Xaa Xaa Xaa Tyr Tyr Xaa Xaa Ser Xaa Lys
1 5 10 15
Gly
<210> 299
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<220>
<221> VARIANT
<222> 4
<223> Xaa = Asp or Gly or Ser or Ile or absent
<220>
<221> VARIANT
<222> 5
<223> Xaa = Ser or Trp or Gly or Tyr or Asp
<220>
<221> VARIANT
<222> 6
<223> Xaa = Ser or Tyr or Thr or Asp
<220>
<221> VARIANT
<222> 8
<223> Xaa = His or Thr or Ser or Tyr
<220>
<221> VARIANT
<222> 11
<223> Xaa = Gly or Ala
<400> 299
Ser Gly Gly Xaa Xaa Xaa Ser Xaa Tyr Tyr Xaa
1 5 10
<210> 300
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<220>
<221> VARIANT
<222> 3
<223> Xaa = Asp or Asn
<220>
<221> VARIANT
<222> 4
<223> Xaa = Glu or Lys or Gln
<220>
<221> VARIANT
<222> 7
<223> Xaa = Ser or Pro
<400> 300
Ser Asp Xaa Xaa Arg Pro Xaa
1 5
<210> 301
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<220>
<221> VARIANT
<222> 1
<223> Xaa = Gly or Ala
<220>
<221> VARIANT
<222> 2
<223> Xaa = Gly or Ala
<220>
<221> VARIANT
<222> 5
<223> Xaa = Gly or Tyr or Gln or Ser or Ala
<220>
<221> VARIANT
<222> 6
<223> Xaa = Ser or Arg or Thr
<220>
<221> VARIANT
<222> 7
<223> Xaa = Thr or Ser
<220>
<221> VARIANT
<222> 9
<223> Xaa = Ala or Ile or Val or Leu or Thr
<220>
<221> VARIANT
<222> 11
<223> Xaa = Thr or Ala or Asp or Pro
<400> 301
Xaa Xaa Tyr Asp Xaa Xaa Xaa Tyr Xaa Asn Xaa
1 5 10
<210> 302
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<220>
<221> VARIANT
<222> 2
<223> Xaa = Asn or Tyr
<220>
<221> VARIANT
<222> 4
<223> Xaa = Met or Leu or Val
<400> 302
Ser Xaa Ala Xaa Ser
1 5
<210> 303
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<220>
<221> VARIANT
<222> 4
<223> Xaa = Ala or Ser
<220>
<221> VARIANT
<222> 6
<223> Xaa = Gly or absent
<220>
<221> VARIANT
<222> 7
<223> Xaa = Ser or Gly
<220>
<221> VARIANT
<222> 12
<223> Xaa = Pro or Gly or Val
<220>
<221> VARIANT
<222> 13
<223> Xaa = Ala or Asp
<400> 303
Gly Ile Ser Xaa Gly Xaa Xaa Asp Thr Tyr Tyr Xaa Xaa Ser Val Lys
1 5 10 15
Gly
<210> 304
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<220>
<221> VARIANT
<222> 4
<223> Xaa = Ser or Ala
<400> 304
Ser Gly Gly Xaa Tyr Ser Ser Tyr Tyr Tyr Ala
1 5 10
<210> 305
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 305
Asn Phe Ala Leu Thr
1 5
<210> 306
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 306
Ile Tyr Ala Leu Ser
1 5
<210> 307
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<220>
<221> VARIANT
<222> 1
<223> Xaa = Ser or Thr
<220>
<221> VARIANT
<222> 2
<223> Xaa = Tyr or Ser
<220>
<221> VARIANT
<222> 4
<223> Xaa = Met or Leu or Val
<400> 307
Xaa Xaa Asp Xaa Asn
1 5
<210> 308
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<220>
<221> VARIANT
<222> 9
<223> Xaa = Ile or Thr
<400> 308
Leu Ile Ser Gly Ser Gly Glu Ile Xaa Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 309
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<220>
<221> VARIANT
<222> 2
<223> Xaa = Asn or Asp
<220>
<221> VARIANT
<222> 3
<223> Xaa = Asn or Asp
<220>
<221> VARIANT
<222> 4
<223> Xaa = Arg or Met
<220>
<221> VARIANT
<222> 10
<223> Xaa = Asp or Tyr
<400> 309
Glu Xaa Xaa Xaa Tyr Arg Phe Phe Asp Xaa
1 5 10
<210> 310
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<220>
<221> VARIANT
<222> 3
<223> Xaa = Ser or Asp
<220>
<221> VARIANT
<222> 8
<223> Xaa = Thr or Ser
<400> 310
Arg Ala Xaa Gln Ser Val Tyr Xaa Tyr Leu Ala
1 5 10
<210> 311
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<220>
<221> VARIANT
<222> 1
<223> Xaa = Gly or Ala or Asp
<220>
<221> VARIANT
<222> 3
<223> Xaa = Ser or Arg
<220>
<221> VARIANT
<222> 4
<223> Xaa = Ser or Asn or Thr
<220>
<221> VARIANT
<222> 7
<223> Xaa = Thr or Ala
<400> 311
Xaa Ala Xaa Xaa Arg Ala Xaa
1 5
<210> 312
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 312
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Asn Val Lys Asn Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Ala Ala Arg Ile Arg Glu Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Tyr Asp Trp Pro Pro
85 90 95
Phe Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 313
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 313
Ser Tyr Asp Leu Asn
1 5
<210> 314
<211> 22
<212> БЕЛОК
<213> Homo sapiens
<400> 314
Ser Tyr Glu Leu Thr Gln Pro Pro Ser Val Ser Val Ser Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys
20
<210> 315
<211> 15
<212> БЕЛОК
<213> Homo sapiens
<400> 315
Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Thr Leu Ile Tyr
1 5 10 15
<210> 316
<211> 32
<212> БЕЛОК
<213> Homo sapiens
<400> 316
Asn Ile Pro Glu Arg Phe Ser Gly Ser Ser Ser Gly Thr Thr Val Thr
1 5 10 15
Leu Thr Ile Ser Gly Val Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys
20 25 30
<210> 317
<211> 10
<212> БЕЛОК
<213> Homo sapiens
<400> 317
Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
1 5 10
<210> 318
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 318
Ser Asn Ala Leu Ser
1 5
<210> 319
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 319
Ser Tyr Ala Leu Ser
1 5
<210> 320
<211> 330
<212> БЕЛОК
<213> Homo sapiens
<400> 320
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu
225 230 235 240
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
325 330
<210> 321
<211> 330
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 321
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Ala Ala Gly Ala Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Ala Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu
225 230 235 240
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
325 330
<210> 322
<211> 326
<212> БЕЛОК
<213> Homo sapiens
<400> 322
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Asn Phe Gly Thr Gln Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Thr Val Glu Arg Lys Cys Cys Val Glu Cys Pro Pro Cys Pro Ala Pro
100 105 110
Pro Val Ala Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
115 120 125
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
130 135 140
Val Ser His Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly
145 150 155 160
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn
165 170 175
Ser Thr Phe Arg Val Val Ser Val Leu Thr Val Val His Gln Asp Trp
180 185 190
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro
195 200 205
Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Gln Pro Arg Glu
210 215 220
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn
225 230 235 240
Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
245 250 255
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
260 265 270
Thr Pro Pro Met Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
275 280 285
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
290 295 300
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
305 310 315 320
Ser Leu Ser Pro Gly Lys
325
<210> 323
<211> 326
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 323
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Asn Phe Gly Thr Gln Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Thr Val Glu Arg Lys Cys Cys Val Glu Cys Pro Pro Cys Pro Ala Pro
100 105 110
Pro Val Ala Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
115 120 125
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
130 135 140
Val Ser His Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly
145 150 155 160
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn
165 170 175
Ser Thr Phe Arg Val Val Ser Val Leu Thr Val Val His Gln Asp Trp
180 185 190
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro
195 200 205
Ser Ser Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Gln Pro Arg Glu
210 215 220
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn
225 230 235 240
Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
245 250 255
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
260 265 270
Thr Pro Pro Met Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
275 280 285
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
290 295 300
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
305 310 315 320
Ser Leu Ser Pro Gly Lys
325
<210> 324
<211> 327
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 324
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro
100 105 110
Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
115 120 125
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
130 135 140
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
145 150 155 160
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
165 170 175
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
180 185 190
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
195 200 205
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
210 215 220
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
225 230 235 240
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
245 250 255
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
260 265 270
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
275 280 285
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
290 295 300
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
305 310 315 320
Leu Ser Leu Ser Leu Gly Lys
325
<210> 325
<211> 107
<212> БЕЛОК
<213> Homo sapiens
<400> 325
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
1 5 10 15
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
20 25 30
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
35 40 45
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
50 55 60
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
65 70 75 80
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
85 90 95
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
100 105
<210> 326
<211> 106
<212> БЕЛОК
<213> Homo sapiens
<400> 326
Gly Gln Pro Lys Ala Asn Pro Thr Val Thr Leu Phe Pro Pro Ser Ser
1 5 10 15
Glu Glu Leu Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp
20 25 30
Phe Tyr Pro Gly Ala Val Thr Val Ala Trp Lys Ala Asp Gly Ser Pro
35 40 45
Val Lys Ala Gly Val Glu Thr Thr Lys Pro Ser Lys Gln Ser Asn Asn
50 55 60
Lys Tyr Ala Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys
65 70 75 80
Ser His Arg Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val
85 90 95
Glu Lys Thr Val Ala Pro Thr Glu Cys Ser
100 105
<210> 327
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 327
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Val Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Ser Asn Phe
20 25 30
Ala Leu Thr Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Thr Ile Gly Ser Gly Asp Thr Tyr Tyr Ala Asp Ser Val Lys Gly
50 55 60
Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln
65 70 75 80
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Lys
85 90 95
Asp Ser Thr Val Ser Trp Ser Gly Asp Phe Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 328
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 328
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Ser Ile Tyr
20 25 30
Ala Leu Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Thr Ile Gly Ala Asp Asp Thr Tyr Tyr Ala Asp Ser Val Lys Gly
50 55 60
Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln
65 70 75 80
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Lys
85 90 95
Asp Ser Thr Val Gly Trp Ser Gly Asp Phe Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 329
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 329
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Asp Leu Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Leu Ile Ser Gly Ser Gly Glu Ile Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Glu Asn Asn Arg Tyr Arg Phe Phe Asp Asp Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 330
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 330
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Asn
20 25 30
Ala Leu Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Gly Ile Ser Ala Gly Gly Ser Asp Thr Tyr Tyr Pro Ala Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Thr Trp Asn His Leu Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 331
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 331
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Asn
20 25 30
Ala Leu Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Gly Ile Ser Ser Gly Ser Asp Thr Tyr Tyr Gly Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Thr Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Glu Thr Trp Asn His Leu Phe Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 332
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 332
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Arg Phe Ser Ser Tyr
20 25 30
Ala Leu Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Ser Gly Gly Asp Thr Tyr Tyr Val Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Glu Thr Trp Asn His Leu Phe Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 333
<211> 106
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 333
Gln Ser Ala Leu Thr Gln Pro Ala Ser Val Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Ile Thr Ile Ser Cys Phe Gly Ser Ser Gly Asn Tyr Gly Leu Val
20 25 30
Ser Trp Tyr Gln Gln His Pro Gly Lys Ala Pro Lys Leu Met Ile Tyr
35 40 45
Tyr Asn Asn Lys Arg Pro Ser Gly Val Ser Asn Arg Phe Ser Gly Ser
50 55 60
Lys Ser Gly Asn Thr Ala Ser Leu Thr Ile Ser Gly Leu Gln Ala Glu
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gly Ala Trp Glu Thr Gly Ser Ala Thr
85 90 95
Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105
<210> 334
<211> 103
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 334
Ser Tyr Glu Leu Thr Gln Pro Pro Ser Val Ser Val Ser Pro Gly Gln
1 5 10 15
Thr Ala Ser Ile Thr Cys Phe Gly Ser Ser Gly Asn Tyr Gly Trp Tyr
20 25 30
Gln Gln Lys Pro Gly Gln Ser Pro Val Leu Val Ile Tyr Tyr Asn Asn
35 40 45
Lys Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser Asn Ser Gly
50 55 60
Asn Thr Ala Thr Leu Thr Ile Ser Gly Thr Gln Ala Met Asp Glu Ala
65 70 75 80
Asp Tyr Tyr Cys Gly Ala Trp Glu Thr Gly Ser Ala Thr Phe Gly Gly
85 90 95
Gly Thr Lys Leu Thr Val Leu
100
<210> 335
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 335
Asp Val Gln Leu Leu Glu Ser Gly Gly Gly Val Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Ser Asn Phe
20 25 30
Ala Met Thr Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Val
35 40 45
Ser Thr Ile Gly Ser Gly Asp Thr Tyr Tyr Ala Asp Ser Val Lys Gly
50 55 60
Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln
65 70 75 80
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Lys
85 90 95
Asp Ser Thr Val Ser Trp Ser Gly Asp Phe Phe Asp Tyr Trp Gly Leu
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 336
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 336
Ser Asp Asp Lys Arg Pro Ser
1 5
<210> 337
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 337
Gly Ser Tyr Ser Ser
1 5
<210> 338
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 338
Ile Tyr Ser
1
<210> 339
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 339
Gly Gly Tyr Asp Gln Ser Ser Tyr Thr
1 5
<210> 340
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 340
Gly Asp Tyr Tyr Ser
1 5
<210> 341
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 341
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Ser Ile Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Val
35 40 45
Ser Thr Ile Gly Ala Asp Asp Thr Tyr Tyr Ala Asp Ser Val Lys Gly
50 55 60
Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln
65 70 75 80
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Lys
85 90 95
Asp Ser Thr Val Gly Trp Ser Gly Asp Phe Phe Asp Tyr Trp Gly Leu
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 342
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 342
Asp Val Gln Leu Val Glu Ser Gly Gly Ala Val Val Arg Pro Gly Glu
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Ala Gly Ile Ser Ala Gly Gly Ser Asp Thr Tyr Tyr Ile Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Glu Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Thr Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Thr Trp Asn His Leu Phe Asp Tyr Trp Gly Leu Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 343
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 343
Ala Leu Thr Gln Pro Ala Ser Val Ser Ala Asn Pro Gly Glu Thr Val
1 5 10 15
Lys Ile Thr Cys Ser Gly Gly Asp Trp Tyr Ser Thr Tyr Tyr Gly Trp
20 25 30
Tyr Gln Gln Lys Ser Pro Gly Ser Ala Pro Val Thr Val Ile His Ser
35 40 45
Asp Asp Lys Arg Pro Ser Asp Ile Pro Ser Arg Phe Ser Gly Ser Ala
50 55 60
Ser Gly Ser Ala Ala Thr Leu Thr Ile Thr Gly Val Arg Val Glu Asp
65 70 75 80
Glu Ala Val Tyr Tyr Cys Ala Gly Tyr Asp Gly Arg Thr Tyr Ile Asn
85 90 95
Thr Phe Gly Ala Gly Thr Thr Leu Thr Val Leu
100 105
<210> 344
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 344
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Ala Gly Ile Ser Ala Gly Gly Ser Asp Thr Tyr Tyr Ile Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Arg Gln Phe Gln Glu Gln Ser Leu
65 70 75 80
Ser Pro Asn Glu Pro Ala Leu Thr Ala Glu Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Glu Thr Trp Asn His Leu Phe Asp Tyr Trp Gly Leu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 345
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 345
Ala Leu Thr Gln Pro Ala Ser Val Ser Ala Asn Pro Gly Glu Thr Val
1 5 10 15
Lys Ile Thr Cys Ser Gly Gly Asp Tyr Tyr Ser Thr Tyr Tyr Gly Trp
20 25 30
Tyr Gln Gln Lys Ser Pro Gly Ser Ala Pro Val Thr Val Ile His Ser
35 40 45
Asp Asp Lys Arg Pro Ser Asp Ile Pro Ser Arg Phe Ser Gly Ser Ala
50 55 60
Ser Gly Ser Ala Ala Thr Leu Thr Ile Ala Gly Val Arg Val Glu Asp
65 70 75 80
Glu Ala Val Tyr Phe Cys Gly Ala Tyr Asp Gly Arg Thr Tyr Ile Asn
85 90 95
Thr Phe Gly Ala Gly Thr Thr Leu Thr Val Leu
100 105
<210> 346
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 346
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser His
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Ala Gly Ile Ser Ala Gly Gly Ser Asp Thr Tyr Tyr Ile Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Ser Ser Leu Tyr
65 70 75 80
Leu Arg Met Asn Ser Leu Thr Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Thr Trp Asn His Leu Phe Asp Tyr Trp Gly Leu Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 347
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 347
Ala Leu Thr Gln Pro Ala Ser Val Ser Ala Asn Pro Gly Glu Thr Val
1 5 10 15
Lys Ile Thr Cys Ser Gly Gly Asp Tyr Tyr Ser Thr Tyr Tyr Ala Trp
20 25 30
Tyr Gln Gln Lys Ser Pro Gly Ser Ala Pro Val Thr Val Ile His Ser
35 40 45
Asp Asp Glu Arg Pro Ser Asp Ile Pro Ser Arg Phe Ser Gly Ser Ala
50 55 60
Ser Gly Ser Ala Ala Thr Leu Ile Ile Thr Gly Val Arg Val Glu Asp
65 70 75 80
Glu Ala Val Tyr Phe Cys Gly Gly Tyr Asp Gly Arg Thr Tyr Ile Asn
85 90 95
Thr Phe Gly Ala Gly Thr Thr Leu Thr Val Leu
100 105
<210> 348
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 348
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Asn
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Ala Gly Ile Ser Ala Gly Gly Ser Asp Thr Tyr Tyr Pro Ala Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Pro Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Thr Leu Thr Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Thr Trp Asn His Leu Phe Asp Tyr Trp Gly Leu Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 349
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 349
Ala Leu Thr Gln Pro Ala Ser Val Ser Ala Asn Pro Gly Glu Thr Val
1 5 10 15
Lys Ile Ala Cys Ser Gly Gly Ser Tyr Tyr Ser Tyr Tyr Tyr Gly Trp
20 25 30
Tyr Gln Gln Lys Ser Pro Gly Ser Ala Leu Val Thr Val Ile Tyr Ser
35 40 45
Asp Asp Lys Arg Pro Ser Gly Ile Pro Ser Arg Phe Ser Gly Ser Ala
50 55 60
Ser Gly Ser Thr Ala Thr Leu Thr Ile Thr Gly Val Arg Ala Glu Asp
65 70 75 80
Glu Ala Val Tyr Tyr Cys Gly Gly Tyr Asp Tyr Ser Ser Tyr Thr Asn
85 90 95
Asp Phe Gly Ala Gly Thr Thr Leu Thr Val Leu
100 105
<210> 350
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 350
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Ala Ser Gly Ser Gly Thr Tyr Tyr Gly Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Met Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Thr Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Thr Trp Asn His Leu Phe Asp Tyr Trp Gly Leu Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 351
<211> 105
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 351
Ala Leu Thr Gln Pro Ala Ser Val Ser Ala Asn Leu Gly Gly Thr Val
1 5 10 15
Glu Ile Thr Cys Ser Gly Gly Ser Ser Ser Tyr Tyr Gly Trp Tyr Gln
20 25 30
Gln Lys Ser Pro Gly Ser Ala Pro Val Thr Val Ile Tyr Ser Asp Asn
35 40 45
Gln Arg Pro Ser Asp Ile Pro Ser Arg Phe Ser Gly Ser Ala Ser Asp
50 55 60
Ser Thr Ala Thr Leu Thr Ile Thr Gly Val Gln Val Glu Asp Glu Ala
65 70 75 80
Ile Tyr Tyr Cys Gly Gly Tyr Asp Ser Ser Thr Tyr Ala Asn Thr Phe
85 90 95
Gly Ala Gly Thr Thr Leu Thr Val Leu
100 105
<210> 352
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 352
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Ser Ser Asn
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Gly Ile Ser Ala Ser Gly Asp Thr Tyr Tyr Ser Gly Ser Met Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Thr Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Glu Thr Trp Asn His Leu Phe Asp Tyr Trp Gly Leu Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 353
<211> 106
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 353
Ala Leu Thr Gln Pro Ala Ser Val Ser Ala Asn Pro Gly Glu Thr Val
1 5 10 15
Lys Ile Thr Cys Ser Gly Gly Ser Asp Ser Tyr Tyr Tyr Gly Trp His
20 25 30
Gln Gln Lys Ser Pro Gly Ser Ala Pro Val Thr Val Ile Tyr Ser Asp
35 40 45
Asp Gln Arg Pro Pro Asp Ile Pro Ser Arg Phe Ser Gly Ser Ala Ser
50 55 60
Gly Ser Thr Thr Thr Leu Thr Ile Thr Gly Val Arg Ala Glu Asp Glu
65 70 75 80
Ala Val Tyr Tyr Cys Gly Gly Tyr Asp Tyr Ser Thr Tyr Thr Asn Thr
85 90 95
Phe Gly Ala Gly Thr Thr Leu Thr Val Leu
100 105
<210> 354
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 354
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe Arg Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Ser Asp Ser Asp Ala Tyr Tyr Val Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu
65 70 75 80
Gln Val Asn Ser Leu Thr Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Glu Thr Trp Asn His Leu Phe Asp Tyr Trp Gly Leu Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 355
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 355
Ala Leu Thr Gln Pro Ala Ser Val Ser Ala Asn Leu Gly Glu Thr Val
1 5 10 15
Lys Ile Thr Cys Ser Gly Gly Asp Ser Ser Ser His Tyr Tyr Gly Trp
20 25 30
Phe Gln Gln Lys Ser Pro Gly Ser Ala Pro Val Thr Leu Ile Tyr Ser
35 40 45
Asp Asp Glu Arg Pro Ser Asp Ile Pro Ser Arg Phe Ser Gly Ser Ala
50 55 60
Ser Gly Ser Thr Ala Thr Leu Thr Ile Thr Gly Val Arg Val Glu Asp
65 70 75 80
Glu Ala Ile Tyr Phe Cys Gly Ala Tyr Asp Gly Ser Thr Tyr Thr Asn
85 90 95
Thr Phe Gly Ala Gly Thr Thr Leu Thr Val Leu
100 105
<210> 356
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 356
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu
1 5 10 15
Ser Leu Arg Leu Ser Cys Glu Ala Ser Gly Phe Thr Phe Ser Ser Asp
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Ser Gly Ser Ser Thr Tyr Tyr Gly Gly Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Thr Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Glu Thr Trp Asn His Leu Phe Asp Tyr Trp Gly Leu Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 357
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 357
Ala Leu Thr Gln Pro Ala Ser Val Ser Ala Ser Pro Gly Glu Thr Val
1 5 10 15
Glu Ile Thr Cys Ser Gly Gly Ser Asp Ser Ser Tyr Tyr Tyr Gly Trp
20 25 30
Tyr Gln Gln Lys Ser Pro Gly Ser Ala Pro Val Thr Val Ile Tyr Ser
35 40 45
Asp Asn Lys Arg Pro Ser Asn Ile Pro Ser Arg Phe Ser Gly Ser Ala
50 55 60
Ser Gly Ser Thr Ala Thr Leu Thr Ile Thr Gly Val Arg Val Glu Asp
65 70 75 80
Glu Ala Val Tyr Tyr Cys Gly Gly Tyr Asp Tyr Ser Thr Tyr Thr Asn
85 90 95
Pro Phe Gly Ala Gly Thr Thr Leu Thr Val Leu
100 105
<210> 358
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 358
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe Arg Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Ser Gly Gly Asp Thr Tyr Tyr Val Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu
65 70 75 80
Gln Val Asn Ser Leu Thr Ala Glu Asp Thr Ala Ile Tyr Tyr Cys Ala
85 90 95
Arg Glu Thr Trp Asn His Leu Phe Asp Tyr Trp Gly Leu Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 359
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 359
Ala Leu Thr Gln Pro Ala Ser Val Ser Ala Asn Leu Gly Glu Thr Val
1 5 10 15
Glu Ile Thr Cys Ser Gly Gly Asp Ser Ser Ser His Tyr Tyr Gly Trp
20 25 30
Tyr Gln Gln Lys Ser Pro Gly Ser Ala Pro Val Thr Val Ile Tyr Ser
35 40 45
Asp Asp Glu Arg Pro Ser Asp Ile Pro Ser Arg Phe Ser Gly Ser Ala
50 55 60
Ser Gly Ser Thr Ala Thr Leu Thr Ile Thr Gly Val Arg Val Glu Asp
65 70 75 80
Glu Ala Ile Tyr Tyr Cys Gly Ala Tyr Asp Gly Ser Thr Tyr Ala Asn
85 90 95
Thr Phe Gly Ala Gly Thr Thr Leu Thr Val Leu
100 105
<210> 360
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 360
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Ala Gly Ile Ser Ala Gly Gly Ser Asp Thr Tyr Tyr Ile Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Val Asn Ser Leu Thr Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Thr Trp Asn His Leu Phe Asp Tyr Trp Gly Leu Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 361
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 361
Ala Leu Thr Gln Pro Ala Ser Val Ser Ala Asn Pro Gly Glu Thr Val
1 5 10 15
Lys Ile Thr Cys Ser Gly Gly Gly Tyr Tyr Ser Thr Tyr Tyr Gly Trp
20 25 30
Tyr Gln Gln Lys Ser Pro Gly Ser Ala Pro Val Thr Val Ile His Ser
35 40 45
Asp Asp Lys Arg Pro Ser Asp Ile Pro Ser Arg Phe Ser Gly Ser Ala
50 55 60
Ser Gly Ser Ala Ala Thr Leu Thr Ile Thr Gly Val Arg Val Glu Asp
65 70 75 80
Glu Ala Val Tyr Tyr Cys Ala Gly Tyr Asp Gly Arg Thr Tyr Ile Asn
85 90 95
Thr Phe Gly Ala Gly Thr Thr Leu Thr Val Leu
100 105
<210> 362
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 362
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe Arg Phe Ser Ser His
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Ser Gly Gly Asp Thr Tyr Tyr Val Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu
65 70 75 80
Gln Val Asn Ser Leu Thr Ala Glu Asp Thr Ala Ile Tyr Tyr Cys Ala
85 90 95
Arg Glu Thr Trp Asn His Leu Phe Asp Tyr Trp Gly Leu Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 363
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 363
Ala Leu Thr Gln Pro Ala Ser Val Ser Ala Asn Leu Gly Glu Thr Val
1 5 10 15
Lys Ile Thr Cys Ser Gly Gly Asp Ser Ser Ser His Tyr Tyr Gly Trp
20 25 30
Tyr Gln Gln Lys Ser Pro Gly Ser Ala Pro Val Thr Val Ile Tyr Ser
35 40 45
Asp Asp Glu Arg Pro Ser Asp Ile Pro Ser Arg Phe Ser Gly Ser Ala
50 55 60
Ser Gly Ser Thr Ala Thr Leu Thr Ile Thr Gly Val Arg Val Glu Asp
65 70 75 80
Glu Ala Ile Tyr Tyr Cys Gly Ala Tyr Asp Gly Ser Thr Tyr Ala Asn
85 90 95
Thr Phe Gly Ala Gly Thr Thr Leu Thr Val Leu
100 105
<210> 364
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 364
Asp Val Gln Leu Val Asp Ser Gly Gly Gly Val Val Arg Pro Gly Glu
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Ala Gly Ile Ser Ala Gly Gly Ser Asp Thr Tyr Tyr Ile Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Thr Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Thr Trp Asn His Leu Phe Asp Tyr Trp Gly Leu Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 365
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 365
Ala Leu Thr Gln Pro Ala Ser Val Ser Ala Asn Pro Gly Glu Thr Val
1 5 10 15
Lys Ile Thr Cys Ser Gly Gly Asp Tyr Tyr Ser Thr Tyr Tyr Gly Trp
20 25 30
Tyr Gln Gln Lys Ser Pro Gly Ser Ala Pro Val Thr Val Ile His Ser
35 40 45
Asp Asp Lys Arg Pro Ser Asp Ile Pro Ser Arg Phe Ser Gly Ser Ala
50 55 60
Ser Gly Ser Ala Ala Thr Leu Thr Ile Thr Gly Val Arg Val Glu Asp
65 70 75 80
Glu Ala Val Tyr Phe Cys Gly Ala Tyr Asp Gly Arg Thr Tyr Ile Asn
85 90 95
Thr Phe Gly Ala Gly Thr Thr Leu Thr Val Leu
100 105
<210> 366
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 366
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Ala Gly Ile Ser Ala Gly Gly Ser Asp Thr Tyr Tyr Ile Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Thr Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Thr Trp Asn His Leu Phe Asp Tyr Trp Gly Leu Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 367
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 367
Ala Leu Thr Gln Pro Ala Ser Val Ser Ala Asn Pro Gly Glu Thr Val
1 5 10 15
Lys Ile Thr Cys Ser Gly Gly Asp Tyr Tyr Ser Thr Tyr Tyr Gly Trp
20 25 30
Tyr Gln Gln Lys Ser Pro Gly Ser Ala Pro Val Thr Val Ile His Ser
35 40 45
Asp Asp Lys Arg Pro Ser Asp Ile Pro Ser Arg Phe Ser Gly Ser Ala
50 55 60
Ser Gly Ser Ala Ala Thr Leu Thr Ile Thr Gly Val Arg Val Glu Asp
65 70 75 80
Glu Ala Val Tyr Phe Cys Gly Ala Tyr Asp Gly Arg Thr Tyr Ile Asn
85 90 95
Thr Phe Gly Ala Gly Thr Thr Leu Thr Val Leu
100 105
<210> 368
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 368
Asp Leu Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Ala Gly Ile Ser Ala Gly Gly Ser Asp Thr Tyr Tyr Ile Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Thr Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Thr Trp Asn His Leu Phe Asp Tyr Trp Gly Leu Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 369
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 369
Ala Leu Thr Gln Pro Ala Ser Val Ser Ala Asn Pro Gly Glu Thr Val
1 5 10 15
Lys Ile Ile Cys Ser Gly Gly Asp Tyr Tyr Ser Thr Tyr Tyr Gly Trp
20 25 30
Tyr Gln Gln Lys Ser Pro Gly Ser Ala Pro Val Thr Val Ile His Ser
35 40 45
Asp Asp Lys Arg Pro Ser Asp Ile Pro Ser Arg Phe Ser Gly Ser Ala
50 55 60
Ser Gly Ser Ala Ala Thr Leu Thr Ile Thr Gly Val Arg Val Glu Asp
65 70 75 80
Glu Ala Val Tyr Phe Cys Gly Ala Tyr Asp Gly Arg Thr Tyr Ile Asn
85 90 95
Thr Phe Gly Ala Gly Thr Thr Leu Thr Val Leu
100 105
<210> 370
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 370
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Ala Gly Ile Ser Ala Gly Gly Ser Asp Ala Tyr Tyr Ile Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Thr Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Thr Trp Asn His Leu Phe Asp Tyr Trp Gly Leu Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 371
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 371
Ala Leu Thr Gln Pro Ala Ser Val Ser Ala Asn Pro Gly Glu Thr Val
1 5 10 15
Lys Ile Thr Cys Ser Gly Gly Asp Trp Tyr Ser Thr Tyr Tyr Gly Trp
20 25 30
Tyr Gln Gln Lys Ser Pro Gly Ser Ala Pro Val Thr Val Ile His Ser
35 40 45
Asp Asp Lys Arg Pro Ser Asp Ile Pro Ser Arg Phe Ser Gly Ser Ala
50 55 60
Ser Gly Ser Ala Ala Thr Leu Thr Ile Thr Gly Val Arg Val Glu Asp
65 70 75 80
Glu Ala Val Tyr Tyr Cys Ala Gly Tyr Asp Gly Arg Thr Tyr Ile Asn
85 90 95
Thr Phe Gly Ala Gly Thr Thr Leu Thr Val Leu
100 105
<210> 372
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 372
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Ala Gly Ile Ser Ala Gly Gly Ser Asp Thr Tyr Tyr Ile Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Thr Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Thr Trp Asn His Leu Phe Asp Tyr Trp Gly Leu Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 373
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 373
Ala Leu Thr Gln Pro Ala Ser Val Ser Ala Asn Pro Gly Glu Thr Val
1 5 10 15
Lys Ile Thr Cys Ser Gly Gly Gly Tyr Tyr Ser Thr Tyr Tyr Gly Trp
20 25 30
Tyr Gln Gln Lys Ser Pro Gly Ser Ala Pro Val Thr Val Ile His Ser
35 40 45
Asp Asp Lys Arg Pro Ser Asp Ile Pro Ser Arg Phe Ser Gly Ser Ala
50 55 60
Ser Gly Ser Ala Ala Thr Leu Thr Ile Thr Gly Val Arg Val Glu Asp
65 70 75 80
Glu Ala Val Tyr Tyr Cys Ala Gly Tyr Asp Ala Arg Thr Tyr Ile Asn
85 90 95
Thr Phe Gly Ala Gly Thr Thr Leu Thr Val Leu
100 105
<210> 374
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 374
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu
1 5 10 15
Ser Leu Arg Leu Ser Cys Glu Ala Ser Gly Phe Thr Phe Ser Ser Asn
20 25 30
Ala Met Ser Trp Ala Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Gly Ile Ser Ser Gly Ser Asp Thr Tyr Tyr Gly Asp Ser Val Lys
50 55 60
Gly Arg Leu Thr Ile Ser Arg Asp Asn Ser Lys Asn Ile Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Thr Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Glu Thr Trp Asn His Leu Phe Asp Tyr Trp Gly Leu Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 375
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 375
Ala Leu Thr Gln Pro Ala Ser Val Ser Ala Asn Pro Gly Glu Thr Val
1 5 10 15
Lys Ile Thr Cys Ser Gly Gly Ile Tyr Ser Ser Tyr Tyr Tyr Ala Trp
20 25 30
Tyr Gln Gln Lys Ser Pro Gly Ser Ala Pro Val Thr Leu Ile Tyr Ser
35 40 45
Asp Asp Lys Arg Pro Ser Asn Ile Pro Ser Arg Phe Ser Gly Ser Ala
50 55 60
Ser Gly Ser Thr Ala Thr Leu Thr Ile Thr Gly Val Arg Ala Glu Asp
65 70 75 80
Glu Ala Val Tyr Phe Cys Gly Gly Tyr Asp Gln Ser Ser Tyr Thr Asn
85 90 95
Pro Phe Gly Ala Gly Thr Thr Leu Thr Val Leu
100 105
<210> 376
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 376
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Asn
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Ala Gly Ile Ser Ala Gly Asp Ser Asp Thr Tyr Tyr Pro Ala Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Pro Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Thr Leu Thr Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Thr Trp Asn His Leu Phe Asp Tyr Trp Gly Leu Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 377
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 377
Ala Leu Thr Gln Pro Ala Ser Val Ser Ala Asn Pro Gly Glu Thr Val
1 5 10 15
Lys Ile Ala Cys Ser Gly Gly Ser Tyr Tyr Ser Tyr Tyr Tyr Gly Trp
20 25 30
Tyr Gln Gln Lys Ser Pro Gly Ser Ala Leu Val Thr Val Ile Tyr Ser
35 40 45
Asp Asp Lys Arg Pro Ser Gly Ile Pro Ser Arg Phe Ser Gly Ser Ala
50 55 60
Ser Gly Ser Thr Ala Thr Leu Thr Ile Thr Gly Val Arg Ala Glu Asp
65 70 75 80
Glu Ala Val Tyr Tyr Cys Gly Gly Tyr Asp Tyr Ser Ser Tyr Thr Asn
85 90 95
Asp Phe Gly Ala Gly Thr Thr Leu Thr Val Leu
100 105
<210> 378
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 378
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Ala Gly Ile Ser Ala Gly Gly Ser Asp Thr Tyr Tyr Ile Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Thr Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Thr Trp Asn His Leu Phe Asp Tyr Trp Gly Leu Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 379
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 379
Ala Leu Thr Gln Pro Ala Ser Val Ser Ala Asn Pro Gly Glu Thr Val
1 5 10 15
Lys Ile Thr Cys Ser Gly Gly Asp Trp Tyr Ser Thr Tyr Tyr Gly Trp
20 25 30
Tyr Gln Gln Lys Ser Pro Gly Ser Ala Pro Val Thr Val Ile His Ser
35 40 45
Asp Asp Lys Arg Pro Ser Asp Ile Pro Ser Arg Phe Ser Gly Ser Ala
50 55 60
Ser Gly Ser Ala Ala Thr Leu Thr Ile Thr Gly Val Arg Val Glu Asp
65 70 75 80
Glu Ala Val Tyr Tyr Cys Ala Gly Tyr Asp Gly Arg Thr Tyr Ile Asn
85 90 95
Thr Phe Gly Ala Gly Thr Thr Leu Thr Val Leu
100 105
<210> 380
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 380
Asp Val Gln Leu Val Glu Ser Gly Gly Ala Val Val Arg Pro Gly Glu
1 5 10 15
Thr Leu Arg Leu Ser Cys Thr Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Ala Ser Gly Ser Asp Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Ser Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Arg Met Ser Ser Leu Thr Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Thr Trp Asn His Leu Phe Asp Tyr Trp Gly Leu Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 381
<211> 106
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 381
Ala Leu Thr Gln Pro Ala Ser Val Ser Ala Asn Pro Gly Glu Thr Val
1 5 10 15
Lys Ile Thr Cys Ser Gly Gly Gly Thr Ser Ser Tyr Tyr Gly Trp Tyr
20 25 30
Gln Gln Lys Ser Pro Gly Ser Ala Pro Val Thr Leu Ile His Ser Asp
35 40 45
Asp Lys Arg Pro Ser Asp Ile Pro Ser Arg Phe Ser Gly Ser Ala Ser
50 55 60
Gly Ser Thr Ala Thr Leu Thr Ile Thr Gly Val Gln Val Glu Asp Glu
65 70 75 80
Ala Val Tyr Tyr Cys Gly Gly Tyr Asp Tyr Thr Thr Tyr Val Asn Thr
85 90 95
Phe Gly Ala Gly Thr Thr Leu Thr Val Leu
100 105
<210> 382
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 382
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Ala Gly Ile Ser Ala Gly Gly Ser Asp Thr Tyr Tyr Ile Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Thr Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Thr Trp Asn His Leu Phe Asp Tyr Trp Gly Leu Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 383
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 383
Ala Leu Thr Gln Pro Ala Ser Val Ser Ala Asn Pro Gly Glu Thr Val
1 5 10 15
Lys Ile Thr Cys Ser Gly Gly Gly Tyr Tyr Ser Thr Tyr Tyr Gly Trp
20 25 30
Tyr Gln Gln Arg Ser Pro Gly Ser Ala Pro Val Thr Val Ile His Ser
35 40 45
Asp Asp Lys Arg Pro Ser Asp Ile Pro Ser Arg Phe Ser Gly Ser Ala
50 55 60
Ser Gly Ser Ala Ala Thr Leu Thr Ile Thr Gly Val Arg Val Glu Asp
65 70 75 80
Glu Ala Val Tyr Tyr Cys Ala Gly Tyr Asp Gly Arg Thr Tyr Leu Asn
85 90 95
Thr Phe Gly Ala Gly Thr Thr Leu Thr Val Leu
100 105
<210> 384
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 384
Asp Val Gln Leu Val Glu Ser Gly Gly Ala Val Val Arg Pro Gly Glu
1 5 10 15
Thr Leu Arg Leu Ser Cys Thr Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Ala Ser Gly Ser Asp Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Ser Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Arg Met Ser Ser Leu Thr Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Thr Trp Asn His Leu Phe Asp Tyr Trp Gly Leu Gly Thr
100 105 110
Leu Val Thr Leu Ser Ser
115
<210> 385
<211> 106
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 385
Ala Leu Thr Gln Pro Ala Ser Val Ser Ala Asn Pro Gly Glu Thr Val
1 5 10 15
Lys Ile Thr Cys Ser Gly Gly Gly Thr Ser Ser Tyr Tyr Gly Trp Tyr
20 25 30
Gln Gln Lys Ser Pro Gly Ser Ala Pro Val Thr Leu Ile His Ser Asp
35 40 45
Asp Lys Arg Pro Ser Asp Ile Pro Ser Arg Phe Ser Gly Ser Ala Ser
50 55 60
Gly Ser Thr Ala Thr Leu Thr Ile Thr Gly Val Gln Ala Glu Asp Glu
65 70 75 80
Ala Val Tyr Tyr Cys Gly Gly Tyr Asp Tyr Thr Thr Tyr Val Asn Thr
85 90 95
Phe Gly Ala Gly Thr Thr Leu Thr Val Leu
100 105
<210> 386
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 386
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Ser
20 25 30
Asp Met Asn Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Val
35 40 45
Ser Leu Ile Ser Gly Ser Gly Glu Ile Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Glu Asn Asp Arg Tyr Arg Phe Phe Asp Tyr Trp Gly Leu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 387
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 387
Glu Thr Val Leu Thr Gln Ser Pro Gly Ile Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Thr Cys Arg Ala Ser Gln Ser Val Tyr Thr Tyr
20 25 30
Leu Ala Trp Tyr Gln Glu Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Ser Arg Ala Ala Gly Ile Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Tyr Asp Arg Pro Pro
85 90 95
Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 388
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 388
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Asp Met Asn Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Val
35 40 45
Ser Leu Ile Ser Gly Ser Gly Glu Ile Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Glu Asn Asn Arg Tyr Arg Phe Phe Asp Tyr Trp Gly Leu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 389
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 389
Lys Thr Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Thr Cys Arg Ala Asp Gln Ser Val Tyr Thr Tyr
20 25 30
Leu Ala Trp Tyr Gln Glu Arg Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Tyr Asp Arg Pro Pro
85 90 95
Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 390
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 390
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Asp Met Asn Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Val
35 40 45
Ser Leu Ile Ser Gly Ser Gly Glu Ile Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Glu Asn Asn Arg Tyr Arg Phe Phe Asp Tyr Trp Gly Leu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 391
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 391
Glu Thr Val Leu Thr Gln Ser Pro Gly Thr Leu Thr Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Tyr Thr Tyr
20 25 30
Leu Ala Trp Tyr Gln Glu Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Ser Arg Ala Thr Gly Val Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Tyr Asp Arg Pro Pro
85 90 95
Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 392
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 392
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Asp Met Asn Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Val
35 40 45
Ser Leu Ile Ser Gly Ser Gly Glu Ile Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Glu Asn Asp Arg Tyr Arg Phe Phe Asp Tyr Trp Gly Leu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 393
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 393
Glu Thr Val Leu Thr Gln Ser Pro Gly Thr Leu Thr Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Thr Cys Arg Ala Ser Gln Ser Val Tyr Thr Tyr
20 25 30
Leu Ala Trp Tyr Gln Glu Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Tyr Asp Arg Pro Pro
85 90 95
Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 394
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 394
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Asp Met Asn Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Val
35 40 45
Ser Leu Ile Ser Gly Ser Gly Glu Ile Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Glu Asn Asn Arg Tyr Arg Phe Phe Asp Tyr Trp Gly Leu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 395
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 395
Glu Thr Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Asn Cys Arg Ala Ser Gln Ser Val Tyr Thr Tyr
20 25 30
Leu Ala Trp Tyr Gln Glu Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Glu Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Tyr Asp Arg Pro Pro
85 90 95
Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 396
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 396
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Asp Met Asn Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Val
35 40 45
Ser Leu Ile Ser Gly Ser Gly Glu Ile Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Glu Asn Asn Arg Tyr Arg Phe Phe Asp Asp Trp Gly Leu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 397
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 397
Glu Thr Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Asn Cys Arg Ala Ser Gln Ser Val Tyr Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Glu Arg Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Thr Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Glu Ser
65 70 75 80
Asp Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Tyr Asp Arg Pro Pro
85 90 95
Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 398
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 398
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Asp Met Asn Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Val
35 40 45
Ser Leu Ile Ser Gly Ser Gly Glu Ile Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Ala Lys Glu Asn Asn Met Tyr Arg Phe Phe Asp Tyr Trp Gly Leu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 399
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 399
Glu Thr Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Tyr Thr Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Arg Leu Leu Ile
35 40 45
His Ala Ala Arg Asn Arg Ala Ala Gly Ile Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Tyr Asp Arg Pro Pro
85 90 95
Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 400
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 400
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Asp Met Asn Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Val
35 40 45
Ser Leu Ile Ser Gly Ser Gly Glu Ile Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Glu Asp Asn Arg Tyr Arg Phe Phe Asp Tyr Trp Gly Leu Gly
100 105 110
Ala Leu Val Thr Val Ser Ser
115
<210> 401
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 401
Glu Thr Val Leu Thr Gln Ser Pro Gly Thr Leu Thr Leu Ser Pro Gly
1 5 10 15
Glu Arg Thr Thr Leu Thr Cys Arg Ala Ser Gln Ser Val Tyr Thr Tyr
20 25 30
Leu Ala Trp Tyr Gln Glu Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Tyr Asp Arg Pro Pro
85 90 95
Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 402
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 402
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Asp Met Asn Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Val
35 40 45
Ser Leu Ile Ser Gly Ser Gly Glu Ile Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Glu Asn Asn Arg Tyr Arg Phe Phe Asp Tyr Trp Gly Leu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 403
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 403
Glu Thr Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Tyr Thr Tyr
20 25 30
Leu Ala Trp Tyr Gln Glu Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Thr Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Tyr Asp Arg Pro Pro
85 90 95
Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 404
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 404
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Ser Ser Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Val
35 40 45
Ser Arg Ile Asn Ser Gly Gly Gly Gly Thr Asp Tyr Ala Glu Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Glu Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Gln Tyr Asp Trp Asn Gly Phe Phe Asp Tyr Trp Gly Leu Gly
100 105 110
Ala Leu Val Thr Val Ser Ser
115
<210> 405
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 405
Glu Thr Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Thr Val Gly Ser Lys
20 25 30
Leu Ala Trp His Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Thr Asn Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Gly Leu Gln Thr
65 70 75 80
Glu Asp Ser Ala Val Tyr Tyr Cys Gln Gln Tyr Tyr Tyr Trp Pro Pro
85 90 95
Tyr Arg Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 406
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 406
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Ser Ser His
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Val
35 40 45
Ser Arg Ile Asn Ser Gly Gly Gly Gly Thr Asp Tyr Ala Glu Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Glu Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Gln Tyr Asp Trp Asn Gly Phe Phe Asp Tyr Trp Gly Leu Gly
100 105 110
Ala Leu Val Thr Val Ser Ser
115
<210> 407
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 407
Glu Thr Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Thr Val Gly Ser Lys
20 25 30
Leu Ala Trp His Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Thr Asn Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Thr
65 70 75 80
Glu Asp Ser Ala Val Tyr Tyr Cys Gln Gln Tyr Tyr Tyr Trp Pro Pro
85 90 95
Tyr Arg Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 408
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 408
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Arg Pro Gly Glu
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Thr Asn Tyr
20 25 30
Ala Val Thr Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Val
35 40 45
Ser Leu Ile Ser Val Thr Gly Thr Thr Tyr Tyr Ala Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Ser Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Gly Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Lys Val Thr Trp Lys Asn Val Phe Asp Tyr Trp Gly Leu Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 409
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 409
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Phe Ser Cys Arg Ala Ser Gln Thr Val Gly Ser Lys
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Asn Thr Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln His Thr Asp Trp Pro Pro
85 90 95
Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 410
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 410
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Arg Pro Gly Glu
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Thr Asn Tyr
20 25 30
Ala Val Thr Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Val
35 40 45
Ser Leu Ile Ser Val Thr Gly Thr Thr Tyr Tyr Ala Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Ser Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Gly Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Lys Val Thr Trp Lys Asn Val Phe Asp Tyr Trp Gly Leu Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 411
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 411
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Phe Ser Cys Arg Ala Ser Gln Thr Val Gly Ser Lys
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Asn Thr Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Arg Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln His Thr Asp Trp Pro Pro
85 90 95
Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 412
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 412
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp His
20 25 30
Asp Met Ser Trp Val Arg Gln Gly Pro Gly Glu Gly Leu Glu Trp Val
35 40 45
Ala Gly Ile Ser Leu Arg Gly Gly Val Thr Trp Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Arg Leu Phe Ser Leu Arg Thr Glu Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Ala Arg Glu Ser Trp Asn Thr Phe Phe Asp Tyr Trp Gly Leu Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 413
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 413
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Thr Ala Thr Leu Ser Cys Arg Ala Ser Gln Asn Val Arg Ser Asn
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Gly Asn Gly Pro Pro
85 90 95
Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 414
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 414
Asp Val Gln Leu Val Glu Ser Glu Gly Gly Val Val Arg Pro Gly Glu
1 5 10 15
Ser Leu Arg Leu Ser Cys Glu Ala Ser Gly Phe Thr Phe Arg Asn Ser
20 25 30
Tyr Met Thr Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Val
35 40 45
Ser Thr Ile Ser Asp Thr Gly Asp Thr Ala Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Ala Lys Ser Trp Ile Trp Trp Thr Phe Phe Asp Tyr Trp Gly Leu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 415
<211> 103
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 415
Ala Leu Thr Gln Pro Ala Ser Val Ser Ala Asn Leu Gly Gly Thr Val
1 5 10 15
Glu Ile Thr Cys Ser Gly Gly Asn Ser Asn His Tyr Gly Trp Tyr Gln
20 25 30
Gln Lys Ser Pro Gly Ser Ala Pro Val Thr Leu Ile Tyr Ala Asp Thr
35 40 45
Asn Arg Pro Ser Asn Ile Pro Ser Arg Phe Ser Gly Ser Thr Ser Gly
50 55 60
Ser Thr Ser Thr Leu Thr Ile Thr Gly Val Gln Ala Glu Asp Glu Ala
65 70 75 80
Val Tyr Tyr Cys Gly Gly Ser Ser Thr Gly Asp Gly Ile Phe Gly Ala
85 90 95
Gly Thr Thr Leu Thr Val Leu
100
<210> 416
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 416
Ser Tyr Glu Leu Thr Gln Pro Pro Ser Val Ser Val Ser Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Ser Gly Gly Ala Tyr Ser Ser Tyr Tyr Tyr
20 25 30
Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Ile Tyr
35 40 45
Ser Asp Ser Lys Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Ser Ser Gly Thr Thr Val Thr Leu Thr Ile Ser Gly Val Gln Ala Glu
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gly Gly Tyr Asp Gln Ser Ser Tyr Thr
85 90 95
Asn Pro Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105
<210> 417
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 417
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Thr Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Tyr Thr Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Tyr Asp Arg Pro Pro
85 90 95
Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 418
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 418
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Thr Cys Arg Ala Ser Gln Ser Val Tyr Thr Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Tyr Asp Arg Pro Pro
85 90 95
Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 419
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 419
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Tyr Thr Tyr
20 25 30
Leu Ala Trp Tyr Gln Glu Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Tyr Asp Arg Pro Pro
85 90 95
Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 420
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 420
Asp Val Gln Leu Leu Glu Ser Gly Gly Gly Val Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Ser Asn Phe
20 25 30
Ala Leu Thr Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Val
35 40 45
Ser Thr Ile Gly Ser Gly Asp Thr Tyr Tyr Ala Asp Ser Val Lys Gly
50 55 60
Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln
65 70 75 80
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Lys
85 90 95
Asp Ser Thr Val Ser Trp Ser Gly Asp Phe Phe Asp Tyr Trp Gly Leu
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 421
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 421
Asp Val Gln Leu Leu Glu Ser Gly Gly Gly Val Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Ser Asn Phe
20 25 30
Ala Val Thr Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Val
35 40 45
Ser Thr Ile Gly Ser Gly Asp Thr Tyr Tyr Ala Asp Ser Val Lys Gly
50 55 60
Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln
65 70 75 80
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Lys
85 90 95
Asp Ser Thr Val Ser Trp Ser Gly Asp Phe Phe Asp Tyr Trp Gly Leu
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 422
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 422
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Ser Ile Tyr
20 25 30
Ala Leu Ser Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Val
35 40 45
Ser Thr Ile Gly Ala Asp Asp Thr Tyr Tyr Ala Asp Ser Val Lys Gly
50 55 60
Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln
65 70 75 80
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Lys
85 90 95
Asp Ser Thr Val Gly Trp Ser Gly Asp Phe Phe Asp Tyr Trp Gly Leu
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 423
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 423
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Ser Ile Tyr
20 25 30
Ala Val Ser Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Val
35 40 45
Ser Thr Ile Gly Ala Asp Asp Thr Tyr Tyr Ala Asp Ser Val Lys Gly
50 55 60
Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln
65 70 75 80
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Lys
85 90 95
Asp Ser Thr Val Gly Trp Ser Gly Asp Phe Phe Asp Tyr Trp Gly Leu
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 424
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 424
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Asp Leu Asn Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Val
35 40 45
Ser Leu Ile Ser Gly Ser Gly Glu Ile Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Glu Asn Asn Arg Tyr Arg Phe Phe Asp Asp Trp Gly Leu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 425
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 425
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Glu
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Asp Val Asn Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Val
35 40 45
Ser Leu Ile Ser Gly Ser Gly Glu Ile Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Glu Asn Asn Arg Tyr Arg Phe Phe Asp Asp Trp Gly Leu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 426
<211> 106
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 426
Gly Gln Pro Lys Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser
1 5 10 15
Glu Glu Leu Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp
20 25 30
Phe Tyr Pro Gly Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro
35 40 45
Val Lys Ala Gly Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn
50 55 60
Lys Tyr Ala Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys
65 70 75 80
Ser His Arg Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val
85 90 95
Glu Lys Thr Val Ala Pro Thr Glu Cys Ser
100 105
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| КОНСТРУКЦИИ, ИМЕЮЩИЕ SIRP-АЛЬФА ДОМЕН ИЛИ ЕГО ВАРИАНТ | 2016 |
|
RU2740672C2 |
| МУЛЬТИСПЕЦИФИЧЕСКАЯ АНТИГЕНСВЯЗЫВАЮЩАЯ МОЛЕКУЛА, ОБЛАДАЮЩАЯ ЗАМЕЩАЮЩЕЙ ФУНКЦИОНАЛЬНОЙ АКТИВНОСТЬЮ КОФАКТОРА КОАГУЛИРУЮЩЕГО ФАКТОРА КРОВИ VIII, И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ УКАЗАННУЮ МОЛЕКУЛУ В КАЧЕСТВЕ АКТИВНОГО ИНГРЕДИЕНТА | 2018 |
|
RU2812909C2 |
| БИСПЕЦИФИЧНЫЕ АНТИГЕНСВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2800779C2 |
| АНТИТЕЛА К ВИРУСУ ДЕНГЕ, ПОЛИПЕПТИДЫ, СОДЕРЖАЩИЕ ВАРИАНТЫ FC-ОБЛАСТЕЙ, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2758596C2 |
| АНТИТЕЛА К ВИРУСУ ДЕНГЕ, ОБЛАДАЮЩИЕ ПЕРЕКРЕСТНОЙ РЕАКТИВНОСТЬЮ С ВИРУСОМ ЗИКА | 2019 |
|
RU2811697C2 |
| БИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА, СПЕЦИФИЧЕСКИ СВЯЗЫВАЮЩИЕСЯ С PD1 И LAG3 | 2018 |
|
RU2778805C2 |
| АНТИТЕЛА К С5 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2746356C2 |
| АНТИ-CD137 АНТИГЕНСВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2829536C2 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ НА ОСНОВЕ АКТИВИРУЮЩИХ Т-КЛЕТКИ БИСПЕЦИФИЧЕСКИХ АНТИГЕНСВЯЗЫВАЮЩИХ МОЛЕКУЛ ПРОТИВ CD3 И ФОЛАТНОГО РЕЦЕПТОРА 1 (FOLR1) И АНТАГОНИСТОВ, СВЯЗЫВАЮЩИХСЯ С ОСЬЮ PD-1 | 2015 |
|
RU2753902C2 |
| СЕЛЕКТИВНЫЕ В ОТНОШЕНИИ ИЗОФОРМЫ АНТИТЕЛА К TGF-БЕТА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2021 |
|
RU2839151C1 |


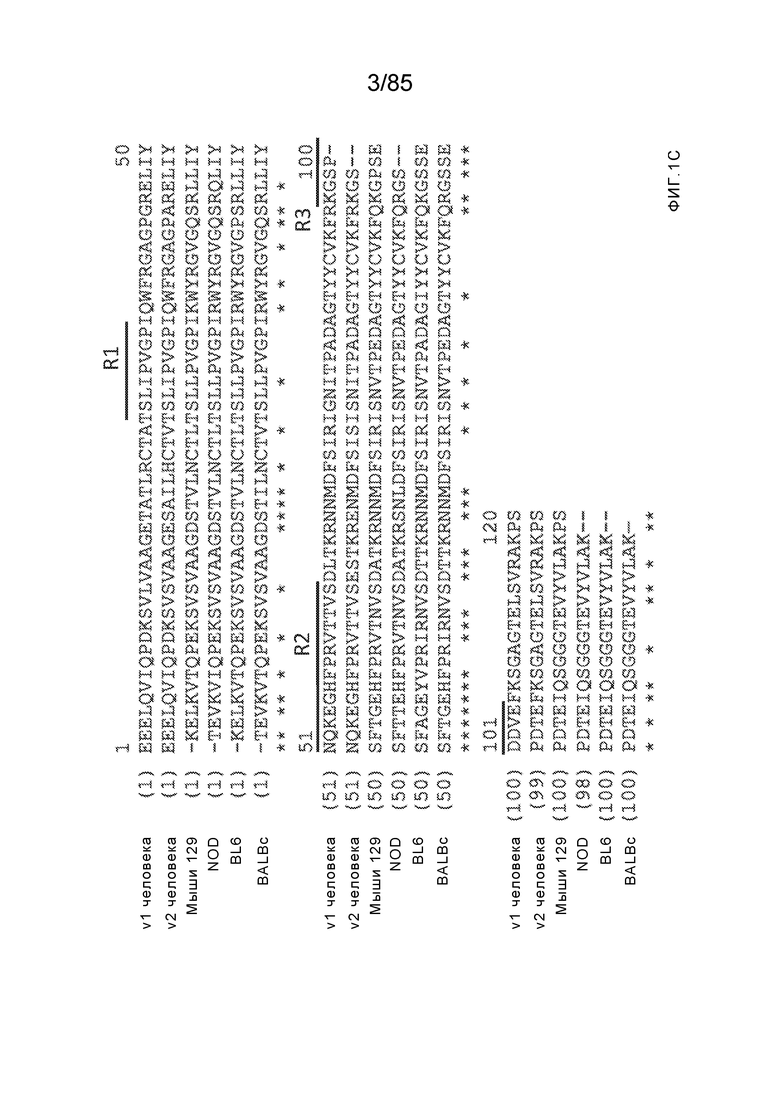

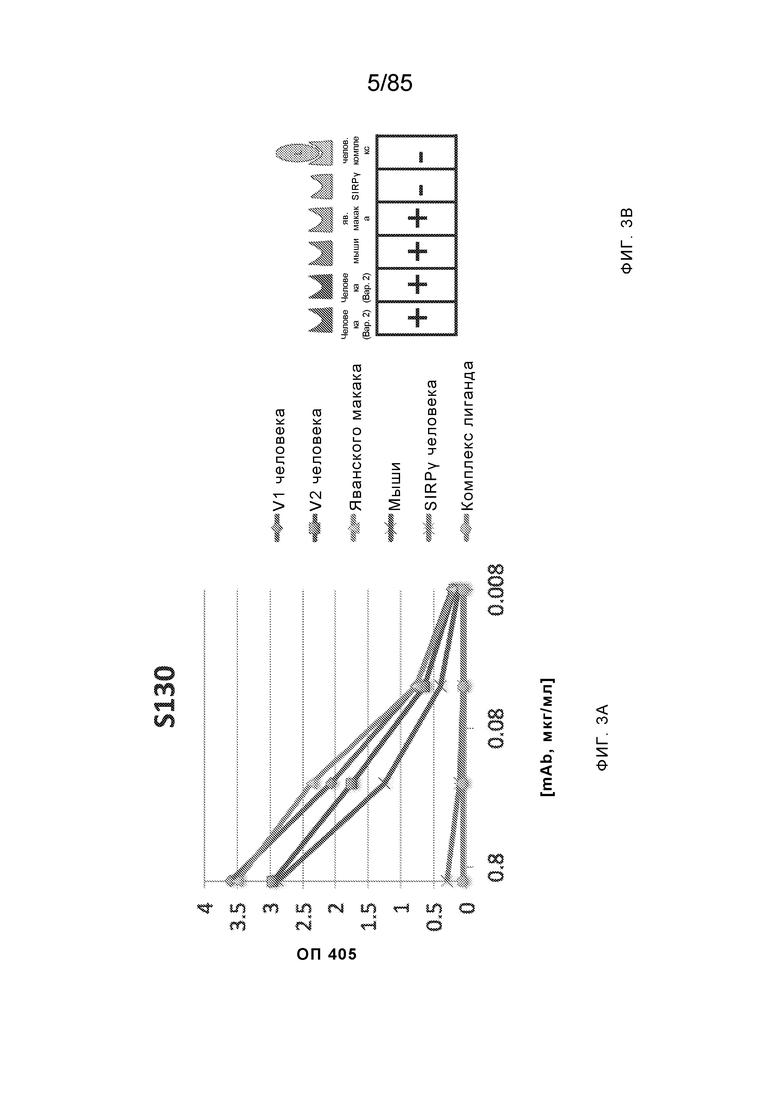
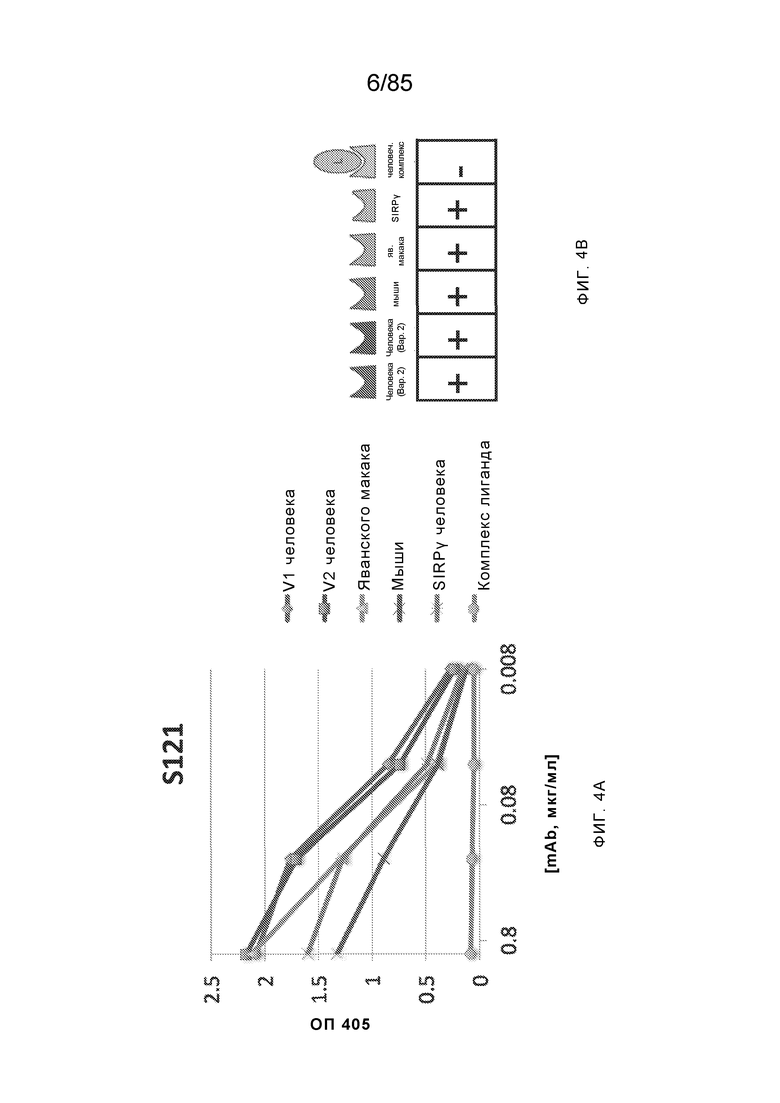
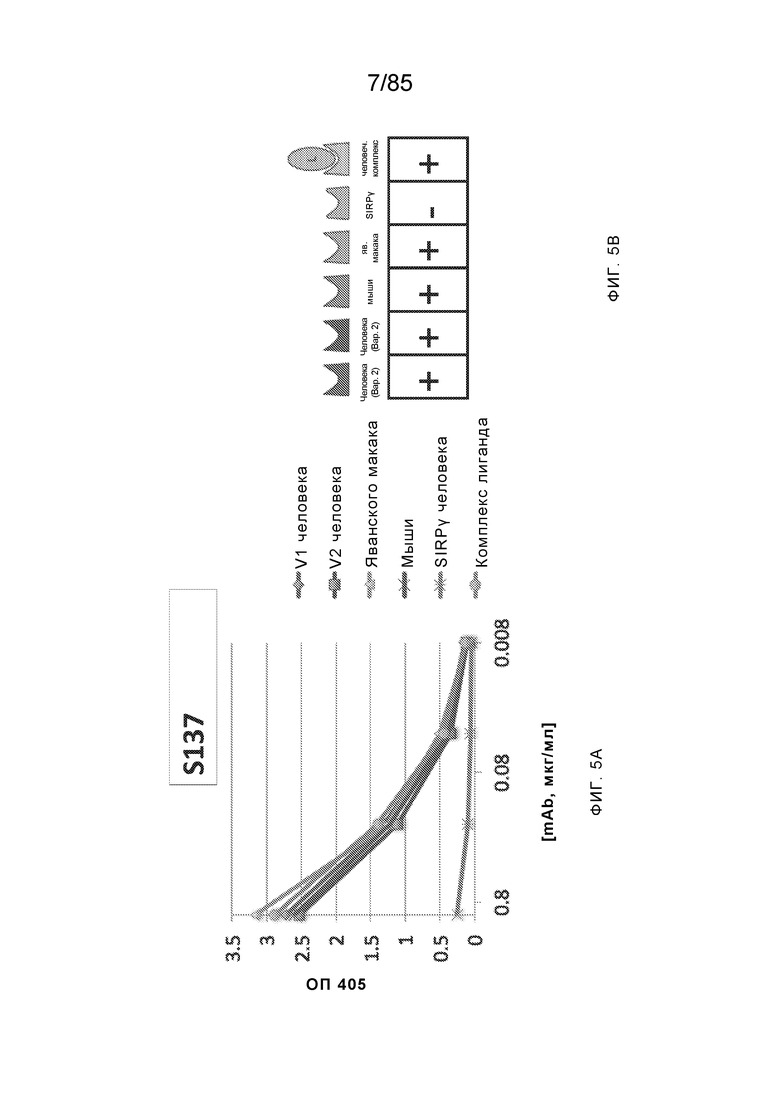
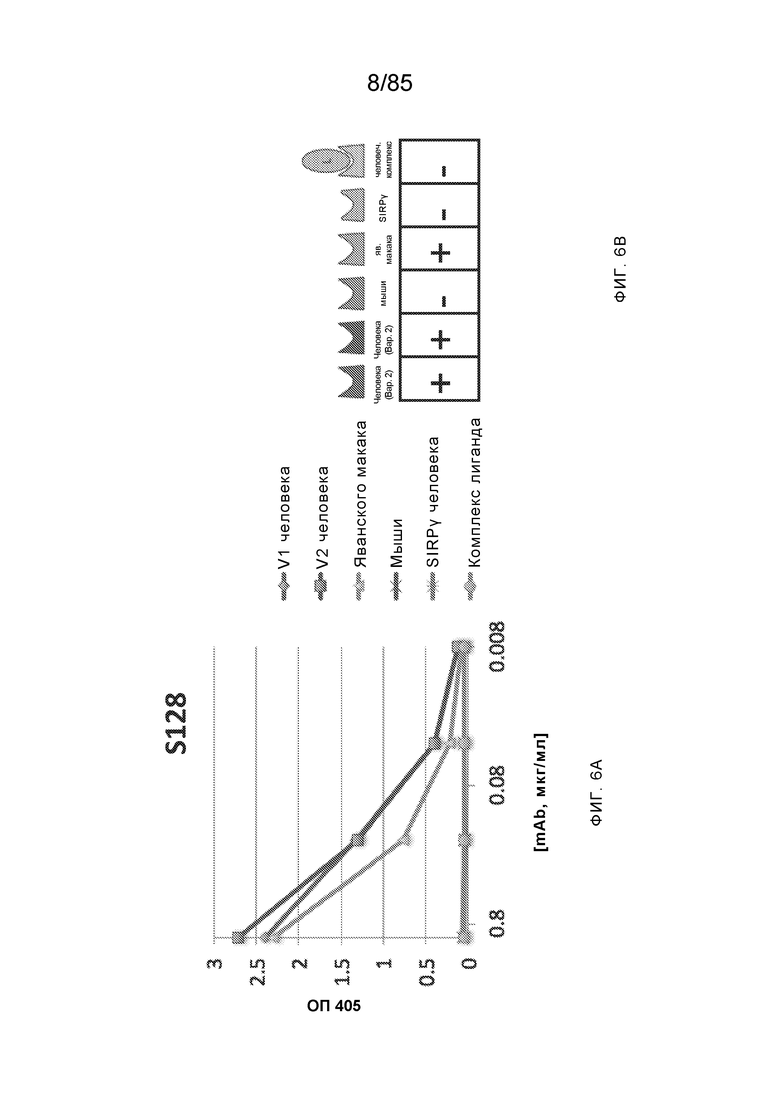
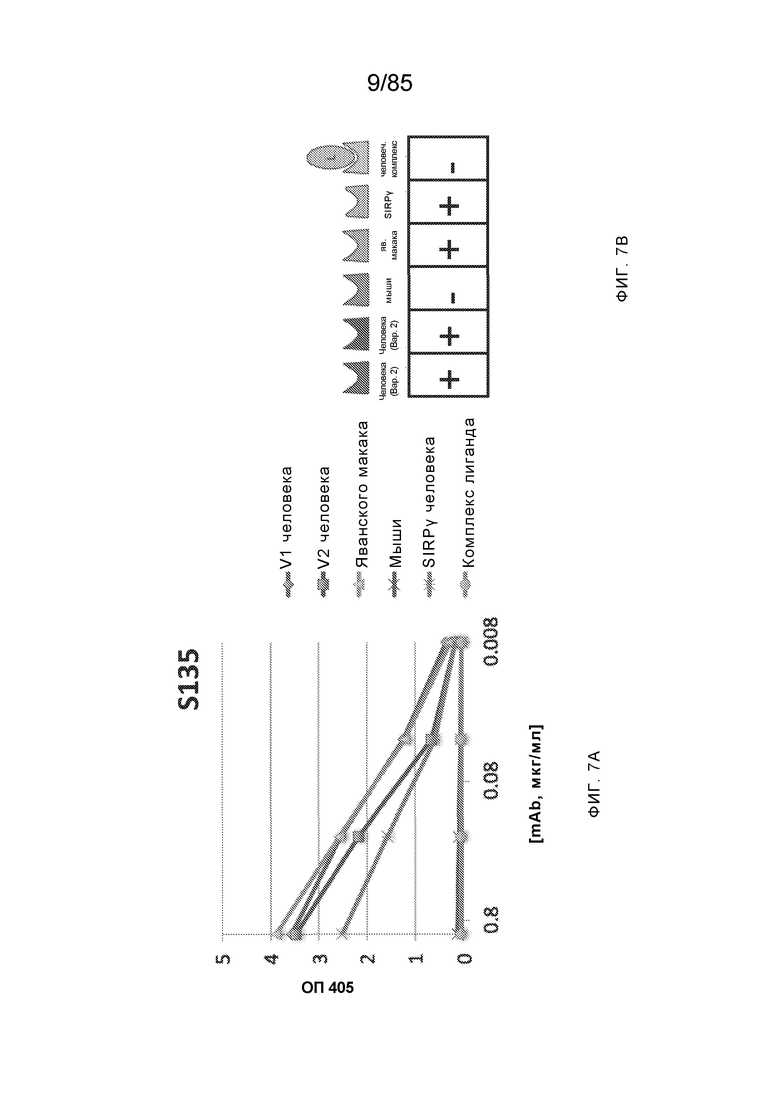
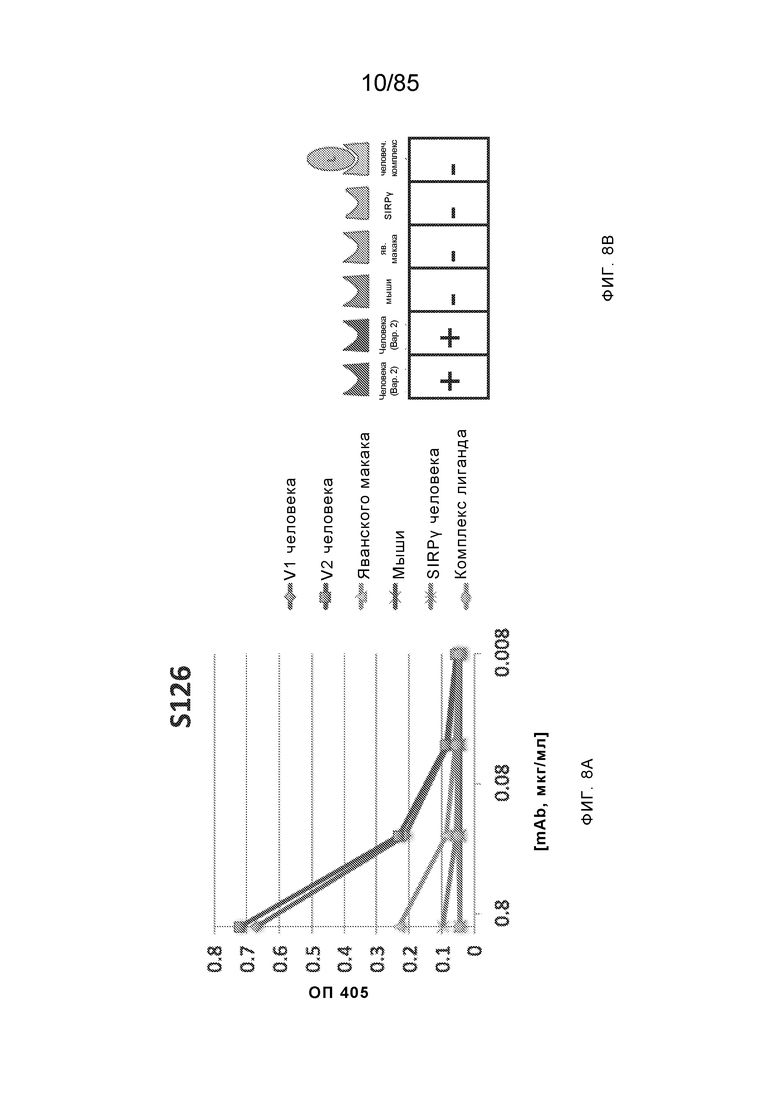

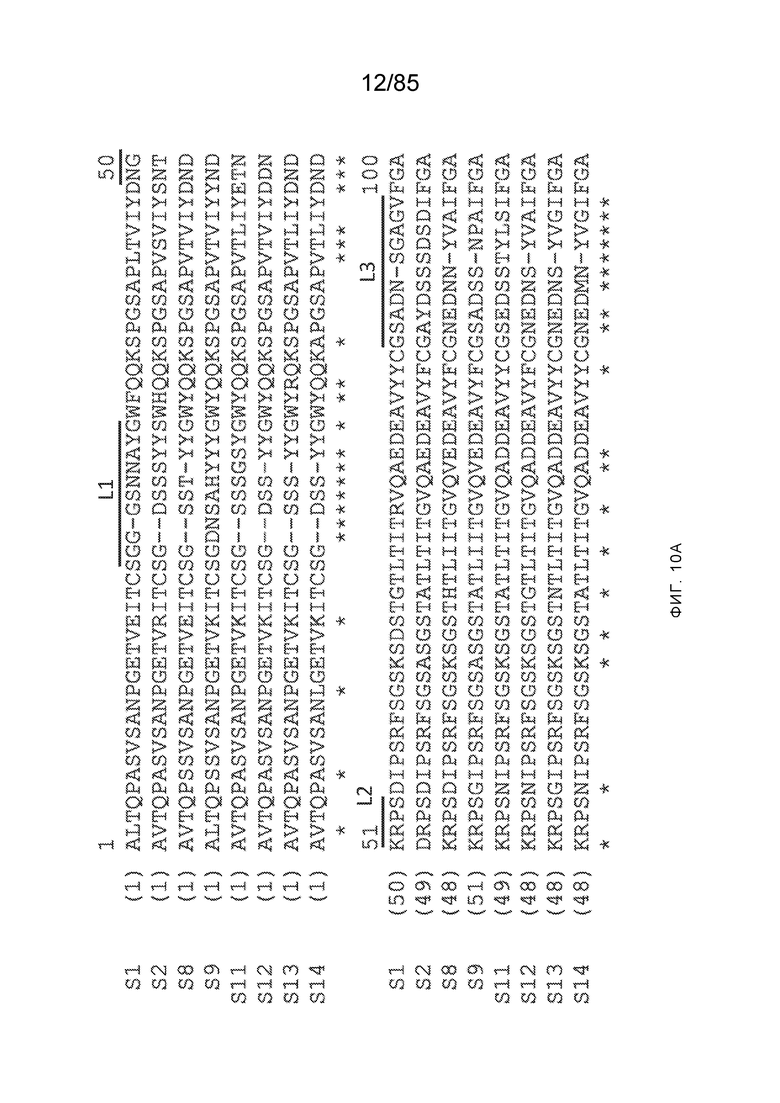




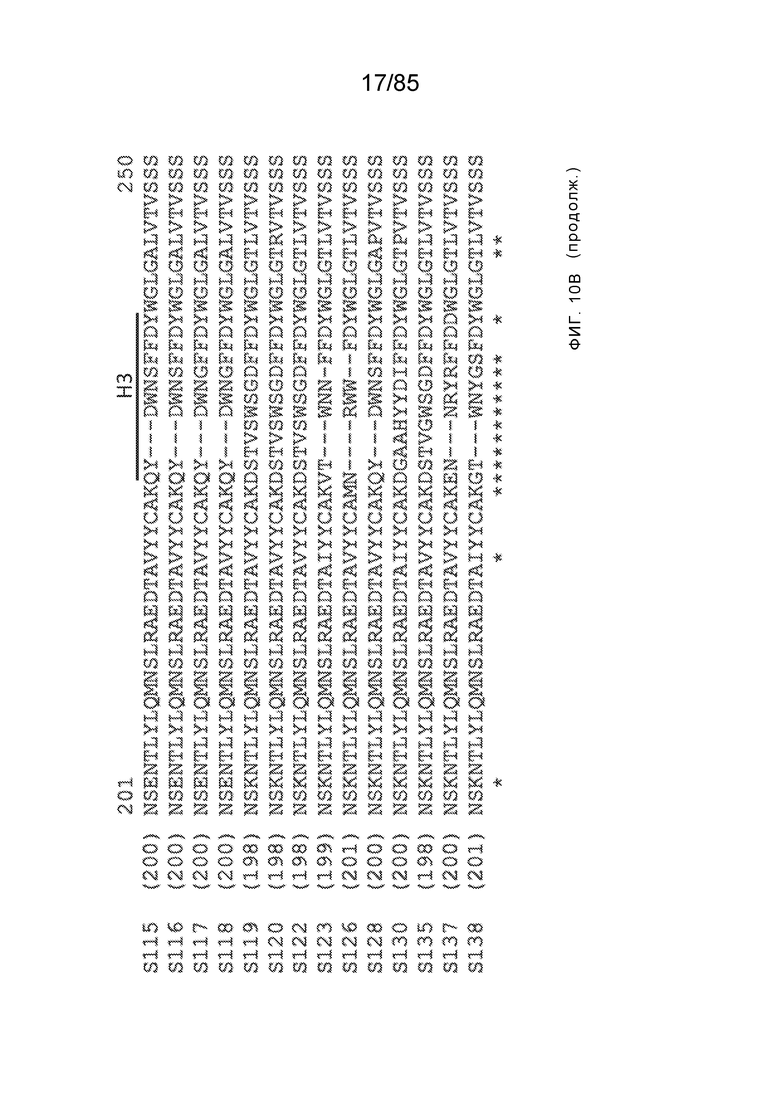


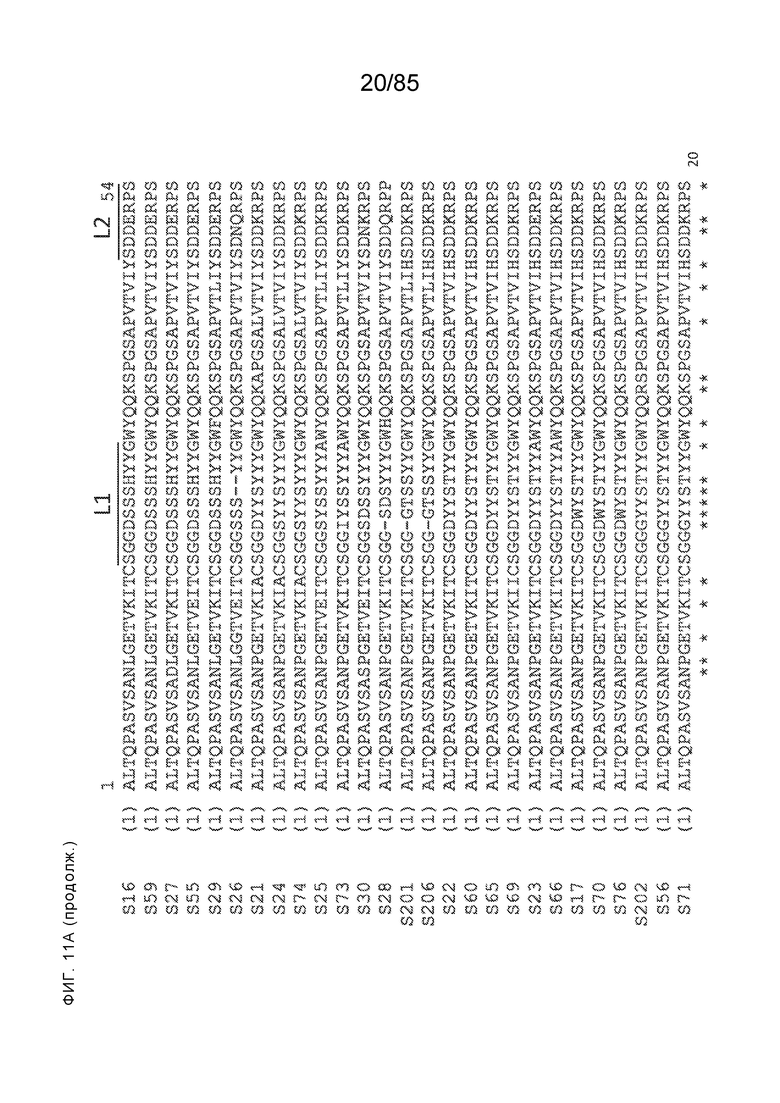













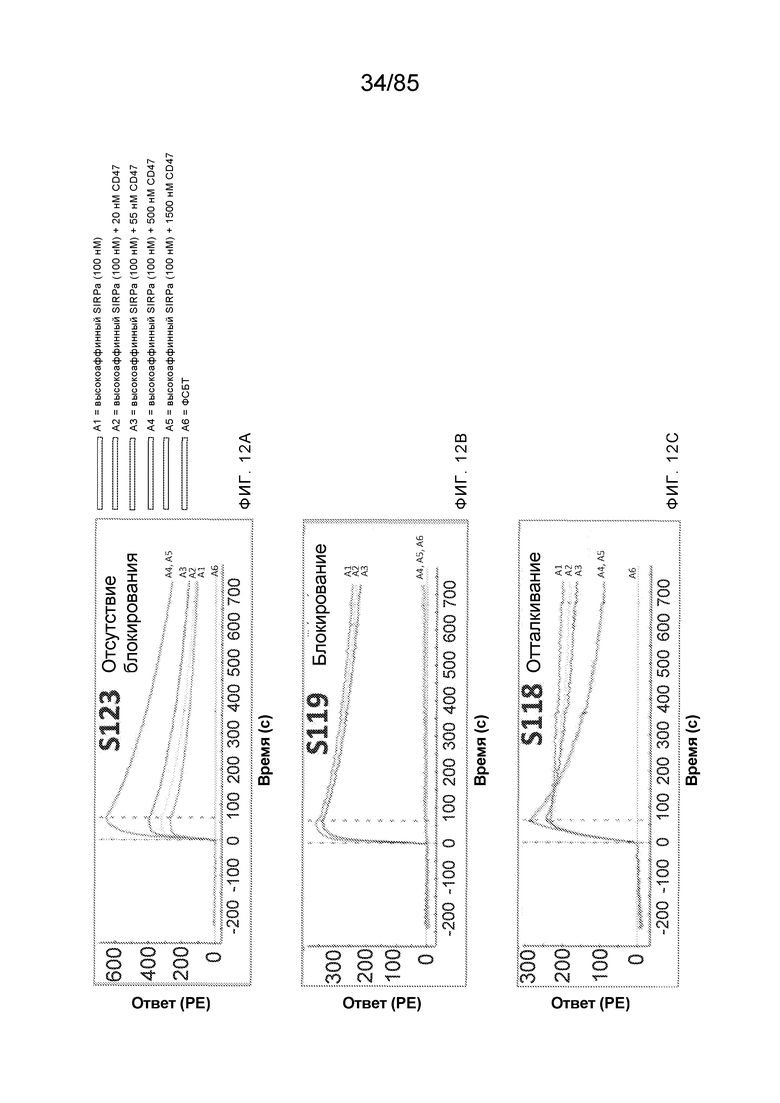
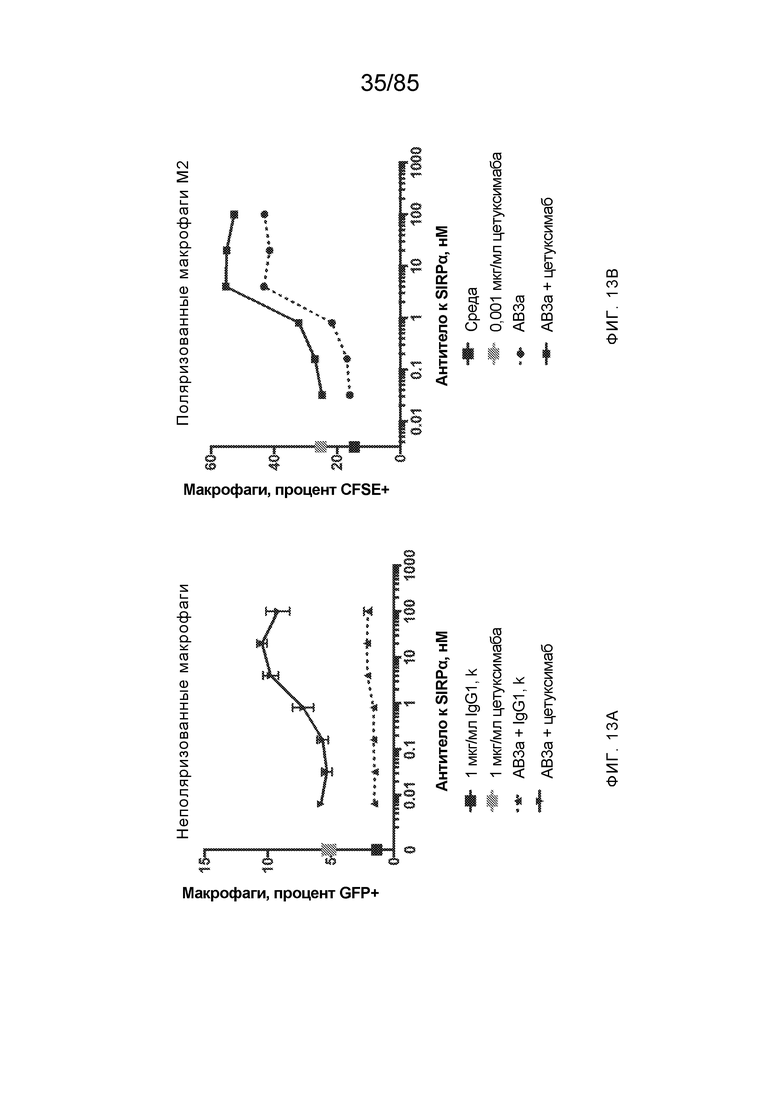
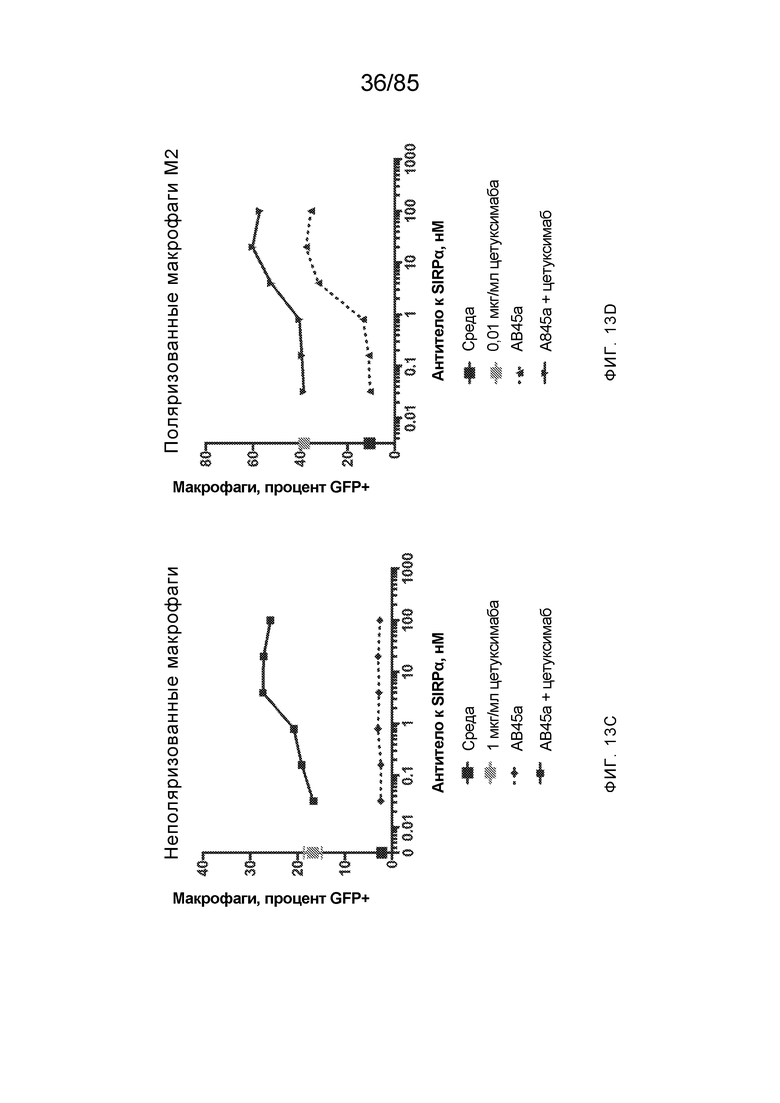

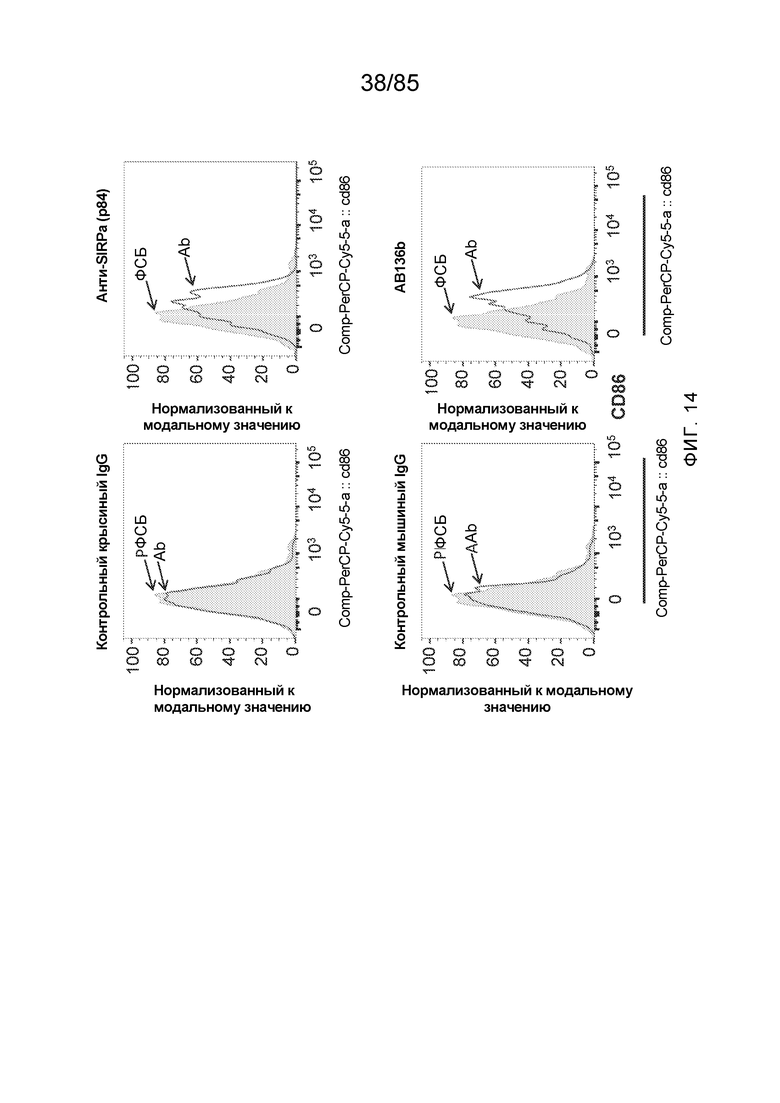
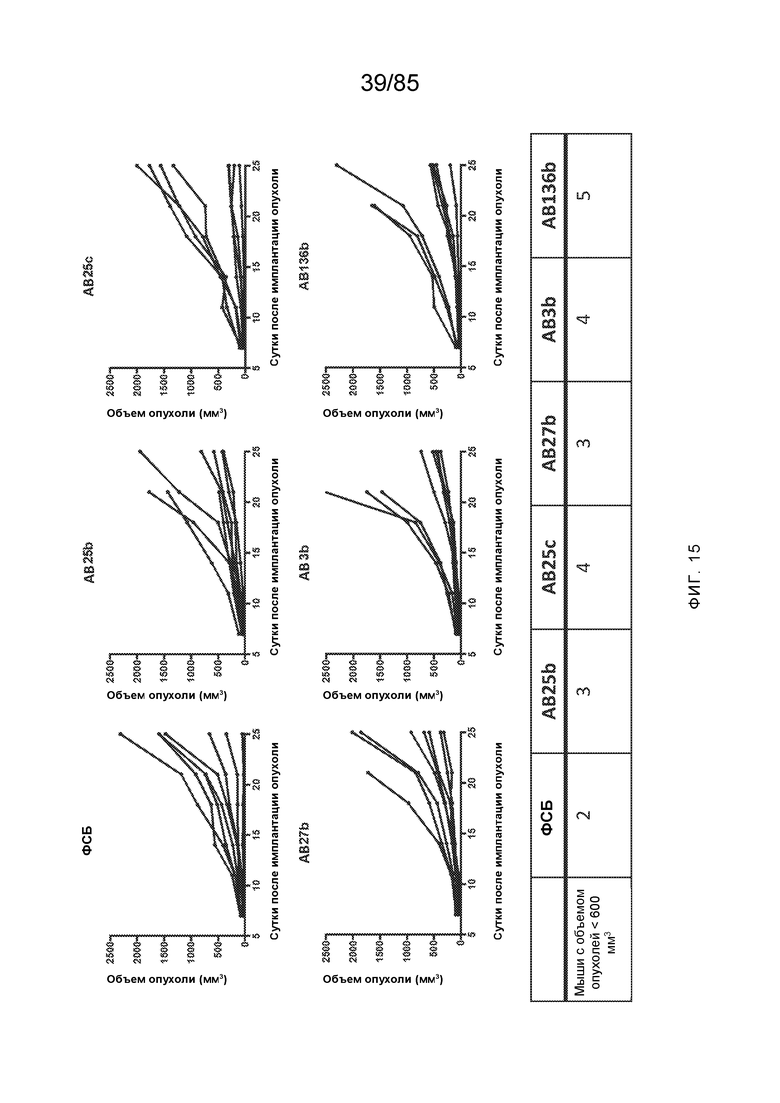

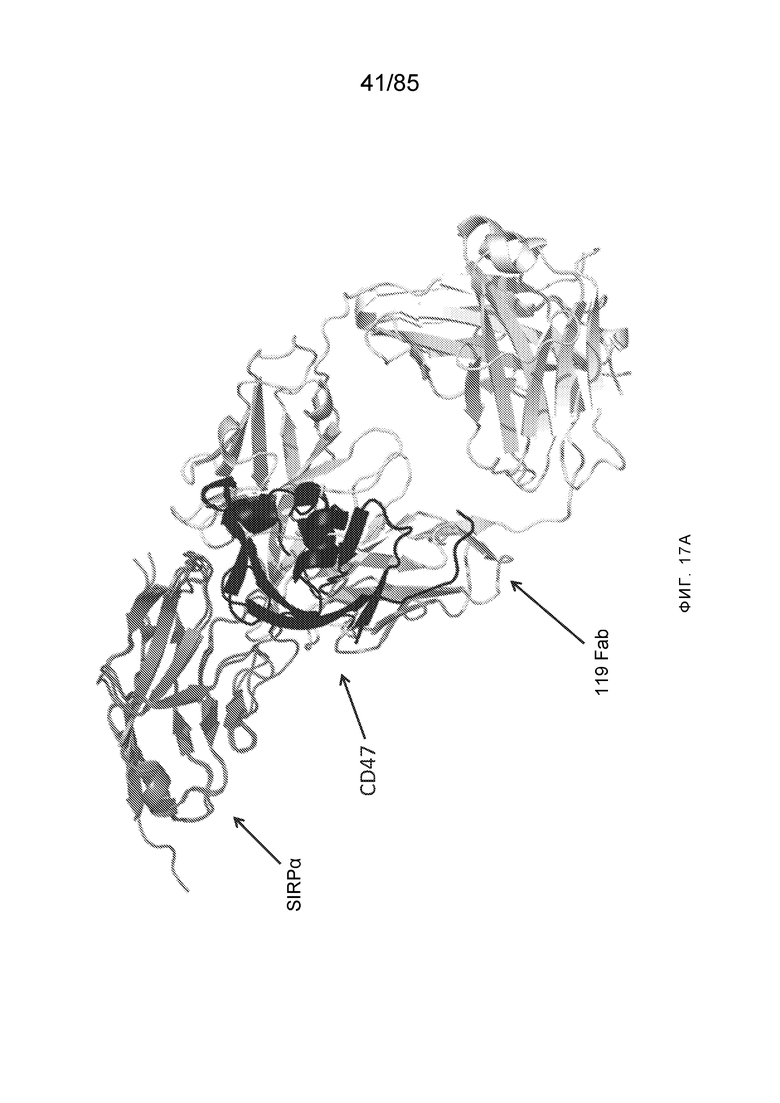

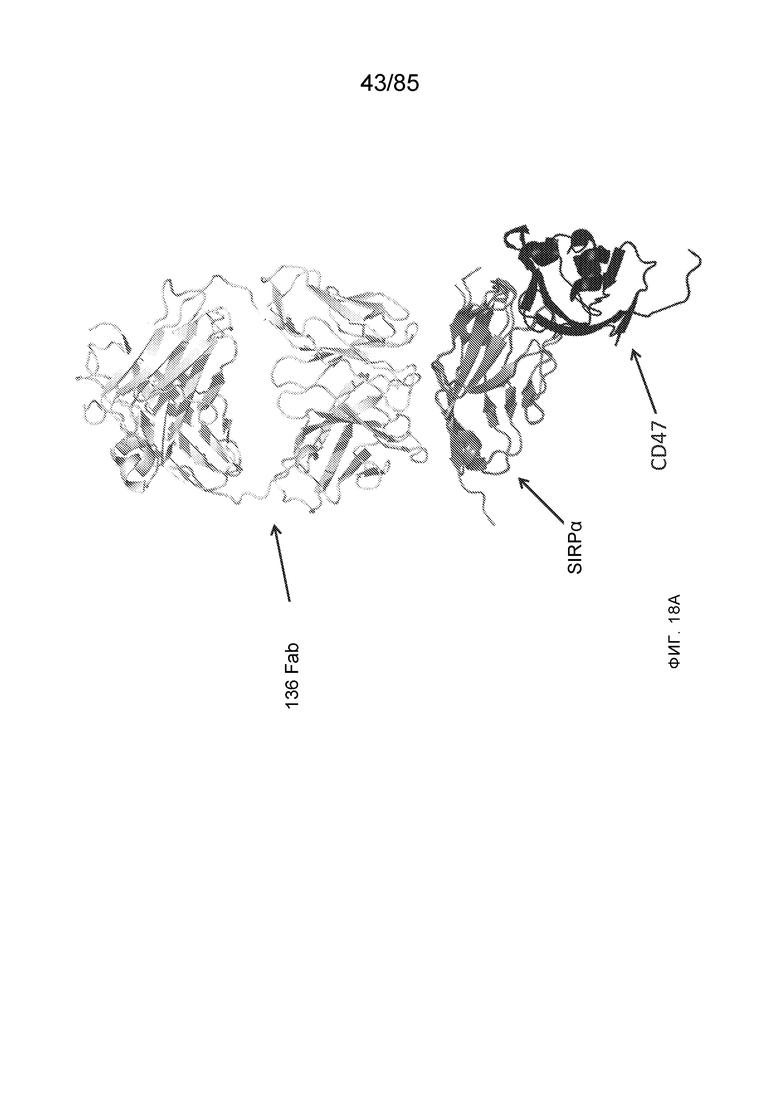
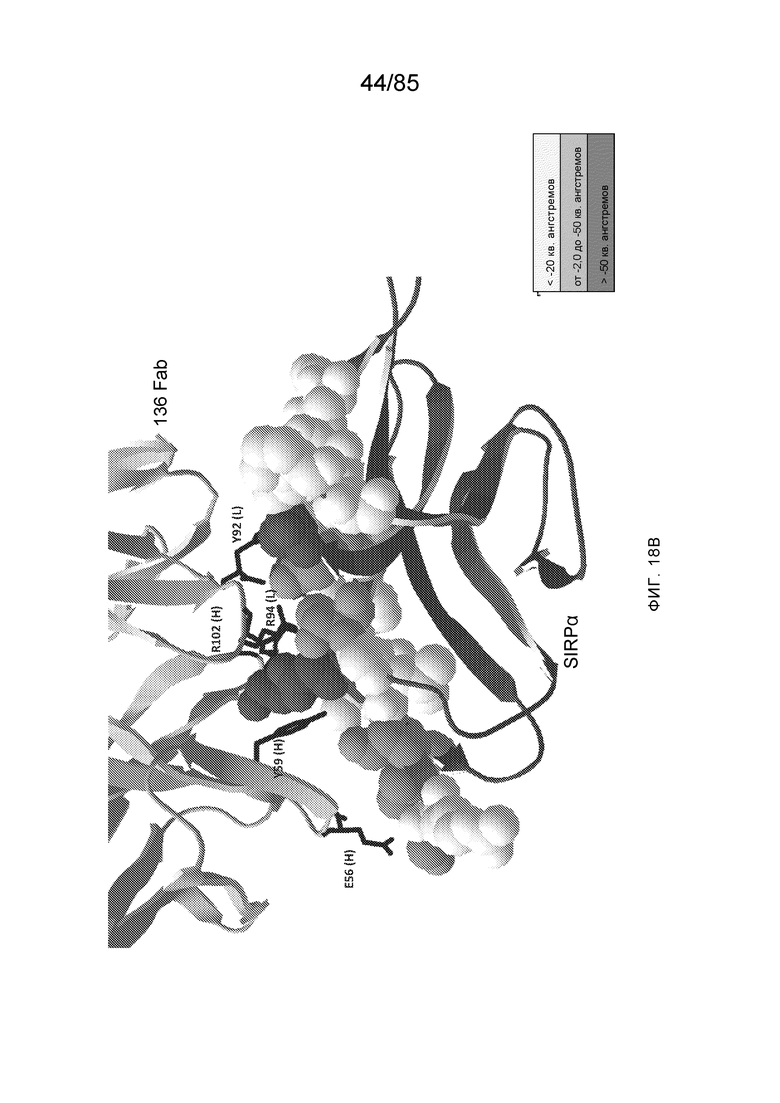
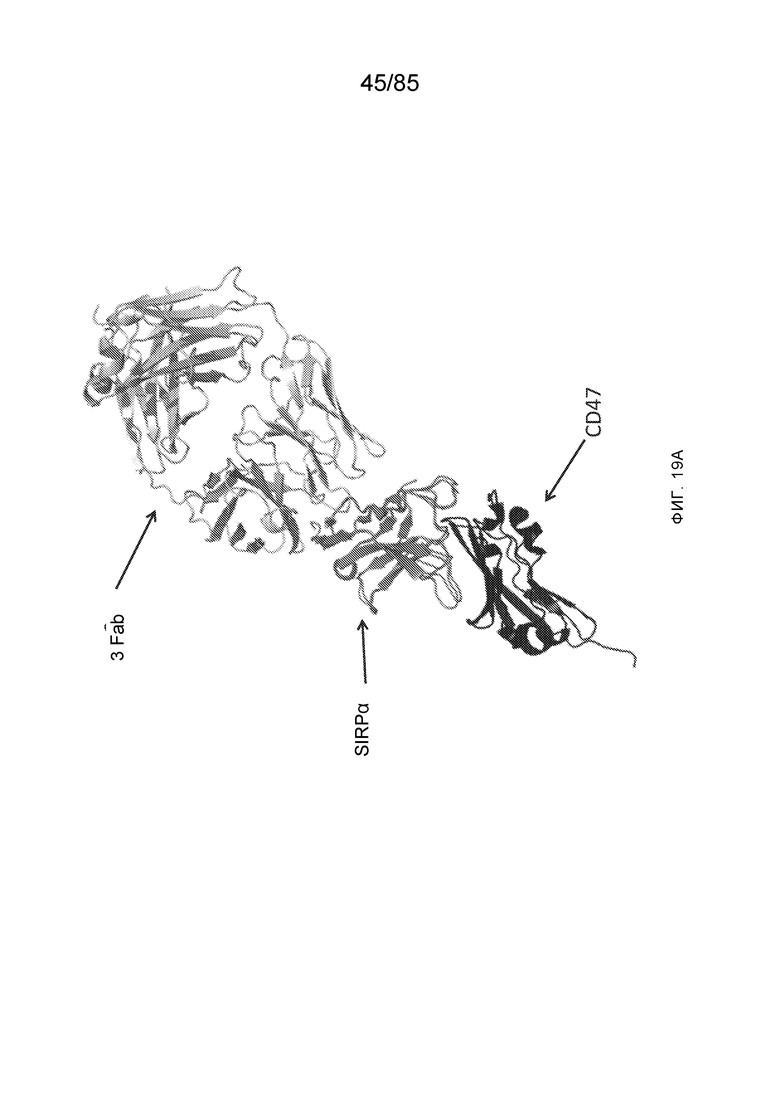

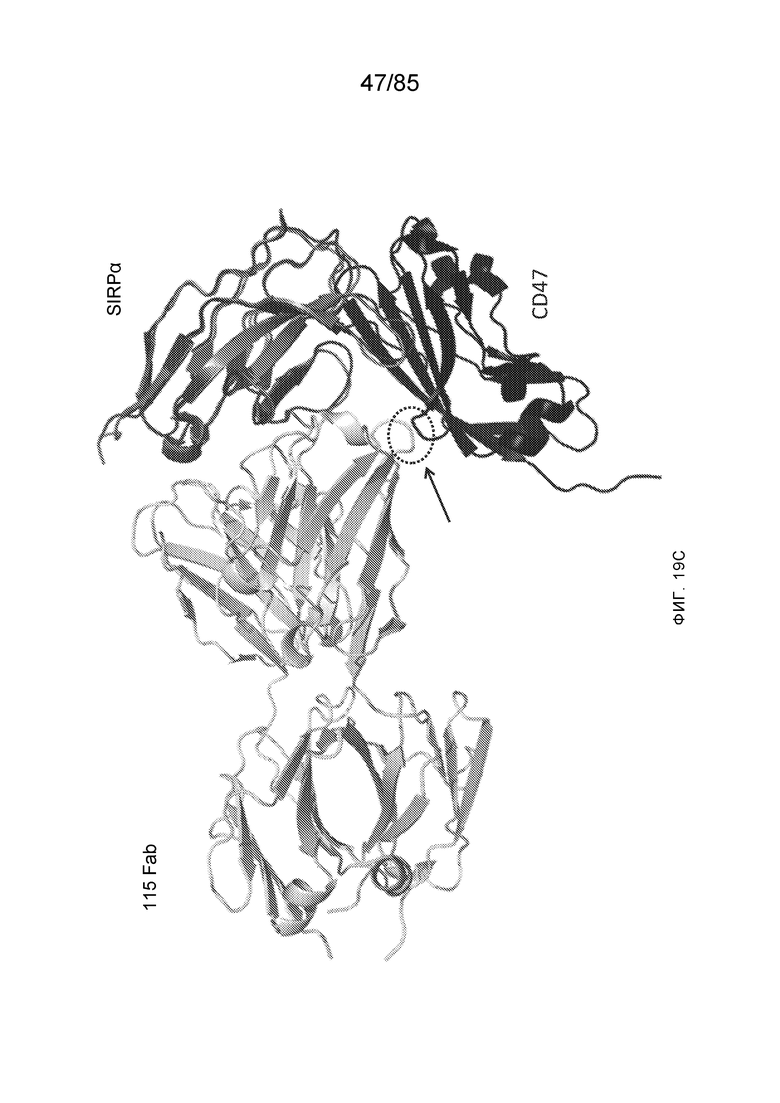

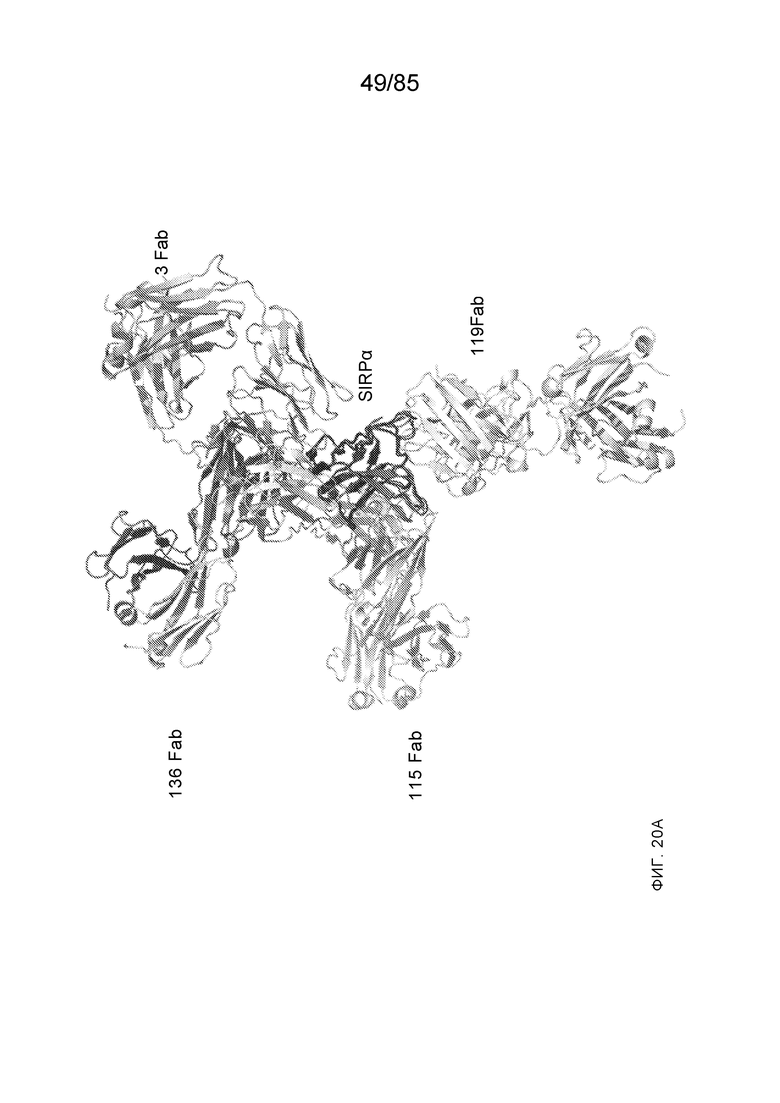
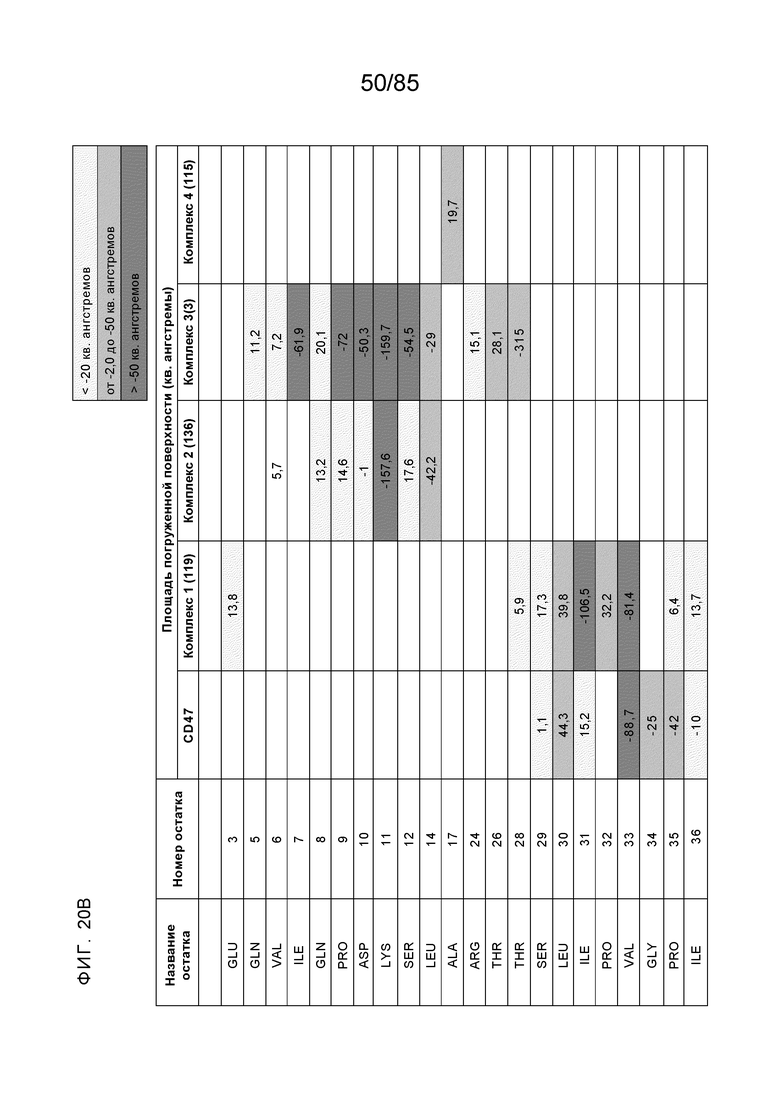
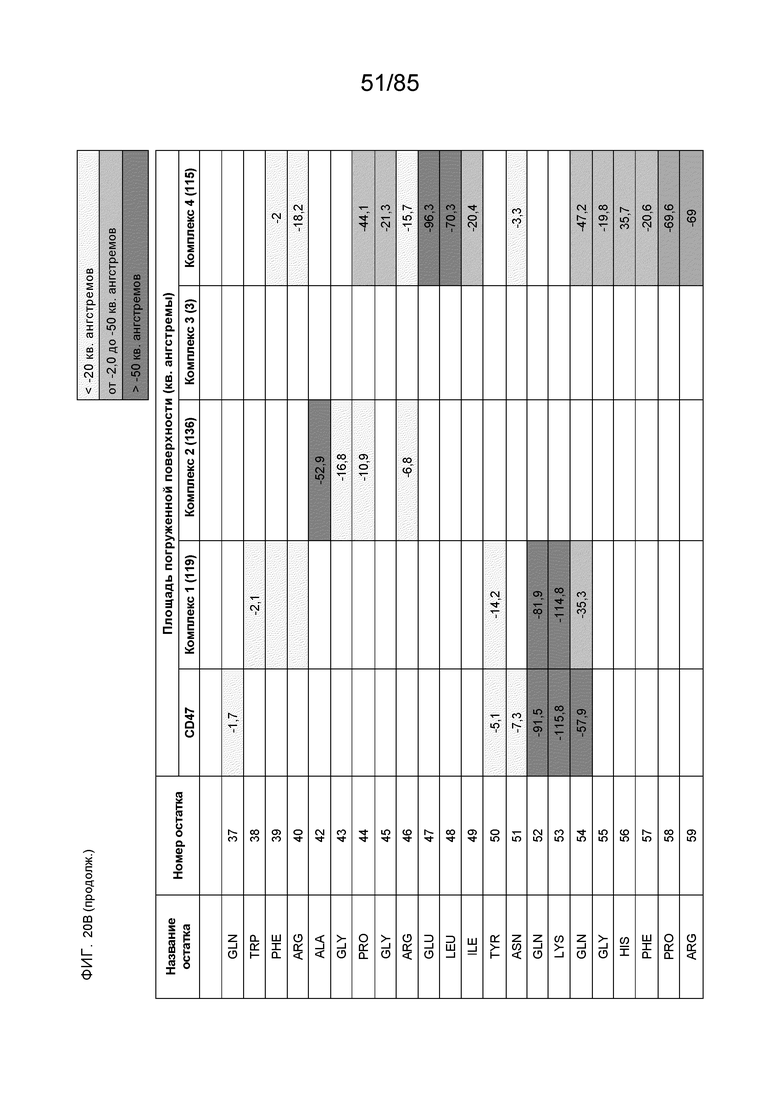
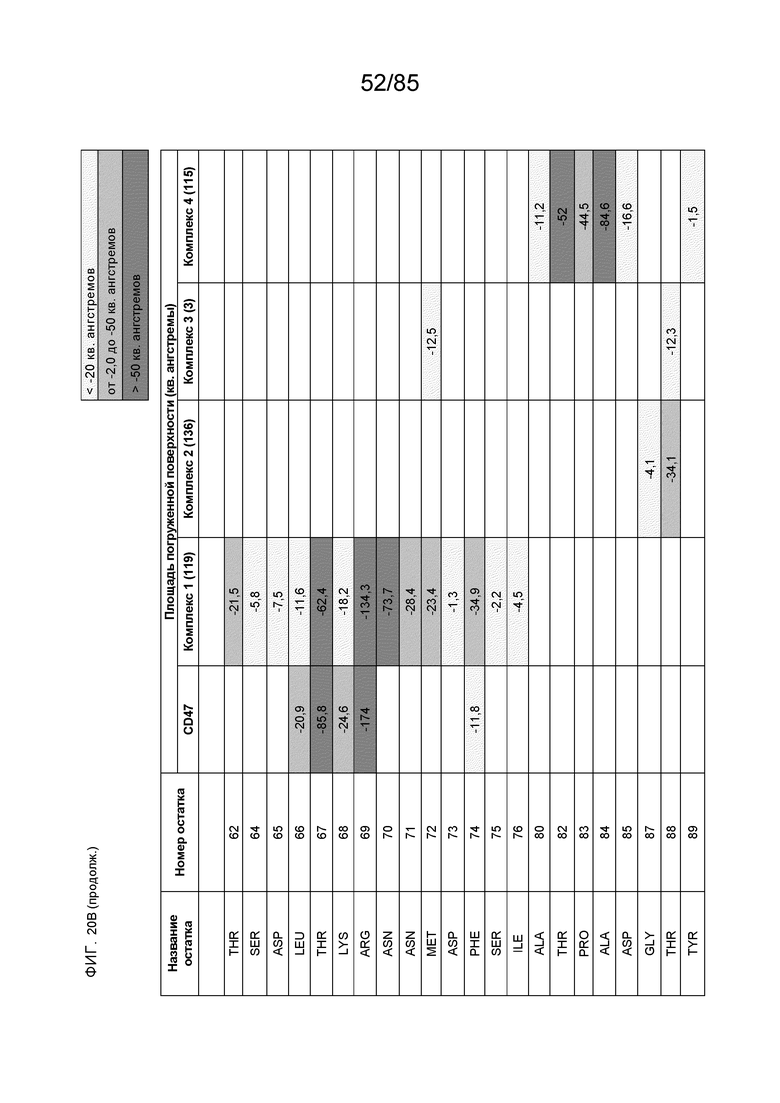
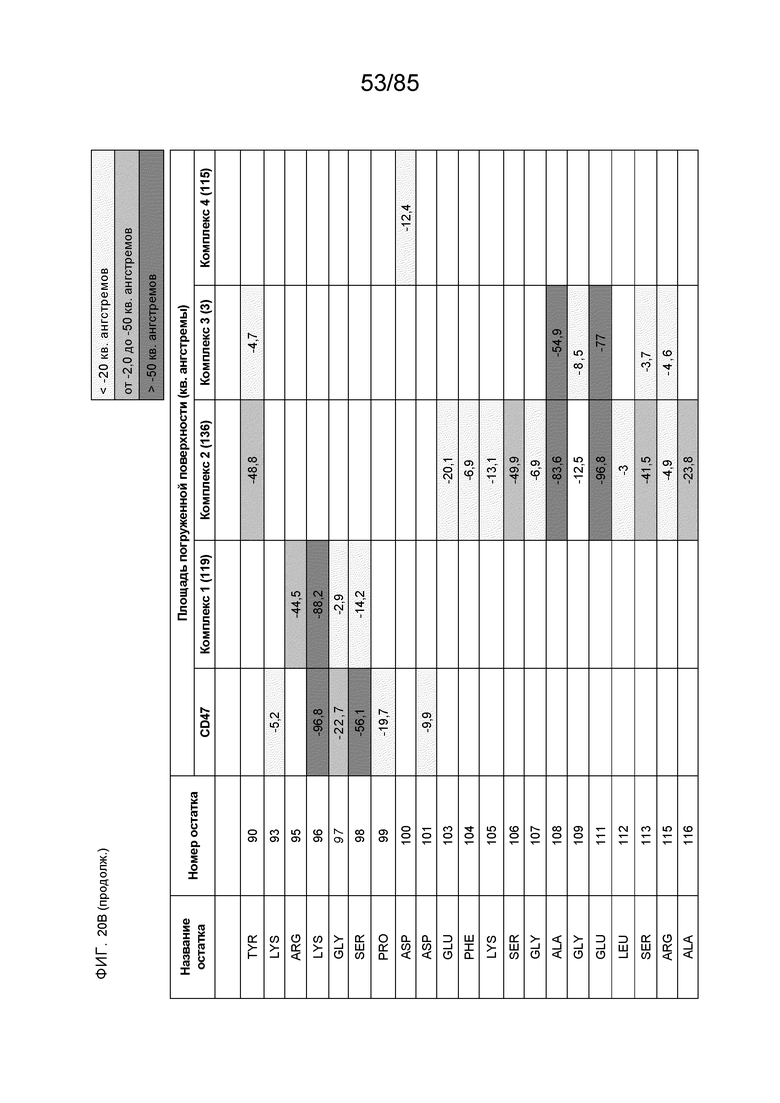
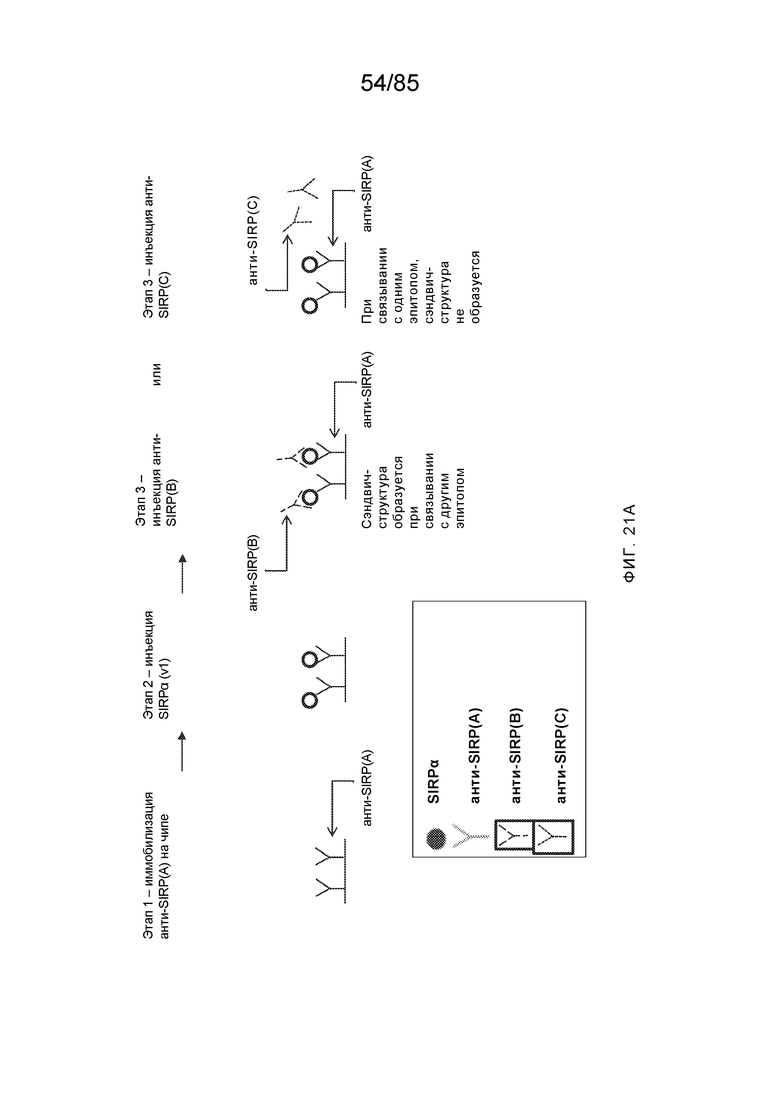
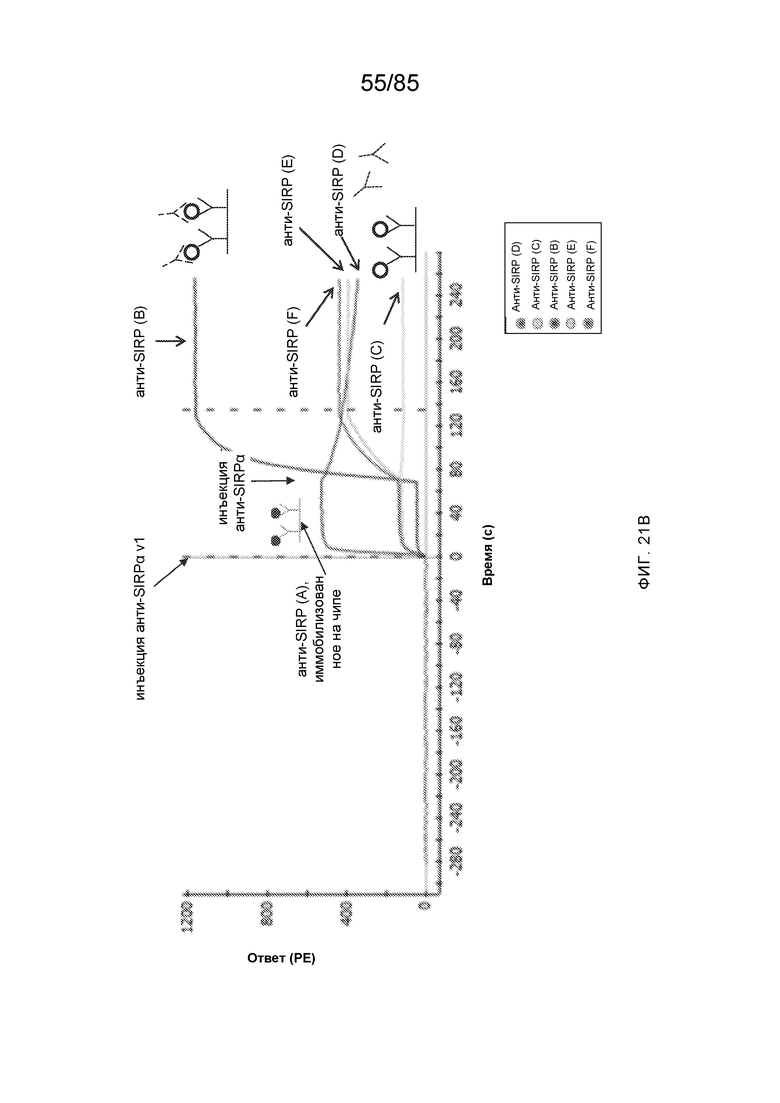
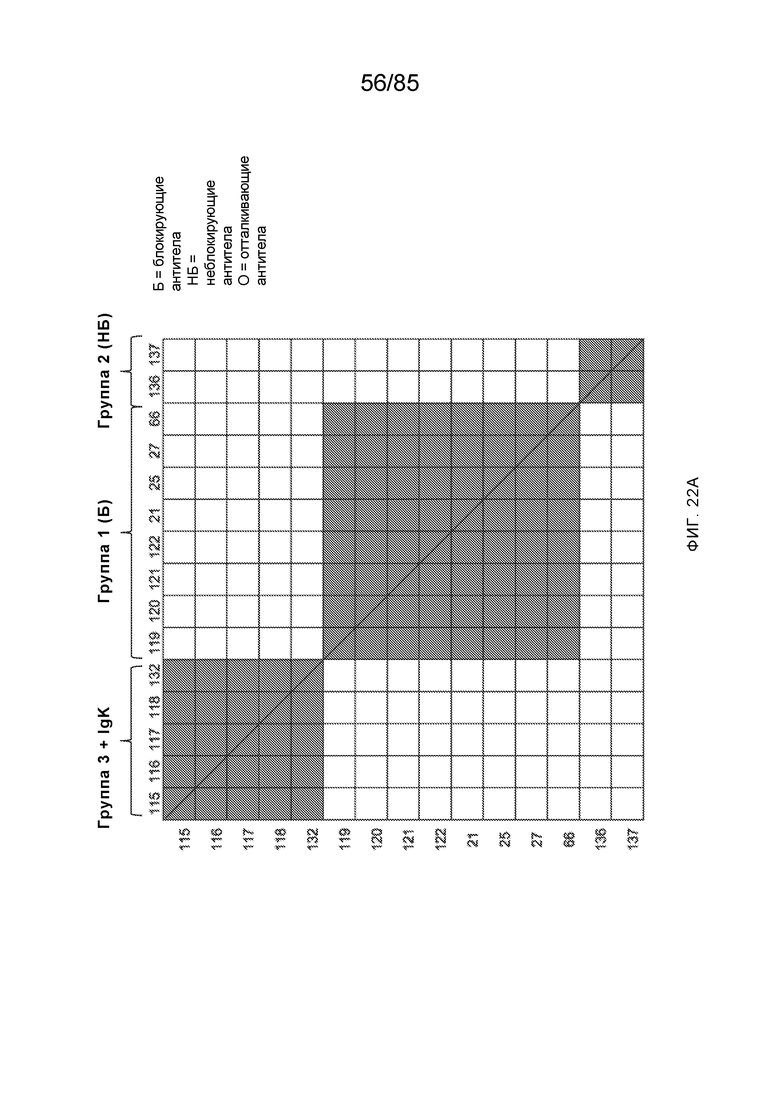
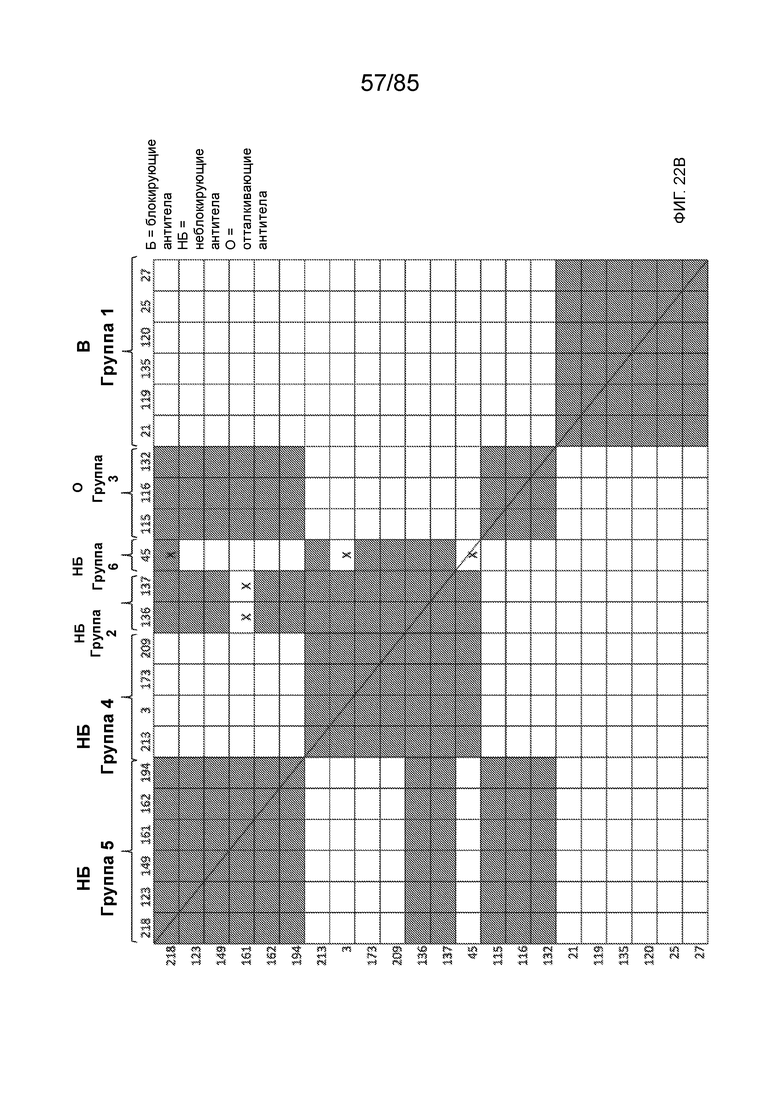
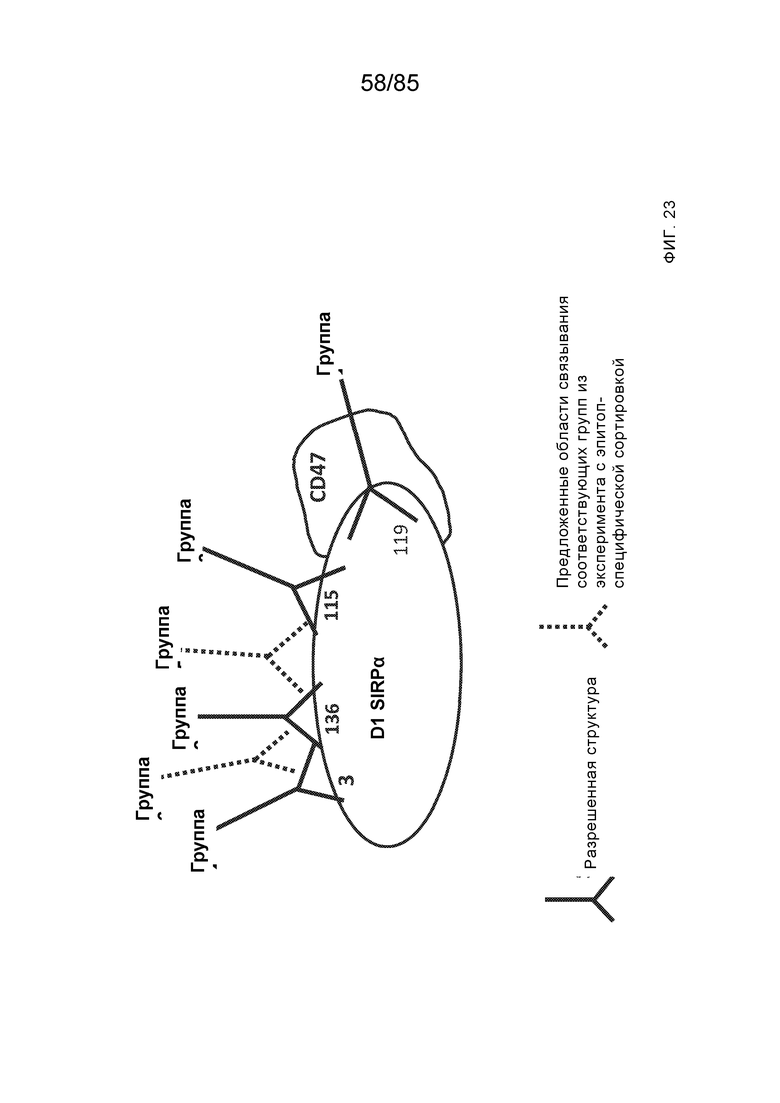






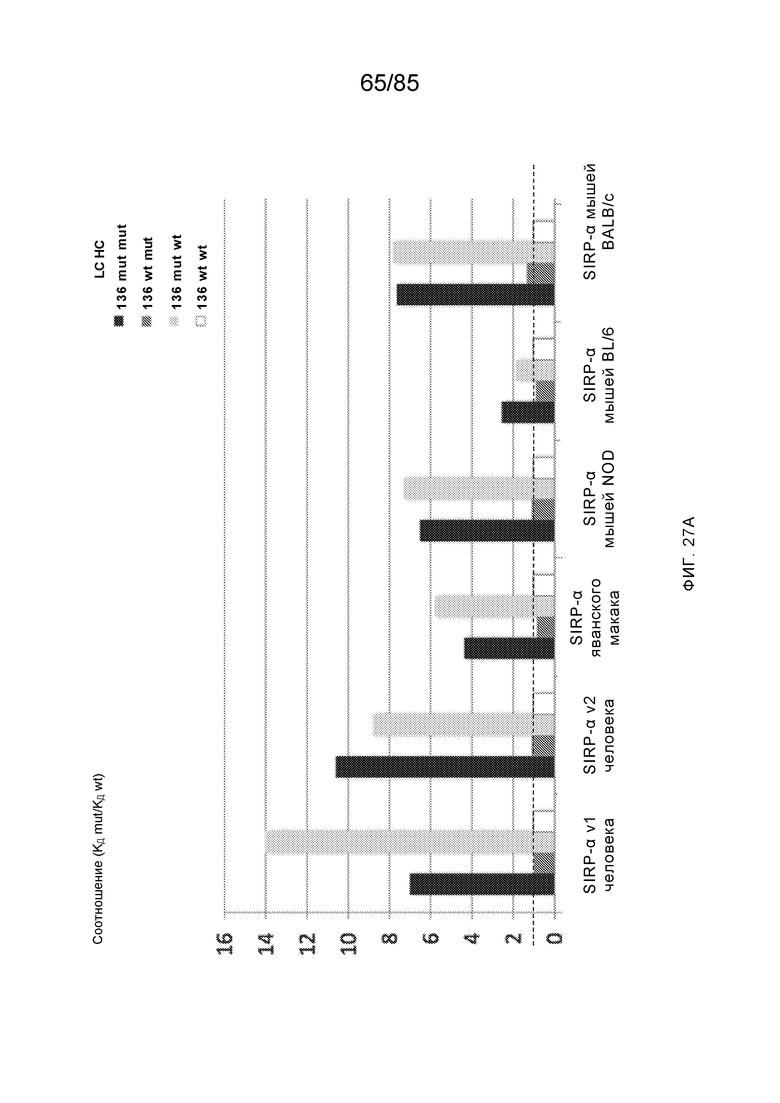
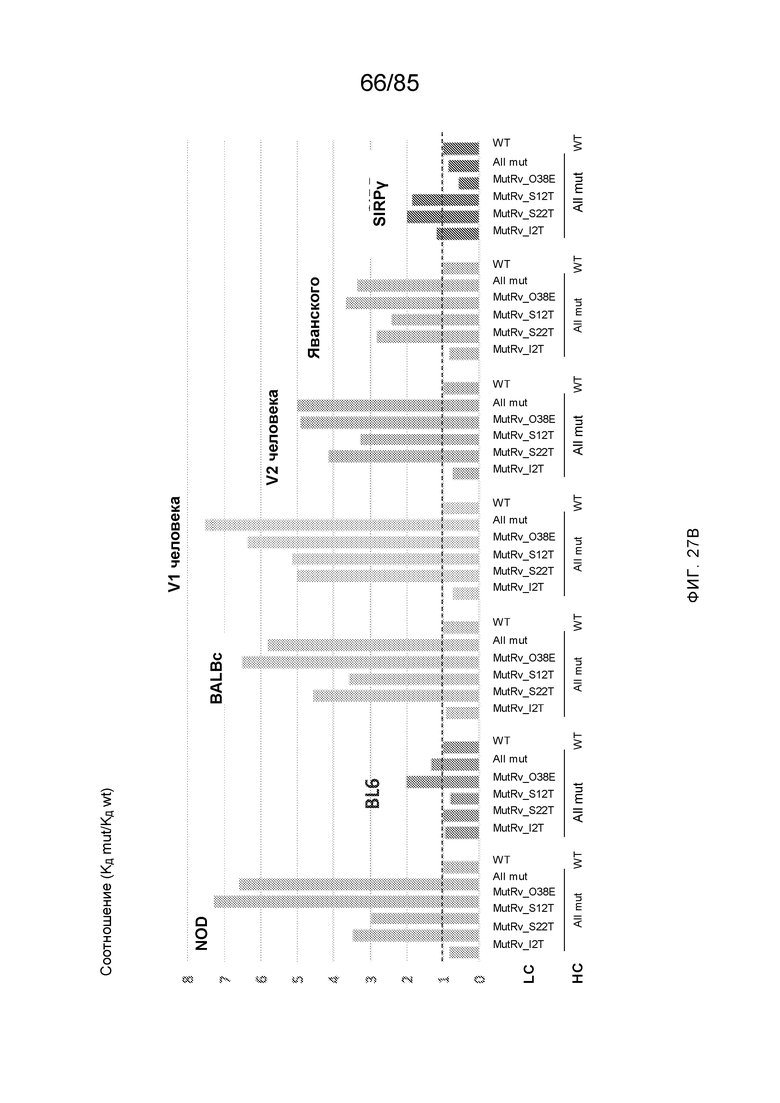



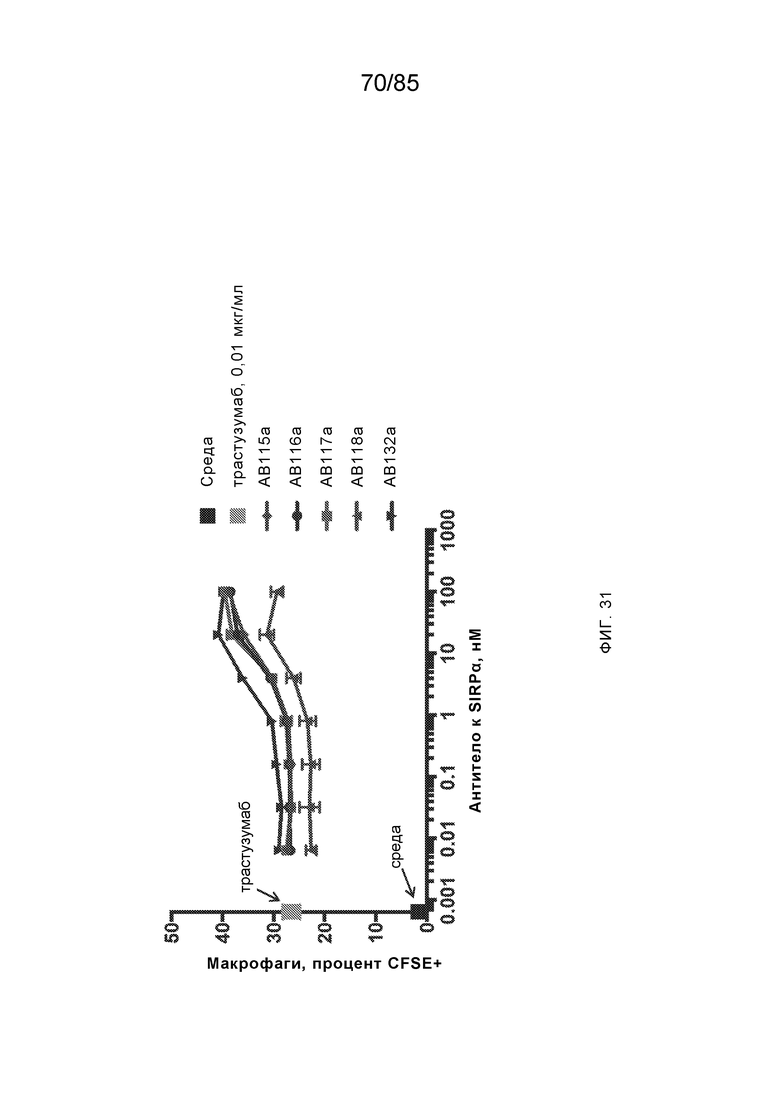
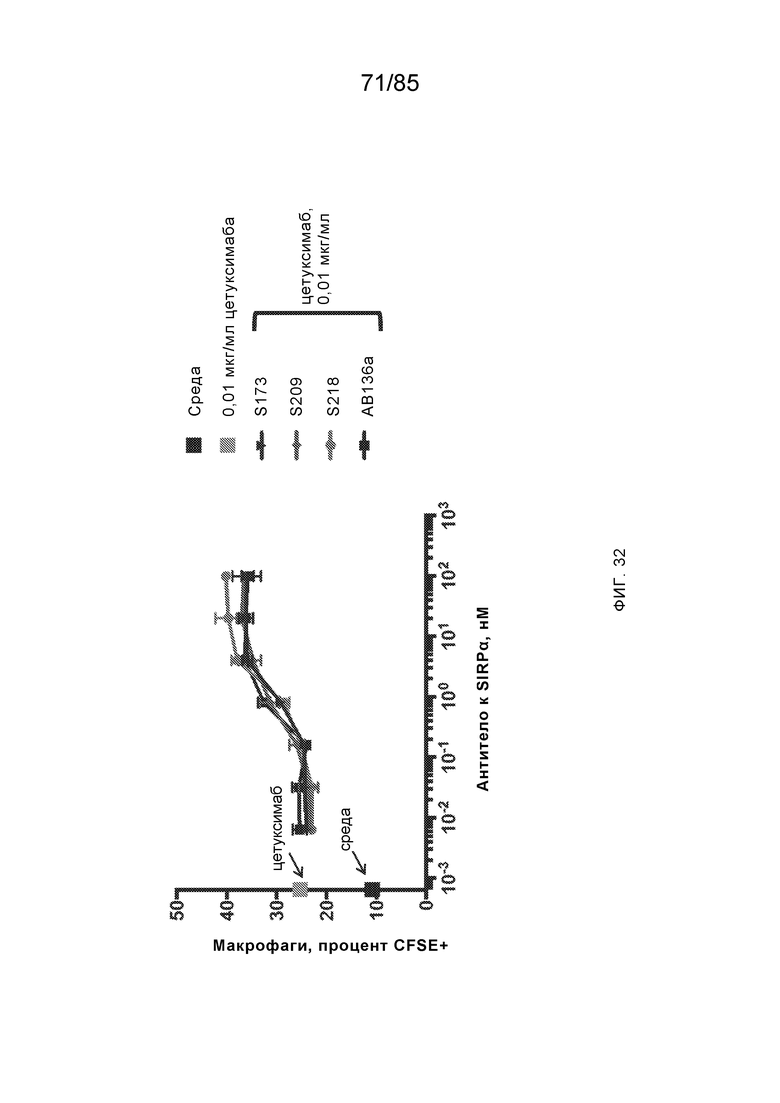
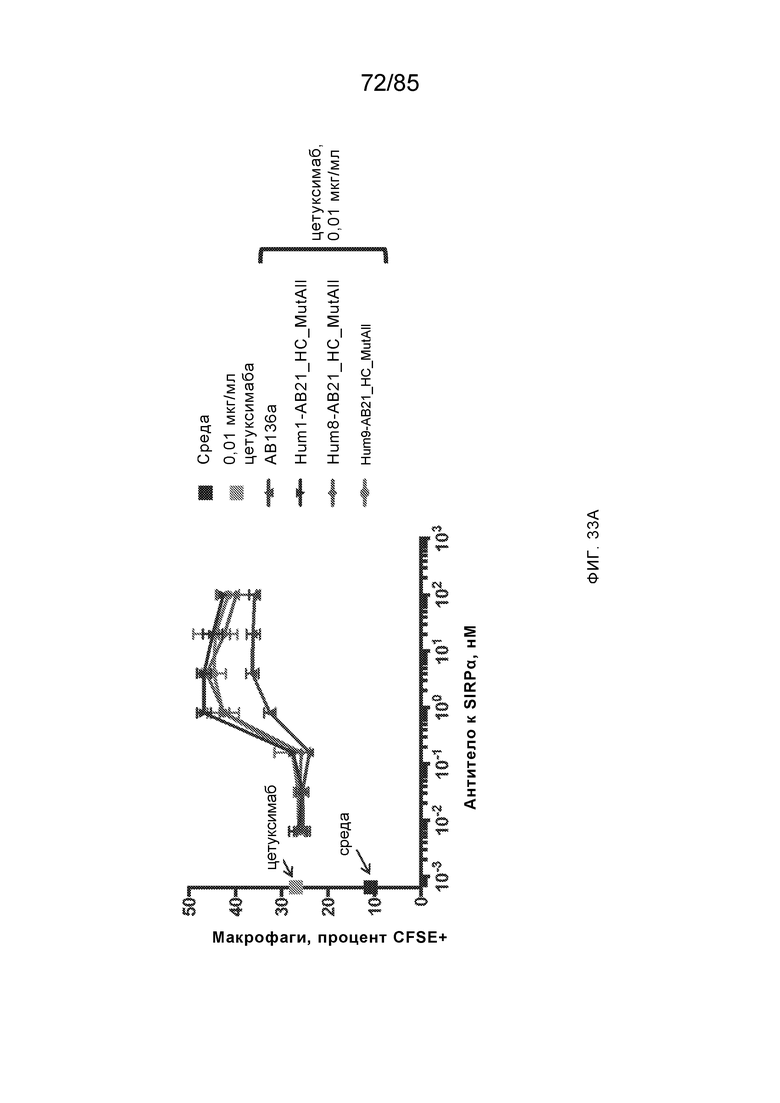
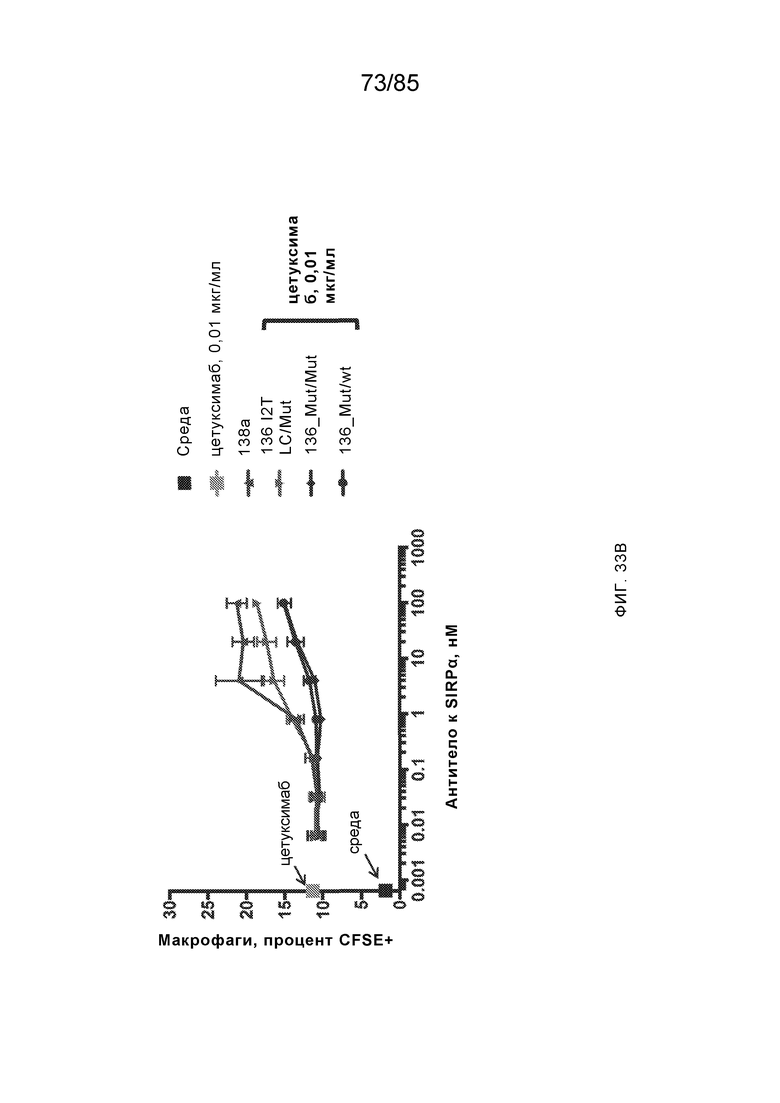

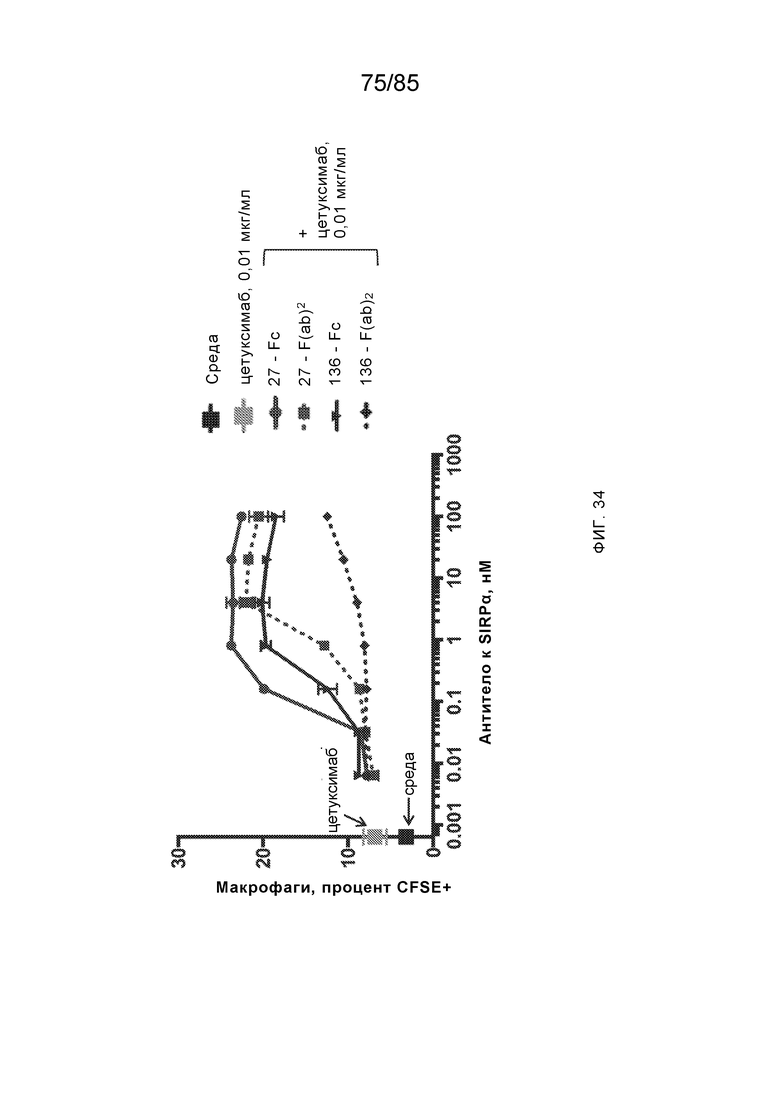

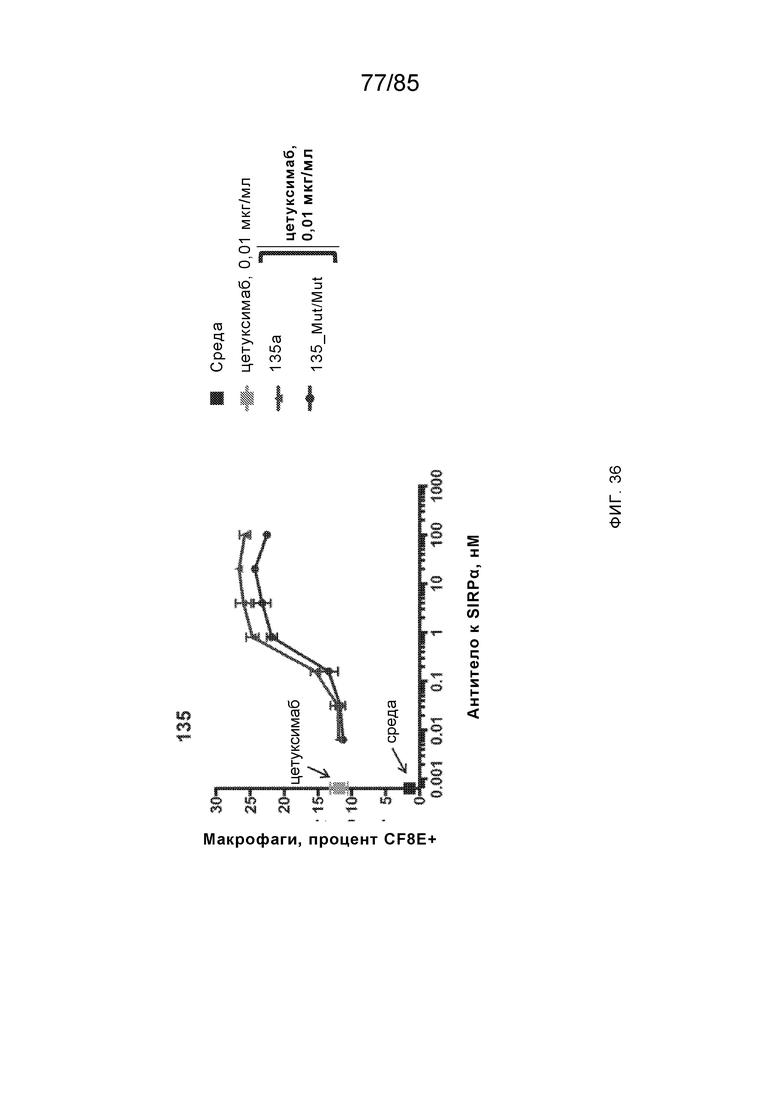
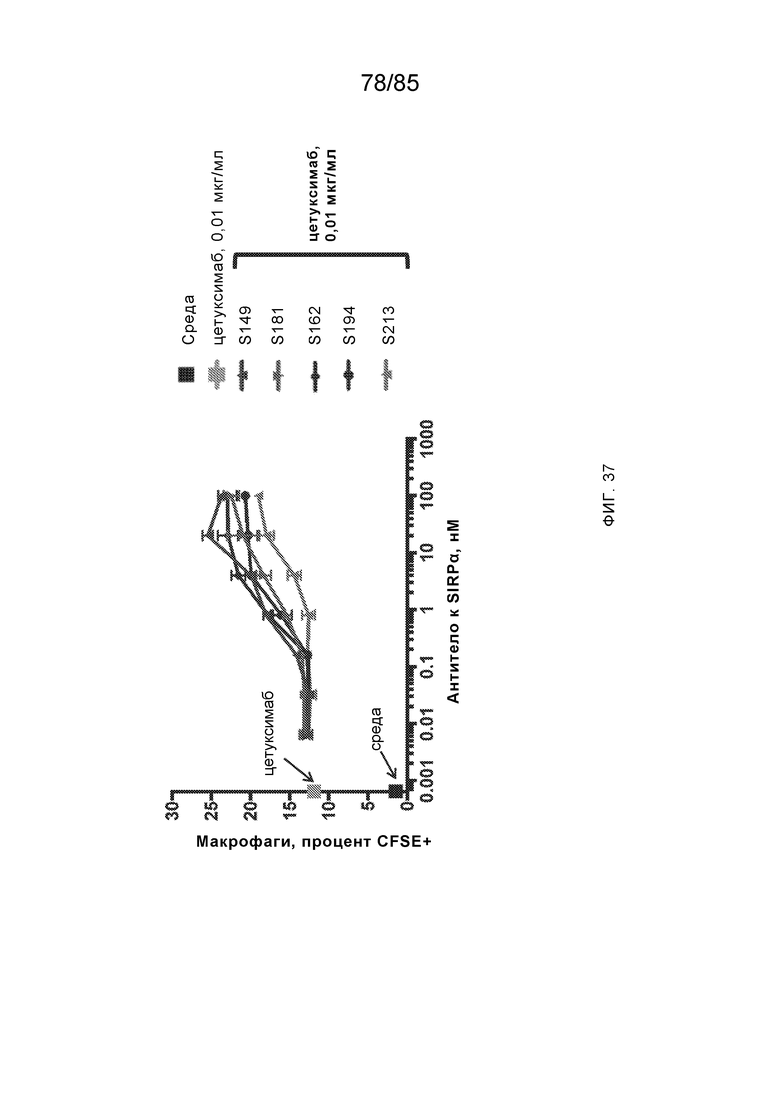
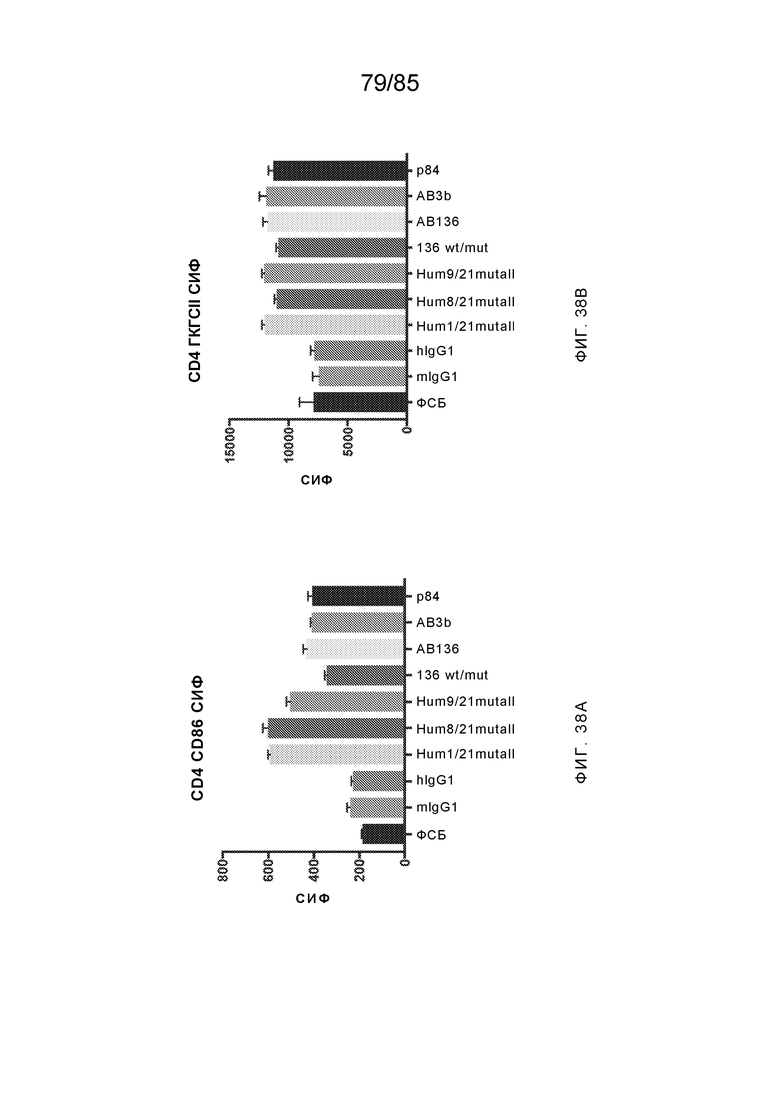
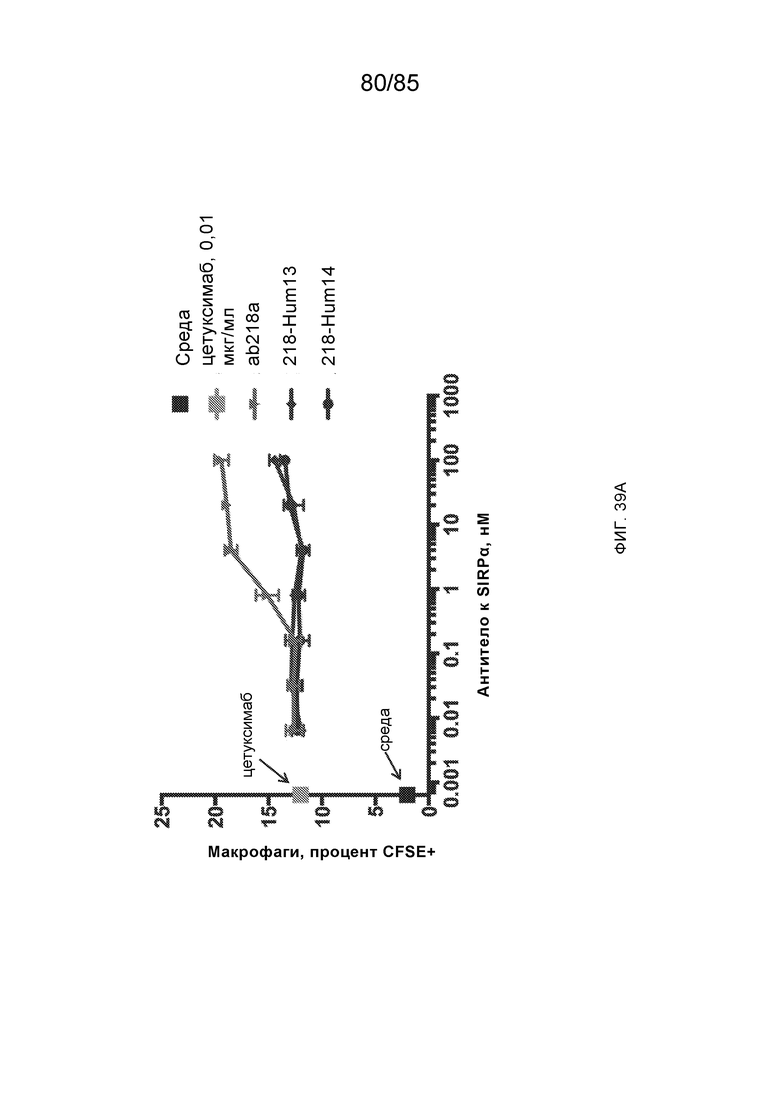
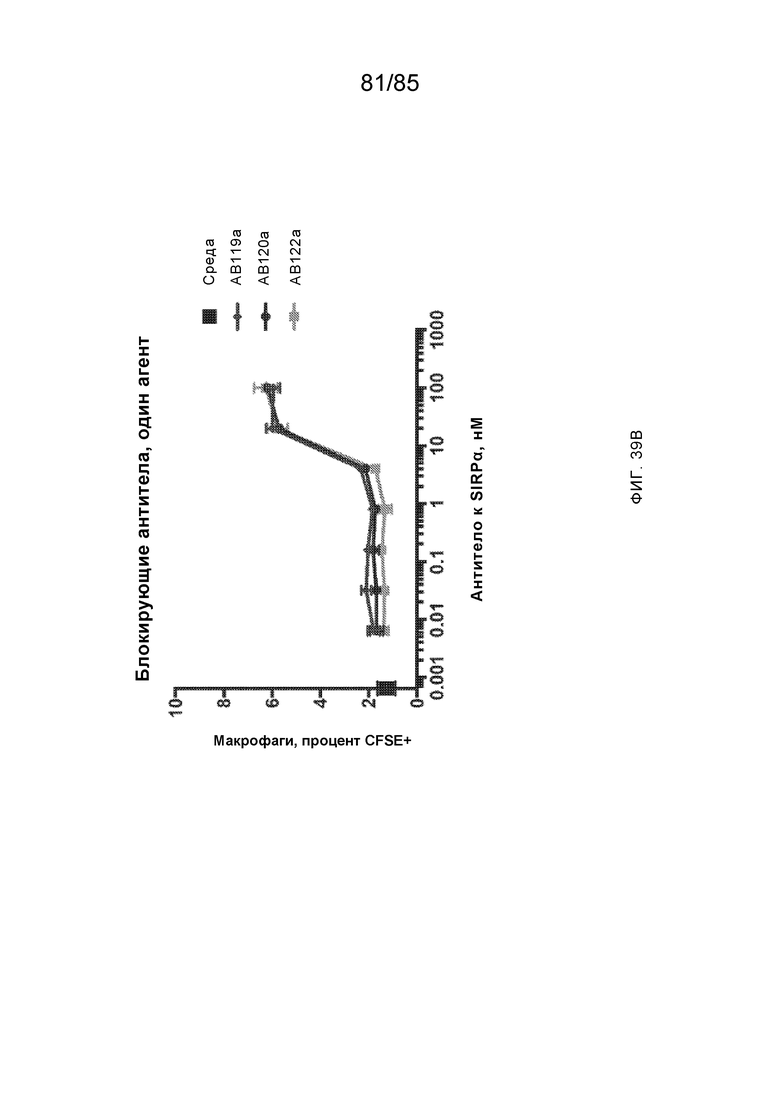
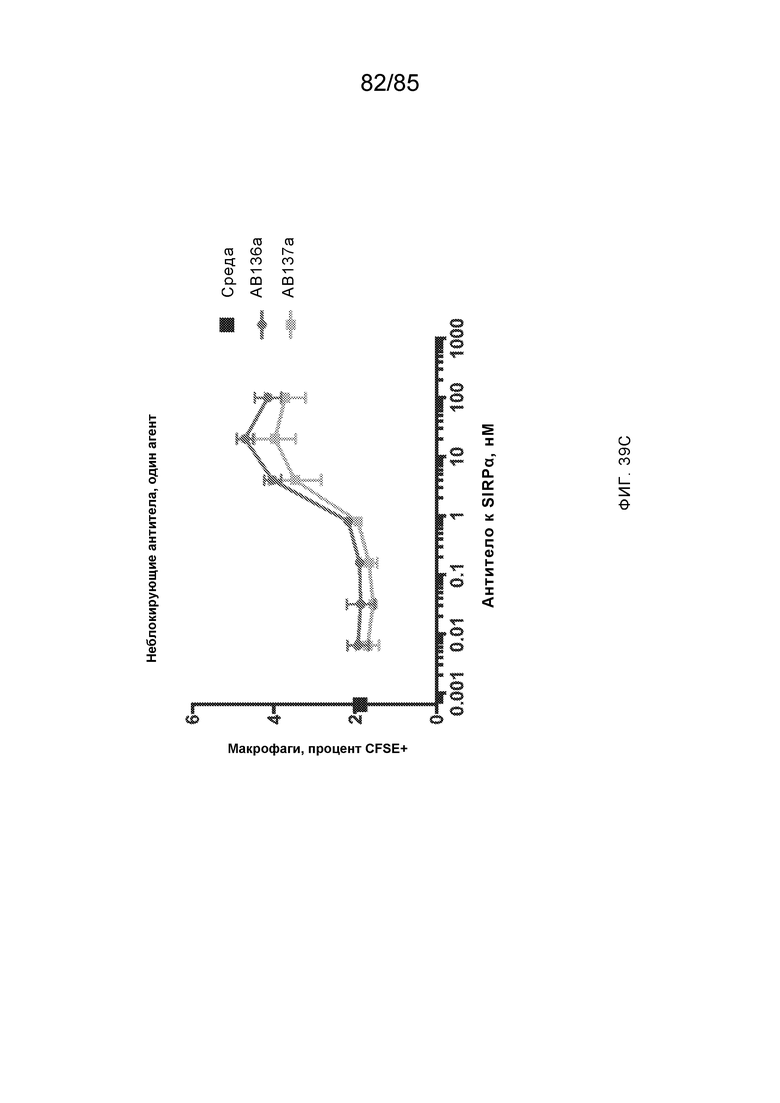
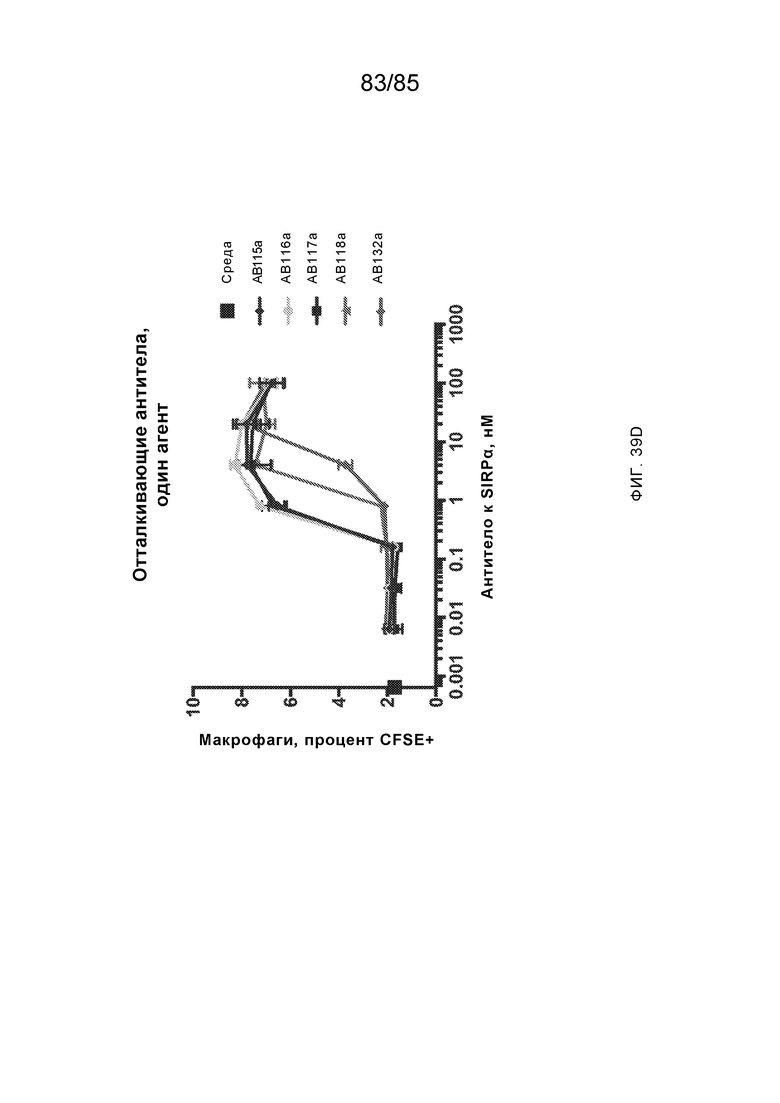
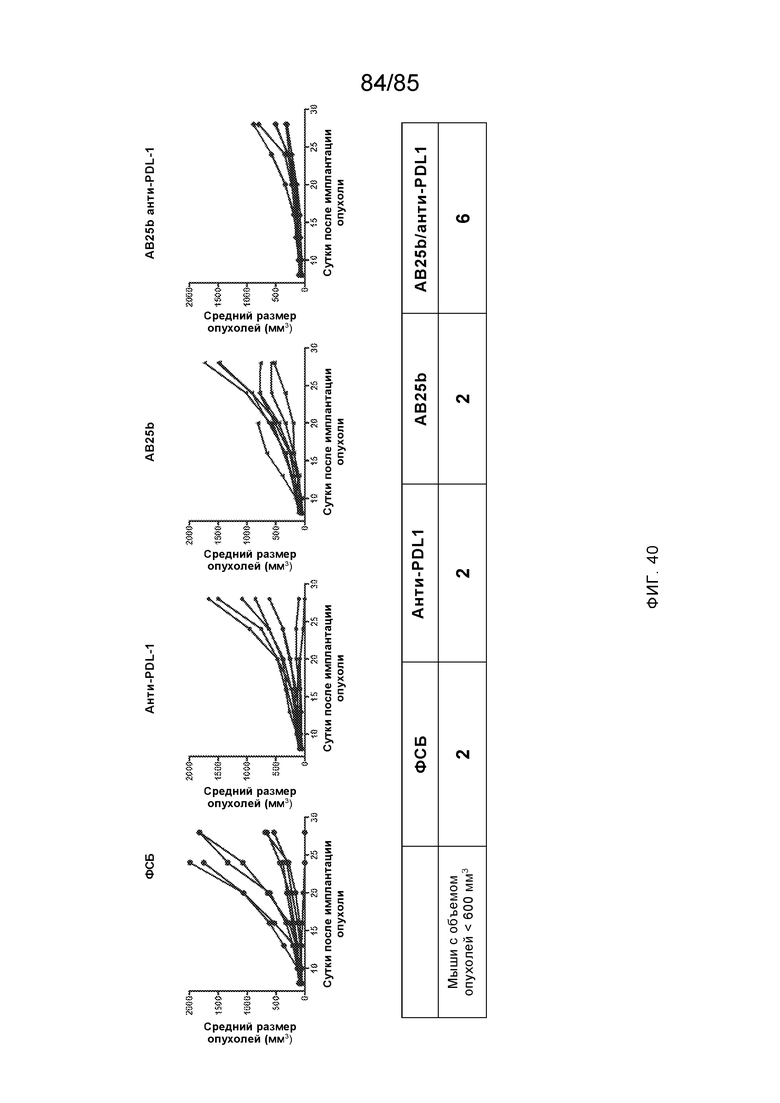
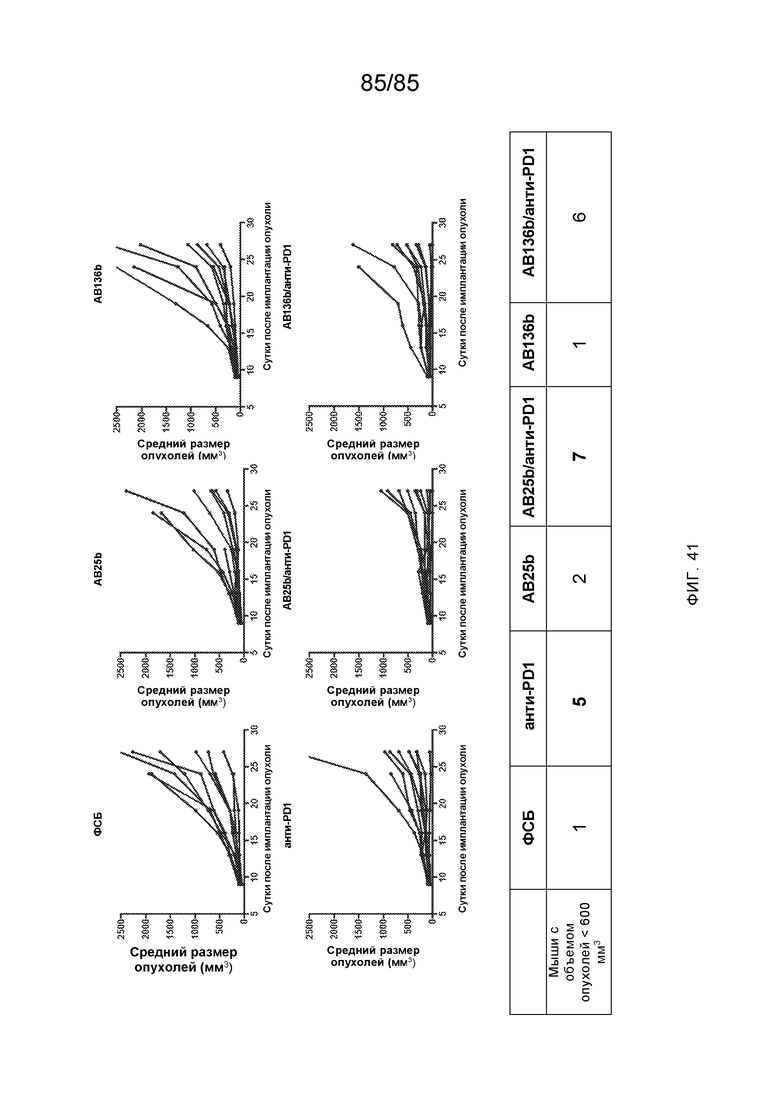
Изобретение относится к области биотехнологии. Предложено антитело, которое связывает внеклеточный домен человеческого полипептида SIRP–α человека. Антитело способно связываться с внеклеточными доменами v1 и v2 полипептида SIRP–α. Также предложены конъюгаты, полинуклеотид, вектор экспрессии и клетка–хозяин, относящиеся к указанному антителу. Кроме того, изобретение относится к способам лечения или замедления прогрессирования рака, аутоиммунного заболевания или воспалительного заболевания. Изобретение позволяет эффективно индуцировать фагоцитоз опухолевых клеток макрофагами, активировать дендритные клетки и ингибировать рост опухоли in vivo при обработке анти–SIRP–α антителами. 9 н. и 50 з.п. ф-лы, 86 ил., 31 табл., 9 пр.
1. Выделенное антитело, которое связывается с внеклеточным доменом полипептида SIRP–α человека,
где антитело способно связываться с внеклеточным доменом полипептида SIRP–α v1 человека и с внеклеточным доменом полипептида SIRP–α v2 человека, и
где антитело содержит:
(a) вариабельный домен тяжелой цепи (VH), содержащий:
(i) последовательность HVR–H1, содержащую аминокислотную последовательность SX1AX2S,
где X1 представляет собой N или Y; и
где X2 представляет собой M, L или V (SEQ ID NO:302);
(ii) последовательность HVR–H2, содержащую аминокислотную последовательность GISAGGSDTYYPASVKG (SEQ ID NO:195), GISSGSDTYYGDSVKG (SEQ ID NO:197) или GISSGGDTYYVDSVKG (SEQ ID NO:201); и
(iii) последовательность HVR–H3, содержащую аминокислотную последовательность ETWNHLFDY (SEQ ID NO:193); и
(b) вариабельный домен легкой цепи (VL), содержащий:
(i) последовательность HVR–L1, содержащую аминокислотную последовательность SGGX1YSSYYYA,
где X1 представляет собой S или A (SEQ ID NO:304);
(ii) последовательность HVR–L2, содержащую аминокислотную последовательность SDDKRPS (SEQ ID NO:336); и
(iii) последовательность HVR–L3, содержащую аминокислотную последовательность GGYDQSSYTNP (SEQ ID NO:172).
2. Антитело по п. 1, где антитело связывается с внеклеточным доменом полипептида SIRP–α v1 человека, содержащим аминокислотную последовательность EEELQVIQPDKSVLVAAGETATLRCTATSLIPVGPIQWFRGAGPGRELIYNQKEGHFPRVTTVSDLTKRNNMDFSIRIGNITPADAGTYYCVKFRKGSPDDVEFKSGAGTELSVRAKPS (SEQ ID NO:5), и
связывается с внеклеточным доменом полипептида SIRP–α v2 человека, содержащим аминокислотную последовательность EEELQVIQPDKSVSVAAGESAILHCTVTSLTPVGPIQWFRGAGPARELIYNQKEGHFPRVTTVSESTKRENMDFSISISNITPADAGTYYCVKFRKGSPDTEFKSGAGTELSVRAKPS (SEQ ID NO:6).
3. Антитело по любому из пп. 1, 2, где антитело связывается с внеклеточным доменом полипептида SIRP–α обезьяны.
4. Антитело по п. 3, где полипептид SIRP–α обезьяны представляет собой полипептид SIRP–α яванского макака.
5. Антитело по п. 4, где антитело связывается с внеклеточным доменом полипептида SIRP–α яванского макака, содержащим аминокислотную последовательность SEQ ID NO:11.
6. Антитело по любому из пп. 1-5, где антитело связывается с внеклеточным доменом полипептида SIRP–α мыши.
7. Антитело по п. 6, где антитело связывается с внеклеточным доменом полипептида SIRP–α мыши, содержащим аминокислотную последовательность SEQ ID NO:7.
8. Антитело по любому из пп. 1–7, где антитело связывается с внеклеточным доменом полипептида SIRP–β человека.
9. Антитело по любому из пп.1–8, где антитело связывается с внеклеточным доменом полипептида SIRP–γ человека.
10. Антитело по п. 8, где антитело связывается с внеклеточным доменом полипептида SIRP–β человека, содержащим аминокислотную последовательность SEQ ID NO:13.
11. Антитело по п. 9, где антитело связывается с внеклеточным доменом полипептида SIRP–γ человека, содержащим аминокислотную последовательность SEQ ID NO:15.
12. Антитело по любому из пп. 1–11, где антитело модулирует передачу сигналов SIRP–α в клетке, экспрессирующей полипептид SIRP–α человека.
13. Антитело по п. 12, где клетка представляет собой лейкоцит, выбранный из группы, состоящей из макрофага, дендритной клетки, нейтрофила, эозинофила и миелоидной супрессорной клетки (MDSC).
14. Антитело по п. 13, где антитело ингибирует передачу сигналов SIRP–α в макрофаге, экспрессирующем полипептид SIRP–α человека.
15. Антитело по любому из пп. 12–14, где антитело усиливает фагоцитоз макрофагом, экспрессирующим полипептид SIRP–α человека.
16. Антитело по любому из пп. 1–15, где антитело блокирует связывание внеклеточного домена полипептида SIRP–α человека и домена IgSF полипептида CD47 человека.
17. Антитело по п. 16, где антитело не связывает комплекс, содержащий вариант D1 SIRP–α, связанный с доменом IgSF CD47,
где вариант D1 SIRP–α представляет собой неприродный высокоаффинный домен D1 SIRP–α и
где вариант D1 SIRP–α связывается с CD47 человека с аффинностью, которая по меньшей мере в 10 раз больше, чем аффинность связывания домена D1 SIRP–α природного происхождения с CD47 человека.
18. Антитело по п. 1, где домен VH содержит
(i) последовательность HVR–H1, содержащую аминокислотную последовательность SNAMS (SEQ ID NO:194), SNAVS (SEQ ID NO:271) или SNALS (SEQ ID NO:318),
(ii) последовательность HVR–H2, содержащую аминокислотную последовательность GISAGGSDTYYPASVKG (SEQ ID NO:195), и
(iii) последовательность HVR–H3, содержащую аминокислотную последовательность ETWNHLFDY (SEQ ID NO:193).
19. Антитело по п. 18, где домен VH содержит аминокислотную последовательность, которая по меньшей мере на 90% идентична аминокислотной последовательности SEQ ID NO:135, 263, 264 или 330.
20. Антитело по п. 1, где домен VH содержит
(i) последовательность HVR–H1, содержащую аминокислотную последовательность SNAMS (SEQ ID NO:194), SNAVS (SEQ ID NO:271) или SNALS (SEQ ID NO:318),
(ii) последовательность HVR–H2, содержащую аминокислотную последовательность GISSGSDTYYGDSVKG (SEQ ID NO:197), и
(iii) последовательность HVR–H3, содержащую аминокислотную последовательность ETWNHLFDY (SEQ ID NO:193).
21. Антитело по п. 20, где домен VH содержит аминокислотную последовательность, которая по меньшей мере на 90% идентична аминокислотной последовательности SEQ ID NO:137, 265, 266 или 331.
22. Антитело по п. 1, где домен VH содержит
(i) последовательность HVR–H1, содержащую аминокислотную последовательность SYAMS (SEQ ID NO:200), SYAVS (SEQ ID NO:272) или SYALS (SEQ ID NO:319),
(ii) последовательность HVR–H2, содержащую аминокислотную последовательность GISSGGDTYYVDSVKG (SEQ ID NO:201), и
(iii) последовательность HVR–H3, содержащую аминокислотную последовательность ETWNHLFDY (SEQ ID NO:193).
23. Антитело по п. 22, где домен VH содержит аминокислотную последовательность, которая по меньшей мере на 90% идентична аминокислотной последовательности SEQ ID NO:139, 267, 268 или 332.
24. Антитело по любому из пп. 1 или 20-23, где домен VL содержит последовательность FW1—HVR-L1—FW2—HVR-L2—FW3—HVR-L3—FW4 (от N–конца к C–концу), где
FW1 содержит аминокислотную последовательность SYELTQPPSVSVSPGQTARITC (SEQ ID NO:314),
FW2 содержит аминокислотную последовательность WYQQKPGQAPVTLIY (SEQ ID NO:315),
FW3 содержит аминокислотную последовательность NIPERFSGSSSGTTVTLTISGVQAEDEADYYC (SEQ ID NO:316), и
FW4 содержит аминокислотную последовательность FGGGTKLTVL (SEQ ID NO:317).
25. Антитело по любому из пп. 1 или 20-24, где домен VL содержит
(i) последовательность HVR–L1, содержащую аминокислотную последовательность SGGSYSSYYYA (SEQ ID NO:170),
(ii) последовательность HVR–L2, содержащую аминокислотную последовательность SDDKRPS (SEQ ID NO:336), и
(iii) последовательность HVR–L3, содержащую аминокислотную последовательность GGYDQSSYTNP (SEQ ID NO:172).
26. Антитело по п. 25, где домен VL содержит аминокислотную последовательность, которая по меньшей мере на 90% идентична аминокислотной последовательности SEQ ID NO:252.
27. Антитело по любому из пп. 1 или 20-24, где домен VL содержит
(i) последовательность HVR–L1, содержащую аминокислотную последовательность SGGAYSSYYYA (SEQ ID NO:261),
(ii) последовательность HVR–L2, содержащую аминокислотную последовательность SDDKRPS (SEQ ID NO:336), и
(iii) последовательность HVR–L3, содержащую аминокислотную последовательность GGYDQSSYTNP (SEQ ID NO:172).
28. Антитело по п. 27, где домен VL содержит аминокислотную последовательность, которая по меньшей мере на 90% идентична аминокислотной последовательности SEQ ID NO:262.
29. Антитело по п. 1, где
(a) домен VH содержит аминокислотную последовательность SEQ ID NO:263, и
домен VL содержит аминокислотную последовательность SEQ ID NO:252;
(b) домен VH содержит аминокислотную последовательность SEQ ID NO:264, и
домен VL содержит аминокислотную последовательность SEQ ID NO:252;
(c) домен VH содержит аминокислотную последовательность SEQ ID NO:330, и
домен VL содержит аминокислотную последовательность SEQ ID NO:252;
(d) домен VH содержит аминокислотную последовательность SEQ ID NO:135, и
домен VL содержит аминокислотную последовательность SEQ ID NO:252;
(e) домен VH содержит аминокислотную последовательность SEQ ID NO:137, и
домен VL содержит аминокислотную последовательность SEQ ID NO:252;
(f) домен VH содержит аминокислотную последовательность SEQ ID NO:139, и
домен VL содержит аминокислотную последовательность SEQ ID NO:252;
(g) домен VH содержит аминокислотную последовательность SEQ ID NO:265, и
домен VL содержит аминокислотную последовательность SEQ ID NO:252;
(h) домен VH содержит аминокислотную последовательность SEQ ID NO:266, и
домен VL содержит аминокислотную последовательность SEQ ID NO:252;
(i) домен VH содержит аминокислотную последовательность SEQ ID NO:331, и
домен VL содержит аминокислотную последовательность SEQ ID NO:252;
(j) домен VH содержит аминокислотную последовательность SEQ ID NO:267, и
домен VL содержит аминокислотную последовательность SEQ ID NO:252;
(k) домен VH содержит аминокислотную последовательность SEQ ID NO:268, и
домен VL содержит аминокислотную последовательность SEQ ID NO:252;
(l) домен VH содержит аминокислотную последовательность SEQ ID NO:332, и
домен VL содержит аминокислотную последовательность SEQ ID NO:252;
(j) домен VH содержит аминокислотную последовательность SEQ ID NO:263, и
домен VL содержит аминокислотную последовательность SEQ ID NO:262;
(m) домен VH содержит аминокислотную последовательность SEQ ID NO:264, и
домен VL содержит аминокислотную последовательность SEQ ID NO:262;
(n) домен VH содержит аминокислотную последовательность SEQ ID NO:330, и
домен VL содержит аминокислотную последовательность SEQ ID NO:262;
(o) домен VH содержит аминокислотную последовательность SEQ ID NO:265, и
домен VL содержит аминокислотную последовательность SEQ ID NO:262;
(p) домен VH содержит аминокислотную последовательность SEQ ID NO:266, и
домен VL содержит аминокислотную последовательность SEQ ID NO:262;
(q) домен VH содержит аминокислотную последовательность SEQ ID NO:331, и
домен VL содержит аминокислотную последовательность SEQ ID NO:262;
(r) домен VH содержит аминокислотную последовательность SEQ ID NO:267, и
домен VL содержит аминокислотную последовательность SEQ ID NO:262;
(s) домен VH содержит аминокислотную последовательность SEQ ID NO:268, и
домен VL содержит аминокислотную последовательность SEQ ID NO:262;
(t) домен VH содержит аминокислотную последовательность SEQ ID NO:332, и
домен VL содержит аминокислотную последовательность SEQ ID NO:262;
(u) домен VH содержит аминокислотную последовательность SEQ ID NO:135, и
домен VL содержит аминокислотную последовательность SEQ ID NO:262;
(v) домен VH содержит аминокислотную последовательность SEQ ID NO:137, и
домен VL содержит аминокислотную последовательность SEQ ID NO:262; или
(w) домен VH содержит аминокислотную последовательность SEQ ID NO:139, и
домен VL содержит аминокислотную последовательность SEQ ID NO:262.
30. Антитело по любому из пп. 1–29, где антитело представляет собой моноклональное антитело.
31. Антитело по любому из пп. 1–29, где антитело представляет собой scFv–Fc антитело.
32. Антитело по любому из пп. 1–29, где антитело содержит константную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:325, 326 или 426.
33. Антитело по любому из пп. 1–29 и 31, где антитело содержит Fc–область.
34. Антитело по п. 33, где антитело содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:320–324.
35. Антитело по п. 33, где Fc–область представляет собой Fc–область человека, выбранную из группы, состоящей из Fc–области IgG1, Fc–области IgG2 и Fc–области IgG4.
36. Антитело по п. 33, где Fc–область содержит Fc–область IgG1 человека, содержащую одну или более мутаций, выбранных из группы, состоящей из L234A, L235A, G237A и N297A в соответствии с нумерацией EU.
37. Антитело по п. 33, где Fc–область содержит Fc–область IgG2 человека, содержащую одну или более мутаций, выбранных из группы, состоящей из A330S, P331S и N297A в соответствии с нумерацией EU.
38. Антитело по п. 33, где Fc–область содержит Fc–область IgG4 человека, содержащую одну или более мутаций, выбранных из группы, состоящей из S228P, E233P, F234V, L235A, L235E, delG236 и N297A в соответствии с нумерацией EU.
39. Антитело по п. 1, где антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из фрагментов Fab, F(ab’)2, Fab’–SH, Fv и scFv.
40. Конъюгат для детекции, содержащий антитело по любому из пп. 1-39, конъюгированное с меткой.
41. Конъюгат для ингибирования клеточной пролиферации или для индукции клеточной смерти, содержащий антитело по любому из пп. 1-39, конъюгированное с цитотоксическим средством.
42. Антитело по любому из пп. 1–39, где антитело является гуманизированным антителом.
43. Антитело по любому из пп. 1–39 и 42, где антитело продуцируется или производится в организме курицы.
44. Полинуклеотид, кодирующий антитело по любому из пп. 1–39, 42 и 43.
45. Вектор экспрессии, содержащий полинуклеотид по п. 44.
46. Клетка–хозяин для получения анти-SIRP-α антитела, где клетка-хозяин содержит полинуклеотид по п. 44 или вектор экспрессии по п. 45.
47. Способ получения анти-SIRP-α антитела, где способ включает культивирование клетки–хозяина по п. 46 так, что продуцируется антитело.
48. Способ по п. 47, дополнительно включающий восстановление антитела из клетки–хозяина.
49. Способ лечения или замедления прогрессирования рака у индивида, где способ включает введение индивиду эффективного количества антитела по любому из пп. 1–39, 42 и 43.
50. Способ по п. 49, дополнительно включающий введение индивиду эффективного количества второго антитела, которое связывается с антигеном, экспрессируемым раком.
51. Способ по п. 50, где антиген, экспрессируемый раком, выбран из группы, состоящей из CD19, CD20, CD22, CD30, CD33, CD38, CD52,CD56, CD70, CD74, CD79b, CD123, CD138, CS1/SLAMF7, Trop–2, 5T4, EphA4, BCMA, муцина 1, муцина 16, PTK7, STEAP1, рецептора эндотелина B, мезотелина, EGFRvIII, ENPP3, SLC44A4, GNMB, нектина 4, NaPi2b, LIV–1A, гуанилила циклазы C, DLL3, EGFR, HER2, VEGF, VEGFR, интегрина αVβ3, интегрина α5β1, MET, IGF1R, TRAILR1, TRAILR2, RANKL, FAP, тенасцина, Ley, EpCAM, CEA, gpA33, PSMA, TAG72, муцина, CAIX, EPHA3, фолатного рецептора α, GD2, GD3 и ГКГС/пептидного комплекса, содержащего пептид из NY–ESO–1/LAGE, SSX–2, белка семейства MAGE, MAGE–A3, gp100/pmel17, Melan–A/MART–1, gp75/TRP1, тирозиназы, TRP2, CEA, PSA, TAG–72, незрелого рецептора ламинина, MOK/RAGE–1, WT–1, SAP–1, BING–4, EpCAM, MUC1, PRAME, сурвивина, BRCA1, BRCA2, CDK4, CML66, MART–2, p53, Ras, β–катенина, TGF–βRII, HPV E6 или HPV E7.
52. Способ по п. 49, дополнительно включающий введение индивиду эффективного количества иммунотерапевтического средства.
53. Способ по п. 52, где иммунотерапевтическое средство содержит второе антитело.
54. Способ по п. 53, где второе антитело связывается с антигеном, выбранным из группы, состоящей из PD–1, PD–L1, OX40, CTLA–4, CD137/4–1BB, TNFR2, B7–H3, FZD7, CD27, CCR4, CSF1R, CSF, TIM–3, LAG–3, VISTA, ICOS, CCR2, IDO, A2R, CD39, CD73, TIGIT, CD80, CD47, аргиназы, TDO и PVRIG.
55. Способ по п. 53, где первое антитело связываетcя с внеклеточным доменом полипептида SIRP–α v1 человека, внеклеточным доменом полипептида SIRP–α v2 человека или с обоими доменами, с внеклеточными доменами обоих полипептидов, полипептида SIRP–α v1 человека и полипептида SIRP–α v2 человека, с константой диссоциации (KD), равной менее 100 нМ,
где первое антитело блокирует связывание между внеклеточным доменом полипептида SIRP–α человека и доменом IgSF полипептида CD47 человека, и
где второе антитело связывается с PD–1.
56. Способ по п. 53, где первое антитело связывается с внеклеточным доменом полипептида SIRP–α v1 человека с константой диссоциации (KD), равной менее 100 нм,
где первое антитело блокирует связывание между внеклеточным доменом полипептида SIRP–α человека и доменом IgSF полипептида CD47 человека, и
где второе антитело связывается с PD–L1.
57. Способ по п. 53, где первое антитело связывается с доменом D1 полипептида SIRP-α человека,
где первое антитело не блокирует связывание между внеклеточным доменом полипептида SIRP-α человека и доменом IgSF полипептида CD47 человека, и
где второе антитело связывается с PD-L1.
58. Способ лечения или замедления прогрессирования аутоиммунного заболевания или воспалительного заболевания у индивида, где способ включает введение индивиду эффективного количества антитела по любому из пп. 1–39, 42 и 43.
59. Способ по п. 58, где аутоиммунное заболевание или воспалительное заболевание выбрано из группы, состоящей из рассеянного склероза, ревматоидного артрита, спондилоартропатии, системной красной волчанки, антителоопосредованного воспалительного или аутоиммунного заболевания, болезни «трансплантат против хозяина», сепсиса, диабета, псориаза, псориатического артрита, атеросклероза, синдрома Шегрена, прогрессирующего системного склероза, склеродермы, острого коронарного синдрома, ишемической реперфузии, болезни Крона, язвенного колита, эндометриоза, гломерулонефрита, нефропатии IgA–типа, поликистозной болезни почек, миастении гравис, идиопатического легочного фиброза, астмы, атопического дерматита, острого респираторного дистресс–синдрома (ARDS), васкулита и воспалительного аутоиммунного миозита.
| SEIFFERT M | |||
| et al., Human Signal-Regulatory Protein Is Expressed on Normal, But Not on Subsets of Leukemic Myeloid Cells and Mediates Cellular Adhesion Involving Its Counterreceptor CD 47, Blood, 1999, vol | |||
| Экономайзер | 0 |
|
SU94A1 |
| Походная разборная печь для варки пищи и печения хлеба | 1920 |
|
SU11A1 |
| LEE W.Y | |||
| et al., Novel Structural Determinants on SIRPα that Mediate Binding to CD47, THE JOURNAL OF IMMUNOLOGY, | |||
Авторы
Даты
2022-05-16—Публикация
2017-09-20—Подача