Изобретение относится к области биотехнологии и может быть использовано в сельском хозяйстве и растениеводстве для биологического контроля, при переработке и обеззараживания от патогенных микроорганизмов органических отходов.
Грибы рода Trichoderma используют в биоконтроле корневых гнилей, вызываемых фитопатогенами родов Fusarium, Alternaria, Bipolaris. Среди них есть так же штаммы, способные непосредственно влиять на рост и развитие растений. Такой эффект от штаммов рода Trichoderma на растения обусловлен быстрой колонизацией ими ризосферы растений, подавлением патогенов и сапротрофных микроорганизмов-конкурентов, улучшением всхожести семян, стимуляцией роста корневой системы и повышением иммунитета растения. Их используют в качестве источника трансгенов и гербицидов, так как ведущий механизм их воздействия на растения связан с продукцией определенных вторичных метаболитов [Zeilinger et al. 2016; Patle et al. 2018]. Представители рода Trichoderma синтезируют ряд стимуляторов роста растений - индолилуксусную кислоту, этилен, салициловую кислоту, соединения с антибиотическим и фитотоксичным действием [Zeilinger et al., 2016; Wu et al., 2018].
Известны штаммы видов Trichoderma asperellum и Т. koningii, которые синтезируют биологически активные вторичные метаболиты, ингибирующие патогенные дрожжевые грибы и бактерии (Reino et al. 2018).
Известен штамм Trichoderma erinaceum, выделенный из древесной коры в Индии, агент биоконтроля и биоудобрения при выращивании риса, ингибирующий фитопатогенные грибы Rhizoctonia solani, Sclerotium rolfsii, R. solani и Helmintosporium oryzae в полевых условиях [Swain et al., 2018).
Известен штамм GDFS1009 Trichoderma asperellum, который обладает противогрибковой активностью в отношении фитопатогенов Fusarium oxysporum f.sp.cucumerinum и Fusarium graminearum - возбудителей увядания огурца и стеблевой гнили кукурузы [Wu et al., 2017].
Наиболее близким к предлагаемому изобретению по спектру биологической активности, который следует принять за ближайший аналог, является штамм Trichoderma asperellum МГ-97 (ВКПМ F- 765) который используют для ускорения переработки органических отходовдождевыми червями, обладающий противогрибными к фитопатогенам и ростстимулирующими растений свойствами [Патент РФ №2467989, приоритет от 27.11.2012].
Недостатками штамма Trichoderma asperellum МГ-97 (ВКПМ F- 765) является невысокая ростстимулирующая активность и степень подавления грибного поражения растений, слабое влияние на развитие дождевых червей. Для Trichoderma asperellum ВКПМ F- 765 неизвестно с каким соединением (или соединениями) связано его антибиотическое и стимулирующее действие на организмы, что осложняет его применение.
Задачей настоящего изобретения является выделение штамма микроскопического гриба Trichoderma viride, который продуцирует стимулирующие рост растений вещество - соясапонин, с высокой активностью к фитопатогенными и условно-патогенным грибам, улучшающий развитие дождевых червей Eisenia fetida.
Сапонины, производные циклопентанпергидрофенантрена, тритерпеновые соединения, а некоторые авторы выделяют также стероидные алкалоиды, синтезируемые различными организмами, которые обладают разнообразным действием на живые организмы, в частности, могут в определенных концентрациях ускорять прорастание семян, рост и развитие растений, проявлять антимикробную активность [Paul et al., 2007; Wu et al., 2012, 2013; Бутова, Сальникова, 2015].
Техническим результатом изобретения является новый синтезирующий соясопанин I штамм Trichoderma viride 346 (ВКПМ F-1525) с высокой ростстимулирующей и антибиотической активностью, в том числе к микроскопическим мицелиальным и дрожжевым грибам - условно-патогенным и фитопатогенным видам, повышает всхожесть семян и интенсивность роста растений, размножение и накопление биомассы дождевыми червями Eisenia fetida.
Сущность изобретения состоит в том, что новый штамм Trichoderma viride 346 (ВКПМ F-1525) выращивают на среде Сабуро и среде с добавлением 3% неохмеленного сусла с рН 7,2 в стационарных условиях в колбах Эйленмейера на 500 мл в течение 14 суток при 25°С. Антибиотические вещества из отфильтрованной культуральной жидкости (КЖ) экстрагируют этилацетатом (в соотношении этилацетат/КЖ 5:1). Антибиотическую активность экстрактов культуральной жидкости определяли с помощью дисково-диффузионного метода. На стерильные бумажные диски («НИИ Пастера», Россия) наносят 10 мкл экстракта с концентрацией 100 мг/мл и высушивают в стерильных условиях.
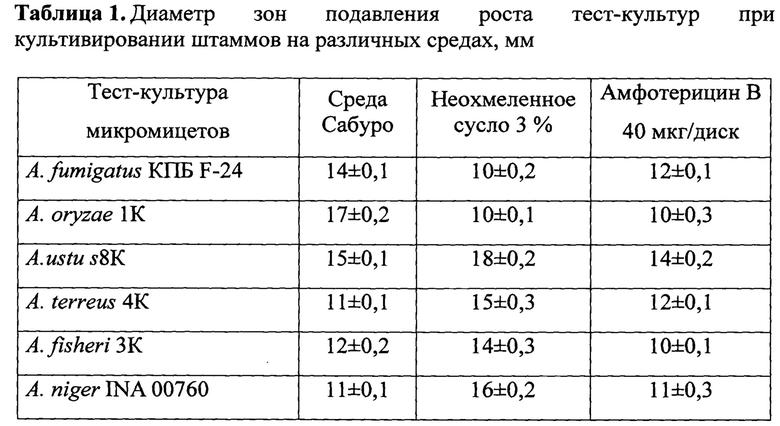
Для оценки активности берут коллекционные тест-культуры мицелиальных и дрожжевых микроскопических грибов - условно-патогенных штаммов, включая токсигенных микромицетов Aspergillus niger INA 00760, Candida albicans ATCC 2091, - A. oryzae 1K, A. niger, A.fumigatus 4K, A.terreus 4K, A. fisheri 3K, A. Flavus 7K, A.ustus 8K и фитопатогеного штамма F. oxysporum VKM F-140. Контролем служат стандартные диски с амфотерицином В («НИИ Пастера», 40 мкг/мл).
Экстракты ингибируют рост всех тест-культур мицелиальных грибов, но особенно эффективны против фитопатогена F. oxysporum VKM F-140, распространенных условно-патогенных (оппортунистических) штаммов A.fumigatus 4К, A.niger INA 00760, С.albicans АТСС 2091. Их активность против этих тест-штаммов превышает таковую у амфотерицина В.
Для фракционирования первичного экстракта используют флеш-хроматографию. Очистка активных фракций происходит с помощью метода обращенно-фазовой высокоэффективной жидкостной хроматографии. Молекулярную массу активного соединения в выделенной фракции устанавливают с помощью LC-MS/MS. Идентичность активного соединения соясапонину I устанавливают путем сравнения спектра фрагментации выделенного соединения описанным в литературных источниках данным для соясапонина I.
Внесением водной суспензии спор и фрагментов мицелия Т.viride F-1525 (2 × 106 КОЕ/кг) в вермикультуру Eisenia fetida на навозе с соломой повышают ее продуктивность. Получают большее (на 40%) количество особей червей после завершения вермикомпостирования, биомассу взрослых червей - на 30%, а коконов на 45%. При применение этой суспензии при выращивании огурцов возрастает всхожесть семян (к 5 суткам она не менее 87%, а длина растений возрастает на 28%, и значительно снижается или полностью устраняется гибель растений от корневой инфекции.
Штамм Trichoderma viride 346 выделен из почвы (южный чернозем, Краснодарский край), из него получен клон 2 группы по вегетативной совместимости, который обладает высокой скоростью роста и интенсивностью спороношения.
Культурально-морфологические особенности штамма. Колонии быстро растущие, достигает 32-38 мм в диаметре на 6 сутки на среде Сабуро, край колонии стерильный, мицелий светло-белого цвета, ровный, конидиальное спороношение от лимонно-желто-зеленого цвета до темно-зеленого, но чаще всего изумрудного цвета в виде компактных или рыхлых пучков. Эксудат отсутствует. Обратная сторона колонии не окрашена или зеленоватого оттенка. Хороший рост на сусло - агаре и среде Чапека. Гифы тонкостенные, неокрашенные, 0,5-2,0 мкм толщиной, часто объединены в тяжи, конидиальное спороношение обильное. Конидиеносцы в основном простые, часто сильно разветвлены, заканчиваются одним или несколькими фиалидами, конидиеносцы длиной 20-30 мкм, конидии чаще всего гладкие эллипсоидные, 3-5 × 2-4 мкм, шаровидные конидии встречаются редко, хламидоспоры, склероции отсутствуют.
Физиолого-биохимические признаки.
Штаммрастетнаглюкозо-пептонном агаре, глюкозо-аммонийном агаре, сусло-агаре, среде Сабуро, Чапека. Оптимальные температура роста 25-26°С. Штамм хорошо и умеренно усваивает следующие легкодоступные углеводы - фруктозу, глюкозу, сахарозу, гликоген, маннозу, трегалозу, ксилозу, а также маннит, уксуснусную, глюконовую, фумаровую, кетоглютаровую кислоты, аденозин и другие органические (пептон) и минеральные источники азота. Штамм продуцирует активные вещества - соясапонины, обладающие антимикробной активностью.
Штамм хранят под слоем вазелинового на среде Чапека (сахароза - 30 г, NaNO3 - 3 г, KH2PO4 - 1 г, MgSO4 7H2O - 0.5 г, KCl - 0.5 г, FeSO4 7H2O - 0.01 г, агар-агар - 15 г) и в пробирках на скошенной среде Чапека при 4°С спересевом через 0,5-1 год. Для длительного хранения используют стандартные методы лиофилизации и криоконсервации.
Штамм 346 идентифицирован как Trichoderma viride на основе секвенирования ITS участков (1-2) и 5.8S rDNA и культурально-морфологических признаков.
Нуклеотидная последовательность ITS (1-2, включая 5.8S) rDNA штамма 346 зарегистрирована в Генбанке под номером КС987155.1.
Степень сходства нового штамма Trichoderma viride PERS. ВКПМ F-1525 с коллекционными штаммами вида Trichoderma viride составляет 98,0%, что указывает наряду с культурально-морфологическими свойствами его принадлежность к Trichoderma viride. Штамм не является генетически модифицированным. Штамм является непатогенным и нетоксичным микроорганизмом.
Штамм Trichoderma viride 346 депонирован во Всероссийской Коллекции Промышленных Микроорганизмов под номером F-1525.
Штамм Trichoderma viride PERS. ВКПМ F-1525 относится к митоспоровым грибам - анаморфам аскомицетного аффинитета: рода Hypocrea, семейства Hypocreaceae, порядка Hypocreales, класса Sordariomycetes, отдела Ascomycota (www.indexmngorum.org).
Изобретение решает задачу расширения ассортимента биопрепаратов с противогрибковой и ростстимулирующей активностью и биологических средств для ускорения роста и размножения дождевых червей при компостировании органических отходов.
Приведенные ниже примеры иллюстрируют изобретение.
Пример 1. Определение фунгицидной активности штамма Trichoderma viride PERS. ВКПМ F-1525 в отношении штаммов условно-патогенных и фитопатогенных мицелиальных и дрожжевых грибов
В качестве посевного материала используют 5-ти суточную культуру гриба, полученную на сусло-агаре. Штамм выращивают на среде Сабуро и среде с добавлением 3% неохмеленного сусла с рН 7,2 в стационарных условиях в колбах на Эйленмейера на 500 мл в течение 14 суток при 25°С. Биомассу мицелия и спор отделяют центрифугированием на центрифуге. Антибиотические вещества из отфильтрованной культуральной жидкости (КЖ) экстрагируют этилацетатом (в соотношении этилацетат/КЖ 5:1). Активные соединения секретируются штаммом в культуральную жидкость.
Полученные экстракты упаривают в вакууме на роторном испарителе  (Швейцария) досуха при 42°С, сухой остаток - препарат хранят при 4°С. Для определения антибиотической активности используют диско-диффузионный метод [Егоров, 2006]. На стерильные бумажные диски («НИИ Пастера», Россия) наносят 10 мкл экстракта с концентрацией 100 мг/мл и высушивают в стерильных условиях.
(Швейцария) досуха при 42°С, сухой остаток - препарат хранят при 4°С. Для определения антибиотической активности используют диско-диффузионный метод [Егоров, 2006]. На стерильные бумажные диски («НИИ Пастера», Россия) наносят 10 мкл экстракта с концентрацией 100 мг/мл и высушивают в стерильных условиях.
Для оценки активности берут коллекционныетест-культуры мицелиальных и дрожжевых микроскопических грибов патогенныхштаммов Aspergillus niger INA 00760, Candida albicans ATCC 2091, условно-патогенных и токсигенных микромицетов - A. oryzae 1К, А. Niger INA 00760, A.fumigatus 4К, A.terreus 4К, A. fisheri 3К, A. Flavus 7К, A.ustus 8К и фитопатогеного штамма F. oxysporum VKM F-140. Контролем служат стандартные диски с амфотерицином В («НИИ Пастера», 40 мкг/мл). Величину диаметра зоны подавления роста тест-культур оценивают на 5-7 сутки. Чашки Петри с дрожжами инкубируют при 37°С на среде Сабуро, с патогенными и условно-патогенными микроскопическими грибами при 28°С на среде Чапека.
Экстракты культуральной жидкости штамма F-1525 Т. viride обладают широким спектром фунгицидной активности в отношении условно-патогенных грибов. Экстракты ингибируют рост всех тест-культур мицелиальных грибов, но особенно эффективны против возбудителя корневой гнили F. oxysporum VKM F-140, условно-патогенных (оппортунистических) штаммов A.fumigatus 4К, A.niger INA 00760, С.albicans ATCC 2091. Антибиотическая активность экстрактов из культуральной жидкости штамма в отношении других тест-объектов подавляющем большинстве случаев превышает активность амфотерицина В (таблица 1).

Пример 2. Выделение, разделение фракций и идентификация индивидуальных антибиотических соединений (соясапонинов) штамма Т. viride F-1525
Штамм Т. virideF-1525 секретирует антимикробные вещества - соесапонин в культуральную жидкость. Для выделения антибиотических веществ культуральную жидкость (КЖ) продуцента экстрагируют этилацетатом в соотношении этилацетат/КЖ 5:1. Полученные экстракты упаривают в вакууме на роторном испарителе "Rotavapor-RBuchi" (Швейцария) досуха при 42°С. Сухой остаток растворяют в водном 50%-ном этаноле и получают спиртовые концентраты.
Фракционирование антибиотического комплекса экстракта проводили с помощью флэш-хроматографии на силикагеле (40-63 μm, размер колонки 40 × 60 мм). Экстракт элюировали ступенчатым градиентом хлористый метилен/метанол (v/v 50:1, 20:1, 10:1, 5:1, 3:1, по 100 мл).
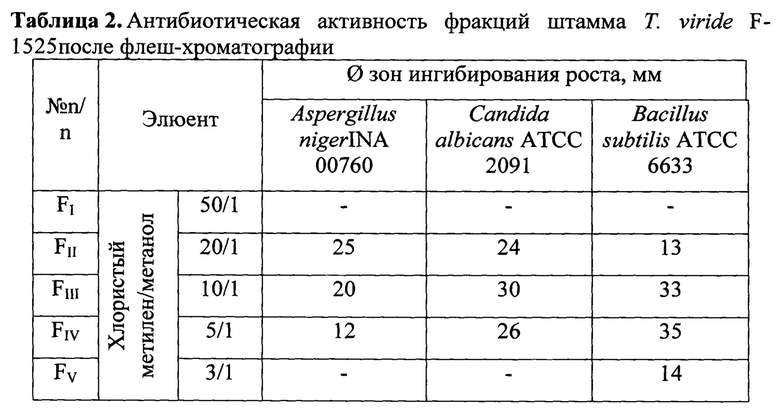
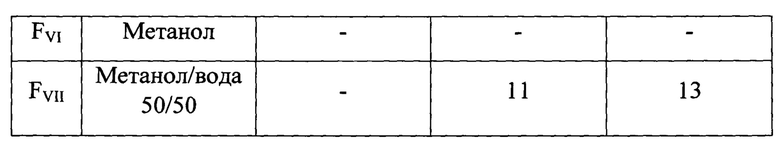
Последовательное разделение антибиотического комплекса экстракта из КЖ на силикагеле методом флэш-хроматографии позволяет получить 7 обогащенных фракций, у которых оценивают спектр антифунгальной активности в отношении условно-патогенных грибов.
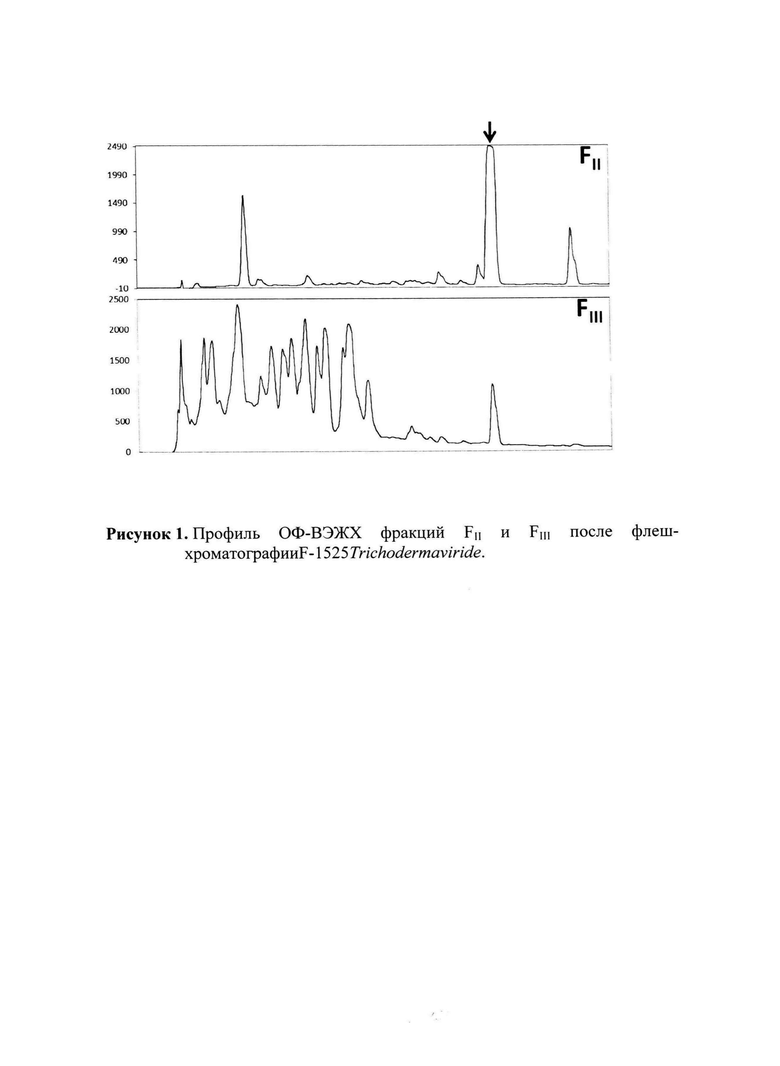
Две фракции FII и FIII, проявляют максимальную активность в отношении грибов, бактерий и дрожжей (Таблица 2), и имеют общие компоненты - соясапонины (Рисунок 1).
Для дальнейший очистки после флэш-хроматографии фракции FII и FIII подвергают фракционированию методом обращенно-фазовой высокоэффективной жидкостной хроматографии (ОФ-ВЭЖХ) с использованием колонки SunFire™C18 5μm 4,6×250 mm ("Waters", Ireland) в линейном градиенте увеличения концентрации подвижной фазы, создаваемым элюентом А (0.1%-ная трифторуксусная кислота (ТФУ) в воде MQ) и элюентом В (80%-ный ацетонитрил с 0.1%-ным водным раствором ТФУ) при скорости потока 1 мл/мин. Для ОФ-ВЭЖХ используют ультраградиентный ацетонитрил фирмы "Panreac" (Испания) и ТФУ производства "Sigma-Aldrich" (США). Детектирование разделяемых веществ осуществляют при 214 нм в градиенте концентрации элюента В: 40-95% - за 20 мин и с последующим изократическим элюированием в течение 20 мин.
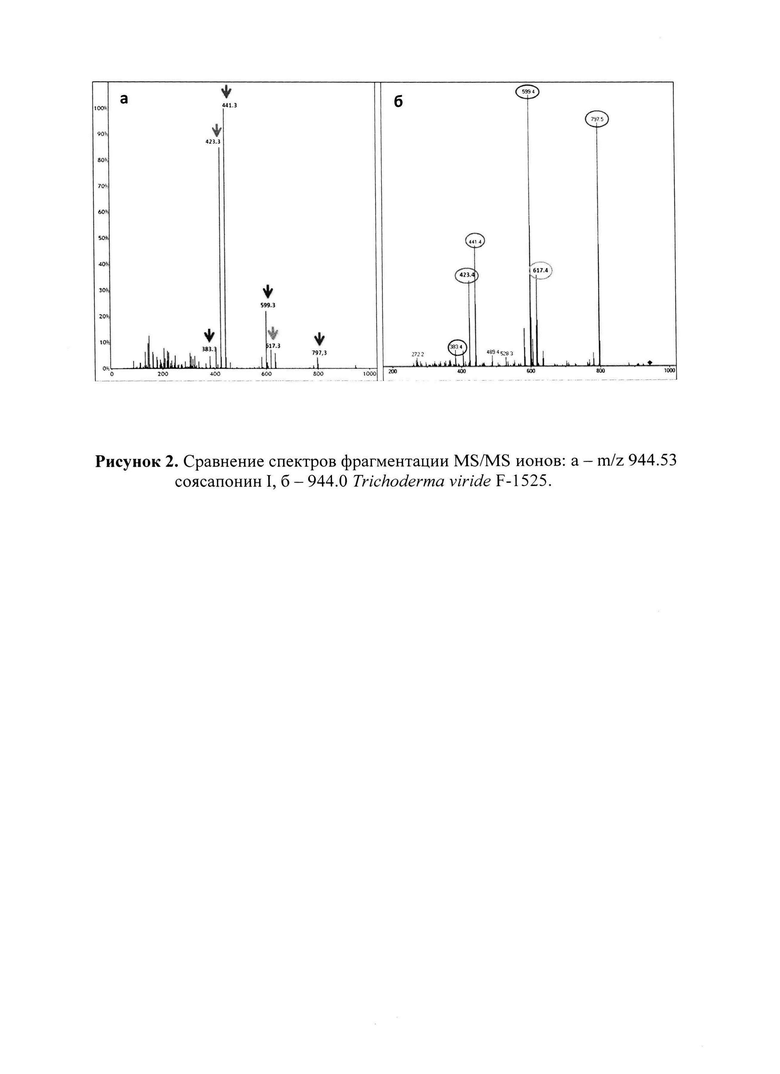
Молекулярные массы активных соединений в выделенной фракции устанавливают с помощью жидкостной хроматографии и тандемной масс-спектрометрии LC-MS/MS. Методом масс-спектрометрического анализа определяют массу активного соединения - 942.5 Да, что совпадает с массой соясапонина I. Идентичность активного соединения соясапонину I устанавливают путем сравнения их спектров фрагментации MS/MS для молекулярных ионов, полученных в режиме регистрации положительных ионов. Спектры фрагментации соясапонина I получают из базы данных «DEREPLICATOR+» (Mohimani et al., 2016). Совпадение паттернов фрагментации выделенного соединения и соясапонина I проиллюстрировано на рисунке 2. Содержание соясапонина в культуральной жидкости составляет от 0,7 до 0,85 г/л среды.
Пример 3. Влияние инокуляции штамма Trichoderma viride F-1525 в вермикультуру на накопление биомассы и численность дождевых червей Eisenia fetida
Используют одновозрастные половозрелые особи Eisenia fetida. Червей содержат в 5,5 литровых пластиковых контейнерах (высота × длина × ширина: 11 × 30 × 16 см) с открытой крышкой и включенным освещением во избежании их выползания. Субстрат для них готовят из коровьего навоза и низинного торф (рН=7) с соломой. Солому пшеницы измельчают на установке КР-01 «Фермер-5» до размеров не более 1 см. В каждый контейнер добавляют 430 г навоза с добавкой торфа, 100 г соломы и 1000 мл дистиллированной воды.
Один вариант опыта представляет 3 контейнера со смесью субстратов, в которые вносят по 50 особей красных калифорнийских червей - Eisenia fetida. Второй вариант - три контейнера с тем же количеством червей (50 особей в контейнере) и штаммом Т.viride F-1525 в количестве (1 × 10 6 КОЕ/ контейнер или 2 × 106 КОЕ/кг) в виде водной суспензии спор и мицелия. Инкубацию(вермикомпостирование) проводят в течение 60 суток при комнатной температуре (18-23°С). Влажность смеси органических субстратов поддерживают на уровне 80% от ее полной влагоемкости.
Получают, что на варианте с внесением T.viride F-1525 в вермикультуру в сравнение с контролем (вариант только с Eisenia fetida) количество червей после завершения вермикомпостирования больше почти на 40%, а биомасса взрослых червей выше на 30% (табл. 3, 4).
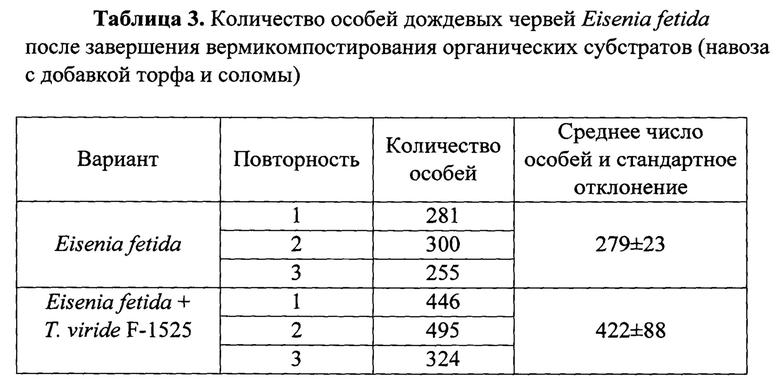

Пример 4. Влияние инокуляции штамма Trichoderma viride F-1525 в вермикультуру на продукцию коконов дождевыми червями Eisenia fetida
Опыт проводят согласно примеру 6 с рядом отличий. Смесь для компостирования составляют из следующего количества субстратов: солома - 100 г, навоз - 323 г, воды - 857 г. Вермикомпостирование проводят в темной комнате. Инокуляцию Trichoderma viride F-1525 проводят в увлажненную солому ((100 граммов соломы + 700 мл воды + 1,5×106 КОЕ Т Viride F-1525) за 5 суток до подготовки смеси для вермикомпостирования и инкубируют ее при комнатной температуре. В контрольный вариант вносят также увлажненную и проинкубированную в течение 5 суток солому. После 60 суток проводят подсчет коконов и получают, что их число на варианте с Trichoderma viride F-1525 значительно больше (в среднем 183 в одном контейнере) по сравнению с контролем (без внесения триходермы) - 126 в одном контейнере (таблица 5).

Пример 5. Активность Trichoderma viride F-1525 в подавлении заболевания растений корневой гнилью
Для оценки способности Tviride F-1525 (титр 5*105 КОЕ/кг субстрата с почвой) подавлять фитопатогенные грибы его вносят в составе образовавшегося вермикомпоста, получаемого по примеру 3, в дерново-подзолистую почву. Почву просеивают через сито 1 мм и смешивают с вермикомпостом соотношении 1:5 по объему. В прямоугольные контейнеры добавляют 400 мл почвы и 100 мл вермикомпоста, масса с водой составляет около 570 г. Выращивают огурцы (15 семян на контейнер) и салатсорт «Букет» (30 семян на контейнер) на искусственном инфекционном фоне F. oxysporumBKM F-140. Фитопатогенный штамм F. oxysporum BKMF-140 вносят в количестве 5×106 КОЕ/г. Растения инкубируют при искусственном освещении, влажности субстрата 35%, которую контролируют весовым способом, и температурном диапазоне 18-24°С. Периодически учитывают гибель (выпад) растений в течение 15 суток (кресс-салат) и 60 суток -огурцы.
Получают, что штамм Т. viride F-1525 существенно снижает заболевание фузариозом салата сорт «Букет» (с 60% до 17%), и полностью устраняет гибель огурцов от фузариозной гнили (таблица 6).
Аналогичный опыт проводят с другим видом фитопатогенного гриба рода Fusarium и также получают снижение гибели растений до 15%.


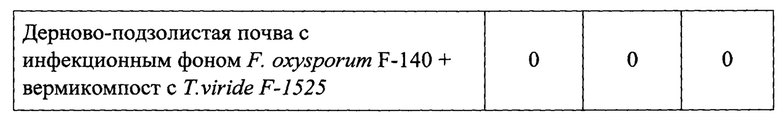
Пример 6. Ростстимулирующий эффект T.virideF-1525 на растения
Опыт проводят с семенами огурца сорта «Фермер F1» в трех кратной повторности (по 30 семян в повторности). Семена увлажняют водой и помещают на дерново-подзолистую почву в контейнере (контрольный вариант), которая предварительно увлажнена до оптимальной влажности 60% от полной влагоемкости. В опытном варианте семена увлажняют водной с суспензией спор и мицелия с остатками культуральной жидкости Т. viride F-1525 (титр спор и фрагментов мицелия - 2 × 106 КОЕ/кг почвы). Инкубацию проводят при постоянной влажности и освещенности, и при комнатной температуре. Учитывают всхожесть семян и длину проростков на 5 сутки. Получают, что всхожесть семян в контроле 60%, а опыте - 93%.Средняя длина проростков в опытном варианте выше, чем контрольном варианте на 22%.
Пример 7. Эффект от инокуляции предлагаемого штамма T.viride F-1525 и штамма-прототипа Trichoderma asperellum ВКПМ F- 765 на накопление биомассы и продукцию коконов дождевыми червями Eisenia fetida
Опыт проводят согласно примеру 3. Контролем служит вариант без внесения штаммов в вермикультура Eisenia fetida в субстрате с 80% влажностью на основе навоза с добавкой торфа и соломы. Оценивают эффект от инокуляции в вермикультуру Eisenia fetida штамма-прототипа Trichoderma asperellum ВКПМ F- 765 и предлагаемого штамма T.viride F-1525 в одинаковой дозе (2 × 106 КОЕ/кг субстрата).
Получают, что на варианте с внесением предлагаемого штамма T.viride F-1525 в вермикультуру биомасса червей после завершения вермикомпостирования больше, чем в контроле (варианте без инокуляции грибов) на 30%, а при применении штамма-прототипа - только на 12%, то есть прибавка в накоплении биомассы червей существенно выше в случае T.viride F-1525.
Биомасса дождевых червей возросла при вермикомпостировании в контроле на 28%, с Trichoderma asperellum на 43%, а по предлагаемому способу с Т. viride F-1525 на 58%.
При инокуляции штамма-прототипа Trichoderma asperellum BKПMF-765 продукция коконов в вермикультуре Eisenia fetida возрастает в среднем на 20% по сравнению с контролем. Число коконов на варианте с предлагаемым штаммом TvirideF-1525 значительно больше (на 45%), чем в контроле, и превышает таковую у штамма-прототипа.
Пример 8. Ростстимулирующая активность предлагаемого штамма Т. virideF-1525 и штамма-прототипа Trichoderma asperellum ВКПМ F-765 на огурцах
Опыт проводят согласно примеру 3. Учитывают всхожесть семян и длину проростков на 5 сутки. Получают, что всхожесть семян в контроле 55%, с штаммом-прототипом - 55%, предлагаемым штаммом - 87%. Средняя длина проростков огурцов при инокуляции штамма-прототипа возрастает на 13%, по сравнению с контролем, а предлагаемого штамма - на 28%, то есть существенно больше (таблица 8).

Пример 9. Способность предлагаемого штамма T.viride F-1525 и штамма - прототипа Trichoderma asperellum ВКПМ F-765 подавлять развитие фузариозной гнили корней огурцов
Опыт проводят согласно примеру 5. Оценивают гибель растений огурца сорта «Ферментер F1» при выращивании на фузариозном инфекционном фоне.
Получают, что в случае инокуляции штамма-прототипа Trichoderma asperellum BKПMF- 765 гибель огурцов от корневой гнили составляет 10 и 22% на 10 и 30 сутки, соответственно, а в случае использования предлагаемого штамма огурцы не погибали в течение данного периода.

Список литературы
Бутова С.Н., Сальникова В.А. Перспективы использования сапониновв пищевой и косметической промышленности (Обзор) // Вестник Российской академии естественных наук. Медицина и биотехнология. 2015. 1. с. 82-84. Егоров Н.С. Основы учения об антибиотиках. Изд-е 6. М.: Наука, 2004, 528 с.
Патент РФ №2467989, приоритет от 27.11.2012.
Mohimani, Н.; Gurevich, A.; Mikheenko, A.; Garg, N.; Nothias, L.-F.; Ninomiya, A.; Takada, K.; Dorrestein, P.C.; Pevzner, P. A. Dereplication of Peptidic Natural Products through Database Search of Mass Spectra // Nature Chemical Biology 2016, 13, 30.
PaulN.C; Kim, W.K., Woo S.K., ParkS., YuS.H. Fungal endophytes in roots of Aralia species and their antifungal activity // Plant Pathol. J. 2007, 23, 287-294. Patle P.N., Navnage N.P., Ramteke P.R. Endophytes in plant system: roles in growth promotion, mechanism and their potentiality in achieving agriculture sustainability // Int J Chem Stud 6(1),2018, 270-274.
Swain H., Adak Т., Mukherjee A.K., Mukherjee P.K., Bhattacharyya P., Behera S., Bagchi T.B., Patro R., Shasmita A., Khandual M.K., Bag Т.К., Dangar S.L., Jena M.Novel Trichoderma strains isolated from tree barks as potential biocontrol agents and biofertilizers for direct seeded rice Microbiol Res 214, 2018:83-90 Wu Hao, Hongyan Yang, Xiangling You and Yuhua Li. Isolation and Characterization of Saponin-Producing Fungal Endophytes from Aralia elata in Northeast China // Int. J. Mol. Sci. 2012, 13, 16255-16266; Wu Hao, Hong-Yan Yang, Xiang-Lin You and Yu-Hua Li. Diversity of endophytic fungi from roots of Panax ginseng and their saponin yield capacities// SpringerPlus. 2013, 2:107-116.
Wu Q, Ni M, Dou K, Tang J, Ren J, Yu C., Chen J, Co-culture of Bacillus amyloliquefaciens ACCC11060 and Trichoderma asperellum GDFS1009 enhanced pathogen-inhibition and amino acid yield Microb Cell Fact.2018.17(1):155.
Zeilinger S., Gruber S., Bansal R., Mukherjee Р.К. (2016) Secondary metabolism in Trichoderma - chemistry meets genomics. Fungal Biol Rev 30:74-90.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПЕРЕРАБОТКИ ОРГАНИЧЕСКИХ ОТХОДОВ | 2011 |
|
RU2467989C2 |
| СПОСОБ УТИЛИЗАЦИИ ЦЕЛЛЮЛОЗОСОДЕРЖАЩИХ ОТХОДОВ | 2012 |
|
RU2488997C1 |
| СПОСОБ ПОЛУЧЕНИЯ БИОУДОБРЕНИЯ | 1997 |
|
RU2125549C1 |
| ШТАММ Trichoderma citrinoviride Bissett - ПРОДУЦЕНТ АНТИБИОТИКОВ-ПЕПТАИБОЛОВ С АНТИГРИБНОЙ И АНТИБАКТЕРИАЛЬНОЙ АКТИВНОСТЬЮ | 2014 |
|
RU2564577C1 |
| СПОСОБ БИОТЕХНОЛОГИЧЕСКОЙ ПЕРЕРАБОТКИ ТВЕРДЫХ ОТХОДОВ ЦЕЛЛЮЛОЗНО-БУМАЖНОЙ ПРОМЫШЛЕННОСТИ ДЛЯ ПОЛУЧЕНИЯ БИОГУМУСА, ВКЛЮЧАЮЩИЙ СТАДИЮ ОБРАБОТКИ ГРИБАМИ И СТАДИЮ ВЕРМИПЕРЕРАБОТКИ | 2013 |
|
RU2562526C2 |
| Способ утилизации мясных отходов пищевых производств | 2024 |
|
RU2838224C1 |
| СПОСОБ ПОЛУЧЕНИЯ БИОГУМУСА | 2009 |
|
RU2408563C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПОЧВОСМЕСИ ДЛЯ ПРОРАЩИВАНИЯ СЕМЯН И РАЗВИТИЯ САЖЕНЦЕВ | 2012 |
|
RU2528711C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЖИДКОГО ОРГАНИЧЕСКОГО УДОБРЕНИЯ ИЗ ОТХОДОВ ОРГАНИЧЕСКОГО ПРОИСХОЖДЕНИЯ | 2016 |
|
RU2654864C2 |
| СПОСОБ И УСТРОЙСТВО ПРОМЫШЛЕННОГО ПОЛУЧЕНИЯ ВЕРМИКОМПОСТА | 2024 |
|
RU2840517C1 |
Изобретение относится к биотехнологии. Штамм Trichoderma viride - продуцент соясапонина I, обладающий высокой противогрибковой и ростстимулирующей активностью, депонирован во Всероссийской Коллекции Промышленных Микроорганизмов под номером F-1525. Изобретение обеспечивает подавление развития корневых инфекций, стимулирование прорастания семян и роста растений, повышает продуктивность вермикультуры Eisenia fetida, использумой для переработки органических остатков. 9 табл., 9 пр., 2 ил.
Штамм микроскопического гриба Trichoderma viride ВКПМ F-1525 - продуцент соясапонина I, обладающий ростстимулирующей активностью в отношении растений и дождевых червей Eisenia fetida и антимикотическим действием к условно-патогенным и фитопатогенным грибам.
| СПОСОБ ПЕРЕРАБОТКИ ОРГАНИЧЕСКИХ ОТХОДОВ | 2011 |
|
RU2467989C2 |
| ШТАММ Trichoderma citrinoviride Bissett - ПРОДУЦЕНТ АНТИБИОТИКОВ-ПЕПТАИБОЛОВ С АНТИГРИБНОЙ И АНТИБАКТЕРИАЛЬНОЙ АКТИВНОСТЬЮ | 2014 |
|
RU2564577C1 |
| CN 0101492646 B, 15.09.2010 | |||
| ШТАММ МИКРОМИЦЕТА ТRICHODERMA VIRIDE, ШТ.23, ОБЛАДАЮЩИЙ ФУНГИЦИДНЫМИ СВОЙСТВАМИ ДЛЯ ПОЛУЧЕНИЯ КОМПЛЕКСНОГО БИОПРЕПАРАТА СО СВОЙСТВАМИ ФУНГИЦИДА И БАКТЕРИАЛЬНОГО УДОБРЕНИЯ, СПОСОБ ПОЛУЧЕНИЯ КОМПЛЕКСНОГО БИОПРЕПАРАТА, КОМПЛЕКСНЫЙ БИОПРЕПАРАТ СО СВОЙСТВАМИ ФУНГИЦИДА И БАКТЕРИАЛЬНОГО УДОБРЕНИЯ | 1999 |
|
RU2186847C2 |
Авторы
Даты
2021-07-07—Публикация
2020-09-24—Подача