По данной заявке испрашивают приоритет патентной заявки США № 61/564,671, которая озаглавлена «Blood Pump Systems and Methods», которая подана 29 ноября 2011 года, и испрашивают приоритет патентной заявки США № 61/524,761, которая озаглавлена «Blood Pump Systems and Methods», которая подана 17 августа 2011 года, которая является частичным продолжением патентной заявки США № 13/030,054, которая озаглавлена «System and Method to Increase the Overall Diameter of Veins», которая подана 17 февраля 2011 года, по которой испрашивают приоритет предварительной заявки США № 61/305,508, которая озаглавлена «System and Method to Increase the Overall Diameter of Veins», которая подана 17 февраля 2010 года и связана с совместно рассматриваемой совместно поданной международной патентной заявкой PCT № PCT/US12/50978, которая озаглавлена «System and Method to Increase the Overall Diameter of Veins and Arteries», которая подана 15 августа 2012 года и связана с совместно рассматриваемой патентной заявкой США № 61/524,759, которая озаглавлена «System and Method to Increase the Overall Diameter of Veins and Arteries», которая подана 17 августа 2011 года, и патентной заявкой США № 61/561,859, которая озаглавлена «System and Method to Increase the Overall Diameter of Veins and Arteries», которая подана 19 ноября 2011 года, все они включены посредством ссылки во всей своей полноте.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к системе кровяного насоса, которая содержит насос, трубки, блок управления и источник питания, посредством чего систему можно использовать, чтобы постоянно увеличивать локальный поток крови в артериях и венах пациента. В частности, это изобретение можно использовать для постоянного увеличения наружного диаметра и диаметра просвета вен и артерий у пациентов, нуждающихся в месте сосудистого доступа для гемодиализа, шунтирующем трансплантате или хирургическом вмешательстве или процедуре другого типа, где вены или артерии большего диаметра являются желаемыми. Это изобретение также можно использовать для обеспечения увеличенного локального потока крови к органам и тканям, нуждающимся в этом, таким как нижние конечности пациента с заболеванием периферических артерий (ЗПА).
УРОВЕНЬ ТЕХНИКИ
В Соединенных Штатах существует более полумиллиона пациентов с хронической почечной недостаточностью (CKD), причем более 100000 новых пациентов с CKD появляется каждый год. Прогнозируют увеличение распространенности в популяции на четыре процента ежегодно из-за таких движущих факторов, как, например, высокое кровяное давление, диабет и старение популяции.
Гемодиализ представляет собой лечение, предпочтительное для 92% пациентов с CKD, поскольку без гемодиализа или некоторых других форм лечения эти пациенты с CKD погибнут. Сосудистую систему типичного пациента с CKD, проходящего лечение гемодиализом, нужно соединять с аппаратом для гемодиализа от двух до трех раз в неделю. Для гемодиализа существует три возможных обыкновенных места сосудистого доступа. Предпочтительное возможное место доступа представляет собой артериовенозную фистулу (АВФ), которая представляет собой непосредственное хирургически созданное соединение между артерией и веной, предпочтительно на запястье или альтернативно на предплечье, верхней части руки, ноге или в паху. Другое возможное место доступа представляет собой артериовенозный трансплантат (АВТ), который представляет собой хирургически созданное соединение между артерией и веной с использованием промежуточной синтетической трубки. Последним основным возможным местом доступа является катетер, вставленный в большую вену на шее, в грудной клетке, ноге или другом анатомическом местоположении.
Пациенты с АВФ имеют более низкую болезненность, более низкую смертность и более низкие расходы на уход по сравнению с пациентами с АВТ или катетером; следовательно, АВФ на запястье представляет собой предпочтительную форму сосудистого доступа для гемодиализа. Пациенты с АВТ или катетером имеют по существу более высокие уровни инфекции и смерти, чем пациенты, которые имеют АВФ, причем пациенты с катетерами имеют наихудшие исходы. Кроме того, пациенты, которые имеют АВТ или катетер, имеют более высокие средние расходы на уход, причем пациенты с катетерами имеют самые высокие расходы. Если пациент подходит для АВФ, запястье или предплечье в общем, является предпочтительным относительно АВФ на верхней части руки из-за более высокого уровня ишемии руки и в общем, более коротких и более глубоких сегментов вены в верхней части руки.
К сожалению, приблизительно 85 процентов пациентов непригодны для АВФ на запястье, главным образом из-за слишком малых диаметров вен и артерий. Кроме того, приблизительно 60 процентов всех созданных АВФ нельзя использовать без дополнительных хирургических и интервенционных процедур из-за возникновения того, что обыкновенно обозначают как «невозможность созревания», которая коррелирует с малым диаметром вены и артерии. Доступность вен и артерий с более крупными диаметрами коррелирует с более высокой приемлемостью АВФ и низким уровнем невозможности созревания.
В настоящее время, существует несколько возможностей перманентно и постоянно увеличивать диаметр вены или артерии. Все существующие способы используют механические способы дилятации, такие как баллонная ангиопластика, которые могут вести к повреждению вен или артерий. Поскольку пациент должен иметь периферические вены и артерии определенного размера, чтобы врач создал АВФ, желательно имеет способ и систему для постоянного и перманентного увеличения размера или диаметра периферических вен или артерий.
В настоящее время существуют небольшие «сердечные насосы». Однако, такие насосы дороги, не имеют размеров и не разработаны для использования в конечности. По существу, существует необходимость в данной области в системах, компонентах и способах для увеличения диаметра периферических вен и артерий при разумных расходах. Дополнительно, существует необходимость в насосном устройстве, которое может увеличивать диаметр периферических вен и артерий.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящая заявка относится к системе кровяного насоса для использования в увеличении диаметра вен и артерий, предпочтительно периферических вен и артерий. Система функционирует для того, чтобы перемещать кровь таким образом, чтобы вызывать увеличение диаметра вены или артерии. Это можно выполнять посредством выброса («выталкивания») крови в вену или артерию или посредством удаления («всасывания») крови из вены или артерии. Посредством любого способа система увеличивает поток крови в сосуде, что в конечном итоге ведет к постоянному увеличению диаметра сосуда. По существу, система и, более конкретно, насос используют механическое средство для того, чтобы активировать пути биологических реакций, что ведет к увеличению или «ремоделированию» вен или артерий. Система имеет кровяной насос, трубки для того, чтобы нести кровь к кровяному насосу и от него, систему управления для того, чтобы осуществлять мониторинг кровяного насоса и модифицировать работу кровяного насоса, и источник мощности. По существу, система содержит группу элементов, которые можно, например, вставлять в артерию одним концом и в вену другим, посредством чего, когда активируют, кровь перекачивают с такой скоростью, что напряжение сдвига у стенки (НСС) на эндотелии вены, артерии или обеих повышают в течение периода времени, достаточного для того, чтобы вызывать постоянное увеличение вены или артерии. Любой из множества насосов можно использовать при условии, что насосом можно управлять для того, чтобы получать желаемое увеличение диаметра кровеносного сосуда.
Можно использовать кровяные насосы различных типов, включая насос положительного смещения и роторный насос, причем насосы роторного типа являются предпочтительными. В одном из вариантов осуществления система роторного кровяного насоса содержит насос, который имеет корпус, который определяет впуск для того, чтобы принимать кровь, и выпуск для того, чтобы выбрасывать кровь. Корпус насоса разработан и имеет размеры для того, чтобы вмещать вращающийся импеллер, подвершенный на несущих. Корпус насоса может иметь первую несущую на впускной части корпуса и вторую несущую на выпускной части корпуса. Кровь входит во вращающийся импеллер и выходит из него, посредством чего импеллер увеличивает скорость крови на выходе. Эту увеличенную скорость извлекают или передают в виде увеличенного давления, поскольку кровь замедляется внутри диффузора насоса, который заканчивается выпуском насоса.
В других вариантах осуществления можно использовать роторные кровяные насосы различных типов. Например, можно использовать осевой насос, радиально-осевой насос или, предпочтительно, центробежный кровяной насос. Кроме того, можно использовать различные несущие импеллера насоса, включая в качестве неограничивающих примеров магнитные несущие, гидродинамические несущие и, предпочтительно, поворотного (контактного) типа. Аналогичным образом, можно использовать диффузоры насоса различных типов, включая в качестве неограничивающих примеров коллектор диффузор или предпочтительно спиральный диффузор.
В одном из вариантов осуществления центробежный кровяной насос с поворотными опорами содержит корпус насоса, который определяет впуск насоса, который имеет диффузор входящего потока для того, чтобы принимать кровь и направлять кровь на импеллер, корпус насоса, который имеет верхнюю грань и верхнюю поворотную опору, которая идет от верхней части корпуса во впуск, и нижнюю грань и нижнюю поворотную опору, которая идет от нижней части корпуса во внутреннее пространство корпуса. Насос также содержит импеллер, подвешенный внутри корпуса, импеллер дополнительно имеет просвет несущей для того, чтобы принимать поворотный элемент импеллера. Поворотный элемент импеллера имеет первый конец для того, чтобы входить в зацепление с поворотной опорой впускной части (верхней), и второй конец для того, чтобы входить в зацепление с поворотной опорой выпускной части (нижней). В одном из вариантов осуществления концы поворотного элемента импеллера являются выпуклыми и по меньшей мере один конец каждой поворотной опоры является вогнутым. В другом варианте осуществления концы поворотного элемента импеллера являются вогнутыми, а поворотные опоры являются выпуклыми. Импеллер может содержать различные конструкции лопастей или лопаток, разработанные для того, чтобы контактировать с кровью и ускорять ее в улитку. Например, импеллер определяет множество лопаток на верхней поверхности импеллера, идущих радиально от центра импеллера к внешнему краю импеллера. Лопатки ускоряют кровь из центрального впуска импеллера к его периферическому выпуску. В другом варианте импеллер не содержит лопатки или лопасти, но содержит средство для того, чтобы перемещать или двигать кровь. Импеллер необязательно содержит по меньшей мере один просвет, вырез или канал для смыва, который идет параллельно центральной оси импеллера от нижней поверхности через импеллер к верхней поверхности. Просвет разрабатывают для того, чтобы предотвращать застой крови под импеллером и вокруг нижней поворотной опоры.
Кровяной насос содержит двигатель, предпочтительно электрический, разработанный для того, чтобы приводить в действие импеллер. В одном из вариантов осуществления кровяной насос содержит приводной двигатель, который имеет по меньшей мере один магнит, механически прикрепленный к импеллеру и по меньшей мере одному якорю, механически прикрепленному к корпусу. Якорь индуцирует электродвижущую силу по меньшей мере на одном магните, прикрепленном к импеллеру. Двигатель насоса может представлять собой бесщеточный моментный двигатель постоянного тока (DC) с осевым пропуском с коммутацией противоэлектродвижущей силы (противо-ЭДС) без датчиков. В двигателе используют спеченный сплав неодимия железа бора (NdFeB) для магнитов в роторе и 3-фазную плоскую конфигурацию катушки типа «ипподром» в статоре. Двигатель имеет соотношение сторон как у диска, с очень малой длиной оси в сравнении с его диаметром.
Система кровяного насоса имеет одну или несколько трубок, включая первую трубку (входящего потока), которая имеет две конца, первый конец, который соединяют по текучей среде с местоположением в сосудистой системе и который принимает кровь из этого местоположения, и второй конец, который соединяют по текучей среде с насосом. Трубка входящего потока доставляет кровь в насос. Система кровяного насоса имеет вторую трубку (выходящего потока), которая имеет два конца, первый конец, который соединяют по текучей среде с насосом и который принимает кровь от насоса, и второй конец, который соединяют по текучей среде с местоположением в сосудистой системе. Выходящий поток доставляет кровь в местоположение в сосудистой системе.
В различных вариантах осуществления трубки системы кровяного насоса имеют индивидуальную длину между 2 см и 110 см и общую длину между 4 см и 220 см, и могут быть усечены хирургом или другим врачом до желаемой длины, в том числе, во время имплантации насосной системы. Каждая трубка имеет внутренний диаметр между 2 мм и 10 мм и предпочтительно между 4 мм и 6 мм. Трубки можно формировать по меньшей мере отчасти из полиуретана (такого как Pellethane® или Carbothane®), поливинилхлорида, полиэтилена, силиконового эластомера, политетрафторэтилена (ПТФЭ), пористого политетрафторэтилена (пПТФЭ), полиэтилентерефталата (ПЭТ, например, дакрона) и их сочетаний. Трубки дополнительно могут содержать эластический резервуар.
Все или части трубок можно упрочнять сплетенным или спирально завитым материалом с памятью формы, таким как нитинол, или другим саморасправляющимся или радиально расширяющимся материалом. Трубки могут иметь скошенные концы, которые соединяют по текучей среде с сосудистой системой. Концы могут быть скошенным под углом между 10 градусами и 80 градусами. Одна или несколько трубок могут иметь множество отверстий или окошек в стенках дистальных концов, когда выполняют с возможностью размещения внутри просвета кровеносного сосуда или другом внутрисосудистом местоположении. Трубки можно прикреплять к насосу с использованием радиально-сжимаемых соединителей.
В одном из вариантов осуществления система кровяного насоса содержит кровяной насос и систему управления для того, чтобы осуществлять мониторинг системы кровяного насоса и модифицировать работу кровяного насоса для того, чтобы поддерживать увеличенное среднее напряжение сдвига у стенки внутри артерии или вены, соединенной по текучей среде с кровяным насосом. Система управления дополнительно выполнена с возможностью поддерживать среднее напряжение сдвига у стенки внутри вены в диапазоне от 0,76 до 23 Па, или предпочтительно в диапазоне от 2,5 до 10 Па. В другом варианте осуществления система управления осуществляет мониторинг и поддерживает увеличенную среднюю скорость крови внутри артерии или вены, соединенной по текучей среде с кровяным насосом. В этом варианте осуществления система управления выполнена с возможностью поддерживать среднюю скорость крови внутри артерии или вены в диапазоне от 10 см/с до 120 см/с, или предпочтительно в диапазоне от 25 см/с до 100 см/с. В любом варианте осуществления система кровяного насоса выполнена с возможностью поддерживать увеличенное среднее напряжение сдвига у стенки или увеличенную среднюю скорость крови в течение по меньшей мере 1 суток, 7 суток, 14 суток, 28 суток, 42 суток, 56 суток, 84 суток или 112 суток.
Система кровяного насоса имеет систему управления для того, чтобы достигать и поддерживать желаемую скорость потока, которая необязательно может содержать управляющее устройство для приема информации и управления работой насоса системы перекачивания крови. Как минимум, систему управления можно приводить в действие вручную для того, чтобы регулировать скорость двигателя. С другой стороны, можно использовать автоматическую (т.е. «умную») систему управления. Необязательно, система управления содержит датчики, которые можно располагать в насосе, трубках или в сосудистой системе пациента. Управляющее устройство может измерять скорость вращения двигателя, основываясь на прохождении через ноль и форме волны противо-ЭДС. Это прохождение через ноль указывает на изменение магнитного полюса ротора на противоположный. Скоростью двигателя управляют посредством широтно-импульсной модуляции (ШИМ) входного напряжения, а крутящим моментом управляют посредством ШИМ входного тока. Управляющее устройство также осуществляет мониторинг других переменных состояния двигателя насоса, таких как ток и напряжение, по которым можно оценивать как скорость потока через систему перекачивания крови, так и напряжение сдвига у стенки в периферическом кровяном сосуде, и управлять ими. Управляющее устройство предпочтительно содержит память, процессор для управления скоростью двигателя насоса, анализа информации, поступающей от электроники привода двигателя и необязательных датчиков, и исполнения инструкций, закодированных в машиночитаемой среде. Система кровяного насоса содержит кабель для электрического соединения управляющего устройства с насосом и необязательными датчиками. Система кровяного насоса также содержит источник мощности, который в различных вариантах осуществления можно интегрировать в управляющее устройство. В различных вариантах осуществления источник мощности для системы кровяного насоса может быть переносным (например, перезаряжаемая батарея или топливная ячейка) или стационарным (например, базовый блок питания, соединенный с сетью переменного тока).
Система управления может получать информацию из различных источников. Электроника привода двигателя внутри управляющего устройства может измерять по меньшей мере одно из скорости двигателя, входной мощности или тока, необходимого для работы насоса. В других вариантах осуществления система управления содержит датчики в кровяном насосе или трубках, которые измеряют по меньшей мере одно из скорости крови, скорости потока крови, сопротивления потоку крови в периферическом кровяном сосуде, кровяного давления, пульсационного индекса и их сочетаний. В других вариантах осуществления система управления содержит датчики в сосудистой системе пациента, которые измеряют по меньшей мере одно из скорости крови, скорости потока крови, кровяного давления, пульсационного индекса, диаметра сосуда и их сочетаний.
В различных вариантах осуществления система управления может оценивать и поддерживать желаемый и повышенный уровень напряжения сдвига у стенки в целевом сосуде или отдающей артерии или вене, используя информацию от управляющего устройства и/или датчиков, такую как скорость двигателя, входная мощность двигателя, скорость потока насоса, напор насоса, давление около сочленения трубки выходящего потока и целевого сосуда, падение давления на протяжении кровеносного сосуда и их сочетания. В целях этой заявки «целевой сосуд», «целевой кровеносный сосуд», «целевая вена» или «целевая артерия» относится к конкретному сегменту артерии или вены, который предназначен для достижения постоянно увеличенного наружного диаметра и диаметра просвета, когда сборочный узел насос-трубка имплантируют, конфигурируют и приводят в действие таким образом, чтобы достичь постоянного увеличения наружного диаметра и диаметра просвета.
Различные способы системы управления можно использовать для того, чтобы автоматически управлять работой системы кровяного насоса. В одном из вариантов осуществления способ определения напряжения сдвига у стенки и управления им в кровеносном сосуде включает стадии измерения вязкости крови, измерения скорости потока крови в системе кровяного насоса или кровеносном сосуде и измерение радиуса кровеносного сосуда. Стадии также включают определение напряжения сдвига у стенки в кровеносном сосуде по измеряемой вязкости крови, измеряемой скорости потока и радиусу кровеносного сосуда, сравнения определяемого напряжения сдвига у стенки с заданным эталонным значением и корректировки скорости кровяного насоса, когда определяемое напряжение сдвига у стенки не приближено к заданному эталонному значению. Стадии повторяют до тех пор, пока определяемое напряжение сдвига у стенки не приблизится к заданному эталонному значению.
В другом варианте осуществления способ вычисления и управления напряжением сдвига у стенки в кровеносном сосуде включает стадии оценки вязкости крови, измерения скорости потока крови в системе кровяного насоса или кровеносном сосуде и измерения радиуса кровеносного сосуда. Стадии также включают определение напряжения сдвига у стенки по оцениваемой вязкости крови, измеряемой скорости потока крови и радиусу кровеносного сосуда, сравнение определяемого напряжения сдвига у стенки с заданным эталонным значением и корректировку скорости кровяного насоса, когда определяемое напряжение сдвига у стенки не приближено к заданному эталонному значению. Стадии повторяют до тех пор, пока определяемое напряжение сдвига у стенки не приблизится к заданному эталонному значению.
В одном из вариантов осуществления способ оценки напряжения сдвига у стенки в кровеносном сосуде и управления им включает стадии оценки вязкости крови, измерения по меньшей мере одной переменной состояния двигателя системы кровяного насоса, выбранной из напряжения, тока или скорости насоса, и оценки скорости потока крови в системе кровяного насоса. Стадии также включают измерение давления в кровеносном сосуде, определение сопротивления сосуда у кровеносного сосуда по оцениваемой скорости потока крови и измеряемому давлению в кровеносном сосуде, оценку радиуса кровеносного сосуда. Стадии дополнительно включают определение напряжения сдвига у стенки по оцениваемой вязкости крови, оцениваемой скорости потока крови и радиусу кровеносного сосуда, по сравнению с определяемым напряжением сдвига у стенки с заданным эталонным значением, и корректировку скорости насоса, когда определяемое напряжение сдвига у стенки не приближено к заданному эталонному значению. Стадии повторяют до тех пор, пока определяемое напряжение сдвига у стенки не приблизится к заданному эталонному значению.
В другом варианте осуществления способ оценки напряжения сдвига у стенки в кровеносном сосуде и управления им с использованием системы кровяного насоса включает стадии оценки вязкости крови, измерения по меньшей мере одной переменной состояния двигателя системы кровяного насоса, выбранной из напряжения, тока или скорости насоса, и оценки скорости потока крови и напора в системе кровяного насоса. Стадии также включают вычисление сопротивления сосуда у кровеносного сосуда по оцениваемой скорости потока крови и оцениваемому напору, оценку радиуса кровеносного сосуда и определение напряжения сдвига у стенки по оцениваемой вязкости крови, оцениваемой скорости потока крови и радиусу кровеносного сосуда. Стадии дополнительно включают сравнение определяемого напряжения сдвига у стенки с заданным эталонным значением и корректировку скорости насоса, когда определяемое напряжение сдвига у стенки не приближено к заданному эталонному значению. Стадии повторяют до тех пор, пока определяемое напряжение сдвига у стенки не приблизится к заданному эталонному значению.
В одном из вариантов осуществления способ оценки напряжения сдвига у стенки в кровеносном сосуде и управления им с использованием системы кровяного насоса включает стадии оценки по меньшей мере одного элемента, выбранного из группы, состоящей из вязкости крови, скорости потока крови, напора в системе кровяного насоса и радиуса кровеносного сосуда, измерения по меньшей мере одной переменной состояния двигателя системы кровяного насоса выбранной из группы, состоящей из напряжения, тока и скорости насоса, и определения напряжения сдвига у стенки в кровеносном сосуде. Стадии также включают сравнение определяемого напряжения сдвига у стенки с заданным эталонным значением и корректировку скорости насоса, когда определяемое напряжение сдвига у стенки не приближено к заданному эталонному значению. Стадии повторяют до тех пор, пока определяемое напряжение сдвига у стенки не приблизится к заданному эталонному значению.
В еще одном другом варианте осуществления, бездатчиковый способ, предназначенный для того, чтобы избегать коллапса кровеносного сосуда, соединенного по текучей среде с системой кровяного насоса, при обнаружении приближения коллапса на впуске системы кровяного насоса, включает стадии измерения тока двигателя кровяного насоса и непрерывного определения представления спектрального анализа тока двигателя кровяного насоса в форме ряда Фурье. Стадии также включают предоставление индикации обнаружения, когда амплитуда второго гармонического члена ряда Фурье превышает эталонное значение, и снижение скорости насоса, когда амплитуда второго гармонического члена ряда Фурье превышает эталонное значение. Стадии повторяют до тех пор, пока амплитуда второго гармонического члена не упадет ниже эталонного значения.
В различных других вариантах осуществления системы и способы, описанные в настоящем документе, могут быть закодированы в машиночитаемых средах, которые можно исполнять с использованием каких-либо эталонных значений или заданных стандартов, используемых системами и способами, можно хранить в базе данных или другой подходящей запоминающей среде.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
На фиг. 1 представлен изометрический вид насоса.
На фиг. 2 представлен разборный изометрический вид насоса, где показаны его компоненты, содержащиеся в теле, идентифицированном на фиг. 1.
На фиг. 3A и 3B представлен вертикальный вид частичного и полного поперечного сечения насоса, соответственно, выполненного по линии сечения 3-3 на фиг. 1.
На фиг. 4A и 4B представлен вертикальный вид частичного и полного поперечного разреза насоса, соответственно, выполненного по линии сечения 4-4 на фиг. 1.
На фиг. 5A-B представлены увеличенные виды области оси поворота area с фиг. 3B и 4B.
На фиг. 6A-B представлены изометрические виды сверху и снизу, соответственно, поворотного элемента импеллера.
На фиг. 7A-B представлены изометрические виды сверху и снизу, соответственно, поворотного элемента импеллера.
На фиг. 8A-B представлены вертикальные виды сбоку вариантов осуществления поворотного элемента импеллера.
На фиг. 9A-B соответствующим образом представлены виды с противоположных торцов репрезентативный несущий штырь, используемый на любой конце оси импеллера для того, чтобы поддерживать и делать возможным вращение поворотного элемента импеллера.
На фиг. 10 представлен вид варианта осуществления верхнего несущего штыря.
На фиг. 11A-B представлены вертикальные виды сбоку вариантов осуществления репрезентативного несущего штыря.
На фиг. 12 представлено продольно сечение репрезентативного сборочного узла несущего штыря.
На фиг. 13 представлен вид сверху впускной головки и кожуха импеллера.
На фиг. 14-16 соответствующим образом представлены вертикальные виды поперечного сечения, выполненного по линиям сечения 14-14, 15-15 и 16-16 на фиг. 13.
На фиг. 17 представлено изометрическое частичное поперечное сечение впускного отверстия камеры импеллера.
На фиг. 18A и 18B соответствующим образом представлены вид сверху части впускной головки, которая определяет впускной канал, и ее торцевой вертикальный вид.
На фиг. 19A и 19B представлены те же соответствующие виды, как на фиг. 18A и 18B, но для другого варианта осуществления.
На фиг. 20A и 20B представлены те же соответствующие виды, как на фиг. 18A и 18B, но для другого варианта осуществления.
На фиг. 21-23 представлены те же виды, как на фиг. 18A, но для трех других вариантов осуществления.
На фиг. 24A и 24B представлены соответствующим образом вид сверху и вертикальный вид сбоку другого варианта осуществления впускной головки и впускного канала, похожие на представленное на фиг. 21, но дополнительно содержащие дугообразную клиновидную часть.
На фиг. 25 представлен изометрический вид насоса с удаленным верхним кожухом импеллера, чтобы показать импеллер, который занимает камеру импеллера.
На фиг. 26 представлен вид в перспективе системы кровяного насоса согласно одному из вариантов осуществления.
На фиг. 27A-27D представлены виды в перспективе соединения между насосом и трубками согласно одному из вариантов осуществления.
На фиг. 28A и 28B представлены виды в перспективе соединения между насосом и трубками согласно одному из вариантов осуществления.
На фиг. 29A и 29B представлены виды в перспективе соединения между насосом и трубками, которое содержит боковой порт согласно одному из вариантов осуществления.
На фиг. 30A и 30B представлены виды в перспективе соединения между насосом и трубками, которое содержит перегородку согласно одному из вариантов осуществления.
На фиг. 31 представлен вид дистальной части трубки выходящего потока согласно одному из вариантов осуществления.
На фиг. 32A и 32B представлены виды внутрисосудистой части трубки входящего потока согласно одному из вариантов осуществления.
На фиг. 33 представлен схематический вид насосной системы согласно одному из вариантов осуществления.
На фиг. 34 представлен схематический вид насосной системы согласно другому варианту осуществления.
На фиг. 35 представлен схематический вид системы управления согласно одному из вариантов осуществления.
На фиг. 36A-36D представлены блок-схемы способов системы управления согласно различным вариантам осуществления.
На фиг. 36E представлен график для давления в анастомозе и скорости потока крови для модели насосной системы in vitro согласно одному из вариантов осуществления.
На фиг. 36F-36H представлены блок-схемы способов системы управления согласно различным вариантам осуществления.
На фиг. 37 представлен схематический вид насосной системы, как применяют в системе кровообращения пациента, согласно одному из вариантов осуществления.
На фиг. 38 представлен схематический вид насосной системы, как применяют в системе кровообращения пациента, согласно второму варианту осуществления.
На фиг. 39 представлен схематический вид системы без насоса, как применяют в системе кровообращения пациента согласно третьему варианту осуществления.
На фиг. 40 представлен схематический вид насосной системы, как применяют в системе кровообращения пациента, согласно четвертому варианту осуществления.
На фиг. 41 представлено продольное сечение сочленения между проксимальным сегментом и дистальным сегментом.
На фиг. 42 представлен вид сверху медицинского набора.
На фиг. 43 представлено схематическое изображение насосной системы, которой управляют в соответствии с давлением выходящего потока.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Системы и компоненты настоящей заявки относятся к системе кровяного насоса. Более конкретно, в различных вариантах осуществления настоящая заявка относится к кровяному насосу, который разработан и имеет размеры для того, чтобы выбрасывать кровь в целевой сосуд или забирать кровь из целевого сосуда таким образом и в течение такого периода времени, что происходит постоянное увеличение диаметра целевого сосуда (вены или артерии). Еще более конкретно, настоящая заявка относится к системе роторного кровяного насоса, выполненного с возможностью постоянно увеличивать среднюю и/или пиковую скорость крови и среднее и/или пиковое напряжение сдвига у стенки в выбранных сегментах вен или артерий в течение периода времени, достаточного для того, чтобы постоянно увеличивать наружный диаметр и диаметр просвета выбранных сегментов вен или артерий. Термин «постоянное увеличение» или «постоянная дилятация», когда используют для того, чтобы описывать дилятацию или увеличению наружного диаметра и диаметра просвета артерии или вены, используют в настоящем документе для того, чтобы обозначать, что даже если насос выключают, увеличение наружного диаметра или диаметра просвета сосуда все еще можно демонстрировать, по сравнению с наружным диаметром или диаметром просвета сосуда перед периодом перекачивания крови. То есть, наружный диаметр или диаметр просвета сосуда стал больше, независимо от давления, создаваемого насосом. Следовательно, систему кровяного насоса можно использовать у определенных пациентов, включая пациентов с CKD, которые нуждаются в месте сосудистого доступа для гемодиализа. Система кровяного насоса может содержать роторный кровяной насос, одну или несколько несущих кровь трубок, систему управления и источник мощности. Система кровяного насоса забирает кровь из одного местоположения в сосудистой системе и выбрасывает кровь в другое местоположение в сосудистой системе. Во время работы, такая система кровяного насоса может постоянно увеличивать среднюю и/или пиковую скорость крови и среднее и/или пиковое НСС в целевом кровеносном сосуде до уровня и в течение периода времени, достаточных для того, чтобы постоянно увеличивать наружный диаметр и диаметр просвета целевого кровеносного сосуда. Система функционирует в конфигурациях, где кровь забирают из целевого кровеносного сосуда или в конфигурациях, где кровь выбрасывают в целевой кровеносный сосуд. Кроме того, систему можно использовать одновременно для того, чтобы увеличивать размер отдающих и принимающих сосудов.
Необязательные несущие кровь трубки могут содержать трубки входящего потока для того, чтобы нести кровь из местоположения в сосудистой системе (такого как отдающая вена, отдающая артерия или правое предсердие) к кровяному насосу, и трубки выходящего потока для того, чтобы нести кровь от кровяного насоса к местоположению в сосудистой системе (такому как принимающая периферическая вена или артерия или принимающее местоположение, такое как правое предсердие). Система кровяного насоса также содержит систему управления. Предпочтительную систему управления разрабатывают для того, чтобы собирать информацию о рабочих параметрах и эффективности системы кровяного насоса и изменениях в сосудистой системе, таких как изменения диаметра отдающей артерии, отдающей вены, принимающей артерии или принимающей вены пациента. Систему кровяного насоса в первую очередь выполняют с возможностью перекачивать такое достаточное количество крови, что желаемое среднее и/или пиковое напряжение сдвига у стенки (НСС) достигают в сегменте кровеносного сосуда («целевой кровеносный сосуд» или «целевой сосуд»), и в течение такого достаточного периода времени, что перманентно или постоянно увеличивают наружный диаметр и диаметр просвета сегмента кровеносного сосуда. Среднее НСС можно вычислять с использованием измеряемого, оцениваемого или предполагаемого диаметра сосуда и измеряемой, оцениваемой или предполагаемой средней скорости потока крови через систему кровяного насоса.
Диаметр кровеносных сосудов можно определять посредством измерения диаметра свободного пространства в центре кровеносного сосуда. В целях этой заявки это измерение обозначают как «диаметр просвета». Диаметр кровеносных сосудов можно определять посредством измерения диаметра таким образом, который включает свободное пространство в центре кровеносного сосуда и стенку кровеносного сосуда. В целях этой заявки это измерение обозначают как «наружный диаметр». Изобретение относится к синхронному и постоянному увеличению наружного диаметра и диаметра просвета периферической вены посредством перемещения крови (предпочтительно с низким пульсовым давлением) в периферическую принимающую вену, тем самым увеличивая скорость крови в периферической принимающей вене и увеличивая НСС на эндотелии периферической принимающей вены. Описаны системы и способы, где скорость крови в периферической принимающей венке и НСС на эндотелии периферической принимающей вены увеличивают посредством использования насоса. Также описаны системы и способы, которые забирают или «всасывают» кровь так, что скорость крови и НСС увеличивают в отдающем сосуде, или артерии или вене. Предпочтительно, насос активно выбрасывает кровь в периферическую принимающую вену, где перекачиваемая кровь имеет сниженное пульсовое давление, например, когда пульсовое давление ниже чем у крови в периферической артерии.
Чтобы начать подробное обсуждение кровяного насоса 25 системы 10, дана ссылка на фиг. 1, на которой представлен изометрический вид кровяного насоса 25. В одном из вариантов осуществления кровяной насос 25 представляет собой миниатюризированный центробежный насос, который имеет магнитный привод, где импеллер насоса приводят во вращательное движение посредством вращения магнитных полей. Например, вращающиеся магнитные поля можно генерировать посредством подачи энергии на множество электромагнитов в конкретной последовательности. В другом примере вращающиеся магнитные поля можно генерировать посредством вращения множества постоянных магнитов или электромагнитов, на которые подают энергию. Насос может иметь диаметр, приблизительно равный таковому у монеты порядка, например, монеты в четверть доллара США, половины доллара США или более крупной. Как показано на фиг. 1, кровяной насос 25 содержит корпус 105, впуск 110, выпуск 115 и кабель 120 питания. Кабель 120 питания соединяет кровяной насос 25 с управляющим устройством 21 системы 14 управления и источником мощности. Источник мощности может представлять собой часть управляющего устройства 21 или быть отдельно. Кабель питания делает возможной связь между управляющим устройством 21 и двигателем кровяного насоса 25. Кабель также можно использовать для того, чтобы передавать мощность от источника мощности к двигателю или насосу. Более конкретно, кабель 120 питания соединяет электрические компоненты магнитного привода внутри корпуса 105 с источником электрической мощности (например, батареей).
Впуск 110 допускает соединение по текучей среде с трубкой 20 входящего потока через соединительное приспособление (например, заершенный конец, фланец и зажимная муфта). Впуск 110 обеспечивает путь текучей среды во входную область (т.е. центр) импеллера насоса. Входная область импеллера может иметь различные конструкции при условии, что кровь на выходе из выпуска получают со скоростью больше, чем на входе. Выпуск 115 допускает соединение по текучей среде с трубкой 30 выходящего потока через соединительное приспособление, похожее на впуск (например, заершенный конец, фланец и зажимная муфта). Выпуск 115 обеспечивает путь текучей среды от выпускной области (т.е. периферии) импеллера насоса.
Как проиллюстрировано на фиг. 2, которая представляет собой разборный изометрический вид кровяного насоса 25, показывающий его компоненты, содержащиеся в корпусе 105, идентифицированный на фиг. 1, кровяной насос 25 содержит впускную головку 125, верхний несущий штырь 130, верхний кожух 135 импеллера, импеллер 140, ось 145 импеллера, сборочный узел 150 магнита, оболочку 155 магнита, нижний несущий штырь 160, нижний кожух 165 импеллера, сборочный узел 170 электрической катушки и крышку 175 оболочки сборочного узла катушки. Впускная головка 125 и верхний кожух 135 импеллера содержат приблизительно по половине впуска 110.
Как показано на фиг. 3A и 3B, которые представляют собой, соответственно, вертикальный вид частичного и полного поперечного сечения кровяного насоса 25, выполненного по линии сечения 3-3 на фиг. 1, компоненты, помеченные в соответствии с фиг. 2, в общем, укладывают друг на друга вместе для того, чтобы формировать насос. Например, как можно понять из фиг. 2-3A, впускная головка 125 и верхний кожух 135 импеллера соответствующим образом содержат верхнюю горизонтально идущую впускную часть 110A и нижнюю горизонтально идущую впускную часть 110B. Типично, впуск и выпуск располагают напротив друг друга и в различных плоскостях. Когда впускную головку 125 и верхний кожух 135 импеллера складывают вместе, они образуют впускной канал 180 текучей среды, идущий через впуск 110 к впускному отверстию импеллера 185. Впускная головка 125 и верхний кожух 135 импеллера соответствующим образом определяют приблизительно верхнюю половину и нижнюю половину канала 180. канавку 190 уплотнения определяют в верхнем кожухе 135 импеллера смежно с границей канала 180 и адаптируют для того, чтобы принимать упругий элемент герметичного уплотнения для создания герметичного уплотнения между впускной головкой 125 и верхним кожухом 135 импеллера.
На фиг. 4A и 4B, соответственно, представлены вертикальный вид частичного и полного поперечного сечения кровяного насоса 25, выполненных по линии сечения 4-4 на фиг. 1. Как можно понять из фиг. 2, 4A, и 4B, верхний кожух 135 импеллера и нижний кожух 165 импеллера соответствующим образом содержат верхнюю горизонтально идущую выпускную часть 115A и нижнюю горизонтально идущую выпускную часть 115B. Когда верхний кожух 135 импеллера и нижний кожух 165 импеллера складывают вместе, они образуют выпускной канал 200 текучей среды (т.е. улитку), который ведет из камеры 205 импеллера к выпуску 115. Верхний кожух 135 импеллера и нижний кожух 165 импеллера соответствующим образом определяют приблизительно верхнюю половину и нижнюю половину канала 200. Канавку уплотнения 211 определяют в нижнем кожухе 165 импеллера смежно с границей канала 200 и камерой 205 импеллера и адаптируют для того, чтобы принимать упругий элемент герметичного уплотнения для создания герметичное уплотнение между верхним кожухом 135 импеллера и нижним кожухом 165 импеллера.
Как показано на фиг. 2-4B, магниты 150 представляют собой множество магнитов в форме кольца или диска. Магниты 150 располагают в объеме оболочки 155 магнита и объеме импеллера 140. Оболочка магнита расположена в импеллере. Оболочка 155 магнита и импеллер 140 соответствующим образом образуют нижнюю и верхнюю части объема, в котором расположены магниты 150. Оболочка магнита, магниты и импеллер объединены вместе в фиксированном неразъемном сборочном узле, который вращается как единое внутри камеры 205 импеллера. Можно использовать альтернативные конструкции, которые вызывают вращение импеллера.
Как проиллюстрировано на фиг. 2-4B, сборочный узел 170 электрической катушки представляет собой множество электрических катушек 210, расположенных по кругу на нижнем кожухе импеллера и необязательно закрытых несущим диском 215. Сборочный узел 170 электрической катушки фиксирован внутри камеры 220 катушки, которая определена в нижнем кожухе 165 импеллера и закрыта крышкой 175 оболочки катушки. Внутренняя нижняя структура 225 отделяет камеру 205 импеллера от камеры 220 катушки. Электрический кабель 120 (см. фиг. 1) идет через проход 230 в нижнем кожухе 165 импеллера к камере 220 катушки и катушкам 210. Электрическая мощность, подаваемая на катушки 210 через электрический кабель 120, генерирует вращающиеся магнитные поля, которые действуют на магниты 150 для того, чтобы вызывать вращение магнитов и импеллера 140, соединенного с магнитами. Вращение импеллера заставляет лопасти импеллера 235 действовать на текучую среду (например, кровь), присутствующую в камере импеллера, что ведет к переносу момента на текучую среду, которую извлекают, поскольку увеличивают давление в выпускном канале 200 текучей среды. Таким образом, текучую среду забирают во впуск 110 при низком давлении и выбрасывают из выпуска 115 при более высоком давлении.
Как показано на фиг. 3A-4B, осью поворота для импеллера 140, магнитов 150 и оболочки 155 является ось 145 импеллера. Как изображено на фиг. 5A-B, верхний несущий штырь 130 и нижний несущий штырь 160 шарнирно несут ось 145 импеллера (т.е. исключают все степени свободы, кроме вращения вокруг одной оси). Верхний несущий штырь 130 расположен и закреплен в цилиндрической выемке 240 во впускной головке 125, тогда как нижний несущий штырь 160 расположен и закреплен в цилиндрической выемке 245 в нижнем кожухе 165 импеллера. Ось 145 импеллера идет через центральное цилиндрическое отверстие 250 в импеллере 140 и фиксирована в нем.
В одном из вариантов осуществления сборочного узла импеллера ось 145 импеллера, верхний несущий штырь 130 и нижний несущий штырь 160 формируют из оксида алюминия высокой степени чистоты, такого как CoorsTek® AD-998. В другом варианте осуществления сборочного узла импеллера ось 145 импеллера, верхний несущий штырь 130 и нижний несущий штырь 160 формируют из упрочненного карбидом кремния оксида алюминия, такого как Greenleaf® WG-300. В обоих вариантах осуществления размеры оси 145 импеллера, верхний несущий штырь 130 и нижний несущий штырь 160 разрабатывают для того, чтобы ограничить контактное напряжение до допустимых уровней для оксида алюминия высокой чистоты или упроченного карбидом кремния оксида алюминия, соответственно, ввиду пиковых осевых нагрузок, создаваемых гидростатическими силами и ударными нагрузками. В другом варианте осуществления сборочного узла импеллера ось 145 импеллера формируют из упрочненного карбидом кремния оксида алюминия, такого как Greenleaf® WG-300, или из оксида алюминия высокой степени чистоты, такого как CoorsTek® AD-998, тогда как верхний несущий штырь 130, нижний несущий штырь 160 или оба формируют из полиэтилена со сверхвысокой молекулярной массой. Дополнительно, геометрия каждого компонента сборочного узла импеллера выбрана для того, чтобы ограничивать усталость и износ для того, чтобы удовлетворять требования системы 10 к безопасности и долговечности.
Как проиллюстрировано на фиг. 6A-7B, поворотный элемент импеллера содержит верхнюю полусферическую выпуклую несущую поверхность 255 и нижнюю полусферическую выпуклую несущую поверхность 260. Как показано на фиг. 6A, 6B, и 8A, один из вариантов осуществления поворотного элемента импеллера имеет общую длину L1 приблизительно 10,15 мм, плюс или минус 0,05 мм, и диаметр D1 оси приблизительно 2 мм, плюс или минус приблизительно 0,01 мм. Верхняя несущая поверхность 255 имеет радиус R1 приблизительно 0,61 мм, плюс или минус 0,02 мм, и проходит на длину L2 за смежную кромку 265 приблизительно 0,55 мм, плюс или минус 0,02 мм. Нижняя несущая поверхность 260 имеет радиус R2 приблизительно 0,31 мм, плюс или минус 0,02 мм, и проходит на длину L21 за смежную кромку 265 приблизительно 0,55 мм, плюс или минус 0,02 мм. Аналогичным образом, другой вариант осуществления оси 145 импеллера, как показано на фиг. 7A, 7B и 8B, имеет общую длину L1 приблизительно 10,15 мм, плюс или минус 0,05 мм, и диаметр D1 оси приблизительно 2 мм, плюс или минус приблизительно 0,01 мм. Верхняя несущая поверхность 255 имеет радиус R1 приблизительно 0,31 мм, плюс или минус 0,02 мм, и проходит на длину L2 за смежную кромку 265 приблизительно 0,55 мм, плюс или минус 0,02 мм. Нижняя несущая поверхность 260 имеет радиус R2 приблизительно 0,31 мм, плюс или минус 0,02 мм, и проходит на длину L21 за смежную кромку 265 приблизительно 0,55 мм, плюс или минус 0,02 мм. Другие размеры и габариты можно использовать в зависимости от размера и эксплуатационных требований насоса. Размеры являются такими, что получаемый насос можно использовать у пациента для того, чтобы увеличивать диаметр сосуда.
Как можно понять из фиг. 5A и 5B, верхний несущий штырь 130 и нижний несущий штырь 160 в общем, имеет такую же конфигурацию, но противоположно ориентированную. Как изображено на фиг. 9A-B, верхний несущий штырь 130 и нижний несущий штырь 160 имеют чашевидную или полусферическую вогнутую несущую поверхность 270 на одном конце и в общем, плоскую поверхность 275 на противоположном конце. Аналогичным образом, на фиг. 10 изображен конкретный вариант осуществления верхнего несущего штыря 130, который имеет чашевидную или полусферическую вогнутую несущую поверхность 270 на одном конце и в общем, плоскую поверхность 275 на противоположном конце. В этом варианте осуществления полусферическая вогнутая несущая поверхность 270 верхнего несущего штыря 130 имеет больший радиус, чем вогнутая несущая поверхность на нижнем несущем штыре 160.
Как проиллюстрировано на фиг. 11A, один из вариантов осуществления несущего штыря 130, 160 имеет общую длину L3 приблизительно 7,5 мм, плюс или минус 0,1 мм, минимальный диаметр D2 оси приблизительно 2 мм, плюс или минус 0,01 мм, и радиус приблизительно 0,6 мм на крае рядом с несущей поверхностью 270. Рядом с ненесущим концом 275 несущего штыря 130, 160, периферически продолжается канавка 280 вокруг штыря для того, чтобы предоставить механический замок для крепления несущего штыря на месте внутри кровяного насоса 25. Аналогичным образом, другой вариант осуществления несущих штырей 130, 160, как проиллюстрировано на фиг. 11B, имеет общую длину L3 приблизительно 7,5 мм, плюс или минус 0,1 мм, минимальный диаметр D2 оси приблизительно 3 мм, плюс или минус 0,01 мм, и радиус приблизительно 0,2 мм на крае рядом с плоским концом 275. Рядом с ненесущим концом несущего штыря 130, 160 имеет место канавка 280, продолжающаяся периферически вокруг оси, используемая для того, чтобы обеспечить механический замок для крепления несущего штыря на месте. Другие размеры и габариты можно использовать в зависимости от размера насоса, материалов несущего штыря и сил, действующих на несущий штырь.
Как можно понять из фиг. 3B, 4B и 5A-11B, выпуклая верхняя несущая поверхность 255 оси 145 импеллера вращательно расположена напротив вогнутой несущей поверхности 270 верхнего несущего штыря 130, а выпуклая нижняя несущая поверхность 260 оси 145 импеллера вращательно расположена напротив вогнутой несущей поверхности 270 нижнего несущего штыря 160. Таким образом, выпуклые несущие концы 255, 260 оси 145 импеллера шарнирно поддерживаются комплементарными вогнутыми несущими поверхностями 270 верхнего и нижнего несущих штырей 130 и 160, соответственно. Соответственно, сборочный узел импеллера может свободно вращаться в камере 205 импеллера на оси 145 импеллера, которую поддерживают конец в конец несущие штыри 130 и 160, в конфигурации, которая обычно известна как «двухштырьковая несущая».
В еще одном другом варианте осуществления сборочного узла импеллера сборочный узел импеллера представляет собой составное из вала 145 импеллера, верхнего несущего штыря 130 и нижнего несущего штыря 160. Составная конструкция полезна в отношении простоты, допусков и стоимости несущих компонентов машинного производства. Все эти конструкции разрабатывают для того, чтобы сделать возможным функционирование двигателя в непрерывном состоянии в течение приблизительно от суток до 1-12 недель или дольше, без поломки.
Как проиллюстрировано на фиг. 12, вал 145 импеллера содержит тело 146 поворотного элемента импеллера и две вставки 147 поворотного элемента импеллера. Тело 146 поворотного элемента импеллера содержит поддающийся машинной обработке металл, такой как нержавеющая сталь, а вставки 147 поворотного элемента импеллера содержит оксид алюминия высокой степени чистоты, такой как CoorsTek AD-998, или упрочненный карбидом кремния оксид алюминия, такой как Greenleaf WG-300. Вставки 147 поворотного элемента импеллера прикрепляют к телу 146 поворотного элемента импеллера посредством адгезива и/или неподвижной посадки. Необязательно, камеру 146A можно заполнять адгезивом или другим заливочным материалом, который устойчив к сжиманию. Указанные выше составная конфигурация и материалы можно применять к вариантам осуществления как верхнего несущего штыря 130, так и нижнего несущего штыря 160, где вставки 148 штыря входят в зацепление со вставками 147 поворотного элемента импеллера. Необязательно, камеры 148A для каждого несущего штыря 130 и 160, можно заполнять адгезивом или другим заливочным материалом, который устойчив к сжиманию.
Впускная головка 125 и ее впускной канал 180 могут иметь различные конфигурации, в зависимости от варианта осуществления кровяного насоса 25. Например, впускная головка 125, изображенная на фиг. 2, показана как имеющая в общем, схожие размеры с верхним кожухом 135 импеллера. В других вариантах осуществления впускная головка 125 может быть по существу меньше и не иметь схожие размеры с верхним кожухом 135 импеллера, как изображено на фиг. 13-15, которые представляют собой виды впускной головки и кожуха импеллера.
Как показано на фиг. 14-16, которые, соответственно, представляют собой вертикальные виды поперечных сечений, выполненных вдоль линий сечения 14-14, 15-15 и 16-16 на фиг. 13, впуск 110 представляет собой конструкцию из двух частей, которая имеет части 110A и 110B, каждая из которых формирует приблизительно половину впуска 110 и соответствующую часть впускной головки 125 и верхнего кожуха 135 импеллера. Каждая часть 110A и 110B определяет собой приблизительно половину впускного канала 180. Как проиллюстрировано на фиг. 14, впускной канал 180 изначально имеет диаметр D5 круга приблизительно 4 мм. Как показано на фиг. 15, впускной канал 180 переходит от круглого поперечного сечения к в общем, прямоугольному поперечному сечению, которое имеет ширину W5 приблизительно 8,4 мм и высоту H5 приблизительно 1,5 мм. Также по мере изменения будут приведены размеры.
Как изображено на фиг. 16, впускной канал 180 окружает впускное отверстие 185 камеры импеллера, которая идет около верхней несущей 145, размещенной во впускной головке 125 и прикрепленной к ней. Как показано на фиг. 17, которая представляет собой изометрическое частичное поперечное сечение впускного отверстия 185 камеры импеллера, впускное отверстие 185 камеры импеллера ведет к камере 205 импеллера рядом со входной областью 300 импеллера 140. Конец верхней несущей оси 145 импеллера идет вверх через отверстие 185 для шарнирного сопряжения с верхним несущим штырем 130, который поддерживает впускная головка 125. Лопасти импеллера 235 идут радиально наружу из входной области 300 импеллера 140.
Как изображено на фиг. 18A и 18B, которые, соответственно, представляют собой вид сверху части впускной головки 110A, определяющей впускной канал 180, и торцевой вертикальный вид того же, в одном из вариантов осуществления впускной канал 180 можно сказать имеет эллиптическую конфигурацию. В частности, цилиндрическая часть 180A канала переходит в части 180C в эллиптическую часть 180B канала. Цилиндрическая островковая часть или грань 305, которая поддерживает верхний несущий штырь 130, в общем, находится в центре в эллиптической части 180B канала и содержит цилиндрическое отверстие 240, которое вмещает верхний несущий штырь 130, схожий с тем, что проиллюстрировано на фиг. 17. В одном из вариантов осуществления цилиндрическая часть 180A канала имеет диаметр D6 приблизительно 4 мм. эллиптическая часть 180B канала имеет ширину W6 приблизительно 12,4 мм. Дистальное расстояние W7 между стенкой грани 305 и дистальным концом стенки, определяющей эллиптическую часть 180B канала, составляет приблизительно 1,5 мм. В других вариантах осуществления цилиндрическая часть 180A канала имеет диаметр D6 приблизительно 5 мм или 6 мм.
Как изображено на фиг. 19A и 19B, на которых представлены виды, соответствующие фиг. 18A и 18B, но для другого варианта осуществления, впускной канал 180 можно сказать так, чтобы он имел круглую конфигурацию. В частности, цилиндрическая часть 180A канала переходит в части 180C в круглую часть 180B канала. Цилиндрическая островковая часть или грань 305, которая поддерживает верхний несущий штырь 130, в общем, располагают в центре круглой части 180B канала и она содержит цилиндрическое отверстие 240, которое вмещает верхний несущий штырь 130, подобно тому, как проиллюстрировано на фиг. 17. В одном из вариантов осуществления цилиндрическая часть 180A канала имеет диаметр D9 приблизительно от 3,5 мм до 4,5 мм, предпочтительно 4 мм. Круглая часть 180B канала имеет ширину W9 приблизительно от 11,5 мм до 13 мм, предпочтительно 12,4 мм. Дистальное расстояние W10 между стенкой грани 305 и дистальным концом стенки, определяющей круглую часть 180B канала, составляет приблизительно от 3,5 мм до 4,5 мм, предпочтительно 4,2 мм. В других вариантах осуществления цилиндрическая часть 180A канала имеет диаметр D6 приблизительно 5 мм или 6 мм.
Как изображено на фиг. 20A и 20B, на которых представлены виды, соответствующие фиг. 18A и 18B, но для другого варианта осуществления, впускной канал 180, можно сказать, имеет сложную дугообразную конфигурацию. В частности, цилиндрическая часть 180A канала переходит в части 180C в сложную дугообразную часть 180B канала. Цилиндрическую островковую часть или грань 305, которая поддерживает верхний несущий штырь 130, в общем, располагают в центре сложной дугообразной части 180B канала и она содержит цилиндрическое отверстие 240, которое вмещает верхний несущий штырь 130, подобно тому, как проиллюстрировано на фиг. 17. В одном из вариантов осуществления цилиндрическая часть 180A канала имеет диаметр D12 приблизительно 4 мм. Сложная дугообразная часть 180B канала имеет ширину W13 приблизительно 8,4 мм. Дистальное расстояние W14 между стенкой грани 305 и куполом 307 дистального конца стенки, определяющей сложную дугообразную часть 180B канала, составляет приблизительно 1,75 мм. Дистальное расстояние W15 между стенкой грани 305 и щелью 310 дистального конца стенки, определяющей сложную дугообразную часть 180B канала, составляет приблизительно от 0,5 мм до 1,5 мм, предпочтительно 1 мм. В других вариантах осуществления цилиндрическая часть 180A канала имеет диаметр D6 приблизительно 5 мм или 6 мм.
Как изображено на фиг. 21-23, на которой представлены те же виды, что и на фиг. 18A, но для трех других вариантов осуществления, впускной канал 180, можно сказать, имеет каплевидную конфигурацию. В частности, цилиндрическая часть 180A канала переходит в каплевидную часть 180B канала. Цилиндрическую островковую часть или грань 305, которая поддерживает верхний несущий штырь 130, в общем, располагают в центре каплевидной части 180B канала, и она содержит цилиндрическое отверстие 240, которое вмещает верхний несущий штырь 130, подобный тому, что проиллюстрировано на фиг. 17. В одном из вариантов осуществления цилиндрическая часть 180A канала имеет диаметр D15 приблизительно 4 мм. каплевидная часть 180B канала имеет ширину W20 приблизительно 8 мм. грань 305 имеет диаметр D16 4 мм. переходная область 180C канала 180 между каплевидной частью 180B и цилиндрической частью 180A имеет стенки, которые расходятся друг от друга под углом AN1 приблизительно 8 градусов. В других вариантах осуществления цилиндрическая часть 180A канала имеет диаметр D6 приблизительно 5 мм или 6 мм.
Для варианта осуществления на фиг. 21, дистальное расстояние W21 между стенкой грани 305 и дистальным концом стенки, определяющей каплевидную часть 180B канала, составляет приблизительно 2 мм. Для варианта осуществления на фиг. 22, дистальное расстояние W21 между стенкой грани 305 и дистальным концом стенки, определяющей каплевидную часть 180B канала, составляет приблизительно 1 мм. Для варианта осуществления на фиг. 23, дистальное расстояние W21 между стенкой грани 305 и дистальным концом стенки, определяющей каплевидную часть 180B канала, составляет приблизительно 0 мм, поскольку грань пересекает дистальный конец стенки, определяющей каплевидную часть канала.
Как проиллюстрировано на фиг. 24A и 24B, которые, соответственно, представляют собой вид сверху и вертикальный вид сбоку другого варианта осуществления впускной головки 110 и впускного канала 180, подобно тому, что представлено на фиг. 21, дугообразная клиновидная часть 320 может идти между дистальной стенкой каплевидной части 180B канала к дистальной стороне грани 305. В таком варианте осуществления цилиндрическую островковую часть или грань 305 в общем, располагают в центре каплевидной части 180B канала и она содержит цилиндрическое отверстие 240, которое вмещает верхний несущий штырь 130, аналогично проиллюстрированному на фиг. 17. В одном из вариантов осуществления размерная конфигурация варианта осуществления, изображенного на фиг. 24A и 24B, по существу представляет собой то же самое, что рассмотрено в отношении фиг. 21, значительное различие заключается в присутствии дугообразной клиновидной части 320. Как можно понять из фиг. 24A и 24B, клиновидная часть 320 имеет стенки, которые являются дугообразными, чтобы плавно загибаться от верхней и смежной стенки каплевидной части 180B канала к вертикальному расширению грани 305. Можно увидеть, что такая клиновидная часть 320 имеет место в варианте осуществления, изображенном на фиг. 3A, 3B и 17, и может уменьшать области застоя потока в впускном канале и облегчать тангенциальный входящий поток текучей среды через впускное отверстие 185 камеры импеллера.
Как показано на фиг. 25, которая представляет собой изометрический вид кровяного насоса 25 с удаленным верхним кожухом импеллера для того, чтобы показать импеллер 140, занимающий камеру 205 импеллера, выпускной канал 200 текучей среды выходит из камеры импеллера по существу по касательной к внешнему периферическому краю импеллера. Как показано на фиг. 3B, 4B, 17 и 25, множество каналов 350 (т.е. отверстий для смыва) распределено периферически вокруг центрального отверстия 250 на поворотном элементе импеллера, и каналы 350, в общем, параллельны центральному отверстию 250 и идут через всю толщину импеллера к дневному свету как на верхней, так и на нижней границах импеллера. Нижние отверстия каналов 350 расположены близко к нижней области контакта несущей между нижней несущей 165 и нижней несущей поверхностью 260 поворотного элемента импеллера (см. фиг. 8). Как результат, текучая среда может течь через каналы 350 для того, чтобы очищать нижнюю область контакта несущей. Например, текучая среда может течь через впускное отверстие 185 камеры импеллера, радиально наружу вдоль лопастей импеллера 235, через пропуск под импеллером и затем обратно в область впускного отверстия 185 камеры импеллера. Этот поток крови служит для того, чтобы очищать нижнюю сторону импеллера, нижнюю область контакта несущей, верхнюю область контакта несущей и область за гранью 305.
Как можно понять из фиг. 3B, 5, 17 и 25, в одном из вариантов осуществления импеллер 140 вращательно поддерживает камера 205 импеллера на валу 145, идущем через центр импеллера. Вал имеет верхний конец несущей и нижний конец несущей, каждый конец поворотно соединен с корпусом насоса с возможностью вращения. Импеллер имеет верхнюю поверхность, нижнюю поверхность и множество каналов 350, идущих через импеллер от верхней поверхности к нижней поверхности. Множество каналов в общем, равномерно распределено радиально вокруг центра импеллера. Кроме того, множество каналов идет через импеллер в общем, параллельно друг другу и валу. Впускной канал 180 ведет ко впускному отверстию 185 камеры импеллера. Впускной канал открывается в камеру импеллера в общем, перпендикулярно впускному каналу. Впускное отверстие идет вдоль по меньшей мере части внешней периферической поверхности вала рядом с верхним концом несущей. Впускное отверстие и отверстия открыты в направлениях, которое в общем, параллельны друг другу. Во время работы насоса, по меньшей мере часть крови, которую перекачивают через камеру импеллера, циркулирует вдоль верхней и нижней поверхностей импеллера через каналы. Таким образом, каналы импеллера устраняют тупиковые концы потоков вокруг импеллера, в общем, сохраняя течение крови вдоль всех контактирующих с кровью поверхностей импеллера. Соответственно, каналы помогают для того, чтобы предотвращать накопление крови вблизи от пересечения вала/импеллера и вдоль сторон и нижней поверхности импеллера.
Корпус и импеллер кровяного насоса 25, включая контактирующие с кровью поверхности, выполняют из различных жестких биологически совместимых материалов. Одна возможность включает пластмассы, более предпочтительно отливаемые под давлением пластмассы, такие как PEEK. В различных вариантах осуществления, контактирующие с кровью поверхности кровяного насоса 25 могут содержать Ti6Al4V, Ti6Al7Nb или другие коммерческие чистые сплавы титана. В одном из вариантов осуществления поверхности компонентов насоса, доступные для крови пациента, могут иметь антитромботические покрытия. Например, просветные поверхности можно покрывать Astute®, антитромботическим покрытием на основе гепарина производства компании BioInteractions Ltd., или Applause™, гепариновым покрытием производства компании SurModics, Inc.
В других вариантах осуществления поверхности компонентов системы кровяного насоса, контактирующие с тканью пациента, могут иметь противомикробные покрытия. Например, внешние поверхности синтетических трубок 16 и 18 или внешние поверхности насоса или силового кабеля 120 (который также известен как «провод») можно покрывать Avert®, поверхностно-активным противомикробным покрытием производства компании BioInteractions Ltd.
В различных вариантах осуществления, кровяной насос 25 можно имплантировать пациенту. Наоборот, в других вариантах осуществления кровяной насос 25 можно оставлять вне пациента. Например, когда располагают вне пациента, кровяной насос 25 можно крепить к пациенту с использованием ленты, швов или других подходящих средств для крепления насоса к пациенту. Систему 10 может питать носимая электроника, которая имеет перезаряжаемые батареи 28, как показано на фиг. 34.
Насос для насосной системы 10, описанной в настоящем документе, может представлять собой роторный насос, включая, например, насос с центробежным потоком, осевой насос, насос с радиальным потоком или радиально-осевой насос. Как показано на фиг. 1-15, в одном из вариантов осуществления насос представляет собой центробежный насос. Не принимая во внимание конкретные ограничения, кровяной насос 25 можно выполнять так, чтобы обычно перекачивать, например, приблизительно от 0,05 до 1,0 л/мин, от 0,2 до 1,5 л или от 0,5 до 3,0 л/мин.
Несмотря на то, что конфигурация насоса, рассмотренная выше в отношении фиг. 1-25, является благоприятной, другие конфигурации насосов можно использовать с насосными системами и способами, описанными в настоящем документе. Соответственно, системы и способы, описанные в настоящем документе, не следует ограничивать конфигурацией насоса, рассмотренной выше в отношении фиг. 1-25, а следует включать насосы всех типов, применимые для систем и способов, описанных в настоящем документе.
Предпочтительный вариант осуществления насосной системы 10, описанный в настоящем документе в отношении фиг. 1-25, отвечает нескольким уникальным потребностям, которые не могут быть удовлетворены какими-либо системами кровяных насосов, известными в данной области. В частности, насосную систему Arteriovenous Fistula Eligibility («AFE») («систему AFE») можно выполнять с возможностью предполагаемого использования в течение вплоть до 12 недель. Кроме того, насосную систему AFE можно выполнять в качестве центробежной системы роторного кровяного насоса для низкой скорости потока (например, от 50 до 1500 мл/мин) и среднего диапазона давлений (например, от 25 до 350 мм рт. ст.). Управляющую схему, используемую в AFE насосной системе, можно оптимизировать для того, чтобы поддерживать стационарное и повышенное средне НСС 0,76-23 Па в целевой вене, которая непосредственно соединена по текучей среде с кровяным насосом или трубкой системы кровяного насоса, или целевой вене, которая соединена по текучей среде с веной, которая непосредственно соединена по текучей среде с кровяным насосом или трубкой системы кровяного насоса. Насосная система AFE выполнена с возможностью работать в течение такого периода времени, что наружный диаметр и диаметр просвета целевой вены будет постоянно увеличен на 25%, 50% или 100% или больше, используя восприятие рабочих параметров и периодическую корректировку скорости.
Для определенных вариантов осуществления трубку входящего потока можно помещать посредством чрескожного доступа, причем часть трубки входящего потока находится во внутрисосудистом местоположении, и трубку выходящего потока можно помещать посредством хирургического доступа, который можно адаптировать к начальному диаметру вены между 1-6 мм. В этой ситуации повышенное среднее НСС в целевом кровеносном сосуде возникает в результате выброса крови в целевой кровеносный сосуд.
Для других вариантов осуществления трубку выходящего потока можно помещать посредством чрескожного доступа, причем часть трубки выходящего потока находится во внутрисосудистом местоположении, а трубку входящего потока можно помещать посредством хирургического доступа, который можно адаптировать к начальному диаметру вены или артерии между 1-6 мм. В этой ситуации повышенное среднее НСС в целевом кровеносном сосуде возникает в результате удаления крови из целевого кровеносного сосуда. В определенной ситуации НСС можно повышать в как в кровеносном сосуде, откуда кровь удаляют, так и в кровеносном сосуде, куда кровь выбрасывают, сделав оба кровеносных сосуда целевыми кровеносными сосудами. Насосная система 10 позволяет достичь как легкости вставления/удаления, так и сопротивления инфицированию. Насосная система 10 представляет собой мобильную систему с насосом, который можно адаптировать или для имплантации или для экстракорпорального размещения. В различных вариантах осуществления насосную систему 10 питает носимая электроника с перезаряжаемыми батареями.
Насосная система 10 содержит трубку 20 входящего потока и трубку 30 выходящего потока, как показано на фиг. 26. Трубка 20 входящего потока расположена в соединении по текучей среде с одним местоположением в сосудистой системе, забирает кровь из этого местоположения и несет ее к кровяному насосу 25. В определенных вариантах осуществления трубка 20 входящего потока выполнена с возможностью размещения по меньшей мере части трубки входящего потока внутри просвета сосудистой системы. В других вариантах осуществления трубку 20 входящего потока соединяют с кровеносным сосудом посредством хирургического анастомоза. Трубка 30 выходящего потока выполнена с возможностью создания соединения по текучей среде с другим местоположением в сосудистой системе и направляет кровь от кровяного насоса 25 к другому местоположению в сосудистой системе. В определенных вариантах осуществления трубка выходящего потока 20 выполнена с возможностью размещения по меньшей мере части трубки выходящего потока внутри просвета сосудистой системы. В других вариантах осуществления трубку 30 выходящего потока соединяют с кровеносным сосудом посредством хирургического анастомоза.
Каждая из трубок 20 и 30 может иметь длину, которая находится в диапазоне между 2 см и 110 см и общую объединенную длину от 4 см до 220 см. Длину каждой трубки 20 и 30 можно усекать до желаемой длины, как определяет местоположение кровяного насоса 25 и местоположение соединений между трубками и сосудистой системой. Трубки 20 и 30 также имеют тонкие, но устойчивые к сжиманию и устойчивые к сгибанию стенки, которые имеют толщину между 0,5 мм и 4 мм и внутренние диаметры, которые находятся между 2 мм и 10 мм. Предпочтительно, внутренние диаметры для трубок составляют от 4 до 6 мм.
Трубки 20 и 30 входящего потока и выходящего потока можно соединять с кровяным насосом 25 с использованием любого подходящего соединителя, который является прочным, препятствует протечке и не восприимчив к непреднамеренному расцеплению. Типично, ведущий край соединителя является тонким, чтобы минимизировать ступенчатое изменение диаметра пути текучей среды между внутренним диаметром трубок 20 и 30 и внутренним диаметром соединителя. Предпочтительно, ступенчатое изменение диаметра пути текучей среды должно составлять меньше 0,5 мм. В одном из вариантов осуществления, как показано фиг. 27A-27D, трубки 20 и 30 соединены с кровяным насосом 25 с использованием заершенных элементов 400A и 400B и радиально сжимаемых держателей (т.е. зажимных муфт) 402A и 402B. В качестве примера, а не ограничения, радиально сжимаемые держатели 402A и 402B могут представлять собой держатели Barблок®, изготавливаемые компанией Saint-Gobain Performance Plastics, подразделением Saint-Gobain S.A. со штаб-квартирой в Курбевуа, Франция. В другом варианте осуществления трубки 20 и 30 соединены с кровяным насосом 25 с использованием стерильных соединителей Pure-Fit®, также изготавливаемых компанией Saint-Gobain Performance Plastics.
Радиально сжимаемые держатели 402A и 402B помещают на проксимальные концы 404 и 406 трубок 20 и 30 входящего потока и выходящего потока, соответственно. Затем трубки 20 и 30 помещают на заершенный элемент 400A и 400B для того, чтобы формировать соединение по текучей среде между трубками и кровяным насосом 25. Цанги 408A и 408B радиально сжимаемых держателей 402A и 402B помещают вдоль трубок 20 и 30 для того, чтобы окружать трубки и заершенные элементы 400A и 400B. Затем внешние муфты 410A и 410B радиальных сжимаемых держателей 402A и 402B перемещают вдоль продольной оси держателей для сжимаемого зацепление соответствующих цанг 408A и 408B, трубок 20 и 30 и заершенных элементов 400A и 400B. В одном из вариантов осуществления внешние муфты 410A и 410B перемещают посредством сжимаемого инструмента, выполненного с возможностью входить в зацепление с внешними муфтами и поддерживать закраину 412A и 412B заершенных элементов 400A и 400B, соответственно. Сжимаемый инструмент также может быть выполнен с возможностью удалять радиальные сжимаемые держатели 402A и 402B.
В других вариантах осуществления можно использовать альтернативные соединители. Предпочтительно альтернативные соединители являются прочными, препятствуют протечке и препятствуют непреднамеренному смещению. Например, как показано на фиг. 28A-B, трубки 20 и 30 входят в зацепление с заершенными элементами, похожими на заершенные элементы 400A и 400B, чтобы формировать соединение по текучей среде между трубками и кровяным насосом 25. Трубки 20 и 30 закрепляют на заершенных элементах с использованием круглых зажимов 414A и 414B, которые прикладывают радиально сжимающее усилие к части трубок на заершенных элементах посредством храпового механизма 416A-416B зажимов. Круглые зажимы 414A и 414B обеспечивают устойчивое к протечкам и прочное соединение, которое может быть снято с использованием инструмента для снятия (не показан), который освобождает храповые механизмы 416A-416B зажимов.
В другом варианте осуществления трубка 20 входящего потока и трубка 30 выходящего потока содержат боковые порты, которые обеспечивают управляемый доступ к пути текучей среды. Боковые порты можно использовать периодически для того, чтобы вводить контраст в путь текучей среды для того, чтобы сделать возможной визуализацию посредством флуороскопии, чтобы получать образцы крови, чтобы вливать лекарственные средства или для других полезных в клинике целей. Подходящей является любая конструкция бокового порта, которая делает возможным периодический доступ к пути текучей среды и не пропускает или не изменяет путь потока текучей среды, когда доступ не осуществляют. В качестве примера, а не ограничения, боковой порт может представлять собой элемент порта «T», который содержит контрольный клапан, который открывается, когда вставляют шприц, и закрывается, когда шприц удаляют. Как показано на фиг. 29A-B, сборочный узел 418 порта «T» с использованием вспомогательной трубки 420 находится в соединении по текучей среде со выпуском насоса 115 и трубкой 30 выходящего потока.
В другом варианте осуществления в боковом порте для трубки 20 входящего потока, трубки 30 выходящего потока или обеих используют порт 422 доступа с перегородкой, который имеет перегородку 424, как показано на фиг. 30A-B, через которую подходящую гиподермальную иглу можно вставлять для доступа, и затем удалять, после чего перегородка закрывается, предотвращая потерю текучей среды из трубки. Подходящие материалы для перегородки 424 включают, но не ограничиваясь этим, силикон, полиуретан и другие эластомерные полимеры. Сегмент трубки 20 или 30 входящего потока и/или выходящего потока, соответственно, который содержит перегородку 424, имеет подходящую толщину для того, чтобы закрывать отверстие от гиподермального прокола, когда удаляют иглу. Как показано на фиг. 30A-B, показан порт 422 доступа с перегородкой, в которой перегородка 424 составляет часть трубки 30 выходящего потока. В качестве примера, а не ограничения, порт 422 доступа с перегородкой может идти приблизительно на один сантиметр по длине трубки 30 выходящего потока. Перегородку 424 можно прикреплять к трубке 30 выходящего потока посредством любого подходящего средства, включая в качестве неограничивающих примеров, адгезивное прикрепление, термическое соединение и термическое соединение между внутренними и внешними слоями стенки трубки.
В различных вариантах осуществления, трубки 20 и 30 могут содержать материалы, широко используемые для изготовления гемодиализных катетеров, такие как полиуретан, поливинилхлорид, полиэтилен, силикон и политетрафторэтилен (ПТФЭ), и включают Pellethane® или Carbothane®. В других вариантах осуществления трубки могут содержать материалы, широко используемые для изготовления гемодиализных трансплантатов или синтетических периферических шунтирующих трансплантатов, таких как пористый политетрафторэтилен (пПТФЭ) или дакрон. В дополнительных вариантах осуществления трубка может содержать комбинации полиуретана, поливинилхлорида, полиэтилена, силикона, ПТФЭ, Pellethane®, Carbothane®, Carbothane® PC-3575, пПТФЭ или дакрона.
Например, вся длина трубки 20 входящего потока может состоять из полиуретана. В другом варианте осуществления, представленном на фиг. 31, сегмент 500 трубки 30 выходящего потока, выполненный с возможностью создания соединения по текучей среде с кровяным насосом 25, состоит из полиуретана, тогда как сегмент 502 трубки выходящего потока, выполненный с возможностью создания соединения по текучей среде с сосудистой системой, состоит из пПТФЭ.
В качестве примера, а не ограничения, и как показано на фиг. 41, которая представляет собой продольное сечение сочленения между проксимальным сегментом 500 и дистальным сегментом 502, проксимальный сегмент 500 трубки 30 выходящего потока соединен с дистальным сегментом 502 трубки выходящего потока во время процесса изготовления посредством размещения одного или нескольких слоев 502A пПТФЭ из дистального сегмента между слоями 500A полиуретана из проксимального сегмента. Затем осуществляют термическое ламинирование перекрывающихся слоев полиуретана и пПТФЭ для того, чтобы связывать проксимальный сегмент 500 и дистальный сегмент 502 вместе.
В другом примере одно или несколько отверстий выполняют внутри перекрывающихся секций пПТФЭ сегмента 502 перед термическим ламинированием трубки. Когда трубку 30 выходящего потока нагревают до температуры, которая достаточна для того, чтобы плавить полиуретан без плавления пПТФЭ (например от 200°F до 500°F), расплавленным полиуретаном заполняют отверстия, созданных в пПТФЭ сегменте 502, и затем остужают его в них. Внутренние и внешние слои полиуретана сегмента 500 соединяют в отверстиях, чтобы механически соединять два сегмента 500 и 502 вместе, а также механически соединять внутренние и внешние слои полиуретана в перекрывающемся сегменте.
Вариант осуществления трубки 30 выходящего потока, которую изготавливают так, чтобы иметь пПТФЭ слой 502A, расположенный между полиуретановыми слоями 500A, полезен в том отношении, что пПТФЭ слой 502A можно легко пришивать к кровеносным сосудам с использованием стандартных способов. Это также относится к случаю с трубкой 20 входящего потока, изготавливаемой, как рассмотрено выше в отношении фиг. 41.
Как проиллюстрировано на фиг. 42, которая представляет собой вид сверху медицинского набора 1000, кровяной насос 25, трубку 20 входящего потока, трубку 30 выходящего потока, управляющее устройство 21 и силовой кабель 120 можно предоставлять в стерильной упаковке 1005 с инструкциями 1010 о том, как собирать и имплантировать насосную систему пациенту. Медицинский набор 1000 также может содержать заершенные элементы 400A и 400B и радиально сжимаемые держатели 402A и 402B. В одном из вариантов осуществления одна или обе трубки 20, 30 изготавливают, как описано выше в отношении фиг. 41, и закрывают внутри стерильной упаковки 1005 наряду с кровяным насосом 25. Медицинский набор 1000, как минимум, содержит систему для выброса или удаления крови и инструкции по осуществлению и использованию.
В одном из вариантов осуществления работой кровяного насоса 25 управляют через блок управления 21 насосной системы 14 управления посредством показаний давления выходящего потока и корректировки скорость насоса, соответственно. Например, как изображено на фиг. 43, которая представляет собой схематическое изображение насосной системы 10, управляемой в соответствии с давлением выходящего потока, датчик давления 1050 выходящего потока может быть функционально связан с выпуском 115 кровяного насоса 25 или ниже по потоку, например, где-то вдоль длины трубки 30 выходящего потока. Процессор 24 может сравнивать показания давления с датчика давления 1050 выходящего потока с диапазоном целевых давлений выходящего потока, который хранится в памяти 27. Затем процессор должен корректировать скорость привода 170 насоса соответствующим образом для того, чтобы показания давления с датчика давления 1050 выходящего потока находились в диапазоне целевых давлений выходящего потока, хранящегося в памяти.
В одном из вариантов осуществления система 14 управления также содержит датчик давления 1060 входящего потока, который может быть функционально связан со впуском 110 кровяного насоса 25 или выше по потоку, например, где-то вдоль длины трубки 20 входящего потока. Процессор 24 может считывать как показания давления с датчика давления 1050 выходящего потока, так и показания давления с датчика давления 1060 входящего потока и вычислять разность давлений. Эту разность давлений затем можно сравнивать с диапазоном целевых разностей давлений, который хранится в памяти 1055. Затем процессор должен корректировать скорость привода 170 насоса для того, чтобы вычисляемая разность давлений находилась в диапазоне целевых разностей давлений, который хранится в памяти.
В других вариантах осуществления трубки 20 и 30 входящего потока и выходящего потока могут быть из любой материала или комбинации материалов при условии, что трубки 20 и 30 проявляют желаемые характеристики, такие как гибкость, стерильность, сопротивление сгибанию и сжиманию, и можно их соединять с кровеносным сосудом через анастомоз или вставлять в просвет кровеносного сосуда, при необходимости. Кроме того, трубки 20 и 30 предпочтительно по желанию проявляют характеристики, необходимые для подкожного туннелирования, например, имеют скользкие покрытия внешней поверхности, такие как покрытия с повышенным скольжением Harmony™.
В качестве другого примера трубки 20 и 30 входящего потока и выходящего потока могут иметь внешний слой, состоящий из другого материала, нежели внутренний слой. Все или часть внешних слоев трубок 20 и 30 входящего потока и выходящего потока также можно покрывать смазкой, такой как кремниевое или гидрофильное покрытие для того, чтобы способствовать подкожному туннелированию и удалению из организма и чтобы смягчать возможные аллергические реакции на латекс. В определенных вариантах осуществления по меньшей мере часть поверхности внешнего слоя трубок 20 и 30 входящего потока и выходящего потока может иметь противомикробное покрытие. В других вариантах осуществления по меньшей мере часть поверхности кровяного насоса 25 или силового кабеля 120 может иметь противомикробное покрытие. Например, можно использовать Avert TM, поверхностно-активное противомикробное покрытие. В определенных вариантах осуществления часть поверхности внешнего слоя трубки входящего потока и выходящего потока может содержать материал для того, чтобы сопротивляться инфекции и содействовать встраиванию в ткань, такой как дакрон велюр, полиэфирный велюр или силикон. Один такой материал представляет собой противомикробный манжет VitaCuff® производства компании Vitaphore Corp. манжет VitaCuff состоит из двух концентрических слоев материала. Внутренний слой сконструирован из медицинского силикона. Внешний, граничащий с тканью слой содержит коллагеновую матрицу с противомикробной активностью, которая свойственна ионам серебра, связанным с коллагеном. В определенных вариантах осуществления этот материал поглощает физиологические текучие среды, быстро расширяется и помогает предоставлять физический барьер на месте выхода. Происходит врастание ткани, что дополнительно закрепляет трубку на месте и уменьшает движение трубки для того, чтобы снижать заболеваемость инфекцией места входа.
В определенных вариантах осуществления по меньшей мере часть контактирующих с кровью просветных поверхностей трубок 20 и 30 входящего потока и выходящего потока можно покрывать антитромботическим средством или материалом. Аналогичным образом, по меньшей мере часть контактирующих с кровью поверхностей кровяного насоса 25 можно покрывать антитромботическим средством или материалом. Например, поверхности можно покрывать покрытием Applause® компании SurModics, Inc., или покрытием Astute® компании BioInteractions Ltd., оба они представляют собой гидрофильные сополимерные покрытия, содержащие гепарин.
В определенных вариантах осуществления по меньшей мере часть трубки 20 входящего потока и трубки 30 выходящего потока предпочтительно упрочняют для того, чтобы сопротивляться сгибанию и сжиманию. Например, трубки 20 и 30 можно упрочнять с использованием нитинола или другого сплава с памятью формы или саморасправляющегося или радиально расширяющегося материала. Предпочтительно, слой сплетенного нитинола оборачивают вокруг по меньшей мере части каждой трубки 20 и 30 или встраивают в стенки трубки. В одном из вариантов осуществления трубку 20 входящего потока упрочняют сплетенным нитинолом, встроенным в стенки трубки. В другом варианте осуществления трубку входящего потока можно упрочнять сплетенной нержавеющей сталью, которую встраивают в стенки трубок 20 и 30. Альтернативно, спираль из нитинола или ПТФЭ можно оборачивать вокруг частей трубок* 20 и 30 или встраивать в них. Например, как показано на фиг. 31, дистальный сегмент 502 трубки 30 выходящего потока имеет пТФЭ спираль 504, встроенную вокруг пПТФЭ трубки, образующей стенку 514 трубки. В других вариантах осуществления спираль из нитинола можно оборачивать вокруг частей трубок 20 и 30 или встраивать в них.
Плотность плетения сплетенного нитинола, встроенного в обе трубки 20 и 30 входящего потока и выходящего потока, обыкновенно измеряемый в пикселях на дюйм («PPI»), типично составляет между приблизительно 10 и 200, и предпочтительно между приблизительно 20 и приблизительно 60. В различных вариантах осуществления, плотность плетения может варьировать вдоль длины трубок 20 и 30 входящего потока и выходящего потока. Например, плотность плетения может быть выше в частя трубок 20 и 30, смежных с кровяным насосом 25, чтобы поддерживать более высокую жесткость трубки и минимизировать риск сжимания трубки извне или коллапса трубки во время всасывания, при этом делая возможной более высокую гибкость в различных сегментах трубок.
В одном из вариантов осуществления, как показано на фиг. 32A-32B, во внутрисосудистой части 506 трубки 20 входящего потока создают окошки с помощью множества боковых отверстий 508. Эти боковые отверстия усиливают входящий поток крови и снижает риск всасывания стенки вены или правого предсердия концевым отверстием в случае частичной обструкции кончика трубки. Предпочтительно, боковые отверстия 508 являются круглыми и имеют диаметр в диапазоне от 0,5 мм до 1,5 мм. Однако, в других вариантах осуществления боковые отверстия 508 могут быть эллиптическими или иметь какую-либо другую геометрическую форму и размер, подходящие для внутрисосудистой аспирации крови.
Как показано на фиг. 31 и 32A-32B, дистальный конец 506 трубки 20 входящего потока и дистальный конец 510 трубки 30 выходящего потока может быть срезанным и скошенным под углом между 10° и 80°. В определенных вариантах осуществления скос снижает риск засасывания стенки вены или правого предсердия концевым отверстием в случае частичной обструкции кончика трубки во время аспирации крови. В других вариантах осуществления скос увеличивает площадь трубки, которой она соединяется с сосудистой системой в анастомозном соединении. Предпочтительно, но без ограничения, дистальные концы 506 и 510 скошены под углом 45°. Трубки 20 и 30 входящего потока и выходящего потока адаптируют для легкого вставления, подкожного туннелирования и удаления, при этом также обеспечивая сопротивление инфицированию и тромбозу.
В одном из вариантов осуществления часть трубки 20 входящего потока можно вставлять в просвет кровеносного сосуда и продвигать в желаемое положение с использованием чрескожного доступа или открытого хирургического доступа. Чтобы содействовать расположению трубок 20 и 30 входящего потока и выходящего потока, трубки могут иметь рентгеноконтрастные маркерные полосы или другие рентгеноконтрастные материалы, встроенные в стенки 512 и 514 трубок входящего потока и выходящего потока, соответственно, которые видны при флуороскопии. Например, части трубок 20 и 30 входящего потока и выходящего потока могут состоять из полиуретана Carbothane® PC-3575, в который встроены соли сульфата бария. В других вариантах осуществления части трубок 20 и 30 входящего потока и выходящего потока, которые выполнены с возможностью вставления в просвет сосудистой системы, могут иметь саморасправляющиеся или радиально расширяющиеся (такие, как можно выполнять посредством встраивания нитинола) стенки с тем, чтобы диаметр внутрисосудистой части трубок 20 и 30 входящего потока и выходящего потока совпадал с диаметром сосудистой системы в этом местоположении, таким как видно при использовании саморасправляющегося сегмента из GORE® Hybrid Vascular Graft.
В различных вариантах осуществления, включая вариант осуществления, представленный на фиг. 37, трубки 20 и 30 входящего потока и выходящего потока можно прикреплять с кровеносным сосудам с использованием хирургического анастомоза, используя шов непрерывного или раздельного типа, которое далее описывают как «анастомозное соединение». Анастомозное соединение также можно выполнять с использованием хирургических зажимов и других стандартных путей создания анастомоза. Например, анастомозное соединение можно создавать между пПТФЭ дистальным сегментом 502 трубки 30 выходящего потока и кровеносным сосудом.
В определенных вариантах осуществления, где создают анастомозное соединение, трубку 30 выходящего потока прикрепляют к кровеносным сосудам, которые имеют начальный диаметр между 1 мм и 20 мм и предпочтительно сосудам, которые имеют начальный диаметр между 1 мм и 6 мм.
Наоборот, в других вариантах осуществления, представленных на фиг. 32A-B и 37-40, части трубок 20 и 30 входящего потока и выходящего потока размещают в кровеносном сосуде или правом предсердии. Например, дистальный конец 506 трубки 20 входящего потока может быть расположен в правом предсердии или верхней полой вене. Как показано на фиг. 32A-32B, боковые отверстия 508 способствуют аспирации или выбросу крови, когда дистальный конец 506 помещен внутри сосуда.
В различных других вариантах осуществления, по меньшей мере одна из трубок 20 и 30 входящего потока и выходящего потока может быть совместима для использования с аппаратом для гемодиализа. Например, пациент, использующий систему кровяного насоса 10, также может нуждаться в том, чтобы получать лечение гемодиализом. В этом примере кровь можно забирать из системы кровяного насоса, пропускать через аппарат для гемодиализа и затем выбрасывать обратно в систему кровяного насоса для доставки обратно в сосудистую систему, тем самым устраняя необходимость создавать дополнительное место сосудистого доступа у пациента.
Как показано на фиг. 35, один из вариантов осуществления системы 14 управления содержит управляющее устройство 21, которое имеет по меньшей мере один процессор 24 и память 27 для доставки мощности на насос и получения информации от кровяного насоса 25, посредством которых информацию используют для того, чтобы задавать и контролировать скорость насоса и оценивать скорость потока текучей среды через насосную систему. Процессор 24 выполнен с возможностью считывания, обработки и исполнения систем, способов и инструкций, закодированных на машиночитаемой среде. Затем система 14 управления оценивает напряжение сдвига у стенки в целевом сосуде с использованием измеряемого или оцениваемого диаметра сосуда и измеряемой или оцениваемой средней скорости потока насосной системы. Управляющее устройство также содержит источник мощности 26, необязательно имеющий батарею 28.
В одном из вариантов осуществления система 14 управления получает обратную связь с датчиком от одного или нескольких датчиков 122. Любые из множества подходящих датчиков можно использовать для того, чтобы обнаруживать любые из множества изменений в физическом количестве крови, кровяном насосе 15, системе кровяного насоса 10 и/или целевом сосуде. Датчики 122 генерируют сигнал, указывающий на изменение, подлежащее анализу и/или обработке. По существу, датчики 122 осуществляют мониторинг различных свойств системы кровяного насоса 10, крови, текущей через систему и целевого кровеносного сосуда на изменения, которые можно обрабатывать и сравнивать с желаемыми эталонными значениями или заданными стандартами. Желаемые эталонные значения или заданные стандарты можно хранить в базе данных или другой подходящей среде.
В различных вариантах осуществления, один или несколько датчиков 122 могут находиться в связи с кровяным насосом 25, трубкой 20 входящего потока, трубкой 30 выходящего потока, отдающим сосудом или местоположением или принимающим сосудом или местоположением. В различных вариантах осуществления систему 14 управления или ее часть можно располагать внутри в корпусе или кожухе кровяного насоса 25. Например, один или несколько датчиков 122 можно располагать во впуске 110 или выпуске 115 кровяного насоса 25. В других вариантах осуществления система 14 управления может быть внешней по отношению к насосу.
Напряжение сдвига у стенки можно использовать в качестве переменной для того, чтобы конфигурировать работу насосной системы 10 для того, чтобы достичь увеличения наружного диаметра и диаметра просвета целевого сосуда или увеличения длины целевого сосуда.
Предполагая, что поток крови по Хагену-Пуазейлю (т.е. ламинарный поток с полностью проявленным параболическим профилем скоростей) в просвете сосуда, который имеет круглое поперечное сечение, НСС можно определять с использованием уравнения:
НСС (Па)=4Qμ/πR3 Уравнение 1,
где:
Q = скорость потока (м3/с)
μ = вязкость крови (Па/с)
R = радиус сосуда (м)
Способ управления напряжением сдвига у стенки №1: ручной
Средним и/или пиковым НСС в целевом кровеносном сосуде можно управлять посредством корректировки скорости насоса, которая влияет на скорость потока крови через систему насос-трубка и, следовательно, поток крови через целевой сосуд. Как показано на фиг. 36A, ручной способ управления 600 может включать непосредственное измерение вязкости крови в блоке 602 (посредством взятия образца крови пациента и ее анализа на вискозиметре), скорости потока крови в системе кровяного насоса или скорости потока крови в целевом сосуде в блоке 604 (посредством размещения ультразвукового датчика потока на любой из трубки входящего потока или выходящего потока или посредством ультразвукового или теплового способа разведения, соответственно) и радиуса сосуда в блоке 606 (посредством различных способов визуализации, включая ангиографию, ультразвук, компьютерную томографию или магнитно-резонансную визуализацию). НСС, действующее на стенку сосуда, определяют в блоке 608, сравнивают с желаемым уровнем в блоках 610 или 612, и затем скорость потока насоса (Q) корректируют через измерения в скорости вращения импеллера насоса в блоках 614 или 616. Изменения в скорости насоса осуществляют посредством варьирования цикла нагрузки широтно-импульсной модуляции входного напряжения двигателя.
Способ управления напряжением сдвига у стенки №2: автоматический с опосредованным измерением вязкости крови, непосредственным измерением потока крови и диаметра целевого кровеносного сосуда
Автоматическая система управления НСС может содержать непосредственное измерение скорости потока крови в насосной системе или целевом сосуде и непосредственное измерение диаметра целевого кровеносного сосуда. Как показано на фиг. 36B, этот автоматический способ 620 управления НСС может включать опосредованные измерения вязкости крови в блоке 622 (оцениваемой, основываясь на известной ее зависимости от измеряемого гематокрита и приблизительного среднего НСС). Периодическую калибровку оценивателя вязкости в блоке 624 можно осуществлять с использованием непосредственных измерений вязкости, как описано ранее. В клинической практике вязкость крови обычно варьирует медленно.
Способ управления напряжением сдвига у стенки №3: автоматический с использованием опосредованного измерения вязкости крови, потока крови, диаметра целевого кровеносного сосуда и непосредственного измерения давления в вене.
Как показано на фиг. 36C, автоматический способ управления НСС 630 может включать опосредованное измерение вязкости крови (оцениваемой, основываясь на ее известной зависимости от измеряемого гематокрита и приблизительного среднего НСС) в блоке 622, скорости потока крови через систему кровяного насоса (оцениваемой, основываясь на ее зависимости от переменных состояния двигателя) в блоке 632, измерение давления целевого кровеносного сосуда в блоке 634 и измерение радиуса сосуда (оцениваемого, основываясь на сопротивлении сосуда) в блоке 638. Сопротивление сосуда вычисляют в блоке 636, основываясь на оцениваемой скорости потока насоса и измеряемом кровяном давлении в сосуде. Периодическую калибровку оценивателей вязкости крови, потока насоса и целевого радиуса сосуда можно осуществлять соответствующим образом с использованием непосредственных измерений в блоках 624, 640 и 642, соответственно, как описано ранее.
Способ управления напряжением сдвига у стенки №4: автоматический опосредованным измерением вязкости крови, потока крови, напора насоса и диаметра целевого кровеносного сосуда
Как показано на фиг. 36D, автоматический способ управления НСС 650 может включать опосредованные измерения вязкости крови (оцениваемой, основываясь на известной ее зависимости от измеряемого гематокрита и приблизительного среднего НСС) в блоке 622, скорости потока крови через систему кровяного насоса (оцениваемой, основываясь на ее зависимости от переменных состояния двигателя) в блоке 632, и радиуса сосуда (оцениваемого, основываясь на сопротивлении сосуда) в блоке 638. Сопротивление сосуда вычисляют в блоке 636, основываясь на скорости потока насоса, оцениваемой в блоке 632, и напоре насоса, где напор насоса также оценивают в блоке 652, основываясь на его зависимости от переменных состояния двигателя. Периодическую калибровку оценивателей вязкости крови, потока насоса и целевого радиуса сосуда можно осуществлять с использованием непосредственных измерений в блоках 624, 640 и 642, соответственно, как описано ранее. Периодическую калибровку оценивателя напора насоса можно осуществлять посредством измерения давлений на впуске насоса и выпуске насоса с использованием отдельных преобразователей давления и вычисления из разности в блоке 654 или посредством непосредственного измерения напора на насосе с использованием дифференциального датчика давления.
Определение скорости потока и напора системы кровяного насоса без датчиков:
Со ссылкой на фиг. 35, процессор 24 адаптируют для того, чтобы обнаруживать и осуществлять мониторинг электрического тока, возникающего в одной или нескольких электрических катушках сборочного узла 170 катушки насоса через кабель 120 питания, что в сочетании с мониторингом напряжения, подаваемого на сборочный узел катушки, позволяет процессору 24 извлекать входную мощность (Pin), потребляемую кровяным насосом 25 и фактическую скорость вращения импеллера 140 (ω). Процессор 24 может оценивать скорость потока насоса (Q) или изменения скорости потока (ΔQ) как функцию от Pin и ω. Например, Q=f[Pin, ω]. Более конкретно, используют следующее уравнение:
Q=a+b×ln(Pin)+c×ω0,5 Уравнение 2,
где:
Q = скорость потока (л/мин)
Pin = входная мощность двигателя (W)
ω = скорость насоса (об./мин)
Входную мощность двигателя извлекают из измеряемого тока двигателя и напряжения. Значения для a, b и c извлекают из кривой, аппроксимирующей график скорости потока насоса как функции скорости двигателя и входной мощности.
Процессор 24 также может оценивать напор насоса (Hp) или изменения напора насоса (ΔHp) в качестве функции Pin и ω. Например, Hp=f[Pin, ω]. Более конкретно, используют следующее уравнение:
Hp=d+e×ln(Pin)+f×ω2,5 Уравнение 3
Значения для d, e и f извлекают из кривой, аппроксимирующей график напора насоса в качестве функции скорости насоса и входной мощности двигателя, где Hp измеряют на трубке 20 входящего потока, насосе 25 и трубке 30 выходящего потока.
Определение сопротивления сосуда и оценка радиуса сосуда:
Сопротивление сосуда (Rv) представляет собой сопротивление потоку, которое нужно преодолеть для того, чтобы протолкнуть кровь через систему кровообращения. Сопротивление равно давлению привода (Hv), деленному на скорость потока. Когда систему кровяного насоса соединяют с целевым сосудом, который является веной, сопротивление сосуда вычисляют с использованием следующего уравнения:
Rv=(Pv-CVP)/Q Уравнение 4,
где:
Hv = потеря напора на периферическом сосуде в пути возврата крови в сердце (мм рт. ст.)
Pv = давление в вене у анастомоза (мм рт. ст.)
CVP = центральное венозное давление (мм рт. ст.)
Rv = сопротивление сосуда ((мм рт. ст⋅мин)/л)
Обычно, CVP находится в диапазоне 2-8 мм рт. ст. и может быть опущено в приведенном выше уравнении, поскольку рабочие диапазоны Pv и Q пропорционально значительно больше. Как проиллюстрировано на фиг. 36E, сопротивление сосуда можно представлять графически в качестве наклона различных кривых 660 зависимости Pv от Q. Поскольку кривые 660 являются нелинейными, наклон представляет функцию Q. Как проиллюстрировано следующим уравнением, сопротивление сосуда можно извлекать посредством временного повышения скорость на несколько сотен об./мин (Δω), измерения получаемого изменения давления в вене (ΔPv) и оценки получаемого изменения потока насоса (ΔQ):
Rv (Q)=ΔPv/ΔQ Уравнение 5
Следует отметить, что сопротивление сосуда представляет собой функцию, которая сильно зависит от диаметра или радиуса сосуда, при этом мелкие вены имеют высокое сопротивление сосуда. Количественно сопротивление сосуда можно определять в различных единицах, например, единицы Вуда ((мм рт. ст. × мин)/л) можно умножать на восемь для того, чтобы осуществить перевод в единицы СИ ((Па×с)/м3).
Альтернативно, напор насоса (Hp) можно использовать в качестве основы для вычисления сопротивления сосуда. Когда система насос-трубка выполнена с возможностью забирать кровь из одного местоположения в сосудистой системе для того, чтобы выбрасывать ее в периферическую артерию или вену, можно обоснованно предположить, что прирост напора в системе (Hp) точно равен падению напора на периферическом сосуде в обратном пути крови в сердце (Hv):
Hv=Hp Уравнение 6
Радиус периферического сосуда обратно пропорционален сопротивлению этого сосуда (Rv), отношению Hv к Q. Предполагая, что имеет место поток крови по Хагену-Пуазейлю в сосуде круглого поперечного сечения, сопротивление сосуда можно представлять с использованием уравнения:
Rv (Па×с/м3)=Pv/Q=8×μ×L/π×R4 Уравнение 7,
где:
Pv выражают в единицах Па
Q выражают в единицах (м3/с)
μ = вязкость крови (Па/с)
R = радиус сосуда (м)
L = длина сосуда (м)
На практике, уравнение 7 следует уточнять, основываясь на измерениях падения давления на конкретных венах известного диаметра in vivo. Это дает эмпирическую форму уравнения:
Rv (Па×с/м3)=K×/R4 Уравнение 8,
где:
K представляет собой эмпирическую константу для целевой вены (м)
Определение напряжения сдвига у стенки:
Напряжение сдвига у стенки в целевом сосуде можно определять, основываясь на приведенных выше уравнениях. Используя уравнение 4, скорость потока насоса можно выражать в соответствии со следующим уравнением:
Q=Pv/Rv Уравнение 9
Используя уравнение 8, радиус сосуда можно выражать в соответствии со следующим уравнением:
R=(K×μ/Rv) 0,25 Уравнение 10
Используя уравнение 1, 9 и 10, напряжение сдвига у стенки можно выражать в соответствии со следующим уравнением:
НСС (Па)=((4×Pv)/(π×K0,75))×(μ/Rv)0,25 Уравнение 11
В различных вариантах осуществления, оцениваемые переменны, используемые системой управления, периодически калибруют. Например, оценки скорости потока и напор периодически калибруют с использованием фактических измеряемых значений с интервалом в диапазоне от 1 минуты и вплоть до 30 суток. Аналогичным образом, оценку радиуса артерии или вены периодически калибруют с использованием фактических измеряемых значений с интервалом в диапазоне от 1 минуты и вплоть до 30 суток.
Признаки безопасности и предупреждения об опасности:
Автоматическая система управления также может содержать признаки безопасности для того, чтобы избегать опасности, связанной с изменениями в сердечнососудистой системе пациента или отказами насосной системы или системы управления насосом. Как показано на фиг. 36F, способ 670 управления скоростью может обнаруживать характерные изменения формы волны тока двигателя, связанные со сниженной предварительной нагрузкой или увеличенной постнагрузкой (например, из-за тромбоза), засасыванием, ограничением потока и надвигающимся коллапсом сосуда около кончика трубки входящего потока в блоке 672. Спектральный анализ формы волны тока двигателя осуществляют с использованием преобразования Фурье в блоке 674. Когда амплитуда второго гармонического члена ряда Фурье превышает заданное значение в блоке 676, возникает засасывание и предполагают, что приближается коллапс. Скорость насоса незамедлительно снижают в блоке 616 и предупреждение об опасности запускают в блоке 678A внутри управляющего устройства 21. По восстановлении нормальной работы предупреждение об опасности отменяют в блоке 678B.
Как показано на фиг. 36G, способ 680 управления скоростью может обнаруживать состояние слабого потока. Когда скорость потока насоса падает ниже безопасного порогового уровня, чтобы избегать тромбоза системы 10 насос-трубка в блоке 682, скорость насоса незамедлительно повышают в блоке 614 и предупреждение об опасности запускают в блоке 678A внутри управляющего устройства 21. По восстановлении нормальной работы, предупреждение об опасности отменяют в блоке 678B.
Как показано на фиг. 36H, способ 690 управления скоростью может обнаруживать состояние высокого напряжения сдвига у стенки. Когда НСС поднимается выше безопасного порогового уровня для того, чтобы избегать повреждения эндотелия сосуда в блоке 692, скорость насоса незамедлительно снижают в блоке 616 и предупреждение об опасности запускают в блоке 678A внутри управляющего устройства 21. По восстановлении нормальной работы, предупреждение об опасности отменяют в блоке 678B.
В еще одном другом варианте осуществления, в котором трубку 20 входящего потока соединяют с артерией, а трубку 30 выходящего потока соединяют с веной, система 14 управления осуществляет мониторинг и модифицирует пульсовое давление потока крови, которую выбрасывают в принимающую вену. Например, система 14 управления может осуществлять мониторинг электрокардиограммы или циклических изменений пульсовой волны крови, поступающей в систему кровяного насоса. Во время сокращения желудочков и распространения пульсовой волны система управления может снижать скорость вращения насоса. Во время систолы и после прохождения пульсовой волны система управления может увеличивать скорость вращения насоса. Таким образом, можно снижать пульсовое давление в крови, входящей в принимающую вену. Альтернативно, пульсовое давление крови в принимающей вене можно периодически проверять вручную, что можно выполнять с использованием ультразвука, и насос можно корректировать вручную, например, посредством настройки характеристик напора насоса, добавления податливого резервуара или эластического резервуара (сегментное или диффузное изменение) во входящий поток или выходящий поток насоса или модулировать скорость насоса. Также можно выполнять другую корректировку. Альтернативно, податливый резервуар или эластический резервуар можно добавлять в трубки входящего потока или выходящего потока во время имплантации системы кровяного насоса.
В различных других вариантах осуществления осуществляют мониторинг системы 14 управления и корректировку вручную или с использованием программного обеспечения или приложения, закодированного на машиночитаемой среде и исполняемого посредством процессора 24 или других автоматизированных систем. Машиночитаемая среда может включать энергозависимые среды, энергонезависимые среды, съемные среды, несъемные среды и/или другую доступную среды, доступ к которой можно осуществлять посредством системы 14 управления. В качестве примера, а не ограничения, машиночитаемая среда может включать компьютерную среду хранения данных и коммуникационную среду. Компьютерные среды хранения данных включают память, энергозависимые среды, энергонезависимые среды, съемные среды и/или несъемные среды, реализованные в способе или технологии хранения информации, такой как машиночитаемые инструкции, структуры данных, программные модули или другие данные.
Программное обеспечение может включать исполняемые инструкции для того, чтобы автоматически корректировать скорость насоса для того, чтобы поддерживать желаемое количество потока крови, среднюю скорость крови и среднее НСС в сегменте сосуда, подлежащем воздействию («целевой сосуд» или «целевой кровеносный сосуд»), в котором постоянное увеличение наружного диаметра и диаметра просвета или длины является желаемым, будь то отдающая артерия, отдающая вена, принимающая артерия или принимающая вена. Альтернативно, наружный диаметр, диаметр просвета, длина и поток крови в целевом сосуде можно периодически проверять вручную, что можно выполнять с использованием ультразвука, и насос можно корректировать вручную, например, посредством настройки характеристик напора насоса или модулирования скорости насоса. Также можно выполнять другие корректировки.
В одном из вариантов осуществления среднюю скорость крови определяют посредством вычисления среднего множества дискретных измерений скорости крови посредством суммирования дискретных измерений и деления суммы на число измерений. Среднюю скорость крови можно вычислять посредством выполнения измерений в течение периода в миллисекунды, секунды, 1 минуту, 5 минут, 15 минут, 30 минут, 1 час или несколько часов.
В другом варианте осуществления среднее НСС определяют посредством выполнения серии дискретных измерений, выполнения множества дискретных определений НСС (с использованием этих измерений), суммирования дискретных НСС определений и деления суммы на число определений. Среднее НСС можно вычислять посредством выполнения измерений и выполнения дискретных определений НСС в течение периода в секунды, 1 минуту, 5 минут, 15 минут, 30 минут, 1 час или несколько часов.
В одном из вариантов осуществления система 14 управления получает информацию от датчика 22 в связи с кровяным насосом 25. В других вариантах осуществления система 14 управления получает информацию от датчика 22 в связи с трубкой 20 входящего потока или трубкой 30 выходящего потока или в сосуде в соединении по текучей среде с трубкой входящего потока или выходящего потока. В различных вариантах осуществления, всю или части системы 14 управления можно располагать внутри корпуса насоса 25, тогда как в других вариантах осуществления всю или часть системы управления можно располагать внутри трубок или внутри управляющего устройства 21.
Системы и способы, описанные в настоящем документе, увеличивают средний уровень НСС в периферических венах и артериях. Нормальное среднее НСС для вен находится в диапазоне между 0,076 Па и 0,76 Па. Системы, описанные в настоящем документе, выполнены с возможностью увеличивать средний уровень НСС в принимающей периферической вене до диапазона между 0,76 Па и 23 Па, предпочтительно до диапазона между 2,5 Па и 10 Па. Нормальное среднее НСС для артерий находится в диапазоне между 0,3 Па и 1,5 Па. Для дилятации артерии системы и способы, описанные в настоящем документе, увеличивают средний уровень НСС до диапазона между 1,5 Па и 23 Па, предпочтительно до диапазона между 2,5 Па и 10 Па. В определенных случаях, постоянное среднее НСС меньше чем 0,76 Па в венах или меньше чем 1,5 Па в артериях может увеличивать наружный диаметр и диаметр просвета этих сосудов, но степень и скорость этого увеличения вероятно не будет клинически значимым или совместимым с регулярной клинической практикой. Постоянное среднее НСС больше чем 23 Па в артериях или венах вероятно вызывает денудацию (утрату) эндотелия кровеносных сосудов или повреждение эндотелия, что, как известно, задерживает дилятацию кровеносных сосудов в ответ на увеличение средней скорости крови и среднего НСС. Перекачивание крови таким образом, который повышает среднее НСС до желаемого диапазона в течение предпочтительно от 1 суток до 84 суток и более предпочтительно между приблизительно 7 и 42 сутками, например, создает постоянное увеличение наружного диаметра и диаметра просвета в принимающей вене, отдающей вене или отдающей артерии так, что вены и артерии, которые были изначально непригодны или субоптимальны для применения в качестве места гемодиализного доступа или шунтирующих трансплантатов из-за малого диаметра вены или артерии, становятся подходящими или более оптимальными. мониторинг процесса перекачивания крови можно осуществлять и корректировать периодически. Например, насос можно корректировать в течение периода в минуты, часы, 1 сутки, 3 суток, 1 неделю или множество недель для того, чтобы учитывать изменения в периферической вене или артерии (такие как постоянное увеличение наружного диаметра и диаметра просвета) до достижения желаемой постоянной дилятации.
Со ссылкой на фиг. 37-40, проиллюстрирована система 10 для того, чтобы повышать наружный диаметр и диаметр просвета вен и артерий, как используют для пациента 1. На фиг. 37, система 10 забирает деоксигенированную венозную кровь из венозной системы пациента и выбрасывает эту кровь в принимающий периферический сосуд 700. Система 10 также повышает среднюю скорость крови в принимающем периферическом сосуде 700 и повышает среднее НСС, прикладываемое к эндотелию принимающего периферического сосуда 700, чтобы повышать наружный диаметр и диаметр просвета принимающего периферического сосуда 700, расположенного, например, в руке или ноге. Диаметр кровеносных сосудов, такой как периферические вены, можно определять посредством измерения диаметра просвета, который представляет собой открытое пространство в центре кровеносного сосуда, где течет кровь, или посредством измерения диаметра всего сосуда, который включает открытое пространство и стенки кровеносного сосуда.
Изобретение также относится к синхронному и постоянному увеличению наружного диаметра и диаметра просвета периферической вены или артерии посредством направления крови в периферическую вену или артерию или из нее, тем самым повышая среднюю скорость крови в периферической вене или артерии и повышая среднее НСС на эндотелии периферической вены или артерии. Описаны системы, где среднюю скорость крови в периферической вене или артерии и среднее НСС на эндотелии периферической вены или артерии увеличивают посредством использования системы кровяного насоса. Предпочтительно, насос направляет кровь в периферическую вену, где перекачиваемая кровь имеет сниженное пульсовое давление, например, когда пульсовое давление ниже, чем у крови в периферической артерии.
Система 10 подходит для того, чтобы поддерживать скорость потока предпочтительно между 50 мл/мин и 2500 мл/мин и необязательно между 50 мл/мин и 1000 мл/мин, при этом также сохраняя диапазон давлений между 25 мм рт. ст. и 350 мм рт. ст. Как описано ранее, систему 14 управления можно оптимизировать для того, чтобы поддерживать постоянное среднее напряжение сдвига у стенки между 0,76 Па и 23 Па в периферических венах так, что наружный диаметр и диаметр просвета периферических вен постоянно увеличивают на целых от 5% до больше чем 200%.
Системы, описанные в настоящем документе, также увеличивают среднюю скорость крови в периферических венах. В покое средняя скорость крови в головной вене у человека в общем, составляет между 5 и 9 см/с (от 0,05 до 0,09 м/с). Для систем, описанных в настоящем документе, среднюю скорость крови в периферической вене увеличивают до диапазона между 10 см/с и 120 см/с (0,1 и 1,2 м/с), предпочтительно до диапазона между 25 см/с и 100 см/с (0,25 м/с и 1,0 м/с), в зависимости от начального наружного диаметра или диаметра просвета периферической принимающей вены и конечного наружного диаметра или диаметра просвета, который является желаемым. Системы, описанные в настоящем документе, также увеличивают среднюю скорость крови в периферических артериях. В покое средняя скорость крови в плечевой артерии в общем, составляет между 10 и 15 см/с (0,1 и 0,15 м/с). Для систем и способов, описанных в настоящем документе, среднюю скорость крови в периферической артерии увеличивают до диапазона между 10 см/с и 120 см/с (0,1 и 1,2 м/с), предпочтительно до диапазона между 25 см/с и 100 см/с (0,25 и 1,0 м/с), в зависимости от начального наружного диаметра или диаметра просвета артерии и конечного наружного диаметра или диаметра просвета, который является желаемым.
Предпочтительно, среднюю скорость крови увеличивают в течение от 1 суток до 84 суток или предпочтительно между 7 и 42 сутками для того, чтобы вызывать постоянное увеличение наружного диаметра и диаметра просвета в периферической принимающей вене, периферической принимающей артерии, периферической отдающей вене или периферической отдающей артерии так, что вены и артерии, которые изначально были непригодны или субоптимальны для применения в качестве места гемодиализного доступа или шунтирующего трансплантата из-за малого диаметра вены или артерии, становятся подходящими. Это также можно выполнять посредством периодического увеличения средней скорости крови во время периода воздействия, с промежуточными периодами нормальной средней скорости крови.
Исследования показали, что базовый уровень гемодинамических сил и изменения гемодинамических сил внутри вен и артерий играют жизненно-важную роль при определении наружного диаметра и диаметра просвета, и длины этих вен и артерий. Например, постоянное увеличение средней скорости крови и среднего НСС может вести к постоянному увеличению диаметра просвета и наружного диаметра, а также длины вен и артерий. Повышенная средняя скорость крови и среднее НСС воспринимают клетки эндотелия, которые запускают сигнальные механизмы, которые ведут к стимуляции гладкомышечных клеток сосудов, привлечению моноцитов и макрофагов и синтезу и высвобождению протеаз, способных разрушать компоненты внеклеточного матрикса, таких как коллаген и эластин. По существу, настоящее изобретение относится к увеличению средней скорости крови и среднего НСС в течение периода времени, достаточного для того, чтобы достичь ремоделирования вен и артерий и увеличения наружного диаметра и диаметра просвета, а также длины вен и артерий.
Системы, описанные в настоящем документе, увеличивают средний уровень НСС в периферической вене или артерии. Нормальное средне НСС для вен находится в диапазоне между 0,076 Па и 0,76 Па. Системы, описанные в настоящем документе, увеличивают средний уровень НСС в венах до диапазона между 0,76 Па и 23 Па, предпочтительно до диапазона между 2,5 Па и 10 Па. Нормальное среднее НСС для артерий находится в диапазоне между 0,3 Па и 1,5 Па. Чтобы постоянно увеличивать наружный диаметр и диаметр просвета артерий, системы и способы, описанные в настоящем документе, увеличивают средний уровень НСС до диапазона между 1,5 Па и 23 Па, предпочтительно до диапазона между 2,5 Па и 10 Па. Предпочтительно, среднее НСС увеличивают в течение между 1 сутками и 84 сутками или предпочтительно между 7 и 42 сутками для того, чтобы вызывать постоянное увеличение наружного диаметра и диаметра просвета в периферической принимающей вене, периферической принимающей артерии, периферической отдающей вене или периферической отдающей артерии так, что вены и артерии, которые изначально были непригодны или субоптимальны для применения в качестве места гемодиализного доступа или шунтирующего трансплантата из-за малого диаметра вены и артерии, становятся подходящими. Это также можно выполнять посредством периодического увеличения среднего НСС во время периода воздействия, с промежуточными периодами нормального среднего НСС.
В некоторых случаях, непрерывные периоды средних уровней НСС в периферических венах ниже 0,076 Па или в периферических артериях ниже 1,5 Па могут вести к увеличенному наружному диаметру и диаметру просвета этих вен и артерий, но степень и скорость этого увеличения вероятно не будет клинически значимой или совместимой с регулярной клинической практикой. Постоянные средние уровни НСС в периферических венах и артериях выше приблизительно 23 Па вероятно вызывают денудацию (утрату) эндотелия вен или повреждение эндотелия вен. Известно, что денудация эндотелия или повреждение эндотелия кровеносных сосудов снижает увеличение наружного диаметра и диаметра просвета кровеносных сосудов в ситуации повышенных средней скорость крови и среднего НСС. Повышенное средне НСС вызывает достаточное постоянное увеличение наружного диаметра и диаметра просвета или длины вен и артери, так что те, которые изначально были непригодны или субоптимальны для применения в качестве места гемодиализного доступа или шунтирующего трансплантата из-за малого диаметра вены или артерии, становятся подходящими или более оптимальными. Диаметр периферической принимающей вены, периферической принимающей артерии, периферической отдающей вены или периферической отдающей артерии можно определять периодически, например, каждые 1 сутки, 3 суток, 1 неделю или несколько недель, например, чтобы сделать возможным корректировку скорости насоса для того, чтобы оптимизировать скорость и степень постоянного увеличения наружного диаметра и диаметра просвета вены и артерии во время периода воздействия.
Системы, описанные в настоящем документе, также увеличивают среднюю скорость крови в периферических венах. В покое, средняя скорость крови в головной вене у человека в общем, составляет между 5 и 9 см/с (0,05 и 0,09 м/с). Для систем, описанных в настоящем документе, среднюю скорость крови в периферической вене увеличивают до диапазона между 10 см/с и 120 см/с (0,1 и 1,2 м/с), предпочтительно до диапазона между 25 см/с и 100 см/с (0,25 м/с и 1,0 м/с), в зависимости от начального наружного диаметра или диаметра просвета периферической принимающей вены и желаемого конечного наружного диаметра и диаметра просвета периферической принимающей вены. Системы, описанные в настоящем документе, также увеличивают среднюю скорость крови в периферических артериях. В покое средняя скорость крови в плечевой артерии в общем, составляет между 10 и 15 см/с (0,1 и 0,15 м/с). Для систем и способов, описанных в настоящем документе, среднюю скорость крови в периферической артерии увеличивают до диапазона между 10 см/с и 120 см/с (0,1 и 1,2 м/с), предпочтительно до диапазона между 25 см/с и 100 см/с (0,25 и 1,0 м/с), в зависимости от начального наружного диаметра или диаметра просвета периферической артерии и желаемого конечного наружного диаметра или диаметра просвета периферической артерии. Предпочтительно, среднюю скорость крови увеличивают в течение от 1 суток до 84 суток или предпочтительно между 7 и 42 сутками для того, чтобы вызывать постоянное увеличение наружного диаметра и диаметра просвета или длины периферической принимающей вены, периферической принимающей артерии, периферической отдающей вены или периферической отдающей артерии так, что вены и артерии, которые изначально были непригодны или субоптимальны для применения в качестве места гемодиализного доступа или шунтирующего трансплантата из-за малого диаметра вены или артерии или неподходящей длины, становятся подходящими. Уровни средней скорости крови в принимающей периферической вене, периферической принимающей артерии, периферической отдающей вене или периферической отдающей артерии ниже 10 см/с (0,1 м/с) может вести к увеличенному наружному диаметру и диаметру просвета этих вен и артерий, но степень и скорость этого увеличения вероятно не будет клинически значимым или совместимым с регулярной клинической практикой. Уровни средней скорости крови в периферических принимающих венах, периферических принимающих артериях, периферических отдающих венах или периферических отдающих артериях выше приблизительно 120 см/с (1,2 м/с) вероятно вызывают денудацию (утрату) эндотелия вен или повреждение эндотелия вен. Известно, что денудация или повреждение эндотелия кровеносных сосудов снижает увеличение наружного диаметра и диаметра просвета кровеносных сосудов, наблюдаемое в ситуации увеличенной средней скорости крови. Увеличенная средняя скорость крови в желаемом диапазоне и в течение достаточного периода времени вызывает достаточное постоянное увеличение наружного диаметра и диаметра просвета или длины вен и артерий, так что те, которые изначально были непригодны или субоптимальны для применения в качестве места гемодиализного доступа или шунтирующего трансплантата из-за малого диаметра вены или артерии или неподходящей длины, становятся подходящими. Наружный диаметр или диаметр просвета периферической принимающей вены, периферической принимающей артерии, периферической отдающей вены и периферической отдающей артерии можно определять периодически, например, каждую минуту(ы), час(ы), 1 сутки, 3 суток, 1 неделю или несколько недель, например, для того, чтобы сделать возможным корректировку скорости насоса для того, чтобы оптимизировать скорость и степень постоянного увеличения наружного диаметра и диаметра просвета вены и артерии во время периода воздействия.
В одном из вариантов осуществления, представленных на фиг. 34, система 10 содержит кровяной насос 25, пару трубок 12 и управляющее устройство 21 для перемещения деоксигенированной венозной крови из отдающей вены или местоположения в венозной системе пациента в периферическую принимающую вену. В различных вариантах осуществления, периферическая принимающая вена может представлять собой головную вену, лучевую вену, срединную вену, локтевую вену, латеральную подкожную вену, срединную головную вену, срединную базилярную вену, базилярную вену, плечевую вену, малую подкожную вену, большую подкожную вену, бедренную вену или другие вены. Можно использовать другие вены, которые можно использовать при создании места гемодиализного доступа или шунтирующего трансплантата, или другие вены, которые можно использовать для других процедур сосудистого хирургического вмешательства, требующих использования вен. Трубки 12 перемещают деоксигенированную кровь в периферическую принимающую вену. Постоянно повышенная средняя скорость крови и повышенное среднее НСС в периферическом сосуде вызывает постоянное и прогрессирующее увеличение наружного диаметра и диаметра просвета периферической принимающей вены. Таким образом, система 10 по настоящему изобретению предпочтительно увеличивает диаметр или длину периферической вены 4 с тем, чтобы ее можно было использовать, например, для того, чтобы конструировать место гемодиализного доступа (такое как АВФ или АВТ), шунтирующий трансплантат или использовать в других клинических ситуациях, где нужна вена определенного диаметра или длины, как определяет специалист в данной области.
Как используют в настоящем документе, деоксигенированная кровь представляет собой кровь, которая прошла через капиллярную систему и в из которой кислород удален окружающими тканями и затем прошла в венозную систему. Периферическая вена, как используют в настоящем документе, обозначает любую вену с частью, находящейся за пределами грудной клетки, брюшной полости или таза. В варианте осуществления, представленном на фиг. 37, периферическая принимающая вена 712 представляет собой головную вену. Однако, в других вариантах осуществления периферическая принимающая вена может представлять собой лучевую вену, срединную вену, локтевую вену, латеральную подкожную вену, срединную головную вену, срединную базилярную вену, базилярную вену, плечевую вену, малую подкожную вену, большую подкожную вену, бедренную вену или другие вены. В дополнение к периферической вене, другие вены, которые можно использовать при создании места гемодиализного доступа или шунтирующего трансплантата, или другие вены, которые можно использовать для других процедур сосудистого хирургического вмешательства, требующих использования вен, также можно использовать в качестве принимающих вен*, таких как те, которые находятся в грудной клетке, брюшной полости и тазу.
На фиг. 37 проиллюстрирован другой вариант осуществления для использования системы 10 для того, чтобы повышать наружный диаметр и диаметр просвета кровеносного сосуда. В этом варианте осуществления система 10 выполнена с возможностью удаления деоксигенированной крови из отдающей вены 700 и перемещения крови в верхнюю полую вену или правое предсердие 702 сердца 704. Как показано, трубку 706 входящего потока соединяют по текучей среде с отдающей веной 700, в этом случае головной веной. В одном из вариантов осуществления соединение можно создавать с использованием короткого пПТФЭ сегмента трубки 706 входящего потока, который используют для того, чтобы крепить трубку 706 входящего потока к отдающей вене 700, тогда как остальной сегмент трубки входящего потока выполняют с использованием полиуретана. В других вариантах осуществления по меньшей мере часть трубки входящего потока или трубки выходящего потока дополнительно содержит нитинол, для сопротивления сгибанию и сжиманию. Как показано, один конец трубки выходящего потока 710 соединяют с кровяным насосом 25, тогда как другой конец трубки выходящего потока соединяют по текучей среде с верхней полой веной и правым предсердием 702 посредством внутрисосудистой части. Для варианта осуществления на фиг. 37 кровяной насос используют для того, чтобы увеличивать скорость, с которой перемешают кровь из отдающей вены 700 в верхнюю полую вену и правое предсердие 702 сердца 704 для того, чтобы достигать желаемого повышенного уровня средней скорости крови и повышенного уровня среднего НСС в отдающей вене 700. Насос работает со скоростью и в течение периода времени, достаточных для того, чтобы прийти к желаемому постоянному увеличению наружного диаметра и диаметра просвета отдающей вены, такому как увеличение на 10%, увеличение на 25%, увеличение на 50 или увеличение на 100% или больше от начального диаметра. В дополнительном варианте осуществления один или несколько венозных клапанов между сочленением трубки 706 входящего потока и отдающей вены 700 и правым предсердием 702 можно делать неработающими или менее работающими (с использованием любого из способов, доступных специалисту в данной области) для того, чтобы сделать возможным ретроградное течение крови в отдающей вене 700 и затем в трубку 706 входящего потока.
На фиг. 38 проиллюстрирован другой вариант осуществления для использования системы 10 для того, чтобы повышать наружный диаметр и диаметр просвета кровеносного сосуда. В этом варианте осуществления система 10 выполнена с возможностью удаления оксигенированной крови из отдающей артерии 712 (в этом случае плечевой артерии) и перемещения крови в верхнюю полую вену и правое предсердие 702 сердца 704. Как показано, трубку 706 входящего потока соединяют по текучей среде с отдающей артерией 712. В одном из вариантов осуществления соединение можно создавать с использованием короткого пПТФЭ сегмента трубки 706 входящего потока, который используют для того, чтобы крепить трубку входящего потока к отдающей артерии 712, тогда как остальной сегмент трубки входящего потока выполняют с использованием полиуретана. В других вариантах осуществления один или оба сегмента трубки 706 входящего потока дополнительно содержат нитинол, например, для сопротивления сгибанию и сжиманию. Как показано, один конец трубки выходящего потока 710 соединяют с кровяным насосом 25, тогда как другой конец трубки выходящего потока соединяют по текучей среде с верхней полой веной и правым предсердием 702 посредством внутрисосудистой части. Для варианта осуществления на фиг. 38 кровяной насос используют для того, чтобы увеличивать скорость, с которой кровь перемещают из отдающей артерии 712 в правое предсердие 702 сердца 704 для того, чтобы достигать желаемого повышенного уровня средней скорости крови и повышенного среднего уровня НСС в отдающей артерии 712. Насос работает со скоростью и в течение периода времени, достаточных для того, чтобы прийти к желаемому постоянному увеличению наружного диаметра и диаметра просвета отдающей артерии, такому как увеличение на 10%, увеличение на 25%, увеличение на 50% или увеличение на 100% или больше от начального диаметра.
В других вариантах осуществления оксигенированную артериальную кровь можно перемещать из отдающей артерии в принимающее местоположение. Отдающие артерии могут включать, но не ограничиваясь этим, лучевую артерию, локтевую артерию, межкостную артерию, плечевую артерию, переднюю большеберцовую артерию, заднюю большеберцовую артерию, малоберцовую артерию, подколенную артерию, глубокую артерию, поверхностную бедренную артерию или бедренную артерию.
На фиг. 39 проиллюстрирован другой вариант осуществления для использования системы 10 для того, чтобы повышать наружный диаметр и диаметр просвета кровеносного сосуда. В этом варианте осуществления система 10 выполнена с возможностью удаления оксигенированной крови из отдающей артерии 712 (в этом случае плечевой артерии) и перемещения крови в верхнюю полую вену и правое предсердие 702 сердца 704. Как показано, трубку 716 соединяют по текучей среде с отдающей артерией 712. В одном из вариантов осуществления соединение можно создавать с использованием короткого пПТФЭ сегмента трубки 716, который используют для того, чтобы крепить трубку входящего потока к отдающей артерии 712, тогда как остальной сегмент трубки входящего потока выполняют с использованием полиуретана. В других вариантах осуществления один или оба сегмента трубки 716 дополнительно содержат нитинол, например, для сопротивления сгибанию и сжиманию. Для варианта осуществления на фиг. 39 не предусмотрен насос, и кровь перемещается пассивно из отдающей артерии 712 с более высоким давлением к верхней полой вене и правому предсердию 702 с более низким давлением, а трубка 716 сконфигурирована по длине и диаметру просвета для тог, чтобы достигать желаемого повышенного уровня средней скорости крови и среднего НСС в отдающей артерии 712. Трубка 716 остается на месте в течение периода времени, достаточного для того, чтобы прийти к желаемому постоянному увеличению наружного диаметра и диаметра просвета отдающей артерии 712, такому как увеличение на 10%, увеличение на 25%, увеличение на 50% или увеличение на 100% или больше от начального диаметра.
На фиг. 40 проиллюстрирован другой вариант осуществления для использования системы 10 для того, чтобы повышать наружный диаметр и диаметр просвета периферической артерии. В этом варианте осуществления система 10 выполнена с возможностью удаления оксигенированной крови из целевой артерии 718, такой как лучевая артерия, и перемещать кровь в принимающую артерию 720, такую как плечевая артерия. Как показано, трубку 706 входящего потока соединяют по текучей среде с целевой артерией 718. В одном из вариантов осуществления соединение между трубкой 706 входящего потока и артерией или трубкой выходящего потока 710 и артерией можно создавать с использованием короткого пПТФЭ сегмента соответствующей трубки, который используют для того, чтобы соединять по текучей среде трубку входящего потока с целевой артерией 718 или трубку выходящего потока 710, которую соединяют по текучей среде с принимающей артерией 720, тогда как остальные сегменты трубок входящего потока и выходящего потока можно выполнять с использованием полиуретана. В других вариантах осуществления один или оба сегмента трубки 706 входящего потока или трубки выходящего потока 710 дополнительно содержат нитинол, например, для сопротивления сгибанию и сжиманию.
Как показано, один конец трубки выходящего потока 710 соединяют с кровяным насосом 25, тогда как другой конец трубки выходящего потока соединяют по текучей среде с принимающей артерией 720. Для варианта осуществления на фиг. 40 кровяной насос 25 используют для того, чтобы увеличивать скорость, с которой кровь забирают из целевой артерии 718 для того, чтобы достигать желаемого повышенного уровня средней скорости крови и повышенного среднего уровня НСС в целевой артерии. Насос работает со скоростью и в течение периода времени, достаточных для того, чтобы прийти к желаемому постоянному увеличению наружного диаметра и диаметра просвета целевой артерии 718, такому как увеличение на 10%, увеличение на 25%, увеличение на 50% или увеличение на 100% или больше от начального диаметра.
Хотя изобретение объяснено в отношении образцовых аспектов и вариантов осуществления, следует понимать, что различные их модификации будут видны специалистам в данной области после прочтения описания. Следовательно, следует понимать, что описываемое в настоящем документе изобретение предназначено для того, чтобы покрывать все модификации, которые попадают в объем приложенной формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СИСТЕМЫ КРОВЯНЫХ НАСОСОВ И СПОСОБЫ | 2012 |
|
RU2619995C2 |
| СИСТЕМА И СПОСОБ ПОВЫШЕНИЯ НАРУЖНОГО ДИАМЕТРА ВЕН И АРТЕРИЙ | 2012 |
|
RU2664156C2 |
| СИСТЕМА И СПОСОБ УВЕЛИЧЕНИЯ НАРУЖНОГО ДИАМЕТРА ВЕН | 2011 |
|
RU2574711C2 |
| СИСТЕМА И СПОСОБ УВЕЛИЧЕНИЯ НАРУЖНОГО ДИАМЕТРА ВЕН | 2011 |
|
RU2741571C2 |
| НАКОНЕЧНИКИ И СИСТЕМЫ КАНАЛОВ И СПОСОБЫ ИХ ИСПОЛЬЗОВАНИЯ | 2017 |
|
RU2752587C2 |
| УСТРОЙСТВО И СПОСОБЫ РЕАЛИЗАЦИИ ПЕРФУЗИОННОГО НАСОСА | 2013 |
|
RU2677537C2 |
| ИМПЛАНТИРУЕМАЯ ВСПОМОГАТЕЛЬНАЯ СЕРДЕЧНАЯ СИСТЕМА | 1998 |
|
RU2203686C2 |
| КАНЮЛЯ ДЛЯ ИНЪЕКЦИЙ, СИСТЕМА ECMO | 2020 |
|
RU2790952C2 |
| УСТРОЙСТВО И СПОСОБ ДОСТАВКИ ФИЗИОЛОГИЧЕСКОГО ДАТЧИКА | 2009 |
|
RU2478338C2 |
| Способ искусственного кровообращения и устройство для его осуществления | 2016 |
|
RU2633947C1 |
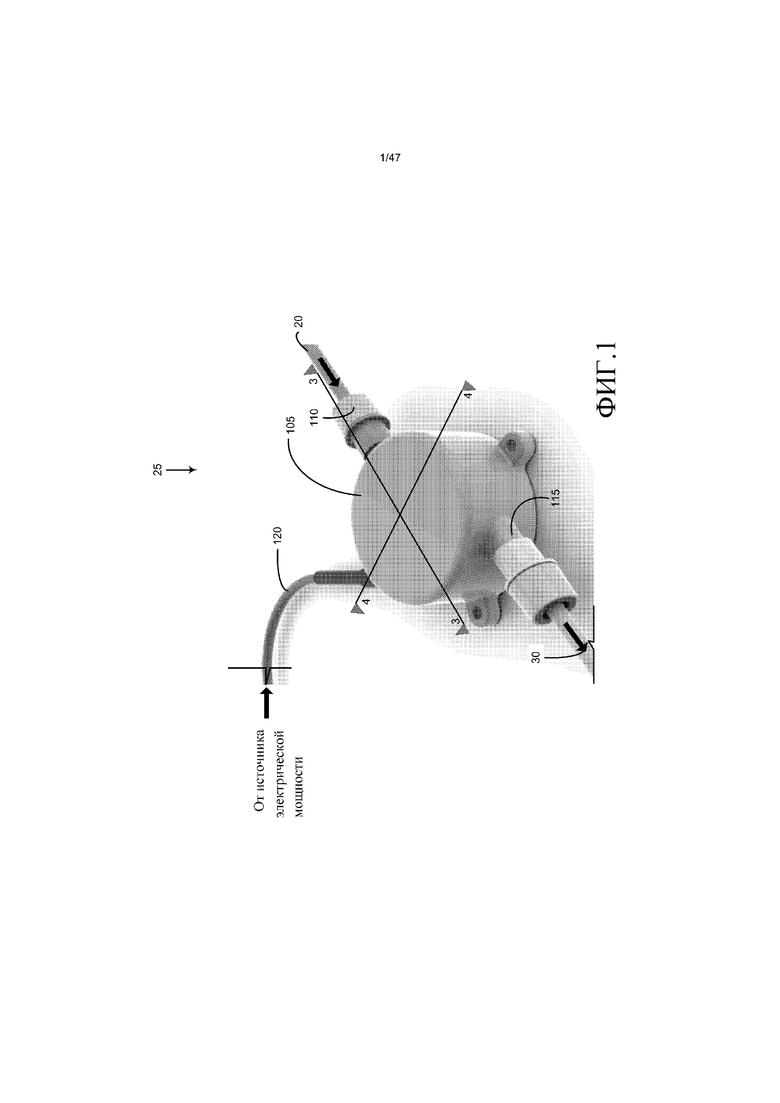
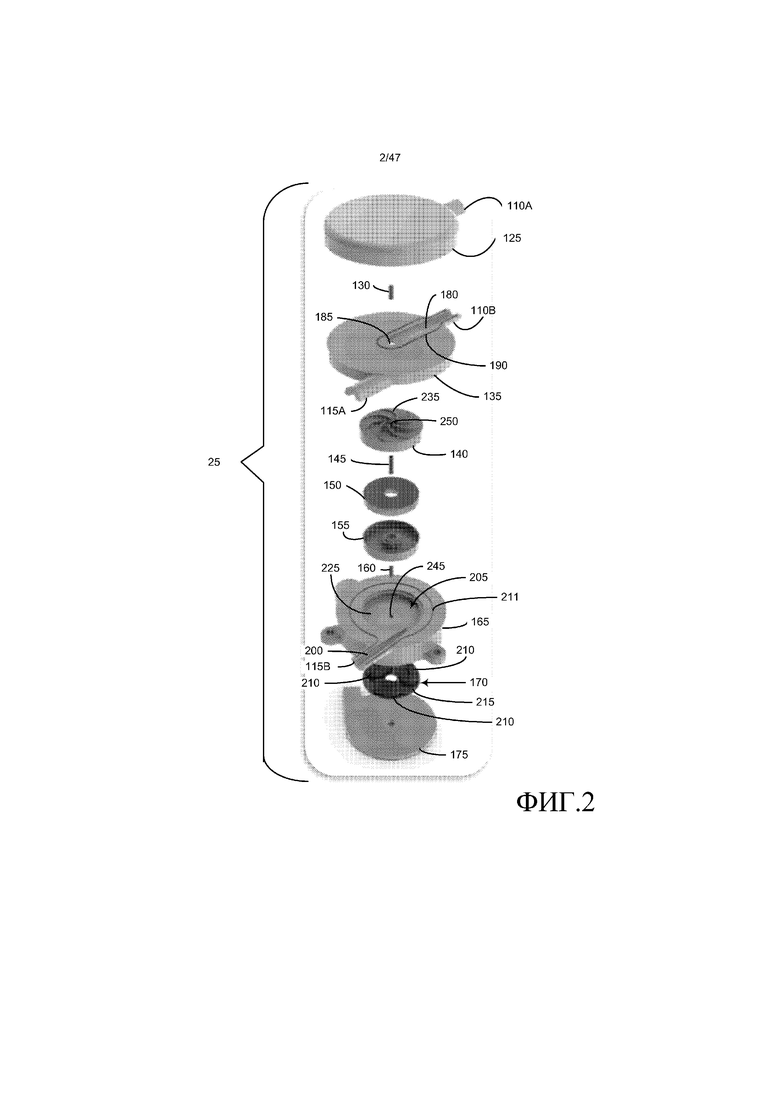
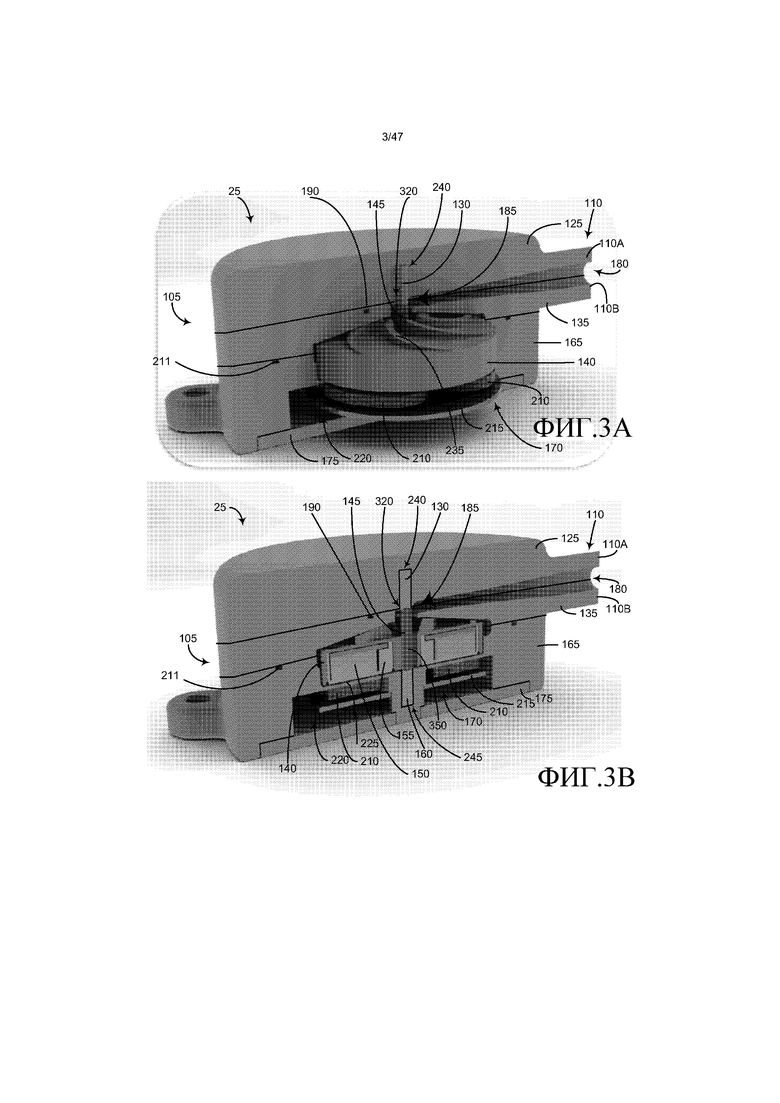

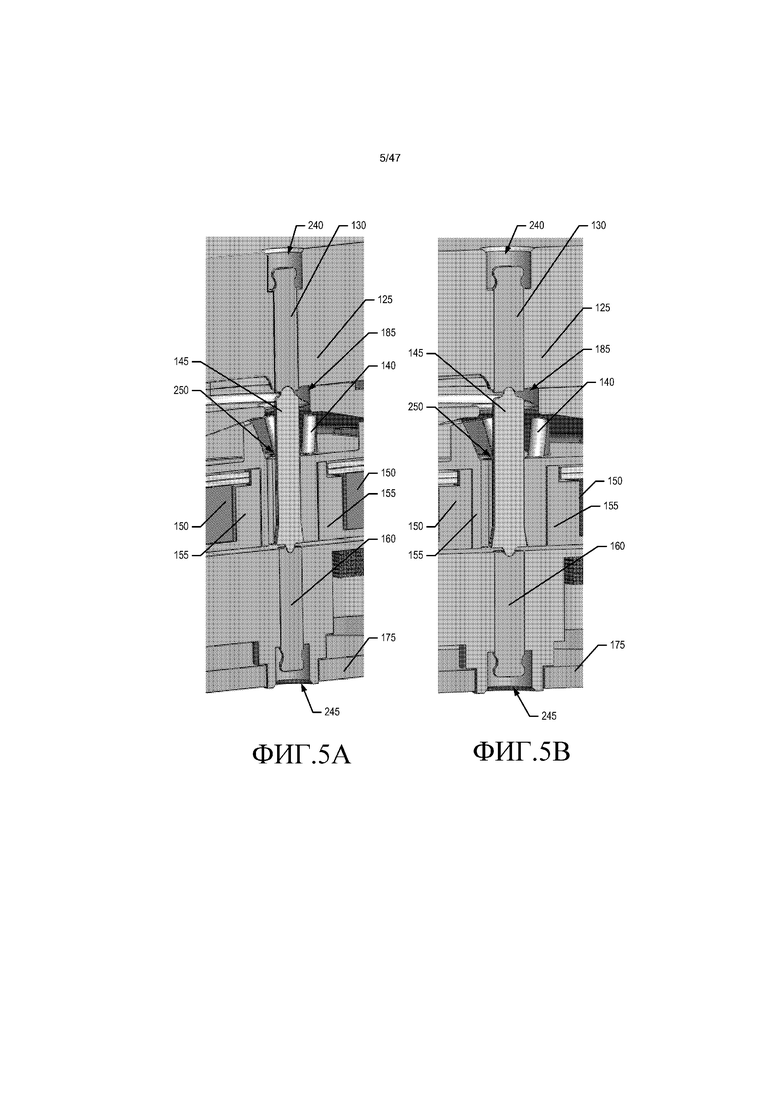
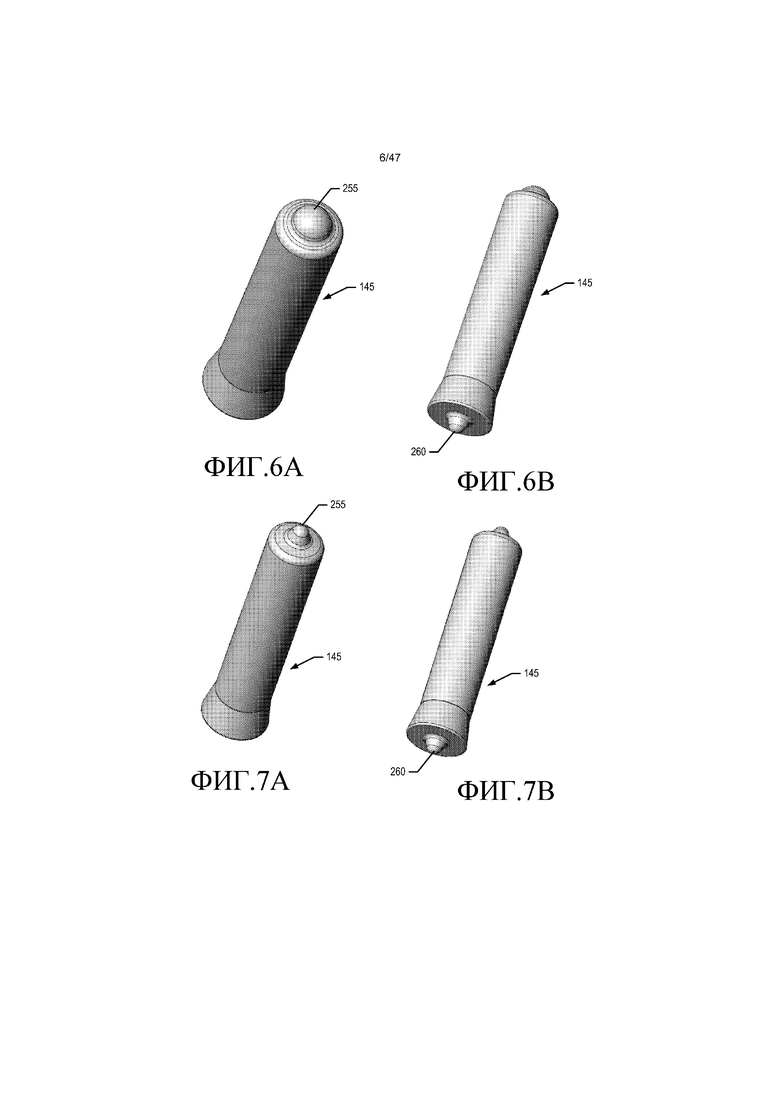
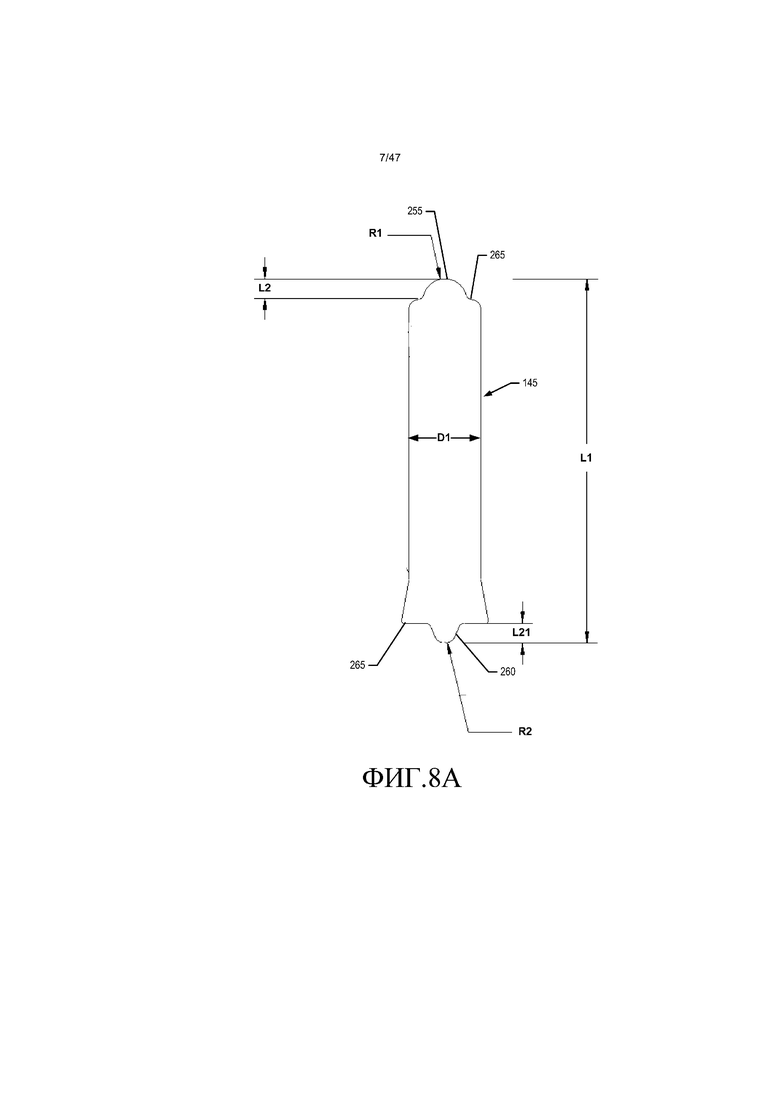
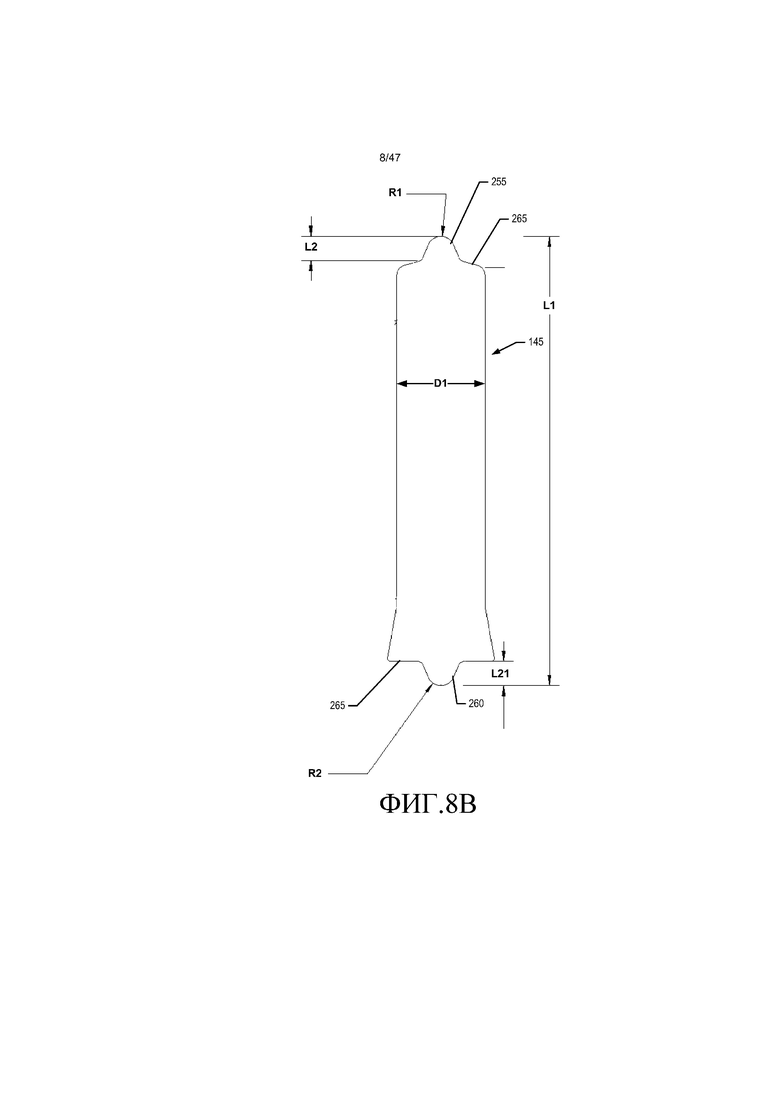


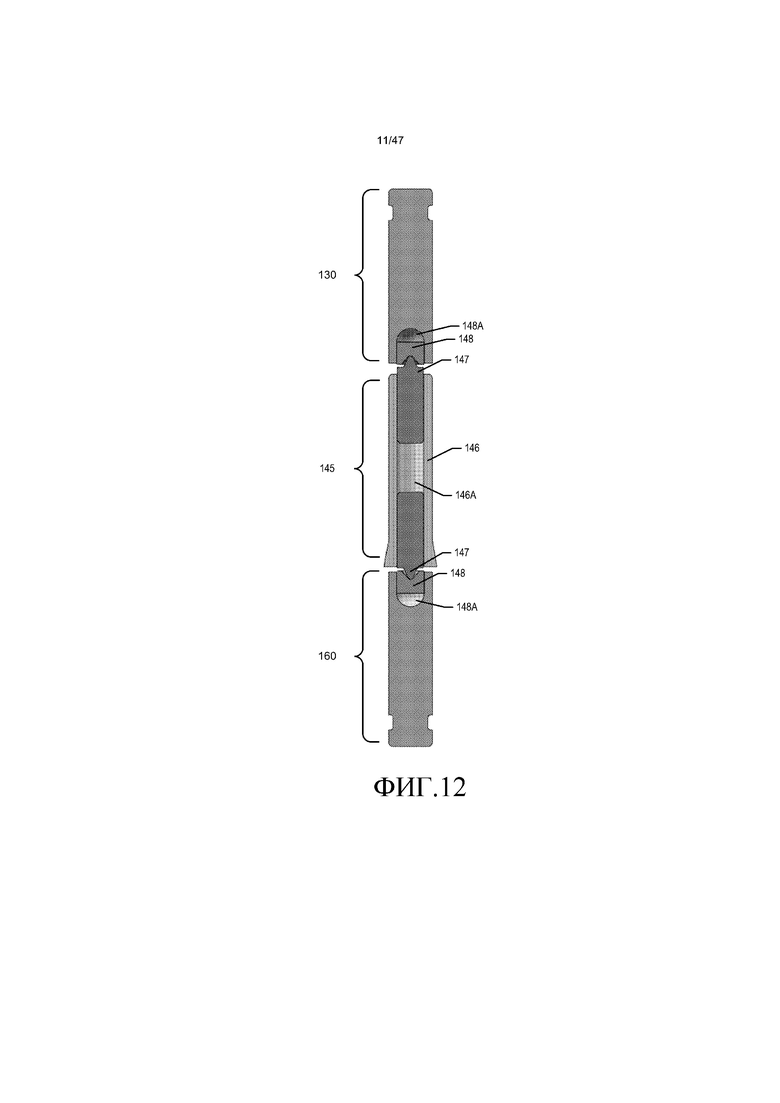
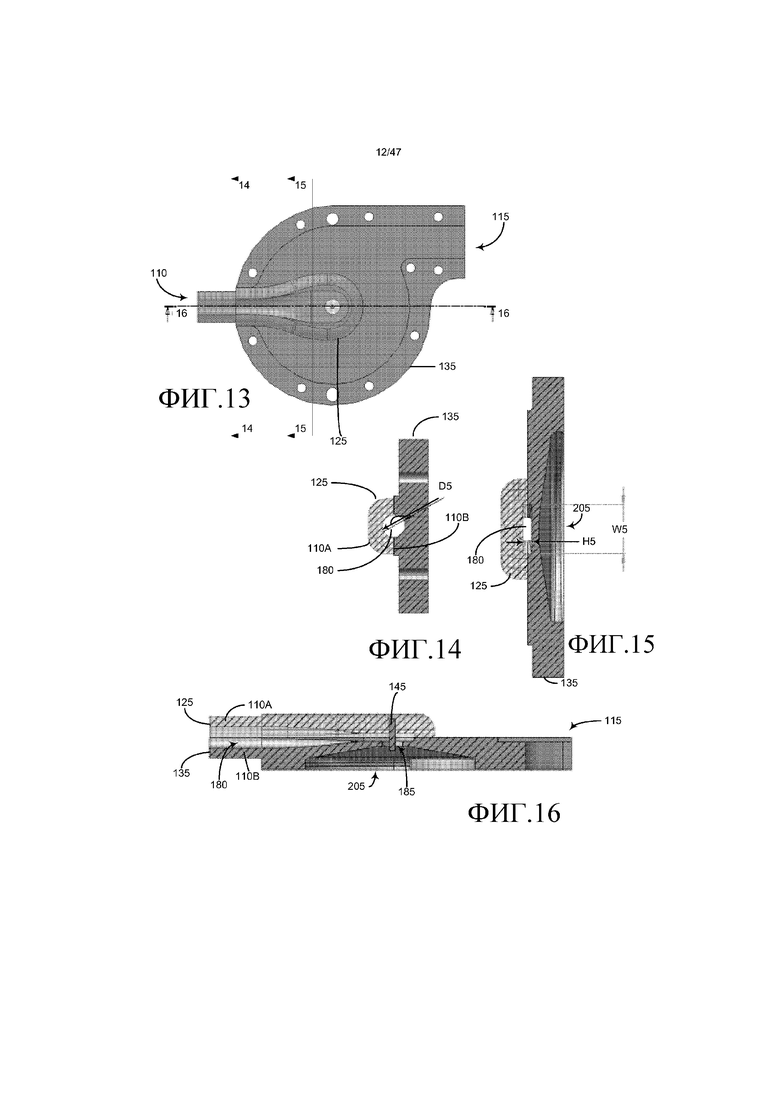


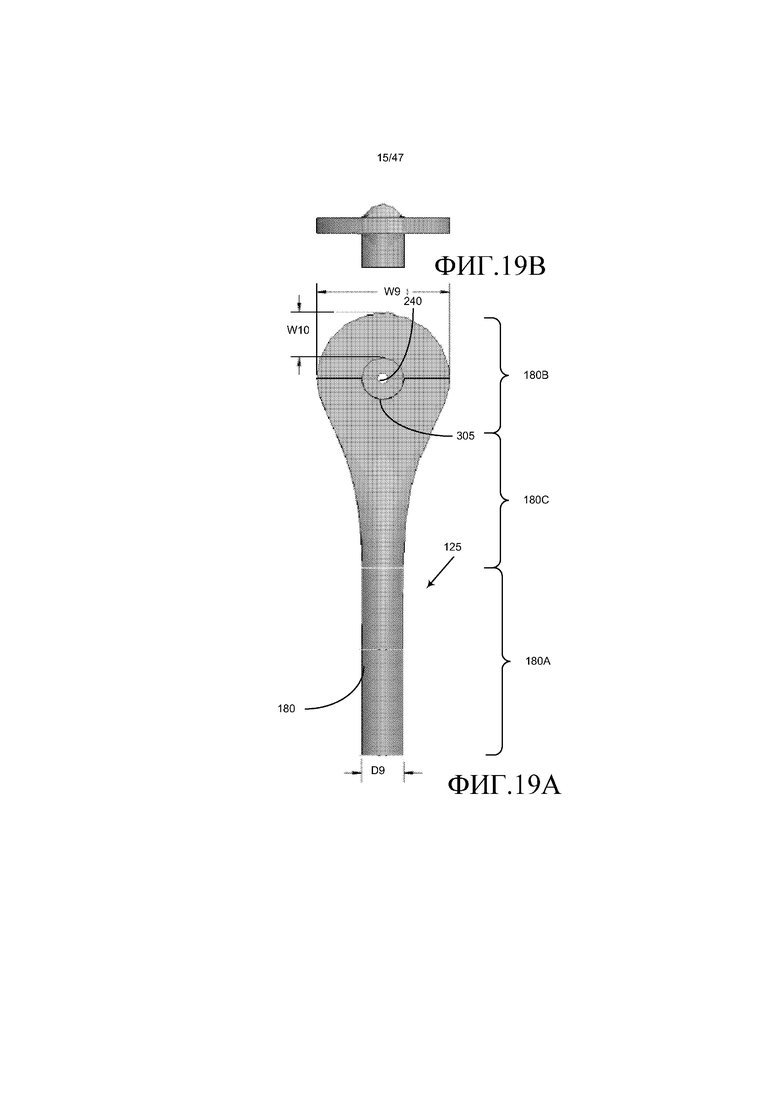
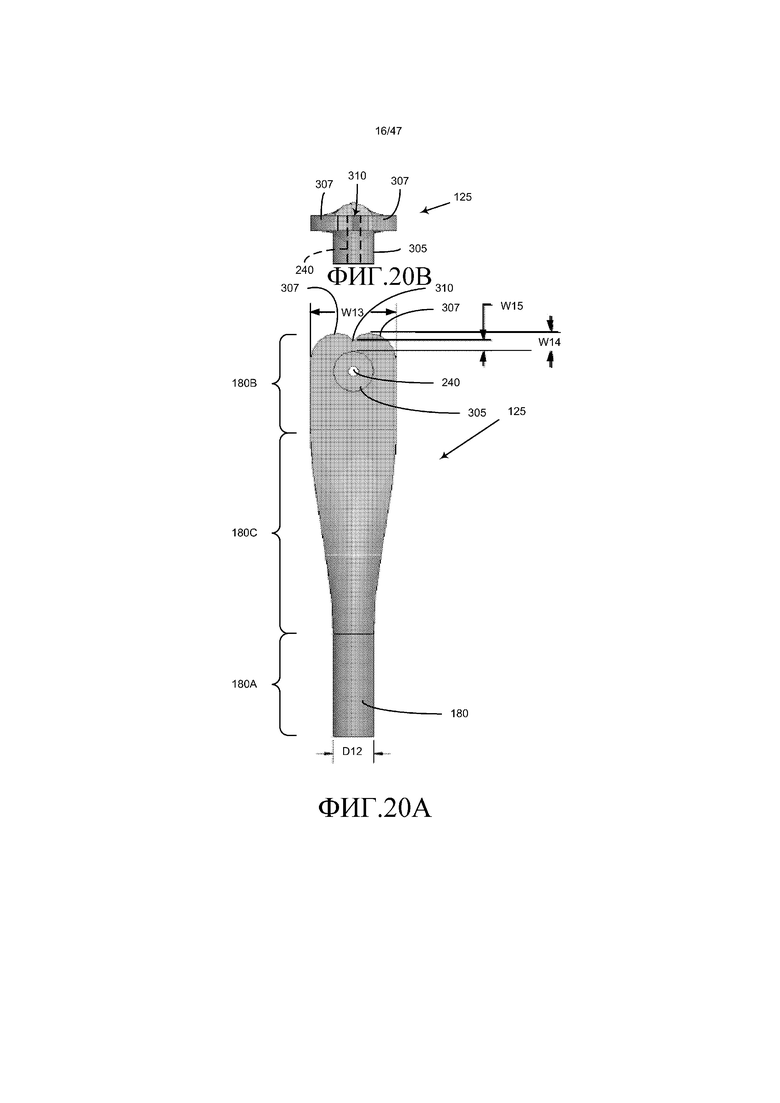
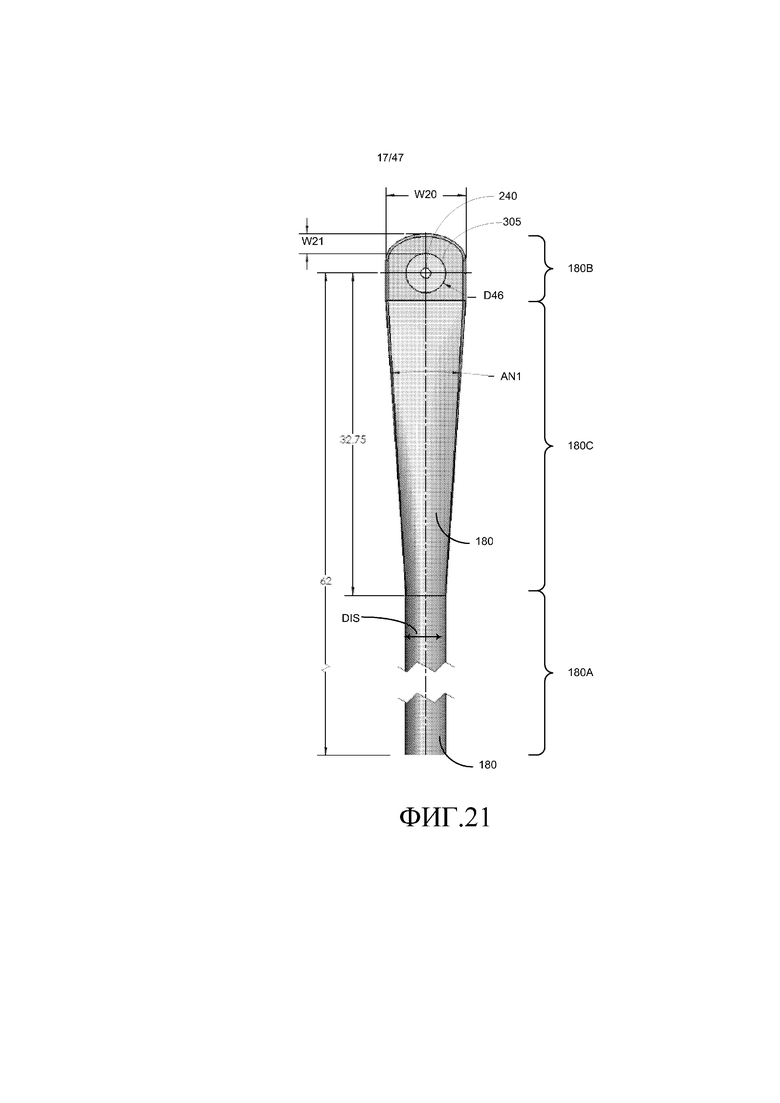
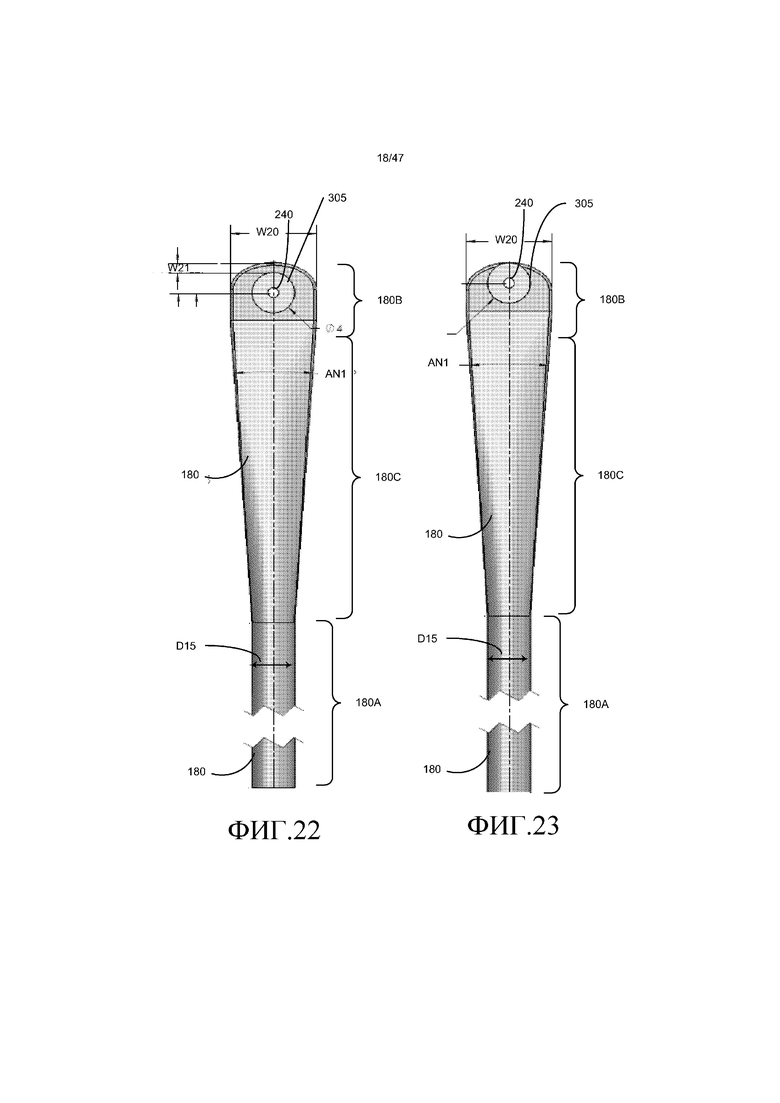
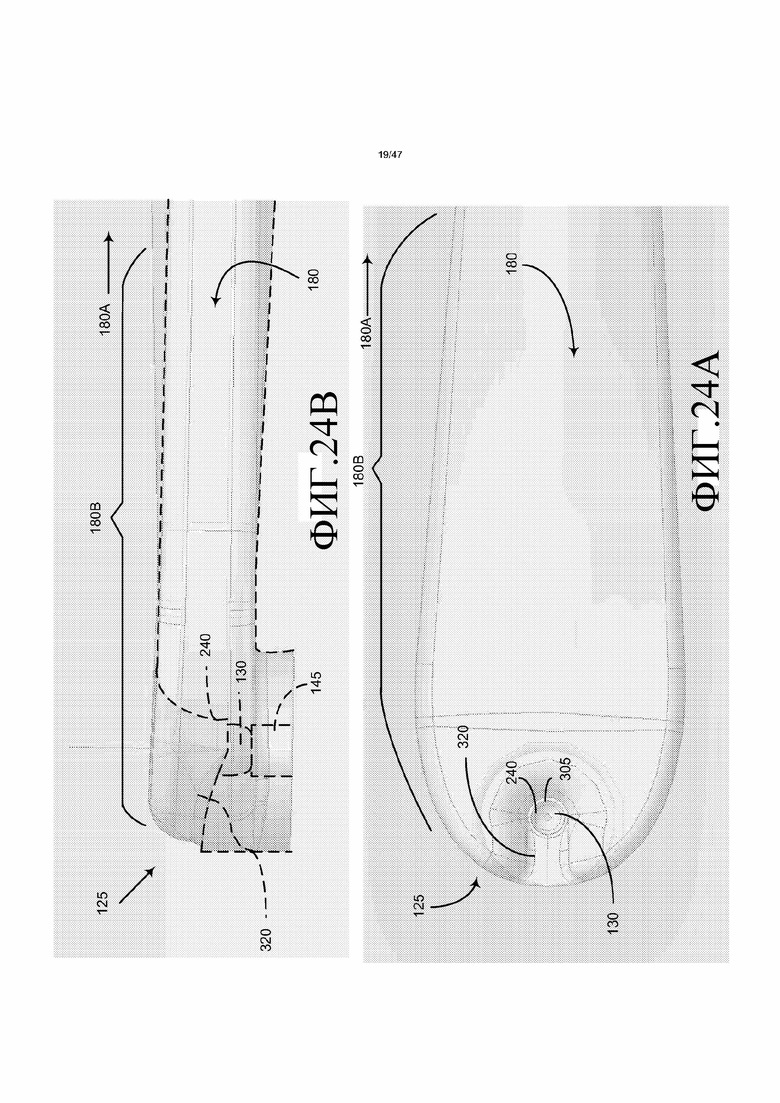
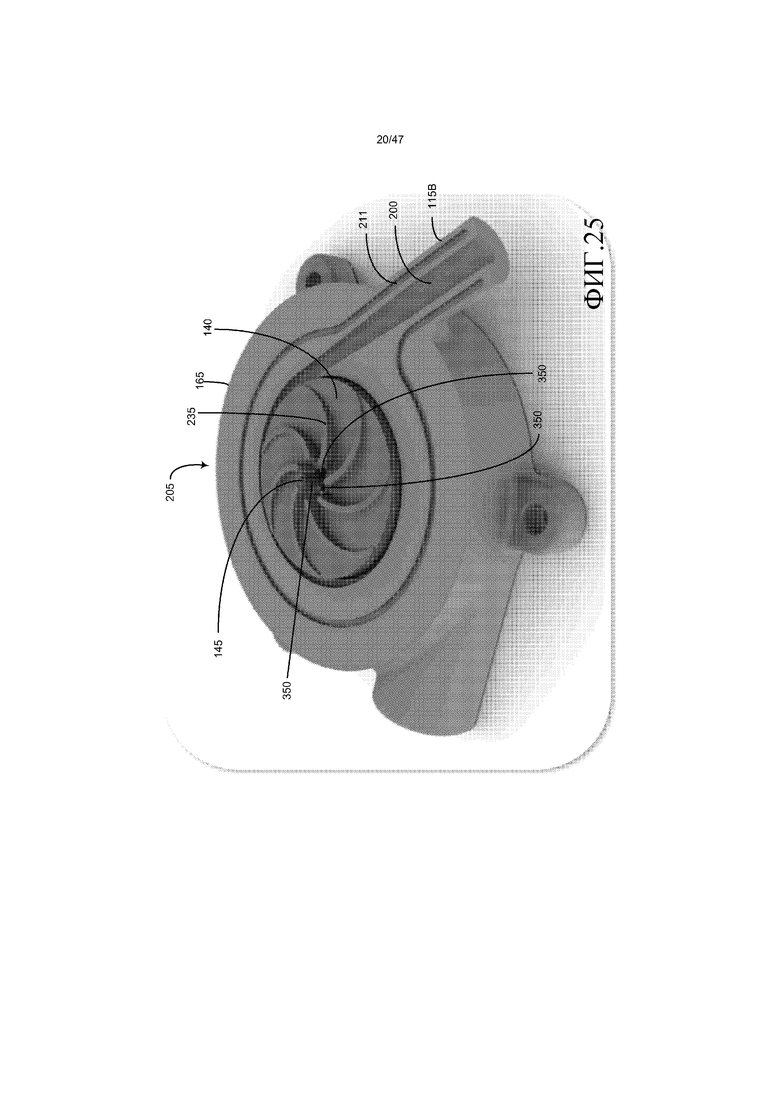

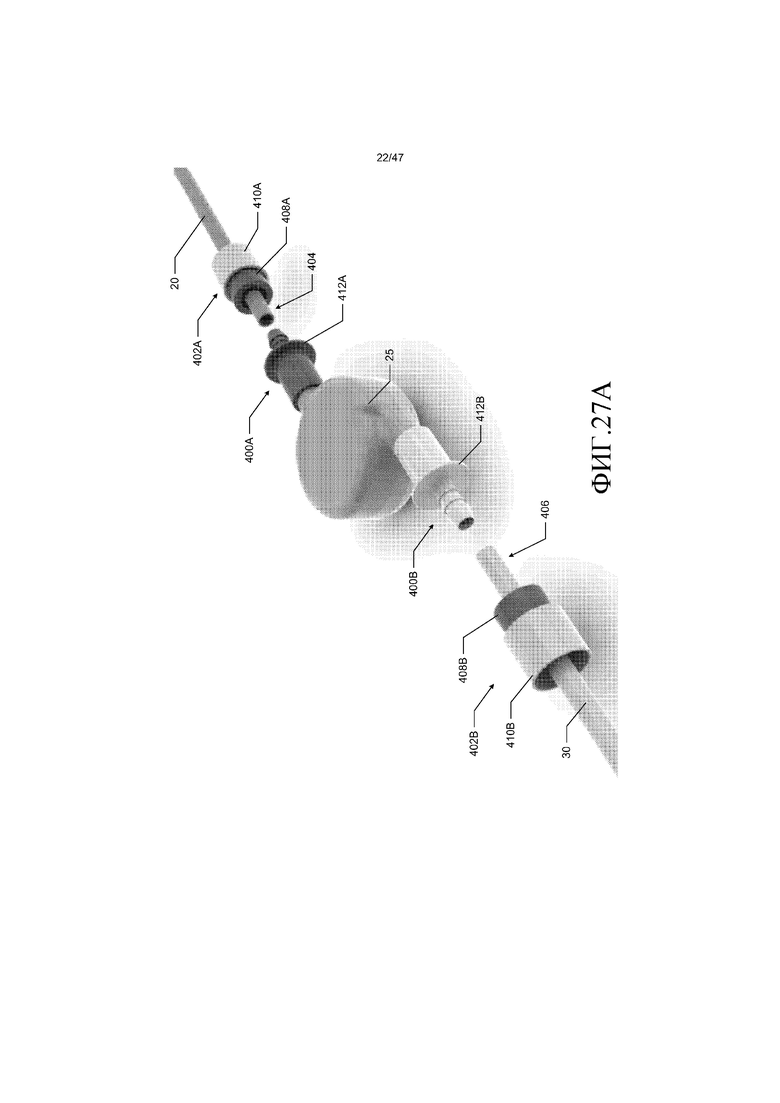
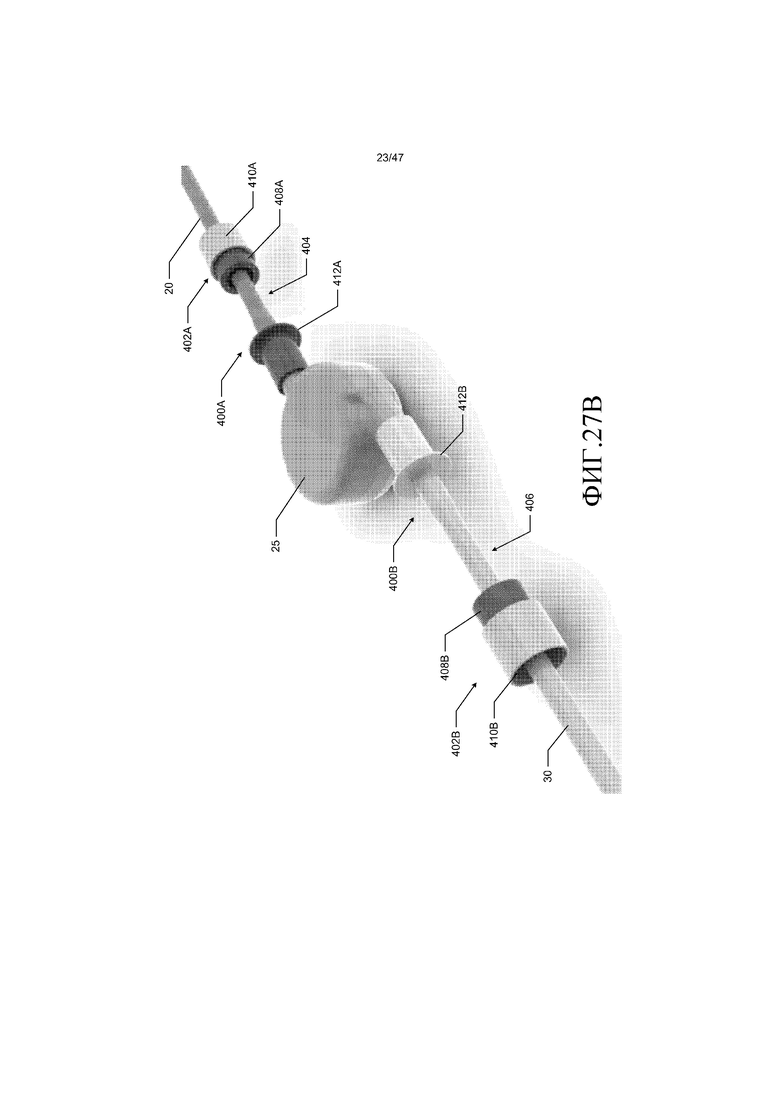
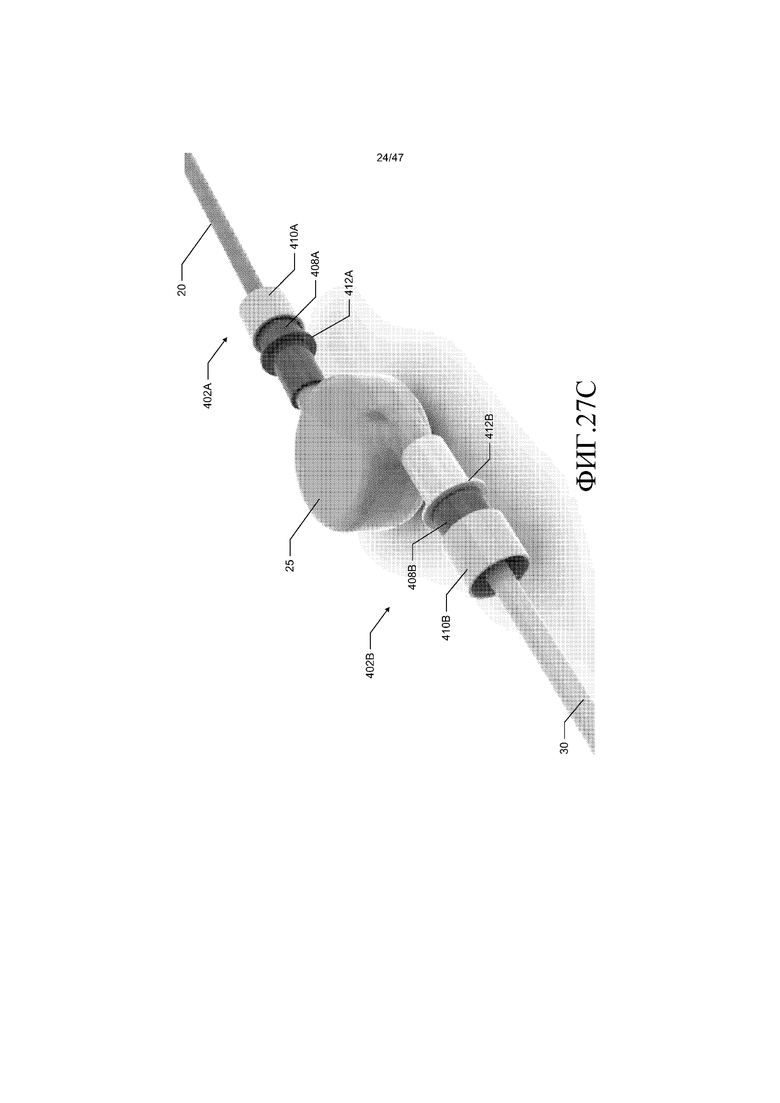




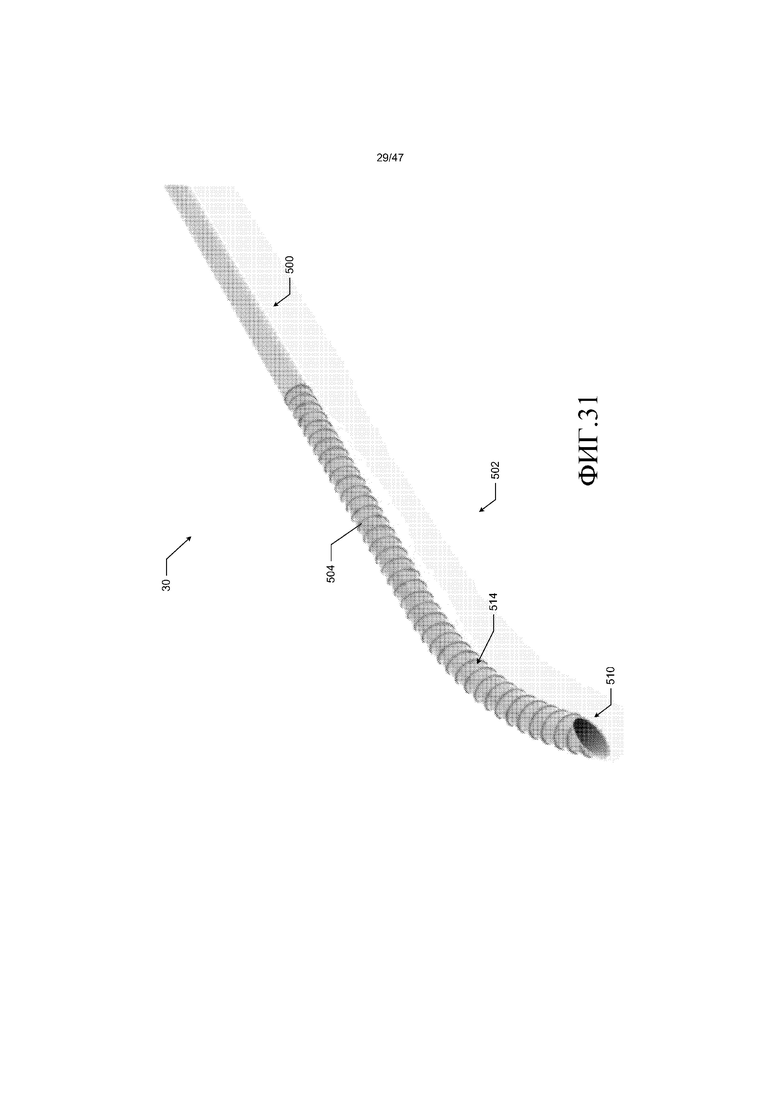
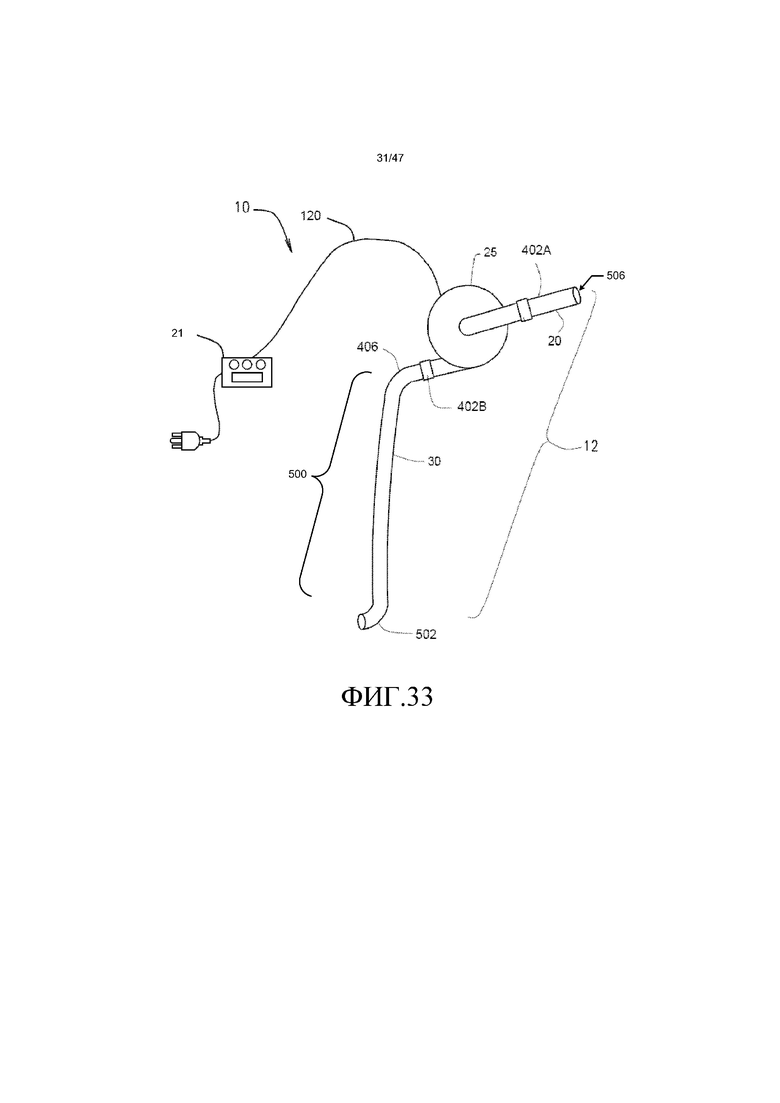

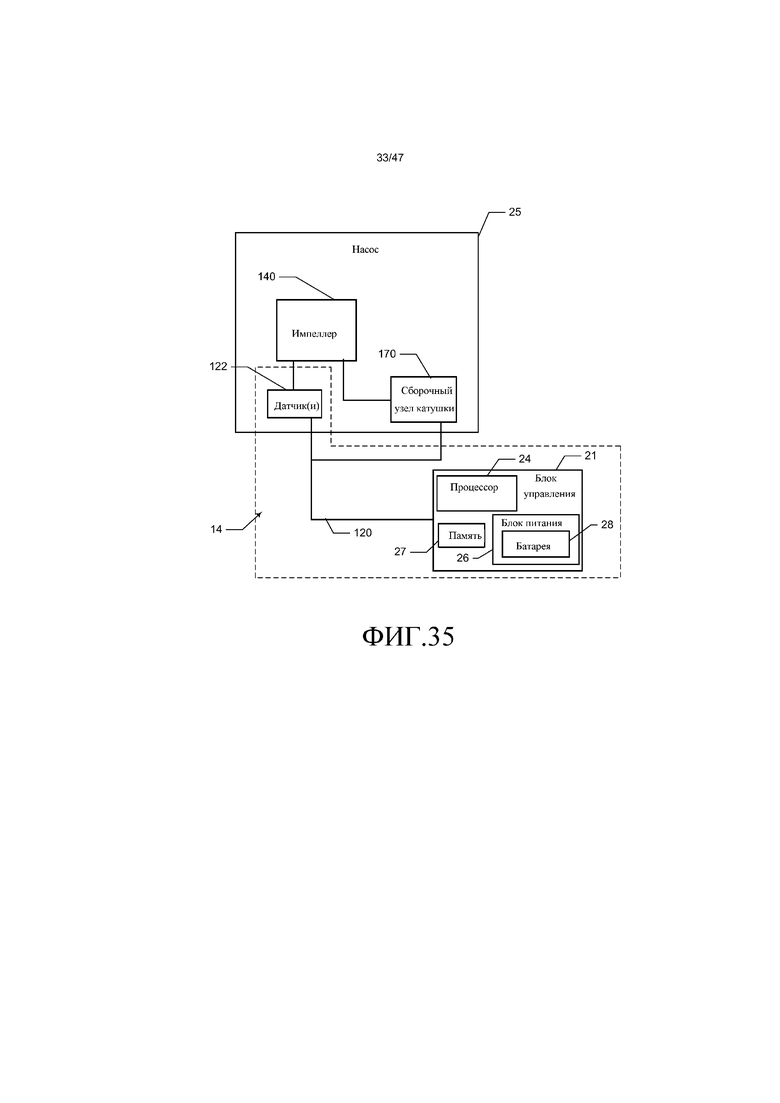


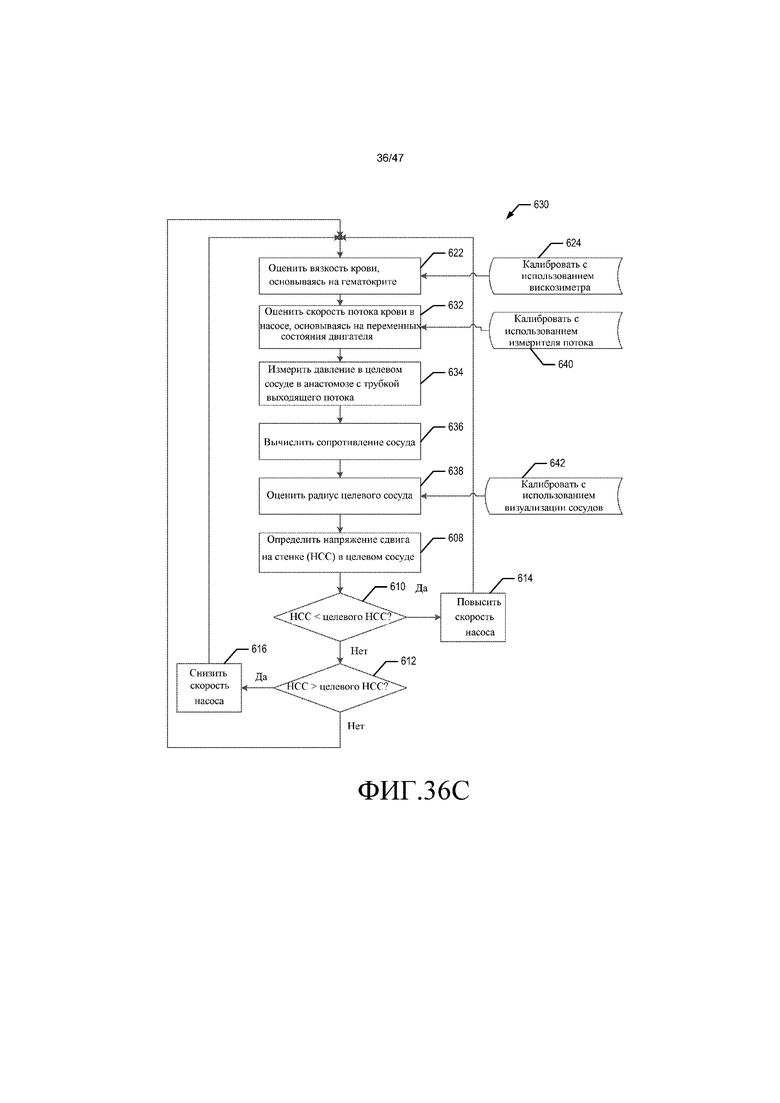
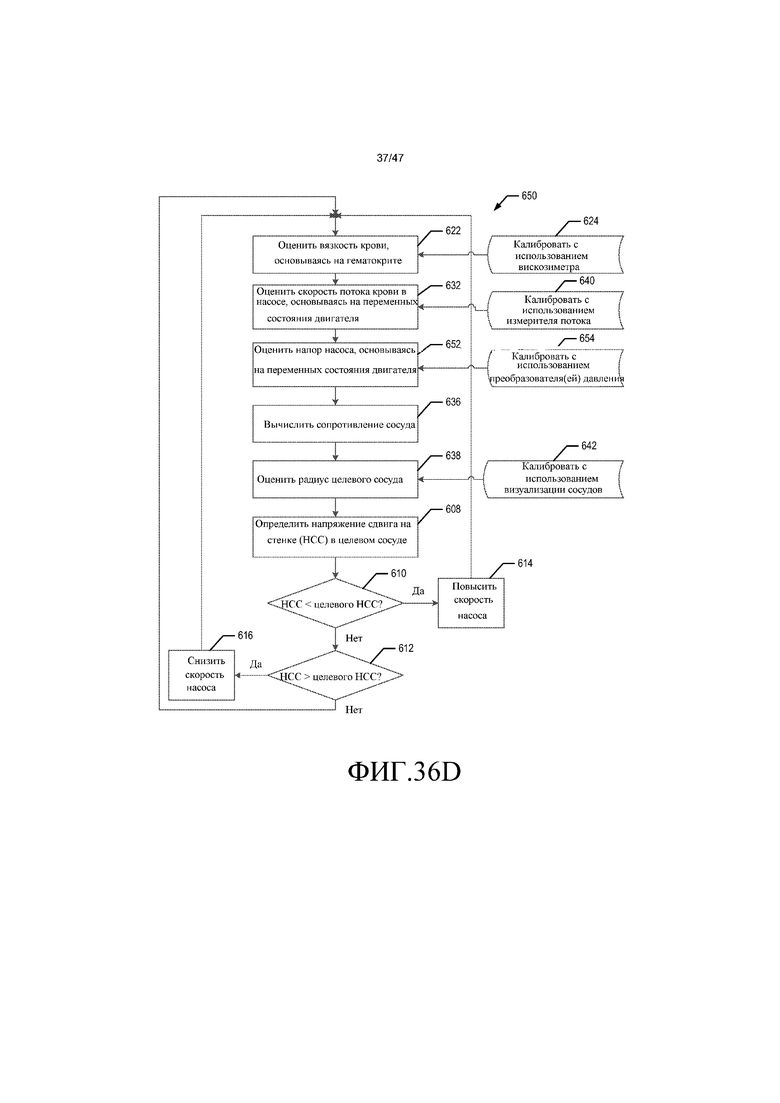
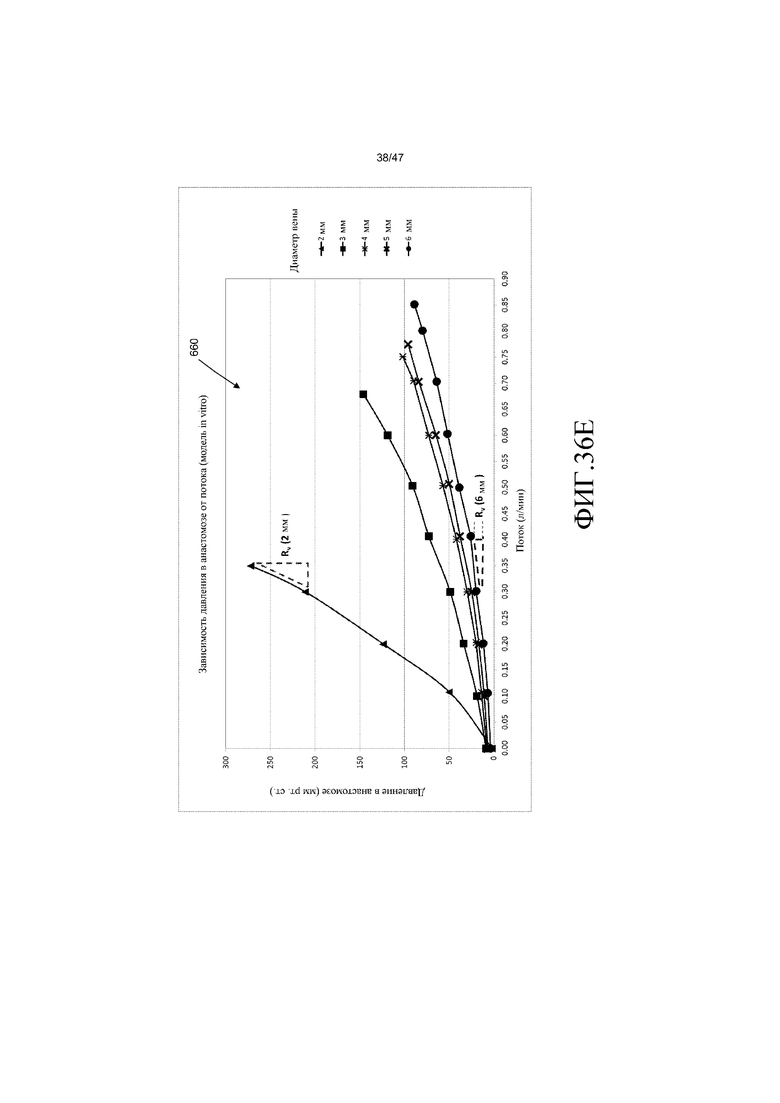


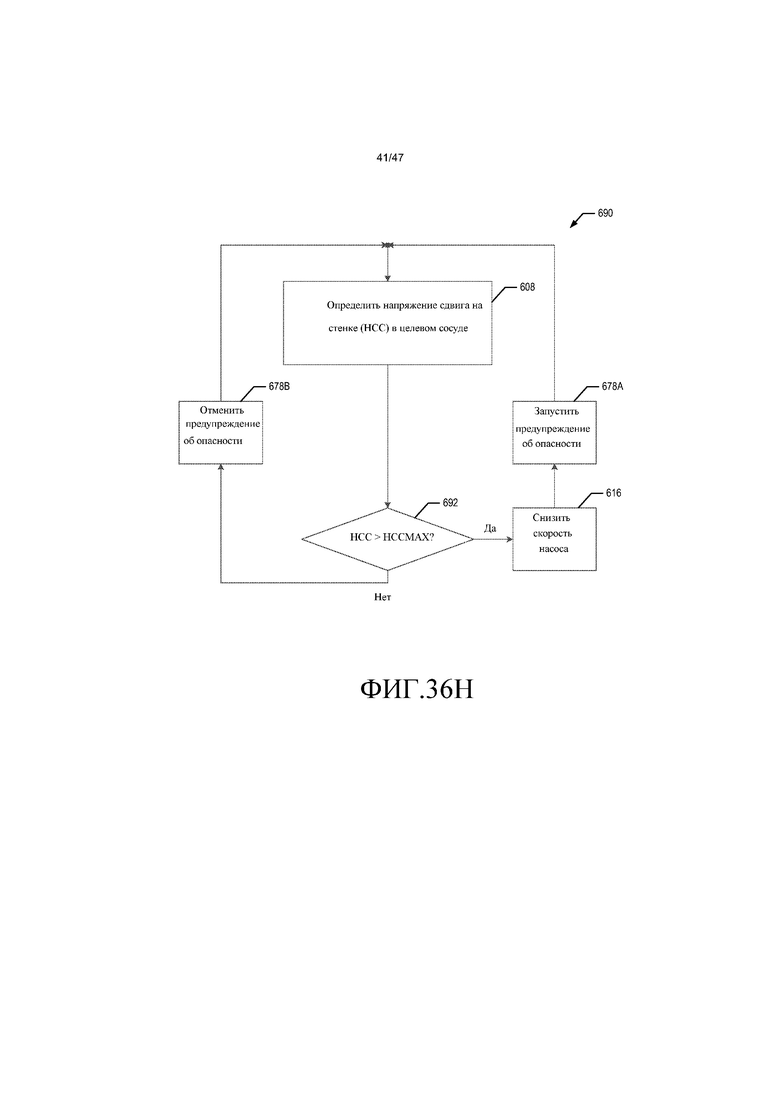

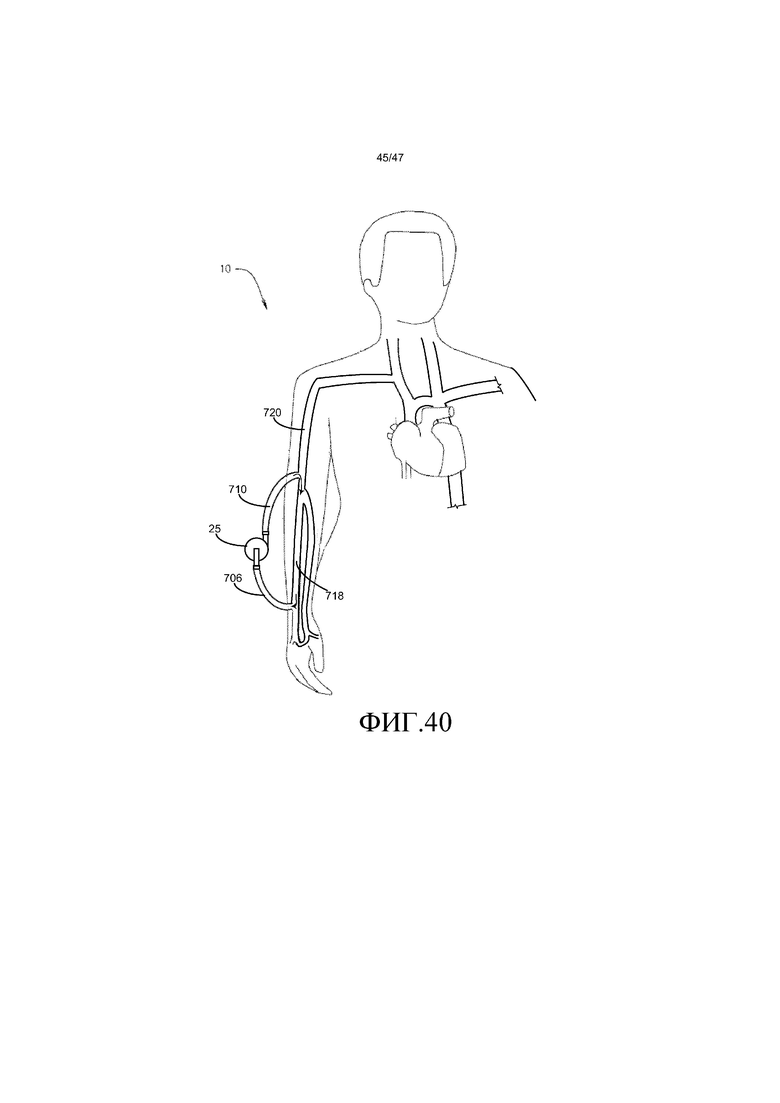


Изобретение относится к медицинской технике. Система центробежного кровяного насоса выполнена с возможностью перекачивания крови в периферическую вену со скоростью от 50 до 1500 мл/мин в течение по меньшей мере 7 дней. Среднее значение сдвигового напряжения стенки периферической вены составляет от 2,5 до 10 Па, а значение пульсового давления в периферической вене меньше, чем это значение в отдающем артериальном сосуде. Система содержит: центробежный кровяной насос, содержащий впуск и выпуск, содержащий диффузор входящего потока, для приема крови и ее направления на импеллер. Импеллер содержит поворотный вал, выполненный с возможностью зацепления с верхней поворотной несущей и нижней поворотной несущей. Лопасти на верхней поверхности импеллера проходят радиально от центра импеллера и выполнены с возможностью направления крови через корпус насоса к выпуску. Магнит механически зацеплен с импеллером. Электрический двигатель выполнен с возможностью магнитного сцепления с магнитом. Электрический двигатель способен вращать по меньшей мере один магнит и импеллер. Первый конец трубки входящего потока соединен по текучей среде со впуском, а второй конец выполнен с возможностью ввода в просвет вены. Трубка входящего потока содержит боковой порт для контролируемого доступа к пути текучей среды. Трубка выходящего потока имеет внутренний диаметр 4-6 мм. Первый ее конец соединен по текучей среде с выпуском, а второй конец выполнен с возможностью создания хирургического анастомоза к периферической вене. Трубка выходящего потока дополнительно содержит боковой порт для управляемого доступа к пути текучей среды. Устройство управления управляет скоростью импеллера, оно содержит вискозиметр, датчик скорости потока и средство измерения радиуса и выполнено с возможностью осуществления измерения вязкости крови; измерения скорости потока крови в системе кровяного насоса или кровеносном сосуде при помощи датчика скорости потока; измерения радиуса кровеносного сосуда при помощи средства измерения радиуса; определения значения сдвигового напряжения стенки на основании оцененной вязкости крови, измеренных скорости потока крови и радиуса кровеносного сосуда посредством устройства управления; сравнивания определенного значения сдвигового напряжения стенки с заданным эталонным значением посредством устройства управления; регулирования скорости кровяного насоса, регулирования сдвигового напряжения до заданного эталонного значения посредством вискозиметра, датчика скорости потока, средства измерения радиуса и устройства управления. Технический результат состоит в обеспечении увеличения диаметра периферических сосудов. 2 н. и 31 з.п. ф-лы, 43 ил.
1. Система центробежного кровяного насоса, выполненная с возможностью перекачивания крови в периферическую вену со скоростью от 50 до 1500 мл/мин в течение по меньшей мере 7 дней, при этом, при работе системы, среднее значение сдвигового напряжения стенки периферической вены составляет от 2,5 до 10 Па, а значение пульсового давления в периферической вене меньше, чем это значение в отдающем артериальном сосуде, при этом система содержит:
а) центробежный кровяной насос, содержащий
впуск и выпуск, содержащий диффузор входящего потока, для приема крови и ее направления на импеллер, при этом диффузор входящего потока дополнительно содержит верхнюю грань, поддерживающую верхнюю поворотную несущую, проходящую от верхней части корпуса во впуск, и нижнюю грань и нижнюю поворотную несущую, проходящую от нижней части корпуса во внутреннее пространство корпуса, при этом импеллер расположен между впуском и выпуском в корпусе, причем импеллер содержит:
поворотный вал импеллера, выполненный с возможностью зацепления с верхней поворотной несущей и нижней поворотной несущей;
лопасти на верхней поверхности импеллера, проходящие радиально от центра импеллера, при этом лопасти выполнены с возможностью направления крови, принятой на впуске, через корпус насоса к выпуску; по меньшей мере один магнит в механическом зацеплении с импеллером;
электрический двигатель, выполненный с возможностью магнитного сцепления с по меньшей мере одним магнитом, при этом электрический двигатель способен вращать по меньшей мере один магнит и импеллер;
b) трубку входящего потока, содержащую первый конец и второй конец, при этом первый конец соединен по текучей среде со впуском, а второй конец выполнен с возможностью ввода в просвет вены, при этом трубка входящего потока содержит по меньшей мере один боковой порт для контролируемого доступа к пути текучей среды в трубке входящего потока; и
с) трубку выходящего потока, имеющую внутренний диаметр 4-6 мм, содержащую первый конец и второй конец, при этом первый конец соединен по текучей среде с выпуском, а второй конец выполнен с возможностью создания хирургического анастомоза к периферической вене, причем трубка выходящего потока дополнительно содержит по меньшей мере один боковой порт для управляемого доступа к пути текучей среды в трубке выходящего потока;
d) устройство управления для управления скоростью импеллера, при этом устройство управления содержит процессор для управления скоростью импеллера, запоминающее устройство, батарею и кабель для электрического соединения устройства управления и центробежного насоса, при этом устройство управления содержит вискозиметр, датчик скорости потока и средство измерения радиуса и выполнено с возможностью осуществления следующих действий:
а) измерения вязкости крови при помощи вискозиметра;
б) измерения скорости потока крови в системе кровяного насоса или кровеносном сосуде при помощи датчика скорости потока;
в) измерения радиуса кровеносного сосуда при помощи средства измерения радиуса;
г) определения значения сдвигового напряжения стенки на основании оцененной вязкости крови, измеренных скорости потока крови и радиуса кровеносного сосуда посредством устройства управления;
д) сравнивания определенного значения сдвигового напряжения стенки с заданным эталонным значением посредством устройства управления;
е) регулирования скорости кровяного насоса, если определенное значение сдвигового напряжения стенки не приближено к заданному эталонному значению посредством устройства управления;
ж) повторения действий а)-е) до тех пор, пока определенное значение сдвигового напряжения не будет приближено к заданному эталонному значению посредством вискозиметра, датчика скорости потока, средства измерения радиуса и устройства управления.
2. Система центробежного кровяного насоса, выполненная с возможностью перекачивания крови в периферическую вену со скоростью от 50 до 1500 мл/мин в течение по меньшей мере 7 дней, при этом, при работе системы, среднее значение сдвигового напряжения стенки периферической вены составляет от 2,5 до 10 Па, а значение пульсового давления в периферической вене меньше, чем это значение в отдающем артериальном сосуде, при этом система содержит:
а) центробежный кровяной насос, содержащий
впуск и выпуск, содержащий диффузор входящего потока, для приема крови и ее направления на импеллер, при этом диффузор входящего потока дополнительно содержит верхнюю грань, поддерживающую верхнюю поворотную несущую, проходящую от верхней части корпуса во впуск, и нижнюю грань и нижнюю поворотную несущую, проходящую от нижней части корпуса во внутреннее пространство корпуса, при этом импеллер расположен между впуском и выпуском в корпусе, причем импеллер содержит:
поворотный вал импеллера, выполненный с возможностью зацепления с верхней поворотной несущей и нижней поворотной несущей;
лопасти на верхней поверхности импеллера, проходящие радиально от центра импеллера, при этом лопасти выполнены с возможностью направления крови, принятой на впуске, через корпус насоса к выпуску; по меньшей мере один магнит в механическом зацеплении с импеллером;
электрический двигатель, выполненный с возможностью магнитного сцепления с по меньшей мере одним магнитом, при этом электрический двигатель способен вращать по меньшей мере один магнит и импеллер;
b) трубку входящего потока, имеющую внутренний диаметр 4-6 мм, содержащую первый конец и второй конец, при этом первый конец соединен по текучей среде со впуском, а второй конец выполнен с возможностью ввода в просвет вены, при этом трубка входящего потока содержит по меньшей мере один боковой порт для контролируемого доступа к пути текучей среды в трубке входящего потока; и
с) трубку выходящего потока, имеющую внутренний диаметр 4-6 мм, содержащую первый конец и второй конец, при этом первый конец соединен по текучей среде с выпуском, а второй конец выполнен с возможностью создания хирургического анастомоза к периферической вене, причем трубка выходящего потока дополнительно содержит по меньшей мере один боковой порт для управляемого доступа к пути текучей среды в трубке выходящего потока;
d) устройство управления для управления скоростью импеллера, при этом устройство управления содержит процессор для управления скоростью импеллера, запоминающее устройство, батарею и кабель для электрического соединения устройства управления и центробежного насоса, при этом устройство управления выполнено с возможностью осуществления следующих действий:
а) непрямое измерение вязкости крови при помощи устройства управления;
б) непрямое определение скорости потока крови в системе кровяного насоса или кровеносном сосуде при помощи устройства управления;
в) непрямое определение радиуса кровеносного сосуда при помощи устройства управления;
г) определение значения сдвигового напряжения стенки на основании оцененной вязкости крови посредством устройства управления;
д) сравнивание определенного значения сдвигового напряжения стенки с заданным эталонным значением посредством устройства управления;
е) регулирование скорости кровяного насоса, если определенное значение сдвигового напряжения стенки не приближено к заданному эталонному значению посредством устройства управления;
ж) повторение действий а)-е) до тех пор, пока определенное значение сдвигового напряжения не будет приближено к заданному эталонному значению посредством устройства управления.
3. Система по п. 2, в которой устройство управления содержит вискозиметр, датчик скорости потока и средство измерения радиуса и выполнено с возможностью осуществления следующих действий:
корректировка значения вязкости крови, определенного непрямым методом, при помощи значения, измеренного вискозиметром;
корректировка значения скорости потока крови, определенного непрямым методом, при помощи значения, измеренного датчиком скорости потока;
корректировка значения радиуса кровеносного сосуда, определенного непрямым методом, при помощи значения, измеренного средством измерения радиуса.
4. Система по любому из пп. 1-3, выполненная с возможностью поддержания, при работе, среднего значения сдвигового напряжения в диапазоне от 0,76 до 23 Па в вене, соединенной по текучей среде с трубкой выходящего потока.
5. Система по п. 1, в которой по меньшей мере одна из трубок входящего и выходящего потоков содержит полиуретан.
6. Система по п. 1, в которой трубка входящего потока или трубка выходящего потока содержит пористый политетрафторэтилен (пПТФЭ).
7. Система по п. 6, в которой трубка входящего потока или трубка выходящего потока содержит соединенные участки из полиуретана и пПТФЭ.
8. Система по п. 1, в которой по меньшей мере часть одной из трубки входящего потока и трубки выходящего потока содержит опорную конструкцию, содержащую материал с памятью формы, или саморасправляющийся материал или нержавеющую сталь.
9. Система по п. 8, в которой материал с памятью формы или саморасправляющийся материал представляет собой нитинол.
10. Система по п. 6 или 7, в которой по меньшей мере часть нитинола или нержавеющей стали сплетена или закручена в спираль.
11. Система по п. 1, в которой по меньшей мере одна из трубки входящего потока и трубки выходящего потока присоединена к кровяному насосу или боковому порту с использованием радиально-сжимаемого соединителя.
12. Система по п. 1 или 2, в которой при работе система выполнена с возможностью поддержания повышенного среднего значения напряжения сдвига стенки внутри вены, соединенной по текучей среде с трубкой выходящего потока, в течение по меньшей мере 14 дней, 28 дней, 56 дней или 112 дней.
13. Система по п. 1, в которой при работе система выполнена с возможностью поддерживать среднюю скорость кровотока в диапазоне от 10 до 120 см/с или от 25 до 100 см/с в вене, соединенной по текучей среде с трубкой выходящего потока.
14. Система по п. 1, в которой трубка входящего потока или трубка выходящего потока выполнена с возможностью усечения.
15. Система по п. 1, в которой по меньшей мере одна из лопастей является дугообразной.
16. Система по п. 1, в которой один или более магнитов образуют кольцо или диск.
17. Система по п. 1, в которой одна или более несущих содержит оксид алюминия, оксид алюминия и оксид циркония или оксид алюминия и карбид кремния.
18. Система по п. 1, в которой концы поворотного вала импеллера являются выпуклыми, а поворотные несущие являются вогнутыми, или в которой концы поворотного вала импеллера являются вогнутыми, а поворотные несущие являются выпуклыми.
19. Система по п. 1, в которой просвет впуска меняет форму от по существу круглой до по существу прямоугольной в районе диффузора входящего потока.
20. Система по п. 1, в которой диффузор входящего потока имеет дугообразную форму.
21. Система по п. 1, в которой части поворотного вала импеллера и верхней поворотной несущей проходят во впуск, что обеспечивает их омывание кровотоком при работе насоса.
22. Система по п. 1, в которой части поворотного вала импеллера и верхней поворотной несущей проходят в зазор нижней несущей, что обеспечивает их омывание кровотоком при работе насоса.
23. Система по п. 1, в которой часть верхней поворотной несущей, проходящая в зазор верхней несущей, поддерживается гранью.
24. Система по п. 1, в которой импеллер содержит каналы, проходящие параллельно центральной оси импеллера от нижней поверхности через импеллер к верхней поверхности.
25. Система по п. 24, в которой при работе насоса нижняя поверхность импеллера и части поверхностей нижней несущей находятся в контакте с кровотоком вокруг и под импеллером и через каналы к верхней поверхности.
26. Система по п. 24, в которой кровоток вокруг и под импеллером и через каналы к верхней поверхности омывает части поверхностей верхней несущей при работе насоса.
27. Система по п. 24, в которой часть верхнего несущего штыря, проходящего в верхний зазор несущей, поддерживается гранью, что обеспечивает омывание кровотоком вокруг и под импеллером через каналы к верхней поверхности области за гранью при работе насоса.
28. Система по п. 1, в которой по меньшей мере одна поверхность, контактирующая с кровью, выполнена из полиэфирэфиркетона (ПЭЭК).
29. Система по п. 1, в которой по меньшей мере одна поверхность, контактирующая с кровью, содержит антитромботическое покрытие, включая поверхности насоса, трубки входящего потока, трубки выходящего потока и боковых портов.
30. Система по п. 29, в которой антитромботическое покрытие содержит гепарин.
31. Система по п. 1, в которой трубка выходящего потока выполнена с возможностью создания соединения с периферической веной с диаметром от 1 до 6 мм при помощи хирургического анастомоза.
32. Система по п. 1, в которой наружная поверхность трубки входящего потока или трубки выходящего потока содержит антимикробное покрытие.
33. Система по п. 1, в котором боковой порт выполнен с возможностью обеспечения соединения по текучей среде с аппаратом для гемодиализа, при этом система центробежного кровяного насоса выполнена с возможностью сосудистого доступа во время гемодиализа.
| US 2005113631 A1, 26.05.2005 | |||
| US 2001001814 A1, 24.05.2001 | |||
| US 7357425 B2, 15.04.2008 | |||
| US 5300015 A1, 20.08.2009 | |||
| US 4795446 A, 03.01.1989 | |||
| ИМПЛАНТИРУЕМАЯ ВСПОМОГАТЕЛЬНАЯ СЕРДЕЧНАЯ СИСТЕМА | 1998 |
|
RU2203686C2 |
Авторы
Даты
2021-08-31—Публикация
2012-08-15—Подача