Перекрестные ссылки на родственные заявки
Для настоящей патентной заявки испрашивается приоритет по предварительной заявке на патент США № 62/378,541, поданной 23 августа 2016 г. Полное раскрытие вышеуказанной предварительной заявки на патент и всех других одновременно поданных не предварительных патентных заявок, претендующих на получение преимущества от этой предварительной заявки, включено в настоящий документ посредством ссылки.
Предпосылки создания изобретения
Раскрытые варианты осуществления относятся к соединениям, имеющим монотерпеноидный и/или фенилпропаноидный фрагмент, а также к способам их получения и применения.
Многие эфирные масла растений содержат монотерпеновые или монотерпеноидные соединения, некоторые из которых являются инсектицидными. Их активность, как правило, меньше, чем у традиционных синтетических инсектицидов, но они так же эффективны в отношении гибели насекомых или борьбы с ними, когда обеспечивается достаточная для вредителя доза.
Было показано, что монотерпеноиды обладают различными свойствами, которые позволяют им манипулировать различными биологическими системами. Было показано, что эти соединения являются инсектицидными, бактерицидными, фунгицидными и гербицидными. Применение некоторых производных монотерпеноидов в качестве потенциальных гербицидов раскрыто в данном документе. Эти соединения убивают растения с помощью иных механизмов, чем описанные в других патентах, которые раскрывают применение монотерпеноидов в качестве гербицидов. Более того, эти соединения избирательны по отношению к двудольным видам растений, что делает их полезными, а их ценность на современном рынке - значительной.
Предполагается, что раскрытые варианты осуществления преодолевают один или несколько недостатков, характерных для данной области техники.
Краткое описание сущности изобретения
Один аспект раскрытых вариантов осуществления относится к соединению формулы (I)
 ,
,
 или
или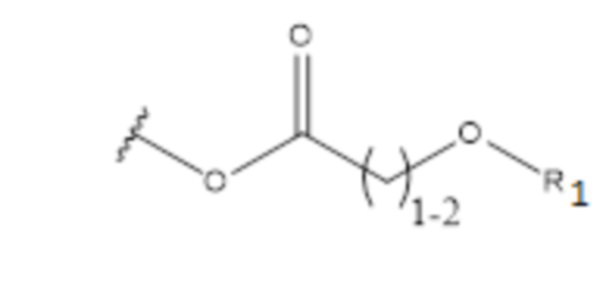 ; где
; где
R1 представляет собой фенилпропаноидный или монотерпеноидный фрагмент;
R2 представляет собой фенилпропаноидный или монотерпеноидный фрагмент или выбран из группы, состоящей из Н, М, замещенного или незамещенного С3-С7 неразветвленного или разветвленного алкила, замещенного или незамещенного С2-С7 неразветвленного или разветвленного алкенила, замещенного или незамещенного С3-С7 неразветвленного или разветвленного алкинила, замещенного или незамещенного С3-С7 неразветвленного или разветвленного циклоалкила, замещенного или незамещенного гетероарила, и замещенного или незамещенного С3-С7 неразветвленного или разветвленного циклоалкенила; и
М представляет собой противоион, выбранный из группы, состоящей из натрия, калия, кальция, магния, железа, цинка, меди и амина.
В соответствии с иллюстративным вариантом осуществления основными используемыми молекулами монотерпеноидов и фенилпропаноидов являются тимол, эвгенол, изоэвгенол, гераниол, ментол, цитронеллол, гераниол, линалоол, коричный спирт, ванилиновая кислота, сиринговая кислота и карвакрол. 2-(2-формилфенокси) уксусная кислота, салициловая кислота, метилсалицилат, феруловая кислота, п-кумаровая кислота, умбеллиферон, пицеол также являются релевантными исходными материалами, которые считаются монотерпеноидами в соответствии с раскрытыми вариантами осуществления.
Раскрытые варианты осуществления проявляют токсичность в качестве системных гербицидов для уничтожения или борьбы с нежелательной растительностью и т.д. Кроме того, эти гербициды являются избирательными по отношению к двудольным видам растений и эффективны против широкого разнообразия видов вредных растений. Эти соединения представляют собой гербицидные химикаты, которые характеризуются меньшим последействием, чем коммерческие гербициды, доступные в настоящее время. Используя природные соединения для производства гербицидных соединений, можно обеспечить более безопасные коммерческие пестицидные составы.
Краткое описание чертежей
Фиг. 1 представляет собой график, демонстрирующий эффективность различных монотерпеноид-оксиуксусных кислот для ингибирования прорастания семян кукурузы, обработанных этими соединениями, из расчета 1% по массе соединения на массу семян. В этом исследовании многочисленные соединения были способны ингибировать прорастание семян кукурузы.
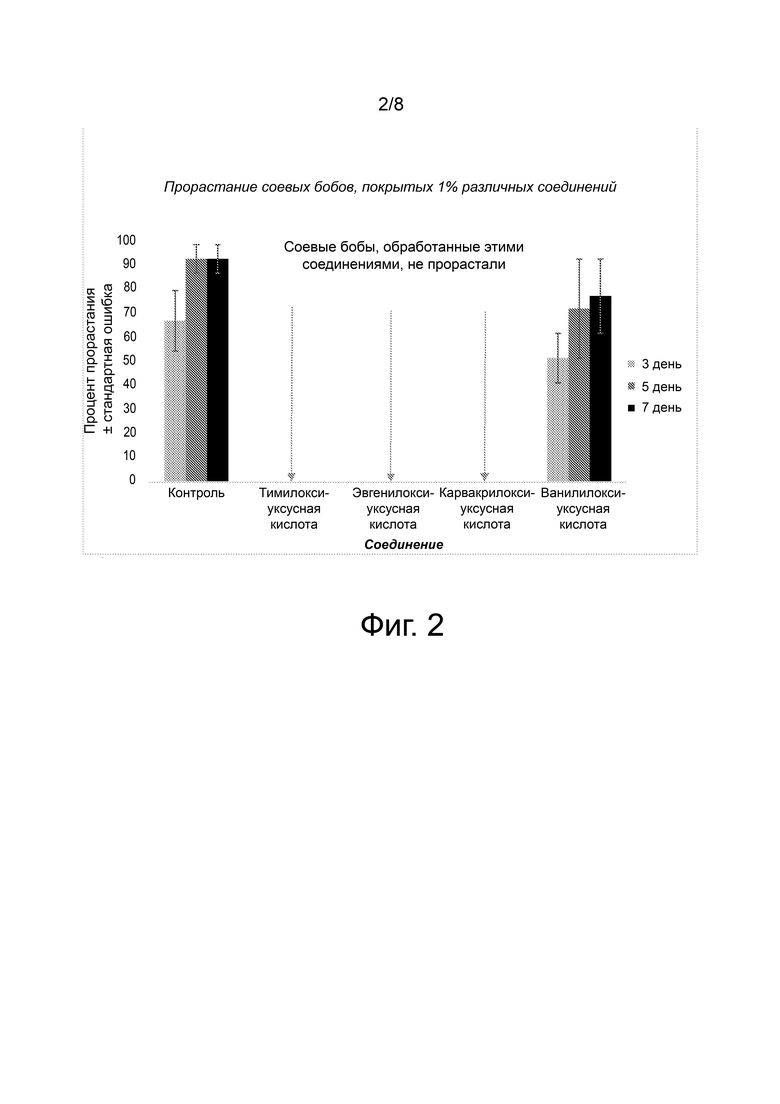
Фиг. 2 представляет собой график, демонстрирующий эффективность различных соединений для ингибирования роста соевых бобов, покрытых 1% по массе соединения на массу фасоли. Три соединения, тимилоксиуксусная кислота, эвгенилоксиуксусная кислота и карвакрилоксиуксусная кислота, предотвращали рост соевых бобов в этом исследовании. Ванилилоксиуксусная кислота является типичным соединением, которое не вызывает значительного ингибирования роста растений при обработке бобов этим соединением.
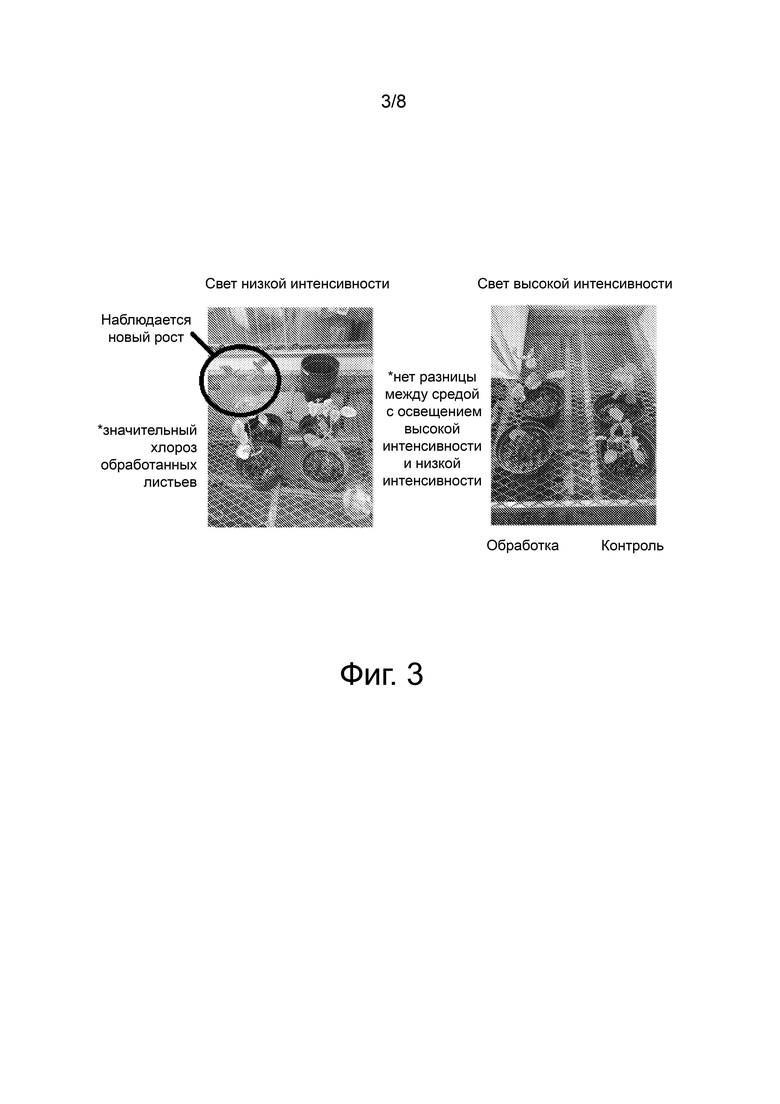
Фиг. 3 иллюстрирует растение сои в возрасте 1 месяца, которое подвергали лиственному опрыскиванию 1% тимилоксиуксусной кислотой, через 14 дней после обработки. Обработанные растения имеют признаки значительного хлороза и увядания. Возможно, что при более высоких концентрациях тимилоксиуксусной кислоты может быть достигнута значительная смертность. Не было очевидных различий в увядании и хлорозе между группами с высокой и низкой интенсивностью света, что указывает на то, что тимилоксиуксусная кислота проявляет свою фитотоксичность через иной способ действия, чем другие терпеноиды. Новый рост наблюдался в группе с низкой интенсивностью света. Скорее всего, это связано с отсутствием света, а не является следствием обработки. Контрольные растения не испытывали каких-либо негативных эффектов, связанных с высокой/низкой интенсивностью освещения.
Фиг. 4 иллюстрирует кислицу, обработанную 20 опрыскиваниями 1% карвакрилоксиуксусной кислоты или 1% 2,4-дихлорфеноксиуксусной кислоты из бытового распылителя MAINStays™, наблюдаемую через 2 дня после обработки. 1% карвакрилоксиуксусная кислота вызывала более быстрый фитотоксический эффект, чем 2,4-дихлорфеноксиуксусная кислота. Растения, обработанные 2,4-дихлоруксусной кислотой с такой частотой, проявляли неконтролируемый рост и некоторый хлороз. Карвакрилоксиуксусная кислота вызывала немедленный и широко распространенный хлороз, сопровождаемый относительно быстрой гибелью растений. Растения погибали намного медленнее от 2,4-дихлорфеноксиуксусной кислоты.
Фиг. 5 иллюстрирует результаты предварительного применения тимилоксиуксусной кислоты и карвакрилоксиуксусной кислоты через 3 недели после обработки. На каждом изображении обработанный горшок показан слева, рядом с контрольным (необработанным) горшком справа. Как тимилоксиуксусная кислота, так и карвакрилоксиуксусная кислота были способны ингибировать рост как кукурузы, так и соевых бобов при применении вскоре после посадки. Из двух составов карвакрилоксиуксусная кислота превзошла тимилоксиуксусную кислоту по ингибированию роста у обоих типов растений. Рост соевых бобов и кислицы был полностью предотвращен при 1% концентрации карвакрилоксиуксусной кислоты, что позволяет предположить, что этот активный ингредиент может быть идеальным гербицидом до появления всходов. Кроме того, этот состав вызывал значительное ингибирование роста кукурузы; однако, растения кукурузы все еще всходили и продолжали расти. В начале испытания тимилоксиуксусная кислота вызывала значительное ингибирование роста как сои, так и кислицы. Однако обработанная кислица характеризовалась латентным ростом после нанесения, и растения в группе обработки могли быть больше, чем контрольные растения.
Фиг. 6 иллюстрирует значительный хлороз и последующую фитотоксичность, которые наблюдались у растений щирицы, обработанных 40 мл 5% монотерпеноидных производных. Как карвакрилоксиуксусная кислота, так и тимилоксиуксусная кислота были способны вызывать значительный хлороз и фитотоксичность у растений щирицы через 2 дня после применения.
Фиг. 7 иллюстрирует значительный хлороз и последующую фитотоксичность, которые наблюдались у растений канатника, обработанных 40 мл 5% монотерпеноидных производных. Как карвакрилоксиуксусная кислота, так и тимилоксиуксусная кислота были способны вызывать значительный хлороз и фитотоксичность у растений канатника через 2 дня после применения.
Фиг. 8 иллюстрирует значительный хлороз и последующую фитотоксичность, которые наблюдались у одуванчиков, обработанных 40 мл 5% монотерпеноидных производных. Как карвакрилоксиуксусная кислота, так и тимилоксиуксусная кислота были способны вызывать значительный хлороз и фитотоксичность у одуванчиков через 2 дня после применения.
Фиг. 9 представляет собой значительный хлороз и последующую фитотоксичность, которые наблюдались у растений мари, обработанных 40 мл 5% монотерпеноидных производных. Как карвакрилоксиуксусная кислота, так и тимилоксиуксусная кислота были способны вызывать значительный хлороз и фитотоксичность у мари через два дня после применения.
Фиг. 10 иллюстрирует значительный хлороз и последующую фитотоксичность, которые наблюдались у растений щетинника, обработанных 40 мл 5% монотерпеноидных производных. Как карвакрилоксиуксусная кислота, так и тимилоксиуксусная кислота были способны вызывать значительный хлороз и фитотоксичность у щетинника через 2 дня после применения.
Подробное описание изобретения
Раскрытые варианты осуществления относятся к соединениям, имеющим монотерпеноидный и/или фенилпропаноидный фрагмент, и к способам их использования.
В частности, раскрытые варианты осуществления относятся к монотерпеноидным и фенилпропаноидным соединениям, полученным из биорациональных источников. Как более подробно обсуждается ниже, соединения производных монотерпеноидов и фенилпропаноидов в вариантах осуществления, раскрытых в данном документе, особенно хорошо подходят для применения в качестве пестицидов, в том числе в качестве гербицидов.
Во всем описании настоящего изобретения для ясности приводятся следующие термины.
Используемый в данном документе термин «монотерпеноид» относится к монотерпено-подобному веществу и используется для общего обозначения производных монотерпеноидов, а также аналогов монотерпеноидов. Под «монотерпеном» подразумевается соединение, имеющее 10-углеродный каркас с нелинейными ветвями. Монотерпен технически относится к соединению с двумя изопреновыми звеньями, соединенными от начала к концу. Следовательно, монотерпеноиды могут включать монотерпены, спирты, кетоны, альдегиды, сложные эфиры, простые эфиры, кислоты, углеводороды без кислородной функциональной группы, и так далее. Общей практикой является отнесение некоторых фенольных соединений, таких как эвгенол, тимол и карвакрол, к монотерпеноидам, потому что их функция практически такая же, как у монотерпеноидов. Однако эти соединения технически не являются «монотерпеноидами» (или «монотерпенами»), потому что они синтезируются не тем же самым путем биосинтеза изопрена, а скорее путем образования фенолов из тирозина. Тем не менее в настоящем изобретении авторы будут следовать общей практике.
Термин «монотерпеноидный спирт» означает любой монотерпеноидный или фенилпропаноидный спирт или фенол, который встречается в природе, включая, например, ациклические, ненасыщенные монотерпеноиды, включая цитронеллол, линалоол, гераниол, нерол и лавандулол; циклические или бициклические ненасыщенные монотерпеноиды, включая карвеол, пинокарвеол, мирценол, миртенол, α-терпениол, 4-терпениол, вербенол и периллиловый спирт; циклические или полициклические насыщенные монотерпеноиды, включая ментол, фенхол, борнеол, изоборнеол и миртанол; изопропилкрезолы, включая тимол, карвакрол или 4-изопропил-3-метилфенол; циклогептатриенолоны, такие как любой изомерный туйаплицин; фенилпропаноидные спирты или фенолы, включая эвгенол, изоэвгенол, коричный спирт, конифериловый спирт, зингерон, умбеллиферон, кумариловый спирт и хавикол; или спирты или фенолы, полученные в результате естественного растительного метаболизма фенилпропаноида, включая ванилин, этилванилин, пиперониловый спирт или сирингальдегид; но не ограничиваясь ими.
Кроме того, O-алкилированные и O-ацилированные монотерпеноиды, например этерифицированные монотерпеноиды, содержащие фрагменты карбоновых кислот или сложноэфирные компоненты и олигоэфиры монотерпеноидов, содержащих фрагменты карбоновых кислот, но не ограничиваясь ими, в настоящем описании называют монотерпеноидными производными.
Термин «фенилпропаноид» относится к разнообразной группе органических соединений, которые синтезируются растениями из аминокислоты фенилаланина. Их название происходит от шестиуглеродной ароматической фенильной группы и трехуглеродного пропиленового хвоста коричной кислоты, которая синтезируется из фенилаланина на первой стадии биосинтеза фенилпропаноидов. Фенилпропаноиды встречаются по всему растительному царству, где они служат важными компонентами ряда структурных полимеров, обеспечивают защиту от ультрафиолетового света, защищают от травоядных животных и патогенов, и обеспечивают взаимодействие растений и опылителей в качестве цветочных пигментов и ароматических соединений.
В соответствии с одним вариантом осуществления монотерпеноидный и/или фенилпропаноидный фрагмент соединений согласно раскрытым вариантам осуществления получают из биорационального источника, такого как растительное летучее вещество, или в качестве компонента растительных эфирных масел, полученных из ткани листьев, стволов, корней; или их смеси.
В настоящем описании термин «алкил» означает алифатическую углеводородную группу, которая может быть прямой или разветвленной. Если не оговорено иное, этот термин относится к алкилу с 2-7 атомами углерода. Типичные алкильные группы включают, например, этил, н-пропил, изопропил, н-бутил, трет-бутил, н-пентил, 3-пентил и тому подобное, но не ограничиваются этим.
Термин «алкенил» означает алифатическую углеводородную группу, содержащую двойную связь углерод-углерод, и которая может быть прямой или разветвленной, имеющей от 2 до примерно 7 атомов углерода в цепи. Неограничивающие примеры алкенильных групп включают этенил, пропенил, н-бутенил, изопрен и изобутенил. Термин «алкенил» может также относиться к углеводородной цепи, имеющей от 2 до 7 атомов углерода, содержащей по меньшей мере одну двойную связь и по меньшей мере одну тройную связь.
Термин «алкинил» означает алифатическую углеводородную группу, содержащую тройную связь углерод-углерод, и которая может быть прямой или разветвленной, имеющей от 3 до 7 атомов углерода в цепи. Неограничивающие примеры алкинильных групп включают пропинил, н-бутинил, 2-бутинил, 3-метилбутинил, пропаргил и н-пентинил.
Термин «циклоалкил» означает неароматическую, насыщенную или ненасыщенную, моно- или полициклическую кольцевую систему, содержащую примерно от 3 до 7 атомов углерода. Типичные циклоалкильные группы включают циклопропил, циклобутил, циклопентил, циклогексил и циклогептил, но не ограничиваются ими.
Термин «циклоалкенил» означает неароматическую, ненасыщенную, моно- или полициклическую кольцевую систему, содержащую примерно от 3 до 7 атомов углерода. Типичные циклоалкенильные группы включают циклопропенил, циклобутенил, циклопентенил, циклогексенил и циклогептенил, но не ограничиваются ими.
Термин «гетероарил» означает ароматическую моноциклическую или полициклическую кольцевую систему, содержащую примерно от 5 до 19 кольцевых атомов или примерно от 5 до 10 кольцевых атомов, где один или несколько атомов в кольцевой системе являются элементами, отличными от углерода, например азотом, кислородом или серой. В случае полициклической кольцевой системы только одно из колец должно быть ароматическим, чтобы кольцевая система была определена как «гетероарил». Конкретные гетероарилы содержат примерно от 5 до 6 кольцевых атомов. Префикс аза-, окса-, тиа- или тио- перед гетероарилом означает, что по меньшей мере атом азота, кислорода или серы, соответственно, присутствует в качестве атома кольца. Атом азота, углерода или серы в гетероарильном кольце может быть при необходимости окислен; азот может быть при необходимости кватернизован. Подходящие гетероарилы включают пиридил, 2-оксо-пиридинил, пиримидинил, пиридазинил, пиразинил, триазинил, фуранил, пирролил, тиофенил, пиразолил, имидазолил, оксазолил, изоксазолил, тиазолил, изотиазолил, триазолил, оксадиазолил, тиадиазолил, тетразолил, индолил, изоиндолил, бензофуранил, бензотиофенил, индолилнил, 2-оксоиндолинил, дигидробензофуранил, дигидробензотиофенил, индазолил, бензимидазолил, бензооксазолил, бензотиазолил, бензоизоксазолил, бензоизотиазолил, бензотриазолил, бензо[1,3]диоксолил, хинолинил, изохинолинил, хиназолинил, циннолинил, фталазинил, хиноксалинил, 2,3-дигидробензо[1,4]диоксинил, бензо[1,2,3]триазинил, бензо[1,2,4]триазинил, 4H-хроменил, индолизинил, хинолизинил, 6aH-тиено[2,3-d]имидазолил, 1Н-пирроло[2,3-b]пиридинил, имидазо[1,2-а]пиридинил, пиразоло[1,5-а]пиридинил, [1,2,4]триазоло[4,3-а]пиридинил, [1,2,4]триазоло[1,5-а]пиридинил, тиено[2,3-b]фуранил, тиено[2,3-b]пиридинил, тиено[3,2-b]пиридинил, фуро[2,3-b]пиридинил, фуро[3,2-b]пиридинил, тиено[3,2-d]пиримидинил, фуро[3,2-d]пиримидинил, тиено[2,3-b]пиразинил, имидазо[1,2-a]пиразинил, 5,6,7,8-тетрагидроимидазо[1,2-а]пиразинил, 6,7-дигидро-4Н-пиразоло[5,1-с][1,4]оксазинил, 2-оксо-2,3-дигидробензо[d]оксазолил, 3,3-диметил-2-оксоиндолинил, 2-оксо-2,3-дигидро-1Н-пирроло[2,3-b]пиридинил, бензо[с][1,2,5]оксадиазолил, бензо[c][1,2,5]тиадиазолил, 3,4-дигидро-2H-бензо[b][1,4]оксазинил, 5,6,7,8-тетрагидро[1,2,4]триазоло[4,3-а]пиразинил, [1,2,4]триазоло[4,3-а]пиразинил, 3-оксо-[1,2,4]триазоло[4,3-а]пиридин-2(3Н)-ил и тому подобное, но не ограничиваются ими.
Используемый в данном изобретении термин «моноциклический» обозначает молекулярную структуру, имеющую одно кольцо.
Используемый в данном изобретении термин «полициклический» или «мультициклический» обозначает молекулярную структуру, имеющую два или более колец, включая конденсированные, мостиковые или спиро-кольца, но не ограничиваясь ими.
Термин «замещенный» конкретно предусматривает и допускает одну или несколько замен, которые являются обычными в данной области техники. Однако специалистам в данной области техники в целом понятно, что заместители должны выбираться так, чтобы они не оказывали неблагоприятного влияния на полезные характеристики соединения и не нарушали его функцию. Подходящие заместители могут включать, например, алкильные группы, алкенильные группы, алкинильные группы, гидрокси группы, оксо группы, меркапто группы, алкилтио группы, алкокси группы, арильные или гетероарильные группы, арилокси или гетероарилокси группы, аралкильные или гетероаралкильные группы, аралкокси или гетероаралкокси группы, аминогруппы, алкил- и диалкиламиногруппы, карбамоильные группы, алкилкарбонильные группы, карбоксильные группы, алкоксикарбонильные группы, алкиламинокарбонильные группы, диалкиламинокарбонильные группы, арилкарбонильные группы, арилоксикарбонильные группы, алкилсульфонильные группы, арилсульфонильные группы, циклоалкильные группы, циано группы, С1-С6 алкилтио группы, арилтиогруппы, нитрогруппы, кетогруппы, ацильные группы, боронатные или боронильные группы, фосфатные или фосфонильные группы, сульфамильные группы, сульфонильные группы, сульфинильные группы и их комбинации. В случае замещенных комбинаций, таких как «замещенный арилалкил», может быть замещена либо арильная, либо алкильная группа, либо арильная и алкильная группы могут быть замещены одним или несколькими заместителями. Кроме того, в некоторых случаях подходящие заместители могут объединяться с образованием одного или нескольких колец, как известно специалистам в данной области техники.
В соответствии с одним вариантом осуществления соединения являются замещенными, что означает, что группа может иметь заместитель у замещаемого атома группы (включая более одного заместителя у одного атома), при условии, что нормальная валентность указанного атома не превышена, и идентичность каждого заместителя не зависит от других. Например, до трех атомов Н в каждом остатке заменены заместителями, такими как алкил, гидрокси, низший алкокси, карбокси, карбоалкокси (также называемый алкоксикарбонилом), карбоксамидо (также называемый алкиламинокарбонилом), циано, карбонил, нитро, амино, алкиламино, диалкиламино, меркапто, алкилтио, сульфоксид, сульфон, ациламино, амидино, фенил, бензил, гетероарил, фенокси, бензилокси или гетероарилокси. Когда заместителем является кето (то есть = 0), тогда на атоме замещаются два атома водорода. Комбинации заместителей и/или переменных допустимы, только если такие комбинации приводят к стабильным соединениям; под «стабильным соединением» подразумевается соединение, которое является достаточно устойчивым для того, чтобы выдержать выделение из реакционной смеси до необходимой степени чистоты, и превращение в агент, предназначенный для подходящего применения.
Согласно некоторым вариантам осуществления соединения являются незамещенными. «Незамещенные» атомы несут все атомы водорода, продиктованные их валентностью.
Термин «соединение» и эквивалентные выражения предназначены для охвата соединений, описанных в данном изобретении. Также предусмотрены соли, оксиды, сольваты, например гидраты, и комплексы включения соединений, где это допускается контекстом, а также любая стереоизомерная форма или смесь любых таких форм этого соединения в любом соотношении. Комплексы включения описаны в Remington, «The Science and Practice of Pharmacy», 19th Ed. 1: 176-177 (1995), полностью включенном в настоящее описание посредством ссылки. Наиболее часто используемые комплексы включения представляют собой комплексы с циклодекстринами, и все комплексы циклодекстрина, природные и синтетические, конкретно охватываются соединениями, раскрытыми в данном изобретении.
Соединения, описанные в настоящем изобретении, могут содержать один или несколько асимметричных центров и, таким образом, могут давать энантиомеры, диастереомеры и другие стереоизомерные формы. Каждый хиральный центр может быть определен с точки зрения абсолютной стереохимии как (R)- или (S)-. Это подразумевает включение всех таких возможных изомеров, а также их смесей, включая рацемические и оптически чистые формы. Оптически активные (R)- и (S)-, (-)- и (+)- или (D)- и (L)- изомеры могут быть получены с использованием хиральных синтонов или хиральных реагентов или разделены с использованием обычных методик. Когда соединения, описанные в настоящем документе, содержат олефиновые двойные связи или другие центры геометрической асимметрии, и если не указано иное, подразумевается, что соединения включают как E, так и Z геометрические изомеры. Аналогичным образом, все таутомерные формы также предназначены для включения в объем изобретения.
Один аспект раскрытых вариантов осуществления относится к соединению формулы (I)
 ,
,
 или
или ; где
; где
R1 представляет собой фенилпропаноидный или монотерпеноидный фрагмент;
R2 представляет собой замещенный или незамещенный фенилпропаноидный или монотерпеноидный фрагмент, или выбран из группы, состоящей из Н, М, замещенного или незамещенного С3-С7 неразветвленного или разветвленного алкила, замещенного или незамещенного С2-С7 неразветвленного или разветвленного алкенила, замещенного или незамещенного С3-С7 неразветвленного или разветвленного алкинила, замещенного или незамещенного С3-С7 неразветвленного или разветвленного циклоалкила, замещенного или незамещенного гетероарила, и замещенного или незамещенного С3-С7 неразветвленного или разветвленного циклоалкенила; и
М представляет собой противоион, выбранный из группы, состоящей из натрия, калия, кальция, магния, железа, цинка, меди и амина.
В одном варианте осуществления соединения формулы (I) R2 представляет собой Н.
В другом варианте осуществления соединения формулы (I) А представляет собой
 ,
,
углерод в скобках единственный, а R2 представляет собой Н.
В еще одном варианте осуществления соединения формулы (I) R2 представляет собой C3-C7 разветвленный алкил, выбранный из группы, состоящей из
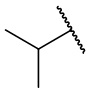 ,
, 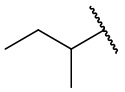 ,
, 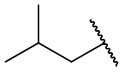 ,
, 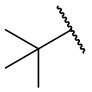 ,
, 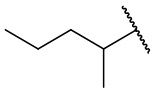 ,
,  ,
, 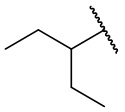 ,
, 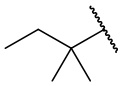 , и
, и  .
.
В другом варианте осуществления соединения формулы (I) R2 представляет собой С2-С7 неразветвленный или разветвленный алкенил, выбранный из группы, состоящей из
 ,
,  ,
, 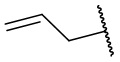 ,
,  ,
,  ,
,  ,
, 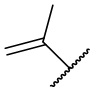 ,
,  ,
, 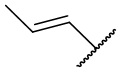 ,
, 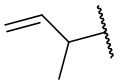 ,
, 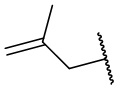 , и
, и 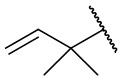 .
.
В другом варианте осуществления соединения формулы (I) R2 представляет собой C3-C7 неразветвленный или разветвленный алкинил, выбранный из группы, состоящей из  ,
, 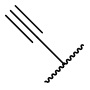 ,
,  ,
, 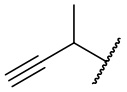 ,
,  , и
, и  .
.
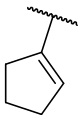
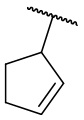
В другом варианте осуществления соединения формулы (I) R2 представляет собой С3-С7 неразветвленный или разветвленный циклоалкил, выбранный из группы, состоящей из
 ,
,  .
. 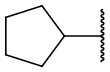 ,
,  ,
, 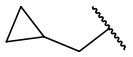 ,
, 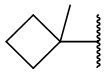 ,
, 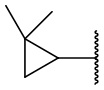 ,
, 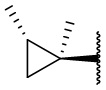 ,
,  ,
,  ,
, 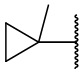 ,
, 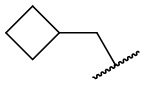 ,
, 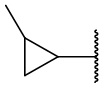 ,
,  ,
,  , и
, и 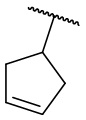 .
.
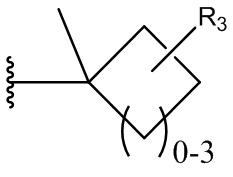
В другом варианте осуществления соединения формулы (I) R2 представляет собой:
 ,
,
где R3 и R4 независимо выбраны из группы, состоящей из Н, метила, этила, пропила, изопропила, винила, аллила и пропаргила.
В более конкретных вариантах осуществления R3 и R4 оба представляют собой Н; R3 и R4 оба представляют собой СН3; R3 представляет собой СН3, а R4 представляет собой Н; или R3 представляет собой аллил, а R4 представляет собой Н.
В другом варианте осуществления соединения формулы (I) R2 представляет собой:
 ,
,
где R3 выбран из группы, состоящей из Н, метила, этила, пропила, изопропила, винила, аллила и пропаргила.
В другом варианте осуществления соединения формулы (I) R1 представляет собой фенипропаноидный фрагмент.
В еще одном варианте осуществления соединения формулы (I) R1 представляет собой монотерпеноидный фрагмент.
В более конкретном варианте осуществления монотерпеноидный фрагмент выбран из группы, состоящей из:

В другом варианте осуществления соединения формулы (I) R2 выбран из группы, состоящей из метила, этила, изопропила, пропила, изобутила, бутила и трет-бутила.
Соединения формулы (I) включают конкретные соединения, приведенные в следующей Таблице 1, но не ограничиваются ими.


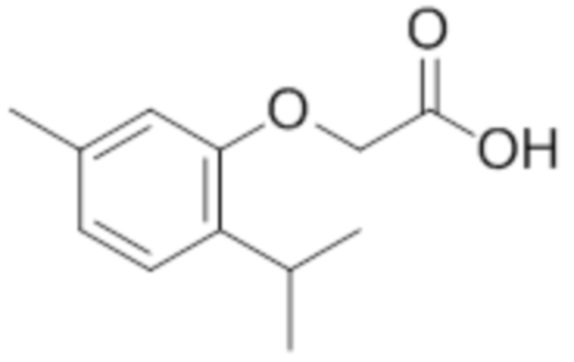


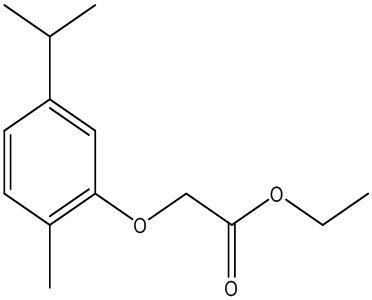
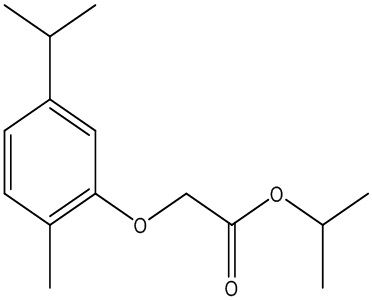
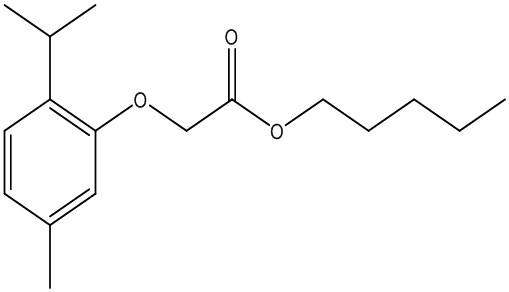
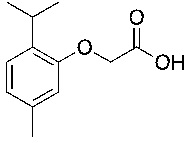

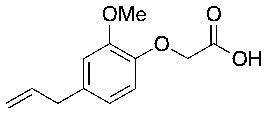
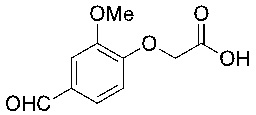



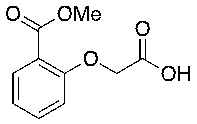
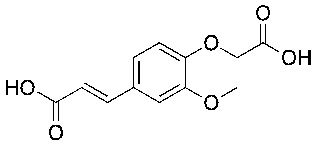
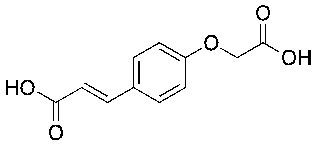
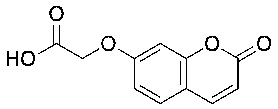

В соответствии с одним вариантом осуществления соединения формулы (I), которые имеют свободную карбоновую кислоту, могут иметь каждую кислоту виде эфира, или карбоновая кислота может быть использована для образования карбоксилатной соли.
В одном варианте осуществления соединения формулы (I) включают конкретные структуры, указанные в Таблице 3, отличные от тимилоксиуксусной кислоты, карвакрилоксиуксусной кислоты и эвгенилоксиуксусной кислоты.
Как отмечалось выше, некоторые примеры соединений могут быть получены из биорационального источника, такого как летучие вещества растений или в качестве компонента эфирных масел растений, полученных из ткани листьев, стволов, корней, или их смеси.
Как отмечалось выше, некоторые соединения являются производными монотерпеноидов или фенилпропаноидов. В качестве неограничивающего примера соединение по настоящему изобретению может быть производным спиртосодержащего монотерпеноида или фенилпропаноида, такого как, например, тимол
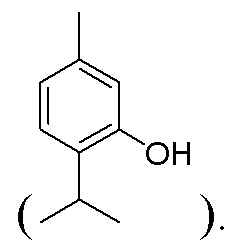
В одном иллюстративном варианте осуществления производное тимола имеет структуру
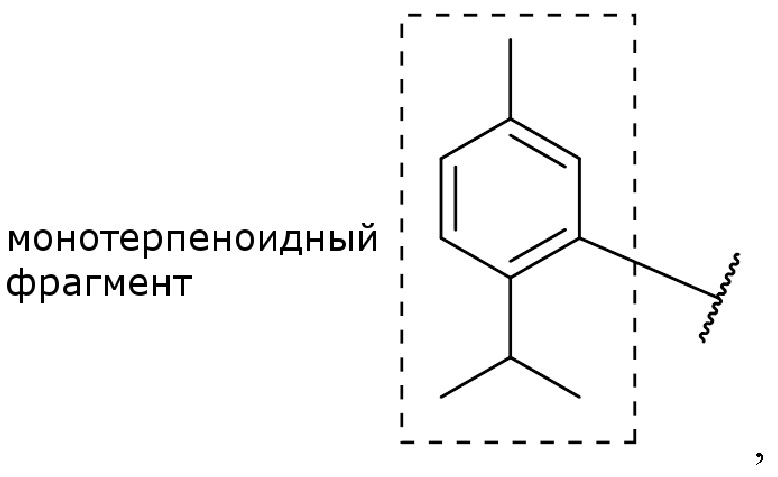
где 10-углеродный скелет тимола составляет монотерпеноид или монотерпеноидный фрагмент (например, R1 формулы (I)), а волнистая линия  представляет связь с остальной частью молекулы.
представляет связь с остальной частью молекулы.
В качестве другого неограничивающего примера соединение может быть производным монотерпеноида или фенилпропаноида, содержащего карбоновую кислоту, такого как, например, цитронелловая кислота

В другом иллюстративном варианте осуществления производное цитронелловой кислоты имеет структуру
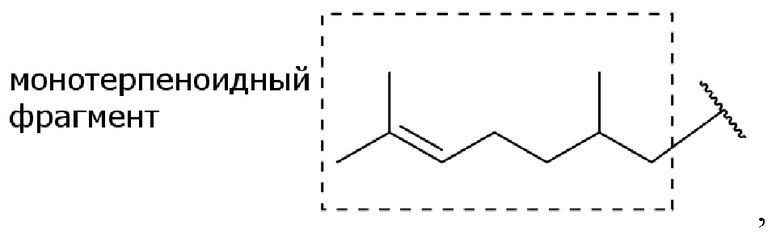
где 9-углеродный скелет цитронелловой кислоты (исключая углерод карбоновой кислоты) составляет монотерпеноид или монотерпеноидный фрагмент, а волнистая линия  представляет собой связь с остальной частью молекулы.
представляет собой связь с остальной частью молекулы.
Таким образом, примеры соединений могут быть получены из монотерпеноидных спиртов (то есть монотерпеноидов, содержащих гидроксильную группу) или из монотерпеноидных карбоновых кислот (то есть монотерпеноидов, содержащих карбоновую кислоту). В альтернативном варианте соединения могут быть получены из фенилпропаноидных спиртов (то есть фенилпропаноидов, содержащих гидроксильную группу) или из фенилпропаноидных карбоновых кислот (то есть фенилпропаноидов, содержащих карбоновую кислоту).
Еще один аспект раскрытых вариантов осуществления относится к гербицидной композиции, содержащей соединения формулы (I) и носитель.
В одном варианте осуществления гербицидная композиция включает подгруппу соединений формулы (I) и носитель. Например, и без ограничения указанным, гербицидная композиция содержит соединение формулы (I), где А представляет собой
 ,
,
углерод в скобках единственный, а R2 представляет собой Н.
В более конкретном варианте осуществления соединения, используемые в гербицидной композиции, включают любое одно или несколько из примеров соединений, представленных в следующей Таблице 2, но не ограничиваются ими.












Гербицидные соединения, приведенные в Таблице 2, указаны в виде свободных карбоновых кислот. Однако каждая кислота может быть этерифицирована или использована для образования карбоксилатной соли.
В конкретном варианте осуществления подходящие сложные эфиры включают метиловые, этиловые, пропиловые, изопропиловые, бутиловые, изобутиловые, 2-бутиловые, трет-бутиловые, амиловые эфиры, но не ограничиваются ими.
В другом конкретном варианте осуществления подходящие карбоксилатные соли включают соли металлов, включая натрий, калий, кальций и магний, но не ограничиваются ими.
В еще одном конкретном варианте осуществления подходящими гербицидными соединениями являются дикислоты, включая диэфиры и двухвалентные анионные соли.
Гербицидные композиции (фитотоксические и/или системные) могут быть применены до или после появления всходов трав, таких как сорняки, для контроля их роста.
Используемый в настоящем изобретении термин «фитотоксический» или «фитотоксикант» или «фитотоксичность» обозначает материалы, которые (1) эффективно контролируют все растения на данном участке или (2) избирательно контролируют рост одного или нескольких видов растений в присутствии других растений. Эти взаимозаменяемые термины также используются для идентификации общей и избирательной контролирующей активности определенных соединений и композиций, раскрытых в настоящем изобретении.
Используемый в настоящем изобретении термин «системный» обозначает гербицидные соединения или композиции, которые поглощаются восприимчивой растительностью и затем перемещаются в части растения, отличные от тех, с которыми они контактировали. Системный гербицид обычно, если не всегда, зависит от транслокационного способа действия для проявления гербицидной активности. Например, при нанесении на листву растений системные гербициды, раскрытые в данном документе, будут поглощаться во время транспирации или иным образом и транспортироваться по всему растению, приводя к устранению нежелательной растительности, корней и всего остального.
Контактная гербицидная активность обеспечивает немедленный контроль вегетации, в то время как системный гербицидный способ действия может более выгодно снизить затраты на обработку, улучшить контроль вегетации, уменьшить как непосредственное, так и остаточное токсическое воздействие на людей и животных, а также уменьшить вероятность сохранения гербицида на собранных пищевых культурах. Непосредственный контроль вегетации определяется как фитотоксичность, которая развивается в течение первых нескольких часов или дней (например, 1-3 дня) после обработки растительной ткани. Это заметно отличается от относительно более медленной активности 2,4-дихлорфеноксиуксусной кислоты.
Используемый в настоящем изобретении термин «контроль» включает действия (1) уничтожения, (2) ингибирования роста, размножения или пролиферации и (3) удаления, уничтожения или иного уменьшения появления и активности растений, и применим к любому из указанных действий или любой их комбинации.
Описанные в настоящем изобретении гербицидные композиции и способы могут проявлять усиленную системную гербицидную активность до и после появления всходов, в результате чего можно использовать значительно меньшие дозы данного гербицида для достижения той же степени контроля вегетации или, в альтернативном варианте, можно добиться более высокой степени контроля вегетации при той же норме внесения. Эти гербицидные композиции и способы могут также обеспечивать контактные гербицидные свойства и в то же время обеспечивать азотные и серные питательные вещества для необходимых растений. Они также могут позволить использовать системные гербициды в сочетании с другими традиционными гербицидными соединениями.
Применение гербицидных композиций из раскрытых вариантов осуществления может быть осуществлено путем опрыскивания листвы, внесения в почву (до и после появления всходов), нанесения порошка и нанесения гранул с субстратом и без него как для широколиственных сорняков, так и для трав. Эффективное количество для фитотоксического или системного контроля представляет собой количество, необходимое для общего или избирательного контроля, то есть фитотоксическое или гербицидное количество. Специалист в данной области техники может легко определить из настоящего описания, включая примеры, подходящую приблизительную норму (нормы) применения.
Все читатели настоящего описания поймут, что иллюстративные варианты осуществления, описанные в данном документе и заявленные ниже, могут быть соответствующим образом применены на практике в отсутствие какого-либо перечисленного признака, элемента или этапа, который является или не является конкретно раскрытым в данном документе. Например, ссылки в этом письменном описании на «один вариант осуществления», «вариант осуществления», «иллюстративный вариант осуществления» и т.п. указывают, что описанный вариант осуществления может включать конкретный признак, структуру или характеристику, но не обязательно что каждый вариант осуществления должен включать данный признак, структуру или характеристику. Более того, такие фразы не обязательно относятся к одному и тому же варианту осуществления. Кроме того, когда конкретный признак, структура или характеристика описываются в связи с одним вариантом осуществления, специалисту в данной области техники известно, как модифицировать такой признак, структуру или характеристику в связи с другими вариантами осуществления, вне зависимости от того, описано ли это явно или нет.
Все публикации и ссылки, цитируемые в данном документе, включая публикации в разделе «Предпосылки создания изобретения», прямо включены в настоящее описание посредством ссылки во всей их полноте. Однако, если есть какие-либо различия между какими-либо аналогичными или идентичными терминами, обнаруженными во включенной публикации или ссылке, и теми, которые явно использованы или определены в данном описании, то эти термины, определения или значения, явно использованные в настоящем описании должны иметь приоритет во всех отношениях. Кроме того, любая ссылка на уровень техники в этом описании не является и не должна восприниматься как подтверждение или какая-либо форма предположения о том, что такой уровень техники является частью общего знания в любой стране.
Примеры
Следующие примеры предоставлены для иллюстрации вариантов осуществления, но они никоим образом не предназначены для ограничения его объема.
Пример 1 - Исследования прорастания
Материалы и методы
Соевые бобы
Первоначально полученные соевые бобы были не обработанными и не содержали пестицидных покрытий. Соевые бобы были подвержены заражению Aphis glycines (соевой тлей) и не были определены как биотип, устойчивый к заражению, что могло бы влиять на результаты. Прорастание обычно происходило через 3-5 дней после увлажнения.
Семена кукурузы
Полученные семена кукурузы были необработанными и не содержали пестицидных покрытий. Используемые семена кукурузы представляли собой штамм кукурузы не-трансгенного типа, чтобы предотвратить искажение результатов. Прорастание обычно происходило между 2-4 днями после увлажнения.
Оценка прорастания
Покрытие семян (твердые соединения)
Покрытие семян выполняли, помещая 20 г семян кукурузы или соевых бобов в контейнер с приблизительно 1 мл 1:5 раствора Elmer Glue®:вода (или смеси другого клея:воды) с небольшим количеством Triton-X 100™ (в количестве 100 мкл/5 мл). Для твердых соединений 0,25 г соединения затем вводили в контейнер. Эту смесь семян, раствора Elmer Glue/воды/ Triton-X 100™ и активного соединения тщательно перемешивали до тех пор, пока семена не покрывались активным ингредиентом.
Покрытие семян (жидкие соединения)
Для каждой обработки 0,25 г жидкого соединения растворяли в 5 мл гексана. В эту смесь гексана и активного ингредиента вводили 0,25 г силикагеля Hi-Sil 233. Растворитель удаляли с использованием роторного испарителя, позволяя соединению адсорбироваться на силикагеле. Эту смесь 0,5 г силикагеля:активного ингредиента затем использовали в качестве твердого материала, используемого для покрытия семян. Затем семена покрывали тем же способом, который использовали для твердого соединения.
Исследования прорастания
Десять соевых бобов или семян кукурузы вводили в стандартные банки с завинчивающейся крышкой вместимостью 1 пинта (Kerr®), окружая бумажными полотенцами, на которые было добавлено 10 мл воды (минимальное количество, необходимое для смачивания бумажного полотенца). Соевые бобы или семена кукурузы группировали вместе, а бумажные полотенца складывали вдвое, чтобы обеспечить постоянное воздействие влаги. После введения соевых бобов или семян кукурузы банки закрывали завинчивающимися крышками на все время эксперимента, чтобы предотвратить высыхание и обеспечить постоянно влажную среду для соевых бобов и семян кукурузы. Прорастание определяли как появление корешка из семенной оболочки. Растения выращивали при комнатной температуре и в цикле свет:темнота 12ч:12ч. Бобы/семена периодически извлекали на протяжении всего эксперимента, чтобы наблюдать количество проростков, четко видимых через 3, 5 и 7 дней после введения бобов/семян. После каждого наблюдения семена/бобы снова помещали во влажное бумажное полотенце и банку с завинчивающейся крышкой, которую затем закрывали. Каждую обработку повторяли дважды, а средний процент прорастания и стандартную ошибку сообщали для каждой временной точки и обработки.
Результаты
Все испытанные соединения вызывали ингибирование прорастания семян/бобов через 3, 5 и 7 дней после помещения семян/бобов во влажное бумажное полотенце. Эти данные свидетельствуют о потенциале этих компонентов в качестве гербицидов, в частности гербицидов, применяемых до появления всходов. Более того, однодольные растения, по-видимому, менее чувствительны к ингибирующему действию в отношении прорастания, вызываемому этими соединениями, чем двудольные (кукуруза по сравнению с соей). Вполне возможно, что эти соединения могут оказывать свое влияние избирательно, причем двудольные растения более восприимчивы, чем однодольные.
Прорастание семян кукурузы в значительной степени ингибировалось всеми испытанными соединениями, за исключением ванилилуксусной кислоты и ванилиновой кислоты - оксиуксусной кислоты (Фиг. 9). Из соединений, которые вызывали значительное ингибирование прорастания семян, метиловый эфир эвгенилоксиуксусной кислоты был наиболее способен к ингибированию роста семян кукурузы. Это может указывать на повышенный потенциал этого соединения для использования в будущих гербицидных составах. Другие соединения были способны значительно уменьшать количество прорастающих семян, а также в некоторых случаях задерживали прорастание семян. Тимилоксиуксусная кислота была способна вызывать второе наиболее значительное ингибирование по сравнению с метиловым эфиром эвгенилоксиацетата и предотвращать любое прорастание в день 3. Как эвгенилоксиуксусная кислота, так и карвакрилоксиуксусная кислота приводили к некоторому уровню прорастания в день 3. Все соединения вызывали значительное ингибирование по сравнению с контролем, и все предотвращали прорастание ниже среднего процента прорастания 35%. Напротив, контроль вызывал 100% прорастание к 7 дню в этом исследовании.
Соевые бобы не прорастали в присутствии всех активных ингредиентов, испытанных в этом исследовании, за исключением ванилилоксиуксусной кислоты, которая не вызывала никакого ингибирующего эффекта, или оказывала лишь незначительное воздействие (Фиг. 10). Более того, ингибирование прорастания семян сои было более выраженным, чем ингибирующий эффект, наблюдаемый при испытании проростков кукурузы. Эта частичная избирательность в отношении контроля двудольных растений в большей степени, чем однодольных, может указывать на сходство с используемыми в настоящее время коммерческими гербицидами. Эта избирательность может быть использована для борьбы с различными сорняками в садах или на сельскохозяйственных полях, не нанося вреда различным однодольным растениям (трава и кукуруза).
Пример 2 - Полив почвы
Материалы и методы
Соевые бобы
Соевые растения сажали под 1 см горшечной почвы и поливали каждые 2-3 дня по мере необходимости. Растения выращивали в горшках (шириной 6 дюймов и глубиной 4,5 дюйма) с примерно 800 мл почвы для каждого растения. Семена прорастают примерно через 3-5 дней после посадки. Растения выращивали в теплице при постоянной температуре и освещении (25±5°C, 12 ч:12 ч цикл свет/темнота). Растения выращивали до достижения возраста 1-2 недели и 3-4 недели; эти растения служили «молодыми» и «старыми» растениями в этом исследовании, соответственно.
Саженцы кукурузы
Кукурузу высаживали под ½’’ горшечной почвы и поливали каждые 2-3 дня по мере необходимости. Растения выращивали в горшках (шириной 6 дюймов и глубиной 4,5 дюйма) с примерно 800 мл почвы для каждого растения. Семена прорастают примерно через 4-7 дней после посадки. Растения выращивали в теплице при постоянной температуре и освещении (25±5°C, 12 ч:12 ч цикл свет/ темнота). Растения выращивали до достижения возраста 1-2 недели и 3-4 недели; эти растения служили «молодыми» и «старыми» растениями в этом исследовании, соответственно.
Исследование с поливом почвы
Составы различных активных ингредиентов готовили с использованием монотерпеноидных производных, гидроксида калия и Triton-X 100™ с целью сольватации активного ингредиента. Составы состояли из 0,5%-1% активного ингредиента по массе (0,5-1 г/100 мл воды) с молярным соотношением 1:1 гидроксида калия, используемого с целью сольватации (135-269 мг/100 мл для тимилоксиуксусной кислоты и карвакрилоксиуксусной кислоты). Triton-X 100™ был введен в состав для улучшения растворимости в конечной концентрации 0,25%. 40 мл препарата (0,5% или 1% активного ингредиента) наносили на каждое растение на разных стадиях жизненного цикла растения. Составы наносили на почву рядом с основанием стебля растения, чтобы избежать контакта с листьями. Наблюдения проводили через 2 дня и 3 недели после полива почвы, чтобы определить влияние обработок на различные типы и стадии растений. Качественные данные приведены в таблице ниже, демонстрирующей влияние каждой концентрации соединения на разные растения и стадии их жизни.
Результаты
Соединения, испытанные по протоколу внесения в почву, успешно ингибировали рост растений на различных стадиях в течение всего эксперимента. Большинство протестированных соединений значительно ингибировали рост как молодых, так и старых растений кукурузы и сои или вызывали значительную фитотоксичность через 3 недели. Контрольный раствор, состоящий из композиции без активного ингредиента (монотерпеноид-оксиуксусной кислоты), не вызывал значительного фитотоксического ответа.
При применении к растениям сои тимилоксиуксусная кислота оказала существенное непосредственное влияние как на молодые, так и на старые растения (Таблица 1). Молодые растения были чувствительны к концентрации 0,5% и 1%. Через 2 дня после воздействия тимилоксиуксусной кислоты растения сои были значительно ингибированы. Незначительное ингибирование наблюдалось у растений, подвергшихся воздействию концентрации 0,5%, тогда как значительное ингибирование наблюдалось у растений, подвергшихся воздействию концентрации 1%. Это было определено, как значительный хлороз и увядание листьев. В итоге листья полностью высохли, и растения погибли. Через 3 недели после воздействия на молодые растения отмечалась 100% гибель, а растения, обработанные как старые растения, погибали при воздействии концентрации 1%. Старое растение, обработанное 0,5% тимилоксиуксусной кислотой, испытывало значительное увядание и хлороз. Восстановление отмерших растений не наблюдалось через 1 месяц после обработки. Метиловый эфир тимилоксиуксусной кислоты также значительно ингибировал рост соевых бобов, и его действие было более выраженным, чем как у карвакрилоксиуксусной кислоты, так и у тимилоксиуксусной кислоты. Интересно, что ванилилоксиуксусная кислота и ванилиновая кислота - оксиуксусная кислота не оказывали фитотоксического действия на соевые растения.
Растения кукурузы реагировали аналогично на такие концентрации как тимилоксиуксусной кислоты, так и карвакрилоксиуксусной кислоты (Таблица 1). Через 2 дня после обработки молодые растения не продемонстрировали каких-либо существенных эффектов в отношении обеих концентраций как тимилоксиуксусной кислоты, так и карвакрилоксиуксусной кислоты. Это заметно отличалось от реакции соевых бобов, которые проявляли значительные эффекты через 2 дня после воздействия. Однако через 3 недели растения проявляли значительное угнетение роста или фитотоксичность. И тимилоксиуксусная кислота, и карвакрилоксиуксусная кислота проявляли фитотоксичность через 3 недели после воздействия. Интересно, что 1% карвакрилоксиуксусная кислота не вызывала гибели через 3 недели, в то время как концентрация 0,5% вызывала гибель. Это может быть просто артефактом единственного опыта в данном исследовании. В этом исследовании тимилоксиуксусная кислота оказалась более фитотоксичной для растений кукурузы. Через 2 дня после обработки концентрации 0,5% и 1% были способны вызывать значительные фитотоксические эффекты в отношении более старых растений. Это не наблюдалось для 0,5% карвакрилоксиуксусной кислоты, которая не вызывала каких-либо существенных эффектов через 2 дня. Опять же, было отмечено, что метиловый эфир тимилоксиуксусной кислоты был наиболее фитотоксичным для кукурузы, и как ванилоксиуксусная кислота, так и ванилиновая кислота-оксиуксусная кислота не вызывали значительных фитотоксических симптомов. В целом, растения кукурузы были менее восприимчивы к этим соединениям по сравнению с соей. Это дополнительно указывает на возможность использования этих соединений в качестве селективных гербицидов, обладающих большей токсичностью в отношении двудольных растений по сравнению с однодольными.

Пример 3. Опрыскивание листьев.
Материалы и методы
Соевые бобы
Соевые растения сажали под 1 см горшечной почвы и поливали каждые 2-3 дня по мере необходимости. Растения выращивали в горшках (шириной 6 дюймов и глубиной 4,5 дюйма) примерно с 800 мл почвы для каждого растения. Растения прорастают примерно через 3-5 дней после посадки. Растения выращивали в теплице при постоянной температуре и освещении (25±5°C, 12 ч:12 ч цикл свет/темнота). Растения выращивали до достижения возраста 4 недель и затем использовали в эксперименте с опрыскиванием листьев.
Испытание с опрыскиванием листьев
Составы готовили так, чтобы они включали 1% тимилоксиуксусную кислоту, 0,269% гидроксид калия и 0,25% Triton-X 100™. Растения сои обрабатывали 10 опрыскиваниями из бытового распылителя MAINStays™, установленного на режим аэрозоля. Это соответствовало минимальному количеству, необходимому для того, чтобы вызвать стекание капель с листьев растений. Признаки фитотоксичности или ингибирования роста наблюдали через 3, 5, 7 и 14 дней после обработки композицией. Растения помещали под свет высокой интенсивности (непосредственно под парниковыми лампами) и свет низкой интенсивности (не под лампой/с окружающим освещением). Интенсивность света была выбрана в качестве фактора для этого экспериментального дизайна. Было показано, что многие терпеноиды являются фитотоксичными в условиях высокой интенсивности света. Этот эффект значительно уменьшается в условиях низкой интенсивности освещения. Если тимилоксиуксусная кислота вызывает фитотоксичность при том же механизме действия, что и другие растительные терпеноиды, между этими различными уровнями интенсивности света должна быть резкая разница в фитотоксичности.
Кислицу на земле теплицы также обрабатывали активным ингредиентом, чтобы лучше оценить влияние обработки листьев на несколько видов растений. Участок с кислицей (примерно 4’ x 3’) обрабатывали 20 опрыскиваниями (режим аэрозоля) из бытового распылителя MAINStays. Эффекты от опрыскиваний были зарегистрированы через 2 дня после обработки.
Результаты
Тимилоксиуксусная кислота была способна вызывать значительные фитотоксические эффекты при местном применении на 1-месячных растениях сои. Эти эффекты преимущественно характеризовались хлорозом листьев растения, которые опрыскивали составом, содержащим 1% тимилоксиуксусную кислоту. Также наблюдалось значительное увядание, сопровождаемое гибелью листьев на каждом из растений, подвергшихся действию активного ингредиента.
Никаких различий между разными уровнями освещения не наблюдалось. Этот результат указывает на то, что тимилоксиуксусная кислота, скорее всего, проявляет свою фитотоксичность через иной способ действия по сравнению с другими фитотоксичными терпеноидами. Более того, возможно, что эти соединения могут проявлять свою активность посредством действия, сходного с действием 2,4-дихлорфеноксиуксусной кислоты.
Обработка кислицы продемонстрировала интересные различия между активными ингредиентами, представленными в этом описании, по сравнению с 2,4-дихлорфеноксиуксусной кислотой - коммерческим контролем. Во-первых, эффекты обработки карвакрилоксиуксусной кислотой были немедленными и очевидными по сравнению с обработкой 2,4-дихлорфеноксиуксусной кислотой. Кроме того, хлороз был гораздо более заметным при обработке карвакрилоксиуксусной кислотой. Гибель наступала быстро через 2 дня после контакта с препаратом карвакрилоксиуксусной кислоты. Для растений, обработанных 2,4-дихлоруксусной кислотой, гибель растений не наблюдалась намного дольше. Этот немедленный гербицидный характер является компонентом всех описанных монотерпеноидов оксиуксусной кислоты и их сложных эфиров.
Таблица 2 представляет собой табличное представление данных, показанных на Фиг. 11 и 12. Значительная гибель листьев и хлороз наблюдались при обоих уровнях освещенности. Никаких серьезных различий между уровнями освещенности не наблюдалось. Это указывает на то, что эти соединения проявляют токсичность посредством механизма, который является уникальным для исходных монотерпеноидов, наносимых на растительную ткань в присутствии света, чтобы вызвать значительное выгорание.
Таблица 2. Краткое изложение основных эффектов в отношении соевых растений
Пример 4. До появления всходов
Материалы и методы
Соевые бобы
Соевые бобы сажали под 1 см горшечной почвы и поливали каждые 2-3 дня по мере необходимости. Растения выращивали в горшках (шириной 6 дюймов и глубиной 4,5 дюйма) с примерно 800 мл почвы для каждого растения. Растения прорастают примерно через 3-5 дней после посадки. Растения выращивали в теплице при постоянной температуре и освещении (25±5°C, 12 ч:12 ч цикл свет/темнота).
Семена кукурузы
Растения кукурузы высаживали под 1/2” горшечной почвы и поливали каждые 2-3 дня по мере необходимости. Растения выращивали в горшках (шириной 6 дюймов и глубиной 4,5 дюйма) с примерно 800 мл почвы для каждого растения. Растения прорастают примерно через 4-7 дней после посадки. Растения выращивали в теплице при постоянной температуре и освещении (25±5°C, 12 ч:12 ч цикл свет/темнота).
Исследование перед появлением всходов
Через 1 день после посадки семян/бобов почву поливали 40 мл препарата с 1% активного ингредиента. Это было сделано для оценки ингибирования прорастания в почве. Растения наблюдали в нескольких моментах времени в течение всего экспериментального интервала. Таблица 8 и Фиг. 13-18, представленные в этом описании, демонстрируют активность соединений через 3 недели после внесения соединений в почву. Качественную оценку роста проводили путем сравнения обработанных растений с необработанным контролем. Наблюдения включали усиление роста (+), незначительное торможение роста (-), значительное торможение роста (--), гибель растений (XXX) и отсутствие наблюдаемых эффектов (без эффекта).
Таблица 3. Влияние соединений на растения до прорастания
Как тимилоксиуксусная кислота, так и карвакрилоксиуксусная кислота оказывали значительное фитотоксическое действие на все растения, которые подвергались действию активных ингредиентов. Из подвергшихся воздействию растений соя была наиболее восприимчивой. Карвакрилоксиуксусная кислота полностью предотвращала появление всходов сои и значительно подавляла рост как кукурузы, так и кислицы. Растения сои также были наиболее восприимчивы к тимилоксиуксусной кислоте. Тем не менее, это соединение также значительно тормозило рост как кукурузы, так и кислицы. В испытаниях до появления всходов карвакрилоксиуксусная кислота была наиболее фитотоксичной из двух обработок. Кроме того, двудольные растения (соевые бобы и кислица) были более восприимчивы к обоим активным ингредиентам, чем однодольные (кукуруза).
Пример 5 - Обработка сорняков
Материалы и методы
Щирица Палмера (Amaranthus palmeri)
Растения щирицы были получены из дикой природы на полях прерии в штате Айова. Растения осторожно пересаживали в горшки (шириной 6 дюймов и глубиной 4,5 дюйма) с примерно 800 мл почвы для каждого растения. Растения содержали в теплице при постоянной температуре и освещении (25±5°C, 12 ч:12 ч цикл свет/темнота). Растения поливали каждые 2-3 дня по мере необходимости. Растения, которые не пережили пересадку, не использовали для этого исследования.
Канатник Теофраста (Abutilon theophrasti)
Растения канатника были получены из дикой природы на полях прерии в штате Айова. Растения осторожно пересаживали в горшки (шириной 6 дюймов и глубиной 4,5 дюйма) с примерно 800 мл почвы для каждого растения. Растения содержали в теплице при постоянной температуре и освещении (25±5°C, 12 ч:12 ч цикл свет/темнота). Растения поливали каждые 2-3 дня по мере необходимости. Растения, которые не пережили пересадку, не использовали для этого исследования.
Одуванчик (Taraxacum officinale)
Семена одуванчика получали с местных полей прерий в Эймсе, штат Айова. Отдельные семена высевали в каждый горшок (шириной 6 дюймов и глубиной 4,5 дюйма) с примерно 800 мл почвы для каждого растения. Для исследования использовали только проросшие растения. Растения обрабатывали через 1-2 недели после появления всходов. Растения поливали каждые 2-3 дня по мере необходимости.
Марь белая (Chenopodium album)
Семена мари были получены на кафедре агрономии в Университете штата Айова. Отдельные семена высевали в каждый горшок (шириной 6 дюймов и глубиной 4,5 дюйма) с примерно 800 мл почвы для каждого растения. Для исследования использовали только проросшие растения. Растения обрабатывали через 1-2 недели после появления всходов. Растения поливали каждые 2-3 дня по мере необходимости.
Щетинник Фабера (Setaria faberi)
Семена щетинника были получены на кафедре агрономии в Университете штата Айова. Три семени высевали в каждый горшок (шириной 6 дюймов и глубиной 4,5 дюйма) с примерно 800 мл почвы для каждого растения. Для исследования использовали только проросшие растения. Растения обрабатывали через 1-2 недели после появления всходов. Растения поливали каждые 2-3 дня по мере необходимости.
Исследование с поливом почвы
Составы из различных активных ингредиентов были созданы с использованием производных монотерпеноидов, гидроксида калия и Triton-X 100™, добавленного с целью сольватации активного ингредиента. Составы включали 5 мас.% активного ингредиента (0,5-1 г/ 100 мл воды) с молярным соотношением 1:1 к гидроксиду калия, используемому для сольватации (135-269 мг/100 мл как для тимилоксиуксусной кислоты, так и для карвакрилоксиуксусной кислоты). Triton-X 100™ добавляли в состав для улучшения растворимости в конечной концентрации 0,25%. 40 мл состава (либо 5% активного ингредиента) наносили на каждое растение через 1-2 недели после появления всходов. Наблюдения проводили через 2 дня и 3 недели после полива составами почвы, чтобы определить влияние обработок на различные типы и стадии растений. Фитотоксичность указана в процентах от общего количества обработанных растений по сравнению с контрольной обработкой, которую осуществляли с помощью аналогичной композиции (без активных производных монотерпеноидов).
Как тимилоксиуксусная кислота, так и карвакрилоксиуксусная кислота были способны убивать 100% обработанных сорняков, которые были обработаны от каждого вида (Таблица 4). Эта фитотоксичность наблюдалась относительно быстро через два дня после первоначальной обработки.
Таблица 4. Процент гибели различных видов сорняков при обработке 40 мл 5% раствора в испытаниях с поливом почвы

Пример 6 - Оценка избирательности и остаточного содержания в почве
Материалы и методы
Щирица Палмера (Amaranthus palmeri)
Семена щирицы Палмера были получены на кафедре агрономии в Университете штата Айова. Отдельные семена высевали в горшок (шириной 1,5 дюйма и глубиной 3 дюйма) с приблизительно 7,5 г почвы для каждого участка. По пять семян на участок было посеяно на многочисленных участках. Спустя один месяц прорастания проросшие растения подсчитывали на каждом участке, и это число использовали для общего количества растений, посаженных на участок, при оценке токсичности.
Дурнишник (Xanthium spp.)
Семена дурнишника были получены на кафедре агрономии в Университете штата Айова. Отдельные семена высевали в горшок (шириной 1,5 дюйма и глубиной 3 дюйма) с приблизительно 7,5 г почвы для каждого участка. По одному семени на участок было посеяно на многочисленных участках. После одного месяца прорастания проросшие растения подсчитывали на каждом участке, и это число использовали для общего количества растений, посаженных на участок, при оценке токсичности.
Щирица бугорчатая (Amaranthus tuberculatus)
Семена щирицы бугорчатой были получены на кафедре агрономии в Университете штата Айова. Отдельные семена высевали в горшок (шириной 1,5 дюйма и глубиной 3 дюйма) приблизительно с 7,5 г почвы для каждого участка. По пять семян на участок сеяли на многочисленных участках. После одного месяца прорастания проросшие растения подсчитывали на каждом участке, и это число использовали для общего количества растений, посаженных на участок, при оценке токсичности.
Мятлик луговой (Poa pretensis)
Семена мятлика были приобретены в пакете под коммерческим названием. Отдельные семена высевали в горшок (шириной 1,5 дюйма и глубиной 3 дюйма) приблизительно с 7,5 г почвы для каждого участка. По 10 семян на участок высевали на многочисленные участки. После одного месяца прорастания проросшие растения подсчитывали на каждом участке, и это число использовали для общего количества растений, посаженных на участке, при оценке токсичности.
Исследование токсичности
Общее количество растений подсчитывали на каждом участке в 24×6 шестиугольных небольших лотках для посадок. Количество проросших семян на каждом участке подсчитывали через месяц, и для каждого участка это число регистрировали и использовали как общее значение для каждого участка. Различные концентрации тимилоксиуксусной кислоты применяли в 5% Triton-X 100 и 1:1 молярном отношении гидроксид калия:тимилоксиуксусная кислота, чтобы способствовать растворимости соединения в воде. 10 мл раствора наносили на каждый участок, и гибель растений оценивали через 3 дня и 2 недели после применения (для некоторых обработок). Гибель в эти моменты времени была подсчитана из общего количества растений, прораставших на каждом участке в начале исследования. В оба момента времени общее количество погибших растений и общее количество растений в начале исследования регистрировали для каждого наблюдения. Пробит-модель использовали для расчета значений LC50 для каждого из соединений, исследованных в этом испытании. Контрольный состав (без активного ингредиента) испытывали на ряде растений и включали в конечную пробит-модель. Этот контрольный состав сам по себе практически не имел эффекта, или оказывал лишь минимальное влияние.
Результаты
Все соединения, испытанные в этом исследовании, были фитотоксичными для рассматриваемых видов растений. Токсичность каждого соединения сравнивали с 2,4-дихлорфеноксиуксусной кислотой (2,4-D), используемой в качестве контрольного коммерческого гербицида. Техническая 2,4-D была приобретена у Sigma Aldrich и включена в составы таким же образом, как инсектицидные активные ингредиенты, описанные в данной заявке. Результаты токсичности тимилоксиуксусной кислоты по сравнению с 2,4-D против щирицы Палмера представлены в Таблице 4. 2,4-D была незначительно более фитотоксичной, чем тимилоксиуксусная кислота; однако 95% доверительные интервалы, значительно перекрывающие друг друга, позволяют предположить отсутствие различий в токсичности обоих этих соединений по отношению к щирице Палмера. Кроме того, через две недели после применения для 2,4-D наблюдалось существенно более низкое значение LC50, чем через три дня после применения. Это не относится к тимилоксиуксусной кислоте, где значение LC50 аналогично наблюдаемому через три дня после применения. Это говорит о том, что 2,4-D в намного большем количестве остается в почве, чем гербицидные соединения, полученные из природных монотерпеноидов, и способна проявлять отложенный эффект. Вполне вероятно, что тимилоксиуксусная кислота быстро проявляет свою токсичность в растении и быстро разлагается в почве, как показывают эти данные.
Также была исследована избирательность этих гербицидов по сравнению с мятликом. Если эти соединения должны использоваться в быту и саду, а также в сельском хозяйстве, крайне важно, чтобы они действовали избирательно против видов двудольных сорняков. Таблица 5 демонстрирует, что тимилоксиуксусная кислота является избирательной в отношении различных видов двудольных сорняков. Отношение избирательности по сравнению с видами мятлика составляло 2,06-5 раз для различных видов сорняков. Отношение избирательности для 2,4-D на тех же самых сорняках составило 2,56-5,97 раз. В целом, отношения избирательности для тимилоксиуксусной кислоты были очень похожи на 2,4-D, широко признанным избирательным гербицидом, применяемым как в домашних, так и в садовых и сельскохозяйственных условиях. Изображения, демонстрирующие фитотоксическое действие против всех описанных видов сорняков, представлены на прилагаемых фигурах.
В той степени, в какой это необходимо для обеспечения подтвержденности описанием, следует понимать, что предмет и/или текст любых прилагаемых пунктов формулы изобретения включен в описание посредством ссылки во всей их полноте.
Всем читателям этого письменного описания будет понятно, что иллюстративные варианты осуществления, описанные в данном документе, могут подходящим образом применяться на практике и в отсутствие какого-либо указанного признака, элемента или этапа, который является или не является конкретно раскрытым в данном документе.
Таблица 5. Сравнение тимилоксиуксусной кислоты и 2,4-D на щирице Палмера
Таблица 6. Сравнение избирательности тимилоксиуксусной кислоты по отношению к двудольным видам сорняков с 2,4-D
| название | год | авторы | номер документа |
|---|---|---|---|
| ГЕРБИЦИДНЫЙ ПРЕПАРАТ ИЗБИРАТЕЛЬНОГО ДЕЙСТВИЯ И СПОСОБ СЕЛЕКТИВНОЙ БОРЬБЫ С СОРНЯКАМИ И ТРАВАМИ | 1995 |
|
RU2150833C1 |
| КОМБИНАЦИЯ ИЗ ГЕРБИЦИДОВ И ЗАЩИТНЫХ СРЕДСТВ | 2002 |
|
RU2291616C2 |
| СПОСОБ БОРЬБЫ С ВРЕДНЫМИ РАСТЕНИЯМИ В КУЛЬТУРАХ ПОЛЕЗНЫХ РАСТЕНИЙ | 2002 |
|
RU2420065C2 |
| ИНСЕКТИЦИДНОЕ ПОКРЫТИЕ ДЛЯ СЕМЯН | 1998 |
|
RU2243657C2 |
| КОМБИНАЦИЯ ГЕРБИЦИД - АНТИДОТ И СПОСОБ УНИЧТОЖЕНИЯ СОРНЯКОВ В ПОСЕВАХ ПОЛЕЗНЫХ РАСТЕНИЙ | 2002 |
|
RU2351132C2 |
| УСИЛЕНИЕ РОСТА РАСТЕНИЯ С ИСПОЛЬЗОВАНИЕМ КАТИОННЫХ ГУАРОВ | 2015 |
|
RU2731078C2 |
| СПОСОБЫ ПОДАВЛЕНИЯ РОСТА СОРНЯКОВ, ГЕРБИЦИДНЫЕ КОМПОЗИЦИИ И ПРОДУКТ | 1996 |
|
RU2147401C1 |
| ЗАМЕЩЁННЫЕ СИДНОНИМИНЫ В КАЧЕСТВЕ АНТИДОТОВ ГЕРБИЦИДОВ | 2021 |
|
RU2772224C1 |
| Гербицидно-антидотный состав (его варианты) | 1980 |
|
SU984394A3 |
| СИНЕРГИЧЕСКИЙ ГЕРБИЦИДНЫЙ КОНТРОЛЬ СОРНЯКОВ И УЛУЧШЕННАЯ ТОЛЕРАНТНОСТЬ СЕЛЬСКОХОЗЯЙСТВЕННЫХ КУЛЬТУР ДЛЯ СОЧЕТАНИЙ 2,4-D-ХОЛИНА, ГЛИФОСАТА И ГЛЮФОСИНАТА НА ТОЛЕРАНТНЫХ ПО ОТНОШЕНИЮ К 2,4-D, ГЛИФОСАТУ И ГЛЮФОСИНАТУ СОЕВЫХ БОБОВ, КУКУРУЗЫ, ХЛОПКА И ДРУГИХ ПОСЕВНЫХ ПЛОЩАДЯХ | 2014 |
|
RU2658993C1 |






Изобретение относится к сельскому хозяйству, в частности к новым химическим соединениям, проявляющим гербицидное действие. Соединение имеет общую структурную формулу (I)  , в которой А представляет собой
, в которой А представляет собой  , а R1 представляет собой незамещенный фенилпропаноидный или монотерпеноидный фрагмент и R2 представляет собой замещенный или незамещенный фенилпропаноидный или монотерпеноидный фрагмент или выбран из группы, состоящей из Н, М, замещенного или незамещенного С3-С7 неразветвленного или разветвленного алкила, замещенного или незамещенного С2-С7 неразветвленного или разветвленного алкенила, замещенного или незамещенного С3-С7 неразветвленного или разветвленного алкинила, замещенного или незамещенного С3-С7 неразветвленного или разветвленного циклоалкила, замещенного или незамещенного гетероарила, и замещенного или незамещенного С3-С7 неразветвленного или разветвленного цикло алкенила; и М представляет собой противоион, выбранный из группы, состоящей из натрия, калия, кальция, магния, железа, цинка, меди и аммония. Новые соединения обладают контактной гербицидной активностью, которая обеспечивает немедленный контроль вегетации, позволяет более выгодно снизить затраты на обработку, улучшить контроль вегетации, уменьшить как непосредственное, так и остаточное токсическое воздействие на людей и животных, а также уменьшить вероятность сохранения гербицида на собранных пищевых культурах, проявляет усиленную системную гербицидную активность до и после появления всходов. 5 н. и 6 з.п. ф-лы, 8 табл., 6 пр., 10 ил.
, а R1 представляет собой незамещенный фенилпропаноидный или монотерпеноидный фрагмент и R2 представляет собой замещенный или незамещенный фенилпропаноидный или монотерпеноидный фрагмент или выбран из группы, состоящей из Н, М, замещенного или незамещенного С3-С7 неразветвленного или разветвленного алкила, замещенного или незамещенного С2-С7 неразветвленного или разветвленного алкенила, замещенного или незамещенного С3-С7 неразветвленного или разветвленного алкинила, замещенного или незамещенного С3-С7 неразветвленного или разветвленного циклоалкила, замещенного или незамещенного гетероарила, и замещенного или незамещенного С3-С7 неразветвленного или разветвленного цикло алкенила; и М представляет собой противоион, выбранный из группы, состоящей из натрия, калия, кальция, магния, железа, цинка, меди и аммония. Новые соединения обладают контактной гербицидной активностью, которая обеспечивает немедленный контроль вегетации, позволяет более выгодно снизить затраты на обработку, улучшить контроль вегетации, уменьшить как непосредственное, так и остаточное токсическое воздействие на людей и животных, а также уменьшить вероятность сохранения гербицида на собранных пищевых культурах, проявляет усиленную системную гербицидную активность до и после появления всходов. 5 н. и 6 з.п. ф-лы, 8 табл., 6 пр., 10 ил.
1. Гербицидная композиция, обладающая фитотоксическим и/или системным действием, содержащая носитель и соединение формулы (I)
 ,
,
где А представляет собой
 и
и
где
R1 представляет собой незамещенный фенилпропаноидный или монотерпеноидный фрагмент;
R2 представляет собой замещенный или незамещенный фенилпропаноидный или монотерпеноидный фрагмент или выбран из группы, состоящей из Н, М, замещенного или незамещенного С3-С7 неразветвленного или разветвленного алкила, замещенного или незамещенного С2-С7 неразветвленного или разветвленного алкенила, замещенного или незамещенного С3-С7 неразветвленного или разветвленного алкинила, замещенного или незамещенного С3-С7 неразветвленного или разветвленного циклоалкила, замещенного или незамещенного гетероарила, и замещенного или незамещенного С3-С7 неразветвленного или разветвленного цикло алкенила; и
М представляет собой противоион, выбранный из группы, состоящей из натрия, калия, кальция, магния, железа, цинка, меди и аммония.
2. Гербицидная композиция по п. 1, отличающаяся тем, что упомянутые соединения формулы (I) представляют собой тимилоксиуксусную кислоту, карвакрилоксиуксусную кислоту, эвгенилоксиуксусную кислоту, ванилилоксиуксусную кислоту, карбоксиметилванилиновую кислоту, салицилоксиуксусную кислоту, карбоксиметилсалициловую кислоту, 2-(2-(метоксикарбонил)фенокси)уксусную кислоту, 3-(4-(карбоксиметокси)-3-метоксифенил)акриловую кислоту, 3-(4-(карбоксиметокси)фенил)акриловую кислоту, кумарин-7-оксиуксусную кислоту, 2-(4-ацетилфенокси)уксусную кислоту, умбеллиферонилоксиуксусную кислоту, пицеилоксиуксусную кислоту или любой (любую) из их соответствующих сложных эфиров и их солей, и их смеси.
3. Гербицидная композиция по п. 2, отличающаяся тем, что упомянутые соответствующие сложные эфиры соединений формулы (I) выбраны из метилового эфира тимилоксиуксусной кислоты, карвакрол эвгенилоксиацетата, геранил тимилоксиацетата, этилтимилоксиацетата, этилкарвакрилоксиацетата, изопропилкарвакрилоксиацетата и амилтимилоксиацетата и их смесей.
4. Гербицидная композиция по п. 2, отличающаяся тем, что упомянутые соединения формулы (I) включают тимилоксиуксусную кислоту, эвгенилоксиуксусную кислоту, метиловый сложный эфир эвгенилоксиуксусной кислоты, карвакрилоксиуксусную кислоту и метиловый сложный эфир тимилоксиацетата.
5. Способ контроля растений-вредителей путем нанесения гербицидной композиции по п. 1 на почву рядом с растениями-вредителями.
6. Способ по п. 5, отличающийся тем, что упомянутое соединение гербицидной композиции по п. 1 выбрано из тимилоксиуксусной кислоты, карвакрилоксиуксусной кислоты, эвгенилоксиуксусной кислоты, ванилилоксиуксусной кислоты, карбоксиметилванилиновой кислоты, салицилоксиуксусной кислоты, карбоксиметилсалициловой кислоты, 2-(2-(метоксикарбонил)фенокси)уксусной кислоты, 3-(4-(карбоксиметокси)-3-метоксифенил)акриловой кислоты, 3-(4-(карбоксиметокси)фенил)акриловой кислоты, кумарин-7-оксиуксусной кислоты, 2-(4-ацетилфенокси)уксусной кислоты, умбеллиферонилоксиуксусной кислоты, пицеилоксиуксусной кислоты или любого из их соответствующих сложных эфиров и их смесей.
7. Способ контроля растений вредителей, в котором на почву около растений-вредителей наносят гербицидную композицию по п. 1, предоставляемую в гранулированном составе.
8. Способ по п. 7, отличающийся тем, что упомянутое соединение гербицидной композиции по п. 1 выбрано из тимилоксиуксусной кислоты, карвакрилоксиуксусной кислоты, эвгенилоксиуксусной кислоты, ванилилоксиуксусной кислоты, карбоксиметилванилиновой кислоты, салицилоксиуксусной кислоты, карбоксиметилсалициловой кислоты, 2-(2-(метоксикарбонил)фенокси)уксусной кислоты, 3-(4-(карбоксиметокси)-3-метоксифенил)акриловой кислоты, 3-(4-(карбоксиметокси)фенил)акриловой кислоты, кумарин-7-оксиуксусной кислоты, 2-(4-ацетилфенокси)уксусной кислоты, умбеллиферонилоксиуксусной кислоты, пицеилоксиуксусной кислоты или любого из их соответствующих сложных эфиров и их смесей.
9. Способ контроля растений-вредителей, в котором непосредственно на листья растений-вредителей наносят гербицидную композицию по п. 1.
10. Способ по п. 9, отличающийся тем, что упомянутое соединение гербицидной композиции по п. 1 выбрано из тимилоксиуксусной кислоты, карвакрилоксиуксусной кислоты, эвгенилоксиуксусной кислоты, ванилилоксиуксусной кислоты, карбоксиметилванилиновой кислоты, салицилоксиуксусной кислоты, карбоксиметилсалициловой кислоты, 2-(2-(метоксикарбонил)фенокси)уксусной кислоты, 3-(4-(карбоксиметокси)-3-метоксифенил)акриловой кислоты, 3-(4-(карбоксиметокси)фенил)акриловой кислоты, кумарин-7-оксиуксусной кислоты, 2-(4-ацетилфенокси)уксусной кислоты, умбеллиферонилоксиуксусной кислоты, пицеилоксиуксусной кислоты или любого из их соответствующих сложных эфиров и их смесей.
11. Гербицидная композиция, содержащая носитель и эффективное количество тимилоксиуксусной кислоты, карвакрилоксиуксусной кислоты, эвгенилоксиуксусной кислоты, умбеллиферонилоксиуксусной кислоты, пицеилоксиуксусной кислоты или сложных эфиров вышеупомянутых кислот, или их смесь.
| MOORE R.M | |||
| "Differential effects of certain phenoxyacetic acid compounds and phenylcarbamates on plant species | |||
| I | |||
| Effect of applications to the soil prior to emergence", AUSTRALIAN JOURNAL OF AGRICULTURAL RESEARCH, 1950, 1, p | |||
| Устройство для устранения мешающего действия зажигательной электрической системы двигателей внутреннего сгорания на радиоприем | 1922 |
|
SU52A1 |
| DONALD P | |||
| GOWING, ROBERT W | |||
| LEEPER "Uncommon Plant Growth Regulators for the Control of Nutgrass and Oxalis", | |||
Авторы
Даты
2021-09-03—Публикация
2017-08-23—Подача