ОБЛАСТЬ ПРИМЕНЕНИЯ ИЗОБРЕТЕНИЯ
Изобретение относится к области гемостатических композиций. Более конкретно, изобретение относится к гемостатическим композициям, содержащим анионобменное вещество и кальция; и способам их применения.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Кровотечение представляет собой термин, обычно применяемый для описания выхода крови из кровеносной системы позвоночных. Кровотечение может возникнуть внутри тела (внутреннее кровотечение) или во вне тела (поверхностное кровотечение). Областью кровотечения может быть практически любая область тела. Обычно, внутреннее кровотечение происходит, когда кровь вытекает из–за повреждения кровеносного сосуда или органа. Поверхностное кровотечение происходит, когда кровь выходит через разрыв кожи, или когда кровь выходит через естественное отверстие в теле, такое как рот, нос, ухо, влагалище или прямая кишка.
Кровотечение могут быть вызвано самыми различными инцидентами или состояниями, в том числе травматическим повреждением (в том числе царапинами, ссадинами, рваными ранами, порезами, колотыми ранами от предметов, таких как игла или нож, травмами с размозжением тканей и огнестрельными ранениями) или определенными медицинскими условиями, такими как условия, связанные с субъектами с нарушениями свертывания, у которых снижено количество факторов свертывания крови. Дополнительно, кровотечение может быть вызвано путем применения определенных лекарственных препаратов, таких как некоторые нестероидные противовоспалительные препараты (НПВП) или предотвращающие коагуляцию лекарственные средства, например, варфарин, низкомолекулярный гепарин, апиксабан (ELIQUIS®), дабигатран (PRADAXA®), эдоксабан (SAVAYSA®) и ривароксабан (XARELTO®).
Продолжительное кровотечение при отсутствии лечения может привести к обескровливанию, то есть, чрезмерному уменьшению объема крови (гиповолемии), что приводит к смерти.
Остановка или контролирование кровотечения, также называемые гемостазом, включающие свертывание крови и стимуляцию, ускорение или усиление этого механизма, представляют собой важную часть как первой помощи, так и хирургического вмешательства. Средства и композиции, которые усиливает, стимулируют или ускоряют гемостаз, называют «гемостатические средства».
Гемостатические средства могут содержать кровоостанавливающие средства, герметизирующие вещества или связующие вещества. Как правило, кровоостанавливающие средства подразделяют на механические кровоостанавливающие средства (желатин, коллаген, окисленная восстановленная целлюлоза, и т. д.), активные кровоостанавливающие средства (такие как тромбин), жидкотекучие кровоостанавливающие средства (такие как желатиновые матрицы в сочетании с тромбином) и герметизирующие вещества на основе фибрина.
Некоторые известные кровоостанавливающие средства требуют длительной подготовки перед применением, включающей многочисленные этапы, которые тратят драгоценное время в чрезвычайных ситуациях.
Биологические кровоостанавливающие средства являются очень эффективными, но все же они несут потенциальный риск для безопасности и их производственная себестоимость высока.
Многие известные кровоостанавливающие средства требуют охлаждения, которое могут быть недоступным или очень дорогостоящим в развивающихся странах, а также в различных ситуациях (в том числе на полях сражений, в изолированных районах, в чрезвычайных ситуациях) или при сбоях в электроснабжении. Более того, требование охлаждения увеличивает затраты на производство, доставку и хранение.
Многие известные кровоостанавливающие средства являются неэффективными для пациентов, которые используют антикоагулянты, такие как гепарин, аспирин или кумадин.
Многие известные кровоостанавливающие средства включают прокоагулянты, которые несут потенциальный риск загрязнения, имеют высокую производственную себестоимость, короткий срок годности и обычно требуют охлаждения.
Таким образом, существует потребность в безопасном и эффективном кровоостанавливающем средстве, который лишен по меньшей мере некоторых недостатков предшествующего уровня техники.
Предшествующий уровень техники включает патенты США №№ 5,502,042 и 8,741,335; публикацию патента США № 2009/0062849; и патентные публикации PCT №№ WO 2013/071235 и 1993/05822.
ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В настоящем изобретении предусмотрена гемостатическая композиция, содержащая анионобменное вещество; кальций и фармацевтически приемлемый носитель, так же как способы их применения для индуцирования гемостаза.
В соответствии с аспектом некоторых вариантов осуществления настоящего изобретения, обеспечивают способ индуцирования гемостаза в области кровотечения у нуждающемся в этом субъекта, способ, который включает нанесение на область кровотечения эффективного количества гемостатической композиции, содержащей анионобменное вещество и соль кальция.
В соответствии с некоторыми вариантами осуществления, анионобменное вещество содержит одну или более положительно заряженных групп, связанных с матрицей.
В соответствии с некоторыми вариантами осуществления, положительно заряженные группы (также называемые поликатионами) обеспечивают с помощью основания, выбранного из группы, состоящей из сильного основания, слабого основания и их комбинации.
В соответствии с некоторыми вариантами осуществления, сильное основание содержит четвертичные аминогруппы.
В соответствии с некоторыми вариантами осуществления, слабое основание содержит аминогруппу, выбранную из группы, состоящей из первичной аминогруппы, вторичной аминогруппы, третичной аминогруппы и их комбинации.
В соответствии с некоторыми вариантами осуществления, слабое основание состоит из диэтиламиноэтильных (ДЭАЭ) групп.
В соответствии с некоторыми вариантами осуществления, матрицу выбирают из группы, состоящей из алифатического сложного полиэфира, полисахарида, полипептида, полистирола–дивинилбензола, белка (такого как коллаген, желатин или альбумин), силикагеля и их комбинации.
В соответствии с некоторыми вариантами осуществления, матрица является перекрестно–сшитой, необязательно, ковалентно перекрестно–сшитой.
В соответствии с некоторыми вариантами осуществления, композиция практически свободна от любого из белков каскада свертывания крови.
В соответствии с некоторыми вариантами осуществления, композиция находится в форме, выбранной из группы, состоящей из суспензии, порошка, волокна, пленки, пластыря и жидкости.
В соответствии с некоторыми вариантами осуществления, в которых композиция имеет форму суспензии или жидкости, композиция дополнительно содержит фармацевтически приемлемый носитель.
В соответствии с некоторыми вариантами осуществления, нанесение осуществляют путем применения давления на композицию, необязательно, по направлению к области кровотечения.
В соответствии с аспектом некоторых вариантов осуществления настоящего изобретения, обеспечивают гемостатическую композицию, содержащую анионобменное вещество; соль кальция; и, необязательно, фармацевтически приемлемый носитель.
В соответствии с некоторыми вариантами осуществления, анионобменное вещество содержит одну или более положительно заряженных групп, связанных с матрицей.
В соответствии с некоторыми вариантами осуществления, анионобменное вещество связано с твердой фазой.
В соответствии с некоторыми вариантами осуществления, положительно заряженные группы состоят из основания, выбранного из группы, состоящей из сильного основания, слабого основания и их комбинации.
В соответствии с некоторыми вариантами осуществления, сильное основание содержит четвертичные аминогруппы.
В соответствии с некоторыми вариантами осуществления, слабое основание содержит аминогруппу, выбранную из группы, состоящей из первичной аминогруппы, вторичной аминогруппы, третичной аминогруппы и их комбинации.
В соответствии с некоторыми вариантами осуществления, слабое основание состоит из диэтиламиноэтильных (ДЭАЭ) групп.
В соответствии с некоторыми вариантами осуществления, матрицу выбирают из группы, состоящей из алифатического сложного полиэфира, полисахарида, полипептида, полистирола–дивинилбензола, силикагеля и их комбинации.
В соответствии с некоторыми вариантами осуществления, матрица является перекрестно–сшитой, необязательно, ковалентно перекрестно–сшитой.
В соответствии с некоторыми вариантами осуществления, полисахарид выбирают из группы, состоящей из целлюлозы, декстрана, агарозы и их комбинаций.
В соответствии с некоторыми вариантами осуществления, белок представляет собой структурный белок, такой как коллаген или желатин, или белки, имеющие высокое содержание в плазме крови, такие как альбумин.
В соответствии с некоторыми вариантами осуществления, композиция практически свободна от любого из белков каскада свертывания крови.
В соответствии с некоторыми вариантами осуществления, композиция находится в форме, выбранной из группы, состоящей из суспензии, порошка, пленки, пластыря и жидкости.
В соответствии с некоторыми вариантами осуществления, композиция в форме суспензии или жидкости дополнительно содержит фармацевтически приемлемый носитель.
В соответствии с аспектом некоторых вариантов осуществления настоящего изобретения, обеспечивают гемостатическую композицию, содержащую диэтиламиноэтил (ДЭАЭ), связанный с матрицей; и соль кальция.
В соответствии с аспектом некоторых вариантов осуществления настоящего изобретения, обеспечивают способ получения гемостатической композиции, включающий получение анионобменного вещества с помощью ковалентного связывания одной или более положительно заряженных групп с перекрестно–сшитой матрицей; и добавления соли кальция к указанному анионобменному веществу.
В соответствии с аспектом некоторых вариантов осуществления настоящего изобретения, обеспечивают гемостатическую композицию, получаемую способом, раскрытым в настоящем документе.
Как применяют в настоящем документе, термин «индуцирование гомеостаза» соответствует вызыванию, возникновению, стимуляции, ускорению и/или усилению гемостаза.
Как применяют в настоящем документе, термин «область кровотечения» соответствует области, которая активно кровоточит и области, склонной или восприимчивой к геморрагическим осложнениям, таким как, например, область хирургического вмешательства, область анастомоза и/или область наложения шва.
Как применяют в настоящем документе, термин «фармацевтически приемлемый носитель» соответствует любому инертному разбавителю или носителю, который не обладает биологической активностью и подходит для применения людьми или другими животными. Носитель может быть выбран из любого из носителей, известных в данной области техники, таких как, без ограничения этим, фосфатный буферный раствор (ФБР), физиологический раствор, раствор хлорида натрия, раствор хлорида кальция, лактат Рингера (ЛР), 5% декстроза в нормальном физиологическом растворе, различные сахариды, сахарные спирты (такие как маннит, сорбит) и вода для инъекций.
Как применяют в настоящем документе, термин «суспензия» соответствует густому, мягкому, влажному веществу. Обычно, суспензию получают путем смешивания сухих ингредиентов (например, порошка или твердых гидрофильных частиц) с жидкостью. Концентрация сухих ингредиентов может составлять от 0,5% до 99% масс./масс. всей композиции суспензии. Обычно, суспензия представляет собой пластичный в диапазоне температур 15–40 °C материал.
Как применяют в настоящем документе, термин «свободный от» по отношению к компоненту композиции соответствует компоненту, который присутствует в композиции в концентрации менее 0,1% масс./масс. общей композиции.
В настоящем документе термины «содержащий», «включающий» и «имеющий», а также их грамматические варианты, должны пониматься как определение указанных элементов, атрибутов, стадий или компонентов, однако они не исключают добавления одного или более дополнительных элементов, атрибутов, этапов, компонентов или их групп. Эти термины охватывают термины «состоящий из» и «состоящий по существу из».
При использовании в настоящем документе термины в единственном числе означают «по меньшей мере один», либо «один или более», за исключением случаев, когда иное явно определяется контекстом.
В настоящем документе термин «приблизительно» относится к ± 10%.
Все технические и научные термины, используемые в настоящем документе, если не указано иное, имеют общепринятое значение, понятное любому специалисту в данной области, к которой имеет отношение изобретение. Кроме того, описания, материалы, способы и примеры приводятся только в целях иллюстрации и не имеют ограничительного характера. При практическом применении настоящего изобретения могут применяться способы и материалы, аналогичные или эквивалентные описанным в настоящем документе.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Некоторые варианты осуществления изобретения описаны в настоящем документе со ссылками на сопроводительные рисунки. Описание вместе с Фиг. позволяет специалисту в данной области понять, каким образом некоторые варианты осуществления изобретения можно применять на практике. Рисунки представлены для целей иллюстрации, и авторы не делают попытки показать структурные элементы какого–либо варианта осуществления подробнее, чем это необходимо для фундаментального понимания изобретения. Для полной ясности следует упомянуть, что некоторые объекты, изображенные на Фиг., показаны не в масштабе.
На Фигурах представлено следующее:
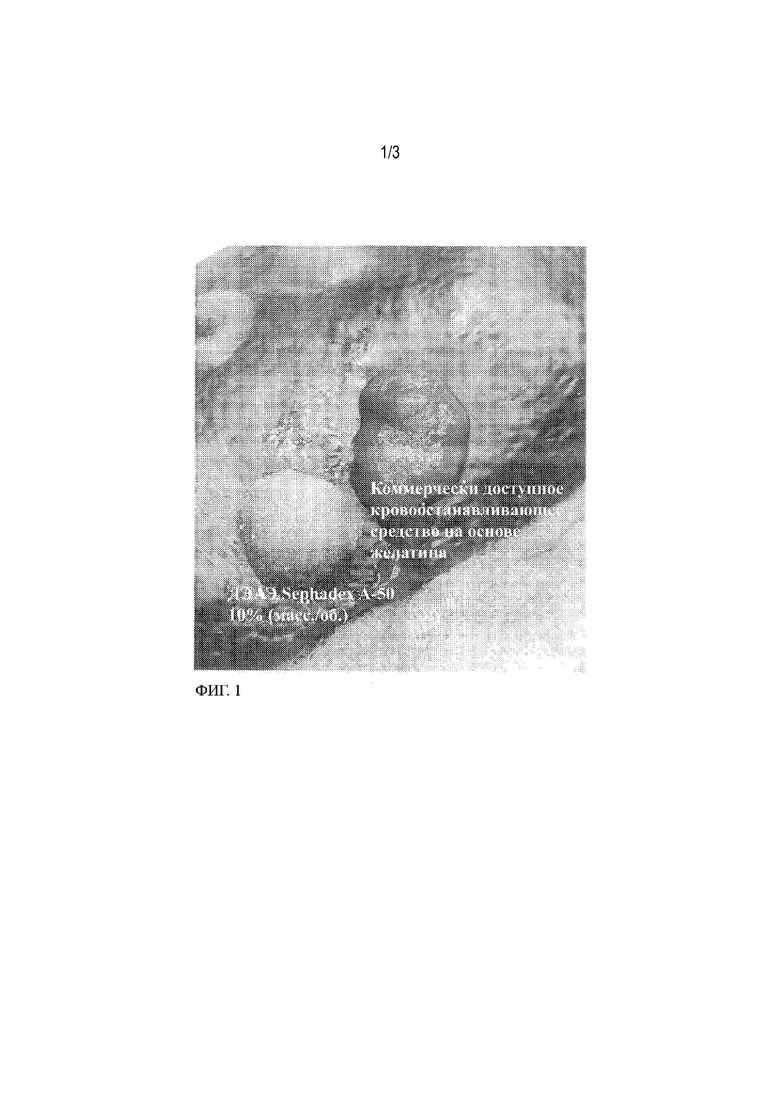
Фиг. 1 демонстрирует снижение кровотечения в in–vivo модели гепаринизированного круглого перфорированного отверстия в селезенке свиньи (диаметр 4 мм/глубина 2 мм) после нанесения ДЭАЭ SEPHADEX™ A–50 (10% масс./об.) и коммерчески доступное кровоостанавливающее средство на основе желатина, со временем сдавливания 30 секунд (для ДЭАЭ SEPHADEX™ A–50) или 60 секунд (для коммерчески доступного кровоостанавливающего средства на основе желатина).
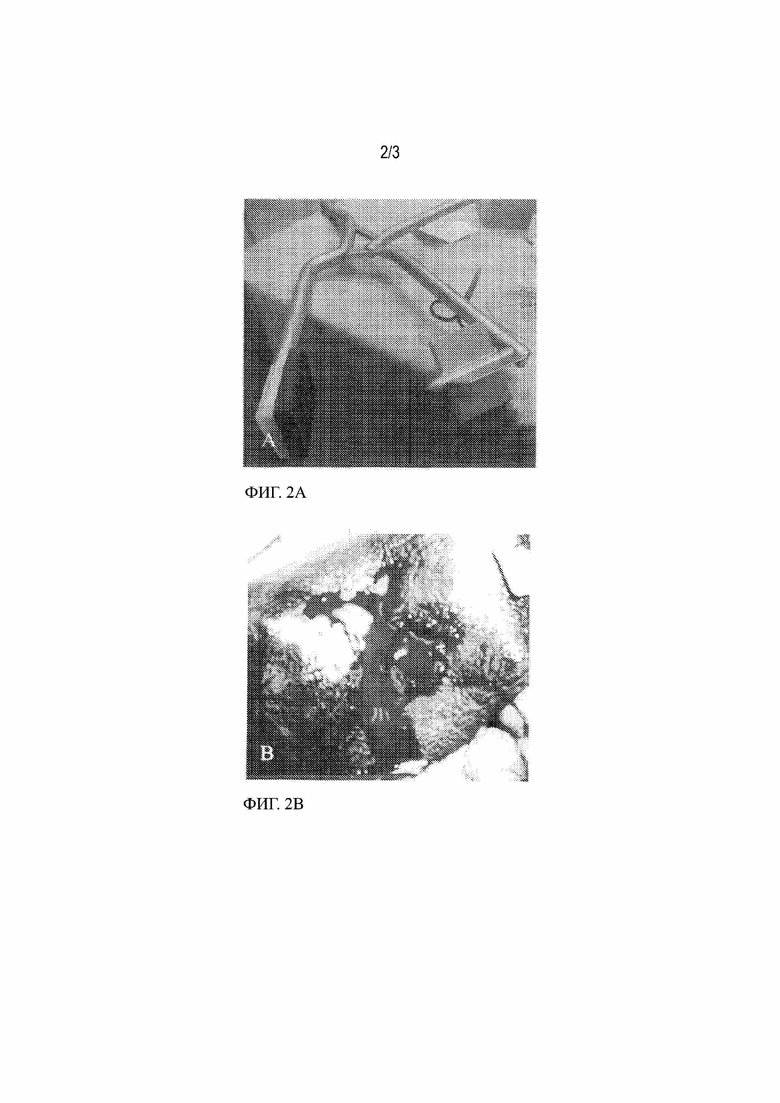
Фиг. 2а демонстрирует устройство, применяемое в модели проблемного кровотечения в селезенке свиньи, чтобы создать «пулевидную» рану. Фиг. 2b демонстрирует рану, создаваемую с помощью устройства на Фиг. 2a в селезенке свиньи. Как видно на Фиг. 2b, рана приводит к тяжелому кровотечению из селезенки. ДЭАЭ SEPHADEX™ A–50 получают в виде суспензии 10% масс./об. в 20 мM CaCl2 и накладывают на рану. После нанесения суспензии и времени сдавливания 4 минуты, интенсивность кровотечения после нанесения оценивают таким образом, как описано на Фиг. 1. Фиг. 2c демонстрирует пулевидную рану после нанесения ДЭАЭ SEPHADEX™ A–50 и тампонирования, которая достигает полного гемостаза сильно кровоточащей раны.
ОПИСАНИЕ НЕКОТОРЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
В настоящем изобретении предусмотрена гемостатическая композиция, содержащая анионобменное вещество; соль кальция и, необязательно, фармацевтически приемлемый носитель, так же как способы их применения в достижении гемостаза.
Принципы, способы применения и варианты осуществления изобретения, раскрытого в настоящем документе, можно лучше понять при рассмотрении сопроводительного описания. При внимательном ознакомлении с описанием специалист в данной области сможет реализовать изобретение без лишних усилий и экспериментальной работы.
Перед более подробным разъяснением по меньшей мере одного варианта осуществления следует понимать, что в своей сфере применения изобретение не обязательно ограничивается отдельными элементами конструкции и расположением компонентов и/или способами, приведенными в описании ниже. Изобретение допускает другие варианты осуществления или применение на практике или осуществление различными способами.
Фразеология и терминология в настоящем документе используются в целях описания и не должны считаться ограничивающими.
В соответствии с аспектом некоторых вариантов осуществления настоящего изобретения, обеспечивают способ индуцирования гемостаза у субъекта, нуждающегося в этом в области кровотечения, способ, который включает нанесение на область кровотечения эффективного количества гемостатической композиции, содержащей анионобменное вещество и соль кальция.
В соответствии с аспектом некоторых вариантов осуществления настоящего изобретения, обеспечивают гемостатическую композицию, содержащую анионобменное вещество и соль кальция для применения в индуцировании, гемостазе в области кровотечения.
В соответствии с аспектом некоторых вариантов осуществления настоящего изобретения, обеспечивают применение гемостатической композиции, содержащей анионобменное вещество и соль кальция, в производстве лекарственного препарата для индуцирования гемостаза.
В соответствии с аспектом некоторых вариантов осуществления настоящего изобретения, обеспечивают применение гемостатической фармацевтической композиции, содержащей анионобменное вещество и соль кальция, в производстве лекарственного препарата для индуцирования гемостаза.
В соответствии с некоторыми вариантами осуществления способа, композиции для применения, применения или способа получения, раскрытых в настоящем документе, анионобменное вещество содержит одну или более положительно заряженных групп (при pH от 2 до 10) (также называемых поликатионами), связанных с матрицей. В некоторых подобных вариантах осуществления, гемостатическую композицию освобождают от полианионов.
В соответствии с некоторыми вариантами осуществления способа, фармацевтической композиции для применения, применения или способа получения, раскрытых в настоящем документе, анионобменное вещество содержит одну или более положительно заряженных групп (при рН от 2 до 10) (также называемых поликатионами), связанных с матрицей. В некоторых подобных вариантах осуществления, гемостатическую композицию освобождают от полианионов (таких как полианионные полимеры).
Полианионы представляют собой молекулы или химические комплексы, имеющие более одного отрицательного заряда. Поликатионы представляют собой молекулы или химические комплексы, имеющие более одного положительного заряда.
В другом варианте осуществления, матрица может содержать анионные остатки; тем не менее, общий результирующий заряд анионобменного вещества будет положительным.
В соответствии с некоторыми вариантами осуществления, положительно заряженные группы присутствуют в гемостатической композиции при общей ионной емкости не менее 2 ммоль/г, например, от 2 до 5, от 3 до 4 ммоль/г.
Как применяют в настоящем документе, термин «общая ионная емкость» соответствует общему количеству заряженных областей в композиции, которые доступны для обмена. Общая ионная емкость выражают на основе сухой массы, сырой массы или сырого объема.
В соответствии с некоторыми вариантами осуществления, анионобменное вещество присутствует при концентрации 0,5–99% масс./об. общей гемостатической композиции, необязательно, при концентрации 5–15% масс./об. общей гемостатической композиции, такой как, например, 5%, 6%, 7%, 8%, 9%, 10%, 11%, 12%, 13% 14% или 15%.
В соответствии с некоторыми вариантами осуществления, в которых анионобменное вещество присутствует при концентрации по меньшей мере 10% масс./об. общей гемостатической композиции, соотношение между анионобменным веществом и кальцием в гемостатической композиции лежит в диапазоне от 1:5 до 1:70. В некоторых вариантах осуществления, соотношение составляет приблизительно 1:34.
В соответствии с некоторыми вариантами осуществления, положительно заряженные группы состоят из основания, выбранного из группы, состоящей из сильного основания (такого как содержащее четвертичные аминогруппы), слабого основания (такого как содержащее аминогруппу выбранную из группы, состоящей из первичной аминогруппы, вторичной аминогруппы, третичной аминогруппы) и их комбинации.
В соответствии с некоторыми вариантами осуществления, слабое основание состоит из диэтиламиноэтильных (ДЭАЭ) групп.
В соответствии с некоторыми вариантами осуществления, положительно заряженные группы связывают с матрицей, например, подложку матрицы посредством линкера, присутствующего между подложкой матрицы и положительно заряженными группами.
В соответствии с некоторыми вариантами осуществления, матрицу выбирают из группы, состоящей из алифатического сложного полиэфира, полисахарида, полипептида (такого как желатин, альбумин сыворотки крупного рогатого скота (АБС) или коллаген или их комбинаций), полиакриламида, сополимера акрилатов, полистирола–дивинилбензола, силикагеля и их комбинации.
В соответствии с некоторыми вариантами осуществления, матрица является перекрестно–сшитой, необязательно, ковалентно перекрестно–сшитой. В некоторых подобных вариантах осуществления, матрицу освобождают от ионных поперечных связей.
В соответствии с некоторыми вариантами осуществления, полисахарид выбирают из группы, состоящей из целлюлозы, декстрана, агарозы и их комбинаций.
В соответствии с некоторыми вариантами осуществления, матрица содержит SEPHADEX™ (декстран), SEPHACEL™ (целлюлоза) или TOYOPEARL™ (гидроксилированный метакриловый полимер) или их комбинации. В соответствии с некоторыми вариантами осуществления, композиция находится в форме, выбранной из группы, состоящей из суспензии, порошка, пленки, пластыря и жидкости. В соответствии с некоторыми подобными вариантами осуществления, в которых композиция находится в форме суспензии или жидкости, композиция дополнительно содержит фармацевтически приемлемый носитель.
В соответствии с некоторыми вариантами осуществления способа, раскрытыми в настоящем документе, нанесение гемостатической композиции на место кровотечения осуществляют путем применения давления (например, с марлей) на композицию по направлению к месту кровотечения.
В соответствии с аспектом некоторых вариантов осуществления настоящего изобретения, обеспечивают гемостатическую композицию, содержащую анионобменное вещество; соль кальция; и, необязательно, фармацевтически приемлемый носитель.
В соответствии с некоторыми вариантами осуществления, анионобменное вещество содержит одну или более положительно заряженных групп (также называемых поликатионами), связанных с матрицей. В некоторых подобных вариантах осуществления, гемостатическая композиция практически свободна от полианионов.
В соответствии с некоторыми вариантами осуществления, положительно заряженные группы присутствуют в гемостатической композиции при общей ионной емкости не менее 2 ммоль/г, например, от 2 до 5, от 3 до 4 ммоль/г.
В соответствии с некоторыми вариантами осуществления, в которых анионобменное вещество присутствует при концентрации по меньшей мере 10% масс./об. общей гемостатической композиции, соотношение между анионобменным веществом и кальцием в гемостатической композиции лежит в диапазоне от 1:5 до 1:70. В некоторых вариантах осуществления, соотношение составляет приблизительно 1:34.
В соответствии с некоторыми вариантами осуществления, анионобменное вещество присутствует при концентрации 1–99% масс./об. общей гемостатической композиции, необязательно, при концентрации 5–15% масс./об. общей гемостатической композиции, такой как, например, 5%, 6%, 7%, 8%, 9%, 10%, 11%, 12%, 13% 14% или 15%.
В соответствии с некоторыми вариантами осуществления, положительно заряженные группы обеспечивают с помощью основания, выбранного из группы, состоящей из сильного основания (такого как содержащее четвертичные аминогруппы), слабого основания (такого как содержащее аминогруппу, выбранную из группы, состоящей из первичной аминогруппы, вторичной аминогруппы, третичной аминогруппы и их комбинации) и их комбинации.
В соответствии с некоторыми вариантами осуществления, слабое основание содержит диэтиламиноэтиловые (ДЭАЭ) группы.
В соответствии с некоторыми вариантами осуществления, положительно заряженные группы связывают с матрицей посредством линкера, присутствующего между подложкой матрицы и положительно заряженными группами.
В соответствии с некоторыми вариантами осуществления, матрицу выбирают из группы, состоящей из полисахарида, полипептида (такого как желатин, альбумин сыворотка крупного рогатого скота (АБС) или коллаген или их комбинации), полиакриламида, сополимера акрилатов, полистирола–дивинилбензола, силикагеля и их комбинации.
В соответствии с некоторыми вариантами осуществления, матрица является перекрестно–сшитой, необязательно, ковалентно перекрестно–сшитой. В некоторых подобных вариантах осуществления, матрицу освобождают от ионных поперечных связей.
В соответствии с некоторыми вариантами осуществления, полисахарид выбирают из группы, состоящей из целлюлозы, декстрана, агарозы и их комбинаций.
В соответствии с некоторыми вариантами осуществления, матрица содержит SEPHADEX™ (декстран), SEPHACEL™ (целлюлоза) или TOYOPEARL™ (гидроксилированный метакриловый полимер) или их комбинации.
В соответствии с некоторыми вариантами осуществления, композиция находится в форме, выбранной из группы, состоящей из суспензии, порошка, пленки, пластыря и жидкости. В соответствии с некоторыми подобными вариантами осуществления, в которых композиция находится в форме суспензии или жидкости, композиция дополнительно содержит фармацевтически приемлемый носитель.
В соответствии с некоторыми вариантами осуществления, соль, применяемая в настоящем документе, представляет собой положительный двухвалентный катион.
В соответствии с некоторыми вариантами осуществления способа, композиции для применения, применения или гемостатической композиции, раскрытых в настоящем документе, кальций присутствует в гемостатической композиции в виде соли кальция, такой как хлорид кальция, ацетат кальция, лактат кальция, оксалат кальция, карбонат кальция, глюконат кальция, фосфат кальция, глицерофосфат кальция или их комбинации. В некоторых вариантах осуществления, соль кальция представляет собой хлорид кальция, которая, необязательно, присутствует в виде раствора, дополнительно, необязательно, при концентрации от 1 до 100 мM. В некоторых подобных вариантах осуществления, кальций, который присутствует в гемостатической композиции, представляет собой хлорид кальция.
В соответствии с некоторыми вариантами осуществления способа, композиции для применения, применения или гемостатической композиции, раскрытых в настоящем документе, гемостатическая композиция практически освобождена от всех белков каскада свертывания крови.
В соответствии с некоторыми вариантами осуществления, матрицу освобождают от следующих полианионных полимеров: альгинатов и/или гиалуронов.
В соответствии с некоторыми вариантами осуществления, матрицу освобождают от одного или более перекрестно–сшиваемых полианионных полимеров, выбранных из группы, состоящей из полистиролсульфоната (такого как полистиролсульфонат натрия), полиакрилата (такого как полиакрилат натрия), полиметакрилата (такого как полиметакрилат натрия), поливинилсульфата (такого как поливинилсульфат натрия), полифосфата (такого как полифосфат натрия), йота–каррагинана, каппа–каррагинана, геллановой камеди, карбоксилметилцеллюлозы, карбоксилметилагарозы, карбоксилметилдекстрана, карбоксилметилхитина, карбоксилметилхитозана, полимера, модифицированного карбоксилметиловой группой, альгината (такого как альгинат натрия), полимера, содержащего множество карбоксилатных групп, ксантановой камеди и их комбинаций.
В соответствии с некоторыми вариантами осуществления, полимеры матрицы не модифицируют путем добавления карбоксиметильных (КМ) групп.
В соответствии с некоторыми вариантами осуществления, биосовместимый полимер модифицируют с помощью диэтиламиноэтильных (ДЭАЭ) групп, чтобы получить катионные функциональная группы, для того, чтобы стать поликатионным полимером.
В соответствии с некоторыми вариантами осуществления, поликатионный полимер выбирают из группы, состоящей из хитозана (такого как хлорид хитозана), хитина, диэтиламиноэтил–декстрана, диэтиламиноэтил–целлюлозы, диэтиламиноэтил–агарозы, диэтиламиноэтил–альгината, полимера, модифицированного диэтиламиноэтильной группой, полимера, содержащего множество протонированных аминогрупп и полипептида, имеющего среднюю изоэлектрическую точку остатка выше 7, и их комбинаций. Предпочтительно, поликатионный полимер представляет собой диэтиламиноэтил–декстран (ДЭАЭ–декстран).
В соответствии с некоторыми вариантами осуществления способа, композиции для применения, применения или гемостатической композиции, раскрытых в настоящем документе, матрицу освобождают от альгиновой кислоты и пектиновой кислоты.
В соответствии с аспектом некоторых вариантов осуществления настоящего изобретения, обеспечивают гемостатическую композицию, содержащую диэтиламиноэтил (ДЭАЭ), связанный с матрицей; и соль кальция.
В соответствии с аспектом некоторых вариантов осуществления настоящего изобретения, обеспечивают способ получения гемостатической композиции, включающий получение анионобменного вещества с помощью ковалентного связывания по меньшей мере одной положительно заряженной группы с перекрестно–сшитой матрицей; и добавления соли кальция к указанному анионобменному веществу.
В соответствии с дополнительным аспектом подобных вариантов осуществления настоящего изобретения, обеспечивают гемостатическую композицию, получаемую способом, раскрытым в настоящем документе.
В соответствии с некоторыми вариантами осуществления способа, композиции для применения, применения или гемостатической композиции, раскрытых в настоящем документе, гемостатическая композиция практически лишена всех биологических кровоостанавливающих средств, то есть освобождена от всех белковых компонентов каскада свертывания крови, а именно фибриногена, фибрина, фактора V, фактора Va, фактора VII, фактора VIIa, фактора VIII, фактора VIIIa, фактора IX, фактора IXa, фактора X, фактора Xa, фактора XIa, фактора XI, фактора XII, фактора XIIa, тканевого фактора (ТФ) и тромбина и протромбиназного комплекса, протромбина и фактора Виллебранда, теназного комплекса, высокомолекулярного кининогена (ВМК), прокалликреина, калликреина, тромбопластина.
В соответствии с некоторыми вариантами осуществления способа, композиции для применения, применения или гемостатической композиции, раскрытых в настоящем документе, гемостатическая композиция практически освобождена от всех белков каскада свертывания крови (таких как тромбин, протромбин и фибриноген).
В некоторых вариантах осуществления, анионобменное вещество содержит матрица (также называемые «подложка», «подкладка», «основа», «базовые гранулы» или «смола»), которая может быть твердой или полутвердой, необязательно в форме гранул, с которой связана одна или более положительно заряженных групп.
Преимущественно, матрица способна поддерживать давление, которое обычно оказывается во время хирургического вмешательства при использовании вспомогательных материалов, для остановки кровотечения без разрушения.
В некоторых вариантах осуществления, матрица содержит перекрестно–сшитый полимер. В некоторых вариантах осуществления, твердый или полутвердый материал матрицы не растворяется и не разрушается, пока не будет достигнут гемостаз (по меньшей мере через 1 минуту после нанесения гемостатической композиции).
В соответствии с некоторыми вариантами осуществления, полимер, из которого образована матрица, является нерастворимым в воде и является, предпочтительно, пористым, имеющим эксклюзионный предел по меньшей мере 20 кДа.
В соответствии с некоторыми вариантами осуществления, матрица, когда подвергается физическому сдавливанию рукой, не разрушается.
Как применяют в настоящем документе, термин «положительно заряженные группы» соответствует молекуле, содержащей химические группы, которые несут положительный заряд в диапазоне рН от 2,0 до 10, такие как аммоний, алкиламмоний, диалкиламмоний, триалкиламмоний, четвертичный аммоний, диэтиламиноэтильные (ДЭАЭ), диметиламиноэтильные (ДМАЭ), триэтиламиноэтильные, триметиламиноэтильные, алкильные группы, функциональные амино группы (например, NR2H+), диэтил–(2–гидроксипропил)аминоэтильные, триметиламино–гидроксипропильные и их комбинации.
В другом варианте осуществления, анионобменное вещество имеет несколько значений pKa, лежащих в диапазоне от 6 до 14. В дополнительном варианте осуществления, анионобменное вещество имеет отдельное значение pKa выше 9.
В соответствии с некоторыми вариантами осуществления, анионобменное вещество содержит ДЭАЭ, связанный с любой матрицей, о которой известно, что она обладает гемостатическими свойствами, для увеличения гемостатической эффективности матрицы. Примеры подходящих матриц включают, без ограничения этим, желатин, целлюлозу, коллаген и крахмал.
В соответствии с некоторыми вариантами осуществления, гемостатическая композиция содержит смесь, по меньшей мере, анионобменного вещества и кальция. Термин «смесь» предназначен для обозначения любой формы смеси, гомогенной или негомогенной, по меньшей мере, анионобменного вещества и кальция. Смесь может необязательно дополнительно содержать другие ингредиенты.
В соответствии с некоторыми вариантами осуществления, смесь является по существу свободной или освобожденной от любого белкового компонента каскада свертывания крови (т.e. подобные компоненты присутствуют в композиции при концентрации менее 0,1% об./об. общей композиции), например, смесь может быть по существу свободной или освобожденной от тромбина и фибриногена.
В соответствии с некоторыми вариантами осуществления, смесь представляет собой суспензию, порошок или жидкую смесь.
В соответствии с некоторыми вариантами осуществления, смесь обеспечивают в замороженном состоянии, так что перед применением продукт оттаивают и доводят до комнатной температуры (т.e. в диапазоне 15–40 °C), в котором смесь находится в своем пригодном для применения состоянии.
В соответствии с некоторыми вариантами осуществления, композиция, раскрытая в настоящем документе, останавливает кровотечение раны в пределах 1 минуты.
Как применяют в настоящем документе, термин «кровоостанавливающее средство» или «гемостатическая композиция» соответствует материалу или композиции, которая функционирует путем связывания крови в сгусток, т.e. индуцирует гемостаз. Обычно, кровоостанавливающее средство повышает коагуляцию крови.
В другом варианте осуществления, термин «индуцирует гемостаз», по отношению к композиции, соответствует композиции, которая вызывает свертывание крови путем активации факторов свертывания, таких как протромбин, что приводит к прекращению кровотечения или снижению интенсивности кровотечения.
Как применяют в настоящем документе, термин «останавливает кровотечение» или «прекращение кровотечения», по отношению к композиции, соответствует композиции, которая, при накладывании на область раны, приводит к отсутствию кровотечения, например, по шкале от 0 (отсутствие кровотечения) до 5, как описано в разделе МАТЕРИАЛЫ И СПОСОБЫ ниже.
Как применяют в настоящем документе, термин «снижение интенсивности кровотечения» (также называемый в настоящем документе «гемостатической эффективностью») соответствует разности между исходной интенсивностью кровотечения и интенсивностью кровотечения после нанесения.
Как применяют в настоящем документе, термин «исходная интенсивность кровотечения» соответствует интенсивности кровотечения, которую оценивают сразу после образования раны и до нанесения композиции, например, по шкале от 0 до 5, как описано в разделе МАТЕРИАЛЫ И СПОСОБЫ ниже.
Как применяют в настоящем документе, термин «интенсивность кровотечения после нанесения» в течение определенного времени сдавливания соответствует интенсивности кровотечения, которую оценивают сразу после нанесения композиции и по прошествии времени сдавливания, например, по шкале от 0 до 5, как описано в разделе МАТЕРИАЛЫ И СПОСОБЫ ниже.
Гемостатическая эффективность композиции может оцениваться в терминах времени сдавливания, при накладывании на кровоточащую рану.
Как применяют в настоящем документе, термин «время сдавливания» соответствует времени, в течение которого на кровоточащую рану после нанесения композиции осуществляют сдавливание рукой. Обычно, это усилие равно силе, обычно оказываемой хирургом при использовании вспомогательных продуктов для достижения гемостаза. В некоторых вариантах осуществления, в которых не оказывают сдавливание, время сдавливания упоминают как равное 0 секунд.
В некоторых вариантах осуществления, время сдавливания составляет приблизительно от 8 до 12 минут. В некоторых вариантах осуществления, в проблемном кровотечении, время сдавливания составляет приблизительно 5 минут. В некоторых вариантах осуществления, в кровотечении, встречающемся в общехирургической операции, время сдавливания составляет приблизительно от 1 до 2 минут. «Проблемное кровотечение» определяют как геморрагия класса III и выше, в соответствии с классификацией ВОЗ. Обычно, геморрагия класса III влечет за собой потерю 30–40% объема циркулирующей крови. Типичные симптомы включают: падение кровяного давления пациента, увеличение частоты сердечных сокращений, периферическую гипоперфузию (шок).
Не желая быть связанными какой–либо одной теорией, изобретатели выдвигают гипотезу, что когда композицию, как раскрывают в настоящем документе, накладывают на кровоточащую рану или область, тромбин генерируется in–situ. Неожиданно было обнаружено, что это генерирование тромбина in–situ происходит в достаточной степени и с достаточной для достижения гемостаза скоростью.
Преимущественно, присутствие физической матрицы позволяет легко наносить гемостатическую композицию на место кровотечения, необязательно, при сдавливании. Более того, матрица сама по себе может способствовать коагуляции путем захвата тромбоцитов, аналогично окисленной восстановленной целлюлозе (ОВЦ).
Как показано в разделе «Примеры» ниже, было обнаружено, что матрица является необходимым условием для гемостатических возможностей положительно заряженной функциональной группы, такой как ДЭАЭ. Обычно, матрица должна быть такой природы, чтобы она не растворялась при исходном контакте с жидкостями и поддерживает свою целостность вплоть до достижения гемостаза, например, в течение по меньшей мере 1 минуты, и делает возможным аггрегацию белков крови для концентрирования локально в области раны, что позволяет инициировать каскад коагуляции. Преимущественно, матрица стабильна под давлением, обычно оказываемым хирургом во время общехирургической операции для достижения гемостаза. Преимущественно, природа матрицы такова, что она распространяется на и/или в пределах раны после нанесения, необязательно, с применением сдавливания.
Согласно изобретению было обнаружено, что разные типы Sephadex и коммерчески доступное кровоостанавливающее средство на основе желатина не способны остановить кровотечение (в модели кровотечения печени), т.e. не наблюдается снижения интенсивности кровотечения.
Различные типы Sephadex при включении одного и того же основного полимера, т.e. перекрестно–сшитого декстрана, обеспечиваемого в виде порошков, из которых получают суспензии, неожиданно уменьшал кровотечение.
Кроме того, после нанесения Sephadex ДЭАЭ, с селезенкой осуществляют манипуляции вручную путем складывания органа с двух сторон и повторное кровотечение не происходит.
Было установлено, что в то время, как коммерчески доступное кровоостанавливающее средство на основе желатина не способно остановить кровотечение по прошествии времени сдавливания в 60 секунд, ДЭАЭ SEPHADEX™ A–50 10% (масс./об.) успешно останавливает кровотечение даже спустя короткого времени сдавливания в 30 секунд. Также было обнаружено, что композиция, содержащая анионобменное вещество, такое как ДЭАЭ, связанный с матрицей, вместе с солью кальция, приводит к полному гемостазу.
Эти композиции по существу приводят к полному гемостазу независимо от конкретной используемой матрицы.
Также было обнаружено, что композиция, содержащая анионобменное вещество, такое как ДЭАЭ, связанный с такой матрицей, как SEPHADEX™, SEPHACEL™ и TOYOPEARL™ (декстран, целлюлоза и гидроксилированный метакриловый полимер, соответственно), вместе с солью кальция, приводит к полному гемостазу.
Более конкретно, было обнаружено, что ДЭАЭ Sephadex в CaCl2 способен прекратить кровотечение спустя 60 и 30 секунд сдавливания.
Было обнаружено, что для снижения интенсивности кровотечения может быть применено нанесение ДЭАЭ SEPHADEX™ A–50 (8% масс./об.) без сдавливания.
Гемостатические возможности композиции, содержащей ДЭАЭ Sephadex (такие как ДЭАЭ SEPHADEX™ A–50) и соль кальция, как было обнаружено, демонстрируют эффективность, аналогичную таковой коммерчески доступного кровоостанавливающего средства на основе желатина с тромбином, например, при применении такого же времени сдавливания (такого как 30 секунд или 10 секунд сдавливания). Тем не менее, гемостатическая возможность кровоостанавливающего средства, основанного на анионобменном веществе, содержащем ДЭАЭ, связанный с матрицей, и соль кальция, по существу превосходит таковую коммерчески доступного кровоостанавливающего средства на основе желатина в отсутствие такого биологически активного компонента, как тромбин.
Согласно изобретению было установлено, что композицию, содержащую ДЭАЭ Sephadex, получают с NaCl, но отсутствие соли кальция не снижает интенсивность кровотечения.
Результаты показывают, что применение композиции, содержащей ДЭАЭ группы, связанные с матрицей, в присутствие соли кальция эффективно достигает гемостаза.
Результаты также показывают, что время сдавливания от 30 до 60 секунд после нанесения ДЭАЭ Sephadex в присутствие соли кальция приводит к полному гемостазу.
Время гемостаза (TTH) нормальной плазмы в присутствие кальция (например, измеренное с помощью факторов свертывания крови) составляет приблизительно 200 секунд. В то время как TTH нормальной плазмы в присутствие кальция и анионобменного вещества, в соответствии с изобретением, лежит в диапазоне приблизительно от 10 до 180 секунд, например, в диапазоне приблизительно от 10 до 60 секунд, в диапазоне приблизительно от 10 до 30 секунд, в диапазоне приблизительно от 15 до 60 секунд, в диапазоне приблизительно от 15 до 30 секунд и в диапазоне приблизительно от 30 до 60 секунд. В одном из вариантов осуществления, TTH составляет около 30 секунд.
В соответствии с изобретением, было показано, что анионобменное вещество, такое как ДЭАЭ, связанный с матрицей, вместе с солью кальция обеспечивает полный гемостаз. Этот результат был получен независимо от используемой матрицы. Результаты сопоставимы с таковыми, полученными при использовании коммерчески доступного кровоостанавливающего средства, такого как желатин вместе с тромбином.
Было обнаружено, что ЧАЭ SEPHADEX™ вместе с солью кальция снижает кровотечение.
Композиция, освобожденная от соли кальция, и/или матрица не имеют влияние на интенсивность кровотечения.
Эти результаты с ДЭАЭ и ЧАЭ предполагают, что композиция, содержащая анионобменное вещество, связанное с матрицей, и содержащая соль кальция, является эффективной в качестве кровоостанавливающего средства.
Гемостатические возможности ДЭАЭ, связанного с перекрестно–сшитым полимером, в присутствие соли кальция, дополнительно подтверждаются более сложной моделью проблемного кровотечения, модифицированной по сравнению с раскрытой в Holcomb JB, Pusateri AE, Harris RA, et al. (Effect of dry fibrin sealant dressings versus gauze packing on blood loss in grade V liver injuries in resuscitated swine. J Trauma. 1999; 46:49 –58), которая включена в настоящую заявку посредством ссылки во всей своей полноте.
Было показано, что ДЭАЭ, связанный с перекрестно–сшитой матрицей в соответствии с изобретением, был успешным в достижении полного гемостаза in–vivo в модели гепаринизированного круглого перфорированного отверстия в селезенке свиньи, тогда как ДЭАЭ, не связанный с матрицей, не способен снижать интенсивность кровотечения.
Плотность (т.e. присутствие) положительно заряженных групп, которые связаны с матрицей, как раскрыто в настоящем документе, как показано, имеют важное значение для достижения гемостаза. Заряды на матрице могут преимущественно присутствовать при плотности, которая является достаточной для достижения гемостаза в соответствии с изобретением.
Согласно изобретению было обнаружено, что не все оцененные положительные заряды обеспечивают такой же уровень гемостатической эффективности. Поэтому для того, чтобы оценить плотность заряда и тип заряда, можно провести анализ с целью убедиться в наличии оптимального диапазона плотности.
Например, синтезированная матрица может быть мономеризована, например, путем кислого гидролиза, и нанесена на аналитический инструмент (например, жидкостной хроматографии высокого давления, газовой хроматографии), способный разделить мономеры, основываясь на разнице зарядов, которые они несут. Таким образом, для оценки плотности заряда на определенной молекуле может быть выполнен анализ.
ПРИМЕРЫ
МАТЕРИАЛЫ И СПОСОБЫ
Таблица 1. Материалы
№ № 17–0043–01
Размер частиц (сухих): 50–150 мкм.
Поставляется в виде порошка и готовится в виде суспензии (жидкотекучий материал) для нанесения путем добавления к порошку 20 мM раствора CaCl2.
№ в кат. 17–0051–01
Размер частиц (сухих): 10–40 мкм.
Поставляется в виде порошка и готовится в виде суспензии для нанесения путем добавления к порошку 20 мM раствора CaCl2.
№ в кат. 17–0180–01
Размер частиц (сухих): 40–120 мкм.
Лиганд (группа катионов): диэтиламиноэтил (ДЭАЭ).
Поставляется в виде порошка и готовится в виде суспензии для нанесения путем добавления к порошку 20 мM растворов CaCl2 или NaCl.
№ в кат. 17–0500–01
Размер частиц: 40–160 мкм.
Лиганд: ДЭАЭ.
Поставляется в виде суспензии в 24% этаноле (об./об.).
Суспензию декантировали, оставляя суспензию в течение 40 минут при комнатной температуре (20 – 25 °C), чтобы частицы могли осесть, затем супернатант удаляли и заменяли на 20 мM раствор CaCl2. Процедуру повторяли 3 раза.
На следующем этапе, суспензию помещали на бумагу для сушки (на 1–2 минуты) для получения суспензии для нанесения.
№ в кат. 0043201
Размер частиц (средний): 65 мкм.
Лиганд: ДЭАЭ.
Поставляется в виде суспензии в 20% этаноле (об./об.).
Получают в виде порошок для нанесения путем высушивания суспензии в течение 12 часов в вакуумной печи при 25 °C, получаемый порошок перемешивали с 10% (об./об.) CaCl2 (добавляли в виде соли).
№ в кат. 17–0240–01
Размер сухих частиц: 40–120 мкм.
Лиганд (группа анионов): Сульфопропил (СП)
Поставляется в виде порошка и готовится в виде суспензии для нанесения путем добавления к порошку 20 мM раствора CaCl2.
№ в кат. 17–0200–01
Размер частиц (сухих): 40–120 мкм.
Лиганд (группа катионов): Диэтил–(2–гидрокси–пропил)аминоэтил (ЧАЭ)
Поставляется в виде порошка и готовится в виде суспензии для нанесения путем добавления к порошку 20 мM раствора CaCl2.
№ в кат. 21097
№ в кат. 471321
Чистота (GC) > 99,50%
Концентрация желатина 11% масс./об.
Концентрация желатина 11% масс./об.
Конечная концентрация тромбина: 250 МЕ/мл.
Конечная концентрация ионов кальция: 10 мМ.
Лиганд: ДЭАЭ.
Средняя молекулярная масса Mw: 450000–550000.
Поставляется в виде порошка
Получали в виде порошка для нанесения, смешивая с 10% (об./об.) CaCl2 (добавляли в виде соли).
In–vivo модель круглого перфорированного отверстия.
Модель была основана на модель, предварительно описанная в WO 2012087774 A1, с некоторыми изменениями. Эта модель оценивает эффективность исследуемой композиции в снижении кровотечения in–vivo (гемостатическую эффективность).
Первоначально, освобождали орган, на котором исследовали гемостаз, а затем подвергали его одному биопсийному перфорированному отверстию (диаметр 4 мм, глубина 2 мм в Примере 1 и 5; диаметр 4 мм, глубина 2 мм или диаметр 8 мм, глубина 3 мм в Примере 2, второй эксперимент). Удаляли ткань из перфорированного отверстия. Оценивали исходную интенсивность кровотечения («исходное кровотечение») по шкале от 0 до 5, где: 0 – «Без кровотечения»; 1 – «Подкровливание»; 2 – «Очень легкое кровотечение»; 3 – «Легкое кровотечение»; 4 – «Умеренное кровотечение»; 5 – «Тяжелое кровотечение».
Для оценки гемостатической эффективности каждой исследуемой композиции, примерно 0,5 мл суспензии или 100 мг порошок (для композиций, которые накладывали в виде порошка) накладывали на кровоточащую рану перфорированного отверстия. Композиции, которые накладывали в виде суспензии, накладывали в рану с помощью шприца; композиции, которые накладывали в виде порошка, накладывали непосредственно на рану.
После нанесения композиций, сдавливание рукой, необязательно, осуществляли в течение определенного времени (также называемого в настоящем документе «временем сдавливания») с применением марли. После сдавливания, марлю удаляли и оценивали интенсивность кровотечения непосредственно после нанесения и спустя дополнительную 1 минуту, либо качественно (да/нет) или количественно (используя шкалу от 0 до 5, как описано выше).
Исследуемую композицию, которая снижает интенсивность кровотечения (которое начинается по меньшей мере с 3) до 1 (подкровливание) или 0 (без кровотечения), считали эффективной. Для качественного определения, присутствие или отсутствие кровотечения проверяли визуально, а также при помощи кусочка марли, прижатого к краю обрабатываемой области.
Модель гепаринизированного биопсийного перфорированного отверстия считается подходящей моделью для оценивания сильного гемостаза.
Время гемостаза (TTH) оценивали после нанесения композиция. Время гемостаза (TTH) оценивали после нанесения композиция. TTH определяли как временной интервал от нанесения композиции до наблюдения полного гемостаза (оценка 0).
Пример 1. Гемостатические свойства композиции, содержащей анионобменное вещество и соль кальция в in–vivo модели селезенки
Исходное оценивание гемостатических свойств композиции, содержащей анионобменное вещество и соль кальция, осуществляли в in–vivo модели гепаринизированного круглого перфорированного отверстия в селезенке свиньи как описано выше, с применением ДЭАЭ, ковалентно связанным с Sephadex (ДЭАЭ–SEPHADEX™) в качестве анионобменного вещества. В этом эксперименте, размер перфорированного отверстия составлял 4 мм в диаметре, 2 мм в глубину. После нанесения применяли время сдавливания 30 или 60 секунд. ДЭАЭ SEPHADEX™ A–50 исследовали в двух концентрациях. В этом эксперименте, интенсивность кровотечения после нанесения оценивали качественно.
Следующие композиции (см. подробности в Таблице 1 выше) оценивали на их гемостатическую эффективность:
1. ДЭАЭ SEPHADEX™ A–50, полученный в виде 10% масс./об. суспензии в 20 мM растворе CaCl2 (0,5 мл содержит 50 мг ДЭАЭ SEPHADEX™ A–50) (время сдавливания 30 секунд);
2. ДЭАЭ SEPHADEX™ A–50, полученный в виде 6,6% масс./об. суспензии в 20 мM растворе CaCl2 (0,5 мл содержит 33 мг ДЭАЭ SEPHADEX™ A–50) (время сдавливания 60 секунд);
3. SEPHADEX™ G–75 Superfine, полученный в виде 10% масс./об. суспензии в 20 мM растворе CaCl2 (0,5 мл содержит 50 мг на SEPHADEX™ G–75 Superfine) (время сдавливания 60 секунд);
4. SEPHADEX™ G–50 Medium, полученный в виде 10% масс./об. суспензии в 20 мM растворе CaCl2 (0,5 мл содержит 50 мг SEPHADEX™ G–50 Medium) (время сдавливания 60 секунд);
5. Коммерчески доступное кровоостанавливающее средство на основе желатина получали в виде суспензии (0,5 мл содержит 55 мг желатина) (время сдавливания 60 секунд).
Все четыре образца SEPHADEX™ содержат такой же основной полимер, перекрестно–сшитый декстран. Композиции 1–4 обеспечивали в виде порошков, из которых готовили суспензии, как описано в Таблице 1 выше. Коммерчески доступное жидкотекучее кровоостанавливающее средство на основе желатина применяли в качестве контроля.
Было обнаружено, что SEPHADEX™ G–50 Medium, SEPHADEX™ G–75 Superfine и коммерчески доступное кровоостанавливающее средство на основе желатина не способны для остановки кровотечение, т.e. не наблюдали снижение интенсивности кровотечения (результаты не показаны).
Неожиданно, ДЭАЭ SEPHADEX™ A–50 снижает кровотечение при всех исследуемых временах сдавливания. После нанесения Sephadex ДЭАЭ™ A–50, с селезенкой осуществляли манипуляции вручную путем складывания органа с двух сторон. Повторного кровотечения не происходили ни при одной из испытанных концентраций и после двух различных времен сдавливания (результаты не показаны). Поскольку гемостаз происходил только в матрице с добавлением групп ДЭАЭ, был сделан вывод, что гемостатическое влияние обусловлено наличием групп ДЭАЭ.
Фиг. 1 показывает приводимый в качестве примера результат, полученный с применением ДЭАЭ SEPHADEX™ A–50 10% (масс./об.) и коммерчески доступного желатина. Как показано на фигуре, коммерчески доступное кровоостанавливающее средство на основе желатина не способно остановить кровотечение по прошествии времени сдавливания 60 секунд, в то время как ДЭАЭ SEPHADEX™ A–50 10% (масс./об.) успешно останавливает кровотечение даже после более короткого времени сдавливания в 30 секунд.
Пример 2. Влияние композиций, содержащих анионобменное вещество и кальций на гемостаз в in–vivo модели печени свиньи
В следующем Примере влияние на гемостаз каждого из компонентов композиции, содержащей анионобменное вещество и соль кальция, оценивали, отдельно и в комбинации, с применением in–vivo модели гепаринизированного круглого перфорированного отверстия в печени свиньи, как описано выше. Этот эксперимент определяет, какой из компонентов композиции является необходимым для достижения гемостаза.
Получение каждой композиция описано в Таблице 1 выше. Время сдавливания приведено в Таблице 2 ниже. В этом эксперименте, исходная интенсивность кровотечения и интенсивность кровотечения после нанесения оценивали по шкале 0–5.
Оценивали следующие композиции:
1. ДЭАЭ SEPHADEX™ A–50, полученный в виде 8% масс./об. суспензии в 20 мM растворе CaCl2 (0,5 мл содержит 40 мг ДЭАЭ SEPHADEX™ A–50);
2. Коммерчески доступное кровоостанавливающее средство на основе желатина, полученное в виде суспензии (0,5 мл содержит 55 мг желатина);
3. Коммерчески доступное кровоостанавливающее средство на основе желатина с тромбином, полученное в виде суспензии (0,5 мл содержит 55 мг желатина);
4. SEPHADEX™ G–50 Medium, полученный в виде 14% масс./об. суспензии в 20 мM растворе CaCl2 (0,5 мл содержит 70 мг SEPHADEX™ G–50 Medium).
5. ДЭАЭ SEPHADEX™ A–50, полученный в виде 8% масс./об. суспензии в 20 мM растворе NaCl (0,5 мл содержит 40 мг ДЭАЭ SEPHADEX™ A–50);
6. СП SEPHADEX™ C–50, полученный в виде 8% масс./об. суспензии в 20 мM растворе CaCl2 (0,5 мл содержит 40 мг SP SEPHADEX™ C–50);
7. ЧАЭ SEPHADEX™, полученный в виде 8% масс./об. суспензии в 20 мM растворе CaCl2 (0,5 мл содержит 40 мг ЧАЭ SEPHADEX™);
8. ДЭАЭ SEPHACEL™, полученный в виде суспензии (100 мг); и
9. TOYOPEARL DEAE–650M™, полученный в форме порошка (100 мг).
Время сдавливания после нанесения каждой исследуемой композиции и результаты интенсивности кровотечения приведены в Таблице 2. Снижение интенсивности кровотечения рассчитывали путем вычитания интенсивности кровотечения после нанесения из исходной интенсивности кровотечения.
Таблица 2. Влияние исследуемых композиций на снижение интенсивности кровотечения (модель кровотечения печени)
(8% масс./об.)
* Рассчитывали путем вычитания интенсивности кровотечения после нанесения из исходной интенсивности кровотечения.
Таблица 3: Влияние исследуемых композиций на снижение интенсивности кровотечения (модель кровотечения печени)
(100 г суспензии)
(100 мг порошка)
(8% масс./об.)
(8% масс./об.)
с 20 мM NaCl
(14% масс./об.)
(8% масс./об.)
* Рассчитывали путем вычитания интенсивности кровотечения после нанесения из исходной интенсивности кровотечения.
В общем, можно видеть, что композиция, содержащая анионобменное вещество, такое как ДЭАЭ, связанный с матрицей, вместе с солью кальция, приводит к полному гемостазу (смотри Таблицу 2 для ДЭАЭ SEPHADEX™ A–50, ДЭАЭ SEPHACEL™ и TOYOPEARL DEAE–650M™, все содержат соль кальция). Эти композиции по существу приводят к полному гемостазу независимо от конкретной используемой матрицы. Например, такие матрицы, как SEPHADEX™, SEPHACEL™ и TOYOPEARL™ (декстран, целлюлоза и гидроксилированный метакриловый полимер, соответственно) имели схожее влияние на снижение интенсивности кровотечения.
Более конкретно, ДЭАЭ SEPHADEX™ A–50 8% масс./об. в CaCl2 способен прекратить кровотечение спустя 60 и 30 секунд сдавливания. Результаты также показывали, что для снижения интенсивности кровотечения может быть применено нанесение ДЭАЭ SEPHADEX™ A–50 (8% масс./об.) без сдавливания (Таблица 2).
Гемостатические возможности композиции, содержащей ДЭАЭ SEPHADEX™ A–50 и соль кальция, демонстрировали эффективность, схожую с таковой коммерчески доступного кровоостанавливающего средства на основе желатина с тромбином, при применении такого же время сдавливания (30 секунд), и даже только с 10 секундами сдавливания. Тем не менее, гемостатическая возможность кровоостанавливающего средства, основанного на анионобменном веществе, содержащем ДЭАЭ, связанный с матрицей, и соль кальция, по существу превосходит таковую коммерчески доступного кровоостанавливающего средства на основе желатина в отсутствие такого биологически активного компонента, как тромбин.
Как показано в Таблице 3, композицию, содержащую ДЭАЭ SEPHADEX™, получали с NaCl, а отсутствие соли кальция не продуцировало снижение интенсивности кровотечения, так что можно сделать вывод, что образец не был эффективным в остановке кровотечения.
При оценивании воздействия ионобменной группы на гемостатическую возможность, было показано, что SP SEPHADEX™, содержащий анионную группу, сульфопропил (СП) с солью кальция, не снижает интенсивность кровотечения. Другими словами, материал с отрицательной (СП) группой, вместо положительной (ДЭАЭ) группы, был не эффективным в качестве кровоостанавливающего средства.
Дополнительно было показано, что четвертичный аминоэтил, ЧАЭ SEPHADEX™ с солью кальция, был способным снижать интенсивность кровотечения.
Также было показано, как в Примере 1, что матрица сама по себе, в отсутствие функциональной группы (SEPHADEX™ G–50 с солью кальция, но без ДЭАЭ групп), не имела гемостатической эффективности.
Результаты показывают, что применение композиции, содержащей ДЭАЭ группы, связанные с матрицей, в присутствие соли кальция эффективно достигает гемостаза.
Результаты также показывали, что время сдавливания 30 и 60 секунд после нанесения ДЭАЭ SEPHADEX™ A–50 (8% масс./об.) приводит к полному гемостазу и поэтому TTH определяли как 30 секунд.
Таким образом, было показано, что анионобменное вещество, такое как ДЭАЭ, связанный с матрицей, вместе с солью кальция обеспечивает полный гемостаз. Этот результат был получен независимо от используемой матрицы. Результаты сопоставимы с таковыми, полученными при использовании коммерчески доступного кровоостанавливающего средства, такого как желатин с тромбином.
Было обнаружено, что ЧАЭ SEPHADEX™ вместе с солью кальция снижает кровотечение.
Композиция, освобожденная от соли кальция, и/или матрица не имеют влияние на интенсивность кровотечения.
Эти результаты предполагают, что композиция, содержащая анионобменное вещество и соль кальция, является эффективной в качестве кровоостанавливающего средства.
Пример 3. Влияние композиций, содержащих анионобменное вещество и соль кальция, на гемостаз в in–vivo модели селезенки свиньи
Предыдущий эксперимент показал, что композиция, содержащая анионобменное вещество, состоящее из ДЭАЭ, связанного с перекрестно–сшитым полимером, и соли кальция, была эффективной в снижении интенсивности кровотечения в in–vivo модель круглого перфорированного отверстия в селезенке.
В этом эксперименте, гемостатическую активность композиции подкрепляли другой моделью, in–vivo моделью гепаринизированного круглого перфорированного отверстия в селезенке свиньи (осуществленную таким образом, как описано выше). В отношении интенсивности кровотечения, эта модель была более тяжелой, чем предыдущая модель. Время сдавливания для всех образцов составляло 30 секунд. Для образцов 1–6, размер перфорированного отверстия составлял 4 мм в диаметре, 2 мм в глубину. Для образцов 7–9, размер перфорированного отверстия составлял 8 мм в диаметре, 3 мм в глубину. Обычно, тяжесть кровотечения увеличивалась с увеличением размера перфорированного отверстия и/или добавлением гепарина.
Следующие образцы исследовали на их гемостатическую эффективность:
1. ДЭАЭ SEPHADEX™ A–50, полученный в виде 8% масс./об. суспензии в 20 мM растворе CaCl2 (0,5 мл содержит 40 мг ДЭАЭ SEPHADEX™ A–50);
2. ДЭАЭ SEPHADEX™ A–50, полученный в виде 10% масс./об. суспензии в 20 мM растворе CaCl2 (0,5 мл содержит 50 мг ДЭАЭ SEPHADEX™ A–50), исследуемая в двух экземплярах;
3. Коммерчески доступное кровоостанавливающее средство на основе желатина, полученное в виде суспензии (0,5 мл содержит 55 мг желатина);
4. Коммерчески доступное кровоостанавливающее средство на основе желатина с тромбином, полученное в виде суспензии (0,5 мл содержит 55 мг желатина);
5. SEPHADEX™ G–50 Medium, полученный в виде 14% масс./об. суспензии в 20 мM растворе CaCl2 (0,5 мл содержит 70 мг SEPHADEX™ G–50 Medium);
6. ДЭАЭ SEPHADEX™ A–50, полученный в виде 8% масс./об. суспензии в 20 мM растворе NaCl (0,5 мл содержит 40 мг ДЭАЭ SEPHADEX™ A–50);
7. Чистый ДЭАЭ;
8. CaCl2 (20 мM); и
9. ДЭАЭ с CaCl2.
Было отмечено, что ДЭАЭ SEPHADEX™ A–50 8% и 10% масс./об. в присутствие CaCl2 были в состоянии снизить интенсивность кровотечения (наблюдали снижение на приблизительно 2–3 пунктов), с более высоким процентом, обеспечивающим лучшие результаты. В этой модели, гемостатические возможности Sephadex ДЭАЭ ™ A–50 превосходили те, которые имеют кровоостанавливающее средство с или без тромбина на основе коммерчески доступного желатина.
Как показано для эксперимента с печенью, и SEPHADEX™ G–50 сам по себе, и ДЭАЭ SEPHADEX™ с солью натрия не способны снизить интенсивность кровотечения.
Чистый ДЭАЭ не способен снизить интенсивность кровотечения. Поэтому был сделан вывод, что когда ДЭАЭ не связан с перекрестно–сшитым полимером, он не функционирует в качестве эффективного кровоостанавливающего средства (т.e. не происходит значительное снижение кровотечения). Добавление соли кальция не улучшает гемостатические возможности ДЭАЭ в отсутствие матрицы, как можно видеть для композиции, содержащей ДЭАЭ с композицией соли кальция (0 пунктов снижения). Также было продемонстрировано, что одна соль кальция сама по себе не обладает гемостатическими возможностями.
Этот эксперимент дополнительно подтверждает предыдущий эксперимент и показывает, что для продемонстрированной гемостатической эффективности требовалось сочетание соли кальция, групп ДЭАЭ и матрицы.
Пример 4. Гемостатические свойства раствора, содержащего анионобменное вещество и соль кальция, в in–vivo в модели проблемного кровотечения селезенки свиньи
В этом Примере, гемостатические возможности ДЭАЭ, связанного с перекрестно–сшитым полимером, в присутствие соли кальция, дополнительно исследовали в более сложной модели проблемного кровотечения, модифицированной по сравнению с раскрытой в Holcomb JB, Pusateri AE, Harris RA, et al. (Effect of dry fibrin sealant dressings versus gauze packing on blood loss in grade V liver injuries in resuscitated swine. J Trauma. 1999; 46:49 –58), которая включена в настоящую заявку посредством ссылки во всей своей полноте.
ДЭАЭ SEPHADEX™ A–50, полученный в виде 10% масс./об. суспензии в 25 мM растворе CaCl2. Перфорированное отверстие выполняли с применением специально предназначенного для этих целей устройства (смотри Фиг. 2a), приводящее к X–образной ране, где каждое плечо имеет длину 5,5 см, а центральное отверстие в форме пули имеет 1,5 см в глубину и 9,5 мм в диаметре (Фиг. 2b). Рана представляла собой проблемное кровотечение (такое как пулевая травма).
Приблизительно 20 мл исследуемой композиции накладывали на рану. На область раны осуществляли сдавливание рукой в течение четырех минут. Исследуемая композиция останавливала кровотечение.
Эксперимент осуществляли в трех экземплярах (еще два повтора) и получали схожие результаты.
Если в первом испытании присутствовало недостаточно материала для достижения полного гемостаза, затем накладывали дополнительный материал и оказывали сдавливание в течение дополнительных трех минут. После этого достигали полный гемостаз.
Пример 5. Оценивание требований к матрице
В следующем примере требования к матрице, с которой связан ДЭАЭ, дополнительно оценивали с использованием in–vivo модели гепаринизированного круглого перфорированного отверстия в селезенке свиньи, как описано выше. Получение композиций описано в Таблице 1 выше. Время сдавливания составляло 60 секунд. В этом эксперименте, исходная интенсивность кровотечения и интенсивность кровотечения после нанесения оценивали по шкале 0–5.
ДЭАЭ Dextran 500 представляет собой поликатионное производное Dextran, полученное из декстрана со средней молекулярной массой 500 кДа, в котором цепи декстрана не являются перекрестно–сшитыми.
Оценивали следующие композиции:
1. ДЭАЭ SEPHADEX™ A–50, полученный в виде 10% масс./об. суспензии в 20 мM растворе CaCl2 (0,5 мл содержит 40 мг ДЭАЭ SEPHADEX™ A–50);
2. ДЭАЭ декстран 500, полученный с 10% (об./об.) порошка CaCl2 (100 мг порошка содержали 90 мг ДЭАЭ декстрана и 10 мг CaCl2).
Результаты по интенсивности кровотечения для различных исследуемых композиций приведены в Таблице 4.
Таблица 4: Влияние исследуемых композиций на снижение интенсивности кровотечения в модели кровотечения селезенки
Соль
(10% масс./об.)
100 мг
100 мг
ДЭАЭ, связанный с перекрестно–сшитой матрицей, был успешным в достижении полного гемостаза, тогда как ДЭАЭ не связан с матрицей, не способной снижать интенсивность кровотечения.
Пример 6: Влияние положительно заряженных групп на гемостаз
Плотность (т.e. присутствие) положительно заряженных групп, которые связаны с матрицей, как раскрыто в настоящем документе, как показано, имеют важное значение для достижения гемостаза. Заряды на матрице должны преимущественно присутствовать при плотности, которая является достаточной для достижения гемостаза, как определено выше.
В предыдущих примерах было показано, что не все оцененные положительные заряды обеспечивают такой же уровень гемостатической эффективности. Поэтому для того, чтобы оценить плотность заряда и тип заряда, проводили анализ с целью убедиться в наличии оптимального диапазона плотности.
С этой целью синтезированная матрица мономеризована, например, путем кислого гидролиза, и нанесена на аналитический инструмент (например, жидкостной хроматографии высокого давления, газовой хроматографии), способный разделить, основываясь на разнице зарядов, которые они несут. Таким образом, анализ выполняли для оценки плотности заряда на определенной молекуле.
Следует понимать, что определенные элементы изобретения, которые для ясности раскрыты в контексте отдельных вариантов осуществления, также могут предлагаться в комбинации в одном варианте осуществления. И наоборот, различные элементы изобретения, которые для краткости описаны в контексте одного варианта осуществления, также могут предлагаться по отдельности, или в любой подходящей субкомбинации, или подходящим образом в любом другом описанном варианте осуществления изобретения. Определенные элементы, описанные в контексте различных вариантов осуществления, не должны считаться неотъемлемыми элементами этих вариантов осуществления, если только вариант осуществления не функционирует без этих элементов.
Хотя изобретение описано во взаимосвязи с конкретными вариантами его осуществления, специалисту в данной области будет понятно, что существует множество его альтернативных вариантов, модификаций и вариаций. Соответственно, предполагается, что оно охватывает все такие альтернативные варианты, модификации и вариации, относящиеся к объему прилагаемой формулы изобретения.
Цитирование или обозначение любой ссылки в настоящей заявке не должны пониматься как признание того, что такая ссылка указывает на прототип настоящего изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ГЕМОСТАТИЧЕСКИЙ ПРЕПАРАТ, СОДЕРЖАЩИЙ ЭКСТРАКТ GOLDEN MOSS | 2011 |
|
RU2581918C2 |
| ГЕМОСТАТИЧЕСКАЯ КОМПОЗИЦИЯ | 2016 |
|
RU2741304C2 |
| ГЕМОСТАТИЧЕСКАЯ КОМПОЗИЦИЯ, ВКЛЮЧАЮЩАЯ ГИАЛУРОНОВУЮ КИСЛОТУ | 2005 |
|
RU2369408C2 |
| ГЕМОСТАТИЧЕСКАЯ КОМПОЗИЦИЯ, ВКЛЮЧАЮЩАЯ ГИАЛУРОНОВУЮ КИСЛОТУ | 2009 |
|
RU2486921C2 |
| ГЕМОСТАТИЧЕСКИЕ СПРЕИ И КОМПОЗИЦИИ | 2005 |
|
RU2377022C9 |
| КРОВООСТАНАВЛИВАЮЩИЕ МАТЕРИАЛЫ И УСТРОЙСТВА С ГАЛЬВАНИЧЕСКИМ МАТЕРИАЛОМ В ВИДЕ ЧАСТИЦ | 2012 |
|
RU2628877C2 |
| ГЕМОСТАТИЧЕСКИЕ КОМПОЗИЦИИ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2017 |
|
RU2756891C2 |
| ГЕМОСТАТИЧЕСКАЯ СМЕСЬ КОРОТКИХ И ДЛИННЫХ ВОЛОКОН НА ОСНОВЕ ЦЕЛЛЮЛОЗЫ | 2016 |
|
RU2731371C2 |
| ПРОКОАГУЛЯНТНЫЕ ПЕПТИДЫ, ИХ ПРОИЗВОДНЫЕ И ИХ ПРИМЕНЕНИЕ | 2012 |
|
RU2635510C2 |
| ГЕМОСТАТИЧЕСКИЙ РАСТВОР С ПРОТИВОЛИМФОРЕЙНЫМИ СВОЙСТВАМИ И СПОСОБ ЕГО ПРИГОТОВЛЕНИЯ | 2021 |
|
RU2774582C1 |

Настоящая группа изобретений относится к области медицины, а именно к средствам, используемым для остановки кровотечений. Предложенная гемостатическая композиция содержит анионообменное вещество, содержащее одну или более положительно заряженных групп, связанных с матрицей, и соль кальция, при этом композиция свободна от полианионов. В другом воплощении, получена и описана гемостатическая композиция, включающая: диэтиламиноэтил (ДЭАЭ), связанный с матрицей, и соль кальция, где гемостатическая композиция свободна от полианионов. Также обеспечен способ получения гемостатических композиций. Технический результат: получены и описаны композиции, обладающие улучшенными гемостатическими свойствами. 5 н. и 22 з.п. ф-лы, 2 ил., 4 табл., 6 пр.
1. Композиция, содержащая анионобменное вещество, содержащее одну или более положительно заряженных групп, связанных с матрицей, и соль кальция, для применения в качестве лекарственного препарата для индуцирования гемостаза в области кровотечения, где композиция свободна от полианионов.
2. Композиция по п. 1, отличающаяся тем, что положительно заряженные группы обеспечивают посредством основания, выбранного из группы, состоящей из сильного основания, слабого основания и их комбинации.
3. Композиция по п. 2, отличающаяся тем, что сильное основание содержит четвертичные аминогруппы.
4. Композиция по п. 2, отличающаяся тем, что слабое основание содержит аминогруппу, выбранную из группы, состоящей из первичной аминогруппы, вторичной аминогруппы, третичной аминогруппы и их комбинации.
5. Композиция по п. 2, отличающаяся тем, что слабое основание состоит из диэтиламиноэтильных групп (ДЭАЭ).
6. Композиция по любому из пп. 1-5, отличающаяся тем, что матрицу выбирают из группы, состоящей из алифатического сложного полиэфира, полисахарида, полипептида, полистирола-дивинилбензола, силикагеля и их комбинации.
7. Композиция по любому из пп. 1-6, отличающаяся тем, что матрица является поперечно-сшитой.
8. Композиция по п. 7, отличающаяся тем, что матрица является ковалентно поперечно-сшитой.
9. Композиция по любому из пп. 1-8, отличающаяся тем, что композиция практически свободна от всех белков каскада свертывания крови.
10. Композиция по любому из пп. 1-9, отличающаяся тем, что композиция находится в форме, выбранной из группы, состоящей из суспензии, порошка, пленки, пластыря и жидкости.
11. Композиция по п. 10, отличающаяся тем, что композиция в форме суспензии или жидкости дополнительно содержит фармацевтически приемлемый носитель.
12. Композиция по любому из пп. 1-11, где применение включает приложение давления на композицию, необязательно по направлению к месту кровотечения.
13. Гемостатическая композиция, включающая:
анионобменное вещество, содержащее одну или более положительно заряженных групп, связанных с матрицей;
соль кальция; и
необязательно фармацевтически приемлемый носитель,
где гемостатическая композиция свободна от полианионов.
14. Гемостатическая композиция по п. 13, отличающаяся тем, что положительно заряженные группы обеспечивают посредством основания, выбранного из группы, состоящей из сильного основания, слабого основания и их комбинации.
15. Гемостатическая композиция по п. 14, отличающаяся тем, что сильное основание содержит четвертичные аминогруппы.
16. Гемостатическая композиция по п. 14, отличающаяся тем, что слабое основание содержит аминогруппу, выбранную из группы, состоящей из первичной аминогруппы, вторичной аминогруппы, третичной аминогруппы и их комбинации.
17. Гемостатическая композиция по п. 14, отличающаяся тем, что слабое основание состоит из диэтиламиноэтильных групп (ДЭАЭ).
18. Гемостатическая композиция по любому из пп. 13-17, отличающаяся тем, что матрицу выбирают из группы, состоящей из алифатического сложного полиэфира, полисахарида, полипептида, полистирола-дивинилбензола, силикагеля и их комбинации.
19. Гемостатическая композиция по любому из пп. 13-18, отличающаяся тем, что матрица является поперечно-сшитой.
20. Гемостатическая композиция по п. 19, отличающаяся тем, что поперечно-сшитый полимер является ковалентно поперечно-сшитым.
21. Гемостатическая композиция по любому из пп. 18-20, отличающаяся тем, что полисахарид выбирают из группы, состоящей из целлюлозы, декстрана, агарозы и их комбинаций.
22. Гемостатическая композиция по любому из пп. 13-21, отличающаяся тем, что композиция практически свободна от всех белков каскада свертывания крови.
23. Гемостатическая композиция по любому из пп. 13-22, отличающаяся тем, что композиция находится в форме, выбранной из группы, состоящей из суспензии, порошка, пленки, пластыря и жидкости.
24. Гемостатическая композиция по п. 23, отличающаяся тем, что композиция в форме суспензии или жидкости дополнительно содержит фармацевтически приемлемый носитель.
25. Гемостатическая композиция, включающая:
диэтиламиноэтил (ДЭАЭ), связанный с матрицей; и
соль кальция,
где гемостатическая композиция свободна от полианионов.
26. Способ получения гемостатической композиции, включающий:
получение анионобменного вещества, содержащего одну или более положительно заряженных групп, с помощью ковалентного связывания одной или более положительно заряженных групп с поперечно-сшитой матрицей; и
добавление соли кальция к указанному анионобменному веществу,
где получаемая гемостатическая композиция свободна от полианионов.
27. Гемостатическая композиция, полученная способом по п. 26.
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
| Прибор, замыкающий сигнальную цепь при повышении температуры | 1918 |
|
SU99A1 |
| Способ размножения копий рисунков, текста и т.п. | 1921 |
|
SU89A1 |
| RU 2006131128 A, 10.03.2008. | |||
Авторы
Даты
2021-09-30—Публикация
2017-12-13—Подача