Заявка, рассматриваемая в данный момент, содержит Список последовательностей, который представлялся в формате ASCII посредством системы EFS-Web, и включен путем ссылки в полном объеме в настоящую заявку. Упомянутая копия в формате ASCII, созданная 28 июня 2011 года, называется ETH5623.txt и имеет размер 4.912 байт.
ОБЛАСТЬ ПРИМЕНЕНИЯ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится в общем к реагентам и устройствам для стимуляции гемостаза и материалам для заживления тканей, а конкретнее к синтетическим пептидам, обладающим сильными гемостатическими свойствами и свойствами заживления тканей в сочетании с каркасами, такими как гемостатическими каркасами, основанными на желатине.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Кровь - это жидкая ткань, содержащая эритроциты, лейкоциты, форменные элементы крови и тромбоциты, растворенные в жидкой фазе. Жидкой фазой является плазма, которая содержит кислоты, липиды, растворенные электролиты и белки. Особым белком, пребывающим во взвешенном состоянии в жидкой фазе, является фибриноген. При возникновении кровотечения фибриноген вступает в реакцию с водой и тромбином (энзим) и образует фибрин, вещество, нерастворимое в крови, и образующее сгустки при полимеризации.
При самых различных условиях животные, в том числе люди, могут страдать кровотечениями, связанными с ранами или хирургическими процедурами. В некоторых ситуациях, кровотечение сравнительно слабое, и нормальных функций свертывания крови, дополненных применением простых приемов первой помощи, оказывается достаточно. В иных ситуациях может иметь место существенное кровотечение. В таких ситуациях обычно требуется специализированное оборудование и материалы, а также обученный персонал для оказания необходимой помощи.
Для решения упомянутых выше проблем были разработаны материалы для контроля чрезмерного кровотечения.
Ранее использовались известные материалы, такие как желатин, коллаген, окисленная целлюлоза, тромбин, фибриноген и другие материалы, но каждый из этих материалов имеет свои ограничения к применению. Например, одним из видов коагулирующих материалов, используемых ранее в данной области, являются белки или энзимы, произведенные на основе крови, в том числе фибриноген и/или тромбин, являющиеся дорогими, требующими специальных условий хранения и интенсивной очистки для предотвращения возможности заражения инфекционными заболеваниями, передающимися через кровь.
Гемостатические устройства, содержащие жидкий тромбин, имеют особые требования к обращению для поддержания биологической активности тромбина. Например, жидкий тромбин необходимо охлаждать, чтобы поддерживать его стабильность во время хранения. Опасения вызывает и безопасность, которой требуется уделять внимание, и которая связана с использованием тромбина человеческого или животного происхождения, так как существует риск заражения или иммуногенности. К тому же тромбин и фибриноген, очищенные от человеческой или животной плазмы, очень дороги. Таким образом, выгодной представляется разработка инновационного гемостаза с большей стабильностью при хранении, более низким риском вирусного и другого заражения и более низкой иммуногенностью, который будет дешевле и сможет работать в среде гепаринизированной крови.
Белок человека Тромбоспондин-1 (TSP-1) и родственные белки, как указывается в литературе, принимают участие в ангиогенезе и агрегации тромбоцитов. TSP-1 является гомотримерным гликопротеином (MW ~450K) и впервые был обнаружен в тромбоцитах как белок, чувствительный к тромбину.
В статье «Эволюционирующая роль тромбоспондина-1(TSP1) в гемостазе и сосудистой биологии» авторов Боннефой и др., Cell. Mol. Life Sci. 65 (2008) 713-727 указывается, что TSP1 принимает участие в ангиогенезе, воспалительных процессах, заживлении ран и гемостазе, в статье также рассматривается структура и домены TSP1, равно как и связывание аминокислотного (SEQ ID NO: 1) пептида для CD47.
Статья «Агрегация тромбоцитов, вызванная C-терминальным пептидом тромбоспондина-1, нуждается в стыковочном белке, но в значительной степени независима от альфа II b/бета3» авторов Трумел и др., напечатанная в журнале «Тромбоз и гемостаз», выпуск от 02/2003;1(2):320-9, указывает на то, что тромбоспондин-1 (TSP1) обильно выделяется во время активации тромбоцитов и играет определенную роль в необратимой агрегации тромбоцитов. Пептид, получаемый из С-терминального домена TSP1, SEQ ID NO: 1 способен по меньшей мере частично активировать тромбоциты человека путем связывания с белком, связанным с интегрином.
Статья «Тромбоспондин действует посредством белка, связанного с интегрином, для активации интегрина тромбоцитов» авторов Чунг и др., J Biol Chem 1997; 272 № 23, выпуск от 6 июня, с. 14740-14746, сообщает о том, что пептид из CBD, SEQ ID NO: 2 (4N1K), был идентифицирован как IAP-агонист. TS1, CBD и пептид IAP-агонист (4N1K), образованный из CBD из TS1, активируют интегрин тромбоцита aIIbb3, в результате чего тромбоциты распространяются на иммобилизированный фибриноген, происходит стимуляция агрегации тромбоцитов и усиленное фосфорилирование тирозином фокального слипания киназы.
Статья «Тромбоспондин стимулирует агрегацию белков» авторов Тусзынски и др., Blood, 72, 109-115 (1988), сообщает о том, что пока роль TSP в гемостазе до конца не ясна, теоретически допускается, что TSP поперечно связывает агрегат тромбоцит-фибриноген, стабилизирует формирование сгустков фибрина и модулирует фибринолиз, а также о том, что, исходя из результатов исследования, напрашивается вывод о способности TSP играть регулирующую роль в гемостазе путем замедления адгезии тромбоцитов и предоставления нетромбообразующей поверхности.
В статье «Тромбоспондин-1 действует посредством IAP/CD47 для сочетания с коллагеном в альфа2бета1-опосредованной активации тромбоцитов» авторов Чунг и др., Blood, выпуск от 15 июля 1999 г.; 94(2):642-8, описан пептид-агонист CD47, 4N1K (SEQ ID NO: 2), полученный из CBD, который сочетается с растворимым коллагеном при агрегации плазмы, насыщенной тромбоцитами. 4N1K и интактный TS1 также вызывают агрегацию промытых не размешанных тромбоцитов на иммобилизированном коллагене с резким повышением фосфолирования тирозина.
Статья «Стимуляция активации и агрегации тромбоцитов карбоксил-терминальным пептидом, полученным в результате связывания тромбоспондина с рецептором белка, связанного с интегрином» авторов Дораги и др., J. Biol Chem 1997; 272:1323-1330, сообщает о том, что пептид из карбоксильного сайта терминации транскрипции тромбоспондина, SEQ ID NO: 1, прямо и специфично вызывает активацию и агрегацию промытых тромбоцитов человека от различных доноров при концентрациях 5-25 ммоль. При менее высоких концентрациях пептид сочетается с близкими к оптимальным концентрациям ADP для стимулирования агрегации. Афинная хроматография и иммунопреципитация пептида с моноклональным антителом использовалась для идентификации рецептора для карбоксил-терминального пептида в качестве белка, связанного с интегрином. Белок, связанный с интегрином, оставался связанным с SEQ ID NO: 1, содержащим столбик пептида, при промывании со скремблированным пептидом в присутствии 5 ммоль ЭДТА, свидетельствуя о двухвалентной катион-независимой ассоциации. Напрашивается вывод о том, что белок, связанный с интегрином, является первичным сенсорным рецептором для тромбоспондина на поверхности покоящихся тромбоцитов и причастен к потенциированию реакции агрегации тромбоцитов.
Статья «Белок, связанный с интегрином и тромбоспондином (CD47) физически и функционально модифицирует интегрин альфа IIbбета3 своим внеклеточным доменом» авторов Фуджимото и др., J Biol Chem 2003; 278:26655-26665, сообщает о том, что пептид из связующего домена С-терминальной клетки, SEQ ID NO: 2 (4N1K), связывается с IAP и стимулирует интегрин-зависимые функции клетки, в том числе агрегацию тромбоцитов. Агрегация тромбоцитов, вызванная 4N1K, не полностью замедлялась элиминацией энергии азидом натрия и 2-дезокси-D-глюкозой, хотя реакция тромбоцитов, вызванная ADP или коллагеном, была полностью угнетена.
Статья «С-терминальный пептид тромбоспондина вызывает агрегацию тромбоцитов через сигнальный путь, связанный с цепочкой Fc-рецептора, и посредством агглютинации» авторов Туласне и др., Blood 2001; 98:3346-3352, сообщает о том, что пептид из С-терминального домена тромбоспондина-1 (Arg-Phe-Tyr-Val-Val-Met-Trp-Lys (SEQ ID NO: 1), известный как 4N1-1) вызывает агрегацию тромбоцитов и связывается с белком, связанным с интегрином (IAP), который также известен как CD47. Было обнаружено, что 4N1-1 или его производный пептид, 4N1K, вызывает резкое фосфорилирование g цепочки Fc-рецептора (FcR), Syk, SLP-76 и фосфолипазы C g2 в тромбоцитах человека. Данная ссылка сообщает о том, что С-терминальный пептид тромбоспондина вызывает агрегацию тромбоцитов через сигнальный путь, связанный с цепочкой Fc-рецептора, и посредством агглютинации.
Статья «С-терминальный пептид тромбоспондина-1 стимулирует четкий сигнальный путь, но вызывает агглютинацию тромбоцитов или других клеток, независящую от активации» авторов Войт и др., FEBS Letters, 2003; 544: 240-245, сообщает о том, что пептид из С-терминального домена тромбоспондина-1 (4N1-1) предлагается для стимуляции агрегации тромбоцитов с помощью инновационного механизма, подразумевающего как агглютинацию, независящую от активации, так и гликопротеин (GP) IIb/IIIa-опосредованную агрегацию, зависящую от активации, которая включает в себя GPVI сигнализирование, но не включает в себя CD47. Данное исследование показывает, что 4N1-1 стимулировал другую модель пути передачи сигнала по сравнению с той, которую стимулирует конвульксин GPVI-агониста. Более того, агрегация тромбоцитов, вызванная 4N1-1- не зависела от активации и GPVI или GPIIb/IIIa. 4N1-1 также стимулировал независящую от активации агглютинацию отличных мегакариоцитарных и немегакариоцитарных клеток. 4N1-1-вызывал агглютинацию клеток, но не замедлял сигнализирование тромбоцитов анти-CD47 антителами.
Статья «Модель агрегации тромбоцитов, включающая в себя многочисленные взаимодействия тромбоспондина-1, фибриногена и рецептора GPIIbIIIa» авторов Боннефой и др., J Biol Chem 2001; 276:5605-5612, сообщает о том, что Тромбоспондин-1 (TSP) может после выделения из α гранул тромбоцитов принимать участие в агрегации тромбоцитов, но механизм его действия мало понятен. В исследовании оценивалась способность TSP образовывать межтромбоцитарные поперечные мостики путем взаимодействия с фибриногеном (Fg), с применением либо гранул, покрытых Fg, либо Fg, связанного с активированным интегрином GPIIbIIIa (GPIIbIIIa*), иммобилизированном на гранулах или на активированных фиксированных тромбоцитах (AFP), т.е. в системе без тромбоцитного сигнализирования и механизмов секреции.
Патент США № 5399667 под названием «Пептиды, связывающиеся с рецептором тромбоспондина» авторов Фрейзиер и др. сообщает об инновационных коротких пептидах, которые связываются с рецептором тромбоспондина-1, который предпочтительно имеет пять аминокислотных остатков, которые разделяют тетрапептид Arg-Val-Ala-Val (SEQ ID NO: 20) и имеют особые последовательности. К тому же в упомянутом патенте говорится о пептиде, содержащем VVM, который связывается с рецептором тромбоспондина-1, который выбирают из группы, состоящей из RFYVVMWKQVTQS (SEQ ID NO: 8) (SEQ ID NO:1 в ‘667) и их фрагментов, содержащих по меньшей мере последовательность SEQ ID NO: 3 и SEQ ID NO: 4 и их фрагментов, содержащих по меньшей мере последовательность SEQ ID NO: 5.
Патент США № 5190920 под названием “Способ использования синтетических аналогов тромбоспондина для угнетения метастатической активности“ авторов Джейкоб и др. относится в общем к фрагментам пептидов и синтетическим аналогам тромбоспондина (TSP), которые сохраняют активность, присущую тромбоспондину. Представляются соединения и композиции, содержащие фрагменты, и способы использования синтетических аналогов тромбоспондина для стимуляции или угнетения активности, присущей тромбоспондину.
В публикации международной патентной заявки 1996/040033 авторов Таддеус и др. описывается гемостатический участок, состоящий из биологически разлагаемой матрицы, эпсилон-аминокапроновых кислот (EACA) и пептидов, активирующих рецептор тромбина (TRAP). Это изобретение раскрывает множество вариантов осуществления, содержащих желатин, альгинаты, окисленную регенерированную целлюлозу или коллаген в качестве матрицы и EACA, TRAP, кальций, RGD-пептид и кальций в качестве активных компонентов. Раскрываемые последовательности включают SFLLRNPNDKYEPF (SEQ ID NO: 9), SFLLRNPNDKYEP (SEQ ID NO: 10), SFLLRNPNDKYE (SEQ ID NO: 11), SFLLRNPNDKY (SEQ ID NO: 12), SFLLRNPNDK (SEQ ID NO: 13), SFLLRNPND (SEQ ID NO: 14), SFLLRNPN (SEQ ID NO: 15), SFLLRNP (SEQ ID NO: 16), SFLLRN (SEQ ID NO: 17), SFLLR (SEQ ID NO: 18), SFLL (SEQ ID NO: 19), SFL и их производные.
В патенте США № 7285580 под названием «Способы использования праймер молекул для усовершенствования механической прочности тканевых клеев и заживителей» автора Стедронски сообщается о том, что кроме естественных белков различные рекомбинантно произведенные белки также могут найти применение в тканевых клеях и заживителях. Здесь могут найти применение не только описанные выше натуральные белки, произведенные рекомбинантно, но и различные поперечно-сшиваемые искусственные рекомбинантные белки. Предпочтительные искусственные рекомбинантно произведенные белки включают в себя белки, содержащие повторяющиеся участки встречающихся в природе блоков последовательностей аминокислот из таких встречающихся в природе структурных белков как фиброин, эластин, коллаген, кератин и т.п. Предпочтительные для использования белки с повторяющимися участками включают SELP8K, SELP0K-CS1 и SELP0K.
Публикация международной патентной заявки 2009/040034 под названием «ИСПОЛЬЗОВАНИЕ ПЕПТИДА В КАЧЕСТВЕ ТЕРАПЕВТИЧЕСКОГО СРЕДСТВА» автора Бевек и др. направлена на использование пептидного соединения Arg-Phe-Tyr-Val-Val-Met-Trp-Lys-OH (SEQ ID NO: 1) в качестве терапевтического средства в профилактике и/или лечении рака, аутоиммунных заболеваний, фиброзов, воспалительных заболеваний, нейродегенеративных заболеваний, инфекционных заболеваний, заболеваний легких, сердечнососудистых заболеваний и к тому же относится к фармацевтическим композициям предпочтительно в форме лиофилизата или жидкого буферного раствора или искусственной композиции материнского молока или заменителя материнского молока, содержащего пептид Arg-Phe-Tyr-Val-Val-Met-Trp-Lys-OH (SEQ ID NO: 1) необязательно с по меньшей мере одним фармацевтически приемлемым носителем, криопротектантом, лиопротектантом, вспомогательным веществом и/или разжижающим кровь веществом.
ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение направлено на гемостатический материал или материал для заживления тканей, имеющий (a) пептид, имеющий последовательность SEQ ID NO: 1 или его последовательность аналогов аминокислот, и (b) каркас для упомянутого пептида или аналогичной последовательности аминокислот. Каркас представляет собой предпочтительно гемостатический материал, например, природный или генно-инженерный абсорбируемый полимер, синтетический абсорбируемый полимер или их комбинации. Природные или генно-инженерные полимеры могут быть выбраны из группы, состоящей из белка, полисахарида или их комбинаций. Белок может быть выбран из группы, состоящей из протромбина, тромбина, фибриногена, фибрина, фибронектина, гепариназы, фактора X/Xa, фактора VII/VIIa, фактора IX/IXa, фактора XI/XIa, фактора XII/XIIa, тканевого фактора, батроксобина, анкрода, экарина, фактора фон Виллебранда, коллагена, эластина, альбумина, желатина, гликопротеинов поверхности тромбоцитов, вазопрессина, аналогов вазопрессина, эпинефрина, селектина, прокоагулянтного яда, ингибитора активатора плазминогена, агентов, активирующих тромбоциты, пептидов или их комбинаций. Полисахарид может быть выбран из группы, состоящей из целлюлозы, алкилцеллюлозы, метилцеллюлозы, алкилгидроксиалкилцеллюлозы, гидроксиалкилцеллюлозы, сульфата целлюлозы, солей карбоксиметилцеллюлозы, карбоксиметилцеллюлозы, карбоксиэтилцеллюлозы, хитина, карбоксиметил хитина, гиалуроновой кислоты, солей гиалуроновой кислоты, альгината, альгиновой кислоты, пропиленгликольальгината, гликогена, декстрана, декстрансульфата, курдлана, пектина, пуллулана, ксантана, хондроитина, хондроитинсульфатов, карбоксиметилдекстрана, карбоксиметил хитозана, гепарина, гепаринсульфата, гепарана, гепарансульфата, дерматансульфата, кератансульфата, каррагинанов, хитозана, крахмала, амилозы, амилопектина, поли-N-глюкозамина, полиманнуроновой кислоты, полиглюкуроновой кислоты, полигулуроновой кислоты, производных упомянутых полисахаридов или их комбинаций. Синтетический абсорбируемый полимер может представлять собой алифатический сложнополиэфирный полимер, алифатический сложнополиэфирный со-полимер или их комбинацию.
Желатин может быть в форме абсорбируемой гемостатической порошковой матрицы, губкообразной матрицы, пастообразной матрицы, гелеобразной матрицы или их комбинаций. К тому же желатин может являться поперечно сшитым и находиться в форме частиц с жидким носителем. Жидкий носитель может представлять собой нормальный физиологический раствор, причем желатин и пептид(ы) по существу однородно смешаны в сочетании с нормальным физиологическим раствором как с жидкой фазой. Концентрация желатина в упомянутом гемостатическом материале (порошок, губка, паста или гель) составляет от приблизительно 0,0025 ммоль до приблизительно 1,25 ммоль. Одна или несколько добавок или соединений может быть включена в гемостатическую смесь, выбранную из группы, состоящей из противомикробных агентов, поверхностно-активных веществ, антиоксидантов, увлажнителей, смачивающих агентов, лубрикантов, загустителей, разбавителей и стабилизаторов излучения. Кроме того, может быть добавлен глицерин в количестве, улучшающем экструзионное прессование.
В одном варианте осуществления, этот пептид конъюгирован с биосовместимым полимером. Биосовместимый полимер может представлять собой гидрофильный полимер, такой как полиэтиленгликоль, производные полиэтиленгликоля, полипропиленгликоль, полисахарид, модифицированный полисахарид, белок, модифицированный белок, пептид, полилактидгликолид, капролактон, триметиленкарбонат, крахмал, модифицированный крахмал, желатин, коллаген или их комбинации.
В альтернативном варианте, гидрофильный полимер представляет собой полиэтиленгликоль, имеющий молекулярную массу, выбранную, чтобы обеспечить быстрый гемостаз или быстрое заживление ткани. Молекула полиэтиленгликоля может представлять собой линейную молекулу, разветвленную молекулу, звездообразную молекулу или их комбинацию. Молекулярная масса может быть в среднем от приблизительно 1000 дальтон до приблизительно 8000 дальтон, предпочтительно указанная молекулярная масса составляет в среднем 2000 или 5000 дальтон.
В альтернативном варианте осуществления гемостатический материал или материал для заживления тканей содержит последовательность аналогов аминокислот, полученную из последовательности SEQ ID NO: 1, где по меньшей мере одна аминокислота замещена соответствующим аналогом аминокислоты. Последовательность аналогов аминокислот может быть выбрана из группы, состоящей из SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5 и их комбинаций.
Настоящее изобретение также относится к способу обеспечения кровоостанавливающего лечения или заживления тканей в месте раны, включающего следующие этапы: (а) формирование гемостатического материала или материала для заживления тканей, как описано выше, и (b) нанесение гемостатического материала или материала для заживления тканей на место раны.
Настоящее изобретение также относится к способу получения гемостатического материала или материала для заживления тканей, включающему этапы: (а) получения пептида, имеющего последовательность SEQ ID NO: 1 или его последовательности аналогов аминокислот, причем указанный пептид дополнительно конъюгирован с полиэтиленгликолем; (b) получения абсорбируемого каркаса; и (с) смешивания указанного пептида с указанным абсорбируемым каркасом по существу гамогенно, формируя гемостатический материал или материал для заживления тканей.
В одном варианте осуществления гемостатический материал или материал для заживления тканей и способы, описанные выше, используют у пациента, имеющего гепаринизированную кровь или иначе содержащую агенты, предотвращающие образование сгустков или коагуляцию крови.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На Фиг. 1 показаны данные времени до достижения гемостаза для нескольких исследованных систем.
На Фиг. 2 показаны данные времени до достижения гемостаза для нескольких исследованных систем.
На Фиг. 3 показаны данные времени до достижения гемостаза для нескольких исследованных систем.
На Фиг. 4 показаны данные времени до достижения гемостаза для нескольких исследованных систем.
На Фиг. 5 показаны данные времени до достижения гемостаза для нескольких исследованных систем.
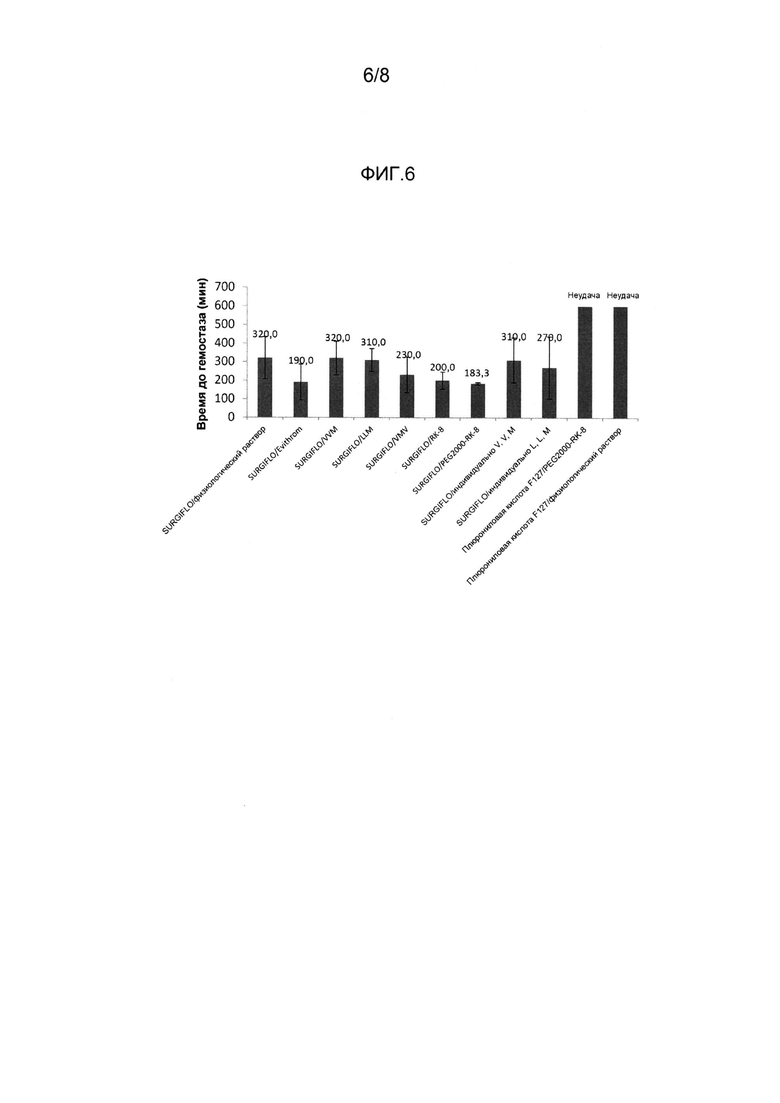
На Фиг. 6 показаны данные времени до достижения гемостаза для нескольких исследованных систем.
На Фиг. 7 показаны данные времени до достижения гемостаза для нескольких исследованных систем в гепаринизированной крови.
На Фиг. 8 показаны данные времени до достижения гемостаза для двух исследованных систем в неактивированной модели тромбоцитов.
Подробное описание изобретения
Названия аминокислот и пептидов обычно сокращают, как показано ниже:
В соответствии с вариантом осуществления настоящего изобретения было определено, что 8-аминокислотный пептид, имеющий последовательность RFYVVMWK (Arg-Phe-Tyr-Val-Val-Met-Trp-Lys (SEQ ID NO: 1)), также называемый здесь RK-8 (необязательно PEG-конъюгированный или пегилированный), который может быть получен из белка человека TSP-1, имеет сильные гемостатические свойства и/или заживляющие ткани свойства при использовании в комбинации с каркасом, предпочтительно гемостатическим каркасным материалом.
Предпочтительные гемостатические каркасы являются натуральными или генно-инженерными абсорбируемыми полимерами или синтетическими абсорбируемыми полимерами или их смесями. Примерами натуральных или генно-инженерных абсорбируемых полимеров являются белки, полисахариды и их комбинации. Белки включают в себя протромбин, тромбин, фибриноген, фибрин, фибронектин, гепариназу, фактор X/Xa, фактор VII/VIIa, фактор IX/IXa, фактор XI/XIa, фактор XII/XIIa, тканевый фактор, батроксобин, анкрод, экарин, фактор фон Виллебранда, коллаген, эластин, альбумин, желатин, гликопротеины поверхности тромбоцитов, вазопрессин и аналоги вазопрессина, эпинефрин, селектин, прокоагулянтный яд, ингибитор активатора плазминогена, агенты, активирующие тромбоциты, синтетические пептиды гемостатического действия и/или их комбинации. Полисахариды включают без ограничения целлюлозу, алкилцеллюлозу, например, метилцеллюлозу, алкилгидроксиалкилцеллюлозу, гидроксиалкилцеллюлозу, сульфат целлюлозы, соли карбоксиметилцеллюлозы, карбоксиметилцеллюлозу, карбоксиэтилцеллюлозу, хитин, карбоксиметилхитин, гиалуроновую кислоту, соли гиалуроновой кислоты, альгинат, альгиновую кислоту, пропиленгликольальгинат, гликоген, декстран, декстрансульфат, курдлан, пектин, пуллулан, ксантан, хондроитин, хондроитинсульфаты, карбоксиметилдекстран, карбоксиметилхитозан, хитозан, гепарин, гепаринсульфат, гепаран, гепарансульфат, дерматансульфат, кератансульфат, каррагинаны, хитозан, крахмал, амилозу, амилопектин, поли-N-глюкозамин, полиманнуроновую кислоту, полиглюкуроновую кислоту, полигулуроновую кислоту, производные любых упомянутых выше веществ. Примеры синтетических абсорбируемых полимеров представляют собой алифатические сложнополиэфирные полимеры, со-полимеры и/или их комбинации. Алифатические полиэфиры, как правило, синтезируют путем полимеризации с раскрытием цикла мономеров, включая, помимо прочего, молочную кислоту, лактид (включая L-, D-, мезо и D-, L-смеси), гликолевую кислоту, гликолид, ε-капролактон, п-диоксанон (1,4-диоксан-2-он) и триметиленкарбонат (1,3-диоксан-2-он). В одном варианте осуществления натуральный абсорбируемый полимер представляет собой желатин, например, SURGIFLOTM, от компании «Ethicon, Inc», который представляет собой сшитый желатин в форме частиц, смешанный с жидким носителем и газовым компонентом в устройстве доставки, таком как шприц.
В одном из вариантов осуществления используется последовательность аналогов аминокислот, при этом по меньшей мере одна аминокислота в последовательности SEQ ID NO: 1 замещена аналогом или биологически подобной аминокислотой. Таблица аналогов или биологически подобных аминокислот приводится ниже:
Аминокислоты могут быть в форме L, D или их производных [например, псевдо аминокислота, функционализированная аминокислота (например, фторированная аминокислота … и т.д.), бета-аминокислота, гамма-аминокислота … и т.д.]. Примерами особенно предпочтительных аналогичных пептидов последовательности пептидов SEQ ID NO: 1 являются:
KRFYVVMWKK
(Lys-Arg-Phe-Tyr-Val-Val-Met-Trp-Lys-Lys (SEQ ID NO: 2))
RFYVVM (Arg-Phe-Tyr-Val-Val-Met (SEQ ID NO: 3))
FIRVVMYEGKK
(Phe-Ile-Arg-Val-Val-Met-Tyr-Glu-Gly-Lys-Lys (SEQ ID NO: 4))
IRVVM (Ile-Arg-Val-Val-Met (SEQ ID NO: 5))
В соответствии с вариантом осуществления настоящего изобретения пептид дополнительно конъюгирован с биосовместимым полимером, более предпочтительно, с гидрофильным полимером. Гидрофильный полимер может представлять собой полиэтиленгликоль, производные полиэтиленгликоля, полипропиленгликоль, полисахарид, модифицированный полисахарид, белок, модифицированный белок, полипептид, полилактидгликолид, капролактон или триметиленкарбонат и/или их комбинации.
В соответствии с вариантом осуществления настоящего изобретения амино пептиды, содержащие последовательность SEQ ID NO: 1 для гемостаза, которые объединены с каркасом (например, желатином), обеспечивают следующие преимущества: низкая молекулярная масса пептидов, таких как SEQ ID NO:1, являются более стабильными, чем большие белковые гемостатические агенты, такие как тромбин, и могут храниться без охлаждения. Крупномасштабное производство пептидов может выполняться посредством технологии рекомбинантной ДНК или химического пептидного синтеза, причем оба способа более экономически эффективны, чем очистка биологических продуктов (например, тромбина). Амино пептид SEQ ID NO: 1 и аналоговые пептиды, которые сопряжены с PEG, предпочтительно имеют улучшенную растворимость пептида. Кроме того, было обнаружено, что пегилированные пептиды более эффективны при более низких концентрациях для гемостаза и хорошо работают в гепаринизированной крови.
К тому же настоящее изобретение относится к методу проведения гемостатического лечения кровоточащих мест, включающему этапы приготовления гемостатического препарата, описанного выше, и к методу применения гемостатического препарата в местах кровотечения.
Настоящее изобретение также относится к способу получения полужидкого гемостатического препарата, включающему в себя этап смешивания гемостатической матрицы с агентом, способствующим гемостазу, содержащим аминокислотный пептид SEQ ID NO: 1 и/или его последовательность аналогов аминокислот, и этап нанесения полученного материала на место раны.
Описание носителей желатина. Желатиновым материалом в настоящем изобретении предпочтительно является жидкостно-проницаемая, нерастворимая в воде желатиновая губка или паста. Желатин, являющийся денатурируемой формой белка коллагена, используется в различных повязках на рану. Поскольку желатиновые гели имеют довольно низкую точку плавления, они не очень стабильны при температуре тела. Таким образом, обязательно нужно стабилизировать эти гели, устанавливая поперечные сшивки между цепочками белков. На практике, это достигается обычно обработкой желатина глутаральдегидом или формальдегидом или в ходе термообработки. Таким образом, сшитый желатин может быть сформирован в виде сухих губок, которые используются для провоцирования гемостаза в кровоточащих ранах, или переведен в форму пылевидного аэрозоля.
Используемый в настоящей заявке термин «гель» используется для обозначения разбухшей, гидратированной полимерной сети, по существу сплошной по объему. Белковый гель состоит из по существу сплошной сети соединенных молекул белка и жидкого (обычно водного) растворителя, который заполняет объем внутри белковой матрицы. Белковая матрица оказывает сильное вязкое сопротивление на молекулы растворителя, предотвращая их свободное течение. Составляющие гелевую сеть молекулы могут быть связаны ионными, гидрофобными, металлическими или ковалентными связями. Ковалентная связь является наиболее термически стабильной из перечисленных связей.
В одном варианте осуществления изобретения, стерильные композиции настоящего изобретения могут содержать твердые, пористые или непористые частицы биосовместимого полимера, подходящего для использования в гемостазе, биосовместимую жидкость и описанный выше гемостатический экстракт в качестве его трех основных составляющих. Частицы, жидкость и гемостатический экстракт соединяются и смешиваются при условиях, позволяющих получить практически однородное соединение, содержащее сплошную жидкую фазу, в состав которой входит гемостатический экстракт, и в которой гомогенно распределены твердые полимерные частицы. Количество и средний диаметр частиц, содержащихся в соединении, и относительное количество твердых частиц, жидкости и гемостатического экстракта эффективно для того, чтобы соединение имело гемостатические и физические свойства, как описано в настоящей заявке далее.
Используемые в настоящей заявке термины «сплошной» и «не сплошной» используются в обычном значении слов в контексте стандартной номенклатуры для описания и определения дисперсии.
Используемый в настоящей заявке термин «практически однородный» обозначает, что физическое состояние соединения или пасты, в которой в жидкой фазе гомогенно распределены твердые частицы, таково, что соотношение твердые частицы : жидкость и плотность любого участка поперечного сечения соединения или пасты практически одинаковы.
Используемый в настоящей заявке термин «стерильный» означает практически свободный от живых микробов и/или микроорганизмов и, как определено далее и описано в правительственных стандартах, относится к соединениям и медицинским приборам, описанным и заявленным в настоящей заявке.
Используемые в настоящей заявке термины «гемостатический» или «гемостатические свойства» означают способность останавливать или уменьшать кровотечение, как это было бы понято специалистами в области гемостаза, как далее показано на специфических примерах.
Для изготовления твердых частиц, применяемых в соединениях настоящего изобретения, могут использоваться различные биосовместимые природные, полусинтетические или синтетические полимеры. Выбранный полимер должен быть практически нерастворимым в жидкости, выбранной для определенного соединения. Предпочтительно использовать нерастворимые в воде биодеградирующие полимеры, которые обеспечивают механическое, химическое и/или биологическое гемостатическое воздействие. Полимеры, которые могут быть применены, включают, без ограничений, белки и полисахариды. Используемые полисахариды включают оксидизированную целлюлозу, хитозан, хитин, альгинат, оксидизированный альгинат и оксидизированный крахмал. Биосовместимый полимер, используемый для приготовления частиц, предпочтительно является сшитым или денатурированным белком, таким как желатин, коллаген, фибриноген или фибронектин. Предпочтительный желатиновый порошок является частично сшитым желатиновым порошком, изготовленным путем перемалывания желатиновой губки в частицы, средний диаметр которых составляет приблизительно 40-1200 микрон, предпочтительно 100-1000 микрон, и определяется лазерной дифракцией.
Стерильные соединения настоящего изобретения предпочтительно содержат сплошную жидкую фазу, в которой распределен гемостатический экстракт и твердые частицы на основе желатина. В зависимости от определенного медицинского прибора и его применения, жидкость может быть на водной или неводной основе. Предпочтительно, чтобы жидкая фаза была водной. Водные жидкости могут содержать, без ограничений, биосовместимые водные растворы, такие как раствор хлорида кальция или натрия хлорида. Более предпочтительно использовать жидкую фазу, содержащую раствор натрия хлорида. Жидкая фаза и фаза твердых пылевидных частиц присутствуют в относительных количествах, необходимых для того, чтобы обеспечить соединению, например, пасте или кашице, наличие гемостатических свойств. В некоторых вариантах осуществления изобретения массовое соотношение твердых частиц к жидкости, как правило, составляет от около 1:1 до около 1:2 или от около 1:3 до около 1:8 или даже до около 1:5.
Гемостатические соединения могут дополнительно содержать эффективные количества одного или нескольких добавок или соединений, в том числе, но не ограничиваясь, антибактериальными препаратами, сурфактантами, антиоксидантами, увлажнителями, смачивающими реагентами, лубрикантами, загустителями, разжижающими кровь веществами, веществами, стабилизирующими действие облучения, например, поглотителями свободных радикалов, смягчителями и стабилизаторами. Например, для улучшения экструдируемости или инъективности соединения может добавляться глицерол. При применении глицерола, он может присутствовать в соединении в количестве от 0% до 20% по весу, исходя из веса жидкой фазы. Предпочтительно, чтобы соединение содержало от 1% до 10% глицерола по весу соединения, исходя из веса жидкой фазы. Предпочтительнее, чтобы соединение содержало от 1% до 5% глицерола по весу соединения, исходя из веса жидкой фазы.
В дополнение для улучшения свойств соединений могут использоваться четвертичные амины. Например, бензалкония хлорид, полибрен или Onamer M могут использоваться в содержании до 1% веса соединения, исходя из веса жидкой фазы. Предпочтительно, чтобы соединение содержало от 0,001% до 0,01% бензалкония хлорида по весу соединения, исходя из веса жидкой фазы. Более предпочтительно, чтобы соединение содержало от 0,002% до 0,006% бензалкония хлорида по весу соединения, исходя из веса жидкой фазы. Считается, что четвертичные амины могут выполнять несколько функций, выступая в роли антибактериального препарата, вспенивающего препарата, вещества, поглощающего свободные радикалы и в качестве нейтрализатора гепарина.
Гемостатический препарат может дополнительно содержать эффективное количество одной или нескольких добавок или соединений, выбранных из группы антибактериальных препаратов, сурфактантов, антиоксидантов, увлажнителей, смачивающих реагентов, лубрикантов, загустителей, разжижающих кровь веществ, веществ, стабилизирующих действие облучения, например, поглотителей свободных радикалов, смягчителей, и стабилизаторов, а более конкретно, содержащий вытяжку, повышающую количество глицерола, а преимущественно, препарат, в котором присутствует глицерол в количестве от 1% до 20% в весовом соотношении жидкой фазы всего гемостатического препарата.
Такие гемостатические препараты могут дополнительно содержать нейтрализаторы гепарина, дополнительные прокоагуллянты или гемостатические препараты, такие как фибриноген, фибрин, фактор Xa или фактор Vila. Под термином «эффективное количество» в настоящей заявке понимается количество, необходимое для обеспечения тех свойств соединения, для которых в него добавляется добавка. Эффективное количество также ограничивается максимальным количеством, которое может быть добавлено в соединение, не вызывая пагубных биологических эффектов.
Методы включения пептидов в носители желатина. В одном из вариантов осуществления для приготовления соединений настоящего изобретения приготавливается практически однородная паста, путем смешивания частиц с жидкостью для образования однородной пасты. Жидкость содержит материал гемостатического пептида и может содержать эффективные количества других добавок, растворенных в ней, как описано выше. Смешивание может производиться путем экструдирования или смешиванием в замкнутом пространстве при условиях, обеспечивающих однородную дисперсию твердых частиц в жидкой фазе. С другой стороны для приготовления соединений настоящего изобретения можно использовать мешалку, например, планетарная мешалка. Жидкость, содержащая материал гемостатического пептида, добавляется в мешалку. Жидкость может содержать эффективное количество добавок, растворенных в ней перед добавлением в раствор частиц. Например, можно приготовить физиологический раствор, содержащий материал гемостатического пептида, глицерол и бензалконийхлорида и добавить его в мешалку. Твердые частицы добавляются в мешалку через некоторое время; мешалка продолжает смешивание до тех пор, пока не будут добавлены все ингредиенты. Смешивание продолжается до тех пор, пока не будет образовано практически однородное соединение, содержащее твердые частицы, гомогенно распределенные в сплошной жидкой фазе.
В другом варианте осуществления, гемостатический пептид применяется в форме спрея или прессовки на основную поверхность практически сухой губки.
Гемостатическое соединение, приготовленное методом, описанным выше, может подвергаться стерилизации для обеспечения стерильности соединений, содержащих гемостатический пептид. В ряде вариантов осуществления соединения передаются к медицинским приборам, как описано выше, а прибор, содержащий гемостатическое соединение, стерилизуется, предпочтительно с помощью ионизирующего облучения. Предпочтительнее проводить стерилизацию гамма-лучами, как показано в примерах настоящей заявки.
Соединения настоящего изобретения, описанные в данной заявке, являются стерильными, так как подвергаются воздействию облучения уровня, например, ионизирующего излучения. Такое излучение может включать электронный пучок или гамма-лучи. Уровень излучения и условия стерилизации, в том числе время, в течение которого соединения подвергаются воздействию облучения, таковы, что обеспечивают стерильность соединений, как описано в настоящей заявке. Обладая преимуществами этого раскрытия, специалист в данной области технологий сможет с готовностью определить необходимый уровень облучения для обеспечения стерильности соединений.
Медицинские приборы, в которых могут применяться гемостатические соединения настоящего изобретения, включают любые приборы, используемые в настоящее время для подачи текучей или инъективной гемостатической пасты или кашицы к месту кровотечения или к ране, требующей гемостаз. Можно вручную воспользоваться губкой или применить другие средства традиционным способом. Место кровотечения, требующее гемостаз, может быть результатом раны или хирургической процедуры. Примеры приборов или применений включают помпы, такие как помпы Becton Dickinson или помпы с люэровским переходником Monoject. Другие устройства подробно описаны в патенте США № 6045570, содержание которого полностью включено в настоящий документ путем ссылки.
Синтетические пептиды разной последовательности были синтезированы путем Fmoc-опосредованного твердотельного поддерживаемого пептидного синтеза. PEG-конъюгированные пептиды, PEG2000-RK-8 или PEG5000-RK-8, обозначаемые как P2K-RK-8 или P5K-RK-8, соответственно, были синтезированы путем конъюгации метоксиполиэтиленгликоль-N-гидроксисукцинимида (mPEG-NHS) на N-конец очищенной последовательности SEQ ID NO: 1 путем синтеза в растворе. Пептиды очищали с помощью C18 RP-HPLC с получением чистоты >95%. Их идентичность была проанализирована с помощью MALDI-TOF MS или ESI-MS.
Смеси с SurgifloTM, который представляет собой гемостатическую матрицу на основе желатина, приготавливали следующим образом. Исследуемые препараты включали смеси SurgifloTM на основе желатина с 2 мл нормального физиологического раствора или 2 мл нормального физиологического раствора, содержащего активный компонент, или, например, последовательность SEQ ID NO: 1, пегилированную последовательность SEQ ID NO: 1 или ее аналог; или с 2 мл раствора EVITHROMTM, содержащего в основном тромбин человека (полное соединение Evithrom® содержит тромбин человека (800-1200 МЕ/мл), хлорид кальция, альбумин человека, маннит, ацетат натрия и воду для инъекций).
Для исследуемого препарата SurgifloTM тщательно смешивали с гемостатическим материалом, в ходе следующих этапов: 1. Набрали 2 мл раствора гемостатического материала, такого как физиологический раствор или физиологический раствор с пептидом в пустой шприц; 2. Смешали 2 компонента путем подключения люэровского переходника к предварительно наполненному шприцу и присоединения к другому концу люэровского переходника шприца, содержащего раствор гемостатического материала с последующим впрыскиванием раствора гемостатического материала в предварительно наполненный шприц; 3. Продолжили смешивать компоненты, перегоняя объединенный материал назад и вперед до тех пор, пока консистенция не стала однородной, и нанесли на рану.
Все концентрации в примерах и диаграммах относятся к концентрации в 2 мл физиологического раствора до смешивания с 6 мл SurgifloTM. После смешивания концентрация активного ингредиента или вспомогательного вещества в испытываемом препарате будет соответствовать ¼ от концентрации в физиологическом растворе; Например, концентрация 5 ммоль, на которую ссылаются в примерах, соответствует конечной концентрации 0,25×5 ммоль = 1,25 ммоль в гемостатическом материале.
На фигурах «SF» обозначает гемостатическую матрицу SurgifloTM; а «TH» обозначает EVITHROMTM от компании «Ethicon, Inc.», содержащий местный тромбин (человека), 800~1200 МЕ/мл.
Хотя в нижеследующих примерах демонстрируются некоторые варианты реализации настоящего изобретения, их следует интерпретировать не как ограничение области изобретения, а как дополнительное средство для полного описания изобретения.
Пример 1
На Фиг. 1 представлены данные о времени в минутах до достижения гемостаза для нескольких испытанных систем, каждая из которых включала SurgifloTM, (обозначен как «SF») и различные виды добавок для улучшения гемостаза, в том числе тромбин человека (на диаграмме обозначен как «TH») и синтетический пептид SEQ ID NO: 1, имеющий концентрацию в диапазоне от 0,01 ммоль до 5 ммоль. Смеси SurgifloTM с тромбином на диаграмме обозначены как «SF/TH»; смеси SurgifloTM с пептидом SEQ ID NO: 1 на диаграмме обозначены «SF/RK-8».
Данные собраны с использованием модели биопсии печени свиньи [8 мм в ширину × 7 мм в глубину], с первоначальным временем тампонады: 30 с; временем наблюдения: 30 с; N - количество экспериментов для каждой точки данных; N=3. Величина ошибки на диаграммах соответствует стандартным отклонениям.
Было проведено исследование гемостатической активности с использованием модели биопсии печени свиньи с отверстием раны шириной 8 мм × глубиной 7 мм, сделанным на печени, испытываемый препарат наносился на свежеобразованную рану, после чего следовало воздействие обтурирующим цифровым давлением (тампонада). Изначально давление применялось в течение 30 секунд, время измерялось с помощью электронного таймера. После 30-секундной тампонады, действие цифрового давления прекращалось; марлевая прокладка на образце была незамедлительно удалена. Была проведена оценка гемостаза в течение 30-секундного периода. Если свободноструйное кровотечение не наблюдалось в течение 30 секунд, записывалось время до гемостаза в формате минут и секунд, и испытание для такого образца заканчивалось. Если замечалось свободноструйное кровотечение, то давление и марля применялись повторно в течение дополнительной 30 секундной тампонады и периодов наблюдения до тех пор, пока не достигался гемостаз, или до тех пор, пока период проведения испытания не достигал десяти минут. Гемостаз определялся по прекращению свободноструйного кровотечения через менее чем десять минут. В качестве отрицательного результата контроля использовался марлевый тампон.
Как видно из Фиг. 1, смесь SurgifloTM с большей концентрацией последовательности SEQ ID NO: 1 (5 ммоль), имеет эффективность, подобную эффективности смеси SurgifloTM с тромбином (SF/TH), что говорит о сильном гемостатическом эффекте пептида SEQ ID NO: 1.
Пример 2
На Фиг. 2 представлены данные о времени в минутах до достижения гемостаза для нескольких испытанных систем, каждая из которых включала SurgifloTM, (обозначен как «SF») и различные виды добавок для улучшения гемостаза, в том числе тромбин человека (на диаграмме обозначен как "TH") и PEG-конъюгированный (или пегилированный) синтетический пептид SEQ ID NO: 1. Для PEG-конъюгации, использовали PEG2000 или полиэтиленгликоль со средним молекулярным весом 2000 дальтон, обозначенный на диаграмме как «P2K». Смеси пегилированной последовательности SEQ ID NO: 1 и SurgifloTM обозначена на диаграмме как «SF/P2K-RK-8». Смесь испытывали с концентрацией последовательности SEQ ID NO: 1 в диапазоне от 0,05 ммоль до 5 ммоль.
Данные были получены с использованием исследования на живом организме модели биопсии селезенки свиньи [6 мм в ширину × 3 мм в глубину], первоначальное время тампонады: 30 с; временем наблюдения: 30 с; N=3.
Было проведено исследование гемостатической активности с использованием модели биопсии селезенки свиньи с отверстием раны шириной 6 мм × глубиной 3 мм, сделанным на селезенке, испытываемый препарат наносился на свежеобразованную рану, после чего следовало воздействие обтурирующим цифровым давлением (тампонада). Изначально давление применялось в течение 30 секунд, время измерялось с помощью электронного таймера. После 30-секундной тампонады действие цифрового давления прекращалось; марлевая прокладка на образце была незамедлительно удалена. Была проведена оценка гемостаза в течение 30-секундного периода. Если свободноструйное кровотечение не наблюдалось в течение 30 секунд, записывалось время до гемостаза в формате минут и секунд, и испытание для такого образца заканчивалось. Если замечалось свободноструйное кровотечение, то давление и марля применялись повторно в течение дополнительной 30-секундной тампонады и периодов наблюдения до тех пор, пока не достигался гемостаз, или до тех пор, пока период проведения испытания не достигал десяти минут. Гемостаз определялся по прекращению свободноструйного кровотечения через менее чем десять минут. В качестве отрицательного результата контроля использовался марлевый тампон.
Как видно из Фиг. 2, в смесях с SurgifloTM, пегилированная последовательность SEQ ID NO: 1 сравнима с тромбином в диапазоне концентраций от 0,05 ммоль до 5 ммоль, показывая практически такое же время до достижения гемостаза, как и тромбин, при концентрации 0,1 ммоль пегилированной последовательности SEQ ID NO: 1.
Пример 3
На Фиг. 3 представлены данные о времени в минутах до достижения гемостаза для нескольких испытанных систем, каждая из которых включала SurgifloTM, (обозначен как «SF») и различные виды контролирующих веществ или добавок для улучшения гемостаза, в том числе: тромбин человека (обозначенный как «SF/TH»); пептид SEQ ID NO: 1 (обозначенный как «SF/RK-8»), имеющий концентрацию 5 ммоль; последовательность SEQ ID NO: 1 конъюгированная с PEG 2000 (обозначенная на диаграмме как «SF/PEG2000-RK8»), имеющая концентрацию 5 ммоль; PEG-2000 (обозначенный на диаграмме как «SF/PEG2000»), имеющий концентрацию 5 ммоль; и нормальный физиологический раствор (обозначенный на диаграмме как «SF/физиологический раствор»).
Данные были получены с использованием исследования в живом организме модели биопсии селезенки свиньи [6 мм в ширину × 3 мм в глубину], первоначальное время тампонады: 30 с; время наблюдения: 30 с; N=3.
Как видно из Фиг. 3, прямое сравнение смесей SurgifloTM с последовательностью SEQ ID NO: 1 и с пегилированной последовательностью SEQ ID NO: 1 со смесями с тромбином и контролирующими веществами, представляющими смеси с отсутствием гемостаза, в том числе вспомогательные вещества, представленные PEG2000 и нормальным физиологическим раствором, указывает на то, что смеси SurgifloTM с пегилированной последовательностью SEQ ID NO: 1 (5 ммоль) и последовательностью SEQ ID NO: 1 (5 ммоль) показывают подобный гемостатический эффект, как и смеси с тромбином. Смеси SurgifloTM с пегилированной последовательностью SEQ ID NO: 1 и с последовательностью SEQ ID NO: 1 показали гораздо более короткое время до достижения гемостаза по сравнению со смесями SurgifloTM с физиологическим раствором и PEG2000 (5 ммоль).
Пример 4
На Фиг. 4 представлены данные о времени в минутах до достижения гемостаза для нескольких испытанных систем, каждая из которых включала SurgifloTM, (обозначен как «SF») и различные виды контролирующих веществ или добавок в различных концентрациях для улучшения гемостаза, в том числе:
- Последовательность SEQ ID NO: 1, конъюгированная с PEG 2000 (обозначенная на диаграмме как «SF/PEG2000-RK8»), имеющая концентрации 0,05-5 ммоль;
- Пептид SEQ ID NO: 1 (обозначенный как «SF/RK-8»), имеющий концентрации 0,05-5 ммоль;
- Контролирующее вещество: SurgifloTM с тромбином человека (обозначенное как «SF/TH»);
- Контролирующее вещество: SurgifloTM с нормальным физиологическим раствором (обозначенное на диаграмме как «SF/физиологический раствор»).
Данные были получены с использованием исследования на живом организме модели биопсии селезенки свиньи [6 мм в ширину × 3 мм в глубину], первоначальное время тампонады: 30 с; время наблюдения: 30 с; N=3.
Как видно из Фиг. 4, прямое сравнение смесей SurgifloTM с последовательностью SEQ ID NO: 1 и пегилированной последовательностью SEQ ID NO: 1 со смесями с тромбином и с нормальным физиологическим раствором указывает на то, что смеси SurgifloTM с пегилированной последовательностью SEQ ID NO: 1 показывают лучшую или подобную гемостатическую эффективность по сравнению со смесями SurgifloTM с тромбином при всех концентрациях, при чем особенно короткое время до достижения гемостаза наблюдалось при концентрации 0,05 ммоль пегилированной последовательности SEQ ID NO: 1. К тому же, смеси SurgifloTM с последовательностью SEQ ID NO: 1 показали гемостатическую эффективность, сравнимую со смесями SurgifloTM с тромбином. Во всех случаях гемостатическая эффективность была выше по сравнению со смесями SurgifloTM с физиологическим раствором. Дальнейший анализ указывает на то, что последовательность SEQ ID NO: 1 показала лучшую гемостатическую эффективность, чем последовательность SEQ ID NO: 1 и тромбин в смесях с SurgifloTM.
Пример 5
На Фигуре 5 представлены данные о времени в минутах до достижения гемостаза для нескольких испытанных систем, основанных на различных гемостатических каркасах, в том числе SurgifloTM, (обозначенного на диаграмме как «SF») и каркас, изготовленный из окисленной регенерированной целлюлозы или ОРЦ порошка (обозначенного на диаграмме как «ORC»).
Окисленная регенерированная целлюлоза (ОРЦ) является известным и широко используемым кровоостанавливающим средством, производимым компанией «Ethicon, Inc.» под названиями SURGICEL Original, SURGICEL Nu-Knit, SURGICEL Fibrillar и SURGICEL SNoW. ОРЦ порошок изготавливали путем размалывания ОРЦ ткани с последующим перемешиванием получившегося порошка с нормальным физиологическим раствором и/или с соответствующим пептидом.
Изобретатели исследовали следующие композиции на основе ОРЦ:
- смеси ОРЦ с пегилированной последовательностью SEQ ID NO: 1 в концентрации 5 ммоль (обозначенной на диаграмме как «ORC/PEG2000-RK-8»)
- смеси ОРЦ с последовательностью SEQ ID NO: 1 в концентрации 5 ммоль (обозначенной на диаграмме как «ORC/RK-8»)
- смеси ОРЦ с нормальным физиологическим раствором
Данные были получены с использованием исследования на живом организме модели биопсии селезенки свиньи [6 мм в ширину × 3 мм в глубину], первоначальное время тампонады: 30 с; время наблюдения: 30 с; N=4.
Сравнение с контролирующими веществами указывает на то, что композиции на основе ОРЦ вели себя как кровоостанавливающие средства, сравнимые с SurgifloTM с нормальным физиологическим раствором (обозначенные на диаграмме как «SF/физиологический раствор») и показали более длительное время до достижения гемостаза по сравнению с SurgifloTM с тромбином человека (обозначенным как "SF/TH"). Таким образом, гемостатический каркас на основе ОРЦ не подходит для использования с последовательностью SEQ ID NO: 1 и/или с пегилированной последовательностью SEQ ID NO: 1.
Фиг. 5 далее иллюстрирует данные, полученные с использованием смесей SurgifloTM с пегилированной последовательностью SEQ ID NO: 1 и пегилированной последовательностью SEQ ID NO: 1 подобно 8-аминокислотным пептидам с различными последовательностями в концентрациях 5 ммоль. В Таблице 1 представлены последовательности SEQ ID NO: 1 и три последовательности SEQ ID NO: 1 подобно 8-аминокислотным пептидам, наряду с сокращенными обозначениями на диаграмме. Все пептиды, включающие SEQ ID NO: 1, были пегилированными.
Пептидные последовательности
8-аминокислотный пептид PEG2000-KVYRWFMV (SEQ ID NO: 21) или PEG2000-произвольно RK-8 имеет произвольную последовательность KVYRWFMV (SEQ ID NO: 21);
8-аминокислотный пептид PEG2000-RL4L5K8 или PEG2000-SEQ ID NO: 6 имеет последовательность RFYLLMWK ((Arg-Phe-Tyr-Leu-Leu-Met-Trp-Lys) SEQ ID NO: 6)), аналог RK-8, но с VVM вместо LLM, где V и L представляют собой аналоги аминокислот.
8-аминокислотный пептид PEG2000-KR-8 или PEG2000-SEQ ID NO: 7 имеет последовательность KYFLLQFR ((Lys-Tyr-Phe-Leu-Leu-Gln-Phe-Arg) SEQ ID NO: 7)), где каждая отдельная аминокислота RK-8 заменяется аналогом аминокислоты с отличной боковой цепочкой.
Анализ данных указывает на то, что 8-аминокислотный пегилированный пептид, имеющий последовательность, подобную RK-8, в особенности SEQ ID NO: 6, показал подобную гемостатическую эффективность по сравнению с пегилированной последовательностью SEQ ID NO: 1 и тромбином.
Пегилированный 8-аминокислотный пептид SEQ ID NO: 7 показал немного более длительное время до достижения гемостаза по сравнению с непегилированной последовательностью SEQ ID NO: 1.
Пегилированная произвольная последовательность 8-аминокислотного пептида KVYRWFMV (SEQ ID NO: 21) показала более длительное время до достижения гемостаза по сравнению со смесью «SF/физиологический раствор».
Пример 6
На Фиг. 6 представлены данные о времени в секундах до достижения гемостаза для нескольких испытанных систем, основанных на различных гемостатических каркасах, в том числе SurgifloTM, (обозначенного на диаграмме как «Surgiflo»), и каркас, изготовленный из плюроновой кислоты F127 (обозначенной на диаграмме как «Pluronic acid F127»).
Плюроновая кислота F127 представляет собой (PPO)x-(PEO)y блок-со-полимер, имеющий среднюю молекулярную массу 12600 дальтон. Она закупалась у компании «BASF» и приготавливалась следующим образом: 0,58 г плюроновой кислоты F127 смешивали с 2 мл физиологического раствора или физиологического раствора, содержащего 5 ммоль пегилированного PR-8.
Данные были получены с использованием исследования на живом организме модели биопсии селезенки свиньи [6 мм в ширину × 3 мм в глубину], первоначальное время тампонады: 30 с; время наблюдения: 30 с.
Анализ данных указывает на то, что смеси плюроновой кислоты с пегилированным RK-8 и нормальным физиологическим раствором не прошли гемостатическое исследование. Таким образом, композиции на основе плюроновой кислоты проявили себя как неэффективные кровоостанавливающие средства и не подходят для использования с пегилированным RK-8.
На Фиг. 6 также представлены данные, полученные с помощью смесей SurgifloTM с физиологическим раствором (обозначенных как «Surgiflo/Физиологический раствор») и с EvithromTM (тромбином человека, местный тромбин (человека), 800~1200 МЕ/мл) (обозначенных как «Surgiflo/Evithrom»), использованных в качестве контролирующих веществ, так же как и смеси SurgifloTM с:
- Короткими 3-аминокислотными пептидами, имеющими последовательности VVM, LLM, VMV, при концентрациях 5 ммоль (обозначены на диаграмме как «Surgiflo/VVM»; «Surgiflo/LLM»; «Surgiflo/VMV»).
- Пептидом SEQ ID NO: 1 (обозначенный как «Surgiflo/RK-8»), имеющим концентрацию 5 ммоль.
- Последовательностью SEQ ID NO: 1, конъюгированной с PEG 2000 (обозначенная на диаграмме как «Surgiflo/PEG2000-RK8»), имеющей концентрацию 5 ммоль.
- Смесью трех отдельных аминокислот V, V, M; (обозначены на диаграмме как «Surgiflo/individual V,V,M»), имеющей концентрацию 5 ммоль каждая).
- Смесью трех отдельных аминокислот L, L, M; (обозначены на диаграмме как «Surgiflo/individual L,L,M»), имеющей концентрацию 5 ммоль каждая).
3-аминокислотные пептиды, VVM, LLM и VMV, синтезировали на базе компании «GenScript USA Inc».
Анализ данных, представленных на Фиг. 6, указывает на то, что смеси SurgifloTM с отдельными аминокислотами и короткими 3-аминокислотными пептидами были неэффективными в качестве кровоостанавливающих агентов, за исключением пептида VMV, который продемонстрировал определенную эффективность.
Дальнейший анализ данных показывает, что последовательность SEQ ID NO: 1 и последовательность PEG SEQ ID NO: 1 действовали также, как и тромбин.
Пример 7
На Фиг. 7 представлены данные о времени в минутах до достижения гемостаза для нескольких испытанных систем и контролирующих веществ, использующих гепаринизированную кровь.
В качестве модели использовали модель биопсии гепаринизированной селезенки свиньи: 6 мм в ширину × 3 мм в глубину, время тампонады: 30 сек; время наблюдения: 30 сек; активированное время свертывания сохранялось дольше 300 сек путем настаивания дополнительных 2000 МЕ гепариного раствора при необходимости. 9975 МЕ Гепаринового раствора первоначально применили к свинье весом 39,1 кг.
Как видно из представленных данных:
- Марля (как негативный контроль) использовалась без какого-либо гемостатического активного материала) не прошла испытание в качестве кровоостанавливающего средства в гепаринизированной крови;
- Смесь SurgifloTM с тромбином (обозначенная как «SF/TH») не прошла испытание в качестве кровоостанавливающего средства в гепаринизированной крови;
- Смесь SurgifloTM с нормальным физиологическим раствором (обозначенная как «SF/Физиологический раствор») не прошла испытание в качестве кровоостанавливающего средства в гепаринизированной крови;
- SurgifloTM с 2 мл последовательности SEQ ID NO: 1 с концентрацией 5 ммоль в физиологическом растворе (обозначен как «SF/RK-8») не прошел испытание в качестве кровоостанавливающего средства в гепаринизированной крови;
- SurgifloTM с 2 мл последовательности PEG2000-SEQ ID NO: 1 с концентрацией 5 ммоль в физиологическом растворе (обозначен как «SF/P2K-RK-8») дал определенный гемостатический эффект, но при этом время до достижения гемостаза было слишком продолжительным (6,8 мин) и это не практично;
- SurgifloTM с 2 мл последовательности PEG5000-SEQ ID NO: 1 с концентрацией 5 ммоль в физиологическом растворе (обозначен как «SF/P5K-RK-8») дал значительный гемостатический эффект.
Таким образом, пегилированная последовательность SEQ ID NO: 1, а именно PEG-5000, конъюгированный с последовательностью SEQ ID NO: 1, показала лучшую гемостатическую эффективность по сравнению с тромбином, непегилированной последовательностью SEQ ID NO: 1, и другими контролирующими веществами в гепаринизированной крови.
Пример 8
При проведении стендового испытания синтетическая пористая подкладка обрабатывалась пегилированной последовательностью SEQ ID NO: 1 в физиологическом растворе или с контролирующим раствором физиологического раствора для оценки взаимодействия с кровью. Были приготовлены образцы путем добавления 100 мкл пегилированной последовательности SEQ ID NO: 1 в нормальный физиологический раствор (0,5 ммоль) или 200 мкл нормального физиологического раствора в 0,025 г Монокрил(полиглекапрон 25)- подкладку. Пропитанные Монокрил(полиглекапрон 25)-подкладки затем высушивали на воздухе в течение 2 часов с последующим 1-часовым вакуумным процессом сушки.
150 мкл свежей крови свиньи затем добавляли на каждую подкладку отдельно и выдерживали ее при комнатной температуре в течение 2 минут. Затем подкладки переносили в чашку Петри, содержащую 20 мл физиологического раствора, наблюдая как некоагулированная кровь распространялась из подкладок. Наблюдалось значительное количество коагулированной крови, уловленной в монокриловой подкладке, обработанной пегилированной последовательностью SEQ ID NO: 1, в то время как также наблюдалось сильное распространение некоагулированной крови из контрольной подкладки. Таким образом пегилированная последовательность SEQ ID NO: 1 показала действие, способствующее быстрой коагуляции крови.
Пример 9
При проведении стендового испытания была испытана пегилированная последовательность SEQ ID NO: 1 в нормальном физиологическом растворе, непегилированная последовательность SEQ ID NO: 1 в нормальном физиологическом растворе и контрольный раствор для оценки взаимодействия с кровью. Были приготовлены образцы путем добавления 100 мкл пегилированной последовательности SEQ ID NO: 1 в нормальный физиологический раствор (0,5 ммоль), последовательности SEQ ID NO: 1 в нормальный физиологический раствор (0,5 ммоль) и нормального физиологического раствора в отдельные пробирки, содержащие 100 мкл крови свиньи, содержащей цитрат натрия (0,105 ммоль). Помутнение крови наблюдалось сразу же во время добавления раствора пегилированной последовательности SEQ ID NO: 1 или последовательности SEQ ID NO: 1 в кровь, в то время как помутнение крови не наблюдалось в пробирке с контрольным раствором физиологического раствора. Полное выпадение крови в осадок наблюдалось спустя 2 часа в пробирках, содержащих пегилированную последовательность SEQ ID NO: 1 или последовательность SEQ ID NO: 1, в то время, как неполное выпадение крови в осадок наблюдалось в пробирке с контрольным раствором нормального физиологического раствора. Таким образом пегилированная последовательность SEQ ID NO: 1 и непегилированная последовательность SEQ ID NO: 1 показали действие, способствующее быстрой коагуляции крови.
Пример 10
На Фиг. 8 представлены данные о времени в минутах до достижения гемостаза для двух испытанных систем, каждая из которых включала SurgifloTM и различные виды контролирующих веществ и добавок для улучшенного гемостаза, в том числе:
- 0,5 ммоль пептида SEQ ID NO: 1, конъюгированного с PEG 2000 в физиологическом растворе (обозначен на диаграмме как «Surgiflo/0,5 мМ PEG2000-RK8 в физиологическом растворе»).
- Контролирующее вещество: SurgifloTM с тромбином человека (обозначенное как «Surgiflo/TH»).
Данные были получены с использованием биопсии селезенки свиньи, обработанной клопидогрелем и ацетилсалициловой кислотой (6 мм в ширину × 3 мм в глубину, время тампонады: 30 сек; время наблюдения: 30 сек; следующие пероральные дозировки применялись для 4-месячной самки свиньи (вес: 66,1 кг):
за 2 дня до лабораторного исследования: 300 мг Плавикса и 325 мг аспирина.
за 1 день до лабораторного исследования: 75 мг Плавикса и 325 мг аспирина.
В день лабораторного исследования: 75 мг Плавикса и 325 мг аспирина перед операцией.
Данные, представленные на Фигуре 8, показывают, что пептид Surgiflo/Pegylated SEQ ID NO: 1 работает так же, как Surgiflo/Thrombin в активированной модели тромбоцитов и показывает подобную гемостатическую эффективность. Таким образом, пептид SEQ ID NO: 1 показывает гемостатическую эффективность не только в бескомпромиссной крови, в гепаринизированной крови, но и в крови, активированной тромбоцитами.












Группа изобретений относится к области медицины, а именно для регуляции гемостаза и заживления ран. Группа изобретений включает гемостатический материал, содержащий пептид, имеющий последовательность SEQ ID NO: 1 или его последовательность аналогов аминокислот, и каркас, в котором упомянутый каркас представляет собой натуральный полимер желатин, где желатин содержит абсорбируемую гемостатическую порошкообразную матрицу, губкообразную матрицу, пастообразную матрицу, гелеобразную матрицу или их комбинации, и указанный желатин является сшитым и находится в форме частиц с жидким носителем, а также материал для заживления тканей аналогичного состава и способ обеспечения кровоостанавливающего лечения или заживления тканей в месте раны, включающий формирование гемостатического материала или материала для заживления тканей аналогичного состава и нанесение гемостатического материала или материала для заживления тканей на место раны. Данная группа изобретений позволит расширить арсенал технических средств гемостатического назначения, которые могут успешно работать и в среде гепаринизированной крови. 3 н. и 30 з.п. ф-лы,8 ил., 1 табл.,10 пр.
1. Гемостатический материал, содержащий:
(a) пептид, имеющий последовательность SEQ ID NO: 1 или его последовательность аналогов аминокислот, и
(b) каркас,
в котором упомянутый каркас представляет собой натуральный полимер, причем указанным полимером является желатин, причем указанный желатин содержит абсорбируемую гемостатическую порошкообразную матрицу, губкообразную матрицу, пастообразную матрицу, гелеобразную матрицу или их комбинации, и указанный желатин является сшитым и находится в форме частиц с жидким носителем.
2. Гемостатический материал по п. 1, который дополнительно содержит нормальный физиологический раствор, причем желатин и пептид по существу однородно смешаны в сочетании с нормальным физиологическим раствором как с жидкой фазой.
3. Гемостатический материал по п. 2, в котором концентрация упомянутого пептида в упомянутом гемостатическом материале составляет от приблизительно 0,0025 ммоль до приблизительно 1,25 ммоль.
4. Гемостатический материал по п. 3, который дополнительно содержит эффективные количества одной или нескольких добавок или соединений, выбранных из группы, состоящей из антибактериальных препаратов, поверхностно-активных веществ, антиоксидантов, увлажнителей, смачивающих реагентов, лубрикантов, загустителей, разбавителей, веществ, стабилизирующих действие облучения, и их комбинаций.
5. Гемостатический материал по п. 4, который дополнительно содержит глицерин в количестве, улучшающем экструзионное прессование.
6. Гемостатический материал по п. 1, в котором упомянутый пептид конъюгирован с биологически совместимым полимером.
7. Гемостатический материал по п. 6, в котором упомянутый биологически совместимый полимер представляет собой гидрофильный полимер.
8. Гемостатический материал по п. 7, в котором упомянутый гидрофильный полимер выбран из группы, состоящей из полиэтиленгликоля, производных полиэтиленгликоля, полипропиленгликоля, полисахарида, модифицированного полисахарида, белка, модифицированного белка, пептида, полилактидгликолида, капролактона, триметиленкарбоната, крахмала, модифицированного крахмала, желатина, коллагена и их комбинации.
9. Гемостатический материал по п. 7, в котором гидрофильный полимер представляет собой полиэтиленгликоль, имеющий молекулярную массу, выбранную так, чтобы обеспечить быстрый гемостаз или быстрое заживление ткани.
10. Гемостатический материал по п. 9, в котором молекула упомянутого полиэтиленгликоля представляет собой линейную молекулу, разветвленную молекулу, звездообразную молекулу или их комбинации.
11. Гемостатический материал по п. 10, в котором упомянутая молекулярная масса составляет в среднем от приблизительно 1000 дальтон до приблизительно 8000 дальтон.
12. Гемостатический материал по п. 10, в котором упомянутая молекулярная масса составляет в среднем 2000 дальтон.
13. Гемостатический материал по п. 10, в котором упомянутая молекулярная масса составляет в среднем 5000 дальтон.
14. Гемостатический материал по п. 10, в котором концентрация упомянутого пептида в упомянутом гемостатическом материале составляет от приблизительно 0,0025 ммоль до приблизительно 1,25 ммоль, и в котором упомянутый полиэтиленгликоль имеет молекулярную массу от приблизительно 2000 до приблизительно 5000 дальтон.
15. Гемостатический материал по п. 1, в котором упомянутая последовательность аналогов аминокислот получена из упомянутой последовательности SEQ ID NO: 1, где по меньшей мере одна аминокислота замещена соответствующим аналогом аминокислот.
16. Гемостатический материал по п. 15, где упомянутая последовательность аналогов аминокислот выбрана из группы, состоящей из SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5 и их комбинаций.
17. Материал для заживления тканей, содержащий:
(a) пептид, имеющий последовательность SEQ ID NO: 1 или его последовательность аналогов аминокислот, и
(b) каркас,
в котором упомянутый каркас представляет собой натуральный полимер, причем указанным полимером является желатин, причем указанный желатин содержит абсорбируемую гемостатическую порошкообразную матрицу, губкообразную матрицу, пастообразную матрицу,гелеобразную матрицу или их комбинации, и указанный
желатин является сшитым и находится в форме частиц с жидким носителем.
18. Материал для заживления тканей по п. 17, который дополнительно содержит нормальный физиологический раствор, причем желатин и пептид по существу однородно смешаны в сочетании с нормальным физиологическим раствором как с жидкой фазой.
19. Материал для заживления тканей по п. 18, в котором концентрация упомянутого пептида в упомянутом гемостатическом материале составляет от приблизительно 0,0025 ммоль до приблизительно 1,25 ммоль.
20. Материал для заживления тканей по п. 19, который дополнительно содержит эффективные количества одной или нескольких добавок или соединений, выбранных из группы, состоящей из антибактериальных препаратов, поверхностно-активных веществ, антиоксидантов, увлажнителей, смачивающих реагентов, лубрикантов, загустителей, разбавителей, веществ, стабилизирующих действие облучения, и их комбинаций.
21. Материал для заживления тканей по п. 20, который дополнительно содержит глицерин в количестве, улучшающем экструзионное прессование.
22. Материал для заживления тканей по п. 17, в котором упомянутый пептид конъюгирован с биологически совместимым полимером.
23. Материал для заживления тканей по п. 22, в котором упомянутый биологически совместимый полимер представляет собой гидрофильный полимер.
24. Материал для заживления тканей по п. 23, в котором упомянутый гидрофильный полимер выбран из группы, состоящей из полиэтиленгликоля, производных полиэтиленгликоля, полипропиленгликоля, полисахарида, модифицированного полисахарида, белка, модифицированного белка, пептида, полилактидгликолида, капролактона, триметиленкарбоната, крахмала, модифицированного крахмала, желатина, коллагена и их комбинации.
25. Материал для заживления тканей по п. 23, в котором гидрофильный полимер представляет собой полиэтиленгликоль, имеющий молекулярную массу, выбранную так, чтобы обеспечить быстрый гемостаз или быстрое заживление ткани.
26. Материал для заживления тканей по п. 25, в котором молекула упомянутого полиэтиленгликоля представляет собой линейную молекулу, разветвленную молекулу, звездообразную молекулу или их комбинации.
27. Материал для заживления тканей по п. 26, в котором упомянутая молекулярная масса составляет в среднем от приблизительно 1000 дальтон до приблизительно 8000 дальтон.
28. Материал для заживления тканей по п. 26, в котором упомянутая молекулярная масса составляет в среднем 2000 дальтон.
29. Материал для заживления тканей по п. 26, в котором упомянутая молекулярная масса составляет в среднем 5000 дальтон.
30. Материал для заживления тканей по п. 26, в котором концентрация упомянутого пептида в упомянутом материале для заживления тканей составляет от приблизительно 0,0025 ммоль до приблизительно 1,25 ммоль, и в котором упомянутый полиэтиленгликоль имеет молекулярную массу от приблизительно 2000 до приблизительно 5000 дальтон.
31. Материал для заживления тканей по п. 17, в котором упомянутая последовательность аналогов аминокислот получена из упомянутой последовательности SEQ ID NO: 1, где по меньшей мере одна аминокислота замещена соответствующим аналогом аминокислот.
32. Материал для заживления тканей по п. 31, где упомянутая последовательность аналогов аминокислот выбрана из группы, состоящей из SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5 и их комбинаций.
33. Способ обеспечения кровоостанавливающего лечения или заживления тканей в месте раны, включающий следующие этапы:
(a) формирование гемостатического материала или материала для заживления тканей по любому из пп. 1, 16, 17 или 32, и
(b) нанесение гемостатического материала или материала для заживления тканей на место раны.
| WO 2009040034 A2, 02.04.2009 | |||
| WO 2009153748 A2, 23.12.2009 | |||
| US 5399667 A1, 21.03.1995 | |||
| JUN CHUNG et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Blood, 1999.V | |||
| Экономайзер | 0 |
|
SU94A1 |
| ВЕРТИКАЛЬНЫЙ ВЕТРЯНОЙ ДВИГАТЕЛЬ | 1923 |
|
SU642A1 |
Авторы
Даты
2017-11-13—Публикация
2012-06-14—Подача