Изобретение относится к медицине, а именно, к сердечно-сосудистой хирургии и кардиоанестезиологии и может быть использовано для органопротекции головного, спинного мозга, висцеральных органов и нижней половины тела при операциях на грудной аорте в условиях циркуляторного ареста (ЦА).
Хирургическое вмешательство на дуге аорты является высокотехнологичной операцией и требует проведения гипотермического циркуляторного ареста и мероприятий по защите головного мозга и висцеральных органов.
В настоящее время в качестве основного метода системной органопротекции при этих вмешательствах используется гипотермия разной степени (легкая, умеренная, углубленная, глубокая). Несмотря на преимущества гипотермии, оказывающее защитное влияние на головной мозг и внутренние органы, продолжительность ее ограничена [1]. Так, при продолжительности гипотермического циркуляторного ареста более 40 минут возрастает количество неврологических осложнений, а при увеличении более 65 минут значительно увеличивается вероятность летального исхода [2]. Кроме того, широко известны такие специфические осложнения, как неконтролируемое кровотечение на фоне коагулопатии, полиорганная недостаточность и увеличение степени выраженности системного воспалительного ответа. Таким образом, тенденция к сокращению времени хирургического вмешательства и контролируемому повышению температуры тела во время циркуляторного ареста представляется обоснованной. Однако в условиях увеличения температуры повышается риск ишемического повреждения головного и спинного мозга, висцеральных органов и нижней половины тела [3]. С целью профилактики неврологического дефицита стали применять дополнительные перфузионные методы органопротекции. На сегодняшний день для этого широко применяется ретро- и антеградная церебральная перфузия. На современном этапе наиболее оптимальным, физиологичным и рекомендуемым методом защиты головного мозга при вмешательствах на дуге аорты с циркуляторным арестом является антеградная перфузия головного мозга (АПГМ) в условиях умеренной гипотермии [4]. АПГМ используется в унилатеральном и билатеральном вариантах. Данные ряда исследований не выявили преимущества билатеральной перфузии перед унилатеральной в отношении частоты неврологических осложнений и летальности [5, 6]. Авторы связывают развитие неврологического дефицита при билатеральной церебральной перфузии с необходимостью дополнительных манипуляций на брахиоцефальных сосудах, что увеличивает риск эмболизации артерий головного мозга.
С целью обеспечения защиты нижней половины тела от ишемии при операциях на дуге аорты в комплексе с антеградной перфузией головного мозга используют дистальную перфузию через бедренную артерию с окклюзией нисходящей аорты баллонным окклюзирующим катетером, введенным антеградно в просвет сосуда [7].
Недостатками способа являются необходимость выполнения дополнительного доступа для канюляции бедренной артерии и риск дополнительных источников кровотечения, послеоперационных раневых осложнений. Перфузия через бедренную артерию также несет риски тромбо- и атероэмболии при значительном атеросклеротическом поражении аортальной стенки, а также риск ретроградной диссекции у пациентов с расслоением аорты, которые могут сопровождается мальперфузией внутренних органов [8].
Несмотря на имеющиеся наработки относительно перфузионной защиты не только головного мозга, но также и нижней половины тела при операциях на дуге аорты вопрос комплексной перфузионной органопротекции остается до сих пор открытым. Так, до сих пор не определены условия её применения, включая уровень гипотермии, направление потока перфузии, а также не предложен надежный контроль объемной скорости перфузии верхней и нижней половины туловища.
Известен способ перфузии при тотальных реконструкциях на дуге аорты путем дублирования артериальной магистрали посредством У-образного переходника после основного артериального насоса, при которой осуществляется параллельная перфузия головы и тела. При этом осуществляют регуляцию объема перфузии головы путем изменения диаметра «головной» магистрали с помощью венозного окклюдера, уменьшая просвет артериальной линии до расчетных показателей [9].
Данный способ является наиболее близким к заявляемому по технической сущности и достигаемому результату и выбран в качестве прототипа.
Недостатками данного способа являются отсутствие контроля дистальной перфузии и отдельного регулирования скорости потока по магистралям для головы и тела вследствие использования одного насоса, что не дает возможности отдельно выставлять параметры перфузии для головы и тела с целью исключения риска гипоперфузии и мальперфузии разных бассейнов. Способ регулирования скорости перфузии в «головной» магистрали путем изменения диаметра магистрали венозным окклюдером рассматривается как недостаточно объективный критерий объемной скорости.
Изобретение относится к медицине, а именно, к сердечно-сосудистой хирургии и кардиоанестезиологии и может быть использовано для органопротекции головного, спинного мозга, висцеральных органов и нижней половины тела при операциях на грудной аорте в условиях циркуляторного ареста (ЦА).
Хирургическое вмешательство на дуге аорты является высокотехнологичной операцией и требует проведения гипотермического циркуляторного ареста и мероприятий по защите головного мозга и висцеральных органов.
В настоящее время в качестве основного метода системной органопротекции при этих вмешательствах используется гипотермия разной степени (легкая, умеренная, углубленная, глубокая). Несмотря на преимущества гипотермии, оказывающее защитное влияние на головной мозг и внутренние органы, продолжительность ее ограничена [1]. Так, при продолжительности гипотермического циркуляторного ареста более 40 минут возрастает количество неврологических осложнений, а при увеличении более 65 минут значительно увеличивается вероятность летального исхода [2]. Кроме того, широко известны такие специфические осложнения, как неконтролируемое кровотечение на фоне коагулопатии, полиорганная недостаточность и увеличение степени выраженности системного воспалительного ответа. Таким образом, тенденция к сокращению времени хирургического вмешательства и контролируемому повышению температуры тела во время циркуляторного ареста представляется обоснованной. Однако в условиях увеличения температуры повышается риск ишемического повреждения головного и спинного мозга, висцеральных органов и нижней половины тела [3]. С целью профилактики неврологического дефицита стали применять дополнительные перфузионные методы органопротекции. На сегодняшний день для этого широко применяется ретро- и антеградная церебральная перфузия. На современном этапе наиболее оптимальным, физиологичным и рекомендуемым методом защиты головного мозга при вмешательствах на дуге аорты с циркуляторным арестом является антеградная перфузия головного мозга (АПГМ) в условиях умеренной гипотермии [4]. АПГМ используется в унилатеральном и билатеральном вариантах. Данные ряда исследований не выявили преимущества билатеральной перфузии перед унилатеральной в отношении частоты неврологических осложнений и летальности [5, 6]. Авторы связывают развитие неврологического дефицита при билатеральной церебральной перфузии с необходимостью дополнительных манипуляций на брахиоцефальных сосудах, что увеличивает риск эмболизации артерий головного мозга.
С целью обеспечения защиты нижней половины тела от ишемии при операциях на дуге аорты в комплексе с антеградной перфузией головного мозга используют дистальную перфузию через бедренную артерию с окклюзией нисходящей аорты баллонным окклюзирующим катетером, введенным антеградно в просвет сосуда [7].
Недостатками способа являются необходимость выполнения дополнительного доступа для канюляции бедренной артерии и риск дополнительных источников кровотечения, послеоперационных раневых осложнений. Перфузия через бедренную артерию также несет риски тромбо- и атероэмболии при значительном атеросклеротическом поражении аортальной стенки, а также риск ретроградной диссекции у пациентов с расслоением аорты, которые могут сопровождается мальперфузией внутренних органов [8].
Несмотря на имеющиеся наработки относительно перфузионной защиты не только головного мозга, но также и нижней половины тела при операциях на дуге аорты вопрос комплексной перфузионной органопротекции остается до сих пор открытым. Так, до сих пор не определены условия её применения, включая уровень гипотермии, направление потока перфузии, а также не предложен надежный контроль объемной скорости перфузии верхней и нижней половины туловища.
Известен способ перфузии при тотальных реконструкциях на дуге аорты путем дублирования артериальной магистрали посредством У-образного переходника после основного артериального насоса, при которой осуществляется параллельная перфузия головы и тела. При этом осуществляют регуляцию объема перфузии головы путем изменения диаметра «головной» магистрали с помощью венозного окклюдера, уменьшая просвет артериальной линии до расчетных показателей [9].
Данный способ является наиболее близким к заявляемому по технической сущности и достигаемому результату и выбран в качестве прототипа.
Недостатками данного способа являются отсутствие контроля дистальной перфузии и отдельного регулирования скорости потока по магистралям для головы и тела вследствие использования одного насоса, что не дает возможности отдельно выставлять параметры перфузии для головы и тела с целью исключения риска гипоперфузии и мальперфузии разных бассейнов. Способ регулирования скорости перфузии в «головной» магистрали путем изменения диаметра магистрали венозным окклюдером рассматривается как недостаточно объективный критерий объемной скорости.
Целью изобретения является профилактика висцеральной ишемии и ишемии нижних конечностей, сокращение ранних послеоперационных осложнений со стороны внутренних органов и нижних конечностей.
Поставленная цель достигается с помощью комбинированной перфузионной органопротекции, для чего выполняют искусственное кровообращение и унилатеральную перфузию головного мозга через брахиоцефальный ствол, магистраль которого подключена к основному насосу, а антеградную дистальную перфузию тела выполняют через дополнительную артериальную магистраль, присоединенную к катетеру Фолея, который вводят в нисходящую аорту непосредственно перед формированием дистального аортального анастомоза, затем артериальную магистраль устанавливают в отдельный дополнительный насос, синхронизированный с основным в режиме, при котором происходит остановка дополнительного насоса при остановке основного насоса, а поток через дополнительный насос не равен и не превышает поток через основной насос.
Новым в предлагаемом в качестве изобретения является выполнение искусственного кровообращения и унилатеральной перфузии головного мозга через брахиоцефальный ствол, магистраль которого подключена к основному насосу, а выполнение антеградной дистальной перфузии тела через дополнительную артериальную магистраль, установленную в отдельный насос, синхронизированный с основным в режиме, при котором происходит остановка дополнительного насоса при остановке основного насоса, а поток через дополнительный насос не равен и не превышает поток через основной насос.
Существенные признаки, характеризующие изобретение, проявили в совокупности новые свойства, явно не вытекающие из уровня техники и неочевидные для специалиста. Идентичной совокупности признаков не обнаружено в патентной и научно-медицинской литературе. Данное изобретение может быть использовано в практическом здравоохранении для повышения качества и эффективности лечения.
Предлагаемое изобретение соответствует условиям патентоспособности «Новизна», «Изобретательский уровень», «Промышленная применимость».
Заявляемое изобретение будет понятно из следующего описания и приложенных к нему фигур.
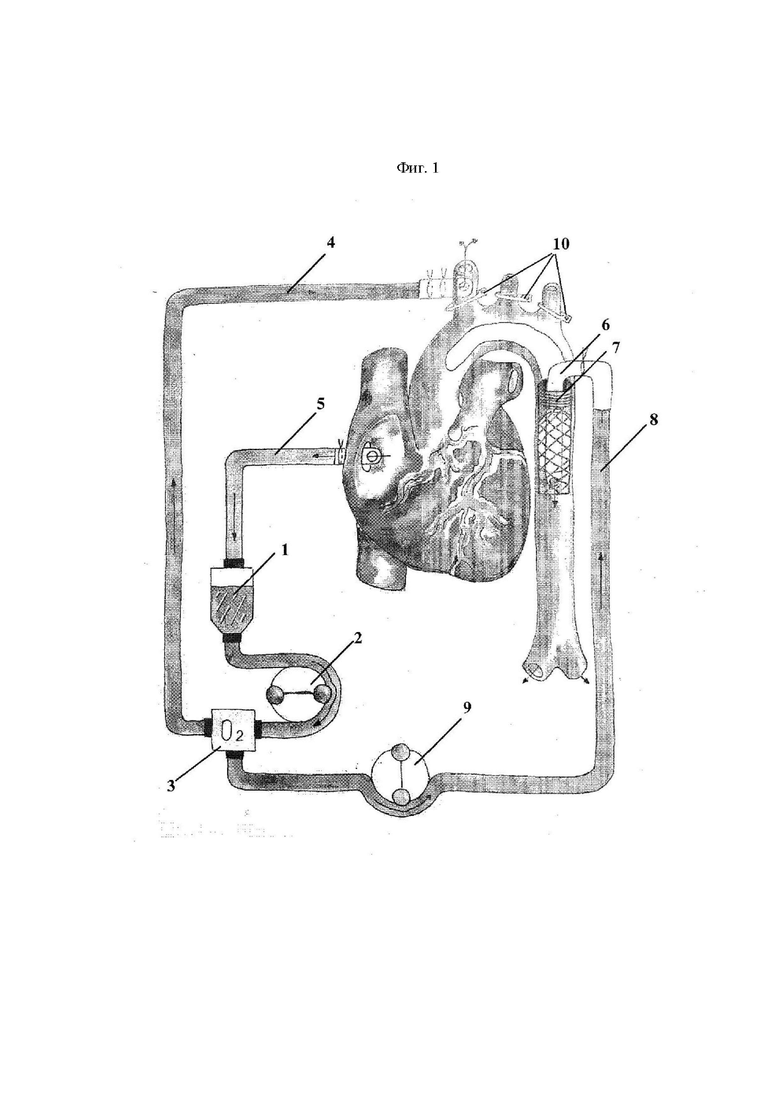
На фиг.1 изображена схема искусственного кровообращения с дистальной перфузией и АПГМ, где
1 – венозный/кардиотомный резервуар
2 – основной роликовый насос
3 – оксигенатор 3
4 – основная артериальная магистраль к БЦС
5 – венозная магистраль
6 - катетер с окклюзирующим раздувающимся баллоном (катетер Фолея)
7 – протез аорты (стентграфт)
8 – дополнительная артериальная магистраль для дистальной перфузии, подсоединенная к катетеру Фолея
9 – насос дополнительной артериальной магистрали для дистальной перфузии,
10 – зажимы на супрааортальных артериях (БЦС, левая общая сонная артерия, левая подключичная артерия)
Способ осуществляют следующим образом:
Проводят искусственное кровообращение (ИК) и антеградную перфузию головного мозга (АПГМ) с параллельной антеградной перфузией нижней половины тела, при этом АПГМ проводят через предварительно вшитый синтетический протез (8-10 мм) в брахиоцефальный ствол (БЦС) 1, через который проводят ИК и АПГМ, магистраль, которого подключена к основному насосу 2, а дистальную перфузию проводят с помощью дополнительной артериальной магистрали диаметром 1/4" 8, присоединенной к катетеру Фолея 28Fr с раздувающимся окклюзирующим баллоном (объемом 30 мл) 6. При этом Катетер Фолея вводят антеградно в нисходящую аорту через просвет синтетического протеза непосредственно перед формированием дистального аортального анастомоза. Входной конец магистрали подсоединяют к кардиоплегическому порту оксигенатора 3. Затем магистраль устанавливают в отдельный насос 9, синхронизированный с основным в режиме, при котором происходит остановка дополнительного насоса при остановке основного насоса, а поток через дополнительный насос не равен и не превышает поток через основной насос, что является непременным условием для безопасности процедуры в аспекте массивной воздушной эмболии. Объемную скорость перфузии при ИК и АПГМ регулируют с помощью основного насоса аппарата ИК. АПГМ осуществляют со скоростью перфузии 8-10 мл/кг/мин и перфузионным давлением 60-80 мм.рт.ст. Дистальную перфузию выполняют в условиях умеренной и/или легкой (25-30°С) гипотермии со скоростью 20 мл/кг/мин (1500-2500 мл/мин) под контролем перфузионного давления, осуществляемым через дополнительный датчик давления, установленный в линию.
Для оценки эффективности способа комбинированной перфузионной органопротекции применяют инвазивный мониторинг артериального давления (АД) в обеих лучевых (или плечевых) артериях и в одной из бедренных артерий. Также осуществляют контроль регионарной оксигенации нижних конечностей (верхняя треть икроножной мышцы) и церебральной оксиметрии (rSO2, %) правого и левого полушария с использованием инфракрасной спектроскопии (Invos 5100, Somanetics Corp.).
После протезирования дуги аорты с включением супрааортальных сосудов в возобновляют ИК по схеме «правое предсердие-БЦС». На этом этапе магистраль для дистальной перфузии удаляют из аорты. По завершении аортальной реконструкции дополнительную магистраль используют для контролируемого по потоку и давлению заполнения оксигенированной кровью левых отделов сердца с целью их дезаэрации через дренаж левого желудочка, установленного в правую верхнюю легочную вену. Таким образом, линия, используемая для дистальной перфузии, является многофункциональной.
Проведение данного способа перфузии позволяет фактически избежать циркуляторного ареста во время формирования дистального аортального анастомоза и, соответственно, развития или усугубления ишемического повреждения органов. Кроме того, способ комплексной органопротекции не требует выполнения дополнительного доступа к магистральным артериям для подключения искусственного кровообращения. Немаловажной положительной характеристикой данного способа является возможность контроля объемов дистальной перфузии и АПГМ за счет использования двух насосов (отдельного для каждой линии), что, в свою очередь, исключает риск гипо- или гиперперфузии головного мозга, которое может наблюдаться при использовании одного насоса и Y-образного коннектора для получения отдельных линий для антеградной и дистальной перфузии.
Предлагаемый способ технически прост, не ухудшает визуализацию операционного поля и экспозиции раны, не требует использования дополнительных и трудоёмких технологий.
Пример 1
Пациент С., 56 лет, оперирован с применением способа комбинированой перфузионной органопротекии. Диагноз: Острое расслоение аорты тип А по Stanford, I тип по DeBakey. Гипертоническая болезнь III стадии, 3 степени, риск 4.
Пациенту выполнена реконструкция восходящего отдела и дуги аорты по методике «замороженный хобот слона» с использованием гибридного стент-графт «E-vita open plus 28 мм» в условиях искусственного кровообращения, фармакохолодовой кардиоплегии, умеренной гипотермии (28°С) и комбинированной перфузионной органопротекции.
После проведения полной продольной срединной стернотомии обнажены восходящая аорты, дуга аорты, проксимальная часть нисходящей аорты и проксимальные участки супрааортальных ветвей.
Выполнено краевое пережатие брахиоцефального ствола. После вскрытия проведена ревизия просвета БЦС – сосуд не расслоен. Наложен анастомоз между БЦС и сосудистым протезом 10 мм по типу «конец в бок». В протез установлена артериальная канюля для проведения антеградной унилатеральной перфузии головного мозга и ИК. Канюляция правого предсердия. Подключение к аппарату искусственного кровообращения по схеме: правое предсердие – брахиоцефальный ствол. Установлен дренаж левого желудочка через правую верхнюю легочную вену. Начато искусственное кровообращение и охлаждение больного до температуры в носоглотке 26°С.
По достижении целевой температуры пережата восходящая аорта, выполнена аортотомия, начата раздельная антеградная кардиоплегия через устья коронарных артерий раствором «Кустодиол». Затем пережаты БЦС, левой общей сонной артерии и левой подключичной артерии и начат циркуляторный арест с унилатеральной антеградной перфузией головного мозга со скоростью 10 мл/кг/мин, АД в правой лучевой артерии – 65 мм Hg, церебральная оксиметрия справа rSO2 – 60%, слева rSO2 – 56%. На данном этапе регуляция объемной скорости через основную магистраль осуществлялась изменением работы основного насоса. Далее в нисходящую аорту был имплантирован стент-графт «E-vita open plus 28 мм» с последующей установкой в нисходящую аорту через просвет стент-графта катетера Фолея 28Fr (диаметр просвета 7,5 мм) для дистальной перфузии. После раздувания окклюзирующего баллона манжеты физиологическим раствором начинали дистальную перфузию со скоростью 20 мл/кг/мин (1500-2500 мл/мин) под контролем перфузионного давления, осуществляемым через дополнительный датчик давления, установленный в линию. Контроль адекватности дистальной перфузии проводили с помощью измерения АД в левой бедренной артерии (50 мм Hg) и измерения регионарной оксигенации нижних конечностей (rSO2 – 65%). После формирования дистального аортального анастомоза и реимплантации брахиоцефальных артерий в протез графта, катетер Фолея удален из нисходящей аорты. Возобновлено ИК по схеме «правое предсердие-БЦС» с одновременным согреванием пациента. По завершении аортальной реконструкции выполнена дезаэрация левых отделов сердца, с помощью дополнительной магистрали, подсоединенной к дренажу левого желудочка, установленного через правую верхнюю легочную вену. После окончания процедуры заполнения сердца кровью снят зажим с протеза аорты. На фоне стабильной сердечной деятельности остановлено ИК. Удален дренаж левого желудочка, деканюлировано правого предсердия, удалена артериальная канюля из протеза к БЦС. Операция закончена дренированием полостей перикарда, металлоостиосинтезом грудины и послойным ушиванием мягких тканей.
После завершения операции пациент переведен в палату интенсивной терапии.
Продолжительность искусственного кровообращения составила 139 минуты, время сердечного ареста – 113 минут, время АПГМ и дистальной перфузии тела – 67 минут, время циркуляторного ареста нижней половины тела – 2 минуты.
Интраоперационные показатели гемодинамики и сатурации венозной крови головного мозга, нижней конечности, фиксировавшиеся на всех этапах операции, свидетельствуют об эффективности комбинированой перфузионой органопротекции. Лактат крови во время дистальной перфузии и по окончании операции не превышал 1,8 ммоль/л.
Пациент был экстубирован на следующее утро, переведен в общую палату, выписан из стационара на 12-е сутки в удовлетворительном состоянии.
Способ применен у 8 взрослых больных. Подготовка к операции и анестезиологическое обеспечение у всех пациентов были одинаковыми. Всем пациентам требовалась сложная реконструкция дуги аорты.
Применение предлагаемого способа позволяет сократить время циркуляторного ареста нижней половины тела за счет применения дистального компонента комплексной органопротекции, что, обеспечивает профилактику висцеральной ишемии и ишемии нижних конечностей, что способствует сокращению ранних послеоперационных осложнений со стороны внутренних органов и нижних конечностей.
Список литературы
1. Yan TD, Bannon PG, Bavaria J, et al. Consensus on hypothermia in aortic arch surgery. Ann Cardiothorac Surg. 2013;2(2):163-168. doi: 10.3978/j.issn.2225-319X.2013.03.03.
2. Luehr M, Bachet J, Mohr FW, Etz CD. Modern temperature management in aortic arch surgery: the dilemma of moderate hypothermia. Eur J Cardiothorac Surg. 2014;45(1):27–39. doi:10.1093/ejcts/ezt154.
3. Griepp RB, Griepp EB. Perfusion and cannulation strategies for neurological protection in aortic arch surgery. Ann Cardiothorac Surg. 2013;2(2):159-162. doi: 10.3978/j.issn.2225-319X.2013.03.12.
4. Leshnower BG, Myung RJ, Kilgo PD, Vassiliades TA, Vega JD, Thourani VH, Puskas JD, Guyton RA, Chen EP. Moderate hypothermia and unilateral selective antegrade cerebral perfusion: a contemporary cerebral protection strategy for aortic arch surgery. Ann Thorac Surg. 2010 Aug;90(2):547-54. doi: 10.1016/j.athoracsur.2010.03.118. PMID: 20667348.
5. Angeloni E, Melina G, Refice SK, Roscitano A, Capuano F, Comito C, Sinatra R. Unilateral versus bilateral antegrade cerebral protection during aortic surgery: an updated meta-analysis. Ann Thorac Surg. 2015;99:2024–2031. http://dx.doi.org/10.1016/j.athoracsur.2015.01.070.
6. Tong G, Zhang B, Zhou X, Tao Y, Yan T, Wang X, Lu H, Sun Z, Zhang W. Bilateral versus unilateral antegrade cerebral perfusion in total arch replacement for type A aortic dissection. J Thorac Cardiovasc Surg. 2017;154:767-775. http://dx.doi.org/10.1016/j.jtcvs.2017.02.053.
7. Touati GD, Marticho P, Farag M, Carmi D, Szymanski C, Barry M, Trojette F, Caus T. Totally normothermic aortic arch replacement without circulatory arrest. Eur J Cardiothorac Surg. 2007 Aug;32(2):263-8; discussion 268. doi: 10.1016/j.ejcts.2007.04.035. Epub 2007 Jun 11. PMID: 17561411.
8. Osumi M, Wada H, Morita Y, Shimizu M, Sukehiro Y, Amako M, Minematsu N, Matsumura H, Nishimi M, Tashiro T. Safety and efficacy of ascending aorta cannulation during repair of acute type A aortic dissection. Gen Thorac Cardiovasc Surg. 2014;62:296–300. Doi: 10.1007/s11748-013-0355-9.
9. Патент №2670007 С1 Российская Федерация, МПК: A61B 17/00 , Способ перфузии при тотальных реконструкциях на дуге аорты / Комаров Р.Н., Москалёв Д.Б., Бояркин Е.В., Яворовский А.Г., Чернявский С.В., Молочников И.О., Яковлева К.Н; заявитель и патентообладатель: Комаров Роман Николаевич (RU), Москалев Дмитрий Борисович (RU) - №2017127169, заявл. 28.07.2017; опубл. 18.10.2018, Бюл. № 29
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ органопротекции при протезировании проксимальной части дуги аорты | 2022 |
|
RU2789385C1 |
| СПОСОБ ПРОВЕДЕНИЯ АДЕКВАТНОЙ ПЕРФУЗИИ ГОЛОВНОГО МОЗГА ПРИ ОПЕРАЦИЯХ НА ВОСХОДЯЩЕМ ОТДЕЛЕ И ЧАСТИ ДУГИ АОРТЫ БЕЗ ЦИРКУЛЯТОРНОГО АРЕСТА | 2019 |
|
RU2734466C1 |
| СПОСОБ УНИЛАТЕРАЛЬНОЙ ПЕРФУЗИИ ГОЛОВНОГО МОЗГА ПРИ ОПЕРАЦИЯХ НА ДУГЕ АОРТЫ | 2014 |
|
RU2570286C2 |
| Способ искусственного кровообращения при реконструктивной операции на дуге аорты | 2019 |
|
RU2724871C1 |
| СПОСОБ ПРОТЕЗИРОВАНИЯ ДУГИ АОРТЫ ПО МЕТОДИКЕ "ПОЛУДУГИ" БЕЗ ЦИРКУЛЯТОРНОГО АРЕСТА | 2019 |
|
RU2726472C1 |
| Система и способ селективной билатеральной перфузии головного мозга при реконструктивной операции на дуге аорты, проводимой в условиях искусственного кровообращения | 2019 |
|
RU2734136C1 |
| СПОСОБ ПЕРФУЗИИ ПРИ ТОТАЛЬНЫХ РЕКОНСТРУКЦИЯХ НА ДУГЕ АОРТЫ | 2017 |
|
RU2670006C1 |
| СПОСОБ ИНТРАОПЕРАЦИОННОЙ ЗАЩИТЫ ГОЛОВНОГО МОЗГА ПРИ ЛЕЧЕНИИ РАССЛАИВАЮЩЕЙ АНЕВРИЗМЫ АОРТЫ 1 ТИПА ПО DEBACKEY | 2023 |
|
RU2819994C1 |
| Способ проведения искусственного кровообращения и антеградной церебральной перфузии в период циркуляторного ареста при реконструкции дуги аорты у пациентов с аберрантной подключичной артерией | 2020 |
|
RU2751587C1 |
| СПОСОБ ОДНОМОМЕНТНОГО ПОЛНОГО ПРОТЕЗИРОВАНИЯ ГРУДНОЙ АОРТЫ | 2020 |
|
RU2755214C1 |
Изобретение относится к медицине, а именно к сердечно-сосудистой хирургии и кардиоанестезиологии. Выполняют искусственное кровообращение и унилатеральную перфузию головного мозга через брахиоцефальный ствол, магистраль которого подключена к основному насосу, а антеградную дистальную перфузию тела выполняют через дополнительную артериальную магистраль, присоединенную к катетеру Фолея. При этом указанный катетер вводят в нисходящую аорту непосредственно перед формированием дистального аортального анастомоза. Затем артериальную магистраль устанавливают в отдельный дополнительный насос, синхронизированный с основным в режиме, при котором происходит остановка дополнительного насоса при остановке основного насоса, а поток через дополнительный насос не равен и не превышает поток через основной насос. Способ позволяет избежать циркуляторного ареста за счет применения антеградной перфузии головного мозга через брахиоцефальный ствол и антеградной дистальной перфузии тела, обеспечить профилактику висцеральной ишемии головного мозга и ишемии нижних конечностей, сократить количество ранних послеоперационных осложнений со стороны головного мозга, внутренних органов и нижних конечностей. 1 ил., 1 пр.
Способ проведения комбинированной перфузионной органопротекции при операциях на дуге аорты у взрослых пациентов, заключающийся в проведении искусственного кровообращения и антеградной перфузии головного мозга с параллельной антеградной перфузией нижней половины тела, отличающийся тем, что выполняют искусственное кровообращение и унилатеральную перфузию головного мозга через брахиоцефальный ствол, магистраль которого подключена к основному насосу, а антеградную дистальную перфузию тела выполняют через дополнительную артериальную магистраль, присоединенную к катетеру Фолея, который вводят в нисходящую аорту непосредственно перед формированием дистального аортального анастомоза, затем артериальную магистраль устанавливают в отдельный дополнительный насос, синхронизированный с основным в режиме, при котором происходит остановка дополнительного насоса при остановке основного насоса, а поток через дополнительный насос не равен и не превышает поток через основной насос.
| СПОСОБ ПРОВЕДЕНИЯ АДЕКВАТНОЙ ПЕРФУЗИИ ГОЛОВНОГО МОЗГА ПРИ ОПЕРАЦИЯХ НА ВОСХОДЯЩЕМ ОТДЕЛЕ И ЧАСТИ ДУГИ АОРТЫ БЕЗ ЦИРКУЛЯТОРНОГО АРЕСТА | 2019 |
|
RU2734466C1 |
| СПОСОБ УНИЛАТЕРАЛЬНОЙ ПЕРФУЗИИ ГОЛОВНОГО МОЗГА ПРИ ОПЕРАЦИЯХ НА ДУГЕ АОРТЫ | 2014 |
|
RU2570286C2 |
| Способ искусственного кровообращения при реконструктивной операции на дуге аорты | 2019 |
|
RU2724871C1 |
| Белов Ю.В., Чарчян Э.Р | |||
| Защита головного мозга в реконструктивной хирургии дуги аорты (обзор литературы) | |||
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| Stephane Leung Wai Sang, MD, et al., A simple method to establish antegrade cerebral perfusion during | |||
Авторы
Даты
2022-03-17—Публикация
2021-04-19—Подача