Данное изобретение относится к комбинированным препаратам и фармацевтическим композициям, и их применению в качестве лекарственных средств, в частности для лечения рака или инфекции, и к способам лечения рака или инфекции.
После выхода из тимуса интактные Т-клетки распространяются в кровь через лимфатические узлы и отыскивают чужеродные («не свои») антигены, презентированные специфическими антиген-презентирующими клетками (APC), как правило, дендритными клетками. Т-клетки могут распознавать не только патоген-ассоциированные антигены, но также аномально экспрессируемые собственные белки - выделяющие мутированные или трансформированные туморогенные клетки - как «не свои». Если Т-клетки обнаруживают свой специфический антиген в контексте подходящих костимулирующих молекул, клетки активируются и повышающе регулируют активацию и молекулы хоминга. Эти Т-клетки, называемые эффекторные Т-клетки, способны попадать в воспаленные ткани в поисках зараженных или раковых клеток. Среди других функций, эффекторные Т-клетки могут продуцировать воспалительные цитокины и/или цитолитические гранулы, приводя к апоптозу или некрозу инфицированных или опухолевых клеток.
На протяжении всего иммунного ответа локальные и системные понижающе регулирующие силы минимизируют повреждение здоровых клеток и тканей. Они могут включать иммуносупрессивные цитокины, регуляторные Т-клетки (Treg) и передачу отрицательных сигналов из других клеток. Опухолевые антигенспецифические Т-клетки демонстрируют ослабленную эффекторную функцию и истощенный фенотип, характеризующийся сниженной выработкой провоспалительных цитокинов и гипореактивностью на антигенную рестимуляцию. Это опосредуется клеточными внешними механизмами, такими как регуляторные Т-клетки (Treg), и клеточными внутренними механизмами, такими как ингибирующие молекулы, которые повышающе регулируются в истощенных инфильтрирующих опухоль лимфоцитах (TIL).
Пути иммунных контрольных точек сильно понижающе регулируют активацию Т-клеток с целью удержания под контролем начинающейся Т-клеточной иммунной реакции и уменьшения вероятности иммунной атаки против нормальных тканей. Однако во время опухолеобразования раковые клетки могут задействовать эти коингибирующие пути, чтобы противостоять обнаружению или избежать элиминации адаптивной иммунной системой. Белок запрограммированной смерти клетки 1 (PD-1) является важнейшей молекулой контрольной точки, которая экспрессируется Т-клетками при активации. Как полагают, путь контрольной точки PD-1 действует в первую очередь в периферических тканях для подавления происходящих иммунных ответов и/или предупреждения повреждения собственных тканей. Помимо Т-клеток, PD-1 экспрессируется В-клетками, клетками натуральными киллерами (NK), дендритными клетками и активированными моноцитами. Лиганды PD-1 - которые, среди других, включают PD-L1 и PD-L2 - экспрессируются макрофагами и моноцитами, и они могут быть индуцированы в ряде типов клеток в воспалительной среде.
Способность неиммунных клеток экспрессировать лиганды для PD-1, в первую очередь PD-L1, используется опухолями как один из способов избежать иммунной атаки. Опухолевые клетки также могут понижающе регулировать экспрессию антигена во избежание обнаружения. В дополнение, продукция иммуносупрессивных медиаторов и удерживание Treg и иммуносупрессивных клеток в микроокружении опухоли может подавлять противоопухолевые иммунные ответы.
Фигура 1 (взятая у Harvey, Clinical Pharmacology & Therapeutics, 2014, Vol. 96(2), pages 214-223) показывает роль пути PD-1 в ускользании от противоопухолевого иммунологического надзора и механизм действия блокады пути PD-1: (a) PD-1 при активации Т-клеток. Т-клетки активируются посредством (i) связывания MHC плюс пептид на APC с TCR и затем (ii) связывания CD80/86 APC с CD28 T-клеток. У больных раком опухолевые клетки также служат в качестве APC. При активации Т-клеток индуцируется экспрессия PD-1; (b) PD-1 при истощении T-клеток. В ситуациях хронической инфекции или постоянной стимуляции PD-L1 посылает сигналы через PD-1 T-клетки для «выключения» Т-клеток с целью минимизировать повреждение здоровой ткани (блокируется сигнальный путь активации). Опухолевые клетки могут повышающее регулировать PD-L1 с целью «выключения» Т-клеток, которые могут их разрушить. (c) Блокирование сигнального пути PD-1/PD-L1 позволяет Т-клеткам сохранять их эффекторные функции. У больных раком активированные опухолеспецифические Т-клетки могут убивать опухолевые клетки и секретировать цитокины, которые активируют /рекрутируют другие иммунные клетки для участия в противоопухолевом ответе.
Клонирование PD-1 описано у Ishida, et al. (The EMBO Journal (1992), vol.11(11), p.3887-3895). Последовательность кДНК человеческого PD-1 зарегистрирована под номером доступа GenBank NM_005018. Последовательность кДНК человеческого PD-L1 дана под номером доступа GenBank AF233516, а последовательность кДНК человеческого PD-L2 дана под номером доступа GenBank NM_025239.
В сентябре 2014 года Администрация США по пищевым продуктам и лекарственным веществам (FDA) выдала ускоренное одобрение для кейтруды (пембролизумаб) для лечения больных с прогрессирующей или нерезектабельной меланомой, которые больше не реагируют на другие лекарственные препараты. Кейтруда (Merck & Co.) представляет собой гуманизированное моноклональное антитело IgG4 против PD-1. Оно содержит последовательности вариабельного участка очень высокоаффинного мышиного антитела к PD-1 человека, привитого в человеческий иммуноглобулин IgG4, с изменениями для повышения стабильности. Кейтруда блокирует связывание PD-1 с PD-L1 и PD-L2.
В декабре 2014 года FDA США также дала ускоренное одобрение для Опдиво (ниволумаб), нового лечения больных с нерезектабельной или метастатической меланомой, которые больше не реагируют на другие лекарственные препараты. Опдиво (Bristol-Myers Squibb) представляет собой полностью человеческое моноклональное антитело IgG4 к PD-1, которое блокирует связывание PD-1 с PD-L1 и PD-L2.
Ниволумаб подвергли самой глубокой клинической оценке при раке легкого среди ингибиторов пути PD-1. Очевидность действия как в виде монотерапии при плоскоклеточном и неплоскоклеточном немелкоклеточном раке легких (NSCLC), так и в комбинации с традиционной химиотерапией продемонстрирована у больных NSCLC. Пембролизумаб оценивали в продолжающихся клинических испытаниях у больных NSCLC (NCT01295827).
Ряд других перспективных агентов, нацеленных на путь PD-1 (ингибиторы пути PD-1) находятся в клинической разработке (см. таблицу 1.1 ниже):
Таблица 1.1. Ингибиторы пути PD-1 в клинической разработке, кроме пембролизумаба и ниволумаба (взято в таблице 1 Harvey, Clinical Pharmacology & Therapeutics, 2014, Vol. 96(2), pages 214-223)
ADCC, антителозависимая клеточно-опосредованная цитотоксичность; IgG, иммуноглобулин G; PD-1, запрограммированной смерти-1; PD-L1, лиганд 1 PD.
Дополнительным ингибитором пути PD-1 в клинической разработке является Авелумаб (также известный как MSB0010718C), полностью человеческое анти-PD-L1 моноклональное антитело IgG1, совместно разрабатываемый Merck KGaA и Pfizer.
Несмотря на недавнее одобрение FDA Кейтруды и Опдиво для лечения прогрессирующей меланомы и многообещающие результаты против NSCLC в клинических испытаниях от агентов, нацеленных на путь PD-1, остается потребность в предоставлении более эффективных видов лечения рака, в предоставлении видов лечения, эффективных для более широкого количества больных раком, в предоставлении эффективных видов лечения других видов рака и в предоставлении эффективных видов лечения рака с уменьшенными побочными эффектами.
Ген активации лимфоцитов 3 (LAG-3) представляет собой мембранный белок гомолога CD4 типа I с четырьмя внеклеточными доменами суперсемейства иммуноглобулинов. Подобно CD4, LAG-3 образует олигомеры на поверхностях Т-клеток и связывается с молекулами MHC класса II на антиген-презентирующих клетках (APC), но со значительно большей аффинностью, чем CD4. LAG-3 экспрессируется на активированных T-лимфоцитах CD4+ и CD8+, где он связывается с комплексом CD3/рецептор Т-клетки на поверхности клетки и понижающе регулирует передачу сигнала. Как следствие, он понижающе регулирует пролиферацию, функцию и гомеостаз T-клеток. LAG-3 повышающе регулируется на истощенных Т-клетках по сравнению с эффекторными или Т-клетками памяти. LAG-3 также повышающе регулируется на инфильтрирующих опухоли лимфоцитах (TIL), и блокада LAG-3 с применением анти-LAG-3 антител может усиливать противоопухолевые T-клеточные ответы.
Blackburn et al (Nat Immunol. 2009; 10(1): 29-37) описывают корегулирование истощения T-клеток CD8+ во время хронической вирусной инфекции многими ингибирующими рецепторами. Используя мышиную модель вируса хронического лимфоцитарного хориоменингита (LCMV), авторы продемонстрировали, что истощенные антигенспецифические Т-клетки CD8+ повышали экспрессию вплоть до семи ингибирующих рецепторов (PD-1, LAG3, 2B4, CD160, CTLA-4, PIR-B и GP49) по сравнению с клетками памяти или интактными Т-клетками CD8+. Коэкспрессия множественных отдельных ингибирующих рецепторов была связана с более значительным истощением T-клеток и более серьезной инфекцией. Блокада T-клеточных ингибирующих рецепторов PD-1 и LAG-3 (с применением анти-PD-L1 и анти-LAG-3 антител) улучшала Т-клеточные ответы и снижала вирусную нагрузку in vivo.
Woo et al (Cancer Research 2011; 72(4): 917-927) описывают коэкспрессию PD-1 и LAG-3 на инфильтрирующих опухоль Т-клетках CD4+ и CD8+ в трансплантируемых опухолях. Двойное лечение антителами анти-LAG-3/анти-PD-1 излечило большинство мышей с развившимися опухолями, которые были большей частью резистентны к лечению единственным антителом.
На основании иммуномодулирующей роли LAG-3 в функции T-клеток при хронических инфекциях и раке, прогнозируемый механизм действия для LAG-3-специфичных моноклональных антител состоит в ингибировании отрицательной регуляции опухолеспецифических эффекторных Т-клеток.
LAG-3 также кодирует альтернативный вариант сплайсинга, который транслируется в растворимую форму LAG-3 (sLAG-3). В виде растворимой молекулы, LAG-3 активирует антиген-презентирующие клетки (APC) посредством передачи сигналов MHC класса II, приводя к увеличенным ответам антигенспецифических T-клеток in vivo (Triebel, Trends Immunol., 2003, 24: 619-622).
Основной противоопухолевый иммунный ответ опосредован через активацию цитотоксических (Tc1) Т-клеток CD8 типа 1, NK-клеток и моноцитов/макрофагов. В кратковременных анализах ex vivo растворимая форма белка LAG-3 (IMP321) индуцирует соответствующий ответ цитотоксического типа в мононуклеарных клетках периферической крови (PBMC) (Brignone et al, Journal of Immunology, 2007, 179: 4202-4211). IMP321 связывается с меньшей частью клеток MHC класса II+ в PBMC, включая все миелоидные дендритные клетки, и с небольшой фракцией моноцитов. Через четыре часа после добавления IMP321 PBMC данные миелоидные клетки продуцируют TNF-α и CCL4. Через 18 часов 1% Т-клеток CD8+ и 3,7% NK-клеток продуцируют цитокины Tc1, такие как IFN-α и/или TNF-α. Ранняя активация APC посредством IMP321 необходима для данной активации Tc1-типа, поскольку чистые отсортированные Т-клетки CD8+ не могут быть активированы IMP321. Только «обученные» антигеном, полностью дифференцированные Т-клетки CD8 гранзим+ (эффекторные и эффекторные клетки памяти, но не интактные или центральные Т-клетки памяти) индуцируются IMP321 для полной активации Tc1.
В настоящее время установлено, что ингибитор пути PD-1 (антитело анти-PD-1 или антитело анти-PD-L1) и растворимое производное LAG-3 (IMP321), действующее как активатор APC, вместе синергетически активируют Т-клетки (в частности, Т-клетки CD8+) in vitro.
Данная синергетическая активация Т-клеткой является неожиданной. При двухкомпонентном лечении антителами анти-LAG-3/анти-PD-1, описанном Woo et al (supra), антитело анти-LAG-3, как ожидается, подавляет отрицательную регуляцию опухолеспецифических эффекторных Т-клеток посредством LAG-3, тогда как растворимое производное LAG-3 (IMP321), как ожидается, действует через иной механизм, такой как активатор APC.
Согласно изобретению, предоставлен комбинированный препарат, который содержит: (a) белок LAG-3 или его производное, которое способно связываться с молекулами MHC класса II; и (b) ингибитор пути PD-1.
Термин «комбинированный препарат», как используется в данной заявке, относится к «набору частей» в том смысле, что компоненты (a) и (b) комбинации, как определено выше, можно дозировать независимо или посредством использования различных комбинированных препаратов с различными количествами компонентов (a) и (b) комбинации. Компоненты можно вводить одновременно или друг за другом. Если компоненты вводят друг за другом, предпочтительно промежуток времени между введениями выбирают такой, чтобы терапевтический эффект комбинированного использования компонентов был больше, чем эффект, который мог бы быть получен посредством применения только какого-либо одного из компонентов (a) и (b) комбинации.
Компоненты комбинированного препарата могут присутствовать в одной комбинированной стандартной лекарственной форме, или в виде первой стандартной лекарственной формы компонента (a) и отдельной второй стандартной лекарственной формы компонента (b). Соотношение общих количеств компонента (a) комбинации и компонента (b) комбинации, подлежащих введению в комбинированном препарате, может варьировать, например, чтобы справиться с потребностями субпопуляции больных, подлежащих лечению, или с потребностями отдельного больного, которые могут быть обусловлены, например, конкретных заболеванием, возрастом, полом или массой тела больного.
Предпочтительно, существует по меньшей мере одно благотворное действие, например, улучшение действия ингибитора пути PD-1, или улучшение действия LAG-3 или его производного, или взаимное улучшение действия компонентов (a) и (b) комбинации, например, более чем аддитивное действие, дополнительные преимущественные действия, меньшие побочные эффекты, меньшая токсичность или комбинированный терапевтический эффект по сравнению с эффективной дозой одного или обоих компонентов (a) и (b) комбинации, и весьма предпочтительно, синергизм компонентов (a) и (b) комбинации.
Комбинированный препарат изобретения может быть предоставлен в виде фармацевтического комбинированного препарата для введения млекопитающему, предпочтительно человеку. Вместе с фармацевтически приемлемым носителем, эксципиентом или разбавителем необязательно может быть предоставлен белок LAG-3 или его производное, и/или вместе с фармацевтически приемлемым носителем, эксципиентом или разбавителем необязательно может быть предоставлен ингибитор пути PD-1.
LAG-3 или его производное может присутствовать в дозе, которая представляет собой молярный эквивалент, составляющий 0,25-30 мг, 1-30 мг или 6-30 мг производного LAG-3, LAG-3Ig слитого белка IMP321. Основываясь на результатах фармакокинетических данных, полученных у пациентов с метастатическим почечно-клеточным раком, было показано, что дозы 6-30 мг на подкожную (s.c.) инъекцию IMP321 являются безопасными и предоставляют приемлемое системное воздействие. Концентрация в крови IMP321, превышающая 1 нг/мл в течение по меньшей мере 24 часов после s.c. инъекции, получена у больных, которым инъецировали дозы IMP321 более 6 мг.
Комбинированный препарат изобретения может содержать множество доз белка LAG-3 или его производного.
Ингибитор пути PD-1 может представлять собой агент, который ингибирует связывание PD-1 с PD-L1 и/или PD-L2. В частности, агент может ингибировать связывание человеческого PD-1 с человеческим PD-L1 и/или человеческим PD-L2. Агент может ингибировать связывание PD-1 с PD-L1 и/или PD-L2 по меньшей мере на 50%, 60%, 70%, 80% или 90%. Приемлемые анализы для определения связывания PD-1 с PD-L1 или PD-L2, посредством анализа с использованием поверхностного плазмонного резонанса (SPR) или анализ методом проточной цитометрии описаны у Ghiotto et al (Int. Immunol. Aug 2010; 22(8): 651-660). Агент может ингибировать связывание PD-1 с PD-L1 и/или PD-L2, например, посредством связывания с PD-1, с PD-L1 или с PD-L2. Агент может представлять собой антитело, подходящее моноклональное антитело, такое как человеческое или гуманизированное моноклональное антитело. Агент может представлять собой фрагмент или производное антитела, которое сохраняет способность ингибировать связывание PD-1 с PD-L1 и/или PD-L2.
Примеры антител анти-PD-1, пригодных для применения согласно изобретению, включают: пембролизумаб (MK-3475), гуманизированное моноклональное антитело IgG4; Ниволумаб, полностью человеческое моноклональное антитело IgG4; Пидилизумаб (CT-011), гуманизированное IgG1 моноклональное антитело. Примером ингибитора пути PD-1, который связывается с PD-1, но не является антителом, является AMP-224. AMP-224 представляет собой рекомбинантный слитый белок внеклеточного домена PD-L2 и Fc-участок человеческого IgG. AMP-224 вызывает истощение Т-клеток, высоко экспрессирующих PD-1. Примеры анти-PD-L1 антител, пригодных для применения согласно изобретению, включают: BMS-936559, полностью человеческое IgG4 моноклональное антитело; MEDI4736 (Durvalumab), полностью человеческое моноклональное антитело; MPDL3280A, человеческое моноклональное антитело, содержащее Fc-домен сконструированного IgG для предотвращения ADCC; Авелумаб (также известный как MSB0010718C), полностью человеческое анти-PD-L1 IgG1 моноклональное антитело.
Доза ингибитора пути PD-1 будет зависеть от конкретного используемого ингибитора пути PD-1. В целом, обычно назначаемая доза ингибитора пути PD-1 для больного человека может составлять от 0,1 до 10 мг/кг, например, от 0,1 до 1 мг/кг или от 1 до 10 мг/кг. Термин «обычно назначаемая доза» используется в данной заявке для включения дозы, которая является такой же, как доза или в пределах диапазона доз, которая является безопасной и терапевтически эффективной для введения субъекту (соответственно, субъекту человеку) в виде монотерапии, или которая одобрена соответствующим регулирующим органом для введения субъекту (соответственно, субъекту человеку) в виде монотерапии. Примеры обычно назначаемых человеку доз известных ингибиторов пути PD-1 при использовании в виде монотерапии включают:
Пембролизумаб (MK-3475): 2-10 мг/кг каждые две или три недели. Например, FDA США одобрила введение 2 мг/кг Кейтруды (пембролизумаб) в виде внутривенной инфузии в течение 30 минут каждые 3 недели;
Ниволумаб: 0,1-10 мг/кг каждые две недели. Например, FDA США одобрила введение 3 мг/кг Опдиво (ниволумаб) в виде внутривенной инфузии в течение 60 минут каждые 2 недели;
BMS-936559: 0,3-10 мг/кг каждые две недели.
Ингибитор пути PD-1 можно вводить любым пригодным путем, например, парентерально (включая подкожную, внутривенную или внутримышечную инъекцию). Ингибиторы пути PD-1, одобренные или находящиеся в разработке в настоящее время, вводят в виде внутривенной инфузии.
Комбинированный препарат изобретения может включать множество доз ингибитора пути PD-1.
Белок LAG-3 может представлять собой выделенный природный или рекомбинантный белок LAG-3. Белок LAG-3 может включать аминокислотную последовательность белка LAG-3 от любых пригодных видов, таких как белок LAG-3 мышей и приматов, но предпочтительно человеческий белок LAG-3. Аминокислотная последовательность человеческого и мышиного белка LAG-3 представлена на Фигуре 1 у Huard et al (Proc. Natl. Acad. Sci. USA, 11: 5744-5749, 1997). Последовательность человеческого белка LAG-3 повторена на Фигуре 15 ниже (SEQ ID NO: 1). Аминокислотные последовательности четырех внеклеточных доменов суперсемейства Ig (D1, D2, D3, и D4) человеческого LAG-3 также определены на Фигуре 1 у Huard et al., с аминокислотными остатками: 1-149 (D1); 150-239 (D2); 240-330 (D3); и 331-412 (D4).
Производные белка LAG-3 включают растворимые фрагменты, варианты или мутанты белка LAG-3, которые способны связываться с молекулами MHC класса II. Известно, что некоторые производные белка LAG-3 способны связываться с молекулами MHC класса II. Многие примеры таких производных описаны у Huard et al (Proc. Natl. Acad. Sci. USA, 11: 5744-5749, 1997). Данный документ описывает характеристики сайта связывания MHC класса II на белке LAG-3. Описаны способы получения мутантов LAG-3, а также количественный анализ клеточной адгезии для определения способности мутантов LAG-3 связывать позитивные клетки Дауди класса II. Было определено связывание некоторых различных мутантов LAG-3 с молекулами MHC класса II. Некоторые мутации были способны снижать связывание класса II, тогда как другие мутации повышали аффинность LAG-3 для молекул класса II. Многие из остатков, важных для связывания белков MHC класса II, собраны в основе большой внепетлевой структуры домена D1 LAG-3 из 30 аминокислот. Аминокислотная последовательность внепетлевой структуры домена D1 человеческого белка LAG-3 представляет собой GPPAAAPGHPLAPGPHPAAPSSWGPRPRRY (SEQ ID NO: 2), подчеркнутая последовательность на Фигуре 15.
Производное белка LAG-3 может содержать внепетлевую последовательность из 30 аминокислот домена D1 человеческого LAG-3 или вариант такой последовательности с одной или более консервативными аминокислотными заменами. Вариант может содержать аминокислотную последовательность, которая имеет по меньшей мере 70%, 80%, 90% или 95% идентичность аминокислот с 30 аминокислотами внепетлевой последовательности домена D1 человеческого LAG-3.
Производное белка LAG-3 может содержать аминокислотную последовательность домена D1, и необязательно домена D2, белка LAG-3, предпочтительно человеческого белка LAG-3.
Производное белка LAG-3 может содержать аминокислотную последовательность, которая имеет по меньшей мере 70%, 80%, 90% или 95% идентичность аминокислот с доменом D1, или с доменом D1 и D2, белка LAG-3, предпочтительно человеческого белка LAG-3.
Производное белка LAG-3 может содержать аминокислотную последовательность доменов D1, D2, D3 и необязательно D4, белка LAG-3, предпочтительно человеческого белка LAG-3.
Производное белка LAG-3 может содержать аминокислотную последовательность, которая имеет по меньшей мере 70%, 80%, 90% или 95% идентичность аминокислот с доменом D1, D2 и D3 или с доменом D1, D2, D3 и D4, белка LAG-3, предпочтительно человеческого LAG-3.
Идентичность последовательностей между аминокислотными последовательностями можно определить посредством сравнения выравнивания последовательностей. Когда эквивалентная позиция в сравниваемых последовательностях занята одной и той же аминокислотой, тогда молекулы в той позиции являются идентичными. Оценка выравнивания в процентах от идентичности является функцией количества идентичных аминокислот в позициях, общих для сравниваемых последовательностей. При сравнении последовательностей оптимальные выравнивания могут потребовать, чтобы гэпы, вводимые в одну или более последовательностей, учитывали возможные вставки и делеции в последовательностях. В способах сравнения последовательностей можно использовать штраф за гэпы, так что для одинакового числа идентичных молекул в сравниваемых последовательностях выравнивание последовательности с как можно меньшим числом пробелов, отражающее более высокую связанность между двумя сравниваемыми последовательностями, будет получать более высокую оценку, чем выравнивание с множеством гэпов. Вычисление максимального процента идентичности предполагает получение оптимального выравнивания с учетом штрафов за гэпы.
Пригодные компьютерные программы для проведения сравнения последовательностей широко доступны в коммерческом и государственном секторе. Примеры включают MatGat (Campanella et al., 2003, BMC Bioinformatics 4: 29; программу, доступную на http://bitincka.com/ledion/matgat), Gap (Needleman & Wunsch, 1970, J. Mol. Biol. 48: 443-453), FASTA (Altschul et al., 1990, J. Mol. Biol. 215: 403-410; программу, доступную на http://www.ebi.ac.uk/fasta), Clustal W 2.0 и X 2.0 (Larkin et al., 2007, Bioinformatics 23: 2947-2948; программу, доступную на http://www.ebi.ac.uk/tools/clustalw2) и EMBOSS Pairwise Alignment Algorithms (Needleman & Wunsch, 1970, supra; Kruskal, 1983, В: Time warps, string edits и macromolecules: the theory и practice sequence comparison, Sankoff & Kruskal (eds), pp 1-44, Addison Wesley; программ, доступных на http://www.ebi.ac.uk/tools/emboss/align). Все программы можно запускать с использованием параметров по умолчанию.
Например, сравнение последовательностей может быть проведено с использованием метода «иглы» EMBOSS Pairwise Alignment Algorithms, который определяет оптимальное выравнивание (включая гэпы) двух последовательностей при рассмотрении по всей их длине и предоставляет процентную оценку идентичности. Параметры по умолчанию для сравнения последовательностей аминокислот (опция «Protein Molecule») могут представлять собой Штраф за продолжение гэпа: 0.5, Штраф за открытие гэпа: 10.0, Матрица: Blosum 62.
Сравнение последовательностей может выполняться по всей длине эталонной последовательности.
Производное белка LAG-3 может быть слито с аминокислотной последовательностью Fc иммуноглобулина, предпочтительно аминокислотной последовательностью Fc человеческого IgG1, необязательно посредством линкерной аминокислотной последовательности.
Способность производного белка LAG-3 связываться с молекулами MHC класса II можно определить с применением количественного анализа клеточной адгезии, как описано у Huard et al (supra). Аффинность производного белка LAG-3 для молекул MHC класса II может составлять по меньшей мере 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 100% аффинности человеческого белка LAG-3 для молекул класса II. Предпочтительно аффинность производного белка LAG-3 для молекул MHC класса II составляет по меньшей мере 50% аффинности человеческого белка LAG-3 для молекул класса II.
Примеры пригодных производных белка LAG-3, которые способны связываться с молекулами MHC класса II, включают производные, в том числе:
аминокислотные остатки с 23 по 448 последовательности человеческого LAG-3;
аминокислотную последовательность доменов D1 и D2 LAG-3;
аминокислотную последовательность доменов D1 и D2 LAG-3 с замещением аминокислот в одной или более из следующих позиций: позиция 73, где ARG замещен GLU; позиция 75, где ARG замещен ALA или GLU; позиция 76, где ARG замещен GLU; позиция 30, где ASP замещен ALA; позиция 56, где HIS замещен ALA; позиция 77, где TYR замещен PHE; позиция 88, где ARG замещен ALA; позиция 103, где ARG замещен ALA; позиция 109, где ASP замещен GLU; позиция 115, где ARG замещен ALA;
аминокислотную последовательность домена D1 LAG-3 с делецией аминокислотных остатков с 54 по 66;
рекомбинантный растворимый человеческий слитый белок LAG-3Ig (IMP321) -димер 200 кДа, продуцируемый в клетках яичников китайского хомячка, трансфицированных плазмидой, кодирующей внеклеточный домен hLAG-3, слитый с Fc человеческого IgG1. Последовательность IMP321 дана в SEQ ID NO: 17 US 2011/0008331.
Согласно изобретению, также предоставлена фармацевтическая композиция, которая содержит (a) белок LAG-3 или его производное, который способен связываться с молекулами MHC класса II; (b) ингибитор пути PD-1; и (c) фармацевтически приемлемый носитель, эксципиент или разбавитель.
Согласно изобретению, дополнительно предоставлен комбинированный препарат или фармацевтическая композиция изобретения для применения в качестве лекарственного средства.
Изобретение также предоставляет комбинированный препарат или фармацевтическую композицию изобретения для предотвращения, лечения или улучшения рака.
Дополнительно согласно изобретению предоставлено применение комбинированного препарата или фармацевтической композиции изобретения в производстве лекарственного средства для предотвращения, лечения или улучшения рака.
Также предоставлен согласно изобретению способ предотвращения, лечения или улучшения рака, который включает введение белка LAG-3 или его производного, который способен связываться с молекулами MHC класса II, и ингибитор пути PD-1, субъекту, нуждающемуся в таком предотвращении, лечении или улучшении.
Авторы изобретения принимают во внимание, что комбинированные препараты и композиции изобретения также можно применять для предотвращения, лечения или улучшения инфекции, в частности хронической или персистирующей инфекции.
При острой инфекции активированные патогенспецифические цитотоксические CD8 T-лимфоциты (CTL) пролиферируют и приобретают эффекторные функции, такие как продукция цитокинов и цитотоксические свойства, которые позволяют им эффективно устранять инфекцию. После устранения остается небольшой пул патогенспецифических Т-клеток памяти, которые обладают способностью очень быстро реактивироваться и приобретать их уничтожающие функции после повторного воздействия того же патогена. Однако, во время хронической инфекции этого не происходит, поскольку патогенспецифические CTL, как обнаружено, функционально неполноценны и не способны элиминировать инфекцию. Эти истощенные CTL определяют посредством их нарушенной пролиферативной активности, продукции цитокинов и потери цитотоксической способности (см. Фигуру 1(b) и обзор Hofmeyer et al., Journal of Biomedicine и Biotechnology, Volume 2011, Article ID 451694).
Данный феномен был первоначально определен с использованием общепринятой мышиной модели хронической вирусной инфекции у мышей, вируса лимфоцитарного хориоменингита (LCMV) (Zajac, et al., The Journal of Experimental Medicine, vol. 188, no. 12, pp. 2205-2213, 1998; Gallimore, et al., The Journal of Experimental Medicine, vol. 187, no. 9, pp. 1383-1393, 1998.). Штамм Armstrong LCMV вызывает острую инфекцию, которая устраняется иммунной системой, генерирующей стойкую память CTL. С другой стороны, штамм Клон 13 LCMV создает хроническую инфекцию у мышей, которая приводит CTL в состояние истощения и не способна устранять инфекцию. Дополнительно, по сравнению с нормальными Т-клетками, истощенные CTL имеют метаболический дефицит и измененную экспрессию генов, участвующих в хемотаксисе, адгезии и миграции (Wherry, et al., Immunity, vol. 27, no. 4, pp. 670-684, 2007).
В исследовании, проведенном с целью выявления механизмов, приводящих к истощению, генетический профиль истощенных CTL от хронической инфекции LMCV сравнивали с генетическим профилем функциональных CTL, реагирующих на острую инфекцию LCMV (Barber, et al., Nature, vol. 439, no. 7077, pp. 682-687, 2006). Было обнаружено, что истощенные CTL имеют значительную сверхэкспрессию PD-1, тогда как функциональные LCMV-специфичные CTL не имели ощутимой экспрессии PD-1. Было обнаружено, что экспрессия PD-1 коррелирует с определенным функциональным нарушением, наблюдаемым в истощенных Т-клетках и, в свою очередь, с более высокой вирусной нагрузкой. Блокирование пути PD-1/PD-L1 антитело анти-PD-L1м у хронически инфицированных мышей приводило к усиленному ответу CTL, который вызывает снижение вирусной нагрузки. Экспрессия PD-1 истощенными CTL зависит от персистирующей антигенспецифической стимуляции, поскольку потеря презентации специфического эпитопа при хронической инфекции приводит к функциональному восстановлению и снижению экспрессии PD-1 на эпитопспецифических CTL (Blattman, et al., Journal of Virology, vol. 83, no. 9, pp. 4386-4394, 2009). Персистирующая антигенная стимуляция при хронической вирусной инфекции имеет прогрессирующее влияние на потерю функции CTL и коррелированное увеличение экспрессии PD-1, что означает, что более истощенные CTL (PD-1hi) менее восприимчивы к функциональному спасению посредством блокады PD-1, нежели другие (PD-1int) (Blackburn, et al., Proceedings of the National Academy of Sciences of the United States of America, vol. 105, no. 39, pp. 15016-15021, 2008).
Согласно изобретению, дополнительно предоставлен комбинированный препарат или фармацевтическая композиция изобретения для применения при предотвращении, лечении или улучшении инфекции.
Также предоставлено согласно изобретению применение комбинированного препарата или фармацевтической композиции изобретения в производстве лекарственного средства для предотвращения, лечения или улучшения инфекции.
Также согласно изобретению предоставлен способ предотвращения, лечения или улучшения инфекции, который включает введение белка LAG-3 или его производного, которое способно связываться с молекулами MHC класса II, и ингибитор пути PD-1, субъекту, нуждающемуся в таком предотвращении, лечении или улучшении.
В конкретных вариантах осуществления инфекция представляет собой хроническую или персистирующую инфекцию. Термин «хроническая или персистирующая инфекция» используется в данной заявке для ссылки на инфицирование патогеном, который индуцирует классический ответ CTL у инфицированного субъекта, но инфекция не устраняется, приводя к присутствию истощенных PD-1-экспрессирующих, патогенспецифических CTL с нарушенной способностью к пролиферации, выработке цитокинов и потере цитотоксических свойств.
Примеры инфекций, которые можно лечить согласно изобретению, включают вирусные, бактериальные, грибковые или протозойные инфекции, особенно хронические или персистирующие вирусные, бактериальные, грибковые или протозойные инфекции.
Вирусная инфекция может быть вызвана, например, аденовирусом, аденоассоциированным вирусом, вирусом В (macacine herpesvirus I), вирусом ВК, буньявирусом, вирусом чикунгунья, вирусом Коксаки, коронавирусом, цитомегаловирусом, вирусом восточного лошадиного энцефалита, вирусом Эбола, энтеровирусом, вирусом Эпштейна-Барр, хантавирусом, вирусом гепатита А, вирусом гепатита В, вирусом гепатита С, вирусом гепатита D, вирусом гепатита Е, вирусом герпеса, вирусом простого герпеса 1, вирусом простого герпеса 2, пенящимся вирусом человека, вирусом герпеса человека 3, вирусом герпеса человека 5, вирусом герпеса человека 6, вирусом герпеса человека 7, вирусом иммунодефицита человека, папилломавирусом человека, β-лимфотропным вирусом человека, вирусом человеческого Т-клеточного лейкоза I, вирусом человеческого Т-клеточного лейкоза II, вирусом гриппа, вирусом Джона Каннингема, JEV, герпесвирусом, ассоциированным с саркомой Капоши, вирусом Ласса, вирусом лимфоцитарного хориоменингита, вирусом Марбурга, вирусом кори, вирусом эпидемического паротита, вирусом Нипах, норовирусом, вирусом Норфолк, ортореовирусом, вирусом парагриппа, парвовирусом, полиовирусом, вирусом бешенства, реовирусом, респираторно-синцитиальным вирусом, риновирусом, вирусом лихорадки Рифт-Валли, ротавирусом, вирусом краснухи, вирусом натуральной оспы, вирусом энцефалита Сент-Луис, вирусом variola major, вирусом variola minor, вирусом ветряной оспы, вирусом лихорадки западного Нила, вирусом западного энцефалита лошадей или вирусом желтой лихорадки).
В конкретных вариантах осуществления вирусная инфекция вызвана вирусом гепатита (например, вирусом гепатита В, вирусом гепатита С), лентивирусом (например, вирусом иммунодефицита человека) или вирусом герпеса (например, вирусом простого герпеса 1, вирусом простого герпеса 2).
Бактериальная инфекция может быть вызвана, например, Escherichia coli, Clostridium difficile, Salmonella thyphimurium, Pseudomonas aeruginosa, Vibrio cholerae, Neisseria gonorrhoeae, Helicobacter pylori, Hemophilus influenzae, Shigella dysenteriae, Staphylococcus aureus, Mycobacterium tuberculosis, Streptococcus pneumonia или Chlamydia trachomatis.
Грибковая инфекция может быть вызвана, например, Candida, Aspergillus, Cryptococcus, Coccidioides, Histoplasma, Pneumocystis или Stachybotrys.
Протозойная инфекция может быть вызвана, например, Amoebozoa, Excavata, Chromalveolata, Entamoeba, Plasmodium, Giardia, Trypanosoma, Coccidia, Besnoitia, Dicrocoelium или Leishmania.
Дополнительно согласно изобретению предоставлен комбинированный препарат или фармацевтическая композиция изобретения для применения при предотвращении, лечении или улучшении заболевания, расстройства или патологического состояния, которое можно лечить, предотвратить или улучшить посредством активации Т-клеток, в частности посредством активации CD8-положительных Т-клеток.
Также согласно изобретению предоставлено применение комбинированного препарата или фармацевтической композиции изобретения при производстве лекарственного средства для предотвращения, лечения или улучшения заболевания, расстройства или патологического состояния, которое можно лечить, предотвратить или улучшить посредством активации Т-клеток, в частности посредством активации CD8-положительных Т-клеток.
Также предоставлен согласно изобретению способ предотвращения, лечения или улучшения заболевания, расстройства или патологического состояния, которое можно лечить, предотвратить или улучшить посредством активации Т-клеток, в частности посредством активации CD8-положительных Т-клеток, который включает введение белка LAG-3 или его производного, который способен связываться с молекулами MHC класса II, и ингибитора пути PD-1, субъекту, нуждающемуся в таком предотвращении, лечении или улучшении.
В некоторых вариантах осуществления заболевание, расстройство или патологическое состояние, которое можно лечить, предотвратить или улучшить посредством активации Т-клеток, может не включать рак.
Также предоставлен согласно изобретению комбинированный препарат или фармацевтическая композиция изобретения для применения с целью улучшения иммунного ответа, опосредованного T-клетками, в частности иммунного ответа, опосредованного CD8-положительными T-клетками.
Изобретение также предоставляет применение комбинированного препарата или фармацевтической композиции изобретения в производстве лекарственного средства для улучшения иммунного ответа, опосредованного T-клетками, в частности иммунного ответа, опосредованного CD8-положительными T-клетками.
Согласно изобретению дополнительно предоставлен способ улучшения иммунного ответа, опосредованного T-клетками, в частности иммунного ответа, опосредованного CD8-положительными T-клетками, который включает введение белка LAG-3 или его производного, который способен связываться с молекулами MHC класса II, и ингибитор пути PD-1, субъекту, нуждающемуся в таком улучшенном иммунном ответе, опосредованном T-клетками.
В некоторых вариантах осуществления улучшение иммунного ответа, опосредованного T-клетками, или иммунного ответа, опосредованного CD8-положительными T-клетками, может не включать предотвращение, лечение или улучшение рака.
Белок LAG-3 или его производное и ингибитор пути PD-1 можно вводить субъекту последовательно, т.е. белок LAG-3 или его производное можно вводить перед, вместе или после ингибитора пути PD-1.
Белок LAG-3 или его производное и ингибитор пути PD-1 можно вводить субъекту в течение 96 часов, 72 часов, 48 часов, 24 часов или 12 часов друг от друга.
В качестве альтернативы, белок LAG-3 или его производное и ингибитор пути PD-1 можно совместно вводить субъекту, например, в виде композиции, содержащей белок LAG-3 или его производное и ингибитор пути PD-1, или посредством одновременного введения раздельных доз белка LAG-3 или его производного и ингибитора пути PD-1.
Согласно некоторым вариантам осуществления, субъекту вводят множество доз белка LAG-3 или его производного и/или множество доз ингибитора пути PD-1.
Согласно некоторым вариантам осуществления, дозу белка LAG-3 или его производного вводят перед, вместе или после каждого введения двух или более доз ингибитора пути PD-1.
Например, дозу белка LAG-3 или его производного можно вводить в течение 96 часов, 72 часов, 48 часов, 24 часов или 12 часов, после каждого введения двух или более доз ингибитора пути PD-1.
Выбор соответствующих дозировок компонентов, используемых в комбинированной терапии в соответствии с настоящим изобретением может быть определен и оптимизирован специалистом в данной области, например, посредством наблюдения за больным, включая общее состояние больного, и ответ на комбинированную терапию. Оптимизация, например, может быть необходима, если определили, что больной не демонстрирует желаемый терапевтический эффект или наоборот, если больной испытывает нежелательные или неблагоприятные побочные эффекты, которые слишком многочисленны или имеют опасную степень тяжести.
Дозы компонентов, используемые в комбинированной терапии согласно изобретению, могут быть выбраны для предоставления терапевтически эффективного количества компонентов в комбинации.
«Эффективное количество» комбинированной терапии может представлять собой количество, которое приводит к уменьшению по меньшей мере одного патологического параметра, ассоциированного с раком. Например, в некоторых вариантах осуществления эффективное количество комбинированной терапии представляет собой количество, которое является эффективным для достижения уменьшения по меньшей мере приблизительно 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% или 90% патологического параметра по сравнению с ожидаемым уменьшением параметра, ассоциированным с раком, без комбинированной терапии. Например, патологический параметр может представлять собой опухолевый рост или скорость опухолевого роста.
В качестве альтернативы, «эффективное количество» комбинированной терапии может представлять собой количество, которое приводит к увеличению клинической пользы, связанной с лечением рака. Например, в некоторых вариантах осуществления «эффективное количество» комбинированной терапии представляет собой количество, которое является эффективным для достижения повышения по меньшей мере приблизительно 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% или 90% клинической пользы по сравнению с ожидаемой клинической пользой без комбинированной терапии. Например, клиническая польза может представлять собой скорость ответа опухоли на лечение, выживаемость без прогрессирования заболевания, общую выживаемость или повышенную чувствительность к последующему лечению.
В качестве альтернативы, «эффективное количество» комбинированной терапии может представлять собой количество, которое приводит к изменению по меньшей мере одного полезного параметра, связанного с лечением рака. Например, в некоторых вариантах осуществления «эффективное количество» комбинированной терапии представляет собой количество, которое является эффективным для достижения изменения параметра по меньшей мере приблизительно на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% или 90% по сравнению с ожидаемым изменением параметра, связанного с лечением рака без комбинированной терапии. Например, параметром может быть увеличение числа циркулирующих опухолевых антигенспецифических Т-клеток CD8+, или уменьшение числа опухолевых антигенспецифических регуляторные Т-клеток, или увеличение числа активированных Т-клеток, в частности активированных CD8+ Т-клеток, уменьшение числа истощенных антигенспецифических Т-клеток CD8+, или увеличение числа циркулирующих функциональных (т.е. неистощенных) антигенспецифических Т-клеток CD8+.
В вариантах осуществления, связанных с лечением инфекции, «эффективное количество» комбинированной терапии может представлять собой количество, которое приводит к уменьшению по меньшей мере одного патологического параметра, ассоциированного с инфекцией. Например, в некоторых вариантах осуществления эффективное количество комбинированной терапии представляет собой количество, которое является эффективным для достижения уменьшения по меньшей мере приблизительно 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% или 90% патологического параметра по сравнению с ожидаемым уменьшением параметра, ассоциированного с инфекцией без комбинированной терапии. Например, патологическим параметром может быть вирусная нагрузка (например, число вирусных частиц или количество вирусной ДНК на мл крови), бактериальная нагрузка (например, количество бактериальной ДНК на мл крови или число бактериальных колоний после 1-21 дня периода роста на различных агаровых пластинах).
Пригодные способы измерения вирусной и бактериальной нагрузки хорошо известны квалифицированным специалистам в данной области. Например, способы измерения вирусной нагрузки посредством ELISA сравнил Goldschmidt et al. (Clinical и Diagnostic Laboratory Immunology, July 1998, p. 513-518). Способы измерения вирусной нагрузки с использованием различных имеющихся на рынке анализов для обнаружения вирусной нуклеиновой кислоты сравнили Holguin et al. (Eur J Clin Microbiol Infect Dis. 1999 Apr; 18(4):256-9) и Swenson et al. (J. Clin. Microbiol. 2014 Feb; 52(2): 517-523). Примером статьи, описывающей измерение бактериальной нагрузки посредством ПЦР в реальном времени, является Nadkarni et al. (Microbiology (2002), 148, 257-266). Данная статья ссылается на Bergeyʹs Manual of Determinative Bacteriology, в настоящее время замененной на Bergeyʹs Manual of Systematic Bacteriology, 2nd Edition. Молекулярный анализ бактериальной нагрузки описан Honeyborne et al. (J. Clin. Microbiol. 2011 49:3905-3911, и J. Clin. Microbiol. 2014 Aug;52(8):3064-7). Перечень одобренных FDA скрининговых исследований для измерения вирусной и бактериальной нагрузок можно найти на сайте FDA по адресу:
www.fda.gov/BiologicsBloodVaccines/BloodBloodProducts/ApprovedProducts/LicensedProductsBLAs/BloodDonorScreening/InfectiousDisease/ucm080466.htm.
В качестве альтернативы, «эффективное количество» комбинированной терапии может представлять собой количество, которое приводит к увеличению клинической пользы, связанной с лечением инфекции. Например, в некоторых вариантах осуществления «эффективное количество» комбинированной терапии представляет собой количество, которое является эффективным для достижения увеличения клинической пользы по меньшей мере приблизительно на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% или 90% по сравнению с ожидаемой клинической пользой без комбинированной терапии.
В качестве альтернативы, «эффективное количество» комбинированной терапии может представлять собой количество, которое приводит к изменению по меньшей мере одного полезного параметра, связанного с лечением инфекции. Например, в некоторых вариантах осуществления «эффективное количество» комбинированной терапии представляет собой количество, которое является эффективным для достижения изменения параметра по меньшей мере приблизительно на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% или 90% по сравнению по сравнению с ожидаемым изменением параметра, связанного с лечением без комбинированной терапии. Например, параметром может быть увеличение числа активированных Т-клеток, в частности активированных Т-клеток CD8+, увеличение числа циркулирующих функциональных (т.е. неистощенных) антигенспецифических Т-клеток CD8+, или уменьшение числа истощенных антигенспецифических Т-клеток CD8+, или уменьшение числа антигенспецифических регуляторных Т-клеток.
Согласно изобретению, комбинированное лечение можно использовать для повышения терапевтического эффекта ингибитора пути PD-1, или белка LAG-3 или его производного по сравнению с действием ингибитора пути PD-1, или белка LAG-3 или его производного в виде монотерапии, или для уменьшения доз отдельных компонентов полученных в итоге комбинаций наряду с предотвращением или дополнительным снижением риска нежелательных или вредных побочных действий отдельных компонентов.
В одном варианте осуществления белок LAG-3 или его производное, и ингибитор пути PD-1 каждый назначают в дозе, которая находится в пределах обычно назначаемого диапазона доз для каждого соединения в виде монотерапии. Соединения могут назначаться в виде отдельных дозировок или в виде дозировки комбинации. Такие комбинации обеспечивают повышенную эффективность по сравнению с действием одного из соединений в виде монотерапии.
В другом варианте осуществления белок LAG-3 или его производное, и ингибитор пути PD-1 каждый назначают в дозе, которая ниже обычной назначаемой дозы для каждого компонента в виде монотерапии, но в дозах, которые обладают терапевтической эффективностью в комбинации. Компоненты могут назначаться в виде отдельных дозировок или в виде дозировки комбинации. Дозировки компонентов в комбинации могут быть выбраны, чтобы обеспечить такой же уровень терапевтической эффективности, как у белка LAG-3 или его производного, или ингибитора пути PD-1 в виде монотерапии, но с преимуществом в том, что более низкие дозы белка LAG-3 или его производного, и ингибитора пути PD-1 снижают риск неблагоприятных побочных действий по сравнению с назначаемыми дозировками каждого соединения в виде монотерапии.
В другом варианте осуществления назначаемая дозировка ингибитора пути PD-1 находится в пределах обычно назначаемого диапазона доз для монотерапии, и белок LAG-3 или его производное назначают в дозировке, которая ниже обычно назначаемой дозы для монотерапии.
В дополнительном варианте осуществления назначаемая дозировка ингибитора пути PD-1 ниже обычно назначаемой дозы для монотерапии, а белок LAG-3 или его производное назначают в дозировке, которая находится в пределах обычно назначаемого диапазона доз для монотерапии.
Предпочтительные дозировки ниже обычно назначаемой дозы для монотерапии представляют собой дозы, которые достигают 50% или 25% обычно назначаемой дозы. Например, дозировками ниже обычно назначаемой дозы для монотерапии могут быть дозы, которые составляют 1-50%, 1-25%, 1-10%, 2-50%, 2-25%, 2-10% обычно назначаемой дозы ингибитора пути PD-1 и/или белка LAG-3 или его производного.
Обычно назначаемая доза белка LAG-3 или его производного для монотерапии у субъекта человека может представлять собой дозу, которая является молярным эквивалентом, составляющим 0,25-30 мг, 1-30 мг или 6-30 мг производного LAG-3, LAG-3Ig слитого белка IMP321.
Обычно назначаемая доза ингибитора пути PD-1 для монотерапии у субъекта человека может составлять от 0,1 до 10 мг/кг, от 0,1 до 1 мг/кг или от 1 до 10 мг/кг. Например, обычно назначаемая доза пембролизумаба для монотерапии у субъекта человека может составлять 2-10 мг/кг, например, 2 мг/кг, обычно назначаемая доза ниволумаба для монотерапии у субъекта человека может составлять 0,1-10 мг/кг, например, 3 мг/кг, и обычно назначаемая доза BMS-936559 для монотерапии у субъекта человека может составлять 0,3-10 мг/кг.
В конкретных вариантах осуществления комбинированных препаратов или композиций изобретения назначаемая дозировка ингибитора пути PD-1 является ниже обычно назначаемой дозы для монотерапии, например, 1-50%, 1-25%, 1-20%, 1-10%, 2-50%, 2-25%, 2-20%, 2-10%, 0,1-50%, 0,1-25%, 0,1-20%, 0,1-10%, <20%, <10%, 0,1-<20%, 0,1-<10%, 0,01-<20% или 0,01-<10% обычно назначаемой дозы ингибитора пути PD-1.
Примеры пригодных доз ингибитора пути PD-1 и белка LAG-3 или его производного, согласно изобретению, приведены в Таблице 1.2 ниже:
Таблица 1.2. Примеры доз ингибитора пути PD-1 и белка LAG-3 или его производного, в соответствии с вариантами осуществления комбинированных препаратов или композиций изобретения
мг/кг [мг дозы на 70 кг массы тела человека]
(дана в виде мг дозы IMP321 или ее молярного эквивалента)
Производным LAG-3 может быть любое из производных LAG-3, описанных выше или показанных на фигуре 7. В конкретных вариантах осуществления производным LAG-3 является IMP321.
При введении в отдельных дозировках белок LAG-3 или его производное, и ингибитор пути PD-1 можно вводить по существу одновременно (например, в течение приблизительно 60 минут, приблизительно 50 минут, приблизительно 40 минут, приблизительно 30 минут, приблизительно 20 минут, приблизительно 10 минут, приблизительно 5 минут или приблизительно 1 минуты друг от друга) или разделенными по времени приблизительно на 1 час, приблизительно на 2 часа, приблизительно на 4 часа, приблизительно на 6 часов, приблизительно на 10 часов, приблизительно на 12 часов, приблизительно на 24 часа, приблизительно на 36 часов, приблизительно на 72 часа или приблизительно на 96 часов или более.
Квалифицированный специалист будет способен определить и оптимизировать подходящий период времени для последовательного введения, в зависимости от конкретной комбинации белка LAG-3 или его производного, и ингибитора пути PD-1. Период времени предпочтительно выбран так, чтобы имелось по меньшей мере одно благотворное действие, например, улучшение действия белка LAG-3 или его производного, или ингибитора пути PD-1, или взаимное улучшение действия скомбинированных компонентов, например, более чем аддитивное действие, дополнительное преимущественное действие, меньшие побочные эффекты, меньшая токсичность или комбинированный терапевтический эффект по сравнению с неэффективной дозой одного или обоих скомбинированных компонентов, и весьма предпочтительно, синергизм скомбинированных компонентов.
Следует принимать во внимание, что оптимальный период времени будет зависеть от таких факторов, как время, взятое для пиковой концентрации в плазме соединения, которая должна быть достигнута после введения, и период полуэлиминации каждого соединения. Предпочтительно разница во времени является меньшей, чем время полужизни первого компонента, подлежащего введению.
Квалифицированный специалист также будет способен определить соответствующее время для введения. В определенных вариантах осуществления ингибитор пути PD-1 можно вводить утром, а белок LAG-3 или его производное вводят по меньшей мере однократно в тот же день. В других вариантах осуществления ингибитор пути PD-1 и белок LAG-3 или его производное можно вводить по существу в одно время.
В некоторых вариантах осуществления ингибитор пути PD-1 может вводить субъекту, например, медицинский работник, а субъект может быть снабжен дозой белка LAG-3 или его производного, например, в предварительно заполненном шприце, чтобы ввести позднее (например, позднее в тот же день или на следующий день).
Ингибитор пути PD-1 и белок LAG-3 или его производное можно вводить ежедневно, еженедельно, каждые две недели, каждые три недели, ежемесячно, каждые 2 месяца, 3 месяца, 4 месяца, 5 месяцев, 6 месяцев, 7 месяцев, 8 месяцев, 9 месяцев, 10 месяцев, 11 месяцев, 1 год, 2 года, 3 года, 4 года, 5 лет или более.
Субъект может получать дозы ингибитора пути PD-1 и белка LAG-3 или его производного, на протяжении периода, составляющего недели, месяцы или годы. Например, 1 неделю, 2 недели, 3 недели, 1 месяц, 2 месяца, 3 месяца, 4 месяца, 5 месяца, 6 месяца, 7 месяца, 8 месяцев, 9 месяцев, 10 месяцев, 11 месяцев, 1 год, 2 года, 3 года, 4 года, 5 лет или более.
Субъект может являться субъектом млекопитающим, соответственно субъектом человеком.
Виды рака, которые можно лечить согласно изобретению, включают виды рака, при которых опухолевые клетки рака экспрессируют PD-L1 и/или PD-L2 (т.е. PD-L1- и/или PD-L2-положительные виды рака).
Экспрессию PD-L1 выявили в карциномах легкого, яичника, почки и ободочной кишки и в злокачественной меланоме, но не в нормальных тканях, включая легкие, матку, почки, ободочную кишку или кожу (Benson et al, Blood 116, 2286-2294 (2010); Blank et al, Int. J. Cancer 119, 317-327 (2006); Dong, et al, Nat. Med. 8, 793-800 (2002)). Экспрессия PD-L1 опухолевыми клетками связана с неблагоприятным прогнозом при раке груди, раке желудка, раке пищевода, гепатоцеллюлярной карциноме, злокачественной меланоме, раке яичников, раке поджелудочной железы, почечноклеточной карциноме и уротелиальном раке (Zou & Chen, Nat. Rev. Immunol. 8, 467-477 (2008)).
Также имеются доказательства, подтверждающие, что опухоли человека могут экспрессировать PD-L2 (Rozali, et al, Clin. Dev. Immunol. 2012, 656340 (2012); Karim, et al, Clin. Cancer Res. 15, 6341-6347 (2009)). Фибробласты, ассоциированные с немелкоклеточным раком легкого (NSCLC-), конститутивно экспрессируют как PD-L1, так и PD-L2. Также у больных с PD-L2-положительным (по сравнению с PD-L2-отрицательным) раком пищевода, яичников или гепатоцеллюлярным раком описано снижение выживаемости.
Виды рака, которые можно лечить согласно изобретению, также включают виды рака, при которых инфильтрирующие опухоль лимфоциты (TIL), особенно TIL CD8+, экспрессируют PD-1, или виды рака, при которых TIL экспрессируют более высокие уровни PD-1, чем циркулирующие лимфоциты.
У больных как NSCLC, так и меланомой, на TIL наблюдали более высокие уровни PD-1, чем на циркулирующих лимфоцитах (Blank, et al, Int. J. Рак 119, 317-327 (2006); Zhang et al, Cell. Mol. Immunol. 7, 389-395 (2010)). В периферической крови вакцинированных больных меланомой экспрессируют PD-1 и специфические к антигену меланомы цитотоксические лимфоциты и Treg (Wang, et al, Int. Immunol. 21, 1065-1077 (2009)). Также имеется отрицательная корреляция между экспрессией опухоли PD-L2 и присутствием TIL CD8+ при раке пищевода (Rozali, et al, Clin. Dev. Immunol. 2012, 656340 (2012)).
TIL CD8+, выделенные из NSCLC, имеют повышенную экспрессию PD-1 и нарушенные функциональные ответы (пролиферация in vitro и продукция воспалительных цитокинов) по сравнению с циркулирующими Т-клетками CD8+ или Т-клетками CD8+ от здоровых добровольцев. Добавление анти-PD-L1 антител значительно улучшает способность TIL CD8+ к пролиферации и продукции интерферона-γ in vitro (Zhang, et al, Cell. Mol. Immunol. 7, 389-395 (2010)). В похожем исследовании с использованием культур опухолевых дендритных клеток и TIL у больных раком яичников добавление анти-PD-L1 антител значительно увеличивало выработку интерферона-γ TIL в ответ на опухолевые антигены. Когда эти TIL переносили иммунодефицитным мышам с опухолями яичников, наблюдали сниженный опухолевый рост по сравнению с опухолевым ростом у мышей контрольных групп (Curiel, et al, Nat. Med. 9, 562-567 (2003)).
Конкретно, виды рака, которые можно лечить согласно изобретению, включают рак кожи, легкого (особенно плоскоклеточный или неплоскоклеточный NSCLC), яичников, почек, ободочной кишки, колоректальный рак, молочной железы, желудка, пищевода, поджелудочной железы, мочевого пузыря, уротелиальный и печени.
Другие примеры видов рака, которые можно лечить согласно изобретению, включают меланому (например, метастатическую злокачественную меланому), рак простаты (например, гормонорезистентную аденокарциному простаты), рак головы и шеи (например, плоскоклеточную карциному головы и шеи), рак шейки матки, рак щитовидной железы, глиобластому, глиому, лейкоз, лимфому (например, В-клеточную лимфому), рак надпочечников, СПИД-ассоциированный рак, альвеолярную саркому мягких тканей, астроцитарную опухоль, рак костей, рак головного и спинного мозга, метастатическую опухоль головного мозга, опухоль каротидного тельца, хондросаркому, хордому, хромофобную почечноклеточную карциному, светлоклеточную карциному, доброкачественную фиброзную гистиоцитому кожи, десмопластическую мелкокруглоклеточную опухоль, эпендимому, саркому Юинга, внескелетную миксоидную хондросаркому, несовершенный костный фиброгенез, фиброзную дисплазию костей, рак желчного пузыря или желчных путей, гестационную трофобластическую болезнь, эмбрионально-клеточную опухоль, злокачественное заболевание системы крови, гепатоцеллюлярную карциному, опухоль островковых клеток поджелудочной железы, саркому Капоши, рак почек, липому/доброкачественную липоматозную опухоль, липосаркому/злокачественной липоматозную опухоль, медуллобластому, менингиому, карциному клеток Меркеля, множественные эндокринные неоплазии, множественную миелому, миелодиспластический синдром, нейробластому, нейроэндокринную опухоль, папиллярную карциному щитовидной железы, опухоль паращитовидных желез, рак у детей, злокачественную опухоль оболочек периферических нервов, феохромоцитому, опухоль гипофиза, рак простаты, увеальную меланому заднего отдела глаза, редкие гематологические расстройства, метастатический рак почки, рабдоидную опухоль, рабдомиосаркому, саркому, саркому мягких тканей, плоскоклеточный рак, рак желудка, синовиальную саркому, рак яичка, рак вилочковой железы, тимому, метастатический рак щитовидной железы или рак матки.
В целом, компоненты комбинации изобретения или композиции изобретения можно вводить с помощью известных средств, в любой подходящей готовой форме, посредством любого подходящего пути. В некоторых вариантах осуществления белок LAG-3 или его производное вводят парентерально (включая подкожную, внутривенную или внутримышечную инъекцию). В некоторых вариантах осуществления ингибитор пути PD-1 вводят внутривенно. В конкретных вариантах осуществления белок LAG-3 или его производное вводят подкожно, а ингибитор пути PD-1 вводят внутривенно.
Пригодные фармацевтические композиции и лекарственные формы можно приготовить с использованием общепринятых способов, известных специалистам в области лекарственных форм и описанных в релевантных текстах и литературе, например, у Remington: The Science и Practice of Pharmacy (Easton, Pa.: Mack Publishing Co., 1995).
Особенно предпочтительным является составление комбинаций или композиций изобретения в стандартной лекарственной форме для легкости введения и равномерности дозировки. Термин «стандартная лекарственная форма», как используется в данной заявке, относится к физически дискретным единицам, пригодным в качестве разовых дозировок для индивидов, подлежащих лечению. То есть композиции получают в виде дискретных единиц дозирования, каждая из которых содержит заранее установленное количество «разовой дозы» действующего вещества, рассчитанное для получения желаемого терапевтического эффекта совместно с требуемым фармацевтическим носителем. Спецификация стандартной лекарственной формы изобретения зависит от характерных особенностей действующего вещества, подлежащего доставке. Дозировки можно дополнительно определить посредством ссылки на обычную дозу и способ введения ингредиентов. Следует отметить, что в некоторых случаях две или более отдельных единиц дозирования в комбинации предоставляют терапевтически эффективное количество действующего вещества, например, две таблетки или капсулы, взятые вместе, могут обеспечить терапевтически эффективную дозу, так что разовая доза в каждой таблетке или капсуле составляет приблизительно 50% терапевтически эффективного количества.
Лекарственные средства согласно изобретению для парентерального введения включают стерильные водные и неводные растворы, суспензии и эмульсии. Инъекционные водные растворы содержат действующее вещество в водорастворимой форме. Примеры неводных растворителей или несущих растворов включают жирные кислоты, такие как оливковое масло и кукурузное масло, синтетические сложные эфиры жирных кислот, такие как этилолеат или триглицериды, низкомолекулярные спирты, такие как пропиленгликоль, синтетические гидрофильные полимеры, такие как полиэтиленгликоль, липосомы и подобные. Парентеральные лекарственные формы также могут содержать адъюванты, такие как солюбилизаторы, консерванты, увлажняющие агенты, эмульгаторы, диспергирующие агенты и стабилизаторы, и водные суспензии могут содержать вещества, которые повышают вязкость суспензии, такие как карбоксиметилцеллюлоза натрия, сорбитол и декстран. Инъекционные лекарственные формы могут быть превращены в стерильные посредством включения стерилизующего агента, фильтрации через задерживающий бактерии фильтр, облучения или нагревания. Их также можно изготавливать с применением стерильной инъекционной среды. Действующее вещество также может быть в высушенной, напр., в лиофилизированной форме, которую можно регидратировать с помощью подходящей среды непосредственно перед введением посредством инъекции.
В дополнение к ранее описанным лекарственным формам, действующее вещество может быть получено в виде депо-препарата для регулируемого высвобождения действующего вещества, предпочтительно замедленного высвобождения в течение продолжительного периода времени. Эти лекарственные формы с замедленным высвобождением, как правило, вводят посредством имплантации (например, подкожно или внутримышечно или посредством внутримышечной инъекции).
Комбинированные препараты изобретения могут быть упакованы с инструкциями для введения компонентов комбинации. Инструкции могут быть записаны на подходящем носителе или основе для записи. Например, инструкции могут быть напечатаны на основе, такой как бумага или пластмасса. Инструкции могут присутствовать в виде листка-вкладыша, при маркировке контейнера или его компонентов (т.е., могут быть связаны с упаковкой или дополнительной упаковкой). В других вариантах осуществления инструкции присутствуют в виде файла для электронного хранения данных, имеющегося на пригодном машиночитаемом электронном носителе, например, CD-ROM, дискете. Некоторые или все компоненты комбинированного препарата могут быть упакованы в подходящую упаковку для сохранения стерильности.
Варианты осуществления изобретения описаны ниже, посредством только примера, со ссылкой на сопровождающие рисунки, на которых:
Фигура 1 показывает роль пути PD-1 в ускользании опухоли от иммунологического надзора и механизм действия блокирования пути PD-1 (APC, антиген-презентирующая клетка; IFN-γ, интерферон-γ; MHC, главный комплекс гистосовместимости; PD-1, запрограммированная смерть клетки-1; PD-L1, PD лиганд 1; TCR, T-клеточный рецептор);
Фигура 2 демонстрирует действие LAG-3Ig и анти-PD1 антитела на секрецию IFN-γ индуцированную антигенной стимуляцией;
Фигура 3 демонстрирует действие LAG-3Ig и анти-PD1 антитела на секрецию IFN-γ, индуцированную антигенной стимуляцией;
Фигура 4 демонстрирует действие LAG-3Ig и анти-PD1 антитела на секрецию IFN-γ, индуцированную антигенной стимуляцией;
Фигура 5 демонстрирует действие LAG-3Ig и анти-PD1 антитела на секрецию TNFα, IL-6, RANTES, индуцированную антигенной стимуляцией;
Фигура 6 демонстрирует действие LAG-3Ig и анти-PD1 антитела на экспрессию маркеров активации, индуцированную антигенной стимуляцией. Следует отметить, что состояние для итоговой колонки в каждой диаграмме Фигуры 6 составляет «1000 нг/мл анти-PD1+30 нг/мл LAG-3Ig», а не «30 нг/мл анти-PD1+1000 нг/мл LAG-3Igʺ как показано на Фигуре;
Фигура 7 демонстрирует иллюстрацию производных белка LAG-3, слитого с последовательностью Fc Иммуноглобулина (IgFc);
Фигура 8 демонстрирует связывание производных LAG-3 с MHC класса II-положительными клетками;
Фигура 9 демонстрирует подавление связывания производного LAG-3 с MHC класса II-положительными клетками антителами, которые блокируют связывание LAG-3 с молекулами MHC класса II;
Фигура 10 демонстрирует активацию клеток THP-1 производными LAG-3, как определено посредством секреции CCL4;
Фигура 11 демонстрирует активацию клеток THP-1 производными LAG-3, как определено посредством секреции TNF-α;
Фигура 12 демонстрирует подавление активации моноцитов, индуцированной производными LAG, антителами, которые блокируют связывание LAG-3 с молекулами MHC класса II;
Фигура 13 демонстрирует активацию антиген-презентирующих клеток (APC) производными LAG-3;
Фигура 14 демонстрирует активацию CD8-положительных Т-клеток производными LAG-3;
Фигура 15 демонстрирует аминокислотную последовательность зрелого человеческого белка LAG-3. Четыре внеклеточных домена суперсемейства Ig находятся в аминокислотных остатках: 1-149 (D1); 150-239 (D2); 240-330 (D3); и 331-412 (D4). Аминокислотная последовательность внепетлевой структуры домена D1 человеческого белок LAG-3 показана подчеркнутой жирным;
Фигура 16 демонстрирует действие LAG-3Ig и анти-PD-L1 антител на экспрессию маркеров активации, индуцированную антигенной стимуляцией;
Фигура 17 демонстрирует действие LAG-3Ig и различных антител анти-PD-1 (Ab1 и Ab2) на секрецию IFN-γ и TNF-α, индуцированную антигенной стимуляцией;
Фигура 18 демонстрирует действие LAG-3Ig и различных анти-PD-L1 антител (Ab3, Ab4, Ab5, и Ab6) на секрецию IFN-γ и TNF-α, индуцированную антигенной стимуляцией; and
Фигура 19 демонстрирует действие различных производных LAG-3 (IMP321, IMP321 R75A, LAG3 D1D4-линкер2-Ig) и антител анти-PD-1 на секрецию IFN-γ, индуцированную антигенной стимуляцией.
В примерах, таблицах и фигурах ниже термин «анти-PD1 антитело» используется как синоним для «антитела анти-PD-1», а термин «анти-PDL1 антитело» используется как синоним для «антитела анти-PD-L1».
Пример 1
Действие LAG-3Ig и анти-PD1 антител на секрецию IFN-γ, индуцированную антигенной стимуляцией
Этот пример демонстрирует действие растворимого производного LAG-3 (LAG-3Ig, также известного как IMP321) и анти-PD1 антитела на активацию Т-клеток in vitro с использованием анализа секреции IFN-γ. Мононуклеарные клетки периферической крови (PBMC) включают лимфоциты (Т-клетки, В-клетки и NK-клетки), моноциты и дендритные клетки. IFN-γ в основном секретируется активированными CD4+ и CD8+ памяти и эффекторными Т-клетками и NK-клетками при активации. После рестимуляции специфическим антигеном in vitro индуцируется секреция IFN-γ.
PBMC от трех здоровых доноров (0,2×106 клеток/лунка, при 1×106M/мл в растворе Complete Roswell Park Memorial Institute (RPMI)+10% фетальной бычьей сыворотке (FBS)) инкубировали с пулом пептидов, охватывающих последовательность человеческого цитомегаловируса (CMV) pp65 в трех повторностях (PepTivator® CMV pp65 от Miltenyi Biotec, Cat. # 130-093-435), в присутствии или отсутствии 30 нг/мл LAG-3Ig и указанных концентраций анти-PD1 mAb (клон EH12.1, BD biosciences, Cat. #562138). Пул пептидов состоял главным образом из 15-мерных последовательностей, с перекрытием из 11 аминокислот, охватывающим полную последовательность белка pp65 штамма AD169 человеческого CMV (Swiss-Prot Acc. No. P06725).
Т-клеточный ответ оценивали посредством измерения концентрации IFN-γ в клеточных супернатантах через два дня после стимуляции с применением BD Cytometric Bead Array.
Концентрации IFN-γ, присутствующие в объединенных повторениях для каждого донора, отмечены в Таблице 2 ниже. Фигура 2 демонстрирует концентрации IFN-γ, нанесенные в зависимости от концентрации анти-PD1 mAb для каждого донора.
Таблица 2. Секреция IFN-γ, индуцированная антигеном в присутствии анти-PD1 антител, с LAG-3Ig и без него
Результаты показывают, что секреция IFN-γ значительно увеличивалась, когда PBMC инкубировали в присутствии 30 нг/мл LAG-3Ig и меньших концентраций анти-PD1 антител по сравнению только с анти-PD1 антител. Например, для каждого донора увеличение концентрации IFN-γ выше исходного уровня (т.е. концентрации IFN-γ при отсутствии анти-PD1 и LAG-3Ig) в присутствии 30 нг/мл LAG-3Ig и 30 нг/мл анти-PD1 антител было больше, чем сумма соответствующего увеличения в присутствии только 30 нг/мл LAG-3Ig и только 30 нг/мл анти-PD1 антитела, как показано в Таблице 3 ниже. Действие комбинации LAG-3Ig и анти-PD1 антител для каждого донора было, таким образом, синергетическим.
Таблица 3. Увеличение концентрации IFN-γ выше исходной, индуцированное антигеном в присутствии 30 нг/мл анти-PD1 антител и/или 30 нг/мл LAG-3Ig
Результаты также показывают, что секреция IFN-γ, индуцированная комбинацией LAG-3Ig и относительно низкой концентрацией анти-PD1 антител (30 нг/мл), была эквивалентна секреции IFN-γ, индуцированной гораздо большей концентрацией (300 нг/мл-1000 нг/мл, от 10 до более 30 раз выше) только анти-PD1 антитела. Для доноров номер 1 и 3 сходные концентрации IFN-γ вырабатывались, когда PBMC инкубировали с 30 нг/мл анти-PD1 и 30 нг/мл LAG-3Ig по сравнению с 1000 нг/мл только анти-PD1 антитела. Для донора номер 2 сходные концентрации IFN-γ вырабатывались, когда PBMC инкубировали с 30 нг/мл анти-PD1 и 30 нг/мл LAG-3Ig по сравнению с 300 нг/мл и 1000 нг/мл только анти-PD1 антитела.
На основании данных результатов пришли к выводу, что Т-клеточный ответ in vitro (как измерено посредством секреции IFN-γ), индуцированный относительно низкими дозами анти-PD1 антител, синергетически увеличивался (приблизительно в ~7,5, 1,5, и 2 раза для доноров номер 1, 2 и 3, соответственно) растворимым производным LAG-3. Также пришли к выводу, что эквивалентный Т-клеточный ответ in vitro получен с примененеием приблизительно в 10-30 раз меньше анти-PD1 антител, если их комбинировали с растворимым производным LAG-3.
Пример 2
Действие LAG-3Ig и анти-PD1 антител на секрецию IFN-γ, индуцированную антигенной стимуляцией
Этот пример демонстрирует действие растворимого производного LAG-3 (LAG-3Ig) и анти-PD1 антител на активацию Т-клеток in vitro с использованием анализа секреции IFN-γ.
PBMC от 10 здоровых доноров (0,2×106 клеток/лунка, при 1×106M/мл in Complete RPMI+10%FBS) инкубировали с пулом пептидов, охватывающих последовательность CMV pp65 в трех повторностях (PepTivator® CMV pp65 от Miltenyi Biotec, Cat. # 130-093-435), без какой-либо добавки (среды), с 30 нг/мл или 1000 нг/мл анти-PD1 mAb (клон EH12.1, BD biosciences Cat. # 562138), с 30 нг/мл LAG-3Ig или с 30 нг/мл LAG-3Ig и 30 нг/мл анти-PD1 mAb.
Т-клеточный ответ оценивали посредством измерения Концентрации IFN-γ в клеточных супернатантах через два дня после стимуляции с использованием BD Cytometric Bead Array.
Концентрации IFN-γ в объединенных повторениях для каждого состояния стимуляции, для каждого донора отмечены в Таблице 4 ниже. Среднее значение результатов, полученных от 10 доноров, показаны в Таблице 5. Результаты для каждого донора также нанесены на фигурах 3 и 4. Статистические различия (*p<0,05) показаны черным на фигуре 3.
Таблица 4. Секреция IFN-γ, индуцированная антигеном в присутствии анти-PD1 антител с LAG-3Ig и без него
Таблица 5. Средняя концентрация IFN-γ для каждого отдельного условия стимуляции
Результаты показывают, что секреция IFN-γ была намного выше для каждого донора, когда PBMC инкубировали в присутствии 30 нг/мл LAG-3Ig и 30 нг/мл анти-PD1 антител по сравнению с 30 нг/мл LAG-3Ig или 30 нг/мл только анти-PD1 антител. Таблица 5 демонстрирует, что увеличение средней концентрации IFN-γ выше среднего исходного уровня (т.е. средней концентрации IFN-γ при отсутствии анти-PD1 и LAG-3Ig) в присутствии 30 нг/мл LAG-3Ig и 30 нг/мл анти-PD1 антител было более значительным, чем сумма соответствующего увеличения в присутствии 30 нг/мл только LAG-3Ig и 30 нг/мл только анти-PD1 антитела (т.е. 765 > 239+172). Действие комбинации LAG-3Ig и анти-PD1 антитела было, таким образом, синергетическим.
Результаты также показывают, что секреция IFN-γ, индуцированная комбинацией LAG-3Ig и относительно низкой концентрацией анти-PD1 антител (30 нг/мл) являлось эквивалентной секреции IFN-γ, индуцированной гораздо более высокой концентрацией (1000 нг/мл, более 30 раз выше) только анти-PD1 антител.
На основании данных результатов пришли к выводу, что Т-клеточный ответ in vitro (как измерено посредством секреция IFN-γ), индуцированный относительно низкими дозами анти-PD1 антител, синергетически увеличивался (в среднем приблизительно в 2 раза) растворимым производным LAG-3. Также пришли к выводу, что эквивалентный Т-клеточный ответ in vitro получен с использованием более чем в 30 раз меньше анти-PD1 антител, если их комбинировали с растворимым производным LAG-3.
Пример 3
Действие LAG-3Ig и анти-PD1 антител на секрецию TNF-α, IL-6, RANTES, индуцированную антигенной стимуляцией
Этот пример демонстрирует действие растворимого производного LAG-3 (LAG-3Ig) и анти-PD1 антител на активацию Т-клеток in vitro посредством измерения секреции TNF-α, IL-6 и RANTES (CCL5).
PBMC от 10 здоровых доноров (0,2×106 клеток/лунка, при 1×106M/мл в Complete RPMI+10%FBS) инкубировали с пулом пептидов, охватывающим последовательность CMV pp65 в трех повторностях (PepTivator® CMV pp65 от Miltenyi Biotec, Cat. # 130-093-435), без какой-либо добавки (среды), с 30 нг/мл или 1000 нг/мл анти-PD1 mAb (клон EH12.1, BD biosciences Cat. # 562138), с 30 нг/мл LAG-3Ig или с 30 нг/мл LAG-3Ig и 30 нг/мл анти-PD1 mAb.
Т-клеточный ответ оценивали посредством измерения концентрации TNF-α, IL-6 и RANTES (CCL5) в клеточных супернатантах через 2 дня после стимуляции с использованием BD Cytometric Bead Array.
Концентрация цитокинов/хемокинов в объединенных повторениях для каждого состояния стимуляции, для каждого донора отмечены в Таблицах 6-8 ниже. Среднее значение результатов, полученных от 10 доноров, показаны в Таблице 9, и увеличение среднего значения выше среднего исходного уровня показано в Таблице 10. Результаты для каждого донора также нанесены на фигуре 5, и статистические различия (*p<0,05) показаны черным.
Таблица 6. Секреция TNF-α, индуцированная антигеном в присутствии анти-PD1 антител с LAG-3Ig и без него
Таблица 7. Секреция IL-6, индуцированная антигеном в присутствии анти-PD1 антител с LAG-3Ig и без него
Таблица 8. Секреция RANTES (CCL5), индуцированная антигеном в присутствии анти-PD1 антител с LAG-3Ig и без него
Таблица 9. Средняя концентрация TNF-α, IL-6 и RANTES (CCL5) для каждого отдельного условия стимуляции
Таблица 10. Увеличение средней концентрации TNF-α, IL-6 и RANTES (CCL5) выше среднего исходного уровня для каждого отдельного условия стимуляции
Результаты показывают, что -6 была намного выше для каждого донора, когда PBMC инкубировали в присутствии 30 нг/мл LAG-3Ig и 30 нг/мл анти-PD1 антител, по сравнению с 30 нг/мл LAG-3Ig или 30 нг/мл только анти-PD1 антител. Таблица 10 демонстрирует, что увеличение средней концентрации IL-6 выше среднего исходного уровня (т.е. средней концентрации IL-6 при отсутствии анти-PD1 и LAG-3Ig) в присутствии 30 нг/мл LAG-3Ig и 30 нг/мл анти-PD1 антител было более значительным, чем сумма соответствующего увеличения в присутствии 30 нг/мл только LAG-3Ig и 30 нг/мл только анти-PD1 антител (т.е. 8594 > 732+2964). Действие комбинации LAG-3Ig и анти-PD1 антител было, таким образом, синергетическим.
Результаты также показывают, что секреция IL-6, индуцированная комбинацией LAG-3Ig и относительно низкой концентрацией анти-PD1 антител (30 нг/мл) была эквивалентна секреции IL-6, индуцированной гораздо более высокой концентрацией (1000 нг/мл, более 30 раз выше) только анти-PD1 антител.
На основании данных результатов пришли к выводу, что Т-клеточный ответ in vitro (как измерено посредством IL-6 секреции), индуцированный относительно низкими дозами анти-PD1 антител, синергетически увеличивался (в среднем более чем в 2,3 раза) растворимым производным LAG-3.
Пример 4
Действие LAG-3Ig и анти-PD1 антител на экспрессию маркеров активации, индуцированную антигенной стимуляцией
Этот пример демонстрирует действие растворимого производного LAG-3 (LAG-3Ig) и анти-PD1 антител на экспрессию маркеров активации Т-клеток.
PBMC от 7 здоровых доноров (0.2×106 клеток/лунка, at 1×106M/мл in Complete RPMI+10%FBS) инкубировали с пулом пептидов, охватывающим последовательность CMV pp65 в трех повторностях (PepTivator® CMV pp65 от Miltenyi Biotec, Cat. # 130-093-435), без какой-либо добавки (среды), с 30 нг/мл или 1000 нг/мл анти-PD1 mAb (клон EH12.1, BD biosciences Cat. # 562138), с 30 нг/мл LAG-3Ig, или с 30 нг/мл LAG-3Ig и 30 или 1000 нг/мл анти-PD1 mAb.
Т-клеточный ответ оценивали посредством фенотипирования клеток на экспрессию трех маркеров активации (LAG-3, CD69 и CD25) через два дня после стимуляции посредством проточной цитометрии.
Процент CD8 клеток, экспрессирующих LAG-3, CD69 или CD25, по меньшей мере один из трех маркеров активации (LAG-3, CD69 или CD25), или все три маркера активации (LAG-3, CD69 и CD25) в объединенных повторениях для каждого состояния стимуляции отмечены в Таблицах 11-15 ниже. Среднее значение результатов полученных для 7 доноров показаны в Таблице 16, и увеличение среднего значения выше среднего исходного уровня показано в Таблице 17. Результаты для каждого донора также нанесены на фигуре 6, а статистические различия (*p<0,05) показаны черным.
Таблица 11. Процент CD8 клеток, экспрессирующих LAG-3, для каждого отдельного условия стимуляции
Таблица 12. Процент CD8 клеток, экспрессирующих CD69, для каждого отдельного условия стимуляции
Таблица 13. Процент CD8 клеток, экспрессирующих CD25, для каждого отдельного условия стимуляции
Таблица 14. Процент CD8 клеток, экспрессирующих какой-либо один из трех маркеров активации (LAG-3, CD69 или CD25), для каждого отдельного условия стимуляции
Таблица 15. Процент CD8 клеток, экспрессирующих все три маркера активации (LAG-3, CD69 и CD25), для каждого отдельного условия стимуляции
Таблица 16. Средний процент CD8 клеток, экспрессирующих LAG-3, CD69, CD25, какой-либо один из трех маркеров активации (LAG-3, CD69 или CD25) или все три маркера активации (LAG-3, CD69 и CD25), для каждого отдельного условия стимуляции
Таблица 17. Увеличение среднего процента CD8 клеток, экспрессирующих LAG-3, CD69, CD25, какой-либо один из трех маркеров активации (LAG-3, CD69 или CD25) или все три маркера активации (LAG-3, CD69 и CD25) выше среднего исходного уровня, для каждого отдельного условия стимуляции
Результаты показывают, что стимуляция 30 нг/мл антител анти-PD-1 и 30 нг/мл LAG-3Ig, или 1000 нг/мл антител анти-PD-1 и 30 нг/мл LAG-3Ig приводила к синергетическому увеличению среднего процента CD8 клеток, экспрессирующих какой-либо или все три маркера активации.
Результаты также показывают, что стимуляция 30 нг/мл антител анти-PD-1 и 30 нг/мл LAG-3Ig приводила к значительно большему среднему проценту CD8 клеток, экспрессирующих какой-либо или все три маркера активации, чем стимуляция 1000 нг/мл антител анти-PD-1.
На основании данных результатов пришли к выводу, что CD8+ Т-клеточный ответ in vitro (как измерено посредством экспрессии маркеров активации Т-клеток), индуцированный относительно низкими дозами анти-PD1 антител, синергетически увеличивался растворимым производным LAG-3. Также пришли к выводу, что значительно улучшенный CD8+ Т-клеточный ответ in vitro получали с использованием более чем в 30 раз меньше анти-PD1 антител, если их комбинировали с растворимым производным LAG-3.
Поскольку известно, что ингибиторы пути PD-1 (такие как Кейтруда и Опдиво) активируют CD8+ Т-клетки и данная активация связана с противораковым действием, результаты, представленные в примерах выше, предоставляют доказательство, что улучшенное противораковое действие может быть получено посредством совместного введения ингибитора пути PD-1 с белком LAG-3 или его производным, который способен связываться с молекулами MHC класса II. В качестве альтернативы, аналогичное противораковое действие может быть получено посредством совместного введения ингибитора пути PD-1 с белком LAG-3 (или его производным, которое способно связываться с молекулами MHC класса II) при более низких дозах (например, в дозах 10-30 раз ниже) ингибитора пути PD-1 по сравнению с введением ингибитора пути PD-1 в виде монотерапии. Такое совместное введение, как ожидается, уменьшает побочные эффекты, вызванные ингибитором пути PD-1.
Аналогично, поскольку также известно, что активация CD8+ Т-клеток эффективна против инфекции, включая хроническую или персистирующую инфекцию, результаты, представленные в примерах выше, также предоставляют доказательство, что совместное введение ингибитора пути PD-1 с белком LAG-3 или его производным, который способен связываться с молекулами MHC класса II, можно применять для более эффективного предотвращения, лечения или улучшения инфекции. В качестве альтернативы, аналогичное действие против инфекции может быть получено посредством совместного введения ингибитора пути PD-1 с белком LAG-3 (или его производным, которое способно связываться с молекулами MHC класса II) при более низких дозах (например, при дозах в 30-100 раз ниже) ингибитора пути PD-1 по сравнению с введением ингибитора пути PD-1 в виде монотерапии. Такое совместное введение, как ожидается, уменьшает побочные эффекты, вызванные ингибитором пути PD-1.
Пример 5
Связывание производных LAG-3 с MHC класса II-положительными клетками
Несколько производных LAG-3 были протестированы на их способность связываться с MHC класса II-положительными клетками:
i) домены D1-D4 LAG-3, связанные с последовательностью Fc иммуноглобулина (Ig Fc) посредством первого линкера (LAG-3 D1D4-линкер1-Ig, sLAG-3 D1D4-Ig, LAG-3Ig или IMP321);
ii) домены D1-D4 LAG-3, связанные с последовательностью Fc иммуноглобулина вторым линкером (LAG-3 D1D4-линкер2-Ig, или sLAG-3 D1D4-линкерB-Ig);
iii) домены D1 и D2 of LAG-3, связанные с последовательностью Fc иммуноглобулина посредством второго линкера (LAG-3 D1D2-линкер2-Ig, или sLAG-3 D1D2-линкерB-Ig); и
iv) домены D1-D4 LAG-3, связанные с последовательностью Fc иммуноглобулина посредством первого линкера, но с мутацией в сайте связывания MHC класса II домена D1 LAG-3, в позиции R75 (R75A), которая улучшает связывание с молекулами MHC класса II в три раза или более (Huard et al., Proc. Natl. Acad. Sci. USA, 1997, 94:5744) (IMP321 R75A).
Производные проиллюстрированы на фигуре 7.
MHC класса II+ клетки Раджи инкубировали в течение 45 минут при 4°C с различными концентрациями производных LAG-3 или с человеческим антителом IgG1 (hIgG1) в качестве отрицательного контроля. Молекулы LAG-3, связанные с поверхностью клеток, выявляли с помощью конъюгированных с FITC козьих антимышиных Ig (Coulter). Клетки подвергали анализу посредством проточной цитометрии. Результаты, выраженные в виде единиц интенсивности флуоресценции, показаны на фигуре 8. Результаты показывают, что все производные LAG-3 связаны с MHC класса II-положительными клетками.
Пример 6
Подавление связывания производного LAG-3 IMP321 с MHC класса II-положительными клетками антителами, которые блокируют связывание LAG-3 с молекулами MHC класса II
17B4 и 11E3 представляют собой анти-LAG-3 моноклональные антитела, которые, как известно, блокируют связывание LAG-3 с молекулами MHC класса II. Связывание конъюгата IMP321 (LAG-3Ig-Alexa 488) с MHC класса II-положительными В-клетками (клетки Раджи) определяли после предварительной инкубации конъюгата (4мкг/мл при 4°C) с блокирующим антителом 17B4 или 11E3, или с изотипически сходным моноклональным антителом (mIgG1) отрицательного контроля. Флуоресцентный анализ клеток выполняли с использованием сортировки клеток с активированной флуоресценцией (FACS). Результаты показаны на фигуре 9.
Результаты показывают, что связывание IMP321 с клетками Раджи подавлялось LAG-3-специфичными моноклональными антителами, которые блокируют связывание LAG-3 с молекулами MHC класса II.
Пример 7
Активация моноцитов производными LAG-3
Клетки THP-1 инкубировали в течение 4 часов при 4°C с производными LAG-3, проиллюстрированными на фигуре 5, или с человеческим IgG1 в качестве отрицательного контроля. Величину секреции клетками THP-1 хемокина CCL4 и цитокин Фактор некроза опухоли-α, TNF-α, определяли и использовали в качестве показателя активации моноцитов. Количественно определяли секрецию CCL4 и TNF-α в клеточном супернатанте с использованием Cytometric Beads Array. Результаты определения CCL4 показаны на фигуре 10, а результаты определения TNF-α показаны на фигуре 11.
Результаты показывают, что все производные LAG-3 были способны активировать моноциты THP-1.
Пример 8
Подавление индуцированной IMP321 активации моноцитов антителами, которые блокируют связывание LAG-3 с молекулами MHC класса II
IMP321 (20 нг/мл) предварительно инкубировали с антителом 17B4 или 11E3 (5 минут при 37°C) перед инкубацией смеси с клетками THP-1 в течение 4 часов при 37°C. Величину секреции CCL4 клетками THP-1 использовали для определения уровня активации моноцитов. Результаты двух экспериментов показаны на фигуре 12.
Результаты демонстрируют, что индуцированная IMP321 активация моноцитов подавляется блокированием анти-LAG-3 mAb 17B4 и 11E3. Это указывает на то, что способность IMP321 to активировать моноциты зависит от связывания IMP321 с молекулами MHC класса II.
Пример 9
Активации первичных антиген-презентирующих клеток (APC) производными LAG-3
Человеческие мононуклеарные клетки периферической крови (PBMC) инкубировали в течение 4 часов при 37°C с производными LAG-3, проиллюстрированными на фигуре 7, или с человеческим IgG1 в качестве отрицательного контроля, в присутствии брефелдина, ингибитора секреции. Цитокиновый ответ APC, присутствующих в PBMC, определяли посредством внутриклеточного окрашивания CCL4, хемокина, который как известно благоприятствует Th1 и CD8-положительному ответу, и TNF-α, многофункционального цитокина, который непосредственно подавляет опухолеобразование. Результаты анализировали посредством цитометрии. Результаты, представленные в виде процента клеток, экспрессирующих CCL4 и/или TNF-α в MHC класса II-положительных клетках, показаны на фигуре 13.
Результаты показывают, что все протестированные производные LAG-3 индуцируют продукцию CCL4 и TNF-α в первичных APC.
Пример 10
Активация CD8+ Т-клеток производными LAG-3
Человеческие PBMC инкубировали в течение 18 часов с производными LAG-3, проиллюстрированными на фигуре 7, или с человеческим IgG1 в качестве отрицательного контроля. Брефелдин присутствовал в течение последних 16 часов инкубации. Цитокиновый ответ CD8+ Т-клеток после 18 часового воздействия производными LAG-3 сопровождали внутриклеточным окрашиванием CCL4, IFN-γ и TNF-α и анализировали посредством цитометрии. Результаты, представленные в виде процента клеток, экспрессирующих CCL4, IFN-γ и/или TNF-α в CD3+ /CD8+ Т-клетках, показаны на фигуре 14.
Результаты показывают, что все протестированные производные LAG-3 индуцируют активацию типа 1 цитотоксических CD8-положительных Т-клеток (клетки Tc1). Можно заключить, что через связывание с молекулами MHC класса II, экспрессируемыми APC, производные LAG-3 индуцируют активацию клеток Tc1. Активация клеток Tc1 формирует основной противоопухолевый иммунный ответ.
Пример 11
Действие LAG-3Ig и анти-PD-L1 на экспрессию маркеров активации, индуцированную антигенной стимуляцией
Этот пример демонстрирует действие растворимого производного LAG-3 (LAG-3Ig) и анти-PD-L1 антител на экспрессию маркеров активации Т-клеток.
PBMC от 12 здоровых доноров (0,2×106 клеток/лунка, при 1 M/мл в complete RPMI +10% FBS) инкубировали с пулом пептидов, охватывающих последовательность CMV pp35 в трех повторностях, без какой-либо добавки (среды), с 30 нг/мл или 3000 нг/мл анти-PD-L1 гуманизированных антител (BPS Bioscience, каталог # 71213), с 30 нг/мл LAG-3Ig или с 30 нг/мл LAG-3Ig и 30 нг/мл анти-PD-L1 антител.
Т-клеточный ответ оценивали посредством фенотипирования клеток на экспрессию трех маркеров активации (LAG-3, CD69 и CD25) через три дня после стимуляции посредством проточной цитометрии.
Процент CD8 клеток, экспрессирующих LAG-3, CD69 или CD25, по меньшей мере один из трех маркеров активации (LAG-3, CD69 или CD25) или все три маркера активации (LAG-3, CD69 и CD25), в объединенных повторениях, для каждого состояния стимуляции, отмечены в Таблицах 18-22 ниже. Средние показатели результатов, полученных для 12 доноров, показаны в Таблице 23, а увеличение среднего значения выше среднего исходного уровня показано в Таблице 24. Результаты для каждого донора также нанесены на фигуре 16, и статистические различия (*p<0,05) показаны черным.
Таблица 18. Процент CD8 клеток, экспрессирующих LAG-3, для каждого отдельного условия стимуляции
Таблица 19. Процент CD8 клеток, экспрессирующих CD69, для каждого отдельного условия стимуляции
Таблица 20. Процент CD8 клеток, экспрессирующих CD25, для каждого отдельного условия стимуляции
Таблица 21. Процент CD8 клеток, экспрессирующих какой-либо один из трех маркеров активации (LAG-3, CD69 или CD25), для каждого отдельного условия стимуляции
(LAG-3, CD69 или CD25)
Таблица 22. Процент CD8 клеток, экспрессирующих все три маркера активации (LAG-3, CD69 и CD25), для каждого отдельного условия стимуляции
Таблица 23. Средний процент CD8 клеток, экспрессирующих LAG-3, CD69, CD25, какой-либо один из трех маркеров активации (LAG-3, CD69 или CD25) или все три маркера активации (LAG-3, CD69 и CD25), для каждого отдельного условия стимуляции
Таблица 24. Увеличение среднего процента CD8 клеток, экспрессирующих LAG-3, CD69, CD25, какой-либо один из трех маркеров активации (LAG-3, CD69 или CD25) или все три маркера активации (LAG-3, CD69 и CD25) выше среднего исходного уровня, для каждого отдельного условия стимуляции
Результаты показывают, что стимуляция 30 нг/мл анти-PD-L1 антител и 30 нг/мл LAG-3Ig приводила к синергетическому увеличению среднего процента CD8 клеток, экспрессирующих какой-либо или все три маркера активации.
Результаты также показывают, что стимуляция 30 нг/мл анти-PD-L1 антител и 30 нг/мл LAG-3Ig приводила к значительно большему среднему проценту CD8 клеток, экспрессирующих какой-либо или все три маркера активации, чем стимуляция 3000 нг/мл только анти-PD-L1 антител.
На основании данных результатов пришли к выводу, что Т-клеточный ответ in vitro CD8+ (как измерено посредством экспрессии маркеров активации Т-клеток), индуцированный относительно низкими дозами анти-PD-L1 антител, синергетически увеличивался растворимым производным LAG-3. Также пришли к выводу, что значительно улучшенный CD8+ Т-клеточный ответ in vitro получен с использованием в 100 раз меньше анти-PD-L1 антител, если их комбинировали с растворимым производным LAG-3.
Поскольку известно, что ингибиторы пути PD-1 (такие как Кейтруда и Опдиво) активируют CD8+ Т-клетки и эта активация связана с противораковым действием, результаты, представленные в примерах выше, предоставляют доказательство, что улучшенное противораковое действие может быть получено посредством совместного введения ингибитора пути PD-1 с белком LAG-3 или его производным, который способен связываться с молекулами MHC класса II. В качестве альтернативы, аналогичное противораковое действие может быть получено посредством совместного введения ингибитора пути PD-1 с белком LAG-3 (или его производным, которое способно связываться с молекулами MHC класса II) при более низких дозах (например, при дозах в 30-100 раз ниже) ингибитора пути PD-1 по сравнению с введение ингибитора пути PD-1 в виде монотерапии. Такое совместное введение, как ожидается, уменьшает побочные эффекты, вызванные ингибитором пути PD-1.
Аналогично, поскольку известно, что активация Т-клеток CD8+ также эффективна против инфекции, включая хронические или персистирующие инфекции, результаты, представленные в примерах выше, также предоставляют доказательство, что совместного введения ингибитора пути PD-1 с белком LAG-3 или его производным, который способен связываться с молекулами MHC класса II, можно применять для предотвращения, лечения или улучшения инфекция более эффективно. В качестве альтернативы, аналогичное действие против инфекции может быть получено посредством совместного введения ингибитора пути PD-1 с белком LAG-3 (или его производным, которое способно связываться с молекулами MHC класса II) в более низких дозах (например, в дозах в 30-100 раз ниже) ингибитора пути PD-1 по сравнению с введением ингибитора пути PD-1 в виде монотерапии. Такое совместное введение, как ожидается, уменьшает побочные эффекты, вызванные ингибитором пути PD-1.
Пример 12
Действие LAG-3Ig и различных анти-PD-1 или анти-PD-L1 антител на продукцию IFN-γ и TNF-α, индуцированную антигенной стимуляцией
Этот пример демонстрирует действие растворимого производного LAG-3 (LAG-3Ig) и множества различных анти-PD-1 или анти-PD-L1 антител на активацию Т-клеток in vitro с использованием анализов секреции IFN-γ и TNF-α.
PBMC от здоровых доноров (0,2×106 клеток/лунка при 1 M/мл в полном RPMI +10% FBS) инкубировали с пулом пептидов, охватывающих последовательность CMV pp35 в трех повторностях, без какой-либо добавки (среды), с 30 нг/мл или 1000 нг/мл антител анти-PD-1 (Ab1 или Ab2) или анти-PD-L1 антител (Ab3, Ab4, Ab5 или Ab6), с 10 или 30 нг/мл LAG-3Ig или с 10 или 30 нг/мл LAG-3Ig и 30 нг/мл анти-PD-1 или анти-PD-L1 антител.
Т-клеточный ответ оценивали посредством измерения концентрации IFN-γ и TNF в супернатанте клеточной культуры через три дня после стимуляции с использованием BD Cytometric Bead Array.
Анти-PD-1: Ab1 (клон MIH4 из BD Pharmingen, каталог #557823) и Ab2 (гуманизированное анти-PD-1 из BPS bioscience, каталог #71120);
Анти-PD-L1: Ab3 (клон MIH1 от eBioscience, каталог #16-5983-82), Ab4 (клон MIH5 от eBioscience каталог #16-5982-81), Ab5 (Клон 1-111A от eBioscience каталог #14-9971-81) и Ab6 (гуманизированное анти-PD-L1 от BPS bioscience, каталог #71213).
Концентрации IFN-γ и TNF-α в объединенных повторениях для каждого состояния стимуляции для антител анти-PD-1 отмечены в Таблице 25. Результаты нанесены на фигуре 17.
Таблица 25. Секреция IFN-γ и TNF-α, индуцированная антигеном в присутствии антител анти-PD-1 с LAG-3Ig и без него
Результаты показывают, что для каждого антитела анти-PD-1 секреция IFN-γ увеличивалась, когда PBMC инкубировали в присутствии LAG-3Ig и более низких концентраций антител анти-PD-1, по сравнению только с антителом анти-PD-1. Например, увеличение концентрации IFN-γ выше исходного уровня (т.е. концентрации IFN-γ при отсутствии анти-PD-1 и LAG-3Ig) в присутствии 30 нг/мл LAG-3Ig и 30 нг/мл Ab1 антител анти-PD-1, или 10 нг/мл LAG-3Ig и 30 нг/мл Ab2 антител анти-PD-1 было более значительным, чем сумма соответствующего увеличения в присутствии только LAG-3Ig и 30 нг/мл только антител анти-PD-1 (т.е. для Ab1 235,1 > -53,3+144,6; для Ab2 273,8 > 176,1+18,2). Действие комбинации LAG-3Ig и каждого отдельного антитела анти-PD-1 было, таким образом, синергетическим.
Результаты также показывают, что секреция IFN-γ, индуцированная комбинацией LAG-3Ig и относительно низкой концентрацией антител анти-PD-1 (30 нг/мл), была намного выше, чем секреция IFN-γ, индуцированная гораздо более высокой концентрацией (1000 нг/мл, более чем в 30 раз выше) только антител анти-PD-1 (т.е. для Ab1 235,1 > 107,7; для Ab2 273,8 > 27,3).
В отношении секреции TNF-α, только антитело анти-PD-1 (в относительно низкой или высокой концентрации) тоже не оказывало влияния на секрецию TNF-α. Однако, для каждого антитела анти-PD-1 секреция TNF-α увеличивалась, когда PBMC инкубировали в присутствии LAG-3Ig и более низких концентраций антитела анти-PD-1, по сравнению только с антителом анти-PD-1. Например, увеличение концентрации TNF-α выше исходного уровня (т.е. концентрации TNF-α при отсутствии анти-PD-1 и LAG-3Ig) в присутствии 30 нг/мл LAG-3Ig и 30 нг/мл Ab1 антител анти-PD-1, или 10 нг/мл LAG-3Ig и 30 нг/мл Ab2 антител было более значительным, чем сумма соответствующего увеличения в присутствии только LAG-3Ig и 30 нг/мл только антител анти-PD-1 (т.е. для Ab1 118,7 > 0,9+82,2; для Ab2 12,778 > 2,563+9,858). Действие комбинации LAG-3Ig и каждого отдельного антитела анти-PD-1 было, таким образом, синергетическим.
Результаты также показывают, что секреция TNF-α, индуцированная комбинацией LAG-3Ig и относительно низкой концентрацией антител анти-PD-1 (30 нг/мл) была значительно выше, чем секреция TNF-α, индуцированная гораздо более высокой концентрацией (1000 нг/мл, более чем в 30 раз выше) только антител анти-PD-1 (т.е. для Ab1 118,7 > 1,6; for Ab2 12,778 > 2,494).
На основании данных результатов пришли к выводу, что Т-клеточный ответ in vitro (как измерено посредством секреции IFN-γ и TNF-α), индуцированный относительно низкими дозами антител анти-PD-1, синергетически увеличивался растворимым производным LAG-3. Также пришли к выводу, что значительно больший Т-клеточный ответ in vitro получен с использованием более чем в 30 раз меньше антител анти-PD-1, если их комбинировали с растворимым производным LAG-3. Эти эффекты наблюдали с различными антителами анти-PD-1.
Концентрации IFN-γ и TNF-α в объединенных повторениях для каждого состояния стимуляции для анти-PD-L1 антител отмечены в Таблице 26. Результаты показаны на фигуре 18.
Таблица 26. Секреция IFN-γ и TNF-α, индуцированная антигеном в присутствии анти-PD-L1 антител, с LAG-3Ig и без него
Результаты показывают, что для каждого антитела анти-PD-L1 секреция IFN-γ увеличивалась, когда PBMC инкубировали в присутствии LAG-3Ig и более низких концентраций анти-PD-L1 антител по сравнению только с антителами анти-PD-L1. Например, увеличение концентрации IFN-γ выше исходного уровня (т.е. концентрации IFN-γ при отсутствии анти-PD-L1 и LAG-3Ig) в присутствии 10 или 30 нг/мл LAG-3Ig и 30 нг/мл анти-PD-L1 антител было более значительным, чем сумма соответствующего увеличения в присутствии 10 или 30 нг/мл только LAG-3Ig и 30 нг/мл только анти-PD-L1 антител (т.е. для Ab3 226,5 > 28,5+79,1; для Ab4 126,03 > 2,31+8,00; for Ab5 180,34 > 19,84+30,11; for Ab6 95,14 > -16,51+19,84). Действие комбинации LAG-3Ig и каждого отдельного антитела анти-PD-L1 было, таким образом, синергетическим.
Результаты также показывают, что секреция IFN-γ, индуцированная комбинацией LAG-3Ig и относительно низкой концентрацией анти-PD-L1 антител (30 нг/мл), была значительно выше, чем секреция IFN-γ, индуцированная гораздо более высокой концентрацией (1000 нг/мл, более чем в 30 раз выше) только анти-PD-L1 антител (т.е. для Ab3 226,5 > 55,5; для Ab4 126,03 > -10,66; для Ab5 180,34 > 10,89; для Ab6 95,14 > -49,61).
В отношении секреции TNF-α, для анти-PD-L1 антител Ab3, Ab4 и Ab5, секреция TNF-α увеличивалась, когда PBMC инкубировали в присутствии LAG-3Ig и более низких концентраций анти-PD-L1 антител по сравнению только с антителами анти-PD-L1. Например, увеличение концентрации TNF-α выше исходного уровня (т.е. концентрации TNF-α при отсутствии анти-PD-L1 и LAG-3Ig) в присутствии 10 или 30 нг/мл LAG-3Ig и 30 нг/мл Ab3, Ab4 или Ab5 анти-PD-L1 антител было более значительным, чем сумма соответствующего увеличения в присутствии только LAG-3Ig и 30 нг/мл Ab3, Ab4 или Ab5 только анти-PD-L1 антител (т.е. для Ab3 9,0 > -1,8+2,4; для Ab4 80,34 > 2,08+58,71; для Ab5 137,84 > 5,53+84,21). Действие комбинации LAG-3Ig и этих различных анти-PD-L1 антител было, таким образом, синергетическим.
Хотя синергетическое действие на секрецию TNF-α для антитела анти-PD-L1 Ab6 в комбинации с LAG-3Ig не наблюдалось, это могло быть вследствие высокого уровня секреции TNF-α в присутствии только данного антитела. Тем не менее, уровень секреции TNF-α в присутствии комбинации Ab6 и LAG-3Ig был выше, чем в присутствии только антитела Ab6 (при 30 нг/мл и при 1000 нг/мл).
Результаты также показывают, что секреция TNF-α, индуцированная комбинацией LAG-3Ig и относительно низкой концентрацией антитела анти-PD-L1 (30 нг/мл) была значительно выше, чем секреция TNF, индуцированная гораздо более высокой концентрацией (1000 нг/мл, более 30 раз выше) только антитела анти-PD-L1 (т.е. для Ab3 9,0 > 0,6; для Ab4 80,34 > 2,50; для Ab5 137,84 > 4,00; for Ab6 100,99 > 47,81).
На основании данных результатов пришли к выводу, что Т-клеточный ответ in vitro (как измерено посредством секреции IFN-γ и TNF), индуцированный относительно низкими дозами антитела анти-PD-L1, синергетически увеличивался растворимым производным LAG-3. Также пришли к выводу, что значительно больший Т-клеточный ответ in vitro получен с использованием более чем в 30 раз меньше анти-PD-L1 антител, если их комбинировали с растворимым производным LAG-3. Данный эффект наблюдали с различными антителами анти-PD-L1.
Пример 13
Действие производных LAG-3 и антитела анти-PD-1 на продукцию IFN-γ, индуцированную антигенной стимуляцией
Этот пример демонстрирует действие множества различных растворимых производных LAG-3 (производных (i), (ii) и (iv) описаны в Примере 5 и проиллюстрированы на фигуре 7) и антитела анти-PD-1 на активацию Т-клеток in vitro с использованием анализа секреции IFN-γ.
PBMC от здоровых доноров (0,2×106 клеток/лунку при 1 M/мл в полном RPMI+10% FBS) инкубировали с пулом пептидов, охватывающих последовательность CMV pp35 в трех повторностях, без какой-либо добавки (среды), с 30 нг/мл или 1000 нг/мл антитела анти-PD-1 (клон EH12), с 30 нг/мл производное LAG-3 (IMP321, IMP321 R75A или LAG3 D1D4-линкер2-Ig) или с 30 нг/мл производного LAG-3 и 30 нг/мл анти-PD-1.
Т-клеточный ответ оценивали посредством измерения концентрации IFN-γ в супернатанте клеточной культуры через три дня после стимуляции с использованием BD Cytometric Bead Array.
Концентрация IFN-γ в объединенных повторениях для каждого состояния стимуляции отмечена в Таблице 27. Результаты показаны на фигуре 19.
Таблица 27. Секреция IFN-γ, индуцированная антигеном в присутствии антитела анти-PD-1 с различными производными LAG-3 и без них
Результаты показывают, что для каждого производного LAG-3 секреция IFN-γ увеличивалась, когда PBMC инкубировали в присутствии 30 нг/мл производного LAG-3 и 30 нг/мл антитела анти-PD-1 по сравнению с 30 нг/мл производного LAG-3 или только 30 нг/мл антитела анти-PD-1. Например, увеличение концентрации IFN-γ выше исходного уровня (т.е. концентрации IFN-γ при отсутствии анти-PD-1 и производного LAG-3) в присутствии 30 нг/мл производного LAG-3 и 30 нг/мл антитела анти-PD-1 была значительнее, чем сумма соответствующего увеличения в присутствии 30 нг/мл производного LAG-3 alone и 30 нг/мл только антитела анти-PD-1 (т.е. для IMP321 572,3 > 249,7+22,3; для IMP321 R75A 511,2 > 317,3+22,3; для LAG3 D1D4-линкер2-Ig 520,7 > 258,0+22,3). Действие комбинации антитела анти-PD-1 и каждого отдельного производного LAG-3 было, таким образом, синергетическим.
Результаты также показывают, что секреция IFN-γ, индуцированная комбинацией каждого производного LAG-3 и относительно низкой концентрацией антитела анти-PD-1 (30 нг/мл), была значительно выше, чем секреция IFN-γ, индуцированная гораздо более высокой концентрацией (1000 нг/мл, более чем в 30 раз выше) только антитела анти-PD-1 (т.е. для IMP321 572,3 > 85,9; для IMP321 R75A, 511,2 > 85,9; для LAG3 D1D4-линкер2-Ig 520,7 > 85,9).
На основании данных результатов пришли к выводу, что Т-клеточный ответ in vitro (как измерено посредством секреции IFN-γ), индуцированный относительно низкими дозами антитела анти-PD-1, синергетически увеличивался множеством различных растворимых производных LAG-3, каждое из которых сохраняет способность связывать MHC класса II-положительные клетки. Также пришли к выводу, что значительно больший Т-клеточный ответ in vitro получен с использованием более чем в 30 раз меньше антитела анти-PD-1, если его комбинировали с любым из растворимых производных LAG-3.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ TUSC2-ИММУНОТЕРАПИИ | 2017 |
|
RU2755903C2 |
| НОВЫЙ ПОДХОД К ЛЕЧЕНИЮ РАКА С ПРИМЕНЕНИЕМ ИММУНОМОДУЛЯЦИИ | 2016 |
|
RU2817047C2 |
| ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2017 |
|
RU2759728C2 |
| НОВЫЕ МОЛЕКУЛЫ АНТАГОНИСТИЧЕСКИХ АНТИ-TNFR2-АНТИТЕЛ | 2019 |
|
RU2829587C2 |
| НОВЫЙ ПОДХОД К ЛЕЧЕНИЮ РАКА С ПРИМЕНЕНИЕМ ИММУНОМОДУЛЯЦИИ | 2016 |
|
RU2711380C2 |
| Анти-LAG-3 антитела | 2016 |
|
RU2760582C2 |
| ИММУНОМОДИФИЦИРУЮЩИЕ ЧАСТИЦЫ ДЛЯ ЛЕЧЕНИЯ РАКА | 2019 |
|
RU2794261C2 |
| Способ оценки чувствительности опухоли к иммуноонкологическим препаратам | 2021 |
|
RU2771760C1 |
| ИНГИБИТОР КОНТРОЛЬНЫХ ТОЧЕК И ЦЕЛЫЕ КЛЕТКИ МИКОБАКТЕРИЙ ДЛЯ ПРИМЕНЕНИЯ В ТЕРАПИИ РАКА | 2016 |
|
RU2733033C2 |
| СНИЖЕНИЕ СИСТЕМНЫХ УРОВНЕЙ ИЛИ АКТИВНОСТИ РЕГУЛЯТОРНЫХ Т-КЛЕТОК ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЯ И ПОРАЖЕНИЯ ЦНС | 2017 |
|
RU2815892C1 |

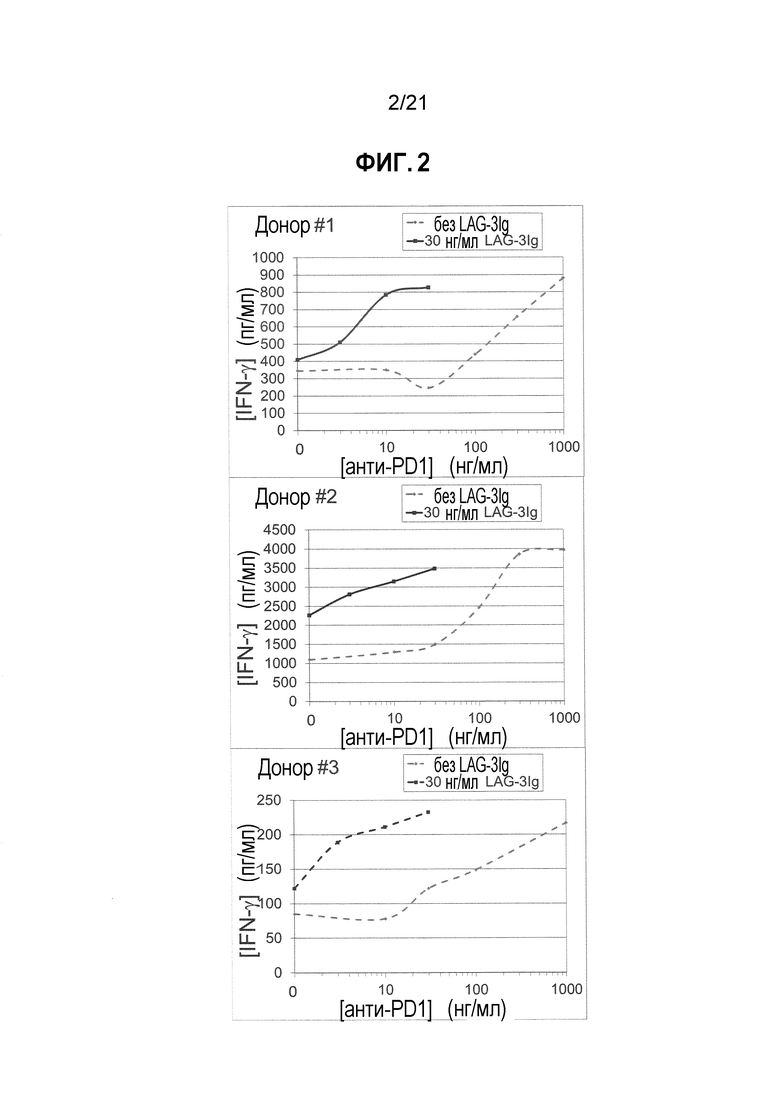
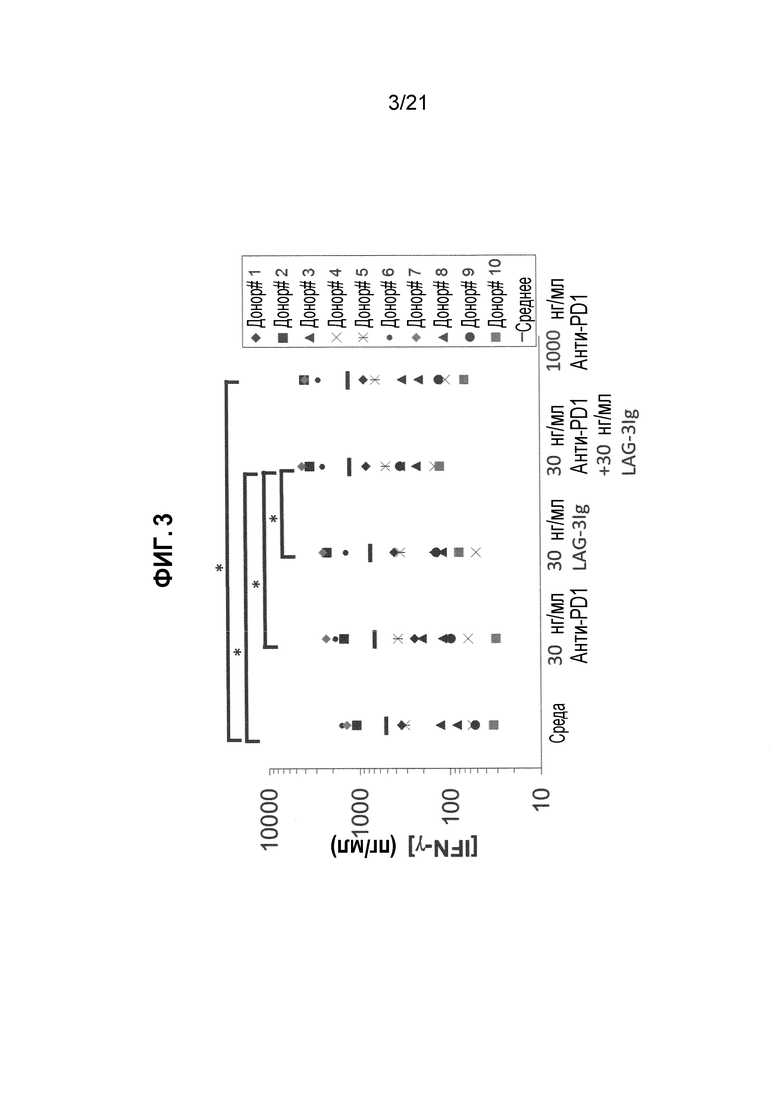
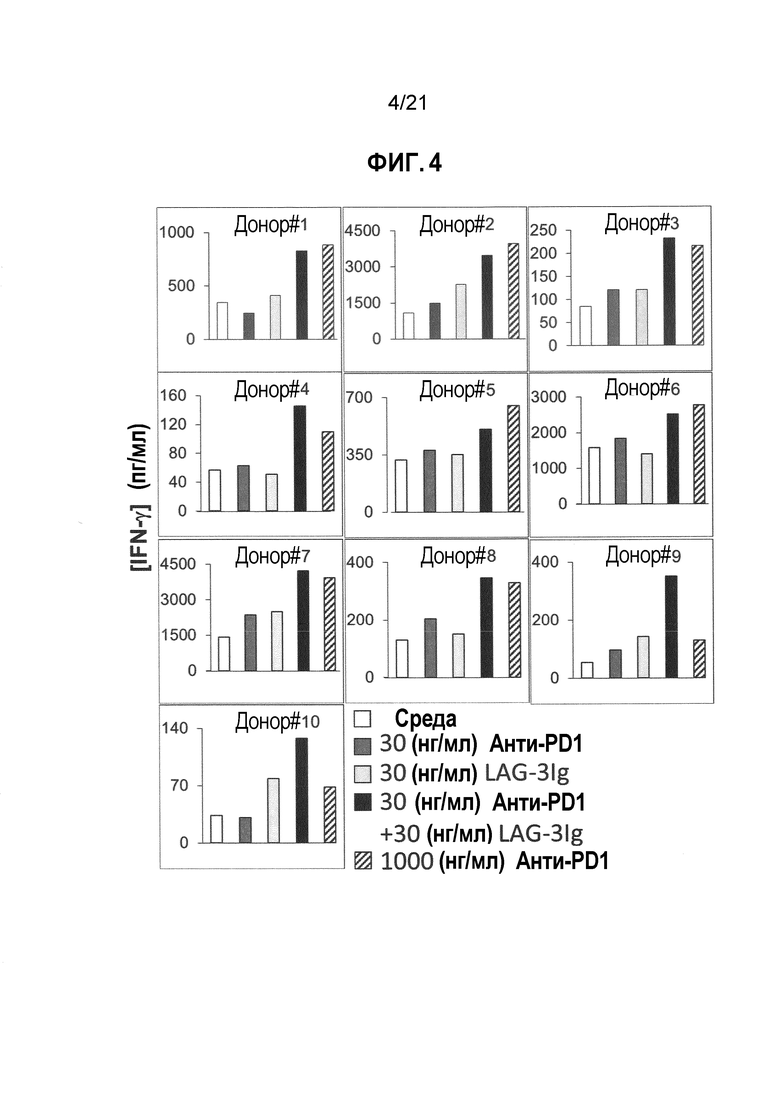
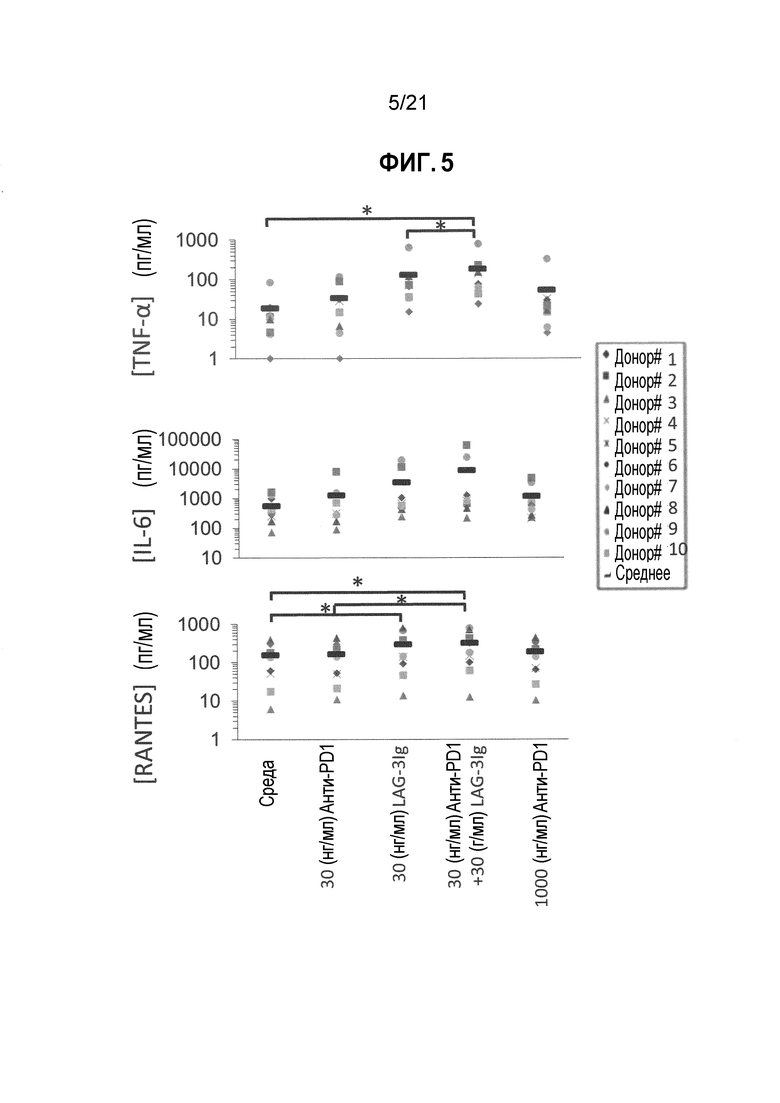
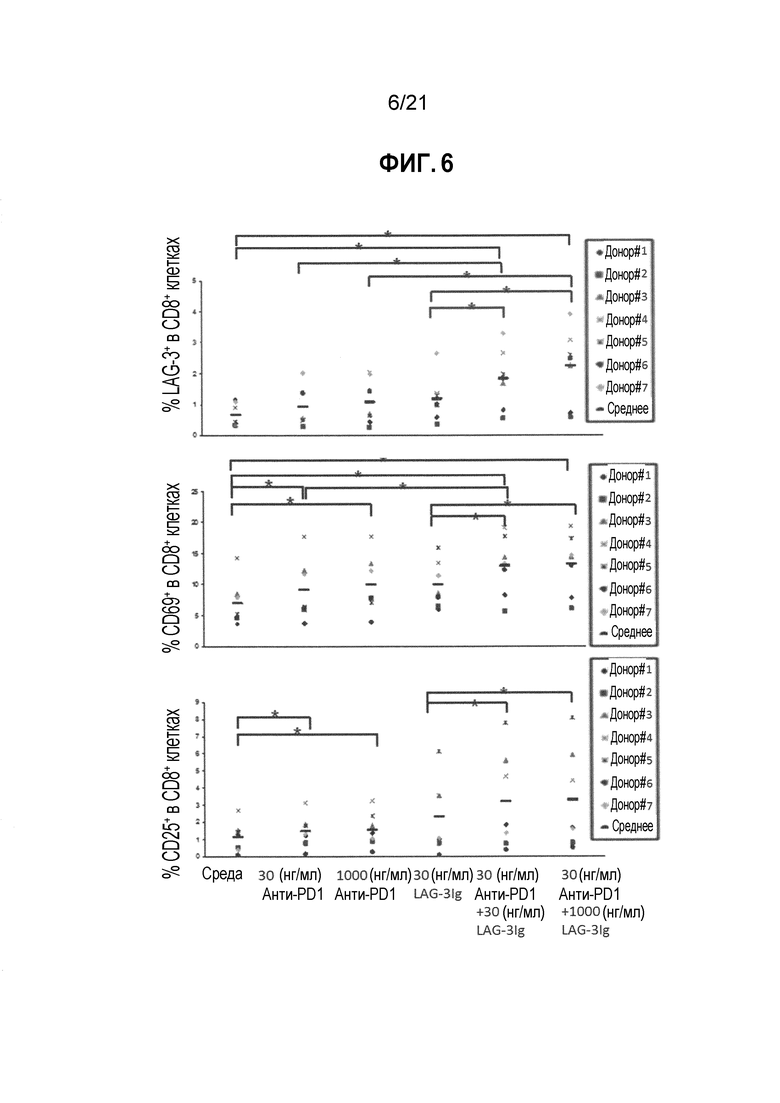
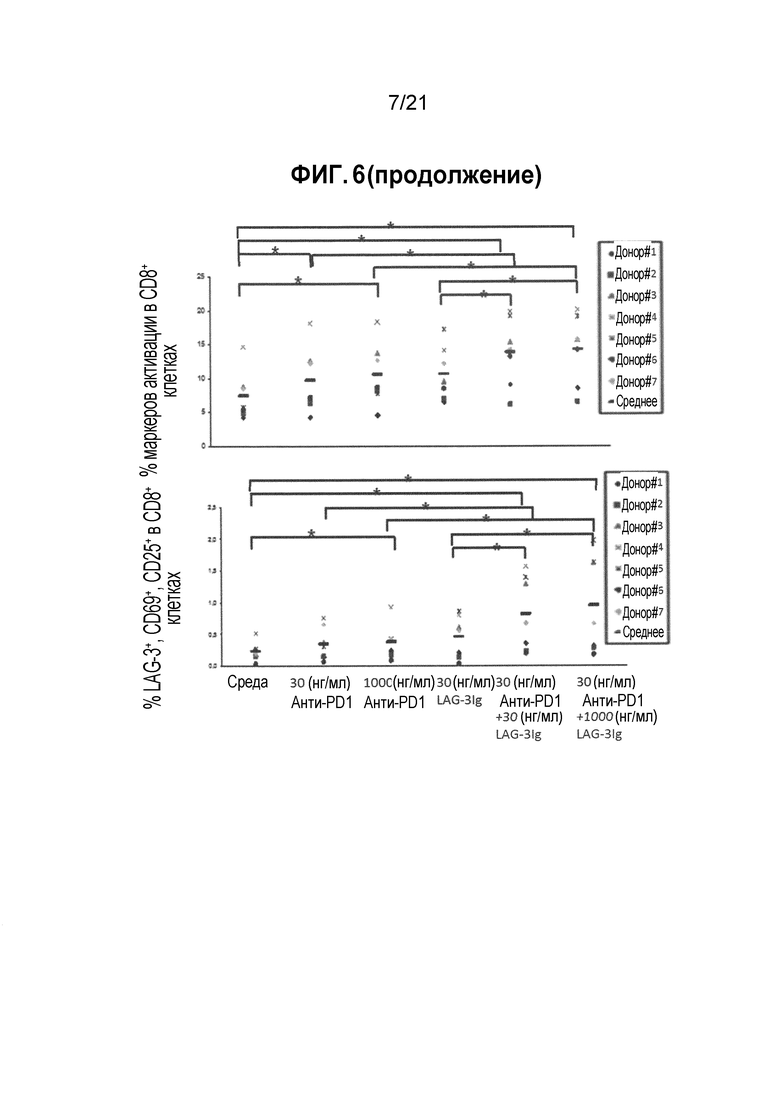

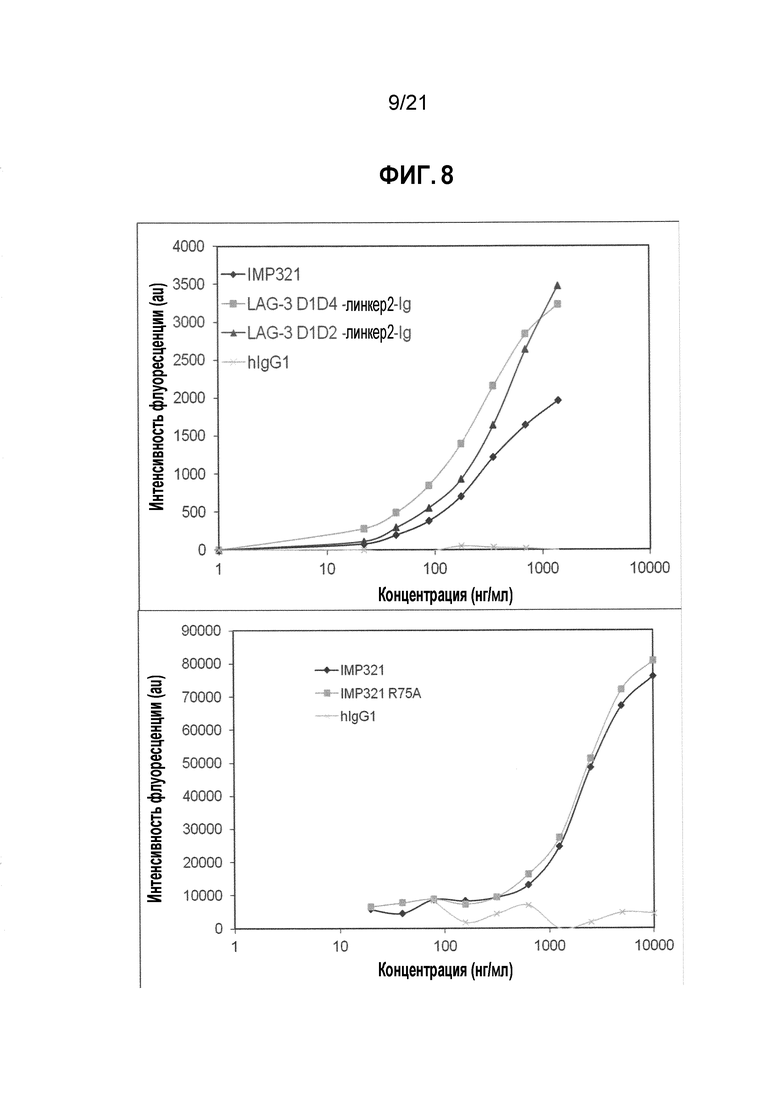
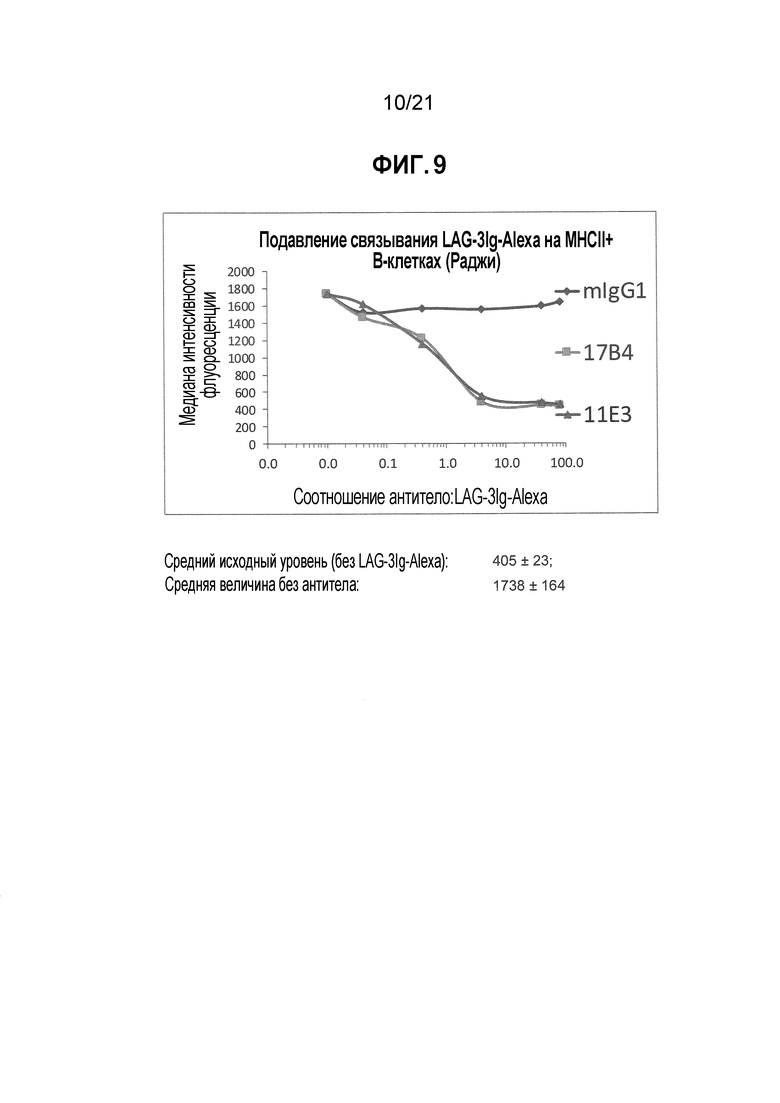
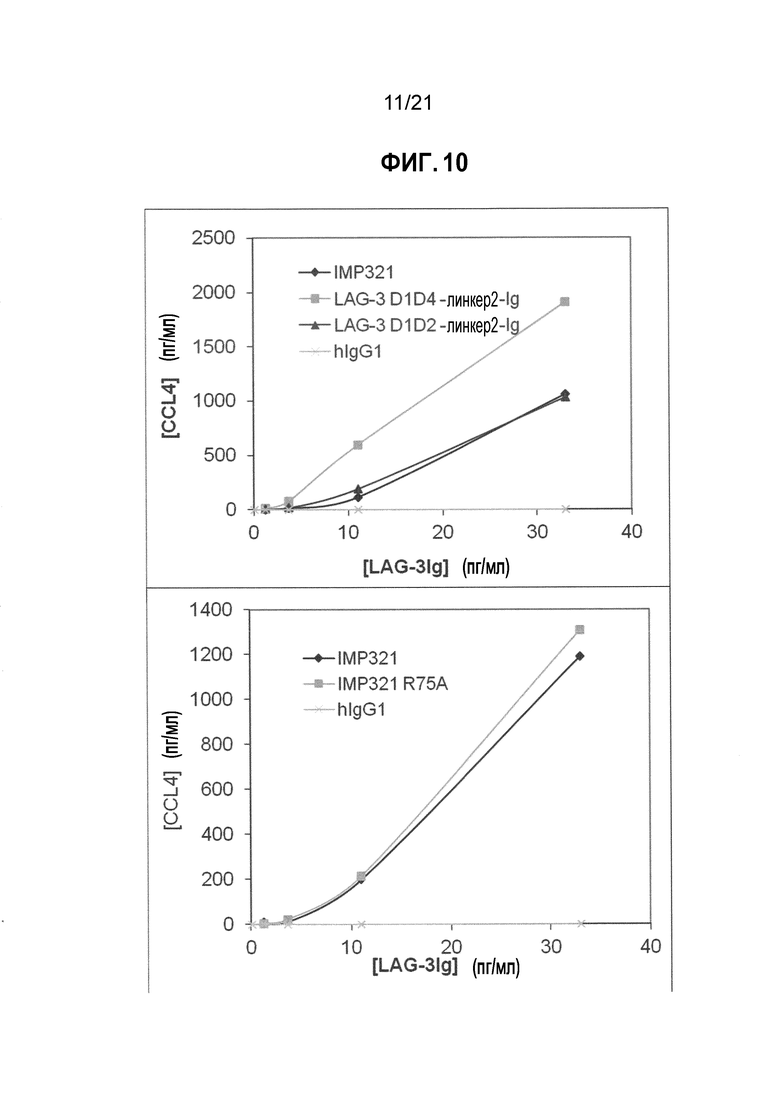
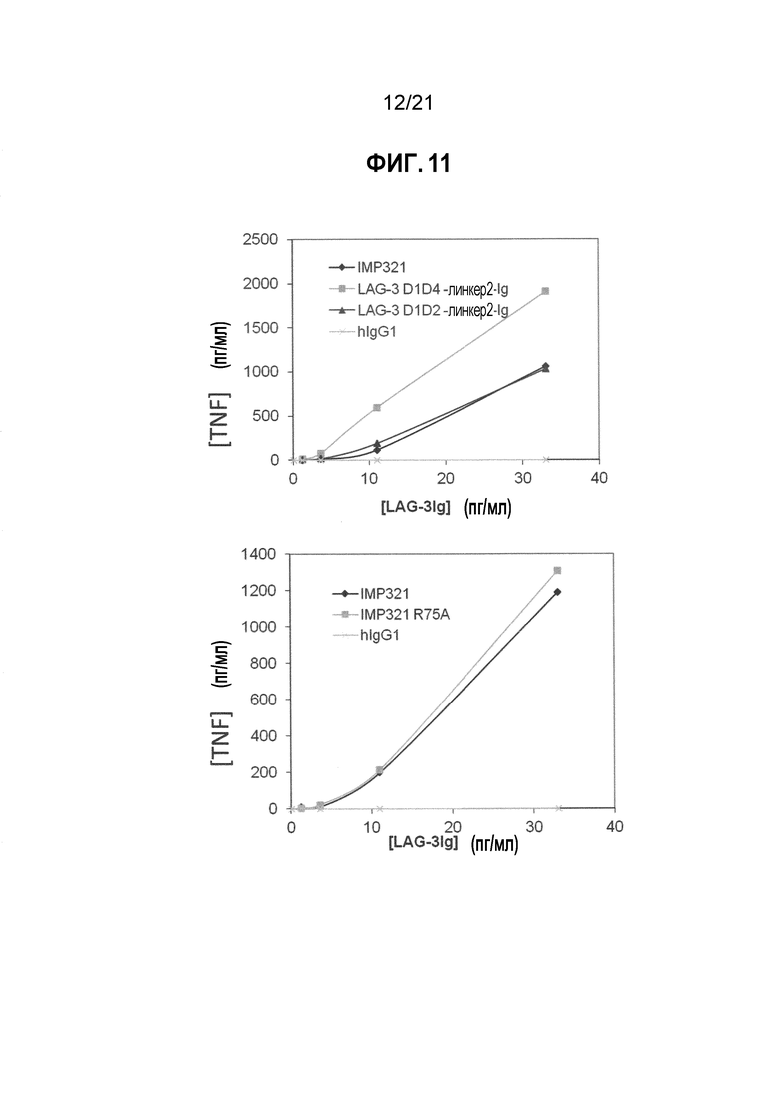
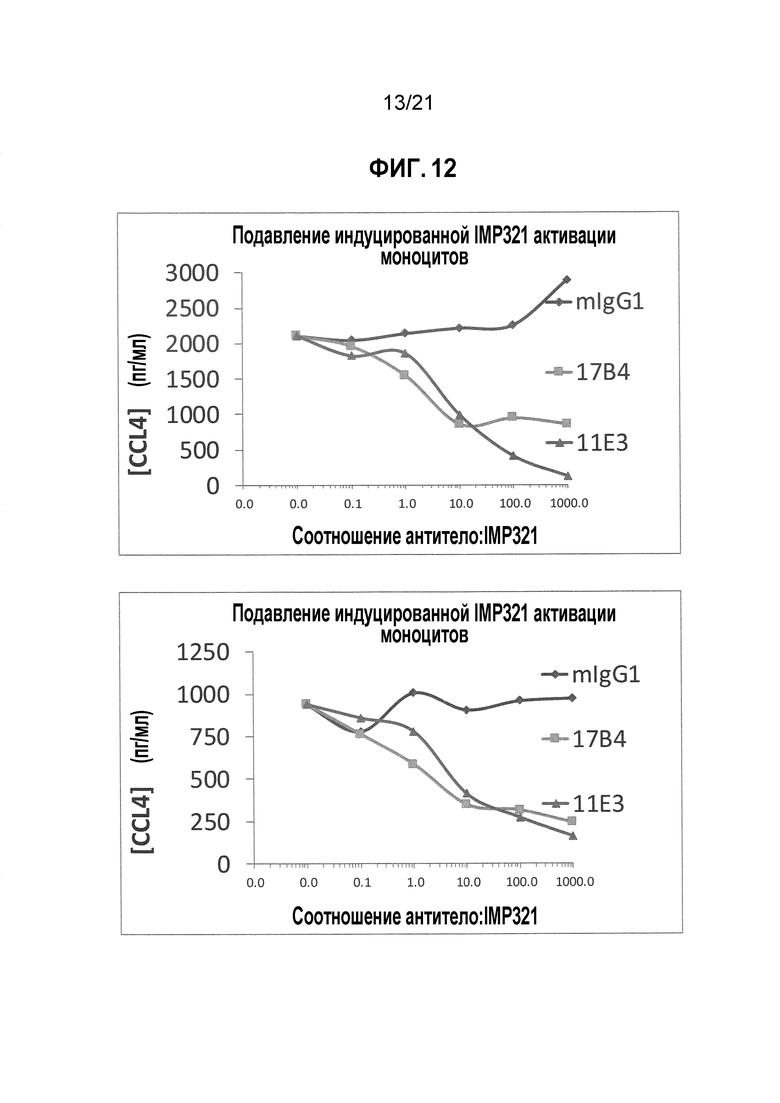
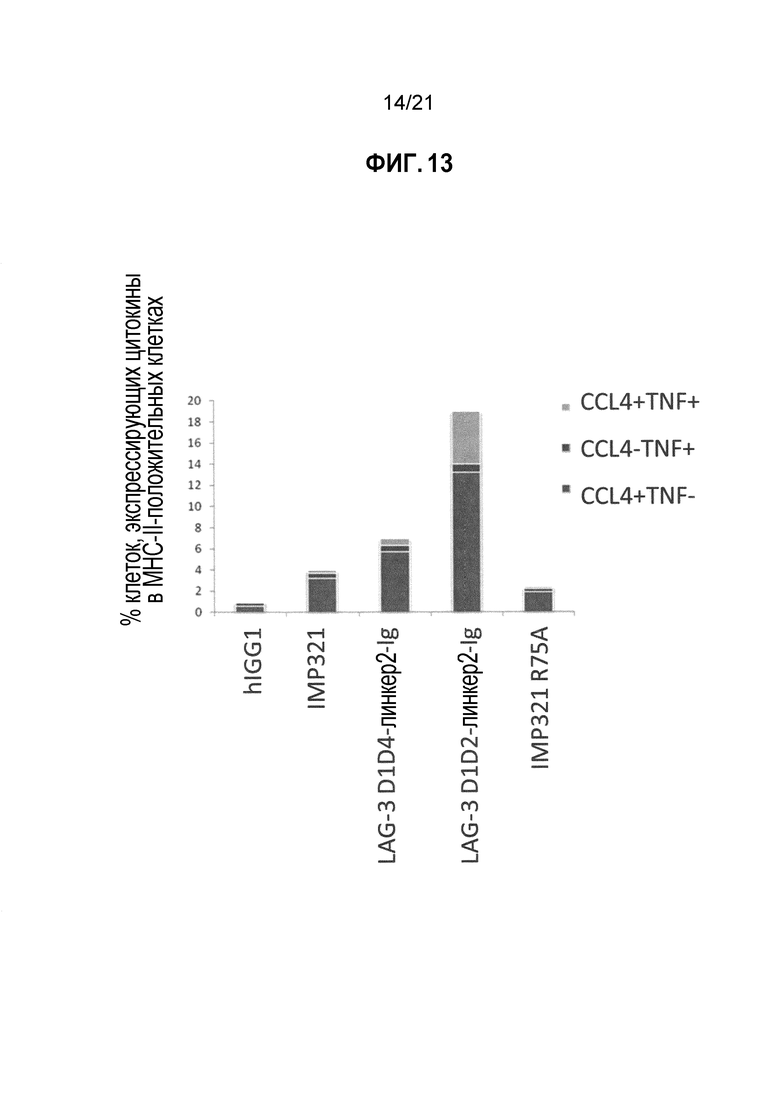
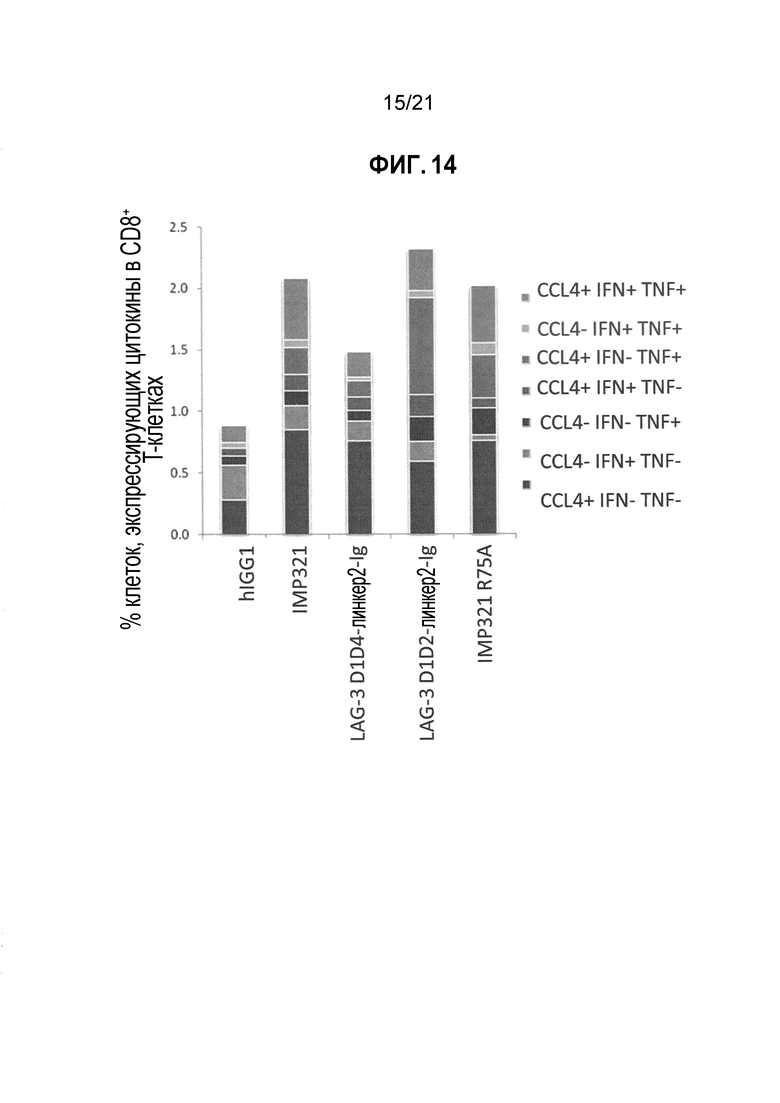

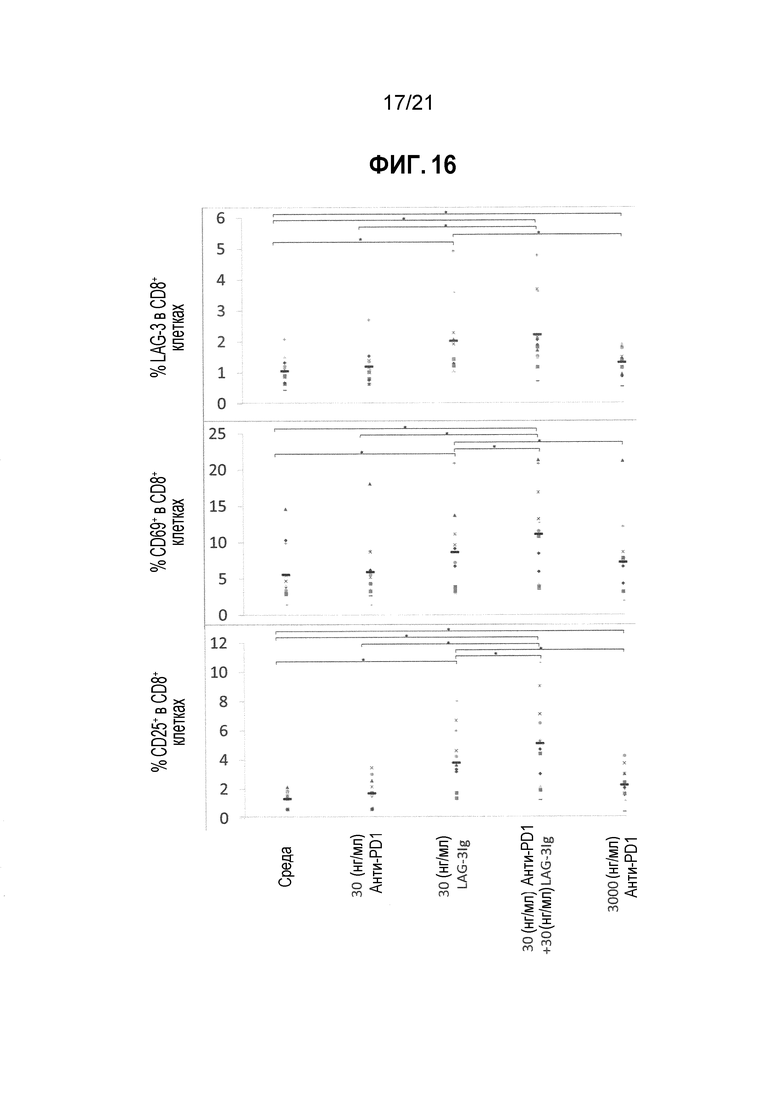
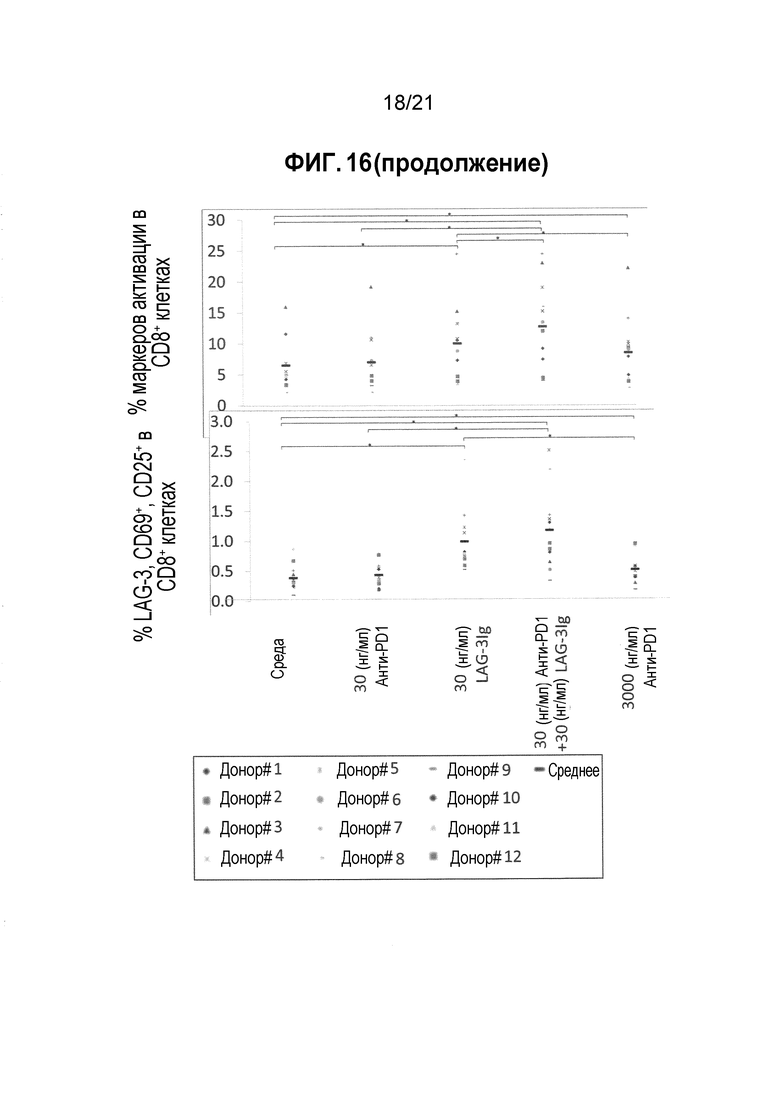
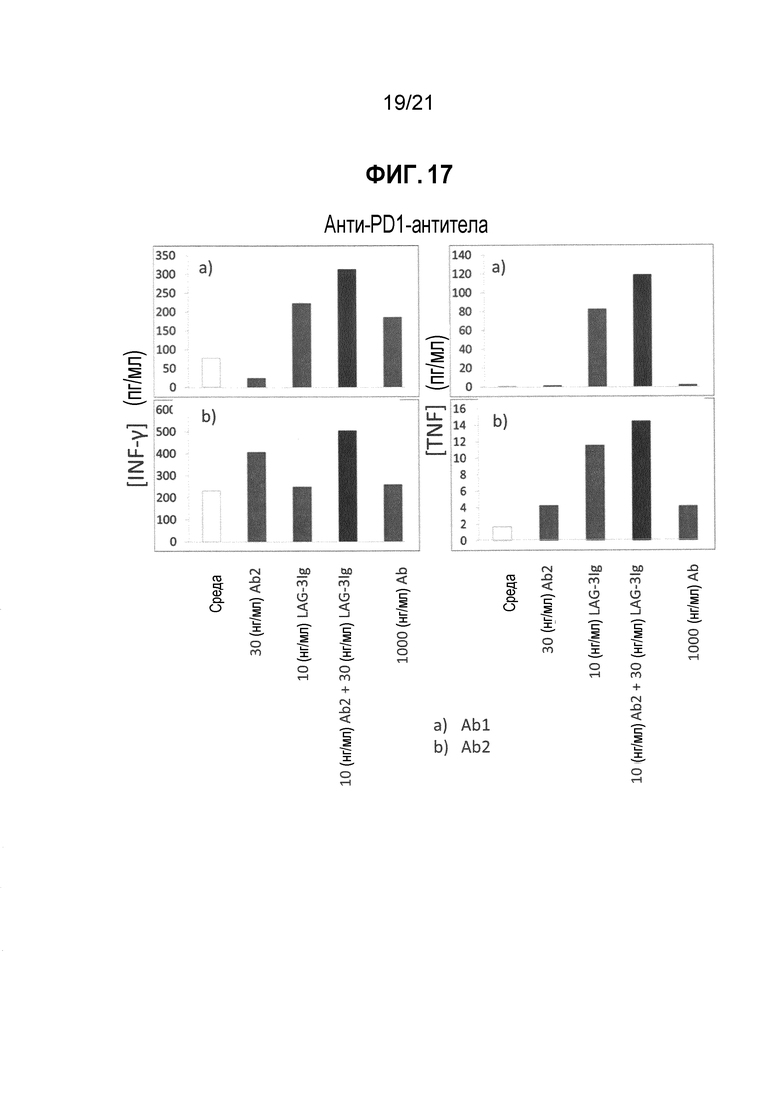
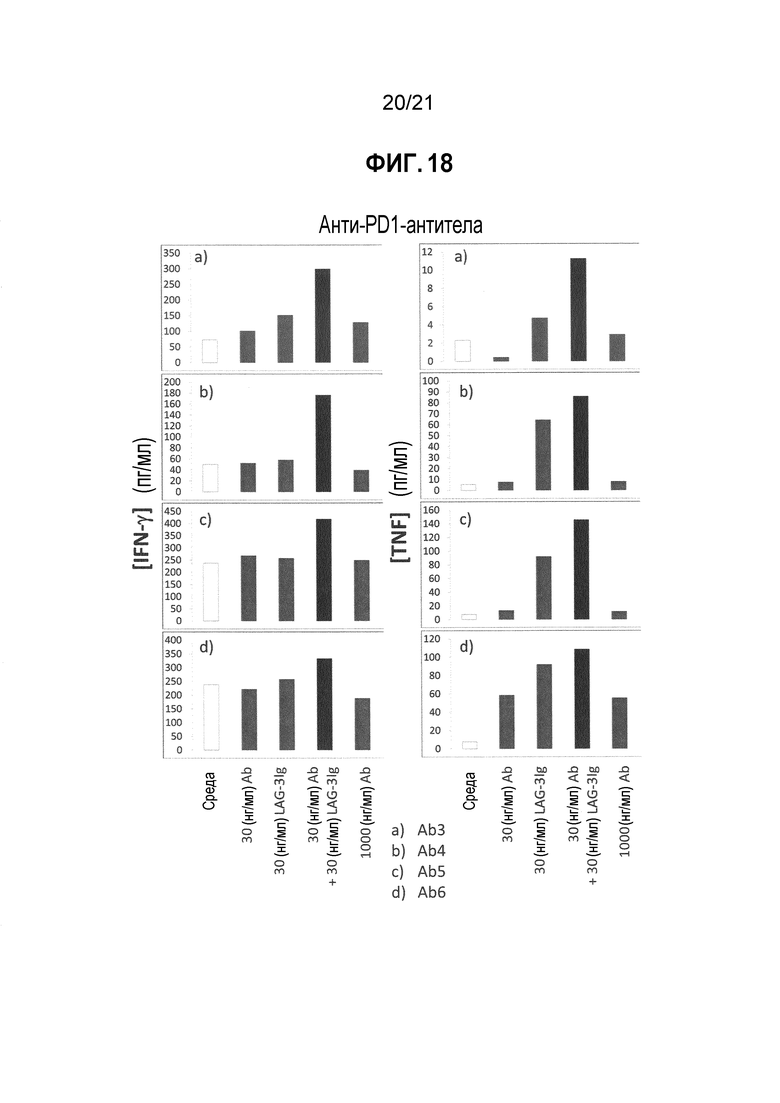
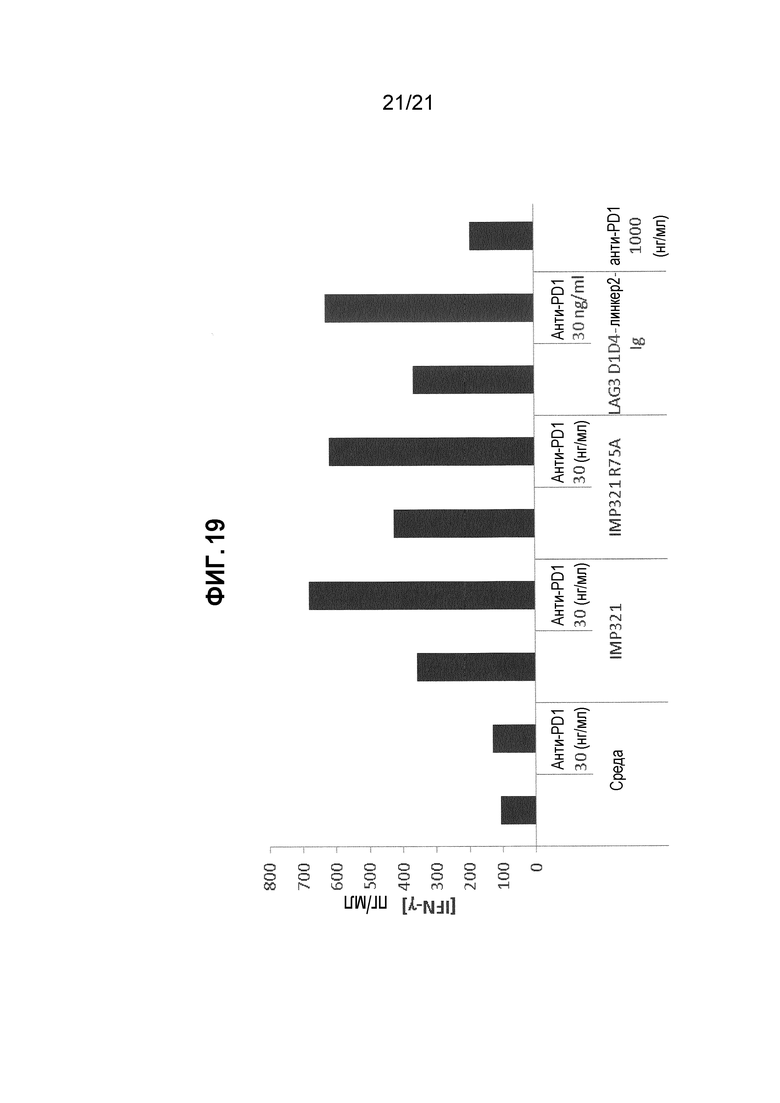
Предложенная группа изобретений относится к области медицины. Предложен комбинированный препарат для лечения рака или улучшения состояния при раке, который содержит растворимый белок LAG-3 или производное белка LAG-3, которое содержит рекомбинантный растворимый человеческий LAG-3Ig слитый белок IMP321, и ингибитор пути белка запрограммированной смерти клетки-1 (PD-1), содержащий анти-PD-1 антитело или анти-PD-L1 антитело. Предложено применение комбинированного препарата для лечения рака или улучшения состояния при раке. Предложенная группа изобретений обеспечивает синергетическую активацию Т-клеток для предотвращения, лечения или улучшения рака. 2 н. и 12 з.п. ф-лы, 19 ил., 27 табл., 13 пр.
1. Комбинированный препарат для лечения рака или улучшения состояния при раке, который содержит:
(a) растворимый белок LAG-3 или производное белка LAG-3, которое способно связываться с молекулами MHC класса II, где производное белка LAG-3 содержит рекомбинантный растворимый человеческий LAG-3Ig слитый белок IMP321, и где растворимый белок LAG-3 или производное белка LAG-3 связывается с молекулами MHC класса II на антиген-презентирующих клетках (APC), таким образом активируя APC и также активируя Т-клетки; и
(b) ингибитор пути белка запрограммированной смерти клетки-1 (PD-1), где ингибитор пути PD-1 содержит анти-PD-1 антитело или анти-PD-L1 антитело.
2. Комбинированный препарат по п. 1 для совместного введения или последовательного введения белка LAG-3 или его производного и ингибитора пути PD-1.
3. Комбинированный препарат по п. 1 или 2, при этом белок LAG-3 или его производное присутствует в дозе, которая является молярным эквивалентом 0,25-30 мг LAG-3Ig слитого белка IMP321.
4. Комбинированный препарат по п. 1 или 2, который содержит множество доз белка LAG-3 или его производного.
5. Комбинированный препарат по п. 1 или 2, который содержит множество доз ингибитора пути PD-1.
6. Комбинированный препарат по п. 1 или 2, при этом ингибитор пути PD-1 содержит антитело анти-PD-1.
7. Комбинированный препарат по п. 1 или 2, при этом анти-PD-1 антитело представляет собой пембролизумаб, или ниволумаб, или пидилизумаб.
8. Комбинированный препарат по п. 1 или 2, при этом ингибитор пути PD-1 содержит антитело анти-PD-L1.
9. Комбинированный препарат по п. 8, при этом анти-PD-L1 антитело представляет собой BMS-936559, MEDI4736, MPDL3280A или MSB0010718C.
10. Комбинированный препарат по п. 1 или 2, при этом ингибитор пути PD-1 присутствует в дозе, составляющей вплоть до 50%, 1-50%, 1-25% или 1-10% обычно назначаемой дозы ингибитора пути PD-1 в виде монотерапии.
11. Комбинированный препарат по п. 1 или 2, при этом ингибитор пути PD-1 присутствует в дозе, составляющей 0,1-50%, 0,1-25%, 0,1-20%, 0,1-10%, <20%, <10%, 0,1-<20%, 0,1-<10%, 0,01-<20% или 0,01-<10% обычно назначаемой дозы ингибитора пути PD-1 в виде монотерапии.
12. Применение комбинированного препарата по любому из пп.1-11 для лечения рака или улучшения состояния при раке.
13. Применение комбинированного препарата по п. 12, при этом рак представляет собой рак кожи, легкого, яичников, почек, ободочной кишки, колоректальный рак, молочной железы, желудка, пищевода, поджелудочной железы, мочевого пузыря, уротелия или печени или меланому, рак простаты, рак головы и шеи, рак шейки матки, рак щитовидной железы, глиобластому, глиому, лейкоз, лимфому, рак надпочечников, СПИД-ассоциированный рак, альвеолярную саркому мягких тканей, астроцитарную опухоль, рак костей, рак головного и спинного мозга, метастатическую опухоль головного мозга, опухоль каротидного тельца, хондросаркому, хордому, хромофобную почечноклеточную карциному, светлоклеточную карциному, доброкачественную фиброзную гистиоцитому кожи, десмопластическую мелкокруглоклеточную опухоль, эпендимому, саркому Юинга, внескелетную миксоидную хондросаркому, несовершенный костный фиброгенез, фиброзную дисплазию костей, рак желчного пузыря или желчных путей, гестационную трофобластическую болезнь, эмбрионально-клеточную опухоль, злокачественное заболевание системы крови, гепатоцеллюлярную карциному, опухоль островковых клеток поджелудочной железы, саркому Капоши, рак почек, липому/доброкачественную липоматозную опухоль, липосаркому/злокачественную липоматозную опухоль, медуллобластому, менингиому, карциному клеток Меркеля, множественные эндокринные неоплазии, множественную миелому, миелодиспластический синдром, нейробластому, нейроэндокринную опухоль, папиллярную карциному щитовидной железы, опухоль паращитовидных желез, рак у детей, злокачественную опухоль оболочек периферических нервов, феохромоцитому, опухоль гипофиза, рак простаты, увеальную меланому заднего отдела глаза, редкие гематологические расстройства, метастатический рак почки, рабдоидную опухоль, рабдомиосаркому, саркому, саркому мягких тканей, плоскоклеточный рак, рак желудка, синовиальную саркому, рак яичка, рак вилочковой железы, тимому, метастатический рак щитовидной железы или рак матки.
14. Применение комбинированного препарата по п. 13, где рак легкого представляет собой плоскоклеточную или неплоскоклеточную немелкоклеточную карциному легкого, NSCLC, меланома представляет собой метастатическую злокачественную меланому, рак простаты представляет собой гормонорезистентную аденокарциному простаты, рак головы и шеи представляет собой плоскоклеточную карциному головы и шеи, или лимфома представляет собой В-клеточную лимфому.
| WO 2008156712 A1, 24.12.2008 | |||
| WO 2014194293 A1, 04.12.2014 | |||
| US 2011150892 A1, 23.06.2011 | |||
| US 2014341920 A1, 20.11.2014 | |||
| КОНДЕНСАТООТВОДЧИК | 1993 |
|
RU2044949C1 |
| ПРИСПОСОБЛЕНИЕ К РУЧКЕ КРАНА МАШИНИСТА ДЛЯ УПРАВЛЕНИЯ ВОЗДУШНОЙ ПЕСОЧНИЦЕЙ | 1925 |
|
SU3740A1 |
| ЧИССОВ В.И | |||
| под ред | |||
| и др | |||
| Онкология | |||
| Национальное руководство | |||
| М., "ГЭОТАР-Медиа", 2008, c.323-327 | |||
| WOO S.-R | |||
| et al | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
Авторы
Даты
2022-08-12—Публикация
2016-01-08—Подача