Область техники
[0001] Настоящее изобретение относится к маркеру и способу определения болезни Паркинсона.
Предпосылки создания изобретения
[0002] Болезнь Паркинсона (БП) известна как нейродегенеративное заболевание, которое прогрессирует с возрастом, и, по оценкам специалистов, к 2030 году число пациентов во всем мире может достигать 10 миллионов человек. Исследования здоровых индивидуумов также указывали на присутствие телец Леви, позитивных по α-синуклеину, в желудочно-кишечном тракте, в ткани обонятельных органов и в сердце, хотя симптомы БП отсутствовали, и было высказано предположение, что эти гистологические повреждения присутствуют еще до развития заболевания, а патологическое состояние при БП постепенно прогрессирует и также поражает центральную нервную систему.
[0003] Аналогичным образом, было обнаружено, что α-синуклеин присутствовал в тонком кишечнике у пациентов с БП еще за 20 лет до начала развития заболевания (непатентный документ 1). Помимо этих признаков, ольфактометрия (непатентный документ 2) и сцинтиграфия миокарда MIBG (не-патентный документ 3) были зарегистированы как факторы, подходящие для детектирования БП на ранней стадии, и было высказано предположение о наличии поражений в периферических органах. Запор представляет собой симптом, наблюдаемый еще до начала развития БП, и группа исследователей в Гонолулу показала, что запор наблюдается в среднем в течение 10 лет или более до начала развития БП (не-патентный документ 4).
Список цитируемой литературы
Непатентные документы
[0004]
Непатентный документ 1: Hawkes CH, et al., Parkinsonism Relat. Disord., 2010, 16(2): 79-84
Непатентный документ 2: Katzenschlager R, et al., Curr. Opin. Neurol., 2004, 17(4): 417-423
Непатентный документ 3: Hirayama M, et al., J. Auton. Nerv. Syst., 1995, 53(2-3): 230-234
Непатентный документ 4: Abbott RD, et al., Neurology, 2001, 57(3): 456-462.
Сущность изобретения
Техническая проблема
[0005] В настоящее время не существует какой-либо информации о изменении времени пребывания микробиоты в тонком кишечнике одного пациента с БП. В настоящее время необходимо разработать простой способ определения прогрессирования патологического состояния при БП.
Решение проблемы
[0006] Для решения вышеупомянутых проблем, авторами настоящего изобретения было проведено исследование для того, чтобы определить, приводит ли изменение времени пребывания микробиоты у одного пациента к изменению патологического состояния или нет, в целях определения взаимосвязи между изменением патологического состояния при БП и бактериями тонкого кишечника, а также было проведено измерение кишечной микробиоты и компонентов крови, и было проведено перспективное обследование пациентов с БП и его домочадцев в течение 2 лет. В результате, авторами было обнаружено, что степень тяжести состояния при БП может быть определена путем измерения повышения или снижения уровня кишечных бактерий у пациентов с БП in vivo, и что кишечные бактерии могут быть маркером для детектирования БП, и на этой основе было разработано настоящее изобретение. Кроме того, авторами настоящего изобретения было обнаружено, что ухудшение состояния при БП может быть определено по уровню липополисахаридов (LPS) в крови или по уровню белка, связывающегося с липополисахаридом, в крови (LBP) в качестве индикатора.
[0007] То есть, настоящее изобретение относится к таким нижеследующим аспектам, как [1]-[14]:
[1] Маркер для определения болезни Паркинсона, где указанный маркер представляет собой количество одной или более кишечных бактерий, выбранных из группы, состоящей из Bifidobacterium, группы Bacteroides fragilis, Lactobacillus brevis, и подгруппы Lactobacillus plantarum и/или общего количества кишечных бактерий.
[2] Маркер в соответствии с [1], где определением болезни Паркинсона является определение риска прогрессирования болезни Паркинсона.
[3] Маркер в соответствии с [2], где прогрессированием болезни Паркинсона является прогрессирование симптома запора или психического симптома.
[4] Маркер в соответствии с [3], где психическим симптомом является один или более симптомов, выбранных из группы, состоящей из галлюцинации, нарушения когнитивной функции и раздражительности.
[5] Способ определения прогрессирования патологического состояния у пациента с болезнью Паркинсона, включающий измерение количества одной или более кишечных бактерий, выбранных из группы, состоящей из Bifidobacterium, группы Bacteroides fragilis, Lactobacillus brevis, и подгруппы Lactobacillus plantarum и/или общего количества кишечных бактерий у пациента в два или более различных моментов времени и сравнение этих количеств.
[6] Способ в соответствии с [5], где прогрессированием патологического состояния у пациента с болезнью Паркинсона является прогрессирование симптома запора или психического симптома.
[7] Способ в соответствии с [6], где психическим симптомом является один или более симптомов, выбранных из группы, состоящей из галлюцинации, нарушения когнитивной функции и раздражительности.
[8] Маркер для определения болезни Паркинсона, где указанный маркер представляет собой уровень LPS в крови и/или уровень LBP в крови.
[9] Маркер в соответствии с [8], где определением болезни Паркинсона является определение риска прогрессирования болезни Паркинсона.
[10] Маркер в соответствии с [9], где прогрессированием болезни Паркинсона является прогрессирование симптома запора или психического симптома.
[11] Маркер в соответствии с [10], где психическим симптомом является один или более симптомов, выбранных из группы, состоящей из галлюцинации, нарушения когнитивной функции и раздражительности.
[12] Способ определения прогрессирования патологического состояния у пациента с болезнью Паркинсона, включающий измерение уровней LPS в крови и/или уровней LBP в крови у пациента в два или более различных моментов времени и сравнение этих уровней.
[13] Способ в соответствии с [12], где прогрессированием патологического состояния у пациента с болезнью Паркинсона является прогрессирование симптома запора или психического симптома.
[14] Способ в соответствии с [13], где психическим симптомом является один или более симптомов, выбранных из группы, состоящей из галлюцинации, нарушения когнитивной функции и раздражительности.
[15] Набор для осуществления способа в соответствии с любым из [5]-[7], где указанный набор содержит протокол измерения кишечных бактерий в соответствии с любым из [1]-[4].
Преимущественные эффекты изобретения
[0008] В соответствии с настоящим изобретением, риск прогрессирования БП может быть определен путем измерения количества специфических кишечных бактерий или измерения количества специфических кишечных бактерий в два или более различных моментов времени и сравнение этих количеств. Кроме того, прогрессирование БП может быть определено путем сравнения уровней LPS в крови или уровней LBP в крови.
Краткое описание чертежей
[0009]
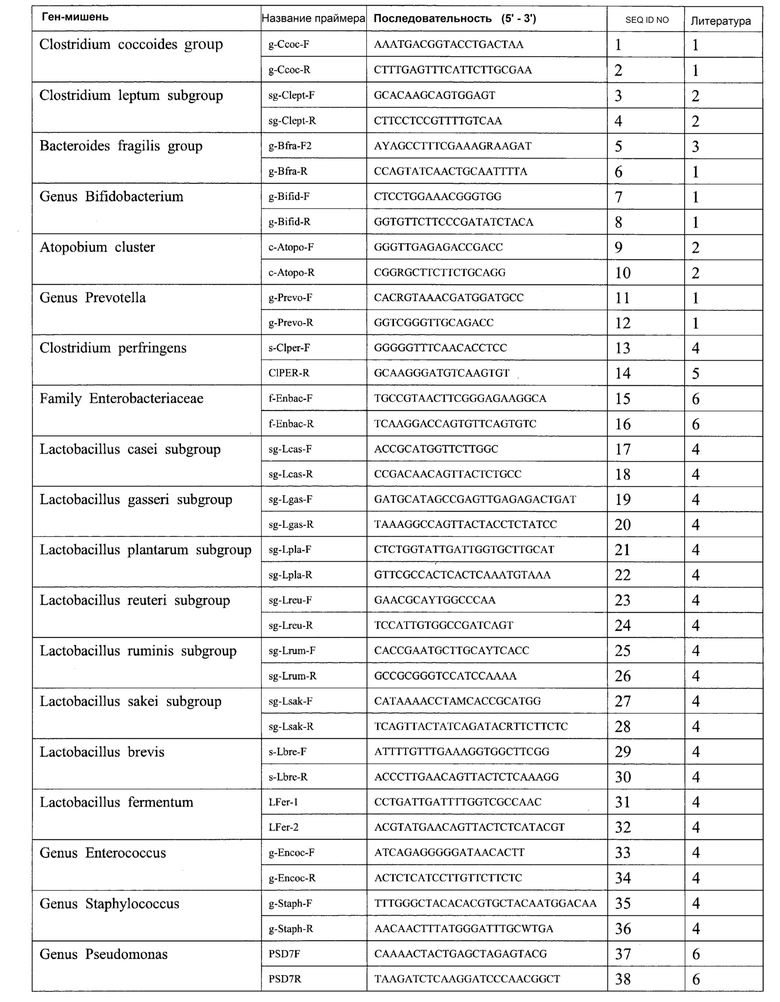
[Фигура 1] На фигуре 1 показана корреляция между уровнем LBP в сыворотке и частотой экскреции (А: БП-группа, В: контрольная группа).
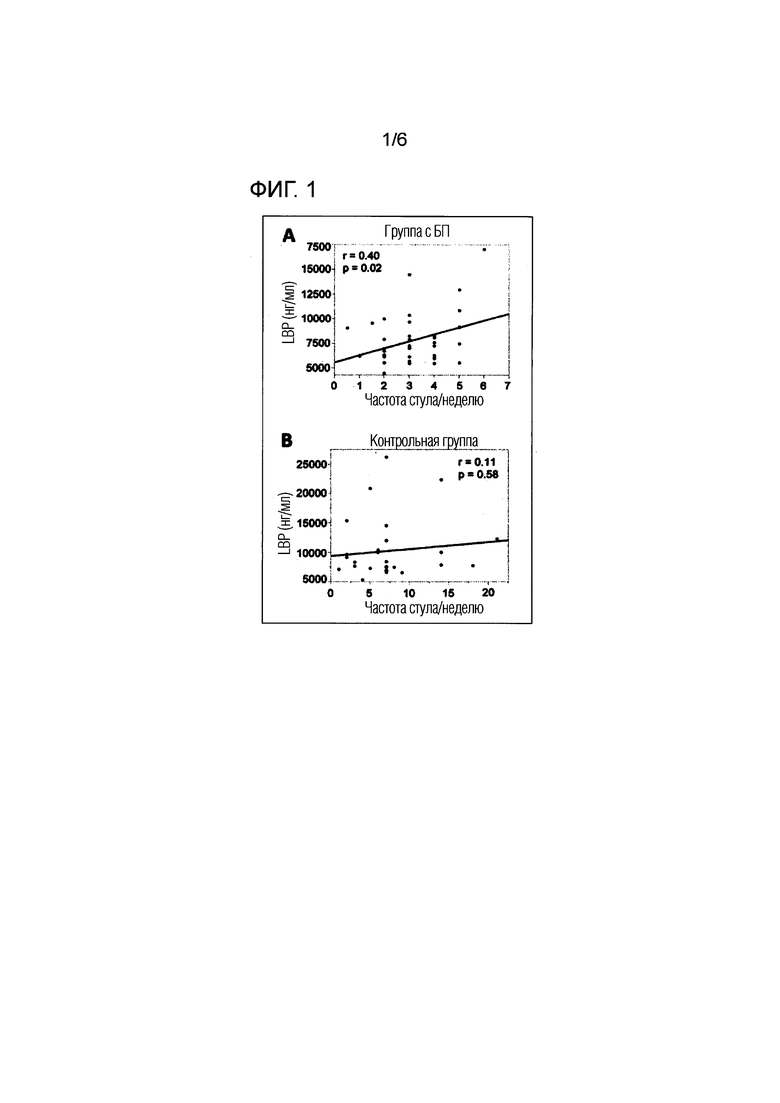
[Фигура 2] На фигуре 2 показана корреляция между изменением по шкале UPDRS Части 1 (изменением через два года после начала наблюдения) и количеством бактерий группы Bacteroides fragilis (А) или Bifidobacterium (В) в начале наблюдения.
[Фигура 3] На фигуре 3 показана корреляция между изменением уровня LBP в сыворотке (изменением через два года после начала наблюдения) и количеством бактерий подгруппы Lactobacillus plantarum (А) или Lactobacillus brevis (В) в начале наблюдения. На графике (С) показана корреляция, достигнутая путем исключения образцов, в которых количество бактерий подгруппы Lactobacillus plantarum ниже предела детектирования, а на графике (D) показана корреляция, достигнутая путем исключения образцов, в которых количество бактерий Bacteroides fragilis ниже предела детектирования.
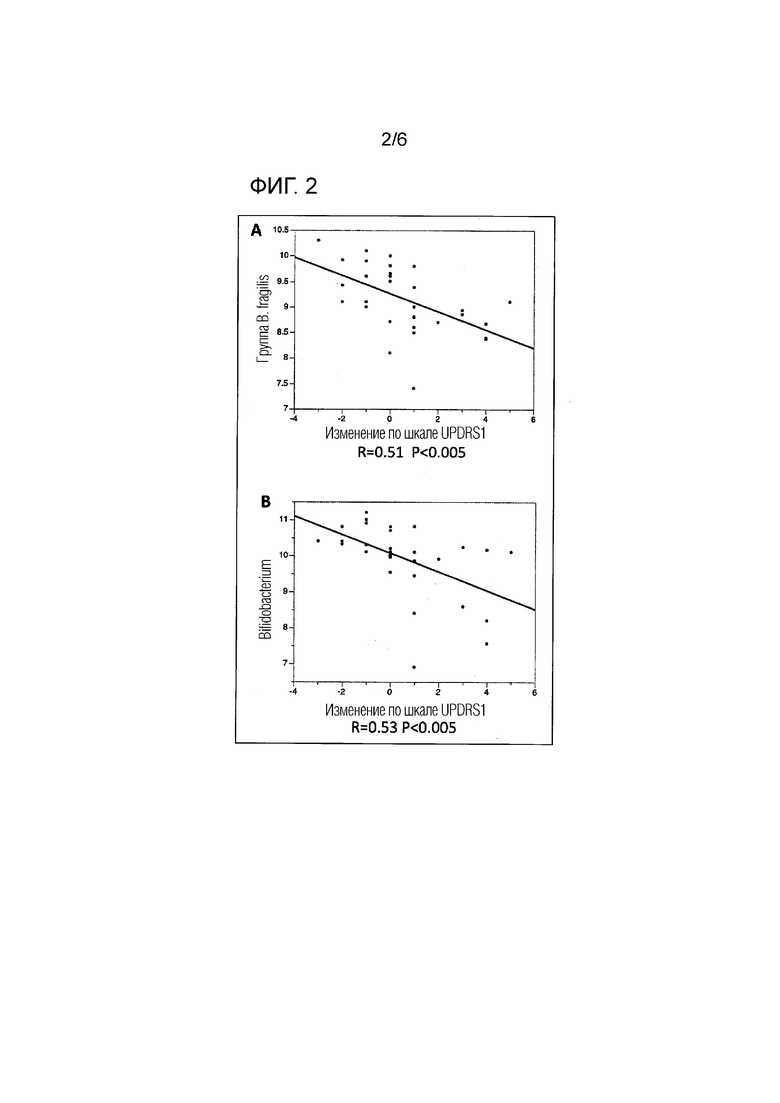
[Фигура 4] На фигуре 4 показана корреляция между изменением уровня LBP в сыворотке (изменением через два года после начала наблюдения) и количеством бактерий подгруппы Lactobacillus gasseri в начале наблюдения.
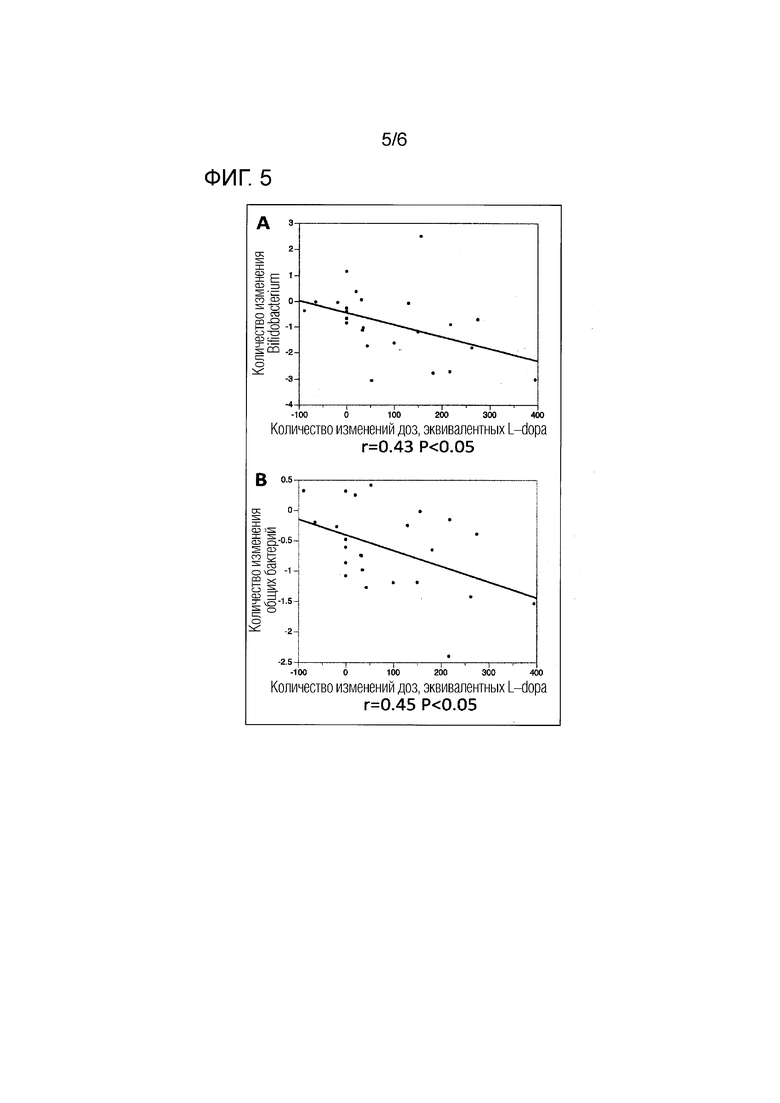
[Фигура 5] На фигуре 5 показана корреляция между изменением LED (дозы, эквивалентной дозе L-dopa) и изменением количества Bifidobacterium (А) или изменением общего количества кишечных бактерий в целых фекалиях (В).
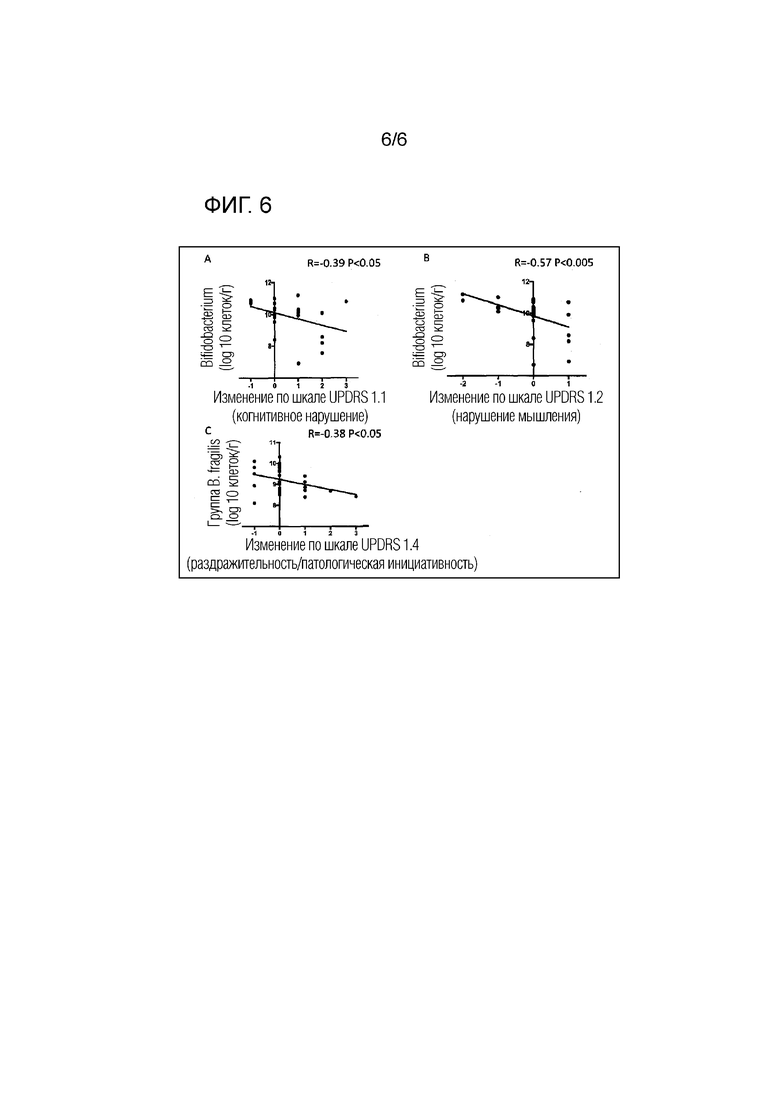
[Фигура 6] На фигуре 6 показана (А) корреляция между изменением оценки ухудшения когнитивной функции (UPDRS 1.1) (изменением через два года после начала наблюдения) и количеством Bifidobacterium в начале наблюдения; (В) корреляция между изменением оценки нарушения мышления (UPDRS 1.2) (изменением через два года после начала наблюдения) и количеством Bifidobacterium в начале наблюдения; и (С) корреляция между изменением оценки раздражительности/патологической инициативности (UPDRS 1.4) (изменением через два года после начала наблюдения) и количеством бактерий группы Bacteroides fragilis в начале наблюдения.
Описание вариантов осуществления изобретения
[0010] Маркер для определения БП согласно изобретению представляет собой количество одной или более кишечных бактерий, выбранных из группы, состоящей из Bifidobacterium, группы Bacteroides fragilis, Lactobacillus brevis и подгруппы Lactobacillus plantarum и/или общего количества кишечных бактерий. Хотя известно, что эти кишечные бактерии присутствуют в тонком кишечнике человека, однако, до сих пор отсутствуют какие-либо данные о взаимосвязи между кишечными бактериями и прогрессированием состояния при БП. В данном случае, общим количеством кишечных бактерий является, например, общее количество бактерий, определенное методом подсчета DAPI, хотя этот метод не ограничивается ими. Общее количество бактерий может представлять собой сумму количества бактерий, принадлежащих к множеству видов бактерий, преобладающих в тонком кишечнике и составляющих приблизительно 70% или более от общего количества бактерий, определенного методом подсчета DAPI. Примерами общего количества бактерий является сумма количества бактерий 19 видов, представленных ниже в Примере (Таблица 1).
[0011] Как описано ниже в Примере, наблюдается значительная корреляция между количеством кишечных бактерий в фекалиях пациента с БП и прогрессированием состояния при БП. В частности, снижение количества по меньшей мере одной, а предпочтительно, двух или более кишечных бактерий, выбранных из группы, состоящей из Bifidobacterium, группы Bacteroides fragilis, Lactobacillus brevis и подгруппы Lactobacillus plantarum и/или общего количества кишечных бактерий, указывает на повышение риска прогрессирования БП.
[0012] В данном случае, прогрессирование БП или прогрессирование состояния у пациента с БП означает, что патологическое состояние фактически прогрессирует, и его тяжесть повышается. Риск прогрессирования БП или риск прогрессирования состояния у пациента с БП означает вероятность дальнейшего прогрессирования состояния при БП в будущем по сравнению с фактическим патологическим состоянием, наблюдаемым в настоящее время.
[0013] Риск прогрессирования БП может быть определен путем измерения количества кишечных бактерий в образце и использования такого количества в приближенном линейном уравнении (например, в приближенных линейных уравнениях, представленных ниже в Примере (например, на фигурах 2, 3, 5 и 6)), предварительно полученном для измерения корреляции между количеством кишечных бактерий и прогрессированием патологического состояния. Примерами образцов являются биологические образцы, взятые у индивидуума, например, образцы содержимого пищеварительного тракта, такие как кишечная жидкость и фекалии. При этом, предпочтительным образцом являются фекалии из-за их неинвазивности.
[0014] Кроме того, значительная корреляция также наблюдалась между уровнем LBP в крови и запором, который является типичным симптомом при БП. То есть, предполагается, что уровень LBP снижается у группы, у которой частота стула является низкой (что указывает на симптом запора), и состояние при БП, вероятно, ухудшается, и что уровень LBP повышается у группы, у которой частота стула является высокой (что указывает на отсутствие симптома запора), и состояние при БП, вероятно, имеет тяжесть легкой степепи. Поскольку у пациентов с БП уровень LBP и уровень LPS имеют обратную корреляцию, то предполагается, что уровень LPS будет повышаться у группы с обострением состояния при БП, а уровень LPS будет снижаться у группы с умеренным состоянием при БП. В соответствии с этим, прогрессирование БП может быть определено путем оценки изменения уровня LPS в крови и/или уровня LBP в крови.
[0015] В частности, определение прогрессирования патологического состояния у пациента с БП может быть осуществлено путем измерения количества одной или более кишечных бактерий, выбранных из группы, состоящей из Bifidobacterium, группы Bacteroides fragilis, Lactobacillus brevis и подгруппы Lactobacillus plantarum и/или общего количества кишечных бактерий у пациента в два или более различных моментов времени и сравнения измеренного количества бактерий.
[0016] Измерение в два или более моментов времени означает, что измерение кишечных бактерий осуществляют в определенный момент времени, а затем в одни или более моментов времени через определенный интервал времени. Интервал времени варьирует в зависимости, например, от состояния и патологического состояния пациента и не имеет конкретных ограничений. Так, например, подходящим произвольно выбранным периодом является период от 1 недели до 5 лет, например, 1 неделя, 2 недели, 3 недели, 4 недели, 1 месяц, 2 месяца, 3 месяца, 6 месяцев, 9 месяцев, 1 год, 2 года, 3 года, 4 года или 5 лет.
[0017] При определении прогрессирования патологического состояния у пациента с БП, если количество кишечных бактерий у одного пациента с БП измеряют в два или более различных моментов времени, и если количество кишечных бактерий имеет тенденцию к снижению, то это может означать, что тяжесть БП повышается. В противоположность этому, если количество кишечных бактерий имеет тенденцию к повышению, то это может означать, что тяжесть БП снижается. В частности, если количество одной или более бактерий, выбранных из группы, состоящей из Bifidobacterium, группы Bacteroides fragilis, Lactobacillus brevis и подгруппы Lactobacillus plantarum и/или общего количества кишечных бактерий снижается, то это может означать, что тяжесть состояния при БП повышается, и наоборот, если количество таких бактерий повышается, то это может означать, что тяжесть состояния при БП снижается.
[0018] Определение БП (определение риска прогрессирования БП или определение прогрессирования симптома БП) может быть осуществлено путем измерения количества кишечных бактерий в образце и сравнения для того, чтобы определить, является ли такое количество больше или меньше, чем эталонное количество, которое представляет собой величину (Р), отложенную по вертикальной оси на момент времени 0, отложенный по горизонтальной оси, в приближенном линейном уравнении, предварительно полученном для оценки корреляции между количеством кишечных бактерий (по вертикальной оси) и прогрессированием патологического состояния (по горизонтальной оси). Кроме того, определение БП может быть также осуществлено путем сравнения изменения количества кишечных бактерий для того, чтобы определить, является ли такое количество больше или меньше, чем эталонное количество, которое представляет собой величину (Q), отложенную по вертикальной оси на момент времени 0, отложенный по горизонтальной оси, в приближенном линейном уравнении, предварительно полученном для оценки корреляции между изменением количества кишечных бактерий, оцененного в два или более различных моментов времени (по вертикальной оси) и прогрессированием патологического состояния (по горизонтальной оси) у одного пациента с БП. Так, например, исходя из приближенного линейного уравнения, показанного ниже в Примере (например, фигуры 2, 3, 5 и 6), если удовлетворяются один или более из нижеследующих критериев, то это может указывать на высокий риск прогрессирования БП или на высокую вероятность прогрессирования симптома БП. Эти критерии могут быть также использованы в комбинации.
[0019]
(1) Количество Bifidobacterium на 1 грамм образца в произвольно выбранный момент времени меньше, чем количество клеток Р1 (Р1: величина, отложенная по вертикальной оси на момент времени 0, отложенный по горизонтальной оси, на фигуре 2В).
(2) Количество бактерий группы Bacteroides fragilis на 1 грамм образца в произвольно выбранный момент времени меньше, чем количество клеток Р2 (Р2: величина, отложенная по вертикальной оси на момент времени 0, отложенный по горизонтальной оси, на фигуре 2А).
(3) Количество Lactobacillus brevis на 1 грамм образца в произвольно выбранный момент времени меньше, чем количество клеток Р3 (Р3: величина, отложенная по вертикальной оси на момент времени 0, отложенный по горизонтальной оси, на фигуре 3В или 3D).
(4) Количество бактерий подгруппы Lactobacillus plantarum на 1 грамм образца в произвольно выбранный момент времени меньше, чем количество клеток Р4 (Р4: величина, отложенная по вертикальной оси на момент времени 0, отложенный по горизонтальной оси, на фигуре 3А или 3С).
(5) Количество изменений общего количества кишечных бактерий на 1 грамм образца в произвольно выбранный момент времени меньше, чем количество клеток Q1 (Q1: величина, отложенная по вертикальной оси на момент времени 0, отложенный по горизонтальной оси, на фигуре 5B).
(6) Количество изменений количества Bifidobacterium на 1 грамм образца в два или более моментов времени меньше, чем количество клеток Q2 (Q2: величина, отложенная по вертикальной оси на момент времени 0, отложенный по горизонтальной оси, на фигуре 5А).
[0020] Кроме того, прогрессирование БП у пациента может быть определено путем измерения уровней LPS в крови и/или уровней LBP в крови пациента с БП в два или более различных моментов времени и сравнения измеренных уровней (уровней LPS или уровней LBP). Выражение «два или более моментов времени» имеет значение, определенное выше. Уровни LPS и/или LBP в крови, предпочтительно, представляют собой уровни в сыворотке.
[0021] При определении степени тяжести БП, если уровни LPS и/или уровни LBP у одного пациента с БП измеряют в два или более различных моментов времени, и если уровень LPS имеет тенденцию к повышению, то это может означать, что тяжесть БП повышается. В противоположность этому, если уровень LPS имеет тенденцию к снижению, то это может означать, что тяжесть БП снижается. Если уровень LBP имеет тенденцию к снижению, то это может означать, что тяжесть БП повышается. В противоположность этому, если уровень LBP имеет тенденцию к повышению, то это может означать, что тяжесть БП снижается.
[0022] В настоящем изобретении, измерение количества кишечных бактерий в образце включает измерение (количественную оценку) количества кишечных бактерий. Примерами способов измерения количества кишечных бактерий в образце являются способ культивирования кишечных бактерий в соответствующей среде и подсчета количества бактерий; способ культивирования кишечных бактерий в жидкой среде для отбора и измерение ее мутности или оптической плотности; метод FISH и метод количественной ОТ-ПЦР (метод ОТ-кол.ПЦР). Из этих методов, предпочтительным является метод ОТ-кол.ПЦР.
[0023] Метод ОТ-ПЦР описан ниже. Аналитический метод, проводимый с помощью метода ОТ-ПЦР, может быть осуществлен, например, путем проведения (1) стадии экстракции РНК из представляющей интерес бактерии в образце; (2) стадии синтеза кДНК посредством реакции обратной транскрипции (ОТ) с использованием фрагмента нуклеиновой кислоты (праймера), который гибридизуется с экстрагированной РНК с последующим проведением ПЦР с использованием кДНК в качестве матрицы, и (3) стадии детектирования фрагмента ДНК, амплифицированного в стадии (2). Фрагмент ДНК (ПЦР-продукт), специфичный к представляющей интерес кишечной бактерии, может быть получен путем объединения фрагмента нуклеиновой кислоты с матричной кДНК, происходящей от образца, и проведения реакции амплификации. Количество представляющих интерес кишечных бактерий в образце может быть определено путем мониторинга ПЦР-продукта в течение определенного периода времени и идентификации количества циклов ПЦР в момент времени, когда количество ДНК будет достигать определенного уровня.
[0024] Наблюдение амплифицированного ПЦР-продукта в течение определенного периода времени может быть осуществлено путем мечения ПЦР-продукта интеркалирующим флуоресцентным красителем, таким как SYBR(R) зеленый I, и измерения интенсивности флуоресценции в каждом цикле ПЦР. Интеркалирующий краситель имеет свойство интеркалировать двухцепочечную нуклеиновую кислоту, и тем самым, повышать интенсивность флуоресценции, что позволяет точно измерять ПЦР-продукт, образованный из кДНК бактерии-мишени посредством ПЦР-реакции. В частности, подходящим для использования является SYBR(R) зеленый I.
[0025] Представляющая интерес кишечная бактерия в образце может быть количественно определена путем идентификации количества циклов ПЦР (порогового цикла: СТ), когда интенсивность флуоресценции (количество ДНК) будет достигать определенного уровня, выбранного произвольно. Кроме того, например, может быть также использован зонд TaqMan или «молекулярный маяк», меченный флуоресцентным красителем. Зонд TaqMan и «молекулярный маяк» представляют собой зонды, в которых флуоресцентный краситель и связаны с олигонуклеотидом, гомологичным внутренней последовательности области, амплифицируемой с помощью ПЦР, и используются вместе в ПЦР-реакции. Поскольку флуоресценция испускается в процессе реакции ПЦР-амплификации посредством взаимодействия между флуоресцентным красителем и гасителем, связанными с зондом, то может быть проведен мониторинг амплифицированного ПЦР-продукта в течение определенного периода времени путем измерения интенсивности флуоресценции в каждом цикле ПЦР.
[0026] Представляющая интерес кишечная бактерия в образце может быть количественно определена по калибровочной кривой логарифмических величин количества бактерий, измеренного, например, методом подсчета DAPI или методом культивирования, и величин СТ. То есть, калибровочную кривую строят заранее путем отложения логарифмических величин количества бактерий-мишеней на горизонтальной оси и величин СТ на вертикальной оси, и величину СТ, выраженную как результат ПЦР-реакции, откладывают на калибровочной кривой для количественной оценки представляющей интерес кишечной бактерии в образце.
[0027] Для осуществления способа определения БП согласно изобретению предпочтительно использовать набор, содержащий протокол измерения количества кишечных бактерий в образце. Этот набор включает реагент для определения маркера согласно изобретению и протокол (протокол, описывающий, например, способ оценки кишечных бактерий и способ определения БП, в частности, эталона для определения степени тяжести и факторов, которые влияют на результаты оценки и степень такого влияния). Определение может быть осуществлено, как и в вышеописанном способе определения, с использованием эталона. В данном случае, примерами реагентов для оценки маркера являются реагент для оценки количества вышеописанных кишечных бактерий; реагент для детектирования мРНК; и реагент для детектирования ДНК.
[0028] Количество бактерий in vivo варьирует в зависимости, например, от образа жизни и пищевых привычек каждого пациента. Статус прогрессирования БП может быть определен путем сравнения количества бактерий в образцах, взятых у одного пациента и измеряемых в различные периоды времени.
Примеры
[0029] Настоящее изобретение будет более подробно описано на Примерах, которые являются неограничивающими.
Используемый бактериальный штамм
Были использованы бактериальные штаммы, хранящиеся в Yakult Central Institute, Yakult Honsha Co., Ltd. и указанные в Таблице 1. Исходное количество бактерий в каждом бактериальном штамме доводили приблизительно до 1×104 клеток.
Условия культивирования каждого бактериального штамма указаны в Таблице 1. Подробное описание условий культивирования А и В приводится ниже.
Условие А: стационарное культивирование осуществляли в бульоне GAM, модифицированном путем добавления 1% глюкозы, при 37°C в анаэробных условиях в течение 24-72 часов.
Условие В: стационарное культивирование осуществляли в бульоне MRS при 37°C в анаэробных условиях в течение 24-72 часов.
Условие С: стационарное культивирование осуществляли в бульоне BHI при 37°C в анаэробных условиях в течение 18 часов.
Эти бактериальные клетки подсчитывали методом DAPI, а затем соответствующим образом разводили до достижения определенного количества бактерий и получали жидкость, содержащую каждую бактерию.
[0030] [Таблица 1]
(ATCC 27340)
[0031] Сравнительный пример 1
Получение специфического праймера
В Таблице 2 указан каждый праймер, используемый для измерения количества кишечных бактерий. В Таблице 2 также указана литература, в которой описан каждый праймер.
[0032]
[Таблица 2]
[0033]
1. Matsuki T, Watanabe K, Fujimoto J, Miyamoto Y, Takada T, Matsumoto K, et al. Development of 16S rRNA-gene-targeted group-specific primers for the detection and identification of predominant bacteria in human feces. Appl Environ Microbiol 2002;68: 5445-5451.
2. Matsuki T, Watanabe K, Fujimoto J, Takeda T, Tanaka R. Use of 16S rRNA gene-targeted group-specific primers for real-time PCR analysis of predominant bacteria in human feces. Appl Environ Microbiol 2004;70: 7220-7228.
3. Matsuki T. Development of quantitative PCR detection method with 16S rRNA gene-targeted genus- and species-specific primers for the analysis of human intestinal microflora and its application. Nihon Saikingaku Zasshi 2007;62: 255-261.
4. Matsuda K, Tsuji H, Asahara T, Matsumoto K, Takada T, Nomoto K. Establishment of an analytical system for the human fecal microbiota, based on reverse transcription-quantitative PCR targeting of multicopy rRNA molecules. Appl Environ Microbiol 2009;75: 1961-1969.
5. Kikuchi E, Miyamoto Y, Narushima S, Itoh K. Design of species specific primers to identify 13 species of Clostridium harbored in human intestinal tracts. Microbiol Immunol 2002;46: 353-358.
6. Matsuda K, Tsuji H, Asahara T, Kado Y, Nomoto K. Sensitive quantitative detection of commensal bacteria by rRNA-targeted reverse transcription-PCR. Appl Environ Microbiol 2007;73: 32-39.
[0034]
Сравнительный пример 2
Построение калибровочной кривой, используемой в ОТ-ПЦР
Была построена калибровочная кривая, используемая для количественной оценки представляющих интерес кишечных бактерий в образцах. В частности, в соответствии с описанной ниже процедурой, калибровочная кривая была построена по количеству кишечных бактерий, измеренному методом подсчета DAPI и отложенному по горизонтальной оси, и по величинам CT, отложенным по вертикальной оси.
1) RNAlater (Ambion, Inc., 400 мкл) добавляли к бактериальной жидкости (200 мкл) каждого бактериального штамма, полученного как описано выше в параграфе «Используемый бактериальный штамм», а затем эту жидкость оставляли на 5 минут при комнатной температуре. После этого проводили центрифугирование при 13000×g в течение 5 минут, и супернатант удаляли путем декантирования. После удаления супернатанта, к остатку добавляли буфер для лизиса (450 мкл, полученный путем смешивания 346,5 мкл буфера RLT, 100 мкл ТЕ и 3,5 мкл β-меркаптометанола на один образец) и стеклянные сферы, имеющие диаметр 0,1 мм (TOMY Seiko Co., Ltd., 300 мг).
2) Пробирку с образцом помешали на шейкер (ShakeMaster), а затем встряхивали в течение 5 минут для разрушения бактериальных клеток.
3) В пробирку с образцом добавляли насыщенный водой фенол (500 мкл), а затем перемешивали путем вихревого размешивания в течение 5-10 секунд.
4) Пробирку с образцом помещали на нагревательный блок при 60°C, а затем проводили реакцию в течение 10 минут (методом с использованием горячего фенола).
5) В пробирку с образцом добавляли хлороформ/изоамиловый спирт (24:1, 100 мкл), а затем перемешивали путем вихревого размешивания в течение 5-10 секунд.
6) После центрифугирования (13000×g в течение 5 минут), 470 мкл супернатанта переносили в другую 1,5 мл-микропробирку с крышкой.
7) В микропробирку добавляли хлороформ/изоамиловый спирт (24:1, 470 мкл), а затем перемешивали путем вихревого размешивания в течение 5-10 секунд.
8) После центрифугирования (13000×g в течение 5 минут), 400 мкл супернатанта переносили в другую 1,5 мл-микропробирку с крышкой.
9) В микропробирку добавляли 3М ацетат Na (рН 5,4, 40 мкл) и изопропанол (400 мкл), а затем содержимое смешивали путем переворачивания.
10) Осуществляли центрифугирование (20000×g в течение 10 минут).
11) После удаления супернатанта путем декантирования, к остатку добавляли 80% этанол (500 мкл).
12) После центрифугирования (20000×g в течение 2 минут), супернатант удаляли путем декантирования.
13) После сушки воздухом (приблизительно в течение 20 минут путем открывания пробирки) добавляли воду, не содержащую нуклеазы (Ambion, Inc.), до получения концентрации 2×108 клеток/мл исходя из количества бактерий, измеренного методом DAPI, и смесь перемешивали до получения гомогенного раствора. Кроме того, осуществляли 10-кратное серийное разведение водой, не содержащей нуклеазы. Образцы, разведенные в пределах от 2×10–3 до 2×10 клеток/мл, использовали в качестве образцов РНК, описанных ниже в 14), и подвергали ОТ-кол.ПЦР.
14) ОТ-кол.ПЦР осуществляли с использованием набора для ОТ-ПЦР QIAGEN OneStep (QIAGEN). Реакционный раствор (общий объем: 10 мкл) состоит из буфера для ОТ-ПЦР 1×QIAGEN OneStep, 0,5×Q-раствора, 0,4 мМ смеси dNTP, 1/25 количества смеси ферментов для ОТ-ПЦР QIAGEN OneStep, 1/100000 количества SYBR(R) зеленого I (Molecular Probes, Inc.), эталонного красителя 1×ROX (Invitrogen), 0,60 мкМ каждого праймера, представленного в Таблице 2, и 5 мкл образца РНК, полученного как описано выше в 13).
15) Реакционный раствор подвергали обратной транскрипции при 50°C в течение 30 минут, а затем обратную транскриптазу инактивировали путем нагревания при 95°C в течение 15 минут. Затем проводили 45 циклов, а именно: 94°C в течение 20 секунд при 55°C или 60°C (55°C для SEQ ID NO: 1, 2 и 15-29 Таблицы 2, 60°C для SEQ ID NO: 3-14, 29 и 30, 55°C для SEQ ID NO: 31-34 и 60°C для SEQ ID NO: 35-39) в течение 20 секунд и при 72°C в течение 50 секунд с получением продукта амплификации. Количество продукта амплификации измеряли для каждого цикла по интенсивности флуоресценции SYBR(R) зеленого I и строили кривую для ПЦР. Затем определяли базовую линию и пороговое значение интенсивности флуоресценции, после чего определяли количество циклов (величину CT), для которых строили ПЦР-кривую и определяли их пороговое пересечение. Полученную величину CT откладывали на графике по вертикальной оси, а количество бактерий в образце, подвергаемом ПЦР-реакции, откладывали по горизонтальной оси. В этих анализах использовали компьютерную программу системы детектирования последовательностей (SDS) (Applied Biosystems). Кроме того, для того, чтобы подтвердить, является ли ПЦР-амплификация специфической или нет, отдельно измеряли температуру денатурации. Температуру денатурации измеряли путем продуцирования продукта амплификации, а затем проводили реакцию при 94°C в течение 15 секунд, после чего температуру медленно повышали с 55°C или 60°C до 99°C со скоростью 0,2°C/секунд, а затем строили график, где температуры откладывали по горизонтальной оси, а интенсивность флуоресценции SYBR(R) зеленого I откладывали по вертикальной оси и строили кривую денатурации продукта амплификации, после чего измеряли температуру, при которой интенсивность флуоресценции резко снижалась. Эту серию реакций проводили на системе ABI PRISM(R) 7900HT (Applied Biosystems).
16) Калибровочную кривую строили по данным количества кишечных бактерий, измеренным методом DAPI и отложенным по горизонтальной оси, и по соответствующим величинам CT, полученным с помощью ОТ-кол.ПЦР и отложенным по вертикальной оси.
[0035]
Пример 1
(1) Взаимосвязь между БП и кишечной микробиотой
Кишечная микробиота пациентов с БП была тщательно оценена для установления взаимосвязи между БП и кишечной микробиотой.
В группу были включены 52 пациента с БП (мужчины: 21, женщины: 31, в возрасте 68,9 ± 6,8) и 36 соответствующих пациентов (мужчины: 21, женщины: 15, в возрасте 68,4 ± 9,7) в качестве контроля. Клинические симптомы БП оценивали по шкале классификации тяжести Хоэна-Яра (HY) и по унифицированной шкале оценок болезни Паркинсона (UPDRS), Части 1-4.
В группе пациентов с БП, 42 пациента должны были наблюдаться в течение 2 лет. Кроме того, 6 пациентов, которые, как было установлено, имели другое заболевание во время наблюдения, были исключены из эксперимента. В соответствии с этим, в группу исследования входило всего 36 пациентов.
[0036]
(2) Биохимический тест
Уровень связывающегося с липополисахаридом (LPS) белка LBP в сыворотке измеряли с помощью набора для ELISA (HK315-01, Hycult Biotech). Уровень диаминоксидазы (DAO) измеряли с помощью набора для ELISA (K8500, Immundiagnostik AG).
[0037]
(3) Измерение количества бактерий в фекалиях с помощью ОТ-кол.ПЦР таргентирующей рРНК
(а) Получение образца для экстракции РНК
RNAlater (Ambion, Inc., 0,2 мл) добавляли к фекалиям (4 мг), взятым у пациента или у контроля, а затем оставляли на 5 минут при комнатной температуре. После этого проводили центрифугирование при 14000×g в течение 10 минут, и супернатант удаляли путем декантирования, а затем остаток использовали в качестве образца для экстракции РНК.
(b) Экстракция нуклеиновой кислоты
РНК экстрагировали в соответствии с нижеследующей процедурой.
1) Буфер для лизиса (450 мкл, полученный путем смешивания 346,5 мкл буфера RLT, 100 мкл ТЕ и 3,5 мкл β-меркаптоэтанола на один образец), и стеклянные сферы, имеющие диаметр 0,1 мм (300 мг) добавляли к образцу для экстракции РНК, полученному как описано выше в (а).
2) Нуклеиновую кислоту экстрагировали способом, описанным в 2)-12) Сравнительного примера 2.
3) После сушки воздухом (приблизительно в течение 20 минут путем открывания пробирки) добавляли воду, не содержащую нуклеазы (200 мкл), и смесь перемешивали для однородного растворения с получением образца РНК.
(с) Измерение количества бактерий
Образец РНК, полученный в (b), анализировали на количество бактерий методом ОТ-кол.ПЦР. ОТ-кол.ПЦР осуществляли способом, описанным в 14) и 15) Сравнительного примера 2.
[0038] Статистический анализ
Статистический анализ осуществляли с помощью пакета статистических компьютерных программ JMP Pro версии 11.0.0 (SAS Institute, Cary, NC). Результаты анализа представлены как среднее ± стандартное отклонение. Для сравнения групп использовали U-критерий Манна-Уитни и t-критерий Стьюдента, а анализ на корреляцию осуществляли методом корреляции Спирмэна. Величина р=0,05 или менее или коэффициент корреляции 0,3 или более рассматривались как статистически значимые. Выбросы, которые были идентифицированы по критерию Смирнова как резко отличающиеся значения, были исключены.
[0039]
Результаты
(1) Информация о пациенте
В Таблице 3 представлена информация по баллам для каждого параметра, где индивидуумы были подразделены на здоровых индивидуумов и пациентов с БП.
[0040]
[Таблица 3]
Информация о пациенте
(Ежедневная активность)
(Оценка двигательной активности)
(Осложнения после терапии)
[0041]
а: среднее и стандартное отклонение
[0042]
В Таблице 3 продемонстрировано, что частота стула у группы пациентов с БП была ниже, чем у группы здоровых индивидуумов.
[0043]
(2) Биохимический тест
На фигуре 1 показана корреляция между уровнем LBP в сыворотке и частотой стула (А: БП-группа, В: контрольная группа). У группы пациентов с БП наблюдалась позитивная корреляция между уровнем LBP в сыворотке и частотой стула, но такая корреляция не наблюдалась у группы здоровых индивидуумов (фигура 1А и фигура 1В). Исходя из этих результатов было высказано предположение, что снижение уровня LBP в сыворотке приводит к еще большему прогрессированию состояния при БП. В соответствии с этим, прогрессирование патологического состояния у пациентов с БП может быть определено путем мониторинга уровня LBP в крови у одного пациента с БП.
[0044]
(3) Изменение патологического состояния при БП в течение 2 лет
Пациенты с БП были подразделены на две группы для сравнения, то есть, группу (группу с прогрессирующим заболеванием), у которой наблюдалось значительное прогрессирование состояния при БП, и группу (группу с непрогрессирующим заболеванием), отличающуюся от группы с прогрессирующим заболеванием по изменению состояния через 2 года по сравнению с состоянием в начале наблюдения (0 лет), в качестве индикатора. В группу с прогрессирующим заболеванием были включены пациенты, у которых наблюдалось прогрессирование по 15 пунктам или более по всей шкале UPDRS, или которые находились в клинике или не могли находиться в клинике или не могли посещать клинику из-за прогрессирования состояния при БП. Пациенты, у которых наблюдалось прогрессирование менее, чем по 15 пунктам по всей шкале UPDRS, были включены в группу с непрогрессирующим заболеванием.
(3-1) Сравнение оценок для группы с прогрессирующим заболеванием и группы с непрогрессирующим заболеванием
В Таблице 4 показано сравнение оценок, где пациенты были подразделены на группу с прогрессирующим заболеванием и группу с непрогрессирующим заболеванием.
[0045]
[Таблица 4]
Общая информация о пациенте для сравнения
L–dopa
[0046]
(3-2) Изменение клинических параметров через 2 года
В Таблице 5 показаны изменения уровня LBP в сыворотке путем сравнения уровней в начале наблюдения и на момент времени через 2 года.
[0047]
[Таблица 5]
Изменение уровня LBP в сыворотке через 2 года
[0048]
В Таблице 5 показано, что уровень LBP в сыворотке у группы с прогрессирующим заболеванием снижался через 2 года, а уровень LBP в сыворотке у группы с непрогрессирующим заболеванием имел тенденцию к увеличению.
[0049]
(4) Корреляция между изменением клинического симптома при БП и изменением бактериального состава
Была проведена корреляция изменений в оценках (изменений через 2 года после начала наблюдений) по шкале UPDRS Части 1 (познавательные способности, поведение и настроение) как клинический симптом БП, и количества бактерий группы Bacteroides fragilis или Bifidobacterium в начале наблюдения (0 лет). Эти результаты представлены на Фигуре 2. При этом наблюдалась значимая негативная корреляция с изменением оценок по шкале UPDRS Части 1 через 2 года (фигуры 2А и 2В). Исходя из этих результатов было установлено, что количество бактерий Bifidobacterium и группы Bacteroides fragilis в начале наблюдения (0 лет) может быть использовано в качестве маркера для определения риска прогрессирования БП (в частности, психического симптома).
[0050]
(5) Корреляция между изменением уровня LBP в сыворотке и изменением бактериального состава
На фигуре 3 показаны результаты оценки корреляции между изменением уровня LBP в сыворотке (изменением через два года после начала наблюдения) и количеством бактерий Lactobacillus brevis или подгруппы Lactobacillus plantarum в начале наблюдения (0 лет). Изменение уровня LBP в сыворотке указывало на значимую позитивную корреляцию с количеством бактерий подгруппы Lactobacillus plantarum и Lactobacillus brevis в начале наблюдения (0 лет)(Фигура 3А и Фигура 3В). Высокая корреляция наблюдалась у групп, у которых образцы с низким пределом детектирования бактерий подгруппы Lactobacillus plantarum или Lactobacillus brevis, были исключены (Фигура 3С и Фигура 3D). Эти результаты позволяют предположить, что большее количество бактерий Lactobacillus brevis в начале наблюдения (0 лет) или большее количество бактерий подгруппы Lactobacillus plantarum в начале наблюдения (0 лет) приводило к повышению уровня LBP в сыворотке (состояние при БП улучшалось), и в противоположность этому, меньшее количество бактерий Lactobacillus brevis в начале наблюдения (0 лет) или меньшее количество бактерий подгруппы Lactobacillus plantarum в начале наблюдения (0 лет) приводило к снижению уровня LBP в сыворотке (состояние при БП ухудшалось). Поскольку изменение уровня LBP в сыворотке, вероятно, дает значимо позитивную корреляцию с количеством бактерий Lactobacillus brevis и подгруппы Lactobacillus plantarum в начале наблюдения (0 лет), то считается, что количество этих бактерий в начале наблюдения (0 лет) может быть использовано в качестве маркера для определения риска прогрессирования БП.
[0051]
На фигуре 4 показаны результаты подтверждения корреляции между изменением уровня LBP в сыворотке (изменением через два года после начала наблюдения) и количеством бактерий подгруппы Lactobacillus gasseri в начале наблюдения (0 лет). В отличие от бактерий (кишечных бактерий согласно изобретению), представленных на Фигуре 3, какой-либо значимой корреляции между изменением уровня LBP в сыворотке и бактерий подгруппы Lactobacillus gasseri не наблюдалось. В результате анализа, проводимого авторами изобретения не различные кишечные бактерии, было обнаружено, что другие кишечные бактерии (15 видов), включая бактерии подгруппы Lactobacillus gasseri, значимо не коррелировали с прогрессированием болезни Паркинсона (в частности, с риском такого прогрессирования). В соответствии с этим, было подтверждено, что эти кишечные бактерии не могут быть использованы в качестве маркера для определения согласно изобретению.
[0052]
(6) Корреляция между изменением дозы, эквивалентной дозе L-dopa, и изменением количества бактерий
На фигуре 5 показана корреляция между изменением дозы, эквивалентной дозе L-dopa (изменений дозы через два года после начала наблюдения), и количеством Bifidobacterium (А) или общим количеством кишечных бактерий (В). Общее количество кишечных бактерий определяли как сумму количества бактерий 19 видов, указанных в Таблице 1. Количество Bifidobacterium (А) и общее количество кишечных бактерий (В) снижалось по мере увеличения дозы, эквивалентной дозе L-dopa (LED), где L-dopa представляет собой средство для лечения БП, в результате чего была обнаружена значимо негативная корреляция. Существует вероятность того, что у пациентов с большим снижением Bifidobacterium наблюдалась тенденция к прогрессированию симптома, а поэтому этим пациентам было необходимо вводить еще большую дозу лекарственного средства. Исходя из этих результатов можно сделать вывод, что количество Bifidobacterium (количественное изменение) может быть использовано в качестве маркера для определения риска прогрессирования БП.
[0053]
(7) Корреляция между изменением по шкале UPDRS и изменением количества бактерий
На фигуре 6 показана корреляция между изменением оценки подшкалы общей унифицированной шкалы БП, UPDRS (количественным изменением через два года после начала наблюдения) и количества бактерий в начале наблюдения. Из подпунктов UPDRS Части 1 (познавательная способность, поведение и настроение) оценивали 1.1 (когнитивное нарушение), 1.2 (нарушение мышления) и 1.4 (раздражительность/патологическая инициативность). В результате, негативные корреляции наблюдались между Bifidobacterium и изменением по шкале 1.1 (когнитивное нарушение) или 1.2 (нарушение мышления) (Фигуры 6А и 6В) и между бактериями группы Bacteroides fragilis и изменением по шкале 1.4 (раздражительность/патологическая инициативность)(Фигура 6С). Это означает, что прогрессирование состояния при БП может быть определено путем измерения количества этих бактерий.
[0054]
Как описано выше, кишечные бактерии могут быть использованы для определения прогрессирования патологического состояния при БП.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> KABUSHIKI KAISHA YAKULT HONSHA
National University Corporation Nagoya University
<120> Маркер для оценки и способ оценки болезни Паркинсона
<130> YK0104
<150> JP 2017-098973
<151> 2017-05-18
<160> 38
<170> PatentIn version 3.5
<210> 1
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер, сконструированный на основе группы Clostridium coccoides
<400> 1
aaatgacggtacctgactaa
<210> 2
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер, сконструированный на основе группы Clostridium coccoides
<400> 2
ctttgagtttcattcttgcgaa
<210> 3
<211> 16
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер, сконструированный на основе подгруппы Clostridium leptum
<400> 3
gcacaagcagtggagt
<210> 4
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер, сконструированный на основе подгруппы Clostridium leptum
<400> 4
cttcctccgttttgtcaa
<210> 5
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер, сконструированный на основе группы Bacteroides fragilis
<400> 5
ayagcctttcgaaagraagat
<210> 6
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер, сконструированный на основе группы Bacteroides fragilis
<400> 6
ccagtatcaactgcaatttta
<210> 7
<211> 17
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер, сконструированный на основе рода Bifidobacterium
<400> 7
ctcctggaaacgggtgg
<210> 8
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер, сконструированный на основе рода Bifidobacterium
<400> 8
ggtgttcttcccgatatctaca
<210> 9
<211> 17
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер, сконструированный на основе кластера Atopobium
<400> 9
gggttgagagaccgacc
<210> 10
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер, сконструированный на основе кластера Atopobium
<400> 10
cggrgcttcttctgcagg
<210> 11
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер, сконструированный на основе рода Prevotella
<400> 11
cacrgtaaacgatggatgcc
<210> 12
<211> 16
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер, сконструированный на основе рода Prevotella
<400> 12
ggtcgggttgcagacc
<210> 13
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер, сконструированный на основе Clostridium perfringens
<400> 13
gggggtttcaacacctcc
<210> 14
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер, сконструированный на основе Clostridium perfringens
<400> 14
gcaagggatgtcaagtgt
<210> 15
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер, сконструированный на основе семейства Enterobacteriaceae
<400> 15
tgccgtaacttcgggagaaggca
<210> 16
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер, сконструированный на основе семейства Enterobacteriaceae
<400> 16
tcaaggaccagtgttcagtgtc
<210> 17
<211> 17
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер, сконструированный на основе подгруппы Lactobacillus casei
<400> 17
accgcatggttcttggc
<210> 18
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер, сконструированный на основе подгруппы Lactobacillus casei
<400> 18
ccgacaacagttactctgcc
<210> 19
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер, сконструированный на основе подгруппы Lactobacillus gasseri
<400> 19
gatgcatagccgagttgagagactgat
<210> 20
<211> 25
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер, сконструированный на основе подгруппы Lactobacillus gasseri
<400> 20
taaaggccagttactacctctatcc
<210> 21
<211> 25
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер, сконструированный на основе подгруппы Lactobacillus plantarum
<400> 21
ctctggtattgattggtgcttgcat
<210> 22
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер, сконструированный на основе подгруппы Lactobacillus plantarum
<400> 22
gttcgccactcactcaaatgtaaa
<210> 23
<211> 16
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер, сконструированный на основе подгруппы Lactobacillus reuteri
<400> 23
gaacgcaytggcccaa
<210> 24
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер, сконструированный на основе подгруппы Lactobacillus reuteri
<400> 24
tccattgtggccgatcagt
<210> 25
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер, сконструированный на основе подгруппы Lactobacillus ruminis
<400> 25
caccgaatgcttgcaytcacc
<210> 26
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер, сконструированный на основе подгруппы Lactobacillus ruminis
<400> 26
gccgcgggtccatccaaaa
<210> 27
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер, сконструированный на основе подгруппы Lactobacillus sakei
<400> 27
cataaaacctamcaccgcatgg
<210> 28
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер, сконструированный на основе подгруппы Lactobacillus sakei
<400> 28
tcagttactatcagatacrttcttctc
<210> 29
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер, сконструированный на основе Lactobacillus brevis
<400> 29
attttgtttgaaaggtggcttcgg
<210> 30
<211> 25
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер, сконструированный на основе Lactobacillus brevis
<400> 30
acccttgaacagttactctcaaagg
<210> 31
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер, сконструированный на основе Lactobacillus fermentum
<400> 31
cctgattgattttggtcgccaac
<210> 32
<211> 26
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер, сконструированный на основе Lactobacillus fermentum
<400> 32
acgtatgaacagttactctcatacgt
<210> 33
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер, сконструированный на основе рода Enterococcus
<400> 33
atcagagggggataacactt
<210> 34
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер, сконструированный на основе рода Enterococcus
<400> 34
actctcatccttgttcttctc
<210> 35
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер, сконструированный на основе рода Staphylococcus
<400> 35
tttgggctacacacgtgctacaatggacaa
<210> 36
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер, сконструированный на основе рода Staphylococcus
<400> 36
aacaactttatgggatttgcwtga
<210> 37
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер, сконструированный на основе рода Pseudomonas
<400> 37
caaaactactgagctagagtacg
<210> 38
<211> 25
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер, сконструированный на основе рода Pseudomonas
<400> 38
taagatctcaaggatcccaacggct
<---

Изобретение относится к биотехнологии, медицине. Предложен способ определения прогрессирования патологического состояния у пациента с болезнью Паркинсона, включающий измерение количеств одной или более кишечных бактерий, выбранных из группы, состоящей из Bifidobacterium, группы Bacteroides fragilis, Lactobacillus brevis и подгруппы Lactobacillus plantarum и/или общего количества кишечных бактерий у пациента в два или более различных моментов времени и сравнение этих количеств; в случае, если количество снижается, считают, что тяжесть состояния при болезни Паркинсона повышается, если количество повышается, считают, что тяжесть состояния при болезни Паркинсона снижается. Изобретение обеспечивает расширение арсенала способов определения прогрессирования патологического состояния при болезни Паркинсона. 2 з.п. ф-лы, 6 ил., 5 табл., 1 пр.
1. Способ определения прогрессирования патологического состояния у пациента с болезнью Паркинсона, включающий измерение количеств одной или более кишечных бактерий, выбранных из группы, состоящей из Bifidobacterium, группы Bacteroides fragilis, Lactobacillus brevis и подгруппы Lactobacillus plantarum и/или общего количества кишечных бактерий у пациента в два или более различных моментов времени и сравнение этих количеств, при этом если количество снижается, это может означать, что тяжесть состояния при болезни Паркинсона повышается, и если количество повышается, это может означать, что тяжесть состояния при болезни Паркинсона снижается.
2. Способ по п. 1, где прогрессированием патологического состояния у пациента с болезнью Паркинсона является прогрессирование симптома запора или психического симптома.
3. Способ по п. 2, где психическим симптомом является один или более симптомов, выбранных из группы, состоящей из галлюцинации, нарушения когнитивной функции и раздражительности.
| SATORU HASEGAWA et al., "Intestinal dysbiosis and lowered serum lipopolysacсharide-binding protein in Parkinson's disease", Plos ONE, 2015, v | |||
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| MATSUDA K | |||
| et al., "Establishment of an analytical system for the human fecal microbiota, based on reverse transcription-quantitative | |||
Авторы
Даты
2022-12-02—Публикация
2018-05-17—Подача