Область техники изобретения
Настоящее изобретение относится к новым штаммам молочнокислых бактерий и т. п., а более конкретно, к новым штаммам молочнокислых бактерий или новым смесям штаммов молочнокислых бактерий, которые выделены из кимчи или человеческих экскрементов и характеризуются различными физиологическими активностями, такими как антиоксидантная активность, активность, подавляющая β-глюкуронидазу, активность, подавляющая продуцирование липополисахаридов (LPS), или активность, индуцирующая экспрессию белка плотного контакта. Более того, настоящее изобретение относится к различным пищевым и лекарственным применениям новых штаммов молочнокислых бактерий или новых смесей штаммов молочнокислых бактерий.
Уровень техники изобретения
По мере того, как человечество развивалось в процветающее общество, еда быстрого приготовления быстро стала популярной, и картина заболеваний также резко изменилась. В частности, у современных людей частота появления нарушения кишечной флоры, синдрома кишечной проницаемости, колита, заболеваний печени, аллергических заболеваний, ожирения и т. п. возрастает из-за привычек употребления еды быстрого приготовления на основе мяса и жира, нерегулярного питания, чрезмерного употребления алкоголя, отсутствия физической нагрузки, чрезмерного напряжения, воздействия вредных сред и т. п.
Нарушение кишечной флоры
В желудочно-кишечном тракте организма человека существует много бактерий. В организме человека присутствует приблизительно 10 триллионов нормальных клеток, однако присутствует приблизительно 100 триллионов бактерий, которые приблизительно в 10 раз больше, чем нормальные клетки. Эти бактерии можно разделить на полезные бактерии, которые способствуют здоровью кишечника человека, и вредные бактерии, которые вредны для здоровья человека. Здоровье организма человека может поддерживаться тогда, когда полезные бактерии, такие как Lactobacillus, Bifidobacterium, Streptococcus, Leuconostoc, Pediococcus, Sporolactobacillius и т. п., являются более преобладающими в желудочно-кишечном тракте, чем вредные бактерии. В противном случае могут быть вызваны заболевания, такие как ожирение, синдром кишечной проницаемости, заболевания печени, ускоренное старение, энтерит и т. п.
Синдром кишечной проницаемости
Желудочно-кишечный тракт организма человека состоит из слизи и ворсинок, которые эффективно поглощают питательные компоненты, однако предотвращают поглощение патогенных микроорганизмов с высокой молекулярной массой или токсинов, продуцируемых этими микроорганизмами. В дополнение к этому организм человека обладает иммунной системой, способной защищать организм от проникновения внешних антигенов с высокой молекулярной массой. Однако из-за заражения многими патогенными микроорганизмами или токсинами, чрезмерного напряжения, потребления продуктов, как например рационы с высоким содержанием жиров, способные пролиферировать вредные бактерии, живущие в желудочно-кишечном тракте, чрезмерного употребления алкоголя, злоупотребления лекарственными средствами (например, антибиотиками) и т. п., кишечная флора нарушается, возникают аномалии в иммунной системе желудочно-кишечного тракта, и экспрессия белков плотного контакта ингибируется. Если экспрессия белков плотного контакта ингибируется, то плотный контакт слизистой оболочки кишечника становится ослабленным, и увеличивается проникновение в организм больших молекул из-за ослабленной щели и аномалий в иммунной системе. Синдром кишечной проницаемости также известен как синдром негерметичности кишечника и относится к состоянию, при котором внешние, такие как менее переваренные пищевые продукты, патогенные микроорганизмы, токсины или т. п., непрерывно вводятся в кровь, поскольку барьерная система плотного контакта эпителиальных клеток, образующих желудочно-кишечный тракт, не работает как следует. В случае если возникает синдром кишечной проницаемости, внешние антигены, которые обычно не всасываются в организм, проникают в организм, вызывая таким образом язвенный колит, заболевание Крона, повреждение печени, нарушение функции печени, аллергические заболевания (в том числе астму), атопию, аутоиммунные заболевания, стеаторею, нарушение всасывания в пищеварительном тракте, угри, ускоренное старение, эндотоксемию, кишечную инфекцию, экзему, синдром раздраженного кишечника, синдром хронической усталости, псориаз, ревматоидный артрит, недостаточность поджелудочной железы, воспалительные заболевания суставов или т. п.
Колит
Хотя ранее было известно, что частота возникновения язвенного колита и заболевания Крона высока у европейцев, количество пациентов с язвенным колитом и заболеванием Крона в восточных странах, включая Корею, в последнее время быстро растет из-за изменений в образе жизни, таких как пищевые привычки. Однако причина неясна, и таким образом фундаментальный способ лечения этих заболеваний еще не установлен. По этой причине применяются лекарственные средства, которые не направлены на полное лечение, а направлены на облегчение симптомов и поддержание этого облегченного состояния в течение максимально возможного периода времени. В качестве лекарственных средств для этой симптоматической терапии в основном применяются средства на основе аминосалициловой кислоты, средства на основе адренокортикостероидов, иммунодепрессанты и т. п.; однако, как сообщалось, они вызывают различные побочные эффекты. Например, сообщалось, что сульфасалазин, который часто используется в качестве средства на основе аминосалициловой кислоты вызывает побочные эффекты, в том числе тошноту, рвоту, анорексию, сыпь, головную боль, повреждение печени, лейкоцитопению, аномальные эритроциты, протеинурию, диарею и т. п. В дополнение к этому, средства на основе адренокортикостероидов, обычно применяются с помощью перорального введения преднизолона, инфузии, суппозитория, внутривенной инъекции или т. п., однако при длительном применении вызывают сильные побочные эффекты, такие как язва желудка или некроз бедра. Однако прекращение приема лекарственных средств может вызвать возвращение симптомов, и поэтому эти лекарственные средства необходимо применять постоянно. Соответственно, существует потребность в разработке средств для лечения заболеваний кишечника, таких как язвенный колит, заболевания Крона и т. п., которые обладают превосходными эффектами, являются безопасными и не вызывают побочных эффектов. Синдром раздраженного кишечника (IBS) также является хроническим заболеванием брюшной полости, причина которого неясна. В настоящее время нет основного терапевтического средства для IBS, и симптоматическая терапия проводится с целью облегчения симптомов каждого типа IBS. Например, для IBS-диареи применяют антихолинергическое средство, обладающее спазмолитическим действием, которое подавляет сокращение гладких мышц, а для IBS-констипации применяют солевые слабительные. Для IBS-чередования, которое трудно контролировать с помощью лекарственных средств, в основном применяют средство для улучшения двигательной функции желудочно-кишечного тракта.
Заболевания печени
Печень в организме человека выполняет такие роли, как энергетический метаболизм (обработка питательных веществ, а также хранение и удаление отходов), детоксикация токсинов, синтез сывороточных белков и беспрепятственное поглощение жира в кишечнике с помощью секреции желчных соков, а также имеет важное значение в иммунитете (защите организма) и метаболизме витаминов. Однако заражение вирусами гепатита, или чрезмерное употребление алкоголя, или питание с высоким содержанием жиров могут вызывать заболевания печени, такие как гепатит, ожирение печени или цирроз печени. В дополнение к этому, заболевания печени также могут вызываться лекарственными средствами (лекарственными средствами для лечения туберкулеза, аспирином, антибиотиками, анестетиками, антигипертензивными лекарственными средствами, оральными контрацептивами и т. д.), врожденными нарушениями обмена веществ, сердечной недостаточностью, шоком или т. п. При возникновении заболевания печени оно может развиться в хронический гепатит, начинаясь с острого гепатита с усталостью, рвотой, диареей, анорексией, желтухой, болями в правом верхнем квадранте, лихорадкой или мышечной болью.
Аллергические заболевания
По мере усложнения общества и развития промышленности и цивилизации, увеличивались загрязнение окружающей среды и напряжение, а по мере того, как изменялись пищевые привычки, количество пациентов с аллергическими заболеваниями увеличивалось с каждым годом. Количество пациентов с аллергическими заболеваниями, такими как атопия, анаксилоз, астма и т. п., составляло менее 1% в 1980 году, однако быстро увеличивалось до 5% или больше в 2000-х годах и оценивалось как составляющее более 10%, включая потенциальных пациентов. Аллергические заболевания вызваны чрезмерными иммунными реакциями организма, которые являются результатом реакций антиген-антитело, и при этом аллергические заболевания классифицируются на типы 1-4 реакций гиперчувствительности на основании времени ответа и того, включают ли они комплементы. Реакции гиперчувствительности 1-го типа включают атопию, анафилактический шок, бронхиальную астму, крапивницу, поллиноз и т. п.; реакции гиперчувствительности 2-го типа включают ненадлежащее переливание крови, аутоиммунную гемолитическую анемию, гемолитическую анемию, вызванную лекарственными средствами, гранулоцитопению, тромбоцитопеническую пурпуру и т. п.; реакции гиперчувствительности 3-го типа включают эритему, лимфатическую опухоль, артралгию, артрит, нефрит, острый гломерулонефрит после стрептококковой инфекции и т. п.; и реакции гиперчувствительности 4-го типа включают хроническое воспаление и т. п. Чтобы улучшить аллергические заболевания, предпочтительно удалить аллергены (домашняя пыль, клещи и т. д.) с кожи с помощью душа или купания и избежать приема аллергена. Однако, в случае если аллергические заболевания не улучшаются, применяют такие лекарственные средства, как стероиды, антигистамины, иммунодепрессанты или т. п., которые легко вызывают побочные эффекты, такие как атрофия кожи, вазодилатация, обесцвечивание, пурпура (стероиды), сонливость (антигистамины), почечная недостаточность (иммунодепрессанты) и т. п. Среди лекарственных средств, разработанных до настоящего времени, нет лекарственных средств, которые способны полностью излечить виды аллергии, и ожидается, что эти лекарственные средства улучшат симптомы, однако будут иметь проблемы с возникновением значительных побочных эффектов.
Ожирение
Ожирение представляет собой метаболическое расстройство, вызванное дисбалансом потребления омкалорий и расходом энергии, и вызвано увеличением размера (гипертрофией) или увеличением числа (гиперплазией) in vivo адипоцитов в морфологическом плане. Ожирение является не только самым распространенным нарушением, связанным с недостаточным питанием, в западном обществе, но и распространенность ожирения в Корее также быстро возрастает из-за улучшения пищевых привычек и вестернизации образа жизни. Следовательно, большое значение приобретают лечение и предупреждение ожирения. Ожирение является важным фактором, который беспокоит человека в психологическом плане, а также повышает риск развития различных заболеваний взрослых людей в социальном плане. Известно, что ожирение непосредственно связано с увеличением распространенности различных заболеваний взрослых людей, таких как диабет 2 типа, гипертония, гиперлипидемия, сердечные заболевания и т. п. (Cell 87:377, 1999), а также заболевания, связанные с ожирением, в совокупности называются метаболическим синдромом или синдромом инсулинорезистентности и, как сообщается, эти заболевания вызывают артериосклероз и сердечно-сосудистые заболевания. Терапевтические средства от ожирения, известные на данный момент, Xenical (Roche Pharmaceuticals, Швейцария), Reductil (Abbott, США), Exolise (Arkopharma, Франция) и т. п., и в значительной степени классифицируются на средства для подавления аппетита, промоторы расхода энергии и ингибиторы абсорбции жира. Большинство терапевтических средств от ожирения представляют собой средства для подавления аппетита, которые подавляют аппетит посредством контроля нейротрансмиттеров, связанных с гипоталамусом. Однако общепринятые терапевтические средства вызывают побочные эффекты, такие как сердечные заболевания, респираторные заболевания, неврологические заболевания и т. п., и при этом стойкость их эффектов также низка. Таким образом, необходима разработка улучшенных терапевтических средств от ожирения. В дополнение к этому, среди разрабатываемых в настоящее время продуктов мало или совсем нет терапевтических средств, которые обладают удовлетворительным терапевтическим эффектом, не вызывая побочных эффектов, и следовательно необходима разработка нового терапевтического средства от ожирения.
Пробиотики в совокупности относятся к живым микроорганизмам, которые улучшают микробную среду хозяина в желудочно-кишечном тракте животных, в том числе людей, и оказывают благоприятные эффекты в отношении здоровья хозяина. Чтобы быть эффективными в качестве пробиотиков, необходимо обладать превосходной устойчивостью к кислотам, устойчивостью к желчи и способностью прилипания к эпителиальным клеткам, поскольку большинство этих пробиотиков должны проникать в тонкую кишку при пероральном введении и должны быть прикреплены к кишечной поверхности. Молочнокислые бактерии применяют в качестве пробиотиков, потому что они играют роль в разложении волокнистых и сложных белков, чтобы получать важные питательные вещества, при этом живя в пищеварительной системе организма человека. Сообщалось, что молочнокислые бактерии проявляют такие эффекты, как поддержание нормальной кишечной флоры, восстановление кишечной флоры, антидиабетические и антигиперлипидемические эффекты, подавление канцерогенеза, подавление колита и неспецифическая активность иммунной системы хозяина. Среди этих молочнокислых бактерий штаммы Lactobacillus sp. являются основными членами нормальных микробных сообществ, обитающих в кишечнике организма человека и давно известны как важные для поддержания здорового состояния пищеварительного тракта и вагинальной среды. В настоящее время согласно рекомендациям Министерства здравоохранения США все штаммы Lactobacillus, депонированные в Американской коллекции типовых культур (ATCC), классифицируются как «уровень биологической безопасности 1», который признан как не имеющий потенциального риска вызывать заболевания у людей или животных. При этом сообщалось, что молочнокислые бактерии кимчи, которые участвуют в ферментации кимчи, обладают иммуноусиливающими эффектами, антимикробными эффектами, антиоксидантными эффектами, противораковыми эффектами, эффектами в отношении ожирения, эффектами, предупреждающими гипертонию, или эффектами, предупреждающими констипацию [Hivak P, Odrska J, Ferencik M, Ebringer L, Jahnova E, Mikes Z. One-year application of Probiotic strain Enterococcus facium M-74 decreases Serum cholesterol levels. : Bratisl lek Listy 2005; 106(2); 67-72; Agerholm-Larsen L. Bell ML. Grunwald GK. Astrup A.: The effect of a probiotic milk product on plasma cholesterol: a metaanalysis of short-term intervention studies; Eur J Clin Nutr. 2000; 54(11) 856-860; Renato Sousa, Jaroslava Helper, Jian Zhang, Strephen J Lewis and Wani O Li; Effect of Lactobacillus acidophilus supernants on body weight and leptin expression in rats; BMC complementary and alternative medicine. 2008; 8(5)1-8].
Поскольку были известны различные биологически активные активности молочнокислых бактерий, то недавно были проведены исследования для разработки молочнокислых бактериальных штаммов, которые обладают превосходными функциями, при этом являясь безопасными для человека, и применения эти штаммов по отношению к препаратам или функциональным продуктам питания. Например, в публикации заявки на патент Кореи № 10-2009-0116051 раскрыта Lactobacillus brevis HY7401, которая проявляет эффекты лечения и предупреждения колита. Кроме того, в публикации заявки на патент Кореи № 10-2006-0119045 раскрыты молочнокислые бактерии для предупреждения или лечения атопического дерматита, которые выбраны из группы, состоящей из Leuconostoc citreum KACC 91035, Leuconostoc mesenteroides subsp. mesenteroides KCTC 3100 и Lactobacillus brevis KCTC 3498. Кроме того, в публикации заявки на патент Кореи № 10-2013-0092182 раскрыта функциональная здоровая пища для предупреждения алкогольного заболевания печени или облегчения похмелья, которая содержит Lactobacillus brevis HD-01 (номер доступа: KACC91701P), обладающую превосходной способностью расщеплять спирт. В дополнение к этому, в публикации заявки на патент Кореи № 10-2010-0010015 раскрыт штамм Lactobacillus johnsonii HFI 108 (KCTC 11356BP), обладающий активностью, снижающей уровень холестерина в крови, и активностью в отношении ожирения. В дополнение к этому, в публикации заявки на патент Кореи № 10-2014-0006509 раскрыта композиция для предупреждения или лечения ожирения, содержащая штамм Bifidobacterium longum CGB-C11 (номер доступа: KCTC 11979BP), который продуцирует конъюгированную линолевую кислоту в качестве активного ингредиента.
Однако не было сообщений о технологии, связанной с молочнокислыми бактериями, способной уменьшать тяжесть или лечить все нарушения в кишечной флоре, синдром кишечной проницаемости, колит, заболевания печени, аллергические заболевания, ожирение и т. п., количество которых возрастает у современных людей. Следовательно, существует потребность в проведении скрининга нового штамма, характеризующегося различными функциональными возможностями, и разработке препаратов, функциональных продуктов питания и т. п. с использованием этого штамма.
Раскрытие изобретения
Техническая задача
Настоящее изобретение было выполнено в соответствии с уровнем техники, описанным выше, и целью настоящего изобретения является обеспечение новых молочнокислых бактерий, обладающих различными физиологическими активностями или функциональными возможностями, необходимыми для пробиотиков, а также их пищевые и лекарственные применения.
Другой целью настоящего изобретения является создание новой смеси молочнокислых бактерий, способной проявлять различные максимизированные физиологические активности или функциональные возможности, а также пути ее пищевого и лекарственного применения.
Решение технической задачи
Авторы настоящего изобретения провели скрининг многочисленных молочнокислых бактерий из кимчи или человеческих экскрементов и обнаружили, что среди этих подвергнутых скринингу молочнокислых бактерий определенный штамм Lactobacillus sp., определенный штамм Bifidobacterium sp. или их смесь проявляют превосходный эффект в отношении восстановления повреждения кишечника, такого как синдром кишечной проницаемости, повреждения печени, такого как ожирение печени, аллергических заболеваний, таких как атопический дерматит, воспалительных заболеваний, таких как колит, или ожирения, за счет чего завершая настоящее изобретение.
Для достижения вышеуказанных целей вариант осуществления настоящего изобретения предусматривает молочнокислые бактерии, выбранные из Lactobacillus brevis, содержащей нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 1, Bifidobacterium longum, содержащей нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 3, Lactobacillus plantarum, содержащей нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 4, Lactobacillus plantarum, содержащей нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 5, или Bifidobacterium longum, содержащей нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 7. Lactobacillus brevis, Lactobacillus plantarum или Bifidobacterium longum характеризуются антиоксидантной активностью, активностью, подавляющей β-глюкуронидазу, активностью, подавляющей продуцирование липополисахаридов (LPS), или активностью, индуцирующей экспрессию белка плотного контакта. Другой вариант осуществления настоящего изобретения предусматривает фармацевтическую композицию для предупреждения или лечения повреждения кишечника, повреждения печени, аллергического заболевания, воспалительного заболевания или ожирения, содержащую молочнокислые бактерии, выбранные из Lactobacillus brevis, содержащей нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 1, Bifidobacterium longum, содержащей нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 3, Lactobacillus plantarum, содержащей нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 4, Lactobacillus plantarum, содержащей нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 5, или Bifidobacterium longum, содержащей нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 7, культуру молочнокислых бактерий, лизат молочнокислых бактерий или экстракт молочнокислых бактерий в качестве активного ингредиента. Еще один вариант осуществления настоящего изобретения предусматривает пищевую композицию для предупреждения или уменьшения тяжести повреждения кишечника, повреждения печени, аллергического заболевания, воспалительного заболевания или ожирения, содержащую Lactobacillus brevis, содержащую нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 1, Bifidobacterium longum, содержащую нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 3, Lactobacillus plantarum, содержащую нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 4, Lactobacillus plantarum, содержащую нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 5, или Bifidobacterium longum, содержащую нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 7, культуру молочнокислых бактерий, лизат молочнокислых бактерий или экстракт молочнокислых бактерий в качестве активного ингредиента.
Для достижения других целей настоящего изобретения один вариант осуществления настоящего изобретения предусматривает смесь двух или более молочнокислых бактерий, выбранных из группы, состоящей из Lactobacillus brevis, содержащей нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 1, Bifidobacterium longum, содержащей нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 3, Lactobacillus plantarum, содержащей нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 4, Lactobacillus plantarum, содержащей нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 5, и Bifidobacterium longum, содержащей нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 7. Смесь молочнокислых бактерий обладает антиоксидантной активностью, активностью, подавляющей β-глюкуронидазу, активностью, подавляющей продуцирование липополисахаридов (LPS), или активностью, индуцирующей экспрессию белка плотного контакта. Другой вариант осуществления настоящего изобретения предусматривает композицию для предупреждения или лечения повреждения кишечника, повреждения печени, аллергического заболевания, воспалительного заболевания или ожирения, содержащую смесь двух или более молочнокислых бактерий, выбранных из группы, состоящей из Lactobacillus brevis, содержащей нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 1, Bifidobacterium longum, содержащей нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 3, Lactobacillus plantarum, содержащей нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 4, Lactobacillus plantarum, содержащей нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 5, и Bifidobacterium longum, содержащей нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 7, культуру смеси молочнокислых бактерий, лизат смеси молочнокислых бактерий или экстракт смеси молочнокислых бактерий в качестве активного ингредиента. Еще один вариант осуществления настоящего изобретения предусматривает пищевую композицию для предупреждения или уменьшения тяжести повреждения кишечника, повреждения печени, аллергического заболевания, воспалительного заболевания или ожирения, содержащую смесь двух или более молочнокислых бактерий, выбранных из группы, состоящей из Lactobacillus brevis, содержащей нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 1, Bifidobacterium longum, содержащей нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 3, Lactobacillus plantarum, содержащей нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 4, Lactobacillus plantarum, содержащей нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 5, и Bifidobacterium longum, содержащей нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 7, культуру смеси молочнокислых бактерий, лизат смеси молочнокислых бактерий или экстракт смеси молочнокислых бактерий в качестве активного ингредиента.
Положительные эффекты
Определенный штамм Lactobacillus sp. или определенный штамм Bifidobacterium sp. в соответствии с настоящим изобретением выделены из кимчи или человеческих экскрементов и, таким образом, являются очень безопасными и характеризуются различными физиологическими активностями, такими как антиоксидантная активность, активность, подавляющая β-глюкуронидазу, активность, подавляющая продуцирование липополисахаридов (LPS), или активность, индуцирующая экспрессию белка плотного контакта. Соответственно, определенный штамм Lactobacillus или определенный штамм Bifidobacterium sp., или их смесь в соответствии с настоящим изобретением можно применять в качестве функционального пищевого продукта или лекарственного материала, пригодных для предупреждения, уменьшения тяжести или лечения повреждения кишечника, повреждения печени, аллергического заболевания, воспалительного заболевания или ожирения.
Описание графических материалов
На ФИГ. 1 представлен график, демонстрирующий изменение значения GOT, в случае если молочнокислые бактерии вводили животным моделям с повреждением печени, индуцированным D-галактозамином в первом эксперименте по настоящему изобретению.
На ФИГ. 2 представлен график, демонстрирующий изменение значения GPT, в случае если молочнокислые бактерии вводили животным моделям с повреждением печени, индуцированным D-галактозамином в первом эксперименте по настоящему изобретению.
На ФИГ. 3 представлен график, демонстрирующий изменение значения MDA, в случае если молочнокислые бактерии вводили животным моделям с повреждением печени, индуцированным D-галактозамином в первом эксперименте по настоящему изобретению.
На ФИГ. 4 представлен график, демонстрирующий эффект молочнокислых бактерий, подвергнутых скринингу в первом эксперименте по настоящему изобретению, в отношении воспалительной реакции дендритных клеток, индуцированной липополисахаридом (LPS). Левый график на ФИГ. 4 демонстрирует эффект молочнокислых бактерий в отношении клеток, не обработанных LPS (липополисахаридом), а на правом графике показан эффект молочнокислых бактерий в отношении клеток, обработанных LPS (липополисахаридом).
На ФИГ. 5 представлен график, демонстрирующий эффект Bifidobacterium longum CH57 в отношении воспалительной реакции макрофагов, индуцированной LPS (липополисахаридом), в первом эксперименте по настоящему изобретению.
На ФИГ. 6 показаны результаты анализа эффекта Lactobacillus brevis CH23 в отношении дифференциации Т-клеток (выделенных из селезенки) в клетки Th17 или клетки Treg с помощью системы сортировки клеток с активированной флуоресценцией, в первом эксперименте по настоящему изобретению.
На ФИГ. 7 показаны результаты анализа эффекта Lactobacillus brevis CH23, Bifidobacterium longum CH57 или их смеси в отношении экспрессии белка ZO-1 в клетках СаСО2 в первом эксперименте по настоящему изобретению.
На ФИГ. 8 показаны физические свойства толстой кишки или активность миелопероксидазы (MPO), показывающие эффект Bifidobacterium longum CH57 в отношении животных моделей с острым колитом, индуцированным TNBS, в первом эксперименте по настоящему изобретению.
На ФИГ. 9 изображены гистологические снимки, демонстрирующие эффект Bifidobacterium longum CH57 в отношении животных моделей с острым колитом, индуцированным TNBS, в первом эксперименте по настоящему изобретению.
На ФИГ. 10 показаны уровни цитокинов, связанных с воспалением, показывающие эффект Bifidobacterium longum CH57 в отношении животных моделей с острым колитом, индуцированным TNBS, в первом эксперименте по настоящему изобретению.
На ФИГ. 11 показаны физические свойства толстой кишки или активность миелопероксидазы (MPO), показывающие эффект Lactobacillus brevis CH23 в отношении животных моделей с острым колитом, индуцированным TNBS, в первом эксперименте по настоящему изобретению.
На ФИГ. 12 изображены гистологические снимки толстой кишки, которые демонстрируют эффект Lactobacillus brevis CH23 в отношении животных моделей с острым колитом, индуцированным TNBS, в первом эксперименте по настоящему изобретению.
На ФИГ. 13 показаны диаграммы дифференциации Т-клеток, показывающие эффект Lactobacillus brevis CH23 в отношении животных моделей с острым колитом, индуцированным TNBS, в первом эксперименте по настоящему изобретению.
На ФИГ. 14 показаны уровни цитокинов, связанных с воспалением, показывающие эффект Lactobacillus brevis CH23 в отношении животных моделей с острым колитом, индуцированным TNBS, в первом эксперименте по настоящему изобретению.
На ФИГ. 15 показаны физические свойства толстой кишки или активность миелопероксидазы (MPO), показывающие эффект смеси Bifidobacterium longum CH57 и Lactobacillus brevis CH23 в отношении животных моделей с острым колитом, индуцированным TNBS, в первом эксперименте по настоящему изобретению.
На ФИГ. 16 изображены гистологические снимки, демонстрирующие эффект смеси Bifidobacterium longum CH57 и Lactobacillus brevis CH23 в отношении животных моделей с острым колитом, индуцированным TNBS, в первом эксперименте по настоящему изобретению.
На ФИГ. 17 показаны уровни цитокинов, связанных с воспалением, показывающие эффект смеси Bifidobacterium longum CH57 и Lactobacillus brevis CH23 в отношении животных моделей с острым колитом, индуцированным TNBS, в первом эксперименте по настоящему изобретению.
На ФИГ. 18 показаны изменения веса, показывающие эффект смеси Bifidobacterium longum CH57 и Lactobacillus brevis CH23 в отношении животных моделей с индуцированным ожирением в первом эксперименте по настоящему изобретению.
На ФИГ. 19 показаны физические свойства толстой кишки, активность миелопероксидазы (MPO), гистологические снимки толстой кишки и т. п., показывающие эффект смеси Bifidobacterium longum CH57 и Lactobacillus brevis CH23 в отношении животных моделей с индуцированным ожирением в первом эксперименте по настоящему изобретению.
На ФИГ. 20 показаны уровни цитокинов, связанных с воспалением, показывающие эффект смеси Bifidobacterium longum CH57 и Lactobacillus brevis CH23 в отношении животных моделей с индуцированным ожирением в первом эксперименте по настоящему изобретению.
На ФИГ. 21 показаны маркеры воспалительной реакции, показывающие эффект смеси Bifidobacterium longum CH57 и Lactobacillus brevis CH23 в отношении животных моделей с индуцированным ожирением в первом эксперименте по настоящему изобретению.
На ФИГ. 22 показаны диаграммы дифференциации Т-клеток в клетки Th17, показывающие эффект молочнокислых бактерий в отношении животных моделей с острым колитом, индуцированным TNBS, во втором эксперименте по настоящему изобретению.
На ФИГ. 23 показаны диаграммы дифференциации Т-клеток в клетки Treg, показывающие эффект молочнокислых бактерий в отношении животных моделей с острым колитом, индуцированным TNBS, во втором эксперименте по настоящему изобретению.
На ФИГ. 24 показаны маркеры воспалительной реакции, показывающие эффект молочнокислых бактерий в отношении животных моделей с острым колитом, индуцированным TNBS, во втором эксперименте по настоящему изобретению.
На ФИГ. 25 изображены снимки, демонстрирующие эффект молочнокислых бактерий в отношении слизистой оболочки желудка мышей с язвой желудка, индуцированной этанолом, во втором эксперименте по настоящему изобретению.
На ФИГ. 26 показан общий показатель поражения желудка, показывающий эффект молочнокислых бактерий в отношении слизистой оболочки желудка мышей с язвой желудка, индуцированной этанолом, во втором эксперименте по настоящему изобретению.
На ФИГ. 27 показан индекс язвы, показывающий эффект молочнокислых бактерий в отношении слизистой оболочки желудка мышей с язвой желудка, индуцированной этанолом, во втором эксперименте по настоящему изобретению.
На ФИГ. 28 показан индекс гистологической активности, показывающий эффект молочнокислых бактерий в отношении слизистой оболочки желудка мышей с язвой желудка, индуцированной этанолом, во втором эксперименте по настоящему изобретению.
На ФИГ. 29 показана активность миелопероксидазы (MPO), показывающая эффект молочнокислых бактерий в отношении слизистой оболочки желудка мышей с язвой желудка, индуцированной этанолом, во втором эксперименте по настоящему изобретению.
На ФИГ. 30 показаны уровни экспрессии CXCL4, показывающие эффект молочнокислых бактерий в отношении слизистой оболочки желудка мышей с язвой желудка, индуцированной этанолом, во втором эксперименте по настоящему изобретению.
На ФИГ. 31 показаны уровни экспрессии TNF-α, показывающие эффект молочнокислых бактерий в отношении слизистой оболочки желудка мышей с язвой желудка, индуцированной этанолом, во втором эксперименте по настоящему изобретению.
Принцип изобретения
Как используется в данном документе, будут определены термины, используемые в настоящем изобретении.
Как используется в данном документе, термин «культура» означает продукт, полученный с помощью культивирования микроорганизма в известной жидкой среде или твердой среде, и таким образом предназначен для включения микроорганизма.
Как используется в данном документе, термины «фармацевтически приемлемый» и «ситологически приемлемый» не означают какого-либо существенного стимулирования организма, какого-либо подавления биологической активности и характеристик вводимого активного вещества.
Как используется в данном документе, термин «предупреждение» относится ко всем действиям, которые подавляют симптомы или замедляют прогрессирование конкретного заболевания с помощью введения композиции по настоящему изобретению.
Как используется в данном документе, термин «лечение» относится ко всем действиям, которые уменьшают тяжесть или благоприятно изменяют симптомы конкретного заболевания с помощью введения композиции по настоящему изобретению.
Как используется в данном документе термин «уменьшение тяжести» относится ко всем действиям, которые по меньшей мере снижают значение параметра, относящегося к состоянию, подлежащему лечению, например степени проявления симптома.
Как используется в данном документе, термин «введение» означает предоставление композиции по настоящему изобретению субъекту любым подходящим способом. Как используется в данном документе, термин «субъект» означает всех животных, в том числе людей, обезьян, собак, коз, свиней или крыс, у которых имеется конкретное заболевание, симптомы которого могут быть ослаблены с помощью введения композиции по настоящему изобретению.
Как используется в данном документе, термин «фармацевтически эффективное количество» относится к количеству, достаточному для лечения заболеваний при приемлемом соотношении польза/риск, применимом к любому терапевтическому лечению. Фармацевтически эффективное количество может быть определено в зависимости от факторов, в том числе типа заболевания субъекта, тяжести заболевания, активности лекарственного средства, чувствительности к лекарственному средству, времени введения, способа введения, скорости экскреции, продолжительности лечения и лекарственных средств, применяемых в комбинации с композицией, и других факторов, известных в области медицины.
Далее в данном документе настоящее изобретение будет описано подробно.
Один аспект настоящего изобретения относится к новым молочнокислым бактериям, обладающим различными физиологическими активностями, или к новой смеси молочнокислых бактерий, которые могут характеризоваться повышенными физиологическими активностями.
Новые молочнокислые бактерии в соответствии с одним вариантом осуществления настоящего изобретения выбраны из Lactobacillus brevis, содержащей нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 1, Bifidobacterium longum, содержащей нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 3, Lactobacillus plantarum, содержащей нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 4, Lactobacillus plantarum, содержащей нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 5, или Bifidobacterium longum, содержащей нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 7, и обладает антиоксидантной активностью, активностью, подавляющей β-глюкуронидазу, активностью, подавляющей продуцирование липополисахаридов (LPS), или активностью, индуцирующей экспрессию белка плотного контакта.
Lactobacillus brevis, содержащая нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 1, представляет собой анаэробную бациллу, выделенную из кимчи, положительную к окрашиванию по Граму, способную выжить в широком диапазоне температур, с низкими значениями pH и высокими концентрациями солей и продуцирующую глюкозидазу. Кроме того, Lactobacillus brevis, содержащая нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 1, использует D-рибозу, D-ксилозу, D-глюкозу, D-фруктозу, эскулин, салицин, мальтозу, мелибиозу, 5-кетоглюконат и т. п. в качестве источников углерода. В дополнение к этому, Lactobacillus brevis, содержащая нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 1, предпочтительно представляет собой Lactobacillus brevis CH23 (номер доступа: KCCM 11762P). Bifidobacterium longum, содержащая нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 3, представляет собой анаэробную бациллу, выделенную из человеческих экскрементов, положительную к окрашиванию по Граму и продуцирующую глюкозидазу. Кроме того, Bifidobacterium longum, содержащая нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 3, использует D-галактозу, D-глюкозу, D-фруктозу и т. п. в качестве источников углерода. В дополнение к этому, Bifidobacterium longum, содержащая нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 3, предпочтительно представляет собой Bifidobacterium longum CH57 (номер доступа: KCCM 11764P). Lactobacillus plantarum, содержащая нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 4, представляет собой анаэробную бациллу, выделенную из кимчи и положительную к окрашиванию по Граму. Кроме того, Lactobacillus plantarum, содержащая нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 4, использует D-рибозу, D-галактозу, D-глюкозу, D-фруктозу, D-маннозу, маннит, сорбит, N-ацетилглюкозамин, амигдалин, арбутин, эскулин, салицин, целлобиозу, мальтозу, мелибиозу, сахарозу, трегалозу, мелецитозу и т. п. в качестве источников углерода. В дополнение к этому, Lactobacillus plantarum, содержащая нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 4, предпочтительно представляет собой Lactobacillus plantarum LC5 (номер доступа: KCCM 11800P). Lactobacillus plantarum, содержащая нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 5, представляет собой анаэробную бациллу, выделенную из кимчи и положительную к окрашиванию по Граму. Кроме того, Lactobacillus plantarum, содержащая нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 5, использует L-арабинозу, D-рибозу, D-глюкозу, D-фруктозу, D-маннозу, маннит, сорбит, N-ацетилглюкозамин, амигдалин, арбутин, эскулин, салицин, целлобиозу, мальтозу, лактозу, мелибиозу, сахарозу, трегалозу, мелецитозу и т. п. в качестве источников углерода. В дополнение к этому, Lactobacillus plantarum, содержащая нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 5, предпочтительно представляет собой Lactobacillus plantarum LC27 (номер доступа: KCCM 11801P). Bifidobacterium longum, содержащая нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 7, представляет собой анаэробную бациллу, выделенную из человеческих экскрементов и положительную к окрашиванию по Граму. Кроме того, Bifidobacterium longum, содержащая нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 7, использует L-арабинозу, D-рибозу, D-ксилозу, D-глюкозу, D-фруктозу, эскулин, мальтозу, лактозу, мелибиозу, сахарозу и т. п. в качестве источников углерода. В дополнение к этому, Bifidobacterium longum, содержащая нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 7, предпочтительно представляет собой Bifidobacterium longum LC67 (номер доступа: KCCM 11802P).
Смесь молочнокислых бактерий в соответствии с вариантом осуществления настоящего изобретения представляет собой смесь двух или более молочнокислых бактерий, выбранных из Lactobacillus brevis, содержащей нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 1, Bifidobacterium longum, содержащей нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 3, Lactobacillus plantarum, содержащей нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 4, Lactobacillus plantarum, содержащей нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 5, и Bifidobacterium longum, содержащей нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 7. Ввиду синергического эффекта молочнокислых бактерий, смесь молочнокислых бактерий в соответствии с вариантом осуществления настоящего изобретения предпочтительно представляет собой комбинацию Lactobacillus brevis, содержащей нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 1, и Bifidobacterium longum, содержащей нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 3. В дополнение к этому, ввиду синергического эффекта молочнокислых бактерий, смесь молочнокислых бактерий в соответствии с вариантом осуществления настоящего изобретения предпочтительно представляет собой комбинацию одной или более Lactobacillus sp., выбранных из Lactobacillus brevis, содержащей нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 4, или Lactobacillus plantarum, содержащей нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 5; и Bifidobacterium longum, содержащей нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 7. Смесь молочнокислых бактерий характеризуется более высокой антиоксидантной активностью, активностью, подавляющей β-глюкуронидазу, активностью, подавляющей продуцирование липополисахаридов (LPS), или активностью, индуцирующей экспрессию белка плотного контакта, чем один вид молочнокислых бактерий, из-за синергического эффекта специфического штамма Lactobacillus sp. и специфического штамма Bifidobacterium sp., и является более выгодной с точки зрения функциональных пищевых продуктов и лекарственных материалов. В смеси молочнокислых бактерий в соответствии с вариантом осуществления настоящего изобретения Lactobacillus brevis, содержащая нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 1, предпочтительно представляет собой Lactobacillus brevis CH23 (номер доступа: KCCM 11762P); Bifidobacterium longum, содержащая нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 3, предпочтительно представляет собой Bifidobacterium longum CH57 (номер доступа: KCCM 11764P); Lactobacillus plantarum, содержащая нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 4, предпочтительно представляет собой Lactobacillus plantarum LC5 (номер доступа: KCCM 11800P); Lactobacillus plantarum, содержащая нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 5, предпочтительно представляет собой Lactobacillus plantarum LC27 (номер доступа: KCCM 11801P); и Bifidobacterium longum, содержащая нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 7, предпочтительно представляет собой Bifidobacterium longum LC67 (номер доступа: KCCM 11802P).
Другой аспект настоящего изобретения связан с различными применениями новых молочнокислых бактерий или новой смеси молочнокислых бактерий. В качестве применения новых молочнокислых бактерий настоящее изобретение предусматривает композицию для предупреждения, уменьшения тяжести или лечения повреждения кишечника, повреждения печени, аллергического заболевания, воспалительного заболевания или ожирения, содержащую молочнокислые бактерии из Lactobacillus brevis, содержащей нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 1, Bifidobacterium longum, содержащей нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 3, Lactobacillus plantarum, содержащей нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 4, Lactobacillus plantarum, содержащей нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 5, или Bifidobacterium longum, содержащей нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 7, их культуру, их лизат или их экстракт в качестве активного ингредиента. Кроме того, в качестве применения новой смеси молочнокислых бактерий настоящее изобретение предусматривает композицию для предупреждения, уменьшения тяжести или лечения повреждения кишечника, повреждения печени, аллергического заболевания, воспалительного заболевания или ожирения, содержащую смесь двух или более молочнокислых бактерий, выбранных из Lactobacillus brevis, содержащей нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 1, Bifidobacterium longum, содержащей нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 3, Lactobacillus plantarum, содержащей нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 4, Lactobacillus plantarum, содержащей нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 5, и Bifidobacterium longum, содержащей нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 7, их культуру, их лизат или их экстракт в качестве активного ингредиента. В композиции по настоящему изобретению технические характеристики Lactobacillus brevis, Lactobacillus plantarum и Bifidobacterium longum являются такими, как описано выше, и поэтому их описание пропущено. Повреждение кишечника относится к состоянию, при котором функция кишечника (особенно тонкой кишки или толстой кишки) является аномальной из-за нарушения кишечной флоры или т. п. Предпочтительно, повреждение кишечника представляет собой синдром кишечной проницаемости. Кроме того, повреждение печени относится к состоянию, при котором функция печени является аномальной вследствие внешних факторов или внутренних факторов. Предпочтительно, повреждение печени выбрано из гепатита, ожирения печени или цирроза печени. Кроме того, гепатит включает все формы неалкогольного гепатита и алкогольного гепатита. Более того, ожирение печени включает все формы неалкогольного ожирения печени и алкогольного ожирения печени. Кроме того, аллергическое заболевание не ограничено в своем роде, если оно вызвано чрезмерными иммунными реакциями живого организма, и предпочтительно выбрано из атопического дерматита, астмы, фарингита или хронического дерматита. Кроме того, воспалительное заболевание не ограничено в своем роде, если оно вызвано воспалительными реакциями, и предпочтительно выбрано из гастрита, язвы желудка, артрита или колита. Более того, артрит включает ревматоидный артрит. Колит относится к состоянию, при котором воспаление возникает в толстой кишке из-за бактериальной инфекции или патологической ферментации содержимого кишечника. Формы колита включают инфекционный колит и неинфекционный колит. Конкретные примеры колита включают воспалительные заболевания кишечника, синдром раздраженного кишечника и т. п. Кроме того, воспалительные заболевания кишечника включают ульцеративный колит, заболевание Крона и т. п.
В настоящем изобретении культуру молочнокислых бактерий или культуру смеси молочнокислых бактерий получают с помощью культивирования определенного штамма или смеси штаммов в среде. Среда может быть выбрана из известных жидких сред или твердых сред, и может представлять собой, например, жидкую среду MRS, агаровую среду MRS или агаровую среду BL.
В настоящем изобретении композиция может быть осуществлена в виде фармацевтической композиции, пищевой добавки, пищевой композиции (в частности, функциональной пищевой композиции), кормовой добавки или т. п. в зависимости от предполагаемого применения или аспекта. В дополнение к этому, содержание молочнокислых бактерий или смеси молочнокислых бактерий в качестве активного ингредиента также можно регулировать в широком диапазоне в зависимости от конкретного типа, предполагаемого применения или аспекта композиции.
Содержание новых молочнокислых бактерий, новой смеси молочнокислых бактерий, их культуры, их лизата или их экстракта в качестве активного ингредиента в фармацевтической композиции в соответствии с настоящим изобретением конкретно не ограничено. Например, содержание может составлять от 0,01 до 99 вес. %, предпочтительно от 0,5 до 50 вес. %, более предпочтительно от 1 до 30 вес. % исходя из общего веса композиции. В дополнение к этому фармацевтическая композиция в соответствии с настоящим изобретением может дополнительно содержать, в дополнение к активному ингредиенту, добавки, такие как фармацевтически приемлемые носители, вспомогательные вещества или разбавители. Носители, вспомогательные вещества и разбавители, которые могут содержаться в фармацевтической композиции в соответствии с настоящим изобретением, включают лактозу, декстрозу, сахарозу, сорбит, маннит, ксилит, эритрит, мальтит, крахмал, аравийскую камедь, альгинат, желатин, фосфат кальция, силикат кальция, целлюлозу, метилцеллюлозу, микрокристаллическую целлюлозу, поливинилпирролидон, воду, метилгидроксибензоат, пропилгидроксилбензоат, тальк, стеарат магния и минеральное масло. В дополнение к этому фармацевтическая композиция в соответствии с настоящим изобретением может дополнительно содержать, помимо новых молочнокислых бактерий, новую смесь молочнокислых бактерий, их культуру, их лизат или их экстракт, один или более активных ингредиентов, обладающих эффектом предупреждения или лечения повреждения кишечника, повреждения печени, аллергического заболевания, воспалительного заболевания или ожирения. Фармацевтическая композиция в соответствии с настоящим изобретением может быть получена в виде составов для перорального введения или составов для парентерального введения, и при этом составы могут быть получены с использованием разбавителей или вспомогательных веществ, таких как наполнители, сухие разбавители, связующие, смачивающие средства, разрыхлители, поверхностно-активные вещества и т. п., которые обычно применяются. Твердые составы для перорального введения включают таблетки, пеллеты, порошки, гранулы, капсулы и т. п., и эти твердые композиции могут быть получены с помощью смешивания активного ингредиента по меньшей мере с одним вспомогательным веществом, например, крахмалом, карбонатом кальция, сахарозой, лактозой или желатином. В дополнение к простым наполнителям могут также применяться смазывающие вещества, такие как стеарат магния или тальк. Жидкие составы для перорального введения включают суспензии, растворы, эмульсии и сироп и могут содержать различные вспомогательные вещества, например, смачивающие средства, ароматизаторы, ароматические вещества, консерванты и т. п. в дополнение к воде и жидкому парафину, которые часто применяются как простые разбавители. Составы для парентерального введения включают стерилизованные водные растворы, неводные растворы, суспензии, эмульсии, лиофилизированные препараты и суппозитории. Пропиленгликоль, полиэтиленгликоль, растительные масла, такие как оливковое масло, инъекционные сложные эфиры, такие как этилолеат и т. п., могут применяться в качестве неводных растворителей или суспендирующих средств. В качестве основы суппозиториев можно применять витепсол, макрогол, Tween 61, масло какао, лауриновый жир, глицерожелатин и т. п. Кроме того, композиция может быть предпочтительно составлена в зависимости от каждого заболевания или компонента с помощью подходящего способа, известного из уровня техники, или способа, раскрытого в Remington's Pharmaceutical Science (последнее издание), Mack Publishing Company, Истон, Пенсильвания. Фармацевтическую композицию по настоящему изобретению можно вводить перорально или парентерально млекопитающим, в том числе людям, в соответствии с требуемым способом. Пути для парентерального введения включают внешнее нанесение на кожу, внутрибрюшинную инъекцию, интраректальную инъекцию, подкожную инъекцию, внутривенную инъекцию, внутримышечную инъекцию, интраторакальную инъекцию или т. п. Доза фармацевтической композиции по настоящему изобретению конкретно не ограничена, до тех пор пока она представляет собой фармацевтически эффективное количество. Доза может варьироваться в зависимости от веса пациента, возраста, пола, состояния здоровья, рациона, времени введения, способа введения, скорости экскреции и тяжести заболевания. Суточная доза фармацевтической композиции по настоящему изобретению конкретно не ограничена, однако предпочтительно составляет от 0,1 до 3000 мг/кг исходя из активного ингредиента, более предпочтительно от 1 до 2000 мг/кг исходя из активного ингредиента и может вводиться один или несколько раз в сутки.
Кроме того, содержание новых молочнокислых бактерий, новой смеси молочнокислых бактерий, их культуры, их лизата или их экстракта в качестве активного ингредиента в пищевой композиции в соответствии с настоящим изобретением составляет от 0,01 до 99 вес. %, предпочтительно от 0,1 до 50 вес. %, более предпочтительно от 0,5 до 25 вес. % исходя из общего веса композиции, но не ограничивается ими. Пищевая композиция по настоящему изобретению может находиться в форме пеллет, порошков, гранул, инфузий, таблеток, капсул, жидкости или т. п., и конкретные примеры пищи могут включать мясные продукты, колбасы, хлебобулочные изделия, виды шоколада, конфеты, закуски, кондитерские изделия, виды пиццы, виды рамена, другие виды лапши, жевательные резинки, молочные продукты, в том числе виды мороженого, различные виды супов, напитки, виды чая, функциональную воду, напитки, алкогольные напитки, витаминные комплексы и т. п. и могут включать все продукты здорового питания в общем смысле. Пищевая композиция по настоящему изобретению может дополнительно содержать в качестве дополнительных ингредиентов ситологически приемлемые носители, различные ароматизаторы или природные углеводы, в дополнение к активному ингредиенту. Кроме того, пищевая композиция по настоящему изобретению может содержать различные питательные вещества, витамины, электролиты, ароматизаторы, красители, пектиновую кислоту и ее соль, альгиновую кислоту и ее соль, органическую кислоту, защитный коллоидный загуститель, средство, регулирующее значение рН, стабилизатор, консервант, глицерин, спирт, карбонизирующее средство, используемое для газированных напитков, и т. п. Кроме того, пищевая композиция по настоящему изобретению может содержать плодово-ягодную мякоть для получения натуральных плодово-ягодных соков, напитков на основе плодово-ягодных соков и овощных напитков. Эти ингредиенты могут применяться раздельно или в виде смеси. Вышеописанные природные углеводы могут включать моносахариды, такие как глюкоза и фруктоза, дисахариды, такие как мальтоза и сахароза, полисахариды, такие как декстрин и циклодекстрин, и сахарные спирты, такие как ксилит, сорбит и эритрит. В качестве ароматизатора может использоваться натуральный ароматизатор, такой как тауматин или экстракт стевии, или синтетический ароматизатор, такой как сахарин или аспартам.
Далее в данном документе настоящее изобретение будет описано более подробно со ссылкой на примеры. Однако следует понимать, что эти примеры предназначены только для иллюстрирования технических характеристик настоящего изобретения для большей ясности и не ограничивают объем настоящего изобретения.
I. Первый эксперимент по скринингу молочнокислых бактерий и оценки их эффектов
1. Выделение и идентификация молочнокислых бактерий
(1) Выделение молочнокислых бактерий из кимчи
Каждый из кимчи с китайской капустой, кимчи с редиской и кимчи с зеленым луком измельчали, и измельченную жидкость суспендировали в жидкой среде MRS (бульон MRS, Difco, США). Затем супернатант собирали, переносили в агаровую среду MRS (Difco, США) и культивировали анаэробно при 37°С в течение приблизительно 48 часов, а затем выделяли штаммы, которые образовывали колонии.
(2) Выделение молочнокислых бактерий из человеческих экскрементов
Человеческие экскременты суспендировали в жидкой среде GAM (бульон GAM; Nissui Pharmaceutical, Япония). Затем супернатант собирали, переносили в агаровую среду BL (Nissui Pharmaceutical, Япония) и культивировали анаэробно при 37°С в течение приблизительно 48 часов, а затем выделяли штаммы Bifidobacterium sp., которые образовывали колонии.
(3) Идентификация подвергнутых скринингу молочнокислых бактерий
Анализировали физиологические характеристики и последовательности 16S rDNA штаммов, выделенных из кимчи или человеческих фекалий, с целью идентификации видов штаммов, и штаммам присваивали названия. В таблице 1 ниже приведены контрольные номера и названия штаммов молочнокислых бактерий, выделенных из кимчи с китайской капустой, кимчи с редиской, кимчи с зеленым луком, а также из человеческих фекалий.
Таблица 1
Среди штаммов, показанных в таблице 1 выше, Lactobacillus brevis CH23 представлял собой грамположительную анаэробную бациллу, не образовывавшую спор и способную выживать даже в аэробных условиях. Кроме того, Lactobacillus brevis CH23 выживал при температуре от 10 до 42°C и представляла собой кислотоустойчивый штамм, стабильный при рН 2 в течение 2 часов. Кроме того, Lactobacillus brevis CH23 выживал даже в 2% растворе хлорида натрия и активно продуцировал глюкозидазу. В дополнение к этому, для химической классификации Lactobacillus brevis CH23 анализировали его 16S rDNA, и в результате было показано, что Lactobacillus brevis CH23 имеет нуклеотидную последовательность под SEQ ID NO: 1. Нуклеотидную последовательность 16S rDNA Lactobacillus brevis CH23 идентифицировали с помощью BLAST в Gene Bank (http://www.ncbi.nlm.nih.gov/), и в результате штамм Lactobacillus brevis, имеющий такую же нуклеотидную последовательность 16S rDNA, что и Lactobacillus brevis CH23, обнаружен не был, и Lactobacillus brevis CH23 продемонстрировал 99% гомологию с последовательностью 16S rDNA штамма Lactobacillus brevis FJ004.
Среди штаммов, показанных в таблице 1 выше, Lactobacillus johnsonii CH32 представлял собой грамположительную анаэробную бациллу, не образовывавшую спор и способную выживать даже в аэробных условиях. Кроме того, Lactobacillus johnsonii CH32 стабильно выживал при температуре до 45°C и был кислотоустойчивым штаммом, стабильным при рН 2 в течение 2 часов. Более того, Lactobacillus johnsonii CH32 активно продуцировал β-глюкозидазу, но не продуцировал β-глюкуронидазу. В дополнение к этому, для химической классификации Lactobacillus johnsonii CH32 анализировали его 16S rDNA, и в результате было показано, что Lactobacillus johnsonii CH32 имеет нуклеотидную последовательность под SEQ ID NO: 2. Нуклеотидную последовательность 16S rDNA Lactobacillus johnsonii CH32 идентифицировали с помощью BLAST в Gene Bank (http://www.ncbi.nlm.nih.gov/), и в результате штамм Lactobacillus johnsonii, имеющий такую же нуклеотидную последовательность 16S rDNA, что и Lactobacillus johnsonii CH32, обнаружен не был, и Lactobacillus johnsonii CH32 продемонстрировал 99% гомологию с последовательностью 16S rDNA штамма Lactobacillus johnsonii JCM 2012.
Среди штаммов, показанных в таблице 1 выше, Bifidobacterium longum CH57 представлял собой грамположительную анаэробную бациллу, не образовывавшую спор и проявлявшую очень низкую жизнеспособность в аэробных условиях. Кроме того, Bifidobacterium longum CH57 был термически неустойчивым. Кроме того, Bifidobacterium longum CH57 активно продуцировал глюкозидазу, но не продуцировал β-глюкуронидазу. В дополнение к этому, для химической классификации Bifidobacterium longum CH57 анализировали его 16S rDNA, и в результате было показано, что Bifidobacterium longum CH57 имеет нуклеотидную последовательность под SEQ ID NO: 3. Нуклеотидную последовательность 16S rDNA Bifidobacterium longum CH57 идентифицировали с помощью BLAST в Gene Bank (http://www.ncbi.nlm.nih.gov/), и в результате штамм Bifidobacterium longum, имеющий такую же нуклеотидную последовательность 16S rDNA, что и Bifidobacterium longum CH57, обнаружен не был, и Bifidobacterium longum CH57 продемонстрировал 99% гомологию с последовательностью 16S rDNA штамма Bifidobacterium longum CBT-6.
В дополнение к этому, среди физиологических характеристик Lactobacillus brevis CH23, Lactobacillus johnsonii CH32 и Bifidobacterium longum CH57 анализировали коэффициент использования источника углерода с использованием ферментации сахара с помощью набора API (модель API 50 CHL, производства BioMerieux, США). В таблице 2 ниже показаны результаты анализа коэффициента использования Lactobacillus brevis CH23 источника углерода; в таблице 3 ниже показаны результаты анализа коэффициента использования Lactobacillus johnsonii CH32 источника углерода; и в таблице 4 ниже показаны результаты анализа коэффициента использования Bifidobacterium longum CH57 источника углерода. В таблицах 2, 3 и 4 «+» означает случай, когда коэффициент использования источника углерода являлся положительным; «-» означает случай, когда коэффициент использования источника углерода являлся отрицательным; и «±» означает случай, когда коэффициент использования источника углерода допускал двоякое толкование. Как показано в таблицах 2, 3 и 4 ниже, Lactobacillus brevis CH23, Lactobacillus johnsonii CH32 и Bifidobacterium longum CH57 продемонстрировали, что коэффициент использования источника углерода отличался от коэффициента использования других штаммов того же вида по отношению к некоторым источникам углерода.
Таблица 2
1) Suriasih K., Aryanta WR, MahardikaG, Astawa NM. Microbiological and Chemical Properties of Kefir Made of Bali Cattle Milk. Food Science and Quality Management 2012; 6:112-22.
Таблица 3
2) Pridmore RD, Berger B, Desiere F, Vilanova D, Barretto C, Pittet AC, Zwahlen MC, Rouvet M, Altermann E, Barrangou R, Mollet B, Mercenier A, Klaenhammer T, Arigoni F, Schell MA. The genome sequence of the probiotic intestinal bacterium Lactobacillus johnsonii NCC 533. Proc Natl Acad Sci U S A. 2004 Feb 24; 101(8):2512-7.
Таблица 4
3) Lukacova D, Karovucova J, Greifova M, Greif G, Sovcikova A, Kohhajdova Z. In vitro testing of selected probiotic characteristics of Lactobacillus plantarum and Bifidobacterium longum. Journal of Food and Nutrition Research 2006; 45: 77-83.
(4) Информация о депонировании молочнокислых бактерий
Авторы настоящего изобретения депонировали Lactobacillus brevis CH23 в Корейском центре культур микроорганизмов (адрес: Yurim Building, 45, Hongjenae 2ga-gil, Seodaemun-gu, Сеул, Корея), Международном органе по депонированию, 1 сентября 2015 г. под номером доступа KCCM 11762P. Кроме того, авторы настоящего изобретения депонировали Lactobacillus johnsonii CH32 в Корейском центре культур микроорганизмов (адрес: Yurim Building, 45, Hongjenae 2ga-gil, Seodaemun-gu, Сеул, Корея), Международном органе по депонированию, 1 сентября 2015 г. под номером доступа KCCM 11763P. Кроме того, авторы настоящего изобретения депонировали Bifidobacterium longum CH57 в Корейском центре культур микроорганизмов (адрес: Yurim Building, 45, Hongjenae 2ga-gil, Seodaemun-gu, Сеул, Корея), Международном органе по депонированию, 1 сентября 2015 г. под номером доступа KCCM 11764P.
2. Оценка эффекта молочнокислых бактерий в отношении уменьшения тяжести повреждения кишечника или кишечной проницаемости
Чтобы оценить эффект молочнокислых бактерий, выделенных из кимчи или человеческих экскрементов, в отношении уменьшения тяжести повреждения кишечника или кишечной проницаемости, у молочнокислых бактерий измеряли антиоксидантную активность, активность, подавляющую продуцирование липополисахаридов (LPS), активность, подавляющую β-глюкуронидазу (вредный кишечный фермент), и активность, индуцирующую экспрессию белка плотного контакта.
(1) Экспериментальные способы
* Антиоксидантная активность
Для получения раствора DPPH растворяли в этаноле DPPH (2,2-дифенил-1-пикрилгидразил) до концентрации 0,2 мМ. Суспензию молочнокислых бактерий (1 × 108 КОЕ/мл) или раствор витамина С (1 г/мл) добавляли к 0,1 мл раствора DPPH и культивировали при 37°С в течение 20 минут. Культуру центрифугировали при 3000 об./мин. в течение 5 минут, и супернатант собирали. Затем измеряли поглощение супернатанта при 517 нм, и рассчитывали антиоксидантную активность молочнокислых бактерий.
* Активность, подавляющая продуцирование липополисахаридов (LPS)
В 0,9 мл стерильного физиологического солевого раствора суспендировали 0,1 г свежих экскрементов человека и разбавляли в 100 раз общей анаэробной средой для получения фекальной суспензии. К 9,8 мл стерильной анаэробной среды (Nissui Pharmaceuticals, Япония) добавляли 0,1 мл фекальной суспензии и 0,1 мл молочнокислых бактерий (1 × 104 или 1 × 105 КОЕ) и культивировали анаэробно в течение 24 часов. Затем культуру обрабатывали ультразвуком в течение приблизительно 1 часа для разрушения наружной клеточной мембраны бактерий, и центрифугировали при 5000×g, и собирали супернатант. Затем с помощью набора LAL для анализа (Limulus Amoebocyte Lysate) (производства Cape Cod Inc., США) измеряли содержание LPS (липополисахарида) (который является типичным эндотоксином) в супернатанте. В дополнение к этому, чтобы оценить активность подавления пролиферации E. coli молочнокислых бактерий, культуру, полученную в том же эксперименте, как описано выше, разбавляли в 1000 раз и в 100000 раз и культивировали в среде DHL, а затем подсчитывали количество клеток E.coli.
*Активность, подавляющая β-глюкуронидазу
В реактор помещали 0,1 мл 0,1 мМ раствора п-нитрофенил-β-D-глюкуронида, 0,2 мл 50 мМ фосфатно-солевого буферного раствора, и 0,1 мл суспензии молочнокислых бактерий (полученной суспендированием культуры молочнокислых бактерий в 5 мл физиологического солевого раствора), и подвергали ферментативной реакции β-глюкуронидазы, и для прекращения реакции добавляли 0,5 мл 0,1 мМ раствора NaOH. Затем реакционный раствор центрифугировали при 3000 об./мин. в течение 5 минут, и супернатант собирали. Затем измеряли поглощение супернатанта при 405 нм.
* Активность, индуцирующая экспрессию белка плотного контакта
Клетки СаСО2, полученные из Корейского банка клеточных линий, культивировали в среде RPMI 1640 в течение 48 часов, а затем культивированные клетки CaCO2 распределяли в каждую лунку 12-луночного планшета с плотностью, составлявшей 2 × 106 клеток/лунка. Затем каждую лунку обрабатывали 1 мкг LPS (липополисахарида) или комбинацией 1 мкг LPS (липополисахарида) и 1 × 103 КОЕ молочнокислых бактерий и инкубировали в течение 24 часов. Затем культивируемые клетки собирали из каждой лунки, и уровень экспрессии белка плотного контакта ZO-1 в клетках измеряли с помощью способа иммуноблоттинга.
(2) Экспериментальные результаты
Измеряли антиоксидантную активность, активность, подавляющую продуцирование липополисахаридов (LPS), активность, подавляющую β-глюкуронидазу, и активность, индуцирующую экспрессию белка плотного контакта у молочнокислых бактерий, выделенных из кимчи или человеческих экскрементов, и результаты измерения показаны в таблицах 5 и 6 ниже. Как представлено в таблицах 5 и 6 ниже, Lactobacillus curvatus CH5, Lactobacillus sakei CH11, Lactobacillus brevis CH23, Lactobacillus johnsonii CH32, Bifidobacterium pseudocatenulatum CH38 и Bifidobacterium longum CH57 обладали превосходной антиоксидантной активностью, активностью, сильно подавляющей продуцирование липополисахаридов (LPS) и β-глюкуронидазы, и сильно индуцирующей экспрессию белка плотного контакта. Эти молочнокислые бактерии характеризуются превосходным антиоксидантным эффектом, характеризуются превосходным эффектом подавления ферментативной активности вредных бактерий кишечной флоры, связанных с воспалением и канцерогенезом, подавляют продуцирование эндотоксина LPS (липополисахарида), продуцируемого вредными бактериями кишечной флоры, и индуцируют экспрессию белка плотного контакта. Таким образом, эти молочнокислые бактерии способны облегчить синдром кишечной проницаемости.
Таблица 5
Таблица 6
* Конечная концентрация молочнокислых бактерий при измерении антиоксидантной активности: 1 × 104 КОЕ/мл; концентрация молочнокислых бактерий, добавленных для измерения активности, подавляющей бета-глюкуронидазу, и активности, подавляющей продуцирование липополисахаридов (LPS): 1 × 104 КОЕ/мл; концентрация молочнокислых бактерий при измерении активности, индуцирующей экспрессию белка плотного контакта: 1 × 104 КОЕ/мл.
* Критерии для измерения различных активностей молочнокислых бактерий: очень сильно (+++; >90%); сильно (++; >60-90%); слабо (+; >20-60%); не менее или менее 20% (-; <20%).
3. Оценка эффекта молочнокислых бактерий в отношении уменьшения тяжести повреждения печени
Исходя из оценки эффекта молочнокислых бактерий в отношении уменьшения тяжести повреждения кишечника или синдрома кишечной проницаемости, были выбраны следующие семь штаммов: Lactobacillus curvatus CH5, Lactobacillus sakei CH11, Lactobacillus fermentum CH15, Lactobacillus brevis CH23, Lactobacillus johnsonii CH32, Bifidobacterium pseudocatenulatum CH38 и Bifidobacterium longum CH57. Эффект каждого из этих выбранных штаммов или смеси этих штаммов в отношении уменьшения тяжести повреждения печени оценивали с использованием различных животных моделей с повреждением печени.
(1) Измерение эффекта молочнокислых бактерий, уменьшающего тяжесть повреждения печени, с помощью эксперимента с использованием животных моделей с повреждением печени, индуцированным D-галактозамином
1) Экспериментальный способ
Мышей (C57BL/6, самцы) разделяли на несколько групп, каждая из которых состояла из 6 животных. D-галактозамин вводили внутрибрюшинно тестируемым животным из групп, отличных от нормальной группы, в дозе, составлявшей 800 мг/кг, для индуцирования повреждения печени. Через 2 часа после внутрибрюшинного введения D-галактозамина 1 × 109 КОЕ молочнокислых бактерий вводили перорально тестируемым животным из групп, отличных от нормальной группы и группы отрицательного контроля, один раз в сутки в течение 3 суток. В дополнение к этому, вместо молочнокислых бактерий тестируемым животным группы положительного контроля перорально вводили силимарин в дозе, составлявшей 100 мг/кг, один раз в сутки в течение 3 суток. Через 6 часов после последнего введения лекарственного средства отбирали кровь из сердца. Отобранный образец крови оставляли отстаиваться при комнатной температуре в течение 60 минут и центрифугировали при 3000 об./мин. в течение 15 минут для отделения сыворотки. Уровни GPT (глутаминпируваттрансаминазы) и GOT (глутаматоксалацетаттрансаминазы) в отделенной сыворотке измеряли с использованием набора для анализа крови (набор для измерения ALT & AST, Asan Pharm. Co., Корея).
В дополнение к этому у тестируемых животных иссекали образец ткани печени, и измеряли количество малонового диальдегида (MDA), присутствующего в ткани печени. Малоновый диальдегид является маркером перекисного окисления липидов. В частности, 0,5 г иссеченной ткани печени добавляли к 16-кратному объему раствора RIPA (0,21 М маннит, 0,1 М EDTA-2Na, 0,07 М сахарозы, 0,01 М основания Trizma), а затем гомогенизировали с использованием гомогенизатора. Гомогенизированный раствор центрифугировали при 3000 об./мин. в течение 10 минут, и собирали гомогенат печени. К 0,4 мл 10% SDS добавляли 0,5 мл гомогената печени, инкубировали при 37°C в течение 30 минут и охлаждали, а затем к ним добавляли 3 мл 1% фосфатного буфера и 1 мл 0,6% TBA, и нагревали на водной бане при 100°C в течение 45 минут для получения раствора образца. Добавляли полученный раствор образца и смешивали с 4 мл н-бутанола, а затем центрифугировали при 3000 об./мин. в течение 10 минут, и супернатант собирали. Для количественной оценки MDA измеряли поглощение собранного супернатанта при 535 нм. В дополнение к этому была построена калибровочная кривая для измерения MDA с использованием 1,1,3,3-тетраэтоксипропана.
2) Экспериментальные результаты
На ФИГ. 1 представлен график, демонстрирующий изменение значения GOT, в случае если молочнокислые бактерии вводили животным моделям с повреждением печени, индуцированным D-галактозамином; на ФИГ. 2 представлен график, демонстрирующий изменение значения GPT, в случае если молочнокислые бактерии вводили животным моделям с повреждением печени, индуцированным D-галактозамином; и на ФИГ. 3 представлен график, демонстрирующий изменение значения MDA, в случае если молочнокислые бактерии вводили животным моделям с повреждением печени, индуцированным D-галактозамином.
На оси х на ФИГ. 1-3 «Nor» означает нормальную группу; «Con» означает группу отрицательного контроля, в которой какие-либо лекарственные средства не вводились животным моделям с повреждением печени, индуцированным D-галактозамином; «ch11» означает группу, которой вводили Lactobacillus sakei CH11; «ch15» означает группу, которой вводили Lactobacillus fermentum CH15; «ch23» означает группу, которой вводили Lactobacillus brevis CH23; «ch32» означает группу, которой вводили Lactobacillus johnsonii CH32; «ch38» означает группу, которой вводили Bifidobacterium pseudocatenulatum CH38; «ch57» означает группу, которой вводили Bifidobacterium longum CH57; «ch57+ch11» означает группу, которой вводили смесь молочнокислых бактерий, полученную с помощью смешивания Bifidobacterium longum CH57 и Lactobacillus sakei CH11 в одинаковых количествах; «ch57+ch23» означает группу, которой вводили смесь молочнокислых бактерий, полученную с помощью смешивания Bifidobacterium longum CH57 и Lactobacillus brevis CH23 в одинаковых количествах; «ch57+ch32» означает группу, которой вводили смесь молочнокислых бактерий, полученную с помощью смешивания Bifidobacterium longum CH57 и Lactobacillus johnsonii CH32 в одинаковых количествах; и «SM» означает группу положительного контроля, которой вводили силимарин вместо молочнокислых бактерий.
Как показано на ФИГ. 1-3, в случае если каждый из Lactobacillus brevis CH23, Lactobacillus johnsonii CH32 и Bifidobacterium longum CH57 вводили животным моделям, в которых значения GOT, GPT и MAD увеличивались из-за повреждения печени, тяжесть повреждения печени уменьшалась. В частности, в случае если вводили смесь молочнокислых бактерий Bifidobacterium longum CH57 и Lactobacillus brevis CH23 или смесь молочнокислых бактерий Bifidobacterium longum CH57 и Lactobacillus johnsonii CH32, тяжесть повреждения печени значительно уменьшалась. В дополнение к этому, специфические молочнокислые бактерии или смесь молочнокислых бактерий, выбранных из них, продемонстрировали улучшенный эффект в отношении уменьшения тяжести повреждения печени по сравнению с силимарином, который применяется в качестве лекарственного средства для лечения повреждения печени. Эти результаты показывают, что специфические молочнокислые бактерии или смесь молочнокислых бактерий, выбранных из них, эффективны для уменьшения тяжести ожирения печени, вызванного алкоголем и рационами с высоким содержанием жиров, или для уменьшения тяжести заболеваний печени, вызванных окислительным стрессом.
(2) Измерение эффекта молочнокислых бактерий, уменьшающего тяжесть повреждения печени, с помощью эксперимента с использованием животных моделей с повреждением печени, индуцированным трет-бутилпероксидом
1) Экспериментальный способ
Мышей (C57BL/6, самцы) разделяли на несколько групп, каждая из которых состояла из 6 животных. Трет-бутилпероксид вводили внутрибрюшинно тестируемым животным из групп, отличных от нормальной группы, в количестве, составлявшем 2,5 ммоль/кг, для индуцирования повреждения печени. Через 2 часа после внутрибрюшинного введения трет-бутилпероксида 2 × 109 КОЕ молочнокислых бактерий вводили перорально тестируемым животным из групп, отличных от нормальной группы и группы отрицательного контроля, один раз в сутки в течение 3 суток. В дополнение к этому, вместо молочнокислых бактерий тестируемым животным группы положительного контроля перорально вводили силимарин в дозе, составлявшей 100 мг/кг, один раз в сутки в течение 3 суток. Через 6 часов после последнего введения лекарственного средства отбирали кровь из сердца. Отобранный образец крови оставляли отстаиваться при комнатной температуре в течение 60 минут и центрифугировали при 3000 об./мин. в течение 15 минут для отделения сыворотки. Уровни GPT (глутаминпируваттрансаминазы) и GOT (глутаматоксалацетаттрансаминазы) в отделенной сыворотке измеряли с использованием набора для анализа крови (набор для измерения ALT & AST, Asan Pharm. Co., Корея).
2) Экспериментальные результаты
В таблице 7 ниже представлены изменения значений GOT и GPT в случае если молочнокислые бактерии вводились животным моделям с повреждением печени, индуцированным трет-бутилпероксидом. Как представлено в таблице 7 ниже, Lactobacillus brevis CH23, Lactobacillus johnsonii CH32 и Bifidobacterium longum CH57 продемонстрировали превосходные эффекты в отношении уменьшения тяжести повреждения печени по сравнению с силимарином, и смесь молочнокислых бактерий Bifidobacterium longum CH57 и Lactobacillus brevis CH23 или смесь молочнокислых бактерий Bifidobacterium longum CH57 и Lactobacillus johnsonii CH32 продемонстрировали улучшенный эффект в отношении уменьшения тяжести повреждения печени.
Таблица 7
В таблице 7 выше «CH23» означает Lactobacillus brevis CH23; «CH32» означает Lactobacillus johnsonii CH32; «CH57» означает Bifidobacterium longum CH57; «CH57+CH23» означает смесь молочнокислых бактерий, полученную с помощью смешивания Bifidobacterium longum CH57 и Lactobacillus brevis CH23 в одинаковых количествах; и «CH57+CH32» означает смесь молочнокислых бактерий, полученную с помощью смешивания Bifidobacterium longum CH57 и Lactobacillus johnsonii CH32 в одинаковых количествах.
4. Оценка эффекта молочнокислых бактерий в отношении уменьшения тяжести аллергии
(1) Измерение подавления дегрануляции с помощью молочнокислых бактерий
Клеточную линию RBL-2H3 (клеточная линия тучных клеток крысы, Корейский банк клеточных линий, № по кат. 22256) культивировали с DMEM (модифицированная по способу Дульбекко среда Игла, Sigma, 22256), содержащей 10% FBS (фетальная бычья сыворотка) и L-глютамин в увлажненном 5% CO2-инкубаторе при 37°С. Клетки, содержащиеся в культуральной среде, флотировали с использованием раствора трипсина-EDTA, и всплывающие клетки выделяли, собирали и использовали в эксперименте. Собранные клетки RBL-2H3 распределяли в 24-луночный планшет с плотностью 5 × 105 клеток/лунка и сенсибилизировали с помощью инкубирования с 0,5 мкг/мл моноклонального IgE мыши в течение 12 часов. Сенсибилизированные клетки промывали 0,5 мл сираганового буфера (119 мМ NaCl, 5 мМ KCl, 0,4 мМ MgCl2, 25 мМ PIPES, 40 мМ NaOH, pH 7,2), а затем инкубировали с 0,16 мл сираганового буфера (дополненного 5,6 мМ глюкозы, 1 мМ CaCl2, 0,1% BSA) при 37°С в течение 10 минут. Затем к клеточной культуре в качестве тестируемого лекарственного средства добавляли молочнокислые бактерии до концентрации, составлявшей 1 × 104 КОЕ/мл, или к клеточной культуре в качестве контрольного лекарственного средства добавляли 0,04 мл DSCG (динатрия кромогликат), и через 20 минут клетки активировали с помощью 0,02 мл антигена (1 мкг/мл DNP-BSA) при 37°С в течение 10 минут. Затем клеточную культуру центрифугировали при 2000 об./мин. в течение 10 минут, и супернатант собирали. Переносили в 96-луночный планшет 0,025 мл собранного супернатанта и затем 0,025 мл 1 мМ п-NAG (раствор п-нитрофенил-N-ацетил-β-D-глюкозамида в 0,1 М цитратном буфере, рН 4,5), а затем обеспечивали реакцию смеси при 37°С в течение 60 минут. Затем реакцию останавливали с помощью добавления 0,2 мл 0,1 М Na2CO3/NaHCO3, и показатель поглощения при 405 нм измеряли с помощью анализатора ELISA.
(2) Измерение подавления зуда с помощью молочнокислых бактерий
Мышей BALB/c разделяли на несколько групп, каждая из которых состояла из 5 животных. Вводили перорально в качестве тестируемого лекарственного средства один раз в сутки в течение 3 суток 1 × 109 КОЕ молочнокислых бактерий тестируемым группам, отличным от нормальной группы и контрольной группы, или вводили перорально в качестве контрольного лекарственного средства DSCG (динатрия кромогликат) или азеластин в количестве, составлявшем 0,2 мг/мышь, один раз в сутки в течение 3 суток. Через 1 час после последнего введения лекарственного средства мышей оставляли в клетке для наблюдения (24 см × 22 см × 24 см) в течение 10 минут, чтобы акклиматизироваться к окружающей среде, а затем брили заднюю часть головы. Затем мышам из нормальной группы вводили физиологический солевой раствор, а мышам других тестируемых групп вводили индуктор зуда (50 мкг соединения 48/80, Sigma, США) с помощью иглы 29 калибра. Затем каждую мышь сразу же помещали в клетку для наблюдения, и поведение вследствие зуда наблюдали в условиях без присмотра с помощью записи на 8-миллиметровую видеокамеру (SV-K80, Samsung) в течение 1 часа. Царапание задней ногой области инъекции рассматривалось как поведение вследствие зуда, а царапание других частей не рассматривалось как таковое.
(3) Измерение подавления проницаемости сосудов с помощью молочнокислых бактерий
Известно, что в областях с индуцированным зудом проницаемость сосудов увеличена. Этот эксперимент был проведен для того, чтобы проверить, могли ли молочнокислые бактерии эффективно подавлять проницаемость сосудов, вызванную различными соединениями. В соответствии с тем же способом, как и описанный выше эксперимент для измерения подавляющей зуд активности, лекарственное средство вводили тем же мышам. Затем физиологический солевой раствор инъецировали подкожно в заднюю часть головы мышей из нормальной группы, а индуктор зуда (50 мкг соединения 48/80, Sigma, США) вводили подкожно в заднюю часть головы мышей другой тестируемой группы. Затем в хвостовую вену вводили 0,2 мл 1% раствора синего Эванса (Sigma, США), и через 1 час мышей подвергали эвтаназии. Кожу подкожно инъецированной области иссекали и инкубировали в 1 мл 1 н. КОН при 37°С в течение ночи. На следующий день инкубированную ткань кожи смешивали с 4 мл 0,6 н. смеси фосфорная кислота-ацетон (5:13) и центрифугировали при 3000 об./мин. в течение 15 минут, и супернатант собирали и измеряли поглощение при 620 нм. Подавление (%) проницаемости сосудов рассчитывали с использованием следующего уравнения:
Подавление (%) = {1 - [показатель поглощения области, обработанной лекарственным средством и индуктором зуда, – показатель поглощения области, не обработанной индуктором зуда] / [показатель поглощения области, обработанной индуктором зуда, – показатель поглощения области, не обработанной индуктором зуда]} x 100.
(4) Экспериментальные результаты
В таблице 8 ниже показаны результаты измерения скорости подавления дегрануляции, скорости подавления зуда и скорости подавления капиллярной проницаемости молочнокислыми бактериями. В таблице 8 ниже «CH5» означает Lactobacillus curvatus CH5; «CH11» означает Lactobacillus sakei CH11; «CH15» означает Lactobacillus fermentum CH15; «CH23» означает Lactobacillus brevis CH23; «CH32» означает Lactobacillus johnsonii CH32; «CH38» означает Bifidobacterium pseudocatenulatum CH38; «CH57» означает Bifidobacterium longum CH57; ch57+ch11» означает смесь молочнокислых бактерий, полученную с помощью смешивания Bifidobacterium longum CH57 и Lactobacillus sakei CH11 в одинаковых количествах; «CH57+CH23» означает смесь молочнокислых бактерий, полученную с помощью смешивания Bifidobacterium longum CH57 и Lactobacillus brevis CH23 в одинаковых количествах; и «CH57+CH32» означает смесь молочнокислых бактерий, полученную с помощью смешивания Bifidobacterium longum CH57 и Lactobacillus johnsonii CH32 в одинаковых количествах.
Как представлено в таблице 8 ниже, Lactobacillus curvatus CH5, Lactobacillus brevis CH23, Lactobacillus johnsonii CH32 и Bifidobacterium longum CH57 эффективно подавляли дегрануляцию базофилов, а Bifidobacterium longum CH57 очень сильно подавлял зуд и проницаемость сосудов. В дополнение к этому, по сравнению с этими только молочнокислыми бактериями смесь этих молочнокислых бактерий, в частности смесь Bifidobacterium longum CH57 и Lactobacillus brevis CH23, или смесь Bifidobacterium longum CH57 и Lactobacillus johnsonii CH32 демонстрировали более высокие скорости подавления дегрануляции, скорости подавления зуда и скорости подавления проницаемости сосудов. Таким образом, видно, что эти молочнокислые бактерии или их смеси могут очень эффективно уменьшать тяжесть аллергической атопии, астмы, фарингита, хронического дерматита или т. п.
Таблица 8
5. In vitro оценка противовоспалительного эффекта и эффекта подавления кишечной проницаемости молочнокислых бактерий
(1) Выделение дендритных клеток и измерение маркера воспаления
Иммунные клетки выделяли из костного мозга мышей C57BL/6 (самцы, 20-23 г) с использованием RPMI 1640 (содержащего 10% FBS, 1% антибиотиков, 1% глутамакса, 0,1% меркаптоэтанола). Выделенные клетки обрабатывали буфером для лизиса RBC, промывали, распределяли в каждую лунку 24-луночного планшета, обрабатывали GM-CSF и IL-4 при соотношении 1:1000 и культивировали. Через 5 дней культивирования среду заменяли свежей средой, и через 8 дней клетки собирали и использовали в качестве дендритных клеток. Затем дендритные клетки высевали в 24-луночный планшет с плотностью, составлявшей 0,5 × 106 клеток/лунка, и обрабатывали молочнокислыми бактериями (тестируемое вещество) и индуктором воспаления LPS (липополисахаридом) в течение 2 часов или 24 часов, а затем собирали супернатант и клетки. Используя собранный супернатант, посредством способа иммуноблоттинга измеряли уровни экспрессии IL-10 и IL-12.
На ФИГ. 4 представлен график, демонстрирующий эффект молочнокислых бактерий, подвергнутых скринингу согласно настоящему изобретению, в отношении воспалительной реакции дендритных клеток, индуцированной липополисахаридом (LPS). Левый график на ФИГ. 4 демонстрирует эффект молочнокислых бактерий в отношении клеток, не обработанных LPS (липополисахаридом), а на правом графике показан эффект молочнокислых бактерий в отношении клеток, обработанных LPS (липополисахаридом). В дополнение к этому, на оси х на ФИГ. 4 «Nor» означает группу, не обработанную тестируемыми молочнокислым бактериями и индуктором воспаления LPS (липополисахаридом); «LPS» означает группу, обработанную индуктором воспаления LPS (липополисахаридом); «ch11» означает группу, обработанную Lactobacillus sakei CH11; «ch15» означает группу, обработанную Lactobacillus fermentum CH15; «ch23» означает группу, обработанную Lactobacillus brevis CH23; «ch32» означает группу, обработанную Lactobacillus johnsonii CH32; «ch38» означает группу, обработанную Bifidobacterium pseudocatenulatum CH38; «ch57» означает группу, обработанную Bifidobacterium longum CH57; «ch57+ch11» означает группу, обработанную смесью молочнокислых бактерий, полученной с помощью смешивания Bifidobacterium longum CH57 и Lactobacillus sakei CH11 в одинаковых количествах; «CH57+CH23» означает группу, обработанную смесью молочнокислых бактерий, полученной с помощью смешивания Bifidobacterium longum CH57 и Lactobacillus brevis CH23 в одинаковых количествах; и «CH57+CH32» означает группу, обработанную смесью молочнокислых бактерий, полученной с помощью смешивания Bifidobacterium longum CH57 и Lactobacillus johnsonii CH32 в одинаковых количествах.
Как показано на ФИГ. 4, Lactobacillus sakei CH11, Lactobacillus brevis CH23 и Lactobacillus johnsonii CH32 индуцировали продуцирование IL-10 дендритных клеток, полученных с помощью дифференциации после выделения из костного мозга, эффективно подавляли продуцирование IL-12, индуцированное LPS (липополисахаридом), а также эффекты увеличивались в случае применения в комбинации с Bifidobacterium longum CH57. В частности, смесь Bifidobacterium longum CH57 и Lactobacillus brevis CH23 проявляла наилучший эффект в отношении подавления воспаления. В случае если дендритные клетки являются контролируемыми, клетки Treg (регуляторные Т-клетки) могут эффективно контролироваться. По данной причине молочнокислые бактерии, подвергнутые скринингу в настоящем изобретении, способны эффективно уменьшать тяжесть хронических воспалительных заболеваний, таких как колит, аутоиммунных заболеваний, таких как ревматоидный артрит и т. п.
(2) Выделение макрофагов и измерение маркера воспаления
Мышей C57BL/6J (20-23 г) возрастом 6 недель приобретали у RaonBio Co., Ltd. В брюшную полость каждой мыши вводили 2 мл 4% стерильного тиогликолята, и через 96 часов мышей анестезировали, и 8 мл среды RPMI 1640 вводили в брюшную полость каждой мыши. Через 5-10 минут среду RPMI (в том числе макрофаги) в брюшной полости мышей извлекали, центрифугировали при 1000 об./мин. в течение 10 минут, а затем дважды промывали средой RPMI 1640. Макрофаги высевали в 24-луночный планшет с плотностью, составлявшей 0,5 × 106 клеток/лунка, и обрабатывали тестируемым веществом на основе молочнокислых бактерий и индуктором воспаления LPS (липополисахаридом) в течение 2 часов или 24 часов, а затем собирали супернатант и клетки. Собранные клетки гомогенизировали в буфере (Gibco). Используя собранный супернатант, уровни экспрессии цитокинов, таких как TNF-α и IL-1β, измеряли с помощью набора ELISA. В дополнение к этому, используя собранные клетки, уровни экспрессии p65 (NF-каппа B), p-p65 (фосфор-NF-каппа B) и β-актина измеряли с помощью способа иммуноблоттинга. В частности, отбирали 50 мкг супернатанта и подвергали электрофорезу на 10% (вес/об.) полиакриламидном геле SDS в течение 1 часа и 30 минут. Подвергнутый электрофорезу образец переносили на нитроцеллюлозную мембрану в условиях 100 В и 400 мА в течение 1 часа и 10 минут. Нитроцеллюлозную мембрану с перенесенным образцом блокировали 5% обезжиренным молоком в течение 30 минут, а затем три раза промывали PBS-Tween в течение 5 минут каждый раз и инкубировали с разбавлением 1:100 первичного антитела (Santa Cruz Biotechnology, США) в течение ночи. Затем мембрану промывали три раза в течение 10 минут каждый раз и инкубировали с разбавлением вторичного антитела (Santa Cruz Biotechnology, США) 1:1000 в течение 1 часа и 20 минут. Затем мембрану промывали три раза в течение 15 минут каждый раз, и ее проявляли с помощью флуоресценции и визуализировали.
На ФИГ. 5 представлен график, демонстрирующий эффект Bifidobacterium longum CH57 в отношении воспалительной реакции макрофагов, индуцированной LPS (липополисахаридом). Как показано на ФИГ. 5, Bifidobacterium longum CH57 эффективно подавлял воспалительную реакцию, индуцированную LPS (липополисахаридом).
(3) Выделение Т-клеток из селезенки и измерение дифференциации в клетки Th17 или клетки Treg
У мышей C56BL/6J отделяли селезенку, соответствующим образом измельчали и суспендировали в 10% FCS-содержащей среде RPMI 1640, и из нее выделяли CD4 Т-клетки с использованием набора для выделения CD4 T-клеток (MiltenyiBiotec, Бергиш-Гладбах, Германия). Выделенные CD4 Т-клетки высевали в 12-луночный планшет с плотностью, составлявшей 5 × 105/лунка, и к ним добавляли антитело к CD3 (1 мкг/мл, MiltenyiBiotec, Бергиш-Гладбах, Германия) и антитело к CD28 (1 мкг/мл, MiltenyiBiotec, Бергиш-Гладбах, Германия) или антитело к CD3 (1 мкг/мл, MiltenyiBiotec, Бергиш-Гладбах, Германия), антитело к CD28 (1 мкг/мл, MiltenyiBiotec, Бергиш-Гладбах, Германия), рекомбинантный IL-6 (20 нг/мл, MiltenyiBiotec, Бергиш-Гладбах, Германия) и рекомбинантный трансформирующий фактор роста бета (1 нг/мл, MiltenyiBiotec, Бергиш-Гладбах, Германия). Во время культивирования клеток к ним добавляли 1 x 103 или 1 × 105 КОЕ молочнокислых бактерий, и клетки культивировали в течение 4 суток. Затем клетки культуры окрашивали антителом к FoxP3 или антителом к IL-17A, и распределение клеток Th17 и Treg анализировали с использованием системы FACS (сортировка клеток с активированной флуоресценцией) (система C6 Flow Cytometer®, Сан-Хосе, Калифорния, США).
На ФИГ. 6 показаны результаты анализа эффекта Lactobacillus brevis CH23 в отношении дифференциации Т-клеток (выделенных из селезенки) в клетки Th17 или клетки Treg с помощью системы сортировки клеток с активированной флуоресценцией. Как показано на ФИГ. 6, Lactobacillus brevis CH23 подавлял дифференциацию Т-клеток в клетки Th17 (клетки Т-хелперы 17) и стимулировал дифференциацию Т-клеток в клетки Treg. Эти результаты свидетельствуют о том, что Lactobacillus brevis CH23 способен эффективно уменьшать тяжесть воспалительных заболеваний, таких как колит и артрит.
(4) Измерение эффекта молочнокислых бактерий в отношении экспрессии белка ZO-1 клеток CaCO2
Клетки СаСО2, полученные из Корейского банка клеточных линий, культивировали в среде RPMI 1640 в течение 48 часов, а затем культивированные клетки CaCO2 распределяли в 12-луночный планшет с плотностью, составлявшей 2 × 106 клеток/лунка. Затем каждую лунку обрабатывали 1 мкг LPS (липополисахарида) отдельно или комбинацией 1 мкг LPS (липополисахарида) и 1 × 103 КОЕ или 1 × 105 КОЕ молочнокислых бактерий, а затем инкубировали в течение 24 часов. Затем культивируемые клетки собирали из каждой лунки, и уровень экспрессии белка плотного контакта ZO-1 измеряли с помощью способа иммуноблоттинга.
На ФИГ. 7 показаны результаты анализа эффекта Lactobacillus brevis CH23, Bifidobacterium longum CH57 или их смеси в отношении экспрессии белка ZO-1 клеток СаСО2. На ФИГ. 7 «CH23» означает Lactobacillus brevis CH23; «CH57» означает Bifidobacterium longum CH57; «mix» означает смесь молочнокислых бактерий, полученную с помощью смешивания Bifidobacterium longum CH57 и Lactobacillus johnsonii CH32 в одинаковых количествах. Как показано на ФИГ. 7, обработка с помощью Lactobacillus brevis CH23 и Bifidobacterium longum CH57 увеличивала экспрессию белка плотного контакта ZO-1, а обработка смесью Bifidobacterium longum CH57 и Lactobacillus johnsonii CH32 синергетически увеличивала экспрессию белка плотного контакта ZO-1. В случае если экспрессия белка плотного контакта увеличивается, in vivo проникновение токсичных веществ может быть заблокировано, за счет чего предотвращается прогрессирование колита, артрита и повреждения печени.
6. In vivo оценка противовоспалительного эффекта и эффекта, уменьшающего тяжесть колита, молочнокислых бактерий
(1) Тестируемые животные
Мышей C57BL/6 (24-27 г) возрастом 5 недель приобретали у OrientBio и размещали в контролируемых условиях окружающей среды (влажность: 50±10%, температура: 25±2°C, цикл 12 ч. свет/12 ч. темнота), а затем использовали в эксперименте. В качестве корма использовали стандартный экспериментальный корм (Samyang, Корея), и при этом животные имели доступ к питьевой воде ad libitum. Во всех экспериментах одна группа состояла из 6 животных.
(2) Индуцирование колита с помощью TNBS и введение образца
Одну группу тестируемых животных использовали в качестве нормальной группы, а тестируемых животных других групп обрабатывали 2,4,6-тринитробензолсульфоновой кислотой (TNBS) для индуцирования острого колита. В частности, тестируемых животных слегка анестезировали эфиром, а затем в толстую кишку через анальное отверстие вводили раствор в виде смеси 2,5 г TNBS (2,4,6-тринитробензолсульфоновой кислоты) и 100 мл 50% этанола в количестве по 0,1 мл каждый раз с применением шприца с круглым наконечником объемом 1 мл, поднимали вертикально и выдерживали в течение 30 секунд, за счет чего вызывая воспаление. С другой стороны, нормальной группе вводили перорально 0,1 мл солевого раствора. На следующий день молочнокислые бактерии или смесь молочнокислых бактерий в качестве тестируемого образца суспендировали в солевом растворе и вводили перорально каждой мыши в количестве, составлявшем 2,0 × 109 КОЕ, один раз в сутки в течение трех суток. На следующий день, после окончания введения образца, животных умерщвляли диоксидом углерода, часть толстой кишки в пределах от слепой кишки до участка сразу перед анальным отверстием иссекали и использовали. При этом тестируемым животным нормальной группы перорально вводили только солевой раствор вместо молочнокислых бактерий. Кроме того, тестируемым животным группы отрицательного контроля, после индукции колита с помощью TNBS, перорально вводили только солевой раствор вместо молочнокислых бактерий. Кроме того, тестируемым животным группы положительного контроля перорально вводили вместо молочнокислых бактерий 50 мг/кг сульфасалазина, который представляет собой лекарственное средство для лечения колита.
(3) Макроскопический анализ толстой кишки
Определяли длину и внешний вид иссеченной толстой кишки, и внешний вид анализировали с помощью оценки в соответствии с критериями (Hollenbach et al., 2005, Criteria of Degit of Colitis), показанными в таблице 9 ниже. После полного удаления содержимого толстой кишки ткань толстой кишки промывали солевым раствором. Часть промытой ткани толстой кишки фиксировали 4% раствором формальдегида, чтобы использовать ее в качестве образца патологической ткани, а остаток хранили при замораживании при -80°С для молекулярно-биологического анализа.
Таблица 9
(4) Измерение активности миелопероксидазы (MPO)
Гомогенизировали 100 мг ткани толстой кишки в 200 мкл 10 мМ калий-фосфатного буфера (рН 7,0), содержащего 0,5% гексадецилтриметиламмонийбромида. Гомогенизированную ткань центрифугировали при 10000×g и 4°C в течение 10 минут, и супернатант собирали. Добавляли 50 мкл супернатанта к 0,95 мл реакционного раствора (содержащего 1,6 мМ тетраметилбензидина и 0,1 мМ H2O2), и обеспечивали реакцию при 37°С, и в различные моменты времени во время реакции измеряли оптическую плотность при 650 нм. Для расчета активности миелопероксидазы (MPO) 1 мкмоль/мл пероксида, полученного с помощью реакции, использовали в качестве 1 единицы.
(5) Измерение маркера воспаления
С помощью способа вестерн-блоттинга измеряли маркеры воспаления, такие как p-p65, p65, iNOS, COX-2 и β-актин. В частности, в соответствии с тем же способом, как и при эксперименте для измерения активности миелопероксидазы (MPO), получали супернатант. Отбирали 50 мкг супернатанта и подвергали электрофорезу на 10% (вес/об.) полиакриламидном геле SDS в течение 1 часа и 30 минут. Подвергнутый электрофорезу образец переносили на нитроцеллюлозную мембрану в условиях 100 В и 400 мА в течение 1 часа и 10 минут. Нитроцеллюлозную мембрану с перенесенным образцом блокировали 5% обезжиренным молоком в течение 30 минут, а затем три раза промывали PBS-Tween в течение 5 минут каждый раз и инкубировали с разбавлением 1:100 первичного антитела (Santa Cruz Biotechnology, США) в течение ночи. Затем мембрану промывали три раза в течение 10 минут каждый раз и инкубировали с разбавлением вторичного антитела (Santa Cruz Biotechnology, США) 1:1000 в течение 1 часа и 20 минут. Затем мембрану промывали три раза в течение 15 минут каждый раз, и ее проявляли с помощью флуоресценции и визуализировали.
Кроме того, связанные с воспалением цитокины, такие как TNF-α, IL- 1β и т. п., измеряли с использованием набора ELISA.
(6) Экспериментальные результаты
На ФИГ. 8 показаны физические свойства толстой кишки или активность миелопероксидазы (MPO), показывающие эффект Bifidobacterium longum CH57 в отношении животных моделей с острым колитом, индуцированным TNBS; на ФИГ. 9 изображены гистологические снимки толстой кишки, которые демонстрируют эффект Bifidobacterium longum CH57 в отношении животных моделей с острым колитом, индуцированным TNBS; и на ФИГ. 10 показаны уровни цитокинов, связанных с воспалением, показывающие эффект Bifidobacterium longum CH57 в отношении животных моделей с острым колитом, индуцированным TNBS. На ФИГ. 8-10 «NOR» означает нормальную группу; «TNBS» означает группу отрицательного контроля; «CH57» означает группу, которой вводили Bifidobacterium longum CH57; и «SS50» означает группу, которой вводили сульфасалазин. Как показано на ФИГ. 8-10, Bifidobacterium longum CH57 эффективно уменьшал тяжесть колита с учетом веса животных моделей с TNBS-индуцированным острым колитом, маркеров колита, длины толстой кишки, активности миелопероксидазы (MPO) и т. п., и продемонстрировал улучшенный эффект в отношении уменьшения тяжести колита по сравнению с сульфасалазином. В дополнение к этому Bifidobacterium longum CH57 подавлял продуцирование воспалительного цитокина и увеличивал продуцирование противовоспалительного цитокина IL-10 у животных моделей с TNBS-индуцированным острым колитом.
На ФИГ. 11 показаны физические свойства толстой кишки или активность миелопероксидазы (MPO), показывающие эффект Lactobacillus brevis CH23 в отношении животных моделей с острым колитом, индуцированным TNBS; на ФИГ. 12 изображены гистологические снимки толстой кишки, которые демонстрируют эффект Lactobacillus brevis CH23 в отношении животных моделей с острым колитом, индуцированным TNBS; на ФИГ. 13 показаны диаграммы дифференциации Т-клеток, демонстрирующие эффект Lactobacillus brevis CH23 в отношении животных моделей с острым колитом, индуцированным TNBS; и на ФИГ. 14 показаны уровни цитокинов, связанных с воспалением, показывающие эффект Lactobacillus brevis CH23 в отношении животных моделей с острым колитом, индуцированным TNBS. На ФИГ. 11-14 «N» означает нормальную группу; «TNBS» означает группу отрицательного контроля; «CH23» означает группу, которой вводили Lactobacillus brevis CH23; и «SS» означает группу, которой вводили сульфасалазин. Как показано на ФИГ. 11-14, Lactobacillus brevis CH23 эффективно уменьшал тяжесть колита с учетом веса животных моделей с TNBS-индуцированным острым колит, маркеров колита, длины толстой кишки, активности миелопероксидазы (MPO) и т. п., и продемонстрировал улучшенный эффект в отношении уменьшения тяжести колита по сравнению с сульфасалазином. В дополнение к этому, Lactobacillus brevis CH23 подавлял дифференциации Т-клеток в клетки Th17 и индуцировал дифференциации Т-клеток в клетки Treg у животных моделей с TNBS-индуцированным острым колитом. Кроме того, Lactobacillus brevis CH23 подавлял продуцирование воспалительного цитокина и увеличивал продуцирование противовоспалительного цитокина IL-10 у животных моделей с TNBS-индуцированным острым колитом.
На ФИГ. 15 показаны физические свойства толстой кишки или активность миелопероксидазы (MPO), показывающие эффект смеси Bifidobacterium longum CH57 и Lactobacillus brevis CH23 в отношении животных моделей с острым колитом, индуцированным TNBS; на ФИГ. 16 изображены гистологические снимки, демонстрирующие эффект смеси Bifidobacterium longum CH57 и Lactobacillus brevis CH23 в отношении животных моделей с острым колитом, индуцированным TNBS; и на ФИГ. 17 показаны уровни цитокинов, связанных с воспалением, показывающие эффект смеси Bifidobacterium longum CH57 и Lactobacillus brevis CH23 в отношении животных моделей с острым колитом, индуцированным TNBS. На ФИГ. 15-17 «NOR» означает нормальную группу; «TNBS» означает группу отрицательного контроля; «BL» означает группу, которой вводили смесь молочнокислых бактерий, полученную с помощью смешивания Bifidobacterium longum CH57 и Lactobacillus brevis CH23 в одинаковых количествах; и «SS50» означает группу, которой вводили сульфасалазин. Как показано на ФИГ. 15-17, смесь молочнокислых бактерий Bifidobacterium longum CH57 и Lactobacillus brevis CH23 значительно улучшала эффекты в отношении уменьшенного веса модельных животных с TNBS-индуцированным острым колитом, увеличенных уровней маркера колита, сокращения длины толстой кишки и увеличения активности миелопероксидазы (MPO), и ее эффект в отношении уменьшения тяжести колита был значительно лучше, чем у сульфасалазина. В дополнение к этому, смесь молочнокислых бактерий Bifidobacterium longum CH57 и Lactobacillus brevis CH23 значительно подавляла продуцирование воспалительного цитокина и резко увеличивала продуцирование противовоспалительного цитокина IL-10 у животных моделей с TNBS-индуцированным острым колитом.
7. In vivo оценка эффекта, снижающего ожирение, и противовоспалительного эффекта молочнокислых бактерий
(1) Экспериментальный способ
В общей сложности 24 мыши C57BL6/J приобретали у RaonBio Co., Ltd. и адаптировали к кормовому рациону (Purina) в условиях температуры 20±2°C, влажности 50±10% и цикла 12 ч. свет/12 ч. темнота в течение 1 недели. Затем тестируемых животных разделяли на три группы (LFD, HFD и HFD+BL), каждая из которых состояла из 8 животных, при этом группу LFD кормили нормальным рационом (LFD, 10% калорий, полученных из жиров, Research, Нью-Джерси, США) в течение 4 недель, а группу HFD и группу HFD+BL кормили рационом с высоким содержанием жиров (HFD, 60% калорий, полученных из жиров, Research, Нью-Джерси, США) в течение 4 недель. Затем группе LFD вводили перорально PBS, и кормили обычным рационом в течение 4 недель. Кроме того, группе HFD вводили перорально PBS, и кормили рационом с высоким содержанием жиров в течение 4 недель. В дополнение к этому группе HFD+BL вводили перорально суспензию PBS из 2 × 109 КОЕ смеси молочнокислых бактерий, пока кормили рационом с высоким содержанием жиров в течение 4 недель. Смесь молочнокислых бактерий получали смешиванием Bifidobacterium longum CH57 и Lactobacillus brevis CH23 в одинаковых количествах.
(2) Анализ эффекта в отношении ожирения и противовоспалительного эффекта смеси молочнокислых бактерий
Эффект в отношении ожирения смеси молочнокислых бактерий анализировали с помощью изменения веса. В дополнение к этому, противовоспалительный эффект смеси молочнокислых бактерий анализировали с использованием того же способа, что и в эксперименте на животных моделях с TNBS-индуцированным острым колитом.
(3) Экспериментальные результаты
На ФИГ. 18 показаны изменения веса, показывающие эффект смеси Bifidobacterium longum CH57 и Lactobacillus brevis CH23 в отношении животных моделей с индуцированным ожирением; на ФИГ. 19 показаны физические свойства толстой кишки, активность миелопероксидазы (MPO), гистологические снимки толстой кишки и т. п., которые показывают эффект смеси Bifidobacterium longum CH57 и Lactobacillus brevis CH23 в отношении животных моделей с индуцированным ожирением; на ФИГ. 20 показаны уровни цитокинов, связанных с воспалением, показывающие эффект смеси Bifidobacterium longum CH57 и Lactobacillus brevis CH23 в отношении животных моделей с индуцированным ожирением; и на ФИГ. 21 показаны маркеры воспалительной реакции, показывающие эффект смеси Bifidobacterium longum CH57 и Lactobacillus brevis CH23 в отношении животных моделей с индуцированным ожирением. Как показано на ФИГ. 18-21, смесь молочнокислых бактерий Bifidobacterium longum CH57 и Lactobacillus brevis CH23 значительно уменьшала увеличенный вес, повышала уровни маркера колита и увеличивала активность миелопероксидазы (MPO) у животных моделей с ожирением, индуцированным рационом с высоким содержанием жиров, а также подавляла развитие колита. В дополнение к этому, смесь молочнокислых бактерий Bifidobacterium longum CH57 и Lactobacillus brevis CH23 значительно подавляла продуцирование воспалительного цитокина и увеличивала продуцирование противовоспалительного цитокина IL-10 у животных моделей с ожирением, индуцированным рационом с высоким содержанием жиров.
II. I. Второй эксперимент по скринингу молочнокислых бактерий и оценки их эффектов
1. Выделение и идентификация молочнокислых бактерий
(1) Выделение молочнокислых бактерий из кимчи
Каждый из кимчи с китайской капустой, кимчи с редиской и кимчи с зеленым луком измельчали, и измельченную жидкость суспендировали в жидкой среде MRS (бульон MRS, Difco, США). Затем супернатант собирали, переносили в агаровую среду MRS (Difco, США) и культивировали анаэробно при 37°С в течение приблизительно 48 часов, а затем штаммы Bifidobacterium longum, которые образовывали колонии, разделяли в соответствии с формой.
(2) Выделение молочнокислых бактерий из человеческих экскрементов
Человеческие экскременты суспендировали в жидкой среде GAM (бульон GAM; Nissui Pharmaceutical, Япония). Затем супернатант собирали, переносили в агаровую среду BL (Nissui Pharmaceutical, Япония) и культивировали анаэробно при 37°С в течение приблизительно 48 часов, а затем выделяли штаммы Bifidobacterium sp., которые образовывали колонии.
(3) Идентификация подвергнутых скринингу молочнокислых бактерий
Анализировали характеристики окрашивания по Грамму, физиологические характеристики и последовательности 16S rDNA штаммов, выделенных из кимчи или человеческих фекалий, с целью идентификации видов штаммов, и штаммам присваивали названия. В таблице 10 ниже приведены контрольные номера и названия штаммов молочнокислых бактерий, выделенных из кимчи с китайской капустой, кимчи с редиской и кимчи с зеленым луком, а в таблице 11 ниже приведены контрольные номера и названия штаммов молочнокислых бактерий, выделенных из человеческих экскрементов.
Таблица 10
Таблица 11
Было показано, что Lactobacillus plantarum LC5, представленная в таблице 10 выше, представляла собой грамположительную анаэробную бациллу, и ее 16S rDNA имела нуклеотидную последовательность под SEQ ID NO: 4. Нуклеотидную последовательность 16S rDNA Lactobacillus plantarum LC5 идентифицировали с помощью BLAST в Gene Bank (http://www.ncbi.nlm.nih.gov/), и в результате штамм Lactobacillus plantarum, имеющий такую же нуклеотидную последовательность 16S rDNA, как и у Lactobacillus plantarum LC5, обнаружен не был, и Lactobacillus plantarum LC5 продемонстрировал 99% гомологию с последовательностью 16S rDNA штамма Lactobacillus plantarum KF9. Кроме того, было показано, что Lactobacillus plantarum LC27, представленная в таблице 10 выше, представляла собой грамположительную анаэробную бациллу, и ее 16S rDNA имела нуклеотидную последовательность под SEQ ID NO: 5. Нуклеотидную последовательность 16S rDNA Lactobacillus plantarum LC27 идентифицировали с помощью BLAST в Gene Bank (http://www.ncbi.nlm.nih.gov/), и в результате штамм Lactobacillus plantarum, имеющий такую же нуклеотидную последовательность 16S rDNA, как и у Lactobacillus plantarum LC27, обнаружен не был, и Lactobacillus plantarum LC27 продемонстрировал 99% гомологию с последовательностью 16S rDNA штамма Lactobacillus plantarum JL18. В дополнение к этому было показано, что Lactobacillus plantarum LC28, представленная в таблице 10 выше, представляла собой грамположительную анаэробную бациллу, и ее 16S rDNA имела нуклеотидную последовательность под SEQ ID NO: 6. Нуклеотидную последовательность 16S rDNA Lactobacillus plantarum LC28 идентифицировали с помощью BLAST в Gene Bank (http://www.ncbi.nlm.nih.gov/), и в результате штамм Lactobacillus plantarum, имеющий такую же нуклеотидную последовательность 16S rDNA, как и у Lactobacillus plantarum LC28, обнаружен не был, и Lactobacillus plantarum LC28 продемонстрировал 99% гомологию с последовательностью 16S rDNA штамма Lactobacillus plantarum USIM01.
Было показано, что Bifidobacterium longum LC67, представленная в таблице 11 выше, представляла собой грамположительную анаэробную бациллу, и ее 16S rDNA имела нуклеотидную последовательность под SEQ ID NO: 7. Нуклеотидную последовательность 16S rDNA Bifidobacterium longum LC67 идентифицировали с помощью BLAST в Gene Bank (http://www.ncbi.nlm.nih.gov/), и в результате штамм Bifidobacterium longum, имеющий такую же нуклеотидную последовательность 16S rDNA, как и у Bifidobacterium longum LC67, обнаружен не был, и Bifidobacterium longum LC67 продемонстрировал 99% гомологию с последовательностью 16S rDNA штамма Bifidobacterium longum CBT-6. Кроме того, было показано, что Bifidobacterium longum LC68, представленная в таблице 11 выше, представляла собой грамположительную анаэробную бациллу, и ее 16S rDNA имела нуклеотидную последовательность под SEQ ID NO: 8. Нуклеотидную последовательность 16S rDNA Bifidobacterium longum LC68 идентифицировали с помощью BLAST в Gene Bank (http://www.ncbi.nlm.nih.gov/), и в результате штамм Bifidobacterium longum, имеющий такую же нуклеотидную последовательность 16S rDNA, как и у Bifidobacterium longum LC68, обнаружен не был, и Bifidobacterium longum LC68 продемонстрировал 99% гомологию с последовательностью 16S rDNA штамма Bifidobacterium longum IMAUFB067.
В дополнение к этому, среди физиологических характеристик Lactobacillus plantarum LC5, Lactobacillus plantarum LC27 и Bifidobacterium longum LC67 и Bifidobacterium longum LC68 анализировали коэффициент использования источника углерода с использованием ферментации сахара с помощью набора API (модель API 50 CHL, производства BioMerieux, США). В таблице 12 ниже приведены результаты анализа коэффициента использования источника углерода Lactobacillus plantarum Lactobacillus plantarum LC5 и Lactobacillus plantarum LC27, а в таблице 13 приведены результаты анализа коэффициента использования источника углерода Bifidobacterium longum LC67 и Bifidobacterium longum LC68. В таблицах 12 и 13 ниже «+» означает случай, когда коэффициент использования источника углерода являлся положительным; «-» означает случай, когда коэффициент использования источника углерода являлся отрицательным; и «±» означает случай, когда коэффициент использования источника углерода допускал двоякое толкование. Как приведено в таблицах 12 и 13 ниже, Lactobacillus plantarum LC5, Lactobacillus plantarum LC27, Bifidobacterium longum LC67 и Bifidobacterium longum LC68 продемонстрировали, что коэффициент использования источника углерода отличался от коэффициента использования известных штаммов того же вида по отношению к некоторым источникам углерода.
Таблица 12
Таблица 13
(4) Информация о депонировании молочнокислых бактерий
Авторы настоящего изобретения депонировали Lactobacillus plantarum LC5 в Корейском центре культур микроорганизмов (адрес Yurim Building, 45, Hongjenae 2ga-gil, Seodaemun-gu, Сеул, Корея), Международном органе по депонированию, 11 января 2016 г. под номером доступа KCCM 11800P. Кроме того, авторы настоящего изобретения депонировали Lactobacillus plantarum LC27 в Корейском центре культур микроорганизмов (адрес Yurim Building, 45, Hongjenae 2ga-gil, Seodaemun-gu, Сеул, Корея), Международном органе по депонированию, 11 января 2016 г. под номером доступа KCCM 11801P. Кроме того, авторы настоящего изобретения депонировали Bifidobacterium longum LC67 в Корейском центре культур микроорганизмов (адрес Yurim Building, 45, Hongjenae 2ga-gil, Seodaemun-gu, Сеул, Корея), Международном органе по депонированию, 11 января 2016 г. под номером доступа KCCM 11802P.
2. Оценка эффекта молочнокислых бактерий в отношении уменьшения тяжести повреждения кишечника или кишечной проницаемости
Чтобы оценить эффект молочнокислых бактерий, выделенных из кимчи или человеческих экскрементов, в отношении уменьшения тяжести повреждения кишечника или кишечной проницаемости, у молочнокислых бактерий измеряли антиоксидантную активность, активность, подавляющую продуцирование липополисахаридов (LPS), активность, подавляющую β-глюкуронидазу (вредный кишечный фермент), и активность, индуцирующую экспрессию белка плотного контакта.
(1) Экспериментальные способы
* Антиоксидантная активность
Для получения раствора DPPH растворяли в этаноле DPPH (2,2-дифенил-1-пикрилгидразил) до концентрации 0,2 мМ. Суспензию молочнокислых бактерий (1 × 108 КОЕ/мл) или раствор витамина С (1 г/мл) добавляли к 0,1 мл раствора DPPH и культивировали при 37°С в течение 20 минут. Культуру центрифугировали при 3000 об./мин. в течение 5 минут, и супернатант собирали. Затем измеряли поглощение супернатанта при 517 нм, и рассчитывали антиоксидантную активность молочнокислых бактерий.
* Активность, подавляющая продуцирование липополисахаридов (LPS)
В 0,9 мл стерильного физиологического солевого раствора суспендировали 0,1 г свежих экскрементов человека и разбавляли в 100 раз общей анаэробной средой для получения фекальной суспензии. К 9,8 мл стерильной анаэробной среды (Nissui Pharmaceuticals, Япония) добавляли 0,1 мл фекальной суспензии и 0,1 мл молочнокислых бактерий (1 × 104 или 1 × 105 КОЕ) и культивировали анаэробно в течение 24 часов. Затем культуру обрабатывали ультразвуком в течение приблизительно 1 часа для разрушения наружной клеточной мембраны бактерий, и центрифугировали при 5000×g, и собирали супернатант. Затем с помощью набора LAL для анализа (Limulus Amoebocyte Lysate) (производства Cape Cod Inc., США) измеряли содержание LPS (липополисахарида) (который является типичным эндотоксином) в супернатанте. В дополнение к этому, чтобы оценить активность подавления пролиферации E. coli молочнокислых бактерий, культуру, полученную в том же эксперименте, как описано выше, разбавляли в 1000 раз и в 100000 раз и культивировали в среде DHL, а затем подсчитывали количество клеток E.coli.
*Активность, подавляющая β-глюкуронидазу
В реактор помещали 0,1 мл 0,1 мМ раствора п-нитрофенил-β-D-глюкуронида, 0,2 мл 50 мМ фосфатно-солевого буферного раствора, и 0,1 мл суспензии молочнокислых бактерий (полученной суспендированием культуры молочнокислых бактерий в 5 мл физиологического солевого раствора), и подвергали ферментативной реакции β-глюкуронидазы, и для прекращения реакции добавляли 0,5 мл 0,1 мМ раствора NaOH. Затем реакционный раствор центрифугировали при 3000 об./мин. в течение 5 минут, и супернатант собирали. Затем измеряли поглощение супернатанта при 405 нм.
* Активность, индуцирующая экспрессию белка плотного контакта
Клетки СаСО2, полученные из Корейского банка клеточных линий, культивировали в среде RPMI 1640 в течение 48 часов, а затем культивированные клетки CaCO2 распределяли в каждую лунку 12-луночного планшета с плотностью, составлявшей 2 × 106 клеток/лунка. Затем каждую лунку обрабатывали 1 мкг LPS (липополисахарида) или комбинацией 1 мкг LPS (липополисахарида) и 1 × 103 КОЕ молочнокислых бактерий и инкубировали в течение 24 часов. Затем культивируемые клетки собирали из каждой лунки, и уровень экспрессии белка плотного контакта ZO-1 в клетках измеряли с помощью способа иммуноблоттинга.
(2) Экспериментальные результаты
Измеряли антиоксидантную активность, активность, подавляющую продуцирование липополисахаридов (LPS), активность, подавляющую β-глюкуронидазу, и активность, индуцирующую экспрессию белка плотного контакта у молочнокислых бактерий, выделенных из кимчи или человеческих экскрементов, и результаты измерения показаны в таблицах 14-16 ниже. Как представлено в таблицах 14-16 ниже, Lactobacillus plantarum LC5, Lactobacillus plantarum LC15, Lactobacillus plantarum LC17, Lactobacillus plantarum LC25, Lactobacillus plantarum LC27, Lactobacillus plantarum LC28, Bifidobacterium longum LC55, Bifidobacterium longum LC65, Bifidobacterium longum LC67 и Bifidobacterium longum LC68 характеризовались превосходной антиоксидантной активностью, сильно подавляющей продуцирование липополисахаридов (LPS) и β-глюкуронидазы, и сильно индуцирующей экспрессию белка плотного контакта. В частности, Bifidobacterium longum LC67 продемонстрировали самую лучшую активность, индуцирующую экспрессию белка плотного контакта. Эти молочнокислые бактерии характеризуются превосходным антиоксидантным эффектом, характеризуются превосходным эффектом подавления ферментативной активности вредных бактерий кишечной флоры, связанных с воспалением и канцерогенезом, подавляют продуцирование эндотоксина LPS (липополисахарида), продуцируемого вредными бактериями кишечной флоры, и индуцируют экспрессию белка плотного контакта. Таким образом, эти молочнокислые бактерии способны облегчить синдром кишечной проницаемости.
Таблица 14
Таблица 15
Таблица 16
* Конечная концентрация молочнокислых бактерий при измерении антиоксидантной активности: 1 × 104 КОЕ/мл; концентрация молочнокислых бактерий, добавленных для измерения активности, подавляющей бета-глюкуронидазу, и активности, подавляющей продуцирование липополисахаридов (LPS): 1 × 104 КОЕ/мл; концентрация молочнокислых бактерий при измерении активности, индуцирующей экспрессию белка плотного контакта: 1 × 104 КОЕ/мл.
* Критерии для измерения различных активностей молочнокислых бактерий: очень сильно (+++; >90%); сильно (++; >60-90%); слабо (+; >20-60%); не менее или менее 20% (-; <20%).
3. Оценка эффекта молочнокислых бактерий в отношении уменьшения тяжести повреждения печени
Исходя из оценки эффекта молочнокислых бактерий в отношении уменьшения тяжести повреждения кишечника или синдрома кишечной проницаемости, были выбраны следующие десять штаммов: Lactobacillus plantarum LC5, Lactobacillus plantarum LC15, Lactobacillus plantarum LC17, Lactobacillus plantarum LC25 Lactobacillus plantarum LC27, Lactobacillus plantarum LC28, Bifidobacterium longum LC55, Bifidobacterium longum LC65, Bifidobacterium longum LC67 и Bifidobacterium longum LC68. Эффект каждого из этих выбранных штаммов молочнокислых бактерий или смеси этих штаммов в отношении уменьшения тяжести повреждения печени оценивали с использованием животных моделей с повреждением печени, индуцированным трет-бутилпероксидом.
1) Экспериментальный способ
Мышей (C57BL/6, самцы) разделяли на несколько групп, каждая из которых состояла из 6 животных. Трет-бутилпероксид вводили внутрибрюшинно тестируемым животным из групп, отличных от нормальной группы, в дозе, составлявшей 2,5 ммоль/кг, для индуцирования повреждения печени. Через 2 часа после введения трет-бутилпероксида вводили перорально 2 × 109 КОЕ молочнокислых бактерий тестируемым животным из групп, отличных от нормальной группы и группы отрицательного контроля, один раз в сутки в течение 3 суток. В дополнение к этому, вместо молочнокислых бактерий тестируемым животным группы положительного контроля перорально вводили силимарин в дозе, составлявшей 100 мг/кг, один раз в сутки в течение 3 суток. Через 6 часов после последнего введения лекарственного средства отбирали кровь из сердца. Отобранный образец крови оставляли отстаиваться при комнатной температуре в течение 60 минут и центрифугировали при 3000 об./мин. в течение 15 минут для отделения сыворотки. Уровни GPT (глутаминпируваттрансаминазы) и GOT (глутаматоксалацетаттрансаминазы) в отделенной сыворотке измеряли с использованием набора для анализа крови (набор для измерения ALT & AST, Asan Pharm. Co., Корея). В дополнение к этому, 1 г ткани печени иссекали из каждого испытуемого животного, добавляли к солевому раствору и гомогенизировали с использованием гомогенизатора, и супернатант анализировали с помощью набора ELISA для измерения уровня TNF-α.
(2) Экспериментальные результаты
В таблице 17 ниже представлены изменения значений GOT, GPT и TNF-α, в случае если молочнокислые бактерии вводили животным моделям с повреждением печени, индуцированным трет-бутилпероксидом. Как представлено в таблице 17 ниже, Lactobacillus plantarum LC5, Lactobacillus plantarum LC27, Lactobacillus plantarum LC28, Bifidobacterium longum LC67 и Bifidobacterium longum LC68 продемонстрировали превосходные эффекты в отношении уменьшения тяжести повреждения печени по сравнению с силимарином, и смеси этих молочнокислых бактерий продемонстрировали лучшие эффекты в отношении уменьшения тяжести повреждения печени.
Таблица 17
В таблице 17 выше «LC5» означает Lactobacillus plantarum LC5; «LC15» означает Lactobacillus plantarum LC15; «LC17» означает Lactobacillus plantarum LC17; «LC25» означает Lactobacillus plantarum LC25; «LC27» означает Lactobacillus plantarum LC27; «LC28» означает Lactobacillus plantarum LC28; «LC55» означает Bifidobacterium longum LC55; «LC65» означает Bifidobacterium longum LC65; «LC67» означает Bifidobacterium longum LC67; «LC68» означает Bifidobacterium longum LC68; «LC5+LC67» означает смесь молочнокислых бактерий, полученную с помощью смешивания Lactobacillus plantarum LC5 и Bifidobacterium longum LC67 в одинаковых количествах; «LC5+LC68» означает смесь молочнокислых бактерий, полученную с помощью смешивания Lactobacillus plantarum LC5 и Bifidobacterium longum LC68 в одинаковых количествах; «LC27+LC67» означает смесь молочнокислых бактерий, полученную с помощью смешивания Lactobacillus plantarum LC27 и Bifidobacterium longum LC67 в одинаковых количествах; «LC27+LC68» означает смесь молочнокислых бактерий, полученную с помощью смешивания Lactobacillus plantarum LC27 и Bifidobacterium longum LC68 в одинаковых количествах; и «LC28+LC67» означает смесь молочнокислых бактерий, полученную с помощью смешивания Lactobacillus plantarum LC28 и Bifidobacterium longum LC67 в одинаковых количествах. В следующих таблицах, представляющих экспериментальные результаты, одни и те же символы используются для одиночных молочнокислых бактерий или смесей молочнокислых бактерий.
4. Оценка эффекта молочнокислых бактерий в отношении уменьшения тяжести аллергии
(1) Измерение подавления дегрануляции с помощью молочнокислых бактерий
Клеточную линию RBL-2H3 (клеточная линия тучных клеток крысы, Корейский банк клеточных линий, № по кат. 22256) культивировали с DMEM (модифицированная по способу Дульбекко среда Игла, Sigma, 22256), содержащей 10% FBS (фетальная бычья сыворотка) и L-глютамин в увлажненном 5% CO2-инкубаторе при 37°С. Клетки, содержащиеся в культуральной среде, флотировали с использованием раствора трипсина-EDTA, и всплывающие клетки выделяли, собирали и использовали в эксперименте. Собранные клетки RBL-2H3 распределяли в 24-луночный планшет с плотностью 5 × 105 клеток/лунка и сенсибилизировали с помощью инкубирования с 0,5 мкг/мл моноклонального IgE мыши в течение 12 часов. Сенсибилизированные клетки промывали 0,5 мл сираганового буфера (119 мМ NaCl, 5 мМ KCl, 0,4 мМ MgCl2, 25 мМ PIPES, 40 мМ NaOH, pH 7,2), а затем инкубировали с 0,16 мл сираганового буфера (дополненного 5,6 мМ глюкозы, 1 мМ CaCl2, 0,1% BSA) при 37°С в течение 10 минут. Затем к клеточной культуре в качестве тестируемого лекарственного средства добавляли молочнокислые бактерии до концентрации, составлявшей 1 × 104 КОЕ/мл, или к клеточной культуре в качестве контрольного лекарственного средства добавляли 0,04 мл DSCG (динатрия кромогликат), и через 20 минут клетки активировали с помощью 0,02 мл антигена (1 мкг/мл DNP-BSA) при 37°С в течение 10 минут. Затем клеточную культуру центрифугировали при 2000 об./мин. в течение 10 минут, и супернатант собирали. Переносили в 96-луночный планшет 0,025 мл собранного супернатанта и затем 0,025 мл 1 мМ п-NAG (раствор п-нитрофенил-N-ацетил-β-D-глюкозамида в 0,1 М цитратном буфере, рН 4,5), а затем обеспечивали реакцию смеси при 37°С в течение 60 минут. Затем реакцию останавливали с помощью добавления 0,2 мл 0,1 М Na2CO3/NaHCO3, и показатель поглощения при 405 нм измеряли с помощью анализатора ELISA.
(2) Экспериментальные результаты
В таблице 18 ниже представлены результаты измерения подавления (%) дегрануляции молочнокислыми бактериями. Как представлено в таблице 18, Lactobacillus plantarum LC5, Lactobacillus plantarum LC27, Lactobacillus plantarum LC28, Bifidobacterium longum LC67, Bifidobacterium longum LC68 и их смеси эффективно подавляют дегрануляцию базофилов. Таким образом, эти молочнокислые бактерии или их смеси могут очень эффективно уменьшать тяжесть аллергической атопии, астмы, фарингита, хронического дерматита или т. п.
Таблица 18
5. In vivo оценка противовоспалительного и иммунорегулирующего эффектов молочнокислых бактерий
(1) Выделение макрофагов и измерение маркера воспаления
Мышей C57BL/6J (20-23 г) возрастом 6 недель приобретали у RaonBio Co., Ltd. В брюшную полость каждой мыши вводили 2 мл 4% стерильного тиогликолята, через 96 часов мышей анестезировали, и 8 мл среды RPMI 1640 вводили в брюшную полость каждой мыши. Через 5-10 минут среду RPMI (в том числе макрофаги) в брюшной полости мышей извлекали, центрифугировали при 1000 об./мин. в течение 10 минут, а затем дважды промывали средой RPMI 1640. Макрофаги высевали в 24-луночный планшет с плотностью, составлявшей 0,5 × 106 клеток/лунка, и обрабатывали тестируемым веществом на основе молочнокислых бактерий и индуктором воспаления LPS (липополисахаридом) в течение 2 часов или 24 часов, а затем собирали супернатант и клетки. В данном случае молочнокислые бактерии использовали при концентрации, составляющей 1 × 104 КОЕ/мл, для обработки клеток. Собранные клетки гомогенизировали в буфере (Gibco). Используя собранный супернатант, уровни экспрессии цитокинов, таких как TNF-α, измеряли с помощью набора ELISA. В дополнение к этому, используя собранные клетки, уровни экспрессии p65 (NF-каппа B), p-p65 (фосфор-NF-каппа B) и β-актина измеряли с помощью способа иммуноблоттинга. В частности, отбирали 50 мкг супернатанта и подвергали электрофорезу на 10% (вес/об.) полиакриламидном геле SDS в течение 1 часа и 30 минут. Подвергнутый электрофорезу образец переносили на нитроцеллюлозную мембрану в условиях 100 В и 400 мА в течение 1 часа и 10 минут. Нитроцеллюлозную мембрану с перенесенным образцом блокировали 5% обезжиренным молоком в течение 30 минут, а затем три раза промывали PBS-Tween в течение 5 минут каждый раз и инкубировали с разбавлением 1:100 первичного антитела (Santa Cruz Biotechnology, США) в течение ночи. Затем мембрану промывали три раза в течение 10 минут каждый раз и инкубировали с разбавлением вторичного антитела (Santa Cruz Biotechnology, США) 1:1000 в течение 1 часа и 20 минут. Затем мембрану промывали три раза в течение 15 минут каждый раз, и ее проявляли с помощью флуоресценции и визуализировали. Измеряли интенсивность проявленной полосы, а затем ингибирование (%) рассчитывали с использованием следующего уравнения. В следующем уравнении нормальная группа означает группу, в которой макрофаги обрабатывали только солевым раствором; группа, обработанная LPS, означает группу, в которой макрофаги обрабатывали с помощью только LPS; и группа, обработанная молочнокислыми бактериями, означает группу, в которой макрофаги обрабатывали как молочнокислыми бактериями, так и LPS.
Ингибирование (%) = (уровень экспрессии в группе, обработанной LPS, – уровень экспрессии в группе, обработанной молочнокислыми бактериями) / (уровень экспрессии в группе, обработанной LPS, – уровень экспрессии в нормальной группе) x 100
В таблице 19 ниже представлено ингибирование активации NF-каппа В и ингибирование экспрессии TNF-α в случае если макрофагов с воспалением, индуцированным LPS (липополисахаридом), обрабатывали молочнокислыми бактериями. Как представлено в таблице 19 ниже, Lactobacillus plantarum LC5, Lactobacillus plantarum LC27, Lactobacillus plantarum LC28, Bifidobacterium longum LC67, Bifidobacterium longum LC68 и их смеси эффективно подавляют воспаление, индуцированное LPS (липополисахаридом).
Таблица 19
(2) Выделение Т-клеток из селезенки и измерение дифференциации в клетки Th17 или клетки Treg
У мышей C56BL/6J отделяли селезенку, соответствующим образом измельчали и суспендировали в 10% FCS-содержащей среде RPMI 1640, и из нее выделяли CD4 Т-клетки с использованием набора для выделения CD4 Т-клеток (MiltenyiBiotec, Бергиш-Гладбах, Германия). Выделенные CD4 Т-клетки высевали в 12-луночный планшет с плотностью, составлявшей 5 × 105/лунка, и к ним добавляли антитело к CD3 (1 мкг/мл, MiltenyiBiotec, Бергиш-Гладбах, Германия) и антитело к CD28 (1 мкг/мл, MiltenyiBiotec, Бергиш-Гладбах, Германия) или антитело к CD3 (1 мкг/мл, MiltenyiBiotec, Бергиш-Гладбах, Германия), антитело к CD28 (1 мкг/мл, MiltenyiBiotec, Бергиш-Гладбах, Германия), рекомбинантный IL-6 (20 нг/мл, MiltenyiBiotec, Бергиш-Гладбах, Германия) и рекомбинантный трансформирующий фактор роста бета (1 нг/мл, MiltenyiBiotec, Бергиш-Гладбах, Германия). Во время культивирования клеток к ним добавляли 1 x 103 или 1 × 105 КОЕ молочнокислых бактерий, и клетки культивировали в течение 4 суток. Затем клетки культуры окрашивали антителом к FoxP3 или антителом к IL-17A, и распределение клеток Th17 и клеток Treg анализировали с использованием системы FACS (сортировка клеток с активированной флуоресценцией) (система C6 Flow Cytometer®, Сан-Хосе, Калифорния, США).
В таблице 20 ниже представлен уровень дифференциации Т-клеток (выделенных из селезенки) в клетки Th17 в случае если Т-клетки были обработаны антителом к CD3, антителом к CD28, IL-6 и TGF-β, а в таблице 21 ниже представлен уровень дифференциации Т-клеток (выделенных из селезенки) в клетки Treg в случае если Т-клетки обрабатывали антителом к CD3 и антителом к CD28. Как представлено в таблицах 20 и 21 ниже, Lactobacillus plantarum LC5, Lactobacillus plantarum LC27, Lactobacillus plantarum LC28, Bifidobacterium longum LC67, Bifidobacterium longum LC68 и их смеси подавляли дифференциацию Т-клеток в клетки Th17 (клетки Т-хелперы 17) и стимулировали дифференциацию Т-клеток в клетки Treg. Эти результаты свидетельствуют о том, что молочнокислые бактерии или их смеси способны эффективно уменьшать тяжесть воспалительных заболеваний, таких как колит или артрит.
Таблица 20
Таблица 21
6. In vivo оценка противовоспалительного эффекта и эффекта, уменьшающего тяжесть колита, молочнокислых бактерий
(1) Тестируемые животные
Мышей C57BL/6 (24-27 г) возрастом 5 недель приобретали у OrientBio и размещали в контролируемых условиях окружающей среды (влажность: 50±10%, температура: 25±2°C, цикл 12 ч. свет/12 ч. темнота), а затем использовали в эксперименте. В качестве корма использовали стандартный экспериментальный корм (Samyang, Корея), и при этом животные имели доступ к питьевой воде ad libitum. Во всех экспериментах одна группа состояла из 6 животных.
(2) Индуцирование колита с помощью TNBS и введение образца
Одну группу тестируемых животных использовали в качестве нормальной группы, а тестируемых животных других групп обрабатывали 2,4,6-тринитробензолсульфоновой кислотой (TNBS) для индуцирования острого колита. В частности, тестируемых животных слегка анестезировали эфиром, а затем в толстую кишку через анальное отверстие вводили раствор в виде смеси 2,5 г TNBS (2,4,6-тринитробензолсульфоновой кислоты) и 100 мл 50% этанола в количестве по 0,1 мл каждый раз с применением шприца с круглым наконечником объемом 1 мл, поднимали вертикально и выдерживали в течение 30 секунд, за счет чего вызывая воспаление. С другой стороны, нормальной группе вводили перорально 0,1 мл солевого раствора. На следующий день молочнокислые бактерии или смесь молочнокислых бактерий в качестве тестируемого образца суспендировали в солевом растворе и вводили перорально каждой мыши в количестве, составлявшем 2,0 × 109 КОЕ, один раз в сутки в течение трех суток. На следующий день, после окончания введения образца, животных умерщвляли диоксидом углерода, часть толстой кишки в пределах от слепой кишки до участка сразу перед анальным отверстием иссекали и использовали. При этом тестируемым животным нормальной группы перорально вводили только солевой раствор вместо молочнокислых бактерий. Кроме того, тестируемым животным группы отрицательного контроля, после индукции колита с помощью TNBS, перорально вводили только солевой раствор вместо молочнокислых бактерий. Кроме того, тестируемым животным группы положительного контроля перорально вводили вместо молочнокислых бактерий 50 мг/кг сульфасалазина, который представляет собой лекарственное средство для лечения колита.
(3) Макроскопический анализ толстой кишки
Определяли длину и внешний вид иссеченной толстой кишки, и внешний вид анализировали с помощью оценки в соответствии с критериями (Hollenbach et al., 2005, Criteria of Degit of Colitis), показанными в таблице 22 ниже. После полного удаления содержимого толстой кишки ткань толстой кишки промывали солевым раствором. Часть промытой ткани толстой кишки фиксировали 4% раствором формальдегида, чтобы использовать ее в качестве образца патологической ткани, а остаток хранили при замораживании при -80°С для молекулярно-биологического анализа.
Таблица 22
(4) Измерение активности миелопероксидазы (MPO)
Гомогенизировали 100 мг ткани толстой кишки в 200 мкл 10 мМ калий-фосфатного буфера (рН 7,0), содержащего 0,5% гексадецилтриметиламмонийбромида. Гомогенизированную ткань центрифугировали при 10000×g и 4°C в течение 10 минут, и супернатант собирали. Добавляли 50 мкл супернатанта к 0,95 мл реакционного раствора (содержащего 1,6 мМ тетраметилбензидина и 0,1 мМ H2O2), и обеспечивали реакцию при 37°С, и в различные моменты времени во время реакции измеряли оптическую плотность при 650 нм. Для расчета активности миелопероксидазы (MPO) 1 мкмоль/мл пероксида, полученного с помощью реакции, использовали в качестве 1 единицы.
(5) Измерение маркера воспаления
С помощью способа вестерн-блоттинга измеряли маркеры воспаления, такие как p-p65, p65, iNOS, COX-2 и β-актин. В частности, в соответствии с тем же способом, как и при эксперименте для измерения активности миелопероксидазы (MPO), получали супернатант. Отбирали 50 мкг супернатанта и подвергали электрофорезу на 10% (вес/об.) полиакриламидном геле SDS в течение 1 часа и 30 минут. Подвергнутый электрофорезу образец переносили на нитроцеллюлозную мембрану в условиях 100 В и 400 мА в течение 1 часа и 10 минут. Нитроцеллюлозную мембрану с перенесенным образцом блокировали 5% обезжиренным молоком в течение 30 минут, а затем три раза промывали PBS-Tween в течение 5 минут каждый раз и инкубировали с разбавлением 1:100 первичного антитела (Santa Cruz Biotechnology, США) в течение ночи. Затем мембрану промывали три раза в течение 10 минут каждый раз и инкубировали с разбавлением вторичного антитела (Santa Cruz Biotechnology, США) 1:1000 в течение 1 часа и 20 минут. Затем мембрану промывали три раза в течение 15 минут каждый раз, и ее проявляли с помощью флуоресценции и визуализировали.
Кроме того, связанные с воспалением цитокины, такие как TNF-α, IL-17, IL-10 и т. п., измеряли с использованием набора ELISA.
(6) Анализ иммунорегулирующих маркеров
Иссеченную толстую кишку дважды промывали 2,5 мМ раствором EDTA. Промытую толстую кишку перемешивали в среде RPMI, содержащей 1 мг/мл коллагеназы типа VIII (Sigma), при 30°С в течение 20 минут и фильтровали для отделения собственного слоя слизистой оболочки. Затем собственный слой слизистой оболочки обрабатывали 30-100% раствором перколла и центрифугировали для отделения Т-клеток. Отделенные Т-клетки окрашивали антителом к FoxP3 или антителом к IL-17A, и распределение клеток Th17 и Treg анализировали с использованием системы FACS (сортировка клеток с активированной флуоресценцией) (система C6 Flow Cytometer®, Сан-Хосе, Калифорния, США).
(7) Экспериментальные результаты
В таблице 23 ниже представлены эффекты молочнокислых бактерий в отношении веса толстой кишки, физических свойств толстой кишки, активности миелопероксидазы (MPO) и содержания цитокинов, связанных с воспалением, в случае если молочнокислые бактерии вводили животным моделям с TNBS-индуцированным острым колитом. Как представлено в таблице 23 ниже, животные модели с острым колитом, индуцированным с помощью TNBS, продемонстрировали снижение веса, снижение макроскопического показателя толстой кишки, уменьшение длины толстой кишки и увеличенную активность MPO. Однако, в случае если молочнокислые бактерии вводили животным моделям с острым колитом, индуцированным TNBS, все эти маркеры улучшались. В частности, введение только Bifidobacterium longum LC67 или введение смеси Bifidobacterium longum LC67 и Lactobacillus plantarum LC5 продемонстрировало весьма превосходный эффект в отношении уменьшения тяжести колита. В дополнение к этому животные модели с острым колитом, индуцированным TNBS, продемонстрировали увеличенные уровни TNF-α и IL-17 и увеличенные уровни IL-10. Однако, в случае если молочнокислые бактерии вводили животным моделям с острым колитом, индуцированным TNBS, все эти маркеры улучшались. В частности, в случае если вводили только Bifidobacterium longum LC67, или вводили смесь Bifidobacterium longum LC67 и Lactobacillus plantarum LC5, то уровни TNF-α и IL-17 значительно снижались, а уровни IL-10 значительно увеличивались.
Таблица 23
На ФИГ. 22 показаны диаграммы дифференциации Т-клеток в клетки Th17, которые показывают эффект молочно-кислых бактерий в отношении животных моделей с острым колитом, индуцированным TNBS, и на ФИГ. 23 показаны диаграммы дифференциации Т-клеток в клетки Treg, которые показывают эффект молочно-кислых бактерий в отношении животных моделей с острым колитом, индуцированным TNBS. На ФИГ. 22 и 23 «NOR» означает нормальную группу; «TNBS» означает группу отрицательного контроля; «LC5» означает группу, которой вводили Lactobacillus plantarum LC5; «LC27» означает группу, которой вводили Lactobacillus plantarum LC27, «LC67» означает группу, которой вводили Bifidobacterium longum LC67; «LC68» означает группу, которой вводили Bifidobacterium longum LC68; «LC5+LC67» означает группу, которой вводили смесь молочнокислых бактерий, полученную с помощью смешивания Lactobacillus plantarum LC5 и Bifidobacterium longum LC67 в одинаковых количествах; «LC27+LC68» означает группу, которой вводили смесь молочнокислых бактерий, полученную с помощью смешивания Lactobacillus plantarum LC27 и Bifidobacterium longum LC68 в одинаковых количествах; и «SS» означает группу, которой вводили сульфасалазин. Как показано на ФИГ. 22 и 23, в случае животных с острым колитом, индуцированным TNBS, дифференциация Т-клеток в клетки Th17 стимулировалась, а дифференциация Т-клеток в клетки Treg подавлялась. Однако, в случае если молочнокислые бактерии вводили животным с острым колитом, индуцированным TNBS, то дифференциация Т-клеток в клетки Th17 подавлялась, а дифференциация T-клеток в клетки Treg стимулировалась. В частности, в случае если вводили только Bifidobacterium longum LC67 или смесь Bifidobacterium longum LC67 и Lactobacillus plantarum LC5, то дифференциация Т-клеток в клетки Th17 значительно подавлялась, а дифференциация Т-клеток в клетки Treg значительно стимулировалась.
На ФИГ. 24 показаны маркеры воспалительной реакции, показывающие эффект молочнокислых бактерий в отношении животных моделей с острым колитом, индуцированным TNBS. На ФИГ. 24 «Nor» означает нормальную группу; «T» означает группу отрицательного контроля; «LC5» означает группу, которой вводили Lactobacillus plantarum LC5; «LC27» означает группу, которой вводили Lactobacillus plantarum LC27; «LC67» означает группу, которой вводили Bifidobacterium longum LC67; «LC68» означает группу, которой вводили Bifidobacterium longum LC68; «LC5+LC67» означает группу, которой вводили смесь молочнокислых бактерий, полученную с помощью смешивания Lactobacillus plantarum LC5 и Bifidobacterium longum LC67 в одинаковых количествах; «LC27+LC68» означает группу, которой вводили смесь молочнокислых бактерий, полученную с помощью смешивания Lactobacillus plantarum LC27 и Bifidobacterium longum LC68 в одинаковых количествах, и «SS» означает группу, которой вводили сульфасалазин. Как показано на ФИГ. 24, в случае модельных животных с острым колитом, индуцированным TNBS, NF-κB (p-p65) активировался, и уровни экспрессии COX-2 и iNOS увеличивались. Однако, в случае если вводили молочнокислые бактерии, то активация NF-κB (p-p65) ингибировалась, и уровни экспрессии COX-2 и iNOS также уменьшались. В частности, введение только Bifidobacterium longum LC67 или введение смеси Bifidobacterium longum LC67 и Lactobacillus plantarum LC5 проявило превосходные эффекты в отношении ингибирования активации NF-κB (p-p65) и ингибирования экспрессии COX-2 и iNOS.
7. In vivo оценка эффекта молочнокислых бактерий в отношении уменьшения тяжести алкоголь-индуцированной язвы желудка
(1) Тестируемые животные
Мышей C57BL/6 (24-27 г) возрастом 5 недель приобретали у OrientBio и размещали в контролируемых условиях окружающей среды (влажность: 50±10%, температура: 25±2°C, цикл 12 ч. свет/12 ч. темнота), а затем использовали в эксперименте. В качестве корма использовали стандартный экспериментальный корм (Samyang, Корея), и при этом животные имели доступ к питьевой воде ad libitum. Во всех экспериментах одна группа состояла из 6 животных.
(2) Индукция язвы желудка алкоголем и введение образца
Одной тестируемой группе вводили перорально один раз в сутки в течение 3 суток 1 × 109 КОЕ Lactobacillus plantarum LC27, суспендированной в солевом растворе. Другой тестируемой группе вводили перорально один раз в сутки в течение 3 суток 1 × 109 КОЕ Bifidobacterium longum LC67, суспендированной в солевом растворе. Еще одной тестируемой группе вводили перорально один раз в сутки в течение 3 суток 1 × 109 КОЕ смеси молочнокислых бактерий, полученной с помощью смешивания Lactobacillus plantarum LC27 и Bifidobacterium longum LC67 в одинаковых количествах после ее суспендирования в солевом растворе. В дополнение к этому, группе положительного контроля вводили перорально ранитидин, коммерческое средство для лечения язвы желудка, один раз в сутки в течение 3 суток в количестве, составлявшем 50 мг/кг. В дополнение к этому, нормальной группе и группе отрицательного контроля вводили перорально один раз в сутки в течение 3 суток 0,2 мл солевого раствора. После того как образец вводили перорально в течение 3 дней, тестируемым мышам не давали еды и воды в течение 18 часов. На 4-й день эксперимента через 1 час после введения солевого раствора мышам всех тестируемых групп, отличных от нормальной группы, вводили перорально 0,2 мл 99% чистого этанола для индукции язвы желудка. В дополнение к этому нормальной группе вместо этанола вводили 0,2 мл солевого раствора.
(3) Измерение макроскопического маркера, связанного с повреждением желудка
Через 3 часа после введения этанола тестируемых мышей умерщвляли, и ткань желудка рассекали в продольном направлении и промывали раствором фосфатно-солевого буферного раствора PBS, а затем степень повреждения желудка исследовали визуально или микроскопически и оценивали (см. Park, S.W., Oh, T.Y., Kim,Y.S., Sim, H., et al., Artemisia asiatica extracts protect against ethanol-induced injury in gastric mucosa of rats. J. Gastroenterol. Hepatol. 2008, 23, 976-984).
(4) Измерение активности миелопероксидазы (MPO)
Гомогенизировали 100 мг ткани желудка в 200 мкл 10 мМ калий-фосфатного буфера (рН 7,0), содержащего 0,5% гексадецилтриметиламмонийбромида. Затем раствор ткани центрифугировали при 10000×g и 4°C в течение 10 минут, и супернатант собирали. Добавляли 50 мкл супернатанта к 0,95 мл реакционного раствора (содержащего 1,6 мМ тетраметилбензидина и 0,1 мМ H2O2), и обеспечивали реакцию при 37°С, и в различные моменты времени во время реакции измеряли оптическую плотность при 650 нм. Для расчета активности миелопероксидазы (MPO) 1 мкмоль/мл пероксида, полученного с помощью реакции, использовали в качестве 1 единицы.
(5) Измерение маркеров воспаления
Выделяли 2 мкг mRNA из ткани желудка с помощью набора Qiagen RNeasy Mini и синтезировали в cDNA с использованием Takara Prime Script Rtase. Затем измеряли уровни экспрессии лиганда CXCL4 [хемокин (CXC-мотив) 4] и TNF-α (фактор некроза опухоли-альфа) с использованием количественной полимеразной цепной реакции в реальном времени (термоциклер Qiagen, предварительно смешанное средство Takara SYBER, условия термического циклирования: активация ДНК-полимеразы в течение 5 мин. при 95°С, затем 40 циклов амплификации в течение 10 с при 95°С и в течение 45 с при 60°С). В таблице 24 ниже представлены последовательности праймеров, используемые для анализа каждого цитокина в количественной полимеразной цепной реакции в реальном времени.
Таблица 24
(6) Экспериментальные результаты
На ФИГ. 25 изображены снимки, демонстрирующие эффект молочнокислых бактерий в отношении слизистой оболочки желудка мышей с язвой желудка, индуцированной этанолом, во втором эксперименте по настоящему изобретению; на ФИГ. 26 показан общий показатель поражения желудка, показывающий эффект молочнокислых бактерий в отношении слизистой оболочки желудка мышей с язвой желудка, индуцированной этанолом, во втором эксперименте по настоящему изобретению; на ФИГ. 27 показан индекс язвы, показывающий эффект молочнокислых бактерий в отношении слизистой оболочки желудка мышей с язвой желудка, индуцированной этанолом, во втором эксперименте по настоящему изобретению; и на ФИГ. 28 показан индекс гистологической активности, показывающий эффект молочнокислых бактерий в отношении слизистой оболочки желудка мышей с язвой желудка, индуцированной этанолом, во втором эксперименте по настоящему изобретению. Кроме того, на ФИГ. 29 показана активность миелопероксидазы (MPO), показывающая эффект молочнокислых бактерий в отношении слизистой оболочки желудка мышей с язвой желудка, индуцированной этанолом, во втором эксперименте по настоящему изобретению. В дополнение к этому на ФИГ. 30 показаны уровни экспрессии CXCL4, показывающие эффект молочнокислых бактерий в отношении слизистой оболочки желудка мышей с язвой желудка, индуцированной этанолом, во втором эксперименте по настоящему изобретению; и на ФИГ. 31 показаны уровни экспрессии TNF-α, показывающие эффект молочнокислых бактерий в отношении слизистой оболочки желудка мышей с язвой желудка, индуцированной этанолом, во втором эксперименте по настоящему изобретению. На ФИГ. 30 и 31 уровни экспрессии CXCL4 и уровни экспрессии TNF-α в тестируемых группах, отличных от нормальной группы, выражены с кратным изменением относительно уровней экспрессии в нормальной группе. На ФИГ. 25-31, «Nor» означает нормальную группу; «этанол» означает группу отрицательного контроля с этанол-индуцированной язвой желудка и введенным физиологическим раствором в виде образца; «этанол+ранитидин» означает тестируемую группу с этанол-индуцированной язвой желудка и введенным ранитидином в виде образца; «этанол+LC27» означает тестируемую группу с этанол-индуцированной язвой желудка и введенным Lactobacillus plantarum LC27 в виде образца; «этанол+LC67» означает тестируемую группу с этанол-индуцированной язвой желудка и введенным Bifidobacterium longum LC67 в виде образца; и «этанол+LC27/LC67» означает тестируемую группу с этанол-индуцированной язвой желудка и введенной смесью молочнокислых бактерий, полученной с помощью смешивания Lactobacillus plantarum LC27 и Bifidobacterium longum LC67 в равных количествах, в виде образца. Как показано на ФИГ. 25-29, Bifidobacterium longum LC67, Lactobacillus plantarum LC27 или их смесь эффективно уменьшали тяжесть повреждения желудка или язвы желудка, индуцированных этанолом. Кроме того, как показано на ФИГ. 30 и 31, Bifidobacterium longum LC67, Lactobacillus plantarum LC27 или их смесь значительно снижали уровни маркеров воспаления у мышей с этанол-индуцированными повреждением желудка или язвой желудка.
8. In vivo оценка эффекта молочнокислых бактерий в отношении уменьшения тяжести алкоголь-индуцированного повреждения печени
(1) Тестируемые животные
Мышей C57BL/6 (24-27 г) возрастом 5 недель приобретали у OrientBio и размещали в контролируемых условиях окружающей среды (влажность: 50±10%, температура: 25±2°C, цикл 12 ч. свет/12 ч. темнота), а затем использовали в эксперименте. В качестве корма использовали стандартный экспериментальный корм (Samyang, Корея), и при этом животные имели доступ к питьевой воде ad libitum. Во всех экспериментах одна группа состояла из 6 животных.
(2) Индукция повреждения печени алкоголем и введение образца
Одной тестируемой группе вводили перорально один раз в сутки в течение 3 суток 1 × 109 КОЕ Lactobacillus plantarum LC27, суспендированной в солевом растворе. Другой тестируемой группе вводили перорально один раз в сутки в течение 3 суток 1 × 109 КОЕ Bifidobacterium longum LC67, суспендированной в солевом растворе. Еще одной тестируемой группе вводили перорально один раз в сутки в течение 3 суток 1 × 109 КОЕ смеси молочнокислых бактерий, полученной с помощью смешивания Lactobacillus plantarum LC27 и Bifidobacterium longum LC67 в одинаковых количествах после ее суспендирования в солевом растворе. Группе положительного контроля вводили перорально силимарин, коммерческое средство для лечения повреждения печени, один раз в сутки в течение 3 суток в количестве, составлявшем 50 мг/кг. В дополнение к этому нормальной группе и группе отрицательного контроля вводили перорально один раз в сутки в течение 3 суток 0,1 мл солевого раствора. Через 3 часа после 3 суток перорального введения образца или солевого раствора вводили внутрибрюшинно этанол мышам всех тестируемых групп, отличных от нормальной группы, в количестве, составлявшем 6 мл/кг, чтобы индуцировать повреждение печени. В дополнение к этому нормальной группе вместо этанола вводили внутрибрюшинно солевой раствор в количестве, составлявшем 6 мл/кг. Затем тестируемым мышам не давали еды и воды в течение 12 часов, а затем умерщвляли, и отбирали кровь из сердца.
(3) Измерение маркеров функции печени и результаты
Отобранный образец крови оставляли отстаиваться при комнатной температуре в течение 60 минут и центрифугировали при 3000 об./мин. в течение 15 минут для отделения сыворотки. Уровни GPT (глутаминпируваттрансаминазы) и GOT (глутаматоксалацетаттрансаминазы) в отделенной сыворотке измеряли с использованием набора для анализа крови (набор для измерения ALT & AST, Asan Pharm. Co., Корея), и результаты измерения представлены в таблице 25 ниже. Как показано в таблице 25 ниже, Bifidobacterium longum LC67, Lactobacillus plantarum LC27 или их смесь эффективно уменьшают тяжесть этанол-индуцированного повреждения печени. В частности, Bifidobacterium longum LC67 продемонстрировал улучшенный эффект по сравнению с силимарином, который представляет собой коммерческое средство для лечения повреждения печени.
Таблица 25
* LC27: Lactobacillus plantarum LC27
* LC67: Bifidobacterium longum LC67
* LC27/LC67: смесь молочнокислых бактерий, полученная с помощью смешивания Lactobacillus plantarum LC27 и Bifidobacterium longum LC67 в одинаковых количествах.
Хотя настоящее изобретение было описано выше со ссылкой на примеры, объем настоящего изобретения не ограничивается этими примерами, и при этом возможны различные модификации без отхода от объема и идеи настоящего изобретения. Следовательно, объем защиты настоящего изобретения должен интерпретироваться как включающий все варианты осуществления, входящие в прилагаемую формулу изобретения.
--->
Перечень последовательностей
<110> ЮНИВЕРСИТИ-ИНДАСТРИ КООПЕРЕЙШН ГРУП ОФ КЮН ХЕЕ ЮНИВЕРСИТИ
<120> НОВАЯ БИФИДОБАКТЕРИЯ, ХАРАКТЕРИЗУЮЩАЯСЯ РАЗЛИЧНЫМИ ФУНКЦИЯМИ,
И ЕЕ ПРИМЕНЕНИЕ
<130> PCT-16-130
<150> KR 10-2015-0130124
<151> 2015-09-15
<150> KR 10-2016-0005018
<151> 15.01.2016
<160> 8
<170> KopatentIn 2.0
<210> 1
<211> 1132
<212> ДНК
<213> Неизвестно
<220>
<223> 16S rDNA Lactobacillus brevis CH23
<400> 1
agggataaca cttggaaaca ggtgctaata ccgtataaca acaaaatccg catggatttt 60
gtttgaaagg tggcttcggc tatcacttct ggatgatccc gcggcgtatt agttagttgg 120
tgaggtaaag gcccaccaag acgatgatac gtagccgacc tgagagggta atcggccaca 180
ttgggactga gacacggccc aaactcctac gggaggcagc agtagggaat cttccacaat 240
ggacgaaagt ctgatggagc aatgccgcgt gagtgaagaa gggtttcggc tcgtaaaact 300
ctgttgttaa agaagaacac ctttgagagt aactgttcaa gggttgacgg tatttaacca 360
gaaagccacg gctaactacg tgccagcagc cgcggtaata cgtaggtggc aagcgttgtc 420
cggatttatt gggcgtaaag cgagcgcagg cggtttttta agtctgatgt gaaagccttc 480
ggcttaaccg gagaagtgca tcggaaactg ggagacttga gtgcagaaga ggacagtgga 540
actccatgtg tagcggtgga atgcgtagat atatggaaga acaccagtgg cgaaggcggc 600
tgtctagtct gtaactgacg ctgaggctcg aaagcatggg tagcgaacag gattagatac 660
cctgstagtc catgccgtaa acgatgagtg ctaagtgttg gagggtttcc gcccttcagt 720
gctgcagcta acgcattaag cactccgcct ggggagtacg accgcaaggt tgaaactcaa 780
aggaattgac gggggcccgc acaagcggtg gagcatgtgg tttaattcga agctacgcga 840
agaaccttac caggtcttga catcttctgc caatcttaga gataagacgt tcccttcggg 900
gacagaatga caggtggtgc atggttgtcg tcagctcgtg tcgtgagatg ttgggttaag 960
tcccgcaacg agcgcaaccc ttattatcag ttgccagcat tcagttgggc actctggtga 1020
gactgccggt gacaaaccgg aggaaggtgg ggatgacgtc aaatcatcat gccccttatg 1080
acctgggcta cacacgtgct acaatggacg gtacaacgag tcgcgaagtc gt 1132
<210> 2
<211> 1258
<212> ДНК
<213> Неизвестно
<220>
<223> 16S rDNA Lactobacillus brevis CH32
<400> 2
gtaacttgcc caagagactg ggataacacc tggaaacaga tgctaatacc ggataacaac 60
actagacgca tgtctagagt ttgaaagatg gttctgctat cactcttgga tggacctgcg 120
gtgcattagc tagttggtaa ggtaacggct taccaaggca atgatgcata gccgagttga 180
gagactgatc ggccacattg ggactgagac acggcccaaa ctcctacggg aggcagcagt 240
agggaatctt ccacaatgga cgaaagtctg atggagcaac gccgcgtgag tgaagaaggg 300
tttcggctcg taaagctctg ttggtagtga agaaagatag aggtagtaac tggccttgat 360
ttgacggtaa ttccccagaa agtcacggct aactacgtgc cagcagccgc ggtaatacgt 420
aggtggcaag cgttgtccgg atttattggg cgtaaagcga gtgcaggcgg ttcaataagt 480
ctgatgtgaa agccttcggc tcaaccggag aattgcatca gaaactgttg aacttgagtg 540
cagaagagga gagtggaact ccatgtgtag cggtggaatg cgtagatata tggaagaaca 600
ccagtggcga aggcggctct ctggtctgca actgacgctg aggctcgaaa gcatgggtag 660
cgaacaggat tagataccct ggtagtccat gccgtaaacg atgagtgcta agtgttggga 720
ggtttccgcc tctcagtgct gcagctaacg cattaagcac tccgcctggg gagtacgacc 780
gcaaggttga aactcaaagg aattgacggg ggcccgcaca agcggtggag catgtggttt 840
aattcgaagc aacgcgaaga accttaccag gtcttgacat ccagtgcaaa cctaagagat 900
taggtgttcc cttcggggac gctgagacag gtggtgcatg gctgtcgtca gctcgtgtcg 960
tgagatgttg ggttaagtcc cgcaacgagc gcaacccttg tcattagttg ccatcattaa 1020
gttgggcact ctaatgagac tgccggtgac aaaccggagg aaggtgggga tgacgtcaag 1080
tcatcatgcc ccttatgacc tgggctacac acgtgctaca atggacggta caacgagaag 1140
cgaacctgcg aaggcaagcg gatctcttaa agccgttctc agttcggact gtaggctgca 1200
actcgcctac acgaagctgg aatcgctagt aatcgcggaa cagtacgccg cggtgaat 1258
<210> 3
<211> 1348
<212> ДНК
<213> Неизвестно
<220>
<223> 16S rDNA Bifidobacterium longum CH57
<400> 3
cgggctttgc ttggtggtga gagtggcgaa cgggtgagta atgcgtgacc gacctgcccc 60
atacaccgga atagctcctg gaaacgggtg gtaatgccgg atgctccagt tgatcgcatg 120
gtcttctggg aaagctttcg cggtatggga tggggtcgcg tcctatcagc ttgacggcgg 180
ggtaacggcc caccgtggct tcgacgggta gccggcctga gagggcgacc ggccacattg 240
ggactgagat acggcccaga ctcctacggg aggcagcagt ggggaatatt gcacaatggg 300
cgcaagcctg atgcagcgac gccgcgtgag ggatggaggc cttcgggttg taaacctctt 360
ttatcgggga gcaagcgaga gtgagtttac ccgttgaata agcaccggct aactacgtgc 420
cagcagccgc ggtaatacgt agggtgcaag cgttatccgg aattattggg cgtaaagggc 480
tcgtaggcgg ttcgtcgcgt ccggtgtgaa agtccatcgc ttaacggtgg atccgcgccg 540
ggtacgggcg ggcttgagtg cggtagggga gactggaatt cccggtgtaa cggtggaatg 600
tgtagatatc gggaagaaca ccaatggcga aggcaggtct ctgggccgtt actgacgctg 660
aggagcgaaa gcgtggggag cgaacaggat tagataccct ggtagtccac gccgtaaacg 720
gtggatgctg gatgtggggc ccgttccacg ggttccgtgt cggagctaac gcgttaagca 780
tcccgcctgg gggagtacgg ccgcaaggct aaaactcaaa gaaattgacg ggggcccgca 840
caagcggcgg agcatgcgga ttaattcgat gcaacgcgaa gaaccttacc tgggcttcac 900
atgttcccga cggtcgtaga gatacggctt cccttcgggg cgggttcaca ggtggtgcat 960
ggtcgtcgtc agctcgtgtc gtgagatgtt gggttaagtc ccgcaacgag cgcaaccctc 1020
gccccgtgtt gccagcggat tatgccggga actcacgggg gaccgccggg gttaactcgg 1080
aggaaggtgg ggatgacgtc agatcatcat gccccttacg tccagggctt cacgcatgct 1140
acaatggccg gtacaacggg atgcgacgcg gcgacgcgga gcggatccct gaaaaccggt 1200
ctcagttcgg atcgcagtct gcaactcgac tgcgtgaagg cggagtcgct agtaatcgcg 1260
aatcagcaac gtcgcggtga atgcgttccc gggccttgta cacaccgccc gtcaagtcat 1320
gaaagtgggc agcacccgaa gccggtgg 1348
<210> 4
<211> 1421
<212> ДНК
<213> Неизвестно
<220>
<223> 16S rDNA Lactobacillus brevis LC5
<400> 4
ctggtattga ttggtgcttg catcatgatt tacatttgag tgagtggcga actggtgagt 60
aacacgtggg aaacctgccc agaagcgggg gataacacct ggaaacagat gctaataccg 120
cataacaact tggaccgcat ggtccgagct tgaaagatgg cttcggctat cacttttgga 180
tggtcccgcg gcgtattagc tagatggtgg ggtaacggct caccatggca atgatacgta 240
gccgacctga gagggtaatc ggccacattg ggactgagac acggcccaaa ctcctacggg 300
aggcagcagt agggaatctt ccacaatgga cgaaagtctg atggagcaac gccgcgtgag 360
tgaagaaggg tttcggctcg taaaactctg ttgttaaaga agaacatatc tgagagtaac 420
tgttcaggta ttgacggtat ttaaccagaa agccacggct aactacgtgc cagcagccgc 480
ggtaatacgt aggtggcaag cgttgtccgg gatttattgg gcgtaaagcg agcgcaggcg 540
gttttttaag tctgatgtga aagccttcgg ctcaaccgaa gaagtgcatc ggaaactggg 600
aaacttgagt gcagaagagg acagtggaac tccatgtgta gcggtgaaat gcgtagatat 660
atggaagaac accagtggcg aaggcggctg tctggtctgt aactgacgct gaggctcgaa 720
agtatgggta gcaaacagga ttagataccc tggtagtcca taccgtaaac gatgaatgct 780
aagtgttgga gggtttccgc ccttcagtgc tgcagctaac gcattaagca ttccgcctgg 840
ggagtacggc cgcaaggctg aaactcaaag gaattgacgg gggcccgcac aagcggtgga 900
gcatgtggtt taattcgaag ctacgcgaag aaccttacca ggtcttgaca tactatgcaa 960
atctaagaga ttagacgttc ccttcgggga catggataca ggtggtgcat ggttgtcgtc 1020
agctcgtgtc gtgagatgtt gggttaagtc ccgcaacgag cgcaaccctt attatcagtt 1080
gccagcatta agttgggcac tctggtgaga ctgccggtga caaaccggag gaaggtgggg 1140
atgacgtcaa atcatcatgc cccttatgac ctgggctaca cacgtgctac aatggatggt 1200
acaacgagtt gcgaactcgc gagagtaagc taatctctta aagccattct cagttcggat 1260
tgtaggctgc aactcgccta catgaagtcg gaatcgctag taatcgcgga tcagcatgcc 1320
gcggtgaata cgttcccggg ccttgtacac accgcccgtc acaccatgag agtttgtaac 1380
acccaaagtc ggtggggtaa ccttttagga accagccgcc t 1421
<210> 5
<211> 1356
<212> ДНК
<213> Неизвестно
<220>
<223> 16S rDNA Lactobacillus brevis LC27
<400> 5
tttacatttg attgagtggc gaactggtga gtaacacgtg ggaaacctgc ccagaagcgg 60
gggataacac ctggaaacag atgctaatac cgcataacaa cttggaccgc atggtccgag 120
tttgaaagat ggcttcggct atcacttttg gatggtcccg cggcgtatta gctagatggt 180
ggggtaacgg ctcaccatgg caatgatacg tagccgacct gagagggtaa tcggccacat 240
tgggactgag acacggccca aactcctacg ggaggcagca gtagggaatc ttccacaatg 300
gacgaaagtc tgatggagca acgccgcgtg agtgaagaag ggtttcggct cgtaaaactc 360
tgttgttaaa gaagaacata tctgagagta actgttcagg tattgacggt atttaaccag 420
aaagccacgg ctaactacgt gccagcagcc gcggtaatac gtaggtggca agcgttgtcc 480
ggatttattg ggcgtaaagc gagcgcaggc ggttttttaa gtctgatgtg aaagccttcg 540
gctcaaccga agaagtgcat cggaaactgg gaaacttgag tgcagaagag gacagtggaa 600
ctccatgtgt agcggtgaaa tgcgtagata tatggaagaa caccagtggc gaaggcggct 660
gtctggtctg taactgacgc tgaggctcga aagtatgggt agcaaacagg attagatacc 720
ctggtagtcc ataccgtaaa cgatgaatgc taagtgttgg agggtttccg cccttcagtg 780
ctgcagctaa cgcattaagc attccgcctg gggagtacgg ccgcaaggct gaaactcaaa 840
ggaattgacg ggggcccgca caagcggtgg agcatgtggt ttaattcgaa gctacgcgaa 900
gaaccttacc aggtcttgac atactatgca aatctaagag attagacgtt cccttcgggg 960
acatggatac aggtggtgca tggttgtcgt cagctcgtgt cgtgagatgt tgggttaagt 1020
cccgcaacga gcgcaaccct tattatcagt tgccagcatt aagttgggca ctctggtgag 1080
actgccggtg acaaaccgga ggaaggtggg gatgacgtca aatcatcatg ccccttatga 1140
cctgggctac acacgtgcta caatggatgg tacaacgagt tgcgaactcg cgagagtaag 1200
ctaatctctt aaagccattc tcagttcgga ttgtaggctg caactcgcct acatgaagtc 1260
ggaatcgcta gtaatcgcgg atcagcatgc cgcggtgaat acgttcccgg gccttgtaca 1320
caccgcccgt cacaccatga gagtttgtaa caccca 1356
<210> 6
<211> 1325
<212> ДНК
<213> Неизвестно
<220>
<223> 16S rDNA Lactobacillus brevis LC28
<400> 6
catcatgatt tacatttgag tgagtggcga actggtgagt aacacgtggg aaacctgccc 60
agaagcgggg gataacacct ggaaacagat gctaataccg cataacaact tggaccgcat 120
ggtccgagtt tgaaagatgg cttcggctat cacttttgga tggtcccgcg gcgtattagc 180
tagatggtgg ggtaacggct caccatggca atgatacgta gccgacctga gagggtaatc 240
ggccacattg ggactgagac acggcccaaa ctcctacggg aggcagcagt agggaatctt 300
ccacaatgga cgaaagtctg atggagcaac gccgcgtgag tgaagaaggg tttcggctcg 360
taaaactctg ttgttaaaga agaacatatc tgagagtaac tgttcaggta ttgacggtat 420
ttaaccagaa agccacggct aactacgtgc cagcagccgc ggtaatacgt aggtggcaag 480
cgttgtccgg atttattggg cgtaaagcga gcgcaggcgg ttttttaagt ctgatgtgaa 540
agccttcggc tcaaccgaag aagtgcatcg gaaactggga aacttgagtg cagaagagga 600
cagtggaact ccatgtgtag cggtgaaatg cgtagatata tggaagaaca ccagtggcga 660
aggcggctgt ctggtctgta actgacgctg aggctcgaaa gtatgggtag caaacaggat 720
tagataccct ggtagtccat accgtaaacg atgaatgcta agtgttggag ggtttccgcc 780
cttcagtgct gcagctaacg cattaagcat tccgcctggg gagtacggcc gcaaggctga 840
aactcaaagg aattgacggg ggcccgcaca agcggtggag catgtggttt aattcgaagc 900
tacgcgaaga accttaccag gtcttgacat actatgcaaa tctaagagat tagacgttcc 960
cttcggggac atggatacag gtggtgcatg gttgtcgtca gctcgtgtcg tgagatgttg 1020
ggttaagtcc cgcaacgagc gcaaccctta ttatcagttg ccagcattaa gttgggcact 1080
ctggtgagac tgccggtgac aaaccggagg aaggtgggga tgacgtcaaa tcatcatgcc 1140
ccttatgacc tgggctacac acgtgctaca atggatggta caacgagttg cgaactcgcg 1200
agagtaagct aatctcttaa agccattctc agttcggatt gtaggctgca actcgcctac 1260
atgaagtcgg aatcgctagt aatcgcggat cagcattccg cggtgaatac gttcccgggc 1320
cttgt 1325
<210> 7
<211> 1342
<212> ДНК
<213> Неизвестно
<220>
<223> 16S rDNA Bifidobacterium longum LC67
<400> 7
ggctttgctt ggtggtgaga gtggcgaacg ggtgagtaat gcgtgaccga cctgccccat 60
acaccggaat agctcctgga aacgggtggt aatgccggat gctccagttg atcgcatggt 120
cttctgggaa agctttcgcg gtatgggatg gggtcgcgtc ctatcagctt gacggcgggg 180
taacggccca ccgtggcttc gacgggtagc cggcctgaga gggcgaccgg ccacattggg 240
actgagatac ggcccagact cctacgggag gcagcagtgg ggaatattgc acaatgggcg 300
caagcctgat gcagcgacgc cgcgtgaggg atggaggcct tcgggttgta aacctctttt 360
atcggggagc aagcgagagt gagtttaccc gttgaataag caccggctaa ctacgtgcca 420
gcagccgcgg taatacgtag ggtgcaagcg ttatcccgga attattgggc gtaaagggct 480
cgtaggcggt tcgtcgcgtc cggtgtgaaa gtccatcgct taacggtgga tccgcgccgg 540
gtacgggcgg gcttgagtgc ggtaggggag actggaattc ccggtgtaac ggtggaatgt 600
gtagatatcg ggaagaacac caatggcgaa ggcaggtctc tgggccgtta ctgacgctga 660
ggagcgaaag cgtggggagc gaacaggatt agataccctg gtagtccacg ccgtaaacgg 720
tggatgctgg atgtggggcc cgttccacgg gttccgtgtc ggagctaacg cgttaagcat 780
cccgcctggg ggagtacggc cgcaaggcta aaactcaaag aaattgacgg gggcccgcac 840
aagcggcgga gcatgcggat taattcgatg caacgcgaag aaccttacct gggcttgaca 900
tgttcccgac ggtcgtagag atacggcttc ccttcggggc gggttcacag gtggtgcatg 960
gtcgtcgtca gctcgtgtcg tgagatgttg ggttaagtcc cgcaacgagc gcaaccctcg 1020
ccccgtgttg ccagcggatt atgccgggaa ctcacggggg accgccgggg ttaactcgga 1080
ggaaggtggg gatgacgtca gatcatcatg ccccttacgt ccagggcttc acgcatgcta 1140
caatggccgg tacaacggga tgcgacgcgg cgacgcggag cggatccctg aaaaccggtc 1200
tcagttcgga tcgcagtctg caactcgact gcgtgaaggc ggagtcgcta gtaatcgcga 1260
atcagcaacg tcgcggtgaa tgcgttcccg ggccttgtac acaccgcccg tcaagtcatg 1320
aaagtgggca gcacccgaag cg 1342
<210> 8
<211> 1343
<212> ДНК
<213> Неизвестно
<220>
<223> 16S rDNA Bifidobacterium longum LC68
<400> 8
cggcttcggg tgctgcccac tttcatgact tgacgggcgg tgtgtacaag gcccgggaac 60
gcattcaccg cgacgttgct gattcgcgat tactagcgac tccgccttca cgcagtcgag 120
ttgcagactg cgatccgaac tgagaccggt tttcagggat ccgctccgcg tcgccgcgtc 180
gcatcccgtt gtaccggcca ttgtagcatg cgtgaagccc tggacgtaag gggcatgatg 240
atctgacgtc atccccacct tcctccgagt taaccccggc ggtcccccgt gagttcccgg 300
cataatccgc tggcaacacg gggcgagggt tgcgctcgtt gcgggactta acccaacatc 360
tcacgacacg agctgacgac gaccatgcac cacctgtgaa cccgccccga agggaagccg 420
catctctacg accgtcggga acatgtcaag cccaggtaag gttcttcgcg ttgcatcgaa 480
ttaatccgca tgctccgccg cttgtgcggg cccccgtcaa tttctttgag ttttagcctt 540
gcggccgtac tccccaggcg ggatgcttaa cgcgttagct ccgacacgga acccgtggaa 600
cgggccccac atccagcatc caccgtttac ggcgtggact accagggtat ctaatcctgt 660
tcgctcccca cgctttcgct cctcagcgtc agtaacggcc cagagacctg ccttcgccat 720
tggtgttctt cccgatatct acacattcca ccgttacacc gggaattcca gtctccccta 780
ccgcactcaa gcccgcccgt acccggcgcg gatccaccgt taagcgatgg actttcacac 840
cggacgcgac gaaccgccta cgagcccttt acgcccaata attccggata acgcttgcac 900
cctacgtatt accgcggctg ctggcacgta gttagccggt gcttattcaa cgggtaaact 960
cactctcgct tgctccccga taaaagaggt ttacaacccg aaggcctcca tccctcacgc 1020
ggcgtcgctg catcaggctt gcgcccattg tgcaatattc cccactgctg cctcccgtag 1080
gagtctgggc cgtatctcag tcccaatgtg gccggtcgcc ctctcaggcc ggctacccgt 1140
cgaagccacg gtgggccgtt accccgccgt caagctgata ggacgcgacc ccatcccata 1200
ccgcgaaagc tttcccagaa gaccatgcga tcaactggag catccggcat taccacccgt 1260
ttccaggagc tattccggtg tatggggcag gtcggtcacg cattactcac ccgttcgcca 1320
ctctcaccac caagcaaagt ctc 1343
<---
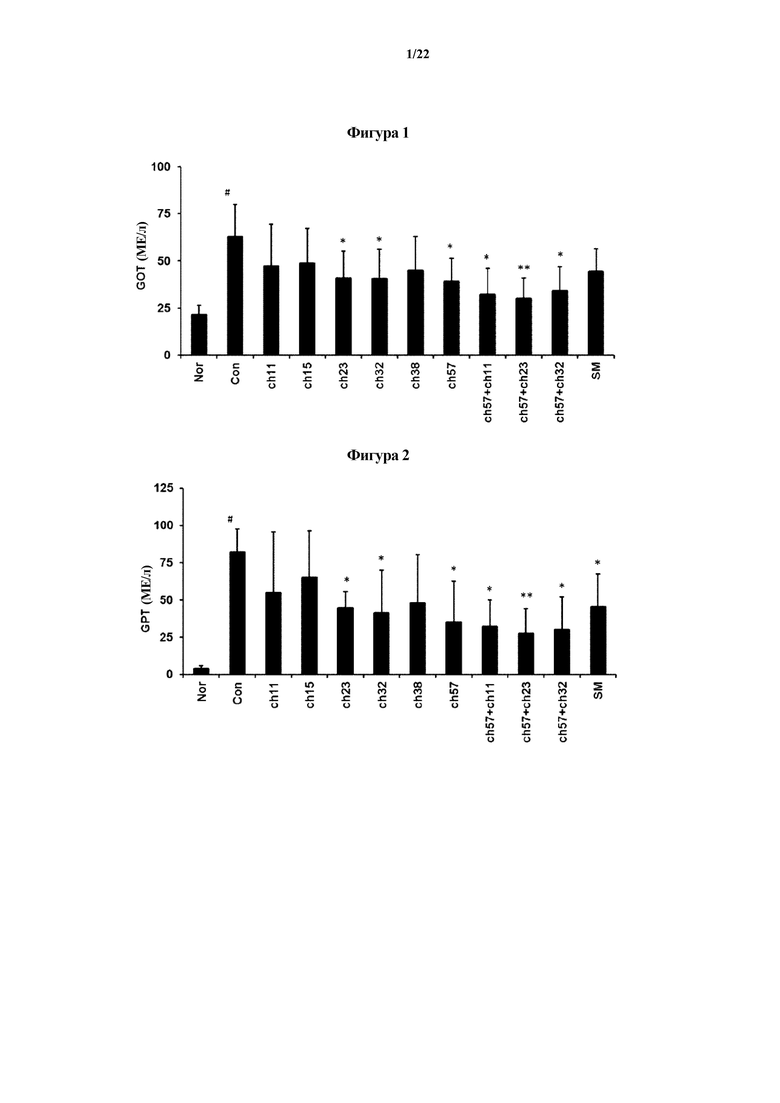
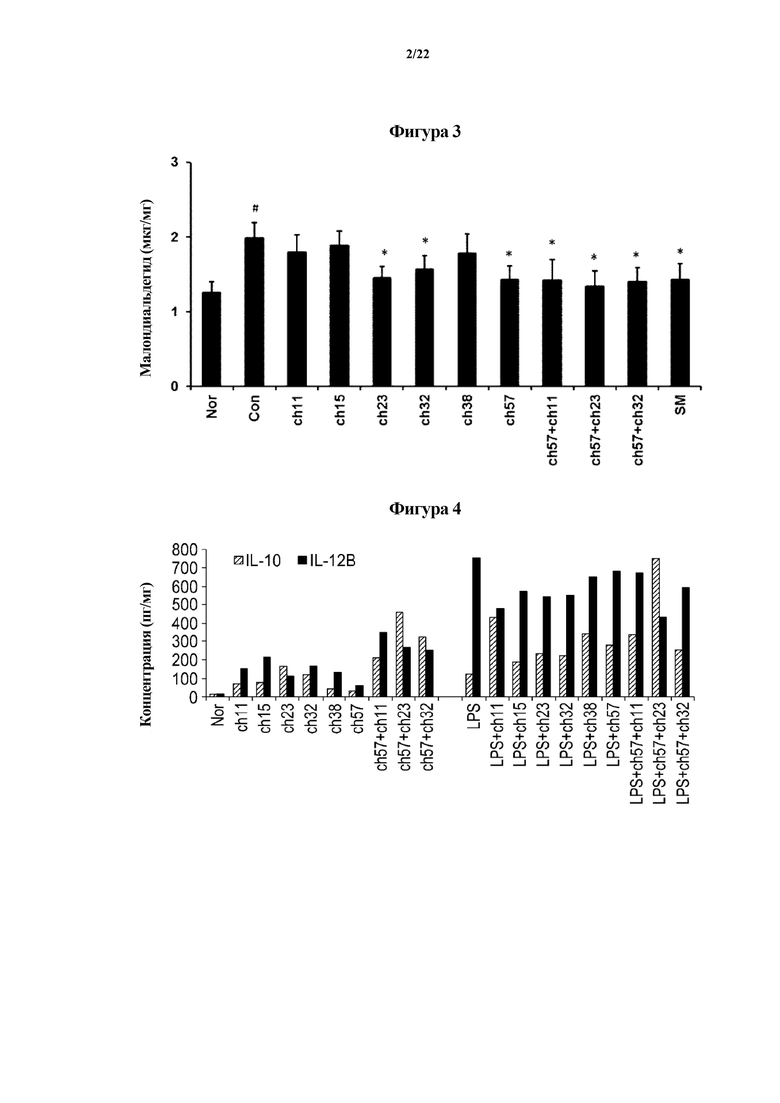
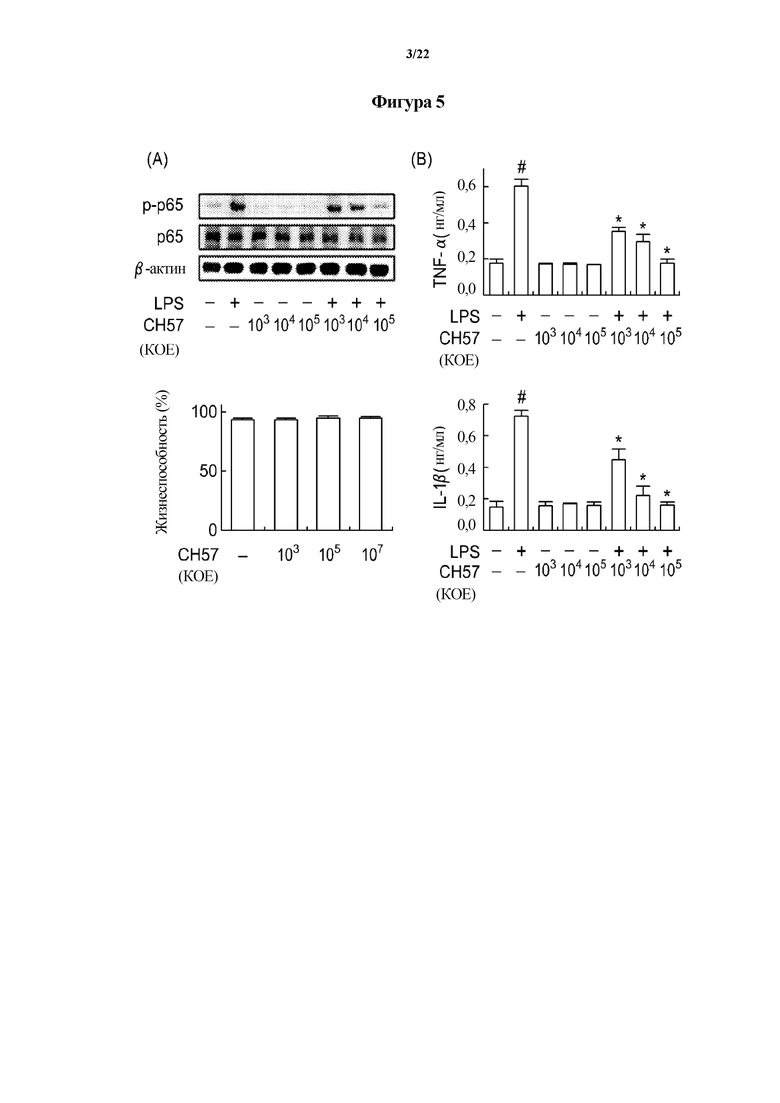
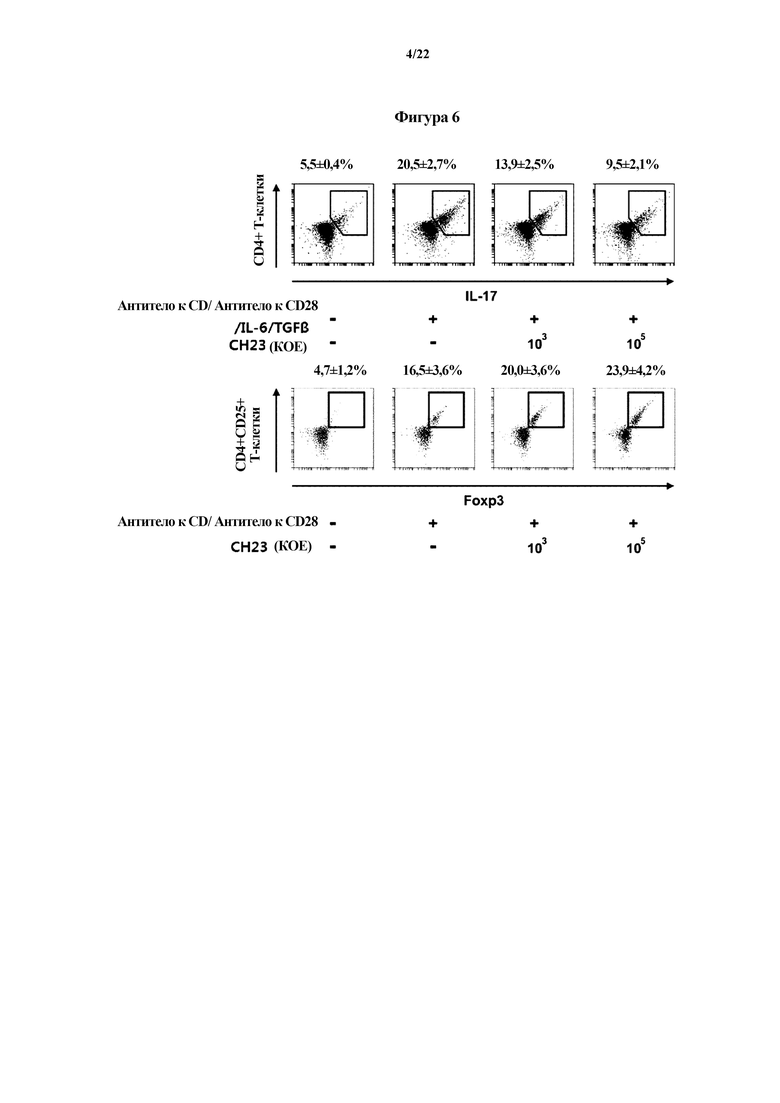
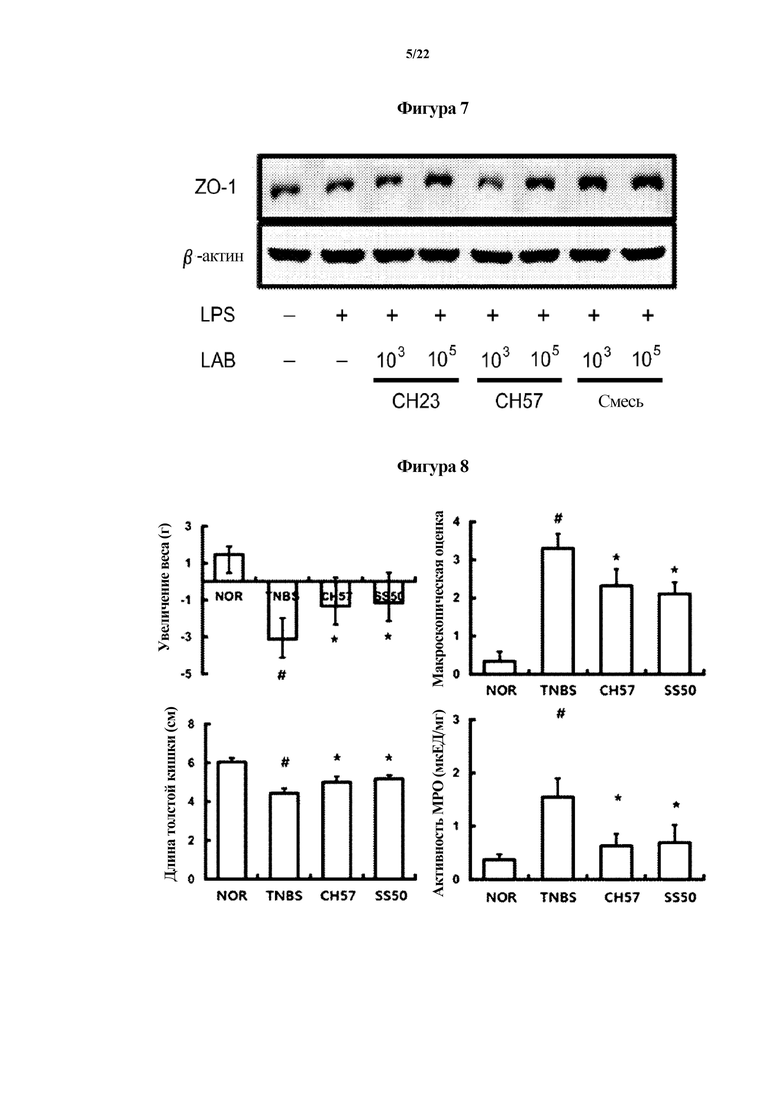
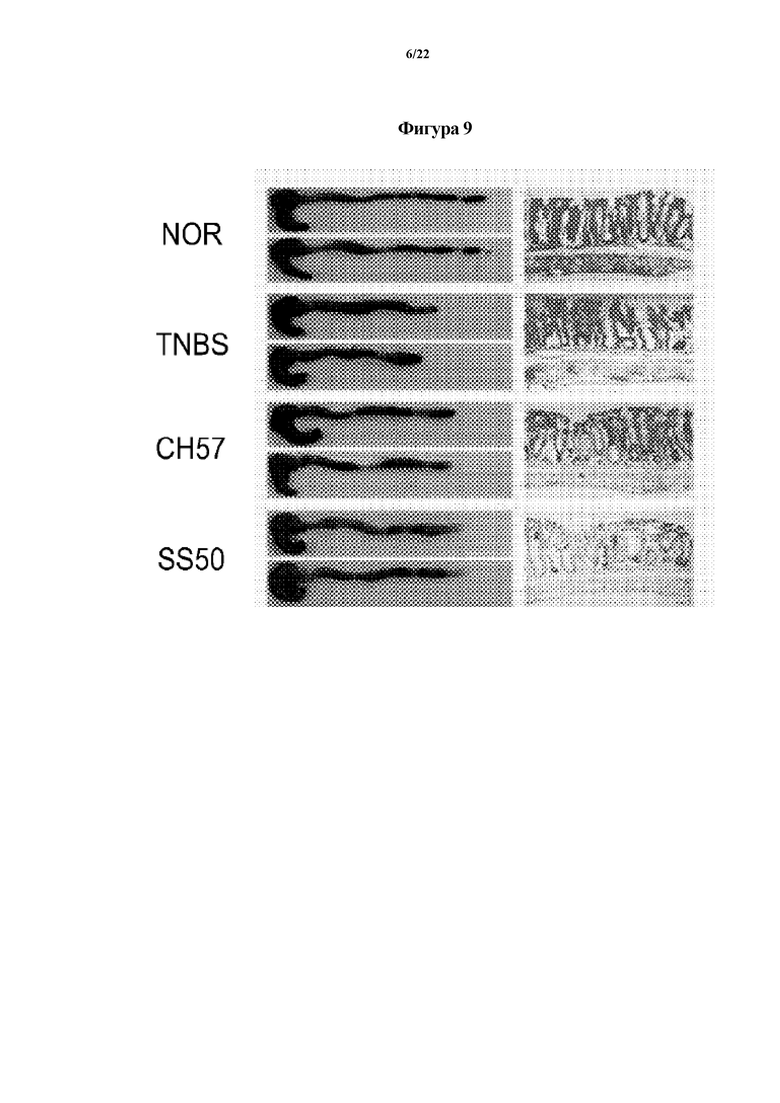
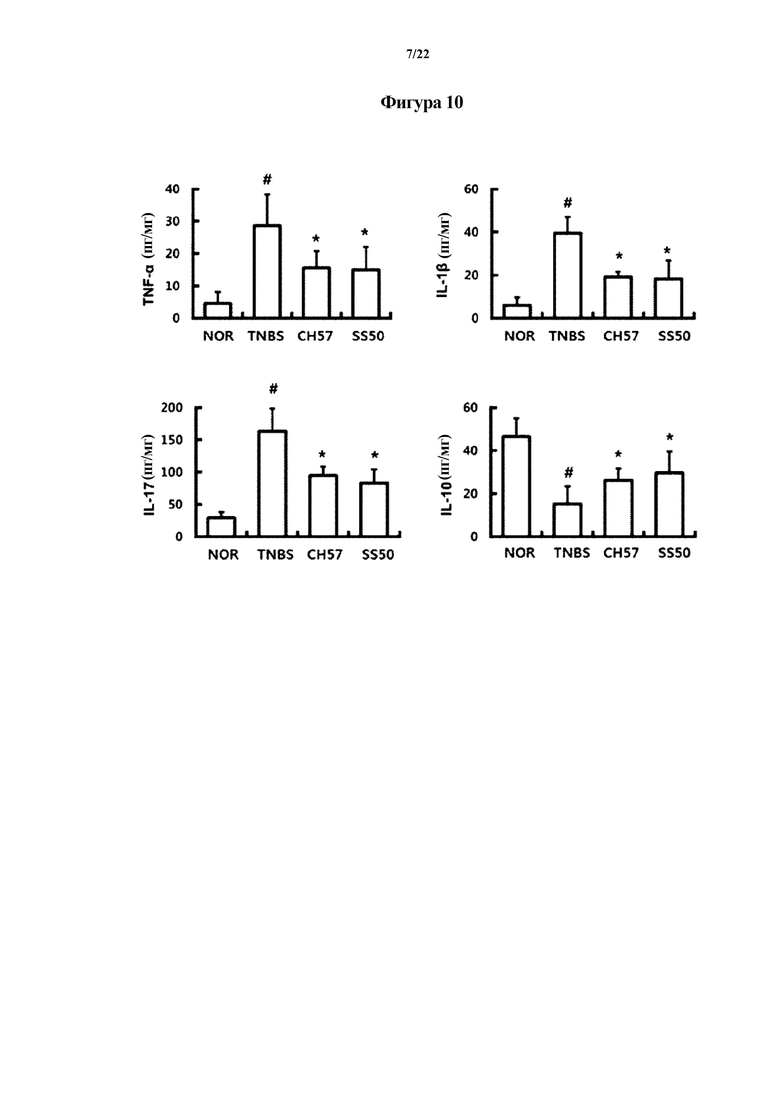
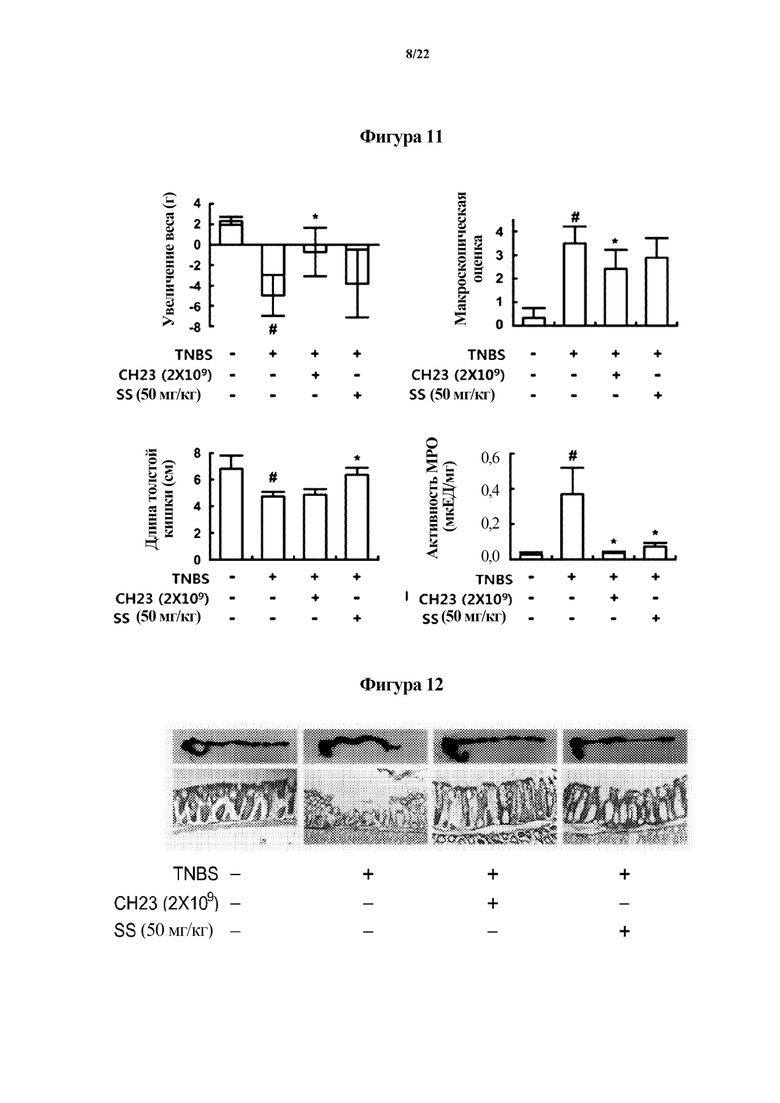

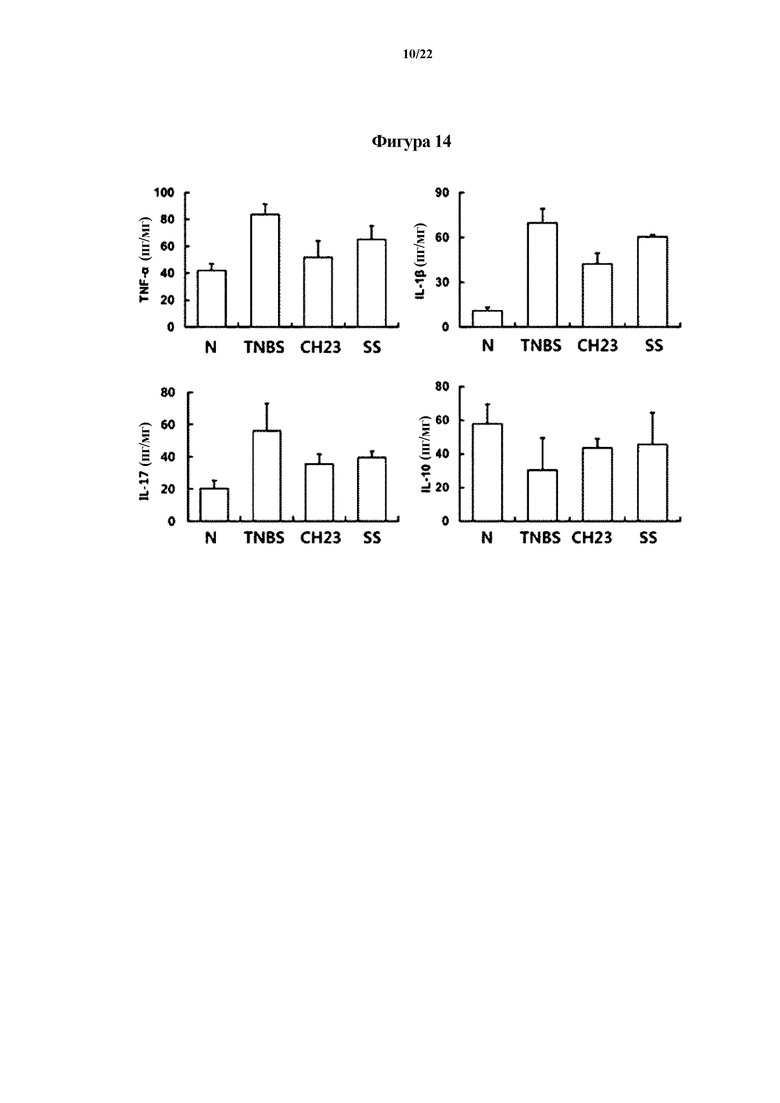
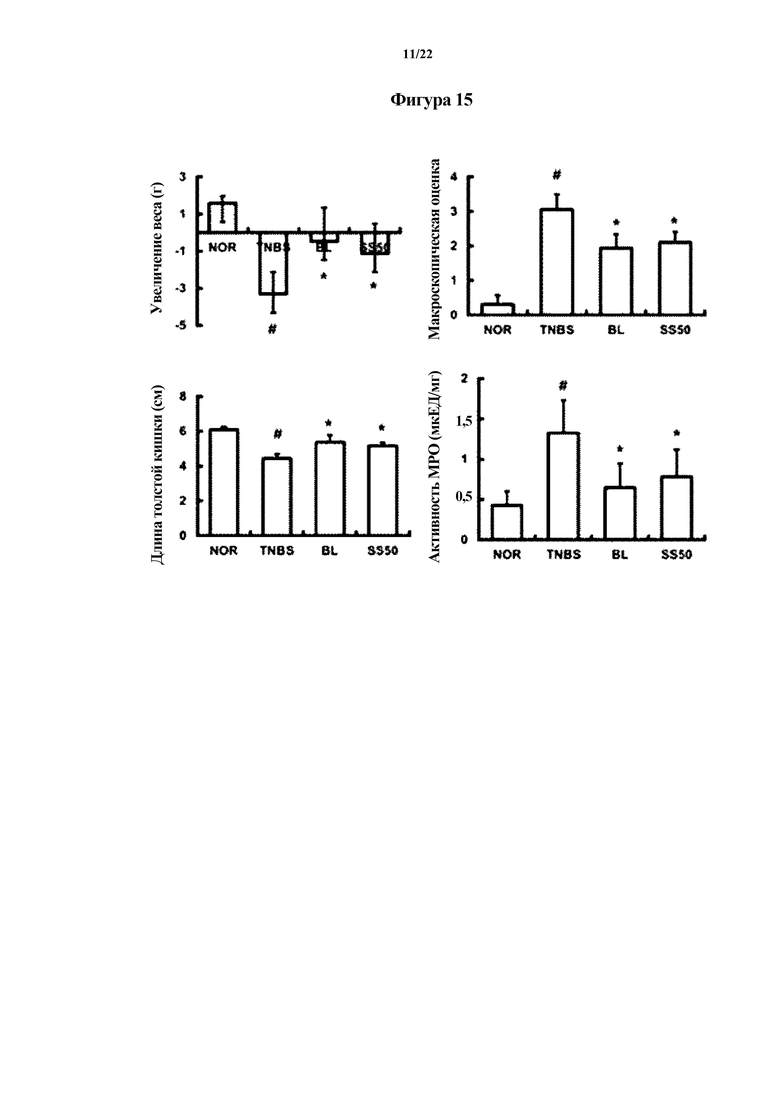
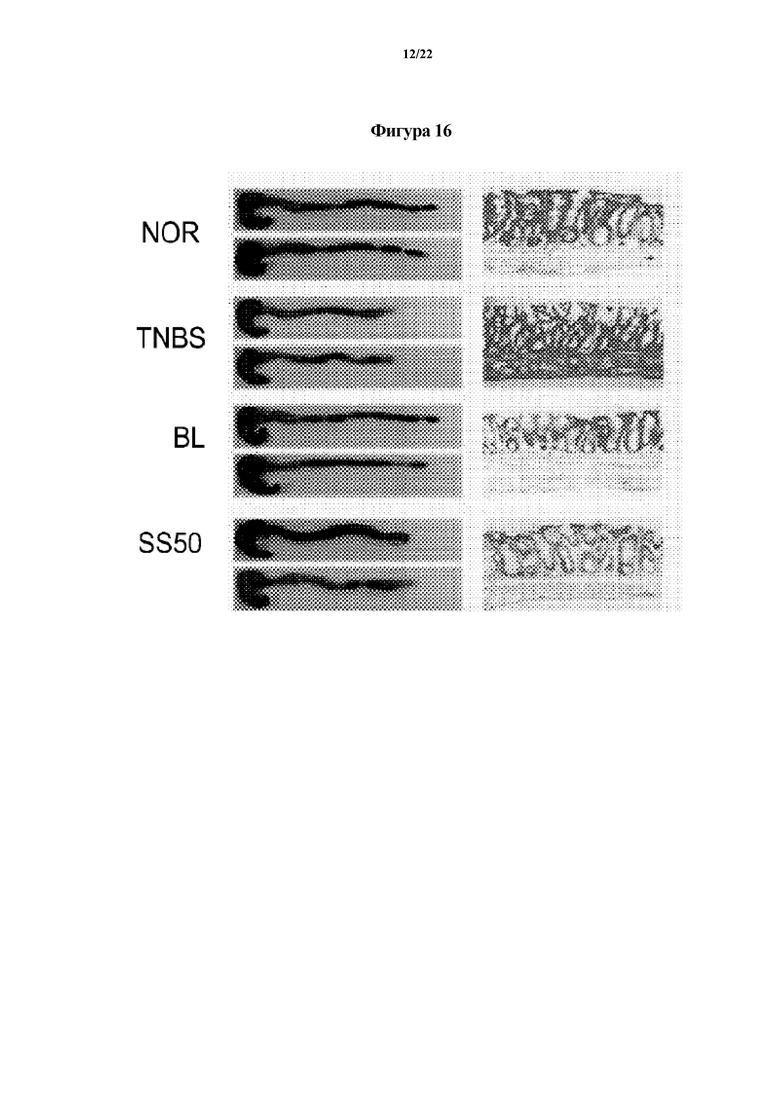
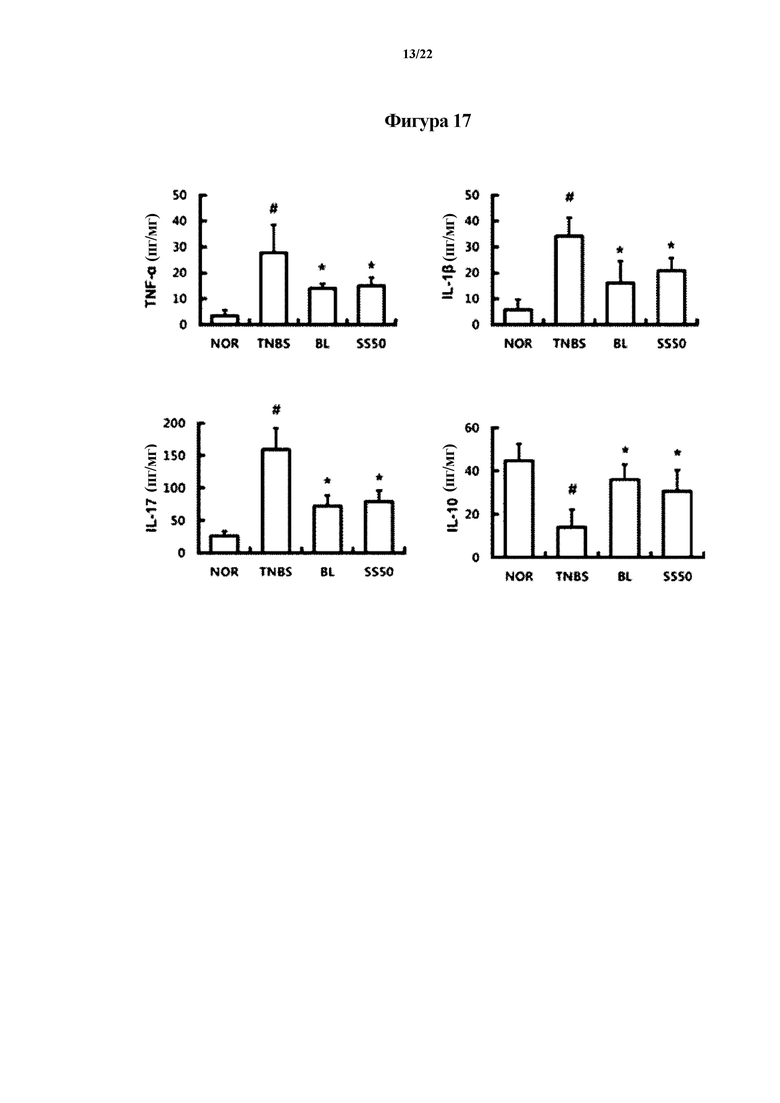
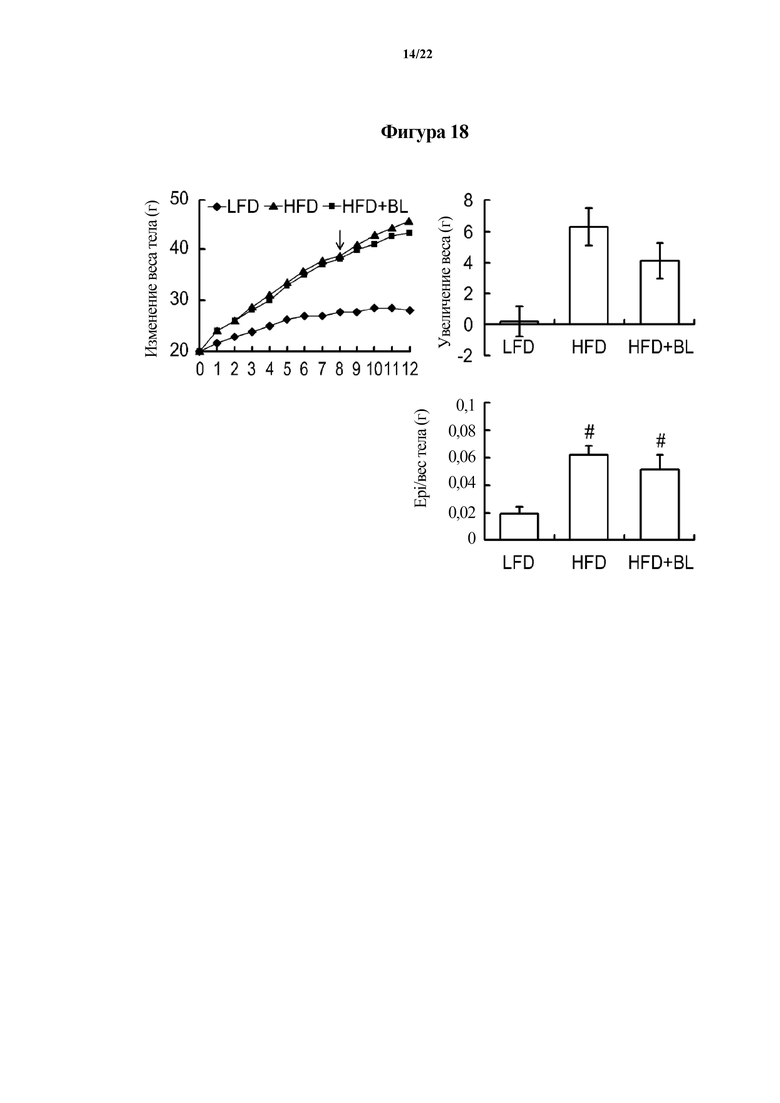
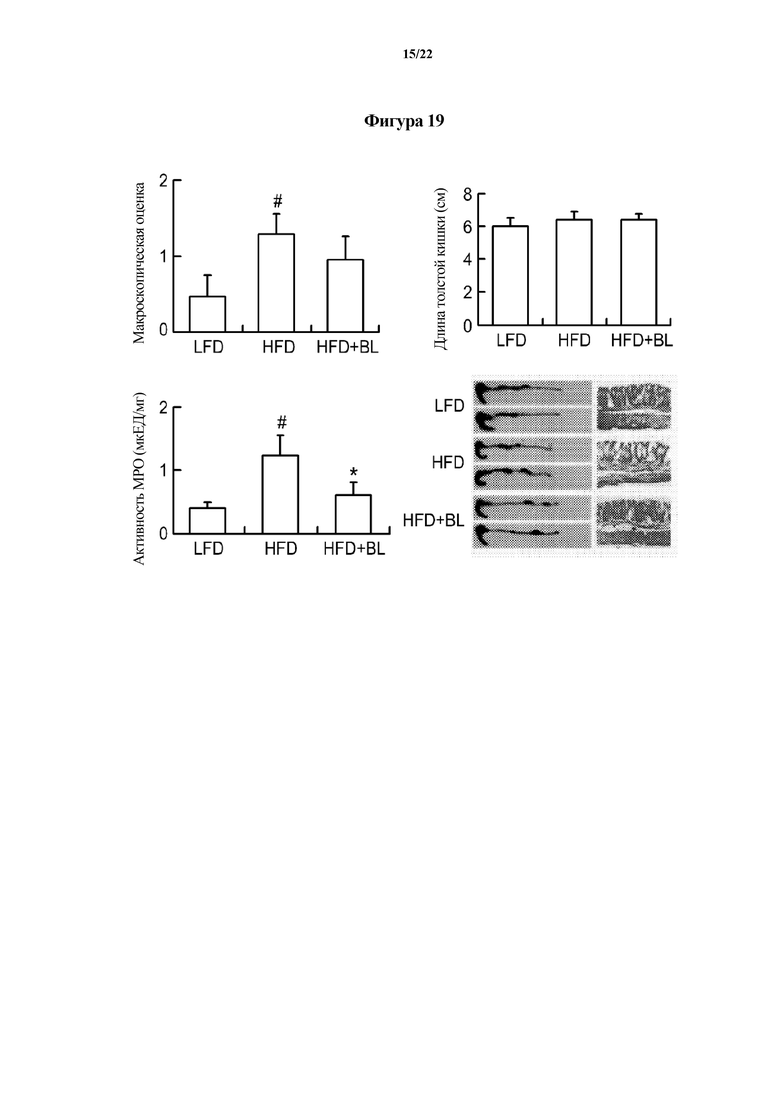

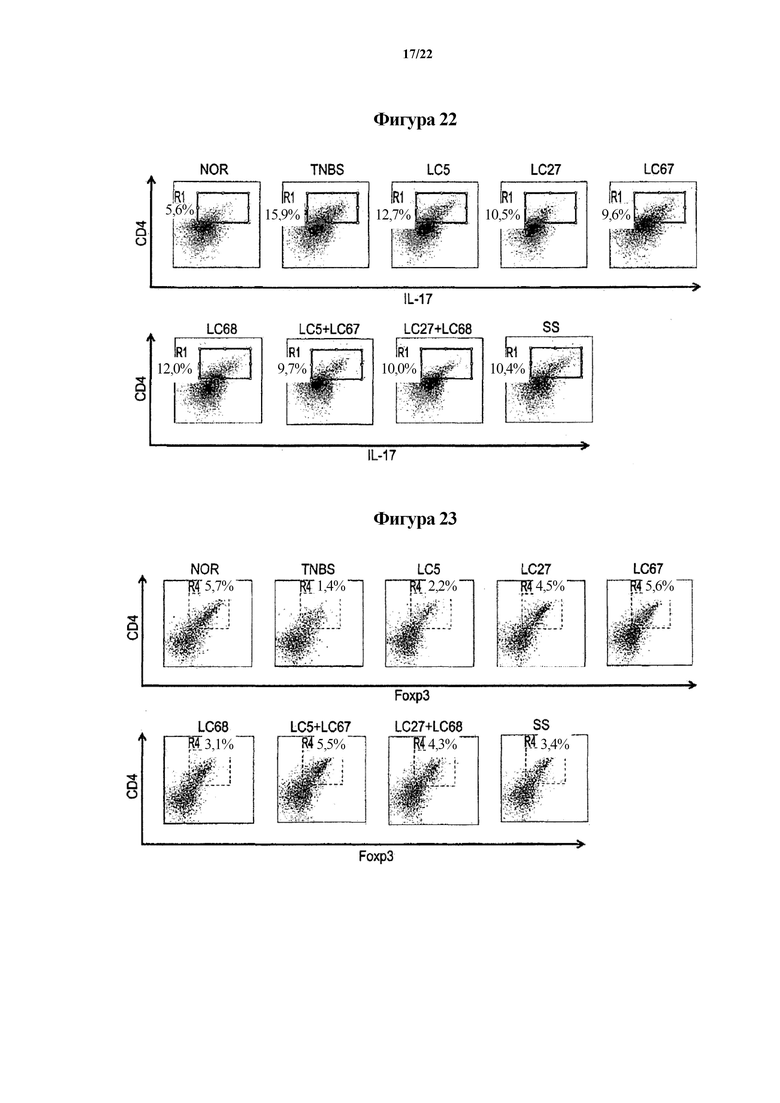
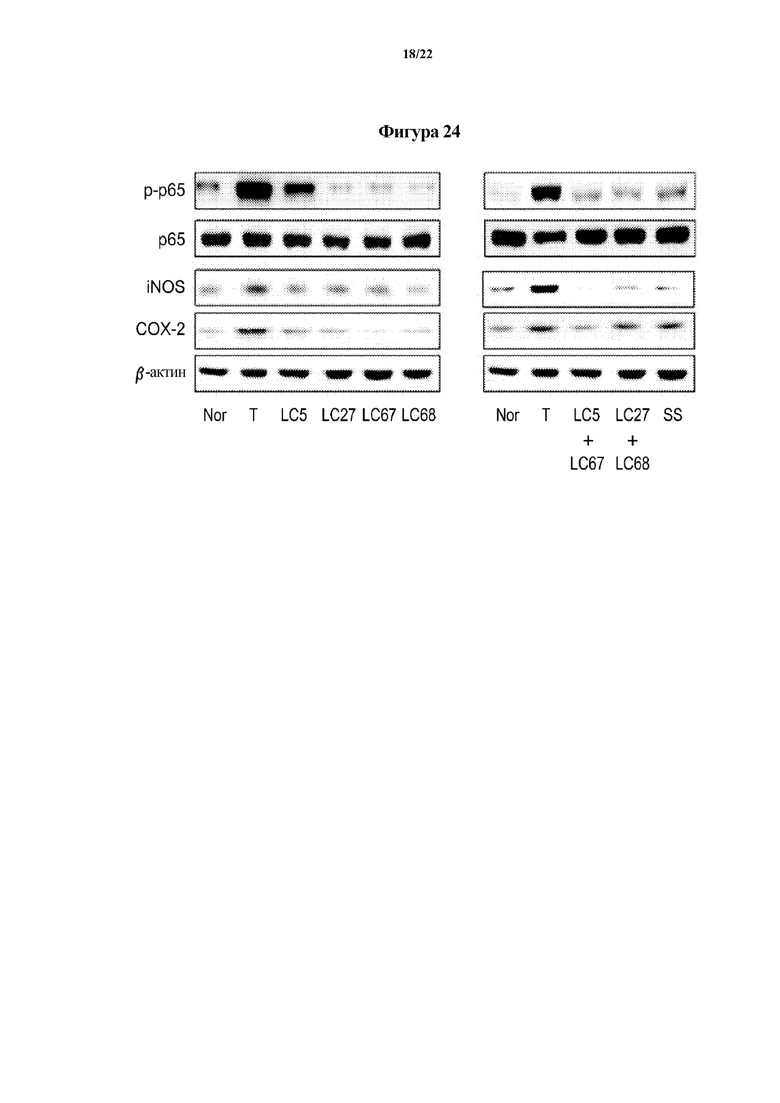
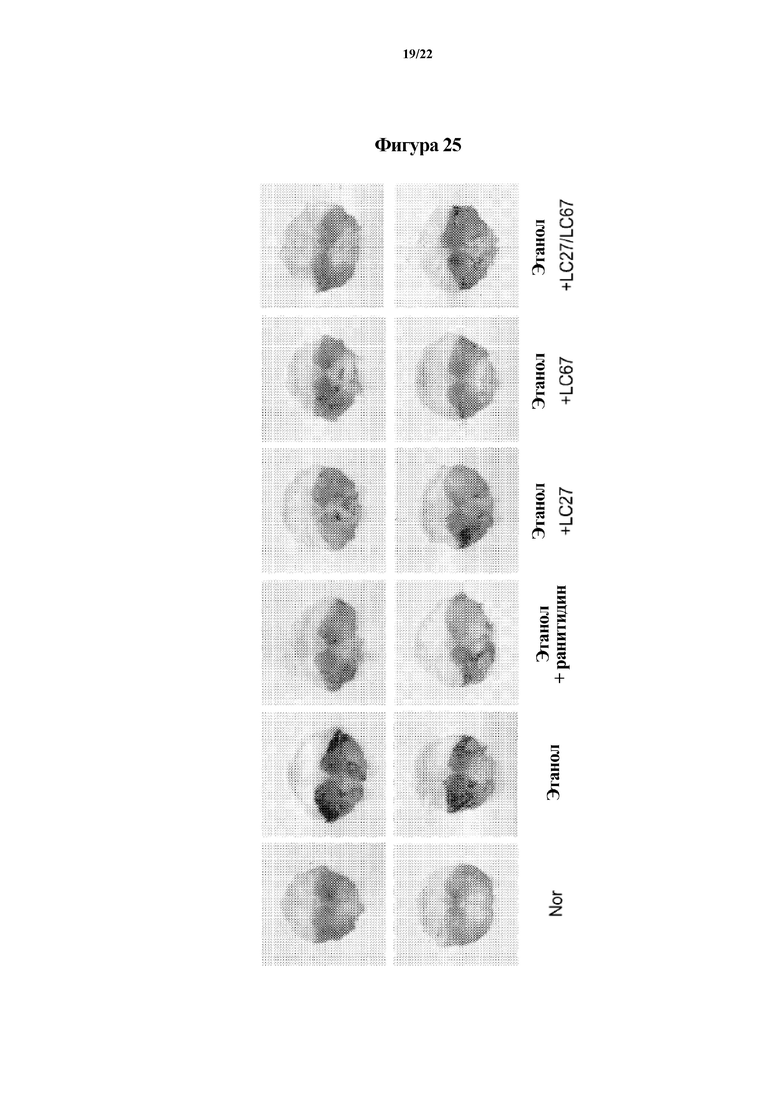

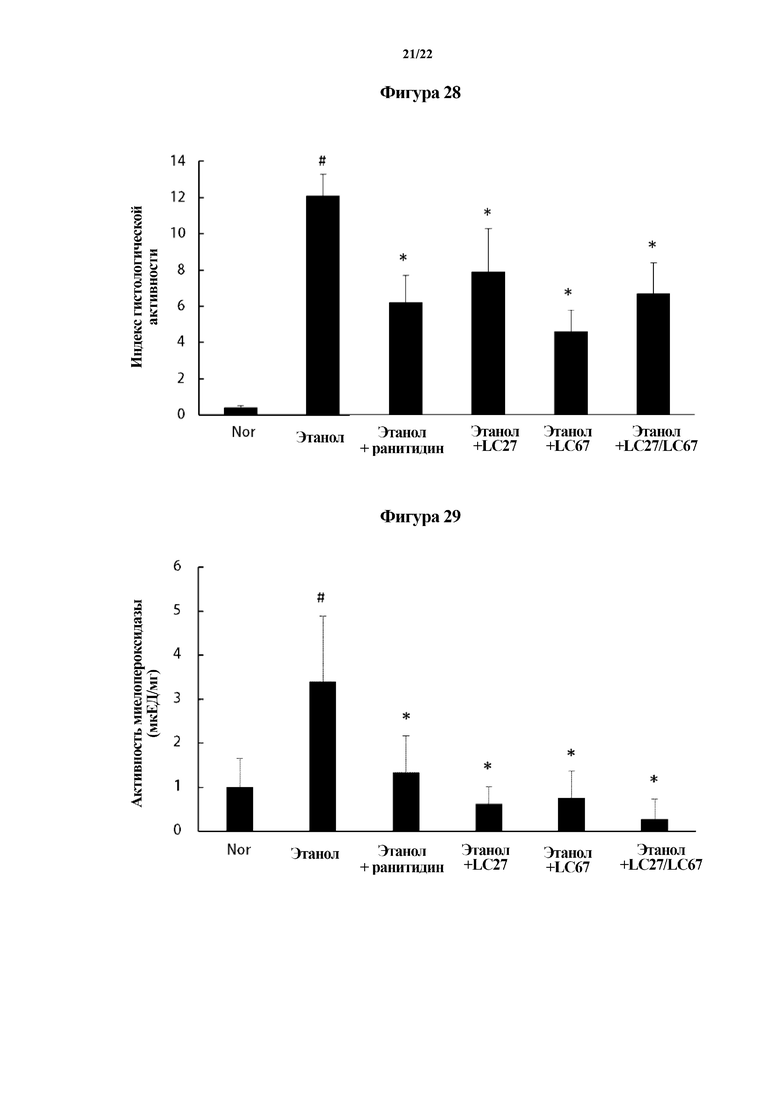
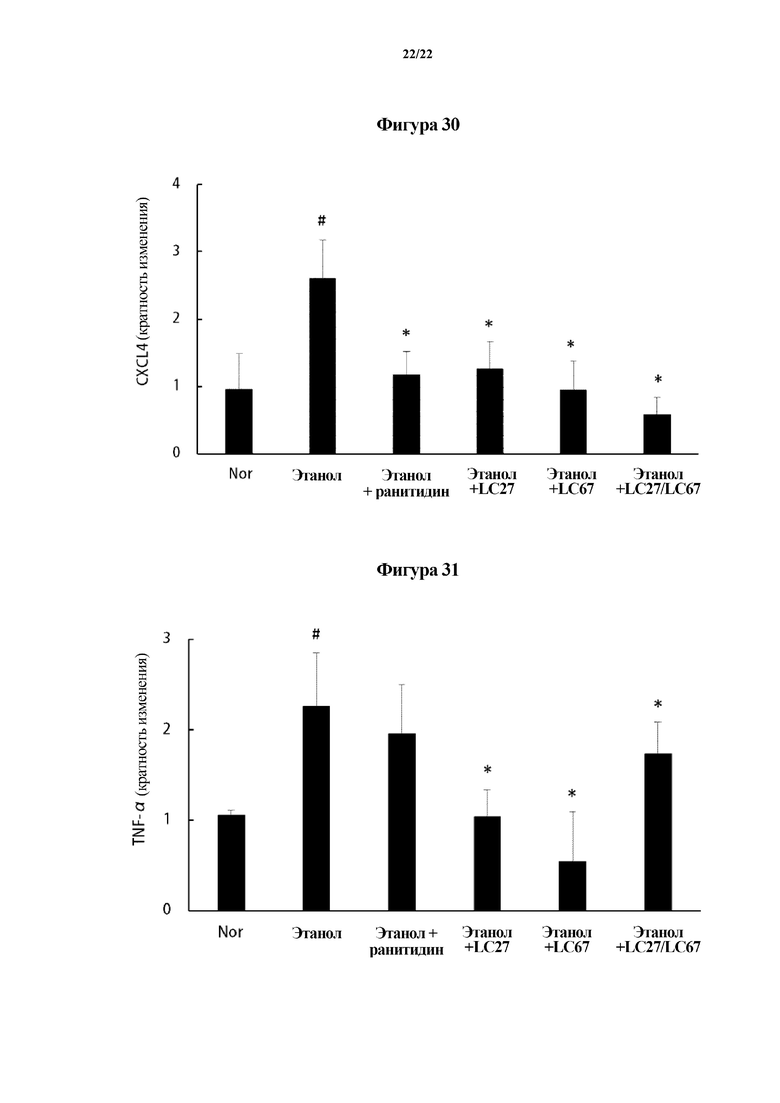
Группа изобретений относится к штамму Bifidobacterium longum, его культуре, композициям, способам. Предложен штамм Bifidobacterium longum LC67 с номером доступа KCCM 11802Р для использования в разработке функциональной пищевой и фармацевтической композиции. При этом штамм обладает антиоксидантной активностью, активностью, подавляющей бета-глюкуронидазу, активностью, подавляющей продуцирование липополисахаридов, и активностью, индуцирующей экспрессию белка плотного контакта. Предложена также культура штамма Bifidobacterium longum LC67 с номером доступа KCCM 11802Р для использования в разработке функциональной пищевой и фармацевтической композиции. Указанный штамм или его культура используются в составе фармацевтической композиции для предупреждения или лечения заболевания печени, вызванного окислительным стрессом или алкоголем. Указанные композиции применяются для изготовления лекарственного препарата. Также предложены способы предупреждения или лечения заболевания печени, вызванного окислительным стрессом или алкоголем. Изобретения эффективны в отношении предупреждения или лечения заболевания печени, вызванного окислительным стрессом или алкоголем. 8 н. и 5 з.п. ф-лы, 31 ил., 25 табл.
1. Штамм Bifidobacterium longum LC67 с номером доступа KCCM 11802Р для использования в разработке функциональной пищевой и фармацевтической композиции, обладающий антиоксидантной активностью, активностью, подавляющей бета-глюкуронидазу, активностью, подавляющей продуцирование липополисахаридов, и активностью, индуцирующей экспрессию белка плотного контакта.
2. Культура штамма Bifidobacterium longum LC67 с номером доступа KCCM 11802Р для использования в разработке функциональной пищевой и фармацевтической композиции, обладающего антиоксидантной активностью, активностью, подавляющей бета-глюкуронидазу, активностью, подавляющей продуцирование липополисахаридов, и активностью, индуцирующей экспрессию белка плотного контакта.
3. Штамм Bifidobacterium longum LC67 по п. 1, где штамм Bifidobacterium longum LC67 содержит нуклеотидную последовательность 16S rDNA, представленную под SEQ ID NO: 7.
4. Фармацевтическая композиция для предупреждения или лечения заболевания печени, вызванного окислительным стрессом, содержащая фармацевтически эффективное количество штамма Bifidobacterium longum LC67 с номером доступа KCCM 11802Р или культуры штамма Bifidobacterium longum LC67 с номером доступа KCCM 11802Р.
5. Фармацевтическая композиция для предупреждения или лечения заболевания печени, вызванного алкоголем, содержащая фармацевтически эффективное количество штамма Bifidobacterium longum LC67 с номером доступа KCCM 11802Р.
6. Способ предупреждения или лечения заболевания печени, вызванного окислительным стрессом, включающий введение фармацевтической композиции, содержащей фармацевтически эффективное количество штамма Bifidobacterium longum LC67 с номером доступа KCCM 11802Р или культуры штамма Bifidobacterium longum LC67 с номером доступа KCCM 11802Р, субъекту.
7. Способ предупреждения или лечения заболевания печени, вызванного алкоголем, включающий введение фармацевтической композиции, содержащей фармацевтически эффективное количество штамма Bifidobacterium longum LC67 с номером доступа KCCM 11802Р.
8. Применение фармацевтической композиции, содержащей фармацевтически эффективное количество штамма Bifidobacterium longum LC67 с номером доступа КССМ 11802Р или культуры штамма Bifidobacterium longum LC67 с номером доступа KCCM 11802Р, для изготовления лекарственного препарата, предназначенного для предупреждения или лечения заболевания печени, вызванного окислительным стрессом.
9. Применение фармацевтической композиции по п. 8, где композиция дополнительно содержит фармацевтически эффективное количество одной или более молочнокислых бактерий, выбранных из группы, состоящей из штамма Lactobacillus brevis СН23 с номером доступа KCCM 11762Р, штамма Bifidobacterium longum СН57 с номером доступа KCCM 11764Р, штамма Lactobacillus plantarum LC5 с номером доступа KCCM 11800Р.
10. Применение фармацевтической композиции по п. 8, где заболевание печени выбрано из группы, состоящей из неалкогольного гепатита, неалкогольного ожирения печени и неалкогольного цирроза печени.
11. Применение фармацевтической композиции, содержащей фармацевтически эффективное количество штамма Bifidobacterium longum LC67 с номером доступа KCCM 11802Р, для изготовления лекарственного препарата, предназначенного для предупреждения или лечения заболевания печени, вызванного алкоголем.
12. Применение фармацевтической композиции по п. 11, где композиция дополнительно содержит фармацевтически эффективное количество одной или более молочнокислых бактерий, выбранных из группы, состоящей из штамма Lactobacillus brevis СН23 с номером доступа KCCM 11762Р, штамма Bifidobacterium longum CH57 с номером доступа KCCM 11764Р и штамма Lactobacillus plantarum LC5 с номером доступа KCCM 11800Р.
13. Применение фармацевтической композиции по п. 11, где заболевание печени выбрано из группы, состоящей из алкогольного гепатита, алкогольного ожирения печени и алкогольного цирроза печени.
| HAN S.Y | |||
| ET AL | |||
| Hepatoprotective effect of lactic acid bacteria, inhibitors of beta-glucuronidase production against intestinal microflora | |||
| Arch Pharm Res | |||
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| PMID: 15832821 | |||
| US 7544356 B2, 09.06.2009 | |||
| WO 2013109635 A1, 25.07.2013 | |||
| ПРОБИОТИЧЕСКИЙ ШТАММ БИФИДОБАКТЕРИЙ | 2010 |
|
RU2546251C2 |
Авторы
Даты
2022-03-15—Публикация
2020-09-30—Подача