Изобретение относится к области ветеринарной паразитологии и может быть использовано в птицеводческих хозяйствах разной специализации при заболеваниях молодняка кур и индеек аскаридиями.
Птицеводство играет большую роль в производстве животного белка, важнейшей составляющей питания человека. На сегодня наша страна входит в пятерку крупнейших стран в мире по производству мяса птицы и яиц: при чем основными производителями мяса птицы у нас являются птицефабрики, их доля в общем объеме составляет более 92%.
Проведенными исследованиями установлено влияние технологии содержания птиц на эпизоотическое состояние хозяйства.
Работами ученых доказано, что каждое птицеводческое хозяйство, практикующее напольное содержание птиц, неблагополучно по паразитарным болезням, и чаще всего, гельминтами и особенно аскаридиями.
Несмотря на проведение противоэпизоотических мероприятий, полной профилактики паразитозов среди поголовья в птицеводческих хозяйствах не достигается. Об этом свидетельствуют работы отечественных и зарубежных ветеринарных паразитологов [1-5].
Аскаридиозом наиболее часто и тяжело болеют цыплята и молодняк до 8-10-месячного возраста. Взрослые куры в основном болеют в субклинической форме и являются разносчиками инвазии. Среди разных пород кур наиболее восприимчивы к инвазии куры русской белой и юбилейной пород, а более устойчивы к ней куры породы род-айланд. При этом источником заражения цыплят аскаридиозом могут служить не только зараженные куры, но и перезимовавшие яйца аскаридий. Следует учесть, что самки аскаридий весьма плодовиты: в течение своей жизни одна самка способна выделить до 50 млн. яиц, которые повсюду рассеиваются в птичнике и во внешней среде. Отсюда, самые опасные очаги инвазии - птичники, выгульные площадки, где скапливается контаминированный инвазионными элементами помет кур и молодняка.
Инвазирование молодняка птиц может происходить в любое время года, но наиболее интенсивное течение отмечают во влажный теплый сезон.
В неблагополучных птицеводческих хозяйствах передача инвазии происходит через загрязненные яйцами аскаридий подстилку, инвентарь, корма и воду. Механическими разносчиками яиц аскаридий часто становятся синантропные птицы, грызуны, насекомые: мухи, тараканы, сверчки, а также обслуживающий персонал - на обуви, одежде и предметах ухода за птицей. Широкому распространению аскаридиоза среди цыплят способствует различные нарушения технологии выращивания молодняка: повышенная влажность воздуха и подстилки, скученность птицы в помещениях, неполноценное кормление, контакт между цыплятами и птицей старших возрастных групп и нарушения ветеринарно-санитарных правил. К тому же яйца аскаридий устойчивы во внешней среде и даже в зонах с дождливым летом и холодными зимами яйца аскаридий птиц способны сохранять жизнеспособность больше года.
Для достижения устойчивых результатов в борьбе с аскаридиозом кур усилиями ученых и практиков предложено ряд средств и препаратов как против эндогенных стадий, так и против экзогенных. Проблема аскаридиоза птиц продолжает ставить задачи перед исследователями, а именно совершенствовать меры борьбы с инвазией и разрабатывать способ борьбы с экзогенной стадией развития яиц аскаридий кур при напольной технологии их содержания, особенно ремонтного молодняка кур яичных пород.
В числе современных средств, используемых против экзогенных стадий развития яиц аскаридий птиц, следует отметить: 4%-ный раствор едкого натрия, который должен иметь температуру не ниже 80°С; 7%-ный раствор аммиака; 2%-ная эмульсия ортохлорфенола; 10%-ный раствор однохлористого йода, однака эффективность отмеченный ранее средств не устраивает запросы современного птицеводства, которые требует комбинированные средства, состоящие из нескольких активных компонентов и вспомогательных веществ.
В качестве комбинированного средства можно рассматривать следующее, которое в своем составе в качестве действующих веществ содержит: парахлорметаксиленол, сульфоновую кислоту, молочную кислоту, а также вспомогательные моменты: поверхностно-активные вещества при их совместном применении в оптимальных концентрациях.
Первые два из отмеченных веществ: парахлорметаксиленол и сульфоновая кислота известны как высокоэффективные средства при инфекциях бактериальной, вирусной и грибковой этиологии, а также для уничтожения спорулированных и неспорулированных форм риккетсий и эймерий в птицеводстве. Следующее вещество, входящее в состав рассматриваемого средства, - молочная кислота, является антисептиком и оказывает действие на оболочку яиц аскаридий, облегчает доступ действующим веществам (ДВ). Рассматриваемые выше вещества при совместном применении против яиц аскаридий птиц оказывают синергическое действие на биологические объекты, а используемые вспомогательные компоненты - поверхностно-активные вещеста, обеспечивают очистку пола, стен и технологического оборудования от биозагрязнений и равномерно распределяют ДВ по поверхности, обеспечивая высокую эффективность.
В задачу наших исследований входило разработать способ дезинвазии против экзогенной стадии развития яиц аскаридий птиц при напольной технологии содержания доступными средствами пригодными для применения как ручным, так и механизированным способом, не оказывая повреждающее действие на обрабатываемое технологическое оборудование.
Решение поставленной задачи достигается тем, что в качестве способа дезинвазии против экзогенных стадий развития аскаридий птиц для обработки птичников было использовано составленное нами комплексное средство, имеющее следующий состав: парахлорметаксиленол - 34%, сульфоновая кислота - 26%, молочная кислота - 5%, вспомогательные компоненты - поверхностно активные вещества - 23%, вода - до 100% и назвали мы его «аскарицид». Из доступных заявителю источников информации не известна указанная совокупность существующих признаков, позволяющих получать указанный технический результат, поэтому заявляемое изобретение соответствует условию патентоспособности «новизна».
Заявителю не известны средства аналогичного назначения, в которых были раскрыты отличительные признаки заявляемого изобретения с получением от использования его в какой-либо совокупности признаков указанного технического результата. Следовательно, заявляемое изобретение соответствует условию патенспособоности «изобретательский уровень».
Доказательства промышленной применимости заявляемого приводятся в следующих примерах.
Пример 1. Приготовление рабочих растворов с разными концентрациями средства дезинвазии.
Исследования по данной проблеме проводили в условиях лаборатории «Всероссийского научно-исследовательского института фундаментальной и прикладной паразитологии животных и растений имени К.И. Скрябина (ВНИИП) - филиал ФГБНУ ФНЦ ВИЭВ РАН (г. Москва).
Рабочий раствор с разными концентрациями комбинированного дез. средства - «аскарицид» готовили следующим образом. Взяли четыре чистые стеклянные колбы на один литр и наливали по 700 мл дистиллированной воды и в первые три из них добавляли по 5; 10 и 20 мл средства, тщательно размешивали в течение пяти минут и раствор был готов к использованию. В четвертую колбу 700 мл воды добавляли 40 г кристаллического фенола, размешивали, объем доводили до одного литра, снова размешивали, дали отстояться и раствор был готов к использованию.
Пример 2. Подготовка культуры яиц гельминтов Ascaridia galli.
Сбор яиц аскаридий из фекалий зараженных птиц проводили несколькими методами. При их выделении по флотационному методу Фюллеборна из проб зараженного молодняка кур с помощью паразитологической петли снимали поверхностную пленку и собирали в чашку Петри с дистиллированной водой, трижды отмывали яйца от соли, подсчитывали их количество в одной капле (10 мкл), затем в 1 мл, перемешивали со слоем консерванта (1%-ный раствор соляной кислоты) на дистилированной воде и использовали в дальнейшей работе.
По второму методу яйца получали из гонад половозрелых оплодотворенных самок аскаридий, которых после извлечения из кишечника отмывали физиологическим раствором. Половые продукты извлекали из концевых отделов матки, прилегающих к вагине не далее чем на 1,0-1,5 см, препарируя гельминта. Затем яйца гомогенизировали на часовом стекле и перемешивали в чашке Петри со слоем консерванта (1%-ный раствор соляной кислоты), подсчитывали их количество в 1 мл и использовали в работе.
Пример 3. Изучение овоцидной активности разных концентраций комплексного препарата «аскарицид».
Овоцидную активность разных концентраций «аскарицида» по сравнению с фенолом изучали в лабораторном опыте in vitro после культивирования яиц Ascaridia galli в чашках Петри в термостате при 26-28°С в условиях влажной камеры в течение 30 суток. В каждую камеру закладывали по 2000 экземпляров птиц аскаридий.
Первая камера служила контрольной, она оставалась без воздействия средствами дезинвазии, а культивирование в ней проходило в дистиллированной воде. Во вторую камеру внесли 4% водный раствор фенола с экспозицией 24 ч, после чего культивирование также проводили на дистиллированной воде. В третью, четвертую и пятую камеру внесли 0,5; 1 и 2% растворы «аскарицида» соответственно с экспозицией 24 ч при культивировании на дистиллированной воде. По окончании экспозиции яйца Ascaridia galli из камер 2-5 отмывали трехкратно с дистиллированной водой, затем микроскопировали для выявления морфологических изменений и ставили на культивирование. В период культивирования яиц один раз в два дня проводили аэрацию и контроль за эмбриогенезом.
Наблюдения в период культивирования яиц показали, что в первой камере (контрольная) развитие яиц аскаридий с образованием бластомеров отмечали начиная с третьих суток, а образование личинок в яйцах - на 10-12 сутки после постановки на культивирование. Личинки в яйцах были подвижные с 14 до 20 сутки, затем они были в покое и становились подвижными только при подогревании. Во второй камере (фенол, 4%) в процессе культивирования бластомеров образовалось на порядок меньше. В третьей камере («аскарицид» 0,5%) за все время культивирования бластомеры в яйцах развивались только у незначительной их части. В четвертой и пятой камерах («аскарицид», 1 и 2% соответственно) за все время культивирования бластомеры в яйцах не развивались.
Оценку выживаемости яиц в ходе культивирования устанавливали путем подсчета под микроскопом (по 100 яиц из каждой камеры). В первой контрольной камере (дистиллированная вода) погибших яиц было 2%. Во второй камере (фенол) погибших было 88%. В третьей камере («аскарицид», 0,5%) погибших яиц было 96%. В четвертой и пятой камерах при осмотре все яйца были погибшими.
При осмотре после культивирования пробы из первой контрольной камеры (дистиллированная вода) нами было обнаружено 98 подвижных личинок. В пробах из второй (фенол) и третьей («аскарицид», 0,5%) камер после центрифугирования находили 12 и 4 подвижных личинок аскаридий соответственно. В пробах из четвертой и пятой камер подвижных личинок внутри яиц аскаридий не обнаружено.
Для определения интенсэффективности использованных дезинфектантов и разных концентраций была использована следующая форма:
ИЭ=(КЯЛК-КЯЛО)/КЯЛК×100,
где ИЭ - интенсэффективность препарата (концентрации), %;
КЯЛК - количество яиц с личинками в контрольной группе, экз.;
КЯЛО - количество яиц с личинками в опытной группе, экз.
Используя полученные нами в опыте данные, определили интенсэффективность «аскарицида» в концентрации 0,5%:
ИЭ0,5%=(98-4)/98×100=95,92%
Интенсэффективность испытанного нами препарата «аскарицид» в концентрациях 1 и 2% составила 100%, поскольку все осмотренные после центрифугирования яйца аскаридий были погибшими.
Следует отметить, что под действием водного раствора «аскарицида» в концентрации 1% все заложенные яйца погибают, но их количество сохраняется (100 экз.), тогда как при использовании концентрации 2% из общего количества заложенных яиц аскаридий оставалось только 9 экз. погибших яиц, которые были сильно деформированы.
Взятый нами в качестве препарата сравнения фенол (4%) показал против яиц аскаридий птиц следующую эффективность:
ИЭф=(98-12)/98×100=87,8%
Поскольку в четвертой и пятой камерах (концентрации «аскарицид» 1 и 2%) все осмотренные после центрифугирования яйца были погибшими, биопроба с материалом из этих камер не проводилась, и был использован только материал из первых трех камер.
Жизнеспособность яиц аскаридий определяли при световой микроскопии, путем окрашивания витальными красками по 30 яиц из каждой камеры. Для окраски яиц использовали раствор, состоящий из метиленового синего, молочной кислоты и едкой щелочи в соотношении 0,05 г; 0,5 г и 15 мл соответственно. Живые яйца из камер не окрашивались, а зародыши мертвых яиц были окрашены в синий цвет. Жизнеспособность личинок оценивали по их подвижности.
Для подтверждения жизнеспособности яиц после обработки препаратами проводили биологическую пробу в условиях вивария института на 20 цыплятах породы юбилейная, мясо-яичного направления продуктивности 15-дневного возраста, которые были приобретены в птицеводческом хозяйстве Московской области.
Опытных цыплят подвергали нумерации и индивидуальному взвешиванию и разделили по принципу аналогов на четыре группы (по 5 голов в каждой) и содержали их в сетчатых клетках с 16 по 51 дня жизни. В 16 дней всех цыплят подвергали копроскопическому обследованию по методу Дарлинга; по его результатам, они были свободны от яиц гельминтов и ооцист эймерий. Цыплят распределили следующим образом: 1 группа - контрольная незараженная, им в 16 дней задавали по 1 мл физраствора с помощью микропипетки; 2 группа - контрольная зараженная, которая получала по 1 мл суспензии яиц аскаридий (400 экз.) на 1 голову; 3 группа - зараженная материалом после воздействия фенолом (4%) при той же концентрации яиц аскаридий (400 экз./мл); 4 группа - зараженная материалом после воздействия «аскарицида» (0,5%) при той же концентрации яиц аскаридий.
За все время опыта цыплята всех четырех групп находились в аналогичных условиях содержания и получали одинаковый рацион. В течение всего периода опыта (35 дней, с 16 до 51 дня жизни) за цыплятами вели ежедневные клинические наблюдения за общим состоянием, поведением, приемом корма и воды, видимыми физиологическими изменениями.
Для определения концентрации яиц аскаридий в фекалиях от цыплят каждой группы отдельно брали пробы на 20; 25; 30 и 35 дни после инокуляции.
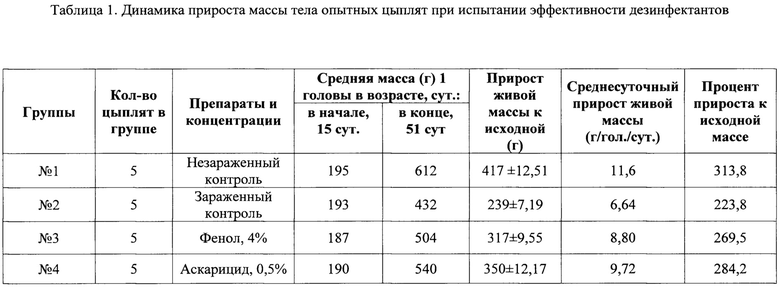
Исследования in vivo. По данным клинических исследований цыплята разных групп имели лишь незначительные отличия. У цыплят 1 группы (интактный контроль) во все сроки исследований яиц аскаридий не находили, тогда как у цыплят 2 группы (зараженного контроля) яйца находили через 25; 30 и 35 дней после инокуляции в количестве от 840 до 3500 экз./г помета. У цыплят 3 группы (фенол) яйца находили через 30 и 35 дней после инокуляции в количестве 460-1600 экз./г помета. Цыплята 4 группы («аскарицид», 0,5%) также выделяли с фекалиями яйца через 30 и 35 дней после инокуляции в количестве 280-740 экз./г помета (табл. 1).
На 36 день опыта цыплят всех четырех групп подвергали взвешиванию, убою и вскрытию. По данным вскрытия цыплята 1 контрольной группы были свободны от аскаридий. У цыплят 2 контрольной группы в кишечнике находили в среднем 46 экз. аскаридий. У цыплят 3 группы (фенол) аскаридий были найдены в кишечнике двух цыплят в количестве 7 и 16 экз. У цыплят 4 группы («аскарицид», 0,5%) аскаридий обнаружены в кишечнике только у одного цыпленка в количестве 8 экз.
Результаты биопробы с экспериментальным заражением цыплят показали поголовное инвазирование цыплят зараженного контроля (экстенсинвазированность, ЭИ - 100%), что свидетельствует об успешном функционировании данной модели, при достаточно высокой интенсивности аскаридиозной инвазии (интенсивность инвазии ИИ - 46 экз).
Цыплята 3 группы, получавшие материал, обработанный 4%-ным раствором фенола, были заражены аскаридиями на 40% (ЭИ 40%), при средней интенсивности инвазии 11,5 экз. (ИИ - 11,5 экз./голову).
Наименьшее заражение аскаридиями было у цыплят 4 группы, получавших материал, обработанный 0,5% раствором «аскарицида».
Результаты взвешивания цыплят показали, что незараженный контроль имел наибольший прирост по отношению к исходной массе, тогда как цыплята 2 группы (зараженный контроль) - наименьший. Безусловно, аскаридий в кишечнике зараженных цыплят оказали отрицательное влияние на усвоение корма и рост. Цыплята обеих групп, получавших обработанные препаратами суспензии аскаридий, характеризовались промежуточными значениями данного показателя. Среднесуточный прирост живой массы цыплят следовал аналогичной закономерности.
Полученные данные показывают, что под влиянием интенсивной аскаридиозной инвазии цыплята зараженного контроля (2 группа) имели за время опыта прирост живой массы достоверно меньше - на 29,4%, чем цыплята незараженного контроля (р<0,05). В 3 и 4 группах (получавших суспензии яиц, обработанные фенолом и «аскарицидом» (0,5%) соответственно), отставали от незараженного контроля на 23,98 и 16,1% соответственно.
Пример 4. Производственное испытание эффективности комплексного средства «аскарицид» против яиц аскаридий индюшат.
Эффективность комплексного средства «аскарицид» 1%-ный против яиц аскаридий индюшат в производственном испытании устанавливали опытным путем с искусственной закладкой яиц аскаридий на контрольные площадки по сравнению с базовым препаратом фенолом 4%-ным при экспозиции 2 часа. Испытание проводили в условиях индейководческого хозяйства Московской области в марте-апреле 2021 года. В птичнике №2 с бетонным полом, где заранее проводили чистку и дезинфекцию, были выбраны три площадки по 1 м2. Каждая площадка была отделена от другой пластиковыми рейками и площадки имели ровную поверхность для исключения подтека дезраствора. В начале испытания на площадки равномерно наносили приготовленную культуру A.galli в разведении с 50 мл дистиллированной воды, используя малый пульверизатор и оставляли на 20 минут для пропитывания. На каждую площадку наносили по 2000 инвазированных яиц аскаридий. По истечении времени на опытную площадку №1 наносили комплексное средство «аскарицид» 1%-ный, норма 0,2 л на 1 м2 при экспозиции 2 часа, на площадку №2 наносили раствор фенола 4%-ного при норме 0,5 л на 1 м2 и экспозиции 2 часа. Площадка №3 была контрольная и препарат для дезинвазии не наносили.
По истечении 2 часов из поверхности каждой площадки брали смывы, используя кисточку и дистиллированную воду. Собранный с поверхности каждой площадки смыв переносили в пластиковую бутылку, объем доводили до 1000 мл, перемешивали 2-3 раза и оставляли на 24 часа при комнатной температуре (+20±2°). По истечении времени содержимое сливали до отметки, оставшиеся 30 мл раствора использовали для биопробы.
Смывы, собранные из площадок №1, №2 и №3 были использованы для биопробы на индюшатах 15-суточного возраста. В каждой группе было по 4 цыпленка, которым задавали по 1 мл суспензии с яйцами A.galli в дозе 500 экз. на голову.
Оценку общего состояния опытных индюшат после назначения суспензии яиц аскаридий, оценивали по данным ежедневных клинических наблюдений.
Для установления зараженности аскаридиями опытных индюшат подвергали копроскопическим исследованиям по Фюллеборну через 15, 20, 25 и 30 дней после биопробы.
По результатам проведенных исследований индюшата первой группы, получавшие яйца аскаридий, обработанные средством «аскарицид» были свободны от аскаридий. Во второй группе один цыпленок был инвазирован аскаридиями (11 экз.), тогда как в контрольной группе все цыплята были заражены аскаридиями, их количество при вскрытии показало от 27 до 45 экз. на кишечник.
При производственном испытании средство «аскарицид» 1%-ный показал высокую эффективность против яиц аскаридий индюшат: ИЭ - 100%. Тогда как интенсэффективность базового препарата фенола 4%-ного составило 84,7%.
Результаты проведенных лабораторных исследований по изучению овоцидных свойств комплексного средства «аскарицид» в разных концентрациях в опыте in vitro на дистиллированной воде показали, что под действием разных его концентраций количество погибших яиц аскаридий Ascaridia galli (интенсэффективность) составило: для 0,5% раствора - 95,9%; 1 и 2% - 100%. Использованный в качестве препарата сравнения фенол (4%) показал интенсэффективность 87,8%.
В связи с тем, что по результатам испытаний концентрации «аскарицид» 1 и 2% показали одинаковую 100%-ную эффективность, то для широкого практического применения для обработки против яиц аскаридий птичников в период их подготовки к заселению молодняком кур, по экономическим соображениям, следует рекомендовать 1% концентрацию препарата.
Испытания показали высокую эффективность комплексного средства «аскарицид» в 1% концентрации против аскаридий молодняка кур и индеек. Производственное испытание средства «аскарицид» 1%-ный показал высокую эффективность против яиц аскаридий индюшат: ИЭ - 100%. Данная концентрация может быть рекомендована к применению в птицеводческих хозяйствах страны при подготовки птичников к заселению молодняком против экзогенных стадий аскаридий.
Источники информации
1. Акбаев М.Ш., Василевич Ф.И., Акбаев Р.М и др. Паразитология и инвазионные болезни животных. - М., 2008. - 776 с.
2. Инструкция о мероприятиях по предупреждению и ликвидации заболеваний животных гельминтозами. - М., 1999. - 72 с.
3. Правила проведения дезинфекции и дезинвазии объектов госветнадзора. - М., 2002. - 74 с.
4. Сафиуллин Р.Т. Паразитарные болезни птиц, средства и методы борьбы. - М., 2019 - 260 с.
5. Чалышева Э.И., Сафиуллин Р.Т. Эпизоотическая ситуация по кишечным паразитическим простейшим молодняка индеек на птицефабриках центральной России // Сборник научных статей по материалам международной научной конференции «Теория и практика борьбы с паразитарными болезнями». - М., 2019. - С. 690-695.
| название | год | авторы | номер документа |
|---|---|---|---|
| Средство для дезинвазии объектов внешней среды | 2020 |
|
RU2748168C1 |
| Средство для дезинвазии объектов внешней среды | 2020 |
|
RU2727519C1 |
| Система мероприятий по борьбе с эндо- и экзогенными стадиями кокцидий цыплят-бройлеров при напольной технологии их содержания | 2020 |
|
RU2751602C1 |
| СПОСОБ ДЕЗИНВАЗИИ ПРОТИВ ООЦИСТОВ КОКЦИДИЙ ПТИЦ | 2011 |
|
RU2454995C1 |
| СПОСОБ ДЕЗИНВАЗИИ ПРОТИВ ООЦИСТ КОКЦИДИЙ ПТИЦ | 2017 |
|
RU2640500C1 |
| Средство для дезинвазии объектов внешней среды против ооцист эймерий индеек | 2022 |
|
RU2786886C1 |
| ПИПЕРАЗИНОВАЯ СОЛЬ БИС(ОКСИМЕТИЛ)ФОСФИНОВОЙ КИСЛОТЫ, ОБЛАДАЮЩАЯ АНТИГЕЛЬМИНТНОЙ АКТИВНОСТЬЮ | 2002 |
|
RU2211835C1 |
| Способ профилактики и лечения ремонтного молодняка кур яичных пород при кокцидиозах | 2016 |
|
RU2627612C1 |
| СПОСОБ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ЦЫПЛЯТ БРОЙЛЕРОВ ПРИ КОКЦИДИОЗАХ | 2015 |
|
RU2571269C1 |
| ТРИФЕНИЛ-(3,5-ДИ-ТРЕТ-БУТИЛ-4-ГИДРОКСИБЕНЗИЛ)ФОСФОНИЙ БРОМИД, ОБЛАДАЮЩИЙ АНТИГЕЛЬМИНТНОЙ АКТИВНОСТЬЮ | 2012 |
|
RU2495667C1 |
Изобретение относится к области ветеринарной паразитологии и может быть использовано в птицеводческих хозяйствах разной специализации при заболеваниях молодняка кур и индеек аскаридиями. Способ дезинвазии против экзогенной стадии развития яиц аскаридий птиц включает обработку, при которой в качестве дезинфектанта используют комплексное средство, содержащее, мас. %: парахлорметаксименол - 34, сульфоновую кислоту - 26, молочную кислоту - 5, вспомогательные компоненты, в качестве которых применяют поверхностно-активные вещества - 23, а остальное - вода до 100. При этом обработку птичников осуществляют комплексным средством в концентрации 1,0% в дозе 0,2 л на м2 при экспозиции 2 ч. Изобретение обеспечивает создание способа дезинвазии против экзогенной стадии развития яиц аскаридий птиц при напольной технологии содержания доступными средствами, пригодными для применения как ручным, так и механизированным способом, не оказывая повреждающее действие на обрабатываемое технологическое оборудование. 1 табл., 4 пр.
Способ дезинвазии против экзогенной стадии развития яиц аскаридий птиц, включающий обработку, отличающийся тем, что в качестве дезинфектанта используют комплексное средство, содержащее, мас. %:
обработку птичников осуществляют комплексным средством в концентрации 1,0% в дозе 0,2 л на м2 при экспозиции 2 ч.
| Средство для дезинвазии объектов внешней среды | 2020 |
|
RU2727519C1 |
| СПОСОБ ДЕЗИНВАЗИИ ПРОТИВ ООЦИСТ КОКЦИДИЙ ПТИЦ | 2017 |
|
RU2640500C1 |
| Способ профилактики и лечения паразитарных болезней сельскохозяйственных животных и птиц | 2019 |
|
RU2709535C1 |
| WO 2007009606 A2, 25.01.2007 | |||
| DE 3814202 A1, 09.11.1989 | |||
| US 20180360048 A1, 20.12.2018. | |||
Авторы
Даты
2023-01-09—Публикация
2021-05-27—Подача