Изобретение относится к области ветеринарии, а именно - ветеринарной паразитологии, и может быть использовано в животноводческих хозяйствах при гельминтозах и протозоозах.
Следует отметить, что паразитарные болезни животных в нашей стране представляют серьезную проблему для интенсивного развития разных отраслей, особенно в хозяйствах с большой концентрацией поголовья. Среди разных отраслей животноводства в нашей стране по росту производства птицеводство и свиноводство занимают лидирующие положения.
Вместе с тем, наряду с позитивными тенденциями в современном птицеводстве и свиноводстве страны остается немало проблем, требующих комплексного решения. В их число входят: распространение паразитарных болезней птиц и свиней, совершенствование диагностики ряда болезней и разработка новых эффективных технологий профилактики и лечения таких опасных и приносящих большой экономический ущерб инвазионных болезней птиц как эймериоз, криптоспоридиоз, дерманиссиоз, гистомоноз, аскаридиоз, гетеракидоз и другие, а у свиней изоспороз, эймериоз, балантидиоз, аскаридоз, трихоцефалез, эзофагостомоз.
Практика работы успешных птицефабрик и свинокомплексов показывает, что профилактика паразитозов птиц и свиней включает в себя комплекс лечебно-профилактических мероприятий, направленных как против экзогенных (ооцисты, цисты, яйца во внешней среде), так и против эндогенных стадий возбудителя (внутри организма птицы, свиней и других животных) с использованием современных противопаразитарных препаратов.
В отличие от ранее отмеченных отраслей скотоводство в нашей стране развивается по традиционной технологии, которая не обеспечивает защиты животных от паразитозов, среди которых основное значение имеют паразитические простейшие, гельминтозы и арахно-энтомозы. Ущерб от паразитарных болезней крупного рогатого скота, прежде всего, обусловлен снижением продуктивности и ухудшением качества животноводческой продукции, а при высокой интенсивности инвазии и гибелью животных, особенно молодняка.
Проведенными исследованиями ученых установлено, что каждое скотоводческое хозяйство, практикующее стойлово-выгульное содержание с использованием пастбищ, неблагополучно по паразитарным болезням и, прежде всего, паразитическим простейшим, среди которых по экстенсивности инвазии наиболее часто встречается букстонеллез. Источником инвазии является зараженные животные, восприимчивые к инвазии животные всех возрастов, но наибольшая интенсивность инвазии отмечена у коров в зимние месяцы.
Несмотря на проведение противоэпизоотических мероприятий полной профилактики паразитозов среди поголовья животных в птицеводческих, свиноводческих и скотоводческих хозяйствах не достигается. Об этом свидетельствуют работы отечественных и зарубежных ветеринарных паразитологов.
В неблагополучных хозяйствах передача инвазии происходит через загрязненные инвазионными элементами (ооцисты кокцидий, цисты балантидий, букстонелл и яйца гельминтов) кормушки, корма, воду, подстилки, инвентарь. Механическими разносчиками инвазионных элементов часто становятся насекомые, грызуны, синатропные птицы, а также обслуживающий персонал - на обуви, одежде, предметах ухода.
Способствуют повсеместному распространению паразитарных болезней животных различные нарушения технологии выращивания молодняка: скученность поголовья в помещениях, повышенная влажность воздуха и подстилки, неполноценное кормление и нарушения ветеринарно-санитарных правил.
Исследованиями установлено, что инвазионные элементы многих паразитов животных весьма устойчивы во внешней среде и сохраняют свою жизнеспособность в течение длительного времени: ооциститы эймирий птиц и кокциидий свиней - больше года, цисты баланидий свиней - больше года, цисты букстонелл крупного рогатого скота в течение многих месяцев, яйца свиной аскариды - больше четырех лет, яйца аскаридий и гетеракисов птиц -больше года, яйца токсокар плотоядных - больше двух лет.
Следует напомнить, что эпизоотический процесс при паразитарных болезнях животных, как и при многих заразных болезнях, состоит из трех звеньев: источник инвазии, факторы передачи и восприимчивые животные. Воздействуя на факторы передачи инвазии можно прерывать данную цепочку, уничтожая экзогенную стадию - ранее отмеченных паразитов.
Для борьбы с паразитарными болезнями животных предложено значительное количество препаратов, как против эндогенных стадий, так и экзогенных. Проблема паразитозов животных ставит задачи перед исследователями - совершенствовать меры борьбы с инвазией, разработать средства и способы дезивазии объектов внешней среды против ооцист и цист паразитических простейших и яиц гельминтов.
Из известных средств дезинвазии, которые применяют против экзогенных стадий паразитических простейших и гельминтов уместно отметить 4%-ный раствор едкого натра, который должен иметь на поверхности объекта температуру не ниже 80°С, 2%-ная эмульсия ортохлорфенола, 7%-ный раствор аммиака, 10%-ный раствор однохлористого йода (1-6). Отмеченные средства дезинвазии применяют во многих животноводческих хозяйствах, но их эффективность не устраивает запросы практики.
Учитывая ранее отмеченное и особую устойчивость ооцист и цист паразитических простейших и яиц гельминтов во внешней среде, эффективное средство дезивазии против них, возможно создать, используя несколько активных компонентов и вспомогательных веществ. В числе таких препаратов следует рассматривать глутаровый альдегид и йод кристаллический при их совместном применении оптимальных концентраций.
Следует отметить, что для дезинвазии объектов внешней среды против цист букстонелл крупного рогатого скота авторами разработано комплексное средство цистодез. Однако данное средство показало недостаточную эффективность против ооцист кокцидий птиц и яиц свиной аскариды. Исходя из отмеченного нами было создано другое комплексное средство «Парадезил» с измененным соотношением входящих в состав компонентов, которая оказала существенное влияние на эффективность и расширила показания к использованию для дезинвазии против паразитарных объектов животных.
Первый из отмеченных препаратов - глутаровый альдегид является известным дезинфицирующим средством для наружного применения. Второй из упомянутых - йод кристаллический - эффективное средство в отношении возбудителей инфекционных и инвазионных болезней, которое вызывает коагуляцию белков клетки ранее отмеченных возбудителей с образованием йодаминов.
В качестве вспомогательного вещества был использован полиэтиленгликоль 400 (ПЭГ-400), обладающий высокими эмульгирующими свойствами, что делает его близким к лецитину и кефалину, благодаря этому он оказывает эффективное смягчающие действия на ооцист и цист паразитических простейших и яйца гельминтов. Под воздействием полиэтиленгликоля в дальнейшем клеточная мембрана оболочки ооцист, цист и яиц паразита частично растворяется, тем самым открывая доступ для проникновения внутрь ооцист, цист и яиц средств дезинвазии.
Следует отметить, что при совместном применении против ооцист и цист паразитических простейших и яиц гельминтов отмеченные выше средства оказывают синергетическое действие на паразитический объект, а использованные нами в качестве вспомогательных веществ иодид калия, спирт этиловый обеспечивают лучшую растворимость йода кристаллического, а ПЭГ-400 - известный высокоэффективный эмульгатор способствует очистке пола, стен и технологического оборудования, тем самым повышает биодоступность объекта к действию препаратов.
В задачу наших исследований входило разработать эффективное средство дезинвазии против ооцист и цист паразитических простейших и яиц гельминтов животных доступными средствами, пригодными для применения как ручным, так и механическим способом, не оказывая коррозионное воздействие на имеющееся в животноводческих помещениях технологическое оборудование.
Решение поставленной задачи достигается тем, что в качестве средства дезинвазии против ооцист и цист паразитических простейших и яиц гельминтов был использован составленный нами концентрированный комплексный препарат Парадезил, имеющий следующий состав: действующие вещества - глутаровый альдегид 7%, йод кристаллический 1,5% и вспомогательные компоненты - йодид калия 0,5%, спирт этиловый 11%, полиэтиленгликоль 400 - 30% и вода до 50%, соответственно в соотношении массы, %: 7,0; 1,5; 0,5; 11; 30; 50.
Из доступных заявителю источников информации не известны указанная совокупность существующих признаков, позволяющих получать указанный технический результат, поэтому заявляемое изобретение соответствует условию патентоспособности «новизна».
Заявителю также не известны средства аналогичного назначения, в которых были раскрыты отличительные признаки заявляемого изобретения с получением от использования его в какой-либо совокупности признаков указанного технического результата. Следовательно, заявляемое изобретение соответствует условию патентоспособности изобретательский уровень.
Доказательства промышленной применимости заявляемого приводятся в следующих примерах.
Примеры конкретного исполнения.
Пример 1. Приготовления рабочих растворов, разведений культуры ооцист эймерий, цист букстонелл и яиц свиной аскариды, осуществление лизис-теста и культивирование с разной концентрацией препарата Парадезил.
Исследования по обозначенной проблеме проводили в условиях лаборатории ООО «Научный центр ветеринарной паразитологии и терапии»
Рабочий раствор с разными концентрациями комбинированного препарата Парадезил готовили следующим образом. Брали четыре стеклянные колбы на 1 л и наливали по 700 мл дистиллированной воды и в первые три из них добавляли по 30; 40 и 50 мл средства Парадезил, тщательно размешивали в течение 5 минут, объем доводили до 1 литра, снова размешивали в течение 5 минут и раствор был готов к использованию. В четвертую колбу к 700 мл воды добавляли 40 г кристаллического фенола, размешивали, объем доводили до 1 литра, снова размешивали, дали отстояться и раствор был готов к использованию.
Приготовление культуры ооцист Eimeria spp.
Для сбора ооцист использовали фекалии спонтанно зараженных эймериями бройлеров 3-4-х недельного возраста при напольной технологии их содержания на птицефабрике. Материал от спонтанно инвазированных бройлеров исследовали флотационным методом Фюллеборна. Из проб зараженных бройлеров с помощью паразитологической петли снимали поверхностную пленку и собирали в чашку Петри с дихлорированный водой, трижды отмывали ооцист от соли, подсчитывали их количество в 1 капле, затем в 1 мл перемешивали со слоем консерванта - 2%-ный раствор бихромата калия и использовали в дальнейшей работе.
При приготовлении буфера SWH к 3300 мл дистиллированной воды добавили 17,5 мл 10%-ного раствора хлорида кальция и 5 мл 10%-ного раствора сульфата магния, автоклавировали в течении 15 минут при 120°С, рН определяли с помощью прибора «Аквилон-410».
Для проведения лизис-теста приготовленные дезинфектанты (3; 4 и 5%-ные растворы Парадезил и 4%-ный фенол) и буфер по отдельности поместили по 50 мл в 250 мл колбы Эрленмейера и добавили по 50 мл раствора с ооцистами кокцидий в концентрации 2000 ооцист/мл. После чего эти колбы Эрленмейера ставили на вибростолик со скоростью вращения 100 об/минуту на 2 часа. Затем содержимое из колбы выливали в пластиковую бутылку с завинчивающейся крышкой объемом 1500 мл. колбу с остатком раствора ополаскивали несколько раз и сливали в пластиковую бутылку и объем доводили буфером до 1500 мл. Затем бутылку несколько раз (три раза) переворачивали и оставляли при комнатной температуре (20±2°С) в течение 24 часов. По истечении времени раствор сливали до отметки, 30 мл осадка переливали в новую емкость объемом 100 мл, пластиковую бутылку ополаскивали несколько раз с использованием буфера, доводя объем до 50 мл.
Приготовление культуры цист Buxtonella sulcata.
Цист букстонелл крупного рогатого скота собирали из свежих фекалий зараженных животных при исследовании в условиях лаборатории методом последовательных промываний. Концентрировали собранный материал путем центрифугирования и трижды промывали дистиллированной водой, из собранной культуры цист букстонелл для дальнейшей работы готовили разведение и подсчитывали их количество в 1 мл под микроскопом.
Все приготовленные растворы дезинфектантов и дистиллированную воду (контроль) для проведения лизис-теста по отдельности поместили в 100 мл колбы по 50 мл и добавили по 20 мл суспензию с цистами букстонелл крупного рогатого скота в концентрации 200 цист/ мл и размешивали.
В дальнейшем эти колбы ставили на вибростолик со скоростью вращения 100 об/мин на 2 часа. Затем содержимое из колбы выливали в пластиковую бутылку с завинчивающейся крышкой объемом 1000 мл. Колбу с остатком раствора ополаскивали несколько раз и сливали в пластиковую бутылку и объем доводили до 1000 мл. Бутылку с раствором для лучшего смешивания переворачивали три раза и оставляли в лаборатории при комнатной температуре (20±2°С) на 24 часа. По истечении времени раствор сливали до отметки 30 мл, осадок переливали в новую емкость объемом 100 мл, бутылку ополаскивали дистиллированной водой несколько раз, доводя объем до 50
Приготовление культуры яиц Ascaris suum
Яиц свиной аскариды собирали из свежих фекалий зараженного молодняка свиней, при исследовании по флотационному методу Фюллеборна. Из проб зараженных свиней с помощью паразитологической петли снимали поверхностную пленку и собирали в чашку Петри с дистиллированной водой, трижды отмывали яйца от соли, подсчитывали их количество в одной капле, затем в 1 мл перемешивали со слоем консерванта - 1%-ный раствор HCl на дистиллированной воде и использовали в дальнейшей работе.
Пример 2. Биопроба по экспериментальному заражению цыплят-бройлеров для определения эффективности препарата Парадезил для дезивазии.
Опыт по испытанию разных концентраций препарата Парадезил для дезивазии проводили в условиях вивария ООО «Научный центр ветеринарной паразитологии и терапии» на 60 цыплятах 14-дневного возраста, свободных от кокцидий и корма их не содержали противококцидиозные препараты. В своей работе для контроля концентрации спорулированных ооцист кокцидий (2000 ооцист/мл) использовали камеру Мак Мастера и микроскоп МБС, а для разведения применяли буфер SWH с таким расчетом, чтобы возможно было ввести 1 мл суспензии каждому цыпленку. Магнитную мешалку использовали для достижения хорошего смешивания материала. Всех опытных цыплят подвергали клиническому обследованию, индивидуальной нумерации, взвешиванию и по принципу аналогов разделили на шесть групп по 10 цыплят в каждой.
Цыплятам первой, второй и третий группы задавали по 1 мл суспензии ооцист эймерий, обработанной 3; 4 и 5%-ной концентрацией препарата Парадезил внутрь при помощи микро-пипетки постепенно. Цыплятам четвертый группы задавали по 1 мл суспензии ооцист эймерий, обработанной 4%-ным раствором фенола (базовой препарат). Цыплята пятой группы получали по 1 мл суспензии, содержащую 2000 ооцист/мл - зараженной контроль. Цыплята шестой группы получали по 1 мл буферного раствора и служили «чистым» контролем.
За время опыта цыплят всех шести групп содержали в аналогичных условиях, и они имели одинаковый рацион. За все время опыта за цыплятами вели ежедневные клинические наблюдения за общим состоянием, их поведением, приемом корма и воды, видимыми физиологическими изменениями и другими.
От цыплят каждой группы отдельно для установления ооцист в фекалиях с 6 по 12 сутки собирали ежедневно весь помет, взвешивали, добавляли воду до массы 2000 г, смешивали смесителем в течение 5 минут. Из каждой группы для дальнейших исследований отбирали пробы в количестве 25 г, которые консервировали 4%-ным раствором бихромата калия, размешивая миксером, доводили до однородной массы, затем перекладывали в микроконтейнеры с завинчивающейся крышкой и хранили в холодильнике при температуре +4°С.
Ооцист в 1 г фекалий определяли флотационным методом Фюллеборна с использованием насыщенного раствора натрия хлористого плотностью 1,18 г/см3, а их количество подсчитывали с использованием камеры Мак Мастера.
Эффективность дезинвазии при назначении разных концентраций препарата Парадезил, а также 4%-ной концентрации базового препарата фенола определяли, исходя из процента снижение выделения ооцист эймерий после воздействия на них отмеченными концентрациями дезинфектантов по сравнению с цыплятами зараженного контроля, которым давали по 2000 ооцист/мл.
Исследования по определению ооцист в фекалиях опытных цыплят, собранных с 6 по 12-е сутки после назначения обработанной дезинфектантами суспензии, их определенное количество находили, но не во всех группах. Так, при исследовании опытных цыплят первой группы, которым назначали суспензию ооцист, обработанную 3%-ной концентрацией Парадезил, ооцист эймерий в фекалиях находили во все сроки исследований и средний показатель в одной камере за все сроки исследований составил 1,62. Количество ооцист эймерий в 1 г помета по этой группе составило 324 экземпляра, что в проценте от контроля 6,92%. Отсюда, интенсэффективность Парадезил в 3%-ной концентрации или процент снижение количества ооцист после воздействия на них отмеченной концентрации препарата равняется 93,08% (табл. 1).
Результаты исследований проб помета от цыплят 2 и 3-й групп, которые получали суспензию ооцист, обработанную 4 и 5%-ной концентрацией Парадезил, ни в одном случае ооцист не находили, что дает нам основание утверждать о 100%-ной эффективности комплексного препарата Парадезил в отмеченных концентрациях против ооцист кокцидий птиц.
В четвертой группе цыплят после назначения суспензии ооцист, обработанной 4%-ной концентрацией фенола (базовой препарат) ооцист в помете находили во все сроки исследований (с 1 по 7 день) в количестве от 0,4 до 10,4 экз. в камере, а средний показатель в 1-й камере за период исследование составил 5,4 экз. Количество ооцист в 1 г помета по данной группе равнялась 1080 экз., что составляет 23,08% от контроля.
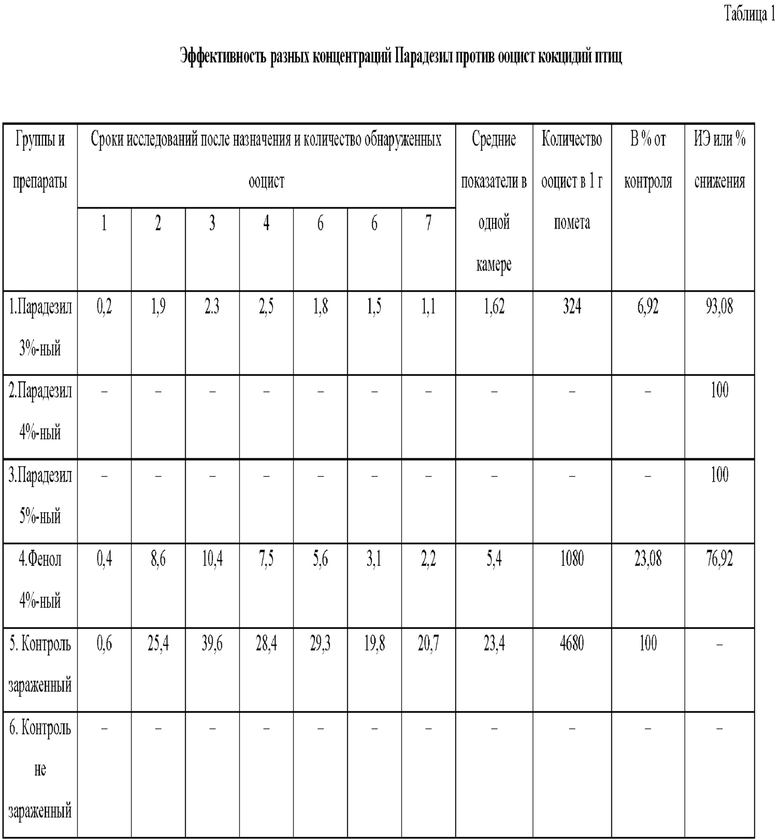
Отсюда, интенсэффективность фенола в 4%-ной концентрации против ооцист кокцидий составила 76,92%. Цыплята 5-й группы, получавшие 2000 спорулированных ооцист/мл во все сроки исследований с пометом выделяли ооцист эймерий в количестве от 0,6 до 39.6 экз. в камере и средний показатель в одной камере за период исследований составил 23,4 экз. Количество ооцист в 1 г. помета по группе зараженного контроля составило 4680 экз. И этот показатель использовался как исходный при расчете процента снижения количества ооцист или интенэффективность испытанных в опыте препаратов их концентраций.
Цыплята 6-й группы, которые получали буфер без ооцист, служили незараженным контролем и во все сроки исследований оставались свободными от инвазии.
Интенсэффективность использованных в своих иследованиях дезинфектантов или процент снижения количества ооцист эймерий определяли, используя следующую формулу:
ИЭ=(КОк-КОд)/КОк×100, где
ИЭ - интенсэффективность препарата, %;
КОк - количество ооцист у цыплят контрольной группы;
КОд - количество ооцист у цыплят, получивших обработанные дезинфектантом ооцисты.
Используя полученные нами в опыте данные, определяли интенсэффективность препарата Парадезил в 3%-ной концентрации
ИЭ=(4680-324)/4680×100=93,085 (р<0,05)
В концентрациях 4 и 5%-ной препарат Парадезил показал против ооцист эймерий 100%-ную эффективность.
Использованный нами в качестве базового препарата фенол 4%-ный показал против ооцист эймерий:
ИЭ=(4680-1080)/4680×100=76,92%-ную эффективность.
Пример 3. Биопроба по экспериментальному заражения телят букстонеллами для определения эффективности препарата Парадезил для дезинвазии.
Исследования по испытанию разных концентраций препарата Парадезил для дезинвазии проводили в условиях экспериментального хозяйства «Клёново-Чегодаево» Московской области на 36 телятах 6-месячного возраста, свободных от букстонелл и корма их не содержали препараты против паразитических простейших. Концентрацию букстонелл - 200 цист/мл в приготовленной культуре контролировали, использую камеру Мак Мастера и микроскоп МБС, а для разбавления дистиллированную воду, с таким расчетом, чтобы при назначении каждому теленку 5 мл суспензии общее количество букстонелл составило 1000 экз./голову. Опытных телят подвергали клиническому обследованию, индивидуальной нумерации, взвешиванию и по принципу аналогов разделили на шесть групп по шесть животных в каждой.
Телятам первой, второй и третьей группы задавали по 5 мл суспензии цист букстонелл, обработанной 3; 4 и 5%-ными растворами препарата Парадезил внутрь при помощи минизонда. Телятам четвертый группы назначали по 5 мл суспензии цист букстонелл, обработанной 4%-ным раствором фенола (базовый препарат). Телята пятой группы получали по 5 мл суспензию, содержащую цисты букстонелл в количестве 200 экз/мл. и служили зараженным контролем. Телятам шестой группы задавали по 5 мл дистилированной воды, и они служили незараженным контролем.
Животные всех 6 групп за период опыта находились в аналогичных условиях содержания, их кормили по зоотехническим нормам. За телятами вели ежедневные клинические наблюдения в течение всего периода опыта за общим состоянием, их поведением, приемом корма и воды, видимыми физиологическими показателями.
В ходе опыта с 6 по 12-е сутки после заражения для определения цист букстонелл в фекалиях от телят каждой группы отдельно собирали все фекалии, взвешивали, добавляли воду до 7000 г, смешивали смесителем в течении 7 минут. Пробы для дальнейших исследований отбирали из каждой группы в количестве 50 г., которые консервировали 4%-ным раствором бихромата калия, размешивали миксером, перекладывали в пластиковые емкости с завинчивающейся крышкой и хранили в холодильнике при температуре +4°С.
Цист букстонелл в фекалиях телят устанавливали методом последовательных промываний, а их количество подсчитывали с использованием камеры Мак Мастера.
Процент снижения выделения цист букстонелл или интенсэффективность после воздействия на них разными концентрациями препарата Парадезил и базовым препаратом фенол определяли по сравнению с количеством цист от телят зараженного контроля, которые получали по 200 цист/мл.
Результаты исследований отобранных проб показали, что в фекалиях опытных телят, котором назначали цисты букстонелл, обработанные дизинфектантами, их находили в определенном количестве, но не во всех группах. Так, при исследовании опытных телят 1-й группы, которым назначали суспензию цист, обработанную 3%-ной концентрацией препарата Парадезил, цист букстонелл в фекалиях находили через 2, 3, 4, 5 и 6 суток в количестве от 5 до 10 экз., что в среднем 5,14 экз. Средний показатель в одной камере за все сроки исследований составил 0,73. Количество цист букстонелл в 1 г фекалий по данной группе составила 146 экз., что в проценте от контроля - 6,5%. Отсюда, интенсэффективность препарата Парадезил в 3%-ной концентрации или процент снижения количества цист после воздействия на них 3%-ной концентрацией препарата составила 93,5% (табл. 2).
У телят 2 и 3 группы, которым давали суспензию цист, обработанную 4 и 5%-ной концентрацией препарата Парадезил при исследовании проб фекалий ни в одном случае цист букстонелл не находили, что свидетельствует о 100%-ной эффективности препарата Парадезил в отмеченных концентрация против цист букстонелл крупного рогатого скота.
У телят 4-й группы после назначения суспензии цист букстонелл, обработанной 4%-ной концентрацией фенола (базовой препарат), цист в фекалиях находили во все сроки исследований в количестве от 9 до 39 экз. в камере, а средний показатель в одной камере за период исследования составил 3,26. Количество цист в 1 г фекалий по данной группе равнялось 652 экз., что составило 30,38% от контроля. Отсюда, интенсэффективность фенола в 4%-ной концентрации против цист букстонелл крупного рогатого скота составила 69,62%.
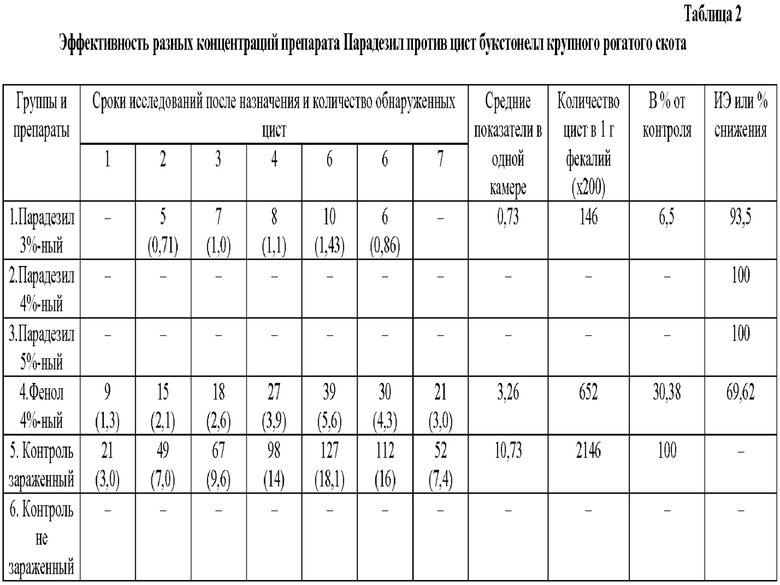
Телята 5-й контрольной группы получавшие 200 цист/мл во все сроки исследований с фекалиями выделяли цисты в количестве от 21 до 127 экз. и в среднем 75,1 в камере. Средний показатель в 1-й камере за период исследований составил 10,73. Количество цист в 1 г фекалий по данной группе составило 2146 и этот показатель нами использовался как исходный при расчете интенсэффективности испытаний в опыте препаратов.
Телята 6-й контрольной группы, которые получали дистиллированную воду без цист во все сроки исследований оставались свободными от инвазии.
Интенсэффективность испытанных в своих исследованиях дезинфектантов определяли, используя следующую формулу:
ИЭ=(КОк-КОд)/КОк×100, где
ИЭ - интенсэффективность препарата, %;
КОк - количество цист у телят контрольной группы;
КОд - количество цист у телят, получивших обработанные дезинфектантом цисты.
Используя полученные нами в опыте данные, определяли интенсэффективность препарата Парадезил в 3%-ной концентрации
ИЭ=(2146-146)/2146×100=93,2%
В концентрациях 4 и 5%-ной препарат Парадезил показал против цист букстонелл показал 100%-ную эффективность.
Использованный нами в качестве базового препарата фенол 4%-ный показал против цист букстонелл крупного рогатого скота:
ИЭ=(2146-652)/2146×100=69,62%-ную интенэффективность.
Пример 4. Изучение овоцидной активности разных концентраций препарата Парадезил против яиц свиной аскариды в лабораторном опыте и биопробы по заражению белых мышей.
Овоцидную активность разных концентраций Парадезил и рекомендованной концентрации фенола изучали в опыте по культивированию яиц Ascaris suum в термостате при 26-28°С в чашках Петри в условиях влажный камеры в течение 30 суток, в каждый из которых закладывали по 1000 экз. яиц. Первая камера была контрольной, где культивирование проходило в физрастворе. Во вторую, третью и четвертую камеры вносили раствор, содержащий 3, 4 и 5%-ную концентрацию комплексного препарата Парадезил соответственно. После 24 часовой экспозиции яиц Ascaris suum отмывали трехкратно дистиллированной водой, микроскопировали для выявления изменений структуры и ставили на культивирование. В период культивирования яиц проводили аэрацию один раз в два дня и вели наблюдения за эмбриогенезом. Жизнеспособность яиц Ascaris suum определяли по внешнему виду при световой микроскопии, путем окрашивания и постановкой биопробы.
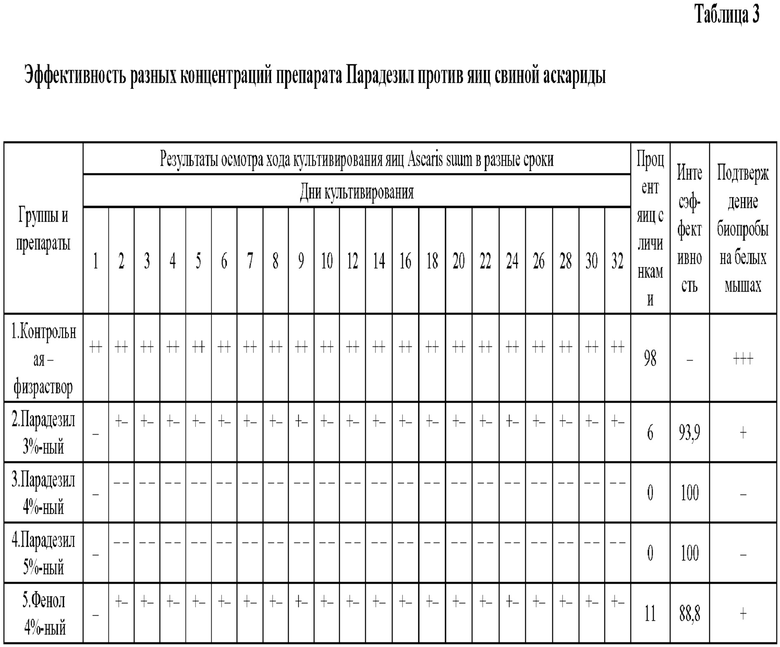
При осмотре под микроскопом после 24-часовой экспозиции яиц Ascaris suum в разных дезинфектантах каких-либо изменений в их структуре перед постановкой на культивирование не выявляли. Тогда как яйца контрольной группы, находящиеся в физиологическом растворе, были на стадии двух бластомеров. При осмотре через 2; 4; 6 и 8 суток, в котором наблюдали активное развитие бластомеров - их было 4, 8, 16, 32 и т д. Во 2-й группе, где яйца Ascaris suum были обработаны 3%-ным раствором препарата Парадезил в отмеченные сроки развития бластомеров наблюдали у 5-10% яиц. В 3 и 4-й группах, где яйца Ascaris suum были обработаны 4 и 5%;-ными растворами препарата Парадезил во все сроки наблюдений развития бластомеров и личинок в яйцах не отмечали. В 5-й группе, где яйца Ascaris suum были обработаны базовым препаратом фенола 4%-ным развитие бластомеров, а затем и личинок отмечали у 10-17% яиц.
Наши наблюдения, проведенные через 10; 12; 14 дней и дальше с начала культивирования дали возможность увидеть развитие личинок внутри яиц Ascaris suum, которые делали активные движения до 24 и 28-дневного периода, а затем они переставали двигаться.
Следует отметить, что наиболее четкая картина развития бластомеров и личинок внутри инвазионных яиц свиной аскариды было нами отмечена в контрольной группе.
Во 2-й и 6-й группах бластомеры и личинки развивались не во всех яйцах Ascaris suum, их приходилось искать и выделять для дальнейшего на 6 люд нения.
Через 32 дня культивирования яиц Ascaris suum в термостате проводили заключительную оценку, согласно которой в контрольной группе 98% яиц Ascaris suum имели развившиеся внутри личинки. Во второй группе после обработки 3%-ной концентрацией препарата Парадезил только 6% яиц Ascaris suum имели развившиея внутри личинки. А в шестой группе после обработки 4%-ной концентрацией фенола этот показатель составил 11% (табл. 3).
Интенсэффективность Парадезил против яиц Ascaris suum в 3%-ной концентрации составила; 93,6%, а в 4 и 5%-ной концентрациях - 100%. Базовый препарат фенол 4%-ный обеспечил 88,8%-ную интенсэффективность.
Получив высокую интенсэффективность в лабораторном опыте, решили их подтвердить постановкой биопробы.
Нужно отметить, что биопроба - это наиболее точный метод определения жизнеспособности инвазионных яиц аскарид посредством их дачи внутрь белым мышам.
Биопробу по экспериментальному заражению белых мышей путем дачи яиц свиной аскариды после культивирования проводили на 60 мышах массой 18 - 20 г, которых разделили на шесть групп по 10 в каждой. Мышей каждый группы содержали изолированно в клетках и им назначали через пластиковую трубку внутрь по 200 яиц Ascaris suum, которые ранее были подвергнуты культивированию в течение 32 дней и взяты из групп 1-6.
После назначения инвазионного материала за мышами вели клинические наблюдения, кормили и поили их по нормам, содержали в условиях вивария.
Через 10 дней мышей каждый группы подвергали умерщвлению эфирным наркозом по отдельности. После вскрытия мышей их легкие и печень измельчали и исследовали по метуду Бермана. Заправляли дихлорированной водой аппараты Бермана, оставляли при комнатной температуре (+22°С) на 2 часа. При исследовании осадка находили мигрирующих личинок аскарид в разном количестве. Так, в первый группе личинок аскарид находили у всех зараженных мышей, их количество колебалось от 17 до 135 экз. Во второй группе мышей, которым задавали яйца Ascaris suum после воздействия 3%-ным раствором препарата Парадезил личинок аскарид находили у трех в количестве от 11 до 32 экз. В третьей и четвертой группах мышей, которым задавали яйца после воздействия 4 и 5%-ными концентрациями препарата Парадезил мигрирующих личинок аскарид в легких и печени не находили. В пятой группе мышей, получавших яйца аскарид после воздействия на них 4%-ным раствором фенола, личинок аскарид находили у четырех в количестве от 17 до 56 экз.
Таким образом, комплексный препарат Парадезил в концентрации 4% показал в биопробах по экспериментальному заражению цыплят-бройлеров эймериями, при заражении телят букстонеллами и биопробе по заражению белых мышей яйцами свиной аскариды высокую интенсэффективность (ИЭ - 100%).
В 3%-ной концентрации препарат Парадезил против ооцист эймерий цыплят показал 93%-ную ИЭ. Против цист букстонелл ИЭ составила 93,2% и против яиц свиной аскариды ИЭ равнялась 93,9%.
Определена активная и эффективная концентрация комплексного препарата Парадезил против разных инвазионных объектов в лабораторных опытах и при биопробе на разных моделях, которая пригодна для дезинвазии объектов внешней среды.
Пример 5. Производственное испытание эффективности комплексного средства Парадезил против ооцист и цист паразитических простейших, а также яиц гельминтов животных.
Эффективность комплексного средства Парадезил 4%-ного против ооцист эймерий цыплят, цист букстонелл крупного рогатого скота и против яиц свиной аскариды в производственном испытании устанавливали опытным путем с искусственной закладкой ооцист эймерий птиц, цист букстонелл яиц свиной аскариды на контрольные площадки по сравнению с базовым препаратом фенолом 4%-ным при экспозиции 2 часа. Испытания проводили в условиях экспериментального хозяйства Кленово-Чегодаево Московской области в августе - сентябре 2019 г. В свинарнике №3 с бетонным полом, где заранее проводили чистку и дезифекцию, были выбраны 5 площадок по 1 м2. Каждая площадка была отделена от другой пластиковыми рейками и площади имели равную поверхность для исключения подтека дезраствора. В начале испытания на площадки равномерно наносили приготовленные культуры в разведении с 50 мл дистиллированной водой, используя малый пульверизатор и оставляли на 20 минут для пропитывания. На площадку №1 наносили 2000 спорулированных ооцист Eimeria spp, на площадку №2 наносили 1000 цист Buxtonella sulcata, на площадку №3, №4 и №5 наносили по 2000 инвазионных яиц аскарид Ascaris suum. По истечении времени на опытные площадки №1, №2 и №3 наносили комплексное средство Парадезил 4%-ный, нормы 0,5 л на 1 м2 при экспозиции 2 часа. На площадку №4 наносили раствор фенола 4%-ного при норме 0,5 л на 1 м2 и экспозиции 2 часа. Площадка №5 была контрольная и препараты для дезинвазии не наносили.
По истечении 2 часов из всей поверхности каждый опытной площадки брали смывы, используя кисточку и дистиллированную воду. Собранный с поверхности каждой площадки смыв переносили в пластиковую бутылку, объем доводили до 1000 мл, перемешивали 2-3 раза и оставляли на 24 часа при комнатной температуре (+20±2°С). По истечении времени содержимое сливали до отметки, оставшиеся 30 мл раствора использовали для биопробы.
Смыв, собранный из площадки №1 доводили до объема 50 мл и использовали для искусственного заражения 10 цыплят-бройлеров 14-дневного возраста, которым внутрь задавали по 1 мл суспензия с помощью микропипетки постепенно. В задаваемом объеме суспензии было 2000 ооцист/мл.
Смыв, собраный из площадки №2-30 мл был использован для биопробы на 6 телятах 6-месячного возраста, которым задавали по 5 мл суспензия букстонелл с помощью минизонда внутрь.
Смывы, собранные из площадок №3, №4 и №5 были использованы для биопробы на белых мышах массой 18-20 г. Предварительно делали разведение, чтобы в 1 мл было 200 инвазированных яиц Ascaris suum. В каждой группе было по 10 мышей, которых содержали изолированно, а суспензию задавали с помощью пластиковой микроконюли.
Оценку общего состояния опытных цыплят, телят и мышей после назначения суспензии ооцист эймерий, цист букстонелл и яиц свиной аскариды, обработаной раствором Парадезил и фенола, а также чистой культурой яиц аскарид, проводили по данным ежедневных клинических наблюдений.
При исследовании собранных с 6 по 12 сутки после назначения ооцист эймерий, цист букстонелл проб фекалий цыплят и телят, которым назначали суспензию из смыва площадок №1 и №2 ооцисты эймерий и цист букстонелл не выделены.
При вскрытии 10 мышей, которым задавали суспензию из смыва площадки №3 (Парадезил) в легких и печени мигрирующих личинок аскарид не находили. При вскрытии 10 мышей, получавших суспензию из смыва площадке №4 (фенол) личинки аскарид в легких и печени обнаружены у трех мышей в количестве от 12 до 37 экз.
При вскрытии 10 мышей, которым назначали суспензию из смыва площадки №5 (контроль) без дезинфектанта личинок аскарид в легких и печени находили у всех 10 в количестве от 26 до 129 экз.
Результаты, полученные при производственном испытании комплексного средства Парадезил 4%-ного в дозе 0,5 л/м2, при экспозиции 2 часа свидетельствует о высокой эфективности испытанного средства для дезинвазии против ооцист эймерий, цист букстонелл крупного рогатого скота и яиц свиной аскариды: ИЭ - 100%. Тогда как интенсэффективность базового препарата фенола 4%-ного составила 68,9%.
Источники информации
1. Акбаев М.Ш., Василевич Ф.И., Акбаев Р.М и др. Паразитология и инвазионные брлезни животных. - М, 2008. - 776 с.
2. Вершинин И.И. Кокцидиозы животных и их дифференциальная диагностика // Екатеринбург.: Уральская ГСХА. - 1996. - 264 с.
3. Крылов М.В. Определитель паразитических простейших: человека, домашних животных и сельскохозяйственных растений. - Зоологический ин-т РАН, 1996. - 602 с.
4. Сафиуллин Р.Т. Паразитарные болезни птиц, средства и методы борьбы. - М., 2019. - 260 с.
5. Шибитов С.К. Диагностика букстонеллеза крупного рогатого скота // Российский паразитологический журнал. - 2019. - Т. 13. - №. 1. - С. 41 46.
6. Правила проведения дезинфекции и дезинвазии объектов госветнадзора. - М., 2002. - 74 с.
7. Патент №2673677 29 ноября 2018 бюл. 34 «Способ дезинвазии против цист букстонелл крупного рогатого скота»
| название | год | авторы | номер документа |
|---|---|---|---|
| Средство для дезинвазии объектов внешней среды | 2020 |
|
RU2748168C1 |
| Средство дезинвазии против паразитических простейших молодняка крупного рогатого скота | 2023 |
|
RU2802317C1 |
| Способ дезинвазии против экзогенной стадии развития яиц аскаридий птиц | 2021 |
|
RU2787391C2 |
| Средство для дезинвазии против цист букстонелл крупного рогатого скота | 2017 |
|
RU2673677C1 |
| Способ дезинвазии сточных вод и их осадков при помощи ультразвука | 2019 |
|
RU2715168C1 |
| СПОСОБ ДЕЗИНВАЗИИ ПРОТИВ ООЦИСТ КОКЦИДИЙ ПТИЦ | 2017 |
|
RU2640500C1 |
| СПОСОБ ДЕЗИНВАЗИИ ПРОТИВ ООЦИСТОВ КОКЦИДИЙ ПТИЦ | 2011 |
|
RU2454995C1 |
| Система мероприятий по борьбе с эндо- и экзогенными стадиями кокцидий цыплят-бройлеров при напольной технологии их содержания | 2020 |
|
RU2751602C1 |
| Средство для дезинвазии объектов внешней среды против ооцист эймерий индеек | 2022 |
|
RU2786886C1 |
| Средство для дезинфекции и дезинвазии объектов внешней среды | 2024 |
|
RU2824629C1 |
Изобретение относится к области ветеринарии и может быть использовано в животноводческих хозяйствах для дезинвазии объектов внешней среды при гельминтозах и протозоозах. Средство дезинвазии против ооцист и цист паразитических простейших и яиц гельминтов животных получено из следующих компонентов, масс. %: глутаровый альдегид 7, йод кристаллический 1,5, йодид калия 0,5, спирт этиловый 11, полиэтиленгликоль 400-30, вода 50. Изобретение обеспечивает повышение эффективности и расширение показаний к использованию заявленного средства. 3 табл., 5 пр.
Средство дезинвазии против ооцист и цист паразитических простейших и яиц гельминтов животных, характеризующееся тем, что средство получено из следующих компонентов, масс. %:
| Средство для дезинвазии против цист букстонелл крупного рогатого скота | 2017 |
|
RU2673677C1 |
| СПОСОБ ДЕЗИНВАЗИИ ПРОТИВ ООЦИСТ КОКЦИДИЙ ПТИЦ | 2017 |
|
RU2640500C1 |
| ОБЕЗЗАРАЖИВАЮЩЕЕ СРЕДСТВО | 2003 |
|
RU2236854C1 |
| DE 3814202 A1, 09.11.1989 | |||
| САФИУЛЛИН Р.Т., ШИБИТОВ С.К | |||
| и др | |||
| Эффективность комплексного препарата делеголь против ооцист эймерий птиц | |||
| SCIENCES OF EUROPE, 2016, N2(2), с.115-119 | |||
| САФИУЛЛИН Р.Т., ШИБИТОВ С.К | |||
| Дезинвазия объектов внешней среды против | |||
Авторы
Даты
2020-07-22—Публикация
2020-02-16—Подача