Изобретение относится к активным ингредиентам и способам, которые являются полезными для уменьшения видимых признаков старения на человеческой коже. Более конкретно, изобретение относится к применению ацетилированной гиалуроновой кислоты или ее натриевой соли для подавления некоторых разрушающих матрикс ферментов, которые вовлечены в вызванное временем и ультрафиолетовым (УФ) излучением повреждение кожи. Изобретение также относится к новым формам ацетилированной гиалуроновой кислоты, полезным для уменьшения видимых признаков старения, и к способам их получения.
Желание выглядеть привлекательно естественно поощряется современных потребителей. Несмотря на то, что идеал привлекательности претерпевает изменения с течением времени, повсеместно признается, что состояние и внешний вид нашей кожи представляет собой важное составляющее в привлекательности внешнего вида.
Потребителям в настоящее время предлагается множество косметических продуктов для ухода за кожей. Как правило, эти продукты находятся в форме кремов и лосьонов, содержащих воду для увлажнения кожи и жиры и липиды для ее повторного смазывания, и они оказывают воздействие на самый внешний слой кожи.
Смягчающее кожу воздействие гиалуроновой кислоты известно из уровня техники. Тем не менее, также известно, что физическое состояние гиалуроновой кислоты в косметических препаратах со временем ухудшается. Ацетилированная гиалуроновая кислота была предложена в ЕР 0725083 в качестве альтернативы гиалуроновой кислоте, поскольку сообщалось, что она обладает такими же самыми смягчающими кожу функциями, как и гиалуроновая кислота, но не демонстрирует того же самого ухудшения физического состояния, как свободная кислота. Однако в ЕР 0725083 не предложено или не намекается на применение ацетилированной гиалуроновой кислоты в лечении эффектов старения на коже или вызывающих его причин.
Существует несколько описаний ацетилированной гиалуроновой кислоты и ацетилгиалуроната с различными степенями замещения ацетила, имеющих низкую молекулярную массу (ЕР 0725083; и CN 106176286) и промежуточную молекулярную массу (Saturnino et al. в Biomed Research International, 2014, 921549: "Acetylated hyaluronic acid: enhanced bioavailability and biological studies"; и Oka et al. в Polymer, 41: "Differential scanning calorimetry studies on the mechanism of skin-softening effect of sodium acetylhyaluronate"), которые могут быть использованы при уходе за кожей. Однако, как будет показано ниже, эти продукты обладают существенными недостатками по сравнению с продуктом по настоящему изобретению.
Обеспечение эффективных косметических препаратов, полезных для лечения причин старения кожи и за счет этого уменьшения видимых признаков старения, остается неудовлетворенной потребностью.
Структурный каркас кожи называется ее внеклеточным матриксом. Этот внутренний каркас включает сеть из сцепленных между собой полимеров, таких как коллаген и эластин, внутри которых содержатся клетки кожи. Он отвечает за механические свойства кожи, включая твердость, прочность, упругость и эластичность. Физические показатели старения кожи отражают состояние матрикса кожи. Более конкретно, чем слабее и менее регулярен матрикс, тем больше морщин, шероховатостей и растяжек будет на коже.
Внеклеточный матрикс кожи представляет собой важный ресурс, который в здоровой и молодой коже как продуцируется, так и потребляется. Гладкость, твердость и молодость человеческой кожи в значительной степени зависят от состояния ее матрикса, который, в свою очередь, зависит от баланса синтеза матрикса и разрушения/рециклинга матрикса. Внеклеточный матрикс кожи состоит из коллагенов (коллаген I типа является наиболее преобладающим); эластинов и других компонентов, таких как гликозаминогликаны (GAG). Матрикс синтезируется фибробластами в дерме и подвергается ремоделированию несколькими специфическими ферментами (металлопротеиназы матрикса или ММР). Эти ферменты обычно вовлечены в заживление ран, однако они демонстрируют увеличенную экспрессию во время старения, вызванного временем или УФ, вследствие чего они способствуют интенсивному и неконтролируемому разрушению матрикса, которое, как известно, ответственно за видимые признаки старения, такие как стягивание кожи и образование морщин. Существует приблизительно 20 ММР, которые сгруппированы в различные категории в зависимости от их субстратной специфичности. Среди них находятся коллагеназы, желатиназы, стромелизины и ММР мембранного типа. ММР-1 представляет собой наиболее известную коллагеназу вовлеченную в расщепление структурных коллагенов, таких как коллаген 1 типа. ММР-3 представляет собой стромелизин, который вовлечен в расщепление коллагенов базальной мембраны, таких как коллаген IV.
Белки матрикса представляют собой большие структурные молекулы, которые обладают длительными периода полувыведения (порядка 70 лет в случае эластина). Следовательно, эти вещества сложно восполнять или обновлять в течение обычной человеческой жизни. Существует само прогрессирующее изменение и разрушение матрикса, которое ускоряется с возрастом, разрушая и ослабляя каркас кожи и создавая видимые признаки старения.
Старение кожи представляет собой результат присущего ей процесса старения со временем, на который накладываются факторы окружающей среды, преимущественно состоящие из воздействия ультрафиолетового излучения. Уровни ММР широко увеличиваются в процессе нормального возрастного старения, и факторы окружающей среды действуют таким образом, что дополнительно увеличивают уровни ММР. Уменьшение уровней ферментов ММР и возвращение их к нормальным для молодого возраста уровням, которое достаточно для того, чтобы предотвратить разрушение матрикса, и сохранить здоровый матрикс, может способствовать уменьшению или устранению видимых признаков старения на человеческой коже.
Остается потребность в обеспечении способами и косметическими препаратами для нанесения на кожу, которые могут обратить или уменьшить разрушение матрикса кожи путем подавления или уменьшения увеличенных уровней ферментов, разрушающих матрикс, таких как ММР, до сбалансированных уровней, обнаруживаемых в молодой или здоровой коже.
Изобретение относится к применению ацетилированной гиалуроновой кислоты или ее натриевой соли (ацетилгиалуронат натрия) для контроля баланса разрушающих матрикс веществ во внеклеточном матриксе кожи, уменьшения степени разрушения важнейших белков матрикса, таких как коллаген, и для уменьшения видимых признаков старения (вызванных временем и вызванных окружающей средой), в частности, для предупреждения или уменьшения морщин на коже и для достижения и поддержания молодо выглядящей кожи.
Соответственно, изобретение охватывает следующие аспекты и воплощения:
Способ подавления разрушения внеклеточного матрикса кожи, ассоциированного с повышенными уровнями разрушающих матрикс ферментов, где указанный способ включает стадию нанесения на кожу эффективного количества ацетилированной гиалуроновой кислоты или ее натриевой соли, в частности в форме композиции по уходу за кожей по настоящему изобретению.
Описанный выше способ, который представляет собой способ уменьшения видимых признаков старения кожи, более конкретно способ предупреждения или уменьшения морщин.
Описанный выше способ, где разрушающие матрикс ферменты представляют собой металлопротеиназы матрикса, и более конкретно ферменты ММР-1 или ММР-3.
Описанный выше способ, где ацетилированная гиалуроновая кислота или ее натриевая соль действует для уменьшения степени разрушения коллагена во внеклеточном матриксе, в частности его разрушения металлопротеиназами.
Низкомолекулярная фракция ацетилированной гиалуроновой кислоты или ее натриевой соли с высокой степенью ацетилирования для применения в описанном здесь способе.
Описанные выше ацетилированная гиалуроновая кислота или ее натриевая соль имеют средневзвешенную молекулярную массу приблизительно 50 кДа или меньше, более конкретно приблизительно 35 кДа или меньше, и еще более конкретно приблизительно 30 кДа или меньше.
Ацетилированная гиалуроновая кислота или ее натриевая соль, описанные выше, имеющие средневзвешенную молекулярную массу приблизительно 50 кДа или меньше, более конкретно приблизительно 35 кДа или меньше, и еще более конкретно приблизительно 30 кДа или меньше, и показатель полидисперсности, составляющий меньше чем 2,3, более конкретно меньше чем 2,0, более конкретно меньше чем 1,8, более конкретно меньше чем 1,7, более конкретно меньше чем 1,6 или менее, более конкретно меньше чем 1,5, более конкретно меньше чем 1,4, и более конкретно приблизительно 1,3 или менее.
Ацетилированная гиалуроновая кислота или ее натриевая соль, описанные выше, имеющие степень ацетилирования, больше чем 3,6, более конкретно 3,7 или больше, более конкретно 3,8 или больше, более конкретно 3,9 или больше, и более конкретно 4.
Ацетилированная гиалуроновая кислота или ее натриевая соль, описанные выше, имеющие степень ацетилирования больше чем 3,6, более конкретно 3,7 или больше, более конкретно 3,8 или больше, более конкретно 3,9 или больше, и более конкретно 4, определенные с использованием количественного 2D NMR (ядерного магнитного резонанса).
Способ получения низкомолекулярной ацетилированной гиалуроновой кислоты или ее натриевой соли, имеющих средневзвешенную молекулярную массу 50 кДа или меньше, и среднюю степень ацетилирования больше чем 3,6, включающий стадии
(1) отбора низкомолекулярной гиалуроновой кислоты, имеющей молекулярную массу 50 кДа или меньше, более конкретно 35 кДа или меньше, или еще более конкретно 30 кДа или меньше;
(2) подвергания ее условиям ацетилирования, где условия ацетилирования предпочтительно включают стадию взаимодействия низкомолекулярной гиалуроновой кислоты со смесью уксусной кислоты/уксусного ангидрида в присутствии сильной кислоты; и
(3) выделения низкомолекулярной ацетилированной гиалуроновой кислоты, предпочтительно путем осаждения с помощью добавления воды.
Косметический препарат, включающий эффективное количество ацетилированной гиалуроновой кислоты или ее натриевой соли, которые описаны выше.
Композиция для ухода за кожей, включающая низкомолекулярную ацетилированную гиалуроновую кислоту или ее натриевую соль, отличающуюся тем, что низкомолекулярная ацетилированная гиалуроновая кислота или ее натриевая соль имеют средневзвешенную молекулярную массу 50 кДа или меньше и среднюю степень ацетилирования больше чем 3,6.
Косметический препарат и, в частности, композиция для ухода за кожей, описанные выше, включающие по меньшей мере один косметически приемлемый эксципиент.
Эти и другие аспекты изобретения будут лучше понятны в свете следующего подробного описания конкретных воплощений изобретения.
«Старение кожи» представляет собой термин, который относится к изменениям, которым подвергается кожа с возрастом, как вследствие старения с возрастом, так и путем воздействия на кожу солнца (фотостарение) или путем других агентов окружающей среды, таких как табачный дым, экстремальные климатические условия холода, тепла или ветра, химические примеси или загрязнения, и включает все внешние видимые и/или изменения, различимые путем прикосновения, таких как развитие неровностей на коже, таких как морщины, тонкие морщины, складки, неровности или шероховатости, увеличение размера пор, утрата эластичности, утрата прочности, утрата гладкости, утрата способности восстанавливаться после деформации, провисание кожи, такое как провисшие щеки, появление мешков под глазами или появление двойного подбородка, среди прочего, изменения цвета кожи, такие как пятна, покраснение или появление областей сверхпигментации, таких как возрастные пятна или веснушки, аномальная дифференцировка, гиперкератинизация, эластоз, кератоз, утрата структуры коллагена и другие гистологические изменения рогового слоя дермы или эпидермиса, но не ограничиваясь ими.
Известно, что увеличенный уровень металлопротеиназ матрикса (ММР) представляет собой ключевой фактор в старении кожи. ММР, такие как ММР-1 и ММР-3, вовлечены в разрушение матрикса, и в частности в разрушение коллагена I типа, который представляет собой наиболее важный тип коллагена, находящийся в дерме. Во время процесса возрастного старения, а также в результате воздействия УФ излучения и воздействия других агентов окружающей среды, продукция ММР увеличивается, что приводит к разрушению дермы, стягиванию кожи, образованию морщин, то есть к первым видимым симптомам старения кожи.
Неожиданно, обнаружили, что ацетилированная гиалуроновая кислота или ее натриевая соль, способны уменьшать уровни ММР, в частности ММР-1 и ММР-3. Заявитель полагает, не желая быть связанным теорией, что сниженный уровень ММР является результатом подавления генов, кодирующих эти ферменты.
Биологическое действие ацетилированной гиалуроновой кислоты или ее натриевой соли по настоящему изобретению продемонстрировано в нескольких исследованиях по экспрессии генов, проведенных на трех основных типах клеток, присутствующих в коже: фибробластах, кератиноцитах и меланоцитах. Биологическое воздействие ацетилированной гиалуроновой кислоты или ее натриевой соли также определяли при помощи белковых и функциональных исследований in vitro. Авторы изобретения обнаружили существование новой активности против старения, связанной с ограниченным разрушением матрикса и защитой кожи от симптомов старения. Эти исследования описаны более подробно далее в примерах.
В то же время обнаружили, что ацетилированная гиалуроновая кислота, описанная в CN 106176286 (полученная из Bloomage Freda Biopharm Co., Ltd.), не вызывает какого-либо генного ответа.
Обнаружение того, что ацетилированная гиалуроновая кислота или ее натриевая соль, при нанесении на кожу, могут вызывать биологическое действие, проявляемое как уменьшение видимых признаков старения кожи, такое как уменьшение морщин на коже, дает возможность специалисту в данной области техники создать косметические препараты для нанесения на кожу человека.
Косметические препараты, и в частности композиции по уходу за кожей, по настоящему изобретению содержат косметически приемлемое количество ацетилированной гиалуроновой кислоты или ее натриевой соли.
Понятно, что косметически эффективное количество ацетилированной гиалуроновой кислоты или ее натриевой соли будет нетоксичным, но достаточным количеством ацетилированной гиалуроновой кислоты или натриевой соли для обеспечения требуемого эффекта. В отношении общей массы косметического препарата, в частности композиции для ухода за кожей, ацетилированная гиалуроновая кислота или ее натриевая соль могут быть представлены в количествах от приблизительно 0,005 до приблизительно 5,0% по массе, и, более конкретно, от приблизительно 0,05 до приблизительно 0,5% по массе.
Косметические препараты, и в частности композиции по уходу за кожей, по настоящему изобретению могут содержать один или более чем один косметически приемлемый эксципиент. Любые эксципиенты, обычно используемые при приготовлении косметических препаратов для нанесения на человеческую кожу, могут быть использованы в настоящем изобретении. Подходящие эксципиенты включают ингредиенты, которые могут влиять на органолептические свойства, проницаемость кожи и биологическую доступность ацетилированной гиалуроновой кислоты или ее натриевой соли, но не ограничиваются ими. Более конкретно, они включают жидкости, такие как вода, масла или поверхностно-активные вещества, включая вещества из нефти, животного, растительного или синтетического происхождения, такие как, без ограничения, арахисовое масло, соевое масло, минеральное масло, кунжутное масло, касторовое масло, полисорбаты, сложные эфиры сорбита, сульфаты простых эфиров, сульфаты, бетаины, гликозиды, мальтозиды, жирные спирты, ноноксинолы, полоксамеры, полиоксиэтилены, полиэтиленгликоли, декстрозу, глицерин, дигитонин и т.п.
Косметический препарат, и в частности композиция для ухода за кожей, может находиться в форме липосомной композиции, смешанных липосом, олеосом, ниосом, этосом, милличастиц, микрочастиц, наночастиц и наночастиц твердое вещество-липиды, везикул, мицелл, смешанных мицелл поверхностно-активных веществ, смешанных мицелл поверхностно-активное вещество-фосфолипид, миллисфер, микросфер и наносфер, липосфер, милликапсул, микрокапсул и нанокапсул, а также микроэмульсий и наноэмульсий, которые могут быть добавлены для достижения большей проникающей способности ацетилированной гиалуроновой кислоты или ее натриевой соли.
Косметический препарат, и в частности композиция для ухода за кожей, может быть получена в любой из форм: твердой, жидкой или полутвердой, полезной для нанесения на кожу местно или путем трансдермального применения. Таким образом, эти препараты для местного или трансддермального применения включают крема, множественные эмульсии, такие как, без ограничения, эмульсии масло и/или силикон в воде, эмульсии вода-в-масле и/или силиконе, эмульсии типа вода/масло/вода или вода/силикон/вода и эмульсии типа масло/вода/масло или силикон/вода/силикон, микроэмульсии, эмульсии и/или растворы, жидкие кристаллы, безводные композиции, водные дисперсии, масла, молоко, бальзамы, пены, водные или масляные лосьоны, водные или масляные гели, крем, водно-спиртовые растворы, водно-гликолевые растворы, гидрогели, линименты, серум, мыла, маски для лица, сыворотки, полисахаридные пленки, мази, муссы, помады, пасты, порошки, пластинки, карандаши и спреи или аэрозоли (спреи), включая не смываемые и смываемые композиции.
Обнаружение того, что ацетилированная гиалуроновая кислота или ее натриевая соль вызывает биологическое действие, было особенно неожиданным с учетом того, что не возможно вызвать это действие при использовании немодифицированной гиалуроновой кислоты или соли, что подтверждает то, что активность связана с ацетилированием формы свободной кислоты или соли.
Особенно предпочтительные формы ацетилированной гиалуроновой кислоты или ее натриевой соли для использования в настоящем изобретении отличаются тем, что они обладают очень высокой степенью ацетилирования. Более конкретно, предпочтительные формы ацетилированной гиалуроновой кислоты отличаются средней степенью ацетилирования больше чем 3,6, более конкретно 3,7 или выше, более конкретно 3,8 или выше, более конкретно 3,9 или выше, и более конкретно 4.
Гиалуроновая кислота представляет собой полисахарид, состоящий из повторяющегося мономера, содержащего N-ацетилглюкозамин и глюкуроновую кислоту. Она может существовать в форме свободной кислоты или в форме натриевой соли. В ацетилированной форме термин "степень ацетилирования" понимают как показатель количества гидроксильных групп на повторяющейся полимерной единице, которые являются ацетилированными. Каждая повторяющаяся единица полимера нативной гиалуроновой кислоты/соли содержит четыре гидрокисльные группы, которые могут быть ацетилированными, и степень ацетилирования представляет собой показатель того, сколько этих групп замещены ацетильной группой.
Измерение степени ацетилирования особенно затруднено при использовании обычных аналитических способов. Например, авторы изобретения обнаружили, что традиционный одномерный NMR (ядерный магнитный резонанс) является неэффективным из-за совмещения химических сдвигов протонов, которые необходимо измерять.
Тем не менее, заявитель выявил аналитический способ с использованием двухмерного NMR, при котором N-ацетильную группу на глюкозаминовой группировке гиалуроновой кислоты или ее натриевой соли используют в качестве внутреннего стандарта для количественного определения ацетильной функциональной группы, введенной в процессе ацетилирования.
Для интегрирования этих двух типов сигналов (О-ацетильная группа и N-ацетил) заявитель внес поправки в метод 2D-NMR. Более конкретно, способ 2D-NMR представляет собой гетеронуклеарный способ (анализ при помощи гетероядерной спектроскопии с одноквантовым переносом когеренции (HSQC)), измеряющий протонный сигнал в одном измерении, и сигнал с ядра углерода во втором измерении.
Путем использования метода 2D-NMR заявитель обнаружил, что является возможным ясно отличать N-ацетильный сигнал от сигналов, связанных с О-ацетильными группами, что позволяет сделать объемную интеграцию этих групп, и, таким образом, обеспечивает количественное определение степени ацетилирования. Основная схема подходящего эксперимента HSQC изложена в следующих параграфах.
Анализ степени ацетилирования осуществляют при помощи способа 1Н-13С HSQC, усиленного градиентом, позволяющего объемную интеграцию для приведенных ацетильных групп количественным образом.
Константа связывания 1H-13C обеспечивает информацию, касающуюся связи атомов в молекуле, и при NMR спектроскопии ответственна за появление множества сигналов в спектре. Объемы интегрирования перекрестных пиков в эксперименте HSQC модулируются при помощи константы связывания 1H-13C 1JC,H. Однако перекрестные пики, возникающие в результате различных констант связывания, обычно не допускают количественной интеграции. Однако заявитель успешно обнаружил, что в случае настоящего аналитического способа 1JC,H(N-ацетил) была по существу равна 1JC,H(O-ацетил), что позволяет провести количественный анализ.
В качестве стандартных количественных определений 1D-NMR достаточная релаксационная задержка может гарантировать, чтобы как N-ацетильный, так и О-ацетильный, протоны имели время для релаксации между одним сканом и другим для того, чтобы оставаться в пределах количественных условий. Кроме того, для ограничения дифференцированной Т2 релаксации между N- и О-ацетильными интересующими группами в последовательности, две задержки, заданные (4 X JC,H)-1 в переносе INEPT (нечувствительные ядра, усиленные за счет поляризационного переноса) в HSQC были максимально короткими, например приблизительно 1,5 миллисекунд.
Измерения 2D-NMR могут быть осуществлены на любом приборе высокого поля, существующем в области техники. Пример подходящего прибора представляет собой прибор NMR с полем высокой напряженности, оборудованный системой измерения линейных величин Cryoprobe, более конкретно Bruker Avance III 600 МГц, MicroCryoprode TCI 1,7 мм.
Образцы для анализа могут быть приготовлены в виде 1,2 мг ацетилированной гиалуроновой кислоты или ее натриевой соли, растворенной в 50 мл D2O с 99,96% D. Раствор с образцом может быть перенесен в пробирку для NMR (1,7 мм, Bruker) для измерения. Типичные параметры измерения включают: Т=60°C; количество сканов = 4; холостые сканы = 32; задержка для восстановления = 10 с; время экспозиции = 177 мс; ширина спектра (1Н)=6,0 млн-1; ширина спектра (13С)=110 млн-1; смещение 1H-импульса = 3,5 млн-1; смещение 13С-импульса = 60 млн-1; временной интервал (1Н)=1272; временной интервал (13С)=256. Программное обеспечение для регистрации и обработки данных, включающее интеграцию перекрестных пиков, представляет собой Top Spin 3.0 (Bruker).
В частности, этот метод 2D-NMR позволяет отличить ацетилированную гиалуроновую кислоту или натриевую соль по настоящему изобретению от продукта, описанного в ЕР 0725083, и представленного на рынке Shiseido: ацетилгиалуронат от Shiseido имеет среднюю степень ацетилирования лишь приблизительно 3,6. Это является важным, поскольку продукт Shiseido также оказывается уступающим продукту по настоящему изобретению в отношении противовозрастной активности, как показано в примере 5 далее.
Ацетилированная гиалуроновая кислота или натриевая соль, используемые в способах и косметических препаратах, в частности композиции по уходу за кожей, по настоящему изобретению представляет собой низкомолекулярную ацетилированную гиалуроновую кислоту или ее натриевую соль. Термин "низкомолекулярный" относится к полимерному материалу, имеющему средневзвешенную молекулярную массу (Mw), составляющую 50 кДа или меньше, более конкретно 35 кДа или меньше, более конкретно приблизительно 30 кДа или меньше, более конкретно 25 кДа или меньше, более конкретно 20 кДа или меньше, более конкретно 15 кДа или меньше, и еще более конкретно приблизительно от 10 кДа до 15 кДа, например 13 кДа ± 1 кДа.
Молекулярная масса полимерных фракций ацетилированной гиалуроновой кислоты или ее натриевая соли должны быть до некоторой степени узко диспергированы. Предпочтительно, ацетилированная гиалуроновая кислота или ее натриевая соль имеет показатель полидисперсности (Mw/Mn), который составляет меньше чем 2,0, более конкретно меньше чем 1,8, более конкретно меньше чем 1,7, более конкретно меньше чем 1,6 или меньше, более конкретно меньше чем 1,5, и более конкретно приблизительно 1,4 или меньше.
Для сравнения продукты, описанные в ЕР 0725083 (полученные от Shiseido) и CN 106176286 (полученные от Freda) анализировали при помощи SEC-HPLC (гель-фильтрационная хроматография и высокоэффективная жидкостная хроматография) с использованием детекции путем светорассеяния. Получили следующие результаты:
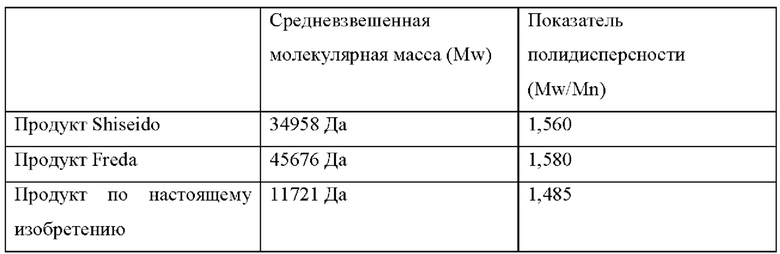
Собственная вязкость ацетилированной гиалуроновой кислоты или ее натриевой соли предпочтительно меньше чем 0,3 дл/г (30 см3/г), и более конкретно 0,245 дл/г (24,5 см3/г) ± 0,01 дл/г (1 см3/г).
Вышеприведенные физические параметры могут быть измерены при помощи HPLC гель-фильтрационной хроматографии. Подходящий прибор представляет собой Viscotek GPC max VE2001, оборудованный тремя детекторами (Viscotek TDA 305): рефрактометром, капиллярным вискозиметром и детектором светорассеяния.
Измерения светорассеяния характеризуют распределение размеров частиц путем измерения углового изменения интенсивности света, рассеиваемого по мере того, как лазерный пучок проходит через образец с диспергированными частицами. Крупные частицы отражают свет с относительно меньшими углами по сравнению с лазерным пучком и небольшие частицы отражают свет с относительно большими углами. Данные по интенсивности углового светорассеяния затем анализировали для расчета размера частиц, ответственных за формирование картины рассеяния, с использованием теории Ми светорассеяния. Размер частиц приводят в виде диаметра сферы с эквивалентным объемом. Гель-фильтрационная хроматография (SEC) представляет собой аналитический способ, который разделяет растворенные макромолекулы по размеру на основе их элюирования с колонок, заполненных пористым гелем. Когда SEC сочетают с детектором светорассеяния, вискозиметром и детектором концентрации (известно как тройная детекция), тогда можно измерить молекулярную массу, молекулярный размер и собственную вязкость.
В типичном протоколе измерения ацетилированную гиалуроновую кислоту или ее натриевую соль (0,2 г) растворяют в буфере TBS (100 мл) путем перемешивания в течение 1 ч при 45°C, а затем хранения раствора в течение еще 2 ч при комнатной температуре при перемешивании для полной гидратации полимера. Раствор фильтруют через 0,2 мкм нейлоновый шприцевой фильтр. Раствор затем инжектируют в HPLC SEC LALS (100 мкл). Анализ осуществляют со скоростью 0,35 мл/мин с буфером TBS с рН 7 при 35°C. Типичное время анализа составляет 90 минут и типичный инжектируемый объем составляет 100 мкл.
Низкомолекулярная ацетилированная гиалуроновая кислота или ее натриевая соль представляет собой предпочтительное вещество для использования в способах и косметических препаратах, в частности композиций по уходу за кожей по настоящему изобретению. Полагают, что применение низкомолекулярного вещества является удобным из-за его превосходного свойства проникать через кожу по сравнению с высокомолекулярными фракциями.
Гиалуроновая кислота или ее натриевая соль могут быть ацетилированы в соответствии со способами, известными в области техники.
В подходящем способе гиалуроновую кислоту растворяют в смеси уксусного ангидрида и уксусной кислоты. После этого, сильную кислоту, такую как серная кислота, добавляют в раствор для осуществления ацетилирования. Такой способ описан в ЕР 0725083 В1.
В воплощении изобретения отношение смешивания (мас./мас.) уксусной кислоты к уксусному ангидриду может варьировать в пределах диапазона от 1:4 до 1:1. Отношение смешивания (мас./мас.) сильной кислоты к гиалуроновой кислоте может составлять от 1:5 до 1:1.
Заявитель неожиданно обнаружил, что особенно высокой степени ацетилирования можно достичь в том случае, если реакцию ацетилирования осуществлять с использованием низкомолекулярной гиалуроновой кислоты в качестве исходного вещества. Не желая быть связанными теорией, предполагают, что низкомолекулярная гиалуроновая кислота легче и в более значительной степени ацетилируется чем высокомолекулярное исходное вещество, поскольку гидроксильные группы менее стерически затруднены в низкомолекулярном исходном веществе и, таким образом, легче ацетилируются. По этой причине предпочтительно, чтобы ацетилированную гиалуроновую кислоту или ее натриевую соль по настоящему изобретению получали с использованием низкомолекулярной гиалуроновой кислоты или натриевой соли в качестве исходного субстрата.
Соответственно, в еще одном аспекте по настоящему изобретению предложен способ ацетилирования гиалуроновой кислоты, где исходное вещество гиалуроновая кислота представляет собой низкомолекулярную фракцию, имеющую средневзвешенную молекулярную массу приблизительно 50 кДа или меньше, более конкретно приблизительно 35 кДа или меньше, и еще более конкретно приблизительно 30 кДа или меньше.
Путем использования субстрата гиалуроновой кислоты, имеющей вышеупомянутую низкую молекулярную массу, можно получать гиалуроновую кислоту с высокой степенью ацетилирования или ее натриевую соль, имеющую средневзвешенную молекулярную массу (Mw) 50 кДа или меньше, более конкретно 35 кДа или меньше, более конкретно приблизительно 30 кДа или меньше, более конкретно 25 кДа или меньше, более конкретно 20 кДа или меньше, более конкретно 15 кДа или меньше, и еще более конкретно приблизительно от 10 кДа до 15 кДа, например 13 кДа ± 1 кДа. Эти низкомолекулярные формы ацетилированной гиалуроновой кислоты и ацетилгиалуроната натрия образуют дополнительные аспекты настоящего изобретения.
Способ получения низкомолекулярной ацетилированной гиалуроновой кислоты или ее натриевой соли, где указанный способ включает стадии отбора низкомолекулярной гиалуроновой кислоты, имеющей средневзвешенную молекулярную массу приблизительно 50 кДа или меньше, более конкретно приблизительно 35 кДа или меньше, и еще более конкретно приблизительно 30 кДа или меньше, и ее взаимодействие в ацетилирующих условиях, например описанных в настоящем описании условиях, образует еще один аспект настоящего изобретения.
При помощи описанного выше способа синтеза получают неочищенную реакционную смесь, содержащую требуемую ацетилированную гиалуроновую кислоту, из которой ацетилированную гиалуроновую кислоту предпочтительно выделяют и очищают.
Соответственно, в еще одном из аспектов изобретения предложен способ выделения низкомолекулярной ацетилированной гиалуроновой кислоты из неочищенной реакционной смеси, содержащей низкомолекулярную ацетилированную гиалуроновую кислоту в растворе.
В конкретном воплощении изобретения способ выделения низкомолекулярной ацетилированной гиалуроновой кислоты включает стадию ее осаждения из раствора с помощью добавления воды.
Характерная низкая молекулярная масса ацетилированной гиалуроновой кислоты дает возможность для осуществления стадии осаждения с помощью добавления воды, а не дополнительного летучего органического растворителя. Последнее противопоставляется способам предшествующего уровня техники, в которых для осаждения из неочищенной реакционной смеси натриевых солей ацетилированной гиалуроновой кислоты используют дополнительные летучие органические растворители, такие как ацетон.
Учитывая сложность удаления всех органических растворителей во время обработки, натриевые соли гиалуроновой кислоты, образующиеся в соответствии со способами предшествующего уровня техники, могут содержать остатки летучего растворителя, которые могут быть нежелательны. Значительное преимущество настоящего изобретения заключается в том, что может быть получена низкомолекулярная ацетилированная гиалуроновая кислота без летучих органических растворителей, таких как ацетон.
Низкомолекулярная ацетилированная гиалуроновая кислота, не содержащая остатков летучего органического растворителя, образует еще один аспект настоящего изобретения.
Кроме того, низкомолекулярная ацетилированная гиалуроновая кислота, не содержащая летучий органический растворитель, может быть далее превращена в свою натриевая соль в соответствии со способом, описанным ниже, и натриевая соль низкомолекулярной ацетилированной гиалуроновой кислоты, не содержащая летучие органические растворители, образует еще один аспект настоящего изобретения.
До стадии осаждения может быть желательно удалить, по меньшей мере частично, не прореагировавшую уксусную кислоту и уксусный ангидрид из реакционной смеси. Уксусная кислота является растворителем для низкомолекулярной ацетилированной гиалуроновой кислоты, и ее частичное удаление вместе с уксусным ангидридом облегчает осаждение низкомолекулярной ацетилированной гиалуроновой кислоты за счет того, что обеспечивает возможность для проведения стадии осаждения с относительно небольшими объемами добавленной воды.
Смесь уксусная кислота/уксусный ангидрид может быть удалена путем дистилляции, оставляющей неочищенную реакционную смесь в форме вязкой пасты, состоящей в основном из требуемой низкомолекулярной ацетилированной гиалуроновой кислоты. Затем к этой неочищенной смеси добавляют воду для осуществления осаждения. Дистиллированная смесь уксусная кислота/уксусный ангидрид может быть собрана и повторно использована.
В предпочтительном воплощении изобретения количество добавленной воды составляет от 1 до 5 массовых эквивалентов, более конкретно от 2 до 4 массовых эквивалентов на одну часть неочищенной реакционной смеси, содержащей требуемую ацетилированную гиалуроновую кислоту. По мере добавления воды к реакционной смеси остаточный уксусный ангидрид гидролизуется. Сильно экзотермический гидролиз предпочтительно осуществляют таким образом, что температура реакционной массы не превышает 40°C.
Удаление уксусной кислоты/уксусного ангидрида может быть осуществлено путем дистилляции. Перед стадией дистилляции может быть желательным нейтрализовать любую сильную кислоту в реакционной смеси для того, чтобы избежать контакта ацетилированной гиалуроновой кислоты с сильной кислотой в условиях дефлегмации, что может привести к возникновению нежелательного обесцвечивания. Таким образом, корректирование рН неочищенной реакционной смеси до осуществления осаждения является предпочтительной стадией в способе выделения и очистки в соответствии с настоящим изобретением.
Соответственно, в еще одном аспекте изобретения предложен способ выделения низкомолекулярной ацетилированной гиалуроновой кислоты из реакционной смеси, содержащей низкомолекулярную ацетилированную гиалуроновую кислоту в растворе, где указанный способ включает стадию осаждения низкомолекулярной ацетилированной гиалуроновой кислоты из раствора при рН от 5 до 8 с помощью добавления воды.
В конкретном воплощении изобретения предложен способ выделения низкомолекулярной ацетилированной гиалуроновой кислоты из реакционной смеси, содержащей низкомолекулярную ацетилированную гиалуроновую кислоту в растворе, где указанный способ включает стадию корректирования рН реакционной смеси до значения рН в диапазоне от 5 до 8 и осаждения низкомолекулярной ацетилированной гиалуроновой кислоты из этого раствора с помощью добавления воды.
Для цели настоящего изобретения корректирование рН может быть осуществлено с использованием подходящего буферного агента, например фосфатов, ацетатов и цитратов, известных для такой цели, и более конкретно, забуферивание осуществляют путем добавления эффективного количества ацетата натрия.
Осажденная ацетилированная гиалуроновая кислота может быть отделена и выделена из других компонентов реакционной смеси путем фильтрования через подходящий фильтр, такой как любой текстильный фильтр с малой величиной ячейки, известный для такой цели.
Осажденная низкомолекулярная ацетилированная гиалуроновая кислота может быть подвергнута дополнительным процедурам обработки после осаждения. Например, она может быть промыта водой для удаления каких-либо следов водорастворимых примесей до осуществления сушки осажденного вещества для того, чтобы получить низкомолекулярную ацетилированную гиалуроновую кислоту в форме светлого белого легкотекучего порошка без или практически без желтоватого оттенка.
Низкомолекулярная ацетилированная гиалуроновая кислота может быть использована в этой форме в способах и косметических препаратах, в частности в композициях по уходу за кожей по настоящему изобретению.
На этой стадии также может быть желательным подвергнуть ацетилированную гиалуроновую кислоту дополнительным процедурам обработки, таким как стадия отбеливания или полировки для удаления любого нежелательного желтого окраса с использованием, например, активированного угля. Очищенная ацетилированная гиалуроновая кислота после этого может быть высушена, возможно, в вакууме, с получением ацетилированной гиалуроновой кислоты в форме, подходящей для применения в способах и косметических препаратах по настоящему изобретению без дополнительной модификации.
Альтернативно, может быть желательным превратить низкомолекулярную ацетилированную гиалуроновую кислоту в ее натриевую соль.
Ацетилированная гиалуроновая кислота по настоящему изобретению может быть превращена в ее соответствующую натриевую соль при помощи стадии нейтрализации.
Нейтрализация может быть осуществлена путем добавления водного источника ионов натрия, такого как гидроксид натрия, ацетат натрия или любое другое подходящее содержащее ионы натрия основание, в водный раствор или суспензию низкомолекулярной ацетилированной гиалуроновой кислоты.
Стадия нейтрализации может быть осуществлена при температуре от 0 до 30°C, и время реакции может варьировать в диапазоне от 0,5 до 12 часов.
Во время нейтрализации желательно, чтобы основание, например гидроксид натрия, добавляли в раствор или суспензию низкомолекулярной ацетилированной гиалуроновой кислоты медленно для того, чтобы ощутимые концентрации основания не образовывались, и значение рН не превышало приблизительно 9, более конкретно приблизительно 8, более конкретно приблизительно 7,5, более конкретно приблизительно 7, и еще более конкретно приблизительно 6,5. Вследствие этого, не образуются никакие нежелательные побочные продукты, и удается избежать возникновение нежелательного обесцвечивания.
В течение реакции нейтрализации для удобства может быть осуществлено отслеживание рН реакционной смеси, и нейтрализованный раствор соответствующего низкомолекулярного ацетилгиалуроната натрия получают тогда, когда рН достигает 6,5±0,5.
Раствор низкомолекулярного ацетилгиалуроната натрия, который образует еще один аспект настоящего изобретения, может быть использован в этой форме в способах и косметических препаратах, в частности композициях по уходу за кожей по настоящему изобретению без дополнительной модификации. Тем не менее, если желательно использовать раствор ацетилгиалуроната натрия в виде неочищенного вещества в указанных композициях и способах, тогда желательно включать в раствор подходящий антимикробный агент, и такие агенты хорошо известны в области техники.
Альтернативно, низкомолекулярный ацетилгиалуронат натрия может быть дополнительно обработан для того, чтобы перевести его в твердую форму, более конкретно в форму порошка.
Способы предшествующего уровня техники для выделения ацетилгиалуроната натрия в его твердой форме включают стадию его осаждения из водного ацетонового раствора с использованием чистого ацетона. Тем не менее, выделение и очистка, осуществляемые таким путем, могут оставлять остатки летучего органического растворителя в конечном продукте, и этих растворителей по возможности, как правило, следует избегать (или при возможности удалять) для того, чтобы соответствовать спецификациям продукта и другим показателям качестве, которые, как правило, могут потребоваться от сырья, прдназначенного для применения в косметической промышленности.
Кроме того, вследствие высокой растворимости низкомолекулярного ацетилгиалуроната натрия в воде, в летучих органических растворителях, а также в их смесях, он не может быть получен в твердой форме путем осаждения.
Таким образом, еще один аспект по настоящему изобретению основан на задаче, заключающейся в том, чтобы предложить способ получения не содержащего летучий органический растворитель низкомолекулярного ацетилгиалуроната натрия в твердой форме, и предпочтительно в форме порошка, который является светло-белым, легкотекучим и легким в обработке.
Заявителю удалось выполнить эти задачи, и им предложен способ превращения водного раствора низкомолекулярного ацетилгиалуроната натрия в форму порошка, где указанный способ включает стадию дегидратирования раствора низкомолекулярного ацетилгиалуроната натрия. Стадия дегидратации может быть осуществлена при помощи известных методов, таких как лиофилизация. Тем не менее, более предпочтительно стадию дегидратации осуществляют путем распылительной сушки.
Соответственно, в еще одном аспекте настоящего изобретения предложен способ дегидратирования жидкой водной среды, и, в частности, раствора, включающего ацетилгиалуронат натрия, в частности, ацетилгиалуронат натрия, полученный в соответствии с описанным здесь способом.
В одном из воплощений изобретения предложен описанный выше способ, где указанный способ включает стадии распыления жидкой водной среды каплями в осушительной камере, в которой поддерживаются условия, вызывающие выпаривание жидкой водной среды с образованием частиц ацетилгиалуроната натрия.
В более конкретном воплощении температура на входе камеры для распылительной сушки составляет приблизительно 150°C, и температура на выходе камеры для распылительной сушки составляет приблизительно 70°C или меньше.
В более конкретном воплощении воздух нагнетают в осушительную камеру, так, чтобы температура на выходе из осушительной камеры уменьшалась до приблизительно 40-50°C.
Высушенный путем распыления ацетилгиалуронат натрия, который образует еще один аспект настоящего изобретения, демонстрирует требуемые свойства, такие как высокая насыпная плотность, форма и текучесть, которые делают продукт легким для обработки, транспортировки и применения. Возможность избежать продукта с низкой плотностью и пыльного продукта представляет собой особенное преимущество ацетилгиалуроната натрия, высушенного путем распыления.
Высушенный путем распыления ацетилгиалуронат натрия образуется с достаточной белизной и прозрачностью, которые в высшей степени подходят для использования в продуктах, предназначенных для косметических применений, в частности для композиций по уходу за кожей.
Высушенный путем распыления продукт, получающийся в соответствии со способом, описанным выше, образует еще один аспект изобретения.
Как низкомолекулярая ацетилированная гиалуроновая кислота, так и низкомолекулярный ацетилгиалуронат натрия, легко включаются в косметические препараты, и, в частности, в композиции по уходу за кожей. Благодаря своей очень низкой молекулярной массе и своей порошковой физической форме, они не являются вязкими или комковатыми, и могут быть легко растворены или суспендированы в водных средах, и смешаны в косметических основаниях.
Кроме того, поскольку сильно окрашенные ингредиенты могут быть неприемлемы в качестве сырьевых материалов для производителей косметических препаратов, весьма благоприятно, чтобы как низкомолекулярная ацетилированная гиалуроновая кислота, так и низкомолекулярный ацетилгиалуронат натрия, могли быть получены в виде белых порошков без или по существу без желтоватого оттенка, и которые не изменяют или не нарушают цветовой тон какого-либо косметического препарата, в который они могут быть включены, независимо от количества материала, используемого в косметическом препарате.
После завершения обработки ацетилированной гиалуроновой кислоты или ее натриевой соли может быть осуществлена стадия отбеливания или полировки, путем которых устраняется незначительное обесцвечивание с использованием подходящего отбеливающего агента, такого как глина или форма активированного угля. Тем не менее, такие стадии не особенно эффективны для обесцвечивания таких продуктов, которые уже сильно обесцвечены в результате синтеза.
Особенностью настоящего изобретения является то, что описанные здесь способы получения и выделения обеспечивают низкомолекулярную ацетилированную гиалуроновую кислоту и низкомолекулярный ацетилгиалуронат натрия в виде продуктов, которые находятся в форме белых порошков с достаточной яркостью и прозрачностью, которые в случае осуществления стадии отбеливания или полировки способны эффективно обесцвечивать продукты.
Более конкретно, описанные в настоящей заявке способы способы получения и выделения обеспечивают получение низкомолекулярной ацетилированной гиалуроновой кислоты и низкомолекулярного ацетилгиалуроната натрия в виде продуктов, которые находятся в форме белых порошков, каждый из которых имеет величину L* 90 или больше; и величину b*, которая меньше чем 8, где величины b* и b* представляют собой координаты системы хроматичности CIELAB.
Осветленность и оттенок порошка могут быть охарактеризованы при помощи координат хроматичности CIELAB L* а* b* в соответствии с колориметрическими способами, известными в области техники. Величина L* представляет собой величину, которая обозначает насыщенность белого в веществе и указывается значением от 0 до 100. Значение величины L* 100 указывает на самое яркое состояние (полностью белое), а значение величины L* 0 указывает на самое темное состояние (полностью черный). Величина b* обозначает желто-белый оттенок вещества. Чем больше величина b*, тем выше степень желтизны. Чем меньше величина b*, тем выше степень синевы.
Как величина L*, так и величина b*, могут быть измерены с использованием любого подходящего имеющегося в продаже спектрофотометра, такого как Minolta CM3500d. Этот спектрофотометр должен быть включен в течение по меньшей мере одного часа до проведения измерений. Предназначенный для этого стеклянный контейнер должен быть заполнен наполовину твердым продуктом, измеряемым с осторожностью для обеспечения того, что дно контейнера полностью покрыто продуктом. После этого заполненный контейнер должен быть помещен в специально предназначенный для этого держатель для образца. Следует нажать кнопку «образец» ("sample") на приборе и величины L* и b* считываются с панели дисплея. Перед осуществлением каких-либо измерений прибор должен быть откалиброван на ноль и 100% отражение путем помещения специально предназначенных для этого черных и белых объектов в окно оптического сенсора прибора.
Далее следует ряд примеров, предназначенных для дополнительной иллюстрации настоящего изобретения.
Пример 1: Способ получения ацетилгиалуроната натрия
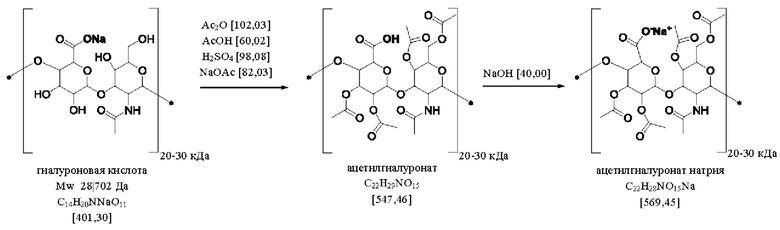
Реактор объемом 5 л продували азотом и загружали гиалуроновой кислотой (Renovhyal™ производства Soliance, молекулярная масса 10-50 кДа; 300 г, 0,7 моль). Добавляли технический уксусный ангидрид (2160 г, 21,2 моль), и уксусную кислоту (525 г, 8,7 моль), и температуру суспензии устанавливали на уровне 25°C. Добавляли 96% серную кислоту (194 г, 1,9 моль) в течение периода 10 минут. Температуру поддерживали на уровне 25°C путем внутреннего контроля. Перемешивание поддерживали в течение 15 часов. Внутренний контроль отключали и ацетат натрия (154 г, 1,9 моль) добавляли при перемешивании. Температуру увеличивали до 35°C и перемешивание продолжали в течение 30 минут. Реактор опустошали до 40 мбар (4 кПа) и температуру рубашки устанавливали равной 50°C. В течение периода, равного 5 часам, смесь уксусного ангидрида и уксусной кислоты удаляли путем перегонки (1343 г). Оставшееся слегка пастообразное, но все еще перемешиваемое содержимое реактора охлаждали до комнатной температуры и добавляли воду (5500 мл) (сначала очень осторожно), постоянно поддерживая температуру смеси ниже 50°C. Постепенно образовывалась мелкодисперсная белая суспензия. Твердые вещества выделяли путем фильтрования и промывали водой (10 л). Твердые вещества затем ресуспендировали в воде (700 мл) и смесь нейтрализовали (рН 6,5) путем добавления 1 М NaOH (600 мл) с получением раствора ацетилгиалуроната натрия (1520 г, с=0,11 г/г). Этот раствор подвергали распылительной сушке с получением ацетилгиалуроната натрия (175 г, 0,3 моль, выход 44%) в виде тонкодисперсного свободно текучего порошка. Анализ при помощи HSQC-NMR (гетероядерный ядерный магнитный резонанс с одноквантовым переносом когеренции) указывал на степень ацетилирования, равную 3,9.
Пример 2: Способ выделения ацетилгиалуроната натрия методом распылительной сушки
Распылительную сушку 11% водного раствора ацетилгиалуроната натрия осуществляли с использованием аппарата для распылительной сушки GEA VERSATILE-SD™ 6.3, оборудованного центробежным тонкодисперсным распылителем, с использованием следующих параметров:
- Температура загружаемого материала: 15°C
- Температура на входе: 150°C
- Температура на выходе: 70°C
- Скорость загрузки: 20 кг/ч
- Производительность вентилятора: 400 кг воздуха/ч
Скорость вращения перемешивающих устройств: 12000 об/мин
Получали белый свободно текучий порошок ацетилгиалуроната натрия.
Пример 3: Цитотоксичность
Предварительные оценки цитотоксичности ацетилгиалуроната натрия в отношении фибробластов и меланоцитов осуществляли при помощи теста с использованием МТТ (3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия бромид). Вкратце, клетки высевали на 96-луночные культуральные планшеты и обрабатывали ацетилгиалуронатом натрия в различных концентрациях 10, 5, 1, 0,5, 0,1, 0,05, 0,01 и 0,005 мг/мл, соответственно, в течение 24 ч и 48 ч. Цитотоксичность оценивали при помощи раствора МТТ (5 мг/мл, разведенного в отношении 1/6 в физиологическом растворе, забуференном фосфатом (PBS)). Планшеты инкубировали в течение 4 ч при 37°C, в условиях защиты от света. Нерастворимый пурпурный формазановый продукт разводили в 50 мкл DMSO (диметилсульфоксид), и оптическую плотность считывали при 560 нм при использовании микропланшетного ридера (TECAN).
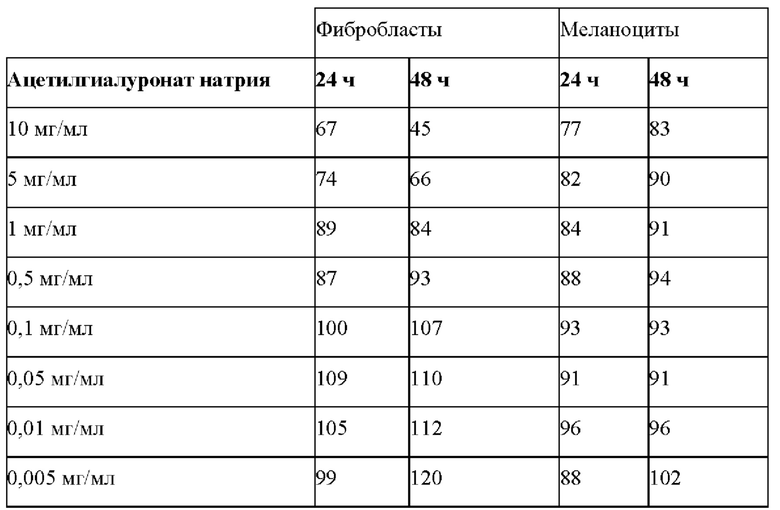
Таблица 1: Оценка цитотоксичности, осуществляемая при помощи теста МТТ, на фибробластах и меланоцитах
В отношении воздействия ацетилгиалуроната натрия на фибробласты с точки зрения цитотоксичности, он вызывал цитотоксичность только в концентрациях 10 и 5 мг/мл. Ниже этих доз не обнаруживали никакого действия.
В отношении его воздействия на меланоциты только концентрация 10 мг/мл ацетилгиалуроната натрия демонстрировала цитотоксическое действие. Ниже этой дозы действие на меланоциты отсутствовало (таблица 1).
Оптимальную концентрацию, которая может быть использована без того, чтобы вызвать токсические действия на каждом из типов клеток, определили равной 0,1 мг/мл для фибробластов и 0,5 мг/мл для меланоцитов. Эти концентрации использовали во время биологических экспериментов.
Пример 4: Транскриптомная оценка
Для идентификации потенциальной биологической активности ацетилгиалуроната натрия осуществляли транскриптомный анализ in vitro на двух типах клеток, представленных в коже, включающих меланоциты и фибробласты. Ее исследовали на 128 генах, распределенных на двух планшетах для проведения транскриптомного анализа. Первый планет был специфическим в отношении в отношении функции дермы с множеством генов, вовлеченных во внеклеточный матрикс, ремоделирование матрикса, окислительную защиту, стрессовые ответы, заживление ран и другие биологические функции. Второй планшет был специфическим в отношении функций пигментации кожи с наиболее важными генами, вовлеченными в синтез меланина, образование и созревание меланосом и другие функции, связанные с меланоцитами.
Транскриптомный анализ осуществляли при помощи Rt-qPCR (количественная полимеразная цепная реакция в реальном времени) с использованием анализов TaqMan в трех повторностях для каждого типа клеток. Вкратце, после 24 ч клеточной стимуляции при использовании 0,1 мг/мл для фибробластов и 0,5 мг/мл для меланоцитов общую РНК экстрагировали методом выделения РНК с тризолом (Trizol). Общую РНК количественно определяли при помощи спектрометра, и концентрации доводили до уровня 400 нг/мкл. Количество РНК подтверждали при помощи миграции в агарозном геле. Общую РНК подвергали обратной транскрипции до кДНК с использованием набора cDNA Verso kit в соответствии с рекомендациями производителя. Обратную транскрипцию подтверждали при помощи классической ПЦР, направленной против гена домашнего хозяйства ген RPL32. кДНК затем использовали для осуществления RT-qPCR, при которой 10 нг кДНК помещали в лунку с использованием методики TaqMan assay.
Полученные результаты представлены в таблице 2 ниже. Индукцию на уровне в более чем 1,3 раза (как положительная, так и отрицательная) по сравнению с состоянием без обработки рассматривают как показатель биологической модификации.
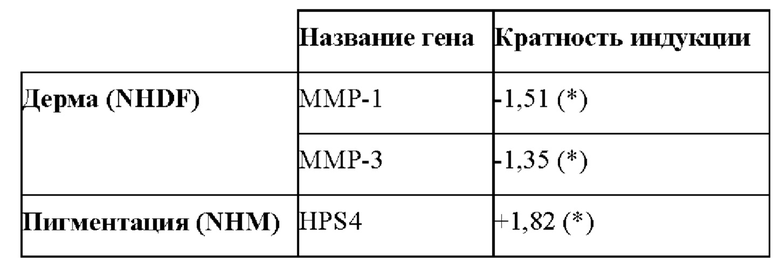

Таблица 2: Гены, которые существенно модулируются ацетилгиалуронатом натрия на фибробластах (дерма) и меланоцитах (пигментация). p<0,05 *
Пример 5: Влияние ацетилгиалуроната натрия на фибробласты (дерма)
В отношении результатов, относящихся к дерме, ММР-1 и ММР-3 представляют собой две металлопротеиназы матрикса, вовлеченные в разрушение матрикса, такого как коллаген I типа, который представляет собой наиболее важный коллаген, представленный в дерме.
В процессе старения продукция ММР увеличивается, что приводит к разрушению внутрикожного матрикса, которое способствует стягиванию кожи и образованию морщин. Они представляют собой первые видимые показатели старения кожи.
Это явление может быть ускорено внешними факторами, такими как УФ излучение. Несомненно, УФ вызывает окислительный стресс в коже, который отвечает за существенное увеличение высвобождения ММР, которое, в свою очередь, способствует преждевременному старению кожи вследствие сильного разрушения матрикса.
Результаты транскриптомного анализа свидетельствуют о том, что ацетилгиалуронат натрия может ограничивать этот эффект путем понижающей регуляции ММР-1 и ММР-3 (таблица 2).
Была разработана специфическая модель старения in-vitro на фибробластах, способная к сверхэкспрессии ММР-1 и ММР-3 за счет окислительного стресса (H2O2 100 мкМ-200 мкМ в течение 2 ч). Вкратце, фибробласты подвергали предварительной обработке ацетилгиалуронатом натрия (0,1 мг/мл) в базальной среде в течение 2 ч до индуцирования окислительного стресса. После окислительного стресса фибробласты инкубировали в течение 48 ч в базальной среде при 37°C, предоставляя возможность для аккумулирования ММР в культуральной среде. Количество ММР-1 и ММР-3, высвобождающееся из супернатантов, затем оценивали при помощи мультиплексного способа с использованием технологии Luminex (принцип ELISA (иммуноферментный анализ) на частицах).
Высвобождение ММР-1:

Таблица 3: Влияние ацетилгиалуроната натрия на высвобождение ММР-1, вызванное окислительным стрессом in vitro на фибробластах (выраженное в относительных единицах). * - p<0,05; н.з. незначимо. Процентные величины, представленные в скобках, отражают уровень ингибирования, вызванного ацетилгиалуронатом натрия или гиалуронатом натрия относительно отсутствия активного вещества.
Было продемонстрировано, что ацетилгиалуронат натрия значительно уменьшал секрецию ММР-1, опосредованную окислительным стрессом на белковом уровне. В противоположность этому, обнаружили, что гиалуронат натрия не был способен воспроизводить это действие, что подтверждает то, что обнаруженные эффекты являлись следствием ацетилирующей модификации (таблица 3).
Сравнительное исследование высвобождения ММР-1:
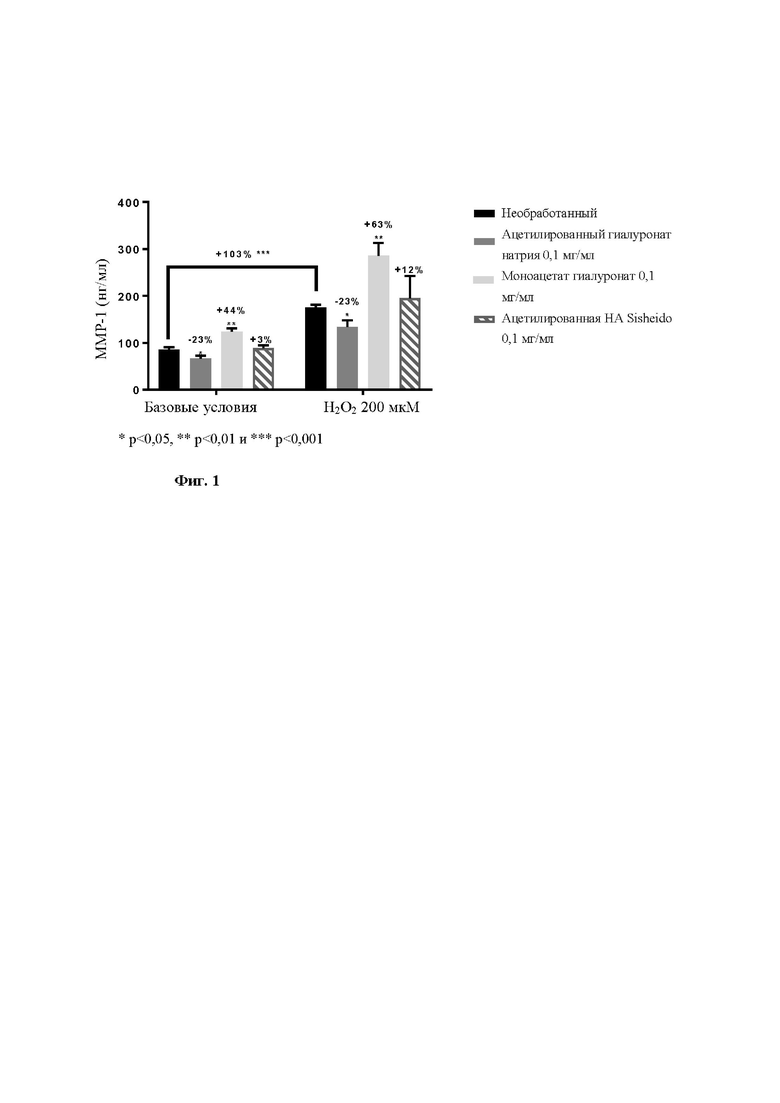
Для сравнения эффекты (а) продукта по настоящему изобретению, (б) гиалуроната моноацетата и (в) ацетилированного гиалуроната в соответствии с ЕР 0725083 (от Shiseido; средняя степень ацетилирования приблизительно 3,6; ММ (молекулярная масса) приблизительно 100 кДа) на ММР-1 исследовали в соответствии со следующей процедурой.
Фибробласты после абдоминальной биопсии европеоидной женщины (возраст 26 лет) засеивали в 12-луночные планшеты в концентрации 200000 клеток/лунку в 1 мл полной среды (ZenBio, название DF-1). Через 24 ч после высевания полную среду заменяли на базальную среду без сыворотки крови (Zen-Bio, название DF-2). После 24 ч выращивания в базальной среде клетки предварительно инкубировали с тестируемыми продуктами в концентрации 0,1 мг/мл в течение 2 ч при 37°C и затем подвергали воздействию окислительного стресса (Н2О2 200 мкМ) в течение 2 ч при 37°C.Культуральную среду заменяли на базальную среду и клетки инкубировали в течение еще 48 ч при 37°C. Супернатант собирали и хранили при -80°C до проведения анализа.
Количественное определение ММР-1 осуществляли с использованием набора RayBio® Human MMP-1 ELISA kit иммуноферментный анализ на иммуносорбенте in vitro для количественного измерения про и активной форм человеческого ММР-1 в сыворотке крови, плазме крови и супернатантах клеточной культуры. В этом анализе используется антитело, специфическое в отношении человеческой ММР-1, покрывающее 96-луночный планшет. Стандарты и образцы пипетируют в лунки и ММР-1, представленная в образце, связывается с лунками за счет иммобилизированного антитела. Лунки промывают и добавляют биотинилированное антитело против человеческой ММР-1. После отмывания несвязанного биотинилированного антитела конъюгированный с HRP (пероксидаза хрена) стрептавидин пипетируют в лунки. Лунки вновь промывают, в лунки добавляют раствор субстрата ТМВ (3,3',5'5'-тетраметилбензидин), и окрашивание развивается пропорционально количеству связавшейся ММР-1. Останавливающий раствор изменяет окрашивание с голубого на желтое, и интенсивность окрашивания измеряют при 450 нм.
ММР-1 измеряли после разведения образцов 1/100 в трех повторностях. Стандартную кривую строили в двух повторностях. В соответствии со стандартными концентрациями ММР-1 18000, 6000, 2000, 666,7, 222,2, 74,07 и 24,69 пг/мл рассчитывали четырехпараметрическую логистическую регрессию.
Результаты представлены на фиг. 1.
В базовых условиях обнаружили, что только ацетилированный гиалуронат натрия по настоящему изобретению (а) вызывал значительное ингибирование продукции ММР-1 (-23%). Моноацетат гиалуронат (б) не воспроизводил этот эффект и даже демонстрировал противоположное действие, заключающееся в увеличении продукции ММР-1 (+44%). Ацетилированная гиалуроновая кислота от Sisheido (в) не оказывала существенного действия на высвобождение ММР-1 в этих экспериментальных условиях (+3%).
В условиях окислительного стресса, опосредованного Н2О2 (без обработки ацетилированным гиалуронатом) для воспроизводства эффекта старения, бы обнаружена значительная сверхпродукция ММР-1 (+103%), которая валидировала эксперимент.
Предварительная инкубация с ацетилированным гиалуронатом натрия по настоящему изобретению (а) вызывала значительное уменьшение опосредованной стрессом продукции ММР-1, тогда как другие продукты демонстрировали обратный эффект с +63% и +12% для моноацетата гиалуроната (б) и ацетилированной гиалуроновая кислоты от Sisheido (в), соответственно.
В заключение, только ацетилированный гиалуронат натрия по настоящему изобретению (а) демонстрирует эффективную активность в отношении ингибирования высвобождения ММР-1 в базовых условиях и в присутствии окислительного стресса (напоминающего старение).
Высвобождение ММР-3:
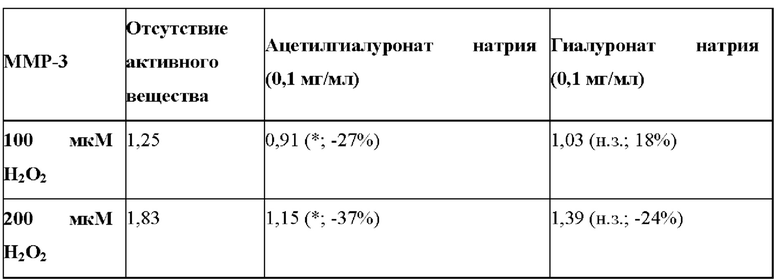
Таблица 4: Влияние ацетилгиалуроната натрия на высвобождение ММР-3, вызванное окислительным стрессом in vitro на фибробластах (выраженное в относительных единицах). * - p<0,05; н.з. незначимо. Процентные величины, представленные в скобках, отражают величину ингибирования, вызванного ацетилгиалуронатом натрия относительно отсутствия активного вещества (отсутствие ацетилгиалуроната натрия).
Было продемонстрировано, что ацетилгиалуронат натрия значительно уменьшал секрецию ММР-3, опосредованную окислительным стрессом на белковом уровне. В противоположность этому, обнаружили, что гиалуронат натрия не был способен воспроизводить это действие, что подтверждает то, что обнаруженный эффект, был следствием ацетилирующей модификации (таблица 4).
Измерения флуоресценции
ММР высвобождаются в двух формах, включающих инактивированную проформу (про-ММР) и активную форму с отщепленным пропептидом (ММР). Только активные ММР способны вызывать разрушение коллагена. Использовали коллаген DQ-типа I, который представляет собой коллаген I типа, флуоресцентно связанный с гасителем. При своем разрушении он способствует высвобождению гасителя и испусканию флуоресценции. Наконец, измеряли испускаемую флуоресценцию, которая пропорциональна разрушению коллагена. Этот эксперимент осуществляли непосредственно в тех же самых экспериментальных условиях, которые использовали для количественного определения секреции ММР-1 и ММР-3. Вкратце, супернатант инкубировали с DQ-коллагеном в течение 4 ч при комнатной температуре, и флуоресценцию измеряли при помощи микропланшетного ридера (TECAN) с длиной волны возбуждения 495 нм и длиной волны испускания 515 нм.
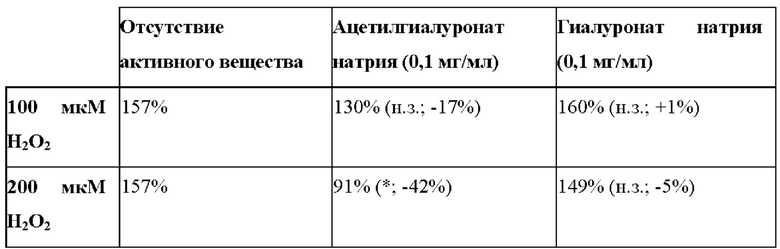
Таблица 5: Влияние ацетилгиалуроната натрия на разрушение коллагена I типа после окислительного стресса in vitro на фибробластах (выраженное в относительных единицах). * - p<0,05; н.з. - незначимо. Процентные величины, представленные в скобках, отражают уровень ингибирования, вызванного ацетилгиалуронатом натрия или гиалуронатом натрия относительно отсутствия активного вещества.
Было обнаружено, что ацетилгиалуронат натрия уменьшал разрушение DQ-коллагена, такое как обнаруженное по уменьшению уровня флуоресценции (таблица 5). Эти результаты продемонстрировали, что ацетилгиалуронат натрия ограничивает высвобождение активных форм ММР-1 и ММР-3, ответственных за разрушение DQ-коллагена. В целом, эти результаты in vitro обеспечили то, что ацетилгиалуронат натрия обладает антивозрастной активностью путем воздействия на ремоделирование матрикса, которое вовлечено в видимые признаки старения кожи. Несомненно, он ограничивает старение путем понижающей регуляции ММР-1 и ММР-3, которая контролирует разрушение матрикса, такого как коллаген I типа. В дополнение, гиалуронат натрия не способен обеспечить те же самые результаты, что подтверждает то, что его биологическая активность связана с ацетилирующей модификацией (таблица 5).
Пример 6: Влияние ацетилгиалуроната натрия на меланоциты (меланоциты)
Функция пигментации
В отношении функции пигментации обнаружили, что ацетилгиалуронат натрия вызывает значительное увеличение экспрессии генов HPS4, MITF и ENDR6 на транскриптомном уровне. Эти результаты свидетельствуют о том, что он может обладать пропигментирующим свойством. Действие ацетилгиалуроната натрия на синтез меланина in vitro анализировали на меланоцитах в базовых условиях и стимулированных условиях, опосредованных добавлением L-тирозинового субстрата. Вкратце, в отношении базовых условий меланоциты инкубировали в 24-луночном планшете в течение 24 ч выращивания культуры. Среду затем заменяли на культуральную среду с ацетилгиалуронатом натрия или без него или немодифицированный гиалуронат натрия в концентрациях 0,1, 0,25, 0,5 и 1 мг/мл, соответственно, или контроль (L-тирозин 1 мМ). Клетки инкубировали в течение 10 суток с двумя возобновлениями обработки после 3 и 7 суток инкубации.
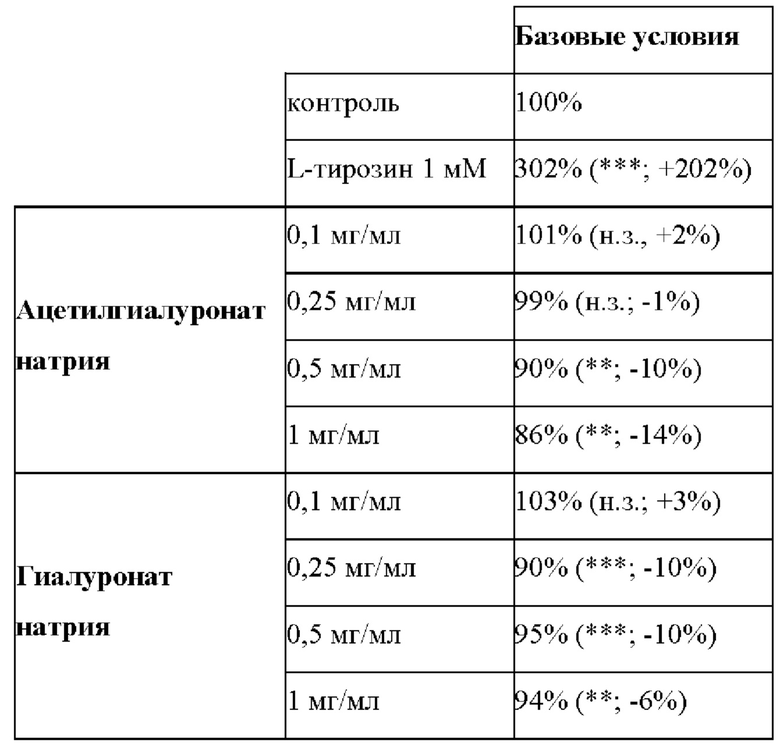
Таблица 6: Влияние ацетилгиалуроната натрия на синтез меланина in vitro на меланоциты в базовом состоянии (выраженное в % относительно контрольных условий). ** - p<0,01**; *** - p<0,001; н.з. - незначимо. Процентные величины в скобках отражают эффекты, вызванные тестируемыми соединениями (L-тирозин, ацетилгиалуронат натрия и гиалуронат натрия относительно действия при отсутствии тестируемого соединения (контроль)).
Результаты показали, что ацетилгиалуронат натрия вызывает уменьшение синтеза меланина в базовых условиях с действием, зависящим от дозы (+2% при 0,1 мг/мл и -9% при 1 мг/мл). Немодифицированный гиалуронат натрия был менее эффективным, что демонстрирует то, что ацетилирование улучшает биологическую активность гиалуроната натрия.
Стимулирование
В отношении стимулированного состояния меланоциты инкубировали в 24-луночных планшетах в течение 24 часов выращивания культуры. Среду затем заменяли на культуральную среду, содержащую L-тирозин (1 мМ), дополненный ацетилгиалуронатом натрия или не модифицированным гиалуронатом натрия в концентрациях 0,1, 0,25, 0,5 и 1 мг/мл, соответственно, или контроль (липоевая кислота 5 мкг/мл). Клетки инкубировали в течение 10 суток с двумя возобновлениями обработки после 3 и 7 суток инкубирования.

Таблица 7: Влияние ацетилгиалуроната натрия на синтез меланина in vitro на меланоциты в стимулированном состоянии (выраженное в % относительно 1 мМ L-тирозина в качестве контрольных условий). * - p<0,05; ** - p<0,01; *** - p<0,001; н.з. - незначимо. Процентные величины в скобках отражают действия, вызванные тестируемыми соединениями (липоевая кислота, ацетилгиалуронат натрия и гиалуронат натрия относительно действия при отсутствии тестируемого соединения (контроль)).
Результаты демонстрировали то, что ацетилгиалуронат натрия вызывает увеличение синтеза меланина с обратным действием в зависимости от доз (+11% при 0,1 мг/мл и -7% при 1 мг/мл). Немодифицированный гиалуронат натрия был менее эффективным, что демонстрирует то, что ацетилирование улучшает биологическую активность гиалуроната натрия.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИЯ, УСИЛИВАЮЩАЯ ЭФФЕКТИВНОСТЬ, И ЕЕ ПРИМЕНЕНИЕ | 2021 |
|
RU2824140C1 |
| ГЕЛЬ ГИАЛУРОНОВОЙ КИСЛОТЫ ДЛЯ ВНУТРИКОЖНОЙ ИНЪЕКЦИИ | 2007 |
|
RU2448740C2 |
| КОМБИНАЦИЯ ГИАЛУРОНОВОЙ КИСЛОТЫ И СУЛЬФАТИРОВАННОГО ПОЛИСАХАРИДА | 2015 |
|
RU2683567C2 |
| СОСТАВ ПРЕПАРАТА ДЛЯ СТИМУЛЯЦИИ РОСТА ВОЛОС | 2023 |
|
RU2812523C1 |
| ГЕЛЕВАЯ КОМПОЗИЦИЯ ДЛЯ ОБРАБОТКИ КОЖНЫХ ПОКРОВОВ | 2020 |
|
RU2753638C2 |
| Косметическая композиция для увлажнения и заживления кожи | 2017 |
|
RU2660350C1 |
| Гидрогелевая водорастворимая композиция на основе гиалуроновой кислоты и ионов поливалентных металлов и способ ее получения | 2019 |
|
RU2710074C1 |
| СМЕСИ КАРНОЗИНА И ГИАЛУРОНОВОЙ КИСЛОТЫ И ИХ ПРИМЕНЕНИЕ | 2011 |
|
RU2602297C2 |
| ИНЪЕЦИРУЕМАЯ МЕДИЦИНСКАЯ КОМПОЗИЦИЯ | 2021 |
|
RU2788726C1 |
| Тоник для ухода за кожей | 2020 |
|
RU2755201C1 |
Группа изобретений относится к уходу за кожей. Композиция для ухода за кожей содержит низкомолекулярную ацетилированную гиалуроновую кислоту или ее натриевую соль, при этом низкомолекулярная ацетилированная гиалуроновая кислота или ее натриевая соль имеет средневзвешенную молекулярную массу от 10 до 15 кДа, среднюю степень ацетилирования больше чем 3,8 и показатель полидисперсности меньше чем 1,5. Также раскрыты способ получения низкомолекулярной ацетилированной гиалуроновой кислоты, способ получения натриевой соли низкомолекулярной ацетилированной гиалуроновой кислоты, порошок низкомолекулярной ацетилированной гиалуроновой кислоты или ее натриевой соли для ухода за кожей, способ подавления разрушения внеклеточного матрикса кожи, ассоциированного с повышенными уровнями разрушающих матрикс ферментов. Группа изобретений обеспечивает лечение видимых эффектов старения на человеческой коже. 5 н. и 10 з.п. ф-лы, 1 ил., 7 табл., 6 пр.
1. Композиция для ухода за кожей, содержащая низкомолекулярную ацетилированную гиалуроновую кислоту или ее натриевую соль, отличающаяся тем, что низкомолекулярная ацетилированная гиалуроновая кислота или ее натриевая соль имеет средневзвешенную молекулярную массу от 10 до 15 кДа, среднюю степень ацетилирования больше чем 3,8 и показатель полидисперсности меньше чем 1,5.
2. Композиция для ухода за кожей по п. 1, отличающаяся тем, что низкомолекулярная ацетилированная гиалуроновая кислота или ее натриевая соль имеет среднюю степень ацетилирования 3,9 или больше, и еще более конкретно 4,0.
3. Композиция для ухода за кожей по п. 1 или 2, отличающаяся тем, что низкомолекулярная ацетилированная гиалуроновая кислота или ее натриевая соль имеет средневзвешенную молекулярную массу 13 кДа плюс/минус 1 кДа.
4. Композиция для ухода за кожей по любому из пп. 1-3, отличающаяся тем, что низкомолекулярная ацетилированная гиалуроновая кислота или ее натриевая соль имеет показатель полидисперсности 1,4 или меньше.
5. Композиция для ухода за кожей по любому из пп. 1-4, отличающаяся тем, что степень ацетилирования определена количественным 2D NMR (ядерным магнитным резонансом).
6. Способ получения низкомолекулярной ацетилированной гиалуроновой кислоты, имеющей средневзвешенную молекулярную массу от 10 до 15 кДа, среднюю степень ацетилирования больше чем 3,8 и показатель полидисперсности меньше чем 1,5, включающий стадии:
(1) отбора низкомолекулярной гиалуроновой кислоты, имеющей молекулярную массу 30 кДа или меньше;
(2) подвергания ее условиям ацетилирования; и
(3) выделения низкомолекулярной ацетилированной гиалуроновой кислоты путем осаждения с помощью добавления воды.
7. Способ получения натриевой соли низкомолекулярной ацетилированной гиалуроновой кислоты, имеющей средневзвешенную молекулярную массу от 10 до 15 кДа, среднюю степень ацетилирования больше чем 3,8 и показатель полидисперсности меньше чем 1,5, включающий стадии:
(1) отбора низкомолекулярной гиалуроновой кислоты, имеющей молекулярную массу 30 кДа или меньше;
(2) подвергания ее условиям ацетилирования;
(3) выделения низкомолекулярной ацетилированной гиалуроновой кислоты путем осаждения с помощью добавления воды; и
(4) взаимодействия низкомолекулярной ацетилированной гиалуроновой кислоты с основанием, которое обеспечивает источник ионов натрия, с получением раствора ацетилгиалуроната натрия.
8. Способ по п. 7, где превращение низкомолекулярной ацетилированной гиалуроновой кислоты в ацетилгиалуронат натрия осуществляют при pH, который не превышает 9, более конкретно, который не превышает 8, более конкретно, который не превышает 7, и, еще более конкретно, который не превышает 6,5.
9. Способ по п. 7 или 8, дополнительно включающий стадию
(5) дегидратации раствора путем лиофилизации или распылительной сушки.
10. Способ по любому из пп. 7-9, где условия ацетилирования включают стадию взаимодействия низкомолекулярной гиалуроновой кислоты со смесью уксусная кислота/уксусный ангидрид в присутствии сильной кислоты.
11. Порошок низкомолекулярной ацетилированной гиалуроновой кислоты или ее натриевой соли для ухода за кожей, где низкомолекулярная ацетилированная гиалуроновая кислота или ее натриевая соль имеет средневзвешенную молекулярную массу от 10 до 15 кДа, среднюю степень ацетилирования больше чем 3,8 и показатель полидисперсности меньше чем 1,5, где порошок является белым и имеет значение L* 90 или больше и значение b* меньше чем 8, где величина L* обозначает насыщенность белого в веществе и величина b* обозначает желто-белый оттенок вещества.
12. Способ подавления разрушения внеклеточного матрикса кожи, ассоциированного с повышенными уровнями разрушающих матрикс ферментов, где указанный способ включает стадию нанесения на кожу эффективного количества композиции по уходу за кожей по любому из пп. 1-5 либо низкомолекулярной ацетилированной гиалуроновой кислоты или ее натриевой соли по п. 11.
13. Способ по п. 12, который представляет собой способ уменьшения видимых признаков старения на коже.
14. Способ по п. 12 или 13, где разрушающие матрикс ферменты представляют собой металлопротеиназы, в частности MMP-1 или MMP-3.
15. Способ по любому из пп. 12-14, где ацетилированная гиалуроновая кислота или ее натриевая соль подавляют разрушение коллагена во внеклеточном матриксе.
| ОТСЕКАЮЩАЯ ЗАКРЫВАЮЩАЯ ДЕТАЛЬ И УСТРОЙСТВО ДЛЯ ФОРМОВАНИЯ ПИЩЕВЫХ ПРОДУКТОВ | 2015 |
|
RU2644188C1 |
| КОМПЛЕКСНОЕ КОСМЕТИЧЕСКОЕ СРЕДСТВО | 2014 |
|
RU2543651C1 |
| WO 1996005233 A1, 22.02.1996 | |||
| УСТРОЙСТВО ДЛЯ ЛЕЧЕНИЯ ДЕРМАТОЛОГИЧЕСКИХ СОСТОЯНИЙ | 2005 |
|
RU2388504C2 |
| ПОЛИМЕРНЫЕ КОМПОЗИЦИИ МОДИФИЦИРОВАННОЙ ГИАЛУРОНОВОЙ КИСЛОТЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2010 |
|
RU2539395C2 |
| ИММУНОГЕННЫЕ КОМПОЗИЦИИ АНТИГЕНОВ STAPHYLOCOCCUS AUREUS | 2010 |
|
RU2536981C9 |
| CN 104004208 B, 03.02.2016 | |||
| CN 106176286 B, 28.05.2019. | |||
Авторы
Даты
2023-01-19—Публикация
2018-03-08—Подача