ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
Эта заявка испрашивает приоритет Предварительной заявки на Патент США № 61/230074, зарегистрированной 30 июля 2009 года, и Предварительной заявки на Патент США № 61/311953, зарегистрированной 09 марта 2010 года, содержание которых приводится здесь путем ссылки на них.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Изобретение в целом относится к гиалуроновой кислоте, имеющей низкий уровень модификации функциональных групп, к смесям, образуемым в результате контролируемой реакции такой слегка модифицированной гиалуроновой кислоты с подходящими дифункциональными или многофункциональными реагентами, и имеющим отношение к ним композициям гидрогеля и предшественника гидрогеля. Описываемые в изобретении композиции являются слегка сшитыми и обладают низкими провоспалительными свойствами при введении in vivo, и могут быть использованы, наряду с другими областями применения, например, в качестве медицинских устройств, биомедицинских адгезивов и герметиков, и для доставки в строго определенное место биоактивных веществ.
УРОВЕНЬ ТЕХНИКИ
Гиалуроновая кислота является природным анионным несульфатированным гликозаминогликаном, который широко распространен в соединительных, эпителиальных и нервных тканях. В среднем, в организме человека с массой тела 70 кг (154 фунтов) содержится приблизительно 15 граммов гиалуроновой кислоты, треть из которой обновляется (разлагается и синтезируется) каждый день (Stern R., Euro J Cell Biol 83 (7): 317-25, (2004)). Так как гиалуроновая кислота обнаруживается в качестве природного вещества во многих тканях организма и, в силу этого, является биологически совместимой, считается, что она хорошо подходит для применения в биомедицине. И на самом деле, многие полимерные материалы, включающие гиалуроновую кислоту (также называемую гиалуронаном), ее дериватизированные формы, и ее конъюгаты, могут быть использованы в качестве инъецируемых биоматериалов, а также в медицинских устройствах и имплантируемых материалах. Применения включают доставку молекул лечебного средства в строго определенное место, использование в качестве адгезивов или герметиков, в тканевой инженерии, в качестве вязкоупругих добавок, и для заживления ран. Гиалуроновая кислота, при введении и использовании в качестве терапевтического средства в ее природной форме, обычно быстро выводится из организма, что делает необходимым ее частые инъекции. Обычно, полимерный гель или предшественник геля может проявлять подходящие свойства, с точки зрения химизма реакции и состояний, характеристик гелеобразования, и/или терапевтического эффекта в одной или более in-vitro моделях, но в конкретных случаях не удается добиться положительных свойств таких эффектов in vivo или в лечебных целях.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В первом аспекте, предлагается гиалуроновая кислота, модифицированная на 10% или менее в результате реакции с дивинилсульфоном. В частности, гиалуроновая кислота содержит 10% или менее ее гидроксильных групп, дериватизированных путем проведения реакции присоединения с дивинилсульфоном.
В конкретном варианте осуществления, гиалуроновая кислота имеет 1-10% ее гидроксильных групп, дериватизированных в 2-(винилсульфонил)этокси группы. Получаемую активированную гиалуроновую кислоту, имеющую низкий уровень активации дивинилсульфоном, в описании изобретения обычно называют (2-(винилсульфонил)этокси)1-10%гиалуроновой кислотой или "ВС-ГК".
В еще одном варианте осуществления, гиалуроновая кислота имеет степень конверсии гидроксильных групп в 2-(винилсульфонил)этокси группы, выбранную из 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9% и 10%.
В еще более конкретном варианте осуществления, гиалуроновая кислота имеет степень конверсии гидроксильных групп в 2-(винилсульфонил)этокси группы около 4-5% на повторяющееся звено дисахарида.
В еще одном варианте осуществления, (2-(винилсульфонил)этокси)1-10%гиалуроновая кислота имеет молекулярную массу приблизительно от 700 до приблизительно 3 миллионов дальтонов.
Во втором аспекте, предлагается гидрогель, образуемый путем реакции (2-(винилсульфонил)этокси)1-10%гиалуроновой кислоты с тиольным сшивающим реагентом, имеющим две или более тиольных групп.
В родственном варианте осуществления, тиольный сшивающий реагент имеет от двух до приблизительно 8 тиольных групп. В еще одном варианте осуществления, тиольный сшивающий реагент имеет число тиольных групп, выбранных из 2, 3, 4, 5, 6, 7 и 8.
В еще одном варианте осуществления, относящемся ко второму аспекту, тиольным сшивающим реагентом является функционализированный тиолом полиэтиленгликоль (ПЭГ) (то есть, ПЭГ-тиол).
В дополнительном варианте осуществления вышеизложенного, полиэтиленгликольтиол имеет молекулярную массу приблизительно от 250 до приблизительно 20000 дальтонов.
В родственном варианте осуществления, функционализированный тиолом полиэтиленгликоль является линейным и имеет тиольную группу на каждом конце, то есть, является полиэтиленгликольдитиолом (ПЭГ дитиолом).
В еще одном варианте осуществления, функционализированный тиолом полиэтиленгликоль является полимером с четырьмя цепочками в виде расходящихся лучей и имеет ядро пентаэритрита.
В еще одном варианте осуществления, функционализированный тиолом полиэтиленгликоль имеет полиольное ядро, выбранное из глицерина, димера глицерина (3,3'-оксидипропан-1,2-диола)триметилолпропана, сорбита, пентаэритрита, и гексаглицерина.
В дополнительном варианте осуществления, гидрогель, образуемый путем реакции (2-(винилсульфонил)этокси)1-10% гиалуроновой кислоты и тиольным сшивающим реагентом, содержит менее чем десять процентов непрореагировавшего тиола и менее чем 10% непрореагировавших винилсульфоновых групп. Количество оставшихся непрореагировавших тиольных групп может быть определено, например, с помощью метода с реактивом Эллмана.
В еще одном дополнительном варианте осуществления, гидрогель, образуемый путем реакции (2-(винилсульфонил)этокси)1-10%гиалуроновой кислоты с тиольным сшивающим реагентом, содержит массовый процент полимера в воде приблизительно от 0,5 до 5,0 процентов. В одном или более вариантах осуществления, в качестве иллюстрации содержаний полимера в воде в массовых процентах для получаемого гидрогеля выбирают 0,5, 1,0, 1,5, 2,0, 2,5, 3,0, 3,5, 4,0, 4,5 и 5 процентов.
В еще одном варианте осуществления, гидрогель, образуемый путем реакции (2-(винилсульфонил)этокси)1-10%гиалуроновой кислоты с тиольным сшивающим реагентом, существует в форме частиц с размером приблизительно от 0,10 до 3,0 миллиметров.
В еще одном варианте осуществления, вышеупомянутые частицы гидрогеля находятся в форме водной суспензии.
В еще одном дополнительном варианте осуществления, гидрогель, описанный в любом одном или более из приведенных выше вариантов осуществления, диспергирован в водном растворе немодифицированной гиалуроновой кислоты.
В еще одном дополнительном и более конкретном варианте осуществления, предлагается композиция, включающая сшитые частицы гидрогеля в растворе гиалуроновой кислоты в физиологическом растворе, в котором частицы гидрогеля образуются в результате реакции полиэтиленгликольдитиола (ПЭГ-дитиола) с гиалуроновой кислотой, имеющей 1-10% гидроксильных групп, дериватизированных с помощью 2-(винилсульфонил)этокси групп.
В еще одном дополнительном варианте осуществления, гидрогель, описанный в любом одном или более из приведенных выше вариантов осуществления, включает биоактивный агент. В конкретном варианте осуществления, биоактивным агентом является кортикостероид. В еще одном более конкретном варианте осуществления, биоактивным агентом является ацетонид триамцинолона.
В еще одном альтернативном варианте осуществления, гидрогель, описанный в любом одном или более из приведенных выше вариантов осуществления, включает живые клетки.
В дополнительном варианте осуществления, гидрогель, образуемый путем реакции (2-(винилсульфонил)этокси)1-10% гиалуроновой кислоты с бифункциональным или многофункциональным тиольным сшивающим реагентом, проявляет низкие провоспалительные свойства при внутрисуставной инъекции в экспериментальной модели на козах.
В конкретном варианте осуществления, гидрогель проявляет низкие провоспалительные свойства, на что указывает ответная лейкоцитарная реакция в связанной синовиальной жидкости.
В еще одном конкретном варианте осуществления, гидрогель проявляет низкие провоспалительные свойства при внутрисуставной инъекции в экспериментальной модели на козах, на что указывает подсчет суммарных баллов при проведении наблюдений.
В еще одном дополнительном варианте осуществления, гидрогель является стерильным.
В еще одном дополнительном варианте осуществления, предлагаемый изобретением гидрогель расфасовывают в шприц.
В еще одном дополнительном варианте осуществления, предлагается способ введения любой из описанных в изобретении композиций гидрогеля во внутрисуставное пространство сустава субъекта.
Кроме того, в третьем аспекте, предлагается способ получения (2-(винилсульфонил)этокси)1-10%гиалуроновой кислоты. Способ включает реакцию гиалуроновой кислоты с дивинилсульфоном при реакционных условиях, которые обеспечивают реакцию не более чем приблизительно 10% гидроксильных групп на повторяющихся звеньях дисахарида в гиалуроновой кислоте с дивинилсульфоном с образованием (2-(винилсульфонил)этокси)1-10%гиалуроновой кислоты.
В родственном варианте осуществления, реакция включает взаимодействие гиалуроновой кислоты с мольным избытком дивинилсульфона.
В дополнительном варианте осуществления, стадию реакции проводят в условиях окружающей среды.
В еще одном варианте осуществления, стадию реакции проводят в течение от 10 секунд до приблизительно 120 секунд в условиях окружающей среды.
В еще одном варианте осуществления, стадию реакции проводят в водном растворе основания.
В дополнительном варианте осуществления, способ дополнительно включает прерывание реакции путем добавления кислоты. В родственном варианте осуществления, добавляют соответствующее количество кислоты для корректировки величины pH в интервале приблизительно от 4 до 6,5.
В четвертом аспекте, описываемым в изобретении способом является способ получения гидрогеля. Способ включает реакцию (2-(винилсульфонил)этокси)1-10%гиалуроновой кислоты с тиольным сшивающим реагентом, имеющим две или более тиольных групп при реакционных условиях, которые обеспечивают образование сшитого гидрогеля. Подходящие тиольные сшивающие реагенты включают функционализированный тиолом полиэтиленгликоль, алкандитиолы и другие подобные реагенты.
В родственном варианте осуществления, реакцию проводят при физиологической величине pH.
В еще одном варианте осуществления, реакцию проводят в отсутствии инициатора полимеризации.
В еще одном варианте осуществления, реакцию проводят без использования источника внешней энергии.
В еще одном варианте осуществления, реакцию проводят при температуре в интервале от 20°C до 45°C.
В еще одном дополнительном варианте осуществления, гидрогель включает 10% или менее непрореагировавших винилсульфоновых или тиольных групп. Предпочтительно, чтобы гидрогель включал 5% или менее непрореагировавших сульфоновых или тиольных групп. В конкретном варианте осуществления, гидрогель практически не включает обнаруживаемые непрореагировавшие винилсульфоновые или тиольные группы.
В пятом аспекте, предлагается набор, включающий шприц, где шприц включает гидрогель, образуемый путем реакции (2-(винилсульфонил)этокси)1-10%гиалуроновой кислоты с описанным выше тиольным сшивающим реагентом.
В еще одном родственном варианте осуществления, шприц включает гидрогель, описанный в любом одном или более из приведенных выше вариантов осуществления, где гидрогель диспергируют в водном растворе немодифицированной гиалуроновой кислоты. В родственном варианте осуществления, водным раствором является физиологический раствор.
В родственном варианте осуществления, шприц имеет форму, подходящую для внутрисуставной инъекции гидрогеля с использованием иглы с размером 18-21.
В еще одном родственном варианте осуществления, шприц включает гидрогель, описанный в любом одном или более из приведенных выше вариантов осуществления, где гидрогель дополнительно включает биоактивный агент. В родственном варианте осуществления, биоактивный агент выбирают из группы, состоящей из стероидов, факторов роста, антипролиферативных средств, и антибиотиков. В еще более конкретном варианте осуществления, гидрогель включает приблизительно от 0,01% до приблизительно 20% по массе биоактивного агента, разумеется, в зависимости от эффективности биоактивного агента. Другими словами, содержание менее активного агента в гидрогеле будет обычно определяться верхней границей приведенного выше интервала, например, приблизительно 10-20% по массе, в то время как содержание сильнодействующего биоактивного агента будет определяться нижней границей интервала, например, приблизительно от 0,01 до 3% по массе. В конкретном варианте осуществления, в котором биоактивным агентом является ацетонид триамцинолона, гидрогель включает приблизительно от 0,1 до 1% по массе биоактивного агента.
В еще одном варианте осуществления, шприц включает гидрогель, описанный в любом одном или более из приведенных выше вариантов осуществления, где гидрогель дополнительно включает живые клетки. Примеры живых клеток включают стволовые клетки, паренхимальные стволовые клетки, полученные из крови клетки и клетки костного мозга.
В шестом аспекте, предлагается способ доставки плохо растворимого в воде биоактивного агента путем введения субъекту описанного в изобретении гидрогеля, включающего плохо растворимый в воде биоактивный агент, диспергированный в гидрогеле.
В седьмом аспекте, описывается способ лечения острого и хронического воспаления, связанного с остеоартритом, ревматоидным артритом, другими воспалительными артритами, и с периодическим применением, путем инъекции субъекту гидрогеля в соответствии с любым одним или более описанными в изобретении аспектами или вариантами осуществления во внутрисуставное пространство сустава, такого как колено. В конкретном варианте осуществления, то есть, когда гидрогель включает добавленный в него кортикостероид, способ является эффективным с точки зрения повреждения хряща, которое уменьшается по сравнению с повреждением хряща, происходящим при введении эквивалентного количества кортикостероида, не включенного в гидрогель, как это показано при внутрисуставной инъекции в экспериментальной модели на козах с помощью суммы баллов по системе оценки Мэнкина через 28 дней после инъекции. В родственном варианте осуществления, упомянутый выше способ, то есть, инъекция гидрогеля во внутрисуставное пространство сустава, является эффективным для облегчения боли у субъекта по сравнению с болью, испытываемой субъектом до инъекции ему гидрогеля. Обычно, субъект начинает испытывать облегчение боли в течение приблизительно от одного часа до приблизительно одной недели после инъекции, более предпочтительно, в течение приблизительно от одного часа до приблизительно 3 дней после инъекции. Другими словами, облегчение боли обычно наступает в течение приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23 или 24 часов после инъекции, или, если не в течение первых двадцати четырех часов, то в течение 1, 2, 3, 4, 5, 6, или 7 дней после инъекции. Обычно, предполагается, что период облегчения боли составляет приблизительно от 3 до 9 месяцев, то есть, от 3, 4, 5, 6, 7, 8, 9 месяцев или даже более.
В восьмом аспекте, предлагается способ снижения степени повреждения хряща при введении страдающему от остеоартрита субъекту кортикостероида во внутрисуставное пространство сустава путем добавления кортикостероида в сшитый гидрогель до введения или при введении субъекту. Сшитым гидрогелем обычно является гидрогель на основе гиалуроновой кислоты, который будет описан более подробно ниже. Примером сшитого гидрогеля является гидрогель, который является гиалуроновой кислотой, модифицированной до степени 10% или менее путем реакции с дивинилсульфоном и затем сшитой с помощью тиольного сшивающего реагента, имеющего две или более тиольных групп. Как ни удивительно, но в результате включения кортикостероида в сшитый гидрогель происходит меньшее повреждение хряща, чем в случае введения эквивалентной дозы кортикостероида, без включения его в гидрогель.
В девятом аспекте, относящемся к вышеприведенным аспектам, в способе лечения остеоартрита путем введения субъекту терапевтически эффективного количества кортикостероида во внутрисуставное пространство сустава, изобретение предлагает усовершенствование, включающее введение кортикостероида в форме композиции сшитого гидрогеля, включающей кортикостероид, в результате чего уменьшается степень повреждения хряща, чем в случае введения эквивалентной дозы кортикостероида, без включения его в гидрогель.
В конкретном варианте осуществления, относящемся к седьмому, восьмому и девятому аспектам, кортикостероид выбирают из группы, состоящей из гидрокортизона, ацетата гидрокортизона, ацетата кортизона, пивалата тиксокортола, преднизолона, метилпреднизолона, преднизона, триамцинолона, солей триамцинолона, таких как триамцинолона ацетонид, триамцинолона бенетонид, триамцинолона фуретонид, триамцинолона гексацетонид, триамцинолона диацетат, триамцинолонового спирта, мометазона, амцинонида, будезонида, дезонида, флуоцинонида, флуоцинолона ацетонида, хальцинонида, бетаметазона, бетаметазона натрий фосфата, дексаметазона, дексаметазона натрий фосфата, флуокортолона, гидрокортизон-17-бутирата, гидрокортизон-17-валерата, аклометазона дипропионата, бетаметазона валерата, бетаметазона дипропионата, предникарбата, клобетазон-17-бутирата, клобетазол-17-пропионата, флуокортолона капроата, флуокортолона пивалата, флупреднидена ацетата, моногидрата беклометазона дипропионата, флунизолида, флутиказона пропионата, моногидрата мометазона фуроата и флутиказона фуроата.
В еще более конкретном варианте осуществления, кортикостероидом является ацетонид триамцинолона.
В десятом аспекте, предлагается лекарственная форма, включающая плохо растворимое в воде лекарственное средство, такое как стероид, заключенное в трехмерную структуру описываемого в изобретении гидрогеля, и инъекция такой лекарственной формы во внутрисуставное пространство сустава.
В одном варианте осуществления, относящемся к вышеприведенным аспектам, включение частиц стероида внутрь гидрогеля является эффективной мерой для предотвращения непосредственного контакта большинства частиц стероида с тканями сустава.
В еще одном родственном варианте осуществления, включение частиц стероида внутрь гидрогеля является эффективной мерой для максимизации локализованной концентрации стероида в суставе и минимизации его общей концентрации в организме.
В еще одном дополнительном варианте осуществления, включение частиц стероида внутрь гидрогеля является эффективной мерой для защиты частиц стероида от преждевременного удаления из сустава.
В еще одном дополнительном варианте осуществления, в результате включения стероида в гидрогель, терапевтическая эффективность стероида достигается при более низкой суммарной дозе, чем в случае, когда не используют включения стероида в гидрогель, и при этом минимизируются нежелательные местные и системные побочные эффекты.
В родственном аспекте, предлагается применение описываемого в изобретении гидрогеля для инъекции или имплантации рядом или в кость, зубы, нервы, хрящ, кровеносные сосуды, мягкие ткани или другие ткани млекопитающего.
Дополнительные варианты осуществления композиций, способов, наборов, и других осуществлений станут понятными из следующего описания, примеров и пунктов формулы изобретения. Из приведенного выше и последующего описания является очевидным, что все, без исключения, описанные в изобретении отличительные признаки и все, без исключения, комбинации двух или более таких отличительных признаков, входят в объем настоящего изобретения, при условии, что отличительные признаки, включенные в такую комбинацию, не являются взаимно несовместимыми. Кроме того, любой отличительный признак или комбинация отличительных признаков может быть специально исключена из любого варианта осуществления настоящего изобретения. Дополнительные аспекты и преимущества настоящего изобретения излагаются в последующем описании, в частности, при рассмотрении в сочетании с сопровождающими описание примерами и чертежами.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На ФИГ. 1 приведен спектр 1H ЯМР модифицированной винилсульфоном гиалуроновой кислоты (ГК-ВС), полученной как описано в Примере 1. С помощью ЯМР было определено, что гиалуроновая кислота имеет степень винилсульфонового замещения приблизительно четыре процента на дисахарид.
На ФИГ. 2 приведена графическая зависимость процента высвобождения плохо растворимого в воде модельного лекарственного средства, ацетонида триамцинолона, от порядкового номера образцов, приготовление которых описано в Примере 16.
На ФИГ. 3 приведена графическая зависимость высвобожденной суммарной массы плохо растворимого в воде модельного лекарственного средства, ацетонида триамцинолона, от порядкового номера образцов, приготовление которых описано в Примере 16.
На ФИГ. 4 приведена графическая зависимость количества высвобождаемого триамцинолона ацетонида от порядкового номера образцов, приготовление которых описано в Примере 16.
На ФИГ. 5 графически представлено количество лейкоцитов в синовиальной жидкости (число клеток в кубическом миллиметре) в колене коз, в которое инъецировали Испытуемый материал 1, относительно группы, подвергнутой лечению другими испытуемыми материалами, оцененное через 24 часа после инъекции 1,5 мл, описанными в Примере 17. Испытуемый материал 1=ГК-ВС/ПЭГ-(SH)2 гель.
На ФИГ. 6 графически представлено абсолютное количество лейкоцитов в синовиальной жидкости (абсолютное количество=суммарный объем × количество лейкоцитов в синовиальной жидкости) в колене коз, в которое инъецировали Испытуемый материал 1, относительно группы, подвергнутой лечению другими испытуемыми материалами, оцененное через 24 часа после инъекции 1,5 мл, описанными в Примере 17. Испытуемый материал 1=ГК-ВС/ПЭГ-(SH)2 гель.
На ФИГ. 7 графически представлено дифференциальное распределение лейкоцитов с синовиальной жидкости (среднее для групп) в колене подвергнутых инъекции коз относительно группы, подвергнутой лечению другими испытуемыми материалами, оцененное через 24 часа после инъекции 1,5 мл, описанными в Примере 17. Для каждого испытуемого материала показано распределение полиморфоядерных лейкоцитов (PMN), лимфоцитов, моноцитов и эозинофилов (Eos).
На ФИГ. 8 графически представлено среднее суммарное количество баллов для синовиальной жидкости, тканей сустава, и объединенные баллы синовиальной жидкости и тканей сустава (Таблица 6) для колен подвергнутых инъекции коз для каждого типичного испытуемого материала, описанных в Примере 17, где Общее суммарное количество баллов=Количество баллов для синовиальной жидкости+суммарное количество баллов для сустава. Максимальное количество баллов для синовиальной жидкости или суммарное количество баллов для сустава составляет 8 при величине 0 в норме; максимальное количество баллов для общего суммарного количества баллов составляет 16 при величине 0 в норме.
На ФИГ. 9 приведена оценка в баллах степени окрашивания красителем сафранином О для образцов хряща суставов коз, подвергнутых лечению с помощью испытуемых материалов, описанных подробно в Примере 34, через 14 дней после инъекции. Испытуемый материал 1: ГК-ВС-ПЭГ-(SH)2, Испытуемый материал 2: ГК-ВС-ПЭГ-(SH)2-TA.
На ФИГ. 10 приведена оценка в баллах степени окрашивания красителем сафранином О для образцов хряща суставов коз, подвергнутых лечению с помощью испытуемых материалов, описанных подробно в Примере 34, через 28 дней после инъекции.
На ФИГ. 11 приведены результаты начисления количества баллов по системе оценки Мэнкина для образцов хряща суставов коз, подвергнутых лечению с помощью испытуемых материалов, описанных подробно в Примере 34, через 28 дней после инъекции.
На ФИГ. 12 и ФИГ. 13 представлены характерные гистологические препараты медиального бедренного мыщелка, окрашенные сафранином О (40X), через 14 дней (Фиг. 12) и 28 дней (Фиг. 13) после инъекции, соответственно, описанные подробно в Примере 34.
На ФИГ. 14 графически представлено среднее количество лейкоцитов в синовиальной жидкости (среднее+стандартное отклонение) для всех животных относительно Испытуемого материала и Контрольного материала, оцененное через 24 часа после внутрисуставной инъекции объемом 1,5 мл, как это описано подробно в Примере 45.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Далее настоящее изобретение описывается более подробно. Однако это изобретение может быть осуществлено во множестве различных форм, и приведенные в описании изобретения варианты осуществления не следует истолковывать в качестве ограничений для изобретения; более того, эти варианты осуществления приводятся для того, чтобы полностью и исчерпывающе раскрыть для специалистов в этой области сущность и объем изобретения.
Содержание всех цитируемых выше или ниже в описании изобретения публикаций, патентов и заявок на патенты, приводится в описании изобретения путем ссылки на них, если не указано иначе. В случае, когда один и тот же термин определяется как в публикации, патенте, или заявке на патент, содержание которых приводится путем ссылки на них, так и в описании настоящего изобретения, предпочтение следует отдавать определению, приводимому в описании настоящего изобретения. Для публикаций, патентов, и заявок на патенты, упоминаемых в связи с описанием конкретного типа соединения, химизма, и так далее, части документа, относящиеся к таким соединениям, химизму, и так далее, являются такими частями, содержание которых приводится в описании изобретения путем ссылки на них.
Определения
Следует отметить, что используемые в этом описании изобретения формы единственного числа включают и обозначение множественных объектов, если это явно не противоречит смыслу содержания. Так, например, ссылка на "полимер" включает не только один полимер, но также и два или более одинаковых или отличных друг от друга полимеров.
Если специально не указано иначе, то определения терминов в изобретении являются стандартными определениями, используемыми в области органического синтеза, в области полимеров и в области фармацевтики.
В описании и в пунктах формулы настоящего изобретения будет использоваться следующая терминология в соответствии с описываемыми ниже определениями.
"Биосовместимый полимер" является полимером, чьи продукты разложения совместимы с живой тканью, или который может обладать полезными биологическими свойствами. Биосовместимый полимер может быть биосовместимым сам по себе, и/или может быть синергетически биосовместимым при использовании в сочетании с биологически активным средством.
Термин "полимер гиалуроновой кислоты" относится к полимеру, включающему повторяющиеся дисахаридные подзвенья гиалуронана, где повторяющиеся звенья могут быть дериватизированы в одном или более положениях D-глюкуроновой кислоты и/или D-N-ацетилглюкозаминового звена повторяющегося дисахаридного субзвена. Предполагается, что термин "полимер гиалуроновой кислоты" включает в себя гиалуроновую кислоту (называемую также гиалуронаном), дериватизированную гиалуроновую кислоту, солевые формы, комплексы гиалуроновой кислоты со сшивающими реагентами, и конъюгаты гиалуроновой кислоты. Предполагается, что термин "гиалуроновая кислота" относится к немодифицированной или недериватизированной гиалуроновой кислоте.
Термины "производное гиалуроновой кислоты" или "дериватизированная гиалуроновая кислота" или "модифицированная гиалуроновая кислота" относятся к гиалуроновой кислоте, которая была дериватизирована в результате реакции, например, с одним или более небольшими химическими звеньями, такими как дивинилсульфон или другие подобные звенья.
Дериватизированный тиолом полимер гиалуроновой кислоты относится к описанному выше полимеру гиалуроновой кислоты, имеющему три или более повторяющихся звеньев дисахарида и включающему, по меньшей мере, одну сульфгидрильную (тиольную) группу.
Термин "реакционноспособная" относится к функциональной группе (например, присутствующей в полимере), которая при обычных условиях проведения органического синтеза легко вступает в реакцию или участвует в реакции с приемлемой скоростью. Эта группа противопоставляется тем группам, которые либо вообще не реагируют, либо требуют использование активных катализаторов или создания практически нереальных условий реакции для осуществления взаимодействия (то есть, "нереакционноспособной" или "инертной" группе).
Используемый в описании изобретения термин "молекулярная масса" или молекулярный вес применительно к водорастворимому полимеру, такому как гиалуроновая кислота, относится к условной среднечисленной молекулярной массе полимера, определенной с помощью метода многоуглового рассеяния света. Молекулярная масса может быть выражена либо как среднечисленная молекулярная масса, либо как средневесовая молекулярная масса. Если не указано иначе, то все упоминания в изобретении о молекулярной массе относятся к среднечисленной молекулярной массе.
Термин "гидрогель" относится к водосодержащей трехмерной гидрофильной полимерной структуре или гелю, в котором вода является диспергирующей фазой и в котором содержание воды составляет более чем 50 масс.%. Описываемые в изобретении гидрогели обычно не требуют введения инициаторов или ускорителей сшивания для достижения требуемой степени сшивки.
"Стерильной" композицией является композиция, которая не содержит жизнеспособных микробов, что определяется с помощью пробы на стерильность в соответствии с требованиями Фармакопеи США. Смотрите документ "The United States Pharmacopeia", 30th Revision, The United States Pharmacopeial Convention: 2008.
Используемый в описании изобретения термин "слегка сшитый" или "имеющий низкую степень сшивания" означает, что при протекании реакции сшивания с образованием конечных сшитых гелей в реакции обычно участвуют приблизительно от 40% до приблизительно 100% доступных для сшивания мест, тогда как модифицированная гиалуроновая кислота, используемая в качестве исходного материала для образования геля, имеет 10% или менее ее гидроксильных групп в активированной/дериватизированной форме для образования гидрогеля, который рассматривается в целом как слегка сшитый.
Гидрогель, который проявляет низкие провоспалительные свойства при внутрисуставной инъекции в экспериментальной модели на козах, является гидрогелем, который при исследовании описываемой в изобретении внутрисуставной инъекции в экспериментальной модели на козах характеризуется количеством лейкоцитов в синовиальной жидкости менее чем 20000 клеток на кубический миллиметр через 24 часа после инъекции, и предпочтительно, чтобы количество лейкоцитов в синовиальной жидкости составляло менее чем 15000 клеток на кубический миллиметр через 24 часа после инъекции, где число лейкоцитов является средним числом из трех проб, взятых у трех индивидуально инъецированных животных.
Содержащий кортикостероид гидрогель, который "снижает повреждение хряща" или "который приводит к меньшему повреждению хряща", чем эквивалентная доза кортикостероида, вводимая субъекту в отсутствии гидрогеля, обычно характеризуют с помощью любой подходящей модели для оценки повреждения хряща, но предпочтительно проводить его оценку с помощью описанной подробно в изобретении инъекции в колено в экспериментальной in-vivo модели на козах. Данные эксперимента обычно собирают, по меньшей мере, через 7 дней после инъекции, но не более чем через 28 дней после инъекции. Предпочтительной системой оценки является суммарное количество баллов по системе оценки Мэнкина; материал, который снижает повреждение хряща, оцениваемое как описано выше, по сравнению с применением лишь одного лекарственного средства, является материалом, который характеризуется улучшенной средней суммой баллов по сравнению с лекарственным средством (то есть, кортикостероидом), которое вводят в эквивалентном количестве. Предпочтительно, чтобы суммарное количество баллов по системе оценки Мэнкина для включенного в гидрогель лекарственного средства улучшалось, по меньшей мере, на один или более баллов по сравнению с суммарным количеством баллов по системе оценки Мэнкина для лекарственного средства, вводимого без его включения в гидрогель.
Используемые равнозначно термины "лекарственное средство" или "фармацевтически активное средство" или "биоактивный агент" или "активный агент" обозначают любое органическое или неорганическое соединение или вещество, обладающее биоактивностью и приспособленное или применяемое для терапевтических целей. Более широкое понятие "лекарственного средства" включает белки, гормоны, противораковые средства, синтезированные химические соединения и миметики, олигонуклеотиды, ДНК, РНК и препараты генной инженерии. Предполагается, что ссылка на используемое в описании изобретения лекарственное средство, также как и ссылка на другие химические соединения, в соответствующих случаях включает соединение в любой из его фармацевтически приемлемых форм, включая изомеры, такие как диастереомеры и энантиомеры, соли, сольваты и полиморфы, конкретные кристаллические формы, а также рацемические смеси и чистые изомеры описываемых в изобретении соединений.
Используемый в описании изобретения термин "твердое вещество" обозначает нетекучее вещество, включающее кристаллические формы, их полиморфы, некристаллические аморфные вещества, осадки, и частицы, или другие подобные твердые вещества. Каждая из этих твердых форм может иметь различные размеры, приблизительно от 0,01 микрон до 2000 микрон, например, приблизительно от 0,01 микрон до 1 микрона, от 1 микрона до 100 микрон, от 100 микрон до 1000 микрон, от 1000 микрон до 2000 микрон, от 1100 микрон до 1500 микрон, и от 1500 микрон до 2000 микрон.
Приводимые в описании изобретения размеры частиц относятся к диаметрам частиц и обычно определяются с помощью ситового анализа. Описываемые размеры или интервалы обычно соответствуют размеру отверстия в сите или сетке. Можно использовать таблицу для перевода размера частиц из одной системы в другую, например, в миллиметры из соответствующего конкретного значения меш или номера сита. Смотрите, например, Примеры 39 и 40.
"Нерастворимым в воде лекарственным средством" или "плохо растворимым в воде лекарственным средством" является лекарственное средство, имеющее растворимость в воде ниже 10 мг/мг.
Приводимые в описании изобретения термины "эффективное количество" или "фармацевтически эффективное количество" или "терапевтически эффективное количество" композиции (или гидрогеля или полимера), относятся к нетоксичному, но достаточному количеству композиции для обеспечения требуемой ответной реакции, такой как предотвращение, уменьшение, или исключение боли у субъекта. Точное требуемое количество будет отличаться от субъекта к субъекту, в зависимости от вида, возраста и общего состояния здоровья субъекта, тяжести состояния, подвергаемого лечению, используемого конкретного лекарственного средства или средств, специфических особенностей композиции, способа введения и других подобных факторов. В любом конкретном случае соответствующее "эффективное" количество может быть определено обычным специалистом в этой области путем проведения соответствующего эксперимента.
"Лечение" или "проведение лечения" острой или подострой боли включает: подавление боли, то есть, приостановление обычного процесса развития или возврата боли, или облегчение боли, то есть, снижение силы боли, испытываемой субъектом.
"Необязательный" или "необязательно" означает, что далее описываемое обстоятельство может произойти, а может и не произойти, поэтому, описание включает примеры, при которых обстоятельство имеет место, и примеры, когда оно не происходит.
Термин "значительно" в отношении определенного признака или величины означает значительную степень или почти полное значение (то есть, степень 85% или более) в отношении определенного признака или величины.
Предполагается, что термин "приблизительно", особенно в отношении данного количества, включает отклонения в плюс или минус пять процентов.
В следующих далее разделах могут также встречаться дополнительные определения.
Краткий обзор
Настоящая заявка основывается, по меньшей мере, частично, на открытии авторами изобретения гидрогелей, имеющих чрезвычайно низкие провоспалительные свойства при их введении in vivo. При проведении исследований, относящихся к настоящему изобретению, авторы изобретения выяснили, что многие биосовместимые гидрогели, имеющие, казалось бы, благоприятные химические, реологические и другие физические свойства, и которые проявляют себя положительно в ряде биосовместимых и общепринятых in-vitro и in-vivo моделях, могут вызывать воспаление и боль, в частности, при внутрисуставной инъекции. При исследовании инъекции в сустав на экспериментальной модели на козах и сравнении с аналогичными гидрогельными композициями, было обнаружено, что описываемые в изобретении материалы обладают исключительно низкими провоспалительными свойствами. Смотрите, например, Пример 17 и Фигуры 4-8. Обычно, гидрогели настоящего изобретения при введении во внутрисуставное пространство сустава (например, при исследовании инъекции в сустав на экспериментальной модели на козах) характеризовались пониженные негативные или нежелательные побочные воздействиями на хрящ, по сравнению с введением во внутрисуставное пространство сустава либо эквивалентного количества производимой промышленностью вязкоупругой добавки, либо введением эквивалентного количества активного реагента, не включенного в описываемый в изобретении гидрогель.
Неожиданно было обнаружено, что включение кортикостероида в сшитый гидрогель, такой как описанный в изобретении, по факту приводит к меньшему повреждению хряща, чем в случае введения эквивалентной или более высокой дозы кортикостероида, не заключенного в гидрогель. Смотрите, например, Пример 34 и Фигуры 9-13. Кроме того, в изобретении приводятся результаты, указывающие на то, что внутрисуставная инъекция гидрогелей настоящего изобретения не дает местных или системных эффектов ни при введении их самих по себе (то есть, в отсутствии активного агента), ни при введении в комбинации с кортикостероидом, таким как ацетонид триамцинолона.
Описанные в изобретении исключительные по свойствам гидрогели получают обычно путем регулируемой реакции гиалуроновой кислоты, имеющей четко определенные низкие степени модификации функциональной группы, с подходящими дифункциональными или многофункциональными сшивающими реагентами. Получаемые гидрогели получают в мягких условиях без использования инициаторов или ускорителей или других вредных добавок. Предполагается, что получаемые гидрогели будут иметь минимальное число непрореагировавших реакционноспособных групп, и их получают из минимального числа реагентов и реакционных компонентов. Гидрогели прочно сшиты, и было также показано, что их можно применять для захвата и высвобождения биоактивных агентов в замедленном и установившемся во времени режиме. Смотрите, например, Фигуры 2-3.
Характерные признаки композиции, способ и наборы, и другие подобные вопросы обсуждаются более подробно ниже.
Полимеры дериватизированной гиалуроновой кислоты
Гидрогели настоящего изобретения могут быть образованы из различных полимерных материалов. Предпочтительными являются биоразлагаемые или биопоглащаемые полимеры, модифицированные до известной степени содержания одной или более реакционноспособных функциональностей. Предпочтительно, чтобы полимером являлся полианионный полисахарид (PAS). Неограничивающие примеры полианионных полисахаридов включают, например, гиалуроновую кислоту (ГК), карбоксиметилцеллюлозу (КМЦ), карбоксиметиламилозу (КМА), хондроитин-4-сульфат, хондроитин-6-сульфат, дерматан сульфат, дерматан-6-сульфат, гепарин сульфат, гепарин, кератин сульфат и их производные, и их комбинации. Такие полимеры известны в технике и описаны, например, в Патенте США № 6056970. Другие биоразлагаемые полимеры включают фибрин, фибриноген, крахмал, полиаминокислоты; пептиды, белки, желатин и коллаген.
Предпочтительным полимером является гиалуроновая кислота, называемая также гиалуронаном. Гиалуроновая кислота является природным линейным полисахаридом, состоящим из чередующихся дисахаридных звеньев N-ацетил-D-глюкозамина и D-глюкуроновой кислоты, соединенных чередующимися β 1->3 глюкуронидными и β 1->4 глюкозаминидными связями, в результате чего повторяющимся звеном является (1->4)-β-D-GlcA-(1->3)-β-D-GlcNAc. Гиалуроновую кислоту для использования при приготовлении одного или более из испытуемых гидрогелей обычно дериватизируют с помощью одной или более реакционноспособных групп, таких как винилсульфоновая, акрилатная, метакрилатная, и другие подобные группы. Предпочтительно, чтобы гиалуроновую кислоту дериватизировали с помощью только одной реакционноспособной группы. Степень модификации или дериватизации может находиться в интервале от 1% до 100% модификации реакционноспособных функциональных групп в полимере, хотя низкие степени модификации полимера обычно являются предпочтительными.
Одним примером модифицированной гиалуроновой кислоты является гиалуроновая кислота, дериватизированная в результате реакции ее гидроксильных групп с дивинилсульфоном. Гиалуроновая кислота может обычно иметь степень модификации реакционноспособных гидроксильных групп в интервале приблизительно от 1 до приблизительно 80%. Другими словами, 1% степени модификации или замещения означает, что в среднем 1% дисахаридных звеньев гиалуроновой кислоты содержит винилсульфоновую группу. Предпочтительно, чтобы гиалуроновая кислота имела бы степень модификации реакционноспособных гидроксильных групп приблизительно в интервале 1-50%. Более предпочтительно, чтобы гиалуроновая кислота имела бы степень модификации реакционноспособных гидроксильных групп в интервале приблизительно от 1 до приблизительно 25%. В конкретном варианте осуществления, гиалуроновую кислоту модифицируют до степени 10% или менее путем реакции с дивинилсульфоном. В частности, в предпочтительном варианте осуществления, гиалуроновая кислота имеет 10% или менее гидроксильных групп, дериватизированных в результате реакции присоединения с дивинилсульфоном. Гидроксильные группы гиалуроновой кислоты превращаются в (2-(винилсульфонил)этокси) группы. Полученную активированную гиалуроновую кислоту называют обычно в описании изобретения (2-(винилсульфонил)этокси)гиалуроновой кислотой или ВС-ГК. В частности, гиалуроновая кислота может иметь степень конверсии гидроксильных групп в (2-(винилсульфонил)этокси) группы, выбранную из следующих значений: 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9% и 10%. В качестве варианта, гиалуроновая кислота может иметь степень конверсии гидроксильных групп, входящую в интервал между любыми двумя приведенными выше процентами: например, 1-10%, 2-10%, 3-10%, 4-10% и так далее для всех без исключения комбинаций приводимых целых чисел, например, 2-7%, 2-6%, 3-8%, 3-7% и так далее. В еще одном более конкретном варианте осуществления гиалуроновая кислота имеет степень конверсии гидроксильных групп в (2-(винилсульфонил)этокси) группы приблизительно 4-5% на повторяющееся дисахаридное звено. В конкретных случаях, уровень модификации функциональной группы гиалуроновой кислоты четко указан (то есть, определен), для того чтобы скорректировать и оптимизировать концентрацию сшивающего реагента, наряду с другими параметрами, что в результате позволяет регулировать последующую реакцию сшивания. Степень замещения/модификации исходного полимера может быть определена с помощью любого из ряда соответствующих методов, например, ЯМР, УФ или ИК анализа, или элементного анализа. Предпочтительным методом расчета процента замещения полимера, такого как гиалуроновая кислота, является ЯМР, например, протонный ЯМР. Смотрите, например, Пример 1, в котором степень модификации гиалуроновой кислоты определяли на основе отношения относительных площадей пиков, соответствующих винилсульфоновой и ацетамидметильной группы гиалуроновой кислоты в спектре 1H ЯМР.
Полимер может также включать гидразидные реакционноспособные группы и/или аминоокси реакционноспособные группы, описанные в патентном документе PCT/US/2004/040726 (WO 2005/056608), при этом содержания соответствующих частей указанного изобретения, связанных с дериватизацией таких полимеров и с самими полученными полимерами, приводятся здесь путем ссылки на них.
В качестве варианта, полимер может быть тиол-дериватизированным, таким как тиол-дериватизированная гиалуроновая кислота. Примеры полимеров тиол-дериватизированной гиалуроновой кислоты включают примеры, описанные в Патентах США №№ 6884788; 6620927; 6548081; 6537979; 6013679; 5502081 и 5356883, при этом содержания соответствующих частей, которые связаны с такими тиол-дериватизированными полимерами, приводятся здесь путем ссылки на них.
Дополнительные примеры полимеров гиалуроновой кислоты включают цистеин-дериватизированную гиалуроновую кислоту, включая, но этим не ограничивая, те полимеры, которые описаны в публикации "Controlled Release from Glycosaminoglycan Drug Complexes" R. V. Sparer et al., Chapter 6, pages 107-119, in T. J. Roseman et al., CONTROLLED RELEASE DELIVERY SYSTEMS, Marcel Dekker, Inc., New York (1983).
Примеры дополнительных предпочтительных полимеров включают гиалуроновую кислоту, дериватизированную с помощью подвешенной тиольной группы, связанной с N-ацилмочевинной группой через гидрокарбильную, арильную, замещенную гидрокарбильную, или замещенную арильную группу. Иллюстрации полимеров для применения в предлагаемых изобретением композициях и способах включают Carbylan™-S (описанный подробно в патентном документе International Patent Publication No. WO 2005/056608).
Дополнительные дериватизированные полимеры включают гиалуроновую кислоту, ковалентно связанную с реакционноспособным сшивающим реагентом, таким как дифункциональное или многофункциональное акрилатное, аллильное или метакрилатное соединение. Типичные сшивающие реагенты для модификации гиалуроновой кислоты включают, но этим не ограничивая, полиэтиленгликоль диакрилат (ПЭГДА), полиэтиленгликоль диметакрилат (ПЭГДМ), полиэтиленгликоль диакриламид (ПЭГДАА) и полиэтиленгликоль диметакриламид (ПЭГДМА) и их производные. ПЭГ-звенья приведенных выше сшивающих реагентов могут быть олигомерными или полимерными, например, включающими от 2 до 100 или более подзвеньев. Дополнительные сшивающие реагенты, подходящие для модификации/функционализации полимера, такого как гиалуроновая кислота, включают акрилат декстрана, метакрилат декстрана, глицидил метакрилат декстрана, функционализированная метакрилатом гиалуроновая кислота, функционализированная акрилатом гиалуроновая кислота, диметакрилат глицерина, 1,3-диглицеринат диакрилат глицерина, акрилат сорбита и их производные.
Дериватизированная гиалуроновая кислота или другой полимер обычно может иметь среднечисленную молекулярную массу в интервале приблизительно от 700 до 3000000 дальтонов. Иллюстрациями интервалов молекулярной массы являются интервалы приблизительно от 1000 до 2000000 дальтонов, или приблизительно от 5000 до 1000000 дальтонов. Дополнительные подходящие интервалы молекулярных масс включают интервалы приблизительно от 50000 дальтонов до приблизительно 1000000 дальтонов, или приблизительно от 100000 дальтонов до приблизительно 1200000 дальтонов, или приблизительно от 90000 дальтонов до приблизительно 300000 дальтонов. Молекулярные массы гиалуроновой кислоты обычно являются значениями среднечисленной молекулярной массы, которые могут быть определены, например, с помощью эксклюзионной хроматографии с детектором многоуглового рассеяния лазерного света (MALLS-SEC). В зависимости от источника происхождения, гиалуроновая кислота может иметь полидисперсность (Mw/Mn) до приблизительно 3, или более предпочтительно, до приблизительно 2. Обычно, гиалуроновая кислота в качестве исходного материала может иметь достаточно узкое молекулярно-массовое распределение, со значениями меньше чем приблизительно 2,5, более предпочтительно, меньше чем приблизительно 2. Примеры интервалов полидисперсностей гиалуроновой кислоты включают интервал приблизительно от 1,02 до приблизительно 2,5, где исходная гиалуроновая кислота может иметь полидисперсность приблизительно 1,02, 1,05, 1,1, 1,2, 1,3, 1,3, 1,5, 1,6, 1,7, 1,8, 1,9, 2,0, 2,1, 2,2, 2,3, 2,4 или 2,5, или даже выше. В качестве варианта, подходящая в качестве исходного материала для дериватизации гиалуроновая кислота может иметь вязкость, обычно в сантипуазах, при конкретной концентрации в воде, которая соответствует любому одному или более приведенным выше интервалам среднечисленной молекулярной массы.
Сшивающий реагент
Примеры сшивающих реагентов, эффективных при образовании гидрогелей, имеющих описанные в изобретении предпочтительные признаки, включают соединения, имеющие две или более реакционноспособные группы, расположенные на центральной молекуле "C". Центральной молекулой может являться линейный или циклический алкан, олигомерный или полимерный ПЭГ, или любая другая такая подходящая центральная молекула. В случае сшивающих реагентов на основе ПЭГ, полиэтиленгликоль может быть линейным, разветвленным (имеющим два полимерных ответвления), или многоразветвленным (например, имеющим 3, 4, 5, 6, 7, 8 или более полимерных разветвлений). Следовательно, в таких случаях, центральной молекулой обычно может являться линейный ПЭГ, разветвленный ПЭГ, имеющий 2 разветвления, или многоразветвленный ПЭГ, имеющий ответвления ПЭГ, исходящие из центрального ядра. Иллюстрации ядер для таких многоразветвленных полимеров включают эритрит, пентаэритрит, триметилолпропан, глицерин, димер глицерина (3,3'-оксидипропан-1,2-диол), олигомеры глицерина, сорбит, гексаглицерин, и другие подобные соединения.
Например, сшивающий реагент может являться центральной молекулой "C", имеющей расположенные на ней тиольные или акрилатные группы. Тиолсодержащий сшивающий реагент включает две или более тиольных группы. Такие тиольные группы могут реагировать с винилсульфоном, например, внутри дериватизированной винилсульфоном гиалуроновой кислоты. Иллюстрации тиольных сшивающих реагентов включают ПЭГ-дитиол (HS-ПЭГ-SH), ПЭГ-тритиол с 3 разветвлениями (глицериновое ядро), ПЭГ-тетратиол с 4 разветвлениями (пентаэритритовое ядро), или ПЭГ-октатиол с 8 разветвлениями (гексаглицериновое ядро). Приведенные выше реагенты из многоразветвленного ПЭГ могут также иметь не все разветвления, функционализированные с помощью тиола. Дополнительные подходящие тиольные реагенты, имеющие ПЭГ в качестве центральной молекулы, производятся фирмой Laysan Bio (Arab, Alabama), также как ароматические дитиолы производятся фирмой NanoScience. Другие подходящие тиольные сшивающие реагенты включают димеркаптоянтарную кислоту, 2,3-димеркапто-1-пропансульфоновую кислоту, дигидролипоевую кислоту, функционализированный тиолом декстран, и функционализированную тиолом гиалуроновую кислоту. Могут также быть использованы сшивающие реагенты, имеющие концевые акрилатные группы, расположенные на центральной молекуле. Например, подходящими для использования в качестве сшивающих реагентов являются описанные выше центральные молекулы, в которых тиольные группы замещены на ацилатные или метакрилатные группы. Дополнительные примеры сшивающих реагентов включают примеры, описанные в патентном документе PCT/US/2004/040726.
Сшивающие реагенты также включают молекулы, содержащие акрилатные, аллильные или метакрилатные группы. Акрилатные, аллильные или метакрилатные сшивающие реагенты могут быть по природе мономерными или полимерными. В одном варианте осуществления, сшивающий реагент выбирают из группы, включающей полиэтиленгликоль диакрилат (ПЭГДА), полиэтиленгликоль диметакрилат (ПЭГДМ), полиэтиленгликоль диакриламид (ПЭГДАА) и полиэтиленгликоль диметакриламид (ПЭГДМА), акрилат декстрана, метакрилат декстрана, глицидил метакрилат декстрана, функционализированную метакрилатом гиалуроновую кислоту, функционализированную акрилатом гиалуроновую кислоту, диметакрилат глицерина, 1,3-диглицеринат диакрилат глицерина, акрилат сорбита и их производные.
Молекулярная масса сшивающего реагента обычно меньше, чем молекулярная масса описанной выше модифицированной гиалуроновой кислоты или другого полимера. Обычно, молекулярная масса сшивающего реагента находится в интервале приблизительно от 200 до приблизительно 20000 дальтонов. Дополнительными примерами интервалов молекулярных масс для сшивающего реагента являются интервалы приблизительно от 1000 до приблизительно 10000 дальтонов (например, имеющие молекулярную массу 1 кд, 2 кд, 3 кд, 4 кд, 5 кд, 6 кд, 7 кд, 8 кд, 9 кд или 10 кд, где кд обозначает килодальтон) или даже приблизительно от 1000 до 5000 дальтонов. Примеры молекулярных масс для сшивающего реагента, такого как ПЭГ дитиол, или любой из других описанных выше подходящих сшивающих реагентов, включают наряду с прочими приблизительно 3350, 3400 и 5000 дальтонов.
Биоактивные агенты
Предлагаемые изобретением гидрогели, предшественники гидрогелей, и относящиеся к ним композиции и/или наборы могут необязательно включать биоактивный агент. Биоактивные агенты, которые могут быть введены в предлагаемые изобретением композиции и комбинации, включают противомикробные вещества, антибиотики, анальгетики, антипролиферативные/антимитотические средства, включающие природные продукты, такие как алкалоиды барвинка (например, винбластин, винкристин, и винорелбин), паклитаксел, эпидиподофиллотоксины (например, этопозид, тенипозид), антибиотики (дактиномицин (актиномицин D) даунорубицин, доксорубицин и идарубицин), антрациклины, митоксантрон, блеомицин, пликамицин (митрамицин) и митомицин, ферменты (L-аспарагиназу); антипролиферативные/антимитотические алкилирующие агенты, такие как азотистые иприты (мехлоретамин, циклофосфамид и аналоги, мелфалан, хлорамбуцил), этиленимины и метилмеламины (гексаметилмеламин и тиотепа), алкилсульфонаты- бусульфан, нитрозомочевины (кармустин (BCNU) и аналоги, стрептозоцин), тразены - дакарбазинин (DTIC); антипролиферативные/антимитотические антиметаболиты, такие как аналоги фолиевой кислоты (метотрексат), аналоги пиримидина (фторурацил, флоксуридин, и цитарабин), аналоги пурина и родственные ингибиторы (меркаптопурин, тиогуанин, пентостатин и 2-хлордезоксиаденозин [кладрибин]); координационные комплексы платины (цисплатин, карбоплатин), прокарбазин, гидроксимочевину, митотан, аминоглутетимид; гормоны (например, эстроген); антикоагулянты (гепарин, соли синтетического гепарина и другие ингибиторы тромбина); фибринолитические средства (такие как тканевой активатор плазминогена, стрептокиназу и урокиназу), аспирин, дипиридамол, тиклопидин, клопидогрель, абциксимаб; средства против миграции опухолевых клеток; антисекреторные вещества (такие как брефелдин A); противовоспалительные средства, такие как адренокортикальные стероиды (гидрокортизон, ацетат гидрокортизона, ацетат кортизона, пивалат тиксокортола, преднизолон, метилпреднизолон, преднизон, триамцинолона ацетонид (или любые другие фармацевтически приемлемые соли триамцинолона), триамцинолоновый спирт, мометазон, амцинонид, будезонид, дезонид, флуоцинонид, флуоцинолон ацетонид, халцинонид, бетаметазон, бетаметазона натрий фосфат, дексаметазон, дексаметазона натрий фосфат, и флуокортолон, гидрокортизон-17-бутират, гидрокортизон-17-валерат, аклометазона дипропионат, бетаметазона валерат, бетаметазона дипропионат, предникарбат, клобетазон-17-бутират, клобетазол-17-пропионат, флуокортолона капроат, флуокортолона пивалат, и флупреднидена ацетат. Моногидрат дипропионата беклометазона, флунизолид, пропионат флутиказона, моногидрат фуроата мометазона, ацетонид триамцинолона, фуроат флутиказона, нестероидные средства (производные салициловой кислоты, например, аспирин); производные парааминофенола, то есть, ацетоминофен; индол- и инденуксусные кислоты (индометацин, сулиндак и этодолак), гетероарилуксусные кислоты (толметин, диклофенак и кеторолак), арилпропионовые кислоты (ибупрофен и производные), антраниловые кислоты (мефенамовую кислоту и меклофенамовую кислоту), энольные кислоты (пироксикам, теноксикам, фенилбутазон и оксифентатразон), набуметон, соединения золота (ауранофин, ауротиоглюкоза, натрий тиомалат золота); иммунодепрессанты (циклоспорин, такролимус (FK-506), сиролимус (рапамицин), азатиоприн, мофетила микофенолат); митогенные или морфогенетические белки, пептиды или миметики фактора роста; фактор роста эндотелия сосудов (VEGF), фактор роста фибробластов (FGF), члены суперсемейства трансформирующего фактора роста-β (TGF-β), включающие TGF-β и костные морфогенетические белки (BMP), такие как BMP-2, 3, 4, 5, 6, 7, 8; фактор роста инсулина и инсулиноподобный фактор роста (IGF), фактор роста гепатоцитов (HGF), факторы роста эпидермиса (EGF), белки семейства Hedgehog (SHH и IHH), активины, ингибины, деминерализованный костный матрикс (DBM) и факторы роста тромбоцитов (PDGF's), гематопоэтические факторы роста (G-CSF, CSF-1, GM-CSF, эритропоэтин, цитокины и лимфокины, включая семейство интерлейкинов (от IL-1 до IL-34)), интерфероны, ростовые факторы нервов (NGF), нейтрализующие, антагонистические или агонистические антитела, агонисты или антагонисты рецептора фактора роста, доноры оксида азота; антисмысловые олигонуклеотиды, факторы транскрипции, медиаторы сигнальных каскадов, и их комбинации.
Антибиотики включают антибиотики семейства линкомицина (относящиеся к классу антибиотиков, вначале извлекаемых из бактерий Streptomyces Lincolnensis); антибиотики семейства тетрациклина (относящиеся к классу антибиотиков, вначале извлекаемых из бактерий Streptomyces Aureofaciens); антибиотики на основе серосодержащих соединений, такие как сульфонамиды; и другие подобные. Примеры антибиотиков семейства линкомицина включают сам линкомицин (6,8-дидезокси-6-[[(1-метил-4-пропил-2-пирролидинил)карбонил]амино]-1-тио-L-трео-α-D-галактооктопиранозид), клиндамицин, 7-дезокси, 7-хлор производное линкомицина (например, 7-хлор-6,7,8-тридезокси-6-[[(1-метил-4-пропил-2-пирролидинил)карбонил]амино]-1-тио-L-трео-α-D-галактооктопиранозид), и их фармакологически приемлемые соли и эфиры. Примеры антибиотиков семейства тетрациклина включают сам тетрациклин 4-(диметиламино)-1,4,4α,5,5α,6,11,12α-октагидро-3,6,12,12α-пентагидрокси-6-метил-1,11-диоксо-2-нафтаценкарбоксамид), хлортетрациклин, окситетрациклин, тетрациклин, демеклоциклин, ролитетрациклин, метациклин и доксициклин и их фармацевтически приемлемые соли и эфиры, в частности, соли присоединения кислот, такие как гидрохлоридная соль. Примеры антибиотиков на основе серосодержащих соединений включают, но этим не ограничивая, сульфонамиды, сульфацетамид, сульфабензамид, сульфадиазин, сульфадоксин, сульфамеразин, сульфаметазин, сульфаметизол, сульфаметоксазол, и их фармакологически приемлемые соли и эфиры, например, сульфацетамид натрия. Противомикробные вещества и/или антибиотики дополнительно включают такие соединения, как эритромицин, бацитрацин, неомицин, пенициллин, полимиксин B, тетрациклины, виомицин, хлормицетин и стрептомицины, цефазолин, ампициллин, азактам, тобрамицин, клиндамицин и гентамицин.
Анальгетики включают такие соединения, как лидокаин, бензокаин и маркаин.
Предлагаемый изобретением гидрогель может также включать живые клетки. Примеры живых клеток включают стволовые клетки, паренхимальные стволовые клетки, выделенные из крови клетки и клетки костного мозга.
В одном предпочтительном варианте осуществления, гидрогель включает кортикостероид. Примеры подходящих кортикостероидов включают гидрокортизон, ацетат гидрокортизона, ацетат кортизона, пивалат тиксокортола, преднизолон, метилпреднизолон, преднизон, триамцинолон, соли триамцинолона, такие как ацетонид триамцинолона, бенетонид триамцинолона, фуретонид триамцинолона, гексацетонид триамцинолона, диацетат триамцинолона, триамцинолоновый спирт, мометазон, амцинонид, будезонид, дезонид, флуоцинонид, ацетонид флуоцинолона, хальцинонид, бетаметазон, бетаметазон натрий фосфат, дексаметазон, дексаметазон натрий фосфат, флуокортолон, гидрокортизон-17-бутират, гидрокортизон-17-валерат, дипропионат аклометазона, валерат бетаметазона, дипропионат бетаметазона, предникарбат, клобетазон-17-бутират, клобетазол-17-пропионат, капроат флуокортолона, пивалат флуокортолона, ацетат флупреднидена, моногидат дипропионата беклометазона, флунизолид, пропионат флутиказона, моногидрат фуроата мометазона, и фуроат флутиказона.
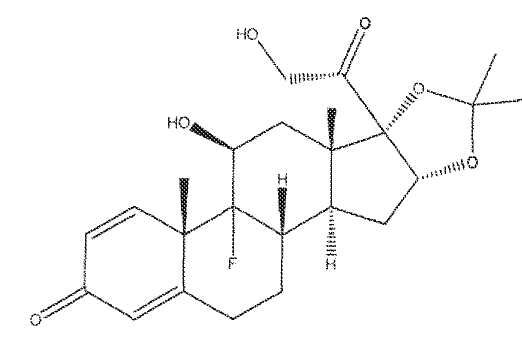
Одним предпочтительным соединением для применения в лекарственной форме в виде предлагаемого изобретением гидрогеля является триамцинолон (11β,16α)-9-фтор-11,16,17,21-тетрагидроксипрегна-1,4-диен-3,20-дион), или его фармацевтически приемлемая соль или сольват. Структура ацетонида триамцинолона показана ниже.
Биоактивный агент может обычно быть смешан с гидрогелем, суспендирован в гидрогеле, или заключен внутрь предлагаемого изобретением гидрогеля. В качестве варианта, биоактивный агент может находиться в форме полимерного конъюгата, или, может быть ковалентно связан, но с дальнейшей возможностью высвобождения, с компонентом, используемым для приготовления гидрогеля, например, с модифицированной гиалуроновой кислотой или сшивающим реагентом.
Гидрогели
Предлагаемые изобретением гидрогели обычно получают путем реакции описанной выше модифицированной гиалуроновой кислоты или другого подходящего полимера со сшивающим реагентом (также описанным выше) при условиях, которые являются оптимальными для образования геля. Обычно, для осуществления оптимальной реакции корректируют, наряду с реакционными условиями, относительные количества реагентов и реакционноспособных групп. Образование геля проводят в мягких и контролируемых условиях. Предпочтительно, чтобы получаемый гидрогель содержал в совокупности менее чем двадцать процентов непрореагировавших функциональных групп, содержавшихся в исходных модифицированной гиалуроновой кислоте и сшивающем реагенте, более предпочтительно, 5% или менее непрореагировавших функциональных групп, содержавшихся в исходных модифицированной гиалуроновой кислоте и сшивающем реагенте, или в идеальном варианте, практически необнаруживаемые количества непрореагировавших функциональных групп, таких как непрореагировавшие винилсульфоновые или тиольные группы. Такие низкие уровни непрореагировавших функциональных групп в получаемом геле являются предпочтительными с точки зрения получения геля, имеющего низкие провоспалительные свойства при введении in vivo, например, в сустав. В конкретном варианте осуществления, гидрогель, получаемый реакцией (2-(винилсульфонил)этокси)1-10% гиалуроновой кислоты с тиольным сшивающим реагентом, содержит менее чем десять процентов непрореагировавших тиольных и винилсульфоновых групп. Число непрореагировавших функциональных групп контролируется путем тщательного постоянного наблюдения за условиями реакции, путем корректировки соотношения реагентов, и имея информацию о степени модификации исходной гиалуроновой кислоты.
Полученные таким образом гидрогели обычно могут содержать массовый процент полимера в воде (POLY/HOH) в интервале приблизительно от 0,5 до 5,0 процентов или даже больше. В одном или нескольких вариантах осуществления, в качестве иллюстраций массовых процентов полимера в воде для получаемого гидрогеля выбирают 0,5, 1,0, 1,5, 2,0, 2,5, 3,0, 3,5, 4,0, 4,5 и 5 процентов.
Образование предлагаемых изобретением слегка сшитых гидрогелей обусловлено, по меньшей мере, частично, низкой степенью модификации исходной модифицированной гиалуроновой кислоты. Например, степень модификации гиалуроновой кислоты в результате реакции с дивинилсульфоном может контролироваться путем соответствующей корректировки времени реакции, как это показано в Примере 6. Например, для того чтобы поддерживать степень модификации ниже приблизительно 20%, обычно применяют время реакции для образования 2-(винилсульфонил)этокси)1-20% гиалуроновой кислоты при условиях окружающей среды (например, 20-25°C) около 3 минут. Реакцию предпочтительно проводить при мольном избытке дивинилсульфона или другого соответствующего реагента модификации, такого как дифункционального или многофункционального акрилатного или метакрилатного реагента. Как видно из результатов в Примере 6, и как можно было бы ожидать, более короткое время реакции к более низким степеням модификации исходного полимера, например, гиалуроновой кислоты. Например, при условиях окружающей среды, очень короткое время реакции, то есть, порядка нескольких секунд, давало в результате модифицированную винилсульфоном гиалуроновую кислоту, имеющую приблизительно 4% замещения на винилсульфоновые группы, а время реакции в одну минуту давало в результате гиалуроновую кислоту с замещением 8% на винилсульфоновые группы. Для иллюстрации влияния времени реакции и условий на достигаемые степени замещения в получаемом полимере смотрите Таблицу 1. В одном варианте осуществления, условия реакции корректируют для получения замещенной винилсульфоном гиалуроновой кислоты, имеющей приблизительно от 1% до приблизительно 10% замещения. В родственном варианте осуществления, реакцию модификации проводят при условиях окружающей среды в течение приблизительно от 10 секунд до приблизительно 120 секунд. Реакция модификации, например, реакция гиалуроновой кислоты и дивинилсульфона, может быть проведена в щелочных условиях, например, в водном растворе щелочи, таком как водный раствор гидроксида натрия, водный раствор гидроксида калия, или с использованием любого другого подходящего основания, которое растворимо в воде, и затем реакция может быть остановлена путем добавления кислоты, такой как хлористоводородная кислота, серная кислота, фосфорная кислота, или другие подобные кислоты. Обычно, кислоту добавляют в тот момент и в количестве, достаточном для корректировки величины pH в интервале приблизительно от 4 до 6,5 или около этого, когда требуется остановить реакцию с целью достижения требуемой степени модификации функциональных групп исходного полимера. Затем продукт может необязательно быть подвергнут очистке, например, путем диализа, и необязательно высушен, например, путем лиофилизации.
Композицию предшественника гидрогеля затем слегка сшивают, необязательно, в присутствии сшивающего реагента, если это необходимо. Например, модифицированная винилсульфоном гиалуроновая кислота, такая как описанная выше 2-(винилсульфонил)этокси)1-20%гиалуроновая кислота, или 2-(винилсульфонил)этокси)1-10%гиалуроновая кислота, реагирует с подходящим сшивающим реагентом, таким как функционализированный тиолом ПЭГ, таким как описанный выше ПЭГ-дитиол, или другим соответствующим сшивающим реагентом при условиях реакции, приводящих к образованию сшитого гидрогеля. В предпочтительном варианте осуществления, реакцию сшивания проводят в водном растворе, например, при физиологических условиях. В одном варианте осуществления, реакцию проводят в физиологическом растворе. Смотрите, например, Примеры 2, 3, 4 и 5. Объемные отношения реагентов могут быть скорректированы с учетом требуемых свойств получаемого гидрогеля, и они зависят от концентраций растворов реагентов, конкретных молекулярных масс и структуры реагентов, и других подобных факторов. Например, иллюстрации относительных мольных отношений функциональной группы к сшивающему реагенту, когда, например, примером функциональной группы является винилсульфон, содержащийся в модифицированной винилсульфоном гиалуроновой кислоте, и относительное количество сшивающего реагента относится к самому сшивающему реагенту, например, молекуле сшивающего реагента, а не к числу реакционноспособных групп, таких как тиольные группы, содержащиеся в молекуле сшивающего реагента, такого как ПЭГ-дитиол, включают следующие отношения: приблизительно от 1 до 2,5, или приблизительно от 1,25 до 2,0, или приблизительно от 1,3 до приблизительно 1,8. В качестве варианта, сшивающий реагент может быть добавлен в виде твердого вещества к раствору модифицированной гиалуроновой кислоты. В случае, когда требуется стерильная лекарственная форма, сшивающий реагент стерилизуют перед его добавлением, например, с помощью электроннолучевой обработки. Реакцию сшивания обычно проводят при мягких реакционных условиях, например, при температурах в интервале приблизительно от 20°C до приблизительно 45°C, например, при любой одной из следующих температурах: 20°C, 21°C, 22°C, 23°C, 24°C, 25°C, 26°C, 27°C, 28°C, 29°C, 30°C, 31°C, 32°C, 33°C, 34°C, 35°C, 36°C, 37°C, 38°C, 39°C, 40°C, 41°C, 42°C, 43°C, 44°C или 45°C. После смешения или реакции модифицированной гиалуроновой кислоты и сшивающего реагента, и любых других необязательных реагирующих компонентов, полученную композицию обычно подвергают взаимодействию, например, в термостате, в течение периода времени, достаточного для образования геля. В зависимости от температуры реакции, реагенты обычно подвергают взаимодействию в течение периода времени приблизительно от 8 до приблизительно 36 часов, или приблизительно от 10 до приблизительно 24 часов, или приблизительно от 12 до приблизительно 18 часов.
Реакция сшивания может быть проведена в стерильных условиях, то есть, с использованием стерильных реагентов и при стерильных условиях, обычно описываемых в сопровождающих примерах, для получения стерильного гидрогеля. Например, все компоненты раствора могут быть стерильно отфильтрованы до реакции, что в результате позволяет получать стерильную композицию.
Дополнительные примеры слегка сшитых гидрогелей получают, например, путем сшивания материалов из модифицированной тиолом гиалуроновой кислоты, таких как Carb-S™. Материал Carb-S™ получают путем карбоксиметилирования гиалуроновой кислоты с последующей реакцией с 3,3'дитиобис(пропионового гидразида), ДТПГ, в присутствии реагента сочетания, и затем путем восстановления дисульфидных групп с помощью такого реагента, как дитиотреитол. Смотрите, например, патентный документ U.S. Patent Publication No. US2008-002595. Дополнительные материалы из модифицированной тиолом гиалуроновой кислоты описаны в патентном документе U.S. Patent Publication No. US2009-0105093; иллюстративным материалом, описанным в упомянутой выше публикации является гиалуроновая кислота, дериватизированная путем реакции с тиолсодержащим гидразидом. Гидрогель может также быть получен из модифицированной тиолом гиалуроновой кислоты, описанной в Патенте США № 6884788. В предпочтительном варианте осуществления, упомянутые выше материалы из модифицированной тиолом гиалуроновой кислоты получают с помощью описанных методов синтеза, за исключением того, что степень модификации исходного материала из гиалуроновой кислоты является низкой, в результате чего менее чем приблизительно 20% или, еще более предпочтительно, менее чем приблизительно 10% гидроксильных групп гиалуроновой кислоты подвергаются химической модификации. Такие материалы из дериватизированной тиолом гиалуроновой кислоты могут быть слегка сшитыми вследствие способности тиолов к самопроизвольному взаимодействию. В качестве варианта, слегка сшитый гидрогель может быть получен путем реакции с сшивающим реагентом, таким как ПЭГ-акрилат.
В одном или более конкретных вариантах осуществления, композиция сшитого гидрогеля содержит активное средство. Предпочтительные классы биоактивных агентов включают стероиды, факторы роста, антипролиферативные средства и антибиотики. Одним особенно предпочтительным классом активного средства для включения в гидрогели настоящего изобретения являются кортикостероиды. Иллюстрации кортикостероидов включают, но этим не ограничивая, следующие кортикостероиды: триамцинолон, соли триамцинолона, такие как ацетонид триамцинолона, гексацетонид триамцинолона, бенетонид триамцинолона, фуретонид триамцинолона и диацетат триамцинолона и другие подобные кортикостероиды, и метилпреднизолон. Обычно, получаемый гидрогель содержит приблизительно от 0,01% по массе до приблизительно 20% по массе биоактивного средства, в зависимости от его активности. Иллюстративными количествами биоактивного агента, содержащегося в гидрогеле (от суммарной массы влажного гидрогеля) являются приблизительно от 10% до приблизительно 20% по массе, например, для менее активного биоактивного агента, и приблизительно от 0,01% до приблизительно 10% по массе, или приблизительно от 0,01% до приблизительно 5%, или приблизительно от 0,01% до приблизительно 3%, или приблизительно от 0,1 до приблизительно 2% биоактивного агента, или даже приблизительно от 0,1 до приблизительно 1% биоактивного агента, например, для более активного биоактивного агента, такого как ацетонид триамцинолона. В конкретных вариантах осуществления, гидрогель применяют для доставки плохо растворимого в воде биоактивного агента путем включения такого биоактивного агента в гидрогель.
Предпочтительно, чтобы гидрогели настоящего изобретения получали и в мягких реакционных условиях, и в отсутствии инициатора полимеризации. Кроме того, достаточное гелеобразование происходит и в отсутствии внешнего источника энергии. Например, реакция гелеобразования может быть проведена при температуре в интервале приблизительно от 20°C до 45°C и в отсутствии инициаторов и ускорителей. Кроме того, гелеобразование, то есть, образование гидрогеля, происходит без выделения каких-либо побочных химических мономерных продуктов. Следовательно, предлагаемые изобретением гидрогели содержат минимальное число добавок или вредных примесей, которые могли бы в принципе вызывать провоспалительную ответную реакцию при введении in-vivo.
Стерильные гидрогели могут быть получены в стерильных условиях, например, путем помещения водных растворов модифицированной гиалуроновой кислоты и сшивающего реагента в отдельный стерильный шприц и/или центрифужную пробирку, и затем тщательного смешения. Обычно, смешиваемые реагенты (то есть, модифицированную гиалуроновую кислоту и сшивающий реагент) помещают в термостат, установленный на соответствующую температуру (например, в интервале приблизительно от 20°C до 45°C), до тех пор, пока из материалов не образуется гель. Смотрите, например, Пример 2, 18, 21, 22, 23, 24, 25, 27, 28, 29 и 30 для типичных способов приготовления композиций гидрогелей, включающих примеры объемных отношений реагентов.
Дополнительная немодифицированная гиалуроновая кислота, обычно в форме водного раствора или смеси, может необязательно быть добавлена либо в композицию предшественника геля до образования геля, либо после образование геля (например, в суспензию геля), для получения композиции, включающей частицы сшитого гидрогель в водном растворе гиалуроновой кислоты. Смотрите, например, Пример 8. Среднечисленная молекулярная масса гиалуроновой кислоты (а именно, немодифицированной гиалуроновой кислоты) в растворе обычно находится в интервале приблизительно от 750000 до приблизительно 1200000 дальтонов или даже выше. Предпочтительным водным раствором является физиологический раствор гиалуроновой кислоты, где примерные водные растворы гиалуроновой кислоты, добавляемые в гидрогель, имеют концентрации в интервале приблизительно от 0,3% до приблизительно 4%, или приблизительно от 0,5% до приблизительно 2% по массе. Одна типичная композиция включает следующие относительные количества компонентов: 4 мл суспензии геля ((2-(винилсульфонил)этокси)1-10%гиалуроновая кислота/ПЭГ-дитиол) с 2 мл гиалуроновой кислоты при концентрации 20 мг/мл. Особенно предпочтительная композиция включает 4 мл суспензии геля ((2-(винилсульфонил)этокси)4%гиалуроновая кислота/ПЭГ-дитиол) с 2 мл гиалуроновой кислоты при концентрации 20 мг/мл. Обычно, конечное содержание гиалуроновой кислоты в получаемом набухшем геле находится в интервале приблизительно от 0,05 до 5 процентов (от 0,5 мг/мл до 50 мг/мл). Предпочтительно, чтобы конечное содержание гиалуроновой кислоты в получаемом набухшем геле составляло приблизительно от 0,1 до 3 процентов, или приблизительно от 0,1 до 1 процента, или приблизительно от 0,5 до 0,8%. Иллюстративное конечное содержание гиалуроновой кислоты в получаемом набухшем геле может, например, соответствовать любому из следующих значений процентов 0,1 , 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0, 2,0, 3,0, 4,0 и 5,0. Например, характерные относительные количества (массовые отношения) гиалуроновой кислоты к частицам сшитого (например, (2-(винилсульфонил)этокси)1-10%гиалуроновая кислота/ПЭГ-дитиол) гидрогеля в получаемой композиции обычно находится в пределах приблизительно от 10:1, или приблизительно от 5:1, или приблизительно от 3:1, или приблизительно от 1:1. Получаемая композиция может также необязательно содержать одно или более поверхностно-активных веществ. Иллюстрации поверхностно-активных веществ включают натрий-карбоксиметилцеллюлозу, полисорбат 80, твин 80, полиэтиленгликоль (например, ПЭГ 3350), и другие подобные вещества.
При желании, биоактивный реагент может быть добавлен в реакционную смесь перед сшиванием или, в качестве варианта, добавлен в сшитый гель после его образования. Примеры 9-16 иллюстрируют получение гидрогеля, а также включение и последующее замедленное высвобождение биоактивного агента, ацетонида триамцинолона, из типичных композиций гидрогеля. В качестве варианта, в испытуемые гидрогели могут быть включены живые клетки, такие как, стволовые клетки, паренхимальные стволовые клетки, извлеченные из крови клетки и клетки костного мозга.
В случае испытуемых гидрогелей, с включенным в них биоактивным агентом или без него, гидрогель может быть диспергирован в растворе одного или более описанных выше полианионных полисахаридов (PAS). Не ограничивающие примеры полианионных полисахаридов помимо гиалуроновой кислоты (ГК) включают, например, карбоксиметилцеллюлозу (КМЦ), карбоксиметиламилозу (КМА), хондроитин-4-сульфат, хондроитин-6-сульфат, сульфат дерматана, дерматин-6-сульфат, сульфат гепарина, гепарин, сульфат кератина и их производные, и их комбинации. Такие полимеры известны в технике и описаны, например, в Патенте США № 6056970. Другие растворы полимеров, в которых испытуемые гидрогели могут быть диспергированы, включают фибрин, фибриноген, крахмал, полиаминокислоты; пептиды, белки, желатин, коллаген и полиэтиленгликоль. Для диспергирования частиц испытуемого гидрогеля может быть использован раствор, содержащий одну или более комбинаций упомянутых выше полимеров. Растворы полимера могут быть приготовлены в интервале концентраций, по меньшей мере, от 0,1 мг/мл до максимальной растворимости в воде или 0,9% физиологическом растворе. Как уже было описано ранее, одним предпочтительным полимером является гиалуроновая кислота с молекулярной массой от 500000 до 3 миллионов в интервале концентраций приблизительно от 10 мг/мл до приблизительно 25 мг/мл. Комбинация раствора полимера и гидрогеля может быть приготовлена в стерильных условиях, в силу чего конечная расфасованная комбинация является стерильной.
Как описано в Примере 8, испытуемые гидрогели могут быть смешаны в различных соотношениях с раствором выбранного полимера. Объемные отношения при смешении испытуемого гидрогеля и раствора полимера могут включать, но этим не ограничивая, приблизительно 1:10, 1:9, 1:8, 1:7, 1:6, 1:5, 1:4, 1:3, 1:2, 1:1, 2:1, 3:1, 4:1, 5:1, 6:1, 7:1, 8:1, 9:1, 10:1. Предпочтительными объемными отношениями при смешении испытуемого гидрогеля и раствора полимера являются приблизительно 3:1, 2:1 и 1:1.
Величина pH дисперсий испытуемых гидрогелей и дисперсий комбинаций испытуемый гидрогель/раствор полимера может быть изменена путем добавления буферов, кислот и оснований. Предпочтительный интервал значений pH для дисперсий испытуемых гидрогелей и дисперсий комбинаций испытуемый гидрогель/раствор полимера составляет приблизительно 5-8, и более предпочтительно, приблизительно 6-7,6.
Ионная сила дисперсий испытуемых гидрогелей и дисперсий комбинаций испытуемый гидрогель/раствор полимера может быть изменена путем добавления солей. Одной предпочтительной солью, используемой для изменения ионной силы дисперсий испытуемых гидрогелей и дисперсий комбинаций испытуемый гидрогель/раствор полимера, является хлорид натрия. Предпочтительную конечную ионную силу дисперсий испытуемых гидрогелей и дисперсий комбинаций испытуемый гидрогель/раствор полимера выбирают так, чтобы дисперсии испытуемых гидрогелей и дисперсии комбинаций испытуемый гидрогель/раствор полимера являлись приблизительно изотоническими.
В дисперсии испытуемых гидрогелей и дисперсии комбинаций испытуемый гидрогель/раствор полимера могут быть также добавлены фармацевтически приемлемые консерванты. Они могут включать такие соединения, как бензоат натрия или бензиловый спирт.
Дисперсии испытуемых гидрогелей и дисперсии комбинаций испытуемый гидрогель/раствор полимера могут, в конкретных вариантах осуществления, быть расфасованы в шприц. Шприц может быть изготовлен из пластмассы (например, полипропилена, поликарбоната, полистирола) или стекла или любого другого фармацевтически приемлемого материала. Объем дисперсий испытуемых гидрогелей и дисперсий комбинаций испытуемый гидрогель/раствор полимера, содержащийся в шприце, может составлять приблизительно от 0,5 мл до 20 мл, при этом предпочтительными объемами являются 1 мл, 2 мл, 3 мл, 4 мл, 5 мл, 6 мл и 7 мл.
Получаемый материал гидрогеля может быть переработан в частицы с размером в интервале приблизительно от 0,10 до 3,0 миллиметров (смотрите, например, Примеры 3 и 4), или может находиться в форме водной суспензии геля. Например, гелеобразный материал может быть разбит на кусочки, смешан с физиологическим раствором и подвергнут набуханию. Затем из гелеобразного материала могут быть получены частицы соответствующего размера путем экструзии через сито с соответствующим размером ячеек, например, приблизительно от 0,10 до 3,0 миллиметров. Получаемые частицы при помещении их в водную среду образуют суспензию геля. В одном варианте осуществления, гель расфасовывают в шприц, подходящий для использования с иглой с размером 18-21, в результате чего гидрогель может быть инъецирован во внутрисуставное пространство. Обычно, объем композиции гидрогеля, инъецируемый во внутрисуставное пространство субъекта, составляет приблизительно от 0,5 до приблизительно 8 мл, предпочтительно, приблизительно от 3 до 6 мл, или даже приблизительно 4-6 мл.
Как показано в сопровождающих Примерах, гидрогели могут быть получены в виде стерильных композиций.
Описанные выше и в Примерах гидрогели могут быть предложены в герметичном контейнере, таком как шприц (который может быть закрыт, необязательно с помощью колпачка с отверстием). Шприц может затем быть помещен в упаковку, такую как пакет из фольги, которую затем герметизируют. Пакет может быть герметизирован под вакуумом, герметизирован в атмосфере инертного газа, такого как азот или аргон, или герметизирован после одного или более циклов вакуумирование/заполнение газом, где газом для заполнения является инертный газ, такой как азот или аргон. В случае пакета, герметизированного с помощью одного или более циклов вакуумирование/заполнение газом, цикл может быть скорректирован так, чтобы пакет в итоге был герметизирован либо под вакуумом, либо с помощью инертного газа. Пакет может необязательно содержать поглотитель влаги и/или поглотитель кислорода.
Применения
Описываемые в изобретении композиции геля обладают преимуществом вследствие пониженных нежелательных побочных воздействий на хрящ по сравнению с производимыми промышленностью вязкоупругими добавками и, в вариантах осуществления, в которых гидрогель дополнительно включает биоактивный агент, характеризуются пониженными нежелательными побочными воздействиями на хрящ по сравнению с введением эквивалентного количества активного агента без его включения в гидрогель. Предлагаемые изобретением композиции геля характеризуются, наряду с другими положительными признаками, исключительно низкими провоспалительными свойствами, проиллюстрированными в Примере 17 и на Фигурах 4-8.
Описываемые в изобретении полимерные композиции гиалуроновой кислоты могут быть использованы в инъецируемых или имплантируемых лекарственных формах, для применения, например, при эмбриональном развитии, формировании ткани, заживлении ран, ангиогенезе и онкогенезе. Смотрите, D.D. Allison and K.J. Grande-Allen, Tissue Engineering, Vol. 12, Number 8, 2131-2140 (2006), G.D. Prestwich et al, Tissue Engineering, Vol. 12, Number 8, 2171-2180 (2006), G.D. Prestwich et al, Tissue Engineering, Vol. 12, Number 12, 3405-3416 (2006). Композиции гидрогеля, включающие кортикостероид, такой как ацетонид триамцинолона, применяют для облегчения испытываемой субъектом боли. Инъекция терапевтически эффективного количества композиции гидрогеля во внутрисуставное пространство сустава может обеспечивать, например, длительное облегчение испытываемой субъектом боли в суставе. Идеально, если после инъекции субъект с самого начала испытывает в заметной степени облегчение боли в интервале от одного часа до одной недели, или более предпочтительно, приблизительно от одного часа до приблизительно одного дня после инъекции. Обычно, инъекция гидрогеля приводит к определенной степени облегчения боли в течение периода приблизительно от трех до девяти месяцев после инъекции. В зависимости от конкретного субъекта и подвергаемого лечению состояния, объем терапевтически эффективной дозы гидрогеля обычно составляет приблизительно от 0,5 мл до 20 мл, при этом примеры объемов включают 1 мл, 2 мл, 3 мл, 4 мл, 5 мл, 6 мл и 7 мл.
Например, предлагаемые изобретением композиции гидрогеля, необязательно содержащие один или более биоактивных агентов, могут быть использованы в качестве адгезионных композиций, например, в качестве тканевых клеев и уплотнителей, которые могут быть использованы в различных случаях применения, включая предотвращение кровотечения, закрытие открытых ран, и другие биомедицинские области применения. Эти композиции могут быть использованы, например, при сшивании хирургически рассеченных или разорванных в результате травмы тканей, для остановки кровотечения, такого как кровотечение из ран, для предотвращения рестеноза или коагуляции крови, для доставки лекарственного средства; для устранения ямок на коже, и для способствования заживлению и восстановлению живой ткани. Предлагаемая изобретением композиция полимера на основе гиалуроновой кислоты может быть использована для добавления или индуцирования и регенерации поврежденных органов или тканей у млекопитающего, такого как человек. Композиция после внедрения или включения субъекту разлагается или рассасывается, или, в качестве варианта, остается в организме субъекта (например, млекопитающего) без негативных для него воздействий.
Испытуемые композиции могут быть использованы в качестве тканевых наполнителей, кожных наполнителей, средств для увеличения объема и инвагинационных средств, а также в качестве средств для устранения дефектов/травм хряща и средств активизации восстановления и/или роста кости.
Испытуемые композиции могут также быть использованы при лечении остеоартрита или ревматоидного артрита, или для других воспалительных артритов, таких как падагра или болезнь отложения кристаллов пирофосфата кальция (например, путем инъекции в внутрисуставное пространство сустава), или для уменьшения или предотвращения спаек, которые могут образовываться после хиругической операции. Было обнаружено, что испытуемые композиции можно применять для уменьшения повреждения хряща при инъекции кортикостероида в результате включения кортикостероида в предлагаемый изобретением материал гидрогеля.
В качестве одного конкретного метода оценки вышеизложенных положительных эффектов для случая, когда гидрогель содержит заключенный в нем кортикостероид и способ позволяет снижать повреждение хряща по сравнению с повреждением хряща при введении эквивалентного количества кортикостероида без его включения в гидрогель, такое уменьшенное повреждение хряща характеризуют с помощью суммы баллов по системе оценки Мэнкина через 28 дней после инъекции в сустав в экспериментальной модели на козах. Смотрите Пример 34 для описания определения суммы баллов по системе оценки Мэнкина. Кроме того, могут быть использованы дополнительные показатели для оценки уменьшения повреждения хряща; такие параметры и соответствующие данные также приведены в Примере 34.
Некоторые преимущества, связанные с захватом/заключением частиц стероида внутри предлагаемого изобретением гидрогеля, включают одно или более из следующих. Например, захват частиц стероидов внутри гидрогелей настоящего изобретения позволяет предотвратить непосредственный контакт большей части частиц стероида с тканями сустава. Более того, захват частиц стероидов внутри гидрогелей настоящего изобретения позволяет максимизировать локальную концентрацию стероида в суставе, и в тоже время минимизировать его системную концентрацию. Кроме того, захват частиц стероидов в лекарственных формах гидрогелей настоящего изобретения позволяет предотвратить преждевременный уход частиц стероида из сустава. И наконец, в результате захвата стероида внутри гидрогеля, терапевтическая эффективность стероида достигается при более низкой суммарной дозе, чем в случае без захвата стероида внутри гидрогеля, вследствие чего минимизируются нежелательные местные и системные побочные эффекты. Смотрите, например, Примеры 14-16 вместе с Фигурами 2, 3 и 4, демонстрирующие линейную зависимость высвобождения лекарственного средства из примера композиции гидрогеля при контролируемом и замедленном режиме высвобождения в течение времени.
В случае композиций на основе гидрогелей, включающих биоактивный агент, такие композиции могут быть использованы в качестве систем доставки лекарственного средства для лечения наряду с другими таких состояний, как остеоартрит, синусит, аллергический ринит и хронический риносинусит. Такие композиции могут также быть использованы в качестве наполнителей для кожи, средств устранения дефектов/повреждений хряща и средств для ускорения восстановления и/или роста кости.
Далее настоящая заявка на изобретение описывается вместе с конкретными вариантами осуществления, которые, как предполагается, не ограничивают объем изобретения. И даже напротив, настоящая заявка на изобретение охватывает все альтернативные варианты, модификации и эквиваленты, включаемые в объем пунктов формулы изобретения. Таким образом, с целью иллюстрации конкретных вариантов осуществления и для облегчения понимания методик и концептуальных аспектов изобретения, далее будет описано осуществление настоящего изобретения.
ПРИМЕРЫ
Следующие примеры приводятся для того, чтобы представить обычным специалистам в этой области полное раскрытие и описание того, как предлагаемые изобретением соединения, композиции и способы получают, осуществляют и оценивают, и предполагается, что эти примеры являются только иллюстрациями. Следовательно, примеры ни в коей мере не ограничивают объем изобретения. Существуют многочисленные варианты и комбинации реакционных условий, например, концентраций компонентов, подходящих растворителей, смесей растворителей, температур, давлений и других реакционных параметров и условий, которые могут быть использованы для оптимизации характеристик продукта, таких как чистота, выход и другие подобные параметры. Считается, что они также входят в объем настоящего изобретения.
ПРИМЕР 1
СИНТЕЗ ДЕРИВАТИЗИРОВАННОЙ ВИНИЛСУЛЬФОНОМ ГИАЛУРОНОВОЙ КИСЛОТЫ (ГК-ВС) - НИЗКАЯ СТЕПЕНЬ МОДИФИКАЦИИ
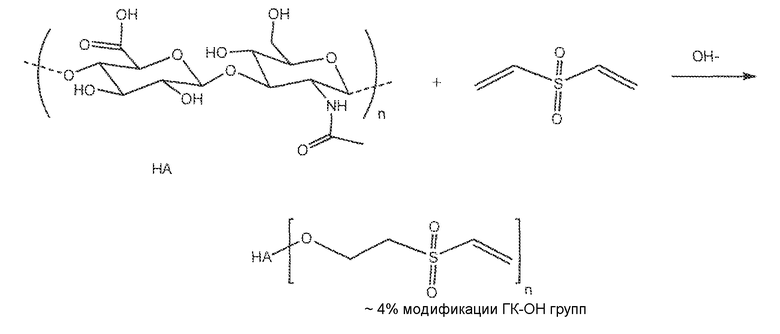
В круглодонную колбу объемом 1 л загружали 5 г гиалуроновой кислоты (ГК) [9,4×104 спз (3% в воде)]. Добавляли к ГК 500 мл стерильной отфильтрованной воды. Колбу устанавливали в роторный испаритель, скорость вращения которого поддерживали в интервале 20-100 об/мин. Колбу с раствором вращали до тех пор, пока не растворялась вся ГК (приблизительно 16-18 часов). Затем раствор НА (10 мг/мл) переносили в стеклянный лабораторный стакан объемом 1 л. Помещали в раствор мешалку, которая была соединена вверху с приводом устройства для перемешивания, и устанавливали скорость перемешивания, которая обеспечивала интенсивное перемешивание раствора. Добавляли к перемешиваемому ГК раствору 333 мл 0,25N раствора NaOH (83,2 мл 1N NaOH, добавленные к 249,8 мл деионизированной воды). Через приблизительно 1 минуту, к перемешиваемому раствору быстро добавляли 150 мл раствора дивинилсульфона (18 мл дивинилсульфона, растворенного в 132 мл деионизированной воды). Через 15 секунд (от момента завершения добавления раствора дивинилсульфона), корректировали величину pH раствора в интервале от 5 до 6 путем быстрого добавления приблизительно 14 мл 6N HCl. Затем реакционный раствор подвергали диализу с использованием проточной фильтрации вдоль потока (система Spectra/Por™, картридж P/N M6-100S-301-01P). Суммарный объем был в 11 раз больше объема исходного раствора. После завершения стадии очистки, раствор концентрировали до содержания приблизительно 14-20 мг/мл. Функционализированную винилсульфоном ГК (ГК-ВС) удаляли из системы с помощью фильтрации вдоль потока и помещали в пластиковый контейнер, который затем закрывали c помощью навинчивающейся сверху крышки. Отбирали образец ГК-ВС, замораживали при -80°C и затем лиофилизировали. Высушенный образец отправляли на анализ с помощью 1H-ЯМР.
Определение процента замещения винилсульфоном для ГК-ВС
Приблизительно 15-17 мг высушенного образца загружали в тарированную пробирку объемом 2 мл. Образец ресуспендировали в 1,5 мл D2O. Образец переносили в ампулу для ЯМР-спектроскопии. Снимали 1H-ЯМР спектр (256 сканов) образца и распечатывали его со специфическими пиками в областях при 6,3-6,5 ppm (2 пика от 2 CH2=протоны от винилсульфонового остатка) и 1,5-2,5 ppm (синглет от 3 CH3-протонов от N-ацетильной группы ГК), которые интегрировали. Процент модификации вычисляли следующим образом:
% модификация = 150×(интеграл пиков винилсульфона)/(интеграл пика ацетамида).
1H-ЯМР спектр (ФИГ. 1) показал, что ГК имела степень замещения винилсульфоном приблизительно 4%, исходя из интегрирования пиков винилсульфона относительно метильной группы ацетамида гиалуроновой кислоты.
Образец ГК-ВС использовали для определения массы в сухом состоянии, которую использовали для определения конкретной концентрации ГК-ВС раствора. Концентрация ГК-ВС составляла 18 мг/мл.
ПРИМЕР 2
СИНТЕЗ ГЕЛЯ, ПРИГОТАВЛИВАЕМОГО ИЗ МОДИФИЦИРОВАННОЙ ВИНИЛСУЛЬФОНОМ ГИАЛУРОНОВОЙ КИСЛОТЫ (ГК-ВС) И ПЭГ3400-ДИТИОЛА
Раствор ГК-ВС, приготовленный как описано в Примере 1, разбавляли с помощью деионизированной воды до концентрации 14 мг/мл. Помещали 11 мл раствора ГК-ВС в стерильный шприц объемом 20 мл. Раствор ГК-ВС фильтровали через шприцевой фильтр с размером пор 0,2 мкм в стерильную центрифужную пробирку объемом 50 мл. Приготавливали раствор 50 мг/мл ПЭГ-(SH)2 [фирмы Laysan Bio Inc, позиция в каталоге # SH-PEG-SH-3400-1g] путем растворения 40,1 мг ПЭГ-(SH)2 в 0,802 мл деионизированной воды. Раствор ПЭГ-(SH)2 переносили в стерильный шприц объемом 1 мл и фильтровали через шприцевой фильтр с размером пор 0,2 мкм. Переносили 10 мл стерильной отфильтрованной ГК-ВС в стерильную центрифужную пробирку объемом 50 мл. Добавляли к раствору ГК-ВС 250 мкл 0,5M раствора фосфата натрия (отфильтрованного через шприцевой фильтр с размером пор 0,2 мкм). Полученный раствор тщательно перемешивали. К раствору ГК-ВС добавляли 380 мкл [19 мг ПЭГ-(SH)2] стерильного 50 мг/мл раствора ПЭГ-(SH)2. Полученный раствор тщательно перемешивали. Для обеспечения стерильности, приведенные выше стадии осуществляли в боксе для проведения биологических исследований. Затем раствор ГК-ВС/ПЭГ-(SH)2 помещали в термостат с температурой 37°C, по меньшей мере, на 16 часов для активизации образования геля. По меньшей мере, через 16 часов, раствор ГК-ВС/ПЭГ-(SH)2 сшивался с образованием геля. Затем гелеобразный материал извлекали из термостата.
ПРИМЕР 3
ПРИГОТОВЛЕНИЕ СУСПЕНЗИИ ГЕЛЯ ГК-ВС/ПЭГ-(SH)2 - ОДНОКРАТНАЯ ЭКСТРУЗИЯ
Гель ГК-ВС/ПЭГ-(SH)2 из Примера 2 измельчали механически на кусочки с помощью стеклянной палочки. Переносили гель в стерильный шприц объемом 60 мл, который закрывали с помощью колпачка. К гелю добавляли 40 мл 0,9% стерильного раствора NaCl. Вставляли поршень в цилиндр шприца, и шприц переворачивали. Снимали со шприца колпачок для сбрасывания избыточного давления, и затем колпачок надевали. Шприц переворачивали несколько раз для обеспечения хорошего перемешивания физиологического раствора и кусочков геля. Проводили набухание геля в течение ночи (по меньшей мере, в течение 16 часов).
С помощью пробойника для кожи диаметром 23 мм вырубали из полиэфирной сетки (фирмы McMaster Carr, # по каталогу 9218T13, размер отверстий: 20,3×20,3, размер квадратов/прямоугольников: 0,0331", номинальное значение в микронах: 840 микрон, доля живого сечения: 46, диаметр нити: 0,0157") диск диаметром 23 мм. Диск вставляли в держатель шприцевого фильтра диаметром 25 мм (фирмы Cole Palmer, # по каталогу EW-29550-42), и держатель фильтра закрывали. Держатель фильтра, который содержал сетку, стерилизовали в автоклаве. Со шприца удаляли колпачок, и шприцевой фильтр, содержащий сетку, соединяли со шприцом. Гель экструдировали через сетку в стерильную центрифужную пробирку объемом 50 мл. Центрифужную пробирку закрывали с помощью навинчивающейся сверху крышки. Получаемым продуктом являлась слегка вязкая суспензия частиц, из которой частицы практически не осаждались, и обычно оставались в суспендированном виде. Приведенные выше стадии осуществляли в боксе для проведения биологических исследований.
ПРИМЕР 4
ПРИГОТОВЛЕНИЕ СУСПЕНЗИИ ГЕЛЯ ГК-ВС/ПЭГ-(SH)2 - ДВУКРАТНАЯ ЭКСТРУЗИЯ
Гель ГК-ВС/ПЭГ-(SH)2 из Примера 2 измельчали механически на кусочки с помощью стеклянной палочки. Гель переносили в стерильный шприц объемом 60 мл, который закрывали с помощью колпачка. К гелю добавляли 40 мл 0,9% стерильного раствора NaCl. Вставляли поршень в цилиндр шприца, и шприц переворачивали. Снимали со шприца колпачок для сбрасывания избыточного давления, и затем колпачок надевали. Шприц переворачивали несколько раз для обеспечения хорошего перемешивания физиологического раствора и кусочков геля. Проводили набухание геля в течение ночи (по меньшей мере, в течение 16 часов).
С помощью пробойника для кожи диаметром 23 мм вырубали из полиэфирной сетки (фирмы McMaster Carr, # по каталогу 9218T13, размер отверстий: 20,3×20,3, размер квадратов/прямоугольников: 0,0331", номинальное значение в микронах: 840 микрон, доля живого сечения: 46, диаметр нити: 0,0157") диск диаметром 23 мм. Диск вставляли в держатель шприцевого фильтра диаметром 25 мм (фирмы Cole Palmer, # по каталогу EW-29550-42), и держатель фильтра закрывали. Держатель фильтра, который содержал сетку, стерилизовали в автоклаве. Со шприца удаляли колпачок, и шприцевой фильтр, содержащий сетку, соединяли со шприцом. Гель экструдировали через сетку в стерильную центрифужную пробирку объемом 50 мл. Экструдированный гель затем помещали в стерильный шприц объемом 60 мл, и шприц соединяли со шприцевым фильтром, который содержал сетку. Гель экструдировали через сетку в стерильную центрифужную пробирку объемом 50 мл. Центрифужную пробирку закрывали с помощью навинчивающейся сверху крышки. Приведенные выше стадии осуществляли в боксе для проведения биологических исследований.
ПРИМЕР 5
ПРИГОТОВЛЕНИЕ ШПРИЦОВ, ЗАГРУЖЕННЫХ СУСПЕНЗИЕЙ ГЕЛЯ ГК-ВС/ПЭГ-(SH)2
В стерильный стеклянный шприц (B&D) объемом 10 мл, на который был надет колпачок, переносили 5 мл приготовленной суспензии геля ГК-ВС/ПЭГ-(SH)2 (из Примера 3 или Примера 4). В верхнюю часть шприца вставляли стерильную пробку. Стержень поршня вкручивали в пробку. Шприц переворачивали, и как только суспензия геля достигала пробки, колпачок шприца слегка ослабляли и нажимали на поршень до тех пор, пока из шприца не удалялась большая часть воздуха. На шприц одевали колпачок. Приведенные выше стадии осуществляли в боксе для проведения биологических исследований.
ПРИМЕР 6
СИНТЕЗ ДЕРИВАТИЗИРОВАННОЙ ВИНИЛСУЛЬФОНОМ ГИАЛУРОНОВОЙ КИСЛОТЫ
Приготавливали композиции ГК-ВС, имеющие различные степени замещения, с помощью метода, описанного в Примере 1, за исключением того, что увеличивали время проведения реакции. В результате увеличения времени реакции, получали более высокую степень винилсульфонового замещения. Результаты этих реакций приведены в таблице ниже:
ПРИМЕР 7
СИНТЕЗ ГЕЛЯ ГК-ВС/ПЭГ-(SH)2
Образцы ГК-ВС, имеющие различные степени винилсульфонового замещения (Пример 6) использовали для приготовления гелей ГК-ВС/ПЭГ-(SH)2 с помощью метода и при соотношениях реагентов, описанных в Примере 2. Каждый из исходных материалов образовывал гель при реакции с ПЭГ-дитиолом.
ПРИМЕР 8
ПРИГОТОВЛЕНИЕ СУСПЕНЗИИ ГЕЛЯ ГК-ВС/ПЭГ-(SH)2 С ГИАЛУРОНОВОЙ КИСЛОТОЙ
В круглодонную колбу объемом 250 мл загружали 2 г гиалуроновой кислоты [9,4×104 спз (3% в воде)]. Добавляли к гиалуроновой кислоте в колбе 100 мл стерильного физиологического раствора. Колбу устанавливали в роторный испаритель (Buchi) и вращали при скорости 50 об/мин, по меньшей мере, в течение 16 часов с получением 2% раствора гиалуроновой кислоты. Последующий ряд стадий проводили в боксе для проведения биологических исследований. Раствор гиалуроновой кислоты фильтровали через стерильный фильтр с размером пор 0,2 мкм. Используя суспензию геля ГК-ВС/ПЭГ-(SH)2 (приготовленную в Примере 3 или 4), приготавливали ряд композиций, для которых приготовленную суспензия геля ГК-ВС/ПЭГ-(SH)2 смешивали с гиалуроновой кислотой. Объемы раствора гиалуроновой кислоты и суспензии геля ГК-ВС/ПЭГ(SH)2, используемые для приготовления композиций, приведены в таблице ниже:
Указанные объемы раствора гиалуроновой кислоты и суспензии геля ГК-ВС/ПЭГ-(SH)2, приведенные в таблице выше, добавляли в стерильную центрифужную пробирку объемом 15 мл. Пробирку закрывали крышкой, и пробирку переворачивали то вверх, то вниз, до тех пор, пока хорошо не перемешивались компоненты. Каждую композицию затем переносили в стеклянный шприц объемом 10 мл, который имел колпачок, после чего вставляли поршень и удаляли избыток воздуха. Затем на шприц надевали колпачок.
ПРИМЕР 9
СИНТЕЗ ГЕЛЯ ГК-ВС-ПЭГ-(SH)2, СОДЕРЖАЩЕГО АЦЕТОНИД ТРИАМЦИНОЛОНА
Раствор ГК-ВС, приготовленный как описано в Примере 1, разбавляли с помощью деионизированной воды до концентрации 14 мг/мл. Помещали 11 мл раствора ГК-ВС в стерильный шприц объемом 20 мл. Раствор ГК-ВС фильтровали через шприцевой фильтр с размером пор 0,2 мкм в стерильную центрифужную пробирку объемом 50 мл. Приготавливали раствор 50 мг/мл ПЭГ-(SH)2 путем растворения 40,1 мг ПЭГ3400-(SH)2 в 0,802 мл деионизированной воды. Раствор ПЭГ-(SH)2 переносили в стерильный шприц объемом 1 мл и фильтровали через стерильный шприцевой фильтр с размером пор 0,2 мкм. Переносили 10 мл стерильной отфильтрованной ГК-ВС в стерильную центрифужную пробирку объемом 50 мл. Добавляли к раствору ГК-ВС 100 мг ацетонида триамцинолона (фирмы Spectrum Chemicals, фармакопейной чистоты, тонко измельченный). Закрывали центрифужную пробирку крышкой, и раствор переворачивали то ваверх, то вниз, до тех пор, пока ацетонид триамцинолона не был гомогенно смешан с ГК-ВС. Добавляли к раствору ГК-ВС 250 мкл 0,5M раствора фосфата натрия (отфильтрованного через шприцевой фильтр с размером пор 0,2 мкм). Полученный раствор тщательно перемешивали. К раствору ГК-ВС добавляли 380 мкл стерильного 50 мг/мл раствора ПЭГ-(SH)2. Полученный раствор тщательно перемешивали. Приведенные выше стадии осуществляли в боксе для проведения биологических исследований. Затем раствор ГК-ВС/ПЭГ-(SH)2 помещали в термостат с температурой 37°C, по меньшей мере, на 16 часов для активизации образования геля. На этой стадии, раствор ГК-ВС/ПЭГ(SH)2 сшивался с образованием геля. Затем гелеобразный материал извлекали из термостата. Полученный гель содержит приблизительно 0,2% ацетонида триамцинолона.
Приведенная выше методика была проведена таким же образом, как выше, за исключением того, что к раствору ГК-ВС добавляли 20 мг ацетонида триамцинолона (фирмы Spectrum Chemicals, фармакопейной чистоты, тонко измельченный).
ПРИМЕР 10
ПРИГОТОВЛЕНИЕ СУСПЕНЗИИ ГЕЛЯ ГК-ВС-ПЭГ-(SH)2, СОДЕРЖАЩЕЙ АЦЕТОНИД ТРИАМЦИНОЛОНА: ОДНОКРАТНАЯ ЭКСТРУЗИЯ
Содержащий ацетонид триамцинолона гель ГК-ВС/ПЭГ-(SH)2 (Пример 9) измельчали механически на кусочки с помощью стеклянной палочки. Переносили гель в стерильный шприц объемом 60 мл, который закрывали с помощью колпачка. К гелю добавляли 40 мл 0,9% стерильного раствора NaCl. Вставляли поршень в цилиндр шприца, и шприц переворачивали. Снимали со шприца колпачок для сбрасывания избыточного давления, и затем колпачок надевали. Шприц переворачивали несколько раз для обеспечения хорошего перемешивания физиологического раствора и кусочков геля. Проводили набухание геля в течение ночи (по меньшей мере, в течение 16 часов).
С помощью пробойника для кожи диаметром 23 мм вырубали из полиэфирной сетки (фирмы McMaster Carr, # по каталогу 9218T13, размер отверстий: 20,3×20,3, размер квадратов/прямоугольников: 0,0331", номинальное значение в микронах: 840 микрон, доля живого сечения: 46, диаметр нити: 0,0157") диск диаметром 23 мм. Диск вставляли в держатель шприцевого фильтра диаметром 25 мм (фирмы Cole Palmer, # по каталогу EW-29550-42), и держатель фильтра закрывали. Держатель фильтра, который содержал сетку, стерилизовали в автоклаве. Со шприца удаляли колпачок, и шприцевой фильтр, содержащий сетку, соединяли со шприцом. Гель экструдировали через сетку в стерильную центрифужную пробирку объемом 50 мл. Центрифужную пробирку закрывали с помощью навинчивающейся сверху крышки. Приведенные выше стадии осуществляли в боксе для проведения биологических исследований.
ПРИМЕР 11
ПРИГОТОВЛЕНИЕ СУСПЕНЗИИ ГЕЛЯ ГК-ВС-ПЭГ-(SH)2, СОДЕРЖАЩЕЙ АЦЕТОНИД ТРИАМЦИНОЛОНА: ДВУКРАТНАЯ ЭКСТРУЗИЯ
Содержащий ацетонид триамцинолона гель ГК-ВС/ПЭГ-(SH)2 (Пример 9) измельчали механически на кусочки с помощью стеклянной палочки. Гель переносили в стерильный шприц объемом 60 мл, который закрывали с помощью колпачка. К гелю добавляли 40 мл 0,9% стерильного раствора NaCl. Вставляли поршень в цилиндр шприца, и шприц переворачивали. Снимали со шприца колпачок для сбрасывания избыточного давления, и затем колпачок надевали. Шприц переворачивали несколько раз для обеспечения хорошего перемешивания физиологического раствора и кусочков геля. Проводили набухание геля в течение ночи (по меньшей мере, в течение 16 часов).
С помощью пробойника для кожи диаметром 23 мм вырубали из полиэфирной сетки (фирмы McMaster Carr, # по каталогу 9218T13, размер отверстий: 20,3×20,3, размер квадратов/прямоугольников: 0,0331", номинальное значение в микронах: 840 микрон, доля живого сечения: 46, диаметр нити: 0,0157") диск диаметром 23 мм. Диск вставляли в держатель шприцевого фильтра диаметром 25 мм (фирмы Cole Palmer, # по каталогу EW-29550-42), и держатель фильтра закрывали. Держатель фильтра, который содержал сетку, стерилизовали в автоклаве. Со шприца удаляли колпачок, и шприцевой фильтр, содержащий сетку, соединяли со шприцом. Гель экструдировали через сетку в стерильную центрифужную пробирку объемом 50 мл. Экструдированный гель затем помещали в стерильный шприц объемом 60 мл, и шприц соединяли со шприцевым фильтром, который содержал сетку. Гель экструдировали через сетку в стерильную центрифужную пробирку объемом 50 мл. Центрифужную пробирку закрывали с помощью навинчивающейся сверху крышки. Приведенные выше стадии осуществляли в боксе для проведения биологических исследований.
ПРИМЕР 12
ПРИГОТОВЛЕНИЕ ШПРИЦОВ С СУСПЕНЗИЕЙ ГЕЛЯ, СОДЕРЖАЩЕЙ АЦЕТОНИД ТРИАМЦИНОЛОНА
В стерильный стеклянный шприц (B&D) объемом 10 мл, на который был надет колпачок, переносили 5 мл приготовленной суспензии геля ГК-ВС/ПЭГ-(SH)2, содержащей ацетонид триамцинолона (Пример 10 или Пример 11). В верхнюю часть шприца вставляли стерильную пробку. Стержень поршня вкручивали в пробку. Шприц переворачивали, и как только суспензия геля достигала пробки, колпачок шприца слегка ослабляли и нажимали на поршень до тех пор, пока из шприца не удалялась большая часть воздуха. На шприц плотно надевали колпачок. Приведенные выше стадии осуществляли в боксе для проведения биологических исследований.
ПРИМЕР 13
ПРИГОТОВЛЕНИЕ СУСПЕНЗИИ ГЕЛЯ ГК-ВС/ПЭГ-(SH)2, СОДЕРЖАЩЕГО АЦЕТОНИД ТРИАМЦИНОЛОНА, С ГИАЛУРОНОВОЙ КИСЛОТОЙ
В круглодонную колбу объемом 250 мл загружали 2 г гиалуроновой кислоты [9,4×104 спз (3% в воде)]. Добавляли к гиалуроновой кислоте в колбе 100 мл стерильного физиологического раствора. Колбу устанавливали в роторный испаритель (Buchi) и вращали при скорости 50 об/мин, по меньшей мере, в течение 16 часов с получением 2% раствора гиалуроновой кислоты. Используя суспензию геля ГК-ВС/ПЭГ-(SH)2, содержащего ацетонид триамцинолона (полученного в Примере 10 или 11), приготавливали ряд композиций, для которых суспензию геля ГК-ВС/ПЭГ-(SH)2, содержавшего ацетонид триамцинолона, смешивали с гиалуроновой кислотой. Объемы раствора гиалуроновой кислоты и суспензии геля ГК-ВС/ПЭГ(SH)2, содержащего ацетонид триамцинолона, используемые для приготовления композиций, приведены в таблице ниже:
Указанные объемы раствора гиалуроновой кислоты и суспензии геля ГК-ВС/ПЭГ-(SH)2, содержащего ацетонид триамцинолона, приведенные в таблице выше, добавляли в стерильную центрифужную пробирку объемом 15 мл. Пробирку закрывали крышкой, и пробирку переворачивали то вверх, то вниз, до тех пор, пока хорошо не перемешивались компоненты. Каждую композицию затем переносили в стеклянный шприц объемом 10 мл, который имел колпачок, после чего вставляли поршень и удаляли избыток воздуха. Затем на шприц надевали колпачок. Приведенные выше стадии осуществляли в боксе для проведения биологических исследований.
ПРИМЕР 14
ПРИГОТОВЛЕНИЕ ОБРАЗЦОВ ДЛЯ ИССЛЕДОВАНИЯ ВЫСВОБОЖДЕНИЯ АЦЕТОНИДА ТРИАМЦИНОЛОНА
Переносили 1,5 мл содержащего ацетонид триамцинолона геля ГК-ВС/ПЭГ-(SH)2 (приготовленного согласно Примеру 11) в стеклянный сцинтилляционный флакон емкостью 20 мл. Добавляли с помощью пипетки в сцинтилляционный флакон, содержащий гелеобразный материал, 15 мл PBS (pH 7,4). Сцинтилляционный флакон закрывали завинчивающейся крышкой, и флакон помещали на виброшейкере (фирмы Barnstead International, Model M26125) в термостат с температурой 37°C.
ПРИМЕР 15
ОТБОР ОБРАЗЦОВ БУФЕРА ПРИ ИССЛЕДОВАНИИ ВЫСВОБОЖДЕНИЯ АЦЕТОНИДА ТРИАМЦИНОЛОНА
Сцинтилляционный флакон, который содержал гель с заключенным в нем ацетонидом триамцинолона и PBS буфер (описанный в Примере 14), извлекали из термостата с температурой 37°C в различные моменты времени. Оставшейся суспензии геля давали возможность осесть на дно сцинтилляционного флакона. Завинчивающуюся крышку удаляли и отбирали с помощью серологической пипетки 13 мл PBS буфера и переносили в пластиковую центрифужную пробирку объемом 50 мл. Затем добавляли с помощью пипетки 13 мл свежего PBS буфера (pH 7,4) в сцинтилляционный флакон, содержащий гель.
ПРИМЕР 16
АНАЛИЗ СРЕДЫ, В КОТОРУЮ ВЫДЕЛЯЛСЯ АЦЕТОНИД ТРИАМЦИНОЛОНА, МЕТОДОМ ВЫСОКОЭФФЕКТИВНОЙ ЖИДКОСТНОЙ ХРОМАТОГРАФИИ
13 мл образца буфера (Пример 15) разбавляли до 40 мл с помощью смеси MeOH:H2O=80:20. Образец стряхивали, и приблизительно 1 мл переносили во флакон для ВЭЖХ. Содержание ацетонида триамцинолона в образце буфера определяли при следующих хроматографических условиях:
Установка ВЭЖХ: Agilent 1100 series
Колонка: Zorbax SB-C18, 5 микрон, 4,6×160 мм
Температура колонки: 30°C
Расход: 1,0 мл/мин
Детектирование: УФ при 239 нм
Время выполнения: 8 минут
Объем вводимой пробы: 50 мкл
Подвижная фаза: 0,05%TFA в ACN: 0,05%TFA в H2O, 56:44
Время удерживания ацетонида триамцинолона: ~3,3 минуты
Количество ацетонида триамцинолона в образцах буфера определяли путем сопоставления площади пика концентрации ацетонида триамцинолона с калибровочной кривой. Образцы для калибровочных кривых ацетонида триамцинолона получали путем приготовления исходного раствора ацетонида триамцинолона в метаноле и затем последовательного разбавления исходного раствора с помощью смеси 0,05% TFA в ACN: 0,05% TFA в H2O, 56:44. Эти образцы анализировали при указанных выше хроматографических условиях, и полученную площадь пика наносили на графическую зависимость от концентрации ацетонида триамцинолона. Процент высвобождения ацетонида триамцинолона приведен на ФИГ. 2, суммарная масса высвобожденного ацетонида триамцинолона приведена на ФИГ. 3, и количество высвобождаемого ацетонида триамцинолона на момент отбора образца приведено на ФИГ. 4.
Образцы отбирали через каждые 24 часа с понедельника по пятницу; в субботу и воскресенье отбор образцов не производился.
Как показано на Фиг. 2, практически все лекарственное средство высвобождалось к моменту времени отбора образцов 12. Высвобождение лекарственного средства происходило по линейной зависимости во времени, и его можно было регулировать. Предпочтительно, что происходило практически полное высвобождение лекарственного средства, а не наоборот, когда значительное количество лекарственного средства могло бы оставаться захваченным внутри геля. Кроме того, вместо изначального мгновенного высвобождения лекарственного средства, лекарственное средство высвобождалось в течение времени в медленном и стабильном режиме. На Фиг. 3 подобным образом показано кумулятивное высвобождение лекарственного средства, в миллиграммах, в зависимости от момента времени отбора образца. Как показано на Фиг. 4, количество лекарственного средства, высвобождаемое из геля, было практически постоянным между моментами времени отбора образцов, что указывает на линейную зависимость высвобождения лекарственного средства в регулируемом и стабильном режиме во времени.
ПРИМЕР 17
ВНУТРИСУСТАВНАЯ ИНЪЕКЦИЯ ПРИМЕРА СУСПЕНЗИИ ГЕЛЯ ГК-ВС/ПЭГ-(SH)2
Образец суспензии геля ГК-ВС/ПЭГ-(SH)2 (приготовленный как в Примере 5) инъецировали внутрисуставно в коленную чашечку (колено) коз со сформировавшимся скелетом вместе с дополнительными испытуемыми материалами 2-4, которые использовали для сравнения. Смотрите также публикацию D. Jackson and T. Simon, Osteoarthritis and Cartilage, Vol. 14, Issue 12, p. 1248-125, в которой приведена дополнительная информация по используемой экспериментальной модели на козах.
ИСПЫТУЕМЫЙ МАТЕРИАЛ 1: гель ГК-ВС/ПЭГ-(SH)2 (Пример 5)
ИСПЫТУЕМЫЙ МАТЕРИАЛ 2: диакрилат ПЭГ, сшитый с помощью бистиольного сшивающего реагента
ИСПЫТУЕМЫЙ МАТЕРИАЛ 3: 4-звенный функционализированный с помощью лизина ПЭГ, который был подвергнут сшиванию с образованием геля
ИСПЫТУЕМЫЙ МАТЕРИАЛ 4: гель, полученный из диакрилата ПЭГ (материал был подвергнут обработке в автоклаве)
Смотрите Примеры 31-33 для приготовления Испытуемых материалов 2-4. Все инъекции проводили в условиях строгой стерильности. Всех животных анестезировали путем внутривенной инъекции диазепама (0,1-0,5 мг/кг) и кетамина (4,4-7,5 мг/кг). Каждое колено было физически обследовано на выбивание, амплитуду движения, припухлость, температуру, крепитацию, на траекторию движения коленной чашечки, и вальгусные/варусные нарушения.
Все инъекции проводили с использованием обычных асептических методов. Левое и правое колено подготавливали для инъекции путем выстригания шерсти в соответствующих областях и затем дезинфицирования их с помощью тщательной обработки хлоргексидином. Животного переводили в положение лежа на спине. Правое колено дезинфицировали три раза путем тщательной обработки хлоргексидином, чередующейся с обработкой с помощью 70% изопропилового спирта, и окрашивали раствором йода.
Для инъекции в каждый коленный сустав использовали стандартную методику. Стерильную иглу 21 размера длиной 2 дюйма вводили во внутрисуставное пространство через переднемедиальный доступ. Вводили иглу до касания с боковой стенкой межмыщелковой вырезки медиального бедренного мыщелка и слегка отводили ее назад. Инъецировали в правый сустав 1,5 мл суспензия геля ГК-ВС/ПЭГ(SH)2. Инъекционную иглу удаляли, и поддерживали повышенное давление в месте инъекции. Инъецированный коленный сустав затем 20 раз подвергали полному циклу на "сгибание - разгибание".
После инъекции был проведена проверка тех животных, которые проявляли признаки недомогания и дискомфорта, и в случае необходимости, им вводили дополнительное количество анальгетика. Все методы обработки регистрировали в соответствующей документации по исследованию.
Инъецируемые животные были гуманно умерщвлены через 24±1 часов после начала инъекции путем внутривенного введения диазепама 0,22 мг/кг и кетамина 10 мг/кг для достижения состояния общей анестезии. Затем анестезированным животным вводили внутрижелудочно летальную дозу концентрированного раствора хлорида калия (KCl) до тех пор, пока не констатировали остановку сердца.
После сбора коленных суставов, их вскрывали и проводили визуальный осмотр инъецированных коленных суставов, приведенный в Таблице 5. Фотографирование не проводили.
Визуальная оценка и сбор образцов
Кроме того, проводили полуколичественное оценивание сустава с помощью единственного эксперта, которое приведено в Таблице 6.
Качественная оценка на основе визуального осмотра
Суммарное количество баллов при визуальном осмотре составляло сумму баллов окрашивания, гиперемии, и отечности (0-8 баллов). Смотрите Фиг. 6.
После сбора синовиальной жидкости из открытых суставов, регистрировали суммарный объем. Визуально и полуколичественно в баллах оценивали вязкость, прозрачность и цвет жидкости, как показано в Таблице 7. С помощью гемоцитометра определяли суммарное количество лейкоцитов. Кроме того, был приготовлен мазок синовиальной жидкости для дифференциального микроскопического анализа. Оставшуюся синовиальную жидкость сохраняли в замороженном виде в криопробирках с индивидуальными этикетками при -80°C. Мазок синовиальной жидкости сохраняли для возможного проведения анализа в будущем.
Описание и оценка в баллах синовиальной жидкости
Суммарное количество баллов для синовиальной жидкости составляло сумму баллов цвета, прозрачности и сухожилия (0-8 баллов).
Результаты приведены в графическом виде на Фиг. 5-8. Как можно увидеть на Фиг. 5, пример геля, имеющего описываемые в изобретении характерные признаки, характеризовался количеством лейкоцитов в синовиальной жидкости, которое было значительно ниже, чем количество лейкоцитов, наблюдаемое для Испытуемых материалов 2-4. И на самом деле, количество лейкоцитов для Испытуемых материалов 2-4 составляло приблизительно в 5 раз, 9 раз и 8 раз большую величину, чем наблюдаемую для Испытуемого материала 1. Несмотря на то, что испытуемые материалы 2-4 проявляют in-vitro свойства (например, химизм, свойства геля, легкость введения, и так далее), указывающие на возможность их фармацевтического применения, тем не менее, эти результаты демонстрируют очевидное превосходство Испытуемого материала 1 и аналогичных ему материалов, с точки зрения наличия значительно более низких провоспалительных свойств при исследовании на экспериментальной модели коз, по сравнению, казалось бы, со сопоставимыми испытуемыми материалами. Как это ни удивительно, но все другие показатели указывали на применимость других испытуемых материалов для использования в качестве вязкоупругой добавки и в других близких областях применения.
Данные на Фиг. 6, демонстрирующие абсолютное количество лейкоцитов в синовиальной жидкости (абсолютное количество=суммарной объем × количество лейкоцитов в синовиальной жидкости) коленей инъецированных коз, дополнительно подтверждают вышесказанное. А именно, исходя из абсолютного количества лейкоцитов в синовиальной жидкости, пример Испытуемого материала 1 демонстрирует поразительно низкую ответную воспалительную реакцию в экспериментальной модели на козах, чем Испытуемые материалы 2-4. Значения для Испытуемых материалов 2-4 приблизительно в 4 раза, в 12 раз, и более чем в 9 раз выше, чем для Испытуемого материала 1, что указывает на поразительное и значительное преимущество Испытуемого материала 1 при оценке на колене коз.
На Фиг. 7 графически представлено дифференциальное распределение лейкоцитов в синовиальной жидкости (средние значения для групп) в инъецированных коленях коз относительно группы, подвергнутой обработке испытуемым материалом, оцененное через 24 часа после 1,5 мл инъекции, как описано в Примере 17.
Для каждого Испытуемого материала приведено распределение полиморфоядерных лейкоцитов (PMN), лимфоцитов, моноцитов и эозинофилов (Eos). Полиморфоядерные лейкоциты и эозинофилы являются важными клеточными участниками в целом ряде видов острого и хронического воспаления. Процент полиморфоядерных лейкоцитов для Испытуемого материала 1 (относительно лимфоцитов, моноцитов и эозинофилов) был значительно ниже, чем для других испытуемых материалов (приблизительно 50% по сравнению с 70% и выше для испытуемых материалов 2-4), что является еще одним указанием на предпочтительные более низкие провоспалительные свойства примера Испытуемого материала 1 по сравнению с другими испытуемыми материалами.
И наконец, на Фиг. 8 приведены средние значения суммы баллов для синовиальной жидкости, суставных тканей, и объединенные баллы синовиальной жидкости и суставных тканей (Таблица 6) для инъецированных коленей коз для каждого типичного Испытуемого материала.
Суммарная визуальная оценка в баллах=Количество баллов для синовиальной жидкости+Суммарное количество баллов для сустава.
Максимальное количество баллов для синовиальной жидкости или суммарное количество баллов для сустава составляет 8, при этом норма составляет 0.
Максимальное количество баллов для суммарной визуальной оценки составляет 16, при этом норма составляет 0.
Как показано на Фиг. 8, Испытуемый материал 1 продемонстрировал поразительный результат. И на самом деле, на основе всех оценок в баллах, проведенных путем описанного выше визуального наблюдения, было показано, что Испытуемый материал 1 практически не вызывает ответной воспалительной реакции, с количеством баллов для синовиальной жидкости, суставных тканей, и их комбинацией, характерной для нормального состояния или почти нормального. В отличие от этого, типичные Испытуемые материалы 2-4 дали визуальные оценки, как для синовиальной жидкости, так и для сустава, которые не отражали нормального состояния и указывали на воспаление в коленном суставе в результате введения испытуемого материала. Эти результаты демонстрируют удивительные и предпочтительные свойства иллюстративного Испытуемого материала 1 с точки зрения возможности использования для терапевтических применений in-vivo.
ПРИМЕР 18
СИНТЕЗ ГЕЛЯ ГК-ВС/ПЭГ-(SH)4
Раствор ГК-ВС, приготовленный в Примере 1, разбавляют деионизированной водой до концентрации 12,6 мг/мл. 18 мл раствора ГК-ВС помещают в стерильный шприц объемом 20 мл. Раствор ГК-ВС фильтруют через стерильный шприцевой фильтр с размером пор 0,2 мкм в стерильную центрифужную пробирку объемом 50 мл. 200 мг ПЭГ(SH)4, C(CH2O(CH2CH2O)nCH2CH2SH)4, [фирмы Laysan Bio Inc, Mw 10000, номер по каталогу 4armPEG-SH-10kD-1g] (подвергнутый электроннолучевой обработке) добавляют в 2 мл стерильного отфильтрованного 0,17M раствора фосфата натрия в 1M физиологическом растворе (pH 7,4). После растворения, раствор ПЭГ-(SH)4 добавляют к раствору ГК-ВС. Полученный раствор тщательно перемешивают. Затем дают возможность раствору ГК-ВС/ПЭГ-(SH)4 образовать гель при комнатной температуре. Гелеобразный материал может быть превращен в суспензию геля таким же образом, как это описано в Примерах 3 и 4. Гель может быть приготовлен в присутствии ацетонида триамцинолона с помощью методики, описанной в Примерах 9, 10 и 11. Гиалуроновая кислота может быть добавлена к композиции геля с помощью метода, описанного в Примере 8. Гиалуроновая кислота может быть добавлена к композиции геля, содержащего ацетонид триамцинолона, с помощью методики, описанной в Примере 13.
ПРИМЕР 19
СИНТЕЗ КАРБОКСИМЕТИЛГИАЛУРОНОВОЙ КИСЛОТЫ (CM-ГК ИЛИ CARBYLAN™)
Водный раствор NaOH (200 мл, 45% масса/объем) добавляли в стакан емкостью 500 мл и перемешивали (с помощью магнитной мешалки) при температуре окружающей среды. Добавляли в стакан емкостью 500 мл порошок гиалуроновой кислоты (20 г) [фирмы Novozymes, молекулярная масса 0,8-1,0 миллион]. После отстаивания в течение 2 часов, смесь гиалуроновой кислоты переносили в стакан емкостью 4 л с 1500 мл изопропанола и покрытой тефлоном магнитной мешалкой, и затем добавляли при перемешивании раствор 20 г хлоруксусной кислоты в 500 мл изопропанола. После перемешивания в течение 1 часа при температуре окружающей среды, перемешивание прекращали и давали возможность материалу осесть в течение приблизительно 10-20 минут. Из смеси удаляли как можно большее количество надосадочной жидкости. К полученной смеси добавляли 1000 мл дистиллированной воды. После окончания растворения, корректировали величину pH раствора до приблизительно pH 7,0 путем добавления 6,0N HCl. Затем объем раствора доводили до 2 л с помощью деионизированной воды. Раствор очищали с помощью проточной фильтрация вдоль потока (TFF), используя 10 л деионизированной воды в качестве буфера обмена.
Кроме того, структура, синтез и исследование карбоксиметилгиалуроновой кислоты описаны в патентном документе International Patent Publication No. 2005/056608 (Фиг. 5 и Пример 3), содержание соответствующих частей которого приводится здесь путем ссылки на него.
ПРИМЕР 20
СИНТЕЗ СОЕДИНЕНИЯ КАРБОКСИМЕТИЛГИАЛУРОНОВАЯ КИСЛОТА-ДИТИОБИС(ДИГИДРАЗИД ПРОПИОНОВОЙ КИСЛОТЫ) (CM-ГК-ДТПГ ИЛИ CARBYLAN™-S)
3,3'-Дитиобис(дигидразид пропановой кислоты) (DTP) синтезировали в соответствии с ранее опубликованной методикой (Vercruysse, K.P.; Marecak, D.M.; Marecek, J. F.; Prestwich, G.D. "Synthesis and in vitro degradation of new polyvalent hydrazide cross-linked hydrogels of hyaluronic acid", Bioconjugate Chem. (1997) 8:686-694; Shu, X.Z.; Liu, Y.; Luo, Y.; Roberts, M.C.; Prestwich, G.D. "Disulfide crosslinked hyaluronan hydrogels", Biomacromolecules (2002) 3:1304-1311). Добавляли DTP (16,7 г, 0,07 моль) к приготовленному выше раствору CarbylanTM, и корректировали величину pH раствор до 4,75 путем добавления либо раствора HCl, либо раствора NaOH. Затем добавляли 0,384 г 1-этил-3[3-(диметиламино)пропил]карбодиимида (EDC) [фирмы Sigma-Aldrich], и поддерживали величину pH раствора при pH 4,75 путем добавления 6,0 N HCl при непрерывном перемешивании с помощью магнитной мешалки при комнатной температуре.
Через 4 часа добавляли 50 г дитиотреитола (DTT) [фирмы Biovectra], и корректировали величину pH раствора до 8,5 путем добавления концентрированного раствора NaOH. Затем после перемешивания с помощью магнитной мешалки при комнатной температуре в течение 12-24 часов, корректировали величину pH реакционной смеси до pH 3,0 путем добавления 6,0N HCl. Подкисленный раствор очищали и концентрировали с помощью проточной фильтрации вдоль потока (TFF), используя 20 л 1 мM HCl, pH 3,0. Затем раствор концентрировали до объема приблизительно 1 л.
Структура, синтез и исследование соединения карбоксиметилгиалуроновая кислота - дитиобис(дигидразид пропановой кислоты) описаны в патентном документе International Patent Publication No. 2005/056608 (Фиг. 5 и Пример 4), содержание соответствующих частей которого приводится здесь путем ссылки на него.
ПРИМЕР 21
СИНТЕЗ ГЕЛЯ CM-ГК-ДТПГ/ПЭГ-(АКРИЛАТ)2
Раствор CM-ГК-ДТПГ, приготовленный в Примере 20, разбавляют деионизированной водой до концентрации 17,5 мг/мл. В стерильный шприц объемом 60 мл помещают 30 мл раствора CM-ГК-ДТПГ. Раствор CM-ГК-ДТПГ фильтруют через стерильный шприцевой фильтр с размером пор 0,2 мкм в стерильную центрифужную пробирку объемом 50 мл. Приготавливают раствор 40 мг/мл ПЭГ-(акрилат)2 [фирмы Laysan Bio Inc., молекулярная масса 3400, номер по каталогу ACRL-PEG-ACRL3400-1g] путем растворения 600 мг ПЭГ-(акрилат)2 в 15 мл буфера из 0,2M фосфата натрия (pH 7,4). Раствор ПЭГ-(акрилат)2 переносят в стерильный шприц объемом 20 мл и фильтруют через стерильный шприцевой фильтр с размером пор 0,2 мкм. Переносят 20 мл стерильно отфильтрованного CM-ГК-ДТПГ в стерильную центрифужную пробирку объемом 50 мл. Добавляют 10 мл раствора ПЭГ-(акрилат)2 в раствор CM-ГК-ДТПГ. Полученный раствор тщательно перемешивают. Затем дают возможность раствору CM-ГК-ДТПГ/ПЭГ-(акрилат)2 образовать гель при комнатной температуре.
ПРИМЕР 22
СУСПЕНЗИЯ ГЕЛЯ CM-ГК-ДТПГ/ПЭГ-(АКРИЛАТ)2
Гель CM-ГК-ДТПГ/ПЭГ-(акрилат)2 (полученный в Примере 21) превращают в суспензию геля с помощью методики, описанной в Примерах 3 и 4, соответственно.
ПРИМЕР 23
ГЕЛЬ CM-ГК-ДТПГ/ПЭГ-(АКРИЛАТ)2, СОДЕРЖАЩИЙ АЦЕТОНИД ТРИАМЦИНОЛОНА
Раствор CM-ГК-ДТПГ, приготовленный в Примере 20, разбавляют деионизированной водой до концентрации 14 мг/мл. В стерильный шприц объемом 20 мл помещают 11 мл раствора CM-ГК-ДТПГ. Раствор CM-ГК-ДТПГ фильтруют через стерильный шприцевой фильтр с размером пор 0,2 мкм в стерильную центрифужную пробирку объемом 50 мл. Приготавливают раствор 50 мг/мл ПЭГ-(акрилат)2 [фирмы Laysan Bio Inc, молекулярная масса 3400, номер по каталогу ACRL-PEG-ACRL-3400-1g] путем растворения 40,1 мг ПЭГ-(акрилат)2 в 0,802 мл деионизированной воды. Раствор ПЭГ-(акрилат)2 переносят в стерильный шприц объемом 1 мл и фильтруют через стерильный шприцевой фильтр с размером пор 0,2 мкм. 10 мл стерильного отфильтрованного CM-ГК-ДТПГ переносят в стерильную центрифужную пробирку объемом 50 мл. Добавляли к раствору CM-ГК-ДТПГ 20 мг ацетонида триамцинолона (фирмы Spectrum Chemicals, фармокопейной чистоты, тонкоизмельченный). Центрифужную пробирку закрывали крышкой, и пробирку с раствором переворачивали то вверх, то вниз, до тех пор, пока ацетонид триамцинолона гомогенно не смешивался с CM-ГК-ДТПГ. К раствору CM-ГК-ДТПГ добавляют 250 мкл 0,5M раствора фосфата натрия. Полученный раствор тщательно перемешивают. К раствору CM-ГК-ДТПГ добавляют 380 мкл [19 мг ПЭГ-(акрилат)2] стерильного раствора 50 мг/мл ПЭГ-(акрилат)2. Полученный раствор тщательно перемешивают. Раствор CM-ГК-ДТПГ/ПЭГ-(акрилат)2, который содержал ацетонид триамцинолона, затем помещают в термостат с температурой 37°C, по меньшей мере, на 16 часов. На этой стадии, раствор CM-ГК-ДТПГ/ПЭГ-(акрилат)2, который содержал ацетонид триамцинолона, сшивается с образованием геля. Затем гелеобразный материал извлекали из термостата.
Синтез геля повторяют, используя 33 мг, 50 мг, 75 мг, 100 мг, 125 мг, 150 мг, 175 мг, 200 мг, 225 мг, 250 мг, 375 мг, 400 мг и 500 мг ацетонида триамцинолона, соответственно.
Гели превращали в суспензию геля с помощью методики, описанной в Примере 3 и 4.
ПРИМЕР 24
СИНТЕЗ СУСПЕНЗИИ ГЕЛЯ ГК-ВС-ПЭГ-(SH)2, СОДЕРЖАЩЕГО АЦЕТОНИД ТРИАМЦИНОЛОНА
Гели ГК-ВС-ПЭГ-(SH)2, содержащие ацетонид триамцинолона приготавливают с помощью методики, описанной в Примере 9, за исключением того, что для приготовления каждого геля использовали 33 мг, 50 мг, 75 мг, 100 мг, 125 мг, 150 мг, 175 мг, 200 мг, 225 мг, 250 мг, 375 мг, 400 мг и 500 мг ацетонида триамцинолона, соответственно.
Гели превращали в суспензию геля с помощью методики, описанной в Примере 3 и 4.
ПРИМЕР 25
СИНТЕЗ ГЕЛЯ CM-ГК-ДТПГ/ПЭГ-(АКРИЛАТ)4
Раствор CM-ГК-ДТПГ, приготовленный в Примере 20, разбавляют деионизированной водой до концентрации 14 мг/мл. В стерильный шприц объемом 20 мл помещают 11 мл раствора CM-ГК-ДТПГ. Раствор CM-ГК-ДТПГ фильтруют через стерильный шприцевой фильтр с размером пор 0,2 мкм в стерильную центрифужную пробирку объемом 50 мл. Приготавливают раствор 50 мг/мл ПЭГ-(акрилат)4 [фирмы Laysan Bio Inc, молекулярная масса 10000, номер по каталогу 4arm-PEG-ACRL10K-1g] путем растворения 40,1 мг ПЭГ-(акрилат)4 в 0,802 мл деионизированной воды. Раствор ПЭГ-(акрилат)4 переносят в стерильный шприц объемом 1 мл и фильтруют через стерильный шприцевой фильтр с размером пор 0,2 мкм. Переносят 10 мл стерильного отфильтрованного CM-HADTPH в стерильную центрифужную пробирку объемом 50 мл. В раствор CM-ГК-ДТПГ добавляют 250 мкл 0,5M раствора фосфата натрия. Полученный раствор тщательно перемешивают. Добавляют к раствору CM-ГК-ДТПГ 560 мкл [28 мг ПЭГ-(акрилат)4] стерильного раствора 50 мг/мл ПЭГ-(акрилат)4. Полученный раствор тщательно перемешивают. Раствор CM-ГК-ДТПГ/ПЭГ-(акрилат)4 затем помещают в термостат с температурой 37°C, по меньшей мере, на 16 часов. На этой стадии, раствор CM-ГК-ДТПГ/ПЭГ-(акрилат)4 сшивается с образованием геля. Затем гелеобразный материал извлекают из термостата. Гелеобразный материал может быть превращен в суспензию геля таким же образом, как это описано в Примере 3 и 4. Гель может быть приготовлен в присутствии ацетонида триамцинолона с помощью методики, описанной в Примерах 9, 10 и 11. Гиалуроновая кислота может быть добавлена к композиции геля с помощью методики, описанной в Примере 8. Гиалуроновая кислота может быть добавлена к композиции геля, содержащего ацетонид триамцинолона, с помощью методики, описанной в Примере 13.
ПРИМЕР 26
СИНТЕЗ СОЕДИНЕНИЯ ГИАЛУРОНОВАЯ КИСЛОТА-ДИТИОБИС(ДИГИДРАЗИД ПРОПАНОВОЙ КИСЛОТЫ) (ГК-ДТПГ)
3,3'-Дитиобис(дигидразид пропановой кислоты) (ДТПГ) синтезировали в соответствии с ранее опубликованной методикой (Vercruysse, K.P.; Marecak, D.M.; Marecek, J.F.; Prestwich, G.D. "Synthesis and in vitro degradation of new polyvalent hydrazide cross-linked hydrogels of hyaluronic acid", Bioconjugate Chem. (1997) 8:686-694; Shu, X.Z.; Liu, Y.; Luo, Y.; Roberts, M.C; Prestwich, G.D. "Disulfide crosslinked hyaluronan hydrogels", Biomacromolecules (2002) 3: 1304-1311). 3,3'-Дитиобис(дигидразид пропановой кислоты) (16,7 г, 0,07 моль) добавляли к приготовленному выше раствору гиалуроновой кислоты (20 г гиалуроновой кислоты [Mw 0,8-1,0 миллион], растворенной в 1000 мл деионизированной воды), и корректировали величину pH раствора до 4,75 путем добавления либо раствора HCl, либо раствора NaOH. Затем, добавляли 0,384 г 1-этил-3-[3(диметиламино)пропил]карбодиимида (EDC) [фирмы Sigma-Aidrich], и поддерживали величину pH раствора при pH 4,75 путем добавления 6,0N HCl при непрерывном перемешивании с помощью магнитной мешалки при комнатной температуре. Через 4 часа, добавляли 50 г дитиотреитола (DTT) [фирмы Biovectra], и корректировали величину рН раствора до 8,5 путем добавления концентрированного раствора NaOH. Затем через 12-24 часов перемешивания с помощью магнитной мешалки при комнатной температуре, корректировали величину рН реакционной смеси до pH 3,0 путем добавления 6,0N HCl. Подкисленный раствор очищали и концентрировали с помощью проточной фильтрация вдоль потока (TFF), используя 20 л 1 мM HCl, pH 3,0. Раствор затем концентрировали до объема приблизительно 1 л.
ПРИМЕР 27
СИНТЕЗ ГЕЛЯ ГК-ДТПГ/ПЭГ-(АКРИЛАТ)2
Раствор ГК-ДТПГ, приготовленный в примере 26, разбавляют деионизированной водой до концентрации 14 мг/мл. В стерильный шприц объемом 20 мл помещают 11 мл раствора ГК-ДТПГ. Раствор ГК-ДТПГ фильтруют через стерильный шприцевой фильтр с размером пор 0,2 мкм в стерильную центрифужную пробирку объемом 50 мл. Приготавливают раствор 50 мг/мл ПЭГ-(акрилат)2 [фирмы Laysan Bio Inc, молекулярная масса 3400, номер по каталогу ACRL-PEG-ACRL-3400-1g] путем растворения 40,1 мг ПЭГ-(акрилат)2 в 0,802 мл деионизированной воды. Раствор ПЭГ-(акрилат)2 переносят в стерильный шприц объемом 1 мл и фильтруют через стерильный шприцевой фильтр с размером пор 0,2 мкм. Переносят 10 мл стерильного отфильтрованного раствора ГК-ДТПГ в стерильную центрифужную пробирку объемом 50 мл. К раствору ГК-ДТПГ добавляют 250 мкл 0,5M раствора фосфата натрия. Полученный раствор тщательно перемешивают. К раствору ГК-ДТПГ добавляют 380 мкл [19 мг ПЭГ-(акрилат)2] стерильного 50 мг/мл раствора ПЭГ-(акрилат)2. Полученный раствор тщательно перемешивают. Раствор ГК-ДТПГ/ПЭГ-(акрилат)2 затем помещают в термостат с температурой 37°C, по меньшей мере, на 16 часов. На этой стадии, раствор ГК-ДТПГ/ПЭГ-(акрилат)2 сшивается с образованием геля. Затем гелеобразный материал извлекают из термостата.
ПРИМЕР 28
СУСПЕНЗИЯ ГЕЛЯ ГК-ДТПГ/ПЭГ-(АКРИЛАТ)2
Гель ГК-ДТПГ/ПЭГ-(акрилат)2 (полученный в Примере 27) превращают в суспензию геля с помощью методики, описанной в Примерах 3 и 4, соответственно.
ПРИМЕР 29
ГЕЛЬ ГК-ДТПГ/ПЭГ-(АКРИЛАТ)2, СОДЕРЖАЩИЙ АЦЕТОНИД ТРИАМЦИНОЛОНА
Раствор CM-ГК-ДТПГ, приготовленный в Примере 20, разбавляют деионизированной водой до концентрации 17,5 мг/мл. Помещают 30 мл раствора CM-ГК-ДТПГ в стерильный шприц объемом 60 мл. Раствор CM-ГК-ДТПГ фильтруют через стерильный шприцевой фильтр с размером пор 0,2 мкм в стерильную центрифужную пробирку объемом 50 мл. Добавляют 100 мг порошка стерильного ацетонида триамцинолона, и полученную смесь тщательно перемешивают. Приготавливают раствор 40 мг/мл ПЭГ-(акрилат)2 [фирмы Laysan Bio Inc, молекулярная масса 3400, номер по каталогу ACRL-PEG-ACRL3400-1g] путем растворения 600 мг ПЭГ-(акрилат)2 в 15 мл буфера из 0,2M раствора фосфата натрия (pH 7,4). Раствор ПЭГ-(акрилат)2 переносят в стерильный шприц объемом 20 мл и фильтруют через стерильный шприцевой фильтр с размером пор 0,2 мкм. Переносят 20 мл стерильного отфильтрованного раствора CM-HADTPH в стерильную центрифужную пробирку объемом 50 мл. К раствору CM-ГК-ДТПГ добавляют 10 мл раствор ПЭГ-(акрилат)2. Полученный раствор тщательно перемешивают. Затем раствору CM-ГК-ДТПГ/ПЭГ-(акрилат)2 дают возможность образовать гель при комнатной температуре.
Синтез геля повторяют, используя 33 мг, 50 мг, 75 мг, 125 мг, 150 мг, 175 мг, 200 мг, 225 мг, 250 мг, 375 мг, 400 мг и 500 мг ацетонида триамцинолона, соответственно.
Гели превращают в суспензию геля с помощью методики, описанной в Примерах 3 и 4.
ПРИМЕР 30
СИНТЕЗ ГЕЛЯ ГК-ДТПГ/ПЭГ-(АКРИЛАТ)4
Раствор ГК-ДТПГ, полученный в Примере 20, разбавляют деионизированной водой до концентрации 14 мг/мл. В стерильный шприц объемом 20 мл помещают 11 мл раствора ГК-ДТПГ. Раствор ГК-ДТПГ фильтруют через стерильный шприцевой фильтр с размером пор 0,2 мкм в стерильную центрифужную пробирку объемом 50 мл. Приготавливают раствор 50 мг/мл ПЭГ-(акрилат)4 [фирмы Laysan Bio Inc, молекулярная масса 10000, номер по каталогу 4arm-PEG-ACRL-10K-1g] путем растворения 40,1 мг ПЭГ-(акрилат)4 в 0,802 мл деионизированной воды. Раствор ПЭГ-(акрилат)4 переносят в стерильный шприц объемом 1 мл и фильтруют через стерильный шприцевой фильтр с размером пор 0,2 мкм. Переносят 10 мл стерильного отфильтрованного раствора ГК-ДТПГ в стерильную центрифужную пробирку объемом 50 мл. Добавляют к раствору ГК-ДТПГ 250 мкл 0,5M раствора фосфата натрия. Полученный раствор тщательно перемешивают. К раствору ГК-ДТПГ добавляют 560 мкл [28 мг ПЭГ-(акрилат)4] стерильного раствора 50 мг/мл ПЭГ-(акрилат)4. Полученный раствор тщательно перемешивают. Раствор ГК-ДТПГ/ПЭГ-(акрилат)4 затем помещают в термостат с температурой 37°C, по меньшей мере, на 16 часов. На этой стадии, раствор ГК-ДТПГ/ПЭГ-(акрилат)4 сшивается с образованием геля. Затем гелеобразный материал извлекают из термостата. Гелеобразный материал может быть превращен в суспензию геля таким же образом, как это описано в Примере 3 и 4. Гель может быть приготовлен в присутствии ацетонида триамцинолона с помощью методики, описанной в Примерах 9, 10 и 11. Гиалуроновая кислота может быть добавлена к композиции геля с помощью методики, описанной в Примере 8. Гиалуроновая кислота может быть добавлена к композиции геля, содержащего ацетонид триамцинолона, с помощью методики, описанной в Примере 13.
ПРИМЕР 31
ПРИГОТОВЛЕНИЕ ГЕЛЯ ПЭГ-ДИАКРИЛАТ (ИСПЫТУЕМЫЙ МАТЕРИАЛ 4)
Загружали 1,466 г полиэтиленгликоль-диакрилата [ПЭГ-ДА] (фирмы Laysan Bio, номер по каталогу ACRL-PEG-ACRL-3400-1g) в стерильную емкость объемом 125 мл. К ПЭГ-ДА добавляли 22 мл стерильного физиологического раствора. После растворения, фильтровали ПЭГ-ДА/NaCl через шприцевой фильтр с размером пор 0,2 мкм в дезинфицированную колбу Эрленмейера. Фильтровали 0,150M карбонатный буфер с pH 8,2 через шприцевой фильтр с размером пор 0,2 мкм, и 1 мл этого стерильного раствора добавляли к раствору ПЭГ-ДА. Колбу закрывали с помощью резиновой диафрагмы, и из раствора удаляли газы путем барбатирования через него азота в течение 10 минут. К газовой линии подсоединяли фильтр с размером пор 0,2 мкм для обеспечения стерильности воздуха. Приготавливали раствор 400 мг/мл аскорбата натрия путем добавления 1,2 г аскорбата натрия в пробирку из термостойкого стекла с мембранной крышкой. В пробирку добавляли 3 мл деионизированной воды. После растворения, раствор фильтровали через шприцевой фильтр с размером пор 0,2 мкм в стерильную центрифужную пробирку объемом 15 мл. К раствору ПЭГ-ДА добавляли 0,8 мл стерильного отфильтрованного раствора 400 мг/мл аскорбата натрия. К раствору ПЭГ-ДА добавляли 0,8 мл стерильного отфильтрованного раствор 400 мг/мл персульфата натрия. Раствор перемешивали путем образования завихрения раствора. Колбу закрывали с помощью красной резиновой мембраны и из раствора удаляли газы путем барботирования через раствор азота в течение 15 минут. К газовой линии для подачи азота, используемого для дегазации раствора, подсоединяли фильтр с размером пор 0,2 мкм. Раствор помещали в термостат с температурой 37°C, по меньшей мере, на 18 часов для образования геля. Гель переносили в шприц объемом 30 мл. Вырубали из листа сетки круглый диск диаметром 23 мм с помощью пробойника для кожи диаметром 23 мм. Диск из сетки помещали в шприцевой фильтр из поликарбоната диаметром 25 мм, в котором были удалены фильтрующие слои. Гель экструдировали через сетку (с отверстиями 1 мм×1 мм) в стакан объемом 250 мл. К 25 мл экструдированного геля добавляли 100 мл стерильного физиологического раствора. Через 40 минут, надосадочный физиологический раствор сливали и добавляли еще 125 мл стерильного физиологического раствора. Эту процедуру повторяли 3 раза. После последней промывки, добавляли 45 мл набухшего геля к 45 мл физиологического раствора, и суспензию осторожно перемешивали. Корректировали величину pH получаемого раствора в интервале от 7,0 до 7,4 с помощью комбинации 1N NaOH и 1N HCl. 1,5 мл этой суспензии геля помещали в стеклянный шприц объемом 5 мл. Надевали на шприц колпачок. Затем шприц стерилизовали в автоклаве при 250°C в течение 15 минут.
ПРИМЕР 32
ПРИГОТОВЛЕНИЕ ГЕЛЯ ПЭГ-ДИАКРИЛАТ/БИСТИОЛ (ИСПЫТУЕМЫЙ МАТЕРИАЛ 2)
Загружали 630 мг полиэтиленгликоль-диакрилат [ПЭГ-ДА] (фирмы Laysan Bio, номер по каталогу ACRL-PEG-ACRL-3400-1g) в сцинтилляционный флакон объемом 20 мл. Добавляли 6 мл деионизированнОЙ воды. После растворения, раствор фильтровали через шприцевой фильтр с размером пор 0,2 мкм. Растворяли 48 мг N,N'-бис(акрилоил)цистамина (фирмы Sigma, A4929) в 6 мл тетрагидрофурана (THF) в стеклянном сцинтилляционном флаконе. После растворения, этот раствор смешивали с раствором ПЭГ-ДА. Флакон закрывали навинчивающейся мембранной крышкой, и из раствора удаляли газы путем барботирования азота в течение 10 минут. К раствору ПЭГ-ДА добавляли 50 мкл раствора 400 мг/мл аскорбата натрия (приготовленного с использованием деионизированной воды и отфильтрованного через шприцевой фильтр с размером пор 0,2 мкм). К раствору ПЭГ-ДА добавляли 50 мкл раствора 400 мг/мл персульфата натрия (приготовленного с использованием деионизированной воды и отфильтрованного через шприцевой фильтр с размером пор 0,2 мкм). Возвращали на место мембранную крышку, и из раствора удаляли газы путем барботирования азота в течение 10 минут. Раствор помещали в сушильный шкаф, в котором была установлена температура 60°C. Раствор превращался в гель через 15 минут. Гель извлекали из сушильного шкафа и охлаждали до комнатной температуры. Гель переносили в шприц объемом 30 мл. Вырубали из листа сетки круглый диск диаметром 23 мм с помощью пробойника для кожи диаметром 23 мм. Диск из сетки помещали в шприцевой фильтр из поликарбоната диаметром 25 мм, в котором были удалены фильтрующие слои. Гель экструдировали через сетку (с отверстиями ~0,8 мм×~0,8 мм) в стакан объемом 400 мл. К экструдированному гелю добавляли 200 мл деионизированной воды. Через 45 минут надосадочную жидкость выливали и добавляли еще 200 мл деионизированной воды. Эту процедуру повторяли 4 раза. Затем стадии промывки повторяли 3 раза с использованием 0,9% физиологического раствора. Надосадочную жидкость удаляли и оставшийся гель опять экструдировали через сетку (описанную выше). 1,5 мл этой суспензии геля помещали в стеклянный шприц объемом 5 мл. Надевали на шприц колпачок. Затем шприц стерилизовали в автоклаве при 250°C в течение 15 минут.
ПРИМЕР 33
ПРИГОТОВЛЕНИЕ ГЕЛЯ ПЭГ-(LYS)4 (ИСПЫТУЕМЫЙ МАТЕРИАЛ 3)
В стеклянную емкость объемом 60 мл загружали 1,0 г ПЭГ-(lys)4 [4-звенный полиэтиленгликоль (Mw 10000), концевые гидроксильные группы которого функционализировали с помощью глутарового ангидрида и затем с помощью лизина]. Добавляли к ПЭГ-(lys)4 34 мл дихлорметана. К раствору добавляли 333 мкл диизопропилкарбодиимида (фирмы Ruka, 38370). Раствор превращался в гель приблизительно через 30 минут. Давали возможность продолжаться процессу гелеобразования в течение, по меньшей мере, 18 часов. Гель переносили в шприц объемом 30 мл. Вырубали из листа сетки круглый диск диаметром 23 мм с помощью пробойника для кожи диаметром 23 мм. Диск из сетки помещали в шприцевой фильтр из поликарбоната диаметром 25 мм, в котором были удалены фильтрующие слои. Гель экструдировали через сетку (с отверстиями ~0,38 мм×~0,38 мм) в стакан объемом 400 мл. Промывали 33 мл геля с помощью 330 мл ацетона. Через 30 минут, ацетон удаляли. Процедуру промывки повторяли 4 раза. Затем гель сушили под вакуумом (Приблизительно 18 часов под вакуумом). Добавляли 771 мг высушенного геля к 52 мл физиологического раствора, и давали возможность гелю набухать в течение 5 часов. Гель затем продавливали через сетку (с отверстиями ~0,38 мм×~0,38 мм). 1,5 мл этой суспензии геля помещали в стеклянный шприц объемом 5 мл. Надевали на шприц колпачок. Затем шприц стерилизовали в автоклаве при 250°C в течение 15 минут.
ПРИМЕР 34
IN-VIVO ИССЛЕДОВАНИЕ: ВНУТРИСУСТАВНАЯ ИНЪЕКЦИЯ СШИТОГО ГК-ВС-ПЭГ-(SH)2 ГИДРОГЕЛЯ, СОДЕРЖАЩЕГО КОРТИКОСТЕРОИД
Слегка сшитый гидрогель, приготовленный путем реакции гиалуроновая кислота, модифицированная винилсульфоном, с ПЭГ-дитиолом (ГК-ВС-ПЭГ-(SH)2), содержащий кортикостероид, ацетонид триамцинолона, инъецировали во внутрисуставное пространство коленного сустава коз. Для оценки местных и системных воздействий таких инъекций были проведены морфологические исследования и гистологические исследования синовиальной жидкости. Подробности исследования приведены ниже.
A. Испытуемые материалы
Испытуемый материал 1. ГК-ВС-ПЭГ-(SH)2 (сшитый гидрогель на основе ГК, не содержащий лекарственного средства) приготавливали следующим образом.
Раствор ГК-ВС, приготовленный в Примере 1, разбавляли с помощью деионизированной воды до концентрации 14 мг/мл. В стерильный шприц объемом 20 мл помещали 11 мл раствора ГК-ВС. Раствор ГК-ВС фильтровали через стерильный шприцевой фильтр с размером пор 0,2 мкм в стерильный шприц объемом 20 мл. Приготавливали раствор 50 мг/мл ПЭГ(SH)2 путем растворения 40,1 мг ПЭГ-(SH)2 в 0,802 мл деионизированной воды. Переносили раствор ПЭГ-(SH)2 в стерильный шприц объемом 3 мл, и фильтровали через шприцевой фильтр с размером пор 0,2 мкм. Переносили 10 мл стерильного отфильтрованного раствора ГК-ВС в стерильную центрифужную пробирку объемом 50 мл. К раствору ГК-ВС добавляли 250 мкл 0,5M раствора фосфата натрия. Полученный раствор тщательно перемешивали. К раствору ГК-ВС добавляли 380 мл стерильного раствора 50 мг/мл ПЭГ-(SH)2. Полученный раствор тщательно перемешивали. Затем раствор ГК-ВС/ПЭГ-(SH)2 помещали в термостат с температурой 37°C, по меньшей мере, на 16 часов. На этой стадии, раствор ГК-ВС/ПЭГ-(SH)2 сшивался с образованием геля. Затем гелеобразный материал извлекали из термостата.
Испытуемый материал 2. ГК-ВС-ПЭГ-(SH)2-ацетонид триамцинолона ("ГК-ВС-ПЭГ(SH)2-TA") приготавливали следующим образом.
Смешивали 100,2 мг ацетонида триамцинолона (фирмы Sicor, фармокапейной чистоты, тонкоизмельченный) с 2 мл деионизированной воды в сцинтилляционном флаконе объемом 20 мл. После диспергирования с помощью ультразвука в течение 20 минут, материал стерилизовали в автоклаве при 250°C в течение 15 минут. Помещали 9 мл раствор ГК-ВС, приготовленного в Примере 1, с концентрацией 18,3 мг/мл в стерильный шприц объемом 20 мл. Раствор ГК-ВС фильтровали через шприцевой фильтр с размером пор 0,2 мкм в стерильный шприц объемом 10 мл. Приготавливали раствор 50 мг/мл ПЭГ-(SH)2 путем растворения 35 мг ПЭГ-(SH)2 в 0,7 мл деионизированной воды. Раствор ПЭГ(SH)2 переносили в стерильный шприц объемом 3 мл и фильтровали через стерильный шприцевой фильтр с размером пор 0,2 мкм. Переносили 7,6 мл стерильного отфильтрованного раствора ГК-ВС в раствор ацетонида триамцинолона. Добавляли во флакон, содержащий ГК-ВС и ацетонид триамцинолона, 370 мкл деионизированной воды и 250 мкл 0,5M раствор фосфата натрия. Полученный раствор тщательно перемешивали. К раствору ГК-ВС/ацетонид триамцинолона добавляли 380 мкл стерильного раствора 50 мг/мл ПЭГ-(SH)2. Полученный раствор тщательно перемешивали. Затем раствор ГК-ВС/ацетонид триамцинолона/ПЭГ-(SH)2 помещали в термостат с температурой 37°C, по меньшей мере, на 16 часов. На этой стадии, раствор ГК-ВС-ПЭГ-(SH)2-TA сшивался с образованием геля. Затем гелеобразный материал извлекали из термостата.
Испытуемый материал 3. Ацетонид триамцинолона, 2 мг/мл (препарат Kenalog-10; 10 мг/мл ацетонида триамцинолона, разбавленный физиологическим раствором до 2 мг/мл).
Испытуемый материал 4. Ацетонид триамцинолона, 8 мг/мл (препарат Kenalog-40; 40 мг/мл ацетонида триамцинолона, разбавленный физиологическим раствором до 8 мг/мл).
Контроль. Физиологический раствор, 0,9% хлорида натрия.
Все испытуемые материалы до использования хранили при комнатной температуре. Из каждого испытуемого или контрольного материала приготавливали дозу объемом 1,5 мл для каждой индивидуальной внутрисуставной инъекции.
B. Животные
Для этого исследования использовали суммарно 24 козы со сформировавшимся скелетом. Их приобретали у источника, одобренного Министерством сельского хозяйства США. В начале исследования животные весили от 63 до 97 фунтов.
Козы приобретались у одобренного Министерством сельского хозяйства США источника, и их проверяли на отсутствие козлиного артрита-энцефалита (CAE) и болезни Джона, перед тем как подвергнуть их исследованию. Для каждого животного было проведено обследование общего состояния здоровья (с учетом визуального обследования состояния конечностей, незатрудненности дыхания, и отсутствия диареи и выделения из носа) квалифицированным ветеринаром, перед тем как их подвергнуть исследованию. Животных обследовали на любой признак заболевания или хромоты. Отбор животных в группу для исследования определялся отсутствием заболевания, клиническим здоровьем, и отсутствием факта использования коленного сустава для исследований в прошлом. Коз подвергали акклиматизации в течение соответствующего периода времени, определяемого соответствующими нормами. Условия содержания животного соответствовало действующим законам и нормам, относящимся к лабораторным животным. После инъекции коз содержали в находящихся внутри помещения больших выгонах (загонах). В течение всего времени козы находились в условиях свободного поведения.
Все животные получали приблизительно 2 фунта в день пищевого рациона для некрупного жвачного животного, а также неизмельченное сено. Доступ к водопроводной воде был неограничен. Кормление прекращали приблизительно за 12-24 часа до анестезии, а доступ к воде прекращали приблизительно за 12 часов до инъекций.
Животных ежедневно осматривали на предмет общего состояния здоровья на протяжении всего курса исследования. Если животные проявляли какие-либо признаки послеоперационных осложнений или другие признаки заболевания, боли или стресса, то предпринимались соответствующие меры. Кроме того, в маловероятном случае травмы, болезни, или агонии животного, оказывали медицинскую помощь в соответствии с существующей ветеринарной практикой.
C. Терапия
Исследование было спланировано следующим образом.
Группы и назначенная терапия
(1,5 мл)
(1,5 мл)
У каждого из животных производили замеры массы тела, размера сустава по окружности и амплитуды движения сустава перед инъекцией (День 1) и непосредственно перед умерщвлением (День 14 или 28).
Основная методика инъекции была одинаковой для всех субъектов. Все инъекции проводили в условиях строгой стерильности. Животных анестезировали путем внутривенной инъекции диазепама (0,1-0,5 мг/кг) и кетамина (4,4-7,5 мг/кг). Каждое колено было физически обследовано на выбивание, амплитуду движения, припухлость, температуру, крепитацию, на траекторию движения коленной чашечки, и вальгусные/варусные нарушения.
Все инъекции проводили с использованием обычных асептических методов. Левое и правое колено подготавливали для инъекции путем выстригания шерсти в соответствующих областях и затем дезинфицирования их путем тщательной обработки хлоргексидином. Животное переводили в положение лежа на спине. Правое колено дезенфицировали три раза путем тщательной обработки хлоргексидином, чередующейся с обработкой с помощью 70% изопропилового спирта, и окрашивали раствором йода.
Для инъекции в каждый коленный сустав использовали стандартную методику. Стерильную иглу 21 размера длиной 2 дюйма вводили во внутрисуставное пространство через переднемедиальный доступ. Вводили иглу до касания с боковой стенкой межмыщелковой вырезки медиального бедренного мыщелка и слегка отводили ее назад. Инъецировали в правый сустав 1,5 мл соответствующего Испытуемого материала. Инъекционную иглу удаляли, и поддерживали повышенное давление в месте инъекции. Инъецированный коленный сустав затем 20 раз подвергали полному циклу на "сгибание - разгибание". Сразу после этого, левый коленный сустав дезинфицировали три раза путем тщательной обработки хлоргексидином, чередующейся с обработкой с помощью 70% изопропилового спирта, и окрашивали раствором йода, и инъецировали в левый коленный сустав 1,5 мл Контрольного материала таким же образом, как описано выше для правого коленного сустава. Инъекционную иглу удаляли, и поддерживали повышенное давление в месте инъекции. Инъецированный коленный сустав затем 20 раз подвергали полному циклу на "сгибание - разгибание".
После инъекции был проведена проверка тех животных, которые проявляли признаки недомогания и дискомфорта, и в случае необходимости, им вводили дополнительное количество анальгетика. Все методы обработки регистрировали в соответствующей документации по исследованию.
D. Анализ
Взятие крови: Брали кровь у каждого животного непосредственно перед началом исследования, и через 5 часов после инъекции и через 1, 4, 7, 14 и 28 дней у каждого из оставшихся животных. В каждый указанный момент времени проводили клинический анализ крови и химический анализ крови.
Некропсия: Животных гуманно умерщвляли либо через 14 дней, либо 28 дней после начала инъекции путем внутривенного введения диазепама 0,22 мг/кг и кетамина 10 мг/кг для достижения состояния общей анестезии. Затем анестезированным животным вводили внутрижелудочно летальную дозу концентрированного раствора хлорида калия (KCl) до тех пор, пока не констатировали остановку сердца.
Визуальные морфологические наблюдения: После сбора коленных суставов, их вскрывали и проводили описанный в таблице 9 визуальный осмотр инъецированных коленных суставов.
Визуальная оценка и сбор образцов
Кроме того, проводили полуколичественное оценивание сустава с помощью единственного эксперта, как показано в Таблице 10.
Качественная оценка на основе визуального осмотра
Суммарное количество баллов при визуальном осмотре составляло сумму баллов окрашивания, гиперемии, и отечности (0-8 баллов).
Оценка синовиальной жидкости
После сбора синовиальной жидкости из открытых суставов, регистрировали суммарный объем. Визуально и полуколичественно в баллах оценивали вязкость, прозрачность и цвет жидкости, как показано в Таблице 11. С помощью гемоцитометра определяли суммарное количество лейкоцитов. Кроме того, был приготовлен мазок синовиальной жидкости для дифференциального микроскопического анализа. Оставшуюся синовиальную жидкость сохраняли в замороженном виде в криопробирках с индивидуальными этикетками при -80°C. Мазок синовиальной жидкости сохраняли для возможного проведения анализа в будущем.
Описание и оценка в баллах синовиальной жидкости
Суммарное количество баллов для синовиальной жидкости составляло сумму баллов цвета, прозрачности и сухожилия (0-8 баллов).
Гистологическая оценка:
Сразу после диссекции и последующей визуальной оценки поверхности сустава, был сделан сагиттальный срез медиального феморального мыщелка (MFC) каждого сустава. Каждый из этих срезов помещали в 10% нейтральный забуференный формалин. Фиксированную ткань отправляли с помощью службы ночной доставки на фирму Premier Laboratories для обработки. Срезы правого и левого медиального феморального мыщелка подвергали обработке с помощью стандартных гистологических методик и окрашивали гематоксилином и эозином (H&E) и сафранином-O (SAF-O) с контрольным окрашиванием красителем зеленым прочным. Микроскопические препараты срезов медиального феморального мыщелка оценивали с помощью системе оценки Мэнкина в баллах для остеоартрита, приведенной в таблице 12.
Модифицированная система оценки Мэнкина в баллах
E. Результаты
Результаты оценки в баллах по системе Мэнкина для образцов хряща суставов, подвергнутых терапии с помощью различных композиций, приведены в таблицах 13a-h и показаны на Фигуре 11. На Фигуре 9 (14 дней после проведения терапии) и Фигуре 10 (28 после проведения терапии) приведены оценки в баллах окрашенных сафранином-O образцов хряща суставов, подвергнутых терапии с помощью композиций, через 14 и 28 дней после проведенной терапии, соответственно.
Оценка в баллах феморального хряща по системе Мэнкина через 14 дней, группа 1
RFC
RFC
RFC
LFC
LFC
LFC
МОДИФИЦИРОВАННАЯ СИСТЕМА ОЦЕНКИ МЭНКИНА В БАЛЛАХ
Неровности
поверхности [1]
Более широко распространенные неровности поверхности [2]
Щели в переходной зоне [3]
Щели в радиальной зоне [4]
Щели в кальцинированной зоне [5]
Полная дезорганизация [6]
Среднеочаговый и многоочаговый дефицит клеток [1]
Среднеочаговый и многоочаговый дефицит клеток с клонированием [2]
Интенсивный очаговый и диффузный дефицит клеток [3]
Небольшое снижение окрашивания [1]
Умеренное снижение окрашивания [2]
Сильное снижение окрашивания [3]
Окрашивание отсутствует [4]
Пересечение кровеносными сосудами [1]
Оценка в баллах феморального хряща по системе Мэнкина через 14 дней, группа 2
RFC
RFC
RFC
LFC
LFC
LFC
МОДИФИЦИРОВАННАЯ СИСТЕМА ОЦЕНКИ МЭНКИНА В БАЛЛАХ
Неровности поверхности [1]
Более широко распространенные неровности поверхности [2]
Щели в переходной зоне [3]
Щели в радиальной зоне [4]
Щели в кальцинированной зоне [5]
Полная дезорганизация [6]
Среднеочаговый и многоочаговый дефицит клеток [1]
Среднеочаговый и многоочаговый дефицит клеток с клонированием [2]
Интенсивный очаговый и диффузный дефицит клеток [3]
Небольшое снижение окрашивания [1]
Умеренное снижение окрашивания [2]
Сильное снижение окрашивания [3]
Окрашивание отсутствует [4]
Пересечение кровеносными сосудами [1]
Оценка в баллах феморального хряща по системе Мэнкина через 14 дней, группа 3
RFC
ацетонид
2 мг/мл
RFC
ацетонид
2 мг/мл
RFC
ацетонид
2 мг/мл
LFC
LFC
LFC
МОДИФИЦИРОВАННАЯ СИСТЕМА ОЦЕНКИ МЭНКИНА В БАЛЛАХ
Неровности поверхности [1]
Более широко распространенные неровности поверхности [2]
Щели в переходной зоне [3]
Щели в радиальной зоне [4]
Щели в кальцинированной зоне [5]
Полная дезорганизация [6]
Среднеочаговый и многоочаговый дефицит клеток [1]
Среднеочаговый и многоочаговый дефицит клеток с клонированием [2]
Интенсивный очаговый и диффузный дефицит клеток [3]
Небольшое снижение окрашивания [1]
Умеренное снижение окрашивания [2]
Сильное снижение окрашивания [3]
Окрашивание отсутствует [4]
Пересечение кровеносными сосудами [1]
Оценка в баллах феморального хряща по системе Мэнкина через 14 дней, группа 4
RFC
ацетонид
8 мг/мл
RFC
ацетонид
8 мг/мл
RFC
ацетонид
8 мг/мл
LFC
LFC
LFC
МОДИФИЦИРОВАННАЯ СИСТЕМА ОЦЕНКИ МЭНКИНА В БАЛЛАХ
Неровности поверхности [1]
Более широко распространенные неровности поверхности [2]
Щели в переходной зоне [3]
Щели в радиальной зоне [4]
Щели в кальцинированной зоне [5]
Полная дезорганизация [6]
Среднеочаговый и многоочаговый дефицит клеток [1]
Среднеочаговый и многоочаговый дефицит клеток с клонированием [2]
Интенсивный очаговый и диффузный дефицит клеток [3]
Небольшое снижение окрашивания [1]
Умеренное снижение окрашивания [2]
Сильное снижение окрашивания [3]
Окрашивание отсутствует [4]
Пересечение кровеносными сосудами [1]
Оценка в баллах феморального хряща по системе Мэнкина через 28 дней, группа 5
RFC
ГК-ВС
RFC*
ГК-ВС
RFC
ГК-ВС
LFC
LFC*
LFC
МОДИФИЦИРОВАННАЯ СИСТЕМА ОЦЕНКИ МЭНКИНА В БАЛЛАХ
Неровности поверхности [1]
Более широко распространенные неровности поверхности [2]
Щели в переходной зоне [3]
Щели в радиальной зоне [4]
Щели в кальцинированной зоне [5]
Полная дезорганизация [6]
Среднеочаговый и многоочаговый дефицит клеток [1]
Среднеочаговый и многоочаговый дефицит клеток с клонированием [2]
Интенсивный очаговый и диффузный дефицит клеток [3]
Небольшое снижение окрашивания [1]
Умеренное снижение окрашивания [2]
Сильное снижение окрашивания [3]
Окрашивание отсутствует [4]
Пересечение кровеносными сосудами [1]
Оценка в баллах феморального хряща по системе Мэнкина через 28 дней, группа 6
RFC
ГК-ВС/ТА
RFC
ГК-ВС/ТА
RFC
ГК-ВС/ТА
LFC
LFC
LFC
МОДИФИЦИРОВАННАЯ СИСТЕМА ОЦЕНКИ МЭНКИНА В БАЛЛАХ
Неровности поверхности [1]
Более широко распространенные неровности поверхности [2]
Щели в переходной зоне [3]
Щели в радиальной зоне [4]
Щели в кальцинированной зоне [5]
Полная дезорганизация [6]
Среднеочаговый и многоочаговый дефицит клеток [1]
Среднеочаговый и многоочаговый дефицит клеток с клонированием [2]
Интенсивный очаговый и диффузный дефицит клеток [3]
Небольшое снижение окрашивания [1]
Умеренное снижение окрашивания [2]
Сильное снижение окрашивания [3]
Окрашивание отсутствует [4]
Пересечение кровеносными сосудами [1]
Оценка в баллах феморального хряща по системе Мэнкина через 28 дней, группа 7
по системе оценки Мэнкина
RFC
ацетонид
2 мг/мл
RFC
ацетонид
2 мг/мл
RFC
ацетонид
2 мг/мл
LFC
LFC
LFC
МОДИФИЦИРОВАННАЯ СИСТЕМА ОЦЕНКИ МЭНКИНА В БАЛЛАХ
Неровности поверхности [1]
Более широко распространенные неровности поверхности [2]
Щели в переходной зоне [3]
Щели в радиальной зоне [4]
Щели в кальцинированной зоне [5]
Полная дезорганизация [6]
Среднеочаговый и многоочаговый дефицит клеток [1]
Среднеочаговый и многоочаговый дефицит клеток с клонированием [2]
Интенсивный очаговый и диффузный дефицит клеток [3]
Небольшое снижение окрашивания [1]
Умеренное снижение окрашивания [2]
Сильное снижение окрашивания [3]
Окрашивание отсутствует [4]
Пересечение кровеносными сосудами [1]
Оценка в баллах феморального хряща по системе Мэнкина через 28 дней, группа 8
RFC*
ацетонид
8 мг/мл
RFC
ацетонид
8 мг/мл
RFC
ацетонид
8 мг/мл
LFC*
LFC
LFC
МОДИФИЦИРОВАННАЯ СИСТЕМА ОЦЕНКИ МЭНКИНА В БАЛЛАХ
Неровности поверхности [1]
Более широко распространенные неровности поверхности [2]
Щели в переходной зоне [3]
Щели в радиальной зоне [4]
Щели в кальцинированной зоне [5]
Полная дезорганизация [6]
Среднеочаговый и многоочаговый дефицит клеток [1]
Среднеочаговый и многоочаговый дефицит клеток с клонированием [2]
Интенсивный очаговый и диффузный дефицит клеток [3]
Небольшое снижение окрашивания [1]
Умеренное снижение окрашивания [2]
Сильное снижение окрашивания [3]
Окрашивание отсутствует [4]
Пересечение кровеносными сосудами [1]
В хряще на 28 день не было разницы в оценках по модифицированной системе Мэнкина для геля ГК-ВС-ПЭГ-(SH)2 и контрольного материала. Наблюдалось потери в интенсивности окрашивания сафранином-О, выраженные умеренным увеличением части оценок в баллах по модифицированной системе Мэнкина для групп 7 и 8 по сравнению либо с группой 5, либо с группой 6. В период от 14 дня до 28 не наблюдалось увеличения оценок в баллах по модифицированной системе Мэнкина для обеих групп, подвергнутых терапии только одним ацетонидом триамцинолона (группы 7 и 8). Такое увеличение этих оценок в баллах в течение времени не наблюдается для группы 5, подвергнутой терапии с использованием геля ГК-ВС-ПЭГ-(SH)2, или для группы 6, подвергнутой терапии с использованием геля ГК-ВС-ПЭГ-(SH)2-TA.
Результаты этого исследования показывают отсутствие местных и системных эффектов через 28 дней после внутрисуставной инъекции 1,5 мл только геля ГК-ВС-ПЭГ-(SH)2 , или геля ГК-ВС-ПЭГ-(SH)2-TA, объединенного с 2 мг/мл ацетонида триамцинолона, в коленный сустав коз. Отрицательное воздействие на хрящ включенного в гель ГК-ВС-ПЭГ-(SH)2 ацетонида триамцинолона было меньшим, чем воздействие инъекции эквивалентной дозы или более высокой дозы только одного ацетонида триамцинолона.
Специфическое окрашивание гликозаминогликана с помощью сафранина-O показало, что отрицательное воздействие на хрящ ацетонида триамцинолона при концентрации 2 мг/мл (3 мг) в композиции с гелем ГК-ВС-ПЭГ-(SH)2 было меньшим, чем в случае 2 мг/мл (3 мг) и 8 мг/мл (12 мг) болюсной дозы ацетонида триамцинолона на 14 день и 28 день после инъекции.
На Фиг. 12 и 13 показаны типичные окрашенные сафранином-О гистологические микропрепараты (40X) медиального феморального мыщелка через 14 дней (Фиг. 12) и 28 дней (Фиг. 13) после инъекции. На фигурах показано, что наблюдается более интенсивное окрашивание сафранином-O для образца хряща из суставов, подвергнутых терапии с использованием ацетонида триамцинолона, включенного в гидрогель, чем для образца хряща, подвергнутого терапии с использованием эквивалентной дозы только одного ацетонида триамцинолона, который инъецировали непосредственно в сустав (то есть, не включенный в гидрогель).
ПРИМЕР 35
ИЗМЕРЕНИЕ СИЛЫ ЭКСТРУЗИИ
Силу, требуемую для экструзии продукта ГК-ВС/ПЭГ-(SH)2/ГК (Пример 5, Пример 41) и продукта ГК-ВС/ПЭГ-(SH)2/ГК с ацетонидом триамцинолона (Пример 38), измеряли с помощью установки с электроприводом для измерения силы Chatillon (установка с электроприводом Chatillon LTCM-6 с цифровым прибором измерения силы Chatillon DFE-025, фирмы Ametec TCI Division). Приспособление для фиксации шприца объемом 10 мл крепили на опорной плите установки с электроприводом таким образом, чтобы прибор измерения силы располагался непосредственно над стержнем поршня шприца. Включали установку, и устанавливали величину скорости хода 3 дюйма в минуту путем установки диска управления скоростью вращения в положение "3". Перемещали консоль движка установки в наивысшую точку. Удаляли колпачок со стеклянного шприца объемом 10 мл, который содержал подвергаемую испытанию композицию, и подсоединяли иглу 21 размера к незакрытому концу шприца. После того как шприц помещали в держатель для шприца, консоль движка установки медленно перемещали вниз до тех пор, пока датчик прибора измерения силы слегка не касался стержня поршня шприца. Под наконечником иглы 21 размера помещали пробирку объемом 16 мл. Устанавливали прибор измерения силы на регистрацию максимальной силы. Обнуляли показания прибора измерения силы. Затем нажимали тумблерный переключатель установки, в результате чего оказывалось давление на поршень шприца, и содержимое шприца выдавливалось через иглу 21 размера. Установку с электроприводом останавливали непосредственно перед моментом достижения ограничительной нижней части шприца. Регистрировали максимальную силу экструзии, отображаемую на экране дисплея прибора для измерения силы. Результаты испытания различных композиций приведены ниже:
(Серия NB30:16)
(Серия M0229)
(Серия M0231)
ПРИМЕР 36
ПОСТОЯНСТВО СИЛЫ ЭКСТРУЗИИ ГК-ВС/ПЭГ-(SH)2 С ГК ВО ВРЕМЕНИ
Силу, требуемую для экструзии продукта ГК-ВС/ПЭГ-(SH)2/ГК (Пример 5), как функцию от времени измеряли с помощью установки с электроприводом для измерения силы Chatillon (установка с электроприводом Chatillon LTCM-6 с цифровым прибором измерения силы Chatillon DFE-025, фирмы Ametec TCI Division). Силу экструзии измеряли сразу после того как был приготовлен продукт, и затем через 1 месяц и через 3 месяца после начального измерения. Образцы хранили при комнатной температуре в течение 3 месяцев. Силу экструзии измеряли для каждого образца следующим образом. Приспособление для фиксации шприца объемом 10 мл крепили на опорной плите установки с электроприводом таким образом, чтобы прибор измерения силы располагался непосредственно над стержнем поршня шприца. Включали установку, и устанавливали величину скорости хода 3 дюйма в минуту путем установки диска управления скоростью вращения в положение "3". Перемещали консоль движка установки в наивысшую точку. Удаляли колпачок со стеклянного шприца объемом 10 мл, который содержал подвергаемую испытанию композицию, и подсоединяли иглу 21 размера к незакрытому концу шприца. После того как шприц помещали в держатель для шприца, консоль движка установки медленно перемещали вниз до тех пор, пока датчик прибора измерения силы слегка не касался стержня поршня шприца. Под наконечником иглы 21 размера помещали пробирку объемом 16 мл. Устанавливали прибор измерения силы на регистрацию максимальной силы. Обнуляли показания прибора измерения силы. Затем нажимали тумблерный переключатель установки, в результате чего оказывалось давление на поршень шприца, и содержимое шприца выдавливалось через иглу 21 размера. Установку с электроприводом останавливали непосредственно перед моментом достижения ограничительной нижней части шприца. Регистрировали максимальную силу экструзии, отображаемую на экране дисплея прибора для измерения силы. Результаты для серии NB30:16 приведены ниже, и они показывают, что отсутствует реальное изменение силы, требуемой для экструзии продукта через иглу 21 размера, на протяжении 3 месяцев.
ПРИМЕР 37
ПРИГОТОВЛЕНИЕ ГЕЛЯ ГК-ВС/ПЭГ-(SH)2/TA С ГК
Загружали 170,8 мг, 341,3 мг, 511,7 мг, и 682,7 мг стерильного ацетонида триамцинолона в 4 раздельных стерильных пластиковых емкости объемом 125 мл, которые маркировали как TA 10 мг, TA 20 мг, TA 30 мг и TA 40 мг, соответственно. Каждую емкость, содержащую TA, взвешивали на весах, и в каждую из 4 емкостей добавляли 14,98 г, 14,99 г, 14,99 г и 15,01 г стерильного отфильтрованного (отфильтрованного через стерильные фильтры с размером пор 0,2 мкм, поливинилиденфторидную мембрану) раствора 14 мг/мл ГК-ВС в воде по порядку от TA 10 мг до ТА 40 мг. Порошок TA и раствор ГК-ВС смешивали путем перемешивания до тех пор, пока получаемые растворы не выглядели визуально гомогенными. В каждую емкость добавляли 0,375 мл стерильного отфильтрованного (через стерильный фильтр с размером пор 0,2 мкм) 1M раствор фосфата натрия, pH 7,4, и полученные смеси тщательно перемешивали. В каждую емкость добавляли 0,543 мл раствора 50 мг/мл ПЭГ-дитиол 3350 [ПЭГ(SH)2] (стерильный отфильтрованный через стерильный фильтр с размером пор 0,2 мкм) и тщательно перемешивали. Приведенные выше стадии осуществляли в боксе для проведения биологических исследований. Смеси помещали на ночь в сушильный шкаф с температурой 37°C. Композиции вынимали из сушильного шкафа, наружную часть емкостей протирали смесью 70/30 изопропанол/вода и затем переносили в бокс для проведения биологических исследований. Каждый гель измельчали с помощью стерильной палочки. В емкости, маркированные как TA 10 мг, 20 мг, 30 мг и 40 мг, соответственно добавляли 86,23 г, 86,25 г, 86,40 г и 86,23 г раствора 7,83 мг/мл ГК в 0,9% физиологическом растворе (отфильтрованного через стерильный фильтр с размером пор 0,2 мк, поливинилиденфторидную мембрану). Каждой смеси давали возможность набухать при комнатной температуре в течение 3 часов. Каждую смесь затем пропускали через сетку с размером отверстий 0,85 мкм, установленную в корпусе фильтра [Вырубали диск из полиэфирной сетки диаметром 23 мм (фирмы McMaster Carr, номер по каталогу 9218T13, размер отверстий: 20,3×20,3, размер квадратов/прямоугольников: 0,0331", номинальное значение в микронах: 840 микрон, доля живого сечения: 46, диаметр нити: 0,0157") с помощью пробойника для кожи диаметром 23 мм. Диск вставляли в держатель шприцевого фильтра диаметром 25 мм (фирмы Cole Palmer, номер по каталогу EW-29550-42), и держатель фильтра закрывали. Держатель фильтра, который содержал сетку, стерилизовали в автоклаве]. Собранную после пропускания через сетку смесь затем вторично пропускали через сетку с размером отверстий 0,85 мкм. Собранную смесь затем хранили в пластиковой емкости.
ПРИМЕР 38
РАСФАСОВКА ГЕЛЯ ГК-ВС/ПЭГ-(SH)2/TA С ГК
Затем 6 мл каждой композиции из Примера 37 переносили в стеклянный шприц объемом 10 мл (стеклянный шприц BD Hypak, P/N 47262119), который имел колпачок. Стержень поршня вкручивали в задний торец стерильной пробки (BD, P/N 47318319), после чего пробку/поршень вставляли в корпус шприца. Шприц переворачивали, и колпачок шприца слегка ослабляли. Нажимали на поршень до тех пор, пока из шприца не удалялась большая часть воздуха. Затем на шприц плотно надевали колпачок. Приведенные выше стадии осуществляли в боксе для проведения биологических исследований. Процесс повторяли до тех пор, пока не был расфасован весь продукт.
ПРИМЕР 39
ОПРЕДЕЛЕНИЕ РАЗМЕРА ЧАСТИЦ - ПРОМЫВКА ДЕИОНИЗИРОВАННОЙ ВОДОЙ
Сита из нержавеющей стали с размером отверстий 2,36 мм (контрольное сито #8 по стандарту США), 1,4 мм (контрольное сито #14 по стандарту США), 1 мм (контрольное сито #18 по стандарту США), 0,85 мм (контрольное сито #20 по стандарту США), 0,6 мм (контрольное сито #30 по стандарту США), 0,425 мм (контрольное сито #40 по стандарту США), 0,25 мм (контрольное сито #60 по стандарту США), и 0,150 мм (контрольное сито #100 по стандарту США) промывали деионизированной водой, и вытирали насухо с помощью безворсовых салфеток Kimwipes. После определения массы каждого сита, их устанавливали друг на друга, начиная с самого маленького размера (#100) внизу до самого большого размера (#8) наверху. В верхнее сито медленно наливали 100 мл композиции ГК-ВС/ПЭГ-(SH)2/TA с ГК (Пример 37). После того, как большая часть жидкого компонента образца проходила через верхнее сито, медленно добавляли в верхнее сито приблизительно 50 мл деионизированной воды, для того чтобы промыть компонент геля, который был задержан на сите. После того, как жидкий компонент проходил через сито, сито удаляли из стопки. Этот процесс повторяли до тех пор, пока каждое сито не было промыто и удалено из стопки. Капли избыточной воды, которые оставались на каждом сите, удаляли с помощью туалетной бумаги. Определяли суммарную массу каждого сита (массу сита и задержанного геля). Рассчитывали массу частиц геля, задержанных на каждом сите, путем вычитания исходной массы сита из суммарной массы сита. Рассчитывали процент задержанного каждым ситом геля путем деления массы геля, задержанного на конкретном сите, на суммарную массу геля, задержанного на всех ситах.
ПРИМЕР 40
ОПРЕДЕЛЕНИЕ РАЗМЕРА ЧАСТИЦ - ПРОМЫВКА ФИЗИОЛОГИЧЕСКИМ РАСТВОРОМ
Сита из нержавеющей стали с размером отверстий 2,36 мм (контрольное сито #8 по стандарту США), 1,4 мм (контрольное сито #14 по стандарту США), 1 мм (контрольное сито #18 по стандарту США), 0,85 мм (контрольное сито #20 по стандарту США), 0,6 мм (контрольное сито #30 по стандарту США), 0,425 мм (контрольное сито #40 по стандарту США), 0,25 мм (контрольное сито #60 по стандарту США), и 0,150 мм (контрольное сито #100 по стандарту США) промывали деионизированной водой, и вытирали насухо с помощью безворсовых салфеток Kimwipes. После определения массы каждого сита, их устанавливали друг на друга, начиная с самого маленького размера (#100) внизу до самого большого размера (#8) наверху. В верхнее сито медленно наливали 100 мл композиции ГК-ВС/ПЭГ-(SH)2/TA с ГК (TA 10) (Пример 37). После того, как большая часть жидкого компонента образца проходила через верхнее сито, медленно добавляли в верхнее сито приблизительно 50 мл 0,9% физиологического раствора, для того чтобы промыть компонент геля, который был задержан на сите. После того, как жидкий компонент проходил через сито, сито удаляли из стопки. Этот процесс повторяли до тех пор, пока каждое сито не было промыто и удалено из стопки. Капли избыточного физиологического раствора, которые оставались на каждом сите, удаляли с помощью туалетной бумаги. Определяли суммарную массу каждого сита (массу сита и задержанного геля). Рассчитывали массу частиц геля, задержанных на каждом сите, путем вычитания исходной массы сита из суммарной массы сита. Рассчитывали процент задержанного каждым ситом геля путем деления массы геля, задержанного на конкретном сите, на суммарную массу геля, задержанного на всех ситах.
ПРИМЕР 41
СУСПЕНЗИЯ ГЕЛЯ ГК-ВС/ПЭГ-(SH)2 С ГИАЛУРОНОВОЙ КИСЛОТОЙ - ГК НАБУХАНИЕ
Каждую из трех стерильных емкостей объемом 125 мл взвешивали на весах, и добавляли в каждую из трех емкостей 14,97 г, 14,95 г и 15,00 г раствора 14 мг/мл ГК-ВС в воде (отфильтрованного через стерильные фильтры с размером пор 0,2 мкм, поливинилиденфторидную мембрану). В каждую емкость добавляли 0,375 мл стерильного отфильтрованного (через стерильный фильтр с размером пор 0,2 мкм) 1M раствор фосфата натрия, pH 7,4, и тщательно перемешивали. В каждую емкость добавляли 0,543 мл раствора 50 мг/мл ПЭГ(SH)2 (стерильный отфильтрованный через стерильный фильтр с размером пор 0,2 мкм) и тщательно перемешивали. Приведенные выше стадии осуществляли в боксе для проведения биологических исследований. Смеси помещали на ночь в сушильный шкаф с температурой 37°C. Композиции вынимали из сушильного шкафа, наружную часть емкостей протирали смесью 70/30 изопропанол/вода и затем переносили в бокс для проведения биологических исследований. Каждый гель измельчали с помощью стерильной палочки. Затем в емкости добавляли 86,40 г, 86,21 г и 86,31 г раствора 7,83 мг/мл ГК в 0,9% физиологическом растворе (отфильтрованного через стерильный фильтр с размером пор 0,2 мк, поливинилиденфторидную мембрану). Гели набухали при комнатной температуре в течение 3 часов. Каждую смесь затем пропускали через сетку с размером отверстий 0,85 мкм, установленную в корпусе фильтра [Вырубали диск из полиэфирной сетки диаметром 23 мм (фирмы McMaster Carr, номер по каталогу 9218T13, размер отверстий: 20,3×20,3, размер квадратов/прямоугольников: 0,0331", номинальное значение в микронах: 840 микрон, доля живого сечения: 46, диаметр нити: 0,0157") с помощью пробойника для кожи диаметром 23 мм. Диск вставляли в держатель шприцевого фильтра диаметром 25 мм (фирмы Cole Palmer, номер по каталогу EW-29550-42), и держатель фильтра закрывали. Держатель фильтра, который содержал сетку, стерилизовали в автоклаве]. Собранную после пропускания через сетку смесь затем вторично пропускали через сетку с размером отверстий 0,85 мкм. Собранную смесь затем хранили в пластиковой емкости.
ПРИМЕР 42
РАСФАСОВКА СУСПЕНЗИИ ГЕЛЯ ГК-ВС/ПЭГ-(SH)2 С ГИАЛУРОНОВОЙ КИСЛОТОЙ
Затем 6 мл каждой композиции из Примера 41 переносили в стеклянный шприц объемом 10 мл (стеклянный шприц BD Hypak, P/N 47262119), который имел колпачок. Стержень поршня вкручивали в задний торец стерильной пробки (BD, P/N 47318319), после чего пробку/поршень вставляли в корпус шприца. Шприц переворачивали, и колпачок шприца слегка ослабляли. Нажимали на поршень до тех пор, пока из шприца не удалялась большая часть воздуха. Затем на шприц плотно надевали колпачок. Приведенные выше стадии осуществляли в боксе для проведения биологических исследований. Процесс повторяли до тех пор, пока не был расфасован весь продукт.
ПРИМЕР 43
ОПРЕДЕЛЕНИЕ РАЗМЕРА ЧАСТИЦ - ПРОМЫВКА ФИЗИОЛОГИЧЕСКИМ РАСТВОРОМ
Сита из нержавеющей стали с размером отверстий 2,36 мм (контрольное сито #8 по стандарту США), 1,4 мм (контрольное сито #14 по стандарту США), 1 мм (контрольное сито #18 по стандарту США), 0,85 мм (контрольное сито #20 по стандарту США), 0,6 мм (контрольное сито #30 по стандарту США), 0,425 мм (контрольное сито #40 по стандарту США), 0,25 мм (контрольное сито #60 по стандарту США), и 0,150 мм (контрольное сито #100 по стандарту США) промывали деионизированной водой, и вытирали насухо с помощью безворсовых салфеток Kimwipes. После определения массы каждого сита, их устанавливали друг на друга, начиная с самого маленького размера (#100) внизу до самого большого размера (#8) наверху. В верхнее сито медленно наливали 100 мл композиции суспензии геля ГК-ВС/ПЭГ-(SH)2 с гиалуроновой кислотой (Пример 41). После того, как большая часть жидкого компонента образца проходила через верхнее сито, медленно добавляли в верхнее сито приблизительно 50 мл 0,9% физиологического раствора, для того чтобы промыть компонент геля, который был задержан на сите. После того, как жидкий компонент проходил через сито, сито удаляли из стопки. Этот процесс повторяли до тех пор, пока каждое сито не было промыто и удалено из стопки. Капли избыточного физиологического раствора, которые оставались на каждом сите, удаляли с помощью туалетной бумаги. Определяли суммарную массу каждого сита (массу сита и задержанного геля). Рассчитывали массу частиц геля, задержанных на каждом сите, путем вычитания исходной массы сита из суммарной массы сита. Рассчитывали процент задержанного каждым ситом геля путем деления массы геля, задержанного на конкретном сите, на суммарную массу геля, задержанного на всех ситах.
римент-1
римент-2
римент-3
ПРИМЕР 44
СТЕРИЛЬНОСТЬ И ПРОВЕДЕНИЕ ИСПЫТАНИЯ НА ЭНДОТОКСИН
Гель ГК-ВС/ПЭГ-(SH)2 с ГК (Пример 42, Пример 5) и гель ГК-ВС/ПЭГ-(SH)2/TA С ГК (Пример 37, TA10) подвергали испытанию на стерильность и эндотоксины с помощью компании WuXi AppTec с использованием протокола # BS210CВY.203 и BE215CВY.203, соответственно. Все образцы были стерильными и имели уровни эндотоксинов <0,5 ЕД/мл.
ПРИМЕР 45
IN VIVO ИСПЫТАНИЕ НА БИОСОВМЕСТИМОСТЬ ГК-ВС/ПЭГ-(SH)2 С ГК
Для изучения биосовместимости in vivo испытуемого материала в сравнении с выпускаемым промышленностью вязкоупругим продуктом, было проведено следующее in-vivo исследование на козах.
Используемые для исследования материалы:
Испытуемый материал: Гидрогель - ГК-ВС/ПЭГ-(SH)2 с ГК [Серия NB51:119]
Контрольный материал: Синвиск - выпускаемая промышленностью вязкоэластичная добавка
Для этого исследования использовали суммарно 6 коз со сформировавшимся скелетом. Их приобретали у источника, одобренного Министерством сельского хозяйства США. В начале исследования животные весили от 65 до 99 фунтов. Коз проверяли на отсутствие козлиного артрита-энцефалита (CAE) и болезни Джона, перед тем как их подвергнуть исследованию. Для каждого животного было проведено обследование общего состояния здоровья (с учетом визуального обследования состояния конечностей, незатрудненности дыхания, и отсутствия диареи и выделения из носа) квалифицированным ветеринаром, перед тем как подвергнуть их исследованию. Животных обследовали на любой признак заболевания или хромоты. Отбор животных в группу для исследования определялся отсутствием заболевания, клиническим здоровьем, и отсутствием факта использования коленного сустава для исследований в прошлом. Коз подвергали акклиматизации в течение соответствующего периода времени, определяемого соответствующими нормами. Условия содержания животного соответствовало действующим законам и нормам, относящимся к лабораторным животным, а именно, Акту об охране диких животных, Общему закону 89-544 с внесенными изменениями в Общий закон 99-198, федеральный регистр 52:16, Министерство сельского хозяйства США - Служба инспекции животных и растений (USDA-APHIS), 1985 и Политике Министерства здравоохранения США по гуманному обращению с лабораторными животными, Служба по защите рисков при проведении научных исследований/Национальный институт здравоохранения США, Сентябрь, 1986. После инъекции коз содержали в находящихся внутри помещения больших выгонах (загонах). В течение всего времени козы находились в условиях свободного поведения. Все животные получали приблизительно 2 фунта в день пищевого рациона для некрупного жвачного животного, а также неизмельченное сено. Доступ к водопроводной воде был неограничен. Кормление прекращали приблизительно за 12-24 часа до анестезии, а доступ к воде прекращали приблизительно за 12 часов до инъекций. Каждое животное маркировали с помощью особой ушной бирки.
Терапия
Исследование было спланировано следующим образом.
Группы и назначенная терапия
(1,5 мл)
(1,5 мл)
Гидрозольный испытуемый материал
Синвиск
Гидрозольный испытуемый материал
Синвиск
Гидрозольный испытуемый материал
Синвиск
Синвиск
Гидрозольный испытуемый материал
Синвиск
Гидрозольный испытуемый материал
Синвиск
Гидрозольный испытуемый материал
Основная методика инъекции была одинаковой для всех субъектов. Все инъекции проводили в условиях строгой стерильности. Животных анестезировали путем внутривенной инъекции диазепама (0,1-0,5 мг/кг) и кетамина (4,4-7,5 мг/кг). Каждое колено было физически обследовано на выбивание, амплитуду движения, припухлость, температуру, крепитацию, на траекторию движения коленной чашечки и вальгусные/варусные нарушения. Все инъекции проводили с использованием обычных асептических методов. Левое и правое колено подготавливали для инъекции путем выстригания шерсти в соответствующих областях и затем дезинфицирования их путем тщательной обработки хлоргексидином. Животное переводили в положение лежа на спине. Правое колено дезинфицировали три раза путем тщательной обработки хлоргексидином, чередующейся с обработкой с помощью 70% изопропилового спирта, и окрашивали раствором йода.
Для инъекции в каждый коленный сустав использовали стандартную методику. Стерильную иглу 21 размера длиной 2 дюйма вводили во внутрисуставное пространство через переднемедиальный доступ. Вводили иглу до касания с боковой стенкой межмыщелковой вырезки медиального бедренного мыщелка и слегка отводили ее назад. Инъецировали в правый сустав 1,5 мл Испытуемого материала для Группы 1A или 1,5 мл Контрольного материала для Группы 1B. Инъекционную иглу удаляли, и поддерживали повышенное давление в месте инъекции. Инъецированный коленный сустав затем 20 раз подвергали полному циклу на "сгибание - разгибание". Сразу после этого, левый коленный сустав дезинфицировали три раза путем тщательной обработки хлоргексидином, чередующейся с обработкой с помощью 70% изопропилового спирта, и окрашивали раствором йода, и инъецировали в левый коленный сустав 1,5 мл Контрольного материала для Группы 1A или 1,5 мл Испытуемого материала для Группы 1B таким же образом, как описано выше для правого коленного сустава. Инъекционную иглу удаляли, и поддерживали повышенное давление в месте инъекции. Инъецированный коленный сустав затем 20 раз подвергали полному циклу на "сгибание - разгибание".
После инъекции был проведена проверка тех животных, которые проявляли признаки недомогания и дискомфорта, и в случае необходимости, им вводили дополнительное количество анальгетика. Все методы обработки регистрировали в соответствующей документации по исследованию.
Животных гуманно умерщвляли через 24±1 часов после начала инъекции путем внутривенного введения диазепама 0,22 мг/кг и кетамина 10 мг/кг для достижения состояния общей анестезии. Затем анестезированным животным вводили внутрижелудочно летальную дозу концентрированного раствора хлорида калия (KCl) до тех пор, пока не констатировали остановку сердца.
Анализ
Визуальные морфологические наблюдения
После сбора коленных суставов, их вскрывали и проводили описанный в таблице 20 визуальный осмотр инъецированных коленных суставов. Проводили фотографирование. Дегенеративные изменения суставов не оценивали.
Визуальная оценка и сбор образцов
Кроме того, проводили полуколичественное оценивание сустава с помощью единственного эксперта, как показано в Таблице 21.
Качественная оценка на основе визуального осмотра
Суммарное количество баллов при визуальном осмотре составляло сумму баллов окрашивания, гиперемии, и отечности (0-8 баллов).
Оценка синовиальной жидкости
После сбора синовиальной жидкости из открытых суставов, регистрировали суммарный объем. Визуально и полуколичественно в баллах оценивали вязкость, прозрачность и цвет жидкости, как показано в Таблице 22. С помощью гемоцитометра определяли суммарное количество лейкоцитов. Кроме того, был приготовлен мазок синовиальной жидкости для дифференциального микроскопического анализа. Оставшуюся синовиальную жидкость сохраняли в замороженном виде в криопробирках с индивидуальными этикетками при -80°C. Мазок синовиальной жидкости сохраняли для возможного проведения анализа в будущем.
Описание и оценка в баллах синовиальной жидкости
Суммарное количество баллов для синовиальной жидкости составляло сумму баллов цвета, прозрачности и сухожилия (0-8 баллов).
Результаты
В таблице ниже и на ФИГ. 14 показано, что ГК-ВС/ПЭГ-(SH)2 с ГК является биосовместимым в суставе в течение 24 часов в экспериментальной модели коз.
Визуальные оценки в баллах синовиальной жидкости и сустава (отсортированные относительно Испытуемого материала (TM) и Контрольного материала)
Прозрачность; сухожилие
Прозрачность: C=прозрачная (0), H=белесоватая (1), D=мутная (2)
Сухожилие (вязкость): N - нормальная (0), A=аномальная (1), W=водянистая (2)
TM=Испытуемый материал
Дифференциация клеток и количество лейкоцитов (WBC) в синовиальной жидкости
бирка
мм3
в синовиальной жидкости
TM
с поверх-ностными клетками
фагоцитоз
TM
PMN
Лимфо-циты
Моно-циты
Эозино-филы
Базо-филы
отклонение
отклонение
PMN=полиморфноядерные лейкоциты
WBC=лейкоциты
TM=Испытуемый материал
Для специалистов в этой области является очевидным, что для описанных выше вариантов осуществления могут быть сделаны изменения без их отклонения от общей идеи изобретения. Поэтому, следует иметь в виду, что раскрываемые конкретные варианты осуществления не ограничивают изобретение, и предполагается, что изобретение охватывает модификации, которые соответствуют сущности и объему изобретения, определяемым прилагаемым пунктами формулы изобретения. Любая комбинация описанных выше элементов во всех возможных их вариантах входит в объем изобретения, если только в описании изобретения не указано иначе, или же если это явно противоречит смыслу.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИИ КОЖНОГО НАПОЛНИТЕЛЯ ДЛЯ ЛЕЧЕНИЯ МЕЛКИХ МОРЩИН | 2012 |
|
RU2626513C2 |
| СШИВАЕМЫЕ IN SITU ПОЛИСАХАРИДНЫЕ КОМПОЗИЦИИ И ВАРИАНТЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2734419C2 |
| Протез синовиальной жидкости и способ его получения | 2021 |
|
RU2782921C1 |
| КОМПОЗИЦИЯ СО СШИТОЙ ГИАЛУРОНОВОЙ КИСЛОТОЙ ДЛЯ НАРАЩИВАНИЯ ТКАНЕЙ | 2003 |
|
RU2351367C9 |
| НАПОЛНИТЕЛЬ С ГИАЛУРОНОВОЙ КИСЛОТОЙ, ИМЕЮЩИЙ ВЫСОКУЮ СПОСОБНОСТЬ ЛИФТИНГА И НИЗКУЮ СИЛУ ИНЪЕКЦИИ | 2019 |
|
RU2770541C1 |
| КОМПОЗИЦИЯ КОЖНОГО НАПОЛНИТЕЛЯ И СПОСОБ ЛЕЧЕНИЯ | 2012 |
|
RU2679317C1 |
| КОМПОЗИЦИИ КОЖНЫХ НАПОЛНИТЕЛЕЙ | 2012 |
|
RU2638713C2 |
| ИМПЛАНТАТЫ ДЛЯ МОДЕЛИРОВАНИЯ, УВЕЛИЧЕНИЯ ИЛИ КОРРЕКЦИИ ЧАСТЕЙ ЛИЦА, НАПРИМЕР ПОДБОРОДКА | 2016 |
|
RU2715234C2 |
| ВЫСОКОМОЛЕКУЛЯРНЫЕ КОСМЕТОЛОГИЧЕСКИЕ КОМПОЗИЦИИ | 2020 |
|
RU2839279C1 |
| ГЕЛЕВЫЕ ПОЛИСАХАРИДНЫЕ КОМПОЗИЦИИ И СПОСОБЫ ДЛИТЕЛЬНОЙ ДОСТАВКИ ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2008 |
|
RU2472487C2 |
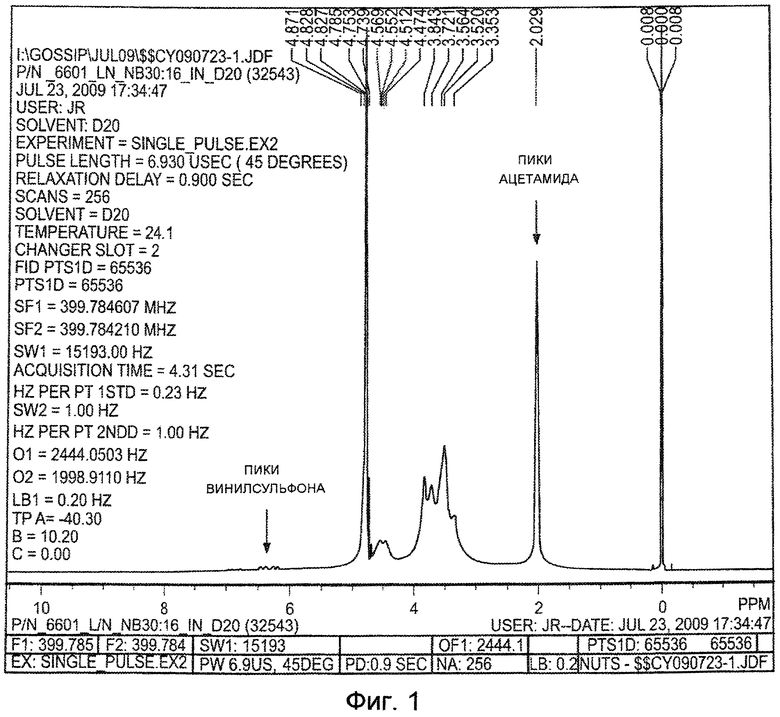
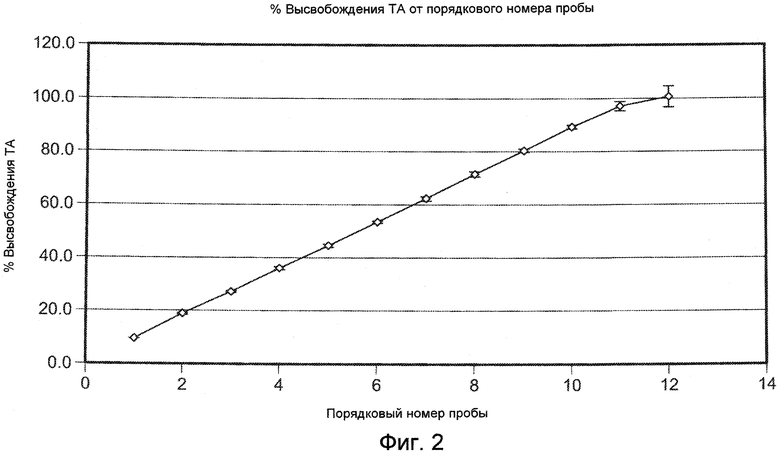
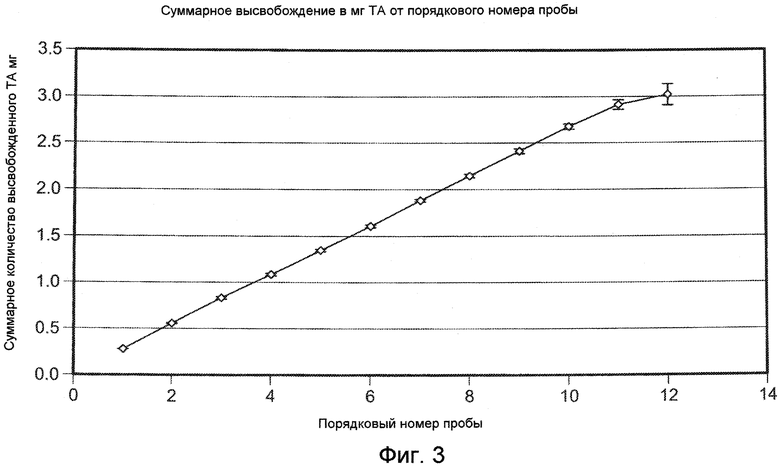
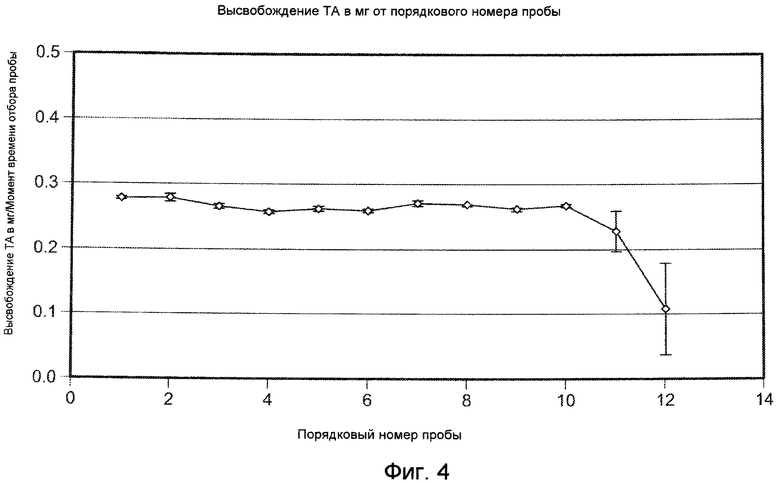
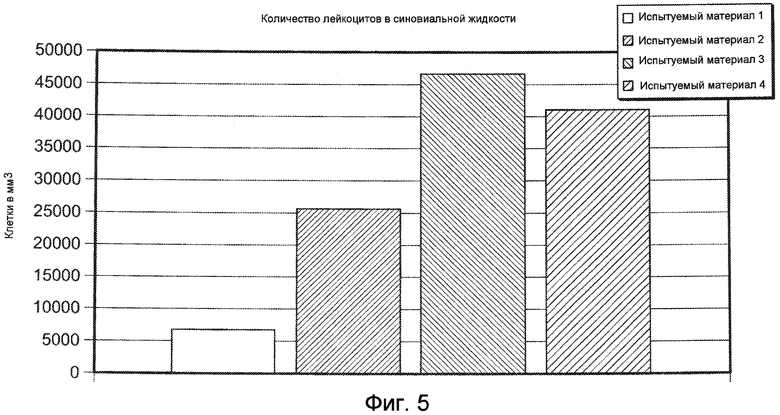
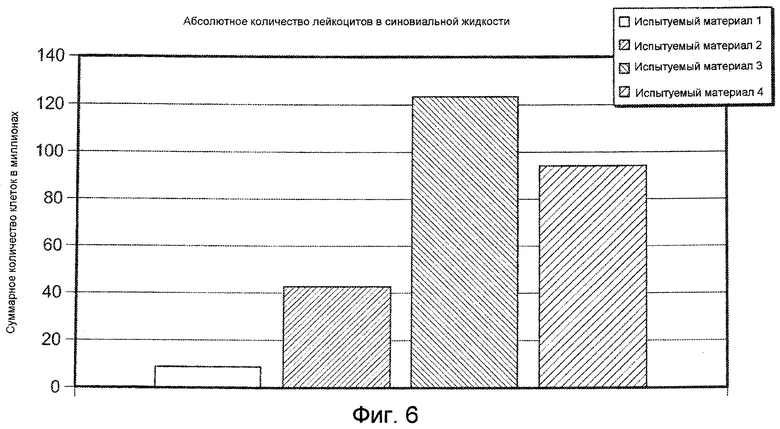
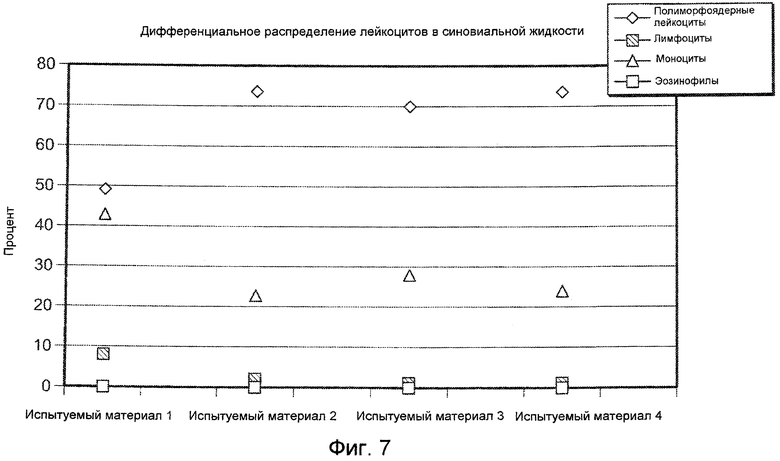
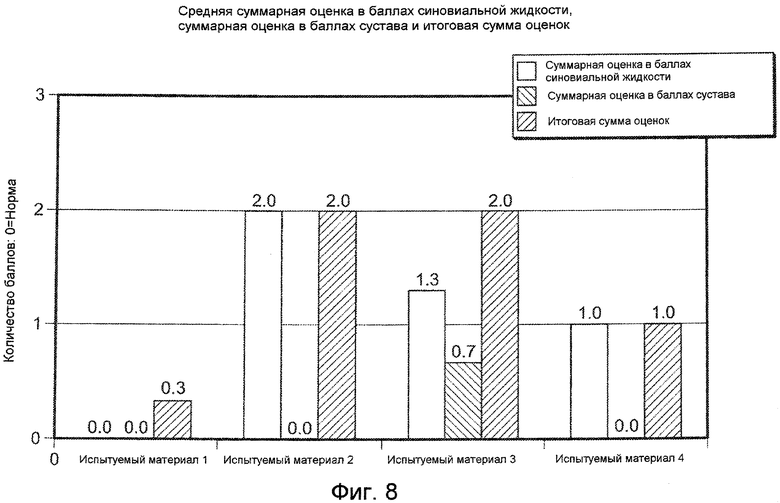
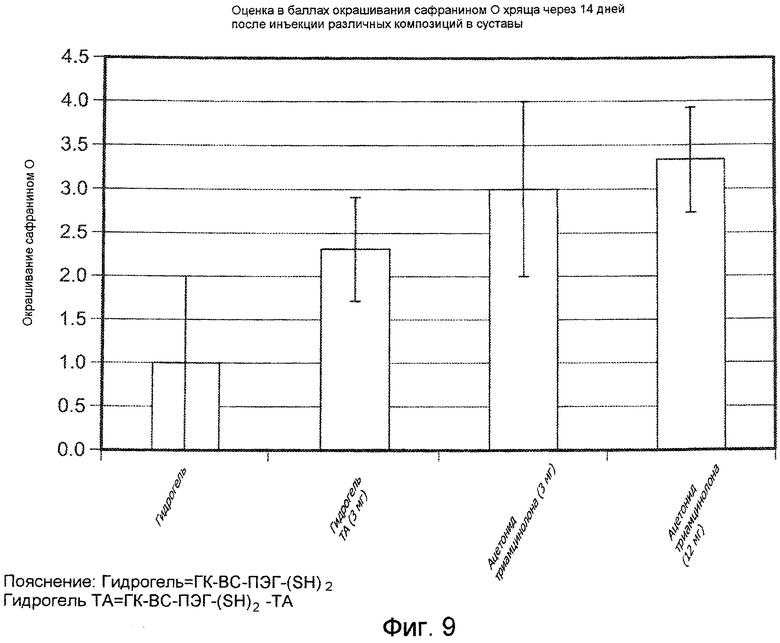
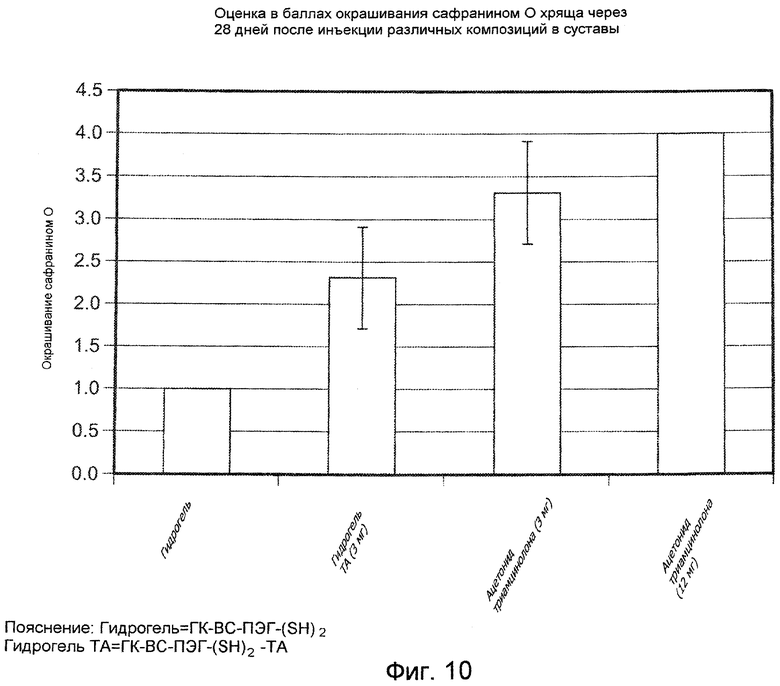
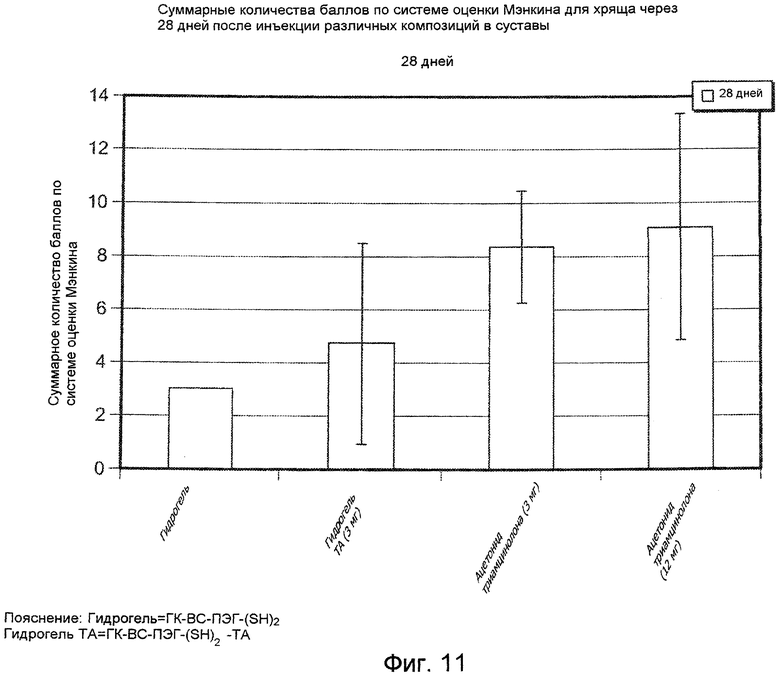
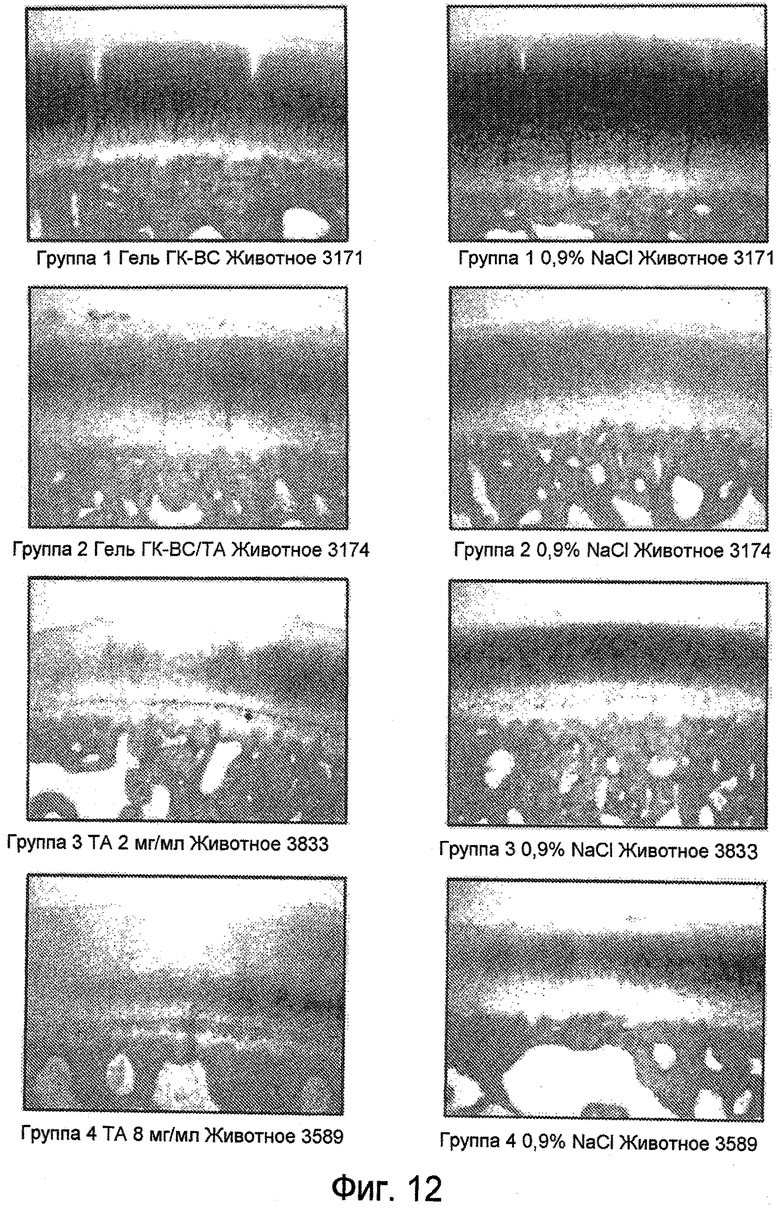
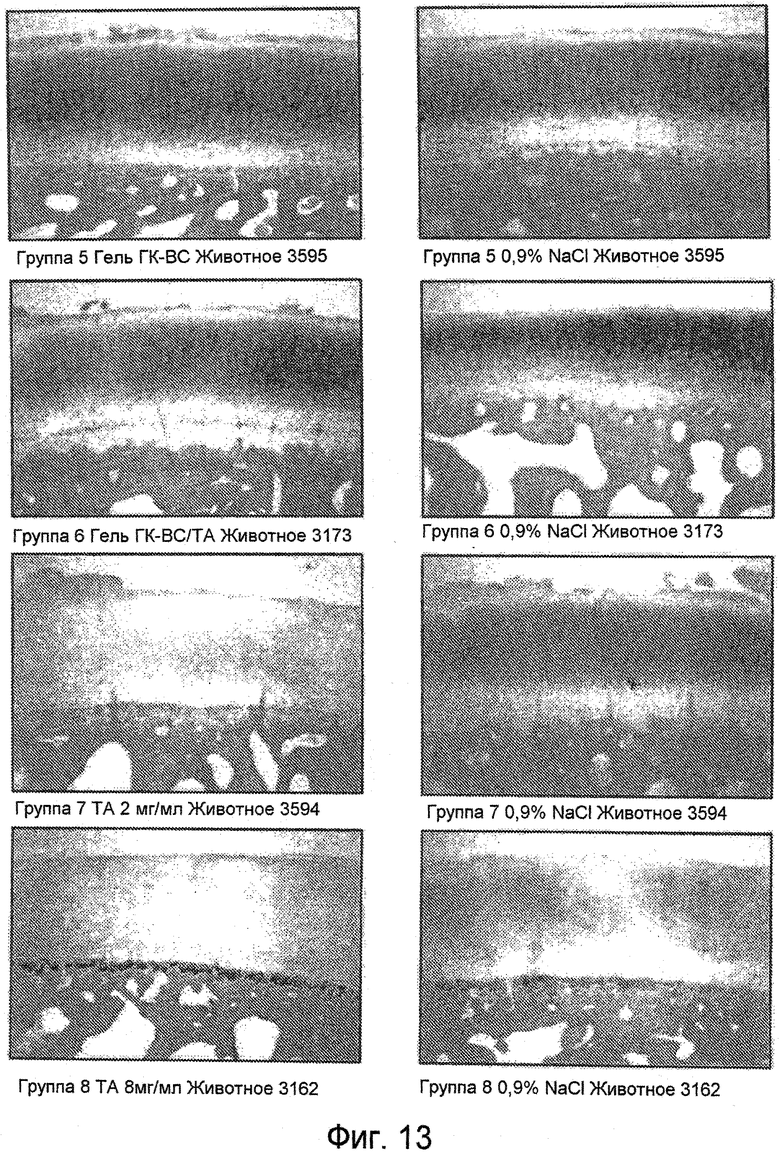
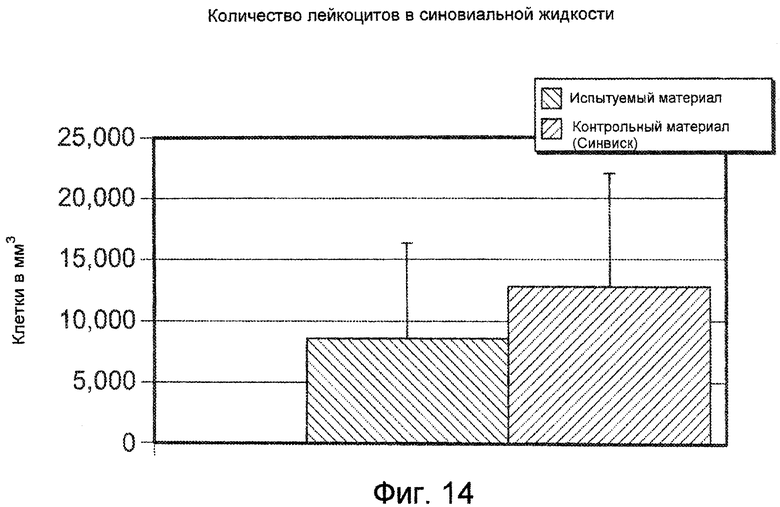
 Группа изобретений относится к медицине. Описаны композиции, включающие гиалуроновую кислоту с низкой степенью модификации функциональных групп, и смеси, получаемые в результате регулируемой реакции такой слегка модифицированной гиалуроновой кислоты с подходящими дифункциональными или многофункциональными сшивающими реагентами. Композиции обладают низкими противовоспалительными свойствами при инъекции in vivo и могут быть использованы в качестве медицинских устройств, биомедицинских адгезивов и герметиков, а также для доставки в строго определенное место биоактивных веществ. 10 н. и 39 з.п. ф-лы, 14 ил., 24 табл., 45 пр.
Группа изобретений относится к медицине. Описаны композиции, включающие гиалуроновую кислоту с низкой степенью модификации функциональных групп, и смеси, получаемые в результате регулируемой реакции такой слегка модифицированной гиалуроновой кислоты с подходящими дифункциональными или многофункциональными сшивающими реагентами. Композиции обладают низкими противовоспалительными свойствами при инъекции in vivo и могут быть использованы в качестве медицинских устройств, биомедицинских адгезивов и герметиков, а также для доставки в строго определенное место биоактивных веществ. 10 н. и 39 з.п. ф-лы, 14 ил., 24 табл., 45 пр.
1. Гидрогель для использования в медицине, образуемый путем реакции гиалуроновой кислоты, имеющей 1-10% гидроксильных групп, дериватизированных путем реакции с дивинилсульфоном ("2-(винилсульфонил)этокси)1-10%гиалуроновой кислотой"), с сшивающим реагентом, представляющим собой тиол-функционализированный полиэтиленгликоль, имеющий 2 или 4 тиольные группы.
2. Гидрогель по п.1, где гиалуроновая кислота имеет степень конверсии гидроксильных групп в 2-(винилсульфонил)этокси группы, выбранную из 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9% и 10%.
3. Гидрогель по п.2, где гиалуроновая кислота имеет степень конверсии гидроксильных групп в 2-(винилсульфонил)этокси группы приблизительно 4-5% на повторяющееся звено дисахарида.
4. Гидрогель по любому из пп.1-3, где гиалуроновая кислота имеет среднечисленную молекулярную массу в интервале от 700 до 3 миллионов дальтонов.
5. Гидрогель по любому из пп.1-3, где функционализированный тиолом полиэтиленгликоль имеет молекулярную массу в интервале приблизительно от 250 до приблизительно 20000 дальтонов.
6. Гидрогель по п.5, где функционализированный тиолом полиэтиленгликоль является полиэтиленгликольдитиолом (ПЭГ дитиолом).
7. Гидрогель по п.1, где функционализированный тиолом полиэтиленгликоль является четырехзвенным и имеет пентаэритовое ядро.
8. Гидрогель по любому из пп.1-3, 6 или 7, включающий менее чем десять процентов непрореагировавших тиольных групп и менее чем 10% непрореагировавших винилсульфоновых групп.
9. Гидрогель по любому из пп.1-3, 6 или 7, включающий массовый процент полимера в воде в интервале приблизительно от 0,5 до 5,0 процентов.
10. Гидрогель по любому из пп.1-3, 6 или 7, включающий биоактивный агент.
11. Композиция для использования в медицине, включающая частицы гидрогеля по любому из пп.1-9 в водном растворе гиалуроновой кислоты.
12. Композиция по п.11, где частицы гидрогеля имеют размер в интервале приблизительно от 0,10 до 3,0 миллиметров.
13. Композиция по п.11 в форме водной суспензии.
14. Композиция по п.11, где водный раствор является физиологическим раствором.
15. Композиция по п.11, где композиция представляет собой стерильную композицию.
16. Композиция по п.11, дополнительно включающая биоактивный агент.
17. Композиция по п.16, где биоактивный агент является кортикостероидом.
18. Композиция по п.17, где кортикостероид является фармацевтически приемлемой солью триамцинолона.
19. Композиция по п.18, где кортикостероид является ацетонидом триамцинолона.
20. Композиция по п.11, включающая живые клетки.
21. Композиция по п.11, расфасованная в шприц.
22. Гидрогель по любому из пп.1-3, 6 или 7, расфасованный в шприц.
23. Композиция по п.21, экструдируемая через шприц с иглой 21 размера.
24. Гидрогель по п.22, экструдируемый через шприц с иглой 21 размера.
25. Применение гидрогеля по одному из пп.1-10 для введения во внутрисуставное пространство сустава субъекта.
26. Применение композиции по любому из пп.11-20 для введения во внутрисуставное пространство сустава субъекта.
27. Применение по п.25 для лечения острого или хронического воспаления.
28. Применение по п.26 для лечения острого или хронического воспаления.
29. Применение по п.27, где острое или хроническое воспаление связано с остеоартритом, ревматоидным артритом, другими воспалительными артритами и повторяющимся применением.
30. Применение по п.28, где острое или хроническое воспаление связано с остеоартритом, ревматоидным артритом, другими воспалительными артритами и повторяющимся применением.
31. Применение гидрогеля по любому из пп.1-10 для инъекции или имплантации около или внутрь кости, зубов, нервов, хряща, кровеносных сосудов, мягких тканей или других тканей млекопитающего.
32. Применение композиции по любому из пп.11-20 для инъекции или имплантации около или внутрь кости, зубов, нервов, хряща, кровеносных сосудов, мягких тканей или других тканей млекопитающего.
33. Способ получения (2-(винилсульфонил)этокси)1-10%гиалуроновой кислоты, включающий (i) реакцию гиалуроновой кислоты с молярным избытком дивинилсульфона при температуре окружающей среды в течение периода времени до 3 минут, приводящую в результате к взаимодействию от 1% до 10% гидроксильных групп на повторяющихся звеньях дисахарида гиалуроновой кислоты с дивинилсульфоном.
34. Способ по п.33, проводимый в водном растворе основания.
35. Способ по п.33, где стадию реакции проводят при температуре 20-25°С.
36. Способ по п.33, где стадию реакции проводят в течение времени от 10 секунд до приблизительно 120 секунд.
37. Способ по п.34, где водный раствор основания выбирают из водного раствора гидроксида натрия или водного раствора гидроксида калия.
38. Способ по п.34, где способ дополнительно включает прерывание реакции путем добавления кислоты.
39. (2-(Винилсульфонил)этокси)1-10%гиалуроновая кислота для использования в медицине, полученная способом по любому из пп.33-38.
40. Применение (2-(винилсульфонил)этокси)1-10%гиалуроновой кислоты для получения гидрогеля, имеющего низкую степень сшивания, в результате реакции с сшивающим реагентом, представляющим собой тиол-функционализированный полиэтиленгликоль, имеющий 2 или 4 тиольные группы.
41. Способ получения гидрогеля, имеющего низкую степень сшивания, включающий реакцию (2-(винилсульфонил)этокси)1-10%гиалуроновой кислоты с сшивающим реагентом, представляющим собой тиол-функционализированный полиэтиленгликоль, имеющий 2 или 4 тиольные группы, в водном растворе при температуре в интервале от 20°С до 45°С.
42. Способ по п.41, где реакцию проводят при физиологическом значении рН.
43. Способ по п.41, где сшивающий реагент, представляющий собой тиол-функционализированный полиэтиленгликоль, стерилизуют перед стадией реакции.
44. Способ по п.41, где после стадии реакции полученной смеси дают возможность прореагировать в течение периода времени от 8 до 36 часов с образованием в результате геля.
45. Способ по п.41, проводимый в стерильных условиях.
46. Способ по любому из пп.41-45, дополнительно включающий добавление активного средства в водный раствор.
47. Способ по п.46, где активное средство является кортикостероидом.
48. Способ по п.47, где кортикостероид выбирают из ацетонида триамцинолона, гексацетонида триамцинолона, бенетонида триамцинолона и фуретонида триамцинолона.
49. Способ по п.47, где кортикостероид является ацетонидом триамцинолона.
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
2015-01-20—Публикация
2010-07-23—Подача