Изобретение относится к медицине, а именно к экспериментальной медицине, кардиологии и касается лечения больных с фибрилляцией предсердий.
Актуальность темы продиктована высокой распространенностью фибрилляции предсердий (ФП) и сравнительно высоким риском ее рецидивирования после эндоваскулярного лечения. ФП представляет собой наджелудочковую аритмию, характеризующуюся хаотической электрической активностью предсердий с частотой их сокращения 300-700 уд./мин. и нерегулярным ритмом желудочков (при условии отсутствия полной атриовентрикулярной блокады). Нарушения внутрисердечной гемодинамики при ФП приводят к резкому увеличению риска тромбоза и, в частности, тромбоэмболического инсульта. ФП является самой распространенной тахиаритмией в клинической практике, заболеваемость которой достигает 1-2%. Поскольку риск развития ФП увеличивается с возрастом, есть основания ожидать удвоения числа пациентов с ФП в ближайшие 30 лет, что связано с увеличением среднего возраста населения (Kirchhof P. et al. Eur Heart J. 2016;10:2-60). Эндоваскулярная изоляция легочных вен является «золотым стандартом» лечения фармакорезистентной ФП, однако она сопровождается стабильным восстановлением ритма предсердий в течение 5 лет менее чем в 50% случаев, даже при условии проведения в экспертных медицинских центрах (Weerasooriya R. et al. J Am Coll Cardiol. 2011;57:160-166). В связи с этим в настоящее время разрабатываются различные дополнительные подходы, направленные на повышение эффективности катетерной аблации при ФП, одним из которых является деструкция нейронов ганглионарных сплетений сердца.
Ганглионарные сплетения (ГС) сердца представляют собой взаимосвязанные кластеры нейронов, формирующих вегетативные ганглии на поверхности сердца, преимущественно в эпикардиальной жировой ткани. В состав ГС входят как афферентные, так и эфферентные нейроны симпатической и парасимпатической нервной системы. Доказано, что интегральное повышение нейрональной активности ГС способствует как инициации, так и поддержанию нарушений ритма сокращения предсердий при ФП (Ро S.S. et al. Heart Rhythm. 2006;3:201-208). Предположительно, это происходит за счет триггерного механизма, инициированного ранней постдеполяризацией кардиомиоцитов предсердий (Patterson Е. et al. J Am Coll Cardiol. 2006;47:1196-1206). Гиперактивация ГС включает повышение частоты разрядов как симпатических, так и парасимпатических нейронов, что получило отражение в виде концепции симпатовагального разряда (Sharifov O.F. et al. J Am Coll Cardiol. 2004;43:483^190). Известно, что холинергическая стимуляция вызывает уменьшение продолжительности потенциала действия кардиомиоцитов, а адренергическая - увеличение интенсивности высвобождения Са2+из саркоплазматического ретикулума. Оба фактора увеличивают входящий натриевый ток через «прямой» вариант работы натрий-кальциевого обменника, что и вызывает раннюю постдеполяризацию (Nakagawa Н. et al. Heart Rhythm. 2009;6:S26-S34).
Эти представления о механизмах индукции ФП привели к внедрению в клиническую практику методики торакоскопической аблации ГС либо в варианте основного метода лечения ФП, либо, чаще, в качестве дополнительного подхода к традиционной изоляции легочных вен.
Результаты проведенных мета-анализов подтверждают эффективность аблации ГС, выполняемой совместно с изоляцией устьев легочных вен, по крайней мере у пациентов с пароксизмальной формой ФП (Kampaktsis P.N. et al. J Interv Card Electrophysiol. 2017;50:253-260). Вместе с тем, используемые методы аблации ГС основаны на необратимом и неселективном воздействии на различные нейроны ГС, что снижает потенциальную клиническую значимость данной процедуры. Точный механизм положительного влияния аблации ГС на течение ФП остается неизвестным.
В последние годы в литературе появились работы, посвященные более направленному и потенциально обратимому воздействию на нейроны ГС.Так, для этого были использованы нагруженные неселективным нейротоксином N-изопропилакриламидом магнитные наночастицы (НЧ), вводимые непосредственно в ГС или в соответствующую расположению ГС коронарную артерию, с последующим воздействием внешнего магнитного поля для обеспечения концентрации НЧ в зоне ГС (Yu L. et al. Circulation. 2010;122:2653-2659).
Имеются сообщения об использовании для деструкции нейронов ГС магнитных (Yu L. et al. JACC Clin Electrophysiol. 2018;4:1347-1358) и немагнитных наночастиц, содержащих хлорид кальция (O'Quinn М.Р. et al. Heart Rhythm. 2019;16:597-605).
Известно, что липосомальная форма препаратов обеспечивает многократное увеличение их доставки в нервные клетки за счет эффективного прохождения содержимого липосом в нейроны (Zhigaltsev I.V. et al. J Liposome Res. 2001;11(1):55-71).
Также известны перспективные исследования, связанные с долгосрочным подавлением мерцательной аритмии путем инъекции ботулинического токсина в эпикардиальные жировые подушки у пациентов, перенесших операцию на сердце: годичное наблюдение за рандомизированным пилотным исследованием (Pokushalov Е. et al. Circ Arrhythm Electrophysiol. 2015;8:1334-1341). Использование ботулинического токсина для модуляции активности нейронов ГС обеспечивает блокаду экзоцитоза синаптических везикул, содержащих ацетилхолин. Известное исследование принято за прототип к заявляемому способу.
Задача заявляемого изобретения заключается в создании способа воздействия на ганглионарные сплетения сердца, позволяющего повысить эффективность лечения больных с фибрилляцией предсердий после эндоваскулярного лечения путем введения селективных нейротоксинов, инкапсулированых в липосомы, в жировую ткань сердца.
Технический эффект достигаемый заявляемым изобретением состоит в минимизировании потенциальных побочных эффектов, возникающих в результате попадания нейротоксинов в кровоток и их действия на удаленные нейрональные структуры и обеспечении более интенсивного воздействия на целевую ткань, за счет введения в жировую ткань сердца, где находятся скопления ганглиев предсердий, иннервирующих предсердия и желудочки, селективного нейротоксина - 6-гидроксидопамина, инкапсулированного в липосомы.
Этот технический результат достигается тем, что в предлагаемом способе вводят селективный нейротоксин - 6-гидроксидопамин, инкапсулированный в липосомы, путем трансэндокардиальных микроинъекций в жировую ткань сердца.
Отличием предлагаемого способа от прототипа является:
- во-первых, введение селективного нейротоксина - 6-гидроксидопамина;
- во-вторых, вводимый селективный нейротоксин 6-гидроксидопамина, инкапсулирован в липосомы. В отличие от введения свободных нейротоксинов, липосомы обеспечивают эффект задержки селективных нейротоксинов в целевой ткани с постепенным их высвобождением, что позволяет избежать быстрого удаления нейротоксинов из ткани ГС;
в - третьих, введение селективных нейротоксинов, инкапсулированных в липосомы, осуществляют путем трансэндокардиальных микроинъекций.
Способ трансэндокардиальных микроинъекций выполняется следующим образом.
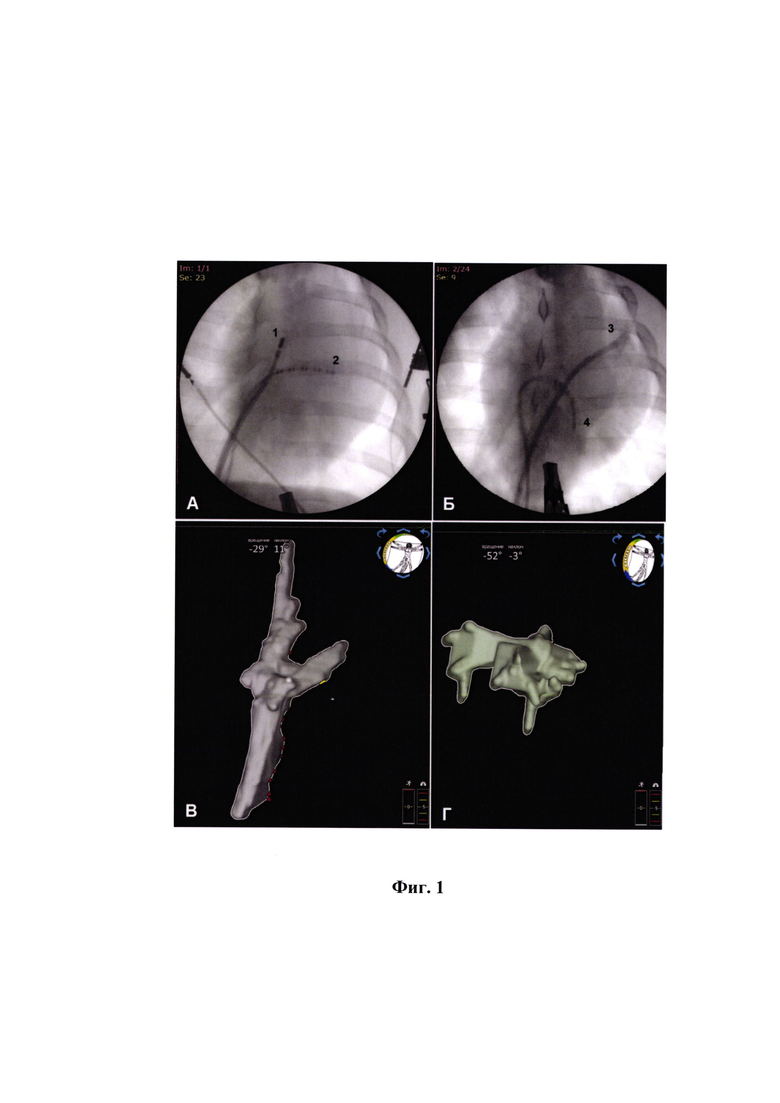
Для трансэндокардиальных микроинъекций используется эндомикардиальный инъекционный катетер, (например, MyoStar, Biosense-Webster Inc., США) введенный через интродьюсер, установленный в бедренную вену. Затем строится 3D карта предсердий с использованием 3D-навигационной системы картирования и рентгенографической установки. При необходимости можно выполнить исходные электрофизиологические измерения: эффективный рефрактерный период (ЭРП), точка Венкебаха и оценить степень индуцируемости фибрилляции предсердий (ФП). Для выполнения трансэндокардиальных микроинъекций в дорсальные (задние для человека) стенки правого и/или левого предсердий, катетер позиционируется перпендикулярно эндокардиальной поверхности предсердия и игла выдвигается на 2-3 мм. Правильное расположение катетера подтверждается рентгенологическим контролем и оценкой положения электрода по данным ЗБ-навигационной системы картирования (фиг. 1А и Б). После выполненной инъекции на карте ставится отметка в виде точки и выполняется следующая инъекция. За одну операцию выполняется от 20 до 30 инъекций с расстоянием между инъекциями 2-5 мм. Все места инъекций видны на карте предсердий (фиг. 1В).
Для установления эффекта от нейротоксинов через один-полтора часа от момента завершения эндокардиальных инъекций выполняется повторное электрофизиологическое исследование. Известно, что денервация сердца вызывает укорочение ЭРП и изменяется степень устойчивости к ФП.
Для подтверждения осуществимости изобретения проводилось исследование на лабораторных свиньях. В группе исследовались 6 свиней. Всем свиньям группы вводили селективный нейротоксин - 6-гидроксидопамин, В среднем одной свинье проводилось по 30 трансэндокардиальных микроинъекций соответствующего селективного нейротоксина.
Пример Липосомальную форму для селективного нейротоксина 6-гидроксидопамина (ЛПС 6-ГД) готовили следующим образом. Сначала готовили липидную пленку. Для этого растворяли соевый лецитин и холестерин в хлороформе в соотношении 10:1 с добавлением 1% альфа токоферола ацетата. Потом растворитель упаривали на ротационном испарителе под вакуумом до образования тонкой липидной пленки. Затем готовили гидратирующий раствор на основе селективного нейротоксина 6-гидроксидопамина следующим образом. Порошок 6-гидроксидопамина растворяли в подкисленном физиологическом растворе с рН~4,5-5 для предотвращения быстрого окисления нейротоксина. Раствор получался персикового цвета. Готовым раствором нейротоксина гидратировали высушенную липидную пленку. На выходе получали липосомы с включенным селективным нейротоксином 6-гидроксидопамином с концентрацией 2 мг/мл. Полученный раствор транспортировали при температуре+4°С для проведения эксперимента in vivo.
Далее осуществляли трансэндокардиальное введение ЛПС 6-ГД с мониторированием эффективного рефрактерного периода. Было проведено по 30 трансэндокардиальных микроинъекций ЛПС 6-ГД в жировую ткань сердца через медиальную часть дорсальной стенки правого предсердия каждой свинье, то есть из полости правого предсердия инъекционным катетером вводили нейротоксины в жировую ткань, которая покрывает наружную стенку правого предсердия и крупные сосуды в воротах сердца, куда входят и выходят анатомические структуры, связующие орган с телом: нервы, артерии, вены и лимфатические сосуды. Целью введения ЛПС 6-ГД были нервы и скопления ганглиев, которые сконцентрированы в хилусе сердца, анатомически расположенного на дорсальной стороне предсердий. Через 60 и 90 минут после выполнения трансэндокардиальных введений ЛПС 6-ГД наблюдалось укорочение эффективного рефрактерного периода в ходе эксперимента (Таблица 1).

ЭРП - эффективный рефрактерный период; ПП - правое предсердие; мс -миллисекунды; МПП - межпредсердная перегородка. Значения представлены в виде среднего значения ± стандартное отклонение среднего значения.
После трансэндокардиальных инъекций ЛПС-6ГД наблюдалось повышение устойчивости миокарда к ФП через 90 минут после инъекций, что проявлялось в отсутствии эпизодов ФП, длящихся более 3 минут (Таблица 2). Все эпизоды аритмий прекращались спонтанно и не превышали по длительности двух минут и только четверть из всех эпизодов ФП были устойчивыми, т.е. продолжались более 30 секунд.

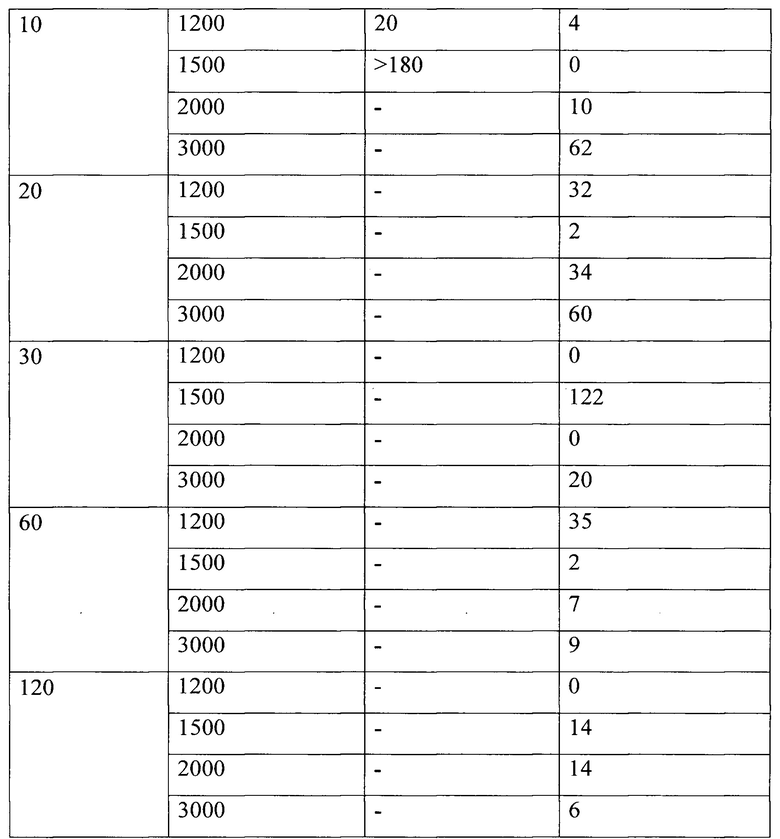
В данном опыте исходно выполнялся короткий протокол индукции фибрилляции предсердий по причине возникновения продолжительного эпизода аритмии после 10 секундной индукции с частотой 1500 имп. в мин.
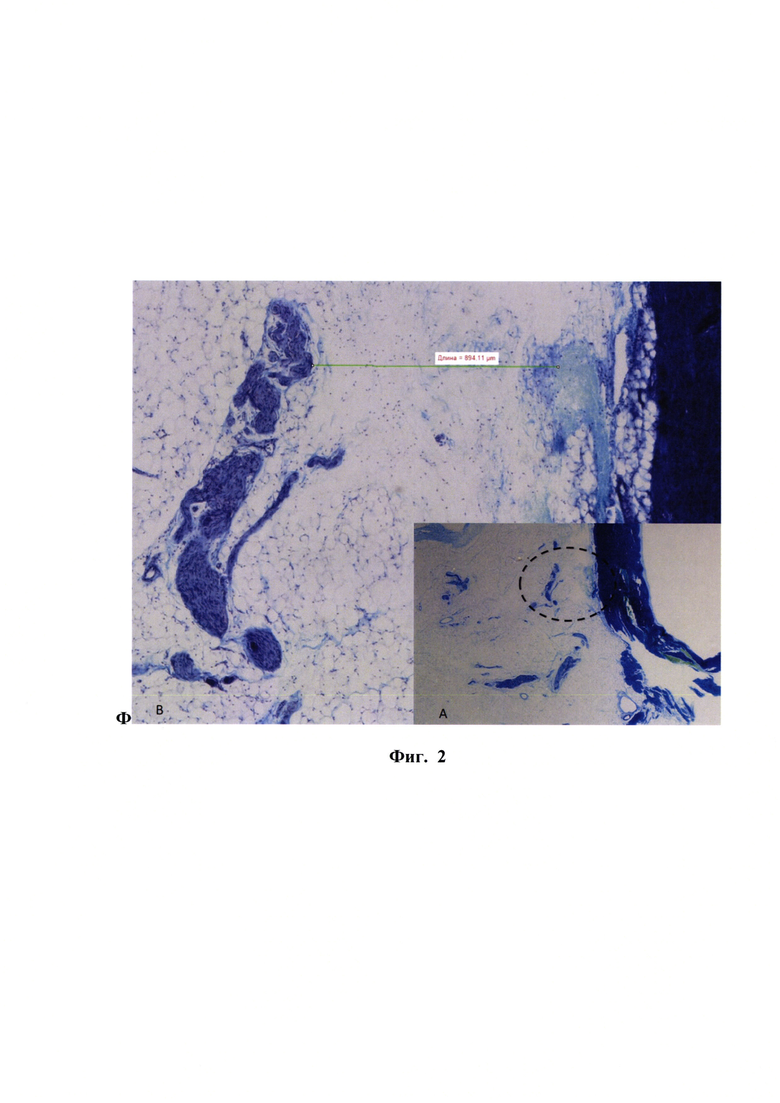
Положительный эффект от использования предложенного способа подтверждали также результатами гистологического исследования. Трансэндокардиальные микроинъекции сопровождались небольшими геморрагиями в предсердную стенку, по которым можно установить локализацию инъекций и их глубину по отношению к эндокарду и ганглионарным сплетениям. Образцы миокарда предсердий фиксировали и окрашивали гематоксилин эозином и по Нисслю (фиг. 2). Расстояние от края ближайшей геморрагии до ближайшего нервного пучка или ганглия колебалось в пределах от 38 до 1397 мкм, что свидетельствует о достижении кончиком иглы слоя эпикардиального жира, в котором находится ганглионарное сплетение.
Таким образом селективный нейротоксин 6-гидроксидопамин препятствует индукции и поддержанию фибрилляции предсердий и разработанный способ повышает эффективность лечения больных с фибрилляцией предсердий после эндоваскулярного лечения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ИНТЕРВЕНЦИОННОГО ЛЕЧЕНИЯ ПАРОКСИЗМАЛЬНОЙ ФОРМЫ ФИБРИЛЛЯЦИИ ПРЕДСЕРДИЙ | 2007 |
|
RU2364370C1 |
| Способ определения электроанатомического субстрата при контактном картировании высокой плотности эндокардиальной поверхности левого предсердия для стратификации риска рецидива фибрилляции предсердий после циркулярной изоляции легочных вен у пациентов с пароксизмальной и персистирующей фибрилляцией предсердий | 2016 |
|
RU2649506C1 |
| Способ прогнозирования риска позднего постаблационного рецидива фибрилляции предсердий у пациентов с фибрилляцией предсердий без структурно-функциональных изменений миокарда на основе радиомического анализа эпикардиальной жировой ткани | 2022 |
|
RU2789384C1 |
| Способ моделирования устойчивой фибрилляции предсердий у животных (варианты) | 2021 |
|
RU2760087C1 |
| Способ устранения типичного трепетания предсердий при выполнении торакоскопических операций, направленных на лечение фибрилляции предсердий | 2018 |
|
RU2703847C1 |
| СПОСОБ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ ВТОРИЧНОЙ ЛЕГОЧНОЙ ГИПЕРТЕНЗИИ У ПАЦИЕНТОВ С ПОРОКАМИ МИТРАЛЬНОГО КЛАПАНА | 2016 |
|
RU2661710C2 |
| Способ лечения желудочковых нарушений ритма сердца (варианты) | 2016 |
|
RU2651044C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АНАТОМИИ СЕРДЦА И КРУПНЫХ СОСУДОВ | 2013 |
|
RU2539993C2 |
| СПОСОБ ТОРАКОСКОПИЧЕСКОЙ АБЛЯЦИИ ПРИ ФИБРИЛЛЯЦИИ ПРЕДСЕРДИЙ | 2022 |
|
RU2782148C1 |
| СПОСОБ ЛЕЧЕНИЯ ФИБРИЛЛЯЦИИ ПРЕДСЕРДИЙ У ПАЦИЕНТОВ С АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИЕЙ | 2010 |
|
RU2477158C2 |
Изобретение относится к медицине, а именно к экспериментальной медицине и кардиологии. Выполняют трансэндокардиальные микроинъекции 6-гидроксидопамина, инкапсулированные в липосомы, в жировую ткань сердца. Способ позволяет повысить эффективность лечения больных с фибрилляцией предсердий после эндоваскулярного лечения. 2 ил., 2 табл.
Способ воздействия на ганглионарные сплетения сердца, включающий введение селективного нейротоксина - 6-гидроксидопамина, инкапсулированного в липосомы, в эпикардиальную жировую ткань сердца в зоне ганглионарных сплетений, в концентрации 2 мг/мл, путем трансэндокардиальных микроинъекций с помощью эндомикардиального инъекционного катетера, который позиционируют под рентгенологическим контролем перпендикулярно стенки предсердий, причем после каждой выполненной трансэндокардиальной микроинъекции ставят отметку, в виде точки, на предварительно построенной 3D-карте предсердий с использованием 3D-навигационной системы картирования и рентгенографической установки и выполняют следующую трансэндокардиальную микроинъекцию; за одну операцию выполняют от 20 до 30 трансэндокардиальных микроинъекций с расстоянием между инъекциями 2-5 мм.
| Driessen AHG, Berger WR, Krul SPJ, et al | |||
| Ganglion plexus ablation in advanced atrial fibrillation: the AFACT study | |||
| J Am Coll Cardiol | |||
| Токарный резец | 1924 |
|
SU2016A1 |
| КОМПОЗИЦИИ, СПОСОБЫ И СИСТЕМЫ ДЛЯ СИНТЕЗА И ПРИМЕНЕНИЕ ВИЗУАЛИЗИРУЮЩИХ СРЕДСТВ | 2011 |
|
RU2710736C2 |
| Бокерия Л | |||
| А | |||
| и др | |||
| ЛЕВОСТОРОННЯЯ СИМПАТИЧЕСКАЯ ДЕНЕРВАЦИЯ СЕРДЦА В ЛЕЧЕНИИ ВРОЖДЕННОГО СИНДРОМА УДЛИНЕННОГО ИНТЕРВАЛА Q-T, АННАЛЫ АРИТМОЛОГИИ, 2006, 5, 37-41 | |||
| Wu | |||
Авторы
Даты
2023-03-21—Публикация
2022-03-09—Подача