Изобретение относится к области медицины, а именно к лечению нарушений сердечного ритма, предпочтительно желудочковых аритмий, в условиях кардиохирургического стационара для снижения социально значимых потерь от внезапной сердечной смерти (ВСС).
Актуальность и социальная значимость ВСС неоспорима и подтверждена всеми ведущими медицинскими научными, практическими международными сообществами и союзами (Всероссийское научное общество кардиологов, Европейское общество кардиологов, Американский колледж кардиологии, Ассоциация Нарушений Ритма Сердца, Всемирная Организация Здравоохранения). По расчетным данным в РФ внезапно от сердечных причин ежегодно умирает 200000-250000 человек (Центральная база статистических данных Федеральной службы государственной статистики, 2010 год).
Согласно полученным при проведении суточном мониторировании ЭКГ у пациентов, умерших внезапно, установлено, что в подавляющем большинстве случаев (85%) механизмами развития ВСС являются желудочковые тахиаритмии - желудочковая тахикардия (ЖТ) и фибрилляция желудочков (ФЖ) с последующим развитием асистолии (Национальные Рекомендации по определению риска и профилактике внезапной сердечной смерти, Всероссийское научное общество кардиологов, 2012 год). Среди заболеваний сердца основной причиной ВСС является ИБС, на долю которой приходится до 80% всех случаев (Zipes DP, Wellens HJJ. Sudden cardiac death. Circulation 1998; 98:2334-2351).
Основным принципом лечения и профилактики развития жизнеугрожающих аритмий является выключение из проведения зон замедленного проведения электрического импульса. Данные зоны представляют собой физиологически и/или патологические измененные очаги миокарда в виде «слоенного пирога», причиной появления которых являются острые сердечные катастрофы (инфаркт миокарда), хронические заболевания (кардиомиопатии) либо врожденные аномалии развития сердца. Миокард в этих зонах представляется собой чередующие участки неповрежденного миокарда и фиброзной ткани, а «выключение» этих участков никак не влияет на сократительную способность сердца, в то время как проведение электрического импульса возбуждения становится однонаправленным и гомогенным (Catheter Ablation of Scar-based Ventricular Tachycardia: Relationship of Procedure Duration to Outcomes and Hospital Mortality / Yu R et al, Heart Rhythm. 2014 Oct. 3. pii: S1547-5271(14)01131-Х).
Единственным на сегодняшний день радикальным методом лечения желудочковой тахикардии, а также методом профилактики фибрилляции желудочков является метод радиочастотной катетерной аблации (EHRA/HRS/APHRS expert consensus on ventricular arrhythmias / Europace (2014) 16, 1257-1283 doi:10.1093/europace/euul94). При аблации происходит коагуляция промежуточного миокарда с дальнейшим превращением его в рубцовую ткань, не способную к электрическому проведению импульса.
Но метод катетерной аблации обладает следующими недостатками:
1. Низкая проникающая способность радиочастотного электрического тока аблационного катетера (не более 7 мм);
2. Высокая морфологическая гетерогенность тканей после аблации, что является причиной крайне низкой терапевтической эффективности лечения ФЖ и ЖТ в отдаленном периоде наблюдения;
3. Техническая сложность процедуры заключается в неоднородности эндокардиальной и эпикардиальной поверхности сердца (трабекулярность, папиллярные мышцы, хорды, синусы сердца), при таких условиях практически невозможно выполнить непрерывные аблационные линии, ограничивающие целевую зону по периметру и на всю глубину миокарда;
4. Высокий процент послеоперационных осложнений, который связан с длительностью процедуры, часто превышающей 4-5 часов, с развитием перфораций сердца, воспалительным синдромом за счет объема пораженной поверхности, с частыми летальными случаями;
5. Высокая стоимость комплексного оперативного лечения (с учетом имплантации кардиовертер-дефибриллятора может превышать 1 млн рублей на человека)
С другой стороны, эффекта блокирования проведения электрического сигнала в миокарде можно добиться другим способом, с помощью инъекции ботулинического нейротоксина. Нейротоксины получают из штаммов бактерии Clostridium botulinum. Существуют несколько серотипов ботулинических нейротоксинов, но в клинической практике наиболее широко используется ботулинический нейротоксин типа А (БНТА). Известен механизм биологического действия БНТА, который заключается в блокаде белка SNAP-25 в пресинаптической мембране, что приводит к невозможности присоединения внутриклеточных везикул, нагруженных ацетилхолином, к клеточной стенке. В результате чего прекращается проведение сигнала между клетками через синапс вследствие отсутствия нейромедиатора. На уровне сердца действие БНТА проявляется локальным блокированием возбуждения миокарда в зоне инъекции, которое, однако, не имеет генерализованного действия и не затрагивает основные водители ритма и проводящие нервные пучки.
Известен фармацевтический состав (RU 2535115), содержащий нейротоксин ботулина, активный агент и физиологически приемлемый наполнитель, отличающийся тем, что в качестве нейротоксина ботулина состав содержит ботулотоксин типа А, в качестве активного агента - мукополисахарид хитозоль, взятые в соотношении 1:(103-109), предпочтительно 1:(106-108) по массе соответственно. Недостатком данной композиции является отсутствие подтвержденного антиаритмического действия при нарушении ритма сокращений желудочков сердца.
Задачей изобретения является разработка способа лечения желудочковых нарушений ритма сердца с помощью фармацевтического состава (далее BTS), содержащего ботулинический нейротоксин типа А, путем инъекции в зоны, являющиеся очагом эктопического возбуждения миокарда желудочков.
Технический результат - разработан метод профилактики и лечения желудочковой тахикардии (ЖТ) и фибрилляции желудочков (ФЖ) для пациентов, которым противопоказана радиочастотная аблация миокарда, при этом инфильтрация миокарда желудочка, содержащего очаг эктопического возбуждения, приводит к максимально равномерной денервации ткани.
Задача решается двумя способами проведения операции: 1) под контролем зрения с выполнением срединной стернотомии (при «открытой» операции) - лечение путем превентивного введения BTS в стенку желудочка, а именно в целевые зоны, являющиеся очагом эктопического возбуждения миокарда желудочков; 2) способом миниинвазивного интрамиокардиального введения BTS, в стенку желудочка, а именно в целевые зоны, являющиеся очагом эктопического возбуждения миокарда желудочков.
Вариант 1 включает контроль электрокардиографии, инвазивный контроль артериального давления, контроль насыщения периферической крови кислородом, инфузионную поддержку кровообращения, выполнение срединной стернотомии, накладывание ранорасширителя, выполнение перикардотомии. Затем в область левого желудочка, питаемого нисходящей ветвью левой коронарной артерии, выполняют инъекции фармацевтическим составом, содержащим ботулинический нейротоксин типа А. Каждую инъекцию производят в целевые зоны в объеме 0,2-0,4 мл, при этом суммарная доза ботулинического нейротоксина типа А составляет 0,5-0,9 Ед/кг веса.
Вариант 2 включает контроль электрокардиографии, инвазивный контроль артериального давления, контроль насыщения периферической крови кислородом, выделение бедренной артерии, установку интродьюсера, введение инъекционного катетера под контролем рентгеноскопии, выполнение электроанатомического картирования левого желудочка. Затем в предварительно определенные целевые зоны левого желудочка производят инъекции фармацевтическим составом, содержащим ботулинический нейротоксин типа А. После удаляют инъекционный катетер и интродьюсер с одновременным затягиванием кисетного шва на бедренной артерии. Каждую инъекцию производят в целевые зоны в объеме 0,2-0,4 мл, при этом суммарная доза ботулинического нейротоксина типа А составляет 0,5-0,9 Ед/кг веса.
Для точной локализации областей эктопии используется метод электроанатомического картирования с помощью системы Noga ХР Cardiac Navigation System (Biosense Webster, Inc., США). Инъекция препарата, содержащего БНТА, производится двумя способами: под контролем зрения непосредственно в миокард желудочка, для чего выполняется открытая операция, или миниинвазивной техникой с помощью специализированного эндоваскулярного катетера для эндомиокардиальной инъекции Myostar Injection Catheter (Biosense Webster, Inc., США).
Специализированные эндоваскулярные катетеры для эндомиокардиальной инъекции, а также система цифровой электромагнитной навигации сердца давно и активно представлена на международном и российском рынке медицинских услуг, использование официально разрешено на территории РФ, США, стран Евросоюза, Китая, Индии, стран СНГ. Данные навигационные системы и катетеры используются рутинно в клинической практике для введения непосредственно в сердечную мышцу аутологичных стволовых клеток, их производных, антибиотиков, препаратов генной трансдукции, активации факторов роста (Efficiency of intramyocardial injections of autologous bone marrow mononuclear cells in patients with ischemic heart failure: a randomized study / Pokushalov E, Romanov A et al. / J Cardiovasc Transl Res. 2010 Apr; 3(2):160-8).
Представленные изображения иллюстрируют:
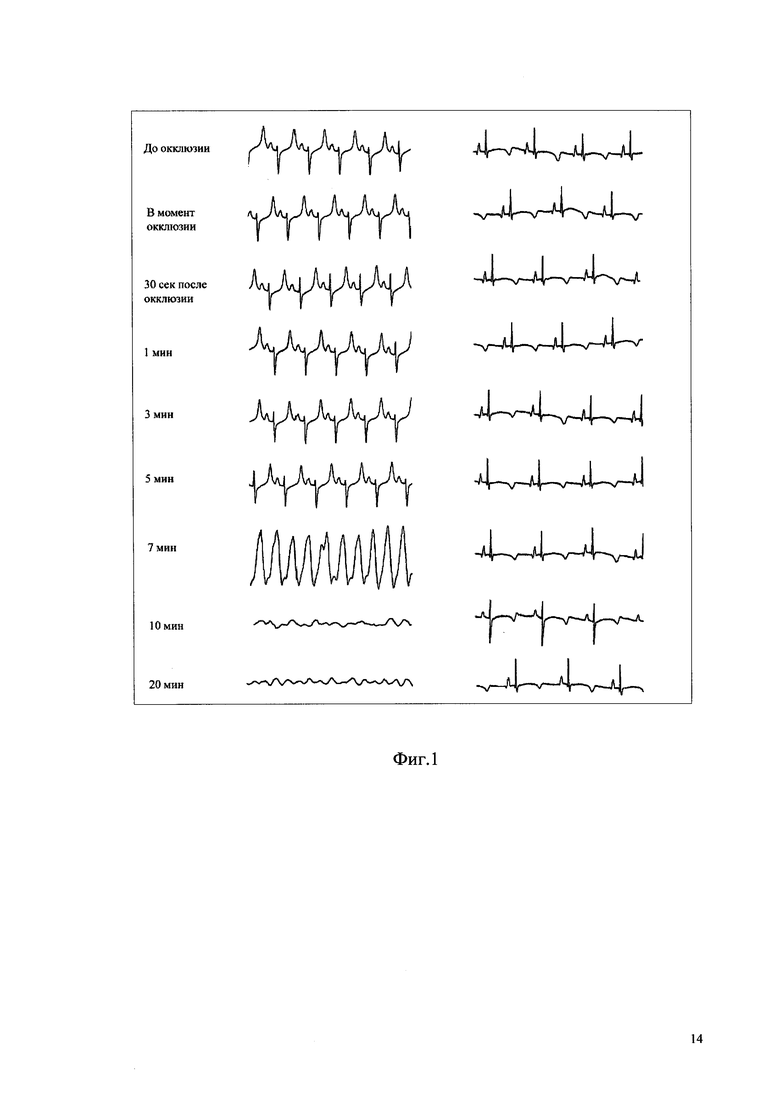
Фиг. 1 - Динамика ЭКГ после перевязки нисходящей ветви левой коронарной артерии у экспериментальных животных контрольной (слева) и опытной (справа) групп.
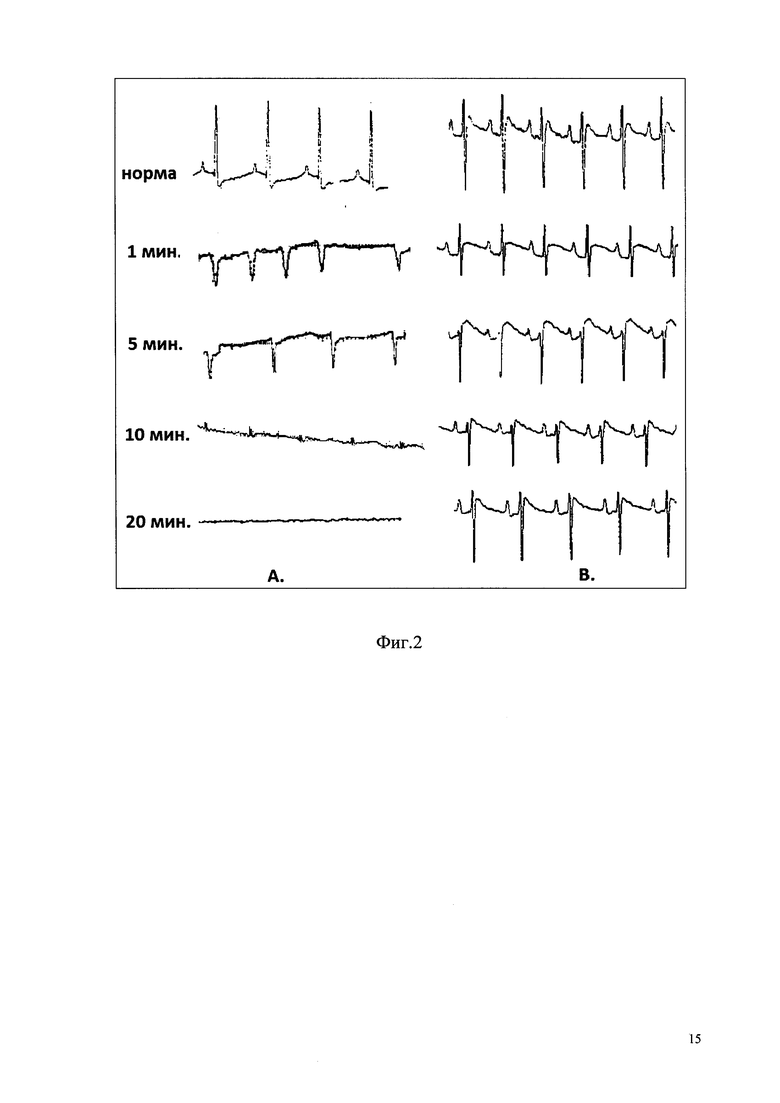
Фиг. 2 - Влияние BTS на фибрилляцию желудочков сердца, вызванную внутривенным введением адреналина: А - фибрилляция желудочков, вызванная адреналином (в/в, 100 мкг/кг); В - влияние адреналина на сердечную деятельность после превентивной инъекции BTS.
Изобретение подтверждается следующими примерами.
Пример 1. Способ моделирования ФЖ и его лечения путем превентивного введения BTS в стенку желудочка у животных при «открытой» операции.
Экспериментальная работа осуществлялась согласно этическим нормам, регламентирующим эксперименты на животных в соответствии с международными и российскими нормативно-правовыми документами («Европейская конвенция о защите позвоночных животных, используемых для экспериментов или в иных научных целях: EST №123» от 18 марта 1986 г. Страсбург, 1986; «Об утверждении правил лабораторной практики: приказ Министерства здравоохранения Российской Федерации» №267 от 19 июня 2003 г.).
Подготовку к операции производили следующим способом. Утром в день операции ветеринарный врач выполнял премедикацию комбинацией препаратов атропин, золетил-100 и кетамин. Дозировку в каждом конкретном случае выбирали исходя из веса животного. После наступления сна животное тщательно мыли, выбривали щетину на ушах, грудной клетке, на внутренней поверхности бедра и на хвосте, взвешивали. Переносили на операционный стол и закрепляли в положении «на спине». В краевую вену уха устанавливали периферический катетер для инъекций подходящего размера, к грудной клетке прикрепляли датчики для электрокардиографии. Плетизмографический датчик для контроля насыщения периферической крови кислородом крепили на хвост. Для контроля артериального давления в левую бедренную артерию пункционным способом устанавливали артериальный катетер, через который присоединяли систему инвазивного контроля давления. Все критически важные витальные параметры - пульс, артериальное давление, температуру в глотке, ЭКГ, насыщение крови кислородом - фиксировали в режиме «реального времени» системой мониторинга IntelliVue МР40 (Phillips, Германия). Динамику данных вносили в наркозную карту экспериментального животного с периодичностью 15 минут. После этого внутривенно вводили миорелаксант (адруан, 4 мг) и выполняли интубацию трахеи трубкой диаметром 7-8 мм. Раздували обтурирующую манжету, подсоединяли аппарат искусственной вентиляции легких Julian Plus (Draeger, Германия), начинали принудительную вентиляцию чистым кислородом, содержащим 3% севофлюрана (по объему) с частотой 12-14 циклов в минуту. Дыхательный объем подбирали индивидуально в зависимости от веса животного. Через установленный ранее периферический катетер проводили инфузионную поддержку кровообращения кристаллоидными (раствор Рингера, изотонический раствор) и/или коллоидными (гелафузин, полиглюкин) растворами. Объем инфузии определялся врачом-ветеринаром согласно весоростовым показателям и данным объективного мониторинга витальных функций экспериментального животного. При необходимости для контроля диуреза устанавливали мягкий мочевой катетер.
Исследование проводили на 2 группах мини-свиней «Минисибс» (ИЦиГ СО РАН) по 3 особи в каждой. В опытной группе выполняли инъекцию BTS в области левого желудочка, питаемые нисходящей ветвью левой коронарной артерии (НВЛКА). Производили 5-7 инъекций по 0,2-0,4 мл каждая, таким образом, чтобы достичь суммарной дозы 0,9 Ед БНТА/кг веса животного (данная доза является предпочтительной). Объем инъекции 0,2-0,4 мл не влияет на функциональные свойства миокарда в области инъекции, объем определен экспериментально. Затем через 60 минут выполняли перевязку данной ветви на расстоянии 0,1-0,2 см после ее выхода из-за ушка левого предсердия. В контрольной группе выполняли перевязку НВЛКА без введения препарата.
Хирургический доступ и оперативный прием следующие. Выполняли срединную стернотомию, накладывали ранорасширитель для разведения краев стернотомной раны, производили перикардотомию, листки перикарда разводили на держалках. Производили 5-7 инъекций препарата по 0,2-0,4 мл каждая. Затем удаляли ранорасширитель, стернотомную рану прикрывали стерильной салфеткой и производили хирургическую паузу на 60 минут для достижения терапевтического действия препарата. В ходе всей операции производили мониторирование ЭКГ. Если после введения BTS появлялись ЭКГ-признаки острого инфаркта миокарда, животное исключали из дальнейшего исследования.
Для моделирования ФЖ под нисходящую ветвь левой коронарной артерии на расстоянии 0,1-0,2 см после ее выхода из-за ушка левого предсердия, где располагается бифуркация, проводили лигатуру из плетеной синтетической нити диаметром 2/0 и завязывали узел, но не затягивая его. Далее в течение 60 с регистрировали ЭКГ, после чего осуществляли одномоментную перевязку коронарной артерии путем затягивания узла на лигатуре. Желудочковая экстрасистолия у экспериментальных животных контрольной группы развивалась в первые 1-7 минут наблюдения. ЭКГ регистрировали в момент перевязки артерии, далее через 30 с, 1, 3, 5, 10 и 20 мин. Животных, у которых не возникало нарушений ритма, в эксперимент не включали.
В результате показано, что одномоментная перевязка нисходящей ветви левой коронарной артерии у мини-свиней контрольной группы приводила к развитию нарушений сердечного ритма желудочков по типу политопной желудочковой экстрасистолии, ЖТ с переходом в ФЖ и летальным исходом. Превентивная инъекция препарата BTS в дозировке 0,9 Ед/кг за 60 минут до перевязки НВЛКА предотвращала развитие желудочковых нарушений сердечного ритма (фиг. 1). Летальных исходов среди экспериментальных животных отмечено не было.
Пример 2. Способ моделирования ФЖ и его лечения путем превентивного интрамиокардиального введения фармацевтического состава, содержащего ботулинический нейротоксин типа А, в стенку желудочка у животных
Исследование проводили на 2 группах мини-свиней «Минисибс» (ИЦиГ СО РАН) по 3 особи в каждой. В опытной группе производили 5-7 инъекций BTS по 0,2-0,4 мл каждая таким образом, чтобы достичь суммарной дозы 0,9 Ед БНТА/кг веса животного (данная доза является предпочтительной). Объем инъекции 0,2-0,4 мл не влияет на функциональные свойства миокарда в области инъекции, объем определен экспериментально. Инъекции выполняли за 60 минут до моделирования желудочковых нарушений ритма. В контрольной группе использовали интактных животных. Модель ФЖ производили внутривенным введением раствора адреналина гидрохлорида в дозе 100 мг/кг
Анестезиологическое обеспечение использовали аналогично указанному в примере 1. Животных опытной группы готовили следующим образом. Для выполнения миниинвазивной интрамиокардиальной инъекции кожу операционного поля в проекции правой бедренной артерии трижды обрабатывали раствором бетадина, накрывали стерильной простыней с окном для доступа к коже. Затем выполняли кожный разрез, ткани разделяли ножницами тупым способом, визуализировали бедренную артерию. При необходимости использовали электронож-коагулятор Force-EZ (ValleyLab, США) или аналогичный. Артерию выделяли из окружающих тканей на протяжении 2-5 см. В зоне установки интродьсера монофиламентной нерассасывающейся полипропиленовой нитью Prolen диаметром 5/0 с атравматической иглой (или аналогом) накладывали кисетный шов, но не затягивали его. После этого артерию внутри области наложения кисетного шва пунктировали иглой, заводили проволочный проводник и устанавливали интродьюсер размером 8Fr. Проводник убирали. В интродьюсер вводили инъекционный катетер Myostar с помощью С-дуги ОЕС9800 (GE Helthcare, США) под контролем рентгеноскопии продвигали катетер до левого желудочка, периодически выполняя контрольную артериографию введением 5-20 мл рентген-контрастного препарата Визипак-320 (или аналога), чтобы удостовериться в правильности положения катетера. Производили электроанатомическое картирование левого желудочка с помощью системы NogaXP, затем выдвигали инъекционную иглу и вводили 0,2-0,4 мл препарата BTS, в предполагаемую электроанатомическую проекцию зоны аритмии.
На заключительном этапе экспериментальной операции удаляли инъекционный катетер и интродьюсер с одновременным затягиванием кисетного шва на бедренной артерии. Контролировали отсутствие кровотечения, при необходимости выполняли хирургический гемостаз. Рану послойно ушивали нерассасывающейся полипропиленовой нитью Prolen (или аналог) диаметром 2/0.
В результате показано, что внутривенное введение адреналина у животных контрольной группы вызывало политопную желудочковую экстрасистолию, переходящую в фибрилляцию желудочков с летальным исходом в течение 5-10 минут. Превентивная инъекция препарата BTS в дозировке 0,9 Ед/кг за 60 минут до введения адреналина предотвращала развитие желудочковых нарушений сердечного ритма (фиг. 2).
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ лечения желудочковых нарушений сердечного ритма | 2024 |
|
RU2841459C1 |
| Способ моделирования устойчивой фибрилляции предсердий у животных (варианты) | 2021 |
|
RU2760087C1 |
| СПОСОБ ХИМИЧЕСКОЙ АБЛАЦИИ ГИПЕРТРОФИРОВАННОГО УЧАСТКА МИОКАРДА | 2014 |
|
RU2568166C1 |
| СПОСОБ РАДИОЧАСТОТНОЙ АБЛАЦИИ ОЧАГА ЭКТОПИЧЕСКОЙ ТАХИКАРДИИ В ВЫВОДНОМ ОТДЕЛЕ ЛЕВОГО ЖЕЛУДОЧКА | 2010 |
|
RU2428109C1 |
| Способ воздействия на ганглионарные сплетения сердца | 2022 |
|
RU2792282C1 |
| СПОСОБ ТРАНСРАДИАЛЬНОЙ КАТЕТЕРНОЙ АБЛЯЦИИ ПРИ НЕИШЕМИЧЕСКИХ ЖЕЛУДОЧКОВЫХ НАРУШЕНИЯХ РИТМА С ЛОКАЛИЗАЦИЕЙ В ЛЕВОМ ЖЕЛУДОЧКЕ СЕРДЦА | 2014 |
|
RU2570539C1 |
| Композиция для химической аблации тканей и её применение | 2022 |
|
RU2791906C1 |
| Способ увеличения объема повреждения миокарда желудочков при радиочастотной аблации | 2022 |
|
RU2802151C1 |
| СПОСОБ ЛЕЧЕНИЯ РЕЗИСТИВНОЙ АРТЕРИАЛЬНОЙ ЛЕГОЧНОЙ ГИПЕРТЕНЗИИ | 2016 |
|
RU2694583C1 |
| Способ лазерной деструкции патологических очагов проводящей системы сердца | 2018 |
|
RU2680916C1 |
Изобретение относится к медицине, а именно к кардиохирургии, и касается лечения желудочковых нарушений ритма сердца. Для этого в очаги эктопического возбуждения миокарда желудочка вводят фармацевтический состав, содержащий ботулинический нейротоксин типа А. Введение состава осуществляют в объеме 0,2-0,4 мл с содержанием ботулинического нейротоксина в суммарной дозе 0,5-0,9 Ед/кг. Введение осуществляют в ходе операции, которую выполняют путем срединной стернотомии или способом миниинвазивного интрамиокардиального введения. Способ обеспечивает денервацию очагов эктопичского возбуждения миокарда и, соответственно, эффективное лечение или профилактику желудочковой тахикардии и фибрилляции желудочков у пациентов, которым противопоказана радиочастотная аблация миокарда. 2 н. и 1 з.п. ф-лы, 2 ил., 2 пр.
1. Способ лечения желудочковых нарушений ритмов сердца, включающий контроль электрокардиографии, инвазивный контроль артериального давления, контроль насыщения периферической крови кислородом, инфузионную поддержку кровообращения, выполнение срединной стернотомии, накладывание ранорасширителя, выполнение перикардотомии, отличающийся тем, что в область левого желудочка, питаемого нисходящей ветвью левой коронарной артерии, выполняют инъекции фармацевтическим составом в объеме 0,2-0,4 мл, содержащим ботулинический нейротоксин типа А в суммарной дозе 0,5-0,9 Ед/кг веса.
2. Способ по п. 1, отличающийся тем, что инъекции производят в целевые зоны, являющиеся очагом эктопического возбуждения миокарда желудочков.
3. Способ лечения желудочковых нарушений ритмов сердца, включающий контроль электрокардиографии, инвазивный контроль артериального давления, контроль насыщения периферической крови кислородом, выделение бедренной артерии, установку интродьюсера, введение инъекционного катетера под контролем рентгеноскопии, выполнение электроанатомического картирования левого желудочка, отличающийся тем, что в зоны, являющиеся очагами эктопического возбуждения миокарда левого желудочка, производят инъекции фармацевтическим составом в объеме 0,2-0,4 мл, содержащим ботулинический нейротоксин типа А в суммарной дозе 0,5-0,9 Ед/кг веса, затем удаляют инъекционный катетер и интродьюсер с одновременным затягиванием кисетного шва на бедренной артерии.
| СПОСОБ ЛЕЧЕНИЯ ФИБРИЛЛЯЦИИ ПРЕДСЕРДИЙ У ПАЦИЕНТОВ С АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИЕЙ | 2010 |
|
RU2477158C2 |
| ФАРМАЦЕВТИЧЕСКИЙ СОСТАВ, СОДЕРЖАЩИЙ НЕЙРОТОКСИН БОТУЛИНА | 2005 |
|
RU2407541C2 |
| ФАРМАЦЕВТИЧЕСКИЙ СОСТАВ, СОДЕРЖАЩИЙ НЕЙРОТОКСИН БОТУЛИНА | 2013 |
|
RU2535115C1 |
| US 2012184950 A1, 19.07.2012 | |||
| СТРЕЛЬНИКОВ А.Г | |||
| и др | |||
| "Нейротоксическая денервация автономной системы левого предсердия в целях лечения и профилактики фибрилляции предсердий: экспериментальное исследование" | |||
| Патология кровообращения и кардиохирургия | |||
| Устройство для закрепления лыж на раме мотоциклов и велосипедов взамен переднего колеса | 1924 |
|
SU2015A1 |
| Р | |||
| ЛАСКАВИ и др | |||
| "Ботулинический токсин типа А" | |||
| Практическое руководство, М., "МЕДпресс-информ", 2012, с.12, найдено 12.10.2017 из Интернет: 03book.ru›upload/iblock.laskawi_Botulinum. | |||
Авторы
Даты
2018-04-18—Публикация
2016-08-22—Подача