Область изобретения
Объекты настоящего изобретения направлены на упаковку с индивидуальной дозой, включающую в себя капсулу с одной дозой, содержащую, по меньшей мере, один фармацевтический активный ингредиент, запечатанный в защищенную от открытия детьми обертку, что создает непроницаемый барьер против факторов окружающей среды.
Уровень техники
Капсулы на одну порцию, которые работают с автоматическими варочными машинами, позволяют без проблем приготовить одну порцию напитка для потребления. Этот метод особенно полезен для приготовления напитков, содержащих фармацевтические активные ингредиенты, поскольку пользователи таких продуктов обычно ищут простоту использования и удобство. Кроме того, удобные одноразовые капсулы побуждают пользователей использовать продукты, содержащие фармацевтические активные ингредиенты, которые полезны для их здоровья и благополучия, за счет оптимизации процесса приготовления. Заваривание разовой порции напитка также предотвращает отходы, поскольку позволяет не готовить больше, чем нужно пользователю.
В настоящее время доступны одноразовые капсулы, которые, как правило, предназначены для использования с кофе, чаем и т.п. Такие продукты не подходят для использования с фармацевтическими активными ингредиентами из-за чувствительности таких ингредиентов. В частности, стандартные капсулы на одну порцию не способны защитить чувствительные фармацевтические активные ингредиенты от воздействия окружающей среды. Крайне важно, чтобы такие продукты были разработаны для поддержания качества ингредиентов, предотвращая воздействие воды, кислорода и других факторов окружающей среды. Следовательно, чувствительные фармацевтические препараты должны быть упакованы в барьерную упаковку, чтобы предотвратить разложение и сохранить эффективность и безопасность в течение всего срока их хранения.
Кроме того, жизненно важно, чтобы любые продукты, используемые для размещения фармацевтических препаратов, были упакованы в защищенную от детей упаковку, чтобы дети не проглатывали потенциально опасные вещества. Текущая статистика показывает, что почти треть зарегистрированных педиатрических воздействий токсичных веществ произошла из-за непреднамеренного приема лекарств, и что более семидесяти процентов смертельных исходов у детей произошло из-за непреднамеренного воздействия опасных веществ. Таким образом, упаковка, защищенная от детей, была областью значительных исследований в течение последних нескольких десятилетий.
Помимо размещения в защищенной от детей упаковке, не менее важно, чтобы упаковка для фармацевтических активных ингредиентов была пригодна для использования пожилыми людьми с проблемами подвижности рук. Потребители с артритом и люди с ограниченными возможностями имеют более высокий уровень потребления фармацевтических препаратов на душу населения. Открытие упаковки, защищенной от детей, может вызвать болезненную нагрузку на запястно-пястные суставы у пользователей, страдающих артритом или подобными заболеваниями. Это может помешать пожилым людям использовать такие продукты и получать доступ к жизненно важным фармацевтическим препаратам.
Основываясь на отмеченных выше проблемах, очень желательна одна порционная капсула, содержащая, по меньшей мере, один фармацевтический активный ингредиент, которая запечатана в защищенную от детей и доступную для пожилых взрослых упаковку, которая также обеспечивает непроницаемый барьер против факторов окружающей среды.
Сущность изобретения
Объекты настоящего изобретения относятся к упаковке с индивидуальной дозой для использования с автоматической варочной машиной, содержащей: капсулу с одной дозой, включающую в себя чашку, имеющую дно и боковую стенку, проходящую от дна к ободу, окружающему отверстие, пространство между дном и боковой стенкой, определяющее внутреннее пространство, по меньшей мере, один фармацевтический активный ингредиент, предусмотренный во внутреннем пространстве чашки, и крышку, прикрепленную к ободу чашки, тем самым закрывая отверстие и удерживая, по меньшей мере, один фармацевтический активный ингредиент во внутреннем пространстве чашки; и внешнюю обертку, охватывающую всю капсулу с одной дозой и запечатывающую в себе капсулу с одной дозой, причем внешняя обертка является защищенной от детей и создает непроницаемый барьер, препятствующий прохождению жидкостей и газов, и при этом внешняя обертка является многослойной структурой, включающей в себя первый слой, представляющий собой слой биаксиально ориентированного полиэтилентерефталата, второй слой, представляющий собой слой полиэтилена, третий слой, представляющий собой слой алюминиевой фольги, и четвертый слой, являющийся слоем иономера.
Настоящее изобретение также предусматривает, что, по меньшей мере, один фармацевтический активный ингредиент представляет собой ацетаминофен, фенилэфрин, декстрометорфан, дифенгидрамин, ибупрофен, псевдоэфедрин, гвайфенезин, ацетилцистеин, хлорфенирамин, цетиризин, левоцетиризин, доксиламинсукцинат или их комбинацию. В одном из вариантов настоящего изобретения, по меньшей мере, один фармацевтический активный ингредиент представляет собой ацетаминофен. В другом варианте осуществления настоящего изобретения, по меньшей мере, один фармацевтический активный ингредиент представляет собой комбинацию ацетаминофена, фенилэфрина и декстрометорфана. В другом варианте осуществления настоящего изобретения, по меньшей мере, один фармацевтический активный ингредиент представляет собой комбинацию ацетаминофена, фенилэфрина и дифенгидрамина. В другом варианте настоящего изобретения, по меньшей мере, один фармацевтический активный ингредиент представляет собой комбинацию гвайфенезина и декстрометорфана.
Настоящее изобретение дополнительно предусматривает, что упаковка с индивидуальной дозой более чем на 7 0% защищена от детей, как определено тестом на безопасность для детей. В предпочтительном варианте осуществления настоящего изобретения упаковка с однократной дозой на 100% защищена от детей, как определено тестом на безопасность для детей.
Настоящее изобретение также предусматривает, что внешняя обертка имеет толщину примерно 7 0-100 микрон. Настоящее изобретение дополнительно предусматривает, что первый слой внешней обертки имеет толщину примерно 20-30 микрон. Настоящее изобретение также предусматривает, что второй слой внешней обертки имеет толщину примерно 10-2 0 микрон. Настоящее изобретение дополнительно предусматривает, что третий слой внешней обертки имеет толщину примерно 7-12 микрон. Настоящее изобретение дополнительно предусматривает, что четвертый слой внешней обертки имеет толщину 30-40 микрон.
Настоящее изобретение также предусматривает, что внешняя обертка имеет скорость пропускания паров влаги менее 0,001 г Н2О/100 дюймов2/24 часа. Настоящее изобретение также предусматривает, что внешняя обертка имеет скорость пропускания кислорода менее 0,001 см3/100 дюймов2/24 часа.
Настоящее изобретение дополнительно предусматривает, что внешняя обертка имеет длину примерно 130-140 мм и ширину примерно 80-90 мм в горизонтальном положении.
Настоящее изобретение дополнительно предусматривает, что четвертый слой одного конца внешней обертки сложен и приклеен к четвертому слою другого конца внешней обертки для создания запечатанной части и герметизации капсулы для одной дозы внутри внешней обертки.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
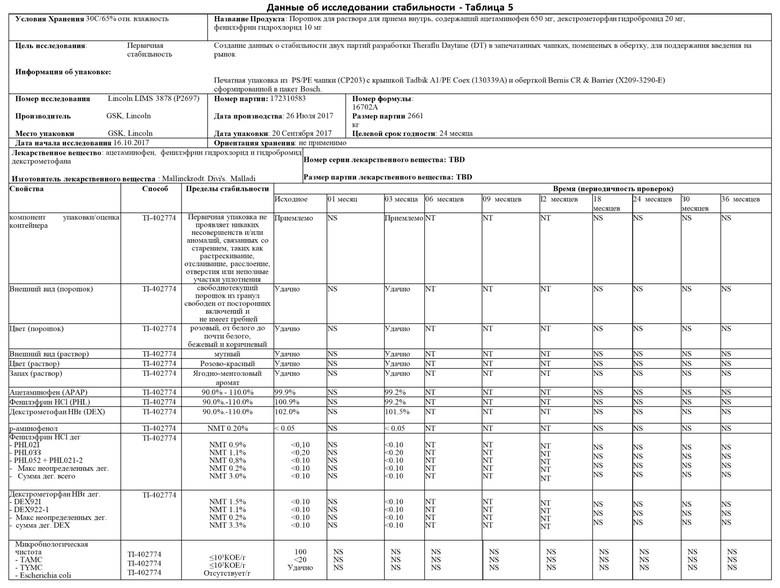
На фиг. 1 показан вид в перспективе капсулы для одной дозы по настоящему изобретению;
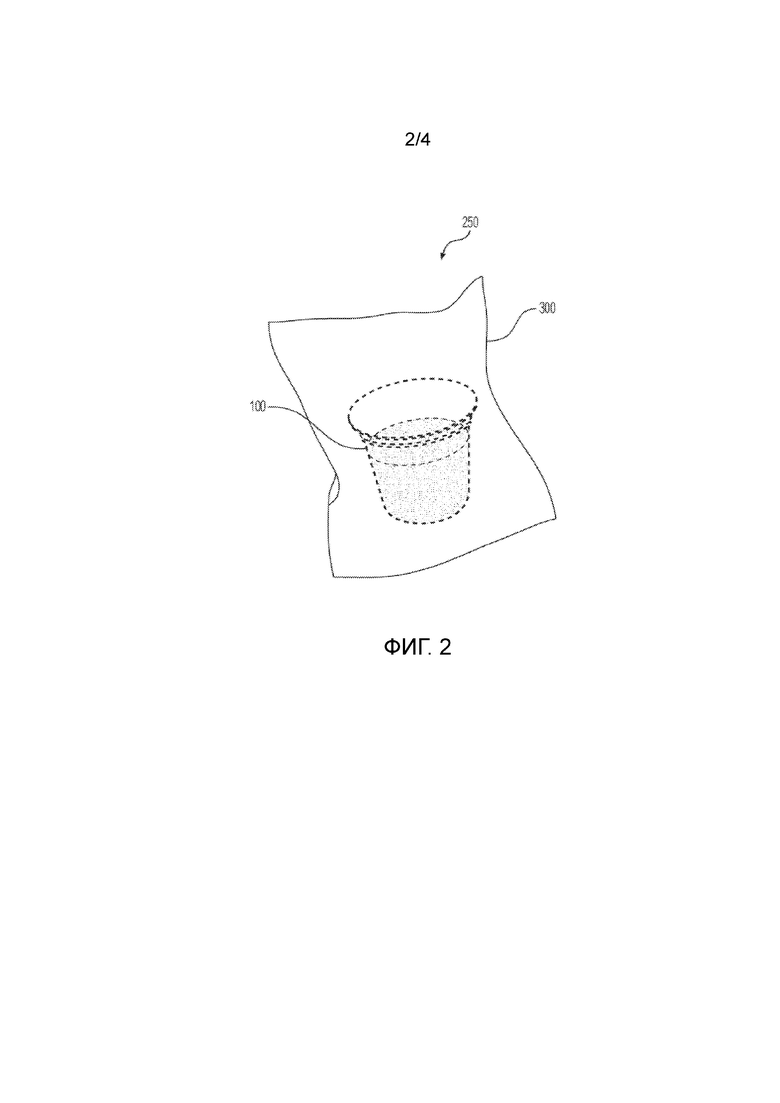
Фиг. 2 - вид в перспективе пакета с индивидуальной дозой по настоящему изобретению;
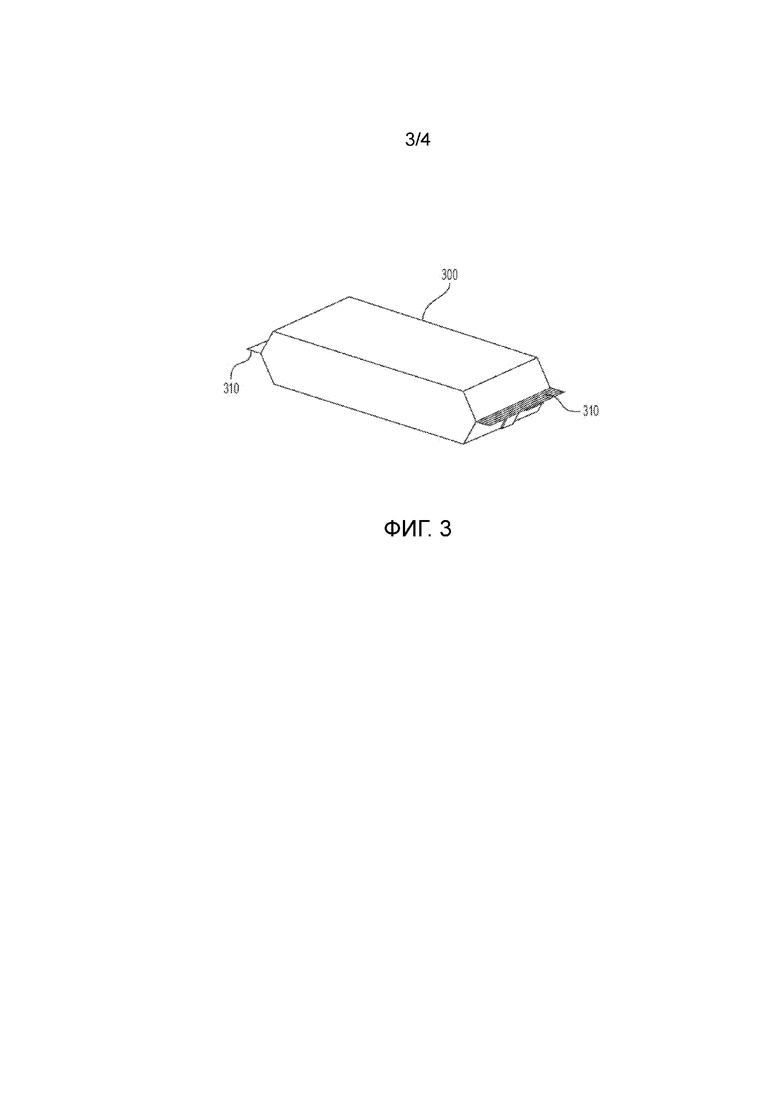
На фиг. 3 показан вид в перспективе внешней обертки согласно настоящему изобретению; и
На Фиг. 4 показано поперечное сечение слоев внешней обертки по настоящему изобретению.
Подробное описание
Объекты настоящего изобретения относятся к упаковке с индивидуальной дозой, включающей капсулу с одной дозой, для использования в автоматической варочной машине для приготовления разовой порции напитка, содержащего, по меньшей мере, один фармацевтический активный ингредиент. Капсула с одной дозой служит первичной упаковкой для, по меньшей мере, одного фармацевтического активного ингредиента. Капсула с одной дозой дополнительно упаковывается и запечатывается во вторичную упаковку, представляющую собой внешнюю обертку, которая создает защищенную от детей и доступную для пожилых людей упаковку вокруг капсулы. Кроме того, внешняя обертка обеспечивает барьер, непроницаемый для окружающей среды, включая, помимо прочего, воду и кислород.
Упаковка 250 с индивидуальной дозой в соответствии с настоящим изобретением в целом изображена на Фиг. 2. В частности, фиг. 2 иллюстрирует вид в перспективе капсулы 100 с одной дозой, содержащей, по меньшей мере, один фармацевтический активный ингредиент 2 00, упакованный и запечатанный внутри внешней обертки 300. Во время использования одну капсулу 100 с дозой можно извлечь из внешней обертки 300 и поместить в автоматическую варочную машину для приготовления.
На фиг. 1 показан вид в перспективе капсулы 100 с одной дозой в соответствии с настоящим изобретением. Как показано на Фиг. 1, капсула 100 с одной дозой включает в себя чашку 110 и крышку 12 0. Чашка 110 имеет дно 150 и боковую стенку 160, идущую вверх от дна 150 к ободу 130, окружающему отверстие 170. Отверстие 170 ведет к внутреннему пространству 140, ограниченному боковой стенкой 160 и дном 150 чашки 110. Крышка 12 0 может быть прикреплена к ободу 130 чашки 110 для создания постоянного воздухонепроницаемого уплотнения. Во время цикла заваривания крышка 120, дно 150 и/или боковая стенка 160 могут быть проколоты или иным образом пронизаны автоматической варочной машиной, так что жидкость, такая как вода, может попасть в чашку 110 для смешивания с фармацевтическим активным ингредиентом 2 00, и приготовленный напиток может быть выпущен из чашки 110.
Не ограничивающие примеры материалов, которые могут быть включены в многослойный материал чашки 110, крышки 12 0 или внешней обертки 300, включают полистирол, этиленвиниловый спирт, полиэтилен, биаксиальноориентированный полиэтилентерефталат, полиэтиленвинилацетат высокой плотности, полиэтилен, сополимеры циклических олефинов, биаксиальноориентированный полиамид, иономер, полихлортрифторэтилен, полипропилен, полиэфир, аморфный полиэтилентерефталат, поливинилхлорид, полиэтилен, алюминиевую фольгу, полиэтилентерефталатгликоль, полиэтилентерефталатгликоль, полиэтилентерефталат любой плотности, полиэтилентерефталат любой плотности, полиэтилентерефталат любой плотности, полиэтилентерефталат с любой ориентацией их сочетание. Каждый слой слоистого материала чашки 110, крышки 12 0 или внешней обертки 300 может быть прикреплен к соседнему слою посредством клея.
В предпочтительном варианте осуществления чашка 110, включающая дно 150 и боковую стенку 160, может представлять собой многослойную структуру, изготовленную из любых подходящих материалов, которые обеспечивают желаемые барьерные свойства. Предпочтительно, чашка 110 включает в себя, по меньшей мере, внешний слой полистирола, средний слой этиленвинилового спирта (EVOH) и внутренний полиэтиленовый слой.
Во время заваривания в стандартной автоматической варочной машине чашка 110 может подвергаться воздействию очень горячей жидкости; таким образом, чашка 110 должна сохранять свою форму и надежно удерживать фармацевтический активный ингредиент 200 во внутреннем пространстве 140 во время процесса заваривания. В качестве внешнего слоя чашки 110 можно использовать полистирол благодаря его высокой устойчивости при экстремальных температурах. Кроме того, автоматическая варочная машина может проткнуть дно 150 чашки 110, чтобы обеспечить проход приготовленного напитка через чашку 110 в контейнер пользователя для потребления. Полистирол является хрупким, то есть он ломается под воздействием напряжения без значительной деформации, и позволяет легко и надежно протыкать дно 150 чашки 110 с помощью любой стандартной автоматической варочной машиной. Напиток, приготовленный для употребления, может быть любого объема. В некоторых вариантах реализации приготовленный напиток может быть 5 жидких унций, 8 жидких унций или 10 жидких унций. В предпочтительном варианте объем приготовленного напитка составляет 8 жидких унций.
Чашка 110 может включать средний слой EVOH, который защищает фармацевтический активный ингредиент 200 от порчи благодаря его низкой проницаемости для кислорода. Это увеличивает срок хранения и надежность фармацевтического активного ингредиента 200, хранящегося во внутреннем пространстве 140 чашки 110.
Фармацевтический активный ингредиент 2 00, находящийся во внутреннем пространстве 14 0 чашки 110, может быть любым соединением или композицией, которые можно использовать для лечения и/или предотвращения заболевания и/или обеспечения общего улучшения здоровья и благополучия пользователя. Не ограничивающие примеры фармацевтического активного ингредиента включают в себя безрецептурные активные вещества, ингредиенты, отпускаемые без рецепта, витамины, минералы, материалы растительного происхождения, материалы, повышающие энергию, пробиотики, клетчатку, пребиотики, противоотечные средства, противовоспалительные средства, средства для подавления кашля, отхаркивающие, антигистаминные, противокашлевые, обезболивающие или любые их комбинации.
Фармацевтический активный ингредиент 200 может представлять собой ацетаминофен, фенилэфрин, декстрометорфан, дифенгидрамин, ибупрофен, псевдоэфедрин, гвайфенезин, ацетилцистеин, хлорфенирамин, цетиризин, левоцетиризин, доксиламинсукцинат, лоратадин или любую их комбинацию. Однако, настоящее изобретение может использоваться с любым фармацевтическим активным ингредиентом или любой комбинацией фармацевтических активных ингредиентов или комбинацией фармацевтических активных ингредиентов с одним или несколькими наполнителями. Фармацевтический активный ингредиент 200 может быть в любой подходящей форме, включая, помимо прочего, порошок, жидкость, гель или таблетку.
В предпочтительном варианте фармацевтический активный ингредиент может представлять собой комбинацию ацетаминофена, фенилэфрина и декстрометорфана. В другом предпочтительном варианте фармацевтически активный ингредиент может представлять собой комбинацию ацетаминофена, фенилэфрина и дифенгидрамина. В другом предпочтительном варианте фармацевтически активным ингредиентом может быть ацетаминофен.
В некоторых вариантах реализации один или несколько фармацевтических активных ингредиентов могут присутствовать в количестве от примерно 1 мг до примерно 2000 мг. В вариантах реализации, в которых фармацевтический активный ингредиент 200 включает ацетаминофен, он присутствует в количестве от примерно 300 мг до примерно 1000 мг. В предпочтительном воплощении ацетаминофен присутствует в количестве примерно 650 мг. В другом предпочтительном воплощении ацетаминофен присутствует в количестве примерно 500 мг. В вариантах реализации, в которых фармацевтически активный ингредиент 200 включает фенилэфрин, он присутствует в количестве от примерно 5 мг до примерно 30 мг. В предпочтительном варианте фенилэфрин присутствует в количестве примерно 10 мг. В вариантах реализации, в которых фармацевтический активный ингредиент 200 включает декстрометорфан, он присутствует в количестве от примерно 5 мг до примерно 30 мг. В предпочтительном варианте декстрометорфан присутствует в количестве примерно 20 мг. В вариантах реализации, в которых фармацевтический активный ингредиент включает дифенгидрамин, он присутствует в количестве от примерно 5 мг до примерно 50 мг. В предпочтительном варианте осуществления дифенгидрамин присутствует в количестве примерно 25 мг.
Не ограничивающие примеры эксципиентов включают ароматизаторы, наполнители, разрыхлитель, глиданты, смазывающие вещества, антиоксиданты, подсластители, красители, консерванты, смазки, сорбенты или любую их комбинацию. Подходящие ароматизаторы могут включать, например, мяту, ментол, перечную мяту, грушанку, сладкую мяту, ванилин, карамель, шоколад, кофе, корицу, гвоздику, цитрусовые, лимон, зеленый чай, белый чай, ромашку, лайм, апельсин, виноград, вишню, клубнику, фруктовый пунш, мед, мед-лимон, другие фруктовые вкусы или любое их сочетание. Подходящие наполнители могут включать, например, мальтодекстрин, диоксид кремния, цитрат натрия, трехосновной фосфат кальция, безводную лимонную кислоту, цитрат натрия, различные сорта микрокристаллической целлюлозы, такие как Avicel PH101, Avicel PH102 и Avicel PH2 00, кукурузный крахмал или любой другой их сочетание. Подходящие разрыхлители могут включать, например, натрийгликолят крахмала [Explotab], сшитый поливинилпирролидон, кукурузный крахмал, гуммиарабик, натрийкроскармеллозу [Ac-di-sol], карбоксиметилцеллюлозу натрия, вигум, альгинаты или любую их комбинацию. Подходящие глиданты могут включать, например, тальк, кукурузный крахмал, стеариновую кислоту, стеарат кальция, полиэтиленгликоль, диоксид кремния, стеарилфумарат натрия, стеарат магния, растительные и минеральные масла или любую их комбинацию. Подходящие лубриканты могут включать, например, стеарат магния, стеариновую кислоту и ее фармацевтически приемлемые соли щелочных металлов, стеарат кальция, стеарат натрия, Cab-O-Sil, силоид, лаурилсульфат натрия, хлорид натрия, лаурилсульфат магния, тальк или любые другие вещества или их сочетание. Подходящие антиоксиданты могут включать, например, альфа-токоферол, бета-токоферол, гамма-токоферол, дельта-токоферол, бутилированный гидрокситолуол (ВНТ), бутилированный гидроксианизол (ВНА), аскорбиновую кислоту, фумаровую кислоту, яблочную кислоту, аскорбилпальмитат, пропилгаллат натрия, натрий метабисульфит натрия или любую их комбинацию. Подходящие подсластители могут включать, например, ацесульфам калия, аспартам, сахарозу или любую их комбинацию. Подходящие цвета могут включать, например, FD&C. синий №1, FD&C красный №40, D&C желтый №10, FD&C синий №1, FD&C красный №40.
В предпочтительном варианте осуществления крышка 120 может представлять собой многослойную структуру, изготовленную из любых подходящих материалов, которые обеспечивают желаемые барьерные свойства. Крышка 120 предпочтительно включает в себя, по меньшей мере, внешний слой грунтовки, средний слой алюминиевой фольги и внутренний слой герметика. Крышка 120 может быть надежно и постоянно прикреплена к ободу 130 чашки 110 с помощью внутреннего слоя герметика крышки 120 с фармацевтическим активным ингредиентом 200 во внутреннем пространстве 140 чашки 110. Внутренний слой герметика может создавать воздухонепроницаемое уплотнение между крышкой 120 и чашкой 110, которое дополнительно защищает фармацевтический активный ингредиент 200.
Общая толщина крышки 120 составляет от примерно 65 микрон до примерно 82 микрон. Предпочтительно, общая толщина крышки 120 составляет около 73,8 мкм. Внешний слой грунтовки имеет толщину от около 4 микрон до около 9 микрон. Предпочтительно, внешний слой грунтовки имеет толщину около 6,8 мкм. Средний слой алюминиевой фольги имеет толщину от примерно 34 микрон до примерно 40 микрон. Предпочтительно средний слой алюминиевой фольги имеет толщину около 37 микрон. Внутренний слой герметика имеет толщину от около 27 микрон до около 33 микрон. Предпочтительно, внутренний слой герметика имеет толщину около 30 микрон. Общая толщина крышки 120 после тиснения составляет от примерно 100 микрон до примерно 150 микрон. Предпочтительно, общая толщина крышки 120 после тиснения составляет около 125 микрон. В целом многослойная структура крышки 120 имеет скорость пропускания водяного пара менее 0,05 г/100 дюйм2/24 часа.
Хотя чашка 110 и крышка 120, как описано выше, обеспечивают барьерные свойства, их самих может быть недостаточно для защиты чувствительного фармацевтического активного ингредиента 200 по настоящему изобретению. Таким образом, капсула 100 с одной дозой может быть дополнительно упакована и запечатана внутри многослойной внешней обертки 300 для обеспечения дополнительной защиты от воды, кислорода и других факторов окружающей среды. Внешняя обертка 300 может полностью окружать капсулу 100 с одной дозой, тем самым герметизируя капсулу 100 с одной дозой внутри внешней обертки 300.
В частности, внешняя обертка 300 обеспечивает уровень защиты от влаги и защиты детей, который требуется для фармацевтических продуктов. Это более высокий стандарт, чем того требуют производители одноразовых капсул, используемых для чая, кофе или других подобных напитков. Внешняя обертка 300 может иметь длину от около 135 мм до около 14 0 мм и ширину от около 80 мм до около 90 мм, когда она уложена плоско на поверхность без запечатанной внутри капсулы 100 с одной дозой. Предпочтительно, длина внешней обертки 300 составляет около 135 мм, а ширина внешней обертки 300 составляет около 86,5 мм, когда она уложена плоско на поверхности без запечатанной внутрь капсулы 100 с одной дозой. Кроме того, внешняя обертка 300 может иметь общую толщину от примерно 7 0 микрон до примерно 100 микрон. Предпочтительно, толщина внешней обертки 300 составляет около 7 9,2 мкм.
На фиг. 4 показано поперечное сечение слоев внешней обертки 300 по настоящему изобретению. Внешняя обертка 300 может быть изготовлена из любых подходящих материалов, обеспечивающих желаемые барьерные свойства. В предпочтительном варианте осуществления внешняя обертка 300 включает первый слой, представляющий собой слой 410 биаксиальноориентированного полиэтилентерефталата (ВоРЕТ). Первый слой 410 представляет собой полиэфирную пленку, изготовленную из
полиэтилентерефталата, растянутую в двух разных направлениях для улучшения механической ориентации. Первый слой 410 обеспечивает несколько полезных характеристик для настоящего изобретения, включая, помимо прочего, высокую прочность на разрыв, долговечность, барьерные свойства и прозрачность.
Кроме того, первый слой 410 внешней обертки 300 имеет толщину от примерно 20 микрон до примерно 30 микрон. Предпочтительно, первый слой 410 имеет толщину около 2 3 микрон. Толщина первого слоя 410 увеличивает прочность внешней обертки 300 и делает ее защищенной от детей. Обычно толщина слоя ВоРЕТ, используемого для аналогичных продуктов, будет намного меньше; однако такие аналогичные продукты не будут защищены от детей и, следовательно, не могут использоваться с фармацевтическими ингредиентами.
В предпочтительном варианте осуществления внешняя обертка 300 включает второй слой, представляющий собой слой 420 полиэтилена (РЕ), имеющий толщину от примерно 10 микрон до примерно 20 микрон. Предпочтительно толщина второго слоя 420 составляет около 13 микрон. В частности, второй слой 420 может быть белым РЕ-слоем. Второй слой 420 может обеспечивать белый фон для печати и связывать первый слой 410 с третьим слоем 430.
В предпочтительном варианте осуществления внешняя обертка 300 включает третий слой, представляющий собой слой 430 алюминиевой фольги. Третий слой 430 имеет толщину от примерно 7 микрон до примерно 12 микрон. Предпочтительно толщина третьего слоя 430 составляет около 8,9 мкм. Третий слой 430 позволяет внешней обертке 300 быть стойкой к прохождению жидкостей и газов, включая, среди прочего, воду и кислород. В частности, молекулярная структура алюминиевой фольги создает прочный барьер, который идеально подходит для использования с фармацевтическими ингредиентами благодаря их чувствительности к факторам окружающей среды.
Третий слой 430 исключает воздействие жидкостей и газов; тем самым продлевая срок хранения настоящего изобретения и поддерживая качество и эффективность фармацевтического активного ингредиента 200, содержащегося в чашке 110. Кроме того, третий слой 430 является долговечным и прочным, при этом он легок и податлив. Следовательно, он идеально подходит для упаковки продуктов различных форм и размеров без потери барьерных свойств.
В предпочтительном варианте осуществления внешняя обертка включает четвертый слой, представляющий собой слой 440 иономера. Четвертый слой 440 имеет толщину от примерно 30 микрон до примерно 40 микрон. Предпочтительно, толщина четвертого слоя 440 составляет около 34,3 мкм. Четвертый слой 440 представляет собой герметик и может быть загнут на себя для создания уплотнения вокруг капсулы 100 с одной дозой.
Как можно видеть на фиг. 4, первый слой 410 может быть самым внешним слоем внешней обертки 300 на внешней стороне. Второй слой 42 0 может быть предусмотрен между первым слоем 410 и третьим слоем 430. Третий слой 430 может быть предусмотрен между вторым слоем 420 и четвертым слоем 440. Четвертый слой 440 может быть самым внутренним слоем внешней обертки 300 на герметизирующей или внутренней стороне.
На фиг. 3 показан вид в перспективе капсулы 100 с одно дозой, запечатанной внутри внешней обертки 300. Как показано на фиг. 3, четвертый слой 440 одного конца внешней обертки 300 может быть прикреплен к четвертому слою 440 другого конца внешней обертки 300 для создания герметичной части 310. Герметичная часть 310 обеспечивает идеальное уплотнение для дополнительной защиты фармацевтического активного ингредиента 200, содержащегося в капсуле 100 с одной дозой.
Внешняя обертка 300 имеет скорость пропускания паров влаги менее 0,005 г Н2О/100 дюйм2/24 часа. Предпочтительно, внешняя обертка 300 имеет скорость пропускания паров влаги менее 0,001 г Н2О/100 дюйм2/2 4 часа. Скорость пропускания паров влаги наружной оберткой была проверена при температуре 100°F и относительной влажности 90%. Кроме того, внешняя обертка 300 имеет скорость пропускания кислорода менее 0,005 см3/100 дюйм2/24 часа. Предпочтительно, внешняя обертка 300 имеет скорость пропускания кислорода менее 0,001 см3/100 дюйм2/24 часа. Скорость прохождения кислорода проверялась при температуре 73°F и относительной влажности 0%. Таким образом, внешняя обертка 300 имеет превосходные барьерные свойства для кислорода и влаги, идеально подходящие для фармацевтического активного ингредиента 200, который может использоваться в упаковке 250 с индивидуальной дозой.
Кроме того, внешняя обертка 300 обеспечивает защищенную от детей и прочную на разрыв упаковку для капсулы 100 с одно дозой. Определение устойчивый к разрыву относится к материалу, который способен испытывать разумный уровень напряжения и/или деформации без существенной потери целостности при воздействии сил, которые могут быть приложены человеком. Очень важно, чтобы внешняя обертка 300 была недоступной для детей, чтобы предотвратить проглатывание детьми потенциально опасных веществ, таких как фармацевтический активный ингредиент 2 00, который может храниться в чашке 110 по настоящему изобретению.
Стандартизированный тест на безопасность для детей в соответствии с 16.CFR § 1700 Упаковка для предотвращения отравления была выполнена в соответствии с настоящим изобретением, неудачный тест определяется как тот, когда ребенок открывает пакет или получает доступ к содержимому пакета. В одном варианте осуществления настоящее изобретение может быть защищено от детей, и ему может быть присвоена оценка, которая упоминается как значение F. Значение F - это количество единичных доз, доступ к которым считается неудачным тестом. Значение F определяется на основе количества единичных доз, которые могут вызвать серьезную травму или серьезное заболевание у ребенка, исходя из веса ребенка 25 фунтов (11,4 кг). В варианте осуществления настоящего изобретения упаковка 250 с индивидуальной дозой может быть упаковкой с F=1. В другом варианте осуществления упаковка 250 с индивидуальной дозой по настоящему изобретению может быть упаковкой с F=3. В другом варианте осуществления упаковка 250 с индивидуальной дозой по настоящему изобретению может быть упаковкой с F=4. В другом варианте осуществления упаковка 250 с индивидуальной дозой по настоящему изобретению может быть упаковкой с F=5. В предпочтительном варианте осуществления настоящего изобретения упаковка с индивидуальной дозой представляет собой упаковку с F=2.
Тест на безопасность для детей показал, что упаковка 250 с индивидуальной дозой более чем на 7 0% защищена от детей, когда упаковка представляет собой упаковку с F=1, F=2, F=3, F=4 или F=5. В другом варианте осуществления упаковка с индивидуальной дозой является более чем на 80% защищенной от детей, когда упаковка представляет собой упаковку F=1, F=2, F=3, F=4 или F=5. В предпочтительном варианте осуществления упаковка с индивидуальной дозой на 100% является защищенной от детей, когда упаковка представляет собой упаковку с F=1, F=2, F=3, F=4 или F=5.
Дополнительно, тест для взрослых пожилых людей в соответствии с 16.CFR §1700 Упаковка для предотвращения отравления был выполнен на внешней обертке 300 по настоящему изобретению, чтобы гарантировать, что взрослые с проблемами подвижности могли получить доступ к капсуле 100 с одной дозой. В одном варианте реализации более 90% испытуемых пожилых людей успешно открыли внешнюю обертку 300 с помощью ножниц или других подходящих средств. В предпочтительном варианте осуществления 10 0% испытуемых пожилых людей успешно открывали внешнюю обертку 300 ножницами или другими подходящими средствами.
Дополнительные аспекты настоящего изобретения могут быть направлены на способы лечения симптомов простуды и/или гриппа, аллергии или других заболеваний, включающие приготовление напитка, как описано здесь, и введение или употребление приготовленного напитка. Дополнительные аспекты настоящего изобретения могут быть направлены на использование напитка, приготовленного, как описано в настоящем описании, для лечения симптомов простуды и/или гриппа, аллергии или других заболеваний.
Пример 1:
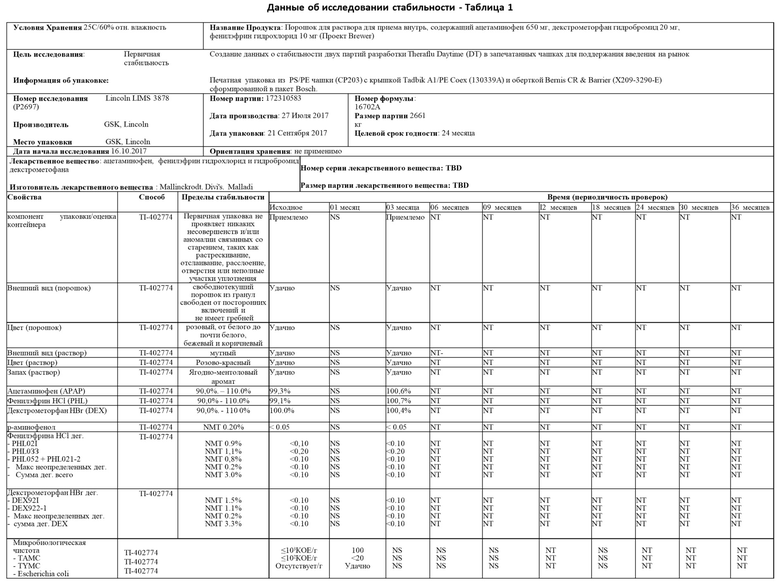
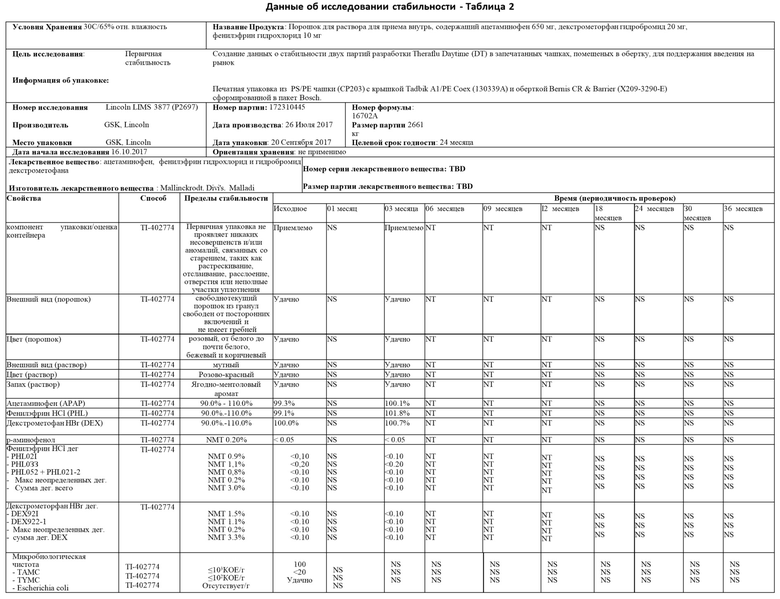
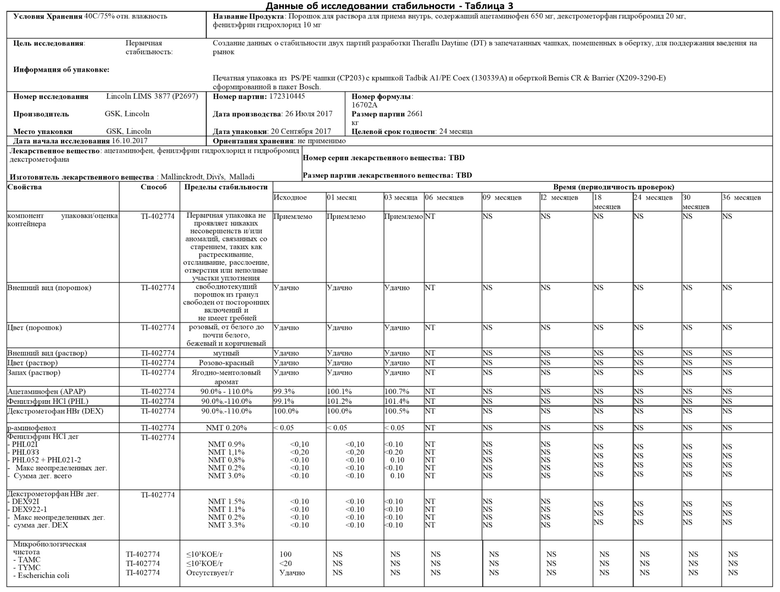
Пример 1 описывает стабильность и подходящий срок хранения настоящего изобретения. В частности, исследование стабильности было проведено в варианте осуществления настоящего изобретения, в котором фармацевтический активный ингредиент 200 представляет собой комбинацию 650 мг ацетаминофена, 10 мг фенилэфринаи 20 мг декстрометорфана.
Настоящее изобретение было протестировано в условиях длительного хранения при температуре 25°С и относительной влажности 60%, в промежуточных условиях хранения при температуре 30°С и относительной влажности 65%, а также в условиях ускоренного хранения при температуре температура 40°С и относительная влажность 75%.
Как показано в таблицах 1-3 ниже, исследование в целом пришло к выводу, что данные для оценки соответствуют спецификациям для всех временных точек и условий хранения. В частности, данные, полученные для внешнего вида гранул и раствора, соответствовали спецификациям для всех временных точек и условий хранения. Данные, полученные для анализа для каждого активного вещества, соответствовали спецификациям для всех временных точек и условий хранения с минимальными изменениями во времени. Данные, полученные для р-аминофенола, не показали увеличения разложения для всех временных точек и условий хранения с максимальными результатами менее 0,05%. Данные, сгенерированные для PHL021, PHL033, PHL052+PHL021-2, максимум неуказанных продуктов разложения (дег.) и общая сумма продуктов разложения, находились в пределах допустимых значений в каждый запланированный момент времени и условия хранения. Данные, сгенерированные для DEX921, DEC922-1, неопределенных продуктов разложения, а также максимальное и суммарное количество продуктов разложения, находились в пределах допустимых значений в каждый запланированный момент времени и в каждом состоянии хранения. Микробиологическая чистота настоящего изобретения оценивалась по общему количеству аэробных микробов (ТАМС), общему количеству комбинированных дрожжей и плесени (TYMC), а также по отсутствию специфических микроорганизмов E.coli. Доказано, что микробиологическая чистота соответствует требованиям спецификации готового продукта для всех протестированных образцов.
На основании результатов, отмеченных выше, исследование стабильности пришло к выводу, что существует высокий уровень уверенности в том, что настоящее изобретение является достаточно надежным и что капсула 100 с индивидуальной дозой может обеспечить долгосрочную стабильность фармацевтического активного ингредиента 200 во внутреннем пространстве 140 корпуса чашки 110.
Данные по долгосрочной и ускоренной стабильности продемонстрировали, что настоящее изобретение не подвергается неблагоприятному воздействию, если оно упаковано в капсулу 100 с одной дозой. Следовательно, срок хранения настоящего изобретения составляет 24 месяца при упаковке в капсулу 100 с одной дозой настоящего изобретения и хранении при температуре ниже 25°С или эквивалентной.
Исследование температурных циклов было выполнено для исследования стабильности настоящего изобретения при хранении в условиях замораживания и последующем оттаивании. Для воздействия замораживания-оттаивания настоящее изобретение подвергали воздействию в течение 12 часов при -20°С, а затем 12 часов при 10°С, всего 5 циклов и 10 циклов. Кроме того, было проведено высокотемпературное статическое исследование при 50°С в течение двух недель. По результатам исследования сделан вывод о том, что настоящее изобретение не чувствительно к температуре замораживания, оттаивания и высоким температурам.
Примечания к таблице 1
Неудачно = тест вне спецификации
NT = не испытано, ND = He определено, NS = He масштабировано
NMT = He более чем
NR = Нет результата
N/А = не применимо



Пример 2:
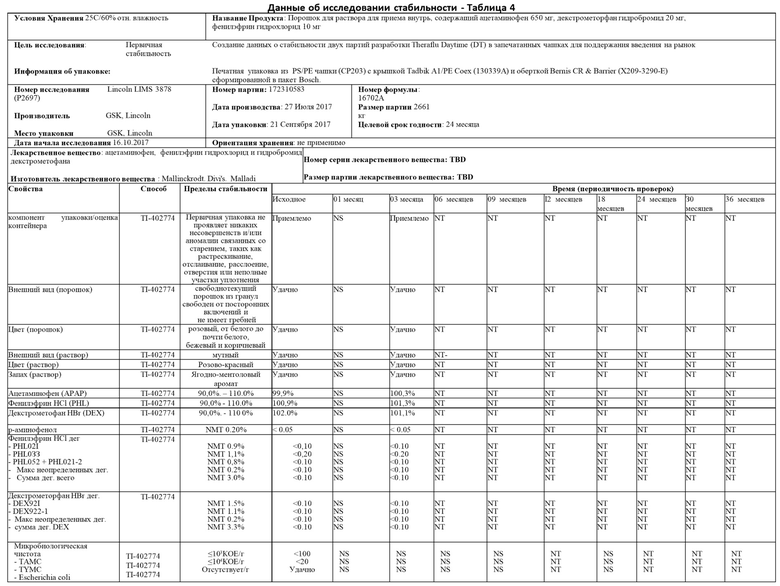
Пример 2 описывает стабильность и подходящий срок хранения настоящего изобретения. В частности, исследование стабильности было проведено в варианте осуществления настоящего изобретения, в котором фармацевтический активный ингредиент 200 представляет собой комбинацию 650 мг ацетаминофена, 10 мг фенилэфринаи 25 мг дифенгидрамина.
Настоящее изобретение было испытано в условиях длительного хранения при температуре 25°С и относительной влажности 60%, в промежуточных условиях хранения при температуре 30°С и относительной влажности 65%, а также в условиях ускоренного хранения при температуре температура 4 0°С и относительной влажности 75%.
Как видно из Таблиц 4-6 ниже, исследование в целом пришло к выводу, что данные для оценки соответствуют спецификациям для всех временных точек и условий хранения. В частности, данные, полученные для внешнего вида гранул и раствора, соответствовали спецификациям для всех временных точек и условий хранения. Данные, полученные для анализа для каждого активного вещества, соответствовали спецификациям для всех временных точек и условий хранения с минимальными изменениями во времени. Данные, полученные для р-аминофенола, не показали увеличения разложения для всех временных точек и условий хранения с максимальными результатами менее 0,05%. Данные, сгенерированные для PHL021, PHL033, PHL052+PHL021-2, неуказанных продуктов разложения, а также максимальное количество и сумма общих продуктов разложения находились в пределах допустимых значений в каждый запланированный момент времени и условия хранения. Данные, полученные по компонентам разложения DPH, ВЕН, ВРН, неуказанным компонентам разложения, а также максимальному количеству и сумме всех продуктов разложения, находились в пределах допустимых значений в каждый запланированный момент времени и условия хранения. Микробиологическая чистота настоящего изобретения оценивалась по общему количеству аэробных микробов, общему количеству комбинированных дрожжей и плесени, а также по отсутствию специфических микроорганизмов E.coli. Доказано, что микробиологическая чистота соответствует требованиям спецификации готового продукта для всех протестированных образцов.
На основании результатов, отмеченных выше, исследование стабильности пришло к выводу, что существует высокий уровень уверенности в том, что настоящее изобретение является достаточно надежным и что отдельная порционная капсула 100 может обеспечить долгосрочную стабильность фармацевтического активного ингредиента 200 во внутреннем пространстве 140 корпуса чашки 110.
Данные долгосрочной, промежуточной и ускоренной стабильности продемонстрировали, что настоящее изобретение не подвергается неблагоприятному воздействию при упаковке в капсулу 100 с одной дозой. Следовательно, срок хранения настоящего изобретения составляет 24 месяца при упаковке в капсулу 100 с одной дозой настоящего изобретения и хранении при температуре ниже 25°С или эквивалентной ей.
Исследование температурных циклов было выполнено для исследования стабильности настоящего изобретения при хранении в условиях замораживания и последующем оттаивании. Для воздействия замораживания-оттаивания настоящее изобретение подвергали воздействию в течение 12 часов при -20°С, а затем 12 часов при 10°С, всего 5 циклов и 10 циклов. Кроме того, было проведено высокотемпературное статическое исследование при 50°С в течение двух недель. По результатам исследования сделан вывод о том, что настоящее изобретение не чувствительно к температуре замораживания, оттаивания и высоких температур.



Пример 3:
В Примере 3 подробно описан метод тестирования и результат теста на безопасность для детей, проведенного для настоящего изобретения, чтобы гарантировать его соответствие Закону об упаковке для предотвращения отравления от 197 0 Положений и Своду федеральных нормативных актов, раздел 16: Часть 1700.20. Метод тестирования и результаты теста подробно описаны ниже.
Метод тестирования на безопасность для детей:
25 мальчиков и 25 девочек в возрасте от 42 месяцев до 51 месяца включительно были протестированы парами в двух разных тестовых ситуациях. 30% детей были в возрасте 42-44 месяца, 40% детей были в возрасте 45-48 месяцев и 30% детей были в возрасте 4 9-51 месяцев. Все дети были подготовлены заранее и получили подробную информацию.
Сначала в комнату поместили пару детей, вручили одинаковые пакеты, и администратор попросил их «пожалуйста, попробуйте открыть это для меня». Затем каждому ребенку было дано 5 минут, чтобы попытаться открыть свой пакет. Администратор внимательно наблюдал за детьми все время во время теста и никаким образом не влиял на детей ни вербально, ни невербально. Детям была предоставлена свобода передвижения для работы с упаковками, т.е. детям разрешалось вставать, опускаться на пол, стучать или поддевать упаковку. Детям также разрешили поговорить друг с другом об открытии пакетов и посмотреть, как друг друга пытаются открыть пакеты. Если ребенок открывал пакет, администратор говорил «спасибо», брал пакет у ребенка и помещал его в недоступном для ребенка месте. Ребенка не просили открыть пакет второй раз.
По истечении 5 минут администратор продемонстрировал, как открыть пакет, если какой-либо ребенок не открыл свой пакет. Для демонстрации администратор использовал была использована отдельная демонстрационная упаковка. Перед демонстрацией детей попросили отложить свои пакеты в сторону, и им не разрешали продолжать попытки открыть их. Во время демонстрации администратор держал упаковку примерно в двух футах от детей и открывал упаковку с нормальной скоростью, как будто администратор собирался использовать содержимое. Администратор не стал преувеличивать никаких движений. Администратор также не обсуждал и не описывал, как открыть пакет.
После демонстрации администратор начал второй 5-минутный тестовый период, проинструктировав детей подсказкой «теперь вы пытаетесь открыть свои пакеты». Если один или оба ребенка не открывали свои упаковки зубами в течение первых 5 минут тестового периода, администратор проинструктировал детей перед началом второго 5 минутного тестового периода, что «вы можете использовать зубы, если хотите». Затем администратор наблюдала за детьми во время второго 5-минутного периода тестирования или до тех пор, пока оба ребенка не открыли свои пакеты, в зависимости от того, что наступит раньше.
Результаты тестирования на безопасность для детей:
За первые 5 минут тестирования (перед демонстрацией) было зарегистрировано нулевое количество открытий. Кроме того, во втором 5-минутном тестовом периоде (после демонстрации) было зарегистрировано нулевое количество открытий. Это соответствует общему проценту 0,00% для полного 10-минутного теста, что находится в пределах допуска US 16CFR § 1700.20. Таким образом, настоящее изобретение соответствует требованиям испытаний на безопасность для детей согласно US 16 CFR § 1700.20, как показано в таблице 7.
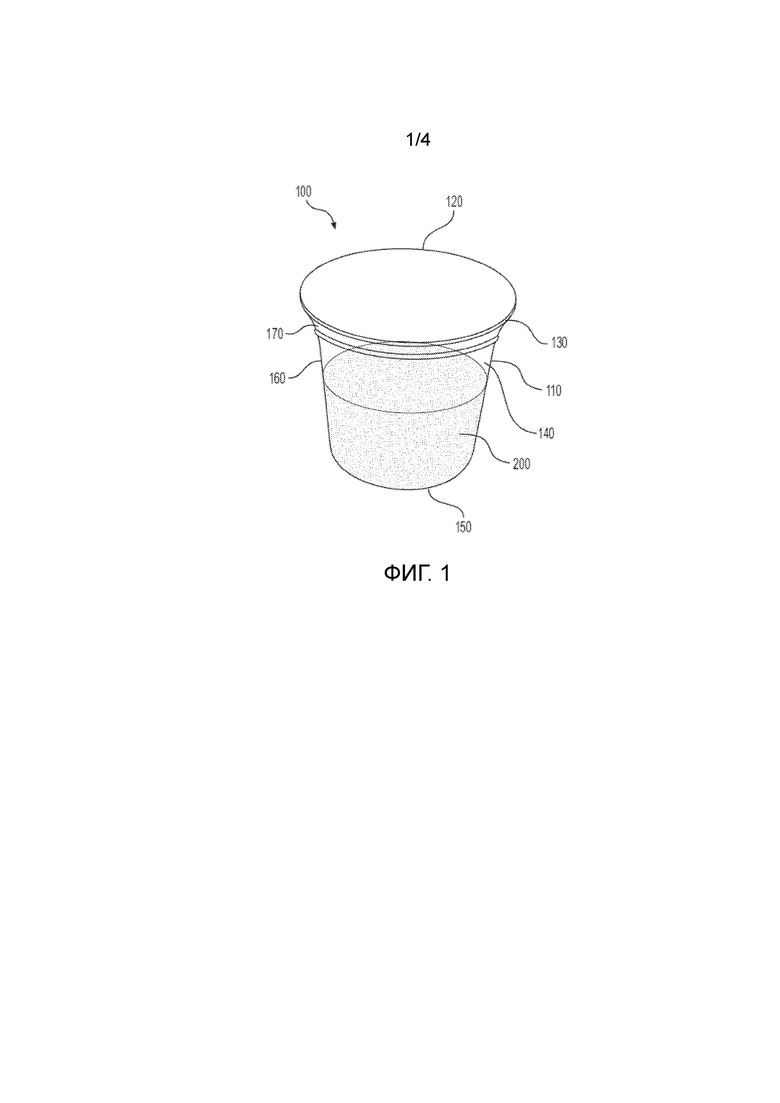
Эти результаты основаны на предположении, что открытие пакета определяется как ситуация, когда ребенок получает доступ к 1 (или более) единицам, упакованным в упаковку. Это соответствует частоте отказов F=1. В таблице 7 ниже указано количество открытий упаковки, которые будут считаться успешными, потребуют продолжения тестирования или будут считаться неудачными в течение первых 5 минут тестирования и полного 10 минутного теста в соответствии с US 16 CFR § 1700.20.
Пример 4:
В Примере 4 подробно описан метод тестирования и результат теста для взрослого пожилого возраста, проведенного в соответствии с настоящим изобретением, чтобы гарантировать его соответствие Закону об упаковке для предотвращения отравления от 197 0 Положений и Своду федеральных нормативных актов, раздел 16: Часть 1700.20. Метод тестирования и результаты теста подробно описаны ниже.
Метод тестирования взрослых:
Тест проводился со 100 участниками, из которых 70% были женщинами и 30% мужчинами. 25% участников были в возрасте от 50 до 54 лет, 25% участников были в возрасте от 55 до 59 лет и 50% участников были в возрасте от 60 до 7 0 лет. Каждый участник участвовал в тесте индивидуально и не находился в присутствии других участников или посторонних. Тест проводился в хорошо освещенном и свободном от отвлекающих факторов помещении.
Администратор начал первый 5-минутный тестовый период с инструкции участнику открыть предоставленный пакет в соответствии с инструкциями на пакете. Участнику было предоставлено до 5 минут, чтобы прочитать инструкции и открыть пакет. Через 5 минут или когда участник открыл пакет, в зависимости от того, что наступило раньше, администратор забрал у участника все тестовые материалы.
Затем администратор начал второй тестовый период с предоставления участнику другого идентичного пакета. Второй тестовый период длился 1 минуту. Администратор проинструктировал участника, что это идентичный пакет, и снова открыть его по инструкции. Также администратор проинформировал участников, что для вскрытия упаковки они должны разрезать ножницами уплотнения по концам. После второго периода тестирования или когда участник открыл пакет, в зависимости от того, что произошло раньше, администратор забрал у участника все тестовые материалы.
Результаты тестирования пожилых взрослых:
16 CFR § 17 00.2 0 допускает 10% неудачных открытий. Результаты теста для взрослых пожилых людей, проведенного в соответствии с описанной процедурой, показывают, что в течение первого периода тестирования было зарегистрировано ноль неудачных попыток открыть пакет. За второй период тестирования зафиксировано ноль неудачных попыток вскрытия упаковки. Это соответствует общему проценту 0,00% для полного 10-минутного теста, что находится в пределах допуска US 16 CFR § 1700.20. Таким образом, настоящее изобретение соответствует требованиям к испытаниям для взрослых согласно 16 CFR § 1700.20.

Группа изобретений относится к медицинским упаковкам с индивидуальной дозой. Упаковка с индивидуальной дозой для использования с автоматической варочной машиной содержит капсулу с одной дозой, включающую чашку, имеющую дно и боковую стенку, проходящую от дна до обода, окружающего отверстие, при этом пространство между дном и боковой стенкой определяет внутреннее пространство. Фармацевтический активный ингредиент находится во внутреннем пространстве чашки. Крышка прикреплена к ободу чашки, тем самым закрывая отверстие и удерживая фармацевтический активный ингредиент во внутреннем пространстве чашки. Внешняя обертка окружает целиком капсулу с одной дозой и запечатывает в себе капсулу с одной дозой. Внешняя обертка создает непроницаемый барьер, препятствующий проникновению жидкостей и газов. Внешняя обертка представляет собой многослойную структуру, включающую первый слой, представляющий собой двухосно ориентированный слой полиэтилентерефталата, второй слой, представляющий собой слой полиэтилена, третий слой, являющийся слоем алюминиевой фольги, и четвертый слой, являющийся слоем иономера. Внешняя обертка является на 100% защищенной от детей с нулевым количеством открытий в течение 10-минутного периода. Раскрыта многослойная внешняя обертка. Технический результат состоит в обеспечении упаковки, защищенной от детей и доступной для пожилых взрослых с непроницаемым барьером против факторов окружающей среды. 2 н. и 22 з.п. ф-лы, 4 ил., 7 табл.
1. Упаковка с индивидуальной дозой для использования с автоматической варочной машиной, содержащая:
капсулу с одной дозой, включающую в себя:
чашку, имеющую дно и боковую стенку, проходящую от дна до обода, окружающего отверстие, при этом пространство между дном и боковой стенкой определяет внутреннее пространство,
по меньшей мере один фармацевтический активный ингредиент, находящийся во внутреннем пространстве чашки, и
крышку, прикрепленную к ободу чашки, тем самым закрывая отверстие и удерживая по меньшей мере один фармацевтический активный ингредиент во внутреннем пространстве чашки; и
внешнюю обертку, окружающую целиком капсулу с одной дозой и запечатывающую в себе капсулу с одной дозой, причем внешняя обертка создает непроницаемый барьер, препятствующий проникновению жидкостей и газов,
при этом внешняя обертка представляет собой многослойную структуру, включающую в себя первый слой, представляющий собой двухосно-ориентированный слой полиэтилентерефталата, второй слой, представляющий собой слой полиэтилена, третий слой, являющийся слоем алюминиевой фольги, и четвертый слой, являющийся слоем иономера, при этом
внешняя обертка является на 100% защищенной от детей с нулевым количеством открытий в течение 10-минутного периода.
2. Упаковка с индивидуальной дозой по п.1, в которой по меньшей мере один фармацевтически активный ингредиент представляет собой ацетаминофен, фенилэфрин, декстрометорфан, дифенгидрамин, ибупрофен, псевдоэфедрин, гвайфенезин, ацетилцистеин, хлорфенирамин, цетиризин, левоцетиризамин, доксиламинсукцин или их комбинацию.
3. Упаковка с индивидуальной дозой по п.2, в которой по меньшей мере один фармацевтически активный ингредиент представляет собой ацетаминофен.
4. Упаковка с индивидуальной дозой по п.2, в которой по меньшей мере один фармацевтический активный ингредиент представляет собой комбинацию ацетаминофена, фенилэфрина и декстрометорфана.
5. Упаковка с индивидуальной дозой по п.2, в которой по меньшей мере один фармацевтический активный ингредиент представляет собой комбинацию ацетаминофена, фенилэфрина и дифенгидрамина.
6. Упаковка с индивидуальной дозой по п.2, в которой по меньшей мере один фармацевтический активный ингредиент представляет собой комбинацию гвайфенезина и декстрометорфана.
7. Упаковка с индивидуальной дозой по п.1, в которой внешняя обертка имеет толщину 70-100 мкм.
8. Упаковка с индивидуальной дозой по п.1, в которой первый слой внешней обертки имеет толщину 20-30 мкм.
9. Упаковка с индивидуальной дозой по п.1, в которой второй слой внешней обертки имеет толщину 10-20 мкм.
10. Упаковка с индивидуальной дозой по п.1, в которой третий слой внешней обертки имеет толщину 7-12 мкм.
11. Упаковка с индивидуальной дозой по п.1, в которой четвертый слой внешней обертки имеет толщину 30-40 мкм.
12. Упаковка с индивидуальной дозой по п.1, в которой внешняя обертка имеет скорость пропускания паров влаги менее 0,001 г H2O/100 дюймов2/24 часа.
13. Упаковка с индивидуальной дозой по п.1, в которой внешняя обертка имеет скорость пропускания кислорода менее 0,001 см3/100 дюймов2/24 часа.
14. Упаковка с индивидуальной дозой по п.1, в которой внешняя обертка имеет длину 130-140 мм и ширину 80-90 мм в горизонтальном положении.
15. Упаковка с индивидуальной дозой по п.1, в которой четвертый слой одного конца внешней обертки сложен и приклеен к четвертому слою другого конца внешней обертки для создания запечатанной части и герметизации капсулы с одной дозой внутри внешней обертки.
16. Упаковка с индивидуальной дозой по п.1, являющаяся на 100% доступной для пожилых взрослых с нулевым количеством неудачных открытий в течение 10-минутного периода.
17. Многослойная внешняя обертка, содержащая:
первый слой, представляющий собой двухосно-ориентированный слой полиэтилентерефталата;
второй слой, представляющий собой слой полиэтилена;
третий слой, представляющий собой слой алюминиевой фольги;
и четвертый слой, представляющий собой иономерный слой,
при этом внешняя обертка защищена от детей и создает непроницаемый барьер, препятствующий проникновению жидкостей и газов, при этом
внешняя обертка является на 100% защищенной от детей с нулевым количеством открытий в течение 10-минутного периода.
18. Многослойная внешняя обертка по п.17, в которой первый слой многослойной внешней обертки имеет толщину 20-30 мкм.
19. Многослойная внешняя обертка по п.17, в которой второй слой многослойной внешней обертки имеет толщину 10-20 мкм.
20. Многослойная внешняя обертка по п.17, в которой третий слой многослойной внешней обертки имеет толщину 7-12 мкм.
21. Многослойная внешняя обертка по п.17, в которой четвертый слой многослойной внешней обертки имеет толщину 30-40 мкм.
22. Многослойная внешняя обертка по п.17, имеющая скорость пропускания водяного пара менее 0,001 г Н2О/100 дюймов2/24 часа.
23. Многослойная внешняя обертка по п.17, имеющая скорость пропускания кислорода менее 0,001 см3/100 дюймов2/24 часа.
24. Многослойная внешняя обертка по п.17, являющаяся на 100% доступной для пожилых взрослых с нулевым количеством неудачных открытий в течение 10-минутного периода.
| US 20160145037 A1, 26.05.2016 | |||
| US 20110303095 A1, 15.12.2011 | |||
| US 8617677 B2, 31.12.2013 | |||
| US 2011200683 A1, 18.08.2011 | |||
| JP 6198182 B1, 20.09.2017 | |||
| Подъемник блока судна | 2022 |
|
RU2784120C1 |
| WO 2015123211 A1, 20.08.2015 | |||
| КОМПОЗИТНЫЙ МАТЕРИАЛ, УПАКОВКА И НОСИТЕЛЬ, ВЫПОЛНЕННЫЕ НА ОСНОВЕ КОМПОЗИТНОГО МАТЕРИАЛА, И СПОСОБ ПОЛУЧЕНИЯ КОМПОЗИТНОГО МАТЕРИАЛА | 2008 |
|
RU2379066C1 |
Авторы
Даты
2023-07-31—Публикация
2019-06-11—Подача