Родственные Заявки
Согласно настоящей заявке испрашивается приоритет в соответствии с предварительной заявкой на выдачу патента США №: 62/530518, поданной 10 июля 2017 г., предварительной заявкой на выдачу патента США №: 62/599223, поданной 15 декабря 2017 г., предварительной заявкой на выдачу патента США №: 62/614111, поданной 5 января 2018 г., и предварительной заявкой на выдачу патента США №: 62/673424, поданной 18 мая 2018 г., полное содержание каждой из перечисленных выше заявок на выдачу патента включено в данный документ посредством ссылки.
Настоящая заявка также связана с международной заявкой № PCT/US2016/065245, поданной 7 декабря 2016 г., предварительной заявкой на выдачу патента США №: 62/264013, поданной 7 декабря 2015 г., предварительной заявкой на выдачу патента США №: 62/315228, поданной 30 марта 2016 г., предварительной заявкой на выдачу патента США №: 62/366304, поданной 25 июля 2016 г., и с предварительной заявкой на выдачу патента США №: 62/429241, поданной 2 декабря 2016 г., полное содержание каждой из перечисленных выше заявок на выдачу патента включено настоящим в данный документ посредством ссылки.
Кроме того, настоящая заявка связана с предварительной заявкой на выдачу патента США №: 61/992057, поданной 12 мая 2014 г., предварительной заявкой на выдачу патента США №: 62/089018, поданной 8 декабря 2014 г., предварительной заявкой на выдачу патента США №: 62/102281, поданной 12 января 2015 г., и международной заявкой № PCT/US2015/030337, поданной 12 мая 2015 г., полное содержание каждой из перечисленных выше заявок на выдачу патента включено настоящим в данный документ посредством ссылки.
Настоящая заявка также связана с предварительной заявкой на выдачу патента США №: 61/638952, поданной 26 апреля 2012 г., предварительной заявкой на выдачу патента США №: 61/669249, поданной 9 июля 2012 г., предварительной заявкой на выдачу патента США №: 61/734573, поданной 7 декабря 2012 г., заявкой на выдачу патента США №:13/837129, поданной 15 марта 2013 г., сейчас это патент США №: 9127274, заявкой на выдачу патента США №: 14/806084, поданной 22 июля 2015 г., сейчас это патент США №: 9376680, заявкой на выдачу патента США №: 15/070358, поданной 15 марта 2016 г., и международной заявкой № PCT/US2013/038218, поданной 25 апреля 2013 г. Настоящая заявка также связана с международной заявкой № PCT/US2012/065601, поданной 16 ноября 2012 г., полное содержание каждой из перечисленных выше заявок на выдачу патента включено настоящим в данный документ посредством ссылки.
Список Последовательностей
Настоящая заявка содержит Список Последовательностей, который был представлен в электронном виде в формате ASCII и настоящим полностью включен посредством ссылки. Указанная копия ASCII, созданная 2 июля 2018 г., называется 117811-02720_SL.TXT и имеет размер 21147 байт.
Уровень Техники Изобретения
Serpinc1 является элементом суперсемейства ингибиторов сериновых протеиназ (серпинов). Serpinc1 представляет собой ингибитор протеазы плазмы, который ингибирует тромбин, а также другие активированные сериновые протеазы системы коагуляция, такие как факторы X, IX, XI, XII и VII и, таким образом, регулирует каскад свертывания крови. Антикоагулянтная активность Serpinc1 усиливается в присутствии гепарина и других родственных гликозаминогликанов, которые катализируют образование комплексов тромбин:антитромбин (TAT).
Нарушения свертываемости, либо наследственные, либо приобретенные, являются условиями, в которых появляется недостаточное свертывание крови. Например, гемофилия представляет собой группу наследственных генетических нарушений свертываемости, которые нарушают способность организма регулировать свертывание или коагуляцию крови. Гемофилия A представляет собой рецессивное сцепленное с Х хромосомой генетическое нарушение, связанное с отсутствием функционального фактора свертывания VIII и охватывает 80% случаев гемофилии. Гемофилия B представляет собой рецессивное сцепленное с Х хромосомой генетическое нарушение, связанное с отсутствием функционального фактора свертывания IX. Она охватывает приблизительно 20% случаев гемофилии. Гемофилия C представляет собой аутосомное генетическое нарушение, связанное с отсутствием функционального фактора свертывания XI. Гемофилия C не полностью рецессивная, так как гетерозиготные особи также демонстрируют повышенное кровотечение.
Хотя в настоящее время не существует лечения гемофилии, ее можно регулировать с помощью регулярных инфузий недостающего фактора свертывания, например, фактора VIII при гемофилии A. Однако у некоторых больных гемофилией вырабатываются антитела (ингибиторы) против вводимых им замещающих факторов и, таким образом, они становятся невосприимчивыми к замещающему фактору свертывания. Соответственно, у таких больных нельзя правильно регулировать кровотечения.
Выработка ингибиторов в высоком титре, например, фактора VIII и других факторов свертывания является наиболее тяжелым осложнением, связанным с лечением гемофилии, и делает лечение кровотечений очень сложной задачей. В настоящее время единственными стратегиями остановки кровотечения у таких больных является использование «шунтирующих средств», таких как шунтирующая активность при ингибиторах фактора VIII (FEIBA) и активированного рекомбинантного фактора VII (rFVIIa), плазмоферез, постоянное замещение фактора и индукция иммунной толерантности, ни одна из которых не является полностью эффективной. Соответственно, в данной области существует потребность в альтернативных методах лечения больных, имеющих нарушение свертываемости, такое как гемофилия.
Сущность изобретения
Настоящее изобретение по меньшей мере частично основано на неожиданном открытии, что у больных гемофилией без ингибиторов, которым вводят терапевтически эффективное количество композиции иРНК, которое влияет на опосредованное РНК-индуцированным сайленсинговым комплексом (RISC) расщепление РНК-транскриптов гена Serpinc1, кровотечение можно лечить терапевтически эффективным количеством замещающего фактора, такого как фактор VIII или фактор XI, меньшим чем рекомендованное эффективное количество замещающего фактора, например, рекомендованное всемирной федерацией гемофилии (см., например, Srivastava, et al., «Guidelines for the Management of Hemophilia», Hemophilia Epub 6 July 2012; DOI:10,1111/j,1365-2516,2012,02909.x) и/или управлением пищевых продуктов и лекарственных средств;, и что у больных гемофилией с ингибиторами и которым вводят терапевтически эффективное количество композиции иРНК, которое влияет на опосредованное РНК-индуцированным сайленсинговым комплексом (RISC) расщепление РНК-транскриптов гена Serpinc1, кровотечение можно лечить терапевтически эффективным количеством шунтирующего средства, такого как активированный концентрат протромбинового комплекса (aPCC) или рекомбинантный фактор VIIa (rFVIIa), меньшим чем рекомендованное эффективное количество шунтирующего средства, например, рекомендованное всемирной федерацией гемофилии (см., например, Srivastava, et al., «Guidelines for the Management of Hemophilia», Hemophilia Epub 6 July 2012; DOI:10,1111/j,1365-2516,2012,02909.x) и/или управлением пищевых продуктов и лекарственных средств.
Соответственно, в одном аспекте в настоящем изобретении представлен способ лечения кровотечения у больного, имеющего нарушение свертываемости, такое как гемофилия без ингибиторов. Способ включает введение больному фиксированной дозы от приблизительно 30 мг до приблизительно 90 мг средства двухцепочечной рибонуклеиновой кислоты (РНКи), которая ингибирует экспрессию Serpinc1, причем средство двухцепочечной РНКи содержит смысловую нить и антисмысловую нить, причем антисмысловая нить содержит область комплементарности к иРНК, кодирующей Serpinc1, которая содержит по меньшей мере 15 соседних нуклеотидов, отличающихся не более чем на 3 нуклеотида от нуклеотидной последовательности 5’-UUGAAGUAAAUGGUGUUAACCAG-3’ (SEQ ID NO: 15), причем по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити представляют собой модифицированные нуклеотиды, и при этом смысловая нить конъюгирована с лигандом, присоединенным на 3’-конце; и введение больному терапевтически эффективного количества замещающего фактора, причем эффективное количество замещающего фактора уменьшено по сравнению с рекомендованным эффективным количеством замещающего фактора, за счет этого происходит лечение кровотечения у больного гемофилией без ингибиторов.
В другом аспекте в настоящем изобретении представлен способ лечения кровотечения у больного, имеющего нарушение свертываемости, такое как гемофилия с ингибиторами. Способы включают введение больному фиксированной дозы от приблизительно 30 мг до приблизительно 90 мг средства двухцепочечной рибонуклеиновой кислоты (РНКи), которая ингибирует экспрессию Serpinc1, причем средство двухцепочечной РНКи содержит смысловую нить и антисмысловую нить, причем антисмысловая нить содержит область комплементарности к иРНК, кодирующей Serpinc1, которая содержит по меньшей мере 15 соседних нуклеотидов, отличающихся не более чем на 3 нуклеотида от нуклеотидной последовательности 5’-UUGAAGUAAAUGGUGUUAACCAG-3’ (SEQ ID NO: 15), причем по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити представляют собой модифицированные нуклеотиды, и при этом смысловая нить конъюгирована с лигандом, присоединенным на 3’-конце; и введение больному терапевтически эффективного количества шунтирующего средства, причем эффективное количество шунтирующего средства уменьшено по сравнению с рекомендованным эффективным количеством шунтирующего средства, за счет этого происходит лечение кровотечения у больного гемофилией с ингибиторами.
В одном аспекте в настоящем изобретении представлен способ лечения кровотечения у больного, имеющего нарушение свертываемости, такое как гемофилия без ингибиторов. Способ включает введение больному фиксированной дозы от приблизительно 40 мг до приблизительно 90 мг средства двухцепочечной рибонуклеиновой кислоты (РНКи), которая ингибирует экспрессию Serpinc1, причем средство двухцепочечной РНКи содержит смысловую нить и антисмысловую нить, причем антисмысловая нить содержит область комплементарности к иРНК, кодирующей Serpinc1, которая содержит по меньшей мере 15 соседних нуклеотидов, отличающихся не более чем на 3 нуклеотида от нуклеотидной последовательности 5’-UUGAAGUAAAUGGUGUUAACCAG-3’ (SEQ ID NO: 15), причем по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити представляют собой модифицированные нуклеотиды, и при этом смысловая нить конъюгирована с лигандом, присоединенным на 3’-конце; и введение больному терапевтически эффективного количества замещающего фактора, причем эффективное количество замещающего фактора уменьшено по сравнению с рекомендованным эффективным количеством замещающего фактора, за счет этого происходит лечение кровотечения у больного гемофилией без ингибиторов.
В другом аспекте в настоящем изобретении представлен способ лечения кровотечения у больного, имеющего нарушение свертываемости, такое как гемофилия с ингибиторами. Способы включают введение больному фиксированной дозы от приблизительно 40 мг до приблизительно 90 мг средства двухцепочечной рибонуклеиновой кислоты (РНКи), которая ингибирует экспрессию Serpinc1, причем средство двухцепочечной РНКи содержит смысловую нить и антисмысловую нить, причем антисмысловая нить содержит область комплементарности к иРНК, кодирующей Serpinc1, которая содержит по меньшей мере 15 соседних нуклеотидов, отличающихся не более чем на 3 нуклеотида от нуклеотидной последовательности 5’-UUGAAGUAAAUGGUGUUAACCAG-3’ (SEQ ID NO: 15), причем по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити представляют собой модифицированные нуклеотиды, и при этом смысловая нить конъюгирована с лигандом, присоединенным на 3’-конце; и введение больному терапевтически эффективного количества шунтирующего средства, причем эффективное количество шунтирующего средства уменьшено по сравнению с рекомендованным эффективным количеством шунтирующего средства, за счет этого происходит лечение кровотечения у больного гемофилией с ингибиторами.
Средство двухцепочечной РНКи можно вводить больному в двух или более дозах.
В некоторых вариантах осуществления средство двухцепочечной РНКи вводят больному один раз в месяц, один раз каждые пять недель, один раз каждые шесть недель, один раз каждые семь недель, один раз каждые 2 месяца, один раз в квартал или по необходимости.
В одном варианте осуществления средство двухцепочечной РНКи вводят больному один раз в месяц. В другом варианте осуществления средство двухцепочечной РНКи вводят больному один раз каждые шесть недель. В одном варианте осуществления средство двухцепочечной РНКи вводят больному один раз каждые 2 месяца. В еще одном варианте осуществления средство двухцепочечной РНКи вводят больному один раз в квартал.
Средство двухцепочечной РНКи можно вводить больному, например, в виде фиксированной дозы от приблизительно 25 мг до приблизительно 100 мг, например, от приблизительно 25 мг до приблизительно 95 мг, от приблизительно 25 мг до приблизительно 90 мг, от приблизительно 25 мг до приблизительно 85 мг, от приблизительно 25 мг до приблизительно 80 мг, от приблизительно 25 мг до приблизительно 75 мг, от приблизительно 25 мг до приблизительно 70 мг, от приблизительно 25 мг до приблизительно 65 мг, от приблизительно 25 мг до приблизительно 60 мг, от приблизительно 25 мг до приблизительно 50 мг, от приблизительно 50 мг до приблизительно 100 мг, от приблизительно 50 мг до приблизительно 95 мг, от приблизительно 50 мг до приблизительно 90 мг, от приблизительно 50 мг до приблизительно 85 мг, от приблизительно 50 мг до приблизительно 80 мг, от приблизительно 30 мг до приблизительно 100 мг, от приблизительно 30 мг до приблизительно 90 мг, от приблизительно 30 мг до приблизительно 80 мг, от приблизительно 40 мг до приблизительно 100 мг, от приблизительно 40 мг до приблизительно 90 мг, от приблизительно 40 мг до приблизительно 80 мг, от приблизительно 60 мг до приблизительно 100 мг, от приблизительно 60 мг до приблизительно 90 мг, от приблизительно 25 мг до приблизительно 55 мг, от приблизительно 25 мг до приблизительно 65 мг, от приблизительно 30 мг до приблизительно 95 мг, от приблизительно 30 мг до приблизительно 85 мг, от приблизительно 30 мг до приблизительно 75 мг, от приблизительно 30 мг до приблизительно 65 мг, от приблизительно 30 мг до приблизительно 55 мг, от приблизительно 40 мг до приблизительно 95 мг, от приблизительно 40 мг до приблизительно 85 мг, от приблизительно 40 мг до приблизительно 75 мг, от приблизительно 40 мг до приблизительно 65 мг, от приблизительно 40 мг до приблизительно 55 мг или от приблизительно 45 мг до приблизительно 95 мг.
В некоторых вариантах осуществления средство двухцепочечной РНКи можно вводить в фиксированной дозе приблизительно 25 мг, приблизительно 30 мг, приблизительно 35 мг, приблизительно 40 мг, приблизительно 45 мг, приблизительно 50 мг, приблизительно 55 мг, приблизительно 60 мг, приблизительно 65 мг, приблизительно 70 мг, приблизительно 75 мг, приблизительно 80 мг, приблизительно 85 мг, приблизительно 90 мг, приблизительно 95 мг или приблизительно 100 мг.
В некоторых вариантах осуществления средство двухцепочечной РНКи вводят больному в фиксированной дозе приблизительно 25 мг; или в фиксированной дозе приблизительно 50 мг; или в фиксированной дозе приблизительно 80 мг; или в фиксированной дозе приблизительно 100 мг.
В одном варианте осуществления средство двухцепочечной РНКи вводят больному подкожно.
В одном варианте осуществления больным является человек.
Гемофилией может быть гемофилия A, гемофилия B или гемофилия C.
В одном варианте осуществления все нуклеотиды смысловой нити и все нуклеотиды антисмысловой нити представляют собой модифицированные нуклеотиды.
В одном варианте осуществления модифицированные нуклеотиды независимо выбирают из группы, состоящей из 2’-деокси-2’-фтор-модифицированного нуклеотида, 2’-деокси-модифицированного нуклеотида, заблокированного нуклеотида, лишенного азотистого основания нуклеотида, 2’-амино-модифицированного нуклеотида, 2’-алкил-модифицированного нуклеотида, морфолинонуклеотида, фосфорамидата и нуклеотида, содержащего неприродное основание.
Область комплементарности может быть по меньшей мере 17 нуклеотидов в длину или 19 нуклеотидов в длину.
В одном варианте осуществления область комплементарности составляет от 19 до 21 нуклеотида в длину. В другом варианте осуществления область комплементарности составляет от 21 до 23 нуклеотидов в длину.
В одном варианте осуществления каждая нить имеет не более чем 30 нуклеотидов в длину.
По меньшей мере одна нить средства двухцепочечной РНКи может содержать 3’-выступ по меньшей мере из 1 нуклеотида или 3’-выступ по меньшей мере из 2 нуклеотидов, например, из 2, 3, 4, 5, 6, 7, 9, 10, 11, 12, 13, 14 или 15 нуклеотидов. В других вариантах осуществления по меньшей мере одна нить средства РНКи содержит 5’-выступ по меньшей мере из 1 нуклеотида. В некоторых вариантах осуществления по меньшей мере одна нить содержит 5’-выступ по меньшей мере из 2 нуклеотидов, например, из 2, 3, 4, 5, 6, 7, 9, 10, 11, 12, 13, 14 или 15 нуклеотидов. В других вариантах осуществления как 3’, так и 5’ конец одной нити средства РНКи содержат выступ по меньшей мере из 1 нуклеотида.
В некоторых вариантах осуществления лигандом является N-ацетилгалактозамин (GalNAc). Лигандом может быть один или более GalNAc, присоединенных к средству РНКи через моновалентный, бивалентный или трехвалентный разветвленный линкер. Лиганд может быть конъюгирован с 3’ концом смысловой нити средства двухцепочечной РНКи, 5’ концом смысловой нити средства двухцепочечной РНКи, 3’ концом антисмысловой нити средства двухцепочечной РНКи или 5’ концом антисмысловой нити средства двухцепочечной РНКи.
В некоторых вариантах осуществления средства двухцепочечной РНКи согласно изобретению содержат множество, например, 2, 3, 4, 5 или 6 GalNAc, каждый из которых независимо присоединен к множеству нуклеотидов средства двухцепочечной РНКи через множество моновалентных линкеров.
В некоторых вариантах осуществления лиганд представляет собой
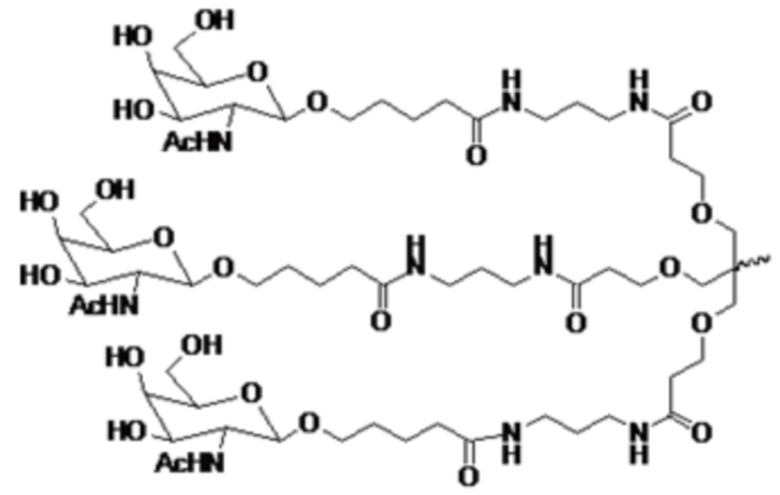 .
.
В одном варианте осуществления средство РНКи конъюгировано с лигандом, как показано на следующей схеме
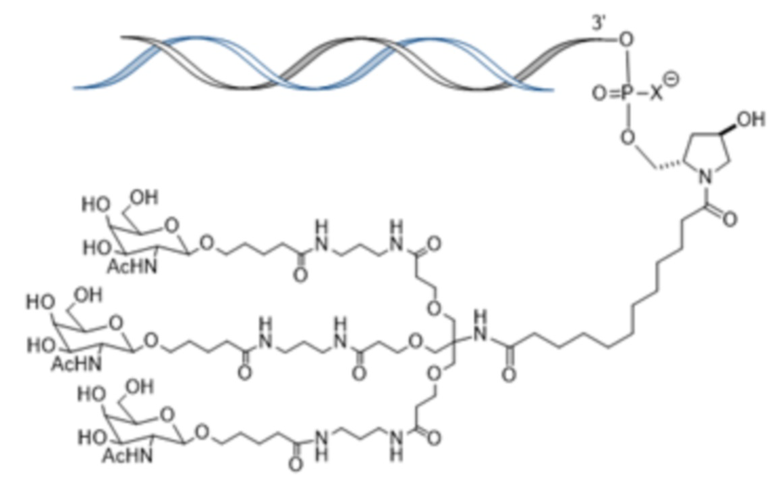
и при этом X представляет O или S.
В одном варианте осуществления X представляет O.
В одном варианте осуществления область комплементарности состоит из нуклеотидной последовательности 5’-UUGAAGUAAAUGGUGUUAACCAG-3’(SEQ ID NO: 15).
В одном варианте осуществления средство двухцепочечной РНКи содержит смысловую нить, содержащую нуклеотидную последовательность 5’-GGUUAACACCAUUUACUUCAA-3’(SEQ ID NO: 16), и при этом антисмысловая нить содержит нуклеотидную последовательность 5’-UUGAAGUAAAUGGUGUUAACCAG-3’(SEQ ID NO: 15).
В одном варианте осуществления смысловая нить содержит 5’-GfsgsUfuAfaCfaCfCfAfuUfuAfcUfuCfaAf-3’ (SEQ ID NO:13), а антисмысловая нить содержит 5’-usUfsgAfaGfuAfaAfuggUfgUfuAfaCfcsasg-3’ (SEQ ID NO:14), причем a, c, g и u представляют 2′-O-метил (2′-OMe) A, C, G или U; Af, Cf, Gf или Uf представляют 2′-фтор A, C, G или U; а s представляет фосфоротиоатную связь.
В одном варианте осуществления смысловая нить содержит 5’-GfsgsUfuAfaCfaCfCfAfuUfuAfcUfuCfaAf-3’ (SEQ ID NO:13), а антисмысловая нить содержит 5’-usUfsgAfaGfuAfaAfuggUfgUfuAfaCfcsasg-3’ (SEQ ID NO:14), причем a, c, g и u представляют 2′-O-метил (2′-OMe) A, C, G или U; Af, Cf, Gf или Uf представляют 2′-фтор A, C, G или U; а s представляет фосфоротиоатную связь; и при этом смысловая нить конъюгирована с лигандом, как показано на следующей схеме
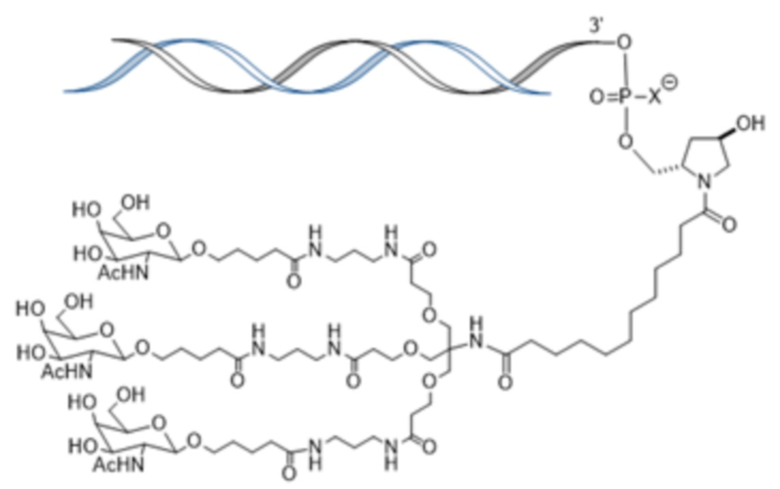 ,
,
где X представляет O или S.
В одном варианте осуществления средство вводят в виде фармацевтической композиции. В одном варианте осуществления средство РНКи вводят в незабуференном растворе, таком как физиологический раствор или вода.
В другом варианте осуществления siRNA вводят с буферным раствором, таким как буферный раствор, содержащий ацетат, цитрат, проламин, карбонат или фосфат или любые их комбинации. В одном варианте осуществления буферным раствором является забуференный фосфатом физиологический раствор (PBS).
В одном варианте осуществления введение больному средства дцРНК снижает активность Serpinc1 приблизительно на 75% или более.
В одном варианте осуществления замещающим фактором является фактор VIII. Терапевтически эффективное количество фактора VIII, вводимое больному, может быть меньше, чем приблизительно 200 МЕ/кг, или меньше, чем приблизительно 190 МЕ/кг, или меньше, чем приблизительно 180 МЕ/кг, или меньше, чем приблизительно 170 МЕ/кг, или меньше, чем приблизительно 160 МЕ/кг, или меньше, чем приблизительно 150 МЕ/кг, или меньше, чем приблизительно 140 МЕ/кг, или меньше, чем приблизительно 130 МЕ/кг, или меньше, чем приблизительно 120 МЕ/кг, или меньше, чем приблизительно 110 МЕ/кг, или меньше, чем приблизительно 100 МЕ/кг, или меньше, чем приблизительно 90 МЕ/кг, или меньше, чем приблизительно 80 МЕ/кг, или меньше, чем приблизительно 70 МЕ/кг, или меньше, чем приблизительно 60 МЕ/кг, или меньше, чем приблизительно 50 МЕ/кг, или меньше, чем приблизительно 40 МЕ/кг, или меньше, чем приблизительно 30 МЕ/кг, или меньше, чем приблизительно 20 МЕ/кг, или меньше, чем приблизительно 10 МЕ/кг. В одном варианте осуществления терапевтически эффективное количество фактора VIII, вводимое больному, от приблизительно в полтора раза до приблизительно в пять раз меньше, чем рекомендованное эффективное количество фактора VIII, например, доза от приблизительно 5 МЕ/кг до приблизительно 20 МЕ/кг или от приблизительно 10 МЕ/кг до приблизительно 20 МЕ/кг, например, приблизительно 5, 10, 15 или 20 МЕ/кг. В одном варианте осуществления кровотечение представляет собой кровотечение средней тяжести. В другом варианте осуществления кровотечение представляет собой кровотечение большой тяжести.
В другом варианте осуществления замещающим фактором является фактор IX. Терапевтически эффективное количество фактора IX может быть меньше, чем приблизительно 200 МЕ/кг, или меньше, чем приблизительно 190 МЕ/кг, или меньше, чем приблизительно 180 МЕ/кг, или меньше, чем приблизительно 170 МЕ/кг, или меньше, чем приблизительно 160 МЕ/кг, или меньше, чем приблизительно 150 МЕ/кг, или меньше, чем приблизительно 140 МЕ/кг, или меньше, чем приблизительно 130 МЕ/кг, или меньше, чем приблизительно 120 МЕ/кг, или меньше, чем приблизительно 110 МЕ/кг, или меньше, чем приблизительно 100 МЕ/кг, или меньше, чем приблизительно 90 МЕ/кг, или меньше, чем приблизительно 80 МЕ/кг, или меньше, чем приблизительно 70 МЕ/кг, или меньше, чем приблизительно 60 МЕ/кг, или меньше, чем приблизительно 50 МЕ/кг, или меньше, чем приблизительно 40 МЕ/кг, или меньше, чем приблизительно 30 МЕ/кг, или меньше, чем приблизительно 20 МЕ/кг, или меньше, чем приблизительно 10 МЕ/кг. В одном варианте осуществления терапевтически эффективное количество фактора IX, вводимое больному, от приблизительно двух раз до приблизительно шести раз меньше, чем рекомендованное эффективное количество фактора IX, например, доза от приблизительно 10 МЕ/кг до приблизительно 30 МЕ/кг или от приблизительно 20 до приблизительно 30 МЕ/кг, например, приблизительно 10, 15, 20, 25 или приблизительно 30 МЕ/кг. В одном варианте осуществления кровотечение представляет собой кровотечение средней тяжести. В другом варианте осуществления кровотечение представляет собой кровотечение большой тяжести.
В одном варианте осуществления шунтирующим средством является активированный концентрат протромбинового комплекса (aPCC). Терапевтически эффективное количество aPCC может быть меньше, чем приблизительно 100 Е/кг, или меньше, чем приблизительно 90 Е/кг, или меньше, чем приблизительно 80 Е/кг, или меньше, чем приблизительно 70 Е/кг, или меньше, чем приблизительно 60 Е/кг, или меньше, чем приблизительно 50 Е/кг, или меньше, чем приблизительно 40 Е/кг, или меньше, чем приблизительно 30 Е/кг, или меньше, чем приблизительно 20 Е/кг, или меньше, чем приблизительно 10 Е/кг. В одном варианте осуществления терапевтически эффективное количество aPCC, вводимое больному, от приблизительно двух раз до приблизительно трех раз меньше, чем рекомендованное эффективное количество aPCC, например, доза от приблизительно 30 до приблизительно 50 Е/кг. В одном варианте осуществления кровотечение представляет собой кровотечение средней тяжести. В другом варианте осуществления кровотечение представляет собой кровотечение большой тяжести.
В другом варианте осуществления шунтирующим средством является рекомбинантный фактор VIIa (rFVIIa). Терапевтически эффективное количество шунтирующего средства может быть меньше, чем приблизительно 120 мкг/кг, или меньше, чем приблизительно 110 мкг/кг, или меньше, чем приблизительно 100 мкг/кг, или меньше, чем приблизительно 90 мкг/кг, или меньше, чем приблизительно 80 мкг/кг, или меньше, чем приблизительно 70 мкг/кг, или меньше, чем приблизительно 60 мкг/кг, или меньше, чем приблизительно 50 мкг/кг, или меньше, чем приблизительно 40 мкг/кг, или меньше, чем приблизительно 30 мкг/кг, или меньше, чем приблизительно 20 мкг/кг. В одном варианте осуществления терапевтически эффективное количество rFVIIa, вводимое больному, приблизительно в два раза меньше, чем рекомендованное эффективное количество rFVIIa, например, доза приблизительно 45 мкг/кг. В одном варианте осуществления кровотечение представляет собой кровотечение средней тяжести. В другом варианте осуществления кровотечение представляет собой кровотечение большой тяжести.
В одном аспекте в настоящем изобретении представлен способ лечения кровотечения у больного гемофилией, например, гемофилией A, гемофилией B или гемофилией C без ингибиторов. Способ включает введение, например, подкожное введение больному фиксированной дозы приблизительно 80 мг средства двухцепочечной рибонуклеиновой кислоты (РНКи), которая ингибирует экспрессию Serpinc1, причем средство двухцепочечной РНКи содержит смысловую нить и антисмысловую нить, причем смысловая нить содержит 5’-GfsgsUfuAfaCfaCfCfAfuUfuAfcUfuCfaAf-3’ (SEQ ID NO:13), а антисмысловая нить содержит 5’-usUfsgAfaGfuAfaAfuggUfgUfuAfaCfcsasg-3’ (SEQ ID NO:14), причем a, c, g и u представляют 2′-O-метил (2′-OMe) A, C, G или U; Af, Cf, Gf или Uf представляют 2′-фтор A, C, G или U; а s представляет фосфоротиоатную связь; и при этом 3’-конец смысловой нити конъюгирован с лигандом, как показано на следующей схеме
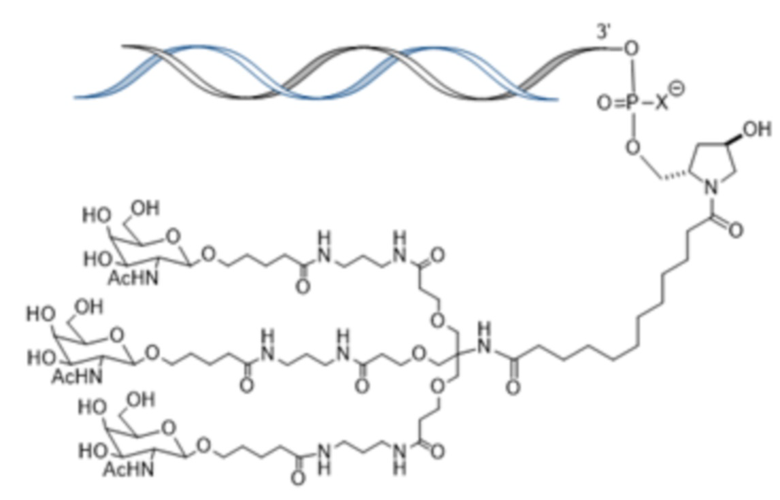 ,
,
где X представляет O или S; и введение больному терапевтически эффективного количества замещающего фактора, причем эффективное количество замещающего фактора уменьшено по сравнению с рекомендованным эффективным количеством замещающего фактора, за счет этого происходит лечение кровотечения у больного гемофилией без ингибиторов.
В другом аспекте в настоящем изобретении представлен способ лечения кровотечения у больного гемофилией, например, гемофилией A, гемофилией B или гемофилией C с ингибиторами. Способ включает введение, например, подкожное введение больному фиксированной дозы приблизительно 80 мг средства двухцепочечной рибонуклеиновой кислоты (РНКи), которая ингибирует экспрессию Serpinc1, причем средство двухцепочечной РНКи содержит смысловую нить и антисмысловую нить, причем смысловая нить содержит 5’-GfsgsUfuAfaCfaCfCfAfuUfuAfcUfuCfaAf-3’ (SEQ ID NO:13), а антисмысловая нить содержит 5’-usUfsgAfaGfuAfaAfuggUfgUfuAfaCfcsasg-3’ (SEQ ID NO:14), причем a, c, g и u представляют 2′-O-метил (2′-OMe) A, C, G или U; Af, Cf, Gf или Uf представляют 2′-фтор A, C, G или U; а s представляет фосфоротиоатную связь; и при этом 3’-конец смысловой нити конъюгирован с лигандом, как показано на следующей схеме
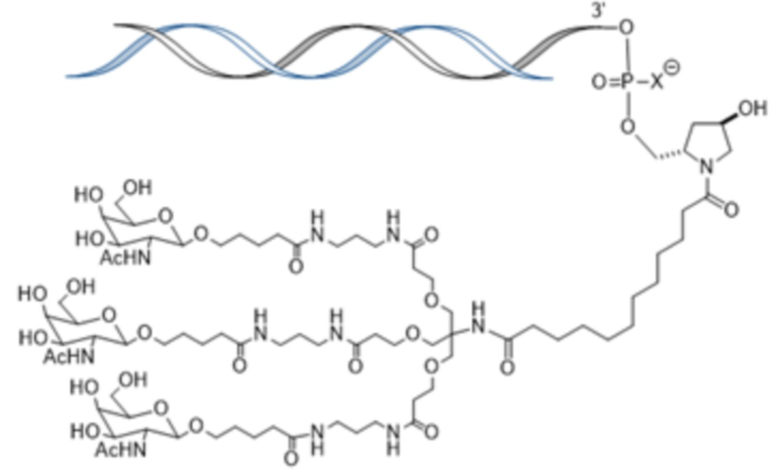 ,
,
где X представляет O или S; и введение больному терапевтически эффективного количества шунтирующего средства, причем эффективное количество шунтирующего средства уменьшено по сравнению с рекомендованным эффективным количеством шунтирующего средства, за счет этого происходит лечение кровотечения у больного гемофилией с ингибиторами.
В одном варианте осуществления фиксированную дозу средства РНКи вводят больному подкожно.
В одном варианте осуществления фиксированную дозу средства РНКи вводят больному один раз в месяц.
Гемофилией может быть гемофилия A, гемофилия B или гемофилия C.
Краткое Описание Чертежей
На фиг. 1A представлен график, показывающий влияние одной подкожной дозы 0,03 мг/кг AT3SC-001 на уровни образования тромбина в плазме у одного здорового субъекта-человека.
На фиг. 1B представлен график, показывающий влияние одной подкожной дозы 0,03 мг/кг AT3SC-001 на уровни образования тромбина в плазме у одного здорового субъекта-человека.
На фиг. 1C представлен график, показывающий влияние одной подкожной дозы 0,03 мг/кг AT3SC-001 на уровни образования тромбина в плазме у одного здорового субъекта-человека.
На фиг. 1D представлен график, показывающий влияние одной подкожной дозы 0,03 мг/кг AT3SC-001 на уровни образования тромбина в плазме у одного здорового субъекта-человека.
На фиг. 2A представлен график, показывающий влияние одной подкожной дозы 0,03 мг/кг AT3SC-001 на уровни белка AT (Serpinc1) в плазме у одного здорового субъекта-человека.
На фиг. 2B представлен график, показывающий влияние одной подкожной дозы 0,03 мг/кг AT3SC-001 на уровни белка AT (Serpinc1) в плазме у одного здорового субъекта-человека.
На фиг. 3 представлен график, показывающий связь между процентным значением нокдауна AT (Serpinc1) и процентным увеличением пиковой образования тромбина у здоровых больных, которым ввели одну подкожную дозу 0,03 мг/кг AT3SC-001.
На фиг. 4 представлен график, показывающий влияние многократных доз 0,015 мг/кг, 0,045 мг/кг или 0,075 мг/кг AT3SC-001 на уровни белка AT (Serpinc1) в плазме у людей-больных гемофилией A или B.
На фиг. 5A представлен график, показывающий влияние многократных доз 0,225 мг/кг, 0,450 мг/кг, 0,900 мг/кг, 1,800 мг/кг или 80 мг AT3SC-001 на уровни белка AT (Serpinc1) в плазме у людей-больных гемофилией A или B.
На фиг. 5B представлен график, показывающий зависимое от дозы влияние AT3SC-001 на уровни белка AT (Serpinc1) в плазме у больных-людей.
На фиг. 6A представлен график, показывающий влияние многократных доз 0,015 мг/кг или 0,045 мг/кг AT3SC-001 на пиковые уровни тромбина у людей-больных гемофилией A или B.
На фиг. 6B представлен график, показывающий влияние многократных доз 0,015 мг/кг или 0,045 мг/кг AT3SC-001 на образование тромбина в виде процентного изменения относительно группового базового уровня у людей-больных гемофилией A или B.
На фиг. 7 представлен график, показывающий влияние многократных доз 0,045 мг/кг AT3SC-001 на время образования сгустков и время свертывания у одного больного гемофилией A (больного 101-009).
На фиг. 8 представлен график, показывающий среднее максимальное снижение AT при месячной эквивалентной дозе.
На фиг. 9 представлен график, показывающий влияние многократных доз AT3SC-001 на образование тромбина по квартилям снижения AT. Квадраты обозначают медианный и межквартильный диапазон.  % изменение пикового TG: р<0,001, критерий Манна-Уитни при сравнении с группой АТЗ ниже чем <25%.
% изменение пикового TG: р<0,001, критерий Манна-Уитни при сравнении с группой АТЗ ниже чем <25%.
На фиг. 10A представлен график, показывающий относительную активность AT в отношении процентного пиковой образования тромбина, достигаемого с помощью фактора VIII, что определяют у больного, которому вводят 225 мкг/кг qM AT3SC-001.
На фиг. 10B представлен график, показывающий относительную активность AT в отношении процентного пиковой образования тромбина, достигаемого с помощью фактора VIII, что определяют у больного, которому вводят 1800 мкг/кг qM AT3SC-001.
На фиг. 10C представлен график, показывающий относительную активность AT в отношении процентного пиковой образования тромбина, достигаемого с помощью фактора VIII, что определяют у больного, которому вводят 80 мг qM AT3SC-001.
На фиг. 11 представлен график, показывающий влияние многократных доз AT3SC-001 на кровотечение по квартилям снижения AT. ABR, среднегодовая частота кровотечений; SEM, стандартная ошибка среднего значения.  Число пациентов с временем нахождения в квартиле;
Число пациентов с временем нахождения в квартиле;  Для каждого пациента ABR в каждом квартиле расчитывают по 365,24*(число явлений кровотечения/число дней в квартиле).
Для каждого пациента ABR в каждом квартиле расчитывают по 365,24*(число явлений кровотечения/число дней в квартиле).
На фиг. 12 представлена таблица, показывающая данные по кровотечению для больных, включенных в часть C I фазы клинического исследования AT3SC-001. РРх - профилактика; OD - по требованию; ABR, среднегодовая частота кровотечений; AsBR, среднегодовая частота спонтанных кровотечений;  Апостериорный анализ леченых явлений кровотечения во время периодов начала (0-28 день) и наблюдения (29 день - до последнего визита исследования или последней дозы + 56 дней, что наступит раньше;
Апостериорный анализ леченых явлений кровотечения во время периодов начала (0-28 день) и наблюдения (29 день - до последнего визита исследования или последней дозы + 56 дней, что наступит раньше;  ABR до исследования, выводимая из медицинских записей; ** - исключенные пациенты С5-4, выбывшие из анализа.
ABR до исследования, выводимая из медицинских записей; ** - исключенные пациенты С5-4, выбывшие из анализа.
На фиг. 13A представлен график, показывающий среднегодовую частоту кровотечений (ABR) перед началом исследования, на начальном этапе исследования и во время этапа наблюдения исследования для всех когорт введения доз в части C I фазы клинического исследования AT3SC-001. РРх - профилактика; OD - по требованию; ABR, среднегодовая частота кровотечений; AsBR, среднегодовая частота спонтанных кровотечений;  Апостериорный анализ леченых явлений кровотечения во время периодов начала (0-28 день) и наблюдения (29 день - до последнего визита исследования или последней дозы + 56 дней, что наступит раньше;
Апостериорный анализ леченых явлений кровотечения во время периодов начала (0-28 день) и наблюдения (29 день - до последнего визита исследования или последней дозы + 56 дней, что наступит раньше;  ABR до исследования, выводимая из медицинских записей; ** - исключенные пациенты С5-4, выбывшие из анализа.
ABR до исследования, выводимая из медицинских записей; ** - исключенные пациенты С5-4, выбывшие из анализа.
На фиг. 13B представлен график, показывающий среднегодовую частоту кровотечений (ABR) перед началом исследования, на начальном этапе исследования и во время этапа наблюдения исследования для когорты 80 мг (80 мг qM x3) раз в месяц в части C I фазы клинического исследования AT3SC-001. РРх - профилактика; OD - по требованию; ABR, среднегодовая частота кровотечений; AsBR, среднегодовая частота спонтанных кровотечений;  Апостериорный анализ леченых явлений кровотечения во время периодов начала (0-28 день) и наблюдения (29 день - до последнего визита исследования или последней дозы + 56 дней, что наступит раньше;
Апостериорный анализ леченых явлений кровотечения во время периодов начала (0-28 день) и наблюдения (29 день - до последнего визита исследования или последней дозы + 56 дней, что наступит раньше;  ABR до исследования, выводимая из медицинских записей; ** - исключенные пациенты С5-4, выбывшие из анализа.
ABR до исследования, выводимая из медицинских записей; ** - исключенные пациенты С5-4, выбывшие из анализа.
На фиг. 14A представлен график, показывающий относительную активность AT в отношении процентного пиковой образования тромбина, достигаемого с помощью фактора VIII, что определяют у больного с ингибитором, которому вводят фиксированную ежемесячную дозу 50 мг AT3SC-001.
На фиг. 14B представлен график, показывающий относительную активность AT в отношении процентного пиковой образования тромбина, достигаемого с помощью фактора VIII, что определяют у больного с ингибитором, которому вводят фиксированную ежемесячную дозу 50 мг AT3SC-001.
На фиг. 14C представлен график, показывающий относительную активность AT в отношении процентного пиковой образования тромбина, достигаемого с помощью фактора VIII, что определяют у больного с ингибитором, которому вводят фиксированную ежемесячную дозу 50 мг AT3SC-001.
На фиг. 14D представлен график, показывающий относительную активность AT в отношении процентного пиковой образования тромбина, достигаемого с помощью фактора VIII, что определяют у больного с ингибитором, которому вводят фиксированную ежемесячную дозу 50 мг AT3SC-001.
На фиг. 14E представлен график, показывающий относительную активность AT в отношении процентного пиковой образования тромбина, достигаемого с помощью фактора VIII, что определяют у больного с ингибитором, которому вводят фиксированную ежемесячную дозу 50 мг AT3SC-001.
На фиг. 14F представлен график, показывающий относительную активность AT в отношении процентного пиковой образования тромбина, достигаемого с помощью фактора VIII, что определяют у больного с ингибитором, которому вводят фиксированную ежемесячную дозу 50 мг AT3SC-001.
На фиг. 15 представлен график, показывающий влияние многократных доз 50 мг или 80 мг AT3SC-001 на среднюю активность AT (Serpinc1) относительно базового уровня у людей-больных гемофилией A или B с ингибиторами.
На фиг. 16 представлен график, показывающий, что эффект снижения AT многократных доз 50 мг AT3SC-001 коррелирует с повышенным образованием тромбина у больного гемофилией A.
На фиг. 17A представлена таблица, показывающая данные по кровотечению для больных, включенных в часть D I фазы клинического исследования AT3SC-001. OLE - открытое расщиренное исследование; ABR, среднегодовая частота кровотечений; AsBR, среднегодовая частота спонтанных кровотечений;  Апостериорный анализ леченых явлений кровотечения во время периодов начала (0-28 день) и наблюдения (29 день - до последнего визита исследования или последней дозы + 56 дней, что наступит раньше;
Апостериорный анализ леченых явлений кровотечения во время периодов начала (0-28 день) и наблюдения (29 день - до последнего визита исследования или последней дозы + 56 дней, что наступит раньше;  ABR до исследования, выводимая из медицинских записей; ^Пациенты, перешедшие во 2 фазу OLE начиная с прекращения сбора данных.
ABR до исследования, выводимая из медицинских записей; ^Пациенты, перешедшие во 2 фазу OLE начиная с прекращения сбора данных.
На фиг. 17B представлен график, показывающий среднегодовую частоту кровотечений (ABR) перед началом исследования, на начальном этапе исследования и во время этапа наблюдения исследования для всех больных в части D I фазы клинического исследования AT3SC-001. Медианная ABR, период до исследования: 31; Медианная ABR, период наблюдения: 0; Пациенты, сообщившие об отсутствии кровотечений: 9/16 (56%); Пациенты, сообщившие об отсутствии спонтанных кровотечений (AsBR=0) 11/16 (69%). OLE - открытое расширенное исследование; ABR, среднегодовая частота кровотечений; AsBR, среднегодовая частота спонтанных кровотечений.
На фиг. 18 представлен график, показывающий влияние многократных доз 80 мг AT3SC-001 на среднюю активность AT (Serpinc1) относительно базового уровня у человека-больного гемофилией без ингибиторов во II фазе открытого расширенного (OLE) исследования AT3SC-001.
На фиг. 19A представлен график, показывающий влияние многократных доз 50 мг или 80 мг AT3SC-001 на среднюю активность AT (Serpinc1) относительно базового уровня у людей-больных гемофилией A или B с ингибиторами или без них, во II фазе открытого расширенного (OLE) исследования AT3SC-001.
На фиг. 19B представлен график, показывающий влияние многократных доз 50 мг или 80 мг AT3SC-001 на пиковое выработка тромбина у людей-больных гемофилией A или B с ингибиторами или без них, во II фазе открытого расширенного (OLE) исследования AT3SC-001. Заштрихованная часть графика отображает диапазон пиковых уровней тромбина, наблюдаемых у здоровых людей-добровольцев (HV), которым вводили AT3SC-001 с нокдауном AT менее 25% в I фазе исследования AT3SC-001, описанной в примере 1. Пунктирная линия через область HV представляет медианный пиковый уровень тромбина, наблюдаемый у здоровых людей-добровольцев (HV) с нокдауном AT менее 25%, которым вводили AT3SC-001 в I фазе исследования AT3SC-001, описанной в примере 1.
Фиг. 20А: сводка медианных значений ABR у пациентов без ингибиторов. На фиг. 20A представлен график, показывающий среднегодовую частоту кровотечений (ABR) перед началом исследования, на начальном этапе исследования и во время этапа наблюдения исследования у больных гемофилией A или B без ингибиторов из больных во II фазе OLE клинического исследования AT3SC-001. Продолжительность медианного значения в период наблюдения: 13 месяцев (диапазон 2-19); Средняя активность АТ в период наблюдения (относительно базового уровня): 22%.  Период наблюдения, определяемый как 29 день лечения до более раннего из переноса данных или 56 дней после последней дозы. ABR, среднегодовая частота кровотечений; AsBR, среднегодовая частота спонтанных кровотечений; РРх - профилактика; OD - по требованию.
Период наблюдения, определяемый как 29 день лечения до более раннего из переноса данных или 56 дней после последней дозы. ABR, среднегодовая частота кровотечений; AsBR, среднегодовая частота спонтанных кровотечений; РРх - профилактика; OD - по требованию.
Фиг. 20В: сводка медианных значений ABR у пациентов с ингибиторами. На фиг. 20B представлен график, показывающий среднегодовую частоту кровотечений (ABR) перед началом исследования и во время этапа наблюдения исследования у больных гемофилией A или B с ингибиторами из больных во II фазе OLE клинического исследования AT3SC-001. Продолжительность медианного значения в период наблюдения: 6 месяцев (диапазон 1-11); Средняя активность АТ в период наблюдения (относительно базового уровня): 18%.  Период наблюдения, определяемый как 29 день лечения до более раннего из переноса данных или 56 дней после последней дозы. ABR, среднегодовая частота кровотечений; AsBR, среднегодовая частота спонтанных кровотечений; РРх - профилактика; OD - по требованию.
Период наблюдения, определяемый как 29 день лечения до более раннего из переноса данных или 56 дней после последней дозы. ABR, среднегодовая частота кровотечений; AsBR, среднегодовая частота спонтанных кровотечений; РРх - профилактика; OD - по требованию.
На фиг. 21 представлена таблица, показывающая характеристики кровотечений, происходящих у пациентов с гемофилией A или B с ингибиторами или без них во II фазе OLE клинического исследования AT3SC-001.  Пациенты получали лечение для боли в животе, так как не было уверенности, было ли это кровотечение.
Пациенты получали лечение для боли в животе, так как не было уверенности, было ли это кровотечение.
На фиг. 22 представлена таблица, показывающая управление кровотечениями, происходящими у пациентов с гемофилией A или B без ингибиторов во II фазе OLE клинического исследования AT3SC-001.FVIII, фактор VIII; FIX, фактор IX. Использованные продукты замещающих факторов: Advate, Aimafix, Benefix, Eloctate, Haemate, Helixate, Immunate, Immunine, Octanate, Recombinate, Refacto.
На фиг. 23 представлена таблица, показывающая характеристики кровотечений, происходящих у пациентов с гемофилией A или B с ингибиторами во II фазе OLE клинического исследования AT3SC-001. aPCC, активированный концентрат протромбинового комплекса; rFVIIa, рекомбинантный фактор VIIa; BPA, шунтирующее средство; Применяемые шунтирующие средства: FEIBA, NovoSeven, Prothromplex.
На фиг. 24A представлен график, показывающий влияние ежемесячной фиксированной дозы 50 мг или 80 мг AT3SC-001 на количество фактора VIII, необходимое для управления кровотечениями у больных гемофилией A без ингибиторов.
На фиг. 24B представлен график, показывающий влияние ежемесячной фиксированной дозы 50 мг или 80 мг AT3SC-001 на количество фактора IX, необходимое для управления кровотечениями у больных гемофилией B без ингибиторов.
На фиг. 24C представлен график, показывающий влияние ежемесячной фиксированной дозы 50 мг или 80 мг AT3SC-001 на количество rFVIIa, необходимое для управления кровотечениями у больных гемофилией A или B с ингибиторами.
На фиг. 24D представлен график, показывающий влияние ежемесячной фиксированной дозы 50 мг или 80 мг AT3SC-001 на количество aPCC необходимое для управления кровотечениями у больных гемофилией A или B с ингибиторами.
На фиг. 25A представлен график, показывающий влияние добавления aPCC на образование тромбина в образцах плазмы у больного гемофилией A с ингибиторами перед (нижняя линия) и после (верхняя линия) введения больному AT3SC-001.
На фиг. 25B представлен график, показывающий влияние добавления rFVIIa на образование тромбина в образцах плазмы у больного гемофилией A с ингибиторами перед (нижняя линия) и после (верхняя линия) введения больному AT3SC-001.
На фиг. 26A представлен график, показывающий влияние добавления aPCC на образование тромбина в образцах плазмы у больного гемофилией A без ингибиторов перед (нижняя линия) и после (верхняя линия) введения больному AT3SC-001.
На фиг. 26B представлен график, показывающий влияние добавления rFVIIa на образование тромбина в образцах плазмы у больного гемофилией A без ингибиторов перед (нижняя линия) и после (верхняя линия) введения больному AT3SC-001.
На фиг. 26C представлен график, показывающий влияние добавления aPCC на образование тромбина в образцах плазмы у больного гемофилией A без ингибиторов перед (нижняя линия) и после (верхняя линия) введения больному AT3SC-001.
На фиг. 26D представлен график, показывающий влияние добавления rFVIIa на образование тромбина в образцах плазмы у больного гемофилией A без ингибиторов перед (нижняя линия) и после (верхняя линия) введения больному AT3SC-001.
На фиг. 26E представлен график, показывающий влияние добавления aPCC на образование тромбина в образцах плазмы у больного гемофилией A без ингибиторов перед (нижняя линия) и после (верхняя линия) введения больному AT3SC-001.
На фиг. 26F представлен график, показывающий влияние добавления rFVIIa на образование тромбина в образцах плазмы у больного гемофилией A без ингибиторов перед (нижняя линия) и после (верхняя линия) введения больному AT3SC-001.
На фиг. 26G представлен график, показывающий влияние добавления aPCC на образование тромбина в образцах плазмы у больного гемофилией A без ингибиторов перед (нижняя линия) и после (верхняя линия) введения больному AT3SC-001.
На фиг. 26H представлен график, показывающий влияние добавления rFVIIa на образование тромбина в образцах плазмы у больного гемофилией A без ингибиторов перед (нижняя линия) и после (верхняя линия) введения больному AT3SC-001.
На фиг. 26I представлен график, показывающий влияние добавления aPCC на образование тромбина в образцах плазмы у больного гемофилией A без ингибиторов перед (нижняя линия) и после (верхняя линия) введения больному AT3SC-001.
На фиг. 26J представлен график, показывающий влияние добавления rFVIIa на образование тромбина в образцах плазмы у больного гемофилией A без ингибиторов перед (нижняя линия) и после (верхняя линия) введения больному AT3SC-001.
На фиг. 26K представлен график, показывающий влияние добавления aPCC на образование тромбина в образцах плазмы у больного гемофилией A без ингибиторов перед (нижняя линия) и после (верхняя линия) введения больному AT3SC-001.
На фиг. 26L представлен график, показывающий влияние добавления rFVIIa на образование тромбина в образцах плазмы у больного гемофилией A без ингибиторов перед (нижняя линия) и после (верхняя линия) введения больному AT3SC-001.
На фиг. 26M представлен график, показывающий влияние добавления aPCC на образование тромбина в образцах плазмы у больного гемофилией A без ингибиторов перед (нижняя линия) и после (верхняя линия) введения больному AT3SC-001.
На фиг. 26N представлен график, показывающий влияние добавления rFVIIa на образование тромбина в образцах плазмы у больного гемофилией A без ингибиторов перед (нижняя линия) и после (верхняя линия) введения больному AT3SC-001.
На фиг. 27A представлен график, показывающий влияние многократных доз AT3SC-001 на образование тромбина по квартилям снижения AT в I/II фазах открытого расширенного (OLE) клинического исследования.
На фиг. 27B представлен график, показывающий смоделированное влияние многократных доз AT3SC-001 на образование тромбина по квартилям снижения AT.
На фиг. 27C представлена диаграмма рассеяния, показывающая сильную корреляцию между смоделированным TG (на фиг. 27B) и измеренным TG (на фиг. 27A).
На фиг. 28A представлено смоделированные in silico кривые образования тромбина для разных уровней AT и 0,1% Фактора FVIII (моделирование тяжелой Гемофилии A).
На фиг. 28B представлено изображение карты интенсивности пикового тромбина при разных дозах Фактора VIII (единичная доза) и уровне AT для тяжелой Гемофилии A.
На фиг. 28C представлено изображение карты интенсивности пикового тромбина при разных дозах FIX (единичная доза) и уровне AT для тяжелой Гемофилии B.
На фиг. 29A представлен график, показывающий смоделированный пиковый тромбиновый потенциал (nM) в качестве функции времени для 5, 10, 20 и 50 МЕ/кг фактора FVIII с AT при 100%.
На фиг. 29B представлен график, показывающий смоделированный пиковый тромбиновый потенциал (nM) в качестве функции времени для 5, 10, 20 МЕ/кг фактора FVIII с AT при 20% базового уровня.
Подробное Описание Изобретения
Настоящее изобретение основано по меньшей мере частично на неожиданном открытии, что у больных гемофилией (например, гемофилией A, гемофилией B или гемофилией C) без ингибиторов, которым вводят терапевтически эффективное количество композиции иРНК, которое влияет на опосредованное РНК-индуцированным сайленсинговым комплексом (RISC) расщепление РНК-транскриптов гена Serpinc1, кровотечение можно лечить терапевтически эффективным количеством замещающего фактора, такого как фактор VIII или фактор XI, меньшим чем рекомендованное эффективное количество замещающего фактора, например, рекомендованное всемирной федерацией гемофилии (см., например, Srivastava, et al., «Guidelines for the Management of Hemophilia», Hemophilia Epub 6 July 2012; DOI:10,1111/j,1365-2516,2012,02909.x; все содержание которого включено в данный документ посредством ссылки) и/или управлением пищевых продуктов и лекарственных средств (см., например, ADVATE (Antihemophilic Factor (Recombinant)) product insert; 11/2016; BeneFIX (Coagulation Factor IX (Recombinant) product insert; 11/2011; все содержание каждого из которых включено в данный документ посредством ссылки). Соответственно, в настоящем изобретении представлен способ лечения кровотечения у больного гемофилией без ингибиторов. Способ включает введение больному фиксированной дозы от приблизительно 30 мг до приблизительно 90 мг средства двухцепочечной рибонуклеиновой кислоты (РНКи), которая ингибирует экспрессию Serpinc1, причем средство двухцепочечной РНКи содержит смысловую нить и антисмысловую нить, причем антисмысловая нить содержит область комплементарности к иРНК, кодирующей Serpinc1, которая содержит по меньшей мере 15 соседних нуклеотидов, отличающихся не более чем на 3 нуклеотида от нуклеотидной последовательности 5’-UUGAAGUAAAUGGUGUUAACCAG-3’ (SEQ ID NO: 15), причем по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити представляют собой модифицированные нуклеотиды, и при этом смысловая нить конъюгирована с лигандом, присоединенным на 3’-конце; и введение больному терапевтически эффективного количества замещающего фактора, причем эффективное количество замещающего фактора уменьшено по сравнению с рекомендованным эффективным количеством замещающего фактора, за счет этого происходит лечение кровотечения у больного гемофилией без ингибиторов.
В другом аспекте в настоящем изобретении представлен способ лечения кровотечения у больного гемофилией без ингибиторов. Способ включает введение больному фиксированной дозы от приблизительно 40 мг до приблизительно 90 мг средства двухцепочечной рибонуклеиновой кислоты (РНКи), которая ингибирует экспрессию Serpinc1, причем средство двухцепочечной РНКи содержит смысловую нить и антисмысловую нить, причем антисмысловая нить содержит область комплементарности к иРНК, кодирующей Serpinc1, которая содержит по меньшей мере 15 соседних нуклеотидов, отличающихся не более чем на 3 нуклеотида от нуклеотидной последовательности 5’-UUGAAGUAAAUGGUGUUAACCAG-3’ (SEQ ID NO: 15), причем по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити представляют собой модифицированные нуклеотиды, и при этом смысловая нить конъюгирована с лигандом, присоединенным на 3’-конце; и введение больному терапевтически эффективного количества замещающего фактора, причем эффективное количество замещающего фактора уменьшено по сравнению с рекомендованным эффективным количеством замещающего фактора, за счет этого происходит лечение кровотечения у больного гемофилией без ингибиторов.
Настоящее изобретение также по меньшей мере частично основано на открытии, что у больных гемофилией (например, гемофилией A, гемофилией B или гемофилией C) с ингибиторами, которым вводят терапевтически эффективное количество композиции иРНК, которое влияет на опосредованное РНК-индуцированным сайленсинговым комплексом (RISC) расщепление РНК-транскриптов гена Serpinc1, кровотечение можно лечить терапевтически эффективным количеством шунтирующего средства, такого как активированный концентрат протромбинового комплекса (aPCC) или рекомбинантный фактор VIIa (rFVIIa), меньшим чем рекомендованное эффективное количество шунтирующего средства, например, рекомендованное всемирной федерацией гемофилии (см., например, Srivastava, et al., «Guidelines for the Management of Hemophilia», Hemophilia Epub 6 July 2012; DOI:10,1111/j,1365-2516,2012,02909.x) и/или управлением пищевых продуктов и лекарственных средств (см., например, NovoSeven RT, Coagulation FactorVIIA (Recombinant) product insert; 07/2014; FEIBA, Anti- Inhibitor Coagulation Complex product insert; 11/2013; все содержание каждого из которых включено в данный документ посредством ссылки).
Соответственно, в другом аспекте в настоящем изобретении представлен способ лечения кровотечения у больного гемофилией с ингибиторами. Способы включают введение больному фиксированной дозы от приблизительно 30 мг до приблизительно 90 мг средства двухцепочечной рибонуклеиновой кислоты (РНКи), которая ингибирует экспрессию Serpinc1, причем средство двухцепочечной РНКи содержит смысловую нить и антисмысловую нить, причем антисмысловая нить содержит область комплементарности к иРНК, кодирующей Serpinc1, которая содержит по меньшей мере 15 соседних нуклеотидов, отличающихся не более чем на 3 нуклеотида от нуклеотидной последовательности 5’-UUGAAGUAAAUGGUGUUAACCAG-3’ (SEQ ID NO: 15), причем по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити представляют собой модифицированные нуклеотиды, и при этом смысловая нить конъюгирована с лигандом, присоединенным на 3’-конце; и введение больному терапевтически эффективного количества шунтирующего средства, причем эффективное количество шунтирующего средства уменьшено по сравнению с рекомендованным эффективным количеством, например, одобренным управлением пищевых продуктов и лекарственных средств, шунтирующего средства, за счет этого происходит лечение кровотечения у больного гемофилией с ингибиторами.
В другом аспекте в настоящем изобретении представлен способ лечения кровотечения у больного гемофилией с ингибиторами. Способы включают введение больному фиксированной дозы от приблизительно 40 мг до приблизительно 90 мг средства двухцепочечной рибонуклеиновой кислоты (РНКи), которая ингибирует экспрессию Serpinc1, причем средство двухцепочечной РНКи содержит смысловую нить и антисмысловую нить, причем антисмысловая нить содержит область комплементарности к иРНК, кодирующей Serpinc1, которая содержит по меньшей мере 15 соседних нуклеотидов, отличающихся не более чем на 3 нуклеотида от нуклеотидной последовательности 5’-UUGAAGUAAAUGGUGUUAACCAG-3’ (SEQ ID NO: 15), причем по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити представляют собой модифицированные нуклеотиды, и при этом смысловая нить конъюгирована с лигандом, присоединенным на 3’-конце; и введение больному терапевтически эффективного количества шунтирующего средства, причем эффективное количество шунтирующего средства уменьшено по сравнению с рекомендованным эффективным количеством, например, одобренным управлением пищевых продуктов и лекарственных средств, шунтирующего средства, за счет этого происходит лечение кровотечения у больного гемофилией с ингибиторами.
Средства иРНК для применения в способах согласно изобретению обычно содержат РНК нить (антисмысловую нить), имеющую область, которая составляет приблизительно 30 нуклеотидов или менее в длину, например, 15-30, 15-29, 15-28, 15-27, 15-26, 15-25, 15-24, 15-23, 15-22, 15-21, 15-20, 15-19, 15-18, 15-17, 18-30, 18-29, 18-28, 18-27, 18-26, 18-25, 18-24, 18-23, 18-22, 18-21, 18-20, 19-30, 19-29, 19-28, 19-27, 19-26, 19-25, 19-24, 19-23, 19-22, 19-21, 19-20, 20-30, 20-29, 20-28, 20-27, 20-26, 20-25, 20-24,20-23, 20-22, 20-21, 21-30, 21-29, 21-28, 21-27, 21-26, 21-25, 21-24, 21-23 или 21-22 нуклеотида в длину, причем эта область по существу комплементарна по меньшей мере части иРНК-транскрипта гена Serpinc1.
В других вариантах осуществления одна или обе нити средств двухцепочечной РНКи согласно изобретению составляет до 66 нуклеотидов в длину, например, 36-66, 26-36, 25-36, 31-60, 22-43, 27-53 нуклеотида в длину, с областью по меньшей мере 19 соседних нуклеотидов, которая по существу комплементарна по меньшей мере части иРНК-транскрипта гена Serpinc1. В некоторых вариантах осуществления смысловая и антисмысловые нити образуют дуплекс 18-30 соседних нуклеотидов.
В некоторых вариантах осуществления средства иРНК для применения в способах согласно изобретению содержат РНК нить (антисмысловую нить), которая может иметь до 66 нуклеотидов в длину, например, 36-66, 26-36, 25-36, 31-60, 22-43, 27-53 нуклеотида в длину, с областью по меньшей мере 19 соседних нуклеотидов, которая по существу комплементарна по меньшей мере части иРНК-транскрипта гена Serpinc1. В некоторых вариантах осуществления такие средства иРНК, имеющей антисмысловые нити большей длины, могут содержать вторую нить РНК (смысловую нить) 20-60 нуклеотидов в длину, причем смысловая и антисмысловые нити образуют дуплекс 18-30 соседних нуклеотидов.
В следующем подробном описании раскрыто получение и использование композиций, содержащих иРНК для ингибирования экспрессии гена Serpinc1, а также композиции, варианты применения и способы лечения больных с заболеваниями и нарушениями, которые получили бы пользу в результате ингибирования и/или уменьшения экспрессии этого гена.
I. Определения
Чтобы настоящее изобретение можно было понять более легко, сперва нужно определить некоторые термины. Кроме того, следует заметить, что всякий раз, когда указывается значение или диапазон значений параметра, предполагается, что значения и диапазоны, промежуточные к указанным значениям, также предназначены составлять часть настоящего изобретения.
Формы единственного числа в рамках настоящего изобретения относятся к одному или более чем одному (то есть по меньшей мере одному) грамматическому объекту формы. В качестве примера, «элемент» означает один элемент или более чем один элемент, например, множество элементов.
Термин «включающий» в рамках настоящего изобретения означает и используется взаимозаменяемо с выражением «включающий, но без ограничения».
Термин «или» в рамках настоящего изобретения означает и используется взаимозаменяемо с термином «и/или», если только в контексте явно не указано иное.
В рамках настоящего изобретения «Serpinc1» относится к конкретному полипептиду, экспрессируемому в клетке. Serpinc1 также известен как ингибитор пептидазы серпина, клада C (антитромбин; AT), элемент 1; антитромбин III; AT3; антитромбин; и кофактор гепарина 1. Последовательность иРНК-транскрипта Serpinc1 человека можно найти, например, по номеру доступа в GenBank GI:254588059 (NM_000488; SEQ ID NO:1). Последовательность иРНК Serpinc1 макака-резус можно найти, например, по номеру доступа в GenBank GI:157167169 (NM_001104583; SEQ ID NO:2). Последовательность иРНК Serpinc1 мыши можно найти, например, по номеру доступа в GenBank GI:237874216 (NM_080844; SEQ ID NO:3). Последовательность иРНК Serpinc1 крысы можно найти, например, по номеру доступа в GenBank GI:58865629 (NM_001012027; SEQ ID NO:4).
Термин «Serpinc1» в рамках настоящего изобретения также относится к конкретному полипептиду, экспрессируемому в клетке встречающимися в природе вариантами последовательности ДНК гена Serpinc1, такими как однонуклеотидный полиморфизм гена Serpinc1. было идентифицировано множество SNP внутри гена Serpinc1, которые можно найти, например, в NCBI dbSNP (см., например, www.ncbi.nlm.nih.gov/snp). Неограничивающие примеры SNP внутри гена Serpinc1 можно найти в NCBI dbSNP номера доступа rs677; rs5877; rs5878; rs5879; rs941988; rs941989; rs1799876; rs19637711; rs2008946; и rs2227586.
В рамках настоящего изобретения «больным» является животное, например, млекопитающее, в том числе примат (например, человек, не являющийся человеком примат, например, макака и шимпанзе), непримат (например, корова, свинья, верблюд, лама, лошадь, коза, кролик, овца, хомяк, морская свинка, кошка, собака, крыса, мышь, лошадь и кит) или птица (например, утка или гусь). В одном варианте осуществления больным является человек, например, человек, получающий лечение или проходящий оценку заболевания, нарушения или состояния, который получил бы пользу от уменьшения экспрессии Serpinc1; человек с риском заболевания, нарушения или состояния, который получил бы пользу от уменьшения экспрессии Serpinc1; человек, имеющий заболевание, нарушение или состояние, который получил бы пользу от уменьшения экспрессии Serpinc1; и/или человек, получающий лечение заболевания, нарушения или состояния, который получил бы пользу от уменьшения экспрессии Serpinc1, как описано в данном документе.
В рамках настоящего изобретения термины «лечение» или «обработка» относятся к полезному или желательному результату, включая, но без ограничения, облегчение или устранение выраженности одного или более симптомов, уменьшение степени кровотечения, стабилизированное (то есть без ухудшения) состояние кровотечения, сокращение или ослабление кровотечения, будь то обнаруживаемое или не обнаруживаемое, или устранение кровотечения. «Лечение» также может означать продление жизни по сравнению с ожидаемой продолжительностью жизни в отсутствие лечения. В способах согласно изобретению лечение включает в себя лечение по требованию и управление эпизодами кровотечений, периоперационное ведение кровотечения и обычную профилактику для уменьшения частоты эпизодов кровотечений.
Термин «ниже» в контексте уровня Serpinc1 у больного или маркера или симптома заболевания относится к статистически значимому уменьшению такого уровня. Уменьшение может составлять, например, по меньшей мере 10%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или более и предпочтительно до уровня, принятого в качестве нормального диапазона для человека без такого нарушения.
В рамках настоящего изобретения «предотвращение» или «профилактика» при использовании со ссылкой на заболевание, нарушение или его состояние, которое получило бы пользу от уменьшения экспрессии гена Sertpinc1, относится к снижению вероятности, что у больного проявится симптом, связанный с таким заболеванием, нарушением или состоянием, например, такой симптом, как кровотечение. Вероятность развития кровотечения уменьшается, например, когда у человека, имеющего один или более факторов риска кровотечения, либо не происходит развитие кровотечения, либо кровотечение развивается с меньшей тяжестью относительно популяции, имеющей те же факторы риска и не получающих лечение, как описано в данном документе. Отсутствие развития заболевания, нарушения или состояния или уменьшение развития симптома, связанного с таким заболеванием, нарушением или состоянием (например, по меньшей мере приблизительно на 10% по клинически принятой шкале для этого заболевания или нарушения), или проявление отсроченных симптомов с задержкой (например, на дни, недели, месяцы или годы) считается эффективной профилактикой.
В рамках настоящего изобретения термин «нарушение свертываемости» представляет собой заболевание или нарушение, которое приводит к слабому свертыванию крови и/или избыточному кровотечению. Нарушение свертываемости может быть наследственным нарушением, таким как гемофилия или болезнь Виллебранда, или приобретенным нарушением, связанным, например, с диссеминированным внутрисосудистым свертыванием, ассоциированной с беременностью эклампсией, дефицитом витамина K, аутоиммунным нарушением, воспалительным заболеванием кишечника, язвенным колитом, дерматологическим заболеванием (например, псориаз, пемфигус), респираторным заболеванием (например, астма, хроническое обструктивное заболевание легких), аллергической реакцией на лекарственный препарат, например, результатом применения лекарственных средств, таких как аспирин, гепарин и варфатин, диабетом, инфекцией острого гепатита B, инфекцией острого гепатита C, злокачественной или солидной опухолью (например, предстательной железы, легких, толстой кишки, поджелудочной железы, желудка, желчного протока, головы и шеи, шейки матки, молочной железы, меланомой, почек и/или гематологической злокачественной опухолью). В одном варианте осуществления наследственным нарушением свертываемости является гемофилия, например, гемофилия A, B или C. В одном варианте осуществления у больного, имеющего наследственное нарушение свертываемости, например, гемофилию, вырабатываются ингибиторы, например, ингибиторы аллогенных антител, на заместительную коагуляционную терапию, и в данном документе он упоминается как «больной с ингибитором». В одном варианте осуществления у больного с ингибитором имеется гемофилия A. В другом варианте осуществления у больного с ингибитором имеется гемофилия B. В еще одном варианте осуществления у больного с ингибитором имеется гемофилия C.
В одном варианте осуществления нарушением свертываемости является редкое нарушение свертываемости (RBD). RBD может быть приобретенным RBD или наследственным RBD. Наследственные RBD включают в себя нарушения, связанные с дефицитом факторов свертывания - фибриногена, FII, FV, объединенного FV и FVIII, FVII, FX, FXI, FXIII, и врожденный дефицит зависимых от витамина K факторов (VKCFD). Они обычно передаются в виде аутосомно-рецессивных состояний, хотя в некоторых случаях, таких как FXI и дисфибриногенемия, могут быть аутосомно-доминантными. RBD зарегистрированы в большинстве популяций с частотой встречаемости гомогозигот или двойных гетерозигот, варьирующей от 1 на 500000 для дефицита FVII до 1 на 2-3 миллиона для протромбина и FXIII. Относительная частота варьирует среди популяций, являясь боле высокой там, где распространены кровные или эндогамные браки, с повышенной частотой специфических мутантных генов.
Иллюстративные RBD включают в себя афибриногенемию (фибриноген; дефицит фактора I); гипофибриногенемию (фибриноген; дефицит фактора I); дисфибриногенемию (фибриноген; дефицит фактора I); гиподисфибриногенемия (фибриноген; дефицит фактора I); гипопротромбинемию (протромбин; дефицит фактора II); дефицит протромбина (протромбин; дефицит фактора II); тромбофилию (протромбин; дефицит фактора II); врожденный дефицит антитромбина III (тромбопластин; Фактор III; тканевый фактор); парагемофилию (проакцелерин; Фактор V; лабильный фактор); болезнь Оврена (проакцелерин; Фактор V; лабильный фактор); резистентность к активированному протеину С (проакцелерин; Фактор V; лабильный фактор); болезнь Александера (стабильный фактор проконвертин; Фактор VII); врожденный дефицит проконвертина/Фактора VII (стабильный фактор проконвертин; Фактор VII); дефицит фактора Стюарта-Прауэра (фактор Стюарта-Прауэра; Фактор X); врожденный дефицит Фактора XIIIa/b (представляет собой фибрин-стабилизирующий фактор; Фактор XIII); наследственный дефицит Фактора XIII (фибрин-стабилизирующий фактор; Фактор XIII); и дефицит фибрин-стабилизирующего фактора (фибрин-стабилизирующий фактор; Фактор XIII).
Термин «терапевтически эффективное количество» в рамках настоящего изобретения предназначен включать в себя количество средства РНКи, которого при введении больному, имеющему нарушение свертываемости и кровотечение, достаточно для влияния на лечение заболевания (например, путем уменьшения, уменьшения выраженности или стабилизации существующего заболевания или одного или более симптомов заболевания). «Терапевтически эффективное количество» может варьировать в зависимости от средства РНКи, способа введения средства, заболевания и его тяжести и анамнеза, возраста, веса, семейного анамнеза, набора генов, типов предшествующих или сопутствующих методов лечения, при наличии, и других индивидуальных характеристик больного, подлежащего лечению.
Термин «профилактически эффективное количество» в рамках настоящего изобретения предназначен включать в себя количество иРНК, которого при введении больному, имеющему нарушение свертываемости, но не кровотечение, например, больному, имеющему нарушение свертываемости, которому запланирована операция (например, периоперационное лечение), достаточно для предотвращения или уменьшения выраженности заболевания или одного или более симптомов заболевания. уменьшение выраженности заболевания включает в себя замедление прохождения заболевания или уменьшение тяжести развившегося позднее заболевание. «Профилактически эффективное количество» может варьировать в зависимости от иРНК, способа введения средства, степени риска заболевания и анамнеза, возраста, веса, семейного анамнеза, набора генов, типов предшествующих или сопутствующих методов лечения, при наличии, и других индивидуальных характеристик пациента, подлежащего лечению.
Термин «терапевтически эффективное количество» или «профилактически эффективное количество» также включает в себя количество средства РНКи, которое оказывает некоторое необходимое местное или системное воздействие при разумном соотношении польза/риск, применимом к любому лечению. ИРНК, используемую в способах согласно настоящему изобретению, можно вводить в достаточном количестве для получения разумного соотношения польза/риск, применимого к такому лечению.
«Рекомендованное терапевтически эффективное количество замещающего фактора» и «рекомендованное терапевтически эффективное количество шунтирующего средства» представляют собой дозы замещающего фактора или шунтирующего средства, соответственно, достаточные для образования тромбина и устранения кровотечения и/или достаточные для достижения пикового уровня фактора в плазме больного с кровотечением, предложенные всемирной федерацией гемофилии (см., например, Srivastava, et al., «Guidelines for the Management of Hemophilia», Hemophilia Epub 6 July 2012; DOI:10.1111/j.1365-2516.2012.02909.x; ADVATE (Antihemophilic Factor (Recombinant)) product insert; 11/2016; и BeneFIX (Coagulation Factor IX (Recombinant) product insert; 11/2011. Все содержание каждого из вышеприведенных документов включено в данный документ посредством ссылки.
Например, рекомендованной дозой замещающего фактора или шунтирующего средства для больного, имеющего незначительное кровотечение, является доза, достаточная для достижения пикового уровня фактора VIII в плазме приблизительно 10-40 МЕ/дл; рекомендованной дозой замещающего фактора или шунтирующего средства для больного с кровотечением средней тяжести, является доза, достаточная для достижения пикового уровня фактора VIII в плазме приблизительно 30-60 МЕ/дл; рекомендованной дозой замещающего фактора или шунтирующего средства для больного, имеющего сильное кровотечение, является доза, достаточная для достижения пикового уровня фактора VIII в плазме приблизительно 60-100 МЕ/дл; рекомендованной дозой замещающего фактора или шунтирующего средства для больного во время операции является доза, достаточная для достижения пикового уровня фактора VIII в плазме приблизительно 30-60 МЕ/дл (см., например, Таблицы 1 и 2 ADVATE (Antihemophilic Factor (Recombinant)) product insert; 11/2016).
Рекомендованной дозой замещающего фактора или шунтирующего средства для больного, имеющего незначительное кровотечение, является доза, достаточная для достижения пикового уровня фактора IX в плазме приблизительно 10-30 МЕ/дл; рекомендованной дозой замещающего фактора или шунтирующего средства для больного с кровотечением средней тяжести, является доза, достаточная для достижения пикового уровня фактора IX в плазме приблизительно 25-50 МЕ/дл; рекомендованной дозой замещающего фактора или шунтирующего средства для больного, имеющего сильное кровотечение, является доза, достаточная для достижения пикового уровня фактора IX в плазме приблизительно 50-100 МЕ/дл.
Выражение «фармацевтически приемлемый» используют в настоящем документе для ссылки на те соединения, материалы, композиции и/или лекарственные формы, которые находятся в рамках медицинской точки зрения, подходят для применения в контакте с тканями больных-людей и больных-животных без избыточной токсичности, раздражения, аллергической реакции или других проблем или осложнений, соразмерных с разумным соотношением польза/риск.
Выражение «фармацевтически приемлемый носитель» в рамках настоящего изобретения означает фармацевтически приемлемый материал, композицию или среду, такую как жидкий или твердый наполнитель, разбавитель, эксципиент, вспомогательное средство для изготовления (например, смазка, тальк магний, стеарат кальция или цинка или стеариновая кислота) или материал для инкапсулирования растворителя, участвующий в переносе или транспортировке рассматриваемого соединения из одного органа или части организма, в другой орган или часть организма. Каждый носитель должен быть «приемлемым» в смысле совместимости с другими ингредиентами готовой формы и не наносить вред больному, получающему лечение. Некоторые примеры материалов, которые могут служить в качестве фармацевтически приемлемых носителей, включают: (1) сахара, такие как лактоза, глюкоза и сахароза; (2) крахмалы, такие как кукурузный крахмал и картофельный крахмал; (3) целлюлозу и ее производные, такие как натрий карбоксиметилцеллюлоза, этилцеллюлоза и ацетат целлюлозы; (4) порошковый трагакант; (5) солод; (6) желатин; (7) смазывающие средства, такие как стеарат магния, натрий лаурилсульфат и тальк; (8) эксципиенты, такие как како масло и воски для суппозитариев; (9) масла, такие как арахисовое масло, хлопковое масло, сафлоровое масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; (10) гликоли, такие как пропиленгликоль; (11) полиолы, такие как глицерин, сорбитол, маннитол и полиэтиленгликоль; (12) сложные эфиры, такие как этилолеат и этил лаурат; (13) агар; (14) буферные средства, такие как гидроксид магния и гидроксид алюминия; (15) альгиновую кислоту; (16) апирогенную воду; (17) изотонический физиологический раствор; (18) раствор Рингера; (19) этиловый спирт; (20) pH-забуференные растворы; (21) сложные полиэфиры, поликарбонаты и/или полиангидриды; (22) объемообразующие средства, такие как полипептиды и аминокислоты (23) сывороточный компонент, такой как сывороточный альбумин, HDL и LDL; и (22) другие нетоксичные совместимые вещества, используемые в фармацевтических готовых формах.
В рамках настоящего изобретения «последовательность-мишень» относится к соседнему участку нуклеотидной последовательности молекулы иРНК, образованной во время транскрипции гена Serpinc1, содержащему иРНК, которая является продуктом процессинга РНК первичного продукта транскрипции. В одном варианте осуществления участок-мишень последовательности будет по меньшей мере достаточно длинным, чтобы служить в качестве субстрата для иРНК-направленного расщепления у или около этого участка нуклеотидной последовательности молекулы иРНК, образованной во время транскрипции гена Serpinc1.
Последовательность-мишень может быть приблизительно 9-36 нуклеотидов в длину, например, приблизительно 15-30 нуклеотидов в длину. Например, последовательность-мишень может быть приблизительно 15-30 нуклеотидов, 15-29, 15-28, 15-27, 15-26, 15-25, 15-24, 15-23, 15-22, 15-21, 15-20, 15-19, 15-18, 15-17, 18-30, 18-29, 18-28, 18-27, 18-26, 18-25, 18-24, 18-23, 18-22, 18-21, 18-20, 19-30, 19-29, 19-28, 19-27, 19-26, 19-25, 19-24, 19-23, 19-22, 19-21, 19-20, 20-30, 20-29, 20-28, 20-27, 20-26, 20-25, 20-24, 20-23, 20-22, 20-21, 21-30, 21-29, 21-28, 21-27, 21-26, 21-25, 21-24, 21-23 или 21-22 нуклеотида в длину. Также предполагается, что диапазоны и длины, промежуточные к указанным выше диапазонам и длинам, являются частью изобретения.
В рамках настоящего изобретения термин «нить, содержащая последовательность» относится к олигонуклеотиду, содержащему цепь нуклеотидов, которая описана с помощью упоминаемой последовательности с использованием стандартной нуклеотидной номенклатуры.
Каждый из «G», «C», «A», «T» и «U» обычно обозначает нуклеотид, который в качестве основания содержит гуанин, цитозин, аденин, тимидин и урацил, соответственно. Однако должно быть понятно, что термин «рибонуклеотид» или «нуклеотид» может также относиться к модифицированному нуклеотиду, как более подробно изложено ниже, или к имитирующему замещающему фрагменту (см., например, Таблицу 1). Специалисту хорошо известно, что гуанин, цитозин, аденин и урацил можно заменить другими фрагментами без существенного изменения свойств спаривания оснований олигонуклеотида, содержащего нуклеотид, несущий такой замещающий фрагмент. Например, без ограничения, нуклеотид, содержащий в качестве своего основания инозин, может составлять пару с нуклеотидами, содержащими аденин, цитозин или урацил. Вследствие этого, нуклеотиды, содержащие урацил, гуанин или аденин, можно заменить в нуклеотидных последовательностях дцРНК, представленной в изобретении, нуклеотидом, содержащим, например, инозин. В другом примере аденин и цитозин в любом месте в олигонуклеотиде можно заменить на гуанин и урацил, соответственно, с образованием неоднозначного спаривания оснований G-U с иРНК-мишенью. Последовательности, содержащие такие замещающие фрагменты, подходят для композиций и способов, представленных в изобретении.
Термины «иРНК», «средство РНКи», «средство иРНК», «средство РНК-интерференции», которые используют взаимозаменяемо в данном документе, относятся к препарату, который содержит РНК согласно определению этого термина в данном документе и который опосредует направленное расщепление РНК-транскрипта посредством пути РНК-индуцированного сайленсингового комплекса (RISC). ИРНК направляет специфичную к последовательности деградацию иРНК с помощью процесса, известного как РНК-интерференция (РНКи). ИРНК модулирует, например, ингибирует, экспрессию Serpinc1 в клетке, например, в клетке больного, например, больного-млекопитающего.
В одном варианте осуществления средство РНКи согласно изобретению содержит одноцепочечную РНК, которая взаимодействует с последовательностью РНК-мишенью, например, последовательностью иРНК-мишенью Serpinc1, для направления расщепления РНК-мишени. Не желая связывать себя теорией полагают, что длинная двухцепочечная РНК, введенная в клетки, расщепляется на миРНК эндонуклеазой III типа, известной как Dicer (Sharp et al., (2001) Genes Dev. 15:485). Dicer, рибонуклеаза-III-подобный фермент, процессирует дцРНК на малые интерферирующие РНК по 19-23 пар оснований с характерными 3’-выступами из двух оснований (Bernstein, et al., (2001) Nature 409:363). Затем миРНК встраиваются в РНК-индуцированный сайленсинговый комплекс (RISC), где одна или более хеликаз расплетают дуплекс миРНК, позволяя комплементарной антисмысловой нити направлять распознавание мишени (Nykanen, et al., (2001) Cell 107:309). При связывании с подходящей иРНК-мишенью одна или более эндонуклеаз внутри RISC расщепляют мишень, чтобы вызвать сайлесинг (Elbashir, et al., (2001) Genes Dev. 15:188). Таким образом, в одном аспекте изобретение относится к одноцепочечной РНК (миРНК), создаваемой внутри клетки, которая способствует образованию комплекса RISC, влияющему на сайлесинг гена-мишени, то есть гена Serpinc1. Соответственно, термин «миРНК» также использован в данном документе для ссылки на РНКи, как описано выше.
В другом варианте осуществления средством РНКи может быть одноцепочечная миРНК, которую вводят в клетку или организм для ингибирования иРНК-мишени. Средства одноцепочечной РНКи связываются с эндонуклеазой RISC, Argonaute 2, которая затем расщепляет иРНК-мишень. Одноцепочечные миРНК обычно составляют 15-30 нуклеотидов и являются химически модифицированными. Конструкция и тестирование одноцепочечных миРНК описаны в патенте США № 8101348 и в Lima et al., (2012) Cell 150: 883-894, все содержание каждого из которых включено настоящим в данный документ посредством ссылки. Любую из антисмысловых нуклеотидных последовательностей, описанных в данном документе, можно использовать в качестве одноцепочечной миРНК, как описано в данном документе, или в качестве химически модифицированной с помощью способов, описанных в Lima et al., (2012) Cell 150;:883-894.
В другом варианте осуществления «иРНК» для применения в композициях, вариантах применения и способах согласно изобретению является двухцепочечная РНК, которая упоминается в данном документе, как «средство двухцепочечной РНКи», «молекула двухцепочечной РНК (дцРНК)», «средство дцРНК» или «дцРНК». Термин «дцРНК» относится к комплексу молекул рибонуклеиновой кислоты, имеющих сдвоенную структуру, содержащую две встречно-параллельные и по существу комплементарные нити нуклеиновой кислоты, упоминаемые как имеющие «смысловую» и «антисмысловую» ориентации относительно РНК-мишени, то есть гена Serpinc1. В некоторых вариантах осуществления изобретения двухцепочечная РНК (дцРНК) запускает деградацию РНК-мишени, например, иРНК, через посттранскрипционный механизм ген-сайлесинга, упоминаемый в данном документе как РНК-интерференция или РНКи.
В общем, большинство нуклеотидов каждой нити молекулы дцРНК представляют собой рибонуклеотиды, но как подробно описано в данном документе, каждая или обе нити также могут содержать один или более не рибонуклеотидов, например, деоксирибонуклеотид и/или модифицированный нуклеотид. Кроме того, как использовано в этом описании, «средство РНКи» может содержать рибонуклеотиды с химическими модификациями; средство РНКи может содержать существенные модификации во многих нуклеотидах.
В рамках настоящего изобретения термин «модифицированный нуклеотид» относится к нуклеотиду, независимо имеющему фрагмент модифицированного сахара, модифицированную межнуклеотидную связь и/или модифицированное нуклеиновое основание. Таким образом, термин модифицированный нуклеотид охватывает замены, добавления или удаление, например, функциональной группы или атома, в межнуклеозидных связях, фрагментах сахара или нуклеиновых основаниях. Модификации, подходящие для применения в средствах согласно изобретению, включают в себя все типы модификаций, раскрытых в данном документе или известных в данной области. Для целей этого описания и формулы изобретения термин «средство РНКи» охватывает любые такие модификации, которые используют в молекуле типа миРНК.
Сдвоенная область может иметь любую длину, которая обеспечивает специфическую деградацию необходимой РНК-мишени через путь RISC и может варьировать от приблизительно 9 до 36 пар оснований в длину, например, приблизительно 15-30 пар оснований в длину, например, приблизительно 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35 или 36 пар оснований в длину, например, приблизительно 15-30, 15-29, 15-28, 15-27, 15-26, 15-25, 15-24, 15-23, 15-22, 15-21, 15-20, 15-19, 15-18, 15-17, 18-30, 18-29, 18-28, 18-27, 18-26, 18-25, 18-24, 18-23, 18-22, 18-21, 18-20, 19-30, 19-29, 19-28, 19-27, 19-26, 19-25, 19-24, 19-23, 19-22, 19-21, 19-20, 20-30, 20-29, 20-28, 20-27, 20-26, 20-25, 20-24,20-23, 20-22, 20-21, 21-30, 21-29, 21-28, 21-27, 21-26, 21-25, 21-24, 21-23 или 21-22 пары оснований в длину. Также предполагается, что частью изобретения являются диапазоны и длины, промежуточные указанным выше диапазонам и длинам.
Две нити, образующие сдвоенную структуру, могут быть разными участками одной большой молекулы РНК, или они могут быть отдельными молекулами РНК. Когда две нити являются частью одной большой молекулы и, следовательно, связаны непрерывной цепью нуклеотидов между 3’-концом одной нити и 5’-концом соответствующей другой нити, образующих сдвоенную структуру, связывающая цепь РНК называется «шпилечная петля». Шпилечная петля может содержать по меньшей мере один непарный нуклеотид. В некоторых вариантах осуществления шпилечная петля может содержать по меньшей мере 2, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, по меньшей мере 7, по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 20, по меньшей мере 23 или более непарных нуклеотидов.
Когда две по существу комплементарные нити дцРНК состоят из отдельных молекул РНК, эти молекулы не должны, но могут быть ковалентно связаны. Когда две нити ковалентно связаны посредством иной, чем непрерывная цепь нуклеотидов между 3’-концом одной нити и 5’-концом соответствующей другой нити, образующих сдвоенную структуру, связывающая структура называется «линкер». Нити РНК могут иметь одинаковое или разное количество нуклеотидов. Максимальным количеством пар оснований является количество нуклеотидов в самой короткой нити дцРНК минус любые выступы, которые имеются в дуплексе. В дополнение к сдвоенной структуре РНКи может содержать выступы в один или более нуклеотидов.
В одном варианте осуществления средством РНКи согласно изобретению является дцРНК 24-30 нуклеотидов, которая взаимодействует с последовательностью РНК-мишенью, например, последовательностью иРНК-мишенью Serpinc1, для направления расщепления РНК-мишени. Не желая связывать себя теорией, длинная двухцепочечная РНК, введенная в клетки, расщепляется на миРНК эндонуклеазой III типа, известной как Dicer (Sharp et al., (2001) Genes Dev. 15:485). Dicer, рибонуклеаза-III-подобный фермент, процессирует дцРНК на малые интерферирующие РНК по 19-23 пары оснований с характерными 3’-выступами из двух оснований (Bernstein, et al., (2001) Nature 409:363). Затем миРНК встраиваются в РНК-индуцированный сайленсинговый комплекс (RISC), где одна или более хеликазы расплетают дуплекс миРНК, позволяя комплементарной антисмысловой нити направлять распознавание мишени (Nykanen, et al., (2001) Cell 107:309). При связывании с подходящей иРНК-мишенью одна или более эндонуклеаз внутри RISC расщепляют мишень, чтобы вызвать сайлесинг (Elbashir, et al., (2001) Genes Dev. 15:188).
В рамках настоящего изобретения термин «нуклеотидный выступ» относится по меньшей мере к одному непарному нуклеотиду, который выступает из сдвоенной структуры иРНК, например, дцРНК. Например, когда 3'-конец одной нити дцРНК выступает за пределы 5'-конца другой нити или наоборот, имеется нуклеотидный выступ. ДцРНК может содержать выступ по меньшей мере из одного нуклеотида; альтернативно выступ может содержать по меньшей мере два нуклеотида, по меньшей мере три нуклеотида, по меньшей мере четыре нуклеотида, по меньшей мере пять нуклеотидов или более. Нуклеотидный выступ может содержать или состоять из аналога нуклеотида/нуклеозида, содержащего деоксинуклеотид/нуклеозид. Выступ (выступы) могут быть на смысловой нити, антисмысловой нити или любой их комбинации. Кроме того, нуклеотид (нуклеотиды) выступа могут иметься на 5'-конце, 3'-конце или на обоих концах либо антисмысловой, либо смысловой нити дцРНК.
В одном варианте осуществления антисмысловая нить дцРНК имеет 1-10 нуклеотидов, например, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 нуклеотидов, выступ на 3’-конце и/или 5’-конце. В одном варианте осуществления смысловая нить дцРНК имеет 1-10 нуклеотидов, например, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 нуклеотидов, выступ на 3’-конце и/или 5’-конце. В другом варианте осуществления один или более нуклеотидов в выступе заменены на нуклеозид тиофосфат.
В некоторых вариантах осуществления выступ на смысловой нити или антисмысловой нити или на обеих может иметь большую длину, более чем 10 нуклеотидов, например, 10-30 нуклеотидов, 10-25 нуклеотидов, 10-20 нуклеотидов или 10-15 нуклеотидов в длину. В некоторых вариантах осуществления расширенный выступ находится на смысловой нити дуплекса. В некоторых вариантах осуществления расширенный выступ находится на 3’-конце смысловой нити дуплекса. В некоторых вариантах осуществления расширенный выступ находится на 5’-конце смысловой нити дуплекса. В некоторых вариантах осуществления расширенный выступ находится на антисмысловой нити дуплекса. В некоторых вариантах осуществления расширенный выступ находится на 3’-конце антисмысловой нити дуплекса. В некоторых вариантах осуществления расширенный выступ находится на 5’-конце антисмысловой нити дуплекса. В некоторых вариантах осуществления один или более нуклеотидов в расширенном выступе заменен на нуклеозид тиофосфат.
«Тупой» или «тупой конец» означает, что на этом конце средства двухцепочечной РНКи нет непарных нуклеотидов, то есть нет нуклеотидного выступа. Средством РНКи «с тупым концом» является дцРНК, которая является двухцепочечной по всей своей длине, то есть нуклеотидного выступа нет ни на одном конце молекулы. Средства РНКи согласно изобретению содержат средства РНКи с нуклеотидными выступами на одном конце (то есть средства с одним выступом и одним тупым концом) или с нуклеотидными выступами на обоих концах.
Термин «антисмысловая нить» или «направляющая нить» относится к нити иРНК, например, дцРНК, которая содержит область, которая по существу комплементарна последовательности-мишени, например, иРНК Serpinc1. В рамках настоящего изобретения термин «область комплементарности» относится к области на антисмысловой нити, которая по существу комплементарна последовательности, например, последовательности-мишени, например, нуклеотидной последовательности Serpinc1, согласно определению в данном документе. Когда область комплементарности не полностью комплементарна последовательности-мишени, во внутренних или терминальных областях молекулы могут быть несовпадения. В общем, наиболее допустимые несовпадения находятся в терминальных областях, например, в пределах 5, 4, 3 или 2 нуклеотидов 5’-и/или 3’-конца иРНК.
Термин «смысловая нить» или «сопровождающая нить» в рамках настоящего изобретения относится к нити иРНК, которая содержит область, которая по существу комплементарна области антисмысловой нити согласно определению этого термина в данном документе.
В рамках настоящего изобретения термин «область расщепления» относится к области, которая находится в непосредственной близости к сайту расщепления. Сайтом расщепления является сайт в мишени, в котором происходит расщепление. В некоторых вариантах осуществления область расщепления содержит три основания на каждом конце сайта расщепления и в непосредственной близости к нему. В некоторых вариантах осуществления область расщепления содержит два основания на каждом конце сайта расщепления и в непосредственной близости к нему. В некоторых вариантах осуществления сайт расщепления конкретно находится на сайте, ограниченном нуклеотидами 10 и 11 антисмысловой нити, а область расщепления содержит нуклеотиды 11, 12 и 13.
В рамках настоящего изобретения и если не указано иное, термин «комплементарный» при использовании для описания первой нуклеотидной последовательности относительно второй нуклеотидной последовательности относится к способности олигонуклеотида или полинуклеотида, содержащего первую нуклеотидную последовательность, гибридизироваться и в определенных условиях образовывать сдвоенную структуру с олигонуклеотидом или полинуклеотидом, содержащим вторую нуклеотидную последовательность, как будет понятно специалисту. Такими условиями, например, могут быть жесткие условия, причем жесткие условия могут включать в себя: 400 мМ NaCl, 40 мМ PIPES pH 6,4, 1 мМ EDTA, 50°C или 70°C в течение 12-16 часов с последующей промывкой (см., например, «Molecular Cloning: Laboratory Manual, Sambrook, et al., (1989) Cold Spring Harbor Laboratory Press). Можно применять другие условия, такие как физиологически значимые условия, которые могут встречаться в организме. Специалист сможет определить набор условий, наиболее подходящий для тестирования комплементарности двух последовательностей в соответствии с окончательным применением гибридизированных нуклеотидов.
Комплементарные последовательности внутри иРНК, например, внутри дцРНК, как описано в данном документе, содержат спаривание оснований олигонуклеотида или полинуклеотида, содержащего первую нуклеотидную последовательность, с олигонуклеотидом или полинуклеотидом, содержащим вторую нуклеотидную последовательность на протяжении всей длины одной или обеих нуклеотидных последовательностей. Такие последовательности в данном документе могут называться «полностью комплементарные» друг относительно друга. Однако, когда первая последовательность в данном документе называется «по существу комплементарной» относительно второй последовательности, две последовательности могут быть полностью комплементарными, или они могут образовывать одну или более, но обычно не более чем на 5, 4, 3 или 2 несовпадающих пар оснований при гибридизации для дуплекса до 30 пар оснований, сохраняя в то же время способность гибридизироваться в условиях, наиболее значимых для их конечного применения, например, ингибирования экспрессии гена посредством пути RISC. Однако, когда два олигонуклеотида конструируют с образованием при гибридизации одного или более одноцепочечных выступов, такие выступы не следует расценивать, как несовпадения относительно определения комплементарности. Например, дцРНК, содержащая один олигонуклеотид, 21 нуклеотид в длину, и другой олигонуклеотид, 23 нуклеотида в длину, причем более длинный олигонуклеотид содержит последовательность в 21 нуклеотид, которая полностью комплементарна более короткому олигонуклеотиду, для целей, описанных в данном документе, может упоминаться также, как «полностью комплементарная».
«Комплементарные» последовательности в рамках настоящего изобретения также могут содержать или быть полностью образованы из не Уотсон-Криковских пар оснований и/или пар оснований, образованных из неприродных и модифицированных нуклеотидов, при условии соблюдения вышеуказанных требований относительно их способности гибридизироваться. Такие не Уотсон-Криковские пары оснований включают в себя, но без ограничения, неоднозначное или Хугстиновское спаривание оснований G:U.
Термины «комплементарная», «полностью комплементарная» и «по существу комплементарная» в данном документе можно использовать в отношении совпадения оснований между смысловой нитью и антисмысловой нитью дцРНК или между антисмысловой нитью средства иРНК и последовательностью-мишенью, как будет понятно из контекста их использования.
В рамках настоящего изобретения полинуклеотид, который «по существу комплементарен по меньшей мере части» информационной РНК (иРНК), относится к полинуклеотиду, который по существу комплементарен соседнему участку представляющей интерес иРНК (например, иРНК, кодирующей Serpinc1). Например, полинуклеотид комплементарен по меньшей мере части иРНК Serpinc1, если последовательность по существу комплементарна непрерывному участку иРНК, кодирующей Serpinc1.
Соответственно, в некоторых вариантах осуществления полинуклеотиды антисмысловой нити, раскрытые в данном документе, полностью комплементарны последовательности-мишени Serpinc1. В других вариантах осуществления полинуклеотиды антисмысловой нити, раскрытые в данном документе, по существу комплементарны последовательности-мишени Serpinc1 и содержат соседнюю нуклеотидную последовательность, которая по меньшей мере приблизительно на 80% по всей своей длине комплементарна эквивалентной области нуклеотидной последовательности SEQ ID NO:1 или фрагменту SEQ ID NO:1, например, комплементарна приблизительно на 85%, приблизительно на 86%, приблизительно на 87%, приблизительно на 88%, приблизительно на 89%, приблизительно на 90%, приблизительно на 91%, приблизительно на 92%, приблизительно на 93%, приблизительно на 94%, приблизительно на 95%, приблизительно на 96%, приблизительно на 97%, приблизительно на 98% или приблизительно на 99%.
В одном варианте осуществления средство РНКи согласно изобретению содержит смысловую нить, которая по существу комплементарна антисмысловому полинуклеотиду, который, в свою очередь, комплементарен последовательности-мишени Serpinc1, и при этом полинуклеотид смысловой нити содержит соседнюю нуклеотидную последовательность, которая по всей своей длине комплементарна по меньшей мере приблизительно на 80% эквивалентной области нуклеотидной последовательности SEQ ID NO:5 или фрагменту любой одной из SEQ ID NO:5, например, комплементарна приблизительно на 85%, приблизительно на 86%, приблизительно на 87%, приблизительно на 88%, приблизительно на 89%, приблизительно на 90%, приблизительно на 91%, приблизительно на 92%, приблизительно на 93%, приблизительно на 94%, приблизительно на 95%, приблизительно на 96%, приблизительно на 97%, приблизительно на 98% или приблизительно на 99%.
В одном аспекте изобретения средством для применения в способах и композициях согласно изобретению является молекула одноцепочечной антисмысловой РНК, которая ингибирует иРНК-мишень посредством механизма антисмыслового ингибирования. Молекула одноцепочечной антисмысловой РНК комплементарна последовательности внутри иРНК-мишени. Одноцепочечные антисмысловые олигонуклеотиды могут ингибировать трансляцию стехиометрическим образом путем спаривания оснований с иРНК и физически препятствуя механизму трансляции, см. Dias, N. et al., (2002) Mol Cancer Ther 1:347-355. Молекула одноцепочечной антисмысловой РНК может быть от приблизительно 15 до приблизительно 30 нуклеотидов в длину и иметь последовательность, которая комплементарна последовательности-мишени. Например, молекула одноцепочечной антисмысловой РНК может содержать последовательность, которая составляет по меньшей мере приблизительно 15, 16, 17, 18, 19, 20 или более соседних нуклеотидов из любой одной из антисмысловых последовательностей, описанных в данном документе.
Термин «ингибирование» в рамках настоящего изобретения используют взаимозаменяемо с «уменьшение», «сайлесинг», «понижающее регулирование», «супрессия» и другими аналогичными терминами, и включает любой уровень ингибирования.
Выражение «ингибирование экспрессии Serpinc1» в рамках настоящего изобретения включает в себя ингибирование экспрессии любого гена Serpinc1 (такого как, например, ген Serpinc1 мыши, ген Serpinc1 крысы, ген Serpinc1 макаки или ген Serpinc1 человека), а также вариантов или мутантов гена Serpinc1, которые кодируют белок Serpinc1.
«Ингибирование экспрессии гена Serpinc1» включает в себя любой уровень ингибирования гена Serpinc1, например, по меньшей мере частичную супрессию экспрессии гена Serpinc1, например, ингибирование по меньшей мере приблизительно на 5%, по меньшей мере приблизительно на 10%, по меньшей мере приблизительно на 15%, по меньшей мере приблизительно на 20%, по меньшей мере приблизительно на 25%, по меньшей мере приблизительно на 30%, по меньшей мере приблизительно на 35%, по меньшей мере приблизительно на 40%, по меньшей мере приблизительно на 45%, по меньшей мере приблизительно на 50%, по меньшей мере приблизительно на 55%, по меньшей мере приблизительно на 60%, по меньшей мере приблизительно на 65%, по меньшей мере приблизительно на 70%, по меньшей мере приблизительно на 75%, по меньшей мере приблизительно на 80%, по меньшей мере приблизительно на 85%, по меньшей мере приблизительно на 90%, по меньшей мере приблизительно на 91%, по меньшей мере приблизительно на 92%, по меньшей мере приблизительно на 93%, по меньшей мере приблизительно на 94%, по меньшей мере приблизительно на 95%, по меньшей мере приблизительно на 96%, по меньшей мере приблизительно на 97%, по меньшей мере приблизительно на 98% или по меньшей мере приблизительно на 99%.
Экспрессию гена Serpinc1 можно оценивать на основании уровня любой переменной, связанной с экспрессией гена Serpinc1, например, уровня иРНК Serpinc1, уровня белка Serpinc1 или, например, уровней комплекса тромбин:антитромбин в качестве меры возможности образования тромбина, времени кровотечения, протромбинового времени (PT), количества тромбоцитов и/или активированного частичного тромбопластинового времени (aPTT). Ингибирование можно оценивать по снижению абсолютного или относительного уровня одного или более из этих переменных по сравнению с контрольным уровнем. Контрольным уровнем может быть любой тип контрольного уровня, который используют в данной области, например, базовый уровень до введения дозы или уровень, определяемый у похожего больного, в клетке или образце, не получающих лечение или получающих лечение контролем (таким как, например, контроль только с буфером или контроль с неактивным средством).
В одном варианте осуществления по меньшей мере частичную супрессию экспрессии гена Serpinc1 оценивают по уменьшению количества иРНК Serpinc1, которые можно выделить или выявить в первой клетке или группе клеток, в которых транскрибирован ген Serpinc1 и которую или которые обработали таким образом, чтобы ингибировать экспрессию гена Serpinc1 по сравнению со второй клеткой или группой клеток, по существу идентичных первой клетке или группе клеток, но которую или которые не обработали таким образом (контрольные клетки). Степень ингибирования можно выразить в показателях

Выражение «введение клетки в контакт со средством РНКи», таким как дцРНК в рамках настоящего изобретения включает в себя введение клетки в контакт с помощью любого возможного средства. Введение клетки в контакт со средством РНКи включает в себя введение клетки в контакт с иРНК in vitro или введение клетки в контакт с иРНК in vivo. Введение в контакт можно осуществить прямо или непрямо. Таким образом, например, средство РНКи можно поместить в физический контакт с клеткой посредством индивидуального выполнения способа или, альтернативно, средство РНКи можно поместить в ситуацию, которая впоследствии обеспечит ей возможность или позволит войти в контакт с клеткой.
Введение клетки в контакт in vitro можно осуществить, например, путем инкубации клетки со средством РНКи. Введение клетки в контакт in vivo можно осуществить, например, путем инъекции средства РНКи в ткань, где находится клетка, или около нее или путем инъекции средства РНКи в другую зону, например, в кровоток или в подкожное пространство, таким образом, чтобы препарат впоследствии достиг ткани, где находится клетка, которую нужно ввести в контакт. Например, средство РНКи может содержать и/или быть связано с лигандом, например, GalNAc3, который направляет средство РНКи в представляющий интерес участок, например, печень. Также возможны комбинации способов введения в контакт in vitro и in vivo. Например, клетку также можно ввести в контакт in vitro со средством РНКи и впоследствии трансплантировать больному.
В одном варианте осуществления введение клетки в контакт с иРНК включает в себя «введение» или «доставку иРНК в клетку» путем облегчения или влияния на поглощение или абсорбцию в клетке. Абсорбция или поглощение иРНК может проходить через самостоятельные диффузионные или активные клеточные процессы или с помощью вспомогательных средств или устройств. Введение иРНК в клетку может быть in vitro и/или in vivo. Например, для введения in vivo иРНК можно инъецировать в участок ткани или вводить системно. Доставку in vivo также можно осуществить с помощью системы доставки бета-глюкана, такой как системы, описанные в патентах США №№ 5032401 и 5607677 и Публикации США № 2005/0281781, все содержание которых включено настоящим в данный документ посредством ссылки. Введение в клетку in vitro включает в себя способы, известные в данной области, такие как электропорация и липофекция. Дальнейшие подходы описаны в данном документе ниже и/или известны в данной области.
II. Способы согласно изобретению
В настоящем изобретении представлены терапевтические способы лечения кровотечения у больного гемофилией (например, гемофилией A, гемофилией B или гемофилией C), которые включают введение больному средства иРНК или фармацевтической композиции, содержащей средство иРНК согласно изобретению, например, в количестве, которое снижает активность Serpinc1 у больного приблизительно на 75% или более, и замещающего фактора или шунтирующего средства в терапевтически эффективном количестве, которое уменьшено по сравнению с рекомендованным терапевтически эффективным количеством замещающего фактора или шунтирующего средства, например, рекомендованным всемирной федерацией гемофилии (см., например, Srivastava, et al., «Guidelines for the Management of Hemophilia», Hemophilia Epub 6 July 2012; DOI:10,1111/j,1365-2516,2012,02909.x) и/или управлением пищевых продуктов и лекарственных средств ((см., например, ADVATE (Antihemophilic Factor (Recombinant)) product insert; 11/2016; BeneFIX (Coagulation Factor IX (Recombinant) product insert; 11/2011) (например, в количестве, достаточном для образования тромбина и устранения кровотечения (образования сгустка). Все содержание каждого из вышеизложенных документов включено в данный документ посредством ссылки.
Как описано в примерах ниже, было неожиданно обнаружено, что у больных гемофилией, например, гемофилией A, гемофилией B или гемофилией C с ингибиторами или без них, введение средства РНКи, которое ингибирует экспрессию Serpinc1, в количестве, которое снижает активность Serpinc1 у больного приблизительно на 75% или более, уменьшает среднегодовую частоту кровотечений и спонтанную годовую частоту кровотечений, и что кровотечениями можно управлять (тромбин вырабатывается, а кровотечение останавливается) с помощью замещающего фактора или шунтирующего средства в терапевтически эффективном количестве, которое уменьшено по сравнению с рекомендованным терапевтически эффективным количеством замещающего фактора или шунтирующего средства.
Подходящие замещающие факторы для применения в способах согласно изобретению включают в себя Фактор VIII, например, Адват, Элокат, Гаэмат, Геликсат, Иммунат, Октанат, Рекомбинат и Рефакто, или фактор IX, например, Аимафикс, Бенефикс, Иммунин и Рефакто. Подходящие шунтирующие средства для применения в способах согласно изобретению включают в себя активированные концентраты протромбинового комплекса (aPCC), например, FEIBA и Протромплекс, и Рекомбинантный фактор VIIa (rFVIIa), например, НовоСэвен.
Замещающим фактором может быть Фактор VIII, а терапевтически эффективное количество замещающего фактора, вводимое больному в способах согласно изобретению, составляет дозу, достаточную для достижения пикового уровня фактора VIII в плазме приблизительно 10-100 МЕ/дл, например, приблизительно 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 или приблизительно 100 МЕ/дл.
Например, терапевтически эффективное количество фактора, замещающего фактор VIII, вводимое больному, может быть меньше, чем приблизительно 200 МЕ/кг, или меньше, чем приблизительно 190 МЕ/кг, или меньше, чем приблизительно 180 МЕ/кг, или меньше, чем приблизительно 170 МЕ/кг, или меньше, чем приблизительно 160 МЕ/кг, или меньше, чем приблизительно 150 МЕ/кг, или меньше, чем приблизительно 140 МЕ/кг, или меньше, чем приблизительно 130 МЕ/кг, или меньше, чем приблизительно 120 МЕ/кг, или меньше, чем приблизительно 110 МЕ/кг, или меньше, чем приблизительно 100 МЕ/кг, или меньше, чем приблизительно 90 МЕ/кг, или меньше, чем приблизительно 80 МЕ/кг, или меньше, чем приблизительно 70 МЕ/кг, или меньше, чем приблизительно 60 МЕ/кг, или меньше, чем приблизительно 50 МЕ/кг, или меньше, чем приблизительно 40 МЕ/кг, или меньше, чем приблизительно 30 МЕ/кг, или меньше, чем приблизительно 20 МЕ/кг, или меньше, чем приблизительно 10 МЕ/кг. В одном варианте осуществления терапевтически эффективное количество фактора VIII, вводимое больному, от приблизительно в полтора раза до приблизительно в пять раз меньше, чем рекомендованное эффективное количество замещающего фактора, например, доза от приблизительно 5 до приблизительно 20 МЕ/кг или от приблизительно 10 до приблизительно 20 МЕ/кг, например, 5, 10, 15 или 20 МЕ/кг. В одном варианте осуществления кровотечение представляет собой кровотечение средней тяжести. В другом варианте осуществления кровотечение представляет собой кровотечение большой тяжести.
Замещающим фактором может быть Фактор IX, а терапевтически эффективное количество замещающего фактора, вводимое больному в способах согласно изобретению, составляет дозу, достаточную для достижения пикового уровня фактора IX в плазме приблизительно 10-100 МЕ/дл, например, приблизительно 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 или приблизительно 100 МЕ/дл.
Например, терапевтически эффективное количество фактора, замещающего фактор IX, может быть меньше, чем приблизительно 200 МЕ/кг, или меньше, чем приблизительно 190 МЕ/кг, или меньше, чем приблизительно 180 МЕ/кг, или меньше, чем приблизительно 170 МЕ/кг, или меньше, чем приблизительно 160 МЕ/кг, или меньше, чем приблизительно 150 МЕ/кг, или меньше, чем приблизительно 140 МЕ/кг, или меньше, чем приблизительно 130 МЕ/кг, или меньше, чем приблизительно 120 МЕ/кг, или меньше, чем приблизительно 110 МЕ/кг, или меньше, чем приблизительно 100 МЕ/кг, или меньше, чем приблизительно 90 МЕ/кг, или меньше, чем приблизительно 80 МЕ/кг, или меньше, чем приблизительно 70 МЕ/кг, или меньше, чем приблизительно 60 МЕ/кг, или меньше, чем приблизительно 50 МЕ/кг, или меньше, чем приблизительно 40 МЕ/кг, или меньше, чем приблизительно 30 МЕ/кг, или меньше, чем приблизительно 20 МЕ/кг, или меньше, чем приблизительно 10 МЕ/кг. В одном варианте осуществления терапевтически эффективное количество фактора IX, вводимое больному, от приблизительно двух раз до приблизительно шести раз меньше, чем рекомендованное эффективное количество замещающего фактора, например, доза от приблизительно 10 до приблизительно 30 МЕ/кг или от приблизительно 20 до приблизительно 30 МЕ/кг, например, приблизительно 10, 15, 20, 25 или 30 МЕ/кг. В одном варианте осуществления кровотечение представляет собой кровотечение средней тяжести. В другом варианте осуществления кровотечение представляет собой кровотечение большой тяжести
Шунтирующим средством может быть aPCC, а терапевтически эффективное количество шунтирующего средства, вводимое больному в способах согласно изобретению, составляет дозу, достаточную для образования тромбина и устранения кровотечения.
Например, терапевтически эффективное количество шунтирующего средства aPCC может быть меньше, чем приблизительно 100 Е/кг, или меньше, чем приблизительно 90 Е/кг, или меньше, чем приблизительно 80 Е/кг, или меньше, чем приблизительно 70 Е/кг, или меньше, чем приблизительно 60 Е/кг, или меньше, чем приблизительно 50 Е/кг, или меньше, чем приблизительно 40 Е/кг, или меньше, чем приблизительно 30 Е/кг, или меньше, чем приблизительно 20 Е/кг, или меньше, чем приблизительно 10 Е/кг. В одном варианте осуществления терапевтически эффективное количество aPCC, вводимое больному, от приблизительно двух раз до приблизительно трех раз меньше, чем рекомендованное эффективное количество замещающего фактора, например, доза от приблизительно 30 до приблизительно 50 Е/кг, например, приблизительно 30, 35, 40, 45 или 50 Е/кг. В одном варианте осуществления кровотечение представляет собой кровотечение средней тяжести. В другом варианте осуществления кровотечение представляет собой кровотечение большой тяжести.
Шунтирующим средством может быть rFVIIa, а терапевтически эффективное количество шунтирующего средства, вводимое больному в способах согласно изобретению, составляет дозу, достаточную для образования тромбина и устранения кровотечения.
Например, терапевтически эффективное количество шунтирующего средства rFVIIa меньше, чем приблизительно 120 мкг/кг, или меньше, чем приблизительно 110 мкг/кг, или меньше, чем приблизительно 100 мкг/кг, или меньше, чем приблизительно 90 мкг/кг, или меньше, чем приблизительно 80 мкг/кг, или меньше, чем приблизительно 70 мкг/кг, или меньше, чем приблизительно 60 мкг/кг, или меньше, чем приблизительно 50 мкг/кг, или меньше, чем приблизительно 40 мкг/кг, или меньше, чем приблизительно 30 мкг/кг, или меньше, чем приблизительно 20 мкг/кг. В одном варианте осуществления терапевтически эффективное количество rFVIIa, вводимое больному, приблизительно в два раза меньше, чем рекомендованное эффективное количество замещающего фактора, например, доза приблизительно 45 мкг/кг. В одном варианте осуществления кровотечение представляет собой кровотечение средней тяжести. В другом варианте осуществления кровотечение представляет собой кровотечение большой тяжести.
В некоторых вариантах осуществления средство РНКи вводят в фиксированной дозе от приблизительно 25 мг до приблизительно 100 мг, например, от приблизительно 25 мг до приблизительно 95 мг, от приблизительно 25 мг до приблизительно 90 мг, от приблизительно 25 мг до приблизительно 85 мг, от приблизительно 25 мг до приблизительно 80 мг, от приблизительно 25 мг до приблизительно 75 мг, от приблизительно 25 мг до приблизительно 70 мг, от приблизительно 25 мг до приблизительно 65 мг, от приблизительно 25 мг до приблизительно 60 мг, от приблизительно 25 мг до приблизительно 50 мг, от приблизительно 50 мг до приблизительно 100 мг, от приблизительно 50 мг до приблизительно 95 мг, от приблизительно 50 мг до приблизительно 90 мг, от приблизительно 50 мг до приблизительно 85 мг, от приблизительно 50 мг до приблизительно 80 мг, от приблизительно 30 мг до приблизительно 100 мг, от приблизительно 30 мг до приблизительно 90 мг, от приблизительно 30 мг до приблизительно 80 мг, от приблизительно 40 мг до приблизительно 100 мг, от приблизительно 40 мг до приблизительно 90 мг, от приблизительно 40 мг до приблизительно 80 мг, от приблизительно 60 мг до приблизительно 100 мг, от приблизительно 60 мг до приблизительно 90 мг, от приблизительно 25 мг до приблизительно 55 мг, от приблизительно 25 мг до приблизительно 65 мг, от приблизительно 30 мг до приблизительно 95 мг, от приблизительно 30 мг до приблизительно 85 мг, от приблизительно 30 мг до приблизительно 75 мг, от приблизительно 30 мг до приблизительно 65 мг, от приблизительно 30 мг до приблизительно 55 мг, от приблизительно 40 мг до приблизительно 95 мг, от приблизительно 40 мг до приблизительно 85 мг, от приблизительно 40 мг до приблизительно 75 мг, от приблизительно 40 мг до приблизительно 65 мг, от приблизительно 40 мг до приблизительно 55 мг или от приблизительно 45 мг до приблизительно 95 мг.
В некоторых вариантах осуществления средство РНКи вводят в фиксированной дозе приблизительно 25 мг, приблизительно 30 мг, приблизительно 35 мг, приблизительно 40 мг, приблизительно 45 мг, приблизительно 50 мг, приблизительно 55 мг, приблизительно 60 мг, приблизительно 65 мг, приблизительно 70 мг, приблизительно 75 мг, приблизительно 80 мг, приблизительно 85 мг, приблизительно 90 мг, приблизительно 95 мг или приблизительно 100 мг.
В одном варианте осуществления средство РНКи вводят больному в дозе, которая снижает активность Serpinc1 приблизительно на 75% или более
Соответственно, в одном аспекте в настоящем изобретении представлен способ лечения кровотечения у больного гемофилией без ингибиторов. Способ включает введение больному фиксированной дозы от приблизительно 30 мг до приблизительно 90 мг средства двухцепочечной рибонуклеиновой кислоты (РНКи), которая ингибирует экспрессию Serpinc1 (например, количества, которое снижает активность Serpinc1 у больного приблизительно на 75% или более), причем средство двухцепочечной РНКи содержит смысловую нить и антисмысловую нить, причем антисмысловая нить содержит область комплементарности к иРНК, кодирующей Serpinc1, которая содержит по меньшей мере 15 соседних нуклеотидов, отличающихся не более чем на 3 нуклеотида от нуклеотидной последовательности 5’-UUGAAGUAAAUGGUGUUAACCAG-3’ (SEQ ID NO: 15), причем по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити представляют собой модифицированные нуклеотиды, и при этом смысловая нить конъюгирована с лигандом, присоединенным на 3’-конце; и введение больному терапевтически эффективного количества замещающего фактора, причем эффективное количество замещающего фактора уменьшено по сравнению с рекомендованным эффективным количеством замещающего фактора (например, количество, достаточное для достижения пикового уровня фактора VIII в плазме, составляет приблизительно 10-100 МЕ/дл (например, доза меньше, чем приблизительно 200 МЕ/кг фактора VIII, например, доза от приблизительно 5 до приблизительно 20 МЕ/кг фактора VIII); или количество, достаточное для достижения пикового уровня фактора IX в плазме, составляет приблизительно 10-100 МЕ/дл (например, доза меньше, чем приблизительно 200 МЕ/кг фактора IX, например, доза от приблизительно 10 до приблизительно 30 МЕ/кг фактора IX)), за счет этого происходит лечение кровотечения у больного гемофилией без ингибиторов.
В другом аспекте в настоящем изобретении представлен способ лечения кровотечения у больного гемофилией с ингибиторами. Способы включают введение больному фиксированной дозы от приблизительно 30 мг до приблизительно 90 мг средства двухцепочечной рибонуклеиновой кислоты (РНКи), которая ингибирует экспрессию Serpinc1 (например, количества, которое снижает активность Serpinc1 у больного приблизительно на 75% или более), причем средство двухцепочечной РНКи содержит смысловую нить и антисмысловую нить, причем антисмысловая нить содержит область комплементарности к иРНК, кодирующей Serpinc1, которая содержит по меньшей мере 15 соседних нуклеотидов, отличающихся не более чем на 3 нуклеотида от нуклеотидной последовательности 5’-UUGAAGUAAAUGGUGUUAACCAG-3’ (SEQ ID NO: 15), причем по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити представляют собой модифицированные нуклеотиды, и при этом смысловая нить конъюгирована с лигандом, присоединенным на 3’-конце; и введение больному терапевтически эффективного количества шунтирующего средства, причем эффективное количество шунтирующего средства уменьшено по сравнению с рекомендованным эффективным количеством шунтирующего средства (например, количество, достаточное для образования тромбина и устранения кровотечения, например, доза меньше, чем приблизительно 100 Е/кг aPCC (например, доза от приблизительно 30 до 50 Е/кг PCC); доза меньше, чем приблизительно 120 мкг/кг rFVIIa (например, доза приблизительно 45 мкг/кг rFVIIa)), за счет этого происходит лечение кровотечения у больного гемофилией с ингибиторами.
В другом аспекте в настоящем изобретении представлен способ лечения кровотечения у больного гемофилией без ингибиторов. Способ включает введение больному фиксированной дозы от приблизительно 40 мг до приблизительно 90 мг средства двухцепочечной рибонуклеиновой кислоты (РНКи), которая ингибирует экспрессию Serpinc1 (например, количество, которое снижает активность Serpinc1 у больного приблизительно на 75% или более), причем средство двухцепочечной РНКи содержит смысловую нить и антисмысловую нить, причем антисмысловая нить содержит область комплементарности к иРНК, кодирующей Serpinc1, которая содержит по меньшей мере 15 соседних нуклеотидов, отличающихся не более чем на 3 нуклеотида от нуклеотидной последовательности 5’-UUGAAGUAAAUGGUGUUAACCAG-3’ (SEQ ID NO: 15), причем по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити представляют собой модифицированные нуклеотиды, и при этом смысловая нить конъюгирована с лигандом, присоединенным на 3’-конце; и введение больному терапевтически эффективного количества замещающего фактора, причем эффективное количество замещающего фактора уменьшено по сравнению с рекомендованным эффективным количеством замещающего фактора (например, количество, достаточное для достижения пикового уровня фактора VIII в плазме, составляет приблизительно 10-100 МЕ/дл (например, доза меньше, чем приблизительно 200 МЕ/кг фактора VIII, например, доза от приблизительно 5 до приблизительно 20 МЕ/кг фактора VIII); или количество, достаточное для достижения пикового уровня фактора IX в плазме, составляет приблизительно 10-100 МЕ/дл (например, доза меньше, чем приблизительно 200 МЕ/кг фактора IX, например, доза от приблизительно 10 до приблизительно 30 МЕ/кг фактора IX)), за счет этого происходит лечение кровотечения у больного гемофилией без ингибиторов.
В другом аспекте в настоящем изобретении представлен способ лечения кровотечения у больного гемофилией с ингибиторами. Способы включают введение больному фиксированной дозы от приблизительно 40 мг до приблизительно 90 мг средства двухцепочечной рибонуклеиновой кислоты (РНКи), которая ингибирует экспрессию Serpinc1 (например, количество, которое снижает активность Serpinc1 у больного приблизительно на 75% или более), причем средство двухцепочечной РНКи содержит смысловую нить и антисмысловую нить, причем антисмысловая нить содержит область комплементарности к иРНК, кодирующей Serpinc1, которая содержит по меньшей мере 15 соседних нуклеотидов, отличающихся не более чем на 3 нуклеотида от нуклеотидной последовательности 5’-UUGAAGUAAAUGGUGUUAACCAG-3’ (SEQ ID NO: 15), причем по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити представляют собой модифицированные нуклеотиды, и при этом смысловая нить конъюгирована с лигандом, присоединенным на 3’-конце; и введение больному терапевтически эффективного количества шунтирующего средства, причем эффективное количество шунтирующего средства уменьшено по сравнению с рекомендованным эффективным количеством шунтирующего средства (например, количество, достаточное для образования тромбина и устранения кровотечения, например, доза меньше, чем приблизительно 100 Е/кг aPCC (например, доза от приблизительно 30 до 50 Е/кг PCC); доза меньше, чем приблизительно 120 мкг/кг rFVIIa (например, доза приблизительно 45 мкг/кг rFVIIa)), за счет этого происходит лечение кровотечения у больного гемофилией с ингибиторами.
В одном аспекте в настоящем изобретении представлено средство двухцепочечной рибонуклеиновой кислоты (РНКи), которое ингибирует экспрессию Serpinc1, подходящее для введения больному в фиксированной дозе от приблизительно 30 мг до 90 мг (например, в количестве, которое снижает активность Serpinc1 у больного приблизительно на 75% или более); и замещающий фактор, подходящий для введения больному в дозе, уменьшенной по сравнению с рекомендованным эффективным количеством замещающего фактора (например, количество, достаточное для достижения пикового уровня фактора VIII в плазме, составляет приблизительно 10-100 МЕ/дл (например, доза меньше, чем приблизительно 200 МЕ/кг фактора VIII, например, доза от приблизительно 5 до приблизительно 20 МЕ/кг фактора VIII); или количество, достаточное для достижения пикового уровня фактора IX в плазме, составляет приблизительно 10-100 МЕ/дл (например, доза меньше, чем приблизительно 200 МЕ/кг фактора IX, например, доза от приблизительно 10 до приблизительно 30 МЕ/кг фактора IX)) для применения в способе лечения кровотечения у больного гемофилией, например, гемофилией A, гемофилией B или гемофилией C без ингибиторов. Средство РНКи содержит смысловую нить и антисмысловую нить, причем антисмысловая нить содержит область комплементарности к иРНК, кодирующей Serpinc1, которая содержит по меньшей мере 15 соседних нуклеотидов, отличающихся не более чем на 3 нуклеотида от нуклеотидной последовательности 5’-UUGAAGUAAAUGGUGUUAACCAG-3’ (SEQ ID NO: 15), причем по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити представляют собой модифицированные нуклеотиды, и при этом смысловая нить конъюгирована с лигандом, присоединенным на 3’-конце.
В другом аспекте в настоящем изобретении представлено средство двухцепочечной рибонуклеиновой кислоты (РНКи), которое ингибирует экспрессию Serpinc1, подходящее для введения больному в фиксированной дозе от приблизительно 30 мг до 90 мг (например, в количестве, которое снижает активность Serpinc1 у больного приблизительно на 75% или более); и шунтирующее средство, подходящее для введения больному в дозе, уменьшенной по сравнению с рекомендованным эффективным количеством шунтирующего средства (например, количество, достаточное для образования тромбина и устранения кровотечения, например, доза меньше, чем приблизительно 100 Е/кг aPCC (например, доза от приблизительно 30 до 50 Е/кг PCC); доза меньше, чем приблизительно 120 мкг/кг rFVIIa (например, доза приблизительно 45 мкг/кг rFVIIa)) для применения в способе лечения кровотечения у больного гемофилией, например, гемофилией A, гемофилией B или гемофилией C с ингибиторами. Средство РНКи содержит смысловую нить и антисмысловую нить, причем антисмысловая нить содержит область комплементарности к иРНК, кодирующей Serpinc1, которая содержит по меньшей мере 15 соседних нуклеотидов, отличающихся не более чем на 3 нуклеотида от нуклеотидной последовательности 5’-UUGAAGUAAAUGGUGUUAACCAG-3’ (SEQ ID NO: 15), причем по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити представляют собой модифицированные нуклеотиды, и при этом смысловая нить конъюгирована с лигандом, присоединенным на 3’-конце.
В одном аспекте в настоящем изобретении представлено средство двухцепочечной рибонуклеиновой кислоты (РНКи), которое ингибирует экспрессию Serpinc1, подходящее для введения больному в фиксированной дозе от приблизительно 40 мг до 90 мг (например, количество, которое снижает активность Serpinc1 у больного приблизительно на 75% или более); и замещающий фактор, подходящий для введения больному в дозе, уменьшенной по сравнению с рекомендованным эффективным количеством замещающего фактора (например, количество, достаточное для достижения пикового уровня фактора VIII в плазме, составляет приблизительно 10-100 МЕ/дл (например, доза меньше, чем приблизительно 200 МЕ/кг фактора VIII, например, доза от приблизительно 5 до приблизительно 20 МЕ/кг фактора VIII); или количество, достаточное для достижения пикового уровня фактора IX в плазме, составляет приблизительно 10-100 МЕ/дл (например, доза меньше, чем приблизительно 200 МЕ/кг фактора IX, например, доза от приблизительно 10 до приблизительно 30 МЕ/кг фактора IX)) для применения в способе лечения кровотечения у больного гемофилией, например, гемофилией A, гемофилией B или гемофилией C без ингибиторов. Средство РНКи содержит смысловую нить и антисмысловую нить, причем антисмысловая нить содержит область комплементарности к иРНК, кодирующей Serpinc1, которая содержит по меньшей мере 15 соседних нуклеотидов, отличающихся не более чем на 3 нуклеотида от нуклеотидной последовательности 5’-UUGAAGUAAAUGGUGUUAACCAG-3’ (SEQ ID NO: 15), причем по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити представляют собой модифицированные нуклеотиды, и при этом смысловая нить конъюгирована с лигандом, присоединенным на 3’-конце.
В другом аспекте в настоящем изобретении представлено средство двухцепочечной рибонуклеиновой кислоты (РНКи), которое ингибирует экспрессию Serpinc1, подходящее для введения больному в фиксированной дозе от приблизительно 40 мг до 90 мг (например, количество, которое снижает активность Serpinc1 у больного приблизительно на 75% или более); и шунтирующее средство, подходящее для введения больному в дозе, уменьшенной по сравнению с рекомендованным эффективным количеством шунтирующего средства (например, количество, достаточное для образования тромбина и устранения кровотечения, например, доза меньше, чем приблизительно 100 Е/кг aPCC (например, доза от приблизительно 30 до 50 Е/кг PCC); доза меньше, чем приблизительно 120 мкг/кг rFVIIa (например, доза приблизительно 45 мкг/кг rFVIIa)) для применения в способе лечения кровотечения у больного гемофилией, например, гемофилией A, гемофилией B или гемофилией C с ингибиторами. Средство РНКи содержит смысловую нить и антисмысловую нить, причем антисмысловая нить содержит область комплементарности к иРНК, кодирующей Serpinc1, которая содержит по меньшей мере 15 соседних нуклеотидов, отличающихся не более чем на 3 нуклеотида от нуклеотидной последовательности 5’-UUGAAGUAAAUGGUGUUAACCAG-3’ (SEQ ID NO: 15), причем по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити представляют собой модифицированные нуклеотиды, и при этом смысловая нить конъюгирована с лигандом, присоединенным на 3’-конце.
В вышеизложенных способах и вариантах применения в одном варианте осуществления область комплементарности состоит из нуклеотидной последовательности 5’-UUGAAGUAAAUGGUGUUAACCAG-3’(SEQ ID NO: 15).
В одном варианте осуществления средство двухцепочечной РНКи содержит смысловую нить, содержащую нуклеотидную последовательность 5’-GGUUAACACCAUUUACUUCAA-3’(SEQ ID NO: 16), и при этом антисмысловая нить содержит нуклеотидную последовательность 5’-UUGAAGUAAAUGGUGUUAACCAG-3’(SEQ ID NO: 15).
В одном варианте осуществления смысловая нить содержит 5’-GfsgsUfuAfaCfaCfCfAfuUfuAfcUfuCfaAf-3’ (SEQ ID NO:13), а антисмысловая нить содержит 5’-usUfsgAfaGfuAfaAfuggUfgUfuAfaCfcsasg-3’ (SEQ ID NO:14), причем a, c, g и u представляют 2′-O-метил (2′-OMe) A, C, G или U; Af, Cf, Gf или Uf представляют 2′-фтор A, C, G или U; а s представляет фосфоротиоатную связь.
В одном варианте осуществления смысловая нить содержит 5’-GfsgsUfuAfaCfaCfCfAfuUfuAfcUfuCfaAf-3’ (SEQ ID NO:13), а антисмысловая нить содержит 5’-usUfsgAfaGfuAfaAfuggUfgUfuAfaCfcsasg-3’ (SEQ ID NO:14), причем a, c, g и u представляют 2′-O-метил (2′-OMe) A, C, G или U; Af, Cf, Gf или Uf представляют 2′-фтор A, C, G или U; а s представляет фосфоротиоатную связь; и при этом смысловая нить конъюгирована с лигандом, как показано на следующей схеме
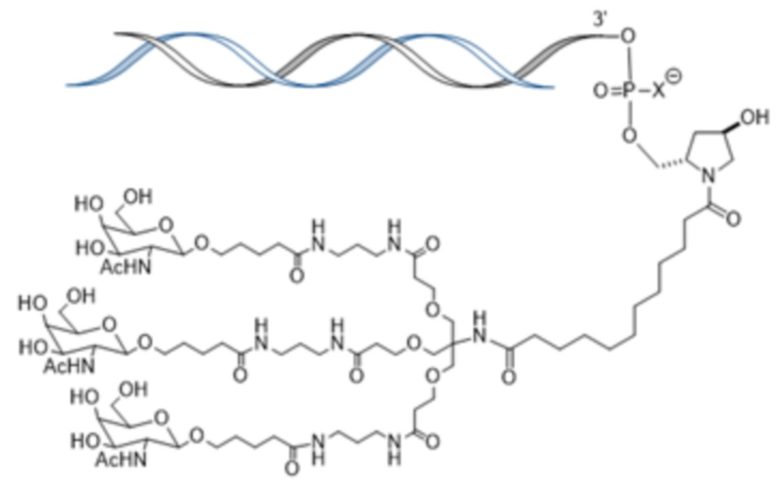 ,
,
где X представляет O или S.
В одном варианте осуществления средство вводят в виде фармацевтической композиции. В одном варианте осуществления средство РНКи вводят в незабуференном растворе, таком как физиологический раствор или вода.
В другом варианте осуществления средство РНКи вводят с буферным раствором, таким как буферный раствор, содержащий ацетат, цитрат, проламин, карбонат или фосфат или любые их комбинации. В одном варианте осуществления буферным раствором является забуференный фосфатом физиологический раствор (PBS).
В одном аспекте в настоящем изобретении представлено средство двухцепочечной рибонуклеиновой кислоты (РНКи), которое ингибирует экспрессию Serpinc1, подходящее для введения больному в фиксированной дозе приблизительно 80 мг (например, в количестве, которое снижает активность Serpinc1 у больного приблизительно на 75% или более); и замещающий фактор, подходящий для введения больному в дозе, уменьшенной по сравнению с рекомендованным эффективным количеством замещающего фактора (например, количество, достаточное для достижения пикового уровня фактора VIII в плазме, составляет приблизительно 10-100 МЕ/дл (например, доза меньше, чем приблизительно 200 МЕ/кг фактора VIII, например, доза от приблизительно 5 до приблизительно 20 МЕ/кг фактора VIII); или количество, достаточное для достижения пикового уровня фактора IX в плазме, составляет приблизительно 10-100 МЕ/дл (например, доза меньше, чем приблизительно 200 МЕ/кг фактора IX, например, доза от приблизительно 10 до приблизительно 30 МЕ/кг фактора IX)) для применения в способе лечения кровотечения у больного гемофилией, например, гемофилией A, гемофилией B или гемофилией C без ингибиторов. Средство РНКи содержит смысловую нить и антисмысловую нить, причем смысловая нить содержит 5’-GfsgsUfuAfaCfaCfCfAfuUfuAfcUfuCfaAf-3’ (SEQ ID NO:13), а антисмысловая нить содержит 5’-usUfsgAfaGfuAfaAfuggUfgUfuAfaCfcsasg-3’ (SEQ ID NO:14), причем a, c, g и u представляют 2′-O-метил (2′-OMe) A, C, G или U; Af, Cf, Gf или Uf представляют 2′-фтор A, C, G или U; а s представляет фосфоротиоатную связь; и при этом 3’-конец смысловой нити конъюгирован с лигандом, как показано на следующей схеме
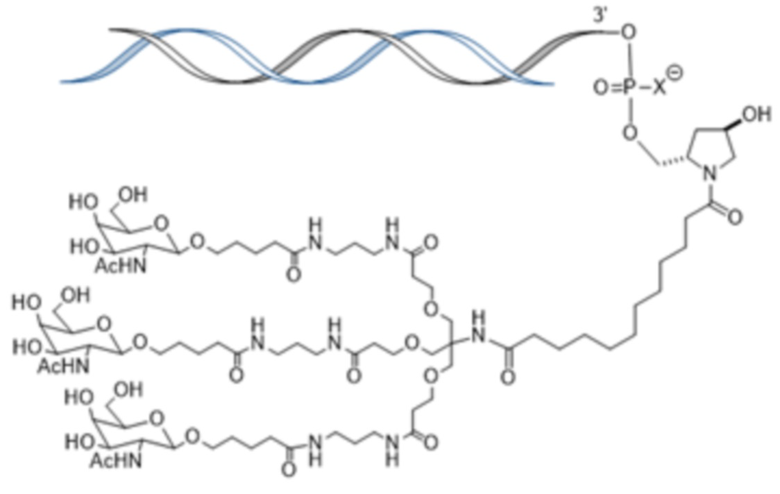 ,
,
где X представляет O или S.
В другом аспекте в настоящем изобретении представлено средство двухцепочечной рибонуклеиновой кислоты (РНКи), которое ингибирует экспрессию Serpinc1, подходящее для введения больному в фиксированной дозе приблизительно 80 мг (например, в количестве, которое снижает активность Serpinc1 у больного приблизительно на 75% или более); и шунтирующее средство, подходящее для введения больному в дозе, уменьшенной по сравнению с рекомендованным эффективным количеством шунтирующего средства (например, количество, достаточное для образования тромбина и устранения кровотечения, например, доза меньше, чем приблизительно 100 Е/кг aPCC (например, доза от приблизительно 30 до 50 Е/кг PCC); доза меньше, чем приблизительно 120 мкг/кг rFVIIa (например, доза приблизительно 45 мкг/кг rFVIIa)) для применения в способе лечения кровотечения у больного гемофилией, например, гемофилией A, гемофилией B или гемофилией C с ингибиторами. Средство РНКи содержит смысловую нить и антисмысловую нить, причем смысловая нить содержит 5’-GfsgsUfuAfaCfaCfCfAfuUfuAfcUfuCfaAf-3’ (SEQ ID NO:13), а антисмысловая нить содержит 5’-usUfsgAfaGfuAfaAfuggUfgUfuAfaCfcsasg-3’ (SEQ ID NO:14), причем a, c, g и u представляют 2′-O-метил (2′-OMe) A, C, G или U; Af, Cf, Gf или Uf представляют 2′-фтор A, C, G или U; а s представляет фосфоротиоатную связь; и при этом 3’-конец смысловой нити конъюгирован с лигандом, как показано на следующей схеме
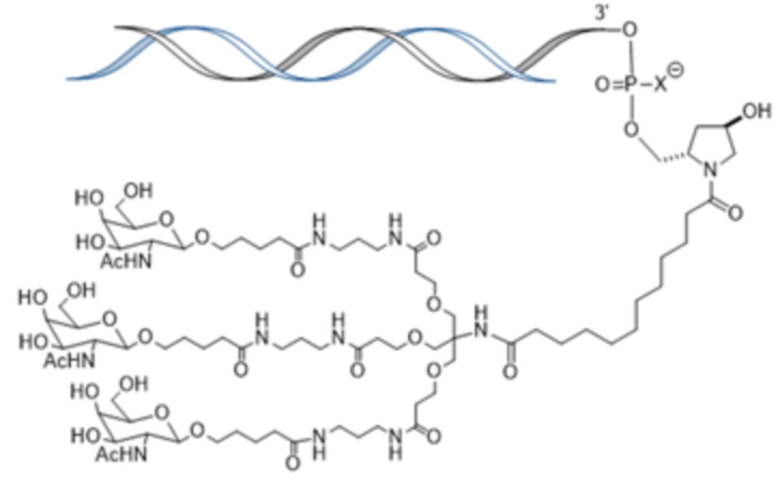 ,
,
где X представляет O или S.
В одном варианте осуществления фиксированная доза средства РНКи подходит для подкожного введения.
В одном варианте осуществления фиксированная доза средства РНКи подходит для введения больному один раз в месяц.
В настоящем изобретении также представлены способы профилактики по меньшей мере одного симптома у больного, имеющего нарушение, который получил бы пользу от уменьшения экспрессии Serpinc1, например, нарушение свертываемости, например, гемофилию. Способы включают введение больному профилактически эффективной дозы, например, количества, которое снижает активность Serpinc1 у больного приблизительно на 75% или более, например, фиксированной дозы от приблизительно 25 мг до приблизительно 100 мг средства иРНК, например, дцРНК, согласно изобретению (например, фармацевтической композиции, содержащей дцРНК согласно изобретению), с профилактикой за счет этого по меньшей мере одного симптома у больного, имеющего нарушение, который получил бы пользу от уменьшения экспрессии Serpinc1. В одном варианте осуществления способы включают введение больному профилактически эффективной дозы, например, фиксированной дозы приблизительно 50 мг, средства иРНК, например, дцРНК, согласно изобретению (например, фармацевтической композиции, содержащей дцРНК согласно изобретению), с профилактикой за счет этого по меньшей мере одного симптома у больного, имеющего нарушение, который получил бы пользу от уменьшения экспрессии Serpinc1. В другом варианте осуществления способы включают введение больному профилактически эффективной дозы, например, фиксированной дозы приблизительно 80 мг, средства иРНК, например, дцРНК, согласно изобретению (например, фармацевтической композиции, содержащей дцРНК согласно изобретению), с профилактикой за счет этого по меньшей мере одного симптома у больного, имеющего нарушение, который получил бы пользу от уменьшения экспрессии Serpinc1.
В другом аспекте в настоящем изобретении представлены способы лечения больного, имеющего нарушение, который получил бы пользу от уменьшения экспрессии Serpinc1, например, нарушение свертываемости, например, гемофилию, которые включают введение больному, например, человеку, терапевтически эффективной дозы, например, количества, которое снижает активность Serpinc1 у больного приблизительно на 75% или более, например, фиксированной дозы от приблизительно 25 мг до приблизительно 100 мг средства иРНК, нацеленного на ген Serpinc1, или фармацевтической композиции, содержащей средство иРНК, нацеленное на ген Serpinc1, за счет этого происходит лечение больного, имеющего нарушение, который получил бы пользу от уменьшения экспрессии Serpinc1. В одном варианте осуществления способы включают введение больному терапевтически эффективной дозы, например, фиксированной дозы приблизительно 50 мг, средства иРНК, например, дцРНК, согласно изобретению (например, фармацевтической композиции, содержащей дцРНК согласно изобретению), за счет этого происходит лечение больного, имеющего нарушение, который получил бы пользу от уменьшения экспрессии Serpinc1. В другом варианте осуществления способы включают введение больному терапевтически эффективной дозы, например, фиксированной дозы приблизительно 80 мг, средства иРНК, например, дцРНК, согласно изобретению (например, фармацевтической композиции, содержащей дцРНК согласно изобретению), за счет этого происходит лечение больного, имеющего нарушение, который получил бы пользу от уменьшения экспрессии Serpinc1.
В другом аспекте в изобретении представлены варианты применения профилактически эффективной дозы, например, количества, которое снижает активность Serpinc1 у больного приблизительно на 75% или более, например, фиксированной дозы от приблизительно 25 мг до приблизительно 100 мг, иРНК, например, дцРНК, согласно изобретению для профилактики по меньшей мере одного симптома у больного с нарушением, который получил бы пользу от уменьшения и/или ингибирования экспрессии Serpinc1, таким как нарушение свертываемости, например, гемофилия. В одном варианте осуществления в изобретении представлены варианты применения профилактически эффективной дозы, например, фиксированной дозы приблизительно 50 мг, иРНК, например, дцРНК, согласно изобретению для профилактики по меньшей мере одного симптома у больного с нарушением, который получил бы пользу от уменьшения и/или ингибирования экспрессии Serpinc1, таким как нарушение свертываемости, например, гемофилия. В другом варианте осуществления в изобретении представлены варианты применения профилактически эффективной дозы, например, фиксированной дозы приблизительно 80 мг, иРНК, например, дцРНК, согласно изобретению для профилактики по меньшей мере одного симптома у больного с нарушением, который получил бы пользу от уменьшения и/или ингибирования экспрессии Serpinc1, таким как нарушение свертываемости, например, гемофилия.
В дополнительном аспекте в настоящем изобретении представлены варианты применения профилактически эффективной дозы, например, количества, которое снижает активность Serpinc1 у больного приблизительно на 75% или более, например, фиксированной дозы от приблизительно 25 мг до приблизительно 100 мг средства иРНК согласно изобретению при изготовлении лекарственного средства для профилактики по меньшей мере одного симптома у больного с нарушением, который получил бы пользу от уменьшения и/или ингибирования экспрессии Serpinc1, таким как нарушение свертываемости, например, гемофилия. В одном варианте осуществления в настоящем изобретении представлены варианты применения профилактически эффективной дозы, например, фиксированной дозы приблизительно 50 мг средства иРНК согласно изобретению при изготовлении лекарственного средства для профилактики по меньшей мере одного симптома у больного с нарушением, который получил бы пользу от уменьшения и/или ингибирования экспрессии Serpinc1, таким как нарушение свертываемости, например, гемофилия. В другом варианте осуществления в настоящем изобретении представлены варианты применения профилактически эффективной дозы, например, фиксированной дозы приблизительно 80 мг средства иРНК согласно изобретению при изготовлении лекарственного средства для профилактики по меньшей мере одного симптома у больного с нарушением, который получил бы пользу от уменьшения и/или ингибирования экспрессии Serpinc1, таким как нарушение свертываемости, например, гемофилия.
В другом аспекте в настоящем изобретении представлены варианты применения терапевтически эффективной дозы, например, количества, которое снижает активность Serpinc1 у больного приблизительно на 75% или более, например, фиксированной дозы от приблизительно 25 мг до приблизительно 100 мг средства иРНК согласно изобретению для лечения больного, например, больного, который получил бы пользу от уменьшения и/или ингибирования экспрессии Serpinc1. В одном варианте осуществления в настоящем изобретении представлены варианты применения терапевтически эффективной дозы, например, фиксированной дозы приблизительно 50 мг, средства иРНК согласно изобретению для лечения больного, например, больного, который получил бы пользу от уменьшения и/или ингибирования экспрессии Serpinc1. В другом варианте осуществления в настоящем изобретении представлены варианты применения терапевтически эффективной дозы, например, фиксированной дозы приблизительно 80 мг, средства иРНК согласно изобретению для лечения больного, например, больного, который получил бы пользу от уменьшения и/или ингибирования экспрессии Serpinc1.
В еще одном аспекте в настоящем изобретении представлено использование средства иРНК, например, дцРНК, согласно изобретению, нацеленного на ген Serpinc1, или фармацевтической композиции, содержащей терапевтически эффективную дозу, например, количество, которое снижает активность Serpinc1 у больного приблизительно на 75% или более, например, фиксированную дозу от приблизительно 25 мг до приблизительно 100 мг средства иРНК, нацеленного на ген Serpinc1, при изготовлении лекарственного средства для лечения больного, например, больного, который получил бы пользу от уменьшения и/или ингибирования экспрессии Serpinc1, такого как больной с нарушением свертываемости, например, гемофилию. В одном варианте осуществления в настоящем изобретении представлено использование средства иРНК, например, дцРНК, согласно изобретению, нацеленного на ген Serpinc1, или фармацевтической композиции, содержащей терапевтически эффективную дозу, например, фиксированную дозу приблизительно 50 мг, средства иРНК, нацеленного на ген Serpinc1, при изготовлении лекарственного средства для лечения больного, например, больного, который получил бы пользу от уменьшения и/или ингибирования экспрессии Serpinc1, такого как больной с нарушением свертываемости, например, гемофилию. В другом варианте осуществления в настоящем изобретении представлено использование средства иРНК, например, дцРНК, согласно изобретению, нацеленного на ген Serpinc1, или фармацевтической композиции, содержащей терапевтически эффективную дозу, например, фиксированную дозу приблизительно 80 мг, средства иРНК, нацеленного на ген Serpinc1, при изготовлении лекарственного средства для лечения больного, например, больного, который получил бы пользу от уменьшения и/или ингибирования экспрессии Serpinc1, такого как больной с нарушением свертываемости, например, гемофилию.
В некоторых вариантах осуществления изобретения, например, когда средство двухцепочечной РНКи содержит смысловую нить и антисмысловую нить, причем антисмысловая нить содержит область комплементарности к иРНК, кодирующей Serpinc1, которая содержит по меньшей мере 15 соседних нуклеотидов, отличающихся не более чем на 3 нуклеотида от нуклеотидной последовательности 5’-UUGAAGUAAAUGGUGUUAACCAG-3’ (SEQ ID NO: 15), причем по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити представляют собой модифицированные нуклеотиды, и при этом смысловая нить конъюгирована с лигандом, присоединенным на 3’-конце, такое средство вводят в фиксированной дозе от приблизительно 25 мг до приблизительно 100 мг, например, в фиксированной дозе приблизительно 25 мг; или в фиксированной дозе приблизительно 50 мг; или в фиксированной дозе приблизительно 80 мг; или в фиксированной дозе приблизительно 100 мг. В одном варианте осуществления фиксированная доза составляет 50 мг. В другом варианте осуществления фиксированная доза составляет 80 мг.
Соответственно, в одном аспекте в изобретении представлены способы профилактики по меньшей мере одного симптома у больного, имеющего нарушение, который получил бы пользу от уменьшения экспрессии Serpinc1, например, нарушение свертываемости, например, гемофилию. Способы включают введение больному профилактически эффективной дозы, например, количества, которое снижает активность Serpinc1 у больного приблизительно на 75% или более, например, фиксированной дозы от приблизительно 25 мг до приблизительно 100 мг средства двухцепочечной рибонуклеиновой кислоты (РНКи), содержащей смысловую нить и антисмысловую нить, причем антисмысловая нить содержит область комплементарности к иРНК, кодирующей Serpinc1, которая содержит по меньшей мере 15 соседних нуклеотидов, отличающихся не более чем на 3 нуклеотида от нуклеотидной последовательности 5’-UUGAAGUAAAUGGUGUUAACCAG-3’ (SEQ ID NO: 15), причем по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити представляют собой модифицированные нуклеотиды, и при этом смысловая нить конъюгирована с лигандом, присоединенным на 3’-конце, (например, фармацевтической композиции, содержащей средство РНКи), с профилактикой за счет этого по меньшей мере одного симптома у больного, имеющего нарушение, который получил бы пользу от уменьшения экспрессии Serpinc1. В одном варианте осуществления фиксированная доза составляет 50 мг. В другом варианте осуществления фиксированная доза составляет 80 мг.
В другом аспекте в настоящем изобретении представлены способы лечения больного, имеющего нарушение, который получил бы пользу от уменьшения экспрессии Serpinc1, например, нарушение свертываемости, например, гемофилию, которые включают введение больному, например, человеку, терапевтически эффективной дозы, например, количества, которое снижает активность Serpinc1 у больного приблизительно на 75% или более, например, фиксированной дозы от приблизительно 25 мг до приблизительно 100 мг средства двухцепочечной рибонуклеиновой кислоты (РНКи), содержащей смысловую нить и антисмысловую нить, причем антисмысловая нить содержит область комплементарности к иРНК, кодирующей Serpinc1, которая содержит по меньшей мере 15 соседних нуклеотидов, отличающихся не более чем на 3 нуклеотида от нуклеотидной последовательности 5’-UUGAAGUAAAUGGUGUUAACCAG-3’ (SEQ ID NO: 15), причем по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити представляют собой модифицированные нуклеотиды, и при этом смысловая нить конъюгирована с лигандом, присоединенным на 3’-конце, или фармацевтической композиции, содержащей средство иРНК, нацеленное на ген Serpinc1, за счет этого происходит лечение больного, имеющего нарушение, который получил бы пользу от уменьшения экспрессии Serpinc1. В одном варианте осуществления фиксированная доза составляет 50 мг. В другом варианте осуществления фиксированная доза составляет 80 мг.
В другом аспекте в изобретении представлены варианты применения профилактически эффективной дозы, например, количества, которое снижает активность Serpinc1 у больного приблизительно на 75% или более, например, фиксированной дозы от приблизительно 25 мг до приблизительно 100 мг средства двухцепочечной рибонуклеиновой кислоты (РНКи), содержащей смысловую нить и антисмысловую нить, причем антисмысловая нить содержит область комплементарности к иРНК, кодирующей Serpinc1, которая содержит по меньшей мере 15 соседних нуклеотидов, отличающихся не более чем на 3 нуклеотида от нуклеотидной последовательности 5’-UUGAAGUAAAUGGUGUUAACCAG-3’ (SEQ ID NO: 15), причем по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити представляют собой модифицированные нуклеотиды, и при этом смысловая нить конъюгирована с лигандом, присоединенным на 3’-конце, для профилактики по меньшей мере одного симптома у больного с нарушением, который получил бы пользу от уменьшения и/или ингибирования экспрессии Serpinc1, таким как нарушение свертываемости, например, гемофилия. В одном варианте осуществления фиксированная доза составляет 50 мг. В другом варианте осуществления фиксированная доза составляет 80 мг.
В дополнительном аспекте в настоящем изобретении представлены варианты применения профилактически эффективной дозы, например, количества, которое снижает активность Serpinc1 у больного приблизительно на 75% или более, например, фиксированной дозы от приблизительно 25 мг до приблизительно 100 мг средства двухцепочечной рибонуклеиновой кислоты (РНКи), содержащей смысловую нить и антисмысловую нить, причем антисмысловая нить содержит область комплементарности к иРНК, кодирующей Serpinc1, которая содержит по меньшей мере 15 соседних нуклеотидов, отличающихся не более чем на 3 нуклеотида от нуклеотидной последовательности 5’-UUGAAGUAAAUGGUGUUAACCAG-3’ (SEQ ID NO: 15), причем по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити представляют собой модифицированные нуклеотиды, и при этом смысловая нить конъюгирована с лигандом, присоединенным на 3’-конце, при изготовлении лекарственного средства для профилактики по меньшей мере одного симптома у больного с нарушением, который получил бы пользу от уменьшения и/или ингибирования экспрессии Serpinc1, таким как нарушение свертываемости, например, гемофилия. В одном варианте осуществления фиксированная доза составляет 50 мг. В другом варианте осуществления фиксированная доза составляет 80 мг.
В другом аспекте в настоящем изобретении представлены варианты применения терапевтически эффективной дозы, например, количества, которое снижает активность Serpinc1 у больного приблизительно на 75% или более, например, фиксированной дозы от приблизительно 25 мг до приблизительно 100 мг средства двухцепочечной рибонуклеиновой кислоты (РНКи), содержащей смысловую нить и антисмысловую нить, причем антисмысловая нить содержит область комплементарности к иРНК, кодирующей Serpinc1, которая содержит по меньшей мере 15 соседних нуклеотидов, отличающихся не более чем на 3 нуклеотида от нуклеотидной последовательности 5’-UUGAAGUAAAUGGUGUUAACCAG-3’ (SEQ ID NO: 15), причем по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити представляют собой модифицированные нуклеотиды, и при этом смысловая нить конъюгирована с лигандом, присоединенным на 3’-конце, для лечения больного, например, больного, который получил бы пользу от уменьшения и/или ингибирования экспрессии Serpinc1. В одном варианте осуществления фиксированная доза составляет 50 мг. В другом варианте осуществления фиксированная доза составляет 80 мг.
В еще одном аспекте в настоящем изобретении представлено использование средства иРНК, например, дцРНК, согласно изобретению, нацеленного на ген Serpinc1, или фармацевтической композиции, содержащей терапевтически эффективную дозу, например, количество, которое снижает активность Serpinc1 у больного приблизительно на 75% или более, например, фиксированную дозу от приблизительно 25 мг до приблизительно 100 мг средства двухцепочечной рибонуклеиновой кислоты (РНКи), содержащей смысловую нить и антисмысловую нить, причем антисмысловая нить содержит область комплементарности к иРНК, кодирующей Serpinc1, которая содержит по меньшей мере 15 соседних нуклеотидов, отличающихся не более чем на 3 нуклеотида от нуклеотидной последовательности 5’-UUGAAGUAAAUGGUGUUAACCAG-3’ (SEQ ID NO: 15), причем по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити представляют собой модифицированные нуклеотиды, и при этом смысловая нить конъюгирована с лигандом, присоединенным на 3’-конце, при изготовлении лекарственного средства для лечения больного, например, больного, который получил бы пользу от уменьшения и/или ингибирования экспрессии Serpinc1, такого как больной с нарушением свертываемости, например, гемофилию. В одном варианте осуществления фиксированная доза составляет 50 мг. В другом варианте осуществления фиксированная доза составляет 80 мг.
Способы и варианты применения изобретения включают введение композиции, описанной в данном документе, таким образом, чтобы экспрессия гена-мишени Serpinc1 уменьшалась, например, в течение приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79 или приблизительно 80 дней. В одном варианте осуществления экспрессия гена-мишени Serpinc1 уменьшается в течение длительного срока, например, по меньшей мере приблизительно семи дней или более, например, приблизительно одной недели, двух недель, трех недель, приблизительно четырех недель, приблизительно 5 недель, приблизительно 6 недель, приблизительно 2 месяцей, приблизительно квартала или дольше.
Уменьшение экспрессии гена можно оценить с помощью любых способов, известных в данной области. Например, уменьшение экспрессии Serpinc1 можно определять путем определения уровня экспрессии иРНК Serpinc1 с использованием способов, рутинных для специалиста в данной области, например, Northern blotting, qRT-PCR, путем определения уровня белка Serpinc1 с использованием способов, рутинных для специалиста в данной области, таких как Western blotting, иммунологические методы и/или путем определения биологической активности Serpinc1, например, влияния одной или более молекул, связанных с клеточным механизмом свертывания крови (или самим свертыванием крови в условиях in vivo). В одном варианте осуществления для оценки экспрессии Serpinc1 определяют время образования тромбина, время образования сгустков и/или время свертывания с использованием, например, тромбоэластометрического анализа ROTEM® цельной крови.
Введение дцРНК согласно способам и вариантам применения изобретения может приводить у пациента со связанным с Serpinc1 заболеванием к уменьшению тяжести, признаков, симптомов и/или маркеров таких заболеваний или нарушений. Под «уменьшением» в этом контексте подразумевают статистически значимое уменьшение такого уровня. Уменьшение может составлять, например, по меньшей мере приблизительно 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или приблизительно 100%.
Эффективность лечения или предотвращения заболевания можно оценить, например, путем измерения прогрессирования заболевания, ремиссии заболевания, тяжести симптомов, частоты кровотечений, уменьшения боли, качества жизни, дозы лекарственного препарата, необходимого для поддержания эффекта лечения, уровня маркера заболевания или любого другого измеряемого параметра, подходящего для данного заболевания, которое лечат или профилактику которого проводят. Специалист в данной области имеет все возможности отслеживать эффективность лечения или предотвращения путем измерения любого одного из таких параметров или любой комбинации параметров. Например, эффективность лечения нарушения свертываемости можно оценивать, например, путем периодического контроля уровней тромбина:антитромбина. Сравнение более поздних показателей с первоначальными показателями дает врачу указание, является ли лечение эффективным. Специалист в данной области имеет все возможности отслеживать эффективность лечения или предотвращения путем измерения любого одного из таких параметров или любой комбинации параметров. В связи с введением иРНК, нацеленной на Serpinc1, или ее фармацевтической композиции, «эффективно против» нарушения свертываемости указывает, что введение клинически подходящие образом приводит к положительному эффекту по меньшей мере для статистически значимой доли пациентов, такому как улучшение симптомов, исцеление, уменьшение заболевания, удлинение жизни, улучшение качества жизни или другой эффект, обычно признаваемый положительным врачами, знакомыми с лечением нарушений свертываемости и связанных с ними причин.
Лечебный или профилактический эффект очевиден при наличии статистически значимого улучшения одного или более параметров статуса заболевания или при невозможности ухудшения или развития симптомов, когда они ожидались бы в противном случае. В качестве примера, благоприятное изменение по меньшей мере на 10% измеряемого параметра заболевания, а предпочтительно по меньшей мере на 20%, 30%, 40%, 50% или более, может указывать на эффективное лечение. Эффективность данного лекарственного средства иРНК или готовой формы этого лекарственного средства также можно оценивать с использованием экспериментальной животной модели для данного заболевания, известной в данной области. При использовании экспериментальной животной модели эффективность лечения подтверждается, когда наблюдается статистически значимое уменьшение маркера или симптома.
Альтернативно, эффективность можно измерить с помощью уменьшения тяжести заболевания, которое специалист в данной области диагностики определяет на основании клинически принятой шкалы оценки тяжести заболевания. Любое положительное изменение, приводящее, например, к снижению тяжести заболевания, измеряемого с использованием подходящей шкалы, отображает адекватное лечение с использованием готовой формы иРНК или иРНК, как описано в данном документе.
ИРНК (или фармацевтические композиции, содержащие иРНК) можно вводить больному приблизительно один раз в неделю, приблизительно два раза в месяц, приблизительно один раз каждые шесть недель, приблизительно один раз каждые 2 месяца или один раз в квартал.
Средство двухцепочечной иРНК можно вводить больному в виде одной или более доз. Например, средство двухцепочечной иРНК можно вводить больному в виде ежемесячной дозы от приблизительно 0,200 мг/кг до приблизительно 1,825 мг/кг. Альтернативно, средство двухцепочечной иРНК можно вводить больному в фиксированной дозе от приблизительно 25 мг до приблизительно 100 мг.
В одном варианте осуществления средство двухцепочечной РНКи, содержащей смысловую нить и антисмысловую нить, причем антисмысловая нить содержит область комплементарности к иРНК, кодирующей Serpinc1, которая содержит по меньшей мере 15 соседних нуклеотидов, отличающихся не более чем на 3 нуклеотида от нуклеотидной последовательности 5’-UUGAAGUAAAUGGUGUUAACCAG-3’ (SEQ ID NO: 15), причем по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити представляют собой модифицированные нуклеотиды, и при этом смысловая нить конъюгирована с лигандом, присоединенным на 3’-конце, вводят вводят больному в фиксированной дозе от приблизительно 25 до приблизительно 100 мг, например, приблизительно 25 мг, 50 мг, 80 мг или 100 мг. В одном варианте осуществления фиксированная доза составляет 50 мг. В другом варианте осуществления фиксированная доза составляет 80 мг.
Введение может быть повторным, например, на регулярной основе, например, ежемесячно, в течение одного месяца, двух месяцев, трех месяцев, четырех месяцев или дольше. После первоначального курса лечения лечение можно проводить реже. Например, после введения раз в месяц в течение трех месяцев, введение можно повторять один раз в квартал, в течение года или дольше.
Соответственно, в некоторых вариантах осуществления средство РНКи вводят по схеме применения, которая включает в себя «фазу загрузки» часто проводимых введений, за которой может следовать «фаза поддержания», в которой средство РНКи вводят с более длительными интервалами.
Загрузочный график применения и/или поддерживающий график применения необязательно можно повторять в течение одной или более итераций. Количество итераций может зависеть от достижения требуемого эффекта, например, супрессии гена Serpinc1 и/или достижения терапевтического или профилактического эффекта, например, увеличения свертывания крови, уменьшения времени образования сгустков и/или уменьшения времени свертывания.
Введение иРНК может уменьшать уровни Serpinc1, например, в клетке, ткани, крови, моче или другом компартменте пациента по меньшей мере приблизительно на 5%, 6%, 7%, 8%, 9%, 10%, 11%, 12%, 13%, 14%, 15%, 16%, 17%, 18%, 19%, 20%, 21%, 22%, 23%, 24%, 25%, 26%, 27%, 28%, 29%, 30%, 31%, 32%, 33%, 34%, 35%, 36%, 37%, 38%, 39%, 40%, 41%, 42%, 43%, 44%, 45%, 46%, 47%, 48%, 49%, 50%, 51%, 52%, 53%, 54%, 55%, 56%, 57%, 58%, 59%, 60%, 61%, 62%, 63%, 64%, 65%, 66%, 67%, 68%, 69%, 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или по меньшей мере приблизительно на 99% или более.
иРНК можно вводить путем внутривенной инфузии в течение некоторого периода времени, например, в течение периода 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или приблизительно 25 минут.
Перед введением полной дозы иРНК, пациентам можно вводить меньшую дозу, например, 5% инфузия, и отслеживать побочные эффекты, такие как аллергическая реакция. В другом примере у пациента можно отслеживать нежелательные иммуностимулирующие эффекты, такие как повышенные уровни цитокинов (например, TNF-альфа или INF-альфа).
Благодаря ингибирующему влиянию на экспрессию Serpinc1 композиция согласно изобретению или полученная из нее фармацевтическая композиция может улучшить качество жизни.
иРНК согласно изобретению можно вводить в «голом» виде или в виде «свободной иРНК». голую иРНК вводят в отсутствие фармацевтической композиции. голая иРНК может быть в подходящем буферном растворе. буферный раствор может содержать ацетат, цитрат, проламин, карбонат или фосфат или любые их комбинации. В одном варианте осуществления буферным раствором является забуференный фосфатом физиологический раствор (PBS). pH и осмолярность буферного раствора, содержащего иРНК, можно регулировать таким образом, чтобы он подходил для введения больному.
Альтернативно, иРНК согласно изобретению можно вводить в виде фармацевтической композиции, такой как липосомальная готовая форма дцРНК.
Больными, которые получили бы пользу от уменьшения и/или ингибирования экспрессии гена Serpinc1, являются больные, имеющие нарушение свертываемости, например, наследственное нарушение свертываемости или приобретенное нарушение свертываемости, как описано в данном документе. В одном варианте осуществления у больного с наследственным нарушением свертываемости имеется гемофилия, например, гемофилия A, B или C. В одном варианте осуществления больным с наследственным нарушением свертываемости, например, гемофилией, является больной с ингибитором (больной, который стал невосприимчивыми к замещающему фактору свертывания). В одном варианте осуществления у больного с ингибитором имеется гемофилия A. В другом варианте осуществления у больного с ингибитором имеется гемофилия B. В еще одном варианте осуществления у больного с ингибитором имеется гемофилия C. Лечение больного, который получил бы пользу от уменьшения и/или ингибирования экспрессии гена Serpinc1, включает терапевтическое (например, по требованию, например, больного с кровотечением (спонтанным кровотечением или кровотечением в результате травмы) и неспособностью к свертыванию) и профилактическое (например, больного без кровотечения и/или которому предстоит хирургическое вмешательство) лечение.
В изобретении, кроме того, представлены способы и варианты применения для применения иРНК или ее фармацевтической композиции, например, для лечения больного, который получил бы пользу от уменьшения и/или ингибирования экспрессии Serpinc1, например, больного с нарушением свертываемости, в комбинации с другими фармацевтическими препаратами и/или другими терапевтическими способами, например, с известными фармацевтическими препаратами и/или известными терапевтическими способами, такими как, например, те, что в настоящее время используют для лечения этих нарушений.
Например, в некоторых вариантах осуществления иРНК, нацеленную на Serpinc1, вводят в комбинации, например, с препаратом, полезным при лечении нарушения свертываемости, как описано в другом месте в данном документе. Например, дополнительные терапевтические средства и терапевтические способы, подходящие для лечения больного, который получил бы пользу от уменьшения экспрессии Serpinc1, например, больного с нарушением свертываемости, включают в себя свежезамороженную плазму (FFP); рекомбинантный FVIIa; рекомбинантный FIX; концентраты FXI; содержащие vWF FVIII концентраты с инактивированным вирусом; лечение с десенсибилизацией, которое может включать в себя большие дозы FVIII или FIX, наряду со стероидами или внутривенным иммуноглобулином (IVIG) и циклофосфамидом; плазмоферез в сочетании с иммуносупрессией и инфузией FVIII или FIX с или без антифибриолитической терапии; индукцию иммунной толерантности (ITI) с или без иммуносупрессивной терапии (например, циклофосфамид, преднизон и/или антитела против CD20); десмопрессина ацетат [DDAVP]; антифибринолитики, такие как аминокапроновая кислота и транексамовая кислота; активированный концентрат протромбинового комплекса (PCC); антигемофильные средства; кортикостероиды; иммуносупрессивные средства; и эстрогены.
ИРНК и дополнительное терапевтическое средство и/или лечение можно вводить одновременно и/или в той же комбинации, например, парентерально, или дополнительное терапевтическое средство можно вводить в виде части отдельной композиции или в отдельное время и/или с помощью другого способа, известного в данной области или описанного в данном документе.
В одном варианте осуществления в настоящем изобретении представлены способы лечения больного с нарушением свертываемости, например, гемофилией, путем подкожного введения больному соединения AT3SC-001 (AD-57213-Смысловая нить: 5’-GfsgsUfuAfaCfaCfCfAfuUfuAfcUfuCfaAf-3’ (SEQ ID NO:13) и Антисмысловая нить: 5’-usUfsgAfaGfuAfaAfuggUfgUfuAfaCfcsasg-3’ (SEQ ID NO:14), причем a, c, g и u представляют 2′-O-метил (2′-OMe) A, C, G или U; Af, Cf, Gf или Uf представляют 2′-фтор A, C, G или U; а s представляет фосфоротиоатную связь) в фиксированной дозе от приблизительно 25 мг до приблизительно 100 мг, например, в фиксированной дозе приблизительно 25 мг, приблизительно 50 мг, приблизительно 80 мг или приблизительно 100 мг (например, в количестве, которое снижает активность Serpinc1 у больного приблизительно на 75% или более). В одном варианте осуществления фиксированная доза составляет 50 мг. В другом варианте осуществления фиксированная доза составляет 80 мг.
III. ИРНК для применения в способах согласно изобретению
В данном документе описаны способы применения улучшенных средств двухцепочечной РНКи, которые ингибируют экспрессию гена Serpinc1 в клетке, например, в клетке больного, например, млекопитающего, такого как человек, имеющий связанное с Serpinc1 нарушение, например, нарушение свертываемости, например, гемофилию.
Соответственно, в изобретении представлены средства двухцепочечной РНКи с химическими модификациями, способными ингибировать экспрессию гена-мишени (то есть гена Serpinc1) in vivo. В некоторых аспектах изобретения по существу все нуклеотиды иРНК согласно изобретению являются модифицированными. В других вариантах осуществления изобретения все нуклеотиды иРНК согласно изобретению являются модифицированными. ИРНК согласно изобретению, в которых «по существу все нуклеотиды являются модифицированными» в значительной степени, но не полностью модифицированы и могут содержать не более чем на 5, 4, 3, 2 или 1 немодифицированных нуклеотидов.
Средство РНКи содержит смысловую нить и антисмысловую нить. Каждая нить средства РНКи может варьировать от 12-30 нуклеотидов в длину. Например, каждая нить может быть между 14-30 нуклеотидов в длину, 17-30 нуклеотидов в длину, 19-30 нуклеотидов в длину, 25-30 нуклеотидов в длину, 27-30 нуклеотидов в длину, 17-23 нуклеотида в длину, 17-21 нуклеотид в длину, 17-19 нуклеотидов в длину, 19-25 нуклеотидов в длину, 19-23 нуклеотида в длину, 19-21 нуклеотид в длину, 21-25 нуклеотидов в длину или 21-23 нуклеотида в длину.
Смысловая нить и антисмысловая нить обычно образуют двойную двухцепочечную РНК («дцРНК»), также упоминаемую в данном документе как «средство РНКи». Двойная область средства РНКи может составлять 12-30 пар нуклеотидов в длину. Например, двойная область может составлять между 14-30 пар нуклеотидов в длину, 17-30 пар нуклеотидов в длину, 27-30 пар нуклеотидов в длину, 17-23 пары нуклеотидов в длину, 17-21 пару нуклеотидов в длину, 17-19 пар нуклеотидов в длину, 19-25 пар нуклеотидов в длину, 19-23 пары нуклеотидов в длину, 19-21 пару нуклеотидов в длину, 21-25 пар нуклеотидов в длину или 21-23 пары нуклеотидов в длину. В другом примере двойную область выбирают из 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26 и 27 нуклеотидов в длину.
В одном варианте осуществления средство РНКи может содержать одну или более выступающих областей и/или кэпирующих групп на 3’-конце, 5’-конце или на обоих концах одной или обеих нитей. Выступ может составлять 1-6 нуклеотидов в длину, например, 2-6 нуклеотидов в длину, 1-5 нуклеотидов в длину, 2-5 нуклеотидов в длину, 1-4 нуклеотида в длину, 2-4 нуклеотида в длину, 1-3 нуклеотида в длину, 2-3 нуклеотида в длину или 1-2 нуклеотида в длину. Выступы могут быть результатом того, что одна нить длиннее другой, или результатом того, что две нити одинаковой длины расположены в шахматном порядке. Выступ может образовывать несоответствие с иРНК-мишенью, или он может быть комплементарным последовательностям гена-мишени, или может представлять собой другую последовательность. Первая и вторая нити также могут быть соединены, например, дополнительными основаниями с образованием шпильки или другими линкерами без основания.
В одном варианте осуществления каждый из нуклеотидов в выступающей области средства РНКи независимо может представлять собой модифицированный или немодифицированный нуклеотид, содержащий, но без ограничения модифицированный 2’-сахар, например, 2-F, 2’-O-метил, тимидин (T), 2`-O-метоксиэтил-5-метилуридин (Teo), 2`-O-метоксиэтиладенозин (Aeo), 2`-O-метоксиэтил-5-метилцитидин (m5Ceo) и любые их комбинации. Например, TT может быть последовательностью выступа для любого конца на любой нити. Выступ может образовывать несоответствие с иРНК-мишенью, или он может быть комплементарным последовательностям гена-мишени, или может представлять собой другую последовательность.
5’-или 3’-выступы на смысловой нити, антисмысловой нити или на обеих нитях средства РНКи могут быть фосфорилированы. В некоторых вариантах осуществления выступающая область (области) содержит два нуклеотида, имеющих фосфоротиоат между двумя нуклеотидами, причем два нуклеотида могут быть одинаковыми или разными. В одном варианте осуществления выступ находится на 3’-конце смысловой нити, антисмысловой нити или обеих нитей. В одном варианте осуществления этот 3’-выступ находится на антисмысловой нити. В одном варианте осуществления этот 3’-выступ находится на смысловой нити.
Средство РНКи может содержать только один выступ, который может усилить активность интерференции РНКи, не влияя на ее общую стабильность. Например, одноцепочечный выступ может быть расположен на 3’-терминальном конце смысловой нити или, альтернативно, на 3’-терминальном конце антисмысловой нити. РНКи также может иметь тупой конец, расположенный на 5’-конце антисмысловой нити (или 3’-конце смысловой нити) или наоборот. В общем, антисмысловая нить РНКи имеет нуклеотидный выступ на 3’-конце, а 5’-конец - тупой. Не желая связывать себя теорией, асимметричный тупой конец на 5’-конце антисмысловой нити и выступ на 3’-конце антисмысловой нити способствуют загрузке направляющей нити в процесс RISC.
Любую из нуклеиновых кислот, представленных в изобретении, можно синтезировать и/или модифицировать с помощью способов, хорошо известных в данной области, таких как способы, описанные в «Current protocols in nucleic acid chemistry», Beaucage, S.L. et al., (Edrs.), John Wiley & Sons, Inc. New York, NY, USA, который настоящим включен в данный документ посредством ссылки. Модификации включают в себя, например, концевые модификации, например, 5’-концевые модификации (фосфорилирование, конъюгация, инвертированные связи) или 3’-концевые модификации (конъюгация, ДНК нуклеотиды, инвертированные связи и т.д.); модификации оснований, например, замещение стабилизирующими основаниями, дестабилизирующими основаниями или основаниями, которые образуют пару оснований с расширенным репертуаром партнеров, удаление оснований (лишенные азотистого основания нуклеотиды) или конъюгированные основания; модификации сахаров (например, в 2’-положении или в 4’-положении) или замещение сахара; и/или модификации остова, включая модификацию или замещение фосфодиэфирных связей. Конкретные примеры соединений иРНК, полезных в вариантах осуществления, описанных в данном документе, включают, но без ограничения РНК, содержащие модифицированные остовы или не натуральные межнуклеозидные связи. РНК, имеющие модифицированные остовы, среди прочего включают те, которые не имеют в остове атома фосфора. Для целей этого описания и как иногда упоминается в данной области, модифицированные РНК, которые не имеют атома фосфора в своем межнуклеозидном остове, также можно считать олигонуклеозидами. В некоторых вариантах осуществления модифицированные иРНК будут иметь в своем межнуклеозидном остове атом фосфора.
Остовы модифицированных РНК включают, например, фосфоротиоаты, хиральные фосфоротиоаты, фосфорoдитиоаты, фосфотриэфиры, аминоалкилфосфотриэфиры, метил- и другие алкилфосфонаты, включая 3'-алкиленфосфонаты и хиральные фосфонаты, фосфинаты, фосфорамидаты, включая 3'-амино фосфорамидат и аминоалкилфосфорамидаты, тионофосфорамидаты, тионоалкилфосфонаты, тионоалкилфосфотриэфиры и боранофосфаты, имеющие нормальные 3'-5' связи, 2'-5'-связанные их аналоги, и те, что имеют обратную полярность, причем соседние пары нуклеозидных звеньев связаны 3'-5' с 5'-3' или 2'-5' с 5'-2'. Также включены разные соли, смешанные соли и формы свободных кислот.
Примеры патентов США, в которых изложено получение вышеуказанных фосфорсодержащих связей, включают, но без ограничения, патенты США №№ 3687808; 4469863; 4476301; 5023243; 5177195; 5188897; 5264423; 5276019; 5278302; 5286717; 5321131; 5399676; 5405939; 5453496; 5455233; 5466677; 5476925; 5519126; 5536821; 5541316; 5550111; 5563253; 5571799; 5587361; 5625050; 6028188; 6124445; 6160109; 6169170; 6172209; 6 239265; 6277603; 6326199; 6346614; 6444423; 6531590; 6534639; 6608035; 6683167; 6858715; 6867294; 6878805; 7015315; 7041816; 7273933; 7321029; и патент США RE39464, все содержание каждого из которых включено настоящим в данный документ посредством ссылки.
Остовы модифицированных РНК, которые не содержат в них атом фосфора, имеют остовы, которые образованы с помощью алкильных или циклоалкильных межнуклеозидных связей с короткими цепями, смешанных гетероатомов и алкильных или циклоалкильных межнуклеозидных связей или одной или более гетероатомных или гетероциклических межнуклеозидных связей с короткими цепями. Они включают в себя те, что имеют морфолиновые связи (образованные частично из сахарной части нуклеозида); силоксановые остовы; сульфидные, сульфоксидные и сульфоновые остовы; формацетиловые и тиоформацетиловые остовы; метиленформацетиловые и тиоформацетиловые остовы; алкенсодержащие остовы; сульфаматные остовы; остовы метиленимино и метиленгидразино; сульфонатные и сульфонамидные остовы; амидные остовы; и другие, имеющие смешиванные части компонентов N, O, S и CH2.
Примеры патентов США, в которых изложено получение вышеуказанных олигонуклеозидов, включают, но без ограничения, патенты США №№ 5034506; 5166315; 5185444; 5214134; 5216141; 5235033; 564562; 5264564; 5405938; 5434257; 5466677; 5470967; 5489677; 5541307; 5561225; 5596086; 5602240; 5608046; 5610289; 5618704; 5623070; 5663312; 5633360; 5677437; и 5677439, все содержание каждого из которых включено настоящим в данный документ посредством ссылки.
В других вариантах осуществления предусмотрены подходящие РНК-миметики для использования в иРНК, в которых как сахар, так и межнуклеозидная связь, то есть остов, нуклеотидных звеньев замещают новыми группами. Звенья оснований сохраняют для гибридизации с подходящим соединением-мишенью нуклеиновой кислоты. Одно такое олигомерное соединение, РНК-миметик, которое, как показано, имеет отличные гибридизационные свойства, обозначено как пептидная нуклеиновая кислота (PNA). В соединениях PNA сахарный остов РНК заменен содержащим амид остовом, в частности, аминоэтилглициновым остовом. Основания нуклеиновой кислоты сохранены и связаны прямо или непрямо с аза-атомами азота амидной части остова. Примеры патентов США, в которых изложено получение соединений PNA, включают, но без ограничения, патенты США №№ 5539082; 5714331 и 5719262, все содержание каждого из которых включено настоящим в данный документ посредством ссылки. Дополнительные соединения PNA, подходящие для использования в иРНК согласно изобретению, описаны, например, в Nielsen et al., Science, 1991, 254, 1497-1500.
Некоторые варианты осуществления, представленные в изобретении, включают в себя РНК с фосфоротиоатными остовами и олигонуклеозиды с гетероатомными остовами, и в частности --CH2--NH--CH2-, --CH2--N(CH3)--O--CH2--[известный как метилен (метилимино) или MMI остов], --CH2--O--N(CH3)--CH2--, --CH2--N(CH3)--N(CH3)--CH2--и --N(CH3)--CH2--CH2--[где нативный фосфодиэфирный остов представлен как --O--P--O--CH2--] процитированного выше патента США № 5489677, и амидные остовы процитированного выше патента США № 5602240. В некоторых вариантах осуществления РНК, представленные в данном документе, имеют остовы структуры морфолино процитированного выше патента США № 5034506.
Модифицированные РНК также могут содержать один или более замещенных фрагментов сахаров. ИРНК, например, дцРНК, представленные в данном документе, могут содержать в 2'-положении одно из следующего: OH; F; O-, S-или N-алкил; O-, S-или N-алкенил; O-, S-или N-алкинил; или O-алкил-O-алкил, причем алкил, алкенил и алкинил могут представлять собой замещенный или незамещенный C1-C10 алкил или C2-C10 алкенил и алкинил. Иллюстративные подходящие модификации включают в себя O[(CH2)nO]mCH3, O(CH2)nOCH3, O(CH2)nNH2, O(CH2)nCH3, O(CH2)nONH2 и O(CH2)nON[(CH2)nCH3)]2, где n и m составляют от 1 до приблизительно 10. В других вариантах осуществления дцРНК в 2’ положении содержат одно из следующего: C1-C10 низший алкил, замещенный низший алкил, алкарил, аралкил, O-алкарил или O-аралкил, SH, SCH3, ОCN, Cl, Br, CN, CF3, ОCF3, SОCH3, SO2CH3, ONO2, NO2, N3, NH2, гетероциклоалкил, гетероциклоалкарил, аминоалкиламино, полиалкиламино, замещенный силил, группу расщепления РНК, репортерную группу, интеркалятор, группу для улучшения фармакокинетических свойств иРНК или группу для улучшения фармакодинамических свойств иРНК и другие заместители, имеющие аналогичными свойства. В некоторых вариантах осуществления модификации включают в себя 2'-метоксиэтокси (2'-O--CH2CH2ОCH3, также известный как 2'-O-(2-метоксиэтил) или 2'-MOE) (Martin et al., Helv. Chim. Acta, 1995, 78:486-504), то есть алкокси-алкокси группу. Другой иллюстративной модификацией является 2'-диметиламинооксиэтокси, то есть группа O(CH2)2ON(CH3)2, также известная как 2'-DMAOE, как описано в примерах в данном документе ниже, и 2'-диметиламиноэтоксиэтокси (также известный в данной области как 2'-O-диметиламиноэтоксиэтил или 2'-DMAEOE), то есть 2'-O--CH2--O--CH2--N(CH2)2.
Другие модификации включают в себя 2'-метокси (2'-ОCH3), 2'-аминопропокси (2'-ОCH2CH2CH2NH2) и 2'-фтор (2'-F). Аналогичные модификации также можно получить в других положениях РНК в иРНК, особенно в 3'-положении сахара на 3'-конце нуклеотида или в 2'-5' связанных дцРНК и в 5'-положении 5'-конца нуклеотида. ИРНК также могут иметь миметики сахаров, такие как циклобутиловые фрагменты вместо пентофуранозилового сахара. Примеры патентов США, в которых изложено получение таких модифицированных структур сахаров, включают, но без ограничения, патенты США №№ 4981957; 5118800; 5319080; 5359044; 5393878; 5446137; 5466786; 5514785; 5519134; 5567811; 5576427; 5591722; 5597909; 5610300; 5627053; 5639873; 5646265; 5658873; 5670633; и 5700920, некоторые из которых в большинстве случаев принадлежат рассматриваемой в данный момент заявке. Все содержание каждого из вышеизложенных документов включено настоящим в данный документ посредством ссылки.
иРНК также может содержать модификации или замены нуклеиновых оснований (часто упоминаемых в данной области просто «основание»). В рамках настоящего изобретения «немодифицированные» или «натуральные» нуклеиновые основания включают в себя пуриновые основания аденин (A) и гуанин (G), и пиримидиновые основания тимин (T), цитозин (C) и урацил (U). Модифицированные нуклеиновые основания включают в себя другие синтетические и натуральные нуклеиновые основания, такие как деокси-тимин (dT), 5-метилцитозин (5-me-C), 5-гидроксиметилцитозин, ксантин, гипоксантин, 2-аминоаденин, 6-метил и другие алкильные производные аденина и гуанина, 2-пропил и другие алкильные производные аденина и гуанина, 2-тиоурацил, 2-тиотимин и 2-тиоцитозин, 5-галоурацил и цитозин, 5-пропинилурацил и цитозин, 6-азоурацил, цитозин и тимин, 5-урацил (псевдоурацил), 4-тиоурацил, 8-гало, 8-амино, 8-тиол, 8-тиоалкил, 8-гидроксил и другие 8-замещенные аденины и гуанины, 5-гало, особенно 5-бром, 5-трифторметил и другие 5-замещенные урацилы и цитозины, 7-метилгуанин и 7-метиладенин, 8-азагуанин и 8-азааденин, 7-деазагуанин и 7-деазааденин и 3-деазагуанин и 3-деазааденин. Дополнительные нуклеиновые основания включают в себя основания, раскрытые в патенте США № 3687808, основания, раскрытые в Biochemistry, Biotechnology и Medicine, Herdewijn, P. ed. Wiley-VCH, 2008; основания, раскрытые в Concise Encyclopedia Of Полимер Science И Engineering, pages 858-859, Kroschwitz, J. L, ed. John Wiley & Sons, 1990, основания, раскрытые в Englisch et al., Angewandte Chemie, International Edition, 1991, 30, 613, и основания, раскрытые в Sanghvi, Y S., Chapter 15, dsRNA Research и Applications, pages 289-302, Crooke, S. T. И Lebleu, B., Ed., CRC Press, 1993. Некоторые из этих нуклеиновых оснований особенно полезны для увеличения аффинности связывания олигомерных соединений, представленных в изобретении. Они включают в себя 5-замещенные пиримидины, 6-азапиримидины и N-2, N-6 и 0-6 замещенные пурины, включая 2-аминопропиладенин, 5-пропинилурацил и 5-пропинилцитозин. 5-метилцитозиновые замены, как показано, повышают стабильность дуплекс нуклеиновых кислот на 0,6-1,2°C (Sanghvi, Y. S., Crooke, S. T. И Lebleu, B., Eds., dsRNA Research и Applications, CRC Press, Boca Raton, 1993, pp. 276-278) и представляют собой иллюстративные замены оснований, еще лучше в сочетании с 2'-O-метоксиэтильными модификациями сахаров.
Примеры патентов США, в которых изложено получение некоторых из вышеуказанных модифицированных нуклеиновых оснований, а также других модифицированных нуклеиновых оснований, включают, но без ограничения, приведенные выше патенты США №№ 3687808 4845205; 513030; 5134066; 5175273; 5367066; 5432272; 5457187; 5459255; 5484908; 5502177; 5525711; 5552540; 5587469; 5594121 5596091; 5614617; 5681941; 5750692; 6015886; 6147200; 6166197; 6222025; 6235887; 6380368; 6528640; 6639062; 6617438; 7045610; 7427672; и 7495088, все содержание каждого из которых включено настоящим в данный документ посредством ссылки.
РНК в иРНК также можно модифицировать для включения одного или более фрагментов бициклических сахаров. «бициклический сахар» представляет собой фуранозильное кольцо, модифицированное за счет соединения мостиком двух атомов. «Бициклический нуклеозид» («BNA») представляет собой нуклеозид, имеющий фрагмент сахара, содержащий мостик, связывающий два атома углерода сахарного кольца, с образованием за счет этого бициклической кольцевой системы. В некоторых вариантах осуществления мостик связывает 4′-углерод и 2′-углерод сахарного кольца. Таким образом, в некоторых вариантах осуществления средство согласно изобретению может содержать РНК в иРНК, которую также можно модифицировать для включения одной или более заблокированных нуклеиновых кислот (LNA). Заблокированная нуклеиновая кислота представляет собой нуклеотид, имеющий модифицированный фрагмент рибозы, причем фрагмент рибозы содержит дополнительный мостик, связывающий 2' и 4' углероды. Другими словами, LNA представляет собой нуклеотид, содержащий бициклический фрагмент сахара, содержащий 4'-CH2-O-2' мостик. Эта структура эффективно «блокирует» рибозу в 3'-эндо структурной конформации. было показано, что добавление заблокированных нуклеиновых кислот к миРНК увеличивает стабильность миРНК в сыворотке и уменьшает не относящиеся к мишени эффекты (Elmen, J. et al., (2005) Nucleic Acids Research 33(1):439-447; Mook, OR. et al., (2007) Mol Canc Ther 6(3):833-843; Grunweller, A. et al., (2003) Nucleic Acids Research 31(12):3185-3193).
Примеры бициклических нуклеозидов для использования в полинуклеотидах согласно изобретению включают без ограничения нуклеозиды, содержащие мостик между 4′ и 2′ атомами рибозильного кольца. В некоторых вариантах осуществления средства антисмысловых полинуклеотидов согласно изобретению содержат один или более бициклических нуклеозидов, содержащих 4′-2′ мостик. Примеры таких 4′-2′ связанных бициклических нуклеозидов, включают, но без ограничения 4′-(CH2)-O-2′ (LNA); 4′-(CH2)-S-2′; 4′-(CH2)2-O-2′ (ENA); 4′-CH(CH3)-O-2′ (также называемые «конформационно ограниченный этил нуклеозид» или «cEt») и 4′-CH(CH2ОCH3)-O-2′ (и его аналоги; см., например, патент США № 7399845); 4′-C(CH3)(CH3)-O-2′ (и его аналоги; см., например, патент США № 8278283); 4′-CH2-N(ОCH3)-2′ (и его аналоги; см., например, патент США № 8278425); 4′-CH2-O-N(CH3)-2′ (см., например, Публикацию Патента США № 2004/0171570); 4′-CH2-N(R)-O-2′, причем R представляет H, C1-C12 алкил или защитную группу (см., например, патент США № 7427672); 4′-CH2-C(H)(CH3)-2′ (см., например, Chattopadhyaya et al., J. Org. Chem. 2009, 74, 118-134); и 4′-CH2-C(=CH2)-2′ (и его аналоги; см., например, патент США № 8278426). Все содержание каждого из вышеизложенных документов включено настоящим в данный документ посредством ссылки.
Дополнительные примеры патентов США и публикаций патентов США, в которых изложено получение заблокированных нуклеотидов нуклеиновых кислот, включают, но без ограничения, следующее: патенты США №№ 6268490; 6525191; 6670461; 6770748; 6794499; 6998484; 7053207; 7034133; 7084125; 7399845; 7427672; 7569686; 7741457; 8022193; 8030467; 8278425; 8278426; 8278283; US 2008/0039618; и US 2009/0012281, все содержание каждого из которых включено настоящим в данный документ посредством ссылки.
Можно получить любой из вышеприведенных бициклических нуклеозидов, имеющих одну или более стереохимических конфигураций сахаров, содержащих, например, α-L-рибофуранозу и β-D-рибофуранозу (см. WO 99/14226).
РНК в иРНК также можно модифицировать для включения одного или более конформационно ограниченных этил нуклеотидов. В рамках настоящего изобретения «конформационно ограниченный этил нуклеотид» или «cEt» представляет собой заблокированную нуклеиновую кислоту, содержащую бициклический фрагмент сахара, содержащий 4'-CH(CH3)-0-2' мостик. В одном варианте осуществления конформационно ограниченный этил нуклеотид находится в S конформации, упоминаемой в данном документе как «S-cEt».
иРНК согласно изобретению также может содержать один или более «конформационно ограниченных нуклеотидов» («CRN»). CRN представляют собой аналоги нуклеотидов с линкером, связывающим C2’и C4’ углероды рибозы или C3 и -C5′ углероды рибозы. CRN блокируют рибозное кольцо в стабильную конформацию и увеличивают аффинность гибридизации к иРНК. Линкер имеет достаточную длину для помещения кислорода в оптимальное положение для стабильности и аффинности, что приводит к меньшей складчатости рибозного кольца.
Примеры публикаций, в которых изложено получение некоторых из вышеуказанных CRN, включают, но без ограничения, публикацию патента США № 2013/0190383; и PCT публикация WO 2013/036868, все содержание каждого из которых включено настоящим в данный документ посредством ссылки.
Один или более нуклеотидов иРНК согласно изобретению также могут содержать нуклеотид с замещенным гидроксиметилом. «Нуклеотид с замещенным гидроксиметилом» представляет собой ациклический 2’-3’-секо-нуклеотид, также называемый модификация «незаблокированной нуклеиновой кислоты» («UNA»).
Примеры публикаций США, в которых изложено получение UNA, включают, но без ограничения, патент США № 8314227; и публикацию патента США №№ 2013/0096289; 2013/0011922; и 2011/0313020, все содержание каждого из которых включено настоящим в данный документ посредством ссылки.
Потенциально стабилизирующие модификации на концах молекул РНК могут включать в себя N-(ацетиламинокапроил)-4-гидроксипролинол (Hyp-C6-NHAc), N-(капроил-4-гидроксипролинол (Hyp-C6), N-(ацетил-4-гидроксипролинол (Hyp-NHAc), тимидин-2'-0-деокситимидин (эфир), N-(аминокапроил)-4-гидроксипролинол (Hyp-C6-амино), 2-докосаноил-уридин-3»-фосфат, инвертированное основание dT(idT) и другие. Раскрытие этой модификации можно найти в PCT Публикация № WO 2011/005861.
A. Модифицированные иРНК, содержащие Мотивы согласно Изобретению
В некоторых аспектах изобретения средства двухцепочечной РНКи согласно изобретению включают в себя средства с химическими модификациями, которые раскрыты, например, в Предварительной Заявке США № 61/561710, поданной 18 ноября 2011 года или в PCT/US2012/065691, поданной 16 ноября 2012 года, все содержание каждого из которых включено в данный документ посредством ссылки.
Как показано в данном документе, в Предварительной Заявке № 61/561710 и в PCT/US2012/065691 превосходный результат можно получить путем введения одного или более мотивов трех идентичных модификаций трех последовательных нуклеотидов в смысловую нить и/или антисмысловую нить средства РНКи, особенно в сайте расщепления или около него. В некоторых вариантах осуществления смысловая нить и антисмысловая нить средства РНКи в ином случае могут быть полностью модифицированы. Введение этих мотивов нарушает характер модификации, при наличии, смысловой и/или антисмысловой нити. Средство РНКи может быть необязательно конъюгировано с лигандом-производным GalNAc, например, на смысловой нити. Полученные средства РНКи демонстрируют превосходную активность выключения генов.
Более конкретно, неожиданно было обнаружено, что когда смысловую нить и антисмысловую нить средства двухцепочечной РНКи модифицируют, чтобы иметь один или более мотивов трех идентичных модификаций трех последовательных нуклеотидов в сайте расщепления или около него по меньшей мере одной нити средства РНКи, активность выключения генов средства РНКи была значительно улучшена.
В одном варианте осуществления средство РНКи представляет собой элемент с двумя тупыми концами по 19 нуклеотидов в длину, причем смысловая нить содержит по меньшей мере один мотив трех 2’-F модификаций трех последовательных нуклеотидов в положениях 7, 8, 9 от 5’-конца. Антисмысловая нить содержит по меньшей мере один мотив трех 2’-O-метил модификаций трех последовательных нуклеотидов в положениях 11, 12, 13 от 5’-конца.
В другом варианте осуществления средство РНКи представляет собой элемент с двумя тупыми концами по 20 нуклеотидов в длину, причем смысловая нить содержит по меньшей мере один мотив трех 2’-F модификаций трех последовательных нуклеотидов в положениях 8, 9, 10 от 5’-конца. Антисмысловая нить содержит по меньшей мере один мотив трех 2’-O-метил модификаций трех последовательных нуклеотидов в положениях 11, 12, 13 от 5’-конца.
В еще одном варианте осуществления средство РНКи представляет собой элемент с двумя тупыми концами по 21 нуклеотид в длину, причем смысловая нить содержит по меньшей мере один мотив трех 2’-F модификаций трех последовательных нуклеотидов в положениях 9, 10, 11 от 5’-конца. Антисмысловая нить содержит по меньшей мере один мотив трех 2’-O-метил модификаций трех последовательных нуклеотидов в положениях 11, 12, 13 от 5’-конца.
В одном варианте осуществления средство РНКи содержит смысловую нить в 21 нуклеотид и антисмысловую нить в 23 нуклеотида, причем смысловая нить содержит по меньшей мере один мотив трех 2’-F модификаций трех последовательных нуклеотидов в положениях 9, 10, 11 от 5’-конца; антисмысловая нить содержит по меньшей мере один мотив трех 2’-O-метил модификаций трех последовательных нуклеотидов в положениях 11, 12, 13 от 5’-конца, причем один конец средства РНКи - тупой, тогда как другой конец содержит выступ из 2 нуклеотидов. Предпочтительно, выступ из 2 нуклеотидов находится на 3’-конце антисмысловой нити. Когда выступ из 2 нуклеотидов находится на 3’-конце антисмысловой нити, может быть две фосфоротиоатные межнуклеотидные связи между тремя концевыми нуклеотидами, причем двумя из трех нуклеотидов являются нуклеотиды выступа, а третий нуклеотид представляет собой парный нуклеотид вслед за нуклеотидом выступа. В одном варианте осуществления средство РНКи дополнительно имеет две фосфоротиоатные межнуклеотидные связи между тремя концевыми нуклеотидами как на 5’-конце смысловой нити, так и на 5’-конце антисмысловой нити. В одном варианте осуществления каждый нуклеотид на смысловой нити и антисмысловой нити средства РНКи, содержащих нуклеотиды, которые являются частью мотивов, представляют собой модифицированные нуклеотиды. В одном варианте осуществления каждый остаток независимо модифицирован 2’-O-метилом или 3’-фтором, например, в чередующемся мотиве. Необязательно, средство РНКи кроме того содержит лиганд (предпочтительно GalNAc3).
В одном варианте осуществления средство РНКи содержит смысловую и антисмысловую нити, причем средство РНКи содержит первую нить, имеющую длину, которая составляет по меньшей мере 25 и самое большее 29 нуклеотидов, и вторую нить, имеющую длину, которая составляет самое большее 30 нуклеотидов по меньшей мере с одним мотивов из трех 2’-O-метил модификаций трех последовательных нуклеотидов в положении 11, 12, 13 от 5-конца;, причем 3’-конец первой нити и 5’-конец второй нити образуют тупой конец, а вторая нить на 1-4 нуклеотида длиннее на ее 3’-конце чем первая нить, причем двойная область, которая составляет по меньшей мере 25 нуклеотидов в длину, а вторая нить является достаточно комплементарной иРНК-мишени по меньшей мере по 19 нуклеотидам по длине второй нити для уменьшения экспрессии гена-мишени, когда средство РНКи вводят в клетку млекопитающего, и при этом расщепление дайсера средства РНКи предпочтительно приводит к миРНК, содержащей 3’-конец второй нити, уменьшая за счет этого экспрессию гена-мишени у млекопитающего. Необязательно, средство РНКи кроме того содержит лиганд.
В одном варианте осуществления смысловая нить средства РНКи содержит по меньшей мере один мотив трех идентичных модификаций трех последовательных нуклеотидов, причем один из мотивов находится на сайте расщепления на смысловой нити.
В одном варианте осуществления антисмысловая нить средства РНКи также может содержать по меньшей мере один мотив трех идентичных модификаций трех последовательных нуклеотидов, причем один из мотивов находится в сайте расщепления или около него на антисмысловой нити
Для средства РНКи, имеющего двойную область в 17-23 нуклеотида в длину, сайт расщепления антисмысловой нити обычно составляет приблизительно 10, 11 и 12 позиций от 5’-конца. Таким образом, мотивы трех идентичных модификаций могут находиться в 9, 10, 11 позициях; 10, 11, 12 позициях; 11, 12, 13 позициях; 12, 13, 14 позициях; или 13, 14, 15 позициях антисмысловой нити, причем отсчет начинается с 1-го нуклеотида от 5’-конца антисмысловой нити, или отсчет начинается от 1-го парного нуклеотида внутри двойной области от 5’-конца антисмысловой нити. Сайт расщепления на антисмысловой нити также может изменяться согласно длине дуплексной области РНКи от 5’-конца.
Смысловая нить средства РНКи может содержать по меньшей мере один мотив трех идентичных модификаций трех последовательных нуклеотидов на сайте расщепления нити; а антисмысловая нить может иметь по меньшей мере один мотив трех идентичных модификаций трех последовательных нуклеотидов в сайте расщепления нити или около него. Когда смысловая нить и антисмысловая нить образуют дуплекс дцРНК, смысловую нить и антисмысловую нить можно выровнять так, чтобы один мотив трех нуклеотидов на смысловой нити и один мотив трех нуклеотидов на антисмысловой нити имели перекрытие по меньшей мере в один нуклеотид, то есть по меньшей мере один из трех нуклеотидов мотива на смысловой нити образует пару оснований по меньшей мере с одним из трех нуклеотидов мотива на антисмысловой нити. Альтернативно перекрываться могут по меньшей мере два нуклеотида, или перекрываться могут все три нуклеотида.
В одном варианте осуществления смысловая нить средства РНКи может содержать более чем один мотив трех идентичных модификаций трех последовательных нуклеотидов. Первый мотив может находиться в сайте расщепления нити или около него, а другие мотивы могут представлять собой wing модификации. Термин «wing модификации» в данном документе относится к мотиву, находящемуся в другой части нити, которая отделена от мотива в сайте расщепления или около него той же самой нити. wing модификации либо находятся рядом с первым мотивом, либо отделены по меньшей мере одним или более нуклеотидами. Когда мотивы находятся в непосредственной близости друг к другу, то состав мотивов отличается друг от друга, а когда мотивы отделены одним или более нуклеотидами, то составы могут быть одинаковыми или разными. Может иметься две или более wing модификаций. Например, когда имеется две wing модификации, каждая из wing модификаций может находиться на одном конце относительно первого мотива, который находится в сайте расщепления или около него или с одной стороны переднего мотива.
Как и смысловая нить, антисмысловая нить средства РНКи может содержать более чем один мотив трех идентичных модификаций трех последовательных нуклеотидов, причем по меньшей мере один мотив находится в сайте расщепления нити или около него. Эта антисмысловая нить также может содержать одну или более wing модификаций, выровненных аналогично wing модификациям, которые могут иметься на смысловой нити.
В одном варианте осуществления wing модификации на смысловой нити или антисмысловой нити средства РНКи обычно не содержат первых одного или двух концевых нуклеотидов на 3’-конце, 5’-конце или на обоих концах нити.
В другом варианте осуществления wing модификации на смысловой нити или антисмысловой нити средства РНКи обычно не содержат первых одного или двух парных нуклеотидов внутри двойной области на 3’-конце, 5’-конце или на обоих концах нити.
Когда каждая из смысловой нити и антисмысловой нити средства РНКи содержит по меньшей мере одну боковую модификацию, wing модификации могут приходиться на один и тот же конец дуплексной области и иметь перекрытие из одного, двух или трех нуклеотидов.
Когда каждая из смысловой нити и антисмысловой нити средства РНКи содержит по меньшей мере две wing модификации, смысловую нить и антисмысловую нить можно выровнять так, чтобы две модификации, каждая из одной нити, приходились на один конец дуплексной области, имеющей перекрытие из одного, двух или трех нуклеотидов; две модификации, каждая из одной нити, приходились на другой конец дуплексной области, имеющей перекрытие из одного, двух или трех нуклеотидов; две модификации одной нити приходились на каждую сторону переднего мотива, имеющего перекрытие из одного, двух или трех нуклеотидов в двойной области.
В одном варианте осуществления каждый нуклеотид на смысловой нити и антисмысловой нити средства РНКи, содержащих нуклеотиды, которые являются частью мотивов, может быть модифицированным. Каждый нуклеотид может быть модифицирован с одинаковыми или разными модификациями, которые могут содержать одно или более изменений одного или обоих не связывающих фосфат атомов кислорода и/или одного или более связывающих фосфат атомов кислорода; изменение составляющей рибозного сахара, например, 2В одном варианте осуществления, когда средство РНКи гидроксила на рибозном сахаре; полное замещение фрагмента фосфата на «дефосфо» линкеры; модификацию или замещение существующего в природе основания; и замещение или модификацию рибозо-фосфатного остова.
Так как нуклеиновые кислоты являются полимерами субъединиц, многие модификации возникают в положении, которое повторяется внутри нуклеиновой кислоты, например, модификация основания или фрагмента фосфата или несвязывающего O фрагмента фосфата. В некоторых случаях модификация будет возникать у больного во всех позициях в нуклеиновой кислоте, но во многих случаях нет. В качестве примера, модификация может происходить только в 3’ или 5’ терминальном положении, может происходить только в терминальной области, например, в положении на терминальном нуклеотиде или в последних 2, 3, 4, 5 или 10 нуклеотидах нити. Модификация может происходить в двухцепочечной области, в одноцепочечной области или в обеих. Модификация может происходить только в двухцепочечной области РНК или может происходить только в в одноцепочечной области РНК. Например, фосфоротиоатная модификация в несвязывающем O положении может происходить только на одном или обоих концах, может происходить только в терминальной области, например, в положении на терминальном нуклеотиде или в последних 2, 3, 4, 5 или 10 нуклеотидах нити или может происходить в двухцепочечных и одноцепочечных областях, особенно на концах. 5’-конец или концы могут быть фосфорилированы.
Может быть можно, например, улучшить стабильность, включить конкретные основания в выступах или включить модифицированные нуклеотиды или нуклеотиды-имитаторы в одноцепочечных выступах, например, в 5’ или 3’-выступе или в обоих. Например, может быть нужно включить в выступы пуриновые нуклеотиды. В некоторых вариантах осуществления все или некоторые основания в 3’ или 5’-выступе могут быть модифицированы, например, с помощью модификации, описанной в данном документе. Модификации могут включать в себя, например, использование модификаций в 2’ положении рибозного сахара с помощью модификаций, известных в данной области, например, использование модифицированных деоксирибонуклеотидов, 2’-деокси-2’-фтора (2’-F) или 2’-O-метила вместо рибосахара нуклеинового основания и модификации ы фосфатной группе, например, фосфоротиоатные модификации. Выступы не должны быть гомологичными последовательности-мишени.
В одном варианте осуществления каждый остаток смысловой нити и антисмысловой нити независимо модифицирован LNA, HNA, CeNA, 2’-метоксиэтилом, 2’-O-метилом, 2’-O-аллилом, 2’-C-аллилом, 2’-деокси, 2’-гидроксилом или 2’-фтором. Нити могут содержать более чем одну модификацию. В одном варианте осуществления каждый остаток смысловой нити и антисмысловой нити независимо модифицирован 2’-O-метилом или 2’-фтором.
Обычно на смысловой нити и антисмысловой нити имеется по меньшей мере две разные модификации. Этими двумя модификациями могут быть модификации 2’-O-метилом или 2’-фтором или другие.
В одном варианте осуществления Na и/или Nb содержат модификации чередующегося порядка. Термин «чередующийся мотив» в рамках настоящего изобретения относится к мотиву, имеющему одну или более модификаций, причем каждая модификация находится на чередующихся нуклеотидах одной нити. чередующийся нуклеотид может относиться к одному на каждые два нуклеотида или к одному на каждые три нуклеотида или к аналогичному порядку. Например, если каждый из A, B и C отображает один тип модификации в нуклеотиде, чередующийся мотив может быть «ABABABABABAB…», «AABBAABBAABB…», «AABAABAABAAB…», «AAABAAABAAAB…», «AAABBBAAABBB…» или «ABCABCABCABC…» и т.д.
Тип модификаций, содержащихся в чередующемся мотиве, может быть одинаковым или разным. Например, если каждый из A, B, C, D отображает один тип модификаций в нуклеотиде, чередующийся порядок, то есть модификации на каждые два нуклеотида, может быть таким же, но каждую из смысловой нити или антисмысловой нити можно выбирать из нескольких возможностей модификаций внутри чередующегося мотива, например, «ABABAB…», «ACACAC…» «BDBDBD…» или «CDCDCD…» и т.д.
В одном варианте осуществления средство РНКи согласно изобретению содержит сдвиг порядка модификаций для чередующегося мотива на смысловой нити относительно порядка модификаций для чередующегося мотива на антисмысловой нити. Сдвиг может быть такой, чтобы модифицированная группа нуклеотидов смысловой нити соответствовала иным образом модифицированной группе нуклеотидов антисмысловой нити и наоборот. Например, при спаривании смысловой нити с антисмысловой нитью в дуплексе дцРНК чередующийся мотив на смысловой нити может начинаться с «ABABAB» от 5’-3’ нити, а чередующийся мотив на антисмысловой нити может начинаться с «BABABA» от 5’-3’ нити внутри двойной области. В качестве еще одного примера, чередующийся мотив на смысловой нити может начинаться с «AABBAABB» от 5’-3’ нити, а чередующийся мотив на антисмысловой нити может начинаться с «BBAABBAA» от 5’-3’ нити внутри двойной области, так что происходит полный или частичный сдвиг порядков модификаций между смысловой нитью и антисмысловой нитью.
В одном варианте осуществления средство РНКи содержит порядок чередующегося мотива модификации 2’-O-метилом, а модификация 2’-F на смысловой нити первоначально имеет сдвиг относительно порядка чередующегося мотива модификации 2’-O-метилом и первоначальной модификации 2’-F на антисмысловой нити, то есть модифицированного 2'-O-метилом нуклеотида на паре оснований смысловой нити с 2'-F модифицированным нуклеотидом на антисмысловой нити и наоборот. 1 положение смысловой нити может начинаться с модификации 2'-F, и 1 положение антисмысловой нити может начинаться с модификации 2'-O-метилом.
Введение одного или более мотивов трех идентичных модификаций трех последовательных нуклеотидов в смысловую нить и/или антисмысловую нить нарушает первоначальный порядок модификаций, присутствующих на смысловой нити и/или антисмысловой нити. Это нарушение порядка модификаций смысловой и/или антисмысловой нити путем введения одного или более мотивов трех идентичных модификаций трех последовательных нуклеотидов в смысловую и/или антисмысловую нить неожиданно улучшает активность сайлесинга гена для гена-мишени.
В одном варианте осуществления, когда мотив трех идентичных модификаций трех последовательных нуклеотидов вводят в любую из нитей, модификация нуклеотида, следующего за мотивом, представляет собой иную модификацию, чем модификация мотива. Например, участок последовательности, содержащий мотив, представляет собой «…NaYYYNb…», где «Y» отображает модификацию мотива трех идентичных модификаций на три последовательные нуклеотид, а «Na» и «Nb» отображают модификацию нуклеотида, следующего за мотивом «YYY», который отличается от модификации Y, и где Na и Nb могут быть одинаковыми или разными модификациями. Альтернативно, Na и/или Nb могут иметься или отсутствовать при наличии wing модификации.
Средство РНКи может кроме того содержать по меньшей мере одну фосфоротиоатную или метилфосфонатную межнуклеотидную связь. Модификация фосфоротиоатной или метилфосфонатной межнуклеотидной связи может происходить в любом нуклеотиде смысловой нити или антисмысловой нити или на обеих нитях в любом положении нити. Например, модификация межнуклеотидной связи может происходить на каждом нуклеотиде на смысловой нити и/или антисмысловой нити; каждая модификация межнуклеотидной связи может происходить в чередующемся порядке на смысловой нити и/или антисмысловой нити; или смысловая нить или антисмысловая нить может содержать обе модификации межнуклеотидной связи в чередующемся порядке. чередующийся порядок модификации межнуклеотидной связи на смысловой нити может быть одинаковым или отличаться от антисмысловой нити, а чередующихся порядок модификации межнуклеотидной связи на смысловой нити может иметь сдвиг относительно чередующегося порядка модификации межнуклеотидной связи на антисмысловой нити.
В одном варианте осуществления РНКи содержит модификацию фосфоротиоатной или метилфосфонатной межнуклеотидной связи в выступающей области. Например, выступающая область может содержать два нуклеотида, имеющих фосфоротиоатную или метилфосфонатную межнуклеотидную связь между двумя нуклеотидами. Также модификацию межнуклеотидной связи можно получить для связывания нуклеотидов выступа с терминальными парными нуклеотидами внутри двойной области. Например, по меньшей мере 2, 3, 4 или все нуклеотиды выступа могут быть связаны посредством фосфоротиоатной или метилфосфонатной межнуклеотидной связи, и необязательно могут быть дополнительные фосфоротиоатные или метилфосфонатные межнуклеотидные связи, связывающие нуклеотид выступа с парным нуклеотидом, который находится вслед за нуклеотидом выступа. Например, могут быть по меньшей мере две фосфоротиоатные межнуклеотидные связи между тремя концевыми нуклеотидами, в которых два из трех нуклеотидов представляют собой нуклеотиды выступа, и третий представляет собой парный нуклеотид вслед за нуклеотидом выступа. Эти три терминальных нуклеотида могут быть на 3’-конце антисмысловой нити, 3’-конце смысловой нити, 5’-конце антисмысловой нити и/или 5’-конце антисмысловой нити.
В одном варианте осуществления выступ из 2 нуклеотидов находится на 3’-конце антисмысловой нити, а между тремя концевыми нуклеотидами имеется две фосфоротиоатные межнуклеотидные связи, причем двумя из трех нуклеотидов являются нуклеотиды выступа, а третий нуклеотид представляет собой парный нуклеотид вслед за нуклеотидом выступа. Необязательно, средство РНКи может дополнительно иметь две фосфоротиоатные межнуклеотидные связи между тремя концевыми нуклеотидами как на 5’-конце смысловой нити, так и на 5’-конце антисмысловой нити.
В одном варианте осуществления средство РНКи имеет несовпадение (несовпадения) с мишенью внутри дуплекса или их комбинации. «Несовпадением» может быть неканоническое спаривание оснований или не являющееся каноническим спаривание нуклеотидов. Несовпадение может находиться в выступающей области или двойной области. Пара оснований может быть ранжирована на основе их свойства способствовать диссоциации или плавлению (например, на основе свободной энергии ассоциации или диссоциации конкретного спаривания, самый простой подход состоит в том, чтобы исследовать пары на основе отдельных пар, хотя также можно использовать следующих соседей или аналогичный анализ). С точки зрения содействия диссоциации: A:U предпочтительнее, чем G:C; G:U предпочтительнее, чем G:C; а I:C предпочтительнее, чем G:C (I=инозин). Несовпадения, например, неканонические или не являющиеся каноническими спаривания (как описано в другом месте в данном документе) предпочтительнее, чем канонические (A:T, A:U, G:C) спаривания; а спаривания, которые содержат универсальное основание предпочтительнее, чем канонические спаривания. «универсальным основанием» является основание, которое демонстрирует способность к замене любого из четырех нормальных оснований (G, C, A, и U) без значимой дестабилизации взаимодействий в парах соседних оснований или нарушения ожидаемой функциональной биохимической утилитарности модифицированного олигонуклеотида. Неограничивающие примеры универсальных оснований включают в себя 2'-деоксиинозин (гипоксантиновый деоксинуклеотид) или его производные, аналоги нитроазола и гидрофобные ароматические основания без водородных связей.
В одном варианте осуществления средство РНКи содержит по меньшей мере одну из первых 1, 2, 3, 4 или 5 пар оснований внутри дуплексной области от 5’-конца антисмысловой нити, независимо выбираемых из группы: A:U, G:U, I:C, и несовпадающие пары, например, неканонические или не являющиеся каноническими спаривания или спаривания, которые содержат универсальное основание, что способствует диссоциации антисмысловой нити на 5’-конце дуплекса.
В одном варианте осуществления нуклеотид в 1 позиции внутри двойной области от 5’-конца на антисмысловой нити выбирают из группы, состоящей из A, dA, dU, U и dT. Альтернативно по меньшей мере одной из первых 1, 2 или 3 пар оснований внутри двойной области от 5’-конца антисмысловой нити является пара оснований AU. Например, первой парой оснований внутри двойной области от 5’-конца антисмысловой нити является пара оснований AU.
В другом варианте осуществления нуклеотидом на 3’-конце смысловой нити является деокси-тимин (dT). В другом варианте осуществления нуклеотидом на 3’-конце антисмысловой нити является деокси-тимин (dT). В одном варианте осуществления имеется короткая последовательность нуклеотидов деокси-тимин, например, два нуклеотида dT на 3’-конце смысловой и/или антисмысловой нити.
В одном варианте осуществления последовательность смысловой нити можно отобразить формулой (I):
причем:
каждый из i и j независимо составляет 0 или 1;
каждый из p и q независимо составляет 0-6;
каждый Na независимо представляет олигонуклеотидную последовательность, содержащую 0-25 модифицированных нуклеотидов, причем каждая последовательность содержит по меньшей мере два по-разному модифицированных нуклеотида;
каждый Nb независимо представляет олигонуклеотидную последовательность, содержащую 0-10 модифицированных нуклеотидов;
каждый из np и nq независимо представляет нуклеотид выступа;
причем Nb и Y имеют не одинаковую модификацию; а
каждый из XXX, YYY и ZZZ независимо представляет один мотив трех идентичных модификаций трех последовательных нуклеотидов. Предпочтительно YYY представляет все 2’-F модифицированные нуклеотиды.
В одном варианте осуществления Na и/или Nb содержат модификации чередующегося порядка.
В одном варианте осуществления мотив YYY находится в сайте расщепления смысловой нити или около него. Например, когда средство РНКи имеет двойную область длиной 17-23 нуклеотида, мотив YYY может находиться в сайте расщепления или около него (например: может находиться в позициях 6, 7, 8, 7, 8, 9, 8, 9, 10, 9, 10, 11, 10, 11,12 или 11, 12, 13) смысловой нити, причем отсчет начинается с 1-го нуклеотида от 5’-конца;, или необязательно отсчет начинается с 1-го парного нуклеотида внутри двойной области от 5’-конца.
В одном варианте осуществления i составляет 1, а j составляет 0, или i составляет 0, а j составляет 1, или оба i и j составляют 1. Следовательно, смысловая нить может быть представлена следующими формулами:
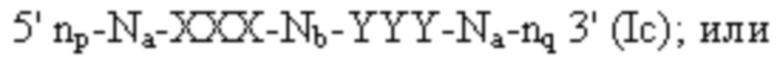
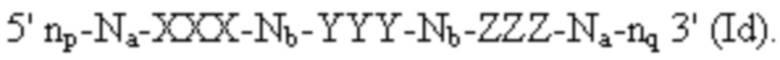
Когда смысловая нить представлена формулой (Ib), Nb представляет олигонуклеотидную последовательность, содержащую 0-10, 0-7, 0-5, 0-4, 0-2 или 0 модифицированных нуклеотидов. Каждый Na независимо может представлять олигонуклеотидную последовательность, содержащую 2-20, 2-15 или 2-10 модифицированных нуклеотидов.
Когда смысловая нить представлена в виде формулы (Ic), Nb представляет олигонуклеотидную последовательность, содержащую 0-10, 0-7, 0-10, 0-7, 0-5, 0-4, 0-2 или 0 модифицированных нуклеотидов. Каждый Na может независимо представлять олигонуклеотидную последовательность, содержащую 2-20, 2-15 или 2-10 модифицированных нуклеотидов.
Когда смысловая нить представлена в виде формулы (Id), каждый Nb независимо представляет олигонуклеотидную последовательность, содержащую 0-10, 0-7, 0-5, 0-4, 0-2 или 0 модифицированных нуклеотидов. Предпочтительно, Nb составляет 0, 1, 2, 3, 4, 5 или 6. Каждый Na может независимо представлять олигонуклеотидную последовательность, содержащую 2-20, 2-15 или 2-10 модифицированных нуклеотидов.
Каждый из X, Y и Z могут быть одинаковыми или отличаться друг от друга.
В других вариантах осуществления i составляет 0, и j составляет 0, а смысловую нить можно отобразить формулой:
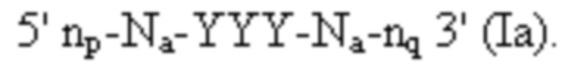
Когда смысловая нить представлена формулой (Ia), каждый Na независимо может представлять олигонуклеотидную последовательность, содержащую 2-20, 2-15 или 2-10 модифицированных нуклеотидов.
В одном варианте осуществления последовательность антисмысловой нити РНКи можно отобразить формулой (II):
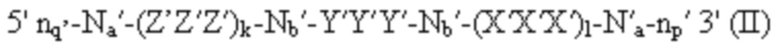
причем:
k и l каждый независимо составляет 0 или 1;
p’ и q’ каждый независимо составляет 0-6;
каждый Na′ независимо представляет олигонуклеотидную последовательность, содержащую 0-25 модифицированных нуклеотидов, причем каждая последовательность содержит по меньшей мере два по-разному модифицированных нуклеотида;
каждый Nb′ независимо представляет олигонуклеотидную последовательность, содержащую 0-10 модифицированных нуклеотидов;
каждый Np′ и nq′ независимо представляют нуклеотид выступа;
причем Nb’ и Y’ имеют не одинаковую модификацию;
а
X′X′X′, Y′Y′Y′ и Z′Z′Z′ каждый независимо представляет один мотив трех идентичных модификаций трех последовательных нуклеотидов.
В одном варианте осуществления Na’ и/или Nb’ содержат модификации чередующегося порядка.
Мотив Y′Y′Y′ находится в сайте расщепления антисмысловой нити или около него. Например, когда средство РНКи имеет двойную область длиной 17-23 нуклеотида, мотив Y′Y′Y′ может находиться в позициях 9, 10, 11; 10, 11, 12; 11, 12, 13; 12, 13, 14; или 13, 14, 15 антисмысловой нити, причем отсчет начинается с 1-го нуклеотида от 5’-конца;, или необязательно отсчет начинается с 1-го парного нуклеотида внутри двойной области от 5’-конца. Предпочтительно, мотив Y′Y′Y′ находится в позициях 11, 12, 13.
В одном варианте осуществления мотив Y′Y′Y′ составляют все 2’-OMe модифицированные нуклеотиды.
В одном варианте осуществления k составляет 1, а l составляет 0, или k составляет 0, а l составляет 1, или и k и l составляют 1.
Следовательно, антисмысловая нить может быть представлена следующими формулами:
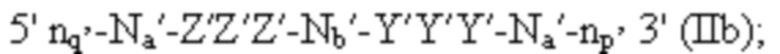
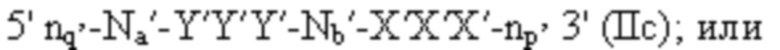
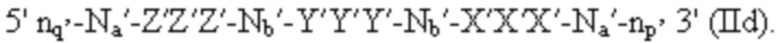
Когда антисмысловая нить представлена формулой (IIb), Nb’ представляет олигонуклеотидную последовательность, содержащую 0-10, 0-7, 0-10, 0-7, 0-5, 0-4, 0-2 или 0 модифицированных нуклеотидов. Каждый Na’ независимо представляет олигонуклеотидную последовательность, содержащую 2-20, 2-15 или 2-10 модифицированных нуклеотидов.
Когда антисмысловая нить представлена в виде формулы (IIc), Nb’ представляет олигонуклеотидную последовательность, содержащую 0-10, 0-7, 0-10, 0-7, 0-5, 0-4, 0-2 или 0 модифицированных нуклеотидов. Каждый Na’ независимо представляет олигонуклеотидную последовательность, содержащую 2-20, 2-15 или 2-10 модифицированных нуклеотидов.
Когда антисмысловая нить представлена в виде формулы (IId), каждый Nb’ независимо представляет олигонуклеотидную последовательность, содержащую 0-10, 0-7, 0-10, 0-7, 0-5, 0-4, 0-2 или 0 модифицированных нуклеотидов. Каждый Na’ независимо представляет олигонуклеотидную последовательность, содержащую 2-20, 2-15 или 2-10 модифицированных нуклеотидов. Предпочтительно, Nb составляет 0, 1, 2, 3, 4, 5 или 6.
В других вариантах осуществления k составляет 0, а l составляет 0, а антисмысловую нить можно отобразить формулой:
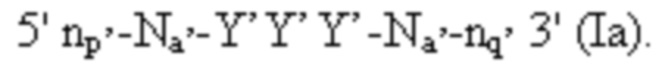
Когда антисмысловая нить представлена в виде формулы (IIa), каждый Na’ независимо представляет олигонуклеотидную последовательность, содержащую 2-20, 2-15 или 2-10 модифицированных нуклеотидов.
Каждый из X′, Y′ и Z′ могут быть одинаковыми или отличаться друг от друга.
Каждый нуклеотид смысловой нити и антисмысловой нити может быть независимо модифицирован LNA, HNA, CeNA, 2’-метоксиэтилом, 2’-O-метилом, 2’-O-аллилом, 2’-C-аллилом, 2’-гидроксилом или 2’-фтором. Например, каждый нуклеотид смысловой нити и антисмысловой нити независимо модифицирован 2’-O-метилом или 2’-фтором. Каждый X, Y, Z, X′, Y′ и Z′, в частности, может представлять модификации 2’-O-метилом или модификации 2’-фтором.
В одном варианте осуществления смысловая нить средства РНКи может содержать мотив YYY, находящийся в 9, 10 и 11 позициях нити, когда двойная область составляет 21 нуклеотид, причем отсчет начинается с 1-го нуклеотида от 5’-конца, или необязательно отсчет начинается с 1-го парного нуклеотида внутри двойной области от 5’-конца; и Y отображает модификации 2’-F. Смысловая нить может дополнительно содержать мотив XXX или мотивы ZZZ в качестве wing модификаций на противоположном конце дуплексной области; и XXX и ZZZ каждый независимо представляет модификацию 2’-OMe или модификацию 2’-F.
В одном варианте осуществления антисмысловая нить может содержать мотив Y′Y′Y′, находящийся в позициях 11, 12, 13 нити, причем отсчет начинается с 1-го нуклеотида от 5’-конца, или необязательно отсчет начинается с 1-го парного нуклеотида внутри двойной области от 5’-конца; а Y′ отображает модификации 2’-O-метилом. Антисмысловая нить может дополнительно содержать мотив X′X′X′ или мотивы Z′Z′Z′ в качестве wing модификаций на противоположном конце дуплексной области; и X′X′X′ и Z′Z′Z′ каждый независимо представляет модификацию 2’-OMe или модификацию 2’-F.
Смысловая нить, представленная любой из приведенных выше формул (Ia) (Ib) (Ic) и (Id), образует дуплекс с антисмысловой нитью, представленной любой из формул (IIa) (IIb) (IIc) и (IId), соответственно.
Соответственно, средства РНКи для применения в способах согласно изобретению могут содержать смысловую нить и антисмысловую нить, причем каждая нить имеет 14-30 нуклеотидов, РНКи дуплекс, представленный формулой (III):
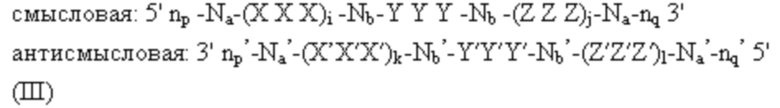
причем:
i, j, k и l каждый независимо составляет 0 или 1;
p, p′, q и q′ каждый независимо составляет 0-6;
каждый Na и Na’ независимо представляет олигонуклеотидную последовательность, содержащую 0-25 модифицированных нуклеотидов, причем каждая последовательность содержит по меньшей мере два по-разному модифицированных нуклеотида;
каждый Nb и Nb’ независимо представляет олигонуклеотидную последовательность, содержащую 0-10 модифицированных нуклеотидов;
причем
каждый Np’, np, nq’ и nq, каждый из которых может присутствовать или не присутствовать, независимо отображает нуклеотид выступа; а
XXX, YYY, ZZZ, X′X′X′, Y′Y′Y′ и Z′Z′Z′ каждый независимо представляет один мотив трех идентичных модификаций трех последовательных нуклеотидов.
В одном варианте осуществления i составляет 0, а j составляет 0; или i составляет 1, а j составляет 0; или i составляет 0, а j составляет 1; или и i и j составляют 0; или оба i и j составляют 1. В другом варианте осуществления k составляет 0, а l составляет 0; или k составляет 1, а l составляет 0; k составляет 0, а l составляет 1; или и k и l составляют 0; или и k и l составляют 1.
Иллюстративные комбинации смысловой нити и антисмысловой нити, образующих РНКи дуплекс, включают в себя формулы ниже:
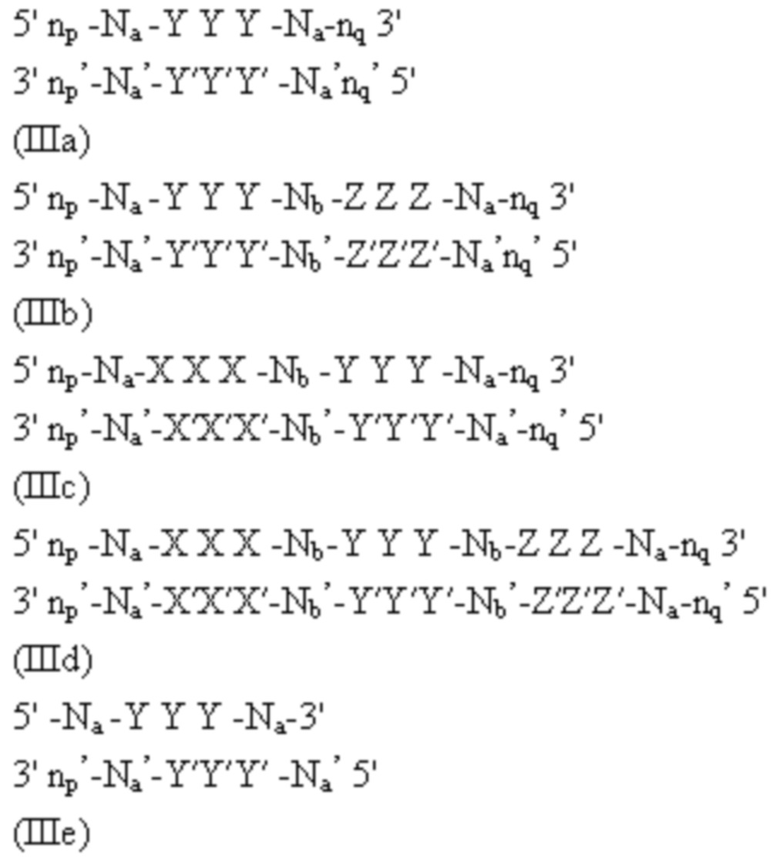
Когда средство РНКи представлено формулой (IIIa), каждый Na независимо представляет олигонуклеотидную последовательность, содержащую 2-20, 2-15 или 2-10 модифицированных нуклеотидов.
Когда средство РНКи представлено формулой (IIIb), каждый Nb независимо представляет олигонуклеотидную последовательность, содержащую 1-10, 1-7, 1-5 или 1-4 модифицированных нуклеотида. Каждый Na независимо представляет олигонуклеотидную последовательность, содержащую 2-20, 2-15 или 2-10 модифицированных нуклеотидов.
Когда средство РНКи представлено формулой (IIIc), каждый Nb, Nb’ независимо представляет олигонуклеотидную последовательность, содержащую 0-10, 0-7, 0-10, 0-7, 0-5, 0-4, 0-2 или 0 модифицированных нуклеотидов. Каждый Na независимо представляет олигонуклеотидную последовательность, содержащую 2-20, 2-15 или 2-10 модифицированных нуклеотидов.
Когда средство РНКи представлено формулой (IIId), каждый Nb, Nb’ независимо представляет олигонуклеотидную последовательность, содержащую 0-10, 0-7, 0-10, 0-7, 0-5, 0-4, 0-2 или 0 модифицированных нуклеотидов. Каждый Na, Na’ независимо представляет олигонуклеотидную последовательность, содержащую 2-20, 2-15 или 2-10 модифицированных нуклеотидов. Каждый из Na, Na’, Nb и Nb’ независимо содержит модификации чередующегося порядка.
Когда средство РНКи представлено формулой (IIId), каждый Nb, Nb’ независимо представляет олигонуклеотидную последовательность, содержащую 0-10, 0-7, 0-10, 0-7, 0-5, 0-4, 0-2 или 0 модифицированных нуклеотидов. Каждый Na, Na’ независимо представляет олигонуклеотидную последовательность, содержащую 2-20, 2-15 или 2-10 модифицированных нуклеотидов. Каждый из Na, Na’, Nb и Nb’ независимо содержит модификации чередующегося порядка.
Когда средство РНКи представлено формулой (IIIe), каждый Na и Na′ независимо представляет олигонуклеотидную последовательность, содержащую 0-25 нуклеотидов, которые являются либо модифицированными, либо немодифицированными, или их комбинации, причем каждая последовательность содержит по меньшей мере два по-разному модифицированных нуклеотида.
Каждый из X, Y и Z в формулах (III), (IIIa), (IIIb), (IIIc), (IIId) и (IIIe) могут быть одинаковыми или отличаться друг от друга.
Когда средство РНКи представлено формулой (III), (IIIa), (IIIb), (IIIc), (IIId) и (IIIe), по меньшей мере один из нуклеотидов Y может образовывать пару оснований с одним из нуклеотидов Y′. Альтернативно по меньшей мере два нуклеотида Y образуют пары оснований с соответствующими нуклеотидами Y′; или все три нуклеотида Y все образуют пары оснований с соответствующими нуклеотидами Y′.
Когда средство РНКи представлено формулой (IIIb) или (IIId) по меньшей мере один из нуклеотидов Z может образовывать пару оснований с одним из нуклеотидов Z′. Альтернативно по меньшей мере два из нуклеотидов Z образуют пары оснований с соответствующими нуклеотидами Z′; или все три нуклеотида Z все образуют пары оснований с соответствующими нуклеотидами Z′.
Когда средство РНКи представлено формулой (IIIc) или (IIId), по меньшей мере один из нуклеотидов X может образовывать пару оснований с одним из нуклеотидов X′. Альтернативно по меньшей мере два нуклеотида X образуют пары оснований с соответствующими нуклеотидами X′; или все три нуклеотида X все образуют пары оснований с соответствующими нуклеотидами X′.
В одном варианте осуществления модификация нуклеотида Y отличается от модификации нуклеотида Y’, модификация нуклеотида Z отличается от модификации нуклеотида Z’, и/или модификация нуклеотида X отличается от модификации нуклеотида X’.
В одном варианте осуществления, когда средство РНКи представлено формулой (IIId), модификации Na представляют модификации 2′-O-метилом или 2′-фтором. В другом варианте осуществления, когда средство РНКи представлено формулой (IIId), модификации Na представляют модификации 2′-O-метилом или 2′-фтором, и np′ >0, а по меньшей мере один np′ связан с соседним нуклеотидом фосфоротиоатной связью. В еще одном варианте осуществления, когда средство РНКи представлено формулой (IIId), модификации Na представляют модификации 2В одном варианте осуществления, когда средство РНКи -O-метилом или 2В одном варианте осуществления, когда средство РНКи -фтором, np′ >0, а по меньшей мере один np′ связан с соседним нуклеотидом фосфоротиоатной связью, и смысловая нить конъюгирована с одним или более производными GalNAc, присоединенными через моновалентный, бивалентный или трехвалентный разветвленный линкер. В другом варианте осуществления, когда средство РНКи представлено формулой (IIId), модификации Na представляют модификации 2В одном варианте осуществления, когда средство РНКи -O-метилом или 2В одном варианте осуществления, когда средство РНКи -фтором, np′ >0, а по меньшей мере один np′ связан с соседним нуклеотидом фосфоротиоатной связью, смысловая нить содержит по меньшей мере одну фосфоротиоатную связь, и смысловая нить конъюгирована с одним или более производными GalNAc, присоединенными через моновалентный, бивалентный или трехвалентный разветвленный линкер.
В одном варианте осуществления, когда средство РНКи представлено формулой (IIIa), модификации Na представляют модификации 2В одном варианте осуществления, когда средство РНКи -O-метилом или 2В одном варианте осуществления, когда средство РНКи -фтором, np′ >0, а по меньшей мере один np′ связан с соседним нуклеотидом фосфоротиоатной связью, смысловая нить содержит по меньшей мере одну фосфоротиоатную связь, и смысловая нить конъюгирована с одним или более производными GalNAc, присоединенными через моновалентный, бивалентный или трехвалентный разветвленный линкер.
В одном варианте осуществления средство РНКи представляет собой мультимер, содержащий по меньшей мере два дуплекса, представленных формулой (III), (IIIa), (IIIb), (IIIc), (IIId) и (IIIe), причем дуплексы связаны линкером. Линкер может быть расщепляемым или нерасщепляемым. Необязательно, мультимер кроме того содержит лиганд. Каждый из дуплексов может выделять один и тот же ген или два разных гена; или каждый из дуплексов может выделять один и тот же ген в двух разных сайтах-мишенях.
В одном варианте осуществления средство РНКи представляет собой мультимер, содержащий три, четыре, пять, шесть или более дуплексов, представленных формулой (III), (IIIa), (IIIb), (IIIc), (IIId) и (IIIe), причем дуплексы связаны линкером. Линкер может быть расщепляемым или нерасщепляемым. Необязательно, мультимер кроме того содержит лиганд. Каждый из дуплексов может выделять один и тот же ген или два разных гена; или каждый из дуплексов может выделять один и тот же ген в двух разных сайтах-мишенях.
В одном варианте осуществления два средства РНКи, представленных формулой (III), (IIIa), (IIIb), (IIIc), (IIId) и (IIIe), связаны друг с другом на 5-конце, а один или оба 3’-конца необязательно конъюгированы с лигандом. Каждое из средств может выделять один и тот же ген или два разных гена; или каждое из средств может выделять один и тот же ген в двух разных сайтах-мишенях.
В разных публикациях описаны мультимерные средства РНКи, которые можно использовать в способах согласно изобретению. Такие публикации включают в себя WO2007/091269, патент США № 7858769, WO2010/141511, WO2007/117686, WO2009/014887 и WO2011/031520, все содержание каждого из которых включено настоящим в данный документ посредством ссылки.
Средство РНКи, которое содержит конъюгации одного или более углеводных фрагментов со средством РНКи, может оптимизировать одно или более свойств средства РНКи. Во многих случаях углеводный фрагмент будет присоединен к модифицированной субъединице средства РНКи. Например, сахар рибоза одной или более рибонуклеотидных субъединиц средства дцРНК можно заменить на другой фрагмент, например, неуглеводный (предпочтительно циклический) носитель, к которому присоединен углеводный лиганд. рибонуклеотидная субъединица, в которой сахар рибоза субъединицы был заменен таким образом, упоминается в данном документе, как субъединица модификации замещения рибозы (RRMS). Циклический носитель может представлять собой карбоциклическую кольцевую систему, то есть все атомы кольца представляют собой атомы углерода, или гетероциклическую кольцевую систему, то есть один или более атомов кольца могут представлять собой гетероатом, например, азот, кислород, серу. Циклический носитель может представлять собой моноциклическую кольцевую системв или может содержать два или более колец, например, слитых колец. Циклический носитель может представлять собой полностью насыщенную кольцевую систему, или он может содержать одну или более двойных связей.
Лиганд может быть присоединен к полинуклеотиду посредством носителя. Носители содержат (i) по меньшей мере одну «точку присоединения к остову», предпочтительно две «точки присоединения к остову» и (ii) по меньшей мере одну «связывающую точку присоединения». «Точка присоединения к остову» в рамках настоящего изобретения относится к функциональной группе, например, гидроксильной группе, или в общем, к связи, доступной для включения носителя в остов, и которая подходит для этого, например, к фосфату или к модифицированному фосфату, например, в серосодержащий остов рибонуклеиновой кислоты. «Связывающая точка присоединения» (TAP) в некоторых вариантах осуществления относится к атому составного кольца циклического носителя, например, к атому углерода или гетероатому (отличному от атома, который обеспечивает точку присоединения к остову), который связывает выбранный фрагмент. Фрагментом может быть, например, углевод, например, моносахарид, дисахарид, трисахарид, тетрасахарид, олигосахарид и полисахарид. Необязательно, выбранный фрагмент связан с помощью промежуточной связи с циклическим носителем. Таким образом, циклический носитель будет часто содержать функциональную группу, например, аминогруппу, или в общем обеспечивать связь, которая подходит для включения или связывания с составным кольцом другого химического структурного элемента, например, лиганда.
Средства РНКи могут быть конъюгированы с лигандом посредством носителя, причем носителем может быть циклическая группа или ациклическая группа; предпочтительно, циклическую группу выбирают из пирролидинила, пиразолинила, пиразолидинила, имидазолинила, имидазолидинила, пиперидинила, пиперазинила, [1,3]диоксолана, оксазолидинила, изоксазолидинила, морфолинила, тиазолидинила, изотиазолидинила, квиноксалинила, пипридазинолила, тетрагидрофурила и декалина; предпочтительно, ациклическую группу выбирают из серинолового остова или диэтаноламинового остова.
В некоторых конкретных вариантах осуществления средством РНКи для применения в способах согласно изобретению является AT3SC-001 (AD-57213 - Смысловая нить: 5’-GfsgsUfuAfaCfaCfCfAfuUfuAfcUfuCfaAf-3’ (SEQ ID NO:13) и Антисмысловая нить: 5’-usUfsgAfaGfuAfaAfuggUfgUfuAfaCfcsasg-3’ (SEQ ID NO:14), причем a, c, g и u представляют 2′-O-метил (2′-OMe) A, C, G или U; Af, Cf, Gf или Uf представляют 2′-фтор A, C, G или U; а s представляет фосфоротиоатную связь.
Эти средства могут кроме того содержать лиганд.
Лиганды
Средства двухцепочечной РНК (дцРНК) согласно изобретению могут необязательно быть конъюгированы с одним или более лигандами. Лиганд можно присоединить к смысловой нити, антисмысловой нити или к обеим нитям на 3’-конце, 5’-конце или на обоих концах. Например, лиганд может быть конъюгирован со смысловой нитью. В предпочтительных вариантах осуществления лиганд конъюгирован с 3’-концом смысловой нити.
В одном варианте осуществления лиганд представляет собой углеводный конъюгат, такой как моносахарид. В одном варианте осуществления лигандом является N-ацетилгалактозамин (GalNAc) GalNAc или производное GalNAc. В некоторых вариантах осуществления изобретения GalNAc или производное GalNAc присоединяют к средству иРНК согласно изобретению посредством моновалентного линкера. В некоторых вариантах осуществления GalNAc или производное GalNAc присоединяют к средству иРНК согласно изобретению посредством бивалентного линкера. В других вариантах осуществления изобретения GalNAc или производное GalNAc присоединяют к средству иРНК согласно изобретению посредством трехвалентного линкера.
В одном варианте осуществления углеводный конъюгат для использования в композициях и способах согласно изобретению выбирают из группы, состоящей из:
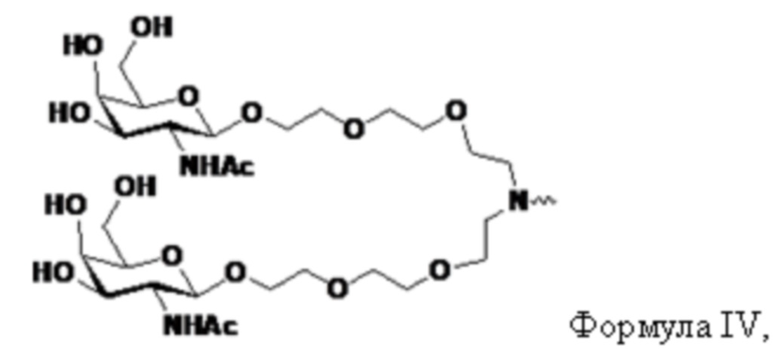
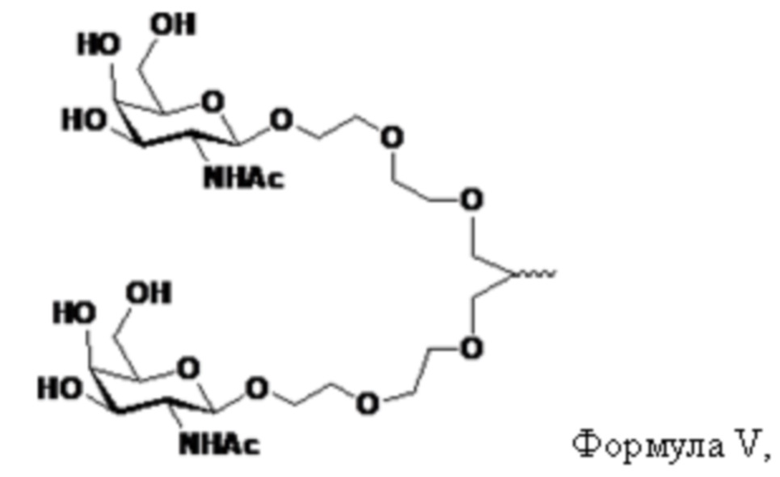
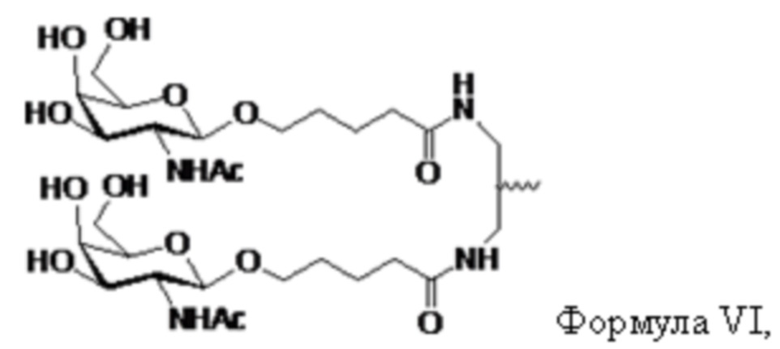
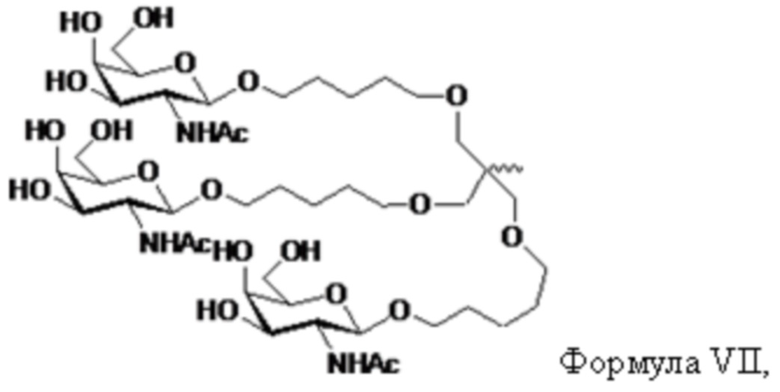
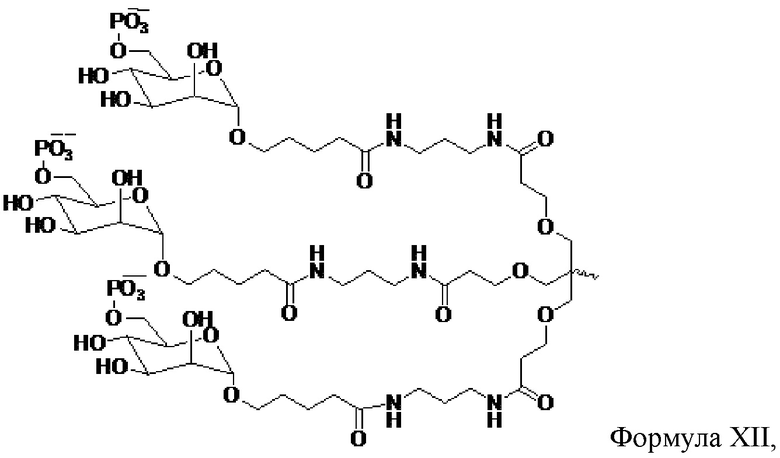
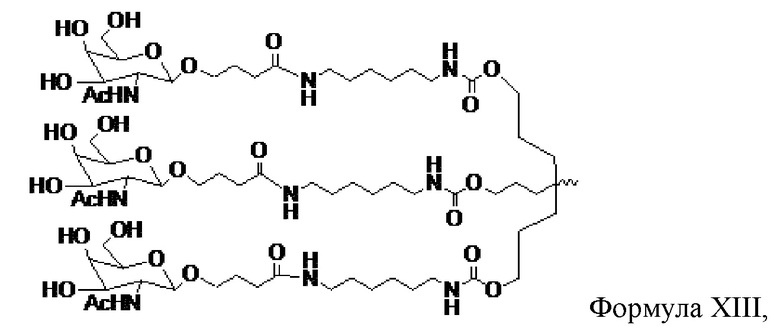
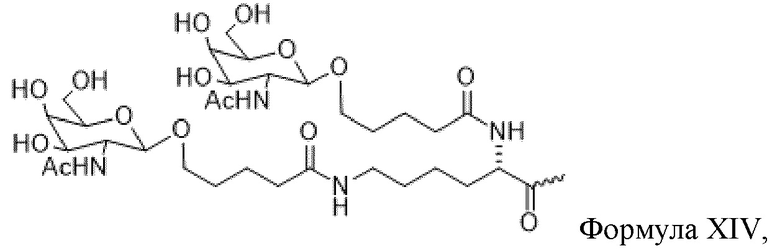
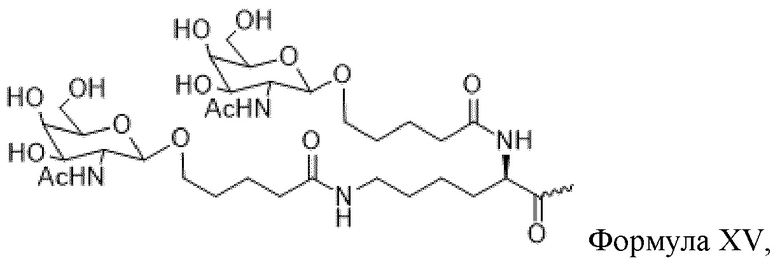
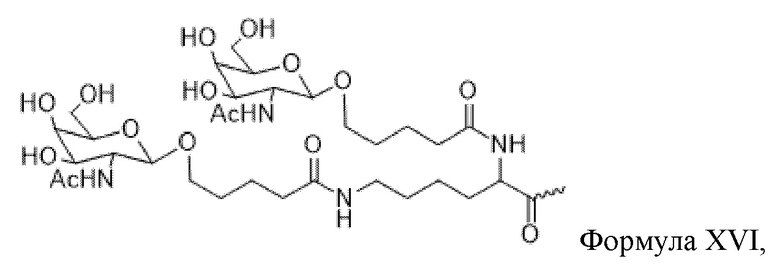
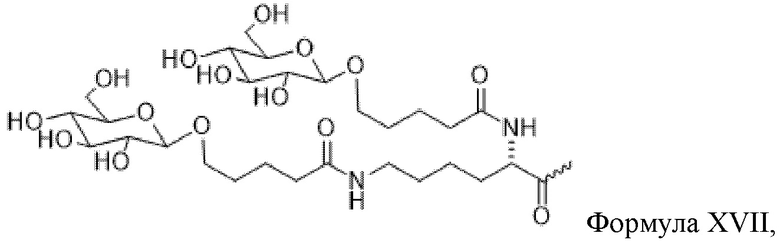
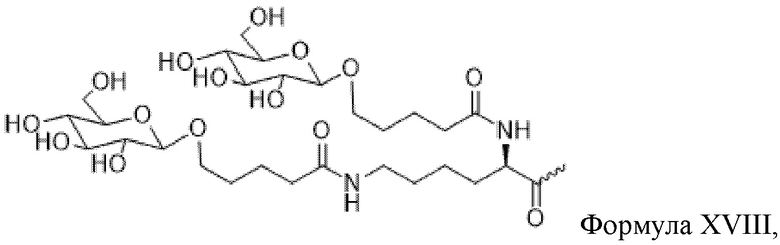
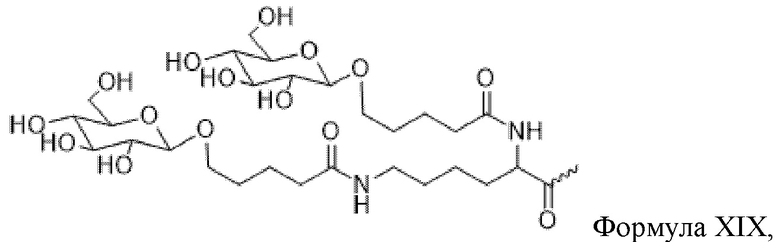
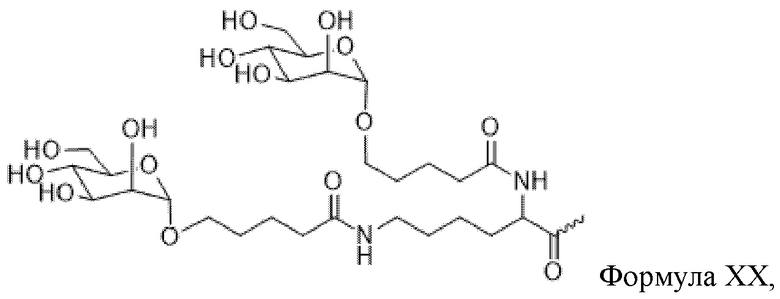
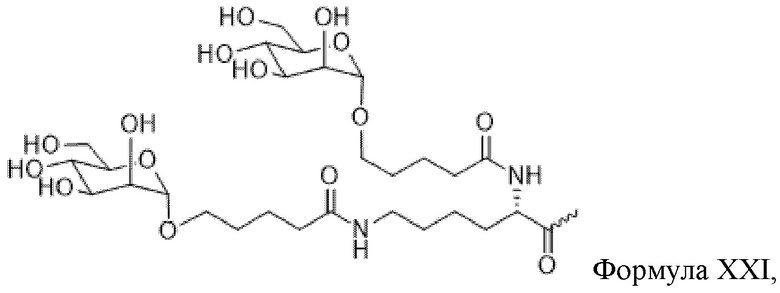
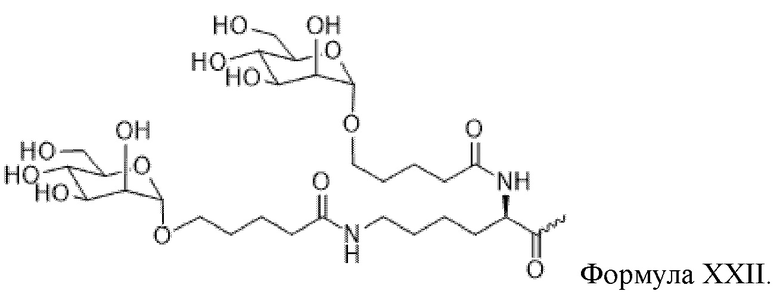
В одном варианте осуществления GalNAc или производным GalNAc является GalNAc3:
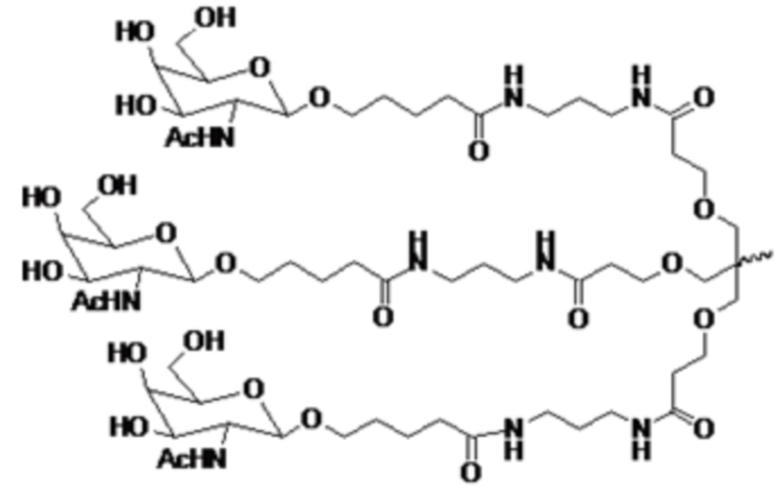 .
.
В некоторых вариантах осуществления лиганд, например, лиганд GalNAc, присоединяют к 3′-концу средства РНКи. В одном варианте осуществления средство РНКи конъюгировано с лигандом, например, лигандом GalNAc, как показано на следующей схеме
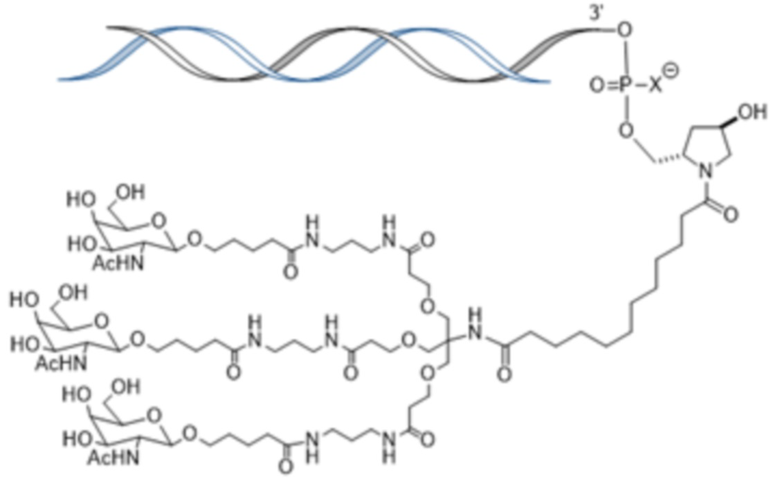
причем X представляет O или S. В одном варианте осуществления X представляет O.
Большое множество структурных единиц можно связать со средствами РНКи согласно настоящему изобретению. Предпочтительными фрагментами являются лиганды, которые соединяют, предпочтительно ковалентно, либо прямо или непрямо посредством промежуточной связи.
В предпочтительных вариантах осуществления лиганд изменяет распределение, нацеливание или время жизни молекулы, в которую он включен. В предпочтительных вариантах осуществления лиганд обеспечивает повышенную аффинность к выбранной мишени, например, молекуле, клетке или типу клеток, компартменту, рецептору, например, компартменту клетки или органа, ткани, органу или области организма, например, по сравнению с объектами, у которых отсутствует такой лиганд. Лиганды, обеспечивающие повышенную аффинность к выбранной мишени, также назваются нацеливающими лигандами.
Некоторые лиганды могут иметь эндосомолитические свойства. Эндосомолитические лиганды способствуют лизису эндосомы и/или транспортировке композиций согласно изобретению или ее компонентов из эндосомы в цитоплазму клетки. Эндосомолитическим лигандом может быть полианионный пептид или пептидомиметик, который показывает pH-зависимую мембранную активность и фузогенность. В одном варианте осуществления эндосомолитический лиганд принимает свою активную конформацию при эндосомном pH. «Активной» конформацией является конформация, в которой эндосомолитический лиганд способствует лизису эндосомы и/или транспортировке композиции согласно изобретению или ее компонентов из эндосомы в цитоплазму клетки. Иллюстративные эндосомолитические лиганды включают в себя GALA пептид (Subbarao et al., Biochemistry, 1987, 26: 2964-2972), EALA пептид (Vogel et al., J. Am. Chem. Sос., 1996, 118: 1581-1586) и их производные (Turk et al., Biochem. Biophys. Acta, 2002, 1559: 56-68). В одном варианте осуществления эндосомолитический компонент может содержать химическую группу (например, аминокислоту), которая будет подвергаться изменению заряда или протонированию в ответ на изменение pH. Эндосомолитический компонент может быть линейным или разветвленным.
Лиганды могут улучшать транспортировку, гибридизацию и свойства специфичности и также могут улучшать устойчивость к нуклеазе полученного натурального или модифицированного олигорибонуклеотида или полимерной молекулы, содержащей любую комбинацию мономеров, описанных в данном документе, и/или натуральных или модифицированных рибонуклеотидов.
Лиганды в общем могут содержать терапевтические модификаторы, например, для улучшения поглощения; диагностические соединения или репортерные группы, например, для контроля распределения; сшивающие средства; и придающие устойчивость к нуклеазе фрагменты. Общие примеры включают в себя липиды, стероиды, витамины, сахара, белки, пептиды, полиамины и пептидные миметики.
Лиганды могут включать в себя вещество природного происхождения, такое как белок (например, альбумин сыворотки человека (HSA), липопротеин низкой плотности (LDL), липопротеин высокой плотности (HDL) или глобулин); углевод (например, декстран, пуллулан, хитин, хитозан, инулин, циклодекстрин или гиалуроновую кислоту); или липид. Лигандом также может быть рекомбинантная или синтетическая молекула, такая как синтетический полимер, например, синтетическая полиаминокислота, олигонуклеотид (например, аптамер). Примеры полиаминокислот включают в себя полиаминокислоту, представляющую собой полилизин (PLL), поли L-аспарагиновую кислоту, поли L-глутаминовую кислоту, сополимер стирола и ангидрида малеиновой кислоты, сополимер поли(L-лактида-ко-гликолидом), сополимер дивинилового эфира и малеинового ангидрида, сополимер N-(2-гидроксипропил)метакриламида (HMPA), полиэтиленгликоль (PEG), поливиниловый спирт (PVA), полиуретан, поли(2-этилакриловую кислоту), N-изопропилакриламидные полимеры или полифосфазин. Примеры полиаминов включают в себя: полиэтиленимин, полилизин (PLL), спермин, спермидин, полиамин, псевдопептид-полиамин, пептидомиметический полиамин, дендримерный полиамин, аргинин, амидин, протамин, катионный липид, катионный порфирин, четвертичную соль полиамина или альфа-спиральный пептид.
Лиганды также могут содержать нацеливающие группы, например, нацеливающее на клетку или ткань средство, например, лектин, гликопротеин, липид или белок, например, антитело, которое связывается с указанным типом клеток, таким как клетка почки. Нацеливающей группой может быть тиротропин, меланотропин, лектин, гликопротеин, поверхностно-активный белок A, углевод муцина, мультивалентная лактоза, мультивалентная галактоза, N-ацетил-галактозамин, N-ацетил-глюкозамин, мультивалентная манноза, мультивалентная фукоза, гликозилированные полиаминокислоты, мультивалентная галактоза, трансферрин, бисфосфонат, полиглутамат, полиаспартат, липид, холестерин, стероид, желчная кислота, фолат, витамин B12, биотин, RGD пептид, RGD пептидомиметик или аптамер.
Другие примеры лигандов включают в себя красители, интеркалирующие агенты (например, акридины), перекрестносшивающие средства (например, псорален, митомицин C), порфирины (TPPC4, тексафирин, сапфирин), полициклические ароматические углеводы (например, феназин, дигидрофеназин), искусственные эндонуклеазы или хелатор (например, EDTA), липофильные молекулы, например, холестерин, холевую кислоту, адамантан-уксусную кислоту, 1-пирен масляную кислоту, дигидротестoстерон, 1,3-бис-O(гексадецил)глицерин, геранилоксигексильную группу, гексадецилглицерин, борнеол, ментол, 1,3-пропaндиол, гептадецильную группу, пальмитиновую кислоту, миристиновую кислоту, O3-(олеоил)литохолевую кислоту, O3-(олеоил)холеновую кислоту, диметокситритил или феноксазин) и конъюгаты пептидов (например, пептид antennapedia, пептид Tat), алкилирующие средства, фосфат, амино, меркапто, PEG (например, PEG-40K), MPEG, [MPEG]2, полиамино, алкил, замещенный алкил, радиомеченые маркеры, ферменты, гаптены (например, биотин), стимуляторы транспорта/абсорбции (например, аспирин, витамин E, фолиевая кислота), синтетические рибонуклеазы (например, имидазол, бизимидазол, гистамин, кластеры имидазола, конъюгаты акридина-имидазола, Eu3+ комплексы тетраазамакроциклы), динитрофенил, HRP или AP.
Лиганды могут представлять собой белки, например, гликопротеины или пептиды, например, молекулы, имеющие специфическую аффинность к колиганду, или антитела, например, антитело, которое связывается с указанным типом клеток, например, с раковой клеткой, эндотелиальной клеткой или костной клеткой. Лиганды также могут представлять собой гормоны и рецепторы гормонов. Они также могут представлять собой непептидные виды, такие как липиды, лектины, углеводы, витамины, кофакторы, мультивалентную лактозу, мультивалентную галактозу, N-ацетил-галактозамин, N-ацетил-глюкозамин, мультивалентную маннозу, мультивалентную фукозу или аптамеры. Лигандом может быть, например, липополисахарид, активатор p38 MAP киназы или активатор NF-κB.
Лигандом может быть вещество, например, лекарственное средство, которое может увеличивать поглощение средства иРНК в клетку, например, за счет разрушения клеточного цитоскелета, например, за счет разрушения клеточных микротрубочек, микрофиламентов и/или промежуточных филаментов. Лекарственным средством может быть, например, таксон, винкристин, винбластин, цитохалазин, нокодазол, джасплакинолид, латрункулин A, фаллоидин, свинголид A, инданоцин или миосервин.
Лиганд может увеличивать поглощение олигонуклеотида в клетку путем, например, активации противовоспалительного ответа. Иллюстративные лиганды, которые будут иметь такое влияние, включают в себя фактор альфа некроза опухоли (TNFальфа), интерлейкин-1 бета или интерферон гамма.
В одном аспекте лиганд представляет собой липид или основанную на липиде молекулу. Такой липид или основанная на липиде молекула предпочтительно связывает сывороточный белок, например, альбумин сыворотки человека (HSA). Связывающий HSA лиганд обеспечивает распределение конъюгата в ткани-мишени, например, в непочечные ткани-мишени организма. Например, тканью-мишенью может быть печень, содержащая паренхимные клетки печени. В качестве лигандов также можно использовать другие молекулы, которые могут связывать HSA. Например, можно использовать напроксен или аспирин. Липид или основанный на липиде лиганд может (a) повышать устойчивость к деградации конъюгата, (b) повышать нацеливание или транспортировку в клетку-мишень или клеточную мембрану, и/или (c) его можно использовать для регулирования связывания с сывороточным белком, например, HSA.
Основанный на липиде лиганд можно использовать для модулирования, например, управления связывания конъюгата с тканью-мишенью. Например, менее вероятно, что липид или основанный на липиде лиганд, который связывается с HSA более сильно, будет нацелен на почку и, следовательно, менее вероятно будет выводиться из организма. Липид или основанный на липиде лиганд, который связывается с HSA менее сильно, можно использовать для нацеливания конъюгата на почку.
В предпочтительном варианте осуществления основанный на липиде лиганд связывает HSA. Предпочтительно, он связывает HSA с достаточной аффинностью, так что конъюгат будет предпочтительно распределяться в непочечную ткань. Однако предпочтительно, чтобы аффинность не была настолько сильной, чтобы связывание HSA-лиганд не могло быть обратимым.
В другом предпочтительном варианте осуществления основанный на липиде лиганд связывает HSA слабо или не связывает совсем, так что конъюгат предпочтительно будет распределяться в почку. Вместо или в дополнение к основанному на липиде лиганду также можно использовать другие фрагменты, которые нацелены на клетки почки.
В другом аспекте лиганд представляет собой фрагмент, например, витамин, который поглощается клеткой-мишенью, например, пролиферирующей клеткой. Они особенно полезны для лечения нарушений, характеризующихся нежелательной пролиферацией клеток, например, злокачественного или незлокачественного типа, например, раковых клеток. Иллюстративные витамины включают в себя витамин A, E и K. Другие иллюстративные витамины включают в себя витамины B, например, фолиевую кислоту, B12, рибофлавин, биотин, пиридоксал или другие витамины или питательные вещества, поглощаемые раковыми клетками. Также включены HAS, липопротеин низкой плотности (LDL) и липопротеин высокой плотности (HDL).
В другом аспекте лиганд представляет собой проникающее в клетку средство, предпочтительно спиральное проникающее в клетку средство. Предпочтительно, средство является амфипатическим. Иллюстративным средством является пептид, такой как tat или antennopedia. Если средством является пептид, оно может быть модифицированным, включая пептидилмиметик, инвертомеры, непептидные или псевдо-пептидные связи и использование D-аминокислот. Спиральное средство предпочтительно представляет собой альфа-спиральное средство, которое предпочтительно имеет липофильную и липофобную фазу.
Лигандом может быть пептид или пептидомиметик. Пептидомиметик (также упоминаемый в данном документе, как олигопептидомиметик) представляет собой молекулу, способную складываться в определенную трехмерную структуру, аналогичную натуральному пептиду. фрагмент пептида или пептидомиметика может иметь длину приблизительно 5-50 аминокислот, например, длину приблизительно 5, 10, 15, 20, 25, 30, 35, 40, 45 или 50 аминокислот. Пептидом или пептидомиметиком может быть, например, проникающий в клетку пептид, катионный пептид, амфипатический пептид или гидрофобный пептид (например, состоящий главным образом из Tyr, Trp или Phe). Пептидным фрагментом может быть дендримерный пептид, конформационно ограниченный пептид или сшитый пептид. В другом альтернативном варианте пептидный фрагмент может содержать последовательность транслокации через гидрофобную мембрану (MTS). Иллюстративным гидрофобным содержащим MTS пептидом является RFGF, имеющий аминокислотную последовательность AAVALLPAVLLALLAP (SEQ ID NO: 9). Аналог RFGF (например, аминокислотная последовательность AALLPVLLAAP (SEQ ID NO: 10)), содержащий гидрофобную MTS, также может быть нацелен на фрагмент. Пептидным фрагментом может быть «доставляющий» пептид, который может переносить большие полярные молекулы, включая пептиды, олигонуклеотиды и белок, через клеточные мембраны. Например, было обнаружено, что последовательности из белка HIV Tat (GRKKRRQRRRPPQ (SEQ ID NO: 11)) и белка Drosophila Antennapedia (RQIKIWFQNRRMKWKK (SEQ ID NO: 12)) способны функционировать в качестве доставляющих пептидов. Пептид или пептидомиметик может быть закодирован произвольной последовательностью ДНК, например, пептид, идентифицированный из библиотеки фагового дисплея или комбинаторной библиотеки одна гранула - одно соединение (OBOC) (Lam et al., Nature, 354:82-84, 1991). Предпочтительно пептид или пептидомиметик, связанный со средством иРНК, посредством включенного мономерного звена, представляет собой нацеленный на клетку пептид, такой как аргинин-глицин-аспарагиновая кислота (RGD)-пептид или RGD миметик. Пептидный фрагмент может варьировать в длину от приблизительно 5 аминокислот до приблизительно 40 аминокислот. Пептидные фрагменты могут иметь структурную модификацию, например, для увеличения стабильности или направления конформационных свойств. Можно использовать любые структурные модификации, описанные ниже. RGD пептидный фрагмент можно использовать для нацеливания на опухолевую клетку, например, на эндотелиальную опухолевую клетку или опухолевую клетку рака молочной железы (Zitzmann et al., Cancer Res. 62:5139-43, 2002). RGD пептид может облегчать нацеливание средства иРНК на опухоли множества других тканей, включая легкие, почку, селезенку или печень (Aoki et al., Cancer Gene Therapy 8:783-787, 2001). Предпочтительно, RGD пептид облегчит нацеливание средства иРНК на почку. RGD пептид может быть линейным или циклическим, и его можно модифицировать, например, гликозилировать или метилировать для облегчения нацеливания на конкретные ткани. Например, гликозилированный RGD пептид может доставлять средство иРНК в опухолевую клетку, экспрессирующую αVβ3 (Haubner et al., Jour. Nucl. Med. 42:326-336, 2001). Можно использовать пептиды, которые нацелены на маркеры, которыми богаты пролиферирующие клетки. Например, RGD содержащие пептиды и пептидомиметики могут нацеливаться на раковые клетки, в частности, на клетки, в которых имеется интегрин. Таким образом, можно использовать RGD пептиды, циклические пептиды, содержащие RGD, RGD пептиды, которые содержат D-аминокислоты, а также синтетические RGD миметики. В дополнение к RGD, можно использовать другие фрагменты, которые нацелены на лиганд интегрина. В общем, такие лиганды можно использовать для регулирования пролиферации клеток и ангиогенеза. Предпочтительные конъюгаты этого типа лиганда нацелены на PECAM-1, VEGF или другой вызывающий рак ген, например, вызывающий рак ген, описанный в данном документе.
«Проникающий в клетку пептид» способен проникать в клетку, например, в микробную клетку, такую как клетка бактерий или грибов или клетка млекопитающих, например, клетка человека. Проникающий в микробную клетку пептид может представлять собой, например, α-спиральный линейный пептид (например, LL-37 или церопин P1), содержащий дисульфидную связь пептид (например, α-дефензин, β-дефензин или бактенецин) или пептид, содержащий только одну или две доминирующие аминокислоты (например, PR-39 или индолицидин). Проникающий в клетку пептид также может содержать сигнал ядерной локализации (NLS). Например, проникающий в клетку пептид может представлять собой двойной амфипатический пептид, такой как MPG, который является производным домена пептида слияния HIV-1 gp41 и NLS большого T-антигена SV40 (Simeoni et al., Nucl. Acids Res. 31:2717-2724, 2003).
В одном варианте осуществления нацеливающим пептидом может быть амфипатический α-спиральный пептид. Иллюстративные амфипатические α-спиральные пептиды включают, но без ограничения, цекропины, ликотоксины, парадаксины, буфорин, CPF, бомбининоподобный пептид (BLP), кателицидины, кератотоксины, пептиды S. clava, миксиновые кишечные антимикробные пептиды (HFIAP), магаинины, бревинины-2, дермасептины, мелитины, плейроцидин, пептиды H2A, пептиды Xenopus, эскулентин-1 и каерины. Предпочтительно для сохранения стабильности целостности спирали необходимо предусмотреть ряд факторов. Например, необходимо использовать максимальное количество стабилизирующих спираль остатков (например, leu, ala или lys), и необходимо использовать минимальное количество дестабилизирующих спираль остатков (например, пролин или циклические мономерные звенья). Необходимо предусмотреть кэпирующий остаток (например, иллюстративным N-кэпирующим остатком является Gly), и/или чтобы обеспечить дополнительную H-связь для стабилизации спирали, можно использовать C-концевое амидирование. Стабильность может обеспечить образование солевых мостиков между остатками с противоположными зарядами, отделенными i ± 3 или i ± 4 позиции. Например, катионные остатки такие как лизин, аргинин, гомо-аргинин, орнитин или гистидин могут образовывать солевые мостики с анионными остатками глутаматом или аспартатом.
Пептидные и пептидомиметические лиганды включают в себя лиганды, которые имеют природное происхождение, или модифицированные пептиды, например, пептиды D или L; пептиды α, β или γ; N-метил пептиды; азапептиды; пептиды, имеющие один или более амид, то есть пептид, группировки которого заменены на одну или более группировок мочевины, тиомочевины, карбамата или сульфонилмочевины; или циклические пептиды.
Нацеливающим лигандом может быть любой лиганд, который способен нацеливаться на конкретный рецептор. Примерами являются: фолат, GalNAc, галактоза, манноза, манноза-6P, кластеры сахаров, такие как кластер GalNAc, кластер маннозы, кластер галактозы или аптамер. Кластером является комбинация двух или более звеньев сахаров. Нацеливающие лиганды также включают в себя лиганды интегриновых рецепторов, лиганды хемокиновых рецепторов, трансферрин, биотин, лиганды серотониновых рецепторов, PSMA, эндотелин, GCPII, соматостатин, лиганды LDL и HDL. Лиганды также могут быть основаны на нуклеиновой кислоте, например, аптамер. Аптамер может быть немодифицированным или иметь любую комбинацию модификаций, раскрытых в данном документе.
Средства эндосомального высвобождения включают в себя имидазолы, поли или олигоимидазолы, PEI, пептиды, фузогенные пептиды, поликарбоксилаты, поликатионы, маскированные олиго или поликатионы или анионы, ацетали, полиацетали, кетали/поликетали, ортоэфиры, полимеры с маскированными или немаскированными катионными или анионными зарядами, дендримеры с маскированными или немаскированными катионными или анионными зарядами.
ФК модулятор означает фармакокинетический модулятор. ФК модуляторы включают в себя липофилы, желчные кислоты, стероиды, аналоги фосфолипидов, пептиды, связывающие белок средства, PEG, витамины и т.д. Иллюстративные ФК модуляторы включают в себя, но без ограничения, холестерин, жирные кислоты, холевую кислоту, литохолевую кислоту, диалкилглицериды, диацилглицерид, фосфолипиды, сфинголипиды, напроксен, ибупрофен, витамин E, биотин и т.д. Также известно, что олигонуклеотиды, которые содержат ряд фосфоротиоатных связей, связываются с сывороточным белком, таким образом под настоящее изобретение в качестве лигандов (например, в качестве модулирующих ФК лигандов) также подпадают короткие олигонуклеотиды, например, олигонуклеотиды приблизительно 5 оснований, 10 оснований, 15 оснований или 20 оснований, содержащие множество фосфоротиоатных связей в остове.
Кроме того, под настоящее изобретение в качестве модулирующих ФК лигандов также подпадают аптамеры, которые связывают компоненты сыворотки (например, белки сыворотки).
Другие конъюгаты лигандов подпадают под изобретение, описанное в заявках на выдачу патента США USSN: 10/916185, поданной 10 августа 2004 года; USSN: 10/946873, поданной 21 сентября 2004 года; USSN: 10/833934, поданной 3 августа 2007 года; USSN: 11/115989 поданной 27 апреля 2005 года и USSN: 11/944227 поданной 21 ноября 2007 года, которые полностью включены посредством ссылки для всех целей.
Когда имеется два или более лигандов, все лиганды могут иметь одинаковые свойства, все могут иметь разные свойства, или некоторые лиганды имеют одинаковые свойства, тогда как другие имеют разные свойства. Например, лиганд может иметь нацеливающие свойства, иметь эндосомолитическую активность или иметь модулирующие ФК свойства. В предпочтительном варианте осуществления все лиганды имеют разные свойства.
Лиганды можно связать с олигонуклеотидами в разных местах, например, на 3’-конце, на 5’-конце и/или во внутреннем положении. В предпочтительных вариантах осуществления лиганд присоединяют к олигонуклеотидам посредством промежуточной связи, например, носителя, описанного в данном документе. Лиганд или связанный лиганд может находиться на мономере, когда мономер встраивают в растущую нить. В некоторых вариантах осуществления лиганд можно включить посредством соединения с мономером-«предшественником» после встраивания мономера-«предшественника» в растущую нить. Например, в растущую олигонуклеотидную нить можно встроить мономер, имеющий, например, амино-концевую связь (то есть не имеющий связанного лиганда), например, TAP-(CH2)nNH2. В последующей операции, то есть после включения мономера-предшественника в нить лиганд, имеющий электрофильную группу, например, пентафторфенилэфирную или альдегидную группу, может впоследствии быть присоединен к мономеру-предшественнику путем соединения электрофильной группы лиганда с концевой нуклеофильной группой связи мономера-предшественника.
В другом примере можно включить мономер, имеющий химическую группу, подходящую для участия в реакции клик-химии, например, азидную или алкиновую концевую связь/линкер. В последующей операции, то есть после включения мономера-предшественника в нить, лиганд, имеющий комплементарную химическую группу, например, алкин или азид, можно присоединить к мономеру-предшественнику путем соединения вместе алкина и азида.
Для двухцепочечных олигонуклеотидов лиганды можно присоединить к одной или обеим нитям. В некоторых вариантах осуществления средство двухцепочечной иРНК содержит лиганд, конъюгированный со смысловой нитью. В других вариантах осуществления средство двухцепочечной иРНК содержит лиганд, конъюгированный с антисмысловой нитью.
В некоторых вариантах осуществления лиганд может быть конъюгирован с нуклеиновыми основаниями, фрагментами сахаров или межнуклеозидными связями молекул нуклеиновых кислот. Конъюгация с пуриновыми нуклеиновыми основаниями или их производными может происходить в любом положении, включая эндоциклические и экзоциклические атомы. В некоторых вариантах осуществления пуриновые нуклеиновые основания во 2-, 6-, 7-или 8-позициях присоединяют к фрагменту конъюгата. Конъюгация с пиримидиновыми нуклеиновыми основаниями или их производными также может происходить в любом положении. В некоторых вариантах осуществления пиримидиновое нуклеиновое основание во 2-, 5- и 6-позициях можно заместить фрагментом конъюгата. Конъюгация с фрагментами сахаров нуклеозидов может происходить в любом атоме углерода. Иллюстративные атомы углерода фрагмента сахара, которые можно присоединить к фрагменту конъюгата, включают в себя 2', 3' и 5' атомы углерода. 1' позиция также может быть присоединена к фрагменту конъюгата, например, в лишенном азотистого основания остатке. Межнуклеозидные связи также могут нести фрагменты конъюгатов. Для фосфорсодержащих связей (например, фосфодиэфирных, фосфоротиоатных, фосфорoдитиоатных, фосфорoамидатных и тому подобное) фрагмент конъюгата можно присоединить прямо к атому фосфора или к атому O, N или S, связанному с атомом фосфора. Для амино- или амидо-содержащих межнуклеозидных связей (например, PNA) фрагмент конъюгата можно присоединить к атому азота амина или амида или к соседнему атому углерода.
Можно использовать любой подходящий лиганд в области РНК-интерференции, хотя обычно лиганд представляет собой углевод, например, моносахарид (такой как GalNAc), дисахарид, трисахарид, тетрасахарид, полисахарид.
Линкеры, которые соединяют лиганд с нуклеиновой кислотой, включают в себя линкеры, обсуждавшиеся выше. Например, лигандом может быть одно или более производных GalNAc (N-ацетилглюкозамин), присоединенных через моновалентный, бивалентный или трехвалентный разветвленный линкер.
В одном варианте осуществления дцРНК согласно изобретению конъюгирована с бивалентными и трехвалентными разветвленными линкерами, содержащими структуры, показанные в любой из формул (IV) - (VII):
 ,
,  ,
,  или
или 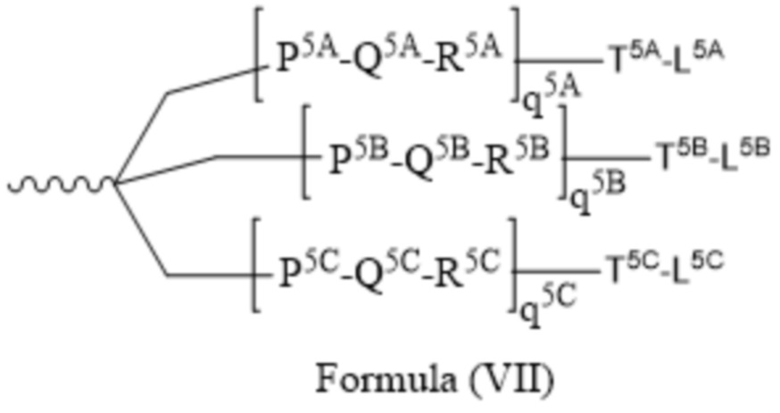 ;
;
причем:
q2A, q2B, q3A, q3B, q4A, q4B, q5A, q5B и q5C представлены независимо для каждого случая 0-20, и при этом повторяющееся звено может быть одинаковым или отличаться;
P2A, P2B, P3A, P3B, P4A, P4B, P5A, P5B, P5C, T2A, T2B, T3A, T3B, T4A, T4B, T4A, T5B, T5C каждый независимо для каждого случая отсутствует, представляет CO, NH, O, S, OC(O), NHC(O), CH2, CH2NH или CH2O;
Q2A, Q2B, Q3A, Q3B, Q4A, Q4B, Q5A, Q5B, Q5C независимо для каждого случая отсутствуют, представляют алкилен, замещенный алкилен, причем один или более метиленов могут прерываться или заканчиваться одним или более из O, S, S(O), SO2, N(RN), C(R’)=C(R’’), C≡C или C(O);
R2A, R2B, R3A, R3B, R4A, R4B, R5A, R5B, R5C каждый независимо для каждого случая отсутствует, представляет NH, O, S, CH2, C(O)O, C(O)NH, NHCH(Ra)C(O), -C(O)-CH(Ra)-NH-, CO, CH=N-O, 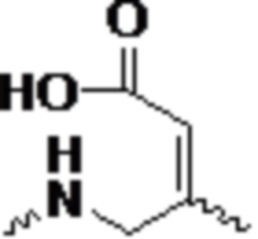 ,
, 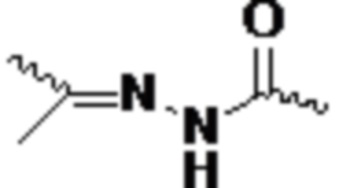 ,
,  ,
, 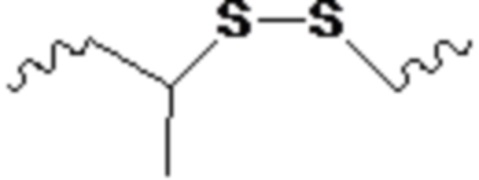 ,
, 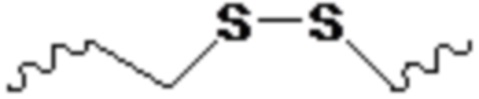 или гетероциклил;
или гетероциклил;
L2A, L2B, L3A, L3B, L4A, L4B, L5A, L5B и L5C отображают лиганд; то есть каждый независимо для каждого случая представляет моносахарид (такой как GalNAc), дисахарид, трисахарид, тетрасахарид, олигосахарид или полисахарид; и
Ra представляет H или боковую цепь аминокислоты.
Трехвалентные конъюгирующие производные GalNAc особенно полезны для использования со средствами РНКи для ингибирования экспрессии гена-мишени, например, согласно формуле (VII):
 ,
,
причем L5A, L5B и L5C представляют моносахарид, такой как производное GalNAc.
Примеры подходящих бивалентных и трехвалентных разветвленных линкерных групп, связывающих GalNAc производные, включают в себя, но без ограничения, следующие соединения:
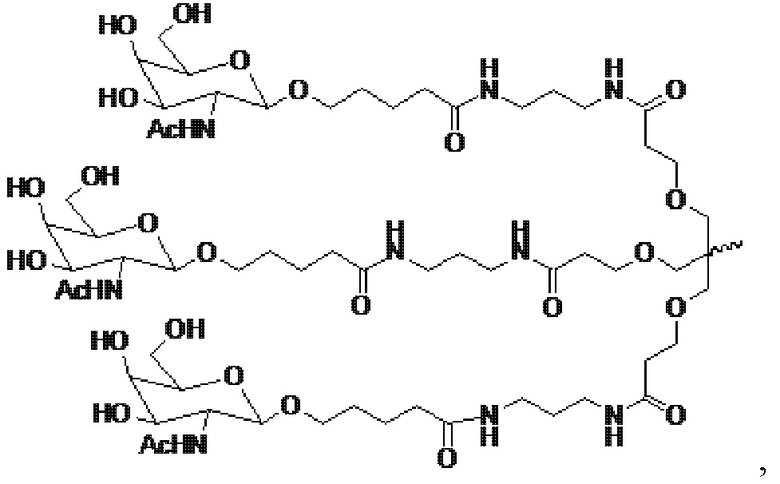
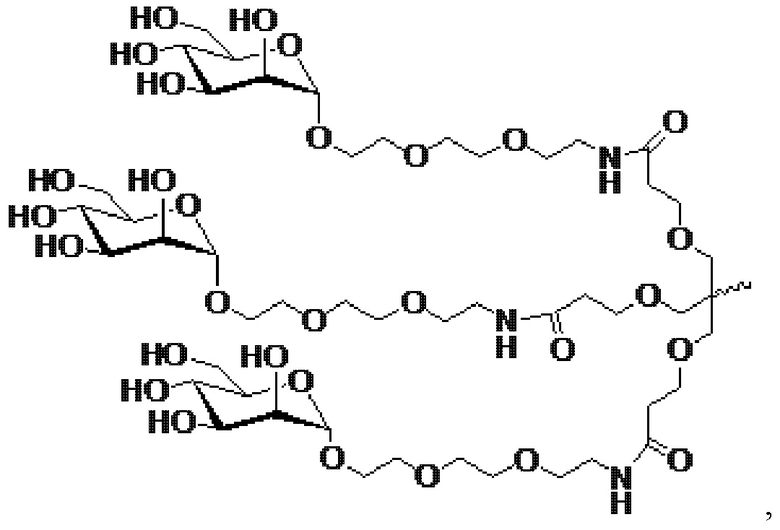
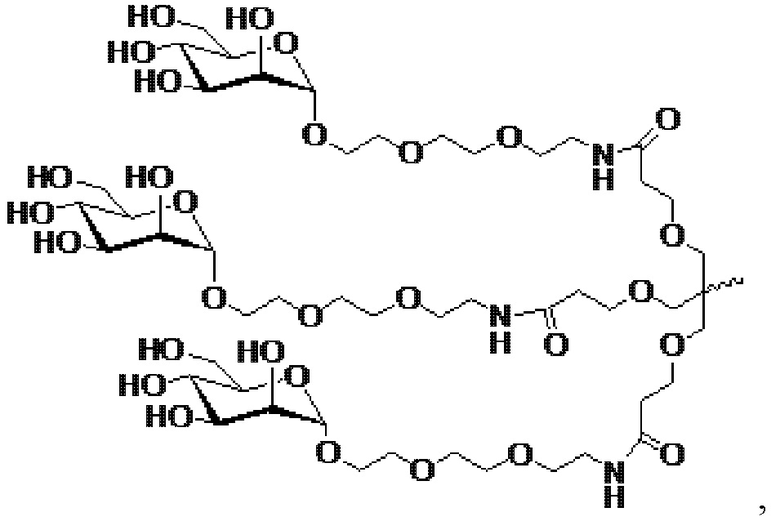
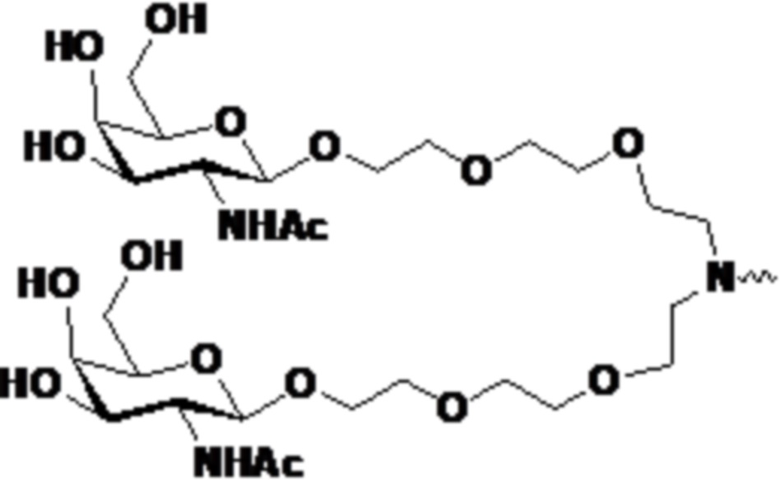 ,
, 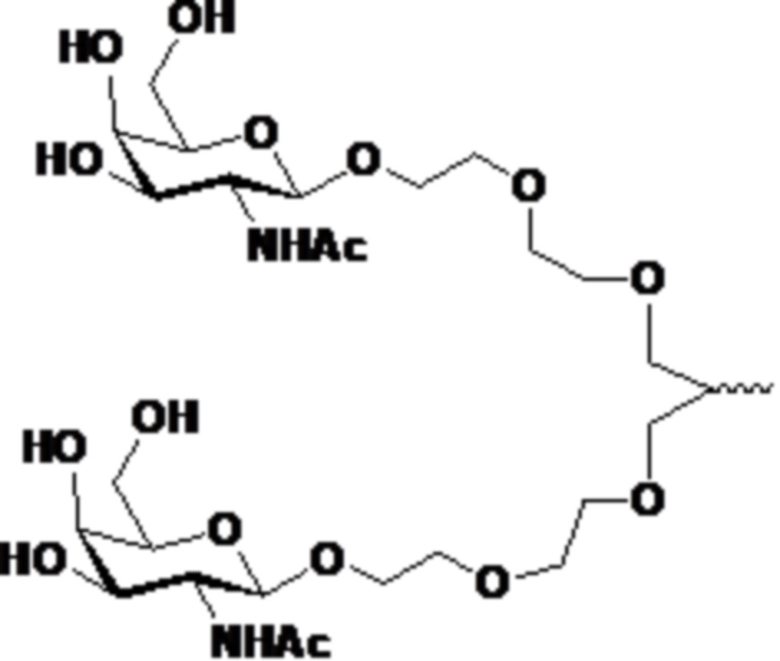 ,
,
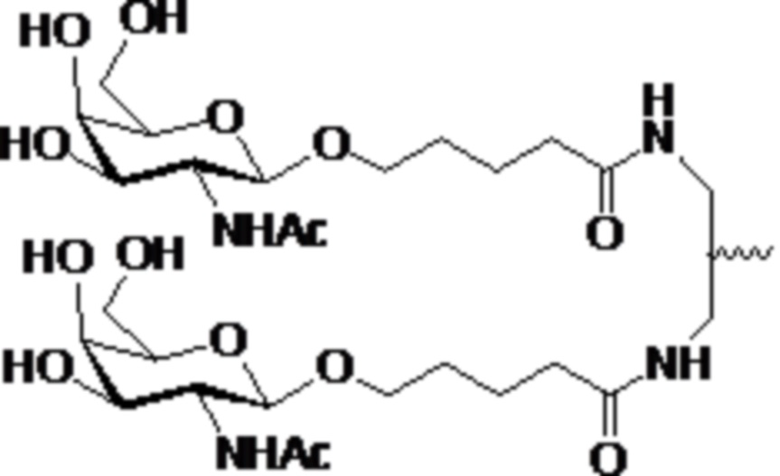 ,
, 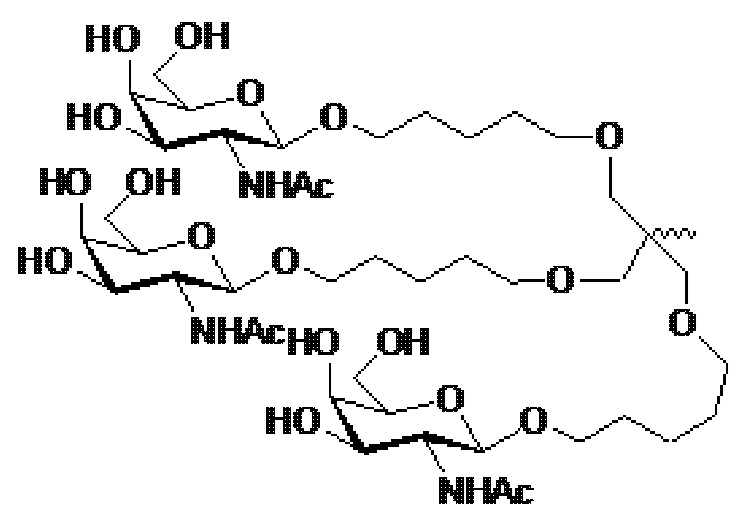
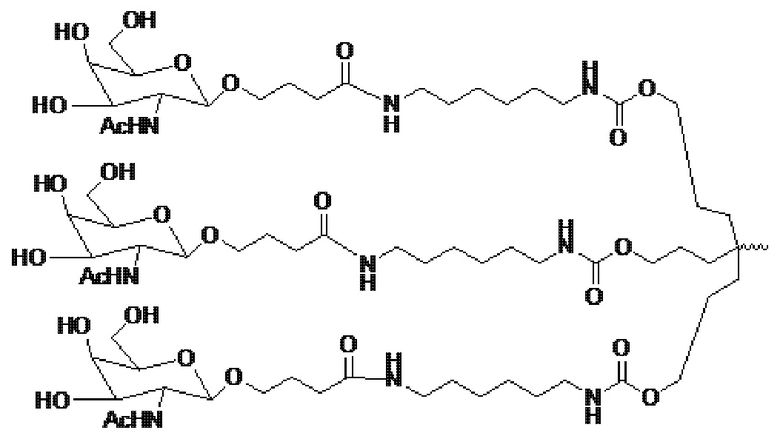 ,
,
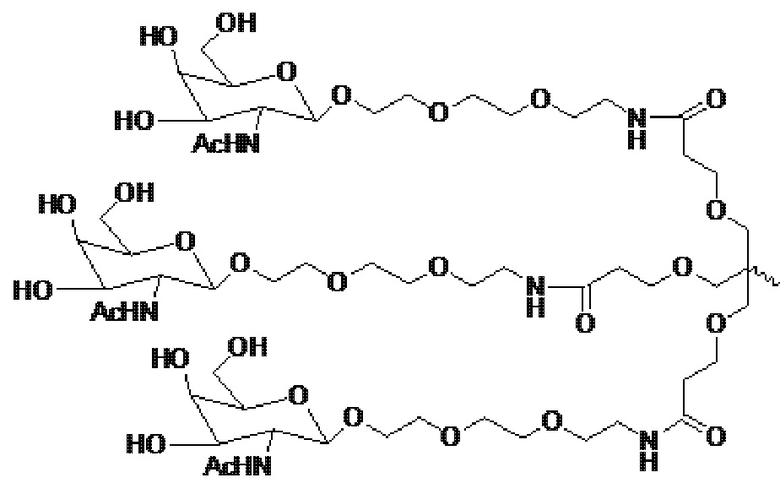 , or
, or
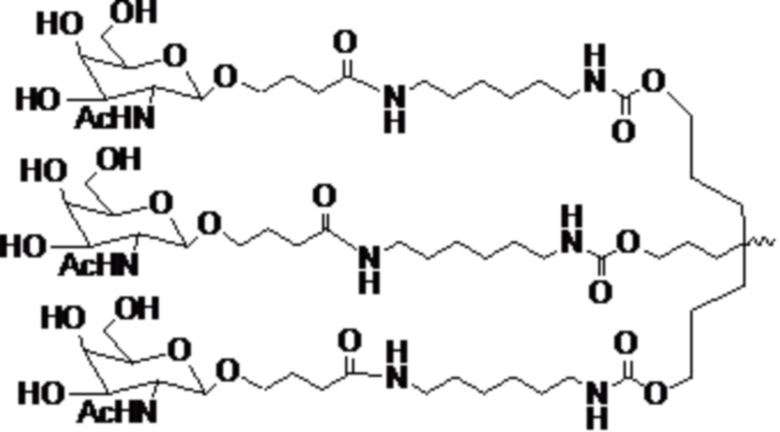 .
.
Примеры патентов США, в которых изложено получение РНК конъюгатов, включают, но без ограничения, патенты США №№ 4828979; 4948882; 5218105; 5525465; 5541313; 5545730; 5552538; 5578717 5580731; 5591584; 5109124; 5118802; 5138045; 5414077; 5486603; 5512439; 5578718; 5608046; 4587044; 4605735; 4667025; 4762779; 4789737; 4824941; 4835263; 4876335; 4904582; 4958013; 5082830; 5112963; 5214136; 5082830; 5112963; 5214136; 5245022; 5254469; 5258506; 5262536; 5272250; 5292873; 5317098; 5371241 5391723; 5416203 5451463; 5510475; 5512667; 5514785; 5565552; 5567810; 5574142; 5585481; 5587371; 5595726; 5597696; 5599923; 5599928 и 5688941; 6294664; 6320017; 6576752; 6783931; 6900297; 7037646; 8106022, все содержание каждого из которых включено настоящим в данный документ посредством ссылки.
Необязательна равномерная модификация всех позиций данного соединения, и фактически более чем одну из вышеупомянутых модификаций можно включить в одно соединение или даже в один нуклеозид внутри иРНК. Настоящее изобретение также включает в себя соединения иРНК, которые представляют собой химерные соединения.
«Химерные» соединения иРНК или «химеры» в контексте настоящего изобретения представляют собой соединения иРНК, предпочтительно дцРНК, которые содержат две или более химически разные области, каждая из которых состоит по меньшей мере из одной мономерной единицы, то есть нуклеотида в случае соединения дцРНК. Эти иРНК обычно содержат по меньшей мере одну область, в которой РНК модифицирована таким образом, чтобы придать иРНК повышенную устойчивость к деградации нуклеазы, повышенное клеточное поглощение и/или повышенную аффинность связывания с нуклеиновой кислотой-мишенью. Дополнительная область иРНК может служить в качестве субстрата для ферментов, способных расщеплять гибриды РНК:ДНК или РНК:РНК. В качестве примера, РНКазой H является клеточная эндонуклеаза, которая расщепляет нить РНК дуплекса РНК:ДНК. Следовательно, активация РНКазы H приводит к расщеплению РНК-мишени, значительно улучшая за счет этого эффективность ингибирования иРНК экспрессии гена. В результате, при использовании химерных дцРНК часто можно получить сопоставимые результаты с более короткими иРНК по сравнению с фосфоротиоат деокси дцРНК, гибридизирующимися с той же самой областью-мишенью. Расщепление РНК-мишени обычно можно выявить посредством гель-электрофореза, а при необходимости, с помощью родственных методов гибридизации нуклеиновой кислоты, известных в данной области.
В некоторых случаях РНК в иРНК можно модифицировать с помощью группы не лиганда. ряд молекул не лигандов конъюгировали с иРНК для того, чтобы улучшить активность, клеточное распределение или клеточное поглощение иРНК, и в научной литературе доступны методы выполнения таких конъюгаций. Такие фрагменты не лиганды включают в себя липидные фрагменты, такие как холестерин (Kubo, T. et al., Biochem. Biophys. Res. Comm. 2007, 365(1):54-61; Letsinger et al., Prос. Natl. Acad. Sci. USA, 1989, 86:6553), холевая кислота (Manoharan et al., Bioorg. Med. Chem. Lett. 1994, 4:1053), тиоэфир, например, гексил-S-тритилтиол (Manoharan et al., Ann. N.Y. Acad. Sci. 1992, 660:306; Manoharan et al., Bioorg. Med. Chem. Let. 1993, 3:2765), тиохолестерин (Oberhauser et al., Nucl. Acids Res. 1992, 20:533), алифатическая цепь, например, додекандиоловые или ундециловые остатки (Saison-Behmoaras et al., EMBO J. 1991, 10:111; Kabanov et al., FEBS Lett. 1990, 259:327; Svinarchuk et al., Biochimie, 1993, 75:49), фосфолипид, например, ди-гексадецил-рац-глицерин или триэтиламмоний 1,2-ди-O-гексадецил-рац-глицеро-3-H-фосфонат (Manoharan et al., Tetrahedron Lett. 1995, 36:3651; Shea et al., Nucl. Acids Res. 1990, 18:3777), полиаминовая или полиэтиленгликолевая цепь (Manoharan et al., Nucleosides & Nucleotides, 1995, 14:969) или адамантановая уксусная кислота (Manoharan et al., Tetrahedron Lett. 1995, 36:3651), пальмитиловый фрагмент (Mishra et al., Biochim. Biophys. Acta, 1995, 1264:229) или октадециламиновый или гексиламино-карбонил-оксихолестериновый фрагмент (Crooke et al., J. Pharmacol. Exp. Ther. 1996, 277:923). Примеры патентов США, в которых изложено получение таких конъюгатов РНК, перечислены выше. Обычные протоколы конъюгации включают синтез РНК, несущих аминолинкер в одной или более позициях последовательности. Затем аминогруппу вводят в реакцию с конъюгированной молекулой с использованием подходящих связывающих или активирующих реагентов. реакцию конъюгации можно проводить либо с РНК, все еще связанной с твердой подложкой, либо после расщепления РНК в фазе раствора. Очистка конъюгата РНК с помощью HPLC обычно дает чистый конъюгат.
В некоторых вариантах осуществления средством двухцепочечной РНКи согласно изобретению является AT3SC-001 (AD-57213).
VI. Доставка иРНК согласно изобретению
Доставка иРНК согласно изобретению в клетку, например, в клетку больного, такого как больной-человек (например, нуждающийся в этом больной, такой как больной с нарушением свертываемости) можно добиться с помощью ряда разных путей. Например, доставку можно выполнить путем введения клетки в контакт с иРНК согласно изобретению либо in vitro, либо in vivo. Доставку In vivo можно выполнить путем введения композиции, содержащей иРНК, например, дцРНК, прямо больному. Альтернативно, доставку In vivo можно выполнить непрямо путем введения одного или более векторов, которые кодируют и направляют экспрессию иРНК. Эти альтернативные варианты дополнительно обсуждаются ниже.
В общем, любой способ доставки молекулы нуклеиновой кислоты (in vitro или in vivo) можно приспособить для применения с иРНК согласно изобретению (см., например, Akhtar S. И Julian RL. (1992) Trends Cell. Biol. 2(5):139-144 и WO94/02595, которые полностью включены в данный документ посредством ссылки). Для доставки In vivo факторы, которые необходимо учитывать для доставки молекулы иРНК, включают, например, биологическую стабильность доставляемой молекулы, предотвращение неспецифических эффектов и накопление доставляемой молекулы в ткани-мишени. Неспецифические эффекты иРНК можно минимизировать за счет местного введения, например, путем прямой инъекции или имплантации в ткань или местного введения препарата. Местное введение в участок обработки делает максимальной местную концентрацию средства, ограничивает воздействие средства на системные ткани, которые в противном случае могут быть повреждены средством или которые могут разрушать средство, и обеспечивает необходимость введения более низкой общей дозы молекулы иРНК. Несколько исследований показали успешный нокдаун продуктов гена при местном введении иРНК. Например, было показано, что внутриглазная доставка дцРНК VEGF как путем инъекции в стекловидное тело макаке-крабоеду (Tolentino, MJ. et al (2004) Retina 24:132-138), так и путем субретинальных инъекций мышам (Reich, SJ. et al (2003) Mol. Vis. 9:210-216) предотвращает неоваскуляризацию в экспериментальной модели возрастной макулярной дегенерации. Кроме того, прямая внутриопухолевая инъекция дцРНК мышам уменьшает объем опухоли (Pille, J. et al (2005) Mol. Ther, 11:267-274) и может продлить продолжительность жизни мышей опухоленосителей (Kim, WJ. et al (2006) Mol. Ther. 14:343-350; Li, S. et al (2007) Mol. Ther. 15:515-523). РНК-интерференция также была успешна при местной доставке в CNS путем прямой инъекции (Dorn, G. et al., (2004) Nucleic Acids 32:e49; Tan, PH. et al (2005) Gene Ther. 12:59-66; Makimura, H. et al (2002) BMC Neurosci. 3:18; Shishkina, GT. et al (2004) Neuroscience 129:521-528; Thakker, ER. et al (2004) Proc. Natl. Acad. Sci. U.S.A. 101:17270-17275; Akaneya, Y. et al (2005) J. Neurophysiol. 93:594-602) и в легкие путем интраназального введения (Howard, KA. et al (2006) Mol. Ther. 14:476-484; Zhang, X. et al (2004) J. Biol. Chem. 279:10677-10684; Bitko, V. et al (2005) Nat. Med. 11:50-55). Для введения иРНК системно для лечения заболевания РНК можно модифицировать или альтернативно доставлять с использованием системы доставки лекарственных средств; оба способа действуют с предотвращением быстрого разрушения дцРНК эндо- и экзо-нуклеазами in vivo. Модификация РНК или фармацевтический носитель также может обеспечить нацеливание композиции иРНК на ткань-мишень и избежать нежелательных не относящихся к мишени эффектов. Молекулы иРНК можно модифицировать с помощью химической конъюгации с липофильными группами, такими как холестерин, для улучшения клеточного поглощения и предотвращения распада. Например, мышам иРНК системно инъецировали направленный против ApoB, конъюгированный с липофильным холестерином фрагмент, что приводило к нокдауну apoB иРНК как в печени, так и в тощей кишке (Soutschek, J. et al (2004) Nature 432:173-178). было показано, что конъюгация иРНК с аптамером для ингибирования роста опухоли и опосредует регрессию опухоли в мышиной модели рака предстательной железы (McNamara, JO. et al (2006) Nat. Biotechnol. 24:1005-1015). В альтернативном варианте осуществления иРНК можно доставлять с использованием систем доставки лекарственных средств, таких как наночастица, дендример, полимер, липосомы или катионная система доставки. Положительно заряженные катионные системы доставки облегчают связывание (отрицательно заряженной) молекулы иРНК, а также улучшают взаимодействия на отрицательно заряженной клеточной мембране для обеспечения эффективного поглощения иРНК клеткой. Катионные липиды, дендримеры или полимеры можно либо связать с иРНК, либо индуцировать с образованием везикулы или мицеллы (см., например, Kim SH., et al (2008) Journal of Controlled Release 129(2):107-116), которая заключает в себя иРНК. Образование везикул или мицелл кроме того предотвращает деградацию иРНК при системном введении. Способы получения и введения катионных-иРНК комплексов находятся в пределах компетенции специалиста в данной области (см., например, Sorensen, DR. et al (2003) J. Mol. Biol 327:761-766; Verma, UN. et al (2003) Clin. Cancer Res. 9:1291-1300; Arnold, AS et al (2007) J. Hypertens. 25:197-205, которые полностью включены в данный документ посредством ссылки). Некоторые неограничивающие примеры систем доставки лекарственных средств, используемых для системной доставки иРНК, включают в себя DOTAP (Sorensen, DR. et al (2003), supra; Verma, UN. et al (2003), supra), Олигофектамин, «твердые липидные частицы нуклеиновых кислот» (Zimmermann, TS., et al (2006) Nature 441:111-114), кардиолипин (Chien, PY. et al (2005) Рак Gene Ther. 12:321-328; Pal, A. et al (2005) Int J. Oncol. 26:1087-1091), полиэтиленимин (Bonnet ME. et al (2008) Pharm. Res. Aug 16 Epub ahead of print; Aigner, A. (2006) J. Biomed. Biotechnol. 71659), Arg-Gly-Asp (RGD) пептиды (Liu, S. (2006) Mol. Pharm. 3:472-487) и полиамидамины (Tomalia, DA. et al (2007) Biochem. Sоc. Trans. 35:61-67; Yoo, H. et al (1999) Pharm. Res. 16:1799-1804). В некоторых вариантах осуществления иРНК образует комплекс с циклодекстрином для системного введения. Способы введения и фармацевтические композиции иРНК и циклодекстринов можно найти в патенте США № 7427605, который полностью включен в данный документ посредством ссылки.
А. Вектор, кодируемый иРНК согласно изобретению
иРНК, нацеленную на ген Serpinc1, можно экспрессировать из единиц транскрипции, вставленных в векторы ДНК или РНК (см., например, Couture, A, et al., TIG. (1996), 12:5-10; Skillern, A. et al., медународная PCT Публикация № WO 00/22113, Conrad, медународная PCT Публикация № WO 00/22114 и Conrad, патент США № 6054299). Экспрессия может быть кратковременной (порядка от часов до недель) или продолжительной (от недель до месяцев или дольше) в зависимости от конкретной используемой конструкции и ткани-мишени или типа клеток. Эти трансгены можно ввести в виде линейной конструкции, круглой плазмиды или вирусного вектора, который может представлять собой интегрированный или неинтегрированный вектор. Трансген также можно сконструировать, чтобы обеспечить возможность его наследования в виде внехромосомной плазмиды (Gassmann, et al., Proc. Natl. Acad. Sci. USA (1995) 92:1292).
Отдельную нить или нити иРНК можно трансскрибировать из промотера в вектор экспрессии. Когда для получения, например, дцРНК нужно экспрессировать две отдельные нити, можно совместно ввести два отдельных вектора экспрессии (например, путем трансфекции или инфекции) в клетку-мишень. Альтернативно каждую отдельную нить дцРНК можно трансскрибировать с помощью промотеров, которые оба находятся в одной и той же плазмиде экспрессии. В одном варианте осуществления дцРНК экспрессируют в виде инвертированных повторных полинуклеотидов, соединенных линкерной полинуклеотидной последовательностью таким образом, чтобы дцРНК имела структуру стебель-петля.
Векторы экспрессии иРНК обычно представляют собой ДНК плазмиды или вирусные векторы. Для получения рекомбинантных конструкций для экспрессия иРНК, как описано в данном документе, можно использовать векторы экспрессии, совместимые с эукариотическими клетками, предпочтительно векторы, совместимые с клетками позвоночных. Векторы экспрессии эукариотических клеток хорошо известны в данной области и доступны из ряда коммерческих источников. Обычно, представлены такие векторы, которые содержат удобные сайты рестрикции для вставки нужного сегмента нуклеиновой кислоты. Доставка экспрессирующих иРНК векторов может быть системной, например, с помощью внутривенного или внутримышечного введения, путем введения в клетки-мишени, эксплантированные у пациента, с последующим повторным введением пациенту или с помощью любого другого средства, которое обеспечивает введение в нужную клетку-мишень.
Плазмиды экспрессии иРНК можно трансфицировать в клетки-мишени в виде комплекса с катионными липидными носителями (например, олигофектамином) или некатионными основанными на липидах носителями (например, Transit-TKO™). В изобретении также предусмотрено множество трансфекций липидов для опосредованных иРНК нокдаунов, нацеленных на разные области РНК-мишени в течение периода недели или более. Успешное введение векторов в клетки-хозяева можно отслеживать, используя разные известные способы. Например, о кратковременной трансфекции может сигнализировать репортер, такой как флуоресцентный маркер, такой как зеленый флуоресцентный белок (GFP). Стабильную трансфекцию клеток ex vivo можно обеспечить с использованием маркеров, которые обеспечивают трансфицированным клеткам устойчивость к конкретным факторам окружающей среды (например, антибиотикам и лекарственным средствам), например, устойчивость к гигромицину B.
Вирусные векторные системы, которые можно использовать со способами и композициями, описанными в данном документе, включают, но без ограничения (a) аденовирусные векторы; (b) ретровирусные векторы, включающие в себя, но без ограничения лентивирусные векторы, вирус мышиного лейкоза Молони и т.д.; (c) аденоассоциированные вирусные векторы; (d) векторы на основе вируса простого герпеса; (e) векторы SV 40; (f) векторы на основе вируса полиомы; (g) векторы на основе вируса папилломы; (h) пикорнавирусные векторы; (i) поксвирусные векторы, такие как ортопокс, например, векторы на основе вируса осповакцины или авипоксвируса, например, поксвирус канареек или птичий поксвирус; и (j) на основе зависимого от хелпера или выпотрошенного аденовируса. Также полезными могут быть вирусы с дефектной репликацией. Разные векторы будут или не будут включаться в геном клетки. При необходимости конструкции могут содержать вирусные последовательности для трансфекции. Альтернативно, конструкцию можно встраивать в векторы, способные к эписомальной репликации, например, векторы EPV и EBV. Конструкциям для рекомбинантной экспрессии иРНК, как правило, требуются регуляторные элементы, например, промотеры, энхансеры и т.д., чтобы обеспечить экспрессию иРНК в клетках-мишенях. Другие аспекты, которые необходимо учитывать для векторов и конструкций, дополнительно описаны ниже.
Векторы, полезные для доставки иРНК, будут содержать регуляторные элементы (промотер, энхансер и т.д.), достаточные для экспрессии иРНК в нужной клетке или ткани-мишени. регуляторные элементы могут быть выбраны, чтобы обеспечить либо конститутивную, либо регулируемую/индуцибельную экспрессию.
Экспрессию иРНК можно точно регулировать, например, путем использования индуцибельной регуляторной последовательности, которая чувствительна к определенным физиологическим регуляторам, например, уровням циркулирующей глюкозы или гормонам (DОCHerty et al., 1994, FASEB J. 8:20-24). Такие индуцибельные системы экспрессии, подходящие для регулирования экспрессии дцРНК в клетках или у млекопитающих, включают в себя, например, регулирование с помощью экдизона, с помощью эстрогена, прогестерона, тетрациклина, химических индукторов димеризации и изопропил-бета-D1-тиогалактопиранозида (IPTG). Специалист в данной области сможеть выбрать подходящую регуляторную/промотерную последовательность на основании предполагаемого использования трансгена иРНК.
Можно использовать вирусные векторы, которые содержат последовательности нуклеиновых кислот, кодирующие иРНК. Например, можно использовать ретровирусный вектор (см. Miller et al., Meth. Enzymol. 217:581-599 (1993)). Эти ретровирусные векторы содержат компоненты, необходимые для правильной упаковки вирусного генома и интеграции в ДНК клетки-хозяина. Последовательности нуклеиновых кислот, кодирующие иРНК, клонируют в один или более векторов, которые облегчают доставку нуклеиновой кислоты пациенту. Более подробную информацию о ретровирусных векторах можно найти, например, в Boesen et al., Biotherapy 6:291-302 (1994), в котором описано использование ретровирусного вектора для доставки гена mdr1 в гематопоэтические стволовые клетки для того, чтобы сделать стволовые клетки более резистентными к химиотерапии. Другие ссылки, иллюстрирующие использование ретровирусных векторов в генной терапии: Clowes et al., J. Clin. Invest. 93:644-651 (1994); Kiem et al., Blood 83:1467-1473 (1994); Salmons and Gunzberg, Human Gene Therapy 4:129-141 (1993); and Grossman and Wilson, Curr. Opin. in Genetics and Devel. 3:110-114 (1993). Лентивирусные векторы, предполагаемые для применения, включают в себя, например, векторы на основе ВИЧ, описанные в патентах США №№ 6143520; 5665557; и 5981276, которые включены в данный документ посредством ссылки.
Также предполагается использование аденовирусов для доставки иРНК согласно изобретению. Аденовирусы являются особенно привлекательными средствами, например, для доставки генов в эпителий дыхательных путей. Аденовирусы в естественных условиях инфицируют эпителий дыхательных путей, при этом они вызывают легкое заболевание. Другими мишенями для основанных на аденовирусах системах доставки является печень, центральная нервная система, эндотелиальные клетки и мышцы. Аденовирусы обладают преимуществом способности инфицировать неделящиеся клетки. У Kozarsky и Wilson, Current Opinion in Genetics and Development 3:499-503 (1993), представлен обзор основанной на аденовирусах генной терапии. У Bout et al., Human Gene Therapy 5:3-10 (1994) продемонстрировано использование аденовирусных векторов для переноса генов в эпителий дыхательных путей макак резус. Другие примеры использования аденовирусов в генной терапии можно найти в Rosenfeld et al., Science 252:431-434 (1991); Rosenfeld et al., Cell 68:143-155 (1992); Mastrangeli et al., J. Clin. Invest. 91:225-234 (1993); PCT Publication WO94/12649; и Wang, et al., Gene Therapy 2:775-783 (1995). Подходящий AV вектор для экспрессии иРНК, представленной в изобретении, способ конструирования рекомбинантного AV вектора и способ доставки вектора в клетки-мишени описаны в Xia H et al., (2002), Nat. Biotech. 20: 1006-1010.
Векторы на основе аденоассоциированного вируса (AAV) также можно использовать для доставки иРНК согласно изобретению (Walsh et al., Proc. Soc. Exp. Biol. Med. 204:289-300 (1993); патент США № 5436146). В одном варианте осуществления иРНК можно экспрессировать в виде двух отдельных комплементарных одноцепочечных молекул РНК из рекомбинантного AAV вектора, имеющего, например, либо U6 или H1 РНК промотеры или цитомегаловирусный (СМV) промотер. Подходящие AAV векторы для экспрессии дцРНК, представленной в изобретении, способы конструирования рекомбинантного AV вектора и способы доставки векторов в клетки-мишени описаны в Samulski R et al., (1987), J. Virol. 61: 3096-3101; Fisher K J et al., (1996), J. Virol, 70: 520-532; Samulski R et al., (1989), J. Virol. 63: 3822-3826; в патенте США № 5252479; в патенте США № 5139941; в международной заявке на патент № WO 94/13788; и в международной заявке на патент № WO 93/24641, все раскрытие которых включено в данный документ посредством ссылки.
Другим вирусным вектором, подходящим для доставки иРНК согласно изобретению, является поксвирус, такой как вирус осповакцины, например, ослабленной осповакцины, например, модифицированный вирус Ankara (MVA) или NYVAC, авипоксвирус, такой как птичий поксвирус или поксвирус канареек.
Тропизм вирусных векторов можно модифицировать путем псевдотипирования векторов белками оболочки или другими поверхностными антигенами из других вирусов или путем замещения разных вирусных капсидных белков, в зависимости от ситуации. Например, лентивирусные векторы можно псевдотипировать поверхностными белками вируса везикулярного стоматита (VSV), бешенства, лихорадки Эбола, Мокола и тому подобное. Можно получить AAV векторы для нацеливания на разные клетки путем конструирования векторов для экспрессии разных серотипов капсидных белков; см., например, Rabinowitz J E et al., (2002), J Virol 76:791-801, все раскрытие которого включено в данный документ посредством ссылки.
Фармацевтический препарат вектора может содержать вектор в приемлемом разбавителе или может содержать матрицу медленного высвобождения, в которую встроено средство доставки гена. Альтернативно, когда целый вектор доставки гена можно получить из рекомбинантных клеток интактным, например, ретровирусные векторы, фармацевтический препарат может содержать одну или более клеток, которые вырабатывают система доставки гена.
V. Фармацевтические композиции согласно изобретению
В настоящем изобретении также представлены фармацевтические композиции и готовые формы, которые содержат иРНК согласно изобретению. В одном варианте осуществления, представленном в данном документе, представлены фармацевтические композиции, содержащие иРНК, как описано в данном документе, и фармацевтически приемлемый носитель. Фармацевтические композиции, содержащие иРНК, полезны для лечения заболевания или нарушения, связанного с экспрессией или активностью гена Serpinc1, например, заболевания, связанного с Serpinc1. Такие фармацевтические композиции составляют на основе режима доставки. Одним примером являются композиции, которые составляют для системного введения посредством парентеральной доставки, например, посредством подкожной (SC) или внутривенной (IV) доставки. Другим примером являются композиции, которые составляют для прямой доставки в паренхиму головного мозга, например, путем инфузии в головной мозг, например, путем постоянной инфузии через насосную систему. Фармацевтические композиции согласно изобретению можно вводить в дозировках, достаточных для ингибирования экспрессии гена Serpinc1.
В некоторых вариантах осуществления изобретения, например, когда фармацевтическая композиция содержит средство двухцепочечной РНКи, содержащее один или более мотивов трех идентичных модификаций трех последовательных нуклеотидов, включая один такой мотив в сайте расщепления средства или около него, шесть фосфоротиоатных связей и лиганд GalNAc, такую композицию вводят в дозе от 0,200 до приблизительно 1,825 мг/кг, от 0,200 до приблизительно 1,800 мг/кг, от приблизительно 0,200 до приблизительно 1,700 мг/кг, от приблизительно 0,200 до приблизительно 1,600 мг/кг, от приблизительно 0,200 до приблизительно 1,500 мг/кг, от приблизительно 0,200 до приблизительно 1,400 мг/кг, от приблизительно 0,200 до приблизительно 1,400 мг/кг, от приблизительно 0,200 до приблизительно 1,200 мг/кг, от приблизительно 0,200 до приблизительно 1,100 мг/кг, от приблизительно 0,200 до приблизительно 1,000 мг/кг, от приблизительно 0,200 до приблизительно 0,900 мг/кг, от приблизительно 0,200 до приблизительно 0,800 мг/кг, от приблизительно 0,200 до приблизительно 0,700 мг/кг, от приблизительно 0,200 до приблизительно 0,600 мг/кг, от приблизительно 0,200 до приблизительно 0,500 мг/кг, от приблизительно 0,200 до приблизительно 0,400 мг/кг, от приблизительно 0,225 до приблизительно 1,825 мг/кг, от приблизительно 0,225 до приблизительно 1,800 мг/кг, от приблизительно 0,225 до приблизительно 1,700 мг/кг, от приблизительно 0,225 до приблизительно 1,600 мг/кг, от приблизительно 0,225 до приблизительно 1,500 мг/кг, от приблизительно 0,225 до приблизительно 1,400 мг/кг, от приблизительно 0,225 до приблизительно 1,400 мг/кг, от приблизительно 0,225 до приблизительно 1,200 мг/кг, от приблизительно 0,225 до приблизительно 1,100 мг/кг, от приблизительно 0,225 до приблизительно 1,000 мг/кг, от приблизительно 0,225 до приблизительно 0,900 мг/кг, от приблизительно 0,225 до приблизительно 0,800 мг/кг, от приблизительно 0,225 до приблизительно 0,700 мг/кг, от приблизительно 0,225 до приблизительно 0,600 мг/кг, от приблизительно 0,225 до приблизительно 0,500 мг/кг, от приблизительно 0,225 до приблизительно 0,400 мг/кг, от приблизительно 0,250 до приблизительно 1,825 мг/кг, от приблизительно 0,250 до приблизительно 1,800 мг/кг, от приблизительно 0,250 до приблизительно 1,700 мг/кг, от приблизительно 0,250 до приблизительно 1,600 мг/кг, от приблизительно 0,250 до приблизительно 1,500 мг/кг, от приблизительно 0,250 до приблизительно 1,400 мг/кг, от приблизительно 0,250 до приблизительно 1,400 мг/кг, от приблизительно 0,250 до приблизительно 1,200 мг/кг, от приблизительно 0,250 до приблизительно 1,100 мг/кг, от приблизительно 0,250 до приблизительно 1,000 мг/кг, от приблизительно 0,250 до приблизительно 0,900 мг/кг, от приблизительно 0,250 до приблизительно 0,800 мг/кг, от приблизительно 0,250 до приблизительно 0,700 мг/кг, от приблизительно 0,250 до приблизительно 0,600 мг/кг, от приблизительно 0,250 до приблизительно 0,500 мг/кг, от приблизительно 0,250 до приблизительно 0,400 мг/кг, от приблизительно 0,425 до приблизительно 1,825 мг/кг, от приблизительно 0,425 до приблизительно 1,800 мг/кг, от приблизительно 0,425 до приблизительно 1,700 мг/кг, от приблизительно 0,425 до приблизительно 1,600 мг/кг, от приблизительно 0,425 до приблизительно 1,500 мг/кг, от приблизительно 0,425 до приблизительно 1,400 мг/кг, от приблизительно 0,425 до приблизительно 1,400 мг/кг, от приблизительно 0,425 до приблизительно 1,200 мг/кг, от приблизительно 0,425 до приблизительно 1,100 мг/кг, от приблизительно 0,425 до приблизительно 1,000 мг/кг, от приблизительно 0,425 до приблизительно 0,900 мг/кг, от приблизительно 0,425 до приблизительно 0,800 мг/кг, от приблизительно 0,425 до приблизительно 0,700 мг/кг, от приблизительно 0,425 до приблизительно 0,600 мг/кг, от приблизительно 0,425 до приблизительно 0,500 мг/кг, от приблизительно 0,450 до приблизительно 1,825 мг/кг, от приблизительно 0,450 до приблизительно 1,800 мг/кг, от приблизительно 0,450 до приблизительно 1,700 мг/кг, от приблизительно 0,450 до приблизительно 1,600 мг/кг, от приблизительно 0,450 до приблизительно 1,500 мг/кг, от приблизительно 0,450 до приблизительно 1,400 мг/кг, от приблизительно 0,450 до приблизительно 1,400 мг/кг, от приблизительно 0,450 до приблизительно 1,200 мг/кг, от приблизительно 0,450 до приблизительно 1,100 мг/кг, от приблизительно 0,450 до приблизительно 1,000 мг/кг, от приблизительно 0,450 до приблизительно 0,900 мг/кг, от приблизительно 0,450 до приблизительно 0,800 мг/кг, от приблизительно 0,450 до приблизительно 0,700 мг/кг, от приблизительно 0,450 до приблизительно 0,600 мг/кг, от приблизительно 0,450 до приблизительно 0,500 мг/кг, от приблизительно 0,475 до приблизительно 1,825 мг/кг, от приблизительно 0,475 до приблизительно 1,800 мг/кг, от приблизительно 0,475 до приблизительно 1,700 мг/кг, от приблизительно 0,475 до приблизительно 1,600 мг/кг, от приблизительно 0,475 до приблизительно 1,500 мг/кг, от приблизительно 0,475 до приблизительно 1,400 мг/кг, от приблизительно 0,475 до приблизительно 1,400 мг/кг, от приблизительно 0,475 до приблизительно 1,200 мг/кг, от приблизительно 0,475 до приблизительно 1,100 мг/кг, от приблизительно 0,475 до приблизительно 1,000 мг/кг, от приблизительно 0,475 до приблизительно 0,900 мг/кг, от приблизительно 0,475 до приблизительно 0,800 мг/кг, от приблизительно 0,475 до приблизительно 0,700 мг/кг, от приблизительно 0,475 до приблизительно 0,600 мг/кг, от приблизительно 0,475 до приблизительно 0,500 мг/кг, от приблизительно 0,875 до приблизительно 1,825 мг/кг, от приблизительно 0,875 до приблизительно 1,800 мг/кг, от приблизительно 0,875 до приблизительно 1,700 мг/кг, от приблизительно 0,875 до приблизительно 1,600 мг/кг, от приблизительно 0,875 до приблизительно 1,500 мг/кг, от приблизительно 0,875 до приблизительно 1,400 мг/кг, от приблизительно 0,875 до приблизительно 1,400 мг/кг, от приблизительно 0,875 до приблизительно 1,200 мг/кг, от приблизительно 0,875 до приблизительно 1,100 мг/кг, от приблизительно 0,875 до приблизительно 1,000 мг/кг, от приблизительно 0,875 до приблизительно 0,900 мг/кг, от приблизительно 0,900 до приблизительно 1,825 мг/кг, от приблизительно 0,900 до приблизительно 1,800 мг/кг, от приблизительно 0,900 до приблизительно 1,700 мг/кг, от приблизительно 0,900 до приблизительно 1,600 мг/кг, от приблизительно 0,900 до приблизительно 1,500 мг/кг, от приблизительно 0,900 до приблизительно 1,400 мг/кг, от приблизительно 0,900 до приблизительно 1,400 мг/кг, от приблизительно 0,900 до приблизительно 1,200 мг/кг, от приблизительно 0,900 до приблизительно 1,100 мг/кг, от приблизительно 0,900 до приблизительно 1,000 мг/кг, от приблизительно 0,925 до приблизительно 1,825 мг/кг, от приблизительно 0,925 до приблизительно 1,800 мг/кг, от приблизительно 0,925 до приблизительно 1,700 мг/кг, от приблизительно 0,925 до приблизительно 1,600 мг/кг, от приблизительно 0,925 до приблизительно 1,500 мг/кг, от приблизительно 0,925 до приблизительно 1,400 мг/кг, от приблизительно 0,925 до приблизительно 1,400 мг/кг, от приблизительно 0,925 до приблизительно 1,200 мг/кг, от приблизительно 0,925 до приблизительно 1,100 мг/кг или от приблизительно 0,925 до приблизительно 1,000 мг/кг. Значения и диапазоны, промежуточные к вышеприведенным указанным значениям, также предназначены составлять часть настоящего изобретения, например, средство РНКи можно вводить больному в дозе от приблизительно 0,015 мг/кг до приблизительно 0,45 мг/кг.
Например, средство РНКи, например, средство РНКи в фармацевтической композиции можно вводить в дозе приблизительно 0,2 мг/кг, 0,225 мг/кг, 0,25 мг/кг, 0,275 мг/кг, 0,3 мг/кг, 0,325 мг/кг, 0,35 мг/кг, 0,375 мг/кг, 0,4 мг/кг, 0,425 мг/кг, 0,45 мг/кг, 0,475 мг/кг, приблизительно 0,5 мг/кг, 0,525 мг/кг, 0,55 мг/кг, 0,575 мг/кг, приблизительно 0,6 мг/кг, 0,625 мг/кг, 0,65 мг/кг, 0,675 мг/кг, приблизительно 0,7 мг/кг, 0,725 мг/кг, 0,75 мг/кг, 0,775 мг/кг, приблизительно 0,8 мг/кг, 0,925 мг/кг, 0,95 мг/кг, 0,975 мг/кг, приблизительно 1,0 мг/кг, 1,025 мг/кг, 1,05 мг/кг, 1,075 мг/кг, приблизительно 1,1 мг/кг, 1,125 мг/кг, 1,15 мг/кг, 1,175 мг/кг, приблизительно 1,2 мг/кг, 1,225 мг/кг, 1,25 мг/кг, 1,275 мг/кг, приблизительно 1,3 мг/кг, 1,325 мг/кг, 1,35 мг/кг, 1,375 мг/кг, приблизительно 1,4 мг/кг, 1,425 мг/кг, 1,45 мг/кг, 1,475 мг/кг, приблизительно 1,5 мг/кг, 1,525 мг/кг, 1,55 мг/кг, 1,575 мг/кг, приблизительно 1,6 мг/кг, 1,625 мг/кг, 1,65 мг/кг, 1,675 мг/кг, приблизительно 1,7 мг/кг, 1,725 мг/кг, 1,75 мг/кг, 1,775 мг/кг или приблизительно 1,8 мг/кг. Значения, промежуточные к вышеприведенным указанным значениям, также предназначены составлять часть настоящего изобретения.
В некоторых вариантах осуществления изобретения, например, когда средство двухцепочечной РНКи содержит смысловую нить и антисмысловую нить, причем антисмысловая нить содержит область комплементарности к иРНК, кодирующей Serpinc1, которая содержит по меньшей мере 15 соседних нуклеотидов, отличающихся не более чем на 3 нуклеотида от нуклеотидной последовательности 5’-UUGAAGUAAAUGGUGUUAACCAG-3’ (SEQ ID NO: 15), причем по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити представляют собой модифицированные нуклеотиды, и при этом смысловая нить конъюгирована с лигандом, присоединенным на 3’-конце, такое средство в фармацевтической композиции вводят в дозе от приблизительно 0,200 до приблизительно 1,825 мг/кг, от 0,200 до приблизительно 1,800 мг/кг, от приблизительно 0,200 до приблизительно 1,700 мг/кг, от приблизительно 0,200 до приблизительно 1,600 мг/кг, от приблизительно 0,200 до приблизительно 1,500 мг/кг, от приблизительно 0,200 до приблизительно 1,400 мг/кг, от приблизительно 0,200 до приблизительно 1,400 мг/кг, от приблизительно 0,200 до приблизительно 1,200 мг/кг, от приблизительно 0,200 до приблизительно 1,100 мг/кг, от приблизительно 0,200 до приблизительно 1,000 мг/кг, от приблизительно 0,200 до приблизительно 0,900 мг/кг, от приблизительно 0,200 до приблизительно 0,800 мг/кг, от приблизительно 0,200 до приблизительно 0,700 мг/кг, от приблизительно 0,200 до приблизительно 0,600 мг/кг, от приблизительно 0,200 до приблизительно 0,500 мг/кг, от приблизительно 0,200 до приблизительно 0,400 мг/кг, от приблизительно 0,225 до приблизительно 1,825 мг/кг, от приблизительно 0,225 до приблизительно 1,800 мг/кг, от приблизительно 0,225 до приблизительно 1,700 мг/кг, от приблизительно 0,225 до приблизительно 1,600 мг/кг, от приблизительно 0,225 до приблизительно 1,500 мг/кг, от приблизительно 0,225 до приблизительно 1,400 мг/кг, от приблизительно 0,225 до приблизительно 1,400 мг/кг, от приблизительно 0,225 до приблизительно 1,200 мг/кг, от приблизительно 0,225 до приблизительно 1,100 мг/кг, от приблизительно 0,225 до приблизительно 1,000 мг/кг, от приблизительно 0,225 до приблизительно 0,900 мг/кг, от приблизительно 0,225 до приблизительно 0,800 мг/кг, от приблизительно 0,225 до приблизительно 0,700 мг/кг, от приблизительно 0,225 до приблизительно 0,600 мг/кг, от приблизительно 0,225 до приблизительно 0,500 мг/кг, от приблизительно 0,225 до приблизительно 0,400 мг/кг, от приблизительно 0,250 до приблизительно 1,825 мг/кг, от приблизительно 0,250 до приблизительно 1,800 мг/кг, от приблизительно 0,250 до приблизительно 1,700 мг/кг, от приблизительно 0,250 до приблизительно 1,600 мг/кг, от приблизительно 0,250 до приблизительно 1,500 мг/кг, от приблизительно 0,250 до приблизительно 1,400 мг/кг, от приблизительно 0,250 до приблизительно 1,400 мг/кг, от приблизительно 0,250 до приблизительно 1,200 мг/кг, от приблизительно 0,250 до приблизительно 1,100 мг/кг, от приблизительно 0,250 до приблизительно 1,000 мг/кг, от приблизительно 0,250 до приблизительно 0,900 мг/кг, от приблизительно 0,250 до приблизительно 0,800 мг/кг, от приблизительно 0,250 до приблизительно 0,700 мг/кг, от приблизительно 0,250 до приблизительно 0,600 мг/кг, от приблизительно 0,250 до приблизительно 0,500 мг/кг, от приблизительно 0,250 до приблизительно 0,400 мг/кг, от приблизительно 0,425 до приблизительно 1,825 мг/кг, от приблизительно 0,425 до приблизительно 1,800 мг/кг, от приблизительно 0,425 до приблизительно 1,700 мг/кг, от приблизительно 0,425 до приблизительно 1,600 мг/кг, от приблизительно 0,425 до приблизительно 1,500 мг/кг, от приблизительно 0,425 до приблизительно 1,400 мг/кг, от приблизительно 0,425 до приблизительно 1,400 мг/кг, от приблизительно 0,425 до приблизительно 1,200 мг/кг, от приблизительно 0,425 до приблизительно 1,100 мг/кг, от приблизительно 0,425 до приблизительно 1,000 мг/кг, от приблизительно 0,425 до приблизительно 0,900 мг/кг, от приблизительно 0,425 до приблизительно 0,800 мг/кг, от приблизительно 0,425 до приблизительно 0,700 мг/кг, от приблизительно 0,425 до приблизительно 0,600 мг/кг, от приблизительно 0,425 до приблизительно 0,500 мг/кг, от приблизительно 0,450 до приблизительно 1,825 мг/кг, от приблизительно 0,450 до приблизительно 1,800 мг/кг, от приблизительно 0,450 до приблизительно 1,700 мг/кг, от приблизительно 0,450 до приблизительно 1,600 мг/кг, от приблизительно 0,450 до приблизительно 1,500 мг/кг, от приблизительно 0,450 до приблизительно 1,400 мг/кг, от приблизительно 0,450 до приблизительно 1,400 мг/кг, от приблизительно 0,450 до приблизительно 1,200 мг/кг, от приблизительно 0,450 до приблизительно 1,100 мг/кг, от приблизительно 0,450 до приблизительно 1,000 мг/кг, от приблизительно 0,450 до приблизительно 0,900 мг/кг, от приблизительно 0,450 до приблизительно 0,800 мг/кг, от приблизительно 0,450 до приблизительно 0,700 мг/кг, от приблизительно 0,450 до приблизительно 0,600 мг/кг, от приблизительно 0,450 до приблизительно 0,500 мг/кг, от приблизительно 0,475 до приблизительно 1,825 мг/кг, от приблизительно 0,475 до приблизительно 1,800 мг/кг, от приблизительно 0,475 до приблизительно 1,700 мг/кг, от приблизительно 0,475 до приблизительно 1,600 мг/кг, от приблизительно 0,475 до приблизительно 1,500 мг/кг, от приблизительно 0,475 до приблизительно 1,400 мг/кг, от приблизительно 0,475 до приблизительно 1,400 мг/кг, от приблизительно 0,475 до приблизительно 1,200 мг/кг, от приблизительно 0,475 до приблизительно 1,100 мг/кг, от приблизительно 0,475 до приблизительно 1,000 мг/кг, от приблизительно 0,475 до приблизительно 0,900 мг/кг, от приблизительно 0,475 до приблизительно 0,800 мг/кг, от приблизительно 0,475 до приблизительно 0,700 мг/кг, от приблизительно 0,475 до приблизительно 0,600 мг/кг, от приблизительно 0,475 до приблизительно 0,500 мг/кг, от приблизительно 0,875 до приблизительно 1,825 мг/кг, от приблизительно 0,875 до приблизительно 1,800 мг/кг, от приблизительно 0,875 до приблизительно 1,700 мг/кг, от приблизительно 0,875 до приблизительно 1,600 мг/кг, от приблизительно 0,875 до приблизительно 1,500 мг/кг, от приблизительно 0,875 до приблизительно 1,400 мг/кг, от приблизительно 0,875 до приблизительно 1,400 мг/кг, от приблизительно 0,875 до приблизительно 1,200 мг/кг, от приблизительно 0,875 до приблизительно 1,100 мг/кг, от приблизительно 0,875 до приблизительно 1,000 мг/кг, от приблизительно 0,875 до приблизительно 0,900 мг/кг, от приблизительно 0,900 до приблизительно 1,825 мг/кг, от приблизительно 0,900 до приблизительно 1,800 мг/кг, от приблизительно 0,900 до приблизительно 1,700 мг/кг, от приблизительно 0,900 до приблизительно 1,600 мг/кг, от приблизительно 0,900 до приблизительно 1,500 мг/кг, от приблизительно 0,900 до приблизительно 1,400 мг/кг, от приблизительно 0,900 до приблизительно 1,400 мг/кг, от приблизительно 0,900 до приблизительно 1,200 мг/кг, от приблизительно 0,900 до приблизительно 1,100 мг/кг, от приблизительно 0,900 до приблизительно 1,000 мг/кг, от приблизительно 0,925 до приблизительно 1,825 мг/кг, от приблизительно 0,925 до приблизительно 1,800 мг/кг, от приблизительно 0,925 до приблизительно 1,700 мг/кг, от приблизительно 0,925 до приблизительно 1,600 мг/кг, от приблизительно 0,925 до приблизительно 1,500 мг/кг, от приблизительно 0,925 до приблизительно 1,400 мг/кг, от приблизительно 0,925 до приблизительно 1,400 мг/кг, от приблизительно 0,925 до приблизительно 1,200 мг/кг, от приблизительно 0,925 до приблизительно 1,100 мг/кг или от приблизительно 0,925 до приблизительно 1,000 мг/кг. Значения и диапазоны, промежуточные к вышеприведенным указанным значениям, также предназначены составлять часть настоящего изобретения, например, средство РНКи можно вводить больному в дозе от приблизительно 0,015 мг/кг до приблизительно 0,45 мг/кг.
Например, средство РНКи, например, средство РНКи в фармацевтической композиции можно вводить в дозе от приблизительно 0,2 мг/кг, 0,225 мг/кг, 0,25 мг/кг, 0,275 мг/кг, 0,3 мг/кг, 0,325 мг/кг, 0,35 мг/кг, 0,375 мг/кг, 0,4 мг/кг, 0,425 мг/кг, 0,45 мг/кг, 0,475 мг/кг, приблизительно 0,5 мг/кг, 0,525 мг/кг, 0,55 мг/кг, 0,575 мг/кг, приблизительно 0,6 мг/кг, 0,625 мг/кг, 0,65 мг/кг, 0,675 мг/кг, приблизительно 0,7 мг/кг, 0,725 мг/кг, 0,75 мг/кг, 0,775 мг/кг, приблизительно 0,8 мг/кг, 0,925 мг/кг, 0,95 мг/кг, 0,975 мг/кг, приблизительно 1,0 мг/кг, 1,025 мг/кг, 1,05 мг/кг, 1,075 мг/кг, приблизительно 1,1 мг/кг, 1,125 мг/кг, 1,15 мг/кг, 1,175 мг/кг, приблизительно 1,2 мг/кг, 1,225 мг/кг, 1,25 мг/кг, 1,275 мг/кг, приблизительно 1,3 мг/кг, 1,325 мг/кг, 1,35 мг/кг, 1,375 мг/кг, приблизительно 1,4 мг/кг, 1,425 мг/кг, 1,45 мг/кг, 1,475 мг/кг, приблизительно 1,5 мг/кг, 1,525 мг/кг, 1,55 мг/кг, 1,575 мг/кг, приблизительно 1,6 мг/кг, 1,625 мг/кг, 1,65 мг/кг, 1,675 мг/кг, приблизительно 1,7 мг/кг, 1,725 мг/кг, 1,75 мг/кг, 1,775 мг/кг или приблизительно 1,8 мг/кг. Значения, промежуточные к вышеприведенным указанным значениям, также предназначены составлять часть настоящего изобретения.
В некоторых вариантах осуществления фармацевтическую композицию, содержащую средство иРНК, вводят больному в фиксированной дозе. «фиксированная доза» (например, доза в мг) означает, что одну дозу средства иРНК используют для всех больных независимо от каких-либо специфических связанных с больным факторов, таких как вес. В одном конкретном варианте осуществления фиксированная доза средства иРНК согласно изобретению основана на заданном весе или возрасте.
В некоторых вариантах осуществления фармацевтическую композицию, содержащую средство иРНК, вводят в фиксированной дозе от приблизительно 25 мг до приблизительно 100 мг, например, от приблизительно 25 мг до приблизительно 95 мг, от приблизительно 25 мг до приблизительно 90 мг, от приблизительно 25 мг до приблизительно 85 мг, от приблизительно 25 мг до приблизительно 80 мг, от приблизительно 25 мг до приблизительно 75 мг, от приблизительно 25 мг до приблизительно 70 мг, от приблизительно 25 мг до приблизительно 65 мг, от приблизительно 25 мг до приблизительно 60 мг, от приблизительно 25 мг до приблизительно 50 мг, от приблизительно 50 мг до приблизительно 100 мг, от приблизительно 50 мг до приблизительно 95 мг, от приблизительно 50 мг до приблизительно 90 мг, от приблизительно 50 мг до приблизительно 85 мг, от приблизительно 50 мг до приблизительно 80 мг, от приблизительно 30 мг до приблизительно 100 мг, от приблизительно 30 мг до приблизительно 90 мг, от приблизительно 30 мг до приблизительно 80 мг, от приблизительно 40 мг до приблизительно 100 мг, от приблизительно 40 мг до приблизительно 90 мг, от приблизительно 40 мг до приблизительно 80 мг, от приблизительно 60 мг до приблизительно 100 мг, от приблизительно 60 мг до приблизительно 90 мг, от приблизительно 25 мг до приблизительно 55 мг, от приблизительно 30 мг до приблизительно 95 мг, от приблизительно 30 мг до приблизительно 85 мг, от приблизительно 30 мг до приблизительно 75 мг, от приблизительно 30 мг до приблизительно 65 мг, от приблизительно 30 мг до приблизительно 55 мг, от приблизительно 40 мг до приблизительно 95 мг, от приблизительно 40 мг до приблизительно 85 мг, от приблизительно 40 мг до приблизительно 75 мг, от приблизительно 40 мг до приблизительно 65 мг, от приблизительно 40 мг до приблизительно 55 мг или от приблизительно 45 мг до приблизительно 95 мг.
В некоторых вариантах осуществления фармацевтическую композицию, содержащую средство иРНК, вводят в фиксированной дозе приблизительно 25 мг, приблизительно 30 мг, приблизительно 35 мг, приблизительно 40 мг, приблизительно 45 мг, приблизительно 50 мг, приблизительно 55 мг, приблизительно 60 мг, приблизительно 65 мг, приблизительно 70 мг, приблизительно 75 мг, приблизительно 80 мг, приблизительно 85 мг, приблизительно 90 мг, приблизительно 95 мг или приблизительно 100 мг.
Фармацевтическую композицию, содержащую иРНК, можно вводить больному приблизительно один раз в месяц, приблизительно один раз каждые пять недель, приблизительно один раз каждые шесть недель, приблизительно один раз каждые 2 месяца или один раз в квартал.
Фармацевтическую композицию, содержащую средство иРНК, можно вводить больному в виде одной или более доз. В некоторых вариантах осуществления фармацевтические композиции, содержащие средство двухцепочечной иРНК, можно вводить больному в виде ежемесячной дозы от приблизительно 0,200 мг/кг до приблизительно 0,250 мг/кг, ежемесячной дозы от приблизительно 0,425 мг/кг до приблизительно 0,475 мг/кг, ежемесячной дозы от приблизительно 0,875 мг/кг до приблизительно 0,925 мг/кг или в виде ежемесячной дозы от приблизительно 1,775 мг/кг до приблизительно 1,825 мг/кг. В некоторых вариантах осуществления фармацевтические композиции, содержащие средство двухцепочечной иРНК, можно вводить больному в фиксированной дозе от приблизительно 25 мг до приблизительно 100 мг, например, приблизительно 25 мг, приблизительно 50 мг, приблизительно 80 мг или приблизительно 100 мг.
Фармацевтическую композицию можно вводить путем внутривенной инфузии в течение некоторого периода времени, например, в течение периода 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, и 21, 22, 23, 24 или приблизительно 25 минут. Введение может быть повторным, например, на регулярной основе, например, раз в неделю, раз в две недели (то есть каждые две недели), ежемесячно, каждые два месяца, каждые три месяца, каждые четыре месяца или дольше. После первоначального курса лечения лечение можно проводить с меньшей частотой. Например, после введения раз в неделю или раз в две недели в течение трех месяцев введение можно повторять один раз в месяц, в течение шести месяцев или года или дольше.
Фармацевтическую композицию можно вводить один раз в день, или иРНК можно вводить в виде двух, трех или более вспомогательных доз через подходящие интервалы на протяжение дня или даже с использованием постоянной инфузии или доставки посредством готовой формы с регулируемым высвобождением. В этом случае иРНК, содержащаяся в каждой вспомогательной дозе, должна быть соответственно меньше для достижения общей суточной дозы. Единицу дозы также можно составить для доставки в течение нескольких дней, например, с использованием обычной готовой формы с замедленным высвобождением, которая обеспечивает продолжительное высвобождение иРНК в течение периода несколько дней. готовые формы с замедленным высвобождением хорошо известны в данной области и особенно полезны для доставки средств в конкретное место, например, как можно использовать со средствами согласно настоящему изобретению. В этом варианте осуществления единица дозы содержит соответствующую величину суточной дозы.
В других вариантах осуществления единичная доза фармацевтических композиций может быть продолжительной, так что последующие дозы вводят с интервалами не более чем на 1, 2, 3, 4, 5, 6, 7 или 8 недель. В некоторых вариантах осуществления изобретения единичную дозу фармацевтических композиций согласно изобретению вводят один раз в месяц.
Специалисту будет понятно, что определенные факторы могут влиять на дозировку и сроки, необходимые для эффективного лечения больного, включая, но без ограничения тяжесть заболевания или нарушения, предыдущие методы лечения, общее состояние здоровья и/или возраст больного и другие имеющиеся заболевания. Кроме того, лечение больного терапевтически эффективным количеством композиции может включать в себя однократное лечение или серию курсов лечения. Оценки эффективности дозировок и периодов полувыведения in vivo для иРНК человека, охватываемых изобретением, можно проводить с использованием обычных методов или на основе тестирования in vivo с использованием подходящей животной модели, как описано в другом месте в данном документе.
Достижения в области генетики мыши позволили создать ряд мышиных моделей для изучения различных заболеваний человека, таких как нарушение свертываемости крови, которые получили бы пользу от снижения экспрессии Serpinc1. Такие модели можно использовать для тестирования iRNA in vivo, а также для определения терапевтически эффективной дозы. Подходящие мышиные модели известны в данной области и включают в себя, например, мышиные модели Hemophilia A и мышиные модели Hemohphilia B, например, мышей, содержащих нокаут гена фактора свертывания крови, таких как мыши, которые описаны в Bolliger et al. (2010) Thromb Haemost 103: 1233-1238, Bi L, et al. (1995) Nat Genet 10: 119-21, Lin et al. (1997) Blood 90: 3962-6, Kundu et al. (1998) Blood 92: 168-74, Wang et al. (1997) Proc Natl Acad Sci U S A 94: 11563-6 и Jin et al. (2004) Blood 104: 1733.
Фармацевтические композиции согласно настоящему изобретению можно вводить разными способами в зависимости от того, нужно ли местное или системное лечение, и от области, подлежащей лечению. Введение может быть местным (например, посредством трансдермального пластыря), легочным, например, посредством ингаляции или инсуффляции порошков или аэрозолей, в том числе посредством небулайзера; интратрахеальным, интраназальным, эпидермальным и трансдермальным, пероральным или парентеральным. Парентеральное введение включает в себя внутривенную, внутриартериальную, подкожную, внутрибрюшинную или внутримышечную инъекцию или инфузию; подкожное, например, посредством имплантированного устройства; или внутричерепное, например, интрапаренхиматозное, интратекальное или внутрижелудочковое введения.
иРНК можно доставлять таким образом, чтобы нацеливать на конкретную ткань, такую как печень (например, гепатоциты печени).
Фармацевтические композиции и готовые формы для местного введения могут включать в себя трансдермальные пластыри, мази, лосьоны, крема, гели, капли, суппозитарии, спреи, жидкости и порошки. Необходимыми или желательными могут быть обычные фармацевтические носители на водной, порошковой или масляной основе, загустители и тому подобное. Также могут быть полезны презервативы с покрытием, перчатки и тому подобное. Подходящие готовые формы для местного применения включают в себя те, в которых иРНК, представленные в изобретении, находятся в смеси со средством для местной доставки, таким как липиды, липосомы, жирные кислоты, сложные эфиры жирных кислот, стероиды, хелатообразующие средства и поверхностно-активные вещества. Готовые формы для местного применения подробно описаны в патенте США № 6747014, который включен в данный документ посредством ссылки.
А. Дополнительные Готовые формы
i. Эмульсии
Композиции согласно настоящему изобретению можно получать и составлять в виде эмульсий. Эмульсии обычно представляют собой гетерогенные системы одной жидкости, диспергированной в другой в виде капель обычно диаметром свыше 0,1 мкм (см., например, Ansel's Pharmaceutical Dosage Forms and Drug Delivery Системы, Allen, LV., Popovich NG., and Ansel HC., 2004, Lippincott Williams & Wilkins (8th ed.), New York, NY; Idson, in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 199; Rosoff, in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., Volume 1, p. 245; Block in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 2, p. 335; Higuchi et al., in Remington's Pharmaceutical Sciences, Mack Publishing Co., Easton, Pa., 1985, p. 301). Эмульсии часто представляют собой двухфазные системы, содержащие две несмешиваемые жидкие фазы, тщательно перемешанные и диспергированные друг с другом. В общем, эмульсии могут относиться к типу либо вода в масле (w/o), либо масло в воде (o/w). Когда водную фазу тонко разделяют и диспергируют в виде мелких капель в объемную масляную фазу, полученную композицию называют эмульсия вода в масле (w/o). Альтернативно, когда масляную фазу тонко разделяют и диспергируют в виде мелких капель в объемную водную фазу, полученную композицию называют эмульсия масло в воде (o/w). В дополнение к диспергированным фазам эмульсии могут содержать дополнительные компоненты и активное лекарственное средство, которое может присутствовать в виде раствора либо в водной фазе, либо в масляной фазе, либо в виде отдельной фазы. Также при необходимости в эмульсиях могут присутствовать фармацевтические эксципиенты, такие как эмульгаторы, стабилизаторы, красители и антиоксиданты. Фармацевтические эмульсии также могут представлять собой множественные эмульсии, которые состоят из более чем двух фаз, как например, в случае эмульсий масло в воде в масле (o/w/o) и вода в масле в воде (w/o/w). Такие сложные готовые формы часто обеспечивают определенное преимущество, которых нет у простых двойных эмульсий. Множественные эмульсии, в которых отдельные капли масла эмульсии o/w заключают в себе небольшие капли воды, составляют эмульсию w/o/w. Также система капель масла, заключенных в шарики воды, стабилизированные в масляной постоянной фазе, обеспечивает получение эмульсии o/w/o.
Эмульсии характеризуются небольшой или отсутствием термодинамической стабильности. Часто, диспергированная или дисперсная фаза эмульсии хорошо диспергируется во внешнюю или постоянную фазу и сохраняется в этой форме посредством эмульгаторов или за счет вязкости готовой формы. Любая из фаз эмульсии может быть полутвердой или твердой, как в случае основ мазей эмульсионного типа и кремов. Другие средства стабилизации эмульсий включают использование эмульгаторов, которые можно включать в любую фазу эмульсии. В широком смысле эмульгаторы можно разделить на четыре категории: синтетические поверхностно-активные вещества, эмульгаторы природного происхождения, абсорбционные основы и мелкодисперсные твердые вещества (см., например, HC., 2004, Lippincott Williams & Wilkins (8th ed.), New York, NY; Idson, in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 199).
Синтетические поверхностно-активные вещества, также известные как поверхностно-активные средства, нашли широкое применение в рецептурах эмульсй и рассмотрены в литературе (см., например, Ansel's Pharmaceutical Dosage Forms and Drug Delivery Systems, Allen, LV., Popovich NG., and Ansel HC., 2004, Lippincott Williams & Wilkins (8th ed.), New York, NY; Rieger, in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 285; Idson, in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), Marcel Dekker, Inc., New York, N.Y., 1988, volume 1, p. 199). Поверхностно-активные вещества обычно являются амфифильными и содержат гидрофильную и гидрофобную часть. Соотношение гидрофильной и гидрофобной природы поверхностно-активного вещества называют гидрофильно-липофильным балансом (HLB) и является ценным инструментом для классификации и выбора поверхностно-активных веществ при получении готовых форм. Поверхностно-активные вещества можно классифицировать на разные классы на основании природы гидрофильной группы: неионная, анионная, катионная и амфотерная (см., например, Ansel's Pharmaceutical Dosage Forms and Drug Delivery Systems, Allen, LV., Popovich NG., and Ansel HC., 2004, Lippincott Williams & Wilkins (8th ed.), New York, NY Rieger, in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 285).
Эмульгаторы природного происхождения, используемые в эмульсионных готовых формах, содержат ланолин, пчелиный воск, фосфатиды, лецитин и аравийскую камедь. Абсорбирующие основы обладают гидрофильными свойствами, так что они могут впитывать воду с образованием эмульсий w/o, сохраняя при этом свою полутвердую консистенцию, например, безводный ланолин и гидрофильный вазилин. Тонкоизмельченные твердые вещества также используют в качестве хороших эмульгаторов, особенно в комбинации с поверхностно-активными веществами и в вязких препаратах. Они включают в себя полярные неорганические твердые вещества, такие как гидроксиды тяжелых металлов, ненабухающие глины, такие как бентонит, аттапульгит, гекторит, каолин, монтмориллонит, коллоидный силикат алюминия и коллоидный силикат магния и алюминия, пигменты и неполярные твердые вещества, такие как углерод или глицерилтристеарат.
Также в эмульсионные готовые формы включено большое множество неэмульгирующих материалов, которые вносят вклад в свойства эмульсий. Они включают в себя жиры, масла, воски, жирные кислоты, жирные спирты, жирные сложные эфиры, увлажнители, гидрофильные коллоиды, консерванты и антиоксиданты (Block, in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 335; Idson, in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 199).
Гидрофильные коллоиды или гидроколлоиды включают в себя камеди природного происхождения и синтетические полимеры, такие как полисахариды (например, аравийскую камедь, агар, альгиновую кислоту, каррагенан, гуаровую камедь, камедь карайи и трагакант), производные целлюлозы (например, карбоксиметилцеллюлозу и карбоксипропилцеллюлозу) и синтетические полимеры (например, карбомеры, эфиры целлюлозы и карбоксивинилполимеры). Они диспергируются или набухают в воде с образованием коллоидных растворов, которые стабилизируют эмульсии путем образования прочных межфазных пленок вокруг капель дисперсной фазы и путем увеличения вязкости внешней фазы.
Поскольку эмульсии часто содержат ряд ингредиентов, таких как углеводы, белки, стеролы и фосфaтиды, которые могут легко способствовать росту микробов, эти готовые формы часто включают консерванты. Широко используемые консерванты, включаемые в эмульсионные готовые формы, включают в себя метилпарабен, пропилпарабен, соли четвертичного аммония, хлорид бензалкония, сложные эфиры p-гидроксибензойной кислоты и борную кислоту. В эмульсионные готовые формы также обычно добавляют антиоксиданты для предотвращения ухудшения готовой формы. Используемыми антиоксидантами могут быть поглотители свободных радикалов, такие как токоферолы, алкилгаллаты, бутилированные гидроксианизолы, бутилированный гидрокситолуол или восстанавливающие средства, такие как аскорбиновая кислота и метабисульфит натрия, и синергисты антиоксидантов, такие как лимонная кислота, винная кислота и лецитин.
Применение эмульсионных готовых форм посредством дерматологических, пероральных и парентеральных путей и способы их получения рассмотрены в литературе (см., например, Ansel's Pharmaceutical Dosage Forms and Drug Delivery Systems, Allen, LV., Popovich NG., and Ansel HC., 2004, Lippincott Williams & Wilkins (8th ed.), New York, NY; Idson, in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 199). Эмульсионные готовые формы для пероральной доставки широко используются из-за легкости составления, а также эффективности с точки зрения абсорбции и биодоступности (см., например, Ansel's Pharmaceutical Dosage Forms and Drug Delivery Systems, Allen, LV., Popovich NG., and Ansel HC., 2004, Lippincott Williams & Wilkins (8th ed.), New York, NY; Rosoff, in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 245; Idson, in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 199). Слабительные на минерально-масляной основе, жирорастворимые витамины и пищевые препараты с высоким содержание жиров представляют собой материалы, которые обычно вводят перорально в виде эмульсий o/w.
ii. Микроэмульсии
В одном варианте осуществления настоящего изобретения композиции иРНК и нуклеиновых кислот составляют в виде микроэмульсий. Микроэмульсию можно определить как систему из воды, масла и амфифильного вещества, которая составляет единый оптически изотропный и термодинамически стабильный жидкий раствор (см., например, Ansel's Pharmaceutical Dosage Forms and Drug Delivery Systems, Allen, LV., Popovich NG., and Ansel HC., 2004, Lippincott Williams & Wilkins (8th ed.), New York, NY; Rosoff, in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 245). Обычно микроэмульсии представляют собой системы, которые получают сперва диспергируя масло в водном растворе поверхностно-активного вещества, а затем добавляя достаточное количество четвертого компонента, обычно спирта с промежуточной длиной цепи, с образованием прозрачной системы. Поэтому микроэмульсии также были описаны как термодинамически стабильные, изотропно прозрачные дисперсии двух несмешивающихся жидкостей, которые стабилизированы межфазными пленками поверхностно-активных молекул (Leung and Shah, in: Controlled Release of Drugs: Polymers and Aggregate Systems, Rosoff, M., Ed., 1989, VCH Publishers, New York, pages 185-215). Микроэмульсии обычно получают с помощью комбинации трех - пяти компонентов, которые включают масло, воду, поверхностно-активное вещество, вспомогательное поверхностно-активное вещество и электролит. Относится ли микроэмульсия к типу вода-в-масле (w/o) или масло-в-воде (o/w), зависит от свойств используемого масла и поверхностно-активного вещества, а также от структуры и геометрической упаковки полярных головок и углеводородных хвостов молекул поверхностно-активного вещества (Schott, in Remington's Pharmaceutical Sciences, Mack Publishing Co., Easton, Pa., 1985, p. 271).
Феноменологический подход, использующий фазовые диаграммы, был тщательно изучен и дал специалистам в данной области всесторонние знания о том, как составлять микроэмульсии (см., например, Ansel's Pharmaceutical Dosage Forms and Drug Delivery Systems, Allen, LV., Popovich NG., and Ansel HC., 2004, Lippincott Williams & Wilkins (8th ed.), New York, NY; Rosoff, in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 245; Block, in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 335). По сравнению с обычными эмульсиями микроэмульсии обладают преимуществом солюбилизации нерастворимых в воде лекарств в составе термодинамически стабильных капель, которые образуются спонтанно.
Поверхностно-активные вещества, используемые для получения микроэмульсий, включают, но без ограничения, ионные поверхностно-активные вещества, неионные поверхностно-активные вещества, Brij 96, полиоксиэтиленолеиновые эфиры, сложные эфиры полиглицерина и жирных кислот, тетраглицеролмонолаурат (ML310), тетраглицеролмоноолеат (MO310), гексаглицеролмоноолеат (PO310), гексаглицерол пентаолеат (PO500), декаглицеролмонокапрат (MCA750), декаглицеролмоноолеат (MO750), декаглицеролсеквиолеат (SO750), декаглицеролдекаолеат (DAO750), отдельно или в сочетании с вспомогательными поверхностно-активными веществами. Вспомогательное поверхностно-активное вещество, обычно спирт с короткой цепью, такой как этанол, 1-пропанол и 1-бутанол, служит для увеличения межфазной текучести, проникая в пленку поверхностно-активного вещества и, следовательно, создавая неупорядоченную пленку из-за пустого пространства, создаваемого молекулами поверхностно-активного вещества. Однако микроэмульсии можно получить без использования вспомогательных поверхностно-активных веществ, и в данной области известны самоэмульгирующиеся микроэмульсионные системы без спирта. Водной фазой обычно, но без ограничения, может быть вода, водный раствор лекарственного средства, глицерин, PEG300, PEG400, полиглицерины, пропиленгликоли и производные этиленгликоля. Масляная фаза может включать, но без ограничения, такие материалы, как Captex 300, Captex 355, Capmul MCM, сложные эфиры жирных кислот, моно, ди и триглицериды со средней длиной цепи (C8-C12), сложные эфиры полиоксиэтилированных глицерилов и жирных кислот, жирные спирты, полигликолизированные глицериды, насыщенные полигликолизированные C8-C10 глицериды, растительные масла и силиконовое масло.
Микроэмульсии особенно интересны с точки зрения солюбилизации лекарственных средств и усиления абсорбции лекарственных средств. Для улучшения пероральной биодоступности лекарственных средств, содержащих пептиды, были предложены микроэмульсии на основе липидов (и o/w и w/o) (см., например, патенты США №№ 6191105; 7063860; 7070802; 7157099; Constantinides et al., Pharmaceutical Research, 1994, 11, 1385-1390; Ritschel, Meth. Find. Exp. Clin. Pharmacol., 1993, 13, 205). Микроэмульсии обеспечивают преимущества улучшенной солюбилизации лекарственных средств, защиты лекарственного средства от ферментативного гидролиза, возможного улучшения абсорбции лекарственных средств из-за вызванных поверхностно-активными веществами изменений текучести и проницаемости мембран, легкости получения, легкости перорального введения по сравнению с твердыми лекарственными формами, улучшенной клинической активности и пониженная токсичность (см., например, патенты США №№ 6191105; 7063860; 7070802; 7157099; Constantinides et al., Pharmaceutical Research, 1994, 11, 1385; Ho et al., J. Pharm. Sci., 1996, 85, 138-143). Часто микроэмульсии могут образовываться самопроизвольно, когда их компоненты соединяются при температуре окружающей среды. Это может быть особенно выгодно при составлении термолабильных лекарственных средств, пептидов или иРНК. Микроэмульсии также эффективны при трансдермальной доставке активных компонентов как в косметических, так и в фармацевтических вариантах применения. Ожидается, что микроэмульсионные композиции и готовые формы согласно настоящему изобретению будут способствовать усилению системного поглощения иРНК и нуклеиновых кислот из желудочно-кишечного тракта, а также улучшать локальное клеточное поглощение иРНК и нуклеиновых кислот.
Микроэмульсии согласно настоящему изобретению также могут содержать дополнительные компоненты и добавки, такие как сорбитан моностеарат (Grill 3), лабразол и усилители проникновения, для улучшения свойств готовой формы и для усиления поглощения иРНК и нуклеиновых кислот согласно настоящему изобретению. Усилители проникновения, используемые в микроэмульсиях согласно настоящему изобретению, можно классифицировать как принадлежащие к одной из пяти широких категорий - поверхностно-активные вещества, жирные кислоты, желчные соли, хелатообразующие средства и нехелатообразующие не поверхностно-активные вещества (Lee et al., Critical Reviews in Therapeutic Drug Carrier Systems, 1991, p. 92). Каждый из этих классов обсуждался выше.
iii. Микрочастицы
Средство РНКи согласно изобретению можно включить в частицу, например, микрочастицу. Микрочастицы можно получать с помощью распылительной сушки, но также можно получать другими способами, включая лиофилизацию, выпаривание, сушку в псевдоожиженном слое, вакуумную сушку или комбинацию этих методов.
iv. Усилители проникновения
В одном варианте осуществления в настоящем изобретении использованы разные усилители проникновения, влияющие на эффективную доставку нуклеиновых кислот, особенно иРНК, в кожу животных. Большинство лекарственных средств присутствуют в растворе как в ионизированной, так и в неионизированной форме. Однако обычно через клеточные мембраны проникают только жирорастворимые или липофильные лекарственные средства легко. Было обнаружено, что даже нелипофильные лекарственные средства могут проникать через клеточные мембраны, если пересекаемую мембрану обработать усилителем проникновения. В дополнение к содействию диффузии нелипофильных лекарственных средств через клеточные мембраны усилители проникновения также увеличивают проникновение липофильных лекарственных средств.
Усилители проникновения можно классифицировать как принадлежащие к одной из пяти широких категорий, то есть поверхностно-активные вещества, жирные кислоты, желчные соли, хелатообразующие средства и нехелатообразующие неповерхностно-активные вещества (см., например, Malmsten, M. Surfactants and polymers in drug delivery, Informa Health Care, New York, NY, 2002; Lee et al., Critical Reviews in Therapeutic Drug Carrier Systems, 1991, p.92). Каждый из вышеупомянутых классов улучшителей проникновения описан ниже более подробно.
Поверхностно-активные вещества (или «поверхностно-активные средства») представляют собой химические вещества, которые при растворении в водном растворе уменьшают поверхностное натяжение раствора или межфазное натяжение между водным раствором и другой жидкостью, в результате чего улучшается абсорбция иРНК через слизистую оболочку. В дополнение к желчным солям и жирным кислотам эти усилители проникновения включают в себя, например, лаурилсульфат натрия, полиоксиэтилен-9-лауриловый эфир и полиоксиэтилен-20-цетиловый эфир) (см., например, Malmsten, M. Surfactants and polymers in drug delivery, Informa Health Care, New York, NY, 2002; Lee et al., Critical Reviews in Therapeutic Drug Carrier Systems, 1991, p.92); и перфторхимические эмульсии, такие как FC-43 (Takahashi et al., J. Pharm. Pharmacol., 1988, 40, 252).
Различные жирные кислоты и их производные, которые действуют как усилители проникновения, включают в себя, например, олеиновую кислоту, лауриновую кислоту, каприновую кислоту (н-декановую кислоту), миристиновую кислоту, пальмитиновую кислоту, стеариновую кислоту, линолевую кислоту, линоленовую кислоту, дикапрат, трикапрат, моноолеин (1-моноолеоил-рац-глицерин), дилаурин, каприловую кислоту, арахидоновую кислоту, глицерин-1-монокапрат, 1-додецилазациклогептан-2-он, ацилкарнитины, ацилхолины, C1-20-алкиловые эфиры (например, метиловый, изопропиловый и t-бутиловый) и их моно- и диглицериды (т.е. Олеат, лаурат, капрат, миристат, пальмитат, стеарат, линолеат и т. Д.) (см., например, Touitou, E., et al. Enhancement in Drug Delivery, CRC Press, Danvers, MA, 2006; Lee et al., Critical Reviews in Therapeutic Drug Carrier Systems, 1991, p.92; Muranishi, Critical Reviews in Therapeutic Drug Carrier Systems, 1990, 7, 1-33; El Hariri et al., J. Pharm. Pharmacol., 1992, 44, 651-654).
Физиологическая роль желчи включает в себя облегчение дисперсии и абсорбции липидов и жирорастворимых витаминов (см., Например, Malmsten, M. Surfactants and polymers in drug delivery, Informa Health Care, New York, NY, 2002; Brunton, Chapter 38 in: Goodman & Gilman's The Pharmacological Basis of Therapeutics, 9th Ed., Hardman et al. Eds., McGraw-Hill, New York, 1996, pp. 934-935). Различные природные желчные соли и их синтетические производные действуют как усилители проникновения. Таким образом, термин «желчные соли» включает любые встречающиеся в природе компоненты желчи, а также любые их синтетические производные. Подходящие желчные соли включают в себя, например, желчную кислоту (или ее фармацевтически приемлемую натриевую соль, холат натрия), дегидрохолевую кислоту (дегидрохолат натрия), дезоксихолевую кислоту (дезоксихолат натрия), глюхолевую кислоту (глюхолат натрия), глихолевую кислоту (гликохолат натрия), гликодезоксихолевую кислоту (гликодезоксихолат натрия), таурохолевую кислоту (таурохолат натрия), тауродезоксихолевую кислоту (тауродезоксихолат натрия), хенодезоксихолевую кислоту (хенодезоксихолат натрия), урсодезоксихолевую кислоту (UDCA), натрий-тауро-24,25-дигидрофузидат натрия (STDHF), гликодигидрофузидат натрия и полиоксиэтилен-9-лауриловый эфир (POE) (см., например, Malmsten, M. Surfactants and polymers in drug delivery, Informa Health Care, New York, NY, 2002; Lee et al., Critical Reviews in Therapeutic Drug Carrier Systems, 1991, page 92; Swinyard, Chapter 39 In: Remington's Pharmaceutical Sciences, 18th Ed., Gennaro, ed., Mack Publishing Co., Easton, Pa., 1990, pages 782-783; Muranishi, Critical Reviews in Therapeutic Drug Carrier Systems, 1990, 7, 1-33; Yamamoto et al., J. Pharm. Exp. Ther., 1992, 263, 25; Yamashita et al., J. Pharm. Sci., 1990, 79, 579-583).
Хелатообразующие средства, используемые в связи с настоящим изобретением, можно определить как соединения, которые удаляют ионы металлов из раствора путем образования с ними комплексов, в результате чего увеличивается поглощение иРНК через слизистую оболочку. Что касается их использования в качестве усилителей проникновения в настоящем изобретении, хелатирующие средства имеют дополнительное преимущество, поскольку они также служат в качестве ингибиторов ДНКаз, поскольку для большинства охарактеризованных нуклеаз ДНК для катализа требуются ионы двухвалентных металлов, и поэтому они ингибируются хелатирующими средствами (Jarrett, J. Chromatogr., 1993, 618, 315-339). Подходящие хелатообразующие средства включают, но без ограничения, динатрийэтилендиаминтетраацетат (EDTA), лимонную кислоту, салицилаты (например, салицилат натрия, 5-метоксисалицилат и гомованилат), N-ацильные производные коллагена, лаурет-9 и N-аминоацильные производные бета-дикетонов (енамины) (см., например, Katdare, A. et al., Excipient development for pharmaceutical, biotechnology, and drug delivery, CRC Press, Danvers, MA, 2006; Lee et al., Critical Reviews in Therapeutic Drug Carrier Systems, 1991, page 92; Muranishi, Critical Reviews in Therapeutic Drug Carrier Systems, 1990, 7, 1-33; Buur et al., J. Control Rel., 1990, 14, 43-51).
В рамках настоящего изобретения нехелатирующие не являющиеся поверхностно-активными веществами улучшающие проникновение соединения можно определить как соединения, которые демонстрируют незначительную активность в качестве хелатирующих средств или поверхностно-активных веществ, но, тем не менее, усиливают поглощение иРНК через слизистую оболочку пищеварительного тракта (см., Например, Muranishi, Critical Reviews in Therapeutic Drug Carrier Systems, 1990, 7, 1-33). Этот класс усилителей проникновения включает, например, ненасыщенные циклические мочевины, производные 1-алкил- и 1-алкенилазациклоалканона (Lee et al., Critical Reviews in Therapeutic Drug Carrier Systems, 1991, page 92); и нестероидные противовоспалительные средства, такие как диклофенак натрия, индометацин и фенилбутазон (Yamashita et al., J. Pharm. Pharmacol., 1987, 39, 621-626).
Также в фармацевтические и другие композиции согласно настоящему изобретению можно добавить средства, которые улучшают поглощение иРНК на клеточном уровне. Например, также известно, что катионные липиды, такие как липофектин (Junichi et al, патент США № 5705188), катионные производные глицерина и поликатионные молекулы, такие как полилизин (Lollo et al., PCT Заявка WO 97/30731), улучшают клеточное поглощение дцРНК. Примеры коммерчески доступных трансфекционных реагентов включают среди прочего, например, Lipofectamine™ (Invitrogen; Carlsbad, CA), Lipofectamine 2000™ (Invitrogen; Carlsbad, CA), 293fectin™ (Invitrogen; Carlsbad, CA), Cellfectin™ (Invitrogen; Carlsbad, CA), DMRIE-C™ (Invitrogen; Carlsbad, CA), FreeStyle™ MAX (Invitrogen; Carlsbad, CA), Lipofectamine™ 2000 CD (Invitrogen; Carlsbad, CA), Lipofectamine™ (Invitrogen; Carlsbad, CA), RNAiMAX (Invitrogen; Carlsbad, CA), Oligofectamine™ (Invitrogen; Carlsbad, CA), Optifect™ (Invitrogen; Carlsbad, CA), трансфекционный реагент X-tremeGENE Q2 (RОCHe; Grenzacherstrasse, Switzerland), липосомный трансфекционный реагент DOTAP (Grenzacherstrasse, Switzerland), липосомный трансфекционный реагент DOSPER (Grenzacherstrasse, Switzerland) или Fugene (Grenzacherstrasse, Switzerland), реагент Transfectam® (Promega; Madison, WI), трансфекционный реагент TransFast™ (Promega; Madison, WI), реагент Tfx™-20 (Promega; Madison, WI), реагент Tfx™-50 (Promega; Madison, WI), DreamFect™ (OZ Biosciences; Marseille, France), EcoTransfect (OZ Biosciences; Marseille, France), трансфекционный реагент TransPassª D1 (New England Biolabs; Ipswich, MA, USA), LyoVec™/LipoGen™ (Invitrogen; San Diego, CA, USA), трансфекционный реагент PerFectin (Genlantis; San Diego, CA, USA), трансфекционный реагент NeuroPORTER (Genlantis; San Diego, CA, USA), трансфекционный реагент GenePORTER (Genlantis; San Diego, CA, USA), трансфекционный реагент GenePORTER 2 (Genlantis; San Diego, CA, USA), трансфекционный реагент Cytofectin (Genlantis; San Diego, CA, USA), трансфекционный реагент BaculoPORTER (Genlantis; San Diego, CA, USA), трансфекционный реагент TroganPORTER™ (Genlantis; San Diego, CA, USA), RiboFect (Bioline; Taunton, MA, USA), PlasFect (Bioline; Taunton, MA, USA), UniFECTOR (B-Bridge International; Mountain View, CA, USA), SureFECTOR (B-Bridge International; Mountain View, CA, USA) или HiFect™ (B-Bridge International, Mountain View, CA, USA).
Для улучшения проникновения введенных нуклеиновых кислот можно использовать другие средства, включая гликоли, такие как этиленгликоль и пропиленгликоль, пирролы, такие как 2-пиррол, азоны и терпены, такие как лимонен и ментон.
v. Носители
Некоторые композиции согласно настоящему изобретению также включают в готовую форму соединения-носители. В рамках настоящего изобретения термин «соединение-носитель» или «носитель» может относиться к нуклеиновой кислоте или ее аналогу, которая является инертной (то есть не обладает биологической активностью как таковой), но распознается как нуклеиновая кислота с помощью процессов in vivo, что снижает биодоступность нуклеиновой кислоты, обладающей биологической активностью, например, путем разложения биологически активной нуклеиновой кислоты или содействия ее удалению из кровотока. Совместное введение нуклеиновой кислоты и соединения-носителя, обычно с избытком последнего вещества, может привести к значительному снижению количества нуклеиновой кислоты, выводимой в печени, почках или других экстрациркуляторных резервуарах, предположительно из-за конкуренции между соединением-носителем и нуклеиновой кислотой за общий рецептор. Например, выведение частично фосфоротиоатной дцРНК в ткани печени может быть снижено, если ее совместно вводить с полиинозиновой кислотой, декстрансульфатом, полицитидной кислотой или 4-ацетамидо-4'-изотиоциано-стильбен-2,2'-дисульфокислотой (Miyao et al., DsRNA Res. Dev., 1995, 5, 115-121; Takakura et al., DsRNA & Nucl. Acid Drug Dev., 1996, 6, 177-183).
vi. Эксципиенты
В отличие от соединения-носителя «фармацевтический носитель» или «эксципиент» представляет собой фармацевтически приемлемый растворитель, суспендирующее средство или любую другую фармакологически инертную среду для доставки одной или более нуклеиновых кислот животному. Эксципиент может быть жидким или твердым, и его выбирают с учетом планируемого способа введения, чтобы обеспечить желаемую массу, консистенцию и т. Д., в сочетании с нуклеиновой кислотой и другими компонентами данной фармацевтической композиции. Типичные фармацевтические носители включают в себя, но без ограничения, связывающие средства (например, предварительно желатинизированный кукурузный крахмал, поливинилпирролидон или гидроксипропилметилцеллюлозу и т. Д.); наполнители (например, лактозу и другие сахара, микрокристаллическую целлюлозу, пектин, желатин, сульфат кальция, этилцеллюлозу, полиакрилаты или гидрофосфат кальция и т. Д.); смазывающие вещества (например, стеарат магния, тальк, диоксид кремния, коллоидный диоксид кремния, стеариновую кислоту, стеараты металлов, гидрогенизированные растительные масла, кукурузный крахмал, полиэтиленгликоли, бензоат натрия, ацетат натрия и т. Д.); дезинтегранты (например, крахмал, натрия гликолят крахмала и т. Д.); и смачивающие средства (например, лаурилсульфат натрия и т.д.).
Фармацевтически приемлемые органические или неорганические эксципиенты, подходящие для непарентерального введения, которые не оказывают вредного действия на нуклеиновые кислоты, также могут быть использованы для составления композиций согласно настоящему изобретению. Подходящие фармацевтически приемлемые эксципиенты включают, но без ограничения, воду, солевые растворы, спирты, полиэтиленгликоли, желатин, лактозу, амилозу, стеарат магния, тальк, кремниевую кислоту, вязкий парафин, гидроксиметилцеллюлозу, поливинилпирролидон и тому подобное.
Готовые формы для местного введения нуклеиновых кислот могут включать в себя стерильные и нестерильные водные растворы, неводные растворы в обычных растворителях, таких как спирты, или растворы нуклеиновых кислот в жидких или твердых масляных основах. Растворы также могут содержать буферы, разбавители и другие подходящие добавки. Можно использовать фармацевтически приемлемые органические или неорганические эксципиенты, подходящие для непарентерального введения, которые не оказывают вредного воздействия на нуклеиновые кислоты.
Подходящие фармацевтически приемлемые эксципиенты включают в себя, но без ограничения, воду, растворы солей, спирт, полиэтиленгликоли, желатин, лактозу, амилозу, стеарат магния, тальк, кремниевую кислоту, вязкий парафин, гидроксиметилцеллюлозу, поливинилпирролидон и тому подобное.
vii. Другие Компоненты
Композиции согласно настоящему изобретению могут дополнительно содержать другие дополнительные компоненты, обычно встречающиеся в фармацевтических композициях, на уровне их употребления, установленном в данной области. Так, например, композиции могут содержать дополнительные совместимые фармацевтически активные материалы, такие как, например, противозудные, вяжущие средства, местные анестетики или противовоспалительные средства, или могут содержать дополнительные материалы, полезные для физического составления различных лекарственных форм композиций согласно настоящему изобретению, такие как красители, ароматизирующие средства, консерванты, антиоксиданты, регулирующие прозрачность средства, загустители и стабилизаторы. Однако такие материалы при добавлении не должны чрезмерно влиять на биологическую активность компонентов композиций согласно настоящему изобретению. Составы можно стерилизовать и, при желании, смешивать со вспомогательными средствами, например, смазывающими веществами, консервантами, стабилизаторами, смачивающими средствами, эмульгаторами, солями для воздействия на осмотическое давление, буферами, красителями, ароматизаторами и/или ароматическими веществами и т.п., которые не оказывают вредного влияния при взаимодействии с нуклеиновой кислотой (кислотами) гоотовой формы.
Водные суспензии могут содержать вещества, которые увеличивают вязкость суспензии, включая, например, натрий карбоксиметилцеллюлозу, сорбит и/или декстран. Суспензия также может содержать стабилизаторы.
В некоторых вариантах осуществления фармацевтические композиции, представленные в изобретении, содержат (а) одно или более соединений иРНК и (b) одно или более средств, которые функционируют не посредством механизма РНКи и которые полезны при лечении гемолитического расстройства. Примеры таких средств включают, но без ограничения, противовоспалительное средство, средство против стеатоза, противовирусное и/или противофиброзное средство. Кроме того, в сочетании с описанными в данном документе иРНК также можно использовать другие вещества, обычно используемые для защиты печени, такие как силимарин. Другие средства, полезные для лечения заболеваний печени, включают тельбивудин, энтекавир и ингибиторы протеаз, такие как телапревир и другие, описанные, например, в Tung et al., публикации заявок США №№ 2005/0148548, 2004/0167116 и 2003/0144217; и в Hale et al., публикация заявки США № 2004/0127488.
Токсичность и терапевтическую эффективность таких соединений можно определять стандартными фармацевтическими методами на клеточных культурах или экспериментальных животных, например, для определения LD50 (дозы, летальной для 50% популяции) и ED50 (дозы, терапевтически эффективной в 50% от население). Дозовое соотношение между токсическим и терапевтическим эффектами является терапевтическим показателем, и его можно выразить как соотношение LD50/ED50. Соединения, которые проявляют высокие терапевтические показатели, являются предпочтительными.
Данные, полученные из анализов клеточных культур и исследований на животных, можно использовать при составлении диапазона дозировок для применения у людей. Дозировка композиций, указанных в настоящем изобретении, обычно находится в диапазоне циркулирующих концентраций, которые включают ED50 с небольшой токсичностью или без нее. Дозировка может варьировать в пределах этого диапазона в зависимости от используемой лекарственной формы и используемого пути введения. Для любого соединения, используемого в способах, описанных в изобретении, терапевтически эффективную дозу первоначально можно оценить по анализам клеточных культур. Дозу можно сформулировать на животных моделях для достижения диапазона циркулирующих концентраций в плазме соединения или, при необходимости, полипептидного продукта последовательности-мишени (например, для достижения пониженной концентрации полипептида), включая ISERPINC10 (т.е. концентрации испытуемого соединения, при которой достигнута половина максимального подавления симптомов), как это определено в клеточной культуре. Эту информацию можно использовать для более точного определения полезных доз для человека. Уровни в плазме можно измерфть, например, с помощью высокоэффективной жидкостной хроматографии.
В дополнение к их введению, как обсуждалось выше, иРНК, представленные в изобретении, можно вводить в комбинации с другими известными средствами, эффективными для лечения патологических процессов, опосредованных экспрессией SERPINC1. В любом случае, лечащий врач может регулировать количество и время введения iRNA на основе результатов, наблюдаемых с использованием стандартных мер эффективности, известных в данной области или описанных в данном документе.
VI. Наборы
В настоящем изобретении также представлены наборы для выполнения любого из способов изобретения. Такие наборы содержат одно или более средств РНКи и инструкции по применению, например, инструкции по назначению профилактически или терапевтически эффективного количества средства (средств) РНКи. Необязательно наборы могут дополнительно содержать средство для введения средства РНКи (например, инъекционное устройство) или средства для измерения ингибирования Serpinc1 (например, средство для измерения ингибирования мРНК Serpinc1, белка Serpinc1 и/или активности Serpinc1). Такое средство для измерения ингибирования Serpinc1 может содержать средство для получения образца у субъекта, такого как, например, образец плазмы. Необязательно наборы согласно изобретению могут дополнительно содержать средства для определения терапевтически эффективного или профилактически эффективного количества.
Если не указано иное, все технические и научные термины, используемые в данном документе, имеют то же значение, которое обычно понимают специалисты в области, к которой относится данное изобретение. Хотя на практике или при тестировании иРНК и способов, представленных в изобретении, можно использовать способы и материалы, подобные или эквивалентные тем, которые описаны в настоящем документе, ниже описаны подходящие способы и материалы. Все публикации, заявки на патенты, патенты и другие ссылки, упомянутые в данном документе, полностью включены в данный документ посредством ссылки. Кроме того, материалы, методы и примеры являются только иллюстративными и не предназначены для ограничения.
ПРИМЕРЫ
Hyp-(GalNAc-алкил)3
Пример 1: Введение единичной дозы AT3SC-001 Здоровым Субъектам-людям
Двадцать четыре здоровых человека-добровольца в когортах 3:1 (активное средство:плацебо) получали однократную дозу 0,03 мг/кг, 0,1 мг/кг, 0,3 мг/кг, 0,6 мг/кг или 1,0 мг/кг AT3SC-001 (смысловая нить (5'-3'): GfsgsUfuAfaCfaCfCfAfuUfuAfcUfuCfaAfL96 (SEQ ID NO: 13); антисмысловая нить (5'-3'): usUfsgAfaGfuAfaAfuggUfgUfuAfaCfcsasg (SEQ ID NO:14)). Образцы плазмы собирали в 0, 1, 2, 3, 7, 10, 14, 21, 28, 42, 56 и 70 день после введения для мониторинга уровней белка AT, активности AT и продолжительности сайлесинга белка AT. Уровни белка AT контролировали с использованием ELISA, а уровни активности AT отслеживали путем создания кривых образования тромбина с использованием калиброванного автоматического тромбиноскопа (тканевой фактор=1 пМ). Изменение пикового тромбина в кратном выражении рассчитывали относительно среднего пикового значения тромбина для двух значений до введения дозы для каждого субъекта.
Серьезных побочных эффектов не было, было 3 легких побочных эффекта, которые, вероятно, не были связаны с введением средства, и 1 легкий побочный эффект (головная боль), которое могло быть связано с введением средства. Также не было никаких реакций в месте инъекции, и врачебные осмотры, показатели жизнедеятельности и электрокардиограммы всех субъектов были в пределах нормы. Кроме того, все тесты функции печени, уровни общего билирубина, международное нормализованное соотношение времени протромбина (PT/INR), количество тромбоцитов, уровни гемоглобина и коагуляционные тесты (то есть Активированное частичное тромбопластиновое время (APTT), протромбиновое время (PT), уровни фибриногена и уровни D-димера фибрина) у всех субъектов в ходе исследования не изменились и находились в пределах нормы.
На Фиг. 1A-D и 2A-B показано, что единичная доза 0,03 мг/кг AT3SC-001 приводит к уменьшению уровней белка AT приблизительно на 20% и до 33% (Фиг. 2A и 2B) и к соответствующему уменьшению активности AT (Фиг. 1A-D) с продолжительностью снижения более чем 60 дней.
На Фиг. 3 дополнительно показано, что существует значительная связь между нокдауном AT и пиком образования тромбина. В частности, наблюдалось увеличение пиковой образования тромбина до 152% со средним максимальным увеличением пикового тромбина 138% ± 8,9% (среднее значение ± SEM). Кроме того, и в соответствии с увеличением образования тромбина с увеличением нокдауна AT уровни фактора VIII или IX были нормальными.
Пример 2: Введение многократных доз AT3SC-001 пациентам-людям с гемофилией A или B
Клиническое исследование Фаза I - Части B, C и D
В части B I фазы клинического испытания AT3SC-001 (смысловая нить (5'-3'): GfsgsUfuAfaCfaCfCfAfuUfuAfcUfuCfaAfL96 (SEQ ID NO: 13); антисмысловая нить (5'-3'): usUfsgAfaGfuAfaAfuggUfgUfuAfaCfcsasg (SEQ ID NO:14)) трем пациентам, страдающим гемофилией A (n=2) или B (n=1), подкожно вводили 0,015 мг/кг еженедельно в течение трех недель (15 мкг/кг qw x 3; 15 мкг/кг) AT3SC-001; шести пациентам, страдающим гемофилией А, подкожно вводили 0,045 мг/кг еженедельно в течение трех недель (45 мкг/кг qw x 3; 45 мкг/кг) AT3SC-001; и трем пациентам, имеющим гемофилию A (n=2) или B (n=1), подкожно вводили 0,075 мг/кг еженедельно в течение трех недель (75 мкг/кг qw x 3; 75 мкг/кг) AT3SC-001.
В части C I фазы клинического исследования AT3SC-001 (смысловая нить (5’-3’): GfsgsUfuAfaCfaCfCfAfuUfuAfcUfuCfaAfL96 (SEQ ID NO:13); антисмысловая нить (5’-3’): usUfsgAfaGfuAfaAfuggUfgUfuAfaCfcsasg (SEQ ID NO:14)), трем пациентам, имеющим гемофилию A (n=2) или B (n=1), раз в месяц подкожно вводили дозу 0,225 мг/кг AT3SC-001 в течение трех месяцев (225 мкг/кг qm x 3; 225 мкг/кг); трем пациентам, имеющим гемофилию A (n=2) или B (n=1), раз в месяц подкожно вводили дозу 0,450 мг/кг AT3SC-001 в течение трех месяцев (450 мкг/кг qm x 3; 450 мкг/кг); трем пациентам, имеющим гемофилию A, раз в месяц подкожно вводили дозу 0,900 мг/кг AT3SC-001 в течение трех месяцев (900 мкг/кг qm x 3; 900 мкг/кг); трем пациентам, имеющим гемофилию A, раз в месяц подкожно вводили дозу 1,800 мг/кг AT3SC-001 в течение трех месяцев (1800 мкг/кг qm x 3; 1800 мкг/кг); а шести пациентам, имеющим гемофилию A (n=3) или B (n=3), раз в месяц подкожно вводили фиксированную дозу 80 мг AT3SC-001 в течение трех месяцев (80 мг qM x 3).
В части D I фазы клинического исследования AT3SC-001 (смысловая нить (5’-3’): GfsgsUfuAfaCfaCfCfAfuUfuAfcUfuCfaAfL96 (SEQ ID NO:13); антисмысловая нить (5’-3’): usUfsgAfaGfuAfaAfuggUfgUfuAfaCfcsasg (SEQ ID NO:14)), шести пациентам с ингибиторами, имеющим гемофилию A (n=5) или B (n=1) и использующим шунтирующие средства (BPA) для управления кровотечением, подкожно вводили фиксированную дозу 50 мг AT3SC-001 раз в месяц в течение трех месяцев (50 мг qM x 3); и 10 пациентам, имеющим гемофилию A и использующим шунтирующие средства (BPA) для управления кровотечением, подкожно вводили фиксированную дозу 80 мг AT3SC-001 раз в месяц в течение трех месяцев (80 мг qM x 3).
после введения AT3SC-001 собирали образцы плазмы для отслеживания уровней белка АТ, активности AT и продолжительности сайлесинга белка AT. уровни белка АТ отслеживали с использованием ELISA, а уровни активности AT отслеживали путем построения кривых образования тромбина с использованием калиброванного автоматического тромбиноскопа (тканевой фактор=1 пМ). Изменение пикового тромбина в кратном выражении рассчитывали относительно среднего пикового значения тромбина для двух значений до введения дозы для каждого больного.
В таблице 2 приведены демографические данные и базовые характеристики пациентов, участвующих в частях B, C и D исследования.
Подкожно
Раз в неделю × 3
Подкожно
Раз в месяц × 3
Подкожно
Раз в месяц × 3
N=3
N=6
N=3
N=3
N=3
N=3
N=3
мг
N=6
мг
N=6
мг
N=10
(9)
(14)
(4)
(21)
(15)
(16)
(12)
(12)
(7)
Гемофилия B
1
0
1
1
1
0
0
3
1
0
Средняя
0
0
0
1
0
1
0
1
0
0
(10)
(22)
(8)
(12)
(16)
(2)
(12)
(10)
(17)
Для частей B, C и D исследования не было серьезных побочных эффектов, прекращения лечения, реакций в месте инъекции, и медицинские осмотры, показатели жизненно важных функций и электрокардиограммы всех пациентов были в пределах нормы. Кроме того, все тесты функции печени и полные показатели крови всех пациентов не изменялись в течение исследования и находились в пределах нормы. Также не было никаких тромбоэмболических осложнений в течение этого исследования, и ни у одного из пациентов не наблюдалось клинически значимого повышения уровня D-димера фибрина. Любыми явлениями кровотечения успешно управляли с использованием стандартного коэффициента замены или введения шунтирующего средства. Кроме того, не было случаев образования антител против лекарств (ADA).
Нокдаун уровней АТ в когортах 15 мкг/кг, 45 мкг/кг и 75 мкг/кг, показанный как средний нокдаун АТ относительно базового уровня, изображен на фиг. 4. На фиг. 4 показано, что еженедельные дозы 0,015 мг/кг в течение трех недель AT3SC-001 приводят к среднему максимальному нокдауну AT 29% ± 12% (среднее значение ± SEM). Максимальный нокдаун AT составлял до 53%. На фиг. 4 также показано, что еженедельные дозы 0,045 мг/кг в течение трех недель AT3SC-001 приводят к среднему максимальному нокдауну AT 55 ± 9% (среднее значение ± SEM) и максимальному нокдауну AT 86%. Кроме того, на фиг. 4 также показано, что еженедельные дозы 0,075 мг/кг в течение трех недель AT3SC-001 приводят к среднему максимальному нокдауну AT 61 ± 8% (среднее значение ± SEM) и максимальному нокдауну AT 74%.
Нокдаун уровней АТ в когортах 225 мкг/кг, 450 мкг/кг, 900 мкг/кг, 1800 мкг/кг и 80 мг, показанный как средний нокдаун АТ относительно базового уровня, изображен на фиг. 5А. На фиг. 5А показано, что ежемесячные дозы 0,225 мг/кг в течение трех месяцев AT3SC-001 приводят к среднему максимальному нокдауну AT 70% ± 9% (среднее значение ± SEM). Максимальный нокдаун AT составлял до 80%. На фиг. 5А также показано, что ежемесячные дозы 0,450 мг/кг в течение трех месяцев AT3SC-001 приводят к среднему максимальному нокдауну AT 77 ± 5% (среднее значение ± SEM) и максимальному нокдауну AT 85%. Кроме того, на фиг. 5А также показано, что ежемесячные дозы 0,900 мг/кг в течение трех месяцев AT3SC-001 приводят к среднему максимальному нокдауну AT 78±7% (среднее значение ± SEM) и максимальному нокдауну AT 88%. Кроме того, на фиг. 5А показано, что ежемесячные дозы 1800 мг/кг в течение трех месяцев AT3SC-001 приводят к среднему максимальному нокдауну AT 79 ± 3% (среднее значение ± SEM) и максимальному нокдауну AT 84%. На фиг. 5А также показано, что ежемесячные дозы 80 мг в течение трех месяцев AT3SC-001 приводят к среднему максимальному нокдауну AT 87 ± 1% (среднее значение ± SEM).
Как показано на фиг.5В, на которой представлена зависимость дозы AT3SC-001 от относительного низшей точки уровней белка AT, введение AT3SC-001 пациентам-людям снижает уровни белка AT дозозависимым образом.
Оценка образования тромбина у здоровых людей-добровольцев (пример 1) и пациентов с гемофилией A или B показала, что еженедельные дозы AT3SC-001 приводили к увеличению до 334% (относительно базового уровня) образования тромбина у пациентов с гемофилией со средним увеличением образования тромбина 112 ± 38% (р<0,05) относительно базового уровня при нокдауне АТ ≥50% (фиг. 6В). На фиг. 6А показано, что максимальный пик тромбина, достигаемый у пациентов с гемофилией А или В, которым вводили еженедельные дозы AT3SC-001, находился в низком диапазоне образования тромбина у нормальных субъектов.
Тромбоэластометрический анализ ROTEM® (см., например, Young, et al., (2013) Blood 121:1944) цельной крови одного больного (больного 101-009) показывает, что введение AT3SC-001 по 0,045 мг/кг раз в неделю в течение трех недель не только приводит к увеличению пиковой образования тромбина, но также приводит к заметному и длительному улучшению образования сгустка цельной крови, что показывает снижение времени образования сгустков и времени свертывания (Фиг. 7). У больного 101-009 не было явлений кровотечения со 2 дня, и в настоящее время нет кровотечения 47 дней.
Апостериорный анализ образования тромбина по квартилям снижения AT (части B и C) показывает, что в самом большом квартиле снижения AT (снижение AT >75%) увеличение средней образования тромбина относительно базового уровня составляет 289% (Фиг. 9). Этот уровень образования тромбина находится в диапазоне образования тромбина, наблюдаемом у здоровых добровольцев.
В дополнительном исследовании трех пациентов изучали эквивалентность введения AT3SC-001 и введения фактора VIII. Вкратце, фактор VIII вводили каждому из трех пациентов, и плазму собирали у пациентов через 0,5, 1, 2, 6, 24 и 48 часов после введения. Образцы от каждого субъекта анализировали на уровни фактора VIII и уровни образования тромбина и использовали для определения индивидуальных соотношений фактора VIII-пиковой образования тромбина. Затем эти данные использовали для сравнения с пиковыми уровнями образования тромбина, достигнутыми при введении AT3SC-001. Как показано на фиг. 10A-10C, введение AT3SC-001 достаточно для достижения пиковых уровней образования тромбина у субъекта примерно до того же уровня, который достигается введением субъекту фактора VIII, и достаточно для достижения пиковых уровней образования тромбина, превышающих примерно 40% у больного.
Апостериорный анализ случаев кровотечений по квартилю снижения AT (части B и C) показывает, что наблюдается сниженная склонность к кровотечению с повышением уровней снижения AT со средней оценочной годовой частотой кровотечений (ABR) 5 ± 2 (медиана=1) в самом высоком квартиле понижения AT (фиг. 11). Этот анализ включает более 1100 кумулятивных дней с понижением AT> 75% у 16 пациентов.
Также провели апостериорный анализ явлений кровотечения в когорте части C. На фиг. 12 представлены данные пациента, использованные для этого анализа. Как показано на фиг. 13A, медианная ABR в анамнезе для всех пациентов, включенных в когорту C и получающих профилактические (PPx) замещающие факторы, составляла 2, а медианная ABR в анамнезе для всех пациентов, зарегистрированных в когорте C и получающих замещающие факторы по требованию (OD), составляла 28. Введение AT3SC-001 этим пациентам привело к значительному снижению медианной ABR. В частности, введение AT3SC-001 привело к медианному значению 53% пациентов, сообщивших об отсутствии кровотечений в течение периода наблюдения (с 29-го дня до последнего посещения исследования или до последней дозы+56 дней, что раньше), и медианному значению 82% пациентов, сообщивших об отсутствии спонтанных кровотечений в течение периода наблюдения. На фиг. 13B показано, что для пациентов, получающих ежемесячные дозы 80 мг AT3SC-001 в группе C и получающих профилактические (PPx) замещающие факторы, медианная ABR в анамнезе составляла 6. Однако после введения AT3SC-001 медианная ABR во время периода наблюдения составляла 0.
В части D фазы I исследования оценивали эффект от введения AT3SC-001 у пациентов с гемофилией A или B, у которых выработались антитела (ингибиторы) против получаемых ими замещающих факторов и, таким образом, они стали невосприимчивыми к замещающему фактору коагуляции. Соответственно, для оценки пикового ответа тромбина у этих пациентов перед введением AT3SC-001 пациентам, включенным в когорту 50 мг, вводили их стандартное шунтирующее средство (BPA) (например, активированный концентрат протромбинового комплекса (APCC) и/или активированный рекомбинантный FVII (rFVIIa)), образцы плазмы собирали через 1, 2, 6 и 24 часа после введения BPA, и образцы анализировали на образование тромбина. Как показано на фиг. 14A-14F, снижение AT и образование тромбина у пациентов с ингибиторами, которым вводили AT3SC-001, сравнимы со снижением AT и образованием тромбина, наблюдаемым после введения AT3SC-001 с аналогичными дозами у пациентов без ингибиторов. Кроме того, на фиг.14A-14F показано, что образование тромбина после введения AT3SC-001 постоянно превышает временные уровни, достигаемые при введении BPA.
Как показано на фиг. 15, подкожное введение AT3SC-001 один раз в месяц в дозах 50 мг и 80 мг обеспечивает дозозависимое снижение AT примерно на 80% у пациентов с гемофилией с ингибиторами. Кроме того, как показано на фиг. 16, эффект снижения AT, достигаемый у пациентов, которым вводили AT3SC-001, коррелирует с увеличением образования тромбина.
Также в части D исследования провели апостериорный анализ случаев кровотечений у пациентов. На фиг. 17A показано, что введение AT3SC-001 пациентам с ингибиторами, страдающим гемофилией A или B, один раз в месяц в дозе 50 или 80 мг приводит к значительному снижению ABR до исследования. Кроме того, как показано на фиг. 17B, среднегодовая частота кровотечений (ABR) равна нулю для всех пациентов с ингибиторами, которым вводили AT3SC-001 в части D I фазы этого исследования, и 56% пациентов не имеют кровотечений, а у 69% пациентов ноль спонтанных кровотечений.
Таким образом, AT3SC-001 хорошо переносится пациентами с гемофилией A и B с ингибиторами и без них. Не было никаких SAE, связанных с исследуемым лекарственным средством, и никаких тромбоэмболических осложнений. Данные свидетельствуют о наличии клинической активности и коррекции фенотипа гемофилии у пациентов без ингибиторов. Данные также демонстрируют, что существует зависимое от дозы снижение AT и увеличение образования тромбина при схеме введения дозы подкожно один раз в месяц и что введение фиксированной дозы AT3SC-001 50 или 80 мг обеспечивает последовательное снижение AT приблизительно на 80%.
Кроме того, данные демонстрируют, что введение AT3SC-001 пациентам с ингибиторами приводит к снижению AT и увеличению образования тромбина, что согласуется с пациентами без ингибиторов, и что последовательное увеличение образования тромбина превышает увеличение, кратковременно достигаемое при введении BPA.
Пример 3: Введение многократных доз AT3SC-001 пациентам-людям с гемофилией A или B
II фаза Открытого Расширенного (OLE) Клинического исследования
Во II фазе OLE исследования AT3SC-001 (смысловая нить (5’-3’): GfsgsUfuAfaCfaCfCfAfuUfuAfcUfuCfaAfL96 (SEQ ID NO:13); антисмысловая нить (5’-3’): usUfsgAfaGfuAfaAfuggUfgUfuAfaCfcsasg (SEQ ID NO:14)), пациенты с ингибиторами или без них, которым ранее вводили AT3SC-001 в части B и C I фазы клинических исследований, описанных выше, были допущены к участию во II фазе открытого расширенного (OLE) исследования. Пятнадцать пациентов из части B I фазы исследования с гемофилией A или B без ингибиторов, которым подкожно вводили AT3SC-001 0,015 мг/кг раз в неделю в течение трех недель (15 мкг/кг qw x 3; 15 мкг/кг); или подкожно вводили AT3SC-001 0,045 мг/кг раз в неделю в течение трех недель (45 мкг/кг qw x 3; 45 мкг/кг); или подкожно вводили AT3SC-001 0,075 мг/кг раз в неделю в течение трех недель (75 мкг/кг qw x 3; 75 мкг/кг); и 18 пациентов из части C I фазы исследования с гемофилией A или B без ингибиторов, которым подкожно раз в месяц вводили дозу AT3SC-001 0,225 мг/кг в течение трех месяцев (225 мкг/кг qm x 3; 225 мкг/кг); или подкожно вводили раз в месяц дозу AT3SC-001 0,450 мг/кг в течение трех месяцев (450 мкг/кг qm x 3; 450 мкг/кг); или подкожно вводили раз в месяц дозу AT3SC-001 0,900 мг/кг в течение трех месяцев (900 мкг/кг qm x 3; 900 мкг/кг); или подкожно вводили раз в месяц дозу AT3SC-001 1,800 мг/кг в течение трех месяцев (1800 мкг/кг qm x 3; 1800 мкг/кг); или подкожно вводили раз в месяц фиксированную дозу 80 мг AT3SC-001 в течение трех месяцев (80 мг qM x 3); и 16 пациентов из части D I фазы исследования с гемофилией A или B с ингибиторами, которым подкожно вводили раз в месяц фиксированную дозу 50 мг AT3SC-001 в течение трех месяцев (50 мг qM x 3); или подкожно вводили раз в месяц фиксированную дозу 80 мг AT3SC-001 в течение трех месяцев (80 мг qM x 3), были допущены к участию в этом исследовании.
Тридцать три пациента были включены в данное исследование, причем 29 пациентов продолжили исследование, а 5 пациентов прекратили (4 из-за отзыва согласия и 1 из-за AE). Десяти пациентам с гемофилией A (n=7) или гемофилией B (n=3) без ингибиторов подкожно вводили фиксированную дозу 50 мг AT3SC-001 ежемесячно в течение трех месяцев (50 мг qM x 3); и 9 пациентам с гемофилией A (n=7) или гемофилией B (n=2) без ингибиторов подкожно вводили фиксированную дозу 80 мг AT3SC-001 ежемесячно в течение трех месяцев (50 мг × qM 3). Точно так же 3 пациентам с гемофилией A (n=3) с ингибиторами подкожно вводили фиксированную дозу 50 мг AT3SC-001 ежемесячно в течение трех месяцев (50 мг qM × 3); и 11 пациентам с гемофилией A (n=11) или гемофилией B (n=1) с ингибиторами подкожно вводили фиксированную дозу 80 мг AT3SC-001 ежемесячно в течение трех месяцев (50 мг qM x 3). Демографические данные, базовые характеристики и продолжительность воздействия AT3SC-001 пациентов, включенных в это исследование, приведены в Таблице 3 ниже.
N=10
N=9
N=3
N=11
Гемофилия B
3
2
-
1
Средняя
1
2
-
-
AT3SC-001 в целом хорошо переносился пациентами без ингибиторов в фазе II OLE. Шесть пациентов сообщили о серьезных побочных эффектах (SAE), причем 2 SAE считались, возможно, связанными с введением AT3SC-001; один больной с хронической инфекцией HCV испытывал повышение ALT и АСТ и впоследствии прекратил исследование, а один больной с судорожным расстройством в анамнезе испытал приступ со спутанностью сознания у пациента. Не было никаких тромбоэмболических осложнений или лабораторных признаков патологического образования сгустка. Большинство побочных эффектов (AE) были легкой или средней степени тяжести и не связаны с введением AT3SC-001. увеличение бессимптомной аланинаминотрансферазы (ALT) более чем в 3 раза по сравнению с верхним пределом нормы (ULN) без одновременного повышения уровня билирубина более чем в 2 раза по сравнению с ULN наблюдалось у 11 пациентов, у каждого из которых в анамнезе была инфекция гепатита С. Все явления кровотечения на фоне лечения успешно лечили с помощью замещающего фактора или шунтирующего средства. Кроме того, не было случаев образования антител против лекарств (ADA).
На Фиг. 18, 19A и 19B дополнительно представлена клиническая активность введения AT3SC-001. В частности, как показано на Фиг.18, подкожное введение раз в месяц AT3SC-001 в дозе 80 мг последовательно обеспечивало снижение AT. Как показано на Фиг. 19А, подкожное введение AT3SC-001 один раз в месяц в дозе 50 мг или 80 мг обеспечивает дозозависимое снижение АТ ~ 80% с низкой вариабельностью между пациентами и, как показано на Фиг. 19В, подкожное введение один раз в месяц AT3SC-001 в дозе 50 или 80 мг обеспечивает уровни образования тромбина, приближающиеся к нижнему пределу нормального диапазона.
Также провели предварительный апостериорный анализ явлений кровотечения у пациентов с ингибиторами и без ингибиторов фазы II OLE исследовании. На фиг. 20А показано, что введение AT3SC-001 пациентам с гемофилией A или B без ингибиторов один раз в месяц в дозе 50 или 80 мг приводит к значительному снижению ABR перед исследованием, а на фиг. 20B показано, что введение AT3SC-001 пациентам с гемофилией А или В с ингибиторами один раз в месяц в дозе 50 или 80 мг приводит к значительному снижению ABR перед исследованием. Суммируя медианные значения ABR у всех патентов, участвующих в OLE исследовании, у 48% (16/33) пациентов не было кровотечений в течение периода наблюдения, и в целом медианное значение ABR в течение периода наблюдения составляло 1. Кроме того, 67% пациентов сообщали об отсутствии спонтанных кровотечений в течение периода наблюдения, и, в целом, ABR в течение периода наблюдения составляла 0. Характеристики явлений кровотечения у пациентов с ингибиторами и без них во время OLE исследования показаны на фиг. 21. Явления кровотечений у больных оценивали при снижении антитромбина ≥75%.
На фиг. 22 представлены подробности управления явлениями кровотечения у пациентов с гемофилией A или B без ингибиторов, а на фиг. 23 представлены подробности управления явлениями кровотечения у пациентов с гемофилией A или B с ингибиторами. Удивительно, что больным гемофилией A или B без ингибиторов и пациентам с гемофилией A или B с ингибиторами, которым вводили AT3SC-001 один раз в месяц в дозе 50 или 80 мг и у которых было явление кровотечения, требовались значительно меньшие дозы замещающих факторов или шунтирующего средства по сравнению с дозой, рекомендованной для лечения кровотечения, например, более низкая доза фактора VIII или более низкая доза aPCC.
Таким образом, AT3SC-001 в целом хорошо переносился пациентами с гемофилией A и B с ингибиторами и без них. Кроме того, данные демонстрируют, что AT3SC-001 обладает клинической активностью при том, что подкожное введение один раз в месяц в дозах 50 мг и 80 мг обеспечивает дозозависимое снижение AT на ~ 80% при низкой вариабельности между пациентами и уровнях образования тромбина, приближающихся к нижнему пределу. Нормального диапазона. Кроме того, предварительный апостериорный анализ случаев кровотечения у пациентов с гемофилией A или B с ингибиторами или без них показывает, что введение AT3SC-001 снижало медианное значение ABR до 1, а среднегодовую норму спонтанных кровотечений (AsBR) до нуля. У шестнадцати из тридцати трех (48%) пациентов не было кровотечений, а у двадцати двух из тридцати трех (67%) пациентов в период наблюдения не было спонтанных кровотечений. Все явления кровотечения успешно лечили с помощью замещающего фактора или шунтирующего средства.
Пример 4: Обновленные рекомендации по схеме лечения для управления кровотечением: уменьшение дозы замещающего фактора/шунтирующего средства
Данные, полученные на I фазе и I/II фазе OLE исследований, представленные выше, демонстрируют, что подкожное введение фиксированной дозы 50 мг или 80 мг AT3SC-001 один раз в месяц обеспечивает постоянное снижение AT примерно на 80% и что происходит зависимое от дозы снижение АТ и увеличение образования тромбина у больных гемофилией А или В с ингибиторами и без них.
Данные моделирования in silico подтверждают эти наблюдения, прогнозируя увеличение образования тромбина в ответ на снижение уровней AT, включая в некоторых вариантах осуществлемя снижение уровней AT примерно на 75% или менее. Данные, полученные из образцов плазмы пациентов с гемофилией A и B с ингибиторами и без них показывают усиление реакции образования тромбина на замещающие факторы и шунтирующие средства после введения дозы пациентам, которым вводили AT3SC-001. Кроме того, клинические данные показывают, что для пациентов с гемофилией A или B без ингибиторов (фиг. 22) и пациентов с гемофилией A или B с ингибиторами (фиг. 23), которым вводили AT3SC-001 один раз в месяц в дозе 50 или 80 мг и у которых были случаи кровотечения, использовали более низкие дозы замещающих факторов или шунтирующего агента по сравнению с рекомендуемой дозой для лечения кровотечения, например, более низкая доза фактора VIII или более низкая доза фактора IX, или более низкая доза с увеличенным периодом полувыведения фактора IX, или более низкая доза рекомбинантного фактора VIIa, или более низкая доза aPCC.
Дополнительные клинические данные управления кровотечениями, представленные на фиг. 24A-24D, дополнительно демонстрируют успешное лечение кровотечений у больных, которым вводили AT3SC-001 с более низкими количествами замещающего фактора или шунтирующего средства.
Соответственно, представленные в данном документе данные обосновывают введение более низких доз замещающего фактора или шунтирующего средства больным, которым вводят AT3SC-001, то есть которым вводят фиксированную ежемесячную подкожную дозу 50 или 80 мг, например, при которой введение средства дцРНК субъекту снижает активность Serpinc1 примерно на 75% и более. Поэтому, как изложено в Таблице 4, были обновлены руководящие принципы управления кровотечениями у больных, получающих ежемесячную подкожную дозу 50 мг или 80 мг AT3SC-001, и такими кровотечениями следует управлять с использованием более низких доз замещающего фактора или шунтирующего средства.
Например, рекомендованное эффективное количество замещающего фактора (Фактора VIII) для лечения кровотечения, например, кровотечения средней тяжести или сильного кровотечения у больного гемофилией A без ингибиторов, составляет приблизительно 30-50 МЕ/кг. Однако кровотечение, например, кровотечение средней тяжести или сильное кровотечение у больного гемофилией A, которому раз в месяц вводят фиксированную подкожную дозу 50 мг или 80 мг AT3SC-001, например, при которой введение больному средства дцРНК снижает активность Serpinc1 приблизительно на 75% или более, можно лечить дозой фактора VIII от приблизительно 5 до приблизительно 20 МЕ/кг. Для больных гемофилией B без ингибиторов рекомендованное эффективное количество замещающего фактора (Фактора IX или Фактора IX с удлиненным периодом полувыведения) для лечения кровотечения, например, сильного кровотечения, составляет приблизительно 65-130 МЕ/кг. Однако кровотечение, например, сильное кровотечение у больного гемофилией B, которому вводят раз в месяц фиксированную подкожную дозу 50 мг или 80 мг AT3SC-001, например, при которой введение больному средства дцРНК снижает активность Serpinc1 приблизительно на 75% или более, можно лечить дозой фактора IX или Фактор IX с удлиненным периодом полувыведения от приблизительно 10 до приблизительно 30 МЕ/кг. Для больных гемофилией A или B с ингибиторами рекомендованное эффективное количество шунтирующего средства (активированного концентрата протромбинового комплекса; aPCC) для лечения кровотечения, например, кровотечения средней тяжести или сильного кровотечения составляет приблизительно 100 Е/кг. Однако кровотечение, например, кровотечение средней тяжести или сильное кровотечение у больного гемофилией A или B с ингибиторами, которому вводят раз в месяц фиксированную подкожную дозу 50 мг или 80 мг AT3SC-001, например, при которой введение больному средства дцРНК снижает активность Serpinc1 приблизительно на 75% или более, можно лечить дозой aPCC от приблизительно 30 до приблизительно 50 Е/кг. Для больных гемофилией A или B с ингибиторами рекомендованное эффективное количество шунтирующего средства (рекомбинантного фактора VIIa; rFVIIa) для лечения кровотечения, например, кровотечения средней тяжести или сильного кровотечения составляет приблизительно 90 мкг/кг. Однако кровотечение, например, кровотечение средней тяжести или сильное кровотечение у больного гемофилией A или B с ингибиторами, которому вводят раз в месяц фиксированную подкожную дозу 50 мг или 80 мг AT3SC-001, например, при которой введение больному средства дцРНК снижает активность Serpinc1 приблизительно на 75% или более, можно лечить дозой rFVIIa от приблизительно 10 до приблизительно 45 мкг/кг.
Не применять антифибринолитические вещества в комбинации с фактором BPA
Примечание: Для полноты включены дозы rFVIIa и aPCC. Дополнительное управление эпизодами коровочений необходимо проводить по стандарту лечения. Ожидается, что таких пациентов без ингибиторов следует планово лечить с помощью FVIII и FIX.
Пример 5: Реакция образования тромбина с добавлением Шунтирующих средств в Плазме Пациентов-Людей, которых лечили AT3SC-001, для Лечения гемофилии A
Как указано в примере 4, данные, полученные из образцов плазмы пациентов с гемофилией A с ингибиторами и без них, показывают улучшенную реакцию образования тромбина на замещающие факторы и шунтирующие средства (BPA) после введния пациентам дозы AT3SC-001. В частности, данные, полученные в ходе II фазы OLE исследования, демонстрируют, что подкожное введение дозы AT3SC-001 обеспечивает улучшенную выработку тромбина в образцах плазмы после введения дозы по сравнению с образцами плазмы до введения дозы с добавлением BPA; предполагая, что более низкие дозы BPA можно потенциально использовать для достижения аналогичного гемостатического эффекта.
Чтобы исследовать реакцию образования тромбина на BPA в отобранных образцах плазмы у пациентов с опосредованным AT3SC-001 снижением AT, у 8 пациентов с гемофилией A (7 без ингибиторов, 1 с ингибиторами) собирали плазму с низким содержанием тромбоцитов как до, так и после лечения AT3SC-001. Активность AT в плазме пациента измеряли и нормализовали до нормальной плазмы пула с помощью хромогенного анализа на основе активности FXa (SIEMENS INNOVANCE® Antithrombin). В плазму добавляли ex vivo различные дозы BPA: aPCC (0,5 или 1 ед/мл; соответствует дозам 37,5 и 75 ед/кг, соответственно) или rFVIIa (0,75, 1,75 или 2,5 мкг/мл; соответствует дозам 27, 63 и 90 мкг/кг). Реакцию образования тромбина и уровни активности AT контролировали путем построения кривых образования тромбина с использованием калиброванного автоматического тромбиноскопа (тканевой фактор=1 пМ). Все реагенты, включая калибратор тромбина, набор FluCa и PPP-Reagent-Low (1 пМ тканевого фактора [TF] и 4 мкМ фосфолипида), были получены от Thrombinoscope BV.
Данные, представленные на фигурах 25A-26N, демонстрируют усиленное образование тромбина в образцах плазмы, полученных у больных после достижения снижения AT при введении AT3SC-001. Действительно, только снижение АТ приводило к увеличению пикового образования тромбина. Как aPCC, так и rFVIIa вызывали линейное увеличение пикового образования тромбина при добавлении в плазму пациента, обработанную AT3SC-001. Более низкие дозы aPCC были достаточными для получения пиковых уровней образования тромбина, эквивалентных тем, которые достигаются при введении полной дозы aPCC в плазме до AT3SC-001 у пациентов с гемофилией A с ингибиторами (фиг. 25A и 25B) или без ингибиторов (фиг. 26A-26N). В плазме всех пациентов уровень образования тромбина приближался, но оставался ниже нижнего предела нормального (LLN) диапазона при добавлении всех количеств rFVIIa в плазму со сниженным AT.
Таким образом, усиленное образование тромбина достигалось при введении AT3SC-001 в образцах плазмы после введения дозы по сравнению с образцами плазмы до введения дозы с добавлением шунтирующих средств. Эти результаты также подтверждают использование более низких доз шунтирующих средств по сравнению с рекомендованными дозами для достижения гемостаза у пациентов, у которых происходит кровотечение во время лечения AT3SC-001, как описано в примере 4 выше, включая, например, уменьшенные начальные дозы замещающего фактора или шунтирующего средства и уменьшенную максимальную дозу замещающего фактора или шунтирующего средства, минимальный интервал между дозами и отсутствие повторной дозы замещающего фактора или шунтирующего средства с интервалом менее 24 часов (за исключением rFVIIa).
Пример 6. Количественная системная фармакология (QSP) для прогнозирования образования тромбина с сопутствующим снижением AT и заменой фактора.
Гемофилия А и В - это нарушения свертываемости крови, характеризующиеся недостаточным образованием тромбина из-за недостатка факторов VIII и IX, соответственно. Как описано выше, AT3SC-001 представляет собой вводимый подкожно раз в месяц исследуемый РНКи терапевтический нацеленный антитромбин (AT) в качестве средства улучшения образования тромбина и стимуляции гемостаза у пациентов с гемофилией A и гемофилией B с ингибиторами или без них. У пациентов, получающих AT3SC-001, тем не менее, может быть кровотечение во время лечения, которое может потребовать лечения замещающим фактором. Как описано выше, клинические данные и данные введения ex vivo подтверждают использование более низких доз шунтирующих средств и замещающих факторов по сравнению с рекомендуемыми дозами для достижения гемостаза у пациентов с кровотечением во время лечения AT3SC-001.
Для дальнейшего обоснования использования более низких доз шунтирующих средств и замещающих факторов по сравнению с рекомендованными дозами для достижения гемостаза у пациентов с кровотечением во время лечения AT3SC-001, а также для обеспечения более глубокого понимания взаимосвязи между уровнем AT, введением дозы фактора и образованием тромбина (TG), для моделирования анализа образования тромбина ex vivo (TG) использовали кинетическую модель Quantitative Systems Pharmacology (QSP) in silico, описывающую каскад коагуляции (Nayak, et al. (2015) CPT: pharmacometrics & systems pharmacology 4.7: 396-405). В частности, модель была описана по 66 реакциям и 106 параметрам, а начальные концентрации факторов в плазме варьировали для симуляции гемофилии и редких нарушений свертываемости крови. Кроме того, поскольку концентрации факторов в плазме у разных людей варьируют ± 50%, для моделирования нормального диапазона TG применяли методы Монте-Карло: среднее - 140 нМ; Диапазон 50-250 нМ.
В Таблице ниже представлены входные концентрации факторов, используемые для модели в разных условиях заболевания.
Как изображено на фиг. 27A-27C, данные, полученные с использованием модели QSP, прогнозировали образование тромбина (TG) со снижением AT. В частности, клинический нормальный диапазон для TG совпал с прогнозами QSP, и наблюдалась корреляция между клинически измеренным и прогнозируемым в модели TG для пациентов с понижением АТ. На фиг. 27А изображены измеренные значения TG по результатам I фазы (части A-C), а на фиг. 27В изображены смоделированные значения TG (на основании нокдауна AT), каждое из которых представлено в виде квартилей понижения AT. На фиг. 27C показана диаграмма рассеяния, изображающая сильную корреляцию между моделируемыми данными TG и измеренными данными TG.
Модель QSP in silico также применялась для количественной оценки нелинейной взаимосвязи между TG, снижением АТ и дозой фактора VIII при тяжелой гемофилии А (фиг. 28А). Представление карты интенсивности TG с понижением AT и введением дозы фактора VIII демонстрирует, что для нормализации TG (фиг. 28B) может быть достаточно 5-10 МЕ/кг фактора VIII при уровнях AT, наблюдаемых с AT3SC-001 (10-25%). Точно так же представление карты интенсивности TG с понижением AT и дозой фактора IX демонстрирует, что для нормализации TG (фиг. 28C) может быть достаточно 10-20 МЕ/кг фактора IX при 10-25% AT.
Фармакокинетика факторов (однокамерная модель) и модель QSP объединили для моделирования пикового потенциала тромбина (PTP) в качестве функции времени после дозы факторов. На фиг. 29B (20% базового AT) относительно фиг. 29A (100% AT) показано влияние дозирования фактора с течением времени у пациентов с тяжелой гемофилией A, и продемонстрировано, что снижение AT увеличивает образование тромбина как в пиковые периоды, так и в периоды времени после введения FVIII для кровотечений во время лечения.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> GENZYME CORPORATION
<120> СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ ЯВЛЕНИЯ КРОВОТЕЧЕНИЯ У БОЛЬНОГО
ГЕМОФИЛИЕЙ
<130> 117811-02720
<140>
<141>
<150> 62/530,518
<151> 2017-07-10
<150> 62/599,223
<151> 2017-12-15
<150> 62/614,111
<151> 2018-01-05
<150> 62/673,424
<151> 2018-05-18
<160> 16
<170> PatentIn version 3.5
<210> 1
<211> 1599
<212> ДНК
<213> Homo sapiens
<400> 1
tctgccccac cctgtcctct ggaacctctg cgagatttag aggaaagaac cagttttcag 60
gcggattgcc tcagatcaca ctatctccac ttgcccagcc ctgtggaaga ttagcggcca 120
tgtattccaa tgtgatagga actgtaacct ctggaaaaag gaaggtttat cttttgtcct 180
tgctgctcat tggcttctgg gactgcgtga cctgtcacgg gagccctgtg gacatctgca 240
cagccaagcc gcgggacatt cccatgaatc ccatgtgcat ttaccgctcc ccggagaaga 300
aggcaactga ggatgagggc tcagaacaga agatcccgga ggccaccaac cggcgtgtct 360
gggaactgtc caaggccaat tcccgctttg ctaccacttt ctatcagcac ctggcagatt 420
ccaagaatga caatgataac attttcctgt cacccctgag tatctccacg gcttttgcta 480
tgaccaagct gggtgcctgt aatgacaccc tccagcaact gatggaggta tttaagtttg 540
acaccatatc tgagaaaaca tctgatcaga tccacttctt ctttgccaaa ctgaactgcc 600
gactctatcg aaaagccaac aaatcctcca agttagtatc agccaatcgc ctttttggag 660
acaaatccct taccttcaat gagacctacc aggacatcag tgagttggta tatggagcca 720
agctccagcc cctggacttc aaggaaaatg cagagcaatc cagagcggcc atcaacaaat 780
gggtgtccaa taagaccgaa ggccgaatca ccgatgtcat tccctcggaa gccatcaatg 840
agctcactgt tctggtgctg gttaacacca tttacttcaa gggcctgtgg aagtcaaagt 900
tcagccctga gaacacaagg aaggaactgt tctacaaggc tgatggagag tcgtgttcag 960
catctatgat gtaccaggaa ggcaagttcc gttatcggcg cgtggctgaa ggcacccagg 1020
tgcttgagtt gcccttcaaa ggtgatgaca tcaccatggt cctcatcttg cccaagcctg 1080
agaagagcct ggccaaggta gagaaggaac tcaccccaga ggtgctgcaa gagtggctgg 1140
atgaattgga ggagatgatg ctggtggtcc acatgccccg cttccgcatt gaggacggct 1200
tcagtttgaa ggagcagctg caagacatgg gccttgtcga tctgttcagc cctgaaaagt 1260
ccaaactccc aggtattgtt gcagaaggcc gagatgacct ctatgtctca gatgcattcc 1320
ataaggcatt tcttgaggta aatgaagaag gcagtgaagc agctgcaagt accgctgttg 1380
tgattgctgg ccgttcgcta aaccccaaca gggtgacttt caaggccaac aggcctttcc 1440
tggtttttat aagagaagtt cctctgaaca ctattatctt catgggcaga gtagccaacc 1500
cttgtgttaa gtaaaatgtt cttattcttt gcacctcttc ctatttttgg tttgtgaaca 1560
gaagtaaaaa taaatacaaa ctacttccat ctcacatta 1599
<210> 2
<211> 1545
<212> ДНК
<213> Macaca mulatta
<400> 2
ggcacgagga ccatctccac ttgcccagcc ctgtggaaga ttagcgacca tgtattccaa 60
tgtgatagga accgtagcct ctggaaaaag gaaggtttat cttctgtcct tgctgctcat 120
tggcctctgg gactgtatga cctgtcacgg gagccctgtg gacatctgca cagccaagcc 180
gcgggacatt cccatgaatc ccatgtgcat ttaccgctcc ccggagaaga aggcaactga 240
ggatgagggc tcagaacaga agatccccga ggccaccaac cggcgcgtct gggaactgtc 300
caaggccaat tcccgctttg ctaccacttt ctatcagcac ctggcagatt ccaagaacga 360
caaggataac attttcctgt cacccctgag tgtctccacg gcttttgcta tgaccaagct 420
gggtgcctgt aatgacaccc tcaagcaact gatggaggta tttaagtttg acaccatatc 480
tgagaaaaca tctgatcaga tccacttctt ctttgccaaa ctgaactgcc gactctatcg 540
aaaagccaac aaatcctcca agttagtatc agccaatcgc ctttttggag acaaatccct 600
taccttcaat gagacctacc aggacatcag tgagttggta tacggagcca agctccagcc 660
cctggacttc aaggaaaatg cagagcaatc cagagcggcc atcaacaaat gggtgtccaa 720
taagaccgaa ggccgaatca ccgatgtcat tcccccggaa gccatcaacg agctcactgt 780
tctggtgctg gttaacacca tttacttcaa gggcctgtgg aagtcaaagt ttagccctga 840
gaacacaagg atggaaccgt tctacaaggc tgatggagag tcgtgttcag cgtctatgat 900
gtaccaggaa ggcaagttct gttatcggcg cgtggctgaa ggcacccagg tgcttgagtt 960
gcccttcaag ggtgatgaca tcaccatggt gctcatcctg cccaagcctg agaagagcct 1020
gaccaaggtg gagcaggaac tcaccccaga ggtgctgcag gagtggctgg atgagttgga 1080
ggagatgatg ctggtggttc acatgccccg cttccgcatt gaggacggct tcagtttgaa 1140
ggagcagctg caagacatgg gccttgtcga tctgttcagc cctgaaaagt ccaaactccc 1200
aggtattgtt gcagaaggcc gggatgacct ctatgtctcc gatgcattcc ataaggcatt 1260
tcttgaggta aatgaagaag gcagtgaagc agctgcaagt accgccattg ggattgctgg 1320
ccgttcgcta aaccccaaca gggtgacctt caaggccaac aggcctttcc tggtttttat 1380
aagagaagtt cctctgaaca ctattatctt catgggcaga gtagccaacc cttgtgtgag 1440
ctaaactgtt cttattcttt gtacctcttc ctattttggt ttgtgaatag aagtaaaaat 1500
aaatacaact actcccatct tacattaaaa aaaaaaaaaa aaaaa 1545
<210> 3
<211> 2171
<212> ДНК
<213> Mus musculus
<400> 3
ataggtaatt ttagaaatag atctgatttg tatctgagac attttagtga agtggtgaga 60
tataagacat aatcagaaga catatctacc tgaagacttt aaggggagag ctccctcccc 120
cacctggcct ctggacctct cagatttagg ggaaagaacc agttttcgga gtgatcgtct 180
cagtcagcac catctctgta ggagcatcgg ccatgtattc ccctggggca ggaagtgggg 240
ctgctggtga gaggaagctt tgtctcctct ctctgctcct catcggtgcc ttgggctgtg 300
ctatctgtca cggaaaccct gtggacgaca tctgcatagc gaagccccga gacatccccg 360
tgaatccctt gtgcatttac cgctcccctg ggaagaaggc caccgaggag gatggctcag 420
agcagaaggt tccagaagcc accaaccggc gggtctggga actgtccaag gccaattcgc 480
gatttgccac taacttctac cagcacctgg cagactccaa gaatgacaac gacaacattt 540
tcctgtcacc cttgagcatc tccactgctt ttgctatgac caagctgggt gcctgtaacg 600
acactctcaa gcagctgatg gaggttttta aatttgatac catctccgag aagacatccg 660
accagatcca cttcttcttt gccaaactga actgccgact ctatcgaaaa gccaacaagt 720
cctctgactt ggtatcagcc aaccgccttt ttggagacaa atccctcacc ttcaacgaga 780
gctatcaaga tgttagtgag gttgtctatg gagccaagct ccagcccctg gacttcaagg 840
agaatccgga gcaatccaga gtgaccatca acaactgggt agctaataag actgaaggcc 900
gcatcaaaga tgtcatccca cagggcgcca ttaacgagct cactgccctg gttctggtta 960
acaccattta cttcaagggc ctgtggaagt caaagttcag ccctgagaac acaaggaagg 1020
aaccgttcta taaggtcgat gggcagtcat gcccagtgcc tatgatgtac caggaaggca 1080
aattcaaata ccggcgcgtg gcagagggca cccaggtgct agagctgccc ttcaaggggg 1140
atgacatcac catggtgctc atcctgccca agcctgagaa gagcctggcc aaggtggagc 1200
aggagctcac cccagagctg ctgcaggagt ggctggatga gctgtcagag actatgcttg 1260
tggtccacat gccccgcttc cgcaccgagg atggcttcag tctgaaggag cagctgcaag 1320
acatgggcct cattgatctc ttcagccctg aaaagtccca actcccaggg atcgttgctg 1380
gaggcaggga cgacctctat gtctccgacg cattccacaa agcatttctt gaggtaaatg 1440
aggaaggcag tgaagcagca gcgagtactt ctgtcgtgat tactggccgg tcactgaacc 1500
ccaatagggt gaccttcaag gccaacaggc ccttcctggt tcttataagg gaagttgcac 1560
tgaacactat tatattcatg gggagagtgg ctaatccttg tgtgaactaa aatattctta 1620
atctttgcac cttttcctac tttggtgttt gtgaatagaa gtaaaaataa atacgactgc 1680
cacctcacga gaatggactt ttccacttga agacgagaga ctggagtaca gatgctacac 1740
cacttttggg caagtgaagg gggagcagcc agccacggtg gcacaaacct atatcctggt 1800
gcttttgaag gtagaagcag ggcggtcagg agttaaggcc agttgaggct gggctgcaga 1860
gtgaaagacc atgtctcaag atggtctttc tcctccccaa agtagaaaag aaaaccataa 1920
aaacaagagg taaatatatt actatttcat cttagaggat agcaggcatc ttgaaagggt 1980
agagggacct taaattctca ttattgcccc catactacaa actaaaaaac aaacccgaat 2040
caatctccca taaagacaga gattcaaata agagtattaa acgttttatt tctcaaacca 2100
ctcacatgca taatgttctt atacacagtg tcaaaataaa gagaaatgca tttttataca 2160
aaaaaaaaaa a 2171
<210> 4
<211> 1561
<212> ДНК
<213> Rattus norvegicus
<400> 4
cggagggatt gctcagcact gtctccacgg cttctctgca gaagcgtcca ccatgtattc 60
cccgggaata ggaagtgcgg ttgctggaga gaggaagctt tgtctcctct ctctgctact 120
cattggtgcc ttgggctgtg ctgtctgtca tggaaaccct gtggacgaca tctgcatagc 180
gaagccccga gacatccccg tgaaccccat gtgcatttac cgctcccctg cgaagaaggc 240
cacggaggag gatgtcctag agcagaaggt tccggaagcc accaaccggc gggtctggga 300
actgtccaag gccaattctc gatttgccac taacttctat cagcacctgg cagactccaa 360
gaacgacaac gacaacattt tcctgtcacc cttgagcatc tccacggcgt ttgctatgac 420
caagctgggt gcttgtaata acaccctcaa gcagctgatg gaggttttta aatttgatac 480
catctccgag aagacatccg accagatcca cttcttcttt gccaaactga actgccgact 540
ctatcgaaaa gccaacaagt cctctaactt ggtgtcagcc aaccgccttt ttggagacaa 600
atcccttacc ttcaatgaga gctatcaaga cgttagtgag attgtctatg gagccaagct 660
tcagcccctg gacttcaagg agaatccgga gcaatccaga gtgaccatca acaactgggt 720
agctaataag actgaaggcc gcatcaaaga cgtcatcccc caaggagcca ttgatgagct 780
cactgccctg gtgctggtta acaccattta cttcaagggc ctgtggaagt caaagttcag 840
ccctgagaac acaaggaagg aaccattcca caaagttgat gggcagtcat gcctggtgcc 900
catgatgtac caggaaggca aattcaaata caggcgtgtg ggagagggta cccaggtgct 960
agagatgccc ttcaaggggg acgacatcac catggtgctc atcctgccca agcctgagaa 1020
gagcctggct aaggtggagc aggaactcac cccggagctg ctgcaggagt ggctggatga 1080
gctgtcggag gtcatgcttg tggtccacgt gccccgcttc cgcatcgagg acagcttcag 1140
tctgaaggag cagctgcaag acatgggcct tgttgatctc ttcagccctg agaagtccca 1200
actcccaggg atcattgctg aaggcaggga cgacctcttt gtctccgatg cattccacaa 1260
agcgtttctt gaggtaaatg aggaaggcag tgaagcagca gcgagtactt ctgtcgtgat 1320
tactggccgg tcactgaacc ccagtagggt gaccttcaag gccaacaggc ccttcctggt 1380
tcttataagg gaagtcgcac tgaacactat tatattcatg gggagagtgt ctaatccttg 1440
tgtgaactaa aatattctta atctttgcac cttttcctat ctcggtgttt gttaatggaa 1500
gtaaaaataa atatgactgc cacctcaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1560
a 1561
<210> 5
<211> 1599
<212> ДНК
<213> Homo sapiens
<400> 5
taatgtgaga tggaagtagt ttgtatttat ttttacttct gttcacaaac caaaaatagg 60
aagaggtgca aagaataaga acattttact taacacaagg gttggctact ctgcccatga 120
agataatagt gttcagagga acttctctta taaaaaccag gaaaggcctg ttggccttga 180
aagtcaccct gttggggttt agcgaacggc cagcaatcac aacagcggta cttgcagctg 240
cttcactgcc ttcttcattt acctcaagaa atgccttatg gaatgcatct gagacataga 300
ggtcatctcg gccttctgca acaatacctg ggagtttgga cttttcaggg ctgaacagat 360
cgacaaggcc catgtcttgc agctgctcct tcaaactgaa gccgtcctca atgcggaagc 420
ggggcatgtg gaccaccagc atcatctcct ccaattcatc cagccactct tgcagcacct 480
ctggggtgag ttccttctct accttggcca ggctcttctc aggcttgggc aagatgagga 540
ccatggtgat gtcatcacct ttgaagggca actcaagcac ctgggtgcct tcagccacgc 600
gccgataacg gaacttgcct tcctggtaca tcatagatgc tgaacacgac tctccatcag 660
ccttgtagaa cagttccttc cttgtgttct cagggctgaa ctttgacttc cacaggccct 720
tgaagtaaat ggtgttaacc agcaccagaa cagtgagctc attgatggct tccgagggaa 780
tgacatcggt gattcggcct tcggtcttat tggacaccca tttgttgatg gccgctctgg 840
attgctctgc attttccttg aagtccaggg gctggagctt ggctccatat accaactcac 900
tgatgtcctg gtaggtctca ttgaaggtaa gggatttgtc tccaaaaagg cgattggctg 960
atactaactt ggaggatttg ttggcttttc gatagagtcg gcagttcagt ttggcaaaga 1020
agaagtggat ctgatcagat gttttctcag atatggtgtc aaacttaaat acctccatca 1080
gttgctggag ggtgtcatta caggcaccca gcttggtcat agcaaaagcc gtggagatac 1140
tcaggggtga caggaaaatg ttatcattgt cattcttgga atctgccagg tgctgataga 1200
aagtggtagc aaagcgggaa ttggccttgg acagttccca gacacgccgg ttggtggcct 1260
ccgggatctt ctgttctgag ccctcatcct cagttgcctt cttctccggg gagcggtaaa 1320
tgcacatggg attcatggga atgtcccgcg gcttggctgt gcagatgtcc acagggctcc 1380
cgtgacaggt cacgcagtcc cagaagccaa tgagcagcaa ggacaaaaga taaaccttcc 1440
tttttccaga ggttacagtt cctatcacat tggaatacat ggccgctaat cttccacagg 1500
gctgggcaag tggagatagt gtgatctgag gcaatccgcc tgaaaactgg ttctttcctc 1560
taaatctcgc agaggttcca gaggacaggg tggggcaga 1599
<210> 6
<211> 1545
<212> ДНК
<213> Macaca mulatta
<400> 6
tttttttttt ttttttttta atgtaagatg ggagtagttg tatttatttt tacttctatt 60
cacaaaccaa aataggaaga ggtacaaaga ataagaacag tttagctcac acaagggttg 120
gctactctgc ccatgaagat aatagtgttc agaggaactt ctcttataaa aaccaggaaa 180
ggcctgttgg ccttgaaggt caccctgttg gggtttagcg aacggccagc aatcccaatg 240
gcggtacttg cagctgcttc actgccttct tcatttacct caagaaatgc cttatggaat 300
gcatcggaga catagaggtc atcccggcct tctgcaacaa tacctgggag tttggacttt 360
tcagggctga acagatcgac aaggcccatg tcttgcagct gctccttcaa actgaagccg 420
tcctcaatgc ggaagcgggg catgtgaacc accagcatca tctcctccaa ctcatccagc 480
cactcctgca gcacctctgg ggtgagttcc tgctccacct tggtcaggct cttctcaggc 540
ttgggcagga tgagcaccat ggtgatgtca tcacccttga agggcaactc aagcacctgg 600
gtgccttcag ccacgcgccg ataacagaac ttgccttcct ggtacatcat agacgctgaa 660
cacgactctc catcagcctt gtagaacggt tccatccttg tgttctcagg gctaaacttt 720
gacttccaca ggcccttgaa gtaaatggtg ttaaccagca ccagaacagt gagctcgttg 780
atggcttccg ggggaatgac atcggtgatt cggccttcgg tcttattgga cacccatttg 840
ttgatggccg ctctggattg ctctgcattt tccttgaagt ccaggggctg gagcttggct 900
ccgtatacca actcactgat gtcctggtag gtctcattga aggtaaggga tttgtctcca 960
aaaaggcgat tggctgatac taacttggag gatttgttgg cttttcgata gagtcggcag 1020
ttcagtttgg caaagaagaa gtggatctga tcagatgttt tctcagatat ggtgtcaaac 1080
ttaaatacct ccatcagttg cttgagggtg tcattacagg cacccagctt ggtcatagca 1140
aaagccgtgg agacactcag gggtgacagg aaaatgttat ccttgtcgtt cttggaatct 1200
gccaggtgct gatagaaagt ggtagcaaag cgggaattgg ccttggacag ttcccagacg 1260
cgccggttgg tggcctcggg gatcttctgt tctgagccct catcctcagt tgccttcttc 1320
tccggggagc ggtaaatgca catgggattc atgggaatgt cccgcggctt ggctgtgcag 1380
atgtccacag ggctcccgtg acaggtcata cagtcccaga ggccaatgag cagcaaggac 1440
agaagataaa ccttcctttt tccagaggct acggttccta tcacattgga atacatggtc 1500
gctaatcttc cacagggctg ggcaagtgga gatggtcctc gtgcc 1545
<210> 7
<211> 2171
<212> ДНК
<213> Mus musculus
<400> 7
tttttttttt ttgtataaaa atgcatttct ctttattttg acactgtgta taagaacatt 60
atgcatgtga gtggtttgag aaataaaacg tttaatactc ttatttgaat ctctgtcttt 120
atgggagatt gattcgggtt tgttttttag tttgtagtat gggggcaata atgagaattt 180
aaggtccctc taccctttca agatgcctgc tatcctctaa gatgaaatag taatatattt 240
acctcttgtt tttatggttt tcttttctac tttggggagg agaaagacca tcttgagaca 300
tggtctttca ctctgcagcc cagcctcaac tggccttaac tcctgaccgc cctgcttcta 360
ccttcaaaag caccaggata taggtttgtg ccaccgtggc tggctgctcc cccttcactt 420
gcccaaaagt ggtgtagcat ctgtactcca gtctctcgtc ttcaagtgga aaagtccatt 480
ctcgtgaggt ggcagtcgta tttattttta cttctattca caaacaccaa agtaggaaaa 540
ggtgcaaaga ttaagaatat tttagttcac acaaggatta gccactctcc ccatgaatat 600
aatagtgttc agtgcaactt cccttataag aaccaggaag ggcctgttgg ccttgaaggt 660
caccctattg gggttcagtg accggccagt aatcacgaca gaagtactcg ctgctgcttc 720
actgccttcc tcatttacct caagaaatgc tttgtggaat gcgtcggaga catagaggtc 780
gtccctgcct ccagcaacga tccctgggag ttgggacttt tcagggctga agagatcaat 840
gaggcccatg tcttgcagct gctccttcag actgaagcca tcctcggtgc ggaagcgggg 900
catgtggacc acaagcatag tctctgacag ctcatccagc cactcctgca gcagctctgg 960
ggtgagctcc tgctccacct tggccaggct cttctcaggc ttgggcagga tgagcaccat 1020
ggtgatgtca tcccccttga agggcagctc tagcacctgg gtgccctctg ccacgcgccg 1080
gtatttgaat ttgccttcct ggtacatcat aggcactggg catgactgcc catcgacctt 1140
atagaacggt tccttccttg tgttctcagg gctgaacttt gacttccaca ggcccttgaa 1200
gtaaatggtg ttaaccagaa ccagggcagt gagctcgtta atggcgccct gtgggatgac 1260
atctttgatg cggccttcag tcttattagc tacccagttg ttgatggtca ctctggattg 1320
ctccggattc tccttgaagt ccaggggctg gagcttggct ccatagacaa cctcactaac 1380
atcttgatag ctctcgttga aggtgaggga tttgtctcca aaaaggcggt tggctgatac 1440
caagtcagag gacttgttgg cttttcgata gagtcggcag ttcagtttgg caaagaagaa 1500
gtggatctgg tcggatgtct tctcggagat ggtatcaaat ttaaaaacct ccatcagctg 1560
cttgagagtg tcgttacagg cacccagctt ggtcatagca aaagcagtgg agatgctcaa 1620
gggtgacagg aaaatgttgt cgttgtcatt cttggagtct gccaggtgct ggtagaagtt 1680
agtggcaaat cgcgaattgg ccttggacag ttcccagacc cgccggttgg tggcttctgg 1740
aaccttctgc tctgagccat cctcctcggt ggccttcttc ccaggggagc ggtaaatgca 1800
caagggattc acggggatgt ctcggggctt cgctatgcag atgtcgtcca cagggtttcc 1860
gtgacagata gcacagccca aggcaccgat gaggagcaga gagaggagac aaagcttcct 1920
ctcaccagca gccccacttc ctgccccagg ggaatacatg gccgatgctc ctacagagat 1980
ggtgctgact gagacgatca ctccgaaaac tggttctttc ccctaaatct gagaggtcca 2040
gaggccaggt gggggaggga gctctcccct taaagtcttc aggtagatat gtcttctgat 2100
tatgtcttat atctcaccac ttcactaaaa tgtctcagat acaaatcaga tctatttcta 2160
aaattaccta t 2171
<210> 8
<211> 1561
<212> ДНК
<213> Rattus norvegicus
<400> 8
tttttttttt tttttttttt tttttttttt tttttgaggt ggcagtcata tttattttta 60
cttccattaa caaacaccga gataggaaaa ggtgcaaaga ttaagaatat tttagttcac 120
acaaggatta gacactctcc ccatgaatat aatagtgttc agtgcgactt cccttataag 180
aaccaggaag ggcctgttgg ccttgaaggt caccctactg gggttcagtg accggccagt 240
aatcacgaca gaagtactcg ctgctgcttc actgccttcc tcatttacct caagaaacgc 300
tttgtggaat gcatcggaga caaagaggtc gtccctgcct tcagcaatga tccctgggag 360
ttgggacttc tcagggctga agagatcaac aaggcccatg tcttgcagct gctccttcag 420
actgaagctg tcctcgatgc ggaagcgggg cacgtggacc acaagcatga cctccgacag 480
ctcatccagc cactcctgca gcagctccgg ggtgagttcc tgctccacct tagccaggct 540
cttctcaggc ttgggcagga tgagcaccat ggtgatgtcg tcccccttga agggcatctc 600
tagcacctgg gtaccctctc ccacacgcct gtatttgaat ttgccttcct ggtacatcat 660
gggcaccagg catgactgcc catcaacttt gtggaatggt tccttccttg tgttctcagg 720
gctgaacttt gacttccaca ggcccttgaa gtaaatggtg ttaaccagca ccagggcagt 780
gagctcatca atggctcctt gggggatgac gtctttgatg cggccttcag tcttattagc 840
tacccagttg ttgatggtca ctctggattg ctccggattc tccttgaagt ccaggggctg 900
aagcttggct ccatagacaa tctcactaac gtcttgatag ctctcattga aggtaaggga 960
tttgtctcca aaaaggcggt tggctgacac caagttagag gacttgttgg cttttcgata 1020
gagtcggcag ttcagtttgg caaagaagaa gtggatctgg tcggatgtct tctcggagat 1080
ggtatcaaat ttaaaaacct ccatcagctg cttgagggtg ttattacaag cacccagctt 1140
ggtcatagca aacgccgtgg agatgctcaa gggtgacagg aaaatgttgt cgttgtcgtt 1200
cttggagtct gccaggtgct gatagaagtt agtggcaaat cgagaattgg ccttggacag 1260
ttcccagacc cgccggttgg tggcttccgg aaccttctgc tctaggacat cctcctccgt 1320
ggccttcttc gcaggggagc ggtaaatgca catggggttc acggggatgt ctcggggctt 1380
cgctatgcag atgtcgtcca cagggtttcc atgacagaca gcacagccca aggcaccaat 1440
gagtagcaga gagaggagac aaagcttcct ctctccagca accgcacttc ctattcccgg 1500
ggaatacatg gtggacgctt ctgcagagaa gccgtggaga cagtgctgag caatccctcc 1560
g 1561
<210> 9
<211> 16
<212> PRT
<213> Неизвестный
<220>
<221> источник
<223> /примечание="Описание неизвестного: пептид RFGF"
<400> 9
Ala Ala Val Ala Leu Leu Pro Ala Val Leu Leu Ala Leu Leu Ala Pro
1 5 10 15
<210> 10
<211> 11
<212> PRT
<213> Неизвестный
<220>
<221> источник
<223> /примечание="Описание неизвестного: пептид аналог RFGF"
<400> 10
Ala Ala Leu Leu Pro Val Leu Leu Ala Ala Pro
1 5 10
<210> 11
<211> 13
<212> PRT
<213> вирус иммунодефицита человека
<400> 11
Gly Arg Lys Lys Arg Arg Gln Arg Arg Arg Pro Pro Gln
1 5 10
<210> 12
<211> 16
<212> PRT
<213> Drosophila sp.
<400> 12
Arg Gln Ile Lys Ile Trp Phe Gln Asn Arg Arg Met Lys Trp Lys Lys
1 5 10 15
<210> 13
<211> 21
<212> РНК
<213> Искусственная Последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 13
gguuaacacc auuuacuuca a 21
<210> 14
<211> 23
<212> РНК
<213> Искусственная Последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 14
uugaaguaaa ugguguuaac cag 23
<210> 15
<211> 23
<212> РНК
<213> Искусственная Последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 15
uugaaguaaa ugguguuaac cag 23
<210> 16
<211> 21
<212> РНК
<213> Искусственная Последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 16
gguuaacacc auuuacuuca a 21
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ АССОЦИИРОВАННОГО С SERPINC1 РАССТРОЙСТВА | 2016 |
|
RU2754188C2 |
| КОМПОЗИЦИИ i-PHK ДЛЯ СЕРПИНА C1 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2013 |
|
RU2691580C2 |
| СРЕДСТВА ДЛЯ РНКи, КОМПОЗИЦИИ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, АССОЦИИРОВАННЫХ С ТРАНСТИРЕТИНОМ (TTR) | 2012 |
|
RU2678807C2 |
| КОМПОЗИЦИИ i-РНК ДЛЯ СЕРПИНА c1 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2013 |
|
RU2832033C2 |
| КОМПОЗИЦИИ иРНК ДЛЯ СХОДНОГО С АНГИОПОЭТИНОМ 3(ANGPTL3) БЕЛКА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2012 |
|
RU2711799C2 |
| Композиция системы доставки на основе конъюгата для доставки полинуклеотида РНК-интерференции в клетку печени и способ ее получения | 2011 |
|
RU2623160C9 |
| ЛЕЧЕНИЕ ЗАБОЛЕВАНИЙ, СВЯЗАННЫХ С ИНТЕРФЕРОН-РЕГУЛЯТОРНЫМ ФАКТОРОМ 8 (IRF8), ПУТЕМ ИНГИБИРОВАНИЯ ПРИРОДНОГО АНТИСМЫСЛОВОГО ТРАНСКРИПТА К IRF8 | 2011 |
|
RU2611187C2 |
| ЛЕЧЕНИЕ ЗАБОЛЕВАНИЙ, СВЯЗАННЫХ С ФАКТОРОМ РОСТА ФИБРОБЛАСТОВ 21 (FGF21), ПУТЕМ ИНГИБИРОВАНИЯ ПРИРОДНОГО АНТИСМЫСЛОВОГО ТРАНСКРИПТА К FGF21 | 2011 |
|
RU2610661C2 |
| ТЕРАПЕВТИЧЕСКИЕ КОМПОЗИЦИИ И СПОСОБЫ ПРОТИВ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ С МОЛЕКУЛАМИ РНКИ, НАПРАВЛЕННЫМИ ПРОТИВ HSP47 | 2015 |
|
RU2756253C2 |
| ЛЕЧЕНИЕ ЗАБОЛЕВАНИЙ, СВЯЗАННЫХ С ФАКТОРОМ РОСТА ГЕПАТОЦИТОВ (ФРГ), ПОСРЕДСТВОМ ИНГИБИРОВАНИЯ ПРИРОДНОГО АНТИСМЫСЛОВОГО ТРАНСКРИПТА К ФРГ | 2010 |
|
RU2609631C2 |
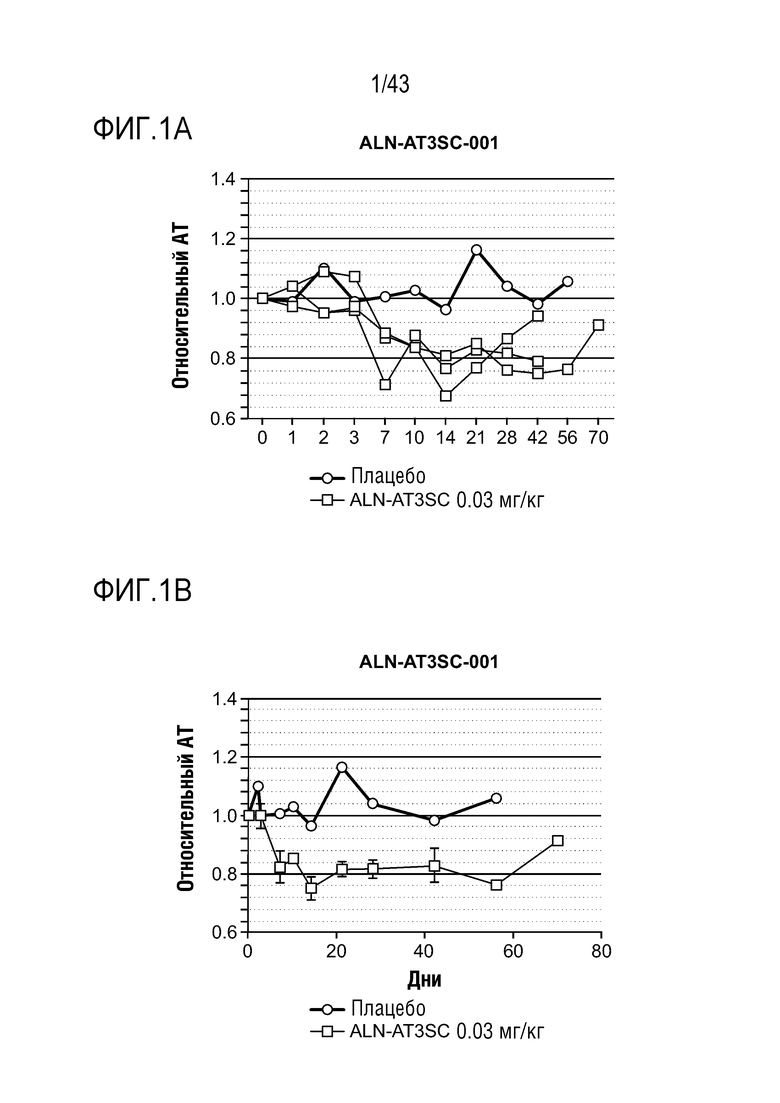
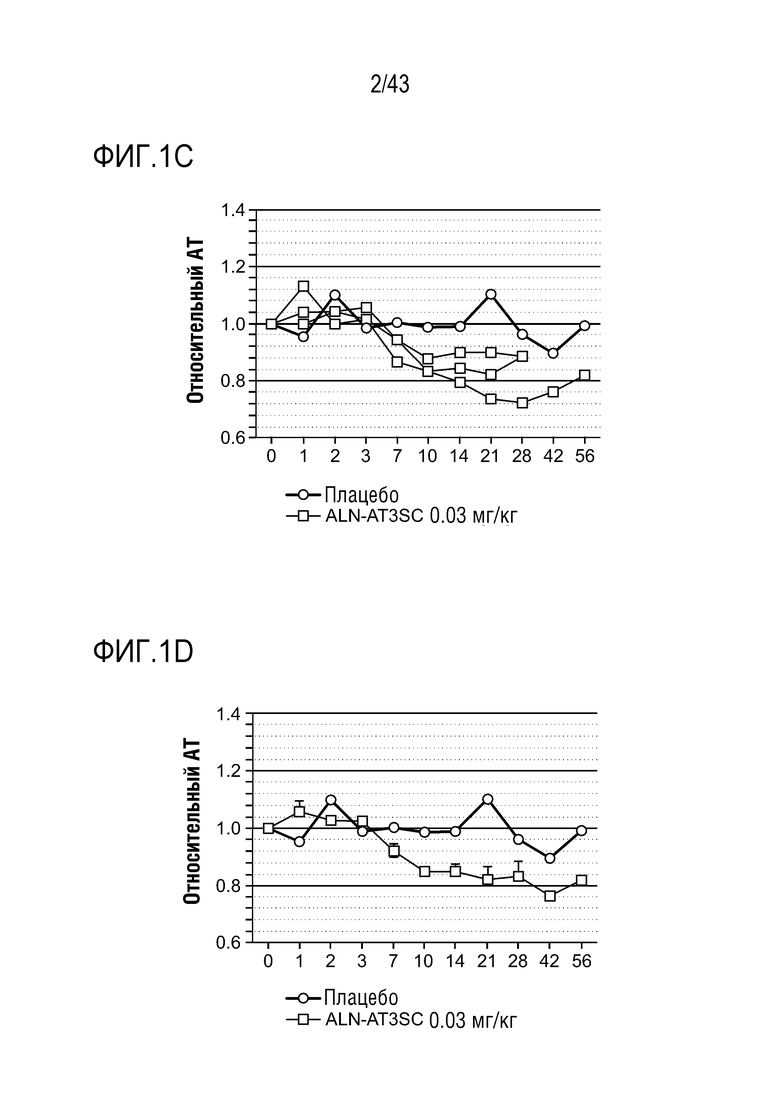
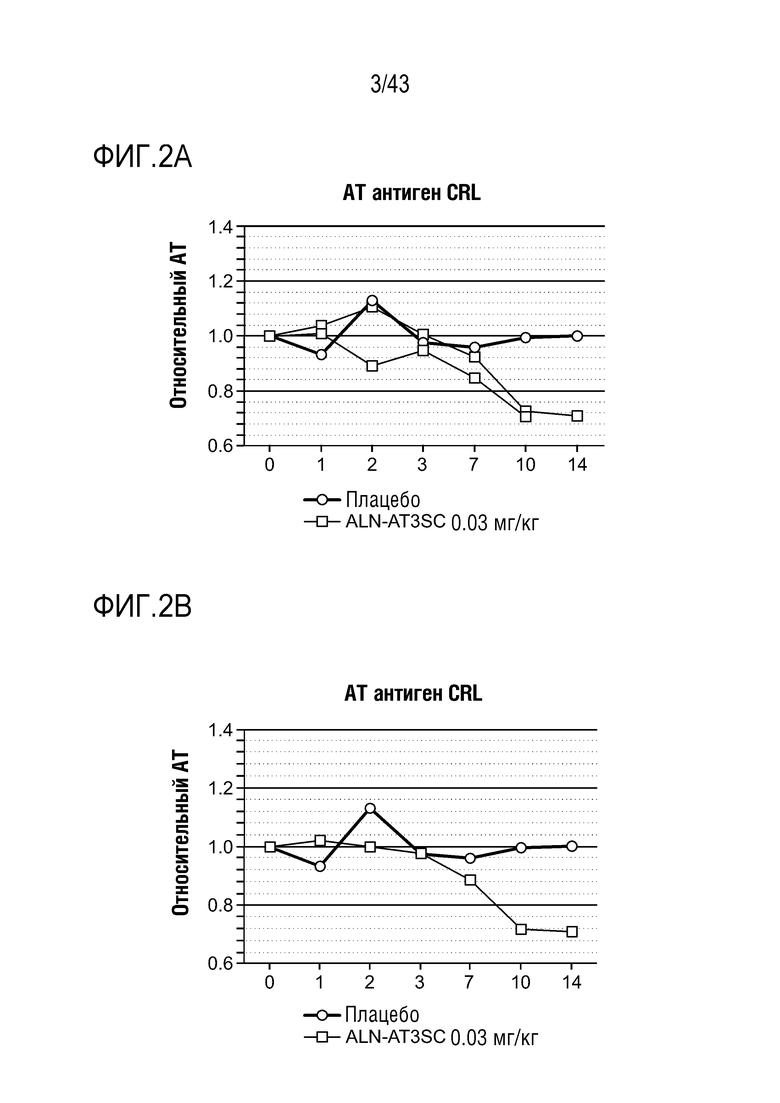
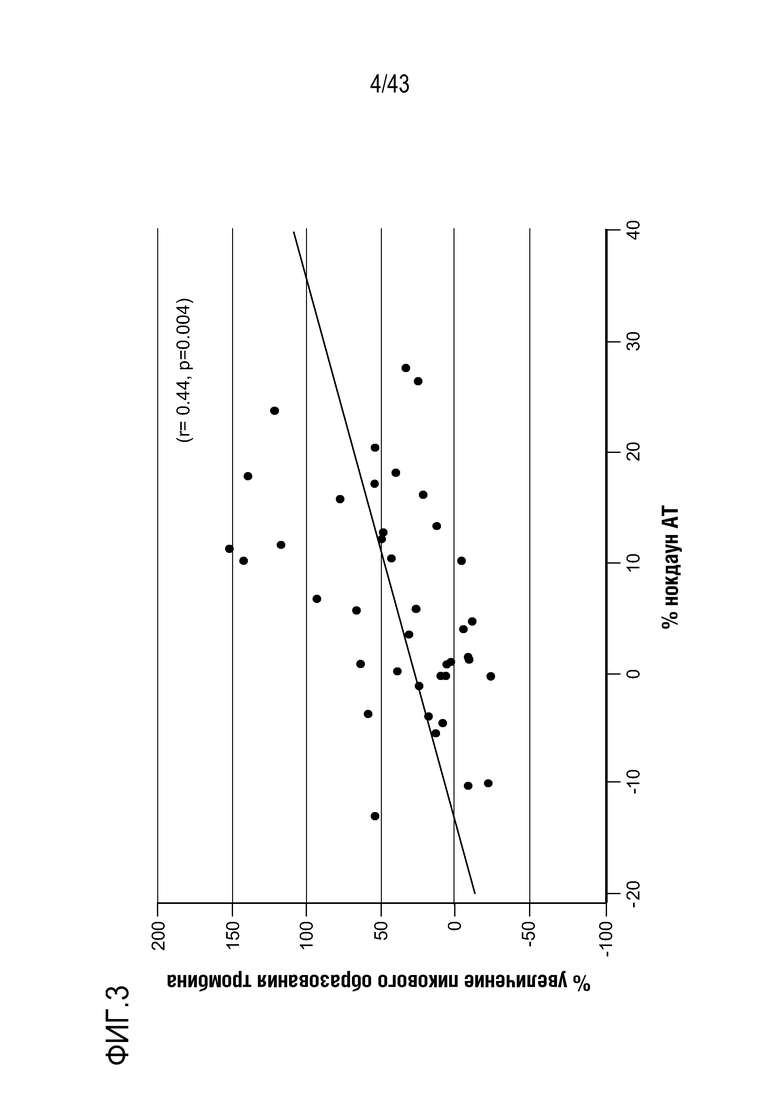
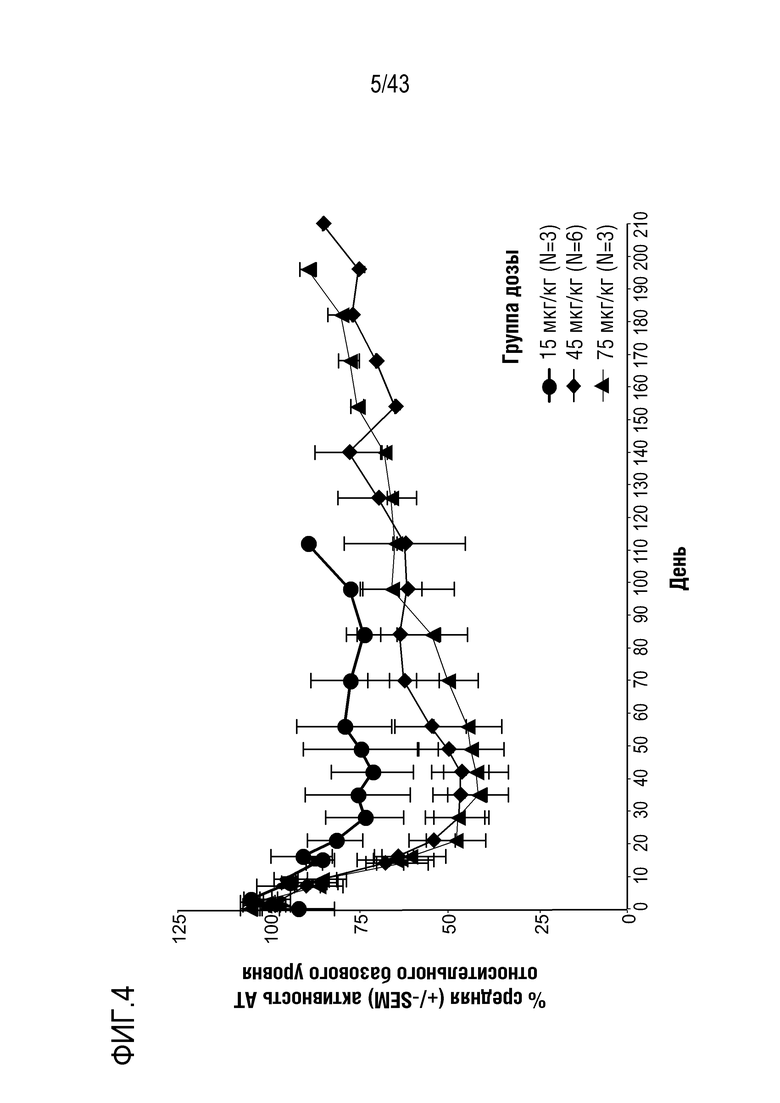
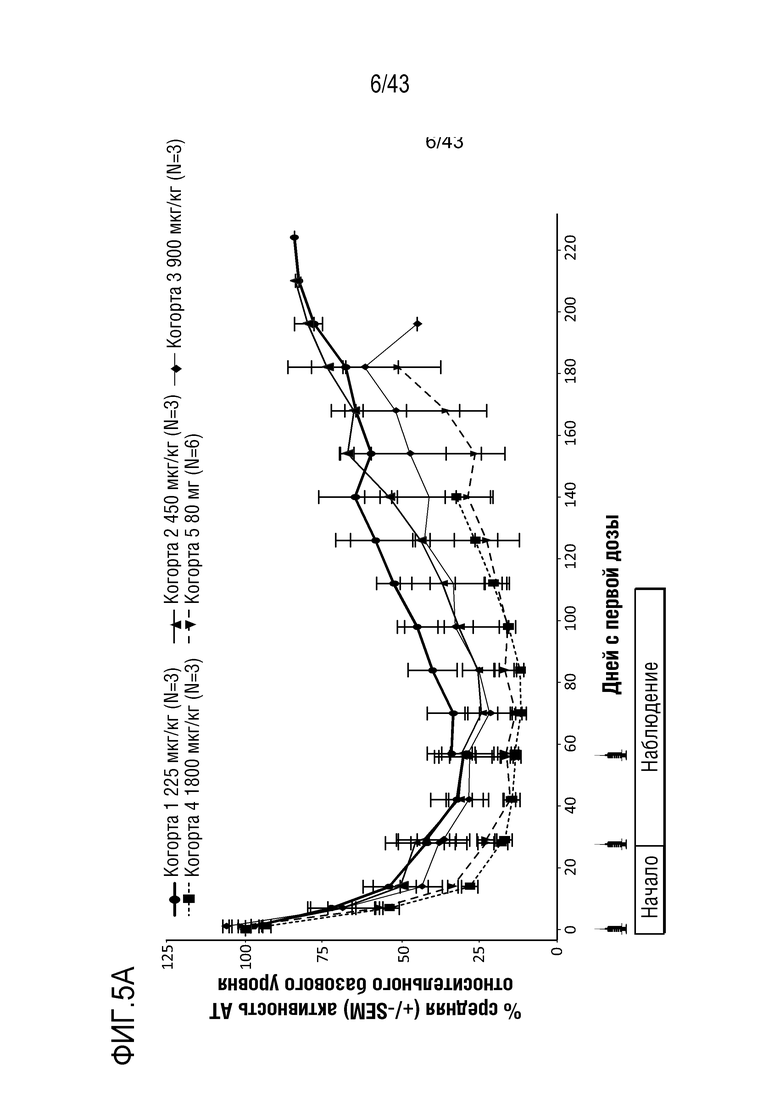
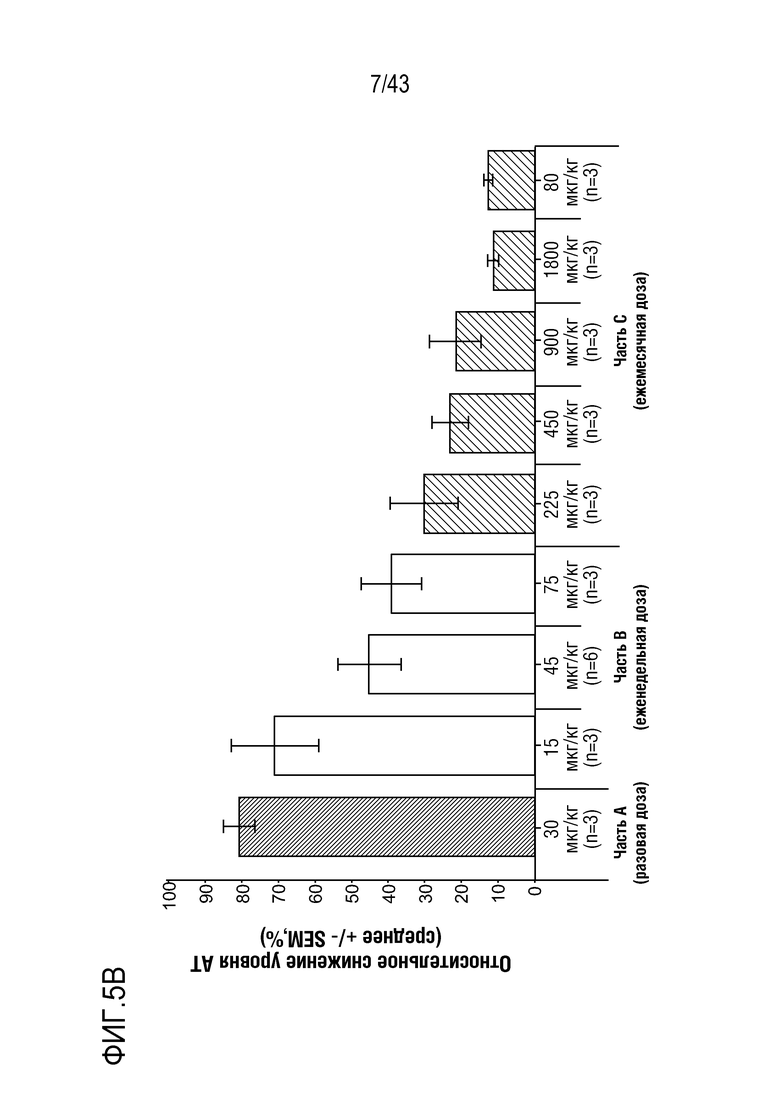
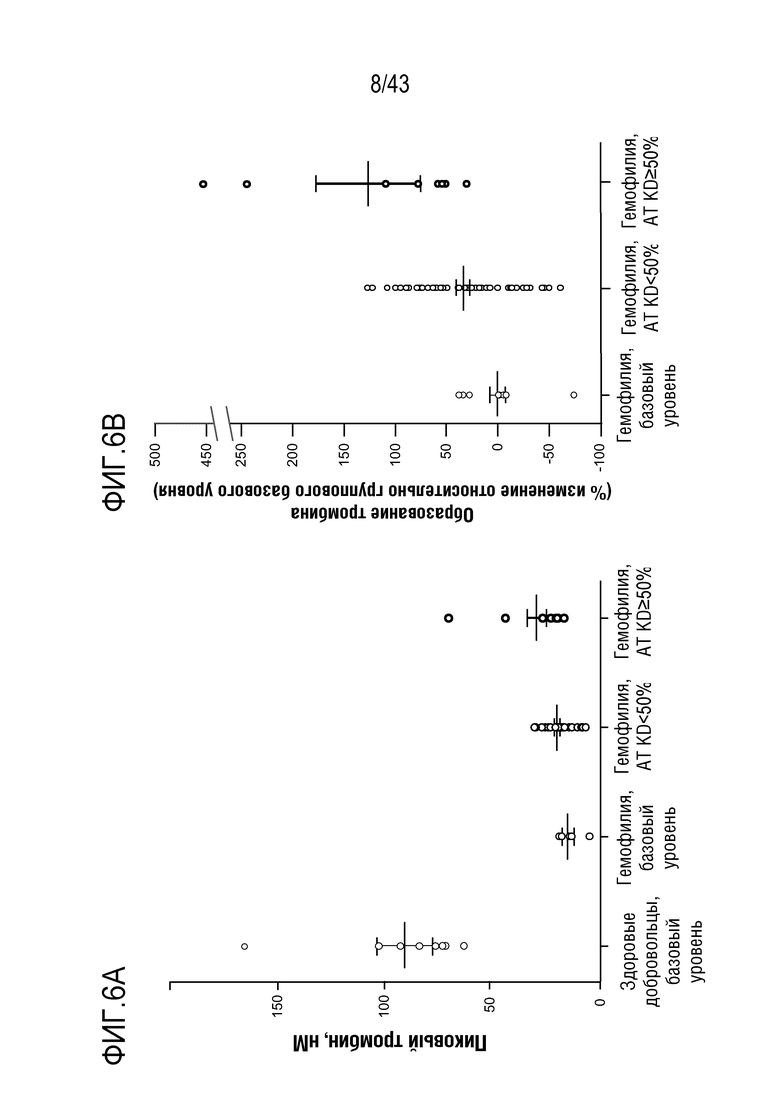
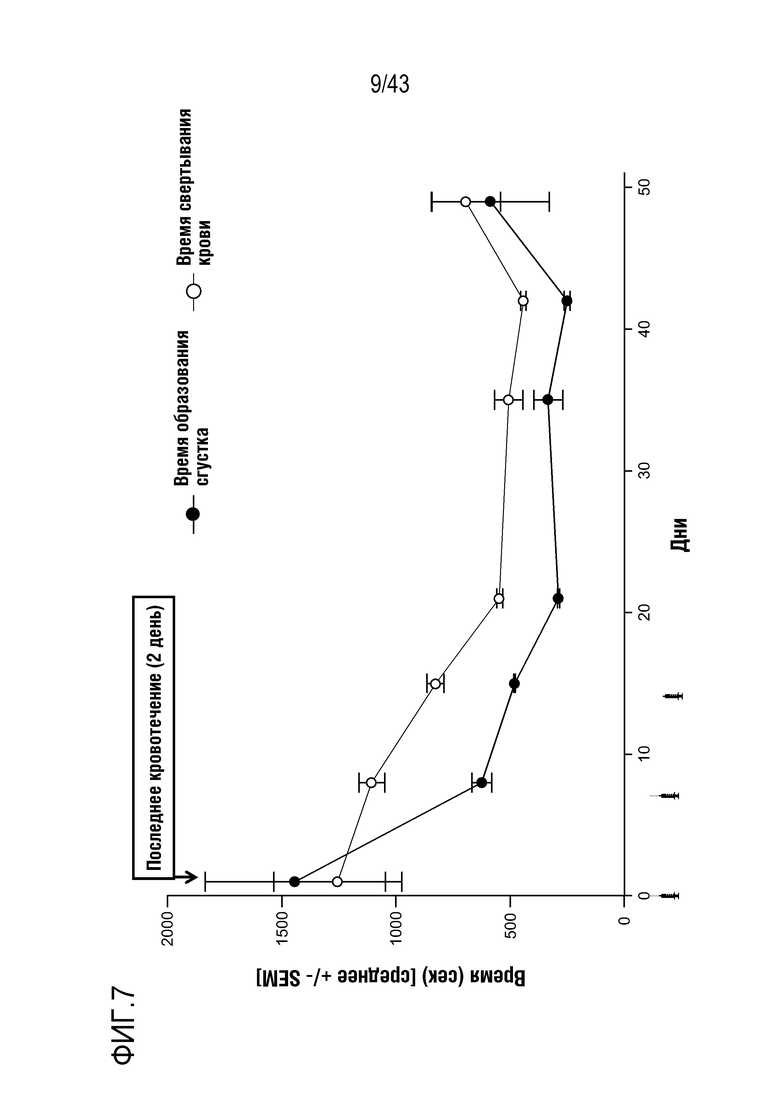
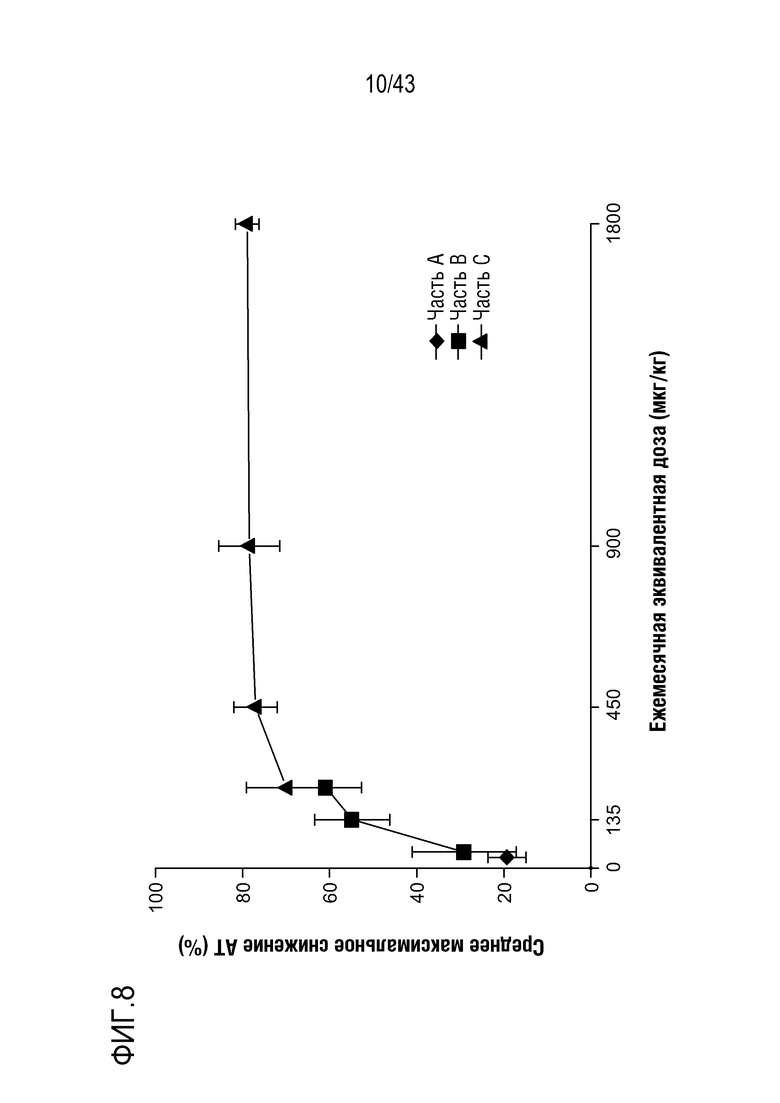
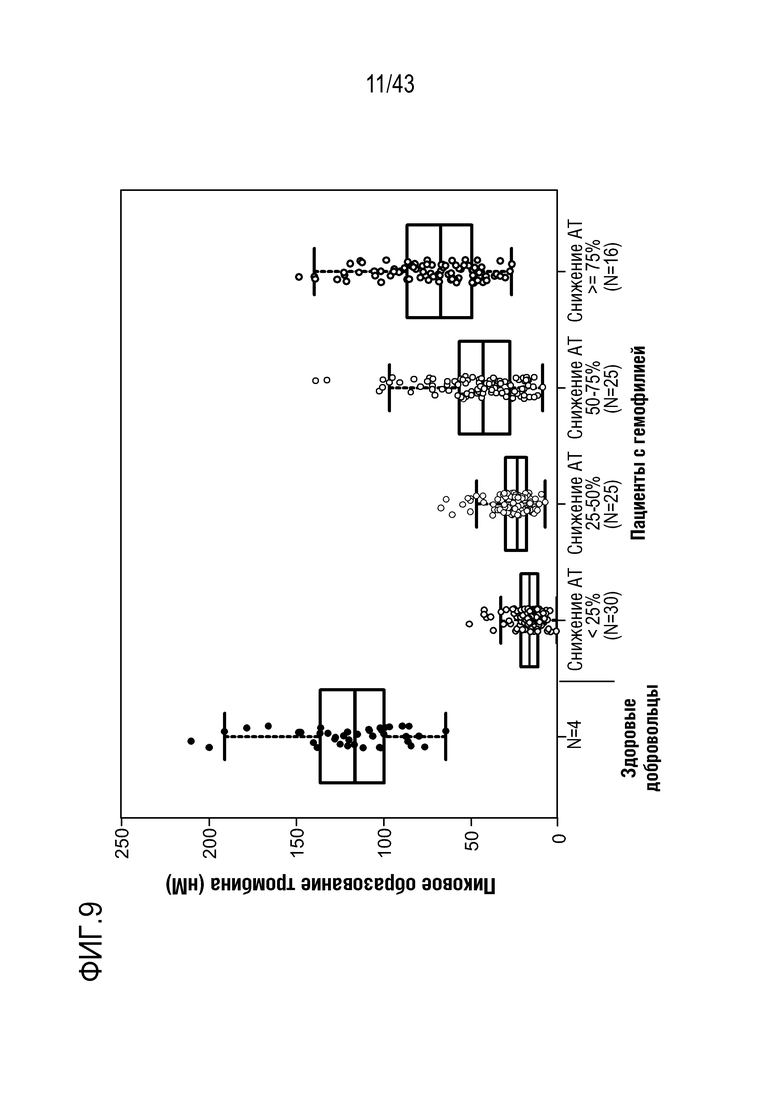
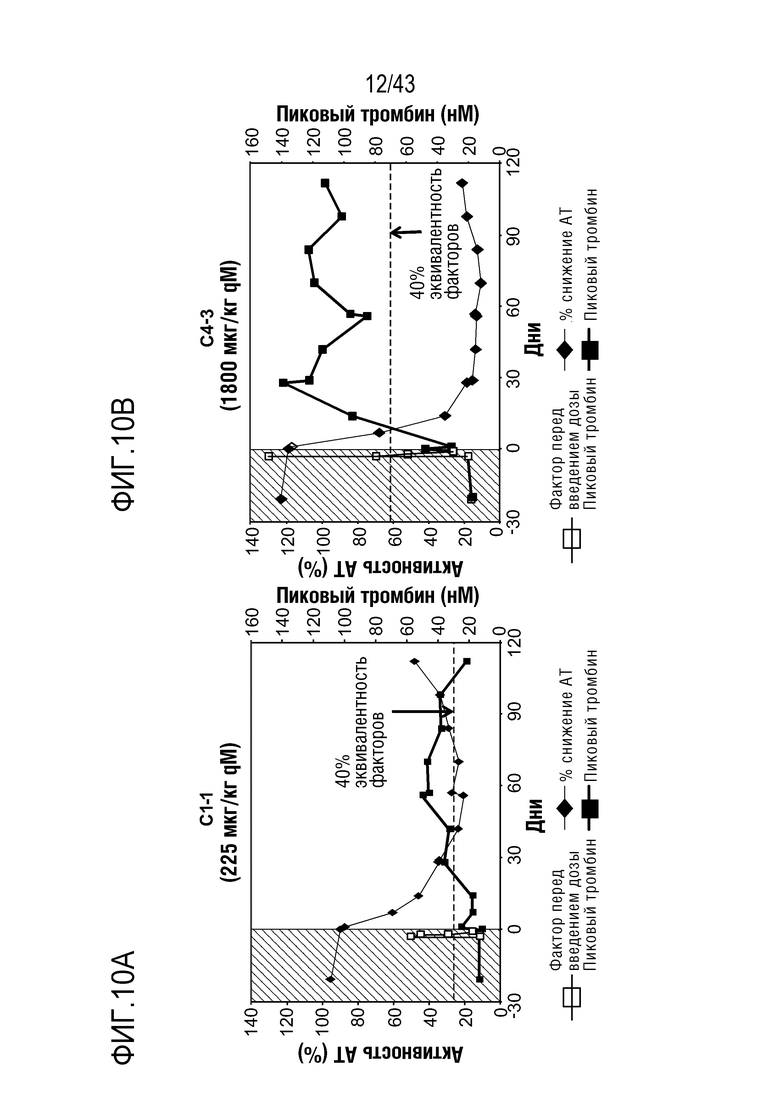
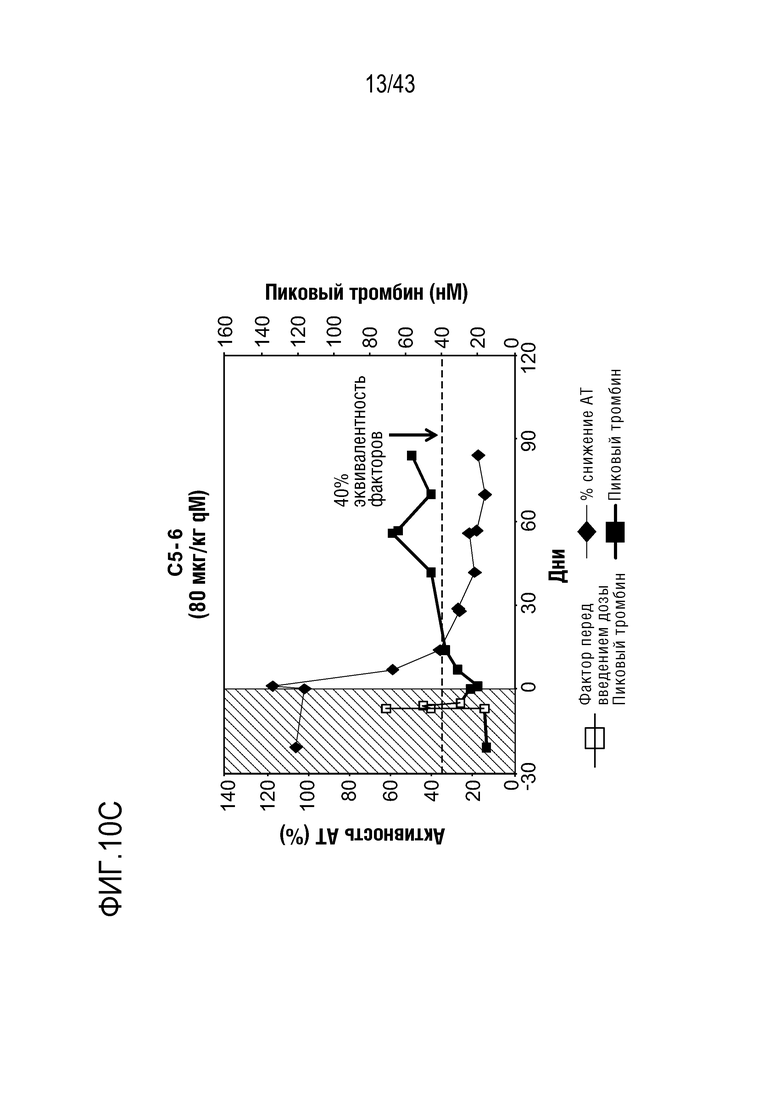
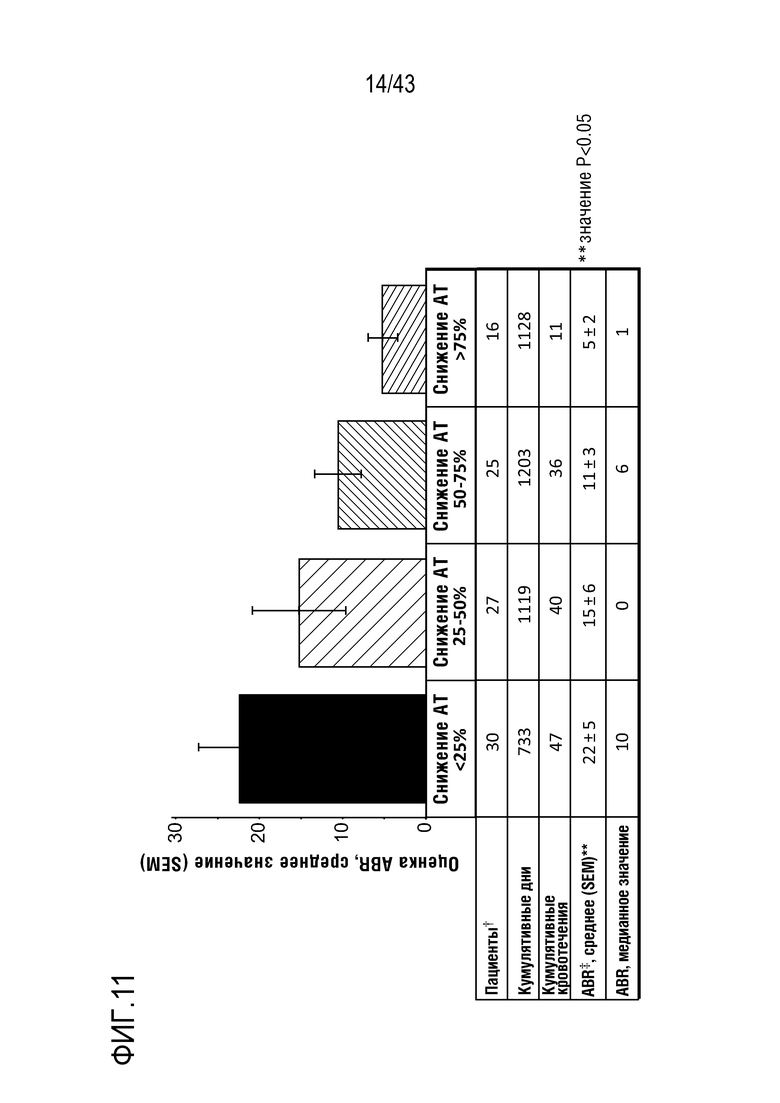
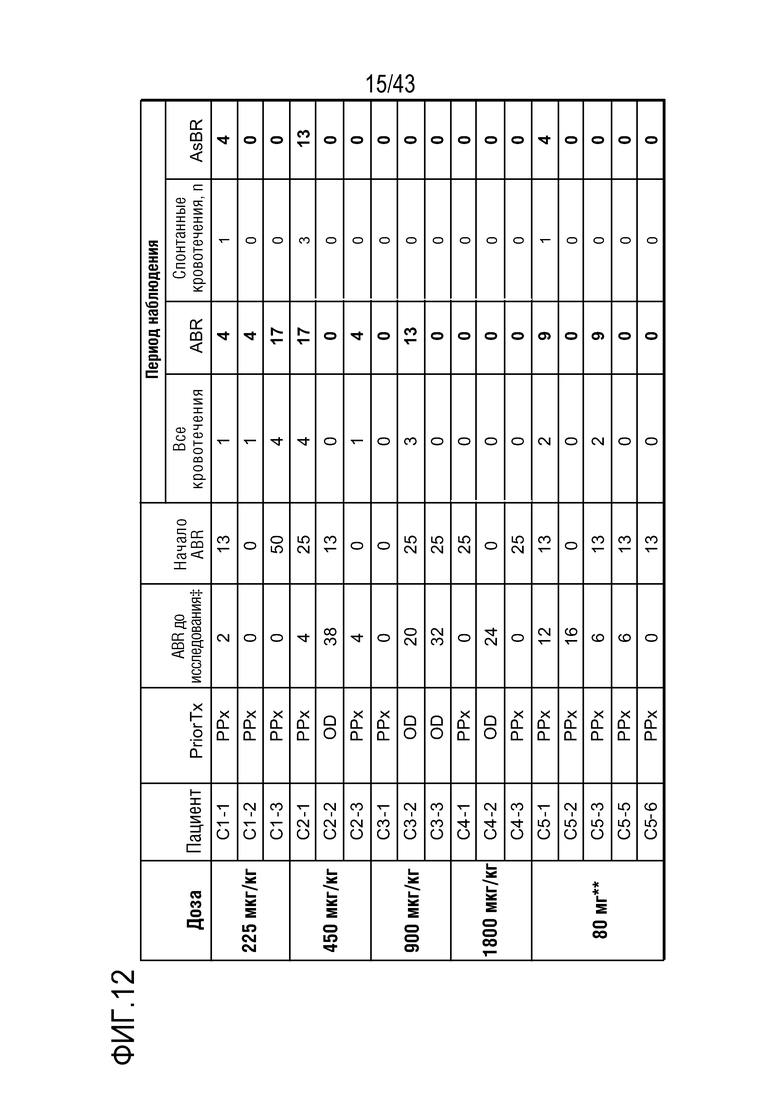
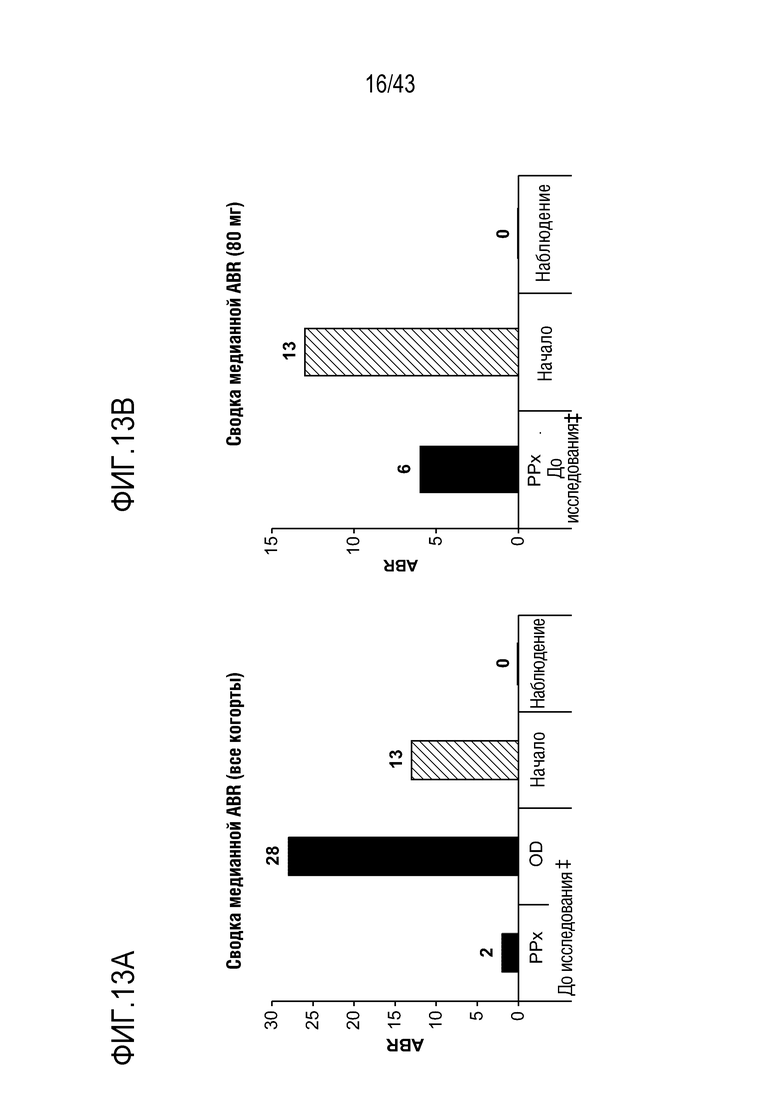
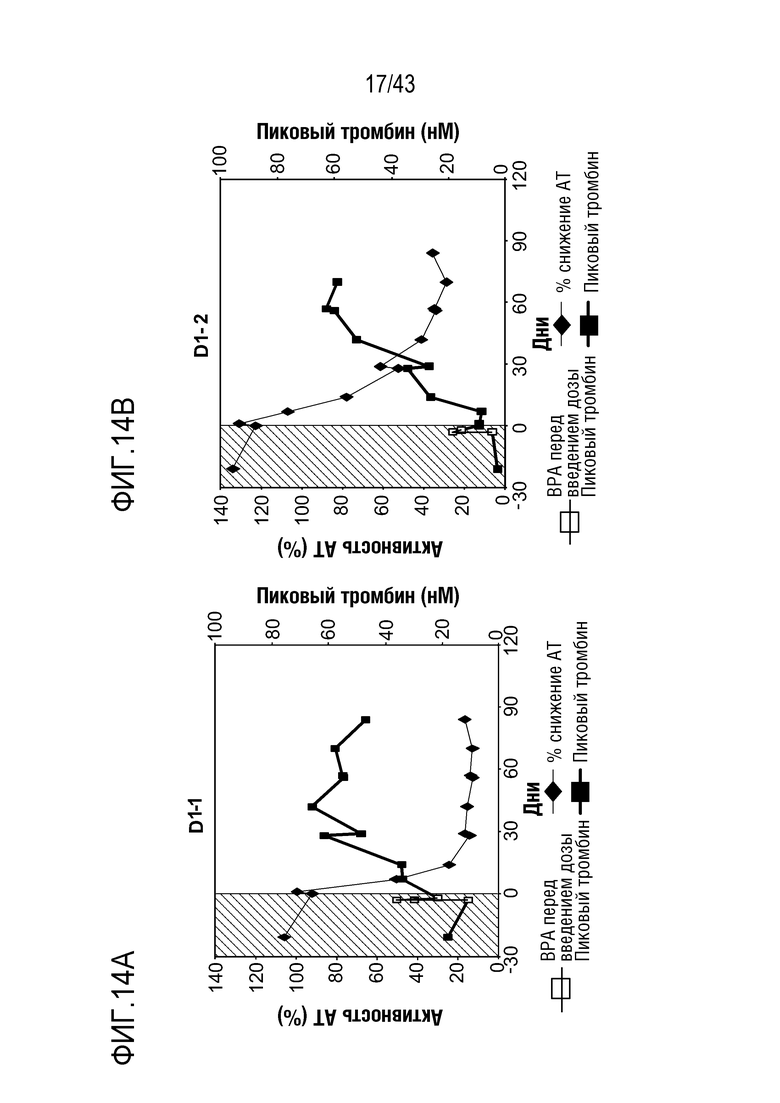
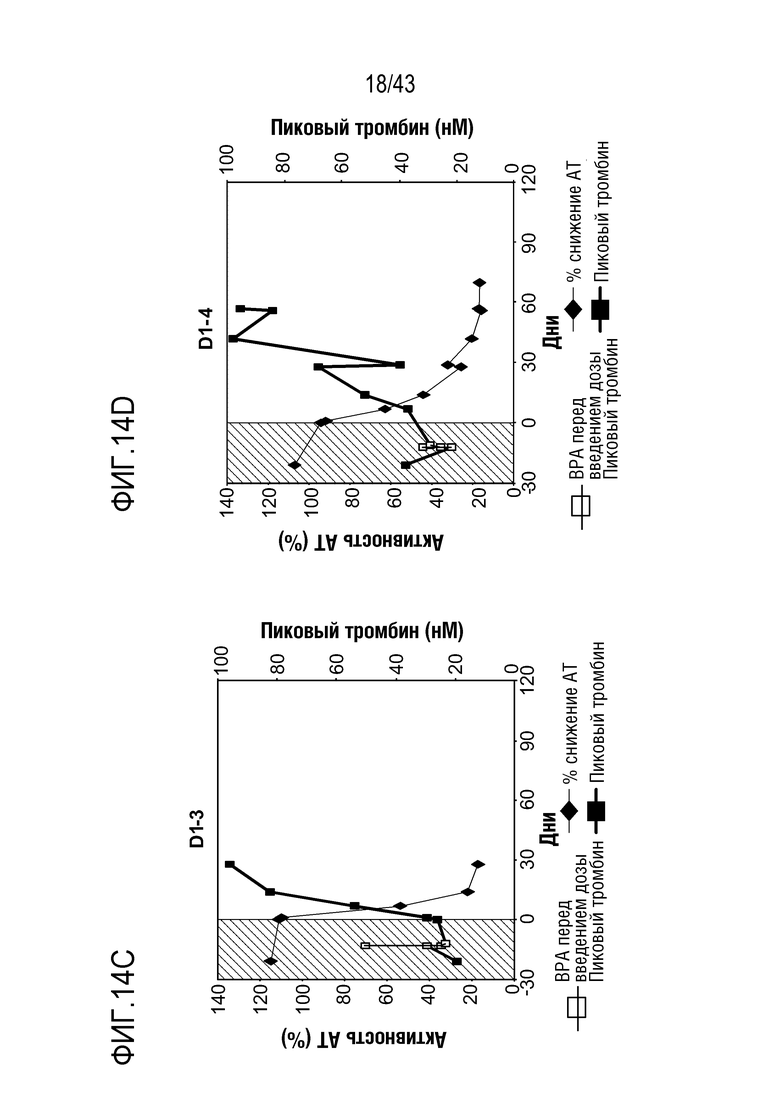
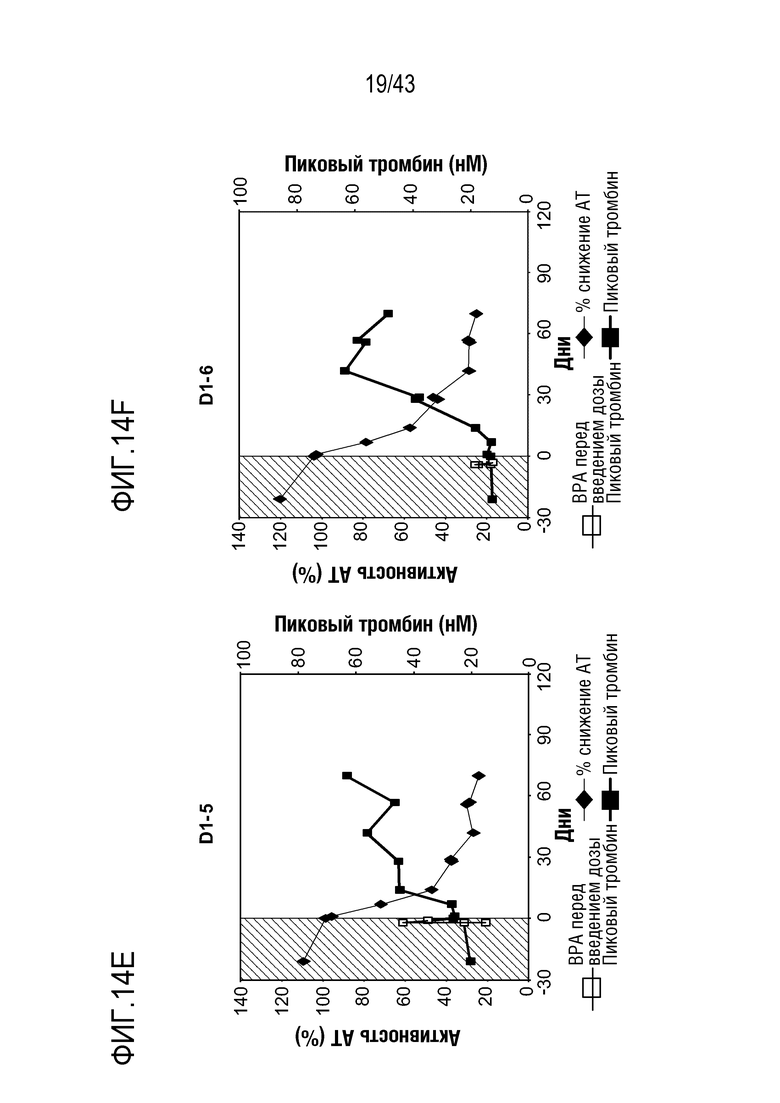
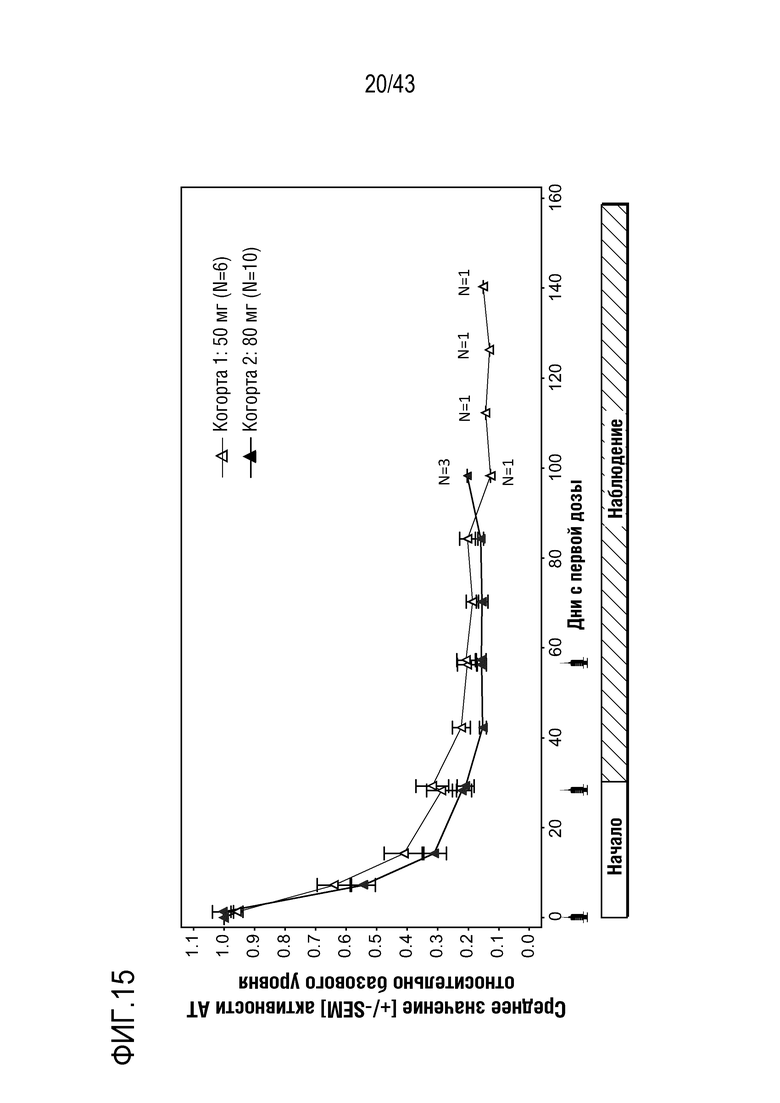
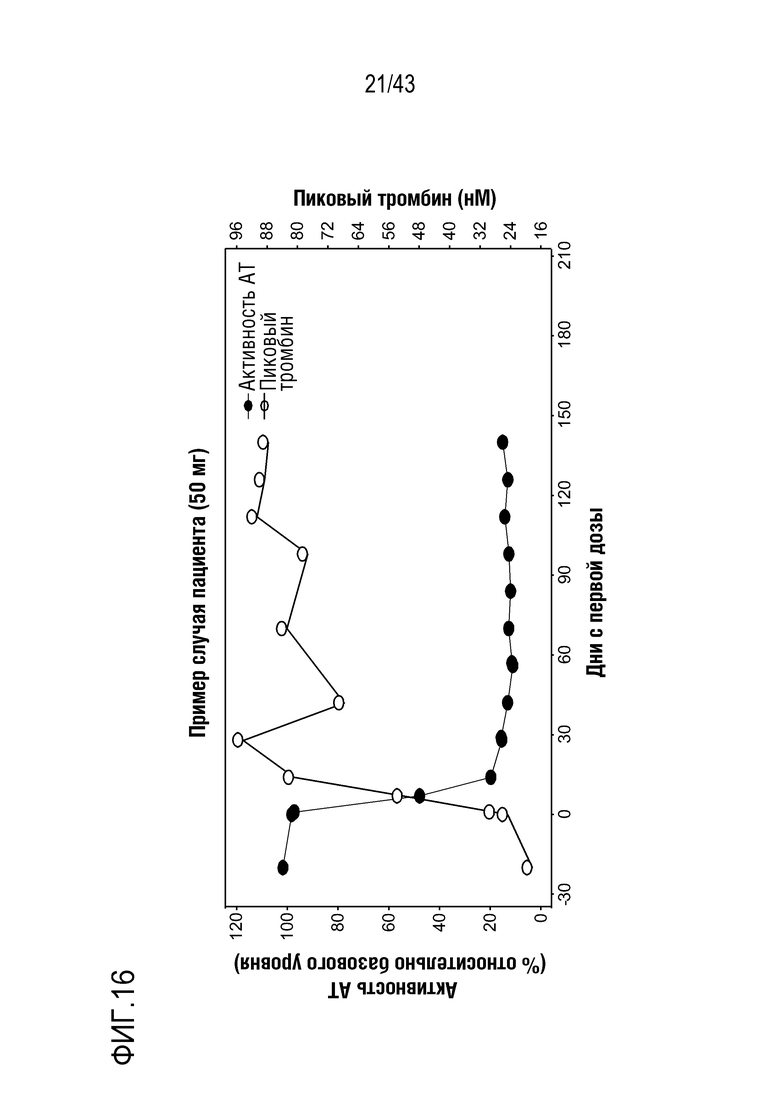
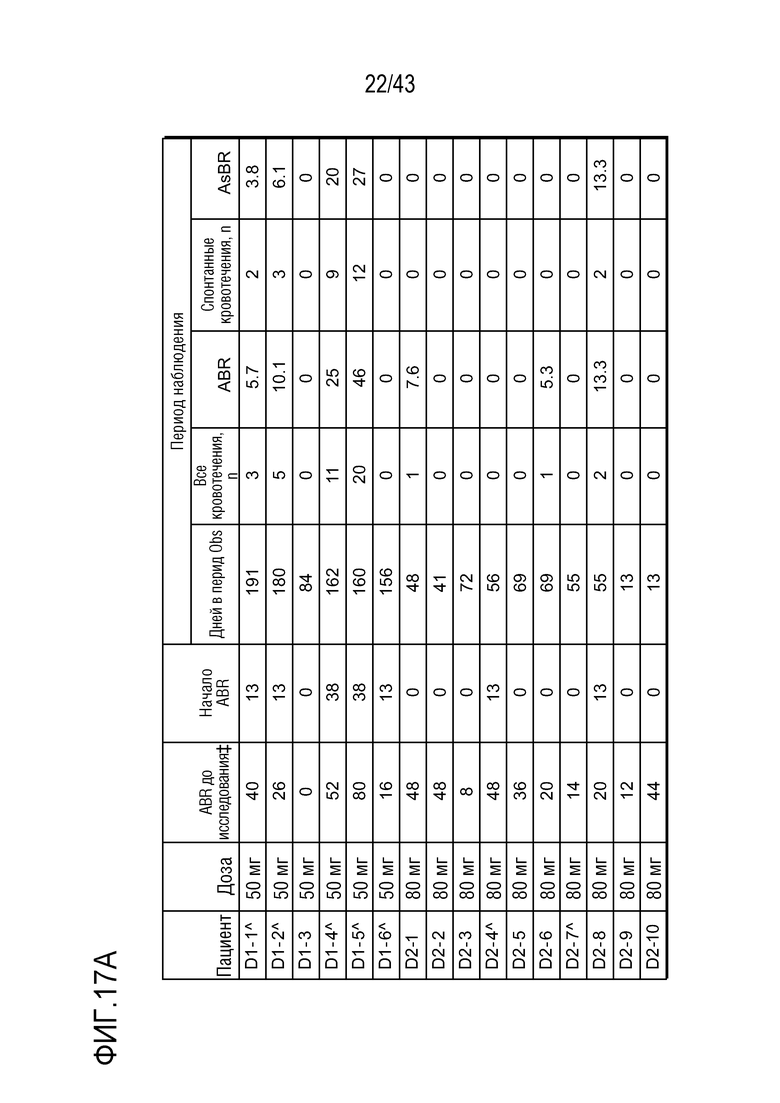
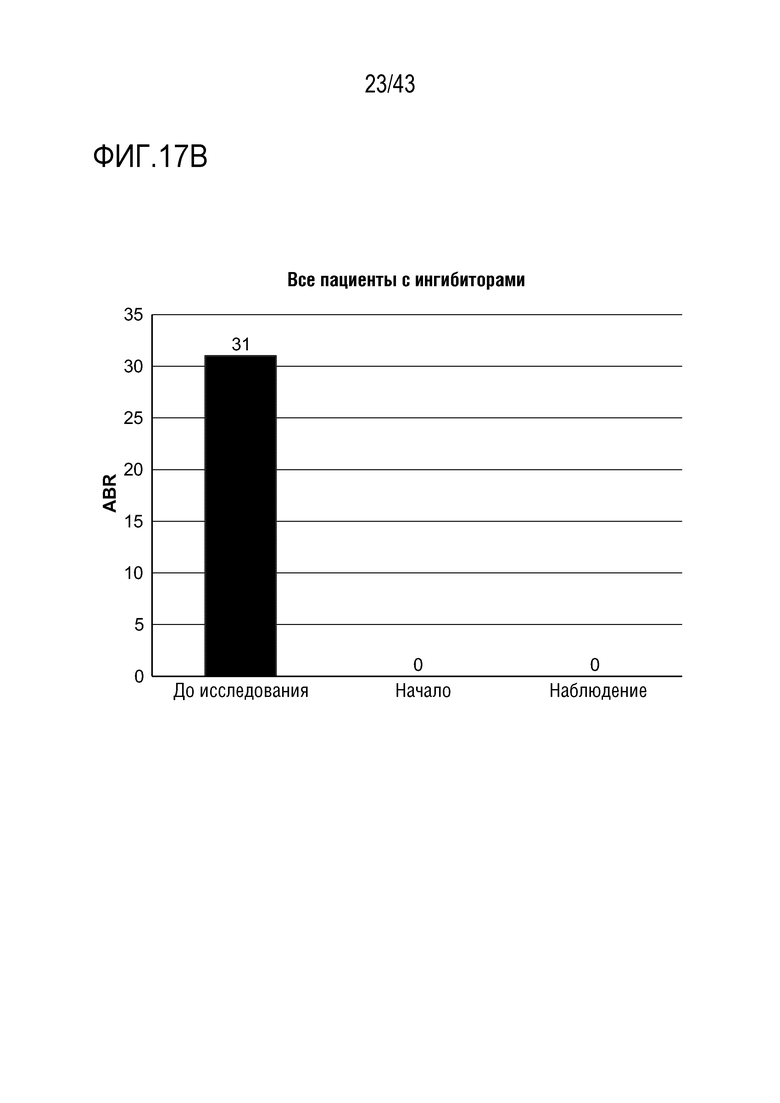
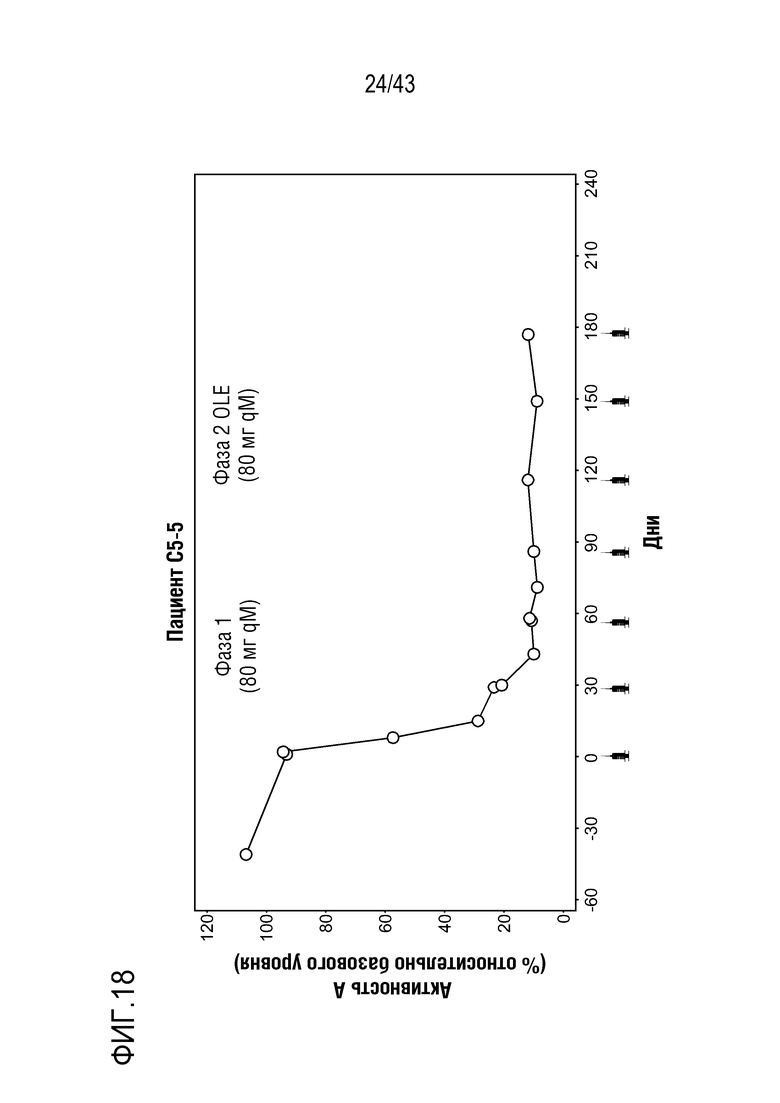
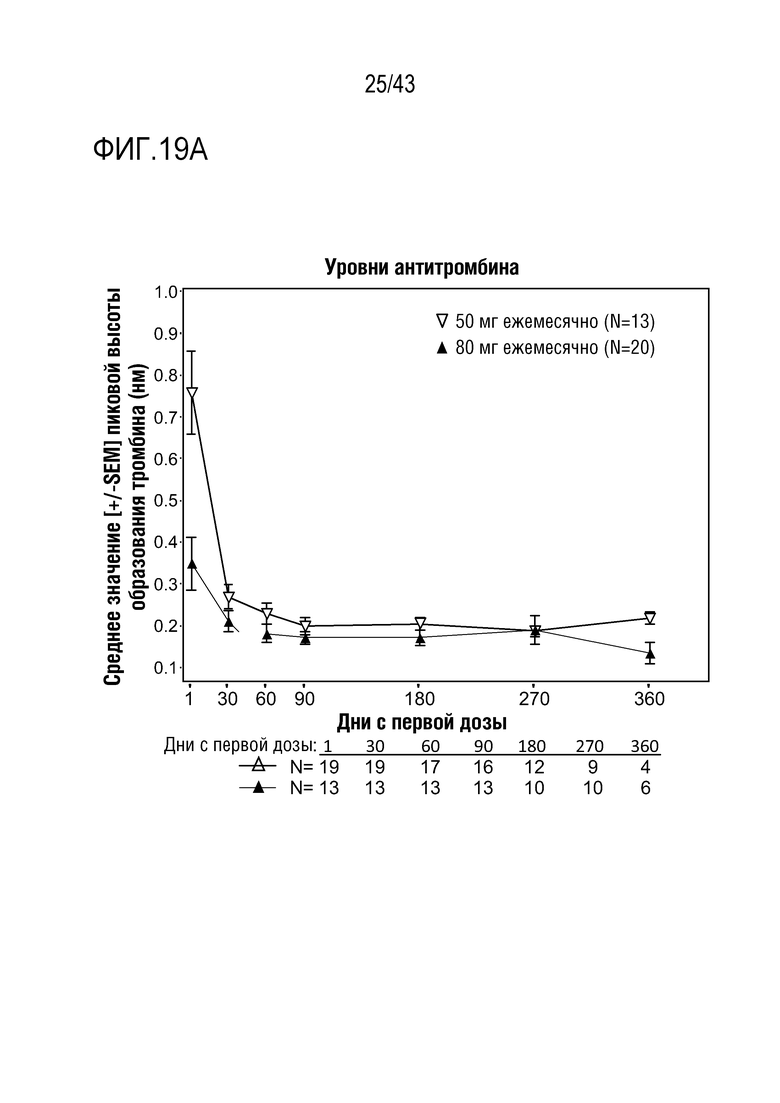
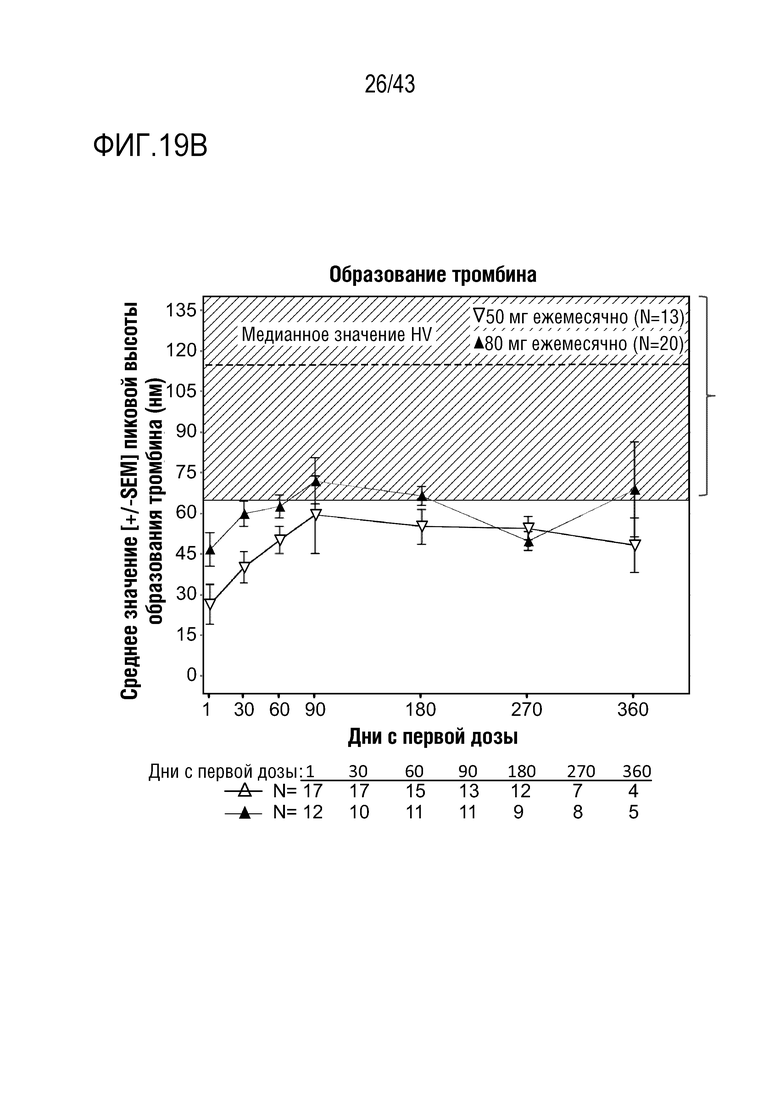
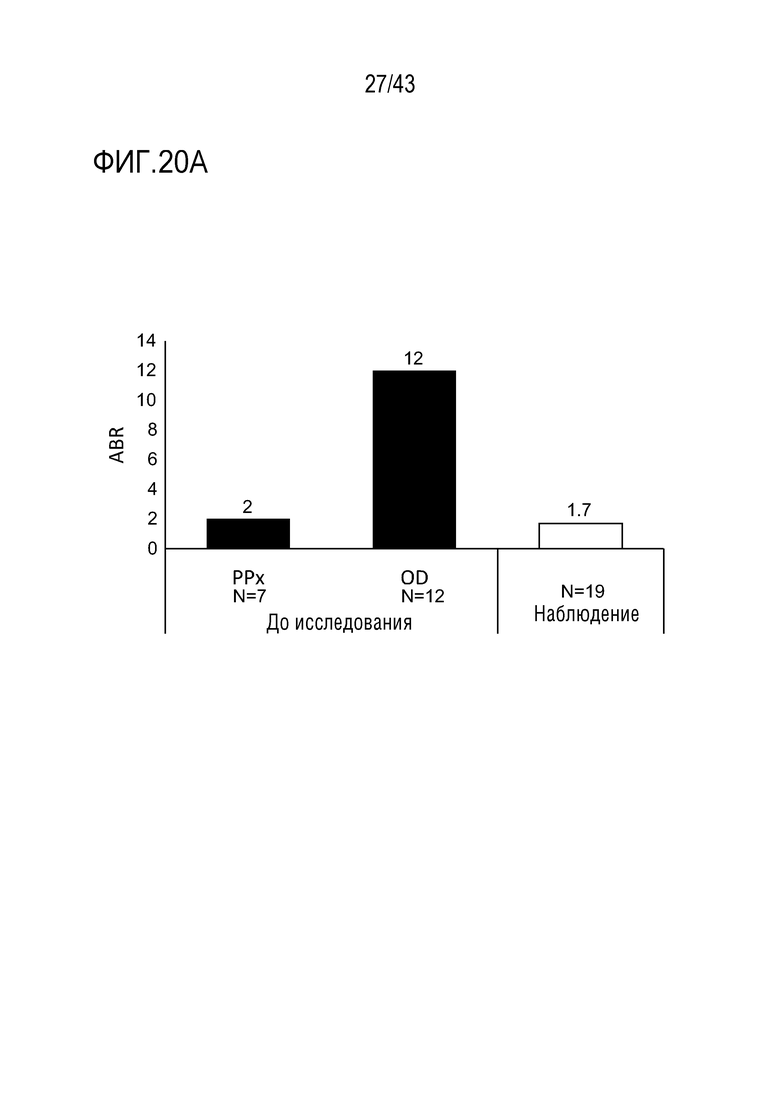
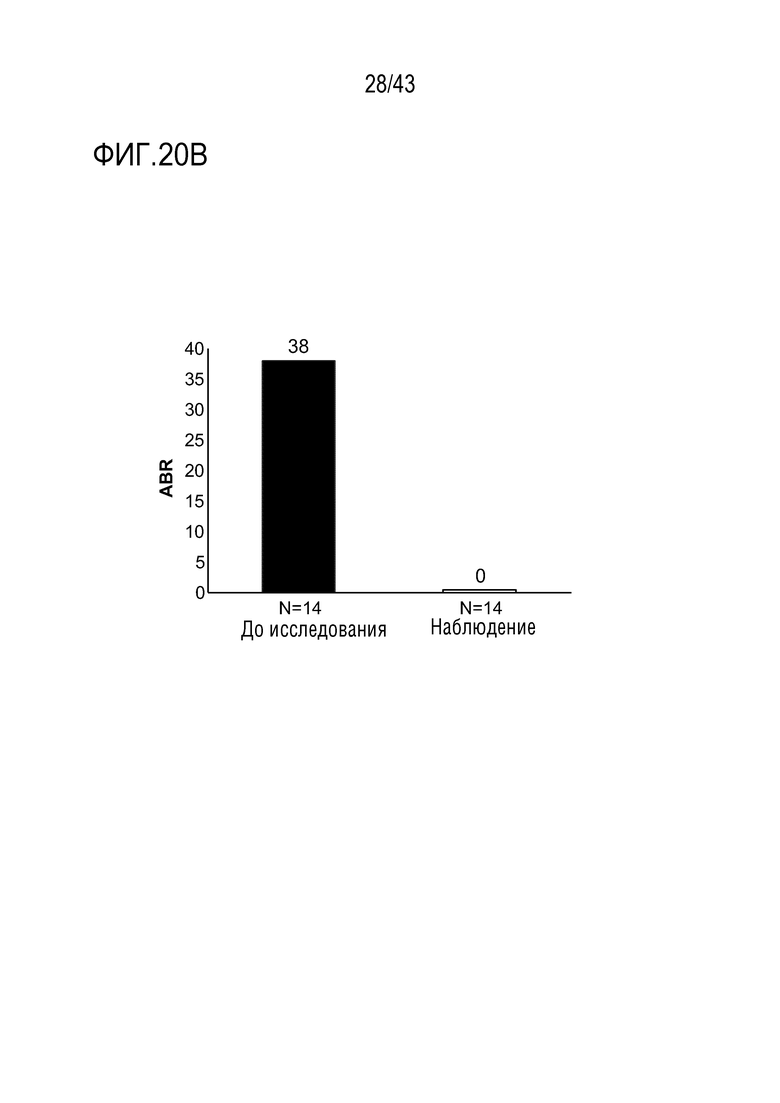
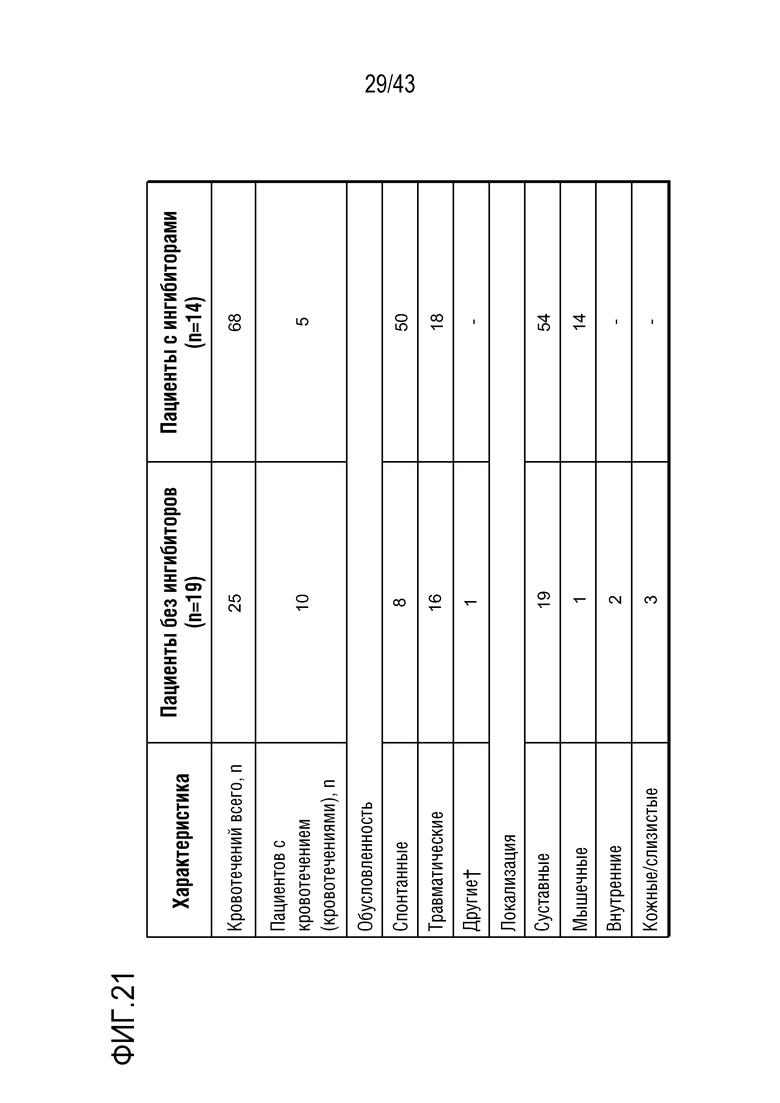
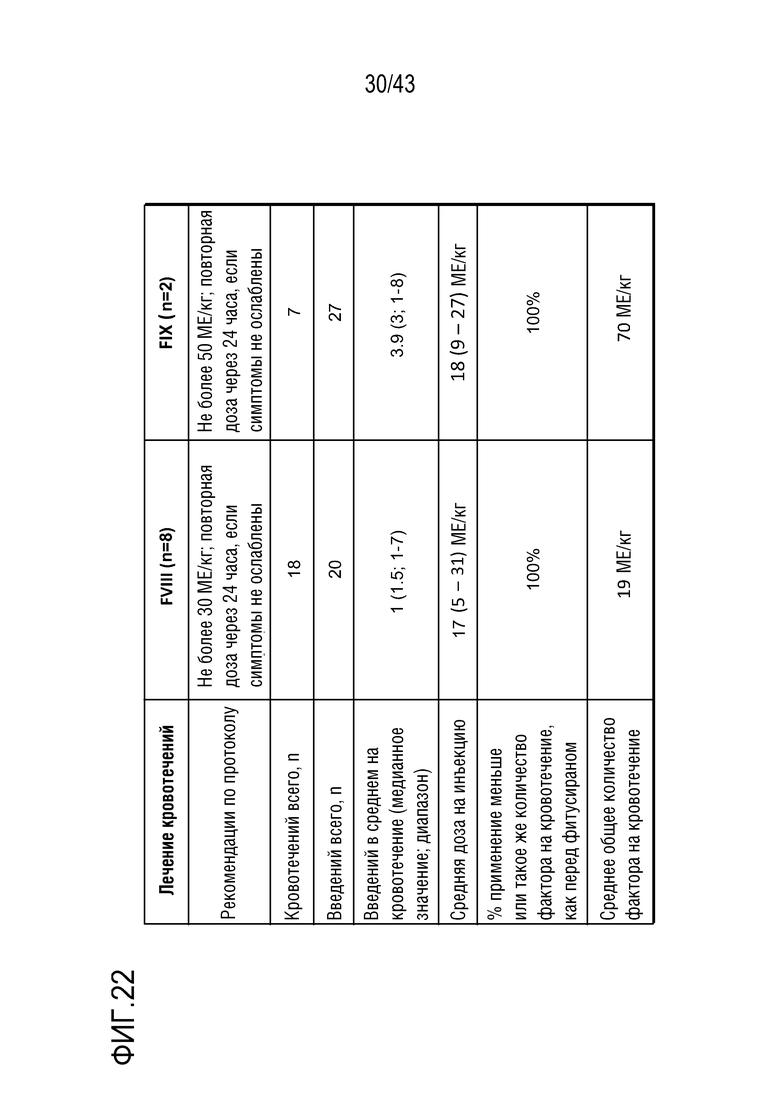
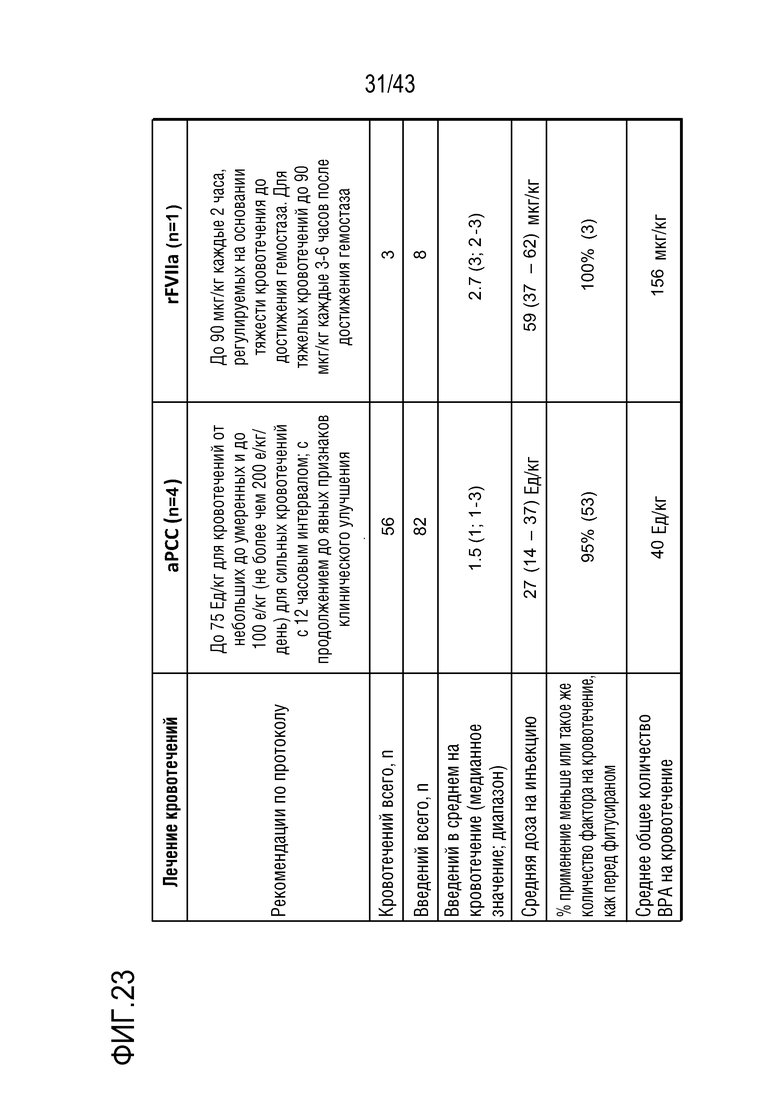
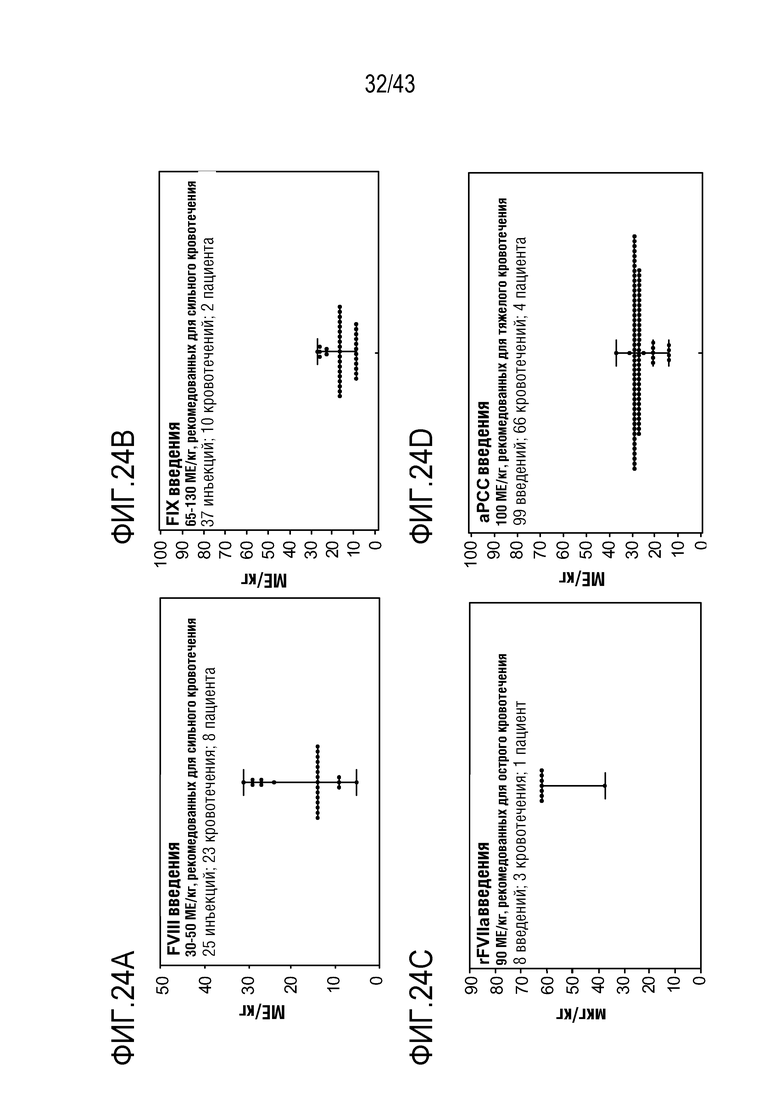
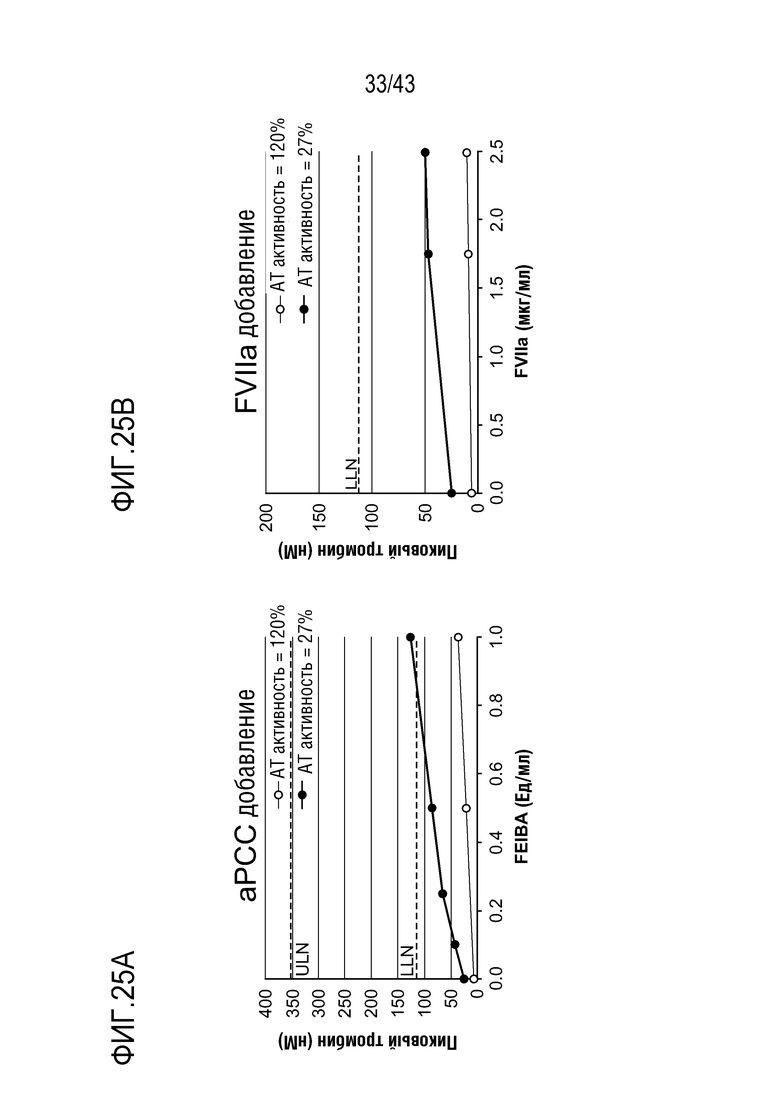
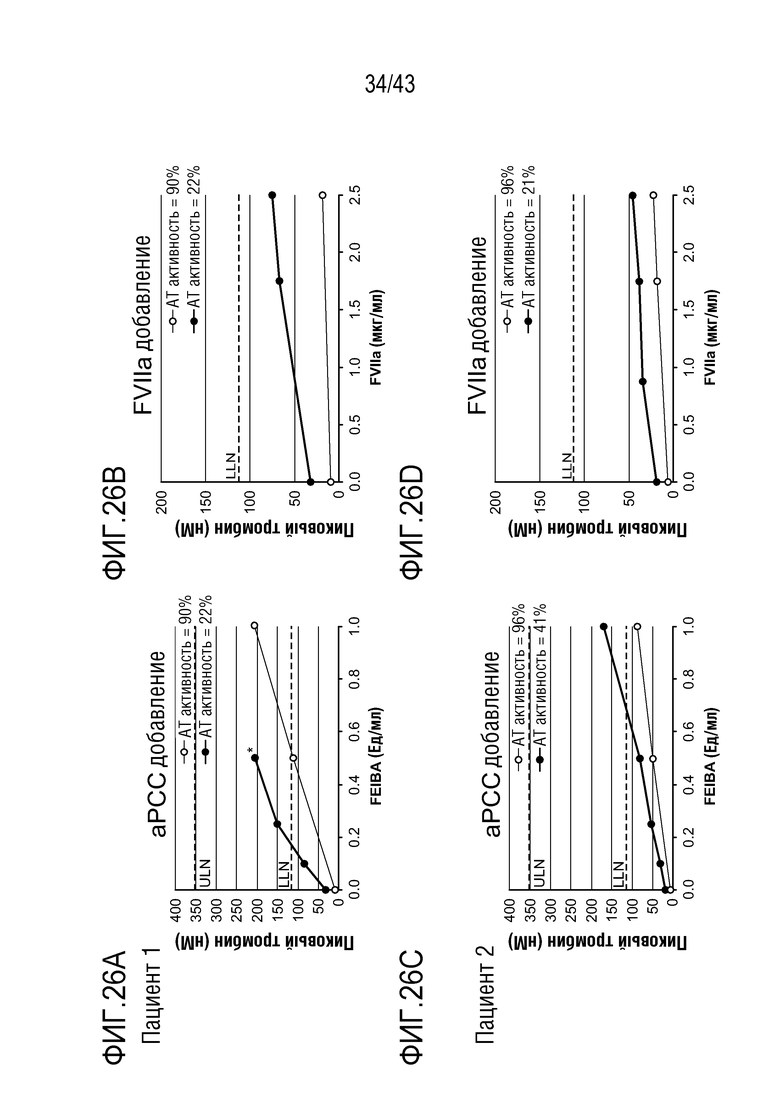
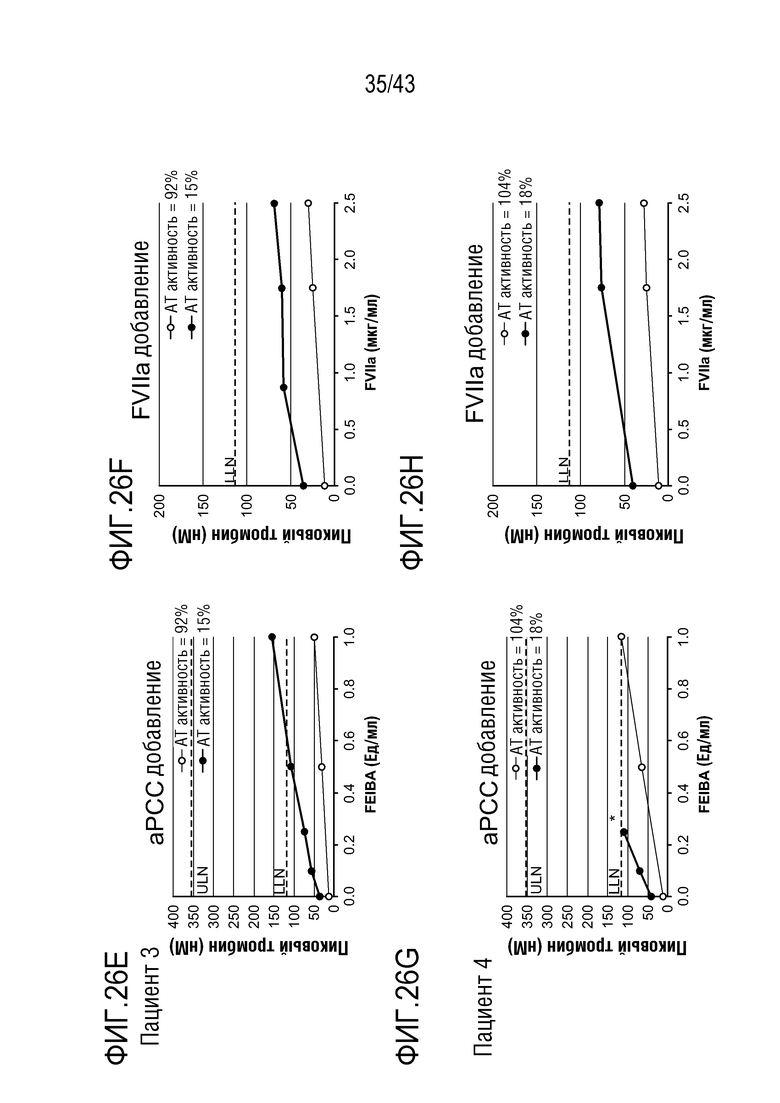
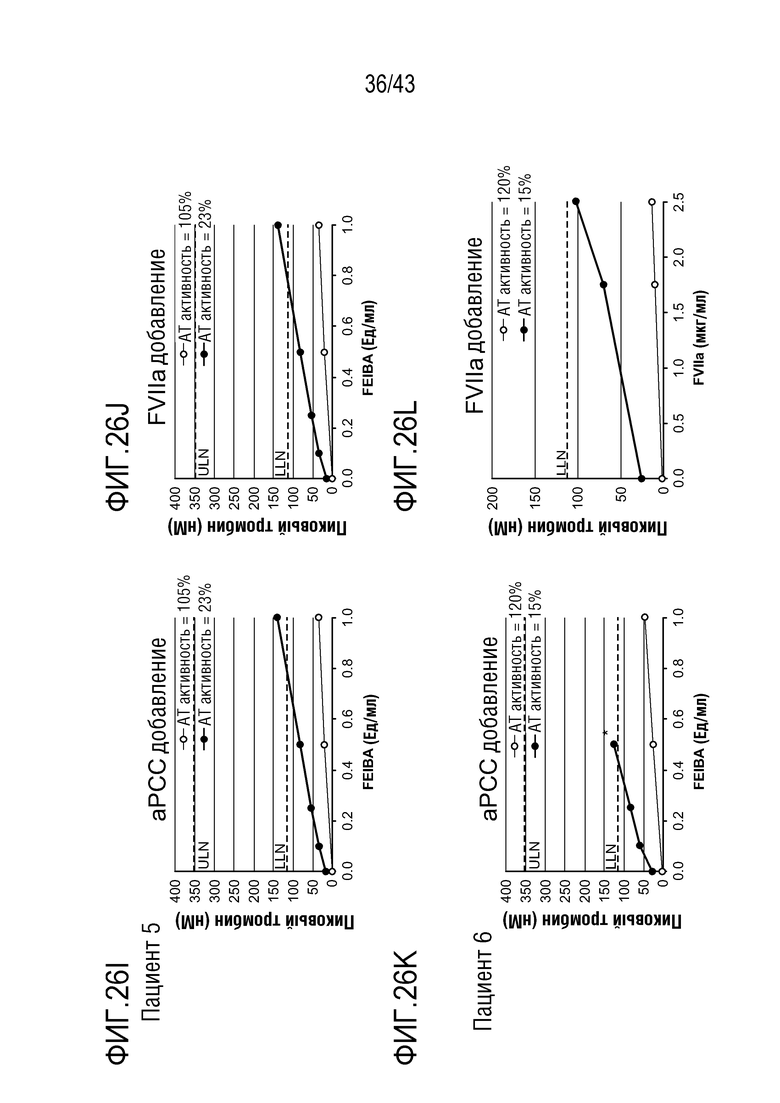
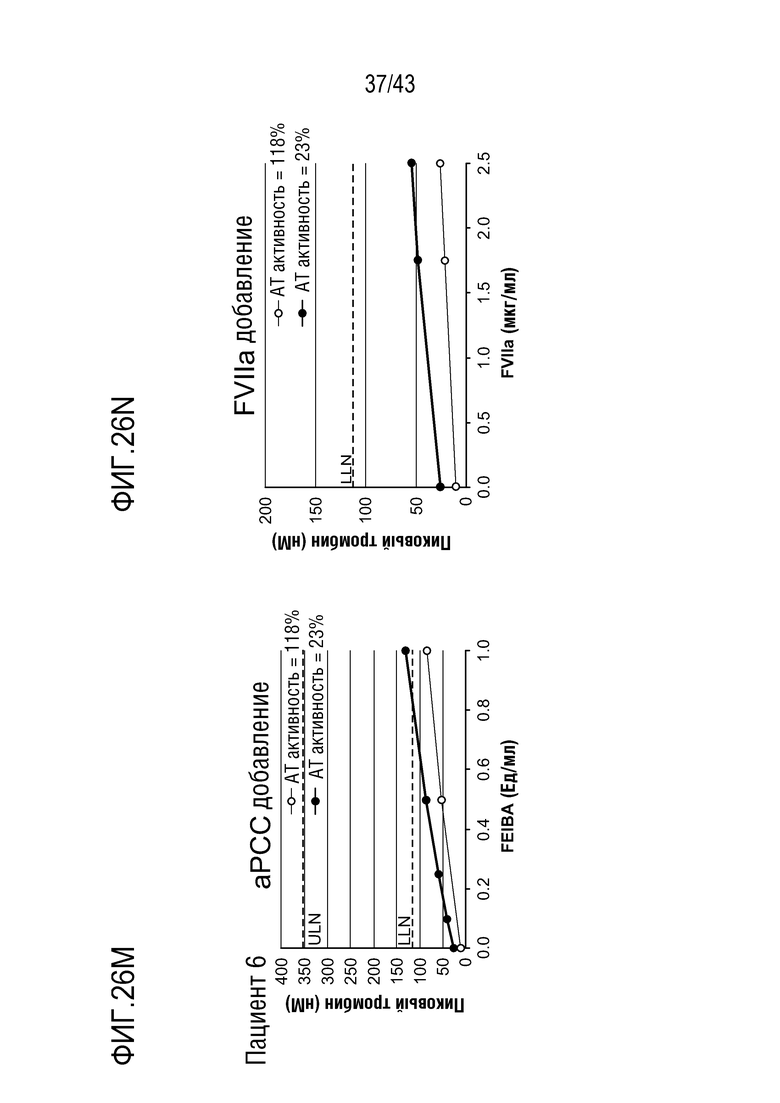
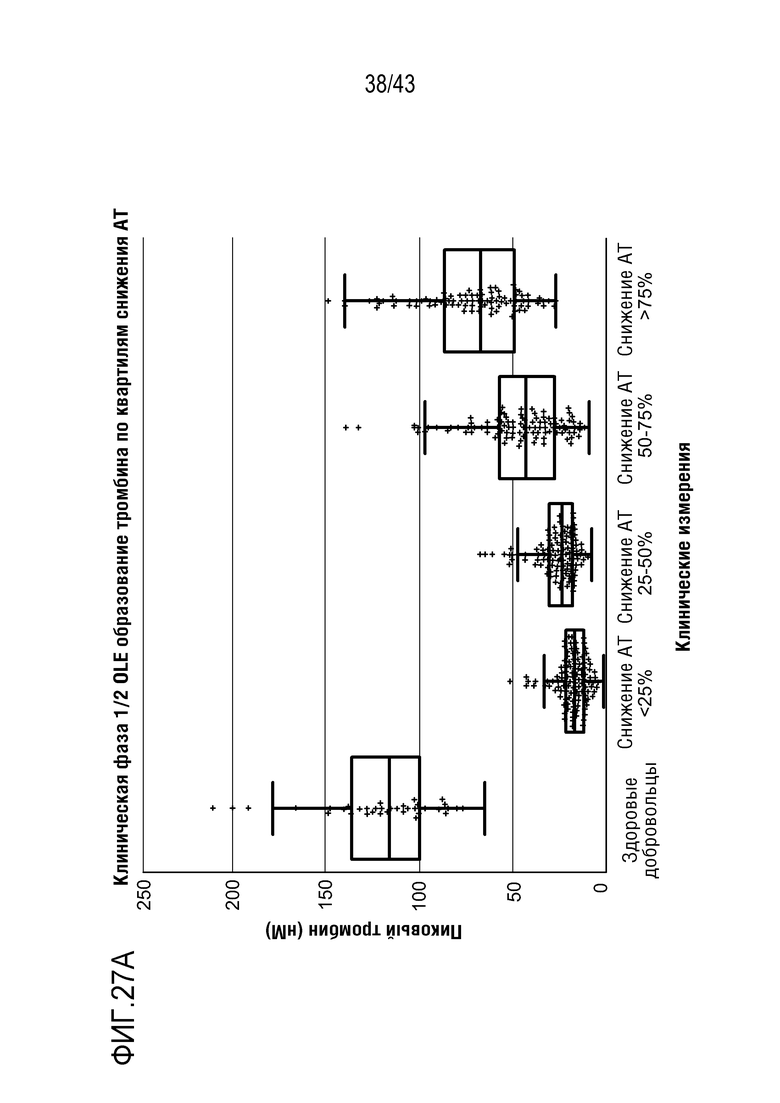
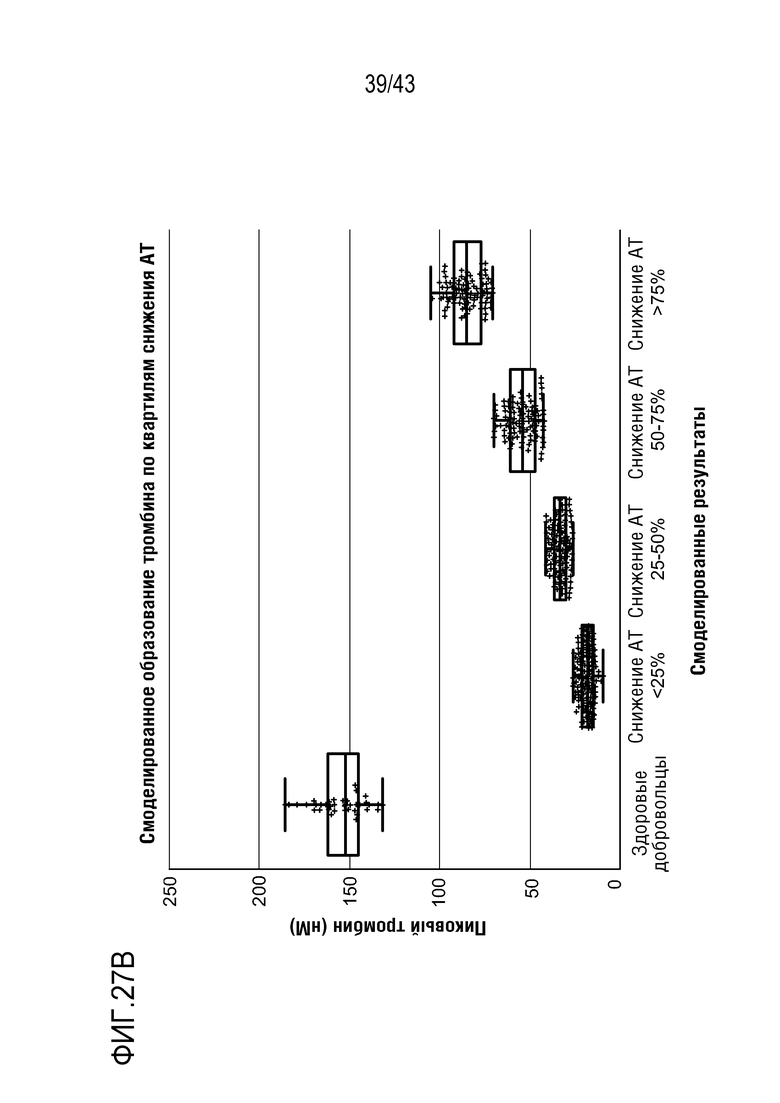
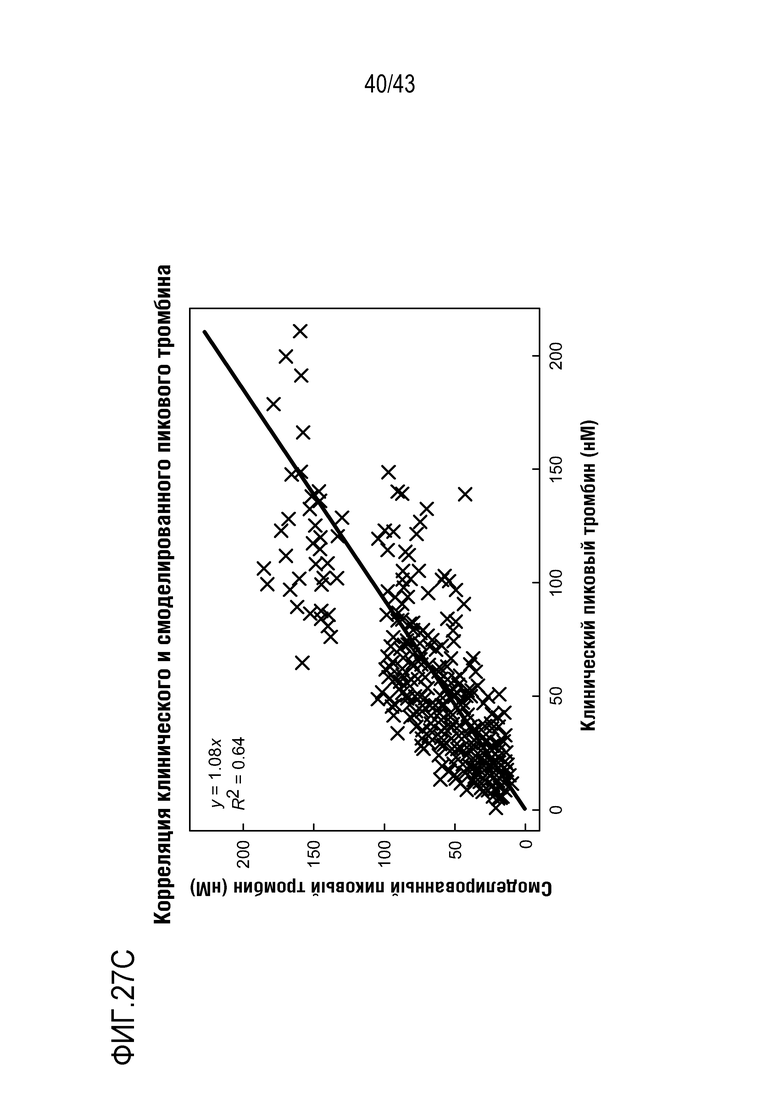
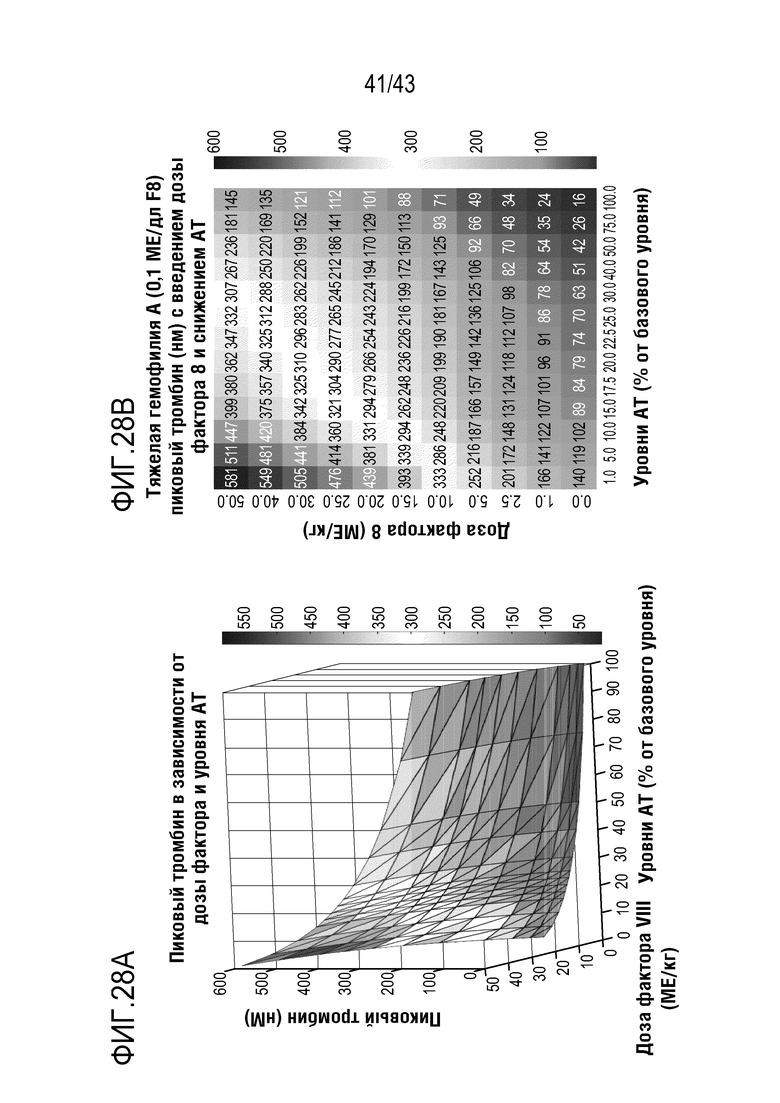
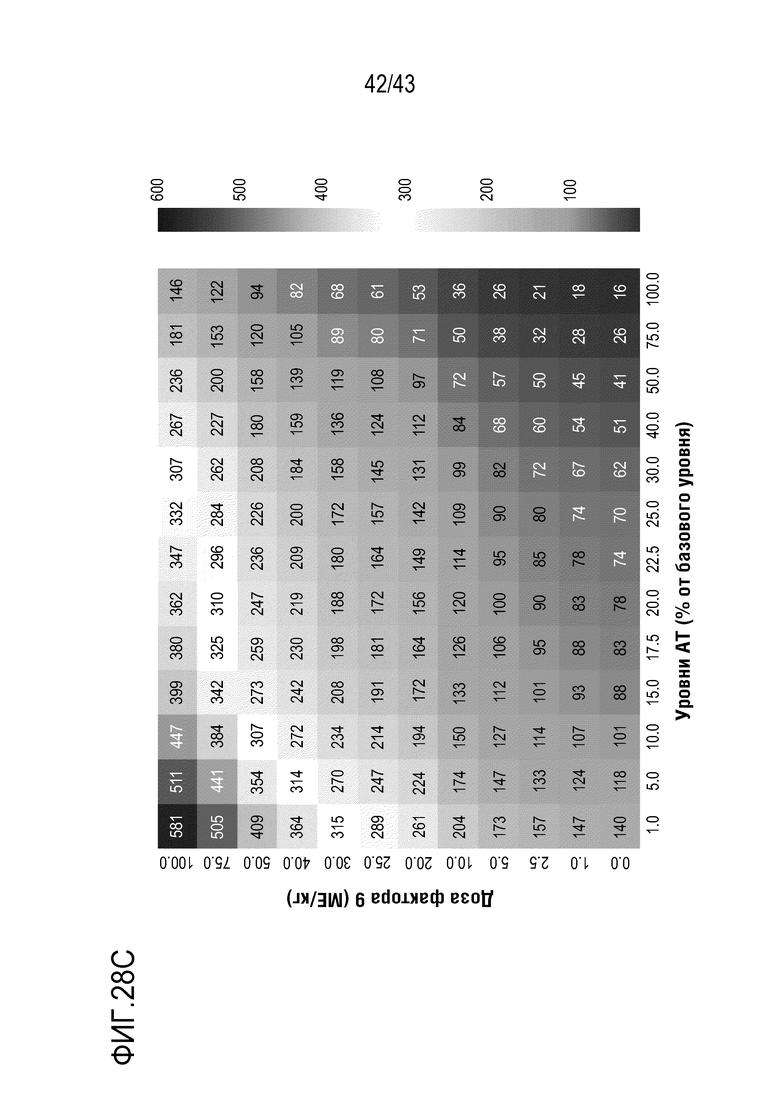
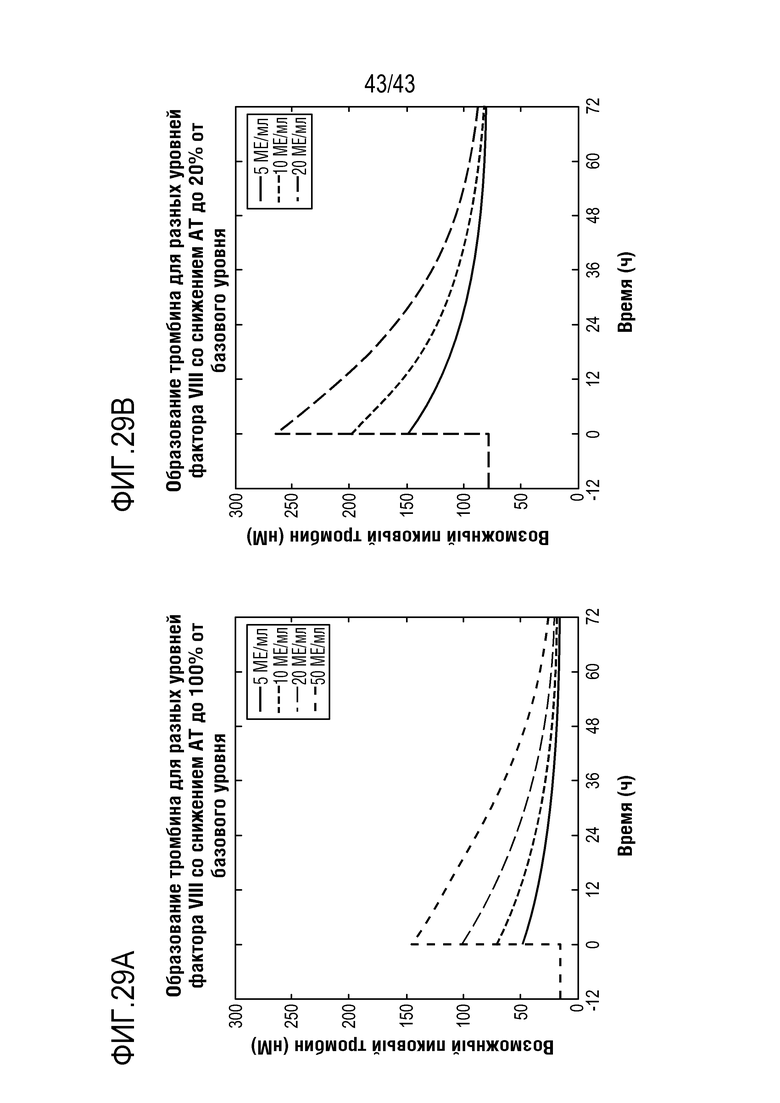
Группа изобретений относится к области медицины, а именно к гематологии и наследственным заболеваниям, и предназначена для профилактического лечения больных гемофилией. Описан способ лечения эпизода кровотечения у больного гемофилией A или B человека с ингибиторами, который проходит рутинную профилактику гемофилии с помощью молекулы двухцепочечной рибонуклеиновой кислоты (дцРНК), где молекула дцРНК содержит смысловую нить и антисмысловую нить; где смысловая нить содержит нуклеотидную последовательность 5'-GfsgsUfuAfaCfaCfCfAfuUfuAfcUfuCfaAf-3' (SEQ ID NO: 13) и антисмысловая нить содержит нуклеотидную последовательность 5'-usUfsgAfaGfuAfaAfuggUfgUfuAfaCfcsasg-3' (SEQ ID NO: 14), где a, c, g и u представляют собой 2'-O-метил (2'-OMe) A, C, G и U соответственно; Af, Cf, Gf и Uf представляют собой 2’-фтор A, C, G и U соответственно; и s представляет собой фосфоротиоатную связь; и где лиганд конъюгирован с 3’-концом смысловой нити, как показано на следующей схеме:
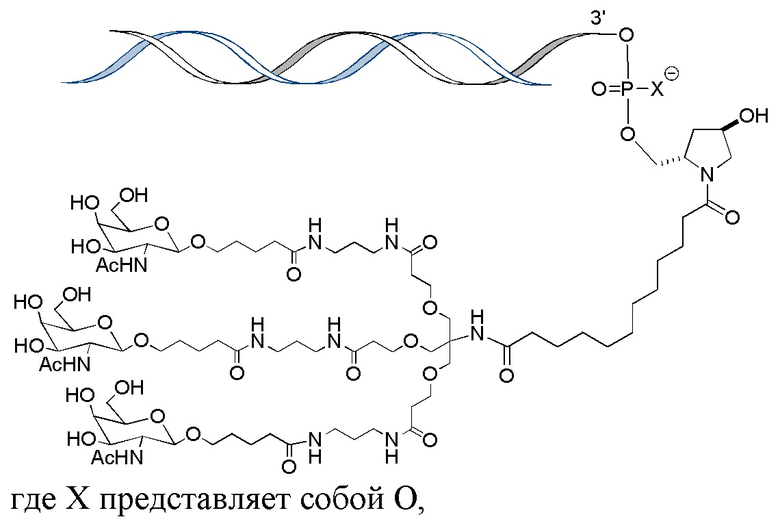
причем способ включает стадию введения пациенту, нуждающемуся в этом, терапевтически эффективного количества концентрата активированного протромбинового комплекса (aPCC), причем терапевтически эффективное количество aPCC - не более чем приблизительно 50 Е/кг на дозу. Кроме того, описаны альтернативные варианты способов профилактического лечения больного гемофилией A или гемофилией В с ингибиторами. Группа изобретений обеспечивает повышение эффективности профилактического лечения больных гемофилией. 9 н. и 27 з.п. ф-лы, 29 ил., 5 табл., 6 пр.
1. Способ лечения эпизода кровотечения у больного гемофилией A или B человека с ингибиторами, который проходит рутинную профилактику гемофилии с помощью молекулы двухцепочечной рибонуклеиновой кислоты (дцРНК),
где молекула дцРНК содержит смысловую нить и антисмысловую нить;
где смысловая нить содержит нуклеотидную последовательность 5'-GfsgsUfuAfaCfaCfCfAfuUfuAfcUfuCfaAf-3' (SEQ ID NO: 13) и антисмысловая нить содержит нуклеотидную последовательность 5'-usUfsgAfaGfuAfaAfuggUfgUfuAfaCfcsasg-3' (SEQ ID NO: 14), где a, c, g и u представляют собой 2'-O-метил (2'-OMe) A, C, G и U соответственно; Af, Cf, Gf и Uf представляют собой 2’-фтор A, C, G и U соответственно; и s представляет собой фосфоротиоатную связь; и
где лиганд конъюгирован с 3’-концом смысловой нити, как показано на следующей схеме:
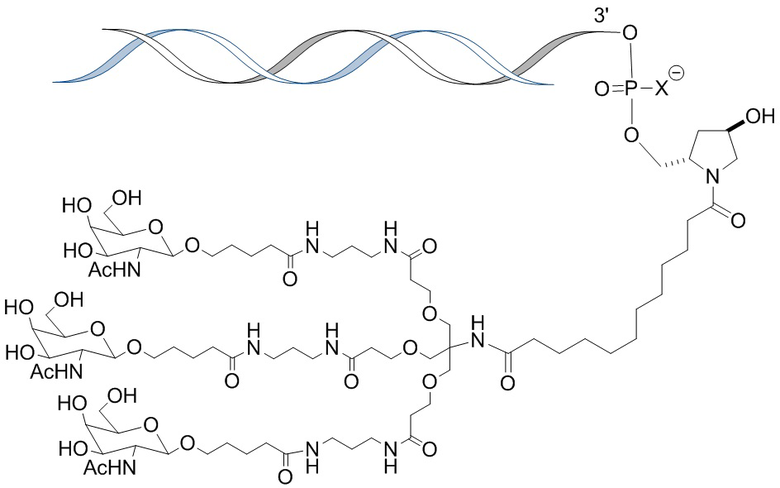 ,
,
где Х представляет собой О,
причем способ включает стадию введения пациенту, нуждающемуся в этом, терапевтически эффективного количества концентрата активированного протромбинового комплекса (aPCC), причем терапевтически эффективное количество aPCC - не более чем приблизительно 50 Е/кг на дозу.
2. Способ лечения эпизода кровотечения у больного гемофилией А или В с ингибиторами, который проходит рутинную профилактику гемофилии с помощью молекулы двухцепочечной рибонуклеиновой кислоты (дцРНК),
где молекула дцРНК содержит смысловую нить и антисмысловую нить;
где смысловая нить содержит нуклеотидную последовательность 5'-GfsgsUfuAfaCfaCfCfAfuUfuAfcUfuCfaAf-3' (SEQ ID NO: 13) и антисмысловая нить содержит нуклеотидную последовательность 5'-usUfsgAfaGfuAfaAfuggUfgUfuAfaCfcsasg-3' (SEQ ID NO: 14), где a, c, g и u представляют собой 2'-O-метил (2'-OMe) A, C, G и U соответственно; Af, Cf, Gf и Uf представляют собой 2’-фтор A, C, G и U соответственно; и s представляет собой фосфоротиоатную связь; и
где лиганд конъюгирован с 3’-концом смысловой нити, как показано на следующей схеме:
 ,
,
где Х представляет собой О,
причем способ включает стадию введения пациенту, нуждающемуся в этом, терапевтически эффективного количества концентрата активированного протромбинового комплекса (aPCC), причем терапевтически эффективное количество aPCC составляет приблизительно 30 Е/кг на дозу.
3. Способ по п.1, где терапевтически эффективное количество aPCC составляет приблизительно 10 Е/кг на дозу.
4. Способ по любому из пп.1-3, в котором введение aPCC повторяют, если необходимо, не менее чем через приблизительно 24 часа.
5. Способ по п.4, в той мере, в какой он зависит от п.1, где терапевтически эффективное количество aPCC составляет приблизительно 50 Е/кг на дозу.
6. Способ по п.1, где терапевтически эффективное количество aPCC составляет не более чем приблизительно 50 Е/кг на 24 часа.
7. Способ лечения эпизода кровотечения у больного гемофилией А или В с ингибиторами, который проходит рутинную профилактику гемофилии с помощью молекулы двухцепочечной рибонуклеиновой кислоты (дцРНК),
где молекула дцРНК содержит смысловую нить и антисмысловую нить;
где смысловая нить содержит нуклеотидную последовательность 5'-GfsgsUfuAfaCfaCfCfAfuUfuAfcUfuCfaAf-3' (SEQ ID NO: 13) и антисмысловая нить содержит нуклеотидную последовательность 5'-usUfsgAfaGfuAfaAfuggUfgUfuAfaCfcsasg-3' (SEQ ID NO: 14), где a, c, g и u представляют собой 2'-O-метил (2'-OMe) A, C, G и U соответственно; Af, Cf, Gf и Uf представляют собой 2’-фтор A, C, G и U соответственно; и s представляет собой фосфоротиоатную связь; и
где лиганд конъюгирован с 3’-концом смысловой нити, как показано на следующей схеме:
 ,
,
где Х представляет собой О,
причем способ включает стадию введения пациенту, нуждающемуся в этом, терапевтически эффективного количества рекомбинантного фактора VIIa (rFVIIa), где терапевтически эффективное количество rFVIIa составляет не более чем приблизительно 45 мкг/кг.
8. Способ лечения эпизода кровотечения у больного гемофилией А или В с ингибиторами, который проходит рутинную профилактику гемофилии с помощью молекулы двухцепочечной рибонуклеиновой кислоты (дцРНК),
где молекула дцРНК содержит смысловую нить и антисмысловую нить;
где смысловая нить содержит нуклеотидную последовательность 5'-GfsgsUfuAfaCfaCfCfAfuUfuAfcUfuCfaAf-3' (SEQ ID NO: 13) и антисмысловая нить содержит нуклеотидную последовательность 5'-usUfsgAfaGfuAfaAfuggUfgUfuAfaCfcsasg-3' (SEQ ID NO: 14), где a, c, g и u представляют собой 2'-O-метил (2'-OMe) A, C, G и U соответственно; Af, Cf, Gf и Uf представляют собой 2’-фтор A, C, G и U соответственно; и s представляет собой фосфоротиоатную связь; и
где лиганд конъюгирован с 3’-концом смысловой нити, как показано на следующей схеме:
 ,
,
где Х представляет собой О,
причем способ включает стадию введения пациенту, нуждающемуся в этом, терапевтически эффективного количества рекомбинантного фактора VIIa (rFVIIa), где терапевтически эффективное количество rFVIIa составляет приблизительно 45 мкг/кг.
9. Способ по п. 7, где терапевтически эффективная доза rFVIIa составляет приблизительно 10 мкг/кг на дозу.
10. Способ по любому из пп.7-9, в котором введение rFVIIa повторяют, если необходимо, не менее чем через приблизительно 2 часа.
11. Способ по п. 7, где терапевтически эффективное количество rFVIIa составляет не более чем приблизительно 45 мкг/кг на 2 часа.
12. Способ по любому из пп.1-11, в котором нуклеотидная последовательность смысловой нити представляет собой 5'-GfsgsUfuAfaCfaCfCfAfuUfuAfcUfuCfaAf-3' (SEQ ID NO: 13) и нуклеотидная последовательность антисмысловой нити представляет собой 5'-usUfsgAfaGfuAfaAfuggUfgUfuAfaCfcsasg-3' (SEQ ID NO: 14).
13. Способ по любому из пп. 1-12, где рутинная профилактика включает введение дозы молекулы дцРНК от приблизительно 30 мг до приблизительное 90 мг путем подкожной инъекции с интервалом приблизительно один раз в месяц или приблизительно один раз в два месяца.
14. Способ по любому из пп.1-12, где рутинная профилактика включает введение дозы молекулы дцРНК приблизительно 50 мг путем подкожной инъекции с интервалом приблизительно один раз в месяц или приблизительно один раз в два месяца.
15. Способ по любому из пп.1-12, где рутинная профилактика включает введение дозы молекулы дцРНК приблизительно 80 мг путем подкожной инъекции с интервалом приблизительно один раз в месяц или приблизительно один раз в два месяца.
16. Способ лечения эпизода кровотечения у больного гемофилией А или В с ингибиторами, который проходит рутинную профилактику гемофилии с помощью молекулы двухцепочечной рибонуклеиновой кислоты (дцРНК),
где молекула дцРНК содержит смысловую нить и антисмысловую нить;
где смысловая нить содержит нуклеотидную последовательность 5'-GfsgsUfuAfaCfaCfCfAfuUfuAfcUfuCfaAf-3' (SEQ ID NO: 13) и антисмысловая нить содержит нуклеотидную последовательность 5'-usUfsgAfaGfuAfaAfuggUfgUfuAfaCfcsasg-3' (SEQ ID NO: 14), где a, c, g и u представляют собой 2'-O-метил (2'-OMe) A, C, G и U соответственно; Af, Cf, Gf и Uf представляют собой 2’-фтор A, C, G и U соответственно; и s представляет собой фосфоротиоатную связь; и
где лиганд конъюгирован с 3’-концом смысловой нити, как показано на следующей схеме:
 ,
,
где Х представляет собой О,
причем способ включает стадию введения пациенту, нуждающемуся в этом, терапевтически эффективного количества активированного протромбинового комплекса (aPCC), причем терапевтически эффективное количество aPCC составляет не более чем приблизительно 50 Е/кг на дозу.
17. Способ лечения эпизода кровотечения у больного гемофилией А или В с ингибиторами, который проходит рутинную профилактику гемофилии с помощью молекулы двухцепочечной рибонуклеиновой кислоты (дцРНК),
где молекула дцРНК содержит смысловую нить и антисмысловую нить;
где смысловая нить содержит нуклеотидную последовательность 5'-GfsgsUfuAfaCfaCfCfAfuUfuAfcUfuCfaAf-3' (SEQ ID NO: 13) и антисмысловая нить содержит нуклеотидную последовательность 5'-usUfsgAfaGfuAfaAfuggUfgUfuAfaCfcsasg-3' (SEQ ID NO: 14), где a, c, g и u представляют собой 2'-O-метил (2'-OMe) A, C, G и U соответственно; Af, Cf, Gf и Uf представляют собой 2’-фтор A, C, G и U соответственно; и s представляет собой фосфоротиоатную связь; и
где лиганд конъюгирован с 3’-концом смысловой нити, как показано на следующей схеме:
 ,
,
где Х представляет собой О,
причем способ включает стадию введения пациенту, нуждающемуся в этом, терапевтически эффективного количества активированного протромбинового комплекса (aPCC), причем терапевтически эффективное количество aPCC составляет приблизительно 50 Е/кг на дозу.
18. Способ лечения эпизода кровотечения у больного гемофилией А или В с ингибиторами, который проходит рутинную профилактику гемофилии с помощью молекулы двухцепочечной рибонуклеиновой кислоты (дцРНК),
где молекула дцРНК содержит смысловую нить и антисмысловую нить;
где смысловая нить содержит нуклеотидную последовательность 5'-GfsgsUfuAfaCfaCfCfAfuUfuAfcUfuCfaAf-3' (SEQ ID NO: 13) и антисмысловая нить содержит нуклеотидную последовательность 5'-usUfsgAfaGfuAfaAfuggUfgUfuAfaCfcsasg-3' (SEQ ID NO: 14), где a, c, g и u представляют собой 2'-O-метил (2'-OMe) A, C, G и U соответственно; Af, Cf, Gf и Uf представляют собой 2’-фтор A, C, G и U соответственно; и s представляет собой фосфоротиоатную связь; и
где лиганд конъюгирован с 3’-концом смысловой нити, как показано на следующей схеме:
 ,
,
где Х представляет собой О,
причем способ включает стадию введения пациенту, нуждающемуся в этом, терапевтически эффективного количества активированного протромбинового комплекса (aPCC), причем терапевтически эффективное количество aPCC составляет приблизительно 30 Е/кг на дозу.
19. Способ по любому из пп. 16-18, дополнительно включающий повторение этапа введения не менее чем через 24 часа.
20. Способ лечения эпизода кровотечения у больного гемофилией A или B человека с ингибиторами, который проходит рутинную профилактику гемофилии с помощью молекулы двухцепочечной рибонуклеиновой кислоты (дцРНК),
где молекула дцРНК содержит смысловую нить и антисмысловую нить,
причем нуклеотидная последовательность смысловой нити представляет собой 5’-GfsgsUfuAfaCfaCfCfAfuUfuAfcUfuCfaAf-3’ (SEQ ID NO: 13), а нуклеотидная последовательность антисмысловой нити представляет собой 5’-usUfsgAfaGfuAfaAfuggUfgUfuAfaCfcsasg-3’ (SEQ ID NO: 14),
где a, c, g и u представляют собой 2′-O-метил (2′-OMe) A, C, G и U соответственно; Af, Cf, Gf и Uf представляют 2′-фтор A, C, G и U соответственно; и s представляет фосфоротиоатную связь; и
при этом 3’-конец смысловой нити конъюгирован с лигандом, как показано на следующей схеме:
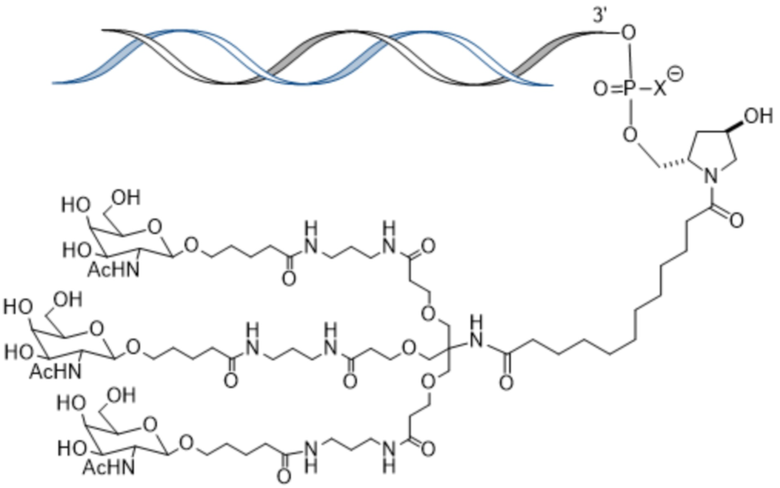 ,
,
где X представляет собой O;
причем способ включает стадию введения пациенту, нуждающемуся в этом, терапевтически эффективного количества рекомбинантного фактора VIIa (rFVIIa), где терапевтически эффективное количество rFVIIa составляет не более чем приблизительно 45 мкг/кг.
21. Способ лечения эпизода кровотечения у больного гемофилией A или B человека с ингибиторами, который проходит рутинную профилактику гемофилии с помощью молекулы двухцепочечной рибонуклеиновой кислоты (дцРНК),
где молекула дцРНК содержит смысловую нить и антисмысловую нить,
причем нуклеотидная последовательность смысловой нити представляет собой 5’-GfsgsUfuAfaCfaCfCfAfuUfuAfcUfuCfaAf-3’ (SEQ ID NO: 13), а нуклеотидная последовательность антисмысловой нити представляет собой 5’-usUfsgAfaGfuAfaAfuggUfgUfuAfaCfcsasg-3’ (SEQ ID NO: 14),
где a, c, g и u представляют собой 2′-O-метил (2′-OMe) A, C, G и U соответственно; Af, Cf, Gf и Uf представляют 2′-фтор A, C, G и U соответственно; и s представляет фосфоротиоатную связь; и
при этом 3’-конец смысловой нити конъюгирован с лигандом, как показано на следующей схеме:
 ,
,
где X представляет собой O; и
причем способ включает стадию введения пациенту, нуждающемуся в этом, терапевтически эффективного количества рекомбинантного фактора VIIa (rFVIIa), где терапевтически эффективное количество rFVIIa составляет приблизительно 45 мкг/кг.
22. Способ по п.20 или 21, дополнительно включающий повторение этапа введения не менее чем через 2 часа.
23. Способ по любому из пп. 1-22, в котором эпизод кровотечения не связан с хирургическим вмешательством.
24. Способ по любому из пп.1-23, в котором эпизод кровотечения является спонтанным.
25. Способ по любому из пп.1-23, в котором эпизод кровотечения возникает в результате травмы.
26. Способ по любому из пп. 1-22, в котором у больного существует риск эпизода кровотечения в результате хирургической операции и где больного лечат BPA в периоперационном периоде.
27. Способ по любому из пп.1-26, в котором эпизод кровотечения возникает в суставе, мышце, коже или слизистой оболочке или происходит внутри.
28. Способ по любому из пп.1-27, в котором молекулу дцРНК вводят больному в виде фармацевтической композиции.
29. Способ по п.28, в котором фармацевтическая композиция содержит забуференный фосфатом физиологический раствор (PBS).
30. Способ по любому из пп.1-29, дополнительно включающий измерение уровней тромбина у больного.
31. Способ по любому из пп.1-30, дополнительно включающий измерение уровней замещающего фактора или шунтирующего средства у больного.
32. Способ по любому из пп. 1-31, где больным является пациент с гемофилией А с ингибиторами.
33. Способ по любому из пп.1-31, где больным является пациент с гемофилией В с ингибиторами.
34. Способ по любому из пп.1-33, где эпизод кровотечения представляет собой небольшой эпизод кровотечения.
35. Способ по любому из пп.1-33, где эпизод кровотечения представляет собой эпизод умеренного кровотечения.
36. Способ по любому из пп.1-33, где эпизод кровотечения представляет собой эпизод сильного кровотечения.
| US 2017159053 A1, 08.06.2017 | |||
| PASI ET AL | |||
| Fitusiran, an Investigational RNAi Therapeutic Targeting Antithrombin for the Treatment of Hemophilia: Updated Results from a Phase 1 and Phase 1/2 Extension Study in Patients with Inhibitors | |||
| Blood Journal, 02.12.2016, vol.128(22), p | |||
| Терморегулятор | 1924 |
|
SU1397A1 |
| Устройство для мытья бутылок | 1930 |
|
SU25416A1 |
| RAGNI ET AL | |||
| Fitusiran, an | |||
Авторы
Даты
2023-08-04—Публикация
2018-07-10—Подача