РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка испрашивает приоритет, в соответствии с параграфом 119(e) Раздела 35 Свода законов США, предварительной заявки США № 62/181,550, поданной 18 июня 2015, содержание которой включено в настоящее описание посредством ссылки во всей своей полноте.
УРОВЕНЬ ТЕХНИКИ
Гомогенные растворы (например, водные растворы), содержащие терапевтический агент, например нейроактивный стероид, описанный в настоящем документе, обеспечивают возможность введения нуждающемуся человеку различными способами введения (например, пероральная, парентеральная (например, внутривенная, внутримышечная, подкожная) доставка). Нейроактивные стероиды, как правило, представляют собой высоко липофильные соединения с низкой собственной растворимостью в воде. В частности, для внутривенного введения растворы в большинстве случаев pH-стабильны или химически стабильны, предпочтительно в течение длительного периода времени.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В настоящем документе предоставлен фармацевтически приемлемый водный раствор, содержащий (например, состоящий по существу из, состоящий из) нейроактивный стероид (например, аллопрегнанолон), простой сульфобутиловый эфир бета-циклодекстрина и буфер; где раствор представляет собой стабильный раствор при pH от приблизительно 3 до приблизительно 9 (например, от приблизительно 5 до приблизительно 7, от приблизительно 5,5 до приблизительно 6,5) в течение по меньшей мере 1, 2, 3, 4 недель; 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 месяцев; 1, 2, 3 лет или более.
В некоторых вариантах осуществления раствор представляет собой стабильный раствор при pH от приблизительно 3 до приблизительно 9 (например, от приблизительно 5 до приблизительно 7, от приблизительно 5,5 до приблизительно 6,5) в течение по меньшей мере 1, 2, 3, 4 недель; 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 месяцев; 1, 2, 3 лет или более при температуре от приблизительно 2°C до приблизительно 8°C.
В некоторых вариантах осуществления раствор представляет собой стабильный раствор при pH от приблизительно 3 до приблизительно 9 (например, от приблизительно 5 до приблизительно 7, от приблизительно 5,5 до приблизительно 6,5) в течение по меньшей мере 1, 2, 3, 4 недель; 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 месяцев; 1, 2, 3 лет или более при температуре от приблизительно 0°C до приблизительно 45°C (например, от приблизительно 0°C до приблизительно 30°C, от приблизительно 15°C до приблизительно 25°C).
Также в настоящем документе предоставлен фармацевтически приемлемый водный раствор, содержащий (например, состоящий по существу из, состоящий из) нейроактивный стероид (например, аллопрегнанолон), сульфобутиловый эфир бета-циклодекстрина и буфер; где: буфер присутствует в концентрации по меньшей мере 0,1 мМ (например, по меньшей мере 0,5 мМ, 1 мМ, 2 мМ, 5 мМ или 10 мМ).
Также в настоящем документе предоставлен фармацевтически приемлемый водный раствор, содержащий (например, состоящий по существу из, состоящий из) нейроактивный стероид (например, аллопрегнанолон), простой сульфобутиловый эфир бета-циклодекстрина и буфер; где: раствор остается по существу не содержащим (например, соответствует требованиям нормативной документации продукта менее чем с 3, 2, 1, 0,5, 0,3, 0,2, 0,1% масс./масс.) примесей (например, раствором по существу не содержащим (например, соответствует требованиям нормативной документации продукта менее чем с 3, 2, 1, 0,5, 0,3, 0,2, 0,1% масс./масс.) примесей при комнатной температуре в течение по меньшей мере 1, 2, 3, 4 недель, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 месяцев, 1, 2, 3 лет или более). В некоторых вариантах осуществления раствор имеет чистоту по меньшей мере 97% в течение по меньшей мере 1, 2, 3, 4 недель; 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 месяцев; 1, 2, 3 лет или более). Например, раствор имеет найденное значение содержания основного вещества 90-110 в течение по меньшей мере 1, 2, 3, 4 недель; 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 месяцев; 1, 2, 3 лет или более).
В некоторых вариантах осуществления раствор остается по существу не содержащим (например, менее 3, 2, 1, 0,5, 0,3, 0,2, 0,1% масс./масс.) примесей в течение по меньшей мере 1, 2, 3, 4 недель; 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 месяцев; 1, 2, 3 лет или более при температуре от приблизительно 2°C до приблизительно 8°C.
В некоторых вариантах осуществления раствор остается по существу не содержащим (например, менее 3, 2, 1, 0,5, 0,3, 0,2, 0,1% масс./масс.) примесей в течение по меньшей мере 1, 2, 3, 4 недель; 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 месяцев; 1, 2, 3 лет или более при температуре от примерно 0°C до примерно 45°C (например, от приблизительно 0°C до приблизительно 30°C, от приблизительно 15°C до приблизительно 25°C).
В некоторых вариантах осуществления буфер в растворе присутствует в концентрации от приблизительно 5 до 10 мМ. В некоторых вариантах осуществления буфер в растворе присутствует в концентрации от приблизительно 0,1 до приблизительно 4 мМ. В некоторых вариантах осуществления буфер в растворе присутствует в концентрации приблизительно 0,1, приблизительно 0,5, приблизительно 1,67 или приблизительно 3,3 мМ.
В некоторых вариантах осуществления раствор дополнительно содержит разбавитель.
В некоторых вариантах осуществления раствор подходит для парентерального применения.
В некоторых вариантах осуществления раствор является гомогенным.
В некоторых вариантах осуществления нейроактивный стероид выбирают из прегнанолона, ганаксолона, альфадалона, альфаксалона и аллопрегнанолона. В некоторых вариантах осуществления нейроактивный стероид представляет собой ганаксолон. В некоторых вариантах осуществления нейроактивный стероид представляет собой аллопрегнанолон.
В некоторых вариантах осуществления нейроактивный стероид представляет собой эстрол.
В некоторых вариантах осуществления содержание нейроактивного стероида по результатам анализа уменьшается менее чем на 10% при хранении в течение 1, 2, 3, 4, 5, 6, 7 дней; 1, 2, 3, 4, 5, 6 месяцев или более, или 1, 2, 3 лет или более при комнатной температуре (например, 23 +/- 2°C).
В некоторых вариантах осуществления содержание нейроактивного стероида по результатам анализа уменьшается менее чем на 10% при хранении в течение 1, 2, 3, 4, 5, 6, 7 дней; 1, 2, 3, 4, 5, 6 месяцев или более, или 1, 2, 3 лет или более при температуре от приблизительно 2 до приблизительно 8°C.
В некоторых вариантах осуществления содержание нейроактивного стероида по результатам анализа уменьшается менее чем на 10% при хранении в течение по меньшей мере 10, 15, 20, 25, 30, 40, 45 минут или более при температуре от приблизительно 110 до приблизительно 130°C (например, от приблизительно 110 до приблизительно 125°C, например, 122 +/- 2°C).
В некоторых вариантах осуществления раствор имеет содержание основного вещества по результатам анализа 100 +/- 10%.
В некоторых вариантах осуществления раствор является химически стабильным. В некоторых вариантах осуществления раствор является физически стабильным. В некоторых вариантах осуществления раствор является pH-стабильным.
В некоторых вариантах осуществления раствор содержит менее 0,5, 0,4, 0,3, 0,2 или 0,1% масс./масс. продукта деградации нейроактивного стероида (например, аллопрегнанолона). В некоторых вариантах осуществления продукт деградации представляет собой продукт окисления нейроактивного стероида (например, продукт окисления аллопрегнанолона, 136). В некоторых вариантах осуществления продукт деградации представляет собой рацемат или эпимер нейроактивного стероида (например, эпимерный продукт аллопрегнанолона, 1269). В некоторых вариантах осуществления количество продукта деградации нейроактивного стероида (например, рацемата или эпимера, или продукта окисления нейроактивного стероида), присутствующего в растворе, является по существу одинаковым (например, соответствует требованиям нормативной документации продукта с +/- 0,1, 0,2, 0,5, 1, 2% масс./масс.) в течение 1, 2, 3, 4, 5, 6, 7 дней или более; 1, 2, 3, 4 недель или более; 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 месяцев или более; 1, 2, 3 лет или более. В некоторых вариантах осуществления количество продукта деградации нейроактивного стероида, присутствующего в растворе, составляет менее 0,1% масс./масс. в течение 1, 2, 3, 4, 5, 6, 7 дней или более; 1, 2, 3, 4 недель или более; 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 месяцев или более; 1, 2, 3 лет или более.
В некоторых вариантах осуществления pH раствора является по существу одинаковым (например, соответствует требованиям нормативной документации продукта, pH составляет +/- 1,2, 1, 0,8, 0,5, 0,3 или менее) в течение 1, 2, 3, 4, 5, 6, 7 дней или более; 1, 2, 3, 4 недель или более; 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 месяцев или более; 1, 2, 3 лет или более.
В некоторых вариантах осуществления pH раствора составляет от приблизительно 3 до приблизительно 9 (например, от приблизительно 5 до приблизительно 7, от приблизительно 5,5 до приблизительно 6,5) в течение 1, 2, 3, 4, 5, 6, 7 дней или более; 1, 2, 3, 4 недель или более; 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 месяцев или более; 1, 2, 3 лет или более.
В некоторых вариантах осуществления раствор находится при температуре от 3°C до 37°C. В некоторых вариантах осуществления раствор находится при температуре от 0°C до 45°C (например, от 0°C и 30°C, например, от 15°C до 25°C). В некоторых вариантах осуществления раствор находится при комнатной температуре (например, 25°C).
В некоторых вариантах осуществления буфер выбирают из кислого, основного или нейтрального буфера. В некоторых вариантах осуществления буфер выбирают из кислого или нейтрального буфера. В некоторых вариантах осуществления буфер имеет pKa от приблизительно 2 до приблизительно 9. В некоторых вариантах осуществления буфер содержит одноосновную кислоту. В некоторых вариантах осуществления буфер содержит многоосновную кислоту (например, цитрат). В некоторых вариантах осуществления буфер выбирают из группы, состоящей из цитрата, фосфата, ацетата, лактата, глюконата, малата, сукцината, Трис, гистидина и тартрата, и их смесей.
В некоторых вариантах осуществления буфер представляет собой цитратный буфер. В некоторых вариантах осуществления цитратный буфер имеет pH от приблизительно 3 до приблизительно 8 (например, от приблизительно 4,5 до приблизительно 7,0, от приблизительно 5,5 до приблизительно 6,5, от приблизительно 5,0 до приблизительно 6,0).
В некоторых вариантах осуществления буфер представляет собой фосфатный буфер. В некоторых вариантах осуществления фосфатный буфер имеет pH от приблизительно 1 до приблизительно 9 (например, от приблизительно 4,5 до приблизительно 7,0, от приблизительно 5,5 до приблизительно 6,5, от приблизительно 5,0 до приблизительно 6,0).
В некоторых вариантах осуществления буфер представляет собой раствор одного или нескольких веществ (например, соли слабой кислоты и слабого основания, смеси слабой кислоты и соли слабой кислоты с сильным основанием).
В некоторых вариантах осуществления буфер выбирают из 4-2-гидроксиэтил-1-пиперазинэтансульфоновой кислоты (HEPES), 2-{[трис(гидроксиметил)метил]амино}этансульфоновой кислоты (TES), 3-(N-морфолино)пропансульфоновой кислоты (MOPS), пиперазин-N,N'-бис(2-этансульфоновая кислота) (PIPES), диметиларсиновой кислоты (какодилат), цитрата (например, солевой раствор цитрата натрия), 2-(N-морфолино)этансульфоновой кислоты (MES), фосфата (например, PBS, D-PBS), сукцината (т.е. 2(R)-2-(метиламино)янтарной кислоты), ацетата, диметилглутарата, малеата, имидазола, N-(2-ацетамидо)-2-аминоэтансульфоновой кислоты (ACES), N,N-бис(2-гидроксиэтил)-2-аминоэтансульфоновой кислоты (BES), бицина, Бис-Трис, бората, N-циклогексил-3-аминопропансульфоновой кислоты (CAPS), глицина, 3-[4-(2-гидроксиэтил)-1-пиперазинил]пропансульфоновой кислоты (HEPPS или EPPS), N-[трис(гидроксиметил)метил]-3-аминопропансульфоновой кислоты, [(2-гидрокси-1,1-бис(гидроксиметил)этил)амино]-1-пропансульфоновой кислоты (TAPS), трицина, Трис, Трис-основания, Трис-буфера, Трис-глицина, Трис-HCl, коллидина, веронала ацетата, N-(2-ацетамидо)иминодиуксусной кислоты; N-(карбамоилметил)иминодиуксусной кислоты (ADA), β-гидрокси-4-морфолинпропансульфоновой кислоты, 3-морфолино-2-гидроксипропансульфоновой кислоты (MOPSO), холаминхлорида, 3-(N,N-бис[2-гидроксиэтил]амино)-2-гидроксипропансульфоновой кислоты (DIPSO), ацетамидоглицина, 3-{[1,3-дигидрокси-2-(гидроксиметил)-2-пропанил]амино}-2-гидрокси-1-пропансульфоновой кислоты (TAPSO), пиперазин-N,N-бис(2-гидроксипропансульфоновая кислота) (POPSO), N-(2-гидроксиэтил)пиперазин-N'-(2-гидроксипропансульфоновая кислота) (HEPPSO), N-циклогексил-2-аминоэтансульфоновой кислоты (CHES), 2-амино-метил-1,3-пропандиола (AMPd) и глицинамида. В некоторых вариантах осуществления буфер содержит пиперазин (например, PIPES, HEPES, POPSO, EPPS).
В некоторых вариантах осуществления буфер содержит соединение, образующее комплексы с неметаллом (например, MES, MOPS, PIPES).
В некоторых вариантах осуществления буфер имеет pH, подходящий для инъекций (например, безопасный, переносимый, не раздражающий).
В некоторых вариантах осуществления буфер находится в пределах своего диапазона эффективной буферной емкости.
В некоторых вариантах осуществления буфер представляет собой цитрат. В некоторых вариантах осуществления цитратный буфер присутствует в концентрации от приблизительно 1 до приблизительно 100 мМ или более. В некоторых вариантах осуществления цитратный буфер присутствует в концентрации 5, 10, 20, 50, 100 мМ или более.
В некоторых вариантах осуществления буфер представляет собой фосфат. В некоторых вариантах осуществления фосфатный буфер присутствует в концентрации от приблизительно 1 до приблизительно 100 мМ или более. В некоторых вариантах осуществления фосфатный буфер присутствует в концентрации 5, 10, 20, 50, 100 мМ или более.
В некоторых вариантах осуществления pH раствора составляет от приблизительно 3 до приблизительно 9 (например, предпочтительно от приблизительно 5 до приблизительно 9, от приблизительно 4,5 до приблизительно 7,0, от приблизительно 5,0 до приблизительно 6,5).
В некоторых вариантах осуществления нейроактивный стероид присутствует в количестве 0,1, 0,5, 1, 1,25, 2,5, 3,75, 5, 6,25, 7,5, 8, 9 или 10 мг/мл или более. В некоторых вариантах осуществления нейроактивный стероид объединен с 2,5, 5, 6, 7,5, 10, 15, 20, 30% масс./об. или более сульфобутилэфир-β-циклодекстрина.
В некоторых вариантах осуществления молярное отношение нейроактивного стероида к простому сульфоалкиловому эфиру-β-циклодекстрина составляет приблизительно 1:1, 1:2, 1:3, 1:4, 1:5, 1:6, 1:7, 1:8, 1:9, 1:10, 1:20: 1:30, 1:50, 1:75, 1:100, 1:120 или более. В некоторых вариантах осуществления молярное отношение нейроактивного стероида к сульфоалкилэфир-β-циклодекстрину составляет приблизительно 0,1, 0,05, 0,03, 0,02, 0,01, 0,008, 0,005 или менее. В некоторых вариантах осуществления нейроактивный стероид представляет собой аллопрегнанолон. В некоторых вариантах молярное отношение аллопрегнанолона к сульфоалкилэфир-β-циклодекстрину составляет приблизительно 1:1, 1:2, 1:3, 1:4, 1:5, 1:6, 1:7, 1:8, 1:9, 1:10, 1:20: 1:30, 1:50, 1:75. В некоторых вариантах осуществления молярное отношение аллопрегнанолона к сульфоалкилэфир-β-циклодекстрину составляет приблизительно 1:1, 1:2, 1:3, 1:4, 1:5, 1:6, 1:7, 1:8, 1:9, 1:10, 1:20. В некоторых вариантах осуществления молярное отношение аллопрегнанолона к сульфоалкилэфир-β-циклодекстрину составляет от приблизительно 1:1 до приблизительно 1:60 (например, от приблизительно 1:1 до приблизительно 1:20, от приблизительно 1:1 до приблизительно 1:15). В некоторых вариантах осуществления молярное отношение аллопрегнанолона к сульфоалкилэфир-β-циклодекстрину составляет от приблизительно 1:3 до приблизительно 1:20 (например, от приблизительно 1:5 до приблизительно 1:10). В некоторых вариантах осуществления раствор дополнительно содержит поверхностно-активное вещество.
В некоторых вариантах осуществления раствор дополнительно содержит хелатирующий агент.
В некоторых вариантах осуществления раствор дополнительно содержит консервант.
В некоторых вариантах осуществления раствор дополнительно содержит изотонирующее средство. В некоторых вариантах осуществления изотонизирующее средство присутствует в количестве для достижения изотоничности.
В некоторых вариантах осуществления раствор стерилизуют путем термообработки.
В одном аспекте в настоящем документе предоставлен фармацевтически приемлемый водный раствор, содержащий (например, состоящий по существу из, состоящий из) нейроактивный стероид, сульфобутиловый эфир бета-циклодекстрина и буфер; причем композиция содержит менее 3, 2, 1, 0,5, 0,3, 0,2, 0,1% масс./масс. примесей (например, раствор по существу не содержит (например, менее 3, 2, 1, 0,5, 0,3, 0,2, 0, 1% масс./масс.) примесей в течение по меньшей мере 1, 2, 3, 4 недель, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 месяцев, 1, 2, 3 лет или более).
В одном аспекте в настоящем документе предоставлен способ получения стабильного раствора, содержащего аллопрагнанолон, причем способ включает контактирование аллопрегнанолона с фармацевтически приемлемым водным раствором, содержащим (например, состоящим по существу из, состоящим из) сульфобутиловый эфир бета-циклодекстрина и буфер.
В некоторых вариантах осуществления раствор находится при температуре от приблизительно 0°C до приблизительно 60°C (например, от приблизительно 20°C до приблизительно 50°C, от приблизительно 35°C до приблизительно 45°C). В некоторых вариантах осуществления раствор находится при комнатной температуре (например, 35-45°C).
В некоторых вариантах осуществления раствор является химически стабильным.
В некоторых вариантах осуществления раствор подвергают автоклавированию (например, подвергают циклам термической стерилизации, например, подвергают воздействию по меньшей мере 10 (например, по меньшей мере 15, 20, 30, 40 минутам) нагрева (например, от 110 до 150°C (например, от 121 до 123°C)). В некоторых вариантах осуществления раствор находится при температуре от 110 до 150°C (например, от 121 до 123°C).
В некоторых вариантах осуществления количество продукта деградации нейроактивного стероида, присутствующего в растворе, составляет менее 0,1% масс./масс. в течение 1, 2, 3, 4, 5, 6, 7 дней или более; 1, 2, 3, 4 недель или более; 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 месяцев или более; 1, 2, 3 лет или более.
В одном аспекте в настоящем документе предоставлен фармацевтически приемлемый водный раствор, содержащий (например, состоящий по существу из, состоящий из) нейроактивный стероид (например, аллопрегнанолон), сульфобутиловый эфир бета-циклодекстрина и буфер; где раствор представляет собой стабильный раствор при pH от приблизительно 3 до приблизительно 9 (например, от приблизительно 5 до приблизительно 7, от приблизительно 5,5 до приблизительно 6,5) в течение по меньшей мере 5 минут, например, по меньшей мере 10, 15, 20, 25, 30, 35, 40, 45, 50, 55 или 60 минут или более при температуре от приблизительно 120°C до приблизительно 124°C; или буфер присутствует в концентрации по меньшей мере 0,1 мМ; или раствор остается по существу не содержащим (например, соответствует требованиям нормативной документации продукта менее чем с 3, 2, 1, 0,5, 0,3, 0,2, 0,1% масс./масс.) примесей в течение по меньшей мере 5 минут, например, по меньшей мере 10, 15, 20, 25, 30, 35, 40, 45, 50, 55 или 60 минут или более при температуре от приблизительно 120°C до приблизительно 124°C.
В одном аспекте в настоящем документе предоставлен способ парентерального введения, причем способ включает смешивание первичного раствора, содержащего аллопрагнанолон (например, раствора, описанного в настоящем документе), с разбавителем (например, водой или жидкостью для инъекций, или физиологическим раствором) с получением разбавленного раствора; и парентеральное введение разбавленного раствора субъекту. В некоторых вариантах осуществления первичный раствор разбавляют с помощью двух частей разбавителя на одну часть первичного раствора. В некоторых вариантах осуществления первичный раствор разбавляют с помощью девяти частей разбавителя на одну часть первичного раствора.
В одном аспекте в настоящем документе предоставлен способ получения водного раствора, содержащего нейроактивный стероид, простой сульфоалкиловый эфир бета-циклодекстрина (например, простой сульфобутиловый эфир бета-циклодекстрина или сульфобутилэфир-β-циклодекстрин) и буфер, в котором раствор перемешивают (например, путем гомогенизации с высоким усилием сдвига) с получением раствора, по существу не содержащего (например, менее чем приблизительно 1, 0,5, 0,2, 0,1% масс./об.) твердых веществ (например, не содержащего каких-либо твердых веществ с размером частиц 0,22, 0,45, 1 микрон или более в диаметре).
В некоторых вариантах осуществления раствор перемешивают подходящим перемешивающим устройством или способом. В некоторых вариантах осуществления смесительное устройство представляет собой лопастную мешалку с высоким усилием сдвига, роторно-статорный смеситель, гомогенизатор, ультразвуковое устройство или микрофлюидизатор.
В некоторых вариантах осуществления роторно-статорный смеситель вращается со скоростью от 2000 до 18000 об/мин. В некоторых вариантах осуществления гомогенизатор работает при давлении от 1000 до 5000 фунтов на квадратный дюйм.
В некоторых вариантах осуществления раствор перемешивают с помощью подходящего смесительного устройства с высоким усилием сдвига, такого как роторно/статорное устройство, гомогенизатор, микрофлюидизатор или устройство для обработки ультразвуком. В некоторых вариантах осуществления смесительное устройство с высоким усилием сдвига (например, роторно/статорное устройство, гомогенизатор, микрофлюидизатор или устройство для обработки ультразвуком использует встроенные модули с высоким усилием сдвига).
В некоторых вариантах осуществления способ используют в течение подходящего периода времени для достижения солюбилизации (например, по меньшей мере 15, 30, 60 или более минут).
В некоторых вариантах осуществления раствор разбавляют разбавителем, например, для получения смеси.
В одном аспекте в настоящем документе предоставлен закрытый контейнер, содержащий нейроактивный стероид, простой сульфоалкиловый эфир бета-циклодекстрина (например, простой сульфобутиловый эфир бета-циклодекстрина или сульфобутилэфир-β-циклодекстрин) и буфер; дополнительно содержащий газообразный слой, содержащий в основном (например, содержащий более 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 99,1, 99,5, 99,98, 99,99% инертного газа (например, азота, аргона).
В некоторых вариантах осуществления газообразный слой содержит менее 21, 20, 17, 15, 12, 10, 8, 5, 3, 1, 0,5, 0,2, 0,1, 0,05% газообразного кислорода (например, не содержит кислород).
В некоторых вариантах осуществления контейнер содержит флакон, пробку или колпачок.
В некоторых вариантах осуществления контейнер представляет собой предварительно заполненный шприц. В некоторых вариантах осуществления контейнер представляет собой стеклянный контейнер. В некоторых вариантах осуществления контейнер представляет собой пластиковый контейнер. В некоторых вариантах осуществления пластиковый контейнер и малое содержание кислорода обеспечены посредством упаковочной обертки (например, многослойного пакета из алюминиевой фольги).
В одном аспекте в настоящем документе предоставлен способ лечения субъекта (например, субъекта, страдающего заболеванием или расстройством, описанным в настоящем документе (например, депрессией (например, послеродовой депрессией), причем способ включает введение водного раствора или смеси, описанных в настоящем документе, тем самым подвергая субъекта лечению.
В одном аспекте в настоящем документе предоставлен способ лечения субъекта (например, субъекта, страдающего заболеванием или расстройством, описанным в настоящем документе (например, депрессией (например, послеродовой депрессией), причем способ включает введение одной части водного раствора, описанного в настоящем документе, на две части разбавителей, описанных в настоящем документе (например, WFI), тем самым подвергая субъекта лечению.
В одном аспекте в настоящем документе предоставлен способ лечения субъекта (например, субъекта, страдающего заболеванием или расстройством, описанным в настоящем документе (например, депрессией (например, послеродовой депрессией), причем способ включает введение одной части водного раствора, описанного в настоящем документе, на девять частей разбавителей, описанных в настоящем документе (например, WFI), тем самым подвергая субъекта лечению.
ПОДРОБНОЕ ОПИСАНИЕ ФИГУР
Фигура 1. Иллюстративное описание процессов деградации аллопрегнанолона.
Фигура 2. Иллюстративное описание растворимости аллопрегнанолона в SBECD.
Фигура 3. Стабильность аллопрегнанолона в фосфатном буфере в момент времени=0, 4, 6 и 12 недель (A) Площадь под кривой при 40°C; (B) Площадь под кривой при 60°C.
Фигура 4. Стабильность аллопрегнанолона в цитратном буфере в момент времени=0, 4, 6 и 12 недель (A) Площадь под кривой при 40°C; (B) Площадь под кривой при 60°C.
Фигура 5. Образование 136 во времени в разных буферах (A) при 40°C; (B) при 60°C.
Фигура 6. Иллюстративная ЖХ-МС-характеристика 1269.
Фигура 7. Иллюстративная характеристика 136.
Фигура 8. Количественный анализ небуферизованного состава с аллопрегнанолоном, произведенный после 12 недель (A) при 40°C и (B) при 60°C.
ПОДРОБНОЕ ОПИСАНИЕ НЕКОТОРЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
В настоящем документе описаны водные растворы или смеси, содержащие нейроактивный стероид, циклодекстрин и буфер; способы их применения и введения, способы их получения и контейнеры, содержащие растворы или смеси.
Определения
В контексте настоящего описания термины "стабилизированный" и "стабильный" водный раствор, описанный в настоящем документе (например, водный раствор, содержащий нейроактивный стероид), относятся к раствору, который является "химически стабильным" и "физически стабильным". Раствор, содержащий нейроактивный стероид является химически стабильным, если нейроактивный стероид не подвергается химическому превращению или деградации (например, рацемизации, эпимеризации, окислению). Например, химически стабильный нейроактивный стероид, например, в растворе, не будет рацемизироваться или эпимеризоваться (например, в восприимчивых положениях (например, рацемизироваться или эпимеризоваться в положении С17 в нейроактивном стероиде)) или окисляться (например, в восприимчивых положениях (например, окисляться в положении С3 нейроактивного стероида)) или восстанавливаться (например, в восприимчивых положениях (например, восстанавливаться в положении С21 нейроактивного стероида), например, через определенный промежуток времени (например, в течение 1, 2, 3, 4, 5, 6, 8, 10, 12, 14, 16, 18, 20, 24 часов или более, 1, 2, 3, 4, 5, 6, 7 дней или более, 1, 2, 3, 4 недель или более, 1, 2, 3, 4, 5, 6, 8, 10, 12 месяцев или более, 1, 2, 3, 4, 5 лет или более) или при температурах (например, температуре окружающей среды или повышенной). В контексте настоящего описания термин "pH-стабильный" относится к раствору, в котором pH раствора является по существу одинаковым (например, +/- 1,2, 1, 0,8, 0,5, 0,3 или менее) в течение 1, 2, 3, 4, 5, 6, 7 дней или более, 1, 2, 3, 4 недель или более, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 месяцев или более; 1, 2, 3, 4, 5 лет или более, например, по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8 недель; 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 месяцев или более; 1, 2, 3, 4, 5 лет или более. Раствор, содержащий нейроактивный стероид, является "физически стабильным", если раствор не подвергается физическим изменениям, таким как изменения цвета или уровня частиц, например, через определенный промежуток времени или при различных температурах. Например, стабильный водный раствор, содержащий нейроактивный стероид, химически стабилен и физически стабилен при изготовлении (например, получении, смешивании, наполнении, маркировке и стерилизации), транспортировке или хранении.
"Анализ на содержание основного вещества" в контексте настоящего описания относится к конкретной процедуре определения стабильности, которая определяет содержание лекарственного вещества. Например, анализ на содержание основного вещества может представлять собой хроматографический метод (например, ВЭЖХ) с использованием стандартного образца.
"Примеси" в контексте настоящего описания относятся к органическим и неорганическим примесям и остаточным растворителям. Например, примеси относятся к рацемизированному или эпимеризированному (например, в восприимчивых положениях (например, рацемизированному или эпимеризированному в положении С17 нейроактивного стероида)) или окисленному (например, в восприимчивых положениях (например, окисленному в положении С3 нейроактивного стероида)), или восстанавленному (например, в восприимчивых положениях (например, восстанавленному в положении С21 нейроактивного стероида) нейроактивному стероиду. Раствор является не содержащим примесей, когда он содержит менее 3, 2, 1, 0,5, 0,3, 0,2 или 0,1% масс./масс. примесей.
"Чистота" в контексте настоящего описания относится к отсутствию примесей, например, в растворе или композиции, относительно их исходных (например, в момент времени=0).
"Стерилизация" в контексте настоящего описания относится к розливу в асептических условиях (например, асептической стерилизации) или к терминальной стерилизации.
Растворы
Водные растворы или смеси, описанные в настоящем документе, содержат нейроактивный стероид. Нейроактивные стероиды обычно представляют собой высоко липофильные соединения с низкой собственной растворимостью в воде. Циклодекстрины, например, циклодекстрины согласно настоящему описанию, могут способствовать стабилизации соединений, например, нейроактивных стероидных соединений. Неожиданно было обнаружено, что некоторые небуферизованные растворы нейроактивных стероидов, содержащие сульфобутилэфир-β-циклодекстрин, не являются pH-стабильными. Например, pH растворов (например, небуферизованных растворов) составляет от приблизительно 3 до приблизительно 9, например, от приблизительно 5 до приблизительно 8, например, от приблизительно 5,5 до приблизительно 7,5. Кроме того, было установлено, что pH растворов (например, небуферизованных растворов) отклоняется (например, pH не остается в пределах желаемого диапазона pH). Было обнаружено, что некоторые буферы хорошо подходят для комбинированного использования с небуферизованными растворами нейроактивных стероидов, содержащими сульфобутилэфир-β-циклодекстрин, например, в клинических условиях, поскольку pH раствора или смеси не изменяется (например, pH оставался в диапазоне от 5,5 до 7,5). Неожиданно было обнаружено, что некоторые буферизованные растворы или смеси были более стабильными, чем некоторые небуферизованные растворы при хранении в течение 1, 2, 3, 4, 5, 6 или более месяцев при температурах от 4 до 40°C. Кроме того, неожиданно было обнаружено, что некоторые буферизованные растворы или смеси, описанные в настоящем документе, являются стабильными (например, физически и химически стабильными), например, при высоких температурах (например, 121°C) в течение коротких периодов времени, для процессов стерилизации (например, процессов стерилизации, описанных в настоящем документе). Например, некоторые буферизованные растворы или смеси, описанные в настоящем документе, являются стабильными (например, физически и химически стабильными) при высоких температурах (например, 121°C) в течение 10, 20, 30, 40, 50, 60, 70, 80, 90 минут или более. Кроме того, неожиданно было обнаружено, что некоторые буферизованные растворы или смеси нейроактивных стероидов, описанные в настоящем документе, являются менее восприимчивыми к образованию примесей в диапазоне температур и времени. Например, некоторые буферизованные растворы или смеси нейроактивных стероидов могут иметь более низкое содержание примесей (например, 2% масс./об. или ниже), чем некоторые небуферизованные растворы нейроактивных стероидов в диапазоне температур или времени хранения.
Некоторые буферизованные растворы или смеси нейроактивных стероидов, описанные в настоящем документе, также являются стабильными (например, химически и физически стабильными) в течение 1, 2, 3, 4, 5, 6, 8, 10, 12, 14, 16, 18, 20, 24 часов или более; 1, 2, 3, 4, 5, 6, 7 дней или более; 1, 2, 3, 4 недель или более; 1, 2, 3, 4, 5, 6, 8, 10, 12 месяцев или более; 1, 2, 3, 4, 5 лет или более. Некоторые буферизированные растворы или смеси нейроактивных стероидов являются стабильными (например, pH-стабильными, химически стабильными) при температуре от приблизительно 3 до приблизительно 125°C. В некоторых вариантах осуществления буферизированные растворы или смеси нейроактивных стероидов являются стабильными при температуре от приблизительно 3 до приблизительно 6°C. В некоторых вариантах осуществления буферизированные растворы или смеси нейроактивных стероидов являются стабильными при температуре приблизительно 4°C. В некоторых вариантах осуществления буферизированные растворы или смеси нейроактивных стероидов являются стабильными при температуре от приблизительно 20 до приблизительно 40°C. В некоторых вариантах осуществления буферизированные растворы или смеси нейроактивных стероидов являются стабильными при комнатной (например, температуре окружающей среды) температуре. В некоторых вариантах осуществления буферизированные растворы или смеси нейроактивных стероидов являются стабильными при температуре приблизительно 25°C. В некоторых вариантах осуществления буферизированные растворы или смеси нейроактивных стероидов являются стабильными при температуре приблизительно 37°C. В некоторых вариантах осуществления буферизированные растворы или смеси нейроактивных стероидов являются стабильными при температуре от приблизительно 115 до приблизительно 125°C, например, в течение нескольких минут (например, 10, 20, 30, 40, 50, 60, 70, 80, 90 минут или более, в течение нескольких часов (например, 1, 2, 3 часов или более). В некоторых вариантах осуществления буферизированные растворы или смеси нейроактивных стероидов являются стабильными при температуре автоклавирования. В некоторых вариантах осуществления буферизированные растворы или смеси нейроактивных стероидов являются стабильными при температуре приблизительно 121°C.
В некоторых вариантах осуществления буферизированные растворы или смеси нейроактивных стероидов, описанные в настоящем документе, являются стабильными при температурах в пределах приблизительно от 20 до 30°C в течение по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8 недель; 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 месяцев или более; 1, 2, 3, 4, 5 лет или более).
В некоторых вариантах осуществления буферизированные растворы или смеси нейроактивных стероидов, описанные в настоящем документе, являются стабильными при температурах в пределах от приблизительно 2 до 8°C в течение по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8 недель; 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 месяцев или более; 1, 2, 3, 4, 5 лет или более).
В некоторых вариантах осуществления буферизированные растворы или смеси нейроактивных стероидов, описанные в настоящем документе, получают для введения путем инъекции субъекту. По существу, они будут получены способами, предназначенными для обеспечения их стерильности и отсутствия пирогенов, механических включений и других загрязнителей и, где это необходимо, содержат ингибиторы роста микроорганизмов. Таким образом, буферизированные растворы или смеси нейроактивных стероидов будут по существу не содержащими видимых твердых частиц. В некоторых вариантах осуществления буферизированные растворы или смеси нейроактивных стероидов, описанные в настоящем документе, могут быть отфильтрованы. В некоторых вариантах осуществления буферизированные растворы или смеси нейроактивных стероидов, описанные в настоящем документе, могут быть стерилизованы (например, стерилизованы фильтрованием (например, отфильтрованы через фильтры 0,45 и 0,22 мкм), нагреванием (например, стерилизацией паром при 121°C или облучением, например, гамма-облучением). В некоторых вариантах осуществления стерилизованные буферизированные растворы или смеси нейроактивных стероидов не содержат повышенных концентраций примесей (например, окисленного нейроактивного стероида или рацемизированного, или эпимеризованного нейроактивного стероида). Например, стерилизованные буферизированные растворы или смеси нейроактивных стероидов не содержат более 0,001, 0,002, 0,005, 0,01, 0,02, 0,05, 0,1, 0,2, 0,5, 1% масс./масс. примесей. В некоторых вариантах осуществления стерилизованные буферизированные растворы или смеси нейроактивных стероидов имеют pH от приблизительно 3 до приблизительно 8 (например, от приблизительно 5 до приблизительно 7, от приблизительно 5,5 до приблизительно 6,5).
В некоторых вариантах осуществления буферизированные растворы или смеси нейроактивных стероидов являются безопасными, хорошо переносимыми или не раздражающими при введении человеку.
В некоторых вариантах осуществления буферизированный нейроактивный стероид согласно настоящему описанию получают в виде эмульсии, подходящей для парентерального введения. Такие эмульсии будут содержать описанный в настоящем документе нейроактивный стероид в подходящем масле или смеси масел, подходящие эмульгирующие ингредиенты, подходящий буфер и другие ингредиенты, необходимые для изменения тоничности и для обеспечения химической и физической стабильности композиции. Как таковые, они будут получены способами, предназначенными для обеспечения их стерильности и отсутствия пирогенов, механических включений и других загрязнителей и, в случае необходимости, содержат ингибиторы роста микроорганизмов. Таким образом, буферизованные растворы нейроактивных стероидов будут по существу не содержащими видимых твердых частиц. В некоторых вариантах осуществления буферизированные растворы нейроактивных стероидов, описанные в настоящем документе, могут быть отфильтрованы. В некоторых вариантах осуществления буферизированные растворы нейроактивных стероидов, описанные в настоящем документе, могут быть стерилизованы (например, стерилизованы фильтрованием (например, отфильтрованы через фильтры 0,45 и 0,22 мкм), нагреванием (например, стерилизацией паром при 121°C или облучением, например, гамма-облучением). В некоторых вариантах осуществления стерилизованные буферизированные эмульсии нейроактивных стероидов сохраняют требуемый размер глобул или капель, чтобы обеспечить безопасное и эффективное введение буферизированной эмульсии нейроактивных стероидов. В некоторых вариантах осуществления стерилизованные буферизированные эмульсии нейроактивных стероидов не содержат повышенных концентраций примесей (например, окисленного нейроактивного стероида или рацемизированного, или эпимеризованного нейроактивного стероида). Например, стерилизованная буферизированная эмульсия нейроактивного стероида не содержит более 0,001, 0,002, 0,005, 0,01, 0,02, 0,05, 0,1, 0,2, 0,5, 1% масс./масс примесей. В некоторых вариантах осуществления стерилизованная буферизированная эмульсия нейроактивного стероида имеет pH от приблизительно 3 до приблизительно 8 (например, от приблизительно 5 до приблизительно 7, от приблизительно 5,5 до приблизительно 6,5).
В некоторых вариантах осуществления буферизированный нейроактивный стероид получают в виде масляного раствора, подходящего для инъекций. Такие масляные растворы будут содержать нейроактивный стероид в подходящем масле или смеси масел и другие ингредиенты по мере необходимости для обеспечения химической и физической стабильности композиции. В некоторых вариантах осуществления выбор масел и эксципиентов состава обеспечивает желаемое высвобождение и устойчивую активность нейроактивного стероида. Как таковые, они будут получены способами, предназначенными для обеспечения их стерильности и отсутствия пирогенов, механических включений и других загрязнителей и, в случае необходимости, содержат ингибиторы роста микроорганизмов. Таким образом, буферизированный масляный раствор нейроактивного стероида будет по существу не содержащим видимых твердых частиц. В некоторых вариантах осуществления буферизированные масляные растворы нейроактивных стероидов, описанные в настоящем документе, могут быть отфильтрованы. В некоторых вариантах осуществления буферизированный масляный раствор нейроактивного стероида, описанный в настоящем документе, может быть стерилизован (например, стерилизован фильтрованием (например, отфильтрован через фильтры 0,45 и 0,22 мкм), нагреванием (стерилизацией сухим жаром >150°C). В некоторых вариантах осуществления стерилизованный буферизированный масляный раствор нейроактивного стероида не содержит повышенных концентраций примесей (например, окисленного нейроактивного стероида или рацемизированного, или эпимеризованного нейроактивного стероида). Например, стерилизованный буферизированный масляный раствор нейроактивного стероида не содержит более 0,001, 0,002, 0,005, 0,01, 0,02, 0,05, 0,1, 0,2, 0,5, 1% масс./масс. примесей.
В некоторых вариантах осуществления буферизированный раствор или эмульсию нейроактивного стероида лиофилизируют. Такой лиофилизированный раствор или эмульсия могут содержать эксципиенты подобные тем, что используются для раствора нейроактивного стероида, описанного в настоящем документе. В некоторых вариантах осуществления лиофилизированный буферизированный раствор или эмульсия нейроактивного стероида могут содержать дополнительные компоненты, известные специалистам в данной области, для улучшения процесса лиофилизации, такие как, но не ограничиваясь ими, сахара, модифицированные углеводные соединения и растворители, такие как трет-бутиловый спирт. Как таковые, они будут получены способами, предназначенными для обеспечения их стерильности и отсутствия пирогенов, механических включений и других загрязнителей и, в случае необходимости, содержат ингибиторы роста микроорганизмов. Таким образом, лиофилизированный буферизированный раствор или эмульсия нейроактивного стероида будут по существу не содержащими видимых твердых частиц при разведении. В некоторых вариантах осуществления лиофилизированный буферизированный раствор или эмульсия нейроактивного стероида, описанные в настоящем документе, могут быть отфильтрованы до и после разведения. В некоторых вариантах осуществления лиофилизированный буферизированный раствор или эмульсия нейроактивного стероида, описанные в настоящем документе, могут быть стерилизованы (например, стерилизованы фильтрованием (например, отфильтрованы через фильтры 0,45 и 0,22 мкм) или облучением (например, гамма-облучением). В некоторых вариантах осуществления лиофилизированный стерилизованный буферизированный раствор или эмульсия нейроактивного стероида не содержат более 0,001, 0,002, 0,005, 0,01, 0,02, 0,05, 0,1, 0,2, 0,5, 1% масс./масс. примесей (например, окисленного нейроактивного стероида или рацемизированного или эпимеризованного нейроактивного стероида). В некоторых вариантах осуществления стерилизованный лиофилизированный буферизированный раствор или эмульсия нейроактивного стероида имеют pH от приблизительно 3 до приблизительно 8 (например, от приблизительно 5 до приблизительно 7, от приблизительно 5,5 до приблизительно 6,5) после разведения.
Смесь
Водные растворы, описанные в настоящем документе, могут быть смешаны с разбавителем, описанным в настоящем документе, с получением "смеси". Подходящие разбавители включают стерильную воду для инъекций ("WFI"), физиологический раствор и декстрозу. В некоторых вариантах осуществления водный раствор, описанный в настоящем документе, смешивают с разбавителем, описанным в настоящем документе, в соотношении водный раствор:разбавитель 1:2. В некоторых вариантах осуществления водный раствор, описанный в настоящем документе, смешивают с разбавителем, описанным в настоящем документе, в соотношении водный раствор:разбавитель 1:9.
В некоторых вариантах осуществления смесь содержит от приблизительно 1 до приблизительно 3 мг/мл нейроактивного стероида. В некоторых вариантах осуществления смесь содержит от приблизительно 1,2 до приблизительно 2,5 мг/мл нейроактивного стероида. В некоторых вариантах осуществления смесь содержит от приблизительно 1,4 до приблизительно 2,0 мг/мл нейроактивного стероида. В некоторых вариантах осуществления смесь содержит от приблизительно 1,6 до приблизительно 1,7 мг/мл нейроактивного стероида. В некоторых вариантах осуществления смесь содержит приблизительно 1,67 мг/мл нейроактивного стероида.
В некоторых вариантах осуществления смесь содержит от приблизительно 0,1 до приблизительно 1 мг/мл нейроактивного стероида. В некоторых вариантах осуществления смесь содержит от приблизительно 0,25 до приблизительно 0,75 мг/мл нейроактивного стероида. В некоторых вариантах осуществления смесь содержит приблизительно 0,5 мг/мл нейроактивного стероида.
В некоторых вариантах осуществления смесь содержит от приблизительно 1% до приблизительно 20% масс./масс. циклодекстрина, например, сульфоалкилэфир-β-циклодекстрина. В некоторых вариантах осуществления смесь содержит от приблизительно 2,5% до приблизительно 15% масс./масс. циклодекстрина, например, сульфоалкилэфир-β-циклодекстрина. В некоторых вариантах осуществления смесь содержит от приблизительно 5% до приблизительно 15% масс./масс. циклодекстрина, например, сульфоалкилэфир-β-циклодекстрина. В некоторых вариантах осуществления смесь содержит от приблизительно 5% до приблизительно 10% масс./масс. циклодекстрина, например, сульфоалкилэфир-β-циклодекстрина. В некоторых вариантах осуществления смесь содержит приблизительно 8,3% масс./масс. циклодекстрина, например, сульфоалкилэфир-β-циклодекстрина.
В некоторых вариантах осуществления смесь содержит от приблизительно 0,1% до приблизительно 10% масс./масс. циклодекстрина, например, сульфоалкилэфир-β-циклодекстрина. В некоторых вариантах осуществления смесь содержит от приблизительно 0,5% до приблизительно 7,5% масс./масс. циклодекстрина, например, сульфоалкилэфир-β-циклодекстрина. В некоторых вариантах осуществления смесь содержит от приблизительно 0,5% до приблизительно 5% масс./масс. циклодекстрина, например, сульфоалкилэфир-β-циклодекстрина. В некоторых вариантах осуществления смесь содержит от приблизительно 1% до приблизительно 5% масс./масс. циклодекстрина, например, сульфоалкилэфир-β-циклодекстрина. В некоторых вариантах осуществления смесь содержит приблизительно 2,5% масс./масс. циклодекстрина, например, сульфоалкилэфир-β-циклодекстрина.
В некоторых вариантах осуществления смесь содержит от приблизительно 1 до приблизительно 3 мг/мл нейроактивного стероида и от приблизительно 1% до приблизительно 20% масс./масс. циклодекстрина, например, сульфоалкилэфир-β-циклодекстрина. В некоторых вариантах осуществления смесь содержит от приблизительно 1,2 до приблизительно 2,5 мг/мл нейроактивного стероида и от приблизительно 2,5% до приблизительно 15% масс./масс. циклодекстрина, например, сульфоалкилэфир-β-циклодекстрина. В некоторых вариантах осуществления смесь содержит от приблизительно 1,4 до приблизительно 2,0 мг/мл нейроактивного стероида и от приблизительно 5% до приблизительно 15% масс./масс. циклодекстрина, например, сульфоалкилэфир-β-циклодекстрина. В некоторых вариантах осуществления смесь содержит от приблизительно 1,6 до приблизительно 1,7 мг/мл нейроактивного стероида и от приблизительно 5% до приблизительно 10% масс./масс. циклодекстрина, например, сульфоалкилэфир-β-циклодекстрина. В некоторых вариантах осуществления смесь содержит приблизительно 1,67 мг/мл нейроактивного стероида и приблизительно 8,3% масс./масс. циклодекстрина, например, сульфоалкилэфир-β-циклодекстрина.
В некоторых вариантах осуществления смесь содержит от приблизительно 0,1 до приблизительно 1 мг/мл нейроактивного стероида и от приблизительно 0,1% до приблизительно 10% масс./масс. циклодекстрина, например, сульфоалкилэфир-β-циклодекстрина. В некоторых вариантах осуществления смесь содержит от приблизительно 0,25 до приблизительно 0,75 мг/мл нейроактивного стероида и содержит от приблизительно 0,5% до приблизительно 5% масс./масс. циклодекстрина, например, сульфоалкилэфир-β-циклодекстрина. В некоторых вариантах осуществления смесь содержит приблизительно 0,5 мг/мл нейроактивного стероида и приблизительно 2,5% масс./масс. циклодекстрина, например, сульфоалкилэфир-β-циклодекстрина.
В некоторых вариантах осуществления смесь содержит буфер, описанный в настоящем документе, например, цитратный буфер, фосфатный буфер. В некоторых вариантах осуществления буфер присутствует в количестве от приблизительно 1 до приблизительно 500 мМ (например, от приблизительно 1 до приблизительно 250 мМ, от приблизительно 1 до приблизительно 200 мМ, от приблизительно 1 до приблизительно 150 мМ, от приблизительно 1 до приблизительно 100 мМ, от приблизительно 1 до приблизительно 50 мМ). В некоторых вариантах осуществления буфер находится на уровне или вблизи физиологического pH. Предпочтительно pH смеси составляет от приблизительно 3 до приблизительно 8 (например, от приблизительно 5 до приблизительно 7, от приблизительно 5,5 до приблизительно 6,5, от приблизительно 5,9 до приблизительно 6,1) или любое конкретное значение в указанном диапазоне. В некоторых вариантах осуществления pH смеси составляет от приблизительно 5 до приблизительно 6,5 или любое конкретное значение в указанном диапазоне (например, 5,5, 5,6, 5,7, 5,8, 5,9, 6, 6,1, 6,2, 6,3, 6,4). В некоторых вариантах осуществления pH смеси составляет приблизительно 6. В некоторых вариантах осуществления буфер представляет собой цитратный буфер, и pH составляет от приблизительно 3 до приблизительно 7,4. В некоторых вариантах осуществления буфер представляет собой цитратный буфер, и pH составляет от приблизительно 5,5 до приблизительно 6,2. В некоторых вариантах осуществления буфер представляет собой фосфатный буфер, и pH составляет от приблизительно 6,2 до 8,2, предпочтительно приблизительно 7,4.
В некоторых вариантах осуществления смесь содержит одну часть буферизированного раствора нейроактивного стероида (буферизированного раствора нейроактивного стероида согласно настоящему описанию) на две части разбавителя (например, WFI).
В некоторых вариантах осуществления смесь содержит одну часть буферизированного раствора нейроактивного стероида (буферизированного раствора нейроактивного стероида согласно настоящему описанию) на девять частей разбавителя (например, физиологический раствор, WFI).
В некоторых вариантах осуществления смесь является изотонической. В некоторых вариантах осуществления смесь является гипотонической. В некоторых вариантах осуществления тоничность смеси регулируется, например, усилителями тоничности, для получения растворов, которые становятся приблизительно 300 мОсм/л или менее.
Буферы
Водные раствор или смесь нейроактивного стероида, описанные в настоящем документе, содержат буфер (например, буфер при pH от приблизительно 3 до приблизительно 8 (например, от приблизительно 5 до приблизительно 7, от приблизительно 5,5 до приблизительно 6,5, от приблизительно 5,9 до приблизительно 6,1). В контексте настоящего описания термин "буфер", "буферная система" или "буферизующий компонент" относится к соединению, которое обычно в сочетании по меньшей мере с одним другим соединением обеспечивает химическую систему в растворе, которая обладает буферной способностью, то есть способностью нейтрализовать в определенных пределах понижающие или повышающие pH эффекты сильных кислот или оснований (щелочей) соответственно с относительно небольшим изменением или отсутствием изменения первоначального значения pH (например, pH до воздействия, например, сильной кислоты или основания). Например, буфер, описанный в настоящем документе, сохраняет или регулирует pH раствора в определенном диапазоне pH. Например, "буферная способность" может относиться к миллимолям (мМ) сильной кислоты или основания (или, соответственно, ионов водорода или гидроксида), необходимым для изменения pH на единицу при добавлении в один литр (стандартная единица) буферного раствора. Из этого определения видно, что чем меньше изменение pH в растворе, вызванное добавлением определенного количества кислоты или щелочи, тем больше буферная способность раствора. См., например, Remington: The Science and Practice of Pharmacy, Mack Publishing Co., Easton, Pennsylvania (19 издание, 1995), глава 17, страницы 225-227. Буферная способность будет зависеть от вида и концентрации буферизующих компонентов.
В соответствии с некоторыми вариантами осуществления буферизующие компоненты присутствуют в растворах в концентрации от 1 мМ, 2 мМ, 5 мМ, 10 мМ, 20 мМ, 50 мМ, 75 мМ, 100 мМ, 150 мМ, 200 мМ, 250 мМ или более.
Предпочтительные буферы включают 4-2-гидроксиэтил-1-пиперазинэтансульфоновую кислоту (HEPES), 2-{[трис(гидроксиметил)метил]амино}этансульфоновую кислоту (TES), 3-(N-морфолино)пропансульфоновую кислоту (MOPS), пиперазин-N,N'-бис(2-этансульфоновая кислота) (PIPES), диметиларсиновую кислоту (какодилат), цитрат (например, солевой раствор цитрата натрия, цитрата калия, цитрата аммония), 2-(N-морфолино)этансульфоновую кислоту (MES), фосфат (например, PBS, D-PBS), сукцинат (т.е. 2(R)-2-(метиламино)янтарную кислоту), ацетат, диметилглутарат, малеат, имидазол, N-(2-ацетамидо)-2-аминоэтансульфоновую кислоту (ACES), N,N-бис(2-гидроксиэтил)-2-аминоэтансульфоновую кислоту (BES), бицин, Бис-Трис, борат, N-циклогексил-3-аминопропансульфоновую кислоту (CAPS), глицин, 3-[4-2-гидроксиэтил)-1-пиперазинил]пропансульфоновую кислоту (HEPPS или EPPS), N-[трис(гидроксиметил)метил]-3-аминопропансульфоновую кислоту, [(2-гидрокси-1,1-бис(гидроксиметил)этил)амино]-1-пропансульфоновую кислоту (TAPS), трицин, Трис, Трис-основание, Трис-буфер, Трис-глицин, Трис-HCl, коллидин, веронала ацетат, N-(2-ацетамидо)иминодиуксусную кислоту; N-(карбамоилметил)иминодиуксусную кислоту (ADA), β-гидрокси-4-морфолинпропансульфоновую кислоту, 3-морфолино-2-гидроксипропансульфоновую кислоту (MOPSO), холаминхлорид, 3-(N,N-бис[2-гидроксиэтил]амино)-2-гидроксипропансульфоновую кислоту (DIPSO), ацетамидоглицин, 3-{[1,3-дигидрокси-2-(гидроксиметил)-2-пропанил]амино}-2-гидрокси-1-пропансульфоновую кислоту (TAPSO), пиперазин-N,N-бис(2-гидроксипропансульфоновая кислота) (POPSO), N-(2-гидроксиэтил)пиперазин-N'-(2-гидроксипропансульфоновая кислота) (HEPPSO), N-циклогексил-2-аминоэтансульфоновую кислоту (CHES), 2-амино-метил-1,3-пропандиол (AMPd) и глицинамид.
В некоторых вариантах осуществления буфер содержит одноосновную кислоту. В некоторых вариантах осуществления буфер содержит многоосновную кислоту (например, цитрат или фосфат). В некоторых вариантах осуществления буфер представляет собой раствор одного или нескольких веществ (например, соли слабой кислоты и слабого основания, смеси слабой кислоты и соли слабой кислоты с сильным основанием). В некоторых вариантах осуществления буфер содержит пиперазин (например, PIPES, HEPES, POPSO, EPPS).
В некоторых вариантах осуществления буфер содержит соединение, образующее комплексы с неметаллом (например, MES, MOPS, PIPES).
В некоторых вариантах осуществления буфер содержит соединение, образующее комплексы с металлом (то есть агент, хелатирующий металл). В некоторых вариантах осуществления агент, хелатирующий металл, представляет собой цитрат.
В некоторых вариантах осуществления буфер представляет собой цитратный буфер. В некоторых вариантах осуществления буфер представляет собой фосфатный буфер. В некоторых вариантах осуществления буфер представляет собой гистидиновый буфер.
В некоторых вариантах осуществления буфер присутствует в концентрации приблизительно 0,01, 0,05, 0,1, 0,5, 1, 5, 10, 20, 50, 100, 200, 250, 500 мМ или более. В некоторых вариантах осуществления буфер присутствует в концентрации от приблизительно 1 до приблизительно 500 мМ, от приблизительно 1 до приблизительно 300 мМ, от приблизительно 1 до приблизительно 200 мМ, от приблизительно 1 до приблизительно 100 мМ, от приблизительно 1 до приблизительно 50 мМ, от приблизительно 10 до приблизительно 500 мМ, от приблизительно 10 до приблизительно 300 мМ, от приблизительно 10 до приблизительно 200 мМ, от приблизительно 10 до приблизительно 100 мМ, от приблизительно 10 до приблизительно 50 мМ.
В некоторых вариантах осуществления буфер присутствует в концентрации от приблизительно 0,01 до приблизительно 10 мМ, от приблизительно 0,05 до приблизительно 5 мМ, от приблизительно 0,05 до приблизительно 5 мМ, от приблизительно 0,1 до приблизительно 5 мМ, от приблизительно 0,1 до приблизительно 3,5 мМ.
В некоторых вариантах осуществления pH водного раствора находится на уровне или вблизи физиологического pH. Предпочтительно pH водного раствора составляет от приблизительно 3 до приблизительно 8 (например, от приблизительно 5 до приблизительно 7, от приблизительно 5,5 до приблизительно 6,5, от приблизительно 5,9 до приблизительно 6,1) или любое конкретное значение в указанном диапазоне. В некоторых вариантах осуществления pH водного раствора составляет от приблизительно 5 до приблизительно 6,5 или любое конкретное значение в указанном диапазоне (например, 5,5, 5,6, 5,7, 5,8, 5,9, 6, 6,1, 6,2, 6,3, 6,4). В некоторых вариантах осуществления pH водного раствора составляет приблизительно 6. Специалист в данной области должен учесть, что pH можно довести до более оптимального pH в зависимости от стабильности нейроактивных стероидов и сульфоалкилэфир-β-циклодекстрина, включенных в раствор. pH можно регулировать, например, с помощью хлористоводородной, фосфорной кислоты или органических кислот, таких как лимонная кислота, молочная кислота, яблочная кислота, винная кислота, уксусная кислота, глюконовая кислота, янтарная кислота и их комбинации. В некоторых вариантах осуществления pH регулируют с помощью основания (например, 1н гидроксида натрия) или кислоты (например, 1н хлористоводородной кислоты).
В некоторых вариантах осуществления буфер представляет собой цитратный буфер, и pH составляет от приблизительно 3 до приблизительно 8. В некоторых вариантах осуществления буфер представляет собой цитратный буфер, и pH составляет от приблизительно 3 до приблизительно 7,4. В некоторых вариантах осуществления буфер представляет собой цитратный буфер, и pH составляет от приблизительно 5,5 до приблизительно 6,2.
В некоторых вариантах осуществления буфер представляет собой фосфатный буфер, и pH составляет от приблизительно 3 до приблизительно 9. В некоторых вариантах осуществления буфер представляет собой фосфатный буфер, и pH составляет от приблизительно 6,2 до приблизительно 8,2. В некоторых вариантах осуществления буфер представляет собой фосфатный буфер, и pH составляет приблизительно 7,4.
Нейроактивные стероиды
Водные растворы или смеси, описанные в настоящем документе, содержат нейроактивный стероид, описанный в настоящем документе. Нейроактивные стероиды (или нейростероиды) представляют собой натуральные, синтетические или полусинтетические стероиды, которые быстро изменяют возбудимость нейронов посредством взаимодействия с нейротрансмиттер-зависимыми воротными ионными каналами. Нейроактивные стероиды осуществляют связывание с мембраносвязанными рецепторами, такими как ингибирующие и(или) возбуждающие нейротрансмиттеры, включая ГАМКA, NMDA и сигма-рецепторы.
Стероиды, которые могут быть классифицированы по функциональным группам в соответствии с химической структурой и физиологической активностью, включают эстрогенные гормоны, прогестационные гормоны и андрогенные гормоны. Особый интерес представляют прогестационные гормоны, называемые в настоящем описании "прогестинами" или "прогестагенами", а также их производные и биоактивные метаболиты. Членами этой широкой семьи являются стероидные гормоны, описанные в Remington's Pharmaceutical Sciences, Gennaro с соавт., Mack Publishing Co. (18-е изд., 1990), 990-993. Как и во всех других классах стероидов, стереоизомерия имеет фундаментальное значение для половых гормонов. В контексте настоящего описания могут быть использованы различные прогестины (например, прогестерон) и их производные, включая как синтетические, так и натуральные продукты, а также метаболиты прогестинов, такие как прогестерон.
В контексте настоящего описания термин "прогестерон" относится к члену семейства прогестинов и включает 21-углеродный стероидный гормон. Прогестерон также известен как D4-прегнен-3,20-дион; Δ4-прегнен-3,20-дион; или прегн-4-ен-3,20-дион. В контексте настоящего описания термин "синтетический прогестин" представляет собой молекулу, структура которой связана со структурой прогестерона, является синтетически полученным и сохраняет биологическую активность прогестерона.
Типичные синтетические прогестины включают, но не ограничиваются ими, замещения в положении 17 прогестерона для введения гидроксильной, ацетильной, гидроксиацетильной, алифатической, нитро или гетероциклической группы, модификации для получения сложных эфиров 17α-OH (например, 17α-гидроксипрогестерона капроат), а также модификации, которые вводят 6-метил, 6-ен и 6-хлор-заместители в прогестерон (например, медроксипрогестерона ацетат, мегестрола ацетат и хломадинона ацетат), и которые сохраняют биологическую активность прогестерона. Такие производные прогестина включают 5-дегидропрогестерон, 6-дегидро-ретропрогестерон (дидрогестерон), аллопрегнанолон (аллопрегнан-3α или 3β-ол-20-он), этинодиола диацетат, гидроксипрогестерона капроат (прегн-4-ен-3,20-дион, 17-(1-оксогекси)окси); левоноргестрел, норэтиндрон, норэтиндрона ацетат (19-норпрегн-4-ен-20-ин-3-он, 17-(ацетилокси)-, (17α)-); норэтинодрел, норгестрел, прегненолон, ганаксолон (также именуемый как CCD-1042 или INN) и мегестрола ацетат. В некоторых вариантах осуществления нейроактивный стероид представляет собой ганаксолон.
Пригодные прогестины также могут включать аллопрегнон-3α или 3β, 20α или 20β-диол (см. каталог Merck 258-261); аллопрегнан-3β,21-диол-11,20-дион; аллопрегнан-3β,17α-диол-20-он; 3,20-аллопрегнандион, аллопрегнан, 3β,11β,17α,20β,21-пентол; аллопрегнан-3β,17α,20β,21-тетрол; аллопрегнан-3α или 3β,11β,17α,21-тетрол-20-он, аллопрегнан-3β,17α или 20β-триол; аллопрегнан-3β,17α,21-триол-11,20-дион; аллопрегнан-3β,11β,21-триол-20-он; аллопрегнан-3β,17α,21-триол-20-он; аллопрегнан-3α или 3β-ол-20-он; прегнандиол; 3,20-прегнандион; прегнан-3α-ол-20-он; 4-прегнен-20,21-диол-3,11-дион; 4-прегнен-11β,17α,20β,21-тетрол-3-он; 4-прегнен-17α,20β,21-триол-3,11-дион; 4-прегнен-17α,20β,21-триол-3-он и метиловый эфир прегненолона. Другие производные прогестина включают сложные эфиры с нетоксичными органическими кислотами, такими как уксусная кислота, бензойная кислота, малеиновая кислота, яблочная кислота, капроновая кислота и лимонная кислота и неорганические соли, такие как гидрохлоридные, сульфатные, нитратные, бикарбонатные и карбонатные соли. Другие подходящие прогестины включают альфаксалон (также именуемый как INN, альфаксолон и альфаксолон), альфадолон (также именуемый как альфадолон), гидроксидион и минаксолон. В некоторых вариантах осуществления нейроактивный стероид представляет собой альфаксолон.
Дополнительные подходящие нейроактивные стероиды раскрыты в публикациях ВОИС №№ WO2013/188792, WO 2013/056181, WO2015/010054, WO2014/169832, WO2014/169836, WO2014/169833, WO2014/169831, WO2015/027227, WO 2014/100228 и Патенте США № 5,232,917, US 8,575,375 и US 8,759,330, которые включены в настоящую заявку посредством ссылки в части нейроактивных стероидов, описанных в них.
В конкретных вариантах осуществления стероиды представляют собой один или несколько из серий седативно-гипнотических 3 альфа-гидрокси восстановленных по кольцу A прегнановых стероидов, которые включают основные метаболиты прогестерона и дезоксикортикостерона, 3альфа-гидрокси-5альфа-прегнан-20-он (аллопрегнанолон) и 3альфа,21-дигидрокси-5альфа-прегнан-20-он (аллотетрагидроDOC), соответственно. Эти 3 альфа-гидроксистероиды не взаимодействуют с классическими внутриклеточными стероидными рецепторами, но связываются стереоселективно и с высоким сродством с рецепторами основного ингибирующего нейротрансмиттера в головном мозге, гамма-аминомасляной кислоты (ГАМК).
В некоторых вариантах осуществления нейроактивные стероиды представляют собой прогестерон, прегнанолон, аллопрегнанолон, альфадалон, ганксолон, альфаксолон или другие аналоги прогестерона. В конкретном варианте осуществления нейроактивный стероид представляет собой аллопрегнанолон или его производное. В некоторых вариантах осуществления нейроактивный стероид представляет собой аллопрегнанолон. Примеры производных включают, но не ограничиваются ими, (20R)-17бета-(1-гидрокси-2,3-бутадиенил)-5альфа-андростан-3альфа-ол (HBAO). Дополнительные производные описаны в WO 2012/127176.
В некоторых вариантах осуществления нейроактивный стероид представляет собой аллопрегнанолон. В некоторых вариантах осуществления нейроактивный стероид представляет собой ганаксолон. В некоторых вариантах осуществления нейроактивный стероид представляет собой альфаксолон.
Липофильная природа нейроактивного стероида (например, прегнанолона, аллопрегнанолона, альфадалона, ганксолона или альфаксолона) может быть изменена для получения состава для введения in vivo. Как обсуждалось выше, нейроактивный стероид (например, прегнанолон, аллопрегнанолон, альфадалон, ганксолон или альфаксолон) может объединен с носителем, таким как циклодекстрин, для улучшения растворимости. Альтернативно или дополнительно, нейроактивный стероид (например, прегнанолон, аллопрегнанолон, альфадалон, ганксолон или альфаксолон) может быть модифицирован с целью улучшения растворимости. Например, полярные группы могут быть введены в положение 16α с целью повышения водорастворимости, доступности мозга и эффективности нейроактивных стероидов, как описано в Kasal с соавт., J. Med. Chem., 52 (7), 2119-215 (2009).
Циклодекстрины
Водный раствор или смесь нейроактивного стероида, описанные в настоящем документе, содержат циклодекстрин. Растворимость нейроактивных стероидов может быть улучшена с помощью циклодекстринов. Стероид-циклодекстриновые комплексы известны в данной области техники. См., например, патент США № 7,569,557 Backensfeld с соавт. и публикацию заявки на патент США № US 2006/0058262 Zoppetti с соавт.
Циклодекстрины представляют собой циклические олигосахариды, состоящие из или содержащие шесть (α-циклодекстрин), семь (β-циклодекстрин), восемь (γ-циклодекстрин) или более α(1,4)-связанных глюкозных остатков. Гидроксильные группы циклодекстринов обращены наружу кольца, в то время как глюкозидный кислород и два кольца не способных к обмену атомов водорода направлены внутрь полости.

Нейроактивные комплексы стероид-циклодекстрин предпочтительно получают из циклодекстрина, выбранного из группы, состоящей из β-циклодекстрина и его производных. Циклодекстрин может быть химически модифицирован таким образом, что некоторые или все первичные или вторичные гидроксильные группы макроцикла, или и те и другие, функционализированы с помощью боковой группы. Подходящие боковые группы включают, но не ограничиваются ими, сульфинил, сульфонил, фосфат, ацил и С1-С12 алкильные группы, необязательно замещенные одним или несколькими (например, 1, 2, 3 или 4) гидрокси, карбокси, карбонилом, ацилом, окси, оксо; или их комбинации. Способы модификации этих спиртовых остатков известны в данной области техники, и многие производные циклодекстрина являются коммерчески доступными, включая сульфобутиловые эфиры β-циклодекстрины, доступные под торговым названием CAPTISOL® от Ligand Pharmaceuticals (La Jolla, Калифорния).
Предпочтительные циклодекстрины включают, но не ограничиваются ими, алкилциклодекстрины, гидроксиалкилциклодекстрины, такие как гидроксипропил β-циклодекстрин, карбоксиалкилциклодекстрины и сульфоалкиловые эфиры циклодекстринов, такие как сульфобутиловый эфир β-циклодекстрина.
В конкретных вариантах осуществления циклодекстрин представляет собой бета-циклодекстрин, имеющий множество зарядов (например, отрицательных или положительных) на поверхности. В более конкретных вариантах осуществления циклодекстрин представляет собой β-циклодекстрин, состоящий из или содержащий множество функциональных групп, которые отрицательно заряжены при физиологическом pH. Примеры таких функциональных групп включают, но не ограничиваются ими, группы карбоновых кислот (карбоксилатные), сульфонатные (RSO3-), фосфонатные группы, фосфинатные группы и аминокислоты, которые отрицательно заряжены при физиологическом pH. Заряженные функциональные группы могут быть связаны непосредственно с циклодекстринами или могут быть связаны с помощью спейсера, такого как алкиленовая цепь. Количество атомов углерода в алкиленовой цепи может варьироваться, но обычно составляет приблизительно от 1 до 10 атомов углерода, предпочтительно 1-6 атомов углерода, более предпочтительно 1-4 атома углерода. Высокосульфированные циклодекстрины описаны в патенте США № 6,316,613.
В одном варианте осуществления циклодекстрины представляют собой β-циклодекстрин, функционализированный множеством сульфобутилэфирных групп. Такие циклодекстрины продаются под торговым названием CAPTISOL®.
CAPTISOL® представляет собой полианионное производное бета-циклодекстрина с натрий сульфонатной солью, отделенной от липофильной полости бутилэфирной спейсерной группой или сульфобутилэфиром (SBE). CAPTISOL® не является отдельными химическими соединениями, но состоит из множества полимерных структур различной степени замещения и позиционных/пространственных изомеров, обусловленных и контролируемых для получения однородного состава с помощью патентованного процесса изготовления, который неоднократно применяется на практике и улучшается для контроля содержания примесей.
CAPTISOL® содержит от шести до семи сульфобутилэфирных групп на молекулу циклодекстрина. Из-за очень низкого pKa групп сульфоновой кислоты CAPTISOL® несет множество отрицательных зарядов при физиологически совместимых значениях pH. Четырехуглеродная бутильная цепь в сочетании с отталкиванием отрицательных зарядов концевой группы, позволяет "расширить" полость циклодекстрина. Это часто приводит к более сильному связыванию с потенциальными лекарственными средствами, чем это может быть достигнуто с использованием других модифицированных циклодекстринов. Это также обеспечивает возможность ионных зарядовых взаимодействий между циклодекстрином и положительно заряженной молекулой лекарственного средства. Кроме того, эти производные придают молекуле значительную растворимость и безопасность для парентерального введения. По сравнению с бета-циклодекстрином CAPTISOL® обеспечивает более высокие характеристики взаимодействия и превосходную растворимость в воде более 100 г/100 мл, улучшение в 50 раз.
Предпочтительно, циклодекстрин присутствует в количестве от приблизительно 0,1% до приблизительно 40% масс./масс. от общего раствора (например, буферизованного раствора нейроактивного стероида), предпочтительно от приблизительно 5% до приблизительно 40% масс./масс., более предпочтительно от приблизительно 10% до приблизительно 40% масс./масс., наиболее предпочтительно от приблизительно 10% до приблизительно 35% масс./масс. В некоторых вариантах осуществления концентрация циклодекстринов составляет от приблизительно 15% до приблизительно 35% масс./масс., предпочтительно от приблизительно 20% до приблизительно 35% масс./масс., более предпочтительно от приблизительно 20% до приблизительно 30% масс./масс. В некоторых вариантах осуществления концентрация циклодекстринов составляет приблизительно 25% масс./масс.
В одном варианте осуществления состав содержит от приблизительно 1 до приблизительно 2, предпочтительно приблизительно 1,5 мг нейроактивного стероида (например, прегнанолона, аллопрегнанолона, альфадалона, ганаксолона, альфаксолона) на мл циклодекстрина, например, CAPTISOL®. В некоторых вариантах осуществления циклодекстрин, например, сульфоалкилэфир-β-циклодекстрин, присутствует в водном растворе, описанном в настоящем документе, в количестве 0,1, 0,2, 0,3, 0,5, 0,7, 1,2, 1,5, 1,8, 2, 2,5, 3, 4, 5, 6, 7, 8, 10, 11, 12 мг/мл или более.
В некоторых вариантах осуществления циклодекстрин, например, сульфоалкилэфир-β-циклодекстрин, присутствует в водном растворе, описанном в настоящем документе, в количестве 1, 2, 3, 5, 7, 10, 12, 20, 25, 30, 40% масс./масс. или более.
В некоторых вариантах осуществления циклодекстрин, например, сульфоалкилэфир-β-циклодекстрин, присутствует в водном растворе, описанном в настоящем документе, в количестве по меньшей мере 0,1, 0,2, 0,3, 0,5, 0,7, 1,2, 1,5, 2, 3, 4, 5, 6, 7, 8, 10 мг/л или более.
В некоторых вариантах осуществления молярное отношение нейроактивного стероида к циклодекстрину, например, сульфоалкилэфир-β-циклодекстрину, составляет приблизительно 0,1, 0,05, 0,03, 0,02, 0,01, 0,008, 0,005 или менее.
Усилители тоничности
Водный раствор или смесь нейроактивного стероида, описанные в настоящем документе, могут дополнительно содержать усилитель тоничности. Тоничность представляет собой эквивалент эффективного осмотического давления или относительную концентрацию растворов, которая определяет направление и степень диффузии. Тоничность может быть отрегулирована, если необходимо, обычно агентами, усиливающими тоничность. Такие агенты могут быть, например, ионного и/или неионнго типа. Примерами ионных усилителей тоничности являются галогениды щелочных или щелочно-замельных металлов, такие как, например, CaCl2, KBr, KCl, LiCl, NaI, NaBr или NaCl, Na2SO4 или борная кислота. Неионными агентами, усиливающими тоничность, являются, например, мочевина, глицерин, сорбит, маннит, пропиленгликоль или декстроза. Описанные водные растворы обычно доводят с помощью агентов тоничности до изотонических (например, от приблизительно 270 до приблизительно 300 мОсм/л, от приблизительно 275 до приблизительно 295 мОсм/л). В некоторых вариантах осуществления описанные водные растворы доводят с помощью агентов тоничности до осмолярности в диапазоне от приблизительно 150 до приблизительно 320 мОсм/л (например, от приблизительно 200 до приблизительно 300 мОсм/л). В некоторых вариантах осуществления водные растворы составляют менее приблизительно 320 мОсм/л (например, менее приблизительно 300, 290, 280, 270, 260, 250 мОсм/л).
В некоторых вариантах осуществления описанные водные растворы являются гипертоническими. Например, водные растворы могут быть гипертоническими (например, от приблизительно 900 до приблизительно 1000 мОсм/л). В некоторых вариантах осуществления водные растворы разбавляют водой для инъекций ("WFI", например, высокоочищенной водой без каких-либо добавленных компонентов; стерильным, непирогенным препаратом дистиллированной воды для инъекций без растворенных веществ), например, для получения изотонического или гипотонического раствора. В некоторых вариантах осуществления смесь разбавляют раствором NaCl (например, физиологическим раствором).
Консерванты
Водный раствор или смесь нейроактивного стероида, описанные в настоящем документе, могут содержать консерванты. Типичные консерванты включают противомикробные средства (например, тканевый активатор плазминогена, сарграмостим, интерлейкины, фенол, бензиловый спирт, метакрезол, парабены (метил, пропил, бутил), бензалкония хлорид, хлорбутанол, тимеросал, фенилртутные соли (ацетат, борат, нитрат)), бензалкония хлорид, бензетония хлорид, хлорбутанол, миристил гамма-пиколиния хлорид, 2-феноксиэтанол, тиомерсал, метилпарабен, пропилпарабен, бутилпарабен, этилендиамин, формальдегид.
Водный раствор или смесь нейроактивного стероида, описанные в настоящем документе, могут содержать антиоксиданты. Типичные антиоксиданты включают бисульфит натрия, соли сернистой кислоты, аскорбиновую кислоту и ее соли, ацетилцистеин, монотиоглицерин), ЭДТА, криопротекторные и лиопротекторные вещества (например, сахара (например, сахароза, трегалоза), аминокислоты (например, глицин, лизин), полимеры (например, жидкий полиэтиленгликоль или декстран), полиолы (например, маннит, сорбит).
Стерилизация
Водный раствор или смесь нейроактивного стероида, описанные в настоящем документе, могут потребовать стерилизации, например, перед введением. Композиции, описанные в настоящем документе, обеспечивают стабильность (например, химическую стабильность, физическую стабильность) в случае процессов стерилизации. В некоторых вариантах осуществления буферизованный раствор или смесь нейроактивного стероида являются стерильными. В некоторых вариантах осуществления водный раствор или смесь нейроактивного стероида стерилизуют посредством процесса асептической обработки (например, розлива в асептических условиях, асептической фильтрации). В некоторых вариантах осуществления водный раствор или смесь нейроактивного стероида стерилизуют с помощью терминальной стерилизации (например, нагреванием (например, сухим жаром или паровым автоклавом) или облучением (например, гамма-облучением). Композиции, описанные в настоящем документе (например, композиции, содержащие буфер согласно настоящему описанию) обеспечивают стабильность (например, химическую стабильность, физическую стабильность) в случае терминальной стерилизации (например, при температурных циклах от приблизительно 120°C до приблизительно 124°C, например, 121°C) или облучения.
Смешивание
Водный раствор или смесь нейроактивного стероида, описанные в настоящем документе, могут нуждаться в перемешивании, например, для получения гомогенных растворов или смесей. В некоторых вариантах осуществления изготовление буферизованного раствора или эмульсии нейроактивного стероида требует энергичного, высокоинтенсивного перемешивания с высоким усилием сдвига (перемешивание). Перемешивание может быть дополнено нагревом или быть без него. В некоторых вариантах нагревание смеси во время перемешивания может способствовать достижению эффективности смешивания и сократить время, необходимое для растворения или эмульгирования. Количество тепла (температура смеси) зависит от смешиваемой системы; но может быть ограничено эксплуатацией оборудования и физико-химической стабильностью смеси. В некоторых вариантах осуществления была найдена температура приблизительно 40°C, пригодная для облегчения получения продукта.
Перемешивание может обеспечиваться такими устройствами, как лопастные мешалки с высоким усилием сдвига, роторно-статорные смесители, гомогенизаторы, ультразвуковые устройства или микрофлюидизаторы. Энергичное, высокоинтенсивное перемешивание или смешивание с высоким усилием сдвига используют для перемешивания и смешивания двух взаимонерастворимых жидкостей или для облегчения растворения твердых частиц в носителе, чтобы сделать их целиком равномерными или однородными. Смесители с высоким усилием сдвига предназначены для индукции движения жидкости с другой скоростью относительно жидкости в смежной области. Растворение или эмульгирование могут быть достигнуты путем превращения одной из фаз продукта в состояние, состоящее из чрезвычайно мелких частиц, распределенных равномерно по всему объему другой жидкости.
Смешивание с помощью лопастей с высоким усилием сдвига может обеспечить достаточное перемешивание для растворения по некоторым вариантам осуществления раствора нейроактивного стероида или эмульгирования. Однако в некоторых вариантах осуществления продолжительность смешивания может быть слишком большой для практических производственных циклов. Перемешивание, обеспечиваемое роторно-статорными смесителями, гомогенизаторами, ультразвуковыми устройствами или микрофлюидизаторами, может ускорять и облегчать растворение, чтобы достичь времени практического производственного цикла. В некоторых вариантах нагревание смеси во время перемешивания может способствовать достижению эффективности смешивания и сократить время, необходимое для растворения или эмульгирования. Количество тепла (температура смеси) зависит от смешиваемой системы; но может быть ограничено эксплуатацией оборудования и физико-химической стабильностью смеси. В некоторых вариантах осуществления температура приблизительно 40°C облегчает получение продукта.
Смесители с высоким усилием сдвига, такие как роторно-статорные смесители, могут обеспечить достаточное перемешивание для растворения по некоторым вариантам осуществления раствора нейроактивного стероида или эмульгирования. Роторы/статоры с высоким усилием сдвига используют вращающуюся лопасть или высокоскоростной ротор, обычно приводимый в действие электродвигателем. Ротор вращается с очень высокой скоростью (например, от 2000 до 18000 об/мин) в смеси внутри неподвижного кольца (статора) для создания потока и сдвига. Всасывание создается из-за высокоскоростного вращения лопастей ротора внутри статора, затягивая смесь в центр роторно/статорного модуля. Высокоскоростная центробежная сила перемещает смесь в сторону периферии ротора к статору, где она подвергается измельчению из-за ограниченного зазора между ротором и статором. Смесь принудительно подвергается интенсивному гидравлическому сдвигу с высокой скоростью через перфорационные отверстия в статоре в смесительный сосуд. Влияние горизонтального (радиального) вытеснения и всасывания смеси в ротор/статор создает режим циркуляции в смесительном сосуде. Конструкция ротора и конструкция статора различаются по типам и конструкциям оборудования; и специалист в данной области может обнаружить, что многочисленные комбинации роторов и конструкций статора могут приемлемо функционировать. Размер роторно/статорного модуля будет определяться в зависимости от размера партии и желаемой продолжительности обработки. Расположение роторно/статорного модуля будет варьироваться в зависимости от конструкции оборудования, но некоторые варианты осуществления могут использовать роторно/статорный модуль, установленный на дне смесительного сосуда или около него. Может использоваться роторно/статорный модуль, установленный наверху, предназначенный для погружения в смесь. Роторно/статорный модуль, установленный снаружи сосуда для смешивания, куда смесь вводится и может быть инициировано ее прохождение или повторная циркуляции через роторно/статорную головку. Желаемая скорость ротора внутри статора обычно варьируется и может быть настроена для обеспечения желаемого потока и смешивания с высоким усилием сдвига в течение практических производственных циклов. Специалисты в данной области техники учтут, что окружная скорость ротора может быть использована для облегчения масштабирования размера роторно/статорного модуля при увеличении размера партии. В некоторых вариантах осуществления нагревание смеси во время перемешивания может способствовать достижению эффективности смешивания при высоком усилии сдвига и сократить время, необходимое для растворения или эмульгирования. Количество тепла (температура смеси) зависит от смешиваемой системы; но может быть ограничено эксплуатацией оборудования и физико-химической стабильностью смеси. В некоторых вариантах осуществления была найдена температура приблизительно 40°C, пригодная для облегчения получения продукта (например, водного раствора или смеси согласно настоящему описанию).
Смесительные устройства с высоким усилием сдвига, такие как гомогенизаторы, могут обеспечивать достаточное перемешивание для растворения по некоторым вариантам осуществления раствора нейроактивного стероида или эмульгирования. Гомогенизаторы обеспечивают высокое усилие сдвига, поскольку они работают для перекачивания смеси при высоком давлении (например, 1000-5000 фунтах на квадратный дюйм) в маленькую камеру, состоящую из седла клапана, ударного кольца и клапана. Смесь протекает под высоким давлением через область между клапаном и седлом клапана с высокой скоростью с помощью и под быстрым перепадом давления Быстрый перепад давления раздрабливает смесь кавитацией и ударом, возникающим при разрушении кавитационного пузырька. Затем смесь ударяет по ударному кольцу, вызывая дополнительное разрушение и сдвиг в смеси. Смесь выгружается в основной объем раствора. Могут быть использованы различные модули клапанов, относительное расположение эмульгатора к партии продукта, несколько модулей клапанов и оборудование с широким диапазоном мощностей. В некоторых вариантах осуществления нагревание смеси во время перемешивания может способствовать достижению эффективности смешивания при высоком усилии сдвига и сократить время, необходимое для растворения или эмульгирования. Количество тепла или контроль температуры процесса смешивания (температура смеси) зависит от смешиваемой системы; но может быть ограничено эксплуатацией оборудования и физико-химической стабильностью смеси. В некоторых вариантах осуществления была найдена температура приблизительно 40°C, пригодная для облегчения получения продукта (например, водного раствора или смеси согласно настоящему описанию).
Смесительные устройства с высоким усилием сдвига, такие как микрофлюидизаторы, могут обеспечивать достаточное перемешивание для растворения по некоторым вариантам осуществления раствора нейроактивного стероида или эмульгирования. Перемешивание с высоким усилием сдвига за счет микрофлюидизаторов вызвано перекачкой смеси при чрезвычайно высокой скорости при высоком давлении (например, от 2000 до 40000 фунтов на квадратный дюйм) через небольшие каналы в камеру взаимодействия. В камере взаимодействия смесь подвергается высокому сдвигу, турбулентности, ударам и кавитации. Все эти силы могут облегчить достижение эффективности смешивания при высоком усилии сдвига и сократить время, необходимое для растворения или эмульгирования. Могут использоваться различные модули камер взаимодействия, относительное расположение микрофлюидизатора к партии продукта и оборудование с широким диапазоном мощностей. Количество тепла или контроль температуры процесса смешивания (температура смеси) зависит от смешиваемой системы; но может быть ограничено эксплуатацией оборудования и физико-химической стабильностью смеси. В некоторых вариантах осуществления была найдена температура приблизительно 40°C, пригодная для облегчения получения продукта.
Смесительные устройства с высоким усилием сдвига, которые используют энергию ультразвука, могут обеспечить достаточное перемешивание для растворения по некоторым вариантам осуществления раствора нейроактивного стероида или эмульгирования. Высокое смещение сдвига за счет результатов ультразвуковой энергии обусловлено кавитацией и быстрым разрушением небольших пузырьков, образованных кавитацией. Эти силы могут облегчить достижение эффективности смешивания при высоком усилии сдвига и сократить время, необходимое для растворения или эмульгирования. Могут использоваться различные ультразвуковые модули, относительное расположение модуля ультразвуковой обработки к партии продукта и оборудование с широким диапазоном мощностей. Количество тепла или контроль температуры процесса смешивания (температура смеси) зависит от смешиваемой системы; но может быть ограничено эксплуатацией оборудования и физико-химической стабильностью смеси. В некоторых вариантах осуществления была найдена температура приблизительно 40°C, пригодная для облегчения получения продукта.
Контейнеры
Также в настоящем документе описаны контейнеры, которые содержат водный раствор или смесь, описанные в настоящем документе. Примеры контейнеров включают мешки (например, пластиковые или полимерные мешки, такие как ПВХ), флаконы (например, стеклянный флакон), бутылки или шприцы. В одном варианте осуществления контейнер выполнен с возможностью доставки раствора или смеси парентерально (например, внутримышечно или внутривенно).
В некоторых вариантах осуществления продукт, предназначенный для инъекций, упаковывается в герметичный стеклянный контейнер соответствующего размера. В некоторых вариантах осуществления продукт предназначен для разбавления перед инфузией и упаковывается в фармацевтический флакон или бутылку (например, подходящего размера, подходящий стеклянный или пластиковый флакон или бутылку). В некоторых вариантах осуществления продукт может быть получен готовым для инъекции и может быть упакован в предварительно заполненный шприц или другое устройство для впрыскивания (например, подходящего размера, подходящая стеклянная или пластиковая упаковка) или контейнер большого объема (например, подходящего размера, подходящий стеклянный или пластиковый контейнер), предназначенный для инфузии. В некоторых вариантах осуществления продукт предоставляется в контейнере, который не выщелачивается (например, не вносит (или не допускает рост) механические примеси или загрязнения в раствор.
Нейродегенеративные заболевания и расстройства
Растворы или смеси, описанные в настоящем документе, могут быть применены в способе, описанном в настоящем документе, например, в лечении расстройства, описанного в настоящем документе, такого как нейродегенеративное заболевание.
Термин "нейродегенеративное заболевание" включает в себя болезни и расстройства, которые связаны с постепенной потерей структуры или функции нейронов, или гибелью нейронов. Нейродегенеративные заболевания и расстройства включают, но не ограничиваются ими, болезнь Альцгеймера (включая сопутствующие симптомы легкой, умеренной или тяжелой когнитивной недостаточности); боковой амиотрофический склероз (БАС); аноксические и ишемические повреждения; атаксию и судороги (в том числе для лечения и предотвращения, и профилактики эпилептиформных припадков, вызванных шизоаффективным расстройством или лекарственными средствами, используемыми для лечения шизофрении); умеренную забывчивость; отек головного мозга; мозжечковую атаксию, включая синдром нейроакантоцитоза Мак-Лауда (MLS); закрытую травму черепа; кому; контузионные травмы (например, травму спинного мозга и травму головы); деменции, включая многоинфарктную деменцию и старческое слабоумие; расстройства сознания; Синдром Дауна; вызванный лекарственными средствами или вызванный лечением Паркинсонизм (например, вызванная нейролептиками острая акатизия, острая дистония, Паркинсонизм или поздняя дискинезия, злокачественный нейролептический синдром или вызванный лечением постуральный тремор); эпилепсию; синдром фрагильной Х-хромосомы; Синдром Жилля де ла Туретта; травму головы; нарушение и потерю слуха; болезнь Хантингтона; синдром Леннокса; вызванную приемом леводопы дискинезию; умственную отсталость; двигательные расстройства, в том числе акинезии и акинетические (ригидные) синдромы (включая кальцификацию базальных ядер головного мозга, кортикобазальную дегенерацию, множественную системную атрофию, комплекс БАС-Паркинсонизм-деменция, болезнь Паркинсона, постэнцефалитический паркинсонизм и прогрессирующий супрануклеарный паралич); мышечные спазмы и расстройства, связанные с мышечной спастичностью или слабостью, включая хорею (такую как доброкачественная наследственная хорея, индуцированная лекарственными средствами хорея, гемибаллизм, болезнь Хантингтона, нейроакантоцитоз, хорея Сиденхама и симптоматическая хорея), дискинезию (включая тики, такие как сложные тики, простые тики, а также симптоматические тики), миоклонус (включая генерализованный миоклонус и фокальный циклоклонус), тремор (например, остаточный тремор, постуральный тремор и интенционный тремор) и дистонию (включая аксиальную дистонию, дистонический графоспазм, гемиплегическую дистонию, пароксизмальную дистонию и фокальную дистонию, такую как блефароспазм, оромандибулярная дистония и спастическая дисфония и кривошея); повреждение нейронов, включая поражение зрения, ретинопатию или макулярную дегенерацию глаза; нейротоксическое повреждение, которое следует за мозговым инсультом, тромбоэмболическим инсультом, геморрагическим инсультом, церебральной ишемией, церебральным вазоспазмом, гипогликемией, амнезией, гипоксией, аноксией, перинатальной асфиксией и остановкой сердца; болезнь Паркинсона; судорожный припадок; эпилептический статус; инсульт; шум в ушах; тубулярный склероз, нейродегенерацию, индуцированную вирусной инфекцией (например, вызванную синдромом приобретенного иммунодефицита (СПИДом) и энцефалопатиями). Нейродегенеративные заболевания также включают, но не ограничиваются ими, нейротоксическое повреждение, которое следует за мозговым инсультом, тромбоэмболическим инсультом, геморрагическим инсультом, церебральной ишемией, церебральным вазоспазмом, гипогликемией, амнезией, гипоксией, аноксией, перинатальной асфиксией и остановкой сердца. Способы лечения или профилактики нейродегенеративного заболевания также включают в себя лечение или профилактику потери функции нейронов, характерной для нейродегенеративного расстройства.
Расстройства настроения
Растворы или смеси, описанные в настоящем документе, могут быть применены в способе, описанном в настоящем документе, например, в лечении расстройства, описанного в настоящем документе, такого как расстройство настроения.
Клиническая депрессия также известна как глубокая депрессия, большое депрессивное расстройство (БДР), тяжелая депрессия, монополярная депрессия, монополярное расстройство и рекуррентная депрессия, и относится к психическому расстройству, характеризующемуся остро ощущаемым и постоянным подавленным настроением, которое сопровождается низкой самооценкой и потерей интереса или удовольствия в обычно доставляемой удовольствие деятельности. Некоторые люди с клинической депрессией испытывают проблемы со сном, теряют вес и, как правило, чувствуют себя взволнованными и раздражительными. Клиническая депрессия влияет на то, как человек чувствует, думает и ведет себя, и может привести к различным эмоциональным и физическим проблемам. Люди с клинической депрессией могут иметь проблемы с повседневными действиями, и она заставляет человека чувствовать себя так, как будто жизнь не стоит того, чтобы жить.
Постнатальная депрессия (ПНД) также именуемая как послеродовая депрессия (ПРД) и относится к типу клинической депрессии, которая негативно воздействует на женщин после родов. Симптомы могут включать грусть, усталость, изменения в привычках сна и питания, снижение сексуального желания, случаи плача, беспокойство и раздражительность. В некоторых вариантах осуществления ПНД представляет собой устойчивую к лечению депрессию (например, устойчивую к лечению депрессию согласно настоящему описанию). В некоторых вариантах осуществления ПНД является рефрактерной депрессией (например, рефрактерной депрессией согласно настоящему описанию).
Атипичная депрессия (АД) характеризуется реактивностью настроения (например, парадоксальной ангедонией) и позитивностью, значительным увеличением веса или повышенным аппетитом. Пациенты, страдающие от АД, также могут иметь увеличенную продолжительность сна или сонливость (гиперсомнию), ощущение тяжести конечностей и значительное снижение социализации вследствие гиперчувствительности к мнимому межличностному отторжению.
Меланхолическая депрессия характеризуется потерей удовольствия (анхедонией) в большинстве или во всех видах деятельности, отказом реагировать на приятные раздражители, подавленным настроением, более выраженным, чем при печали или потери, чрезмерной потерей веса или чрезмерной виной.
Психотическая глубокая депрессия (ПГД) или психотическая депрессия относится к большому депрессивному эпизоду, в частности меланхолического характера, когда человек испытывает психотические симптомы, такие как бредовые идеи и галлюцинации.
Кататоническая депрессия относится к большой депрессии, характеризующейся нарушениями двигательного поведения и другими симптомами. Человек может стать немым и находиться в состоянии ступора, и либо является неподвижным, либо демонстрирует бесцельные или причудливые движения.
Сезонное аффективное расстройство (САД) относится к типу сезонной депрессии, когда человек имеет сезонный характер депрессивных эпизодов, которые появляются осенью или зимой.
Дистимия относится к состоянию, связанному с монополярной депрессией, когда выражены те же физические и когнитивные проблемы. Они не такие тяжелые и имеют тенденцию длиться дольше (например, по меньшей мере 2 года).
Двойная депрессия относится к довольно подавленному настроению (дистимии), которое длится по меньшей мере 2 года и прерывается периодами большой депрессии.
Депрессивное расстройство личности (ДРЛ) относится к расстройству личности с депрессивными особенностями.
Рекуррентная кратковременная депрессия (РКД) относится к состоянию, при котором люди имеют депрессивные эпизоды приблизительно раз в месяц, каждый эпизод длится 2 недели или менее и обычно менее 2-3 дней.
Малое депрессивное расстройство или малая депрессия относится к депрессии, в которой по меньшей мере 2 симптома присутствуют в течение 2 недель.
Биполярное расстройство или маниакальное депрессивное расстройство вызывает экстремальные колебания настроения, которые включают эмоциональные максимумы (мания или гипомания) и минимумы (депрессия). Во время периодов мании человек может чувствовать или вести себя аномально счастливо, энергично или раздражительно. Они часто делают плохо продуманные решения, мало обращая внимания на последствия. Потребность во сне обычно уменьшается. Во время периодов депрессии могут возникать плач, плохой зрительный контакт с другими и негативный взгляд на жизнь. Риск самоубийства среди лиц с расстройством высок, более 6% за 20 лет, в то время как нанесение себе увечий происходит в 30-40%. Другие проблемы психического здоровья, такие как тревожное расстройство и расстройство, вызванное употреблением психоактивных веществ, обычно связаны с биполярным расстройством.
Депрессия, вызванная хроническими заболеваниями, относится к депрессии, вызванной хроническими заболеваниями, такими как рак или хроническая боль, химиотерапия, хронический стресс.
Депрессия, устойчивая к лечению, относится к состоянию, при котором люди лечились от депрессии, но облегчение симптомов не происходит. Например, антидепрессанты или физиологическое консультирование (психотерапия) не облегчают симптомы депрессии у лиц с депрессией, устойчивой к лечению. В некоторых случаях люди с депрессией, устойчивой к лечению, облегчают симптомы, но возвращаются к прежнему состоянию. Рефрактерная депрессия возникает у пациентов, страдающих депрессией, которые устойчивы к стандартным фармакологическим методам лечения, включая трициклические антидепрессанты, MAOI, SSRI и ингибиторы двойного и тройного обратного захвата нейропередатчика и/или анксиолитические лекарственные средства, а также не фармакологическим методам лечения (например, психотерапии, электросудорожной терапии, стимуляции блуждающего нерва и/или транскраниальной магнитной стимуляции).
Суицидальность, суицидальные мысли, суицидальное поведение относятся к склонности человека совершить самоубийство. Суицидальная направленность мышления касается мыслей или необычной озабоченности самоубийством. Диапазон суицидальных мыслей существенно варьируется, например, от мимолетных мыслей до масштабных мыслей, детального планирования, имитаций действий, неполных попыток. Симптомы включают в себя разговоры о самоубийстве, получение средств для совершения самоубийства, отречение от социального контакта, поглощенность смертью, чувство попадания в ловушку или безнадежность в отношении ситуации, увеличение употребления алкоголя или наркотиков, рискованные или самоубийственные вещи, прощание с людьми как будто их больше не увидят.
Предменструальное дисфорическое расстройство (ПМДР) относится к тяжелому, порой лишающему трудоспособности продолжению предменструального синдрома (ПМС). ПМДР вызывает чрезмерное изменение настроения с симптомами, которые обычно начинаются за семь-десять дней до начала менструального цикла женщины и продолжаются в течение первых нескольких дней менструального цикла женщины. Симптомы включают грусть или безнадежность, беспокойство или напряжение, чрезвычайную переменчивость настроения и выраженную раздражительность или гнев.
Симптомы депрессии включают постоянные тревожные или грустные чувства, чувство беспомощности, безнадежность, пессимизм, чувство бесполезности, упадок сил, беспокойство, раздражительность, утомительность, потерю интереса к приятным занятиям или увлечениям, отсутствие позитивных мыслей или планов, чрезмерную сонливость, переедание, потерю аппетита, бессонницу, причинение себе вреда, мысли о самоубийстве и попытки самоубийства. Наличие, тяжесть, частота и продолжительность симптомов могут варьироваться в зависимости от конкретного случая. Симптомы депрессии и ее облегчение могут быть установлены врачом или психологом (например, с помощью изучения психического состояния).
Тревожные расстройства
Растворы или добавки, описанные в настоящем документе, могут быть применены в способе, описанном в настоящем документе, например, в лечении расстройства, описанного в настоящем документе, такого как тревожное расстройство.
Тревожное расстройство представляет собой общий термин, охватывающий несколько различных форм аномального и патологического страха и тревоги. Существующие психиатрические диагностические критерии выявляют большое разнообразие тревожных расстройств.
Генерализованное тревожное расстройство является распространенным хроническим заболеванием, характеризующимся длительной тревожностью, которая не фокусируется ни на одном объекте или ситуации. Лица, страдающие от генерализованной тревоги, испытывают неспецифический постоянный страх и беспокойство и чрезмерно озабочены повседневными делами. Генерализованное тревожное расстройство является наиболее распространенным тревожным расстройством, влияющим на пожилых людей.
При паническом расстройстве человек страдает от кратковременных приступов сильного ужаса и опасений, часто отмеченных тремором, дрожью, спутанностью сознания, головокружением, тошнотой, затрудненным дыханием. Эти панические атаки, определенные APA как страх или дискомфорт, которые внезапно возникают и достигают пика менее чем за десять минут, могут длиться несколько часов и могут быть вызваны стрессом, страхом или даже физическими упражнениями; хотя конкретная причина не всегда очевидна. В дополнение к рекуррентным неожиданным паническим атакам диагноз панического расстройства также требует, чтобы упомянутые атаки имели хронические последствия: либо беспокойство о потенциальных последствиях атак, постоянный страх перед будущими атаками, либо значительные изменения в поведении, связанные с атаками. Соответственно, те, кто страдает от панического расстройства, испытывают симптомы даже вне конкретных эпизодов паники. Часто страдающие паникой замечают нормальные изменения в сердцебиении, что заставляет их думать, что что-то не в порядке с их сердцем или у них начинается другая паническая атака. В некоторых случаях повышенное внимание (сверхнастороженность) к функционированию организма происходит во время панических атак, причем любое воспринимаемое физиологическое изменение интерпретируется как возможное опасное для жизни заболевание (например, крайняя ипохондрия).
Обсессивно-компульсивное расстройство представляет собой тип тревожного расстройства, в первую очередь характеризующегося повторяющимися навязчивыми идеями (тревожными, настойчивыми и навязчивыми мыслями или образами) и непреодолимыми влечениями (побуждает выполнять конкретные действия или ритуалы). Образ мышления ОКР можно сравнить с суевериями, поскольку он связан с верой в причинную связь, где на самом деле ее не существует. Часто процесс совершенно нелогичен; например, принуждение ходить определенным образом может быть использовано для облегчения навязчивой идеи о неминуемом негативном воздействии. И во многих случаях принуждение совершенно необъяснимо, просто желание завершить ритуал, вызванный нервозностью. В меньшем числе случаев страдающие ОКР могут испытывать только одержимость, без явных понуждений; гораздо меньшее количество страдающих испытывают только понуждения.
Самой большой категорией тревожных расстройств является категория фобий, которая включает в себя все случаи, когда страх и тревога вызваны конкретным стимулом или ситуацией. Страдающие обычно ожидают ужасающих последствий от столкновения с объектом своего страха, который может быть чем угодно от животного до места или до телесной жидкости.
Посттравматическое стрессовое расстройство или ПТСР представляет собой тревожное расстройство, которое возникает в результате травматического переживания. Посттравматический стресс может возникнуть в результате чрезвычайной ситуации, такой как боевые действия, изнасилование, захват заложников или даже серьезная авария. Это также может быть следствием длительного (хронического) воздействия тяжелого фактора, вызывающего стресс, например, солдаты, которые переносят отдельные сражения, но не могут справиться с непрерывным боем. Общие симптомы включают воспоминания, реакцию избегания и депрессию.
Расстройства пищевого поведения
Растворы или смеси, описанные в настоящем документе, могут быть применены в способе, описанном в настоящем документе, например, в лечении расстройства, описанного в настоящем документе, такого как расстройство пищевого поведения. Нарушения пищевого поведения характеризуются нарушениями в пищевом поведении и регуляцией веса и связаны с широким спектром неблагоприятных психологических, физических и социальных последствий. Человек с расстройством пищевого поведения может начать употреблять меньше или больше пищи, но в какой-то момент их желание есть меньше или больше выходит из-под контроля. Нарушения пищевого поведения могут быть охарактеризованы тяжелым дистрессом или заботой о массе тела или форме, или крайними усилиями по регулированию веса или приема пищи. Нарушения пищевого поведения включают нервную анорексию, нервную булимию, компульсивное переедание, кахексию и их варианты.
Лица с нервной анорексией обычно видят себя с избыточным весом, даже когда они имеют недостаточный вес. Лица с нервной анорексией могут стать одержимы приемом пищи, едой и контролем веса. Лица с нервной анорексией обычно постоянно взвешиваются, тщательно разделяют пищу на части и едят очень небольшое количество только определенных продуктов. Лица с нервной анорексией могут заниматься компульсивным перееданием, с последующей жесткой диетой, чрезмерными упражнениями, самоиндуцированной рвотой или злоупотреблением слабительными, диуретиками или клизмами. Симптомы включают чрезвычайно низкую массу тела, серьезное ограничение питания, неустанное стремление к худобе и нежелание поддерживать нормальный или здоровый вес, сильное опасение прибавить в весе, искаженное ощущение своего тела и самомнение, на которое сильно влияют субъективная оценка веса и формы тела, или отрицание серьезности низкой массы тела, отсутствие менструации среди девочек и женщин. Другие симптомы включают истончение костей, хрупкие волосы и ногти, сухую и желтоватую кожу, рост тонких волос по всему телу, легкую анемию, потерю мышц и слабость, тяжелые запоры, низкое кровяное давление или замедленное дыхание и пульс, нарушение структуры и функции сердца, повреждение головного мозга, полиорганную недостаточность, снижение внутренней температуры тела, заторможенность, вялость и бесплодие.
Люди с нервной булимией имеют рекуррентные и частые эпизоды употребления необычно большого количества пищи и отсутствие контроля над этими эпизодами. За перееданием следует поведение, которое компенсирует переедание, такое как принудительная рвота, чрезмерное употребление слабительных средств или диуретиков, голодание, чрезмерная физическая нагрузка или комбинация этих поведений.
В отличие от нервной анорексии, люди с нервной булимией обычно поддерживают то, что считается здоровым или нормальным весом, в то время как некоторые из них имеют избыточный вес. Но, как и люди с нервной анорексией, они, как правило, боятся набирать вес, хотят отчаянно терять вес и недовольны своим размером и формой тела. Обычно булимическое поведение происходит тайно, потому что оно часто сопровождается чувством отвращения или стыда. Цикл переедания и приема слабительного средства может происходить где угодно от нескольких раз в неделю до многих раз в день. Другие симптомы включают хроническое воспаление и боль в горле, опухшие слюнные железы в области шеи и челюсти, изношенную зубную эмаль и все более чувствительные и гниющие зубы в результате воздействия кислоты желудка, кислотный рефлюкс и другие желудочно-кишечные заболевания, интестинальное расстройство и раздражение от злоупотребления слабительным, сильное обезвоживание из-за очищения от жидкостей, электролитный дисбаланс (что может привести к сердечному приступу или инсульту).
Люди с компульсивным перееданием теряют контроль над приемом пищи. В отличие от нервной булимии, периоды переедания не сопровождаются компенсаторным поведением, таким как применение слабительного, чрезмерная физическая нагрузка или голодание. Люди с компульсивным перееданием часто имеют избыточный вес или ожирение. Люди с ожирением с компульсивным перееданием подвергаются более высокому риску развития сердечно-сосудистых заболеваний и высокого кровяного давления. Они также испытывают чувство вины, стыда и страдания от их переедания, что может привести к большему перееданию.
Кахексия также известна как "синдром истощения" и является проблемой, связанной с едой, которую испытывают многие раковые больные. Люди с кахексией могут продолжать нормально питаться, но их организм может отказаться от использования витаминов и питательных веществ, которые он принимает внутрь, или они теряют аппетит и перестают есть. Когда человек испытывает потерю аппетита и прекращает есть, можно считать, что у него развитая нервная анорексия.
Эпилепсия
Растворы или смеси, описанные в настоящем документе, могут быть применены в способе, описанном в настоящем документе, например, в лечении расстройства, описанного в настоящем документе, такого как эпилепсия, эпилептический статус или судорожный припадок, например, как описано в WO2013/112605 и WO/2014/031792, содержание которых включено в настоящую заявку во всей своей полноте.
Эпилепсия представляет собой расстройство головного мозга, характеризующееся повторяющимися судорожными припадками с течением времени. Типы эпилепсии могут включать в себя, но не ограничиваются ими, генерализованную эпилепсию, например, детскую абсансную эпилепсию, ювенальную миоклоническую эпилепсию, эпилепсию с генерализованными тонико-клоническими судорогами при пробуждении, синдром Веста, синдром Леннокса-Гасто, парциальную эпилепсию, например, эпилепсию височной доли, эпилепсию лобной доли, доброкачественную фокальную эпилепсию у детей.
Эпилептический статус (ЭС)
Эпилептический статус (ЭС) может включать, например, судорожный эпилептический статус, например, ранний эпилептический статус, постоянный эпилептический статус, рефрактерный эпилептический статус, супер-рефрактерный эпилептический статус; несудорожный эпилептический статус, например, генерализованный эпилептический статус, комплексный парциальный эпилептический статус; генерализованные периодические эпилептиформные разряды; и периодические латеральные эпилептиформные разряды. Судорожный эпилептический статус характеризуется наличием судорожных эпилептических припадков статусного течения и может включать ранний эпилептический статус, постоянный эпилептический статус, рефрактерный эпилептический статус, супер-рефрактерный эпилептический статус. Ранний эпилептический статус лечится терапией первой линии. Постоянный эпилептический статус характеризуется эпилептическими припадками статусного течения, которые сохраняются, несмотря на лечение терапией первой линии, и вводят вторую линию терапии. Рефрактерный эпилептический статус характеризуется эпилептическими припадками статусного течения, которые сохраняются, несмотря на лечение с помощью терапии первой линии и второй линии, и обычно вводят общий анестетик. Супер-рефрактерный эпилептический статус характеризуется эпилептическими припадками статусного течения, которые сохраняются, несмотря на лечение терапией первой линией, терапией второй линии и общей анестезией в течение 24 часов или более.
Несудорожный эпилептический статус может включать, например, фокальный несудорожный эпилептический статус, например, комплексный парциальный несудорожный эпилептический статус, простой парциальный несудорожный эпилептический статус, слабовыраженный несудорожный эпилептический статус; генерализованный несудорожный эпилептический статус, например, абсансный несудорожный эпилептический статус с поздним началом, атипичный абсансный несудорожный эпилептический статус или типичный абсансный несудорожный эпилептический статус.
Композиции, описанные в настоящем документе, также могут быть введены в качестве профилактического средства субъекту, имеющему расстройство ЦНС, например, травматическое повреждение головного мозга, эпилептический статус, например, судорожный эпилептический статус, например ранний эпилептический статус, постоянный эпилептический статус, рефрактерный эпилептический статус, супер-рефрактерный эпилептический статус; несудорожный эпилептический статус, например, генерализованный эпилептический статус, комплексный парциальный эпилептический статус; генерализованные периодические эпилептиформные разряды; и периодические латеральные эпилептиформные разряды; до наступления судорожного припадка.
Судорожный припадок
Судорожный припадок представляет собой физические показатели или изменения в поведении, которые происходят после эпизода аномальной электрической активности в головном мозге. Термин "судорожный припадок" часто используется взаимозаменяемо с "судорогой". Судороги - это когда тело человека дрожит быстро и непроизвольно. Во время судорог мышцы человека постоянно сокращаются и расслабляются.
Основываясь на типе поведения и активности мозга, судорожные припадки делятся на две широкие категории: генерализованные и парциальные (также называемые локальными или фокальными). Классификация типа судорожного припадка помогает врачам диагностировать, имеет ли пациент эпилепсию.
Генерализованные судорожные припадки генерируются электрическими импульсами по всему мозгу, тогда как парциальные судорожные припадки генерируются (по меньшей мере изначально) электрическими импульсами в относительно небольшой части мозга. Часть мозга, генерирующую судорожные припадки, иногда называют очагом.
Существует шесть типов генерализованных судорожных припадков. Наиболее распространенным и существенным и, следовательно, самым известным, является генерализованная судорога, также называемая большим эпилептическим припадком. При этом типе судорожного припадка пациент теряет сознание и обычно падает. Потеря сознания сопровождается генерализованным одеревенением тела (называемым "тонической" фазой судорожного припадка) в течение 30-60 секунд, затем резким судорожным дерганьем ("клонической" фазой) в течение 30-60 секунд, после чего пациент переходит в глубокий сон ("постикальная" или послесудорожная фаза). Во время больших эпилептических припадков могут произойти травмы и несчастные случаи, такие как прикусывания языка и недержание мочи.
Абсансные припадки вызывают кратковременную потерю сознания (всего несколько секунд) с небольшим количеством или отсутствием симптомов. Пациент, чаще всего ребенок, обычно прерывает деятельность и безучастно пристально смотрит. Эти приступы начинаются и заканчиваются внезапно и могут возникать несколько раз в день. Пациенты обычно не знают, что у них приступ, за исключением того, что они могут знать о "потере времени".
Миоклонические судорожные припадки состоят из спорадических подергиваний, обычно по обеим сторонам тела. Пациенты иногда описывают подергивания как кратковременные электрические удары. Когда они сильные, эти припадки могут привести к падению или невольному бросанию предметов.
Клонические припадки представляют собой повторяющиеся, ритмические судорожные движения, в которые вовлечены обе сторонами тела одновременно.
Тонические припадки характеризуются одеревенением мышц.
Атонические припадки состоят из внезапной и общей потери мышечного тонуса, особенно в руках и ногах, что часто приводит к падению.
Приступы, описанные в настоящем документе, могут включать эпилептические припадки; острые повторяющиеся судорожные припадки; кластерные судорожные припадки; непрерывные судорожные припадки; непрекращающиеся судорожные припадки; длительные судорожные припадки; рекуррентные судорожные припадки; эпилептические припадки статусного течения, например, рефрактерный судорожный эпилептический статус, несудорожные эпилептические припадки статусного течения; рефрактерные судорожные припадки; миоклонические судорожные припадки; тонические припадки; тонико-клонические припадки; простые парциальные судорожные припадки; сложные парциальные судорожные припадки; вторично генерализованные судорожные припадки; атипичные абсансные припадки; абсансные припадки; атонические припадки; доброкачественные припадки Роландика; фебрильные судорожные припадки; эмоциональные судорожные припадки; фокальные судорожные припадки; эпилептические припадки смеха; судорожные припадки с генерализованным началом; инфантильные спазмы; джексоновскую эпилепсию; массивные билатеральные миоклонические приступы; мультифокальные судорожные припадки; судорожные припадки с неонатальным началом; ночные судорожные припадки; припадки затылочной доли мозга; посттравматические припадки; слабовыраженные судорожные припадки; припадки Сильвана; зрительные рефлекторные эпилептические припадки; или судорожные припадки, вызванные синдромом отмены.
Тремор
Растворы или смеси, описанные в настоящем документе, могут быть применены в способе, описанном в настоящем документе, например, в лечении расстройства, описанного в настоящем документе, такого как тремор.
Тремор представляет собой непроизвольное, порой ритмичное, сокращение мышц и расслабление, которое может включать в себя колебания или подергивание одной или нескольких частей тела (например, руки, руки, глаза, лица, головы, голосовых связок, туловища, ног).
Мозжечковое дрожание или интенционное дрожание представляет собой медленный, широкий тремор конечностей, возникающий после целенаправленного движения. Мозжечковое дрожание вызвано метастазами в мозжечке или повреждением мозжечка, возникающим, например, из-за опухоли, инсульта, заболевания (например, рассеянного склероза, наследственного дегенеративного расстройства).
Дистонический тремор возникает у лиц, страдающих дистонией, двигательным расстройством, при котором длительные непроизвольные сокращения мышц вызывают скручивание и повторяющиеся движения и/или болезненные и аномальные положения тела или позы. Дистонический тремор может затрагивать любую мышцу в организме. Дистонические тремор происходит нерегулярно и часто может быть ослаблен полным отдыхом.
Эссенциальный тремор или доброкачественный эссенциальный тремор является наиболее распространенным типом тремора. Эссенциальный тремор может быть мягким и непрогрессивным у некоторых и может медленно прогрессировать, начиная с одной стороны тела, но задействует обе стороны в течение 3 лет. Чаще всего задействованы руки, но также могут быть задействованы голова, голос, язык, ноги и туловище. Частота тремора может уменьшаться по мере возраста человека, но серьезность может увеличиться. Повышенная эмоция, стресс, лихорадочное состояние, физическое истощение или низкий уровень сахара в крови могут вызвать тремор и/или увеличить его тяжесть.
Ортостатический тремор характеризуется быстрыми (например, более 12 Гц) ритмическими сокращениями мышц, которые возникают в ногах и туловище сразу после стояния. Судороги ощущаются в бедрах и ногах, и пациент может непроизвольно дрожать, когда его просят встать на одном месте. Ортостатический тремор может возникать у пациентов с эссенциальным тремором.
Паркинсонический тремор вызван повреждением структур в мозге, которые контролируют движение. Паркинсонический тремор часто является предшественником болезни Паркинсона и обычно рассматривается как действие рук по типу "перекатывания пилюль", который также может задействовать подбородок, губы, ноги и туловище. Начало паркинсонического тремора обычно начинается после 60 лет. Движение начинается с одной конечности или с одной стороны тела и может прогрессировать с вовлечением другой стороны.
Физиологический тремор может возникать у нормальных людей и не имеет клинического значения. Это можно увидеть во всех произвольных группах мышц. Физиологический тремор может быть вызван определенными лекарственными средствами, алкоголем или медицинским состоянием, включая сверхактивную щитовидную железу и гипогликемию. Тремор классически имеет частоту приблизительно 10 Гц.
Психогенный тремор или истерический тремор может возникать в покое или во время постурального или кинетического движения. Пациент с психогенным тремором может иметь конверсионное расстройство или другое психическое заболевание.
Рубральный тремор характеризуется крупноволновым медленным тремором, который может присутствовать в состоянии покоя, в положении тела и с интенцией. Тремор связан с состояниями, которые влияют на красное ядро в среднем мозге, классические необычные толчки.
Анестезия/седация
Растворы или смеси, описанные в настоящем документе, могут быть применены в способе, описанном в настоящем документе, например, для индукции анестезии или седации. Анестезия представляет собой фармакологически индуцированное и обратимое состояние амнезии, обезболивания, потери реакции, потери рефлексов скелетных мышц, снижения реакции на стресс или все это одновременно. Эти эффекты могут быть получены от одного лекарственного средства, которое само по себе обеспечивает правильное сочетание эффектов, или иногда с помощью комбинации лекарственных средств (например, гипнотических средств, седативных средств, паралитиков, анальгетиков) для достижения очень специфических комбинаций результатов. Анестезия позволяет пациентам переносить операции и другие процедуры без дистресса и боли, которые они могли бы испытывать в противном случае.
Седация представляет собой снижение раздражительности или возбуждения путем введения фармакологического средства, как правило, для облегчения медицинской процедуры или диагностической процедуры.
Седация и обезболивание включают комплекс состояний сознания, начиная от минимальной седации (анксиолиз) до общей анестезии.
Минимальная седация также известна как анксиолиз. Минимальная седация представляет собой обусловленное действием лекарственного средства состояние, в течение которого пациент обычно реагирует на словесные команды. Когнитивные функции и координация могут быть нарушены. Дыхательные и сердечно-сосудистые функции обычно не затрагиваются.
Умеренная седация/аналгезия (седация с сохранением сознания) представляет собой обусловленное действием лекарственного средства угнетение сознания, во время которого пациент целенаправленно отвечает на словесную команду либо самостоятельно, либо с приложением легкой тактильной стимуляции. Обычно не требуется никаких вмешательств для поддержания свободной проходимости дыхательных путей. Спонтанная вентиляция обычно достаточна. Обычно сохраняется сердечно-сосудистая функция.
Глубокая седация/аналгезия представляет собой обусловленное действием лекарственного средства угнетение сознания, во время которого пациент не может легко реагировать на внешние раздражители, но целенаправленно реагирует (не рефлекторное одергивание от болезненного стимула) после повторной или болезненной стимуляции. Независимая дыхательная функция может быть нарушена, и пациенту может потребоваться помощь в поддержании свободной проходимости дыхательных путей. Спонтанная вентиляция может быть недостаточной. Обычно сохраняется сердечно-сосудистая функция.
Общая анестезия представляет собой обусловленную действием лекарственного средства потерю сознания, во время которой пациент не реагирует на внешние раздражители, даже на болезненные раздражители. Способность поддерживать независимую дыхательную функцию часто нарушается, и часто требуется помощь для поддержания свободной проходимости дыхательных путей. Может потребоваться вентиляция с положительным давлением из-за угнетения спонтанной вентиляции или обусловленного действием лекарственного средства угнетения нервно-мышечной функции. Сердечно-сосудистая функция может быть нарушена.
Седация в отделении интенсивной терапии (ОИТ) позволяет снизить уровень восприятия пациентов окружающей среды и уменьшить их ответ на внешние раздражители. Она может играть определенную роль в лечении критически больного пациента и охватывает широкий спектр контроля симптомов, которые будут изменяться среди пациентов и у отдельных людей в ходе их болезни. Тяжелую седацию в интенсивной терапии использовали для облегчения толерантности к эндотрахеальной трубке и синхронизации аппарата ИВЛ, часто с использованием нервно-мышечных блокаторов.
В некоторых вариантах осуществления седация (например, долгосрочная седация, непрерывная седация) индуцируется и поддерживается в ОИТ в течение длительного периода времени (например, 1 дня, 2 дней, 3 дней, 5 дней, 1 недели, 2 недель, 3 недель, 1 месяца, 2 месяцев). Средства для долгосрочной седации могут иметь большую продолжительность действия. Седативные средства в ОИТ могут иметь короткий период полувыведения.
Процедурная седация и обезболивание, также именуемые как седация с сохранением сознания, представляют собой метод введения седативных средств или диссоциативных средств совместно с анальгетиками или без них, чтобы вызвать состояние, которое позволяет субъекту переносить неприятные процедуры при сохранении кардиореспираторной функции.
Способы введения
Водный раствор или смесь, описанные в настоящем документе, содержащие терапевтически эффективное количество нейроактивного стероида, циклодекстрина и буфера, могут быть введены парентерально (например, интраназально, буккально, внутривенно или внутримышечно, например, внутримышечная инъекция (в/м) или внутривенно).
В одном варианте осуществления водный раствор или смесь, содержащие нейроактивный стероид, вводят в дозе, эквивалентной парентеральному введению нейроактивного стероида от приблизительно 0,1 нг до приблизительно 100 г на кг массы тела, от приблизительно 10 нг до приблизительно 50 г на кг массы тела, от приблизительно 100 нг до приблизительно 1 г на кг массы тела, от приблизительно 1 мкг до приблизительно 100 мг на кг массы тела, от приблизительно 10 мкг до примерно 10 мг на кг массы тела, от приблизительно 100 мкг до приблизительно 5 мг на кг массы тела, от приблизительно 250 мкг до приблизительно 3 мг на кг массы тела, от приблизительно 500 мкг до приблизительно 2 мг на кг массы тела, от приблизительно 1 мкг до приблизительно 50 мг на кг массы тела, от приблизительно 1 мкг до приблизительно 500 мкг на кг массы тела; и от приблизительно 1 мкг до приблизительно 50 мкг на кг массы тела. Альтернативно, количество водного раствора или смеси, содержащих нейроактивный стероид, вводимое для достижения терапевтической эффективной дозы, составляет приблизительно 0,1 нг, 1 нг, 10 нг, 100 нг, 1 мкг, 10 мкг, 100 мкг, 1 мг, 1,5 мг, 2 мг, 3 мг, 4 мг, 5 мг, 6 мг, 7 мг, 8 мг, 9 мг, 10 мг, 11 мг, 12 мг, 13 мг, 14 мг, 15 мг, 16 мг, 17 мг, 18 мг, 19 мг, 20 мг, 30 мг, 40 мг, 50 мг, 60 мг, 70 мг, 80 мг, 90 мг, 100 мг, 500 мг на кг массы тела или более нейроактивного стероида.
В одном варианте осуществления водный раствор или смесь, содержащие нейроактивный стероид, вводят в виде внутривенного болюсного вливания в дозе, эквивалентной парентеральному введению нейроактивного стероида от приблизительно 0,1 нг до приблизительно 100 г на кг массы тела, от приблизительно 10 нг до приблизительно 50 г на кг массы тела, от приблизительно 100 нг до приблизительно 1 г на кг массы тела, от приблизительно 1 мкг до приблизительно 100 мг на кг массы тела, от приблизительно 1 мкг до приблизительно 50 мг на кг массы тела, от приблизительно 10 мкг до приблизительно 5 мг на кг массы тела, от приблизительно 100 мкг до приблизительно 500 мкг на кг массы тела, от приблизительно 100 мкг до приблизительно 400 мкг на кг массы тела, от приблизительно 150 мкг до приблизительно 350 мкг на кг массы тела, от приблизительно 250 мкг до приблизительно 300 мкг на кг массы тела. В одном варианте осуществления водный раствор или смесь, содержащие нейроактивный стероид, вводят в виде внутривенного болюсного вливания в дозе, эквивалентной парентеральному введению нейроактивного стероида от приблизительно 100 до приблизительно 400 мкг/кг. В некоторых вариантах осуществления водный раствор или смесь, содержащие нейроактивный стероид, вводят в виде внутривенного болюсного вливания с содержанием нейроактивного стероида от приблизительно 150 до приблизительно 350 мкг/кг. В некоторых вариантах осуществления водный раствор или смесь, содержащие нейроактивный стероид, вводят в виде внутривенного болюсного вливания с содержанием нейроактивного стероида от приблизительно 250 до приблизительно 300 мкг/кг. В конкретных вариантах осуществления водный раствор или смесь, содержащие нейроактивный стероид, вводят в виде внутривенного болюсного вливания в дозе, эквивалентной приблизительно 100 мкг/кг, 125 мкг/кг, 150 мкг/кг, 175 мкг/кг, 200 мкг/кг, 225 мкг/кг, 250 мкг/кг, 260 мкг/кг, 270 мкг/кг, 280 мкг/кг, 290 мкг/кг, 300 мкг/кг, 325 мкг/кг или 350 мкг/кг нейроактивного стероида.
В одном варианте осуществления водный раствор или смесь, содержащие нейроактивный стероид, вводят в виде внутривенного болюсного вливания в дозе, эквивалентной парентеральному введению нейроактивного стероида от приблизительно 0,1 нмоль/л до приблизительно 100 мкмоль/л на кг массы тела, от приблизительно 1 нмоль/л до приблизительно 10 мкмоль/л на кг массы тела, от приблизительно 10 нмоль/л до приблизительно 10 мкмоль/л на кг массы тела, от приблизительно 100 нмоль/л до приблизительно 10 мкмоль/л на кг массы тела, от приблизительно 300 нмоль/л до приблизительно 5 мкмоль/л на кг массы тела, от приблизительно 500 нмоль/л до приблизительно 5 мкмоль/л на кг массы тела и от приблизительно 750 нмоль/л до приблизительно 1 мкмоль/л на кг массы тела. Альтернативно, количество водного раствора или смеси, содержащих нейроактивный стероид, вводимое для достижения терапевтической эффективной дозы, составляет приблизительно 0,1 нг, 1 нг, 10 нг, 100 нг, 1 мкг, 10 мкг, 100 мкг, 1 мг, 1,5 мг, 2 мг, 3 мг, 4 мг, 5 мг, 6 мг, 7 мг, 8 мг, 9 мг, 10 мг, 11 мг, 12 мг, 13 мг, 14 мг, 15 мг, 16 мг, 17 мг, 18 мг, 19 мг, 20 мг, 21 мг, 22 мг, 23 мг, 24 мг, 25 мг, 26 мг, 27 мг, 28 мг, 29 мг, 30 мг, 40 мг, 50 мг, 60 мг, 70 мг, 80 мг, 90 мг, 100 мг, 500 мг на кг массы тела или более нейроактивного стероида.
В некоторых вариантах осуществления водный раствор или смесь, содержащие нейроактивный стероид, могут быть введены один или несколько раз в день. Продолжительность лечения может составлять, например, один раз в день в течение приблизительно 1, 2, 3, 4, 5, 6, 7 дней или более. В некоторых вариантах осуществления вводят либо разовую дозу в виде индивидуальной единичной дозы, либо нескольких меньших единичных доз, либо путем многократных введений разделенных доз с определенными интервалами. Например, единичную дозу можно вводить через период времени от приблизительно 0 часов до приблизительно 1 часа, от приблизительно 1 часа до приблизительно 24 часов, от приблизительно 1 часа до приблизительно 72 часов, от приблизительно 1 часа до приблизительно 120 часов или от приблизительно 24 часов до по меньшей мере приблизительно 120 часов после травмы. Альтернативно, единичную дозу можно вводить через приблизительно 0,5, 1, 1,5, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 30, 40, 48, 72, 96, 120 часов или более после травмы. Последующие единичные дозы можно вводить через любое время после первоначального введения так, чтобы достигался терапевтический эффект. Например, можно вводить дополнительные единичные дозы для защиты субъекта от вторичной волны отека, который может возникать в течение первых нескольких дней после травмы.
В некоторых вариантах осуществления введение водного раствора или смеси, содержащих нейроактивный стероид, включает в себя период времени, в течение которого происходит отказ от введения.
В контексте настоящего описания термин "отказ" или "доза отказа" относится к протоколу введения, который уменьшает дозу введения пациенту и, таким образом, приводит к постепенному сокращению и окончательному удалению водного раствора или смеси, содержащих нейроактивный стероид, либо в течение фиксированного периода времени, либо в течение времени, определенного эмпирически по результатам оценки врача, основанной на регулярном наблюдении терапевтического ответа субъекта. Период отказа от введения может составлять приблизительно 12, 24, 36, 48 часов или долее. Альтернативно, период отказа от введения может составлять приблизительно от 1 до 12 часов, от приблизительно 12 до приблизительно 48 часов или от приблизительно 24 до приблизительно 36 часов. В некоторых вариантах осуществления период отказа от введения составляет приблизительно 24 часа.
Применяемый отказ может быть "линейным" отказом. Например, "10%" линейный отказ от 500 мг будет составлять 500, 450, 400, 350, 300, 250, 200, 150, 100, 50. В качестве альтернативы можно использовать экспоненциальный отказ, что, если в качестве примера используется приведенная выше программа, экспоненциальный отказ представлял бы собой, например, 500, 450, 405, 365, 329, 296, 266, 239 и т.д. Соответственно, приблизительно 5%, 10%, 15%, 20%, 25%, 30%, 35% или 40% линейный или экспоненциальный отказ может быть использован в способах по изобретению. Кроме того, может быть использован линейный или экспоненциальный отказ приблизительно от 1 до 5%, приблизительно от 6% до 10%, приблизительно от 11% до 15%, приблизительно от 16% до 20%, приблизительно от 21% до 25%, приблизительно от 26% до 30%, приблизительно от 31% до 35%, приблизительно от 36% до 40%.
В других вариантах осуществления введение водного раствора или смеси, содержащей нейроактивный стероид, включает в себя конечный период времени, в течение которого введение нейроактивного стероида постепенно снижается.
В контексте настоящего описания термин "введение с постепенным снижением", "постепенно снижаемая доза" и "постепенное снижение дозы" относится к протоколу введения, который уменьшает дозу введения пациенту и, таким образом, обеспечивает постепенное снижение и возможное удаление водного раствора или смеси, содержащих нейроактивный стероид, либо в течение фиксированного периода времени, либо в течение времени, определенного эмпирически по результатам оценки врача, основанной на регулярном наблюдении терапевтического ответа субъекта. Период постепенно снижающегося введения может составлять приблизительно 12, 24, 36, 48 часов или более. Альтернативно, период постепенно снижающегося введения может составлять приблизительно от 1 до 12 часов, от приблизительно 12 до приблизительно 48 часов или от приблизительно 24 до приблизительно 36 часов. В некоторых вариантах осуществления период постепенно снижающегося введения составляет приблизительно 24 часа.
Применяемое постепенное снижение может быть "линейным" постепенным снижением. Например, линейное "10%" постепенное снижение от 500 мг будет составлять 500, 450, 400, 350, 300, 250, 200, 150, 100, 50 мг. В качестве альтернативы можно использовать экспоненциальное постепенное снижение, что, если в качестве примера используется приведенная выше программа, экспоненциальное постепенное снижение представляло бы собой, например, 500, 450, 405, 365, 329, 296, 266, 239 и т.д. Соответственно, 5%, 10%, 15%, 20%, 25%, 30%, 35% или 40% линейное или экспоненциальное постепенное снижение может быть использовано в способах по изобретению. Кроме того, может быть использовано линейное или экспоненциальное постепенное снижение приблизительно от 1 до 5%, приблизительно от 6% до 10%, приблизительно от 11% до 15%, приблизительно от 16% до 20%, приблизительно от 21% до 25%, приблизительно от 26% до 30%, приблизительно от 31% до 35%, приблизительно от 36% до 40%. В некоторых вариантах осуществления постепенное снижение дозы лекарственного средства составляет приблизительно 25% линейное постепенное снижение.
В одном варианте осуществления водный раствор или смесь, содержащие нейроактивный стероид, вводят в виде внутривенного вливания в количестве нейроактивного стероида/единица времени от приблизительно 20 до приблизительно 5000 мкг/кг/час. В некоторых вариантах осуществления нейроактивный стероид в поддерживающем цикле вводят в виде внутривенного вливания в количестве нейроактивного стероида/единица времени от приблизительно 20 до приблизительно 2500 мкг/кг/час. В некоторых вариантах осуществления нейроактивный стероид в поддерживающем цикле вводят в виде внутривенного вливания в количестве нейроактивного стероида/единица времени от приблизительно 20 до приблизительно 500 мкг/кг/час. В некоторых вариантах осуществления нейроактивный стероид вводят в виде внутривенного вливания со скоростью от приблизительно 20 до приблизительно 250 мкг/кг/час. В некоторых вариантах осуществления нейроактивный стероид вводят в виде внутривенного вливания в количестве нейроактивного стероида/единица времени от приблизительно 20 до приблизительно 200 мкг/кг/ч. В некоторых вариантах осуществления нейроактивный стероид вводят в виде внутривенного вливания в количестве нейроактивного стероида/единица времени от приблизительно 20 до приблизительно 150 мкг/кг/час. В некоторых вариантах осуществления нейроактивный стероид вводят в виде внутривенного вливания в количестве нейроактивного стероида/единица времени от приблизительно 50 до приблизительно 100 мкг/кг/час. В некоторых вариантах осуществления нейроактивный стероид вводят в виде внутривенного вливания в количестве нейроактивного стероида/единица времени от приблизительно 70 до приблизительно 100 мкг/кг/час. В конкретных вариантах осуществления нейроактивный стероид вводят в виде внутривенного вливания в количестве нейроактивного стероида/единица времени приблизительно 25 мкг/кг/час, 50 мкг/кг/час, 75 мкг/кг/час, 80 мкг/кг/час, 85 мкг/кг/час, 86 мкг/кг/час, 87 мкг/кг/час, 88 мкг/кг/час, 89 мкг/кг/час, 90 мкг/кг/час, 100 мкг/кг/час, 125 мкг/кг/час, 150 мкг/кг/час или 200 мкг/кг/час.
В одном варианте осуществления водный раствор или смесь, содержащие нейроактивный стероид, вводят в виде внутривенного вливания в дозе, эквивалентной парентеральному введению нейроактивного стероида от приблизительно 0,1 нг до приблизительно 100 г на кг массы тела, от приблизительно 10 нг до приблизительно 50 г на кг массы тела, от приблизительно 100 нг до приблизительно 1 г на кг массы тела, от приблизительно 1 мкг до приблизительно 100 мг на кг массы тела, от приблизительно 1 мкг до приблизительно 50 мг на кг массы тела, от приблизительно 10 мкг до приблизительно 5 мг на кг массы тела; и от приблизительно 100 мкг до приблизительно 1000 мкг на кг массы тела. В одном варианте осуществления водный раствор или смесь, содержащие нейроактивный стероид, вводят в виде внутривенного вливания в дозе, эквивалентной парентеральному введению нейроактивного стероида от приблизительно 0,1 нмоль/л до приблизительно 100 мкмоль/л на кг массы тела, от приблизительно 1 нмоль/л до приблизительно 10 мкмоль/л на кг массы тела, от приблизительно 10 нмоль/л до приблизительно 10 мкмоль/л на кг массы тела, от приблизительно 100 нмоль/л до приблизительно 10 мкмоль/л на кг массы тела, от приблизительно 300 нмоль/л до приблизительно 5 мкмоль/л на кг массы тела, от приблизительно 500 нмоль/л до приблизительно 5 мкмоль/л на кг массы тела и от приблизительно 750 нмоль/л до приблизительно 5 мкмоль/л на кг массы тела. Альтернативно, количество водного раствора или смеси, содержащих нейроактивный стероид, вводимое для достижения терапевтической эффективной дозы, составляет приблизительно 0,1 нг, 1 нг, 10 нг, 100 нг, 1 мкг, 10 мкг, 100 мкг, 1 мг, 1,5 мг, 2 мг, 3 мг, 4 мг, 5 мг, 6 мг, 7 мг, 8 мг, 9 мг, 10 мг, 11 мг, 12 мг, 13 мг, 14 мг, 15 мг, 16 мг, 17 мг, 18 мг, 19 мг, 20 мг, 21 мг, 22 мг, 23 мг, 24 мг, 25 мг, 26 мг, 27 мг, 28 мг, 29 мг, 30 мг, 40 мг, 50 мг, 60 мг, 70 мг, 80 мг, 90 мг, 100 мг, 500 мг нейроактивного стероида на кг массы тела или выше.
В контексте настоящего описания термин "приблизительно" означает приблизительно плюс или минус десять процентов.
ПРИМЕРЫ
Пример 1. Путь деградации аллопрегнанолона в составах с SBECD
На фигуре 1 представлены два основных пути деградации, обнаруженных для аллопрегнанолона в составах с SBECD. На основании данных, описанных на фигурах 3-5 и 8 и таблицах 1-11 и 16, основной путь деградации, наблюдаемый при pH ~ 6 или менее, представляет собой эпимеризацию аллопрегнанолона в соединение 1269. На основании данных, представленных на фигурах 3-5 и 8 и таблицах 1-11 и 16, основной путь деградации, наблюдаемый при pH ~ 6 или более, представляет собой окисление аллопрегнанолона до соединения 136.
Растворимость аллопрегнанолона определяли в сульфобутилэфир-β-циклодекстрине без буфера. Графическое представление аллопрегнанолона в зависимости от циклодекстрина показано на фигуре 2.
Пример 2. Аллопрегнанолон в сульфобутилэфир-β-циклодекстрине без буфера.
Состав из аллопрегнанолона (5 мг/мл) в 250 мл/мл сульфобутилэфир-β-циклодекстрина получали без буфера и упаковывали в стеклянный флакон типа I.
Конкретно, состав изготавливали путем растворения необходимого количества сульфобутилового эфира Бетадекса натрия (т.е. сульфобутилэфир-β-циклодекстрина) приблизительно в 80% от требуемого количества стерильной воды для инъекций (SWI) в подходящем сосуде с помощью стандартной лопастной мешалки при 35-40°C. Аллопрегнанолон добавляли к небуферизованному раствору сульфобутилового эфира Бетадекса натрия (то есть, сульфобутилэфир-β-циклодекстрину) и перемешивали до растворения с помощью мешалки с высоким усилием сдвига. Перемешивание с высоким усилием сдвига при 35-40°C продолжали до тех пор, пока раствор не становился заметно прозрачным, что указывает на растворение лекарственной субстанции аллопрегнанолона. Нерасфасованный раствор доводили до конечного объема с помощью SWI и перемешивали. Раствор фильтровали через 0,45 мкм фильтр предварительной очистки и в асептических условиях фильтровали через подходящие дублированные стерильные 0,2 мкм фильтры (такие как Millipore PVDF) в предварительно стерилизованный сосуд для наполнения. Стерильным раствором в асептических условиях заполняли предварительно стерилизованные флаконы, герметично закрывали предварительно стерилизованными пробками, и пробки скрепляли с флаконами с помощью алюминиевого обжимного колпачка. Заполненные флаконы проверяли на 100% на видимые частицы и дефекты закрытия контейнера, отбирали пробы на контроль готовой продукции и хранили при 2-8°C.
Результаты стабильности показали тенденцию к снижению pH и признаки деградации (образование соединений 136 и 1269), которая происходила быстрее при более высоких температурах. Присутствие продуктов деградации при более высоких температурах делает химически нестабильным состав с аллопрегнанолоном в этих условиях. Нестабильный состав ограничивает сроки годности к применению веществ в клинических испытаниях на людях и потенциальных коммерческих применениях.
В Таблице 1 осуществляли наблюдение за составами из аллопрегнанолона (5 мг/мл) в 250 мг/мл сульфобутилэфир-β-циклодекстрина без буфера в течение 9 месяцев при 25°C/60% относительной влажности. Регистрировали pH, содержание основного вещества, количество примесей и механических включений.
Стабильность составов
Таблица 1. Состав из 5 мг/мл аллопрегнанолона в 250 мг/мл SBECD, 20 мл флаконы, небуферизованный неавтоклавированный и хранящийся при 25°C/60% относительной влажности в течение 9 месяцев
Известные примеси1
(площадь %)
Количество ≥ 25 мкм:
7
0
16
0
3
5
В Таблице 2 осуществляли наблюдение за составами из аллопрегнанолона (5 мг/мл) в 250 мг/мл сульфобутилэфир-β-циклодекстрина без буфера в течение 3 месяцев при 40°C/75% относительной влажности. Регистрировали pH, содержание основного вещества, количество примесей и механических включений.
Таблица 2. Состав из 5 мг/мл аллопрегнанолона в 250 мг/мл SBECD, в 20 мл флаконах, небуферизованный неавтоклавированный и хранящийся при 40°C/75% относительной влажности в течение 3 месяцев
Известные примеси (площадь %)
Количество ≥ 25 мкм
7
1
3
В таблице 3 осуществляли наблюдение за составами из аллопрегнанолона (5 мг/мл) в 250 мг/мл сульфобутилэфир-β-циклодекстрина без буфера в течение 6 месяцев при 40°C/75% относительной влажности. Регистрировали pH, содержание основного вещества, количество примесей и механических включений.
Таблица 3. Состав из 5 мг/мл аллопрегнанолона в 250 мг/мл SBECD, в 20 мл флаконах, небуферизованный неавтоклавированный и хранящийся при 40°C/75% относительной влажности в течение 6 месяцев
Известные примеси (площадь %)
Количество ≥ 25 мкм
3
7
11
4
Пример 3. Аллопрегнанолон в сульфобутилэфир-β-циклодекстрине с буфером.
Состав из аллопрегнанолона (5 мг/мл) в 250 мг/мл сульфобутилэфир-β-циклодекстрина получали с использованием цитратного буфера и упаковывали в стеклянный флакон типа I.
Семь аллопрегнанолоновых растворов получали, как описано в таблице 4. Пробы каждого из семи растворов подвергали автоклавированию при 121°C в течение 30, 60 и 90 минут. Растворы хранили при комнатной температуре до проведения испытаний. В таблице 5 приведены исходные значения pH для растворов.
Таблица 4. Композиции аллопрегнанолоновых составов, полученных для тестирования
pH 5,5
pH 6,0
pH 6,5
pH 5,5
pH 6,0
pH 6,5
(г/л)
сколько потребуется
Таблица 5. Сводные данные о pH исходных буферов
Сравнение значений содержания основного вещества для неавтоклавированных и автоклавных образцов показано в таблице 6. Данные показывают, что значение содержания основного вещества (%) поддерживалось постоянным для всех исследованных периодов времени автоклаврования.
Таблица 6. Влияние автоклавирования на содержание основного вещества продукта
*Содержание основного вещества в момент времени ноль, неавтоклавированный образец
В таблице 7 сведен состав примесей, в частности количество соединений 136 и 1269, образованных в процессе кратковременного воздействия высоких температур.
Продукт окислительный деградации (соединение 136) наблюдали на уровне 0,13% в контрольном образце после автоклавирования в течение 90 минут. Аналогичные уровни были обнаруживали в 90-минутных буферизованных образцах с pH 5,5 (0,15% для 5 мМ образца и 0,11% для 10 мМ образца). 90-минутные буферизованные образцы с pH 6,5 содержали несколько более низкий уровень продукта окислительной деградации (0,05% для 5 мМ образца и 0,03% для 10 мМ образца).
В условиях настоящего исследования наблюдается заметное и незначительное улучшение в части отсутствия образования соединения 136 при использовании 10 мМ буфера по сравнению с 5 мМ буфером.
Важно отметить, что во время исследования теплового напряжения никакой эпимеризации не наблюдается (образование соединения 1269) - (не обнаружено) для буферизованных составов в сравнении с 0,15% для небуферизованного контроля в момент времени 90 минут.
Таблица 7. Состав примесей после автоклавирования
В таблице 8 сведены исходные значения pH, исходное содержание основного вещества и примесей для каждой партии. В таблицу включены неавтоклавированные контрольные образцы вместе с изначально в T=0 автоклавированными образцами. Образцы анализировали на pH при хранении в течение приблизительно 3 месяцев при комнатной температуре и на содержание основного вещества и примесей - приблизительно через 4 месяца при комнатной температуре.
Таблица 8. Сводные данные об исходном содержании основного вещества и примесей - автоклавированные в сравнении с неавтоклавированными
**Не исследовали в начальный момент времени
pH небуферизованного неавтоклавированного контрольного образца упал на 1,1 единиц pH после 3 месяцев хранения при комнатной температуре, а pH незабуференного автоклавированного контрольного образца упал на 0,6 единиц pH после 3 месяцев хранения при комнатной температуре
pH буферизованных растворов существенно не изменялся (наибольшее зарегистрированное изменение pH составлило 0,1 единицы pH).
Обе концентрации буфера 5 и 10 мМ обеспечивали хороший контроль pH после автоклавирования и хранения.
Исходные данные (T=0) для содержания основного вещества (%) и суммарного содержания примесей в целом по опытным образцам показали стабильный диапазон 100,6-102,9% и 0,79-0,85%, соответственно. Значения содержания основного вещества в образцах в T=4 месяца соответствовали образцам в T=0 и не показали каких-либо признаков деградации. Это также имело место для суммарного содержания примесей.
Большие партии состава из аллопрегнанолона (5 мг/мл) в 250 мл/мл сульфобутилэфир-β-циклодекстрина получали с использованием цитратного буфера и упаковывали в стеклянный флакон типа I.
Конкретно, состав изготавливали путем растворения необходимого количества моногидрата лимонной кислоты (ФСША) и дигидрата цитрата натрия (ФСША) приблизительно в 80% от требуемого количества стерильной воды для инъекций (SWI) в подходящем сосуде с помощью стандартной лопастной мешалки при 35-40°C. Требуемое количество сульфобутилового эфира Бетадекса натрия (то есть сульфобутилэфир-β-циклодекстрина) добавляли к буферному раствору и перемешивали для растворения. pH продукта проверяли и при необходимости доводили соляной кислотой или гидроксидом натрия до pH 6,0 +/- 0,2. Аллопрегнанолон добавляли к буферному раствору сульфобутилового эфира Бетадекса натрия (то сульфобутилэфир-β-циклодекстрину) и перемешивали до растворения с помощью мешалки с высоким усилием сдвига. Перемешивание с высоким усилием сдвига при 35-40°C продолжали до тех пор, пока раствор не становился заметно прозрачным, что указывает на растворение лекарственной субстанции аллопрегнанолона. pH продукта проверяли и при необходимости доводили соляной кислотой или гидроксидом натрия в целях обеспечения pH 6,0 +/- 0,1 продукта. Нерасфасованный раствор доводили до конечного объема с помощью SWFI и перемешивали. Раствор фильтровали через 0,45 мкм фильтр предварительной очистки и в асептических условиях фильтровали через подходящие дублированные стерильные 0,2 мкм фильтры (такие как Millipore PVDF) в предварительно стерилизованный сосуд для наполнения. Стерильным раствором в асептических условиях заполняли предварительно стерилизованные флаконы, герметично закрывали предварительно стерилизованными пробками, и пробки скрепляли с флаконами с помощью алюминиевого обжимного колпачка (компонент, описанный в таблице 9). Заполненные флаконы проверяли на 100% на видимые частицы и дефекты закрытия контейнера, отбирали пробы на контроль готовой продукции и хранили при 2-8°C.
Таблица 9. Виды упаковки для составов
*Не связано с продуктом. Различные цвета использовали для достижения различий между составами.
В таблице 10, осуществляли наблюдение за составами из аллопрегнанолона (5 мг/мл) в 250 мг/мл сульфобутилэфир-β-циклодекстрина в 10 мМ цитратном буфере с pH 6 в течение 6 месяцев при 40°C/75% относительной влажности. Регистрировали pH, содержание основного вещества (например, заявленное содержание в процентах), количество примесей и механических включений.
Таблица 10. Инъекция из 5 мг/мл аллопрегнанолона в 250 мг/мл SBECD, в 20 мл флаконах, в 10 мМ цитратном буфере с pH=6, хранящаяся при 40°C/75% относительной влажности в течение 6 месяцев
В таблице 11 осуществляли наблюдение за составами из аллопрегнанолона (5 мг/мл) в 250 мг/мл сульфобутилэфир-β-циклодекстрина в 10 мМ цитратном буфере с pH 6 контролировали в течение 12 месяцев при 25°C/60% относительной влажности. Регистрировали pH, содержание основного вещества (например, заявленное содержание в процентах), количество примесей и механических включений.
Таблица 11. Инъекция из 5 мг/мл аллопрегнанолона в 250 мг/мл SBECD, в 20 мл флаконах, в 10 мМ цитратном буфере с pH=6, хранящаяся при 25°C/60% относительной влажности в течение 12 месяцев
Пример 4. Терминальная стерилизация аллопрегнанолона для инъекций, 5 мг/мл в 250 мг/мл циклодекстрина (10 мМ цитратный буфер, pH 6,0) в 20 мл флаконах
Эксперименты проводили для того, чтобы продемонстрировать, что процесс стерилизации для инъекции аллопрегнанолона 5 мг/мл в 250 мг/мл Каптизола® (10 мМ цитратный буфер, pH=6,0, 20 мл/флакон) обеспечивает равномерность температуры и биологическое уничтожение по всему объему нагрузки с использованием парового стерилизатора Finn-Aqua, включая демонстрацию того, что отсутствует какой-либо рост известной микробиологической нагрузки Geobacillus stearothermophilus.
Протокол установил и подтвердил процесс стерилизации, и определил, где могут быть размещены датчики нагрузки стерилизатора во время обычной работы с продуктом. Проводили три (3) цикла работы стерилизатора с максимальной нагрузкой и три (3) цикла работы стерилизатора с минимальной нагрузкой для каждого размера флакона с использованием парового стерилизатора Finn-Aqua, модель 91515-DP-RP-GMP-S7, серийный номер C0A41043. Паровой стерилизатор Finn-Aqua представлял собой блок с двустворчатой дверцей, управляемый программируемым логическим контроллером (PLC) Siemens Simatic S7-300. Стерилизатор работал от пользовательского интерфейса, операторкой панели OP27. Размеры внутренней камеры составляли (ш × в × г) 37 дюймов × 61 дюйм × 61 дюйм, при общем внутреннем объеме 75 куб. футов. Имелась одна тележка, которую можно было оснастить до 15 полками. На каждой полке размещалось 8 лотков флаконов (каждый лоток вмещал 162 20 мл флакона). "D-значение" относится к времени, требуемому при температуре (T) для уменьшения удельной микробной популяции на 90% или, времени, требуемому для уменьшения числа выживших в 10 раз (1 log).
Максимальный размер партии автоклава 259 л вмещал приблизительно 12 690 флаконов. Минимальная нагрузка для валидации составляла 3 л на основе минимального размера партии автоклава одного лотка.
Продуктом в асептических условиях заполняли стерильную рабочую камеру производственного оборудования, что поддерживалось посредством моделирования процесса асептической обработки (наполнение средами). Эти оценки процесса асептической обработки подтвердили, что продукт имел гарантированный уровень стерильности (SAL) 10-3. Бионагрузку измеряли в образцах, взятых после заполнения и до терминальной стерилизации. Предполагалось измерить нулевой (0) уровень КОЕ/10 мл и уровень предупреждения >1 КОЕ/10 мл.
Валидацию выполняли с использованием времени выдержки, равного предложенному стандартному времени выдержки, чтобы продемонстрировать способность процесса выполнить сокращение на 8 log нагрузки спор (6 log+коэффициент запаса 2 log). Было определено, что D-значение продукта составляет 3,5 минуты для флакона 20 мл и 4,5 - для флакона 50 мл. Чтобы объединить оба размера флакона одним циклом, было выбрано самое высокое D-значение. Предполагая, что полное уничтожение БИ требует сокращение на 6 log, в результате предлагаемое время воздействия (уничтожения) для цикла валидации будет:
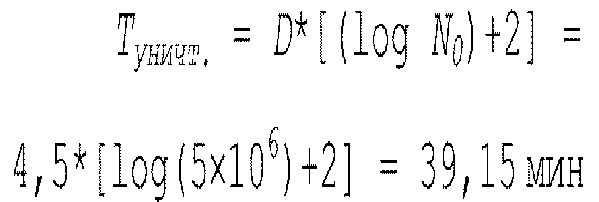
Таким образом, цикл проверки был определен как:

Вычисленное время, которое приводит к десятичному значению, округляется до следующей минуты. Кроме того, чтобы поддерживать температуру продукта выше 121,1°C для стерилизации, заданное значение стерилизатора во время воздействия составляло 122,2°C.
Эффективность процесса терминальной стерилизации определяли по равномерности температуры и демонстрировали сокращение по меньшей мере на 6 log жизнеспособного количества споров G. stearothermophilus, внесенных в количестве от 1 × 106 до 5 × 106 спор на флакон. Основываясь на успешной демонстрации биологического уничтожения в течение цикла валидации, время воздействия в производственном цикле будет иметь время воздействия 40 минут (при подтвержденной температуре воздействия 122,2°C ± 1,0°C), чтобы соответствовать расчетному требуемому времени воздействия рост посева в инокулированном продукте определяли в течение D-значения времени. Для размера пузырька 20 мл выполняли три (3) цикла работы стерилизатора с полной загрузкой, которые состояли из 10-минутного, 15-минутного и 20-минутного времени воздействия. Как только эти три (3) экспериментальных цикла работы были завершены, выбирали оптимальный цикл работы и проверяли путем выполнения дополнительных двух (2) циклов работы стерилизатора.
Валидация состояла из двух частей. Проводили три (3) цикла работы стерилизатора с максимальной нагрузкой с устройствами для измерения температуры и биологическими индикаторами, распределенными по всей камере с особым вниманием на места, определенные с помощью циклов с пустой камерой, выполняемых во время ежегодной повторной аттестации автоклава (местонахождения биологических индикаторов будут размещены в одном и том же месте для каждого цикла). Три (3) цикла работы стерилизатора с минимальной нагрузкой проводили с использованием одного (1) лотка, расположенного на верхней полке камеры (стерилизатор последовательно нагружали с верхней полки камеры, поэтому любые нагрузки стерилизатора с меньшим, чем максимальное, количеством лотков всегда будут иметь лотки на верхней полке стерилизатора).
Биологический индикатор (БИ) размещали рядом у каждого контактного датчика контроля нагрузки/погружного датчика (LPC/PP). Термин "датчик" в контексте данного раздела, относится к устройству для измерения температуры. Все погружные датчики, датчики нагрузки стерилизатора, контактные датчики контроля нагрузки и биологические индикаторы помещали во флаконы, содержащие состав продукта; остальная часть нагрузки состояла из пузырьков, содержащих эквивалентное количество воды. Использование флаконов с водой было приемлемым, поскольку состав продукта представлял собой водный раствор, и его термические свойства были по существу идентичными чистой воде.
Тест с нагрузкой - минимальная и максимальная нагрузка камеры
Цель: продемонстрировать равномерность температуры и биологическое уничтожение по всему объему нагрузки флакона.
Критерии приема:
1) Все выявленные биологические индикаторы (БИ) не должны демонстрировать рост.
2) Все положительные контрольные образцы должны демонстрировать рост в конце инкубации.
3) Все отрицательные контрольные образцы должны иметь отрицательный результат теста на рост в конце инкубации.
4) Все погружные датчики и контактные датчики контроля нагрузки должны поддерживать температурный диапазон 122,2°C±1,0°C во время воздействия.
Пример 5. Характеристические данные соединения 1269.
Отнесение сигналов спектров 1H и 13C ЯМР для 1269 приведены в таблице 12.
Таблица 12. Отнесение сигналов спектров 1H и 13C ЯМР для 1269 (CDCl3)

(м.д.)
J
H (Гц)
(м.д.)
1J
2,3J
1,27
перекр. м
1 H
32,36-1,27
1,38
перекр. м
1 H
36,08-1,38
39,16-1,43: 3J C5-H1
-
1,01
м
1 H
32,41-1,01
53,77-1,13: 3J C9-H12
1,28
перекр. м
1 H
20,91-1,28
20,91-0,72: 2J C11-H9
1,13
перекр. м
1 H
35,57-1,13
35,57-0,90: 3J C12-H18
46,01-0,90: 2J C13-H18
50,55-2,78: 3J C14-H17
1,20
перекр. м
1 H
26,06-1,20
1,70
перекр. м
1 H
24,47-1,70
61,59-2,12: 3J C17-H21
212,96-2,78: 2J C20-H17
ЖХ-МС-анализ 1269 представлен на фигуре 6 и в таблице 13.
Таблица 13. Отнесение сигналов масс-спектра соединения 1269
Пример 6. Характеристические данные соединения 136
Таблица 14. Отнесение сигналов спектров 1H и 13C ЯМР для 136 (CDCl3)
(м.д.)
J
H (Гц)
(м.д.)
1J
2,3J
1,36
перекр. м
1 H
38,73-1,36
2,30
перекр. м
1 H
38,32-2,30
212,01-2,27: 2J C3-H4
2,09
перекр. м
1 H
44,83-2,09
46,85-2,27: 3J C5-H4
29,01-0,94: 2J C6-H7
29,01-2,27: 2J C6-H4
0,94
м
1 H
31,83-0,94
35,87-1,02: 2J C10-H19
1,39
перекр. м
1 H
21,62-1,39
21,62-2,04: 2J C11-H12
1,44
перекр. м
1 H
39,12-1,44
39,12-0,64: 3J C12-H18
44,36-0,64: 2J C13-H18
56,64-0,64: 3J C14-H18
1,23
перекр. м
1 H
24,60-1,39
24,60-1,65: 2J C15-H16
1,65
перекр. м
1 H
23,02-1,65
209,66-2,53: 3J H16-C20
209,66-2,53: 2J C20-H17
ЖХ-МС-анализ 136 представлен на фигуре 7 и в таблице 15.
Таблица 15. Отнесение сигналов масс-спектра соединения 136
Пример 6. pH-стабильность составов из аллопрегнанолона в SBECD
Состав из аллопрегнанолона (5 мг/мл) в 250 мл/мл сульфобутилэфир-β-циклодекстрина получали при разных значениях pH и упаковывали в стеклянный флакон типа I. Содержание основного вещества состава измеряли через 12 недель при 40°C (фигура 8А). Содержание основного вещества состава измеряли через 12 недель при 60°Cм (фигура 8B).
Пример 7. Сравнение эффектов различных буферов
На фигурах 3А-В проиллюстрирована чистота состава, измеренная через 12 недель при 40°C в фосфатном буфере. На фигурах 4A-B проиллюстрирована чистота состава, измеренная через 12 недель при 40°C в цитратном буфере. На фигуре 5 проиллюстрировано образование 136 с течением времени 40°C в разных буферах.
Пример 8. Стабильность состава с аллопрегнанолоном при низких температурах
Определяли стабильность состава из аллопрегнанолона (5 мг/мл) в 250 мг/мл сульфобутилэфир-β-циклодекстрина в 10 мМ цитратном буфере с pH 6, который хранили при 2-8°C в течение 12 месяцев. Данные исследования стабильности приведены в таблице 16.
Таблица 16. Стабильность состава с аллопрегнанолоном, при который хранили при 2-8°C в течение 12 месяцев
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ ЛЕЧЕНИЯ ЭПИЛЕПСИИ ИЛИ ЭПИЛЕПТИЧЕСКОГО СТАТУСА | 2013 |
|
RU2667010C2 |
| СПОСОБЫ ЛЕЧЕНИЯ ЭПИЛЕПСИИ ИЛИ ЭПИЛЕПТИЧЕСКОГО СТАТУСА | 2013 |
|
RU2824132C2 |
| ЛЕКАРСТВЕННЫЕ ФОРМЫ НЕЙРОАКТИВНЫХ СТЕРОИДОВ И СПОСОБЫ ЛЕЧЕНИЯ НАРУШЕНИЙ ЦНС | 2013 |
|
RU2681835C2 |
| НЕЙРОАКТИВНЫЕ СТЕРОИДЫ, ИХ КОМПОЗИЦИИ И ПРИМЕНЕНИЯ | 2017 |
|
RU2766155C2 |
| НЕЙРОАКТИВНЫЕ СТЕРОИДЫ, КОМПОЗИЦИИ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2731000C2 |
| АНЕСТЕЗИРУЮЩИЙ СОСТАВ | 2011 |
|
RU2574022C2 |
| НЕЙРОАКТИВНЫЕ СТЕРОИДЫ, КОМПОЗИЦИИ И ИХ ИСПОЛЬЗОВАНИЕ | 2014 |
|
RU2754534C2 |
| 19-НОР C3,3-ДИЗАМЕЩЕННЫЕ C21-N-ПИРАЗОЛИЛЬНЫЕ СТЕРОИДЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2014 |
|
RU2812930C2 |
| 19-НОР C3, 3-ДИЗАМЕЩЕННЫЕ C21-N-ПИРАЗОЛИЛЬНЫЕ СТЕРОИДЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2014 |
|
RU2675855C2 |
| НЕЙРОАКТИВНЫЕ 19-АЛКОКСИ-17-ЗАМЕЩЕННЫЕ СТЕРОИДЫ И СПОСОБЫ ЛЕЧЕНИЯ С ИХ ПРИМЕНЕНИЕМ | 2013 |
|
RU2663665C2 |
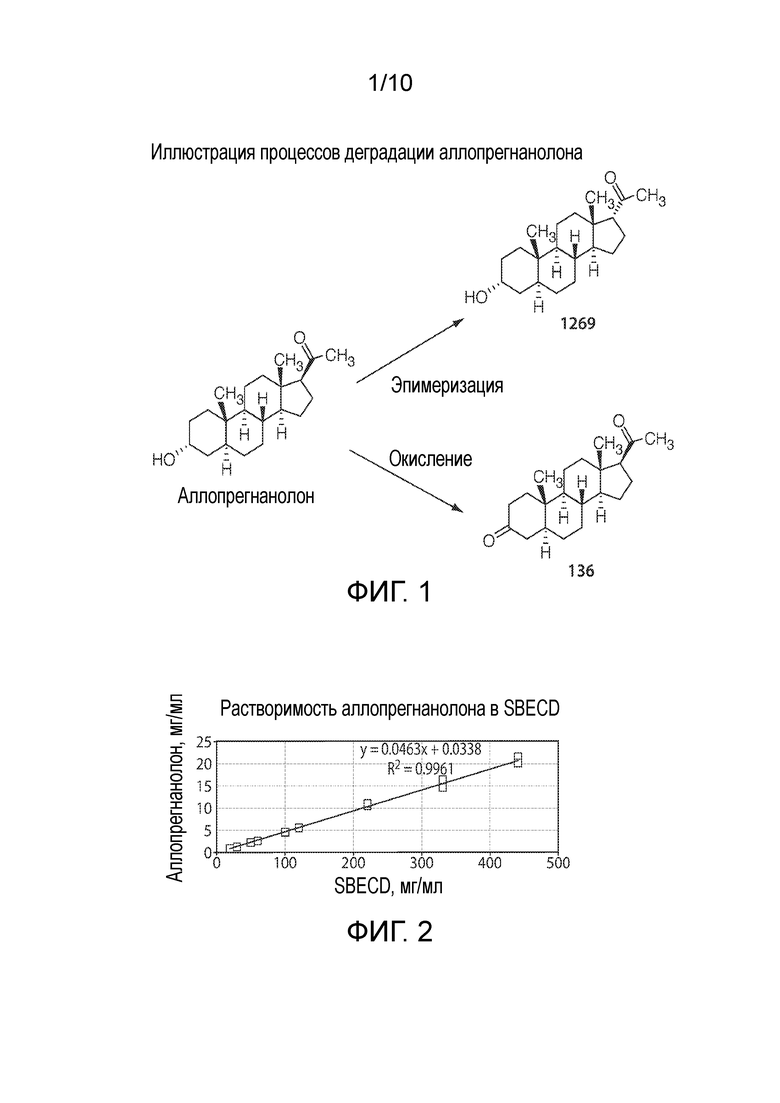
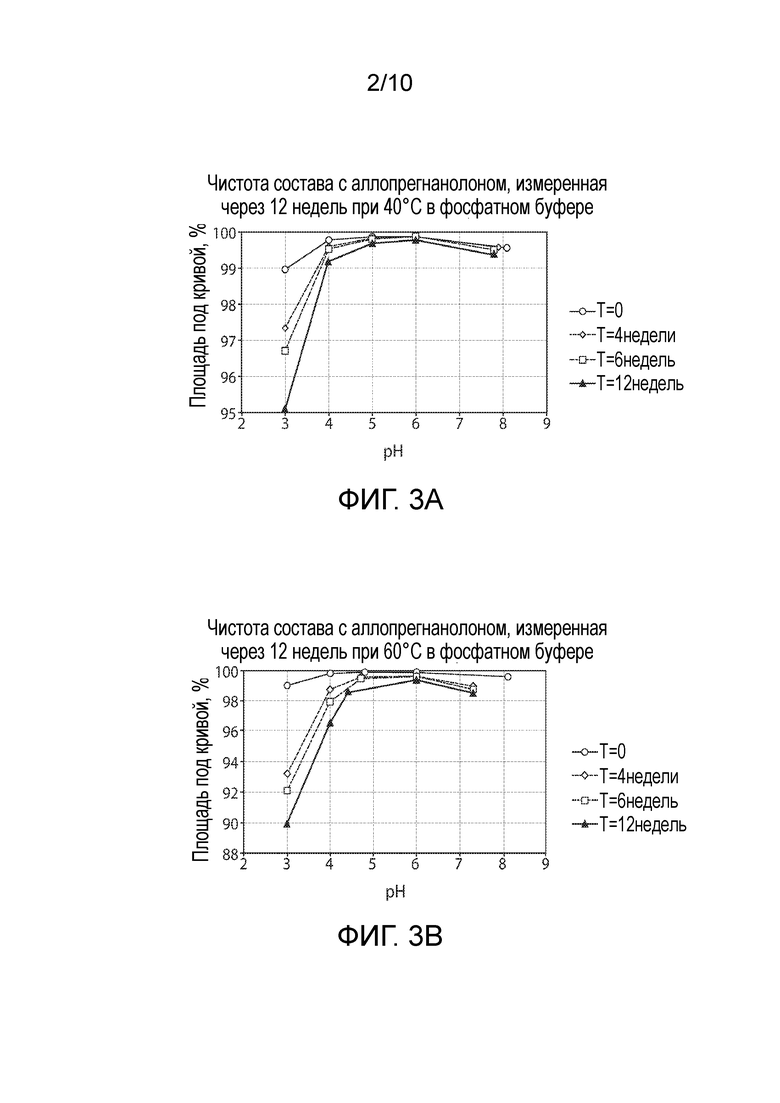
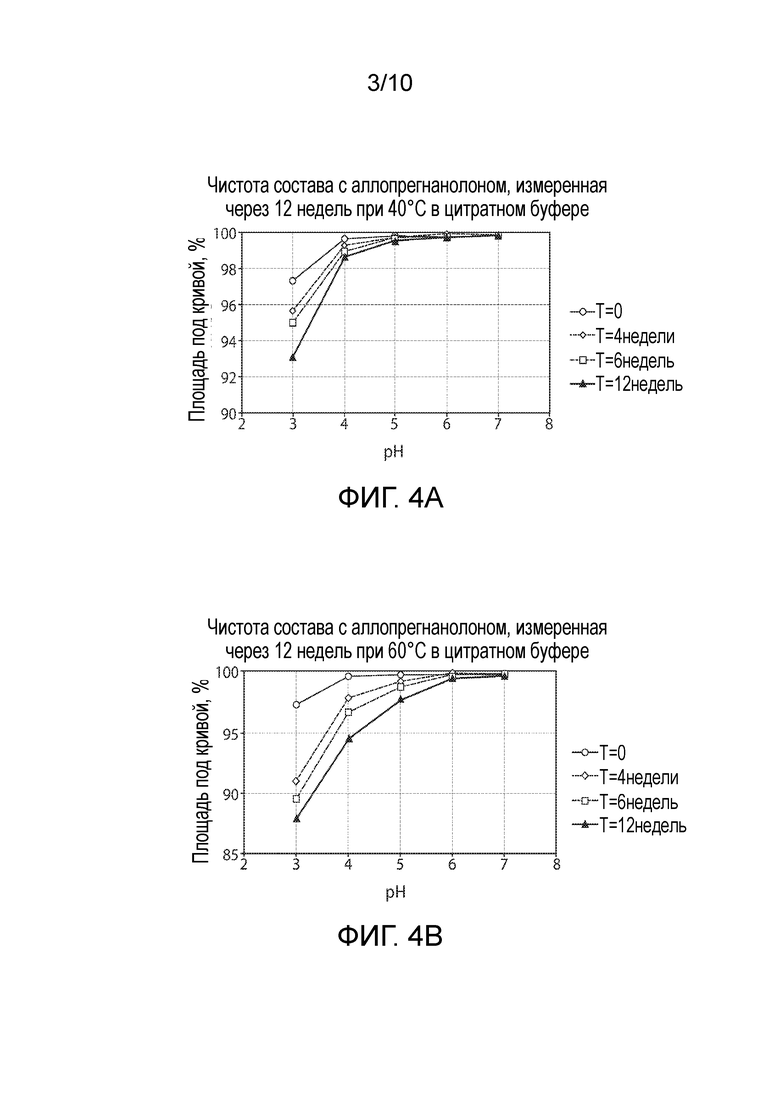
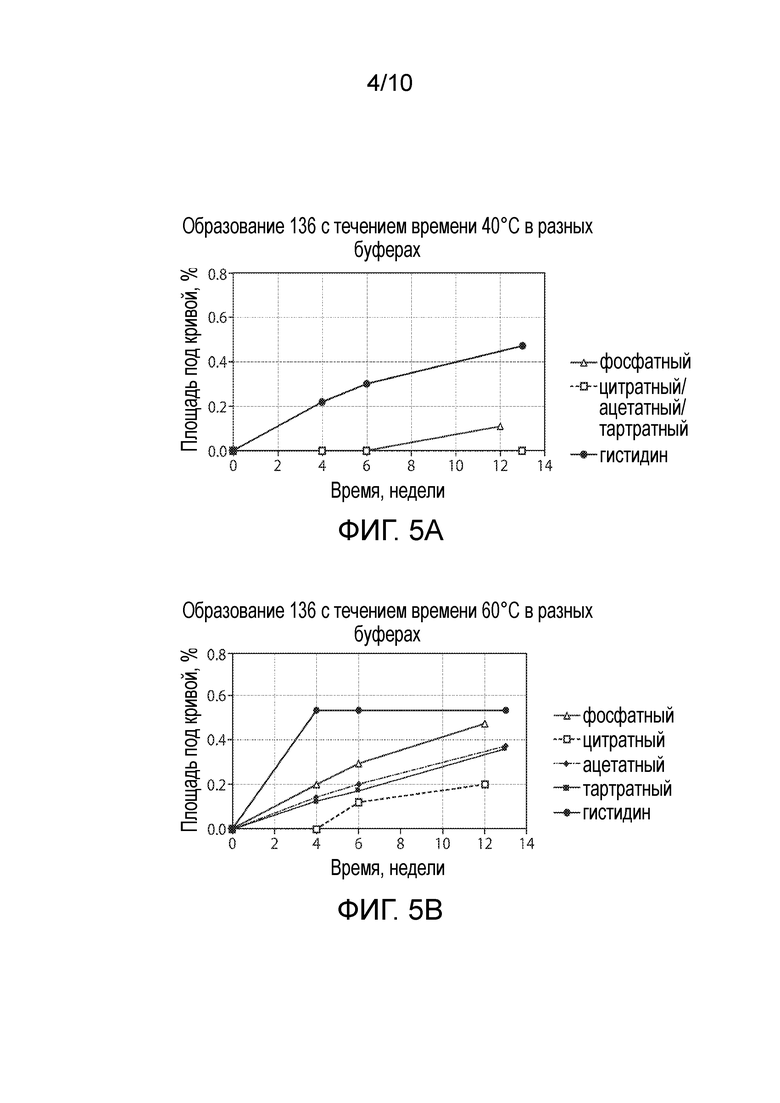

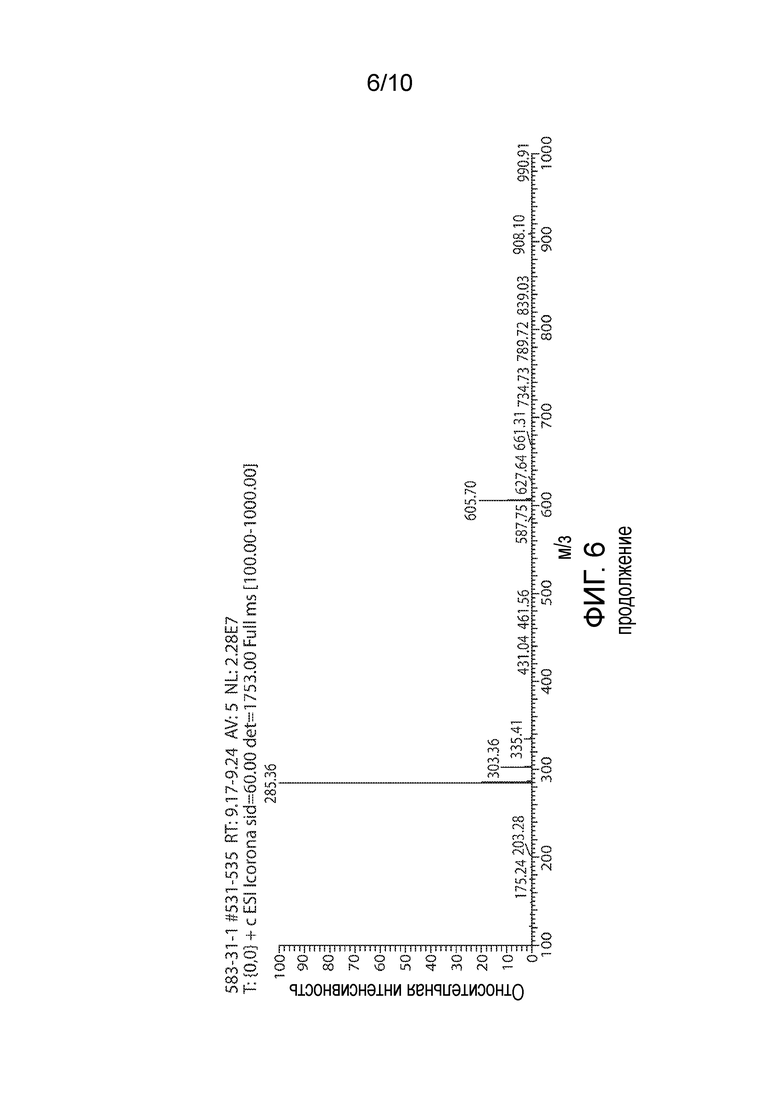
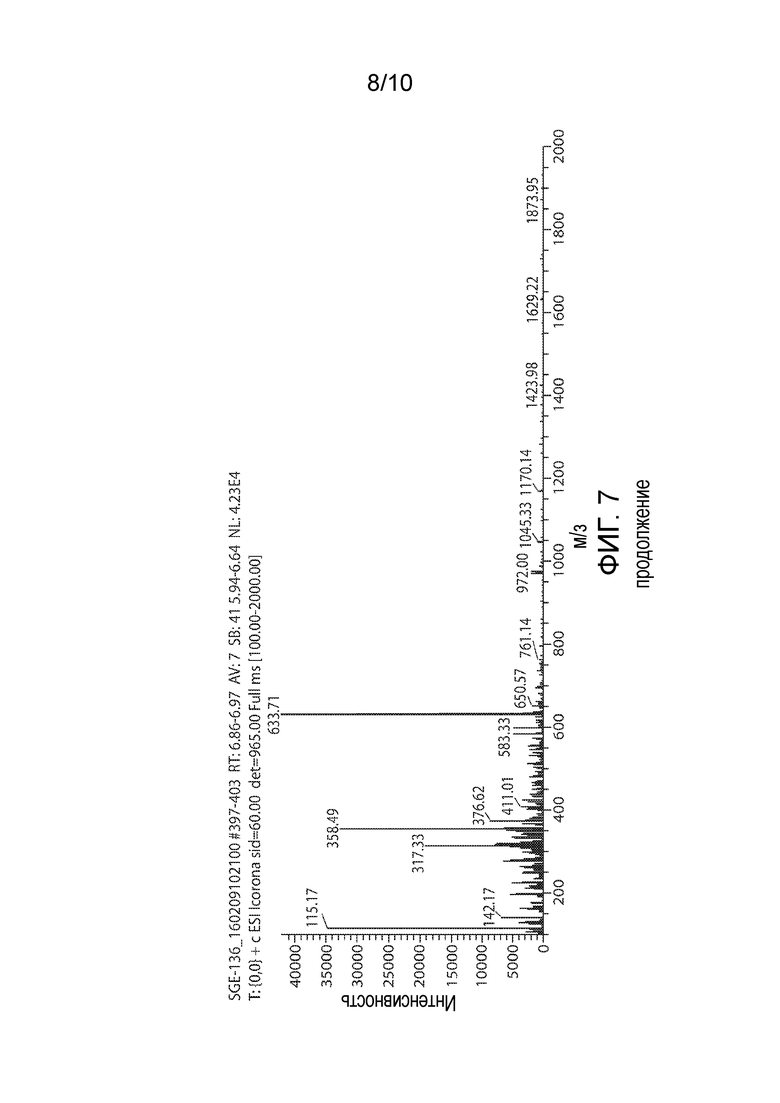
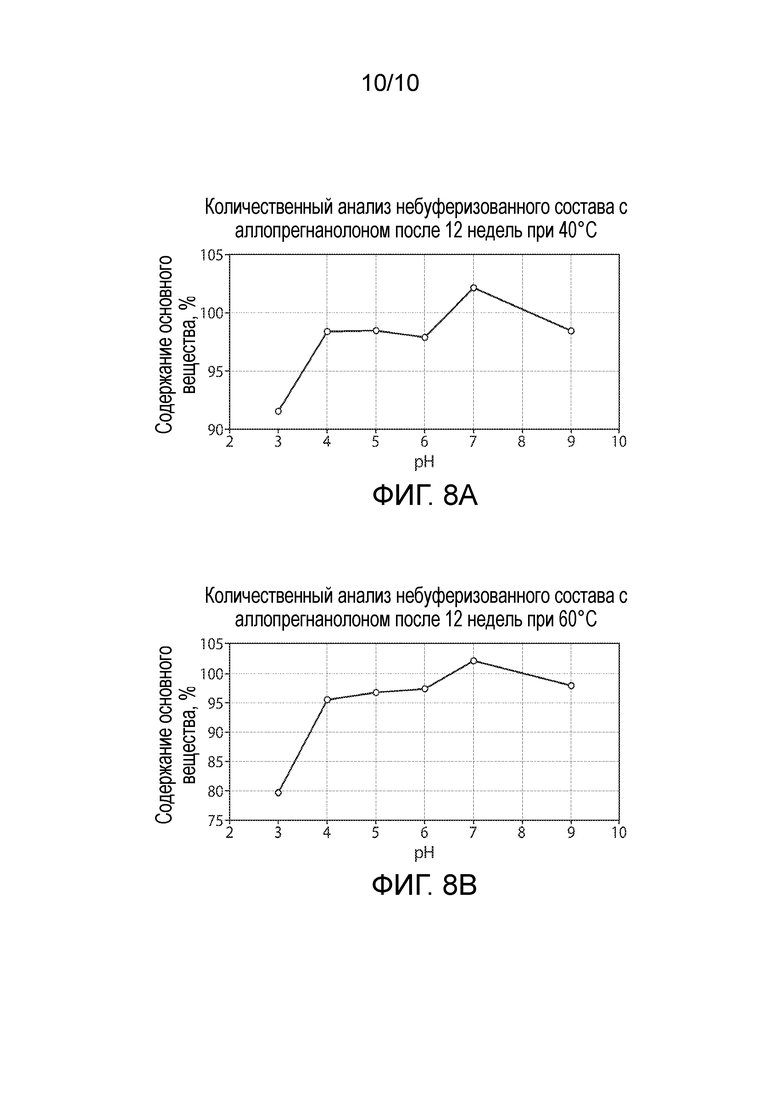
Изобретение относится к раствору аллопрегнанолона. Фармацевтически приемлемый разбавленный водный раствор аллопрегнанолона содержит (i) первый раствор, подвергнутый тепловой обработке, содержащий аллопрегнанолон, простой сульфобутиловый эфир бета-циклодекстрина и цитратный буфер, и (ii) разбавитель; где разбавленный водный раствор изготавливают смешиванием первого раствора, подвергнутого тепловой обработке, с разбавителем, и где первый раствор автоклавируют, подвергая его циклам тепловой стерилизации в течение по меньшей мере 10, 15, 20, 30 или 40 минут при температуре от 110°С до 150°С. Изобретение обеспечивает стабильный раствор. 6 з.п. ф-лы, 8 ил., 16 табл., 8 пр.
1. Фармацевтически приемлемый разбавленный водный раствор аллопрегнанолона, содержащий (i) первый раствор, подвергнутый тепловой обработке, содержащий аллопрегнанолон, простой сульфобутиловый эфир бета-циклодекстрина и цитратный буфер, и (ii) разбавитель; где разбавленный водный раствор изготавливают смешиванием первого раствора, подвергнутого тепловой обработке, с разбавителем, и где первый раствор автоклавируют, подвергая его циклам тепловой стерилизации в течение по меньшей мере 10, 15, 20, 30 или 40 минут при температуре от 110°С до 150°С.
2. Разбавленный водный раствор по п. 1, где разбавленный водный раствор является гомогенным.
3. Разбавленный водный раствор по п. 1, где разбавитель содержит стерильную воду для инъекций или физиологический раствор.
4. Разбавленный водный раствор по п. 1, где температура автоклавирования составляет от 121°С до 123°С.
5. Разбавленный водный раствор по п. 1, где первый раствор, подвергнутый тепловой обработке, содержит 5 мг/мл аллопрегнанолона и 250 мг/мл простого сульфобутилового эфира-β-циклодекстрина.
6. Разбавленный водный раствор по п. 1, где простой сульфобутиловый эфир-β-циклодекстрин включает соль сульфобутилового эфира-β-циклодекстрина.
7. Разбавленный водный раствор по п. 1, где простой сульфобутиловый эфир-β-циклодекстрин включает натриевую соль сульфобутилового эфира-β-циклодекстрина.
| WO 2013112605 A2, 01.08.2013 | |||
| US 2002183293 A1, 05.12.2002 | |||
| КОМПОЗИЦИИ ТЕТРАГИДРОБИОПТЕРИНА И СПОСОБЫ ЕГО КОЛИЧЕСТВЕННОЙ ОЦЕНКИ | 2008 |
|
RU2486899C2 |
Авторы
Даты
2023-09-13—Публикация
2016-06-17—Подача