Изобретение относится к медицине, в частности к онкологии и лучевой терапии (3.1.6), и может быть использовано для проведения лучевой терапии при локализованном раке почки или рецидиве рака почки после предшествующего лечения.
В настоящее время стандартом лечения почечно-клеточного рака (ПКР) является операция в объеме нефрэктомии или резекции почки. Однако проведение хирургического лечения не всегда возможно. Рак почки является радиорезистентной опухолью к традиционному режиму фракционирования лучевой терапии (разовая очаговая доза в 2 Гр). Поэтому проведение стандартных методик лучевой терапии для данной локализации неэффективно. Для достижения клинического эффекта необходимо одномоментно подводить значительно более высокие дозы. Но этому препятствует толерантность окружающих тканей (кишечник, спинной мозг, непораженные части почки). Эта проблема требует комплексного подхода.
Заявленный способ стереотаксической лучевой терапии (СТЛТ) рака почки предполагает подведение сверхвысоких разовых очаговых доз - 15 Грей - ежедневно в течение 3 дней до суммарной очаговой дозы в 45 Грей с соблюдением толерантности окружающих тканей, что достигается следующими решениями:
1. увеличение градиента дозы между опухолью и здоровыми тканями за счет использования радиохирургических методик лучевой терапии, что достигается применением множества некомпланарных полей (порядка 200 и более), увеличение количества полей прямо пропорционально времени лечения; предлагаемое нами решение подразумевает время сеанса лучевой терапии 40-60 минут;
2. высокий градиент спада дозы и длительность лечения требуют точности позиционирования пучков в опухоли, что осложняется сложностью нахождения пациента в фиксированном положении длительное время, а также движением почки внутри организма в процессе дыхания.
Предложенный нами способ предполагает следующие решения:
1. иммобилизация пациента на вакуумном матрасе в положении на спине, руки над головой;
2. контроль положения пациента путем периодического выполнения рентгеновских снимков позвоночника и их сравнения с DRR (Digitally Reconstructed Radiograph, реконструированные цифровым способом аналоги рентгеновских изображений, полученные на основе исходных снимков компьютерной томографии) непосредственно во время сеанса лучевой терапии, что позволяет производить лечение без использования жестких методов фиксации, таких как абдоминальная компрессия;
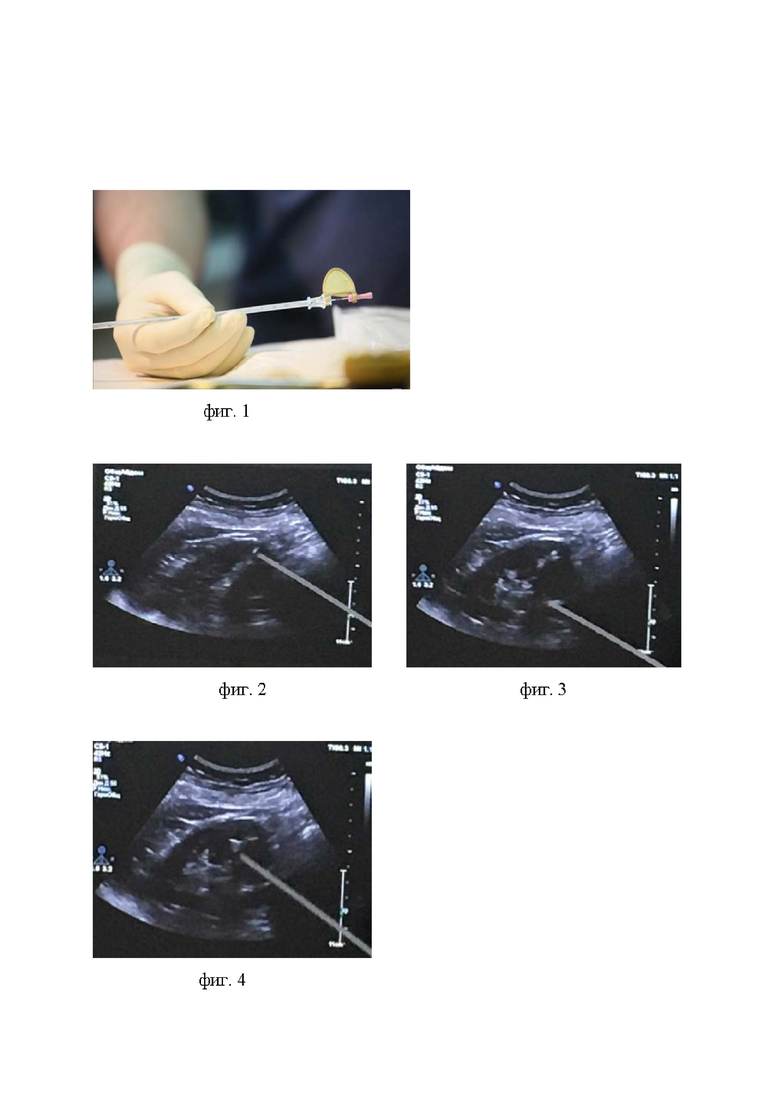
3. контроль за движением почки во время дыхания, что достигается установкой рентгеноконтрастных маркеров в опухоль почки. Важно устанавливать три рентгеноконтрастных маркера в трех плоскостях: фронтальной, сагиттальной и аксиальной. Это позволяет определять смещение опухоли как в краниокаудальном направлении, так и вероятность ее вращения в процессе дыхания, и соответственно, ее топометрию относительно критических структур. Разметочная компьютерная томография (КТ) выполняется через 7 дней после имплантации маркеров, ввиду их возможной миграции на 3-5 мм. Процедура выполняется в жилетке с инфракрасными датчиками дыхания с последующим проведением рентгеноскопии и построением специальной функции корреляции движений датчиков дыхания и маркеров в опухоли почки. Во время сеанса лечения движение опухоли оценивается на основе движения инфракрасных датчиков, что позволяет избежать значительной лучевой нагрузки на весь организм при проведении рентгеноскопии в течение всего сеанса лучевой терапии.
Сочетание проверки положения тела по DRR позвоночника и движения маркеров по инфракрасным маркерам позволяет обеспечить двойной контроль, а также избежать ситуаций миграции маркеров из опухоли относительно планируемого КТ.
Градиент дозы между опухолью и здоровыми тканями.
Применение стандартной конформной лучевой терапии не обеспечивает достаточный спад градиента дозы необходимый для подведения высоких доз.
Ротационное объемно-модулированное облучение (VMAT) позволяет увеличить градиент дозы между опухолью и здоровыми тканями. Данная методика имеет преимущества перед стереотаксической лучевой терапией в меньшем времени лечения и более низких требованиях к фиксации пациента и контролю дыхания, однако конформность такого плана лечения также уступает стереотаксической методике лучевой терапии и не позволяет подводить значительно высокие дозы.
Иммобилизация.
В мире применяются различные системы иммобилизации пациентов во время сеанса стереотаксической лучевой терапии. Так, применение системы BodyFIX уменьшает объем смещения опухоли в среднем на 83% [1]. Эта система состоит из вакуумного матраса, вакуумной подушки и фольги, уложенной поверх пациента с последующим созданием вакуума между фольгой и туловищем человека. Однако это вызывает дискомфорт пациента в процессе лечения, что может отражаться на его переносимости лечения, психологическом комфорте, но при этом не имеет явных преимуществ перед иммобилизацией только на вакуумном матрасе.
В настоящее время в большинстве случаев для иммобилизации используется индивидуальный фиксирующий вакуумный матрас, в котором пациент лежит на спине, руки вдоль туловища. Этот способ имеет ограничение в связи с тем, что с высокой долей вероятности руки будут находиться на возможном пути прохождения луча, что недопустимо и, соответственно, может приводить к изменениям в направлении полей облучения, что может снижать конформность плана лучевой терапии.
В предлагаемом нами способе стереотаксической лучевой терапии опухоли почки положение пациента в фиксирующем матрасе осуществляется в положении на спине, руки над головой, что позволяет избежать описанных ограничений в физико-техническом планировании.
Контроль позиционирования пациента.
Стандартный контроль укладки пациента путем компьютерной томографии рентгеновским конусным пучком (CBCT, Cone Beem Сomputed Тomography) перед лечением не учитывает возможные движения в ходе самой процедуры. При небольшой продолжительности сеанса это может не иметь решающего значения, но при радиохирургических манипуляциях без использования жесткой фиксации имеет принципиальный характер.
При стандартном лечении укладка пациента осуществляется по меткам, вынесенным на кожу на цифровом рентгеновском симуляторе, что не является точным способом позиционирования пациента ввиду высокой вероятности смещения меток в процессе жизнедеятельности человека, а также человеческого фактора некорректности укладки пациента.
Контроль за движением почки во время дыхания.
К решению этой проблемы есть несколько подходов:
• ограничение движения внутренних органов путем наружной компрессии брюшной полости с помощью внешних ограничителей (абдоминальная компрессия) [1]. Недостатками метода является рефлекторное усиление вовлеченности грудной клетки в процесс дыхания, что приводит к непроизвольному движению тела в разных направлениях, и соответственно, к межфракционному изменению положения опухоли, а также психологическому и физическому дискомфорту пациента в процессе лечения;
• ограничение глубины вдоха путем использования специализированных систем, которые состоят из трубки, через которую поступает фиксированный объем воздуха, определенный комфортным для пациента во время разметки на компьютерном томографе. После прохождения запрограммированного объема воздуха, клапан перекрывает дыхательную трубку, помогая пациенту задерживать дыхание на одном и том же уровне, при этом нос пациента зажат. Этот метод имеет весомые ограничения, а именно - психологический дискомфорт, ощущение нехватки воздуха, невозможность некоторых пациентов завершить сеанс лечения, непроизвольные движения в процессе лечения, что негативно сказывается на конформности лечения;
• определение положение почки в разные фазы дыхания с использованием методики четырехмерного сканирования (4D-КТ) без предварительной установки рентгеноконтрастных маркеров в опухоль почки [2]. В таком случае фиксируется положение опухоли во всех фазах дыхательного цикла, и весь этот диапазон движения опухоли включается в объем облучения. В этом способе компьютерная томография проводится на свободном дыхании. Однако этот метод имеет ограничение в виде меньшей прецизионности воспроизведения того положения пациента и опухоли, которые были в момент топометрии.
Описанные выше способы не позволяют контролировать движение почки непосредственно в ходе лечения. Для этого может быть использована рентгеноскопия в режиме реального времени, однако почка не визуализируется на рентгеновских снимках. Для решения этой проблемы выполняется установка рентгеноконтрастных маркеров в опухоль почки.
Имеются публикации по проведению стереотаксической лучевой терапии с установкой только 1 рентгеноконтрастного маркера в опухоль почки [3], что позволяло оценить смещение почки только в краниокаудальном направлении, но делало невозможным оценить истинное смещение опухоли во всех направлениях, соответственно, подведение более высоких разовой и суммарной очаговых доз было чревато увеличением токсичности.
Pham D. с соавторами проводили стереотаксическую лучевую терапию рака почки без установки рентгеноконтрастных маркеров в опухоль, топометрию и планирование лечения осуществляли с помощью 4D-КТ, использовали иммобилизацию системой BodyFix. Отсутствие установки маркеров в почку препятствует точности и воспроизводимости укладки пациента во время лечения, а также делает невозможным контроль за положением опухоли в процессе лечения, что приводит к увеличению рисков повышенной токсичности и невозможности использования более высоких разовых очаговых доз (лечение проводилось до 42 Грей за 3 фракции) [4].
В 2021 году было опубликовано исследование, в котором СТЛТ рака почки проводилось с использованием технологии VMAT и контроля положения пациента перед лечением путем CBCT. Учитывая низкую точность такого вида воспроизводимости укладки, а также более низкую конформность VMAT в сравнении с радиохирургическим методиками, было невозможным подведение высоких разовых доз - лечение проводилось в дозах 30-45 Грей за 5 фракций или 42 Грей за 3 фракции [5].
Патентный поиск.
Senger C. с соавторами проводили лучевую терапию рака почки с разовой очаговой дозой в 12 Гр за 3 фракции. В отличие от предложенного нами способа проводилась имплантация только одного маркера, лечение проводилось с использованием системы контроля за дыханием, но без иммобилизации, в связи с чем пациенты в данном исследовании получали меньшую разовую очаговую дозу [3].
Наиболее близкое к нашей осуществление описанной методики топометрии было у Ponsky L., он устанавливал три маркера в опухоль почки [6]. Иммобилизацию осуществлял на фиксирующем матрасе, но с руками вдоль туловища, спустя 7 дней после установки меток проводил не только мультиспиральную компьютерную томографию, но и магнитно-резонансную томографию для более точной визуализации опухоли, что является более трудоемкой и дорогостоящей процедурой, не имеющей явных преимуществ перед топометрией на компьютерном томографе с предшествующей установкой маркеров, но при этом разовые дозы подводил низкие (от 6 до 12 Грей).
В основу изобретения положена задача определения оптимального способа стереотаксического лучевого лечения локализованного рака почки с точки зрения эффективности лечения, возможности прецизионного подведения высоких разовой и суммарной очаговых доз без риска увеличения токсичности.
Указанная задача решена путем выявления недостатков имеющихся методик проведения стереотаксической лучевой терапии опухоли почки, определения рациональных принципов подготовки к лучевой терапии, принципов топометрии и физико-технического планирования, соблюдение которых позволило добиться высокой прецизионности лечения и, соответственно, сделало возможным увеличить разовую и суммарную очаговые дозы, что повышает эффективность лечения без увеличения почечной токсичности.
Впервые определены и описаны условия для возможности подведения высоких разовой и суммарной доз без увеличения почечной токсичности при проведении стереотаксической лучевой терапии локализованного рака почки.
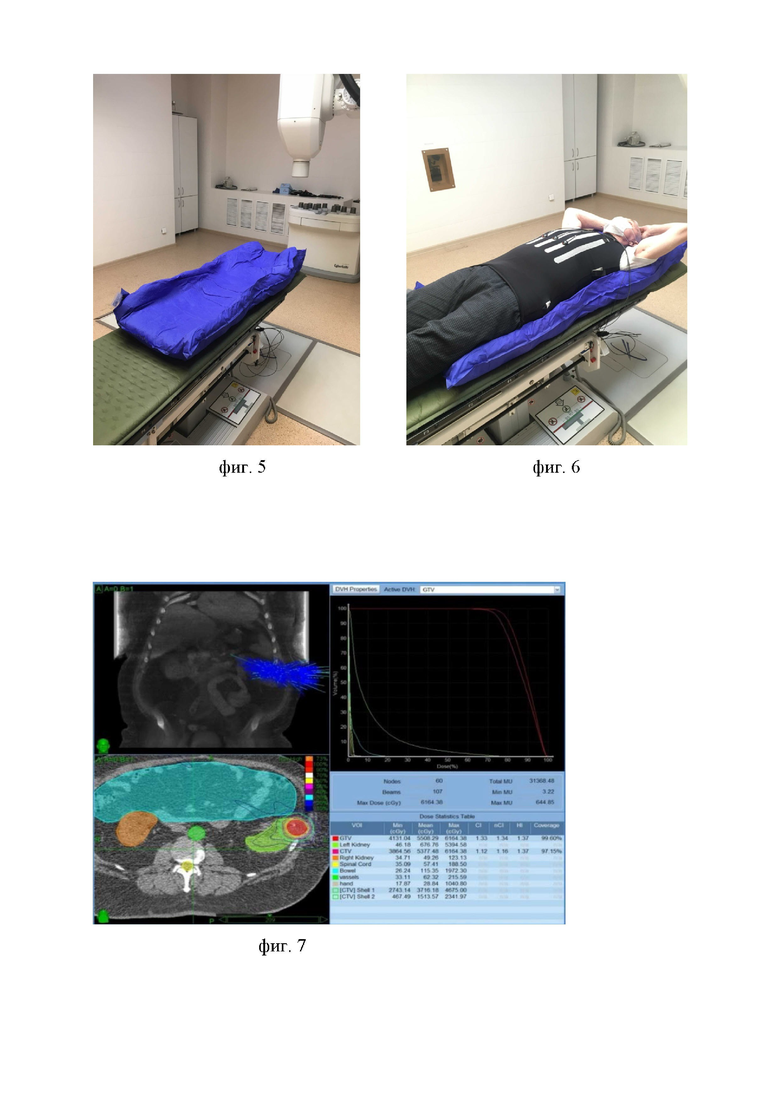
Способ стереотаксической лучевой терапии опухоли почки осуществляют нижеописанным способом. Устанавливают минимум 3 рентгеноконтрастных маркера с помощью иглы (фиг. 1) в опухоль почки под ультразвуковым контролем. Соблюдают следующие критерии постановки меток: на задержке дыхания осуществляют постановку последовательно трех маркеров в опухоль, расстояние между соседними маркерами создают не менее 2 сантиметров, угол - не менее 15 градусов, при невозможности соблюдения данных принципов ввиду малого размера опухоли, допускают установку маркера рядом с опухолью, но не дальше, чем в двух сантиметрах от нее. Перечисленные критерии выведены из расчета ожидаемой миграции маркеров в почке (на 3-5 миллиметров в течение 7-10 дней) как сразу по создавшемуся в процессе их установки каналу, так и в связи со смещением почки в процессе дыхания. Для этапа физико-технического планирования и высокой прецизионности сеансов лечения необходима визуализация маркеров во фронтальной, сагиттальной и аксиальной плоскостях (фиг. 2, фиг. 3, фиг. 4), что формируют соблюдением перечисленных критериев установки рентгеноконтрастных маркеров в опухоль. После транспортировки пациента в отделение на сидячей каталке в течение первых суток контролируют соблюдение пациентом постельного режима для минимизации смещения маркеров, оставляют пациента под наблюдением дежурного врача, осуществляют проведение гемостатической и антибактериальной терапии с профилактической целью. Далее изготавливают индивидуальный вакуумный фиксирующий матрас (фиг. 5), с помощью которого обеспечивают точную воспроизводимость укладки. Матрас изготавливают путем придания необходимого для лечения положения тела (положение на спине, руки над головой) и нагнетанием воздуха в матрас до плотной фиксации пациента в нем. Соблюдают временной интервал не менее 7 дней до проведения топометрии на мультиспиральном компьютерном томографе для окончательной стабилизации маркеров в почке. Топометрию на компьютерном томографе проводят на свободном дыхании с использованием индивидуального фиксирующего матраса, в положении пациента на спине, руки над головой. Предварительно на пациента надевают жилетку с инфракрасными маркерами, указывающими на положение грудной клетки в пространстве (фиг. 6). Физико-техническое планирование (фиг. 7) осуществляют по 80%-ной изодозе на основе принципов радиохирургии с применением 200 и более некомпланарных полей облучения, учитывая индексы конформности и однородности дозного распределения в опухоли и толерантность критических структур, отступ на планируемый облучаемый объем создают 3 мм. Непосредственно перед сеансом лечения осуществляют рентгеноскопический контроль положения тела по костным ориентирам позвоночника и контроль положения маркеров в почке (фиг. 8) с помощью двух рентгеновских трубок, установленных в каньоне линейного ускорителя (фиг. 9). В случае смещения маркеров более чем на 5 мм от их локализации в момент проведения топометрии лечение не проводят, повторяют разметку на мультиспиральном компьютерном томографе и создают новый план лучевой терапии. Лечение осуществляют на линейном ускорителе с помощью системы контроля за дыханием. В процессе сеанса лучевой терапии дыхание пациента отслеживают по наружным маркерам (фиг. 10). Далее системой контроля за дыханием создается корреляционная модель между дыхательной моделью пациента и локализацией маркеров в различных точках дыхательного цикла (фиг. 11). Лечение осуществляют на свободном дыхании с подведением разовой очаговой дозы в 15 Гр до суммарной очаговой дозы в 45 Грей за 3 фракции.
Предлагаемый способ отличается от существующих тем, что описанная совокупность принципов подготовки и проведения лечения - установка трех рентгеноконтрастных маркеров в опухоль, комфортная иммобилизация, которая не приводит к непроизвольным движениям пациента во время лечения, «двойной» рентгеноскопический контроль: по позвоночнику и по рентгеноконтрастным маркерам, - позволяет подводить высокие разовые дозы (15 Грей) в режиме гипофракционирования.
Технический результат: предложенный способ позволяет проводить стереотаксическую лучевую терапию рака почки с высокими разовой и суммарной очаговыми дозами, без увеличения риска повышения почечной токсичности, так как описанные принципы подготовки к лечению позволяют уменьшить отступ на планируемый облучаемый объем до 3 мм и достичь высокой прецизионности лечения без необходимости снижения разовой дозы, так как планирование лечения по 80%-ой изодозе приводит к более однородному распределению дозы внутри опухоли, что в совокупности с перечисленными принципами подготовки к лучевой терапии позволяет подвести высокие разовую и суммарную очаговые дозы к опухоли. Лечение проводится на свободном дыхании, что обеспечивает психологический комфорт для пациентов старшей возрастной группы.
Пример 1.
Пациентка С., 61 год, в 2006г. перенесла нефрэктомию слева по поводу ПКР. В 2011 году выявлено образование в единственной правой почке. Верифицирован почечно-клеточный рак. По поводу чего была выполнена резекция правой почки. Спустя 2 года зафиксирован рецидив рака единственной правой почки. С учетом отсутствия левой почки, рецидива после хирургического лечения в правой почке было решено провести СТЛТ как альтернативу нефрэктомии и, как следствие, диализа. В ноябре 2013г. был проведен курс СТЛТ на область рецидива рака единственной правой почки с РОД=15 Гр до СОД=45 Гр за 3 фракции. Спустя год после лечения у данной пациентки был зафиксирован частичный ответ по критериям RECIST1.1. Спустя 2 года после лечения почечная функция была восстановлена. По настоящее время пациентка наблюдается без признаков рецидива и прогрессирования заболевания.
Пример 2.
Пациентка Г., 55 лет, в январе 2015 года была обследована по поводу наличия образования правой почки. Был верифицирован ПКР. С диагнозом Рак правой почки T1aN0M0 I ст. была госпитализирована для проведения СТЛТ в связи с отказом от оперативного лечения. За 3 фракции было подведено 45 Гр на область опухоли почки. Спустя 1 год после завершения лучевой терапии почечная функция снизилась на 20%, но к концу 2-го года наблюдения она восстановилась. Отмечена стабилизация процесса по критериям RECIST 1.1. По настоящее время пациентка наблюдается без признаков рецидива и прогрессирования заболевания.
Таким образом, осуществление способа СТЛТ при локализованном раке почки у неоперабельных пациентов по представленным принципам позволяет достичь высокого уровня локального контроля над опухолью почки у неоперабельных или отказавшихся от операции пациентов благодаря подведению высокой разовой очаговой дозы в 15 Грей за 3 фракции.
Изобретение применяется в медицине, в частности в онкологии в лечении неоперабельных или отказавшихся от операции пациентов с локализованным раком почки, при лечении рецидива опухоли почки после предшествующего хирургического лечения. Способ можно применять в любом многопрофильном онкологическом учреждении, оснащенном мультиспиральным компьютерным томографом, линейным ускорителем с системой контроля за дыханием.
Литература:
1. Jana Heitmann and Matthias Guckenberger. Immobilization for SBRT: A Crucial Prerequisite Toward Accurate Treatmen.// Springer Nature Switzerland AG, 2019. С. 185-193. doi.org/10.1007/978-3-030-16924-4_18.
2. Peddada AV, Anderson D, Blasi OC, McCollough K, Jennings SB and Monroe AT: Nephron-sparing robotic radiosurgical therapy for primary renal cell carcinoma: single-institution experience and review of the literature. Adv Radiat Oncol 5 (2): 204-211, 2019. PMID: 32280820. DOI: 10.1016/ j.adro. 2019. 10. 001.
3. Senger C, Conti A, Kluge A, Pasemann D et al.: Robotic stereotactic ablative radiotherapy for renal cell carcinoma in patients with impaired renal function. BMC Urol 19 (1): 96, 2019. PMID: 31638979. DOI: 10.1186/s12894-019-0531-z.
4. Pham D, Thompson A, Kron T, et al. Stereotactic ablative body radiation therapy for primary kidney cancer: A 3-dimensional conformal technique associated with low rates of early toxicity. Int J Radiat Oncol Biol Phys 2014;90:1061-8.
5. A Swaminath, P Cheung, R M Glicksman, E K Donovan, M Niglas, D Vesprini, A Kapoor, D Erler, W Chu. Patient-reported Quality of Life following Stereotactic Body Radiation Therapy for Primary Kidney Cancer - Results from a Prospective Cohort Study. Clin Oncol (R Coll Radiol). 2021 Jul;33(7): 468-475. doi: 10.1016/j.clon.2021.03.002. Epub 2021 Mar 26.
6. Ponsky L, Lo SS, Zhang Y, Schluchter M, Liu Y, Patel R et al.: Phase I dose-escalation study of stereotactic body radiotherapy (SBRT) for poor surgical candidates with localized renal cell carcinoma. Radiother Oncol 117 (1): 183-187, 2015. PMID: 26362723. DOI: 10.1016/j.radonc. 2015.08.030.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ стажированной лучевой терапии в лечении метастатических опухолей головного мозга при раке молочной железы | 2023 |
|
RU2827299C1 |
| СПОСОБ РАДИОТЕРАПИИ РАННЕГО РАКА ЖЕЛУДКА | 2022 |
|
RU2789963C2 |
| Способ предлучевой подготовки (топометрии) для проведения внутриполостной лучевой терапии рака пищевода | 2018 |
|
RU2698904C2 |
| СПОСОБ ХИМИОЛУЧЕВОГО ЛЕЧЕНИЯ ОРОФАРИНГЕАЛЬНОГО РАКА | 2016 |
|
RU2632542C1 |
| СПОСОБ ПОСЛЕОПЕРАЦИОННОЙ ЛУЧЕВОЙ ТЕРАПИИ РАКА ЖЕЛУДКА | 2004 |
|
RU2277952C2 |
| Способ лечения сарком мягких тканей конечностей | 2023 |
|
RU2818463C1 |
| СПОСОБ ЛЕЧЕНИЯ НЕРЕЗЕКТАБЕЛЬНЫХ И ПОТЕНЦИАЛЬНО РЕЗЕКТАБЕЛЬНЫХ МЕТАСТАЗОВ КОЛОРЕКАЛЬНОГО РАКА В ПЕЧЕНИ | 2019 |
|
RU2722349C2 |
| Селективное оконтуривание мягких тканей передней грудной стенки у больных раком молочной железы после мастэктомии и реконструктивно-пластической операции с установкой эндопротеза перед радиотерапией по гипофракционированному режиму | 2021 |
|
RU2774857C1 |
| Способ лучевой терапии больных с локорегионарными рецидивами рака предстательной железы после радикальной простатэктомии и наличием единичных отдаленных метастазов | 2019 |
|
RU2712009C1 |
| СПОСОБ ЛЕЧЕНИЯ МЕСТНОРАСПРОСТРАНЕННОГО НЕМЕЛКОКЛЕТОЧНОГО РАКА ЛЕГКОГО | 2012 |
|
RU2489181C1 |

Изобретение относится к медицине, в частности к онкологии и лучевой терапии, и может быть использовано для стереотаксической лучевой терапии локализованного рака почки у неоперабельных больных. Осуществляют установку последовательно трех рентгеноконтрастных маркеров в опухоль почки на задержке дыхания с расстоянием между соседними маркерами не менее двух сантиметров для визуализации маркеров во фронтальной, сагиттальной и аксиальной плоскостях. При малом размере опухоли осуществляют установку маркера рядом с опухолью, но не дальше, чем в двух сантиметрах от нее. Изготовляют индивидуальный фиксирующий матрас. Укладывают пациента на фиксирующий матрас в положении на спине, руки над головой, и нагнетают воздух в матрас до плотной фиксации пациента в нем. Через 7 дней после установки рентгеноконтрастных маркеров проводят конусно-лучевую компьютерную томографию (КЛКТ) на свободном дыхании с использованием индивидуального фиксирующего матраса в положении пациента на спине, руки над головой, с предварительно надетой на пациента жилеткой с инфракрасными маркерами, указывающими на положение грудной клетки в пространстве. Осуществляют планирование по 80%-ной изодозе с применением 200 и более некомпланарных полей облучения с отступом на планируемый облучаемый объем 3 мм. Непосредственно перед сеансом лечения проводят контроль положения тела путем получения рентгенологического изображения позвоночника и сравнения положения позвоночника относительно его положения на КЛКТ. После чего проводят контроль положения маркеров в почке. В случае смещения маркеров более чем на 5 мм от их локализации в момент проведения КЛКТ создают новый план лучевой терапии. Проводят лечение на линейном ускорителе с системой контроля за дыханием с подведением разовой очаговой дозы в 15 Гр до суммарной очаговой дозы в 45 Гр за 3 фракции на свободном дыхании с использованием индивидуального фиксирующего матраса в положении на спине, руки над головой. Способ обеспечивает эффективное лечение без риска увеличения токсичности за счет прецизионного подведения высоких разовой и суммарной очаговых доз. 11 ил., 2 пр.
Способ стереотаксической лучевой терапии локализованного рака почки у неоперабельных больных, заключающийся в том, что осуществляют установку последовательно трех рентгеноконтрастных маркеров в опухоль почки на задержке дыхания с расстоянием между соседними маркерами не менее двух сантиметров для визуализации маркеров во фронтальной, сагиттальной и аксиальной плоскостях, при малом размере опухоли осуществляют установку маркера рядом с опухолью, но не дальше, чем в двух сантиметрах от нее; изготовляют индивидуальный фиксирующий матрас, укладывают пациента на фиксирующий матрас в положении на спине, руки над головой, и нагнетают воздух в матрас до плотной фиксации пациента в нем; через 7 дней после установки рентгеноконтрастных маркеров проводят конусно-лучевую компьютерную томографию (КЛКТ) на свободном дыхании с использованием индивидуального фиксирующего матраса, в положении пациента на спине, руки над головой, с предварительно надетой на пациента жилеткой с инфракрасными маркерами, указывающими на положение грудной клетки в пространстве, осуществляют планирование по 80%-ной изодозе с применением 200 и более некомпланарных полей облучения с отступом на планируемый облучаемый объем 3 мм; непосредственно перед сеансом лечения проводят контроль положения тела путем получения рентгенологического изображения позвоночника и сравнения положения позвоночника относительно его положения на КЛКТ, после чего проводят контроль положения маркеров в почке; в случае смещения маркеров более чем на 5 мм от их локализации в момент проведения КЛКТ создают новый план лучевой терапии; приводят лечение на линейном ускорителе с системой контроля за дыханием с подведением разовой очаговой дозы в 15 Гр до суммарной очаговой дозы в 45 Гр за 3 фракции на свободном дыхании с использованием индивидуального фиксирующего матраса в положении на спине, руки над головой.
| СПОСОБ ЛЕЧЕНИЯ ДИССЕМИНИРОВАННОГО ПОЧЕЧНО-КЛЕТОЧНОГО РАКА | 2017 |
|
RU2681300C1 |
| RU 2019116921 A, 30.11.2020 | |||
| US 20220143422 A1, 12.05.2022 | |||
| US 20220370827 A1, 24.11.2022 | |||
| WO 2016124232 A1, 11.08.2016 | |||
| СТЕПАНОВИЧ Е.А | |||
| и др | |||
| Стереотаксическая лучевая терапия при почечно-клеточном раке | |||
| Опыт и непосредственные результаты | |||
| Злокачественные опухоли | |||
| Способ получения продуктов конденсации фенолов с формальдегидом | 1924 |
|
SU2022A1 |
| HANNAN R | |||
| et al | |||
| Phase II Trial of | |||
Авторы
Даты
2023-11-21—Публикация
2022-12-28—Подача