Настоящее изобретение относится к композициям, содержащим галактоолигосахариды (GOS) и бактерии-пробиотики, полученные способом, включающим стадию выращивания бактерий в содержащей GOS среде, причем такая композиция обладает эффектом усиления синбиотического эффекта бактерий-пробиотиков с GOS. Также рассмотрены полезные для здоровья эффекты бактерий-пробиотиков, полученных таким способом ферментации.
Предпосылки создания изобретения
Бактерии-пробиотики, такие как бифидобактерии, давно используют для обеспечения различных полезных для здоровья эффектов, например, было показано, что они эффективно модулируют иммунный ответ, предотвращают и лечат инфекции, уменьшают воспаление и уменьшают аллергический ответ.
Бифидобактерии, в частности, представляют собой грамположительные анаэробные палочковидные бактерии, способные колонизировать человеческий кишечник и гидролизовать сложные углеводы. Представители рода Bifidobacterium часто применяются в качестве пробиотических микроорганизмов в широком диапазоне продуктов, включая детскую смесь.
Пребиотики также были подробно описаны. Пребиотики представляют собой ингредиенты, такие как олигосахариды, которые обеспечивают полезные для здоровья эффекты при ферментации естественной микрофлорой в кишечнике субъекта или бактериями-пробиотиками, принимаемыми внутрь одновременно с пребиотиками. Полное описание полезных эффектов пребиотиков можно найти, например, у McFarlane et al., Bacterial metabolism and health-related effects of galacto-oligosaccharides and other prebiotics, J Appl Microbiol, 2008, 104:305–344.
Комбинация конкретных типов пребиотиков и пробиотиков обеспечивает повышение синергетического эффекта. В частности, эффект комбинированных пребиотических галактоолигосахаридов (GOS) и пробиотических микроорганизмов, таких как бифидобактерии, подробно отражен документально в научных статьях и патентах. Например, было описано, что комбинация пробиотиков и GOS полезна для модулирования состава кишечной микробиоты (см., например, Environ. Microbiol., 2016, 18 (7): 2185–2195) и для модулирования иммунного ответа, например, для повышения иммунной защиты (см., например, Br J nutr., 2014, 111 (11): 1945–1956), предотвращения инфекций (см., например, Dis. Sci., 2009, 54(5):1071–8; J Clin Gastroenterology, 2008, 42 (Supp 3, Part 2): 224–233) или предотвращения аллергии (см., например, работу Allergy, 2011, 66 (2): 170–177, относящуюся к предотвращению астматических симптомов у младенцев с аллергическим дерматитом). Эффект таких синбиотиков был доказан, в частности, у младенцев, так что несколько композиций детских смесей, содержащих, например, GOS и бактерии-пробиотики, были использованы в коммерческих масштабах.
Было показано, что синбиотический эффект обусловлен потреблением GOS пробиотиками, например бифидобактериями, в желудочно-кишечном тракте субъекта. Таким образом, были проведены дополнительные исследования в отношении способности бактерий-пробиотиков к росту и потреблению GOS. Например, Garrido et al., Utilization of galactooligosaccharides by Bifidobacterium longum subsp. infantis isolates, Food Microbiol, 2013, 33(2): 262–270 исследовали способность 22 изолятов B. longum подвид infantis к росту на GOS. Все изоляты демонстрировали активный рост на этих олигосахаридах. Vernazza et al., Carbohydrate preference, acid tolerance and bile tolerance in five strains of Bifidobacterium; J Appl Microbiol, 2006, 100 (4):846:853, провели анализ пяти штаммов Bifidobacterium на предпочтение углеводов из 12 субстратов. Для сравнения предпочтений субстратов были использованы максимальные темпы роста. Галактоолигосахариды хорошо утилизировались всеми исследованными видами. Watson et al., Selective carbohydrate utilization by lactobacilli and bifidobacteria; J Appl Microbiol, 2013, 114 (4): 1132–1146, также провели испытание шестидесяти восьми бактериальных штаммов, являющихся представителями 29 лактобацилл человеческого происхождения и 39 бифидобактерий (как человеческого, так и животного происхождения) на их способность метаболизировать 10 различных углеводов. Было показано, что галактоолигосахариды (GOS) и лактулоза поддерживают самые благоприятные характеристики роста. Эти исследования подтверждают возможность использования синбиотиков GOS с различными бактериями-пробиотиками.
Другие исследования были сосредоточены на идентификации молекулярных механизмов потребления GOS. В частности, Motherway et al., Transcriptional and functional characterization of genetic elements involved in galacto-oligosaccharide utilization by Bifidobacterium breve UCC2003, Microbial Technology, 2013, 6(1): 67–79, описали определение функциональных характеристик локуса gal B. breve UCC2003, который предназначен для утилизации содержащего галактозу полисахарида галактана растительного происхождения. В этом исследовании было установлено, что для потребления GOS B. breve UCC2003 требуется оперон galCDEGR(A).
Существует постоянная потребность в идентификации дополнительных синбиотических композиций. Полезно не только идентифицировать синбиотические композиции, нацеленные на новые полезные эффекты, но и повышать эффективность композиций, уже известных как обеспечивающие преимущественный эффект для здоровья. Таким образом, желательно улучшить эффективность синбиотических композиций при заданной дозе и/или поддерживать данный уровень активности, уменьшая при этом дозу бактерий-пробиотиков и/или пребиотиков, не уменьшая полезного действия синбиотиков на организм-хозяина. Настоящее изобретение решает эти задачи.
Изложение сущности изобретения
В первом аспекте в изобретении предложена композиция, содержащая эффективное количество галактоолигосахаридов и содержащих оперон galCDEGR(A) бактерий-пробиотиков, причем указанные бактерии-пробиотики получены способом, включающим стадии
a. ферментации бактерий-пробиотиков в среде для выращивания бактерий, содержащей галактоолигосахариды и пептон; и
b. сбора культивированных бактерий-пробиотиков.
Во втором аспекте в изобретении предложены содержащие оперон galCDEGR(A) бактерии-пробиотики, полученные способом, включающим стадии
a. ферментации бактерий-пробиотиков в среде для выращивания бактерий, содержащей галактоолигосахариды и пептон; и
b. сбора культивированных бактерий-пробиотиков;
или композиция изобретения для применения в терапии.
В третьем аспекте в изобретении предложен способ повышения терапевтического эффекта композиции, содержащей галактоолигосахариды и содержащие оперон galCDEGR(A) бактерии-пробиотики, включающий
a. ферментацию бактерий-пробиотиков в среде для выращивания бактерий, содержащей галактоолигосахариды и пептон; и
b. сбор культивированных бактерий-пробиотиков,
перед включением бактерий-пробиотиков в синбиотическую композицию.
Краткое описание графических материалов
Фиг. 1. Кривые средней оптической плотности (OD) для испытуемых штаммов Bifidobacterium, выращенных в течение ночи на BMOS: B. animalis ssp. lactis NCC2818 (A), B. breve NCC466 (B), B. longum NCC435 (C), B. longum NCC3001 (D) и B. longum NCC4020 (E).
Фиг. 2. Кривые средних OD для испытуемых штаммов Bifidobacterium, выращенных в течение ночи на P-GOS: B. animalis ssp. lactis NCC2818 (A), B. breve NCC466 (B), B. longum NCC435 (C), B. longum NCC3001 (D) и B. longum NCC4020 (E).
Фиг. 3. Уменьшение количества олигосахаридов в BM + BMOS (A) и в BM + P-GOS (B) в г на 100 г среды после ферментации испытуемыми штаммами Bifidobacterium.
Фиг. 4. Количество клеток испытуемых штаммов Bifidobacterium, выращенных в BM + BMOS и BM + P-GOS, определенное методом проточной цитометрии.
Фиг. 5. Уменьшение количества олигосахаридов в BM + BMOS (A) и в IM + P-GOS (B) в г на 100 г среды после ферментации 5 штаммами Bifidobacterium.
Фиг. 6. Количество клеток испытуемых штаммов Bifidobacterium, выращенных в IM + BMOS и IM + P-GOS, определенное методом проточной цитометрии.
Фиг. 7. Экспериментальная модель в эксперименте по предварительному кондиционированию с использованием BMOS в качестве источника GOS.
Фиг. 8. Кривые мониторинга рН с помощью Cinac для одного из экспериментов по предварительному кондиционированию штамма NCC2818 B. animalis ssp. lactis на BMOS в качестве источника GOS (A) и на P-GOS в качестве источника GOS (B): (III) продукция биомассы на декстрозе, (IV) продукция биомассы на источнике GOS, (I) биомасса, выращенная на декстрозе после воздействия источника GOS, (II) биомасса, выращенная на источнике GOS после повторного воздействия источника GOS. Смещение увеличения кислотности среды при повторном воздействии источника GOS обозначено полужирной горизонтальной стрелкой.
Фиг. 9. Количество клеток штаммов Bifidobacterium, размноженных в среде IM + декстроза и IM + BMOS, определенное методом проточной цитометрии.
Фиг. 10. Количество клеток штаммов Bifidobacterium, размноженных либо на декстрозе, либо на BMOS, до (t0) и после (GJ) воздействия желудочного сока, определенное методом проточной цитометрии.
Фиг. 11. Количество клеток штаммов Bifidobacterium, размноженных на декстрозе или BMOS, при повторном воздействии BMOS после воздействия желудочного сока, определенное методом проточной цитометрии.
Фиг. 12. Кривые мониторинга рН с помощью Cinac для одного из экспериментов по предварительному кондиционированию штамма NCC466 B. breve на BMOS в качестве источника GOS: (III) продукция биомассы на декстрозе, (IV) продукция биомассы на источнике GOS, (I) биомасса, выращенная на декстрозе после воздействия источника GOS, (II) биомасса, выращенная на источнике GOS после повторного воздействия источника GOS. Смещение увеличения кислотности среды при повторном воздействии источника GOS обозначено полужирной горизонтальной стрелкой.
Фиг. 13. Кривые мониторинга рН с помощью Cinac для одного из экспериментов по предварительному кондиционированию штамма NCC435 B. longum на BMOS в качестве источника GOS: (III) продукция биомассы на декстрозе, (IV) продукция биомассы на источнике GOS, (I) биомасса, выращенная на декстрозе после воздействия источника GOS, (II) биомасса, выращенная на источнике GOS после повторного воздействия источника GOS. Смещение увеличения кислотности среды при повторном воздействии источника GOS обозначено полужирной горизонтальной стрелкой.
Фиг. 14. Кривые мониторинга рН с помощью Cinac для одного из экспериментов по предварительному кондиционированию штамма NCC3001 B. longum на BMOS в качестве источника GOS: (III) продукция биомассы на декстрозе, (IV) продукция биомассы на источнике GOS, (I) биомасса, выращенная на декстрозе после воздействия источника GOS, (II) биомасса, выращенная на источнике GOS после повторного воздействия источника GOS. Смещение увеличения кислотности среды при повторном воздействии источника GOS обозначено полужирной горизонтальной стрелкой.
Фиг. 15. Кривые мониторинга рН с помощью Cinac для одного из экспериментов по предварительному кондиционированию штамма NCC4020 B. longum на BMOS в качестве источника GOS: (III) продукция биомассы на декстрозе, (IV) продукция биомассы на источнике GOS, (I) биомасса, выращенная на декстрозе после воздействия источника GOS, (II) биомасса, выращенная на источнике GOS после повторного воздействия источника GOS. Смещение увеличения кислотности среды при повторном воздействии источника GOS обозначено полужирной горизонтальной стрелкой.
Фиг. 16. Скорость роста клеток штамма NCC 2818 B. animalis ssp. lactis, предварительно выращенного при разном процентном содержании BMOS (треугольники) или декстрозы (квадраты) в качестве источника углерода, при (повторном) воздействии BMOS.
Фиг. 17. Продукция суммарных короткоцепочечных жирных кислот (КЦЖК) после 6 ч ферментации с 0 г/л или 5 г/л BMOS в качестве источника GOS при его введении в среду, либо при одновременном добавлении со штаммом NCC2818 B. animalis ssp. lactis, либо при предварительном кондиционировании штамма NCC2818 B. animalis ssp. lactis источником GOS. Смещение продукции суммарных КЦЖК в связи с синергетическим эффектом между штаммом NCC2818 B. animalis ssp. lactis и источником GOS обозначено полужирной стрелкой, тогда как синергетический эффект между предварительно кондиционированным штаммом NCC2818 B. animalis ssp. lactis и источником GOS показан пунктирной стрелкой.
Фиг. 18. Продукция ацетата после 6 ч ферментации с 0 г/л или 5 г/л BMOS в качестве источника GOS при его введении в среду, либо при одновременном добавлении со штаммом NCC2818 B. animalis ssp. lactis, либо при предварительном кондиционировании штамма NCC2818 B. animalis ssp. lactis источником GOS. Смещение продукции ацетата в связи с синергетическим эффектом между штаммом NCC2818 B. animalis ssp. lactis и источником GOS обозначено полужирной стрелкой, тогда как синергетический эффект между предварительно кондиционированным штаммом NCC2818 B. animalis ssp. lactis и источником GOS показан пунктирной стрелкой.
Фиг. 19. Продукция лактата после 6 ч ферментации с 0 г/л или 5 г/л BMOS в качестве источника GOS при его введении в среду, либо при одновременном добавлении со штаммом NCC2818 B. animalis ssp. lactis, либо при предварительном кондиционировании штамма NCC2818 B. animalis ssp. lactis источником GOS. Смещение продукции лактата в связи с синергетическим эффектом между штаммом NCC2818 B. animalis ssp. lactis и источником GOS обозначено полужирной стрелкой, тогда как синергетический эффект между предварительно кондиционированным штаммом NCC2818 B. animalis ssp. lactis и источником GOS показан пунктирной стрелкой.
Фиг. 20. Продукция аммония после 24 ч ферментации с 0 г/л или 5 г/л BMOS в качестве источника GOS при его введении в среду, либо при одновременном добавлении со штаммом NCC2818 B. animalis ssp. lactis, либо при предварительном кондиционировании штамма NCC2818 B. animalis ssp. lactis источником GOS. Смещение продукции аммония в связи с синергетическим эффектом между штаммом NCC2818 B. animalis ssp. lactis и источником GOS обозначено полужирной стрелкой, тогда как синергетический эффект между предварительно кондиционированным штаммом NCC2818 B. animalis ssp. lactis и источником GOS показан пунктирной стрелкой.
Фиг. 21. Кривые мониторинга рН с помощью iCinac для одного из экспериментов по предварительному кондиционировании высушенного распылением штамма NCC2818 B. animalis ssp. lactis на BMOS в качестве источника GOS. (I) Биомасса, выращенная на декстрозе после воздействия источника GOS, (II) биомасса, выращенная на источнике GOS после повторного воздействия источника GOS. Смещение увеличения кислотности среды при повторном воздействии источника GOS обозначено полужирной горизонтальной стрелкой.
Фиг. 22. Кривые мониторинга рН с помощью iCinac для одного из экспериментов по предварительному кондиционированию штамма NCC533 Lactobacillus johnsonii на BMOS в качестве источника GOS: (I) продукция биомассы на источнике GOS, (III) продукция биомассы на декстрозе, (II) биомасса, выращенная на декстрозе после воздействия источника GOS, (IV) биомасса, выращенная на источнике GOS после повторного воздействия источника GOS. Смещение увеличения кислотности среды при повторном воздействии источника GOS обозначено полужирной горизонтальной стрелкой.
Фиг. 23. Скорость роста клеток штамма NCC 533 Lactobacillus johnsonii, предварительно выращенного при разном процентном содержании BMOS (треугольники) или декстрозы (квадраты) в качестве источника углерода, при (повторном) воздействии BMOS.
Подробное описание изобретения
В настоящем изобретении предложены синбиотические композиции, обладающие улучшенным терапевтическим эффектом. Как будет очевидно из настоящих примеров, синбиотические композиции, включающие в себя содержащие оперон galCDEGR(A) бактерии-пробиотики и GOS, обладают улучшенным эффектом при получении бактерий-пробиотиков способом, включающим стадию ферментации бактерий-пробиотиков в среде для выращивания бактерий, содержащей галактоолигосахариды и пептон.
Способы получения бактерий-пробиотиков для промышленного применения предшествующего уровня техники включают стадию ферментации бактерий в среде для выращивания, содержащей сахар, такой как, например, глюкоза, фруктоза, сахароза, лактоза или декстроза. В проведенных ранее исследованиях также оценили рост бактерий-пробиотиков на GOS. Однако ни в одном из этих исследований не описано повторное воздействие GOS на бактерии после окончания ферментации на GOS, и ни в одном из этих исследований даже не предполагали, что бактерии-пробиотики, выращенные на GOS, могут проявлять преимущественные свойства. В настоящее время авторы настоящего изобретения обнаружили, что бактерии-пробиотики, предварительно размноженные на GOS, при повторном воздействии на них GOS демонстрировали более короткую лаг-фазу по сравнению с бактериями, выращенными на сахаре, таком как декстроза. При предварительном кондиционировании бактерий-пробиотиков GOS (т.е. если они были выращены на GOS в процессе их получения) такие бактерии-пробиотики впоследствии могут быстрее начать потреблять GOS при воздействии на них этого олигосахарида в желудочно-кишечном тракте субъекта. Такое более быстрое потребление GOS сопровождается повышенным полезным эффектом и, в частности, повышенным синбиотическим эффектом для субъекта, потребляющего предварительно кондиционированные бактерии и GOS.
Как видно из примеров настоящей заявки, испытуемые штаммы, предварительно кондиционированные GOS, демонстрировали более короткую лаг-фазу по сравнению с теми, которые были выращены на декстрозе. Различие между длительностью лаг-фазы предварительно кондиционированных бактерий и бактерий, не подвергавшихся предварительному кондиционированию, изменяется в зависимости от штамма, но все испытуемые штаммы проявляют существенно сокращенную лаг-фазу. Сокращенная лаг-фаза связана с более быстрым поглощением GOS предварительно кондиционированными бактериями и с повышенным синбиотическим эффектом. Определено, что именно предварительно кондиционированные бактерии оказывают улучшенное действие на активацию здоровой микробиоты в кишечнике субъекта и проявляют другие преимущества, связанные с более здоровой микробиотой, такие как модулирование иммунной защиты субъекта, усиление иммунной защиты субъекта, предотвращение, лечение или уменьшение инфекций у субъекта, предотвращение, лечение или уменьшение воспаления у субъекта, повышение продукции суммарных короткоцепочечных жирных кислот, ацетата и/или молочной кислоты в желудочно-кишечном тракте субъекта или сокращение продукции аммония в желудочно-кишечном тракте субъекта.
Определения
В настоящем документе следующие термины имеют приведенные ниже определения.
Термин «младенец» означает ребенка в возрасте до 12 месяцев.
Выражение «ребенок младшего возраста» означает ребенка в возрасте от одного до трех лет (также называют ребенком, начинающим ходить).
Выражение «питательная композиция» означает композицию, которой питается субъект. Данная питательная композиция обычно предназначена для перорального или внутривенного применения и обычно включает в себя источник липидов или жира и источник белка.
В конкретном варианте осуществления композиция настоящего изобретения представляет собой гипоаллергенную питательную композицию. Выражение «гипоаллергенная питательная композиция» означает питательную композицию, для которой вероятность того, что она вызовет аллергические реакции, является небольшой.
В конкретном варианте осуществления композиция настоящего изобретения представляет собой «искусственную питательную композицию». Выражение «искусственная питательная композиция» означает смесь, полученную с помощью химических и/или биологических средств, которые могут быть химически идентичны смеси природного происхождения, присутствующей в молоке млекопитающих (т.е. искусственная композиция не является грудным молоком).
Выражение «детская смесь» при использовании в настоящем документе относится к продукту питания, специально предназначенному для употребления в пищу младенцами в течение первых месяцев жизни, который сам по себе удовлетворяет потребности в питании этой категории лиц (статья 2(c) Директивы Европейской комиссии 91/321/EEC 2006/141/EC от 22 декабря 2006 г. о детских смесях и смесях для прикармливаемых детей). Оно также относится к питательной композиции, предназначенной для младенцев, как определено в Codex Alimentarius (Codex STAN 72-1981) и Infant Specialities (включая статью Food for Special Medical Purpose). Выражение «детская смесь» охватывает как «начальную детскую смесь», так и «смесь последующего уровня» или «смесь для прикармливаемых детей».
«Смесь последующего уровня» или «смесь для прикармливаемых детей» дают, начиная с 6-го месяца. Она составляет главный жидкий элемент в постепенно увеличивающемся разнообразии рациона для лиц данной категории.
Выражение «детское питание» означает продукт питания, специально предназначенный для употребления в пищу младенцами или детьми младшего возраста в течение первых лет жизни.
Выражение «детская композиция на зерновой основе» означает продукт питания, специально предназначенный для употребления в пищу младенцами или детьми младшего возраста в течение первых лет жизни.
Термин «обогатитель» относится к жидким или твердым питательным композициям, подходящим для смешивания с грудным молоком или детской смесью.
Выражения «в возрасте дней/недель/месяцев/лет» и «дней/недель/месяцев/лет после рождения» могут использоваться как взаимозаменяемые.
Под «материнским молоком» следует понимать грудное молоко или молозиво матери.
«Олигосахарид» представляет собой сахаридный полимер, содержащий небольшое число (как правило, от трех до десяти) простых сахаров (моносахаридов).
Термин «галактоолигосахарид (-ы)» или «GOS» относится к олигосахариду (-ам), содержащему (-им) по меньшей мере три галактозных звена.
Термин «пребиотик» означает субстрат, селективно утилизируемый микроорганизмами-хозяевами, придающими полезный для здоровья эффект (Согласованное экспертное заключение: Совместное заключение Международной научной ассоциации по пробиотикам и пребиотикам (ISAPP) по определению и сфере применения пребиотиков, Nature Reviews Gastroenterology & Hepatology, 2017, 14, 491–502).
Термин «пробиотик» означает живые микроорганизмы, которые при введении в необходимых количествах придают полезный для здоровья эффект организму-хозяину (Всемирная организация по продовольствию (FAO) / Всемирная организация здравоохранения (ВОЗ), 2002). Клетки микроорганизмов, по существу, представляют собой бактерии или дрожжи.
Термин «синбиотик» означает питательные композиции или пищевые добавки, содержащие комбинацию пробиотика (-ов) и пребиотика (-ов), в которых пребиотик (-и) селективно благоприятствует (-ют) пробиотику (-ам) (см. DeVrese and Schrezenmeir, Probiotics, prebiotics and synbiotics in food biotechnology, Springer Berlin Heidelberg, pp 1–66. Термин «синбиотический эффект» в настоящем документе относится к повышению преимущественного полезного для здоровья эффекта синбиотика по сравнению с эффектом одного пробиотика.
Под термином «КОЕ» следует понимать колониеобразующую единицу.
Под термином «afu» следует понимать единицу активной флуоресценции (active fluorescence unit).
Термин «предварительное кондиционирование» бактерий-пробиотиков означает выращивание бактерий-пробиотиков на GOS в процессе получения бактерий-пробиотиков. Термин «предварительно кондиционированные бактерии-пробиотики» обозначают бактерии-пробиотики, полученные способом, включающим стадию предварительного кондиционирования.
«Оперон galCDEGR(A)» относится к оперону, в котором присутствуют все гены galC, galD, galE, galG и galR и в котором необязательно присутствует ген galA. Таким образом, должно быть понятно, что бактерии-пробиотики, в которых отсутствует ген galA, имеют оперон galCDEGR(A).
Термин «лаг-фаза» относится ко времени, в течение которого бактерии достигают максимальной степени увеличения кислотности среды (TM).
Термин «пептон» означает автолизат или гидролизат из источника белка, такого как дрожжи, мясо, казеин, желатин или растительный источник. «Дрожжевой пептон» представляет собой автолизат или гидролизат из дрожжей.
Если не указано иное, все процентные содержания представляют собой мас.%.
Предварительно кондиционированные бактерии-пробиотики
Бактерии-пробиотики в композиции изобретения обладают опероном galCDEGR(A). Ранее было идентифицировано, что такие гены существенны для роста бактерий-пробиотиков, таких как Bifidobacterium breve, на GOS. См., например, Motherway et al., Transcriptional and functional characterization of genetic elements involved in galacto-oligosaccharide utilization by Bifidobacterium breve UCC2003, Microbial Technology, 2013, 6(1): 67–79.
Оперон galCDEGR(A) представляет собой генный кластер, содержащий гены galC, galD, galE, galG и galR и необязательно содержащий ген galA. Гены galC, galD и galE кодируют систему переносчиков семейства ABC, которая осуществляет специфичную интернализацию GOS с низкой степенью полимеризации (DP, degree of polymerization). Затем он гидролизуется внутриклеточными β-галактозидазами, одну из которых кодирует ген galG. Образующаяся таким путем глюкоза непосредственно поступает в разветвленный (бифидный) шунт, при этом галактоза сначала преобразуется в глюкозу посредством пути Лелуара, после чего также поступает в бифидный шунт. galR представляет собой ДНК-связывающий белок Lacl-типа, контролирующий транскрипцию оперона galCDEGR, а также гена galA. Ген galA кодирует внеклеточную эндогалактаназу, расщепляющую перед интернализацией компоненты GOS с DP выше 3. Ген galA не является необходимым для способности бактерий-пробиотиков к потреблению GOS, поскольку других генов оперона достаточно для потребления олигосахаридов с DP от 2 до 3, в большом количестве содержащихся в GOS. В приведенных ниже примерах будет показано, как бактериальные штаммы, содержащие и не содержащие ген galA, проявляют преимущественно улучшенные синбиотические свойства. В одном варианте осуществления бактерии-пробиотики имеют оперон galCDEGR(A), а ген galA присутствует в бактериальном геноме.
Точная последовательность оперона galCDEGR(A) незначительно различается между штаммами. Однако последовательности этих последовательностей достаточно подобны друг другу, так что специалист в данной области может легко идентифицировать наличие или отсутствие оперона galCDEGR(A) в каком-либо конкретном штамме, у которого был секвенирован геном. Геном бактерий-пробиотиков может быть подвергнут скринингу на гомологию последовательности с последовательностями оперона galCDEGR(A), описанными у Motherway et al., Transcriptional and functional characterization of genetic elements involved in galacto-oligosaccharide utilization by Bifidobacterium breve UCC2003, Microbial Technology, 2013, 6(1): 67–79. Содержащаяся в данном документе информация включена в настоящий документ путем ссылки. Такой скрининг можно проводить, например, с помощью программы BLAST® (Basic Local Alignment Search Tool), разработанной Национальным центром биотехнологической информации США (NCBI).
Предпочтительными содержащими оперон galCDEGR(A) бактериями-пробиотиками являются Bifidobacterium или Lactobacillus, более предпочтительно они выбраны из Bifidobacterium animalis ssp. lactis, Bifidobacterium longum, Bifidobacterium breve и Lactobacillus johnsonii. Наиболее предпочтительно они выбраны из Bifidobacterium animalis ssp. lactis CNCM I-3446, Bifidobacterium longum ATCC BAA-999, Bifidobacterium longum ATCC 15707, Bifidobacterium longum CNCM I-5259, Bifidobacterium breve CNCM I-3914 и Lactobacillus johnsonii CNCM I-1225. В другом предпочтительном варианте осуществления содержащие оперон galCDEGR(A) бактерии-пробиотики представляют собой Bifidobacterium, более предпочтительно они выбраны из Bifidobacterium animalis ssp. lactis, Bifidobacterium longum и Bifidobacterium breve. Наиболее предпочтительно они выбраны из Bifidobacterium animalis ssp. lactis CNCM I-3446, Bifidobacterium longum ATCC BAA-999, Bifidobacterium longum ATCC 15707, Bifidobacterium longum CNCM I-5259 и Bifidobacterium breve CNCM I-3914.
Бактерии-пробиотики, присутствующие в композиции настоящего изобретения, должны представлять собой живые бактерии-пробиотики, поскольку синбиотический эффект обусловлен потреблением GOS бактериями в желудочно-кишечном тракте индивида, потребляющего композицию. Бактерии считаются «живыми», когда они способны размножаться в контролируемых условиях культивирования и образовывать колонии или суспензии, или когда метаболическая активность микроорганизмов и/или целостность мембраны могут быть установлены с помощью способов, известных специалисту в данной области, таких как, например, проточная цитометрия.
Как уже объяснялось выше, бактерии-пробиотики для включения в композицию изобретения необходимо подвергать предварительному кондиционированию, чтобы они обладали улучшенным синбиотическим эффектом при последующем потреблении с GOS, т.е. они должны быть выращены на GOS в процессе их получения. Предпочтительно бактерии-пробиотики получены способом, включающим стадию ферментации бактерий-пробиотиков в среде, содержащей источник GOS, и более предпочтительно источник GOS является единственным источником углеводов. Более предпочтительно бактерии-пробиотики получены способом, включающим в качестве единственной стадии ферментации стадию ферментации бактерий в среде, содержащей источник GOS.
Источник GOS, используемый для выращивания бактерий-пробиотиков, может быть представлен в форме по существу чистого GOS или в составе смеси, такой как смесь углеводов, содержащая GOS. Существенный аспект состоит в том, чтобы обеспечить в среде для выращивания достаточное количество GOS. В предпочтительном варианте осуществления источник GOS добавляют в таком количестве, чтобы обеспечить в ферментационной среде по меньшей мере 0,2%, предпочтительно по меньшей мере 0,25%, более предпочтительно по меньшей мере 0,6% GOS. В предпочтительном варианте осуществления источник GOS предоставляют в таком количестве, чтобы обеспечить в среде для выращивания максимум 3%, предпочтительно максимум 2,8% GOS.
При использовании в качестве источника GOS смеси углеводов предпочтительно, чтобы количество GOS в такой смеси составляло по меньшей мере 20%, предпочтительно по меньшей мере 30%, более предпочтительно по меньшей мере 40%, еще более предпочтительно по меньшей мере 45%, наиболее предпочтительно по меньшей мере 48%. Хотя нет необходимости в том, чтобы бактерии потребляли в процессе ферментации только GOS в качестве источника углерода, высокая доля GOS в источнике GOS способствует тому, что в процессе ферментации преобладает потребление бактериями GOS по сравнению с потреблением других углеводов, что приводит к улучшенному эффекту предварительного кондиционирования.
Одним из конкретных типов смесей углеводов, которые могут преимущественно использоваться в качестве источника GOS для выращивания бактерий-пробиотиков, является смесь GOS и олигосахаридов коровьего молока. В частности, предпочтительно используют смеси GOS с 3’-сиалиллактозой и/или 6’-сиалиллактозой. Действительно, такие смеси содержат некоторые олигосахариды, сходные с олигосахаридами человеческого грудного молока, что обладает особым преимуществом при применении композиции изобретения в качестве детской смеси или в качестве питательной добавки для младенцев. Такие преимущественные эффекты описаны, например, у Simeoni et al.; “Gut microbiota analysis reveals a marked shift to bifidobacteria by a starter infant formula containing a synbiotic of bovine milk-derived oligosaccharides and Bifidobacterium animalis subsp lactis CNCM I-3446”; Environ Microbiol, 2016, 18(7): 2185–2195. Такие композиции, как правило, могут быть получены путем концентрирования деминерализованного пермеата молочной сыворотки с получением концентрированной композиции олигосахаридов коровьего молока и либо добавления GOS, либо получения GOS in situ в результате гидролиза лактозы под действием β-галактозидазы, содержащей в себе как гидролитическую, так и полимеразную активность. Последнее является предпочтительным, поскольку образование GOS в результате гидролиза лактозы посредством β-галактозидазы также снижает содержание лактозы в конечном ингредиенте, который будет использоваться в качестве источника GOS.
Дополнительно предпочтительно, чтобы источник GOS в используемой для получения бактерий-пробиотиков среде для выращивания был таким же, как и ингредиент GOS, который объединяют с бактериями-пробиотиками в композиции настоящего изобретения.
Помимо источника GOS, другие компоненты среды представляют собой широко используемые в данной области компоненты сред для выращивания бактерий-пробиотиков, содержащих минимальные питательные потребности, такие как источник азота (пептон) и минеральные вещества. Например, можно использовать среды, такие как среда для культивирования лактобактерий по Ману, Рогозе и Шарпу (MRS-типа). Таким образом, одним из примеров подходящей среды для выращивания является среда MRS-типа, которую модифицируют так, чтобы источник GOS, как описано выше, использовался в качестве единственного источника углеводов.
Чтобы бактерии-пробиотики проявляли улучшенный синбиотический эффект, полученный в результате описанной в настоящем документе стадии предварительного кондиционирования, среда для выращивания, в которой выращивают бактерии-пробиотики, должна содержать по меньшей мере один пептон в качестве источника азота. Можно использовать любой пептон, обычно используемый в средах MRS-типа, такой как дрожжевой пептон, мясной пептон и казеиновый пептон. Предпочтительный используемый пептон различается в зависимости от штамма. Специалисту в области выращивания конкретных штаммов хорошо известно, какие типы пептонов предпочтительны. Пептон, в частности, обладает преимуществом для штаммов, чувствительных к процессу сушки, в частности, к процессам сушки, связанных с использованием нагревания, таким как распылительная сушка, поскольку доказано, что использование пептона в среде для выращивания эффективно для придания штаммам большей устойчивости в ходе таких процессов. Пептон предпочтительно присутствует в количестве от 0,1 до 7 мас.% в расчете на общую массу среды для выращивания.
Среда для выращивания бактерий, используемая для ферментации бактерий-пробиотиков, предпочтительно также содержит дрожжевой экстракт и более предпочтительно также содержит по меньшей мере одно из полиоксиэтиленсорбитанмоноолеата (Твин® 80), сложного эфира моно- и диглицерида жирных кислот и диацетилвинной кислоты (DATEM) и лецитина. Лецитин обладает особым преимуществом, поскольку он безопасен для применения в продуктах для наиболее чувствительных потребителей, таких как младенцы, включая недоношенных младенцев, или субъекты детского возраста.
В дополнение к пептону он может быть полезен для добавления дополнительных источников азота, таких как дрожжевые экстракты. Такие дрожжевые экстракты хорошо известны специалисту в данной области. Они являются одним из предпочтительных источников азота для бактерий-пробиотиков, особенно подходящим для выращивания бактерий-пробиотиков с высоким выходом. Можно использовать любой тип дрожжевого экстракта, обычно используемого в среде для выращивания бактерий-пробиотиков. Лучший дрожжевой экстракт может различаться в зависимости от штамма. Для каждого штамма следует отбирать конкретный дрожжевой экстракт на основании знаний специалистов в данной области. Дрожжевой экстракт предпочтительно присутствует в количестве вплоть до 6 мас.% в расчете на общую массу среды для выращивания.
Среда для выращивания бактерий может содержать дополнительные ингредиенты, хорошо известные специалисту в данной области, такие как соли. Примеры солей, которые могут быть преимущественно представлены в среде для выращивания, включают карбонат кальция, гидроцитрат диаммония, ацетат натрия, MgSO4, MnSO4 или Na2HPO4. Выбор используемой (-ых) соли (-ей) зависит от штамма, который необходимо получить, и хорошо известен специалисту в данной области.
Стадию ферментации проводят способом, хорошо известным специалисту в данной области. Ферментация включает стадии инокуляции стерильной среды для выращивания определенным количеством бактерий (в КОЕ или afu) с последующей инкубацией при определенной температуре (обычно 37°C) и pH. Приемлемые выходы можно получать при использовании ферментационной среды, содержащей GOS, как описано выше, без изменения условий ферментации по сравнению с теми, которые специалист в данной области использовал бы для ферментации того же штамма со стандартной средой для выращивания.
Ферментацию можно проводить в анаэробных или аэробных условиях в зависимости от штамма, который должен быть получен. Если бактерии-пробиотики относятся к роду Bifidobacterium, ферментацию предпочтительно проводят в анаэробных условиях. Кроме того, pH можно контролировать или не контролировать в зависимости от условий, известных как наилучшие для выращивания конкретного штамма. Температура и продолжительность стадии ферментации различается в зависимости от штамма и также хорошо известны специалисту в области ферментации бактерий-пробиотиков.
Стадию сбора, цель которой состоит в отделении бактериальных клеток от среды для выращивания, также осуществляют способом, хорошо известным специалисту в данной области, например, путем концентрирования бактерий. Стадия сбора может включать в себя стадию промывки, хотя в промышленных способах предпочтительно по возможности избегать стадии промывки, чтобы снизить затраты и способствовать простоте способа.
Бактерии-пробиотики после сбора необязательно высушивают. Стадию сушки можно проводить с использованием любого известного способа, такого как распылительная сушка, сушка в псевдоожиженном слое, воздушная конвективная сушка, атмосферная сушка, вальцовая сушка или сублимационная сушка, и более предпочтительно распылительная сушка.
Необязательно перед стадией сушки бактерии можно дополнительно смешивать с защитными агентами и/или носителями, которые известны специалисту в данной области и целесообразны в зависимости от используемого способа сушки и бактерий, которые необходимо высушить.
Если бактерии-пробиотики содержат оперон galCDEGR(A) неизвестного происхождения, можно легко идентифицировать, подвергались ли бактерии предварительному кондиционированию, как описано в настоящем документе, путем сравнения их роста на GOS и на декстрозе в присутствии конкретного типа пептона и в остальном идентичных условий ферментации. Бактерии настоящего изобретения будут быстрее расти на GOS, чем на декстрозе, тогда как обычные бактерии (т.е. бактерии, предварительно некондиционированные GOS) будут расти на GOS и на декстрозе с одинаковой скоростью или даже медленнее расти на GOS, чем на декстрозе. Конкретный тип пептона представляет собой автолизат или гидролизат из дрожжей со следующим составом:
- AN от 1,6 до 3,2
- TN от 10 до 12
- AN/TN от 13 до 22
Таким образом, в предпочтительном варианте осуществления содержащие оперон galCDEGR(A) бактерии-пробиотики, в котором указанные бактерии-пробиотики получены способом, включающим стадии ферментации бактерий-пробиотиков в содержащей галактоолигосахариды и пептон среде для выращивания бактерий и сбора культивированных бактерий-пробиотиков, в присутствии пептона способны быстрее расти на GOS, чем на декстрозе. Подробный способ идентификации неизвестных бактерий-пробиотиков, как описанные в настоящем документе бактерии, представлен в примере 5 ниже.
Композиция, содержащая предварительно кондиционированные бактерии-пробиотики и GOS
Настоящее изобретение относится к композициям, содержащим эффективное количество, предпочтительно терапевтически эффективное количество GOS и предварительно кондиционированные бактерии-пробиотики, такие как описано выше. Особым преимуществом обладает объединение GOS с бактериями, предварительно кондиционированными GOS, как описано выше, поскольку они вместе проявляют синбиотический эффект сильнее, чем синбиотический эффект GOS с теми же бактериями, которые не были предварительно кондиционированы.
GOS присутствует в композиции в эффективном количестве, предпочтительно в терапевтически эффективном количестве. Такое эффективное или терапевтически эффективное количество различается в зависимости от индивида, потребляющего композицию, а также в зависимости от предполагаемого полезного эффекта. Специалисту в данной области известно, как дозировать количество GOS в зависимости от субъекта, подлежащего лечению, и от желаемого терапевтического эффекта.
Предпочтительно композиция содержит по меньшей мере 0,2%, предпочтительно по меньшей мере 1,5% GOS в расчете на сухое вещество. Более предпочтительно композиция содержит от 1,5 до 8%, предпочтительно от 2 до 7,5%, более предпочтительно от 3 до 8%, более предпочтительно от 4 до 7%, еще более предпочтительно от 5 до 6% и наиболее предпочтительно от 5,5 до 6% GOS.
GOS, содержащийся в композиции, может быть обеспечен любым видом источника GOS при условии, что в композиции представлено эффективное количество, предпочтительно терапевтически эффективное количество GOS, как определено выше. Предпочтительно источник GOS является таким, как описано выше в разделе, посвященном источнику GOS, который используют в среде для выращивания бактерий. Предпочтительно источник GOS, присутствующий в композиции изобретения, представляет собой тот же источник GOS, который использовался в среде для выращивания бактерий для ферментации.
Бактерии-пробиотики, присутствующие в композиции изобретения, представляют собой предварительно кондиционированные бактерии, как определено выше. Предпочтительно бактерии-пробиотики присутствуют в композиции в количестве по меньшей мере 5E+05, предпочтительно 9E+05, более предпочтительно 2E+06 КОЕ на грамм продукта в расчете на массу сухого вещества.
Композиция изобретения может представлять собой любой тип композиции, в которую можно включить бактерии-пробиотики, такую как композиция пищевого продукта, напитка, продукта для кормления животных, питательной добавки для человека или животного, фармацевтическая композиция или косметическая композиция. Продукт может представлять собой твердое вещество или жидкость. Предпочтительно композиция имеет форму порошка, и в этом случае она может быть предназначена для применения конечным потребителем в твердой (например, в форме порошка) или в мягкой форме (например, в форме пасты), или, альтернативно, для восстановления в жидкости перед применением.
Пищевые продукты и напитки включают все продукты, предназначенные для употребления людьми перорально с целью получения питания и/или удовольствия. Например, это может быть питательная композиция, такая как композиция для младенцев и/или детей младшего возраста, для беременных или кормящих женщин или для женщин, желающих забеременеть, для людей, которым необходимо специальное питание из-за неблагоприятного состояния здоровья, или для пожилых людей. Более предпочтительно питательная композиция выбрана из детской смеси, детских композиций на зерновой основе, смеси последующего уровня, молочных смесей для детей от 1 до 3 лет, функциональных молочных продуктов и молочных продуктов для беременных и кормящих женщин или для женщин, желающих забеременеть. Другие примеры пищевых продуктов и напитков включают сладкие и несладкие снэки, порошковые напитки, зерновые продукты и молочные продукты, такие как продукты из молока или йогурты. В одном варианте осуществления продукт представляет собой неферментированный продукт. Более предпочтительно продукт представляет собой детскую смесь, смесь для прикармливаемых детей, молочную смесь для детей от 1 до 3 лет или продукт для беременных или кормящих женщин. Наиболее предпочтительно он представляет собой детскую смесь.
Продукт также может быть представлен в форме пищевого продукта для животных или питательной добавки для животных. Предпочтительно животное представляет собой млекопитающее. Примеры животных включают коров, овец, коз, лошадей, собак, кошек, кроликов, крыс, мышей, рыб, птиц и т.п.
Питательные добавки, как правило, присутствуют в форме жидкости, например охлажденной жидкости, порошка, таблетки или капсулы. Предпочтительно они представлены в форме порошка, таблетки или капсулы. Порошковые добавки, как правило, охватывают добавки, предназначенные для растворения в жидкости, посыпания пищевого продукта или добавления в напиток. Такие добавки предназначены для обеспечения употребляющего их субъекта дополнительными питательными веществами и/или полезным для здоровья эффектом, а также другими полезными ингредиентами, такими как полезные микроорганизмы, например бактерии-пробиотики. Добавку в соответствии с настоящим изобретением можно использовать для обеспечения питательными веществами и/или эффектом, полезным для здоровья людей, а также животных, как определено выше. Например, питательные добавки включают порошковые добавки для добавления в грудное молоко, например для преждевременно родившихся младенцев или младенцев с низким весом при рождении. Они также включают добавки для беременных или кормящих женщин или для женщин, желающих забеременеть.
Фармацевтические продукты включают препараты в форме порошка, таблетки или капсулы, предназначенные для лечения или профилактики неблагоприятного медицинского состояния у нуждающегося в этом субъекта или способствующие благоприятному состоянию здоровья.
Косметические композиции, как правило, предназначены для оказания эстетического воздействия на тело и могут предназначаться для местного применения или могут вводиться перорально, в форме порошка, таблетки или капсулы.
Первое медицинское применение
Предварительно кондиционированные бактерии-пробиотики или композицию, содержащую предварительно кондиционированные бактерии-пробиотики и GOS, как описано выше, можно преимущественно применять в терапии. Таким образом, в изобретении также предложены такие бактерии-пробиотики и такие композиции для применения в терапии.
В настоящем документе под терапией подразумевают вылечивание или предотвращение заболевания или нарушения функции организма, и она также охватывает профилактическое лечение, т.е. предотвращение неблагоприятного медицинского состояния. Под терапией в настоящем документе также подразумевают включение медицинской и ветеринарной терапии.
Как будет показано в приведенных ниже примерах, тот факт, что бактерии были предварительно кондиционированы (т.е. выращены на GOS в процессе их получения), повышает синбиотический эффект бактерий-пробиотиков с GOS при повторном воздействии GOS на бактерии. Это делает описанные выше предварительно кондиционированные бактерии-пробиотики и композицию очень полезными для терапевтических целей.
Даже несмотря на то, что выращивание бактерий-пробиотиков на GOS описано на предшествующем уровне техники, ни один из документов не содержит информацию, которая указывает или даже предполагает преимущество повторного воздействия GOS после ферментации на такие бактерии, выращенные на GOS, и даже в меньшей степени содержит информацию, которая указывает или предполагает, что такие бактерии будут обладать превосходным терапевтическим эффектом (а именно превосходным синбиотическим эффектом при последующем взаимодействии с GOS) по сравнению с бактериями, выращенными на других углеводах.
Терапевтический эффект обусловлен воздействием GOS на бактерии только при контакте с субъектом, будь то, например, в желудочно-кишечном тракте субъекта или на коже субъекта. Предпочтительно терапевтический эффект обусловлен воздействием GOS на бактерии в желудочно-кишечном тракте субъекта.
В одном из вариантов осуществления в настоящем изобретении предложены бактерии-пробиотики, содержащие оперон galCDEGR(A), причем указанные бактерии-пробиотики получены способом, включающим стадии
a. ферментации бактерий-пробиотиков в среде для выращивания бактерий, содержащей галактоолигосахариды и пептон; и
b. сбора культивированных бактерий-пробиотиков,
для применения в терапии, причем бактерии-пробиотики подвергаются воздействию GOS внутри или на поверхности индивида, подлежащего лечению, предпочтительно в желудочно-кишечном тракте индивида, подлежащего лечению.
Иными словами, настоящее изобретение относится к способу лечения субъекта, включающему введение субъекту эффективного количества содержащих оперон galCDEGR(A) бактерий-пробиотиков, причем указанные бактерии-пробиотики получены способом, включающим стадии
a. ферментации бактерий-пробиотиков в среде для выращивания бактерий, содержащей галактоолигосахариды и пептон; и
b. сбора культивированных бактерий-пробиотиков,
и при этом бактерии-пробиотики подвергаются воздействию GOS внутри или на поверхности индивида, подлежащего лечению, предпочтительно в желудочно-кишечном тракте индивида, подлежащего лечению.
В изобретении также предложена композиция, содержащая эффективное количество галактоолигосахаридов и содержащих оперон galCDEGR(A) бактерий-пробиотиков, причем указанные бактерии-пробиотики получены способом, включающим стадии
a. ферментации бактерий-пробиотиков в среде для выращивания бактерий, содержащей галактоолигосахариды и пептон; и
b. сбора культивированных бактерий-пробиотиков,
для применения в терапии.
Иными словами, настоящее изобретение относится к способу лечения субъекта, включающему введение субъекту эффективного количества композиции, содержащей эффективное количество галактоолигосахаридов и содержащих оперон galCDEGR(A) бактерий-пробиотиков, причем указанные бактерии-пробиотики получены способом, включающим стадии
a. ферментации бактерий-пробиотиков в среде для выращивания бактерий, содержащей галактоолигосахариды и пептон; и
b. сбора культивированных бактерий-пробиотиков.
В другом варианте осуществления изобретение относится к применению содержащих оперон galCDEGR(A) бактерий-пробиотиков, причем указанные бактерии-пробиотики получены способом, включающим стадии
a. ферментации бактерий-пробиотиков в среде для выращивания бактерий, содержащей галактоолигосахариды и пептон; и
b. сбора культивированных бактерий-пробиотиков
для производства лекарственного средства.
Предпочтительно лекарственное средство предназначено для введения вместе с GOS.
В дополнительном варианте осуществления изобретение относится к применению композиции, содержащей эффективное количество галактоолигосахаридов и содержащих оперон galCDEGR(A) бактерий-пробиотиков, причем указанные бактерии-пробиотики получены способом, включающим стадии
a. ферментации бактерий-пробиотиков в среде для выращивания бактерий, содержащей галактоолигосахариды и пептон; и
b. сбора культивированных бактерий-пробиотиков
для производства лекарственного средства.
Дополнительные виды медицинского применения
В настоящем изобретении предложены описанные выше предварительно кондиционированные бактерии-пробиотики или композиция для применения в следующих конкретных терапевтических способах:
b) для применения в способе модулирования иммунного ответа у субъекта;
c) для применения в способе усиления иммунной защиты у субъекта;
d) для применения в способе предотвращения, лечения или уменьшения инфекций у субъекта;
e) для применения в способе предотвращения, лечения или уменьшения воспаления у субъекта; и
f) для применения в способе активации здоровой микробиоты в кишечнике субъекта.
Все конкретные перечисленные выше виды терапевтического применения связаны с более быстрым ростом микробиоты и более адекватным метаболизмом микробиоты в желудочно-кишечном тракте.
В настоящем изобретении также предложены описанные выше предварительно кондиционированные бактерии-пробиотики или композиция для применения в следующих конкретных терапевтических способах:
a) для применения в способе улучшения активности микробиоты в желудочно-кишечном тракте субъекта, предпочтительно метаболической активности микробиоты, предпочтительно в желудочно-кишечном тракте младенца или ребенка младшего возраста;
b) для применения в способе повышения продукции суммарных короткоцепочечных жирных кислот в желудочно-кишечном тракте субъекта;
c) для применения в способе повышения продукции ацетата в желудочно-кишечном тракте субъекта;
d) для применения в способе повышения продукции молочной кислоты в желудочно-кишечном тракте субъекта; или
e) для применения в способе снижения продукции аммония в желудочно-кишечном тракте субъекта.
В одном из вариантов осуществления в настоящем изобретении предложены бактерии-пробиотики, содержащие оперон galCDEGR(A), причем указанные бактерии-пробиотики получены способом, включающим стадии
a. ферментации бактерий-пробиотиков в среде для выращивания бактерий, содержащей галактоолигосахариды и пептон; и
b. сбора культивированных бактерий-пробиотиков,
для применения в
I. способе модулирования иммунного ответа у субъекта;
II. способе усиления иммунной защиты у субъекта;
III. способе предотвращения, лечения или уменьшения инфекций у субъекта;
IV. способе предотвращения, лечения или уменьшения воспаления у субъекта; или
V. способе активации здоровой микробиоты в кишечнике субъекта;
VI. способе улучшения активности микробиоты в желудочно-кишечном тракте субъекта, предпочтительно метаболической активности микробиоты, предпочтительно в желудочно-кишечном тракте младенца или ребенка младшего возраста;
VII. способе повышения продукции суммарных короткоцепочечных жирных кислот в желудочно-кишечном тракте субъекта;
VIII. способе повышения продукции ацетата в желудочно-кишечном тракте субъекта;
IX. способе повышения продукции молочной кислоты в желудочно-кишечном тракте субъекта; или
X. способе снижения продукции аммония в желудочно-кишечном тракте субъекта;
при этом бактерии-пробиотики подвергаются воздействию GOS внутри или на поверхности субъекта, подлежащего лечению, предпочтительно в желудочно-кишечном тракте субъекта.
Иными словами, настоящее изобретение относится к способу
I. модулирования иммунного ответа у субъекта;
II. усиления иммунной защиты у субъекта;
III. предотвращения, лечения или уменьшения инфекций у субъекта;
IV. предотвращения, лечения или уменьшения воспаления у субъекта; или
V. активации здоровой микробиоты в кишечнике субъекта;
VI. улучшения активности микробиоты в желудочно-кишечном тракте субъекта, предпочтительно метаболической активности микробиоты, предпочтительно в желудочно-кишечном тракте младенца или ребенка младшего возраста;
VII. повышения продукции суммарных короткоцепочечных жирных кислот в желудочно-кишечном тракте субъекта;
VIII. повышения продукции ацетата в желудочно-кишечном тракте субъекта;
IX. повышения продукции молочной кислоты в желудочно-кишечном тракте субъекта;
или
X. снижения продукции аммония в желудочно-кишечном тракте субъекта, включающему введение субъекту эффективного количества содержащих оперон galCDEGR(A) бактерий-пробиотиков, причем указанные бактерии-пробиотики получены способом, включающим стадии
a. ферментации бактерий-пробиотиков в среде для выращивания бактерий, содержащей галактоолигосахариды и пептон; и
b. сбора культивированных бактерий-пробиотиков,
и при этом бактерии-пробиотики подвергаются воздействию GOS внутри или на поверхности субъекта, подлежащего лечению, предпочтительно в желудочно-кишечном тракте субъекта.
В изобретении также предложена композиция, содержащая эффективное количество галактоолигосахаридов и содержащих оперон galCDEGR(A) бактерий-пробиотиков, причем указанные бактерии-пробиотики получены способом, включающим стадии
a. ферментации бактерий-пробиотиков в среде для выращивания бактерий, содержащей галактоолигосахариды и пептон; и
b. сбора культивированных бактерий-пробиотиков,
для применения в
I. способе модулирования иммунного ответа у субъекта;
II. способе усиления иммунной защиты у субъекта;
III. способе предотвращения, лечения или уменьшения инфекций у субъекта;
IV. способе предотвращения, лечения или уменьшения воспаления у субъекта; или
V. способе активации здоровой микробиоты в кишечнике субъекта;
VI. способе улучшения активности микробиоты в желудочно-кишечном тракте субъекта, предпочтительно метаболической активности микробиоты, предпочтительно в желудочно-кишечном тракте младенца или ребенка младшего возраста;
VII. способе повышения продукции суммарных короткоцепочечных жирных кислот в желудочно-кишечном тракте субъекта;
VIII. способе повышения продукции ацетата в желудочно-кишечном тракте субъекта;
IX. способе повышения продукции молочной кислоты в желудочно-кишечном тракте субъекта; или
X. способе снижения продукции аммония в желудочно-кишечном тракте субъекта.
Иными словами, настоящее изобретение относится к способу
I. модулирования иммунного ответа у субъекта;
II. усиления иммунной защиты у субъекта;
III. предотвращения, лечения или уменьшения инфекций у субъекта;
IV. предотвращения, лечения или уменьшения воспаления у субъекта; или
V. активации здоровой микробиоты в кишечнике субъекта;
VI. улучшения активности микробиоты в желудочно-кишечном тракте субъекта, предпочтительно метаболической активности микробиоты, предпочтительно в желудочно-кишечном тракте младенца или ребенка младшего возраста;
VII. повышения продукции суммарных короткоцепочечных жирных кислот в желудочно-кишечном тракте субъекта;
VIII. повышения продукции ацетата в желудочно-кишечном тракте субъекта;
IX. повышения продукции молочной кислоты в желудочно-кишечном тракте субъекта;
или
X. снижения продукции аммония в желудочно-кишечном тракте субъекта, включающему введение субъекту эффективного количества композиции, содержащей эффективное количество галактоолигосахаридов и содержащих оперон galCDEGR(A) бактерий-пробиотиков, причем указанные бактерии-пробиотики получены способом, включающим стадии
a. ферментации бактерий-пробиотиков в среде для выращивания бактерий, содержащей галактоолигосахариды и пептон; и
b. сбора культивированных бактерий-пробиотиков.
В другом варианте осуществления изобретение относится к применению содержащих оперон galCDEGR(A) бактерий-пробиотиков, причем указанные бактерии-пробиотики получены способом, включающим стадии
c. ферментации бактерий-пробиотиков в среде для выращивания бактерий, содержащей галактоолигосахариды и пептон; и
d. сбора культивированных бактерий-пробиотиков
для производства лекарственного средства для
I. модулирования иммунного ответа у субъекта;
II. усиления иммунной защиты у субъекта;
III. предотвращения, лечения или уменьшения инфекций у субъекта;
IV. предотвращения, лечения или уменьшения воспаления у субъекта; или
V. активации здоровой микробиоты в кишечнике субъекта;
VI. улучшения активности микробиоты в желудочно-кишечном тракте субъекта, предпочтительно метаболической активности микробиоты, предпочтительно в желудочно-кишечном тракте младенца или ребенка младшего возраста;
VII. повышения продукции суммарных короткоцепочечных жирных кислот в желудочно-кишечном тракте субъекта;
VIII. повышения продукции ацетата в желудочно-кишечном тракте субъекта;
IX. повышения продукции молочной кислоты в желудочно-кишечном тракте субъекта;
или
X. снижения продукции аммония в желудочно-кишечном тракте субъекта.
Предпочтительно лекарственное средство предназначено для введения вместе с GOS.
В дополнительном варианте осуществления изобретение относится к применению композиции, содержащей эффективное количество галактоолигосахаридов и содержащих оперон galCDEGR(A) бактерий-пробиотиков, причем указанные бактерии-пробиотики получены способом, включающим стадии
c. ферментации бактерий-пробиотиков в среде для выращивания бактерий, содержащей галактоолигосахариды и пептон; и
d. сбора культивированных бактерий-пробиотиков
для производства лекарственного средства для
I. модулирования иммунного ответа у субъекта;
II. усиления иммунной защиты у субъекта;
III. предотвращения, лечения или уменьшения инфекций у субъекта;
IV. предотвращения, лечения или уменьшения воспаления у субъекта; или
V. активации здоровой микробиоты в кишечнике субъекта;
VI. улучшения активности микробиоты в желудочно-кишечном тракте субъекта, предпочтительно метаболической активности микробиоты, предпочтительно в желудочно-кишечном тракте младенца или ребенка младшего возраста;
VII. повышения продукции суммарных короткоцепочечных жирных кислот в желудочно-кишечном тракте субъекта;
VIII. повышения продукции ацетата в желудочно-кишечном тракте субъекта;
IX. повышения продукции молочной кислоты в желудочно-кишечном тракте субъекта;
или
X. снижения продукции аммония в желудочно-кишечном тракте субъекта.
Способы
В изобретении также предложен способ повышения терапевтического эффекта композиции, содержащей галактоолигосахариды (GOS) и содержащие оперон galCDEGR(A) бактерии-пробиотики, включающий
a. ферментацию бактерий-пробиотиков в среде для выращивания бактерий, содержащей галактоолигосахариды и пептон; и
b. сбор культивированных бактерий-пробиотиков,
перед включением бактерий-пробиотиков в синбиотическую композицию.
Как уже объяснялось выше, и как показано в приведенных ниже примерах, полезный синбиотический эффект содержащих оперон galCDEGR(A)бактерий-пробиотиков с GOS повышается при выращивании бактерий-пробиотиков на GOS в качестве источника углевода по сравнению с бактериями-пробиотиками, выращенными на других олигосахаридах, таких как сахара.
В предпочтительном варианте осуществления способ представляет собой способ повышения эффекта композиции для модулирования иммунной защиты субъекта, усиления иммунной защиты субъекта, предотвращения, лечения или уменьшения инфекций у субъекта, предотвращения, лечения или уменьшения воспаления у субъекта или активации здоровой микробиоты в кишечнике субъекта.
В другом варианте осуществления в изобретении предложен способ повышения способности содержащих оперон galCDEGR(A) бактерий-пробиотиков к потреблению GOS, включающий
a. ферментацию бактерий-пробиотиков в среде для выращивания бактерий, содержащей галактоолигосахариды и пептон; и
b. сбор культивированных бактерий-пробиотиков.
В предпочтительном варианте осуществления такой способ уменьшает время, необходимое бактериям-пробиотикам для начала потребления GOS при воздействии GOS на бактерии-пробиотики после стадии сбора, более предпочтительно при контакте бактерий-пробиотиков с GOS в желудочно-кишечном тракте субъекта. Субъект может представлять собой человека или животное, предпочтительно он представляет собой человека, более предпочтительно он представляет собой младенца или ребенка младшего возраста, либо беременную или кормящую мать, наиболее предпочтительно он представляет собой младенца.
Настоящее изобретение будет более подробно описано ниже с помощью следующих примеров.
Пример 1. Эффект предварительного кондиционирования выбранных бифидобактерий
Выбор штаммов Bifidobacterium с помощью геномного анализа
Для настоящих испытаний были выбраны штаммы видов Bifidobacterium animalis, breve и longum, которые связаны с кишечной микробиотой младенцев и перечислены в таблице 1. При получении в распоряжение генома его подвергали скринингу на присутствие оперона galCDEGR(A), требующегося B. breve UCC2003 для потребления GOS, с помощью программы WallGene 1,5 (Genostar, Монбонно-Сен-Мартен, Франция).
Таблица 1. Штаммы, выбранные для анализа генома
Все подвергнутые скринингу штаммы, для которых был известен геном, обладают опероном galCDEGR(A), отвечающим за захват и гидролиз GOS (таблица 2). С другой стороны, ген galA, кодирующий эндогалактаназу, который разлагает компоненты GOS со степенью полимеризации (DP) > 5, присутствует только в одном штамме B. longum.
Таблица 2. Наличие ( ) или отсутствие (x) оперона galCDEGR(A) и гена galA в выбранных штаммах Bifidobacterium (н/д: геномная последовательность недоступна)
) или отсутствие (x) оперона galCDEGR(A) и гена galA в выбранных штаммах Bifidobacterium (н/д: геномная последовательность недоступна)







2 Рост штаммов Bifidobacterium на GOS
2.1 Бактериальные штаммы
Для штаммов NCC3001 и NCC2818 использовали полученные в лаборатории замороженные стартовые культуры. Для остальных 15 штаммов лиофилизированные культуры повторно активировали в бульоне Мана, Рогозы и Шарпа (MRS) (Oxoid, г. Хэмпшир, Великобритания) с добавлением 0,05% цистеина (Sigma Aldrich, г. Сент-Луис, США, 30120), инкубируя в анаэробном режиме при 37°C. Анаэробные условия создавали в герметичных боксах с помощью пакетов-саше (Thermo Fisher Scientific, г. Уолтем, США) и контролировали с помощью индикаторных полос (Biomérieux, Франция). После 2–3 пассажей повторной активации в бульоне MRS с добавлением 0,05% цистеина готовили аликвоты в соотношении культура : стерильный 85%-ный глицерин (Merck, Германия, 104094) 60 : 40 и хранили при -80°C. При использовании замороженных культур их оттаивали, и перед экспериментами проводили один пассаж в течение ночи в бульоне MRS с добавлением 0,05% цистеина в условиях анаэробиоза.
2.2 Скрининг роста штаммов Bifidobacterium на GOS
Штаммы Bifidobacterium подвергали скринингу на их способность расти на двух различных источниках GOS. Была проведена оценка двух различных источников GOS: смеси углеводов, имеющей состав, представленный в таблице 3 (BMOS; происхождение: Nestlé; 48% GOS) и GOS Purimune™ (происхождение: GTC Nutrition; минимум 90% GOS). Мониторинг роста проводили путем непрерывного измерения оптической плотности (OD). Базовая среда (BM) для выращивания, используемая для селекции штаммов, представляла собой бульон MRS-API с добавлением 0,05% цистеина. Эту базовую среду модифицировали добавлением в качестве источника углерода 30 г BMOS (BM + BMOS; что соответствует 14,4 г чистого GOS) или 30 г GOS Purimune™ (BM + P-GOS; что соответствует 27 г чистого GOS) на литр. Ингредиенты бульона MRS-API и маточные растворы, используемые для приготовления сред для этого и дополнительных экспериментов, а также применяемые процедуры консервации, указаны в таблице 4. Воду, используемую для приготовления растворов, очищали с помощью установки Purelab Ultra (ELGA Labwater, г. Хай-Уиком, Великобритания) (18,2 MОм/см).
Таблица 3. Композиция смеси углеводов BMOS, используемой в качестве источника GOS
Кинетику роста штаммов Bifidobacterium измеряли три раза в 290 мкл каждого вида среды для выращивания (BM, BM + BMOS и BM + P-GOS) в 96-луночных планшетах. Среды инокулировали по 10 мкл ночных культур в бульоне MRS с добавлением цистеина. В качестве отрицательного контроля для каждой из сред для выращивания также использовали три лунки, содержащие среду без инокулята. Помещали 96-луночные планшеты в устройство для считывания микропланшетов SpectraMax 340PC384 (Molecular Devices, г. Саннивейл, США) и применяли следующие параметры кинетики: температура 37 °C, время реакции 24 ч, регистрация оптической плотности при длине волны 620 нм, интервал 15 мин и автоматическое перемешивание в течение 5 с до и после считывания. Затем на основе полученных значений определяли арифметические средние и среднеквадратичные отклонения и строили кривые средних значений для различных штаммов.
Кривые средних значений OD для испытуемых штаммов Bifidobacterium, выращенных на средах BMOS и P-GOS, показаны на фиг. 1 и фиг. 2 соответственно. Среднеквадратичные отклонения значений составляли < 0,05 (данные не представлены). Как на среде с BMOS, так и на среде с P-GOS наблюдался рост всех штаммов. В BM без добавления источника углерода ни для одного из штаммов не наблюдалось увеличения OD (данные не представлены).
Таблица 4. Компоненты, поставщик и способ консервации, используемые для растворов, приготовленных для экспериментов
2.3 Ночная культура выбранных штаммов Bifidobacterium на BMOS и P-GOS
Штаммы Bifidobacterium подвергали испытанию в 20 мл среды для выращивания (BM, BM + лактоза (20 г/л лактозы, таблица 4), BM + BMOS, BM + P-GOS), разлитой в стерильные пробирки Falcon емкостью 50 мл. Среды BM и BM + лактоза служили в качестве отрицательного и положительного контроля роста соответственно. Среды инокулировали по 600 мкл ночных культур в бульоне MRS с добавлением цистеина. Кроме того, в качестве отрицательного контроля использовали 20 мл среды без инокулята. После инокуляции пробирки инкубировали в анаэробном режиме при 37°C в течение 20 ч. После инкубации все пробирки подвергали визуальному скринингу на мутность. В случае пробирок, содержащих BM + BMOS и BM + P-GOS, количество клеток определяли методом проточной цитометрии, а использование олигосахаридов измеряли с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ).
2.4 Измерение роста бактерий с помощью проточной цитометрии
Количество клеток определяли с помощью проточной цитометрии, как описано в ISO 19344:2015 (IDF 232). На первой стадии выполняли серийные десятикратные разведения образцов в растворе соли триптона (Oxoid, LP0042). По 100 мкл каждого соответствующего разведения, содержащего оптимальное значение приблизительно 106 КОЕ/мл, переносили в 880 мкл фосфатно-солевого буфера (PBS, Sigma, P4417) в 96-луночном планшете с глубокими лунками. Впоследствии добавляли 10 мкл раствора йодида пропидия (PI) (Thermo Fisher, P1304MP) 0,2 мМ в воде и 10 мкл раствора Syto 24 (Thermo Fisher, S7559) 0,1 мМ в воде. Затем планшет тщательно перемешивали при 1500 об/мин в течение 30 с, используя миксер MixMate (Eppendorf AG, г. Гамбург, Германия), после чего инкубировали на водяной бане при 37 °C в течение 15 мин в защищенном от света месте. Меченые образцы измеряли с использованием прибора Cytoflex S (Beckman Coulter Inc., г. Брея, США) со следующими параметрами: усиление: флуоресценция (FSC) (120), боковое светорассеяние (SSC) (142), Syto24 (204), PI (115); первичный порог: канал FSC, 5000 (высота) и вторичный порог: канал Syto24, 11 000 (высота); ширина: канал FSC; перемешивание 1,5 с; обращение потока 6 с; скорость потока: 30 мкл/мин; регистрация 10 000 событий за целевой период или 300 с. Таким образом, определяли активные единицы флуоресценции в мл (afu/мл) образцов.
2.5 Определение использования олигосахаридов методом ВЭЖХ
Количество суммарных олигосахаридов в образцах определяли методом ВЭЖХ после мечения 2-аминобензамидом (2-AB), как описано ранее у Austin et al., Determination of beta-galactooligosaccharides by liquid chromatography; International Journal of Analytical Chemistry, 2014: 10, с некоторыми модификациями. Образцы из ночной культуры в среде BM + 3% BMOS соотв. 3% P-GOS центрифугировали при 5000 g в течение 10 мин (Heraeus Multifuge X1R, Thermo Fisher). Супернатанты переносили в пробирки Eppendorf емкостью 2 мл и подвергали термообработке при 80°C в течение 15 мин с помощью термоблока Dri-Block DB-2D (Techne Ltd., г. Кембридж, Великобритания), после чего хранили при температуре -18°C. После использования образцы разводили в деионизированной воде (18 МОм), полученной в системе Milli-Q (Millipore, г. Биллерика, США), с получением приблизительно 2 мг олигосахаридов на мл образца. К 500 мкл разведенного раствора образца добавляли 200 мкл раствора ламинаритриозы (Sigma, L1664) (0,3 ммоль/л). Смесь перемешивали на встряхивателе, после чего аликвоту объемом 20 мкл переносили в 200 мкл реагента 2-AB, который готовили путем полного растворения 0,35 моль/л 2-AB (Sigma, A89804) и 1,0 моль/л цианоборгидрида натрия (Sigma, 71435) в диметилсульфоксиде (Sigma, 41640), содержащем 30% уксусной кислоты (Merck, 1.00063), с помощью ультразвуковой бани. Смесь аликвоты и 2-AB хорошо перемешивали на встряхивателе, а затем инкубировали при 65 ± 1°C на водяной бане в течение 2 ч ± 5 мин. После реакции пробирки перемешивали и охлаждали, помещая их при 4°C по меньшей мере на 10 мин. Впоследствии добавляли 1,5 мл смеси ацетонитрил (Merck, 1.00030)/вода (75/25). Затем пробирки перемешивали на встряхивателе и центрифугировали при 10 000 x g в течение 5 мин (микроцентрифуга Eppendorf 5424), после чего переносили 1 мл супернатанта во флакон, подходящий для автоматического пробоотборника ВЭЖХ.
Меченые олигосахариды разделяли с использованием прибора Ultimate 3000 RS (Dionex, г. Саннивейл, США) в конфигурации, описанной Бенетом (Benet) и Остином (Austin) (2011), на предколонке TSK Gel Amide-80 (3,2 × 15 мм, 3 мкм) и аналитической колонке (4,6 × 150 мм, 3 мкм) (Tosoh Bioscience, г. Штутгарт, Германия). Обнаружение проводили с помощью Dionex RF-2000 с использованием λex = 330 нм и λem = 420 нм. Элюенты A и B представляли собой 100% ацетонитрил и 50 ммоль/л формиата аммония (раствор гидроксида аммония (Merck, 1.05432), муравьиная кислота (Merck, 1.00264)) при pH 4,4 соответственно. Вводили 10 мкл образца раствора меченого олигосахарида в защитный картридж в изократических условиях (98% A) при скорости потока 1 мл/мин в течение 7,5 мин. Затем элюент направляли из защитного картриджа на аналитическую колонку, поддерживаемую при 23°C, и подвижную фазу доводили до 84% A в течение 0,5 мин. Олигосахариды разделяли с использованием следующих условий: 84% A от 8 до 16 мин с последующим линейным градиентом до 61% A на 50-й мин. На 51-й мин колонку промывали в течение 3 мин путем снижения скорости потока до 0,8 мл/мин и изменения состава элюента до 20% A. Впоследствии состав элюента восстанавливали до 90% A в течение 1 мин, после чего снова устанавливали скорость потока 1,0 мл/мин. Эти условия применяли в течение 6 мин, при этом колонку снова уравновешивали, после чего возвращали систему в условия для нанесения следующего образца.
Концентрации олигосахаридов определяли путем интегрирования пиков на полученных флуоресцентных хроматограммах. Площади пиков (относительно внутреннего стандарта) сравнивали со значениями на калибровочной кривой, полученной путем измерения различных концентраций мальтотриозы (Sigma, M8378) с использованием ламинаритриозы в качестве внутреннего стандарта. Полученную таким образом молярную концентрацию каждого компонента преобразовывали в массовую концентрацию с использованием молекулярной массы (ранее определенной методом масс-спектрометрии по Austin et al., Determination of beta-galactooligosaccharides by liquid chromatography; International Journal of Analytical Chemistry, 2014: 10).
Для интегрирования и оценки полученных хроматограмм использовали программное обеспечение системы обработки данных хроматографии Chromeleon 7.2 (Dionex). Чтобы определить количество олигосахаридов, использованных различными штаммами, значения, полученные для среды после ферментации, вычитали из значений, полученных до ферментации. Все измерения выполняли в двух повторностях. Для полученных таким образом значений рассчитывали арифметические средние и среднеквадратичные отклонения.
2.6 Результаты
На хроматограммах, полученных для сред BM + BMOS и BM + P-GOS до ферментации, показаны существенные различия в профилях. Среда BM + BMOS содержала значительно больше лактозы и, следовательно, меньшую долю суммарных олигосахаридов, составляющую 1,19 г, по сравнению с 1,73 г на 100 г среды для BM + P-GOS (таблица 5).
Таблица 5. Количества фракций олигосахаридов (OS) в BM + BMOS и BM + P-GOS на 100 г среды
В то время как оба ингредиента GOS в основном содержали олигосахариды малого размера с DP от 2 до 4, для P-GOS показано широкое разнообразие различных соединений, которые также присутствовали в большем количестве. Это особенно относится к олигосахаридам DP3 и DP4. Вследствие этих различий между ингредиентами GOS также отмечены различия в использовании олигосахаридов штаммами Bifidobacterium в средах BMOS и P-GOS. Дополнительно, для различных штаммов Bifidobacterium продемонстрирован различный характер использования. Если штамм NCC2818 потреблял конкретные соединения, то для NCC435 на основании уменьшения большинства пиков DP2 и DP3 продемонстрирован более общий характер утилизации. Более того, NCC435, помимо метаболизации большого количества олигосахаридов, потреблял практически всю доступную лактозу, в то время как NCC2818 потреблял меньше лактозы и меньше олигосахаридов.
Анализ совокупного уменьшения количества олигосахаридов в процессе ферментации показал, что все 5 испытуемых штаммов Bifidobacterium потребляли олигосахариды, присутствующие в BMOS и P-GOS. В среде BM + BMOS штаммы NCC2818 B. animalis ssp. lactis и B. breve в основном использовали олигосахариды с DP2 и DP3 (фиг. 3 (A)). С другой стороны, штаммы B. longum, кроме DP2 и DP3, дополнительно потребляли олигосахариды большего размера с DP 4 и 5. Более того, штамм NCC4020 B. longum, обладающий геном galA, не метаболизировал больше олигосахаридов, чем штаммы без этого гена. В среде BM + P-GOS все штаммы за исключением NCC2818 использовали более 90% доступных олигосахаридов с DP2 (фиг. 3 (B)). Более того, штаммы в основном метаболизировали фракцию DP3 и небольшие количества DP4. Однако некоторые штаммы, кроме штаммов того же вида, характеризующихся обычным характером потребления, дополнительно использовали олигосахариды с DP5. С другой стороны, не отмечена корреляция между низким потреблением олигосахаридов штаммом NCC2818 B. animalis ssp. lactis, выращенным на среде P-GOS, и большим количеством клеток 9,2 log10 (afu/мл). Количества клеток, полученные для всех штаммов, находились в том же диапазоне, что и значения 8,8–9,2 log10 (afu/мл) и 8,7–9,2 log10 (afu/мл), наблюдаемые для роста на средах BMOS и P-GOS соответственно (фиг. 4).
В последующих экспериментах по предварительному кондиционированию среда для выращивания BM была заменена средой IM, поскольку бульон MRS-API не используется для ферментации в крупных масштабах, и выбранные штаммы демонстрировали хороший рост в промышленной среде, используемой для коммерческого производства B. animalis ssp. lactis NCC2818 (IM). Для подтверждения такого же использования олигосахаридов в новой среде эксперимент по культивированию в течение ночи с последующим анализом потребления олигосахаридов однократно повторяли для выбранных штаммов в среде IM. Показано, что в среде IM + BMOS штаммы B. longum и B. animalis ssp. lactis используют мало олигосахаридов, и общее потребление ими олигосахаридов составляет от 0,12 до 0,21 г на 100 г среды (фиг. 5). С другой стороны, для штамма B. breve были получены результаты, аналогичные наблюдаемым в среде BM. Также показано, что в среде IM + P-GOS штаммы NCC2818 и NCC4020 используют меньше олигосахаридов. Остальные штаммы метаболизировали сходные количества GOS, как и в BM, причем два штамма B. breve показали несколько более высокое потребление. Измеренное количество клеток на обоих источниках углерода для всех штаммов находилось в диапазоне от 8,9 до 9,2 log10 (afu/мл) за исключением NCC4020, для которого достигнуто меньшее количество клеток 8,4 log10 (afu/мл) (фиг. 6).
3 Эксперимент по предварительному кондиционированию
На первой стадии получали биомассу в процессе ферментации либо на декстрозе, либо на ингредиенте GOS (BMOS или P-GOS). Затем ее подвергали воздействию желудочного сока, после чего повторному воздействию ингредиента GOS в процессе ферментации. На фиг. 7 показана схема установки для эксперимента по предварительному кондиционированию при использовании BMOS в качестве источника GOS. Аналогичную установку также применяли со средой P-GOS, в которой в данной схеме BMOS была заменена на P-GOS; Cinac модифицирован согласно Wang; Préadaptation et cryotolérance chez Lactobacillus acidophilus: effet des conditions opératoires; Paris, 2005, Institut National Agronomique Paris-Grignon.
3.1 Предварительное кондиционирование
Штаммы Bifidobacterium выращивали в трех повторностях в 50 мл среды для выращивания (IM + декстроза (30 г/л декстрозы, таблица 4), IM + BMOS), разлитой в стерильные флаконы емкостью 100 мл. Среду инокулировали 107 (afu/мл) и инкубировали при 37°C на водяной бане. Для мониторинга повышения кислотности в процессе ферментации использовали систему Cinac мониторинга pH (Ysebaert, Фрепийон, Франция), которую можно использовать в качестве индикатора роста бактерий, продуцирующих молочную кислоту (Spinnler and Corrieu 1989). После ферментации определяли количество клеток методом проточной цитометрии и посева заливкой. Кроме того, такой же эксперимент однократно повторяли в среде IM + P-GOS для штамма NCC2818, измеряя количество клеток с использованием проточной цитометрии.
3.2 Моделирование с желудочным соком
После ферментации из каждого флакона отбирали объем, содержащий 5 x 109 клеток (определено методом проточной цитометрии), и переносили в стерильные пробирки Eppendorf. Затем эти образцы центрифугировали на Biofuge pico (Heraeus Instruments, г. Ханау, Германия) при 16 060 x g в течение 5 мин. Впоследствии супернатанты отбрасывали, и осадки ресуспендировали в 1 мл 0,9%-ного раствора NaCl (Sigma, S9888). Эту стадию промывки повторяли еще раз для удаления остатков среды для выращивания. Полученную таким образом суспензию биомассы с концентрацией 5 x 109 (afu/мл) добавляли по 200 мкл в 1,8 мл желудочного сока в пробирке Eppendorf емкостью 2 мл. Желудочный сок содержал 2,3 г пепсина (Sigma, P7000) и 5 г NaCl (Sigma, S9888) на литр дистиллированной воды. Его pH доводили до 4,5, чтобы моделировать условия в организме младенца. Пробирки со смесью биомассы и желудочного сока хорошо перемешивали на встряхивателе и впоследствии инкубировали на водяной бане при 37°C в течение 30 мин. До и после инкубации из пробирок отбирали образцы по 100 мкл, чтобы определить уменьшение количества клеток под действием желудочного сока методом проточной цитометрии, как описано в главе 2.4.
3.3 Повторное воздействие GOS на штаммы
Объем, содержащий 5 x 108 клеток, из оставшейся смеси желудочного сока и биомассы использовали для инокуляции 50 мл среды IM + BMOS или IM + P-GOS (107 (afu/мл)). Последующую инкубацию, мониторинг рН с помощью Cinac и определение количества клеток после ферментации проводили так же, как описано выше.
3.4 Посев заливкой
Количество клеток определяли методом посева заливкой. Кратко, выполняли серийные десятикратные разведения образцов в растворе соли триптона (Oxoid, LP0042). Впоследствии 100 мкл соответствующих разведений переносили на чашки Петри и смешивали с агаром MRS (AES Chemunex, г. Брюз, Франция) с добавлением 0,5 г/л цистеина. Анализ выполняли в двух повторностях. Затем чашки инкубировали в герметичных боксах в анаэробных условиях при 37°C в течение 48 ч. Количество колониеобразующих единиц на мл (КОЕ/мл) определяли путем подсчета количества колоний на чашках с соответствующим разведением, определяя их среднее арифметическое значение.
3.5 Результаты
3.5.1 B. animalis ssp. lactis NCC2818
Во время первого пассажа роста изменение pH было очень сходным на обоих источниках углерода, при этом среда, содержащая декстрозу и BMOS, показывала конечное значение pH 4,3 и 4,4 соответственно для одной повторности из трех, показанной на фиг. 8 (A). Кроме того, различий в количестве клеток, достигаемом в конце ферментации, не наблюдалось. При выращивании на декстрозе количество клеток, определенное методами проточной цитометрии и посева заливкой, составляло 9,06 ± 0,15 log10 (afu/мл) и 8,77 ± 0,36 log10 (КОЕ/мл) соответственно (таблица 6). При выращивании на BMOS измеренное количество клеток составляло 8,88 ± 0,20 log10 (afu/мл) (фиг. 9) при определении методом проточной цитометрии и 8,78 ± 0,05 log10 (КОЕ/мл) при определении методом посева заливкой. Последующая обработка желудочным соком не привела к уменьшению количества живых клеток B. animalis ssp. lactis, выращенных на любом из двух источников углерода, и изменения log10 (afu/мл) составляли < │0,05│ (фиг. 10). После повторного воздействия BMOS на биомассу лаг-фаза роста клеток, предварительно размноженных на BMOS, была приблизительно на 2,5 ч короче по сравнению с клетками, выращенными на декстрозе (фиг. 8 (A)).
Сокращение лаг-фазы является ключевым фактором для улучшения синбиотического эффекта in vivo, поскольку быстрый эффект, в частности, необходим с учетом режима кормления младенцев, которых кормят в среднем раз в три часа.
При обеих видах ферментации было достигнут равный конечный pH приблизительно 4,4, который находился в том же диапазоне, что и при размножении клеток. Кроме того, конечное количество клеток в биомассе, предварительно выращенной на декстрозе, и у предварительно кондиционированных клеток достигало соответственно 8,74 ± 0,02 log10 (afu/мл) / 8,67 ± 0,08 log10 (КОЕ/мл) и 8,73 ± 0,12 log10 (afu/мл) / 8,73 ± 0,17 log10 (КОЕ/мл) (фиг. 11).
Таблица 6. Количество клеток, определенное методами проточной цитометрии и посева заливкой, достигаемое в результате ферментации B. animalis ssp. lactis NCC2818 в эксперименте по предварительному кондиционированию
(биомасса, выращенная на декстрозе)
(биомасса, выращенная на BMOS)
Эксперимент повторяли для штамма NCC2818 с P-GOS в качестве GOS-содержащего ингредиента. Конечный pH, достигнутый при размножении клеток, составил 4,3 и 4,4 при выращивании на декстрозе и P-GOS соответственно (фиг. 8 (B)). Количество клеток достигало 9,16 log10 (afu/мл) на декстрозе и 9,04 log10 (afu/мл) на P-GOS (таблица 7). Во время воздействия желудочного сока потеря биомассы не наблюдалась, а измеренное изменение составляло + 0,04 log10 (afu/мл). После ферментации на P-GOS как для предварительно кондиционированной, так и предварительно не кондиционированной биомассы были достигнуты pH 4,8 и количество клеток 8,9 log10 (afu/мл). Лаг-фаза предварительно кондиционированных клеток была приблизительно на 3 часа короче (фиг. 8 (B)). Однако в то же время она была более чем на 6 часов дольше, чем при предыдущей ферментации, в которой биомасса была получена на P-GOS.
Таблица 7. Количество клеток, определенное методом проточной цитометрии, достигаемое в результате ферментации B. animalis ssp. lactis NCC2818 в эксперименте по предварительному кондиционированию P-GOS
(биомасса, выращенная на декстрозе)
(биомасса, выращенная на P-GOS)
3.5.2 Другие штаммы
После размножения на декстрозе и BMOS соответственно количества клеток других штаммов достигали 8,7–9,1 log10 (afu/мл) и 8,5–8,8 log10 (afu/мл), что показывает некоторое уменьшение количества клеток всех штаммов при выращивании на BMOS (фиг. 9). После того как полученные массы подвергали воздействию желудочного сока, ни для одного из штаммов не наблюдали изменений количества клеток, измеренного в log10 (afu/мл) < │0,05│ (фиг. 10). При последующем выращивании клеток на BMOS количества клеток штаммов NCC466, NCC2950 и NCC435 достигали 8,8 log10 (afu/мл) независимо от того, подвергались ли они предварительному кондиционированию на BMOS (фиг. 11). Эти значения находились в том же диапазоне, что и полученные для NCC2818, которые вырастал до 8,73 ± 0,12 log10 (afu/мл). В обеих биомассах штамма NCC3001 количество клеток достигало 8,5 log10 (afu/мл). С другой стороны, B. longum NCC4020 был единственным штаммом, в биомассе которого, предварительно выращенной на BMOS, было определено большее количество клеток по сравнению с выращенной на декстрозе, которое составляло 8,6 log10 (afu/мл) по сравнению с 8,0 log10 (afu/мл).
Для штамма NCC466 при размножении на декстрозе и BMOS не было отмечено различий в увеличении кислотности среды (фиг. 12). Однако после того как эту биомассу подвергали (повторному) воздействию BMOS, лаг-фаза предварительно кондиционированных клеток была приблизительно на 4 ч короче по сравнению с клетками, выращенными на декстрозе.
Для штаммов B. longum NCC435 и NCC3001, не обладающих геном galA, заметных различий между ростом биомассы на декстрозе и BMOS не наблюдалось. При выращивании этих клеток на BMOS после воздействия желудочного сока предварительно кондиционированные клетки штаммов NCC435 (фиг. 13) и NCC3001 (фиг. 14) характеризовались более короткой лаг-фазой, составляющей приблизительно 3 часа и более 5 часов соответственно.
Для штамма NCC4020 B. longum, обладающего геном galA, при выращивании клеток на BMOS наблюдался несколько более низкий конечный pH по сравнению с декстрозой (фиг. 15). После того как полученную биомассу подвергали (повторному) воздействию BMOS, для предварительно кондиционированных клеток была получена кривая увеличения кислотности среды такой же формы, но с приблизительно на 6 ч дольше лаг-фазой по сравнению с кривой, измеренной при выращивании биомассы на BMOS. Однако клетки, которые были предварительно выращены на декстрозе, характеризовались еще более длительной лаг-фазой, и увеличение кислотности среды прекращалось при pH 5,3. Это наблюдение соответствовало меньшему количеству клеток, измеренному для данной ферментации.
Таким образом, ни для одного из штаммов потерь от воздействия желудочного сока не наблюдалось. Кроме того, для всех штаммов наблюдался эффект предварительного кондиционирования, характеризующийся более короткой лаг-фазой роста биомассы, предварительно выращенной на BMOS.
Пример 2. Предварительное кондиционирование Bifidobacterium animalis ssp. lactis различными концентрациями GOS
Эксперимент по предварительному кондиционированию проводили путем выращивания Bifidobacterium lactis NCC2818 на BMOS и декстрозе в качестве источника углерода, как описано в разделе 3 примера 1, но изменяя концентрацию BMOS и декстрозы в ферментационной среде. BMOS использовали в таких концентрациях, чтобы получить 0,28; 0,48; 0,95. 1,44. 1,92; 2,4 и 2,88% GOS. Для BMOS с содержанием GOS 48% эти концентрации чистого GOS соответствуют количествам BMOS 0,6; 1; 2; 3; 4; 5 и 6% соответственно.
Штаммы B. animalis ssp. Lactis выращивали в трех повторностях в 50 мл среды для выращивания (IM + декстроза (30 г/л декстрозы, таблица 4), IM + BMOS), разлитой в стерильные флаконы емкостью 100 мл. Среду инокулировали 107 (afu/мл) и инкубировали при 37°C на водяной бане. Для мониторинга повышения кислотности в процессе ферментации использовали систему Cinac мониторинга pH (Ysebaert, Фрепийон, Франция), которую можно использовать в качестве индикатора роста бактерий, продуцирующих молочную кислоту (Spinnler and Corrieu 1989). После ферментации определяли количество клеток методом проточной цитометрии и посева заливкой.
После ферментации из каждого флакона отбирали объем, содержащий 5 x 109 клеток (определено методом проточной цитометрии), и переносили в стерильные пробирки Eppendorf. Затем эти образцы центрифугировали на Biofuge pico (Heraeus Instruments, г. Ханау, Германия) при 16 060 x g в течение 5 мин. Впоследствии супернатанты отбрасывали, и осадки ресуспендировали в 1 мл 0,9%-ного раствора NaCl (Sigma, S9888). Эту стадию промывки повторяли еще раз для удаления остатков среды для выращивания. Полученную таким образом суспензию биомассы с концентрацией 5 x 109 (afu/мл) добавляли по 200 мкл в 1,8 мл желудочного сока в пробирке Eppendorf емкостью 2 мл. Желудочный сок содержал 2,3 г пепсина (Sigma, P7000) и 5 г NaCl (Sigma, S9888) на литр дистиллированной воды. Его pH доводили до 4,5, чтобы моделировать условия в организме младенца. Пробирки со смесью биомассы и желудочного сока хорошо перемешивали на встряхивателе и впоследствии инкубировали на водяной бане при 37°C в течение 30 мин. До и после инкубации из пробирок отбирали образцы по 100 мкл, чтобы определить уменьшение количества клеток под действием желудочного сока методом проточной цитометрии, как описано в главе 2.4.
Затем бактериальные клетки подвергали повторному воздействию BMOS. Объем, содержащий 5 x 108 клеток, из оставшейся смеси желудочного сока и биомассы использовали для инокуляции 50 мл среды IM + BMOS (107 (afu/мл)). Последующую инкубацию, мониторинг рН с помощью Cinac и определение количества клеток после ферментации проводили так же, как описано выше.
Для каждого испытуемого условия количество бактерий, используемых для инокуляции на стадиях предварительного кондиционирования и (повторного) воздействия, концентрация BMOS на стадии (повторного) воздействия, стадия обработки желудочным соком, среда и температура всегда были одинаковыми. Единственное различие между различными испытуемыми условиями составлял источник углерода (либо BMOS, либо декстроза) и концентрация источника углерода, используемая на стадии предварительного кондиционирования. Для сравнения различных условий использовали время до получения максимальной скорости увеличения кислотности среды (TM), которое означает точку перегиба кривых рН, полученных с помощью системы мониторинга Cinac, поскольку оно является объективным показателем для оценки, насколько быстро растут бактерии. Низкое значение TM означает быстрый рост бактерий.
Как показано на фиг. 16, рост бактерий B. animalis ssp. lactis, предварительно выращенных на BMOS, после повторного воздействия BMOS был быстрее, чем рост бактерий, предварительно выращенных на декстрозе, что указывает на достижение эффекта предварительного кондиционирования в широком диапазоне концентраций и даже при столь низкой концентрации, как 0,28%.
Пример 3. Влияние предварительно кондиционированных бактерий B. animalis ssp. lactis на микробиоту младенца
Цель данного эксперимента заключалась в оценке про- и синбиотического эффекта различных рецептур (предварительно кондиционированные или некондиционированные бактерии-пробиотики в присутствии или в отсутствие GOS) по сравнению с отрицательным контролем во время кратковременной инкубации в толстом кишечнике (48 ч). Цель этой инкубации в толстом кишечнике заключалась в том, чтобы оценить влияние введения холостого раствора, бактерий-пробиотиков отдельно и бактерий-пробиотиков с GOS на активность микроорганизмов (продукция суммарных короткоцепочечных жирных кислот (КЦЖК), ацетата, лактата и аммония) реальной микробиоты младенцев, и оценить, отличается ли это влияние при предварительном кондиционировании бактерий-пробиотиков (т.е. полученных ферментацией с GOS в качестве источника углерода). Для этого испытуемые ингредиенты добавляли в реактор, в котором находилась моделированная среда проксимального отдела толстой кишки ребенка. Чтобы выбрать подходящего донора для эксперимента, перед экспериментом проводили скрининг пяти детей 3-месячного возраста.
1. Моделирование желудочно-кишечного тракта in vitro
В этих экспериментах использовали упрощенное моделирование с помощью непрерывного имитатора микробной экосистемы человека (SHIME®; Simulator of the Human Microbial Ecosystem). Эта модель SHIME® широко используется уже более 20 лет как для научных, так и для промышленных проектов и валидирована с использованием параметров in vivo. После стабилизации микробного сообщества в различных участках толстой кишки в трех отделах толстой кишки заселяются репрезентативные микробные сообщества, различающиеся как по составу, так и по функциональности в различных участках толстой кишки. В этих экспериментах в качестве упрощенной системы SHIME® использовали одностадийную периодическую систему, моделирующую условия толстого кишечника.
2. Кратковременные инкубации в толстом кишечнике
Материал кала от пяти детей-доноров 3-месячного возраста собирали и консервировали с криопротектором. После сбора всех образцов кала проводили эксперимент по предварительному скринингу для выбора наиболее подходящего донора для заключительного эксперимента. Данный предварительный скрининг состоял в кратковременной инкубации в толстом кишечнике, во время которой BMOS добавляли в питательную среду с пониженным содержанием сахара, содержащую базовые питательные вещества, присутствующие в толстой кишке (например, гликаны организма-хозяина, такие как муцин). Для оценки фоновой активности сообщества для каждого донора в эксперимент включали холостой раствор, содержащий только питательную среду с пониженным содержанием сахара (без волокон). Поскольку это был эксперимент по скринингу, инкубации проводили однократно. В результате была получена экспериментальная модель, представленная в таблице 8 ниже.
Таблица 8. Экспериментальная модель эксперимента по предварительному скринингу
Результаты эксперимента по предварительному скринингу позволили выбрать наиболее подходящего донора для заключительного эксперимента. В качестве донора для заключительного эксперимента был выбран донор A, который характеризовался самым сильным бифидогенным эффектом, приводящим к высоким концентрациям ацетата и лактата. В начале этих заключительных кратковременных инкубаций в толстом кишечнике все испытуемые ингредиенты добавляли в питательную среду с пониженным содержанием сахара (как описано выше) вместе с замороженным инокулятом, полученным от ребенка. Также включали холостой раствор. Для учета биологической изменчивости все испытания проводили в трех повторностях, и в результате провели 30 независимых инкубаций, как указано в таблице 9.
Условия инкубации в эксперименте по предварительному скринингу и в заключительном эксперименте предусматривали инкубацию в течение 48 ч при 37°C при встряхивании (90 об/мин) и в анаэробных условиях. Включение в оба эксперимента холостого раствора позволяло оценить конкретное воздействие испытуемых ингредиентов на профиль метаболизма и состав сообщества микробиоты толстой кишки.
В качестве примечания, для проведения исследования механизма действия во время периодической ферментации in vitro, как правило, в качестве оптимальной дозы используют дозу 5 г/л. Более высокие дозы могут приводить к перегрузке системы и слишком сильному накоплению микробных метаболитов, в то время как при дозировке значительно ниже 5 г/л было бы сложно наблюдать чистые эффекты.
Таблица 9. Экспериментальная модель заключительного эксперимента
добавляемое при инкубации в толстой кишке
(предварительное кондиционирование)
3. Конечные точки кратковременных инкубаций
Представленные ниже анализы позволили сравнить кинетику продукции бактериальных метаболитов для различных пребиотиков.
Короткоцепочечные жирные кислоты (КЦЖК) представляют собой показатель для оценки метаболизма углеводов (ацетат, пропионат и бутират) или метаболизма белка (разветвленные КЦЖК) микроорганизмов, и можно проводить сравнение их содержания с типичным характером ферментации нормальной микробиоты желудочно-кишечного тракта (ЖКТ). Образцы для анализа SCFA анализировали после 6 часов инкубации.
Суммарные концентрации КЦЖК отражают общую ферментацию испытуемых ингредиентов. Введение BMOS с бактериями, не прошедшими предварительное кондиционирование (выращенными на декстрозе), приводило к увеличению продукции суммарных КЦЖК через 6 ч по сравнению с введением одного BMOS, что соответствует известному синбиотическому эффекту GOS и B. animalis ssp. lactis. Как показано на фиг. 17, продукция суммарных КЦЖК дополнительно повышалась при введении предварительно кондиционированных бактерий (выращенных на BMOS) вместе с BMOS. Таким образом, продемонстрирован усиленный синбиотический эффект. Увеличение суммарных КЦЖК обусловлено главным образом увеличением количества ацетата, поскольку аналогичный характер наблюдался при определении концентрации ацетата на фиг. 18.
Анализ лактата: кишечник человека населяют как продуцирующие лактат, так и утилизирующие лактат бактерии. Лактат продуцируется молочнокислыми бактериями и снижает pH среды, тем самым также действуя в качестве противомикробного агента. Протонированная молочная кислота может проникать в клетку микроорганизмов, после чего она диссоциирует и высвобождает протоны в клетке, что приводит к увеличению кислотности среды и гибели клеток микроорганизмов. Она также может быть быстро преобразована, в частности, в бутират другими микроорганизмами. Образцы для анализа лактата анализировали после 6 ч инкубации. При введении BMOS и B. animalis ssp. lactis, выращенных на декстрозе, наблюдался синбиотический эффект. Такой эффект дополнительно повышался при предварительном кондиционировании вводимых B. animalis ssp. lactis (выращенных на BMOS), как показано на фиг. 19.
Аммоний является продуктом протеолитического разложения и может также использоваться в качестве косвенного маркера доступности субстрата. Образцы для анализа аммония анализировали через 24 ч после начала инкубации. На фиг. 20 показано, что при введении предварительно кондиционированных B. animalis ssp. lactis продукция аммония снижается по сравнению с введением бактерий, выращенных на декстрозе. Аммоний образуется в результате протеолитической ферментации, связанной с образованием токсичных соединений, таких как п-крезол. Таким образом, высокие концентрации аммония связаны с вредными эффектами для здоровья в толстой кишке. Таким образом, снижение концентрации этого метаболита считают полезным.
Таким образом, был продемонстрирован повышенный синбиотический эффект, полученный вследствие ферментации бактерий-пробиотиков с источником GOS, поскольку данный источник углерода обеспечивает различные полезные для здоровья эффекты у младенца, такие как более здоровая микробиота и связанные с ней полезные эффекты. Кинетика эффектов, наблюдаемых в шестичасовой временной рамке, также согласуется с характером кормления младенца, так как младенцев обычно кормят в среднем раз в три часа.
Пример 4. Эффект предварительного кондиционирования высушенного распылением Bifidobacterium animalis ssp. lactis NCC2818
Проводили эксперимент по предварительному кондиционированию раздела 3 примера 1 с тем отличием, что бактерии B. animalis ssp. lactis после сбора из ферментационной среды были высушены распылением, после чего были подвергнуты повторному воздействию источника GOS.
Бактерии высушивали распылением, как описано ниже: общее содержание твердых веществ биомассы в процентах оценивали с помощью микроволнового и инфракрасного анализатора влажности (SMART Turbo, CEM Corporation, США), чтобы узнать количество порошка защитного агента (ЗА) по массе. Защитный агент, композиция которого описана ниже в таблице 10, потом ресуспендировали в стерильной воде и перемешивали на бане при 60°C до полного растворения, затем смешивали с биомассой. Затем смесь ЗА и биомассы перемешивали в течение 1 ч в ведре со льдом и доводили pH до 7,0 30%-ным раствором NaOH, после чего высушивали распылением. Стадию распылительной сушки выполняли с помощью распылительной мини-сушилки B-290 (Buchi, Швейцария) при температуре на входе ниже 115°C и температуре на выходе ниже 80°C.
Таблица 10. Композиция защитного агента
Перед повторным воздействием BMOS бактерии регидратировали в соотношении 1 : 100 в 0,9% растворе NaCl. Количество клеток определяли методом проточной цитометрии, как описано в разделе 2.4 примера 1, и объем, содержащий 5 x 108 клеток, использовали для инокуляции 50 мл среды IM + BMOS (107 (afu/мл)). Проводили последующую инкубацию, мониторинг рН с помощью Cinac и определение количества клеток после ферментации.
Как показано на фиг. 21, лаг-фаза предварительно кондиционированных бактерий существенно сократилась по сравнению с бактериями, выращенными на декстрозе. Эти результаты показывают, что бактерии, подвергнутые стадии сушки, сохраняют свои преимущественные эффекты.
Пример 5. Предварительное кондиционирование выбранных штаммов Lactobacillus
Эксперимент по предварительному кондиционированию, описанный в разделе 1 примера 3, повторяли с использованием Lactobacillus johnsonii NCC533, которому был присвоен депозитный номер CNCM I-1225, и BMOS в качестве источника GOS.
В данном эксперименте был выбран L. johnsonii NCC533, поскольку он содержит полноразмерный оперон galCDEGR(A) за исключением гена galA.
Результаты показаны на фиг. 22. Размножение исходной культуры на BMOS и на декстрозе представлены кривыми I и III соответственно. Хотя размножение исходной культуры на BMOS начиналось медленнее, в течение 720 минут был получен приемлемый рост, аналогичный полученному при использовании декстрозы в качестве источника углерода. Кривые II и IV показывают кривую роста после повторного воздействия BMOS. Как было показано ранее для штаммов Bifidobacterium в примере 1, лаг-фаза предварительно кондиционированных бактерий значительно короче, чем бактерий, выращенных на декстрозе. Эти результаты подтверждают, что полезный эффект предварительного кондиционирования бактерий-пробиотиков не является специфичным для рода при условии наличия galCEDEGR(A) в бактериальном геноме.
Эксперимент из примера 2 также повторяли с L. johnsonii NCC533 при концентрациях GOS от 0,6 до 2,04% в качестве источника GOS. При использовании в качестве источника углерода BMOS, имеющего содержание GOS 48%, эти концентрации соответствуют количеству BMOS 1,25; 1,75; 2,25; 2,75; 3,25; 3,75 и 4,25% соответственно. Как показано на фиг. 23, рост бактерий L. johnsonii NCC533, предварительно выращенных на BMOS, после повторного воздействия BMOS был быстрее, чем рост бактерий, предварительно выращенных на декстрозе, что указывает на достижение эффекта предварительного кондиционирования в широком диапазоне концентраций.
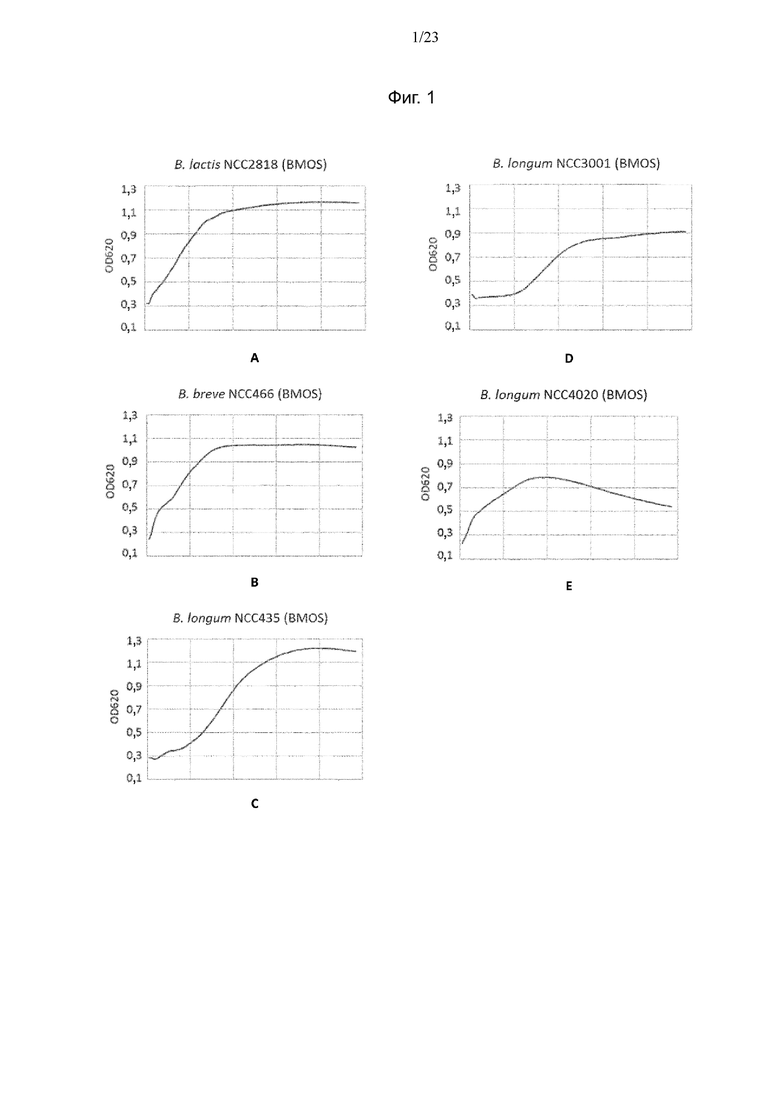
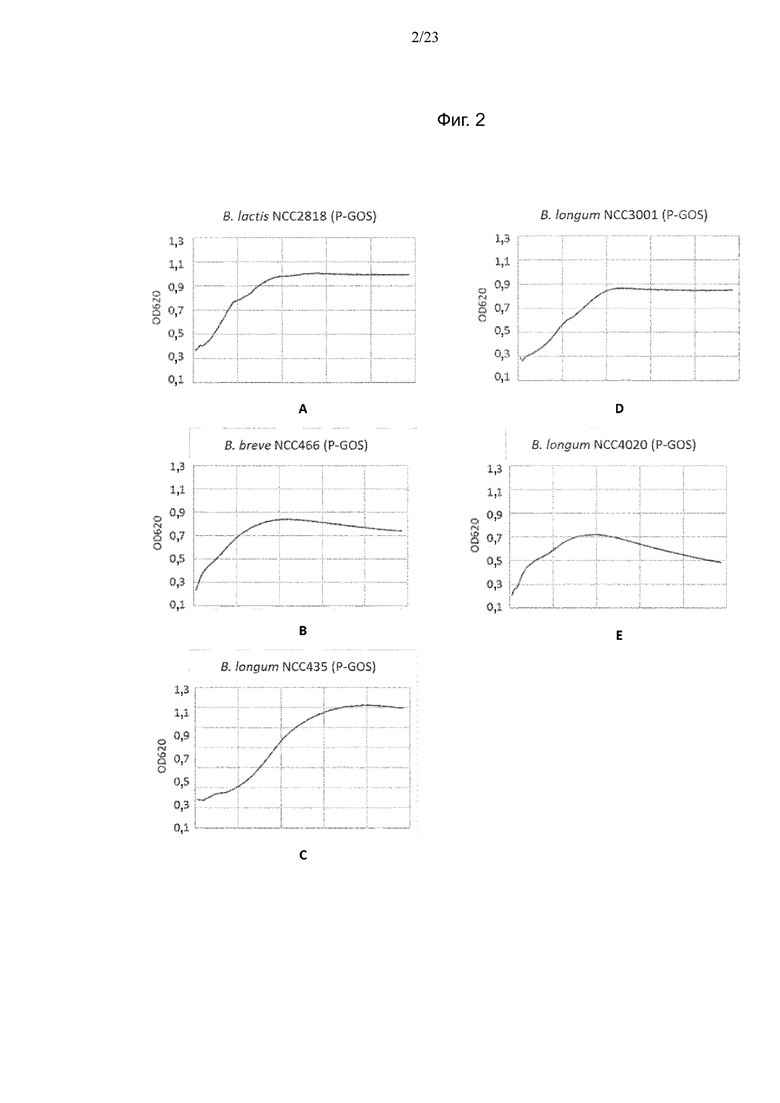
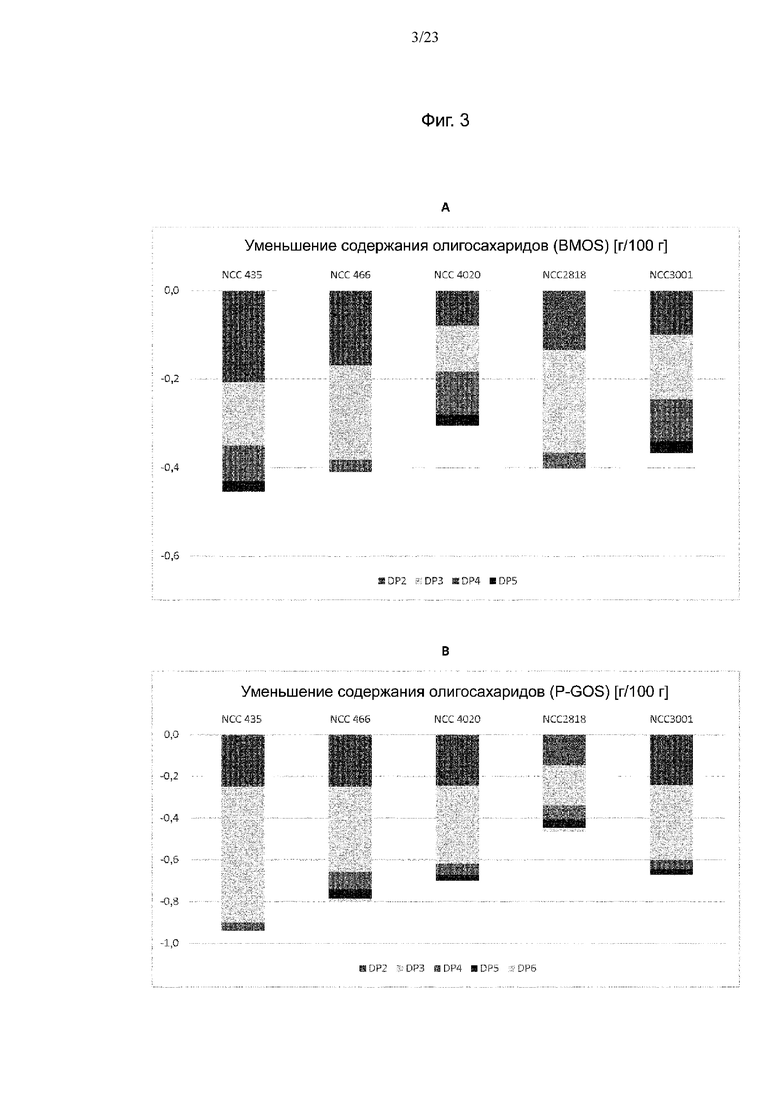
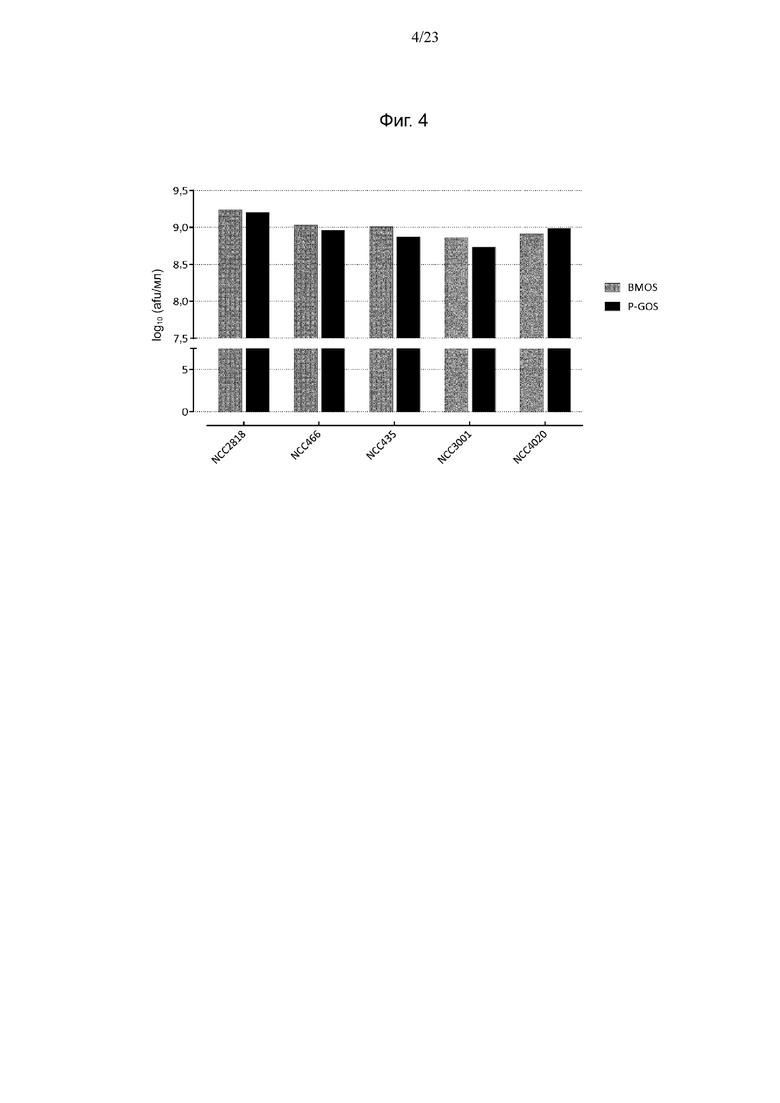
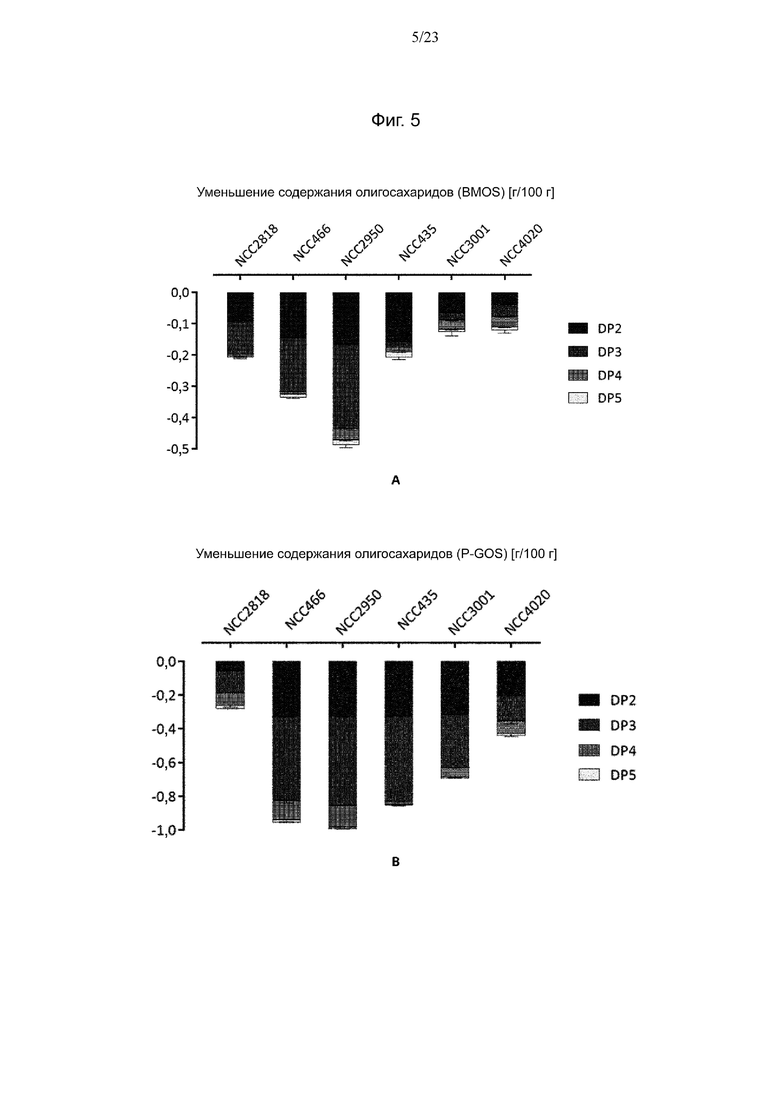
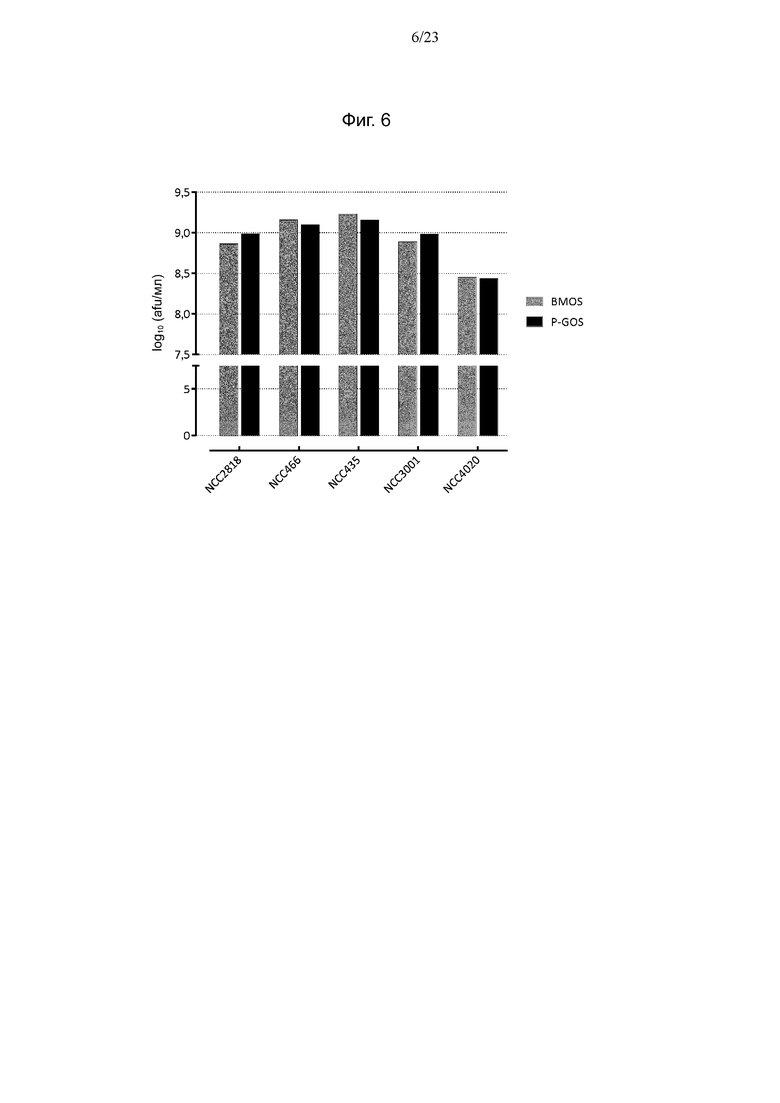
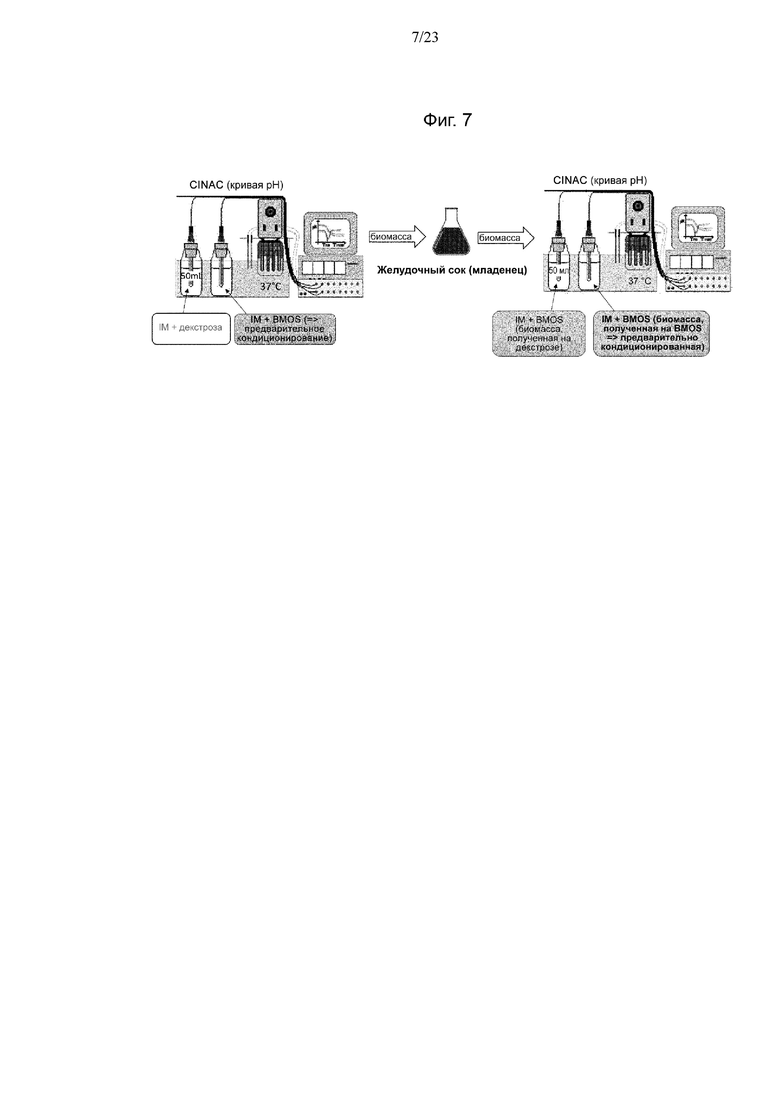
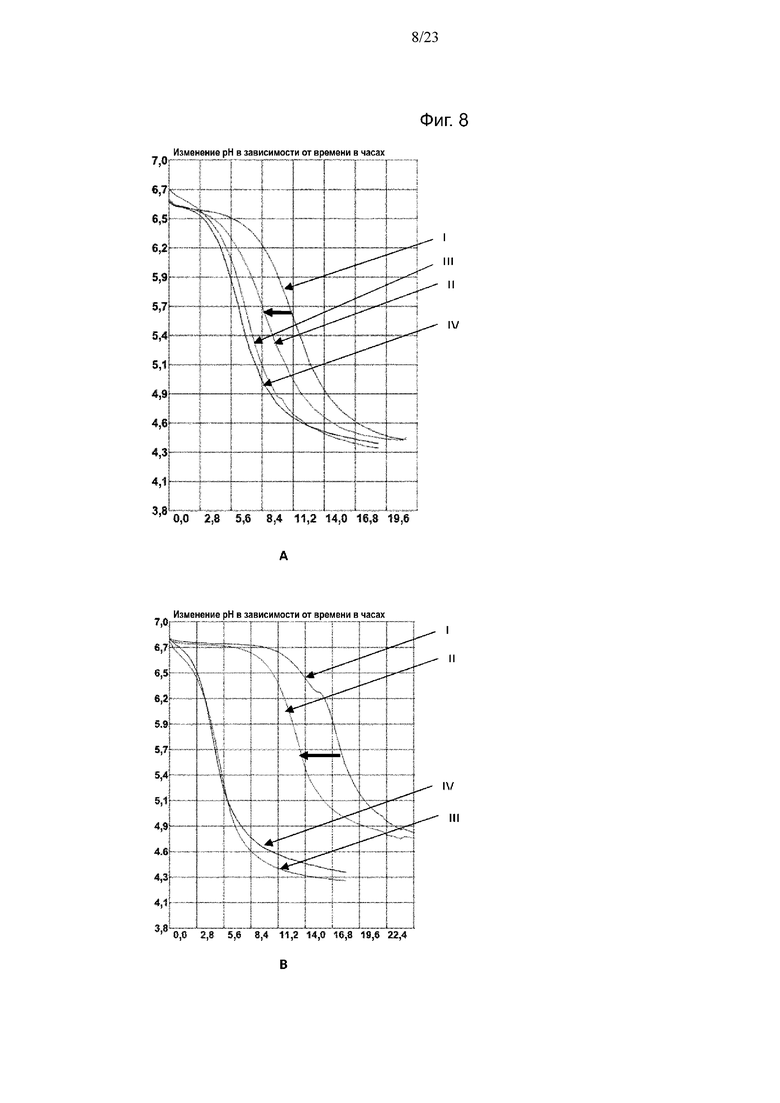
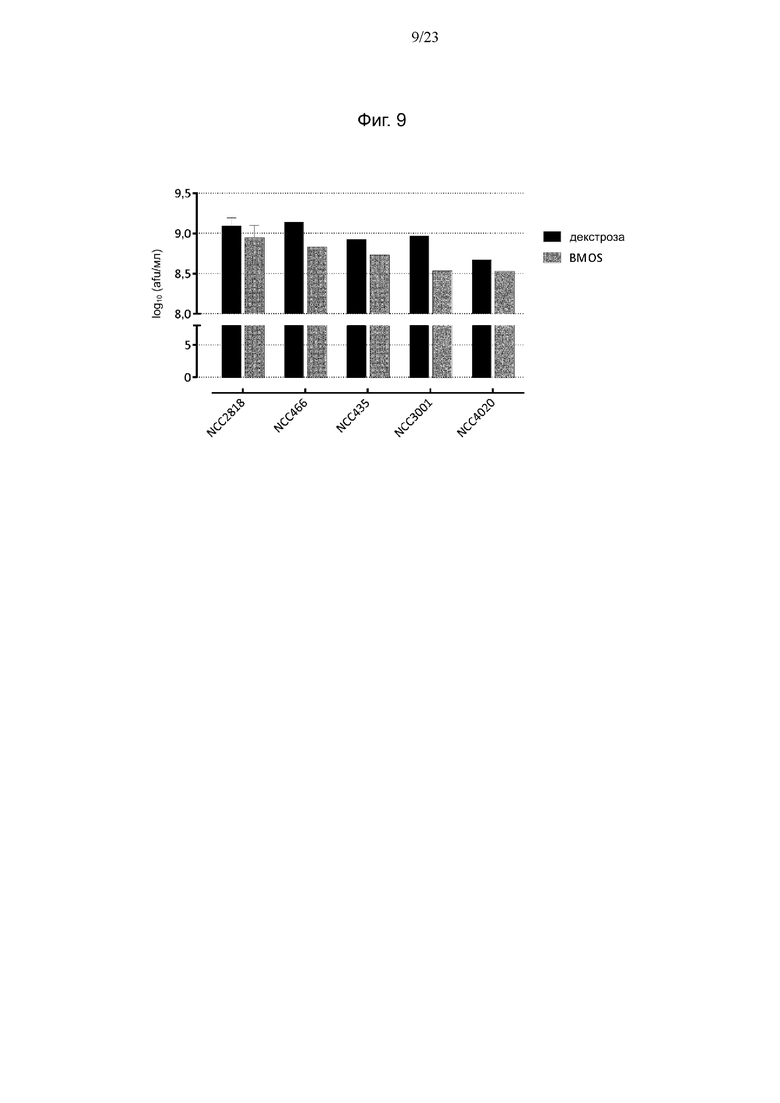
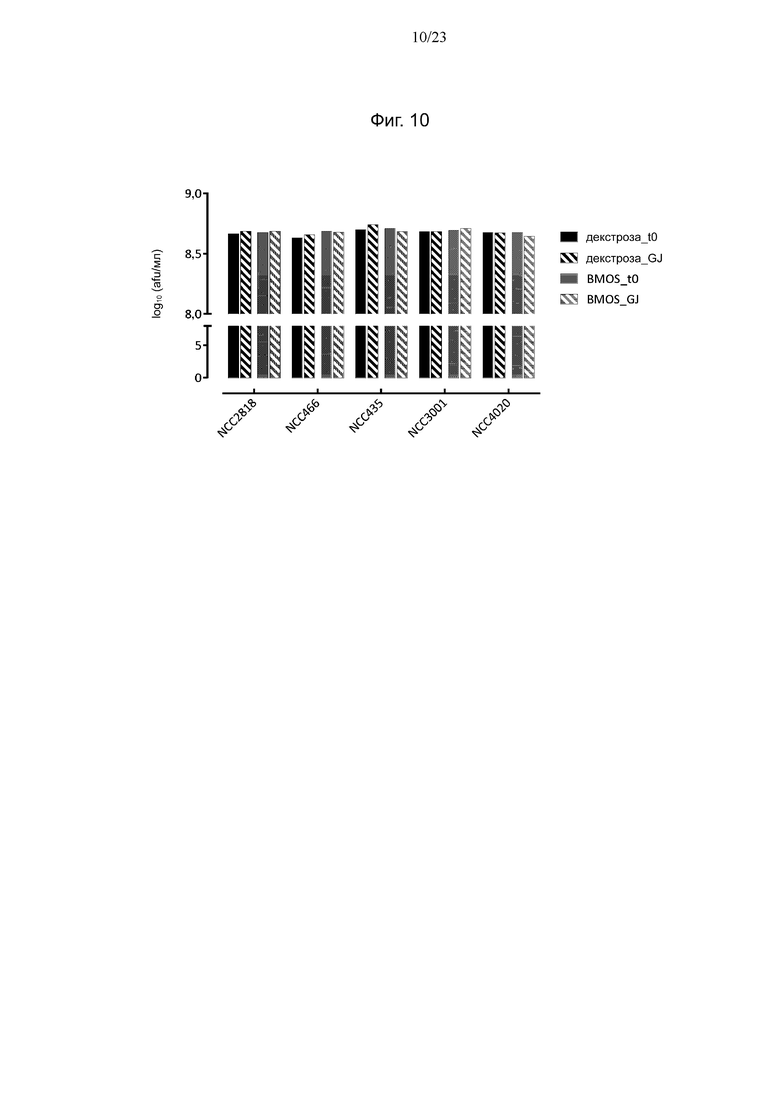
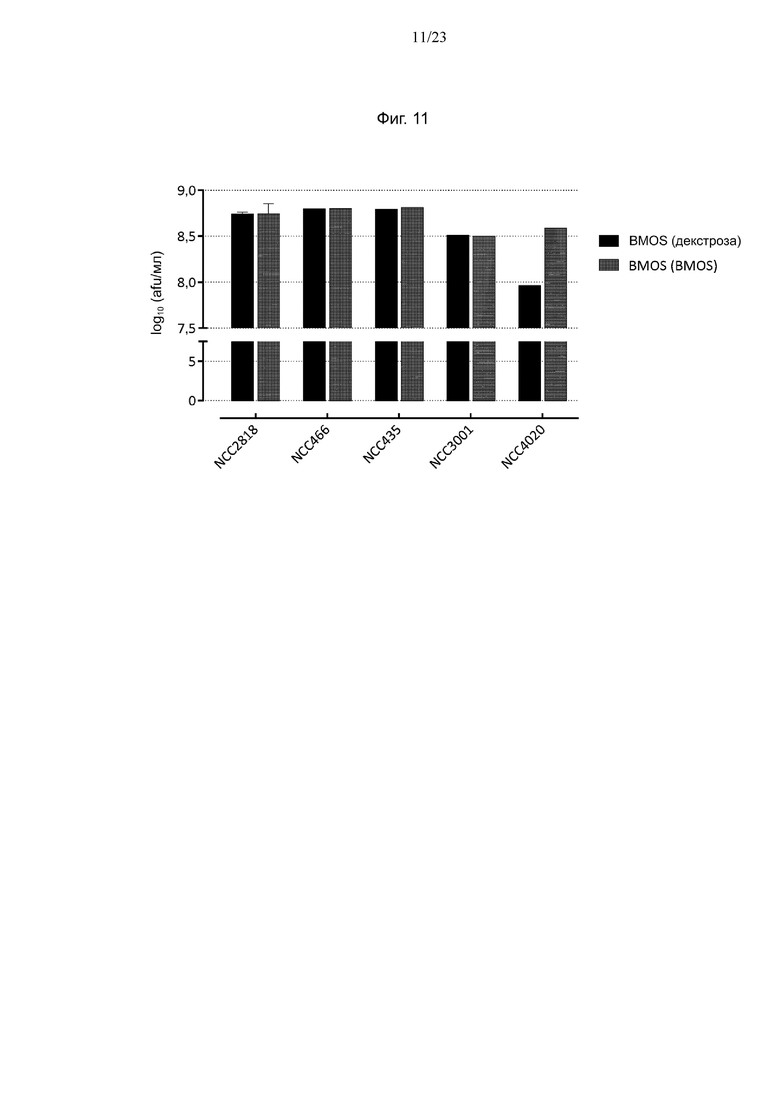
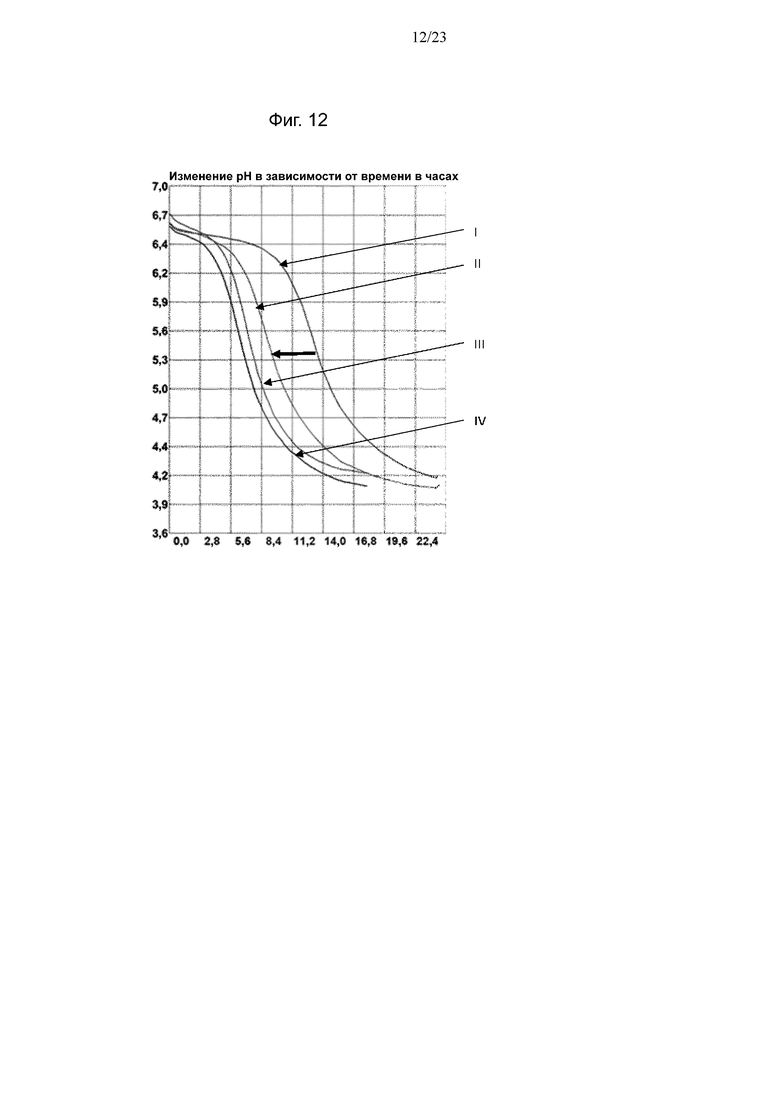
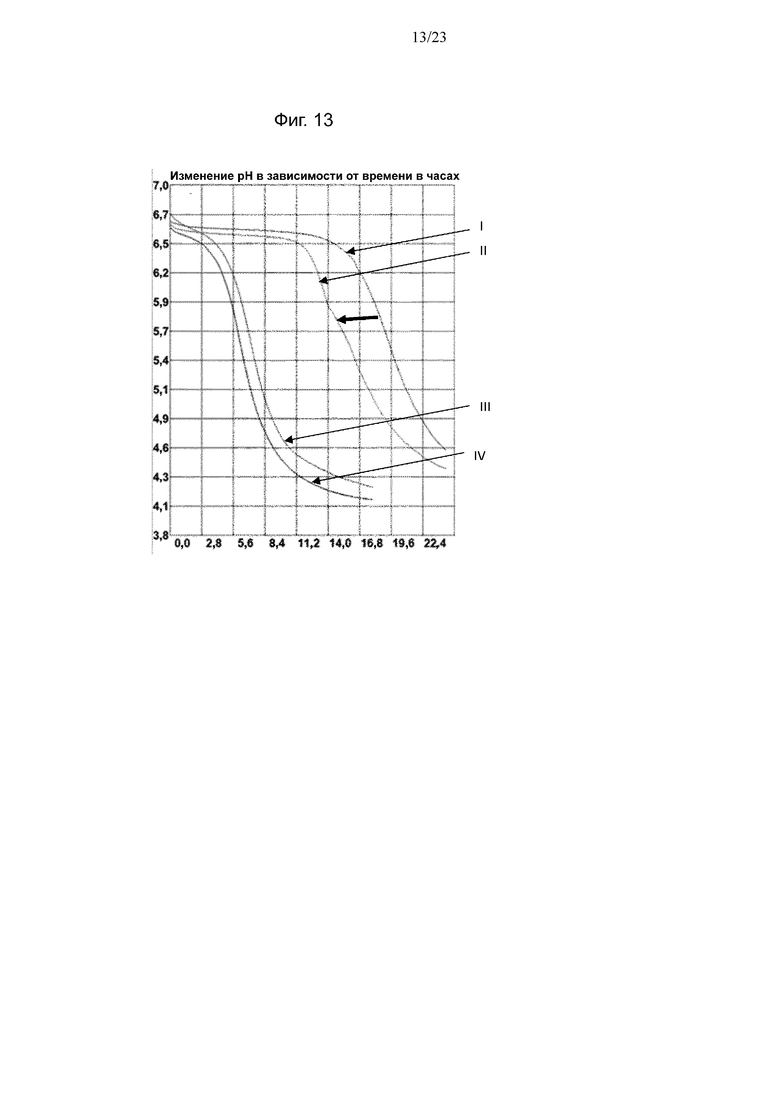
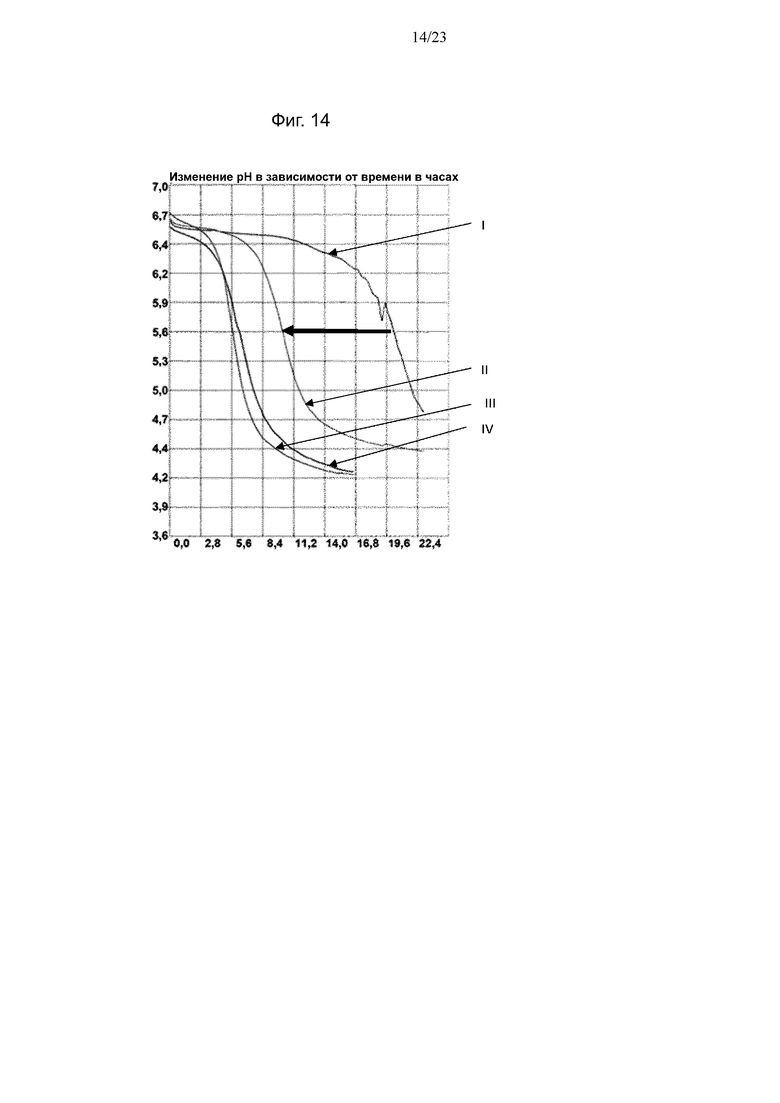
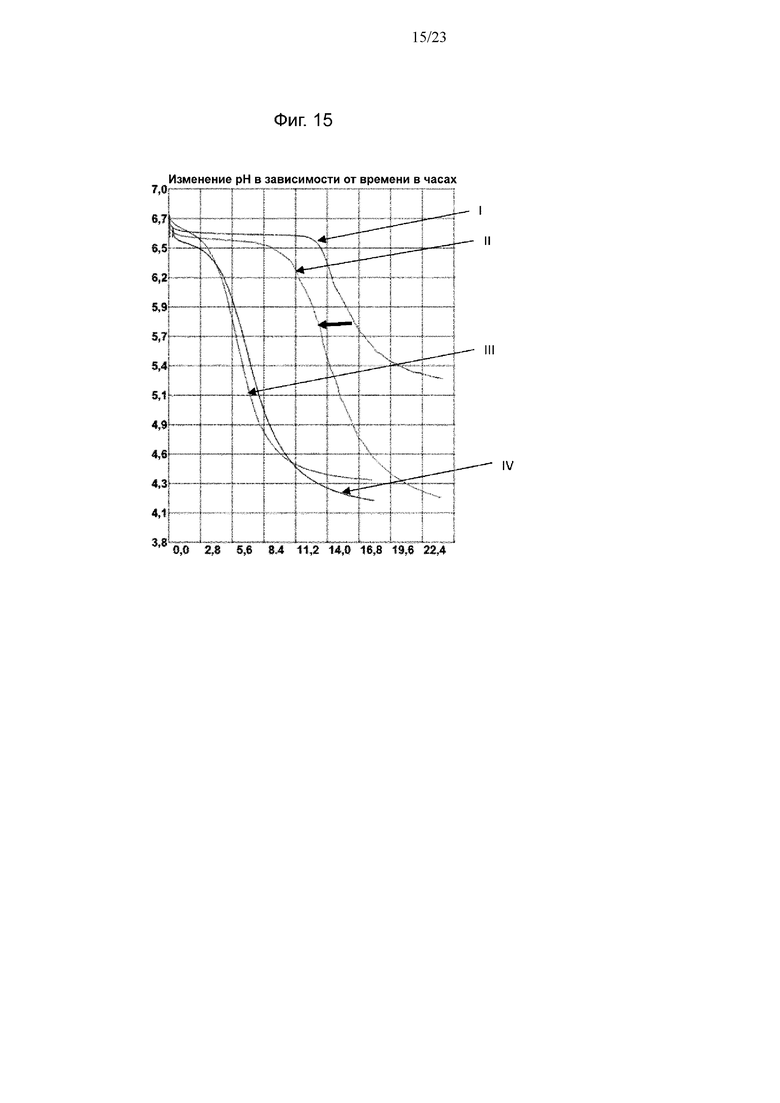
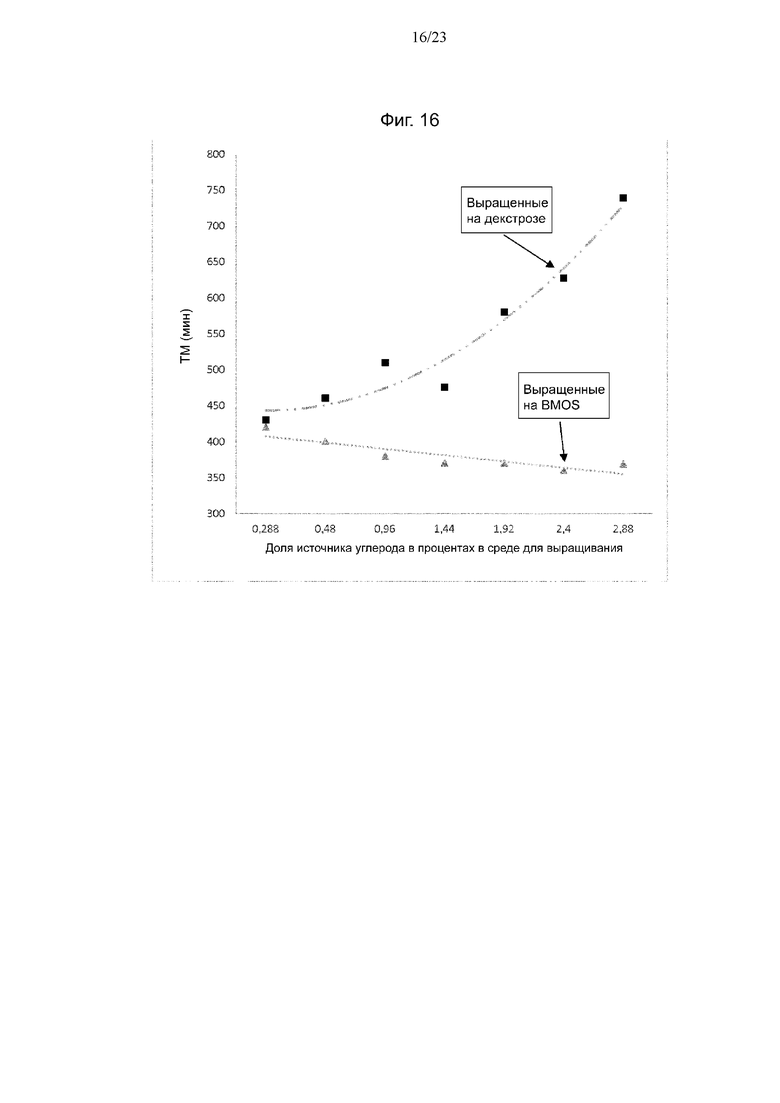
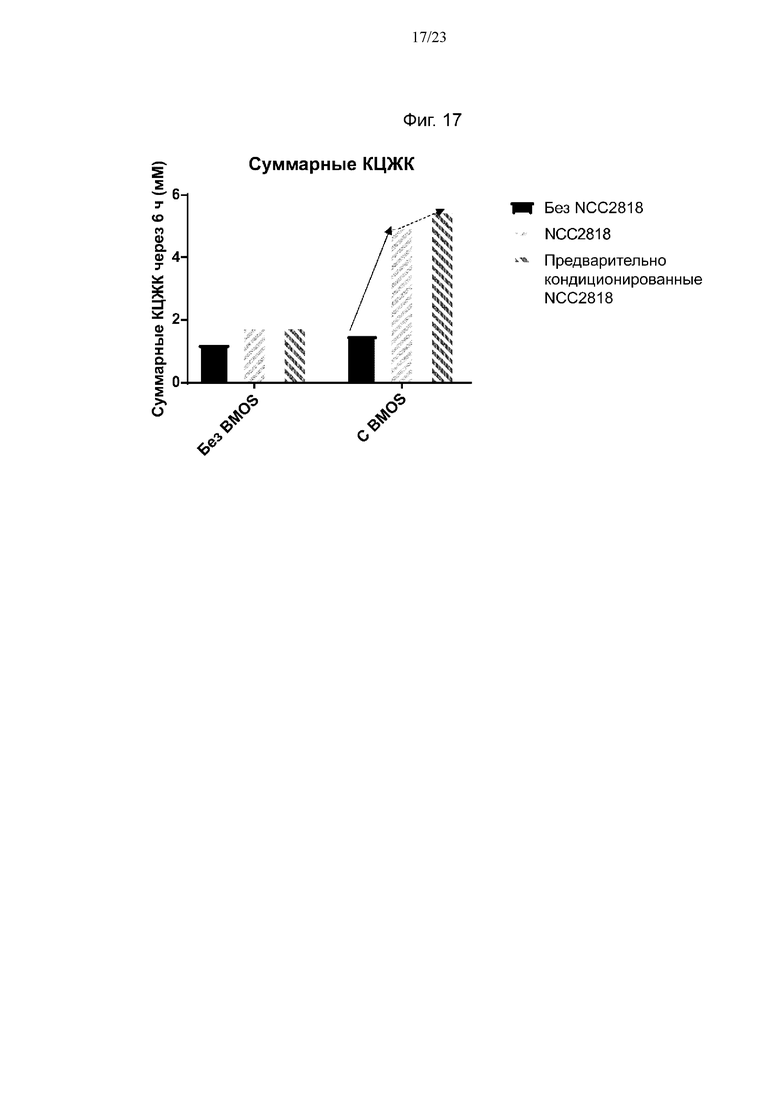
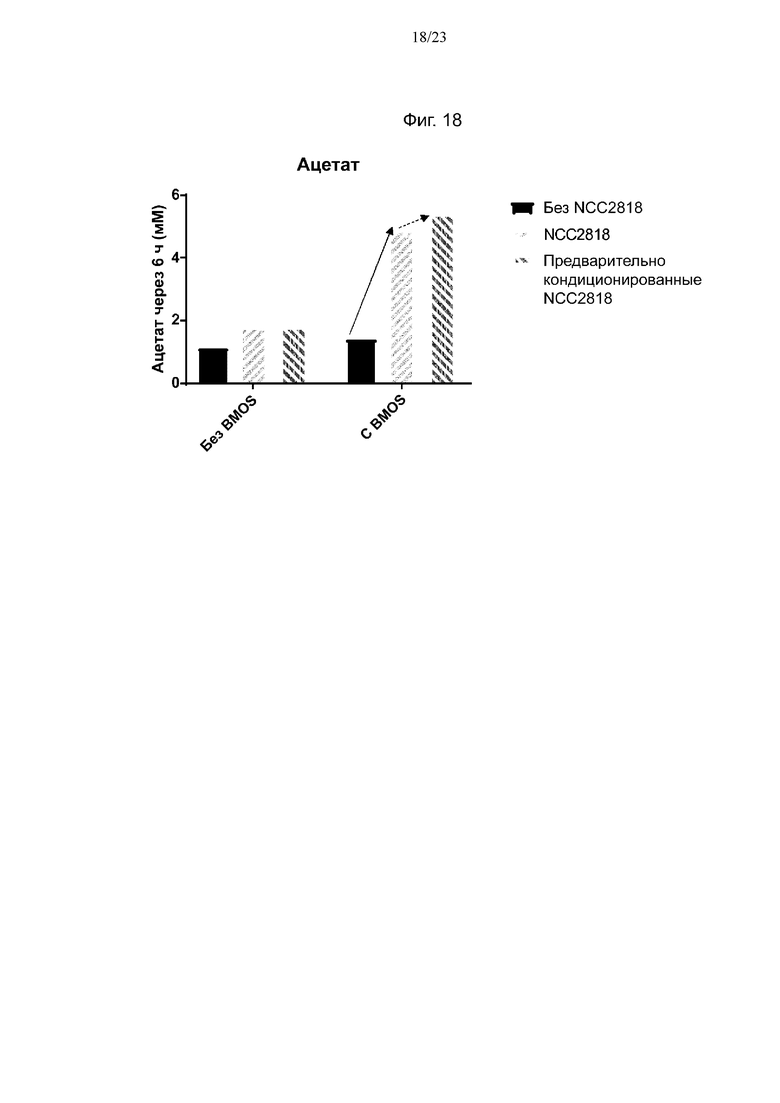
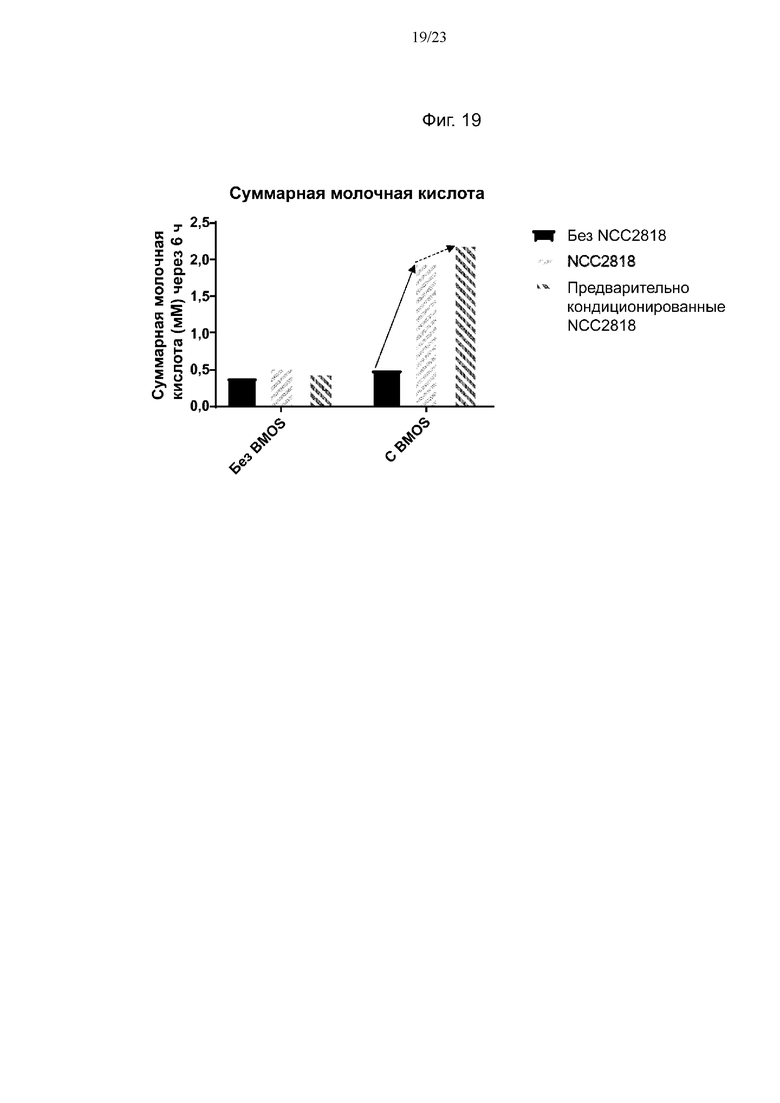
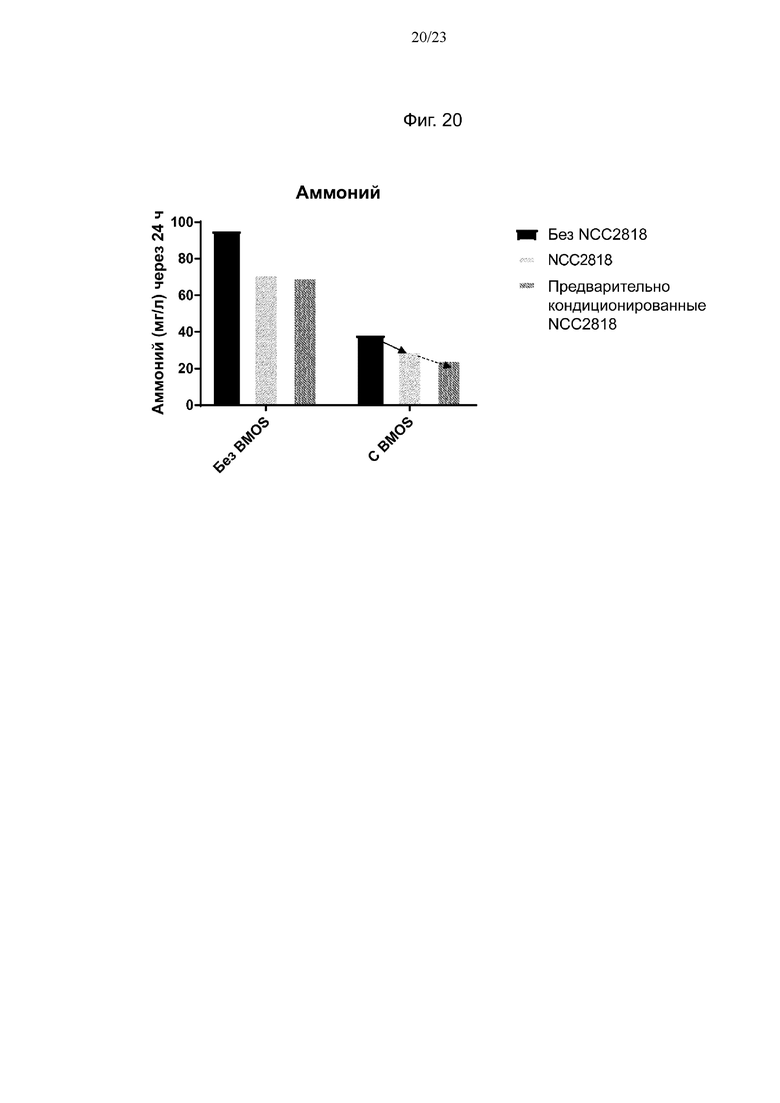
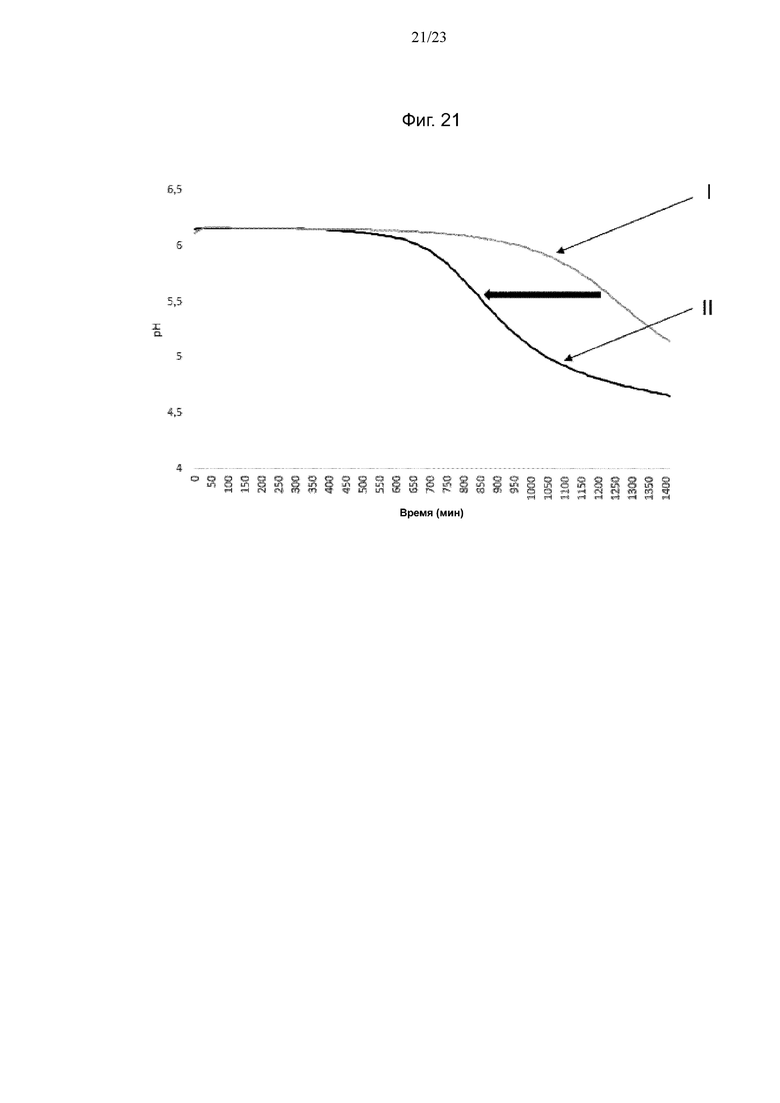
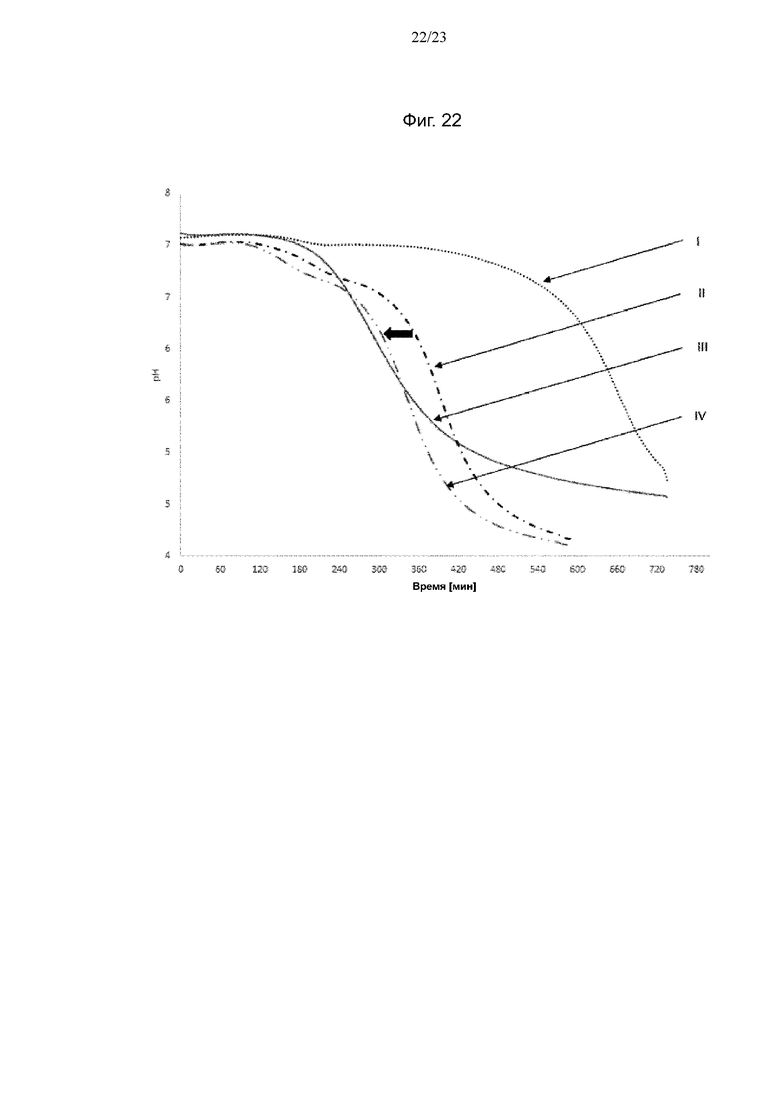
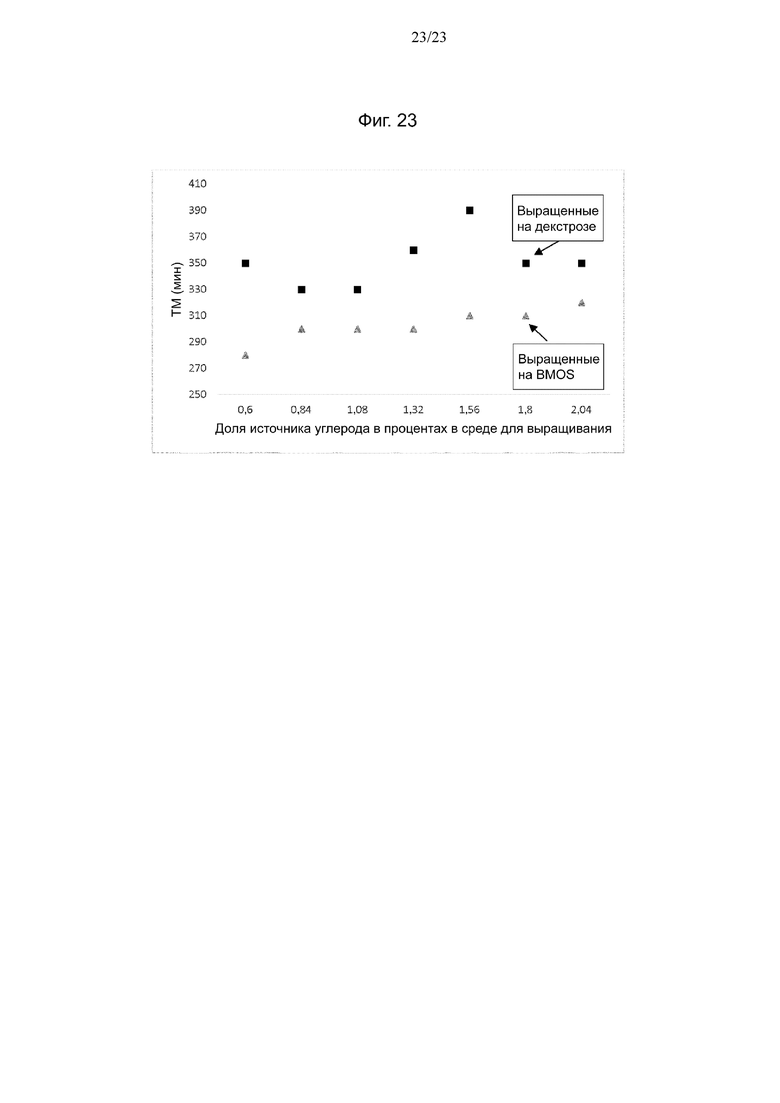
Изобретение относится к биотехнологии. Предложена пробиотическая композиция с повышенным синбиотическим эффектом по сравнению с эффектом только от пробиотика, содержащая эффективное количество галактоолигосахаридов (GOS) и содержащих оперон galCDEGR(A) бактерий-пробиотиков. Также предложены применение указанной композиции для пробиотической терапии за счет увеличения продукции общего количества короткоцепочечных жирных кислот (SCFA) и/или лактата и/или снижения продукции аммония в желудочно-кишечном тракте субъекта и способ повышения пробиотического терапевтического эффекта по сравнению с эффектом только от пробиотика у композиции с повышенным синбиотическим эффектом, содержащей GOS и содержащие оперон galCDEGR(A) бактерии-пробиотики. Изобретение обеспечивает усиление синбиотического эффекта бактерий-пробиотиков и GOS. 3 н. и 4 з.п. ф-лы, 23 ил., 10 табл., 5 пр.
1. Пробиотическая композиция с повышенным синбиотическим эффектом по сравнению с эффектом только от пробиотика, содержащая эффективное количество галактоолигосахаридов (GOS) и содержащих оперон galCDEGR(A) бактерий-пробиотиков, причем указанные бактерии-пробиотики относятся к роду Bifidobacterium или Lactobacillus и получены способом, включающим стадии:
a) ферментации бактерий-пробиотиков в среде для выращивания бактерий, содержащей галактоолигосахариды, пептон и по меньшей мере 3′-сиалиллактозу или 6′-сиалиллактозу;
b) сбора культивированных бактерий-пробиотиков, и
и далее соединение полученной культуры со стадии b) c GOS с получением композиции,
в которой бактерии-пробиотики выбраны из Bifidobacterium animalis ssp. lactis, Bifidobacterium longum, Bifidobacterium breve и Lactobacillus johnsonii.
2. Композиция по п.1, в которой бактерии-пробиотики выбраны из Bifidobacterium animalis ssp. lactis, которому был присвоен депозитный номер CNCM I-3446, Bifidobacterium longum, которому был присвоен депозитный номер ATCC BAA-999, Bifidobacterium longum, которому был присвоен депозитный номер ATCC 15707, Bifidobacterium longum, которому присвоен депозитный номер CNCM I-5259, Bifidobacterium breve, которому был присвоен депозитный номер CNCM I-3914, и Lactobacillus johnsonii, которому был присвоен депозитный номер CNCM I-1225.
3. Композиция по любому из предшествующих пунктов, содержащая по меньшей мере 0,2% галактоолигосахаридов в расчете на сухое вещество.
4. Композиция по любому из предшествующих пунктов, в которой бактерии-пробиотики присутствуют в количестве по меньшей мере 5E+05 КОЕ/г.
5. Композиция по любому предшествующему пункту, представляющая собой питательную композицию, выбранную из детской смеси, детских композиций на зерновой основе, детской смеси последующего уровня, молочных смесей для детей от 1 до 3 лет, функциональных молочных продуктов или молочных продуктов для беременных и кормящих женщин или для женщин, желающих забеременеть.
6. Применение композиции по любому предшествующему пункту или комбинации, содержащей оперон galCDEGR(A) бактерий-пробиотиков, относящихся к роду Bifidobacterium или Lactobacillus, полученных способом, включающим стадии:
a) ферментации бактерий-пробиотиков в среде для выращивания бактерий, содержащей галактоолигосахариды, пептон и по меньшей мере 3′-сиалиллактозу или 6′-сиалиллактозу;
b) сбора культивированных бактерий-пробиотиков; и
далее комбинирован путем соединения полученной культуры со стадии b) c GOS,
для пробиотической терапии за счет увеличения продукции общего количества короткоцепочечных жирных кислот (SCFA) и/или лактата, и/или снижения продукции аммония в желудочно-кишечном тракте субъекта,
в которой бактерии-пробиотики выбраны из Bifidobacterium animalis ssp. lactis, Bifidobacterium longum, Bifidobacterium breve и Lactobacillus johnsonii,
где терапия включает по меньшей мере модуляцию иммунного ответа или усиление иммунной защиты у субъекта, предотвращение, лечение или уменьшение инфекций или воспалений у субъекта, активацию здоровой микробиоты в желудочно-кишечном тракте субъекта, улучшение активности микробиоты в желудочно-кишечном тракте субъекта, метаболической активности микробиоты в желудочно-кишечном тракте младенца или ребенка младшего возраста, предотвращение аллергических реакций у субъекта, который является младенцем или ребенком младшего возраста.
7. Способ повышения пробиотического терапевтического эффекта по сравнению с эффектом только от пробиотика у композиции с повышенным синбиотическим эффектом, содержащей галактоолигосахариды и содержащие оперон galCDEGR(A) бактерии-пробиотики, относящиеся к роду Bifidobacterium или Lactobacillus, включающий:
a) ферментацию бактерий-пробиотиков в среде для выращивания бактерий, содержащей галактоолигосахариды, пептон и по меньшей мере 3′-сиалиллактозу или 6′-сиалиллактозу;
b) сбор культивированных бактерий-пробиотиков, и
далее соединение полученной культуры со стадии b) c GOS с получением композиции,
и вследствие этого повышение продукции общего количества короткоцепочечных жирных кислот (SCFA) и/или лактата, и/или снижение продукции аммония в желудочно-кишечном тракте у субъекта,
в которой бактерии-пробиотики выбраны из Bifidobacterium animalis ssp. lactis, Bifidobacterium longum, Bifidobacterium breve и Lactobacillus johnsonii,
где терапевтический эффект представляет собой эффект модулирования иммунной защиты субъекта, усиления иммунной защиты субъекта, предотвращения, лечения или уменьшения инфекций у субъекта или предотвращения, лечения или уменьшения воспаления у субъекта, предотвращения аллергических реакций у субъекта или стимуляции здоровой микробиоты в желудочно-кишечном тракте субъекта, где субъектом является младенец или ребенок младшего возраста.
| SIMEONI U | |||
| ET AL | |||
| Gut microbiota analysis reveals a marked shift to bifidobacteria by a starter infant formula containing a synbiotic of bovine milk-derived oligosaccharides and Bifidobacterium animalis subsp | |||
| РЕЗЕРВУАР ДЛЯ БЕСФИТИЛЬНЫХ НАГРЕВАТЕЛЬНЫХ ЛАМП | 1925 |
|
SU3446A1 |
| Environ Microbiol | |||
| Токарный резец | 1924 |
|
SU2016A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Найдено онлайн: | |||
Авторы
Даты
2024-05-16—Публикация
2018-08-06—Подача