(Л
С




| название | год | авторы | номер документа |
|---|---|---|---|
| Карбамоильные производные алканоламинов, в качестве регуляторов роста растений | 1982 |
|
SU1707015A1 |
| СПОСОБ ОЦЕНКИ ЗАСУХОУСТОЙЧИВОСТИ СОРТОВ ОЗИМОЙ МЯГКОЙ ПШЕНИЦЫ В УСЛОВИЯХ СКЛОНОВОЙ МИКРОЗОНАЛЬНОСТИ | 2014 |
|
RU2567902C1 |
| Способ определения содержания салициловой кислоты в вегетативных органах растений методом капиллярного электрофореза | 2018 |
|
RU2698913C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ СОДЕРЖАНИЯ МАЛОНОВОГО ДИАЛЬДЕГИДА В ВЕГЕТАТИВНЫХ ОРГАНАХ РАСТЕНИЙ МЕТОДОМ КАПИЛЛЯРНОГО ЭЛЕКТРОФОРЕЗА | 2015 |
|
RU2596791C1 |
| СОСТАВ ДЛЯ ОБРАБОТКИ СЕМЯН ЗЕРНОВЫХ И ГРЕЧИХИ ПЕРЕД ПОСЕВОМ | 1995 |
|
RU2117430C1 |
| СРЕДСТВО ДЛЯ ПОВЫШЕНИЯ УСТОЙЧИВОСТИ РАСТЕНИЙ РИСА К ЗАСОЛЕНИЮ, ПЛОДОВЫХ КОСТОЧКОВЫХ КУЛЬТУР И САХАРНОЙ СВЕКЛЫ К ЗАСУХЕ И ОЗИМОЙ ПШЕНИЦЫ К ЗАСУХЕ И ПОРАЖЕНИЮ ГРИБКОВЫМИ ЗАБОЛЕВАНИЯМИ | 1992 |
|
RU2042326C1 |
| СПОСОБ ПОВЫШЕНИЯ СТРЕССОУСТОЙЧИВОСТИ ЗЕРНОВЫХ КУЛЬТУР | 2018 |
|
RU2703022C1 |
| СПОСОБ ДИАГНОСТИКИ ПОТРЕБНОСТИ РАСТЕНИЙ В ЭЛЕМЕНТАХ ПИТАНИЯ С УЧЕТОМ ФИЗИОЛОГИЧЕСКОГО СОСТОЯНИЯ РАСТЕНИЙ | 2012 |
|
RU2511311C1 |
| ШТАММ БАКТЕРИЙ BACILLUS PUMILUS BIS88 В КАЧЕСТВЕ УНИВЕРСАЛЬНОГО СРЕДСТВА ДЛЯ УЛУЧШЕНИЯ ПИТАНИЯ, УСКОРЕНИЯ РОСТА И УВЕЛИЧЕНИЯ ПРОДУКТИВНОСТИ СЕЛЬСКОХОЗЯЙСТВЕННЫХ ЗЕРНОВЫХ, ОВОЩНЫХ И ТЕХНИЧЕСКИХ КУЛЬТУР, А ТАКЖЕ ИХ ЗАЩИТЫ ОТ БОЛЕЗНЕЙ И СТРЕССОВЫХ ФАКТОРОВ ХЛОРИДНОГО ЗАСОЛЕНИЯ | 2023 |
|
RU2823059C1 |
| УСИЛЕНИЕ СЕЛЬСКОХОЗЯЙСТВЕННЫХ КУЛЬТУР | 2017 |
|
RU2749170C2 |
Использование: сельское хозяйство, способы установления потенциальной устойчивости растений к комплексу стрессовых факторов. Сущность изобретения: способ определения устойчивости растений к стрессовым воздействия включает получение водного эстракта листьев растений и определение оптической плотности экстракта при 260-280 нм и длине оптического пути 0,5 см. В качестве экстаогента используют раствор с рН 3,0-3,8, полученный мембранным электролизом воды в анодной камере. Экстракцию ведут в течение 25- 35 мин при температуре 19-21° С и весовом соотношении листья:экстрагент 1:10 Сорт считают устойчивым, если оптическая плотность экстракта больше или равна 0,9, и неустойчивым, если она меньше 0,9. 4 табл.
Изобретение относится к сельскому хозяйству, а именно к способам установления потенциальной устойчивости растений к комплексу стрессовых факторов (водному, низко- и высокотемпературному стрессам) и может быть использовано в практике гене- тико-селекционных работ при создании высокопродуктивных, устойчивых к факторам внешней среды растений. Для создания новых прогрессивных технологий необходимы сорта, обладающие высокой устойчивостью к неблагоприятным факторам среды. В этом плане актуальным является поиск интегральных способов оценки устойчивости растений к экстремальным воздействиям (засухо-, жаро- и морозоучтойчивость). Исходя из экспресс-информации о состоянии фотосинтетического аппарата растений, можно суммировать многие ответные реакции растительного организма.
Существует ряд методов, позволяющих определять реакцию растения на воздействие неблагоприятных факторов среды.
Так, в настоящее время известны способа оценки морозоустойчивости озимых зерновых культур путем определения количества калия, перешедшего в раствор после охлаждения (авт. св. СССР № 1207431, кл. А 01 G 7/00, 1986), а также способ определения засухоустойчивости растений по выходу электролитов из листьев пшеницы в раствор в результате его прогрева при 30-45° С в течение 4-6 часов (авт. св. СССР № 791328, кл, А 01 G 7/00, 1980). Однако, данные способы позволяют определять морозо- и засухоустойчивость растений лишь в случае воздействия стрессового фактора и возникновения повреждений клеток, в том числе и без оценки степени устойчивости растений в нормаль J
:о о
4
xj
ном функциональном состоянии, т. к. выход электролитов из клеток листа усиливается только в условиях летального повреждения, при глубоком обезвоживании мембран и клетки в целом. Кроме того, вы-ход электролитов зависит от уровня оводненности тканей, что при засухе существенно усложняет процедуру измерений, т. к. для объективной оценки требуется регид- ратация тканей и сопоставление с их устойчивостью, которая при этом возникает (Кожушко Н.Н. Выход электролитов как критерий оценки засухоустойчивости и особенности его использования для зерновых культур // Методы оценки устойчивости растений к неблагоприятным уловиям среды. Всесоюзный НИИ растениеводства им. Н.И. Вавилова. Ленинград. - Колос. 1976, с, 32-43).
Наиболее близким по технической сущности является выбранный авторами в качестве прототипа способ определения засухоустойчивости многолетних растений (авт. св. СССР № 1371612, кл. А 01 G 7/00, 1988) путем измерения буферности рН водной вытяжки растительной ткани, при этом чем выше буферность рН водной вытяжки, тем устойчивее растение к засухе.
Данный способ осуществляется следующим образом.
Отбирают среднюю пробу или побегов, или почек, или листьев у многолетних растений, произрастающих на фоне недостаточной влагообеспеченности (засухе). Для этого навеску 1 кг-10 в 5-кратной повтор- ности тщательно растирают в ступке с дистиллированной водой и переносят в ячейку для измерения рН. Общее количество воды 10 м . После замера рН в ячейку для измерения с пробой добавляют м3 0,1 н. HCI, перемешивают и снова замеряют. По разнице в значениях рН до и после добавления кислоты устанавливают процент сдвига рН.
Однако, хотя этот способ и исключает предварительное воздействие стрессового фактора, но он дает лишь одностороннюю, приблизительную и не точную информацию о степени устойчивости растений к неблагоприятным факторам среды, т. к. в течение онтогенеза растения находятся в зоне действия комплекса неблагоприятных факторов - в летнее время они подвергаются губительному действию почвенной засухи и высоких температур воздуха, а в зимний период- низких температур. Наряду с этим величина рН в интервалах, измеряемых авторами, в значительной степени зависит от многих физических (температура, качество электродов, степень гомогенности среды и др.) и химических (дис- сорциация ионов, скорость растворения, плотность среды, скорость диффузионных
процессов и др.) показателей. Поэтому получение незначительных различий в величинах рН не всегда будет определяться экстрагированием веществ из клеток и тканей растения.
0 Предложенный авторами физико-биохимический показатель, основанный на установлении процента сдвига рН, является попыткой выявить значительные количественные изменения только лишь малых
5 сдвигов рН и не является достаточно корректным и точным при проведении расчетов. Поэтому актуальное значение имеет возможность получения интегральной характеристики устойчивости растений к ком0 плексу стрессовых воздействий.
Целью предполагаемого изобретения является повышение точности способа определения.
Поставленная цель достигается тем, что
5 способ определения устойчивости растений к стрессовым воздействиям предусматривает погружение сегментов листьев растений в электролит - раствор, полученный мембранным электролизом воды в анодной каме0 ре (анолит), с рН 3,0 - 3,8 в течение 25 - 35 мин при температуре 19-21°С и измерение оптической плотности экстракта при длине волны 260-280 нм с помощью двухлучевого спектрометра 356 фирмы Хитачи (Япония).
5 По этому интегральному показателю судят о степени устойчивости растений к комплексу стрессовых факторов - почвенной засухе, низким и высоким температурам воздуха, считая сорт устойчивым, если этот показа0 тель составляет 0,9 и более, и неустойчивым, если он менее 0,9.
Выбор среды рН, при котором производили экстракцию листьев обусловлен тем, что при данных значениях рН, благодаря
5 явлениям осмоса и денатурации белков, в раствор переходят входящие в плоскость мембраныф липиды, которые связаны с белками. Степень выхода липидов изменяет оптическую плотность раствора и позволячет
0 характеризовать общее функциональное состояние растительного организма.
Продолжительность экспонирования листьев в растворе связана с тем, что при коротких экспозициях наблюдается недо5 статочная чувствительность спектрометра, а при длительных - экстрагируются и другие вещества, которые вносят искажение в спектр поглощения и смещают максимум поглощения среды. Кроме того, при более блительных процессах экстракции водный
раствор несколько окрашивается за счет извлечения пигментов, что также вносит искажение в показания спектрометра,
Проведение измерений в интервале температур среды 19-21° С определяется интенсивность перекисного окисления ли- пидов. Более низкие темперетуры среды усложняют измерения, а более высокие - сильно активируют перекисное окисление жирных кислот липидов, что отражается на величине оптической плотности раствора в исследуемом участке спектра.
Проведение измерений в полосе спектра 260-280 нм связано с тем, что в этой области спектра происходит поглощение коротковолновой радиации полярными ли- пидами мембран, которые входят в светосо- бирающий комплекс фотосинтетического аппарата листа, а это особенно существенно для характеристики изменений процесса транспорта электронов и возможности их перестройки при неблагоприятных условиях среды.
Сущность предлагаемого способа подтверждается примерами конкретного выполнения,
Пример 1. В качестве электролита в опытах использовали анолит - воду, полученную мембранным электролизом обычной воды в анодной камере. рН анолита - 3,0-3,8 ±0,1. Термин анолит или анодная жидкость употребляется в специальной химической литературе (Химический словарь. Под ред. С. Собецкой, В. Бернацкого, Д. Крыт, Т. Задорожной (при участии Г. Стиван и Т, Стиван). - Варшава: Научно-техническое издательство. - 1962, с. 32). Электролиз проводили в течение 35 мин при постоянном напряжении 220 В и силе тока 200 мА при обычных условиях. Материалом для катода служила нержавеющая сталь марки ЛХ15Н, содержащая карбид железа (РезС), а анодом - карбид кремния (карборунд, SiC), которые обладают высокими противокоррозионными свойствами. Расстояние между электродами составляло - 40 мм. На катоде происходил процесс восстановления катионов (отдает электроны катионам), а на аноде - процесс окисления анионов (принимает электроны от анионов).
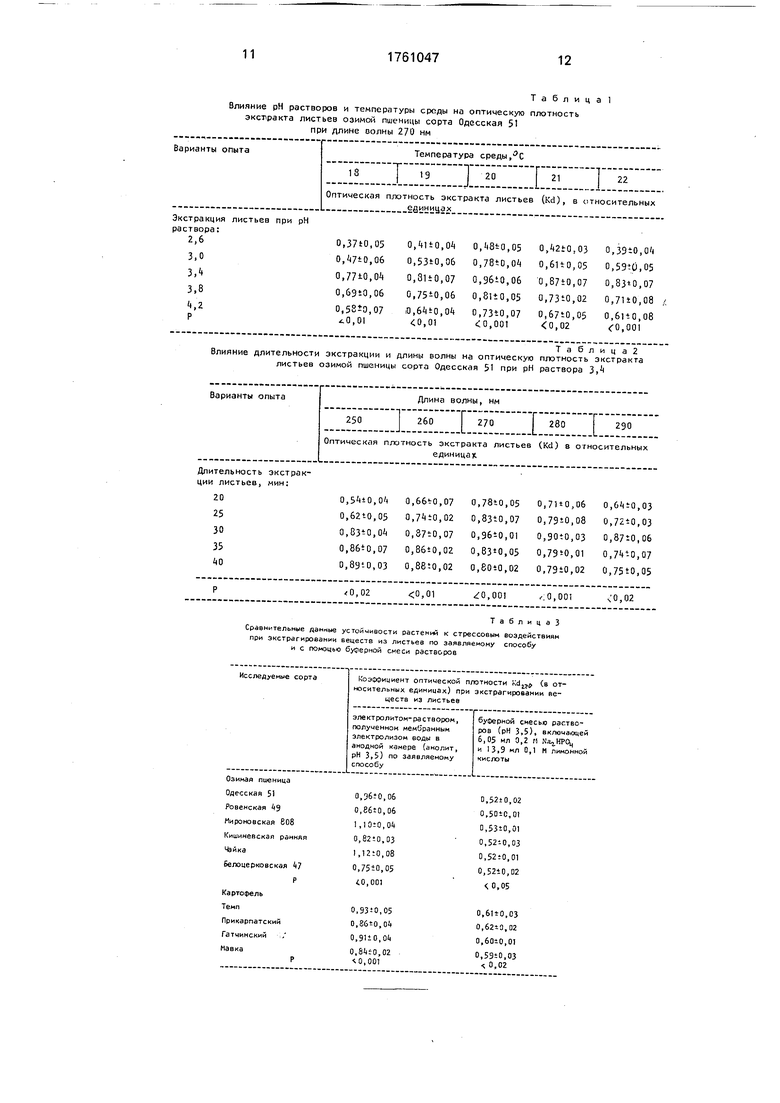
Пример 2. Листья озимой пшеницы засухоустойчивого сорта Одесская 51, взятые в фазу трубкования, помещали в кварцевую кювету с раствором, рН которого равно 2,6; 3,0; 3,4; 3,8.4,2, выдерживали при температурах среды 18°С, 19°С, 20° С, 22°С в течение 30 мин. Затем образовавшийся экстракт переносили в кварцевую кювету толщиной 0,5 см и измеряли оптическую
плотность раствора с помощью двухлучево- го спектрометра 356 фирмы Хитачи (Япония) при длине волны 270 нм. Результаты измерений приведены в табл. 1.
Пример 3. Листья озимой пшеницы
засухоустойчивого сорта Одесская 51, взятые в фазу трубкования, помещали в кварцевую кювету с раствором, рН которого 3,4, и выдерживали при температуры среды
0 20°С в течение 20, 25, 30, 35 и 40 мин. Затем образовавшийся экстракт переносили в кварцевую кювету толщиной 0,5 см и измеряли оптическую плотность раствора с помощью двухлучевого спектрометра 356
5 фирмы Хитачи (Япония), при длине волны 250 нм, 260 нм, 270 нм, 280 нм, 290 нм. Результаты измерений приведены в табл. 2.
Как следует из данных, приведенных в
0 табл. 1 и 2, наиболее оптимальными условиями для экстракции веществ из листьев растений является рН раствора 3,4, температура среды 20° С, продолжительность процесса экстрагирования 30 мин и измере5 ние оптической плотности раствора при длине волны 270 нм.
Для проверки эффективности способа проводили опыты с сортами растений, различающихся по своей устойчивости к стрес0 совым воздействиям.
Пример 4. В опыте использовали сорта озимой пшеницы Одесская 51. Ровен- ская 49, Мироновская 808, Кишиневская ранняя, Чайка и Белоцерковская 47, а также
5 сорта картофеля Темп, Прикарпатская, Гатчинский и Мавка. С этой целью готовили водные экстракты листьев пшеницы на фазе появления 4-го листа, а картофеля - на фазе начала цветения в растворе с рН 3,5 при
0 температуре 20° С и продолжительности процесса экстракции - 30 мин. Оптическую плотность экстрактов листьев определяли при длине волны 270 нм на спектрометре 356 фирмы Хитачи (Япония). Параллельно
5 в опыте определяли оптическую плотность экстрактов по заявляемому нами способу и с помощью стандартной буферной смеси раствора, включающего 6,05 мл 0,2 М N32HP04 и 13,9 мл 0,1 М лимонной кислоты,
0 имеющего диапазон рН от 2,2 до 8,0 при температуре от 15° С до 30° С (Перельман В,И. Краткий справочник химика - М.: 1951, с. 498).
В результате экспермиента установле5 но, что экстрагирование органических и неорганических веществ из листьев растений по предлагаемому нами способу с помощью электролита - раствора, полученного мембранным электролизом воды в анодной камере (анолит), является существенно более
эффективным, чем буферной смесью растворов (табл. 3). Следовательно, применение буферной смеси растворов не позволяет выявить достоверные различия между исследуемыми сортами в коэффициентах оптической плотности. Это обусловлено тем, что химические вещества буферного раствора могут образовывать нерастворимые соединения и комплексы и давать неже- лательные реакции со срезой (Бейтс Р. Определение рН. Теория и практика. - Ленинград, отд., Химия, 1972. - Изд. 2-е, с. 114), подавлять синтез многих ферментов и вызывать дезорганизацию структуры и функций мембран растительной клетки (Ги- зе А. Физиология клетки. - М.: Изд. ИЛ. - 1959, с. 43-54; Гродзинский A.M., Гродзин- ский Д.М. Краткий справочник по физиологии растений. - Киев: Наук, думка, 1964, с. 301).
Среды обычных растворителей вода отличается наиболее высокой диссоциирующей (ионизирующей) способностью (Кульман А.Г. Общая химия. - М.: Изд. с.-х. литературы, журналов и плакатов. 1961, с. 217; Бейтс Р. Определение рН. Теория и практика. - Ленинград, отд., Химия, 1972, - изд. 2-е, с. 162) и, по сравнению с буферными смесями растворов, является нетоксичным, сравнительно энергетически дешевым и легко регенирируемым экстрагентом (Химический энциклопедический словарь. - М.: Советская энциклопедия. Гл. ред. И.Л. Кнунянц. - 1983, с. 693).
Таким образом, можно сделать заключение, что для осуществления предлагаемого нами способа какой-либо раствор веществ любой концентрации с низкими значениями рН неприемлем, поскольку стандартные буферные смеси растворов оказывают ингибирующее влияние на процессы экстракции веществ из листьев расте- ний и не могут использоваться для определения устойчивости растений к стрессовым воздействиям.
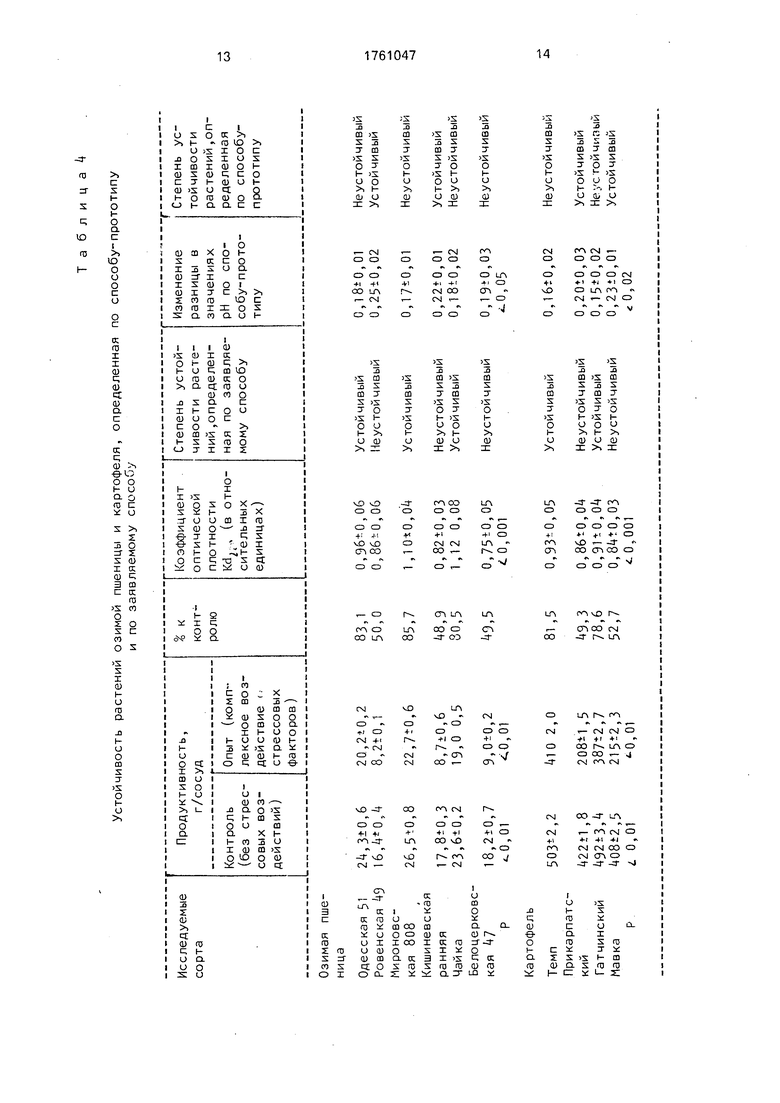
Пример 5. В опыте использовали сорта озимой пшеницы Одесская 51, Ровен- ская 49, Мироновская 808, Кишиневская ранняя, Чайка и Белоцерковская 47, а таку- же сорта картофеля Темп, Прикарпатский, Гатчинский и Мавка. С этой целью готовили водные экстракты листьев исследуемых сортов растений (для озимой пшеницы на фазе появления 4-го листа, для картофеля на фазе начала цветения) в водном растворе с рН 3,5 при температуре 20° С и продолжительности процесса экстракции 30 мин. Оптичес кую плотность экстракта определяли при длине волны 270 нм на спектрометре 356 фирмы Хитачи (Япония). Параллельно в
опыте определяли степень устойчивости растений озимой пшеницы и картофеля к стрессовым воздействия по способу-прототипу (табл. 4).
Полученные экспериментальные данные по способу-прототипу свидетельствуют, что по разнице в значениях рН до и после добавления кислоты не возможно установить существенные достоверные разли0 чия и точно оценивать степень устойчивости растений к комплексу стрессовых факторов среды,
Для подтверждения целесообразности предложенного нами способа в опыте опре5 деляли снижение продуктивности исследуемых растений под воздействием стрессовых факторов (почвенной засухи, низких и высоких температур воздуха).
С этой целью активно вегетирующие
0 растения подвергали воздействию низко-, высокотемпературного и водного стрессов в камерах искусственного климата ВКШ-73 и КНТ-1: низкотемпературный стресс создавали путем промораживания растений до
5 -15° С в течение 2-х суток, высокотемпературный стресс создавали путем выдерживания растений при температуре +40° С в течение 4-х часов, а условия почвенной засухи создавали путем прекращения полива
0 растений в течение 12 суток. При этом влажность почвы в сосудах снижалась до 25% от ее полной влагоемкости, а водный дефицит листьев увеличивался до 45,6%.
Результаты исследований показали
5 (табл. 4), что у сортов растений, обладающих устойчивостью к комплексу стрессовых факторов среды, оптическая плотность экстракта существенно увеличивается от 091 до 1,12 (т. е. составляет 0,9 и более).
0 Напротив, для неустойчивых сортов растений к комплексу стрессовых факторов среды характерно существенное снижение зтого показателя от 0,86 до 0,75 (т. е. менее 0,9). Следует отметить, что способ-прототип
5 предназначен для оценки устойчивости растений только к засухе и не пригоден для определения и оценки устойчивости их к комплексу стрессовых факторов среды. Измеренные нами по способу-прототипу
0 величины не дают возможности выявить достоверные различия между исследуемыми сортами озимой пшеницы и картофеля ввиду низкой точности и незначительной разницы в измеренных значениях рН.
5 В то же время заявляемый нами способ является более эффектвным, чем способ- прототип, т. к. позволяет более надежно оценивать непосредственно устойчивость мембранных структур, которые являются адаптивными мишенями клетки и интегрально отражают потенциальную устойчивость растений к комплексу стрессовых факторов среды. Кроме того, данный способ отличается существенно более высокой точностью, поскольку дает возможность без непосредственного воздействия стрессового фактора характеризовать потенциальную устойчивость и функциональную активность фотосинтетического аппарата растений к водному, низко- и высокотемпературному стрессам.
В предлагаемом нами способе впервые предложено экстрагирование веществ из листьев растений с помощью электролита с низкими значениями рН, полученного мембранным электролизом воды в анодной камере с применением специальных некорродирующих электродов. Это позволяет по сравнению со способом - прототипом получать существенно более высокий положительный эффект, который достигается за счет более высокой разности потенциалов, возникающих между внешней и внутренней поверхностью клеточных мембран листьев растений (рН клетки 6,2, слабо кислая реакция) и электролита - раствора, полученного мембранным электролизом воды в анодной камере (анолит, рН 3,5, крайне кислая реакция). Такие существенные различия обеспечивают более полное и равномерное извлечение из листьев не только органических и неорганических веществ, но также и белков и, особенно, липидов, которые регистрируются по спектрам поглощения только при длине волны 260-280 нм и измеряются с помощью двухлучевого спектрометра 356 фирмы Хитачи (Япония). Важно отметить, что добавление к воде кислоты не дают положительного эффекта.
В предлагаемом нами способе экстрагирование веществ из листьев растений происходит за счет осмоса, вызывающего передвижение воды из раствора, имеющего высокий водный потенциал (ВП), в раствор с низким ВП. При осмосе молекулы воды поступают через полупроницаемую мембрану в гипертонический раствор до тех пор, пока ВП с обеих сторон не станет одинаковым (Рейвн П., Эверт Р., Айк- хорн С. Современная ботаника. - М.: Мир, ч. 1, 1990, с. 65-66).
Таким образом, определение устойчивости растений к комплексу стрессовых факторов по способу-прототипу является существенно менее точным, чем определение устойчивости растений к комплексу стрессовых факторов по заявляемому нами
способу с помощью электролита - водного раствора с рН 3,0-3,8, полученным мембранным электролизом воды в анодной камере. Это обусловлено тем, что условия опыта
в способе-прототипе не позволяют точно регистрировать с помощью селективного электрода малые изменения рН водного экстракта листьев и вносят существенную погрешность в такой незначительно изменяющийся показатель как измеряемая разница рН.
Из литературы (Кульман А.Г. Общая химия, - М.: Изд. с.-х. литературы, журналов и плакатов. 1961, с. 226) известно, что чем
раствор более кислый, тем выше в нем концентрация водородных ионов и тем меньше рН. Это означает, что активность растворов воды - как амфотерного электролита, зависит от рН. В кислых средах концентрации
ионов водорода выше, а в щелочных - наоборот - ниже. (Сена Л.А. Единицы физических величин и их размерности. - М.: Наука. Главная редакция физико-математической литературы. 1988, с. 431).
Предлагаемый нами способ может быть
использован в селекции для отбора и сравнительной оценки степени устойчивости районированных сортов и перспективных линий и форм растений к водному, низко- и
высокотемпературному стрессам. Полученные количественные данные по заявляемому способу могут быть также применены при исследовании механизмов устойчивости и адаптации растений к неблагоприятным факторам среды при их выращивании в контрастных почвенно-климатических зонах.
Формула изобретения
Способ определения устойчивости растений к стрессовым воздействиям, включающий приготовление водного экстракта листьев растений и определение физиоло- го-биохимического показателя экстракта,
отличающийся тем, что, с целью повышения точности способа, экстракцию осуществляют в течение 25-35 мин при 19-21° водным раствором с рН 3,0-3,8, полеченным мембранным электролизом
воды в анодной камере, при массовом соотношении листья : экстрагент 1;10, а в качестве физиолого-биохимического показателя определяют оптическую плотность экстракта при длине волны 260280 нм и длине оптического пути 0,5 см и отномят сорт к устойчивому при показателе, большем или равном 0,9, и неустойчивому, если менее 0,9.
Таблица
Влияние рН растворов и температуры среды на оптическую плотность экстракта листьев озимой пшеницы сорта Одесская 51 при длине волны 270 нм
Таблицах
Влияние длительности экстракции и длины волны на оптическую плотность экстракта листьев озимой пшеницы сорта Одесская 51 при рН раствора 3,
ТаблицзЗ
Сравнительные данные устойчивости растений к стрессовым воздействиям при экстрагировании веществ из листьеа по заявляемому способу и с помоцьо буферной смеси растворов
Озимая пшеница Одесская 51 Ровемская 49 Мироновская 608 Кишиневская ранняя чайка
Белоцерковская 7 Р
Картофель Темп
Прикарпатский Гатчинский Мэвка
D,52iO,02 0,5010,01 0,,01 0,52Ю,03 0,52;0,01 0,5210,02 0,05
0,6ltO,03 0,,02 0,6010,01
0,5910,03 Ч 0,02
Таблица
Устойчивость растений озимой пшеницы и картофеля, определенная по способу-прототипу
и по заявляемому способу
Неустойчивый Устойчивый
Неустойчивый
Устойчивый Неустойчивый
Неустойчивый
Неустойчивый
Устойчивый
Неустойчивый
Устойчивый
| Способ определения засухоустойчивости многолетних растений | 1985 |
|
SU1371612A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
1992-09-15—Публикация
1990-12-13—Подача