Известны щелочные аккумуляторы с отрицательным амальгамным электродом и положительным окисно-ртутным электродом.
При зарядке аккумулятора в результате растворения металлической фазы положительного электрода образуются частицы окисн ртути, плохо проводящие электрический ток. Эти частицы должны быть механически впрессованы в остаточную фазу ртути, например, при помощи пористой упругой мембраны, с тем чтобы возможно большая часть окиси соприкасалась с металлической поверхностью электрода и могла нревращаться в условиях разряда в ртуть. Это влияет на характеристики аккумулятора.
В предложенном аккумуляторе с целью улучшения электрических характеристик в электролит введен ион-комплексообразователь, дающий растворимые соединения с продуктами заряда положительного электрода, например цианид.
В качестве материала для отрицательного электрода можно употреблять, кроме ртути, и другие жидкие металлы, например галлий, или жидкости, обладающие такой же проводимостью, как металлы, например расплавы сплавов Вуда или Розе, в которых растворяются выделяющиеся при зарядке атомы щелочных или щелочноземельных металлов.
В качестве материала для положительного электрода могут быть использованы все металлы, которые образуют растворимые отрицательно заряженные комплексные ионы.
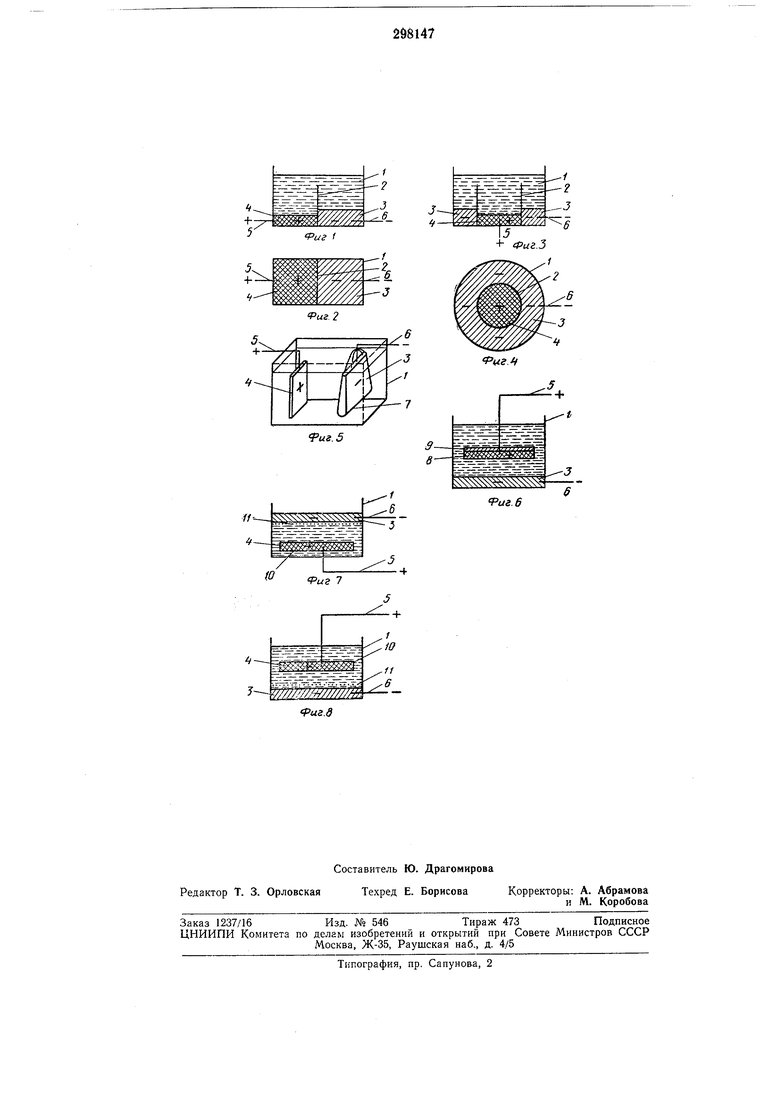
На фиг. 1-8 показан предложенный аккумулятор (варианты выполнения).
Аккумулятор (см. фиг. 1-4) содержит корпус /, разделенный перегородкой 2 на емкости, в одну из которых помещен отрицательный электрод 3, а в другую - положительный электрод 4.
Обе электродные емкости заполнены одним и тем же раствором электролита, покрывающим перегородку 2. Выводные полюсные соединения 5 и 6 состоят из нерастворимого в электролите и в электродном материале вещества, обладающего хорошей электропроводностью. Во время заряда или после окончания заряда жидкий материал отрицательного электрода 3 превращается вследствие выделения из электролита щелочного или щелочноземельного металла в твердую амальгаму или сплав и застывает. Материал положительного электрода 4 частично или полностью расходуется при заряде и растворяется в электролите. При разряде аккумулятора материал положительного электрода выделяется из фазы электролита на положительном полюсном соединении 5 или на оставшейся части положительного электрода 4, в то время как из материала отрицательного электрода 3 в фазу электролита переходят в форме ионов атомы щелочного и/или щелочноземельного металла.
При приложении постоянного напряжения, превышающего напряжение на зажимах аккумулятора и равного приблизительно 2 в, ионы калия из электролита перемещаются к отрицательному электроду, разряжаются и образуют калиевую амальгаму.
Ионы гидроксила и цианида, перемещающиеся к положительному электроду, образуют при разряде окись и цианид ртути. Оба эти соединения образуют с избыточным цианистым калием электролита растворимые комплексные соли по схеме:
HgO+3KCN-i-H2- k Hg {СМ) Hg(GN)2-i-KCN-K Hg(CN3).
Соединение (CN)3 диссоциирует в водном растворе на положительно заряженные ионы калия щ отрицательно заряженные комплексные ионь Hg (СЫ)з.
При разряде аккумулятора калий, имеющийся в амальгаме отрицательного электрода, растворяется с образованием ионов калия в электролите, в то время как отрицательно заряженные ионы Hg (СЫ)з отдают свой заряд на положительном электроде и распадаются при этом на металлическую ртуть и три иона цианида. Благодаря этому восстанавливается первоначальное незаряженное состояние. Вновь образовавшаяся ртуть объединяется с оставшимся в положительном электроде остатком ртутн, в то время как свободные ионы цианида остаются растворенными в электролите.
Поскольку описанный процесс обратим, циклы зарядки и разряда могут повторяться столь часто, сколько это нужно.
Аккумулятор может быть выполнен в виде отдельной конструктивной единицы. Для этого положительный электрод из ртути и отрицательный электрод из амальгамы калия погружают в электролит, состоящий из щелочного раствора комплексного цианида калия - ртути.
Так как отрицательный электрод амальгамирует атомы калия, а в электролите присутствует комплексный цианид ртути, аккумулятор может давать ток. После разряда и последующего приложения постоянного напряжения, превышающего напряжение на зажимах аккумулятора, аккумулятор может быть снова заряжен.
Аккумулятор является полностью заряженным, когда ртуть отрицательного электрода не может больше поглощать ионы калия. Разряженные ионы калня реагируют с водой электролита с образованием газообразного водорода, что является нежелательным. Однако выделение водорода может быть использовано для прекращения процесса зарядки либо автоматического прерывания его. Для этого
образовавшийся водород направляют в электрический конденсатор. В результате создается регулирующая электрическая цепь, в состав которой входит конденсатор, н процесс
зарядки прекращается.
Аккумулятор является полностью заряженным и в том случае, когда ртуть положительного электрода полностью растворяется в электролите, и электрод превращается в проводник, служащий для подачи электрического тока. Этот проводник рекомендуется изготавливать из нерастворимого или плохо растворимого в электролите материала. Можно также сделать емкость отрицательного электрода
меньще емкости положительного электрода, благодаря чему положительный электрод даже после зарядки сохраняет еще некоторый резерв, в то время как отрицательный электрод не может воспринимать дальнейщей зарядки.
В том случае когда положительный электрод содержит больще ртути, чем электролнт может поглотить ее в форме растворимой комплексной соли, ртуть откладывается при последующей зарядке в виде серого осадка, состоящего из плохо растворимого цианида ртути. Эти соединения не препятствуют дальнейшему прохождению тока, и аккумулятор может продолжать заряжаться, причем активная масса положительного электрода и растворенные комплексные ионы цианида ртути переходят в нерастворимый цианид ртути.
Плохо растворимый цианид ртути может образоваться при зарядке и преждевременно,
если сила тока настолько большая, что количество образовавшегося цианида ртутн превышает то количество, которое может раствориться в результате диффузии из электролита комплекса цианидных ионов.
Еслн обеспечить постоянное перемешивание электролита, то концентрация электролита будет везде одинаковой, и поверхность ртути останется чистой до тех пор, пока не будут связаны в комплексы почти все ионы цианида. Оба соединения - нерастворенный цианид ртути и растворенный комплекс цианида ртути - могут быть использованы для получения тока и образуют при разряде аккумулятора металлическую ртуть.
Перемешивать электролит можно либо при помощи мешалкн, погруженной в жидкий электролит, либо путем встряхивания аккумуляторного бака. Оба способа могут быть использованы одновременно или попеременно.
Мешалка должна быть нейтральной хотя бы с поверхности и не подвергаться воздействию электролита; ее можно соединить с электродвигателем и подвесить в середине сосуда. Мешалку можно изготовить магнитной, покрытой слоем синтетического материала. Магнитную мешалку помещают на дно сосуда и приводят в действие постоянно или периодически работающим магнитом, совершающим вращательное или колебательное движение. ды сделать подвижными один относительно другого или поместить аккумулятор в приспособление для встряхивания. В качестве материала для отрицательного электрода, кроме бинарных амальгам, щелочных и щелочноземельных металлов, можно употреблять металлические многокомпонентные системы. В зависимости от выбора катионов, растворенных в электролите, или металлов, амальгированных в ртути отрицательного электрода, можно изменять свойства аккуму. ляторов; напряжение на зажимах, внутреннее сопротивление, емкость из расчета на объемную или весовую единицу, допустимую нагрузку, саморазряд и т. д. Так, например, рекомендуется, чтобы электролит содержал такое количество ионов щелочных или щелочноземельных металлов и гидроксильных ионов, чтобы внутреннее сопротивление аккумулятора было возможно меньщим и, чтобы в процессе зарядки и разряда и между обоими этими процессами оно менялось в возможно меньщей стенени. Для создания аккумулятора с низким саморазрядом используется электролит из гидроокисей натрия с концентрацией 20-50 вес. %. Для создания высокого напряжения на зажимах аккумулятора применяется электролит, который содержит 20-50 вес. % гидрата окиси калия. Аккумулятор с высокой емкостью можно создать при использовании электролита, содержащего высококонцентрированный раствор гидрата окиси лития. Можно также использовать электролит, насыщенный осадком и представляющий собой раствор гидрата окиси щелочного или щелочноземельного металла, в котором присутствуют многочисленные компоненты, такие как NaOH, LiOH, Са(ОН)2. При этом аккумулятор имеет низкий самораздряд. В качестве материала для ноложительного электрода применяются такие металлы, которые образуют с ионами электролита растворимые отрицательно заряженные комплексные 45 ионы. При этом желательно, чтобы комплексные ионы диссоциировали на свои компоненты в возможно меньщей стенени. Комплексный ион ZLm( центральным атомом Z, обладающим п зарядами и m 50 связанными атомами Z, диссоциирует в водном растворе согласно схеме: ZLm ) Z -fmLна компоненты, входящие в его состав. По за- 55 кону действующих масс г 7 1Г / 1 ko ZLm(m-и) И представляет собой константу диссоциации для данного процесса. Чем меньще величина йд, тем более устойчивым является комплексный ион и тем меньщим саморазрядом характеризуется аккуму4060 зультате обмена между ионами , растворенными в электролите, и между атомами щелочного или щелочноземельного металла, присутствующими в амальгаме отрицательного электрода, в соответствии со схемой: Z ++nA- nA++Z, причем А обозначает атом щелочного металла, а Л+ - катион щелочного металла. Многие комплексные ионы имеют низкий kn, например ko иона Си(СЫ)з- составляет величину, меньщую . Процесс диссоциации протекает медленно. Это является существенным преимуществом аккумулятора, так как даже при больщом сроке хранения он имеет незначительный саморазряд, На фиг. 5 показан полностью или частично разряженный аккумулятор с вертикальным расположением электродов. Положительный электрод 4 выполнен из металлической пластины, а отрицательный электрод 3 - из жидкого металла, помещенного в плоский пористый мещок 7 из пластмассы, текстильных волокон или бумаги, устойчивой к щелочи. Ионы электролита могут проникать в поры мещка, а атомы металла отрицательного электрода 3 пройти сквозь эти поры не могут. Положительный электрод 4 может быть выполнен аналогично. Подобно ртути и меди, другие металлы образуют с ионами цианида, а также с другими связанными атомами устойчивые растворимые отрицательно заряженные комплексные ионы. К числу таких металлов относятся серебро, золото, металлы платиновой группы, железо, кобальт, никель, цинк и кадмий. Эти металлы могут быть использованы в качестве материала для положительного электрода. Путем правильного выбора металла создают аккумулятор .с необходимыми свойствами. Так, серебро, золото, платина обеспечивают высокое напряжение на зажимах. Положительный электрод с целью расщирения его применения изготавливают из многих компонентов, например из сплава двух металлов. При этом желательно, чтобы компоненты сплава имели близкие по величине потенциалы растворения и осал дения, например как никель и кобальт. При использовании ноложительного электрода из такого сплава во время зарядки аккумулятора кобальт и никель переходят одновременно в раствор под действием электролита, содержащего цианид, и вновь выделяются на положительном электроде при разряде аккумулятора. В качестве электродного материала можно употреблять сплавы медь - цинк, медь - олово. Для создания низкого напряжения на зажимах применяют положительный электрод, который частично состоит из железа или кобальта, никеля, цинка, кадмия. Можно также изготавливать пололштельный электрод из двух или нескольких слоев металлов (фиг. 6). При зарядке аккумулятоворяется в электролите в первую очередь, а слой 9 более благородного металла начинает растворяться при высоком зарядном напряжении, когда слой 8 уже полностью снят. Желательно, чтобы положительное полюсное соединение 5, состоящее из нерастворимого материала, у конца, погруженного в электролит, имело такое же поверхностное расширение, как и активная масса слоя 8 или 9 положительного электрода. Тогда при разрядке аккумулятора материал положительного электрода отложится почти в геометрической форме, без ветвистых образований и комков. При этом зарядное напряжение быть больше напрял ения на зажимах элемента.
При разряде аккумулятора процессы в электролите протекают в обратном порядке. Спачала, при более высоком напряжении на зажимах на положительной поддерживающей пластине 10 из комплексного иона откладывается серебро.
После этого напряжение на зажимах снижается скачкообразно до потенциала выделения никеля, а затем при дальнейшей разрядке на серебряном слое 9 начинает откладываться никель из комплексного иона. Этот процесс протекает до тех пор, пока в электролите не останется комплексных ионов или пока отрицательный электрод полностью не разрядится. Отложившийся никель образует положительный электродный слой 8.
Преимущество аккумулятора со слоистым положительным электродом заключается в том, что при измерении напряжения на зажимах аккумулятора можно определить его заряженность, так как скачок потенциала указывает, что непосредственно перед ним серебряный слой 9 еще сохраняет свою частичную емкость. Это помогает управлению отключающими органами, например реле, благодаря которым после определенного времени разрядки появляется сигнал, указывающий на необходимость повторной зарядки аккумулятора.
Компонентами многослойных электродов могут быть и другие металлы, потенциалы осаждения или растворения которых достаточно различаются.
X большинству аккумуляторов предъявляются следующие требования: высокий выход по току при зарядке и возможно меньший саморазряд в заряженном состоянии. Для достижения этого в водной фазе электролита, кроме комплексообразователя, растворяют гидрат окиси щелочного или щелочноземельного металла. Благодаря возникающей при этом большой величине рН выделение водорода на отрицательном электроде подавляется, что увеличивает выход по току при зарядке и снижает саморазряд. Кроме того, такой электролит желательно иснользовать хотя бы потому, что многочисленные комплексные ионы гяжелых металлов устойчивы лишь в щелочном растворе. При даже при использовании рекомендуемых цианидов в качестве комплексообразователей из раствора выделяется газообразная синильная кислота, чего при всех обстоятельствах следует избегать.
Для предотвращения возникновения ядовитых веществ использовать вместо 5 ионов цианида ионы тиоцианата (образующие с многочисленными ионами тяжелых металлов растворимые отрицательно заряженные комплексные ионы) или органические анионы, например формиат, ацетат, пропионат, окса0 лат, тартрат, цитрат.
Для этой же цели пригодны анионы аминокислот, хлоруксусных кислот и т. д., а также их замещенных производных. Существуют также другие органические соединения, образующие с тяжелыми металлами растворимые отрицательно заряженные комплексные ионы: комплексоны и клешневидные комплексы, например, нитрилоуксусных кислот, этилендиаминтетрауксусной кислоты, анилиндиуксус0 ной кислоты.
Многочисленные связанные атомы можно сочетать друг с другом, благодаря чему образуются комплексы, состоящие из многих компонентов. К. атомам тяжелых металлов могут
5 присоединяться незаряженные связанные атомы вместе с заряженными связанными атомами. Так, например, вокруг центрального атома могут располагаться вместе с отрицательно заряженными группами акво- и амино0 комплексные молекулы воды или аммиака.
Даже ион гидроксила может образовывать с амфотернореагирующими гидратами окисей металлов, например цинка, алюминия, титана и т. п. растворимые отрицательно заряженные
5 гндроксо-комплексы, например:
Zn(OH)2-f20H-- Zn(OH)(ОН)з4-ЗОН- А1(ОН).
0 В этом случае электролит состоит из водного раствора гидрата окиси щелочного или щелочноземельного металла без других комплексообразующих ионов.
Из таких гидроксо-комплексов после отщеп5 ления воды образуются оксо-комплексы, которые могут служить компонентами электролита:
2А1 (ОН)бЗ- Al2O4 2--f 4ОН-+4Н2О.
0 Из этой группы особое значение имеют комплексные анионы олова, мышьяка и сурьмы, например станниты и станнаты, так как эти вещества могут иметь различную валентность. Центральный атом имеет в данном случае две
валентности. При анодном окислении, например, мышьяка в присутствии гидроксильных ионов сначала образуется ион арсенита As™-Оз з-, а затем, на второй ступени реакции, ион арсената з-. Оба отрицательно заряженных иона легко растворимы в фазе электролита.
При зарядке аккумулятора на положительном электроде из мышьяка сначала образуется арсенит, и этот процесс идет до тех пор, пока электродный материал полностью не растворится. Затем потенциал изменяется скачком, причем у сердечниковой пластины положительного электрода, состоящей, например, из графита, магнетита или другого нерастворимого материала, в процессе дальнейшей зарядки растворяющийся в электролите арсенит окисляется до арсената.
При разряде аккумулятора в случае повышенного напряжения на на положительном электроде арсенат восстанавливается до арсенита. После этого напряжение на зажимах скачкообразно снижается, и в течение дальнейшего процесса разряда на положительном электроде выделяется металлический мышьяк.
Этот скачок потенциала путем измерения напряжения на зажимах может быть использован для контролирования заряженности аккумулятора с помощью указателей или регуляторов.
Следует учитывать, что кислород, присутствующий в комплексных соединениях олова, мышьяка и сурьмы, может быть заменен другими связанными атомами. Так, например, при замене кислорода серой образуются тиоарсениты и тио-арсенаты.
Другие тяжелые металлы, такие как хром, марганец, ванадий, молибден, могут образовывать, лишь находясь в состоянии высшей валентности, растворимые отрицательно заряженные комплексы с гидроксильными группами или оксо-группами. Так, например, хром может быть анодно окислен до нерастворимого гидрата окиси трехвалентного хрома Сг(ОН)з. При дальнейшем анодном окислеНИИ можно получить легко растворимые отрицательно заряженные ионы хромата СтО4, в которых хром находится в шестивалентном состоянии. Этот анион также может быть применен в описываемом аккумуляторе. Однако образование нерастворимого гидрата окиси трехвалентного хрома, выпадающего в виде губчатого осадка, приводит к некоторым затруднениям при использовании его в качестве электродной активной массы.
После нескольких циклов зарядки емкость аккумулятора снижается вследствие образования анодного шлама, не соприкасающегося с положительным электродом и вследствие этого не используемого в качестве электродной активной массы. Другие металлы также образуют нерастворимые гидраты окисей низших валентностей.
Чтобы устранить подобные явления в электролит, кроме гидроксильных ионов, вводят другие комплексообразователи, которые могут перевести гидраты окисей низших валентных состояний в растворимые соединения.
Точно так же могут быть использованы неорганические связанные атомы, объединяющиеся с многочисленными тяжелыми металлами и образующие растворимые отрицательно заряженные комплексные ионы.
генида. Так, например, железо в присутствии избытка ионов фторида образует трехзарядный отрицательно заряженный растворимый комплексный ион . Могут быть использованы и некоторые производные серной кислоты, например хлорсульфоновые кислоты и сульфаминовые кислоты, образующие с различными тяжелыми металлами растворимые отрицательно заряженные комплексные ионы, а также неорганические связанные атомы с органическими группами, с незаряженными связанными атомами, например с водой или аммиаком, служащие для обогащения электролита отрицательно заряженными комплексными ионами.
Электролит должен иметь такой состав, чтобы после зарядки аккумулятора все комплексообразующие анионы были связаны, а поверхность положительного электрода покрылась слоем нерастворимых продуктов реакции, препятствующих дальнейшему прохождению зарядного тока. Тогда за процессом зарядки аккумулятора не нужно наблюдать, и подача зарядного тока автоматически прекращается.
Отрицательный электрод предложенного аккумулятора может состоять в заряженном состоянии из амальгамы щелочного или щелочноземельного металла, а в незаряженном состоянии - из ртути, положительный электрод - из ртути и амальгамы тяжелого металла, а электролит - из гидрата окиси щелочного или щелочноземельного металла и ионов йодида.
При зарядке такого аккумулятора на отрицательном электроде образуется амальгама щелочного или щелочноземельного металла, а на положительном электроде - первичный йодид ртути Hgig (а также йодиды амальгамированных компонентов), который немедленно растворяется под действием избытка ионов йодида:
Hgl2+2KI 2K++ Hgl4 2После того как в электролите перед положительным электродом перестают присутствовать свободные ионы йодида, электрод покрывается слоем нерастворимого йодида ртути (а также нерастворимыми йодидами амальгимированных в нем компонентов), который плотно пристает к нему, предотвращая дальнейшее прохождение зарядного тока. После этого процесс зарядки аккумулятора практически заканчивается.
Чтобы прекратить подачу зарядного напряжения на зажимы аккумулятора, через который больше не проходит ток, можно включать в цепь зарядного тока автоматическое реле, которое при снижении силы тока автоматически выключается.
При разряде аккумулятора поверхностный слой положительного электрода растворяется, и находящиеся в электролите растворенные
11
комплексные ионы достигают положительного электрода и реагируют с ним:
Hgl4 2- Hgo+4IПри этом снова образуются металлическая ртуть и свободные ионы йодида.
В тех случаях когда требуется большая емкость, необходимо, чтобы количество электролита и концентрация ионов йодида в нем были возможно большими. При небольших количествах электролита можно использовать насыщенный раствор йодида, содержаш.ий твердый осадок, например, йодистого калия.
В качестве растворителя для компонентов электролита могут вместо воды применяться спирты, кетоны, пиридин, диметилсульфоксид. Однако внутреннее сопротивление такого аккумулятора, содержащего неводный растворитель, значительно больше, чем внутреннее сопротивление аккумулятора с водным электролитом.
Так же точно, как йодид, реагируют ионы хлорида и бромида, взаимодействующие с ртутью положительного электрода, однако комплексные ионы наиболее эффективно образуются йодидами. Если вместо йодистого калия в электролит добавить хлористый калий или бромистый калий, зарядка аккумулятора при прочих равных условиях прекратится значительно раньше в связи с образованием запорного слоя, состоящего из HgCb или из HgBr2. Емкость такого аккумулятора будет меньше, чем у аккумулятора с йодидом.
Комплексные ионы, образующиеся при зарядке аккумулятора, распределяются в фазе электролита равномерно благодаря процессам конвекции и диффузии.
Потеря электроэнергии при повышении антропии может быть выравнена, если электролит разделить при помощи полупроницаемой мембраны на две реакционные емкости.
Мембрану выбирают таким образом, чтобы мелкие ионы, такие как катионы щелочных и щелочноземельных металлов, а также простые анионы комплексообразователя и гидроксильные ионы свободно могли проходить сквозь ее поры, которые задерживают более крупные комплексные ионы. Такие мембраны и фильтры могут быть выполнены из пластмасс, целлюлозы, спеченных металлических фольг и других материалов.
Растворимые отрицательно заряженные комплексные ионы, образующиеся при зарядке аккумулятора, не могут удаляться из ограниченной мембраной емкости электролита, расположенной у положительного электрода, в то время как все другие ионы могут свободно
12
диффундировать сквозь мембрану в обоих направлениях.
Благодаря этому реакционная емкость у отрицательного электрода остается свободной от комплексных ионов, что препятствует диссоциации комплексных ионов и предотвращает связанную с этим потерю заряда у центрального атома на отрицательном электроде. В результате саморазряд аккумулятора значительно снижается.
Если наложить полупроницаемую мембрану непосредственно на металл отрицательного электрода, то реакционная емкость, окружающая отрицательный электрод, станет очень небольшой, в то время как реакционная емкость у положительного электрода будет заполнена почти всем имеющимся количеством электролита. Этим достигают того, что почти все растворенные в электролите комплексообразующие ионы будут реагировать при зарядке аккумулятора с металлом, переходящим в раствор на положительном электроде, в то время как поступление комплексных ионов к отрицательному электроду будет в основном предотвращено. При уменьшении саморазряда аккумулятор приобретает в этом случае большую емкость, чем аккумулятор, у которого мембрана делит электролит на две реакционные емкости равной величины.
На фиг. 7 показан аккумулятор, в котором жидкий отрицательный электрод 3 расположен горизонтально над положительным электродом 4 и отделен от него электролитом. Жидкий металл электрода 3 удерживается фильтром или полупроницаемой мембраной 11, которая может быть натянута между стенками корпуса.
На фиг. 8 изображен аккумулятор, в электролите которого расположена разделяющая мембрана //, являющаяся проницаемой для небольщих катионов и анионов и непроницаемой для более крупных комплексных ионов.
Аккумулятор может быть герметизирован с помощью уплотнительного кольца или путем привинчивания крышки или заваривания верхнего отверстия корпуса.
Предмет изобретения
Щелочной аккумулятор с отрицательным амальгамным электродом и положительным электродом, например, из окиси ртути, отличающийся тем, что, с целью улучшения электрических характеристик, в электролит введен ион-комплексообразователь, дающий растворимые соединения с продуктами заряда положительного электрода, например цианид.





| название | год | авторы | номер документа |
|---|---|---|---|
| ЭЛЕКТРИЧЕСКИЙ АККУМУЛЯТОР | 1993 |
|
RU2061284C1 |
| КИСЛОТНЫЙ АККУМУЛЯТОР | 2000 |
|
RU2185692C2 |
| ЩЕЛОЧНОЙ АККУМУЛЯТОР | 2000 |
|
RU2173919C1 |
| ЭЛЕКТРИЧЕСКИЙ АККУМУЛЯТОР | 1971 |
|
SU296340A1 |
| АККУМУЛЯТОР НА ОСНОВЕ ИОНОВ ЩЕЛОЧНОГО МЕТАЛЛА С БИМЕТАЛЛИЧЕСКИМ ЭЛЕКТРОДОМ | 2011 |
|
RU2602825C9 |
| СПОСОБ ПОВЫШЕНИЯ ЭЛЕКТРИЧЕСКИХ И ЭКСПЛУАТАЦИОННЫХ ХАРАКТЕРИСТИК СВИНЦОВЫХ АККУМУЛЯТОРОВ | 1996 |
|
RU2142179C1 |
| ПЕРЕЗАРЯЖАЕМЫЙ ЭЛЕМЕНТ АККУМУЛЯТОРНОЙ БАТАРЕИ | 2007 |
|
RU2438212C2 |
| Щелочной аккумулятор | 1934 |
|
SU128515A1 |
| Медно-свинцовый электрический аккумулятор | 1934 |
|
SU44970A1 |
| ЭЛЕКТРИЧЕСКИЙ АККУМУЛЯТОР | 1928 |
|
SU13548A1 |

-3 Т
Риг. 6
Авторы
Даты
1971-01-01—Публикация