(5) УСТРОЙСТВО ФОТОЭЛЕКТРОХИМИЧЕСКОЕ ДЛЯ ОЦЕНКИ |ОКСИЧНОСТИ ЖИДКОСТИ




| название | год | авторы | номер документа |
|---|---|---|---|
| Фотоактивное электрохимическое устройство для оценки токсичности жидкости | 1981 |
|
SU1029077A1 |
| Устройство фотоактивное электрохи-МичЕСКОЕ для ОцЕНКи ТОКСичНОСТи жид-КОСТЕй | 1979 |
|
SU840738A1 |
| Датчик для оценки токсичности жидкости | 1979 |
|
SU855497A1 |
| Фотоактивный электрохимический датчик для оценки токсичности жидкостей | 1986 |
|
SU1427301A1 |
| Способ определения токсичности жидкостей и устройство для его осуществления | 1981 |
|
SU1010557A1 |
| Фотоактивный электрохимический датчик для оценки токсичности жидкости | 1983 |
|
SU1165988A1 |
| Устройство для оценки токсичности жидкостей под давлением | 1981 |
|
SU945793A1 |
| Способ оценки токсичности жидкости | 1987 |
|
SU1515105A1 |
| Способ определения токсичности жидкостей | 1986 |
|
SU1399673A1 |
| Способ определения токсичности воды | 1989 |
|
SU1709212A1 |



1
Изобретение относится к устройствам для анализа воды методом био-. логической индикации, точнее к фотоэлектрохимическим устройствам, и может быть использовано для контроля токсичности сточных и других видов вод.
Известно устройство для исследования интенсивности фотосинтеза и дыхания водорослей, содержащее электрохи- ,Q мический датчик растворенного кислорода, герметично соединенный с камерой, имеющей светопроницаемое-окно и отверстие для ввода суспензии водорослей и добавок, магнитную мешалку, ,5 термостатирующую рубашку, термометр, источник света СП
Недостатками этого устройства являются большая динамическая ошибка, низкая надежность и невозможность 20 автоматизации измерений, а также необходимость значительного времени для анализа, чтосвязано с большим объемом камеры, возможным загрязнением
светопроницаемого окна, содержанием в исследуемой жидкости микроорганизiMQB, влиянием механических примесей в исследуемой жидкости, которая чаш,е всего бывает водой, на процесс огизетрации растворенного кислорода в камере с жидкостью.
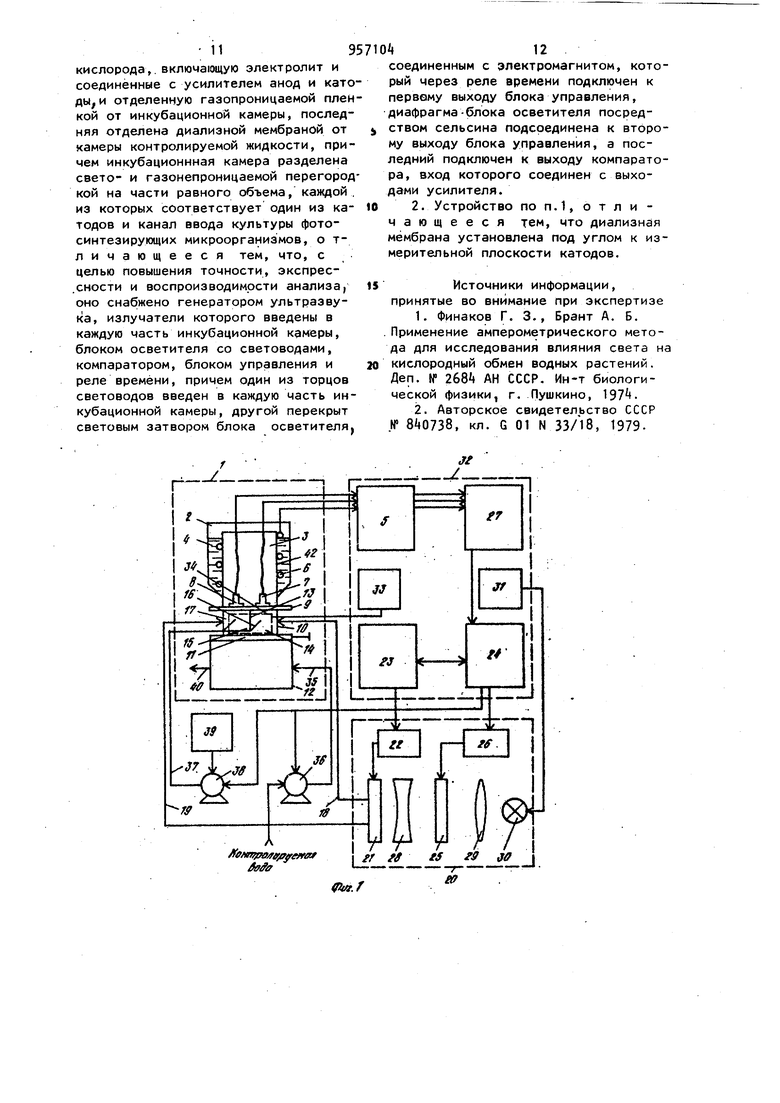
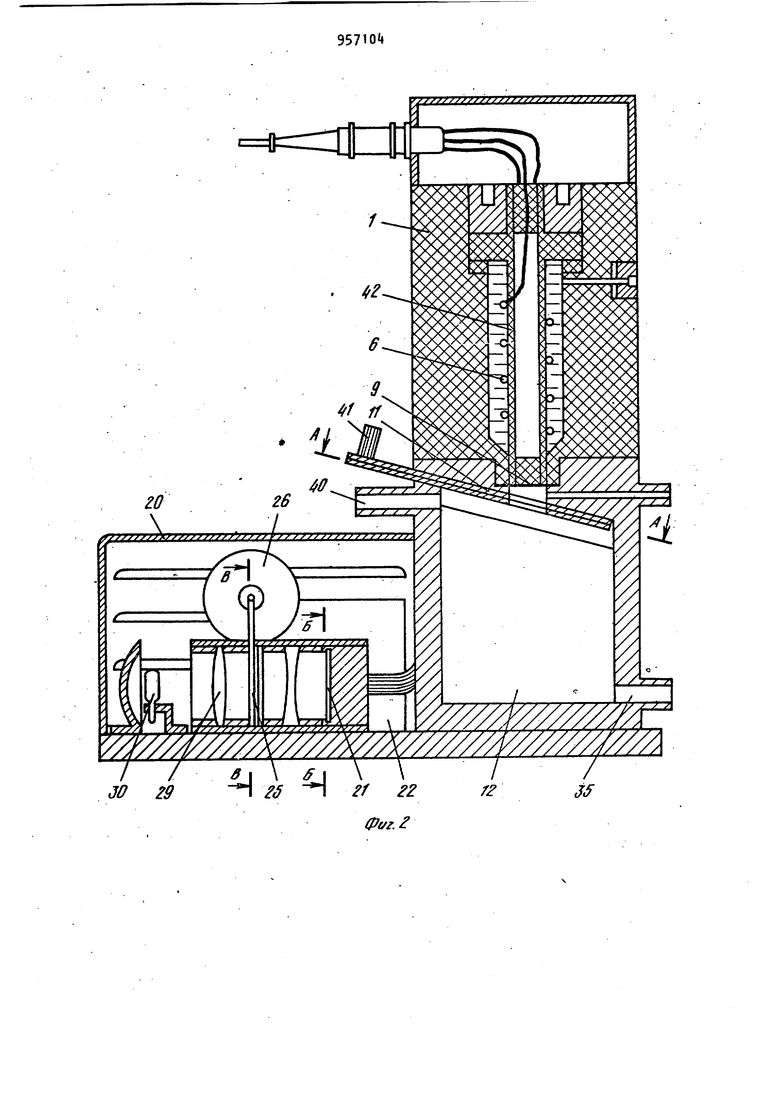
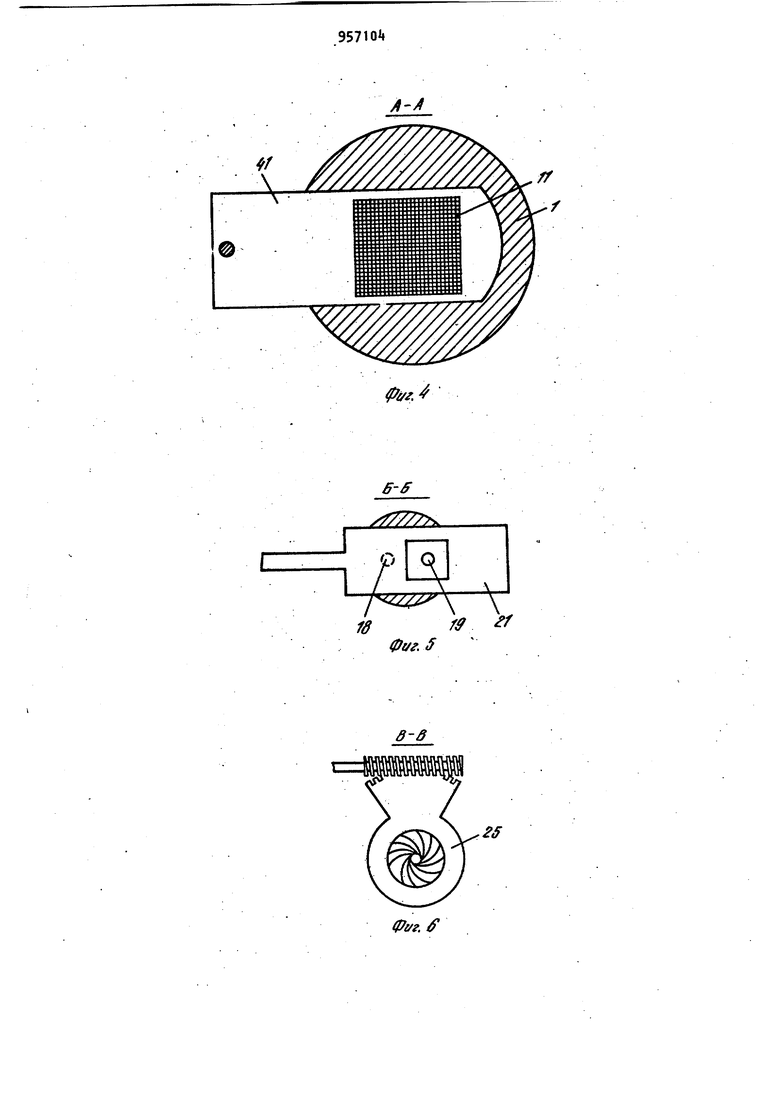
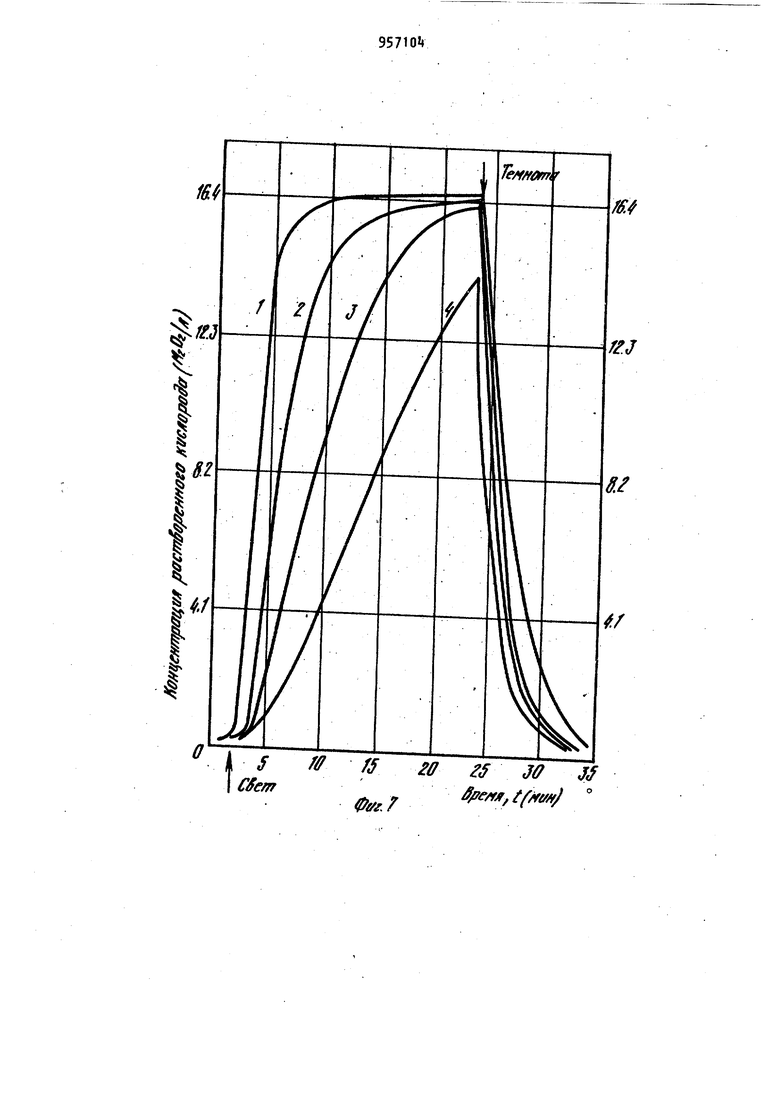
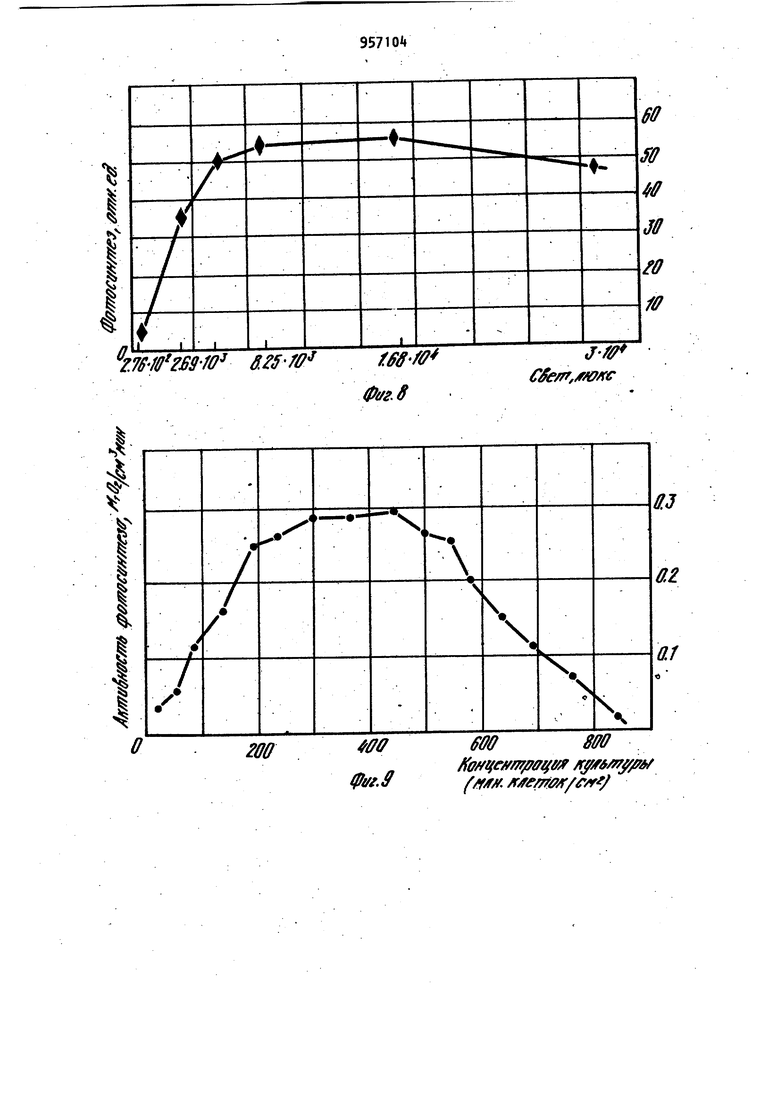
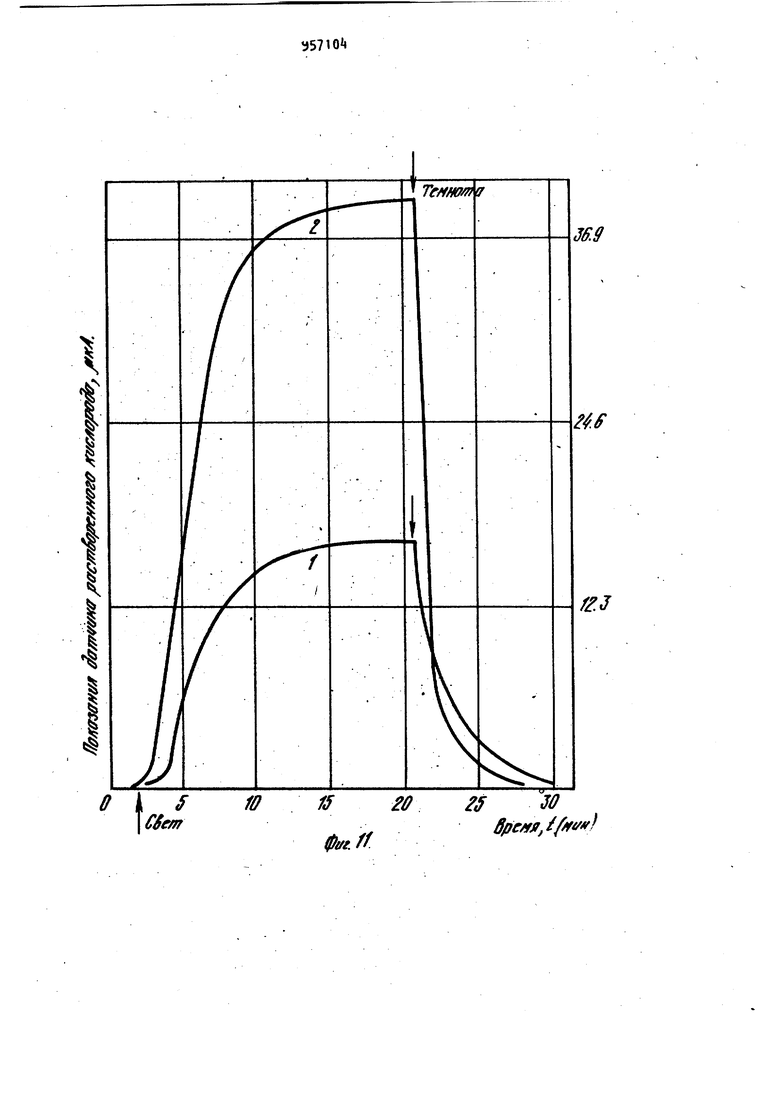
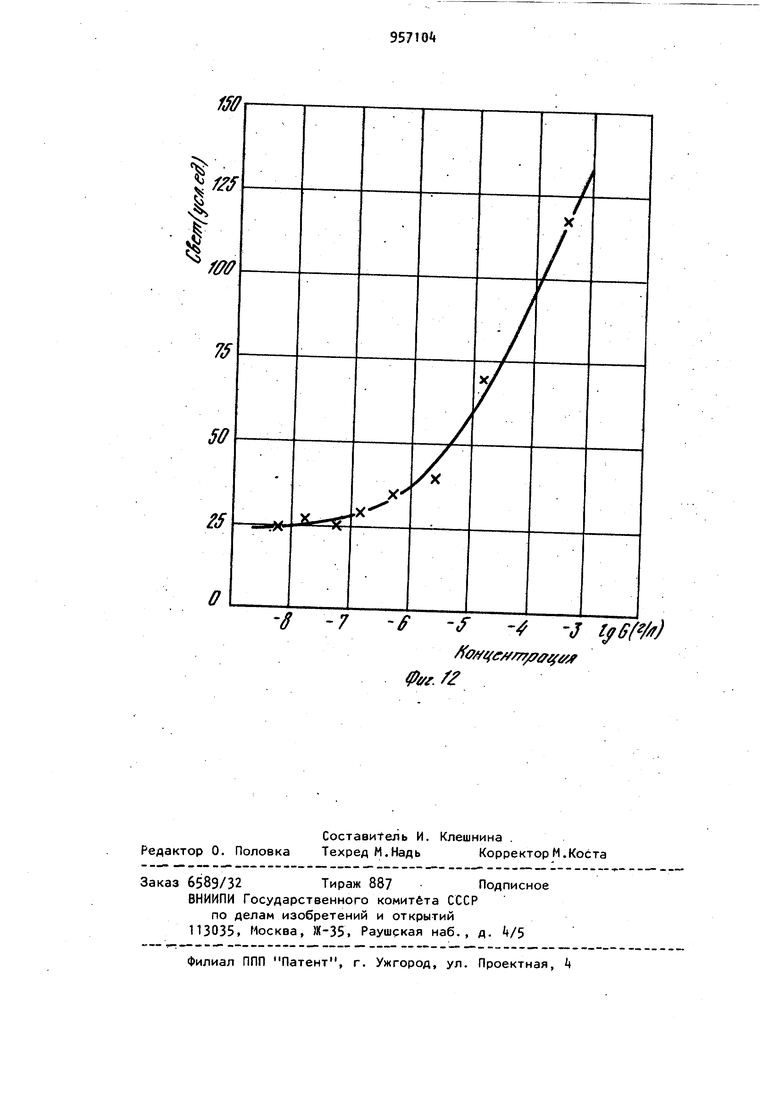
Наиболее близким по технической сущности является фотоэлектрохимическое устройство для оценки токсичности жидкости, корпус которого имеет полость с электрохимическим датчиком растворенного кислорода, включающий электролит и соединенные с усилителем анод и катоды, при этом полость.газопроницаемой пленкой отделена от инкубационной камеры, последняя диализной мембраной отделена от камеры контролируемой жидкости, причем инкубационная камера разделена свето- и газонепроницаемой перегородкой на части равного объема, каждой из которых соответствует один из катодов и каждая часть этой каме ры снабжена каналом ввода культуры фотосинтезирующих микроорганизмов. Одна из частей инкубационной камеры изнутри со стороны диализной мембраны дополнительно ограничена прозрачной газопроницаемой пленкой, непроницаемой для жидкой фазы, Это позволяет проводить оценку токсичности автоматически путем давления активностей фотосинтеза контроль - эталон. Устройство обладает высокой т.оч ностью, просто в изготовлении и не требует высококвалифицированного riep сонала для обслуживания 2. Недостатками известного устройства являются контроль только прозрачных сточных вод, относительная длительность анализа, обусловленная медленным транспортом токсичных веществ через диализную мембрану, низкая воспроизводимость результатов, связанная с загрязнением оптического окна. Измерительная схема устройства не позволяет также проводить оценку токсичности жидкостей при оптймальделения соотношении интенсивности фо тосинтеза, и дыхания микроорганиз Цов,. Целью изобретения является повышение точности экспрессности и воспроизводимости анализа. .; Цель достигается тем. Что фотоэлектрохимическое устройство,для оцен ки токсичности жидкости,корпус котор го имеет полость с электрохимическим датчиком растворенного кислорода, включающую электролит и соединён ные с усилителем анод и катоды и отделенную газопроницаемой пленкой оТ инкубационной камеры, последняя отделена диализной мембраной от камеры контролируемой жидкости , причем ин--; кубационная камера разделена светри газонепроницаемой перегородкой на части равного объема, каждой из которых соответствует один из катодов и канал ввода культуры фотосинтезирующих микроорганизмов, снабжено генератором ультразвука, излучатели ко торого введены в каждую часть инку бацибнной камеры, блоком осветителя. со светодиодами, компаратором, блоко управления и реле времени, причем: ;, один из торцов световодов.введен в ка« дую часть инкубационной камеры, другой перекрыт световым затвором бло,ка осветителя ,.единенным с электромагнитом, который через реле времени подключен к первому выходу блока управления/ диафрагма блока осветителя посредством сельсина подсоединена к второму выходу блока управления, а последний подключен к выходу компаратора , вход которого соединен с выходами усилителя. При этом диализная мембрана установлена под углом ( градусов К измерительной плоскости катодов с возможностью ее съема. Введение иалучателей ультразвука обеспечивает перемешивание культуры водорослей в каждой из частей инкубационной камеры, что повышает точность и воспроизводимость результатов измерений, непрерывную очистку газопроницаемой мембраны от возможного загрязнения, например обрастания бактериальной пленкой и культурой микроорганизмов. Последнее ускоряет .прохождение химических веществ через диализную мембрану. Кроме того, ультразвук действует на культуру микроорганизмов. Действие ультразвука на клетки проявляется в том, что мембрана клетки, так называемая цитоплазматическая мембрана , набухает и становится рыхлой, при этом она Становится более проницаемой для химических веществ, а это влечет за собой увеличение чувствительности водорослей к химическому воздействию. : , :; Введение блока осветителя с оптическим затвором, рассеивающей линзой., диафрагмой, фокусирующей линзой , источником света, сельсином и э.лектромагнитом позволяет сформировать рассеянный свет переменной интенсивности, передаваемый по свето водам непосредственно в йнкубацирнную камеру. Этим исключается сопри Косновение анализируемой среды:;с оптическими окнами устройства. выходного сигнала электрохимического датчика через ..посредство компаратора, блока управления и реле времени с блоком осветителя позволяет измерять интенсивность фотосинтеза и дыхания микроорганизмов в оптк«а 1ьном,с точки зрения точности измерения, режиме. При этом в качестве -информативного параметра используется величина освещения инкубационной камеры. То, что диализная мембрана установлена под углом к измерительной плоскости катодов с возможностью съе ма, обеспечивает предотвращение накапливания пузырьков воздуха на диализной мембране со стороны камеры контролируемой жидкости и засорения взвешенными частичками. Воздух и пена с частичками скапливаются в верхней части контролируемой камеры и уходят из нее через канал вывода жидкости. На фиг. 1 представлена структур-. ная схема устройства для оценки токсичности жидкости; на фиг.. 2 - общий вид корпуса с блоком осветителя (бло .электроники и насосы с культиватором не показаны ) в разрезе по каналам ввода и вывода контролируемой жидкости; на фиг. 3 - общий вид корпуса в разрезе по оси световодов, введенных в инкубационную камеру; на фиг. k - разрез Рг Л на фиг.2; на фиг. 5 - разрез Б-Б на фиг.2; на фиг. 6 - разрез B-S на фиг.2; на фиг. 7 переходные процессы для. водорослей хлорелла лри включении и выключении света при разных интенсивностях облучающего света; на фиг. световая зависимость активности фото синтеза хлореллы; на фиг. 7 зависимость активности фотосинтеза от концентрации клеток водорослей хлорелла; на фиг. 10 - температурная за висимость фотосинтеза и дыхания; на фиг. 11 - переходные процессы (с ультразвуком и без ультразвука для водорослей хлорелла; на фиг. 12зависимость интенсивности света (слу чай, когда фотосинтез равен удвоенному дыханию) от концентрации меди. Устройство фотоэлектрохимическое для оценки токсичности жидкости состоит из корпуса 1, который имеет по лость 2 с электрохимическим датчиком 3 растворенного кислорода, включающим электролит Ц и соединенные с уси лителем 5 анод 6 и катоды 7 и 8. По лость 2, газопроницаемой пленкой 9 отделена йт инкубационной камеры 10, последняя диализной мембраной 11 отделена от камеры контролируемой жидкости 12. При этом инкубационная кам ра 10 перегородкой 13, выполненной свето- и газонепроницаемой, разделена на части 1. и 15, имеющие одинако вый объем, каждой из которых соответ ствует соответственно катод 7 и 8,и каждая часть 14 и 15 снабжена канала ми 16 и 17 ввода культуры фотосинтезирующих микроорганизмов. В каждую часть Ни 15 инкубационной камеры 10 введены соответственно торцы световодов 18 и 19, которые соединяют инкубационную камеру 10 и блок 20 осветителя. Торцы световодов 18 и 19 в блоке 20 осветителя перекрыты световым затвором 21, соединенным с электромагнитом 22, который через реле 23 времени подключен к первому выходу блока 2 управления. Диафрагма 25 посредством сельсина 26 подсоединена к второму выходу блока 2 управления. Вход блока 2 управления подключен к выходу компаратора 27, вход которого соединен с выходом усилителя 5. Блок 20 осветителя включает рассеивающую линзу 28, расположенную между, оптическим затвором 21 и диафрагмой 25,и фокусирующую линзу 29, расположенную между диафрагмой 25 и источником 30 света, который находится в фокусе фокусирующей линзы 29 (фиг.1 и 2). Питание 31 источника 30 света находится в блоке 32 электроники, в котором помимо усилителя 5, реле 23 времени, блока 24 управления и компаратора 27 находится генератор ; 33 ультразвука, соединенный с излучателем З ультразвука. Излучатель 3 ультразвука направленного действия установлен в инкубационной камере 10 так, что он охватывает все ее.части 14 и 15, при этом ось диаграммы направленности параллельна осям каналов 1б и 17 ввода культуры,и комплементарна торцам световодов 18 и 19, введенных в части 14 и 15 инкубационной камер ьЮ через боковые ее поверхности (фиг.З)- Канал 35 ввода жидкости снабжен насосом Зб прокачки контролируемой жидкости. Трубка 37, подводящая культуру фотосинтезирующих микроорганизмов к инкубационной камере 10, снабжена насосом 38 подачи культуры от культиватора 39. Трубка 37 соединена с каналами 16 и 17 ввода культуры, а насосы соединены с третьим выходом блока 24 управления. Канал 35 ввода жидкости (фиг.2) подсоединен к камере 12 контролируемой жидкости в придонной части, а канал 40 ввода жидкости подсоединен к камере 12 контролируемой жидкости в верхней части . В качестве диализной мембраны 11 используют сетку с ячейками 1 - 5 мкм, 795 которая установлена(фиг.2 под углом 75-85° к плоскости катодов 7 и 8 с возможностью сгема. Диализная мембрана 11 установлена в рамке k}, Анод 6 выполнен единым (фигЛ и 2) в виде намотки из серебряной проволоки на стержне 2, в торце которого вмонтированы катоды 7 и 8.из платиновой проволоки диаметром 0,08-0,2 мм Нижняя часть стержня 2 притерта к внутренней поверхности полости 2 корпуса 1. Объем инкубационной камеры 10 вубирают в пределах 15-50 мм. На фиг, Ц показано возможное решение связи диафрагмы 25 с валом сельси на 26. На фиг. 5 показано возможное решение перекрытия торцов световодов 18 и 19 в блоке 20 осветителя оптическим затвором 21. На фиг. 6 показано возможное решение укрепления диализной мембраны 11 в рамке 1. Оценка токсичности жидкости предла гаемым устройством осуществляется следующим образом. При включении блока 32 электроники включается насос 38 подачи культуры, в качестве которой использовались одноклеточные водоросли хлорелла. Культура подается из культиватора 39 по трубке 37 через каналы 16 и 17 ввода культуры в части И и 15 инкубационной камеры 10. Так как объем инкубационной камеры 10 порядка 30, мм, то через 10 с произойдет достаточное уплотнение культуры водорослей в частях 1 и 15 инкубационной камеры 10. Плотность культуры,, необходимая для работы устройства, составляет 180500 млн. клеток на Г см (фиг.9). При этом питательная среда проходит через диализную мембрану 11, так как рамка kl полностью перекрывает нижнюю часть инкубационной камеры 10 (.фиг.6 ).После этого включается насос 36 прокачки жидкости, который работает 20 с и генератор 33 ультразвука, при этом установлена частота 30 Гц. За это время возможные пузырьки воздуха контрол+1руемой жидкости полностью отделяются от диализной мембраны 11 со стороны камеры 12 контролируемой жидкости. Химические вещества, содерм ащиеся в жидкости, проникают через диализную мембрану 11 внутрь инкубационной камеры 10 и врздействуют i на клетки водорослей в течение Ю20 мин. Ультразвук обеспечивает хорошее перемешивание культуры в инкубационной камере 10, активный транспорт токсиканта через диализную мембрану 1 1 , а также повышает чувствительность клеток водорослей к химическому воздействию на них. Так как интенсивн ость ультразвука не более 10 мк Вт на 1 см,.то клетки не повреждаются от ультразвукового воздействия. Через 15. мин включается источник 30 света в блоке 20 осветителя и свет передается световодом, например световодом 18|B часть- Н инкубационной камеры 10, в которой запускается фотосинтез водорослей, при этом происходит повышение растворенного кислорода. Через 12 мин в этой части Т концентрация растворенного кислорода достигает некоторого стационарного уровня, равного в случае максимального освещения без ультразвука 16,5 мгО/л, а с ультразвуком стационарный уровень равен tO (фиг.ПК На фиг. 7 представлены характерные переходные процессы для водорослеи хлорелла при включении и выключении света, при этом измерялась величина растворенного кислорода (1 облучающий свет, равный 5200 люкс, 2-3200 люкс, 3-2700 люкс, 4-«00 люксбез ультразвука). Поэтому в части 15 инкубационнойкамеры 10 величина растворенного кислорода равна нулю, так как в ней происходит процесс дыхания водорослей, т.е. водоросли потребляют и исчерпывают весь растворенный кислород (камера затемнена ). После этого оптический затвор 21 с помощью электромагнита 22, который управляется через реле 23 времени блоком 2 управления, переключает свет на другой световод 19. Такое переключение обеспечивает (ачало фотосинтеза в части 15 и процесса дыхания в части 1А инкубационной камеры 10. При этом с помощью-электрохимического датчика 3 растворенного кислорода в компараторе 27 формируются сигналы, пропорциональные скоростям процессов фотосинтеза и дыхания, а на его выходе - сигнал рассогласования этих скоростей (положительный - в случае, если фотосинтез больше удвоенного дыхания, от(эицательный - наоборот). Зтот сигнал рассогласования поступает на вход блок 2 управления, который уп равляет сельсином 26. Сельсин 26, вал которого будет вращаться в ту или иную сторону в зависимости от знака сигнала рассогласования, будет закрывать или открывать оптическое окно диафрагмы 25 до тех пор, пока не будет выполнено условие: фотосинтез равен удвоенному дыханию водорослей. Значение оптического окна диафрагмы 25 при этом фиксируется и носит информативный характер. Величина интенсивности света, падающего на торцы световодов, изменяется в пределах 200-8000 люкс. Это позволяет значительно менять активность фотосинтеза в широком диапазоне. На фиг. 8 показана световая зависимость активности фотосинтеза хлореллы. Переключение света с одного свето вода на другой осуществляется автоматически через 100 с, а получаемые значения величины освещенности усред няются. Это уменьшает возможную ошибку в измерениях за счет многократной оценки. Так как исследуемая жидкость может иметь различную температуру, то необходимо этот факт учитывать. Хотя электрохимический датчик 3 растворенного кислорода автоматически термоскомпенсирован за счет того, что он имеет один общий анод 6 для всех катодов (в конкретном случае есть два катода 7 и 8), тем не менее не обходимо термостабилизировать исследуемую жидкость. Это связано с тем, что температурный оптимум фотосинтеза и дыхания имеет вид фиг.10), на которой представлены температурные зависимости фотосинтеза - 1 и дыхания 2. Можно не стабилизировать температуру, но тогда необходимо вводит поправочный коэффициент, рассчитанный из этих графиков, что на практике довольно сложно ( температурные за висимости снимались без ультразвука) Введение в устройство излучателя 3 ультразвука существенно повышает чувствительность. На фиг.11 показаны переходные процессы для водорослей хлореллы при включении и выключении света с ультразвуком - 2 ,, без ультразвука - 1 (частота ультразвука равна 30 кГц). Если в контролируемой жидкости на ходится какое-либо химическое вещест ВО, то клетки будут реагировать на них, при этом у них будет изменяться фотосинтез или дыхание, в зависимости от конкретного действия химических веществ на клетку. Так на фиг. 12 показана зависимость интенсивности света (отн.ед.) при условии что фотосинтез равен удвоенному дыханию от концентрации меди ( ультразвук включен. Видно, что в основном медь поражает фотосинтетический аппарат клетки.Из графика можно сделать вывод, что чувствительность устройства высокая. Она удовлетворяет требованиям, предъявляемым службами контроля Госводинспекции. В данном случае в качестве контроля служила дехлорированная водопроводная вода. Для оценки относительной токсичности жидкости необходимо проводить анализ сначала на эталонной жидкости, например на питательной среде или дехлорированной водопроводной воде, а затем на исследуемой жидкости. Такой анализ займет,не более одного ча са, что вполне удовлетворяет требованиям экспрессности проведения контроля. После проведения анализа источник 30 света, ультразвуковой генератор 33 и блок 32 электроники выключаются. Насосм Зб прокачиваетсяпромывочная жидкость (спирт, дистиллированная вода). При этом рамка 1 с диализной мембраной 11 выдвигается так, что между 1 нкубационной камерой 10 и камерой 12 контролируемой жидкости нет границы р.аздела. После промывки все возвращается в исходное положение и устройство готово к следующему циклу работы.Предлагаемое устрой ство просто в изготовлении и не требует высококвалифицированного обслуживающего персонала. Оно может быть использовано в гидрохимических и гидробиологических лабораториях органов Госводинспекции, а также в лабораториях контроля состава сточных вод промышленных предприятий и автоматических-станциях контроля состава сточных вод. Формула изобретения 1. Устройство фотоэлектрохимическое для оценки токсичности жидкости, корпус которого имеет полость с электрохимическим датчиком растворенного
кислорода,, включающую электролит и соединенные с усилителем анод и катоды и отделенную газопроницаемой пленкой от инкубационной камеры, последняя отделена диализной мембраной от камеры контролируемой жидкости, причем инкубационнная камера разделена свето- и газонепроницаемой перегородкой на части равного объема, каждой . из которых соответствует один из катодов и канал ввода культуры фотосинтезирущих микроорганизмов, о тличающееся тем, что, с целью повышения точности, экспрес.сности и воспроизводимости анализа, оно снабжено генератором ультразвука, излучатели которого введены в каждую часть инкубационной камеры, блоком осветителя со световодами, компаратором, блоком управления и реле времени, причем один из торцов световодов введен в каждую часть инкубационной камеры, другой перекрыт
световым затвором блока осветителя
ipta.f
соединенным с электромагнитом, который через реле времени подключен к первому выходу блока управления, диафрагма-блока осветителя посредством сельсина подсоединена к второму выходу блока управления, а последний подключен к выходу компаратора, вход которого соединен с выходами усилителя.
Источники информации,
принятые во внимание при экспертизе
1,Финаков Г. 3., Брант А, Б.
Применение амперометрического метода для исследования влияния света на кислородный обмен водных растений. Деп. № 268k АН СССР. Ин-т биологической физики, г. Пушкино, .
I s JD 29 1 Л // гг
I
к
35
Фиг. г . . . L . , . ., , .i , , J I
m //7/////////////////A
ф&г,
fff. 4
18fff
Фиг.
.1 4
Ч
k
О
200
ff.d
az
0.1
т т
/fof/i effm ffif&f
ef77ff/r/ /ff
д -7 -ff -f - -j )
O/f/eff /77/7ff fjf
.//
Авторы
Даты
1982-09-07—Публикация
1980-06-20—Подача