Изобретение относится к способу стабилизации косметических препаратов с помощью хитозана.
Хитозан может использоваться для лечения ожогов при погружении обожженного участка в раствор ацетата хитозана на поверхности раны образуется пленка, проницаемая для кислорода, который облегчает вылечивание.
Известен хитозан в форме гидрохлорированного раствора, хорошей противоинфекционной активностью по отношению к бактериям, (патент Японии N 8 213 7930).
В патенте Японии N 8 708 3877 упоминается использование хитозана, предпочтительно, разложенного хитоназой, в качестве консерванта различных продуктов.
В области косметики хитозан особенно известен для введения в шампуни и в капиллярные продукты для обеспечения укладки и укрепления волос (патент ФРГ N 2 627 419).
Хитозан позволяет также улучшить моющие и массирующие свойства соединения, наносимого на кожу (патент Японии N 6210014). В основном, стерильно упакованные косметические препараты довольно хорошо сохраняются. Однако они подвергаются опасности заражения за время их применения. При открытии емкости, содержащей препарат, содержащиеся в окружающем воздухе микроорганизмы могут его заразить. Затем в ходе использования препарата его также могут заразить микроорганизмы, находящиеся на поверхности кожи. Это заражение может привести к разрушению препарата.
Целью изобретения является устранение недостатков по предшествующему уровню техники и разработка способа консервации препаратов с помощью хитозана, взятого в качестве консерванта.
Для этой цели хитозан выбирают среди полимеров, имеющих мол.вес 3000 - 700000.
Преимуществом этого изобретения является использование в качестве консерванта натурального продукта, дешевого и имеющего в изобилии.
Другим преимуществом является введение только небольшого количества хитозана в косметический препарат. Другое преимущество заключается в применении продукта, по отношению к которому микроорганизмы не имеют привычки.
Другим преимуществом является консервация косметического препарата в течение длительного времени в стерильной среде (стерильная и герметичная упаковка), а также в нестерильной среде (негерметичная упаковка или упаковка после открытия).
Хитозан получают путем деацетилирования хитина щелочью (гидроокись натрия или калия). Хитин является одним из наиболее широко распространенных на земле биополимеров. Это важный компонент экзоскелета артроподов, такого как кожица насекомых или, например, панцирь ракообразных. Хитин является также составным компонентом клетчатки некоторых плесеней и дрожжей.
Предполагают, что биологическая активность хитозана является следствием его поликатионной природы. Аминные группы хитозана, когда они протонированы, вступают во взаимодействие с электроотрицательными элементами, находящимися на поверхности клеток микроорганизмов.
Это взаимодействие приводит к изменению проницаемости клеточной мембраны, которое вызывает утечку наружу некоторых внутриклеточных компонентов или некоторых ионов. Эта потеря внутриклеточных веществ сопровождается торможением роста микроорганизма. Другие механизмы-генераторы энергии, такие как дыхание или ферментация, также могут нарушаться и/или блокироваться путем добавления хитозана.
Хитозан, используемый согласно настоящему изобретению, может быть продуктом различного происхождения. В частности, он может быть продуктом деацетилирования хитина, поступающего, например, от крабов, креветок или омаров.
Физико-химические свойства и микроструктура хитозана могут зависеть от выбранного источника сырья, а также от различных обработок, таких, как очистка или, например, деацетилирование. Предпочтительный, согласно изобретению, хитозан поступает из хитина, извлеченного из креветок.
Степень деацетилирования хитозана может оказывать определенное влияние на его биологическую активность. Эта степень соответствует количеству высвобожденных аминных групп таким образом, что, чем выше степень, тем более эффективным может быть хитозан.
Степень деацетилирования хитозана, согласно настоящему изобретению, предпочтительно, составляет 70 - 95%.
Отмечено, что длина полимерных цепочек хитозана может влиять на его поведение и может приводить к изменениям его биологической активности, другими словами его способности торможения роста микроорганизмов.
Отмечено, в частности, что, когда хитозан представлен в виде полимера небольшого размера (например, мономер, пентамер, гептамер), его биологическая активность является очень слабой.
Предполагается, что это происходит от того, что цепочка полимера является слишком короткой, плотность локальных зарядов является небольшой и препятствует полимеру желательным образом взаимодействовать с отрицательными частицами на поверхности мембраны клетки. Следовательно, не будет происходить значительного изменения проницаемости этой мембраны.
Хитозаны небольшого размера, следовательно, небольшого молекулярного веса непригодны в качестве консерванта.
Под малым молекулярным весом, понимается вес менее 3000.
Отмечено, что хитозаны большого размера, следовательно, с большим молекулярным весом, также обладают слабой биологической активностью. Предполагается, что это пpоисходит из-за изменения конфигурации молекулы хитозана. Хитозан может иметь конфигурацию от простой спирали до более компактной структуры, почти шарообразной, причем эта вторая структура, вероятно, является благоприятной в случае больших молекулярных весов.
Электростатическое взаимодействие между хитозаном и поверхностью клеток микроорганизмов могло бы ограничиваться вследствие того, что большинство активных групп хитозана были бы замкнуты внутри структуры молекулы и недоступны.
Хитозаны большого размера, следовательно, большего молекулярного веса непригодны в качестве консерванта.
Под большим молекулярным весом понимается вес свыше 700000.
Хитозан, способный тормозить рост микроорганизмов имеет, следовательно, молекулярный вес, составляющий 3000 - 700000 и, предпочтительно, 12000 - 450000.
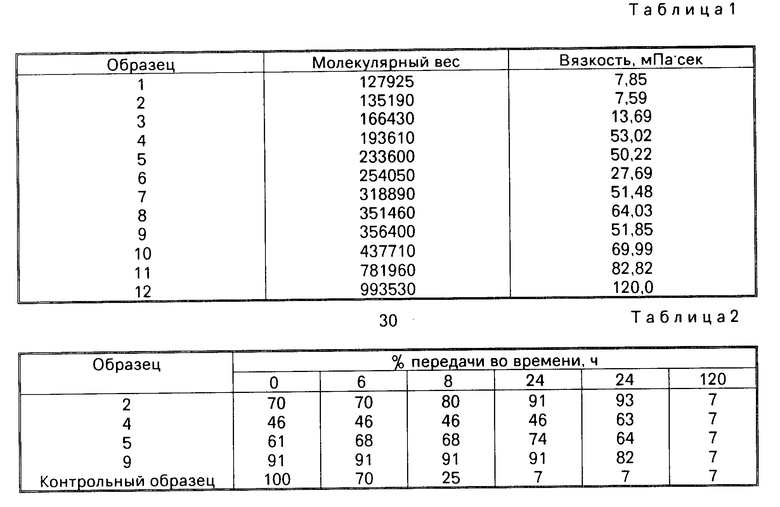
Так как вязкость раствора хитозана зависит от его молекулярного веса, эта величина может использоваться для характеристики раствора хитозана, который может использоваться в рамках настоящего изобретения.
Таким образом, в предпочтительном способе использования хитозана в качестве консерванта косметического препарата, включают хитозан в косметический препарат в виде водного раствора, имеющего вязкость 1 - 80 мПа ˙ с для концентрации 1% хитозана.
Молекулярный вес хитозана и вязкость растворов хитозана измеряются по методам, описанным в конце вводной части описания.
Содержание хитозана в косметическом препарате может влиять на биологическую активность хитозана.
Слишком высокое содержание может вызвать явления отталкивания между полимерами хитозана и препятствовать им в их приближении к клеточной мембране.
Слишком малое содержание может не обеспечить достаточную защиту препарата по отношению к микробному заражению.
Косметический препарат, согласно настоящему изобретению, может иметь содержание хитозана, составляющее 50 - 5000 μ г/г и, предпочтительно, 100 - 300 μ г/г.
Биологическая активность хитозана может также зависеть от его растворимости. Хитозан, включенный в косметический препарат в виде порошка в водной суспензии, может быть менее активным, чем в виде раствора. Растворимость хитозана может быть повышена путем обработки ультразвуком дисперсии хитозана и/или лиофилизации после центрифугирования. Обработка ультразвуком может быть отличным средством для разделения цепочек полимеров, чтобы сделать их более растворимыми. Это приводит к перегруппировке микроструктуры хитозана, которая позволяет повысить его растворимость и даже его биологическую активность. Эта активность может быть удвоена и даже увеличена в восемь раз при использовании хитозана, обработанного ультразвуком и/или лиофилизированного.
Кроме того, чтобы быть биологически активным, хитозан должен, предпочтительно, быть в поликатионной форме, т.е. при рН менее его рКа, который составляет 6,2.
Для обеспечения большой плотности положительных зарядов растворы хитозана имеют, предпочтительно, рН, составляющий 5,0 - 5,5.
Хитозан может включаться в любой косметический препарат такой, как молоко, лосьон, крем или гель. Однако предпочтительно чтобы косметический пpепарат имел небольшое содержание анионов.
Для тестирования биологической активности различных хитозанов используют определенное число микроорганизмов. Эти микроорганизмы выбираются среди микроорганизмов, опасных для здоровья пользователей, или среди микроорганизмов, которые могут привести к разложению косметического препарата. Среди многих микроорганизмов, отвечающих этим критериям, были выбраны:
- отрицательные бактерии (Escherichia coli и Pseudomonas aeruginosa);
- положительные бактерии (Staphylococcus aurens, Streptococcus faecalis и Bacillus cereus) и
- дрожжи (Candida albicans).
Методы измерения. Вязкость измеряется по растворам с 1% хитозана и 1% уксусной кислоты, оставленные на 2 недели для стабилизации вязкости.
Измерение осуществляется с помощью реометра типа VOR Bohlin при следующих условиях:
измерительная цилиндр С. 14
система
натяжной брус 0,24 г.см и 19,8 г.см
исходное время 60 с
выдержки
время измерения 20 с при постоян-
ной деформации
время интегриро- 10 с
вания
температура 20оС
время сдвига 11,64 с-1
Молекулярный вес
Молекулярный вес измеряется путем диффузии лазерного света по методу R, A, Muzzarelli, C.Longh и M.Emanuelli, описанному в статье The molecularweight of chitosans studiea в lazer ligt - sсattering, опубликованной в Carbohydrate Res. 164, 433-442 (1987).
Рост микроорганизмов. Число зародышей может определяться двумя методами: путем отсчета или посредством спектрофотометрии.
1) Отсчет. Отбирают 1 мл образца из анализируемой среды и разбавляют с 9 мл физиологического соляного раствора. Разбавляют этот раствор 10 к 10, затем помещают 1 мл этого разбавленного раствора на пластинку Петри и смешивают с 10 мл питательного агара. Оставляют пластинку на одну ночь при 37оС, затем подсчитывают число развившихся зародышей.
2) Спектрофотометрия. Недостатком предыдущего метода является его продолжительность во времени, более удобно измерять число зародышей в суспензии посредством спектрофотометрии. Суспензия зародышей передает проходящий через нее свет совсем по-другому, чем контрольная суспензия, не содержащая зародышей.
Путем спектрофотометрии измеряют свет, переданный каждым раствором, а восстановление передачи позволяет определять число зародышей в суспензии. Это измерение осуществляется с помощью спектрофотометра с длиной волны 550 нм.
Однако этот метод является не очень чувствительным и позволяет обнаруживать только число зародышей, превышающее или равное 106зародышей на 1 мл.
3). С. albacans. Что касается этих дрожжей, осуществляют микроскопический отсчет с помощью ячейки Нойебауера.
Тесты по биологической активности. Подготавливают различные образцы хитозана в форме культурных водных сред микроорганизмов, содержащих хитозан в растворе, следующим образом:
- для бактерий, подготавливают водную среду САУЕ, содержащую 1% гидролизированного казеина, 0,5% дрожжевого экстракта и 0,2% глюкозы;
- для дрожжей подготавливают водную среду YES, содержащую 0,5% дрожжевого экстракта и 2% сахарозы;
- подкисляют среду до рН 2 путем добавления хлористоводородной кислоты 1 N;
- растворяют разные хитозаны различного происхождения, которые все имеют степень дезацетилирования, составляющую 80 - 95%, в растворе с 1% хлористоводородной кислоты для получения концентрации хитозана в 1%;
- разделяют культурную среду на несколько партий, к которым добавляют, при перемешивании, хитозан;
- рН каждой партии доводят до 5,8 путем добавления едкого натра 1 N, а конечный объем доводят с помощью дистиллированной воды;
- различные партии стерилизуют в автоклаве при 121оС в течение 15 мин.
Контрольные образцы содержат только культурные среды, рН которых доводят до 5,8. Различные тестированные хитозаны указаны в табл.1 в порядке возрастания молекулярного веса и вязкости.
Подготовка культур микроорганизмов. Бактерии культивируют в течение 8 ч на питательной среде (экстракт на базе желатинированной телячьей кожи), затем 16 ч на среде САУЕ при рН 5,8. Дрожжи культивируют в течение 3 дней на среде YES при рН 5,8. Культуру затем разбавляют таким образом, что 1 мл культуры содержит, примерно, 107 зародышей.
Тест 1. Различные образцы хитозана, концентрация которого составляет 50 μ г хитозана на мл культурной среды, инокулируют суспензией зародышей Candida albicans для получения исходного числа примерно 105 зародышей на мл.
Образцы оставляют при 23оС при перемешивании со скоростью 110 об/мин.
Ежедневно измеряют число зародышей в каждом образце.
Отмечают торможение роста С. albicans, вызванное хитозаном, измеряют временной интервал, отделяющий день инокуляции С.albicans ото дня, когда число зародышей С.albicans снова начинает расти.
Получают следующие результаты: (Т = контрольный образец) 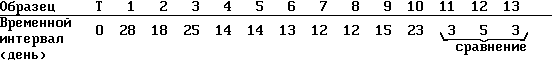
Отмечено, что добавление образцов хитозана позволяет задерживать возобновление роста числа зародышей на период по меньшей мере в 12 дней.
Тест 2. Различные образцы хитозана, концентрация которого составляет 100 μ г хитозана на мл культурной среды, инокулируют с суспензиями различных организмов из расчета один микроорганизм на образец для получения исходного числа примерно 105 на 1 мл.
Оставляют образцы при 37оС (43оС для Р.S.alruginosa) и записывают влияние хитозана на возобновление роста бактерий, измеряя, с одинаковыми интервалами, число зародышей посредством сектрофотометрии.
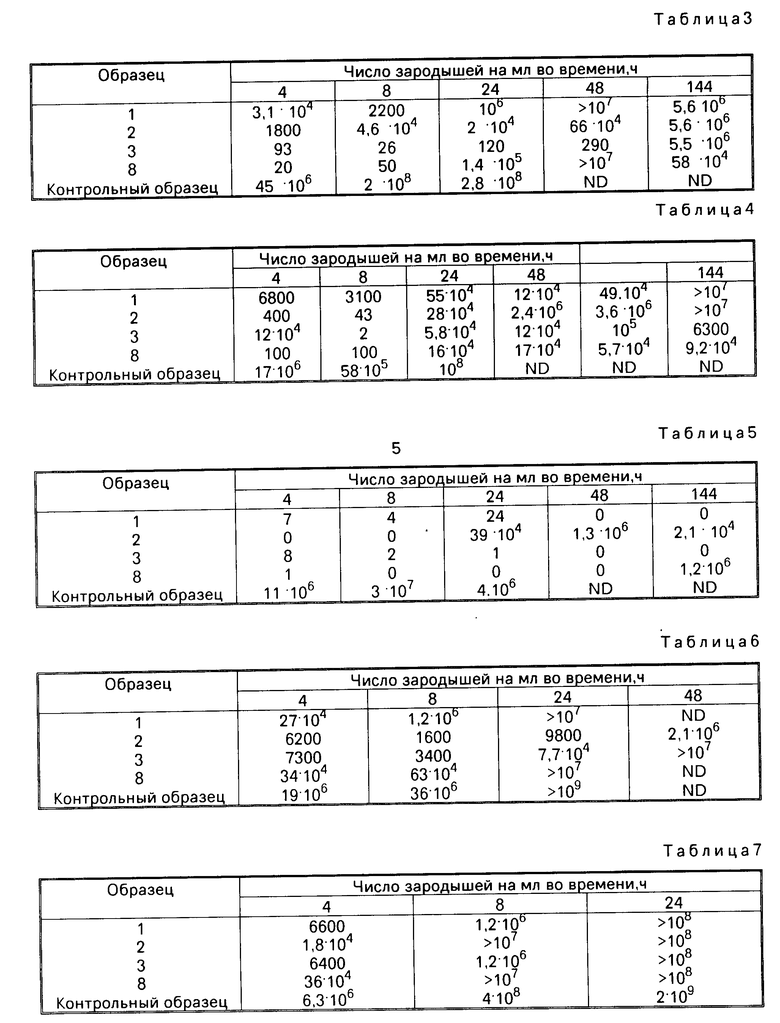
В качестве иллюстрации в табл.2 указано для четырех образцов хитозана изменение процента передачи во времени для бактерии Staph.aurens.
Процент передачи обратно пропорционален числу зародышей в растворе (0 обозначает, что свет трудно передается, учитывая очень большое число имеющихся зародышей).
Исходный процент передачи является равным в зависимости от тестированных образцов. Это происходит в результате появления небольшой мутности в растворе, вызванной взаимодействием хитозана с культурной средой. Однако эта мутность остается постоянной во времени и не влияет на общий чертеж кривых эволюции.
Для каждой тестированной бактерии образцы хитозана классифицируются в зависимости от продолжительности их способности к торможению.
- Staph.aureus по меньшей мере
8 ч 1 по меньшей мере 24 ч 3 - 6 - 7 - 8 - 10 по меньшей мере 48 ч 2 - 4 - 5 - 9
- Strep. faecalis по меньшей мере 6 ч 11 - 12 (сравнение) по меньшей мере 8 ч 3 - 7 - 10 по меньшей мере 48 ч 2 - 4 - 5 - 6 - 8 - 9
- B.cereus по меньшей мере 24 ч 6 - 7 - 8 по меньшей
мере 96 ч 1 - 2 - 3 - 4 - 5 - 9 - 10 E. coli по меньшей мере 6 ч 9 по меньшей мере 8 ч 2 - 4
- PS. aeruginosa по меньшей мере 10 ч 3 - 4 - 10 по меньшей мере 14 ч 2 - 5 - 9
Из этого теста можно сделать заключение, что тестированные образцы хитозана 1 - 10 значительно тормозят рост бактерий.
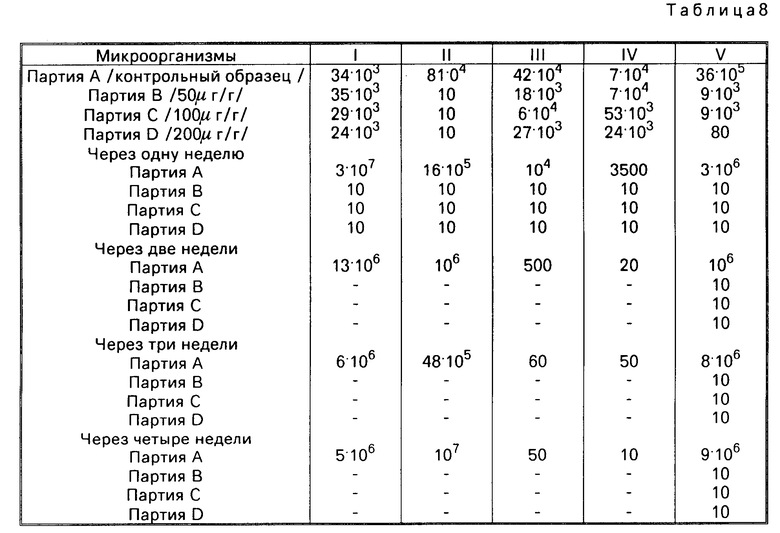
Тест 3. Действуют по способу, похожему на способ, описанный в тесте 2, но используют образцы хитозана, концентрация которого составляет 200 μ г хитозана на мл культурной среды, и что определяют число зародышей путем отсчета.
В табл. 3, 4, 5, 6, 7, показано изменение числа зародышей на мл во времени для различных образцов хитозана и для различных микроорганизмов.
ND = невозможно определить
- Streptococcus faecalis
Первоначально: 2,6 . 106 зародышей на мл
- Staphylococcus aureus
Первоначально: 8,1 . 106 зародышей на мл
- Bacillis cereus
Первоначально: 9,1 . 105 зародышей на мл
- Pseudomonas aeruginosa
Первоначально: 8.1 . 106 зародышей на мл.
- Е. сoli
Первоначально: 1,6 . 105 зародышей на мл
В течение четырех или даже восьми первых часов выдерживания число зародышей, имеющихся в образцах, содержащих хитозан, заметно уменьшается.
Затем это число имеет тенденцию возвращения своего исходного значения и даже его превышения. Эо доказывает, что образцы, содержащие хитозан, обладают бактериостатической активностью по отношению к тестированным микроорганизмам и это в периоды от 4 ч (E.coli) до 48 ч (St.faecalis и St.aureus).
Отмечается также, что образцы 1 и 3 обладают бактерицидной активностью по отношению к бактерии В.cereus.
Эти три теста доказывают, что образцы хитозана, имеющие молекулярный вес, составляющий 3000 - 700000, обладают бактериостатической и даже бактерицидной активностью по отношению к микроорганизмам.
Тест 4. Подготавливают из хитозана, имеющего приблизительно молекулярный вес 128 000, несколько образцов с разными концентрациями от 50 г до 5000 μ г хитозана на мл среды.
Эти образцы инокулируют с суспензией С.albicans для получения исходного числа примерно 105 зародышей на мл, затем каждый образец помещают в несколько стерильных стеклянных трубок, которые затем герметично закрывают.
Оставляют выдерживаться при 23оС в темноте в течение 6 мл. С равными интервалами времени открывают трубку для каждой концентрации и измеряют число имеющихся зародышей.
Для каждой концентрации получают продолжительность, в течение которой хитозан является активным и тормозит рост имеющихся зародышей.
Для образцов, содержащих 250 μ г и более хитозана на мл, рост зародышей тормозится в течение минимальной продолжительности в 6 мес. В этих трубках не обнаруживается никакого роста зародышей.
Для образца, содержащего 50 μ г хитозана на мл, рост зародышей тормозится в течение 5 недель, затем, снова возобновляется.
В качестве сравнения для образца, содержащего 20 μ г хитозана на мл, рост зародышей тормозится только в течение 1 дня.
Следовательно, хитозан может оставаться активным в течение очень длительных периодов, если концентрация является достаточной.
Тест 5 (сравнительный тест). Для возможности изучения активности хитозанов с небольшим молекулярным весом частично гидролизуют 5 г хитозана концентрированной хлористоводородной кислотой в течение 21 ч при 53оС. Полученный хитозан высушивают в вакууме при 30оС, а различные олигомеры разделяют с помощью ионообменной смолы (AУ 50W - X 8), причем использованным элюантом является хлористоводородная кислота с концентрацией, изменяющейся от 1 до 5,5 N. Различные фракции элюата разделяются путем фильтрования на геле (Фрактогель TSK HW-40), причем использованным элюантом является 0,2%-ный раствор муравьиной кислоты. Различные олигомеры идентифицируют хроматографией на тонком слое.
Тестируют антимикробную активность пентамера и гептамера глюкозамина по методу, описанному в тесте 4, с помощью дрожжей С.albicans, и это для различных концентраций хитозана.
Не наблюдают никакого торможения роста дрожжей при концентрации 1 мг хитозана на мл культурной среды (т.е. 1000 μ г/г).
П р и м е р 1. В 600 мл дистиллированной воды диспергируют 10 г хитозана, имеющего молекулярный вес около 180000, степень деацетилирования около 85% , и происходящего из креветок. Добавляют 30 мл уксусной кислоты и все растворяют путем перемешивания. Доводят рН до 5,8 путем добавления едкого натра и доводят объем раствора до 1 л путем добавления дистиллированной воды.
Параллельно подготавливают четыре партии туалетного молока, содержащего 6% алкилового сложного эфира при С12-С18 полиэтиленгликоля, 5% стеарата глицерина, 3% изодециллаурата, 3% триглицеридов кислот жирного ряда при С1 - С18, 1% ацетилового спирта, 0,8% диметикона (силиконовое масло), 0,4% гидроксиэтилцеллюлозы, 3% 70%-ного сорбитола и 0,2% эфирного масла.
Сохраняют одну партию в качестве контрольного образца и добавляют к каждой из трех других партий несколько мл раствора хитозана для получения четырех партий, имеющих соответствующие содержания хитозана 0, 50, 100 и 200 μ г/г. Доводят рН до 6 и дополняют до 100% дистиллированной водой.
Партии инокулируют суспензией микроорганизмов для получения исходного числа около 104 зародышей на мл. Партии сохраняют при температуре окружающей среды и в темном месте. Измеряют число зародышей, имеющихся в туалетном молоке, на различных стадиях развития: после инокуляции, через одну неделю, через две недели, через три недели и через четыре недели.
Выбранными микроорганизмами являются:
I. Е.coli
II. PS. aeruginosa
III. Staph. aureus
IV. Streph. faecalis
V. C. albicans
Получают результаты, представленные в табл.8.
Отмечают, что все виды молока, содержащие хитозан, тормозят рост бактерий или дрожжей, которые они содержат. Эффект заметен сразу с первой недели.
Бактериостатическая и даже бактерицидная активность хитозана является очевидной, даже что касается видов молока с небольшим содержанием хитозана (50 μ г/г).
П р и м е р 2. Косметический крем, содержащий хитозан, получают следующим образом:
- подготавливают 77 мл буферного раствора с рН 5,7 (на базе фосфата натрия);
- в него добавляют 10 мг хитозана, растворенного в разбавленной уксусной кислоте, имеющего молекулярный вес около 180.000, степень деацетилирования около 85% и поступающего из креветок;
- затем добавляют 8 г глицерина, затем смесь нагревают в ванне при 80оС;
- параллельно плавят 15 г стеарата глицерина при 80оС, который медленно добавляют в предыдущую смесь с перемешиванием;
- смесь оставляют охлаждаться до температуры окружающей среды, время от времени гомогенизируя ее.
Получают крем, содержащий 100 μ г/г хитозана.
Таким же образом получают крем, содержащий 250 μ г/г хитозана. Получают также контрольные образцы крема без добавления хитозана. Разные кремы помещают в нестерилизованные горшки и хранят при температуре окружающей среды в темноте. На контрольных образцах признаки заражения появляются по истечении 2 мес. Микроскопический анализ показывает постепенное появление спор и гифов грибков. Кремы, содержащие хитозан, не имеют никаких следов заражения даже по истечении одного года.
Изобретение относится к способу стабилизации косметических препаратов путем введения в качестве консерванта хитозана, имеющего мол.м. 3000 - 700000. 2 з.п. ф-лы, 8 табл.
| Р.Фридман | |||
| "Косметика", 1959. |
Авторы
Даты
1995-02-09—Публикация
1989-11-27—Подача