Изобретение относится к молекулярной биологии, в частности к методу диагностики СПИДа, основанном на детекции генетического материала возбудителя и приспособленным для массовых анализов с возможной автоматизацией процесса.
Следует отметить, что гибридизационный метод используется для диагностики расстройств на генетическом уровне.
В литературе описано обнаружение провируса СПИДа с помощью ПЦР-ОГ, который включает в себя проведение ПЦР с последующим обнаружением размноженного фрагмента путем гибридизации с меченым зондом.
Полученный комплекс отделяется от избытка зонда электрофорезом и обнаруживается авторадиографией.
Предложенный способ включает в себя две основные стадии. Первая это размножение заданного фрагмента генома возбудителя с помощью полимеразной цепной реакции (ПЦР) многократная гибридизация с двумя ориентированными навстречу друг другу олигонуклеотидными зондами, которые далее достраиваются полимеразой либо ее аналога, или комбинации с полимеразными реакциями других типов. Это позволит решить проблему чувствительности (поскольку обеспечивается размножение не менее 107) и использовать максимально простые методы приготовления проб для анализа. На второй стадии амплифицированный продукт обнаруживается путем гибридизации с олигонуклеотидными зондами. В данном случае он применяется как дополнительное средство контроля фрагмент генома возбудителя, уже "узнанный" двумя зондами на первой стадии, "узнается" еще раз зондами. Один из них при этом должен содержать метку, позволяющую обнаружить размноженный продукт: высокая чувствительность на этой стадии не обязательна.
ПЦР амплификацию ДНК исходной пробы можно осуществлять в присутствии двух пар праймеров: одна к фрагменту возбудителя (ВИЧ), другая к маркерному гену. Гель после гибридизации и авторадиографии прокрашивают бромистым этидием. Отрицательный результат определения возбудителя считается однозначным только для тех проб, в которых заметно достаточное количество продукта амплификации маркерного фрагмента.
В способе обнаружения возбудителя СПИДа в крови или культуре лимфоцитов был применен метод ПЦР-амплификации с последующей олигомер-гибридизацией (ПЦР-ОГ). Был разработан новый вариант этого метода, который позволяет обнаружить возбудитель СПИДа на самых ранних стадиях заражения: чувствительность по сравнению с прототипом повышена на порядок при одновременном упрощении методики анализа. С другой стороны, однозначно доказать отсутствие возбудителя, что весьма важно особенно в случае СПИДа. Это достигается тем, что параллельно с обнаружением провируса ВИЧ в той же пробе проводится оценка общего количества генной ДНК и эффективности анализа путем амплификации маркерного гена со второй парой праймеров. Метод ПЦР-ОГ предполагается использовать как контроль при разработке новых методов диагностики СПИДа и просто для проведения анализов проб крови на присутствие ВИЧ. Такие анализы уже проводились.
Сущность изобретения состоит в следующем: смесь после амплификации в присутствии пары праймеров 1 и 2 ограничивающих фрагмент возбудителя (А) или в присутствии двух пар праймеров (добавляется еще пара 1m и 2m, ограничивающих маркерный ген m вводится в гибридизацию с зондами (одним или двумя), имеющими участок связывания внутри фрагмента возбудителя А. Маркерный фрагмент М обнаруживается в той же смеси аналогичным способом или иначе, поскольку последний всегда присутствует в большом количестве. Например, в предлагаемом новом варианте ПЦР-ОГ фрагмент возбудителя обнаруживается путем гибридизации с меченым зондом, а маркерный ген путем прокрашивания бромистым этидием.
Данный подход позволяет применять и другие варианты гибридизационной детекции, применяемые как для возбудителей так и для маркера. Так, для автоматизации процесса фрагмент А (или М) может быть введен в гибридизацию с зондом 3, иммобилизованным на полимерном носителе, и с зондом, содержащим метку радиоактивную или нерадиоактивную.
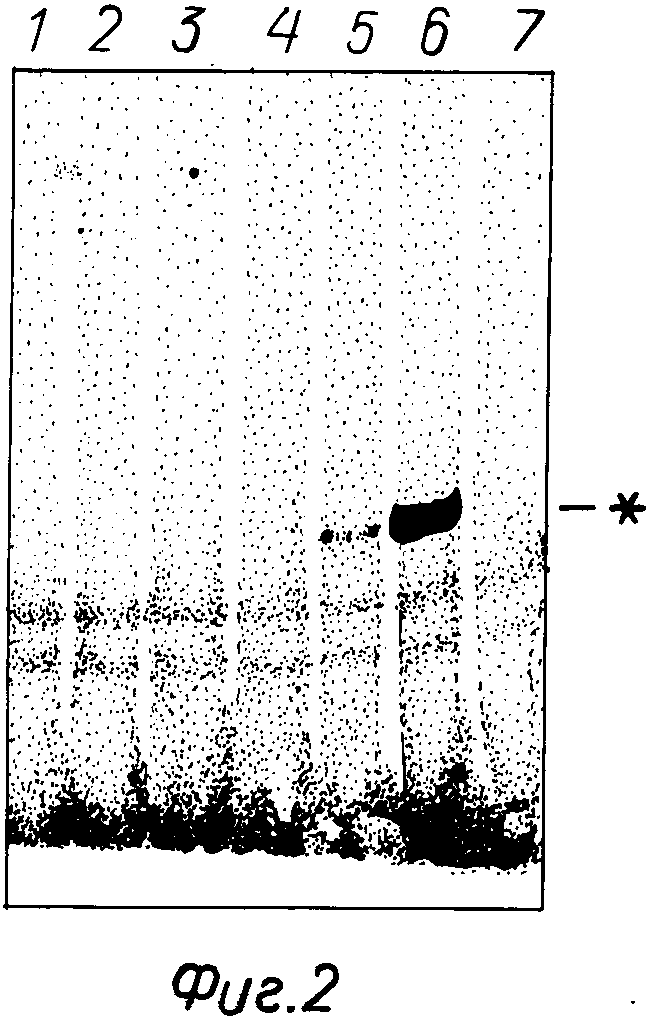
На фиг. 1 показан радиоавтограф геля при анализе препаратов лимфоцитной ДНК методом ПЦР-ОГ. Все пробы содержат ДНК из 1 млн. клеток, среди которых 500(1), 50(2), 10(3) или 0(4) содержат провирус СПИДа. Указано положение меченого зонда 4 и комплекса зонд-амплифицированный фрагмент (*); на фиг. 2 пример определения по методу ПЦР-ОГ провируса СПИДа в препаратах крови от 7 пациентов. Видно, что провирус содержится в разных количествах пробы 5 и 6; в остальных он не обнаружен; на фиг. 3 радиоавтограф геля при определении провируса СПИДа методом ПЦР-ОГ с амплификацией в присутствии пары праймеров р1 р2 (1-5) и двух пар р1 р2 и GH26 GH27 (6-9). Во всех пробах на анализ взята ДНК из 0,5 млн. лимфоцитов, среди которых 18000(1), 500(2, 6), 50(3, 7), 10(4, 8) и 0(5, 9) содержат провирус СПИДа: * положение комплекса зонд-амплифицированный фрагмент; на фиг. 4 тот же гель после прокрашивания бромистым этидием: М маркерный фрагмент; ** фрагмент провируса.
П р и м е р 1. Выбор последовательности праймеров и зондов. Учитывая большую склонность ВИЧа к мутациям, при его обнаружении необходимо использовать праймеры и зонды, соответствующие наиболее консервативным участкам вирусного генома. В качестве таких участков-мишеней предлагается использовать те, которые совпадают по нуклеотидной последовательности в ВИЧ-1 и ВИЧ-2. Такое совпадение или сходство, наблюдаемое для этих двух эволюционно-удаленных разновидностей ВИЧа, может служить гарантией устойчивости выбранных мишеней к возможным новым мутациям.
В связи с изложенным, основой для поиска мишеней стало сопоставление нуклеотидных последовательностей по всей длине генома для hivmn, EMBL accession M17449 (ВИЧ-1) и hiv2rod, EMBL accession M15390 (ВИЧ-2) на компьютере с помощью программы "Microgenie". В этих вирусах совпадает 55,2% последовательности, наиболее совпадают, как и ожидалось, гены gog (позиции 788-2308 в hivmn, 546-2114 в hiv2rod) и pol (2374-5112 в hivmn 900-1979 b). Затем на основе этих данных гена pol выбирают потенциальные мишени для праймеров и зондов, которые далее проверяют на гомологию со всеми имеющимися данными EMBL GenBank (сентябрь 1991 г.) по нуклеотидной последовательности ВИЧ с помощью той же программы "Microgenie". В качестве критериев, определяющих пригодность праймера или зонда, используют следующие: длина мишени не менее 25 звеньев, не более 3 несовпадений (мисматчей) для вирусов семейства ВИЧ-1 и не менее 75% совпадений для ВИЧ-2 (hiv2rod); не допускают мисматчи ближе 3 звеньев от 3' конца, наличие более 1 пары мисматчей, расположенных рядом и выпетливание более 1 звена. Этим критериям удовлетворяют все отобранные праймеры и зонды к гену pol (обозначен р, см. таблицу). При этом р1 р4 используют как зонды 1-4 на фиг. 1. Для р5 (тоже потенциальный зонд) соответствие критериям наблюдается только для вирусов семейства ВИЧ-1.
П р и м е р 2. Синтез зондов и праймеров. Зонды р1, р2 и р4 синтезируют фосфоамидитным методом на автомате-синтезаторе по обычной схеме [4] Для выделения зондов из реакционной смеси используют обращенно-фазовую хроматографию перед снятием метокситритильной 5'-концевой защитной группы. Полученные зонды практически гомогенны по данным гель-электрофореза.
Систему носитель-зонд р3 получают путем фосфоамидитного олигонуклеотидного синтеза. Для этого, пористое стекло типа CPG модифицируют фосфатными группами, на которых далее проводят сборку зонда р3 по той же фосфоамидитной схеме. Степень загрузки носителя фосфатными группами при этом составляет 20 мкмоль/г. Из этих групп примерно 25% вовлекают в последующий олигонуклеотидный синтез. Полученная система характеризовалась низким уровнем неспецифической сорбции меченого зонда (около 0,01%), что свидетельствует о перспективности ее использования в гибридизации по приведенной на фиг. 1 схеме.
П р и м е р 3. Детекция провируса СПИДа модифицированных методом ПЦР-ОГ в культуре лимфоцитов и в крови. Препараты ДНК из культуры лимфоцитов, содержащие известное количество провируса СПИДа, используют как объект при отработке методов диагностики. Также, препараты готовят смешением ДНК из зараженной и незараженной культур лимфоцитов. Детекция и количественная оценка заражения культур лимфоцитов вирусом СПИДа важна при испытаниях новых противовирусных препаратов, которые вначале проводятся на клеточных культурах.
При проведении анализов крови на СПИД проводят отделение лимфоцитов от других компонентов крови путем центрифугирования или гипотонического шока. Далее, лимфоциты, выделенные из крови или из культуры, лизируют протеиназой К или пропазой, которую затем инактивируют прогревом при 95оС. При этом также происходит гарантированная инактивация ВИЧа, что делает полученный лизат безопасным в работе. Далее лизат вводят в ПЦР непосредственно либо после дополнительной депротеинизации и концентрирования ДНК. Следует отметить, что при анализах крови может быть необходимо не только обнаружение провируса в лимфоцитной ДНК, но и РНК-содержащих вирусных частиц в сыворотке крови или полученных из нее лекарственных препаратах. Это также возможно, поскольку ПЦР проходит как для ДНК, так и для РНК.
После проведения ПЦР 1/5 смеси добавляют раствор меченого зонда, содержащий все необходимые компоненты как для гибридизации, так и для гель-электрофореза. Последний проводится сразу же после гибридизации в растворе. Радиоавтография геля после электрофореза (фиг. 1, 2) позволяет выявить полосу, соответствующую продукту гибридизации. В случае ДНК из культуры лимфоцитов наблюдалось соответствие интенсивности этой полосы и количества провируса (фиг. 1, 3 и 4). При анализе на обнаружение провируса СПИДа с использованием р1 и р2 как праймеров ПЦР и р4 как зонда для гибридизации нами был достигнут предел обнаружения, соответствующий 1 зараженному лимфоциту на 100000 незараженных, что выше описанного в литературе.
П р и м е р 4. Сравнение эффективности обнаружения провируса СПИДа методом ПЦР-ОГ в присутствии одной и двух пар праймеров ПЦР. Чувствительность предлагаемой модификации метода ПЦР-ОГ, как было обнаружено, не снижается, если в ПЦР вводить еще одну пару праймеров, ограничивающую участок геномной ДНК, присутствующий во всех клетках в данном случае это фрагмент гена HLA-DO  между праймерами GH26 и GH27. Этот 242-звенный фрагмент при амплификации образуется всегда в значительных количествах, видимых без гибридизации при прокрашивании геля бромистым этидием (фиг. 4) независимо от присутствия в ДНК провируса ВИЧ или любого другого. Поэтому, при анализе на присутствие ВИЧ ПЦР-амплификацию ДНК исходной пробы проводят в присутствии двух пар праймеров: одна к фрагменту возбудителя (ВИЧ), другая к маркерному гену (не обязательно HLA-DO
между праймерами GH26 и GH27. Этот 242-звенный фрагмент при амплификации образуется всегда в значительных количествах, видимых без гибридизации при прокрашивании геля бромистым этидием (фиг. 4) независимо от присутствия в ДНК провируса ВИЧ или любого другого. Поэтому, при анализе на присутствие ВИЧ ПЦР-амплификацию ДНК исходной пробы проводят в присутствии двух пар праймеров: одна к фрагменту возбудителя (ВИЧ), другая к маркерному гену (не обязательно HLA-DO 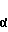 , который может быть не вполне удобен вследствие своей вариабельности. Определение провируса идет параллельно с контролем качества пробы. Гель после гибридизации и авторадиографии прокрашивают бромистым этидием. Отрицательный результат определения возбудителя считается однозначным только для тех проб, в которых заметно достаточное количество продукта амплификации маркерного фрагмента. Отрицательный результат при диагностике СПИДа бывает не менее важен, чем положительный, особенно в случае ошибочных результатов анализа другими методами или при анализе крови "спидофобов" (лиц, безосновательно считающих себя больными СПИДом).
, который может быть не вполне удобен вследствие своей вариабельности. Определение провируса идет параллельно с контролем качества пробы. Гель после гибридизации и авторадиографии прокрашивают бромистым этидием. Отрицательный результат определения возбудителя считается однозначным только для тех проб, в которых заметно достаточное количество продукта амплификации маркерного фрагмента. Отрицательный результат при диагностике СПИДа бывает не менее важен, чем положительный, особенно в случае ошибочных результатов анализа другими методами или при анализе крови "спидофобов" (лиц, безосновательно считающих себя больными СПИДом).
| название | год | авторы | номер документа |
|---|---|---|---|
| НАБОР СИНТЕТИЧЕСКИХ ОЛИГОНУКЛЕОТИДНЫХ ПРАЙМЕРОВ И СПОСОБ ЕГО ПРИМЕНЕНИЯ ДЛЯ ИНДИКАЦИИ ВИРУСОВ ИММУНОДЕФИЦИТА И ЛЕЙКЕМИИ КОШЕК В КЛИНИЧЕСКОМ МАТЕРИАЛЕ МЕТОДОМ МУЛЬТИПЛЕКСНОЙ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ | 2015 |
|
RU2586504C1 |
| ПАРА СИНТЕТИЧЕСКИХ ОЛИГОНУКЛЕОТИДНЫХ ПРАЙМЕРОВ ДЛЯ ВЫЯВЛЕНИЯ ВИРУСА ИММУНОДЕФИЦИТА КОШЕК И СПОСОБ ДИАГНОСТИКИ ВИРУСНОГО ИММУНОДЕФИЦИТА КОШЕК | 2014 |
|
RU2553534C1 |
| ДИАГНОСТИЧЕСКАЯ СИСТЕМА ДЛЯ ВЫЯВЛЕНИЯ ДНК ПРОВИРУСОВ ЛЕЙКОЗА И ИММУНОДЕФИЦИТА КРУПНОГО РОГАТОГО СКОТА МЕТОДОМ МУЛЬТИПЛЕКСНОЙ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ | 2015 |
|
RU2615465C2 |
| НАБОР ДЛЯ ВЫЯВЛЕНИЯ ДНК ПРОВИРУСА ИММУНОДЕФИЦИТА КРУПНОГО РОГАТОГО СКОТА, СОДЕРЖАЩИЙ ПАРУ СПЕЦИФИЧНЫХ ПРАЙМЕРОВ И ЗОНД, И СПОСОБ ДИАГНОСТИКИ ВИРУСНОГО ИММУНОДЕФИЦИТА КРУПНОГО РОГАТОГО СКОТА МЕТОДОМ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ В РЕЖИМЕ РЕАЛЬНОГО ВРЕМЕНИ | 2015 |
|
RU2595373C1 |
| СПОСОБ ЭКСПРЕСС-ДИАГНОСТИКИ ЛЕЙКОЗА КРУПНОГО РОГАТОГО СКОТА | 2016 |
|
RU2644233C2 |
| Способ диагностики вируса лейкоза крупного рогатого скота | 2018 |
|
RU2694966C1 |
| СПОСОБ ОБНАРУЖЕНИЯ ПРОВИРУСА ЛЕЙКОЗА КРУПНОГО РОГАТОГО СКОТА | 2013 |
|
RU2558252C2 |
| СПОСОБ ДИАГНОСТИКИ ИНФЕКЦИЙ ПУТЕМ ОБНАРУЖЕНИЯ ГЕНЕТИЧЕСКОГО МАТЕРИАЛА ВОЗБУДИТЕЛЯ В ИССЛЕДУЕМОЙ ПРОБЕ | 1996 |
|
RU2143113C1 |
| СПОСОБ ДИАГНОСТИКИ ЛЕЙКОЗА КРУПНОГО РОГАТОГО СКОТА МЕТОДОМ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ | 2010 |
|
RU2445370C1 |
| СПОСОБ И НАБОР ДЛЯ ОБНАРУЖЕНИЯ ДНК ВИРУСА АФРИКАНСКОЙ ЧУМЫ СВИНЕЙ МЕТОДОМ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ | 1996 |
|
RU2125089C1 |



Использование: в молекулярной биологии, при диагностике СПИДа. Сущность изобретения: способ обнаружения вируса иммунодефицита человека заключается в том, что проводят амплификацию дезоксирибонуклеиновой кислоты (ДНК) вируса с помощью праймера из 26 звеньев со следующей последовательностью нуклеотидов: GATGGCCCAAAAGTTAAACAATGGCC и праймера из 31-го звена со следующей последовательностью нуклеотидов: TTCTCTTATTAAGTT CTCTGAAATCTACTA, обнаруживают размноженный фрагмент в результате гибридизации с меченым зондом из 36 звеньев CTCCATTTAGTACTGTCTTTT TTCTTTATGGCAAAT и зондом на носителе из 32 звеньев ATTTCTACTAATGCTTTT ATTTTTTCTTCTG. Одновременно амплификацию ДНК вируса осуществляют с использованием в качестве праймеров СН 26 и СН 27. В данном случае гель прокрашивают бромистым этидием. При этом вирус выявляют лишь в случае, если в прокрашенном геле присутствует фрагмент маркерного гена. 1 з.п. ф-лы, 4 ил. 1 табл.
| Pcr protocls : A quide to Method and Applications Academic Press, 1990. |
Авторы
Даты
1995-07-20—Публикация
1993-03-17—Подача