Изобретение относится к диагностике инфекционных заболеваний, основанном на обнаружении генетического материала (ДНК или РНК) возбудителя. При этом возможно проведение массовых анализов с контролем достоверности результата и практически полной автоматизацией процесса.
Известны способы выявления возбудителя, основанные на обнаружении и идентификации его генетического материала, включающие несколько стадий. Прежде всего из биологического образца (крови, другой биологической жидкости, мокроты, клеточной культуры, биопсийного материала и т.д.), либо другого источника (пищевых отходов, сточных вод и т.д.) выделяют генетический материал возбудителя (ДНК или РНК) с очисткой его от примесей, препятствующих проведению следующей стадии анализа. Последняя, как правило, представляет собой размножение заданного фрагмента генома путем полимеразной цепной реакции (ПЦР) [1] или какого-либо ее аналога (например, NASBA [2]). Далее размноженный фрагмент генома возбудителя (если таковой присутствовал в пробе) идентифицируется тем или иным способом [1]; при этом выдается результат анализа в целом.
Недостатком указанных способов является невозможность контроля эффективности как стадии выделения генетического материала, так и ПЦР для каждой из проб.
Наиболее распространенный тип биологических образцов представляет собой пробы, содержащие клетки организма-хозяина, причем количество последних характеризует объем введенного в анализ материала, определяющий, в свою очередь, статистическую достоверность результата. К таким относятся цельная кровь или ее клеточная фракция, биопсии тканей, а также культуральные препараты. При этом геном возбудителя может находиться в виде ДНК внутри клеток-хозяев, как в случае ретровирусов (вирус иммунодефицита (ВИЧ), Т-клеточного лейкоза человека и животных, герпеса) и ДНК-содержащих вирусов, в виде РНК внутри клеток-хозяев (РНК-содержащие вирусы, например, вирус гриппа, классической чумы свиней и т.д.), а также в виде ДНК в составе бактерий, присутствующих среди хозяйских клеток (туберкулез, сибирская язва, хламидии и другие бактериальные инфекции). Особенностью таких образцов является то, что генетический материал возбудителя проходит стадии выделения вместе с таковым из хозяйских клеток и также вместе с ним вводится в ПЦР. Это предоставляет возможность контролировать эффективность как стадии выделения, так и ПЦР для каждой из проб, что и реализуется в ближайшем аналоге данного изобретения [3]. С этой целью ПЦР проводится в присутствии двух пар праймеров - одна на фрагмент генома возбудителя, а другая - на маркерный фрагмент генома организма-хозяина. Таким маркером может быть любой фрагмент, не подверженный мутациям и желательно расположенный в составе однокопийного гена. Копирование этого маркера в ходе ПЦР дает на выходе интенсивный сигнал, наличие которого подтверждает эффективность стадий выделения и ПЦР, особенно при отрицательном результате анализа - отсутствии возбудителя. Если геном последнего представлен в виде ДНК, в качестве маркера может быть использован участок генома организма-хозяина, например, фрагмент гена HLA-DQa [3,4]. Если же определяется РНК возбудителя, то необходимо использовать РНК-маркер, примером которого является мРНК глобинового гена [5].
Одновременная ПЦР-амплификация фрагмента генома возбудителя и маркерного гена хозяйских клеток была проведена и в количественном варианте - в присутствии двух внутренних ДНК-стандартов на возбудитель (ВИЧ) и маркер (HLA-DQa) [4] . Это позволило определять для проб крови инфицированных лиц число копий ВИЧ в расчете на число маркерных генов (и, соответственно, клеточных геномов), и по изменению этой величины судить об эффективности проводимого лечения. Действительно, определяемое при этом число маркерных генов прямо характеризует объем пробы, из которого генетический материал попал в ПЦР после выделения и очистки. Именно эта величина определяет статистическую достоверность результата анализа, так как недостаточный объем введенной в анализ пробы вполне может быть причиной ложного отрицательного результата анализа.
Недостатком указанного способа является невозможность диагностики проб, не содержащих клеток организма-хозяина, либо содержащих их в незначительных и/или изменяющихся случайным образом количествах, а также отсутствие контроля чувствительности обнаружения возбудителя, определяемой эффективностью процессов размножения фрагмента генома и детекции полученного при этом продукта. К пробам, не содержащим клеток организма-хозяина, либо содержащим их в незначительных и/или изменяющимся случайным образом количествах, относятся, например, такие биологические жидкости, как кровяная сыворотка, моча, мокроты и смывы со слизистых оболочек, а также сточные воды. Общей особенностью таких проб, отличающей их от рассмотренных выше, является невозможность использовать количественную ПЦР маркерного гена организма-хозяина [4] для оценки объема введенной в анализ пробы и уровня потерь генетического материала на стадии выделения. Последнее включает в себя лизис частиц возбудителя (вирусов или бактерий) непосредственно в пробе (например, вирусов гепатита в кровяной сыворотке [6] ), иногда с предварительным концентрированием этих частиц фильтрованием или центрифугированием. Хотя методы ПЦР-детекции позволяют обнаруживать даже одну копию ДНК или РНК [1], чувствительность в любой из проб может быть сильно понижена из-за присутствия ингибиторов ПЦР, ошибок оператора, низкого качества реагентов и т.п. Присутствие же в пробе стандарта на возбудитель в минимальном для ПЦР-детекции количестве (оптимальным представляется количество 10 молекул, см. пример) позволит эффективно контролировать протекание стадий размножения фрагмента генома и детекции полученных при этом продуктов. Наличие сигнала подобного "системного контроля" (т.е. стандарта на возбудитель, см. пример) является обязательным при отрицательном результате анализа.
В качестве общего решения указанной проблемы предлагается введение в анализируемую пробу искусственного маркера определенного типа в известном количестве с последующим его использованием для оценки объема пробы и уровня потерь генетического материала. Вводимый маркер может быть двух типов. Во-первых, он может представлять собой непатогенный микроорганизм, моделирующий возбудителя (например, Echerichia coli или другой лабораторный микроорганизм), что позволит контролировать все стадии подготовки пробы, включая лизис и даже концентрирование. При этом любой подходящий фрагмент ДНК или РНК из этого введенного микроорганизма может быть использован в качестве описанного выше маркера, определяемого с помощью количественной ПЦР. Второй тип следует применять в тех случаях, когда для выделения анализируемого генетического материала используется ДНК- или РНК-носитель [7]. Именно последний и является искусственным маркером. Такой маркер-носитель, в отличие от неспецифического носителя (например, полиадениловой кислоты в наборе для детекции РНК гепатита C, предлагаемом фирмой Hoffmann La Roche [6]), должен представлять собой ДНК или РНК определенной структуры. Его количество в пробе должно быть в пределах, приемлемых для количественной детекции с использованием ПЦР со стандартом, и вместе с тем быть достаточно велико для его работы как носителя. Последнее, с учетом приводимых в литературе [7] примеров, может составлять микрограммы для плазмидных ДНК или РНК-транскриптов с них, либо нанограммы для фрагментов ДНК или РНК, получаемых путем ПЦР или комбинации ПЦР-транскрипция соответственно.
Оптимальной системой для регистрации размноженных фрагментов после ПЦР является электрофоретическая. При этом пространственное разделение при электрофорезе в геле размноженных фрагментов возбудителя и системного контроля обеспечивает их раздельную регистрацию. Применение автоматических и компьютерных средств анализа электрофореграмм и тем более их модификация для диагностических работ обеспечит эффективную обработку, хранение и просмотр результатов. Альтернативные варианты одновременной детекции сигналов мишени и системного контроля без разделения компонентов возможны, но представляются более сложными в техническом исполнении. Примером одного из таких вариантов является использование разноцветных флуоресцентных меток при детекции в ячейке митротитровой плашки.
Фиг. 1. представляет профили электрофореграмм при детекции ВИЧ-ДНК для двух проб после 1-й ПЦР. Видны сигналы фрагмента маркерного гена (канал 188) и стандарта GS (канал 214), введенного в смесь в количестве, эквивалентном 40000 клеток. Видно, что в случае пробы 1 в анализ введено более 200 тыс. клеток, а в пробе 2 - менее 20 тыс. В последнем случае объем пробы и статистическая достоверность результата понижены по сравнению с пробой 1.
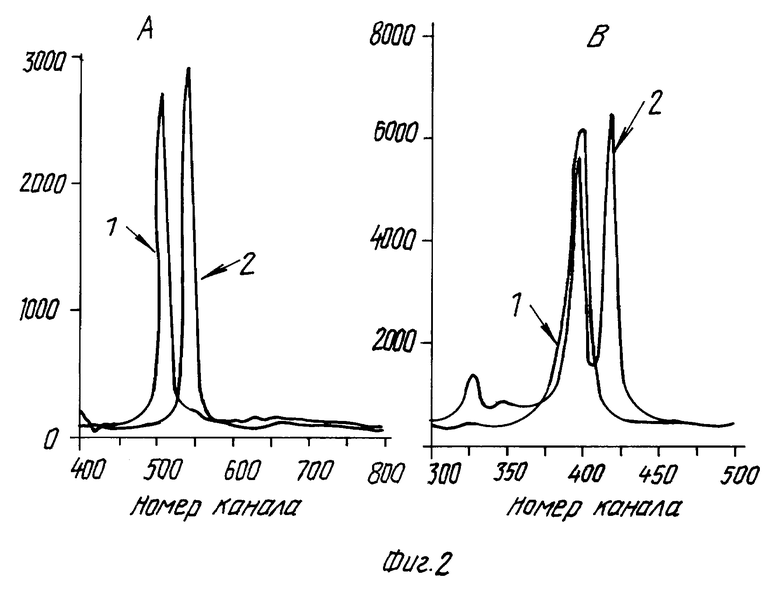
Фиг.2. - профили электрофореграмм при детекции ВИЧ-ДНК после 2-й ПЦР для неинфицированной (1) и инфицированной (2) проб. В анализ было введено 10 (A) или 100 (B) молекул системного контроля-стандарта на ВИЧ (IS). Для отрицательного результата строго обязательно наличие сигнала системного контроля (канал 505 для A или 402 для B), подтверждающего высокую чувствительность определения. При положительном результате он может почти исчезнуть на фоне сигнала ВИЧ-ДНК (канал 550 для A или 422 для B).
Пример: Диагностика ВИЧ-инфекции в пробах крови.
Для этой цели используются праймеры и ДНК-стандарты, описанные ранее [4] для мониторинга развития инфекции путем количественной ПЦР. В качестве системного контроля на ВИЧ применяется стандарт-амплификат IS (здесь и далее все обозначения даны по указанной выше работе [4]), который при ПЦР с подходящим комплектом праймеров дает продукты более длинные по сравнению с таковыми для мишени (ВИЧ-ДНК) на 80 нп. Для контроля выделения ДНК используется количественная ПЦР маркерного гена человека HLA-DQa со стандартом GS. Последний при ПЦР с праймерами GH26 и GH27 образует фрагмент длиной 202 нп, что короче по сравнению с таковым для мишени, имеющим длину 242 нп.
Общей схемой анализа является следующая. Из пробы цельной крови путем центрифугирования отделяется плазма, затем удаляются эритроциты путем отмывки низкоионным буфером. Полученный осадок лейкоцитов лизируется при 95oC в присутствии фосфоцеллюлозы или другого подходящего носителя (например, Chelex-100), что дает препарат ДНК для ПЦР. Возможно применение и других схем фракционирования клеток и лизиса. Анализ ДНК проводится путем двукратной "гнездовой" ПЦР. При первой амплификации в смесь вводятся: клеточный лизат, стандарты на ВИЧ и на маркер, праймеры для 1-й ПЦР на ВИЧ (P9 и P10), праймеры на маркер (GH26 и GH27). Далее 1/30 - 1/20 часть полученной смеси вводится во вторую амплификацию - ПЦР с "гнездовыми" праймерами на ВИЧ (TP7 и AP4 либо APЗ и AP5). Полученные смеси анализируются электрофорезом в обычном агарозном геле, содержащем бромистый этидий. Результаты могут быть зарегистрированы путем наблюдения флуоресценции полос ДНК визуально, либо с помощью прибора - в рассмотренных ниже случаях была применена камера ФМК-1000 с линейным CCD-детектором при статистической обработке сигнала процессором ПС-2101х, выпускаемыми АО "Дельтатех". По профилю электрофореграммы после 1-й ПЦР определяют содержание маркерного гена в анализируемой смеси (т.е. число хозяйских клеток в пробе как показано на фиг. 1). Аналогичным образом после 2-й ПЦР (фиг. 2) регистрируют сигналы ВИЧ-ДНК (если он есть) и системного контроля. Только при наличии последнего и одновременном отсутствии сигнала возбудителя (кривая 1 на фиг. 2 A и B) результат анализа можно считать отрицательным.
Источники информации
1. Mullis К. В. //US Patent N 4683202, 1985; Saiki R.K., Gelfand D.H., Stoffel S. , Scharf S.J., Higuchi R., Horn G.T., Mullis К.В., Ehrlich H.A. //Science. 1988. V. 239. P. 487-491.
2. HIV-I NASBA test kit. Instruction for use. Organon Teknika BV, Boxtel, Holland, 1993.
3. Kellog S.E., Sninsky J.J., Kwok S. //Analyt. Biochem. 1990. V.189. P. 202-208; Елов A.A., Козлова A.B., Медников Б.М., Корнилаева Г.В. и Карамов Э.В. Вопросы вирусологии. 1994, N 3, с. 107-109.
4. Yolov A.A., Kozlova A.V., Yaroslavtseva N.G., Mednikov B.M., Karamov E.V. - Virus genes. 1995. V.1O. N. 1. P. 45-51.
5. Saksela K. , Stevens C., Rubinstein P., Baltimore D. //Proc. Nat. Acad. Sci. USA 1994. V.91. P. 1104-1108.
6. Amplicor HCV specimen preparation kit. Hoffmann La Roche. ART: 0753912; US: 87376,1994.
7. Boom R. , Sol C. J.A., Salimans M.M.M., Jansen C.L., Wertheim van Dillen P. M.E. and van der Noordaa J. - J. Clin. Microbiol. 1990, v. 28, p. 495-503.
Способ предусматривает размножение фрагментов ДНК или РНK с помощью полимеразных цепных реакций (ПЦР) или их аналогов с использованием количественного варианта ПЦР в присутствии двух ДНК- или РНК-стандартов, один из которых введен для контроля чувствительности анализа и потому соответствует размножаемому фрагменту генома возбудителя и присутствует в минимальном для обнаружения количестве, а другой введен для контроля статистической значимости результата, определяемой вовлеченным в анализ объемом пробы, и потому соответствует характеризующему этот объем генетическому маркеру, каковым в зависимости от типа анализируемого материала может быть заданный фрагмент ДНК или РНК клеток организма-хозяина либо специально введенного в пробу биообъекта, моделирующего возбудитель, а также фрагмент генетического материала, использованного как носитель на стадии фракционирования пробы перед ПЦР. Способ обеспечивает достоверность результата анализа. 2 ил.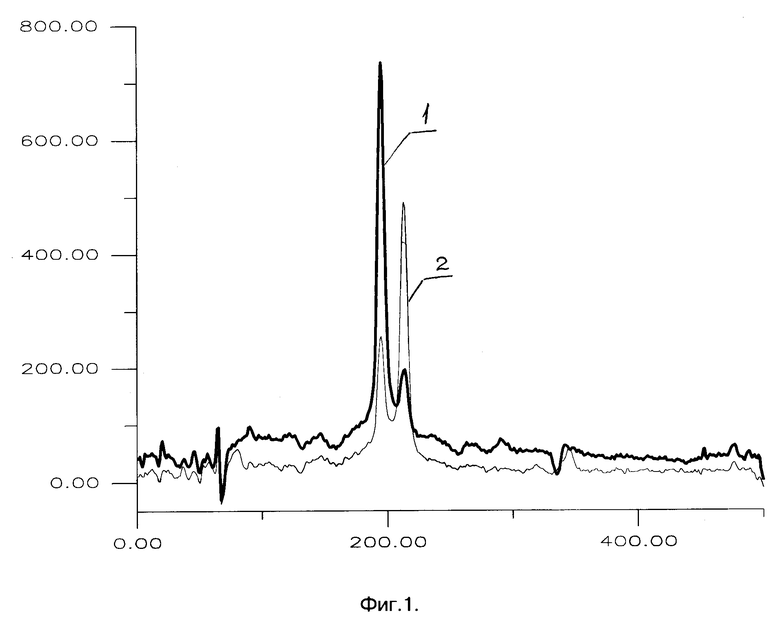
Способ диагностики инфекций путем обнаружения генетического материала возбудителя в исследуемой пробе, предусматривающий размножение фрагментов ДНК или РНК с помощью полимеразных цепных реакций или их аналогов, отличающийся тем, что анализ проводят в присутствии двух ДНК- или РНК- стандартов, один из которых вводят в пробу в минимальном для обнаружения количестве и соответствует размножаемому фрагменту генома возбудителя, а другой соответствует характеризующему объем пробы генетическому маркеру.
Авторы
Даты
1999-12-20—Публикация
1996-08-01—Подача