Изобретение относится к медицинской технике, а именно к устройствам для очистки биологических жидкостей, в частности крови, от токсических веществ с помощью сорбентов, а также может быть использовано при изготовлении мембранных аппаратов для разделения и очистки жидких и газообразных сред в химической, биотехнологической и других отраслях промышленности.
Гемосорбция является современным перспективным методом терапии, дающим положительный эффект при лечении острых и хронических отравлений лекарственными препаратами и химическими ядами (барбитураторами, транквилизаторами, хлорированными углеводородами, фосфорорганическими соединениями и т.п.), уремии, циррозов, гепатита, желчно-каменной болезни, панкреатита, сепсиса, холодовой крапивницы, алкогольного дилирия, пищевой аллергии, бронхиальной астмы, пиротонита, ожоговой болезни и микробной интоксикации. Успешно применение хемосорбции при терапии сердечно-сосудистых заболеваний, в том числе ишемической болезни сердца, гиперхолестеринемии и склеротических изменений сосудов. Однако, для прямого контакта с кровью пригодны далеко не все сорбенты, которые могли бы быть использованы для адсорбции нежелательных компонентов крови. Опасность разрушения форменных элементов крови, микроэмболии сосудов пылевидными частицами сорбентов привели к созданию специальных гранулированных, капсулированных в полимерные пленки, сорбентов. Однако это сложно в промышленной реализации и резко снижает эффективность сорбции.
Существенно расширить ассортимент применяемых сорбентов и диапазон лечебных возможностей позволяет метод плазмосорбции, представляющий собой сочетание двух методов детоксикации обменного плазмафереза и хемосорбции. Однако широкое практическое использование плазмосорбции сдерживается вследствие отсутствия эффективных аппаратов для его осуществления и низкой технологичности известных аппаратов, не позволяющей реализовать крупномасштабное серийное производство этих остродефицитных аппаратов.
Известны колонки одноразового использования для очистки крови, содержащие размещенные в корпусе фильтры, между которыми размещен слой активированного угля или другого сорбента. Недостатками данных устройств являются их низкая эффективность, связанная с проведением процесса очистки цельной крови с реальной возможностью травмирования форменных элементов крови частицами сорбента, возможностью попадания частиц сорбента (угля) в очищенную кровь и возникновения микроэмболии сосудов.
Известно устройство для детоксикации крови, содержащее последовательно соединенные первый насос, первый оксигенатор крови, второй насос, гемосорбционную проточную колонку, второй оксигенатор, первую и вторую ловушку газов из перфторуглерода с теплообменниками, причем первая ловушка соединена с первым оксигенатором и вторым насосом, второй оксигенатор соединен с колонкой и второй ловушкой, которая соединена с третьим насосом, а в качестве оксигенаторов использованы перфторуглеродные оксигенаторы. Недостатками данного устройства являются сложность конструкции, повышенное гидравлическое сопротивление магистралей и недостаточно высокая эффективность функционирования, обусловленная сложностью конструкции и неизбежностью контакта частиц сорбента с форменными элементами крови.
Для снижения возможности повреждения форменных элементов крови сорбентом и попадания сорбента в кровь из сорбционных колонок частицы сорбента покрывают полупроницаемыми полимерными веществами, например, веществом, включающим группы силанола, или размещают между фильтрующим материалом сорбент в виде жгутов. Однако подобные устройства сложны в изготовлении и недостаточно эффективны в эксплуатации.
Известен аппарат для разделения крови на плазму и кровяные тельца, очистки плазмы и последующего смешения очищенной плазмы с потоком крови, состоящий из системы, в которой происходит разделение крови полупроницаемыми полыми волокнами, очистка отделенной плазмы в специальном циркуляционном контуре с сорбентом и последующее введение очищенной плазмы в кровь через полые волокна. Устройство позволяет снизить гемолиз (разрушение форменных элементов крови) и исключить попадание очищающего агента в кровь. Однако оно сложно в изготовлении и недостаточно эффективно в эксплуатации по причине использования полых полупроницаемых волокон.
Наиболее близким по технической сущности и достигаемому при использовании результату (прототипом) является аппарат для очистки крови, в котором проводят разделение крови на плазму и фракцию, обогащенную кровяными тельцами, очистку плазмы и смешение очищенной плазмы с кровью. Аппарат содержит баллон, на противоположных концах которого находятся вход и выход крови, а также полости для неочищенной и очищенной крови, каждая из которых связана, соответственно, с указанными входом и выходом, при этом обе полости сообщаются через пучки полых волокон из полупроницаемых мембран. При этом отсек для обработки крови образован разделением пространства внутри баллона и обеих полостей пористыми пластинами и указанными пучками полых волокон и заполнен сорбентом для очистки крови. Недостатками данного аппарата является сложность конструктивного исполнения и недостаточная эффективность функционирования, связанные с использованием в аппарате полупроницаемых мембран в виде полых волокон.
Необходимость разделения крови на компоненты и очистки отдельных компонентов обусловлена тем обстоятельством, что токсичные вещества в основном содержатся в плазме крови, а заражение вирусными инфекциями при переливании и лечении препаратами крови осуществляется содержащимися в плазме лейкоцитами. Это касается вирусов СПИДа, гепатита, цитамегаловирусов и других, поскольку вирусы живут и размножаются, как известно, не в плазме и вообще не в жидких средах, а внутриклеточно (в ядрах клеток), поэтому удаление ядерных клеток из плазмы, то есть лейкоцитов и др. предотвращает опасность заражения на 96-98% без всякой другой стерилизации. Кроме того, препараты плазмы после удаления лейкоцитов почти утрачивают способность иммунизировать пациентов, предотвращают возможность введения с препаратами злокачественных (лейкозных) клеток и на 90% исчезают реакции на трансфузии (повышение температуры и т.д. ), так как пирогенные субстанции также вырабатываются лейкоцитами. Именно поэтому удаление лейкоцитов из плазмы должно стать обязательной процедурой при заготовке и переработке донорской крови. Однако традиционные методы обработки крови и используемые при этом аппараты не позволяют делать этого.
Целью изобретения является повышение эффективности функционирования мембранных аппаратов для разделения и очистки крови при одновременном упрощении их конструкции и повышения технологичности их изготовления.
Поставленная цель достигается тем, что в мембранном аппарате для очистки крови, содержащем корпус с камерами подвода и отвода крови и расположенные в нем средства для отделения плазмы и очистки плазмы, согласно изобретения средства для отделения плазмы и для очистки плазмы выполнены в виде многокамерного мембранного модуля, содержащего две группы чередующихся, перекрестно направленных по потокам сред камер крови и камер плазмы, образованных набором плоских полупроницаемых мембран и средствами герметизации и открытых со сторон подвода и отвода сред, набор сепарационно-дренажных элементов, размещенных в камерах, при этом средства герметизации выполнены в виде планок из материала, содержащего термопласт, расположенных вдоль направления движения сред и неразъемно соединенных с мембранами с образованием в местах контакта с ними опорных элементов в виде колонн, а сепарационно-дренажные элементы в камерах плазмы выполнены из микропористого материала содержащего сорбент.
Кроме этого, в мембранном аппарате в качестве плоских полупроницаемых мембран использованы трековые мембраны.
Кроме этого, в мембранном аппарате планки выполнены из полимерного клея-расплава.
Кроме этого, в мембранном аппарате размер пор материала сепараторно-дренажных прокладок в камерах плазмы меньше размера частиц разделяемой среды, то есть меньше размера частиц форменных элементов крови (лейкоцитов).
Совокупность общих и частных существенных признаков группы изобретений позволяет не только при одновременном существенном упрощении конструкции мембранного аппарата повысить эффективность его функционирования за счет обеспечения постоянства основных параметров процесса разделения и очистки крови и за счет обеспечения возможности использования трековых мембран, но и существенно повысить технологичность массового изготовления одноразовых мембранных аппаратов для обработки крови.
В случае использования трековых мембран по сравнению с другими используемыми в настоящее время мембранами (например, с мембранами на основе производных целлюлозы, выполненными в виде полых волокон) существенно повышается эффективность отделения плазмы и уменьшается травмирование форменных элементов крови.
Выполнение средств герметизации камер в виде полос-планок на основе материала, содержащего термопласт, позволяет не только повысить эффективность массообмена за счет исключения застойных зон при движении крови и плазмы, но и повысить эффективность герметизации, поскольку клей-расплав при деформации модуля под влиянием температуры вдавливается в поры трековых мембран, и они более надежно приклеиваются. При этом одновременно обеспечивается высокая технологичность массового производства модулей и, соответственно, мембранных аппаратов.
Использование микропористого материала для изготовления сепарационно-дренажных элементов в камерах плазмы позволяет не только повышать трансмембранное давление при разделении крови, но и задерживать случайно попавшие в плазму из-за возможных дефектов мембран форменные элементы крови, что существенно повышает надежность функционирования мембранных модулей и снижает технологические требования к качеству материала полупроницаемых мембран.
Кроме этого, предложенная конструкция модуля позволяет обеспечить автоматизированное серийное производство мембранных модулей и практически уменьшить долю ручного труда при сборке мембранных аппаратов.
Сущность изобретения поясняется чертежами:
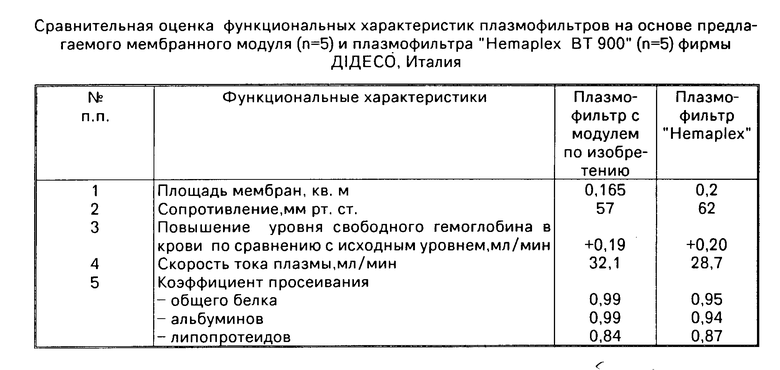
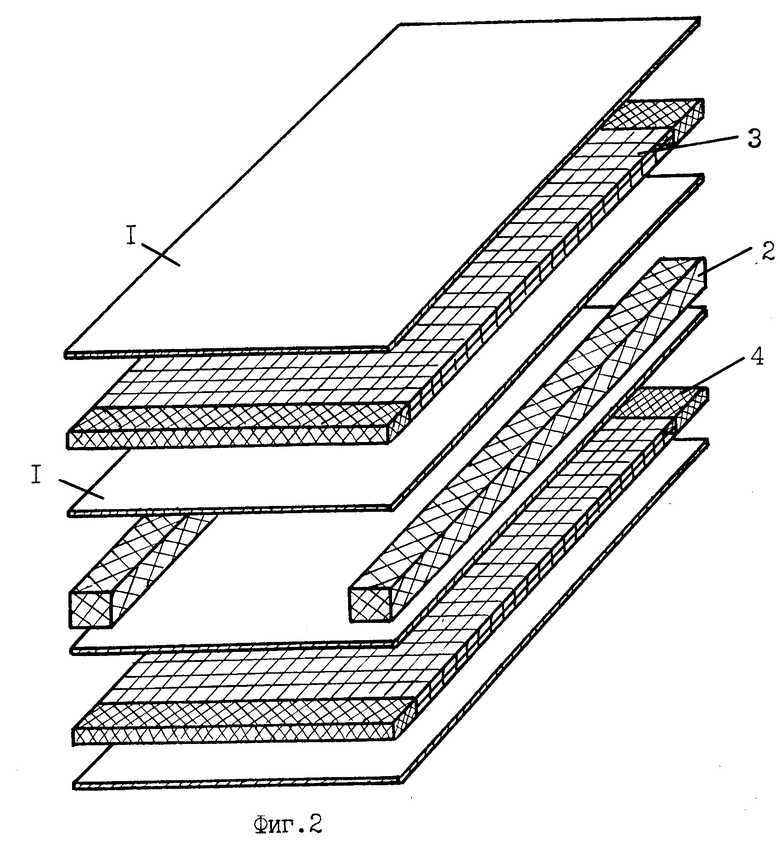
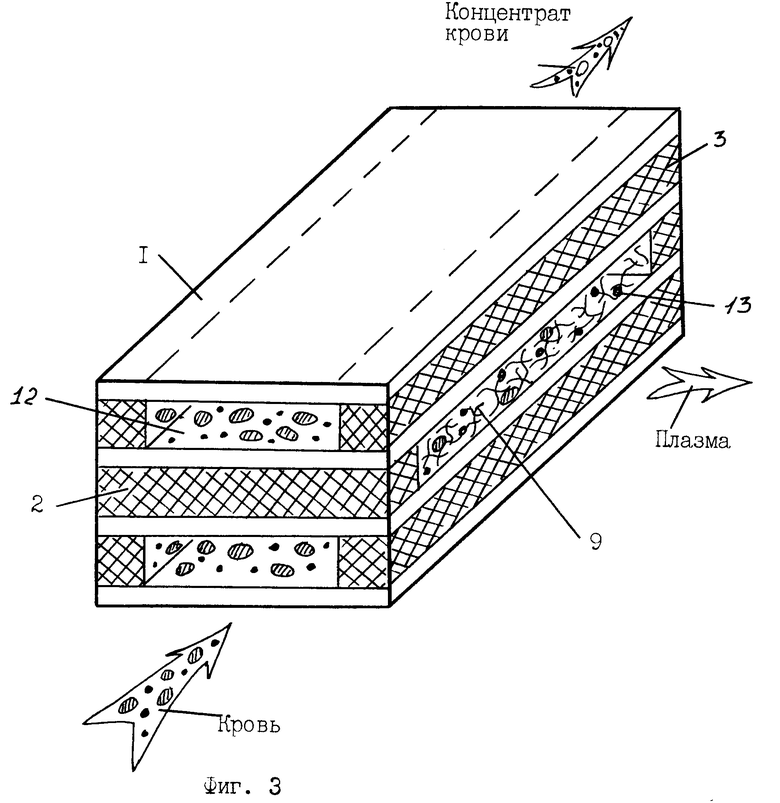
На фиг. 1, 3 изображен общий вид мембранного модуля аппарата для обработки и очистки крови.
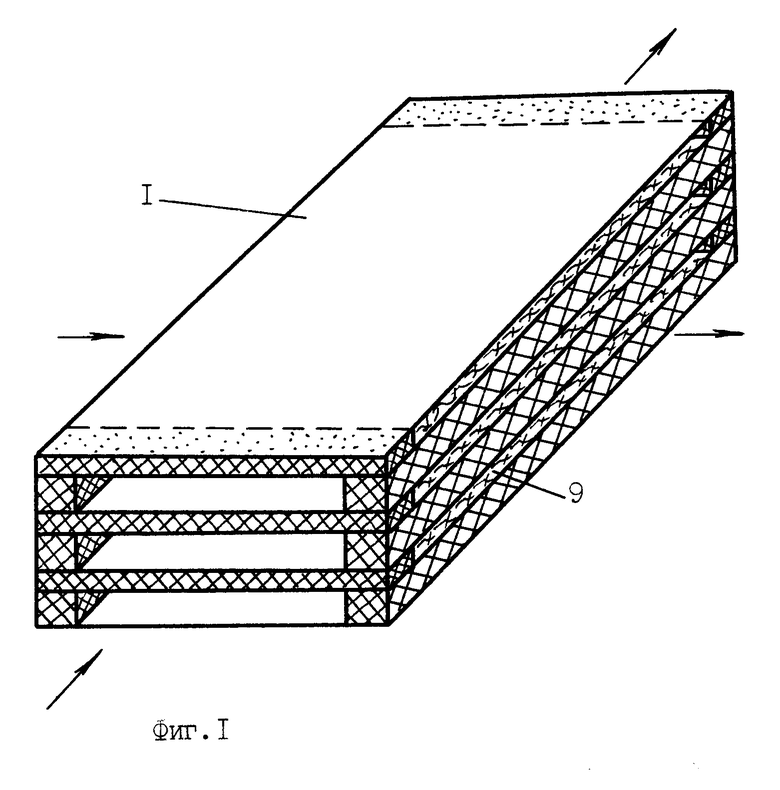
На фиг.2 изображена схема чередования слоев плоских полупроницаемых мембран и сепарационных элементов со средствами герметизации камер в мембранном модуле и очищающим агентом-сорбентом.
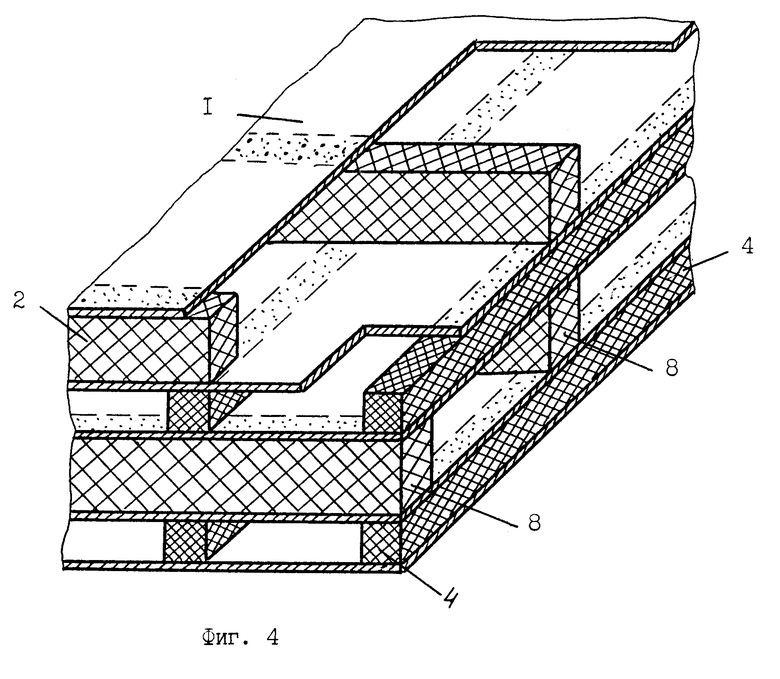
На фиг. 4 схема конструкции композиционных опорных элементов-колонн, образованных чередованием неразъемно соединенных друг с другом слоев мембран и сепарационно-герметизирующих планок-полосок.
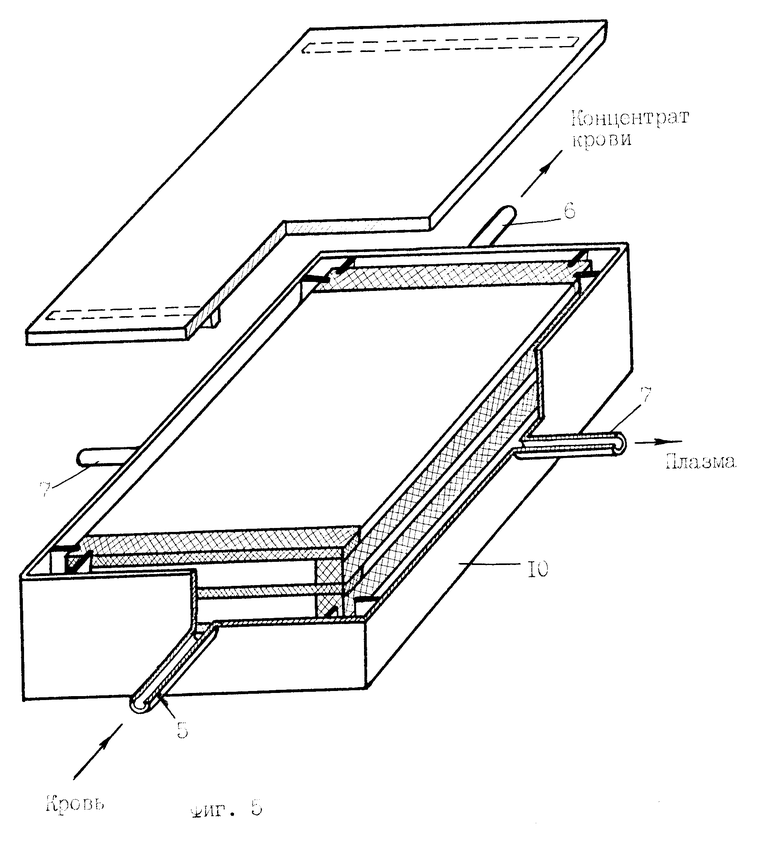
На фиг. 5, 6 общий вид вариантов мембранного аппарата для разделения и очистки крови.
Мембранный аппарат для очистки крови содержит расположенный в жестком 10 или мягком 11 корпусе (фиг.5, 6) многокамерный мембранный модуль для разделения крови и очистки плазмы (фиг.1, 3), состоящий из набора плоских трековых мембран 1 и сепарационно-дренажных элементов камер крови 2 и камер плазмы 3 со средствами герметизации 4 в виде полос-планок из материала, содержащего термопласт, например, полимерный клей-расплав на основе силоктана. Камеры крови 12 и камеры плазмы 13 в мембранном модуле выполнены в виде плоских, щелевых, открытых со сторон подвода и отвода сред каналов, обеспечивающих взаимно перекрестное движение крови и плазмы в камерах. При этом камеры крови (фиг.5, 6) сообщаются через распределитель крови и коллектор концентрата крови с патрубками подвода 5 и отвода 6 разделяемой среды, а камеры плазмы сообщаются, соответственно, с коллекторами плазмы и патрубками отвода плазмы 7. Перекрестно направленные в камерах крови и камерах плазмы полосы-планки 2, 4 образуют по углам или в боковых сторонах мембранного модуля вертикальные опорные композиционные элементы-колонны 8 (фиг.4), получаемые неразъемно соединенными друг с другом слоями мембран и сепарационно-герметизирующих полос-планок 2, 4. При этом сепарационные прокладки в камерах плазмы 3 выполнены из микропористого материала 9, содержащего очищающий агент-сорбент, например, из волокнистого нетканного материала на основе полиамида или стеклобумаги из микротонкого волокна, содержащих волокнистый или порошковый сорбент. В качестве сорбента используют углеродные сорбенты медицинского назначения, например, гранулированные марки ИГИ (гс), СУГС, СКН и др. или волокнистые сорбенты типа Актилена и Ваулена (толщина волокон 6-8 мкм, длина 20-30 мкм), или другие, предназначенные для очистки биологических жидкостей, сорбенты (10).
Характерной особенностью предложенных мембранных аппаратов является использование в качестве мембранного материала трековых мембран, которые представляют собой тонкие (от 5 до 10 микрон) полимерные пленки (например, из лавсана или капрона), в которых специальными технологическими методами изготовлены сквозные цилиндрические поры диаметром от 0,05 до 2 мкм (12). От традиционных, получаемых методами химической технологии, мембран трековые мембраны отличаются высокой однородностью геометрических размеров и правильностью форм пор, высокой селективностью по отношению к выделяемому компоненту, очень низкой адсорбцией компонентов разделяемых сред поверхностью мембраны, биологической инертностью, полной совместимостью с компонентами крови и низким травмирующим действием на форменные элементы крови.
Однако, наряду с высокими функциональными показателями трековые мембраны отличаются малой толщиной (до 5 мкм), низкой механической прочностью (трековые мембраны не выдерживают герметизации прижатием к контурам герметизации и ломаются) вследствие малой толщины, высокой электризуемостью и низкой адгезионностью по отношению к традиционным клеям. Это существенно ограничивало использование трековых мембран в аппаратах известных конструкций, где в основном осуществляется штучная укладка заготовок мембранного материала (размер отдельных заготовок равен размеру мембранного аппарата) между сепарационными элементами и герметизация путем механического прижатия мембран к контурам герметизации.
Предлагаемая по изобретению конструкция мембранного аппарата с плоским многокамерным модулем позволяет обеспечить возможность использования преимуществ трековых мембран и нейтрализовать присущие им отрицательные свойства, так как лента мембранного материала в предлагаемом способе укладывается в складки заготовки мембранных модулей при натяге одновременно для нескольких мембранных модулей, что позволяет исключить проявления нежелательных электростатических явлений, связанных с электризуемостью и исключить необходимость непосредственного соприкосновения производственного персонала с мембранным материалом во время изготовления мембранных модулей.
Использование в качестве материала полосок-планок средств герметизации клея-расплава, например, на основе силактана, обеспечивает надежное приклеивание мембраны к зонам герметизации за счет нагрева под нагрузкой (при этом часть разжиженного клея вдавливается в поры мембран) и одновременно обеспечивает надежную герметизацию модуля в корпусе аппарата.
Выполнение сепарационно-дренажных элементов в камерах крови из микропористого материала позволяет равномерно распределить зоны соприкосновения мембран с сепарационными элементами по всей поверхности мембран, что существенно повышает сопротивляемость мембран действию трансмембранного давления и дает возможность повысить эффективность функционирования за счет обеспечения возможности увеличения перепада давления в камерах крови и камерах плазмы без опасения механического повреждения мембран или уменьшить толщину мембран. Причем даже в случае механических дефектов мембран, что возможно по технологическим особенностям производства трековых мембран, в частности при соприкосновении отдельных треков, случайно попавшие в плазму форменные элементы крови задерживаются микропористым материалом и расположенным в нем волокнистым или порошковым сорбентом.
Кроме этого, предложенная конструкция модуля позволяет обеспечить автоматизированное серийное производство мембранных модулей и практически полностью исключить ручной труд при сборке мембранных аппаратов, что обеспечивает возможность их массового производства.
Мембранный аппарат для разделения и очистки крови работает следующим образом.
Кровь подают через патрубок подвода крови 5 (фиг.5, 6, 7) в распределитель крови, в котором происходит распределение крови по щелевым камерам крови. Под действием внешнего давления кровь проходит через камеры крови, а концентрат собирается в выходном коллекторе концентрата крови и отводится через патрубок отвода крови 6. При этом часть содержащейся в крови плазмы под действием трансмембранного давления проникает через поры трековых мембран в камеры плазмы, откуда отводится через патрубки отвода плазмы 7. При прохождении плазмы через микропористые сепарационно-дренажные элементы с сорбентом происходит ее очистка от нежелательных примесей и токсинов.
Для проверки принципиальной работоспособности и эффективности мембранных модулей использованы трековые мембраны из лавсана (ТУ 95-1667-88) шириной 160 мм, толщиной 10 мкм, размерами пор 0,5 мкм и пористостью 10% Трековые мембраны получены путем бомбардирования лавсановой пленки тяжелыми ионами и обработки полученных треков травильным раствором щелочи (11).
В качестве заготовок сепарационно-дренажных элементов в камерах крови использовали капроновую ткань для сит марки 14К4С (ТУ 17 РСФСР-11086-86) толщиной 270 мкм. В качестве клея-расплава использовали силактан (технические условия оформляются).
В качестве заготовок сепарационно-дренажных элементов в камерах плазмы использовали стеклобумагу, полученную из микротонких стекловолокон диаметром 0,25 мкм, а в качестве клея-расплава для полос-планок использовали также силактан. В качестве сорбентов, наиболее эффективных для проведения плазмосорбции, можно использовать углеволоконные материалы, в частности с иммобилизованными на них аффинными лигандами.
Изготовленный мембранный модуль имел следующие параметры: А 52 мм, В106 мм, ширина боковых зон герметизации 7 мм, рабочая площадь мембран 0,165 кв. м, число секций 2 (фиг.2).
При изготовлении указанного мембранного модуля были приняты следующие параметры блока заготовок мембранных модулей: N 3 и М 1. Таким образом, в данном случае в блоке содержалось N x M3 три мембранных модуля.
Изготавливали мембранные модули следующим образом.
Изготавливали микропористые сепарационно-дренажные элементы, причем сепарационно-дренажные элементы камер плазмы содержали волокнистые и/или порошковые сорбенты.
В заготовки сепарационно-дренажных элементов для камер крови и камер плазмы заподлицо с поверхностью импрегнировали полосы-планки средств герметизации из силактана при температуре 130оС.
Разматывали под натягом рулон трековых мембран и образовывали складки, между которыми поочередно устанавливали заготовки сепарационных элементов камер крови и камер плазмы. Полученную таким образом заготовку блока мембранных модулей помещали на основание специального приспособления и нагружали сверху массивной пластиной с массой (1,8-2,0)˙N˙M кг. В рассматриваемом примере масса пластины составила 5 кг. Приспособление с заготовкой блока мембранных модулей в течение 1,5 часов выдерживали при температуре 130оС, в результате чего происходило приклеивание мембран к зонам герметизации. После охлаждения блока заготовок под нагрузкой получили блок мембранных модулей, который разделили навесными способами (например, резкой) на отдельные мембранные модули (фиг.1.3). Полученные таким образом мембранные модули помещали в корпус и закрывали крышкой под действием механической нагрузки. В случае необходимости дополнительно осуществляли нагрев, выдерживание при температуре и охлаждение аппарата для более надежной герметизации мембранного модуля в корпусе.
Соответствие плазмофильтров мировому уровню проверялось путем сравнения их функциональных характеристик с характеристиками плазмофильтров ведущих зарубежных фирм. Испытания проводились на консервированной цитратом человеческой крови с гематокритом 0,42 л/л при скорости тока крови 100 мл/мин. Результаты испытаний приведены в таблице.
Анализ приведенных в таблице сравнительных данных показывает, что по функциональным характеристикам испытуемые плазмофильтры с использованием предлагаемого мембранного модуля вполне соответствуют мировому уровню.
Для проверки эффективности сорбции проводили сравнительные испытания традиционных сорбционных колонок и предлагаемых по изобретению плоскомембранных модулей в соответствии с интегральным текстом для угольных сорбентов по ГОСТ 4453-74.
П р и м е р 1 (традиционные сорбционные колонки). В качестве сорбционного устройства использовали цилиндрическую колонку объемом 10 куб.см. Масса сорбента 5 г. В качестве сорбента использовали сорбент СКН-2к в виде гранулированного угля с размером гранул 0,2 мм и объемом пор по бензолу 0,6-1,0 куб. см/г. В качестве контрольного красителя использовали раствор красителя метиленового голубого с концентрацией 130,4 мг/л. Расход раствора красителя 1 мл/мин, объем пропускаемого через сорбент раствора красителя 400 мл. При этом концентрация красителя в растворе на выходе из колонки составила 68,4 мг/л.
Таким образом, относительный показатель эффективности сорбции в традиционной колонке, численно равный отношению массы адсорбированного красителя к массе сорбента, составил 4,1 мг/л.
П р и м е р 2. Условия опытов аналогичны примеру 1, но масса сорбента 1,2 г, а в качестве сорбционного устройства использовали плоскомембранное устройство заявляемой конструкции с размерами камер 55х110 мм и с шестью камерами высотой по 1 мм с сорбентом СКН-2к. В качестве плоских полупроницаемых мембран использовали трековые мембраны из лавсановой пленки толщиной 10 мкм с размером пор 0,5 мкм и удельной пористостью 10%
Показатель эффективности сорбции в устройстве заявляемой конструкции при этом составил 26 мг/л.
Таким образом, эффективность сорбции в устройствах заявляемой конструкции более чем в шесть раз выше по сравнению с используемыми в настоящее время сорбционными колонками.
Биосовместимость мембранных модулей доказана испытаниями на кроликах.
Использование заявляемых мембранных модулей и способа их изготовления позволяет существенно повысить технологичность и снизить трудоемкость их изготовления за счет обеспечения возможности полной механизации и автоматизации производства, что позволяет обеспечить крупносерийный выпуск остродефицитных в настоящее время мембранных аппаратов для разделения и очистки крови, в частности плазмофильтров. При этом появляется возможность исключения контакта производственного персонала с отдельными деталями мембранных модулей, что повышает стерильность мембранных аппаратов.
Возможность одновременного выделения плазмы и ее очистки в одном аппарате открывает возможность организации непрерывной очистки плазмы, последующего смешения очищенной плазмы и форменных элементов крови и возвращение очищенной крови пациенту.
| название | год | авторы | номер документа |
|---|---|---|---|
| МЕМБРАННЫЙ МОДУЛЬ ДЛЯ РАЗДЕЛЕНИЯ КРОВИ И СПОСОБ ЕГО ИЗГОТОВЛЕНИЯ | 1991 |
|
RU2046647C1 |
| МЕМБРАННОЕ УСТРОЙСТВО И СПОСОБ ЕГО ИЗГОТОВЛЕНИЯ | 1991 |
|
RU2021823C1 |
| МНОГОСЕКЦИОННЫЙ МНОГОКАМЕРНЫЙ МЕМБРАННЫЙ МОДУЛЬ ДЛЯ РАЗДЕЛЕНИЯ ЖИДКИХ СРЕД И СПОСОБ ЕГО ИЗГОТОВЛЕНИЯ | 1991 |
|
RU2036704C1 |
| МЕМБРАННЫЙ АППАРАТ ДЛЯ ПРОВЕДЕНИЯ ПРОЦЕССОВ МАССООБМЕНА И/ИЛИ РАЗДЕЛЕНИЯ ЖИДКИХ СРЕД | 1991 |
|
RU2029610C1 |
| МЕМБРАННЫЙ МОДУЛЬ ДЛЯ РАЗДЕЛЕНИЯ КРОВИ | 1998 |
|
RU2151633C1 |
| СПОСОБ МЕМБРАННОГО ПЛАЗМАФЕРЕЗА ПО ОДНОИГОЛЬНОЙ СХЕМЕ И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 1995 |
|
RU2113863C1 |
| МЕМБРАННЫЙ МОДУЛЬ (ВАРИАНТЫ) И МЕМБРАННОЕ УСТРОЙСТВО (ВАРИАНТЫ) | 2009 |
|
RU2409413C2 |
| МЕМБРАННЫЙ МОДУЛЬ ДЛЯ РАЗДЕЛЕНИЯ ЖИДКИХ СРЕД И СПОСОБ ЕГО ИЗГОТОВЛЕНИЯ | 2000 |
|
RU2156156C1 |
| РЕЛЬЕФНАЯ ПОРИСТАЯ МЕМБРАНА (ВАРИАНТЫ), СПОСОБ ЕЕ ИЗГОТОВЛЕНИЯ (ВАРИАНТЫ) И МЕМБРАННЫЕ ЭЛЕМЕНТЫ ИЗ РЕЛЬЕФНОЙ ПОРИСТОЙ МЕМБРАНЫ (ВАРИАНТЫ) | 2009 |
|
RU2405620C2 |
| СПОСОБ МЕМБРАННОГО ПЛАЗМАФЕРЕЗА ПО ОДНОИГОЛЬНОЙ СХЕМЕ ПОД ДЕЙСТВИЕМ СИЛЫ ТЯЖЕСТИ И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 1995 |
|
RU2113240C1 |

Изобретение относится к медицинской технике, а именно к устройствам для очистки крови от токсичных веществ с помощью сорбентов (С), а также может быть использовано при изготовлении мембранных аппаратов (МА) для разделения и очистки жидких и газообразных сред в химической, биотехнологической и других отраслях промышленности. Для повышения эффективности функционирования МА при одновременном упрощении их конструкции и повышении технологичности их изготовления в МА, содержащем корпус с камерами подвода и отвода крови и расположенные в нем средства для отделения и очистки плазмы, выполненные в виде многокамерного мембранного модуля, содержащего две группы чередующихся, перекрестно направленных по потокам сред камер крови и камер плазмы, образованных набором плоских полупроницаемых мембран (М) и средствами герметизации (СГ) и открытых со сторон подвода и отвода сред, набор сепарационно-дренажных элементов (СДЭ), размещенных в камерах, при этом СГ выполнены в виде планок из материала, содержащего термопласт, расположенных вдоль направления движения сред и неразъемно соединенных с С с образованием в местах контакта с ними опорных элементов в виде колонн, а СДЭ в камерах плазмы выполнены из микропористого материала, содержащего С. В качестве М могут быть использованы трековые М, а планки выполнены из полимерного клея-расплава. 2 з. п. ф-лы, 6 ил. 1 табл.
| Учебное пособие по математике и черчению для слепых | 1961 |
|
SU139949A1 |
| Устройство для сортировки каменного угля | 1921 |
|
SU61A1 |
Авторы
Даты
1995-10-27—Публикация
1991-09-27—Подача