Изобретение относится к области горного дела и может быть использовано при подземном, кучном и чановом выщелачивании золота из кислотоемких руд.
Известны способы и растворы для выщелачивания золотоносных руд, включающие обработку руд щелочными циан-содержащими составами (Лодейщиков В.В. Извлечение золота из упорных руд и концентратов. М. Недра, 1968) в кучах или пачуках на гидрометаллургических заводах с аэрированием кислородом воздуха. Ионы CN-, диффундирующие в направлении к золоту, растворяют его по реакции: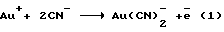
К недостаткам известного решения и состава относится высокая токсичность и экологическая опасность цианидов.
Известен способ и состав (авт. св. СССР N 1319661, кл. E 21 B 43/28, 1985), включающий предварительное закисление руды раствором серной кислоты и выщелачивание золота кислым раствором тиокарбамида, концентрацией 0,03-0,95 г/л, при выдерживании руды на открытом воздухе. К недостаткам известного решения относятся:
высокая стоимость реагента (1500 руб./т);
повышенная агрессивность кислотных растворов к технологическому оборудованию;
цементация золота ионами железа, перешедшими в раствор из руды и его потери;
переход в раствор экологически опасных ионов мышьяка;
относительно большие потери времени на закисление руды при отмывке от примесных ионов (50% и более общей продолжительности работ).
Известен способ и состав для выщелачивания золота, включающий предварительное закисление руды раствором соляной кислоты и выщелачивание руды солянокислыми растворами, включающими галит и молекулярный хлор (Небери В.П. Черпей Э. И. Бабичев Н.И. Красильникова Р.Г. Об извлечении золота из недр способом подземного выщелачивания. Гидрометаллургия золота. М. Недра, 1980, с.63-67), г/л:
HCl 3,6
NaCl 5,8
Cl2 5
Вода Остальное
Данное решение является наиболее близким к предлагаемому по числу общих признаков и выбрано в качестве прототипа. К недостаткам прототипа относятся:
повышенная агрессивность кислотных растворов относительно технологического оборудования;
цементация золота ионами железа, перешедшими в раствор из руды;
переход в раствор экологически опасных ионов мышьяка;
большие потери времени на закисление руды (50% и более от общей продолжительности работ);
относительно низкое извлечение золота: 55% (пример 1);
опасность перевозки и хранения хлора для приготовления хлорной воды;
очень высокий расход кислоты при выщелачивании карбонатных и других кислотоемких руд.
Цель изобретения повышение эффективности извлечения золота, снижение кислотоемкости процесса, обеспечение селективности процесса и устранение опасностей, связанных с приготовлением и использованием хлорной воды и переходом в раствор мышьяка.
Поставленная цель достигается тем, что выщелачивание золота проводят без предварительного закисления и отмывки мышьяка и железа нейтральным раствором, приготовленным непосредственно перед подачей в руду из товарного щелочного гипохлорита натрия (например, гипохлорит натрия ТУ 6-15-746-87) и раствора соляной кислоты, при следующем соотношении ингредиентов, г/л от объема:
Раствор гипохлорита натрия щелочной ТУ 6-15-746-87 (гипохлорита натрия 30-40) 0,6
Раствор соляной кислоты (10-30) 1-4
В товарном щелочном гипохлорите натрия содержание щелочи может изменяться, поэтому для нейтрализации щелочи необходимы различные объемы раствора кислоты (пределы указаны в рецептуре). Но всегда необходимо выдерживать соотношение объемов ингредиентов таким, чтобы полученный раствор имел нейтральную реакцию (pH 7).
Применение нейтрального раствора для выщелачивания золота сводит до минимума переход в раствор ионов железа и ядовитых ионов мышьяка, которые мешают извлечению золота. Расход кислоты, при применении нейтральных растворов может быть снижен пятикратно, по сравнению с прототипом. От предварительного закисления руд можно отказаться, т.к. железо и мышьяк в раствор, практически, не переходят.
Как было установлено экспериментально, снижение эффективности выщелачивания кислыми хлорными хлоридными растворами (по прототипу), при переходе в раствор железа, обусловлено низким окислительно-восстановительным потенциалом среды: + 700-800 мВ, который не обеспечивает устойчивость комплексных ионов золота (AuCl4)-. Снижение эффективности также обусловлено седиментацией золота железом.
Эффективность выщелачивания по предлагаемому способу обеспечивается тем, что нейтрализацию раствора кислоты щелочным раствором гипохлорита осуществляют непосредственно перед подачей в руду. Атомарный хлор, выделяющийся при смешении растворов по реакции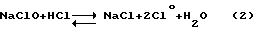
и не успевший соединиться в молекулу Cl2, очень агрессивен по отношении к золоту. Избыток кислоты нейтрализуется щелочью из товарного раствора щелочного гипохлорита.
Сопоставительный анализ с прототипом позволяет сделать вывод, что предлагаемый состав для выщелачивания золота отличается от известного введением нового компонента щелочного гипохлорита натрия или калия, в пропорции, обеспечивающей нейтрализацию кислоты в известном составе.
Отличается решение и по способу выщелачивания: в предлагаемом решении, в отличие от прототипа, выщелачивание проводят без предварительного закисления нейтральными растворами, приготовленными непосредственно перед закачкой в руду, что дает неожиданный эффект повышенную агрессивность раствора и селективность по отношению к золоту (за счет выделения атомарного хлора), при низких расходах кислоты даже в высококарбонатных рудах и других кислотоемких рудах. Сокращается время выщелачивания.
Анализ известных составов для выщелачивания золота показал, что отдельные компоненты из предлагаемого состава известны: HCl, NaOH. Однако, их применение в сочетании с другими компонентами, а не друг с другом и гипохлоритом натрия (калия) в предлагаемых пропорциях, например с тиомочевиной, NaCl, Cl2, не обеспечивает выщелачивающим растворам такие свойства, которые они проявляют в предлагаемом решении: селективность и агрессивность по отношению к золоту, экологическая безопасность продуктов реакции, низкий расход химреагентов и высокая скорость выщелачивания.
Совокупность операций по выщелачиванию золота: выщелачивание без предварительного закисления растворами, нейтрализованными перед подачей в руду. Без соблюдения данных условий эффект от применения предлагаемого состава снижается и близок к прототипу.
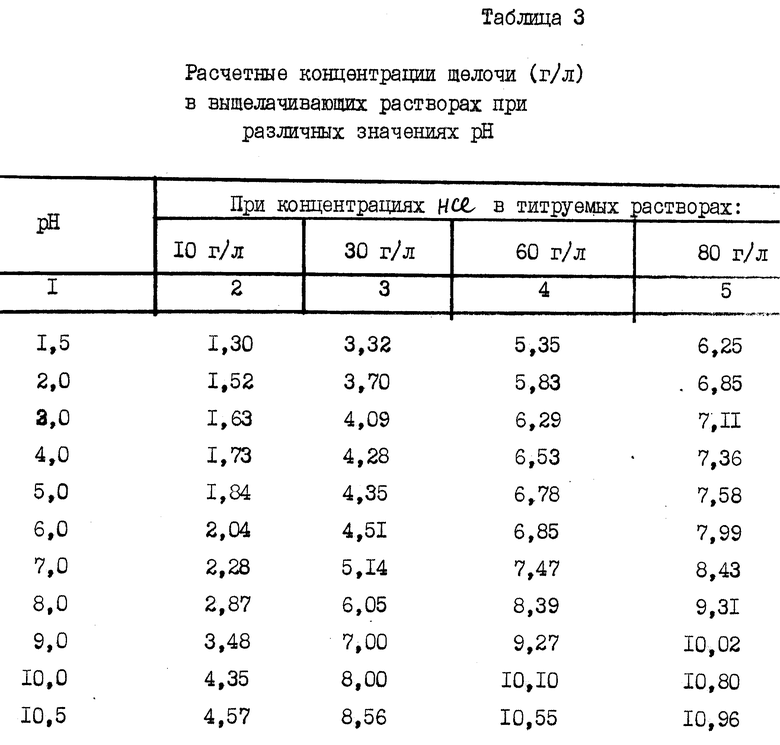
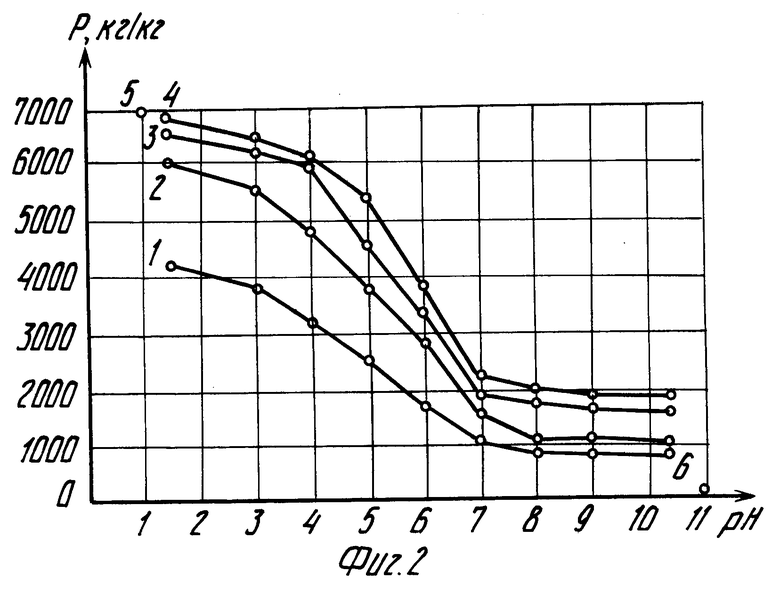
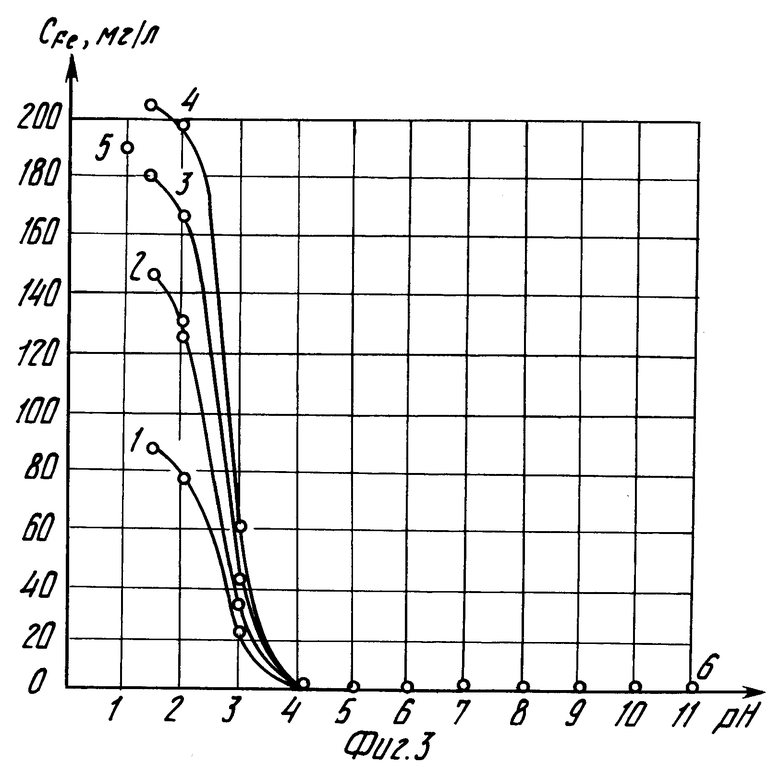
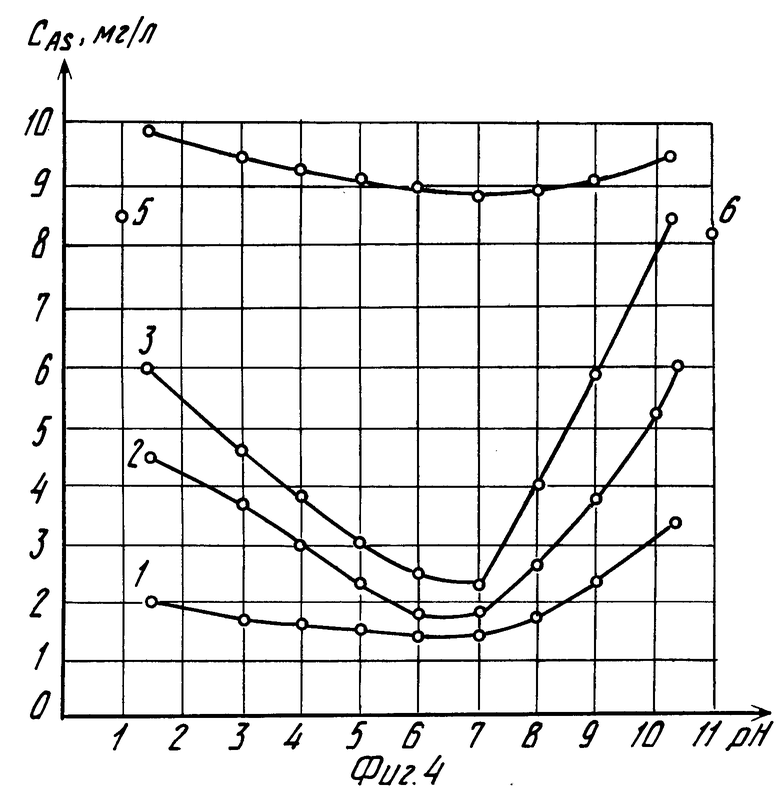
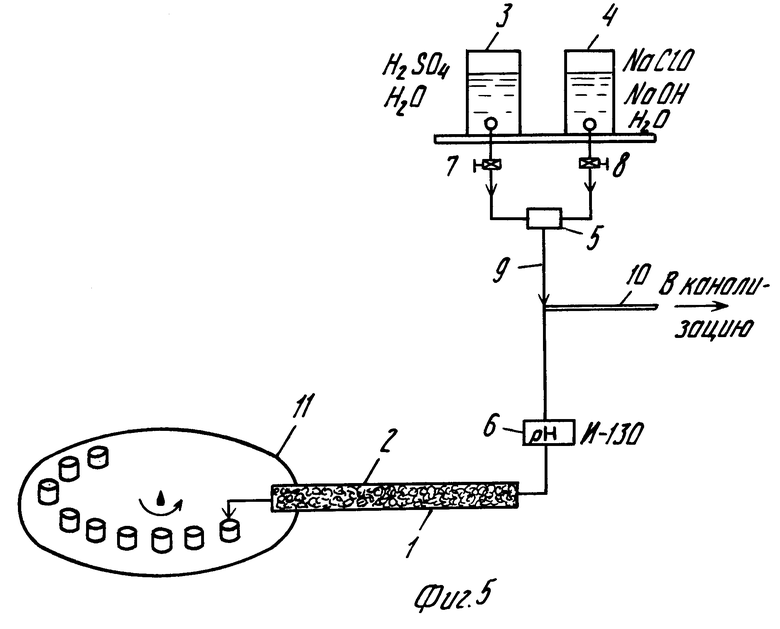
На фиг. 1 и 2 представлены зависимости степени извлечения золота и кислотоемкости от pH раствора; на фиг. 3 и 4 зависимости концентраций раствора железа и мышьяка от pH; на фиг. 5 лабораторная установка для проведения испытаний.
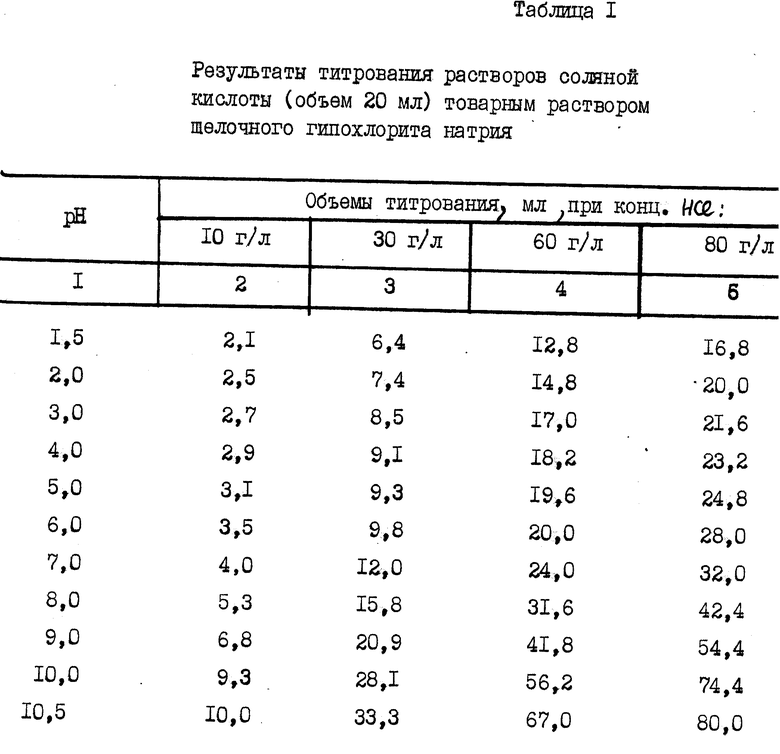
Пример 1. Для проверки эффективности предлагаемого состава и способа выщелачивания золота были выполнены лабораторные опыты, результаты которых представлены в табл. 1.
Были приготовлены навески по 0,2 кг дробленой руды месторождения Коклатас (Узбекистан). Класс крупности 2 мм. Руда сульфидная, окисленная, мышьяковистая, карбонатная (кислотоемкость 70 кг/т). Навески отбирали квартованием. Исходная концентрация золота 2 г/т. Выщелачивание проводили в агитационном режиме, при соотношении Ж Т 3 1. Выщелачивающие растворы готовили следующим образом: в емкостях с водой растворяли соляную кислоту до концентраций 10, 30, 60, 80 г/л. Полученные растворы титровали до нужного значения pH щелочным раствором гипохлорита натрия. Замерив объем ушедшей на титрование кислоты до pH 7, рассчитали количество щелочи в товарном растворе щелочного гипохлорита 13,7 г/л. Объемы растворов гипохлорита, которые пошли на титрование до различных значений pH, представлены в табл. 1.
Зависимости степени извлечения золота (γ,%), кислотоемкости (P, кг/т) от pH раствора и соотношения концентраций кислоты и гипохлорита представлены на фиг. 1 и 2. Переход в раствор железа и мышьяка, в зависимости от тех же условий, охарактеризован на фиг. 3 и 4.
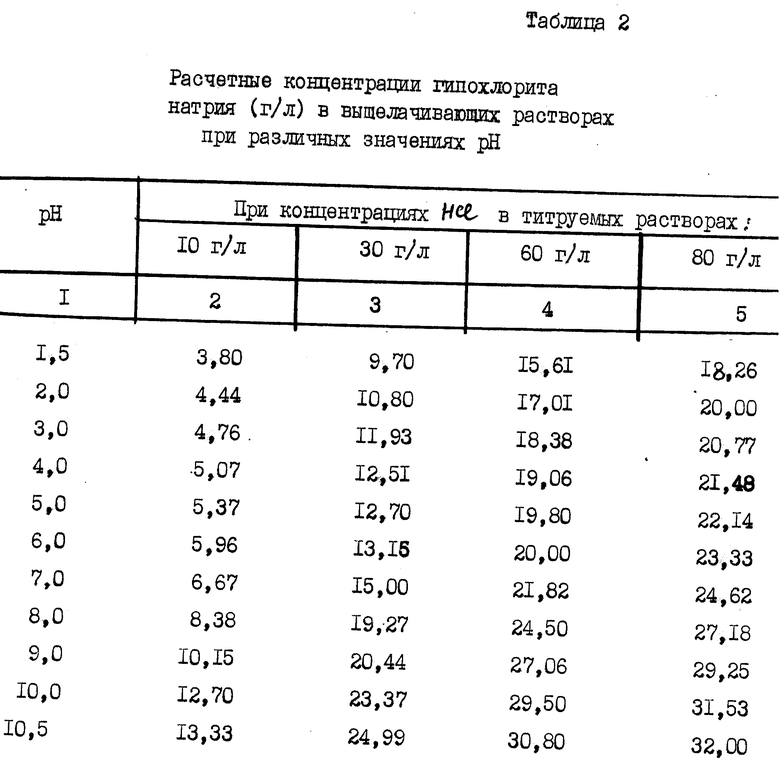
Кривые под номером 1 на всех фигурах соответствуют первоначальной концентрации HCl в выщелачивающем растворе 10 г/л, концентрации гипохлорита натрия 3,80-13,33 г/л, щелочи 1,30-4,57 (табл. 2 и 3). Кривые под номером 2 на всех фигурах соответствуют первоначальной концентрации HCl 30 г/л, концентрации гипохлорита натрия 9,70-24,99 г/л, щелочи 3,32-8,56 г/л; кривые под номером 3 на всех фигурах соответствуют первоначальной концентрации HCl 60 г/л, концентрации гипохлорита натрия 15,61-30,80 г/л, щелочи 5,35-10,55 г/л; кривые под номером 4 соответствуют первоначальной концентрации HCl 80 г/л, концентрации гипохлорита натрия 12,26-32,00 г/л, щелочи 6,25-10,96 г/л.
Кроме того, на фигурах показаны: точка 5 результат выщелачивания по прототипу: закисление 1,25 нормальным раствором HCl в течение 10 сут и выщелачивание раствором HCl (3,6 г/л) плюс NaCl (5,7 г/л) плюс Cl2 (5 г/л); точка 6 результаты выщелачивания товарным раствором щелочного гипохлорита натрия ТУ 6-15-746-87.
Как видно на фиг. 1, с переходом от кислой среды к щелочной, извлечение падает с 70-100% до 25-40% Извлечение сильнокислыми растворами и нейтральными примерно одинаковое. На кривых изменений удельного расхода кислоты на 1 кг извлеченного золота (фиг. 2), переход в область высоких расходов кислоты находится левее точки с pH 7.
Подводя итог рассмотрению фиг. 1 и 2, находим, что оптимальной является нейтральная среда (pH 7). Оптимальное соотношение ингредиентов: концентрация HCl (начальная концентрация до взаимодействия со щелочным гипохлоритом) от 10 до 60 г/л; концентрация гипохлорита натрия 6-22 г/л (табл. 2, 7 строка), щелочи NaOH 2,3-7,5 г/л.
Данный вывод подтверждают и результаты определений концентраций железа (фиг. 3) и мышьяка (фиг. 4). Например, при изменении pH среды с 2-х до 7-ми, концентрация железа в растворе падает со 160 до 0,3 мг/л. Далее (pH>7) изменения концентраций железа незначительны (фиг. 3).
На фиг. 4 кривые изменений концентраций мышьяка, при pH 7 имеют характерный минимум. С увеличением концентрации водородных ионов (pH<7), активизируется разложение арсенопирита, но и сдвигается реакция окисления арсенопирита в сторону образования нерастворимых соединений в основном арсенатов железа (Плаксин И.П. Гидрометаллургия. Избранные труды. М. Наука, 1972). При увеличении pH (более 7), растворимость мышьяка возрастает. Результирующая кривая, характеризующая эти 2 разнонаправленных процесса (растворение выделение мышьяка) в зависимости от pH, имеет минимум при pH 7, что тоже говорит в пользу нейтральной среды.
Сравнивая полученные данные выщелачивания золота по предлагаемому способу и составу и по прототипу (точка 5 на фиг. 1-4), находим, что процесс выщелачивания по предлагаемому способу идет эффективнее: получено большее извлечение, израсходовано меньшее количество химреагентов, получены меньшие концентрации мышьяка и железа в растворе.
Процесс выщелачивания товарным щелочным гипохлоритом натрия без добавления кислоты неэффективен (точка 6 на фиг. 1-4).
Пример 2. Руду 1 (фиг. 5) месторождения "К" помещали в фильтрационную колонку 2, длиной 0,7 м и диаметром 0,05 м. Выщелачивающий раствор из емкостей 3 и 4 подавали под избыточным напором, обеспечивающим фильтрацию раствора через руду. В смесителе 5 происходила реакция взаимодействия щелочного гипохлорита с кислотой, в результате получали раствор с заданным значением pH, контролируемым pH метром 6 марки И-130. Растворы с различными значениями pH получали, регулируя скорости подачи раствора краном 8, задав нужную скорость истечения раствора кислоты краном 7 из емкости 3. Постоянство скорости истечения обеспечивалось капилляром 9, избыток раствора отводили в канализацию через шланг 10. На выходе из колонны отбирали пробы раствора автоматическим пробоотборником 11. Было отработано 2 колонны. Первая кислотным раствором с добавкой щелочного гипохлорита натрия, вторая нейтральным раствором, приготовленным из воды, соляной кислоты и щелочного гипохлорита натрия. Исходная концентрация HCl 20 г/л. Результаты сведены в табл. 4.
Как видно из табл. 4, выщелачивание нейтральным раствором дало большее извлечение и меньший расход химреагентов, чем при выщелачивании кислотным раствором.
Пример 3. Выщелачивание проводили в той же последовательности, что и в примере 2 на 2-х фильтрационных колонках кислотным и нейтральным растворами, но растворы в колонны подавали не сразу после смешения соляной кислоты, воды и щелочного гипохлорита натрия, а спустя 10 дн. Результаты выщелачивания представлены в табл. 5.
Пример 4. Выщелачивание проводили в одной колонне нейтральным раствором в той же последовательности, что в примере 2, но в качестве щелочного раствора гипохлорита натрия брали не товарный раствор (ТУ 6-15-746-87), а раствор полученный путем электролиза 17%-го раствора поваренной соли в проточном бездиафрагменном электролизере при плотности тока 1000-1400 А/м2. Размер лабораторного электролизера 5x10x0,5 см. Питание от источника тока ВД-60, подключенного к электродам через делитель напряжения. Напряжение на электродах 3-5 В. Полученный щелочной гипохлорит натрия (35-40 г/л) смешивали с раствором соляной кислоты (20 г/л) в пропорции, обеспечивающей pH среды на уровне 7. При Ж Т 1,5 достигнуто извлечение 84% золота из окисленной сульфидной руды месторождения Кокпатас.
Пример 5. Выщелачивание проводили в одной колонне нейтральным раствором в той же последовательности, что и в примере 2, но соляную кислоту (20 г/л), после поступления первых порций раствора на выходе из колонны получали путем электролиза раствора, отобранного на выходе колонны и пропущенного через слой ионита АМ-2Б. Электролиз проводили в диафрагменном проточном электролизере размером 5x10x0,5 см. Диафрагма брезентовая со специальной пропиткой. Кислоту отбирали в анодной камере.
Полученный таким образом раствор соляной кислоты смешивали со щелочным гипохлоритом натрия в пропорции, обеспечивающей нейтральную реакцию среды (pH 7). Извлечение при Ж Т 1,5 составило 85% удельный расход кислоты на 1 кг золота составил 21094 кг/кг против 29477 кг/кг в опыте без электролиза маточного раствора (пример 2, табл. 4, графу 4).
Пример 6. Выщелачивание проводили в трех колоннах нейтральными растворами в той же последовательности, что и в примере 2, но кислотные растворы готовили на основе серной (26,4 г/л), азотной (34,6 г/л) и фосфорной (18,1 г/л) кислот. Нормальность кислотных растворов соответствовала нормальности раствора соляной кислоты концентрацией 20 г/л, используемого в предыдущих опытах (примеры 2-5). Растворы смешивали с щелочным гипохлоритом в пропорциях, обеспечивающих нейтральную реакцию среды и сразу же подавали каждый в отдельную колонну. Извлечение при Ж Т 1,5 раствором, включающим серную кислоту, составило 77% азотную кислоту 82% фосфорную 69%
Таким образом, в выщелачивающем растворе может быть использована не только соляная, но и другие минеральные кислоты. Но применение HCl предпочтительней, т.к. она дает большее извлечение (84-85%).
Технико-экономический эффект предлагаемого технического решения, в сравнении с базовым вариантом, рассчитан по увеличению степени извлечения золота из условных 1000 т руды месторождения "К"
Э 1000•(Уц•(K1-K2)•C) 1000•(25•(0,94-0,55)•2) 22000 руб.
где Уц условная прибыль (25 руб. за 1 г);
K1 извлечение по предлагаемому техническому решению 0,84 (фиг. 1, пример 1 в описании);
K2 извлечение по прототипу 0,55 (фиг. 1, точка 5, пример 1 описания);
C концентрация золота в руде (2 г/т).
| название | год | авторы | номер документа |
|---|---|---|---|
| СОСТАВ И СПОСОБ ДЛЯ ВЫЩЕЛАЧИВАНИЯ ЗОЛОТА | 1991 |
|
RU2093672C1 |
| КОМБИНИРОВАННЫЙ СПОСОБ КУЧНОГО ВЫЩЕЛАЧИВАНИЯ ЗОЛОТА ИЗ УПОРНЫХ СУЛЬФИДНЫХ РУД | 2012 |
|
RU2502814C2 |
| СПОСОБ ПЕРЕРАБОТКИ МИНЕРАЛЬНОГО СЫРЬЯ, СОДЕРЖАЩЕГО ЗОЛОТО И СЕРЕБРО, ИЗ РУД НА МЕСТЕ ИХ ЗАЛЕГАНИЯ | 1999 |
|
RU2146763C1 |
| СПОСОБ ВЫЩЕЛАЧИВАНИЯ СУЛЬФИДНЫХ НЕОКИСЛЕННЫХ ЗОЛОТОМЫШЬЯКОВИСТЫХ РУД | 1991 |
|
RU2080449C1 |
| СПОСОБ ИЗВЛЕЧЕНИЯ ЗОЛОТА ИЗ РУД НА МЕСТЕ ИХ ЗАЛЕГАНИЯ | 2003 |
|
RU2246002C1 |
| Способ извлечения золота из золотосодержащего сырья | 2020 |
|
RU2758915C2 |
| СПОСОБ ИЗВЛЕЧЕНИЯ МЕТАЛЛОВ ИЗ МЕТАЛЛСОДЕРЖАЩЕГО МИНЕРАЛЬНОГО СЫРЬЯ | 2010 |
|
RU2476610C2 |
| СПОСОБ ИЗВЛЕЧЕНИЯ ЗОЛОТА ИЗ ЦИАНИСТЫХ РАСТВОРОВ И ПУЛЬП | 1991 |
|
RU2026389C1 |
| СПОСОБ ИЗВЛЕЧЕНИЯ БЛАГОРОДНЫХ МЕТАЛЛОВ ИЗ РУД | 1998 |
|
RU2137855C1 |
| СПОСОБ ПЕРЕРАБОТКИ ЗОЛОТОСУРЬМЯНЫХ КОНЦЕНТРАТОВ | 2009 |
|
RU2412264C2 |


Изобретение относится к горному делу и может быть использовано при подземном кучном и чановом выщелачивании золота из кислотоемких руд. Способ включает приготовление выщелачивающего раствора соляной кислоты и подачу его в руду. Новым является то, что непосредственно перед подачей в руду раствор соляной кислоты нейтрализуют путем добавления в него раствора товарного щелочного гипохлорита натрия или калия. Используют гипохлорит натрия (ТУ-6-15-746-87) или полученный электролизом. Раствор гипохлорита натрия (ТУ-6-15-746-87) подают в количестве 0,6 объема при 1-4 объемах раствора соляной кислоты. 2 с. и 2 з.п. ф-лы, 5 ил., 5 табл.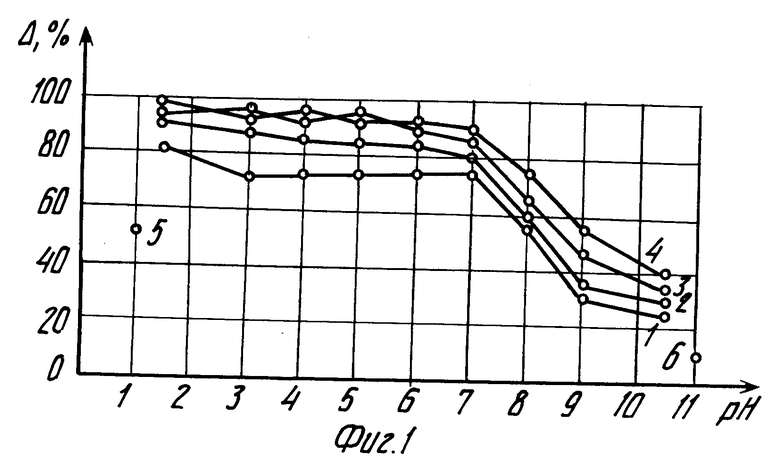
| Лодейщиков В.В | |||
| Извлечение золота из упорных руд и концентратов | |||
| - М.: Недра, 1968 | |||
| Небера В.П | |||
| и др | |||
| Об извлечении золота из недр способом подземного выщелачивания | |||
| Гидрометаллургия золота | |||
| - М.: Недра, 1980, с | |||
| Способ приготовления сернистого красителя защитного цвета | 1915 |
|
SU63A1 |
Авторы
Даты
1997-10-27—Публикация
1991-11-26—Подача