Настоящее изобретение относится к разветвленным алкиламинопроизводным тиазола, способам их получения и содержащим их фармацевтическим композициям.
Некоторые производные 2-амино-тиазола уже известны. В европейской заявке на патент ЕР-0462264 описываются производные 2-амино-тиазола, третичная аминогруппа которых в положении 2 включает 2 заместителя, содержащих каждый по крайней мере один гетероатом. Эти заместители представляют собой производные ароматических или алифатических аминов или производные кислот, кетонов, амидов или тиокетонов. Все эти соединения являются антагонистами ФАТ-acether и находят свое применение при лечении астмы, некоторых аллергических состояний или некоторых воспалительных состояний, заболеваний сердечно-сосудистой системы, гипертонии и различных почечных патологий или в качестве противозачаточных средств. В заявке на патент Великобритании N2022 285 описываются соединения, обладающие контролирующей иммунный ответ активностью и противовоспалительными свойствами. Речь идет о производных тиазола, замещенных в положении 2 вторичными аминогруппами.
Некоторые гетероциклические производные 2-ациламино-тиазола описаны в европейском патенте ЕР-0432040. Эти соединения являются антагонистами холецистокинина и гастрина. Также известны производные 2-амино-4,5-дифенил-тиазола, обладающие противовоспалительными свойствами (патент Японии N0175475). Также известны производные 2-амино-4-/4-оксифенил/-тиазола, пригодные в качестве промежуточных продуктов синтеза для получения производных 2,2-диарил-хромено-тиазола (европейский патент N0205069). Производные 2-/N-метил-N-бензил-амино)-тиазола также описаны в J. Chem. Soc. Perkin, Trans (1984), 2, с.147 153 и в J. Chem. Soc. Perkin, Trans (1983), 2, с.341 347.
В заявке на патент ЕР-N0283390 описываются и заявлены, среди прочих производных тиазола, производные 2-/N-алкил-N-пиридил-алкиламино/-тиазола формулы: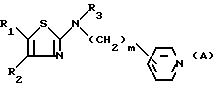
Эти производные, аминогруппа которых в положении 2 замещена неразветвленным пиридил-алкильным радикалом, обладают фармакологически интересными свойствами и особенно проявляют активность, стимулирующую холинергическую центральную передачу. Следовательно, они могут быть использованы в качестве агонистов мускариновых рецепторов и находят свое применение при лечении расстройств памяти и старческого слабоумия.
Соединения настоящего изобретения отличаются от других производных 2-амино-тиазола, описанных в литературе, своими оригинальными структурами и своими новыми фармакологическими свойствами.
Речь идет о производных 2-амино-тиазола, аминогруппа которых в положении 2 представляет собой третичный амин, имеющий алкильный или аралкильный разветвленный заместитель.
Эта особенная структура придает продуктам изобретения очень интересные фармакологические свойства. В самом деле, соединения изобретения в очень незначительных концентрациях ниже 10 мкмоль смещают связь 125I - CRF (125I-кортиколиберин) специфических рецепторов, имеющихся в мембранах коры крысы. Соединения изобретения, следовательно, являются модуляторами эффектов фактора высвобождения кортикотропного гормона (CRF), нейропептида, который контролирует активность гипоталамо-надпочечниковой оси, и находят свое применение при лечении заболеваний, связанных со стрессом, и преимущественно при лечении патологий, связанных с CRF, таких, как, например, психиатрические нарушения, беспокойство, психическая анорексия или другие.
Предметом настоящего изобретения более конкретно являются разветвленные алкиламино-производные тиазола формулы (I):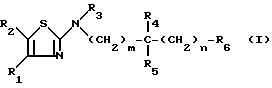
в которой: R1 обозначает радикал формулы A1 или радикал формулы A2: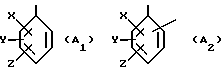
(в которых X, Y, Z, одинаковые или разные, обозначают каждый атом водорода, атом галогена, алкокси-радикал с 1 5 C-атомами, алкильный радикал с 1 5 C-атомами, гидроксильный радикал, пиано-радикал, нитрорадикал, трифторметильный радикал или аралкильный радикал с 7 9 C-атомами);
R2 обозначает атом водорода, атом галогена, алкильный радикал с 1 5 C-атомами, оксиметильный или формильный радикал;
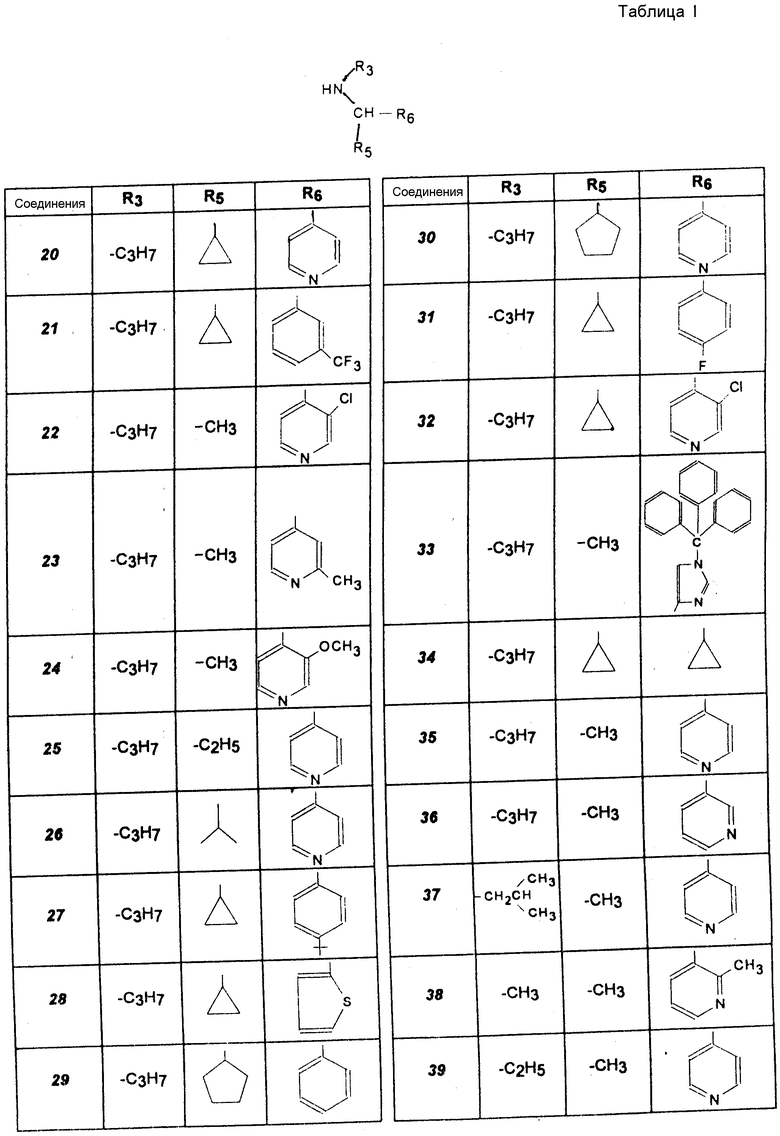
R3 обозначает алкильный радикал с 1 -5 C-атомами, циклоалкильный радикал с 3 -8 C-атомами, алкенильный радикал с 2 6 C-атомами, циклоалкилалкильный радикал с 4 8 C-атомами, или фенильный радикал;
R4 обозначает атом водорода, алкильный радикал с 1 5 C-атомами, циклоалкильный радикал с 3 6 C-атомами, или циклоалкилалкильный радикал с 4 8 C-атомами, с линейной или разветвленной цепью;
R5 обозначает алкильный радикал с 1 -5 C-атомами; циклоалкильный радикал с 3 -8 C-атомами, в известных случаях замещенный алкильными радикалами с 1 5 C-атомами; циклоалкилалкильный радикал с 4 8 C-атомами, имеющий линейную или разветвленную цепь; алкенильный радикал с 2 6 C-атомами, или радикал формулы (В):
(в которой "p" 0, 1, 2 или 3);
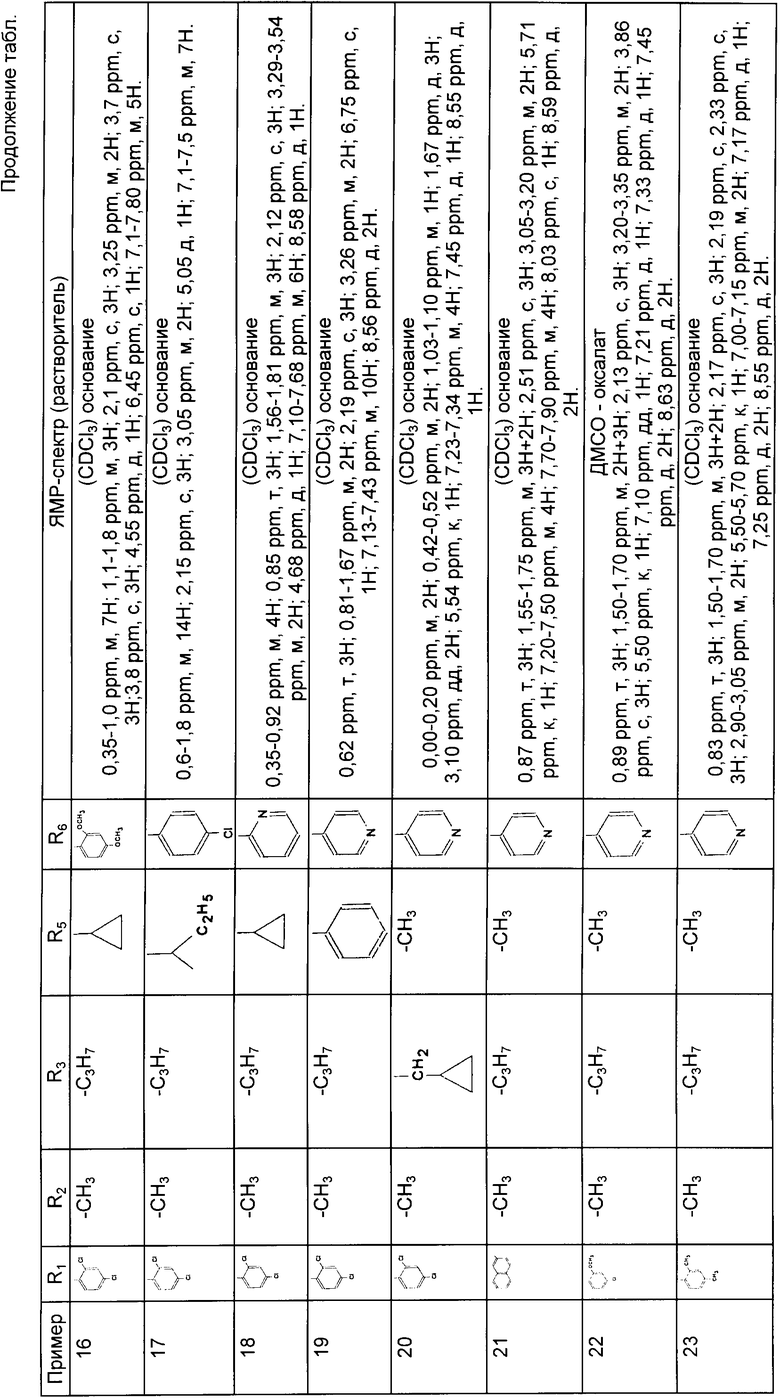
R6 обозначает фенильный радикал, пиридильный радикал, имидазолильный радикал, пирролильный радикал, тиенильный или фурильный радикал (в известных случаях замещенные одним или несколькими атомами галогена, алкокси-радикалами с 1 5 C-атомами, алкильными радикалами с 1 5 C-атомами, гидроксидами, цианогруппами, нитро-группами, трифтор-метильными радикалами, метилтио-радикалами или радикалами формулы (В)) или циклоалкильный радикал с 3 8 C-атомами, в известных случаях замещенный алкильными радикалами с 1 5 C-атомами;
m, n, одинаковые или разные, обозначают каждый 0 или 1;
их стереоизомеры и их соли присоединения неорганической или органической кислоты.
Предпочтительными соединениями изобретения являются соединения формулы I, в которой:
R1 обозначает радикал формулы A1,
R2 обозначает атом галогена, или алкильный радикал с 1 5 C-атомами,
R3 обозначает алкильный радикал с 1 -5 C-атомами, циклоалкильный радикал с 3 -8 C-атомами, или алкенильный радикал с 2 -6 C-атомами,
R5 обозначает алкильный радикал с 1 -5 C-атомами; циклоалкильный радикал с 3 -8 C-атомами, в известных случаях замещенный алкильными радикалами с 1 5 C-атомами; или циклоалкилалкильный радикал с 4 8 C-атомами, имеющий линейную или разветвленную цепь, и R4, R6, m и n имеют указанное для формулы I значение,
их стереоизомеры, также как их соли присоединения неорганической или органической кислоты.
Из них особенно предпочтительная группа соединений может быть представлена формулой IA: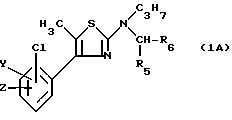
в которой: Y и Z имеют то же самое значение, что и в формуле I,
R5 обозначает алкильный радикал с 1 -5 C-атомами или циклоалкильный радикал с 3 8 C-атомами, в известных случаях замещенный алкильными радикалами с 1 5 C-атомами, или циклоалкилалкильный радикал с 4 - 8 C-атомами, имеющий линейную или разветвленную цепь;
R6 обозначает фенильный радикал или пиридильный радикал (в известных случаях замещенные одним или несколькими атомами галогена, алкокси-радикалами с 1 5 C-атомами, алкильными радикалами с 1 5 C-атомами, гидроксидами, цианогруппами, нитрогруппами, трифторметильными радикалами или метилтио-радикалами); имидазолильный радикал, в известных случаях замещенный алкильным радикалом с 1 5 C-атомами, или циклоалкильный радикал с 3 8 C-атомами, в известных случаях замещенный алкильными радикалами с 1 5 C-атомами,
их стереоизомерами и их солями присоединения неорганической или органической кислоты.
Радикал -C3H7 формулы IA обозначает н-пропильный радикал.
Под термином алкильный или алкенильный радикал понимают линейные или разветвленные радикалы.
Из предпочтительных соединений изобретения можно назвать следующие соединения:
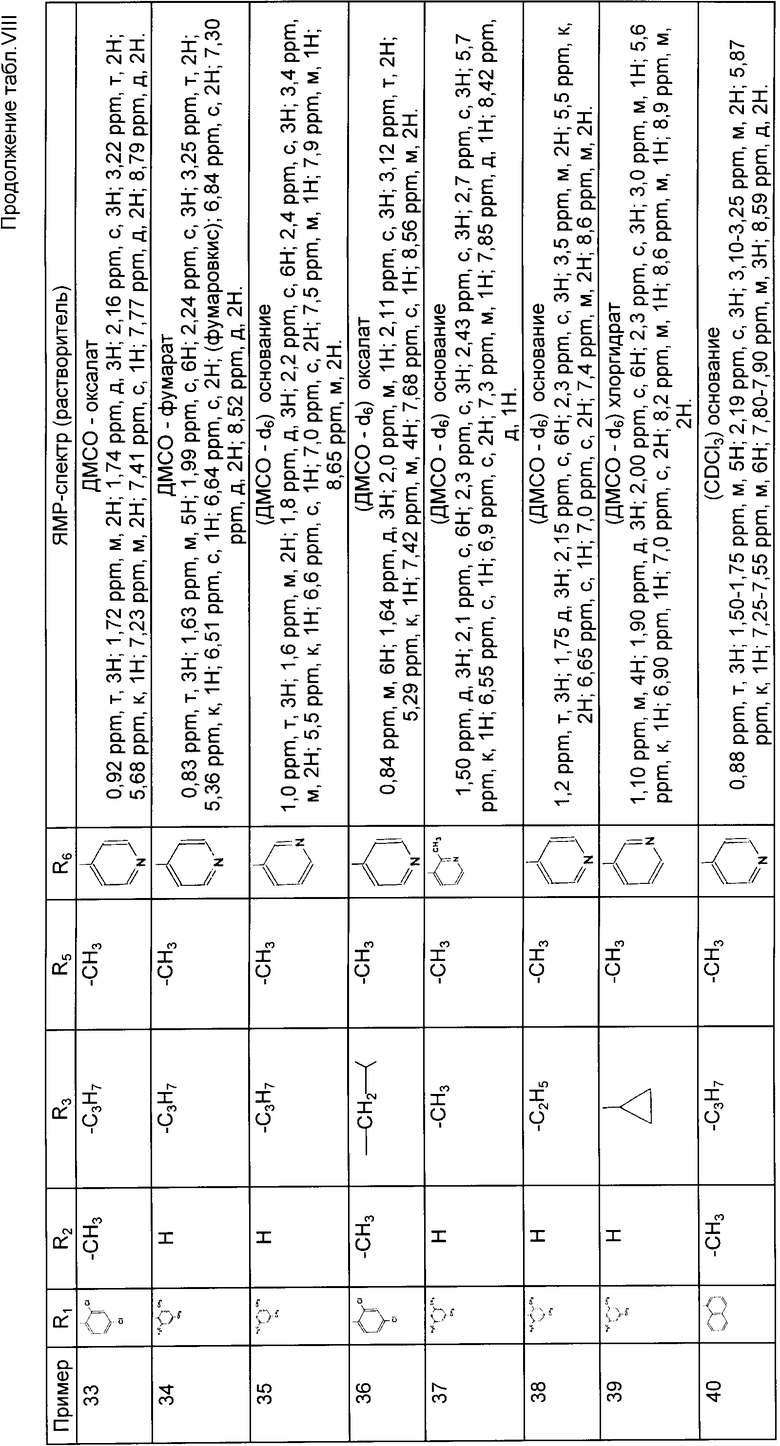
4-/5-хлор-2-метоксифенил)-5-метил-2-/N-пропил-N-/1-пирид-4-ил-1-этил/-амино/-тиазол;
4-/4-хлор-2-метилфенил)-5-метил-2-/N-пропил-N-/1-пирид-4-ил-1-этил)-амино/-тиазол;
4-/2-хлор-4-метилфенил/-5-метил-2/N-пропил-N-/1-пирид-4-ил-1-этил/-амино/-тиазол;
4-/2-хлор-4-метоксифенил/-5-метил-2/N-пропил-N-/1-пирид-4-ил-1-этил/-амино/тиазол;
5-бром-4-/2,4-дихлор-фенил/-2-/N-пропил-N-/1-пирид-4-ил-1-этил/-амино/-тиазол;
4-/2,4-дихлор-фенил/-5-метил-2/N-пропил-2-ен-N-/1-пирид-4-ил-1-этил/- амино/-тиазол;
4-/2,4-дихлор-фенил/-5-метил-2-/N-/ α-метил-бензил/-N-пропил-амино/-тиазол;
4-/2,4-дихлор-фенил/-5-метил-2-/N-/циклопропил-пирид-4-ил-метил/-N-пропил-амино/-тиазол;
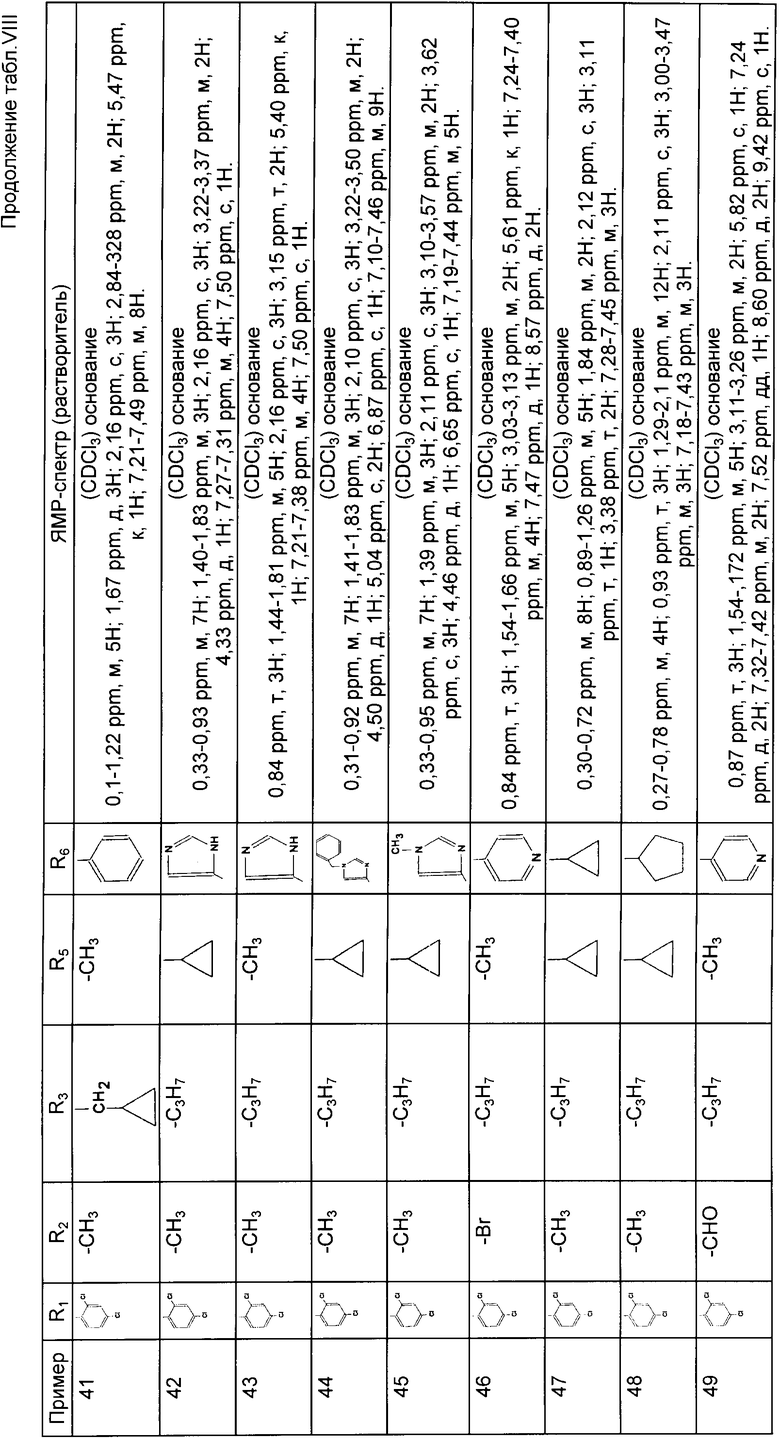
4-/2,4-дихлор-фенил/-5-метил-2-/N-пропил-N-/1-пирид-4-ил-1-этил/-амино/-тиазол;
4-/2,4-дихлор-фенил/-5-метил-2-/N-/1-/2-метил-пирид-4-ил/-1-этил/N-пропил-амино/-тиазол;
4-/2,4-дихлорфенил/-5-метил-2-/N-/1-имидазол-4-ил-1-этил/-N-пропил-амино/-тиазол;
4-/2,4-дихлор-фенил/-5-метил-2-/N-пропил-N-/1-пирид-4-ил-проп-1-ил/-амино/-тиазол;
4-/2,4-дихлор-фенил/-5-метил-2-/N-/2-метил-1-пирид-4-ил-проп-1-ил/-N-пропиламино/-тиазол;
4-/2,4-дихлор-фенил/-5-метил-2/N-/ a-циклопропил-бензил/-N-пропил-амино/-тиазол;
4-/2,4-дихлор-фенил/-5-метил-2-/N-/ a-циклопропил-4-метокси-бензил/-N-пропил-амино/-тиазол;
4-/2,4-дихор-фенил/-5-метил-2-/N-/циклопропил-тиен-2-ил/метил/-N-пропил-амино/-тиазол;
4-/2,4-дихлор-фенил/-5-метил-2-/N-/дициклопропил-метил/-N-пропил-амино/-тиазол;
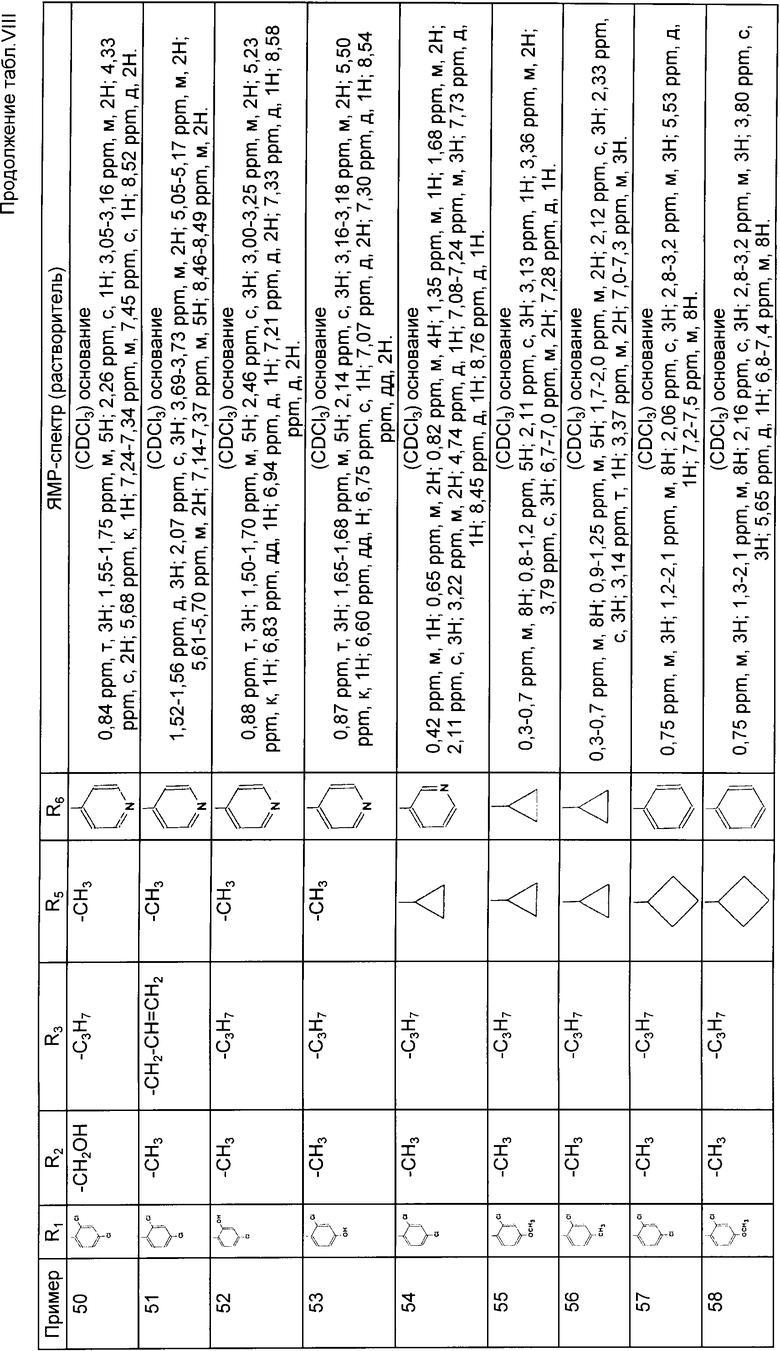
4-/2,4-дихлор-фенил/-5-метил-2-/N-/ a -циклопентил-бензил/-N-пропил-амино/-тиазол;
4-/2,4-дихлор-фенил/-5-метил-2-/N-/циклопентил-пирид-4-ил-метил/-N-пропил-амино/-тиазол;
4-/2,4-дихлор-фенил/-5-метил-2-/N-/ a /циклопропил-4-фтор-бензил/-N-пропил-амино/-тиазол;
4-/2,4-дихлор-фенил/-5-метил-2-/N-/3-хлор-пирид-4-ил/циклопропил-метил-/N-пропил-амино/-тиазол;
4-/2,4-дихлор-фенил/-5-метил-2-/N-пропил-N-/a-пирид-4-ил-бензил/-амино/-тиазол;
4-/2,4-дихлор-фенил/-5-метил-2-/N-/циклопропил-имидазол-4-ил-метил/-N-пропил-амино/-тиазол;
4-/2,4-дихлор-фенил/-5-метил-2/N-/a-циклопропил-3-трифторметил-бензил/-N-пропил-амино/-тиазол;
4-/2,4-дихлор-фенил/-5-метил-2-/N-/циклопентил-циклопропил-метил/-N-пропил-амино/-тиазол;
4-/2,4-дихлор-фенил)-5-метил-2-/N-/циклопропил/1-метил-имидазол-4-ил/-метил/-N-пропил-амино/-тиазол;
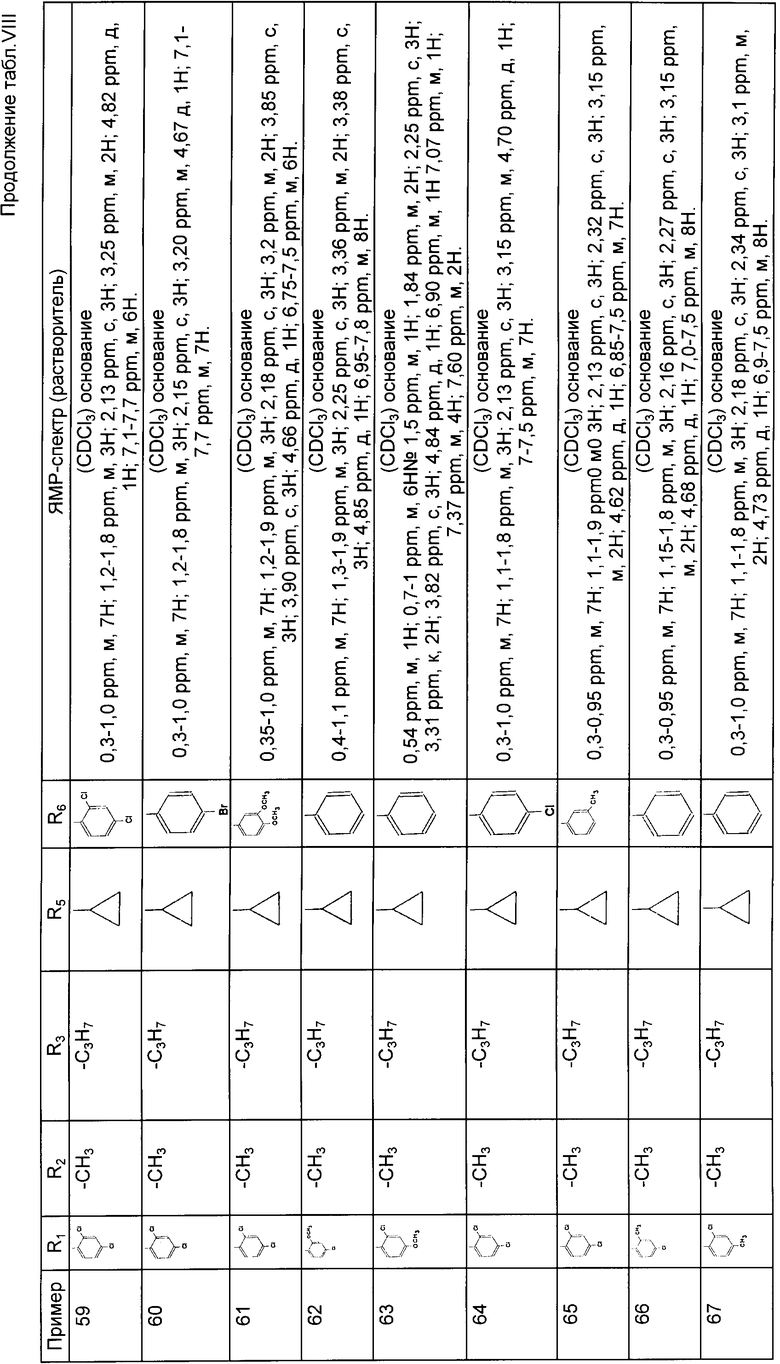
4-/2,4-дихлор-фенил/-5-метил-2-/N-/циклопропил-/1-бензил-имидазол-4-ил/-метил/-N-пропил-амино/-тиазол;
4-/2,4-дихлор-фенил/-5-метил-2-/N-/циклопропил-пирид-2-ил/-метил/-N-пропил-амино-/тиазол;
4-/2-хлор-4-метил-фенил/-5-метил-2-/N-/дициклопропил-метил/-N-пропил-амино/-тиазол;
4-/2,4-дихлор-фенил/-5-метил-2-/N-/циклопропил-пирид-З-ил/-N-пропил-амино/тиазол;
4-/2-хлор-4-метокси-фенил/-5-метил-2-/N-/дициклопропил-метил/-N-пропил-амино/-тиазол;
4-/2,4-дихлор-фенил/-5-метил-2-/N-/ a -циклобутил-бензил-/-N-пропил-амино/-тиазол;
4-/2,4-дихлор-фенил/-5-метил-2-/N-/2,2-дициклопропил-1-этил/-N-пропил-амино/-тиазол.
Все эти соединения могут быть либо в форме свободного основания, либо в солевой форме.
Предметом настоящего изобретения также является способ получения соединений формулы I, отличающийся тем, что a -галоген /предпочтительно a-бром-/-карбонильное производное формулы II: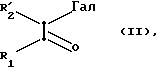
в которой: R1 имеет то же самое значение, что и в формуле I;
R2 обозначает атом водорода или алкильный радикал с 1 5 C-атомами и Гал обозначает атом галогена.
Либо вводят во взаимодействие с тиомочевиной формулы III: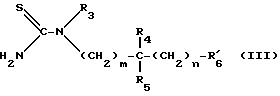
в которой: R3, R4, R5, m и n имеют то же самое значение, что и в формуле I, и имеет то же самое значение, что и R6, за исключением случаев, когда R6 содержит реакционноспособные с атомами азота функции, тогда
имеет то же самое значение, что и R6, за исключением случаев, когда R6 содержит реакционноспособные с атомами азота функции, тогда  обозначает радикал, соответствующий R6, в котором водород вышеуказанной реакционноспособной функции заменен защитной группой, устойчивой к гидролизу в щелочной среде, для получения соединения формулы (I'):
обозначает радикал, соответствующий R6, в котором водород вышеуказанной реакционноспособной функции заменен защитной группой, устойчивой к гидролизу в щелочной среде, для получения соединения формулы (I'):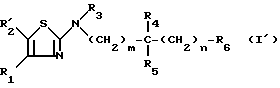
в которой: R1, R3, R4, R5, m и n имеют указанное для формулы I значение имеет значение, указанное для формулы II, и
имеет значение, указанное для формулы II, и имеет значение, указанное для формулы III.
имеет значение, указанное для формулы III.
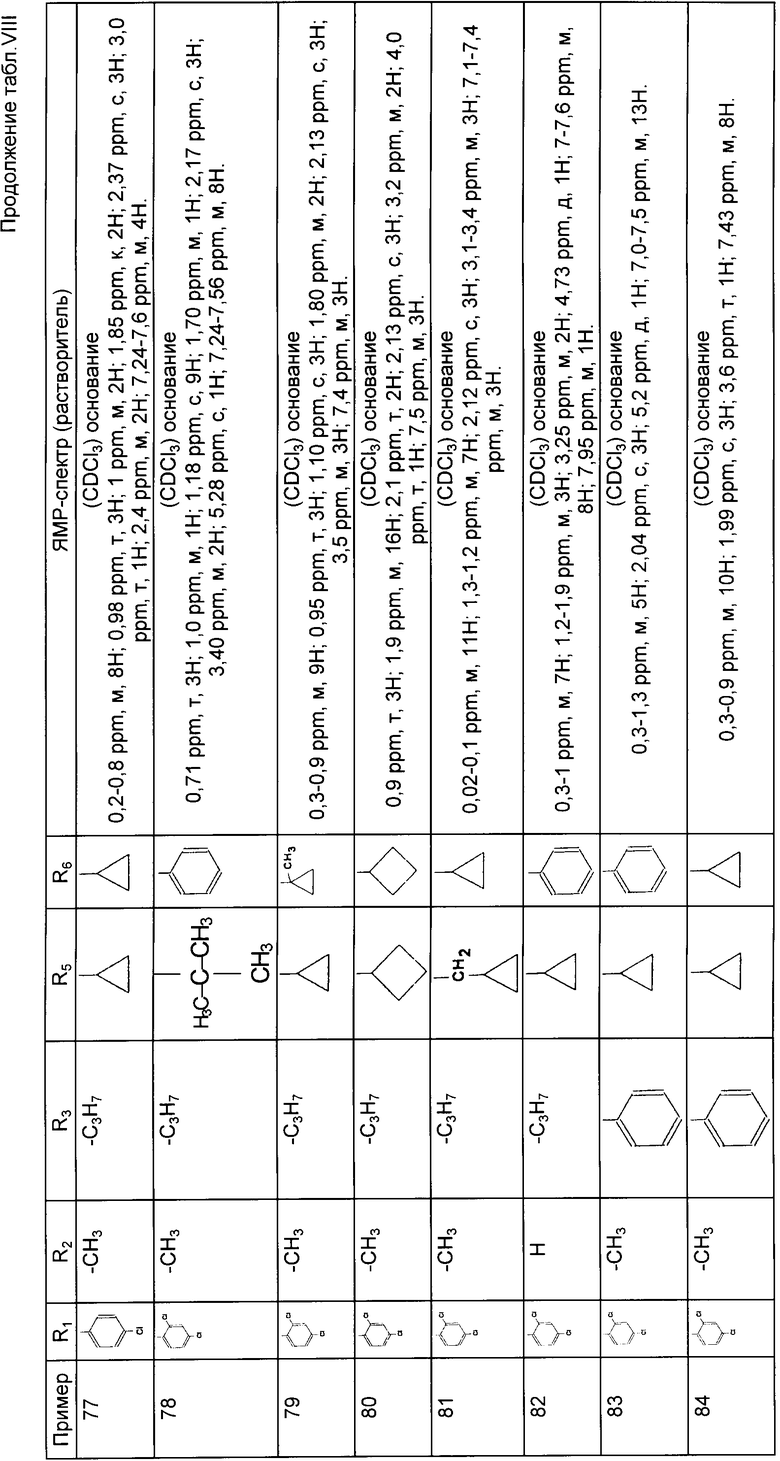
Либо вводят во взаимодействие с тиомочевиной формулы IIIA: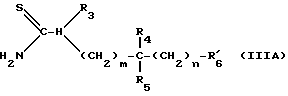
в которой: R1, R5, m и n имеют указанное для формулы I значение и имеет указанное для формулы III значение,
имеет указанное для формулы III значение,
для получения соединений формулы (IV):
в которой: R1, R4, R5, m и n имеют указанное для формулы I значение,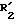 имеет указанное для формулы II значение и
имеет указанное для формулы II значение и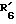 имеет указанное для формулы III значение;
имеет указанное для формулы III значение;
которые вводят во взаимодействие с галогеном формулы V:
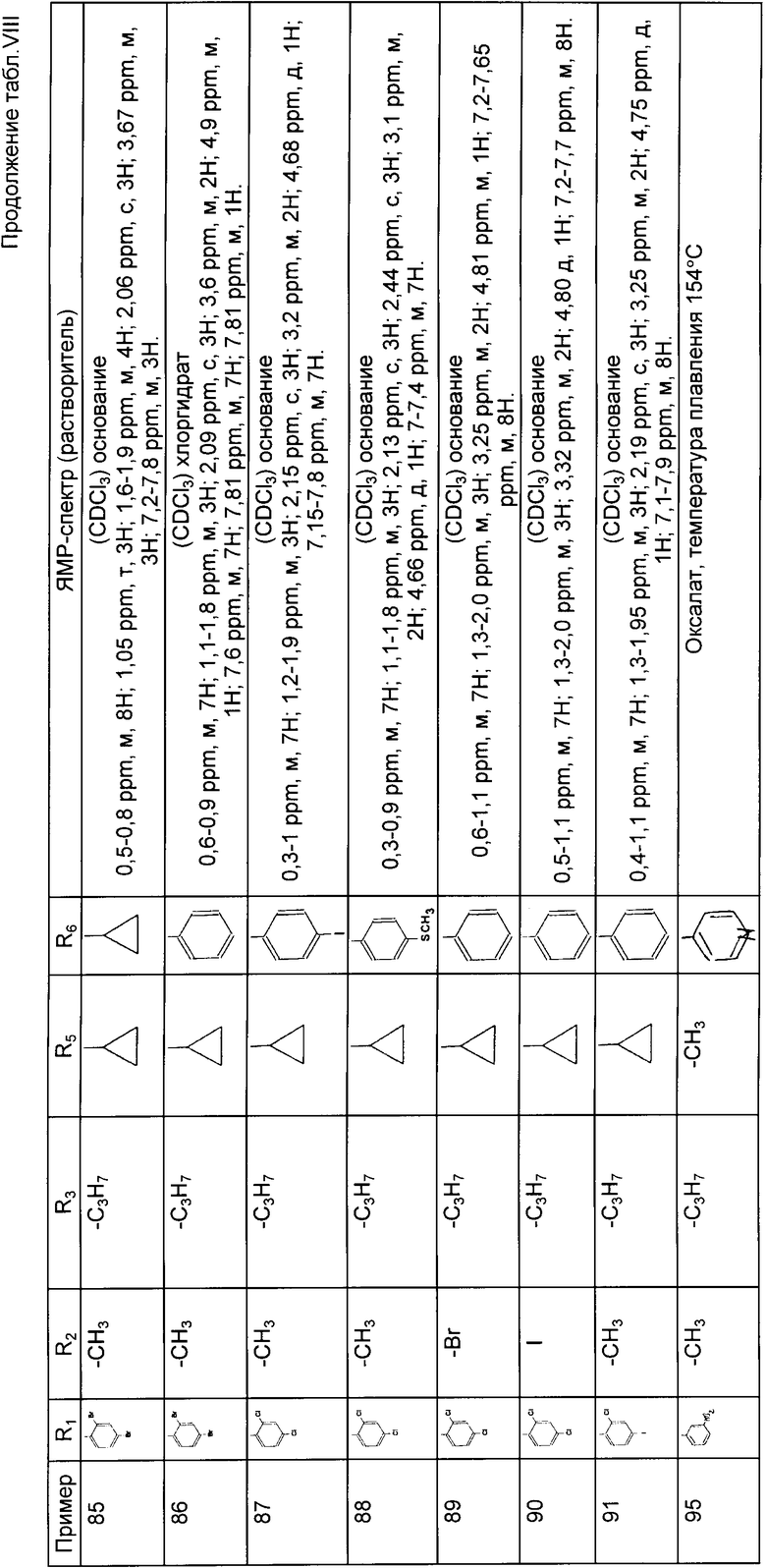
Гал R3, (V)
в которой Гал обозначает атом галогена и R3 имеет указанное для формулы I значение,
для получения соединений формулы I';
и затем соединения формулы I', в которой: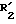 обозначает атом водорода;
обозначает атом водорода;
либо подвергают воздействию галогена для получения соединений формулы I, в которой R2 обозначает атом галогена, которые затем, когда R2 обозначает атом брома, могут быть подвергнуты воздействию другого галогена для получения соединений формулы I, в которой R2 обозначает этот атом галогена;
либо подвергают воздействию оксалилхлорида для получения соединений формулы I, в которой R2 обозначает формильный радикал, которые затем могут быть подвергнуты восстановлению для получения соединений формулы I, в которой R2 обозначает оксиметильный радикал, или
соединения формулы I', в которой 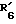 обозначает радикал R6, содержащий фракционноспособные функции с атомами азота, имеющие защитную группу, подвергают кислотному гидролизу для получения соединений формулы I, в которой R6 обозначает радикал, содержащий первичный или вторичный амин;
обозначает радикал R6, содержащий фракционноспособные функции с атомами азота, имеющие защитную группу, подвергают кислотному гидролизу для получения соединений формулы I, в которой R6 обозначает радикал, содержащий первичный или вторичный амин;
и, в случае необходимости, соединения формулы I,
затем разделяют на их возможно стереоизомеры и/или превращают в соответствующие соли органической или неорганической кислоты.
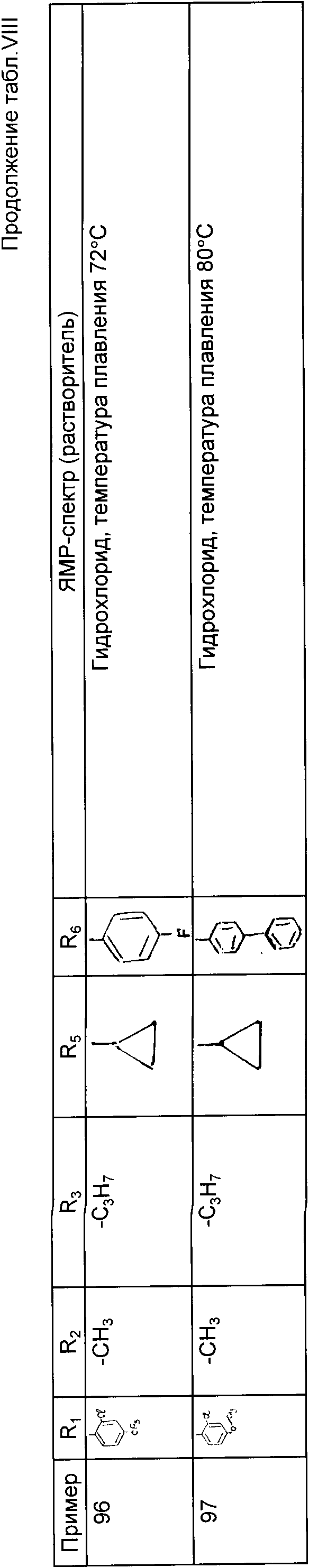
Промежуточные соединения формулы IV, пригодные для получения соединений формулы I, также составляют часть изобретения.
Производные формулы II могут быть получены из соответствующих негалогенированных кетонов формулы: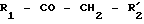
либо воздействием брома в соответствующем органическом растворителе, таком как уксусная кислота, тетрахлорид углерода или диэтиловый эфир;
либо воздействием четвертичных трибромидов аммония согласно способу, описанному в Bull. Chem. Soc. Japan (1987), 60, с.1159-1160 и с.2667-2668;
либо воздействием еще бромида меди-(II) в органическом растворителе, таком как смесь хлороформа с диэтиловым эфиром (J. Org. Chem. (1964) 29, с. 3451-3461).
Кетоны формулы R1-CO-CH2-  обычно представляют собой известные и имеющие в продаже продукты. Эти соединения могут быть получены путем реакции Фриделя-Крафтса, между соединением формулы R1H и ацилгалогенидом формулы
обычно представляют собой известные и имеющие в продаже продукты. Эти соединения могут быть получены путем реакции Фриделя-Крафтса, между соединением формулы R1H и ацилгалогенидом формулы  -CH2-COГал, предпочтительно ацилгалогенидом формулы
-CH2-COГал, предпочтительно ацилгалогенидом формулы 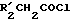 в присутствии кислоты Льюиса.
в присутствии кислоты Льюиса.
Соединения формулы II, в которой:
R1 обозначает радикал формулы A1, замещенный в положениях 2 и 4 атомом галогена, и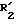 обозначает метильный радикал, могут быть получены из галогенированных производных бензола и особенно из 1,3-дигалогенированных бензолов, с которыми вводят во взаимодействие 2-бром-пропионил-бромид в присутствии хлорида алюминия.
обозначает метильный радикал, могут быть получены из галогенированных производных бензола и особенно из 1,3-дигалогенированных бензолов, с которыми вводят во взаимодействие 2-бром-пропионил-бромид в присутствии хлорида алюминия.
Соединения формулы III и формулы IIIA получают из соединений формулы VI: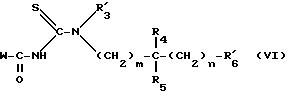
в которой: 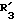 имеет указанное для формулы I значение или обозначает атом водорода;
имеет указанное для формулы I значение или обозначает атом водорода; имеет указанное для формулы III значение и W обозначает фенильный или трет.-бутильный радикал,
имеет указанное для формулы III значение и W обозначает фенильный или трет.-бутильный радикал,
либо путем кислотной обработки, используя предпочтительно соляную кислоту,
либо путем обработки основанием, используя предпочтительно гидроксид натрия.
Когда W представляет собой фенильный радикал, то обработку неорганической кислотой предпочтительно используют, когда 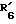 обозначает пиридильный радикал. Обработку основанием осуществляют тогда, когда R5 обозначает циклоалкильную группу, например циклопропильную группу, и когда R6 представляет собой имидазолильный радикал, замещенный на азоте защитной группой, устойчивой к гидролизу в щелочной среде.
обозначает пиридильный радикал. Обработку основанием осуществляют тогда, когда R5 обозначает циклоалкильную группу, например циклопропильную группу, и когда R6 представляет собой имидазолильный радикал, замещенный на азоте защитной группой, устойчивой к гидролизу в щелочной среде.
Когда W обозначает трет.-бутильный радикал, то производные тиомочевины формул III и IIIA получают из соединений формулы VI путем воздействия сильной кислоты, например концентрированной соляной кислоты, при температуре 10 -100oC.
Соединения формулы VI получают путем введения во взаимодействие бензоилизотиоцианата или пивалоилизотиоцианата с аминами формулы VII:
в которой: R4, R5, m и n имеют указанное для формулы I значение;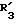 имеет указанное для формулы VI значение и
имеет указанное для формулы VI значение и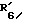 имеет указанное для формулы III значение.
имеет указанное для формулы III значение.
Амины формулы VII, когда речь идет о вторичных аминах, могут быть получены классическими методами. Согласно первому методу, осуществляют алкилирование соответствующего первичного амина формулы VIIA: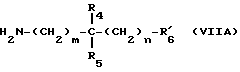
путем воздействия алкилгалогена Гал-R3 формулы V, предпочтительно при нагревании, в присутствии щелочной соли, в полярном органической растворителе, например в диметилформамиде.
Согласно другому методу алкилирования, амины формулы VIIA подвергают воздействию галоидангидрида или ангидрида кислоты в органическом растворителе, выбираемом среди галогенированных углеводородов, таком, как метиленхлорид, в присутствии акцептора протонов, предпочтительно триэтиламина. Получаемый за счет этой реакции амид затем восстанавливают гидридами (AlLiH4 или другими) в органических растворителях типа простых эфиров.
Оба вышеуказанных метода предпочтительно используют для получения соединений формулы VII в виде чистых изомеров.
Другой способ получения соединений формулы VII заключается в конденсации первичного амина формулы R3NH2 с кетоном в дегидратирующей среде для получения соответствующего имина, который затем восстанавливают классическим образом путем воздействия металлического гидрида, предпочтительно боргидрида натрия, или водородом в присутствии соответствующего катализатора. Во время реакции первичного амина формулы R3NH2 с кетоном в дегидратирующей среде предпочтительно используют либо хлорид титана-(IV) (TiCl4), либо катализ за счет п-толуолсульфокислоты.
Амины формулы VII, в которой m и n обозначают 0, получают предпочтительно согласно способу, принцип которого дан в следующей схеме:
Конденсацию альдегида с первичным амином в стадии A реализуют предпочтительно в этаноле или толуоле, при комнатной температуре, а реакцию имина с производным алкиллития в стадии Б осуществляют в диэтиловом эфире или тетрагидрофуране, при температуре 0 -15oC.
Как уже указывалось выше, когда заместитель R6 имеет реакционноспособные функции, эти функции должны быть защищены классическим образом. Например, когда R6 обозначает имидазолильный радикал, его реакционноспособная группа (NH) может быть блокирована трифенилметильной группой. После образования производных формулы I осуществляют удаление защитной группы с помощью неорганической кислоты, например соляной кислоты. Если желают, затем можно получать замещенные на имидазольном радикале производные. Для этого соединения формулы I, в которой R6 обозначает имидазольную группу, вводят во взаимодействие, например, с алкилгалогенидом или аралкилгалогенидом. Реакцию осуществляют в присутствии соли щелочного металла в органическом полярном растворителе, например диметилформамиде, предпочтительно при нагревании. Таким образом получают N-алкил- или N-аралкил-имидазолильные производные.
Алкилирование соединений формулы IV осуществляют в присутствии основания (гидрида натрия, карбоната цезия, карбоната калия и т.д.). Когда реакцию осуществляют в присутствии карбонатов щелочных металлов, в качестве растворителя используют полярные растворители, например диметилформамид. Когда алкилирование осуществляют в присутствии гидридов, то используют предпочтительно тетрагидрофуран. Также можно использовать ароматические углеводороды. Когда реакцию осуществляют в присутствии амида лития, в качестве растворителя предпочтительно используют тетрагидрофуран. Реакцию соединений формулы II с тиомочевинами формулы III или IIIA осуществляют в органической среде в присутствии органического основания, например триэтиламина.
Для получения производных тиазола формулы I, замещенных в положении 5 атомом галогена, из соединений формулы I, не замещенных в положении 5, работают при комнатной температуре, используя в качестве растворителя алкилгалогенид, и предпочтительно в присутствии акцептора протонов.
Соединения формулы I, замещенные в положении 5 атомом галогена, могут быть получены из их аналогов, соединений формулы I, замещенных в положении 5 атомом брома. Эти последние соединения подвергают воздействию галогенирующего агента путем обмена галоген-металл.
Производные тиазола формулы I, замещенные в положении 5 формильным радикалом, получают из соответствующих, незамещенных в положении 5, производных по реакции с оксалилхлоридом. Реакцию осуществляют предпочтительно в органическом растворителе, таком, как диметилформамид. Подвергая производные тиазола формулы I, замещенные в положении 5 формильным радикалом, воздействию восстановителя, такого, как боргидрид натрия, получают соединения формулы I, замещенные в положении 5 тиазольного гетероцикла оксиметильным радикалом. Реакцию осуществляют в спирте при температуре около 0 35oC.
Соединения формулы I, в которой R1 обозначает радикал формулы A1 или A2, замещенный по крайней мере гидроксилом, получают из соединений формулы I, в которой R1 обозначает радикал формулы A1 или формулы A2, замещенный одним или несколькими метокси-радикалами. Для этого эти последние продукты подвергают воздействию кислоты, например бромоводородной кислоты. В этом случае реакцию осуществляют при нагревании.
Соли соединений формулы I с кислотами или основаниями, которые фармацевтически совместимы, представляют собой предпочтительные соли; но соли, которые позволяют выделять соединения формулы I, особенно очищать их или получать чистые изомеры, также составляют предмет изобретения.
Из фармацевтически совместимых кислот для получения солей присоединения соединений формулы I можно назвать соляную, фосфорную, фумаровую, лимонную, щавелевую, серную, аскорбиновую, винную, малеиновую, миндальную, метансульфоновую, лактобионовую, глюконовую, глутаровую, оксиэтилметансульфоновую, сукцинилсульфоновую кислоты и т.д.
Соединения настоящего изобретения обладают очень интересными фармакологическими свойствами. Соединения изобретения, особенно при концентрациях ниже 10 мкмоль (0,01 10 мкмоль), смещают связь 1251-CRF специфических рецепторов, присутствующих в мембранах коры крысы, согласно методу, описанному De Souza E. B./J.Neurosci (1987), 7 (1), с.88-100). Это удивительно и неожиданно, поскольку соединения структуры, близкой к таковой соединений изобретения, но в которых амин в положении 2 тиазольного кольца не содержит разветвленного заместителя, не смещают в значительной степени связь 1251-CRF.
В самом деле, 2-/N-метил-N-/пирид-3-ил-метил/-амино/-4-/2,4,6-триметилфенил/-тиазол, соединение, описанное в примере 112 европейского патента 0 283 390, вызывает смещение только около 8% при концентрации 10-5 М.
Фактор высвобождения кортикотропного (CRF) представляет собой нейропептид, который контролирует гипоталамо-гипофизо-надпочечную ось. Этот фактор ответственен за эндокринные ответы и ответы поведений, связанные со стрессом.
В самом деле, показано, что CRF может модулировать поведение, как также некоторые функции автономной нервной системы (G.G.Koob, F.E.Bloom, Fed. Proc. (1985), 44, с.259; M.R.Brown, L.A.Fisher, Fed. Proc. (1985), 44, с. 243). Преимущественно CRF индуцирует выделение кортикотропина, (АСТН), β-эндорфина и других пептидов, производных про-опиомеланокортина (A. Tazi и др. Regul. Peptides, (1987), 18 с.37; M.R.Brown и др. Regul. Peptides (1986) 16, с.321; C.L.Williams и др. Am. J. Physiol (1987), G 582, с.253).
Соединения изобретения, следовательно, могут быть пригодны для регулирования выделения этих эндогенных веществ. Более конкретно, они находят свое применение для уменьшения ответа на стресс (поведение, эмоциональные состояния, желудочно-кишечные и сердечно-сосудистые расстройства, нарушения иммунной системы) и преимущественно связанные с CRF патологии, например, психиатрические расстройства, беспокойство, нервная анорексия или другие.
Изобретение также относится к фармацевтическим композициям, содержащим в качестве действующего начала по крайней мере одно соединение общей формулы I или одну из его солей с фармацевтически совместимой органической или неорганической кислотой, а в ассоциации с одним или несколькими, соответствующими и инертными, эксципиентами.
Таким образом полученные фармацевтические композиции находятся предпочтительно в различных формах, таких, как, например, таблетки, драже, желатинозные капсулы с лекарством, свечи, растворы для инъекций или для питья.
Дозировка может широко изменяться в зависимости от возраста, веса пациента, природы и тяжести заболевания, так же как от пути введения. Обычно унитарная доза составляет 0,5 200 мг, а суточная доза, используемая в терапии человека, составляет 0,5 800 мг.
Предпочтительным путем введения является оральный или парентеральный.
Следующие примеры, данные в качестве не ограничивающих объема охраны изобретения, иллюстрируют изобретение.
Температуры плавления измерены согласно способу Micro-Kofler.
Спектры протонного магнитного ядерного резонанса (ЯМР-1Н) соединений формулы I регистрируются, в зависимости от случая, при 200 100 МГц или при 80 МГц.
Соединения изобретения имеют количественный элементный анализ согласно теоретически рассчитанному.
Получение соединений формулы II.
Получение I.
2-Бром-1-/2,4,6-триметилфенил/-этан-1-он (соединение 1).
0,3 моль 1-/2,4,6-триметилфенил/-этан-1-она растворяют в 200 мл ледяной уксусной кислоты и прикапывают 31,8 г брома, поддерживая реакционную среду при температуре ниже 10oC. По окончании добавления оставляют реакционную среду для повышения температуры до комнатной и при этой температуре в течение 2 ч выдерживают ее. Затем реакционную среду выливают в 500 мл ледяной воды и органическую фазу экстрагируют диэтиловым эфиром. Органические экстракты промывают водным насыщенным раствором бикарбоната натрия, затем соленой водой и сушат над безводным сульфатом магния. После выпаривания растворителя получают масло, которое может быть использовано без всякой другой очистки.
Другие соединения (соединения 2 13).
Следующие соединения получают согласно способу, описанному для получения 2-бром-1-/2,4,6-триметилфенил/-этан-1-она, используя в качестве исходных веществ адекватные кетоны.
Соединение II.
2-Бром-1-нафт-2-ил-пропан-1-он.
Соединение 3: 2-бром-1-/2,4-диметилфенил/-пропан-1-он.
Соединение 4: 2-бром-1-/4-хлор-2-метилфенил/-пропан-1-он.
Соединение 5: 2-бром-1-/2-хлор-4-метилфенил/-пропан-1-он.
Соединение 6: 2-бром-1-/2-хлор-4-метоксифенил/-пропан-1-он.
Соединение 7: 2-бром-1-/2,4-диметоксифенил/-пропан-1-он.
Соединение 8: 2-бром-1-/4-хлорфенил/-пропан-1-он.
Соединение 9: 2-бром-1-нафт-1-ил-пропан-1-он.
Соединение 10: 2-бром-1-/2,4-дихлорфенил/-этан-1-он.
Соединение 11: 2-бром-1-/4-метоксифенил/-пропан-1-он.
Соединение 12: 2-бром-1-/4-хлор-2-метокси/-пропан-1-он.
Соединение 13: 2-бром-1-/4-метил/-пропан-1-он.
Получение II.
2-Бром-1-/2,4,6-триметоксифенил/-пропан-1-он/.
(Соединение 14).
Доводят до температуры кипения с обратным холодильником суспензию 45,3 г бромида меди-(II) в 150 мл этилацетата и при этой температуре быстро добавляют 25,1 г 1-/2,4,6-триметоксифенил/-пропан-1-она в виде раствора в 150 мл хлороформа. Появляется обильный осадок зеленовато-желтого цвета.
Реакционную среду кипятят с обратным холодильником в течение 2,5 ч. Затем оставляют температуру доходить до комнатной, отфильтровывают нерастворимые соли и промывают диэтиловым эфиром.
Органические фазы обрабатывают животным углем. После удаления твердого вещества фильтрацией концентрируют при пониженном давлении для получения масла. Очищают путем хроматографии на колонке с диоксидом кремния, используя в качестве элюирующего средства смесь циклогексана с этилацетатом (6:4 по объему). Масло. Выход: 60%
Получение III.
2-Бром-1-/2,4-дихлорфенил/-пропан-1-он (соединение 15).
К 7 г 1-/2,4-дихлорфенил/-пропан-1-она, в виде раствора в смеси 420 мл метиленхлорида и 140 мл метанола, при комнатной температуре, добавляют 17,4 г трет. -бутил-аммонийтрибромида. Спустя 24 ч реакционную среду выпаривают досуха, под вакуумом. Обрабатывают водой, экстрагируют этилацетатом, органическую фазу сушат над сульфатом натрия. Выпаривают под вакуумом, затем очищают на колонке с диоксидом кремния, используя в качестве элюирующего средства смесь циклогексана с этилацетатом (20:1 по объему). Масло.
Выход: 78%
Таким же образом также можно получать 2-бром-1-/2-хлор-4-метоксифенил/-пропан-1-он/ (соединение 6).
Получение IV.
2-Бром-1-/2,4-дибромфенил/-пропан-1-он (соединение 16).
К 25 г 1,3-дибромбензола в 250 мл сероуглерода осторожно, при 0oC, добавляют 15 г хлорида алюминия, затем медленно приливают 22,86 г 2-бром-пропионил-бромида. Кипятят с обратным холодильником в течение 8 ч, затем выпаривают под вакуумом сероуглерод и реакционную среду выливают на размельченный лед.
Экстрагируют два раза гептаном, сушат, выпаривают досуха, затем очищают на колонке с диоксидом кремния, используя в качестве элюирующего средства смесь циклогексана с этилацетатом (10:1 по объему) для получения целевого продукта.
Выход: 76%
Вышеописанный способ может быть использован для получения 2-бром-1-/2,4-дихлорфенил/-пропан-1-она (соединение 15), как также 2-бром-1-/3,5-дихлорфенил)-пропан-1-она (соединение 17).
Таким же образом получают 2-бром-1-/2-хлор-4-иод-фенил/-пропан-1-он (соединение 18), используя в качестве исходного продукта 1-хлор-3-иодбензол вместо 1,3-дибромбензола.
Получение соединений формулы VII.
Получение V.
N-/a-Циклопропилбензил/-пропиламин (соединение 19).
К 10 г циклопропилфенилкетона в 60 мл безводного толуола добавляют молекулярное сито 4  и 100 мг п-толуолсульфокислоты, затем 6 г пропиламина. За образованием имина следят путем газохроматографического анализа. По истечении 6 дней нагревания при 55oC реакционную смесь охлаждают, отфильтровывают молекулярное сито и выпаривают досуха под вакуумом. Остаток обрабатывают 100 мл безводного этанола. Охлаждают до 0oC, добавляют маленькими порциями 2,65 г боргидрата натрия. После перемешивания в течение ночи при комнатной температуре выпаривают досуха под вакуумом, обрабатывают водой, гидролизуют с помощью 1н соляной кислоты для доведения pH до величины 2, промывают этилацетатом. Путем добавления 2н раствора гидроксида натрия pH-значение доводят до величины 9, затем экстрагируют несколько раз метиленхлоридом. Органическая фаза после высушивания и выпаривания дает масло, которое может быть непосредственно использовано.
и 100 мг п-толуолсульфокислоты, затем 6 г пропиламина. За образованием имина следят путем газохроматографического анализа. По истечении 6 дней нагревания при 55oC реакционную смесь охлаждают, отфильтровывают молекулярное сито и выпаривают досуха под вакуумом. Остаток обрабатывают 100 мл безводного этанола. Охлаждают до 0oC, добавляют маленькими порциями 2,65 г боргидрата натрия. После перемешивания в течение ночи при комнатной температуре выпаривают досуха под вакуумом, обрабатывают водой, гидролизуют с помощью 1н соляной кислоты для доведения pH до величины 2, промывают этилацетатом. Путем добавления 2н раствора гидроксида натрия pH-значение доводят до величины 9, затем экстрагируют несколько раз метиленхлоридом. Органическая фаза после высушивания и выпаривания дает масло, которое может быть непосредственно использовано.
Выход: 60%
ЯМР 1H (растворитель CDCl3) δ, ppm 0,15 1,7 /м. 11Н/, 2,4 /т.+д. 2Н/, 2,80 /д. 1Н/, 7,3-7,4 /м. 5Н/.
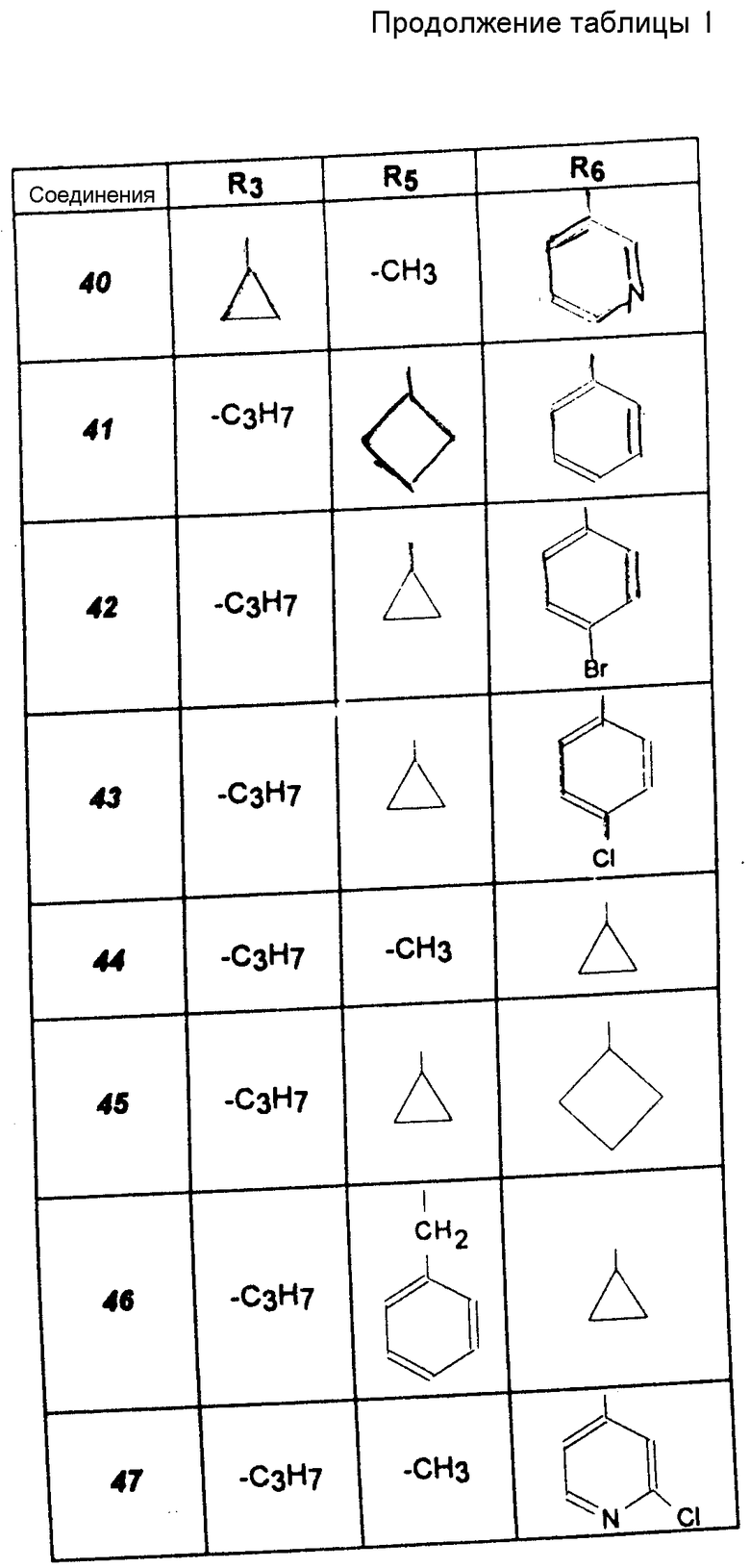
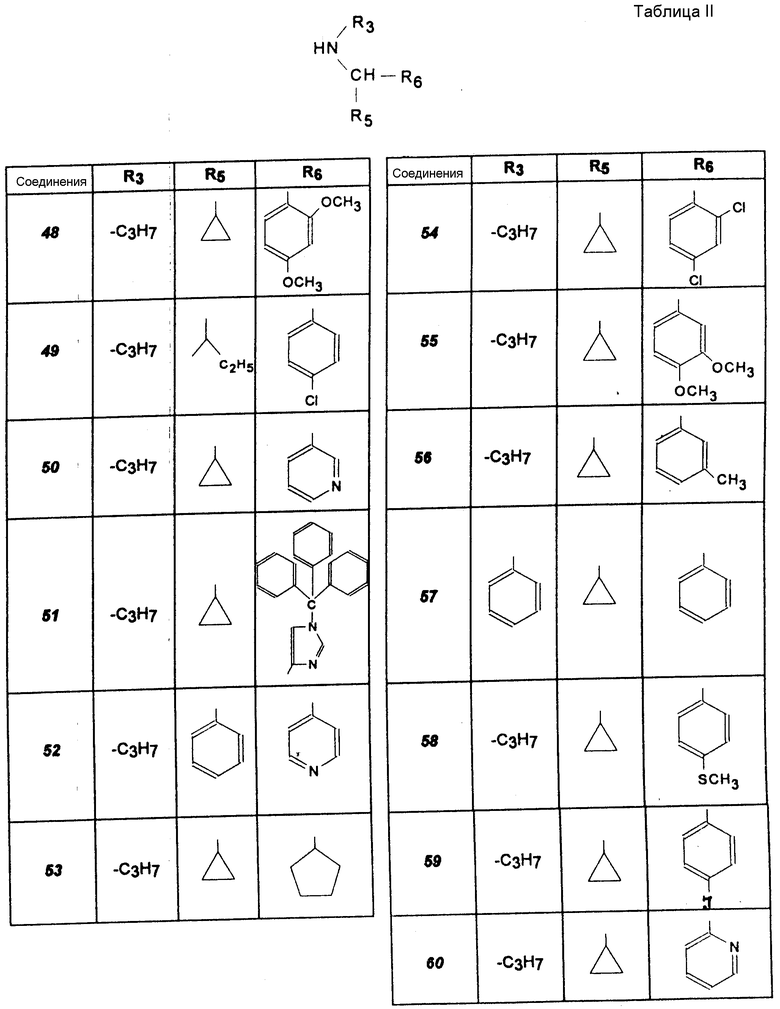
Другие соединения (соединения 20 -47).
Указанные в табл. I амины получают согласно вышеописанному способу.
Получение VI.
N-/Циклопропил-пирид-4-ил-метил/-пропиламин.
(Соединение 20).
N-/Циклопропил-пирид-4-ил-метил/-пропиламин также может быть получен следующим образом.
Стадия A.
1,07 г пирид-4-ил-карбальдегида растворяют в 10 мл абсолютного этанола и медленно добавляют 0,8 г н-пропиламина. Спустя 30 мин перемешивания, выпаривают досуха для получения 1,48 г масла.
Выход: 99%
Стадия Б.
Полученный в предыдущей стадии имин растворяют в 10 мл безводного диизопропилового эфира. К этому раствору при перемешивании и при 0oC добавляют 30 мл раствора циклопропиллития (20 ммоль) в диизопропиловом эфире. После перемешивания в течение 10 ч при комнатной температуре охлаждают до 0oC и прикапывают 3 мл метанола, затем 10 мл 30%-ного водного раствора хлорида аммония. Экстрагируют эфирную фазу 1н соляной кислоты. Водную кислую фазу нейтрализуют бикарбонатом натрия, затем экстрагируют этилацетатом. Сушат над безводным сульфатом натрия и выпаривают досуха для получения бесцветного масла.
Выход: 80%
ЯМР-1H (растворитель CDCl3): d, ppm: 0,28 1,76 /м. 8Н/, 0,88 /т. 3Н/, 1,48 /м. 2Н/, 2,31 2,49 /м. 2Н/, 2,78 /д. 1Н/, 7,35 /д.д. 2Н/, 8,54 /д.д. 2Н/.
Другие соединения (соединения 48 -60).
Указанные в табл. II получают согласно вышеописанному способу.
Получение VII.
N-/Циклопропилметил/-1-пирид-4-ил-этиламин (соединение 61).
Стадия А.
В атмосфере аргона, в трехгорлой колбе емкостью 250 мл, 3,2 мл циклопропанкарбоновой кислоты растворяют в 20 мл безводного метиленхлорида. Охлаждают с помощью ледяной бани и добавляют 8,4 г дициклогексилкарбодиимида, растворенные в 20 мл безводного метиленхлорида. Перемешивают в течение 30 мин и добавляют 5 г 1-пирид-4-ил-этиламина. После перемешивания в течение ночи при комнатной температуре отфильтровывают и удаляют кристаллы белого цвета. Фильтрат выпаривают и полученный остаток очищают на колонке с диоксидом кремния, используя в качестве элюирующего средства смесь этилацетата с гексаном (1:9 по объему) для получения порошка белого цвета.
Выход: 95%
Стадия Б.
В трехгорлой колбе емкостью 250 мл, снабженной капельной воронкой и обратным холодильником, 6 г полученного в стадии А амида растворяют в 20 мл безводного тетрагидрофурана. Нагревают до температуры кипения с обратным холодильником и добавляют 63 мл боран-диметилсульфидного комплекса в виде раствора (2н) в тетрагидрофуране. Кипятят с обратным холодильником в течение 3 ч. Охлаждают и прикапывают 20 мл 3н раствора соляной кислоты. Кипятят с обратным холодильником в течение 1 ч. Подщелачивают с помощью раствора гидроксида натрия и экстрагируют этилацетатом. Сушат над безводным сульфатом натрия и выпаривают досуха.
Выход: 88%
ЯМР-1H (растворитель: CDCl3): d, ppm: 0,02 0,07 (м. 2Н); 0,37 0,50 (м. 2Н); 0,87 0,94 (м. 1Н); 1,33 (д. 3Н); 2,29 (д.д. 2Н); 3,77 (к. 1Н); 7,22 7,25 (д.д. 2Н); 8,53 (д. 2Н).
Получение VIII.
N-Пропил-a-метилбензиламин (соединение 62).
Вводят 23 мл пропиламина в 200 мл диметилформамида, добавляют 32 г карбоната цезия и 9,25 г a-метил-бензил-бромида. Оставляют на 4 ч при комнатной температуре. Выпаривают досуха и обрабатывают водой. Экстрагируют этилацетатом, сушат над безводным сульфатом натрия и выпаривают досуха для получения целевого продукта.
Выход: 95%
ЯМР-1H (растворитель CDCl3): d, ppm 0,86 (т. 3Н); 1,34 (д. 3Н); 1,17 -1,64 (м. 2Н); 2,19 2,54 (м. 2Н); 3,75 (к. 1Н); 7,19 - 7,29 (м. 5Н).
Получение IX.
N-/Циклопропил-пирид-3-ил-метил/-пропиламин.
(Соединение 63).
Стадия A.
К 3 г пирид-3-ил-карбальдегида в 70 мл безводного диэтилового эфира, при -78oC и при перемешивании прикапывают 45 мл 0,625 М раствора циклопропиллития в безводном диэтиловом эфире. Оставляют температуру повышаться до комнатной, добавляют насыщенную хлоридом аммония воду и экстрагируют диэтиловым эфиром, затем метиленхлоридом.
Выход: 78%
Стадия Б.
3,35 г полученного в предыдущей стадии циклопропил-пирид-3-ил-метанола растворяют в 75 мл диоксана и добавляют 13,66 г диоксида марганца. После перемешивания в течение 4 ч при температуре кипения с обратным холодильником реакционную смесь отфильтровывают горячей через целит. Органический раствор после выпаривания под вакуумом приводит к остатку, который очищают путем хроматографии на колонке с диоксидом кремния, используя в качестве элюирующего средства смесь циклогексана с этилацетатом (1:1 по объему) для получения циклопропил-пирид-3-ил-кетона.
Выход: 80%
ЯМР-1H (растворитель CDCl3): d, ppm 1,06 1,34 (м. 4Н), 2,68 (м. 1Н); 7,42 (м. 1Н), 8,23 (м. 1Н); 8,78 (м. 1Н); 9,26 (м. 1Н).
Стадия В.
Осуществляют как описано в получении V, используя полученный в предыдущей стадии кетон, для получения N-/циклопропил-пирид-3-ил/-метил/-пропиламина.
Получение X.
N-/Циклопропил-/2-метил-пирид-4-ил/-метил-/пропиламин.
(Соединение 64).
Стадия А.
К 7, 3 г 4-циано-2-метил-пиридина в 100 мл безводного тетрагидрофурана, при -65oC, добавляют 130 мл 0,7 М раствора циклопропиллития в тетрагидрофуране. После перемешивания в течение 4 ч добавляют метанол и раствор сульфата аммония (6,3 г в 20 мл воды). После экстракции диэтиловым эфиром органическую фазу промывают водой, сушат и выпаривают под вакуумом. Остаток очищают на колонке с диоксидом кремния, используя в качестве элюирующего средства смесь метиленхлорида с метанолом (98:2 по объему). Таким образом получают циклопропил-/2-метил-пирид-4-ил/-кетон.
Выход: 59%
ЯМР-1H (растворитель CDCl3): d, ppm 0,94 1,38 (м. 4Н), 2,62 (с. 3Н), 2,52 2,65 (м. 1Н); 7,57 (м. 2Н); 8,65 (д. 1Н).
Стадия Б.
Осуществляют согласно способу, описанному в получении V, используя полученный в предыдущей стадии кетон, для получения N-/циклопропил-/2-метил-пирид-4-ил/метил/-пропиламина.
Получение XI.
N-/1,2-Дициклопропил-этил/-пропиламин (соединение 65).
К 2,2 г циклопропилметил-циклопропилкетона в 85 мл метиленхлорида добавляют 6,9 мл пропиламина. При комнатной температуре прикапывают 7 мл 1М раствора хлорида титана-(IV) в метиленхлориде. После перемешивания в течение 18 ч добавляют 40 мл безводного метанола. Охлаждают до 0oC и добавляют маленькими порциями 1,0 г боргидрида натрия. После перемешивания в течение ночи при комнатной температуре добавляют 10 мл воды и выпаривают под вакуумом. Обрабатывают водой и экстрагируют метиленхлоридом. Экстрагируют 2н соляной кислотой. Промывают диэтиловым эфиром. Водную фазу нейтрализуют концентрированным раствором гидроксида натрия. Экстрагируют метиленхлоридом, сушат над безводным сульфатом натрия и выпаривают досуха для получения бесцветного масла.
Выход: 76%
ЯМР-1H (растворитель CDCl3): d; ppm 0,0 0,9 (м. 13Н); 1,2 1,75 (м. 5Н); 2,3 2,7 (м. 2Н).
Другие соединения (соединения 66 -70).
Амины, указанные в табл. III, получают согласно описанному в получении XI способу. Соединение 70 получают из циклопропил-метил-фенил-кетона. Это последнее соединение получают из цикло-пропил-ацетонитрила и фенилмагнийбромида.
Получение XII.
N-/2,2-Дициклопропил-1-этил/-пропиламин.
(Соединение 71).
Это соединение получают из 2,2-дициклопропил-ацетальдегида согласно способу, описанному в получении V.
Получение XIII.
N/-1-Фенил-пент-4-ен-1-ил/-пропиламин.
(Соединение 72).
Стадия А.
В атмосфере аргона и при температуре 70oC перемешивают 0,48 мл циклопропил-метил-бромида, растворенных в 20 мл диэтилового эфира, затем добавляют 3 мл раствора трет.-бутиллития (1,7 М в пентане). Оставляют при перемешивании в течение 30 мин.
Стадия Б.
Поступают как описано в получении VI, стадия А, используя бензальдегид вместо пирид-4-ил-карбальдегида.
Стадия В.
В полученный в стадии А реакционный раствор медленно добавляют 730 мг имина, полученного в стадии Б, в виде раствора в 2 мл диэтилового эфира. Оставляют температуру постепенно повышаться до 0oC, затем прикапывают раствор хлорида аммония. Эфирную фазу отделяют от водной фазы и водную фазу экстрагируют диэтиловым эфиром. Эфирные фазы объединяют и экстрагируют 2 раза по 50 мл 1н соляной кислотой. Водные фазы подщелачивают 1н раствором гидроксида натрия, затем экстрагируют 3 раза по 50 мл метиленхлорида. Объединенные органические экстракты промывают водой и водой, насыщенной хлоридом натрия, сушат над безводным сульфатом натрия, затем выпаривают досуха для получения масла.
Выход: 81%
ЯМР-1H (растворитель CDCl3): 0,77 -0,92 ppm (м. 3Н), 1,27 1,93 ppm (м. 6Н), 2,23 2,45 ppm (м. 2Н); 3,57 ppm (т. 1Н); 4,87 5,03 ppm (м. 2Н); 5,60 -5,82 ppm (м. 1Н); 7,25 7,41 ppm (м. 5Н).
Получение XIV.
N-/a-трет.-Бутилбензил/-пропиламин.
(Соединение 73).
К 3 мл раствора трет.-бутиллития (1М в пентане) добавляют 20 мл диэтилового эфира и оставляют при перемешивании при -70oC в течение примерно 30 мин. Затем добавляют 730 мг имина, получение которого описано в стадии Б получения XIII, в виде раствора в 2 мл диэтилового эфира. Постепенно повышают температуру до 0oC, затем гидролизуют водным раствором хлорида аммония. Отделяют эфирную фазу и экстрагируют водную фазу диэтиловым эфиром. Эфирные фазы объединяют и экстрагируют с помощью 100 мл соляной кислоты.
Кислые водные фазы затем подщелачивают раствором гидроксида натрия, затем экстрагируют метиленхлоридом. Органический экстракт после этого промывают водой, затем водой, насыщенной хлоридом натрия, сушат над безводным сульфатом натрия, выпаривают досуха для получения масла.
Выход: 88%
ЯМР-1H /растворитель CDCl3/ d, ppm: 0,84 1,0 /м. 12Н/, 1,36 1,55 /м. 2Н/, 2,29 2,46 /м. 2Н/; 3,30 /с. 1Н/, 7,19 7,35 /м. 5Н/.
Получение соединений формулы III.
Получение XV.
N-/Циклопропил-пирид-4-ил-метил/-N-пропил-тиомочевина.
(Соединение 74).
Стадия А.
N'-Бензоил-N-/циклопропил-пирид-4-ил-метил/-N-пропил-тиомочевина.
0,88 г тиоцианата аммония растворяют в 6 мл безводного ацетона. Охлаждают до 0oC и медленно добавляют 1,1 мл бензоилхлорида в 1 мл ацетона. Кипятят с обратным холодильником в течение 10 мин, затем добавляют 2 г N-/циклопропил-пирид-4-ил/-пропил-амина (соединение 20) в виде раствора в 10 мл ацетона. После нагревания в течение 1 ч растворитель выпаривают. Остаток обрабатывают водой для получения целевого соединения в виде белых кристаллов.
Выход: 75%
Т. пл. 171oC.
Стадия Б.
К 2,5 г полученного в предыдущей стадии соединения в виде раствора в 50 мл этанола добавляют 18 мл 1н раствора гидроксида натрия. Выдерживают реакционную среду в течение 48 ч при 80oC, затем добавляют 10 мл 1н раствора гидроксида натрия и снова выдерживают 24 ч при 80oC.
После выпаривания этанола под вакуумом полученную водную фазу экстрагируют метиленхлоридом. Органическую фазу сушат и выпаривают под вакуумом. Остаток очищают путем хроматографии на колонке с диоксидом кремния, используя в качестве элюирующего средства смесь метиленхлорида с метанолом (98:2 по объему).
Выход: 68%
Т. пл. масло.
ЯМР-1H (растворитель CDCl3): d, ppm 0,85 (т. 3Н), 0,54 1,25 (м. 8Н); 1,78 (м. 2Н); 2,84 3,35 (м. 2Н); 6,03 (д. 1Н); 6,19 (с. 2Н); 7,42 (д. 2Н); 8,58 (д.д. 2Н).
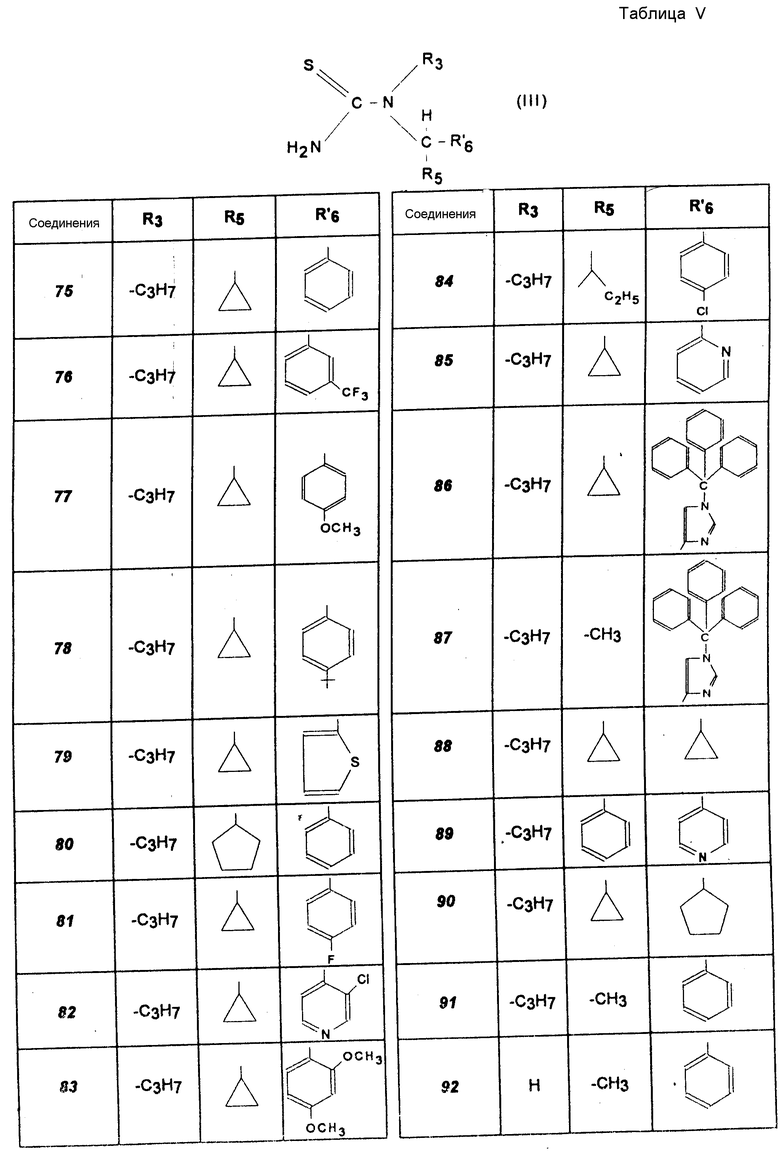
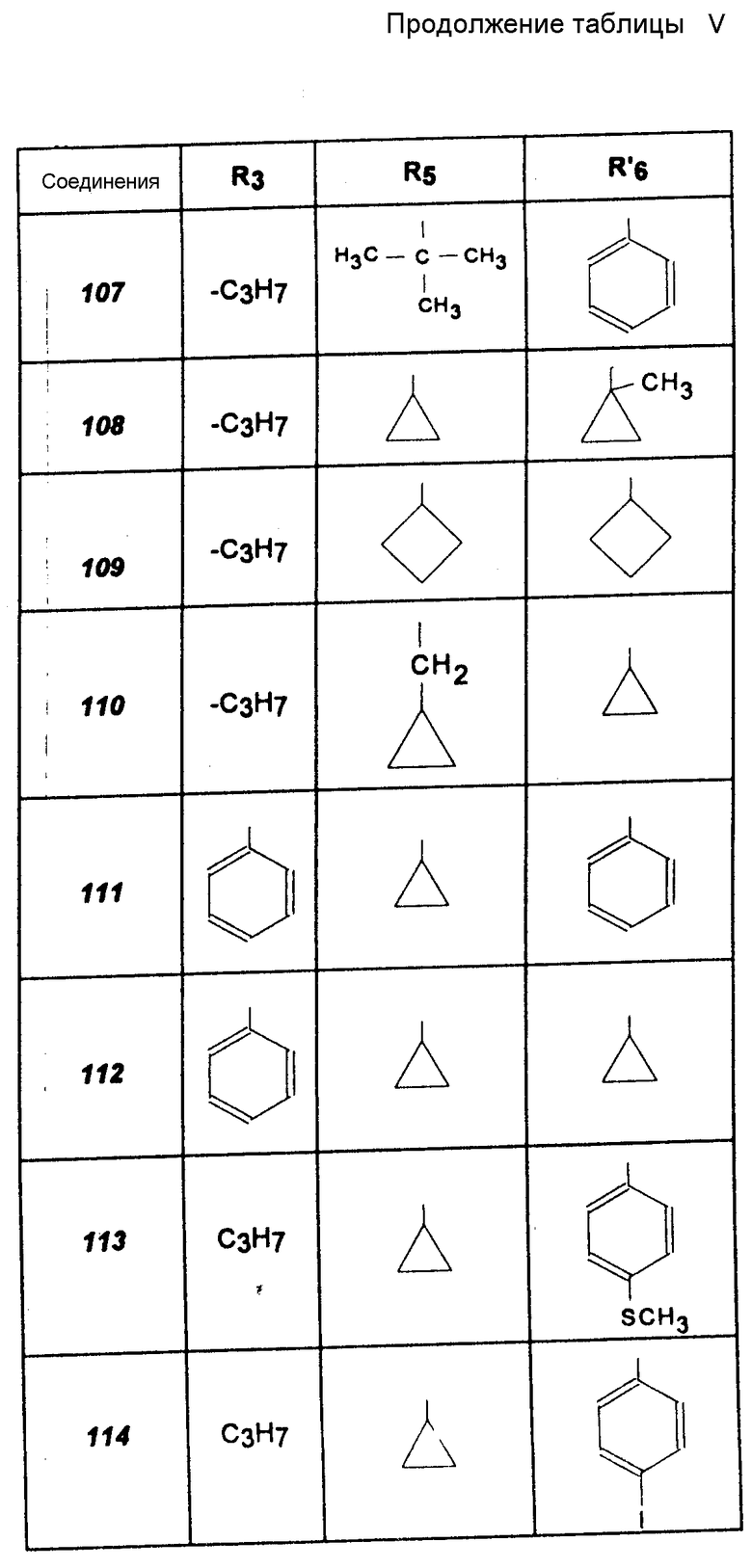
Другие соединения (соединения 75 -113).
Указанные в табл. IV и V производные тиомочевины получают согласно способу, описанному для N-/циклопропил-пирид-4-ил-метил/-8-пропил-мочевины, используя адекватные амины, получение которых указано выше (получение соединений формулы VII), или используя амины, которые имеются в продаже (табл. V, см. с.42 44).
Получение XVI.
N-/1-/3-Хлор-пирид-4-ил/-1-этил/-N-пропил-тиомочевина.
(Соединение 116).
Стадия А.
N'-Бензоил-N-/1-/3-хлор-пирид-4-ил/-1-этил/-N-пропил-тиомочевина.
Это соединение получают согласно способу, указанному в стадии А получения XV, из 1,14 г тиоцианата аммония, 1,74 г бензоилхлорида и 2,7 г N-/1-/3-хлор-пирид-4-ил/-1-этил/-пропиламина (соединение 22).
Стадия Б.
К 1,18 г полученного в стадии А соединения добавляют 6 мл 32%-ной соляной кислоты. Реакционную среду в течение часа нагревают при 80oC, затем охлаждают и добавляют воду. Экстрагируют метиленхлоридом и органическую фазу удаляют. Водную фазу подщелачивают карбонатом натрия и экстрагируют метиленхлоридом. Органическую фазу высушивают и выпаривают под вакуумом. Остаток очищают путем хроматографии на колонке с диоксидом кремния, используя в качестве элюирующего средства смесь метиленхлорида с метанолом (98:2 по объему).
Выход: 98% Масло.
ЯМР-1H (растворитель CDCl3): d, ppm 0,73 (т. 3Н); 1,05 1,66 (м. 2Н); 1,63 (д. 3Н); 3,16 (т. 2Н); 5,87 (с. 2Н); 6,77 (к. 1Н); 7,29 (д. 1Н); 8,53 (д. 1Н); 8,59 (с. 1Н).
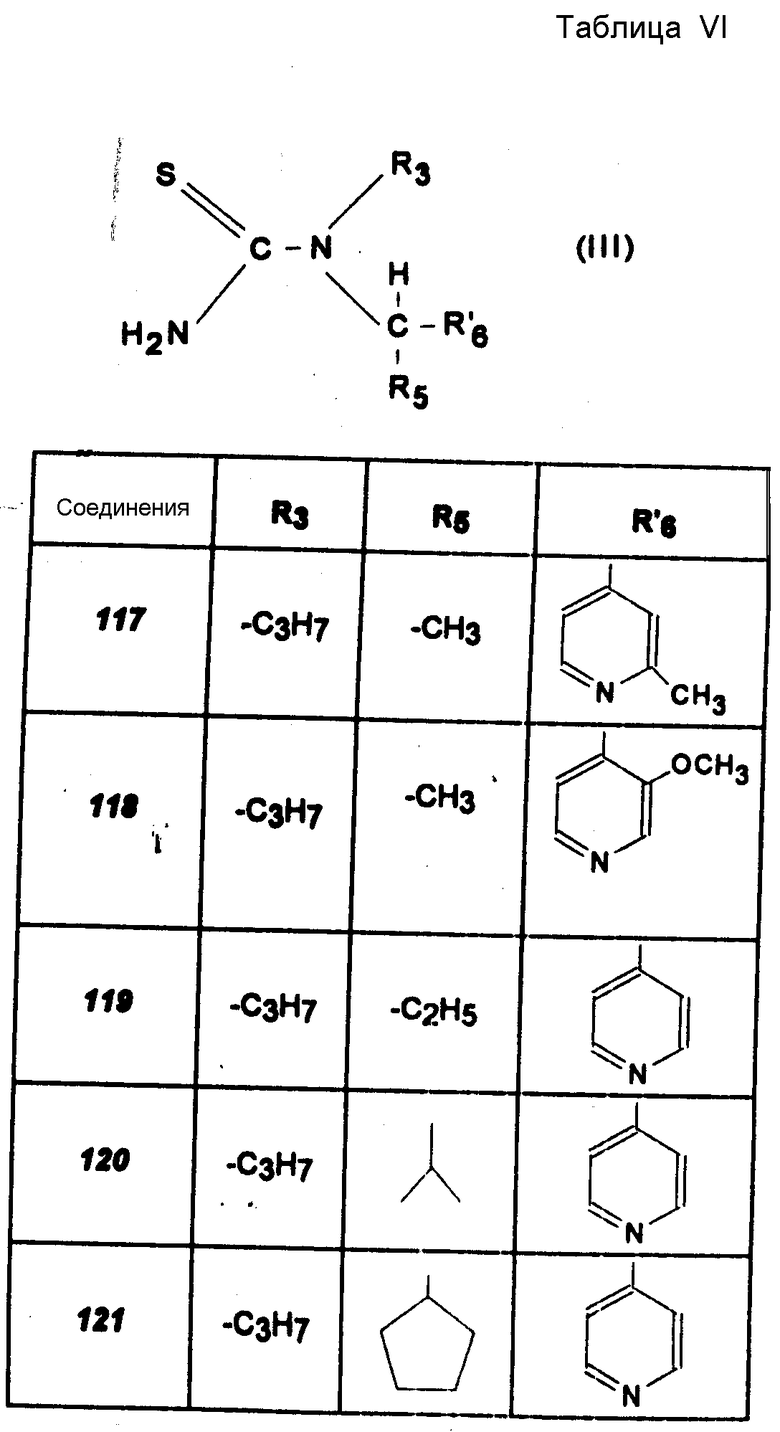
Другие соединения (соединения 117 -121).
Производные тиомочевины, указанные в табл. VI, получают согласно способу, описанному для получения N-/1-/3-хлор-пирид-4-ил/-1-этил/-N-пропил-тиомочевины.
Получение XVII.
N-Циклопропил-метил-N-/1-пирид-4-ил-1-этил/-тиомочевина (соединение 122).
Стадия А.
N'-Пивалоил-N-циклопропил-метил-N-/1-пирид-4-ил-1-этил/-тиомочевина.
В трехгорловой колбе емкостью 100 мл, в атмосфере аргона, 2,9 г тиоцианата калия растворяют в 30 мл ацетона. Охлаждают до 0oC и прикапывают 3,4 мл пивалоилхлорида. Перемешивают при 0oC в течение 5 ч, затем добавляют 4,8 г N-/циклопропил-метил/-1-пирид-4-ил-этиламина (соединение 61). Перемешивают при комнатной температуре в течение ночи. Выпаривают досуха. Остаток обрабатывают водой и экстрагируют метиленхлоридом. Сушат над безводным сульфатом натрия и выпаривают досуха. Полученный порошок промывают гексаном и отфильтровывают.
Выход: 75%
ЯМР-1H (растворитель CDCl3): d, ppm= 0,02 0,07 (м. 2Н); 0,4 0,5 (м. 2Н); 0,96 (м. 1Н); 1,28 (с. 9Н); 1,77 (д. 3Н); 2,90 (д, д. 2Н); 3,4 (м. 1Н); 6,5 (с. 1Н); 7,4 (м. 2Н); 8,61 (д. 2Н).
Стадия Б.
2 г полученного в предыдущей стадии продукта растворяют в 15 мл 32%-ной соляной кислоты и нагревают при 70oC в течение часа. Охлаждают и подщелачивают с помощью насыщенного водного раствора бикарбоната натрия. Экстрагируют этилацетатом, сушат над безводным сульфатом натрия и выпаривают досуха. Остаток обрабатывают смесью гексана с этилацетатом (8:2 по объему). Фильтруют для отделения кристаллов белого цвета.
Выход: 87%
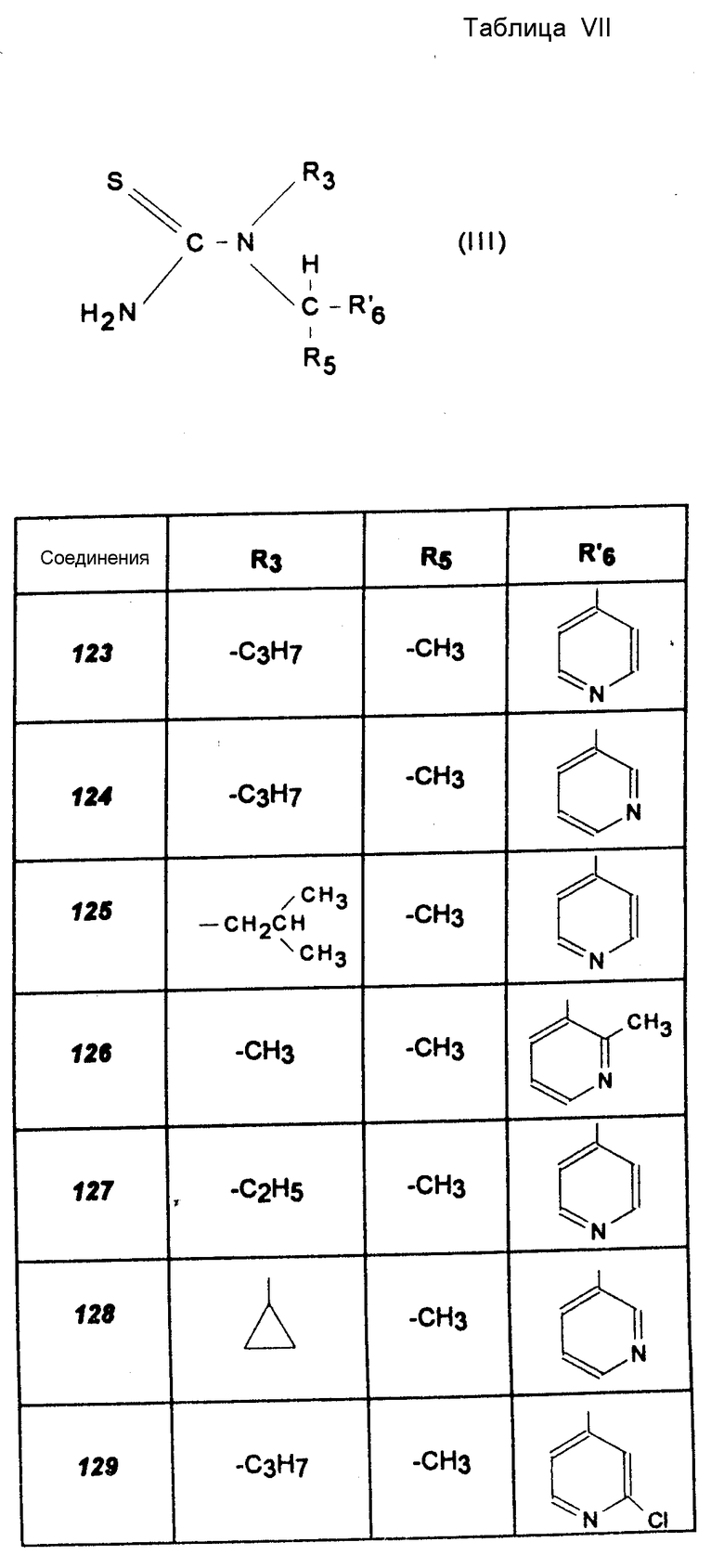
Другие соединения (соединения 123 -129).
Указанные в табл. VII тиомочевины получают согласно способу, описанному в получении XVII.
Примеры.
Пример 1.
4-/2,4-Дихлор-фенил/-5-метил-2-/N-/ a -циклопропил-бензил/-N-пропиламино/-тиазол.
К 1,35 г N-/a-циклопропил-бензил/-N-пропил-тиомочевины (соединение 75) в 35 мл этанола добавляют 546 мг триэтиламина, затем медленно добавляют 1,52 г 2-бром-1-/2,4-дихлор-фенил/-пропан-1-она (соединение 15). После нагревания в течение 3 ч при 75oC удаляют путем отфильтровывания образовавшийся осадок. Этанольный раствор выпаривают досуха. Остаток обрабатывают диэтиловым эфиром и промывают водой вплоть до исчезновения ионов брома. Органическую фазу сушат над безводным сульфатом натрия, затем выпаривают досуха. Остаток обрабатывают диэтиловым эфиром и промывают водой вплоть до исчезновения ионов брома. Органическую фазу сушат над безводным сульфатом натрия, затем выпаривают досуха. Остаток очищают на колонке с диоксидом кремния, используя в качестве элюирующего средства смесь циклогексана с этилацетатом (10:1 по объему), для получения целевого продукта. Перекристаллизуют из ацетонитрила (кристаллы белого цвета).
Выход: 79%
Т.пл. 78 81oC.
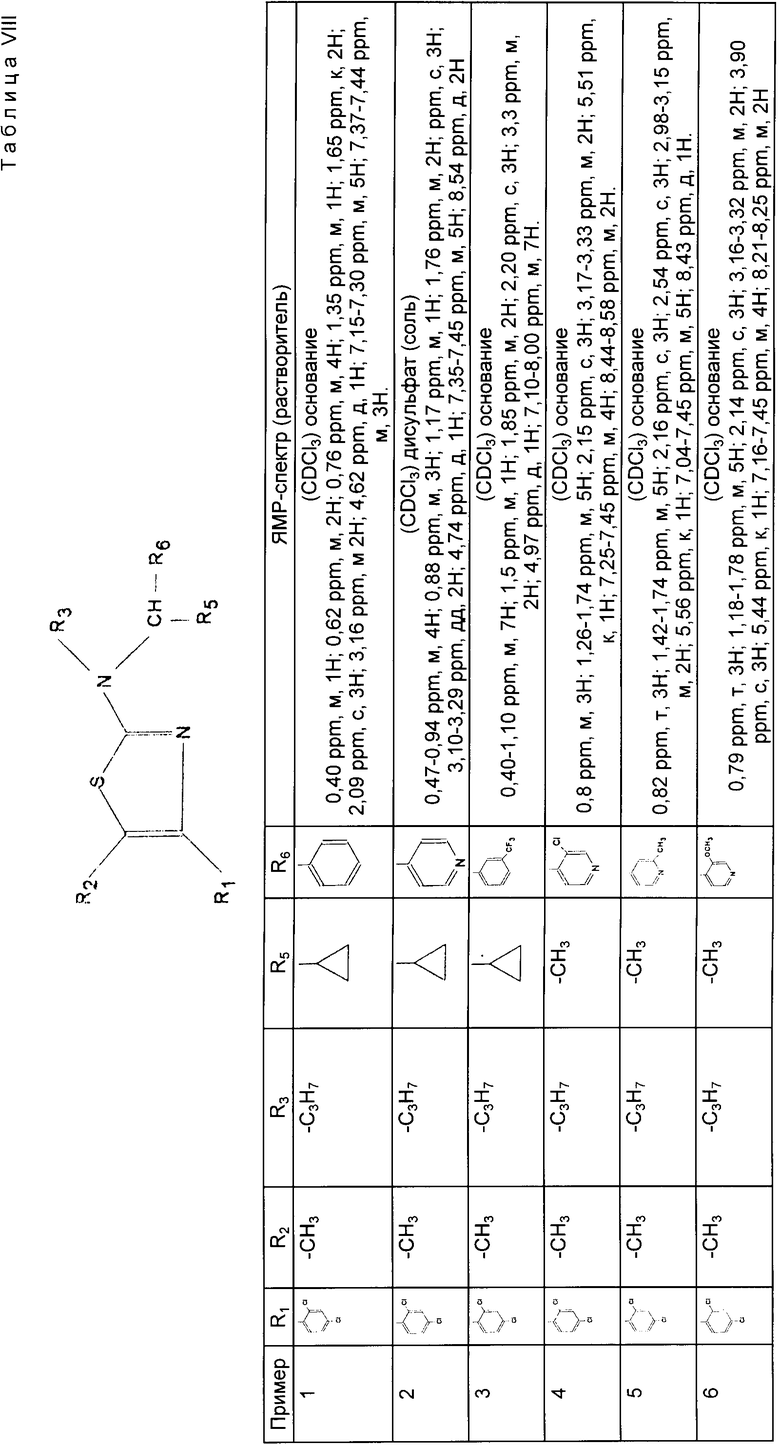
ЯМР-1H-спектр приведен в табл. VIII.
Пример 2.
4-/2,4-Дихлор-фенил/-5-метил-2-/N-/циклопропил-пирид-4-ил-метил/-N-пропил-амино/-тиазол.
Это соединение получают согласно способу, описанному в примере 1, из 1,2 г N-/циклопропил-пирид-4-ил-метил/-N-пропил-тиомочевины (соединение 74) и 1,52 г 2-бром-1-/2,4-дихлор-фенил/-пропан-1-она (соединение 15). Продукт очищают на колонке с диоксидом кремния, используя в качестве элюирующего средства смесь метиленхлорида с метанолом (98:2 по объему).
Масло.
Выход: 78%
Из этого основания, используя адекватные кислоты в виде раствора в этаноле, получают следующие соли:
полуфумарат: т.пл. 98oC;
хлоргидрат: т.пл. 68oC;
дисульфат: т.пл. 186oC.
ЯМР-1H-спектр этого продукта указан в табл. VII.
Примеры 3 40.
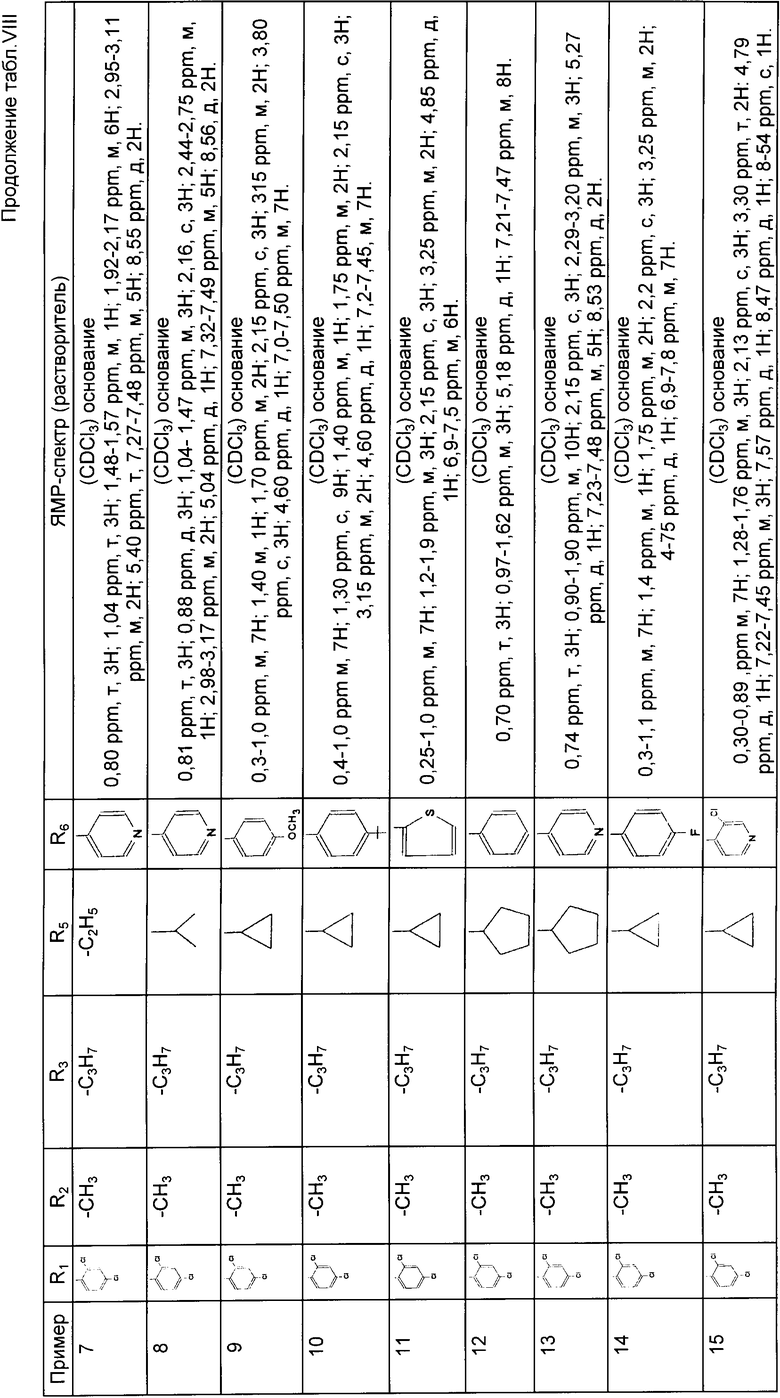
Согласно способу, описанному в примере 1, получают соединения примеров 3 40, используя адекватные производные бромкетонов и тиомочевин. Их спектральные характеристики приведены в табл. VIII.
Пример 41.
4-/2,4-Дихлор-фенил/-5-метил-2-/N-/ a-метил-бензил/-N-циклопропилметиламино/-тиазол.
При 0oC к 0,5 г 4-/2,4-дихлорфенил/-5-метил-2-/N-a-метилбензиламино/-тиазола (Т. пл. 120oC, получен из соединения 92 и соединения 15 согласно описанному в примере 1 способу), в виде раствора в 5 мл безводного тетрагидрофурана добавляют 66 мг гидрида натрия. После перемешивания в течение 30 мин при комнатной температуре прикапывают 0,67 мл циклопропилметилбромида. Кипятят с обратным холодильником в течение 8 ч, охлаждают и реакционную среду разбавляют метиленхлоридом, затем ее выливают на лед. Органическую фазу высушивают и выпаривают для получения масла, которое затем очищают на колонке с диоксидом кремния, используя в качестве элюирующего средства смесь циклогексана с этилацетатом (90:1 по объему).
Выход: 57%
Спектр ЯМР-1H 4-/2,4-дихлор-фенил/-5-метил-2-/N-/a-метил-бензил/-N-циклопропил-метил-амино/-тиазола указан в табл. VIII.
Пример 42.
4-/2,4-Дихлор-фенил/-2-/N-/циклопропил-имидазол-4-ил-метил/-N-пропил-амино/-5-метил-тиазол.
Стадия А.
4-/2,4-Дихлор-фенил/-5-метил-2-/N-/циклопропил-/1-трифенил-метил-имидазол-4-ил/-метил/-N-пропил-амино/-тиазол.
Это соединение получают из N-/циклопропил-/1-трифенилметил-имидазол-4-ил/-метил/-N-пропил-тиомочевины (соединение 86) и 2-бром-1-/2,4-дихлор-фенил/-пропан-1-она (соединение 15) согласно описанному в примере 1 способу.
Стадия Б.
К 3 г полученного в предыдущей стадии продукта в виде раствора в 45 мл ацетона добавляют 45 мл 2н соляной кислоты. После выдерживания в течение ночи при комнатной температуре ацетон выпаривают, оставшуюся водную фазу промывают диэтиловым эфиром, затем добавляют бикарбонат натрия. Образовавшийся осадок экстрагируют 3 раза 100 мл этилацетата. Органическую фазу промывают водным насыщенным раствором хлорида натрия, затем сушат над безводным сульфатом натрия. Выпаривают под вакуумом для получения в виде порошка белого цвета 4-/2,4-дихлорфенил/-5-метил-2-N-/циклопропил-имидазол-4-ил-метил/-N-пропиламино/-тиазола.
Выход: 90%
Т.пл. 83oC.
Спектр ЯМР-1H этого продукта указан в табл. VIII.
Пример 43.
4-/2,4-Дихлорфенил/-5-метил-2-/N-/1-имидазол-4-ил-1-этил/-N-пропиламино/-тиазол.
Это соединение получают согласно способу, описанному в примере 42, используя в стадии А в качестве производного тиомочевины N-/1-/1-трифенилметил-имидазол-4-ил/-1-этил/-N-пропил-тиомочевину (соединение 87). Спектр ЯМР-1H этого продукта указан в табл. VIII.
Пример 44.
4-/2,4-Дихлорфенил/-5-метил-2-/N-/циклопропил-1/-бензилимидазол-4-ил/-метил/-N-пропил-амино/-тиазол.
К 492 мг соединения примера 42 в виде раствора в 10 мл диметил формамида добавляют 320 мг карбоната калия, затем, при 0oC, медленно добавляют 0,12 мл бензилхлорида в виде раствора в 1 мл диметилформамида. Оставляют перемешиваться в течение 3 ч при температуре около 60oC, затем 3 ч при 80oC. Для осаждения добавляют воду. Экстрагируют этилацетатом. Органическую фазу промывают насыщенным раствором хлорида натрия. Выпаривают досуха и остаток очищают путем хроматографии на колонке с диоксидом кремния, используя в качестве элюирующего средства смесь циклогексана с этилацетатом (2:1 по объему).
Выход: 67%
Добавляют адекватное количество 0,1 н соляной кислоты в виде раствора изопропанола для получения соответствующего дихлоргидрата.
Т.пл. 115oC.
Спектр ЯМР-1H 4-/2,4-дихлор-фенил/-5-метил-2-/N-циклопропил-/1-бензил-имидазол-4-ил/-метил/-N-пропил-амино/-тиазола указан в табл. VIII.
Пример 45.
4-/2,4-Дихлорфенил/-5-метил-2-/N-/циклопропил-/1-метилимидазол-4-ил/-метил/-N-пропиламино/-тиазол.
К 856 мг соединения примера 42 в виде раствора в 10 мл ацетона добавляют 570 мг гидроксида калия в виде порошка. Перемешивают в течение 5 мин, затем добавляют 0,14 мл метилиодида. После выдерживания в течение 15 мин при комнатной температуре реакционную смесь разбавляют 100 мл дихлорметана, затем промывают водой и насыщенной хлоридом натрия водой. Органическую фазу сушат над сульфатом натрия, выпаривают досуха, затем остаток подвергают хроматографированию на колонке с диоксидом кремния, используя в качестве элюирующего средства смесь циклогексана с этилацетатом (1:1 по объему).
Таким образом разделяют 4-/2,4-дихлор-фенил/-5-метил-2-/N-/циклопропил-/-метил-имидазол-4-ил/-метил/-N-пропил-амино/-тиазол и 4-/2,4-дихлор-фенил/-5-метил-2-/N-циклопропил/3-метил-имидазол-4-ил/-метил/-N-пропил-амино/-тиазол/ 37:63).
Выход: 33%
Пример 46.
5-Бром-4-/2,4-дихлор-фенил/-2-/N-пропил-N-/1-пирид-4-ил-1-этил/-амино/-тиазол.
1 г 4-/2,4-Дихлор-фенил/-2-/N-пропил-N-/1-пирид-4-ил-1-этил/-амино/-тиазола, соединения примера 25, растворяют в 20 мл метиленхлорида. Добавляют 0,15 мл брома. Перемешивают в течение ночи. Выпаривают досуха. Остаток растворяют в минимальном количестве изопропанола и осаждают диэтиловым эфиром. Отфильтровывают и промывают диэтиловым эфиром, затем растворяют в 5 -ном водном растворе карбоната калия. Экстрагируют этилацетатом, сушат над безводным сульфатом магния и выпаривают досуха для получения целевого продукта в виде масла.
Выход: 80%
Спектр ЯМР-1H 5-бром-4-/2,4-дихлорфенил/-2-/N-пропил-N-/1-пирид-4-ил-1-этил/-амино/-тиазола указан в табл. VIII.
Пример 47.
4-/2,4-Дихлорфенил/-5-метил-2-/N-/дициклопропилметил/-N-пропиламино/-тиазол.
К 1 г N-/дициклопропил-метил/-N-пропил-тиомочевина (соединение 88) в виде раствора в 25 мл безводного этанола добавляют 0,54 мл триэтиламина, затем медленно добавляют 1 г 2-бром-1-/2,4-дихлор-фенил/-пропан-1-она (соединение 15). После кипячения с обратным холодильником в течение 2 ч реакционную смесь выпаривают досуха. Остаток обрабатывают метиленхлоридом и промывают водой вплоть до полного удаления ионов брома. Органическую фазу сушат над безводным сульфатом натрия, затем выпаривают досуха. Остаток очищают на колонке с диоксидом кремния, используя в качестве элюирующего средства смесь циклогексана с этилацетатом (20:1 по объему) для получения целевого продукта в виде масла.
Выход: 88%
Спектр ЯМР-1H указан в табл. VIII.
Для получения соответствующего сульфата к этому основанию добавляют адекватное количество 1М серной кислоты в этаноле.
Т.пл. 140oC.
Пример 48.
4-/2,4-Дихлорфенил/-5-метил-2-/N-/циклопенил-циклопропил-метил/-N-пропил-амино/-тиазол.
Это соединение получают согласно способу, описанному в примере 47, но используя в качестве производного тиомочевины N-/циклопентил-циклопропил-метил/-N-пропил-тиомочевину (соединение 90). Во время очистки на колонке с диоксидом кремния в качестве элюирующего средства используют смесь циклогексана с этилацетатом (10:1 по объему).
Выход: 95%
Спектр ЯМР-1H указан в табл. VIII.
Пример 49.
4-/2,4-Дихлорфенил/-5-формил-2-/N-пропил-N-/1-пирид-4-ил-1-этил/-амино/-тиазол.
В колбу емкостью 100 мл вводят 3 мл диметилформамида. Охлаждают до -30oC и прикапывают 0,45 мл оксалилхлорида. Перемешивают в течение 30 мин при 0oC, затем оставляют температуру повышаться. Тогда добавляют 0,5 г соединения примера 25. Перемешивают в течение 6 ч. Оставляют перемешиваться в течение ночи. Добавляют воду и подщелачивают с помощью 1н раствора гидроксида натрия. Отфильтровывают образовавшийся осадок, получая смолу. Растворяют в минимальном количестве диэтилового эфира и добавляют гексан вплоть до получения легкой мути. Оставляют осаждаться, отфильтровывают и промывают гексаном для получения целевого продукта в виде кристаллов оранжевого цвета.
Выход: 75%
Т.пл. 114oC.
Спектр ЯМР-1H 4-/2,4-дихлор-фенил/-5-формил-2-/N-пропил-N-/1-пирид-4-ил-1-этил/-амино/-тиазола указан в табл. VIII.
Пример 50.
4-/2,4-Дихлорфенил/-5-оксиметил-2-/N-пропил-N-/1-пирид-4-ил-1-этил/-амино/-тиазол.
На ледяной бане охлаждают раствор, содержащий 1,1 г соединения примера 49 в 20 мл безводного метанола, и добавляют 0,2 г боргидрида натрия маленькими порциями. Оставляют реагировать при комнатной температуре, затем выпаривают растворитель. Остаток экстрагируют этилацетатом. Органическую фазу сушат над безводным сульфатом натрия. Выпаривают досуха и остаток растворяют в диэтиловом эфире. Осаждают гексаном для получения целевого продукта в виде порошка оранжевого цвета.
Выход: 72%
Т.пл. 113oC.
Спектр ЯМР-1H этого продукта представлен в табл. VIII.
Пример 51.
4-/2,4-Дихлорфенил/-5-метил-2-/N-пропил-2-ен-N-/1-пирид-4-ил-1-этил/-амино/-тиазол.
В трехгорлой колбе емкостью 100 мл, в атмосфере аргона, 2,0 г 4-/2,4-дихлорфенил/-5-метил-2-/N-/1-пирид-4-ил-1-этил/-амино/-тиазола (получен из N-1-пирид-4-ил-1-этил-тиомочевины и 2-бром-1-/2,4-дихлорфенил/-пропан-1-она (соединение 15), согласно способу, описанному в примере 1 (Т.пл. оксалата 182oC)), растворяют в 20 мл безводного тетрагидрофурана. Добавляют 0,4 г амида лития и перемешивают в течение 1 ч при 50oC. Добавляют 0,43 г аллилбромида и нагревают при 60oC в течение 48 ч. Выпаривают досуха, затем добавляют 10 мл водного 10%-ного раствора гидроксида натрия. Экстрагируют этилацетатом, органическую фазу сушат над безводным сульфатом натрия и выпаривают досуха. Остаток очищают, используя в качестве элюирующего средства смесь этилацетата с гексаном (75: 25 по объему), получая целевой продукт в виде масла.
Выход: 20%
Спектр ЯМР-1H указан в табл. VII.
Для получения 4-/2,4-дихлорфенил/-5-метил-2-/N-пропил-2-ен-N-1/пирид-4-ил-1-этил/-амино/-тиазола 0,4 г снования растворяют в минимальном количестве изопропанола и добавляют 0,18 г предварительно растворенной в изопропаноле щавелевой кислоты. Выпаривают досуха и перекристаллизуют сначала из смеси изопропанола с диэтиловым эфиром (50:50 по объему), затем из изопропанола.
Т.пл. 150oC.
Пример 52.
4-/4-Хлор-2-окси-фенил/-5-метил-2-/N-пропил-N-/1-пирид-4-ил-1-этил/-амино/-тиазол.
В течение 24 ч кипятят с обратным холодильником 700 мг 4-/4-хлор-2-метоксифенил/-5-метил-2-/N-пропил-N-/1-пирид-4-ил-1-этил/-амино/-тиазол соединения примера 22, растворенных в 30 мл концентрированной бромоводородной кислоты. Выпаривают досуха и остаток обрабатывают водой, насыщенной карбонатом калия. Экстрагируют метиленхлоридом, затем выпаривают органический растворитель. Остаток очищают путем хроматографии на колонке с диоксидом кремния, используя в качестве элюирующего средства смесь этилацетата с метанолом (9:1 по объему), получая целевой продукт в виде масла.
Выход: 67%
Спектр ЯМР-1H соединения этого примера указан в табл. VIII.
Пример 53.
4-/2-Хлор-4-окси-фенил/-5-метил-2-/N-пропил-N-/1-пирид-4-ил-1-этил/-амино/-тиазол.
Это соединение получают из соединения примера 27 согласно способу, описанному в примере 52.
ЯМР-1H-спектр 4-/2-хлор-4-оксифенил/-5-метил-2-/N-пропил-N-/1-пирид-4-ил-1-этил/-амино/-тиазола указан в табл. VIII.
Примеры 54 88.
Согласно способу, описанному в примере 1, получают соединения примеров 54 87, используя адекватные производные бромацетонов и тиомочевин. Их спектральные характеристики указаны в табл. VIII.
Пример 89.
5-Бром-4-/2,4-дихлор-фенил/-2-/N-/ a -циклопропил-бензил/-N-пропил-амино/-тиазол.
Это соединение получают из 4-/2,4-дихлорфенил/-2-/N-/a-циклопропил-бензил/-N-пропиламино/-тиазола, соединения примера 82, согласно способу, описанному в примере 46.
ЯМР-1H-спектр указан в табл. VIII.
Пример 90.
4-/2,4-Дихлорфенил/-5-иод-2-/N-/a-циклопропилбензил/-N-пропиламино/-тиазол.
496 мг 5-Бром-4-/2,4-дихлорфенил/-2-/N-/a-циклопропилбензил/-N-пропил-амино/тиазола соединения примера 89 растворяют в 20 мл диэтилового эфира и этот раствор охлаждают до -70oC, затем медленно добавляют 0,8 мл раствора трет. -бутиллития (1,5 г в пентане). После этого медленно приливают 305 мг иода в виде раствора в 20 мл тетрагидрофурана. Температуру медленно доводят до 0oC и гидролизуют с помощью водного насыщенного раствора хлорида натрия и промывают раствором тиосульфата. Очищают как указано в примере 1, получая целевой продукт.
Спектр ЯМР-1H 4-/2,4-дихлор-фенил/-5-иодо-2-/N-/a-цикло-пропил-бензил/-N-пропил-амино/-тиазола указан в табл. VIII.
Пример 91.
4-/2-Хлор-4-иод-фенил/-5-метил-2-/N-/a-циклопропилбензил/-N-пропил-амино/-тиазол.
Это соединение получают из N-/a-циклопропил-бензил/-N-пропилтиомочевины (соединение 75) и 2-бром-1-/2-хлор-4-иод-фенил/-пропан-1-она (соединение 18) согласно способу, описанному в примере 1.
Спектр ЯМР-1H этого соединения указан в табл. VIII.
Пример 92.
4-/2,4-Дихлор-фенил/-5-метил-2-/N-/2,2-дициклопропил-1-этил/-N-пропиламино/-тиазол.
Это соединение получают из 2-бром-1-/2,4-дихлор-фенил/-пропан-1-она (соединение 15) и N-/2,2-дициклопропил-1-этил/-N-пропил-тиомочевины (соединение 115) согласно способу, описанному в примере 1. Смола.
Спектр ЯМР-1H (растворитель CDCl3/: d, ppm 0,0 0,7 (м. 11Н); 0,9 (м. 3Н); 1,4 1,9 (м. 2Н); 2,10 (с. 3Н), 3,3 3,5 (м. 4Н); 7,1 7,4 (м. 3Н).
Пример 93.
4-/2,4-Дихлор-фенил/-5-метил-2-/N-/ a -циклопропил-бензил/-N-пропиламино[тиазол-/изомер /+/] и 4-/2,4-дихлор-фенил/-5-метил-2-/N-/a-циклопропил-бензил/-N-пропил-амино/-тиазол-/изомер /-/]
Оба стереоизомера 4-/2,4-дихлор-фенил/-5-метил-2-/N-/a-циклопропил-бензил/-N-пропил-амино/-тиазола (соединение примера 1) получают согласно двум методам.
Метод А.
Стадия А.
a -Циклопропил-бензиламин.
Выдерживают при перемешивании, при 50oC, в течение 4-х дней, в атмосфере аргона, 100 г циклопропилфенилкетона в 2000 мл метанола с 500 г предварительно высушенного ацетата аммония и 50 г цианоборгидрида натрия в присутствии молекулярного сита  . После охлаждения отфильтровывают молекулярное сито, затем добавляют концентрированную соляную кислоту для доведения pH-значения до величины, равной 2. Раствор выпаривают досуха под вакуумом и остаток обрабатывают водой. Водную фазу промывают диэтиловым эфиром, затем подщелачивают добавлением концентрированного раствора гидроксида калия для того, чтобы pH-значение было выше 10. Экстрагируют два раза метиленхлоридом, промывают насыщенным раствором хлорида натрия, сушат над безводным сульфатом магния, затем концентрируют под вакуумом, получая α-циклопропил-бензил-амин, который используют в следующей стадии без всякой другой очистки.
. После охлаждения отфильтровывают молекулярное сито, затем добавляют концентрированную соляную кислоту для доведения pH-значения до величины, равной 2. Раствор выпаривают досуха под вакуумом и остаток обрабатывают водой. Водную фазу промывают диэтиловым эфиром, затем подщелачивают добавлением концентрированного раствора гидроксида калия для того, чтобы pH-значение было выше 10. Экстрагируют два раза метиленхлоридом, промывают насыщенным раствором хлорида натрия, сушат над безводным сульфатом магния, затем концентрируют под вакуумом, получая α-циклопропил-бензил-амин, который используют в следующей стадии без всякой другой очистки.
Выход: 76%
Стадия Б.
a-Циклопропил-бензиламин-[изомер /+/] / и a-циклопропил-бензиламин-/изомер /-/]
К 275 мл абсолютного этанола добавляют 80,6 г L-/+/-винной кислоты и доводят до температуры кипения с обратным холодильником. Затем прикапывают 79 г полученного в предыдущей стадии a-циклопропил-бензиламина. По окончании добавления реакционную среду медленно охлаждают и получают таким образом кристаллы. Перекристаллизуют эти кристаллы пятикратно из абсолютного этанола. За оптической чистотой полученного амина наблюдают с помощью хроматографии в газовой фазе с реактивом Mosher. a-Циклопропил-бензиламин-/изомер/+/] таким образом получают в форме винной соли с оптической чистотой выше 96%
Выход: 25%
Т.пл. 150oC.
(α)
α -Циклопропил-бензиламин-/изомер /-/] получают из соли после растворения в воде, подщелачивания раствора, экстракции метиленхлоридом, высушивания над безводным сульфатом магния и выпаривания под вакуумом.
(α)
Объединяют этанольные растворы предыдущего разделения и выпаривают досуха. Остаток обрабатывают водой, подщелачивают, экстрагируют метиленхлоридом, сушат над безводным сульфатом магния и выпаривают досуха. Превращают в соль с D-/-/-винной кислотой, используя метод солеобразования вышеуказанного разделения. После 4-х перекристаллизаций из этанола винную соль α -циклопропил-бензил-амина-/изомер /+/] получают с оптической чистотой выше 96%
Выход: 20%
Т.пл. 151oC.
(α)
Стадия В.
4-/2,4-Дихлор-фенил/-5-метил-2-/N- α /-циклопропил-бензил-амино/-тиазол-[изомер/-/] и 4-/2,4-дихлор-фенил/-5-метил-2-//N- a -циклопропил-бензил/-амино/-тиазол-[изомер/+/]
Поступают как описано в получении XV, используя в качестве амина a -циклопропил-бензиламин-[изомер /+/] для получения N-a-циклопропил-бензил-тиомочевины-[изомер /+/] Затем это последнее соединение вводят во взаимодействие с 2-бром-1-/2,4-дихлор-фенил/-пропан-1-оном (соединение 15) согласно способу, описанному в примере 1, для получения 4-/2,4-дихлор-фенил/-5-метил-2-/N-a-циклопропилбензиламино/-тиазола-[изомер /-/] Общий выход: 62%
(α)
4-/2,4-Дихлорфенил/-5-метил-2-/N-/ α -циклопропил-бензил/-амино/-тиазол-[изомер /+/] получают согласно способу, описанному выше, используя в качестве исходного амина a -циклопропил-бензиламин-[изомер /-/]
Стадия Г.
Затем 1,18 г 4-/2,4-дихлорфенил/-5-метил-2-/N-a-циклопропил-бензил-амино/-тиазола -[изомер /-/] растворяют в 35 мл безводного диметилформамида и добавляют при 0oC 145 мг гидрида натрия, затем, после прекращения выделения газов, 370 мг пропил-бромида. Нагревают 2,5 ч при 75oC. Выпаривают досуха, гидролизуют с помощью воды. Водную фазу экстрагируют этилацетатом. Таким образом полученную органическую фазу промывают водой, насыщенной хлоридом магния; сушат над безводным сульфатом магния, затем выпаривают под вакуумом, получая остаток, который очищают на колонке с диоксидом кремния, используя в качестве элюирующего средства смесь циклогексана с этилацетатом (20:1 по объему).
4-/2,4-Дихлор-фенил/-5-метил-2-/N-/ a-циклопропил-бензил/-N-пропиламино/-тиазол [изомер/-/] получают в форме смолообразного продукта.
(α)
Из этого основания и при использовании адекватных кислот в виде раствора в этаноле получают следующие соли:
хлоргидрат: т.пл. 66,5oC;
пара-толуолсульфат: т.пл. 72oC
/+/-Изомер 4-/2,4-дихлор-фенил/-5-метил-2-/N-/α -циклопропил-бензил/-N-пропиламино/-тиазола получают согласно способу, описанному выше, при использовании /+/-изомера 4-/2,4-дихлорфенил/-5-метил-2-/N-/ a -циклопропил-бензил/-амино/-тиазола.
Соответствующий хлоргидрат получают путем введения во взаимодействие /+/-изомера 4-/2,4-дихлорфенил/-5-метил-2-/N-/a-циклопропил-бензил/-N-пропил-амино/-тиазола с раствором соляной кислоты в метаноле.
Т.пл. 71oC.
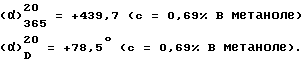
Метод Б.
Стадия А.
α-Циклопропил-бензиламин-[изомер/+/] и a -циклопропил-бензил-амин-[изомер/-/]
Циклопропилфенилкетоксим /E, Z/ получают согласно способу, описанному в Org. Synth. Coll. Т.II, с.70, Blatt, J. Willey and Sons, Inc. Edt. Нью-Йорк-Лондон, Сидней, Авторское право, 1943.
Таким образом полученная смесь содержит 76% изомера E и 24% изомера Z. Перекристаллизуют несколько раз из метанола или изомеризуют в кислой среде согласно нижеприведенному способу.
2 г циклопропилфенилкетоксима (E, Z) растворяют в 20 мл безводного диэтилового эфира и насыщают газообразным хлороводородом. Отфильтровывают образовавшийся осадок, затем добавляют 50 мл 10%-ного водного раствора карбоната калия. Экстрагируют твердое вещество метиленхлоридом. Органическую фазу промывают водой, сушат над безводным сульфатом магния и выпаривают досуха, получая циклопропилфенилкетон-оксим (E).
Чистота: 98%
1,61 г таким образом полученного оксима в виде раствора в 10 мл безводного диметилформамида добавляют к раствору, содержащему 276 мг гидрида натрия в 10 мл безводного диметилформамида. После перемешивания в течение часа при комнатной температуре добавляют 0,75 мл метилиодида. После перемешивания в течение 4 ч реакционную смесь выливают на лед. Экстрагируют этилацетатом, сушат, выпаривают под вакуумом и очищают на колонке с диоксидом кремния, используя в качестве элюирующего средства смесь циклогексана с этилацетатом (50: 1 по объему), получая простой метиловый эфир циклопропилфенилкет-оксима (E). Затем добавляют 385 мг /-/-изомера норэфедрина в виде раствора в 5 мл безводного тетрагидрофурана и, при -30oC, 8,6 мл 1М боран-тетрагидрофуранового комплекса, затем 300 мг простого метилового эфира циклопропилфенилкет-оксима (E) в виде раствора в 3 мл безводного тетрагидрофурана. Кипятят с обратным холодильником в течение 2,5 ч, затем, при 0oC, добавляют 10 мл воды и 10 мл 20-ного раствора гидроксида натрия. Кипятят с обратным холодильником в течение 1,5 ч. После охлаждения экстрагируют метиленхлоридом, органическую фазу сушат и выпаривают досуха. Остаток обрабатывают избытком метанола и в течение 5 ч кипятят с обратным холодильником, затем выпаривают досуха и очищают на колонке с диоксидом кремния, используя в качестве элюирующего средства смесь метиленхлорида с метанолом (96:4 по объему).
Таким образом получают (+)-изомер a-циклопропил-бензиламина с оптической чистотой выше 90%
Выход: 40%
/-/-Изомер a-циклопропил-бензиламина получают согласно вышеописанному способу, но используя во время восстановления простого метилового эфира циклопропилфенилкет-оксима (E) (+)-изомер норэфедрина в качестве хирального агента.
Стадии Б и В.
Их осуществляют затем как описано в методе А, стадии В и Г, для получения /+/-изомера 4-/2,4-дихлор-фенил/-5-метил-2-/N-/a-циклопропилбензил/-N-пропил-амино/-тиазола и /-/-изомера 4-/2,4-дихлор-фенил/-5-метил-2-/N-/a-циклопропилбензил/-N-пропил-амино/-тиазола.
Фармацевтическое приготовление.
Пример 94.
Желатинозные капсулы с 20 мг сульфата 4-/2,4-дихлор-фенил/-2-/N-/дициклопропил-метил/-N-пропил-амино/-5-метил-тиазола.
Сульфат 4-/2,4-дихлорфенил/-2-/N-/дициклопропил-метил/-N-пропил-амино/-5-метил-тиазола - 20 мг
кукурузный крахмал 15 мг
лактоза 25 мг
тальк 5 мг
Для одной желатинозной капсулы с лекарством N 3.
Примеры 95 97.
Характеристики соединений, полученных в этих примерах, представлены в табл. VIII.
Полезность заявленных соединений.
Соединения согласно изобретению, как отмечалось выше, обладают высоким сродством к рецепторам CRF (фактора высвобождения кортикотропного гормона).
Результаты фармакологического теста, иллюстрирующего активность большинства соединений, показанных в примерах, даны в табл. IX XV.
Протокол испытаний соответствует протоколу, описанному в J.Neurosci (1987). 7(1), 88-100, в соответствии с которым смещение связи CRF, меченного радиоактивным изотопом, а именно связи 1251-CRF с его специфическими рецепторами, определялось в присутствии тестируемого соединения. Тесты проводят с использованием рецепторов CRF, находящихся в неочищенных мембранах, полученных из:
коры головного мозга крысы;
мозга мыши или
клеток CHO, трансфецированных с помощью ДНК с рецептора, клонированного из человеческого мозга согласно N.Vita и др. FEBS Letters, 1993, 335(1). 1-5.
Полученные результаты показывают активность заявленных соединений.






Изобретение относится к химии гетероциклических соединений, обладающих активностью в отношении фактора высвобождения кортикотропного гормона. Сущность изобретения: разветвленные алкиламинопроизводные тиазола формулы I, где R1 - нафтил или радикал формулы A1, где X, Y, Z - водород, галоген, C1-C5-алкокси, C1-C5-алкил, гидрокси, нитро или трифторметил, R2 - водород, галоген, C1-C5-алкил, гидроксиметил или формил, R3 - C1-C5-алкил, C3-C8-циклоалкил, C2-C6- алкенил, C4-C8-циклоалкилалкил или фенил, R4 - водород, R5 - C1-C5-алкил, C3-C8-циклоалкил, возможно замещенный C1-C5- алкилом, C4-C8-циклоалкилалкил, C2-C6- алкенил или радикал формулы B, где P = 0, 1, 2 или 3; R6 - возможно замещенный фенил, пиридил, имидазолил или C3-C8- циклоалкил, или тиенил, m, n - 0 или 1, или их возможные стереоизомеры или их соли присоединения с минеральной или органической кислотой. Изобретение касается способов получения соединений формулы I, фармацевтической композиции на их основе, а также алкиламинопроизводных тиазола формулы IV, где R1 - возможно замещенный галогенами фенил,  - C1-C5-алкил, R5 - C1-C5-алкил или C3-C8-циклоалкил,
- C1-C5-алкил, R5 - C1-C5-алкил или C3-C8-циклоалкил,  - фенил или пиридил, в качестве промежуточных соединений, участвующих в синтезе соединений формулы I. 5 с. и 7 з.п. ф-лы, 15 табл.
- фенил или пиридил, в качестве промежуточных соединений, участвующих в синтезе соединений формулы I. 5 с. и 7 з.п. ф-лы, 15 табл.

где R1 нафтил радикал или радикал формулы А1
где X, Y, Z идентичные или разные представляют каждый атом водорода, атом галогена, С1 С5-алкокси, С1 С5-алкил, гидрокси радикал, радикал нитро или трифторметил радикал;
R2 атом водорода, атом галогена, С1 С5-алкил, гидроксиметил или формильный радикал;
R3 С1 С5-алкил, С3 - С8-циклоалкил, С2 С6-алкенил, С4 - С8-циклоалкилалкил или фенил;
R4 атом водорода;
R5 С1 С5-алкил,
С1 С8-циклоалкил, возможно замещенный С1 - С5-алкил, С4 С8-циклоалкилалкил, имеющий линейную или разветвленную цепь, С2 С6-алкенил или радикал формулы В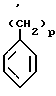
где p 0, 1, 2 или 3;
R6 фенил, в случае необходимости, замещенный одним или несколькими атомами галогена, трифторметил радикалами, С1 - С5-алкокси, С1 С5-алкил, метилтио или радикалами формулы В; пиридил, в случае необходимости, замещенный одним или несколькими атомами галогена, С1 С5-алкокси или С1 - С5-алкил, имидазолил, в случае необходимости, замещенный C1-C5-алкил радикалами или радикалами формулы В; С3 - С5-циклоалкил, в случае необходимости замещенный С1
С5-алкил, или тиенил;
m, n идентичные или разные, каждый 0 или 1,
или их возможные стереоизомеры или их соли присоединения с минеральной или органической кислотой.
R2 атом галогена или С1 С5-алкил;
R3 С1 С5-алкил, С3 С8-циклоалкил или С2 С6-алкенил;
R5 С1 С5-алкил, С3 - С8-циклоалкил, в случае необходимости, замещенный С1 С5-алкилом; или С4 С8-циклоалкилалкил, имеющий линейную или разветвленную цепи;
R4, R6 m и n имеют то же значение, что и в формуле I по п.1,
или их стереоизомеры, или их соли присоединения с минеральной или органической кислотой.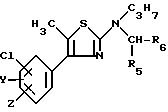
где Y и Z имеют значения, указанные в п.1 формулы изобретения;
R5 C1 C5-алкил, C3 - C8-циклоалкил, в случае необходимости, замещенный C1 C5-алкил, или C4 C8-циклоалкилалкил, имеющий линейную или разветвленную цепь;
R6 фенил радикал, возможно замещенный одним или несколькими атомами галогена, трифторметил радикалами, C1 C5-алкокси, C1 C5-алкил или метилтио; пиридил, в случае необходимости, замещенный одним или несколькими атомами галогена, C1 C5-алкокси или C1 C5-алкил; имидазолил, в случае необходимости, замещенный C1 C5-алкил; или C3 - C8-циклоалкил, в случае необходимости, замещенный C1 - C5-алкил,
или их стереоизомеры, или их соли присоединения с минеральной или органической кислотой.
где R1 имеет значение, указанное в п.1; атом водорода или C1 C5-алкил;
атом водорода или C1 C5-алкил;
Hal атом галогена,
с тиомочевиной формулы III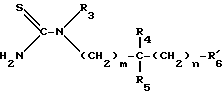
где R3, R4, R5, m и n имеют указанные в п.1 значения, а R6 имеет значение, указанное для R6 в п.1, за исключением случая, когда R6 содержит функции с реакционноспособными атомами азота, тогда  соответствует радикалу R6, в котором водород вышеуказанной реакционноспособной функции заменен защитной группой, устойчивой к гидролизу в щелочной среде, для получения соединения формулы I'
соответствует радикалу R6, в котором водород вышеуказанной реакционноспособной функции заменен защитной группой, устойчивой к гидролизу в щелочной среде, для получения соединения формулы I'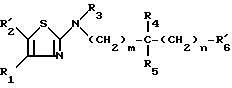
где R1, R3, R4, R5, m и n имеют значения, указанные в п.1; имеет значение, указанное выше;
имеет значение, указанное выше; имеет значение, указанное выше,
имеет значение, указанное выше,
а затем соединение формулы I', в которой  атом водородоа, подвергают либо воздействию галогена для получения соединений формулы 1, в которой R2 атом галогена, которые затем, когда R2 атом брома, подвергают взаимодействию с другим галогеном, чтобы получить соединение формулы I, в которой R2 этот атом галогена, либо воздействию оксалилхлорида для получения соединений формулы I, в которой R2 - формильный радикал, которые подвергают восстановлению для получения соединений формулы I, в которой R2 гидроксиметильный радикал, или соединения формулы I', в которой
атом водородоа, подвергают либо воздействию галогена для получения соединений формулы 1, в которой R2 атом галогена, которые затем, когда R2 атом брома, подвергают взаимодействию с другим галогеном, чтобы получить соединение формулы I, в которой R2 этот атом галогена, либо воздействию оксалилхлорида для получения соединений формулы I, в которой R2 - формильный радикал, которые подвергают восстановлению для получения соединений формулы I, в которой R2 гидроксиметильный радикал, или соединения формулы I', в которой 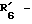 радикал R6, содержащий функции с реакционными атомами азота, имеющие защитную группу, подвергают кислотному гидролизу для получения соединений формулы I, в которой R6 радикал, содержащий первичный или вторичный амин, и, в случае необходимости, соединения формулы I затем разделяют на их возможные стереоизомеры и/или превращают в соответствующие соли с неорганической или органической кислотой.
радикал R6, содержащий функции с реакционными атомами азота, имеющие защитную группу, подвергают кислотному гидролизу для получения соединений формулы I, в которой R6 радикал, содержащий первичный или вторичный амин, и, в случае необходимости, соединения формулы I затем разделяют на их возможные стереоизомеры и/или превращают в соответствующие соли с неорганической или органической кислотой.
где R1 имеет значение, указанное в п.1; атом водорода или C1 С5-алкил;
атом водорода или C1 С5-алкил;
Hal атом галогена,
с тиомочевиной формулы IIIA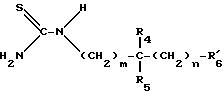
где R4, R5, m и n имеют указанные в п.1 значения, а 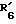 имеет значение, указанное для R6 в п.1, за исключением случае, когда R6 содержит функции с реакционноспособными атомами азота, и тогда
имеет значение, указанное для R6 в п.1, за исключением случае, когда R6 содержит функции с реакционноспособными атомами азота, и тогда 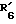 соответствует радикалу R6, в котором водород вышеуказанной реакционноспособной функции заменен защитной группой, устойчивой к гидролизу в щелочной среде, для получения соединения формулы IV
соответствует радикалу R6, в котором водород вышеуказанной реакционноспособной функции заменен защитной группой, устойчивой к гидролизу в щелочной среде, для получения соединения формулы IV
где R1, R4, R5, m и n имеют значения, указанные в п.1;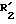 имеет указанное выше значение;
имеет указанное выше значение;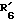 имеет указанное выше значение, которое вводят во взаимодействие с галогенидом формулы V
имеет указанное выше значение, которое вводят во взаимодействие с галогенидом формулы V
Hal R3,
где Hal атом галогена;
R3 имеет значение, указанное в п.1,
для получения соединения формулы I'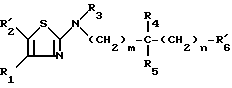
в которой R1, R3, R4, R5, m и n имеют значения, указанные в п.1 изобретения;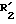 имеет значение, указанное выше;
имеет значение, указанное выше;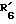 имеет значение, указанное выше,
имеет значение, указанное выше,
а затем соединения формулы I', в которой 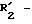 атом водорода, подвергают либо воздействию галогена, чтобы получить соединения формулы I, в которой R2 атом галогена, которые затем, когда R2 атом брома, подвергают воздействию другого галогена для получения соединений формулы I, в которой R2 этот атом галогена, либо воздействию оксалилхлорида для получения соединений формулы I, в которой R2 формильный радикал, которые подвергают восстановлению для получения соединений формулы I, в которой R2 гидроксиметильный радикал, или соединения формулы I', в которой
атом водорода, подвергают либо воздействию галогена, чтобы получить соединения формулы I, в которой R2 атом галогена, которые затем, когда R2 атом брома, подвергают воздействию другого галогена для получения соединений формулы I, в которой R2 этот атом галогена, либо воздействию оксалилхлорида для получения соединений формулы I, в которой R2 формильный радикал, которые подвергают восстановлению для получения соединений формулы I, в которой R2 гидроксиметильный радикал, или соединения формулы I', в которой 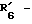 радикал R6, содержащий функции с реакционноспособными атомами азота, имеющие защитную группу, подвергают кислотному гидролизу для получения соединений формулы I, в которой R6 радикал, содержащий первичный или вторичный амин, и в случае необходимости соединения формулы I затем разделяют на их возможные стереоизомеры и/или превращают в соответствующие соли с неорганической или органической кислотой.
радикал R6, содержащий функции с реакционноспособными атомами азота, имеющие защитную группу, подвергают кислотному гидролизу для получения соединений формулы I, в которой R6 радикал, содержащий первичный или вторичный амин, и в случае необходимости соединения формулы I затем разделяют на их возможные стереоизомеры и/или превращают в соответствующие соли с неорганической или органической кислотой.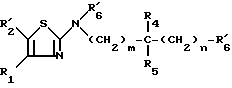
где R1 фенил, в случае необходимости, замещенный атомами галогена;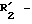 С1 С5-алкил;
С1 С5-алкил;
R5 С1 С5-алкил или С3 - С5-циклоалкил;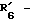 фенильный радикал или пиридильный радикал,
фенильный радикал или пиридильный радикал,
в качестве промежуточных соединений, участвующих в синтезе соединений формулы I.
| ЕР, заявка, 0462264, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| ЕР, заявка, 04324040, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| ЕР, заявка, 0283390, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1998-01-20—Публикация
1993-06-23—Подача