Это изобретение относится к продуктам защиты сельскохозяйственных растений.
Более конкретно, изобретение относится к противогрибковым микроорганизмам, в частности к новому штамму Pseudomonas fluorescens и его использованию для защиты растений против грибкового поражения.
Известен способ защиты растений от грибковых заболеваний путем обработки растений, семян или почвы микроорганизмами (патент СССР N 1477231, A 01 N 63/00, 1989).
Известно, что некоторые штаммы микроорганизма Pseudomonas fluorescens являются эффективными сельскохозяйственными фунгицидами, так в EP N 0376775 описано применение указанного штамма для биоконтроля корневой гнили на семенах кукурузы и гибели проростков.
Целью изобретения является создание штамма с более широким спектром действия.
Антигрибковая активность сильно варьирует среди бесчисленных штаммов микроорганизмов. Штаммами, пригодными в сельском хозяйстве, являются те, которые обладают эффективными уровнями активности против особых целевых грибков.
Одной из таких целей является группа грибков, с которыми связано заболевание, известное как "черная ножка", которое причиняет беспокойство особенно у определенных культур в особых климатических условиях. Применение средств биологической борьбы (СББ) или биопестицидов для борьбы с заболеванием может быть эффективным или более предпочтительным перед использованием стандартных химических средств борьбы.
Предметом настоящего изобретения является получение применимого в сельском хозяйстве фунгицида.
В соответствии с настоящим изобретением представляется новый штамм Pseudomonas fluorescens, биовар 1, депонированный в Национальной коллекции промышленных и морских бактерий под регистрационным номером N C1B 40189 от 1 сентября 1989 г.
Изобретение также включает противогрибковую композицию для сельского хозяйства, содержащую Pseudomonas fluorescens, биовар 1, штамм NC1 B 40189 в качестве активного ингредиента в смеси с композицией носителя, приемлемой в сельскохозяйственной практике.
Примерами типов рецептур для сельского хозяйства, которые могут быть использованы, являются композиции покрытий для семян, жидкость для обработки корней или пропитывания почвы и композиции для гранул или порошков. Основные материалы для этих композиций хорошо известны в этой области.
Кроме того, изобретение предоставляет способ защиты культурных растений от грибковой инфекции, включающий обработку растений или их корней и семян, или ростовой среды для растений фунгицидно эффективной дозировкой вышеназванного штамма Pseudomonas fluorescens, биовар 1, NC1 B 40189. Обработка может быть осуществлена нанесением препарата, содержащего штамм микроорганизмов настоящего изобретения.
Противогрибковый микроорганизм этого изобретения особенно эффективен против грибковых инфекций, связанных с заболеванием "черная ножка", такими грибами, как грибы родов Rhizoctonia, Pythium, Fusarium. Он также активен против Gacumannomyces graminis, который вызывает гниль корневой шейки злаковых культур.
Штамм этого изобретения (N C1B 40189) был выделен из корней самосевного растения пшеницы, отобранных от растений, выросших в Чизелдоне, Свиндоне, Уилтшире, Великобритания. Он был помещен в Национальную коллекцию промышленных и морских бактерий (23 St. Machar Drive, Aberdeen, Scotland, AB 2 1RJ) в соответствии с Будапештским договором, 1 сентября 1989 г.
Здесь далее следует описание выделения, определения характеристик и отбора бактериального изолята с примерами его активности против нескольких грибов, которые инфицируют культурные растения.
Выделение микроорганизма
Бактерия была выделена из корней самосевной пшеницы, выкопанных на поле фермы, известной как фермерское хозяйство Дрейкот, Чизелдон, Свиндон, Уилтшир, Великобритания.
Корни были промыты для удаления всей прилипшей почвы и помещены в стерильную дистиллированную воду в колбе со стеклянными бусами. Корни взбалтывали со стеклянными бусами в течение 15 мин и смывы затем высевали на чашки с агаром Кинга B (протеазный пептон N 3, 20 г, глицерина 10 мл; сульфата калия 1,5 г; сульфата магния семиводного гидрата 1,5 г; технического агара 12 г и 1 л дистиллированной воды при pH 7,2 и включающей циклогексимид 75 мкг/мл; хлоромицетин 12,5 мкг/мл и ампициллин 50 мкг/мл) в разведениях 10:1 и 10:3. Чашки инкубировали в течение трех дней при 20oC.
Бактерии отбирали наугад с агара в чашке и получали субкультуру на агаре, приготовленном на триптическом соевом бульоне 1/10 (ТСА) (3 г триптического соевого бульона; 15 г агара; 1 л воды). Бактерии поддерживали на 1/10 ТСА и сохраняли при 4oC до востребования.
Определение характеристик микроорганизма
Морфологические характеристики штамма Pseudomonas fluorescens N C1B 40189 были определены в Национальной коллекции промышленных и морских бактерий и представлены в табл. 1.
(Тесты описаны в: R. E. Buchanan, N.E. Gibbons. (eds), 1974, Bergey's Manual of Determinative Bacteriology, 8th ed; S.T. Cowan, K.J. Steel, 1974, Manual for Identification of Medical Bacteria).
Первичный отбор на чашках Петри с почвой
Штамм Pseudomonas fluorecsens N C1B 40189 был испытан на активность против Pythium ultimum, с использованием отбора на чашках Петри с почвой.
Чашки Петри (5 см) заполняли 10 мл картофельно-декстрозного агара (КДА). Агаровые цилиндрики (5 мл) из 7-дневной культуры Pythium ultimum, выращенной при 20oC, помещали в центр на КДА.
Чашки инкубировали в течение 5 дней при 20oC, во время которого P.ultimum колонизировал чашку. Minster Mendip суглинок автоклавировали при 120oC в течение 60 мин. К этому добавляли стерильные зародыши пшеницы (% по весу) и хорошо перемешивали. В каждую чашку Петри помещали примерно 8 г почвы, чтобы покрыть газон Pythium.
Применили следующие воздействия (2 мл помещали на чашку Петри):
1) Штамм Pseudomonas fluorecsens N C1B 40189 (культура, выращенная в триптическом соевом бульоне 1/10 (ТСБ) в течение 48 ч при 12oC);
2) Металаксил (100 ч. на м Al);
3) Контроль: один ТСБ 1/10.
Чашки готовили в двух повторностях и инкубировали в течение 4 дней при 10oC.
Результаты представлены в табл. 2. Активность отмечалась на шкале от нуля до 3. Отметка нуля означала, что был значительный рост Pythium; отметка 3 означала, что не было роста мицелия на чашке.
Результаты показывают, что штамм N C1B 40189 подавлял рост грибов в почве. Его активность сравнима с металаксилом, стандартным химическим фунгицидом.
Вторичный отбор на горшечных культурах
Эффективность штамма Pc Pseudomonas fluorescens N C1B 40189 кроме того была испытана против Pythium ultimum и Rhizoctonia solani.
Результаты показывают, что штамм N C1B 40189 обладает активностью против P. ultimum и P. solani в условиях теплицы.
Активность против P.ultimum:
Культуры P.ultimum выращивали на чашках КДА в течение 7 дней при 20oC.
Смесь 200 г серебряного песка, 5 г муки, 4 г зародышей пшеницы Bemax и 40 мл воды автоклавировали при 120oC в течение 20 мин и затем помещали в колбу и засевали 1/4 чашки Pythium. Колбы инкубировали при 20oC в течение 7 дней, затем содержимое каждой колбы смешивали с мелким песком до окончательного веса 300 г.
Одну колбу Pythium смешивали с 8 л суглинка Mendip Minster, чтобы получить стандартное разведение (X). Это стандартное разведение далее разбавляли чистым суглинком Mendip, чтобы получить разведение X/16, используемое в тестах.
Определение проводили в горшках (диаметром 3 дюйма), наполненных на 3/4 зараженной почвой. В каждый горшок высевались пять горошин и покрывались чистой почвой.
Использовались следующие виды обработки (35 мл добавляли в виде орошения в каждый горшок):
1) Штамм Pseudomonas fluorescens N C1B 40189 (культура, выращенная в триптическом соевом бульоне 1/10 (ТСБ) в течение 48 ч при 20oC);
2) Металаксил (0,1 - 5,0 ч. на м Al);
2) Контроль: один ТСБ 1/10.
Для каждого вида обработки готовили пять повторностей.
Растения гороха выращивали в течение 14 дней при 15oC и еженедельно проверяли появление всходов. Растения поливали ежедневно: особое внимание уделялось тому, чтобы обеспечить сохранение влажности почвы во время испытаний, так как заболевание вызывает полегание (выпревание) при условиях охлаждения и влажности.
Результаты представлены в табл. 3.
Результаты для штамма N C1B 40189 и для необработанного контроля показывают, что применение штамма Pseudomonas fluorescens дает возможность появиться значительно большему числу растений гороха.
Активность штамма N C1B 40189 сравнима с активностью химического фунгицида металаксила по уровням проявления болезни.
Активность против R. solani
Культуры R. solani выращивали на чашках КДА в течение 7 дней при 20oC.
Смесь 200 г серебряного песка, 4 г зародышей пшеницы Bemax и 40 мл воды автоклавировали при 120oC в течение 20 мин, затем помещали в колбу и засевали 1/4 чаши Rhizoctonia. Колбы инкубировали при 20oC в течение 7 дней, затем содержимое каждой колбы смешивали с мелким песком до конечного веса 300 г.
Три четверти колбы посевной культуры Rhizoctonia смешивали с 6 л суглинка Mendip Minster, чтобы получить стандартное разведение (V). Эту смесь затем разбавляли чистым суглинком Mendip, чтобы получить разведение V/3, использованное в испытаниях.
Испытания проводили в горшках (диаметром 3 дюйма), наполненных до 3/4 зараженной почвой. Пять горошин высевались в каждый горшок и укрывались чистой почвой.
Использовали следующие виды обработки (35 мл добавляли в каждый горшок в виде орошения):
1) Штамм Pseudomonas fluorescens N C1B 40189 (культура, выращенная в триптическом соевом бульоне 1/10 (ТСБ) в течение 48 ч при 20oC);
2) Пенсикурон (Монсерен при 10 ч/м Al);
3) Больной контроль: только 1/10 ТСБ;
4) Здоровый контроль: только 1/10 ТСБ в почве, не инфицированной Rhizoctonia.
Готовили пять повторностей для каждого вида обработки.
Растения гороха выращивали в течение 14 дней при 24oC, и появление всходов контролировали еженедельно. Растения ежедневно поливали.
Результаты представлены в табл. 4.
Применение штамма Pseudomonas fluorescens N C1B 40189 позволяет появиться значительно большему числу растений гороха по сравнению с больным контролем.
Фактически, применение штамма N C1B 40189 обеспечивает посадки гороха на уровне, сравнимом со здоровым контролем (обработка без P. solani). Активность ВСА также по-видимому выше, чем активность химического фунгицида Монсерена.
Защита против болезней растений: дальнейшие испытания
Штамм Pseudomonas fluorescens N C1B 40189 далее испытывался на активность против Rhizoctonia solani и его способность защищать растений гороха от болезни.
Испытания осуществлялись на прямоугольных лотках (165 мм х 95 мм), наполовину заполненных зараженной почвой (приготовленной по методу, описанному в предыдущем разделе).
Двадцать пять горошин засевали в каждый поднос и покрывали чистой почвой. СББ (штамм N C1B 40189) и контрольные обработки были следующими:
1) Орошение - 100 мл бактериальной суспензии (109 клеток/мл) добавляли в каждый лоток;
2) Гранулы - 10 г предварительно сформированных гранул добавляли на каждый поднос; - гранулы (типов A, B, C), несущие бактериальные клетки, были инокулированы с максимальной плотностью концентрата СББ 4,5•1010 клеток/г;
3) Необработанный - 100 мл воды добавляли в виде орошения на каждый лоток, служащий контролем.
Для каждого вида обработки приготавливали три повторности.
Растения гороха выращивали в течение от 7 до 14 дней при 24oC. Растения ежедневно поливали водой и еженедельно контролировали появление сеянцев.
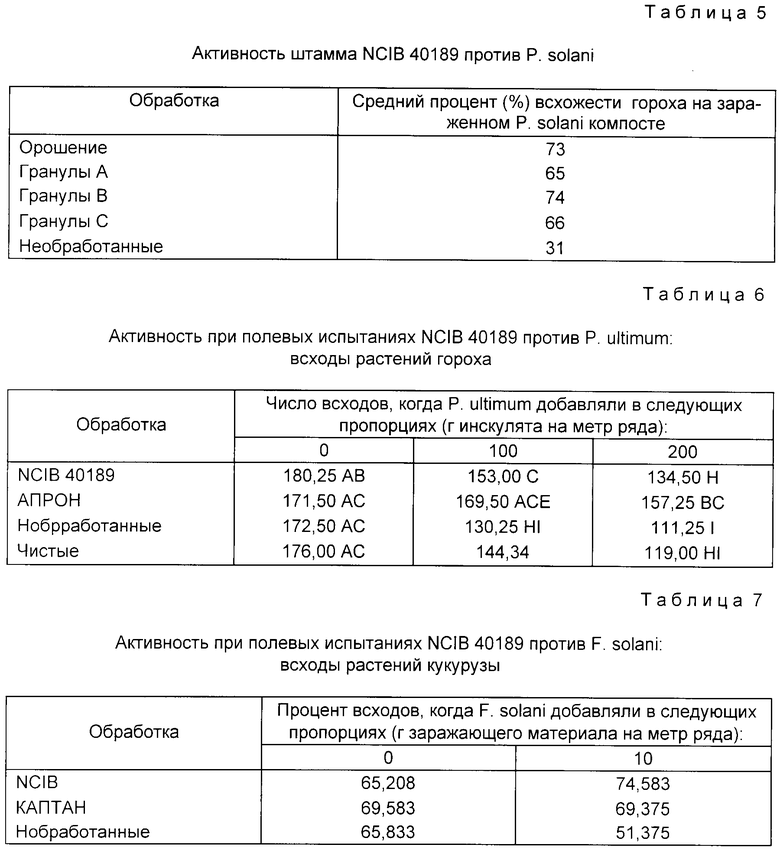
Результаты испытаний из всех экспериментов были сопоставлены и представлены в табл. 5.
Применение штамма N C1B 40189 значительно увеличивало процент появления растений по сравнению с необработанным контролем. Не существует статистически значимого различия между результатами, полученными при обработке орошением или гранулами СББ.
Полевые испытания
Штамм Pseudomonas fluorescens N C1B 40189 применялся при полевых испытаниях в качестве средства биологической борьбы (СББ) против заболевания "черной кожи" у гороха и кукурузы.
Полевые испытания штамма N C1B 40189 проводились на его способность подавления видов Pythium и Fusarium. Результаты сравнивали со стандартными обработками химическими препаратами, и они сообщаются ниже.
В кратком изложении эти результаты показывают, что заболевание, вызываемое Pythium ultimum или Fusarium solani, снижается при применении штамма N C1B 40189 до уровня, сравнимого с уровнем, получаемым при стандартной химической обработке.
Эффективность против Pythium.
Испытания проводили во Франции, используя горох в качестве испытуемой сельхозкультуры.
Возбудитель добавляли в различных пропорциях в виде зараженного пшеничного зерна, полученного следующим образом.
Порции пшеничного зерна (1 кг) замачивали в воде на ночь, воду сливали и зерно автоклавировали при 121oC. Спорам грибов, которые оставались живыми, давали возможность прорасти и расти в течение двух дней перед тем, как зерно повторно автоклавировали при 121oC.
7-дневная чашечная культура Pythium ultimum (выращенная на картофельно-декстрозном агаре при 20oC) добавлялась к пшеничному зерну, и ей давали возможность расти в течение 10 дней, встряхивали, чтобы перераспределить мицелий, и оставляли на дальнейший 11-дневный период роста. После этого заражающий материал был готов к использованию через последующие 14 дней.
Штамм N C1B 40189 применялся в виде смолисто-торфянистого образования (107 клеток-зерно). В качестве химического контроля использовался Апрон (товарный знак), применяемый в пропорциях 30 г Al/100 кг зерна.
Использовали два типа контрольных растений: необработанные семена гороха и чистые семена гороха (которые подвергались зерновой обработке без добавления СББ или химических).
Результаты представлены в табл. 6.
"Число всходов" относится к среднему числу растений, которые появляются спустя 22 дня после посева из 200 семян на полосе длиной 5 м. Буквы, стоящие после чисел "всходов", указывают на статистическую значимость: не наблюдается значительных различий при 5% уровне вероятности между записями с общей буквой.
Первая колонка в табл. 6 показывает результаты контрольного эксперимента, когда испытания проводились на поле с нормальной почвой, без какого-либо добавления возбудителя.
Отсутствие возбудителя в почве дает возможность нормального роста растений. Не существует значительного различия между видами обработки, указывая на то, что добавление штамма N C1B 40189 не создает фитотоксического эффекта.
Другие цифры в табл. 6 представляют результаты для двух видов испытываемых обработок при различных концентрациях возбудителя. Наличие возбудителя в почве снижало число растений, появляющихся из необработанных или чистых семян по сравнению с контрольным экспериментом.
Это показывает, что заболевание присутствует и отрицательно влияет на рост растений. Однако присутствие штамма N C1B 40189 значительно увеличивает число растений, появляющихся при наличии возбудителя.
Эффективность против Fusarium.
Полевые испытания проводили в США (Миссисипи), используя кукурузу в качестве испытуемой сельхозкультуры. Возбудитель (F. solani) добавляли в разных пропорциях в виде зараженного пшеничного зерна, приготовленного, как описано выше.
Штамм N C1B 40189 применялся в виде смолисто-торфяной смеси (107 клеток-зерно). Химическим средством борьбы был Каптан (товарный знак), использованный в виде обработки зерна в рекомендованной пропорции. Необработанное зерно использовалось для контроля растений.
Результаты представлены в табл. 7. Всхожесть оценивается как процент (%) растений 15 дней спустя после посева. Буквы, представленные после процента всхожести, показывают статистическую значимость. Нет значительного различия при 5% уровне вероятности между записями с общей буквой.
Первая колонка табл. 7 показывает результаты контрольных испытаний, где никакого испытуемого возбудителя не добавляли.
Отсутствие возбудителя в почве давало возможность нормального роста растения. Не существует действительно значительного различия между видами обработки, указывая на то, что добавление штамма N C1B 40189 не создает фитотоксического эффекта.
Наличие возбудителя Fusarium solani в почве снижало число взошедших растений из необработанного зерна при сравнении с контрольным экспериментом.
Это показывает, что заболевание присутствует и отрицательно влияет на рост растений. Однако наличие штамма N C1B 40189 значительно увеличивает процент растений, взошедших в присутствии возбудителя. Фактически, обработка штаммом N C1B 40189 улучшала продуктивность растений так, что процент всхожести не отличался значительно от процента всхожести в отсутствие возбудителя.


Использование: микробиологическая промышленность, производство средств защиты растений от грибковых заболеваний. Сущность изобретения: противогрибковое средство представляет собой штамм бактерий Pseudomonas fluorescens 40189. Данный штамм может быть использован самостоятельно или в виде композиции, содержащей вышеуказанный штамм и приемлемый для сельского хозяйства носитель. В качестве носителя целесообразно использовать смолисто-торфяной состав. Противогрибковое средство или композицию, содержащую его, применяют для подавления грибкового поражения, вызываемого грибами рода Pythium, Rhizoctonia, Fusarium или грибами вида Gacumannomyces graminis путем обработки семян, растений или почвы, в которой выращивается или будет выращиваться растение. 3 с. и 5. з.п. ф-лы, 7 табл.
| EP, патент, 0376775, C 12 N 1/20, 1990 | |||
| SU, патент, 1477231, A 01 N 63/00, 1989. |
Авторы
Даты
1998-02-20—Публикация
1992-04-03—Подача