Изобретение относится к биотехнологии и касается нового бактериального штамма Pseudomonas fluorescens P469, обладающего супрессорной активностью в отношении фитопатогенных грибов и бактерий из родов Alternaria, Colletotrichum, Fusarium, Rhizoctonia, Phoma, Phytophthora, Oospora, Erwinia и Pseudomonas, который может быть использован для получения бактериального препарата для защиты растений от фитопатогенов.
Известны штаммы рода Pseudomonas, предназначенные для защиты растений от грибных и бактериальных патогенов (US №5232850). Однако целевое применение этих штаммов ограничено.
Наиболее близким к предлагаемому изобретению является штамм бактерий Pseudomonas putida BKM В-1743Д (патент SU №1805849 A3), предназначенный для получения препарата, используемого для стимуляции роста растений и защиты растений от грибных и бактериальных патогенов. Однако данный штамм имеет более узкий круг супрессируемых фитопатогенов по сравнению с заявляемым штаммом.
Задачей изобретения является получение нового штамма Pseudomonas fluorescens, обладающего способностью к подавлению роста широкого круга фитопатогенных грибов и бактерий, и создание на его основе препарата против болезней растений, вызываемых грибными и бактериальными патогенами.
Поставленная задача решается тем, что предлагается штамм Pseudomonas fluorescens P469, выделенный из ризосферы озимой пшеницы Краснодарского края, с использованием селективной агаризованной среды Кинга В. Основными критериями отбора служили стимуляция роста растений и подавление роста фитопатогенных грибов и бактерий из родов Alternaria, Colletotrichum, Fusarium, Rhizoctonia, Phoma, Phytophthora, Oospora, Erwinia и Pseudomonas. Штамм Р. fluorescens P469 характеризуется следующими свойствами:
Культурально-морфологические признаки
Клетки подвижные, палочковидные, с полярными жгутиками, грамотрицательные, спор не образуют.
Штамм хорошо растет на следующих средах: МПБ (мясопептонный бульон), LB (триптон - 10 г/л, дрожжевой экстракт - 5 г/л, хлористый натрий - 10 г/л, рН 7,2), Кинга Б (пептон - 20 г/л, глицерин - 10 мл/л, MgSO4×7Н2О - 1,5 г/л), ПА (питательном агаре на основе гидролизата кильки (ДИПС, г. Махачкала) - 35 г/л), на минимальной синтетической среде М9 следующего состава: К2НРO4 - 7 г/л, KH4PO4 - 3 г/л, NH4·Cl - 1 г/л, глюкоза - 2 г/л.
Двухсуточные колонии на ПА сероватые, слизистые, плоские, выпуклые к центру, диаметр 1,5-2 мм. Пигмент зеленый, диффундирующий в среду. Под ультрафиолетом зона вокруг колоний флуоресцирует зеленым светом.
Физиолого-биохимические признаки
Облигатный аэроб, температурный оптимум роста 28-30° , не растет при 41° С; растет в пределах рН среды от 5.2 до 8.0. В дополнительных факторах роста не нуждается (прототроф). Образует аргининдигидролазу и оксидазу. Обладает лецитиназной активностью, желатину разжижает, молоко пептонизирует. Крахмал не гидролизует. В качестве источника углерода использует глюкозу, триптофан, глицерин, этиловый спирт, слабо усваивает мальтозу. Не усваивает лактозу, дульцит, рамнозу, сорбит. Использует аммиачные и нитратные соли азота в качестве единственного источника азота.
Устойчивость к антибиотикам
Штамм проявляет устойчивость к стрептомицину (100 мкг/мл), ампициллину (200 мкг/мл) и тетрациклину (10 мкг/мл).
Условия хранения
Штамм бактерий Р. fluorescens P469 хранят на чашках или косяках с МПА, ПА или со средой Кинга Б при 5-7° С. Пересевы на свежие среды - один раз в месяц. Может храниться не менее 6 месяцев на минимальной синтетической среде М9 и не менее 1 года в 15% глицерине при -20° С, в лиофильно-высушенном состоянии с сахарожелатиновым агаром или в полужидкой агаризованной среде под вазелиновым маслом следующего состава: Nutrient Broth (Difco) - 4 г/л, NaCl - 5 г/л, агар - 6 г/л, рН 6,8.
Штамм Р. fluorescens P469 может быть использован в производстве препарата для комплексной защиты растений от широкого круга грибных и бактериальных фитопатогенов. Штамм мало патогенен для теплокровных животных (относится к IV группе патогенности), не токсичен для растений.
Штамм Р. fluorescens P469 депонирован в Центральной коллекции микроорганизмов РАО “Биопрепарат”, коллекционный номер ЦКМ В-1982.
Пример 1, демонстрирующий отсутствие фитотоксичности у штамма Р. fluorescens P469.
Суспензию клеток штамма Р. fluorescens P469 для испытаний готовят следующим образом: в колбу емкостью 750 мл наливают 250 мл стерильной среды LB, вносят 1-2 мл стационарной культуры исследуемого штамма и инкубируют с аэрацией (250 об/мин) при 28° С в течение 24 ч до конечного титра 9× 109 кл/мл. Готовят 1% (v/v) суспензию клеток в стерильной дистиллированной воде (9× 107 кл/мл), в которой на 2 ч замачивают семена огурца сорта “Родничок”. В контрольном опыте семена замачивают в дистиллированной воде. По 50 семян каждого варианта раскладывают на увлажненную дистиллированной водой фильтровальную бумагу, которую помещают в чашки Петри, и выдерживают в термостате при 28° С в течение 5 суток, постоянно увлажняя. Через сутки оценивают всхожесть семян (таблица 1), а через 5 суток проростки морфометрируют, измеряя длину основного корня и стебля.
Фитотоксическую активность штамма рассчитывают по формуле:
А=(100-Д0/Дк·100)%,
где А - показатель фитотоксичности;
Д0 - средний показатель параметра в опыте;
Дк - средний показатель параметра в контроле.
Фитотоксичными считаются те штаммы, показатель фитотоксичности которых превышает 30%. Отрицательные значения показателя А свидетельствуют о стимулирующем эффекте.
Показатели фитотоксичности штамма Р. fluorescens P469 имеют отрицательные значения (таблица 1), свидетельствующие о наличие стимулирующего эффекта.

Всхожесть семян в контроле 100%.
Пример 2, демонстрирующий антагонизм штамма Р. fluorescens P469 в отношении фитопатогенных бактерий.
В качестве тест-объектов используют следующие штаммы фитопатогенных бактерий (в скобках указано вызываемое патогеном заболевание): Pseudomonas solanacearum №9049 (бурая гниль или вилт картофеля), Pseudomonas sp. № 37 (клубневая гниль картофеля), № 115 (мягкая гниль капусты), № 116 (мягкая гниль картофеля) и Erwinia carotovora pv. carotovora S39 (резиновая гниль картофеля).
Тестирование антагонистической активности проводят в чашках Петри методом лунок. Используют метод двух слоев, при котором нижним слоем служит голодный агар (в количестве 20 мл на чашку Петри), а верхним (10 мл) питательная среда, оптимальная для роста того или иного патогена: сахарозопептонный агар для Pseudomonas spp. и картофельно-сахарозный агар или Кинга Б для Erwinia carotovora pv. carotovora. Клетки фитопатогенов вносят поверхностно. Для этого на поверхность застывшего слоя питательной среды наносят 0,2 мл суспензии патогена и растирают шпателем. Концентрация суспензии тест-культур должна соответствовать 10 ЕД стандарта мутности. Затем в агаровом слое делают лунки диаметром 8-10 мм и вносят в них по 0,1 мл культуры штамма Р. fluorescens P469, которые для этого растят в среде LB при 28° С в течение 48 час.
Чашки инкубируют при 28° С в течение 24 ч и визуально регистрируют зоны подавления роста фитопатогенных бактерий вокруг лунок с культурой тестируемого штамма.
Зоны угнетения роста бактерий Erwinia carotovora pv. carotovora S39 составляют 5 мм, a Pseudomonas solanacearum № 9049, Pseudomonas sp. № 37, Erwinia carotovora pv. carotovora № 115 и Erwinia carotovora pv. carotovora № 116 - 15-20 мм, что указывает на антагонистическую активность штамма Р. fluorescens P469 в отношении этих видов фитопатогенов.
Пример 3, демонстрирующий антагонистическую активность штамма Р. fluorescens P469 в отношении фитопатогенных грибов Oospora lactis и Phoma esigia.
Осуществляют аналогично примеру 2, но в качестве индикаторных тест-объектов используют штаммы грибов Oospora lactis № 5 (резиновая гниль картофеля) и Phoma esigia № 6 (фомозная гниль), и клетки фитопатогенов вносят глубинно (0,18 мл суспензии на 10 мл среды) в составе верхнего слоя питательной среды, в качестве которой используют картофельно-сахарозный агар. Зоны угнетения роста грибов Oospora lactis № 5 и Phoma esigia № 6 штаммом Р. fluorescens P469 составляет в этих условиях 10-30 мм, что показывает антагонистические возможности штамма Р. fluorescens P469 в отношении этих фитопатогенных микроорганизмов.
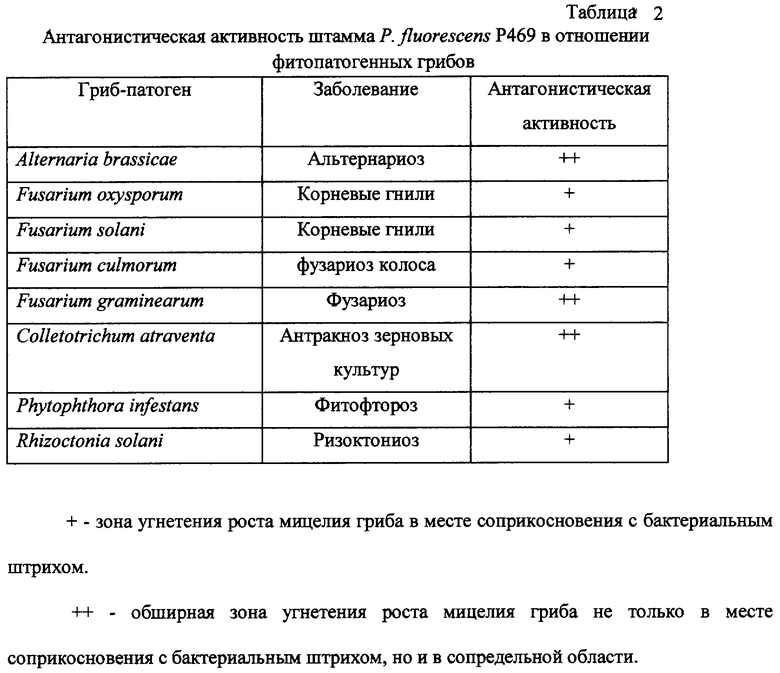
Пример 4, демонстрирующий антагонистическую активность штамма Р. fluorescens P469 в отношении фитопатогенных грибов из родов Alternaria, Fusarium, Colletotrichum, Phytophthora и Rhizoctonia.
Тестирование антагонистической активности проводят в чашках Петри с питательным агаром методом штриха. Готовят суспензию штамма Р. fluorescens P469 с плотностью 109 кл/мл, смывая клетки с бактериального газона стерильным раствором 0,9% NaCl. Суспензии фитопатогенных грибов готовят, смывая мицелиальную и споровую массу с газонов грибов на среде Чапека. По диаметральной линии чашки Петри с питательным агаром на основе гидролизата кильки штрихом засевают суспензию патогенного гриба и перпендикулярно к нему - штрихом - суспензии анализируемых бактериальных культур. Чашки инкубируют при 28-30° С и через 5-7 дней визуально оценивают наличие зоны подавления роста патогенов. Штамм Р. fluorescens P469 угнетает рост следующих фитопатогенных грибов: Alternaria brassicae, Fusarium oxysporum, Fusarium solani, Fusarium culmorum, Fusarium graminearum, Colletotrichum atraventa, Phytophthora infestans, Rhizoctonia solani (таблица 2).
Пример 5, демонстрирующий антагонистическую активность штамма P. fluorescens P469 в отношении фитопатогенного гриба Gaeumannomyces graminis var. ritici.
На чашку Петри с агаризованной средой Каннера сеют бактериальный штамм Р. fluorescens P469 (пятном диаметром 5 мм на расстоянии 3-3,5 см от центра чашки) из суспензии, приготовленной как в примере 4, и выращивают в течение 2 суток для достижения полного синтеза вторичных метаболитов. Затем в центр чашки Петри на поверхность питательного агара помещают сегмент мицелия (диаметром 9 мм) грибного штамма Gaeumannomyces graminis var. tritici, вызывающего офиоболезную гниль корней пшеницы. Мицелий для этого эксперимента выращивают на глюкозокартофельном агаре при комнатной температуре в течение 7 суток. Чашки Петри заклеивают парафильмом для поддержания необходимой влажности и инкубируют при комнатной температуре в течение 5-7 суток. Наличие зоны подавления роста мицелия G. graminis var. tritici штаммом Р. fluorescens P469 свидетельствует об антагонистической активности бактериального штамма в отношении указанного фитопатогенного гриба.
Таким образом, штамм Pseudomonas fluorescens P469 обладает способностью к подавлению роста широкого спектра фитопатогенных микроорганизмов (фитопатогенных грибов и бактерий из родов Alternaria, Colletotrichum, Fusarium, Rhizoctonia, Phoma, Phytophthora, Oospora, Erwinia и Pseudomonas), основных возбудителей болезней зерновых культур и картофеля. Штамм не токсичен для растений в рекомендуемых для обработок концентрациях и может быть использован для создания на его основе препарата, предназначенного для профилактической обработки клубней картофеля (защита от гнилей), а также всходов с целью защиты от фитофтороза.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ РАСТИТЕЛЬНО-МИКРОБНЫХ АССОЦИАЦИЙ ДЛЯ ФИТОРЕМЕДИАЦИИ НА ОСНОВЕ МИКРОРАЗМНОЖАЕМЫХ РАСТЕНИЙ И ПЛАЗМИДОСОДЕРЖАЩИХ РИЗОСФЕРНЫХ БАКТЕРИЙ | 2010 |
|
RU2443771C1 |
| БИОПРЕПАРАТ ДЛЯ СТИМУЛЯЦИИ РОСТА И ЗАЩИТЫ РАСТЕНИЙ ОТ БОЛЕЗНЕЙ, ПОВЫШЕНИЯ УРОЖАЙНОСТИ И ПОЧВЕННОГО ПЛОДОРОДИЯ | 2011 |
|
RU2478290C2 |
| СПОСОБ ЗАЩИТЫ ПОСАДОЧНОГО МАТЕРИАЛА РАСТЕНИЙ ПРОТИВ ЗАБОЛЕВАНИЙ, ВЫЗЫВАЕМЫХ ФИТОПАТОГЕННЫМИ МИКРООРГАНИЗМАМИ | 2008 |
|
RU2380886C1 |
| ШТАММ БАКТЕРИЙ BACILLUS THURINGIENSIS, ПРОЯВЛЯЮЩИЙ ФУНГИЦИДНУЮ АКТИВНОСТЬ, ИНСЕКТИЦИДНУЮ АКТИВНОСТЬ И ПОДАВЛЯЮЩИЙ ВИРУЛЕНТНЫЕ СВОЙСТВА ФИТОПАТОГЕННЫХ БАКТЕРИЙ ERWINIA CAROTOVORA | 2007 |
|
RU2347809C1 |
| ПРЕПАРАТ ДЛЯ ОЧИСТКИ ПОЧВ ОТ МЫШЬЯКА И ЗАЩИТЫ РАСТЕНИЙ ОТ БОЛЕЗНЕЙ, ВЫЗЫВАЕМЫХ ФИТОПАТОГЕННЫМИ ГРИБАМИ, И ШТАММ БАКТЕРИЙ PSEUDOMONAS AUREOFACIENS BKM B-2390 Д ДЛЯ ЕГО ПОЛУЧЕНИЯ | 2006 |
|
RU2323967C2 |
| ШТАММ БАКТЕРИЙ PSEUDOMONAS FLUORESCENS ДЛЯ ЗАЩИТЫ РАСТЕНИЙ ОТ ФИТОПАТОГЕННЫХ ГРИБОВ И БАКТЕРИЙ И СТИМУЛЯЦИИ РОСТА РАСТЕНИЙ | 2016 |
|
RU2646160C2 |
| ШТАММ БАКТЕРИЙ Bacillus subtilis Б 93 ВИЗР ДЛЯ ЗАЩИТЫ КАРТОФЕЛЯ ОТ БОЛЕЗНЕЙ ПРИ ХРАНЕНИИ | 2013 |
|
RU2538157C1 |
| Штамм бактерий BacILLUS мYсоIDеS для получения препарата против возбудителей заболевания картофеля | 1990 |
|
SU1771639A1 |
| ШТАММ БАКТЕРИЙ BACILLUS SUBTILIS, ИСПОЛЬЗУЕМЫЙ ДЛЯ ЗАЩИТЫ РАСТЕНИЙ ОТ ФИТОПАТОГЕННЫХ БАКТЕРИЙ | 1994 |
|
RU2084152C1 |
| Штамм бактерий PSEUDOMONAS FLUORESCENS для получения препарата против возбудителей заболеваний растений | 1990 |
|
SU1825446A3 |
Изобретение относится к биотехнологии и сельскому хозяйству, может быть использовано для получения бактериального препарата против болезней растений, вызываемых фитопатогенными грибами и бактериями, из родов Alternaria, Colletotrichum, Fusarium, Rhizoctonia, Phoma, Phytophthora, Oospora, Erwinia и Pseudomonas. Штамм Pseudomonas fluorescens P469 ЦКМ В-1982 выделен из ризосферы озимой пшеницы Краснодарского края. Штамм хорошо растет на различных средах, в том числе синтетических, в условиях аэрации при 30°С, рН 6,8-7,5. Штамм Pseudomonas fluorescens P469 обладает способностью к подавлению роста широкого круга фитопатогенных грибов и бактерий, стимулирует рост растений. 2 табл.
Штамм бактерий Pseudomonas fluorescens P469 (коллекционный номер ЦКМ В-1982) для получения препарата против болезней растений, вызываемых фитопатогенными грибами и бактериями.
| Штамм бактерий РSеUDомоNаS рUтIDа для получения препарата, используемого для стимуляции роста растений и защиты растений от грибов рода FUSаRIUм и бактерий ERWINIa | 1990 |
|
SU1805849A3 |
| ШТАММ PSEUDOMONAS FLUORESCENS, ПРЕДНАЗНАЧЕННЫЙ ДЛЯ БОРЬБЫ С ФИТОПАТОГЕННЫМИ ГРИБАМИ (ВАРИАНТЫ), СПОСОБ ЕГО ВЫДЕЛЕНИЯ И ПРИМЕНЕНИЯ, КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ДАННЫЙ ШТАММ И СПОСОБ ЕЕ ПРИМЕНЕНИЯ | 1995 |
|
RU2154943C2 |
| ШТАММ БАКТЕРИЙ PSEUDOMONAS FLUORESCENS ДЛЯ ПОЛУЧЕНИЯ ПРЕПАРАТА ПРОТИВ ГРИБКОВЫХ ЗАБОЛЕВАНИЙ РАСТЕНИЙ | 1990 |
|
SU1817874A3 |
| Штамм бактерий PSEUDOMONAS FLUORESCENS для получения препарата против возбудителей заболеваний растений | 1990 |
|
SU1825446A3 |
| US 5232850, 03.08.1993. | |||
Авторы
Даты
2004-09-10—Публикация
2002-05-13—Подача