Изобретение относится к области удовлетворения жизненных потребностей человека, а именно - к сельскому хозяйству, в частности - к производству органических удобрений и может быть использовано для получения биологически активных органических удобрений из органических муниципальных и сельскохозяйственных отходов.
Компост является продуктом процесса аэробного разложения, во время которого важную роль играют микроорганизмы. Преимущественно микроорганизмы разлагают органические вещества до устойчивых гумусоподобных субстанций, которые можно использовать для улучшения качества и плодородности почвы. Удобрительные свойства компоста известны и широко используются для улучшения качества почв [1]. Кроме того, зачастую компост обладает не только удобрительными свойствами, но и способностью подавлять заболевания растений, так называемой супрессивностью [2]. В качестве альтернативы пестицидам, традиционно используемым для подавления заболевания растений, широко изучаются супрессивные компосты, которые, в отличие от пестицидов, не оказывают негативного влияния на почву и произрастающие на ней растения, являющиеся продуктами питания и кормами для животных. Таким образом, замена пестицидов супрессивными компостами, по мнению заявителя, приведет к улучшению качества окружающей среды и жизни человека.
Заявителем проведен анализ уровня техники, выявлены механизмы, объясняющие супрессивность компостов и рассмотрены различные версии проявления механизмов супрессивности, включая физическо-химические и биологические.
На дату представления заявочных материалов ни одна из версий не является преобладающей, таким образом заявителем не выявлено технологии стабильного получения компостов со свойствами супрессивности.
Увеличивающийся общественный интерес к защите окружающей среды и здоровью населения вызывает необходимость усиления исследований в области разработки стратегии рационального природопользования в области агробезопасности, включающей снижение применения фунгицидов, гербицидов и минеральных удобрений [2]. Кроме того, традиционные стратегии, такие как использование устойчивых культурных растений или синтетических фунгицидов, не позволяют подавлять передающиеся через почву патогены растений, которые ежегодно вызывают значительную потерю урожая, в частности - патогены, вызывающие фузариоз. Исходя из этого, для современного сельского хозяйства необходимы новые методы борьбы с фузариозом, обладающие высокой эффективностью, низкой стоимостью и ограниченным воздействием на окружающую среды.
Заболевания растений, вызываемые микроорганизмами
К патогенным микроорганизмам, вызывающим заболевания растений, относятся бактерии, микроскопические грибы, вирусы, а также оомицеты и вироиды [3]. Однако до 85% заболеваний сельскохозяйственных растений вызвано именно микроскопическими грибами. Симптомами заболеваний растений является появление у них необычных свойств (например, окраски или текстуры), новообразований или - наоборот - пустот, западин, а также засыхание или мокрое загнивание растения целиком или отдельных органов. Распространение и развитие патогенов растений обусловлено факторами окружающей среды - температурой, влажностью, ветром. Основными антропогенными факторами увеличения заболеваемости растений является использование монокультур и внедрение новых сортов в сельском хозяйстве [4]. Болезни растений могут протекать без внешних симптомов, а также с их наличием. К внешним симптомам относятся: гнили, некрозы, язвы, мозаики, увядание, опухоли и наросты, деформации, головня, мумификация, парша. Наиболее значительная часть потерь урожая сельскохозяйственных растений обусловлена именно грибными заболеваниями. Практически каждая группа микроскопических грибов имеет в своем составе фитопатогенные виды, способные распространяться на значительные расстояния и переживать неблагоприятные условия среды с помощью спор. В настоящее время описано более 8 тыс. видов фитопатогенных грибов [3]. Их принято подразделять на две группы - некротрофы, действующие как хищники по отношению к растениям (убивающие его путем выделения токсинов или ферментов); и биотрофы, питающиеся за счет живых клеток хозяина [5].
Фитопатогенные грибы могут распространяться различными путями: с токами воздуха и воды, брызгами дождевых капель, разноситься людьми и животными, сельскохозяйственными механизмами, передаваться семенами, клубнями, луковицами, корнями и другими частями больных растений. К основным причинам возникновения грибных заболеваний растений можно отнести: нарушение агротехники, повышенную влажность почвы и воздуха; недостаточную аэрацию почвы, недостаток освещения и тепла, удобрение растений недостаточно разложившимся компостом или навозом, избыток или недостаток удобрений, слаборазвитую корневую систему растений [6].
Симптомами грибных поражений растений являются: пятнистости (церкоспороз, парша и другие), налеты, язвы, пустулы, темные или белесые пятна, налеты или наросты, бугорки или подушечки на поверхности зараженного органа, увядание [7]. К наиболее распространенным возбудителям относятся следующие виды: Magnaporthe oryzae, Botrytis cinerea, Puccinia spp, Ustlago spp., Thielaviopsis spp., Verticillium spp., Scleortinia spp., Ustago spp., Rhozoctonia spp., Phakospora spp., Puccinia spp., Armillaria spp., Manaporthe grisea, Fusarium graminearum, Fusarium oxysporum, Blumeria graminis, Mycosphaerella graminicola, Colletotrichum spp., Ustilago maydis, Melampsora lini [8].
Фузариоз как наиболее распространенное грибковое заболевание растений и борьба с ним.
Одним из наиболее распространенных грибковых заболеваний растений во всем мире является фузариоз, вызываемый грибами рода Fusarium, далее заявителем приведены его виды: F. avenaceum (Ft.) Sacc. (syn.: Gibberella avenacea R.J. Cook), F. culmorum (W.G. Sm.) Sacc, F. gibbosum App. et Wr., F. graminearum Schwabe (syn.: Gibberella zeae (Schwein.) Petch), F. heterosporium Nees, F. oxyspopum, F. oxysporum f. sp. cucumerinum, F. oxysporum f.sp. lycopersici, F. oxysporum f.sp. pisi W.C. Snyder & H.N. Hansen, F. oxysporum Schlecht, F. poae (Peck) Wollenw., F. semitectum Berk et Rav., F. solani, F. solani (Mart.) Appel et Wr., F. solani f.sp. pisi, F. sporotrichioides Sherb., F. verticillioides (Sacc.) Nirenberg и др. [5], таким образом, в мире изучено большое количество видов указанных грибов и проблема борьбы с ними является весьма актуальной.
Из исследованного заявителем уровня техники является общеизвестным факт того, что от грибов рода Fusarium страдают подавляющее большинство сельскохозяйственных растений, в том числе пшеница, рожь, ячмень и другие зерновые, люцерна, кукуруза, горох, соя, рис, подсолнечник, хвойные деревья, томат, огурец, рододендрон, банан и многие другие виды растений. В источнике [9] показано, что в ряде регионов мира грибы рода Fusarium вызывают потери до половины урожая в сельском хозяйстве.
При этом они одновременно вызывают не только снижение урожайности и гибель растений, но и загрязняют сельскохозяйственную продукцию своими выделениями - микотоксинами, оказывающими негативное воздействие на здоровье человека и животных, и проявляющихся в виде язв, дерматитов, кровотечений.
Фузариоз передается через почву, споры Fusarium spp. обладают способностью переживать в почве длительные неблагоприятные периоды [10]. Фузариоз проявляется, прежде всего, в сосудистом увядании растений, потере тургора (тургор - напряженное состояние клеточной оболочки, создаваемое гидростатическое давлением внутри клеточной жидкости), пожелтении и гнили корней [11, стр 653]. Растения, пораженные фузариозом, гибнут преимущественно из-за отравления токсинами, которые выделяют микроскопические грибы, а также вследствие закупорки проводящих сосудов гифами (гифы - микроскопические ветвящиеся нити, образующие вегетативное тело гриба - таллом) [11, стр 138].
В последнее время наблюдается рост заболеваемости сельскохозяйственных растений фузариозом [12]. Это связано с увеличением площадей монокультур, введением новых сортов, пород и гибридов, не обладающих устойчивостью к данному заболеванию, а также нарушениями в процессах посадки, хранения посевного материала и обработке почвы [13]. В связи с этим возросла необходимость создания более эффективных и доступных технологий борьбы с Fusarium spp.
К таким технологиям можно отнести смену севооборота и способов обработки почвы, а также применение химических и биологических методов [14]. К биологическим способам борьбы с фузариозом относятся такие разноплановые мероприятия как прививание растений [15], использование биологически активных веществ [16], синтезируемых живыми организмами, использование биопрепаратов [17] и использование супрессивных почв или компостов [18].
Заявленное техническое решение относится к технологиям и биопрепаратам для борьбы с фузариозом, в силу его эффективности применения по назначению, технологичности и экологической безопасности.
На дату представления заявочных материалов заявителем выявлен широкий спектр микроорганизмов, способных ингибировать патогены растений: Rhizoctonia [19], Bacillus spp. [Gong и др., 2006], Pseudomonas spp. [17], Penicillum spp. [22], Aspergillus spp. [23], Trichoderma spp. [24] и некоторые из которых приведены заявителем далее в качестве обзора уровня техники.
Далее заявителем приведен анализ уровня техники по основным, приведенным выше способам борьбы с фузариозом.
Из исследованного уровня техники заявителем выявлен способ борьбы с грибными заболеваниями с помощью применения биопрепаратов по патенту на изобретение CN 103141518 «Метод приготовления и применения многоцелевых антибиотических биопрепаратов». Сущность известного технического решения состоит в приготовлении композитных агентов биоконтроля, включающем следующие этапы: 1) выделение штаммов из ризосферы злаковых культур - 10 г почвы на 1000 г воды инкубируют 9 часов, при 48°C, выделенные штаммы выращивают на картофельном агаре и мясопептонном агаре; 2) пересев двух выделенных штаммов на среду содержащую 20-30 г - коричневого сахара, 2-5 г дрожжей, с рН равным 7-9 и культивирование в течение 2-3 дней; 3) наращивание штаммов в течение 3-5 дней: Trichoderma viride на картофельном агаре, Bacillus subtilis на мясопептонном агаре; 4) смешение суспензии штаммов с карбонатом кальция: Trichoderma viride 8-10% от массы, Bacillus subtilis в течении 10-12% от массы.
Полученный биопрепарат, содержащий штаммы Bacillus subtilis и Trichoderma viride совместно с карбонатом кальция в качестве носителя, используется против грибных заболеваний, вызванных патогенными грибами родов - Fusarium, Pythium, Rhizoctonia.
Недостатком известного технического решения является низкая выживаемость штаммов биопрепарата, связанная с внесением биопрепарата непосредственно в почву, содержащую недостаточное количество питательных веществ, вследствие высокой конкуренции со стороны аборигенной микрофлоры. Другим недостатком известного технического решения является отсутствие удобрительных свойств у описанного биопрепарата.
Указанные недостатки, по мнению заявителя, могут быть разрешены посредством создания супрессивных компостов, содержащих штаммы - ингибиторы патогенов, а также необходимую питательную среду для их выживания. Микроорганизмы супрессивных компостов подавляют фитопатогенные грибы за счет выделения супрессивных веществ, в результате соревнования за источник питания и экологическую нишу. В силу указанного, микроорганизмы супрессивного компоста усиливают защитные механизмы растений [25]. Одновременно со свойствами супрессивности по отношению к патогенам, такие супрессивные компосты являются источником углерода, азота и ряда других питательных элементов, вследствие чего обладают удобрительными качествами.
Способ приготовления супрессивного компоста
Супрессивные компосты могут быть получены при варьировании исходных субстратов, из которых производится компост, и условий компостирования, а также за счет внесения микроорганизмов, обладающих ингибирующими свойствами по отношению к фитопатогенным организмам, в компостные смеси.
Как указано в источнике [26], компостирование - это экзотермический процесс биологического окисления, в котором органический субстрат подвергается аэробной биодеградации смешанной популяцией микроорганизмов в условиях повышенной температуры и влажности. В процессе биодеградации органический субстрат претерпевает физические и химические превращения с образованием стабильного гумифицированного продукта, сходного по своим физическим свойствам с почвой или перегноем. Компостирование проводится в статических, аэрируемых штабелях, в ямах или в специальных реакторах и представляет собой простой и медленный способ, который, как правило, длится несколько месяцев. Конечный продукт, компост, выход которого составляет около 40% от поступивших отходов, содержит биомассу мертвых, некоторое количество живых микроорганизмов и наиболее стабильные органические соединения [27].
Из исследованного уровня техники заявителем выявлен способ приготовления супрессивных компостов из различных материалов - садовые отходы, солома, кора, биологические отходы, осадок сточных вод [28]. Сущность известного технического решения состоит в приготовлении супрессивных компостов в отношении Fusarium oxysporum, Phytophthora nicotianae, Phytophthora cinnamomi, Rhizoctonia solani, Spathiphyllum cylindrocladium, Verticillium dahliae.
Недостатком известного технического решения является то, что не все полученные компосты обладают супрессивными свойствами, в целом супрессивными являются лишь 54% всех компостных смесей, 43% смесей не влияют на заболеваемость, и в 3% случаев наблюдается повышение заболеваемости.
Из исследованного уровня техники заявителем выявлен способ получения супрессивного компоста на основе сельскохозяйственных отходов (куриный помет, свиной навоз, и навоз крупного рогатого скота, солома, отходы кукурузы) [25]. Сущность известного технического решения состоит в приготовлении супрессивных компостов по отношению к F. oxysporum.
Недостатком известного технического решения является то, что появление супрессивных свойств наблюдается лишь у половины подготовленных компостных смесей. Недостатком известного технического решения является также нестабильность получения компостов с супрессивными свойствами, которая зависит от эффективности процесса компостирования и состава исходных субстратов.
Внесение микроорганизмов в компостную смесь для придания компостам свойств супрессивности.
Распространенным приемом, обеспечивающим усиление супрессивных свойств компоста, является внесение в компосты микроорганизмов, обладающих различными механизмами супрессивности. Широко используется для этой цели внесение микроскопических грибов, относящихся к роду Trichoderma. Их внесение в целом улучшает процессы колонизации, увеличивает урожай растений, в комбинации с другими организмами делает борьбу с патогенами более эффективной [29]. Применение компостов с триходермой может рассматриваться как альтернативный метод борьбы с патогенами растений, поскольку эффекты зрелых компостов усиливаются действием агентов биологического контроля [30].
Из исследованного уровня техники заявителем выявлен способ получения биоудобрения по патенту на изобретение РФ №2125549 «Способ получения биоудобрения», заключающийся в получении биогумуса путем вермикомпостирования сельскохозяйственных и промышленных отходов с использованием дождевых червей и отделения биогумуса от червей, отличающийся тем, что из дождевых червей используют червей "Оболенский гибрид", полученных путем скрещивания "Красного калифорнийского гибрида" с российской популяцией дождевых червей Eisenia foetida, вермикомпостирование осуществляют при 16-24°C в течение 4-6 месяцев и вносят микроорганизмы, обладающие супрессивной активностью.
Недостатком известного способа являются дополнительные затраты на проведение вермикомпостирования, что повышает себестоимость готового продукта.
Из исследованного уровня техники заявителем выявлен способ получения супрессивного компоста из корковых отходов и отходов переработки оливок, в который вносят штамм Т. asperellum Т34 [19].
Сущность известного технического решения состоит в приготовлении супрессивных компостов по отношению к Rhizoctonia solani. Компосты возраста 0,5-1 года демонстрируют супрессивность, равную 13-74% здоровых растений, против достигнутых в заявленном техническом решении 34-95%.
Недостатком известного способа является использование только одного штамма, что приводит к невысоким супрессивным свойствам полученного компоста.
Из исследованного уровня техники заявителем выявлен способ приготовления компоста из осадка сточных вод с применением фототрофных бактерий по патенту на изобретение РФ N 2494083 «Способ приготовления компоста из осадка сточных вод с применением фототрофных бактерий», включающий смешивание обезвоженного осадка сточных вод с органическим компонентом в виде пивной дробины, с целлюлозосодержащим компонентом в виде опилок при объемных соотношениях соответственно 0,5-0,6:0,3-0,4:0,1-0,2, с добавлением компостной закваски в количестве не менее 15% от объема смеси и последующее аэробное компостирование смеси, отличающийся тем, что по окончании высокотемпературной стадии компостирования проведение естественного подсушивания смеси, размещенной слоем около одного метра, осуществляют с одновременным внесением биоактиватора в виде жидкой культуры, содержащей 109-1010 клеток в одном мл суспензии аноксигенных пурпурных фототрофных бактерий Rhodobacter capsulatus в объемных соотношениях к смеси не менее 1:50 соответственно и с выдерживанием без обязательной аэрации в течение 25-30 суток с последующей стабилизацией смеси в буртах в течение 30-35 суток.
Недостатком известного способа является использование только одного штамма, действующего по одному механизму супрессивности из четырех возможных, что приводит к невысоким супрессивным свойствам полученного компоста,
Из исследованного уровня техники заявителем выявлены более эффективные результаты при использовании двух и более штаммов, действующих по нескольким механизмам супрессивности.
Так, из исследованного уровня техники заявителем выявлен способ [31], сущностью которого является способ приготовления компоста, обработанного Т. harzianum, Paecilomyces lilacinus и салициловой кислотой. Показано, что в результате использования компоста, полученного по известному способу, заболеваемость растений может быть снижена до уровня 20% оставшихся больных растений, против достигнутой в заявленном техническом решении - до уровня 5% оставшихся больных растений.
Недостатком известного способа является внесение штаммов микроорганизмов, чужеродных микробному сообществу компостов. Это оказывает негативное влияние на выживаемость внесенных микроорганизмов вследствие их конкурентного вытеснения аборигенными видами и влияния на них (внесенные микроорганизмы) химических компонентов самого компоста.
Из исследованного уровня техники заявителем выявлен способ приготовления супрессивного компоста по отношению к F. oxysporum f.sp. lycopersici [32]. Сущность известного технического решения состоит в добавление к компосту из коровьего навоза штаммов Т. harzianum, Glomus intraradices и штамма, относящегося к роду Pseudomonas. Совместное внесение штаммов повышает системную устойчивость растений и оказывается более эффективным (18% заболевших растений) по сравнению с индивидуальным применением (40-55% заболевших растений).
Недостатком известного способа является внесение штаммов микроорганизмов, чужеродных микробному сообществу компостов. Указанное оказывает негативное влияние на выживаемость внесенных микроорганизмов, вследствие их конкурентного вытеснения аборигенными видами и влияния на них химических компонентов самого компоста.
Скрининг микроорганизмов, обладающих супрессивными свойствами
Принимая во внимание указанное выше, в целях достижения наилучшей приживаемости внесенных микроорганизмов и определения их способности к подавлению патогенов, целесообразно предварительно проводить скрининг - выборочное выделение микроорганизмов с необходимыми свойствами [33].
Из исследованного уровня техники заявителем выявлен способ скрининга потенциального противогрибкового агента по патенту на изобретение РФ №2108038 «Способ скрининга потенциального противогрибкового агента, противогрибковый агент (варианты), сельскохозяйственная противогрибковая композиция и способ ингибирования грибкового поражения растений». Сущность известного технического решения состоит в скрининге потенциального противогрибкового агента, предусматривающем оценку ингибирующего действия исследуемого противогрибкового агента на грибковое заражение двумя тестами, второй из которых осуществляют путем заражения образца почвы патогенным грибком, засевания в зараженную грибком почву семян растений, восприимчивых к заражению этим грибком, внесения в почву исследуемого противогрибкового агента, проращивания семян и выращивания растений, при этом оценку ингибирующего действия противогрибкового агента проводят посредством сравнения состояния выращенных зараженных растений с незаряженными контрольными растениями, отличающийся тем, что первый тест оценки ингибирующего действия противогрибкового агента предусматривает приготовление патогенного мицелия вида Pythium в слое культуральной среды, помещение слоя стерильной почвы на выросший мицелий, добавление в почву исследуемого противогрибкового агента, инкубирование смеси и оценку ингибирующего действия противогрибкового агента на рост патогенного гриба.
Недостатком известного способа является то, что штаммы, оцененные как супрессивные, в дальнейшем в качестве биопрепарата используются отдельно, без внесения компостов, что приводит к низкой выживаемости штаммов биопрепарата. Также недостатком известного технического решения является отсутствие удобрительных свойств у известного противогрибкового агента.
Из исследованного уровня техники заявителем выявлен метод трехступенчатого скрининга супрессивных штаммов бактерий по патенту на изобретение США N 4647533 «Метод скрининга бактерий и применение их для контроля Pythium spp. у зерновых культур». Сущность известного технического решения состоит в скрининге штаммов бактерий, способных подавлять Pythium spp., включающем следующие этапы: 1) выделение штаммов бактерий из ризосферы зерновых культур, зараженных спорами Pythium spp. в концентрации 500-1000 спор/г почвы; 2) скрининг штаммов, выделенных на первой стадии для оценки эффективности подавления Pythium spp.
Недостатком известного способа также является то, что штаммы, оцененные как супрессивные, в дальнейшем в качестве биопрепарата используются отдельно, без внесения компостов, преимущество внесения которых (компостов) описаны ранее.
Наиболее близким к заявленному техническому решению, выбранным заявителем в качестве прототипа, по совокупности совпадающих признаков и по назначению является способ приготовления супрессивных компостов на основе органических отходов, с помощью внесения биопрепарата по патенту на изобретение США №4642131 «Способ получения супрессивного компоста и использование в нем культур микроорганизмов».
Сущностью прототипа является приготовление биопрепарата для ингибирования патогенов растений и/или заболеваний, вызванных патогенами в компосте, полученного известным и описанный в прототипе способом, который (биопрепарат для ингибирования патогенов) состоит из, по крайней мере, одного выделенного штамма грибов рода Trichoderma (Trichoderma hamatum isolate 382, A.T.C.C. No. 20765 и Т. hamatum isolate 559, A.T.C.C. No. 20764) и одной из выделенных бактерий (Pseudomonas maltophilia sp. isolate 76, A.T.C.C. No. 53199 и Flavobacterium sp. isolate 299, A.T.C.C. No. 53198), способ получения супрессивного компоста по отношению к Rhizoctonia solani, Pythium ultimum и Fusarium oxysporum f. sp. conglutenans, с помощью внесения в компост биопрепарата, содержащего по крайней мере один выделенный штамм грибов рода Trichoderma и один выделенный штамм бактерии (Pseudomonas maltophilia sp. isolate 76, A.T.C.C. No. 53199 и Flavobacterium sp. isolate 299, A.T.C.C. No. 53198), способ получения супрессивного компоста в отношении патогенов растений и/или болезней, вызванных ими, включающий внесение в указанный компост, после того, как пик нагревания был пройден, но до общей колонизации указанного компоста мезофильными микроорганизма, смеси культур микроорганизмов, состоящую из, по меньшей мере, одного штамма грибов - антагониста по отношению к Rhizoctonia solani и способного подавлять заболевания, вызываемые указанным фитопатогеном, по меньшей мере, одного бактериального штамма - антагониста по отношению к Pythium ultimum и способного подавлять заболевания, вызываемые указанным фитопатогеном, вносящаяся в количестве не менее 100 КОЕ/г компоста как для бактериального штамма, так и для грибного в пересчете на сухой вес компоста.
Таким образом, известный способ представляет собой получение супрессивного компоста с помощью внесения в него биопрепарата, состоящего из микроорганизмов с супрессивной активностью, один из которых микроскопический гриб рода Trichoderma, а второй - бактериальный штамм одного из родов (Pseudomonas, Flavobacterium). Эти микроорганизмы вносят в компост как совместно в виде биопрепарата, так и отдельно. Недостатками известного способа является:
- необходимость внесения дополнительных минеральных веществ (таких как перлит, торф) при компостировании муниципальных отходов и отходов растительного происхождения, что значительно повышает трудоемкость процесса компостирования;
- отсутствие определения механизмов супрессивного действия использованных штаммов;
- отсутствие определения антагонистической активности выбранных штаммов, ввиду чего невозможно предсказать взаимное влияния штаммов биопрепарата друг на друга при их совместном внесении;
- кратковременный эффект повышения супрессивных свойств, вследствие однократного внесения биопрепарата в компост;
- отсутствие сведений об удобрительных свойствах компостов.
Целью заявленного технического решения является устранение недостатков прототипа путем разработки нового способа получения компостов, обладающих одновременно удобрительными свойствами и стабильными супрессивными свойствами по отношению к возбудителю фузариоза растений Fusarium oxysporum, путем подбора отходов с различными характеристиками.
Цель достигают путем разработки заявленного способа, заключающегося в выполнении следующих действий:
- получении зрелого компоста на основе органических сельскохозяйственных и муниципальных отходов (например, навоз крупного рогатого скота, куриный помет, свежий свиной навоз, отходы соломы, зерна);
- контроле уровня зрелости компостной смеси;
- выделении штаммов микроорганизмов из компостной смеси;
- оценке супрессивных свойств штаммов по 4 механизмам супрессивности;
- выборе для каждого механизма супрессивности штамма микроорганизмов, характеризующегося максимальной эффективностью, из которых будет составлен биопрепарат;
- оценке возможности совместного внесения штаммов в одном биопрепарате, основанной на анализе антагонистической активности выбранных штаммов по отношению друг к другу;
- двукратном внесении биопрепарата из четырех штаммов микроорганизмов, ведущем к увеличению продолжительности проявления супрессивных свойств компоста;
- оценке супрессивных свойств компоста по отношению к возбудителю фузариоза растений Fusarium oxysporum, полученного после внесения биопрепарата;
- оценке удобрительных свойств компоста.
Техническим результатом заявленного технического решения является способ получения компостов, обладающих одновременно удобрительными свойствами и стабильными супрессивными свойствами по отношению к возбудителю фузариоза растений Fusarium oxysporum, путем подбора отходов с различными характеристиками.
Сущность заявленного технического решения заключается в способе получения супрессивного компоста по отношению к возбудителю фузариоза растений Fusarium oxysporum, заключающегося в приготовлении компоста, полученного из сельскохозяйственных отходов, выделении из компоста штаммов микроорганизмов, приготовлении на основе выделенных штаммов биопрепарата, внесении биопрепарата в компост, оценке супрессивности компоста, характеризующимся тем, что проводят оценку супрессивных свойств штаммов по 4 механизмам супрессивности, оценку взаимной антагонистической активности штаммов, осуществляют двукратное внесение биопрепарата в компост, проводят оценку удобрительных свойств супрессивного компоста.
Заявленное техническое решение иллюстрируется Фиг. 1-6.
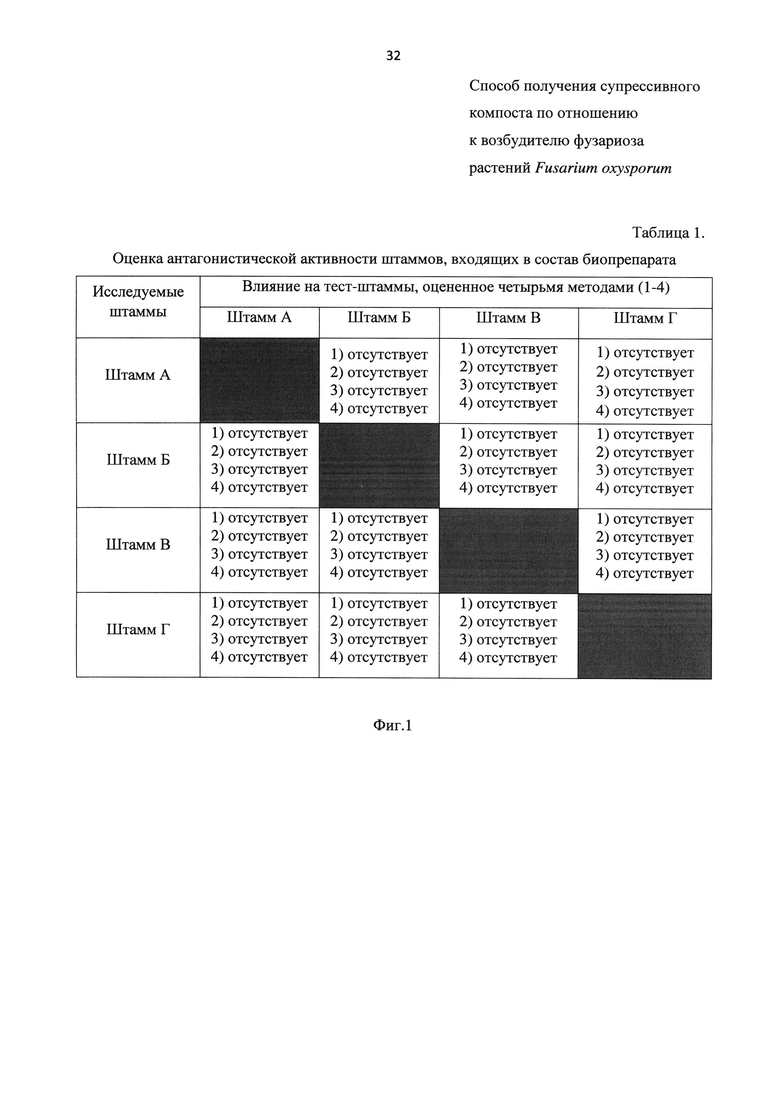
На Фиг. 1 представлена таблица «Оценка антагонистической активности штаммов, входящих в состав биопрепарата». Указанная таблица состоит:
- из 4-х столбцов, в которых представлено влияние на тест-штаммы, оцененное четырьмя методами (1-4) (в первом - штамма А, во втором - штамма Б, в третьем - штамма В, в четвертом - штамма Г);
- из 4-х строк, в которых приведены исследуемые штаммы (в первом - штамм А, во втором - штамм Б, в третьем - штамм В, в четвертом - штамм Г).
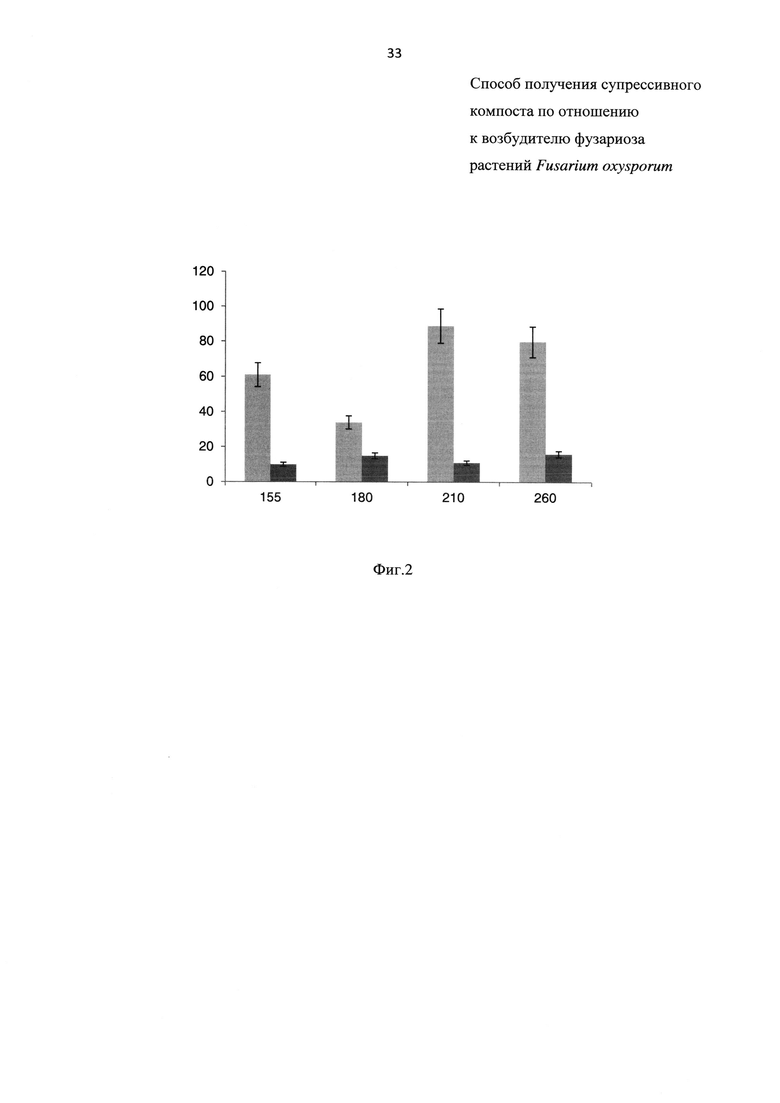
На Фиг. 2 показана супрессивность компостной смеси, обработанной биопрепаратом, составленной из куриного помета (далее - КП), навоза крупного рогатого скота (далее - КРС) и отходов зерна (далее - ОЗ) на 155,180,210 и 260 сут, где
- на оси X - возраст компостных смесей в сутках;
- на оси Y - количестве здоровых растений томата в % от контроля (выращенных на чистой почве);
- светлые столбцы  обозначают смесь КП+КРС+ОЗ;
обозначают смесь КП+КРС+ОЗ;
- темные столбцы  обозначаю контроль без внесения компоста.
обозначаю контроль без внесения компоста.
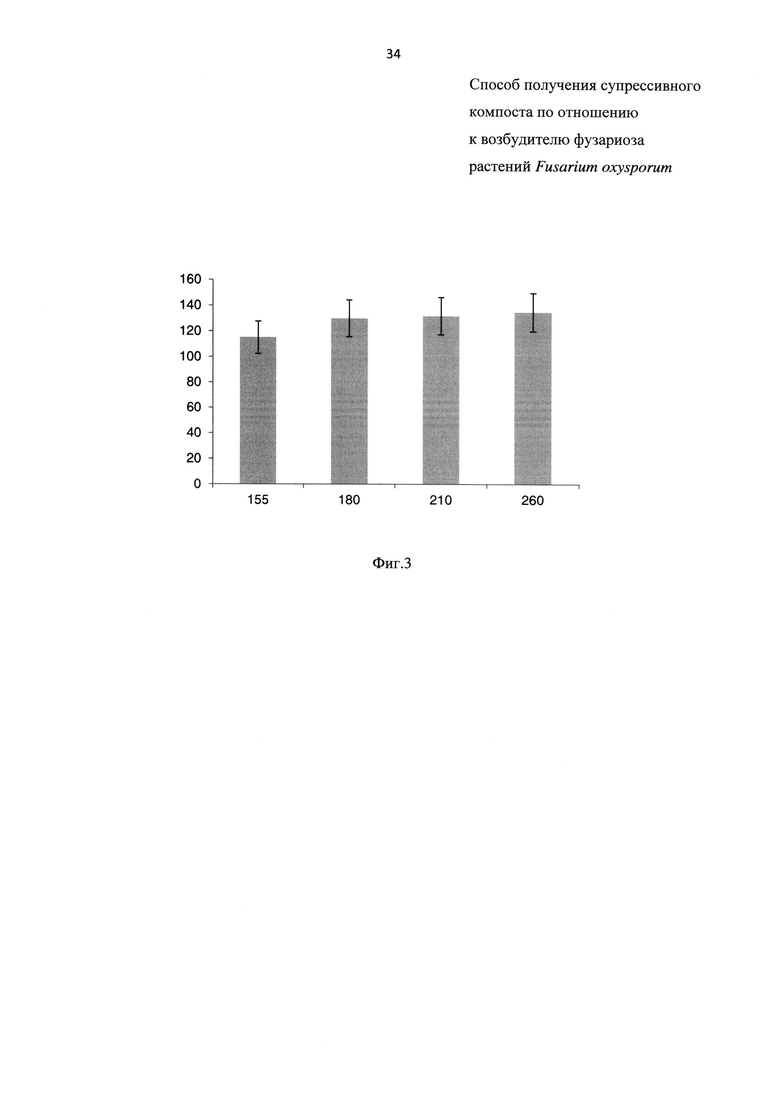
На Фиг. 3 показаны удобрительные свойства компостной смеси, обработанной биопрепаратом, составленной из куриного помета (далее - КП), навоза крупного рогатого скота (далее - КРС) и отходов зерна (далее - ОЗ) на 155, 180, 210 и 260 сут, где
- на оси X - возраст компостных смесей в сутках;
- на оси Y - индекс прорастания (GI) в %.
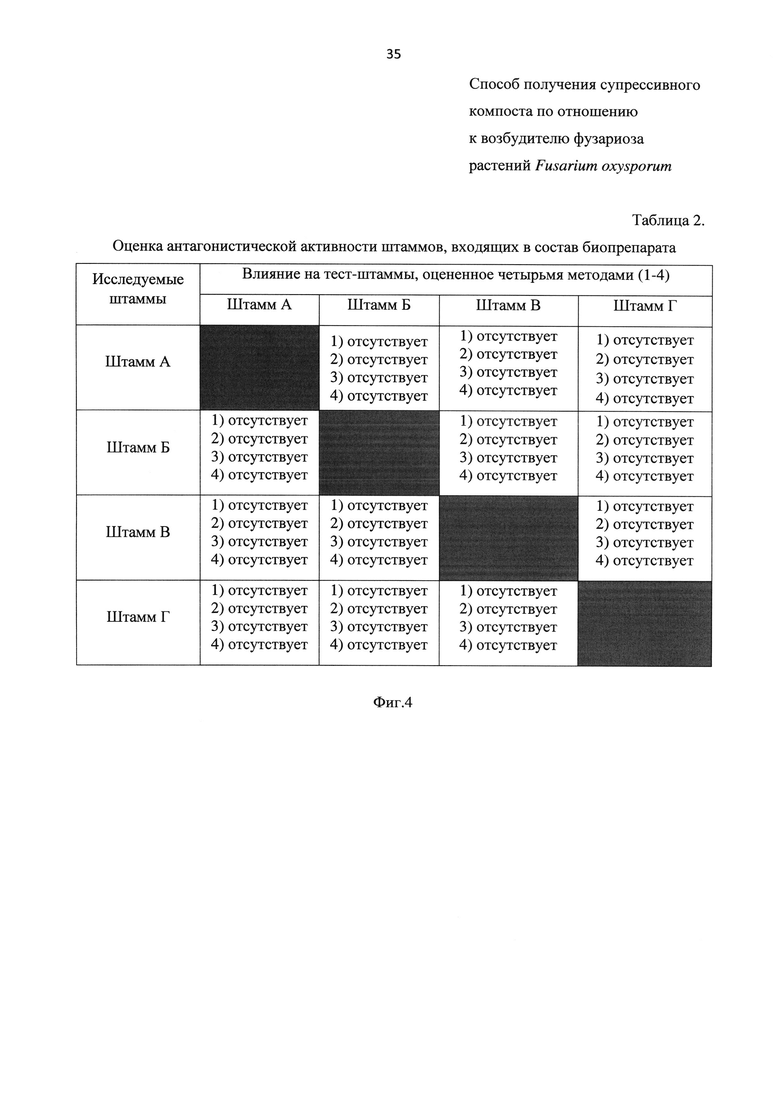
На Фиг. 4 представлена таблица «Оценка антагонистической активности штаммов, входящих в состав биопрепарата». Указанная таблица состоит:
- из 4-х столбцов, в которых представлено влияние на тест-штаммы, оцененное четырьмя методами (1-4) (в первом - штамма А, во втором - штамма Б, в третьем -штамма В, в четвертом - штамма Г);
- из 4-х строк, в которых приведены исследуемые штаммы (в первом - штамм А, во втором - штамм Б, в третьем - штамм В, в четвертом - штамм Г).
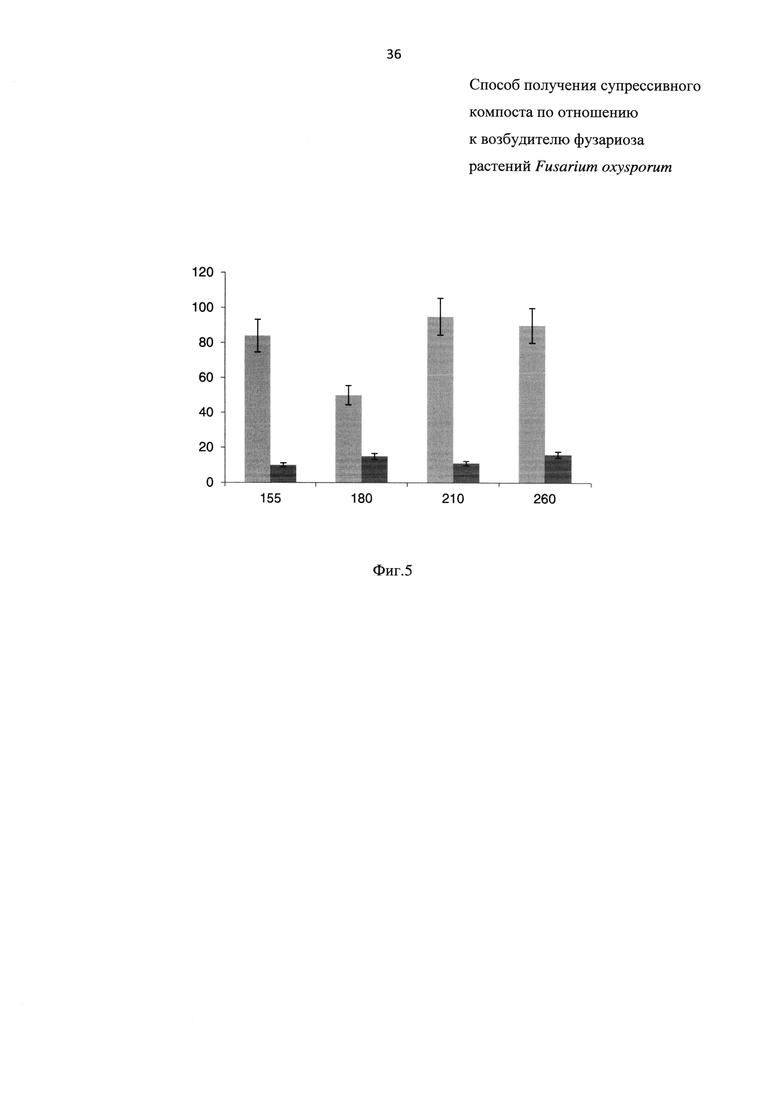
На Фиг. 5 показана супрессивность компостной смеси обработанной биопрепаратом, составленной из свиного навоза (далее - СН) и отходов соломы (далее - ОС) на 155, 180, 210 и 260 сут, где
- на оси X - возраст компостных смесей в сутках;
- на оси Y - количестве здоровых растений томата в % от контроля (выращенных на чистой почве);
- светлые столбцы  обозначают смесь КП+КРС+ОЗ;
обозначают смесь КП+КРС+ОЗ;
- темные столбцы  обозначают контроль без внесения компоста.
обозначают контроль без внесения компоста.
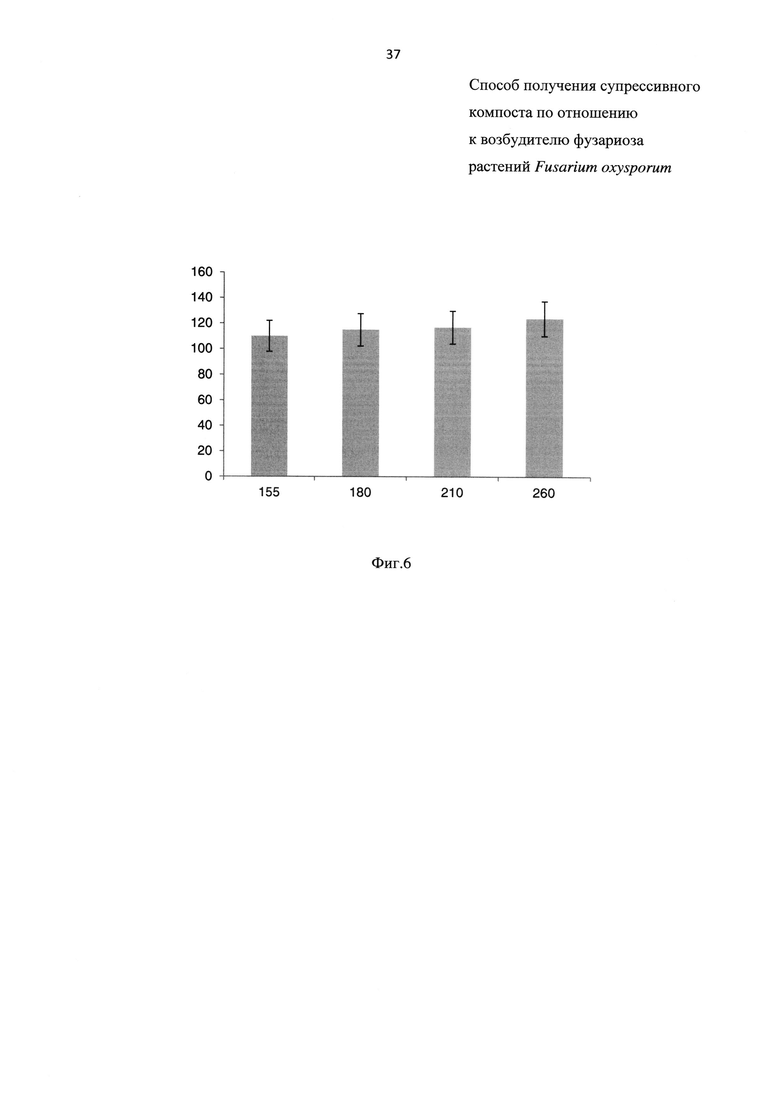
На Фиг. 6 показаны удобрительные свойства компостной смеси, обработанной биопрепаратом, составленной из свиного навоза (далее - СН) и отходов соломы (далее - ОС) на 155, 180, 210 и 260 сут, где
- на оси X - возраст компостных смесей в сутках;
- на оси Y - индекс прорастания (GI) в %.
Заявленное техническое решение реализуют на практике по общему алгоритму, состоящему из четырех этапов.
Первый этап: приготовление компостной смеси
В качестве основы смеси выбирают органические муниципальные или сельскохозяйственные отходы, например куриный помет, коровий навоз, свиной навоз, отходы зерна, соломы и т.д.
Компостная смесь состоит из одного или нескольких органических отходов (в зависимости от характеристик отхода/-ов) и структурирующего агента.
Структурирующий агент вводят для обеспечения пористости компостной смеси, необходимой, в свою очередь, для поддержания оптимальной аэрации с целью обеспечения кислородом микроорганизмов компоста. В качестве структурирующего агента используют отходы зерна, отходы соломы, опилки.
Если предполагается, что компостная смесь состоит, например, из двух органических отходов и структурирующего агента, то на первом этапе берут среднюю пробу отхода 1, отхода 2 и структурирующего агента согласно требованиям на отбор проб для химического анализа [34]. Далее для каждой пробы определяют содержание органического углерода [35], содержание общего азота [36] и влажность [37].
Расчет количества органических отходов в смеси проводят с помощью программы ЭВМ, разработанной авторами заявленного технического решения, «CompostCalc» (свидетельство №2016618803), либо расчетом подбирают соотношение смеси таким образом, чтобы соотношение C/N изменялось в диапазоне 20-40, влажность компостной смеси составляла 40-60%. Далее смешивают отход 1, отход 2 и структурирующий агент в рассчитанном соотношении.
Компостирование проводят в помещении, например, при температуре 25-27°С, при регулярном перемешивании компостной смеси (например, 1 раз/сут) и поддержании влажности смеси, например, на уровне 55%.
Основываясь на изложенном, возможно сделать вывод о том, что первый этап заявленного технического решения, по сравнению с прототипом, отличается тем, что заявителем исключено внесение дополнительных веществ (перлит, торф), что приводит к упрощению технологического процесса компостирования и, соответственно, его удешевлению.
При этом заявитель достигает сопоставимый с прототипом технический результат (получение компостной смеси с супрессивными свойствами по отношению к возбудителю фузариоза растений Fusarium oxysporum) путем оптимизации подбора органических отходов с различными характеристиками, при этом прототип не обладает удобрительными свойствами (исходя из текста описания прототипа).
Второй этап: Оценка зрелости компоста
Для оценки зрелости компоста берут объединенную пробу компоста (ГОСТ 17.4.4.02-84), перемешивают и измельчают для проведения дальнейшего анализа. Далее для компостной смеси определяют респираторную активность (интенсивность дыхания микробного сообщества компостов) [38] и фитотоксичность (влияние компонентов компоста на рост и развитие растений) [39]. При этом в качестве меры фитотоксичности используют индекс прорастания, который рассчитывают согласно методике [40] по формуле:
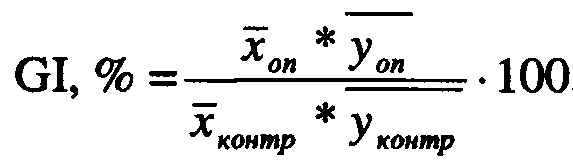 ,
,
где 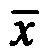 контр - среднее арифметическое длины проростков в контроле, мм;
контр - среднее арифметическое длины проростков в контроле, мм;
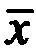 оп - среднее арифметическое длины проростков в опыте, мм;
оп - среднее арифметическое длины проростков в опыте, мм;
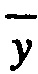 контр - средняя арифметическая всхожесть семян в контроле, %;
контр - средняя арифметическая всхожесть семян в контроле, %;
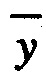 оп - средняя арифметическая всхожесть семян в опыте, %. Если респираторная активность составляет менее 1 мгСО2-С/г и индекс прорастания более 80%, компост можно характеризовать как зрелый и стабильный [26, 41]. Следовательно, такой компост можно использовать в качестве органического удобрения и в него можно вносить биопрепарат.
оп - средняя арифметическая всхожесть семян в опыте, %. Если респираторная активность составляет менее 1 мгСО2-С/г и индекс прорастания более 80%, компост можно характеризовать как зрелый и стабильный [26, 41]. Следовательно, такой компост можно использовать в качестве органического удобрения и в него можно вносить биопрепарат.
Третий этап. Приготовление биопрепарата
Из компостной смеси выделяют аборигенные микроорганизмы методом посева на мясопептонный агар (далее - МПА, среда для культивирования большинства микроорганизмов), и на среду Чапека (среда для культивирования грибных штаммов). Далее штаммы поочередно проверяют на четыре механизма супрессивности:
- механизм конкурентного исключения (хитиназная активность);
- механизм хищничества (протеазная активность);
- механизм синтеза антибиотиков (антагонистическая активность);
- механизм повышения системной устойчивости растений.
Для оценки хитиназной активности используют метод посева микроорганизмов на твердую среду, содержащую в качестве питательного вещества коллоидный хитин. Тот штамм, который способен расти и развиваться, используя в качестве источника питания коллоидный хитин, используют далее для создания биопрепарата (Штамм А).
Для оценки протеазной активности используют метод посева микроорганизмов на среду, содержащую в качестве питательного вещества протеины из сухого молока. Тот штамм, который способен расти и развиваться, используя в качестве источника питания сухое молоко, используют далее для создания биопрепарата (Штамм Б).
Для оценки антагонистической активности по отношению к фитопатогенному микроскопическому грибу Fusarium oxysporum используют метод посева микроорганизмов на среду МПА. Тот штамм, который подавляет рост и развитие Fusarium oxysporum, используют далее для создания биопрепарата (Штамм В).
Оценку повышения системной устойчивости проводят с помощью теста на растениях томата с разделенным корнем, когда одну половину корня выращивают в почве, зараженной фузариозом, а вторую половину корня обрабатывают выделенными штаммами. Тот штамм, внесение которого позволяет развиваться здоровым растениям томата, несмотря на заражение первой половины корня фузариозом, используют для создания биопрепарата (Штамм Г).
Каждый из четырех выбранных штаммов микроорганизмов проверяют на наличие антагонистической активности относительно трех других выделенных заявителем штаммов, используя четыре метода определения антагонистической активности на чашках Петри, представленных далее.
1. Метод перпендикулярных штрихов
На поверхность агаровой среды в чашке Петри высевают штрихом культуру исследуемого штамма микроорганизмов и инкубируют при 28°C в течение определенного времени для образования и диффузии в агар ингибиторных соединений. Затем перпендикулярно от края чашки к штриху выросшей культуру подсевают штрихом культуру тест-штамма. Чашку вновь ингибируют, но теперь при условиях благоприятных для роста тест-культур. О наличии и степени антагонистической активности у испытуемого штамма судят по величине зоны ингибирования тест-штамма на границе со штрихом роста исследуемого штамма [42].
2. Метод капель по Н.А. Глушанову
На поверхность подсушенной агаровой среды наносят капли культур, выращенных на жидкой питательной среде, бактериологической петлей диаметром 2-3 мм и оставляют при комнатной температуре до полного впитывания капли. После этого, отступив 1-2 мм от края первого пятна, наносят каплю второй культуры. Растекаясь, вторая капля заходит на пятно первой культуры примерно на половину диаметра. В наложенной части культуры развиваются при взаимном присутствии (совместное культивирование), конкурируя друг с другом. Свободные части пятен каждой культуры служат контролем жизнеспособности каждой из культур и всхожести питательной среды. После подсыхания второй культуры, чашки с посевами инкубируют крышкой вниз при температуре 28°C. Результат опыта учитывают визуально - по наличию признаков подавления одной культурой другой [43].
3. Метод блоков
Испытуемую культуру высевают на питательный агар в чашки Петри и инкубируют в оптимальных условиях для образования и накопления в агаре ингибиторных соединений. Затем стерильным пробочным сверлом вырезают агаровый блок с выросшей культурой и устанавливают его в другой чашке Петри на поверхности агаровой среды, только что засеянной культурой тест-штамма. Чашку инкубируют в условиях, оптимальных для тест-штамма. О степени антагонистической активности испытуемого микроорганизма судят по величине зоны ингибирования роста тест-штамма вокруг агарового блока [44].
4. Метод лунок
На поверхность агаризованной среды проводят посев газоном тест-штамма. Пробочным сверлом вырезают лунку диаметром 5-7 мм и помещают в нее по 50 мкл культуральной жидкости исследуемого штамма. Чашки Петри инкубируют в термостате и измеряют зону ингибирования тест-штамма вокруг лунки [44, 45].
Далее, в случае отсутствия антагонистической активности штаммов по отношению к друг другу, из выбранных четырех штаммов составляют биопрепарат. Каждый из штаммов выращивают на среде L-бульон, при температуре, например, 28°C, до максимальной оптической плотности среды. Далее определяют концентрацию спор штамма на объем среды (КОЕ/мл) счетчиком клеток Scepter™ 2.0 Cell Counter (Merck Millipore).
В случае наличия антагонистической активности штаммов по отношению к друг другу из выбранных четырех штаммов подбирают другие штаммы (из выделенных ранее на втором этапе).
Четвертый этап
Через 120 суток в стабильный и зрелый компост (уровень респираторной активности менее 1 мг С-CO2/кг и отсутствие фитотоксичности GI<80%) вносят биопрепарат, обладающий супрессивной активностью. Биопрепарат представляет собой смесь из четырех штаммов микроорганизмов, выделенных из компостной смеси и обладающих четырьмя вышеописанными механизмами супрессивности. Биопрепарат вносят в жидком виде. Биопрепарат составляют таким образом, чтобы концентрация микроорганизмов составляла 104 КОЕ/г для микроскопических грибов и 106 КОЕ/г для бактерий.
Для оценки супрессивных свойств компостов с внесенным биопрепаратом используют тест с томатами, выращенными на почве, зараженной фузариозом, с внесением в нее компоста. В качестве негативного контроля используют чистую почву, в качестве позитивного контроля - почву, зараженную фузариозом без внесения компоста.
Для оценки удобрительных свойств компостов с внесенным биопрепаратом используют контактный тест для оценки фитотоксичности [39]. Если фитотоксичность, выраженная в индексе прорастания (GI), более 100%, то компост стимулирует рост и развитие растений, и, соответственно, обладает удобрительными свойствами. В качестве контроля используют чистую почву, без внесения компоста.
Для достижения максимальных супрессивных свойств внесение биопрепарата в компост проводят дважды, с интервалом 50-70 суток, что, по мнению заявителя, позволяет достичь большей выживаемости штаммов биопрепарата в компосте. Второе внесение биопрепарата в компост приводит к большей выживаемости штаммов биопрепарата и, как следствие, значительному увеличению супрессивности по сравнению с первым внесением.
Ниже приведены примеры конкретного осуществления заявленного технического решения.
Пример 1. Получение супрессивного компоста из навоза крупнорогатого скота, куриного помета и отходов зерна
Берут навоз крупнорогатого скота (КРС), куриного помета (КП) и отходы зерна (З) и определяют в каждом из них:
- содержание органического углерода: определено 38%, 89% и 67% соответственно;
- содержание общего азота: определено 4,1%, 0,1% и 5,4% соответственно;
- влажность: определено 35%, 54% и 5,5% соответственно.
На основе полученных данных рассчитывают с помощью программы ЭВМ «CompostCalc» необходимое соотношение отходов в составляемой смеси таким образом, чтобы соотношение C/N изменялось в рекомендованном диапазоне, а именно 20-40, влажность компостной смеси составляла 40-60% [26].
Исходя из приведенных выше данных, заявителем определен состав компостной смеси: 12 кг навоза КРС : 8 кг куриного помета : 11 кг отходов зерна.
Компостирование проводят в помещении при температуре, например, 25-27°C, 1 раз/сут перемешивают компостную смесь, при необходимости доводят влажность компостной смеси до рекомендованной (согласно Epstein [26] рекомендуемая влажность смеси для компостирования составляет 40-60%), оптимальную влажность поддерживают поливом компостной смеси водопроводной водой комнатной температуры.
После 120 сут компостирования отбирают пробу компоста для оценки его зрелости и стабильности. Полученный экспериментально уровень респираторной активности равен 0,56 мг CO2-С/г, уровень фитотоксичности (индекс прорастания GI) равен 109%. Таким образом, принимая во внимание полученные выше результаты, компост характеризуют как зрелый и стабильный, так как полученные значения соответствуют рекомендованному в [26] диапазону зрелости (GI более 80%) и стабильности (респираторная активность менее 1 мг CO2-С/г).
Из указанного возможно сделать вывод о том, что полученный в примере 1 компост можно использовать в качестве органического удобрения и в него можно вносить биопрепарат.
На следующем этапе из компоста готовят компостную суспензию в стерильной водопроводной воде. Для этого берут, например, 5 г компоста и вносят его, например, в 50 мл стерильной водопроводной воды, далее перемешивают на ротаторе в течение, например, 1 часа, затем полученную жидкость центрифугируют. Далее производят посев разбавленной в 106 раз суспензии на среду МПА и Чапека в чашки Петри. После формирования отдельных колоний выделяют отдельные штаммы, на среде МПА выделяют бактериальные штаммы, на среде Чапека - грибные штаммы.
После этого оценивают возможность использования выделенных штаммов для создания биопрепарата. Для каждого из штаммов проводят оценку его хитиназной, протеазной, антагонистической активности и способности его повышать системную устойчивость растений томата. После проведения тестов выбирают штаммы с максимальной хитиназной (Штамм А), протеазной (Штамм Б), антагонистической активностью (Штамм В) и способностью повышать системную устойчивость растений томата (Штамм Г).
Далее оценивают антагонистическую активность каждого из четырех штаммов по отношению к трем оставшимся штаммов четырьмя вышеописанными методами:
1) методом перпендикулярных штрихов;
2) методом капель по Н.А. Глушанову;
3) методом блоков;
4) методом лунок.
Установлено, что ни один из исследуемых штаммов не проявляет антагонистической активности по отношению к трем другим. Результаты приведены на Фиг. 1.
Основываясь на полученных выше данных, сделан вывод, что из выделенных штаммов А-Г, обладающих разными механизмами супрессивности и не обладающих антагонистической активностью по отношению друг к другу (в отличие от прототипа, у которого проверки антагонистической активности штаммов перед составлением биопрепарата не предусмотрено), можно составлять биопрепарат.
Далее наращивают штаммы для составления биопрепарата. Так как выделенные штаммы относятся к разным царствам (грибы, бактерии), их культивирование проводят в течение различного времени:
- штаммы А и Б относятся к грибам, их культивирование проводят в течение, например, 7 сут на среде L-бульон;
- штаммы В и Г относятся к бактериям, их культивирование проводят в течение, например, 14 часов на среде L-бульон.
Далее счетчиком клеток Scepter™ 2.0 Cell Counter (Merck Millipore) определяют концентрацию (КОЕ/мл) для каждого штамма и составляют биопрепарат таким образом, чтобы концентрация бактериальных клеток составляла 106 КОЕ/мл, грибных 104 КОЕ/мл. Исходя из расчета, берут 450 мл штамма А, 450 мл штамма Б, 6 мл штамма В, 3 мл штамма Г и перемешивают для составления биопрепарата.
Далее берут, например, 909 мл биопрепарата в жидком виде и вносят его, например, в 1000 г компостной смеси. Биопрепарат в указанном выше количестве вносят в данную компостную смесь дважды - на 122 и на 180 сут компостирования.
Через 14 суток после внесения биопрепарата оценивают супрессивные свойства компоста и длительность сохранения данных свойств. Супрессивные свойства компостов с внесенным биопрепаратом оценивают в модельной системе «почва - Fusarium oxysporum». Для этого берут, например, 400 г компоста с биопрепаратом, вносят его, например, в 1 600 г почвы, зараженной фитопатогенным грибом Fusarium oxysporum в количестве, например, 1⋅106 КОЕ/кг. Далее в полученную смесь высевают семена томатов сорта «Сибирский скороспелый», неустойчивого к фузариозу.
Через 3 недели оценивают количество растений с отсутствием внешних признаков проявления фузариоза, так называемые здоровые растения.
Результаты эксперимента приведены на Фиг. 2. Как видно из Фиг. 2, супрессивность компостов после первого внесения сохраняется в течение 35 сут, далее происходит ее снижение. Через 58 сут после внесения биопрепарата супрессивность снижается, однако ее уровень достаточно высок: 37% здоровых растений томата, что достоверно отличается от контрольной почвы, зараженной фузариозом и без внесения компоста.
Второе внесение биопрепарата в компост приводит к большей выживаемости штаммов биопрепарата и, как следствие, значительному увеличению супрессивности - в 1,5 раза по сравнению с первым внесением. После второго внесения биопрепарата в компост супрессивность продолжает оставаться высокой в течение не менее 80 сут и превышают таковую после первого внесения.
Далее оценивают удобрительные свойства компостов, результаты эксперимента приведены на Фиг. 3. Как видно из Фиг. 3, индекс прорастания с 155 сут превышает 115% и на протяжении всего эксперимента увеличивается, что говорит о наличии удобрительных свойств компоста, при этом наличие удобрительных свойств у прототипа в тексте описания отсутствует.
Таким образом, из приведенного примера можно сделать вывод, что повторное внесение биопрепарата в компост стабилизирует его супрессивность, в связи с этим рекомендовано двукратное внесение биопрепарата в компост.
Пример 2. Получение супрессивного компоста из свиного навоза и отходов соломы.
Берут отходы свиного навоза (СН) и соломы (ОС) и определяют в них:
- содержание органического углерода: определено 42% и 95% соответственно;
- содержание общего азота: определено 4,7% и 0,05% соответственно;
- влажность: определено 59% и 15% соответственно.
На основе полученных данных рассчитывают с помощью программы ЭВМ «CompostCalc» необходимое соотношение отходов в составляемой смеси таким образом, чтобы соотношение C/N изменялось в рекомендованном диапазоне, а именно 20-40, влажность компостной смеси составляла 40-60%.
Исходя из приведенных выше данных, заявителем определен состав компостной смеси: 18 кг СН:6 кг ОС.
Компостирование проводят в помещении при температуре, например, 25-27°C, 1 раз/сут перемешивают компостную смесь, при необходимости доводят влажность компостной смеси до рекомендованной (согласно Epstein [26] рекомендуемая влажность смеси для компостирования составляет 40-60%), оптимальную влажность поддерживают поливом смеси водопроводной водой комнатной температуры.
После 120 сут компостирования отбирают пробу компоста для оценки его зрелости и стабильности. Полученный экспериментально уровень респираторной активности равен 0,87 мг CO2-С/г, уровень фитотоксичности (индекс прорастания GI) равен 124%. Таким образом, принимая во внимание полученные выше результаты, компост характеризуют как зрелый и стабильный, так как полученные значения соответствуют рекомендованному в [26] диапазону зрелости (GI более 80%) и стабильности (респираторная активность менее 1 мг CO2-С/г).
Из указанного возможно сделать вывод о том, что полученный в примере 2 компост можно использовать в качестве органического удобрения и в него можно вносить биопрепарат.
На следующем этапе из компоста готовят компостную суспензию в стерильной водопроводной воде. Для этого берут, например, 5 г компоста и вносят его, например, в 50 мл стерильной водопроводной воды, далее перемешивают на ротаторе в течение, например, 1 часа, затем полученную жидкость центрифугируют. Далее производят посев разбавленной в 106 раз суспензии на среду МПА и Чапека в чашки Петри. После формирования отдельных колоний выделяют отдельные штаммы, на среде МПА выделяют бактериальные штаммы, на среде Чапека - грибные штаммы.
После этого оценивают возможность использования выделенных штаммов для создания биопрепарата. Для каждого из штаммов проводят оценку его хитиназной, протеазной, антагонистической активности и способности его повышать системную устойчивость растений томата. После проведения тестов выбирают штаммы с максимальной хитиназной (Штамм А), протеазной (Штамм Б), антагонистической активностью (Штамм В) и способностью повышать системную устойчивость растений томата (Штамм Г).
Далее оценивают антагонистическую активность каждого из четырех штаммов по отношению к трем оставшимся штаммов четырьмя вышеописанными методами:
1) методом перпендикулярных штрихов;
2) методом капель по Н.А. Глушанову;
3) методом блоков;
4) методом лунок.
Установлено, что ни один из исследуемых штаммов не проявляет антагонистической активности по отношению к трем другим. Результаты приведены на Фиг. 4.
Основываясь на полученных выше данных, сделан вывод, что из выделенных штаммов А-Г, обладающих разными механизмами супрессивности и не обладающих антагонистической активностью по отношению друг к другу (в отличие от прототипа, у которого проверки антагонистической активности штаммов перед составлением биопрепарата не предусмотрено), можно составлять биопрепарат.
Далее наращивают штаммы для составления биопрепарата. Так как выделенные штаммы относятся к разным царствам (грибы, бактерии), их культивирование проводят в течение различного времени:
- штаммы А и Б относятся к грибам, их культивирование проводят в течение, например, 7 сут на среде L-бульон;
- штаммы В и Г относятся к бактериям, их культивирование проводят в течение, например, 14 часов на среде L-бульон.
Далее счетчиком клеток Scepter™ 2.0 Cell Counter (Merck Millipore) определяют концентрацию (КОЕ/мл) для каждого штамма и составляют биопрепарат таким образом, чтобы концентрация бактериальных клеток составляла 106 КОЕ/мл, грибных 104 КОЕ/мл. Исходя из расчета, берут 320 мл штамма А, 270 мл штамма Б, 8 мл штамма В, 5 мл штамма Г, перемешивают для составления биопрепарата.
Далее берут, например, 603 мл биопрепарата в жидком виде и вносят его, например, в 1000 г компостной смеси. Биопрепарат в указанном выше количестве вносят в данную компостную смесь дважды - на 122 и на 180 сут компостирования.
Через 14 сут после внесения биопрепарата оценивают супрессивные свойства компоста и длительность сохранения данных свойств. Супрессивные свойства компостов с внесенным биопрепаратом оценивают в модельной системе «почва - Fusarium oxysporum». Для этого берут, например, 400 г компоста с биопрепаратом, вносят его, напрмер, в 1 600 г почвы, зараженной фитопатогенным грибом Fusarium oxysporum в количестве, например, 1⋅106 КОЕ/кг. Далее в полученную смесь высевают семена томатов сорта «Сибирский скороспелый», неустойчивого к фузариозу.
Через 3 недели оценивают количество растений с отсутствием внешних признаков проявления фузариоза, так называемые здоровые растения.
Результаты эксперимента приведены на Фиг. 5. Как видно из Фиг. 5, супрессивность компостов после первого внесения сохраняется в течение 35 сут, далее происходит ее снижение. Через 58 сут после внесения биопрепарата супрессивность снижается, однако ее уровень достаточно высок: 50% здоровых растений томата, что достоверно отличается от контрольной почвы, зараженной фузариозом и без внесения компоста.
Второе внесение биопрепарата в компост приводит к большей выживаемости штаммов биопрепарата, и как следствие, значительному увеличению супрессивности - в 1,9 раз по сравнению с первым внесением. После второго внесения биопрепарата в компост супрессивность продолжает оставаться высокой в течение не менее 80 сут и превышает таковую после первого внесения.
Далее оценивают удобрительные свойства компостов, результаты эксперимента приведены на Фиг. 6. Как видно из Фиг. 6, индекс прорастания с 155 сут превышает 110% и на протяжении всего эксперимента увеличивается, что говорит о наличии удобрительных свойств компоста, при этом наличие удобрительных свойств у прототипа в тексте описания отсутствует.
Таким образом, из приведенного примера можно сделать вывод, что повторное внесение биопрепарата в компост стабилизирует его супрессивность, в связи с этим рекомендовано двукратное внесение биопрепарата в компост.
На основании полученных заявителем результатов и приведенных примеров конкретного осуществления можно сделать вывод, что заявителем достигнуты заявленные цели и заявленный технический результат - разработан способ получения компостов, обладающих одновременно удобрительными свойствами и стабильными супрессивными свойствами по отношению к возбудителю фузариоза растений Fusarium oxysporum, путем подбора отходов с различными характеристиками.
Технический результат достигнут путем разработки способа, заключающегося в:
- получении зрелого компоста на основе органических сельскохозяйственных и муниципальных отходов (например, навоз крупного рогатого скота, куриный помет, свежий свиной навоз, отходы соломы, зерна);
- контроле уровня зрелости компостной смеси;
- выделении штаммов микроорганизмов из компостной смеси;
- оценке супрессивных свойств штаммов по 4 механизмам супрессивности;
- выборе для каждого механизма супрессивности штамма микроорганизмов, характеризующегося максимальной эффективностью, из которых будет составлен биопрепарат;
- оценке возможности совместного внесения штаммов в одном биопрепарате, основанной на анализе антагонистической активности выбранных штаммов по отношению друг к другу;
- двукратном внесении биопрепарата из четырех штаммов микроорганизмов, ведущем к увеличению продолжительности проявления супрессивных свойств компоста;
- оценке супрессивных свойств компоста по отношению к возбудителю фузариоза растений Fusarium oxysporum, полученного после внесения биопрепарата;
- оценке удобрительных свойств компоста.
По сравнению с прототипом заявитель исключает внесение дополнительных веществ (перлит, торф), что приводит к упрощению технологического процесса компостирования и, соответственно, его удешевлению. При этом заявитель достигает суммарный технический результат, превышающий технический результат, достигнутый у прототипа, а именно - получение компостной смеси, обладающей одновременно удобрительными свойствами (не описанными у прототипа) и стабильными супрессивными свойствами по отношению к возбудителю фузариоза растений Fusarium oxysporum путем подбора отходов с различными характеристиками посредством выполнения оценки супрессивных свойств штаммов по 4 механизмам супрессивности, оценки взаимной антагонистической активности штаммов, двукратного внесения биопрепарата в компост и проведения оценки удобрительных свойств полученного заявленным способом супрессивного компоста.
Заявленное техническое решение позволяет обеспечить реализацию поставленных целей, а именно разработку принципиально нового способа получения компостов, обладающих одновременно удобрительными свойствами и стабильными супрессивными свойствами по отношению к возбудителю фузариоза растений Fusarium oxysporum, путем подбора отходов с различными характеристиками в соответствии с заявленным способом.
Заявленное техническое решение удовлетворяет критерию «новизна», предъявляемому к изобретениям, так как на дату предоставления заявочных материалов заявителем из подвергнутых анализу источников патентной и не патентной информации РФ и стран зарубежья не выявлена заявленная совокупность признаков с идентичными заявленному техническому решению признаками.
Предполагаемое изобретение удовлетворяет критерию «изобретательский уровень», предъявляемому к изобретениям, т.к. совокупность заявленных признаков обеспечивает получение неочевидных для специалиста технических результатов. Кроме указанного, заявленное техническое решение не является очевидным для специалиста вследствие того, что в соответствии с заявленным техническим решением представляется возможным получать высококачественные супрессивные компосты практически из любых видов органических отходов, имеющихся в наличии на той или иной территории у того или иного хозяйствующего субъекта, что, по мнению заявителя, способствует повышению качества жизни человека.
Заявленное техническое решение удовлетворяет критерию «промышленная применимость», предъявляемого к изобретениям, т.к. было апробировано на практике в условиях лаборатории «Экологические инновации» ФГАОУ ВО КФУ и в условиях полевого эксперимента на базе ООО «Агрохолдинг», в результате которых были реализованы все цели, поставленные в заявленном техническом решении.
Список использованных источников
1.  М., Lazcano С,
М., Lazcano С,  J. The evaluation of stability and maturity during the composting of cattle manure // Chemosphere. 2008. Vol. 70, №3. P. 436-444.
J. The evaluation of stability and maturity during the composting of cattle manure // Chemosphere. 2008. Vol. 70, №3. P. 436-444.
2. Bonanomi G. et al. Identifying the characteristics of organic soil amendments that suppress soilborne plant diseases // Soil Biol. Biochem. 2010. Vol. 42, №2. P. 136-144.
3.  M., Lores M.,
M., Lores M.,  J. Changes in chemical and microbiological properties of rabbit manure in a continuous-feeding vermicomposting system. // Bioresour. Technol. 2013. Vol. 128. P. 310-316.
J. Changes in chemical and microbiological properties of rabbit manure in a continuous-feeding vermicomposting system. // Bioresour. Technol. 2013. Vol. 128. P. 310-316.
4. Vidaver, Lambrecht. Bacteria as Plant Pathogens [Electronic resource]. 2004. URL: http://www.apsnet.org/edcenter/intropp/pathogengroups/pages/bacteria.aspx (accessed: 19.08.2015).
5. Liang J.M. et al. Temporal dynamics and population genetic structure of Fusarium graminearum in the upper Midwestern United States // Fungal Genet. Biol. 2014. Vol. 73. P. 83-92.
6. Грибные заболевания растений. Характеристика. [Electronic resource]. URL: http://cvetivsamare.ru/publ/10-1-0-35.
7. Scholthof K.-B.G. et al. Top 10 plant viruses in molecular plant pathology. // Mol. Plant Pathol. 2011. Vol. 12, №9. P. 938-954.
8. Pernezny K. et al. An outbreak of a leaf spot disease of cabbage in southern Florida caused by Xanthomonas campestris pv. armoraciae. // Plant Dis. 2003. Vol. 87, №7. P. 873-873.
9. Rao S. Principles of weed science. Science Pu. NY, 200AD. 526 p.
10. Gordon T.R. Colonization of Muskmelon and Nonsusceptible Crops by Fusarium oxysporum f. sp. melonis and Other Species of Fusarium // Phytopathology. 1989. Vol. 79, №10. P. 1095.
11. Биологический энциклопедический словарь. "Сов. энци / ed. Гиляров М.. С. 1989. 864 р.
12. Champaco E.R., Martyn R.D., Miller М.Е. Comparison of Fusarium solani and F. oxysporum as Causal Agents of Fruit Rot and Root Rot of Muskmelon // HortScience. American Society for Horticultural Science, 1993. Vol. 28, №12. P. 1174-1177.
13. Madhavi M. et al. Integrated Management of Wilt of Chilli Incited by Fusarium solani // Indian J. Plant Prot. Indian Journal of Plant Protection, 2006. Vol. 34, №2. P. 225-228.
14. Everts K.L. et al. Chemical management of Fusarium wilt of watermelon // Crop Prot. 2014. Vol. 66. P. 114-119.
15. Louws F.J., Rivard C.L., Kubota C. Grafting fruiting vegetables to manage soilborne pathogens, foliar pathogens, arthropods and weeds // Sci. Hortic. (Amsterdam). 2010. Vol. 127, №2. P. 127-146.
16. da Silva Bomfim N. et al. Antifungal activity and inhibition of fumonisin production by Rosmarinus officinalis L. essential oil in Fusarium verticillioides (Sacc.) Nirenberg // Food Chem. 2015. Vol. 166. P. 330-336.
17. Validov S.Z., Kamilova F., Lugtenberg B.J.J. Pseudomonas putida strain PCL1760 controls tomato foot and root rot in stonewool under industrial conditions in a certified greenhouse // Biol Control. 2009. Vol. 48, №1. P. 6-11.
18. Markakis E.A. et al. The suppressive effect of compost amendments on Fusarium oxysporum f.sp. radicis-cucumerinum in cucumber and Verticillium dahliae in eggplant // Crop Prot. 2016. Vol. 79. P. 70-79.
19. Trillas M.I. et al. Composts from agricultural waste and the Trichoderma asperellum strain T-34 suppress Rhizoctonia solani in cucumber seedlings // Biol. Control. 2006. Vol. 39, №1. P. 32-38.
20. Gong M. et al. Study of the antifungal ability of Bacillus subtilis strain PY-1 in vitro and identification of its antifungal substance (iturin A). // Acta Biochim. Biophys. Sin. (Shanghai). Oxford University Press, 2006. Vol. 38, №4. P. 233-240.
21.  A. et al. Effects of Commercial and Indigenous Microorganisms on Fusarium Wilt Development in Chickpea 1.
A. et al. Effects of Commercial and Indigenous Microorganisms on Fusarium Wilt Development in Chickpea 1.
22. Sabuquillo P., De Cal A., Melgarejo P. No TitleBiocontrol of tomato wilt by Penicillium oxalicum formulations in different crop conditions // Biol Control. 2006. Vol. 37, №3. P. 256-265.
23.  F. et al. Antagonistic activity of bacteria and fungi from horticultural compost against Fusarium oxysporum f. sp. melonis // Crop Prot. 2007. Vol. 26, №1. P. 46-53.
F. et al. Antagonistic activity of bacteria and fungi from horticultural compost against Fusarium oxysporum f. sp. melonis // Crop Prot. 2007. Vol. 26, №1. P. 46-53.
24. Savazzini F. et al. Real-time PCR for detection and quantification of the biocontrol agent Trichoderma atroviride strain SC1 in soil. // J. Microbiol. Methods. 2008. Vol. 73, №2. P. 185-194.
25. Galitskaya P. et al. Suppressive properties of composts are determined by their raw materials // Indian J. Sci. Technol. 2015. Vol. 8, №30.
26. Epstein E. The Science of Composting - CRC Press Book [Electronic resource]. 1997. URL: http://www.crcpress.com/The-Science-of-Composting/Epstein/9781566764780 (accessed: 17.08.2015).
27. Zhang L., Sun X. Changes in physical, chemical, and microbiological properties during the two-stage co-composting of green waste with spent mushroom compost and biochar. // Bioresour. Technol. 2014. Vol. 171. P. 274-284.
28. Termorshuizen A.J. et al. Suppressiveness of 18 composts against 7 pathosystems: Variability in pathogen response // Soil Biol. Biochem. 2006. Vol. 38, №8. P. 2461-2477.
29. Попова А.Д., Садыкова B.C. Изучение антагонистических свойств штаммов Trichoderma asperellum в отношении токсинобразующих грибов рода Fusarium // Молодой ученый. 2014. Vol. 8. Р. 328-330.
30. Mehta С.М. et al. Compost: Its role, mechanism and impact on reducing soil-borne plant diseases // Waste Manag. Elsevier Ltd, 2014. Vol. 34, №3. P. 607-622.
31. Abo-Elyousr K.A.M., Hashem M., Ali E.H. Integrated control of cotton root rot disease by mixing fungal biocontrol agents and resistance inducers // Crop Prot. 2009. Vol. 28, №4. P. 295-301.
32. Srivastava R. et al. Evaluation of arbuscular mycorrhizal fungus, fluorescent Pseudomonas and Trichoderma harzianum formulation against Fusarium oxysporum f. sp. lycopersici for the management of tomato wilt // Biol. Control. 2010. Vol. 53, №1. P. 24-31.
33. Фирсов H.H. Микробиология: словарь терминов. 2006. 256 p.
34. ГОСТ 17.4.4.02-84 Охрана природы. Почвы. Методы отбора и подготовки проб для химического, бактериологического, гельминтологического анализа. 1984. Р. 6.
35. ISO 14235:1998 Soil quality - Determination of organic carbon by sulfochromic oxidation. 1998. P. 5.
36. ISO 11261:1995 Soil quality - Determination of total nitrogen - Modified Kjeldahl method. 1995. P. 4.
37. ГОСТ 28268-89. Почвы. Методы определения влажности, максимальной гигроскопической влажности и влажности устойчивого завядания растений. 2006. Р. 8.
38. ISO 16072:2002 - Soil quality - Laboratory methods for determination of microbial soil respiration. 2002.
39. ISO 11269-2:2012 Soil quality - Determination of the effects of pollutants on soil flora -Part 2: Effects of contaminated soil on the emergence and early growth of higher plants. 2012. P. 19.
40. Zucconi F. et al. Evaluating toxicity of immature compost [Phytotoxicity]. JG Press, 1981.
41. Zucconi F. et al. Phytotoxins during the stabilization of organic matter // Compost. Agric. Other Wastes. 1985. P. 73-86.
42. Практикум по микробиологии / ed. Нетрусов А.И. Москва, 2005.
43. Заборских Е.И. Антагонистическая активность ме- зофильных молочнокислых стрептококков и их экспери- ментальная селекция. Иркутск, 1976.
44. Аникиев В.В., Лукомская К.А. Руководство к практи-ческим занятиям по микробиологии. Москва, 1977.
45. Червинец, Ю.В. Бондаренко, В.М. Шабанова Н.А., Самоукина, А.М. Червинец В.М. Бактериоциногенные высокоантагонистические штаммы лактобацилл // Микробиология. 2006. Vol. 7.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ приготовления жидкой питательной среды и способ получения жидкого микробиологического препарата на основе смеси штаммов спорообразующих бактерий-антагонистов фитопатогенных грибов р. Fusarium | 2020 |
|
RU2751487C1 |
| Штаммы, биопрепарат, способ получения биопрепарата и способ биологической защиты сельскохозяйственных культур от фузариоза | 2019 |
|
RU2724464C1 |
| Консорциум микроорганизмов, предназначенный для ускорения разложения остатков растительного происхождения и подавления фитопатогенов на растительных остатках и в почве | 2021 |
|
RU2793209C1 |
| Способ борьбы с фузариозом колоса пшеницы | 2024 |
|
RU2825998C1 |
| СПОСОБ ПЕРЕРАБОТКИ ОРГАНИЧЕСКИХ ОТХОДОВ | 2011 |
|
RU2467989C2 |
| Штамм бактерий Pantoea brenneri, обладающий фосфатмобилизующей и фунгицидной активностью | 2017 |
|
RU2654595C1 |
| БИОПРЕПАРАТ ДЛЯ СТИМУЛЯЦИИ РОСТА И ЗАЩИТЫ РАСТЕНИЙ ОТ БОЛЕЗНЕЙ, ПОВЫШЕНИЯ УРОЖАЙНОСТИ И ПОЧВЕННОГО ПЛОДОРОДИЯ | 2011 |
|
RU2478290C2 |
| ФОСФАТРАСТВОРЯЮЩИЙ ШТАММ ACINETOBACTER SPECIES С ФУНГИЦИДНЫМИ СВОЙСТВАМИ | 2010 |
|
RU2451068C1 |
| ФОСФАТРАСТВОРЯЮЩИЙ ШТАММ PSEUDOMONAS SPECIES 181a С ФУНГИЦИДНЫМИ СВОЙСТВАМИ | 2010 |
|
RU2451069C1 |
| Штамм микромицета Penicillium crustosum ИНА 01369 ВКПМ F-1843 - продуцент антибиотиков, обладающий антимикробной активностью к фитопатогенным грибам рода Fusarium | 2023 |
|
RU2820703C1 |
Изобретение относится к сельскому хозяйству. Способ получения супрессивного компоста по отношению к возбудителю фузариоза растений Fusarium oxysporum заключается в приготовлении компоста, полученного из сельскохозяйственных отходов, выделении из компоста штаммов микроорганизмов, приготовлении на основе выделенных штаммов биопрепарата, внесении биопрепарата в компост, оценке супрессивности компоста, причем проводят оценку супрессивных свойств штаммов по 4 механизмам супрессивности, оценку взаимной антагонистической активности штаммов, осуществляют двукратное внесение биопрепарата в компост, проводят оценку удобрительных свойств супрессивного компоста. Изобретение позволяет получить компосты, обладающие одновременно удобрительными свойствами и стабильными супрессивными свойствами по отношению к возбудителю фузариоза растений Fusarium oxysporum. 6 ил., 2 пр.
Способ получения супрессивного компоста по отношению к возбудителю фузариоза растений Fusarium oxysporum, заключающийся в приготовлении компоста, полученного из сельскохозяйственных отходов, выделении из компоста штаммов микроорганизмов, приготовлении на основе выделенных штаммов биопрепарата, внесении биопрепарата в компост, оценке супрессивности компоста, отличающийся тем, что проводят оценку супрессивных свойств штаммов по 4 механизмам супрессивности, оценку взаимной антагонистической активности штаммов, осуществляют двукратное внесение биопрепарата в компост, проводят оценку удобрительных свойств супрессивного компоста.
| US 4642131 A1, 10.02.1987 | |||
| ФОСФАТРАСТВОРЯЮЩИЙ ШТАММ ACINETOBACTER SPECIES С ФУНГИЦИДНЫМИ СВОЙСТВАМИ | 2010 |
|
RU2451068C1 |
| СПОСОБ ПЕРЕРАБОТКИ ОРГАНИЧЕСКИХ ОТХОДОВ | 2011 |
|
RU2467989C2 |
Авторы
Даты
2017-09-04—Публикация
2016-11-23—Подача