Изобретение относится к области медицины, а именно к онкологии, клинической иммунологии, и может быть преимущественно использовано для лечения онкологических заболеваний.
В настоящее время наибольшее распространение получила стратегия комплексного лечения злокачественных опухолей, направленная, с одной стороны на торможение роста опухолевых клеток с помощью цитостатиков, а с другой стороны на повышение противоопухолевой резистентности организма.
Известно, что противоопухолевые препараты по механизму действия и химическому строению разделяются на несколько групп: алкилирующие соединения, антиметаболиты, антибиотики, вещества растительного или животного происхождения, гормольные препараты, ферменты и другие.
В основе противоопухолевого действия этих соединений лежит нарушение (подавление) обмена нуклеиновых кислот, особенно ядерных нуклеотидов, что ведет к прекращению клеточного деления и роста опухоли (1, 2, 3). Но, поскольку известные противоопухолевые препараты способствуют только подавлению клеточной активности, не затрагивая причины, вызывающей опухоль, то рецидивы опухоли и метастазирование не исключаются.
Известен, например, способ лечения рака яичников, шейки матки и молочной железы путем введения диоксадата в дозе 10-15 мг 2-3 раза в неделю в течение 2-6 недель или однократно в дозе 60-80 мг путем эндолимфатической инфузии (4). Для достижения положительного эффекта необходимо провести 2-3 курса лечения. Недостатком способа является возникновение побочных осложнений, выражающихся в лейкопении, болях в сердце, нарушении аппетита, тошноте.
Известен способ специфической иммунотерапии больных раком молочной железы с помощью клеточных лизатов ауто- или гомологичных опухолевых тканей (5). Недостатком известного способа является его недостаточная эффективность из-за слабой антигенности опухолевых клеток, а также серьезный характер осложнений.
Особым направлением в терапии злокачественных опухолей является разработка способов лечения рака с использованием препаратов из животного сырья, преимущественно из эмбриональных органов животных и человека (6, 7). Препараты, получаемые из животных тканей, обладают существенным преимуществом по сравнению с известным цитостатиками химического происхождения, так как обладают слабым гепатотоксическим и тератогенным действием. Однако применение данных сдерживается из-за ограниченности сырьевой базы и из-за опасности развития аллергических осложнений в виду того, что последние обладают видимой антигенной специфичностью.
Наиболее близким к заявляемому способу является способ (прототип) лечения рака с помощью гомогената эмбриональной ткани (8). Известный способ заключается в следующем: при наружной локализации опухолевого процесса больному наносят в виде аппликаций гомогенат (суспензию) эмбриональной ткани в смеси с фармацевтически пригодным наполнителем, а в случае внутренней локализации опухоли парэнтерально вводят 10 мл 10%-ного водно-солевого гомогената эмбриональной ткани 1-2 раза в день в течение 4-12 недель. В качестве наполнителя используют изотонический раствор хлорида натрия. После месяца лечения частоту введения гомогената эмбриональной ткани постепенно уменьшают до 1-2 раза в неделю и продолжают лечение еще 2-3 мес. Способ особенно эффективен при наружной локализации опухоли, так как часто наблюдается отделение опухоли от соседних здоровых тканей, что благоприятствует успешному хирургическому удалению опухоли. Ближайший противоопухолевый эффект наблюдается через 2-3 недели после начала лечения. Средняя длительность ремиссии составляет 9 мес.
Недостатком известного способа является то, что использование ксеногенной эмбриональной ткани ограничено видовой антигенной специфичностью. Кроме того, предлагаемый для лечения гомогенат эмбриональной ткани представляет собой смесь неустановленного состава, содержащий фетальные белки, пептиды, нуклеиновые кислоты и другие компоненты. Поэтому предлагаемое средство нельзя стандартизовать по составу, так как он будет зависеть от исходной ткани и в процессе лечения могут возникнуть побочные осложнения из-за токсических реакций.
Технической задачей изобретения является ускорение ближайшего клинического противоопухолевого эффекта, удлинение сроков ремиссии, уменьшение побочных осложнений.
Поставленная задача достигается предлагаемым способом лечения злокачественных опухолей путем введения альфа-фетопротеина (АФП) в разовой дозе 500-5000 МЕ/кг веса больного 1-2 раза в сутки в течение 4-6 недель. За МЕ (международная единица) АФП принимают количество белка, равное 1,25 нг. Далее по тексту все будет приведены в МЕ.
АФП представляет собой онкофетальный белок, который получают из абортивного материала человека (природный альфа-фетопротеин) или из осповакцины на эмбриональных клетках легких человека (рекомбинантный альфа-фетопротеин) (9). В заявляемом способе может быть использован любой тип альфа-фетопротеина (природный или рекомбинантный). АФП не пирогенен, не кумулируется в организме, не обладает тератогенным, анафилактогенным, эмбриотоксическим, аллергизирующим и гистаминоподобным свойствами.
Теоретическим обоснованием механизма противоопухолевого действия АПФ является следующее: известно, что процессы трансформации здоровой клетки в опухолевую сопряжены с дерепрессией некоторых эмбриональных генов (10). Это приводит к появлению на клеточной поверхности и в сыворотке крови больного онкофетальных белков, в норме обнаруживаемых только в органах и тканях эмбрионов. К ним относится и АФП. Введение природного или рекомбинантного АФП позволяет снять специфическую иммунологическую толерантность к поверхностным белкам опухолевых клеток и активизировать механизмы противоопухолевой защиты.
Предлагаемый способ заключается в следующем: в зависимости от характера и тяжести заболевания АФП применяют местно или вводят парэнтерально в дозе 500-5000 МЕ/кг. Непосредственно перед применением АПФ, представляющий собой белый порошок или пористую массу, уплотненную в таблетку, растворяют в воде или в 0,9%-ном растворе хлористого натрия до определенной концентрации.
Местное применение наружные аппликации при раке кожи, губы, слизистой полости рта, при длительно не заживающих ранах и трофических язвах. Альфа-фетопротеином смачивают марлевую салфетку и накладывают на место расположения опухоли, затем фиксируют и покрывают сверху полиэтиленовой пленкой с целью предохранения от высыхания. Процедуру проводят один раз в сутки. Разовая доза АПФ составляет 500 5000 МЕ/кг веса больного в сутки. Курс лечения 4-6 недель.
Парэнтеральное применение АФП вводят подкожно, внутримышечно, внутривенно, струйно или капельно в дозе 500 5000 МЕ/кг 1-2 в сутки в течение 4-6 недель. Средняя длительность ремиссии у больных, пролеченных предлагаемым способом, составляет 26 мес. Специфических противопоказаний не отмечается.
Предлагаемым способом было пролечено 55 больных IV клинической группы с онкологическими заболеваниями, прогрессирующими после традиционных видов лечения (рак молочной железы, легких, желудка, поджелудочной железы, толстой кишки, слепой кишки, языка; базалиома носа, бластоцитома боковой кисты шеи, рак почки, мочевого пузыря, кожи). Полный или частичный клинический эффект получен у 34 больных из 55 61,8%). Сроки ремиссии от 2 мес до 4 лет. Ни в один из наблюдений не отмечено побочных эффектов, индивидуальной непереносимости, аллергических реакций. В большинстве случае для получения четкого клинического эффекта было достаточно одного курса лечения. При использовании предложенного способа возможно совместное применение АПФ с антибиотиками широкого спектра действия, иммуномодуляторами и другими лекарственными средствами. При этом АФП сохраняет свое свойство блокировать механизм "иммунологического усиления" (11) и не уменьшает активности антибиотиков и иммуномодуляторов.
Основным существенным отличием предлагаемого способа по сравнению с прототипом является использование в качестве противоопухолевого средства индивидуального препарата высокой степени чистоты онкофетального белка альфа-фетопротеина в экспериментально подобранном оптимальном режиме: разовая доза 500-5000 МЕ/кг местно или парэнтерально, 1-2 раза в сутки в течение 4-6 недель, что позволяет улучшить клинический эффект лечения, уменьшить побочные осложнения при лечении. Опытным путем при применении препарата в клинике было установлено, что использование АФП в разовой дозе меньше 500 МЕ на кг веса больного не оказывает достоверного противоопухолевого эффекта, а использование препарата в дозе, превышающей 5000 МЕ/кг, приводит к неоправданному увеличению расхода препарата без соответствующего усилия лечебного эффекта.
Противоопухолевый эффект АФП обуславливается тем, что последний стимулирует специфический противоопухолевый иммунитет у больных со злокачественными опухолями. Более того, в противоположность известным цитостатическим препаратам АФП не подавляет, а регулирует иммунологические реакции в организме и может быть использован для лечения заболеваний с аутоиммунными нарушениями.
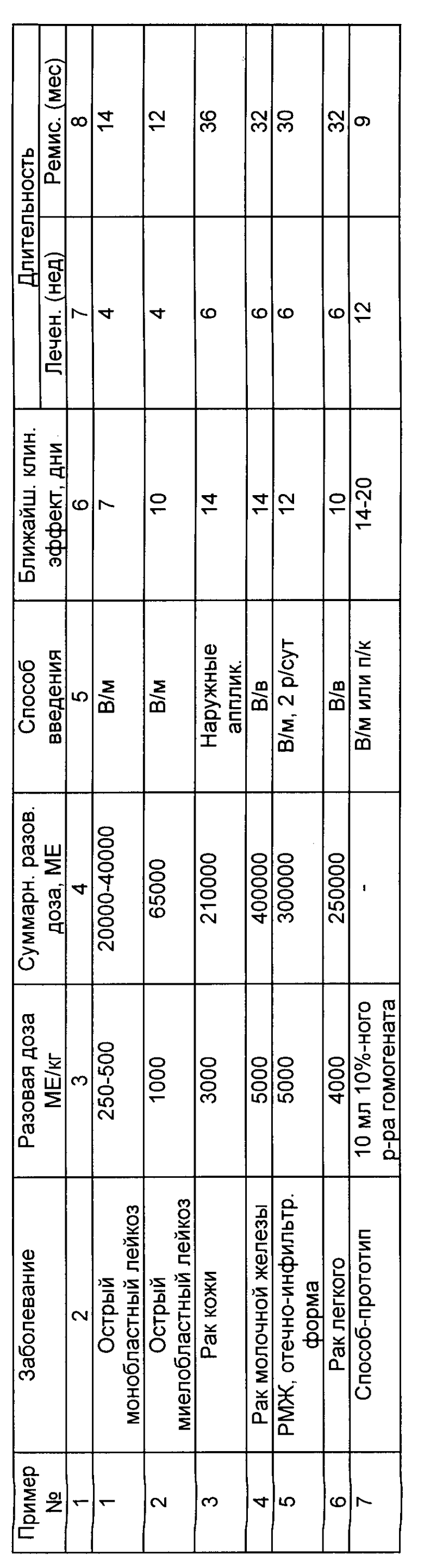
В таблице представлены сравнительные данные эффективности лечения злокачественных опухолей в сравнении с прототипом.
Из таблицы видно, что использование АФП позволяет ускорить ближайший клинический эффект на 4-10 дней, сократить длительность лечения и увеличить длительность ремиссии.
Известно использование АФП для изготовления различных иммунодиагностикумов, необходимых для распознавания ранних стадий рака, угрожающего выкидыша при беременности, а также внутриутробных патологий развития плода (12).
Известно также использование АФП для наработку транспортных антител, применяемых в составе противоопухолевых препаратов, представляющих собой конъюгаты антител к фетальным белкам с токсическими компонентами (например дифтерийным токсином), для адресной доставки токсина к опухоли (13, 14). Однако конъюгаты антител к онкофетальным белком с высокотоксичными соединениями при введении в организм человека могут расщепляться протеазами с развитием общетоксического резорбтивного действия.
В предлагаемом техническом решении АФП использован по новому функциональному назначению: в качестве противоопухолевого лекарственного средства для лечения больных со злокачественными опухолевыми, преимущественно эпителиального и мезенхимального происхождения.
В связи с тем, что в известных патентных и научно-технических источниках аналогичного способа лечения злокачественных опухолей с помощью АФП не обнаружено, можно сделать вывод о соответствии заявляемого технического решения критериям "новизна и изобретательский уровень".
Пример 1. Больная З. 33 года. История болезни 4178/571. Диагноз при поступлении: острый монобластный лейкоз. Развернутая стадия первого этапа. Алейкемический моноклональный вариант.
На первом этапе лечения больной был использован природный альфа-фетопротеин в дозе 250 МЕ/кг. С учетом веса больной суммарная разовая доза составила 20000 МЕ. Препарат вводили внутримышечно 1 раз в сутки в течение 7 дней. Однако, в связи с отсутствием признаков регрессии процесса, увеличили дозу до 500 МЕ/кг (суммарная разовая доза 40000 МЕ). Лечение продолжали еще 3 недели. Ближайший клинический эффект, подтвержденный результатами лабораторных и морфологических анализов, зафиксирован через 7 дней после начала лечения АФП в дозе 500 МЕ/кг. Симптомов интоксикации и аллергии не обнаружено. Вспомогательное лечение витаминотерапия, иммуномодуляторы.
До начала терапии величина поражения костного мозга бластными клетками составляла 75% По окончании лечения результаты лабораторных, клинических и морфологических исследований позволили однозначно утверждать о регрессии процесса. При исследовании пунктатов и трепанобиопсий костного мозга показано, что процент бластных клеток постоянно снижался. Через один месяц лечения зафиксирована нормализация морфологического состава миелограмм и трепанобиопсий. Отмечено восстановление всех показателей периферической крови до нормы. Выписана из клиники в удовлетворительном состоянии. Срок ремиссии 14 мес.
Пример 2. Больная Л. 54 г. История болезни 14533, 9516, 16344. Заболела в июле 1990 г. когда случайно была выявлена лейкопения в анализах крови. В связи с этим госпитализирована в гематологическое отделение Омской областной клинической больницы. В пунктате и трепанате выявлены изменения, характерные для острого миеломонобластного лейкоза, подтвержденного цитохимическими исследованиями. Проведено лечение по схеме "7+3" 3 курса с явлениями миелодепрессии и последующей ремиссией. В ноябре-декабре 1991 г. находилась на лечении в г. Санкт-Петербурге в НИИ Онкологии им. Петрова, где во время проведения очередного курса полихимиотерапии по агрессивной схеме произошла токсическая остановка сердца, клиническая смерть. Реанимация, постреанимационная болезнь. В июне 1991 г. проведено лечение малыми дозами цитозара, проводилась профилактика нейтролейкемии метотрексатом.
В октябре 1991 г. при исследовании костного мозга обнаружено появление миелобластов в виде скоплений (гнезд), а местами и диффузно. Хотя показатели миелограмм были в пределах нормы, больной предложена химиотерапия, но ввиду обширной серьезной сопутствующей патологии, консилиумом врачей и на основании просьб больном и родственников назначен курс лечения альфа-фетопротеином природным человеческим в дозе 1000 МЕ/кг, который вводили в/м, ежедневно, один раз в сутки, в суммарной дозе 65000 МЕ (вес большой 65 кг) в течение одного месяца. Курс фетальной терапии протекал без симптомов интоксикации, аллергических реакций не было. Ближайший клинический эффект был зафиксирован через 10 дней после начала лечения.
Через один месяц лечения при исследовании костного мозга на месте "расцветающих" очагов бластных клеток выявлен очаговый миелофиброз с отсутствием бластных форм клеток.
Больная в удовлетворительном состоянии выписана из клиники под наблюдение гематолога.
Устойчивая ремиссия в течение 12 мес.
Пример 3. Больная Ч. 1937 г. рождения. История болезни 3517. Диагноз: плоскоклеточный ороговевающий рак кожи правой височной области (гистологическое исследование от 13.10.89).
Жалобы: на наличие опухоли в височной области справа. Болен с мая 1989 г.
Локальный статус: на кожи правой височной области определяется выступающая над кожной поверхностью опухоль размерами 5•6 см, мокнущая, синюшного цвета. При пальпации болезненна, с костью не соединена. Начато лечение аппликациями рекомбинантного в дозе 3000 МЕ/кг, с учетом веса больного (70 кг) суммарная разовая доза составила 200000 МЕ. Аппликации выполняли один раз в сутки. Через 14 дней после начала лечения отмечена выраженная реверсия опухолевого очага путем его лизиса. По данным гистологического исследования динамика выражалась в дистрофических изменениях опухолевых клеток, их гибель и резком уменьшении их количества, с замещением соединительной тканью.
Через 4 недели размеры опухоли составляли 2•2,5 см, лечение продолжено. В ходе лечения постепенно исчезал болевой синдром, со стороны органов и систем изменений не обнаружено.
Через 6 недель опухолевый очаг практически единичные скопления опухолевых клеток в состоянии дистрофии, замурованные в фиброзную ткань на фоне обычного эпидермиса. Последующие гистологические исследования не позволили выявить наличия опухолевых клеток. Устойчивая ремиссия в течение 3 лет.
Пример 4. Больная Ю. 52 года, поступила в отделение общей онкологии НКЦ "Биотерапия" 22.02.93 (и/б N 56) с диагнозом: рак молочной железы справа, Т3, N1 М1.
Жалобы на наличие болезненного опухолевого образования в верхнем квадранте правой молочной железы размером 6•8 см, повышенной плотности. В подмышечной области справа определяется увеличенный, плотный лимфоузел.
Гистологически установлен диагноз: карцинома молочной железы, протоковый вариант железисто-солидного рака.
Больная категорически отказалась от оперативного лечения, лучевой и химиотерапии.
При рентгенологическом (маммография) и ультразвуковом обследовании в правом молочной железе в верхнем квадранте определяются диффузные изменения в строме, кожа утолщена. На границе центрального и наружного квадрантов - узловое образование с неровными краями, плотное, размером 3,7•2,2 см. Справа в аксилярной области определяется плотной лимфоузел диаметром 1,5 см.
На обзорной теплограмме молочных желез в верхних квадрантах правой молочной железы имеется несколько очагов выраженного излучения неправильной формы с тенденцией к слиянию, очаг излучения в правой подмышечной области на 3 градуса интенсивнее симметричного участка слева, теплоасимметрия субмаммарных складок за счет усиления излучения справа.
Заключение: имеется несколько "горячих" узлов в верхних квадрантах правой молочной железы с поражением подмышечных лимфоузлов справа.
По настоятельной просьбе больной ей начато лечение альфа-фетопротеином природным человеческим, в дозе 5000 МЕ/кг (суммарная разовая доза с учетом веса больной составила 400000 МЕ), который разводили в 200,0 мл физ. р-ра, вводили 1 раз в сутки в/в на протяжении 2 мес.
После первых введений больная отмечала усиление болевых ощущений в областях опухолевых очагов. Через 1,5-2 ч после каждого введения вслед за усилением болей отмечалась умеренная гипертермия тела (до 37,9o).
Ближайший клинический эффект отмечен через 14 дней, заключающийся в размягчении основного опухолевого узла в правой молочной желез, исчезновение с-ма "лимонной корочки", наблюдаемого ранее, уменьшение подмышечного лимфоузла справа.
На контрольной теплограмме молочных желез очаг излучения в верхне-внутреннем квадранте исчез, в верхне-наружном квадранте очаг излучения стал менее интенсивным (температурный градиент с симметричным участком равен 1o). Термоасимметрия субмаммарных складок исчезла. Исчез очаг излучения в правой подмышечной впадине.
Заключение: в входе лечения термографически отмечается значительная положительная динамика. Сохранился только один "горячий" очаг в верхне-наружнем квадранте правой молочной железы, интенсивность его свечения стала меньше, нет заинтересованности правого подмышечного лимфоузла.
По данным рентгенологического и ультразвукового исследований получены следующие результаты: в наружных отделах правой молочной железы определяется участок фиброза неправильной (звездчатой) формы 2,4•2,3 см с нечеткими контурами неоднородной структуры. Периферические лимфоузлы не определяются.
По данным маммографии отмечается положительная динамика, проявляющаяся в уменьшении толщины кожи в ареолярной области и наружных отделах правой молочной железы.
Через 6 недель терапии по данным клинического и специального обследования опухолевые очаги не выявлены.
На контрольной термографии очагов усиления излучения в проекции правой молочной железы не выявлено. Субмаммарные складки симметричные. Тип рисунка васкулярный. Имеются признаки лимфангита в правой подмышечной области.
Карциноэмбриональный антиген 1,29 нг/мл (норма). СА 19-9 13,71 Е/мл (норма). После лечения из места бывшего опухолевого очага и лимфоузла трижды взята пункционная биопсия.
Заключение: в поле зрения клеточный некротический детрит, клетки с пикнотическими гиперхромными ядрами и коллабированной цитоплазмой, некротические клетки.
Больная выписана по месту жительства. Срок ремиссии 32 мес.
Пример 5. Больная Х. 55 лет, поступила в отделение общей онкологии НКЦ "Биотерапия" 19.04.93 (и/б N 67) с диагнозом: рак правой молочной железы Т2 N 0 M0, состояние после комбинированного лечения. Рецидив опухоли.
Жалобы на наличие опухолевого узла в области п/о рубца.
Диагноз установлен осенью 1992 г. В январе 1993 г. прошла курс предоперационной лучевой терапии и химиотерапии. В марте 1993 г. оперирована. Произведена расширенная секторальная резекция правой молочной железы.
При поступлении в НКЦ "Биотерапия": правая молочная железа меньше левой. По средней линии груди, с переходом на правую молочную железу определяется поперечный послеоперационный рубец в хорошем состоянии. В правой молочной железе по ходу рубца пальпируется плотное опухолевое образование размером 3•4 см.
Произведена пункционная биопсия опухолевого образования. Гистология - инфильтрирующая карционома молочной железы.
На обзорной теплограмме молочных желез в прямой и полубоковой проекциях имеется ограниченный очаг усиления излучения в верхне-наружном квадранте правой молочной железы с участком гипотермии в центре, очаг неправильной формы с тенденцией к слиянию в верхне- и нижневнутренних квадрантах правой молочной железы. Термоасимметрия подмышечных впадин и субмаммарных складок за счет гипертермии справа.
Заключение: имеются "горячие" очаги в верхне- и нижне-внутренних квадрантах и в верхне-наружном квадранте правой молочной железы. В процесс вовлечены подмышечные л/у справа.
По настоятельной просьбе больной ей начато лечение альфа-фетопротеином рекомбинантным человеческим в дозе 5000 МЕ/кг (с учетом веса больной суммарная разовая доза составила 300000 МЕ), который разводили в 5,0 мл физ. р-ра и вводили 2 раза в сутки внутримышечно в течение 6 недель.
Лечение сопровождалось умеренными болевыми ощущениями в местах локализации опухоли (правая молочная железа, подмышечные л/у справа). Отмечалась умеренная гипертермия тела до 37,4o.
Через 12 дней от начала отмечена положительная динамика, заключавшаяся в уменьшении основного опухолевого очага в правой молочной железе и исчезновении подмышечных л/у справа.
На контрольной обзорной теплограмме молочных желез в прямой и полубоковой проекциях имеется умеренная термоасимметрия субмаммарных складок.
В верхне- и нижневнутреннием квадрантах правой молочной железы имеется очаг усиления излучения неправильной формы. Температурный градиент с левой молочной железой 2o. Подмышечные л/у не определяются.
Заключение: термографически имеется положительная динамика. Уменьшалась площадь и интенсивность излучения в области правой молочной железы, исчезло усиление излучения в проекции подмышечных и подключенных л/у справа, исчез очаг некроза в правой молочной железе.
Через 6 недель терапии признаков наличия опухолевого роста у пациентки не выявлено. Контрольная теплограмма в норме. Неоднократные пункционные биопсии из мест локализации опухолевых очагов позволили установить следующую картину: в мазках клетки зрелого многослойного плоского эпителия, клетки эпителия протоков молочной железы без атипичных признаков, жировая ткань. Опухолевых клеток нет.
Больная выписана по месту жительства. Срок ремиссии 30 мес.
Пример 6. Больная А. 56 лет, поступила в отделение общей онкологии НКЦ "Биотерапия" 01.02.93 (и/б N 36) с диагнозом: рак левого легкого T3 N2 M1, состояние после радикальной пульмонэктомии слева, метастаз в 5 ребро слева, с-м Ляриша.
Жалобы на наличие опухолевого образования в области 5 ребра слева по ходу операционного ребра. Жалобы на одышку, слабость, быструю утомляемость, боли в мышцах ног при ходьбе (через 100-150 м), при незначительной физической нагрузке отмечает головокружение и головные боли.
При осмотре больного слева в области 5 ребра определяется болезненное образование хрящевой плотности размером 12х8 см, спаянное с ребром.
Пункционная биопсия злокачественная дермоидная карцинома. Начато лечение альфа-фетопротеином природным человеческим в дозе 4000 МЕ/кг (с учетом веса больного суммарная разовая доза составила 260000 МЕ). Препарат разводили в 100 мл физ. р-ра и вводили 1 раз в сутки в/в в течение 6 недель.
Лечение сопровождалось болевыми ощущениями в месте локализации локализация метастатического очага (5 ребро слева). Через 1-1,5 после введения эмбрионального препарата возникала гипертермия тела до 39,1o, были выражены явления интоксикации вследствие гибели опухолевых клеток.
Ближайший клинический эффект зарегистрирован через 10 дней от начала лечения. Через 4 недели лечения опухолевый очаг уменьшился в размерах в 4 раза, стал мягкий, подвижный. Через 6 недель терапии опухолевый очаг определялся, исчезли болевые ощущения, явления интоксикации и гипертермические реакции, несмотря на продолжение лечения.
Из места локализации опухоли взята операционная биопсия. Опухолевых клеток не выявлено. В ходе лечения у больного исчезли явления с-ма Ляриша. Больной без признаков опухолевого роста выписан домой. Срок ремиссии 32 мес.
Использование предлагаемого способа по сравнению с прототипом позволяет:
сократить срок появления ближайшего клинического эффекта;
уменьшить побочные осложнения за счет введения индивидуального высокоочищенного онкофетального белка специфического действия;
продлить средний срок ремиссии с 9 до 26 мес;
расширить ассортимент противоопухлевых средств животного происхождения, не обладающих токсичностью и стимулирующих специфических противоопухолевый иммунитет больных.
Альфа-фетопротеин легко переносится больными, не угнетает органов кроветворения, у больных улучшается аппетит, что положительно сказывается на состоянии больных с запущенными формами заболевания.
Источники информации:
1. Патент США N 4622325, кл. A 61 K 31/505, опубл. 11.11.86.
2. Авторское свидетельство ССР N 1208619, кл. A 61 K 31/28.
3. Патент России N 2040255, кл. A 61 K 31/15.
4. Авторское свидетельство СССР N 1264423, кл. A 61 K 31/00.
5. Иммунологические аспекты экспериментальной терапии и профилактики рака. /Под ред. Н.В. Васильева. Томск, 1980, 54 с.
6. Заявка ГДР N 228739, кл. A 61 K 45/00, 29.04.83.
7. Заявка ФРГ N 2600442, кл. A 61 K 35/12, 08.01.76.
8. Заявка Франции N 2451193, кл. A 61 K 35/54, 13.03.79.
9. Авторское свидетельство СССР N 583536, кл. A 61 K 37/02, опубл. 05.10.79.
10. Абелев Г.И. "25 лет излучения альфа-фетопротеина" / Онтогенез. 1989, т. 20, N 6, с. 607-615.
11. Ройт А. Основы иммунологии. М. Мир, 1991, 328 с.
12. Патент США N 4966753, кл. A 61 K 39/00, 45/05 опубл. 30.10.90.
13. Cawley D.B. Simpson D.L. Herschman H.R. "Asialoglycoprotein receptor mediates the toxic effectsof an asialofetnin diphteria toxin fragment A conjugate of cultured rat hepatocytes /Prog. Nat I Acad. Sci USA, 1981, v. 78, N 6, p. 3383-3387/.
14. Hirai H. Jaga H. Kaneda H. et al "Alpha-fetoprotcin: its diagrostic specificity and therapeutic use of its antibody" (Human tumor Markers: Biol. Clin. Appl. Proc. 3 rd Jnt. Conf. Jacco. Ameno d' Jschia Napls, Apr. 23-26, 1986, Berlin, New-Iork, 1987, p. 181-201.
Использование: медицина, в частности онкология. Техническая задача: ускорение ближайшего клинического противоопухолевого эффекта и уменьшения побочных осложнений. Сущность изобретения: в зависимости от локализации опухолевого процесса больному наносят в виде аппликаций наружно или вводят парантерально альфа-фетопротеин в разовой дозе 500 - 5000 МЕ/кг один-два раза в сутки в течение 4 - 6 недель. Перед применением препарат разводят в 5 - 200 мл физиологического раствора. Положительный эффект: получение противоопухолевого действия уже через 7 - 10 дней от начала лечения, исключение побочных осложнений. 1 табл.
Способ лечения злокачественных опухолей путем введения лекарственных средств, отличающийся тем, что в качестве лекарственного средства используют альфа-фетопротеин в дозах 500 5000 МЕ/кг один два раза в сутки в течение 4 6 недель.
| FR, заявка N 2451193, кл | |||
| Устройство для сортировки каменного угля | 1921 |
|
SU61A1 |
Авторы
Даты
1998-02-27—Публикация
1995-12-01—Подача