Изобретение относится к новым 19-нор-стероидам, имеющим в 11-бета-положении тиокарбоновую связь, к способу их получения и к промежуточным продуктам синтеза и к фармацевтической композиции, содержащей их.
Объектом изобретения являются соединения формулы (I):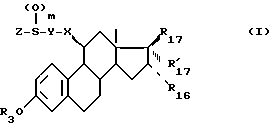
в которой R17 и R'17 являются такими, что и R17 и R'17 образуют вместе кетонную функцию, оксимную функцию, гидрозоновую группу или метиленовый радикал;
или R17 является гидроксилом, оксиметилом или ацилоксирадикалом, имеющим не более 12 атомов углерода, а R'17 является атомом водорода, алкилом, алкенилом или алкинилом, имеющим не более 8 атомов углерода, каждый из этих заместителей может быть в некоторых случаях замещенным;
R3 является атомом водорода, линейным или разветвленным алкилом или циклическим алкилом, имеющим не более 8 атомов углерода, или ацилом, имеющим не более 12 атомов углерода;
R16 является атомом водорода, атомом галоида или алкилом, имеющим не более 8 атомов углерода;
m = 0, 1 или 2;
X, Y и Z являются такими, что
X является метиленовым радикалом ариленовой или ариленоксигруппы, имеющей не более 10 атомов углерода, связанный со стероидом атомом углерода;
Y является линейной или разветвленной алифатической цепью, насыщенной или ненасыщенной, содержащей 1 - 18 атомом углерода, в некоторых случаях прерываемой атомом кислорода,
Z является линейным или разветвленным алкилом, содержащим 1 - 8 атомов углерода, и необязательно замещенным, или
арильным или арилалкильным радикалом, каждый из этих радикалов необязательно замещен, причем алкильный радикал содержит не более 6 атомов углерода, а арильный радикал является моноциклическим радикалом, содержащим 5 или 6 членов, или радикалом, состоящим из конденсированных циклов, содержащим 8 - 10 членов, эти радикалы необязательно содержат 1 или несколько гетероатомов, выбранных среди атомов кислорода, азота или серы,
алкильными радикалами, которые могут являться R'17 и Z, алкенильными или алкинильными радикалами, которые могут являться R'17, и арильные или арилалкильные радикалы, которые могут являться Z, в некоторых случаях замещены одним или несколькими радикалами, выбранными среди радикалов:
галоидов,
амино, алкиламино или диалкиламино, в которых один или более алкильных радикалов имеют 1 - 4 атома углерода,
гидроксила, свободных, этерифицированных или солевых карбоксилов,
алкила, имеющего 1 - 8 атомов углерода, необязательно замещенного одним или несколькими атомами галоида,
оксо, циано, нитро, формила,
ацила или ацилокси, имеющего не более 2 атомов углерода,
алкокси или алкилтио, имеющего 1 - 4 атома углерода, карбамоила,
алкенила или алкинила, имеющего не более 4 атомов углерода,
арила, такого, как определено выше,
и их соли присоединения.
Для ацилоксирадикала речь может идти, например, о производном алифатической или циклоалифатической, насыщенной или ненасыщенной кислоты, а именно алкановой кислоты, такой как, например, уксусная, пропионовая, масляная или изомасляная, валериановая или ундeциловая кислоты, оксиалкановой кислоты, такой как, например, оксиуксусная кислота, циклоалкилкарбоновой или циклоалкилалкановой кислот, таких как, например, циклопропил-, циклопентил- или циклогексилкарбоновая циклопентил- или циклогексилуксусная или пропионовая кислоты, бензойной кислоты, салициловой кислоты или фенилалкановой кислоты, такой как фенилуксусная или фенилпропионовая кислота, аминокислоты, такой как диэтиламиноуксусная кислота или аспаргиновая кислота, муравьиной кислоты или дикислоты, в некоторых случаях в виде соли, такой как, например, бутандиовая кислота или ее мононатриевая соль. Предпочтительно речь идет о производном уксусной, пропионовой или масляной кислоты.
Под ацильным радикалом понимают радикалы, соответствующие приведенным ранее ацилоксирадикалам.
Для алкильных радикалов речь идет о метиле, этиле, пропиле, изопропиле, бутиле, изобутиле, н-пентиле, н-гексиле, 2-метилпентиле, 2,3-диметилбутиле, н-гептиле, 2-метилгексиле, 2-диметилпентиле, 3,3-диметилпентиле, 3-этилпентиле, н-октиле, 2,2-диметилгексиле, 3.3-диметилгексиле, 3-метил-3-этилпентиле.
Предпочтительно речь идет о метиле.
Когда R3 является циклическим алкилом, речь идет о циклопропиле циклобутиле, циклопентиле или циклогексиле. Предпочтительным радикалом является циклопентил.
Для алкоксирадикала речь идет, например, о метокси, этокси, пропокси, бутилоксирадикалах, а для алкилтиорадикалов речь идет о метилтио, этилтио, пропилтио или бутилтиорадикалах.
Алкиленовым радикалом может быть винил, пропенил, изопропенил, аллил, 2-метилаллил, бутенил или изобутенил. Предпочтительными радикалами являются винил или пропенил.
Алкиниловым радикалом может быть этинил, пропинил, пропаргил, бутинил или изобутинил.
Когда R16 является атомом галоида, речь идет об атоме брома, хлора, фтора или йода, предпочтительным является атом брома.
Когда X является ариленом, предпочтительным радикалом является фенилен.
Когда Y является линейной или разветвленной, насыщенной или ненасыщенной алифатической цепью, речь идет о метиленовом, этиленовом, пропиленовом, изопропиленовом, бутиленовом, изобутиленовом или третбутиленовом, н-пентиленовом, н-гексиленовом, 2-метилпентиленовом, 2,3-диметилбутиленовом, н-гептиленовом, 2-метилгексиленовом, 2,2-диметилпентиленовом, 3,3-диметилпентиленовом 3-этилпентиленовом, н-октиленовом, 2,2-диметилгексиленовом, 3,3-диметилгексиленовом, 3-метил-3-этилпентиленовом, нониленовом, 2,4-диметилгептиленовом, н-дециленовом, н-ундециленовом, н-додециленовом, н-тридециленовом, н-тетрадециленовом, н-пентадециленовом, н-гексадециленовом, н-гептадециленовом или н-октадециленовом радикалах, предпочтительными являются н-пентилен, н-гексилен, н-гептилен, н-октилен или н-нонилен.
Речь также может идти о виниленовом, изопропениленовом, аллиленовом, 2-метилаллиленовом, изобутелиленовом, бутениленовом, пентениленовом, гексениленовом, гептениленовом или октениленовом радикалах, предпочтительно о гексениленовом радикале.
Он также может быть этиленом, пропиниленом, пропаргениленом, бутиниленом, изобутиниленом, пентиниленом, гексиниленом, гептиниленом или октиниленом, предпочтительно пропиленом, гексиниленом или октиниленом.
Он также может быть цепью, прерванной атомом кислорода, например оксаполиметиленом, предпочтительно оксидиэтиленовым радикалом.
Когда Z является линейным или разветвленным алкилом, он может быть любым из указанных радикалов, предпочтительно, пропилом, бутилом, н-пентилом.
Когда Z является арилалкилом, алкильный радикал может быть одним из определенных радикалов, например метилом, этилом, пропилом, изопропилом, бутилом, изобутилом, н-пентилом или н-гексилом, предпочтительно метилом или этилом.
Арильная группа, которая может входить в арилалкильную группировку, представляет собой:
моноциклический карбоциклический радикал, например фенил,
моноциклический гетероциклический радикал, например тиенил, фурил, пиранил, пирролил, имидазолил, пиразолил, пиридинил, пиразинил, пиримидинил, пиридазинил, тиазолил, оксазолил, фуразаннил, пирролидинил, имидазолидинил, пиразолинил, тиазолинил, триазолил, тетразолил, а также изомеры положений или гетероатомов, которые эти радикалы могут иметь,
радикал, состоящий из конденсированных карбоциклических циклов, например, нафтил или фенантренил,
радикал, состоящий из конденсированных гетероциклических циклов, например бензофуранил, бензотиенил, бензимидазолил, бензтиазолил, нафто[2, 3-в] тиенил, тиантренил, изобензофуранил, хлороменил, ксантенил, феноксатинил, индолизинил, изоиндолил, 3H-индолил, индолил, индазолил, пуринил, хинолизинил, изохинолил, хинолил, фтализинил, циннолинил, пиридинил, карбазолил, бета-карболинил, акридинил, феназинил, фенотиазинил, феноксазинил, индолинил, изоиндолинил, имидазопиридил, имидазопиримидинил или еще полициклические конденсированные системы, состоящие из моноциклических гетероциклов, таких как определены выше, например, фуро[2,3-в]пиррол или тиено-[2,3-в]-фуран.
Когда Z является арилом или арилалкилом, а качестве примера можно привести такие арильные радикалы, как фенил, фурил, такой как 2-фурил, имидазолил, такой как 2-фурил, имидазолил, такой как 2-имидазолил, пиридил, такой как 2-пиридил, 3-пиридил или 4-пиридил, пиримидинил, такой как пиримид-2-ил, тиазолил, такой как тиазол-2-ил, тиазолинил, такой как тиазолин-2-ил, бензимидазолил, такой как бензимидазол-2-ил, бензотиазолил, такой как бензотиазол-2-ил, цуринил, такой как цурин-7-ил, или хинолил, такой как 4-хинолил, а качестве примера арилалкильного радикала можно привести в частности метильный или этильный радикалы, замещенные одним из приведенных арильных радикалов.
Выражение необязательной, примененное к алкильному радикалу, который может представлять собой R'17 и Z, алкенильному или алкинильному радикалам, которые могут представлять собой R'17, и арильному или арилалкильному радикалам, которые могут представлять собой Z, указывает, что они необязательно могут быть замещены одним или несколькими радикалами, одинаковыми или различными, выбранными среди радикалов, указанных ранее, а именно:
галоида: фтора, хлора, брома, иода,
амино, алкиламино, такого как метиламино или этиламино, диалкиламино, такого как диметиламино, диэтиламино, метилэтиламино,
гидроксила,
карбоксила, свободного или этерифицированного, такого как алкоксикарбонил, например, метоксикарбонил или этоксикарбонил, или в виде соли, например, натриевой или калиевой,
алкила, имеющего 1 - 8 атомов углерода, такого как метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, необязательно замещенного одним или несколькими атомами галоида, например фтора, такого как трифторметил,
оксо, циано, нитро, формила,
ацила, такого как ацетил, пропионил, бутирил, бензоил,
ацилокси, такого как ацетокси, радикал формулы -O-CO-(CH2)n-COOH, в которой n = 1 - 5,
алкокси, такого как метокси, этокси, пропилокси, изопропилокси, бутилокси,
алкилтио, такого как метилтио, этилтио, пропилтио, изопропилтио, бутилтио,
карбамоила,
алкенила, такого как винил, пропенил,
алкинила, такого как этинил, пропинил,
арила, такого как фенил, фурил, тиенил.
В качестве примера таких замещенных радикалов можно привести, например, алкильный радикал, замещенный одним или несколькими атомами галоида, например фтора, такой как трифторэтил, трифторбутил, пентафторпропил, пентафторбутил, пентафторпентил, гептафторбутил или нонафторбутил, алкильный радикал, замещенный арилом, например фенилом, который сам замещен одним или несколькими атомами галоида и/или алкильными радикалами, замещенными одним или несколькими атомами галоида, такой как пентафторбензил, пентафторфенилэтил, пентафторфенилпропил, 4-трифторметил-2,3,5,6-тетрафторбензил.
Можно также упомянуть, например, арильный радикал, замещенный одним или несколькими атомами галоида, например хлора, такой как 2, 3, 4, 5, 6-тетрахлор-4-пиридил, аминной группировкой, такой как 4,6-диамино-2-пиримидинил, гидроксилом, таким как 2, 6-диокси-4-пиримидинил, этерифицированным карбоксилом, например метоксикарбонилом, таким как 2-метоксикарбонилфенил, алкилом, например метилом, таким как N-метилимидазолил, N-метилтриазолил или N-метилтетразолил, необязательно замещенный галоидом, например фтором, такой как 7-/трифторметил/-4-хинолил, оксогруппой и алкильным радикалом, например метилом, такой как 2,3-диметил-2,6-диоксопурин-7-ил.
Изобретение охватывает соли соединений формулы (I), например, когда соединения формулы (I) имеют аминную функцию, соли образованные с соляной, бромистоводородной, азотной, серной, фосфорной, уксусной, муравьиной, пропионовой, бензойной, малеиновой, фумаровой, янтарной, винной, лимонной, щавелевой, глиоксалевой, аспарагиновой кислотами, алкансульфоновыми кислотами, такими как метан или этансульфоновыми кислотами, аренсульфоновыми кислотами, такими как бензол- или пара-толуолсульфоновыми кислотами, и арилкарбоновыми кислотами, или когда соединения формулы (I) несут кислотную функцию, соли щелочных или щелочно-земельных металлов или аммония, в некоторых случаях замещенного.
Среди предпочтительных соединений формулы (I) изобретения можно привести, например, соединения, у которых R3 и R16 являются атомами водорода.
Среди предпочтительных соединений формулы (I) изобретения конкретно можно привести соединения, у которых m = 1, и соединения, у которых m = 2.
Среди соединений изобретения можно упомянуть, например, соединения формулы (I), у которых R17 является гидроксилом, а R17' является атомом водорода или метилом.
Среди соединений изобретения можно в частности упомянуть соединения формулы (I), у которых X является метиленовым радикалом и Y является линейной насыщенной цепью, содержащей 7 - 9 атомов углерода, соединения, у которых X является фениленовым радикалом и Y является линейной насыщенной или ненасыщенной цепью, содержащей 3 - 8 атомов углерода, при условии, что, когда цепь является ненасыщенной, она включает виниленовую или этиниленовую группировку, непосредственно связанную с фениленовым радикалом, и соединения, у которых X является фениленокси-радикалом и Y является линейной насыщенной цепью, содержащей 4 - 7 атомов углерода, необязательно прерываемой атомом кислорода. Когда X является фениленокси-радикалом, Y предпочтительно содержит 5 или 6 атомов углерода.
Среди соединений изобретения специально можно привести соединения формулы (I), у которых Z является линейным алкилом, содержащим 1 - 5 атомов углерода, трифторалкилом, содержащим 2 - 4 атома углерода, пентафторалкилом, содержащим 4 или 5 атомов углерода, нонафторалкилом, содержащим 1 - 4 атома углерода,
радикал, содержащий замещенный фенильный радикал, выбран среди: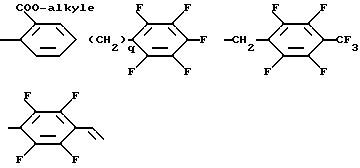
в которых алкил является алкильным радикалом, содержащим 1 - 4 атома углерода, и q равно 1, 2 или 3,
радикал, содержащий гетероцикл из 5 членов, выбран среди: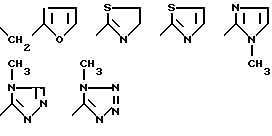
радикал, содержащий 6-членый гетероцикл, выбран среди: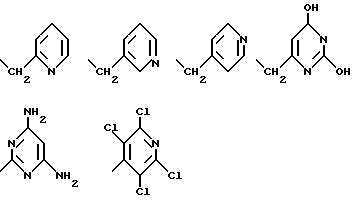
радикал, содержащий гетероцикл с двумя конденсированными циклами, выбран среди: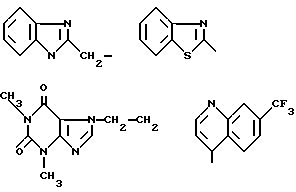 .
.
Среди предпочтительных значений Z можно привести более конкретно пентил и пентафторалкил, а именно пентафторпропил, пентафторбутил или пентафторпентил.
Среди предпочтительных соединений изобретения, следовательно, можно привести соединения, получение которых приведено ниже в экспериментальной части, и более конкретно:
11-бета-[8-[/2-пиридинилметил/тио] октил] -эстра-1,3,5/10/- триен-3,17-бета-диол,
11-бета-[4-[3-[/1метил-1H-имидазол-2-ил/тио] -1-пропинил] фенил] -экстра-1,3,5/10/-триен-3,17-бета-диол,
11-бета-[4-[5-[/2-фуранилметил/тио]пентилокси]фенил]- экстра-1,3,5/10/-триен-3,17-бета-диол,
11-бета-[4-[5-[/2-пиридинилметил/сульфинил] пентилокси] фенил] -экстра-1,3,5/10/-триен-3,17-бета-диол,
11-бета-[4-[5-[/3-пиридинилметил/сульфинил] пентилокси] фенил] -экстра-1,3,5/10/-триен-3,17-бета-диол,
11-бета-[4-[6-[4,4,5,5,5-пентафторпентил/сульфинил] гексилокси] фенил] экстра-1,3,5/10/-триен-3,17-бета-диол,
11-бета-[4-[5-[4,4,5,5,5-пентафторпентил/сульфинил] пентилокси] фенил] экстра-1,3,5/10/-триен-3,17-бета-диол,
11-бета-[4-[5-/пентилсульфонил/пентилокси] фенил] -экстра-1,3,5/10/ -триен-3,17-бета-диол,
11-бета-[4-[/4,4,5,5,5-пентафторпентил/сульфонил] пентилокси] фенил]-17-альфа-метил-экстра-1,3,5/10/-триен-3,17-бета-диол.
Объектом изобретения также является способ получения соединений формулы (I), характеризующийся тем, что соединение формулы (II)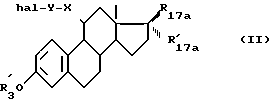 ,
,
в которой R17a и R'17a имеют значения, указанные для R17 и R'17 и в которых необязательные реактивные функции необязательно защищены,
X и Y имеют указанные значения,
R'3 - является атомом водорода или группой, защищающей гидроксильную функцию,
hal является атомом галоида или такой псевдогалоидной группировкой, как тозилат,
подвергают воздействию меркаптана формулы (III):
Za - SH
или его солью, в которой Za имеет значения, указанные для Z, в котором возможные реактивные функции могут быть защищены, затем в некоторых случаях подвергают действию агента, удаляющего защищающие группировки, чтобы получить соединение формулы (IA), соответствующее продукту формулы (I), в которой m = 0, и продукт формулы (IA) при желании подвергают любой из следующих реакций в любом порядке:
восстановлению кетонной функции, которая может быть представлена совокупностью R17 и R'17,
присоединению к кетонной функции, которая может быть представлена R17 и R'17, металлического комплекса формулы (IV)
M - R'17a
в которой M является атомом металла и R'17a имеет указанные значения, при условии, что он не является атомом водорода,
превращению кетонной функции, которая может быть представлена совокупностью R17 и R'17, в оксимную функцию, в гидразоновую группировку или в метиленовую функцию,
селективному ацилированию в положении 17, если R17 является гидроксилом,
галоидированию или алкилированию в положение 16,
алкилированию или ацилированию гидроксильного радикала в положении 3,
частичному или полному восстановлению этиниленовой группировки, если Y является ненасыщенной цепью,
окислению серы в сульфоксид или в сульфон,
необязательному образованию соли с кислотой или основанием.
Соединения формулы (IA), соответствующие соединениям формулы (I), в которой m = 0, получают при взаимодействии соединения формулы (II), в которой hal является, например, атомом хлора, атомом брома или тозилатом, OR3 является гидроксилом, необязательно защищенным, например, ацетилом, трет-бутилом или тетрагидропиранилом, и R17a, R'17a имеют реакционные функции, необязательно защищенные известными способами, с соединением формулы (III), предпочтительно в виде соли, полученной при присоединении, например, карбоната натрия, гидроксида натрия или метилата или этилата натрия, реакцию проводят в нейтральном растворителе, например метаноле, диметилформамиде, гексаметилфосфоротриамиде (ГМФТ) или ацетонитриле (CH3CN), одним или в виде смеси, работая, например, при примерно 50oC или при кипячении с обратным холодильником, если необходимо в присутствии такого реагента, как иодид натрия, потом в некоторых случаях полученное соединение подвергают действию агента, снимающего защиту с реактивных функций.
В зависимости от значений защитной группировки R'3 продукты формулы (IA) могут являться продуктами формулы (I).
Защитные группировки, которые могут быть использованы для защиты реактивных функций, таких как, например, аминогруппа или гидроксил, выбирают среди обычных в органической химии группировок, а более конкретно, обычно применяемых в химии пептидов. Список неисчерпывающих группировок, а также способов их удаления можно найти во французском патенте FK 2499995, содержание которого приводится в настоящей заявке в качестве уровня техники. Можно привести, например тетрагидропиранил или тритил.
В предпочтительном варианте изобретения используют соединения формулы (II), содержащие цепь в 11-бета-положении, заканчивающуюся галоидом или пседогалоидом, таким как, например группой -O-SO2-ф-CH3, в которой ф означает фенилен, как показано в примерах ниже, а также соединения формулы (III), приведенные ниже в экспериментальной части. Не ограничивая, можно привести метиловый эфир 2-меркаптобензойной кислоты, фурфурилмеркаптан, 2-диазолин-2-тиол, 2-меркаптотиазол, 2-меркапто-1-метилимидазол, 1-метил-5-меркапто-1,3,4-триазол, 1-метил-5-меркапто-1,2,3,4-тетразол, 2-пиридинметантиол, 4,6-диаминопиримидин-3-тиол, 2,3,5,6-тетрахлорпиридин-4-тиол, 2-меркаптобензотиазол, 7-трифторметил-4-хинолинтиол и 4,4,5,5,5-пентафторпентатиол.
Когда соединение формулы (IA) имеет защищенные реактивные функции, получают соответствующее незащищенное соединение при действии обычных агентов, например омыляющего агента, такого как поташ, в спиртовой среде или такого гидролизующего агента, как соляная кислота. Приемлемые способы снятия защиты описаны также во французском патенте FK 2499995.
Когда соединение формулы (IA) имеет кетонную функцию в положении 17, получают:
соответствующее 17-бета-гидроксилированное соединение, например при действии такого восстанавливающего агента, как боргидрид натрия в нейтральном растворителе, таком как метанол,
соответствующее соединение, имеющее радикал R'17, представляющий собой алкил, алкенил или алкинил, необязательно замещенный, получают при действии соединения (IV), такого как, например, комплекс лития, согласно способу, описанному в европейском патенте EP 57115,
соответствующее соединение, имеющее оксимную функцию в положении 17, при действии гидроксиламина в виде соли, такой как хлоргидрат, в присутствии слабого основания в среде спирта при температуре кипения с обратным холодильником,
соответствующее соединение, имеющее гидразоновую функцию в положении 17, например при действии производного гидразина, а именно гидразингидрата, в присутствии кислоты, такой как пара-толуолсульфоновая кислота,
соответствующее соединение, имеющее метиленовую функцию в положении 17, используя в соответствии с реакцией Виттига, например, метилтрифенилфосфоний бромид в щелочной среде.
Когда соединение формулы (IA) имеет гидроксильную функцию в положении 3 или 17, получают соответствующее ацилоксилированное в положении 3 или 17-бета соединение при действии селективного ацилирующего агента, например уксусного ангидрида в пиридине.
Когда соединение формулы (IA) имеет этиниленовую группировку, получают соответствующее соединение, имеющее винильную связь, или соответствующее насыщенное соединение при действии восстанавливающего агента для частичного или полного восстановления, или с помощью водорода в присутствии палладия на активированном угле или на сульфате бария и необязательно в присутствии основания, такого как пиридин или хинолин, в случае частичного восстановления, или с помощью одного гидроксида палладия в случае полного восстановления.
Можно получить соединения, имеющие алкильный радикал в положении 16, например, при действии галоидного алкила, такого как метил иодид или этилиодид в присутствии комплекса лития.
Можно получить соединение, имеющее галоид в положении 16, например, при действии брома в кислой среде, а именно в среде уксусной кислоты, или еще при действии такого галоидирующего агента, как N-бром- или N-хлорацетамид, или еще трет-бутилгипохлорита.
Можно подвергнуть соединения формулы (IA) действию агента сульфокисления, например метапериодата натрия или метахлорпербензойной кислоты, чтобы получить соединения формулы (I), в которой m = 1, или сульфонирующего агента, например перфталевой кислоты или мета-хлорпербензойной кислоты, чтобы получить соединения формулы (I), в которой m = 2.
Изобретение также относится к способу получения соединений формулы (I), характеризующемуся тем, что соединение формулы (V):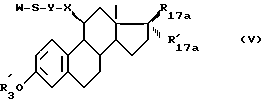
где R17a и R'17a имеют значения, указанные ранее для R17 и R'17, в которых необязательные реактивные функции необязательно защищены,
X и Y имеют указанные значения,
R'3 является атомом водорода или группировкой, защищающей гидроксил,
W является атомом водорода или ацильным радикалом -COR, в котором R является алкилом с 1-5 атомами углерода, вводят в реакцию с соединением формулы (VI):
Za - hal'
или его соли, в которой радикал Za имеет значения, указанные для Z, в котором возможные реактивные функции могут быть защищены, и hal' является реактивной группой, такой как галоид или псевдогалоид, такой как мезилат или тозилат, в присутствии основания, потом в некоторых случаях обрабатывают агентом для удаления защищающих группировок, чтобы получить соединение формулы (IA), как определено выше, и при желании проводят любую из реакций, указанных для соединения формулы (IA).
В соответствии с этим вариантом способа изобретения соединения формулы (IA), соответствующие соединениям формулы (I), в которой m = 0, получают при взаимодействии соединения формулы (V), в которой W является ацилом, например ацетилом, пропионилом, бутирилом, OR'3 является необязательным защищенным гидроксилом, например ацетилом, трет-бутилом или тетрагидропиранилом; реактивные функции, которые имеются в R17a и R'17a, могут быть защищены обычными способами, с соединением формулы (VI) или его солью, например хлоргидратом, реакцию проводят в растворителе, таком как метанол или диметилформамид, необязательно нагревают, например, до примерно 50oC или при температуре кипения с обратным холодильником в присутствии основания, такого как метилат натрия или концентрированный гидроксид натрия.
В предпочтительном варианте осуществления изобретения используют соединения формулы (V), содержащее в 11-бета-положении цепь, заканчивающуюся тиольной группировкой или тиоацетилом, а также соединения формулы (VI), приведенные в экспериментальной части.
Не ограничивая, можно привести еще в качестве соединений формулы (VI) или 3-хлорметилпиридин, 4-хлорметилпиридин, 6-(хлорметил)-урацил, 2-хлорметилбензимидазол, 7-(2-хлорэтил)-теофиллин и их соли присоединения, такие как хлоргидрат или иодпентан, или мезилат, тозилат или галоидное производное пентафторпентила или трифторбутила, предпочтительно 4,4,5,5,5-пентафториодпентан, 4,4,4-трифториодбутан, как показано в примерах ниже.
4,4,5,5,5-Пентафториодпентан, получение которого описано в экспериментальной части, получают при иодировании соответствующего спирта 4,4,5,5,5-фторпентанола, промежуточного продукта, который можно получить, например, при реакции гидрирования в присутствии катализатора, например, никеля Ренея, в метаноле или оксида платины в этаноле, частично ненасыщенного продукта, соответствующего 4,4,5,5,5-пентафтор-2-пентен-1-олу, который описан T. Kitazume et al., J. Am. Chem. Soc., 1985, 107, 5186-5191.
Насыщенный промежуточный спирт, приведенный выше, также может быть получен в соответствии со способом, описанным N.O. Brace, Journal of Fluorine Chemistry, 20 /1982/, 313-327, исходя из иодпентафторэтана, который конденсируют под давлением с аллиловым спиртом в присутствии катализатора, такого как, например, азаизобутиронитрил (АИБН), никеля Ренея в этаноле, тетра-кис-(трифенилфосфино)палладия в гексане или олова и ацетата серебра в метаноле, чтобы получить 2-иод-4,4,5,5,5-пентафторпентанол, который вводят в реакцию гидрирования, например, водородом в присутствии 10% палладия на оксиде магния в метаноле или никеля Ренея в этаноле, или при реакции с гидридом трибутилолова в присутствии азабисизобутиронитрила.
Соединения формулы (IA), полученные в соответствии с вариантом способа, затем при необходимости вводят в одну из реакций, указанных выше, чтобы получить соединение формулы (I).
Соединения формулы (I) обладают интересными фармакологическими свойствами. Изучение продуктов на гормональных рецепторах позволило доказать, что они в частности обладают замечательной антиэстрогенной активностью и антипролиферативными свойствами, как показали результаты испытаний, приведенные ниже. Они также обладают противонидационной активностью.
Эти свойства дают возможность использовать соединения формулы (I) для контроля плодовитости, например, при некоторых формах бесплодия из-за отсутствия овуляции, для контроля рождаемости, например в качестве контрацептива, а именно в качестве пилюль после коитуса, а также для лечения гормонально зависимых карцином, как например, карцином грудной железы и их метастаз, и для лечения доброкачественных опухолей женской груди.
Следовательно, объектом изобретения являются продукты формулы (I) в качестве лекарства.
Среди лекарств изобретения можно привести, в частности, соединения, описанные в экспериментальной части и, в частности, продукты примеров. Среди этих продуктов в качестве лекарства изобретение особенно заявляет следующие соединения формулы (I):
11-бета-/8-//2-пиридинилметил/тио/октил/-эстра-1,3,5/10/- триен-3,17-бета-диол,
11-бета-/4-/3-//1-метил-1H-имидазол-2-ил/тио/-1-пропинил/фенил/ -экстра-1,3,5/10/-триен-3,17-бета-диол,
11-бета-/4-/5-//2-фуранилметил/тио/пентилокси/фенил/- эстра-1,3,5/10/-триен-3,17-бета-диол,
11-бета-/4-/5-//2-пиридинилметил/сульфинил/пентилокси/фенил/- эстра-1,3,5/10/-триен-3,17-бета-диол,
11-бета-/4-/5-//3-пиридинилметил/сульфинил/пентилокси/фенил/-эстра-1,3,5/10/-триен-3,17-бета-диол,
11-бета-/4-/6-/4,4,5,5,5-пентафторпентил/сульфинил/гексилокси/ фенил/эстра-1,3,5/10/-триен-3,17-бета-диол,
11-бета-/4-/5-//4,4,5,5,5-пентафторпентил/сульфонил/пентилокси/ фенил/эстра-1,3,5/10/-триен-3,17-бета-диол,
11-бета-/4-/5-/пентилсульфонил/пентилокси/фенил-эстра-1,3,5/10/ -триен-3,17-бета-диол,
11-бета-4-/5-//4,4,5,5,5-пентафторпентил/сульфонил] пентилокси/ фенил/-17-альфа-метилэстра-1,3,5/10/-триен-3,17-бета-диол.
Полезная позология варьирует в зависимости от лечебного воздействия и от пути введения, она может варьировать, например, от 1 до 100 мг в день для взрослого при оральном введении.
Изобретение охватывает фармацевтические композиции, содержащие в качестве активного начала по крайней мере одно из таких лекарств, как определено выше.
Соединения формулы (I) используют через желудок, парентерально или локально, например подкожно. Они могут быть предписаны в виде простых таблеток или в виде драже, капсул, гранул, суппозиториев, шариков, препаратов для инъекций, помады, кремов, гелей, микросфер, имплантов, пластырей, которые готовят в соответствии с известными методиками.
Одно или несколько активных начал могут быть введены туда вместе с экципиентами, обычно применяемыми в таких фармацевтических композициях, как тальк, гуммиарабик, лактоза, крахмал, стеарат магния, масло какао, водные и неводные носители, растительные и животные жиры, парафиновые производные, гликоли, различные смачивающие агенты, диспергаторы или эмульгаторы, консерванты.
Некоторые промежуточные продукты формул (II) или (V) являются новыми продуктами и, следовательно, являются объектом изобретения также и соединения формул (II) и (V), как они определены ранее.
Новые промежуточные продукты формулы (II), как они определены ранее, получают в соответствии с методикой, пример которой приведен ниже.
В общем соединения формулы (II) могут быть получены согласно следующему способу:
или подвергают соединение формулы (VII)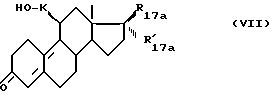
в которой R17a и R'17a имеют указанные ранее значения, K является алифатической цепью, содержащей 2-19 атомов углерода, связанной со стероидным ядром метиленовым радикалом или ариленовой группой,
а/ действию, активирующего спиртовую функцию агента, например тозил хлорида в пиридине, или галоидирующего агента, например четыреххлористого или четырехбромистого углерода, в присутствии трифенилфосфина в нейтральном растворителе, когда K является алифатической цепью,
б/ действию галоидного соединения формулы (VIII):
Br - Y - hal
в которой Y имеет значения, указанные ранее, а hal является галоидом, в присутствии основания, когда K является ариленовой группой, потом в обоих случаях действию ароматизирующего агента, такого как гидроксид палладия на оксиде магния в метаноле или смеси бромистого ацетила с уксусным ангидридом, чтобы получить соответственно соединения формулы (II), в которой X является метиленовым радикалом и соединений формулы (II), в которой X является ариленоксигруппой;
или вводят соединение формулы (VII), такое, как определено выше, сначала в реакцию ароматизации, потом в реакцию а) или б), как описаны,
или соединение формулы (IX):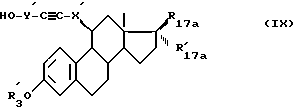
в которой R'3, R17a и R'17a имеют указанные ранее значения, X' являются ариленовой группой и Y' является таким же, как Y, определенный выше, содержащий 2 атома углерода на уровне связи с ариленовой группой, которая представлена X', подвергают действию активирующего спиртовую функцию агента, например четыреххлористого углерода, в присутствии трифенилфосфина в нейтральном растворителе или тозилхлорида в пиридине, чтобы получить соединения формулы (II), в которой X является ариленовой группировкой и Y непосредственно связан с X этиниленовой группой, при желании продукты можно подвергнуть частично или полностью реакции по тройной связи.
Некоторые продукты формулы (VII), необходимые для осуществления способа, являются известными продуктами. Их получение описано в получении продуктов примера 43 и примера 50 в заявке на европейский патент EP 384842, содержание которой приведено здесь в качестве уровня техники. Новые продукты формулы (VII) могут быть получены аналогичным образом, например, по способу, описанному в указанной заявке на патент.
Продукты формулы (IX), необходимые для осуществления способа, являются продуктами, которые получают известными способами, исходя из продуктов формулы (X):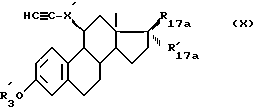
в которой R'3, R17a, R'17a и X' имеют указанные значения.
Исходя из продуктов формулы (X), получают продукты формулы (IX), перемешивая, например, или параформальдегид в присутствии бутилхлорида и хлорида лития в нейтральном растворителе, когда Y' является метиленовым радикалом, или галоидное соединение формулы Rp-O-Y'-Hal1, в которой Hal1 является галоидом, а Rp защищающей группой для спиртовой функции, в присутствии сильного основания, когда Y' является алифатической цепью, имеющей не менее 2 атомов углерода. Примеры такого получения приведены ниже в экспериментальной части.
Можно также непосредственно получить некоторые продукты формулы (II), в которой Hal является галоидом, при реакции с галоидным соединением формулы Hal2-Y'-Hal1, в которой Hal1 и Hal2 соответственно являются галоидом, в присутствии сильного основания.
Продукты формулы (X) описаны в примере в заявке на европейский патент N EP 384842, а другие продукты формулы (X) могут быть получены по аналогии, например, по способу, описанному для получения в примере 31 указанной заявки.
Новые промежуточные соединения формулы (V), такие, как определено ранее, получают по методике, которая приведена в примере ниже.
В общем, соединения формулы (V) могут быть получены согласно следующему способу.
Соединение формулы (II'), соответствующее соединению формулы (II), определенному выше, в котором hal является атомом хлора или брома, подвергают:
или действию иодирующего агента, например иодида натрия, в нейтральном растворителе, таком как ацетон или метилэтилкетон, при нагревании необязательно при температуре кипения с обратным холодильником, потом действию соли тиокарбоновой кислоты формулы (XI):
R - CO - SH
в которой R имеет указанные значения, чтобы получит соединение формулы (V), в которой W является ацильным радикалом,
или действию соединение формулы (XI), указанному выше, чтобы получить дисульфидное соединение формулы (XII):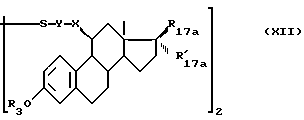
в которой R3, X, Y, R17a и R'17a имеют указанные значения, которое обрабатывают агентом восстановления дисульфида, например, три-н-бутилфосфином, в нейтральном растворителе, таком как водный органический растворитель, чтобы получить соединение формулы (V), в которой W является атомом водорода.
Ниже приводятся примеры, иллюстрирующие изобретение, не ограничивая его, продукты формулы (I), в которой R17 является гидроксилом. R'17 является атомом водорода, m равно 0, 1 или 2, а X имеют значения, указанные в табл.1, представляют собой продукты, которые могут быть получены в рамках изобретения.
Пример 1. 11-бета-[8-[/2-Пиридинилметил/тио] октил] -эстра-1,3-5/10/- триен-3,17-бета-диол.
Стадия A: 17-бета-ацетилокси-11-бета-[/8-ацетилокси/октил]-эстра-4,9-диен-3-он.
К раствору 1,4 г 17-бета-/ацетилокси/-11-бета-/8-оксиоктил/-эстра- 4,9-диен-3-она в 10 см3 пиридина прибавляют 3,6 см3 уксусного ангидрида и 95 мг 4-/диметиламино/пиридина. Раствор перемешивают в течение 1 ч при комнатной температуре, прибавляют 5 см3 и 5 см3 метанола, перемешивают 10 мин при 0 - 5oC, выливают в насыщенный водный раствор хлорида аммония, экстрагируют этилацетатом, промывают насыщенным водным раствором хлорида натрия, сушат и выпаривают досуха при пониженном давлении после удаления пиридина с толуолом. Получают 1,61 г сырого продукта, который хроматографируют на оксиде кремния, элюируя этилацетатомциклогексаном 3 - 7. Таким образом, получают 1,28 г целевого продукта.
ИК-спектр (CHCl3):
C=O 1735 см-1
Диенон 1660-1605 см-1
Стадия B. Диацетат 11-бета-[8-/ацетилокси/октил]-эстра- 1,3,5/10/-триен-3,17-бета-диола.
Растворяют 1,273 г продукта, полученного на предыдущей стадии, в 13 см3 метиленхлорида с 1,3 см3 уксусного ангидрида и 0,65 см3 ацетилбромида, перемешивают 10 мин при 0oC, потом 1,5 ч при комнатной температуре, охлаждают и прибавляют 2 капли воды и 3 см3 метанола. Выливают в насыщенный раствор бикарбоната натрия, экстрагируют метиленхлоридом, промывают водой, сушат и выпаривают досуха при пониженном давлении. Получают 1,387 г целевого продукта.
ИК-спектр:
C=O 1740-1730 см-1.
Ароматика 1610-1590-1500 см-1.
Стадия C. 11-бета-(8-Оксиоктил)-эстра-1,3,5/10/-триен- 3,17-бетадиол.
К раствору 1,337 г продукта, полученного на предшествующей стадии, в 42 см3 метанола, медленно прибавляют 20 см3 2 н. гидроксида натрия и перемешивают 2,5 ч при комнатной температуре, прибавляют 21,5 см3 2н. соляной кислоты, потом выливают в насыщенный раствор бикарбоната натрия, экстрагируют этилацетатом, промывают насыщенным водным раствором, сушат и выпаривают досуха при пониженном давлении. Получают 1,119 г целевого продукта, используемого как таковой на следующей стадии.
Стадия D. 11-бета-(8-Бромоктил)-эстра-1,3,5/10/-триен-3,17-бетадиол.
К раствору 1,107 г продукта, полученного на предшествующей стадии, в 32,5 см3 ацетонитрила с 8,1 см3 тетрагидрофурана и 2,561 г четырехбромистого углерода при 40oC прибавляют по каплям раствор 2,88 г трифенилфосфина в 8,1 см3 метиленхлорида. Перемешивают 1 ч при комнатной температуре и выпаривают досуха при пониженном давлении. Получают 6,05 г продукта, который хорошо хроматографируют на оксиде кремния (элюент этилацетат-циклогексан 3/7). Получают 283 мг целевого продукта.
ИК-спектр:
OH 3605 см-1.
Ароматика 1615-1600-1590-1500 см-1.
Стадия E. 11-бета-[8-[/2-пиридинилметил/тио]октил]-эстра- 1,3,5/10/-триен-3,17-бета-диол.
Перемешивают 5 мин смесь 125 мг 2-пиридинметантиола и 0,98 см3 раствора 51,3 мг/см3 метилата натрия в метаноле, потом прибавляют при комнатной температуре раствор 155 мг продукта, полученного на предшествующей стадии, в 4 см3 метанола, прибавляют 60 мг иодида натрия и перемешивают все 1 ч при кипячении с обратным холодильником. Охлаждают, выливают в воду, экстрагируют этилацетатом, промывают насыщенным водным раствором хлорида натрия и выпаривают досуха при пониженном давлении. Собирают 224 мг продукта, который хроматографируют на оксиде кремния (элюент метиленхлорид-метанол 97,5/2,5, потом снова этилацетатом-циклогексаном 40/60).
ИК-спектр:
OH 3604 см-1.
Ароматика 1616-1598-1584 см-1.
Гетероциклы 1571-1498 см-1.
Пример 2. 11-бета-[4-[3-[/1-метил-1H-имидазол-2-ил/тио]- 1-пропинил]фенил]-эстра-1,3,5/10/-триен-3,17-бета-диол.
Стадия A. 3,17-бета-бис-/Тетрагидро-2H-2-пиранилокси/- 11-бета-/4-этинилфенил/-эстра-1,3,5/10/-триен.
Перемешивают в ультразвуковой кювете смесь из 0,1 см3 хлорбутана, 14 мг литиевого порошка, 540 мг 3-/4-/3,17-бета-бис-/тетрагидро-2H-2-пиранилокси-эстра-1,3,5/10/- триен-11-бета-ил/фенил/-проп-2-ин-1-ола и 2 см3 тетрагидрофурана в течение 30 мин при 30/35oC и прибавляют 29 мг переформальдегида, перемешивают еще несколько минут при 30/35oC, разбавляют водой, подкисляют мононатрийфосфатом, экстрагируют метиленхлоридом, сушат и выпаривают досуха при пониженном давлении. Получают 613 мг продукта, который хроматографируют на оксиде кремния (элюент циклогексан-этилацетат 1/1), при этом собирают 400 мг целевого продукта (т. пл. 214oC).
ИК-спектр:
C≡CH отсутствует.
OH 3609 см-1.
Ароматика 1607-1572-1555-1492 см-1.
Стадия B. 3,17-бета-бис-/Тетрагидро-2H-2-пиранилокси/- 11-бета-[4-/3-хлор-1-пропинил/фенил]-эстра-1,3,5/10/-триен.
Перемешивают 1 ч при комнатной температуре и 2 ч при кипячении с обратным холодильником раствор, содержащий 570 мг продукта, полученного на предыдущей стадии, 14 см3 четыреххлористого углерода, 2 см3 тетрагидрофурана и 4 см3 ацетонитрила и, наконец (порциями) 530 мг трифенилфосфина. Прибавляют 5 г оксида кремния и выпаривают досуха при пониженном давлении. Хроматографируют полученный остаток на оксиде кремния (элюент циклогексанэтилацетат 8 - 2). Собирают 370 мг целевого продукта.
ИК-спектр (CHCl3 на Николет):
OH 3598 см-1.
C≡C 2268/1/ - 2220 - см-1.
Ароматика 1606 - 1560 - 1531 - 1506 см-1.
Стадия C. 3,17-бета-бис-/Тетрагидро-2H-2-пиранилокси/- 11-бета-[4-[3-[/1-метил-1H-имидазол-2-ил/тио]-1-пропинил]фенил]- эстра-1,3,5/10/-триен.
К раствору, охлажденному до -oC, содержащему 90 мг 2-меркапто-1-метилимидазола и 2 см3 тетрагидрофурана, прибавляют 38 мг гидрида натрия в виде 50%-ной дисперсии в масле. Перемешивают 1 ч при 0oC. Прибавляют раствор 2 г продукта, полученного на предшествующей стадии в 2 см3 тетрагидрофурана. Дают нагреться до комнатной температуры и перемешивают еще 3 ч. Выливают реакционную смесь в водный раствор хлорида аммония, экстрагируют этилацетатом, сушат и выпаривают досуха при пониженном давлении. Полученный продукт хроматографируют на оксиде кремния (элюент этилацетат-циклогексан 2/8). Получают 180 мг целевого продукта.
ИК-спектр (CHCl3 на Николет):
OH 3600 см-1.
C≡C 2218 см-1.
Ароматика + гетероцикл 1608 - 1582 - 1506 см-1 комплекс.
Стадия D. 11-бета-[4-[3-[/Метил-1H-имидазол -2-ил/тио]-1-пропинил]фенил] -эстра-1,3,5/10/-триен-3,17-бета-диол.
Перемешивают 2 ч. при комнатной температуре смесь, содержащую 143 мг продукта, полученного на предыдущей стадии, 2 см3 этанола и 2 см3 2н. соляной кислоты. Концентрируют до малого объема, экстрагируют этилацетатом и выпаривают досуха при пониженном давлении. Остаток хроматографируют на оксиде кремния (элюент циклогексан-этилацетат 1/1). Собирают 96 мг целевого продукта.
ИК-спектр (CHCl3 на Николет):
ОH 3608 см-1 + ассоциированные.
C≡C 2210 см-1
Ароматический гетероцикл 1583 - 1554 - 1505 см-1.
Пример 3. 11-бета-[4-[5-[/2-фуранилметил/тио]пентилокси] фенил]-эстра-1,3,5/10/-триен-3,17-бета-диол.
Стадия A. 11-бета-[4-[/5-хлорпентил/окси]фенил]-эстра-4,9-диен-3,17-бета-дион.
Нагревают в течение 6 ч при перемешивании раствор, содержащий 28,2 г 11-бета-(4-оксифенил)-эстра-4,9-диен-3,17-диона (полученного в приготовлении примера 43 заявки на патент EP 384842), 450 см3ацетона, 45 см3 2н. гидроксида натрия и 18,5 см3 1-бром-5-хлорпентана. Выпаривают ацетон и обрабатывают остаток 200 см3 метиленхлорида, промывают водой, сушат и концентрируют до объема 100 см3, прибавляют 10 см3 изопропилового эфира и концентрируют до начала кристаллизации, отфильтровывают, сушат и собирают 26,3 мг продукта, который хроматографируют на оксиде кремния (элюент бензин G-этилацетат 1/1). Получают 4,2 г целевого продукта (т.пл. 220oC).
ИК-спектр (CHCl3):
17-кето 1735 см-1,
3-кето 1658 см-1.
C=C и ароматика 1609-1580-1509 см-1.
Стадия B. 3-Ацетилокси-11-бета-[4-[15-хлорпентил/окси] фенил]- эстра-1,3,5(10)-триен-17-он.
К раствору, охлажденному до +4oC, содержащему 30 г продукта, полученного на предшествующей стадии, в 300 см3 метиленхлорида прибавляют 30 см3 уксусного ангидрида и 15 см3 ацетилбромида. Дают нагреться до комнатной температуры, перемешивают 1 ч, прибавляют при охлаждении 30 см3 метанола и 500 см3 насыщенного раствора бикарбоната натрия. Перемешивают 45 мин при комнатной температуре, декантируют, промывают водой, сушат, потом выпаривают досуха.
Получают 37 г продукта, используемого как таковой, на следующей стадии.
Стадия C. 3-окси-11-бета-[4-[(5-хлорпентил)окси]фенил]-эстра- 1,3,5/10/-триен-17-он.
Перемешивают в течение 40 мин при комнатной температуре раствор, содержащий 37 г продукта, полученного на предыдущей стадии, 200 см3 тетрагидрофурана и 64 см3 2н. гидроксида натрия. Прибавляют 64 см3 2н. соляной кислоты и выпаривают растворители при пониженном давлении. Экстрагируют метиленхлоридом, промывают водой, сушат и выпаривают досуха при пониженном давлении. Получают 32 г целевого продукта, который используют как таковой на следующей стадии.
Стадия D. 11-бета-[4-[/5-хлорпентил/окси] фенил]-эстра-1,3,5/10/ -триен-3,17-бета-диол.
К раствору, содержащему 32 г продукта, полученного на предыдущей стадии, в 150 см3 тетрагидрофурана, прибавляют 150 см3 метанола и при 0+5oC в течение 10 мин 2,56 г боргидрида натрия (95%). Перемешивают при 0+5oC и прибавляют 10 см3 ацетона, отгоняют растворители, обрабатывают остаток метиленхлоридом, промывают водой, сушат и выпаривают досуха. Получают 34 г продукта, который хроматографируют на оксид кремния (элюент толуол-этилацетат 8/2). Собирают 15,15 г целевого продукта (т.пл.165oC, перекристаллизован из этилацетата).
ИК-спектр: (нуйол)
Область поглощения NH/OH
Ароматика 1618 - 1608 - 1582 - 1512 - 1492 см-1
Стадия E. 11-бета-[4-[5-[(2-фуранилметил)тио]пентилокси] фенил]-эстра-1,3,5/10/-триен-3,17-бета-диол.
Перемешивают при кипячении с обратным холодильником в течение 4 ч смесь, содержащую 0,15 см3 фурфурилмеркаптана (90-95%), 81 г метилата натрия, 90 мг иодида натрия, 4 см3 метанола и 234 мг продукта, полученного на предыдущей стадии. Отгоняют метанол при пониженном давлении, обрабатывают этилацетатом, промывают водой, сушат и разгоняют досуха при пониженном давлении. Получают 340 мг продукта, который хроматографируют на оксиде кремния (элюент бензин G - этилацетат 6-4). Собирают 260 мг продукта, который хроматографируют на Лихросорб RP18 (элюент метанол-вода 9-1). Таким образом получают 140 мг целевого продукта.
ИК-спектр (CHCl3):
OH 3602 см-1.
Ароматика + сопряженная система 1610 - 1581 - 1512 - 1504 см-1
Пример 4. 11-бета-[4-[5-[/2-пиридинилметил/тио]пентилокси]фенил]-эстра-1,3,5/10/ -триен-3,17-бета-диол.
Кипятят с обратным холодильником в течение 3 ч раствор, содержащий 0,17 см3 2-пиридинметантиола, 81 мг метилата натрия, 234 мг продукта, полученного на стадии D примера 3, и 4 см3 метанола. Отгоняют метанол, обрабатывают этилацетатом, промывают водой, сушат и выпаривают досуха при пониженном давлении. Собирают 360 мг остатка, который хроматографируют на оксиде кремния (элюент этилацетатбензин G8/2) и таким образом получают 280 мг целевого продукта.
ИК-спектр (CHCl3):
OH 3605 см-1
Ароматика 1610 - 1581 - 1511 см-1.
Пиридин 1594 - 1571 см-1
Пример 5. 11-бета-[4-[5-[(2-пиридинилметил)сульфинил]пентилокси]- фенил] -эстра-1,3,5/10/-триен-3,17-бета-диол.
К раствору 172 мг продукта, полученного в примере 4, в 12 см3 метанола прибавляют 3,7 см3 раствора 0,1М метапериодата натрия в воде. Перемешивают 1,5 ч и прибавляют 3,4 см3 метанола и 0,6 см3 раствора метапериодата после 30 мин перемешивания реакционную среду выливают в воду, экстрагируют этилацетатом, промывают соленой водой и выпаривают досуха при пониженном давлении. Получают 176 мг остатка, который хроматографируют на оксиде кремния два раза (элюент метиленхлорид-метанол 92,5-7,5). Собирают 107 мг целевого продукта
ИК-спектр (CHCl3 на Николет):
OH 3606 см-1.
Гетероциклы и ароматика 1610 - 1596 - 1583 - 1572 - 1512 см-1
Сульфоксид 1031 см-1.
Пример 6. 11-бета-[4-[5-[/3-пиридинилметил/тио]пентокси]фенил]- эстра-1,3,5/10/-триен-3,17-бета-диол.
Стадия A. 11-бета, 11'-бета/-11,11'-[Дитиобис-[5,1-пентокси-(4,1-фенилен)]]-ди- эстра-1,3,5/10/триен-3,17-бета-диол.
Перемешивают при кипячении с обратным холодильником в течение 17 ч 1,9 г 11-бета-[4-[(5-хлорпентил)окси] фенил] -эстра-1,3,5- /10/-триен-3,17-бета-диола, полученного на стадии D примера 3, и 910 мг тиоацетата калия в 20 см3 этанола. Прибавляют 910 мг тиоацетата калия и перемешивают 10 ч при кипячении с обратным холодильником. Отгоняют этанол, обрабатывают остаток этилацетатом, промывают соленой водой, сушат и выпаривают досуха при пониженном давлении. Получают 2,1 г остатка, который хроматографируют на оксиде кремния (элюент этилацетат-бензин G/6/4), собирают при этом 1,72 г целевого продукта.
ИК-спектр (нуйол):
Область поглощения NH/OH
Ароматика 1609 - 1580 - 1510 см-1.
Стадия B. 11-бета[4-[5-[(3-Пиридинилметил)тио] пентилокси] фенил]-эстра-1,3,5/10/-триент-3,17-бета-диол.
а/ Восстановление дисульфида. В раствор 5 см3 метанола с 10% воды и 2 см3 тетрагидрофурана, предварительно дегазированный, вводят 465 мг продукта, полученного на предыдущей стадии, и 0,25 см3 трибутилфосфина. Перемешивают 2 ч при комнатной температуре, экстрагируют этилацетатом, промывают водой, сушат и выпаривают досуха при пониженном давлении. Получают 640 мг меркаптана.
б/ Алкилирование. Растворяют полученный меркаптан в 5 см3 метанола и прибавляют 160 мг метилата натрия и 342 мг хлоргидрата (3-хлорметил)-пиридина 96%-ного.
Эту суспензию перемешивают в течение 55 мин при кипячении с обратным холодильником, дают остыть до комнатной температуры, подкисляют 2 см3 2н. соляной кислоты, подщелачивают бикарбонатом натрия, экстрагируют этилацетатом, промывают соленой водой, сушат и выпаривают досуха при пониженном давлении. Собирают 650 мг продукта, который хроматографируют на оксиде кремния (элюент этилацетатбензин G/8/2). Получают 370 мг целевого продукта.
ИК-спектр (CHCl3):
ОН 3607 см-1
Ароматика 1610 - 1580 - 1512 см-1.
Пример 7. 11-бета-[4-[5-[(3-Пиридинилметил)сульфинил]пентилокси]-фенил] -эстра-1,3, 5/10/триен-3,17-бета-диол.
Работают по методике примера 5, исходя из 177 мг продукта, полученного в примере 6, получают 185 мг сырого продукта, к которому прибавляют 24 мг предшествующего продукта и хроматографируют все на оксиде кремния два раза (элюент метиленхлорид-метанол 9/1). Собирают 138 мг целевого продукта.
ИК-спектр, (CHCl3 на Николет):
ОН 3606 см-1 + общее поглощение.
Ароматика + гетероароматика 1610 - 1580 - 1512 см-1.
Сульфоксид 1030 - 1040 см-1.
Пример 8: 11-бета-[4-[6-[(4,4,5,5,5-Пентафторпентил)тио]гексилокси]фенил] -эстра-1,3,5/10/-триен-3,17-бета-диол.
Стадия A. 11-бета-[4-[(6-хлоргексил)окси] фенил]-эстра-4,9-диен-3,17-дион.
Кипятят с обратным холодильником в течение 5 ч 362 мг 11-бета-/4-оксифенил/-эстра-4,9-диен-3,17-диона, 5 см3 ацетона, 1,5 см3 6-бромхлоргексана и 138 мг карбоната калия. Затем прибавляют 1 см3 6-бром-хлоргексана и перемешивают 16 ч при комнатной температуре. Подкисляют 2н. соляной кислотой, экстрагируют этилацетатом, промывают водой, сушат и выпаривают досуха при пониженном давлении. Собирают 3,48 г продукта, который хроматографируют на оксиде кремния (элюент этилацетат-бензин G 6/4). Полученный остаток перекристаллизовывают из смеси метиленхлорида-изопропилового эфира и получают при этом 290 мг целевого продукта (т.пл. 221oC).
Стадия B. 3-окси-11-бета-[4-[(6-Хлоргексил)окси]фенил]-эстра- 1,3,5/10-триен-17-он.
Работают по методикам стадий B и C примера 3, исходя из 481 мг продукта, полученного на стадии A выше, используя 0,5 см3 уксусного ангидрида и 0,25 см3 ацетилбромида. Получают 483 мг целевого продукта.
Стадия C. 11-бета-[4-[(6-Хлоргексил)окси] фенил]-эстра-1,3,5/10/ -триен-3,17-бета-диол.
Работают по методике стадии D примера 3, исходя из 465 мг продукта, полученного выше, используя 60 мг боргидрида натрия. После хроматографии на оксиде кремния (элюент бензин G - этилацетат 6/4) и перекристаллизации из метиленхлорида получают 300 мг целевого продукта (т. пл. 176oC).
Стадия D. 11-бета-[4-[(6-иодгексил)окси]фенил]-эстра-1,3,5/10/ -триен-3,17-бета-диол.
К раствору 310 мг продукта, полученного на стадии C, в 6 см3 метилэтилкетона прибавляют 150 мг иодида натрия и перемешивают 24 ч при кипячении с обратным холодильником. Прибавляют 100 мг иодида натрия, перемешивают 2 ч при кипячении с обратным холодильником и на 16 ч оставляют при комнатной температуре. Обрабатывают этилацетатом, промывают, сушат и выпаривают досуха при пониженном давлении. Собирают 470 мг целевого продукта, используемого как таковой на следующей стадии.
Стадия E. 11-бета-[4-[(6-Тиоацетил)гексил]окси]фенил]-эстра-1,3,5/10/-триен -3,17-бета-диол.
К раствору 470 мг продукта, полученного на стадии D, в 6 см3 этанола прибавляют 150 мг тиоацетата калия и перемешивают 1 ч 50 мин при 50oC. Отгоняют этанол, обрабатывают этилацетатом, промывают водой, сушат и выпаривают досуха при пониженном давлении. Получают 400 мг остатка, который хроматографируют на оксиде кремния (элюент этилацетат - бензин G 6/4, потом 8/2). Собирают 265 мг целевого продукта (т. пл. - 90oC).
ИК - спектр (CHCl3 на Николет):
OH 3602 см-1.
C=O 1686 см-1.
Ароматика 1610 - 1581 - 1512 см-1.
Стадия F. 11-бета-[4-[6-[(4,4,5,5,5-Пентафторпентил)тио]гексилокси]фенил]- -эстра-1,3,5/10/-триен-3,17-бета-диол.
К раствору 200 мг продукта, полученного выше, и 127 мг 4,4,5,5,5 пентафториодпентана (получение которого приведено ниже) в 5 см3 метанола прибавляют 0, . .. см3 гидроксида натрия. Перемешивают в течение 1 ч при 50oC, потом выпаривают растворитель при пониженном давлении. Остаток обрабатывают метиленхлоридом и 2н. соляной кислотой. Экстрагируют метиленхлоридом, промывают водой, сушат и выпаривают досуха при пониженном давлении. Полученный остаток хроматографируют на оксиде кремния (элюент бензин G - этилацетат 65/35). Получают 149 мг целевого продукта.
ИК-спектр (CHCl3):
OH 3600 см-1
Ароматика 1620 - 1580 - 1512 см-1.
Приготовление исходных соединений примера 8: 4,4,5,5,5-пентафториодпентан.
Стадия A. 4,4,5,5,5-Пентафторпентанол.
Растворяют 10 г 4,4,5,5,5-пентафтор-2-пентен-1-ола (полученного согласно J. Am. Chem. Soc., 107 (1985), 5186-5191: T.Kitazume et Ishikawa) в 100 см3 метанола и гидрируют в присутствии никеля Ренея (0,5 г). Отфильтровывают катализатор, промывают этанолом и после отгонки при пониженном давлении получают целевой спирт с т. кип. 133oC. n
Стадия B 4,4,5,5,5-Пентафториодпентан.
К раствору 2,65 г трифенилфосфина и 0,69 г имидазола в 20 см3 метиленхлорида прибавляют 2,54 г иода и, поддерживая температуру ниже 25oC, раствор, полученный на стадии A, в 3 см3 метиленхлорида. Перемешивают 3 ч, фильтруют, отгоняют метиленхлорид и обрабатывают остаток несколько раз пентаном. После отгонки пентана получают 3,45 г остатка, содержащего целевой продукт, который можно разгонять (т. кип. 42 - 45oC при 40 мбар). n
Пример 9. 11-бета-[4-[6-[(4,4,5,5,5-Пентафторпентил)сульфинил] -гексилокси]фенил]-эстра-1,3,5/10/-триен-3,17-бета-диол.
К раствору 110 мг продукта, полученного в примере 8, в 5,5 см3 метанола прибавляют 0,61 см3 0,5 M раствора метапериодата натрия в воде. Перемешивают 1 ч при комнатной температуре и выпаривают метанол при пониженном давлении. Остаток обрабатывают 2н. соляной кислотой, экстрагируют метиленхлоридом. После сушки и выпаривания досуха растворителя остаток хроматографируют на оксиде кремния (элюент-метиленхлорид-метанол 95/5). Получают 96 мг целевого продукта.
ИК-спектр (CHCl3):
OH 3605 см-1 + ассоциированные.
Ароматика 1610 - 1580 - 1512 см-1.
Сульфоксид 1031 см-1.
Пример 9a. 11-бета-[4-[6-[(/4,4,5,5,5-Пентафторпентил/сульфонил]-гексилокси]фенил] -эстра-1,3,17-бета-диол.
К раствору 150 мг продукта, полученного в примере 8, в 2 см3 метиленхлорида прибавляют 150 мг 70%-ной перфталевой кислоты. Перемешивают 1 ч 15 мин, потом прибавляют водный раствор тиосульфата натрия и водный раствор биокарбоната натрия. Экстрагируют метиленхлоридом, сушат и выпаривают досуха при пониженном давлении. Полученный остаток хроматографируют на оксиде кремния (элюент этилацетат-бензин G 6/4). Получают 130 мг целевого продукта.
ИК-спектр (CHCl3):
OH 3603 см-1 + ассоциированный.
Ароматика 1622 - 1610 - 1570 - 1511 - 1505 см-1.
Сульфон 1305 - 1132 см-1.
Примеры 10 - 13. Работают по методике примера 1, исходя из продукта, полученного на стадии D примера 1, получают соединение примера 10, работая по методике примера 1, но исходя из диацетатов соответствующих соединений формулы (II), таких соединений, как определены выше, в которых Hal является атомом хлора (пример II) или тозилатной группировкой (примеры 12 и 13), используя для каждого примера, меркаптан формулы (III), в котором Za имеет значение, указанное для Z в табл. 2, или его натриевую соль с последующим омылением гидроксидом натрия полученного диацетата, получают целевой диол формулы /I/, соединения примеров 11 - 13.
Соединения примеров 10 - 13 соответствуют соединениям формулы (I), в которой R17 является гидроксилом, R'17 является атомом водорода, m равно 0, X, Y и Z имеют значения, указанные в табл. 2.
ИК-спектры продуктов примеров 10 - 13 приведены в табл. 2.
Продукты, соответствующие примерам 10 - 13, формулы /I/, в которой m равно 1, получены по методике примера 5.
Примеры 14 - 24. Работают по методике примера 2, получают соединения примеров 14 - 21 и, работая по методике примера 2, но исходя из соответствующих соединений формулы (II), получают соединения примеров 22 - 24, соединения формулы (I), в которой R17 является гидроксилом, R17 является атомом водорода, m равно 0, X, Y и Z имеют значения, приведенные в табл. 3, используя в каждом примере меркаптан формулы (III), в котором Z a имеет значения, указанные для Z в табл. 3.
ИК-спектры продуктов примеров 14 - 24 приведены в табл. 3.
Продукты, соответствующие примерам 14 - 24 формулы /I/, в которой m равно 1, получают по методике примера 5.
Примеры 25-29. Работая по методике примера 6, получают соединения примеров 25-27, работая по методике примера 8, получают соединение примера 28, соединения формулы (I), в которой R17 является гидроксилом, R'17 является атомом водорода, m равно 0, X, Y и Z имеют значения указанные в табл. 3, используя для каждого примера соединение формулы (VI), в котором Za имеет значения, указанные для Z в табл. 4.
Получают соединения, соответствующие примерам 25-28 формулы (I), в которой m равно 1, работая по методике примера 5. Пример 29 проводят по этому способу, исходя из соединения примера 25.
ИК-спектры продуктов примеров 25-29 приведены в табл. 4.
Пример 30. 11-бета-[4-[5-[(4,4,5,5,5-Пентафторпентил)тио] пентилокси]фенил]-эстра-1,3,5(10)-триен-3,17-бета-диол.
Работают по методике примера 8, но вводят в реакцию на стадии A 5-бромхлорпентан с 11-бета-/4-оксифенил/-эстра-4,9-диен-3,17-дионом, получают целевой продукт.
ИК-спектр (CHCl3 в Николет):
C = O отсутствует.
OH 3600 см-1.
Ароматика: 1625, 1613, 1570, 1511, 1500 см-1.
Пример 31. 11-бета-[4-[5-[(4,4,5,5,5-Пентафторпентил)сульфинил] - пентилокси]фенил]-эстра-1,3,5/10/-триен-3,17-бета-диол.
Работают по методике примера 9 и, исходя из продукта примера 30, получают целевое соединение.
ИК-спектр (CHCl3 в Николет):
OH 3606 см-1 + ассоциированные.
Ароматика: 1622, 1610, 1570, 1511, 1505 см-1.
Сульфоксид: 1030 см-1.
Пример 32. 11-бета-[4-[5-[(4,4,5,5,5-Пентафторпентил)сульфонил] - пентилокси]фенил]-эстра-1,3,5/10/-триен-3,17-бета-диол.
Работают по методике примера 9a, исходя из 225 мг продукта примера 30, получают 206 мг целевого продукта.
ИК-спектр (CHCl3):
OH 3604 см-1 + ассоциированные.
Ароматика: 1622 /плечо/, 1610, 1570, 1512 см-1.
SO2 1306, 1132 см-1.
Пример 33. 11-бета-[4-[5-(Пентилтил/пентилокси]фенил]-эстра- 1,3,5/10/-триен-3,17-бета-диол.
В раствор в 5 см3 10% воды в метаноле и 2 см3 тетрагидрофурана, предварительно дегазированный, вводят 465 мг продукта, полученного на стадии A примера 6, и 0,25 см3 трифенилфосфина. Перемешивают 1 ч при комнатной температуре, прибавляют 245 мкл иодпентана и 0,3 см3 концентрированного гидроксида натрия. Перемешивают 1 ч при 50oC, разбавляют этилацетатом, подкисляют 1 н. соляной кислотой, экстрагируют этилацетатом, промывают соленой водой, сушат и выпаривают растворитель. После хроматографии остатка на оксиде кремния (элюент: бензин G - этилацетат 70-30) получают 570 мг целевого продукта.
ИК-спектр (CHCl3):
OH: 3600 см-1.
Ароматика: 1610, 1582, 1511 см-1.
Пример 34. 11-бета-[4-[5-(Трифторметил)-4-хинолеинил] тио] пентилокси] фенил-экстра-1,3,5/10/-триен-3,17-бета-диол.
Перемешивают при 95oC в течение 43 ч 400 мг хлорпроизводного, полученного на стадии D примера 3, 300 мг 4-меркапто-7-трифторметилхинолина и 68 мг метилата натрия. Выпаривают растворитель при пониженном давлении, остаток обрабатывают 5% метанола в метиленхлориде, промывают раствор 2н. соляной кислотой, сушат и выпаривают растворитель. После хроматографии на оксиде кремния (элюент: этилацетат-бензин G - триэтиламин 70-30-1, потом этилацетат-триэтиламин 99-1), собирают 391 мг целевого продукта, который очищают новой хроматографией на оксиде кремния (элюент: метиленхлорид-метанол 97-3).
ИК-спектр (CHCl3):
OH: 3600 см-1.
Ароматика: 1610, 1582, 1512, 1505 см-1.
Гетероцикл: 1571, 1328, 1287, 1135, 1068 см-1.
Пример 35. 11-бета-[4-[4-[(4,4,5,5,5-Пентафторпентил)тио [бутилокси]фенил]-эстра-1,3,5/10/-триен-3,17-бета-диол.
Работают по методике стадии F примера 8, исходя из 262 мг 4,4,5,5,5-пентафториодпентана, полученного в примере 8, и 410 мг тиоцетата, приготовленного ниже. Получают 335 мг целевого продукта.
ИК-спектр (CHCl3):
OH: 3600 см-1.
Ароматика: 1610, 1581, 1512 см-1.
C2F5: возможный.
Приготовление 11-бета-[4-[[4-/ацетилтил/бутил] окси] фенил] -эстра -1,3,5/10/-триен-3,17-бета-диола, использованного в примере 35.
Стадия A. 11-бета-[4-[(4-Хлорбутил)окси]фенил]-эстра-4,9-диен- 3,17-дион.
Работают по методике стадии A примера 8, исходя из 11-бета-/4-оксифенил/-эстра-4,9-диен-3,17-диона и 1,04 см3 1-бром-4-хлорбутана. Получают 630 мг целевого продукта. Т.пл. 194oC.
Стадия B. 3-окси-11-бета-[4-[(4-Хлорбутил)окси]фенил]-эстра- 1,3,5/10-триен-17-он.
Работают по методике стадий B и C примера 3, исходя из 1,35 мг продукта, полученного на стадии A выше, используя 1,4 см3 уксусного ангидрида и 0,7 см3 ацетилбромида. Получают 1,48 г целевого продукта.
Стадия C. 11-бета-[4-[(4-Хлорбутил)окси]фенил]-эстра- 1,3,5/10/-триен-3,17-бета-диол.
Работают по методике стадии D примера 3, исходя из 1,48 г продукта, полученного выше, используя 60 мг бромгидрида натрия. Получают после хроматографии на оксиде кремния (элюент: бензин G - этилацетат 6/4) и перекристаллизации из изопропилового эфира 955 мг целевого продукта. Т.пл. 194oC.
Стадия D. 11-бета-[4-[(4-Иодбутил)окси]фенил]-эстра- 1,3,5/10/-триен-3,17-бета-диол.
Работают по методике стадии D примера 8, исходя из 890 мг продукта, полученного выше, 600 мг иодида натрия и 10 см3 метилэтилкетона. Получают 1,19 г целевого продукта
Стадия E. 11-бета-[4-[(4-Тиоацетил)бутил]окси]фенил]-эстра- 1,3,5/10/-триен-3,17-бета-диол.
Работают по методике стадии E примера 8, исходя из 1,18 г продукта, полученного на стадии D, и 460 мг тиоацетата калия. Получают 850 мг целевого продукта. Т.пл. = 90oC.
Стадия 36. 11-бета-[4-[4-[(4,4,4-Трифторпентил)тио]бутилокси] фенил]-эстра-1,3,5/10/-триен-3,17-бета-диол.
Работают по методике стадии F примера 8, исходя из 317 мг 4,4,4-трифтор-1-иодбутана и 410 мг тиоацетата, полученного, как указано в приготовлении 35. Получают 335 мг целевого продукта.
ИК-спектр (CHCl3):
OH: 3615 см-1.
Ароматика: 1610, 1579, 1512, 1501 см-1.
Стадия 37. 11-бета-[4-[5-[(4,4,4-Трифторбутил)тио]пентилокси] фенил]-эстра-1,3,5/10/-триен-3,17-бета-диол.
Работают по методике стадии F примера 8, исходя из 393 мг 4,4,4-трифтор-1-иодбутана и 784 мг тиоацетата, полученного во время приготовления примера 28. Получают 640 мг целевого продукта.
ИК-спектр (CHCl3):
OH: 3601 см-1.
Ароматика: 1610, 1580, 1512 см-1.
Пример 38. 11-бета-[4-[6-[(4,4,4-трифторбутил]тио]гексилокси]- фенил]-эстра-1,3,5/10/-триен-3,17-бета-диол.
Работают по методике стадии F примера 8, исходя из 262 мг 4,4,4-трифтор-1-иодбутана и 523 мг тиоацетата, полученного на стадии E примера 8. Получают 380 мг целевого продукта.
ИК-спектр (CHCl3):
OH: 3602 см-1.
Ароматика: 1610, 1580, 1512 см-1.
Пример 39. 11-бета-[9-[(4,4,5,5,5-пентафторпентил] тио]нонил]-эстра-1,3,5/10/-триен-3,17-бета-диол.
Растворяют 446 мг трифенилфосфина в 2 см3 метиленхлорида, охлаждают до 10oC, прибавляют 116 мг имидазола, перемешивают 15 мин, прибавляют 431 мг иода, перемешивают 30 мин, прибавляют 0,21 см3 4,4,5,5,5-пентафтор-2-пентен-1-ола, перемешивают 4 ч при комнатной температуре, промывают органическую фазу водным насыщенным раствором тиосульфата натрия и получают метиленхлоридный раствор 4,4,5,5,5-пентафториодпентана, используемого как таковой в последующем синтезе. Работают по методике стадии F примера 8, исходя из 618 мг тиоацетата, полученного ниже, в 7 см3 метанола и метиленхлоридного раствора иодированного производного, полученного выше. Получают 1,2 г целевого продукта.
ИК-спектр (CHCl3):
OH: 3601 см-1.
Ароматика: 1609, 1585, 1501 см-1.
CF2-CF3: возможные.
Приготовление 11-бета-[9-/ацетилтио/нонил] -эстра-1,3,5/10/- триен-3,17-бета-диола примера 39.
Стадия A. [(9-бромнонил)окси]диметил-[(1,1-диметил)этил]силан
Охлаждают до 0oC 443,5 г бромнонанола в 2090 см3 метиленхлорида, 314 см3 триэтиламина и 4,58 г диметиламинопиридина. Прибавляют в течение 25 мин 318 г трет-бутилдиметилсилилхлорида, растворенного в 586 см3 метиленхлорида. Перемешивают в течение 17 ч, фильтруют, выпаривают растворитель, остаток обрабатывают гексаном, промывают 0,1н. водным раствором соляной кислоты, потом соленой водой. Выпаривают растворитель и получают 620 г сырого продукта, который перегоняют, и собирают 570 г чистого продукта (т.кип. 110-130oC при 0,15-0,20 мбар).
Стадия B. 11-бета-[9-Оксинонил]эстра-4,9-диен-3,17-дион.
Охлаждают до 0o/+2oC 5,2 см3 раствора магниевого соединения (0,42 моль/л), полученного из продукта стадии A, и 2,3 см3 тетрагидрофурана. Прибавляют 30 мг хлорида меди, перемешивают 30 мин, охлаждают до -30oC и прибавляют 330 мг 3-этилендиокси-5/10/-эпокси-эстр-9/11/-ен-17-она, растворенного в 2 см3 тетрагидрофурана, и перемешивают 45 мин. Прибавляют 6 см3 соляной кислоты и перемешивают 2 ч при комнатной температуре. Выливают в водный насыщенный раствор бикарбоната натрия, экстрагируют этилацетатом, промывают соленой водой, сушат и выпаривают растворитель. После хроматографии остатка на оксиде кремния (элюент: этилацетат-циклогексан 6-4), получают 192 мг целевого продукта.
Стадия C. 11-бета-[9-(4-Метилбензолсульфонилокси)нонил]эстра-4,9-диен-3,17-дион.
Перемешивают в течение 1,5 ч 13,35 г продукта, полученного как указано на стадии B, 65 см3 пиридина, 12,33 г тозил-хлорида и 0,573 г диметиламинопиридина. Выливают в воду, экстрагируют этилацетатом, промывают соленой водой, сушат, выпаривают растворитель, хроматографируют остаток на оксиде кремния (элюент: этилацетат-циклогексан 4-6) и получают 11,79 г целевого продукта.
Стадия D. 3-окси-11-бета-[9-(4-Метилбензолсульфонилокси)нонил]эстра-1,3,5/10/ триен-17-он.
Работают по методике стадий B и C примера 3, исходя из 11,09 г диенона, полученного на стадии C ранее. Получают 9,6 г сырого продукта, который очищают хроматографией на оксиде кремния (элюент: этилацетат-циклогексан 3-7). Получают 9,48 г целевого продукта.
Стадия E. 11-бета-[9-(4-Метилбензолсульфонилокси)нонил]эстра-1,3,5/10/- триен-3,17-бета-диол.
Работают по методике стадии D примера 3, исходя из 889 мг продукта, полученного на стадии D, и получают 890 мг целевого продукта.
Стадия F. 11-бета-[9-/Ацетилтио/нонил] -эстра-1,3,5/10/-триен-3,17-бета-диол.
Работают по методике стадии E примера 8, исходя из 1 г продукта, полученного на стадии E, и 402 мг тиоацетата калия. После хроматографии на оксиде кремния (элюент: этилацетат-циклогексан 3-7) получают 636 мг целевого продукта.
ИК-спектр: (CHCl3):
OH: 3602 см-1
Ароматика: 1610, 1584, 1499 см-1.
Пример 40. 11-бета-[4-[2-[2-[(4,4,5,5,5-пентафторпентил)тио]-этокси]-этокси] фенил]-эстра-1,3,5/10/-триен-3,17-бета-диол.
Работают по методике стадии F примера 8, исходя из 194 мг 4,4,5,5,5-пентафториодпентана, полученного в примере 8, и 313 мг тиоацетата, полученного выше. Получают 330 мг целевого продукта.
ИК-спектр (CHCl3):
OH: 3600 см-1.
Ароматика: 1610, 1584, 1512 см-1
Получение 11-бета-[4-[2-[2-(ацетилтио)этокси] этокси] фенил] -эстра-1,3,5/10/-триен-3,17-бета-диола.
Стадия A. 2-[2-[[1,1-Диметилэтил)диметилсилил]окси]этокси]- этанол.
Прибавляют 20 г диэтиленгликоля к 9,07 г гидрида натрия в 320 см3 тетрагидрофурана, перемешивают 45 мин, прибавляют 28,3 г диметилтетрабутилсилана, перемешивают 3 ч, оставляя при комнатной температуре. Экстрагируют эфиром, промывают водным раствором бикарбоната натрия, соленой водой, сушат и выпаривают растворитель. Получают 40,25 г целевого продукта.
Стадия B. [2-(2-Бромэтокси)этокси](1,1-диметилэтил)диметилсилан.
Прибавляют в течение 15 мин при -15o/-20oC 18,2 г четырехбромистого углерода к смеси, содержащей 11,2 г продукта стадии A и 14,4 г трифенилфосфина в 100 см3 метиленхлорида. Перемешивают в течение 1 ч 15 мин при -15oC, выпаривают растворитель, обрабатывают пентаном, перемешивают при комнатной температуре, отфильтровывают, промывают пентаном и сушат при 50oC при пониженном давлении.
Получают 10,1 г целевого продукта (т.кип. 58oC/0,04 мбар).
Стадия C. 11-бета-[4-[2-[2-[[(1,1-Диметилэтил)-диметилсилил] окси]-этокси]этокси]фенил]-эстра-4,9-диен-3,17-дион.
Прибавляют 412 мг продукта, полученного на стадии B, в растворе в 2 см3 диметилформамида к 362 мг смеси, состоящей из 362 мг 11-бета-/4-оксифенил/-4,9-эстра-диен-3,17-диона, 4 см3 диметилформамида и 55 мг гидрида натрия. Перемешивают 3 ч при комнатной температуре, прибавляют водный раствор хлорида аммония, экстрагируют этилацетатом, промывают соленой водой, сушат и выпаривают растворитель. После хроматографии на оксиде кремния (элюент: этилацетат-бензин G-6-4), получают 400 мг целевого продукта.
Стадия D. 11-бета-[4-[2-(2-Оксиэтокси)этокси] фенил]-эстра-4,9- диен-317-дион.
Прибавляют 1,3 см3 2н. соляной кислоты к 740 мг продукта, полученного на стадии C, в растворе в 8 см3 метанола. Перемешивают 1 ч, выпаривают растворитель, обрабатывают этилацетатом, промывают водным раствором бикарбоната натрия, соленой водой, сушат и выпаривают растворитель. Получают 595 мг целевого продукта.
Стадия E. 11-бета-[4-[2-[2-[(4-Метилбензолсульфонил)окси]этокси] этокси] фенил]эстра-4,9-диен-3,17-дион.
К 690 мг продукта, полученного на стадии D, в 5 см3 пиридина прибавляют 320 мг тозилхлорида и 70 мг диметиламинопиридина, потом снова 2 раза 115 мг тозилхлорида. Перемешивают 2,5 ч, подкисляют 6н. соляной кислотой, экстрагируют этилацетатом, промывают водным раствором бикарбоната натрия, соленой водой, сушат и выпаривают растворитель при пониженном давлении, хроматографируют остаток на оксиде кремния (элюент: этилацетат-бензин G7-3, потом этилацетат).
Получают 710 мг целевого продукта.
Стадия F. 3-Окси-11-бета[4-[2-[2-[[(4-метилбензолсульфонил)окси] -этокси]этокси]фенил]-эстра-1,3,5/10/-триен-17-он.
Работают по методикам стадий B и C примера 3, исходя из 705 мг диенона, полученного на стадии E ранее. Получают 785 мг целевого продукта.
Стадия G. 11-бета-[4-[2-[3-[4-Метилбензолсульфонил)окси]этокси] -этокси] фенил]-эстра-1,3,5/10/-триен-3,17-бета-диол.
Работают по методике стадии D примера 3, исходя из 785 мг продукта, полученного на стадии F выше, получают 434 мг целевого продукта после хроматографии на оксиде кремния (элюент: этилацетат-бензин G 6-4).
Стадия H. 11-бета-[4-[2-[2-(ацетилтио)этокси] этокси] фенил] - эстра-1,3,5/10/-триен-3,17-бета-диол.
Работают по методике стадии E примера 8, исходя из 432 мг продукта, полученного на стадии G выше, и 163 мг тиоацетата калия. Получают после хроматографии на оксиде кремния (элюент: этилацетатбензин G 6-4) 325 мг целевого продукта.
ИК-спектр (CHCl3):
OH: 3601 см-1.
S-C=0: 1689 см-1.
Ароматика: 1610, 1583, 1512 см-1.
Пример 41. 11-бета [4-[5-[(3,3,4,4,4- Пентафторбутил)тио]пентилокси]фенил]-эстра-1,3,5/10/-триен-3,17-бета-диол.
Смешивают 589 мг меркаптана, полученного по методике стадии Ba примера 6, 790 мг 3,3,4,4,4-пентафториодбутана (полученного, как указано для пентафториодпентана в примере 8), 820 мг карбоната цезия и 6 см3 диметилформамида. Нагревают 1 ч при 50oC, охлаждают до комнатной температуры, подкисляют 2н. соляной кислотой, экстрагируют этилацетатом, промывают соленой водой и выпаривают растворитель. После хроматографии на оксиде кремния (элюент: бензин G-этилацетат 6-4) получают 360 мг целевого продукта.
ИК-спектр (CHCl3):
OH: 3600 см-1.
Ароматика: 1610, 1582, 1512 см-1.
Пример 42. 11-бета [4-[6-[(3,3,4,4,4- Пентафторбутил)тио]гексилокси] фенил]эстра-1,3,5/10/-триен-3,17-бета-диол.
Работают по методике примера 41, исходя из 540 мг соответствующего маркаптана (полученного, как указано в примере 6), 700 мг иодного реагента и 730 мг карбоната цезия. Получают 247 мг целевого продукта.
ИК-спектр (CHCl3):
OH: 3608 см-1.
Ароматика: 1610, 1580, 1512, 1503 /пл./ см-1.
Работают по методике примера 9, используя соответствующий исходный диол, содержащий цепь с серосодержащей группой в положении 11, и метапериодат натрия, получают продукты примеров 43 - 53.
Пример 43. 3,7-Дигидро-7-[2-[[5-[4-(3,17-бета-диокси- эстра-1,3,5/10/-триен-11-бета-ил)фенокси] пентил]сульфинил]этил]- 1,3-диметил-1H-пурин-2,6-дион.
ИК-спектр (CHCl3):
OH: 3605 см-1.
C=O: 1704, 1657 см-1.
Сопряженная система + ароматика: 1608, 1581, 1551, 1512 см-1.
S _→ 0 ≈ 1031 см-1.
Пример 44. 11-бета [4-[6-[(4,4,4- Трифторбутил)сульфинил]гексилокси] фенил]-эстра-1,3,5/10/-триен-3,17- бета-диол.
ИК-спектр (CHCl3):
OH ≈ 3604 см-1.
Ароматика: 1610, 1581, 1512 см-1.
S _→ 0 ≈ 1031 см-1.
Пример 45. 11-бета [4-[5-[(4,4,4- Трифторбутил)сульфинил]пентилокси] фенил]-эстра-1,3,5/10/-триен-3,17- бета-диол.
ИК-спектр (CHCl3):
OH: 3607 см-1.
Ароматика: 1610, 1580, 1512 см-1.
 1030 см-1.
1030 см-1.
Пример 46. 11-бета [4-[6-[(2,2,2- Трифторэтил)сульфинил]гексилокси]фенил]-эстра-1,3,5/10/-триен-3,17- бета-диол.
ИК-спектр (CHCl3):
OH ≈ 3602 см-1 + ассоциированные.
Ароматика: 1610, 1581, 1512 см-1.
S _→ 0 ≈ 1044 см-1.
Пример 47. 11-бета [4-[4-[(4,4,4- Трифторбутил)сульфинил]бутилокси]фенил]-эстра-1,3,5/10/-триен-3,17- бета-диол.
ИК-спектр (CHCl3):
OH ≈ 3603 см-1.
Ароматика: 1610, 1581, 1512 см-1.
S _→ 0 ≈ 1030 см-1.
Пример 48. 11-бета-[4-[4-[(4,4,5,5,5- Пентафторпентил)сульфинил]бутилокси]фенил]-эстра-1,3,5/10/-триен-3,17- бета-диол.
ИК-спектр (CHCl3):
OH ≈ 3598 см-1.
Ароматика: 1610, 1584, 1512 см-1.
S _→ 0 ≈ 1031 см-1.
Пример 49. 11-бета-[4-[5-(Пентилсульфинил)пентилокси] фенил] - эстра-1,3,5/10/-триен-3,17-бета-диол.
ИК-спектр (CHCl3):
OH ≈ 3605 см-1.
Ароматика: 1610, 1581, 1512 см-1.
S _→ 0 ≈ 1020 см-1.
Пример 50. 11-бета-[9-[(4,4,5,5,5- (Пентафторпентил)сульфинил]нонил]-эстра-1,3,5/10/-триен-3,17-бета-диол.
ИК-спектр (CHCl3):
OH ≈ 3598 см-1.
Ароматика: 1614, 1608, 1580, 1499 см-1.
S _→ 0 ≈ 1020 см-1
Пример 51. 11-бета-[4-[5-[(3,3,4,4,4- (Пентафторбутил)сульфинил]пентилокси]фенил]-эстра-1,3,5/10/- триен-3,17-бета-диол.
ИК-спектр (CHCl3):
OH: 3596 см-1.
Ароматика: 1610, 1580, 1512 см-1.
Пример 52. 11-бета-[4-[6-[(3,3,4,4,4-пентафторбутил)сульфинил]- гексилокси]фенил]-эстра-1,3,5/10/-триен-3,17-бета-диол.
ИК-спектр (CHCl3):
OH ≈ 3506 см-1.
Ароматика: 1610, 1580, 1512 см-1.
S _→ 0 1043 см-1.
Пример 53. 11-бета-[4-[2-[2-[(4,4,5,5,5-пентафторпентил) сульфинил]-этокси]фенил]-эстра-1,3,5/10/-триен-3,17-бета-диол.
ИК-спектр (CHCl3):
OH ≈ 3606 см-1.
Ароматика: 1610, 1580, 1512 см-1.
S _→ 0 ≈ 1044 см-1.
Работают по методике примера 9a, исходя из 183 мг продукта, полученного, как указано в примере 34, и 172 мг перфталевой кислоты, получают продукт примеров 54 и 55.
Пример 54. 11-бета-[4-[5-[7-(Трифторметил)-4-хинолеинил]- сульфинил]пентилокси]фенил]-эстра-1,3,5/10/-триен-3,17-бета-диол.
ИК-спектр (CHCl3):
OH ≈ 3602 см-1 + ассоциированные.
Ароматика + гетероцикл: 1610, 1583, 1511 см-1.
S _→ 0 1056 см-1.
Пример 55. 11-бета-[4-[5-[7-(Трифторметил)-4-хинолеинил]- сульфонил]пентилокси]фенил]-экстра-1,3,5/10/-триен-3,17-бета-диол.
ИК-спектр (CHCl3):
OH ≈ 3604 см-1 + ассоциированные.
Ароматика + гетероцикл: 1610, 1583, 1511 см-1.
SO2 ≈ 1336 /пл./ и 1160 см-1.
Пример 56. 11-бета-[4-[5-[(4,4,4-Трифторбутил)сульфонил] пентилокси]фенил]-эстра-1,3,5/10/-триен-3,17-бета-диол.
Прибавляют 255 мг мета-хлорпербензойной кислоты в 250 мг диола, полученного по методике примера 37 в 6 см3 метиленхлорида, охлажденного до +4oC. Перемешивают 45 мин, прибавляют тиосульфат натрия, потом раствор бикарбоната натрия, декантируют, выпаривают растворитель, хроматографируют остаток на оксиде кремния (элюент: этилацетат-бензин G 6-4), получают 210 мг целевого продукта.
ИК-спектр (CHCl3):
OH ≈ 3604 см-1.
Ароматика: 1610, 1580, 1512 см-1.
SO2: 1309 и 1136 см-1.
Работая по методике примера 56 и используя соответствующий исходный диол, содержащий цепь с серусодержащей группой в положении 11, и мета-хлорпербензойную кислоту, получают продукты примеров 57-67.
Пример 57. 11-бета-[4-[6-[(4,4,4-Трифторбутил)сульфонил] гексилокси]фенил]-эстра-1,3,5/10/-триен-3,17-бета-диол.
ИК-спектр (CHCl3):
OH ≈ 3602 см-1.
Ароматика: 1610, 1581, 1512 см-1.
SO2: 1306 и ≈1135 см-1.
Пример 58. 11-бета-[4-[4-[(4,4,5,5,5-Пентафторпентил)сульфонил] бутилокси]фенил]-эстра-1,3,5/10/-триен-3,17-бета-диол.
ИК-спектр (CHCl3):
OH ≈ 3605 см-1.
Ароматика: 1610, 1582, 1512 см-1.
SO2: 1305 и ≈ 1132 см-1.
Пример 59. 11-бета-[4-[4-[(4,4,4-Трифторбутил)сульфонил) бутилокси]фенил]-эстра-1,3,5/10/-триен-3,17-бета-диол.
ИК-спектр (CHCl3):
OH/NH комплекс поглощения.
Ароматика: 1610, 1580, 1511 см-1.
SO2: 1296 и 1134 см-1.
Пример 60. 11-бета-[4-[4-(Пентилсульфонил)пентилокси] фенил] - эстра-1,3,5/10/-триен-3,17-бета-диол.
ИК-спектр (CHCl3):
OH: 3600 см-1.
Ароматика: 1610, 1584, 1512 см-1.
SO2: 1297 и 1130 см-1.
Пример 61. 11-бета-[9-[(4,4,5,5,5-Пентафторпентил)сульфонил) нонил]-эстра-1,3,5/10/-триен-3,17-бета-диол.
ИК-спектр (CHCl3):
OH: 3601 см-1.
Ароматика: 1609, 1584, 1500 см-1.
SO2: 1309 и 1134 см-1.
Пример 62. 11-бета-[4-[5-[(3,3,4,4,4-Пентафторбутил)сульфонил]- пентилокси]фенил]-эстра-1,3,5/10/-триен-3,17-бета-диол.
ИК-спектр (CHCl3):
OH: 3596 см-1.
Ароматика: 1610, 1580, 1512 см-1.
Пример 63. 11-бета-[4-[6-[(3,3,4,4,4-Пентафторбутил)сульфонил]- гексилокси]фенил]-эстра-1,3,5/10/-триен-3,17-бета-диол.
ИК-спектр (CHCl3):
OH: 3600 см-1.
Ароматика: 1610, 1580, 1512, 1504 см-1.
SO2: 1298 и 1134 см-1.
Пример 64. 11-бета-[4-[2-[2-[(4,4,5,5,5-Пентафторпентил) сульфонил]этокси]фенил]-эстра-1,3,5/10/-триент-3,17-бета-диол.
ИК-спектр (CHCl3):
OH: 3600 см-1.
Ароматика: 1610, 1580, 1512 см-1.
SO2: 1317 и 1129 см-1.
Пример 65. 11-бета-[4-[5-[(7-(Трифторметил)-4-хинолеинил] сульфинил]пентилокси]фенил]-эстра-1,3,5/10/-триент-3,17-бета-диол.
Этот продукт является идентичным продукту, полученному в примере 54.
ИК-спектр (CHCl3):
OH ≈ 3602 см-1 + ассоциированные.
Ароматика: 1610, 1583, 1511 см-1.
S _→ 0 1056 см-1.
Пример 66. 3-окси-11-бета-[4-[5-[(4,4,5,5,5-Пентафторпентил) сульфинил] пентилокси] фенил] -эстра-1,3,5/10/-триент-3,17-бета-ил- бутандиоат и натриевая соль.
а/ Получение кислоты.
Перемешивают 4 ч при 120oC 380 мг продукта, полученного в примере 31, 355 мг янтарного ангидрида, 40 мг диметиламинопиридина и 4 см3 пиридина. Дают остыть до комнатной температуры, прибавляют 4 см3 метанола, 4 см3 воды и 650 мг карбоната калия. Перемешивают 6,5 ч, охлаждают до 4oC, подкисляют соляной кислотой, экстрагируют этилацетатом, промывают солевой водой, сушат и выпаривают растворители. После хроматографии на оксиде кремния (элюент: бензин G - ацетон 5-5), получают 400 мг кислоты.
ИК-спектр (CHCl3):
OH ≈ 3600 см-1 + поглощение общего типа OH кислоты.
C=O: 1717 см-1 + комплекс.
Ароматика: 1610, 1585, 1512 см-1.
б/ Получение соли.
Растворяют 367 мг кислоты, полученной выше, в 4 см3 этанола, прибавляют 36 мг бикарбоната натрия, растворенного в 4 см3 воды, перемешивают 30 мин, выпаривают этанол, прибавляют 20 см3 воды, фильтруют, потом лиофилизируют. Собирают 250 мг целевого продукта.
Пример 67. 3-окси-11-бета-[4-[5-[(4,4,5,5,5-Пентафторпентил) сульфонил] пентилокси] фенил]-эстра-1,2,5/10/-триен-17-бета-ил- бутандиоат и его натриевая соль
Работают по методике примера 66, исходя из 290 мг продукта примера 32, получают 285 мг продукта в виде кислоты.
ИК-спектр (CHCl3):
OH: 3598, 3518 см-1 + общее поглощение.
C=O: 1716 см-1.
Ароматика: 1610, 1582, 1512 см-1.
SO2: 1304, 1133 см-1.
Переводят в соль 273 мг кислоты, в результате получают 235 мг сырого продукта, учитывая, что он очищен хроматографией на оксиде кремния (элюент: метанол-вода 8-2).
Пример 68. 3-Циклопентилокси-11-бета-[4-[5-[4,4,5,5,5- Пентафторпентил)сульфинил]пентилокси]фенил]-эстра-1,2,5/10/-триен- 17-бета-ол.
Перемешивают в течение 30 мин 1 г продукта, полученного в примере 31, 8,7 см3 диметилформамида и 82 мг гидрида натрия. Потом прибавляют 486 мг циклопентил-метилбензолсульфоната, перемешивают 5 ч, выливают в водный раствор хлорида аммония, экстрагируют этилацетатом, промывают соленой водой, сушат и выпаривают растворитель. Хроматографируют остаток на оксиде кремния (элюент: метиленхлорид-изопропанол 95-5) и получают 861 мг продукта, который кристаллизуют из смеси метиленхлорида/этилового эфира, собирают 777 мг целевого продукта. Т.пл.189oC.
ИК-спектр (CHCl3):
OH≈ 3608 см-1
Ароматика: 1610, 1580, 1570, 1512, 1498 см-1
S _→ 0 ≈ 1043 см-1.
Получение циклопентил-4-метилбензолсульфоната.
Перемешивают 3 ч при комнатной температуре 1 г циклопентанола, 23 см3 пиридина, 4,42 г тозилхлорида и 195,8 мг 4-диметиламинопиридина, выпаривают пиридин, выливают в воду, экстрагируют этилацетатом, промывают молярным водным раствором соляной кислоты, потом соленой водой и насыщенным водным раствором бикарбоната натрия. Выпаривают растворители, растворяют в метаноле, снова прибавляют бикарбонат натрия, выпаривают, хроматографируют остаток на оксиде кремния (элюент: этилацетат-бензин G 1-9) и получают 1,41 г целевого тозилата.
Пример 69: 3-Циклогексилокси-11-бета-[4-[5-[(4,4,5,5,5-пентафторпентил) сульфонил]пентилокси]фенил]-эстра-1,3,5/10/-триен-17-бета-ол.
Работают по методике примера 56, используя 698 мг продукта, полученного в примере 68, и 228 мг мета-хлорпербензойной кислоты, получают 567 мг целевого продукта. Т.пл. 166oC.
ИК-спектр (CHCl3):
OH≈ 3608 см-1
Ароматика: 1610, 1580, 1512, 1498 см-1
Пример 70: 3-Циклопентилокси-11-бета-[4-[5-[(4,4,5,5,5 -пентафторпентил)сульфонил] пентилокси]фенил]-эстра-1,3,5/10/ -триен-17-бета-илбутандиоат и его натриевая соль.
Работает по методике примера 66, исходя из 384 мг продукта, полученного по методике примера 68, получают 301 мг кислоты после кристаллизации из смеси метиленхлорида/изопропилового эфира. Т.пл. 188oC.
ИК-спектр (CHCl3)
C=O: 1716 см-1
Ароматика: 1610, 1580, 1572, 1512, 1498 см-1
Переводят в соль 285,5 мг полученной кислоты, получают 295 мг целевого продукта после лиофилизации.
ИК-спектр (CHCl3):
OH/NH: общее поглощение.
C=O: 1724 см-1
Ароматика: 1609, 1510, 1498 см-1
COO-≈ 1578 cv-1.
Пример 71: 3-окси-11-бета-[4-[5-[(4,4,5,5,5, -Пентафторпентил)тио]-пентилокси]фенил]-эстра-1,3,5/10/-триен-17-бета-он.
Стадия А: 3-Окси-11-бета-[4-[(5-иодпентил)окси] фенил]-эстра-1,3,5,-/10/-триен-17-он.
Работают по методике стадии D примера 8, используют 14,9 г продукта, полученного по методике примера 3C. Получают 13,2 г целевого продукта. Rf= 0,18 (циклогексан-этилацетат 7-3).
Стадия B. 3-Окси-11-бета-[4-[[5-(тиоацетил)пентил]окси]фенил]-эстра-1,3,5/10/триен-17-он.
Работают по методике стадии E примера 8, используя 13,2 г продукта, полученного на стадии A. Получают 9 г целевого продукта. Rf= 0,58 (циклогексан-этилацетат 7-3).
Стадия C: 3-Окси-11-бета-[4-[5-[(4,4,5,5,5-пентафторпентил)тио]-пентилокси]фенил]-эстра-1,3,5/10/триен-17-он.
Работают по методике стадии F примера 8, используя 9 г продукта, полученного на стадии B. Получают 8,63 г целевого продукта. Rf= 0,6 (циклогексан-этилацетат 6-4).
Пример 72: 3-Окси-11-бета-[4-[5-[(4,4,5,5,5, -пентафторпентил)сульфинил] пентилокси]фенил]-эстра-1,3,5/10/ -триен-17-он.
Работают по методике примера 9, используя 180 мг продукта, полученного в примере 71. Получают 120 мг целевого продукта. R=0,37 (метиленхлорид-метанол 95-5).
Пример 73: 3-Окси-11-бета-[4-[5-[(4,4,5,5,5 -пентафторпентил)-сульфонил] пентилокси]фенил]-эстра-1,3,5/10/-триен-17-он.
Работают по методике примера 56, используя 180 мг продукта, полученного в примере 71, и 162 мг мета-хлорпербензойной кислоты. Получают 160 мг целевого продукта.
Пример 74: 17-Метилен-11-бета-[4-[5-[(4,4,5,5,5 -пентафторпентил)-сульфонил]пентилокси]фенил]-эстра-1,3,5/10/-триен-3-ол.
Прибавляют 500 мг продукта, полученного в примере 73, в смесь, состоящую из 815 мг метилтрифенилфосфонийбромида, 5 см3 диоксана и 125 мг метилата натрия. Перемешивают 16 ч при комнатной температуре, прибавляют 100 см3 водного раствора хлорида аммония, экстрагируют метиленхлоридом, сушат, удаляют растворитель при пониженном давлении, хроматографируют остаток на оксиде кремния (элюент: циклогексан-этилацетат 7-3). Получают 80 мг целевого продукта.
ИК-спектр (CHCl3):
Мало или C=0.
OH: 3596 см-1.
C=C: 1656 см-1.
Ароматика: 1610, 1580, 1512 см-1.
Пример 75. 17-бета-(Оксиметил)-11-бета-[4-[5-[(4,4,5,5,5 -пентафторпентил)сульфонил]пентилокси]фенил]-эстра-1,3,5/10/-триен-3-ол.
Охлаждают до +4oC 60 мг продукта, полученного в примере 74, в ... см3 тетрагидрофурана и прибавляют 100 мкл сульфида диметилборана. Перемешивают 2 ч при комнатной температуре, охлаждают до 0oC, прибавляют 200 мкл гидроксида натрия, потом 200 мкл 30%-ной перекиси водорода. Дают нагреться до комнатной температуры, потом подкисляют раствором соляной кислоты. Экстрагируют метиленхлоридом, сушат, удаляют растворитель, хроматографируют остаток на оксиде кремния (элюент: этилацетат-циклогексан 3-7), получают 35 мг целевого продукта.
ИК-спектр (CHCl3):
OH фенольный: 3590 см-1.
Ароматика: 1610, 1580, 1511 см-1.
C=C или C=O сопряженные ≈ 1660 см-1.
Пример 76. Оксим 3-окси-11-бета-[4-[5-[(4,4,5,5,5 -пентафторпентил)сульфонил]пентилокси]фенил]эстра-1,3,5/10/-триен-17-она.
К 1 г продукта, полученного в примере 73, прибавляют смесь, состоящую из 30 см3 этанола и 5 см3 воды, потом 320 мг солянокислого гидроксиламина и 501 ацетата натрия. 2 ч кипятят с обратным холодильником, прибавляют 50 см3 воды, экстрагируют метиленхлоридом, сушат, удаляют растворитель при пониженном давлении, кристаллизуют остаток из изопропилового эфира, фильтруют, хроматографируют остаток на оксиде кремния (элюент: циклогексан-этилацетат 7-3), получают 90 мг целевого продукта.
ИК-спектр (CHCl3):
OH: 3593 см-1 + ассоциированные.
Ароматика: 1610, 1582, 1512 /пл./ см-1.
Пример 77. Гидразон 3-окси-11-бета [4-[5-[(4,4,5,5,5 -пентафторпентил)сульфонил]пентилокси]фенил]-эстра-1,3,5/10/-триен-17-она.
Прибавляют 100 мкл гидразингидрата и 3 мг пара-толуолсульфоновой кислоты к 300 мг продукта, полученного в примере 73, к 3 см3 метанола. Перемешивают 16 ч при комнатной температуре, прибавляют 50 см3 водного раствора бикарбоната натрия, экстрагируют метиленхлоридом, выпаривают растворитель, хроматографируют остаток на оксиде кремния (элюент: этилацетат), получают 190 мг целевого продукта.
ИК-спектр (CHCl3):
OH: 3599 см-1.
NH2: 3395 см-1.
C=N и ароматика: 1610, 1588, 1512, 1503 см-1.
Пример 78. 11-бета-[4-[5-[(4,4,5,5,5 -Пентафторпентил)сульфонил]-пентилокси]фенил]-17-альфа-метилэстра-1,3,5/10/ -триен-3,17-бета-диол.
Дегидратируют в течение 2 ч при 180oC при пониженном давлении гептагидрат хлорида цезия, дают остыть, вводят 1,5 г в 15 см3 тетрагидрофурана, перемешивают 1 ч, прибавляют при -60oC 4 см3 метиллития, растворенного в 1,5 М простого эфира, перемешивают 30 мин, охлаждают до -78oC и прибавляют 300 мг продукта, полученного в примере 71. Перемешивают 1 ч при - 78oC, прибавляют водный раствор хлорида аммония, экстрагируют метиленхлоридом, выпаривают растворитель, хроматографируют остаток на оксиде кремния (элюент: циклогексанэтилацетат 7-3), получают 198 мг 17-метильного производного. Работают по методике примера 56, исходя из 198 мг продукта, полученного выше, и 150 см3 мета-хлорпербензойной кислоты, получают 62 мг целевого продукта. Rf = 0,37 (циклогенксан-этилацетат 1-1).
Пример 79. 3-(Циклопентилокси)-11-бета-[4-[5-[(4,4,5,5,5- пентафторпентил)сульфонил]пентилокси]фенил]-эстра-1,3,5/10/- триен-17-он.
Работают по методике примера 68, используя 300 мг продукта, полученного в примере 71, и 170 мг циклопентил-4-метилбензолсулфоната. Экстрагируют метиленхлоридом полученную реакционную среду, сушат, выпаривают растворитель, хроматографируют остаток на оксиде кремния (элюент: этилацетат-циклогексан 3-7), получают 290 мг целевого продукта используемого как таковой.
Пример 80. 3-/Циклопентилокси/-11-бета-[4-[5-[(4,4,5,5,5- пентафторпентил)сульфонил] пентилокси]фенил]-19-нор-17-альфапрегна- 1,3-5/10/-триен-20-ин-17-бета-ол.
Охлаждают до -78oC 150 мкл триметилсилилацетилена в 5 см3 тетрагидрофурана и прибавляют по каплям 625 мл раствора н-бутиллития в гексане (1,6 М). Перемешивают 30 мин, прибавляют 140 мг продукта, полученного в примере 79, растворенного в 1 см3 тетрагидрофурана, перемешивают 2 ч при комнатной температуре. Прибавляют 2 см3 1 М раствора тетрабутиламмонийфторида в тетрагидрогидрофуране. Перемешивают 1 ч при комнатной температуре, прибавляют 10 см3 воды, экстрагируют метиленхлоридом, сушат и выпаривают растворитель. После хроматографии на оксиде кремния (элюент: циклогексан-этилацетат 7-3), получают 60 мг целевого продукта.
Пример 81. 17-альфа-Этинил-11-бета-[4-[5-[(4,4,5,5,5,-пента- фторпентил)тио]пентилокси]фенил]-эстра-1,3,5/10/-триен-3,17-бета- диол.
Прибавляют 126 мг ацетиленида лития в виде комплекса с этилендиамином /Z:-C≡CH.ЕДА/ к 1 г продукта, полученного в примере 71, в 10 см3 тетрагидрофурана и перемешивают 12 ч при комнатной температуре. Выливают в насыщенный раствор хлорида аммония, экстрагируют метиленхлоридом, промывают 1н раствором соляной кислоты, сушат и удаляют растворитель. После хроматографии на оксиде кремния (элюент: этилацетат-циклогексан 2-8, потом метиленхлорид-метанол 98-2), получают 720 мг целевого продукта, используемого как таковой в следующем примере.
Пример 82. 17-альфа-Этинил-11-бета-[4-[5-[(4,4,5,5,5-пента- фторпентил)сульфонил]пентилокси]фенил]-эстра-1,3,5/10/-триен- 3,17-бета-диол.
Работают по методике примера 56, используя 570 мг продукта, полученного в примере 79, и 1 г мета-хлорпербензойной кислоты. Получают 100 мг целевого продукта.
ИК-спектр (CHCl3).
OH: 3598 см-1.
C≡CH: 3308 см-1.
Ароматика: 1610, 1580, 1510, 1502 см-1.
Пример 83. 11-бета-[4-[5-[(Нонафторбутил)тио]пентилокси] фенил]-эстра-1,3,5/10/-триен-3,17-бета-диол.
Прибавляют в инертной атмосфере 50 мг гидрида натрия к 466 мг продукта, полученного в примере 6Ba, растворенного в 10 см3 диметилформамида, перемешивают 30 мин, прибавляют 0,18 см3 перфторбутилиодида, охлаждают и 15 мин облучают ртутной лампой. Подкисляют 2н раствором соляной кислоты, экстрагируют этилацетатом, промывают водой, сушат, выпаривают растворитель, хроматографируют остаток на оксиде кремния (элюент:бензин G-этилацетат 6-4, потом одним этилацетатом, потом метанол-вода 9-1). Собирают 287 мг целевого продукта. Rf = 0,24.
ИК-спектр (CHCl3):
OH: 3602 см-1.
Ароматика: 1610, 1583, 1512 см-1.
Пример 84. 3-Окси-11-бета-[4-[5-[(4,4,5,5,5-пентафторпентил) сульфонил] пентилокси]фенил]-16-альфа-метилэстра-1,3,5/10/- триен-17-он.
Стадия A. 3-Окси-11-бета-[4-[5-[(4,4,5,5,5-пентафторпентил) тио]пентилокси]фенил]-16-альфа-метилэстра-1,3,5/10/-триен-17-он.
Охлаждают до -78oC 500 мг 3-тетрагидропиранилокси-11-бета- [4-[5-[(4,4,5,5,5-пентафторпентил)тио] пентилокси] фенил]-эстра- 1,3,5/10/-триен-17-она, прибавляют 750 мкг триметилсуфида нитрата лития, перемешивают 10 мин, прибавляют 200 мг метилиодида, перемешивают 1 ч при комнатной температуре, прибавляют насыщенный водный раствор хлорида аммония, экстрагируют метиленхлоридом, сушат, выпаривают растворитель, хроматографируют остаток на оксиде кремния (элюент циклогексан-этилацетат 8-2), получают 280 мг 16-метилового производного, к которому прибавляют 5 см3 этанола, потом 2 см3 соляной кислоты, перемешивают 3 ч при комнатной температуре, прибавляют насыщенный раствор хлорида аммония, экстрагируют метиленхлоридом, сушат и выпаривают растворитель. Остаток хроматографируют на оксиде кремния (элюент: циклогексан-этилацетат 7-3). Получают 150 мг целевого продукта.
Стадия B. 3-Окси-11-бета-[4-[5-[(4,4,5,5,5-пентафторпентил) сульфонил] пентилокси]фенил]-16-альфа-метилэстра-1,3,5/10/-триен- 17-он.
Охлаждают до 0oC 100 мг продукта, полученного выше, в 5 см3 метиленхлорида, прибавляют 90 мг мета-хлорпербензойной кислоты, перемешивают 1 ч при 0oC, прибавляют водный раствор тиосульфата натрия и бикарбоната натрия /1-1/, экстрагируют метиленхлоридом, сушат, выпаривают растворитель, хроматографируют остаток на оксиде кремния (элюент: циклогексан-этилацетат 7-3), получают 60 мг продукта.
ИК-спектр (CHCl3).
C=O 1730 см-1.
Ароматика: 1610, 1578, 1510, 1498 см-1.
Получение 3-тетрагидропиранилокси-11-бета-[4[6[(4,4,5,5,5-пентафторпентил)тио] пентилокси]фенил]-эстра-1,3,5/10/-триен-17-она.
Перемешивают в течение 3 ч при комнатной температуре 4 г 3-окси-11-бета-[4-[5-[(4,4,5,5,5-пентафторпентил)тио] пентилокси] фенил]эстра-1,3,5/10/-триен-17-она, 40 см3 диокса, а 3 см3 дигидропирана и 100 см3 пара-толуолсульфоновой кислоты. Прибавляют 100 см3 водного насыщенного раствора бикарбоната натрия, экстрагируют метиленхлоридом, сушат, выпаривают растворитель, хроматографируют остаток на оксиде кремния (элюент: циклогексан-этилацетат 7-3/ и получают 4,5 г целевого продукта.
Работают на методике стадии D примера 3, исходя из продукта, полученного в примере 84, получают 11-бета[4-[5-[(4,4,5,5,5-пентафторпентил)сульфонил] пентилокси] фенил]-16-альфа-метилэстра-1,3,5/10/триен-3,17-бета-диол.
Пример 85. 11-бета-[4-[5-[(пентафторфенил)метилтио]пентилокси] -фенил] -эстра-1,3,5/10/-триен-3,17-бета-диол.
Работают по методике примера 6Ba, исходя из 350 мг дисульфида и 0,19 см3 трибутилфосфина. К раствору полученного меркаптана прибавляют 0,12 см3 альфа-бром-2,3,4,5,6-пентафтортолуола и 0,15 см3 гидроксида натрия. Перемешивают при 50oC в течение 40 мин, охлаждают, выливают в 2н, раствор соляной кислоты, экстрагируют этилацетатом, сушат, выпаривают растворитель, хроматографируют остаток на оксиде кремния (элюент: бензин G-атил- ацетат 7-3), получают 227 мг целевого продукта.
ИК-спектр (CHCl3)/
OH: 3598 см-1.
Ароматика: 1654, 1610, 1580, 1520, 1506 м-1.
Пример 86. 11-бета-[4-[5-[[(пентафторфенил)метил]сульфонил] пентил]окси] фенил]-эстра-1,3,5/10/триен-3,17-бета-диол.
Работают по методике примера 56, используя 207 мг продукта полученного в примере 85, и 169 мг мета-хлорпербензойнай кислоты. Получают 222 мг целевого продукта после хроматографии на оксиде кремния (элюент: этилацетат-циклогексан 5-5).
ИК-спектр (CHCl3)/
OH: 3603 см-1.
Ароматика: 1654, 1610, 1580, 1520, 1506 см-1.
SO2: 1331, 1131 см-1.
Пример 87. 11-бета-[4-[5-[[2-(Пентафторфенил)этил]тио]пентилокси]фенил] -эстра- 1,3,5/10/-триен-3,17-бета-диол и 11-бета-[4-[5-[(4-этенил-2,3,5,6-тетрафторфенил)тио]пентилокси]фенил]-эстра- 1,3,5/10/-триен-3,17-бета-диол.
Работают по методике примера 6Ba, используя 500 мг дисульфида и 0,27 см3 три-н-бутилтрифенилфосфина. Раствор полученного меркаптана обрабатывают, как указано в примере 85, используя 0,30 см3 1-(2-бромэтил)-2,3,4,5,6-пентафторбензола. Получают 420 мг целевого продукта в виде смеси.
Получение 1-/2-бромэтил/-2,3,4,5,6-пентафторбензола.
Стадия A. 2-(2,3,4,5-пентафторфенил)-этанол.
Нагревают при кипячении с обратным холодильником 2,5 г 2,3,4,5,6-пентафторфенилуксусной кислоты в 25 см3 тетрагидрофурана в присутствии комплекса боргидрид-диметилсульфида. Охлаждают, медленно выливают в ледяную воду, прибавляют водный раствор бикарбонат натрия, экстрагируют этилацетатом, промывают водой, сушат и выпаривают растворитель. Получают 2,24 г целевого продукта.
Стадия B. 1-(2-Бромэтил)-2,3,4,5,6,-пентафторбензол.
Растворяют 2,225 г спирта, полученного на стадии A, в 21,5 см3 метиленхлорида, охлаждают до -20oC, прибавляют 4,35 г тетрабромметана и 3,44 г трифенилфосфина. Перемешивают при +4oC в течение 4 ч, выпаривают растворитель, остаток обрабатывают пентаном, перемешивают, фильтруют, промывают нерастворимый продукт пентаном, объединяют фильтраты и выпаривают растворитель при пониженном давлении. Получают 3,22 г целевого продукта.
Пример 88. 11-бета-[4-[5-[[2-(Пентафторфенил)этил]сульфонил] пентилокси] фенил] -эстра-1,3,5/10/-триен-3,17-бета-диол и 11-бета-[4-[5-[(4-этенил-2,3,5,6-тетрафторфенил)сульфинил] пентилокси] фенил]-экстра-1,3,5/10/-триен-3,17-бета-диол.
Работают по методике примера 56, используя 420 мг смеси, полученной в примере 87, и 346 мг мета-хлорпербензойной кислоты. Получают 443 мг целевого продукта в виде смеси. После хроматографии на оксиде кремния (элюент: этилацетат-циклогексан 5-5, потом ацетон-метиленхлорид 1-9), получают 84 мг пентафторированного производного и 201 мг тетрафторированного производного.
ИК-спектр (CHCI3):
Пентафторированное производное
OH≈3602 см-1.
Ароматика: 1656, 1610, 1580, 1522, 1508 см-1.
SO2 ≈ 1323 см-1
Тетрафторированное производное
OH≈3600 см-1.
C=C: 1648 см-1.
Ароматика: 1610, 1578, 1512, 1478 см-1 (F).
S _→ 0 ≈ 1055 см-1
Пример 89. 11-бета-[4-[5-[3-(Пентафторфенил)пропил]тио]пентилокси]фенил] - эстра-1,3,5/10/-триен-3,17-бета-диол.
Работают по методике примера 85, используя 500 мг дисульфида, полученного по методике примера 6Ba, потом 2 см3 метиленхлоридного раствора 3-иодпропилпентафторбензола. Получают 472 мг целевого продукта.
ИК-спектр (CHCI3).
OH≈ 3598 см-1.
Ароматика: 1655, 1610, 1580, 1521, 1504 см-1.
Получение 3-иодпропилпентафторбензола.
Стадия A. (2,3,4,5,6-Пентафторбензол)-пропионовая кислота.
Прибавляют 971 мг родий-хлор-трис-трифенилфосфина к раствору, содержащему 2,5 г 2,3,4,5-пентафторкоричной кислоты, 34 см3 этанола и 34 см3 толуола, потом пропускают водород /1700 мбар/ в течение 6 ч при комнатной температуре. Выпаривают растворитель, остаток обрабатывают метиленхлоридом, экстрагируют водным 1н. раствором гидроксида натрия, промывают метиленхлоридом, подкисляют соляной кислотой, экстрагируют метиленхлоридом, сушат и выпаривают растворитель при пониженном давлении. Кристаллизуют остаток из циклогексана, получают 2,06 г целевого продукта.
Стадия B. 3-(Пентафторфенил)-пропанол.
Работают, как в приготовлении примера 87, стадия A, используя 1,99 г кислоты, полученной выше, и 2,4 см3 комплекса боргидрид-диметилсульфида. Получают 1,89 г сырого целевого продукта, который хроматографируют на оксиде кремния (элюент: этилацетат циклогексан 4-6).
Стадия C. 3-Иодпропилпентафторбензол.
Охлаждают до +10oC 356 мг трифенилфосфина в 2 см3 метиленхлорида, прибавляют 95 мг имидазола, перемешивают 15 мин, охлаждают до 0oC, прибавляют 357 мг иода, перемешивают 30 мин и дают нагреться до комнатной температуры, прибавляют 315 мг спирта, полученного на стадии B, перемешивают 4 ч и фильтруют. Промывают метиленхлоридный раствор 0,2н. водным раствором тиосульфата натрия, потом водой, получают метиленхлоридный раствор целевого продукта, используемый как таковой в примере 89.
Пример 90. 11-бета-[4-[5-[3-(Пентафторфенил)пропилсульфонил]-пентилокси] фенил] -эстра-1,3,5/10/-триен-3,17-бета-диол.
Работают по методике примера 56, используя 451 мг продукта, полученного в примере 89, и 365 мг мета-хлорпербензойной кислоты. Получают 305 мг целевого продукта после хроматографии на оксиде кремния (элюент: этилацетат-циклогексан 6-4) и кристаллизации из этанола. Т.пл. 130oC.
ИК-спектр (Нуйол):
Область комплекса поглощения OH.
Ароматика: 1659, 1610, 1580, 1522, 1510, 1501 см-1.
SO2: 1358, 1130 см-1.
Пример 91. 11-бета-[4-[5-[[2,3,5,6-Тетрафтор-4-(трифторметил)- фенил] метилтио]пентилокси]фенил]-эстра-1,3,5/10/-триен-3,17-бета-диол.
Работают по методике примера 85, используя 500 мг дисульфида, полученного по методике примера 6Ba, потом 857 мг бром-альфа, альфа, альфа-2,3,5,6-гептафтор-п-ксилола. Получают 259 мг целевого продукта.
ИК-спектр (CHCI3):
OH: 3600 см-1.
Ароматика: 1664, 1610, 1578, 1512, 1500 см-1.
Получение бром-альфа, альфа, альфа-2,3,5,6-гептафтор-n-ксилола.
Кипятят с обратным холодильником 2 г альфа, альфа, альфа-2,3,5,6-гептафтор-n-ксилола в 7,4 см3 четыреххлористого углерода в присутствии 15 мг азоизобутиронитрила и прибавляют в течение 30 мин 1,53 г N-бромсукцинимида, потом продолжают кипятить с обратным холодильником в течение 96 ч. Охлаждают, фильтруют, выпаривают фильтрат, остаток обрабатывают пентаном, выпаривают растворитель и получают 1,40 г продукта, используемого как таковой в примере 91.
Пример 92. 11-бета-[4-[[5-[[2,3,5,6-Тетрафтор-4-(трифторметил)-фенил]метил]сульфонил] пентилокси]фенил]-эстра-1,3,5/10/-триен-3-17-бета-диол.
Работают по методике примера 56, используя 241 мг продукта, полученного в примере 91, и 193 мг мета-хлорпербензойной кислоты. Получают 161 мг целевого продукта после хроматографии на оксиде кремния (элюент: эталацетат-циклогексан 5-5).
ИК-спектр (CHCI3):
OH: 3610 см-1.
Ароматика: 1622, 1611, 1578, 1511, 1504 см-1.
Область CF3 + SO2 : 1336 см-1.
Пример 93. 3,17-Диацетат 11-бета-[9-[(4,4,5,5,5-пентафторпентил)-сульфонил]нонил]-эстра-1,3,5/10/- триен-3,17-бета-диола.
Перемешивают 45 мин при комнатной температуре 3,39 г продукта, полученного в примере 61, в 16,6 см3 пиридина, 3,14 см3 уксусного ангидрида и 154 мг диметиламинопиридина. Прибавляют 5,4 см3 метанола, перемешивают 10 мин, выпаривают растворители, обрабатывают этилацетатом, промывают водным 1M раствором соляной кислоты, потом хлорида натрия, сушат и выпаривают растворитель. После хроматографии на оксиде кремния (элюент: этилацетат-циклогексан 5-5, потом 3-7), получают 3,25 г целевого продукта.
ИК-спектр (CHCI3)
C=O: макс. 1725 см-1, пл.1746 см-1.
Ароматика: 1610, 1602, 1583, 1493 см-1.
SO2: 1309, 1134 см-1.
Пример 94. 17-Ацетат 11-бета-[9-[(4,4,5,5,5-пентафторпентил)сульфонил] нонил]-эстра-1,3,5/10/- триен-3,17-бета-диола.
Охлаждают до 0oC 1,37 г диацетата, полученного в примере 93, в 27,5 см3 метанола с 10% воды и прибавляют 203 мг бикарбоната калия, дают нагреться до комнатной температуры и перемешивают 19 ч. Выливают в 220 см3 воды, дополненной 55 см3 0,1н. соляной кислоты, экстрагируют этилацетатом, сушат и выпаривают растворитель. Получают после хроматографии на оксиде кремния (элюент: этилацетат-циклогексан 35-65) и кристаллизации остатка из смеси метиленхлорида/изопропилового эфира 973 мг целевого продукта. Т.пл.130oC.
ИК-спектр (CHCI3):
OH≈3600 см-1 + ассоциированные
OAC: 1724, 1252 см-1.
Ароматика: 1611, 1585, 1498 см-1.
SO2: 1308, 1134 см-1.
Пример 95. Ацетат-3-метокси-11-бета-[9-(4,4,5,5,5-пентафторпентил)сульфонил]нонил]- эстра-1,3,5/10/-триен-17-бета-ола.
Прибавляют 2,9 см3 воды к 1,05 г фенола, полученного в примере 94, растворенного в 3,9 см3 ацетона, перемешивают, прибавляют 0,3 см3 метилсульфата и 0,83 см3 водного 2н, раствора гидроксида натрия и перемешивают 1 ч при комнатной температуре. Реакционную среду подкисляют 1 см3 2н соляной кислоты, выливают в водный раствор бикарбоната натрия, экстрагируют этилацетатом, сушат, выпаривают растворитель. После хроматографии остатка на оксиде кремния (элюент: этилацетат-циклогексан 3-7) получают 959 мг целевого продукта.
ИК-спектр (CHCI3);
C=O: 1723 см-1,
Ароматика: 1609, 1575, 1500 см-1.
Пример 96. 3,17-Диацетат 11-бета-[4-[5-[(4,4,5,5,5- пентафторпентил]тио] пентилокси]-эстра-1,3,5/10/-триен-3,17-бета-диола.
К 200 мг продукта, полученного в примере 71, растворенного в 2,5 см3 изопропенилацетата, прибавляют 0,1 см3 концентрированной серной кислоты, растворенной в 2,5 см3 изопропенилацетата. Нагревают до 97oC, медленно отгоняют смесь ацетон/изопропенилацетат, прибавляют снова раствор серной кислоты и отгоняют, как ранее. Остаток обрабатывают водным раствором бикарбоната натрия и экстрагируют эфиром. Сушат, выпаривают растворитель и получают 510 мг целевого продукта, используемого как таковой в следующем примере.
Пример 97. 3-Окси-11-бета-[4-[5-[(4,4,5,5,5-пентафторпентил)тио]- пентилокси]фенил]-16-альфа-бромэстра-1,3,5/10/-триен-17-он.
К продукту, полученному в примере 96, растворенному в 3 см3 уксусной кислоты, прибавляют по каплям раствор, содержащий 0,025 см3 брома, 43 мг ацетата натрия и 5 см3 смеси уксусная кислота-вода (40-1). Перемешивают 12 ч при комнатной температуре, прибавляют насыщенный водный раствор бикарбоната натрия, экстрагируют метиленхлоридом, сушат, хроматографируют остаток на оксиде кремния (элюент: этилацетат-циклогексан 3-7) и получают 20 мг целевого продукта.
Пример 98. 3-Окси-11-бета-[4-[5-[(4,4,5,5,5-пентафторпентил)сульфонил] пентилокси]фенил]-16-альфа-бром-эстра-1,3,5/10/-триен-17-он.
Работают по методике примера 56, используя 120 мг продукта, полученного в примере 97, и 100 мг мета-хлорпербензойной кислоты. Получают 38 мг целевого продукта.
ИК-спектр (CHCl3):
C=O: 1750 см-1.
OH: 3595 см-1.
Ароматика: 1611, 1580, 1512, 1502 см-1.
SO2: 1305, 1133 см-1.
Пример 99. 11-бета-[4-[5-[(4,4,5,5,5-Пентафторпентил)сульфонил] - пентилокси]фенил]-16-альфа-бром-эстра-1,3,5/10/-триен-3,17-бета-диол.
Работают по методике стадии D примера 3, исходя из продукта, полученного в примере 98, получают целевой продукт.
Фармацевтические композиции
Готовят таблетки, отвечающие следующей формуле:
Продукт примера 5 - 50 мг
Экципиент (тальк, крахмал, стеарат магния) до конечной массы таблетки - 120 мг
Фармакологическое изучение продуктов изобретения.
1. Изучение активности продуктов изобретения на эстрогенном рецепторе матки мыши.
Умерщвляют неполовозрелых самочек мыши в возрасте 18-21 день, изымаются матки, потом гомогенизируют при 0oC с помощью прибора Поттера тефлон-стекло в буферном растворе TS /Трис 10 мМ, сахароза 0,25 М, HCl pH 7,4/1 г ткани на 25 мл TS/. Гомогент затем ультрацентрифугируют /209000g•30 мин/ при 0oC. Инкубируют аликвоты полученной таким образом надосадочной жидкости при 25oC в течение 5 ч с постоянной концентрацией /T/ тритированного эстрадиола в присутствии возрастающих концентраций или холодного эстрадиола (0 - 1000•10-9 М) или охлажденного испытуемого продукта (1 - 25000•10-9 М/. Потом измеряют концентрацию связанного тритированного эстрадиола (B) в каждом инкубате техникой поглощения углерод-декстрана.
Расчет относительного сродства связи (ARL).
Строят 2 следующие кривые. Процент связанного тритированного гормона B/BO в зависимости от логарифма концентрации стандартного холодного гормона или в зависимости от логарифма концентрации холодного испытуемого гормона.
Определяют прямую следующего уравнения:
I50 = 100 /B/BO + Bмин./BO//2 или I50 = 100/1 + Bмин./BO//2 = 50/1 + Bмин./BO/
где
BO = % связывания тритированного гормона, связанного в отсутствие любого холодного продукта;
B = % тритированного гормона, связанного в присутствии концентрации X холодного продукта;
Bмин. = % тритированного гормона, связанного в присутствии большого избытка стандартного холодного гормона /500 нМ/.
Пересечения прямой I50 и кривых позволяет оценить концентрации стандартного холодного гормона (CH) и холодного испытуемого продукта (CX), которые ингибируют на 50% специфическое связывание тритированного гормона с рецептором.
Относительное сродство связывания (ARL) испытуемого продукта определяют по уравнению:
ARL = 100(CH)/(CX)
Продукт примера - Инкубация 5H эстрогенного рецептора при 25oC
5 - 21,2
7 - 26,3
32 - 56
60 - 18,2
78 - 21,8
2-Анти-пролиферирующая активность продуктов изобретения на рост опухолевых клеток грудной железы MCF-7.
Описание опыта
а/ Культивирование клеток.
Линейные MCF-7 поддерживают в культуре в среде SVF /по 1/ при 37oC во влажной атмосфере, содержащей 5% CO2. Слившиеся клетки собирают трипсинизацией (трипсин 0,05%, ЕДТА 0,02%), потом промывают мягким центрифугированием. Образец суспензии клеток подсчитывают в камере Малассеза.
б/ Изучение роста.
Клетки, повторно суспендированные в среде DSE (от 1) высевают из расчета 50000 клеток на ячейку в планшетах с множеством ячеек (24 ячейки на 2,5 см2). Через 24 ч после высева (j0) добавляют в среду испытуемый продукт в виде этанольного раствора (конечная концентрация в этаноле: 0,1%) при концентрации 10-11 - 10-6 М, контрольные ячейки дают такую же концентрацию этанола. Среды обновляют каждые 48 ч. В конце эксперимента (j7-j9) среду отсасывают и клетки немедленно фиксируют 150 мкл метанола, чтобы дозировать ADN.
Анти-пролиферирующую активность продуктов оценивают по их способности ингибировать увеличение ADN.
в/ Дозирование ADN.
ADN дозируют флуориметрическим методом, используя DABA (3,5-диаминобензойную кислоту) (по 2): прибавляют 150 мкл DABA в каждую ячейку; планшеты затем инкубируют 45 мин при 56oC, потом прибавляют 2 мл 1н. HCl. Измеряют флуоресценцию с помощью флуриметра (длина волны возбуждения: 408 нм, длина волны испускания: 510 нм).
Количество ADN на ячейку оценивают по отношению к этанольной гамме, полученной при работе в тех же условиях со стандартным ADN тимуса теленка.
Результаты.
Концентрацию в нМ, которая ингибирует на 50% рост клеток MCF7 (ИК50) была определена, как указано ниже.
Продукт примера 1 - ИК 50 = 0,024 нМ
Продукт примера 5 - ИК 50 = 0,012 нМ
Продукт примера 7 - ИК 50 = 0,026 нМ
Продукт примера 32 - ИК 50 = 0,1 нМ
Продукт примера 60 - ИК 50 = 0,25 нМ
Продукт примера 78 - ИК 50 = 0,03 нМ
1/ Основную среду готовят следующим образом.
Среда MEM (минимальная существенная среда), к которой добавлены:
незаменимые аминокислоты (ГИБКО) 1%,
пени-стрепто (пенициллин 100 Е/мл, стрептомицин 0,1 мг/мл),
фунгизон 0,1%,
глютамин 2 мМ,
бикарбонат натрия 2,25 мг/мл.
Среда SVF состоит на 95% из основной среды и 5% фетальной сыворотки теленка.
Среда DSE состоит на 95% из основной среды, 5% фетальной сыворотки теленка, лишенной стероида на углерод-декстране и 10-10 М эстрадиола.
2/ Puzas et Goodman, Analytical Biochemistry, т. 86, с. 50, 1978.
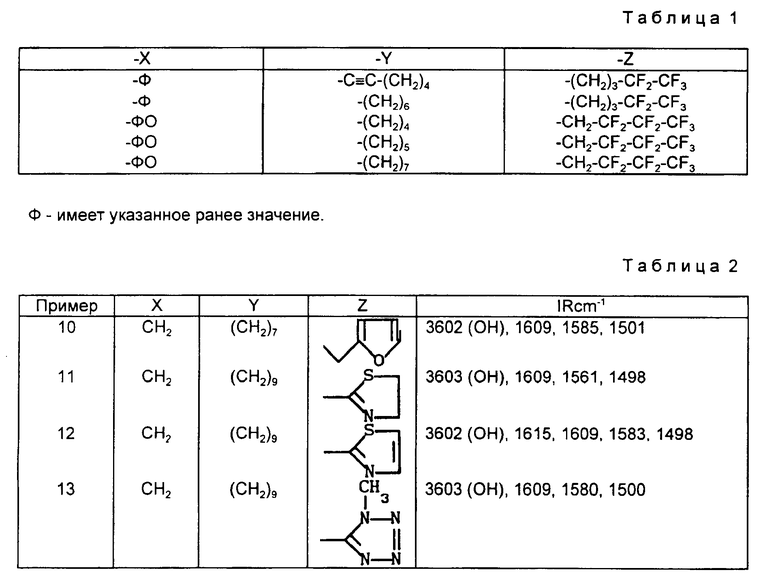

Объектом изобретения являются соединения формы (I), в которой R17 и R'17 являются такими, что или R17 и R'17 вместе образуют кетонную, гидразоновую, оксимную или метиленовую группу, или R17 и R'17 - гидроксигруппа, ацилоксигруппа -C1-C12, R'17 - водород, C1-C8-алкил, этинил, R3 - водород, C1-C4 линейный алкил, циклический C5-C6-алкил, ацил-C1-C12, R16 - водород, галоид, C1-C4-алкил, m равно 0, 1 или 2, X, Y и Z являются такими, что X - метилен, фенилен или фениленокси, связанный со стероидом через атом углерода, насыщенная или ненасыщенная линейная цепь C3-C9, возможно прерываемая атомом кислорода, Z - линейный алкил-C1-C5, трифторалкил-C2-C4, пентафторалкил-C4-C5, нонафторбутил, замещенный фенил, соли присоединения этих соединений, их получение, их применение в качестве лекарства, композиции, содержащие их, и новые промежуточные продукты для их получения.
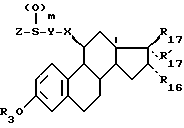
4 с. и 6 з.п. ф-лы, 4 табл.
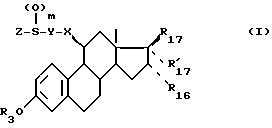
где R1 7 и R1 7' вместе образуют кетогруппу, гидразон, оксим или метиленовую группу, или R1 7 - гидроксигруппа, ацилоксигруппа, имеющая до 12 атомов углерода, а R1 7' - водород, С1 - С8-алкил, этинил;
R3 - водород, С1 - С4-линейный алкил, циклический С5 - С6-алкил, ацил, имеющий до 12 атомов углерода;
R1 6 - водород, галоид или С1 - С4-алкил;
m = 0,1 или 2;
X - метилен, фенилен, фениленокси, связанный со стероидом через атом углерода;
Y - насыщенная или ненасыщенная линейная цепь С3 - С9, возможно прерываемая атомом кислорода;
Z - линейный алкил С1 - С5, трифторалкил С2 - С4, пентафторалкил С4 - С5, нонафторбутил, замещенный фенил, выбранный из группы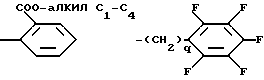
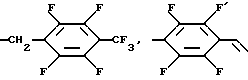
где q = 1,2 или 3,
или пятичленный гетероцикл, выбранный из группы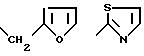

или шестичленный гетероцикл, выбранный из группы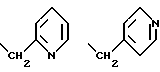
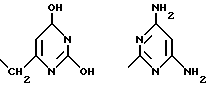

или гетероцикл с двумя конденсированными циклами, выбранный из группы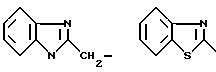
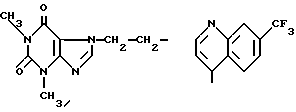
при условии, что когда R3 - водород, R1 7 - гидроксигруппа, R1 7' - этинил или водород, X - 4-фениленокси, Y - (CH2)5-, m = 0, то Z не может быть метилом.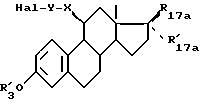
где R1 7 a и R1 7 а' имеют значения по п. 1 для R1 7 и R1 7', в которых имеющиеся функциональные группы могут быть защищены;
Х и Y имеют значения по п.1;
R3' -водород или защитная группа для гидроксила;
Hal - атом галогена, псевдогалоид, такой, как мезильная или тозильная группа,
подвергают действию меркаптана общей формулы III
Za - SH,
где Za имеет значения по п.1 для Z и в котором имеющиеся функциональные группы возможно защищены с последующим в некоторых случаях снятием защиты,
с получением соединения формулы IA, соответствующего соединению формулы I, где m = 0, полученное соединение IA при необходимости вводят в любую из следующих реакций в любом порядке: восстановление имеющейся кетогруппы, присоединения к кетогруппе металлического комплекса общей формулы IY
M - R1 7 A'
где М - атом металла;
R1 7 a' имеет указанное значение, при условии, что он не является водородом;
превращения кетогруппы в оксим-, гидразон- или метиленовую группу, селективного ацелирования по имеющейся в 17-положении гидроксильной группе, галоидирования или алкилирования в положении 16, ацилирования или алкилирования гидроксильной группы в 3-положении, частичного или полного восстановления этиленовой группы, когда Y является ненасыщенной цепью, окисления серы в сульфоксид или в сульфон.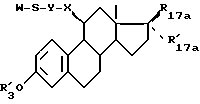
где R1 7 A и R1 7 A' имеют значения по п.1, для R1 7 и R1 7', в которых имеющиеся функциональные группы могут быть защищены;
X и Y имеют значения по п.1;
R3' - водород или защитная группа для гидроксила;
W - водород или ацил COR, где R - алкил С1 - С5,
подвергают действию соединения общей формулы YI
Za - Hal',
где Za имеет значения по п.1 для Z, в котором имеющиеся функциональные группы могут быть защищены;
Hal' имеет значения по п.7 для Hal,
в присутствии основания и затем при необходимости снимают имеющиеся защитные группы с получением соединения формулы IA по п.7, которое при необходимости вводят в одну из реакций, указанных в п.7.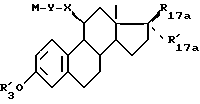
где М - Hal или группа W - S, где Hal - галоген, а W - водород, ацил COR, где R - С1 - С5-алкил;
R1 7 A и R1 7 A' имеют значения по п.1 для R1 7 и R1 7' и в которых имеющиеся функциональные группы могут быть защищены;
R3' - водород или защитная группа для гидроксила;
X и Y имеют значения по п.1, при условии, что если М - Hal, то Х и Y не могут быть метиленом, а R17A не может быть возможно замещенным гидроксилом и R1 7 A' не может быть водородом.
| EP, 0384842 А, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Машковский М.Д | |||
| Лекарственные средства | |||
| - М.: Медицина, 1986. | |||
Авторы
Даты
1998-05-20—Публикация
1992-12-17—Подача