Настоящее изобретение относится к ряду соединений, которые могут рассматриваться как производные тиазолидина и оксазолидина. Настоящее изобретение также относится к способам и композициям, в которых используются указанные соединения, а также к способам получения этих соединений.
Соединения, относящиеся к этому широкому классу соединений, раскрываются в публикациях Европатентов NN 008203, 139421, 441605, 208420, 528734, 177353, 306208 и 356214, а также в WO 92/07850, 92/07839, 91/07107, 92/02520 и 92/03425.
Краткое описание изобретения.
Целью настоящего изобретения является получение серий новых химических соединений, которые могут рассматриваться как производные тиазолидинов и оксазолидинов или как их производные с раскрытым кольцом.
Другой и более конкретной целью настоящего изобретения является получение таких соединений или по крайней мере некоторых из них, которые могут быть использованы для лечения и/или профилактики одного или нескольких заболеваний, таких как гиперлипемия, гипергликемия, недостаточная толерантность к глюкозе, инсулинорезистентность и осложнения диабета.
Другие цели и преимущества настоящего изобретения будут понятны из нижеследующего описания.
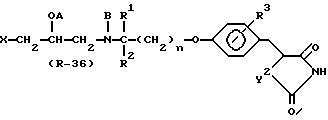
Таким образом, настоящее изобретение относится к соединениям формулы (I):
где
R1 и R2 могут быть одинаковыми или различными и каждый из них представляет атом водорода или алкильную группу, имеющую от 1 до 8 атомов углерода;
R3 представляют атом водорода;
A и B могут быть одинаковыми или различными и каждый представляет атом водорода; алкильную группу, имеющую 1-8 атомов углерода;
A и B, взятые вместе, представляют группы формул: 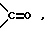
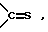
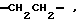
X представляет собой группу формулы W-(CH2)m-X1-, где W представляет фенильную группу, которая является незамещенной или замещена по крайней мере одним заместителем, выбранным из алкильных групп, имеющих от 1 до 4 атомов углерода, алкокси групп, имеющих от 1 до 4 атомов углерода, атомов галогена, фенильных групп, и групп формулы -NRaRb, в которой Ra и Rb являются одинаковыми или различными и каждый представляет атом водорода или алкильную группу, имеющую от 1 до 8 атомов углерода;
X1 представляет одинарную связь, атом кислорода, атом серы, группу формулы 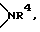 в которой R4 представляет алкильную группу, имеющую от 1 до 8 атомов углерода;
в которой R4 представляет алкильную группу, имеющую от 1 до 8 атомов углерода;
и
m представляет 0 или целое число от 1 до 8,
Y представляет группу формулы: -(CH2)n-Y1,
в которой
Y1 представляет атом кислорода или атом серы, и
n представляет целое число от 1 до 5;
Z представляет группу формулы (I):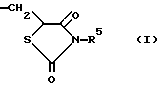
в которой
R5 представляет атом водорода
и, кроме того, настоящее изобретение относится к солям, вышеописанных соединений формулы (I).
Настоящее изобретение также относится к фармацевтической композиции, предназначенной для лечения или профилактики диабета или геперлипемии и содержащей эффективное количество активного соединения в сочетании с фармацевтически приемлемым носителем или разбавителем причем указанное активное соединение выбирают из группы, включающей соединения формулы (I), определенные выше, и их соли.
Кроме того, настоящее изобретение относится к способу лечения или профилактики диабета или гиперлипемии у млекопитающих, включая человека, заключающемуся в том, что указанному млекопитающему вводят эффективное количество активного соединения, выбранного из группы, включающей соединения формулы (I), определенные выше, их соли.
Настоящее изобретение также относится к способам получения соединений настоящего изобретения, описанным более подробно ниже.
Подробное описание изобретения
В соединениях настоящего изобретения алкильные группы, представленные радикалами R1 или R2, могут иметь прямую или разветвленную цепь и содержать от 1 до 8 атомов углерода; при этом в качестве примеров алкильных групп могут служить метильная, этильная, пропильная, изопропильная, бутильная, изобутильная, втор-бутильная, трет-бутильная, пентильная, 2-пентильная, 3-пентильная, 2-метилбутильная, 3-метилбутильная, 3-метилбутильная, 1,1-диметилпропильная, 1,2-диметилпропильная, 2,2-диметилпропильная, гексильная, 2-гексильная, 3-гексильная, 2-метилпентильная, 3-метилпентильная, 4-метилпентильная, 1,1-диметилбутильная, 1,2, -диметилбутильная, 1,3-диметилбутильная, 2,2-диметилбутильная, 2,3-диметилбутильная, 3,3-диметилбутильная, 1,1,2-триметилбутильная, 1,2,2-триметилпропильная, гептильная, 2-гептильная, 3-гептильная, 4-гептильная, 3,3-диметилпентильная, октильная, 1-метилгептильная, 2-этилгексильная и 1,1,3,3-тетраметилбутильная группы. Из них предпочтительными являются прямые или разветвленные алкильные группы, имеющие 1-6 атомов углерода, а наиболее предпочтительными являются метильная и этильная группы.
Если каждый из A и/или B, которые могут быть одинаковыми или различными, представляет алкильную группу, то эта группа может быть прямой или разветвленной алкильной группой, имеющей 1-8 атомов углерода, и аналогичной алкильным группам, примеры которых приводятся выше в отношении R1 и R2.
Если R5 в формуле для Z представляет атом водорода, то соединения настоящего изобретения могут быть превращены в соли с основаниями и с помощью стандартной методики. Примерами таких солей являются: соли щелочных металлов, таких как натрий, калий или литий; соли щелочно-земельных металлов, таких как барий или кальций; соли других металлов, таких как магний или алюминий; соли аммония, соли органических оснований, таких как метиламин, диметиламин, триэтиламин, диизопропиламин, циклогексиламин или дициклогексиламин; и соли, образованные основными аминокислотами, такими как лизин или аргинин. При этом предпочтительными являются фармацевтически приемлемые соли.
Соединения формулы (I) настоящего изобретения могут существовать в виде различных изомеров. Как показано, например, в формуле (Ia):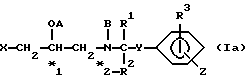
(где R1, R2, R3, A, B, X, Y и Z определены выше), атом углерода, обозначенный *1, всегда является асимметрическим атомом углерода; а атом углерода, обозначенный *2, является асимметрическим атомом в том случае, если R1 и R2 представляют разные группы.
Кроме того, если Z представляет группу формулы (Ia):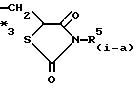
(где R5 определен выше), то атом углерода, обозначенный *3, также является асимметрическим атомом углерода.
Хотя в настоящем описании все изомеры представлены одной молекулярной формулой (I), настоящее изобретение включает отдельные изомеры, а также их смеси, включая рацематы, причем в этих смесях изомеры могут присутствовать в любых соотношениях. Если используется техника стереоспецифического синтеза, либо в качестве исходных материалов используются оптически активные соединения, то могут быть получены непосредственно отдельные изомеры; и с другой стороны, если в качестве конечного продукта получают смесь изомеров, то отдельные изомеры могут быть получены с помощью традиционной техники разделения.
Кроме того, если Z представляет собой группу формулы (i):
а R5 представляет атом водорода, то полученные соединения могут образовывать таутомеры, показанные на нижеследующей схеме: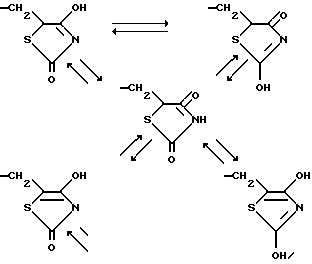
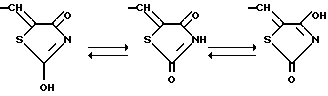
В вышеприведенной формуле (I) все таутомеры и смеси эквивалентных масс или неэквивалентных масс этих таутомеров представлены одной формулой. Поэтому следует отметить, что все указанные изомеры и смеси этих изомеров входят в объем настоящего изобретения.
Более того, настоящее изобретение также включает все сольваты (например, гидраты) соединений формулы (I), их соли.
Более предпочтительными соединениями настоящего изобретения являются такие соединения формулы (I), их соли, в которых:
2) R1 и R2 являются одинаковыми или различными и каждый представляет атом водорода или алкильную группу, имеющую 1-4 атомов углерода;
R3 представляет атом водорода;
A и B являются одинаковыми или различными и каждый представляет атом водорода, метильную, этильную, пропильную, либо A и B взятые вместе, образуют группу формул: 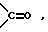
 или -CH2CH2- ;
или -CH2CH2- ;
X представляет группу формулы W-(CH2)m-X1-, где W представляет фенильную группу, которая является незамещенной или замещенной 1-3 заместителями, выбранными из алкильных групп, имеющих от 1 до 4 атомов углерода, алкокси групп, имеющих от 1 до 4 атомов углерода, атомов галогена, фенильных групп и групп формулы -NRaRb, в которой Ra и Rb являются одинаковыми или различными и каждый представляет атом водорода или алкильную группу, имеющую от 1 до 8 атомов углерода,
X1 представляет простую связь, атом кислорода, атом серы или группу формулы -N(-R4), где R4 является метильной, этильной или пропильной группой;
m равно нулю или целому числу от 1 до 6;
Y представляет группу формулы -(CH2)n-Y' где Y' является атомом кислорода или серы, а n равно целому числу от 1 до 5;
Z представляет группу формулы (Vii):
Еще более предпочтительными соединениями настоящего изобретения являются такие соединения формулы (I), их соли, в которых:
3) R1 и R2 оба представляют атомы водорода, либо один из них представляет атом водорода, а другой - алкильную группу, имеющую 1-4 атомов углерода;
R3 представляет атом водорода,
A и B являются одинаковыми или различными и каждый представляет атом водорода, метильную, этильную группу; либо A и B, взятые вместе, образуют группу формулы 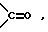
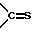 или -CH2CH2-;
или -CH2CH2-;
X представляет группу формулы W -(CH2)m -X1-, где W представляет фенильную группу, которая является незамещенной или замещенной 1-3 заместителями, выбранными из группы включающей в себя: атом галогена, метильную, этильную, фенильную, амино, диметиламино-, метокси- и этокси-группы;
X1 - представляет простую связь, атом кислорода, атом серы или группу формулы -N(Me)-;
m равно нулю или целому числу от 1 до 6;
Y представляет группу формулы -(CH2)n - Y'-, где Y' представляет атом кислорода или атом серы и n равно целому числу от 1 до 3;
и
Z представляет группу формулы (Vii):
Еще более предпочтительными соединениями настоящего изобретения являются такие соединения формулы (I), их соли, в которых:
4) R' и R2 оба представляют атомы водорода, либо один из них представляет атом водорода, а другой представляет метильную, этильную, пропильную или изопропильную группу;
R3 представляет атом водорода,
A представляет атом водорода, а B представляет атом водорода или метильную, этильную группу; либо A или B, взятые вместе, образуют группу формулы 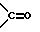 или
или 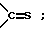
X представляет группу формулы W-(CH2)m-X1, где W представляет галоген-замещенную фенильную, фенилфенильную, метоксифенильную или фенильную группу, X1 представляет атом кислорода или атом серы, m равно нулю или целому числу от 1 до 6;
Y представляет группу формулы -CH2O или -(CH2)2O-;
и
Z представляет группу формулы (Vii):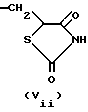
Наиболее предпочтительными соединениями настоящего изобретения являются такие соединения формулы (I), их соли, в которых:
5) R1 и R2 оба представляют атомы водорода, либо один из них представляет атом водорода, а другой представляет метильную или этильную группу;
R3 представляет атом водорода;
A представляет атом водорода, а B представляет атом водорода или метильную группу; либо A и B, взятые вместе, образуют группу формулы 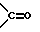 или
или 
X представляет группу формулы W-(CH2)m-O-, где W представляет фенильную, 3-хлорфенильную, 4-хлорфенильную, 3-метоксифенильную, 4-метоксифенильную или 4-фенилфенильную группу; и m равно нулю или целому числу от 1 до 6;
Y представляет группу формулы -CH2O-; и
Z представляет группу формулы (Vii):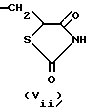
Примеры некоторых соединений настоящего изобретения представлены нижеприведенными формулами (I-1) - (1-7):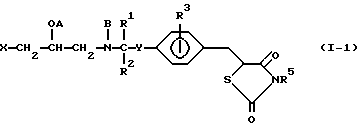

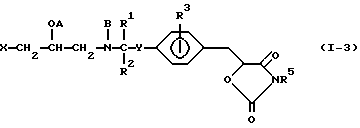
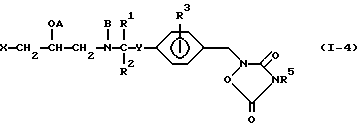
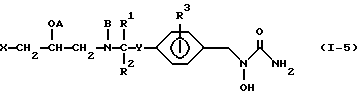
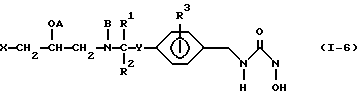
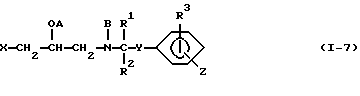
В вышеуказанных формулах заместители являются такими, как они определены в таблицах 1-7 соответственно, то есть таблица 1 относится к формуле (I-1), таблица 2 относится к формуле (1-2) и т.д. до таблицы 7, которая относится к формуле (1-7). В указанных таблицах были использованы следующие обозначения:
Ac - ацетил
Boz - бензоил
Bu - бутил
iBu - изобутил
tBu - т-бутил
Bz - бензил
Car - карбамоил
Et - этил
Etc - этоксикарбонил
Hp - гептил
Hx - гексил
Me - метил
Mec - метоксикарбонил
Oc - октил
Ph - фенил
Piv - пивалоил
Pn - пентил
Pr - пропил
iPr - изопропил
Prn - пропионил
Pyr - пиридил
В таблице 7 положение заместителей R3 и Z по отношению к Y указано в скобках после идентификации заместителя.
Из перечисленных выше соединений предпочтительными являются cоединения NN 1-2, 1-4, 1-48, 1-49, 1-51, 1-64, 1-69, 1-79, 1-91, 1-92, 1-93, 1-94, 1-95, 1-128, 1-158, 1-159, 1-160, 1-161, 1-162, 1-163, 1-164, 1-165, 1-166, 1-167, 1-168, 1-169, 1-170, 1-171, 1-173, 1-176, 1-177, 1-179, 1-180, 1-181, 1-184, 1-186, 1-187, 1-188, 1-189, 1-190, 1-191, 1-192, 1-193, 1-195, 1-197, 1-200, 1-201, 1-204, 1-205, 1-206, 1-207, 1-208 и 1-209, из которых более предпочтительными являются соединения NN 1-2, 1-4, 1-51, 1-64, 1-69, 1-79, 1-91, 1-93, 1-94, 1-95, 1-158, 1-159, 1-160, 1-161, 1-162, 1-164, 1-169, 1-170, 1-173, 1-177, 1-179, 1-180, 1-181, 1-186, 1-187, 1-188, 1-189, 1-190, 1-191, 1-192, 1-193, 1-195, 1-204, 1-205, 1-206 и 1-209. Еще более предпочтительными являются соединения NN 1-2, 1-4, 1-64, 1-91, 1-93, 1-94, 1-95, 1-159, 1-161, 1-162, 1-164, 1-173, 1-179, 1-186, 1-191, 1-193, 1-195, 1-205 и 1-206.
Наиболее предпочтительными соединениями являются следующие соединения NN:
1-2. 5-(4-{3-фенил-2-гидроксипропиламино)пропокси]бензил}- тиазолидин-2,4-дион;
1-93. 5-{ 4-[2-(5-3'-хлорфеноксиметил-2-оксо-оксазолидин-3-ил) этокси] бензил}тиазолидин-2,4-дион;
1-94. 5-{4-[2-(5-3'-хлорфеноксиметил-2-оксо-оксазолидин-3-ил) пропокси] бензил}тиазолидин-2,4-дион;
1-95. 5-{ 4-[2-(5-3'-хлорфеноксиметил-2-тиоксо-оксазолидин-3-ил) пропокси]бензил}тиазолидин-2,4-дион;
1-162. 5-{ 4-[2-(3-6'-фенилгексилокси-2-гидроксипропил-амино) пропокси] бензил}тиазолидин-2,4-дион; и
1-191. 5-{4-[2-(5-3'-хлорфеноксиметил-2-оксо-оксазолидин-3-ил)- бутокси] бензил} тиазолидин-2,4-дион, из которых особенно предпочтительными являются соединения NN 1-2, 1-94 и 1-95.
Соединения настоящего изобретения могут быть получены различными способами, которые обычно используются специалистами для получения соединений такого типа. Например, эти соединения могут быть получены в соответствии с Реакционными схемами A, B, C и F.
Реакционная схема A.
Ниже представлена общая схема, которая может быть использована для получения любого соединения настоящего изобретения.
Реакционная схема A: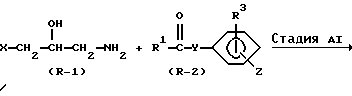
В вышеуказанных формулах X, Y, R1, R3, A, B и Z являются такими, как они были определены выше.
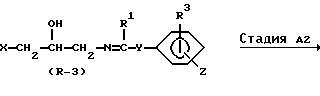
Стадия A1
В Стадии A1 соединение формулы (R-3) получают с помощью реакции аминоспирта формулы (R-1) с соединением формулы (R-2). Соединение (R-2) является известным соединением и может быть получено известными методами, например посредством реакции галогеноацетона и фенолового соединения, описанной в предварительной публикации патента Японии (Kokai) N Hei-6-25118.
Реакция Стадии A1 может быть осуществлена в отсутствии или присутствии дегидратирующего реагента, например угольного ангидрида щелочных металлов, такого как безводный карбонат натрия или безводный карбонат калия; серного ангидрида щелочных металлов, такого как безводный сульфат натрия; хлорангидрида щелочно-земельных металлов, такого как безводный хлорид кальция; серного ангидрида щелочно-земельных металлов, такого как безводный сульфат магния, или молекулярного сита.
Указанную реакцию обычно и предпочтительно осуществляют в присутствии растворителя. Для этой цели может быть использован любой растворитель, при условии, что он не оказывает неблагоприятного действия на реакцию или используемые в ней реагенты, а также при условии, что указанный растворитель способен растворять по крайней мере до определенной степени, участвующие в реакции реагенты. Примерами подходящих растворителей являются углеводороды, такие как бензол, толуол, ксилол, гексан, гептан; галогенированные углеводороды, такие как хлороформ, метиленхлорид и тетрахлорметан; простые эфиры, такие как диэтиловый эфир, тетрагидрофуран и диоксан; амиды, такие как диметилформамид, диметилацетамид и триамид гексаметилфосфорной кислоты; спирты, такие как метанол и этанол; сульфоксиды, такие как диметилсульфоксид или сульфолан; либо смеси любых двух или нескольких из указанных растворителей.
Рассматриваемая реакция может быть осуществлена в широком диапазоне температур, и точное значение реакционной температуры не играет решающей роли для настоящего изобретения. Однако в основном данную реакцию можно проводить при температуре охлаждения льдом вплоть до температуры перегонки растворителя. Время, требуемое для проведения реакции, может также широко варьироваться в зависимости от многих факторов, а именно от реакционной температуры и от природы используемых реагентов и растворителя. Однако при осуществлении реакции в вышеуказанных предпочтительных условиях период времени от 0,5 ч до 10 ч является в основном достаточным.
Данную реакцию предпочтительно осуществляют в углеводородном или спиртовом растворителе в течение периода времени от 1 до 5 ч, при температуре в диапазоне от температуры охлаждения льдом до температуры перегонки растворителя. А более предпочтительно, если данную реакцию осуществляют в бензоле в течение 1-3 ч в условиях нагревания с обратным холодильником для проведения реакции дегидратации.
Стадия A2
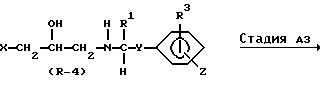
В Стадии A2 соединение формулы (R-4) получают путем восстановления соединения формулы (R-3).
Эту реакцию обычно осуществляют путем гидрогенизации в присутствии восстанавливающего агента или в присутствии катализатора.
Если соединение формулы (R-3) подвергают гидрогенизации в присутствии восстанавливающего агента, то таким агентом может быть, например, гидрид металла, такой как боргидрид лития, боргидрид натрия, цианоборгидрид натрия, алюмогидрид лития или гидрид диизопропилалюминия.
Указанную реакцию обычно и предпочтительно осуществляют в присутствии растворителя. Для этой цели может быть использован любой растворитель при условии, что он не оказывает нежелательного воздействия на реакцию или на используемые в ней реагенты, а также при условии, что указанный растворитель способен растворять, по крайней мере до определенной степени, участвующие в реакции реагенты. Примерами подходящих растворителей являются: углеводороды, такие как бензол, толуол, ксилол, гексан и гептан; простые эфиры, такие как диэтиловый эфир, тетрагидрофуран и диоксан; амиды, такие как диметилформамид, диметилацетамид и триамид гексаметилфосфорной кислоты; спирты, такие как метанол, этанол и изопропанол; либо смеси двух или нескольких из указанных растворителей.
Данная реакция может быть осуществлена в широком диапазоне температур и точное значение реакционной температуры не играет решающей роли для настоящего изобретения. Однако в основном данную реакцию можно проводить в диапазоне температур, начиная от температуры охлаждения льдом до температуры нагревания, например, с использованием обратного холодильника. Время, требуемое для проведения реакции, может быть также широко варьировано в зависимости от многих факторов, а именно от реакционной температуры и от природы используемых реагентов и растворителя. Однако при осуществлении реакции в вышеуказанных предпочтительных условиях, период времени от 0,5 ч до нескольких дней является в основном достаточным.
Данную реакцию предпочтительно осуществлять в спиртовом растворителе в присутствии боргидрида натрия или цианборгидрида натрия в течение периода времени, составляющего от 1 часа до 1 дня, в условиях охлаждения льдом или при температуре в диапазоне от температуры охлаждения льдом до 50oC.
Если соединение формулы (R-3) подвергают реакции гидрогенизации в присутствии катализатора, то таким катализатором может быть стандартный катализатор гидрирования, например палладированный уголь или окись платины.
Эту реакцию обычно и предпочтительно осуществляют в присутствии растворителя. Для этой цели может быть использован, в принципе, любой растворитель при условии, что он не оказывает нежелательного действия на реакцию или на используемые в ней реагенты, и способен растворять, по крайней мере до определенной степени, указанные реагенты. Примерами подходящих растворителей являются простые эфиры, такие как диэтиловый эфир, тетрагидрофуран и диоксан; амиды, такие как диметилформамид и диметилацетамид; спирты, такие как метанол, этанол и изопропанол; сложные эфиры органических кислот, такие как метилацетат и этилацетат; либо смеси двух или нескольких из указанных растворителей.
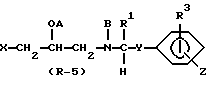
Стадия A3
В Стадии A3 соединение формулы (R-5) получают путем алкилирования, аралкилирования, ацилирования или карбамоилирования соединения формулы (R-4).
Реакции алкилирования и аралкилирования обычно осуществляют посредством реакции соединения формулы (R-4) с алкилгалогеном или аралкилгалогеном, либо с алкиловым или аралкиловым сложным эфиром алкансульфоновой кислоты, либо с арилсульфоновой кислотой (например, с метансульфоновой, бензолсульфоновой или толуолсульфоновой кислотой) в отсутствии или в присутствии агента, связывающего кислоту.
Эту реакцию обычно и предпочтительно осуществляют в присутствии растворителя. Для этой цели может быть использован любой растворитель, при условии, что он не оказывает нежелательного действия на реакцию или на используемые в ней реагенты и способен растворять, по крайней мере до определенной степени, указанные реагенты. Примерами подходящих растворителей являются: углеводороды, такие как бензол, толуол, ксилол, гексан и гептан; простые эфиры, такие как диэтиловый эфир, тетрагидрофуран и диоксан; амиды, такие как диметилформамид, диметилацетамид и триамид гексаметилфосфорной кислоты; сульфоксиды, такие как диметилсульфоксид; галогенированные углеводороды, такие как метиленхлорид, хлороформ и 1,2-дихлорэтан; сульфолан, такие как метиленхлорид, хлороформ и 1,2-дихлорэтан; сульфолан; или смеси любых двух или нескольких указанных растворителей.
Данная реакция может протекать в широком диапазоне температур и точное значение реакционной температуры не играет решающей роли для настоящего изобретения. Однако в основном реакция эта может быть осуществлена в диапазоне температур, начиная от температуры охлаждения льдом до температуры перегонки растворителя. Время, требуемое для проведения реакции, может также широко варьироваться в зависимости от многих факторов, а именно от реакционной температуры и от природы используемых реагентов и растворителя. Однако при осуществлении реакции в вышеуказанных предпочтительных условиях период времени от 0,5 ч до нескольких дней обычно является достаточным.
Реакцию ацилирования обычно проводят в отсутствии или в присутствии акцептора кислоты. Подходящими ацилирующими агентами являются ацилгалогениды и ангидриды кислоты.
Эту реакцию обычно и предпочтительно осуществляют в присутствии растворителя. Для этой цели может быть использован любой растворитель при условии, что он не оказывает нежелательного действия на реакцию или на используемые в ней реагенты и способен растворять, по крайней мере до определенной степени, указанные реагенты. Примерами подходящих растворителей являются: углеводороды, такие как бензол, толуол, ксилол, гексан и гептан; простые эфиры, такие как диэтиловый эфир, тетрагидрофуран и диоксан; амиды, такие как диметилформамид, диметилацетамид и триамид гексаметилфосфорной кислоты; сульфоксиды, такие как диметилсульфоксид; галогенированные углеводороды, такие как метиленхлорид, хлороформ и 1,2-дихлорэтан; сульфолан; либо смеси любых двух или нескольких из указанных растворителей.
Данная реакция может протекать в широком диапазоне температур и точное значение реакционной температуры не играет решающей роли для настоящего изобретения. Однако в основном эта реакция может быть осуществлена в диапазоне температур, начиная от температуры охлаждения льдом до температуры перегонки растворителя. Время, требуемое для проведения реакции, может также широко варьироваться в зависимости от многих факторов, а именно от реакционной температуры и от природы используемых реагентов и растворителя. Однако при осуществлении реакции в вышеуказанных предпочтительных условиях период времени от 0,5 ч до нескольких дней обычно является достаточным.
Если A и B, взятые вместе, представляют собой такую группу, как > C=0, > C=S, то в качестве реакционного агента используется предпочтительно карбонилирующий агент (например, фосген, дифосген, трифосген, карбонилдиимидазол или сложный эфир хлормуравьиной кислоты, такой как этилхлорформат); тиокарбонилирующий агент (например, тиофосген или тиокарбонилдиимидазол), оксалилхлорид, галоидацетилгалогенид (например, хлорацетилхлорид или бромацетилбромид), сульфурилхлорид или галоидметансульфонилгалогенид (например, хлорметансульфонилхлорид).
Эту реакцию обычно осуществляют в отсутствии или в присутствии акцептора кислоты. Если реакцию проводят в присутствии акцептора кислоты, то таким акцептором кислоты может быть, например, органическое основание, такое как триэтиламин, диизопропилэтиламин или пиридин; или неорганическое основание, такое как карбонат натрия, бикарбонат натрия, карбонат калия или бикарбонат калия.
Эту реакцию обычно и предпочтительно осуществляют в присутствии растворителя. Для этой цели может быть использован любой растворитель, при условии, что он не оказывает нежелательного действия на реакцию или на используемые в ней реагенты и способен растворять, по крайней мере до определенной степени, указанные реагенты. Примерами подходящих растворителей являются: углеводороды, такие как бензол, толуол, ксилол, гексан и гептан; галоидированные углеводороды, такие как хлороформ, метиленхлорид, 1,2-дихлорэтан и тетрахлорметан; простые эфиры, такие как диэтиловый эфир, тетрагидрофуран и диоксан; амиды, такие как диметилформамид, диметилацетамид и триамид гексаметилфосфорной кислоты; мочевины, такие как N,N'-диметилимидазолидинон; сульфоксиды, такие как диметилсульфоксид; нитрилы, такие как ацетонитрил и пропионитрил; сульфолан; или смеси любых двух или нескольких из указанных растворителей.
Данная реакция может протекать в широком диапазоне температур и точное значение реакционной температуры не играет решающей роли для настоящего изобретения. Однако в основном эта реакция может быть осуществлена в диапазоне температур, начиная от температуры охлаждения льдом до температуры перегонки реакционной смеси, а более предпочтительно при температуре охлаждения льдом или при температуре в диапазоне от указанной температуры охлаждения льдом до 50oC. Время, требуемое для проведения реакции, может также широко варьироваться в зависимости от многих факторов, а именно от реакционной температуры и от природы реагентов. Однако в большинстве случаев период времени от 0,5 до 50 ч, а более предпочтительно от 5 до 50 ч, является достаточным.
Реакционная схема B.
В этой схеме приводятся несколько способов получения характерных соединений настоящего изобретения с использованием тех же самых исходных материалов, которые были использованы в Реакционной схеме A.
Реакционная схема B1: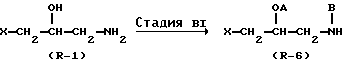
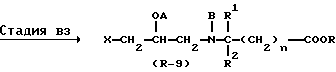
Реакционная схема B2: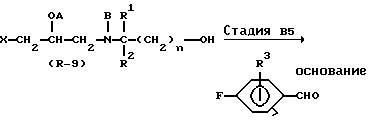

Реакционная схема B3: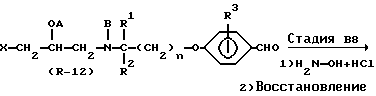

В вышеуказанных формулах X, A, B, R1, R2,  и Z определены выше;
и Z определены выше;
R представляет прямую или разветвленную низшую алкильную группу, имеющую предпочтительно 1 - 6 атомов углерода, а более предпочтительно 1 - 4 атомов углерода, например, одну из групп, проиллюстрированных выше для R1, а в частности, метильную или этильную группу;
Y2 представляет атом кислорода или атом серы;
"Halo" означает атом галогена, такой как атом хлора, атом брома или атом иода; и
Z1 представляет группу формулы (i),
где
R5 представляет трифенилметильную группу.
Стадия BI
В стадии BI соединение формулы (R - 6) получают путем алкилирования, аралкилирования, ацилирования или карбамоилирования соединения формулы (R - I). Эту реакцию осуществляют в основном в соответствии с процедурой, описанной с Стадии A3 Реакционной схемы A, с использованием тех же самых реакционных условий и тех же самых реагентов.
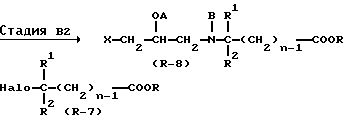
Стадия B2
В Стадии B2 соединение формулы (R - 8) получают с помощью реакции соединения формулы (R - 6) с соединением формулы (R - 7) в присутствии или в отсутствии основания. Если B представляет собой ацильную группу или карбамоильную группу, то предпочтительно, если соединение формулы (R - 6) сначала подвергают взаимодействию с основанием, таким как гидрид натрия, а затем полученное соединение подвергают реакции с соединением формулы (R - 7).
Эту реакцию обычно и предпочтительно осуществляют в присутствии растворителя. Для этой цели может быть использован любой растворитель при условии, что он не оказывает нежелательного действия на реакцию или на используемые реагенты и способен растворять, по крайней мере до определенной степени, указанные реагенты. Примерами подходящих растворителей являются углеводороды, такие как бензол, толуол, ксилол, гексан и гептан; простые эфиры, такие как диэтиловый эфир, тетрагидрофуран и диоксан; амиды, такие как диметилформамид, диметилацетамид и триамид гексаметилфосфорной кислоты; сульфоксиды, такие как диметилсульфоксид; галоидированные углеводороды, такие как метиленхлорид, хлороформ и 1,2-дихлорэтан; сульфолан; или смесь любых двух или нескольких из указанных растворителей.
Данная реакция может протекать в широком диапазоне температур и точное значение реакционной температуры не играет решающей роли для настоящего изобретения. Однако в основном эта реакция может быть осуществлена в диапазоне температур, начиная от температуры охлаждения льдом до температуры нагревания. Время, требуемое для проведения реакции, может так;е широко варьироваться в зависимости от многих факторов, а именно от реакционной температуры и от природы используемых реагентов и растворителя. Однако во многих случаях для осуществления данной реакции период времени от 0,5 ч до нескольких дней является обычно достаточным.
Стадия B3
В Стадии B3 соединение формулы (R - 9) получают путем восстановления соединения формулы (R - 8). В этой реакции может быть использован, в принципе, любой восстанавливающий агент, обычно используемый в реакциях подобного типа. Примерами восстанавливающих агентов являются гидриды металлов, такие как боргидрид натрия, боргидрид лития, алюмогидрид лития и гидрид диизобутилалюминия.
Эту реакцию обычно и предпочтительно осуществляют в присутствии растворителя. Для этой цели может быть использован любой растворитель при условии, что он не оказывает нежелательного действия на реакцию или на используемые реагенты и способен растворять, по крайней мере до определенной степени, указанные реагенты. Примерами подходящих растворителей являются: углеводороды, такие как бензол, толуол, ксилол, гексан и гептан; простые эфиры, такие как диэтиловый эфир, тетрагидрофуран и диоксан; амиды, такие как диметилформамид, диметилацетамид и триамид гексаметилфосфорной кислоты; спирты, такие как метанол, этанол и изопропанол; или смесь любых двух или нескольких из указанных растворителей.
Данная реакция может протекать в широком диапазоне температур, и точное значение реакционной температуры не играет решающей роли для настоящего изобретения. Однако в основном эта реакция может быть осуществлена в диапазоне температур, начиная от температуры охлаждения льдом до температуры нагревания. Время, требуемое для проведения реакции, может также широко варьироваться в зависимости от многих факторов, а именно от реакционной температуры и от природы реагентов. Однако в большинстве случаев период времени, достаточный для проведения реакции, составляет от 0,5 ч до нескольких дней.
Эту реакцию предпочтительно осуществляют в спиртовом растворителе в присутствии боргидрида лития в течение периода времени от 1 ч до 1 дня при температуре в пределах от комнатной температуры до температуры перегонки реакционной смеси.
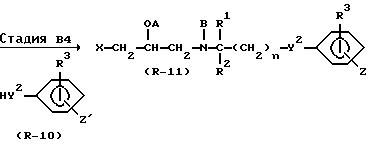
Стадия B4
В Стадии B4 соединение формулы (R - 11) получают посредством реакции Мицунобу (O. Mitsunobu, Synthesis, p. I (1981)), которой подвергают соединение формулы (R - 9) и соединение формулы (R - 10) с последующим удалением трифенилметильной группы.
Первую стадию этой реакции обычно и предпочтительно осуществляют в присутствии растворителя. В этой реакции может быть использован любой растворитель при условии, что он не оказывает нежелательного действия на реакцию или на используемые в ней реагенты и способен растворять, по крайней мере до определенной степени, указанные реагенты. Примерами подходящих растворителей являются углеводороды, такие как бензол, толуол, ксилол, гексан и гептан; галоидированные углеводороды, такие как хлороформ, метиленхлорид и тетрахлорметан; простые эфиры, такие как диэтиловый эфир, тетрагидрофуран и диоксан; амиды, такие как диметилформамид, диметилацетамид и триамид гексаметилфосфорной кислоты; или смесь любых двух или нескольких из указанных растворителей.
Данная реакция может протекать в широком диапазоне температур, и точное значение реакционной температуры не играет решающей роли для настоящего изобретения. Однако в основном эта реакция может быть осуществлена в диапазоне температур, начиная от температуры охлаждения льдом до температуры нагревания, а более предпочтительно при температуре охлаждения льдом, либо в диапазоне температур, начиная от температуры охлаждения льдом до 60oC. Время, требуемое для проведения реакции, может также широко варьироваться в зависимости от многих факторов, а именно от реакционной температуры и от природы используемых реагентов. Однако в большинстве случаев период проведения реакции составляет от нескольких часов до нескольких дней, а более предпочтительно от 5 ч до 3 дней.
Вторую стадию реакции осуществляют посредством реакции взаимодействия полученного соединения с кислотой, такой как уксусная кислота, трифторуксусная кислота или соляная кислота, в присутствии или в отсутствии растворителя; либо посредством реакции каталитического гидрирования полученного соединения в присутствии растворителя.
Если данную реакцию осуществляют посредством взаимодействия полученного соединения с кислотой в присутствии или в отсутствии растворителя, то эта реакция может быть проведена в соответствии со стандартной техникой (например, J. W. Grcene, Protective Groups in Organic Synthesis, John Wiley & Sons; J.F.W. McOmie, Protective Groups in Organic Chemistry, Plenum Press).
Если полученное соединение подвергают реакции каталитического гидрирования в присутствии растворителя, то в этом случае может быть использован любой катализатор, обычно используемый в реакциях такого типа, например палладированный уголь.
Данную реакцию обычно и предпочтительно осуществляют в присутствии растворителя. Для этой цели может быть использован любой растворитель при условии, что он не оказывает нежелательного действия на реакцию или на используемые реагенты и обладает способностью растворять, по крайней мере до определенной степени, указанные реагенты. Примерами подходящих растворителей являются: углеводороды, такие как бензол, толуол, ксилол, гексан и гептан; простые эфиры, такие как диэтиловый эфир, диоксан и тетрагидрофуран; спирты, такие как метанол, этанол и изопропанол; кислоты, такие как муравьиная кислота, уксусная кислота и пропионовая кислота; амиды, такие как диметилформамид, диметилацетамид и триамид гексаметилфосфорной кислоты; или смесь любых двух или нескольких из указанных растворителей.
Данная реакция может протекать в широком диапазоне температур, и точное значение реакционной температуры не играет решающей роли для настоящего изобретения. Однако в основном эта реакция может быть осуществлена в пределах приблизительно от комнатной температуры до температуры нагревания. Время, требуемое для проведения реакции, может также широко варьироваться в зависимости от многих факторов, а именно от реакционной температуры и от природы реагентов. Однако в большинстве случаев период времени, достаточный для осуществления данной реакции, составляет от нескольких часов до нескольких дней, а более предпочтительно от 1 ч до 3 дней.
Указанную реакцию обычно осуществляют при атмосферном давлении, либо, что предпочтительно, при давлении, превышающем атмосферное.
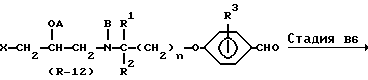
Стадия B5
В Стадии B5 соединение формулы (R - 12) получают с помощью реакции соединения формулы (R - 9) с производным 4-фторбензальдегида, таким как 2-метокси-4-фторбензальдегид или 3-метил-4-фторбензальдегид, в присутствии основания, такого как гидрид натрия.
Эту реакцию обычно и предпочтительно осуществляют в присутствии растворителя. Для этой цели может быть использован любой растворитель при условии, что он не оказывает нежелательного действия на реакцию или на используемые в ней реагенты и обладает способностью растворять, по крайней мере до определенной степени, указанные реагенты. Примерами подходящих растворителей являются: углеводороды, такие как бензол, толуол, ксилол, гексан и гептан; простые эфиры, такие как диэтиловый эфир, тетрагидрофуран и диоксан; амиды, такие как деметилацетамид, диметилформамид и триамид гексаметилфосфорной кислоты; или смесь любых двух или нескольких из указанных растворителей.
Данная реакция может протекать в широком диапазоне температур, и точное значение реакционной температуры не играет решающей роли для настоящего изобретения. Однако в основном эта реакция может быть осуществлена при температуре в пределах от температуры охлаждения льдом до температуры нагревания, а более предпочтительно при температуре охлаждения или при температуре в диапазоне от температуры охлаждения льдом до 60oC. Время, требуемое для проведения реакции, может также широко варьироваться в зависимости от многих факторов, а именно от природы реагентов. Однако в большинстве случаев период времени, достаточный для проведения реакции, составляет от нескольких часов до нескольких дней, а предпочтительно от 3 ч до 3 дней.
Стадия B6
В Стадии B6 соединение формулы (R-13) получают с помощью реакции соединения формулы (R-12) с тиазолидин-2,4-дионом.
Эта реакция может быть проведена в присутствии или в отсутствии катализатора. Если реакция протекает в присутствии катализатора, то примерами подходящих катализаторов могут служить ацетат натрия, ацетат пиперидиния и бензоат пиперидиния.
Данную реакцию обычно и предпочтительно осуществляют в присутствии растворителя. Для этой цели может быть использован любой растворитель при условии, что он не оказывает нежелательного действия на реакцию или на используемые реагенты и обладает способностью растворять, по крайней мере до определенной степени, указанные реагенты. Примерами подходящих растворителей являются углеводороды, такие как бензол, толуол, ксилол, гексан и гептан; простые эфиры, такие как диэтиловый эфир, тетрагидрофуран и диоксан; спирты, такие как метанол, этанол и изопропанол; амиды, такие как диметилформамид, диметилацетамид и триамид гексаметилфосфорной кислоты; галоидированные углеводороды, такие как дихлорметан, хлороформ и 1,2-дихлорэтан; нитрилы, такие как ацетонитрил и пропионитрил; сложные эфиры, такие как этилформат и этилацетат; или смесь любых двух или нескольких из этих растворителей.
Данная реакция может протекать в широком диапазоне температур, и точное значение реакционной температуры не играет решающей роли для настоящего изобретения. Однако в основном эта реакция может быть осуществлена при нагревании. Время, требуемое для проведения реакции, может также широко варьироваться в зависимости от многих факторов, а именно от реакционной температуры и от природы реагентов. Однако в большинстве случаев период, достаточный для проведения реакции, составляет от нескольких часов до нескольких дней.
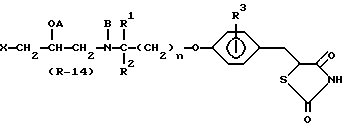
Стадия B7
В Стадии B7 соединение формулы (R - 14) получают путем восстановления соединения формулы (R - 13), например, посредством реакции каталитического гидрирования или посредством реакции восстановления с использованием гидрида металла.
Если соединение формулы (R - 13) подвергают реакции каталитического гидрирования, то этой цели может быть использован любой катализатор, который обычно используется в реакциях такого типа, например палладированный уголь.
Эту реакцию обычно и предпочтительно осуществляют в присутствии растворителя. При этом может быть использован любой растворитель, если он не оказывает нежелательного действия на реакцию или используемые в ней реагенты и если он обладает способностью растворять, по крайней мере до определенной степени, указанные реагенты. Примерами подходящих растворителей являются: углеводороды, такие как бензол, толуол, ксилол, гексан и гептан; простые эфиры, такие как диэтиловый эфир, диоксан и тетрагидрофуран; спирты, такие как метанол, этанол и изопропанол; кислоты, такие как муравьиная кислота, уксусная кислота и пропионовая кислота; амиды, такие как диметилформамид, диметилацетамид и триамид гексаметилфорсфорной кислоты; или смесь любых двух или нескольких из указанных растворителей.
Данная реакция может протекать в широком диапазоне температур, и точное значение реакционной температуры не играет решающей роли для настоящего изобретения. Однако в основном подходящей температурой для осуществления этой реакции является температура в диапазоне примерно от комнатной температуры до температуры нагревания. Время, требуемое для осуществления реакции, может также широко варьироваться в зависимости от многих факторов, а именно от реакционной температуры и от природы реагентов. Однако в большинстве случаев период времени, достаточный для проведения реакции, составляет от нескольких часов до нескольких дней, а предпочтительно от 1 ч до 3 дней.
Эту реакцию обычно осуществляют при атмосферном давлении или предпочтительно при давлении, превышающем атмосферное.
Если соединение формулы (R-13) подвергают восстановлению с использованием гидрида металла, то эта реакция может быть осуществлена методом, описанным в WO 93/1309.
Стадия B8
В Стадии B8 соединение формулы (R-15) получают с помощью реакции соединения формулы (R-12) с гидроксиламином и с последующей реакцией восстановления.
Реакцию соединения формулы (R-12) с гидроксиламином (гидрохлорид) обычно и предпочтительно осуществляют в присутствии растворителя. Для этой цели может быть использован любой растворитель при условии, что он не оказывает нежелательного действия на реакцию или на используемые в ней реагенты и обладают способностью растворять по крайней мере до определенной степени указанные реагенты. Примерами подходящих растворителей являются: углеводороды, такие как бензол, толуол, ксилол, гексан и гептан; простые эфиры, такие как диэтиловый эфир, тетрагидрофуран и диоксан; спирты, такие как метанол, этанол и изопропанол, амиды, такие как диметилформамид, диметилацетамид и триамид гексаметилфосфорной кислоты; галоидированные углеводороды, такие как дихлорметан, хлороформ и 1,2-дихлорэтан; нитрилы, такие как ацетонитрил и пропионитрил; сложные эфиры, такие как этилформат и этилацетат; амины, такие как пиридин и триэтиламин; или смеси любых двух или нескольких из указанных растворителей.
Данная реакция может протекать в широком диапазоне температур, и точное значение реакционной температуры не играет решающей роли для настоящего изобретения. Однако в основном подходящей температурой для проведения этой реакции является температура в диапазоне примерно от комнатной температуры до температуры нагревания. Время, требуемое для осуществления этой реакции, может также широко варьироваться в зависимости от многих факторов, а именно от реакционной температуры и от природы реагентов. Однако в большинстве случаев период времени, достаточный для проведения реакции, составляет от нескольких часов до нескольких дней, а предпочтительно от 1 ч до 3 дней.
Последующую реакцию восстановления осуществляют в основном в соответствии с процедурами, описанными в Стадии A2 Реакционной схемы A; причем эта реакция может быть проведена в тех же самых реакционных условиях и с использованием тех же самых реагентов.
Стадия B9
В Стадии B9 соединение формулы (R-16) получают посредством реакции соединения формулы (R-15) с триметилсилилизоцианатом.
Эту реакцию обычно и предпочтительно осуществляют в присутствии растворителя. При этом может быть использован любой растворитель, если только он не оказывает нежелательного действия на реакцию и на используемые в ней реагенты и если он способен растворять, по крайней мере до определенной степени, указанные реагенты. Примерами подходящих растворителей являются: углеводороды, такие как бензол, толуол, ксилол, гексан и гептан; простые эфиры, такие как диэтиловый эфир, тетрагидрофуран и диоксан; амиды, такие как диметилформамид, диметилацетамид и триамид гексаметилфосфорной кислоты; галоидированные углеводороды, такие как дихлорметан, хлороформ и 1,2-дихлорэтан; нитрилы, такие как ацетонитрил и пропионитрил; сложные эфиры, такие как этилформат и этилацетат; или смесь любых двух или нескольких из указанных растворителей.
Данная реакция может протекать в широком диапазоне температур, и точное значение реакционной температуры не играет решающей роли для настоящего изобретения. Однако в основном подходящей температурой для осуществления этой реакции является температура в диапазоне от температуры охлаждения льдом до температуры нагревания, а предпочтительно реакцию осуществляют при температуре охлаждения льдом, или при температуре в диапазоне от температуры охлаждения льдом до 60oC. Время, требуемое для осуществления этой реакции, может также широко варьироваться в зависимости от многих факторов, а именно от реакционной температуры и от природы реагентов. Однако в большинстве случаев период времени, достаточный для проведения реакции, составляет от нескольких часов до нескольких дней, а предпочтительно от 1 ч до 3 дней.
Стадия B10
В Стадии B10 соединение формулы (R-17) получают с помощью реакции соединения формулы (R-15) с хлоркарбонилизоцианатом.
Эту реакцию обычно и предпочтительно осуществляют в присутствии растворителя. При этом может быть использован любой растворитель, если он не оказывает нежелательного действия на реакцию или используемые в ней реагенты и если он обладает способностью растворять, по крайней мере до определенной степени, указанные реагенты. Примерами подходящих растворителей являются: углеводороды, такие как бензол, толуол, ксилол, гексан и гептан; простые эфиры, такие как диэтиловый эфир, тетрагидрофуран и диоксан; амиды, такие как диметилформамид, диметилацетамид и триамид гексаметилфосфорной кислоты; галоидированные углеводороды, такие как дихлорметан, хлороформ и 1,2-дихлорэтан; нитрилы, такие как ацетонитрил и пропионитрил; сложные эфиры, такие как этилформат и этилацетат; или смесь любых двух или нескольких из указанных растворителей.
Данная реакция может протекать в широком диапазоне температур, и точное значение реакционной температуры не играет решающей роли для настоящего изобретения. Однако в основном подходящей температурой для осуществления этой реакции является температура в диапазоне от температуры охлаждения льдом до температуры нагревания, а предпочтительно при температуре охлаждения льдом либо при температуре в диапазоне от температуры охлаждения льдом до 60oC. Время, требуемое для осуществления этой реакции, может также широко варьироваться в зависимости от многих факторов, а именно от реакционной температуры и от природы реагентов. Однако в большинстве случаев период времени, достаточный для проведения реакции, составляет от нескольких минут для 1 дня.
Реакционная схема C.
Нижеприведенная реакционная схема иллюстрирует альтернативный способ получения соединения формулы (R-9) (см., например, схемы B1 и B2).
Реакционная схема C: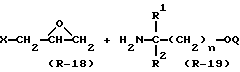
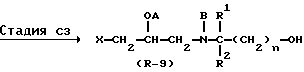
В вышеуказанных формулах X, A, B, R1, R2 и  являются такими, как они были определены выше; а Q представляет собой защитную группу для спирта, например т-бутилметилсилильную группу.
являются такими, как они были определены выше; а Q представляет собой защитную группу для спирта, например т-бутилметилсилильную группу.
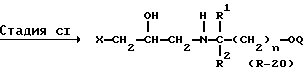
Стадия C1
В Стадии C1 соединение формулы (R-20) получают с помощью реакции соединения формулы (R-18) и соединения формулы (R-19).
Эту реакцию обычно и предпочтительно осуществляют в присутствии растворителя. Для этой цели может быть использован любой растворитель при условии, что он не оказывает нежелательного действия на реакцию или используемые в ней реагенты и обладает способностью растворять, по крайней мере до определенной степени, указанные реагенты. Примерами подходящих растворителей являются: углеводороды, такие как бензол, толуол, ксилол, гексан и гептан; простые эфиры, такие как диэтиловый эфир, тетрагидрофуран и диоксан; спирты, такие как метанол, этанол и изопропанол; амиды, такие как диметилформамид, диметилацетамид и триамид гексаметилфосфорной кислоты; галоидированные углеводороды, такие как метиленхлорид, хлороформ и 1,2-дихлорэтан; нитрилы, такие как ацетонитрил и пропионитрил; сложные эфиры, такие как этилформат и этилацетат; или смесь любых двух или нескольких из указанных растворителей.
Данная реакция может протекать в широком диапазоне температур, и точное значение реакционной температуры не играет решающей роли для настоящего изобретения. Однако в основном эту реакцию осуществляют при нагревании, а предпочтительно при температуре 50oC, или при нагревании с обратным холодильником. Время, требуемое для осуществления реакции, может также широко варьироваться в зависимости от многих факторов, а именно от реакционной температуры и от природы реагентов. Однако в большинстве случаев период времени, достаточный для проведения реакции, составляет от нескольких десятков минут до нескольких дней.
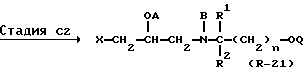
Стадия C2
В Стадии C2 соединение формулы (R-21) получают путем алкилирования, аралкилирования, ацилирования или карбамоилирования соединения формулы (R-20). Эту реакцию в основном осуществляют в соответствии с процедурой Стадии A3 Реакционной схемы A, при тех же самых реакционных условиях и с использованием тех же самых реагентов.
Стадия C3
В Стадии C3 соединения формулы (R-9) получают путем удаления защитной группы Q из соединения формулы (R-21).
Эту реакцию осуществляют с помощью реакции взаимодействия соединения формулы (R-12) с кислотой, такой как уксусная кислота, трифторуксусная кислота, соляная кислота или фтористоводородная кислота; либо с помощью реакции взаимодействия указанного соединения (R-12) с соединением, генерирующим ионы фтора, таким как фторид трибутиламмония, в присутствии или в отсутствии растворителя; либо с помощью реакции каталитического гидрирования указанного соединения в присутствии растворителя.
Реакция, предусматривающая взаимодействие данного соединения с кислотой или ионом фтора в присутствии или в отсутствии растворителя, может быть осуществлена традиционным методом (например, J.W. Greene, Protective Groups in Organic Synthesis, John Wiley & Sons; J.F.W. Mc Omie, Protective Groups in Organic Chemistry, Plenum Press).
Если соединение формулы (R-21) подвергают реакции каталитического гидрирования, то в этой реакции может быть использован катализатор, который обычно используется в реакциях такого типа, например палладированный уголь.
Эту реакцию обычно и предпочтительно осуществляют в присутствии растворителя. Для этой цели может быть использован любой растворитель при условии, что он не оказывает нежелательного действия на реакцию или используемые в ней реагенты и обладает способностью растворять, по крайней мере до определенной степени, указанные реагенты. Примерами подходящих растворителей являются: углеводороды, такие как бензол, толуол, ксилол, гексан и гептан; простые эфиры, такие как диэтиловый эфир, диоксан и тетрагидрофуран; спирты, такие как метанол, этанол и изопропанол; кислоты, такие как муравьиная кислота, уксусная кислота и пропионовая кислота; амиды, такие как диметилформамид, диметилацетамид и триамид гексаметилфосфорной кислоты; либо смесь двух или нескольких из указанных растворителей.
Данная реакция может протекать в широком диапазоне температур, и точное значение реакционной температуры не играет решающей роли для настоящего изобретения. Однако в основном подходящей температурой для осуществления этой реакции является температура в диапазоне от комнатной температуры до температуры нагревания. Время, требуемое для осуществления реакции, может также широко варьироваться в зависимости от многих факторов, а именно от реакционной температуры и от природы реагентов. Однако в большинстве случаев период времени, достаточный для проведения реакции, составляет от нескольких часов до нескольких дней, а более предпочтительно от 1 ч до 3 дней.
Эту реакцию обычно осуществляют при атмосферном давлении или предпочтительно при давлении, превышающем атмосферное.
Реакционная схема C1.
Соединение формулы (R-19), используемое в Стадии C1, может быть получено, как показано в Реакционной схеме C1: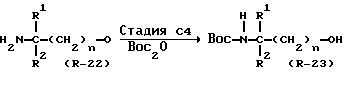
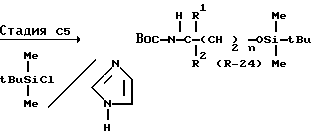
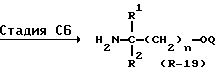
В вышеуказанных формулах R1, R2 и 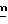 являются такими, как они были определены выше, а Boc представляет собой т-бутоксикарбонильную группу.
являются такими, как они были определены выше, а Boc представляет собой т-бутоксикарбонильную группу.
Так, например, соединение формулы (R-19) может быть получено путем превращения соединения формулы (R-22) в N- т-бутоксикарбонилированное соединение формулы (R-23) с последующим O-силилированием и получением соединения формулы (R-24), а затем удалением т-бутоксикарбонильной группы. Эти реакции могут быть осуществлены стандартными методами (см., например, J.W. Green Protective Groups in Organic Synthesis, John Wiley & Sons; J.F.W. McOmie, Protective Groups in Organic Chemistry. Plenum Press).
Реакционная схема D.
Эта реакционная схема иллюстрирует способ получения соединения формулы (R-27), представляющего собой соединение формулы (R-6), в котором A и B, взятые вместе, являются карбонильной группой и которое может быть затем использовано, как описано выше, в Реакционной схеме B.
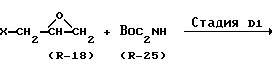
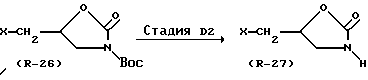
В вышеуказанных формулах X и Boc являются такими, как они были определены выше.
Стадия D1
В Стадии D1 соединение формулы (R-26) получают сначала с помощью реакции соединения формулы (R-25) с гидридом натрия, а затем с помощью реакции полученного соединения с соединением формулы (R-18).
Эту реакцию обычно и предпочтительно осуществляют в присутствии растворителя. При этом может быть использован любой растворитель, если он не оказывает нежелательного действия на реакцию или используемые в ней реагенты и если он обладает способностью растворять, по крайней мере до определенной степени, указанные реагенты. Примерами подходящих растворителей являются: углеводороды, такие как бензол, толуол, ксилол, гексан и гептан; простые эфиры, такие как диэтиловый эфир, тетрагидрофуран и диоксан; амиды, такие как диметилформамид, диметилацетамид и триамид гексаметилфосфорной кислоты; галогидированные углеводороды, такие как метиленхлорид, хлороформ и 1,2-дихлорэтан; нитрилы, такие как ацетонитрил и пропионитрил; сложные эфиры, такие как этилформат и этилацетат; или смесь любых двух или нескольких из указанных растворителей. Из них предпочтительными являются амиды.
Первая стадия реакции может протекать в широком диапазоне температур, и точное значение реакционной температуры не играет решающей роли для настоящего изобретения. Однако в основном подходящей температурой для осуществления этой реакции является температура в диапазоне от температуры охлаждения льдом до температуры нагревания. Время, требуемое для проведения реакции, также может широко варьироваться в зависимости от многих факторов, а именно от реакционной температуры и от природы реагентов. Однако в большинстве случаев период времени, достаточный для проведения реакции, составляет от 0,5 до 5 ч.
Вторая стадия реакции может протекать в широком диапазоне температур, и точное значение реакционной температуры не играет решающей роли для настоящего изобретения. Однако в основном подходящей температурой для осуществления этой реакции является температура в диапазоне от комнатной температуры до 100oC. Время, требуемое для осуществления реакции, может также широко варьироваться в зависимости от многих факторов, а именно от реакционной температуры и от природы реагентов. Однако в большинстве случаев период времени, достаточный для проведения реакции, обычно составляет от 1 ч до нескольких дней.
Стадия D2
В Стадии D2 соединение формулы (R-27) получают с помощью реакции, которой подвергают соединение формулы (R-26) в целях удаления т-бутоксикарбонильной группы, представленной Boc (например, как описано J.W. Green, Protective Groups in Organic Synthesis, John Wiley & Sons; J.F.W. McOmie, Protective Groups in Organic Chemistry, Plenum Press).
Реакционная схема E.
Эта реакционная схема иллюстрирует метод получения соединения (R-1), используемого в качестве исходного материала в Реакционных схемах A и B (см. выше).
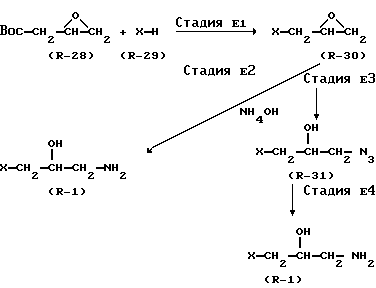
В вышеуказанных формулах X и Halo являются такими, как они были определены ранее.
Стадия E1
В Стадии E1 соединение формулы (R-30) получают посредством реакции соединения формулы (R-29) с соединением формулы (R-28). Эту реакцию обычно проводят в присутствии или в отсутствии основания. При этом может быть использовано любое основание, которое обычно используется в реакциях такого типа. Примерами походящих оснований являются карбонаты щелочных металлов, такие как карбонат натрия и карбонат калия; бикарбонаты щелочно-земельных металлов, такие как бикарбонат натрия; гидриды щелочных металлов, такие как гидрид натрия.
Эту реакцию обычно и предпочтительно осуществляют в присутствии растворителя. При этом может быть использован любой растворитель, если он не оказывает нежелательного действия на реакцию или используемые в ней реагенты и если он обладает способностью растворять, по крайней мере до определенной степени, указанные реагенты. Примерами подходящих растворителей являются: углеводороды, такие как бензол, толуол, ксилол, гексан и гептан; простые эфиры, такие как диэтиловый эфир, тетрагидрофуран и диоксан; спирты, такие как метанол, этанол и изопропанол; амиды, такие как диметилформамид, диметилацетамид и триамид гексаметилфосфорной кислоты; галоидированные углеводороды, такие как метиленхлорид, хлороформ и 1,2-дихлорэтан; нитрилы, такие как ацетонитрил и пропионитрил; сложные эфиры, такие как этилформат и этилацетат, или смесь любых двух или нескольких из указанных растворителей.
Данная реакция может протекать в широком диапазоне температур, и точное значение реакционной температуры не играет решающей роли для настоящего изобретения. Однако в основном подходящей температурой для проведения этой реакции является температура в диапазоне примерно от комнатной температуры до температуры нагревания. Время, требуемое для осуществления реакции, может также широко варьироваться в зависимости от многих факторов, а именно от реакционной температуры и от природы реагентов. Однако в большинстве случаев период времени, достаточный для проведения реакции, составляет от нескольких десятков минут до нескольких дней.
Стадия E2
В Стадии E2 соединение формулы (R-1) получают посредством реакции соединения формулы (R-30) с аммиаком.
Эту реакцию обычно и предпочтительно осуществляют в присутствии растворителя. В этих целях может быть использован любой растворитель при условии, что он не оказывает нежелательного действия на реакцию и используемые в ней реагенты, и при условии, что он обладает способностью растворять, по крайней мере до определенной степени, указанные реагенты. Примерами подходящих растворителей являются: углеводороды, такие как бензол, толуол, ксилол, гексан и гептан; простые эфиры, такие как диэтиловый эфир, тетрагидрофуран и диоксан; спирты, такие как метанол, этанол и изопропанол; амиды, такие как диметилформамид, диметилацетамид и триамид гексаметилфосфорной кислоты; галоидированные углеводороды, такие как метиленхлорид, хлороформ и 1,2-дихлорэтан; нитрилы, такие как ацетонитрил и пропионитрил; сложные эфиры, такие как метилформат, этилформат и этилацетат; вода или смесь любого из двух или нескольких из указанных растворителей.
Данная реакция может протекать в широком диапазоне температур, и точное значение реакционной температуры не играет решающей роли для настоящего изобретения. Однако в основном подходящей температурой для проведения этой реакции является температура в диапазоне примерно от комнатной температуры до температуры нагревания. Время, требуемое для осуществления реакции, может также широко варьироваться в зависимости от многих факторов, а именно от реакционной температуры и от природы реагентов. Однако в большинстве случаев период времени, достаточный для проведения реакции, составляет от нескольких десятков минут до нескольких дней.
Эта реакция может быть также проведена при атмосферном давлении либо в герметично закрытом сосуде.
Стадия E3
В Стадии E3 соединение формулы (R-31) получают с помощью реакции соединения формулы (R-30) с амидом щелочного металла, например азидом лития, азидом натрия или азидом калия.
Эту реакцию обычно и предпочтительно осуществляют в присутствии растворителя. В этих целях может быть использован любой растворитель при условии, что он не оказывает нежелательного действия на реакцию или используемые в ней реагенты, и при условии, что он обладает способностью растворять, по крайней мере до определенной степени, указанные реагенты. Примерами подходящих растворителей являются: углеводороды, такие как бензол, толуол, ксилол, гексан и гептан; простые эфиры, такие как диэтиловый эфир, тетрагидрофуран и диоксан; спирты, такие как метанол, этанол и изопропанол; амиды, такие как диметилформамид, диметилацетамид и триамид гексаметилфосфорной кислоты; галоидированные углеводороды, такие как метиленхлорид, хлороформ и 1,2-дихлорэтан; нитрилы, такие как ацетонитрил и пропионитрил; сложные эфиры, такие как метилформат, этилформат и этилацетат; вода или смесь любых двух или нескольких из указанных растворителей.
Данная реакция может протекать в широком диапазоне температур, и точное значение реакционной температуры не играет решающей роли для настоящего изобретения. Однако в основном подходящей температурой для осуществления этой реакции является температура в диапазоне примерно от комнатной температуры до температуры нагревания. Время, требуемое для осуществления реакции, может также широко варьироваться в зависимости от многих факторов, а именно от реакционной температуры и от природы реагентов. Однако в большинстве случаев период времени, достаточной для проведения реакции, составляет от нескольких десятков минут до нескольких дней.
Стадия E4
В Стадии E4 соединение формулы (R-1) получают посредством реакции соединения формулы (R-31) а алюмогидридом лития, либо посредством реакции каталитического гидрирования, которой подвергают соединение формулы (R-31).
Реакцию соединения формулы (R-31) с алюмогидридом лития обычно и предпочтительно осуществляют в присутствии растворителя. Для этой цели может быть использован любой растворитель при условии, что он не оказывает нежелательного действия на реакцию или используемые в ней реагенты, и при условии, что он обладает способностью растворять, по крайней мере до определенной степени, указанные реагенты. Примерами подходящих растворителей являются: углеводороды, такие как бензол, толуол, ксилол, гексан и гептан; простые эфиры, такие как диэтиловый эфир, тетрагидрофуран и диоксан; либо смесь любых двух или нескольких из указанных растворителей.
Данная реакция может протекать в широком диапазоне температур, и точное значение реакционной температуры не играет решающей роли для настоящего изобретения. Однако в основном подходящей температурой для осуществления этой реакции является температура в диапазоне от температуры охлаждения льдом до температуры нагревания. Время, требуемое для осуществления реакции, может также широко варьироваться в зависимости от многих факторов, а именно от реакционной температуры и от природы реагентов. Однако в большинстве случаев период времени, достаточной для проведения реакции, составляет от нескольких десятков минут до 1 дня.
Если соединение формулы (R-31) подвергают гидрогенизации в присутствии катализатора, то примерами таких катализаторов могут служить стандартные катализаторы гидрирования, например, такие как палладированный уголь и окись платины.
Эту реакцию обычно и предпочтительно осуществляют в присутствии растворителя. При этом может быть использован любой растворитель, если он не оказывает нежелательного действия на реакцию или используемые реагенты и если он обладает способностью растворять, по крайней мере до определенной степени, указанные реагенты. Примерами подходящих растворителей являются: углеводороды, такие как бензол, толуол, ксилол, гексан и гептан; простые эфиры, такие как диэтиловый эфир, тетрагидрофуран и диоксан; спирты, такие как метанол, этанол и изопропанол; амиды, такие как диметилформамид, диметилацетамид и триамид гексаметилфосфорной кислоты; галоидированные углеводороды, такие как метиленхлорид, хлороформ и 1,2-дихлорэтан; нитрилы, такие как ацетонитрил и пропионитрил; сложные эфиры, такие как этилформат и этилацетат; или смесь любых двух или нескольких из указанных растворителей.
Данная реакция может протекать в широком диапазоне температур, и точное значение реакционной температуры не играет решающей роли для настоящего изобретения. Однако в основном подходящей температурой для осуществления этой реакции является температура в диапазоне примерно от комнатной температуры до температуры нагревания. Время, требуемое для осуществления реакции, может также широко варьироваться в зависимости от многих факторов, а именно от реакционной температуры и от природы реагентов. Однако в большинстве случаев период времени, достаточной для проведения реакции, составляет от нескольких десятков минут до нескольких часов.
Эту реакцию обычно осуществляют при атмосферном давлении или предпочтительно при давлении, превышающем атмосферное.
Реакционная схема F.
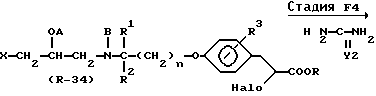
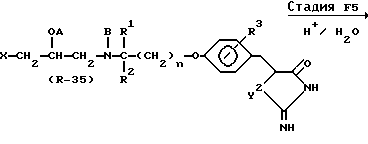
Нижеприведенная реакционная схема иллюстрирует альтернативный способ получения соединений формулы (R-36), которые относятся к соединениям формулы (I) настоящего изобретения.
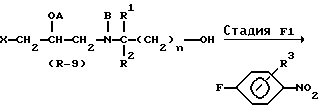
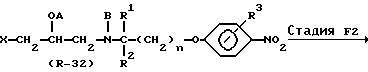
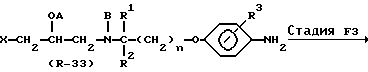
В вышеуказанных формулах X, A, B, R1, R2, R3, y2, R, 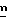 и Halo являются такими, как они были определены выше.
и Halo являются такими, как они были определены выше.
Стадия F1
В Стадии F1 соединение формулы (R-32) получают посредством реакции соединения формулы (R-9) с фтор-4-нитробензолом в присутствии основания.
Эту реакцию обычно и предпочтительно осуществляют в присутствии растворителя. Для этой цели может быть использован любой растворитель при условии, что он не оказывает нежелательного действия на реакцию или используемые реагенты, и при условии, что он обладает способностью растворять, по крайней мере до определенной степени, указанные реагенты. Примерами подходящих растворителей являются: ароматические углеводороды, такие как бензол, толуол и ксилол; простые эфиры, такие как диэтиловый эфир, тетрагидрофуран и диоксан; амиды, такие как диметилформамид, диметилацетамид и триамид гексаметилфосфорной кислоты; или смесь двух или нескольких из указанных растворителей.
В указанной реакции может быть использовано любое основание, при условии, что оно не оказывает нежелательного действия на реакцию; при этом, таким основанием может быть любое основание, которое обычно используется в реакциях такого типа. Примерами подходящих оснований являются: гидрид натрия, гидрид калия, гидроксид натрия, гидроксид калия, диизопропиламид бутиллития и лития.
Данная реакция может протекать в широком диапазоне температур, и точная величина реакционной температуры не имеет решающего значения для настоящего изобретения. Однако в основном подходящей температурой для осуществления этой реакции является температура в диапазоне от температуры охлаждения льдом до температуры нагревания. Время, требуемое для осуществления реакции, может также широко варьироваться в зависимости от многих факторов, а именно от реакционной температуры и от природы реагентов. Однако в большинстве случаев период времени, достаточный для проведения реакции, составляет от 1 ч до нескольких дней.
Стадия F2
В Стадии F2 соединение формулы (R-33) получают путем восстановления соединения формулы (R-32).
Эта реакция может быть осуществлена посредством каталитического гидрирования или посредством восстановления нитрогруппы с использованием цинк-уксусной кислоты или олово-соляной кислоты.
Стадия F3
В Стадии F3 соединение формулы (R-34) получают с помощью реакции арилирования Меервейна, которой подвергают соединение формулы (R-33). Эту реакцию обычно осуществляют методом, описанным в предварительной публикации патента Японии (Kokаi) N Sho 55-22657, и методом S.Oae и др. (Bull. Chem. Soc. Jpn., Vol. 53, стр. 1065 (1980)).
Стадия F4
В Стадии F4 соединение формулы (R-35) получают посредством реакции соединения формулы (R-34) с соединением формулы
где
Y2 представляет собой атом кислорода или атом серы.
Полученное соединение формулы (R-35) может быть выделено, но может быть использовано в Стадии F5 и без выделения.
Стадия F5
В Стадии F5 соединение формулы (R-36) получают посредством катализированной реакции кислотного гидролиза, которой подвергают соединение формулы (R-35). Стадии F4 и F5 обычно осуществляют методом, описанным в предварительной публикации патента Японии (Kokai) N Sho 55-22657.
После завершения любой из вышеописанных реакций нужные соединения, полученные в соответствующих стадиях, могут быть очищены стандартными методами, такими как колоночная хроматография, перекристаллизация, переосаждение или любая их комбинация. Например, в одной из подходящих процедур выделения реакционную смесь экстрагируют путем добавления растворителя, после чего этот растворитель выпаривают из экстракта. Затем полученный осадок вводят в хроматографическую колонку, например, с силикагелем, и получают очищенное целевое соединение.
Биологическая активность.
В испытуемой системе с использованием животных с врожденным диабетом соединения настоящего изобретения показали высокую гипокликемическую активность. Поэтому очевидно, что соединения настоящего изобретения могут быть использованы для лечения и/или предупреждения диабета; осложнений, связанных с диабетом; гиперлипидемии; гипертензии, связанной с ожирением; остеопороза и т.п.
Соединения настоящего изобретения могут быть введены в различных формах в зависимости от конкретного заболевания и состояния пациента. Например, если соединения предназначены для перорального введения, то они могут быть изготовлены в виде таблеток, капсул, гранул, порошков или сиропов; а если соединения предназначены для парентерального введения, то они могут быть изготовлены в виде инъекций (внутривенных, внутримышечных или подкожных), капель или суппозиториев. Для лечения слизистых оболочек глаза соединения настоящего изобретения могут быть введены в виде глазных капель или мазей. Эти препараты могут быть изготовлены стандартными способами, и, если необходимо, активный ингредиент может быть смешан с любой традиционной добавкой, такой как наполнитель, связующее вещество, дезинтегратор, замасливатель, корригирующее средство, солюбилизирующий агент, суспендирующая добавка, эмульгирующее средство или средство для покрытия. Хотя вводимая доза соединений настоящего изобретения может варьироваться в зависимости от симптомов, возраста и веса тела пациента, природы и тяжести заболевания, способа введения и формы лекарственного средства, предназначенного для лечения диабета, его осложнений и/или гиперлипемии, однако суточная доза, рекомендуемая для введения взрослому человеку, составляет от 0,01 до 2000 мг данного соединения и может быть введена в виде разовой дозы, либо разделенной дозы.
Активность соединений настоящего изобретения проиллюстрирована в нижеприведенных экспериментах.
Эксперимент 1. Гипогликемическая активность
В качестве испытуемых животных использовали мышей-самцов с гипергликемией (штамм КК), каждый их которых имел вес тела более 40 г. Каждому животному перорально вводили испытуемое соединение в количестве, указанном в нижеприведенной таблице 8, а затем давали корм по желанию в течение 18 ч. По истечении этого времени из хвостовой вены животного без анестезии брали кровь. Уровень глюкозы в крови (BGL) определяли с помощью анализатора глюкозы в крови (GL-101, изготавливаемого Mitsubishi Kasei Co. или Gluco oder, изготавливаемого Shino Test Co.).
Уровень снижения глюкозы в крови вычисляли по следующему уравнению:
уровень снижения глюкозы в крови (%)=(BGLs=BGLt)/BGLs • 100, где BGLs представляет собой BGL для группы животных, которым вводили лишь один растворитель и не вводили активного соединения, а BGLt представляет собой BGL для группы животных, которым вводили испытуемое соединение.
Полученные результаты показаны в нижеследующей таблице 8, в которой каждое соединение настоящего изобретения обозначено номером примера, в котором описано получение этого соединения.
Как видно из таблицы 8, соединения настоящего изобретения обнаруживают высокую гипогликемическую активность.
Эксперимент 2. Ингибирование альдозоредуктазы
Альдозоредуктазу бычьего хрусталика глаза выделяли и частично очищали методом S. Hyman & J.H. Kinoshita, y.Biol. Chem., 240, 877 (1965) и K.Inagaki. I. Miwa & J.Okuda, Arch. Biochem. Biophys., 316, 337 (1982) и ее активность определяли фотометрически по методу Varma и др. (Biochem. Pharmac., 25, 2505 (1976)). Ингибирование ферментной активности измеряли при концентрации соединений настоящего изобретения 5 мкг/мл и результаты этих измерений представлены в таблице 9.
Эксперимент 3. Токсичность
Токсичность соединений настоящего изобретения испытывали на крысах-самцах F344, которые были разделены на группы, состоящие из 5 животных. Каждому животному перорально в течение 2-х недель вводили испытуемое соединение в дозе, составляющей 50 мг на кг веса тела. В качестве испытуемых соединений использовали соединения примеров 20, 45 (полярное, менее полярное) и 47 (полярное). Животных наблюдали в течение последующих 2-х недель и на протяжении этого периода времени у животных не обнаруживалось каких-либо отклонений, которые можно было бы приписать действию испытуемых соединений. При гематологических исследованиях было обнаружено лишь небольшое снижение числа эритроцитов, которое можно было бы приписать действию соединения примера 45 (менее полярное). Если участь, что каждому животному была введена значительная доза соединения, то нулевая летальность среди животных указывает на то, что соединения настоящего изобретения имеют низкую токсичность.
Таким образом, соединения настоящего изобретения обладают высокой активностью и в то же время очень низкой токсичностью, что делает их идеальными для использования в терапевтических целях.
Настоящее изобретения, кроме того, проиллюстрировано нижеследующими примерами, не ограничивающими, однако, объема настоящего изобретения. В этих примерах номера соединений совпадают с номерами соединений, представленных в таблицах 1-7 (см. выше). Получение некоторых исходных материалов, используемых в некоторых из указанных примеров, проиллюстрировано в получениях, следующих за примерами. Конкретные величины угла вращения были получены путем измерений при комнатной температуре.
Пример 1. 5-{ 4-[2-(5-3'-Хлорфеноксиметил-2-оксо-оксазолидин-3-ил)пропокси]бензил} тиазолидин-2,4-дион (Соединение N 1-94)
К 330 мг 5-{4-[2-(5-3'-хлорфеноксиметил-2-оксооксазолидин-3-ил)пропокси] бензил} -3 -трифенилметилтиазолидин-2,4-диона (полученного в соответствии с описанием, приведенным в Получении 6) при охлаждении льдом добавляли 3 мл трифторуксусной кислоты и полученную смесь перемешивали при комнатной температуре в течение 2 ч. По истечении этого времени реакционную смесь нейтрализовали путем добавления водного раствора бикарбоната натрия, а затем экстрагировали этилацетатом. Экстракт промывали водным раствором хлорида натрия, а затем осушали безводным сульфатом натрия. После этого этилацетат удаляли из экстракта путем выпаривания при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле, используя в качестве элюента смесь этилацетатf и гексана (2:3 по объему), в результате чего получали 160 мг целевого соединения, имеющего т.пл. 50,9o-52,5oC и Rf = 0,45 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 2:1 по объему).
Пример 2. 5-{4-[2-(3-3'-Хлорфенокси-2-гидроксипропиламино)пропокси]бензил}тиазолидин -2,4-дион (Соединение N 1-92)
К раствору 100 мг 3-(3-хлорфенокси)-2-гидроксипропиламина (полученного в соответствии с описанием, приведенным в Получении 13) и 139 мг 5-[4-(2-оксопропокси)бензил] тиазолидин-2,4-диона в 3 мл безводного метанола при охлаждении льдом добавляли 148 мг цианборгидрида натрия. Полученную смесь перемешивали при комнатной температуре в течение 7 ч в потоке газообразного азота. По истечении этого времени реакционную смесь оставляли на ночь, а затем выливали в воду и экстрагировали этилацетатом. Образовавшийся экстракт промывали насыщенным водным раствором хлорида натрия и осушали безводным сульфатом натрия. После этого растворитель удаляли из экстракта путем выпаривания при пониженном давлении и полученный остаток очищали с помощью тонкослойной хроматографии на силикагеле, с использованием в качестве проявляющегося растворителя смеси этилацетата и этанола (8:1 по объему). Таким образом получали 92 мг целевого соединения, имеющего Rf = 0,30 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и этанола, 10:1 по объему).
Пример 3. 5-{4-[2-(3-фенокси-2-гидроксипропиламино)-пропокси]бензил}тиазолидин-2,4-дион (Соединение N 1-16)
Повторяли процедуру, описанную в Примере 2, за исключением того, что использовали 0,98 г 3-фенокси-2-гидроксипропиламина (полученного в соответствии с описанием, приведенным в Получении 15), 3,39 г 5-[4-(2-оксопропокси)-бензил] тиазолидин-2,4-диона, 1,11 г цианоборгидрида натрия и 60 мл безводного метанола. Полученный неочищенный продукт очищали с помощью хроматографии на колонке и силикагелем, используя в качестве элюента смесь этилацетата и этанола (10:1 по объему), в результате чего получали 1,92 г целевого соединения с т.пл. 64-68oC.
Пример 4. 5-{4-[2-(5-Феноксиметил-2-оксооксазолидин- 3-ил)пропокси]бензил}тиазолидин-2,4-дион (Соединение N 1-48)
К раствору 500 мг 5-{4-[2-(3-фенокси-2-гидроксипропиламино)пропокси] бензил} тиазолидин-2,4-диона (полученного в соответствии с описанием, приведенным в Примере 3) в 5 мл безводного диметилформамида при охлаждении льдом добавляли 211 мг N,N'-карбонилдиимидазола и полученную смесь перемешивали при комнатной температуре в течение 5 часов. По истечении этого времени, диметилформамид удаляли из реакционной смеси путем выпаривания при пониженном давлении. После добавления к полученному остатку воды смесь экстрагировали этилацетатом. После этого экстракт промывали водным раствором хлорида натрия, а затем осушали безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания при пониженном давлении и полученный остаток очищали с помощью колоночной хроматографии на силикагеле, используя в качестве элюента смесь этилацетата и гексана (2:1 - 1:1 по объему), в результате чего получали 410 мг целевого соединения, имеющего т.пл. 54 - 56oC.
Пример 5. 5-{4-[2-(3-3'-Хлорфенокси-2-гидроксипропиламино) этоксибензил} тиазолидин-2,4-дион (Соединение N 1-91)
Повторяли процедуру, описанную в Примере 2, за исключением того, что использовали 600 мг 3-(3-хлорфенокси)-2-гидроксипропиламина (полученного в соответствии с описанием, приведенным в Получении 13), 800 мг 5-[4-(2-оксоэтокси)бензил] тиазолидин-2,4-диона (полученного в соответствии с описанием, приведенным в Получении 20), 570 мг цианоборгидрида натрия и 40 мл безводного метанола. Таким образом получали 180 мг целевого соединения, имеющего Rf = 0,35 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этанола и этилацетата, 1 : 4 по объему).
Пример 6. 5-{ 4-[2-(5-3'-Хлорфеноксиметил-2-оксооксазолидин- 3-ил)пропокси]бензил}тиазолидин-2,4-дион (Соединение N 1-93)
Повторяли процедуру, описанную в Примере 4, за исключением того, что использовали 180 мг 5-{4-[2-(3-3'-хлорфенокси-2- гидроксипропиламино)этокси] бензил} тиазолидин-2,4-диона, (полученного в соответствии с процедурой, описанной в Примере 5), 65 мг N,N'-карбонилдиимидазола и 10 мл безводного диметилформамида, в результате чего получали 53 мг целевого соединения, имеющего т. пл. 58 - 63oC и Rf = 0,27 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 2:1 по объему).
Пример 7. 5-{4-[2-(3-Фенил-2-гидроксипропиламино)пропокси] бензил}тиазолидин-2,4-дион (Соединение N 1-2)
500 мг 3-фенил-2-гидроксипропиламина (полученного в соответствии с описанием, приведенным в Получении 17) и 1,0 мг 5-[4-(2-оксопропокси)бензил] тиазолидин-2,4-диона суспендировали в 30 мл безводного бензола и полученную суспензию нагревали с обратным холодильником в течение 30 мин, удаляя при этом воду. Затем растворитель удаляли путем выпаривания при пониженном давлении. Образовавшийся маслообразный продукт растворяли в 20 мл безводного метанола и к полученному раствору (при охлаждении льдом) добавляли 670 мг цианоборгидрида натрия. После этого смесь перемешивали в течение 2 ч в потоке газообразного азота. Затем реакционную смесь выдерживали в течение ночи, после чего растворитель удаляли путем выпаривания при пониженном давлении. К остатку добавляли воду и смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия, а затем осушали безводным сульфатом натрия. Растворитель удаляли из экстракта путем выпаривания при пониженном давлении и образовавшийся остаток вводили в хроматографическую колонку с силикагелем (элюируя смесью этилацетата и метанола, 5:1 по объему), после чего кристаллизовали из этилацетата, в результате чего получали 590 мг целевого соединения, т. пл. 145 - 152oC.
Пример 8. 5-{4-[2-(5-Бензил-2-оксооксазолидин- 3-ил)пропокси]бензил}тиазолидин-2,4-дион (Соединение N 1-4)
Повторяли процедуру, описанную в Примере 4, за исключением того, что использовали 300 мг 5-{4-[2-(3-фенил-2- гидроксипропиламино)пропокси]бензил} тиазолидин-2,4-диона, (полученного в соответствии с описанием, приведенным в Примере 7), 120 мг N,N'-карбонилдиимидазола и 10 мл безводного диметилформамида. Полученный продукт хроматографировали на колонке с силикагелем, используя в качестве элюента смесь этилацетата и гексана (3:2 по объему), в результате чего получали 200 мг целевого соединения с т.пл. 60 - 70oC.
Пример 9. 5-{4-[2-(3-3'-Хлорфенокси-2-гидроксипропиламино) пропилтио]бензил}тиазолидин-2,4-дион (Соединение N 1-158)
Повторяли процедуру, описанную в Примере 2, за исключением того, что использовали 1,0 г 3-(3-хлорфенокси)-2-гидроксипропиламина (полученного в соответствии с описанием, приведенным в Получении 13, 1,5 г 5-[4-(2-оксопропилтио)бензил] тиазолидин-2,4-диона (полученного в соответствии с описанием, приведенным в Получении 18), 940 мг цианоборгидрида натрия и 30 мл безводного метанола. Полученный неочищенный продукт хроматографировали на колонке с силикагелем, используя в качестве элюента смесь этилацетата и этанола (10:1 по объему), в результате чего получали 1,52 мг целевого соединения, имеющего Rf = 0,44 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и этанола, 10:1 по объему).
Пример 10. 5-{ 4-[2-(5-3'-Хлорфеноксиметил-2-оксооксазолидин- 3-ил)пропилтио]бензил}тиазолидин-2,4-дион (Соединение N 1-159)
Повторяли процедуру, описанную в Примере 4, за исключением того, что использовали 300 мг 5-{4-[2-(3-3'-хлорфенокси-2-гидроксипропиламино) пропилтио] бензил} тиазолидин-2,4-диона (полученного в соответствии с описанием, приведенным в Примере 9), 470 мг N,N'-карбонилдиимидазола и 20 мл безводного диметилформамида. Полученный неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле, используя в качестве элюента смесь этилацетата и гексана (3: 2 по объему), в результате чего получали отдельно более полярный диастереомер и менее полярный диастереомер. Соответствующие диастереомеры очищали с помощью обращенно-фазовой препаративной жидкостной хроматографии высокого разрешения [колонка УМС-Раск ODS-A (торговый знак продукта, изготовленного фирмой УМС Co.); элюент - смесь ацетонитрила, воды, уксусной кислоты и триэтиламина, 100:100:1:1 по объему], в результате чего из более полярного диастереомера получали 110 мг целевого соединения, имеющего Rf = 0,15 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 1:1 по объему), а из менее полярного диастереомера получали 120 мг целевого соединения, имеющего Rf = 0,25 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 1:1 по объему).
Пример 11. 5-[4-{2(R)-[5(S)-(3-Хлорфеноксиметил)- 2-оксооксазолидин-3-ил]пропокси}бензил]тиазолидин-2,4-дион (Соединение N 1-94)
Повторяли процедуру, описанную в Примере 1, за исключением того, что использовали 0,96 г 5-[4-{2(R)-[5(S)-(3-хлорфеноксиметил)- 2-оксооксазолидин-3-ил] пропокси}бензил]-3-трифенилметилтиазолидин- 2,4-диона (полученного в соответствии с описанием, приведенным в Получении 29), 4 мл метиленхлорида и 4 мл трифторуксусной кислоты. Таким образом получали 0,52 г целевого соединения, имеющего т. пл. 48 - 53oC (с размягчением) и имеющего [α]D = +54o (метанол, с = 1,000).
Пример 12. 5-[4-{2(S)-[5(R)-(3-Хлорфеноксиметил)- 2-оксооксазолидин-3-ил]пропокси}бензил]тиазолидин-2,4-дион (Соединение N 1-94)
Повторяли процедуру, описанную в Примере 1, за исключением того, что использовали 0,73 мг 5-[4-{2(S)-[5(R)-(3-хлорфеноксиметил)- 2-оксооксазолидин-3-ил] пропокси}бензил]-3-трифенилметилтиазолидин- 2,4-диона (полученного в соответствии с описанием, приведенным в Получении 37), 4 мл метиленхлорида и 4 мл трифторуксусной кислоты, в результате чего получали 0,39 г целевого соединения, имеющего т.пл. 55 - 60oC (с размягчением) и имеющего [α]D = -52,4o (метанол, с = 0,990).
Пример 13. 5-[4-{2(S)-[5(S)-(3-Хлорфеноксиметил)- 2-оксооксазолидин-3-ил]пропокси}бензил]тиазолидин-2,4-дион (Соединение N 1-94)
Повторяли процедуру, описанную в Примере 1, за исключением того, что использовали 0,57 мг 5-[4-{2(R)-[5(R)-(3-хлорфеноксиметил)- 2-оксооксазолидин-3-ил] пропокси}бензил]-3-трифенилметилтиазолидин- 2,4-диона (полученного в соответствии с описанием, приведенным в Получении 45), 2 мл трифторуксусной кислоты и 2 мл метиленхлорида, в результате чего получали 280 мг целевого соединения с температурой плавления 52 - 53oC. [α]D = = -39,7o (метанол, с = 0,965).
Пример 14. 5-[4-{2(R)-[5(R)-(3-Хлорфеноксиметил)- 2-оксооксазолидин-3-ил]пропокси}бензил]тиазолидин-2,4-дион (Соединение N 1-94)
Повторяли процедуру, описанную в Примере 1, за исключением того, что использовали 0,57 г 5-[4-{2(R)-[5(R)-(3-хлорфеноксиметил)- 2-оксооксазолидин-3-ил] пропокси}бензил]-3-трифенилметилтиазолидин- 2,4-диона (полученного в соответствии с описанием, приведенным в Получении 45), 2 мл трифторуксусной кислоты и 2 мл метиленхлорида. Таким образом было получено целевое соединение (280 мг) с т.пл. 52 - 53oC.
[α]D = -39,7o (метанол, с = 0,965).
Пример 15. 5-{4-[2-(3-Бензилокси-2-гидроксипропиламино)пропокси] бензил} тиазолидин-2,4-дион (Соединение N 1-64)
Повторяли процедуру, описанную в Примере 2, за исключением того, что использовали 545 мг 3-бензилокси-2-гидроксипропиламина (полученного в соответствии с описанием, приведенным в Получении 48), 700 мг 5-[4-(2-оксопропокси)бензил] тиазолидин-2,4- диона, 470 мг цианоборгидрида натрия и 60 мл безводного метанола. Полученный неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле, элюируя градиентом смеси этилацетата и этанола (10:1 - 5:1 по объему. Кроме того, полученный продукт очищали с помощью обращенно-фазовой препаративной жидкостной хроматографии высокого разрешения (YMC-Pack ODS-A-торговый знак продукта, изготовленного фирмой YMC Co. ), используя в качестве элюента смесь ацетонитрила, воды, уксусной кислоты и триэтиламина (50:1:1 по объему), в результате чего получали 130 мг целевого продукта в виде бледно-желтого стеклообразного твердого вещества, имеющего Rf = 0,16 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и этанола, 10:1 по объему).
Пример 16. 5-{4-[2-(3-5-Фенилпентилокси-2-гидроксипропиламино)пропокси] бензил}тиазолидин-2,4-дион (Соединение N 1-160)
Повторяли процедуру, описанную в Примере 2, за исключением того, что использовали 820 мг 3-(5-фенилпентилокси)-2-гидроксипропиламина (полученного в соответствии с описанием, приведенным в Получении 51), 840 мг 5-[4-(2-оксопропил)бензил] тиазолидин-2,4-диона, 540 мг цианоборгидрида натрия и 80 мл безводного метанола. Полученный неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле, элюируя градиентом смеси этилацетата и этанола (10:1 - 5:1 по объему). После этого полученный продукт очищали с помощью обращенно-фазовой препаративной жидкостной хроматографии высокого разрешения (YMC-Раск ODS-A-торговый знак продукта, изготовленного фирмой YMC Co. ), используя в качестве элюента смесь ацетонитрила, воды, уксусной кислоты и триэтиламина (50: 50:1:1 по объему). Таким образом получали 250 мг целевого соединения в виде бледно-желтого маслообразного вещества, имеющего Rf = 0,35 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и этанола (5:1 по объему)).
Пример 17. 5-{4-[2-(3-3'-Фенилпропокси-2-гидроксипропиламино)пропокси] бензил}тиазолидин-2,4-дион (Соединение N 1-74)
Повторяли процедуру, описанную в Примере 2, за исключением того, что использовали 720 мг 3-(3-фенилпропокси)-2-гидроксипропиламина (полученного в соответствии с описанием, приведенным в Получении 54), 800 мг 5-[4-(2-оксопропокси)бензил] тиазолидин-2-4-диона, 540 мг цианоборгидрида натрия и 70 мл безводного метанола. Полученный неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле, используя в качестве элюента смесь этилацетата и этанола (10: 1 - 5:1 по объему). Затем полученный продукт очищали с помощью обращенно-фазовой препаративной жидкостной хроматографии высокого разрешения (YMC-Pack ODS-A-торговый знак продукта, изготовленного фирмой YMC Co. ), используя в качестве элюента смесь ацетонитрила, воды, уксусной кислоты и триэтиламина (50:50:1:1 по объему), в результате чего получали 380 мг целевого соединения в виде бледно-желтого стеклообразного твердого вещества, имеющего Rf = 0,29 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и этанола (5:1 по объему).
Пример 18. 5-{ 4-[2-(3-2'-Фенилэтокси-2-гидроксипропиламино)пропокси] бензил}тиазолидин-2,4-дион (Соединение N 1-69)
Повторяли процедуру, описанную в Примере 2, за исключением того, что использовали 0,70 г 3-(2-фенилэтокси)-2-гидроксипропиламина (полученного в соответствии с процедурой, описанной в Получении 57), 1,00 г 5-[4-(2-оксопропокси)бензил] тиазолидин-2,4-диона, 0,71 г цианоборгидрида натрия и 20 мл безводного метанола. Полученный неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле, используя в качестве элюента этилацетат. В результате этой процедуры получали 0,92 г целевого соединения, имеющего т.пл. 46 - 49oC (с размягчением).
Пример 19. 5-{ 4-[2-(3-4'-Фенилбутокси-2-гидроксипропиламино)пропокси] бензил}тиазолидин-2,4-дион (Соединение N 1-161)
Повторяли процедуру, описанную в Примере 2, за исключением того, что использовали 1,20 г 3-(4-фенилбутокси)-2-гидроксипропиламина (полученного в соответствии с описанием, приведенным в Получении 60), 1,00 г 5-[4-(2-оксопропокси)бензил] тиазолидин-2,4-диона, 0,71 г цианоборгидрида натрия и 20 мл безводного метанола. Полученный неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле, используя в качестве элюента смесь этилацетата и этанола (8: 1 по объему), в результате чего получали 1,34 г целевого соединения, имеющего т.пл. 32 - 37oC (с размягчением).
Пример 20. 5-{4-[2-(3-6-Фенилгексилокси-2-гидроксипропиламино)пропокси] бензил}тиазолидин-2,4-дион (Соединение N 1-162)
Повторяли процедуру, описанную в Примере 2, за исключением того, что использовали 864 мг 3-(6-фенилгексилокси)-2-гидроксипропиламина (полученного в соответствии с описанием, приведенным в Получении 63), 800 мг 5-[4-(2-оксопропокси)бензил] тиазолидин-2,4-диона, 540 мг цианоборгидрида натрия и 50 мл безводного метанола. Полученный неочищенный продукт очищали с помощью хроматографии на колонках с силикагелем, используя в качестве элюента градиент смеси этилацетата и этанола (1:0 - 5:1 по объему), в результате чего получали 500 мг целевого соединения в виде бледно-желтого маслообразного вещества, имеющего Rf = 0,42 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и этанола, 5:1 по объему).
Пример 21. 5-{4-[2-(3-8'-Фенилоктилокси-2-гидроксипропиламино)пропокси] бензил}тиазолидин-2,4-дион (Соединение N 1-163)
Повторяли процедуру, описанную в Примере 2, за исключением того, что использовали 0,96 г 3-(8-фенилоктилокси)-2-гидроксипропиламина (полученного в соответствии с описанием, приведенным в Получении 66), 0,80 г 5-[4-(2-оксопропокси)бензил] тиазолидин-2,4-диона, 0,54 г цианоборгидрида натрия и 50 мл безводного метанола. Полученный неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле, используя в качестве элюента градиент смеси этилацетата и этанола (10:1 - 5:1 по объему). В результате этой процедуры получали 360 мг целевого соединения, имеющего Rf = 0,43 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и этанола, 5:1 по объему).
Пример 22. 5-{4-[2-(5-Бензилоксиметил-2-оксооксазолидин-3-ил)пропокси] бензил}тиазолидин-2,4-дион (Соединение N 1-164)
Повторяли процедуру, описанную в Примере 4, за исключением того, что использовали 200 мг 5-{4-[2-(3-бензилокси-2-гидроксипропиламина)пропокси] бензил}тиазолидин-2,4-диона (полученного в соответствии с процедурой, описанной в Примере 15), 73 мг N,N'-карбонилдиимидазола и 20 мл безводного диметилформамида. Полученный неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле, элюируя градиентом смеси этилацетата и гексана (2: 1 - 3:1 по объему). В результате этой процедуры получали 160 мг целевого соединения в виде бледно-желтого стеклообразного твердого вещества, которое представляет собой смесь менее полярного диастереомера, имеющего Rf = 0,49 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 3:1 по объему), и более полярного диастереомера, имеющего Rf = 0,38 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 3:1 по объему).
Пример 23. 5-{4-[2-(5-2'-Фенилэтоксиметил-2-оксооксазолидин-3-ил) пропокси]бензил}тиазолидин-2,4-дион (Соединение N 1-165)
Повторяли процедуру, описанную в Примере 4, за исключением того, что использовали 700 мг 5-{4-[2-(3-2'-фенилэтокси-2-гидроксипропиламино) пропокси] бензил} тиазолидин-2,4-диона (полученного в соответствии с описанием, приведенным в Примере 18), 250 мг N,N'-карбонилдиимидазола и 10 мл безводного диметилформамида. Полученный неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле, используя в качестве элюента смесь гексана и этилацетата (1: 1 по объему), в результате чего получали 650 мг целевого соединения в виде смеси (1:1) полярного диастереомера, имеющего Rf = 0,74 (тонкослойная хроматография на силикагеле с использованием в качестве элюента этилацетата), и менее полярного диастереомера, имеющего Rf = 0,80 (тонкослойная хроматография на силикагеле с использованием в качестве элюента этилацетата).
Пример 24. 5-{4-[2-(5-3'-Фенилпропоксиметил-2-оксооксазолидин-3-ил) пропокси]бензил}тиазолидин-2,4-дион (Соединение N 1-166)
Повторяли процедуру, описанную в Примере 4, за исключением того, что использовали 600 мг 5-{ 4-[2-(3-3'-фенилпропокси-2-гидроксипропиламино) пропокси] бензил} тиазолидин-2,4-диона (полученного в соответствии с описанием, приведенным в Примере 17), 206 мг N,N'-карбонилдиимидазола и 60 мл безводного диметилформамида. Полученный неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле, используя в качестве элюента градиент смеси этилацетата и гексана (1:1 - 3:2 по объему), в результате чего получали отдельно полярный диастереомер и менее полярный диастереомер. Соответствующие диастереомеры очищали с помощью обращенно-фазовой препаративной жидкостной хроматографии высокого разрешения (YMC-Pack ODS-A-торговый знак продукта, изготовленного фирмой YMC Co.), используя в качестве элюента смесь ацетонитрила и воды (1:1 по объему). В результате этой процедуры из полярного диастереомера получали 98 мг целевого соединения, имеющего Rf = 0,46 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 2:1 по объему), а из менее полярного диастереомера получали 189 мг целевого соединения, имеющего Rf = 0,52 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана (2:1 по объему).
Пример 25. 5-{4-[2-(5-4'-Фенилбутоксиметил-2-оксооксазолидин-3-ил) пропокси]бензил}тиазолидин-2,4-дион (Соединение N 1-79)
Повторяли процедуру, описанную в Примере 4, за исключением того, что использовали 550 мг 5-{4-[2-(3-4'-фенилбутокси-2-гидроксипропиламино) пропокси] бензил} тиазолидин-2,4-диона (полученного в соответствии с описанием, приведенным в Примере 19), 180 мг N,N'-карбонилдиимидазола и 10 мл безводного диметилформамида. Полученный неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле, используя в качестве элюента смеси гексана и этилацетата (2:1 по объему). Затем продукт очищали с помощью обращенно-фазовой препаративной жидкостной хроматографии высокого разрешения (YMC-Pack ODS-A-торговый знак продукта, изготовленного фирмой YMC Co.), используя в качестве элюента смесь ацетонитрила, воды, уксусной кислоты и триэтиламина (100: 100: 1:1 по объему), в результате чего получали полярный диастереомер и менее полярный диастереомер. Из полярного диастереомера получали 170 мг целевого соединения, имеющего Rf = 0,71 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя этилацетата), а из менее полярного диастереомера получали 160 мг целевого соединения, имеющего Rf = 0,79 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя этилацетата).
Пример 26. 5-{ 4-[2-(5-5'-Фенилпентилоксиметил-2-оксооксазолидин-3-ил) пропокси]бензил}тиазолидин-2,4-дион (Соединение N 1-167)
Повторяли процедуру, описанную в Примере 4, за исключением того, что использовали 600 мг 5-{ 4-[2-(3-5'-фенилпентилокси-2-гидроксипропиламино) пропокси] бензил} тиазолидин-2,4-диона (полученного в соответствии с описанием, приведенным в Примере 16), 194,3 мг N,N'-карбонилдиимидазола и 60 мл безводного диметилформамида. Полученный неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле, используя в качестве элюента смесь этилацетата и гексана (2:1 по объему). В результате этой процедуры получали 520 мг целевого соединения в виде бледно-желтого маслообразного вещества, которое представляет собой смесь менее полярного диастереомера, имеющего Rf = 0,61 (тонкослойная хроматография на силикагеле с использованием смеси этилацетата и гексана (2:1 по объему) в качестве проявляющего растворителя) и полярного диастереомера, имеющего Rf = 0,52 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 2:1 по объему).
Пример 27. 5-{ 4-[2-(5-6'-Фенилгексилоксиметил-2-оксооксазолидин-3-ил) пропокси]бензил}тиазолидин-2,4-дион (Соединение N 1-168)
Повторяли процедуру, описанную в Примере 4, за исключением того, что использовали 690 мг 5-{ 4-[2-(3-6'-фенилгексилокси-2-гидроксипропиламино) пропокси] бензил}тиазолидин-2,4-диона, полученного в соответствии с описанием, приведенным в Примере 20), 217 мг N,N'-карбонилдиимидазола и 20 мл безводного диметилформамида. Полученный неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле, используя в качестве элюента смесь этилацетата и гексана (1:1 - 3:2 по объему), в результате чего получали 520 мг целевого соединения в виде бледно-желтого маслообразного вещества, которое представляет собой смесь менее полярного диастереомера, имеющего Rf = 0,63 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 3:2 по объему) и полярного диастереомера, имеющего Rf - 0,56 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 3:2 по объему).
Пример 28. 5-{ 4-[2-(5-8'-Фенилоктилоксиметил-2-оксооксазолидин-3-ил)пропокси]бензил}тиазолидин-2,4-дион (Соединение N 1-169)
Повторяли процедуру, описанную в Примере 4, за исключением того, что использовали 660 мг 5-{ 4-[2-(3-8'-фенилоктилокси-2-гидроксипропиламино)пропокси] бензил} тиазолидин-2,4-диона (полученного в соответствии с описанием, приведенным в Примере 21), 197 мг N,N'-карбонилдиимидазола и 20 мл безводного диметилфомамида. Полученный неочищенный продукт очищали с помощью хроматографии на колонках с силикагелем, используя в качестве элюента смесь этилацетата и гексана (1:1 по объему). В результате этой процедуры получали 550 мг целевого соединения в виде смеси полярного диастереомера, имеющего Rf = 0,58 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 3:2 по объему) и менее полярного диастереомера, имеющего Rf - 0,65 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 3:2 по объему).
Пример 29. 5-{ 4-[2-(5-7'-Фенилгептилоксиметил- -2-оксооксазолидин-3-ил)пропокси]-бензил}-тиазолидин-2,4-дион (Соединение N 1-170)
Повторяли процедуру, описанную в Примере 4, за исключением того, что использовали 590 мг 5-{ 4-[2-(3-7'-фенилгептилокси-2-гидроксипропиламино)пропокси] бензил] тиазолидин-2,4-диона (полученного в соответствии с описанием, приведенным в Примере 56), 181 мг N,N'-карбонилдиимидазола и 15 мл безводного диметилформамида. Полученный неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле, используя в качестве элюента смесь этилацетата и гексана (1:1 по объему), в результате чего получали 383 мг целевого соединения в виде смеси полярного диастереомера, имеющего Rf = 0,29 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 1:1 по объему) и менее полярного диастереомера, имеющего Rf = 0,37 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 1:1 по объему).
Пример 30. 5-{ 4-[2-(5-3'-Фторфеноксиметил-2- -оксооксазолидин-3-ил)пропокси]бензил}тиазолидин-2,4-дион (Соединение N 1-171)
Повторяли процедуру, описанную в Примере 1, за исключением того, что использовали 390 мг 5-{4-[2-(5-3'-фторфеноксиметил)-2-оксооксазолидин-3-ил)пропокси] бензил} - 3-трифенилметилитиазолидин-2,4-диона (полученного в соответствии с описанием, приведенным в Получении 74), 2 мл трифторуксусной кислоты и 2 мл метиленхлорида. Таким образом получали 200 мг целевого соединения с т.пл.50-53oC.
Пример 31. 5-{ 4-[2-(5-4'-Метоксифеноксиметил- 2-оксооксазолидин-3-ил)пропокси]бензил}тиазолидин-2,4-дион (Соединение N 1-173)
(a) Повторяли процедуру, описанную в Примере 1, за исключением того, что использовали 0,68 г 5-{4-[2-5-4'-метоксифеноксиметил-2-оксооксазолидин-3-ил)пропокси] бензил} -3-трифенилметилтиазолидин-2,4-диона (менее полярный изомер), полученного в соответствии с описанием, приведенным в Получении 78(a), 2 мл трифторуксусной кислоты и 2 мл метиленхлорида. Таким образом, из менее полярного диастереомера получали 280 мг целевого соединения, имеющего т.пл.49-52oC.
(b) Повторяли процедуру, описанную в Примере 1, за исключением того, что использовали 840 мг 5-{4-[2-(5-4'-метоксифеноксиметил-2-оксооксазолидин-3-ил)пропокси] бензил} -3-трифенилметилтиазолидин-2,4-диона (полярный изомер), полученного в соответствии с описанием, приведенным в Получении 78(b), 2 мл трифторуксусной кислоты и 2 мл метиленхлорида. Таким образом, из полярного диастереомера получали 440 мг целевого соединения с т.пл.54-58oC.
Пример 32. 5-{ 4-[2-(3-3'-Диметиламинофенокси-2-гидроксипропиламино)пропокси]бензил} -тиазолидин-2,4-дион (Соединение N 1-176)
Повторяли процедуру, описанную в Примере 2, за исключением того, что использовали 1,20 г 3-(3-диметиламинофенокси)-2-гидроксипропиламина (полученного в соответствии с описанием, приведенным в Получении 81), 1,81 г 5-[4-(2-оксопропоксибензил]тиазолидин-2,4-диона, 0,96 г цианоборгидрида натрия и 50 мл безводного метанола. Полученный неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле, используя в качестве элюента смесь этилацетата и этанола (20:1 по объему). После перекристаллизации из этанола получали 0,74 г целевого соединения, т.пл.92,1-98oC.
Пример 33. 5-{4-[2-(5-3'-Диметиламинофенокси-метил-2-оксооксазолидин-3-ил)пропокси] -бензил}тиазолидин-2,4-дион(Соединение N 1-177)
Повторяли процедуру, описанную в Примере 4, за исключением того, что использовали 500 мг 5-{4-[2-(3-3'-диметиламинофенокси-2-гидроксипропиламино] пропокси] бензил} тиазолидин-2,4-диона (полученного в соответствии с описанием, приведенным в Примере 32), 195 мг N,N'-карбонилдимидазола и 5 мл безводного диметилформамида. Полученный неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле, используя в качестве элюента смесь этилацетата и гексана (2: 1 по объему), в результате чего получали 380 мг целевого соединения, т.пл.55,5-57,1oC.
Пример 34. 5-{4-[2-(3-4'-Фенилфенокси-2-гидрокси-пропиламино)пропокси] бензил} тиазолидин-2,4-дион (Соединение N 1-179)
Повторяли процедуру, описанную в Примере 1, за исключением того, что использовали 1,00 г 3-(4-фенилфенокси)-2-гидроксипропиламина (полученного в соответствии с описанием, приведенным в Получении 84), 1,46 г 5-[4-(2-оксопропокси)бензил] тиазолидин-2,4-диона, 0,52 г боргидрида натрия и 40 мл безводного метанола. Полученный неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле, используя в качестве элюента градиент смеси этилацетата и метанола (1:0 - 10:1, по объему). Затем полученный продукт очищали с помощью обращенно-фазовой жидкостной хроматографии (элюент - смесь ацетонитрила и воды, 1:1 по объему), описанной в Примере 10, в результате чего получали 174 мг целевого соединения с т.пл. 76,7-80,3oC.
Пример 35. 5-{ 4-[2-(5-4'-Фенилфеноксиметил-2-оксооксазолидин-3-ил)пропокси]бензил- тиазолидин-2,4-дион (Соединение N 1-180)
Повторяли процедуру, описанную в Примере 4, за исключением того, что использовали 500 мг 5-{ 4-[2-(3-4'-фенилфенокси-2-гидроксипропиламино)пропокси] бензил} тиазолидин-2,4-диона (полученного в соответствии с описанием, приведенным в Примере 34), 195 мг N,N'-карбонилдиимидазола и 10 мл безводного диметилфомамида. Полученный неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле, используя в качестве элюента смесь этилацетата и гексана (3:2 по объему), в результате чего получали 0,44 г целевого соединения, т.пл.73,1-75,4oC.
Пример 36. 5-{ 4-[2-(5-4'-Фенилфеноксиметил-2-тиооксаоксозолидин- 3-ил)пропокси]бензил}тиазолидин-2,4-дион (Соединение N 1-181)
К раствору 500 мг 5-{ 4-[2-(3-4'-фенилфенокси-2-гидроксипропиламино)пропокси] бензил} тиазолидин-2,4- диона (полученного в соответствии с описанием, приведенным в Примере 34) в 10 мл безводного метиленхлорида добавляли 218 мг N,N'-тиокарбонилдиимидазола и полученную смесь перемешивали при комнатной температуре в течение часа. По истечении этого времени к реакционной смеси добавляли воду и эту смесь экстрагировали этилацетатом. Экстракт осушали безводным сульфатом натрия, после чего этилацетат удаляли путем выпаривания при пониженном давлении. Полученный остаток очищали путем колоночной хроматографии на силикагеле, используя в качестве элюента смесь этилацетата и гексана (2:3 по объему). Затем полученный продукт очищали с помощью обращенно-фазовой жидкостной хроматографии (элюент - смесь ацетонитрила и воды, 60:40 по объему), описанной в Примере 10, в результате чего получали 136 мг целевого соединения (т.пл. 58,7-60,8oC) из полярного диастереомера и 165 мг целевого соединения (т.пл.177,6 - 180,3oC) из менее полярного диастереомера.
Пример 37. 5-{4-[2-(3-Фенилтио-2-гидроксипропиламино)пропокси] бензил} тиазолидин-2,4-дион (Соединение N 1-182)
Повторяли процедуру, описанную в Примере 2, за исключением того, что использовали 2,95 г 3-фенилтио-2-гидроксипропиламина (полученного в соответствии с описанием, приведенным в Получении 87), 3 г 5-[4-(2- оксопропокси)бензил]тиазолидин-2,4диона, 1,0 г цианоборгидрида натрия и 100 мл безводного метанола, в результате чего получали 1,74 г целевого соединения, т.пл. 176-177oC.
Пример 38. 5-{4-[2-(5-Фенилтиометил-2-оксооксазолидин-3-ил)пропокси]бензил}- тиазолидин-2,4-дион (Соединение N 1-128)
Повторяли процедуру, описанную в Примере 4, за исключением того, что использовали 1,2 г 5-{4-[2-(3-фенилтио-2-гидроксипропиламино) пропокси]бензил} тиазолидин-2,4-диона (полученного в соответствии с описанием, приведенным в Примере 37), 0,52 г N,N'-карбонилдиимидазола и 20 мл безводного диметилформамида. В результате этой процедуры получали 1,15 г целевого соединения в виде смеси (1: 1) полярного диастереомера, имеющего Rf = 0,30 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 1:1 по объему), и менее полярного диастереомера, имеющего Rf = 0,38 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 1:1 по объему).
Пример 39. 5-{ 4-[2-[3-(N-Метил-N-фениламино)-2- гидроксипропиламино] пропокси]бензил}тиазолидин-2,4-дион (Соединение N 1-183)
Повторяли процедуру, описанную в Примере 2, за исключением того, что использовали 1,55 г 3-(N-метил-N-фениламино)-2-гидроксипропиламина (полученного в соответствии с описанием, приведенным в Получении 90), 1,6 г 5-[4-(2-оксипропокси)бензил] тиазолидин-2,4-диона, 0,4 г цианоборгидрида натрия и 50 мл безводного метанола, в результате чего получали 1,39 г целевого соединения, т. пл. 115 - 125oC.
Пример 40. 5-{4-[2-[5-(N-Метил-N-фениламинометил)-2- оксооксазолидин-3-ил пропокси]-бензил}тиазолидин-2,4-дион (Соединение N 1-184)
Повторяли процедуру, описанную в Примере 4, за исключением того, что использовали 0,9 г 5-[4-[2-[3-(N-метил-N-фениламино)-2- гидроксипропиламино] пропокси] бензил]тиазолидин-2,4-диона (полученного в соответствии с описанием, приведенным в Примере 39), 0,36 г N,N'-карбонилдиимидазола и 20 мл безводного диметилформамида. Таким образом получали 0,6 г целевого соединения, имеющего Rf = 0,24 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 1:1 по объему).
Пример 41. 5-{4-[2-(3-3'-Хлорбензилокси-2- гидроксипропиламино)пропокси] бензил}тиазолидин-2,4-дион (Соединение N 1-186)
Повторяли процедуру, описанную в Примере 2, за исключением того, что использовали 3,00 г 3-(3-хлорбензилокси)-2-гидроксипропиламина с чистотой, равной 57% (полученного в соответствии с описанием, приведенным в Получении 93), 5,00 г 5-[4-(2-оксопропокси)бензил]тиазолидин-2,4-диона, 2,64 г цианоборгидрида натрия и 100 мл безводного метанола. Полученный неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле, используя в качестве элюента градиент смеси этилацетата и этанола (10:1 - 4:1 по объему). Затем этот продукт очищали с помощью обращенно-фазовой колоночной хроматографии, используя в качестве элюента смесь ацетонитрила и воды (3:7 по объему), в результате чего получали 302 мг целевого соединения, имеющего температуру 52 - 53oC (с размягчением).
Пример 42. 5-{ 4-[2-(5-3'-Хлорбензилоксиметил-2-оксооксазолидин-3- ил)пропокси]бензил]тиазолидин-2,4-дион (Соединение N 1-187)
Повторяли процедуру, описанную в Примере 4, за исключением того, что использовали 300 мг 5-{ 4-[2-(5-3'-хлорбензилокси-2- -гидроксипропиламино(пропокси]бензил}тиазолидин-2,4-диона (полученного в соответствии с процедурой, описанной в Примере 41), 115 мг N,N'-карбонилдиимидазола и 5 мл безводного диметилформамида. Полученный неочищенный продукт хроматографировали на колонке с силикагелем, используя в качестве элюента градиент смеси этилацетата и гексана (3:2 - 2:1 по объему), в результате чего получали 206 мг целевого соединения, имеющего Rf = 0,25 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 2:1 по объему).
Пример 43. 5-{4-[2-(5-3'-Хлорбензилоксиметил-2-тиооксооксазолидин- 3-ил)пропокси]-бензил}тиазолидин-2,4-дион (Соединение N 1-188)
Повторяли процедуру, описанную в Примере 36, за исключением того, что использовали 300 мг 5-[4-[2-(3,3'-хлорбензилокси)-2- гидроксипропиламино)пропокси] бензил} тиазолидин-2,4-диона (полученного в соответствии с описанием, приведенным в Примере 41), 125 мг N,N'тиокарбонилдиимидазола и 5 мл безводного метиленхлорида. Полученный неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле, используя в качестве элюента смесь этилацетата и гексана (2: 3 по объему), в результате чего получали 191 мг целевого соединения, имеющего Rf = 0,35 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 2:1 по объему).
Пример 44. 5-{ 4-[2-(5-3'-Хлорбензилоксиметил-2- тиооксазолидин-3-ил)пропокси]бензил}тиазолидин-2,4-диона (полученного в соответствии с описанием, приведенным в Примере 43) растворяли в 2 мл метанола и к полученному раствору добавляли раствор, полученный путем разбавления 24 мг метоксида натрия (28% метаноловый раствор) метанолом (1 мл). После этого полученную смесь перемешивали при комнатной температуре в течение часа. После завершения перемешивания растворитель удаляли путем выпаривания при пониженном давлении и получали 50 мг целевого соединения, имеющего температуру плавления 238,7 - 240oC (с разложением).
Пример 45. 5-{ 4-[2-(5-3'-Хлорфеноксиметил-2- тиооксооксазолидин-3-ил)пропокси]бензил}тиазолидин-2,4-дион (Соединение N 1-95)
Повторяли процедуру, описанную в Примере 36, за исключением того, что использовали 300 мг 5-{ 4-[2-(3-3'-хлорфенокси-2- гидроксипропиламино)пропокси] бензил} тиазолидин-2,4-диона (полученного в соответствии с описанием, приведенным в Примере 2), 127 мг N,N'-тиокарбонилдиимидазола и 5 мл безводного диметилформамида. Полученный неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле, используя в качестве элюента смесь этилацетата и гексана (2:3 по объему). Затем этот продукт очищали с помощью обращенно-фазовой колоночной хроматографии (элюент - смесь ацетонитрила и воды, 1:1 по объему), описанной в Примере 10. В результате этой процедуры из полярного диастереомера получали 87 мг целевого соединения, имеющего т. пл. 50,3 - 52,8oC, а из менее полярного диастереомера получали 78 мг целевого соединения с т. пл. 50,6 - 53,1oC.
Пример 46. 5-[4-[2-(3-3'-Хлорфенокси)-2- гидроксипропиламино)бутокси]-бензил}тиазолидин-2,4-дион (Соединение N 1-190)
Повторяли процедуру, описанную в Примере 2, за исключением того, что использовали 1,50 г (3-(3-хлорфенокси)-2-гидроксипропиламина (полученного в соответствии с описанием, приведенным в Получении 13), 2,61 г 5-[4-(2-оксобутокси)бензил] тиазолидин-2,4-диона (полученного в соответствии с описанием, приведенным в Получении 95), 1,40 г цианоборгидрида натрия и 40 мл безводного метанола. Полученный неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле, используя в качестве элюента градиент смеси этилацетата и этанола (1:0 - 10:1 по объему), после чего этот продукт очищали с помощью обращенно-фазовой колоночной хроматографии (элюент - смесь ацетонитрила и воды, 3:7 по объему), описанной в Примере 1. Таким образом получали 2,97 г целевого соединения, имеющего т. пл. 49,5 - 52,8oC (с размягчением).
Пример 47. 5-{4-[2-(5-3'-Хлорфеноксиметил-2-оксооксазолидин-3- ил)бутокси]бензил}тиазолидин-2,4-дион (Соединение N 1-191)
Повторяли процедуру, описанную в Примере 4, за исключением того, что использовали 5,48 г 5-{ 4-[2-(3-3'-хлорфенокси-2- гидроксипропиламино)бутокси]бензил}тиазолидин-2,4-диона (полученного в соответствии с процедурой, описанной в Примере 46), 2,11 г N,N'-карбонилдиимидазола и 60 мл безводного диметилформамида. Полученный неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле, в качестве элюента используют градиент смеси этилацетата и гексана (2:3 - 2:1 по объему). Затем этот продукт очищали с помощью обращенно-фазовой колоночной хроматографии (элюент - смесь ацетонитрила и воды, 9:11 по объему), описанной в Примере 10. В результате этой процедуры из полярного диастереомера получали 1,91 г целевого соединения (т. пл. 150,5 - 154,4oC), а из менее полярного диастереомера получали 1,90 г целевого соединения с т. пл. 54,4 - 55,4oC (с размягчением).
Пример 48. 5-{ 4-[2-(5-3'-Хлорфеноксиметил-2-тиооксооксазолидин- 3-ил)бутокси]-бензил}тиазолидин-2,4-дион (Соединение N 1 -192)
Повторяли процедуру, описанную в Примере 36, за исключением того, что использовали 250 мг 5-{ 4-[2-(3-3'-хлорфенокси-2- гидроксипропиламино)бутокси]бензил}тиазолидин-2,4-диона (полученного в соответствии с описанием, приведенным в Примере 46), 102 мг N,N'-тиокарбонилдиимидазола и 5 мл метиленхлорида. Полученный неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле, используя в качестве элюента смесь этилацетата и гексана (2:3 по объему). Затем продукт этот очищали с помощью обращенно-фазовой колоночной хроматографии, используя в качестве элюента смесь ацетонитрила и воды (1: 1 по объему), как описано в Примере 10. В результате этой процедуры из полярного диастереомера получали 87 мг целевого соединения с т. пл. 54,1 - 56,0oC, а из менее полярного диастереомера получали 85 мг целевого соединения, имеющего т. пл. 57,7 - 59,0oC.
Пример 49. 5-{4-[2-(5-Феноксиметил-2-тиоксооксазолидин-3- ил)пропокси] -бензил}тиазолидин-2,4-дион (Соединение N 1-51)
Повторяли процедуру, описанную в Примере 36, за исключением того, что использовали 205 мг 5-{4--[2-(3-фенокси-2- гидроксипропиламино)пропокси]бензил} тиазолидин-2,4-диона (полученного в соответствии с описанием, приведенным в Примере 3), 95 мг N,N'-тиокарбонилдиимидазола и 5 мл безводного диметилформамида. Полученный неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле, используя в качестве элюента смесь этилацетата и гексана (1:1 по объему). В результате этой процедуры получали 190 мг целевого соединения, имеющего т. пл. 53 - 58oC (с размягчением).
Пример 50. 5-{ 4-[2-(5-3'-Хлорфеноксиметил-2- оксооксазолидин-3-ил)пентилокси]-бензил}тиазолидин-2,4-дион (Соединение N 1-193)
(a) Повторяли процедуру, описанную в Примере 1, за исключение того, что использовали 1,58 г 5-{4-[2-(5-3'-хлорфеноксиметил-2- оксооксазолидин-3-ил)пентилокси] -бензил} -3-трифенилметилтиазолидин- 2,4-диона (не менее полярного изомера, полученного в соответствии с описанием, приведенным в Получении 100), 2 мл трифторуксусной кислоты и 4 мл метиленхлорида. В результате этой процедуры получали 516 мг целевого соединения (т. пл. 50 - 52oC) из менее полярного диастереомера.
(b) Повторяли процедуру, описанную в Примере 1, за исключением того, что использовали 1,45 г 5-{4-[2-(5-3'-хлорфеноксиметил-2- оксооксазолидин-2,4-ил)пентилокси] бензил} -3-трифенилметилтиазолидин- 2,4-диона (полярного изомера, полученного в соответствии с описанием, приведенным в Получении 100), 2 мл трифторуксусной кислоты и 4 мл метиленхлорида. Таким образом было получено 314 мг целевого соединения, имеющего т. пл. 53 - 55oC (из полярного диастереомера).
Пример 51. 5-{4-[2-(5-3'-Хлорфеноксиметил-2-оксооксазолидин-3- ил)-3-метилбутокси]бензил}тиазолидин-2,4-дион (Соединение N 1-195)
(a) Повторяли процедуру, описанную в Примере 1, за исключением того, что использовали 0,92 г 5-{4-[2-(5-3'-хлорфеноксиметил-2- оксооксазолидин-3-ил)-3-метилбутокси]бензил}-3-трифенилметилтиазолидин- 2,4-диона (менее полярного изомера, полученного в соответствии с описанием, приведенным в Получении 101(a)), 2 мл трифторуксусной кислоты и 4 мл метиленхлорида. В результате этой процедуры из менее полярного диастереомера получали 145 мг целевого соединения, имеющего т. пл. 51 - 53oC.
(b) Повторяли процедуру, описанную в Примере 1, за исключением того, что использовали 1,18 г 5-{4-[2-(5-3'-хлорфеноксиметил-2- оксооксазолидин-3-ил)-метилбутокси]бензил}-3-трифторфенилметилтиазолидин- 2,4-диона (полярного изомера, полученного в соответствии с описанием Получения 101 (b)), 2 мл трифторуксусной кислоты и 4 мл метиленхлорида, в результате чего получали 177 мг целевого соединения (т. пл. 57 - 58oC) с полярного диастереомера.
Пример 52. 5-{2-(5-3'-Хлорфеноксиметил-2-оксооксазолидин-3- ил)-2-метилпропокси]бензил}тиазолидин-2,4-дион (Соединение N 1-197).
К 1,5 г смеси 5-{4-[2-(5-3'-хлорфеноксиметил-2- оксооксазолидин-3-ил)-2-метилпропокси]бензил}-2-иминотиазолидин- 4-она и тиомочевины (полученной в соответствии с описанием, приведенным в Получении III) добавляли 4 мл метанола и 15 мл 6 н. водного раствора соляной кислоты. Полученную смесь нагревали с обратным холодильником в течение 5 ч. После завершения нагревания реакционную смесь нейтрализовали путем добавления водного раствора бикарбоната натрия, а затем экстрагировали этилацетатом. Экстракт промывали водным раствором хлорида натрия и осушали безводным сульфатом натрия. После этого этилацетат удаляли из экстракта путем выпаривания при пониженном давлении и полученный остаток хроматографировали на колонке с силикагелем (элюент - смесь этилацетата и гексана, 1:1 по объему). Затем этот остаток очищали с помощью обращенно-фазовой препаративной жидкостной хроматографии высокого разрешения (YMC-Раск ODS-A-торговый знак продукта, изготовленный фирмой YMC Co.), используя в качестве элюента смесь ацетонитрила и воды (1:1 по объему). В результате этой процедуры получали 454 мг целевого соединения, имеющего т. пл. 55 - 58oC.
Пример 53. 5-{4-[3-(5-Феноксиметил-2-оксооксазолидин-3- ил)пропокси]бензил}-тиазолидин-2,4-дион (Соединение N 1-49)
Повторяли процедуру, описанную в Примере 1, за исключением того, что использовали 1,98 г 5-{4-[3-(5-феноксиметил-2- оксооксазолидин-3-ил)пропокси] бензил} -3-трифенилметилтиазолидин- 2,4-диона (полученного в соответствии с описанием, приведенным в Получении 115), 2 мл трифторуксусной кислоты и 4 мл метиленхлорида, в результате чего получали 1,18 г целевого соединения, т. пл. 41 - 43oC.
Пример 54. 5-{4-[4-(5-3'-Хлорфеноксиметил-2-оксооксазолидин-3- ил)бутокси]бензил}тиазолидин-2,4-дион (Соединение N 1-200)
Повторяли процедуру, описанную в Примере 1, за исключением того, что использовали 1,42 г 5-{4-[4-(5-3'-хлорфеноксиметил-2- оксооксазолидин-3-ил)бутокси] бензил} -3-трифенилметилтиазолидин-2,4-диона (полученного в соответствии с описанием, приведенным в Получении 118), 2 мл трифторуксусной кислоты и 4 мл метиленхлорида, в результате чего получали 910 мг целевого соединения, т. пл. 40 - 42oC.
Пример 55. 5-{4-[2-(2-3'-Хлорфеноксиметилморфолино)пропокси]бензил}тиазолидин- 2,4-дион (Соединение N 1-201)
Повторяли процедуру, описанную в Примере 1, за исключением того, что использовали 1,24 г 5-{4-[2-(2-3'- хлорфеноксиметилморфолино)пропокси]бензил}-3-трифенилметилтиазолидин- 2,4-диона (полученного в соответствии с описанием, приведенным в Получении 122), 4 мл трифторуксусной кислоты и 2 мл метиленхлорида, в результате чего получали 181 мг целевого соединения, имеющего т. пл. 51 - 52oC.
Пример 56. 5-{4-[2-(3-7'-Фенилгептилокси-2- гидроксипропиламино)пропокси]-бензил}тиазолидин-2,4-дион (Соединение N 1-204)
Повторяли процедуру, описанную в Примере 2, за исключением того, что использовали 836 мг 3-(7-фенилгептилокси)-2-гидроксипропиламина (полученного в соответствии с описанием, приведенным в Получении 69), 800 мг 5-[4-(2-оксопропокси)-бензил] тиазолидин-2,4-диона, 540 мг цианоборгидрида натрия и 50 мл безводного метанола. Таким образом получали 74 мг целевого соединения, имеющего Rf = 0,21 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и этанола, 5:1 по объему).
Пример 57. 5-[4-{2-[N-(3,3'-Хлорфенокси-2-гидроксипропил)- N-метиламино] -пропокси}бензил]тиазолидин-2,4-дион (Соединение N 1-206)
180 мг параформальдегида и 30 мг п-толуолсульфоновой кислоты добавляли к 300 мг 5-{ 4-[2-(3-3'-хлорфенокси-2- гидроксипропиламино)пропокси]бензил} тиазолидин-2,4-диона (полученного в соответствии с описанием, приведенным в Примере 2) в 20 мл смеси толуола и диоксана (1:1 по объему). Полученную смесь нагревали с обратным холодильником в течение 3 ч. После этого смесь перемешивали в течение 2 дней, а затем добавляли еще 180 мг параформальдегида и 30 мг п-толуолсульфоновой кислоты. Полученную смесь нагревали в течение 8 ч с обратным холодильником. По истечении этого времени растворитель удаляли из реакционной смеси путем выпаривания при пониженном давлении. К образовавшемуся остатку добавляли водный раствор бикарбоната натрия, после чего смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и осушали безводным сульфатом натрия. После этого этилацетат удаляли из экстракта путем выпаривания при пониженном давлении, и полученный остаток очищали с помощью обращенно-фазовой препаративной жидкостной хроматографии высокого разрешения YMC=Раск ODS-A-торговый знак продукта, изготовленного фирмой YMC Co.), используя в качестве элюента смесь ацетонитрила и воды (1:1 по объему). Таким образом получали 78 мг целевого соединения, имеющего т. пл. 64 - 67oC (с размягчением).
Пример 58. 5-{4-[2-(3-4'-Фенилфенокси-2- гидроксипропиламино)этокси]бензил}тиазолидин-2,4-дион (Соединение N 1-207)
Повторяли процедуру, описанную в Примере 2, за исключением того, что использовали 0,42 г (3-4-фенилфенокси)-2-гидроксипропиламина, 10 мл абсолютного этанола, 0,21 г цианоборгидрида натрия и 0,52 г 5-4-(2-оксоэтокси)бензил] тиазолидин-2,4-диона. Полученный неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле (элюент - градиент смеси этилацетата и метанола, 1: 0 - 3:1 по объему), а затем очищали с помощью обращенно-фазовой препаративной жидкостной хроматографии высокого разрешения (колонка YMC-Раск ODS-A-торговый знак), используя в качестве элюента смесь ацетонитрила и воды (3:7 - 7:13 по объему), в результате чего получали 222 мг целевого соединения, имеющего т. пл. 83 - 86oC.
Пример 59. 5-{ 4-[2-(5-4'-Фенилфеноксиметил-2-тиооксооксазолидин- 3-ил)этокси]бензил}тиазолидин-2,4-дион (Соединение N 1-209)
повторяли процедуру, описанную в Примере 4, за исключением того, что использовали 50 мг 5-{4-[2-(3-4'фенилфенокси-2- гидроксипропиламино)этокси] бензил} тиазолидин-2,4-диона, 1 мл безводного метиленхлорида и 22 мг N,N'-тиокарбонилдиимидазола. Полученный неочищенный продукт очищали с помощью обращенно-фазовой препаративной жидкостной хроматографии высокого разрешения (YMC-Раск ODS-A), используя в качестве элюента смесь ацетонитрила и воды (1: 1 - 11:9 по объему), в результате чего получали 42 мг целевого соединения, т. пл. 68 - 70oC.
Получение 1. 3-Хлорфеноксиметилоксиран
50 мл раствора эпибромгидрина (40,96 г) в безводном диметилформамиде по капле прибавляли к смеси 35,70 г 3-хлорфенола, 47,67 г карбоната калия и 200 мл безводного диметилформамида. Полученную смесь нагревали при температуре 62oC в течение 3,5 ч. По истечении этого времени диметилформамид удаляли из реакционной смеси путем выпаривания при пониженном давлении. К образовавшемуся остатку добавляли воду и смесь экстрагировали этилацетатом. Затем экстракт промывали водным раствором хлорида натрия и осушали безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания при пониженном давлении и полученный остаток очищали с помощью колоночной хроматографии на силикагеле, используя в качестве элюента смесь этилацетата и гексана (1:4 по объему), в результате чего получали 43,43 г целевого соединения, имеющего Rf = 0,45 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 1:4 по объему).
Получение 2. 5-(3-Хлорфеноксиметил)-3-т-бутоксикарбонилоксазолидин-2-он
2,18 г гидрида натрия (55% дисперсия в минеральном масле) промывали гексаном, а затем добавляли 50 мл диметилформамида. К полученной смеси по капле (при охлаждении льдом) добавляли раствор 13,3 г ди-т-бутилиминодикарбоксилата в 60 мл диметилформамида. После завершения добавления, к смеси добавляли еще 50 мл диметилформамида. Полученную реакционную смесь перемешивали при той же температуре в течение часа, а затем при комнатной температуре в течение 2 ч. По истечении этого времени к реакционной смеси добавляли 350 мл диметилформамида и 9,2 г 3-хлорфеноксиметилоксирана (полученного в соответствии с описанием, приведенным в Получении 1). Полученную смесь перемешивали в течение 2 дней при комнатной температуре, а затем нагревали в течение 3 ч при 70oC. По истечении этого времени реакционную смесь подкисляли 2 н. водным раствором соляной кислоты до pH 4, охлаждая при этом льдом. Растворитель удаляли из реакционной смеси путем выпаривания при пониженном давлении и к полученному остатку добавляли воду, а затем смесь экстрагировали этилацетатом. Экстракт промывали водным раствором хлорида натрия и осушали безводным сульфатом натрия. Затем этилацетат удаляли из экстракта путем выпаривания при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле, используя в качестве элюента градиент смеси этилацетата и гексана (1:3 - 3:1 по объему), в результате чего получали 9,80 г целевого соединения, имеющего т.пл. 116,2 - 124,0oC.
Получение 3. 5-(3-Хлорфеноксиметил)оксазолидин-2-он
К раствору 1,97 г 5-(3-хлорфеноксиметил)-3-трет-бутоксикарбонилоксазолидин-2-она (полученного в соответствии с описанием, приведенным в Получении 2) в 4 мл безводного тетрагидрофурана при охлаждении льдом добавляли 4 мл трифторуксусной кислоты и полученную смесь перемешивали при комнатной температуре в течение часа. После завершения перемешивания тетрагидрофуран и трифторуксусную кислоту удаляли из реакционной смеси путем выпаривания при пониженном давлении и получали 1,23 г целевого соединения, имеющего Rf = 0,43 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя этилацетата).
Получение 4. Этил-2-[5-(3-хлорфеноксиметил)-2- оксооксазолидин-3-ил]пропионат
0,17 г гидрида натрия (55% (по массе) дисперсия в минеральном масле) промывали гексаном, а затем добавляли 15 мл диметилформамида. К полученной смеси по капле (при охлаждении льдом) добавляли раствор 1,85 г 5-(3-хлорфеноксиметил)оксазолидин-2-она (полученного в соответствии с описанием, приведенным в Получении 3) в 10 мл диметилформамида. Затем к этой смеси добавляли еще 50 мл диметилформамида. После добавления смесь перемешивали при комнатной температуре в течение 2 ч. К полученной реакционной смеси (при охлаждении льдом) добавляли 1,76 г этил-2-бромпропионата в 5 мл диметилформамида и эту смесь перемешивали при комнатной температуре в течение часа. По истечении этого времени диметилформамид удаляли из реакционной смеси путем выпаривания при пониженном давлении. К полученному остатку добавляли воду и смесь экстрагировали этилацетатом. Экстракт промывали водным раствором хлорида натрия и осушали безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания при пониженном давлении и полученный остаток очищали с помощью колоночной хроматографии на силикагеле, используя в качестве элюента смесь этилацетата и гексана (1:1 по объему), в результате чего получали 1,05 г целевого соединения, имеющего Rf = 0,38 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 1:1 по объему).
Получение 5. 2-[5-(3-Хлорфеноксиметил)-2-оксооксазолидин-3-ил] пропанол
(a) К раствору 2,95 г этил 2-[5-(3-хлорфеноксиметил)-2-оксооксазолидин-3-ил] пропионата (полученного в соответствии с описанием, приведенным в Получении 4) в 25 мл тетрагидрофурана добавляли 0,4 г боргидрида лития (при охлаждении льдом). К полученной смеси добавляли 0,37 мл метанола и 5 мл тетрагидрофурана, после чего эту смесь перемешивали при комнатной температуре в течение 2 ч. Тетрагидрофуран удаляли из реакционной смеси путем выпаривания при пониженном давлении и к полученному остатку добавляли водный раствор хлорида натрия, после чего смесь экстрагировали этилацетатом. Экстракт осушали безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания при пониженном давлении, а полученный остаток перекристаллизовывали из этилацетата, в результате чего получали 0,93 г целевого соединения, т.пл. 114 - 115oC.
(b) К раствору 152 мг 3-(2-т-бутилдиметилсилилокси-1-метилэтил)- 5-(3-хлорфеноксиметил)оксазолидин-2-она (полученного в соответствии с описанием, приведенным в Получении 11( в 1 мл безводного тетрагидрофурана (при охлаждении льдом) добавляли 1,2 мл 26%-ного (по массе) раствора фторида тетрабутиламмония в тетрагидрофуране и полученную смесь перемешивали при комнатной температуре в течение 1,5 ч. По истечении этого времени к реакционной смеси добавляли насыщенный водный раствор хлорида натрия и смесь экстрагировали этилацетатом. Полученный экстракт осушали безводным сульфатом натрия. Затем этилацетат удаляли из экстракта путем выпаривания при пониженном давлении и полученный остаток очищали с помощью колоночной хроматографии на силикагеле, используя в качестве элюента градиент смеси этилацетата и этанола (1:0 - 20: 1 по объему). Таким образом получали 97 мг целевого соединения, физико-химические свойства которого были аналогичны свойствам продукта, полученного в соответствии с процедурой, описанной в Получении 5(a).
Получение 6. 5-{ 4-[2-(5-3'-Хлорфеноксиметил-2-оксооксазолидин-3- ил)пропокси]бензил}-3-трифенилметилтиазолидин-2,4-дион
Смесь 344 мг трибутилфосфина, 15 мл безводного бензола, 654 мг 5-(4-гидроксибензил)-3-трифенилметилтиазолидин-2,4-диона и 429 мг азодикарбонилдипиперидина перемешивали при комнатной температуре в течение 30 мин. К полученной смеси добавляли раствор 500 мг 2-[5-(3-хлорфеноксиметил)-2-оксооксазолидин-3-ил]пропанола (полученного в соответствии с процедурой, описанной в Получении 5) в 10 мл бензола. Эту смесь перемешивали в течение ночи, после чего растворитель удаляли из реакционной смеси путем дистилляции при пониженном давлении, а нерастворимые вещества удаляли путем фильтрации. Полученный фильтрат выпаривали досуха при пониженном давлении и образовавшийся остаток очищали путем колоночной хроматографии на силикагеле, используя в качестве элюента смесь этилацетата и гексана (2:3 по объему), в результате чего получали 0,33 г целевого соединения, т.пл. 90,9 - 94,0oC.
Получение 7. 2-Бензилоксикарбониламинопропанол
К раствору 16,9 г DL-аланинола в 100 мл безводного тетрагидрофурана при охлаждении льдом по капле добавляли 31,3 мл триэтиламина. После этого к полученной смеси добавляли 100 г бензилоксикарбонилхлорида (30 - 35% раствор в толуоле). Полученную реакционную смесь перемешивали при комнатной температуре в течение ночи. По истечении этого времени тетрагидрофуран удаляли из реакционной смеси путем выпаривания при пониженном давлении и к полученному остатку добавляли воду. Затем эту смесь экстрагировали этилацетатом. Экстракт промывали водным раствором хлорида натрия и осушали безводным сульфатом натрия. Затем этилацетат удаляли из экстракта путем выпаривания при пониженном давлении и полученный остаток очищали с помощью колоночной хроматографии на силикагеле, используя в качестве элюента смесь этилацетата и гексана, в результате чего получали 18,07 г целевого соединения, имеющего т.пл. 52,2 - 56,6oC.
Получение 8. Бензил N-(2-т-бутилдиметилсилилокси-1- метилэтил)карбамат
К смеси 16,0 г 2-бензилоксикарбониламинопропанола (полученного в соответствии с описанием, приведенным в Получении 7), 12,39 г имидазола и 150 мл диметилформамида (при охлаждении льдом) по капле добавляли раствор 13,72 г т-бутилдиметилсилилхлорида в 50 мл диметилформамида. Полученную смесь перемешивали при комнатной температуре в течение 6,5 ч. По истечении этого времени диметилформамид удаляли из реакционной смеси путем выпаривания при пониженном давлении и к полученному остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали водным раствором хлорида натрия и осушали безводным сульфатом натрия. Затем этилацетат удаляли из экстракта путем выпаривания при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле, используя в качестве элюента смесь этилацетата и гексана (1:6 по объему), в результате чего получали 23,89 г целевого соединения, имеющего т.пл. 68,0 - 70,2oC.
Получение 9. 2-т-Бутилдиметилсилилокси-1-метилэтиламин
В смесь 4,0 г бензил N-(2-т-бутилметилсилилокси-1-метилэтил) карбамата (полученного в соответствии с процедурой, описанной в Получении 8), 0,80 г 10% палладированного угля и 40 мл этанола в течение часа загружали водород. По истечении этого времени водород заменяли на азот, палладированный уголь удаляли путем фильтрации из реакционной смеси и полученный фильтрат концентрировали путем выпаривания при пониженном давлении, в результате чего получали 1,88 г целевого соединения, имеющего Rf = 0,27 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 1:3 по объему).
Получение 10. 1-(3-Хлорфеноксиметил)-2-(2-т- бутилдиметилсилилокси-1-метилэтиламино)этанол
Смесь 1,48 г 2-т-бутилдиметилсилилокси-1-метилэтиламина (полученного в соответствии с описанием, приведенным в Получении 9), 1,44 г 3-хлорфеноксиметилоксирана (полученного в соответствии с описанием, приведенным в Получении 1) и 16 мл этанола нагревали с обратным холодильником в течение 24 ч. По истечении этого времени этанол удаляли из реакционной смеси путем выпаривания при пониженном давлении и полученный остаток очищали с помощью колоночной хроматографии на силикагеле, используя в качестве элюента градиент смеси этилацетата и этанола (1:0 - 10:1 по объему). В результате этой процедуры получали 1,53 г целевого соединения, имеющего Rf = 0,30 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и этанола, 10:1 по объему).
Получение 11. 3-(2-т-Бутилдиметилсилилокси-1-метилэтил)-5- (3-хлорфеноксиметил)оксазолидин-2-он
К раствору 300 мг 1-(3-хлорфеноксиметил)-2-(2-т- бутилдиметилсилилокси-1-метилэтиламино)этанола (полученного в соответствии с описанием, приведенным в Получении 10) в 5 мл диметилформамида добавляли 146 мг, N,N'-карбонилдиимидазола и полученную смесь перемешивали в течение ночи при комнатной температуре. Затем реакционную смесь очищали с помощью колоночной хроматографии на силикагеле, используя в качестве элюента смесь этилацетата и гексана (1: 4 по объему), в результате чего получали 287 мг целевого соединения (смесь диастереомеров), имеющего Rf = 0,30 и 0,17 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 1:3 по объему).
Получение 12. 3-(3-Хлорфенокси)-2-гидроксипропилазид
К 12 мл раствора 0,37 г 3-хлорфеноксиметилоксирана (полученного в соответствии с описанием, приведенным в Получении 1) в смеси метанола и воды (8:1 по объему) добавляли 0,65 г азида натрия и 3 мл метилформата. Полученную смесь перемешивали в течение 9 ч при температуре 50oC. По истечении этого времени растворитель удаляли из реакционной смеси путем выпаривания при пониженном давлении и к полученному остатку добавляли воду, а затем смесь экстрагировали этилацетатом. Экстракт осушали безводным сульфатом натрия, после чего растворитель удаляли из экстракта путем выпаривания при пониженном давлении, в результате чего получали 0,40 г целевого соединения в виде бесцветного маслообразного вещества, имеющего Rf = 0,19 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 1:4 по объему).
Получение 13. 3-(3-Хлорфенокси)-2-гидроксипропиламин
К раствору 0,39 г 3-(3-хлорфенокси)-2-(гидроксипропилазида (полученного в соответствии с процедурой, описанной в Получении 12) в 5 мл безводного тетрагидрофурана в потоке газообразного азота при охлаждении льдом постепенно добавляли 0,19 г алюмогидрата лития. В этих условиях смесь перемешивали в течение полутора часов, после чего избыток алюмогидрата лития разлагали путем добавления воды. Нерастворимые вещества удаляли из реакционной смеси путем фильтрации через слой Целита (торговый знак) и полученный фильтрат осушали безводным сульфатом натрия. Затем растворитель удаляли из реакционной смеси путем выпаривания при пониженном давлении и получали 0,15 г целевого соединения в виде белых кристаллов, т. пл. 55 - 58oC.
Получение 14. 3-Фенокси-2-гидроксипропилазид
Повторяли процедуру, описанную в Получении 12, за исключением того, что использовали 1,00 г феноксиметилоксирана, 1,94 г азида натрия, 10 мл метилформата и 45 мл смеси метанола и воды (8:1 по объему), в результате чего получали 1,30 г целевого соединения в виде бледно-желтого маслообразного вещества, имеющего Rf = 0,26 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 1:4 по объему).
Получение 15. 3-Фенокси-2-гидроксипропиламин
Повторяли процедуру, описанную в Получении 13, за исключением того, что использовали 1,17 г 3-фенокси-2-гидроксипропилазида (полученного в соответствии с описанием, приведенным в Получении 14), 0,46 г алюмогидрида лития и 20 мл безводного тетрагидрофурана в результате чего получали 1,09 г целевого соединения, т. пл. 82 - 84oC.
Получение 16. 3-Фенил-2-гидроксипропилазид
Повторяли процедуру, описанную в Получении 12, за исключением того, что использовали 5 г (±)-(2,3-эпоксипропил)бензола, 12,1 г азида натрия, 60 мл метилформата и 270 мл смеси метанола и воды (8:1 по объему), в результате чего получали 6,03 г целевого соединения в виде бесцветного маслообразного вещества, имеющего Rf = 0,3 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 1:4 по объему).
Получение 17. 3-Фенил-2-гидроксипропиламин
Повторяли процедуру, описанную в Получении 13, за исключением того, что использовали 6,0 г 3-фенил-2-гидроксипропилазида (полученного в соответствии с описанием, приведенным в Получении 16), 2,6 г алюмогидрата лития и 300 мл безводного тетрагидрофурана, в результате чего получали 5,26 целевого соединения, т.пл. 64 - 66oC.
Получение 18. 5-[4-(2-Оксопропилтио)бензил]-тиазолидин-2,4-дион
1,28 г гидрида натрия (55 мас.% дисперсия в минеральном масле) промывали толуолом, а затем добавляли 30 мл диметилформамида. К полученной смеси по капле (при охлаждении льдом) добавляли раствор 3,2 г 5-(4-меркаптобензил)тиазолидин-2,4-диона в 20 мл диметилформамида. Эту смесь перемешивали при комнатной температуре в течение 30 мин. После завершения перемешивания к реакционной смеси при охлаждении льдом добавляли 1,69 мл бромацетона. Затем полученную смесь перемешивания при комнатной температуре в течение 2 ч, после чего выдерживали в течение ночи. Диметилформамид удаляли путем выпаривания при пониженном давлении и к полученному остатку добавляли воду. Полученную смесь подкисляли 1 н. водным раствором соляной кислоты до тех пор, пока pH не становился равным значению в пределах от 2 до 3, после чего смесь экстрагировали этилацетатом. Экстракт промывали водным насыщенным раствором хлорида натрия и осушали безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания при пониженном давлении и полученный остаток очищали с помощью колоночной хроматографии на силикагеле с использованием в качестве элюента этилацетата и гексана (2:3 по объему) и получали 1,68 г целевого соединения, т. пл. 96-102oC.
Получение 19. 5-[4-(2,2-Диэтоксиэтокси)бензил]тиазолидин-2,4-дион
260 мг гидрида натрия (55 мас.% дисперсия в минеральном масле) промывали толуолом, а затем добавляли 5 мл диметилформамида. К полученной смеси при охлаждении льдом добавляли 530 мг 5-(4-гидроксибензил)тиазолидин-2,4-диона и полученную смесь перемешивали в течение 30 мин при комнатной температуре. По истечении этого времени к реакционной смеси при охлаждении льдом добавляли 0,73 мл диэтилацетальбромоальдегида и смесь перемешивали в течение 3 ч при температуре 50oC. Диметилформамид удаляли путем выпаривания при пониженном давлении и к полученному остатку добавляли воду. Эту смесь подкисляли 1 н. водным раствором соляной кислоты до тех пор, пока pH не становился равным значению в пределах от 2 до 3, после чего смесь экстрагировали этилацетатом. Затем экстракт промывали насыщенным водным раствором хлорида натрия и осушали безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания при пониженном давлении и полученный остаток очищали с помощью колоночной хроматографии на силикагеле, используя в качестве элюента смесь этилацетата и гексана (1:2 по объему. В результате этой процедуры получали 600 мг целевого соединения, имеющего Rf = 0,46 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 1:2 по объему).
Получение 20. 5-[4-(2-Оксоэтокси)бензил]тиазолидин-2,4-дион
10,07 г 5-[4-(2,2-диэтоксиэтокси)бензил]тиазолидин-2,4-диона (полученного в соответствии с описанием, приведенным в Получении 19) растворяли в 80 мл тетрагидрофурана и к полученному раствору добавляли 20 мл 6 н. водного раствора соляной кислоты. Затем эту смесь оставляли на ночь при комнатной температуре. Растворитель удаляли из реакционной смеси путем выпаривания при пониженном давлении и к полученному остатку добавляли воду, а затем смесь экстрагировали этилацетатом. После этого экстракт осушали безводным сульфатом натрия, а этилацетат удаляли из экстракта путем выпаривания при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с силикагелем, используя в качестве элюента смесь этилацетата и гексана (2: 3 по объему), в результате чего получали 5,92 г целевого соединения, имеющего Rf = 0,37 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющегося растворителя смеси этилацетата и гексана, 2:1 по объему).
Получение 21. 2-[5-(3-Хлорфеноксиметил)-2-оксооксазолидин-3-ил]пропанол
К раствору 152 мг 3-(2-т-бутилдиметилсилилокси-1-метилэтил)-5-(3-хлорфеноксиметил) оксазолидин-2-она (полученного в соответствии с описанием, приведенным в Получении 11) в 1 мл тетрагидрофурана по капле (при охлаждении льдом) добавляли 1,2 мл 1,0 М раствора фторида тетрабутиламмония в тетрагидрофуране. Полученную смесь перемешивали при комнатной температуре в течение 1,5 ч. По истечении этого времени к реакционной смеси добавляли воду и хлорид натрия, после чего смесь экстрагировали этилацетатом. Экстракт осушали безводным сульфатом натрия, а затем этилацетат удаляли из экстракта путем выпаривания при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле, используя в качестве элюента градиент смеси этилацетата и этанола (1:0 - 20:1 по объему), и получали 97 мг целевого соединения, имеющего Rf = 0,28 ( тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя этилацетата).
Получение 22. (S)-3-Хлорфеноксиметилоксиран
К смеси 2,57 г 3-хлорфенола, 7,86 г трифенилфосфина и 30 мл безводного бензола по капле добавляли 5,22 г диэтилазодикарбоксилата и смесь перемешивали при комнатной температуре в течение часа. После этого к смеси по капли добавляли 2,01 г (R)-глицидола и полученную смесь оставляли при комнатной температуре на 14 ч. По истечении этого времени бензол удаляли из реакционной смеси путем выпаривания при пониженном давлении и полученный остаток очищали с помощью колоночной хроматографии на силикагеле, используя в качестве элюента смесь этилацетата и гексана (1:3 по объему). В результате этой процедуры получали 3,11 г целевого соединения, имеющего Rf = 0,42 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 1:3 по объему).
Получение 23. (R)-2-Бензилоксикарбониламинопропанол
К смеси 5,00 г D-аланинола, 18,49 карбоната калия, 15 мл этилацетата и 15 мл воды по капле добавляли 11,42 г бензилоксикарбонилхлорида. Затем полученную смесь перемешивали в течение 1,5 ч. По истечении этого времени этилацетатный слой отделяли, а водный слой экстрагировали этилацетатом. После этого этилацетатный слой и экстракт объединяли, осушали безводным сульфатом натрия, а затем концентрировали путем выпаривания при пониженном давлении. Неочищенный осадок в виде кристаллов собирали путем фильтрации и промывали гексаном, в результате чего получали 13,68 г целевого соединения, т.пл. 78-80oC.
Получение 24. Бензил N-[2-т-бутилдиметил-силилокси-1(R)-метилэтил]карбамат
Повторяли процедуру, описанную в Получении 8, за исключением того, что использовали 12,54 г (R)-2-бензилоксикарбониламинопропанола (полученного в соответствии с описанием, приведенным в Получении 23), 9,97 г т-бутилдиметилсилилхлорида, 4,90 г имидазола и 150 мл безводного диметилформамида. Таким образом было получено 16,43 г целевого соединения, имеющего Rf = 0,54 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 1:4 по объему).
Получение 25. 2-т-Бутилдиметилсилилокси-1(R)-метилэтиламин
Повторяли процедуру, описанную в Получении 9, за исключением того, что использовали 16,4 г бензил N-2-[т-бутилдиметилсилилокси-1(R)-метилэтил]карбамата (полученного в соответствии с процедурой, описанной в Получении 24), 3,5 г 10% палладированного угля и 100 мл этанола, в результате чего получали 8,55 г целевого соединения, имеющего Rf = 0,27 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 1:3 по объему) и имеющего [α]D = -10,1o (метанол, с = 1,155).
Получение 26. 1(S)-(3-Хлорфеноксиметил)-2-(2-т-бутилдиметилсилилокси-1(R)- метилэтиламино)этанол
Повторяли процедуру, описанную в Получении 10, за исключением того, что использовали 1,48 г 2-т-бутилдиметилсилилокси-1(R)-метилэтиламина (полученного в соответствии с описанием, приведенным в Получении 25), 0,72 г (S)-3-хлорфеноксиметилоксирана (полученного в соответствии с описанием, приведенным в Получении 22) и 10 мл абсолютного этанола, в результате чего получали 1,00 г целевого соединения с Rf = 0,24 (тонкослойная хроматография на силикагеле с использованием этилацетата в качестве проявляющего растворителя) и [α]D = -14,3o (метанол, с=1,025).
Получение 27. 3-[2-т-Бутилдиметилсилилокси-1(R)-метилэтил] -5(S)-(3- хлорфеноксиметил)оксазолидин-2-он
Повторяли процедуру, описанную в Получении 11, за исключением того, что использовали 0,92 г 1(S)-(3-хлорфеноксиметил)-2-[2-т-бутилдиметилсилилокси-1(R)-метилэтиламино] этанола (полученного в соответствии с описанием, приведенным в Получении 26), 0,48 г N, N'-карбонилдиимидазола и 10 мл безводного диметилформамида. Таким образом получали 0,92 г целевого соединения, имеющего Rf = 0,25 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 1:2 по объему) и имеющего [α]D = +34,1o (метанол, с=0,960).
Получение 28. 2(R)-[5(S)-(3-Хлорфеноксиметил)-2-оксооксазолидин-3-ил] пропанол
Повторяли процедуру, описанную в Получении 5, за исключением того, что использовали 0,88 г 3-(2-т-бутилдиметилсилилокси-1(R)-метилсилил)-5(S)-(3-хлорфеноксиметил) оксазолидин-2-она (полученного в соответствии с описанием, приведенным в Получении 27), 6,6 мл фторида тетрабутиламмония (26% раствор в тетрагидрофуране) и 10 мл безводного тетрагидрофурана, в результате чего получали 0,58 г целевого соединения, имеющего Rf = 0,45 (тонкослойная хроматография на силикагеле с использованием этилацетата в качестве проявляющего растворителя) и имеющего [α]D = +45,6o (метанол, с=1,000).
Получение 29. 5-{4-[2(R)-(5(S)-(3-Хлорфеноксиметил-2-оксооксазолидин-3-ил пропокси]бензил}-3-трифенилметилтиазолидин-2,4-дион
Повторяли процедуру, описанную в Получении 6; за исключением того, что использовали 0,52 г 2-(R)-[5(S)-(3-хлорфенокси-метил)-2-оксооксазолидин-3-ил] пропанола (полученного в соответствии с описанием, приведенным в Получении 28), 1,01 г 5-(4-гидроксибензил)-3-трифенилметилтиазолидин-2,4-диона, 0,44 г трибутилфосфина, 0,55 г азодикарбонилдипиперидина и 30 мл безводного бензола. Таким образом получали 1,02 г целевого соединения, имеющего Rf = 0,26 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 1:1 по объему) имеющего [α]D = +35,9o (метанол, с = 1,000).
Получение 30. (R)-3-Хлорфеноксиметилоксиран
Повторяли процедуру, описанную в Получении 22, за исключением того, что использовали 5,14 г 3-хлорфенола, 4,44 г (S)-глицидола, 15,72 г трифенилфосфина, 10,44 г диэтилкарбоксилата и 50 мл безводного бензола, в результате чего получали 6,43 г целевого соединения, имеющего Rf = 0,42 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 1:3 по объему).
Получение 31. (S)-2-Бензилоксикарбонил-аминопропанол
Повторяли процедуру, описанную в Получении 7, за исключением того, что использовали 14,55 г L-аланинола, 126 мл 30-35% раствора бензилоксикарбонилхлорида в толуоле, 29,6 мл триэтиламина и 100 мл безводного тетрагидрофурана, в результате чего получали 8,15 г целевого соединения, т.пл. 79-80oC.
Получение 32. Бензил N-[2-т-бутилдиметил-силилокси-1(S)-метилэтил]карбамат
Повторяли процедуру, описанную в Получении 8, за исключением того, что использовали 7,00 г (S)-2-бензилоксикарбонил-аминопропанола (полученного в соответствии с описанием, приведенным в Получении 31), 6,03 г т-бутилдиметилсилилхлорида, 5,45 г имидазола и 100 мл безводного диметилформамида, в результате чего получали 10,52 г целевого соединения, имеющего Rf = 0,48 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 1:7 по объему).
Получение 33.2-т-Бутилдиметилсилилокси-1(S)-метилэтиламин
Повторяли процедуру, описанную в Получении 9, за исключением того, что использовали 10,22 г бензил N-[2-т-бутилдиметил-силилокси-1(S)-метилэтил] карбамата (полученного в соответствии с процедурой, описанной в Получении 32), 2,00 г 10% палладия на угле и 80 мл этанола, в результате чего получали 5,69 г целевого соединения, имеющего Rf = 0,27 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 1:3 по объему) и имеющего [α]D = +9,7o (метанол, с = 1,040).
Получение 34. 1(R)-(3-Хлорфеноксиметил)-2-[2-т-бутилдиметилсилилокси-1(S)- метилэтиламино]этанол
Повторяли процедуру, описанную в Получении 10, за исключением того, что использовали 1,51 г 2-т-бутилдиметилсилилокси-1(S)-метилэтиламина (полученного в соответствии с описанием, приведенным в Получении 33), 0,74 г (R)-3-хлорфеноксиметилоксирана (полученного в соответствии с описанием, приведенным в Получении 30) и 10 мл абсолютного этанола, в результате чего получали 0,88 г целевого соединения, имеющего Rf = 0,24 (тонкослойная хроматография на силикагеле с использованием этилацетата в качестве проявляющего растворителя) и имеющего [α]D = +15,1o (метанол, с = 1,075).
Получение 35. 3-[2-т-Бутилдиметилсилилокси-1(S)-метилэтил] -5(R)-(3-хлорфеноксиметил] оксазолидин-2-он
Повторяли процедуру, описанную в Получении 11, за исключением того, что использовали 0,82 г 1(R)-(3-хлорфеноксиметил)-2-[2-т-бутилдиметилсилилокси-1(S)-метилэтиламино] этанола (полученного в соответствии с процедурой, описанной в Получении 34), 0,43 г N,N'-карбонилдиимидазола и 10 мл безводного диметилформамида, в результате чего получали 0,85 г целевого соединения, имеющего Rf = 0,25 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 1: 2 по объему) и имеющего [α]D = -33,4o (метанол, с = 1,040).
Получение 36. 2(S)-[5(R)-(3-Хлорфеноксиметил)-2-оксооксазолидин-3-ил] пропанол
Повторяли процедуру, описанную в Получении 5, за исключением того, что использовали 0,78 г 3-[2-т-бутилдиметилсилилокси-1(S)-метилэтил]-5(R)-(3-хлорфеноксиметил)- оксазолидин-2-она (полученного в соответствии с описанием, приведенным в Получении 35), 5,85 г 26% раствора фторида тетрабутиламмония в тетрагидрофуране и 10 мл безводного тетрагидрофурана, в результате чего получали 0,52 г целевого соединения, имеющего т.пл. 92-94oC и имеющего [α]D = -47,8o (метанол, с = 0,980).
Получение 37. 5-{4-[2(S)-5[(R)-(3-хлорфеноксиметил)-2-оксооксазолидин-3-ил]пропокси] бензил}-3-трифенилметилтиазолидин-2,4-дион
Повторяли процедуру, описанную в Получении 6, за исключением того, что использовали 0,46 г 2(S)-[5(R)-(3-хлорфеноксиметил)-2-оксооксазолидин-3-ил] пропанола (полученного в соответствии с описанием, приведенным в Получении 36), 0,90 г 5-(4-гидроксибензил)-3-трифенилметилтиазолидин-2,4-диона, 0,39 г трибутилфосфина, 0,49 г азодикарбонилпиперидина и 30 мл безводного бензола, в результате чего получали 0,79 г целевого соединения, имеющего Rf = 0,26 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 1: 1 по объему) и имеющего [α]D = -35,3o (метанол, с = 1,015).
Получение 38. 1(S)-(3-Хлорфеноксиметил)-2-(2-т-бутилдиметилсилилокси-1(S)-метилэтиламино) этанол
Повторяли процедуру, описанную в Получении 10, за исключением того, что использовали 2,00 г 2-т-бутилдиметилсилилокси-1(S)-метилэтиламина, 1,92 г (S)-3-хлорфеноксиметилоксирана (полученного в соответствии с описанием, приведенным в Получении 22) и 20 мл этанола, в результате чего получали 2,22 г целевого соединения, имеющего Rf = 0,24 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя этилацетата) и имеющего [α]D = +14,7o (метанол, с = 0,995).
Получение 39. 3-[2-т-Бутилдиметилсилилокси-1(S)-метилэтил]-5(S)-(3-хлорфеноксиметил) оксазолидин-2-он
Повторяли процедуру, описанную в Получении 11, за исключением того, что использовали 2,06 г 1 (S)-(3-хлорфеноксиметил)-2-[2-т-бутилдиметилсилилокси-1(S)-метилэтиламино] этанола (полученного в соответствии с процедурой, описанной в Получении 38), 1,07 г N,N'-карбонилдимидазола и 20 мл безводного диметилформамида, в результате чего получали 2,11 г целевого соединения, имеющего Rf = 0,18 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 1:4 по объему) и имеющего [α]D = +51,7o (метанол, с=1,03).
Получение 40. 2(S)-[5(S)-(3-Хлорфеноксиметил)-2-оксооксазолидин-3-ил] пропанол
Повторяли процедуру, описанную в Получении 5(b), за исключением того, что использовали 2,00 г 3-[2-т-бутилдиметилсилилокси-1(S)-метилэтил]-5(S)-(3-хлорфеноксиметил) оксазолидин-2-она (полученного в соответствии с описанием, приведенным в Получении 39), 15 мл 26% раствора фторида тетрабутиламмония в тетрагидрофурана и 20 мл безводного тетрагидрофурана, в результате чего получали 0,85 г целевого соединения, имеющего т.пл. 67-70oC и имеющего [α]D = +57,0o (метанол, с=1,055).
Получение 41. 5-[4-{ 2(S)-[5(S)-(3-Хлорфенокси-метил)-2-оксооксазолидин-3-ил]пропокси} бензил]-3-трифенилметилтиазолидин-2,4-дион
Повторяли процедуру, описанную в Получении 6, за исключением того, что использовали 405 мг трибутилфосфина, 25 мл безводного бензола, 700 мг 2(S)-[5-(S)-(3-хлорфеноксиметил)-2-оксооксазолидин-3-ил]пропанола (полученного в соответствии с описанием, приведенным в Получении 40), 505 мг азодикарбонилдипиперидина и 745 мг 5-(4-гидроксибензил)-3-трифенилметилтиазолидин-2,4-диона, в результате чего получали 340 мг целевого соединения, имеющего т.пл. 80-84oC и имеющего [α]D = +25,9o (метанол, с=0,96).
Получение 42. 1(R)-(3-Хлорфеноксиметил)-2-(2-т-бутилдиметилсилилокси-1(R)-метилэтиламино) этанол
Повторяли процедуру, описанную в Получении 10, за исключением того, что использовали 3,00 г 2-т-бутилдиметилсиллилокси-1(R)-метилэтиламина, 2,95 г (R)-3-хлорфеноксиметилоксирана (полученного в соответствии с описанием, приведенным в Получении 30) и 30 мл этанола, в результате чего получали 3,73 г целевого соединения, имеющего Rf = 0,23 (тонкослойная хроматография на силикагеле с использованием этилацетата в качестве проявляющего растворителя) и имеющего [α]D = -15,6o (метанол, с = 0,990).
Получение 43. 3-[2-т-бутилдиметилсилилокси-1(R)-метилэтил]-5(R)-(3-хлорфеноксиметил)- оксазолидин-2-он
Повторяли процедуру, описанную в Получении 11, за исключением того, что использовали 3,45 г 1(R)-(3-хлорфеноксиметил)-2-(2-т-бутилдиметилсилилокси-1(R)-метилэтиламино) этанола (полученного в соответствии с описанием, приведенным в Получении 42), 1,78 г N,N'-карбонилдиимидазола и 30 мл безводного диметилформамида, в результате чего получали 3,52 г целевого соединения, имеющего Rf =0,74 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 1:1 по объему) и имеющего [α]D = -53,3o (метанол, с=1,020).
Получение 44. 2(R)-[5(R)-(3-Хлорфенокси-метил)-2-оксооксазолидин-3-ил] пропанол
Повторяли процедуру, описанную в Получении 5(b), за исключением того, что использовали 3,25 г 3-[2-т-бутилдиметилсилилокси-1(R)-метилэтил]-5(R)-(3-хлорфеноксиметил) оксазолидин-2-она (полученного в соответствии с описанием, приведенным в Получении 43), 24 мл 26% раствора фторида тетрабутиламмония в тетрагидрофуране и 30 мл безводного тетрагидрофурана, в результате чего получали 2,28 г целевого соединения, имеющего т.пл. 76-78oC и имеющего [α]D = -65,4o (метанол, с=1,060).
Получение 45. 5-[4-{2(R)-[5(R)-(3-Хлорфеноксиметил)-2-оксооксазолидин-3-ил]пропокси} бензил]-3-трифенилметилтиазолидин-2,4-дион
Повторяли процедуру, описанную в Получении 6, за исключением того, что использовали 526 мг трибутилфосфина, 25 мл безводного бензола, 900 мг 2(R)-[5-(R)-(3-хлорфеноксиметил)-2-оксооксазолидин-3-ил]пропанола (полученного в соответствии с описанием, приведенным в Получении 44), 656 мг азодикарбонилдипиперидина и 1,21 г 5-(4-гидроксибензил)-3-трифенилметилтиазолидина-2,4-диона, в результате чего получали 0,65 г целевого соединения, имеющего т.пл. 74-81oC и имеющего [α]D = -29,0o (метанол, с=1,000).
Получение 46. Бензилоксиметилоксиран
4,03 г гидрида натрия (55 мас.% дисперсия в минеральном масле) промывали гексаном, а затем добавляли 200 мл безводного диметилформамида. К полученной смеси по капле и при охлаждении льдом добавляли 20 г безводного бензилового спирта. Затем эту смесь перемешивали в течение часа при комнатной температуре, после чего по капле и при охлаждении льдом добавляли 15,2 мл эпибромгидрина. Полученную смесь перемешивали в течение 1,5 ч, а затем оставляли на ночь. По истечении этого времени диметилформамид удаляли из реакционной смеси путем выпаривания при пониженном давлении и к полученному остатку добавляли воду. После этого смесь экстрагировали этилацетатом. Экстракт промывали водным раствором хлорида натрия и осушали безводным сульфатом натрия. Затем этилацетат удаляли из реакционной смеси путем выпаривания при пониженном давлении и полученный остаток очищали с помощью колоночной хроматографии на силикагеле, используя в качестве элюента градиент смеси этилацетата и гексана (1:6 - 1:5 по объему), в результате чего получали 13 г целевого соединения, имеющего Rf = 0,39 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 1:5 по объему).
Получение 47. 3-Бензилокси-2-гидроксипропилазид
Повторяли процедуру, описанную в Получении 12, за исключением того, что использовали 4,92 г бензилоксиметилоксирана (полученного в соответствии с процедурой, описанной в Получении 46). 160 мл метанола и воды (8:1 по объему), 9,75 г азида натрия и 40 мл метилформата, в результате чего получали 5,7 г целевого соединения в виде бледно-желтого маслообразного вещества, имеющего Rf = 0,22 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 1:5 по объему).
Получение 48. 3-Бензилокси-2-гидроксипропиламин
Повторяли процедуру, описанную в Получении 13, за исключением того, что использовали 5,7 г 3-бензилокси-2-гидроксипропилазида (полученного в соответствии с описанием, приведенным в Получении 47), 2,09 г алюмогидрида лития и 250 мл безводного тетрагидрофурана, в результате чего получали 3,5 г целевого соединения (т.пл. 72-74oC) в виде белых кристаллов.
Получение 49. 5-Фенилпентилоксиметилоксиран
Повторяли процедуру, описанную в Получении 46, за исключением того, что использовали 5 г 5-фенил-1-пентанола, 4,99 мл эпибромгидрина, 1,31 г гидрида натрия (55 мас.% дисперсия в минеральном масле) и 80 мл безводного диметилформамида. Полученный неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле, используя в качестве элюента смесь этилацетата и гексана (1:6 по объему), в результате чего получали 4,2 г целевого соединения в виде бесцветного маслообразного вещества, имеющего Rf = 0,49 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 1:4 по объему).
Получение 50. 3-(5-Фенилпентилокси)-2-гидроксипропилазид
Повторяли процедуру, описанную в Получении 12, за исключением того, что использовали 4,0 г 5-фенилпентилоксиметилоксирана (полученного в соответствии с описанием, приведенным в Получении 49), 5,9 г азида натрия, 160 мл смеси метанола и воды (8:1 по объему) и 40 мл метилформата, в результате чего получали 4,5 г целевого соединения в виде бледно-желтого маслянистого вещества, имеющего Rf = 0,25 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 1:4 по объему).
Получение 51. 3-(5-Фенилпентилокси)-2-гидроксипропиламин
Повторяли процедуру, описанную в Получении 13, за исключением того, что использовали 4,5 г 3-(5-фенилпентилокси)-2-гидроксипропилазида (полученного в соответствии с описанием, приведенным в Получении 50), 1,3 г алюмогидрида лития и 250 мл безводного тетрагидрофурана, в результате чего получали 4,3 г целевого соединения в виде бледно-желтого маслообразного вещества, имеющего Rf = 0,09 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата, этанола и триэтиламина, 10:2:1 по объему_.
Получение 52. 3-Фенилпропоксиметилоксиран
Повторяли процедуру, описанную в Получении 46, за исключением того, что использовали 8 г 3-фенил-1-пропанола, 9,64 мл эпибромгидрина, 2,56 г гидрида натрия (55 мас. % дисперсия в минеральном масле) и 100 мл безводного диметилформамида. Полученный неочищенный продукт очищали с помощью хроматографии на колонке с силикагелем, используя в качестве элюента смесь этилацетата и гексана (1: 6 по объему), и получали 7,2 г целевого соединения в виде бесцветного маслообразного вещества, имеющего Rf = 0,36 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 1:5 по объему).
Получение 53. 3-(3-Фенилпропокси)-2-гидроксипропилазид
Повторяли процедуру, описанную в Получении 12, за исключением того, что использовали 5,77 г 3-фенилпропоксиметиллоксирана (полученного в соответствии с описанием, приведенным в Получении 52), 9,75 г азида натрия, 160 мл смеси метанола и воды (8:1 по объему) и 40 мл метилформата, в результате чего получали 6,6 г целевого соединения в виде бледно-желтого маслообразного вещества, имеющего Rf = 0,27 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 1:5 по объему).
Получение 54. 3-(3-Фенилпропокси)-2-гидроксипропиламин
Повторяли процедуру, описанную в Получении 13, за исключением того, что использовали 6,5 г 3-(3-фенилпропокси)-2-гидроксипропилазида) (полученного в соответствии с описанием, приведенным в Получении 53), 2,1 г алюмогидрида лития и 250 мл безводного тетрагидрофурана, в результате чего получали 6 г целевого соединения в виде бледно-желтого маслообразного вещества, имеющего Rf = 0,09 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата, этанола и триэтиламина, 10:2:1, по объему).
Получение 55. 2-Фенилэтоксиметилоксиран
Повторяли процедуру, описанную в Получении 46, за исключением того, что использовали 4,28 г 2-фенилэтанола, 1,68 г гидрида натрия (55 мас.% дисперсия в минеральном масле), 4,1 мл эпибромгидрина и 100 мл безводного диметилформамида. Полученный неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле, используя в качестве элюента смесь гексана и этилацетата (8: 1 по объему), в результате чего получали 4,68 г целевого соединения в виде бесцветного маслообразного вещества, имеющего Rf = 0,77 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси гексана и этилацетата, 2:1 по объему).
Получение 56. 30(2-Фенилэтокси)-2-гидроксипропилазид
Повторяли процедуру, описанную в Получении 12, за исключением того, что использовали 4,50 г 2-фенилэтоксиметилоксирана (полученного в соответствии с описанием, приведенным в Получении 55), 8,20 г азида натрия, 45 мл метилформата и 180 мл смеси метанола и воды (8:1 по объему). Таким образом получали 5,49 г целевого соединения в виде бесцветного вещества с Rf = 0,70 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси гексана и этилацетата, 2:1 по объему).
Получение 57. 3-(2-Фенилэтокси)-2-гидроксипропиламин
Повторяли процедуру, описанную в Получении 13, за исключением того, что использовали 5,30 г 3-(2-фенилэтокси)-2-гидроксипропилазида (полученного в соответствии с описанием, приведенным в Получении 56), 1,85 г алюмогидрида лития и 120 мл безводного тетрагидрофурана, в результате чего получали 4,47 г целевого соединения в виде бесцветного маслообразного вещества, имеющего Rf = 0,09 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и метанола, 10:1 по объему).
Получение 58. 4-Фенилбутоксиметилоксиран
Повторяли процедуру, описанную в Получении 46, за исключением того, что использовали 5,00 г 4-фенил-1-бутанола, 1,58 г гидрида натрия (55 мас.% дисперсия в минеральном масле), 3,9 мл эпибромгидрина в 110 мл безводного диметилформамида. Полученный неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле, используя в качестве элюента смесь этилацетата и гексана (8:1 по объему), в результате чего получали 3,83 г целевого соединения (бесцветное маслообразное вещество), имеющего Rf = 0,77 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси гексана и этилацетата, 2:1 по объему).
Получение 59. 3-(4-Фенилбутокси)-2-гидроксипропилазид
Повторяли процедуру, описанную в Получении 12, за исключением того, что использовали 3,70 г 4-фенилбутоксиметилоксирана (полученного в соответствии с описанием, приведенным в Получении 58), 5,83 г азида натрия, 37 мл метилформата и 135 мл смеси метанола и воды (8:1 по объему), в результате чего получали 4,46 г целевого соединения в виде бесцветного маслообразного вещества, имеющего Rf = 0,67 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси гексана и этилацетата, 2:1 по объему).
Получение 60. 3-(4-Фенилбутокси)-2-гидроксипропиламин
Повторяли процедуру, описанную в Получении 13, за исключением того, что использовали 4,30 г 3-(4-фенилбутокси)-2-гидроксипропилазида (полученного в соответствии с описанием, приведенным в Получении 59), 1,31 г алюмогидрида лития и 120 мл безводного тетрагидрофурана, в результате чего получали 3,70 г целевого соединения в виде бесцветного маслообразного вещества, имеющего Rf = 0,08 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и метанола, 10:1 по объему).
Получение 61. 6-Фенилгексилоксиметилоксиран
Повторяли процедуру, описанную в Получении 46, за исключением того, что использовали 5 г 6-фенил-1-гексанола, 4,6 мл эпибромгидрина, 1,23 г гидрида натрия (55 мас.% дисперсия в минеральном масле) и 80 мл безводного диметилформамида. Полученный неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле, используя в качестве элюента смесь этилацетата и гексана (1:7 по объему), и получали 4,35 г целевого соединения, имеющего Rf = 0,60 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 1:5 по объему) в виде бесцветного маслообразного вещества.
Получение 62. 3-(6-Фенилгексилокси)-2-гидроксипропилазид
Повторяли процедуру, описанную в Получении 12, за исключением того, что использовали 4 г 6-фенилгексилоксиметилоксирана (полученного в соответствии с описанием, приведенным в Получении 61), 5,5 г азида натрия, 100 мл смеси метанола и воды (8: 1 по объему) и 25 мл метилформата, в результате чего получали 4,5 г целевого соединения в виде бледно-желтого маслообразного вещества, имеющего Rf = 0,39 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 1:5 по объему).
Получение 63. 3-(6-Фенилгексилокси)-2-гидроксипропиламин
Повторяли процедуру, описанную в Получении 13, за исключением того, что использовали 4,5 г 3-(6-фенилгексилокси)-2-гидроксипропилазида (полученного в соответствии с описанием, приведенным в Получении 62), 1,23 г алюмогидрида лития и 150 мл безводного тетрагидрофурана, в результате чего получали 3,14 г целевого соединения в виде бледно-желтого маслообразного вещества с Rf = 0,12 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата, этанола и триэтиламина, 5:1:1 по объему).
Получение 64. 8-Фенилоктилоксиметилоксиран
Повторяли процедуру, описанную в Получении 46, за исключением того, что использовали 4 г 8-фенилоктилового спирта, 3,18 г эпибромгидрина, 0,85 гидрида натрия (55 мас.% дисперсия в минеральном масле) и 80 мл безводного диметилформамида, в результате чего получали 2,42 г целевого соединения, имеющего Rf = 0,51 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 1:6 по объему).
Получение 65. 3-(8-Фенилоктилокси)-2-гидроксипропилазид
Повторяли процедуру, описанную в Получении 12, за исключением того, что использовали 2,4 г 8-фенилоктилоксиметилоксирана (полученного в соответствии с описанием, приведенным в Получении 64), 2,97 г азида натрия, 20 мл метилформата и 80 мл смеси метанола и воды (8:1 по объему), в результате чего получали 2,7 г целевого соединения, имеющего Rf = 0,29 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 1:5 по объему).
Получение 66. 3-(8-Фенилоктилокси)-2-гидроксипропиламин
Повторяли процедуру, описанную в Получении 13, за исключением того, что использовали 2,6 г 3-(8-фенилоктилокси)-2-гидроксипропилазида (полученного в соответствии с описанием приведенным в Получении 65), 0,65 г алюмогидрида лития и 80 мл безводного тетрагидрофурана, в результате чего получали 2,11 г целевого соединения, имеющего т.пл. 50 - 54oC.
Получение 67. 7-Фенилгептилоксиметилоксиран
Повторяли процедуру, описанную в Получении 46, за исключением того, что использовали 2 г 7-фенилгептилового спирта, 1,7 мл эпибромгидрина, 0,44 г гидрида натрия (55 мас.% дисперсия в минеральном масле) и 50 мл безводного диметилформамида, в результате чего получали 1,15 г целевого соединения, имеющего Rf = 0,49 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 1:6 по объему).
Получение 68. 3-(7-Фенилгептилокси)-2-гидроксипропилазид
Повторяли процедуру, описанную в Получении 12, за исключением того, что использовали 1,1 г 7-фенилгептилоксиметилоксирана (полученного в соответствии с описанием, приведенным в Получении 67), 1,4 г азида натрия, 15 мл метилформата и 60 мл смеси метанола и воды (8:1 по объему), в результате чего получали 1,27 г целевого соединения, имеющего Rf = 0,45 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 1:3 по объему).
Получение 69. 3-(7-Фенилгептилокси)-2-гидроксипропиламин
Повторяли процедуру, описанную в Получении 13, за исключением того, что использовали 1,1 г 3-(7-фенилгептилкоси)-2-гидроксипропилазида (полученного в соответствии с описанием, приведенным в Получении 68), 0,287 г алюмогидрида лития и 50 мл безводного тетрагидрофурана. Таким образом получали 0,82 г целевого соединения, имеющего Rf = 0,12 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя этилацетата, этанола и триэтиламина, 5:1:1 по объему).
Получение 70. 3-Фторфеноксиметилоксиран
Повторяли процедуру, описанную в Получении 46, за исключением, что использовали 4,00 г 3-фторфенола, 1,88 г гидрида натрия (55 мас.% дисперсия в минеральном масле), 6,66 г эпибромгидрина и 50 мл безводного диметилформамида, в результате чего получали 5,33 г целевого соединения, имеющего Rf = 0,48 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 1:4 по объему).
Получение 71. 1-(3-Фторфеноксиметил)-2-(2-т-бутилдиметилсилилокси-1- метилэтиламино)этанол
Повторяли процедуру, описанную в Получении 10, за исключением того, что использовали 2,00 г 2-т-бутилдиметилсилилокси-1-метилэтиламина, 1,77 г 3-фторфеноксиметилоксирана (полученного в соответствии с процедурой, описанной в Получении 70) и 20 мл этанола, в результате чего получали 2,13 г целевого соединения, имеющего Rf = 0,17 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя этилацетата).
Получение 72. 3-(2-т-Бутилдиметилсилилокси-1-метилэтил)-5- (3-фторфеноксиметил)оксазолидин-2-он
Повторяли процедуру, описанную в Получении 11, за исключением того, что использовали 2,00 г 1-(3-фторфеноксиметил)-2-(2-т-бутилдиметилсилилокси-1-метилэтиламино)этанола (полученного в соответствии в процедурой, описанной в Получении 71), 20 мл безводного диметилформамида и 1,09 г N,N'-карбонилдиимидазола, в результате чего получали 0,74 г целевого соединения, имеющего Rf = 0,29 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 1:3 по объему) из полярного диастереомера. Из менее полярного диастереомера было получено 1,03 г целевого соединения с т.пл. 54 - 58oC.
Получение 73. 2-[5-(3-Фторфеноксиметил)-оксооксазолидин-3-ил]пропанол
Повторяли процедуру, описанную в Получении 5(b), за исключением того, что использовали 0,93 г 3-(2-т-бутилдиметилсилилокси-1-метилэтил)-5-(3-фторфеноксиметил) оксазолидин-2-она (полученного в соответствии с процедурой, описанной в Получении 72), 9 мл безводного тетрагидрофурана и 7,2 мл 26%-ного раствора фторида тетрабутиламмония в тетрагидрофуране, в результате чего получали 0,63 г целевого соединения с Rf = 0,18 (тонкослойная хроматография на силикагеле с использованием этилацетата в качестве проявляющего растворителя).
Получение 74. 5-{ 4-[2-(5-3'-Фторфеноксиметил-2-оксооксазолидин-3-ил)пропокси]бензил}-3-трифенилметилтиазолидин-2,4-дион
Повторяли процедуру, описанную в Получении 6, за исключением того, что использовали 364 мг трибутилфосфина, 5 мл безводного бензола, 698 мг 5-(4-гидроксибензил)-3-трифенилметилтиазолидин-2,4-диона, 454 мг азодикарбонилдипиперидина и 489 мг 2-[5-(3-фторфеноксиметил)-2-оксооксазолидин-3-ил]пропанола (полученного в соответствии с описанием, приведенным в Получении 73), в результате чего получали 0,52 г целевого соединения, т.пл. 70 - 77oC.
Получение 75. 1-(4-Метоксифеноксиметил-2-(2-т- бутилдиметилсилилокси-1-метилэтиламино-этанол
Повторяли процедуру, описанную в Получении 10, за исключением того, что использовали 3,22 г 2-т-бутилдиметилсилилокси-1- метилэтиламина, 3,00 г 4-метоксифеноксиметилоксирана и 30 мл этанола, в результате чего получали 3,58 г целевого соединения, имеющего Rf = 0,15 (тонкослойная хроматография на силикагеле с использованием этилацетата в качестве проявляющего растворителя).
Получение 76. 3-(2-т-Бутилдиметилсилилокси-1-метилэтил)-5- (4-метоксифенокси-метил)оксазолидин-2-он
Повторяли процедуру, описанную в Получении 11, за исключением того, что использовали 3,36 г 1-(4-метоксифеноксиметил)-2-(2-т- бутилдиметилсилилокси-1-метилэтиламино)этанола (полученного в соответствии с описанием, приведенным в Получении 75), 1,78 г N,N'-карбонилдиимидазола и 30 мл безводного диметилформамида. Таким образом из полярного диастереомера получали 1,42 г целевого соединения, имеющего Rf = 0,41 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 1:2 по объему), а из менее полярного диастереомера получали 1,62 г целевого соединения, имеющего т.пл. 81-85oC.
Получение 77. 2-[5-(4-Метоксифеноксиметил)-2-оксооксазолидин-3- ил]пропанол
(a) Повторяли процедуру, описанную в Получении 5(b), за исключением того, что использовали 1,52 г 3-(2-т- бутилдиметилсилилокси-1-метилэтил)-5-(4-метоксифеноксиметил) оксазолидин-2-она (менее полярного диастереомера, полученного в соответствии с описанием, приведенным в Получении 76), 12 мл фторида тетрабутиламмония (26%-ный раствор в тетрагидрофуране) и 10 мл безводного тетрагидрофурана, в результате чего получали 1,20 г целевого соединения, имеющего т.пл. 80-88oC (из менее полярного диастереомера).
(b) Повторяли процедуру, описанную в Получении 5(b), за исключением того, что использовали 1,26 г 3-(2-т-бутилдиметилсилилокси-1-метилэтил)-5-(4-метоксифеноксиметил) оксазолидин-2,4-она (полярный изомер, полученный в соответствии с описанием, приведенным в Получении 76), 9,6 мл 26%-ного раствора фторида тетрабутиламмония в тетрагидрофуране и 10 мл безводного тетрагидрофурана. Таким образом из полярного диастереомера было получено 0,86 г целевого соединения, т.пл. 62-67oC.
Получение 78. 5-{4-[2-(5-4'-Метоксифеноксиметил-2- оксооксазолидин-3-ил)пропокси]-бензил}-3-трифенилметилтиазолидин- 2,4-дион
(a) Повторяли процедуру, описанную в Получении 6, за исключением того, что использовали 800 мг 2-[5-(4-метоксифеноксиметил)-2- оксооксазолидин-3-ил]пропанола (менее полярного изомера, полученного в соответствии с описанием, приведенным в Получении 77(a)), 688 мг трибутилфосфина, 30 мл безводного бензола, 1,30 г 5-(4-гидроксибензил)-3-трифенилметилтиазолидин-2,4-диона и 858 мг азодикарбонилдипиперидина, в результате чего из менее полярного диастереомера получали 0,75 г целевого соединения с т.пл. 60-66oC.
(b) Повторяли процедуру, описанную в Получении 6, за исключением того, что использовали 0,85 г 2-[5-(4-метоксифеноксиметил)-2- оксооксазолидин-3-ил] пропанола (полярный изомер, полученный в соответствии с описанием, приведенным в Получении 77(b)), 0,73 г трибутилфосфина, 50 мл безводного бензола, 1,68 г 5-(4- гидроксибензил)-3-трифенилметилтиазолидин-2,4-диона и 0,91 г азодикарбонилдипиперидина, в результате чего получали 0,93 г целевого соединения (т.пл. 85-94oC) из полярного диастереомера.
Получение 79. 3-Диметиламинофеноксиметилоксиран
Повторяли процедуру, описанную в Получении 46, за исключением того, что использовали 4,00 г 3-диметиламинофенола, 4,5 мл эпибромгидрина, 153 г гидрида натрия (55 мас.% дисперсия в минеральном масле) и 50 мл диметилформамида. Полученный неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле, используя в качестве элюента смесь этилацетата и гексана (1: 4 по объему), в результате чего получали 4,18 г целевого соединения, имеющего Rf = 0,36 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 1:4 по объему).
Получение 80. 3-(3-Диметиламинофенокси)-2-гидроксипропилазид
Повторяли процедуру, описанную в Получении 12, за исключением того, что использовали 2,0 г 3-диметиламинофеноксиметилоксирана (полученного в соответствии с описанием, приведенным в Получении 79), 3,25 г азида натрия, 20 мл метилформата и 90 мл смеси метанола и воды (8:1 по объему), в результате чего получали 2,34 г целевого соединения, имеющего Rf = 0,35 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 1:4 по объему).
Получение 81. 3-(3-Диметиламинофенолфенокси)-2- гидроксипропиламин
Повторяли процедуру, описанную в Получении 13, за исключением того, что использовали 2,41 г 3-(3-диметиламинофенокси)-2- гидроксипропиламида (полученного в соответствии с описанием, приведенным в Получении 80), 0,76 г алюмогидрида лития и 50 мл безводного тетрагидрофурана, в результате чего получали 1,80 г целевого соединения, имеющего Rf = 0,9 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и этанола, 4:1 по объему).
Получение 82. 4-Фенилфеноксиметилоксиран
Повторяли процедуру, описанную в Получении 46, за исключением того, что использовали 4,00 г 4-фенилфенола, 3,97 г эпибромгидрина, 1,27 г гидрида натрия (55 мас. % дисперсия в минеральном масле) и 80 мл безводного диметилформамида, в результате чего получали 4,43 г целевого соединения, имеющего т.пл. 80,2 - 82,9oC.
Получение 83. 3-(4-Фенилфенокси)-2-гидроксипропилазид
Повторяли процедуру, описанную в Получении 12, за исключением того, что использовали 3,00 г 4-фенилфеноксиметилоксирана (полученного в соответствии с процедурой, описанной в получении 82), 4,23 г азида натрия, 15 мл метилформата и 90 мл смеси метанола и воды (8:1 по объему), в результате чего получали 3,09 г целевого соединения, имеющего т.пл. 72,2 - 73,9oC.
Получение 84. 3-(4-Фенилфенокси)-2-гидроксипропиламин
В смесь 2,94 г 3-(4-фенилфенокси)-2-гидроксипропилазида (полученного в соответствии с описанием, приведенным в Получении 83), 0,3 г 10% палладированного угля и 60 мл этанола в течение 3 ч вводили водород. Затем нерастворимые вещества удаляли путем фильтрации и полученный фильтрат концентрировали путем выпаривания при пониженном давлении, в результате чего получали 2,84 г целевого соединения, т.пл. 137,7-146,8oC.
Получение 85. Фенилтиометилоксиран
К смеси 6 мл эпибромгидрина, 5,45 г гидроксида натрия и 30 мл 1,4-диоксана по капле и при комнатной температуре добавляли раствор 5,0 г тиофенола в 30 мл 1,4-диоксана и полученную смесь перемешивали при комнатной температуре в течение 36 ч. По истечении этого времени нерастворимые твердые вещества удаляли путем фильтрации, а 1,4-диоксан выпаривали из фильтрата и получали остаток. К полученному остатку добавляли воду и смесь экстрагировали этилацетатом. Экстракт промывали водным раствором хлорида натрия и осушали безводным сульфатом натрия. После этого этилацетат удаляли из экстракта путем выпаривания при пониженном давлении и полученный остаток очищали с помощью колоночной хроматографии на силикагеле, используя в качестве элюента смесь этилацетата и гексана (1:10 по объему). В результате этой процедуры получали 6,78 г целевого соединения в виде бесцветного маслообразного вещества, имеющего Rf = 0,60 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 1:10 по объему).
Получение 86. 3-Фенилтио-2-гидроксипропилазид
Повторяли процедуру, описанную в Получении 12, за исключением того, что использовали 7,2 г фенилтиометилоксирана (полученного в соответствии с описанием, приведенным в Получении 85), 14 г азида натрия, 65 мл метилформата и 270 мл смеси метанола и воды (8:1 по объему), в результате чего получали 8,33 г целевого соединения (бесцветное маслообразное вещество) с Rf = 0,23 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 1:10 по объему).
Получение 87. 3-Фенилтио-2-гидроксипропиламин
Повторяли процедуру, описанную в Получении 13, за исключением того, что использовали 8 г 3-фенилтио-2-гидроксипропилазида (полученного в соответствии с описанием, приведенным в Получении 86), 2,9 г алюмогидрида лития и 400 мл безводного тетрагидрофурана, в результате чего получали 6,8 г целевого соединения, т.пл. 57 - 61oC.
Получение 88. N-Метил-N-фениламинометилоксиран
Повторяли процедуру, описанную в Получении 46, за исключением того, что использовали 5 г N-метиланилина, 7,65 мл эпибромгидрина, 2,44 г гидрида натрия (55 мас. % дисперсия в минеральном масле) и 100 мл безводного диметилформамида, в результате чего получали 1,67 г целевого соединения в виде бледно-желтого маслообразного вещества, имеющего Rf = 0,33 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 1:10 по объему).
Получение 89. 3-(N-Метил-N-фениламино)-2-гидроксипропилазид
Повторяли процедуру, описанную в Получении 12, за исключением того, что использовали 1,65 г N-метил-N-фениламинометилоксирана (полученного в соответствии с описанием, приведенным в Получении 88), 3,29 г азида натрия, 15 мл метилформата и 63 мл смеси метанола и воды (8:1 по объему), в результате чего получали 1,9 г целевого соединения в виде бледно-желтого маслообразного вещества, имеющего Rf = 0,09 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 1:15 по объему).
Получение 90. 3-(N-Метил-N-фениламино)-2-гидроксипропиламин
В смесь 1,85 г 3-(N-метил-N-фениламино)-2-гидроксипропилазида (полученного в соответствии с процедурой, описанной в Получении 89), 0,9 г 10% палладия на угле и 30 мл этанола в течение 1,5 ч вводили водород. По истечении этого времени водород заменяли на азот, а палладий на угле из реакционной смеси удаляли путем фильтрации. Фильтрат концентрировали путем выпаривания при пониженном давлении и получали 1,6 г целевого соединения с т. пл. 136oC (при разложении).
Получение 91. 3-Хлорбензилоксиметилоксиран
Повторяли процедуру, описанную в Получении 46, за исключением того, что использовали 5,00 г 3-хлорбензилового спирта, 1,83 г гидрида натрия (55 мас. % дисперсия в минеральном масле), 3,45 мл эпибромгидрина и 60 мл безводного диметилформамида, в результате чего получали 5,45 г целевого соединения, имеющего Rf = 0,31 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 1:6 по объему).
Получение 92. 3-(3-Хлорбензилокси)-2-гидроксипропилазид
Повторяли процедуру, описанную в Получении 12, за исключением того, что использовали 4,73 г 3-хлорбензилоксиметилоксирана (полученного в соответствии с описанием, приведенным в Получении 91), 7,80 г азида натрия, 24 мл метилформата, 135 мл смеси метанола и воды (8:1 по объему) и 10 мл воды, в результате чего получали 5,74 г целевого соединения, имеющего Rf = 0,29 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 1:4 по объему).
Получение 93. 3-(3-Хлорбензилокси)-2-гидроксипропиламин
Повторяли процедуру, описанную в Получении 13, за исключением того, что использовали 6,22 г 3-(3-хлорбензилокси)-2-гидроксипропилазида (полученного в соответствии с описанием, приведенным в Получении 92), 1,97 г алюмогидрида лития и 120 мл безводного тетрагидрофурана, в результате чего получали 3,37 г целевого соединения, имеющего Rf = 0,03 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя этилацетата).
Получение 94. 5-[4-(2-Оксобутокси)бензил]-3- трифенилметилтиазолидин-2,4-дион
Смесь 7,37 мл 1-бром-2-бутанона, 20,0 г 5-(4-гидроксибензил)-3- трифенилметилтиазолидин-2,4-диона, 21,18 г карбоната цезия и 200 мл безводного ацетона перемешивали в течение 3 ч при комнатной температуре. Затем ацетон удаляли путем выпаривания при пониженном давлении, в результате чего получали остаток. К этому остатку добавляли воду и смесь экстрагировали этилацетатом. После этого экстракт промывали водным раствором хлорида натрия, а затем осушали безводным сульфатом натрия. После удаления этилацетата путем выпаривания при пониженном давлении, образовавшийся остаток перекристаллизовывали из смеси этилацетата, диэтилового эфира и диизопропилового эфира, в результате чего получали 19,36 г целевого соединения, т.пл. 155,2 - 156,4oC.
Получение 95. 5-[4-(2-Оксобутокси)бензил]-тиазолидин-2,4-дион
К раствору 19,3 г 5-[4-(2-оксобутокси)бензил]-3-трифенилметилтиазолидин-2,4-диона (полученного в соответствии с описанием, приведенным в Получении 94) в 100 мл метиленхлорида добавляли 50 мл трифторуксусной кислоты. Полученную смесь перемешивали при комнатной температуре в течение полутора часов. После концентрирования путем выпаривания при пониженном давлении получали остаток. К этому остатку добавляли воду и полученную смесь нейтрализовали путем добавления бикарбонат натрия, а затем экстрагировали этилацетатом. После этого экстракт промывали водным раствором хлорида натрия и осушали безводным сульфатом натрия. Этилацетат удаляли путем выпаривания при пониженном давлении и полученный остаток хроматографировали на колонке с силикагелем, используя в качестве элюента смесь этилацетата и гексана (1:2 по объему). После перекристаллизации из смеси этилацетата и диизопропилового эфира получали 9,55 г целевого соединения, имеющего т.пл. 141,5 - 145,7oC.
Получение 96. Этил 2-[5-(3-Хлорфеноксиметил)-2-оксооксазолидин- 3-ил]пентаноат
Повторяли процедуру, описанную в Получении 4, за исключением того, что использовали 1,35 г гидрида натрия (55 мас.% дисперсия в минеральном масле), 6,00 г 5-(хлорфеноксиметил)оксазолидин-2-она, 100 мл безводного диметилформамида и 6,48 г этил 2-бромвалерата. Полученный неочищенный продукт хроматографировали на колонке с силикагелем, используя в качестве элюента смесь этилацетата и гексана (1:3 по объему). В результате этой процедуры получали отдельно полярный диастереомер и менее полярный диастереомер. Таким образом из полярного диастереомера получали 4,5 г целевого соединения, имеющего Rf = 0,58 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 1:1 по объему). Из менее полярного диастереомера получали 4,47 г целевого соединения с т.пл. 43 - 49oC.
Получение 97. 2-[5-(3-Хлорфеноксиметил)-2-оксооксазолидин-3-ил]пентанол
(a) Повторяли процедуру, описанную в Получении 5, за исключением того, что использовали 4,38 г этил 2-[5-(3-хлорфеноксиметил)-2-оксооксазолидин-3-ил] пентаноата (менее полярного изомера, полученного в соответствии с процедурой, описанной в Получении 96), 40 мл безводного тетрагидрофурана, 0,39 г боргидрида лития и 0,29 г безводного метанола, в результате чего из менее полярного изомера получали 2,22 г целевого соединения, имеющего т.пл. 79 - 81oC.
(b) Повторяли процедуру, описанную в Получении 5, за исключением того, что использовали 4,31 г этил 2-[5-(3-хлорфеноксиметил)-2-оксооксазолидин-3-ил] пентаноата (полярного изомера, полученного в соответствии с описанием, приведенным в Получении 96), 40 мл безводного тетрагидрофурана, 0,42 г боргидрида лития и 0,31 г безводного метанола, в результате чего получали (из полярного диастереомера) 2,03 г целевого соединения, т.пл. 98 - 102oC.
Получение 98. 5-{ 4-[2-(5-3'-Хлорфеноксиметил-2-оксооксазолидин-3-ил)пентилокси]бензил}-3-трифенилметилтиазолидин-2,4-дион
(a) Повторяли процедуру, описанную в Получении 6, за исключением того, что использовали 1,00 г 2-[5-(3-хлорфеноксиметил)-2-оксооксазолидин-3-ил] пентанола (менее полярного изомера, полученного в соответствии с описанием, приведенным в Получении 97(a)), 1,07 г 5-(4-гидроксибензил)-3-трифенилметилтиазолидин-2,4-диона, 0,74 г трифенилфосфина, 0,49 г диэтилазодикарбоксилата и 30 мл безводного тетрагидрофурана, в результате чего из менее полярного диастереомера получали 1,58 г целевого соединения с Rf = 0,6 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 1:1 по объему).
(b) Повторяли процедуру, описанную в Получении 6, за исключением того, что использовали 1,00 г 2-[5-(3-хлорфеноксиметил)-2- оксооксазолидин-3-ил] пентанола (полярного изомера, полученного в соответствии с описанием, приведенным в Получении 97(b), 0,88 г 5-(4-гидроксибензил)-3-трифенилметилтиазолидин-2,4-диона, 0,73 г трифенилфосфина, 30 мл безводного тетрагидрофурана и 0,49 г диэтилазодикарбоксилата, в результате чего из полярного диастереомера получали 1,22 г целевого соединения, имеющего Rf = 0,57 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 1:1 по объему).
Получение 99. Метил 2-[5-(3-хлорфеноксиметил)-2- оксооксазолидин-3-ил] -3-метилбутаноат
Повторяли процедуру, описанную в Получении 4, за исключением того, что использовали 0,92 г гидрида натрия (55 мас.% дисперсия в минеральном масле), 80 мл безводного диметилформамида, 4,10 г (5-(3-хлорфеноксиметил)оксазолидин-2-она и 4,16 г метил 2-бромизобутирата, в результате чего получали неочищенный продукт. Этот неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле, используя в качестве элюента градиент смеси этилацетата и гексана (1:3 - 1:2 по объему). Таким образом из полярного диастереомера получали 1,05 г целевого соединения, имеющего Rf = 0,39 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 1:1 по объему), а из менее полярного диастереомера получали 1,23 г целевого соединения, имеющего Rf = 0,48 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 1:1 по объему).
Получение 100. 2-[5-(3-Хлорфеноксиметил)-2-оксооксазолидин- 3-ил] метилбутанол
(a) Повторяли процедуру, описанную в Получении 5, за исключением того, что использовали 1,14 г метил 2-[5-(3-хлорфеноксиметил)-2- оксооксазолидин-3-ил]-3-метилбутаноата (менее полярного изомера, полученного в соответствии с описанием, приведенным в Получении 99), 144 мг боргидрида лития, 12 мл безводного диметилформамида и 105 мг безводного метанола, в результате чего получали 1,02 г целевого соединения, имеющего Rf = 0,26 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 1:1 по объему) из менее полярного диастереомера.
(b) Повторяли процедуру, описанную в Получении 5, за исключением того, что использовали 0,93 г метил 2-[5-(3-хлорфеноксиметил)-2- оксооксазолидин-3-ил] -3-метилбутаноата (полярного изомера, полученного в соответствии с описанием, приведенным в Получении 99), 118 г боргидрида лития, 10 мл безводного тетрагидрофурана и 87 мг безводного метанола, в результате чего из полярного диастереомера получали 0,47 г целевого соединения, имеющего Rf = 0,48 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 2:1 по объему).
Получение 101. 5-{ 4-[2-(5-3'-Хлорфеноксиметил-2-оксооксазолидин- 3-ил)-3-метилбутокси]бензил}-3-трифенилметилтиазолидин-2,4-дион
(a) Повторяли процедуру, описанную в Получении 6, за исключением того, что использовали 800 мг 2-[5-(3-хлорфеноксиметил)-2- оксооксазолидин-3-ил] -3-метилбутанола (менее полярного изомера, полученного в соответствии с описанием, приведенным в Получении 100(a)), 656 мг трифенилфосфина, 20 мл безводного тетрагидрофурана, 791 мг 5-(4-гидроксибензил)-3-трифенилметилтиазолидин-2,4-диона и 435 мг диэтилазодикарбоксилата. Таким образом, из менее полярного диастереомера получали 0,92 г целевого соединения, т.пл. 60-66oC.
(b) Повторяли процедуру, описанную в Получении 6, за исключением того, что использовали 0,90 г 2-[5-(3-хлорфеноксиметил)-2-оксооксазолидин-3-ил]-3-метилбутанола (полярного изомера, полученного в соответствии с описанием, приведенным в Получении 100(b)), 0,76 г трифенилфосфина, 0,88 г 5-(4-гидроксибензил)-3-трифенилметилтиазолидин-2,4-диона, 20 мл безводного тетрагидрофурана и 0,49 г диэтилазодикарбоксилата. В результате этой процедуры из полярного диастереомера получали 1,22 г целевого соединения, имеющего Rf = 0,55 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 1:1 по объему).
Получение 102. 2-Бензилоксикарбониламино-2-метилпропанол
Повторяли процедуру, описанную в Получении 7, за исключением того, что использовали 7,00 г 2-амино-2-метилпропанола, 13,47 г бензилоксикарбонилхлорида, 13,13 г карбоната калия, 35 мл этилацетата и 35 мл воды. Таким образом получали 17,59 г целевого соединения, имеющего Rf = 0,72 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 3:1 по объему).
Пример 103. Бензин N-(2-т-бутилдиметил-силилокси-1,1- диметилэтил)карбамат
Повторяли процедуру, описанную в Получении 8, за исключением того, что использовали 10,00 г 2-бензилоксикарбониламино-2- метилпропанола, 7,35 г имидазола, 150 мл безводного диметилформамида и 8,14 г т-бутилдиметилсилилхлорида, в результате чего получали 14,68 г целевого соединения, имеющего Rf = 0,73 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 1:4 по объему).
Получение 104. 2-т-Бутилдиметилсилилокси-1,1-диметилэтиламин
Повторяли процедуру, описанную в Получении 9, за исключением того, что использовали 8,00 г бензил N-[2-т-бутилдиметилсилилокси- 1,1-диметилэтил]карбамата (полученного в соответствии с описанием, приведенным в Получении 103), 1,60 г 10%-ного палладия на угле и 80 мл этанола, в результате чего получали 4,02 г целевого соединения, имеющего Rf = 0,14 (тонкослойная хроматография на силикагеле с использованием в качестве элюента этилацетата).
Получение 105. 1-(3-Хлорфеноксиметил)-2-(2-т- бутилдиметилсилилокси-1,1-диметилэтиламино)этанол
Повторяли процедуру, описанную в Получении 10, за исключением того, что использовали 3,36 г 2-т-бутилдиметилсилилокси-1,1- диметилэтиламина, 3,05 г 3-хлорфеноксиметилоксирана и 30 мл этанола, в результате чего получали 4,54 г целевого соединения, т.пл. 70,5-77,3oC.
Получение 106. 3-(2-т-Бутилдиметилсилилокси-1,1-диметилэтил)-5- (3-хлорфеноксиметил)оксазолидин-2-он
Повторяли процедуру, описанную в Получении 11, за исключением того, что использовали 5,13 г 1-(3-хлорфеноксиметил)-2-(2-т-бутилдиметилсилилокси-1,1-диметилэтиламино)этанола (полученного в соответствии с описанием, приведенным в Получении 105), 50 мл безводного диметилформамида и 2,59 г N, N'-карбонилдиимидазола. Таким образом было получено 5,27 г целевого соединения, имеющего Rf = 0,33 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 1:4 по объему).
Получение 107. 5-(3-Хлорфеноксиметил)-3-(2-гидрокси-1,1- диметилэтил)-оксазолидин-2-он
К раствору 3,84 г 3-(2-т-бутилдиметилсилилокси-1,1-диметилэтил)- 5-(3-хлорфеноксиметил)оксазолидин-2-она (полученного в соответствии с описанием, приведенным в Получении 106) в 40 мл ацетонитрила по капле добавляли 7 мл 5%-ного раствора фтороводорода в ацетонитриле. Полученную смесь перемешивали при комнатной температуре в течение часа. Затем растворитель удаляли из реакционной смеси путем выпаривания при пониженном давлении, в результате чего получали 2,71 г целевого соединения, т.пл. 81-82oC.
Получение 108. 5-(3-Хлорфеноксиметил)-3-[2-(4-нитрофенокси)-1,1- диметилэтил]-оксазолидин-2-он
К раствору 200 мг 5-(3-хлорфеноксиметил)-3-(2-гидрокси-1,1- диметилэтил)оксазолидин-2-она и 288 мг 4-фторнитробензола в 5 мл диметилформамида при охлаждении льдом тремя порциями добавляли 35 мг гидрида натрия (55 мас.% дисперсия в минеральном масле). После этого полученную смесь перемешивали при той же температуре в течение 30 мин. Затем эту смесь перемешивали при комнатной температуре в течение 7 ч и растворитель удаляли из реакционной смеси путем выпаривания при пониженном давлении. К полученному остатку добавляли воду и смесь экстрагировали этилацетатом. Затем экстракт промывали водным раствором хлорида натрия и осушали безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания при пониженном давлении, после чего остаток очищали с помощью колоночной хроматографии на силикагеле, используя в качестве элюента смесь этилацетата и гексана (2:3) по объему. В результате этой процедуры получали 262 мг целевого соединения, т.пл. 108-112oC.
Получение 109. 3-[2-(4-Аминофенокси)-1,1-диметилэтил]-5- (3-хлорфеноксиметил)оксазолидин-2-он
К раствору 2,34 г 5-(3-хлорфеноксиметил)-3-[2-(4-нитрофенокси)- 1,1-диметилэтил]оксазолидин-2-она (полученного в соответствии с описанием, приведенным в Получении 108) в 70 мл смеси этилацетата и т-бутанола (9:1 по объему) добавляли 6,32 г дигидрата хлорида олова (2). К полученной смеси при температуре 66oC в масляной бане добавляли 0,11 г боргидрида натрия. Затем эту смесь перемешивали при той же температуре в течение 6 ч. По истечении этого времени растворитель удаляли из реакционной смеси путем выпаривания при пониженном давлении, в результате чего образовывался остаток. Этот остаток нейтрализовали путем добавления водного раствора бикарбоната натрия. Осажденные нерастворимые вещества удаляли путем фильтрации и полученный фильтрат экстрагировали этилацетатом. Экстракт промывали водным раствором хлорида натрия и осушали безводным сульфатом натрия. После этого этилацетат удаляли из экстракта путем выпаривания при пониженном давлении, в результате чего получали 1,96 г целевого соединения, имеющего Rf = 0,34 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 4:1 по объему).
Получение 110. Бутил 2-бромо-3-{4-[2-(5-3'-хлорфеноксиметил- 2-оксооксазолидин-3-ил)-2-метилпропокси]фенил}пропионат
К раствору 2,20 г 3-[2-(4-аминофенокси)-1,1-диметилэтил]-5- (3-хлорфеноксиметил)оксазолидин-2-она в 25 мл ацетона по капле (при охлаждении льдом) добавляли 4,82 г 47%-ного водного раствора бромводорода, а затем к полученной смеси добавляли 2 мл водного раствора 462 мг нитрита натрия. Полученную смесь перемешивали при той же температуре в течение 15 мин, а затем при комнатной температуре добавляли 7,18 г бутилакрилата и 157 мг оксида меди (1). После этого полученную смесь перемешивали при комнатной температуре в течение 2,5 ч. Растворитель удаляли из реакционной смеси путем выпаривания при пониженном давлении, образовавшийся остаток нейтрализовали путем добавления водного раствора бикарбоната натрия и смесь экстрагировали этилацетатом. Экстракт промывали водным раствором хлорида натрия и осушали безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания при пониженном давлении, в результате чего получали остаток. Этот остаток очищали с помощью колоночной хроматографии на силикагеле, используя в качестве элюента градиент смеси этилацетата и гексана (1:3 - 1:1 по объему), в результате чего получали 2,24 г целевого соединения, имеющего Rf = 0,44 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 1:2 по объему).
Получение 111. 5-{ 4-[2-(5-3'-Хлорфеноксиметил-2-оксооксазолидин- 3-ил)-2-метилпропокси]бензил}-2-иминотиазолидин-4-он
К раствору 2,07 г бутил 2-бром-3-{4-[2-(5-3'-хлорфеноксиметил-2- оксооксазолидин-3-ил)-2-метилпропокси] фенил} пропионата (полученного в соответствии с описанием, приведенным в Получении 110) в 30 мл метанола добавляли 0,5 г тиомочевины. К полученной смеси добавляли 0,49 г ацетата натрия. Затем полученную смесь нагревали с обратным холодильником в течение 5 ч, после чего растворитель удаляли из реакционной смеси путем выпаривания при пониженном давлении. К полученному остатку добавляли насыщенный водный раствор хлорида натрия и смесь экстрагировали этилацетатом. Экстракт высушивали безводным сульфатом натрия, а этилацетат удаляли путем выпаривания при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле, используя в качестве элюента градиент смеси этилацетата и тетрагидрофурана (1: 0 - 3:1 по объему). В результате этой процедуры получали 1,50 г смеси целевого соединения (Rf = 0,19, тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя этилацетата) и тиомочевины.
Получение 112. 5-Феноксиметилоксазолидин-2-он.
К раствору 500 мг 3-фенокси-2-гидроксипропиламина в 5 мл безводного диметилформамида при охлаждении льдом добавляли 422 мг N,N'-карбонилдиимидазола. Полученную смесь перемешивали при комнатной температуре в течение ночи. По истечении этого времени растворитель удаляли из реакционной смеси путем выпаривания при пониженном давлении и к полученному концентрату добавляли воду. Затем смесь экстрагировали этилацетатом и экстракт промывали водным раствором хлорида натрия и осушали безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания при пониженном давлении, в результате чего получали остаток. Этот остаток очищали с помощью колоночной хроматографии на силикагеле (элюент - этил ацетат) и получали 490 мг целевого соединения, т.пл. 110-111oC.
Получение 113. Этил 3-(5-феноксиметил-2-оксооксазолидин-3-ил)пропионат.
Повторяли процедуру, описанную в Получении 4, за исключением того, что использовали 113 мг гидрида натрия (55 мас.% дисперсия в минеральном масле), 10 мл безводного диметилформамида, 420 мг 5-феноксиметилоксазолидин-2-она (полученного в соответствии с описанием, приведенным в Получении 112) и 471 мг этил 3-бромпропионата. Таким образом было получено 463 мг целевого соединения, имеющего Rf = 0,34 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 2:1 по объему).
Получение 114. 3-(5-Феноксиметил-2-оксооксазолидин-3-ил)пропанол.
Повторяли процедуру, описанную в Получении 5(a), за исключением того, что использовали 1,64 г этил 3-(5-феноксиметил-2-оксооксазолидин-3-ил)пропионата (полученного в соответствии с процедурой, описанной в Получении 113), 15 мл безводного тетрагидрофурана, 244 мг боргидрида лития и 179 мл безводного метанола, в результате чего получали 1,41 г целевого соединения, имеющего Rf = 0,28 (тонкослойная хроматография на силикагеле с использованием этилацетата в качестве проявляющего растворителя).
Получение 115. 5-{4-[3-(5-Феноксиметил-2-оксооксазолидин-3- ил)пропокси] -бензил}-3-трифенилметилтиазолидин-2,4-дион.
Повторяли процедуру, описанную в Получении 6, за исключением того, что использовали 1,29 г трибутилфосфина, 30 мл безводного бензола, 2,98 г 5-(4-гидроксибензил)-3-трифенилметилтиазолидин-2,4-диона, 1,61 г азодикарбонилдипиперидина и 1,33 г 3-(5-феноксиметил-2-оксооксазолидин-3-ил)пропанола (полученного в соответствии с описанием, приведенным в Получении 114). Таким образом получали 2,04 г целевого соединения, т.пл. 70-73oC.
Получение 116. Этил 4-[5-(3-Хлорфеноксиметил)-2- оксооксазолидин-3-ил] бутират
Повторяли процедуру, описанную в Получении 4, за исключением того, что использовали 0,52 г гидрида натрия (55 мас.%, дисперсия в минеральном масле), 30 мл безводного диметилформамида, 2,00 г 5-(3-хлорфеноксиметил)оксазолидин-2-она и 2,34 г этил 4-бромбутирата. Таким образом получали 1,50 г целевого соединения, имеющего Rf = 0,39 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 2:1 по объему).
Получение 117. Этил 4-[5-(3-Хлорфеноксиметил)-2- оксооксазолидин-3-ил] бутанол
Повторяли процедуру, описанную в Получении 5, за исключением того, что использовали 1,43 г этил 4-[5-(3-хлорфеноксиметил)-2- оксооксазолидин-3-ил] бутирата (полученного в соответствии с описанием, приведенным в Получении 116), 183 мг боргидрида натрия, 20 мл безводного тетрагидрофурана и 135 мл безводного метанола. В результате этой процедуры получали 1,26 г целевого соединения, имеющего Rf = 0,31 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя этилацетата).
Получение 118. 5-{ 4-[4-(5-3'-Хлорфеноксиметил-2-оксооксазолидин- 3-ил)бутокси]-бензил}-3-трифенилметилтиазолидин-2,4-дион
Повторяли процедуру, описанную в Получении 6, за исключением того, что использовали 647 мг трибутилфосфина, 20 мл безводного бензола, 1,49 г 5-(4-гидроксибензил)-3-трифенилметилтиазолидин-2,4-диона, 807 мг азодикарбонилдипиперидина и 800 мг 4-[5-(3-хлорфеноксиметил)-2-оксооксазолидин-3-ил]бутанола (полученного в соответствии с описанием, приведенным в Получении 117). В результате этой процедуры получали 1,49 г целевого соединения, т.пл. 68-72oC.
Получение 119. 2-Хлорацетамидо-1-(3-хлорфеноксиметил)этанол
К раствору 300 мг 3-(3-хлорфенокси)-2-гидроксипропиламина в 4 мл безводного тетрагидрофурана при охлаждении льдом добавляли раствор 0,24 мл триэтиламина в 1 мл безводного тетрагидрофурана. Затем к полученной реакционной смеси по капле добавляли 1 мл раствора 192 мг хлорацетилхлорида в безводном тетрагидрофуране. После этого реакционную смесь перемешивали в течение 3 ч при комнатной температуре. По истечении этого времени растворитель удаляли из реакционной смеси путем выпаривания при пониженном давлении и получали остаток. К этому остатку добавляли воду, после чего смесь экстрагировали этилацетатом. Экстракт промывали водным раствором хлорида натрия, а затем осушали безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания при пониженном давлении и полученный остаток очищали с помощью колоночной хроматографии на силикагеле, используя в качестве элюента смесь этилацетата и гексана (3:2 по объему). В результате этой процедуры получали 310 мг целевого соединения, имеющего т.пл. 74-77oC.
Получение 120. Этил 2-[6-(3-хлорфеноксиметил)-3-оксоморфолин-4-ил]пропионат
К раствору 2,49 г гидрида натрия (55 мас.% дисперсия в минеральном масле) в 170 мл диметилформамида при температуре 65oC в масляной бане по капле добавляли раствор 5,50 г 2-хлорацетамидо-1-(3-хлорфеноксиметил)этанола (полученного в соответствии с описанием, приведенным в Получении 119) в 110 мл диметилформамида. После этого полученную реакционную смесь перемешивали при той же температуре в течение часа. Затем к реакционной смеси по капле и при охлаждении льдом добавляли 5,25 г этил 2-бромпропионата и эту смесь перемешивали в течение одного дня. По истечении этого времени растворитель удаляли из реакционной смеси путем выпаривания при пониженном давлении, в результате чего получали остаток. К этому остатку добавляли воду и смесь экстрагировали этилацетатом. Затем экстракт промывали водным раствором хлорида натрия и осушали безводным сульфатом натрия. Этилацетат удаляли из экстракта путем выпаривания при пониженном давлении и полученный остаток очищали с помощью колоночной хроматографии на силикагеле, используя в качестве элюента градиент смеси этилацетата и гексана (1:2 - 3:2 по объему). В результате этой процедуры получали 4,23 г целевого соединения, имеющего Rf = 0,39 (тонкослойная хроматография с использованием в качестве проявляющего растворителя этилацетата).
Получение 121. 2-[2-(3-Хлорфеноксиметил)морфолино]пропанол
К суспензии 0,51 г алюмогидрида лития в 20 мл безводного тетрагидрофурана по капле и при охлаждении льдом добавляли раствор 1,50 г этил 2-[6-(3-хлорфеноксиметил)-3-оксоморфолин-4-ил] пропионата в 10 мл безводного тетрагидрофурана. Полученную смесь перемешивали при комнатной температуре в течение 2,5 ч, после чего избыток алюмогидрида лития разлагали путем добавления к смеси декагидрата сульфата натрия. Нерастворимые вещества удаляли из реакционной смеси с помощью ускорителя фильтрации (ЦелитR, торговый знак), после чего растворитель удаляли из фильтрата путем выпаривания при пониженном давлении, в результате чего получали 0,97 г целевого соединения, имеющего Rf = 0,19 (тонкослойная хроматография на силикагеле с использованием в качестве проявляющего растворителя смеси этилацетата и гексана, 3:1 по объему).
Получение 122. 5-{4-[2-(2-3'-Хлорфеноксиметилморфолино) пропокси]бензил} -3-трифенилметилтиазолидин-2,4-дион
Повторяли процедуру, описанную в Получении 6, за исключением того, что использовали 1,21 г трифенилфосфина, 20 мл безводного тетрагидрофурана, 1,77 г 5-(4-гидроксибензил)-3-трифенилметилтиазолидин-2,4-диона, 0,81 г диэтилазодикарбоксилата и 1,32 г 2-[2-(3-хлорфеноксиметил)морфолино] пропанола (полученного в соответствии с процедурой, описанной в Получении 121). Таким образом получено 1,32 г целевого соединения, имеющего т.пл. 48-53oC.
Дополнительные биологические данные (Гиперлипемическая активность)
При гиперлипемии в крови увеличивается уровень триглицерида, который является одним из липидов сыворотки. Соответственно, степень гиперлипемии можно оценить с помощью измерения количества триглицерида в крови.
Подопытными животными были самцы крыс F344. Каждая группа животных содержала по 5 животных, и животных использовали для эксперимента, когда они достигали возраста 7 недель. Каждому испытываемому давали перорально испытываемое соединение, смешанное с носителем (0,5% CMC), в дозе 50 мг/мг/день в течение 2 недель. Одновременно еще одной группе из 5 животных (контрольная группа) давали перорально только носитель. После введения крысам исследуемых средств в течение 2 недель у каждой крысы брали кровь. Сыворотка крови отделялась и измерялся уровень триглицерида с использованием автоматического анализатора (тип 736, производимый фирмой Хитачи Лтд.). Результаты суммированы в табл. 10.
Как можно видеть из приведенных в табл. 10 результатов, соединения изобретения показали снижение уровня триглицерида.
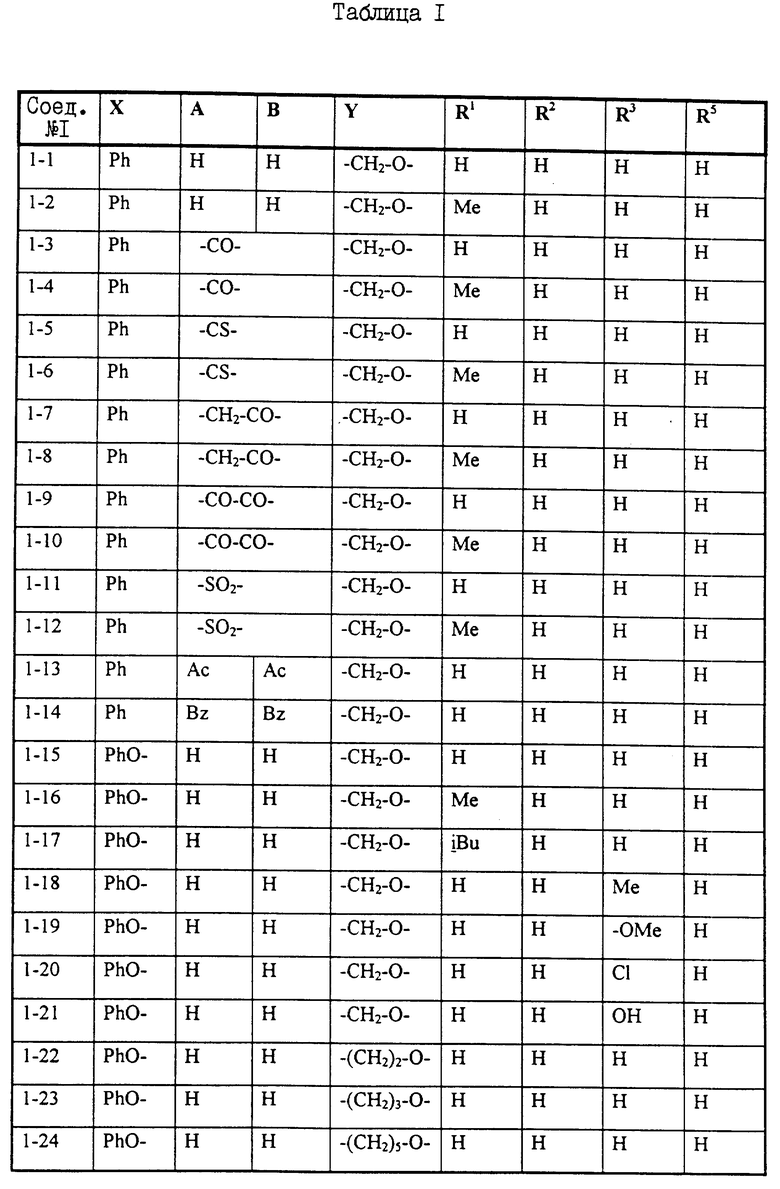
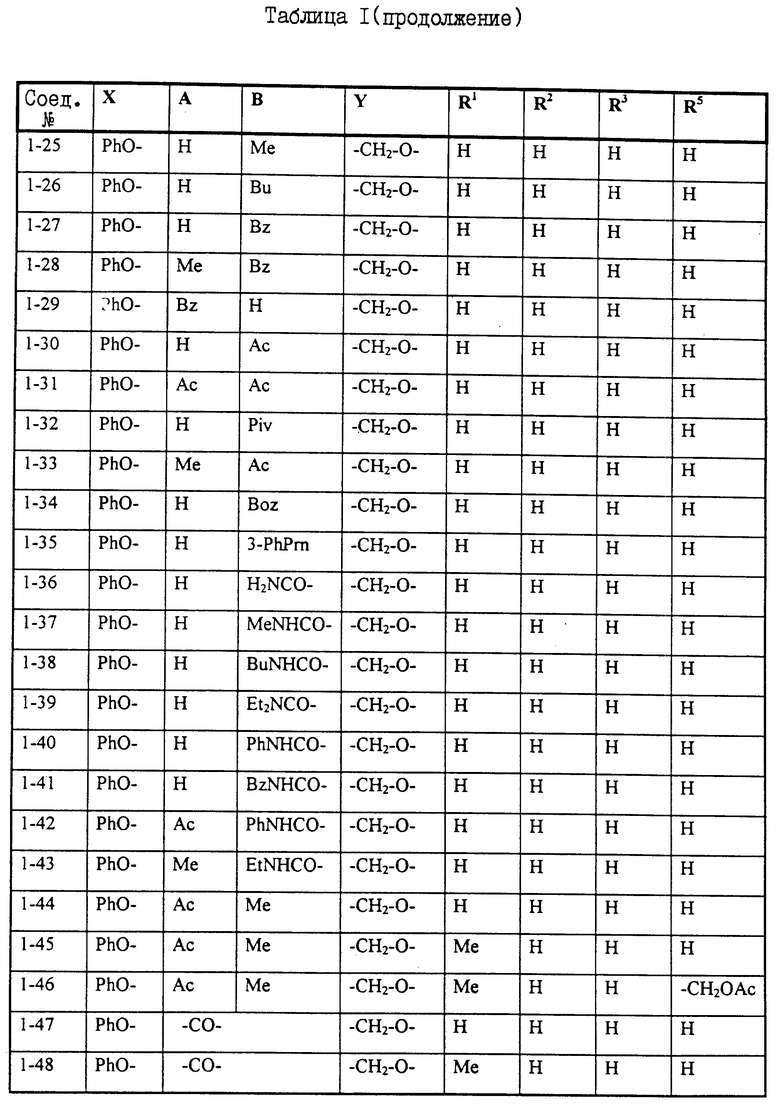
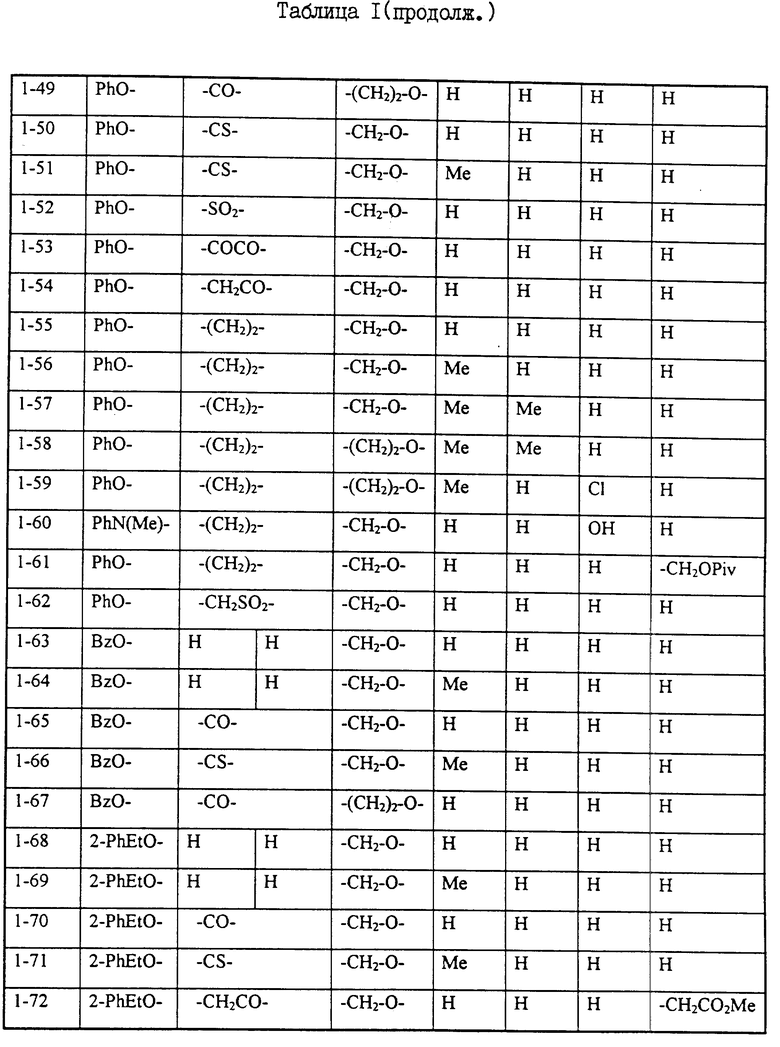
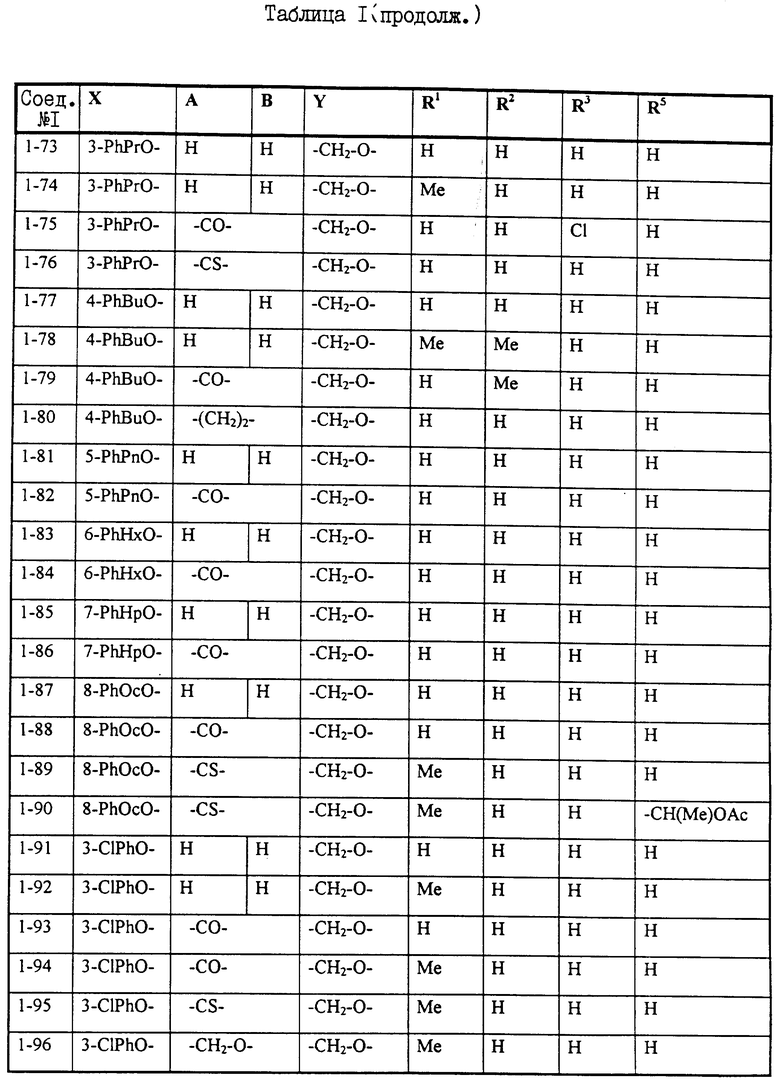
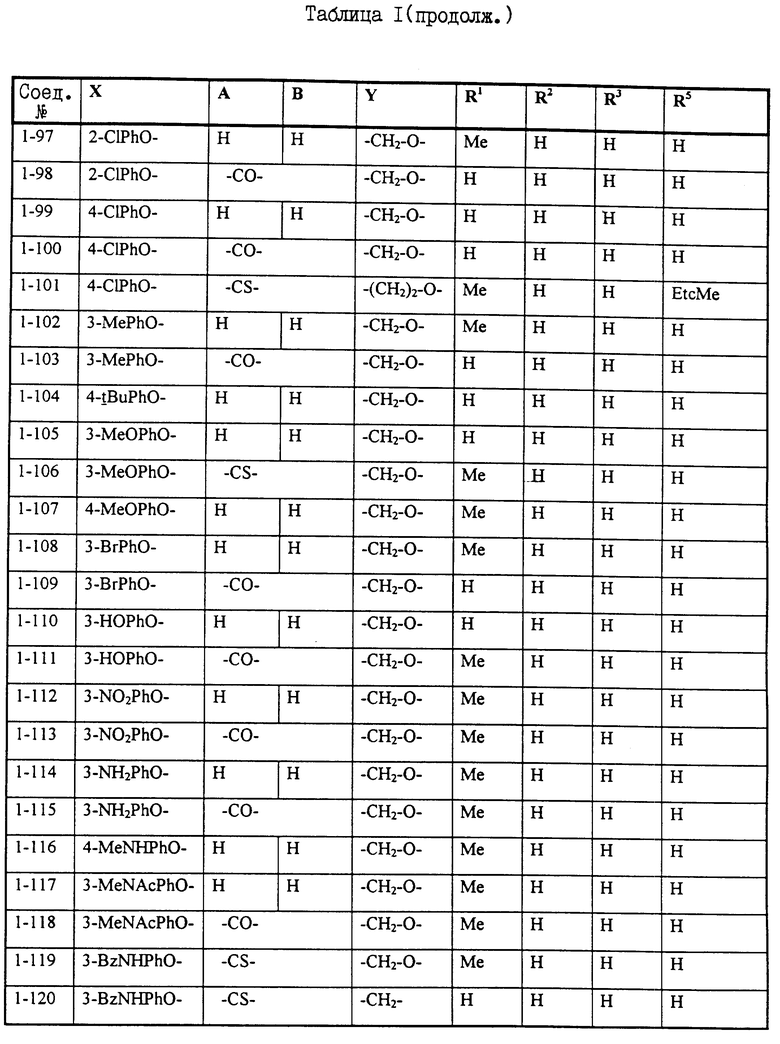
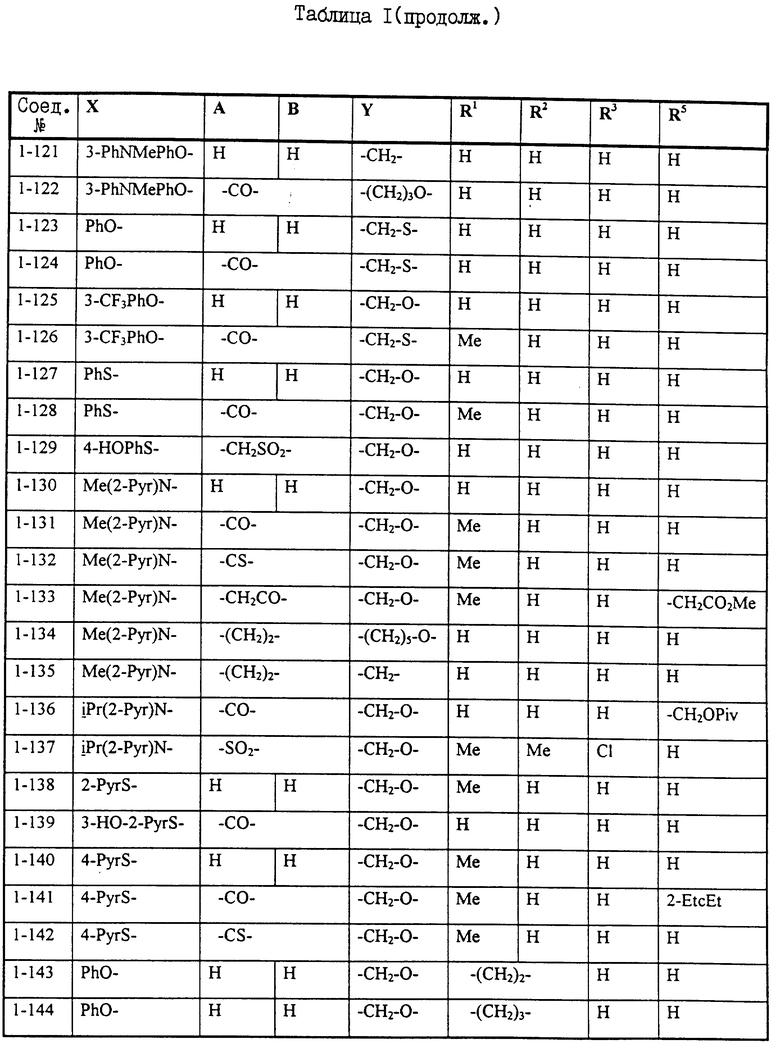

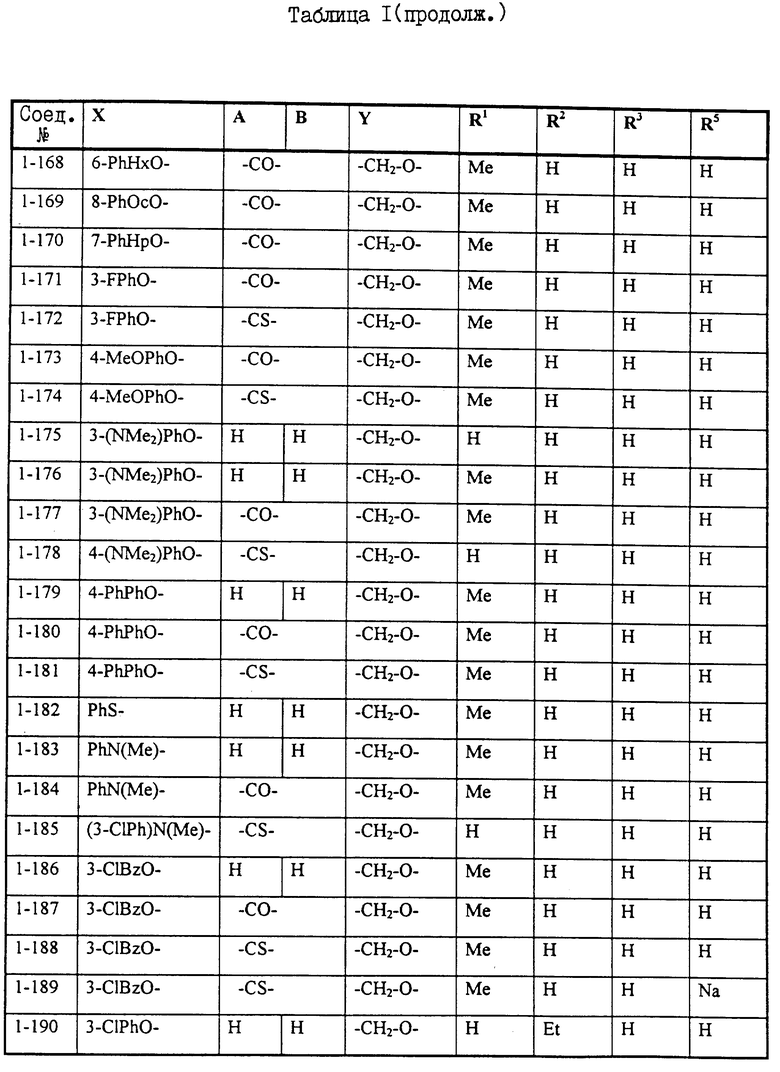
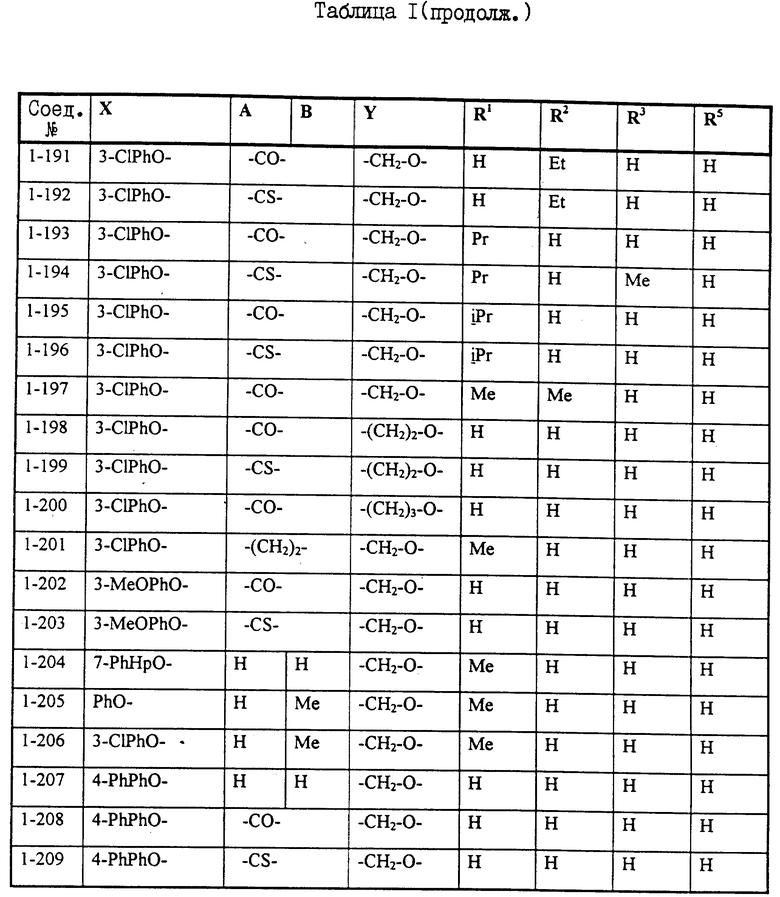
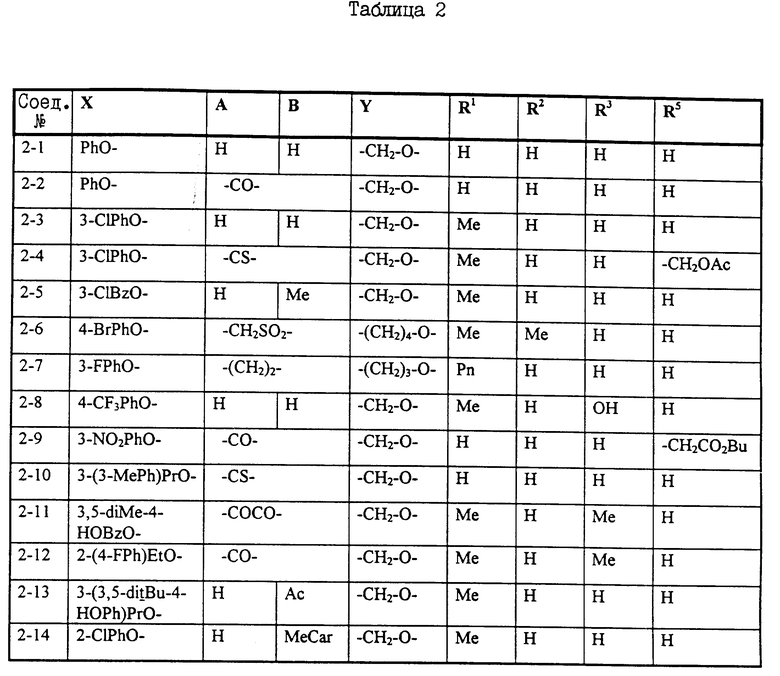
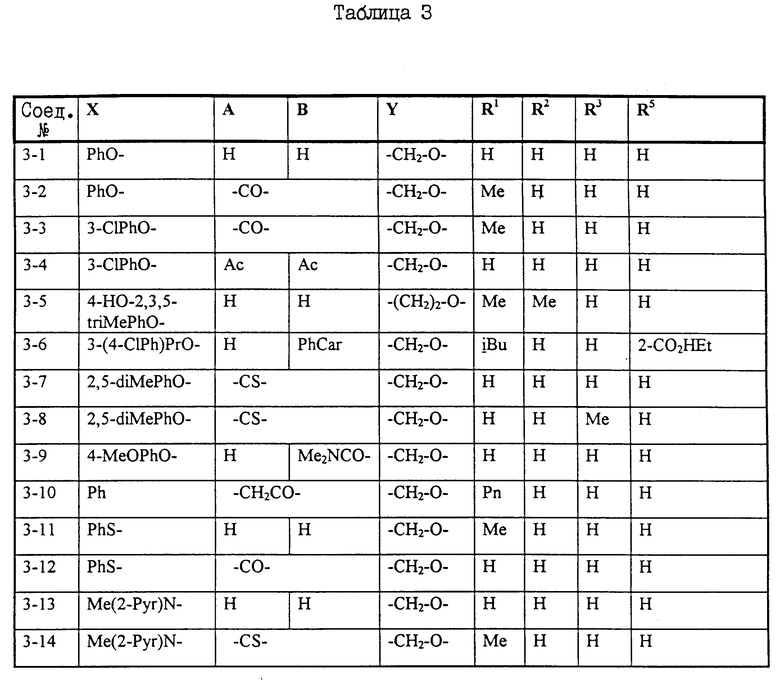
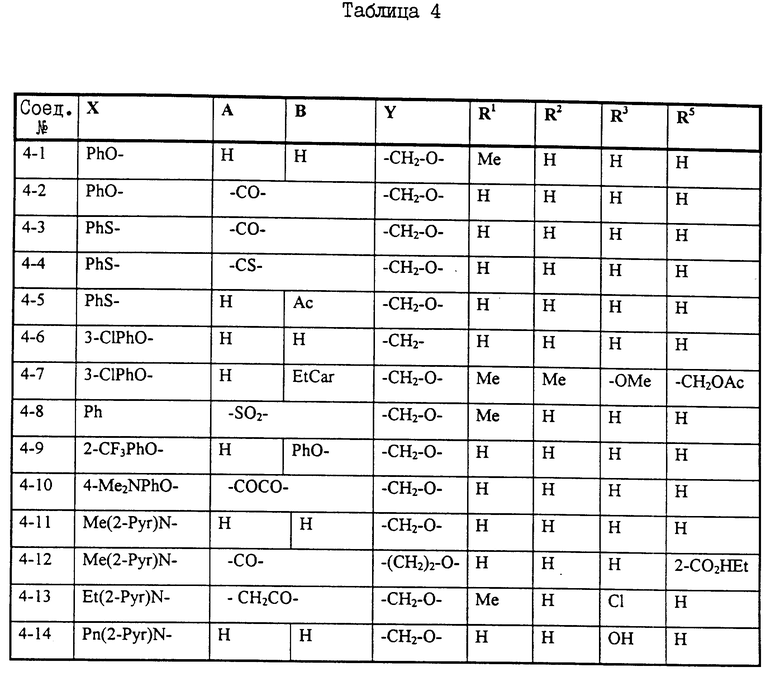
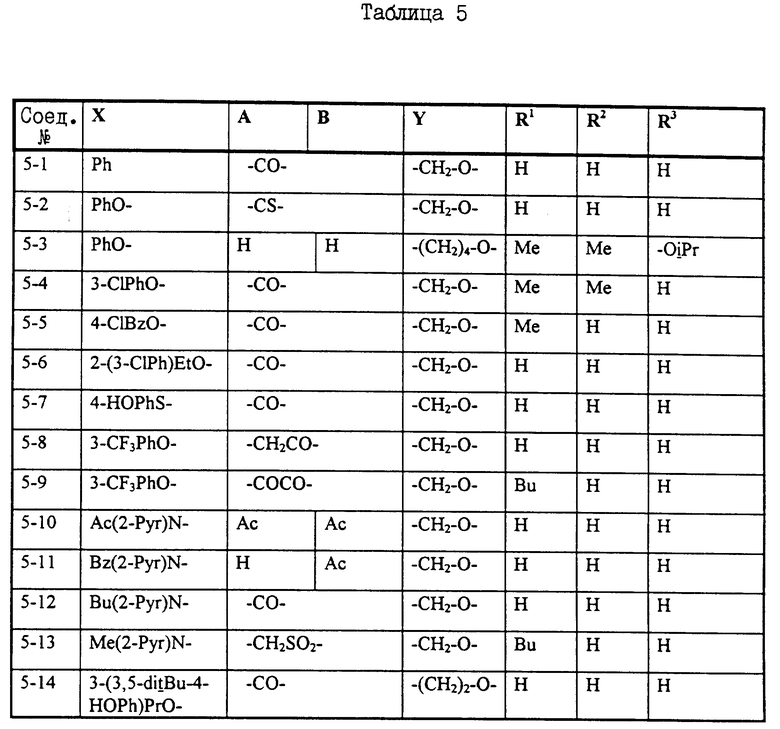
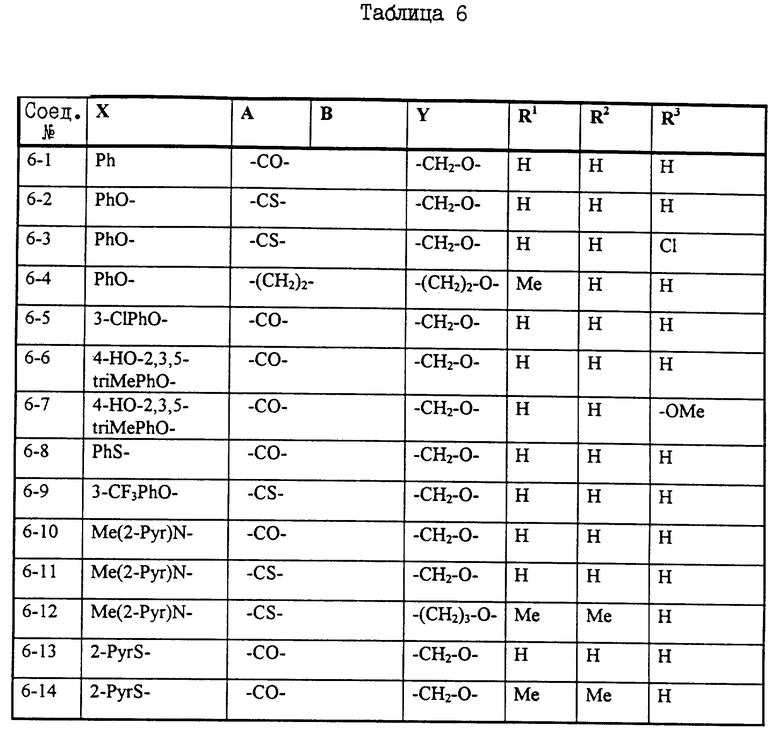
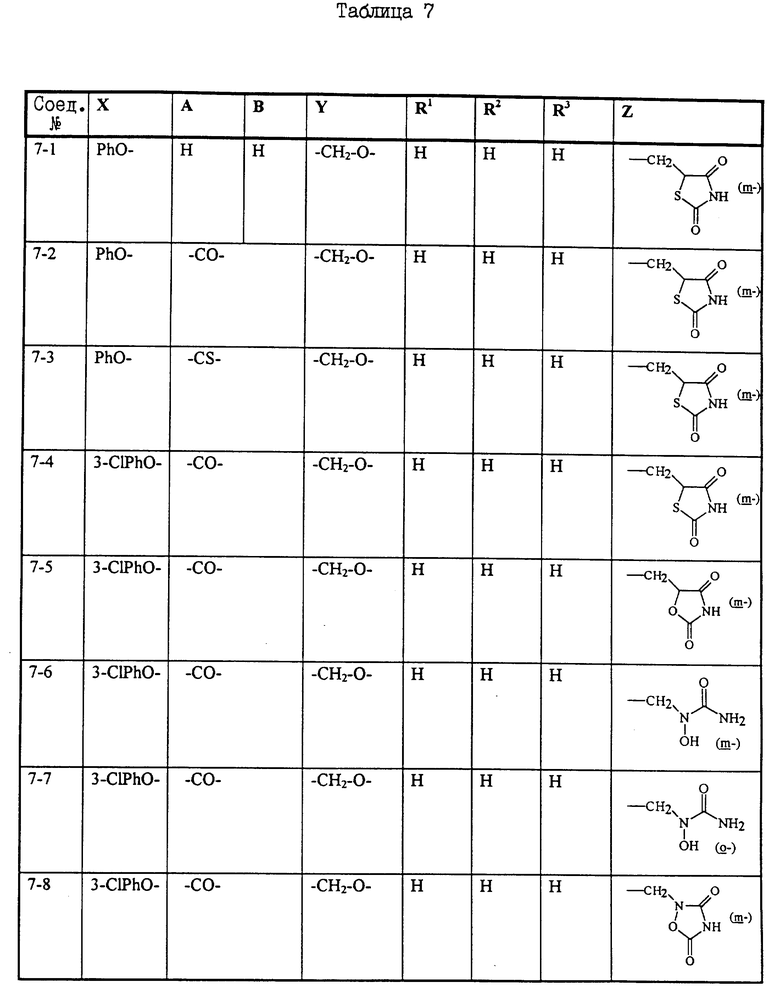
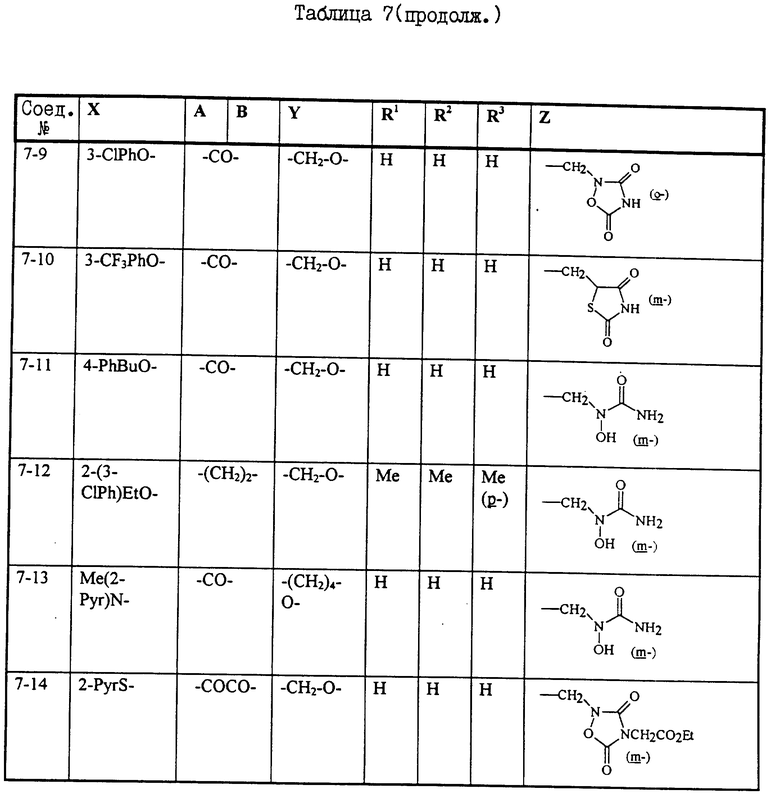
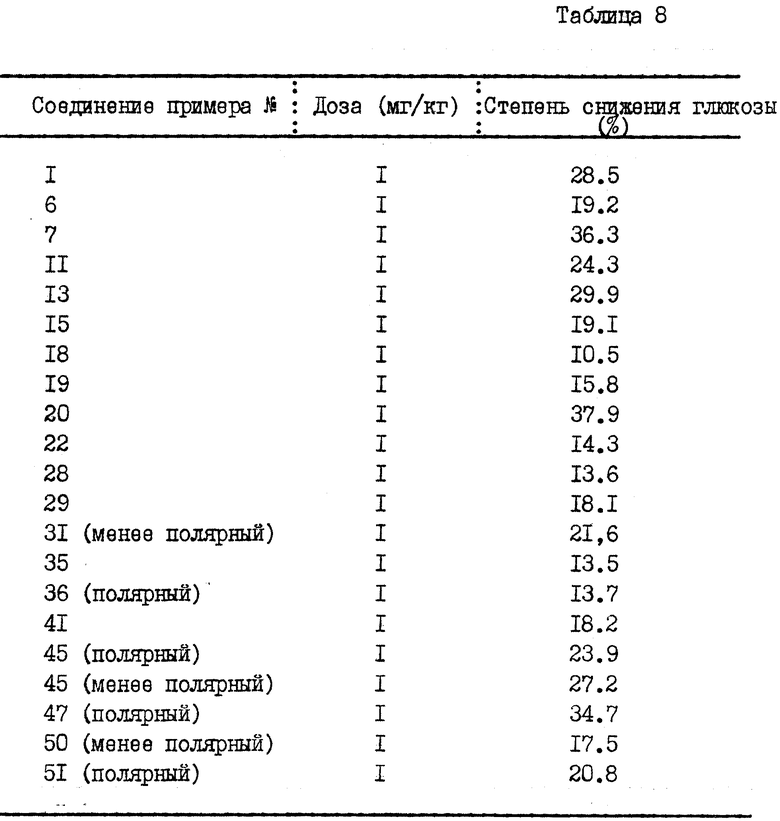
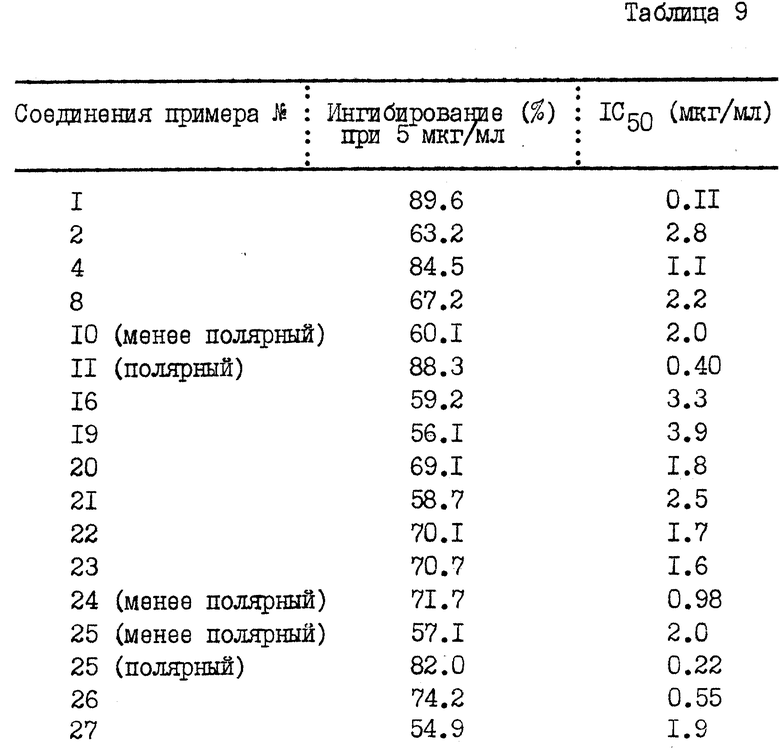
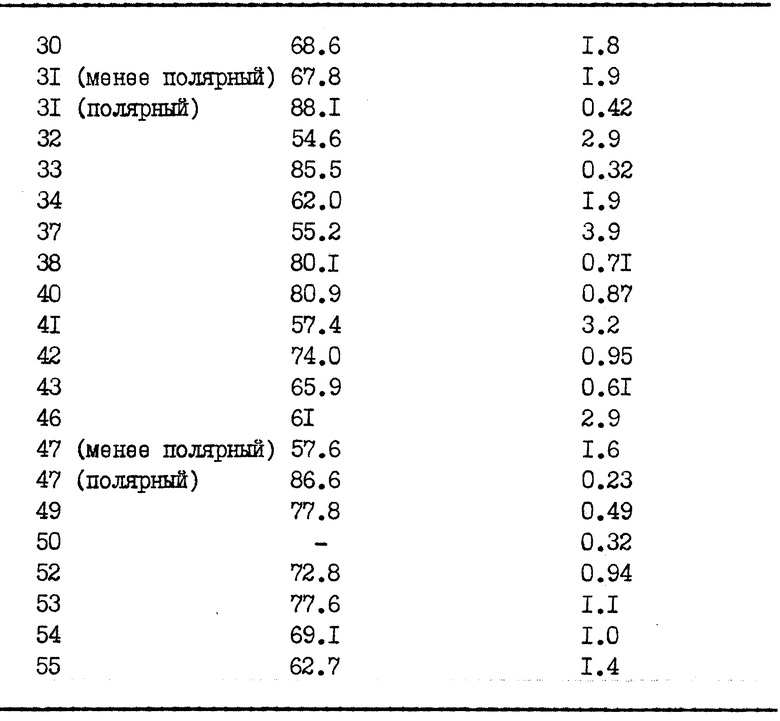

Использование: в медицине. Предложены производные тиазолидина формулы I, где R1 и R2 - одинаковые или различные и каждый представляет водород, алкил, с 1 - 8 атомами углерода, R3 - водород, А и В - одинаковые или различные и каждый представляет водород или алкил 1 - 8 атомами углерода, или А - В - группы: -C=O, =C=S, -CH2CH2-, X - группа W-(CH2)m-X'-, где W - фенил, незамещенный или замещенный, по крайней мере один заместитель, выбранный из алкила с 1 - 4 атомами углерода, алкокси групп с 1 - 4 атомами углерода, галогена, фенила, и групп -NRаRв, где Rа и Rв - одинаковые или различные и каждый представляет водород или алкил с 1 - 8 атомами углерода, X' - одинарная связь, кислород, сера или группа NR4, где R4 - алкил с 1 - 8 атомами углерода, m = 0 - 8, Y - группа формулы -(CH2)n-Y'-, в которой Y' - кислород, сера; n = 1 - 5; Z - группа формулы II, и их соли. Предложена фармацевтическая композиция, содержащая соединение формулы I. Предложен способ лечения и профилактики заболеваний млекопитающих, подвергаемых лечению соединениями, обладающими гипогликемической и гиполипемической активностью. Соединения изобретения показывают снижение глюкозы в крови снижение уровня триглицерина в крови. 3 с. и 25 з.п. ф-лы, 10 табл. 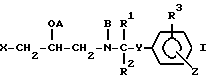
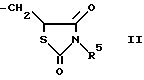 м
м
\ \ \1 1. Производные тиазолидина формулы I \\\6 $$$ \\\1 в которой R<M^ >1<D> и R<M^>2<D> являются одинаковыми или различными и каждый представляет атом водорода или алкильную группу, имеющую от 1 до 8 атомов углерода; \\\4 R<M^ >3<D> - атом водорода; \\\4 А и В являются одинаковыми или различными и каждый представляет атом водорода или алкильную группу, имеющую от 1 до 8 атомов углерода или \\\4 А и В вместе представляют группу формулы \\\6 $$$ $$$ или -CH<Mv>2<D>CH<Mv>2<D>-; \\\4 X - группа формулы \\\6 W - (CH<Mv>2<D>)<Mv>m<D> - X<M^ >1<D>-, \ \\1 в которой W - фенильная группа, которая является незамещенной или замещена по крайней мере одним заместителем, выбранным из алкильных групп, имеющих от 1 до 4 атомов углерода, алкоксигрупп, имеющих от 1 до 4 атомов углерода, атома галогена, фенильных групп и групп формулы \\\6 -NR<M^>a<D>R<M^>b<D>, \\\1 в которой R<M^>a<D> и R<M^ >b<D> являются одинаковыми или различными и каждый представляет атом водорода или алкильную группу, имеющую от 1 до 8 атомов углерода; \\\4 X<M^>1<D> - одинарная связь, атом кислорода, атом серы или группа формулы >> NR<M^>4<D>, в которой R<M^>4<D> - алкильная группа, имеющая 1 - 8 атомов углерода; \\\4 m - 0 или целое число от 1 до 8; \\\4 Y - группа формулы \\\6 -(CH<Mv>2<D>)<Mv>n<D> - Y<M^>1<D>- \\\1 в которой Y<M^>1<D> - атом кислорода или атом серы; \\\4 n - целое число от 1 до 5; \\\4 z - группа формулы i \\\ 6 $$$ \ \ \ 1 в которой R<M^>5<D> - атом водорода, \\\1 и их соли. \\\2 2. Производное тиазолидина по п. 1, в котором R<M^>1<D> и R<M^>2<D> являются одинаковыми или различными и каждый представляет атом водорода или алкильную группу, имеющую 1 - 6 атомов углерода. \\\2 3. Производное тиазолидина по п. 1, в котором А и В являются одинаковыми или различными и каждый представляет атом водорода или алкильную группу, имеющую 1 - 4 атома углерода, или А или В вместе представляют группу формул \\\6 $$$ или -CH<Mv>2<D>CH<Mv>2<D>-. \\ \ 2 4. Производное тиазолидина по п.1, в котором X представляет группу формулы \ \ \ 6 W - (CH<Mv>2<D>)<Mv>m<D> - X<M^>1<D>-, \\\1 в которой W - фенильная группа, которая является незамещенной или замещена 1 - 3 заместителями, выбранными из алкильных групп, имеющих от 1 до 4 атомов углерода, алкоксигрупп, имеющих от 1 до 4 атомов углерода, атомов галогена, фенильных групп и групп формулы \\\6 -NR<M^>a<D>R<M^>b<D>, \\\1 в которой R<M^>a<D> и R<M^>b<D> являются одинаковыми или различными и каждый представляет атом водорода или алкильную группу, имеющую от 1 до 8 атомов углерода; \\\4 X<M^ >1<D> - одинарная связь, атом кислорода, атом серы или группа формулы \\\6 -N(-R<M^ >4<D>)-, \\\1 в которой R<M^>4<D> - алкильная группа, имеющая 1 - 4 атомов углерода; \\\4 m - 0 или целое число от 1 до 8. \\\2 5. Производное тиазолидина по п.1, в котором R<M^>1<D> и R<M^>2<D> являются одинаковыми или различными и каждый представляет атом водорода или алкильную группу, имеющую 1 - 6 атомов углерода; \\\4 А и В являются одинаковыми или различными и каждый представляет атом водорода или алкильную группу, имеющую от 1 до 4 атомов углерода, или А или В вместе образуют группу формулы \\\6 $$$ или -CH<Mv>2<D>CH<Mv>2<D>-; \\\4 X - группа формулы \\\6 W - (CH<Mv>2<D>)<Mv>m<D> - X<M^>1<D>-, \\\1 в которой W - фенильная группа, которая является незамещенной или замещена 1 - 3 заместителями, выбранными из алкильных групп, имеющих 1 - 4 атома углерода, алкоксигрупп, имеющих 1 - 4 атома углерода, атомов галогена, фенильных групп и групп формулы \\\6 -NR<M^>a<D>R<M^>b<D>, \\\1 в которой R<M^ >a<D> и R<M^>b<D> являются одинаковыми или различными и каждый представляет атом водорода или алкильную группу, имеющую 1 - 8 атомов углерода; \\\4 X<M^>1<D> - одинарная связь, атом кислорода, атом серы или группа формулы \ \\6 -N(-R<M^>4<D>)-, \\\1 в которой R<M^>4<D> - алкильная группа, имеющая 1 - 4 атома углерода; \\\4 m - 0 или целое число от 1 до 8; \\\4 Y - группа формулы \ \\6 -(CH<Mv>2<D>)<Mv>n<D>-Y<M^>1<D>-, \\\1 в которой Y<M^ >1<D> - атом кислорода или атом серы; \\\4 n - целое число от 1 до 5; \\\4 Z - группа формулы Vii \ \\6 $$$ \\\2 6. Производное тиазолидина по п.1, в котором R<M^ >1<D> и R<M^>2<D> являются одинаковыми или различными и каждый представляет атом водорода или алкильную группу, имеющую 1-4 атома углерода. \\\2 7. Производное тиазолидина по п.1, в котором А и В являются одинаковыми или различными и каждый представляет атом водорода или метильную, этильную или пропильную группу или А и В вместе образуют группу формулы $$$ или -CH<Mv>2<D>CH<Mv>2<D>-. \\\2 8. Производное тиазолидина по п.1, в котором X - группа формлы \\\6 W - (CH<Mv>2<D>)<Mv>m<D> - X<M^>1<D>-, \\\1 в которой W представляет фенильную группу, которая является незамещенной или замещена 1 - 3 заместителями, выбранными из алкильных групп, имеющих 1 - 4 атома углерода, алкоксигрупп, имеющих 1 - 4 атома углерода, атомов галогена, фенильных групп и групп формулы \\\6 -NR<M^>a<D>R<M^>b<D>, \\\1 в которой R<M^ >a<D> и R<M^>b<D> являются одинаковыми или различными и каждый представляет атом водорода или алкильную группу, имеющую 1 - 8 атомов углерода; \ \\4 X<M^>1<D> - одинарная связь, атом кислорода, атом серы или группа формулы \\\6 -N(-R<M^>4<D>)-, \\\1 в которой R<M^>4<D> - метильная, этильная или пропильная группа; \\\4 m - 0 или целое число от 1 до 6. \\\2 9. Производное тиазолидина по п.1, в котором Y - группа формулы \\\6 -(CH<Mv>2<D>)<Mv>n<D> - Y<M^>1<D>-, \\\1 в которой Y<M^>1<D> - атом кислорода или атом серы, \\\4 n - целое число от 1 до 5. \\\2 10. Производное тиазолидина по п.1, в котором R<M^>1<D> и R<M^>2<D> являются одинаковыми или различными и каждый представляет атом водорода или алкильную группу, имеющую 1 - 4 атома углерода; \\ \ 4 А и В являются одинаковыми или различными и каждый представляет атом водорода, метильную, этильную или пропильную группу, или А и В вместе образуют группу формулы \\\6 $$$ или -CH<Mv>2<D>CH<Mv>2<D>-; \\\4 X - группа формулы \ \ \ 6 W -(CH<Mv>2<D>)<Mv>m<D> - X<M^>1<D>-, \\\1 в которой W - фенильная группа, которая является незамещенной или замещена 1 - 3 заместителями, выбранными из алкильных групп, имеющих 1 - 4 атома углерода, алкоксигрупп, имеющих 1 - 4 атома углерода, атомов галогена, фенильных групп, и групп формулы \ \ \6 -NR<M^>a<D>R<M^>b<D>, \\\1 в которой R<M^>a<D> и R<M^ >b<D> являются одинаковыми или различными и каждый представляет атом водорода или алкильную группу, имеющую 1 - 8 атомов углерода; \\\4 X<M^>1<D> - одинарная связь, атом кислорода, атом серы или группа формулы \\\6 -N(-R<M^ >4<D>)-, \\\1 в которой R<M^>4<D> - метильная, этильная или пропильная группа; \ \ \4 m - 0 или целое число от 1 до 6; \\\4 Y - группа формулы \\\6 -(CH<Mv>2<D>)<Mv>n<D> - Y<M^>1<D>-, \\\1 в которой Y<M^>1<D> - атом кислорода или атом серы; \\\4 n - целое число от 1 до 5; \\\4 Z имеет значения, определенные в п.1. \\\2 11. Производное тиазолидина по п.1, в котором R<M^>1<D> и R<M^>2<D> оба - атом водорода или один из них - атом водорода, а другой - алкильная группа, имеющая 1 - 4 атома углерода. \\\2 12. Производное тиазолидина по п.1, в котором А и В являются одинаковыми или различными и каждый представляет атом водорода, метильную или этильную группу или А и В вместе образуют группу формулы \\\6 $$$ или CH<Mv>2<D>CH<Mv>2<D>-. \\\2 13. Производное тиазолидина по п.1, в котором X - группа формулы \\\6 W -(CH<Mv>2<D>)<Mv>m<D> - X<M^ >1<D>-, \ \\4 в которой W - фенильная группа, которая является незамещенной или замещена 1 - 3 заместителями, выбранными из группы, состоящей из атомов галогена и метильных, этильных, фенильных, амино, диметиламино, метокси и этокси групп; \\\4 X<M^>1<D> - одинарная связь, атом кислорода, атом серы или группа формулы \\\6 -N(Me)-; \\\4 m - 0 или целое число от 1 до 6. \\\2 14. Производное тиазолидина по п.1, в котором Y - группа формулы \\\6 -(CH<Mv>2<D>)<Mv>n<D> - Y<M^>1<D>-, \\\1 в которой Y<M^>1<D> - атом кислорода или атом серы; \\\4 n - целое число от 1 до 3. \\\2 15. Производное тиазолидина по п.1, в котором R<M^>1<D> и R<M^>2<D> оба представляют атом водорода или один из них представляет атом водорода, а другой - алкильную группу, имеющую 1 - 4 атома углерода; \\\4 А и В являются одинаковыми или различными и каждый представляет атом водорода, метильную или этильную группу или А и В вместе образуют группу формул \\\6 $$$ или -CH<Mv>2<D>CH<Mv>2<D>-; \\\4 X - группа формулы \\\6 W - (CH<Mv>2<D>)<Mv>m<D> - X<M^ >1<D>-, \\\1 в которой W - фенильная группа, которая является незамещенной или замещена 1 - 3 заместителями, выбранными из группы, состоящей из атомов галогена и метильных, этильных, фенильных, амино, диметиламино, метокси и этокси групп; \\\4 X<M^>1<D> - одинарная связь, атом кислорода, атом серы или группа формулы -N(Me)-; \\\4 m - 0 или целое число от 1 до 6; \ \\4 Y - группа формулы \\\6 -(CH<Mv>2<D>)<Mv>n<D> - Y<M^>1<D>-, \\\1 в которой Y<M^>1<D> - атом кислорода или атом серы; \\\4 n - целое число от 1 до 3; \\\4 Z - группа формулы Vii \\\6 $$$ \\\2 16. Производное тиазолидина по п. 1, в котором R<M^>1<D> и R<M^>2<D> оба - атом водорода или один из них - атом водорода, а другой - метальная, этильная, пропильная или изопропильная группа. \\\2 17. Производное тиазолидина по п.1, в котором А - атом водорода и В - атом водорода, метильная или этильная группа или А и В вместе образуют группу формулы $$$. \\\2 18. Производное тиазолидина по п.1, в котором X - группа формулы \\\6 W -(CH<Mv>2<D>)<Mv>m<D> - X<M^>1<D>-, \\\1 в которой W - галогензамещенная фенильная группа, фенилфенильная, метоксифенильная или фенильная группа; \\\4 X<M^>1<D> - атом кислорода или атом серы; \\\4 m - 0 или целое число от 1 до 6. \\\2 19. Производное тиазолидина по п.1, в котором Y - группа формулы \\\6 -CH<Mv>2<D>O- или -(CH<Mv>2<D>)<Mv>2<D>O-. \\\2 20. Производное тиазолидина по п.1, в котором R<M^>1<D> и R<M^>2<D> оба - атом водорода или один из них - атом водорода, а другой - метильная, этильная, пропильная или изопропильная группа; \\\4 А - атом водорода и В - атом водорода или метильная или этильная группа или А и В вместе образуют группу формулы $$$; \\\4 X - группа формулы \\\6 W - (CH<Mv>2<D>)<Mv>m<D> - X<M^ >1<D>, \\\1 в которой W - галогензамещенная фенильная группа, фенилфенильная, метоксифенильная или фенильная группа; \\\4 X<M^>1<D> - атом кислорода или атом серы; \\\4 m - 0 или целое число от 1 до 6; \\\4 Y - группа формулы -CH<Mv>2<D>O- или -(CH<Mv>2<D>)<Mv>2<D>O-; \\\4 Z - группа формулы Vii \\\6 $$$ \\\2 21. Производное тиазолидина по п.1, в котором R<M^>1<D> и R<M^ >2<D> оба - атом водорода или один из них - атом водорода, а другой - метильная или этильная группа. \\\2 22. Производное тиазолидина по п.1, в котором А - атом водорода и В - атом водорода или метильная группа или А и В вместе образуют группу формул $$$ \\\2 23. Производное тиазолидина по п.1, в котором X - группа формулы \\\6 W - (CH<Mv>2<D>)<Mv>m<D> -O-, \\\1 в которой W - фенильная, 3-хлорфенильная, 4-хлорфенильная, 3-метоксифенильная, 4-метоксифенильная или 4-фенилфенильная группа; \\\4 m - 0 или целое число от 1 до 6. \\\2 24. Производное тиазолидина по п.1, в котором Y - группа формулы -CH<Mv>2<D>O-. \\\2 25. Производное тиазолидина по п.1, в котором R<M^>1<D> и R<M^>2<D> оба - атом водорода или один из них - атом водорода, а другой - метильная или этильная группа; \\\4 R<M^>3<D> - атом водорода; \\\4 А - атом водорода и В - атом водорода или метильная группа или А и В вместе образуют группу формул $$$ \\\4 X - группа формулы \\\6 W - (CH<Mv>2<D>)<Mv>m<D> -O- \ \ \1 в которой W - фенильная, 3-хлорфенильная, 4-хлорфенильная, 3-метоксифенильная, 4-метоксифенильная или 4-фенилфенильная группа; \\\4 m - 0 или целое число от 1 до 6; \\\4 Y - группа формулы: -CH<Mv>2<D>O-; \\\4 Z - группа формулы Vii \ \ \ 6 $$$ \\\2 26. Производное тиазолидина по п.1, представляющее собой: \\\2 5-{4-[2-(3-фенил-2-гидрооксипропиламино)пропокси] бензил} -тиазолидин-2,4-дион; \\\2 5-{4-[2-(5-3'-хлорфеноксиметил-2-оксооксазолидин-3-ил)этокси] -бензил}тиазолидин-2,4-дион; \\\2 5-{4-[2-(5-3'-хлорфеноксиметил-2-оксооксазолидин-3-ил)пропокси]-бензил}тиазолидин-2,4-дион; \\ \ 2 5-{4-[2-(5-3'-хлорфеноксиметил-2-тиоксооксазолидин-3-ил)пропокси]бензил} тиазолидин-2,4-дион; \\\2 5-{4-[2-(3-6'-фенилгексилокси-2-гидроксипропиламино)пропокси] -бензил} тиазолидин-2,4-дион и \\\2 5-{4-[2-(5-3'-хлорфеноксиметил-2-оксооксазолидин-3-ил)бутокси]бензил}тиазолидин-2,4-дион, \\\1 и их соли. \ \\2 27. Фармацевтическая композиция, обладающая гипогликемической и гиполипемической активностью и активностью ингибирования альдозоредуктазы, которая включает эффективное количество активного соединения в смеси с фармацевтически приемлемым носителем или разбавителем, отличающаяся тем, что в качестве активного соединения она содержит по крайней мере одно производное тиазолидина по любому из пп. 1 - 26. \\\2 28. Способ лечения или профилактики заболеваний млекопитающих, подвергаемых лечению соединения, обладающими гипогликемической или гиполипемической активностью или активностью ингибирования альдозоредуктазы, предусматривающий введение указанному млекопитающему эффективного количества активного соединения, отличающийся тем, что в качестве активного соединения используют по крайней мере одно производное тиазолидина по любому из пп.1 - 26.
| EP, патент, 356214А3, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1998-08-27—Публикация
1995-03-23—Подача