Изобретение относится к области медицины и может быть использовано в хирургии, акушерстве, кардиоангиографии и т.п.
Разработка методов химической антисептики остается актуальной проблемой вследствие постоянного изменения видового состава и свойств гноеродной микробной флоры, что в свою очередь приводит к снижению эффективности антибиотикотерапии, к развитию неблагоприятной ситуации во многих хирургических стационарах в связи с нозокоминальными инфекциями.
В настоящее время для обработки рук медицинского персонала, гнойных ран, операционных полей, а также для стерилизации инструментария используют растворы хлоргексидина биглюконата ("Пливасепт") - препарата, производимого фирмой "Плива" (Хорватия) [1].
В России предстерелизационная обработка инструментария, используемого при эндоскопии и кардиографии, проводится согласно инструкции МЗ и МП РСФСР N 16 от 03.09.1990 г. "Информация о дизинфекции и предстерилизационной очистке инструментария" импортным 2% раствором "Сайдекс" (2,5% глутаровый альдегид в 6% перекиси водорода) или раствором, изготовленным фирмой KIFA (Швеция), имеющим следующий состав: этиловый спирт 96% - 750 мл, формалин 35% - 25 мл, вода дистиллированная - 225 мл, бикарбонат натрия - 1 г на 1 л раствора.
Недостатком раствора "Сайдекс" является его нестабильность, вследствие использования перекиси водорода, и значительный период экспозиции стерилизуемых изделий. Недостатком дезинфицирующего раствора, изготовляемого фирмой KIFA, является высокая испаряемость спирта и формалина, что влечет за собой их значительный расход при интенсивной работе, а также относительно длинный период экспозиции стерилизуемых изделий.
Наиболее близким аналогом данного изобретения, используемым при обработке рук медицинского персонала, гнойных ран, инъекционных и операционных полей является хлоргексидин биглюконат, который обладает широким спектром микробоцидной и спороцидной активности. При обработке кожи используют его 0,5% спиртовые растворы, при дезинфекции инструментария - 2% водные растворы. Недостатком этого препарата является его высокая стоимость, устойчивость к нему некоторых больничных штаммов микробов, а также относительно высокая токсичность.
Задачей данного изобретения является устранение указанных недостатков. Это достигается тем, что в качестве антисептика при обработке операционных полей используют 0,5% спиртовые растворы фосфата полигексаметиленглуанидина (фогуцида), для обработки рук медицинского персонала и гнойных ран - 0,5% водные растворы фогуцида, при дезинфекции инструментария - 1-2% водные растворы фогуцида, для гигиенической антисептики - 2% растворы фогуцида и его композиции с поверхностно-активными веществами.
Фосфат полигексаметиленгуанидина формулы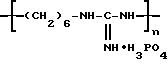
где n = 5-30,
получают из гидрохлорида полигексаметиленгуанидина, выпуск которого освоен отечественной промышленностью. Способ получения фосфата полигексаметиленглуанидиния описан в [2].
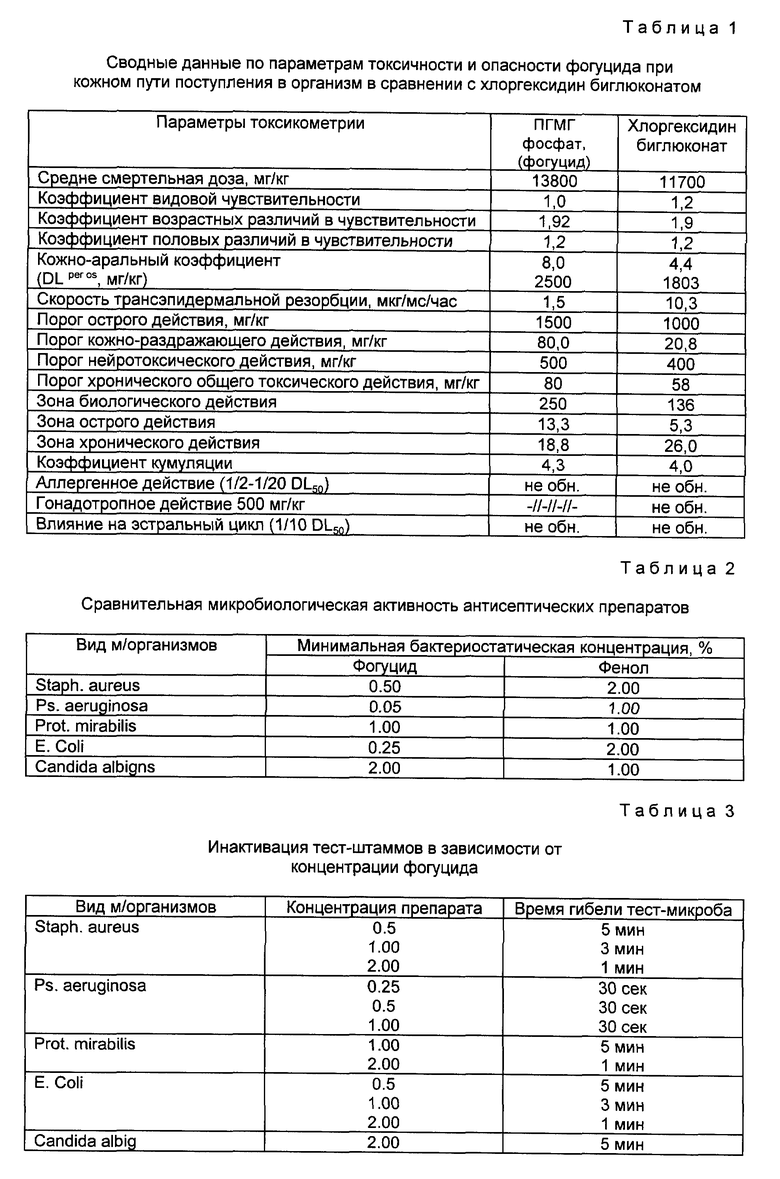
В таблице 1 представлены сводные данные по параметрам токсичности и опасности растворов фогуцида при кожном пути поступления в организм в сравнении с импортным антисептиком хлоргексидин биглюконатом.
Из таблицы видно, что фогуцид, обладающий высокой молекулярной массой относительно хлоргексидина, является менее токсичным веществом. При нанесении его растворов на поверхности образуется пленка, сохраняющая антисептические свойства продолжительное время. Таким образом, по эффективности, безопасности применения, стабильности и дешевизне фогуцид превосходит лучшие зарубежные образцы: хлоргексидин биглюконат, вантоцил, космоцил [3].
Изложенное изобретение иллюстрируется примерами.
Пример 1. Обработка рук медицинского персонала растворами фогуцида.
Испытания проводились в соответствии с рекомендациями Немецкого общества гигиенистов и микробиологов (1981) и дополнениями к ним (1984, 1991).
Согласно этим рекомендациям испытание противомикробной активности антисептиков, дезинфектантов проводят на типовых тест-штаммах. В опытах используют 16-20 часовую культуру тест-штаммов, суспендированную в 0,5% растворе натрия хлорида нейтрального pH. Плотность культуры должна быть установлена в 108-1010 KOE/мл. Препараты для профилактической антисептики должны оказывать быстрый микробостатический или микробоцидный эффект при одно- или двукратном нанесении с небольшим интервалом. Поэтому время действия препарата на бактерии устанавливают от 30 с до 5 мин. Готовят серии разведений испытуемого препарата, которые оказывают и не оказывают противомикробное действие на тест-штаммы бактерий. К опыту ставят контроль на чувствительность тест-штаммов к фенолу (1%, 0,5%, 0,25%, 0,125% и т.д. разведений в 0,5% растворе хлорида натрия).
При допуске новых препаратов в медицинскую практику ставят: а) качественный суспензионный тест; б) количественный суспензионный тест; в) тест, приближенный к практике использования антисептиков.
Определение бактериостатической и фунгистатической активности антисептика фогуцид в качественном суспензионном тесте.
Испытуемый препарат развели в концентрациях: 2%, 1%, 0.5%, 0.025%, 0.05%, 0.25%. К разведениям препарата добавили 20-часовые культуры тест-штаммов пяти видов: кишечной палочки, золотистого стафилококка мирабельного протея, сине-гнойной бактерии, белой кандиды. Плотность культуры соответствовала 109 KOE/мл, экспозиция - 0.5, 1.3 и 5 мин. По истечении экспозиции тест-штаммы высевали на среду KCA, кандиды - на среду Сабуро. Срок инкубации бактерий - 48 ч при температуре 37oC, кандид - 72 ч при 20-25oC. Результаты учитывали по торможению роста микробов. Полученные данные представлены в таблице 2.
Из таблицы 2 видно, что растворы фогуцида значительно эффективнее растворов фенола. Фогуцид губительно действует на грампозитивную микрофлору в концентрации 0.5-2%, грамнегативную - 0.05-1%.
Для гигиенической антисептики препарат считается пригодным, если он тормозит рост всех тест-микробов за 0.5-1 мин в допустимой по переносимости концентрации. Препарат, предназначенный для хирургической антисептики рук, должен тормозить рост всех тест-штаммов при 3-5 минутной экспозиции в допустимой по переносимости концентрации.
Полученные данные свидетельствуют, что для хирургической обработки рук можно применять 0.5-1% растворы фогуцида, для гигиенической антисептики - 2% раствор.
Определение активности фогуцида в количественном суспензионном тесте.
Испытание проводили на тест-штаммах кишечной палочки и золотистого стафилококка. Плотность культуры составила 1•109 KOE/мл. Испытуемые концентрации брали, исходя из результатов качественного суспензионного теста. В качестве контроля - фенол. Смесь препарата и культуры инкубировали 0.5, 1 и 5 мин. По истечении срока инкубации высевали на КСА. Активность препарата оценивали по степени снижения KOE/мл по сравнению с контролем. Препараты для гигиенической антисептики должны снижать KOE/мл кишечной палочки и стафилококков в рекомендуемой для применения концентрации в течение 0.5-1 мин не менее чем на 5 десятичных логарифмов. Препараты для хирургической антисептики должны обеспечить такую же степень за 3-5 мин. (табл.).
Согласно этому тесту предпочтительная концентрация растворов фогуцида для хирургической антисептики 0.5-1%, для гигиенической антисептики - 2% раствор.
Определение активности фогуцида в тестах, приближенных к практическому применению.
В странах Европы за второй стандарт эффективной хирургической антисептики принято считать снижение KOE бактерий, которое достигается после двукратной обработки рук 60% изопропанолом [2].
Кисти рук добровольцев после мытья с мылом под проточной водой опускали в суспензию штамма кишечной палочки 1•109. На втором этапе руки высушивали на воздухе в течение 3 мин, на третьем - делали смыв с контаминированных участков рук, помещая их на 1 мин в физраствор, на четвертом - контаминированные участки рук протирали 3 мл избранной по результатам суспензионных тестов концентрацией антисептика в течиние 1 мин для гигиенической антисептики и в течение 5 мин по 5 мл препарата - для хирургической антисептики, на пятом этапе делали смыв с контаминированных, обработанных и нейтрализованных участков кожи. В контроле использовали 60% раствор изопропанола.
Оценка эффективности испытуемого препарата проводится путем сравнения степени снижения количества кишечной палочки (при искусственной микробной контаминиции - 5 десятичных логарифмов). Данный тест подтверждает правильность выбранных концентраций.
Далее провели сравнительную оценку эффективности фогуцида и хлоргексидина для обработки рук персонала, участвующего в операциях.
Испытания проводились на добровольцах (60 опытов) с экспозицией 1 мин, 5 мин, 1 ч. Руки тщательно мыли проточной водой с мылом. Высушивали стерильной салфеткой. Затем наносили 3 мл препарата и втирали его в течение 1 мин для гигиенической антисептики. Для хирургической антисептики втирали его в кожу в течение 5 мин, повторяя процедуру дважды. Брались посевы на стерильность с обработанных препаратом рук. Одевали стерильные перчатки. Через час делали повторный высев для определения эффективности антисептика.
В условиях бокса смывы засевали на среды с соблюдением правил септики, исключающих возможность вторичных контаминаций. Для этого проверяли обсеменность воздуха в боксе (две чашки Петре с питательным агаром ставили на рабочий стол, выдерживали открытыми 15 мин и помещали в термостат на 24 ч). Результаты представлены в таблице 6.
Из таблицы видно, что использование 0.5-2% растворов фогуцида при хирургической и гигиенической обработке рук более эффективно, чем растворы хлоргексидина, и действие предлагаемого препарата как антисептического средства более продолжительно.
Исследование антибактериальной активности растворов фогуцида в присутствии поверхностно-активных соединений (ПАВ).
В качестве ПАВ использовали полиэтиленгликоль (ПЭГ) и поливинилпирролидон (ПВП) в стандартных соотношениях с конечной концентрацией активного компонента от 0.5% до 0.001%. В качестве контроля использовали традиционный антисептик - хлоргексидин в таких же концентрациях.
Для постановки эксперимента готовили стандартную взвесь тест-культур бактерий в количестве 100 000 микробных клеток, которую вносили в тест-систему, содержащую питательную среду АГВ и исследуемый препарат в соответствующих концентрациях.
Как видно из представленной таблицы, использование ПАВ не влияет на активность растворов фогуцида по отношению к различным видам бактерий, а в некоторых случаях даже увеличивает активность испытуемого средства.
Пример 2. Обработка раствором фогуцида инъекционного и операционного полей.
С целью изучения дезинфицирующих свойств фогуцида использовали его 0,5% раствор в 70o спирте, в качестве контроля - 0,5% спиртовой раствор хлорогексидина. Бактериологический контроль эффективности применения антисептиков проведен в бактериологической лаборатории Иркутского Областного гнойно-септического центра с помощью бактериологического анализатора "Sceptor" (Германия). Обследовано 45 больных в процессе их подготовки к операции. Из них 21 - обработка кожи проведена хлогексидином (1 гр.), 24 - растворами фогуцида (2 гр. ). Диагнозы больных: кишечные свищи, гнойные раны передней брюшной стенки, флегмоны, подпеченочные абсцессы, эмпиемы плевры и т.д. До нанесения раствора дезинфектанта брался посев с необработанной поверхности кожи.
У всех больных 1 и 2 группы с кожи в области оперативного вмешательства до операции была получена полимикробная флора, в большинстве своем способная инициировать и поддерживать гнойно-воспалительные процессы.
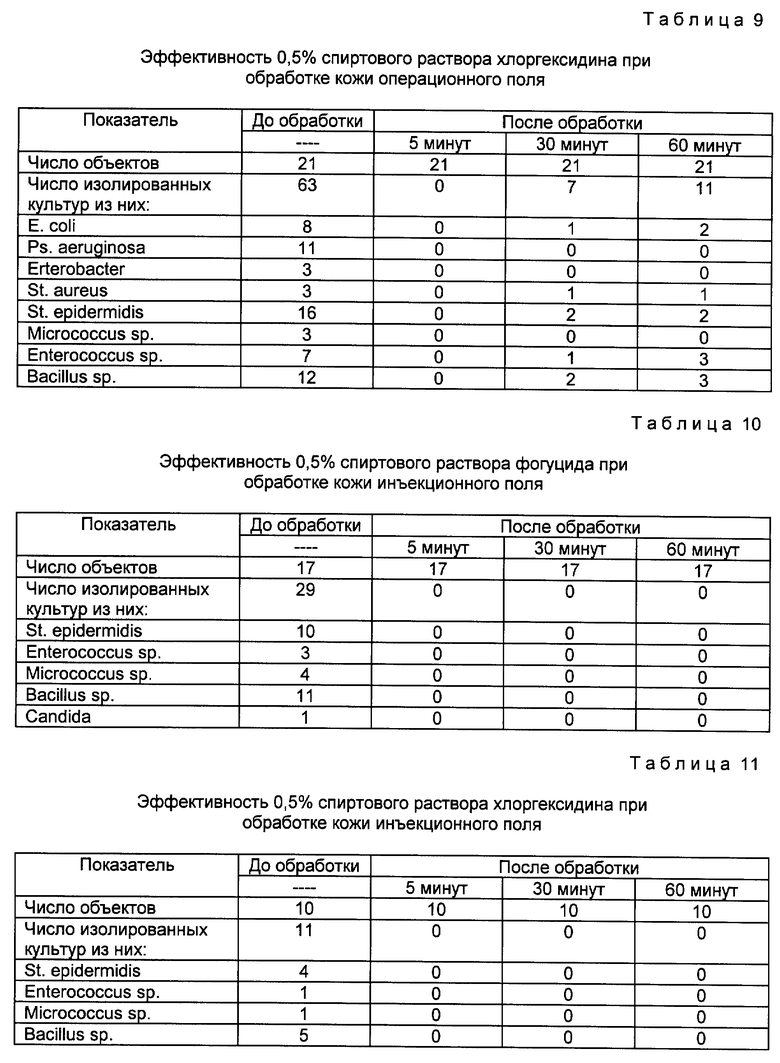
Операционное поле в течение 5 мин обрабатывали марлевыми салфетками, смоченными 0,5% спиртовым раствором дезинфектанта, двухкратно меняя салфетки в течение этого времени. После обработки операционное поле высушивали стерильной сухой салфеткой и брали посев на наличие микрофлоры. После этого на операционное поле наклеивали стерильную марлевую салфетку из четырех слоев марли. Повторные посевы брали из центра операционного поля через 30 и 60 мин. Данные по эффективности используемых растворов представлены в таблицах 8 и 9.
Как видно из таблиц, до обработки кожи с ее поверхности получено 70 культур микроорганизмов. Через 5 и 30 мин после обработки кожи раствором фогуцида поле оказалось стерильным. При обработке кожи раствором хлоргексидина ренифицирование кожи, вероятно, путем эскалации микроорганизмов из губоких слоев кожи происходит уже через 30 мин. Через 60 мин во 2-й группе выделено лишь 2 культуры, а в 1-й группе - 11.
Полученные данные позволяют сделать вывод, что 0,5% спиртовой раствор фогуцида продемонстрировал более высокую активность и был более эффективен в отношении различных бактерий по сравнению с 0,5% спиртовым раствором хлоргексидина.
Проведен бактериологический анализ эффективности 0,5% раствора фогуцида в 70o спирте при обеззараживании кожи в области проведения инъекций и катеризации сосудов. В качестве контроля использовали 0,5% спиртовый раствор хлоргексидина. Обследовано 27 больных отделения гемодиализа. Из них 17 прошли обработку раствором фогуцида и 10 раствором хлоргексидина. Данные представлены в таблице 10 и 11.
Из таблиц видно, что эффективность обработки инъекционного поля обоими препаратами существенно не отличалась. Однако при общей оценке полученных результатов у больных этой группы не было обнаружено таких бактерий как E. coli, Ps. aeruginosal, St. aureus. У 45 больных гнойно-септического центра в исходных посевах кожи было выделено 133 культуры микроорганизмов (295%), а у 27 больных отделения гемодиализа и отделения ангиографии в два раза меньше (148%). Следовательно, при более высокой бактериальной обсемененности кожи, в том числе микроорганизмами, вызывающими наиболее тяжелые клинические формы воспаления, фогуцид оказался более эффективным, чем хлоргексидин. Это имеет особое значение в условиях госпитализации и при проведении операций у гнойных больных.
Пример 3. Исследование влияния водного раствора фогуцида на заживление гнойных ран.
Экспериментальные исследования проводились на неинбредных крысах-самцах линии "Вистар" весом 200-240 г. Общее количество выполненных экспериментов составило 443. Из них 10 - для отработки моделей плоскостной гнойной раны, 10 составили контрольную группу, на 12-ти испытывали 0,05% раствор фогуцида (опытная группа N 1) и на 12-ти - 0,1% раствор фогуцида (опытная группа N 2).
После депиляции участка кожи 3х3 см на спине животного правее позвоночника создавали округлую плоскую рану (диаметр 2,3 см). Дном раны была собственная фасция. По-периметру раны четырьмя кожными швами с целью препятствия контракции кожи фиксировали титановое кольцо с наружным диаметром 2 см и высотой 1,5 мм. В рану вносили 0,5 мл 5% взвеси содержимого толстой кишки (СТК) животных. Микробиологический пейзаж СТК представлен в таблице 12.
Поверхность раны укрывали лоскутом купрофановой (диализной) мембраны предотвращающим высыхание раны и образование струпа. Установлено, что кольцо и мембрана "работают" 6-8 дней. Во всех произведенных опытах, исключая период отработки моделирования, удалось достичь формирования типичного гнойного воспаления к исходу 2-х суток с неотъемлемыми его признаками: наличие гнойного экссудата с неприятным запахом, некротических тканей, гиперимии и инфильтрации в окружности раны.
Лаваж раны осуществляли введением 3-4 мл исследуемых растворов шприцом или катетером под край мембраны на поверхность раны после ее первичной хирургической обработки, которая включала удаление струпа и иссечение видимых некротических тканей.
Для оценки течения заживления ран использовали методы, результаты которых приведены в таблице 13.
Измерение площади раны производили взвешиванием бумажного шаблона на торсионных весах (таблица 14).
Вычисление регенеративно-дегенеративного индекса проводили по формуле:
РДИ = СЯЛ + ПЯЛ/ДФЛ,
где
СЯЛ - сегментоядерные лейкоциты;
ПЯЛ - палочкоядерные лейкоциты;
ДФЛ - дегенеративные формы лейкоцитов.
При значении индекса > 1 можно говорить об окончании фазы очищения и о вступлении раневого процесса в фазу регенерации.
Определение количества KOE на 1 г биоптата края раны осуществляли по методу Jould в модификации Рятинского-Родомана. Полученные данные представлены в таблице 15.
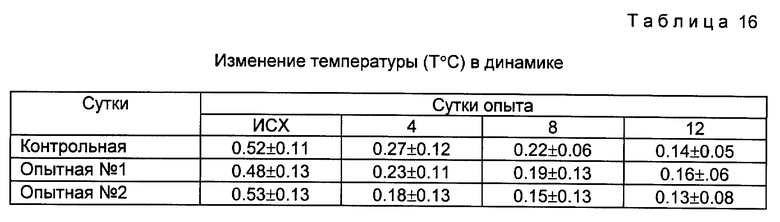
Изменение pH раневой поверхности осуществляли контактным способом при помощи pH-метра АГМИ-01. В результате достоверных отличий между исследуемыми группами в динамике показаний pH не выявлено. Для измерения ректальной температуры использовали линейные контактные датчики Yellow Springs (США). Полученные данные представлены в таблице 16.
Представленные в таблицах 13-16 данные свидетельствуют о статистически значимом лечебном эффекте при обработке ран 0,1% раствором фогуцида, выражающегося в более быстрой нормализации ректальной температуры, в более раннем начале эпитализации, снижении показателей дегенеративных изменений в цитограмме, а также существенном снижении бактериальной тканевой обсемененности к 4 суткам. Это свидетельствует о выраженном антисептическом действии фогуцида и вместе с тем отсутствии локального и резорбтивного токсического эффекта.
Пример 4. Обработка эндоскопов и вспомогательного оборудования водными растворами фогуцида.
В качестве объектов использованы:
резиновые наркозные маски (10 шт.); бужи пластмассовые пищеводные (10 шт. ); волоконнооптические гастродуоденоскопы "Olimpus" (10 шт.); металлические эзофаго- и бронхоскопы "Storz" (10 шт.).
После предстерилизационной очистки повторно используемого инструментария он обработан 0,5-2% водными растворами фогуцида. С помощью марлевой салфетки, смоченной в этих растворах, протирали наружную поверхность указанных объектов. Недоступные механическому протиранию поверхности (каналы приборов) промывали также этими растворами. В том и другом случае время постоянного контакта стерилизуемой поверхности с дезинфектантом составило от 1 до 5 мин.
При проведении бактериологических исследований установлено, что полная стерильность инструментария достигается при использовании 0,5% растворов за 5 мин обработки, а при 1% растворе - к концу 3-й мин обработки.
В специальной серии исследований провели инфицирование эндоскопов и изделий (после их предстерилизационной обработки) тест-штаммами E-coli и St. aureus (108 KOE/мл) с помощью ватного тампона по наружной и внутренней поверхности приборов и инструментов. Затем контаминированные объекты обрабатывали водными растворами фогуцида по описанной выше методике. Материал для бактериологического исследования брали через 1, 3, 5, 10, 15 и 40 мин после обработки 1% раствором фогуцида. В результате установлено, что через 3, 5 и т. д. мин ни одного случая роста микроорганизмов не отмечено. Таким образом, время стерилизации эндоскопического и вспомогательного оборудования значительно сокращается, увеличивается число эндоскопических исследований одним аппаратом. Кроме того, существенно упрощается техника стерилизации, исключающая, повторное промывание каналов гибких эндоскопов и использование специальных стерильных камер.
Пример 5. Стерилизация инструментария, применяемого в кардиоангиографии, водными растворами фогуцида.
Для стерилизации изделий для ангиографии использовали 1-2% раствор фогуцида.
Объекты исследования: изделия из металла (проводники катетеров, переходные краны, иглы Сельдингера, спирали Гиантурно - (40 изд.); из полимерных материалов (катетеры различного устройства, пластмассовые канюли, переходные краны (23 изд.).
Для строгой оценки стерилизующих возможностей 1-2% растворов фогуцида объекты исследования инфицировались тест-штаммами E.coli и St.aureus в концентрациях 108 KOE/мл. После этого изделия обрабатывали 1% (1-ая группа опытов) или 2% (2-ая группа опытов) водными растворами фогуцида. Материал для бактериологического исследования брали через 1, 3, 5, 10, 15, 40 мин.
При использовании 1% раствора фогуцида, объекты были свободны от E.coli на 10 мин, а от St.aureus - на 5 мин стерилизации, тогда как после применения 2% раствора роста микроорганизмов не было обнаружено уже через 1 мин обработки как металлических, так и пластмассовых изделий.
Таким образом, стерилизация изделий и инструментов, используемых в процессе ангиокардиодиагностических и лечебных процедур с помощью 2% раствора фогуцида является эффективным и быстрым методом. Это особенно важно при необходимости экстренной стерилизации или повторной стерилизации при случайном инфицировании изделий во время процедуры.
Предложенный метод расширяет арсенал способов предоперационной обработки изделий для ангиокардиографии, что весьма важно в условиях госпитализации.
Литература
1. Красильников А. П. Справочник по антисептикам. Минск: Высшая школа, 1995.
2. Лулле И.Ж., Лидак М.Ю., Паэгле Т.А., Зидемане А.А., Кравченко Н.Н., Шлев А.П., Каган Г.И., Гембицкий П.А., Симхович Б.З. Авторское свидетельство N 944290., 1981., 23.03.1986., Бюлл. N 11.
3. Патенты США N 2830006, N 4587266; 1986 г., Великобритании N 702268, 1969 г., ФРГ N 2437844, 1982 г.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРИМЕНЕНИЕ СОЛЕЙ ПОЛИГЕКСАМЕТИЛЕНГУАНИДИНИЯ В КАЧЕСТВЕ ПРЕПАРАТОВ, ОБЛАДАЮЩИХ АНТИМИКРОБНОЙ АКТИВНОСТЬЮ ПО ОТНОШЕНИЮ К АНАЭРОБНОЙ И СМЕШАННОЙ ИНФЕКЦИИ | 1997 |
|
RU2143905C1 |
| СПОСОБ АУТОТРАНСПЛАНТАЦИИ ТКАНИ СЕЛЕЗЕНКИ | 1994 |
|
RU2112429C1 |
| ГИДРОКСИЭТИЛЕНБИФОСФОНАТ ПОЛИГЕКСАМЕТИЛЕНГУАНИДИНА, ОБЛАДАЮЩИЙ АНТИСЕПТИЧЕСКИМИ И АНТИДОТНЫМИ СВОЙСТВАМИ | 1998 |
|
RU2147299C1 |
| КОМПЛЕКС ПОЛИВИНИЛПИРРОЛИДОНА И 1,4-ДИ-N-ОКИСИ 2,3-БИС-(ОКСИМЕТИЛ)ХИНОКСАЛИНА(ДИОКСИДИНА) И ЕГО ПРИМЕНЕНИЕ В КАЧЕСТВЕ АНТИМИКРОБНОГО КОМПЛЕКСА С ПРОЛОНГИРОВАННЫМ ЭФФЕКТОМ | 2006 |
|
RU2304589C1 |
| СПОСОБ ЛЕЧЕНИЯ БОЛЬНЫХ КАЛЬКУЛЕЗНЫМ ХОЛЕЦИСТИТОМ | 1997 |
|
RU2129026C1 |
| СПОСОБ ОЦЕНКИ ПРОНИЦАЕМОСТИ КИШЕЧНОГО БАРЬЕРА | 1999 |
|
RU2156110C1 |
| АРГАКРИЛ - НОВОЕ АНТИСЕПТИЧЕСКОЕ И ГЕМОСТАТИЧЕСКОЕ СРЕДСТВО | 2001 |
|
RU2220982C2 |
| СПОСОБ ПОДГОТОВКИ ДЕФЕКТА КОЖНОГО ПОКРОВА К АУТОДЕРМОПЛАСТИКЕ | 2000 |
|
RU2192266C2 |
| СПОСОБ РЕЗЕКЦИИ СЕЛЕЗЕНКИ | 1994 |
|
RU2113177C1 |
| СПОСОБ ЛЕЧЕНИЯ ТЯЖЕЛЫХ ПОВРЕЖДЕНИЙ СЕЛЕЗЕНКИ | 2001 |
|
RU2217062C2 |



Для обработки используют 0,5-2%-ные водные или 0,5%-ные водно-спиртовые растворы фосфата полигексаметиленгуанидиния формулы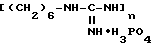
где n = 5 - 30. Используемые растворы малотоксичны и сохраняют свои антисептические свойства длительное время. 16 табл.
Способ обработки рук медицинского персонала, гнойных ран, инъекционных и операционных полей и стерилизации медицинского инструментария, заключающийся в нанесении антисептического раствора, отличающийся тем, что в качестве антисептического раствора используют 0,5 - 2%-ные водные растворы или 0,5%-ные растворы смеси, состоящей из 70% этилового спирта и 30% воды, и фосфата полигексаметиленгуанидиния формулы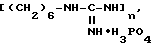
где n = 5 - 30.
| Красильников А.П | |||
| Справочник по антисептикам | |||
| - Минск: Высшая школа, 1995, с.83. |
Авторы
Даты
1998-12-10—Публикация
1997-04-17—Подача